Щелочная фосфатаза — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Щелочная фосфатаза
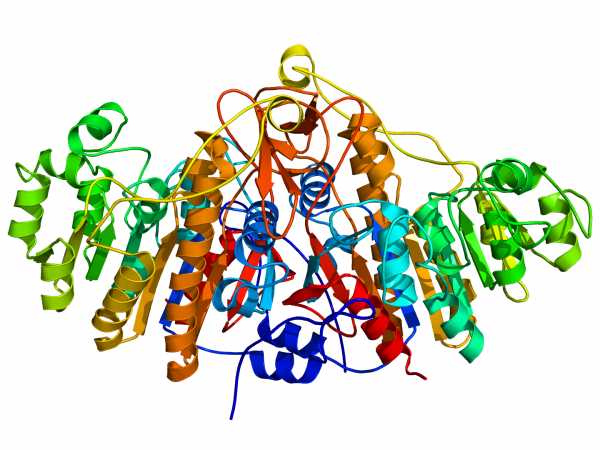 Димер щелочной фосфатазы бактерий. Синим выделен N-конец, красным — C-конец.[1]
Димер щелочной фосфатазы бактерий. Синим выделен N-конец, красным — C-конец.[1]| Обозначения | |
|---|---|
| Символы | ? |
| CAS | [www.nlm.nih.gov/cgi/mesh/2006/MB_cgi?term=9001-78-9&rn=1 9001-78-9] |
| Щелочная фосфатаза | |||||||||
| Идентификаторы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Символ | Alk_phosphatase | ||||||||
| Pfam | [pfam.xfam.org/family?acc=PF00245 PF00245] | ||||||||
| InterPro | [www.ebi.ac.uk/interpro/entry/IPR001952 IPR001952] | ||||||||
| SMART | [smart.embl-heidelberg.de/smart/do_annotation.pl?DOMAIN=SM00098 SM00098] | ||||||||
| PROSITE | [www.expasy.org/cgi-bin/prosite-search-ac?PDOC00113 PDOC00113] | ||||||||
| SCOP | [scop.mrc-lmb.cam.ac.uk/scop/search.cgi?tlev=fa;&pdb=1alk 1alk] | ||||||||
| SUPERFAMILY | [supfam.org/SUPERFAMILY/cgi-bin/search.cgi?search_field=1alk 1alk] | ||||||||
| |||||||||
Щелочная фосфатаза (англ. Alkaline phosphatase, ALP, ALKP) — фермент гидролаза (КФ [www.expasy.org/cgi-bin/nicezyme.pl?3.1.3.1 3.1.3.1]), отщепляющая фосфат (дефосфорилирование) от многих типов молекул, например, нуклеотидов, белков и алкалоидов. Фермент проявляет наибольшую активность в щелочной среде. [2]
Бактерии
У бактерий щелочная фосфатаза располагается в периплазматическом пространстве, снаружи от плазматической мембраны. Щелочная фосфатаза бактерий относительно устойчива к инактивации, денатурации и деградации. Возможно, одной из функций фосфатазы является отщепление фосфатов от органических молекул, так как многие фосфорилированные соединения не могут проникать через плазматическую мембрану.
Свойства
Фермент, выделенный из E. coli, имеет оптимум рН 8.0, [3] в то время как фермент, выделенный из пульпы зуба быка, имеет оптимум рН около 8.5.[4]
Применение
Щелочная фосфатаза применяется в молекулярно-биологических исследованиях для того, чтобы отщепить фосфатные группы на 5′-конце и предотвратить лигирование этих концов. Удаление концевых фосфатов также делает возможным введение концевой радиоактивной метки. Наиболее широко используют щелочную фосфатазу из креветок, которая также наиболее легко инактивируется после отщепления фосфата.
Щелочная фосфатаза также широко используется в иммуноферментном анализе.
Ингибиторы
Все изоферменты щелочной фосфатазы млекопитающих, за исключением плацетарных (PALP и SEAP) ингибируются гомоаргинином.
Нагревание в течение 2 часов при 65 °C инактивирует большинство изоферментов, кроме плацентарных изоформ (PALP и SEAP).
Человек
Физиология
У человека щелочная фосфатаза представлена во всех тканях, особенно высокая концентрация в печени, желчном протоке, почках, костях и плаценте.
В организме человека и других млекопитающих встречаются следующие изоферменты:
- ALPI — кишечная
- ALPL — неспецифичная в тканях печени, костей и почках
- ALPP — плацентарная
Диагностика
Нормальный уровень щелочной фосфатазы от 20 до 140 МЕ/л. [5] Уровень щелочной фосфатазы повышается при закупорке желчного протока.[6] Концентрации у детей и беременных женщин значительно выше. Пониженный уровень щелочной фосфатазы встречается гораздо реже, чем повышенный. Сниженный уровень щелочной фосфатазы — основной показатель гипофосфатазии (редкого заболевания костной ткани), которое характеризуется нарушением формирования скелета, задержкой физического развития, переломами итд.
Оральные контрацептивы снижают уровень щелочной фосфатазы.[7]
См. также
Напишите отзыв о статье «Щелочная фосфатаза»
Примечания
- ↑ PDB [www.rcsb.org/pdb/explore/explore.do?structureId=1ALK 1ALK]: Kim EE, Wyckoff HW (March 1991). «Reaction mechanism of alkaline phosphatase based on crystal structures. Two-metal ion catalysis». J. Mol. Biol. 218 (2): 449–64. DOI:10.1016/0022-2836(91)90724-K. PMID 2010919.
- ↑ Tamás L, Huttová J, Mistrk I, Kogan G (2002). «[www.chempap.org/papers/565a326.pdf Effect of Carboxymethyl Chitin-Glucan on the Activity of Some Hydrolytic Enzymes in Maize Plants]».
- ↑ Garen A, Levinthal C (March 1960). «A fine-structure genetic and chemical study of the enzyme alkaline phosphatase of E. coli. I. Purification and characterization of alkaline phosphatase». Biochim. Biophys. Acta 38: 470–83. DOI:10.1016/0006-3002(60)91282-8. PMID 13826559.
- ↑ Harada M, Udagawa N, Fukasawa K, Hiraoka BY, Mogi M (February 1986). «[jdr.sagepub.com/cgi/pmidlookup?view=long&pmid=3003174 Inorganic pyrophosphatase activity of purified bovine pulp alkaline phosphatase at physiological pH]». J. Dent. Res. 65 (2): 125–7. PMID 3003174.
- ↑ [www.nlm.nih.gov/MEDLINEPLUS/ency/article/003497.htm MedlinePlus Medical Encyclopedia: ALP isoenzyme test]. [www.webcitation.org/67JeIKmni Архивировано из первоисточника 30 апреля 2012].
- ↑ [www.labtestsonline.org/understanding/analytes/alp/test.html ALP: The Test]
- ↑ Schiele F, Vincent-Viry M, Fournier B, Starck M, Siest G (November 1998). «Biological effects of eleven combined oral contraceptives on serum triglycerides, gamma-glutamyltransferase, alkaline phosphatase, bilirubin and other biochemical variables». Clin. Chem. Lab. Med. 36 (11): 871–8. DOI:10.1515/CCLM.1998.153. PMID 9877094.
- Coleman JE (1992). «[arjournals.annualreviews.org/doi/abs/10.1146/annurev.bb.21.060192.002301?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dncbi.nlm.nih.gov Structure and mechanism of alkaline phosphatase]». Annu Rev Biophys Biomol Struct 21: 441–83. DOI:10.1146/annurev.bb.21.060192.002301. PMID 1525473.
Отрывок, характеризующий Щелочная фосфатаза
В это воскресенье Ростовы, по обыкновению, поехали к обедне в домовую церковь Разумовских. Был жаркий июльский день. Уже в десять часов, когда Ростовы выходили из кареты перед церковью, в жарком воздухе, в криках разносчиков, в ярких и светлых летних платьях толпы, в запыленных листьях дерев бульвара, в звуках музыки и белых панталонах прошедшего на развод батальона, в громе мостовой и ярком блеске жаркого солнца было то летнее томление, довольство и недовольство настоящим, которое особенно резко чувствуется в ясный жаркий день в городе. В церкви Разумовских была вся знать московская, все знакомые Ростовых (в этот год, как бы ожидая чего то, очень много богатых семей, обыкновенно разъезжающихся по деревням, остались в городе). Проходя позади ливрейного лакея, раздвигавшего толпу подле матери, Наташа услыхала голос молодого человека, слишком громким шепотом говорившего о ней:– Как похудела, а все таки хороша!
Она слышала, или ей показалось, что были упомянуты имена Курагина и Болконского. Впрочем, ей всегда это казалось. Ей всегда казалось, что все, глядя на нее, только и думают о том, что с ней случилось. Страдая и замирая в душе, как всегда в толпе, Наташа шла в своем лиловом шелковом с черными кружевами платье так, как умеют ходить женщины, – тем спокойнее и величавее, чем больнее и стыднее у ней было на душе. Она знала и не ошибалась, что она хороша, но это теперь не радовало ее, как прежде. Напротив, это мучило ее больше всего в последнее время и в особенности в этот яркий, жаркий летний день в городе. «Еще воскресенье, еще неделя, – говорила она себе, вспоминая, как она была тут в то воскресенье, – и все та же жизнь без жизни, и все те же условия, в которых так легко бывало жить прежде. Хороша, молода, и я знаю, что теперь добра, прежде я была дурная, а теперь я добра, я знаю, – думала она, – а так даром, ни для кого, проходят лучшие годы». Она стала подле матери и перекинулась с близко стоявшими знакомыми. Наташа по привычке рассмотрела туалеты дам, осудила tenue [манеру держаться] и неприличный способ креститься рукой на малом пространстве одной близко стоявшей дамы, опять с досадой подумала о том, что про нее судят, что и она судит, и вдруг, услыхав звуки службы, ужаснулась своей мерзости, ужаснулась тому, что прежняя чистота опять потеряна ею.
«Научи меня, что мне делать, как мне исправиться навсегда, навсегда, как мне быть с моей жизнью… – думала она.
Дьякон вышел на амвон, выправил, широко отставив большой палец, длинные волосы из под стихаря и, положив на груди крест, громко и торжественно стал читать слова молитвы:
– «Миром господу помолимся».
«Миром, – все вместе, без различия сословий, без вражды, а соединенные братской любовью – будем молиться», – думала Наташа.
– О свышнем мире и о спасении душ наших!
«О мире ангелов и душ всех бестелесных существ, которые живут над нами», – молилась Наташа.
Когда молились за воинство, она вспомнила брата и Денисова. Когда молились за плавающих и путешествующих, она вспомнила князя Андрея и молилась за него, и молилась за то, чтобы бог простил ей то зло, которое она ему сделала. Когда молились за любящих нас, она молилась о своих домашних, об отце, матери, Соне, в первый раз теперь понимая всю свою вину перед ними и чувствуя всю силу своей любви к ним. Когда молились о ненавидящих нас, она придумала себе врагов и ненавидящих для того, чтобы молиться за них. Она причисляла к врагам кредиторов и всех тех, которые имели дело с ее отцом, и всякий раз, при мысли о врагах и ненавидящих, она вспоминала Анатоля, сделавшего ей столько зла, и хотя он не был ненавидящий, она радостно молилась за него как за врага. Только на молитве она чувствовала себя в силах ясно и спокойно вспоминать и о князе Андрее, и об Анатоле, как об людях, к которым чувства ее уничтожались в сравнении с ее чувством страха и благоговения к богу. Когда молились за царскую фамилию и за Синод, она особенно низко кланялась и крестилась, говоря себе, что, ежели она не понимает, она не может сомневаться и все таки любит правительствующий Синод и молится за него.
– «Сами себя и живот наш Христу богу предадим».
wiki-org.ru
Щелочная фосфатаза — Википедия. Что такое Щелочная фосфатаза
Материал из Википедии — свободной энциклопедии
| Щелочная фосфатаза | |
| Димер щелочной фосфатазы бактерий. Синим выделен N-конец, красным — C-конец.[1] | |
| Обозначения | |
|---|---|
| CAS | 9001-78-9 |
Щелочна́я фосфата́за (англ. Alkaline phosphatase, ALP, ALKP) — фермент гидролаза (КФ 3.1.3.1), отщепляющая фосфат (дефосфорилирующая) от многих типов молекул, например, нуклеотидов, белков и алкалоидов. Фермент проявляет наибольшую активность в щелочной среде[2].
Бактерии
У бактерий щелочная фосфатаза располагается в периплазматическом пространстве, снаружи от цитоплазматической мембраны. Щелочная фосфатаза бактерий относительно устойчива к инактивации, денатурации и деградации. Возможно, одной из функций фосфатазы является отщепление фосфатов от органических молекул, так как многие фосфорилированные соединения не могут проникать через плазматическую мембрану.
Свойства
Фермент, выделенный из бактерий Escherichia coli, имеет оптимум рН 8.0[3], в то время как фермент, выделенный из пульпы зуба быка, имеет оптимум рН около 8.5[4].
Применение
Щелочная фосфатаза применяется в молекулярно-биологических исследованиях для того, чтобы отщепить фосфатные группы на 5′-конце и предотвратить лигирование этих концов. Удаление концевых фосфатов также делает возможным введение концевой радиоактивной метки. Наиболее широко используют щелочную фосфатазу из креветок, которая также наиболее легко инактивируется после отщепления фосфата.
Щелочная фосфатаза также широко используется в иммуноферментном анализе.
Ингибиторы
Все изоферменты щелочной фосфатазы млекопитающих, за исключением плацетарных (PALP и SEAP), ингибируются гомоаргинином.
Нагревание в течение 2 часов при 65 °C инактивирует большинство изоферментов, кроме плацентарных изоформ (PALP и SEAP).
Человек
Физиология
У человека щелочная фосфатаза представлена во всех тканях, особенно высокая концентрация в печени, желчном протоке, почках, костях и плаценте.
В организме человека и других млекопитающих встречаются следующие изоферменты:
- ALPI — кишечная
- ALPL — неспецифичная в тканях печени, костей и почках
- ALPP — плацентарная
Диагностика
Нормальный уровень щелочной фосфатазы от 20 до 140 МЕ/л[5]. Уровень щелочной фосфатазы повышается при закупорке желчного протока[6]. Концентрации у детей и беременных женщин значительно выше. Пониженный уровень щелочной фосфатазы встречается гораздо реже, чем повышенный. Сниженный уровень щелочной фосфатазы — основной показатель гипофосфатазии (редкого заболевания костной ткани), которое характеризуется нарушением формирования скелета, задержкой физического развития, переломами и т. д.
Оральные контрацептивы снижают уровень щелочной фосфатазы[7].
См. также
Примечания
- ↑ PDB 1ALK: Kim EE, Wyckoff HW (March 1991). «Reaction mechanism of alkaline phosphatase based on crystal structures. Two-metal ion catalysis». J. Mol. Biol. 218 (2): 449–64. DOI:10.1016/0022-2836(91)90724-K. PMID 2010919.
- ↑ Tamás L, Huttová J, Mistrk I, Kogan G (2002). «Effect of carboxymethyl chitin-glucan on the activity of some hydrolytic enzymes in maize plants». Chem. Pap. 56 (5): 326–329.
- ↑ Garen A, Levinthal C (March 1960). «A fine-structure genetic and chemical study of the enzyme alkaline phosphatase of E. coli. I. Purification and characterization of alkaline phosphatase». Biochim. Biophys. Acta 38: 470–83. DOI:10.1016/0006-3002(60)91282-8. PMID 13826559.
- ↑ Harada M, Udagawa N, Fukasawa K, Hiraoka BY, Mogi M (February 1986). «Inorganic pyrophosphatase activity of purified bovine pulp alkaline phosphatase at physiological pH». J. Dent. Res. 65 (2): 125–7. PMID 3003174.
- ↑ MedlinePlus Medical Encyclopedia: ALP isoenzyme test. Архивировано 30 апреля 2012 года.
- ↑ ALP: The Test
- ↑ Schiele F, Vincent-Viry M, Fournier B, Starck M, Siest G (November 1998). «Biological effects of eleven combined oral contraceptives on serum triglycerides, gamma-glutamyltransferase, alkaline phosphatase, bilirubin and other biochemical variables». Clin. Chem. Lab. Med. 36 (11): 871–8. DOI:10.1515/CCLM.1998.153. PMID 9877094.
wiki.sc
Щелочная фосфатаза — Википедия
Материал из Википедии — свободной энциклопедии
| Щелочная фосфатаза | |
|---|---|
| Димер щелочной фосфатазы бактерий. Синим выделен N-конец, красным — C-конец.[1] | |
| Обозначения | |
| CAS | 9001-78-9 |
Щелочна́я фосфата́за (англ. Alkaline phosphatase, ALP, ALKP) — фермент гидролаза (КФ 3.1.3.1), отщепляющая фосфат (дефосфорилирующая) от многих типов молекул, например, нуклеотидов, белков и алкалоидов. Фермент проявляет наибольшую активность в щелочной среде[2].
У бактерий щелочная фосфатаза располагается в периплазматическом пространстве, снаружи от цитоплазматической мембраны. Щелочная фосфатаза бактерий относительно устойчива к инактивации, денатурации и деградации. Возможно, одной из функций фосфатазы является отщепление фосфатов от органических молекул, так как многие фосфорилированные соединения не могут проникать через плазматическую мембрану.
Фермент, выделенный из бактерий Escherichia coli, имеет оптимум рН 8.0[3], в то время как фермент, выделенный из пульпы зуба быка, имеет оптимум рН около 8.5[4].
Щелочная фосфатаза применяется в молекулярно-биологических исследованиях для того, чтобы отщепить фосфатные группы на 5′-конце и предотвратить лигирование этих концов. Удаление концевых фосфатов также делает возможным введение концевой радиоактивной метки. Наиболее широко используют щелочную фосфатазу из креветок, которая также наиболее легко инактивируется после отщепления фосфата.
Щелочная фосфатаза также широко используется в иммуноферментном анализе.
Все изоферменты щелочной фосфатазы млекопитающих, за исключением плацетарных (PALP и SEAP), ингибируются гомоаргинином.
Нагревание в течение 2 часов при 65 °C инактивирует большинство изоферментов, кроме плацентарных изоформ (PALP и SEAP).
Физиология[править | править код]
У человека щелочная фосфатаза представлена во всех тканях, особенно высокая концентрация в печени, желчном протоке, почках, костях и плаценте.
В организме человека и других млекопитающих встречаются следующие изоферменты:
- ALPI — кишечная
- ALPL — неспецифичная в тканях печени, костей и почках
- ALPP — плацентарная
Диагностика[править | править код]
Нормальный уровень щелочной фосфатазы от 20 до 140 МЕ/л[5]. Уровень щелочной фосфатазы повышается при закупорке желчного протока[6]. Концентрации у детей и беременных женщин значительно выше. Пониженный уровень щелочной фосфатазы встречается гораздо реже, чем повышенный. Сниженный уровень щелочной фосфатазы — основной показатель гипофосфатазии (редкого заболевания костной ткани), которое характеризуется нарушением формирования скелета, задержкой физического развития, переломами и т. д.
Оральные контрацептивы снижают уровень щелочной фосфатазы[7].
- ↑ PDB 1ALK: Kim EE, Wyckoff HW (March 1991). “Reaction mechanism of alkaline phosphatase based on crystal structures. Two-metal ion catalysis”. J. Mol. Biol. 218 (2): 449—64. DOI:10.1016/0022-2836(91)90724-K. PMID 2010919.
- ↑ Tamás L, Huttová J, Mistrk I, Kogan G (2002). “Effect of carboxymethyl chitin-glucan on the activity of some hydrolytic enzymes in maize plants” (PDF). Chem. Pap. 56 (5): 326—329.
- ↑ Garen A, Levinthal C (March 1960). “A fine-structure genetic and chemical study of the enzyme alkaline phosphatase of E. coli. I. Purification and characterization of alkaline phosphatase”. Biochim. Biophys. Acta. 38: 470—83. DOI:10.1016/0006-3002(60)91282-8. PMID 13826559.
- ↑ Harada M, Udagawa N, Fukasawa K, Hiraoka BY, Mogi M (February 1986). “Inorganic pyrophosphatase activity of purified bovine pulp alkaline phosphatase at physiological pH”. J. Dent. Res. 65 (2): 125—7. PMID 3003174.
- ↑ MedlinePlus Medical Encyclopedia: ALP isoenzyme test. Архивировано 30 апреля 2012 года.
- ↑ ALP: The Test
- ↑ Schiele F, Vincent-Viry M, Fournier B, Starck M, Siest G (November 1998). “Biological effects of eleven combined oral contraceptives on serum triglycerides, gamma-glutamyltransferase, alkaline phosphatase, bilirubin and other biochemical variables”. Clin. Chem. Lab. Med. 36 (11): 871—8. DOI:10.1515/CCLM.1998.153. PMID 9877094.
ru.wikiyy.com
Щелочная фосфатаза — Википедия. Что такое Щелочная фосфатаза
Статья из Википедии — свободной энциклопедии
| Щелочная фосфатаза | |
|---|---|
| Димер щелочной фосфатазы бактерий. Синим выделен N-конец, красным — C-конец.[1] | |
| Обозначения | |
| CAS | 9001-78-9 |
Щелочна́я фосфата́за (англ. Alkaline phosphatase, ALP, ALKP) — фермент гидролаза (КФ 3.1.3.1), отщепляющая фосфат (дефосфорилирующая) от многих типов молекул, например, нуклеотидов, белков и алкалоидов. Фермент проявляет наибольшую активность в щелочной среде[2].
Бактерии
У бактерий щелочная фосфатаза располагается в периплазматическом пространстве, снаружи от цитоплазматической мембраны. Щелочная фосфатаза бактерий относительно устойчива к инактивации, денатурации и деградации. Возможно, одной из функций фосфатазы является отщепление фосфатов от органических молекул, так как многие фосфорилированные соединения не могут проникать через плазматическую мембрану.
Свойства
Фермент, выделенный из бактерий Escherichia coli, имеет оптимум рН 8.0[3], в то время как фермент, выделенный из пульпы зуба быка, имеет оптимум рН около 8.5[4].
Применение
Щелочная фосфатаза применяется в молекулярно-биологических исследованиях для того, чтобы отщепить фосфатные группы на 5′-конце и предотвратить лигирование этих концов. Удаление концевых фосфатов также делает возможным введение концевой радиоактивной метки. Наиболее широко используют щелочную фосфатазу из креветок, которая также наиболее легко инактивируется после отщепления фосфата.
Щелочная фосфатаза также широко используется в иммуноферментном анализе.
Ингибиторы
Все изоферменты щелочной фосфатазы млекопитающих, за исключением плацетарных (PALP и SEAP), ингибируются гомоаргинином.
Нагревание в течение 2 часов при 65 °C инактивирует большинство изоферментов, кроме плацентарных изоформ (PALP и SEAP).
Человек
Физиология
У человека щелочная фосфатаза представлена во всех тканях, особенно высокая концентрация в печени, желчном протоке, почках, костях и плаценте.
В организме человека и других млекопитающих встречаются следующие изоферменты:
- ALPI — кишечная
- ALPL — неспецифичная в тканях печени, костей и почках
- ALPP — плацентарная
Диагностика
Нормальный уровень щелочной фосфатазы от 20 до 140 МЕ/л[5]. Уровень щелочной фосфатазы повышается при закупорке желчного протока[6]. Концентрации у детей и беременных женщин значительно выше. Пониженный уровень щелочной фосфатазы встречается гораздо реже, чем повышенный. Сниженный уровень щелочной фосфатазы — основной показатель гипофосфатазии (редкого заболевания костной ткани), которое характеризуется нарушением формирования скелета, задержкой физического развития, переломами и т. д.
Оральные контрацептивы снижают уровень щелочной фосфатазы[7].
См. также
Примечания
- ↑ PDB 1ALK: Kim EE, Wyckoff HW (March 1991). «Reaction mechanism of alkaline phosphatase based on crystal structures. Two-metal ion catalysis». J. Mol. Biol. 218 (2): 449–64. doi:10.1016/0022-2836(91)90724-K. PMID 2010919.
- ↑ Tamás L, Huttová J, Mistrk I, Kogan G (2002). «Effect of carboxymethyl chitin-glucan on the activity of some hydrolytic enzymes in maize plants» (PDF). Chem. Pap. 56 (5): 326–329.
- ↑ Garen A, Levinthal C (March 1960). «A fine-structure genetic and chemical study of the enzyme alkaline phosphatase of E. coli. I. Purification and characterization of alkaline phosphatase». Biochim. Biophys. Acta. 38: 470–83. doi:10.1016/0006-3002(60)91282-8. PMID 13826559.
- ↑ Harada M, Udagawa N, Fukasawa K, Hiraoka BY, Mogi M (February 1986). «Inorganic pyrophosphatase activity of purified bovine pulp alkaline phosphatase at physiological pH». J. Dent. Res. 65 (2): 125–7. PMID 3003174.
- ↑ MedlinePlus Medical Encyclopedia: ALP isoenzyme test. Архивировано 30 апреля 2012 года.
- ↑ ALP: The Test
- ↑ Schiele F, Vincent-Viry M, Fournier B, Starck M, Siest G (November 1998). «Biological effects of eleven combined oral contraceptives on serum triglycerides, gamma-glutamyltransferase, alkaline phosphatase, bilirubin and other biochemical variables». Clin. Chem. Lab. Med. 36 (11): 871–8. doi:10.1515/CCLM.1998.153. PMID 9877094.
monateka.com
Щелочная фосфатаза, кишечная — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
| Кишечная щелочная фосфатаза | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||
| Символ | [www.genenames.org/cgi-bin/gene_symbol_report?hgnc_id=437 ALPI] ; IAP | ||||||||||||
| Внешние ID | OMIM: [omim.org/entry/171740 171740 ] MGI: [www.informatics.jax.org/searches/accession_report.cgi?id=MGI:1924018 1924018 ] HomoloGene: [www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=homologene&dopt=HomoloGene&list_uids=122572 122572 ] ChEMBL: [www.ebi.ac.uk/chembldb/index.php/target/inspect/CHEMBL5573 5573] GeneCards: [www.genecards.org/cgi-bin/carddisp.pl?id_type=entrezgene&id=248 ALPI Gene] | ||||||||||||
| номер EC | [www.genome.jp/dbget-bin/www_bget?enzyme+3.1.3.1 3.1.3.1] | ||||||||||||
| |||||||||||||
| Ортологи | |||||||||||||
| Вид | Человек | Мышь | |||||||||||
| Entrez | [www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=gene&cmd=retrieve&dopt=default&list_uids=248&rn=1 248] | [www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=gene&cmd=retrieve&dopt=default&list_uids=11648&rn=1 11648] | |||||||||||
| Ensembl | [www.ensembl.org/Homo_sapiens/geneview?gene=ENSG00000163295;db=core ENSG00000163295] | [www.ensembl.org/Mus_musculus/geneview?gene=ENSMUSG00000036500;db=core ENSMUSG00000036500] | |||||||||||
| UniProt | [www.expasy.org/uniprot/P09923 P09923] | [www.expasy.org/uniprot/Q0VD75 Q0VD75] | |||||||||||
| RefSeq (мРНК) | [www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?val=NM_001631 NM_001631] | [www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?val=NM_007432 NM_007432] | |||||||||||
| RefSeq (белок) | [www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?val=NP_001622 NP_001622] | [www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?val=NP_031458 NP_031458] | |||||||||||
| Локус (UCSC) | [genome.ucsc.edu/cgi-bin/hgTracks?org=Human&db=hg19&position=chr2:233320833-233324742 Chr 2: 233.32 – 233.32 Mb] | [genome.ucsc.edu/cgi-bin/hgTracks?org=Mouse&db=mm9&position=chr1:87125008-87127912 Chr 1: 87.13 – 87.13 Mb] | |||||||||||
| Поиск в PubMed | [www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=Link&LinkName=gene_pubmed&from_uid=248] | [www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=Link&LinkName=gene_pubmed&from_uid=11648] | |||||||||||
Кишечная щелочная фосфатаза — фермент человека, кодируемый геном ALPI (англ. Alkaline phosphatase, intestinal) на 2-й хромосоме. Принадлежит к группе щелочных фосфатаз.
Строение
Ген ALPI состоит из 11-ти экзонов, причём позиции интронов совпадают с таковыми у других двух щелочных фосфатаз человека, что говорит об их общем происхождении от одного гена-предка.[1] На белковом уровне кишечная форма фермента на 86,5 % аналогична плацентарной ЩФ (ALPP) и на 56,6 % — щелочной фосфатазе печени\кости\почек (ALPL).[2]
Функция
Функция кишечной ЩФ изучена слабо. Считается, что при диете с высоким содержанием жиров общий уровень циркулирующей ЩФ повышается за счёт именно этой формы фермента.
В исследовании 2008 года показано, что кишечная ЩФ обладает способностью детоксифицировать липополисахариды и защищать организм от вторжения бактерий через слизистый барьер кишечника.[3] Авторы исследования предположили, что снижение производства кишечной ЩФ при голодании организма является одним из ключевых факторов дисфункции слизистого барьера, наблюдаемой у критически больных пациентов.
Смотри также
- ALPL — печёночная/костная/почечная (неспецифическая) щелочная фосфатаза
- ALPP — плацентарная щелочная фосфатаза
Напишите отзыв о статье «Щелочная фосфатаза, кишечная»
Примечания
- ↑ Henthorn PS, Raducha M, Kadesch T, Weiss MJ, Harris H (August 1988). «[www.jbc.org/cgi/pmidlookup?view=long&pmid=2841341 Sequence and characterization of the human intestinal alkaline phosphatase gene]». J. Biol. Chem. 263 (24): 12011–9. PMID 2841341.
- ↑ Henthorn PS, Raducha M, Edwards YH, Weiss MJ, Slaughter C, Lafferty MA, Harris H (March 1987). «Nucleotide and amino acid sequences of human intestinal alkaline phosphatase: close homology to placental alkaline phosphatase». Proc. Natl. Acad. Sci. U.S.A. 84 (5): 1234–8. PMID 3469665.
- ↑ Goldberg RF, Austen WG, Zhang X, Munene G, Mostafa G, Biswas S, McCormack M, Eberlin KR, Nguyen JT, Tatlidede HS, Warren HS, Narisawa S, Millán JL, Hodin RA (March 2008). «[www.pnas.org/cgi/pmidlookup?view=long&pmid=18292227 Intestinal alkaline phosphatase is a gut mucosal defense factor maintained by enteral nutrition]». Proc. Natl. Acad. Sci. U.S.A. 105 (9): 3551–6. DOI:10.1073/pnas.0712140105. PMID 18292227.
Отрывок, характеризующий Щелочная фосфатаза, кишечная
В покинутой корчме, перед которою стояла кибиточка доктора, уже было человек пять офицеров. Марья Генриховна, полная белокурая немочка в кофточке и ночном чепчике, сидела в переднем углу на широкой лавке. Муж ее, доктор, спал позади ее. Ростов с Ильиным, встреченные веселыми восклицаниями и хохотом, вошли в комнату.– И! да у вас какое веселье, – смеясь, сказал Ростов.
– А вы что зеваете?
– Хороши! Так и течет с них! Гостиную нашу не замочите.
– Марьи Генриховны платье не запачкать, – отвечали голоса.
Ростов с Ильиным поспешили найти уголок, где бы они, не нарушая скромности Марьи Генриховны, могли бы переменить мокрое платье. Они пошли было за перегородку, чтобы переодеться; но в маленьком чуланчике, наполняя его весь, с одной свечкой на пустом ящике, сидели три офицера, играя в карты, и ни за что не хотели уступить свое место. Марья Генриховна уступила на время свою юбку, чтобы употребить ее вместо занавески, и за этой занавеской Ростов и Ильин с помощью Лаврушки, принесшего вьюки, сняли мокрое и надели сухое платье.
В разломанной печке разложили огонь. Достали доску и, утвердив ее на двух седлах, покрыли попоной, достали самоварчик, погребец и полбутылки рому, и, попросив Марью Генриховну быть хозяйкой, все столпились около нее. Кто предлагал ей чистый носовой платок, чтобы обтирать прелестные ручки, кто под ножки подкладывал ей венгерку, чтобы не было сыро, кто плащом занавешивал окно, чтобы не дуло, кто обмахивал мух с лица ее мужа, чтобы он не проснулся.
– Оставьте его, – говорила Марья Генриховна, робко и счастливо улыбаясь, – он и так спит хорошо после бессонной ночи.
– Нельзя, Марья Генриховна, – отвечал офицер, – надо доктору прислужиться. Все, может быть, и он меня пожалеет, когда ногу или руку резать станет.
Стаканов было только три; вода была такая грязная, что нельзя было решить, когда крепок или некрепок чай, и в самоваре воды было только на шесть стаканов, но тем приятнее было по очереди и старшинству получить свой стакан из пухлых с короткими, не совсем чистыми, ногтями ручек Марьи Генриховны. Все офицеры, казалось, действительно были в этот вечер влюблены в Марью Генриховну. Даже те офицеры, которые играли за перегородкой в карты, скоро бросили игру и перешли к самовару, подчиняясь общему настроению ухаживанья за Марьей Генриховной. Марья Генриховна, видя себя окруженной такой блестящей и учтивой молодежью, сияла счастьем, как ни старалась она скрывать этого и как ни очевидно робела при каждом сонном движении спавшего за ней мужа.
Ложка была только одна, сахару было больше всего, но размешивать его не успевали, и потому было решено, что она будет поочередно мешать сахар каждому. Ростов, получив свой стакан и подлив в него рому, попросил Марью Генриховну размешать.
wiki-org.ru
Щелочная фосфатаза Википедия
| Щелочная фосфатаза | |
|---|---|
| Димер щелочной фосфатазы бактерий. Синим выделен N-конец, красным — C-конец.[1] | |
| Обозначения | |
| CAS | 9001-78-9 |
Щелочна́я фосфата́за (англ. Alkaline phosphatase, ALP, ALKP) — фермент гидролаза (КФ 3.1.3.1), отщепляющая фосфат (дефосфорилирующая) от многих типов молекул, например, нуклеотидов, белков и алкалоидов. Фермент проявляет наибольшую активность в щелочной среде[2].
Бактерии
У бактерий щелочная фосфатаза располагается в периплазматическом пространстве, снаружи от цитоплазматической мембраны. Щелочная фосфатаза бактерий относительно устойчива к инактивации, денатурации и деградации. Возможно, одной из функций фосфатазы является отщепление фосфатов от органических молекул, так как многие фосфорилированные соединения не могут проникать через плазматическую мембрану.
Свойства
Фермент, выделенный из бактерий Escherichia coli, имеет оптимум рН 8.0[3], в то время как фермент, выделенный из пульпы зуба быка, имеет оптимум рН около 8.5[4].
Применение
Щелочная фосфатаза применяется в молекулярно-биологических исследованиях для того, чтобы отщепить фосфатные группы на 5′-конце и предотвратить лигирование этих концов. Удаление концевых фосфатов также делает возможным введение концевой радиоактивной метки. Наиболее широко используют щелочную фосфатазу из креветок, которая также наиболее легко инактивируется после отщепления фосфата.
Щелочная фосфатаза также широко используется в иммуноферментном анализе.
Ингибиторы
Все изоферменты щелочной фосфатазы млекопитающих, за исключением плацетарных (PALP и SEAP), ингибируются гомоаргинином.
Нагревание в течение 2 часов при 65 °C инактивирует большинство изоферментов, кроме плацентарных изоформ (PALP и SEAP).
Человек
Физиология
У человека щелочная фосфатаза представлена во всех тканях, особенно высокая концентрация в печени, желчном протоке, почках, костях и плаценте.
В организме человека и других млекопитающих встречаются следующие изоферменты:
- ALPI — кишечная
- ALPL — неспецифичная в тканях печени, костей и почках
- ALPP — плацентарная
Диагностика
Нормальный уровень щелочной фосфатазы от 20 до 140 МЕ/л[5]. Уровень щелочной фосфатазы повышается при закупорке желчного протока[6]. Концентрации у детей и беременных женщин значительно выше. Пониженный уровень щелочной фосфатазы встречается гораздо реже, чем повышенный. Сниженный уровень щелочной фосфатазы — основной показатель гипофосфатазии (редкого заболевания костной ткани), которое характеризуется нарушением формирования скелета, задержкой физического развития, переломами и т. д.
Оральные контрацептивы снижают уровень щелочной фосфатазы[7].
См. также
Примечания
- ↑ PDB 1ALK: Kim EE, Wyckoff HW (March 1991). “Reaction mechanism of alkaline phosphatase based on crystal structures. Two-metal ion catalysis”. J. Mol. Biol. 218 (2): 449—64. DOI:10.1016/0022-2836(91)90724-K. PMID 2010919.
- ↑ Tamás L, Huttová J, Mistrk I, Kogan G (2002). “Effect of carboxymethyl chitin-glucan on the activity of some hydrolytic enzymes in maize plants” (PDF). Chem. Pap. 56 (5): 326—329.
- ↑ Garen A, Levinthal C (March 1960). “A fine-structure genetic and chemical study of the enzyme alkaline phosphatase of E. coli. I. Purification and characterization of alkaline phosphatase”. Biochim. Biophys. Acta. 38: 470—83. DOI:10.1016/0006-3002(60)91282-8. PMID 13826559.
- ↑ Harada M, Udagawa N, Fukasawa K, Hiraoka BY, Mogi M (February 1986). “Inorganic pyrophosphatase activity of purified bovine pulp alkaline phosphatase at physiological pH”. J. Dent. Res. 65 (2): 125—7. PMID 3003174.
- ↑ MedlinePlus Medical Encyclopedia: ALP isoenzyme test. Архивировано 30 апреля 2012 года.
- ↑ ALP: The Test
- ↑ Schiele F, Vincent-Viry M, Fournier B, Starck M, Siest G (November 1998). “Biological effects of eleven combined oral contraceptives on serum triglycerides, gamma-glutamyltransferase, alkaline phosphatase, bilirubin and other biochemical variables”. Clin. Chem. Lab. Med. 36 (11): 871—8. DOI:10.1515/CCLM.1998.153. PMID 9877094.
wikiredia.ru
Щелочная фосфатаза — Википедия
Материал из Википедии — свободной энциклопедии
| Щелочная фосфатаза | |
|---|---|
| Димер щелочной фосфатазы бактерий. Синим выделен N-конец, красным — C-конец.[1] | |
| Обозначения | |
| CAS | 9001-78-9 |
Щелочна́я фосфата́за (англ. Alkaline phosphatase, ALP, ALKP) — фермент гидролаза (КФ 3.1.3.1), отщепляющая фосфат (дефосфорилирующая) от многих типов молекул, например, нуклеотидов, белков и алкалоидов. Фермент проявляет наибольшую активность в щелочной среде[2].
Бактерии
У бактерий щелочная фосфатаза располагается в периплазматическом пространстве, снаружи от цитоплазматической мембраны. Щелочная фосфатаза бактерий относительно устойчива к инактивации, денатурации и деградации. Возможно, одной из функций фосфатазы является отщепление фосфатов от органических молекул, так как многие фосфорилированные соединения не могут проникать через плазматическую мембрану.
Видео по теме
Свойства
Фермент, выделенный из бактерий Escherichia coli, имеет оптимум рН 8.0[3], в то время как фермент, выделенный из пульпы зуба быка, имеет оптимум рН около 8.5[4].
Применение
Щелочная фосфатаза применяется в молекулярно-биологических исследованиях для того, чтобы отщепить фосфатные группы на 5′-конце и предотвратить лигирование этих концов. Удаление концевых фосфатов также делает возможным введение концевой радиоактивной метки. Наиболее широко используют щелочную фосфатазу из креветок, которая также наиболее легко инактивируется после отщепления фосфата.
Щелочная фосфатаза также широко используется в иммуноферментном анализе.
Ингибиторы
Все изоферменты щелочной фосфатазы млекопитающих, за исключением плацетарных (PALP и SEAP), ингибируются гомоаргинином.
Нагревание в течение 2 часов при 65 °C инактивирует большинство изоферментов, кроме плацентарных изоформ (PALP и SEAP).
Человек
Физиология
У человека щелочная фосфатаза представлена во всех тканях, особенно высокая концентрация в печени, желчном протоке, почках, костях и плаценте.
В организме человека и других млекопитающих встречаются следующие изоферменты:
- ALPI — кишечная
- ALPL — неспецифичная в тканях печени, костей и почках
- ALPP — плацентарная
Диагностика
Нормальный уровень щелочной фосфатазы от 20 до 140 МЕ/л[5]. Уровень щелочной фосфатазы повышается при закупорке желчного протока[6]. Концентрации у детей и беременных женщин значительно выше. Пониженный уровень щелочной фосфатазы встречается гораздо реже, чем повышенный. Сниженный уровень щелочной фосфатазы — основной показатель гипофосфатазии (редкого заболевания костной ткани), которое характеризуется нарушением формирования скелета, задержкой физического развития, переломами и т. д.
Оральные контрацептивы снижают уровень щелочной фосфатазы[7].
См. также
Примечания
- ↑ PDB 1ALK: Kim EE, Wyckoff HW (March 1991). «Reaction mechanism of alkaline phosphatase based on crystal structures. Two-metal ion catalysis». J. Mol. Biol. 218 (2): 449–64. doi:10.1016/0022-2836(91)90724-K. PMID 2010919.
- ↑ Tamás L, Huttová J, Mistrk I, Kogan G (2002). «Effect of carboxymethyl chitin-glucan on the activity of some hydrolytic enzymes in maize plants» (PDF). Chem. Pap. 56 (5): 326–329.
- ↑ Garen A, Levinthal C (March 1960). «A fine-structure genetic and chemical study of the enzyme alkaline phosphatase of E. coli. I. Purification and characterization of alkaline phosphatase». Biochim. Biophys. Acta. 38: 470–83. doi:10.1016/0006-3002(60)91282-8. PMID 13826559.
- ↑ Harada M, Udagawa N, Fukasawa K, Hiraoka BY, Mogi M (February 1986). «Inorganic pyrophosphatase activity of purified bovine pulp alkaline phosphatase at physiological pH». J. Dent. Res. 65 (2): 125–7. PMID 3003174.
- ↑ MedlinePlus Medical Encyclopedia: ALP isoenzyme test. Архивировано 30 апреля 2012 года.
- ↑ ALP: The Test
- ↑ Schiele F, Vincent-Viry M, Fournier B, Starck M, Siest G (November 1998). «Biological effects of eleven combined oral contraceptives on serum triglycerides, gamma-glutamyltransferase, alkaline phosphatase, bilirubin and other biochemical variables». Clin. Chem. Lab. Med. 36 (11): 871–8. doi:10.1515/CCLM.1998.153. PMID 9877094.
wiki2.red