Амилоид — это… Что такое Амилоид?
АМИЛОИД — 1) вещество, похожее на крахмал; 2) в медиц. белковое вещество при жировом перерождении почек, печени, селезенки. Полный словарь иностранных слов, вошедших в употребление в русском языке. Попов М., 1907. амилоид (гр. amylon крахмал + eidos вид)… … Словарь иностранных слов русского языка
амилоид — сущ., кол во синонимов: 1 • полисахарид (36) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
АМИЛОИД — АМИЛОИД, см.Амилоидное перерождение … Большая медицинская энциклопедия
Амилоид — * амілоід * аmyloid белок, который имеет бета структуру и вне клеток образует агрегаты (см. ) … Генетика. Энциклопедический словарь
амилоид — (amyloidum; амил + греч. eidos вид) комплекс глобулинов и полисахаридов, являющийся продуктом нарушенного белкового обмена; откладывается в стенках сосудов, а также в строме и (или) оболочке различных органов … Большой медицинский словарь
Амилоид — (от греч. ámylon kpaxmaл и éidos вид) 1) у растений углевод того же состава, что гемицеллюлоза (См. Гемицеллюлозы), или запасная клетчатка, откладывающийся в утолщённых клеточных оболочках семян, а иногда в растущих вегетативных органах… … Большая советская энциклопедия
амилоид — амилоид, амилоиды, амилоида, амилоидов, амилоиду, амилоидам, амилоид, амилоиды, амилоидом, амилоидами, амилоиде, амилоидах (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов
Амилоид — Амилоид (химия) вещество, близкое по свойствам к крахмалу, полисахарид, образующийся при неполном гидролизе целлюлозы. Амилоид (биология) гликопротеин, при избыточном накоплении в тканях приводит к болезни амилоидозу. См. также Болезнь Альцгейме … Википедия
амилоид — амил оид, а … Русский орфографический словарь
АМИЛОИД — синеющее от йода вещество, близкое к крахмалу, находящееся в клетках некоторых грибов, лишайников, а также в семенах некоторых высших растений. Иногда А. называют “грибным крахмалом” … Словарь ботанических терминов
dic.academic.ru
Амилоидоз — Неврология
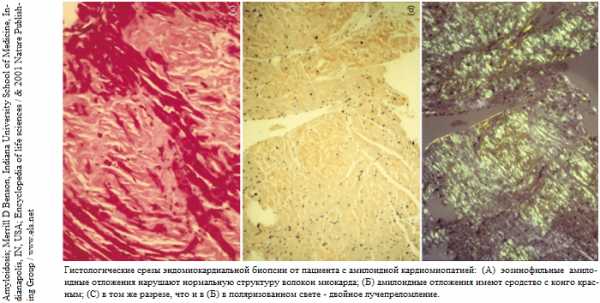
Амилоидоз (амилоидная дистрофия, лат. amyloidosis, греч. amylon крахмал + eidos вид + ōsis) – группа заболеваний, которые отличаются большим разнообразием клинических проявлений и характеризуются внеклеточным (во внеклеточном матриксе) отложением (системным или локальным) нерастворимых патологических фибриллярных белков (белково-полисахаридного комплекса – амилоида) в органах и тканях, которые образуются в результате сложных обменных изменений (белковых дистрофий). Основными органами-мишенями являются сердце, почки, нервная система [центральная и периферическая], печень, однако при системных формах могут поражаться практически все ткани (к редким локализациям относят амилоидоз надпочечников). Амилоидами их назвали потому что, в реакции с йодом они напоминали крахмал. Амилоид долгое время персистирует в организме и даже после смерти в течение долгого времени не подвергается гниению (И.В. Давыдовский, 1967). Амилоидоз может возникнуть самостоятельно или «вторично» в результате другого заболевания.В настоящее время амилоидоз рассматривают как группу заболеваний, которые характеризуются отложением в тканях и органах фибриллярного белка амилоида (ФБА) — особой белковой структуры диаметром 5 — 10 нм и длиной до 800 нм, состоящей из 2 и более параллельных разнонаправленных (антипараллельных) филаментов, образующих кросс-β-складчатую конформацию (см. рис. слева). Именно она определяет специфическое оптическое свойство амилоида – способность к двойному лучепреломлению (выявляемого при окраске конго красным [= метод определения амилоида в тканях]). По современным данным распространённость амилоидоза в популяции колеблется от 0,1 до 6,6%.
Название белка «амилоид» было предложено Рудольфом Вирховым, который позаимствовал его из ботаники, где это слово означало целлюлозу или крахмал. По своей структуре амилоид является сложным гликопротеидом, в котором в структуре с полисахаридами (галактозой, глюкозой, глюкозамином, галактозаминами, маннозой и фруктозой) находятся фибриллярные и глобулярные белки. В амилоиде содержатся белки, близкие по своим особенностям к α1-, β- и γ-глобулинам, альбумину, фибриногену, в нём содержится нейраминовая кислота. Связи белков и полисахаридов очень прочные, что сохраняет его стабильность. В структуре амилоида также находится Р-компонент, составляющий до 15% всего амилоида и идентичный сывороточному белку SAP (сывороточный амилоид P). SAP является белком, продуцируемым клетками печени, относящимся к категории острофазовых (SAP — постоянная составная часть амилоидных депозитов при всех формах амилоидоза).
Амилоидоз полиэтиологичен. Основное значение придают амилоидогенности основного белка-предшественника амилоида (БПА), специфичного для каждой формы амилоидоза. Амилоидогенность определяется изменениями в первичной структуре БПА, закрепленными в генетическом коде или приобретенными в течение жизни вследствие мутаций. Для реализации амилоидогенного потенциала БПА необходимо воздействие ряда факторов, таких как воспаление, возраст, физико-химические условия in situ.
ТАБЛИЦА: Классификация амилоидоза (во всех названиях типов амилоидоза первой буквой является прописная буква «А», означающая слово «амилоид», за ней следует обозначение конкретного БПА — А [амилоидный А-протеин; образуется из сывороточного белка-предшественника SAA — острофазового белка, в норме синтезируемого гепатоцитами, нейтрофилами и фибробластами в следовых количествах], L [легкие цепи иммуноглобулинов], TTR [транстиретин], 2М [β2-микро-глобулин], В [В-протеин], IAPP [островковый амилоидный полипептид] и т.д.).

Обратите внимание! Структурные и химико-физические особенности амилоида определяются основным БПА, содержание которого в фибрилле достигает 80% и является специфичным признаком для каждого типа амилоидоза. У каждого белка (БПА) существенно отличаются механизмы синтеза, утилизации, биологические функции, что определяет различия в клинических проявлениях и подходах к лечению амилоидоза. По этой причине разные формы амилоидоза рассматривают как разные заболевания (см. таблицу ↑).
Несмотря на достигнутый прогресс в изучении амилоида разных типов, конечный этап амилоидогенеза — образование фибрилл амилоида в межклеточном матриксе из БПА — остается во многом невыясненным. По-видимому, это многофакторный процесс, имеющий свои особые черты при разных формах амилоидоза. Рассмотрим процесс амилоидогенеза на примере АА-амилоидоза. Считают, что при образовании АА из SAA имеют значение процесс неполного расщепления SAA протеазами, связанными с поверхностной мембраной моноцитов-макрофагов, и полимеризация растворимого АА-белка в фибриллы, происходящая, как предполагают, также при участии мембранных ферментов. Интенсивность образования АА-амилоида в тканях зависит от концентрации SAA в крови. Количество SAA, синтезируемого клетками разных типов (гепатоцитами, нейтрофилами, фибробластами), повышается во много раз при воспалительных процессах, опухолях (повышение содержания SAA в крови играет основную роль в патогенезе АА-амилоидоза). Однако для развития амилоидоза недостаточно только высокой концентрации SAA, необходимо также наличие у БПА (т.е. у SAA) амилоидогенности. Развитие амилоидоза у человека связывают с депозицией SAA1. В настоящее время известно 5 изотипов SAA1, из которых наибольшую амилоидогенность приписывают изотипам 1.1 и 1.5. Конечный этап амилоидогенеза — образование фибрилл амилоида из БПА — осуществляется при неполном расщеплении протеазами моноцитов-макрофагов. Стабилизация амилоидной фибриллы и резкое снижение растворимости этого макромолекулярного комплекса во многом обусловлены взаимодействием с полисахаридами интерстиция.
Несмотря на различие в типах амилоидного белка, существует общность патогенеза различных клинических форм амилоидоза. Основной причиной развития болезни служит наличие определенного, нередко повышенного количества амилоидогенного БПА. Появление или усиление амилоидогенности может быть обусловлено циркуляцией вариантов белков с повышенной общей гидрофобностью молекулы, нарушенным соотношением поверхностных молекулярных зарядов, что приводит к нестабильности белковой молекулы и способствует ее агрегации в амилоидную фибриллу. На последнем этапе амилоидогенеза происходит взаимодействие амилоидного белка с белками плазмы крови и гликозоаминогликанами тканей. Кроме структурных особенностей, имеют значение также физико-химические свойства межклеточного матрикса, где происходит сборка амилоидной фибриллы. Многие формы амилоидоза можно объединить также по признаку возникновения в пожилом и старческом возрасте (AL, ATTR, AIAPP, AApoA1, AFib, ALys, AANF, A-бета), что указывает на наличие механизмов возрастной эволюции структуры определенных белков в сторону повышения амилоидогенности и позволяет рассматривать амилоидоз как одну из моделей старения организма.
Неврологические аспекты амилоидоза:
читать статью: Парапротеины и их клиническое значение в неврологии (на laesus-de-liro.livejournal.com) [читать]
ATTR-амилоидоз. К ATTR-амилоидозу относят семейную амилоидную полиневропатию, которая наследуется по аутосомно-доминантному типу, и системный старческий амилоидоз. Белком-предшественником при этой форме амилоидоза является транстиретин — компонент молекулы преальбумина, синтезируемый печенью и выполняющий функции транспортного белка тироксина. Установлено, что наследственный ATTR-амилоидоз бывает результатом мутации в гене, кодирующем транстиретин, что приводит к замене аминокислот в молекуле TTR. Существует несколько типов наследственной амилоидной нейропатии: португальский, шведский, японский и ряд других. При наиболее частом семейном варианте (португальском) в 30-й позиции от N-конца молекулы транстиретина метионин заменён на валин, что повышает амилоидогенность белка-предшественника и облегчает его полимеризацию в амилоидные фибриллы. Известно несколько вариантных транстиретинов, чем и обусловлено разнообразие клинических форм наследственной невропатии. Клинически это заболевание характеризуется прогрессирующей периферической и вегетативной невропатией, которая сочетается с поражением сердца, почек и других органов различной степени. Системный старческий амилоидоз развивается после 70 лет в результате возрастных конформационных изменений нормального транстиретина, по-видимому, усиливающих его амилоидогенность. Органы-мишени старческого амилоидоза — сердце, сосуды головного мозга и аорта.
читайте также пост: Транстиретиновая амилоидная полинейропатия (на laesus-de-liro.livejournal.com) [читать]
читайте также статью «Поражение периферической нервной системы при системном амилоидозе» Сафиулина Э.И., Зиновьева О.Е., Рамеев В.В., Козловская-Лысенко Л.В.; ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» МЗ РФ, Москва (журнал «Неврология, нейропсихиатрия, психосоматика» №3, 2018) [читать]
Болезнь Альцгеймера (БА) — это генетически детерминированное прогрессирующее нейродегенеративное заболевание, в основе которого лежит гибель нейронов больших полушарий головного мозга; клиническими проявлениями заболевания являются снижение памяти и других когнитивных функций (интеллект, праксис, гнозис, речь). На данный момент выявлено 4 основных гена, отвечающих за развитие данного заболевания: ген, кодирующий предшественник амилоидного белка (amyloid precursor protein, APP, 21-я хромосома), гены, кодирующие ферменты [альфа-, бета-, гамма-секретазы], метаболизирующие АРР: пресенилин-1 (14-я хромосома), пресенилин-2 (1-я хромосома). Особая роль отводится гетеро- или гомозиготному носительству четвертой изоформы аполипопротеина Е (АПОЕ 4).
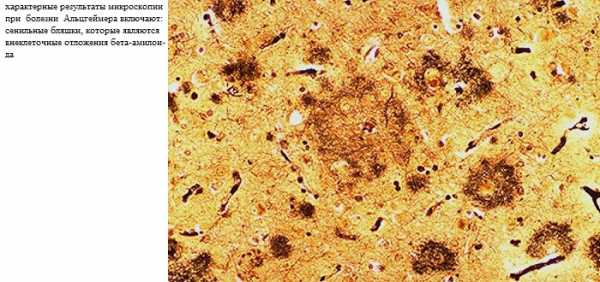
В норме предшественник амилоидного белка (АРР) расщепляется альфа-секретазой на растворимые (одинаковые по величине) полипептиды, которые не являются патогенными, и (АРР) выводится из организма; при патологии генов, отвечающих за метаболизм АРР, последний расщепляется бета- и гамма-секретазами на различные по длине фрагменты. При этом происходит образование нерастворимых длинных фрагментов амилоидного белка (альфа-бета-42), которые в последующем откладываются в веществе (паренхиме) головного мозга и стенках церебральных сосудов (стадия диффузного церебрального амилоидоза), что приводит к гибели нервных клеток. Далее в паренхиме головного мозга происходит агрегация нерастворимых фрагментов в патологический белок – бета-амилоид («гнездные» отложения данного белка в паренхиме головного мозга называют сенильными бляшками). Отложение амилоидного белка в церебральных сосудах приводит к развитию церебральной амилоидной ангиопатии, которая является одной из причин хронической ишемии головного мозга.
читать статью: Церебральная амилоидная ангиопатия (на laesus-de-liro.livejournal.com) [читать]
Бета-амилоид и нерастворимые фракции диффузного амилоидного белка обладают нейротоксическими свойствами. В эксперименте показано, что на фоне церебрального амилоидоза активируются тканевые медиаторы воспаления, усиливается выброс возбуждающих медиаторов (глутамат, аспартат и др.), повышается образование свободных радикалов. Результатом всего этого сложного каскада событий является повреждение нейрональных мембран, индикатором которого является образование внутри клеток нейрофибриллярных сплетений (НФС). НФС представляют собой фрагменты биохимически измененной внутренней мембраны нейрона и содержат гиперфосфорилированный тау-протеин. В норме тау-протеин является одним из основных белков внутренней мембраны нейронов. Наличие внутриклеточных НФС свидетельствует о необратимом повреждении клетки и ее скорой гибели, после которой НФС выходят в межклеточное пространство («НФС-призраки»). В первую очередь и в наибольшей степени страдают нейроны, окружающие сенильные бляшки.
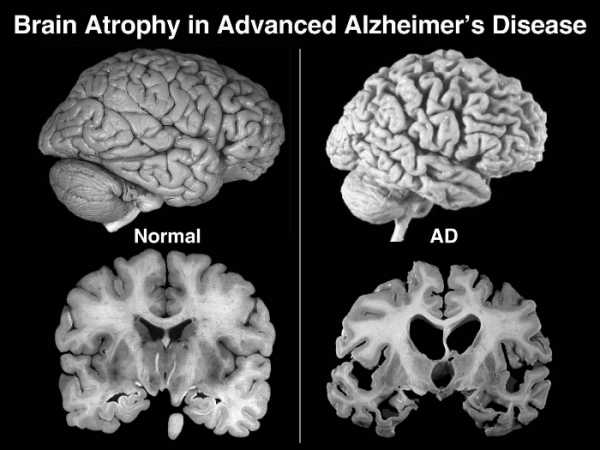
От начала отложения амилоидного белка в головном мозге до развития первых симптомов болезни — легкой забывчивости — проходит 10 — 15 лет. В значительной степени скорость прогрессии БА определяется выраженностью сопутствующей соматической патологии, сосудистых факторов риска, а также интеллектуальным развитием пациента. У пациентов с высоким уровнем образования и достаточной интеллектуальной нагрузкой заболевание течет медленнее, чем у пациентов со средним или начальным образованием и недостаточной интеллектуальной активностью. В этой связи была разработана теория когнитивного резерва, согласно которой при интеллектуальной деятельности мозг человека образовывает новые межнейрональные синапсы и в когнитивный процесс вовлекаются все большие популяции нейронов. Это облегчает компенсацию когнитивного дефекта даже при прогрессирующей нейродегенерации.
Диагностика амилоидоза. Предполагаемый на основании клинических и лабораторных данных амилоидоз необходимо подтвердить морфологически обнаружением амилоида в биоптатах тканей. При подозрении на AL-тип амилоидоза рекомендуют производить пункцию костного мозга. Наиболее часто для диагностики разных типов амилоидоза проводят биопсию слизистой оболочки прямой кишки, почки, печени. Биопсия слизистого и подслизистого слоев прямой кишки позволяет выявить амилоид у 70% больных, а биопсия почки — практически в 100% случаев. У пациентов с синдромом запястного канала исследованию на амилоид необходимо подвергать ткань, удаленную при операции декомпрессии запястного канала. Биопсийный материал для выявления амилоида необходимо окрашивать конго красным с последующей микроскопией в поляризованном свете для выявления способности к двойному лучепреломлению.
Современная морфологическая диагностика амилоидоза включает не только обнаружение, но и типирование амилоида, поскольку тип амилоида определяет терапевтическую тактику. Для типирования часто применяют пробу с перманганатом калия. При обработке окрашенных конго красным препаратов 5%-ным раствором перманганата калия АА-тип амилоида теряет окраску и утрачивает свойство двойного лучепреломления, тогда как AL-тип амилоида сохраняет их. Использование щелочного гуанидина позволяет более точно дифференцировать АА- и AL-амилоидоз. Наиболее эффективным методом типирования амилоида служит иммуногистохимическое исследование с применением антисывороток к основным типам амилоидного белка (специфические антитела против АА-белка, легких цепей иммуноглобулинов, транстиретина и бета-2-мик- роглобулина).
Обратите внимание! Амилоидоз — полисистемное заболевание, поражение только одного органа наблюдается редко. Если в анамнезе упоминается о сочетании таких симптомов, как общая слабость, исхудание, легкое появление кровоподтеков, раннее развитие одышки, периферические отеки, изменения чувствительности (синдром запястного канала) или ортостатическая гипотензия, следует заподозрить амилоидоз. Для наследственного амилоидоза характерен отягощенный семейный анамнез «нейромышечного» поражения неизвестной этиологии или деменции, для амилоидоза Aβ2M — использование гемодиализа, для амилоидоза АА — наличие хронического воспалительного процесса. Также амилоидоз необходимо исключать у пациентов заболеваниями почек неясного генеза, особенно с нефротическим синдромом, в т.ч. у больных с рестриктивной кардиомиопатией. Амилоидоз более вероятен при наличии обоих упомянутых синдромов. При амилоидозе AA доминирующим органом-мишенью, помимо почек, является печень, поэтому при дифференциальной диагностике причин выраженной гепатомегалии в сочетании с поражением почек следует исключить амилоидоз.
Дополнительная литература:
статья «Сложности диагностики и лечения AL-амилоидоза: обзор литературы и собственные наблюдения» В.В. Рыжко, А.А. Клодзинский, Е.Ю. Варламова, О.М. Соркина, М.С. Сатаева, И.И. Калинина, М.Ж. Алексанян; Гематологический научный центр РАМН, Москва (журнал «Клиническая онкогематология» №1, 2009) [читать]
laesus-de-liro.livejournal.com
Что такое амилоидоз, как это устранить: причины и симптомы, лечение
 Такая болезнь, как амилоидоз, возникла много веков назад, и сегодня ее продолжают диагностировать у многих людей во многих странах. При развитии главным симптомом является возникновение отложений в тканях, представленных в виде белковых полисахаридных соединений, которые называются амилоидом.
Такая болезнь, как амилоидоз, возникла много веков назад, и сегодня ее продолжают диагностировать у многих людей во многих странах. При развитии главным симптомом является возникновение отложений в тканях, представленных в виде белковых полисахаридных соединений, которые называются амилоидом.
Определение заболевания
Возникновение подобного недуга приводит к нарушениям в белковом обмене, на фоне чего происходит изменение размеров органа, приобретение им плотности и деревянистой структуры, смена органом своего нормального вида на сальный или даже воскообразный.
Виды патологий
При подобном недуге можно наблюдать множество различных отклонений в организме. Среди них наибольшее распространение получили следующие:
- Развития проявлений туберкулеза;
- Активные нагноения, наблюдаемые на фоне воспалительных процессов кости;
- Абсцесс легких, приобретающий хроническую форму;
- Поражение соединительной ткани, приобретающее системный характер;
- Поражение бронхов гноящимися образованиями, что приобретает хронический характер;
- На фоне возникновения злокачественных поражений лимфоидной ткани и развития злокачественных новообразований различного происхождения;
- Поражение слизистой толстой кишки, приобретающее хроническую форму;
- На фоне рака щитовидки, имеющего молекулярную форму развития;
- На фоне эндокардита, паренхима почки и ряда иных недугов.
Формы амилоидоза
На текущий момент нет четких критериев по выделению известных форм амилоидоза. Если опираться на причины и факторы, то можно выделить следующие формы:
 Идиопатическая форма, с которой начинается развитие болезни. Она проявляется в первую очередь на бронхопульмональной системе. В этом случае страдают такие органы, как паренхима легких, стенки сосудов, слизистая оболочка.
Идиопатическая форма, с которой начинается развитие болезни. Она проявляется в первую очередь на бронхопульмональной системе. В этом случае страдают такие органы, как паренхима легких, стенки сосудов, слизистая оболочка.- Приобретенная форма, которая наступает вслед за первичной. Здесь наблюдаются осложнения в виде развития дополнительных заболеваний. Способствующим фактором являются инфекции, проявляющиеся в форме гнойно-деструктивных процессов, возникновения злокачественных новообразований, лимфолейкозов.
- Наследственная форма, которая имеет семейную предрасположенность. Ее развитие является итогом белковой мутации, которая чаще всего распространяется по мужской линии.
- Старческий амилоидоз развивается отдельно от прочих форм. Ее развитие возможно на фоне прогресса такого недуга, как болезнь Альцгеймера. В качестве проявления следует отметить сердечные сосуды, сосуды мозга и аорту, которые страдают в первую очередь при подобной форме. Главным стимулирующим фактором выступают проблемы с белковым обменом, обусловленные возрастом больного.
- Локальная опухолевидная форма. Она также рассматривается как самостоятельная разновидность недуга. Для ее диагностики необходимо проведение клинических исследований.
Если исходить из степени концентрации фибриллярных белков, то можно выделить такую разновидность недуга, которая чаще всего встречается, как нефротическая.
Симптомы амилоидоза почек
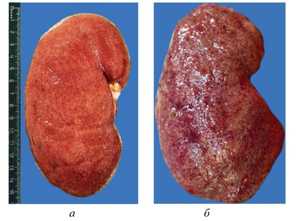
Во время диагностики могут быть обнаружены амилоидные отложения в тканях почек, что характерно для первичной формы недуга. Для рассматриваемых случаев характерно активное проявление нефротического синдрома. Однако чаще всего смерть больного наступает раньше развития непосредственно синдрома. Амилоидозу почек предшествует нефропатия, которую можно определить по следующим симптомам:
- Появление отеков, поражающих всю поверхность подкожного покрова, которые могут иметь постепенный или очень быстрый характер возникновения;
- Асцит, с которым обычно связывают нарушение водно-солевого баланса;
- Возникновение симптомов одышки;
- Возникновение патологии сердечной деятельности;
- Неожиданное диагностирование признаков азотемии;
- начало проявление симптомов, характерных для острой формы гипертонической болезни.
Рассмотренные симптомы начинают развиваться в течение долгого времени. По этой причине уже на основании проявления болезни можно с достаточной точностью сказать, на какую стадию вышло заболевание.
Симптомы амилоидоза
Для рассматриваемого недуга присущи различные симптомы, которые меняются в зависимости от стадии протекания болезни.
- Для латентной стадии характерно отсутствие каких-либо симптомов. Остатки амилоида возникают в промежуточным слое навикулярных клеток. Этот процесс может занимать до 5 лет. Этого времени оказывается достаточно для того, чтобы начал развиваться вторичный, реактивный амилоидоз. Здесь уже удается часто диагностировать новые болезни, которые часто представлены гнойными процессами, поражающими легкими, туберкулезными патологиями или нарушениями суставов.
- Начальная альбуминурическая стадия. Скапливание остатков амилоида происходит между капиллярами почечных клубочков, в петлях и почечных сосудах. При этой форме можно наблюдать сильное повреждение клубочкового фильтра почек, приобретение ими крупных размеров и увеличенной консистенции. Подобная стадия может развиваться в течение 13 лет.
- Стадия невротической отечности. Здесь уже каждый отдел почки имеет осадок амилоида. Его скопление можно отмечать в мозговом слое почки, а также начинает проявляться тканевый склероз. Нарушения почки проявляются в увеличении размеров и приобретении сального вида. Уже имеют место классические симптомы, присущие нефропатии с обширными отеками. Для развития стадии требуется около 6 лет. При этом одними невфротическими симптомами стадия не ограничивается. Вдобавок здесь отмечаются патологии, затрагивающие такие органы, как кишечник, селезенку, печень и лимфоузлы.
- Уремическая терминальная стадия. Ее развитию способствуют такие недуги, как нефроз и гипотония. На этом этапе основные нарушения затрагивают работу почек, что проявляется в первую очередь всё изменении вида и степени плотности.
Однако тот факт, что на почках появляется амилоидный осадок, не может служить основанием, что прочие органы не имеют подобных образований.
- Амилоид может возникать и на кожном покрове, следствием чего может быть образование красных пятен и небольших морщинок.
- Отложения могут возникать в лимфосистеме, что выражается в изменении размеров лимфатических узлов;
- Если отмечается патология пищеварительного тракта, то у больного возникают сложности с глотанием пищи, язык приобретает припухлый вид, начинают проявляться признаки гепатомегалии и расстройства желудка.
- На нервной системе это сказывается в виде появления признаков слабоумия.
- Если осадки амилоида возникают на дыхательных путях, то это приводит к появлению затрудненного дыхания и одышки.
- Большую опасность представляют осадки при появлении их на сердечных мышцах, что чревато появлением патологии сердечного ритма. Другим проявлением может выступать кардиомегалия, на фоне чего возникают условия для остановки сердца и в смерти больного.
Причины амилоидоза
Несмотря на то, что этот недуг был выявлен больше 100 лет назад, до сих пор ученые не смогли точно определить, что же вызывает развитие амилоидоза. В этом плане можно привести лишь научные гипотезы, которые могут лишь в общем виде дать ответ на этот вопрос. Наиболее вероятными причинами следует считать:
 Иммунологическую гипотезу;
Иммунологическую гипотезу;- Проявление белковой мутации;
- Патология белкового обмена, что приводит к повышению концентрации амилоида в сосудистых стенках, железах и плазме крови;
- Воспалительные процессы, которые могут дополняться развитием болезней инфекционного и хронического характера, имевшими место недугами, затронувшими костный мозг.
Когда болезнь достигает стадии, приводящей к летальному исходу больного, то и в этом случае амилоид может еще долго сохранять свою изначальную форму.
Диагностика амилоидоза
На текущий момент не всегда удается точно определить болезнь на ранней стадии развития. Дело в том, что в такие моменты болезнь не проявляется какими-либо изменениями в работе органов. Чтобы уже на начальном этапе обнаружить первые признаки появления отложений амилоида, необходимо исследовать мочу на микроальбуминурию. Именно по результатам этого анализа можно уже на раннем этапе увидеть признаки поражения почки, на основании чего можно обнаружить раннее нарушение сосудов.
Подсказкой почечного амилоидоза могут выступать и данные исследования по уровню содержания цистатина в крови, который дает представление о скорости клубочковой почечной фильтрации. Для сведения к минимуму фактора неопределённости специалисты прибегают и к проведению дополнительных анализов и взятию проб:
- Анализ на клинические показатели крови и мочи.
- Анализ, направленный на установление нормы суточного вывода белка с мочой.
- Установление факторов, обуславливающих увеличение концентрации в моче эритроцитов, лейкоцитов и цилиндров в анализе по Нечипоренко.
- Анализ мочи по Зимницкому, цель которого сводится к установлению факта присутствия гормонов.
- Анализ суточной мочи, призванный установить степень концентрации креатинина (проба реберга).
- Анализ, направленный на установление факта наличия в крови кислот и белковых фракций.
- Анализ почек путем использования метода радиоизотопной рентгенографии и узи-исследования.
- Взятие патогномоничной пробы, предусматривающей использование метиленовой синьки, призванной установить факт наличия амилоидов.
- Исследование гиподермы ткани почек путем проведения забора тканей биоплата.
Потребность в проведении биопсии мышечной ткани языка и десен может возникать в ситуации, когда болезнь перешла в идиопатическая форму с появлением отложений белковых образований, проникнутых в переколлагеновое пространство.
Лечение амилоидоза
Увы, однако на текущий момент не существует эффективных методов, позволяющих полностью вылечить такой недуг, как амилоидоз. Предлагаемые специалистами меры призваны в первую очередь устранить смежные заболевания, а также симптомы, которыми сопровождается их развитие. Другим эффектом их проведения является ослабление прогресса патологических изменений, что осуществляется путем приема медикаментозных препаратов, направленных на улучшение состояния больного.
Если нарушения были обнаружены еще на ранних стадиях развития болезни, то это дает возможность замедлить ее прогресс путем уменьшения негативного влияния со стороны амилоида. Для стабилизации состояния пациента и прекращения появления новых симптомов, оказывающих негативное влияние на организм, эффективно использование индивидуально составленной лечебной программы:
- устранение признаков.
- борьба с невротическими симптомами.
- ограничение количества потребляемой соли.
- прием тиазидовых диуретиков и тиазидных мочегонных препаратов.
- эффективной является мера переливания эритроцитарных масс , направленных на борьбу с гипоксией тканей, возникающих на фоне анемии.
- проведение мер по интенсивной терапии, направленных на устранение нарушений, затрагивающих водно-электролитные процессы.
- обязательной является разработка индивидуального плана питания.
Медикаментозное лечение амилоидоза
Чтобы обеспечить контроль по дальнейшему развитию наблюдаемых нарушений, необходимо принимать лекарственные средства, придерживаясь индивидуально составленной схемы.
- Колхицин — лекарство растительного происхождения, полезный эффект которого заключается в уменьшении скорости перемещения лейкоцитов в пораженные очаги, приводящий к менее активному прогрессированию фагоцитоза микрокристаллов солей.
- Раствор унитиола — прописывается в ситуации, когда имеет место патология работы печени;
- Раствор диметилсульфоксида — обладает противовоспалительным и анальгетическим действием, принимается путем введения во фруктовый сок.
- Делагил — лекарство, которое обладает иммуностимулирующим действием, назначают для борьбы с инфекциями.
Заключение
Амилоидоз представляется сложным в лечении заболеванием, которое требует грамотного выбора методики. Учитывая, что на начальной стадии отсутствуют характерные симптомы, позволяющие диагностировать нарушения, важно регулярно проводить обследования мочи, по результатам которых можно увидеть изменения уровня концентрации белковых соединений. Выбираемое лечение должно составляться с учетом текущей стадии болезни, а также особенностей самого больного. Только в этом случае можно добиться наибольшего эффекта от назначенных лекарств.
pechen.guru
Амилоидоз: симптомы, диагностика, лечение
Амилоидоз – это системное заболевание, характеризующееся отложением в тканях амилоида (сложного белково-полисахаридного комплекса).
Амилоидоз приводит к атрофии, склерозу и недостаточности различных органов.
Частота встречаемости – не менее 1:50 000 (в основном возникает после 60 лет).
Классификация
1. Первичный амилоидоз обусловлен изменениями клеток при миеломной болезни, моноклональной гипергаммаглобулинемии, макроглобулинемии Вальденстрема.
Амилоид состоит из легких цепей иммуноглобулинов, их синтез резко увеличен при указанных заболеваниях.
2. Вторичный амилоидоз возникает вследствие хронических воспалительных заболеваний (например, при ревматоидном артрите, остеомиелите, бронхоэктатической болезни, малярии, туберкулезе, лепре).
Амилоид состоит из фибриллярного белка амилоида и продуктов его распада – сывороточного амилоидного белка.
3. Семейный (идиопатический) амилоидоз. Обычно – врожденный дефект ферментов. Имеется несколько форм врожденного амилоидоза, например при средиземноморской лихорадке (семейный пароксизмальный полисерозит – заболевание неясной причины, проявляющееся болями в животе, приступами лихорадки, плевритом, артритом и высыпаниями на коже).
4. Старческий амилоидоз.
5. Диализный амилоидоз развивается при проведении гемодиализа.
Причины
Причины преимущественного поражения тех или иных органов (почек, кишечника, кожи) неизвестны.
Признаки и течение заболевания разнообразны и зависят от локализации амилоидных отложений, степени их распространенности в органах, длительности заболевания, наличия осложнений.
Чаще наблюдают комплекс симптомов, связанных с поражением нескольких органов.
Проявления амилоидоза:
*желудочно-кишечного тракта
- Увеличение размеров языка
- Нарушение глотания
- Диарея или запоры
- Опухолевидные отложения амилоида в желудке или кишечнике (не часто)
Амилоидоз пищевода обычно сопровождается поражением других отделов пищеварительной системы. Характерны затруднение глотания при проглатывании плотной и сухой пищи, отрыжка.
Амилоидоз желудка обычно сочетается с амилоидозом кишечника и других органов. Проявления: ощущение тяжести в подложечной области после еды, изжога, отрыжка, тошнота.
Амилоидоз кишечника возникает часто, проявляется ощущением дискомфорта, тяжести, реже умеренными болями в животе, нарушениями стула (запорами или упорной диареей). Изолированный опухолевидный амилоидоз кишечника протекает под маской опухоли (боль, непроходимость кишечника), и обычно его выявляют во время операции.
Амилоидоз печени наблюдают сравнительно часто, характерны увеличение и уплотнение печени, нередко появляются синдром портальной гипертензии, реже возникают боли в правом подреберье, тошнота, отрыжка, желтуха, кровоизлияния.
Амилоидоз поджелудочной железы обычно протекает под маской хронического панкреатита; характерны тупая боль в левом подреберье, отрыжка, тошнота, рвота.
*сердца
- Устойчивая к лечению застойная сердечная недостаточность
- Нарушения ритма и проводимости
- Очаговые поражения миокарда (псевдоинфаркт).
*нервной системы
- Периферическая полиневропатия (ощущение жжения, покалывания, «мурашек» в конечностях, нарушение чувствительности)
- Нарушения вегетативной нервной системы (головные боли, голокружение, потливость)
- Ортостатическая гипотензия
- Импотенция
- Сфинктерные расстройства (недержание мочи, кала).
*сухожилий, хрящей
- Синдром запястного канала (онемение, покалывание и пульсирующая боль в пальцах)
- Симметричный полиартрит, плечелопаточный периартрит, плотный отек околосуставных.
*тканей
- Увеличение селезенки.
*органов дыхания
- Охриплость голоса
- Бронхит
- Опухолевидный легочный амилоидоз.
Поражения кожи – папулы, бляшки, узлы, кровоизлияния вокруг глаз («симптом очков»).
А также:
- Вовлечение щитовидной железы со снижением ее функции.
- Вовлечение надпочечников с их недостаточностью.
- Амилоидоз почечный, типичен для всех форм амилоидоза.
Диагностика
- В крови анемия, лейкоцитоз, повышение СОЭ, почти в 80 % случаев в начале заболевания возникают снижение количества белков, гиперглобулинемия, снижение уровня тромбоцитов, натрия, кальция.
- При поражении печени – повышение уровня холестерина, в ряде случаев – билирубина, повышение активности щелочной фосфатазы
- Оценка функций щитовидной железы – возможно снижение функций щитовидной железы
- Оценка функций почек – почти в 50 % случаев амилоидоз начинается с почечной недостаточности. При исследовании мочи, помимо белка, в осадке обнаруживают цилиндры, эритроциты, лейкоциты
- При первичном амилоидозе в плазме крови и/или моче обнаруживают увеличение содержания амилоида
- При вторичном амилоидозе следует обратить внимание на лабораторные признаки хронических воспалительных заболеваний
- В кале – большое количество жира, крахмала, мышечных волокон
Диагностические мероприятия
- Эхокардиография (при подозрении на поражение сердца)
- Рентгенологическое исследование
- Функциональные клинические пробы с конго красным и метиленовым синим (быстрое исчезновение красителей при внутривенном введении из сыворотки крови вследствие их
- фиксации амилоидом и значительное снижение выделения их почками). При первичном амилоидозе эти пробы не всегда информативны
- Биопсия органов – наиболее информативный метод.
Лечение амилоидоза
Общие принципы терапии
Режим домашний, за исключением тяжелых состояний (выраженная сердечная недостаточность, хроническая почечная недостаточность)
При первичном амилоидозе в начальных стадиях процесса – хлорохин 0,25 г 1 р./сут. длительно, сочетание мелфалана и преднизолона, мелфалана, преднизолона и колхицина или только колхицин
При вторичном амилоидозе – лечение основного заболевания (туберкулез, остеомиелит, эмпиема плевры и др.), после излечения которого нередко исчезают и проявления амилоидоза
Перевод пациента с диализным амилоидозом на перитонеальный диализ
При амилоидозе кишечника, протекающем с упорной диареей, – вяжущие средства (висмута субнитрат, адсорбенты)
При вторичном амилоидозе – специфическое лечение основного заболевания
При семейном амилоидозе – колхицин (по 0,6 мг 2–3 р./сут.)
Симптоматическая терапия: витамины, диуретические средства, препараты, снижающие давление, переливание плазмы и т. д.
Рекомендации по питанию
Больным амилоидозом показан длительный (1,5–2 года) прием сырой печени (по 100–120 г/сут.)
Ограничение потребления белка, соли пациентам с хронической почечной недостаточностью
Ограничение соли для пациентов с сердечной недостаточностью
Хирургическое лечение амилоидоза
Удаление селезенки может улучшить состояние вследствие уменьшения количества амилоида, образующегося в организме.
Прогноз
Прогноз при амилоидозе определяется основным заболеванием. Средняя выживаемость – 12–14 месяцев. Женщины часто живут дольше. Заболевание протекает тяжелее у лиц пожилого возраста.
www.diagnos.ru
Амилоидоз — это… Что такое Амилоидоз?
У этого термина существуют и другие значения, см. Амилоид.| Амилоидоз | ||
|---|---|---|
| Микроскопическая картина патологоанатомического препарата с развившимся амилоидозом | ||
| МКБ-10 | E85.85. | |
| OMIM | 105210 | 105210 |
| DiseasesDB | 633 | 633 |
| MeSH | D000686 | D000686 |
Амилоидоз (амилоидная дистрофия) — нарушение белкового обмена, сопровождающееся образованием и отложением в тканях специфического белково-полисахаридного комплекса — амилоида. Амилоид долгое время персистирует в организме и даже после смерти в течение долгого времени не подвергается гниению (И. В. Давыдовский, 1967).
Развитие амилоидоза
Развитие амилоидоза связано с нарушением белково-синтетической функции ретикуло-эндотелиальной системы, накоплением в плазме крови аномальных белков, служащих аутоантигенами и вызывающих образование аутоантител (см. Аллергия). В результате взаимодействия антигена с антителом происходит осаждение грубодисперсных белков, участвующих в образовании амилоида. Откладываясь в тканях (например, в стенках сосудов, железистых и т. п.), амилоид вытесняет функционально специализированные элементы органа, что ведёт к гибели этого органа.
Виды амилоидоза
AL-амилоидоз (immunoglobulin light chains derived) — первичный амилоидоз, вызванный появлением в плазме крови и отложением в самых разных тканях организма аномальных лёгких цепей иммуноглобулинов, синтезируемых малигнизированными плазмоцитами. Тот же процесс идёт и при миеломной болезни (болезнь Рустицкого-Калера, плазмоцитома), но здесь выступает на первый план патологическая пролиферация малигнизированного клона плазмоцитов, инфильтрирующих ткани (чаще всего плоские кости и позвонки, с развитием патологических переломов).
AA-амилоидоз (acquired) — вторичный амилоидоз, вызванный гиперсекрецией печенью белка острой фазы альфа-глобулина в ответ на любое хроническое воспаление. Этот процесс развивается при ревматоидном артрите, анкилозирующем спондилоартрите, бронхоэктатической болезни, хроническом остеомиелите, туберкулёзе, лепре и ряде других заболеваний.
Подвидом данного амилоидоза считается ASC-амилоидоз (systemic cardiovascular), развивающийся у лиц свыше 70 лет. Патогенез в деталях неизвестен.
AF-амилоидоз (средиземноморская перемежающая лихорадка) — наследственная форма амилоидоза, с аутосомно-рецессивным механизмом передачи. Данным видом амилоидоза страдают люди, принадлежащие к определенным этническим группам, живущим по побережью Средиземного моря (евреи-сефарды, греки, арабы, армяне). Существуют разновидности амилоидоза, характерные для определенной географической местности: «португальский амилоидоз» (с преимущественным поражением нервов нижних конечностей), «американский амилоидоз» (с преимущественным поражением нервов верхних конечностей), семейный нефропатический амилоидоз, или «английский амилоидоз», протекающий с симптомами крапивницы, глухоты и лихорадки.
AH-амилоидоз (hemodialisis-related) — наблюдается исключительно у больных, находящихся на гемодиализном лечении. Патогенез связан с тем, что бета-2-микроглобулин MHC I класса, в норме утилизирующийся почками, не фильтруется в гемодиализаторе и накапливается в организме.
AE-амилоидоз — форма местного амилоидоза, развивающаяся в некоторых опухолях, например, в медуллярном раке C-клеток щитовидной железы. В этом случае предшественником амилоида являются патологические фрагменты кальцитонина.
Аβ-амилоидоз — при болезни Альцгеймера, иногда семейные случаи.
AJAPP-амилоидоз — островков Лангерганса при II типе сахарного диабета и инсулиноме
Амилоидоз финского типа — редкий тип амилоидоза, вызываемый мутацией гена GSN, кодирующего белок джелсолин.
Клиническая картина
Интенсивность клинических проявлений зависит от локализации и распространенности амилоидных отложений. Этим обуславливаются длительность заболевания и наличие осложнений. Наиболее типично поражение почек, иногда бывают поражения пищевода, селезенки, кишечника, а также желудка. При амилоидозе почек наблюдается длительный скрытый период болезни, при котором отсутствуют значительные симптомы, — наблюдаются лишь незначительная слабость и снижение активности. После двух недель течения скрытого периода появляются отеки почек, их дисфункция (появление в моче белков — развитие протеинурии, а также форменных элементов крови), сердечная недостаточность. При амилоидозе желудка наблюдаются тяжесть в эпигастральной области, ослабление перистальтики желудка после употребления пищи. При амилоидозе кишечника наблюдаются тяжесть и тупые боли в области живота, диарея.
Микроскопическая характеристика
Амилоид в микропрепаратах выглядит как аморфная эозинофильная масса, которую можно дифференциировать от гиалина специальной окраской и характером накопления в ткани. При использовании красителя конго красный амилоид избирательно выкрашивается в красный цвет, однако для исключения ложноположительных результатов используют исследование в поляризованном свете.
Прижизненная диагностика AA-амилоидоза основана на исследовании инцизионного биоптата слизистой полости рта или щипкового биоптата толстой кишки.
Макроскопическая характеристика
Для органа характерно увеличение размеров, деревянистая плотность, восковидный или сальный вид.
Лечение
Иммунодепрессивные (то есть угнетающие иммунобиологические реакции) и печёночные препараты.
Подтип АА не лечится.
Применение мелфалана и преднизолона, пересадка сердца и почек, гемодиализ способствуют увеличению выживаемости пациентов.
Примечания
Литература
- Сторожаков Г.И. Поражение сердца при амилоидозе // Журнал сердечная недостаточность. — 2008. — № 5. — С. 250-256.
- Саркисова И.А. Ревматоидный артрит как основная причина развития АА-амилоидоза // Клиническая геронтология. — 2009. — № 2. — С. 14-20.
- Первичный системный амилоидоз с поражением сердца и коронарных артерий // Кардиология. — 2010. — № 6. — С. 92-94.
- Кичигина О.Н. Первичный амилоидоз с преимущественным поражением сердца и желудочно-кишечного тракта // Архив патологии. — 2011. — № 3. — С. 59-61.
Ссылки
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 12 мая 2011. |
dic.academic.ru
Амилоиды – это не всегда плохо?
Стэнфордские ученые переворачивают догму «амилоид – это плохо» с ног на голову
LifeSciencesToday по материалам Stanford School of Medicine:
Accused of complicity in Alzheimer’s, amyloid proteins may be getting a bad rap, study finds
Амилоиды, образующие скопления неправильно свернутых белков, обнаруживаемые в мозге пациентов, страдающих болезнью Альцгеймера и другими нейродегенеративными заболеваниями, – считаются в нейробиологии ужасно «плохими парнями», нарушающими нормальную функцию нейронов, отвечающих за память и движения, и ученые всего мира потратили не одно десятилетие на то, чтобы научиться блокировать их синтез и накопление в организме человека.
Но ученые Школы медицины Стэнфордского Университета (Stanford University School of Medicine) взяли твердый курс на восстановление репутации этих белков, образующих так называемые амилоидные бляшки. Похоже, они собираются перевернуть с ног на голову всю нейробиологию.
Первое исследование, опубликованное в августе прошлого года, показало, что один из образующих амилоиды белков – бета-амилоид, напрямую связываемый учеными с развитием болезни Альцгеймера, – может обратить вспять симптомы нейродегенеративного заболевания лабораторных мышей, близкого к рассеянному склерозу человека.
Второе исследование (Kurnellas et al., Amyloid Fibrils Composed of Hexameric Peptides Attenuate Neuroinflammation), опубликованное в апреле этого года в журнале Science Translational Medicine, показало, что небольшие фрагменты нескольких амилоид-образующих белков (в том числе известных «преступников» – тау-белка и прионов) тоже могут быстро смягчать симптомы у мышей с этим заболеванием – несмотря на то, что они могут и образуют длинные фибриллы, ранее считавшиеся оказывающими отрицательное воздействие на нейроны.
«Мы установили, что, по крайней мере, при определенных обстоятельствах, амилоидные пептиды реально помогают мозгу», – говорит руководитель исследования Лоренс Стейнмен (Lawrence Steinman), MD, профессор кафедр неврологии и нейробиологии и педиатрии. «Это действительно переворачивает догму «амилоид – это плохо» с ног на голову. Это потребует изменений в фундаментальных представлениях о нейродегенерации и таких заболеваниях, как рассеянный склероз, болезнь Альцгеймера и болезнь Паркинсона».
Профессор Стейнмен – известный эксперт в области рассеянного склероза, чьи исследования привели к разработке натализумаба (Тисабри, Tysabri) – мощного лекарственного препарата для лечения этого заболевания.
Взятые вместе, эти два исследования – первый шаг к радикально новой идее о том, что полноразмерные амилоид-образующие белки могут в действительности вырабатываться организмом в качестве защитного, а не разрушительного фактора. В частности, исследование профессора Стейнмена показывает, что эти белки могут функционировать в качестве молекулярных шаперонов, сопровождающих и удаляющих из зоны повреждения специфические молекулы, вовлеченные в развитие воспаления и неадекватных иммунных реакций.
Хотя результаты этих двух исследований можно назвать удивительными, определенные предположения о том, что амилоид-образующие белки играют не только негативную роль, высказывались и в более ранних статьях других ученых. В частности, ингибирование, или нокаут, экспрессии нескольких белков в мышиных моделях рассеянного склероза – путь, который должен блокировать прогресс заболевания, если эти белки действительно являются его причиной, – напротив, приводило к усугублению симптомов.
Нельзя отрицать и тот факт, что эти считающиеся опасными амилоид-образующие молекулы на удивление широко распространены. «Мы знаем, что организм вырабатывает много амилоид-образующих белков в ответ на повреждение», – говорит профессор Стейнмен. «Сомневаюсь, что это делается, чтобы нанести организму еще больший вред. Например, прионный белок присутствует в каждой клетке нашего организма. Какова его функция? Вполне возможно, что любое терапевтическое воздействие, направленное на удаление всех этих белов, может мешать их естественной функции».
Схема образования бета-амилоидных бляшек. (Рис. comerbemateaos100.blogspot.ru)
Понимание того, как образуются амилоиды, требует понимания биологии белков, которые по существу являются цепочками, состоящими из более мелких компонентов – аминокислот, – связанных друг с другом конец в конец. Чтобы выполнять свою функцию в клетке, сразу после образования эти аминокислотные цепочки сворачиваются в определенные трехмерные структуры, соответствующие друг к другу, как ключи и замки.
Неправильно свернутый белок, очевидно, не в состоянии выполнять свои функции и должен быть утилизирован клеточной системой организма, управляющей выведением биохимических отходов. Однако амилоид-образующие белки (которых насчитывается около 20) выводятся плохо, если выводятся вообще. Вместо этого они инициируют цепную реакцию с другими неправильно свернутыми белками, образуя длинные нерастворимые цепочки, называемые фибриллами, которые связываются друг с другом с образованием амилоидных скоплений. Эти сгустки неизменно присутствуют в мозге пациентов с нейродегенеративными заболеваниями, такими как болезнь Альцгеймера, болезнь Паркинсона и рассеянный склероз, но не в мозге здоровых людей.
Хотя амилоидные скопления считается вредными для нервных клеток, точный механизм нанесения этого вреда остается не совсем ясным. Один из возможных вариантов неблагоприятного развития событий может основываться на способности фибрилл образовывать цилиндрические поры, нарушающие целостность клеточной мембраны и упорядоченный поток ионов и молекул, используемых клетками для коммуникации и передачи нервных сигналов. Тем не менее, само их присутствие свидетельствует для многих врачей о диагнозе нейродегенерации. До недавнего времени к числу таких врачей относился и профессор Стейнмен.
«Мы начали это исследование, потому что такие молекулы присутствуют в мозге людей с рассеянным склерозом», – говорит Стейнмен. «Мы рассчитывали показать, что присутствие бета-амилоида усугубляет состояние лабораторных животных. Вместо этого мы увидели, что он приносят большую пользу».
Заинтригованные результатами своего первого исследования, ученые проверили эффект небольших, состоящих из шести аминокислот, фрагментов нескольких амилоид-образующих белков, в том числе бета-амилоида, с примерно одинаковой трехмерной структурой. Они установили, что почти все эти крошечные белковые молекулы, или гексамеры, тоже могли временно обращать вспять симптомы рассеянного склероза у мышей (после прекращения лечение признаки заболевания появлялись у животных в течение нескольких дней).
Исследователи заметили, что лечебный эффект гексамеров был связан с их способностью образовывать фибриллы, похожие на их более длинные родительские молекулы, но не идентичные им. Например, эти упрощенные гексамерные фибриллы образуются и распадаются легче, чем состоящие из целых белков. Кроме того, они, как представляется, не могут образовывать цилиндрические поры, способные повреждать клеточные мембраны. Наконец, фибриллы из гексамеров, по-видимому, ингибируют образование фибрилл из полноразмерных белков – возможно, за счет блокирования, или неспособности стимулировать, цепную реакцию, инициирующую образование фибрилл.
Смешав образующие фибриллы гексамеры с плазмой крови трех человек с рассеянным склерозом, исследователи обнаружили, что фибриллы связывают и удаляют из раствора многие потенциально опасные молекулы, вовлеченные в развитие воспаления и иммунного ответа.
«Эти гексамерные фибриллы, как представляется, работают на удаление опасных химических веществ из зоны повреждения», – считает профессор Стейнмен.
Ученые планируют продолжить использование небольших гексамеров в качестве средства терапии нейродегенеративных заболеваний, таких как рассеянный склероз. Необходимы дальнейшие исследования, но профессор Стейнмен полон надежд.
«Уроки, полученные нами в ходе изучения амилоид-образующих белков при рассеянном склерозе, могут быть полезны для лечения инсульта и травм мозга, а также болезни Альцгеймера», – говорит он. «Мы получаем информацию о том, как сегодняшние терапевтические подходы могут влиять на организм, и начинает понимать нюансы, необходимые для разработки успешных методов лечения. Хотя на это и потребуется время, мы решительно настроены на то, чтобы как можно быстрее перенести наши многообещающие результаты из лаборатории в клинику».
Портал «Вечная молодость» http://vechnayamolodost.ru
23.04.2013
www.vechnayamolodost.ru
Амилоидоз — что это такое: причины, симптомы и лечение. Первые признаки амилоидоза, какие органы он может поразить — Женское мнение
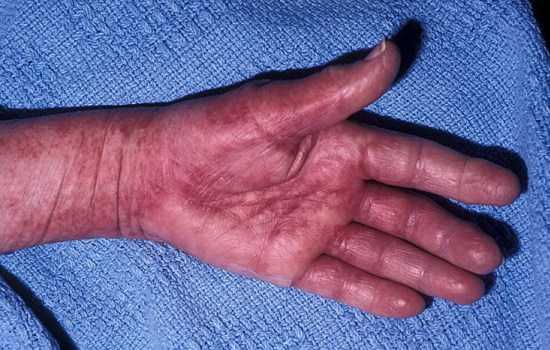
Амилоидоз – это комплекс заболеваний, появляющихся из-за довольно сложных изменений в организме характеризующиеся отложениями амилоидов (плохих белков) в тканях.
Это заболевание способно вызвать поражение кожи, сердца, печени, желудочно-кишечного тракта и других тканей, и других органов.
Признаки амилоидоза
Как и течение болезни, его признаки могут быть самыми разными и квалифицируются от места, где происходит откладывание амилоидов. Например, при поражении органов пищеварительного тракта, человека беспокоит нарушение глотания пищи и частая отрыжка.
При амилоидозе желудка после принятия пищи у человека появляются диспепсические расстройства и тяжесть в эпигастрии. Амилоидоз кишечника чаще сопровождается появлением тяжести, болями в области живота, стойкими запорами или расстройствами желудка.
Также существует изолированное опухолевидное поражение кишечника с его непроходимостью и тупыми болями. Примечательно то, что он протекает сродни опухоли, которая, впрочем, может быть обнаружена только во время операции.
Амилоидоз поджелудочной железы может проявляться, как и хронический панкреатит, который сопровождается болью в подреберье слева, стеатореитом, поносом и диспепсическими проявлениями.
В нередких случаях у человека возникает амилоидоз печени: орган увеличивается в размерах, в нем появляются уплотнения и возникает асцит (брюшная водянка). Больного беспокоит боль в подреберье справа, спленомегалия, диспепсия и желтуха.
Больные амилоидозом первое время могут не замечать ухудшение общего самочувствия и появления слабости, обращаясь к специалисту только при наличии явных признаков нездоровья:
• отеки;
• сильная слабость,
• гипертония;
• одышка;
• расстройство желудка;
• почечная недостаточность;
• аритмия.
Амилоидоз представляет собой системный процесс, который обычно возникает в результате ревматических болезней. Так, на их диагностировании и лечении специализируется ревматолог. Поскольку болезнь при несвоевременном лечении распространяется на другие органы, к лечению больного могут подключаться и другие врачи: например, при заболевании почек необходима консультация нефролога, амилоидозом печени занимается гепатолог, болезни кишечника и желудка лечит гастроэнтеролог.
Диагностика
При диагностировании амилоидоза очень важно быстрее определить, какие именно органы поражены: кожные покровы, сердце, печенка, селезенка, почки и т.д. В случае развития признаков вторичного амилоидоза нужно определить, какое хроническое заболевание стало причиной развития признаков амиоидоза.
Для диагноза болезни врач назначает функциональные пробы, анализы крови в лаборатории, но наиболее правдивым методом диагностики по праву считается биопсия органов, которые помогают обнаружить саму болезнь.
Лечение амилоидоза
Так как первичную форму амилоидоза обнаружить достаточно трудно, далеко не всегда можно вовремя начать адекватное лечение. Терапия вторичного заболевания будет результативной, только если изменения пораженных органов будут не критичными.
Для успешного излечения необходимо устранить причину заболевания, а также как можно быстрее начать симптоматическое лечение.
Врач обычно назначает патогенетические средства, среди которых особое внимания заслуживают хингамин и унитиол, которые применяют в виде инъекций. Также часто используют и иммунодепрессанты, а при лечении симптомов назначают витамины группы В, геппатопротекторы, сердечные гликозиды, препараты железа, диуретики. При необходимости выполняют переливание крови.
При наличии осложнений больного необходимо госпитализировать. В особенности при почечной или сердечной недостаточности. Но в большинстве случаев терапия производится вне больницы. Пациенту необходимо ограничить прием белковой пищи (яйца, мясо, рыба) и соли.
Течение заболевания имеет прогрессирующий характер. У пожилых амилоид протекает в тяжелой форме.
Пациенты, страдающие хронической почечной недостаточностью, могут умереть через год, а при сердечной они проживут не более четырех месяцев.
zhenskoe-mnenie.ru
 Идиопатическая форма, с которой начинается развитие болезни. Она проявляется в первую очередь на бронхопульмональной системе. В этом случае страдают такие органы, как паренхима легких, стенки сосудов, слизистая оболочка.
Идиопатическая форма, с которой начинается развитие болезни. Она проявляется в первую очередь на бронхопульмональной системе. В этом случае страдают такие органы, как паренхима легких, стенки сосудов, слизистая оболочка. Иммунологическую гипотезу;
Иммунологическую гипотезу;