Жизненный цикл ВИЧ (круговорот ВИЧ в клетке). Имя ему СПИД
Жизненный цикл ВИЧ (круговорот ВИЧ в клетке)
Vices superbae
(Неумолимый круговорот судьбы)
Еще со школы всем нам хорошо известно такое понятие, как круговорот веществ в природе. Так вот у ВИЧ тоже есть свой круговорот, а точнее, его жизненный цикл, который связан только с человеком, с определенными его клетками. В окружающей среде без человека вирус совершенно беспомощен и быстро погибает. Если случилось бы такое, что все человечество исчезло с планеты Земля, то тут же исчез бы и ВИЧ. На сегодняшний день это единственно возможный, хотя, понятно, совершенно нереальный, чисто фантастический способ освобождения нашей планеты от ВИЧ. ВИЧ подобен огню, существующему только, если есть горючий материал, сжигающему этот материал дотла и вместе с ним погибающему.
Сейчас уже хорошо известно, как вирус проникает в клетки и как его генетическая программа реализуется в пораженном им организме. Как же ведет себя ВИЧ в своем единственно возможном месте обитания — в человеке? Общая схема поведения вируса в клетках изображена на рис. 8. В целом эта схема сходна у всех ретровирусов, отличия здесь только в деталях, но именно эти детали и делают ВИЧ тем, что он есть — смертельно опасным.
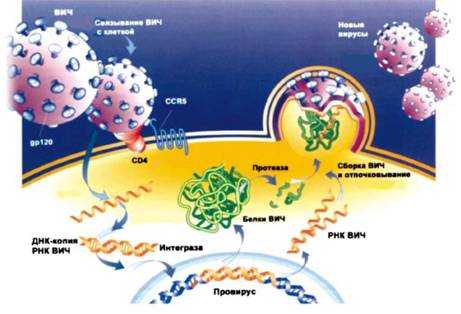
Рис. 8. Инфицируя CD4-лимфоциты, ВИЧ осуществляет ряд превращений, в результате которых происходит его размножение и гибель клетки-хозяина. Подробности см. в тексте.
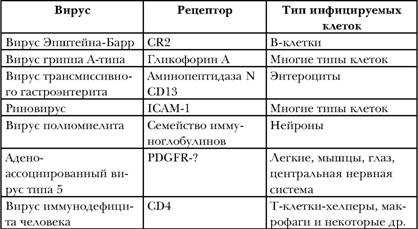
Все вирусы для того, чтобы поразить организм, в первую очередь прикрепляются к клеткам хозяина, связываясь со специфическими белками, которые называются рецепторами. Однако рецепторы для разных типов вирусов совершенно различны (табл. 2). Этим и предопределяется, какие клетки могут быть заражены (инфицированы) данным вирусом, а какие нет. Так, рецептор для вируса полиомиелита имеется только на нейронах; они-то и инфицируются в первую очередь при попадании вируса в организм. А вот риновирус «любит» соединяться с белком по имени ICAM-1, который присутствует на мембранах многих типов клеток, в результате все они могут быть заражены этим вирусом. На сегодняшний день далеко не для всех вирусов обнаружены рецепторы, но это не означает, что их нет. И поиск их продолжается.
Таблица 2
Вирусы человека и рецепторы клеток, с которыми они взаимодействуют
Какова же ситуация в случае ВИЧ? Попав на слизистую оболочку или прямо в кровяное русло человека и циркулируя там, вирус занят только одним: он ищет то место, куда он мог бы проникнуть и где мог бы нормально существовать, чтобы в дальнейшем размножиться. Иначе ВИЧ погибнет. Как видно из табл. 2, ВИЧ способен проникать далеко не во все виды клеток крови, а только в те, которые несут на своей поверхности специальный белок-рецептор — CD4, к которому вирус легко и охотно присоединяется. Белок вируса под названием gp120 (см. рис. 6), расположенный на его поверхности, как радар, находит белок-рецептор CD4 на поверхности клетки и плотно связывается с ним по принципу «ключ-замок». Этому взаимодействию способствуют и некоторые дополнительные белки, которые поэтому называют корецепторами. Имена основных корецепторов для ВИЧ — CCR5 и CXCR4. B нормальных клетках они служат полноценными рецепторами для специфических клеточных белков-регуляторов — хемокинов. А для взаимодействия клеток с ВИЧ они играют всего лишь роль помощников для основного рецептора CD4. Однако без этих белков-корецепторов, так же как без С4-рецептора, вирус проникнуть в клетку не может.
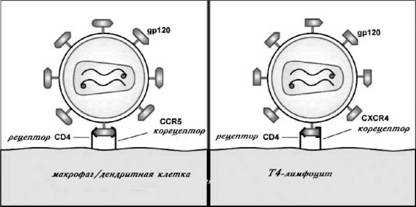
Рис. 9. Схемы взаимодействия ВИЧ с разными типами клеток с участием рецептора (CD4) и корецепторов (CCR5 и CXCR4)
Рецепторы и корецепторы для ВИЧ имеются на поверхности нескольких типов клеток иммунной системы. Наличие С4-рецептора позволяет называть все эти клетки С4-лимфоцитами. В частности, на мембране уже упоминавшихся Т-лимфоцитов-хелперов имеется С4-рецептор и CXCR4-корецептор. С4-рецептор содержится также на поверхности макрофагов и дендритных клеток, которые также одновременно несут и корецептор CCR5 (рис. 9). На ранней стадии ВИЧ-инфекции вирусы обычно имеют большее сродство с макрофагами, поэтому их называют М-троп-ными. Белок оболочки этих вирусов gp120 способен связываться одновременно с С4-рецептором и CCR5-корецептором. На более поздних стадиях ВИЧ приобретает сродство с Т-клетками, поскольку белок gp120 видоизменяется и становится способным связываться с клетками, содержащими как С4-рецептор, так и CXCR4-корецептор. По этой причине такие вирусы называют Т-тропными.
Понятно, что ключевой для взаимодействия ВИЧ и клетки С4-белок-рецептор когда-то возник и существует сейчас в некоторых типах клеток совсем не для того, чтобы вирусу было удобно в них проникать. Это очень важный клеточный белок, который обычно участвует на самых первых этапах сложного процесса передачи сигналов при активации Т-клеток. А ВИЧ просто сумел подобрать «ключ» именно к этому «замку». В результате в организме человека атака вируса идет главным образом именно на С4-содержащие клетки. Основным способом попадания ВИЧ внутрь таких клеток человека является его физическое связывание как с белком-рецептором, так и белком-корецептором, расположенными на клеточной оболочке (рис. 9). Вирус иногда сравнивают с гаечным ключом фиксированного размера: за гайки меньшего размера он не сможет зацепиться, а гайки большего размера вообще не войдут в его паз. Как уже говорилось, взаимодействие вируса и рецептора на поверхности клеток можно также сравнить с ключом и замком. Когда ключ входит в замок — стыковка вируса и клетки произошла, после чего дверь открывается. Происходящее за этим слияние внешней оболочки вируса с мембраной клетки-мишени обеспечивает легкое проникновение (перетекание) вируса внутрь клетки. При этом ВИЧ «раздевается» там: освобождается от своей оболочки.
Затем вирусу, чтобы жить и развиваться, необходимо перевести свою генетическую информацию на понятный клетке-хозяину язык, т. е. информацию, записанную в форме полимерной молекулы РНК, превратить в ДНКовую форму (рис. 8). Для этого клетка синтезирует белок-фермент, закодированный в вирусном геноме, под названием «обратная транскриптаза». Этот фермент и осуществляет образование на РНК однонитевой ДНК-копии. Затем с помощью того же фермента достраивается вторая нить ДНК. И, наконец, новоиспеченная двунитевая ДНК-копия вируса с помощью специального вирусного фермента интегразы встраивается внутрь ДНК клетки-хозяина. Такое состояние вируса получило название провируса. ДНК провируса имеет размер около 10 тыс. пар нуклеоти-дов (п.н.) и окружена с обеих сторон одинаковыми последовательностями нуклеотидов, называемыми длинными концевыми повторами (LTR — сокращенно от англ. long terminal repeats), размером по 600–700 п.н. каждый (рис. 7). B этих длинных концевых повторах содержатся все необходимые для регуляции работы генов элементы, которые и управляют работой вирусных генов в новом для них месте.
Места встраивания вируса в геном человека хотя в целом и случайные, но тем не менее есть определенное предпочтение к тем участкам, которые не «молчат» в клетках, а активно работают. После внедрения в ДНК клетки-хозяина провирус становится для клетки «родным», как и собственные гены. ДНК-провирус, по сути дела, представляет собой небольшой новый текст (программу) в огромном «старом» клеточном ДНКовом тексте. Так вирусная лжепрограмма проникает в главный информационный центр — аппарат клетки. Хотя в человеческой клетке в 100 тыс. раз больше генетической информации, чем в геноме провируса, который влезает в человеческий геном, маленький, но хитрый и проворный ВИЧ в конечном итоге одерживает победу над человеком.
Считалось, что вирус, превратившись в провирус, успокаивается; эту форму иногда называют «покоящимся вирусом». Но в действительности в большинстве случаев дело обстоит скорее всего не совсем так. Что же происходит после образования про-вируса? Завладев «штаб-квартирой» клетки-хозяина, ВИЧ (теперь уже в форме провируса) вскоре начинает отдавать приказы, которым клетка вынуждена подчиняться. Этот момент называют активацией провируса. Насколько неизбежно он наступает? Ответ на этот вопрос, по сути дела, тот же, что и на наивный вопрос, поставленный перед детишками С. Маршаком:
Можно ль козам не бодаться,
Если рожки есть?
В пляс девчонкам не пускаться,
Если ножки есть?
Провирус, имеющий и «рожки» и «ножки», без долгих сомнений и размышлений вступает на тропу войны и «бодается» и «пляшет». Не осознавая еще опасности, клетка сама предоставляет вирусу все необходимы химические компоненты, все свои внутренние резервы для его развития и размножения. Сначала происходит транскрипция провируса, в результате которой образуются новые вирусные РНК, т. е. новые геномы. Подчиняясь генетической программе ВИЧ, которая теперь стала для клетки ее собственной, клетка начинает синтезировать на вирусной РНК вирусные белки. Поскольку первоначально синтезируются большие молекулы-предшественники, другой вирусный белок — протеаза — разрезает их на строго определенные блоки. Так клетка активно производит различные компоненты вируса, истощая этим себя. Затем на поверхности клеточной мембраны из этих компонентов происходит предварительная грубая «сборка» новых вирусных частиц из синтезированных клеткой блоков. Новые вирусы готовы! Они «отпочковываются» от клетки, после чего вирусы становятся «зрелыми», способными инфицировать новые клетки, т. е. готовыми к штурму новых линий обороны. Таков жизненный цикл вируса, который неизбежно заканчивается гибелью инфицированного Т-хелпера. По времени этот цикл (от связывания вируса с клеткой и до выхода первых вирусных частиц из инфицированной клетки) составляет менее суток (обычно от 15 до 20 часов). Скорость размножения ВИЧ очень высока — в организме инфицированного человека образуется порой до 10 млрд. новых вирионов в день. Хотя некоторые из них погибают под действием иммунной системы, остающиеся инфицируют новые лимфоциты, и цикл репликации вируса повторяется. Общее число инфицированных лимфоцитов в организме ВИЧ-позитивных пациентов составляет обычно величину от 10
Действие вируса в Т-клетке можно рассматривать как сценарий некой написанной неизвестным писателем драмы, которая отражает в общих чертах происходящую ситуацию. B данном случае некоторое повторение не помешает читателю более осмысленно понять, что же ВИЧ делает с Т-клеткой, чтобы в конечном итоге привести организм человека к СПИДу (repetitio est mater studiorum — повторение — мать учения).
Сценарий драмы под названием «ВИЧ-потрошитель»
Уже давно драматическая пьеса под этим названием идет ежедневно на миллионах «сценических площадок», но по-прежнему сохраняется в «театральном репертуаре». В этом спектакле и начало, и финал ясны заранее, но от этого интерес зрителя не исчезает.
Главный герой этой пьесы — ВИЧ-убийца. Странствуя по свету, маньяк-убийца ВИЧ попадает в новую страну-организм. Здесь он, обладая изощренными навыками взломщика и имея соответствующий набор ключей, быстро находит «дом», в который проникает без разрешения его хозяйки. Первое, что вирус делает при входе — он начинает «раздеваться». Далее по сценарию ВИЧ, нагрянув неожиданно в гости и встретив у порога растерявшуюся хозяйку, умудряется сразу так заморочить ей голову, что она, словно под гипнозом, начинает делать все, что только непрошеный гость пожелает. Пожеланий немного, но каждое из них исполняется хозяйкой быстро и беспрекословно. В реальности дело происходит так. По «рецепту» гостя, забыв о богатейшей собственной «кулинарной книге», хозяйка «испекает» несколько специальных «блюд»-ферментов — обратную транскриптазу и интегразу. Теперь гость получает возможность быстренько «переодеться» в квартире у хозяйки. Обратная транскриптаза неузнаваемо меняет его облик (это уже не ВИЧ-РНК, а ВИЧ-ДНК). Интеграза способствует тому, что хозяйка окончательно принимает преображенного гостя в свои объятья. ВИЧ становится почти своим, хорошо узнаваемым. Он даже меняет свое имя — теперь ВИЧ называется провирусом. После этого уже трудно сказать, кто в доме гость, а кто хозяин, и в конечном итоге происходит то, что и «задумано» гостем: он неизбежно сам становится хозяином, а хозяйка — его служанкой. Первый акт драмы закончен.
После антракта пьеса продолжается. Во втором акте возможны импровизации действующих «лиц». Провирус некоторое время может играть бессловесную роль. Вроде бы он есть, и вроде бы его нет. Он отдыхает, оценивает ситуацию. Никому не известно, когда он выйдет на сцену и начнет произносить свой монолог, после которого последует быстрый трагический финал. Здесь свою роль играют другие участники спектакля. Их называют факторы — актеры вторых ролей, но без них никак нельзя обойтись. Эти актеры участвуют в спектакле с самого начала, но были малозаметны. Однако если вдруг некоторые их них по каким-то причинам «заболеют», то спектакль вообще не начнется. Во втором акте от актеров-факторов также зависит многое, и в первую очередь время, когда заговорит главный «герой» — провирус. Полностью оценив ситуацию в доме, характер хозяйки, ее образ жизни и возраст, провирус начинает делать свое «черное дело». Он начинает производить огромное свое потомство. Бесконечные измывательства над приютившей его хозяйкой заканчиваются в конце концов ее гибелью. Прожорливое «потомство» набрасывается на соседние дома и, разоряя их, также продолжает размножаться в огромном количестве. Тут и наступает финал — в опустошенную страну вторгаются полчища врагов, которые раньше были малосильными, чтобы справиться самим, и которые в конечном итоге приводят страну-организм к гибели. Утешение для зрителя только одно: вместе погибают все: и хозяева, и их враги. Таков неизбежный финал драмы под названием «ВИЧ-потрошитель», напоминающий по трагизму финал шекспировского «Гамлета». Acta est fibula! (Пьеса сыграна!).
ВИЧ является на сегодняшний день одним из самых глубоко и детально изученных вирусов в истории человечества. Однако, несмотря на это, пока еще далеко не все аспекты ВИЧ-инфекции поняты полностью. Так, остается не до конца ясно, каким именно образом в конечном итоге вирус разрушает иммунную систему, каковы механизмы гибели Т-хелперов, почему некоторые люди с ВИЧ остаются абсолютно здоровыми в течение длительного времени? Тем не менее многое уже сегодня стало понятно. Об этот теперь и поговорим подробнее.
Поделитесь на страничкеСледующая глава >
med.wikireading.ru
как ВИЧ разрушает нашу иммунную систему
Статья на конкурс «био/мол/текст»: СПИД это болезнь иммунной системы, вызываемая вирусом иммунодефицита человека (ВИЧ). При СПИДе у человека медленно, но верно (в течение нескольких лет) развивается тотальный иммунодефицит, когда организм не может справиться почти ни с какими микробами (даже теми, которые никогда не заражают здорового человека). Так как иммунитет борется не только с микробами, но и с раковыми клетками, еще у заболевшего СПИДом резко повышается вероятность заработать рак. ВИЧ использует изощренные механизмы обхода и уничтожения нашей иммунной системы, всегда идя на шаг впереди нее.
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система
Для того чтобы разобраться, как вирус иммунодефицита человека (а именно так расшифровывается ВИЧ) разрушает иммунную систему, нужно прежде всего понять, что же это такое — иммунная система. Согласно одному из определений (по Р.В. Петрову), иммунитет — это способ защиты организма от живых тел и веществ, несущих в себе признаки генетической чужеродности. Проще говоря, иммунитет — это то, что защищает нас от бактерий, вирусов, любых высокомолекулярных чужеродных веществ (вспомним иммунитет против змеиного яда), попавших в организм, а также раковых клеток. В его основе лежат фагоциты (у животных называемые макрофагами), собственно уничтожающие (поглощающие) чужеродные тела, а также Т- и В-клетки иммунитета, осуществляющие точное «наведение» фагоцитов на патоген. При проникновении микроба в организм фагоциты его поглощают и переваривают [29].
Первичное распознавание врага происходит при помощи Toll-like рецепторов, или TLR [30]. Эти молекулы распознают структуры, общие для многих классов патогенов, но отсутствующие у человека (к примеру, TLR5 распознает белок флагеллин — главный компонент жгутиков бактерий, — а TLR3 активируется при наличии двухцепочечной РНК, появляющейся в жизненном цикле многих вирусов, в частности вируса гриппа А). После поглощения микроба его остатки «показываются» (презентируются) Т-хелперам. Т-хелперы активируются, и в свою очередь помогают активироваться B-лимфоцитам (последним для активации нужны молекулы патогена и сигналы активации от Т-хелпера). После этого B-лимфоциты превращаются в плазматические клетки и начинают синтез антител — молекул иммунитета, маркирующих вещества, подобные тем, что активировали B-лимфоциты. Антитела циркулируют в кровотоке и маркируют структуры патогена. Маркированные микробы и другие чужеродные тела поглощаются фагоцитами более эффективно.
Такой «сценарий» работает, когда микроб находится вне клеток организма (в случае заражения большинством бактерий и грибов). Если же враг проникает внутрь клетки (вирусы, некоторые бактерии, простейшие), а также когда враждебной становится сама клетка организма (в случае рака), в дело вступают Т-киллеры. Они находят и уничтожают зараженные клетки, после чего остатки этих клеток поглощаются все теми же фагоцитами. Для активации Т-киллерам требуются Т-хелперы. Помимо Т-киллеров в этом «сценарии» участвуют антитела (и, соответственно, B-лимфоциты), но их роль меньше, чем T-киллеров. Разумеется, в иммунитете есть и другие участники, но основной акцент в борьбе с ВИЧ приходится на тех, что были названы выше.

Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
Жизненный цикл ВИЧ
Рассмотрим жизненный цикл ВИЧ (см. видео). Первая стадия — это проникновение вируса. Сначала любой вирус должен как-нибудь «зацепиться» за клетку, и у разных вирусов для этой цели есть разные «якоря». Имеется таковой и у ВИЧ — белок gp120, который способен взаимодействовать с белком СD4 поверхности человеческой клетки. Это рецептор, присутствующий на многих клетках организма, но больше всего его на Т-хелперах (другое их название — СD4+ T-лимфоциты), — именно на них и направлен ВИЧ в первую очередь. При первоначальном связывании gp120 с CD4 вирусный белок изменяет свою форму и связывается с другими белками поверхности клетки — СХСR4 и ССR5, после чего происходит погружение другого вирусного белка — gp41 — в мембрану клетки. Вслед за этим оболочки клетки и вируса сливаются, и наследственный материал вируса попадает в цитоплазму клетки.
Видео. Жизненный цикл ВИЧ.
Нормальная функция СХСR4 и ССR5 — рецепция цитокинов (небольших растворимых молекул иммунной системы, посредством которых клетки иммунитета «общаются» друг с другом и другими клетками организма). Именно с мутацией ССR5 (Δ32 CCR5) связана врожденная устойчивость некоторых людей, гомозиготных (имеющих 2 копии мутированного CCR5) по этому гену, к ВИЧ [12], [18] (таких людей до 2% в Европе, Индии и странах Ближнего Востока [13]). К сожалению, эта устойчивость не является полной [3]; есть штаммы, заражающие и таких людей. Зато она в какой-то степени проявляется даже у гетерозигот (имеющих одну копию мутированного и одну копию обычного ССR5 ) [12], [18].

Рисунок 2. Проникновение вируса в клетку. А — первоначальное «зацепление» вируса с клеткой; В — начальный этап слияния вируса с клеткой. Условные обозначения: HIV-1 — поверхность капсида наиболее распространенной разновидности вируса — ВИЧ-1; Т-cell — поверхность Т-хелпера; gp120 — вирусный рецептор к к человеческому белку CD4; CD4 —корецептор во взаимодействии Т-лимфоцитов и антиген-презентирующих клеток; одновременно является рецептором к gp120; gp41 — вирусный белок, за который закреплен gp120; помимо этого играет важную роль в слиянии мембран вируса и клетки; CXCR4 или ССR5 — рецепторы хемокинов; корецепторы для белка gp120; RNA — вирусный геном.
После проникновения наследственного материала ВИЧ в клетку происходит процесс обратной транскрипции, то есть перенос информации с вирусной РНК на ДНК. Происходит это потому, что вирусный геном записан в виде РНК, а геном человека — в виде ДНК. Вирусу же «хочется» записать себя в геном клетки, ведь именно он управляет последней. К тому же, если иммунитет имеет средства для распознавания вирусных белков и РНК, то ДНК, интегрированную в геном клетки, иммунитет распознать не может.
Обратная транскрипция осуществляется вирусным белком обратной транскриптазой [31]. Обратная она потому, что обычно в клетке все наоборот — информация переносится с ДНК на РНК (а с РНК — в последовательность аминокислот белков). РНК по сравнению с ДНК очень нестабильна, и поэтому для ВИЧ характерна огромная скорость мутации — в десятки тысяч раз быстрее, чем для человека. Если скорость нейтральных мутаций для ДНК составляет у различных видов и для различных генов в среднем меньше 10−9 замен на сайт в год, то скорость мутирования генетического материала РНК-вирусов — около 10−3 замен на сайт в год (у гена env ВИЧ: 10−2–10−3 замен на сайт в год [21]). Это одна из причин, почему иммунная система не может справиться с ВИЧ — он слишком быстро изменяется.
После обратной транскрипции геном вируса вставляется в геном человека вирусным белком интегразой. Проникнув в геном, вирус может «сидеть» в нем несколько лет, никак себя не проявляя. В основном, вирус начинает размножаться в активированных (делящихся) T-лимфоцитах, хотя по немногу он может работать и в неделящейся клетке [17]. Это главная причина, почему ВИЧ неизлечим (но есть работа, в которой полностью удалось излечить от ВИЧ клеточную культуру [32]) — в человеке всегда есть «дремлющие» копии вируса, неопределимые для иммунной системы, но способные к «пробуждению» в любой момент (та же история и с герпесом — его как и ВИЧ невозможно полностью удалить из организма).
«Будильником» для вируса служит активация клетки: промотор вируса содержит последовательность, гомологичную последовательности NF-κB [10], [15], каковая есть у многих генов иммунитета. (Промотор регулирует работу гена и определяет, как, когда и в каких количествах будет появляться белок в той или иной клетке.) Вспоминая о том, что ВИЧ заражает в основном Т-хелперы, мы получаем интересную картину: пока клетка не активирована, вирус «спит»; как только клетка начинает выполнять свою функцию (иммунитет) — вирус «просыпается» и убивает эту клетку. Можно также добавить, что при ВИЧ-инфекции активируются в первую очередь те клоны Т-клеток, которые специфичны для ВИЧ-белков.
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
Перейдем теперь к тому, как вирус уничтожает иммунную систему. В основном все сводится к включению у Т-клеток запрограммированной клеточной гибели, или апоптоза (В норме апоптоз включается у клеток, которые дефектны или не нужны организму — например, у клеток хвоста эмбриона человека. Большинство потенциальных раковых клеток умирает путем апоптоза. Более того, если клетка «почувствует» при помощи TLR’ов заражение вирусом, она попытается умереть опять-таки через апоптоз (хотя почти у всех вирусов есть механизмы его блокирования)). Само производство вируса не проходит для Т-хелпера бесследно, и со временем он погибает. Причины этого до конца не понятны, но можно выделить несколько возможных.
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4+-клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
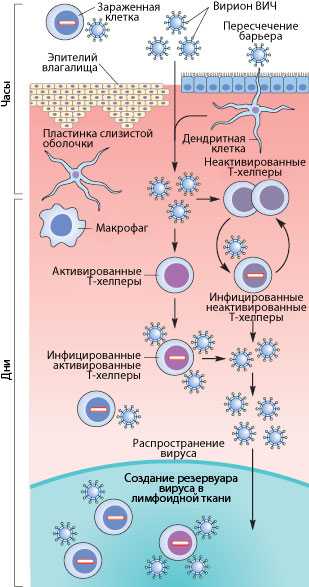
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Но даже в отсутствии микротравм ВИЧ может проникнуть внутрь организма через дендритные клетки (разновидности макрофагов), которые могут выпускать свои отростки в просвет слизистой. Там они захватывают вирусы и бактерии, после чего происходит презентация захваченного материала Т-хелперам. Таким образом организм готовится «тепло встретить» микробов, присутствующих в окружающей среде. Но в нашем случае, дендритные клетки лишь заражаются вирусом — напрямую свободными вирионами или же при контакте с зараженными лимфоцитами, которые могут присутствовать в сперме (общее число лимфоцитов в сперме — до 1 млн/мл и больше).
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
На данный момент имеется огромное количество информации о ВИЧ; известны его структура, последовательность генома, жизненный цикл; изучен почти каждый шаг вируса в организме. Уже сейчас на стадии клинических испытаний находится множество лекарственных средств, а ВААРТ (высокоактивная антиретровирусная терапия) позволяет зараженному ВИЧ иметь почти такую же продолжительность жизни, как у здорового человека. Науке известно и два случая полного излечения от ВИЧ. Один из них известен как случай «берлинского пациента», которому пересадили костный мозг от донора с мутацией Δ32 ССR5. Другой прецедент произошел в США, где ребенка, родившегося от ВИЧ-инфицированной матери, сразу после рождения подвергли ВААРТ. Через два года после рождения девочки мать отказалась продолжать ее лечение, и через 10 месяцев при повторном осмотре врачи констатировали полное выздоровление девочки.
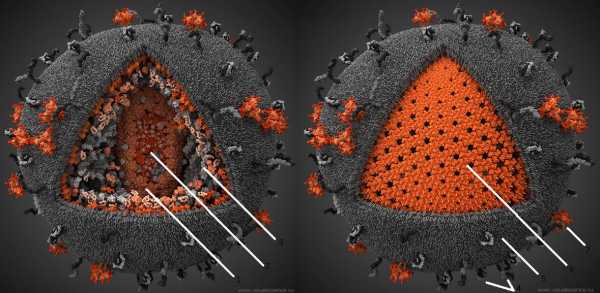
Рисунок 4. Компьютерная модель ВИЧ. Серым цветом показаны человеческие структуры, «украденные вирусом из клетки», красным — вирус-специфические белки. 1 — капсид вируса, состоит из 250 гексамеров и 12 пентамеров белка p24. 2 — Геном вируса, а также связанные с ним белки, представлен двумя идентичными молекулами РНК по ~10000 нуклеотидов в каждой. Всего геном включает девять генов, которые в результате альтернативного сплайсинга кодируют 15 различных белков. 3 — Различные белки, захваченные вирусом из хозяйской клетки. 4 — Человеческие белки, обычно находящиеся на поверхности мембраны клеток. Захваченые в результате отпочковывания, они увеличивают вирулентность вируса. 5 — Внешняя оболочка ВИЧ, ведущая свое происхождение от цитоплазматической мембраны клетки, от которой когда-то отпочковался вирион. 6 — Матрикс, образованный тримерами белка р17. 7 — Тримерные комплексы белков gp120 и gp41, при помощи которых вирус проникает в клетку. На поверхности среднего вириона насчитывается около 20 таких тримеров. Чтобы увидеть рисунок в полном размере, нажмите на него.
…Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.
- J. B. Alimonti. (2003). Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS. Journal of General Virology. 84, 1649-1661;
- Bartz S.R. and Emerman M. (1999). Human immunodeficiency virus type 1 Tat induces apoptosis and increases sensitivity to apoptotic signals by up-regulating FLICE/caspase-8. J. Virol. 73, 1956–1963;
- Robyn Biti, Rosemary Ffrench, Judy Young, Bruce Bennetts, Graeme Stewart, Tong Liang. (1997). HIV-1 infection in an individual homozygous for the CCR5 deletion allele. Nat Med. 3, 252-253;
- Chang H.S., Samaniego F., Nair B.C., Buonaguro L., Ensoli B. (1997). HIV-1 Tat protein exits from cells via a leaderless secretory pathway and binds to extracellular matrix-associated heparan sulfate proteoglycans through its basic region. AIDS. 11, 1421–1431;
- Kevin M. De Cock, Mary Glenn Fowler, Eric Mercier, Isabelle de Vincenzi, Joseph Saba, et. al.. (2000). Prevention of Mother-to-Child HIV Transmission in Resource-Poor Countries. JAMA. 283, 1175;
- Mari´a Eugenia Gonza´lez, Luis Carrasco. (2001). Human Immunodeficiency Virus Type 1 VPU Protein Affects Sindbis Virus Glycoprotein Processing and Enhances Membrane Permeabilization. Virology. 279, 201-209;
- Marko Salmi, Sirpa Jalkanen. (2005). Cell-surface enzymes in control of leukocyte trafficking. Nat Rev Immunol. 5, 760-771;
- Gero Hütter, Daniel Nowak, Maximilian Mossner, Susanne Ganepola, Arne Müßig, et. al.. (2009). Long-Term Control of HIV byCCR5Delta32/Delta32 Stem-Cell Transplantation. N Engl J Med. 360, 692-698;
- Jewett A., Giorgi J.V., Bonavida B. (1990). Antibody-dependent cellular cytotoxicity against HIV-coated target cells by peripheral blood monocytes from HIV seropositive asymptomatic patients. J. Immunol. 145, 4065–4071;
- Kawakami K., Schidereit C., Roeder R.G. (1988). Identification and purification of a human immunoglobulin-enhancer-binding protein (NF-kappa B) that activates transcription from a human immunodeficiency virus type 1 promoter in vitro. Proc. Natl. Acad. Sci. USA. 85, 4700–4704;
- J. Michael Kilby, Joseph J. Eron. (2003). Novel Therapies Based on Mechanisms of HIV-1 Cell Entry. N Engl J Med. 348, 2228-2238;
- Marmor M., Sheppard H.W., Donnell D., Bozeman S., Celum C. (2001). Homozygous and Heterozygous CCR5-[DELTA]32 Genotypes Are Associated With Resistance to HIV Infection. J. Acquir. Immune Defic. Syndr. 27, 472–481;
- Jeremy J. Martinson, Nicola H. Chapman, David C. Rees, Yan-Tat Liu, John B Clegg. (1997). Global distribution of the CCR5 gene 32-basepair deletion. Nat Genet. 16, 100-103;
- RADMILA METLAŠ, VESNA SKERL, VELJKO VELJKOVIČ, ALFONSO COLOMBATTI, SÁNDOR PONGOR. (1994). Immunoglobulin-Like Domain of HIV-1 Envelope Glycoprotein gp120 Encodes Putative Internal Image of Some Common Human Proteins. Viral Immunology. 7, 215-219;
- Gary Nabel, David Baltimore. (1987). An inducible transcription factor activates expression of human immunodeficiency virus in T cells. Nature. 326, 711-713;
- Avi Nath. (2002). Human Immunodeficiency Virus (HIV) Proteins in Neuropathogenesis of HIV Dementia. J INFECT DIS. 186, S193-S198;
- Nathanson N., Overbauch J. (2007). HIV, SIV and the Pathogenesis of AIDS. Viral Pathogenesis and immunity. Second edition, p. 185–200;
- Michel Samson, Frédérick Libert, Benjamin J. Doranz, Joseph Rucker, Corinne Liesnard, et. al.. (1996). Resistance to HIV-1 infection in Caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene. Nature. 382, 722-725;
- G. Shaw, B. Hahn, S. Arya, J. Groopman, R. Gallo, F Wong-Staal. (1984). Molecular characterization of human T-cell leukemia (lymphotropic) virus type III in the acquired immune deficiency syndrome. Science. 226, 1165-1171;
- Peter J. Southern. (2013). Missing out on the biology of heterosexual HIV-1 transmission. Trends in Microbiology. 21, 245-252;
- D A Steinhauer, J J Holland. (1987). Rapid Evolution of RNA Viruses. Annu. Rev. Microbiol.. 41, 409-431;
- Tateyama M., Oyaizu N., McCloskey T.W., Than S., Pahwa S. (2000). CD4 T lymphocytes are primed to express Fas ligand by CD4 cross-linking and to contribute to CD8 T-cell apoptosis via Fas/FasL death signaling pathway. Blood. 96, 195–202;
- V. Veljković, R. Metlaš. (1992). Identification of immunoglobulin recombination elements in human immunodeficiency virus type 1 envelope gene. Immunology Letters. 31, 11-14;
- Michael O. Westendorp, Rainer Frank, Christina Ochsenbauer, Kirstin Stricker, Jens Dhein, et. al.. (1995). Sensitization of T cells to CD95-mediated apoptosis by HIV-1 Tat and gp120. Nature. 375, 497-500;
- M. B. ZAITSEVA, S. A. MOSHNIKOV, A. T. KOZHICH, H. A. FROLOVA, O. D. MAKAROVA, et. al.. (1992). Antibodies to MHC Class II Peptides are Present in HIV-1-Positive Sera. Scand J Immunol. 35, 267-273;
- Zauli G., Gibellini D., Secchiero P., Dutartre H., Olive D., Capitani S., Collette Y. (1999). Lymphoid Cells to Apoptosis via Functional Upregulation of the CD95/CD95 Ligand Pathway. Blood. 93, 1000–1010;
- Зайхнер С. Молекулярная биология ВИЧ для клиницистов;
- Хаитов Р.М. и Игнатьева Г.А. СПИД. Народная академия культуры и общечеловеческих ценностей, 1992;
- Ярилин А.А. Иммунология. ГЭОТАР-Медиа, 2010;
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- «Швейцарский нож» вирусной армии: разгадан секрет обратной транскриптазы;
- Как «вырезать» вирус?;
- Связанные одной лентой.
biomolecula.ru
Гка им.Маймонида. 3 курс, 1 поток. Балин. М.В. Реферат по микробиологии на тему « Возбудитель вич »
2014 год
План:
Историческая справка.
Классификация возбудителя.
Строение вирусной части.
Жизненный цикл развития.
Устойчивость вируса.
Факторы патогенности.
Клиника.
Иммунитет.
Микробиологическая диагностика.
Лечение.
Профилактика.
1) Историческая справка.
Возбудитель ВИЧ- инфекции относится к семейству Retroviridae. Представители этого семейства поражают самых различных животных — грызунов, птиц, млекопитающих, человека. Вирусы входящие в это семейство являются РНК-овыми, они способны с помощью обратной транскриптазы образовывать ДНК на матрице вирусной РНК. ДНК затем способна встраиваться в хромосому клетки и существовать там. Этим обусловлены особенности эпидемиологии ретровирусных инфекций — наличие как горизонтального, так и вертикального пути передачи. Вертикальный путь передачи это путь передачи потомству в составе хромосомы (не в процессе родов, а по наследству во время формирования зиготы). Возбудитель ВИЧ- инфекции относится к роду Lentovirus, который включает в себя тех представителей семейства ретровирусов, которые вызывают медленные вирусные инфекции. ВИЧ-1 был открыт в 1982 году Галло и параллельно Мортанье. ВИЧ-2 был открыт в 1985 году, впервые описан в Западной Африке. Структурно ВИЧ-1 отличается от ВИЧ-2 по строению гликопротеидов мембраны. Чаще всего встречается ВИЧ-1. Клиника, патогенез заболеваний вызываемых вирусами одинаковы.
2) Классификация возбудителя.
Простейшие:
Toxoplasma gondii.
Ysospora belli.
Cryptosporidium spp.
Pneumocystis carinii.
Грибы:
Candida albicans.
Cryptococcus neoformans.
Histoplasma capsulatum.
Coccidioides immitis.
Бактерии:
Salmonella spp.
Mycobacterium avium complex.
Mycobacterium tuberculosis.
Вирусы:
Herpes simplex.
Cytomegalovirus hominis.
Строение вирусной части.
Строение вируса. В центре вирусной частицы находятся 2 зигзагообразных молекулы РНК. Вместе с молекулами РНК находятся 2 молекулы обратной транскриптазы (или ревертазы). Они упакованы с помощью белков: р-15, р-24. Вирус имеющее внешнюю оболочку, представленную белком р-18 и липопротеидную оболочку — суперкапсид. Липопротеид имеет антигенные детерменанты — молекулы гликопротеидов, напоминающие гриб, ножка которого погружена в мембрану суперкапсида, а шляпка обращена наружу. Шляпка образована так называемым гликопротеидом р-120, а ножка представлена gp-41. Весь гликопротеидный рецептор, включающий в себя и шляпку и ножку называется gp- 160. Вирус имеет округлую форму, средние размеры 100-140 нм, вирус является сложным (окружен суперкапсидом и белковыми оболочками). Геном вируса содержит 9 генов из них 3 структурных и 6 регуляторных. Геном является очень изменчивым: постоянно идет процесс антигенного дрейфа. Существует несколько серологических рас вируса: 8 уже сформированных антигенных вариантов: A B C D E F G H. Значение варианта вируса позволяет предположить источник заражения. Так например в Африке чаще всего встречается антигенные варианты F G H, В чаще всего передается среди гомосексуалистов. Высокая изменчивость, текучесть антигенного состава крайне затрудняет разработку специфической профилактики — разработку вакцины.
studfiles.net
Жизненный цикл ВИЧ — ТолВИКИ
Вирус Иммунодефицита Человека (ВИЧ), подобно всем вирусам является внутриклеточным паразитом. Сама по себе вирусная частица не способна размножаться и причинять вред до тех пор, пока она не попадет внутрь клетки-хозяина. Понимание механизма проникновения ВИЧ в клетку и его жизненного цикла дало возможность ученым разработать противовирусные препараты, сдерживающие его развитие, а также работать над созданием профилактических вакцин и препаратов полностью уничтожающих вирус. Для людей, живущих с ВИЧ/СПИДом, знание того, как работает ВИЧ и действуют лекарства, дает возможность не только поверить в эффективность противовирусного лечения, но и дает надежду на будущее. Попадая в организм, тем или иным способом, ВИЧ отдает предпочтение иммунным клеткам, на поверхности которых имеются молекулы (рецепторы) CD4+, благодаря которым вируc проникает в клетку. Основными носителями CD4+ молекул являются Т-лимфоциты-хелперы, которые также называют Т4+ или СD4+-лимфоциты и макрофаги. Эти клетки являются важными элементами иммунной системы и их разрушение под действием ВИЧ приводит к иммунодефициту. Жизненый цикл ВИЧ состот из нескольких этапов и на каждом из них можно создать и применить лекарства, которые остановят его развитие.
Медиа:Lifecycle_animation.swf
Слияние.
Первый этап жизненного цикла ВИЧ – это взаимодействие его с мембраной (оболочкой) клетки-хозяина. Имеющиеся на поверхности вируса белки gp120 соединяются с рецепторами CD4+ и плотно прикрепляются к оболочке клетки. Этот процесс соединения оболочки вируса с мембраной клетки называется “слиянием” и рецепторы CD4+ играют в нем функцию “связного устройства”. Недавно созданные лекарственные препараты, которые называются ингибиторами слияния, могут предотвратить этот процесс.
Транскрипция.
После того, как ВИЧ успешно прикрепился и слился с клеткой, он “открывает” ее, как отмычкой и проникает во внутрь. Генетическая информация ВИЧ заключена в РНК (рибонуклеиновая кислота), а носителем генетической информации клетки, в которую проник вирус, как впрочем и всех клеток человеческого организма, является ДНК (дезоксирибонуклеиновая кислота). Вирусу необходимо перевести свою генетическую информацию, т.е. РНК в ДНК для того, чтобы клетка могла его понять. Для этого ВИЧ использует фермент – обратную транскриптазу, с помощью которой РНК вируса превращается в ДНК-транскрипт (ДНК-копию). Теперь клетка-хозяин понимает ДНК вируса и принимает, как “свою”. Этот процесс называется транскрипцией. Существует ряд противовирусных препаратов – ингибиторы обратной транскриптазы, блокирующие этот процесс.
Интеграция.
Следующий этап жизненного цикла ВИЧ называется интеграцией (объединением). На этом этапе вновь созданная вирусная ДНК, которая называется провирусом, проникает в ядро клетки и встраивается в ее ДНК, т.е. “перепрограммирует” ее. Теперь клетка-хозяин будет “пожизненно” нести инфекционное начало, более того передавать генетический материал ВИЧ потомству. Процесс интеграции происходит благодаря ферменту – интеграза. В настоящее время уже разработаны и находятся на стадии испытания средства препятствующие процессу интеграции. 5Интегрировавший в ДНК клетки, вирус может долгие годы оставаться в неактивном состоянии и ничем себя не обнаруживать. Эта способность ВИЧ объясняет длительный латентный (скрытый) период ВИЧ-инфекции и является главным препятствием для создания препаратов уничтожающих вирус.
Репликация.
Однако возможен и другой вариант, при котором ВИЧ сразу же начинает интенсивное производство себе подобных вирусов. Этот самый ответственный этап в жизненном цикле ВИЧ называется репликацией. Подчиняясь генетической программе вируса клетка-хозяин начинает производить различные компоненты ВИЧ. Составные части вируса объединяются в не зрелый вирус и прикрепляются к внутренней поверхности мембраны клетки. Под действием фермента – протеазы окончательно формируется зрелый вирус. Формированию зрелого вируса могут помешать препараты — ингибиторы протеазы.
Отпочковывание.
На последнем этапе жизненного цикла вирус отпочковывается от клетки, окруженный “клочком” мембраны клетки-хозяина, который содержит последний структурный элемент ВИЧ – белок оболочки. Один из компонентов этого белка gp120 – тот самый белок, определяющий способность ВИЧ заражать новые клетки. Новые вирусы проникают в новые клетки и весь процесс начинается заново.
wiki.tgl.net.ru
Научная иллюстрация вируса иммунодефицита человека (ВИЧ)
Процесс присоединения вирусной частицы к поверхности клетки-мишени и последующее слияние вирусной и клеточной мембран происходит при помощи гликопротеидного комплекса gp120/gp41. Оба белка, входящие в состав этого комплекса, кодируются вирусным геном env и синтезируются сначала в виде белка-предшественника gp160, который по остаткам аспарагина гликозилируется богатыми маннозой олигосахаридами, а затем процессируется с образованием двух субъединиц [1].
Гликопротеидные поверхностные комплексы gp120/gp41 формируют тримеры. На поверхности среднего вириона насчитывается около 20 таких тримеров [2, 3]. В зрелом комплексе субъединицы gp120 и gp41 связаны нековалентно. Белок gp41 является трансмембранным, а gp120 связывается на стадии инфекции с рецептором CD4, расположенном на мембране T-лимфоцитов [4].
В результате взаимодействия gp120 с рецептором CD4 конформация вирусного белка меняется, что дает ему возможность впоследствии связаться с одним из двух корецепторов на поверхности Т-лимфоцита: CCR5 или CXCR4. Это событие влечет за собой конформационные изменения уже в субъединице gp41, которые и провоцируют последующее слияние вирусной и клеточной мембраны [5].
Вместе с клеточной мембраной вирусная частица захватывает и некоторые поверхностные белки заражаемых клеток [6]. В данной модели представлены три белка, захваченные вирионом из клетки-хозяина: ICAM-1, HLA-DR1 и DAF.
HLA-DR1 (Human Leukocyte Antigen) — это одна из молекул главного комплекса гистосовместимости класса II. Молекулы этого класса участвуют в презентации антигенов CD4+ Т-лимфоцитам и могут связываться с рецепторами CD4 на их поверхности. Наличие молекул HLA в мембране вириона ВИЧ повышает его вирулентность [9].
ICAM-1 (Intercellular Adhesion Molecule 1), также известный как CD54) в организме человека участвует в межклеточных взаимодействиях и формировании иммунологических синапсов [7]. Молекула ICAM — это гомодимер, структурно сходный с иммуноглобулинами. Наличие ICAM в оболочке ВИЧ также увеличивает его вирулентность [8].
CD55 (также известный как DAF, Decay-accelerating factor) в человеческих клетках участвует в негативной регуляции клеточной системы комплемента, блокируя сборку мембраноатакующего комплекса. Считается, что этот белок в мембране ВИЧ может предохранять вирион от уничтожения иммунной системой [10].
Мембраны вирусных частиц ВИЧ формируются из мембран зараженных вирусом клеток. При этом вирусная и клеточная мембраны отличаются по соотношению входящих в их состав липидов. Благодаря этому вирусная мембрана оказывается менее пластичной и отличается от клеточной по ряду других свойств [11].
В сравнении с мембраной Т-лимфоцитов, в липидной оболочке ВИЧ содержится существенно больше сфингомиелинов (на), фосфатидилсерина и холестерина, тогда как уровень типичных для клеток млекопитающих фосфатидилхолина и фосфатидилэтаноламина в вирусной мембране ниже в 2–3 раза [12]. Состав вирусной мембраны имеет принципиальное значение для жизнедеятельности ВИЧ. Так, например, ингибирование биосинтеза сфинголипидов может снижать инфекционную способность вируса [13].
Вирусные частицы ВИЧ отпочковываются от сравнительно плотных участков клеточной мембраны со специфическим липидным составом — липидных рафтов. Считается, что эти участки выполняют функции доставочных или концентрационных платформ в таких процессах как передача клеточных сигналов, сортировка мембранных белков или формирование клеточной полярности [14].
Матрикс, образованный структурным белком MA (matrix protein, также обозначаемый как p17)расположен непосредственно под липидной оболочкой вириона, который, как и три других белка ВИЧ (CA, NC и p6), формирующих капсид, нуклеокапсид и участвующих в сборке и nbsp;созревании вириона, кодируется вирусным геном Gag [15].
В зрелом вирионе матрикс состоит из тримеров MA [16]. Каждая из субъединиц тримера связана с молекулой миристиновой кислоты, за счет которой они заякориваются в вирусной мембране [17].
visual-science.com
Вирус иммунодефицита человека
Вирус иммунодефицита человека (ВИЧ) был выделен в 1983 г. группой профессора Люка Монтанье из лимфатического узла больного СПИДом в Парижском институте Пастера. В том же году в США группа профессора Роберта Гало выделила вирус из лимфоцитов периферической крови больных СПИДом. Оба вируса оказались идентичными и ВОЗ в 1987 г. приняла единое название — НIV (Human Immunodeficiency Virus). На русском языке он звучит как ВИЧ – вирус иммунодефицита человека. По мнению некоторых специалистов, ВИЧ произошел от SIV-инфицированного человека 30–90-е годы в Центральной Африке. ВИЧ-2 более сходен с SIV (шимпанзе – естественный хозяин африканского ареала), нежели с ВИЧ-1. ВИЧ-1 распространен во всем мире, первая группа эпидемий прошла в Африке, вторая и третья — в Америке и Западной Европе, четвертая сейчас существует в Азии. Глобальное и интенсивное распространение болезни обусловлено образованием новых штаммов ВИЧ (Патрушева Н.Б. с соавт., 2001; Воробьев П.А. с соавт, 2006).
ВИЧ-инфекция протекает со сменой нескольких стадий, последнюю из которых обозначают термином «синдром приобретенного иммунодефицита» – СПИД. Вирус иммунодефицита человека – представитель семейства ретровирусов относится к подсемейству лентивирусов (медленных вирусов). Зрелый вирион имеет округлую форму диаметром около 100-120 нм. ВИЧ-1 представлен оболочкой, матриксным слоем, оболочкой нуклеотида, геномной РНК, в которую включены фрагмент комплекса интеграции и нуклеопротеиды, а также латеральные тельца (Хаитов Р.М., Игнатьева Г.А.,1992; Карпищенко А.И., 2001). При среднем увеличении в электронном микроскопе можно увидеть ядро и оболочку вируса. Наружная мембрана вируса пронизана собственными белками (оболочечные белки) gр 41 и gр120, получившими название от термина «glycoprotein» с молекулярной массой 41 и 120 kD, связь между ними лабильна. Эти белки образуют 72 отростка на поверхности мембраны вируса, каждый состоит из 3 молекул gр120. Молекулы gр120 могут отрываться от вирусной частицы и с током крови поступать в ткани, что имеет существенное значение в патогенезе ВИЧ-инфекции. Между наружной оболочкой вириона и нуклеотидом существует каркас, толщиной 5-7 нм, который состоит из молекул белка, называемого матриксным протеином р17. Возможно, что р17 имеет выход и на внешнюю сторону вириона, так как известны примеры антител, специфичных к р17, которые проявляют вируснейтрализующую активность in vitro в отношении препарата внеклеточных вирусных частиц (Карпищенко А.И., 2001; Патрушева Н.Б. с соавт., 2001) (рис.1).
Оболочка нуклеотида построена из молекул белка р24. Внутри нуклеотида заключены: геном вируса, представляющий из себя диплоидный набор одноцепочечных молекул РНК (две молекулы РНК), протеин р7, связанный с РНК, и комплекс ферментов: обратная транскриптаза, РНКаза Н, протеаза, интеграза. В зрелых вирионах, вероятно, также в нуклеотиде ВИЧ, содержится регуляторный белок Vpr, продукт гена vpr. В одной вирусной частице содержится несколько копий молекул этого белка, который выполняет решающую роль в жизненном цикле ВИЧ, т.е. является трансактиватором трансляции РНК с вирусных генов в самом начале нового репликативного цикла, когда еще не наработан другой трансактиватор транскрипции и трансляции – вирусный белок Tat (Brookmeyer R., 1991). По бокам от нуклеотида наблюдаются два симметричных электронно-плотных образования, которые называются латеральными тельцами. Их состав и функции еще не известны. В составе зрелых вирионов ВИЧ-2 находят белок Vpx, который составляет более 10 % общей массы белков вириона и относится к регуляторным, но его локализация в вирионе не известна (Покровский В.В., с соавт., 2000).
Белки вириона в организме инфицированного человека определяют иммунный ответ с синтезом иммуноглобулинов (Lender B., 1998). Доказано, что вирусная частица, попавшая в кровоток, прикрепляется с помощью поверхностного гликопротеина gр120 к клеточным рецепторам С134. После прикрепления gр120 отодвигаются, а гидрофобные концы другого поверхностного гликопротеина gр41 проникают сквозь мембрану клетки, в результате чего поверхности клетки и вирусной частицы сливаются. Двухцепочечная РНК проникает в клетку, обратная транскриптаза катализирует синтез провирусной ДНК. Двухцепочечная ДНК интегрируется в ДНК клетки-хозяина с помощью фермента интегразы. Провирусная ДНК становится матрицей для транскрипции, в результате которой образуется РНК, которая дает начало новой вирусной частице (Capon D., Ward R., 1991; Lender B., 1998).
Важнейшие белки ВИЧ-1 и ВИЧ-2
ВИЧ-1
Env- gp 160, 120, 41
gag- p 17, 24, 55
(БЕЛКИ ОБРАТНОЙ ТРАНСКРИПЦИИ)
pol- p 31, 51, 66
ВИЧ-2
Env- gp 140, 105, 36
gag- p 16, 25, 56
(БЕЛКИ ОБРАТНОЙ ТРАНСКРИПЦИИ)
pol- p 58
Характеристика вируса
Вирус не стоек во внешней среде!
Инактивация:
при нагревании до 56% в течение 30′;
при кипячении в течении 1-5′;
при резком изменении рH среды;
быстро погибает под действием дезинфектантов в концентрациях, обычно используемых в практике (3-6% h3О2; 70% этанол; эфир, ацетон и т.д.)
в крови для переливания вирус живет годами;
в замороженной сперме — несколько месяцев;
вирус теряет активность под воздействием защитных ферментов слюны и пота.
Эпидемиология
Источник инфекции
● больной человек на всех стадиях заболевания; ● вирусоноситель Вирус обнаруживают в: — крови — сперме — слюне — грудном молоке — слезной жидкости — вагинальном и цервикальном секретах — биоптатах различных тканей — спинномозговой жидкости
Инфекция передается тремя путями: 1. Половым (беспорядочные половые связи,гомосексуализм, проституция). 2. Парентеральным (наркомания, мед.инструментарий, гемотрансфузии, нанесение татуировок, маникюр, педикюр, ЭКО). 3. От матери плоду (вероятность заражения 25-50%).
ИММУНОПАТОГЕНЕЗ ВИЧ-ИНФЕКЦИИ И СПИДА
Вирус через входные ворота разносится макрофагами по различным органам и тканям. ВИЧ избирательно поражает только клетки несущие белок-рецептор СD4, к которому имеет сродство gp 120 (ключ к замку) – Т-хелперы (Т4-лимфоциты), Т-супрессоры(Т8-лимфоциты), CD8-лимфоциты, 40% моноцитов (макрофагов), 5% В-лимфоцитов, клетки мозга-нейроглия и дендриты, эпителиальные клетки слизистой прямой кишки, сосудистый эндотелий.
Репликативный цикл HIV в клетке Т4
Адгезия белка вируса gp 120(gp 105 при ВИЧ-2) с белком СD4.
Пенетрация — разрушение вирусной частицы.
«Раздевание» вируса и высвобождение его РНК и фермента обратной транскриптазы, с помощью которого на вирионной РНК синтезируется ДНК-копия вируса, которая проникает в ядро клетки-мишени и встраивается в ее геном.
Далее синтезируется кольцевая двунитчатая ДНК, транскрипция, синтез мРНК, трансактивизация, сборка и почкование.
Т-хелперы — резервуар размножения и накопления новых вирусных частиц.
Клинико-иммунологическая классификация ВИЧ-инфекции
О. Нулевая стадия-антитела не выявляются
І. Острая инфекция (мононуклеозоподобный синдром, в крови антитела к ВИЧ)
ІІ. Хроническая лимфаденопатия
ІІІ. ІV. Субклинические нарушения иммунной системы
V. ПреСПИД
VІ. СПИД, антитела к ВИЧ могут не определяться
Клиническая классификация ВИЧ-инфекции:
І. Инкубационный период: от 2-3 недель до 3 месяцев, максимум 1 год (клиники нет, серонегативность;
ІІ. Стадия первичных проявлений:
А. Острая лихорадочная фаза
Б. Бессимптомная фаза (здоровый вирусоноситель, ИФА «+»)
В. Персистирующая генерализованная лимфаденопатия
ІІІ. Стадия вторичных заболеваний
ІV. Терминальная стадия
Иммунология ВИЧ-инфекции
Формируется неполноценность макрофагального и Т-хелперного звеньев системы иммунитета;
динамика соотношения Т-хелперов и Т-супрессоров определяет длительность латентного периода заболевания и вектор поражения внутренних органов и тканей;
у 90-95% инфицированных лиц антитела к ВИЧ появляются в пределах от 3 недель до 3 месяцев, у 52,9% — в течение 6 месяцев, у 0,5-1% — в более поздние сроки;
вируснейтрализующая активность сыворотки крови в целом невысока: антитела становятся простыми свидетелями процесса (высокая мутабельность вируса).
Основные лабораторные
методы:
studfiles.net
Лекция №16. Ретровирусы. Вирус иммунодефицита человека — Мегаобучалка
Вирус иммунодефицита человека (ВИЧ или HIV) относится к семейству ретровирусов, подсемейству лентивирусов (медленных вирусов). Геном ретровирусов уникален — он представлен двумя идентичными молекулами позитивной РНК, т.е. это РНК — вирусы с диплоидным геномом. Свое название ретровирусы получили за отличительные особенности репродукции (РНК à ДНК à иРНК à геномная РНК). Особенности репродукции связаны с функциями фермента обратной транскриптазы (ревертазы или РНК — зависимой ДНК — полимеразы), обладающей тремя видами активности — обратной транскриптазы, РНК — азы и ДНК — полимеразы.
Семейство Retroviridae включает три подсемейства.
1. Lentivirinae — возбудители медленных вирусных инфекций, в т.ч. ВИЧ.
2. Oncovirinae — онкогенные вирусы, с которыми связано превращение клеток в опухолевые. Раньше не знали, как РНК — вирусы могут встраиваться в геном клетки и способствовать опухолевому росту (не были известна возможность обратной транскрипции у вирусов), что тормозило научную разработку вирусологии опухолевого роста.
3. Spumavirinae — “пенящие” вирусы, название которых связано с характерным “вспененным” видом инфицированных ими клеточных культур как результатом интенсивного симпластообразования.
Первыми открытыми в конце 70- х годов ретровирусами были HTLV-1 и HTLV-2 (от “human T- lymphotropic virus) — возбудители Т — клеточных лейкозов и лимфом. Наиболее известны обладающие лимфотропным и цитопатическим действием вирусы ВИЧ-1 (HIV-1 в английском варианте) и ВИЧ-2, вирус иммунодефицита обезьян (ВИО или SIV), к которому по ряду свойств ближе (чем к ВИЧ-1) ВИЧ-2. К настоящему времени имеется информация уже о нескольких сотнях ретровирусов, интегрированных с геномом человека и практически очень мало об их роли в патологии.
История изучения и происхождения ВИЧ.
Синдром приобретенного иммунодефицита (СПИД) впервые выделен как самостоятельное заболевание в США в 1981г. Возбудитель (ВИЧ-1) был описан почти одновременно в 1983г. французом Л.Монтанье и американцем Р.Галло. Эпидемиология нового вида патологии поражала своей необычностью. Почти 100% больных были мужчинами в возрасте 25-49 лет, 94% — гомо- или бисексуалами, отмечалась высокая летальность. У больных были выявлены дефекты клеточного иммунитета, развитие пневмоцистозной пневмонии, кандидоза и саркомы Капоши у них было расценено как оппортунистические заболевания. СПИД окрестили болезнью четырех “H”— по первым буквам английских вариантов слов гомосексуалы, гемофилия, гаитяне и героин. В 1986г. был идентифицирован еще один вирус — ВИЧ-2.
Окончательного ответа на вопрос о месте, времени и условиях возникновения ВИЧ нет. Ретроспективные исследования показали циркуляцию этого вируса по крайней мере с конца 50-х — начала 60-х годов. Прародительницей ВИЧ считают тропическую Африку, где широко распространен ВИО (близкородственный ВИЧ-2) среди обезьян. Первые известные серологические находки ВИЧ отмечены в Африке, здесь же — наибольшая интенсивность передачи ВИЧ наиболее естественным гетеросексуальным путем. Однако эпидемическое распространение ВИЧ — инфекция получила с конца 70-х — начала 80-х годов. В 1987г. выявлен первый случай в России, в настоящее время счет идет на десятки тысяч инфицированных в год. В мире регистрируют десятки миллионов инфицированных ВИЧ в год, ежегодно число вновь инфицированных увеличивается, т.е. налицо пандемия ВИЧ — инфекции.
Структура вириона ВИЧ.
ВИЧ имеет сферическую форму и размеры 100-120 нм в диаметре. Наружная оболочка образована двойным липидным слоем с гликопротеиновыми “шипами”, состоящими из трансмембранного белка gp41 (пронизывает липидный слой) и наружного белка gp120. Эти оболочечные белки кодируются геном env и участвуют в прикреплении вириона к мембранам клеток хозяина. С внутренней стороны липидной оболочки находится матричный каркас, образованный белком р17. Он окружает внутреннюю структуру вириона — нуклеокапсид или сердцевину (англ. — core). Собственная оболочка сердцевины образована “коровским” белком р24. Внутри нуклеокапсида находится геном вируса в виде двух цепочек, связанных белками р7 и р9, полимеразный комплекс ревертазы, протеаза, интеграза (эндонуклеаза), затравочная т — РНК. Наиболее распространен ВИЧ-1, который в зависимости от строения гена env имеет субтипы. Субтипы A-H составляют доминирующую группу M (major), наиболее распространены субтипы С и Е.
Жизненный цикл ВИЧ.
Инфекционный процесс при заражении ВИЧ носит последовательный фазовый характер и начинается с проникновения вируса через слизистую оболочку половых путей или с непосредственного поступления в кровоток. Проникнув в организм, вирус в первую очередь атакует клетки, имеющие специфичный для него рецептор CD4. Этот рецептор имеют в большом количестве Т — хелперы, в меньшем — макрофаги и моноциты, нейроны, клетки нейроглии и некоторые другие клетки (см. лекции по общей иммунологии). Вирус распознает CD4 — рецепторы с помощью своего белка gp120. Процесс инфицирования клетки вирусом осуществляется в два этапа : прикрепления и слияния. Прикрепленный через белок gp120 к рецептору CD4 клетки — мишени вирус белком оболочки gp41 сливается с мембраной клетки. Белок gp41 обеспечивает не только слияние вирусной и клеточной мембран, но и слияние мембран клеток с образованием синцития (многоядерных клеток), обреченного на гибель. Нуклеокапсид, освобожденный от суперкапсида при слиянии мембран, попадает в цитоплазму. На пути к ядру освобождается геномная РНК и ассоциированные с ней компоненты сердцевины. Обратная транскриптаза синтезирует на вирионной РНК минус — цепь ДНК, РНК-аза разрушает вирионную РНК, а вирусная ДНК — полимераза синтезирует на минус — цепи плюс — цепь ДНК.
Двунитевая ДНК транспортируется в ядро клетки, где приобретает кольцевую форму и интегрируется под действием эндонуклеазы (интегразы) с ядром клетки, превращаясь в ДНК — провирус.Последующие этапы жизненного цикла ВИЧ — латентная фаза, фаза активации транскрипции с ДНК- провируса и последующая трансляция белков вируса, наработка компонентов вируса и формирование новых вирионов, их выход из клетки, сопровождающийся цитопатическим эффектом для клетки — мишени.
ДНК — провирус может длительно находиться в неактивном состоянии (персистентное инфицирование). В этот период вирус можно выявить только с помощью ПЦР. Активация транскрипции особым ядерным фактором в результате действия иммунокомпетентных клеток или микробных антигенов приводит к продуктивной фазе — активному размножению ВИЧ. Факторы экспрессии генов ВИЧ — специфические антигены (прежде всего — герпес — вирусы), неспецифические митогены (фитогемагглютинин), цитокины (фактор некроза опухолей, интерфероны, гамма — интерферон), бактериальные иммуномодуляторы (фосфолипиды сальмонелл), глюкокортикостероиды.
Антигенные свойства ВИЧ.
Функция обратной транскриптазы не подвергается контролю, что обусловливает высокую частоту генетических ошибок при репликации и мутации структурных белков вируса. С учетом частоты изменчивости ни один ВИЧ не производит при репликации вирион, в точности соответствующий родительскому. Высокая генетическая изменчивость реализуется в вариабельности антигенных и биологических свойств ВИЧ. Высокой изменчивостью характеризуется продукт гена env — оболочечный белок gp120, особенно петлеобразный V3 — домен (из 35 аминокислот), к которому образуется до 90-95% всех вируснейтрализующих антител.
ВИЧ-1 и ВИЧ-2 имеют существенные отличия в строении, гомология первичной структуры геномов составляет только около 42%, перекрестного иммунитета между этими вирусами нет. Антигенными свойствами обладают все основные структурные элементы вириона, прежде всего — белки. Исключительная генетическая и антигенная изменчивость позволяет вирусу выживать в инфицированном организме.
Наряду с генетическими особенностями, ВИЧ-1 имеет фенотипические различия по ряду свойств — эффективности репликации, характеру цитопатического действия и способности образовывать синцитий (этот признак связан с вирулентностью), преимущественному тропизму к клеткам — моноцитотропные изоляты (начальные этапы болезни) и лимфотропные изоляты (разгар болезни).
Патогенез СПИДа.
Рецептором для ВИЧ является дифференцировочный антиген CD4, имеющий гомологичные участки с иммуноглобулинами и белком gp120 ВИЧ. Расположенный на мембранах Т- хелперов и Т- индукторов, рецептор CD4 в комплексе с белками HLA II класса выполняет функцию распознавания антигенов. Фиксация вируса через gp120 ВИЧ-1 (или gp105 ВИЧ-2) с мембранным рецептором CD4 блокирует основную функцию этих иммунокомпетентных клеток — восприятие сигналов от антиген- представляющих клеток. Последующая репликация вируса ведет к гибели этих клеток и выпадению их функций, т.е. к развитию иммунодефицита. Чем активнее CD4+ клетки, тем активнее процесс репродукции вируса. ВИЧ угнетает преимущественно Т- хелперы -1 (связанные с многими цитокинами клеточного иммунитета), что способствует развитию вирусных инфекций и опухолей.
Сродство вирусного gp120 (gp105 в случае ВИЧ-2) к этому рецептору определяет высокую избирательность поражения клеток. В патологический процесс вовлекаются в первую очередь и в наибольшей степени CD4+ лимфоциты, моноциты крови и макрофаги тканей, дендритные клетки крови, лимфоузлов, селезенки, кожи, альвеолярные и интерстициальные макрофаги легких, микроглия и другие клетки нервной системы, имеющие CD4+ рецепторы. Поражаются также В- и 0- лимфоциты, ретикулярные клетки, эпителиальные клетки кишечника. Большое значение в распространении ВИЧ и длительному сохранению в организме придают клеткам Лангерганса.
В патогенезе ВИЧ — инфекции большое значение имеют механизмы иммунного повреждения. Наличие сходных участков в структуре белков gp120, HLA класса II и CD4 — рецепторов определяет перекрестное реагирование антител к ВИЧ с этими структурами с рядом патологических эффектов (блокада кооперации CD4+ лимфоцитов и HLA класса II, неадекватная стимуляция CD4+ клеток и др.).
Поражение иммунной системы при ВИЧ — инфекции носит системный характер, проявляясь глубокой супрессией Т- и В- звеньев иммунитета. Происходят изменения гиперчувствительности немедленного и замедленного типа, гуморального иммунитета и факторов неспецифической защиты. Наряду с дефицитом CD4+ лимфоцитов в динамике болезни нарастает функциональная недостаточность CD8+ лимфоцитов, NK клеток, нейтрофилов. Нарушение иммунного статуса проявляется рядом синдромов — инфекционным, аллергическим, аутоиммунным, лимфопролиферативным.
Манифестный синдром приобретенного иммунодефицита (СПИД) проявляется в трех основных клинических формах: нейроСПИД, онкоСПИД, инфектоСПИД (оппортунистические инфекции). Это зависит от путей внедрения ВИЧ, его преимущественного тропизма к CD4 Т- лимфоцитам или макрофагам, наличия кофакторов (цитомегаловирус, вирус Эпштейна- Барр), дозы инфекта, иммунного статуса организма и др.
В динамике ВИЧ- инфекции можно выделить следующие основные стадии: заражение, латентный период, появление лабораторных признаков инфекции, первичная клиника острой вирусной (ретровирусной) инфекции (эта стадия может отсутствовать), клинический СПИД (иммунодефицит плюс индикаторные болезни). Особое значение имеет выявление лабораторных признаков ВИЧ- инфекции.
Можно выделить три типа инкубации:
— вирусологическую ( от инфицирования до определения в крови вируса или его антигенов) — в среднем 2 — 4 недели;
— серологическую (от заражения до сероконверсии — появления положительных серологических результатов) — в среднем 8 — 12 недель;
— СПИД — инкубацию (равно или более 10 лет). Безусловный иммунологический критерий СПИДа — снижение CD4+ лимфоцитов до 200 клеток в микролитре.
Лабораторная диагностика.
Лабораторная диагностика ВИЧ — инфекции методически базируется на ИФА, иммуноблоте и ПЦР. Основными ее направлениями являются:
— выявление антител к ВИЧ;
— выявление ВИЧ или его антигенов;
— определение изменений в иммунном статусе.
Для выявления антител применяют ИФА с различными тест — системами (лизатными, рекомбинантными, пептидными антигенами ВИЧ-1 и ВИЧ-2). Основная проблема — ложноположительные результаты (перекрестная реактивность gp120, CD4+ рецепторов, белков HLA II класса и др.). Поэтому исследования в ИФА проводят как правило с использованием параллельно нескольких различных тест — систем.
Иммуноблот чаще применяют как подтверждающий тест для выявления антител к отдельным белкам ВИЧ. Антитела к основным внутренним белкам (р17, р24) обнаруживают у 70% инфицированных и примерно у половины больных СПИДом. В иммуноблоте чаще всего выявляются антитела к gp41 (до 85%) и gp160 (до 100%).
В ранние сроки используют выявление в ИФА антигена р24. Наиболее чувствительным методом выявления ВИЧ является ПЦР — диагностика.
Основным клинико — лабораторным показателем диагностики СПИДа у ВИЧ — инфицированных является определение количества CD4+ лимфоцитов. Уровень ниже 200 клеток/мкл является основным критерием СПИДа.
Лечение является одним из наиболее актуальных и до настоящего времени не решенных проблем ВИЧ — инфекции. Теоретически наиболее оправдано применение препаратов, ингибирующих обратную транскрипцию — зидовудин, азидотимидин, диданозин, ставудин и др. Вакцины против ВИЧ находятся в стадии разработки. С учетом высокой изменчивости вируса это очень сложная задача.
megaobuchalka.ru