Аппендажит
Аппендажит — это редкий доброкачественный самоотрганиченный процесс воспалительной или ишемической этиологии в подвеске сальника. Данный процесс может быть как первичным (спонтанным) так и вторичным, данная статья посвящена первичному аппендажиту подвесок сальника.
Клиническая картина
Сальниковые подвески представляют собой небольшие жировые отростки, располагающиеся вдоль поверхности толстой кишки. В результате перекрута или венозного тромбоза в одном из них может развиться воспалительный процесс, проявляющийся резкой болью в одной из областей живота (наиболее часто — в правой или левой подвздошных областях). Иногда возникают тошнота и рвота. Симптомы могут симулировать аппендицит, холецистит или дивертикулит. Температура тела и результаты лабораторных исследований обычно нормальные. Аппендажит обычно диагностируется случайно, при компьютерной томографии, проводимой для исключения более серьёзной патологии. Чаще всего воспалительный процесс локализуется в области слепой или сигмовидной кишок.
Патология
Аппендажит представляет собой слабовыраженное воспаление одного из многочисленных отростков сальника, которые в количестве 50-100 штук располагаются вдоль толстого кишечника. В основе патогенеза лежит перекрут крупного отростка или спонтанный тромбоз отводящей вены приводящие к ишемии с последующим некрозом.
Диагностика
Ультразвуковое исследование
УЗИ выполняемое в указываемом пациентом месте максимального напряжения брюшной стенки может выявить округлое, не поддающееся компрессии, гиперэхогенное образование, окруженное невыраженной тонкой гипоэхогенной линией. Как правило 2-4 см в диаметре. Типичен локальный невыраженный масс-эффект без признаков утолщения стенки кишечника или асцита.
Компьютерная томография
- овоидное образование жировой плотности прилежащее к толстой кишке, как правило 1.5-3.5 см в диаметре
- окруженное кольцевидной зоной повышенной плотности, толщиной 1-3 мм
- тяжистость окружающей клетчатки за счет воспаления, утолщение прилежащей брюшины
- центральное включение повышенной плотности (представленное тромбированной сосудистой ножкой)
- минимальное утолщение стенки прилежащей толстой кишки, не всегда присутствует, и гораздо менее выраженное чем воспалительные изменения жировой клетчатки
- аппендажит классически локализуется в передних отделах сигмовидной или нисходящей толстой кишки, но в целом может локализоваться в любом месте по ходу толстого кишечника
- может кальцинироваться
Магнитно-резонансная томография
- T1: часто визуализируется в виде округлого образования в высоким МР сигналом, который однако несколько ниже МР сигнала от неизмененной жировой ткани, с тяжистостью за счет воспаления, окруженного кольцевидной зоной гипоинтенсивного МР сигнала толщиной 2-3 мм
- T2: часто визуализируется в виде образования с повышенным МР сигналом на программах с жироподавлением, окруженного кольцевидной зоной гиперинтенсивного МР сигнала толщиной 2-3 мм с тяжистостью; центральная вена имеет низкую интенсивность МР сигнала
- T1 с парамагнетиками: характеризуется выраженным кольцевидным контрастным усилением
Лечение
Аппендажит не требует хирургического вмешательства, так как является самоотграничивающимся процессом, приводящим к отшнуровке и обызвествлению сальникового подвеска с формированием так называемых «свободного тела». Для купирования болевых ощущений могут применяться анальгетики; болевой синдром регрессирует в течение недели.
Осложнения
В редких случаях могут наблюдаться осложнения аппендажита в виде кишечной инвагинации, абсцедирования, перитонита, кишечной непроходимости, нарушения пассажа мочи.
Дифференциальный диагноз
radiographia.info
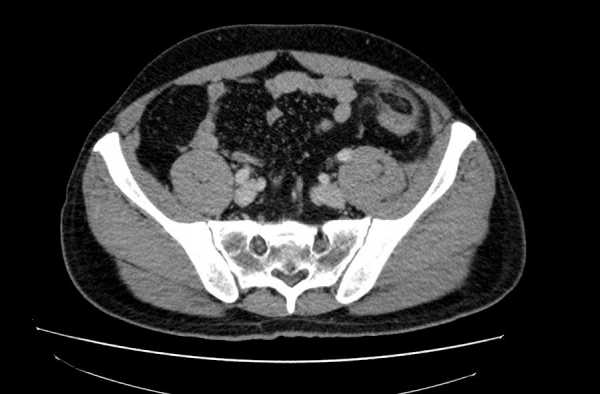
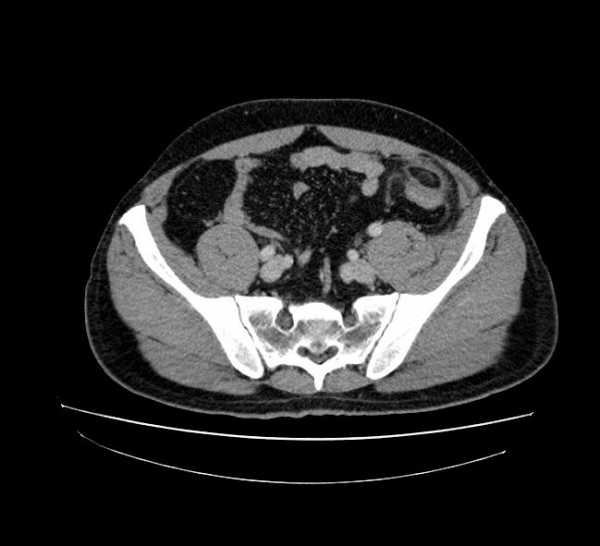
25.05.2012 КТ брюшной полости. Перекрут жирового подвеска (Appendagitis epiploica)
Мужчина, 37 лет. Жалобы на боли в левой подвздошной области. При УЗИ патологии не выялено. Хирурги пальпируют но что-то неубедительно. В направлении — инфильтрат брюшной полости, Neo?
Пы.Сы. Если видео не показывает не надо ничего делать, просто подождите. В данном формате оно начинает работать только после того как полностью загрузится.
Острый аппендагит.
Острый аппендагит наиболее часто проявляется острой болью нижнем квадранте. Его клинические признаки сходны с острым дивертикулитом или, реже, острым аппендицитом. Важно правильно диагностировать острый аппендагит на КТ, потому что он может ошибочно принят за острый живот и привести к ненужной операции.
КТ особенности острого аппендагита — овальное образование 1,5-3,5 см в диаметре жировой плотности, окруженное воспалительными изменениями, которое прилежит к передней стенке сигмовидной ободочной кишки.
Острый аппендагит является самостоятельным ограниченным воспалением жирового привеска, термин аппендагит был введен в 1956 году Lynn и др. и КТ особенности этого состояния впервые были описаны в 1986 году Danielson и др.
Epiploic appendages — жировые привески — перитонеальные мешки на серозной оболочке толстой кишки расположенные на сосудистой ножке. Состоят из жировой ткани и кровеносных сосудов, обычно имею длину 0,5-5см. Самыми крупными являются привески сигмовидной кишки и могут располагаться группами около 100. Как правило, привески видны на КТ, только если они воспалены и /или окруженный жидкостью.
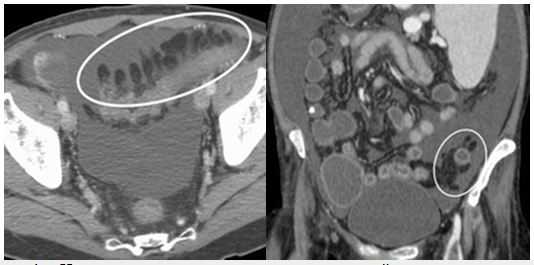
На рисунке 1. Нормальные жировые привески сигмовидной кишки очерчены асцитической жидкостью.
Перекрут привеска с развитием артериальной и венозной окклюзии рассматривается как причина острого аппендагита. Венозный компонент рассматривается потому что каждый придаток кровоснабжается парными артериями, а отток обеспечивается только одной веной. Thomas и др. рассмотрел 197 случаев из литературы и 11 собственных случаев острого аппендагита и классифицировал в соответствии с их причинами: перекрут и воспаление (73%), ущемление грыжи (18%), кишечная непроходимость (8% ) и внутрибрюшные инородные тела (<1%).
Аппендагит в большинстве случаев является ограниченным. В редких случаях может привести к спайкам, обструкции/кишечной непроходимости, формированию инфильтрата, перитониту и / или формированию абсцесса.
Наиболее распространенными местами аппендагита, в порядке убывания частоты, являются участки, прилегающие к сигмовидной кишке, нисходящей ободочной кишке, а также правого гемиколона. Наиболее распространенные КТ особенности острого аппендагита является овальный участок менее 5 см в диаметре (типичный диапазон диаметром 1,5-3,5 см), который имеет плотность жира, граничит с передней стенкой кишки и окружен воспалительными изменениями. Также может наблюдаться утолщение прилежащей париетальной брюшины. Стенка толстой кишки может быть утолщена, но наиболее часто нормальной толщины. Кишечная непроходимость и формирование абсцесса редки. В центре определяется участок повышенной плотности, однако его не исключает диагноз острого аппендагита. В редких случаях может возникнуть воспаление придатка в грыжевом мешке.
случай представленный Юрием Игнатенко
Случай Андрея Мангова – аппендагит в сочетании с дивертикулезом сигмовидной
кишки, без признаков дивертикулита.


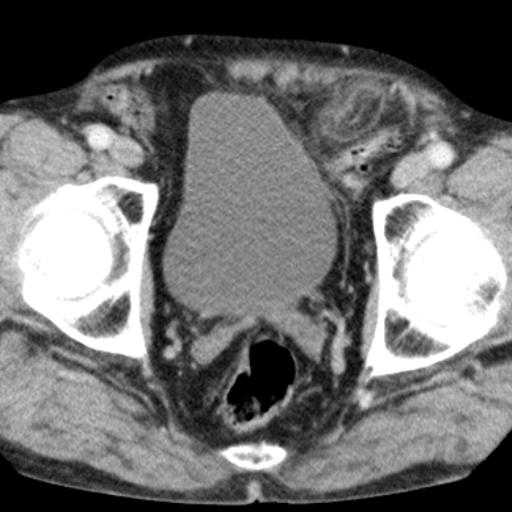
мой случай
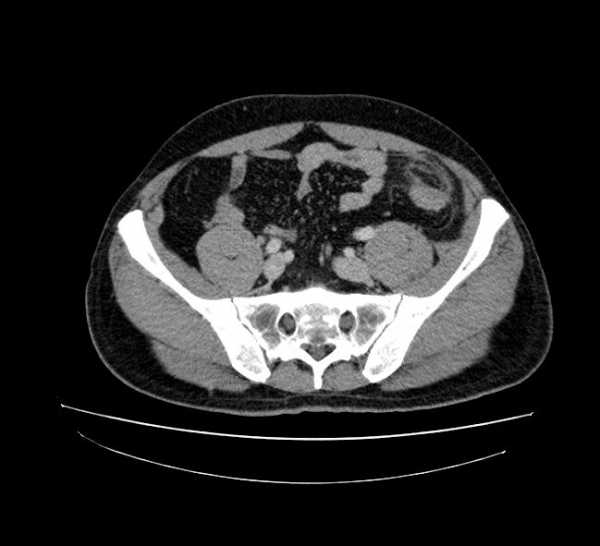

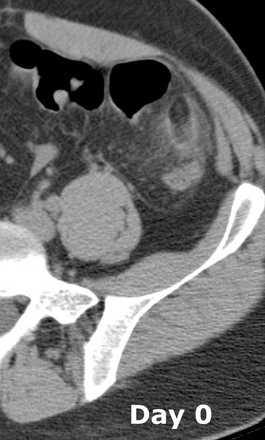
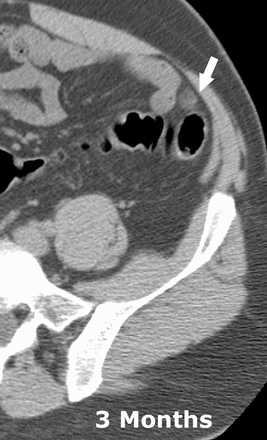
В последующем выполняется контрольно КТ через 6 месяцев после начала клиники. Результат может варьировать от неизмененной картины до уменьшения размеров поражения и остаточных изменений. Хотя у большинства пациентов клинические проявления проходят в течение 2 недель, КТ динамика запаздывает.
Динамическое сравнение КТ-картины при остром аппендагите в начале заболевания и через 3 месяца.
Дифференциальная диагностика острого аппендагита проводится с острым инфарктом сальника, острыми воспалительными процессами, такими как дивертикулит, склерозирующий мезентерит и опухоли и метастазами в сальник.
При остром аппендагите показано консервативное лечение – применение пероральных противовоспалительных препаратов, антибиотики не показаны. Большинство пациентов выздоравливают менее чем через 10 дней.
Всея инфа отсюда: http://radiographics.rsna.com/content/25/6/1521.full?sid=4fd1ae93-66aa-44b0-8698-e1675b7721e0
Переводил сам, может че и не так извините….
все тоже в формате PDF тут: http://yxtblzhka.files.wordpress.com/2011/12/d0bed181d182d180d18bd0b9-d0b0d0bfd0bfd0b5d0bdd0b4d0b0d0b3d0b8d1821.pdf
www.radiographia.ru
Заболевание жировых подвесков слепой кишки Текст научной статьи по специальности «Медицина и здравоохранение»
УДК 616.346
ЗАБОЛЕВАНИЕ ЖИРОВЫХ ПОДВЕСКОВ СЛЕПОЙ КИШКИ Н. Д. Маслакова1, к. м. н., доцент; Н. Ф. Силяева1, д. м. н., профессор; В. П. Василевский1, к. м. н.; А. А. Новицкий2, А.О. Флеров2; В. В. Макарчик2; Т. Б. Теличко1; А. Е. Русак1
1 — УО «Гродненский государственный медицинский университет» 2 — ГУ «1134 Военный клинический медицинский центр Вооруженных сил РБ»Спонтанное воспаление жировых подвесок, расположенных в области слепой кишки, является казуистикой. Анализ клиники в данном случае позволяет выявить общие признаки заболевания с острым аппендицитом. Ключевые слова: жировые подвески, слепая кишка, казуистика.
Appendices epiploicae may be located in the region of intestinum cecum. Their spontaneous inflammation is casuistic. Analysis of clinical presentation in this case allows to detect the common signs of the disease. Key words: Appendices epiploicae, intestinum cecum, casuistic.
Патология жировых подвесков толстого кишечника (appendices epiploicae), по данным разных статистик, составляет 0,09-0,3% острых заболеваний брюшной полости [1, 2, 4, 5]. Чаще всего воспаление appendices epiploicae возникает из-за его перекрута. Чем длиннее подвеска, тем выше вероятность ее перекрута. Средняя длина подвески составляет 3 см, однако может достигать 15 см и более [2, 3, 5]. В дистальных отделах толстой кишки число подвесок и длина постепенно возрастает. По данным различных статистик, при заболевании жировых подвесков заворот был обнаружен у 31,4% больных, тромбоз сосудов и инфаркт — у 15,6%, гангрена — у 19,7%, острое воспаление и нагноение жировых подвесков у — 18,6% [5]. По сведениям рада авторов, число пораженных сальниковых отростков колеблется от 1 до 12 [1, 2, 3, 5]. Летальность при заболеваниях сальниковых отростков достигает 1,6% [2, 3, 5].
Среди причин развития заболевания отмечают избыточную массу тела, пожилой возраст, наличие бурной перистальтики, долихосигма, аномалии развития ободочной кишки, спаечный процесс в брюшной полости, нарушение пассажа по кишечнику, резкое повышение внут-рибрюшного давления, эндокринные нарушения. Как правило, патология жировых подвесков встречается при их локализации на левой половине толстой кишки и, прежде всего, сигмовидной кишки.
Спонтанное воспаление, без перекрута, расположенной в области слепой кишки appendices epiploicae — казуистика [5].
Редкость этой патологии и отсутствие патогномонич-ных признаков затрудняет диагностику. Зачастую больные госпитализируются и оперируются с такими диагнозами, как острый аппендицит, непроходимость кишечника, перитонит и др. Исходя из вышесказанного, необходимо проводить тщательную дифференциальную диагностику данного заболевания, которая не всегда может быть успешной.
Приводим наблюдение.
Пациент К., 40 лет, обратился в военный медицинский центр «1134 ВКМЦ ВС РБ» г. Гродно с жалобами на постоянные тупые боли в эпигастральной области, не имеющие связи с физической нагрузкой, которые спустя 24 часа сместились в правую подвздошную область, сухость во рту, Больным считает себя с 10.06.2011г., не обращался за помощью до 12.10.2011г.
При обследовании на момент поступления: состояние больного удовлетворительное, сознание ясное. На-
блюдается нормостения, ожирение I степени; язык влажный, обложен белым налетом, живот мягкий, резко болезненный в правой подвздошной области. Симптомы Ситковского, Ровзинга, Кохера-Волковича, Щеткина-Блюмберга положительные. Температура тела — 36,2ОС, пульс — 72 уд. в мин., АД — 110/70 мм рт. ст., в общем анализе крови: эритроциты — 4,0х1012/л, НЬ — 137 г/л, лейкоциты — 6,8х109/л, данные общего анализа мочи и биохимического исследования крови в норме. С учетом анамнеза и данных физикального обследования диагностирован острый аппендицит, показана экстренная аппендэк-томия.
После предоперационной подготовки под эпидураль-ным наркозом был произведен разрез по Дьяконову-Вол-ковичу в правой подвздошной области длиной 7 см. Брюшина не изменена. Выпота нет. Купол слепой кишки в рану не выводится из-за спаечного процесса. Произведено рассечение спаек. Червеобразный отросток макроскопически не изменен. На стенке кишки имеется плоскостная некротизированная жировая подвеска 2,0×1,5 см темно-багрового цвета без признаков перекрута (рис. 1). В окружности подвески кишка инфильтрирована на протяжении 3,0×2,0 см. Жировая подвеска взята на зажимы и удалена. Десерозированный участок слепой кишки ушит кисетным швом. Несмотря на то, что аппендикс макроскопически не был изменен, не исключалась возможность возникновения вторичного воспаления в связи с тем, что
Рисунок 1 — Слепая кишка с участком некротизированной жировой подвески
Случай из практики
воспалительный инфильтрат располагался вблизи (5 см ) от основания червеобразного отростка. Произведена аппендэктомия.
Послеоперационный диагноз: острый катаральный аппендицит, некроз жировой подвески.
Послеоперационный период без особенностей. Швы сняты на 7-е сутки рана зажила первичным натяжением. Жалоб нет. 21.06.2011 г. выписан из стационара в удовлетворительном состоянии. По прошествии 1 месяца пациент чувствовал себя хорошо.
Данные гистологического исследования: стенка червеобразного отростка без воспалительных изменений. В appendices epiploicae очаговый некроз, полнокровие сосудов, кровоизлияния и очаговая лимфо-лейкоцитарная инфильтрация ( рис. 2).
Анализ клинической картины болезни позволяет выявить наиболее характерные признаки заболевания сальниковых отростков: наличие ожирения пациента, постоянные тупые боли ноющего характера, возникшие внезапно, без иррадиации, отсутствие тошноты, рвоты, отсутствие напряжения мышц передней брюшной стенки. Наличие симптома «смещения болей». Отсутствие признаков нарастающей интоксикации (удовлетворительное общее состояние пациента, влажный язык, отсутствие гипертермии, чистота пульса 72 уд. в мин. нормальные показатели количества лейкоцитов крови).
Литература
1. Абдулжаватов, И.М. Симптоматика заболеваний жировых подвесков толстой кишки / И . М. Абдулжаватов // Хирургия. -1992. — №2. — С. 76-83.
Рисунок 2 — Гистологическая картина некроза жировой подвески
2 . Забарский, Д.Т. Заворот сальниковых отростков толстой кишки / Д.Т. Забарский, Э.А.Смолкин, Ю.Г.Лившиц // Клиническая хирургия. — 1984.- №3. — С. 59-60.
3 . Рехачов, В.П. Диагностика и лечение перекрута жировых подв есков толстой ки шки / В.П. Рехач ов, Л.Б. Дуберма н, В.А. Ярыгин // Хирургия. — 1989. — №8. — С. 88-90.
4 . Швецов, С.К. Заворот жировых подвесков ободочной кишки / С.К. Швецов, И.А. Балышаков // Хирургия. — 1992. — №2. — С. 76-80 .
5 . Эфендиев, Ш.М Заболевания жировых подвесков ободочной кишки / Ш.М. Эфендиев, О.В. Волков, М.А. Курбанов, Д.М. Джабалов // Хирургия. — 2003. — №10. — С. 64-66.
Поступила 29.12.2011
cyberleninka.ru
Особенности строения толстой кишки |
Общие характеристики
 Толстый кишечник в брюшной полости формирует как бы «рамку» вокруг петель тонкого кишечника. Толстая кишка является конечным отделом пищеварительной системы и отвечает за поглощение солей (в основном — соли натрия) и воды. Содержит большое количество микроорганизмов как по общему числу, так и разнообразию. Длина толстого кишечника составляет около 150 см
Толстый кишечник в брюшной полости формирует как бы «рамку» вокруг петель тонкого кишечника. Толстая кишка является конечным отделом пищеварительной системы и отвечает за поглощение солей (в основном — соли натрия) и воды. Содержит большое количество микроорганизмов как по общему числу, так и разнообразию. Длина толстого кишечника составляет около 150 см
Тонкий кишечник заканчивается илеоцекальным клапаном или Баугиниевой заслонкой, впадая в купол слепой кишки. Слепая кишка находится в правой подвздошной ямке, за которой следует восходящая, поперечная, нисходящая и сигмовидная кишка. Сигмовидная кишка переходит в прямую, заканчивающуюся анальным отверстием. Ободочной называют весь толстый кишечник, за исключением прямой кишки и анального канала. Прямая кишка имеет ряд особенностей как по анатомии, так и по функции и лучше ее описать отдельно.
Поперечная ободочная кишка четко ограничена левым и правым изгибом (селезеночным и печеночным углами соответственно). Вообще, на операции определить отделы толстого кишечника очень сложно, так как по размеру они могут не отличаться. А вот от тонкой толстая кишка отличается заметно. Нужно просто знать ее анатомические особенности.
Анатомические признаки толстого кишечника
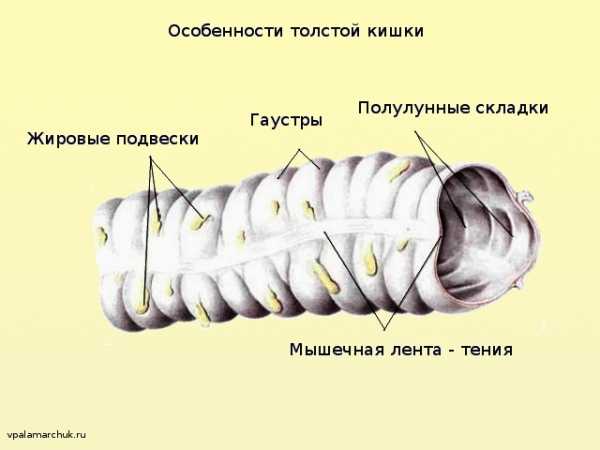
Гаустры
Гаустры толстой кишки являются характерными для нее образованиями, так сказать, ее «визитная карточка». Представляют собой характерные сферические мешочки, ограниченные друг от друга полулунными складками, хорошо видимыми изнутри кишки. И хотя гаустры есть следствие сокращения гладкой мускулатуры (на трупах в секционной они не так четко определяются), они хорошо идентифицируются при рентгенографии и хирургических вмешательствах.

Гаустры прекрасно определяются на ирригоскопии
Тении (ленты)
Структура кишечной стенки толстой кишки (в отличие от тонкой) — не имеет полного внешнего продольного слоя по всей окружности стенки. Наружный мышечный слой сконцентрирован в три продольные ленты — тении, хорошо определяемые невооруженным глазом. В толстом кишечнике выделяют три таких:
— Tenia mesocolica (брыжеечная лента)
— Tenia omentalis (сальниковая лента)
— Tenia libera (свободная лента)
Эти мышечные полоски непрерывны как в восходящем, так и нисходящем отделе кишки. В области купола слепой кишки они встречаются, четко «указывая» на червеобразный отросток, что может облегчить его поиск. Идем по кишке и ищем место схождения мышечных лент. Однако лент нет ни в аппендиксе, ни в прямой кишке. А в сигмовидной кишке есть только две ленты.
Толстокишечные придатки (processus epiploicae, или жировые подвески)
Представляют собой небольшие выпуклости толстой кишки, стенка которых состоит из серозного и субсерозного слоя, заполненные жировой тканью. Для хирурга важно, что в них содержатся терминальные ветви брыжеечных артерий и их хирургического удаления следует избегать.
Отделы ободочной кишки
Слепая кишка
Представляет собой направленный вниз слепой мешочек толстой кишки (так называемый купол слепой кишки), ограничивающийся от восходящей кишки сфинктером Бузи. В слепую кишку открывается подвздошная кишка с помощью илеоцекального отверстия — клапана Тульпы, или Баугиниевой заслонки. Этот клапан очень важен: он разграничивает соверженно разные в физиологическом плане отделы кишечника. Благодаря ему содержимое кишечника движется в одном направлении. Именно илеоцекальному клапану часто приписывают характерное урчание в животе («песня илеоцекального клапана»). Как уже отмечалось, на куполе слепой кишки сходятся три мышечные ленты, отмечая основание червеобразного отростка.
У мужчин самая нижняя часть купола слепой кишки находится на уровне передней-верхней ости правой подвздошной кости. Этот выступ обычно легко прощупывается. Вертикаль же можно провести по середине паховой связки. У женщин высота купола слепой кишки чуть ниже, чем у мужчин и при беременности слепая кишка перемещается выше.
Слепая кишка полностью и частично покрыта брюшиной. В последнем случае она малоподвижна и тогда говорят о «caecum fixatum». При полностью внутрибрюшном расположении (интраперитонеальное расположение) слепая кишка имеет небольшую, около 4 см, брыжейку. Реже бывает так, когда конечный отдел подвздошной кишки вместе со слепой и восходящей кишкой имеют общую брыжейку. И тогда слепая кишка очень подвижна — «caecum mobile».
Диаметр слепой кишки 6-8 см. Это самый широкий отдел толстого кишечника. В области илеоцекального клапана, сверху и снизу имеются верхний и нижний илеоцекальные карманы, в которые могут попадать петли тонкого кишечника, т.н внутренние грыжи, очень сложно диагностируемые.
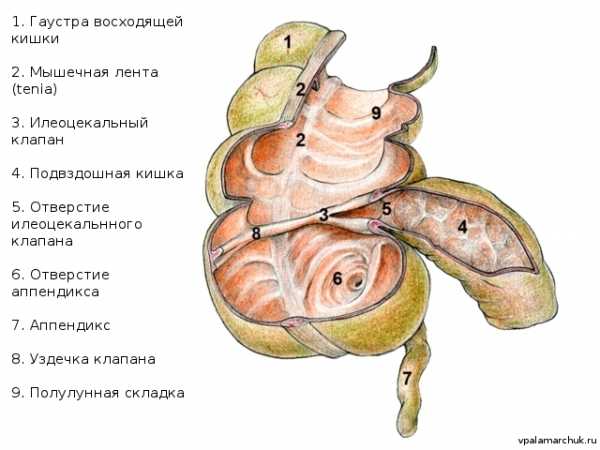
Слепая кишка обычно «урчит» при пальпации. Причина в илеоцекальном клапане
Анатомия восходящей ободочной кишки
Восходящая ободочная кишка (colon ascendens) располагается вертикально в правых отделах живота. Длина ее 12-20 см. Снизу границей со слепой кишки является сфинктер Бузи (довольно часто определяемый при колоноскопии). Восходящая ободочная кишка сверху переходит в поперечную кишку, формируя печеночный изгиб, flexura coli dextra (в отличие от левого, этот изгиб идет приблизительно под прямым углом). Восходящий отдел толстой кишки (также как и нисходящий) плотно фиксирован к задней стенке брюшной полости и покрыт брюшиной только с трех сторон. Вверху задняя стенка кишки прилежит к правой почке.
Строение поперечной ободочной кишки
Поперечная ободочная кишка проходит из правых отделов живота в левые, несколько свисая посередине (при колоноптозе, длинной поперечной кишке может спускаться до малого таза). Заканчивается в левых отделах, формируя селезеночный изгиб, flexura coli dextra, идущий под небольшим острым углом. Иногда это приводит к развитию патологического состояние — синдрома Пайра. Чаще всего к этому приводит очень длинная поперечная ободочная кишка: в таком случае ее средняя часть опускается вплоть до малого таза.
Нисходящая ободочная кишка
Начинается от селезеночного изгиба и идет до перехода в сигмовидную кишку. Располагается вертикально в левых отделах живота. Покрыта брюшиной с трех сторон, как и восходящая у 2/3 людей. У остальной трети имеет маленькую брыжейку. В отличие от предыдущих отделов толстой кишки, где активно идет всасывание воды, функция нисходящей ободочной кишки — хранить отходы до тех пор, пока их можно будет удалить из организма. Здесь начинают формироваться и уплотняться каловые массы. Довольно часто поражается при неспецифическом язвенном колите.
Анатомия сигмовидной кишки
Сигмовидная, потому что формирует петлю S-образной формы, напоминающую греческую букву «сигма». Длина в среднем 35-40 см. Но бывает и до 90 см (долихосигма — довольно частое состояние). Расположена в полости таза и очень подвижна. Ее задача заключается в дальнейшем формировании каловых масс. Кроме того, характерный изгиб кишки имеет важное физиологическое значение: позволяет скапливать газы в верхней части арки и выводить их наружу без выделения фекалий одновременно. В сигмовидной кишке чаще всего встречаются дивертикулы. Кроме того, ввиду своей подвижности, сигмовидная кишка может быть причиной странгуляционной кишечной непроходимости («заворота кишок»). И еще. Вопреки заблуждениям: резервуалом кала является не прямая, а сигмовидная кишка. В прямую кишку каловые массы поступают из сигмовидной непосредственно «в процессе».
Лимфатическая система толстого кишечника
Лимфоотток имеет большое значение как возможный путь метастазирования злокачественных опухолей. Лимфа собирается от слепой кишки, аппендикса, восходящей и поперечной толстой кишки в брыжеечные лимфатические узлы. Лимфоотток от нисходящей, сигмовидной и прямой кишки собирается в парааортальные лимфатические узлы. От поперечной кишки отток идет в панкреатодуоденальные и селезеночные лимфатические узлы. При различных кишечных инфекциях лимфатические узлы могут воспаляться (особенно у детей). В таких случаях речь идет о мезадените, который нередко ставит перед врачом сложную диагностическую задачу, имитируя острую хирургическую патологию.
Иннервация толстой кишки
В поперечной ободочной кишке, слева, имеется непостоянное мышечное утолщение — сфинктер Кэннона-Бема (или левый сфинтер Кэннона, кстати, когда писал о сфинктерах толстой кишки, то писал о более постоянном — правом). Это область является границей кишки в эмбриологическом плане и здесь происходит пересечение ветвей блуждающего нерва (иннервирует все что «до») и сакральных парасимпатических нервов (иннервация толстой кишки после сфинктера).
Вообще, если говорить о физиологии кишечника, то ряд функций, например, перистальтика, могут осуществляться автономно. Причем в толстом кишечнике возможна «ретроперистальтика», когда кишечное содержимое перемещается назад. Автономность перистальтики обеспечивают собственные нервные сплетения: подслизистое сплетение Мейсснера и Шабадаха (Schabadach) и мышечное сплетение Ауэрбаха. Наследственное поражение этих сплетений приводит к болезни Гиршпрунга, когда стенка толстой кишки теряет тонус и очень сильно растягивается. Иннервация прямой кишки осуществляется более сложными рефлексами и центр этих рефлексов располагается в конусе спинного мозга (почему повреждения позвоночника могут приводить к недержанию).
Кровообращение толстого кишечника
Приток крови осуществляется мощными сосудами, отходящими от аорты: верхней и нижней брыжеечной артерией. При попадании тромба (сформировавшегося, например, при мерцательной аритмии в предсердии сердца) в один из этих сосудов развивается очень тяжелое неотложное заболевание — мезентериотромбоз. Последствия очень часто фатальны. А вот с мелкими артериями, питающими кишку все намного лучше за счет многочисленных анастомозов. Как кружевные петли, они обеспечивают непрерывный кровоток при перистальтике и постоянном смещении кишечных петель. При массивном атеросклерозе же может развиваться заболевание — ишемический колит. Или «брюшная жаба»: по аналогии с болями за грудиной при ишемии сердечной мышцы — «грудной жабе». Между бассейнами верхней и нижней брыжеечных артерий в области селезеночного угла имеется анастомоз — дуга Риолана.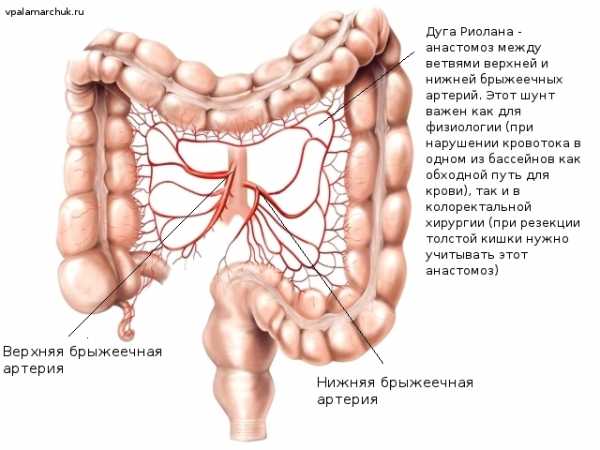
Весь венозный отток собирается в воротную вену и идет через «фильтр» — печень. Исключение — небольшая часть крови минует печень в прямой кишке, где есть т.н. портокавальные анастомозы. Кровь поступает «мимо» печени в нижнюю полую вену. Это может иметь значение при ректальном введении лекарственных средств.
Гистологическое строение толстой кишки
Кишечник как орган, если представить максимально просто, представляет собой полую гибкую трубку, причем многослойную. Внутренний, слизистый слой обеспечивает всасывание питательных веществ и воды, а также обеспечивает иммунный барьер от обитающей в кишечном содержимом богатой микрофлоры. Под этим слоем располагается подслизистый слой, обеспечивающий прочность кишечной стенки. Мышечные слои обеспечивают перистальтику, а также (в основном, в толстой кишке) — перемешивание кишечного содержимого. Снаружи нужна гладкая поверхность, не так ли? Минимум трения между подвижными кишечными петлями обеспечивает брюшина — гладкая серозная оболочка.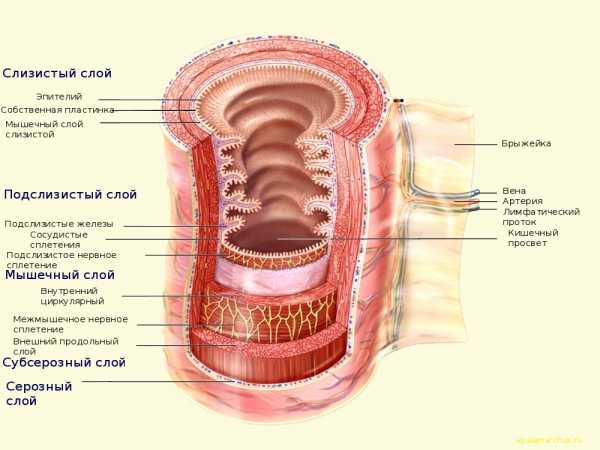 Вообще, как для тонкого, так и для толстого кишечника характерен одинаковый состав слоев клеточной стенки. То есть слои те же, но у толстого кишечника есть свои особенности:
Вообще, как для тонкого, так и для толстого кишечника характерен одинаковый состав слоев клеточной стенки. То есть слои те же, но у толстого кишечника есть свои особенности:
— слизистая толстой кишки имеет гладкую поверхность (нет кишечных ворсинок)
— внешний гладкий мышечный слой собран в ленты — тении
— имеются различия в клеточной структуре эпителия
— складчатость стенки формируется за счет всех слоев стенки (в отличие от ворсин тонкой кишки).
Гистологические слои толстой кишки содержат:
— слизистая оболочка (mucosa)
— подслизистый слой (tela submucosa)
— мышечный слой (tela muscularis propria)
— субсерозный слой (tela subserosa)
— серозная оболочка, или брюшина (tunica serosa)
Слизистый слой толстой кишки. Это внутренний слой, содержащий большое количество крипт (крипты Либеркюна). Это углубления поверхности, в которых имеется большое количество желез. Эти железы намного лучше развиты, чем в тонком кишечнике. Клеточный состав представлен эпителиальными клетками, которые обеспечивают всасывание натрия и воды, бокаловидными клетками, вырабатывающими слизь (в качестве смазки), а также стволовыми клетками в глубине крипт, которые постоянно делятся и восстанавливают кишечный эпителий. Встречаются также эндокринные (энтерохромаффинные) клетки, синтезирующие гормоны. Все это выполняет основные задачи: забрать из кишечного содержимого излишки воды и минеральные вещества, обеспечить надежный барьер от микробов. К тому же слизь бережет саму слизистую от травматизации (ведь содержимое становится все плотнее).
Подслизистый слой. Это слой свободной соединительной ткани, содержащий единичные лимфатические фолликулы, кров
vpalamarchuk.ru
Перекрут жирового подвеска: лечение и диагностика | Хватит болеть
 Перекрут – патология, во время которой жировой подвесок поворачивается вокруг своей оси один или несколько раз.
Перекрут – патология, во время которой жировой подвесок поворачивается вокруг своей оси один или несколько раз.
При этом появляется сдавливание и перекрут питательных сосудов. Подобные заболевания требуют немедленного хирургического вмешательства. Альтернативы никакой нет и быть не может. Если операция не будет произведена вовремя, то яичко отмирает и погибает.
Перекрут жирового подвеска яичек – заворот, перекрут гидатиды (гидатида Морганьи). Достаточно редкое заболевание.
Жировые подвески присутствуют в количестве до шести штук не у каждого мужчины.
Перекрут, как заболевание, начинается очень быстро: сначала возникает внезапная острая боль в какой-либо из половин мошонки, а затем начинает развиваться отек.
В случае не проведения операции, яичко способно потерять до 60% своей функциональной нагрузки из-за появления рубцовых изменений.
Существует еще такие виды перекрутов:
- кистозной ножки;
- толстой кишки;
- яичника и другие.
Диагностика перекрута жирового подвеска
Так, перекрут жирового подвеска толстой кишки с наступающими некротическими изменениями, вполне может быть принят за проявления аппендицита.
Анамнез перекрута, обычно, атипичный.
Общее состояние пациентов, как правило, практически не меняется. Только поступают жалобы на местную боль в области живота. Эти боли не подвержены миграции и изменениям их характера. Об этом всегда следует помнить при дифференциальном подходе к диагностике у пациентов с подозрениями на острую степень аппендицита.
Клинические анализы крови обычно находятся в пределах нормы.
Однако, при отсутствии симптомов регрессии заболевания, хирургического вмешательства, как правило, избежать не удается.
Диагностика до начала проведения операции маловероятна, так как перекрут жирового подвеска обычно становится настоящей находкой для хирурга при проведении лапаротомии. Но даже и при проведении хирургической операции перекрут жирового подвеска обнаружить достаточно проблематично.
Лечение перекрута жирового подвеска
Как мы уже говорили, лечение может быть только одно – хирургическая операция.
Операцию лучше всего проводить как можно раньше (в первые часы после появления болевых ощущений.
Медикаментозного лечения данного заболевания не существует.
Суть операции заключается в следующем: сначала жировой подвесок перевязывают у основания. Затем его иссекают, а оставшийся отросток тщательно перитонизируют.
В очень редких случаях, при развитии нарушений в системе кровообращения жирового подвеска, возможна его самоампутация. В таком случае, жировой подвесок может быть найден в полости брюшины в виде отторгнутого инородного тела.
hvatit-bolet.ru
Перекрут и некроз сальниковых отростков ободочной кишки — Хирургия. Журнал им. Н.И. Пирогова — 2014-02
Перекрут и некроз сальниковых отростков (жировых подвесков, appendices epiploicae) ободочной кишки (далее — отростки) относится к редким заболеваниям и встречается у 0,04-0,3% пациентов с острыми хирургическими заболеваниями органов брюшной полости. Изучению заболеваний отростков до настоящего времени уделяется мало внимания. Как правило, в литературе имеются описания единичных случаев диагностики и лечения перекрута и некроза отростков, и лишь отдельные авторы приводят анализ нескольких десятков наблюдений. Диагноз перекрута и некроза отростков редко удается поставить на дооперационном этапе. В большинстве наблюдений заболевание отростков обнаруживается во время лапароскопии или лапаротомии, показаниями к которым, как правило, служат другие заболевания органов брюшной полости и малого таза [8-10, 15, 16].
В развитии перекрута и некроза отростков считают значимым влияние ряда факторов. Предполагают, что развитию перекрута и некроза отростков способствуют нарушения моторной функции кишечника, наличие воспалительного очага (дивертикулита, холецистита, болезни Крона и др.), спаечного процесса в брюшной полости. К провоцирующим факторам развития заболевания отростков относят резкие движения (сгибание, разгибание), тяжелую физическую нагрузку, резкое снижение массы тела, голодание или переедание, закрытую травму живота [3-9, 15, 17]. Перекрут и некроз отростков встречается у лиц зрелого и пожилого возраста, примерно с одинаковой частотой у мужчин и женщин. В большинстве описанных наблюдений пациенты с перекрутом и некрозом отростков имели избыточную массу тела [3, 5, 6, 11, 12, 14-17].
Перекрут и некроз отростков крайне редко диагностируется на дооперационном этапе — не более в 63% наблюдений [1, 3-4, 7, 9]. Это связано в первую очередь с неспецифичностью клинических проявлений заболевания отростков. Как правило, заболевание возникает остро с постоянных болей в животе, являющихся основным симптомом заболевания [3-6, 8, 14-17]. Боли чаще всего локализуются в левой или правой подвздошной области, могут периодически усиливаться, не иррадиируют (при отсутствии вовлечения в воспалительный процесс других органов). Самостоятельный прием различных лекарственных средств (анальгетиков, спазмолитиков) не купирует болевой синдром, что заставляет больных обращаться за медицинской помощью. Тошнота, рвота, задержка стула и газов, диарея не характерны для перекрута и некроза отростков и встречаются не более чем в 30% наблюдений [1, 6, 14]. Температура тела может оставаться нормальной, а в ряде наблюдений повышается до субфебрильной. Перекрут и некроз отростков характеризуется более мягким течением и более медленным нарастанием симптоматики, что обусловливает позднюю обращаемость ряда пациентов (до 8 сут от начала заболевания). В среднем сроки поступления больных в стационар от начала заболевания составляют 1-3 дня [2, 6, 8, 14, 15].
Физикальное обследование больных, как правило, позволяет выявить только локальную болезненность при пальпации, в ряде наблюдений — локальное напряжение мышц передней брюшной стенки. Существенные диагностические трудности возникают при локализации болей в правой подвздошной области, так как нередко у этих пациентов выявляются симптомы острого аппендицита (Ровзинга, Ситковского и др.) [3, 6, 9].
При длительном существовании перекрута и некроза отростков возможно развитие инфильтратов, вовлекающих соседние органы брюшной полости и малого таза, на что могут указывать жалобы на дизурические явления (при вовлечении стенки мочевого пузыря), боли в правом подреберье (при вовлечении желчного пузыря, печени) и др. Это нередко приводит к постановке ошибочного диагноза и неверной тактике ведения больного [3-6, 9, 14-16].
Лабораторные методы исследования не позволяют обнаружить каких-либо специфических изменений: в анализах крови могут отмечаться умеренный лейкоцитоз (до 12’109/л), незначительное повышение уровня С-реактивного белка. Зарубежные авторы подчеркивают значительную роль ультразвукового исследования, компьютерной и магнитно-резонансной томографии брюшной полости в диагностике перекрута и некроза отростков [11, 12, 14]. Эти неинвазивные методы позволяют визуализировать измененный отросток, провести дифференциальную диагностику с другими заболеваниями органов брюшной полости и малого таза. Тем не менее в 50-63,4% наблюдений неинвазивные лучевые методы не позволяют обнаружить изменений отростков либо при этом их трактуют как другое заболевание [13, 15]. В связи с этим на дооперационном этапе, как правило, устанавливают диагноз других заболеваний органов брюшной полости и малого таза, наиболее частыми являются дивертикулит (до 50% наблюдений), острый аппендицит (13-76,5%), почечная колика (до 35%), перитонит (до 27,3%), заболевания придатков матки (до 19,6%) [1-3, 6-8]. Основным методом диагностики перекрута и некроза отростков большинство авторов считают лапароскопию, позволяющую верифицировать диагноз в 83-100% наблюдений [1, 8-10, 13, 15-16].
В настоящее время вопрос о лечебной тактике при перекруте и некрозе отростков окончательно не решен. Зарубежные авторы придерживаются мнения о консервативном лечении этого заболевания [11, 12], однако такая тактика может приводить к развитию осложнений, рецидиву заболевания (до 10% наблюдений). Большинство авторов являются сторонниками хирургического лечения — удаления пораженного отростка, которое может быть выполнено с использованием как лапароскопического, так и лапаротомного доступов [1, 6, 8, 12, 16]. Некоторые хирурги [3, 6,] предпочитают всегда при перекруте и некрозе отростков выполнять операцию из лапаротомного доступа, в ряде наблюдений сочетая удаление отростка с перитонизацией его ложа серозно-мышечными швами. В последнее время появляется все больше работ, посвященных лапароскопическим вмешательствам при перекруте и некрозе отростков [7, 13, 15-16]. При отсутствии некротических изменений перекрученного отростка ряд авторов предлагают производить эндоскопическую деторсию с помощью манипулятора с последующей оценкой жизнеспособности отростка (выполняется в 4,3-10% наблюдений). В 14,3-100% наблюдений выполняется лапароскопическое удаление патологически измененных отростков с различными способами обработки и пересечения ножки отростка: коагуляцией, клипированием, лигированием [2, 4, 5, 7, 8, 15-16].
Редкая встречаемость, неосведомленность врачей о заболевании отростков, необходимость хирургического лечения заболевания обусловливают актуальность изучения особенностей клинической картины, возможностей различных лабораторно-инструментальных методов в диагностике заболеваний сальниковых отростков ободочной кишки.
Цель исследования — изучение особенностей клинической симптоматики и оценка возможностей лапароскопии в современной диагностике и лечении больных с патологическими изменениями сальниковых отростков ободочной кишки.
Материал и методы
Проведен ретроспективный анализ историй болезни 87 пациентов с диагнозом перекрута и некроза сальниковых отростков ободочной кишки, которым было выполнено лапароскопическое вмешательство в клинике с января 1995 г. по декабрь 2012 г. Возраст больных составил от 20 лет до 81 года (в среднем 44±16 лет). Мужчин было 44 (50,6%), женщин — 43 (49,4%).
Статистический анализ данных осуществлялся с помощью программы SPSS 19. Для качественных признаков данные представлены в абсолютных величинах и долях в процентах. Для количественных признаков с нормальным распределением результатов данные приведены в виде M±SD, где М — средняя арифметическая величина, SD — среднее квадратичное отклонение. Для количественных признаков с распределением результатов, отличающимся от нормального, данные представлены в виде Me [25; 75], где Me — медиана, 25 и 75 — 25-й и 75-й перцентили.
Результаты и обсуждение
В экстренном порядке в клинику поступали 84 (96,6%) пациента, из них 64 (76,2%) были доставлены бригадой скорой медицинской помощи, 20 (23,8%) самостоятельно обратились в приемное отделение клиники. 3 пациентки поступали в плановом порядке для хирургического лечения других заболеваний (папиллярная цистаденома левого яичника, хронический сальпингоофорит, полип сигмовидной кишки). Диагноз перекрута и некроза отростков был заподозрен на догоспитальном этапе врачом поликлиники лишь в 1 наблюдении; врачами приемного отделения — в 5 наблюдениях. Время от начала заболевания до поступления значительно варьировало, составляя от 2 ч до 7 сут (в среднем 48 [24; 69] ч).
Диагностика в стационаре на дооперационном этапе базировалась на жалобах больных, данных анамнеза, физикального обследования, данных лабораторных и инструментальных методов исследования. Клинические проявления перекрута и некроза отростков были скудными и неспецифичными, что приводило к постановке ошибочного диагноза на дооперационном этапе у большинства больных. Основные клинические проявления у пациентов с перекрутом и некрозом отростков приведены в табл. 1.
Ведущим симптомом были постоянные боли в животе, отмечавшиеся у 85 (97,7%) больных. Преимущественной локализацией болей были нижние отделы живота — у 67 (78,8%) больных, часть из них отмечали локальные боли в правой или левой подвздошной области (см. табл. 1). У 7 (8,0%) больных имел место симптом Кохера-Волковича. Иррадиация болей присутствовала у 16 (18,4%) пациентов, чаще в правое бедро. Объяснить возникновение иррадиации болей у этих больных интраоперационными данными не удалось, лишь у 8 из них некротизированные отростки были спаяны с окружающими органами и тканями — стенкой толстой кишки, соседними отростками, большим сальником, париетальной брюшиной или придатками матки. У 14 (16,1%) больных боли усиливались при движении.
При выяснении данных анамнеза 7 (8,0%) больных отмечали наличие провоцирующих факторов: тяжелой физической нагрузки (3), резкого движения (1), приема антибактериальных препаратов (1), пищи (1), алкоголя (1). 26 (29,9%) больных самостоятельно принимали различные лекарственные средства (спазмолитики, анальгетики, антибактериальные препараты), которые не купировали болевой синдром. Неэффективность самостоятельного приема лекарственных препаратов и нарастающая интенсивность болей заставляли больных обращаться за медицинской помощью.
Жалобы на сухость во рту предъявляли 27 (31,0%) больных, на тошноту — 19 (21,8%). Рвота и нарушения стула отмечались у единичных больных. Лихорадкой страдали 33 (37,9%) пациента, чаще с подъемом температуры тела до субфебрильных значений. Нехарактерные жалобы были у 4 пациентов, что заставляло врачей заподозрить другое заболевание и приводило к постановке ошибочного предоперационного диагноза. С учетом данных интраоперационной лапароскопической картины возникновение жалоб можно связать с наличием сочетанных заболеваний, а также с развитием инфильтрата вокруг некротизированного отростка. 2 пациентки предъявляли жалобы на головокружение (интраоперационно, помимо заболевания отростка, обнаружены напряженная киста желтого тела у 1 и цистаденома левого яичника и маточная беременность 5 нед у 1). У одной пациентки были мажущие кровяные выделения из половых путей в течение 11 дней (интраоперационно диагностирован наружный эндометриоз малого таза). Один пациент предъявлял жалобы на учащенное мочеиспускание с резями над лоном (интраоперационно обнаружен плотный инфильтрат вокруг некротизированного отростка, вовлекающий большой сальник, стенку сигмовидной кишки, соседние отростки и фиксированный к париетальной брюшине в области дна мочевого пузыря).
Состояние 81 (93,1%) больного оценивалось как удовлетворительное, 5 (5,8%) — средней тяжести, 1 (1,1%) — тяжелое. Степень тяжести у последних 6 пациентов была связана с наличием сочетанных заболеваний — острого гангренозно-перфоративного аппендицита (1), перфорации дивертикула левой половины ободочной кишки (1), сопутствующих заболеваний терапевтического и неврологического профиля (4). Следует отметить, что 50 (57,5%) больных имели избыточную массу тела, в том числе предожирение выявлено у 13 (15,0%) пациентов, ожирение I степени — у 29 (33,3%), ожирение II степени — у 6 (6,9%), ожирение III степени — у 3 (2,3%). Средний индекс массы тела больных с перекрутом и некрозом отростков составил 29,7±5,0 кг/м2.
Основные данные, полученные при физикальном обследовании и лабораторно-инструментальных методах исследования, представлены в табл. 2.
Язык был влажным у 79 (90,8%), светлый налет на языке отмечался у 60 (69,0%) больных. При осмотре живот у всех больных был симметричным, притупления в отлогих местах живота не было обнаружено ни у одного пациента. Живот был вздут у 5 больных. У большинства пациентов перистальтика была обычной звучности, лишь в 4 наблюдениях отмечалось ее ослабление, у 2 из этих больных интраоперационно обнаружен местный фибринозно-гнойный перитонит.
Локальное напряжение мышц передней брюшной стенки обнаружено у 15 (17,2%) больных.
В большинстве наблюдений — 83 (95,4%) — отмечалась болезненность при пальпации живота, нередко локальная — у 52 (59,8%) больных. Области, в которых выявлена максимальная болезненность при пальпации живота, представлены на рисунке. Рисунок 1. Болезненность при пальпации живота.
Рисунок 1. Болезненность при пальпации живота.
В 77 (88,5%) наблюдениях болезненность при пальпации обнаруживалась в нижних отделах живота, из них в 44 (50,6%) максимальная болезненность выявлена в правой подвздошной области, в 29 (33,3%) — в левой подвздошной области. Симптомы острого аппендицита (Ровзинга, Ситковского, Воскресенского) были обнаружены у 31 (35,6%) больного, что приводило к постановке диагноза острого аппендицита на дооперационном этапе в этих наблюдениях. Во время лапароскопии лишь у 3 из них выявлен острый аппендицит: флегмонозный — у 2, гангренозно-перфоративный — у 1. Симптом Щеткина-Блюмберга от сомнительного до положительного обнаружен у 29 (33,3%) пациентов.
Пальпируемое образование в брюшной полости обнаружено у 3 больных. Интраоперационно у них выявлены рыхлый инфильтрат, состоящий из петли сигмовидной кишки, правой маточной трубы, сальниковых отростков сигмовидной кишки (1), перекрут двух отростков сигмовидной кишки между собой (1), спаянный с париетальной брюшиной отросток сигмовидной кишки (1).
Существенные диагностические трудности на дооперационном этапе встретились у одной больной, предъявляющей жалобы на боли в правом подреберье. При осмотре у нее, помимо болезненности в данной области, выявлялся сомнительный симптом Ортнера, в связи с чем она в течение суток лечилась по поводу острого холецистита. Лишь на следующие сутки боли локализовались в левой подвздошной области, больной была выполнена диагностическая лапароскопия с целью дифференциальной диагностики между дивертикулезом и дивертикулитом левой половины ободочной кишки и перекрутом отростка сигмовидной кишки, последний диагноз подтвержден. Малоподвижное, плотное, болезненное пальпируемое образование в брюшной полости при ректальном, а также двуручном исследовании описано у одной больной. Интраоперационно был обнаружен рыхлый инфильтрат вокруг некротизированного отростка сигмовидной кишки, вовлекающий прядь большого сальника, подпаянный к париетальной брюшине малого таза и правого латерального канала.
При вагинальном исследовании у 6 (14,0%) больных обнаружено болезненное смещаемое образование слева или справа от матки, что заставляло на предоперационном этапе проводить дифференциальную диагностику с гинекологическими заболеваниями: перекрутом цистаденомы яичника (4), разрывом эндометриоидной кисты яичника (1), обострением хронического сальпингоофорита с формированием пиосальпинкса (1). У всех 6 больных во время лапароскопии обнаружен перекрученный и некротизированный отросток сигмовидной кишки, при этом у 2 из них вокруг отростков сформировался рыхлый инфильтрат. Лишь у одной больной из 6 было обнаружено сочетанное заболевание — цистаденома яичника без нарушения питания.
Лабораторные методы обследования у всех больных включали общий анализ крови с определением уровня гемоглобина, эритроцитов и лейкоцитов, общий анализ мочи. Показатели гемоглобина (среднее значение 146 [135; 150] г/л) и эритроцитов (среднее значение 4,88 [4,38; 5,21]’1012/л) в общем анализе крови были в пределах нормы у всех пациентов. Уровень лейкоцитов был повышен у 45 (51,7%) больных: у 28 (32,2%) отмечался умеренный лейкоцитоз с повышением уровня лейкоцитов до (9-12)’109/л, у 17 (19,5%) — более 12’109/л. У 9 больных в процессе динамического наблюдения проводили повторный анализ крови с определением уровня лейкоцитов, его повышение отмечено у 8 из них. Средний уровень лейкоцитов составил 9,0 [8,2; 11,4]’109/л. У 39 (44,8%) больных измеряли СОЭ, среднее значение составило 16 [10; 16] мм/ч.
С целью дообследования и проведения дифференциальной диагностики между различными хирургическими, гинекологическими и урологическими заболеваниями в ряде наблюдений были выполнены рентгенография брюшной полости в поисках свободного газа и уровней жидкости (12), УЗИ органов брюшной полости (7), УЗИ органов малого таза у женщин (8), обзорная урография (12), УЗИ почек (6), экстренная эзофагогастродуоденоскопия (1), экскреторная урография (1), колоноскопия (1). Данные, полученные при перечисленных инструментальных методах исследования, чаще всего были неспецифичны, позволяли исключить другие заболевания брюшной полости и малого таза, но не давали возможности диагностировать перекрут и некроз отростков.
На основании данных рентгенографии брюшной полости выявлен умеренный пневматоз толстой кишки у 4 больных, пневматоз тонкой кишки и единичный уровень жидкости в тонкой кишке у 2 из 12 больных. По данным УЗИ органов брюшной полости обнаружены свободная жидкость в брюшной полости (1), инфильтрат (2; не подтверждено интраоперационными данными).
Интерес представляет больная, поступившая в плановом порядке для полипэктомии по поводу полипа сигмовидной кишки, однако при колоноскопии изменений не обнаружено. Это заставило уточнить анамнез (боли в нижних отделах живота) и назначить консультацию гинеколога, УЗИ органов малого таза. По данным УЗИ малого таза выявлено образование размером до 32 мм, расположенное медиальнее левого яичника и интимно к нему прилежащее, гипоэхогенной ячеистой структуры без кровотока при ЦДК. Выполнена лапароскопия с целью дифференциальной диагностики между цистаденомой яичника с перекрутом в анамнезе и перекрутом отростка кишки (интраоперационно: перекрут отростка сигмовидной кишки). Остальным 7 больным, которым было выполнено УЗИ органов малого таза, на основании обнаруженных изменений и клинических данных поставлены диагнозы гинекологических заболеваний, не подтвержденные интраоперационными данными.
Обзорная урография (12), УЗИ почек (6), экскреторная урография (1) проводились с целью дифференциальной диагностики с почечной коликой на предоперационном этапе, лишь в одном наблюдении нельзя было исключить этот диагноз. Экстренная эзофагогастродуоденоскопия (1) была выполнена на операционном столе в связи с предоперационным диагнозом перфорации язвы луковицы двенадцатиперстной кишки, однако язв и эрозий обнаружено не было.
Ряду больных были назначены консультации специалистов. 24 (55,8%) пациенткам назначена консультация гинеколога, 14 из них был поставлен диагноз острых гинекологических заболеваний. 19 (21,8%) пациентов были консультированы урологом, лишь у 1 из них нельзя было исключить диагноз правосторонней почечной колики. Больные с сопутствующими заболеваниями терапевтического и неврологического профиля консультированы перед лапароскопическим вмешательством терапевтом (11) и неврологом (1), противопоказаний к операции выявлено не было.
Перекрут и некроз отростков по результатам обследования до операции был заподозрен у 30 (34,5%) больных. У 7 (8,0%) из них он был основным диагнозом в предоперационном эпикризе, у 25 (27,5%) подозревался при проведении дифференциальной диагностики с другими острыми хирургическими и гинекологическими заболеваниями. У остальных 57 (65,5%) больных показанием к оперативному вмешательству послужили подозрение на другие острые хирургические и гинекологические заболевания органов брюшной полости и необходимость дифференциальной диагностики между ними. Основные диагнозы в предоперационном эпикризе, по поводу которых выполнялось лапароскопическое вмешательство, представлены в табл. 3.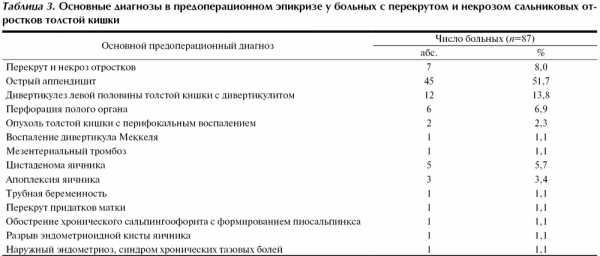
Наиболее частыми предоперационными диагнозами были острый аппендицит (51,7%), дивертикулез с дивертикулитом (13,8%), перфорация полого органа (6,9%), цистаденома яичника (5,7%), апоплексия яичника (3,4%). Стоит отметить, что трудности диагностики перекрута и некроза отростков приводили к тому, что у большинства больных — 60 (68,9%) — лапароскопическое вмешательство проводилось с целью дифференциальной диагностики между несколькими хирургическими — 52 (59,7%), хирургическими и гинекологическими — 6 (6,9%) и несколькими гинекологическими — 2 (2,3%) заболеваниями органов брюшной полости. У 58 (66,7%) больных дифференциальная диагностика проводилась между двумя заболеваниями. У одного больного проводилась дифференциальная диагностика между тремя заболеваниями (острым аппендицитом, острым мезаденитом и перекрутом и некрозом отростка), у одного больного — между четырьмя заболеваниями (дивертикулезом левой половины толстой кишки с дивертикулитом, опухолью толстой кишки с перифокальным воспалением, перекрутом и некрозом отростка и сигмоидитом). Лишь у 27 (31,1%) больных лапароскопическое вмешательство было предпринято в связи с подозрением на наличие какого-либо одного заболевания.
Лапароскопические вмешательства в 74 (85,1%) наблюдениях были выполнены в первые 6 ч после поступления. В среднем время от момента поступления до лапароскопического вмешательства составило 3 [2; 4] ч. 3 больных были оперированы более чем через сутки после поступления: 2 поступившие для планового лечения и 1 получавшая консервативное лечение в связи с диагнозом болевой формы апоплексии яичника.
Лапароскопическая ревизия брюшной полости позволила установить диагноз перекрута и некроза отростков у 84 (96,6%) из 87 больных. У остальных 3 (3,4%) больных диагноз перекрута и некроза отростков был установлен после конверсии, произведенной в связи с наличием плотного инфильтрата брюшной полости (2) и небезопасностью вскрытия абсцесса малого таза, стенкой которого являлась стенка мочевого пузыря (1).
Лапароскопическое лечение перекрута и некроза отростков проведено у 79 (90,8%) из 87 больных. Удаление перекрученных и некротизированных отростков с применением монополярной коагуляции произведено в 61 (77,2%) наблюдении, клипирования — в 9 (11,4%), лигирования — в 1 наблюдении. Самоампутировавшиеся при манипуляциях некротизированные отростки удалены в 7 из 79 наблюдений. У одной больной выполнено иссечение гидатиды маточной трубы, которая вызвала перекрут отростка, после чего отросток признан жизнеспособным и не удалялся.
У остальных 8 (9,2%) больных измененный отросток удален путем лигирования и последующего отсечения ножницами во время лапаротомии. Причинами конверсии у этих 8 больных послужили плотная фиксация отростка к стенке кишки (3), плотный инфильтрат брюшной полости (2), абсцесс малого таза (1), сочетанные заболевания — перфорация дивертикула (1), острый гангренозно-перфоративный аппендицит с ретроцекальным ретроперитонеальным расположением червеобразного отростка (1).
Дооперационная диагностика заболеваний отростков осложняется также возможным сочетанием перекрута и некроза отростков с другими заболеваниями органов брюшной полости и малого таза. Сочетанные заболевания по данным лапароскопического вмешательства были выявлены у 20 (23,0%) больных (табл. 4).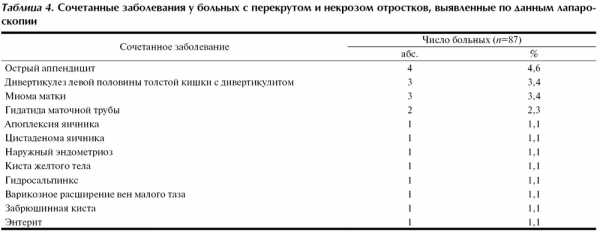
Сочетанное лапароскопическое вмешательство выполнено в 8 (9,2%) наблюдениях, в том числе адгезиолизис (4), удаление гидатиды маточной трубы (2), лапароскопическая аппендэктомия (2), электрокоагуляция очагов эндометриоза (1), вскрытие и коагуляция напряженной кисты желтого тела (1).
Интраабдоминальных осложнений не было. Послеоперационное осложнение в ближайшем послеоперационном периоде наблюдалось у 1 из 79 больных, которым было выполнено лапароскопическое лечение перекрута и некроза отростков. На 9-е сутки после лапароскопического вмешательства у этого больного был выявлен инфильтрат в проекции раны в левой подвздошной области; на 11-е сутки диагностирован неполный наружный толстокишечный свищ. Развитие этого осложнения, по-видимому, было связано с наличием сочетанного заболевания — дивертикулеза левой половины толстой кишки и микроперфорации дивертикула с последующим образованием наружного толстокишечного свища через дренажный ход, что подтверждалось данными фистулографии и ирригоскопии. Послеоперационный период после лапароскопического вмешательства у большинства больных с перекрутом и некрозом отростков протекал без осложнений. Средняя длительность пребывания в стационаре после операции составила 5 [5; 8] сут.
Летальный исход после лапароскопического лечения перекрута и некроза отростков имел место у 1 больной из 79 через 25 ч после вмешательства.
Больная Л., 76 лет, с выраженными сопутствующими терапевтическими (ишемическая болезнь сердца — стенокардия напряжения IV функционального класса, гипертоническая болезнь III стадии, пароксизмальная форма мерцательной аритмии на фоне атеросклеротического кардиосклероза) и неврологическими (атеросклероз сосудов головного мозга, 2 перенесенных острых нарушения мозгового кровообращения с развитием правостороннего гемипареза и дизартрии) заболеваниями поступила в клинику в тяжелом состоянии. В результате обследования возникло подозрение на мезентериальный тромбоз, перитонит в нижних отделах живота, в связи с чем было принято решение о выполнении диагностической лапароскопии. После подготовки в условиях отделения реанимации через 33 ч от начала заболевания, 4 ч после поступления больная была оперирована, диагностирован перекрут и некроз отростка сигмовидной кишки. Произведено лапароскопическое удаление некротизированного отростка путем коагуляции его ножки (в течение 10 мин). Лапароскопическое вмешательство без особенностей, с интраабдоминальным давлением 8 мм рт.ст. Летальный исход был связан с пароксизмом мерцательной аритмии и развитием ишемического инсульта в височно-лобной области левого полушария головного мозга, возникшем через 25 ч после лапароскопического вмешательства.
В 8 наблюдениях была произведена конверсия, при этом осложнение в ближайшем послеоперационном периоде развилось у 1 больной, у которой на 9-е сутки после удаления некротизированного отростка, аппендэктомии (по поводу некроза отростка сигмовидной кишки, вторичного аппендицита) при снятии швов выявлена гематома послеоперационной раны. В последующем проводили консервативное лечение: эвакуацию гематомы, санирующие перевязки, повязки с левомеколем, химотрипсином, обезболивающую и десенсибилизирующую терапию; отмечено медленное заживление раны вторичным натяжением, что было связано с наличием у пациентки сахарного диабета II типа.
Рецидив заболевания отростка после лапароскопического лечения отмечен у 1 (1,3%) из 79 больных. У больной Г., 25 лет, через 28 дней после лапароскопического удаления некротизированного отростка сигмовидной кишки произошел рецидив заболевания с появлением аналогичной клинической картины, напоминающей таковую при остром аппендиците. Выполнена диагностическая лапароскопия, при которой выявлены перекрут и некроз отростка восходящей ободочной кишки; произведено его лапароскопическое удаление с использованием монополярной электрокоагуляции с благоприятным исходом.
Таким образом, клиническая картина и данные лабораторно-инструментальных методов исследования при перекруте и некрозе отростков скудны и неспецифичны, что существенно затрудняет дооперационную диагностику данного заболевания. Предположение о наличии перекрута и некроза отростков до операции возникает в 34,5% наблюдений. В неясных диагностических ситуациях лапароскопия является методом выбора и позволяет диагностировать перекрут и некроз отростков в 96,6% наблюдений. Успешное оперативное лечение с применением лапароскопического доступа возможно в 90,8% наблюдений.
www.mediasphera.ru
Некроз жирового подвеска сигмовидной кишки и жировой ткани
Термин «жировой некроз» означает очаговые омертвения жировой ткани вследствие действия различных факторов. Некроз жировой ткани встречается в области поджелудочной железы, в забрюшинной жировой ткани, среди жира сальника, брыжеек, в жировой клетчатке средостения, жировом покрове эпикарда, жировом слое под париетальной плеврой, в подкожной жировой клетчатке и в костном мозгу.
Анатомическое строение подвесок в сигмовидной кишке, предполагает их заворот и развитие воспаления и некроза. Причиной заворота подвеска может быть спаивание их с париетальной брюшиной или другими органам. Многие обследования пожилых людей, страдающих запорами, позволили сделать вывод, что у них сигмовидная кишка увеличена в размерах и поэтому жировые подвески прижимаются к передней брюшной стенке.
Мышцы передней брюшной стенки вследствие гипотрофичных изменений имеют в наиболее уязвимых местах грыжи, жировые подвески свободного края сигмовидной кишки попадают в углубление или ямку париетальной брюшины, воспаляются и припаиваются к ней. В последующем может развиться некроз.
Различают несколько видов жирового некроза
· Ферментный жировой некроз является следствием острого панкреатита и повреждения поджелудочной железы, образуется при выходе панкреатических ферментов из протоков в окружающие ткани. Панкреатическая липаза расщепляет триглицериды в жировых клетках на глицерин и жирные кислоты, которые в свою очередь взаимодействуют с плазменными ионами кальция, образу мыла кальция. В жировой ткани появляются белые, плотные бляшки и узелки. Если липаза попадает в кровоток, то жировой некроз может быть выявлен во многих участках организма.
· Неферментный жировой некроз диагностируется в молочной железе, подкожной жировой ткани и в брюшной полости, его называют травматическим жировым некрозом. Он вызывает повышение количества макрофагов с пенистой цитоплазмой, нейтрофилов и лимфоцитов. Может происходить процесс образования соединительной ткани (фиброзирование), часто его принимают за процесс формирования опухоли.
Известно, что жировой некроз не преобразовывается в злокачественную опухоль, но может симулировать её . Жировой некроз молочной железы возникает в результате травмы, вследствие чего повреждаются мелкие сосуды, теряется снабжение кровью. Данная патология может возникать при проведении лучевой терапии, при стремительной потере веса.
Заболевание может протекать безболезненно или с ощущением боли при пальпации. Для него характерно увеличение лимфатических узлов и образование ямочек на коже. Лечение заключается в удалении очага жирового некроза методом секторальной резекции.
Воспалительное заболевание или некроз подкожной жировой ткани встречается главным образом у новорожденных.
На сегодняшний день причины не выяснены. Основная локализация патологии наблюдается на ягодицах, бедрах, спине, верхних отделах рук и на лице. Образованию данного процесса предшествует плотный отек кожи. Некроз в этом случае может быть очаговым или распространенным. Определяется он наличием болезненных узлов цвета кожи или красноватых с багровым оттенком и неправильной формы.
На участках поражений может произойти произвольная нейтрализация патологических явлений, от которых не остается следов. Если в зоне поражения некрозом образуются соли кальция, то жидкое содержимое выходит наружу, и тогда могут образоваться небольшие рубцы. В редких случаях возможны следующие симптомы: снижение артериального давления, истощение, рвота и лихорадочные состояния.
Анализы констатируют повышение концентрации кальция в плазме крови и аномально повышенный уровень липидов. Жировой некроз у детей развивается в результате родовой травмы, асфиксии, влияния низких температур или снижения внутренней температуры тела. При исследовании очень важны гистологические изменения, выраженные утолщением фиброзных перегородок, отложением кристаллов внутри жировых клеток и гранулематозных клеточных инфильтратах.
Заболевание носит спонтанный характер, поэтому лечение не требуется, не желательно проводить аспирацию с помощью иглы из флюктуирующих кожных элементов, это может вызвать инфицирование, и тогда возможны непредвиденные осложнения. Существует также диссеминированный некроз жировой ткани, когда некротизируется жировая ткань вокруг суставов.
При этом всегда повышается температура тела, развивается артрит, и разрушаются суставы. Диссеминированный некроз жировой ткани возникает тоже от того, что в кровь или лимфу попадают ферменты поджелудочной железы. Уровень летальных исходов при таком виде некроза жировой ткани весьма высок, всегда нужно помнить, что о любых симптомах плохого самочувствия Вы должны сообщать своему лечащему врачу. Только вовремя оказанная медицинская помощь способствует сохранению здоровья.
kakbyk.ru