Бессмертные клетки HeLa
Анна Старокадомская
«Популярная механика» №4, 2014
В большую науку эти клетки попали совершенно неожиданно. Они были взяты у женщины по имени Генриетта Лакс (HEnrietta LAcks), которая вскоре после этого умерла. Но культура клеток убившей ее опухоли оказалась незаменимым инструментом для ученых.
В биомедицинских исследованиях и при разработке новых видов лечения часто используют выращенные в лаборатории культуры человеческих клеток. Среди множества клеточных линий одна из самых известных — HeLa. Эти клетки, имитирующие организм человека in vitro («в пробирке»), «вечны» — они могут бесконечно делиться, результаты исследований с их использованием достоверно воспроизводятся в разных лабораториях. На своей поверхности они несут достаточно универсальный набор рецепторов, что позволяет использовать их для исследования действия различных веществ, от простых неорганических до белков и нуклеиновых кислот; они неприхотливы в культивировании и хорошо переносят заморозку и консервацию.
Генриетта Лакс
Генриетта Лакс была красивой чернокожей американкой. Она жила в небольшом городке Тернер в Южной Виргинии вместе с мужем и пятью детьми. 1 февраля 1951 года Генриетта обратилась в госпиталь Джонса Хопкинса — ее беспокоили странные выделения, которые она периодически обнаруживала на своем нижнем белье. Медицинский диагноз был страшен и беспощаден — рак шейки матки. Восемь месяцев спустя, несмотря на хирургию и радиотерапию, она умерла. Ей был 31 год.
Пока Генриетта лежала в госпитале Хопкинса, лечащий врач отправил полученные с помощью биопсии клетки опухоли на анализ Джорджу Гею — руководителю лаборатории исследования клеток тканей в госпитале Хопкинса. В то время культивирование клеток вне организма было только на стадии становления, и главной проблемой была неизбежная гибель клеток — после определенного количества делений вся клеточная линия погибала.
Оказалось, что клетки, обозначенные «HeLa» (акроним имени и фамилии Генриетты Лакс), размножались гораздо быстрее клеток из нормальных тканей. Кроме того, злокачественная трансформация сделала эти клетки бессмертными — у них отключилась программа подавления роста после определенного количества делений. In vitro такого прежде не происходило ни с какими другими клетками. Это открывало небывалые перспективы в биологии.
Действительно, никогда до этого момента исследователи не могли считать результаты, полученные на клеточных культурах, полностью достоверными: все опыты проводились на разнородных клеточных линиях, которые в конце концов погибали — иногда даже прежде, чем удавалось получить какие-нибудь результаты. И тут ученые стали обладателями первой стабильной и даже вечной (!) клеточной линии, адекватно имитирующей свойства организма. А когда обнаружилось, что клетки HeLa способны пережить даже пересылку по почте, Гей разослал их своим коллегам по всей стране. Очень скоро спрос на клетки HeLa вырос, и их растиражировали в лабораториях по всему миру. Они стали первой «шаблонной» клеточной линией.

Так получилось, что Генриетта умерла именно в тот день, когда Джордж Гей выступал перед телевизионными камерами, держа в руках пробирку с ее клетками. Он заявил, что началась эпоха новых перспектив в поиске лекарств и медико-биологических исследованиях.
Почему ее клетки так важны?
И он был прав. Линия клеток, идентичная во всех лабораториях мира, позволила быстро получать и независимо подтверждать всё новые и новые данные. Можно смело сказать, что гигантский прыжок молекулярной биологии в конце прошлого века был обусловлен возможностью культивировать клетки in vitro. Клетки Генриетты Лакс стали первыми бессмертными человеческими клетками, которые когда-либо были выращены на искусственной питательной среде. HeLa научили исследователей культивировать сотни других линий раковых клеток. И хотя в последние годы приоритет в этой области смещается в сторону культур клеток нормальных тканей и индуцированных плюрипотентных стволовых клеток (за открытие метода возвращения клеток взрослого организма в эмбриональное состояние японский ученый Синья Яманака получил Нобелевскую премию по физиологии и медицине 2012 года), тем не менее раковые клетки остаются общепринятым стандартом в медико-биологических исследованиях. Основное преимущество HeLa — неудержимый рост на простых питательных средах, что позволяет проводить масштабные исследования при минимуме затрат.
С момента смерти Генриетты Лакс клетки ее опухоли непрерывно использовались для исследования молекулярных закономерностей развития самых разных заболеваний, в том числе рака и СПИДа, для изучения воздействия радиации и токсичных веществ, составления генетических карт и огромного количества других научных задач. В мире биомедицины клетки HeLa стали столь же известны, как лабораторные крысы и чашки Петри. В декабре 1960 года клетки HeLa первыми полетели в космос в советском спутнике. Даже сегодня поражает размах экспериментов, проводившихся тогда советскими генетиками в космосе. Результаты показали, что HeLa хорошо себя чувствуют не только в земных условиях, но и в невесомости.
Без клеток линии HeLa стала бы невозможной разработка вакцины против полиомиелита, созданной Джонасом Солком. Кстати, Солк был настолько уверен в безопасности полученной вакцины (ослабленного вируса полиомиелита), что в доказательство надежности своего лекарства вколол вакцину себе, своей жене и троим детям.
С тех пор HeLa использовали и для клонирования (предварительные опыты по пересадке клеточных ядер перед клонированием знаменитой овцы Долли проводились на HeLa), для отработки методов искусственного оплодотворения и тысяч других исследований (некоторые из них приведены в таблице).
Помимо науки…
Личность самой Генриетты Лакс долгое время не афишировалась. Для доктора Гея, конечно, происхождение клеток HeLa не было тайной, но он полагал, что конфиденциальность в этом вопросе является приоритетом, и в течение многих лет семья Лакс не знала, что клетки Генриетты прославились на весь мир. Тайна раскрылась только после смерти доктора Гея в 1970 году.Напомним, что стандарты стерильности и техники работы с клеточными линиями в то время только зарождались, и некоторые ошибки всплывали лишь спустя годы. Так и в случае с клетками HeLa — через 25 лет ученые выяснили, что множество используемых в исследованиях клеточных культур, происходящих из других типов тканей, включая клетки рака молочной и предстательной желез, оказались зараженными более агрессивными и живучими клетками HeLa. Оказалось, что HeLa могут перемещаться с частицами пыли в воздухе или на недостаточно тщательно вымытых руках и приживаться в культурах других клеток. Это вызвало большой скандал. В надежде решить проблему путем генотипирования (секвенирование — полное прочтение генома — в то время пока еще только планировалось как грандиозный международный проект), одна группа ученых разыскала родственников Генриетты и попросила образцы ДНК семьи, для того чтобы составить карту генов. Таким образом тайное и стало явным.
Кстати, американцы и сейчас переживают больше по поводу того, что семья Генриетты так и не получила компенсацию за использование клеток HeLa без согласия донора. По сей день семья живет в не очень-то хорошем достатке, и материальная помощь была бы очень кстати. Но все запросы упираются в глухую стену — ответчиков давно уж нет, а Медицинская академия и другие научные структуры предсказуемо не желают обсуждать эту тему.

11 марта 2013 года масла в огонь подлила новая публикация, где были представлены результаты полного сиквенса генома клеточной линии HeLa. Опять же, эксперимент был проведен без согласия потомков Генриетты, и после непродолжительных этических споров полный доступ к геномной информации был разрешен только для профессионалов. Тем не менее, полный геномный сиквенс HeLa имеет огромное значение для последующих работ, позволяя использовать клеточную линию в будущих геномных проектах.
Реальное бессмертие?
Злокачественная опухоль, убившая Генриетту, сделала ее клетки потенциально бессмертными. Хотела ли эта женщина бессмертия? И получила ли она его? Если задуматься, возникает фантастическое ощущение — часть живого человека, искусственно размноженная, терпит миллионы испытаний, «пробует на вкус» все лекарства перед тем, как они попадут в испытания на животных, раздраконивается до самых что ни на есть основ молекулярными биологами во всем мире…
Конечно, всё это не имеет никакого отношения к «жизни после жизни». Глупо полагать, что в клетках HeLa, беспрестанно мучимых ненасытными учеными, существует хоть какая-то частичка души несчастной молодой женщины. Тем более что человеческими эти клетки можно считать лишь отчасти. В ядре каждой клетки HeLa — от 76 до 82 хромосом из-за происшедшей в процессе озлокачествления трансформации (нормальные человеческие клетки содержат 46 хромосом), и эта полиплоидность периодически вызывает споры о пригодности клеток HeLa как модели человеческой физиологии. Было даже предложено выделить эти клетки в отдельный, близкий человеку вид, под названием
Тем не менее исследователи всегда помнят об ограничениях, которые необходимо иметь в виду. Во-первых, HeLa, несмотря на все изменения, всё еще остаются человеческими клетками: все их гены и биологические молекулы соответствуют человеческим, а молекулярные взаимодействия в подавляющем большинстве случаев идентичны биохимическим путям здоровых клеток. Во-вторых, полиплоидия делает эту линию более удобной для геномных исследований, так как количество генетического материала в одной клетке увеличено, и результаты получаются более четкими и контрастными. В-третьих, широкое распространение клеточных линий по миру позволяет без проблем повторять опыты коллег и использовать опубликованные данные как фундамент для собственных исследований. Установив основные факты на модели HeLa (а все помнят, что это хоть удобная, но только модель организма), ученые пытаются повторить их на более адекватных модельных системах. Как видно, HeLa и подобные им клетки представляют собой фундамент для всей науки и сегодня. И, несмотря на этические и моральные споры, сегодня хочется почтить память этой женщины, поскольку ее невольный вклад в медицину неоценим: клетки, оставшиеся после нее, спасли и продолжают спасать больше жизней, чем это может сделать любой врач.
Благодарим портал biomolecula.ru за помощь в подготовке статьи
См. также:
Ребекка Склут «Бессмертная жизнь Генриетты Лакс».
Бессмертные клетки Генриетты Лакс
В биомедицинских исследованиях и при разработке новых видов лечения часто используют выращенные в лаборатории культуры человеческих клеток. Среди множества клеточных линий одной из самых известных является HeLa — клетки эндотелия матки. Эти клетки, имитирующие упрощенного «человека» в лабораторных исследованиях, являются «вечными» — они могут бесконечно делиться, переносить десятки лет в морозилке, могут быть поделены на части в разных пропорциях. На своей поверхности они несут достаточно универсальный набор рецепторов, что позволяет использовать их для исследования действия различных цитокинов; они очень не прихотливы в культивировании; они очень хорошо переносят заморозку и консервацию. В большую науку эти клетки попали совершенно неожиданно. Они были взяты у женщины по имени Генриетта Лакс, которая вскоре после этого умерла. Рассмотрим всю историю подробнее.
Генриетта Лакс

Рисунок 1. Генриетта Лакс с мужем Дэвидом.
Генриетта Лакс была красивой чернокожей американкой. Она жила в небольшом городке Тернер в Южной Вирджинии вместе с мужем и пятью детьми. 1 февраля 1951 года Генриетта Лакс обратилась в госпиталь Джонса Хопкинса — её беспокоили странные выделения, которые она периодически обнаруживала на своём нижнем белье. Медицинский диагноз был страшен и беспощаден — рак шейки матки. Восемь месяцев спустя, несмотря на хирургию и радиационное облучение, она умерла. Ей был 31 год.
Пока Генриетта находилась в госпитале Хопкинса, лечащий врач отправил её опухоль (цервикальная биопсия) на анализ Джорджу Гею (George Gey) — начальнику лаборатории исследования клеток тканей в госпитале Хопкинса. Напомним, что в то время культивирование клеток вне организма было только на стадии становления, и главной проблемой была предопределённая гибель клеток — после определенного количества делений вся клеточная линия погибала.
Оказалось, что клетки, обозначенные «HeLa» (акроним имени и фамилии Henrietta Lacks), размножались вдвое быстрее клеток из нормальных тканей. Такого прежде не происходило ни с какими другими клетками in vitro. Кроме того, трансформация сделала эти клетки бессмертными — у них отключилась программа подавления роста после определенного количества делений. Это открывало небывалые перспективы в биологии.
Действительно, никогда до этого момента исследователи не могли считать результаты, полученные на клеточных культурах, столь достоверными: раньше все опыты проводились на разнородных клеточных линиях, которые в конце концов погибали — иногда прежде, чем удавалось получить какие-нибудь результаты. И тут ученые получили первую стабильную и даже вечную (!) клеточную линию, достаточно адекватно имитирующую сущность организма. А когда обнаружилось, что клетки HeLa способны пережить даже пересылку по почте, Гей разослал их своим коллегам по всей стране. Очень скоро спрос на клетки HeLa вырос, и их растиражировали в лабораториях по всему миру. Они стали первой «шаблонной» клеточной линией.
Так получилось, что Генриетта умерла именно в тот день, когда Джордж Гей выступал перед телевизионными камерами, держа в руках пробирку с её клетками, и заявил, что началась новая эпоха в медицинских исследованиях — эпоха новых перспектив в поиске лекарств и исследовании жизни.
Почему её клетки так важны?
И он был прав. Линия клеток, идентичная во всех лабораториях мира, позволила быстро получать и независимо подтверждать всё новые и новые данные. Можно смело сказать, что гигантский прыжок молекулярной биологии в конце прошлого века был обусловлен возможностью культивировать клетки in vitro. Клетки Генриетты Лакс стали первыми бессмертными человеческими клетками, которые когда-либо были выращены на искусственной питательной среде. HeLa научили учёных культивировать сотни других линий раковых клеток. И, хотя до сих пор не найдено условий для культивирования нетрансформированных клеток, раковые клетки в большинстве своём являются адекватной моделью для поиска ответов на вопросы, задаваемые учёными и медиками.
Без клеток линии HeLa стала бы невозможной разработка вакцины против полиомиелита, созданной Джонасом Солком (Jonas Salk). Кстати, Солк был настолько уверен в безопасности полученной вакцины (ослабленного вируса полиомиелита), что в доказательство надёжности своего лекарства сначала вколол вакцину себе, своей жене и троим детям.
С момента смерти Генриетты Лакс клетки её опухоли непрерывно использовалась для исследования таких заболеваний как рак, СПИД, для изучения воздействия радиации и токсичных веществ, составления генетических карт и огромного количества других научных задач. В биомедицинском мире клетки HeLa стали столь же известны, как лабораторные крысы и чашки Петри. В декабре 1960 года клетки HeLa первыми полетели в космос в советском спутнике. Кстати, даже сегодня поражает размах экспериментов, проводимых тогда советскими генетиками в космосе (см. врезку).
Результаты показали, что HeLa хорошо себя чувствуют не только в земных условиях, но и в невесомости. С тех пор HeLa использовали и для клонирования (предварительные опыты по пересадке ядер перед клонированием знаменитой овцы Долли проводились на HeLa), и для составления генетических карт, и для отработки искусственного оплодотворения, и тысяч других исследований (см. рисунок 2).
Рисунок 2. Исследования, проведённые с помощью клеток линии HeLa.
Космическая генетика в СССР
На третьем космическом корабле-спутнике (01.12.1960 г.) в полёт отправились ещё больше живых объектов: две собаки — Пчёлка и Мушка, две морские свинки, две белые лабораторные крысы, 14 чёрных мышей линии С57, семь мышей-гибридов от мышей СБА и С57 и пять белых беспородных мышей. Там же поместили шесть колб с высокомутабельной и семь колб с низкомутабельной линиями дрозофил, а также шесть колб с гибридами. Кроме того, две колбы с мухами были покрыты дополнительной защитой — слоем свинца толщиной 5 г/см2. Помимо этого на корабле находились семена гороха, пшеницы, кукурузы, гречихи, конские бобы. В специальном лотке летали проростки семян лука и нигеллы. На борту корабля имелись несколько пробирок с актиномицетами, ампулы с культурой ткани человека в термостате и вне термостата, шесть пробирок с хлореллой в жидкой среде. В эбонитовых патронах находились запаянные ампулы с бактериальной культурой кишечной палочки и двумя разновидностями фага — Т3 и Т4. В специальных устройствах содержались культура клеток HeLa, лёгочная амниотическая ткань человека, фибробласты, клетки костного мозга кролика, а также контейнер с икрой и спермой лягушки. Были размещены также вирусы табачной мозаики различных штаммов, вирус гриппа.
Из статьи Н. Делоне «У истоков космической генетики» («Наука и Жизнь», № 4, 2008).
Помимо науки…
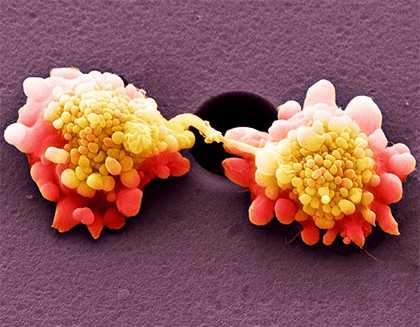
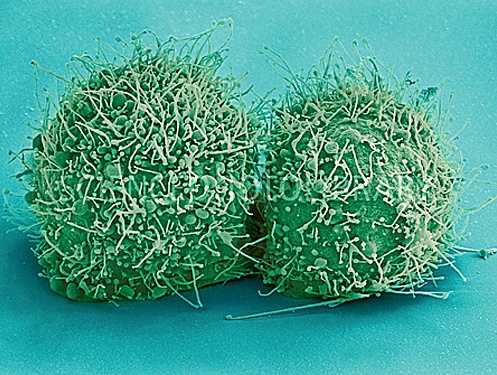
Рисунок 3. Клетки HeLa под сканирующим микроскопом в псевдоцветах.
Личность самой Генриетты Лакс долгое время не афишировалась. Доктор Гей, конечно, знал о происхождении клеток HeLa, но он полагал, что конфиденциальность в этом вопросе является приоритетом, и в течение многих лет семья Лакс не знала, что это именно её клетки прославились на весь мир. После смерти доктора Гея в 1970 году тайна раскрылась. Это случилось следующим образом. Напомним, что стандарты стерильности и техники работы с клеточными линиями только зарождались, и некоторые ошибки всплывали только спустя годы. Так и в случае с клетками HeLa — спустя 25 лет учёные выяснили, что множество клеточных культур, происходящих из других типов тканей, включая клетки молочных желез и предстательной железы, оказались заражёнными более агрессивными и живучими клетками HeLa. Оказалось, что HeLa могут перемещаться с частицами пыли в воздухе или на недостаточно тщательно вымытых руках, и приживаться в культурах других клеток. Это вызвало большой скандал. В надежде решить проблему путем генотипирования (секвенирования генома, напомним, тогда ещё не изобрели), одна группа учёных разыскала родственников Генриетты и попросила дать им образцы ДНК семьи для того, чтобы составить карту генов. Таким образом тайное и стало явным.
Кстати, сейчас американцы переживают больше по поводу того, что семья Генриетты так и не получила компенсацию за использование клеток HeLa без согласия донора. Плюс, и по сей день семья живет в не очень-то хорошем достатке, и материальная помощь была бы очень кстати. Но все запросы упираются в глухую стену — ответчиков давно уж нет, а Медицинская академия и другие научные структуры не хотят поддерживать разговор…
Реальное бессмертие?
Злокачественная опухоль, убившая Генриетту, сделала её клетки потенциально бессмертными. Хотела ли эта женщина бессмертия? И получила ли она его? Если сравнить первую и последнюю фотографии этой статьи, возникает ощущение, как в фантастическом романе — часть живого человека, искусственно размноженная, терпит миллионы испытаний, «пробует на вкус» все лекарства перед тем, как они попадут в аптеку, раздраконивается до самых что ни на есть основ молекулярными биологами во всем мире…
Конечно, всё это не имеет никакого отношения к «жизни после жизни». Мы не допускаем, что в клетках HeLa, круглый год мучимых под ламинарами лабораторий ненасытными аспирантами, существует хоть какая-то частичка души несчастной молодой женщины. Тем не менее, хочется почтить память этой женщины, поскольку её невольный вклад в медицину неоценим — клетки, оставшиеся после неё, спасли и продолжают спасать жизней больше, чем в силах сделать любой врач.
- Zielinski S. (2010). Henrietta Lacks’ „immortal“ cells. Smithsonian Magazine;
- Smith V. (2002). Wonder woman. Baltimore City Paper.
biomolecula.ru
Клетки HeLa : что это такое?
Откуда взялись иммортализованные клетки HeLa?
История получения этих «неумирающих» клеток (иммортализация — способность клеток к бесконечно долгому делению) связана с бедной 31-летней пациенткой Johns Hopkins Hospital в Балтиморе – афро-американкой, матерью пятерых детей по имени Генриетта Лэкс (Henrietta Lacks), которая, проболев раком шейки матки в течение восьми месяцев и пройдя внутреннее облучение (брахитерапию), скончалась в этой больнице 4 октября 1951 года.
Незадолго до этого, предпринимая усилия по лечению Генриетты от цервикальной карциномы, лечащий врач, хирург Говард Уилбур Джонс, взял образец ткани опухоли для исследования и передал в больничную лабораторию, возглавляемую в ту пору бакалавром биологии Джорджем Отто Геем.
Исследования биоптата ошеломили биолога: клетки тканей не погибли через положенное время в результате апоптоза, а продолжали размножаться, причем, с поразительной скоростью. Исследователю удалось выделить одну конкретную структурную ячейку и размножить ее. Полученные клетки продолжали делиться и перестали гибнуть в конце митотического цикла.
И вскоре после смерти пациентки (имя которой не разглашали, а зашифровали в виде сокращения HeLa) появилась загадочная культура клеток HeLa.
Как только стало ясно, что клетки HeLa – доступные вне человеческого тела – не подвержены запрограммированной гибели, спрос на них для различных исследований и экспериментов стал расти. И дальнейшая коммерциализация неожиданной находки вылилась в организацию серийного производства – для продажи клеток HeLa многочисленным научным центрам и лабораториям.
Использование клеток HeLa
В 1955 году клетки HeLa стали первыми клонированными клетками человека, и использование клеток HeLa началось по всему миру: в исследованиях клеточного метаболизма при раке; изучении процесса старения клеток; причин СПИДа; особенностей вируса папилломы человека и других вирусных инфекций; воздействия радиации и токсических веществ; картирования генов; в испытаниях новых фармакологических препаратов; тестировании косметических средств и т.д.
По некоторым данным, культура этих быстрорастущих клеток была использована в 70-80 тыс. медицинских исследований по всему миру. Ежегодно для потребностей науки выращивают около 20 тонн культуры клеток HeLa, зарегистрировано более 10 тыс. патентов с участием данных клеток.
Популяризации нового лабораторного биоматериала способствовало то, что в 1954 году штамм HeLa клеток был использован американскими вирусологами для проверки разработанной ими вакцины против полиомиелита.
В течение десятилетий культура клеток HeLa повсеместно служит простой моделью для создания более наглядных вариантов сложных биологических систем. А возможность клонировать иммортализованные клеточные линии позволяет многократно повторять анализы на генетически идентичных клетках, что является обязательным условием биомедицинских научных исследований.
В самом начале – в медицинской литературе тех лет – отмечалась «выносливость» этих клеток. Действительно, клетки HeLa не прекращают делиться даже в обычной лабораторной пробирке. И делают они это так агрессивно, что стоит лаборантам проявить малейшую неосторожность, клетки HeLa обязательно проникнут в другие культуры и спокойно заменят оригинальные клетки, в результате чего чистата проводимых экспериментов вызывает большие сомнения.
Кстати, в результате одного исследования, которое провели еще в 1974 году, была опытным путем установлена способность клеток HeLa «загрязнять» другие клеточные линии в лабораториях ученых.
Клетки HeLa: что показали исследования?
Почему клетки HeLa ведут себя таким образом? Потому что это не обычные клетки здоровых тканей тела, а клетки опухолевые, полученные из образца ткани раковой опухоли и содержащие патологические измененные гены непрерывного митоза раковых клеток человека. По сути, это клоны злокачественных клеток.
В 2013 году исследователи Европейской лаборатории молекулярной биологии (EMBL) сообщили о том, что с помощью спектрального кариотипирования они установили последовательность ДНК и РНК в геноме Генриетты Лэкс. И, сравнив с клетками HeLa, убедились: между генами HeLa и нормальными человеческими клетками поразительные различия…
Однако еще раньше цитогенетический анализ клеток HeLa привел к открытию многочисленных хромосомных аберраций и частичной геномной гибридизации этих клеток. Выяснилось, что клетки HeLa обладают гипертриплоидным (3n+) кариотипом и производят гетерогенные популяции клеток. При этом более чем у половины клонированных клеток HeLa выявлена анеуплоидия – изменение числа хромосом: 49, 69, 73 и даже 78 вместо 46.
Как оказалось, к геномной нестабильности фенотипа HeLa, потере маркеров хромосом и формированию дополнительных структурных аномалий причастны мультиполярные, полицентрические или многополюсные митозы в клетках HeLa. Это нарушения во время деления клетки, приводящее к патологической сегрегации хромосом. Если для здороаых клеток свойственна митотическая биполярность веретена деления, то в ходе деления раковой клетки образуется большее число полюсов и веретен деления, и обе дочерние клетки получают разное количество хромосом. И многополярность веретена при митозе клеток характерная особенность раковых клеток.
Изучая многополюсные митозы в клетках HeLa, генетики пришли к выводу, что весь процесс деления раковых клеток, в принципе, идет неправильно: профаза митоза короче, и формирование веретена деления предшествует делению хромосом; также раньше начинается метафаза, и хромосомы не успевают занять свое место, распределяясь бессистемно. Ну, а кочичество центросом как минимум вдвое больше необходимого.
Таким образом кариотип клетки HeLa нестаблен и может резко отличаться в разных лабораториях. Следовательно, результаты многих исследований – в условиях утраты генетической идентичности клеточного материала – просто невозможно воспроизвести в других условиях.
Наука сделала большие успехи благодаря способности манипулировать биологическими процессами в управляемом режиме. Последний наглядный пример – создание группой исследователей из США и Китая с помощью 3-D принтера реалистичной модели раковой опухоли, используя клетки HeLa.
ilive.com.ua
Расшифровка генома «бессмертных» клеток HeLa привела к скандалу в США
Затем научная группа из Университета Вашингтона в Сиэттле (США) под руководством Джея Шендура (Jay Shendure) также составила расшифровку генома HeLa и нашла причину, по которой у Лакс развился рак. Они изучили включения генов папилломавируса человека в геном HeLa. Этот вирус и сам несет набор генов, способствующих развитию рака, кроме того, он встроился рядом с онкогеном, мутации в котором приводят к развитию раковых опухолей. Ученые полагают, что близость генов папилломавируса к онкогену была причиной развития у Лакс очень агрессивной формы рака.«Это, наверное, самый худший вариант того, как папилломавирус мог встроиться в ее геном», — пояснил один из авторов исследования Эндрю Эдей (Andrew Adey) из Университета Вашингтона.
Исследования без разрешения
В середине XX века ученым не требовалось разрешение самой Генриетты или ее родственников на использование клеток в исследованиях. Поэтому долгое время члены семьи Лакс не подозревали, какую роль сыграли клетки Генриетты в развитии науки. Однако узнав об использовании клеток HeLa в исследованиях, ее родственники были возмущены тем, что все это происходило без их ведома.
Новый виток развития тема получила в марте 2012 года, когда Штайнмец и его коллеги выложили расшифровку генома клеток HeLa в базы данных, доступные научному сообществу.
Результаты расшифровки геномов обычных людей нельзя публиковать вместе с их личными данными. Но в случае HeLa ученые не нарушили никаких законов и не увидели в этом ничего предосудительного: эти клетки давно стали привычным объектом исследований. Однако семья Лакс была возмущена. Несмотря на отличия HeLa от здоровых человеческих клеток, они могут выявить некоторые наследственные черты семьи. Расшифровка генома была удалена из баз данных, однако это не решило проблему.
Результаты исследования генома клеток HeLa, проведенные группой Шендура, были приняты к печати в журнале Nature. Это подразумевает обязательную публикацию данных исследования. Проблема конфиденциальности расшифровки генома HeLa снова стала актуальной.
Чтобы найти выход из этой ситуации, Фрэнсис Коллинз (Francis Collins), директор, и Кэти Хадсон (Kathy Hudson), замдиректора Национального института здоровья США встретились с представителями семьи Лакс. Вместе они решили опубликовать расшифровку генома HeLa, ограничив к ней доступ. Ученые, которые захотят ознакомится с этими данными, должны будут обратиться в Национальный институт здоровья, где их запрос будут рассматривать, в том числе, представители семьи Лакс. Таким образом Лаксы будут знать, кто и для каких целей использует эти данные, и смогут определять условия их использования. Исследование Шендура стало первым, которое опубликовано с согласия Лаксов.
Конечно, остается возможность восстановить геном HeLa по данным, опубликованным за годы исследования клеток, или расшифровать его заново и снова выложить в интернет. Национальный институт здоровья США не сможет повлиять на тех исследователей, работу которых он не финансирует, пишут руководители института в том же выпуске Nature, где опубликовано исследование Шендура. Однако они призвали научное сообщество уважать права семьи Лакс.
Изменения в законодательстве
Этот случай — уникальный, подчеркивает руководство Национального института здоровья, и поэтому рассматривается в индивидуальном порядке. Однако он привлек внимание общественности к условиям использования биологических образцов в научных исследованиях.
Действующие законы США оставляют возможность получить на основании такого образца полную расшифровку генома человека без его ведома. Единственное ограничение — образец должен быть анонимным. Однако в век компьютерной обработки данных такая защита весьма условна, признает руководство Национального института здоровья.
«Кроме того, взаимоотношения между учеными и участниками исследований развиваются: запрос разрешения подчеркивает, что участники — это партнеры (ученых), а не просто предмет изучения», — пишут Коллинз и Хадсон.
Сейчас руководство Национального института здоровья готовит предложения поправок в американские законы. Если эти изменения будут приняты, ученым придется получать у «доноров» биологических тканей разрешение на использование материала вне зависимости от анонимности исследования.
Читайте также: сколько потребуется времени на телепортацию человека, зачем нужна модель гибели человечества после нашествия зомби, каков возраст «Адама» и «Евы» и многое другое в свежем выпуске еженедельной рубрики «Научный понедельник» на ria.ru >>
ria.ru
Клеточное бессмертие | Журнал Популярная Механика
В большую науку эти клетки попали совершенно неожиданно. Они были взяты у женщины по имени Генриетта Лакс (HEnrietta LAcks), которая вскоре после этого умерла. Но культура клеток убившей ее опухоли оказалась незаменимым инструментом для ученых.
В биомедицинских исследованиях и при разработке новых видов лечения часто используют выращенные в лаборатории культуры человеческих клеток. Среди множества клеточных линий одна из самых известных — HeLa. Эти клетки, имитирующие организм человека in vitro («в пробирке»), «вечны» — они могут бесконечно делиться, результаты исследований с их использованием достоверно воспроизводятся в разных лабораториях. На своей поверхности они несут достаточно универсальный набор рецепторов, что позволяет использовать их для исследования действия различных веществ, от простых неорганических до белков и нуклеиновых кислот; они неприхотливы в культивировании и хорошо переносят заморозку и консервацию.
Генриетта Лакс
Генриетта Лакс была красивой чернокожей американкой. Она жила в небольшом городке Тернер в Южной Виргинии вместе с мужем и пятью детьми. 1 февраля 1951 года Генриетта обратилась в госпиталь Джонса Хопкинса — ее беспокоили странные выделения, которые она периодически обнаруживала на своем нижнем белье. Медицинский диагноз был страшен и беспощаден — рак шейки матки. Восемь месяцев спустя, несмотря на хирургию и радиотерапию, она умерла. Ей был 31 год.
 Невольный вклад Генриетты Лакс в медицину неоценим: клетки, оставшиеся после ее смерти, уже более полувека спасают человеческие жизни.
Невольный вклад Генриетты Лакс в медицину неоценим: клетки, оставшиеся после ее смерти, уже более полувека спасают человеческие жизни.
Пока Генриетта лежала в госпитале Хопкинса, лечащий врач отправил полученные с помощью биопсии клетки опухоли на анализ Джорджу Гею — руководителю лаборатории исследования клеток тканей в госпитале Хопкинса. В то время культивирование клеток вне организма было только на стадии становления, и главной проблемой была неизбежная гибель клеток — после определенного количества делений вся клеточная линия погибала.
Оказалось, что клетки, обозначенные «HeLa» (акроним имени и фамилии Генриетты Лакс), размножались гораздо быстрее клеток из нормальных тканей. Кроме того, злокачественная трансформация сделала эти клетки бессмертными — у них отключилась программа подавления роста после определенного количества делений. In vitro такого прежде не происходило ни с какими другими клетками. Это открывало небывалые перспективы в биологии.

Действительно, никогда до этого момента исследователи не могли считать результаты, полученные на клеточных культурах, полностью достоверными: все опыты проводились на разнородных клеточных линиях, которые в конце концов погибали — иногда даже прежде, чем удавалось получить какие-нибудь результаты. И тут ученые стали обладателями первой стабильной и даже вечной (!) клеточной линии, адекватно имитирующей свойства организма. А когда обнаружилось, что клетки HeLa способны пережить даже пересылку по почте, Гей разослал их своим коллегам по всей стране. Очень скоро спрос на клетки HeLa вырос, и их растиражировали в лабораториях по всему миру. Они стали первой «шаблонной» клеточной линией.
Так получилось, что Генриетта умерла именно в тот день, когда Джордж Гей выступал перед телевизионными камерами, держа в руках пробирку с ее клетками. Он заявил, что началась эпоха новых перспектив в поиске лекарств и медико-биологических исследованиях.
Четыре этапа эксперимента
Сегодня в молекулярной биологии и фармакологии, как правило, используют следующие стадии:
1.HeLa (или любая другая лабораторная клеточная линия).
2.Нетрансформированные короткоживущие клеточные линии — клетки кожи, клетки крови и т. п. С ними работать в разы тяжелее, они быстро гибнут, однако если эксперимент отработан на HeLa, ученые знают что и где искать, и не тратят время на широкий поиск.
3.Модельные организмы — мыши, крысы, обезьяны. Тут уже эксперименты длятся месяцами, и стоят на порядки дороже. Однако это обязательный этап перед проверкой потенциальных лекарств или изучением причин человеческих болезней на людях.
4.Многостадийные клинические исследования на людях.
Почему ее клетки так важны?
И он был прав. Линия клеток, идентичная во всех лабораториях мира, позволила быстро получать и независимо подтверждать все новые и новые данные. Можно смело сказать, что гигантский прыжок молекулярной биологии в конце прошлого века был обусловлен возможностью культивировать клетки in vitro. Клетки Генриетты Лакс стали первыми бессмертными человеческими клетками, которые когда-либо были выращены на искусственной питательной среде. HeLa научили исследователей культивировать сотни других линий раковых клеток. И хотя в последние годы приоритет в этой области смещается в сторону культур клеток нормальных тканей и индуцированных плюрипотентных стволовых клеток (за открытие метода возвращения клеток взрослого организма в эмбриональное состояние японский ученый Синья Яманака получил Нобелевскую премию по физиологии и медицине 2012 года), тем не менее раковые клетки остаются общепринятым стандартом в медико-биологических исследованиях. Основное преимущество HeLa — неудержимый рост на простых питательных средах, что позволяет проводить масштабные исследования при минимуме затрат.

С момента смерти Генриетты Лакс клетки ее опухоли непрерывно использовались для исследования молекулярных закономерностей развития самых разных заболеваний, в том числе рака и СПИДа, для изучения воздействия радиации и токсичных веществ, составления генетических карт и огромного количества других научных задач. В мире биомедицины клетки HeLa стали столь же известны, как лабораторные крысы и чашки Петри. В декабре 1960 года клетки HeLa первыми полетели в космос в советском спутнике. Даже сегодня поражает размах экспериментов, проводившихся тогда советскими генетиками в космосе. Результаты показали, что HeLa хорошо себя чувствуют не только в земных условиях, но и в невесомости.
Без клеток линии HeLa стала бы невозможной разработка вакцины против полиомиелита, созданной Джонасом Солком. Кстати, Солк был настолько уверен в безопасности полученной вакцины (ослабленного вируса полиомиелита), что в доказательство надежности своего лекарства вколол вакцину себе, своей жене и троим детям.
С тех пор HeLa использовали и для клонирования (предварительные опыты по пересадке клеточных ядер перед клонированием знаменитой овцы Долли проводились на HeLa), для отработки методов искусственного оплодотворения и тысяч других исследований (некоторые из них приведены в таблице).
| Год | Исследования | Результат | Год | Исследования | Результат |
|
1951 |
Клетки Hela впервые получены из биопсии ткани рака шейки матки | 1965 | Создание химерных клеток путем слияния Hela с лимфоцитами мыши | Появление гибридов | |
|
1952 |
Hela начали использовать для изучения молекулярных механизмов заражения клеток человека вирусами | Рождение клеточной экспериментальной вирусологии | 1973 |
Hela использована как модель для изучения сальмонеллеза |
Появление клеточных моделей болезней in vitro |
|
1952 |
Отработка методов ведения клеточной культуры Hela | Появление современных стандартов клеточной биологии | 1984 |
На модели Hela доказано, что вирус папилломы может вызывать рак |
Новые направления в антираковых исследованиях |
|
1952 |
Hela использована как модель для изучения полиомиелита | Полиовакцина | 1986 |
На модели Hela показан механизм заражения клеток вирусом иммунодефицита человека |
Более глубокое понимание биологии спида |
|
1952 |
Первые пересылки по почте замороженных клеток | Появление общемировой стандартной клеточной линии | 1989 |
В клетках Hela открыт неизвестный ранее фермент теломераза |
Новое направление в изучении продолжительности жизни |
|
1953 |
Первые эксперименты по окраске хромосом гематоксилином | Зарождение генетической медицины | 1993 |
На модели Hela исследован механизм заражения туберкулезом |
Исследования туберкулеза |
|
1954 |
За счет живучести Hela ученые смогли размножить и изучить клоны отдельных клеток | Зарождение клонирования | 2005 |
Клетки Hela используются для изучения потенциальных опасностей наноструктур |
Изучение действия наноструктур на живые ткани |
|
1954 |
Первое массовое производство клеток Hela для продажи исследовательским лабораториям | Появление коммерческих стандартизированных клеточных линий — стандартизация исследований | 2013 |
Секвенирование генома клеточной линии Hela |
Индивидуальная геномика клеточных линий |
| 1960 | Отправка Hela клеток в космос советскими учеными | Зарождение космической клеточной биологии |
Помимо науки…
Личность самой Генриетты Лакс долгое время не афишировалась. Для доктора Гея, конечно, происхождение клеток HeLa не было тайной, но он полагал, что конфиденциальность в этом вопросе является приоритетом, и в течение многих лет семья Лакс не знала, что клетки Генриетты прославились на весь мир. Тайна раскрылась только после смерти доктора Гея в 1970 году.
Напомним, что стандарты стерильности и техники работы с клеточными линиями в то время только зарождались, и некоторые ошибки всплывали лишь спустя годы. Так и в случае с клетками HeLa — через 25 лет ученые выяснили, что множество используемых в исследованиях клеточных культур, происходящих из других типов тканей, включая клетки рака молочной и предстательной желез, оказались зараженными более агрессивными и живучими клетками HeLa. Оказалось, что HeLa могут перемещаться с частицами пыли в воздухе или на недостаточно тщательно вымытых руках и приживаться в культурах других клеток. Это вызвало большой скандал. В надежде решить проблему путем генотипирования (секвенирование — полное прочтение генома — в то время пока еще только планировалось как грандиозный международный проект), одна группа ученых разыскала родственников Генриетты и попросила образцы ДНК семьи, для того чтобы составить карту генов. Таким образом тайное и стало явным.
Кстати, американцы и сейчас переживают больше по поводу того, что семья Генриетты так и не получила компенсацию за использование клеток HeLa без согласия донора. По сей день семья живет в не очень-то хорошем достатке, и материальная помощь была бы очень кстати. Но все запросы упираются в глухую стену — ответчиков давно уж нет, а Медицинская академия и другие научные структуры предсказуемо не желают обсуждать эту тему.
11 марта 2013 года масла в огонь подлила новая публикация, где были представлены результаты полного сиквенса генома клеточной линии HeLa. Опять же, эксперимент был проведен без согласия потомков Генриетты, и после непродолжительных этических споров полный доступ к геномной информации был разрешен только для профессионалов. Тем не менее, полный геномный сиквенс HeLa имеет огромное значение для последующих работ, позволяя использовать клеточную линию в будущих геномных проектах.
Клеточные рекордсмены
Бессмертность клеток линии HeLa связывают с последствиями инфекции вирусом папилломы человека HPV18. Инфекция вызывала триплодию многих хромосом (образование трёх их копий вместо обычной пары) и расщепление некоторых из них на фрагменты. Кроме того, в результате инфекции повысилась активность ряда регуляторов клеточного роста, таких как гены теломеразы (регулятор «смертности» клетки) и с-Myc (регулятор активности синтеза многих белков). Такие уникальные (и случайные) изменения сделали клетки HeLa рекордсменами по скорости роста и устойчивости даже среди других линий раковых клеток, которых на сегодня насчитывается несколько сотен. Кроме того, полученные изменения генома оказались очень стабильными, и в лабораторных условиях остаются неизменными на протяжении всех прошедших лет.
Реальное бессмертие?
Злокачественная опухоль, убившая Генриетту, сделала ее клетки потенциально бессмертными. Хотела ли эта женщина бессмертия? И получила ли она его? Если задуматься, возникает фантастическое ощущение — часть живого человека, искусственно размноженная, терпит миллионы испытаний, «пробует на вкус» все лекарства перед тем, как они попадут в испытания на животных, раздраконивается до самых что ни на есть основ молекулярными биологами во всем мире…

Конечно, все это не имеет никакого отношения к «жизни после жизни». Глупо полагать, что в клетках HeLa, беспрестанно мучимых ненасытными учеными, существует хоть какая-то частичка души несчастной молодой женщины. Тем более что человеческими эти клетки можно считать лишь отчасти. В ядре каждой клетки HeLa — от 76 до 82 хромосом из-за происшедшей в процессе озлокачествления трансформации (нормальные человеческие клетки содержат 46 хромосом), и эта полиплоидность периодически вызывает споры о пригодности клеток HeLa как модели человеческой физиологии. Было даже предложено выделить эти клетки в отдельный, близкий человеку вид, под названием Helacyton gartleri, в честь Стенли Гартлера, исследовавшего эти клетки, однако всерьез это сегодня не обсуждается.
Тем не менее исследователи всегда помнят об ограничениях, которые необходимо иметь в виду. Во‑первых, HeLa, несмотря на все изменения, все еще остаются человеческими клетками: все их гены и биологические молекулы соответствуют человеческим, а молекулярные взаимодействия в подавляющем большинстве случаев идентичны биохимическим путям здоровых клеток. Во‑вторых, полиплоидия делает эту линию более удобной для геномных исследований, так как количество генетического материала в одной клетке увеличено, и результаты получаются более четкими и контрастными. В-третьих, широкое распространение клеточных линий по миру позволяет без проблем повторять опыты коллег и использовать опубликованные данные как фундамент для собственных исследований. Установив основные факты на модели HeLa (а все помнят, что это хоть удобная, но только модель организма), ученые пытаются повторить их на более адекватных модельных системах. Как видно, HeLa и подобные им клетки представляют собой фундамент для всей науки и сегодня. И, несмотря на этические и моральные споры, сегодня хочется почтить память этой женщины, поскольку ее невольный вклад в медицину неоценим: клетки, оставшиеся после нее, спасли и продолжают спасать больше жизней, чем это может сделать любой врач.
Благодарим портал biomolecula.ru за помощь в подготовке статьи
Статья «Бессмертные клетки HeLa» опубликована в журнале «Популярная механика» (№4, Апрель 2014).www.popmech.ru
📌 HeLa — это… 🎓 Что такое HeLa?
Деление клеток HeLa под электронным микроскопомHeLa — линия «бессмертных» клеток, используемая в научных исследованиях. Была получена 8 февраля 1951 года[1] из раковой опухоли шейки матки пациентки по имени Генриетта Лакс (англ. Henrietta Lacks), умершей от этого заболевания 4 октября того же года. Линия клеток HeLa используется для исследования раковых заболеваний.
Особенности
Клетки HeLa называют «бессмертными», они способны делиться бесконечное число раз, в отличие от обычных клеток, имеющих предел Хейфлика. Это происходит потому, что как и при многих типах раковых опухолей, клетки HeLa производят фермент теломеразу, которая наращивает теломеры на концах ДНК хромосом. Существующая по сей день популяция клеток HeLa унаследована от образцов ткани, извлечённой у Генриетты Лакс. Эти клетки пролиферируют необычайно быстро, даже в сравнении с другими раковыми клетками. Иногда эти клетки заражают культуры других клеток.
Клетки HeLa были с самого начала заражены геномом вируса папилломы; это часто случается с клетками рака, от которого умерла Генриетта. В результате клетки HeLa содержат по 82 хромосомы, в отличие от человеческих 46 хромосом.
Клетки HeLa эволюционировали за эти годы, адаптируясь к росту in vitro, и по причине их разделения возникло несколько ветвей. На данный момент существует несколько линий клеток HeLa, все они происходят от общего предка, эти линии клеток используют в качестве модели раковых клеток и применяются, например, для исследования механизмов передачи сигнала между клетками.
Helacyton gartleri
Из-за способности к неограниченному делению и количества хромосом, не характерного для человека, клетки HeLa были описаны Леем ван Валеном (англ.)русск. как пример создания в современности нового вида, Helacyton gartleri (хелацитон гартлера) названного в честь Стенли М. Гартлера (англ.)русск., исследовавшего эти клетки[2].
Аргументы за выделение в отдельный вид таковы:
- несоответствие числа хромосом у HeLa и людей;
- экологическая ниша клеток HeLa;
- способность клеток HeLa сохраняться и размножаться за пределами возможного для культур обычных человеческих клеток.
Это определение вида не получило, однако, широкого распространения в научном сообществе.
Предлагая выделить клетки HeLa в новый вид, ван Вален также определил новое семейство Helacytidae и род Helacyton[2]. В случае принятия данной систематики, таксоны Homo и Hominidae становятся парафилетическими, поскольку ближайшим предком Helacyton gartleri является Homo sapiens.
Примечания
- ↑ Scherer, William F.; Jerome T. Syverton, George O. Gey (20). «Viral Multiplication in a stable strain of human malignant epithelial cells (strain HELA) derived from an epidermoid carcinoma of the cervix». The Journal of Experimental Medicine 97: 695–715.
- ↑ 1 2 Van Valen LM, Maiorana VC (1991). «HeLa, a new microbial species». Evolutionary Theory & Review 10: 71–4. ISSN 1528-2619.
dic.academic.ru
| Что это за клетки? | В биомедицинских исследованиях и при разработке новых видов лечения часто используют выращенные в лаборатории культуры человеческих клеток. Среди множества клеточных линий одна из самых известных — HeLa. Эти клетки, имитирующие организм человека in vitro («в пробирке»), «вечны» — они могут бесконечно делиться, результаты исследований с их использованием достоверно воспроизводятся в разных лабораториях. На своей поверхности они несут достаточно универсальный набор рецепторов, что позволяет использовать их для исследования действия различных веществ, от простых неорганических до белков и нуклеиновых кислот; они неприхотливы в культивировании и хорошо переносят заморозку и консервацию.
| Генриетта Лакс | Генриетта Лакс была красивой чернокожей американкой. Она жила в небольшом городке Тернер в Южной Виргинии вместе с мужем и пятью детьми. 1 февраля 1951г. Генриетта обратилась в госпиталь Джонса Хопкинса, где ей был поставлен страшный диагноз — рак шейки матки. Восемь месяцев спустя, несмотря на хирургию и радиотерапию, она умерла. Ей был 31 год.
Пока Генриетта лежала в госпитале Хопкинса, лечащий врач отправил полученные с помощью биопсии клетки опухоли на анализ Джорджу Гею — руководителю лаборатории исследования клеток тканей в госпитале Хопкинса. В то время культивирование клеток вне организма было только на стадии становления, и главной проблемой была неизбежная гибель клеток — после определенного количества делений вся клеточная линия погибала. Оказалось, что клетки, обозначенные «HeLa» (акроним имени и фамилии Генриетты Лакс), размножались гораздо быстрее клеток из нормальных тканей. Кроме того, злокачественная трансформация сделала эти клетки бессмертными — у них отключилась программа подавления роста после определенного количества делений. In vitro такого прежде не происходило ни с какими другими клетками. Это открывало небывалые перспективы в биологии. Никогда до этого момента исследователи не могли считать результаты, полученные на клеточных культурах, полностью достоверными: все опыты проводились на разнородных клеточных линиях, которые в конце концов погибали — иногда даже прежде, чем удавалось получить какие-нибудь результаты. И тут ученые стали обладателями первой стабильной и даже вечной клеточной линии, адекватно имитирующей свойства организма. А когда обнаружилось, что клетки HeLa способны пережить даже пересылку по почте, Гей разослал их своим коллегам по всей стране. Очень скоро спрос на клетки HeLa вырос, и их растиражировали в лабораториях по всему миру. Они стали первой «шаблонной» клеточной линией.
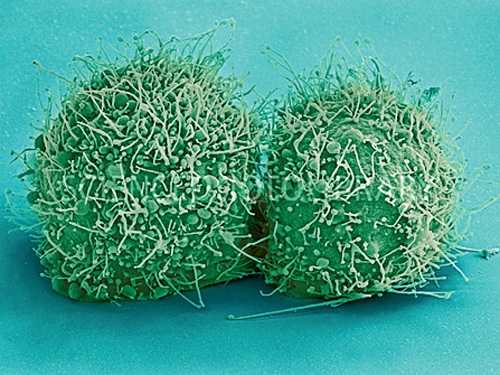
Клетки HeLa, сфотографированные с помощью электронного микроскопа (увеличение примерно в тысячу раз).
Так получилось, что Генриетта умерла именно в тот день, когда Джордж Гей выступал перед телевизионными камерами, держа в руках пробирку с ее клетками. Он заявил, что началась эпоха новых перспектив в поиске лекарств и медико-биологических исследованиях. | Почему ее клетки так важны?
| Линия клеток, идентичная во всех лабораториях мира, позволила быстро получать и подтверждать все новые данные. Гигантский прыжок молекулярной биологии в конце прошлого века был обусловлен возможностью культивировать клетки in vitro. Клетки Генриетты Лакс стали первыми бессмертными человеческими клетками, которые когда-либо были выращены на искусственной питательной среде. HeLa научили исследователей культивировать сотни других линий раковых клеток. Основное преимущество HeLa —рост на простых питательных средах, что позволяет проводить масштабные исследования при минимуме затрат. Клетки HeLa непрерывно использовались для исследования молекулярных закономерностей развития самых разных заболеваний, в том числе рака и СПИДа.
| Помимо науки… | Личность самой Генриетты Лакс долгое время не афишировалась. Доктор Гей полагал, что конфиденциальность в этом вопросе является приоритетом, и в течение многих лет семья Лакс не знала, что клетки Генриетты прославились на весь мир. Тайна раскрылась только после смерти доктора Гея в 1970 г. Стандарты стерильности и техники работы с клеточными линиями в то время только зарождались, и некоторые ошибки всплывали лишь спустя годы. Так и в случае с клетками HeLa — через 25 лет ученые выяснили, что множество используемых в исследованиях клеточных культур, происходящих из других типов тканей, оказались зараженными более агрессивными и живучими клетками HeLa. Оказалось, что HeLa могут перемещаться с частицами пыли в воздухе или на недостаточно тщательно вымытых руках и приживаться в культурах других клеток. Это вызвало большой скандал. В надежде решить проблему путем генотипирования, одна группа ученых разыскала родственников Генриетты и попросила образцы ДНК семьи, для того чтобы составить карту генов. Таким образом тайное и стало явным.
| Реальное бессмертие? | Злокачественная опухоль, убившая Генриетту, сделала ее клетки потенциально бессмертными. Если задуматься, возникает фантастическое ощущение — часть живого человека, искусственно размноженная, терпит миллионы испытаний, «пробует на вкус» все лекарства перед тем, как они попадут в испытания на животных …
Конечно, все это не имеет никакого отношения к «жизни после жизни». Тем более что человеческими эти клетки можно считать лишь отчасти. В ядре каждой клетки HeLa — от 76 до 82 хромосом из-за происшедшей в процессе озлокачествления трансформации (нормальные человеческие клетки содержат 46 хромосом), и эта полиплоидность периодически вызывает споры о пригодности клеток HeLa как модели человеческой физиологии. Тем не менее исследователи всегда помнят об ограничениях, которые необходимо иметь в виду. Во-первых, HeLa, несмотря на все изменения, все еще остаются человеческими клетками: все их гены и биологические молекулы соответствуют человеческим, а молекулярные взаимодействия в подавляющем большинстве случаев идентичны биохимическим путям здоровых клеток. Во-вторых, полиплоидия делает эту линию более удобной для геномных исследований, так как количество генетического материала в одной клетке увеличено, и результаты получаются более четкими и контрастными. В-третьих, широкое распространение клеточных линий по миру позволяет без проблем повторять опыты коллег и использовать опубликованные данные как фундамент для собственных исследований. Установив основные факты на модели HeLa, ученые пытаются повторить их на более адекватных модельных системах. Как видно, HeLa и подобные им клетки представляют собой фундамент для всей науки и сегодня. И, несмотря на этические и моральные споры, сегодня хочется почтить память этой женщины, поскольку ее невольный вклад в медицину неоценим: клетки, оставшиеся после нее, спасли и продолжают спасать больше жизней, чем это может сделать любой врач. |
vestnik.icdc.ru