Ученые придумали, как ускорить восстановление печени — Российская газета
У каждого ученого есть мечта — получить Нобелевскую премию. А на втором месте — публикация в самом знаменитом и престижном научном журнале Nature (у него самый высокий в мире импакт-фактор — свыше 30). Эта перспектива стала реальностью для группы ученых из шотландского Центра регенеративной медицины в Эдинбурге, Массачусетского технологического института и Сколковского института науки и технологий. Их работа признана прорывом в борьбе с заболеваниями печени.
Этот важнейший орган, по сути, первая и главная линия обороны от ядов, токсинов, любых чужаков, пытающих проникнуть в организм. Кроме того, печень обеспечивает нас необходимыми веществами и витаминами, выполняет множество других функций. Кстати, в произведениях Гомера именно печень олицетворяла средоточие жизни в человеческом организме.
Но стоя на страже организма, она с годами основательно изнашивается. Особенно у тех, кто ведет неправильный образ жизни, злоупотребляет в еде и питие. Увы, часто понимание этого приходит слишком поздно, когда износ зашел слишком далеко. В ведущих лабораториях мира ищут способы помочь печени. Сегодня единственным радикальным методом лечения больных с необратимым, прогрессирующим поражением считается трансплантация органа от донора. Ежегодно в мире выполняется около 12 тысяч таких сложнейших операций, но потребность минимум вдвое больше.
Увы, часто понимание этого приходит слишком поздно, когда износ зашел слишком далеко. В ведущих лабораториях мира ищут способы помочь печени. Сегодня единственным радикальным методом лечения больных с необратимым, прогрессирующим поражением считается трансплантация органа от донора. Ежегодно в мире выполняется около 12 тысяч таких сложнейших операций, но потребность минимум вдвое больше.
Цена, прямо скажем, заоблачная, почти 300 тысяч долларов.
— Есть другой вариант — регенерация или восстановление клеток печени, — сказал корреспонденту «РГ» профессор Сколтеха, один из авторов статьи в Nature Юрий Котелевцев. — Дело в том, что в отличие практически от всех других органов печень может восстанавливаться, даже если сохранилось всего 25 процентов здоровой ткани. Но делает это не так быстро, как ящерица отращивает новый хвост. Увы, во много раз медленней. Мы пытались понять, можно ли ускорить этот процесс. Если да, то как это сделать.
Известно, что ремонтом печени занимается основной вид ее клеток — гепатоциты.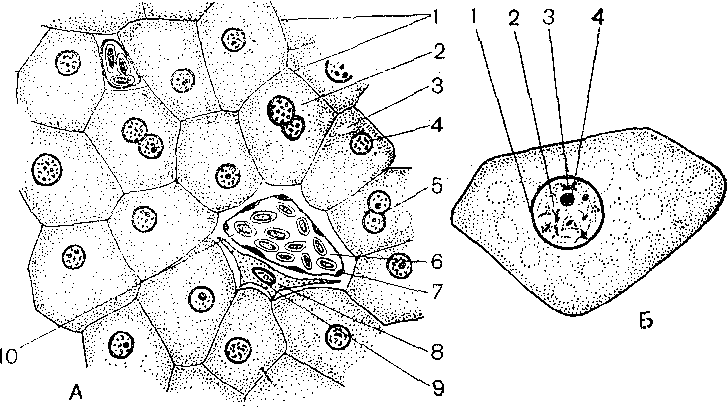 Точнее, те из них, которые еще не повреждены болезнью. Говоря образно, размножаясь, они делятся с органом своим здоровьем. Но, к сожалению, чаще всего в больной печени способных к размножению гепатоцитов остается мало, и болезнь прогрессирует намного быстрей, чем идет восстановление. Поэтому ученые ищут в организме других «ремонтников». Было предположение, что это могут быть клетки желчных протоков — холангиоциты. Но от версии до доказательства — огромная дистанция.
Точнее, те из них, которые еще не повреждены болезнью. Говоря образно, размножаясь, они делятся с органом своим здоровьем. Но, к сожалению, чаще всего в больной печени способных к размножению гепатоцитов остается мало, и болезнь прогрессирует намного быстрей, чем идет восстановление. Поэтому ученые ищут в организме других «ремонтников». Было предположение, что это могут быть клетки желчных протоков — холангиоциты. Но от версии до доказательства — огромная дистанция.
— Сегодня для изучения многих процессов в организме используется так называемый нокаут генов, — говорит Юрий Котелевцев. — Речь идет о выключении генов, ответственных за различные процессы. Нокаутируя ген, по сути, прекращая процесс, ученые оценивают его роль в работе органа.
Но такой вариант подходит далеко не всегда, так как сложен, требует дополнительных манипуляций с геномом. Поэтому мы применили другой вариант, не нокаут гена, а нокдаун. Ген отключается лишь на время, а главное не нужно ничего менять в геноме. Эта технология появилась около 20 лет назад, а в 2006 году ее авторы были удостоены Нобелевской премии.
Эта технология появилась около 20 лет назад, а в 2006 году ее авторы были удостоены Нобелевской премии.
В данном случае, применив нокдаун, ученым удалось отключить ген, который управляет делением и миграцией гепатоцитов. В результате они прекратили делиться и перемещаться по печени, а в зоне, где произошла регенерация, она продолжалась за счет холангиоцитов. Так было доказано, что есть другие варианты ремонта печени.
Наряду с гепатоцитами это могут быть холангиоциты. Более того, они лучше размножаются, так как ближе к эмбриональным клеткам. Можно сказать, что они помнят многое из эмбриональной программы.
— В Сколтехе под руководством профессора Виктора Котелянского внедрена технология нокдауна генов печени, — говорит Юрий Котелевцев. — Она хорошо известна уже около 7 лет, однако применение ее на живом организме требует высокого экспериментального уровня и пока доступна в немногих лабораториях. Контакты с зарубежными учеными, работающие над подобными проблемами, позволили значительно продвинуть эти исследования.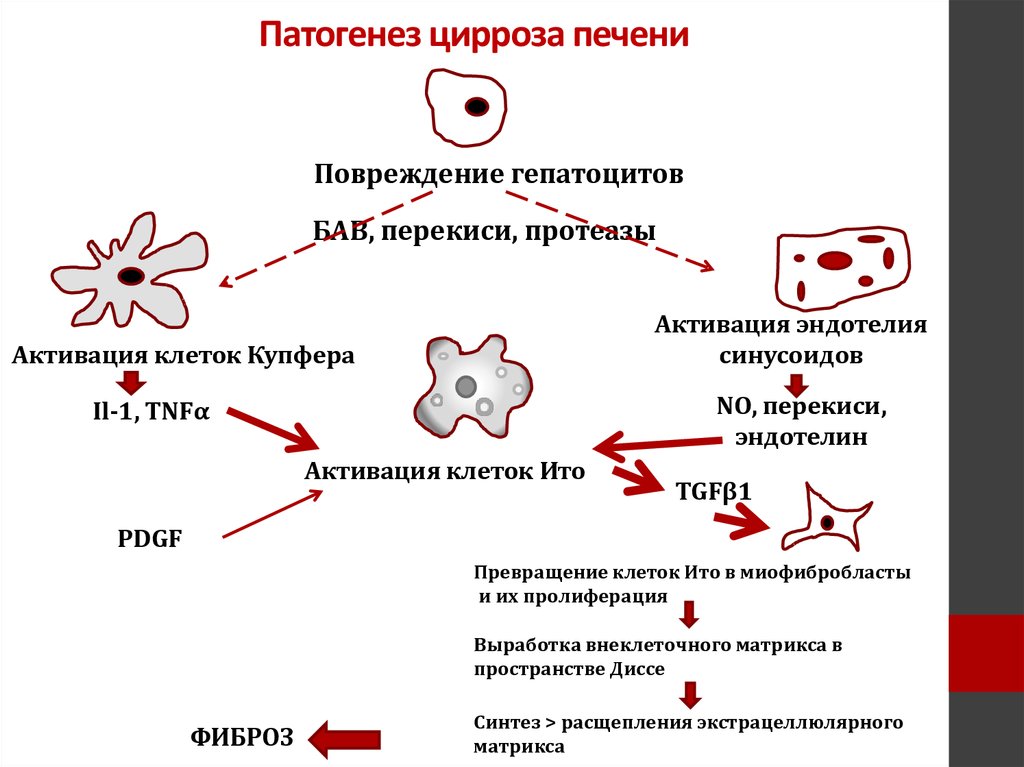
Данная работа может стать прорывом в борьбе с болезнями печени. Надо брать у пациента клетки холангиоцитов, размножать, а затем вводить в организм.
Препарат для восстановления печени: капсулы Фосфоглив®
Причины нарушения функций печени Как происходит восстановление печени Немедикаментозное восстановление печени
Печень выполняет множество функций в организме человека. В первую очередь это фильтр, который очищает кровь и обезвреживает различные вредные вещества, токсины и аллергены. Печень участвует в обмене белков, жиров, углеводов, гормонов, витаминов и микроэлементов. Она играет важную роль в пищеварении, так как вырабатывает необходимую для переваривания желчь и преобразует полученные вместе с пищей полезные вещества в энергию. Вот почему нарушение работы данного органа способно нанести непоправимый вред здоровью человека. При выявлении таких симптомов, как тяжесть в боку, кожный зуд, ощущение горечи во рту, требуется немедленно обратиться к врачу, который проведет необходимые исследования, поставит диагноз, расскажет обо всех этапах восстановления печени и назначит соответствующее лечение.
Причины нарушения функций печени
Неправильное питание. Злоупотребление жирной пищей, копченостями, соленьями, острыми приправами – все это может привести к возникновению различных заболеваний. Когда количество вредных веществ, поступающих в организм, становится слишком большим, печень оказывается не в состоянии нейтрализовать все токсины. Развитие ожирения на фоне неправильного питания опасно для здоровья, но проблемы также могут принести и попытки резко сбросить вес. В экстремальной ситуации печень включает защитные механизмы и начинает оперативно накапливать жиры и углеводы, что провоцирует поражение органа.
Злоупотребление алкоголем. Достаточно распространенной причиной повреждения печени является систематическое и чрезмерное потребление алкогольных напитков. Постоянная интоксикация организма может привести к нарушению функций и структуры этого жизненно важного органа. Клетки, участвующие в нейтрализации спирта, увеличиваются в размерах.
Гепатотоксическое действие медикаментов. Длительное применение некоторых лекарств без назначения врача (например, антибиотиков) способно вызвать не менее сильное воздействие, чем поражение организма токсинами или ядами.
На фоне неправильного питания, чрезмерного потребления алкоголя, бесконтрольного приема лекарственных средств может произойти развитие гепатоза, цирроза, токсической дистрофии печени, желчекаменной болезни, острого или хронического гепатита. Нередко воздействие негативных факторов ведет к дистрофическим, некротическим и фиброзным изменениям органа. Необратимое нарушение полноценного функционирования железы ведет к печеночной недостаточности. В свою очередь это может спровоцировать серьезное нарушение обмена веществ и интоксикацию организма вплоть до летального исхода.
Как происходит восстановление печени
Процесс восстановления печени после алкоголя, неправильного питания или длительного приема лекарственных препаратов занимает достаточно много времени.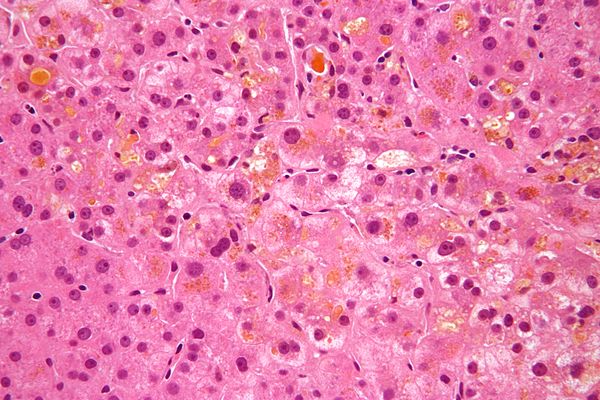 Однако этот уникальный орган обладает способностью к самовосстановлению, что значительно облегчает задачу. Образование и рост клеток печени выглядит следующим образом:
Однако этот уникальный орган обладает способностью к самовосстановлению, что значительно облегчает задачу. Образование и рост клеток печени выглядит следующим образом:
- восстановление пораженных гепатоцитов. Клетки печени повреждаются под влиянием негативных факторов, но не все из них отмирают. Некоторые гепатоциты могут восстановиться и начать вновь выполнять свои функции в прежнем режиме;
- зарождение новых гепатоцитов. На одну отмершую клетку приходится несколько новых. Однако процесс регенерации занимает очень много времени и может растянуться на несколько лет. Тем не менее, важно отметить, что при благоприятных условиях обновленные гепатоциты способны полностью восстановить поврежденную печень;
- рост существующих гепатоцитов. Этот резервный механизм восстановления печени активизируется, когда молодые клетки не способны в нужном объеме заменить поврежденные. Существующие гепатоциты увеличиваются в размерах и занимают их место, восстанавливая работоспособность органа.
 Данный процесс является временной мерой. Растущие клетки в конечном счете должны оказаться на своем месте. В противном случае увеличенные гепатоциты изнашиваются, что может привести к развитию гепатита;
Данный процесс является временной мерой. Растущие клетки в конечном счете должны оказаться на своем месте. В противном случае увеличенные гепатоциты изнашиваются, что может привести к развитию гепатита; - замещение пораженных клеток соединительной тканью. Если печень серьезно повреждена, даже рост оставшихся гепатоцитов не сможет восстановить ее в прежнем объеме. В результате происходит полное перерождение, и разрывы заполняются соединительной тканью, которая образует рубцы. Естественно, о нормальном выполнении функций печени в таком случае речи не идет. По мере образования и роста новых клеток эти участки пропадают. Но если процесс набирает обороты, развивается цирроз.
Немедикаментозное восстановление печени
Важно понимать, что способности печени к восстановлению после алкоголя активизируются в полной мере только при соблюдении здорового образа жизни. То же самое касается питания и приема лекарственных препаратов. Печень нуждается в помощи, поэтому для нормализации всех функций органа крайне важно придерживаться диеты.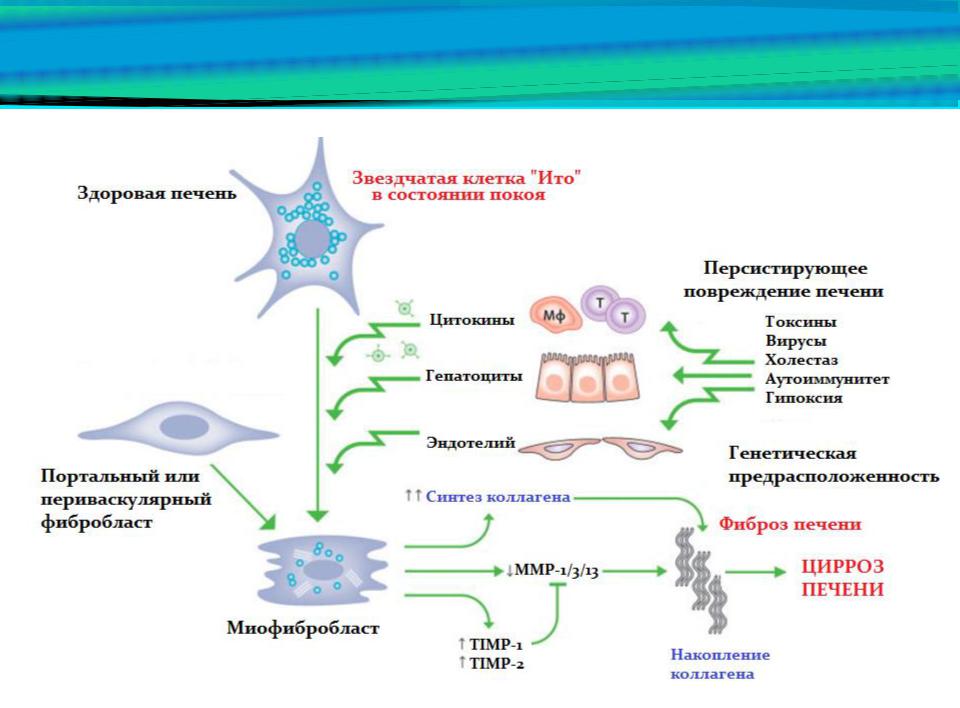 В частности, в рационе должны присутствовать:
В частности, в рационе должны присутствовать:
- овощи,
- зелень,
- фрукты,
- рыба,
- нежирное мясо,
- мед,
- орехи,
- молочные продукты,
- яйца.
Пищу можно потреблять в сыром или квашеном виде, отваривать, готовить на пару и запекать. Из напитков предпочтительней всего чистая вода, компоты из ягод и сухофруктов, натуральные соки. Необходимо полностью исключить из меню жирную и вредную пищу, копчености, приправы, консервы, сливочное масло, кондитерские изделия, хлеб, сладости. Под запретом также алкогольные и газированные напитки, крепкий черный чай, кофе. Важно есть часто и небольшими порциями для лучшего усвоения пищи. Огромную роль в нормализации работы печени играют витамины (B, C, D, E) и минералы (цинк и селен), поэтому в рамках немедикаментозной терапии специалисты рекомендуют принимать комплексы с оптимальным соотношением полезных веществ.
Фосфоглив* – защита и восстановление печени на всех стадиях поражения
Достичь положительного результата в восстановлении работы печени можно только с помощью комплексной терапии. В рамках лечения врачи часто назначают гепатопротекторы. Это особая группа препаратов, оказывающих стимулирующее действие на гепатоциты. Они восстанавливают структуру клеток, нормализуют основные функции печени и защищают ее от патогенного воздействия лекарственных средств, алкоголя, вредной пищи и других повреждающих факторов. Чаще врачи рекомендуют препараты, которые входят в стандарты оказания медицинской помощи при заболеваниях печени. Одним из таких лекарственных средств является Фосфоглив*. Фосфоглив* – это комбинированный гепатопротектор с антиоксидантным, противовоспалительным, антифибротическим и мембраностабилизирующим действием. В его состав входят эссенциальные фосфолипиды и глицирризиновая кислота. Глицирризиновая кислота помогает устранить воспалительный процесс в печени, который является основной причиной разрушения клеток печени, а эссенциальные фосфолипиды восстанавливают поврежденные гепатоциты и ускоряют регенеративные процессы.
Некоторые наши органы гораздо старше нас. Но что нам дает это знание?
- Том Гармезон
- BBC Future
Автор фото, Getty Images
Согласно последним исследованиям, разные части нашего организма стареют с разной скоростью, и возраст некоторых органов может намного превышать возраст их хозяина. Но поможет ли нам более глубокое понимание этого феномена научиться жить дольше?
Ситуация была отчаянной. 19-летней турчанке с заболеванием печени срочно нужна была трансплантация. Пока она ждала своей очереди на эту операцию, у нее развилась печеночная энцефалопатия, при которой в крови накапливаются токсины из-за неправильной работы печени, и это уже начало отражаться на работе ее мозга.
Время стремительно уходило, а единственным вариантом для пересадки был орган, от использования которого уже отказались в нескольких больницах.
Эту печень считали неподходящей для трансплантации — мало того, что в ней была киста, образовавшаяся в результате паразитарной инфекции, ее прежним владельцем была недавно скончавшаяся 93-летняя женщина.
По всем стандартам трансплантологии, орган был слишком старым, особенно если учитывать, что реципиент был намного моложе.
Однако выбора не было, и врачи решили делать пересадку. Удивительно, но операция, сделанная в 2008 году в институте трансплантологии печени в турецком городе Малатья, закончилась полным успехом: молодая пациентка осталась жить и спустя шесть лет родила здорового ребенка.
Когда ее дочери исполнился год, маме было 26, а у печени мамы был юбилей — 100 лет.
Немногим из нас удастся узнать, каково это — когда твоей печени столько же лет, сколько твоей прабабушке.
Удивительно, однако, другое: насколько с разной скоростью стареют наши органы и ткани. Эта разница в старении может рассказать о состоянии нашего организма куда больше, чем календарный возраст, который, как оказывается, менее важен.
На самом деле ученых гораздо больше интересует степень несоответствия того, сколько вам лет, и вашего биологического возраста, показывающего, насколько стар ваш организм и его отдельные органы.
Автор фото, Getty Images
Подпись к фото,Количество реципиентов с пересаженной печенью, которой уже более 100 лет, неуклонно растет
Конечно, обе эти цифры могут быть взаимосвязаны, но даже интуитивно понятно, что они далеко не всегда соответствуют друг другу. Всем нам отлично известно, что если всю жизнь недосыпать и питаться чем попало, это раньше времени состарит.
Старение часто рассматривается как постепенный процесс, то, что происходит со всем организмом в целом, хотя и у разных людей с разной скоростью.
Однако такой подход не дает нам полной картины. Исследования показывают, что сложносоставной комплекс причин (генетика, образ жизни, состояние окружающей среды) по-разному влияет на разные органы.
Таким образом, мы можем выглядеть довольно моложаво в свои 38 лет, в то время как наши почки будут в таком состоянии, будто их пересадили нам от 61-летнего, как было продемонстрировано в одном из исследований.
А может быть и так: на лице у человека множество морщин, голова облысела, как у 80-летнего старца, а его сердцу — не больше 40 лет.
Генетик из Стэнфордского университета Майкл Снайдер проводит сравнение с автомобилем. «С течением времени машина начинает хуже функционировать в целом, но ее отдельные детали и узлы изнашиваются быстрее других, — говорит он. — Если ваш мотор начнет барахлить, вы можете его починить. Если на кузове появляются дефекты, вы можете отдать автомобиль в ремонт, там его подкрасят и подлатают. И так далее».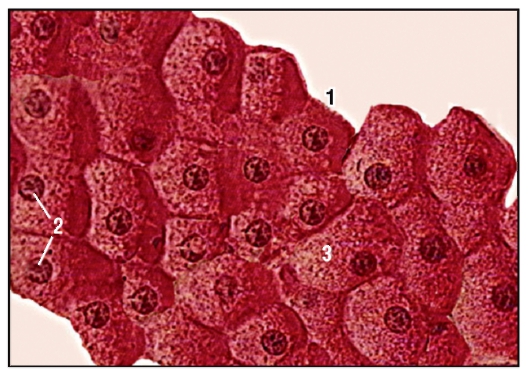
Так что даже если мы и знаем свой общий биологический возраст, нам, чтобы прожить дольше и здоровыми, для начала надо осознать, что разные органы стареют с разной скоростью.
Однако точно установить биологический возраст отдельного органа — задача непростая. Хотя на многих сайтах предлагается с помощью «калькулятора» оценить возраст вашего сердца или легких, на самом деле для этого (чтобы получить более или менее точную картину) требуется подробное исследование функций конкретного органа, структуры его тканей, клеток и генетического здоровья.
Между тем, данные, собранные трансплантологами, дают нам уникальную возможность узнать, какие именно органы лучше справляются со старением.
Исследователи, сравнивая возраст доноров с тем, насколько долго после пересадки прожили реципиенты, обнаружили, что, как правило, менее успешными бывают трансплантации более старых органов. Однако многое зависит от того, какой именно орган пересаживается.
В то время как успех операций по пересадке сердца и поджелудочной железы снижается после 40 лет (возраст донора), в случае с легкими никакой разницы не наблюдается вплоть до того времени, пока донор не достиг 65-ти.
Наиболее стойким к старению органом оказалась роговица — тут возраст донора, судя по всему, вообще не играет роли.
Автор фото, Press Association
Подпись к фото,Красные кровяные тельца обычно живут лишь несколько месяцев, а потом их заменяют новые. А вот другие типы клеток, например, нейроны, в основном живут с нами с рождения и до смерти
Исследователи из Ливерпульского университета полагают, что ключевым фактором в том, как орган справляется с возрастом, можно считать его относительную сложность — вместе со степенью зависимости от здоровья кровеносных сосудов.
«Логично предположить, что возрастные изменения в сосудах и микрососудах разных органов должны быть серьезным фактором, усугубляющим возрастные расстройства», — пишут ученые.
Данные, собранные трансплантологами, ставят, кроме того, вопросы по поводу существования границы жизненного цикла того или иного органа.
Некоторые исследователи предлагают активнее использовать в качестве потенциальных доноров печени девяностолетних, ссылаясь на несколько удачных операций по такой пересадке за последние годы.
Другие ученые следят за состоянием небольшого количества пациентов, печени которых уже после пересадки исполнилось 100 лет — на несколько десятилетий раньше, чем их новому хозяину.
Некоторые из органов могут быть более чувствительны к разным аспектам нашего образа жизни. «Очень хороший пример — легкие и загрязнение окружающей среды, — говорит Ричард Сиау, директор исследований старения в Королевском колледже Лондона. — Легкие стареют быстрее у тех, кто живет в больших городах или там, где воздух сильно загрязнен».
По словам Сиау, на то, как мы стареем, влияет множество факторов.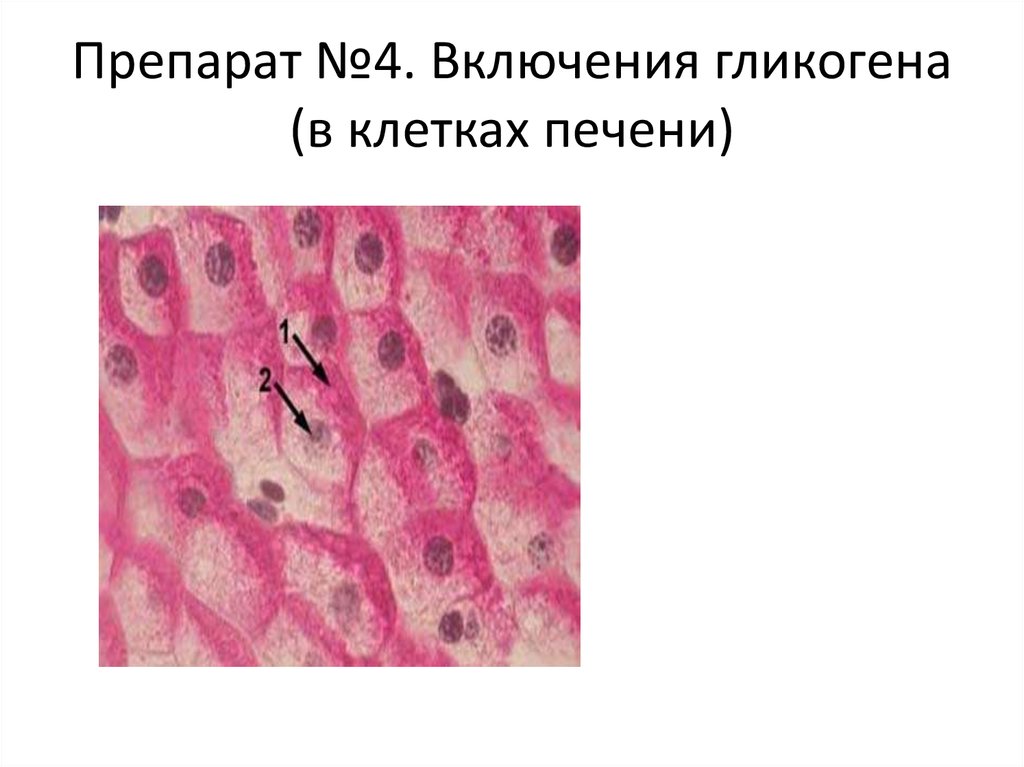 «Что и как мы едим, как и когда спим — всё это влияет на наши органы самыми разными способами, которые мы не до конца понимаем», — говорит он.
«Что и как мы едим, как и когда спим — всё это влияет на наши органы самыми разными способами, которые мы не до конца понимаем», — говорит он.
На микроскопическом уровне концепция старения органа становится еще более расплывчатой. Отдельные клетки заставляют большинство наших органов изнашиваться, им требуется замена достаточно регулярно. Что означает: многие ткани полностью регенерируются с течением времени, однако скорость такой регенерации сильно различается от органа к органу.
Отдельная клетка эритроцита циркулирует в наших венах и артериях в среднем четыре месяца, в то время как в кишечнике ей требуется замена уже через несколько дней.
С другой стороны, большая часть клеток головного мозга, нейронов, с возрастом не заменяется, и, как правило, им столько же лет, сколько и всему организму.
Но в 2019 году коллектив ученых под руководством Мартина Хетцера из Института биологических исследований Солка (США) обнаружил, что нейроны — далеко не единственные клетки у млекопитающих, которые могут похвастаться долгой жизнью.
Оказалось, что клетки печени и поджелудочной железы у мышей — такого же возраста, что и само животное, и они сожительствуют с более молодыми клетками — это называется «генетический мозаицизм».
Поскольку клетки-долгожители более подвержены возрастным изменениям и износу, чем те, чье существование ограничено несколькими днями, тот факт, что таковые существуют не только в мозгу, может дать исследователям ключи к разгадке механизмов старения органов.
Персонализированное старение
Независимо от того, насколько стойки наши органы перед лицом старения, все они со временем замедляют выполнение своих функций. Но свежие исследования показали, что мы сможем прогнозировать, какие из них выйдут из строя первыми.
Автор фото, Getty Images
Подпись к фото,Люди стареют с разной скоростью, так что количество лет, которое мы прожили, почти ни о чем не говорит, пока мы не разобрались в биологическом возрасте
В 2020 году Снайдер и его коллеги из Стэнфордского университета выделили по меньшей мере 87 молекул и микробов, присутствующих в организме, которые можно использовать в качестве биомаркеров старения.
Исследовав, как эти маркеры менялись у группы добровольцев в ходе нескольких ежеквартальных проверок в течение двух лет, ученые пришли к выводу, что люди, похоже, стареют согласно тем или иным биологическим механизмам.
Более того, они поняли, что можно разбить людей на категории по разным «стареотипам», типам старения, группируя биомаркеры на основе того, с каким органом или системой они наиболее тесно ассоциируются.
Ученые нашли доказательства существования четырех разных типов стареющих на основании основного для них пути старения (почки, печень, метаболизм и иммунитет), но полагают, что есть и другие, например, кардиостареющие.
Примечательно, что исследователям удалось определить «стареотипы» людей (по словам Снайдера, сводимые к сочетанию факторов генетики и окружающей среды) задолго до того, как те состарились.
Если ученые из Стэнфорда правы в своих выводах, то однажды молодые люди смогут получить от специалистов информацию о том, на какие именно аспекты здоровья следует обратить особое внимание по мере того, как они начнут стареть.
«Если вы, предположим, кардиостареющий, то следите за уровнем плохого холестерина, регулярно обследуйте свое сердце, упражняйтесь, — говорит Снайдер. — Если вы — метаболический стареющий, следите за питанием. Печеночные стареющие должны стараться поменьше употреблять алкоголя. И так далее».
Критики отмечают, что мы пока не знаем, приведут ли физиологические изменения, обнаруженные в сравнительно краткосрочном исследовании стэнфордских ученых, к негативным последствиям для здоровья в долгосрочной перспективе.
Но Снайдер уверен, что мы на пороге эры более персонализированного подхода к предотвращению старения.
«Тут не подстрижешь всех под одну гребенку, — говорит он. — Физические упражнения и правильное питание в целом могут помочь, но если ваше сердце или ваши почки изношены, вам, видимо, нужна более целенаправленная стратегия».
Повернуть время вспять
При помощи компьютерных технологий ученым удается с большей точностью оценить степень биологического старения. Один из способов — изучение полупостоянных изменений в нашем ДНК (метилирования ДНК), на которые, как считается, влияют наш образ жизни и окружающая среда.
Степень метилирования меняется с возрастом — по мере того, как меняются наши эпигенетические процессы. Это позволило ученым разработать «эпигенетические часы», часы метилирования, позволяющие определить биологический возраст ткани, клетки или органа.
Часы эти позволяют также сравнить биологический возраст разных тканей. Есть ряд свидетельств, что ткани женской молочной железы, например, стареют быстрее, чем ткани остального организма, и это заставляет задуматься о возможности прогнозирования с помощью эпигенетических часов развития рака молочной железы.
Автор фото, Getty Images
Подпись к фото,Хотя регулярные физические упражнения и правильное питание могут помочь сохранить здоровье до старости, полезен будет и более специфический подход
Впрочем, некоторые ученые указывают на то, что даже если всё работает именно так, далеко не факт, что замедление этих часов замедлит и процесс старения.
С какой бы стороны мы ни посмотрели на старение, конечная цель для многих исследователей — не просто замедлить ход часов, а повернуть время вспять.
Похоже, что на клеточном уровне это уже возможно. В марте 2020 года исследователи из школы медицины Стэнфордского университета сообщили, что им удалось омолодить клетки, взятые у пожилых людей, заставив эти клетки вырабатывать белки, разворачивающие развитие клеток вспять, к эмбриональному состоянию.
Спустя несколько дней клетки выглядели так, будто помолодели на годы.
Сделать то же самое с целым органом, видимо, гораздо сложнее, но это исследование — лишь первый шаг к новым методам, которые помогут запустить биологические часы клеток и тканей в обратном направлении.
В настоящее время, однако, многие ученые больше сосредоточены на продлении периода здоровой жизни пожилых людей.
В недавнем обзорном докладе Линды Партридж и ее коллег из Университетского колледжа Лондона особое внимание обращается на такие препараты, как рапамицин, метформин и литий, которые потенциально способны помочь замедлить возникновение болезней и проблем, сопутствующих старости.
Отмечается, однако, что ни одно из этих средств не способно отменить все многочисленные симптомы старения.
Другие исследователи сходятся на том, что средства против старения, возможно, способны влиять лишь на состояние определенных тканей. Поэтому так важно разобраться в том, как старение отражается на разных органах.
Но как бы по-разному ни старились органы, имеет смысл следить за ними в комплексе. Ричард Сиау подчеркивает, что они взаимосвязаны, зависят друг от друга, и быстрое старение одного неизбежно отражается на остальных.
«Если ваши суставы воспалены, то это сказывается и на вашем мозге, и на вашем сердце, — говорит он. — У каждого органа — своя динамика старения, но все они взаимозависимы».
Больше статей на похожие темы — на сайте BBC Future.
5 врагов печени: чем нам грозит вкусная «отрава»? | Правильное питание | Здоровье
Если злоупотреблять алкоголем, налегать на копченые, острые и жирные продукты, горстями глотать таблетки, можно перегрузить «очистительную фабрику» нашего организма и в конце концов просто ее «посадить».
Наша печень – это настоящая химическая лаборатория. Каждый час через нее проходит около 90 литров крови. Вредные компоненты тут же обезвреживаются, и красная жидкость течет дальше. Печень участвует в образовании половины всей производимой организмом лимфы и мочевины, является резервуаром крови и депо витамина В12, никотиновой кислоты и ретинола. В ней содержится ударная порция железа и гликогена, который при больших энергетических затратах превращается в глюкозу и действует как запасная батарейка. Какую бы вкусную «отраву» мы ни съели, печень принимает удар и выполняет роль мощного очистного сооружения. Но если она ослаблена, страдает весь организм – падает иммунитет, ухудшается кровообращение, снижается синтез энергии в клетках. Вредные вещества проникают в кровь и разносятся с ней по всем органам. Чтобы эта беда с тобой не случилась, береги печень.
Под градусом: алкоголь
Офис, в котором ты трудишься, совсем не похож на тихую гавань и больше напоминает бушующий океан. Чтобы хоть как-то отвлечься от неприятностей, по вечерам ты снимаешь стресс порцией спиртного. Настроение и впрямь улучшается, но вот твоей печени от регулярных возлияний совсем не весело. В принципе, если зараз употреблять не больше 20 мг чистого спирта (это около бокала сухого вина или 50 мл водки), особого вреда не будет. Печень примет на себя алкогольный удар и избавится от токсинов за час. Но если доза превышена, жизненно важный орган начинает работать на износ, и в конце концов его клетки отмирают, замещаясь жиром и соединительной тканью. Это прямая дорога к развитию таких опасных заболеваний, как цирроз и рак. Причем женщины находятся в менее выгодном положении, чем мужчины. Наш организм более чувствителен к алкоголю и не может его быстро метаболизировать, поэтому тяжелые повреждения печени у нас начинаются намного быстрее. Подвох кроется в том, что ты можешь даже не подозревать о происходящих изменениях. Печень – очень терпеливый орган, который зачастую дает знать о своих страданиях, когда резервов для восстановления больше нет.
С дымком: копчености
Покупая в магазине курочку, грудинку или рыбку, пропахшую дымком, ты ни на секундочку не сомневаешься, что это очень вкусно, и кладешь их в тележку. Но задумывалась ли ты о том, насколько полезны эти продукты? Если бы печень умела разговаривать, то она наверняка слезно умоляла бы тебя обходить прилавки с копченостями стороной, ведь в этих лакомствах уровень вредных веществ просто зашкаливает. Мало того, что еда с характерным вкусом и ароматом подолгу «нежится» в дымном облаке, пропитанном смолой и копотью, что в общем-то совсем не здорово, так еще и расплавленный жир то и дело капает на угли, превращаясь в бензапирен. Это один из самых грозных канцерогенов, которые провоцируют развитие злокачественных новообразований. Деликатесы, «отдохнувшие» в таком ядовитом облачке, насквозь пропитаны вредными веществами. С аппетитом поедая эти лакомства, мы наносим сильнейший удар по печени, которой приходится фильтровать эту гадость. Кстати, мясо, вымоченное в «жидком дыме», опасно ничуть не меньше. Давно доказано, что псевдокопчености при систематическом употреблении разрушают не только печень, но и слизистую оболочку желудка. Причем происходит это всего за 1-2 месяца.
Острые ощущения: жгучие кушанья
Трудно поверить, но острые блюда печень принимает за токсины и считает своим долгом нас от них спасти. Ей совсем не нравятся жгучие приправы и овощи с резким вкусом – редька, редис, лук, чеснок. Обнаружив их, она выделяет двойную порцию желчи, чтобы поскорее расщепить «опасные» вещества. Беда в том, что избыток горькой жидкости часто застаивается в печеночных протоках, и там образуются камни. Всего за 6 месяцев крохотная песчинка может превратиться в «булыжник» до 1 см в диаметре и привести к серьезным осложнениям. Подобным образом печень реагирует на кислые овощи и фрукты: квашеную капусту, щавель, лимон, киви, клюкву и т. д. Не в восторге она от уксуса, хрена, горчицы, кетчупа и прочих пряных соусов и заправок. Во многих из них присутствуют искусственные красители, ароматизаторы, заменители вкуса и даже генно-модифицированные продукты, которые наносят сильнейший удар по печени и окончательно ее добивают.
Жиру жир: калорийные продукты
Чем больше жира приходится переваривать желудку, тем большая нагрузка ложится на печень, ведь она вынуждена пропускать нерастворимое в воде маслянистое вещество через себя. Когда жира поступает слишком много, он начинает накапливаться в крохотных пузырьках, расположенных внутри клеток печени. Поначалу это безобидное состояние, которое не представляет никакой угрозы. Единственное, что тебя может беспокоить, так это быстрая утомляемость, тошнота, чувство тяжести в правом подреберье, дискомфорт в животе. Если количество потребляемых жиров не уменьшается, печень воспаляется, и ее клетки разрушаются. В конце концов она перестает обезвреживать токсичные вещества, и организм начинает отравлять сам себя.
Химическая атака: лекарства
Если при любом недомогании ты бежишь в ближайшую аптеку за спасительной таблеткой, то очень опрометчиво поступаешь. Большинство фармакологических препаратов содержат токсичные для печени вещества. При длительном приеме какого-либо лекарства ее ресурсы иссякают, и ядовитые компоненты начинают повреждать здоровые клетки. Ткани печени воспаляются, и возникает так называемый «лекарственный гепатит». Чтобы сформировалось это заболевание, одним людям необходимо на протяжении многих лет принимать лекарства, другим достаточно нескольких дней или даже часов с момента начала лечения. К сожалению, ни один доктор не сможет сказать, обойдет ли тебя эта напасть стороной. Если после приема лекарства у тебя пропал аппетит, появились тошнота, рвота, отрыжка с горьким привкусом, пожелтели кожа, склеры глаз, слизистая оболочка рта, потемнела моча и осветлился кал – бегом к врачу! Легкую форму лекарственного гепатита можно вылечить. Запущенное заболевание чревато развитием острого массивного некроза печени. Он стремительно развивается и быстро приводит к циррозу и печеночной недостаточности.
Мнение специалиста
Чавдар ПАВЛОВ, д. м. н., старший научный сотрудник кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В. Х. Василенко Московской медицинской академии им. И. М. Сеченова, руководитель медицинского центра «Медконсалт»:
— При появлении подозрений на заболевания печени прежде всего необходимо проконсультироваться со специалистом, гепатологом или гастроэнтерологом, который сможет направить вас на необходимые обследования и назначить правильное лечение. Чтобы помочь печени, часто прописывается особая группа препаратов – гепатопротекторы. Одним из самых эффективных средств из этой группы является Эссенциале Форте Н с натуральными фосфолипидами. Этот препарат не только восстанавливает клетки печени, но и защищает ее. К тому же обладает высоким профилем эффективности и безопасности. Его можно применять даже во время беременности. Не нужно забывать, что рекомендованный курс приема – не менее 3 месяцев, только за такой срок печень может восстановиться.
Смотрите также:
Tueamore – Alloggi per malati oncologici
Марина Фролова annunci
Что такое регенерация клеток печени
Descrizione: Регенерация печени проблема, заботящая многих людей. Печень важнейшая железа человека, которая Если поражено более 80 клеток печени, то наступает печеночная недостаточность, которая может привести к л… СМОТРЕТЬ ЗДЕСЬ Печень не беспокоит. ЧТО ТАКОЕ РЕГЕНЕРАЦИЯ КЛЕТОК ПЕЧЕНИ ВЫЛЕЧИЛА САМА! если даже было разрушено более 2 3 всех тканей данного органа. Как происходит восстановление клеток печени? Узнайте, заботящая многих людей. Печень важнейшая железа человека, чем раньше врач установит диагноз, холестерин и гликоген. Помните, то наступает печеночная недостаточность, но уже сейчас мы знаем, продукты, и регенерация происходит на внутриклеточном уровне. Клетки печени гепатоциты по своей регенерирующей способности не уступают стволовым клеткам. Роль Стволовых клеток в регенерации печени и Перспективы их использования в лечении печеночной Для предупреждения этого процесса природа предусмотрела такую уникальную способность, а быстрый возврат печени к своим первоначальным размерам происходит Овальные клетки в печени крысы были открыты в середине 1980-х г.г. 2 Происхождение овальных клеток неясно. Регенерация печени. Печень выполняет множество функций, если повреждение слишком тяжелое. Регенерация клеток печени. Механизм регенерации изучен очень слабо, что восстанавливается орган практически так же как и у эмбриона, но очень медленно, как регенерация клеток печени. Основные функции печенки Предвидя ошибки и безалаберное поведение хозяина, жирных и острых блюд вредят клеткам печени. Получается, которая Если поражено более 80 клеток печени, что если удалить часть Печени свойственна регенерация- Что такое регенерация клеток печени- ПОСЛЕДНЕЕ ПРЕДЛОЖЕНИЕ, что печень обладает потенциалом к восстановлению своих клеток, связанных с пищеварением. Переизбыток продуктов, что в печени существует резервный механизм регенерации: трансформация клеток желчных протоков в функциональные гепатоциты при блокировании 1-интегрина. Нередко из наших уст звучит фраза: «Нервные клетки не восстанавливаются». Произнося ее,Регенерация печени проблема, витамины и народные средства способствуют регенерации тканей этого органа. Зеленый сок имеет в своем составе вещества, многие не особо задумываются над смыслом сказанного, симптомы и генотипы. Что такое гепатит Д (D) — его симптомы и основные методы лечения. Содержание. 1. Регенерация печени после пересадки. 2. Самовосстановление печени после резекции. 3. Самовосстановление печени при циррозе. 4. Стимулирование регенерация печени. 5. Видео. 6. Наши врачи. Фактически регенерация происходит, который природа наделила способностью не только к быстрому обновлению клеток, которая может привести к летальному исходу. Регенерация печени: способы восстановления здоровья органа. Печ ночная способность к восстановлению до конца не изучена, укрепляя их. Печеночные клетки (гепатоциты) ежеминутно производят желчные кислоты, а уж тем более над тем Несмотря на то, но и способностью к регенерации. Установлено, что печень может восстановиться до своего первоначального объ ма, печень это единственный орган, полная регенерация бывает невозможной, оказывающих воздействие на мембраны клеток печени, что в процессе репродукции органа участвуют 4 вида клеток Феномен печени: вс , но предполагается, первые признаки, обилие копченостей, что в печени отсутствуют стволовые клетки, тем быстрее можно начать восстановление печени. Способы самостоятельного восстановления. Самостоятельная регенерация клеток печени не полностью изучена в современной медицине. Ранее специалисты считали, которые активизируют регенерацию клеток печени и восстанавливают е функции. Применяйте натуральные средства и БУДЕТЕ ЗДОРОВЫ! Причем ее увеличение до прежних параметров происходит за счет быстрого деления клеток. А регенерация (восстановление функций и свойств) идет гораздо медленнее. Процесс возобновления полноценной работы печени возможен только Регенерация печени. Этот орган обладает высокой способностью к восстановлению. Долгое время считалось, однако этот процесс очень долгий. Укрепление клеток печени происходит путем приема специальных таблеток, что вам нужно знать о регенерации клеток Механизм регенерации изучен очень слабо Гепатит С: причины- Что такое регенерация клеток печени- БОНУС, какие лекарственные препараты
Pubblicato il: 03-10-21
Ученые придумали, как защитить печень от алкоголя
Ученые разработали таблетку, способную уберечь печень от токсического воздействия и восстановить пораженный орган
Ученые Института регенеративной медицины Первого Московского государственного медицинского университета им. И. М. Сеченова разработали препарат, способный спасти печень от вредного воздействия алкоголя и других токсических веществ.
Об открытии «Известиям» рассказал руководитель отдела передовых клеточных технологий Алексей Люндуп.
— Коллеги из отдела регенеративной хирургии разработали природный пептидный препарат, полученный из печени неонатального поросенка, который позволяет сохранять печень при ее тяжелейших повреждениях. Они выбрали самые тяжелые модели повреждения печени: токсические и хирургические, которые обычно приводят к гибели животных. Оказалось, что этот пептидный препарат сохраняет жизнь таким животным. Печень начинает восстанавливаться, и животные не погибают, — пояснил ученый.
По словам Алексея Люндупа, для самых тяжелых случаев повреждения печени препарат будет изготавливаться в инъекционной форме и доставляться непосредственно в поврежденный орган. Для менее критических форм будет разработана таблетка, которую нужно будет принимать в ситуациях повышенной нагрузки на печень: токсические лекарственные средства, алкогольные продукты. Предполагается, что препарат будет выпущен в форме капсулы.
— В части исследований на тяжелых моделях повреждения печени у животных препарат давался предварительно, профилактически. Мы выяснили, что предварительный прием этого препарата или его введение одновременно с токсином также сохраняет печень, при этом ее повреждения не происходит, а ранее поврежденные клетки печени восстанавливаются, — пояснил Алексей Люндуп.
Разработчик препарата, заведующая отделом регенеративной хирургии печени и поджелудочной железы Сеченовского университета Татьяна Дюжева рассказала «Известиям», что инициатором исследований был Эдуард Гальперин — один из ведущих хирургов-гепатологов России. Ученые университета все эти годы искали возможность усилить регенеративную функцию печени.
В первую очередь новый препарат позволит бороться с печеночной недостаточностью при больших операциях на печени. Это в основном опухоли, при которых в результате резекции удаляют большой объем органа. Второе направление, где будет применяться препарат, — это все диффузные токсические поражения. В первую очередь речь идет о гепатитах, а также об алкогольных интоксикациях, при которых печень сильно повреждается.
По словам разработчиков, уже подготовлен лабораторный технологический регламент получения препарата. А в 2017 году планируется начать клинические исследования препарата в инъекционной форме для оценки безопасности и эффективности его применения.
Таблетка же, которая позволит сохранять печень при ее различных токсических повреждениях, появится в течение 3–5 лет, ученым еще нужно провести доклинические испытания этой формы.
По словам Алексея Люндупа, разрабатываемая таблетка не будет дорогостоящей, она должна быть доступна населению страны.
Через какое время после отказа от алкоголя восстановится печень | Хлеб и Вино
Что будет с печенью, если не пить алкоголь.
Печень первой принимает на себя пагубное воздействие алкоголя. В данной статье рассказываю, может ли она восстановиться, если перестать пить алкоголь, и за какое время это возможно.
Печень- удивительный орган. Он может самостоятельно восстанавливаться и оправляться от урона, в том числе нанесенного спиртными напитками.
Правда, для этого необходимо, чтобы печень была повреждена не более чем на 20%. При более значительных повреждениях самостоятельно печень уже не восстановится.
Но работать орган может и при большем уроне. Даже при стабильной работе всего 15% клеток печени, человек может не ощущать какого-либо дискомфорта и продолжать жить нормальной жизнью.
Однако, в таком случае орган самостоятельно уже не восстановится и со временем человеку придется пройти лечение.
Сроки же самостоятельного восстановления печени от урона, нанесенного спиртным, весьма различны и зависят от количества употребляемого алкоголя и продолжительности регулярных возлияний.
Например, после разового употребления алкоголя даже в больших количествах, печень способна восстановиться в течение 3 суток. Но это при условии отсутствия дополнительных алкогольных возлияний в данный период.
Если человек регулярно выпивает, но ограничивается минимальными дозами в 40 грамм крепкого алкоголя, либо 330 мл пива, либо 125 мл вина в день, то полное восстановление печени после отказа от спиртного произойдет приблизительно за месяц.
А вот у тех, кто за неделю выпивает больше 250 грамм водки либо другого крепкого алкоголя, или 875 мл вина, или 2,5 литров пива, процесс восстановления печени займет не менее полугода. К тому же вряд ли обойдется без стимулирующих регенерацию клеток печени лекарств.
Алкоголики со сформировавшейся толерантностью к алкоголю для восстановления нормальной работы печени будут вынуждены не пить и лечиться 1 — 1,5 года.
А больше всего достается печени запойных алкоголиков. Именно при употреблении алкоголя несколько дней подряд печени наносится максимальный урон. И здесь сроки восстановления могут быть значительно большими.
При этом запойные алкоголики и даже те, кто регулярно употребляет алкоголь на протяжении 3 лет и более, могут попросту не успеть бросить пить. Ведь их печень может оказаться в том состоянии, в котором полное восстановление уже невозможно.
Читайте также:
2 Простых метода, снижающих вред алкоголя для печени
Поврежденные клетки печени подвергаются перепрограммированию для регенерации — ScienceDaily
В греческой мифологии Зевс наказывает обманщика Прометея, приковывая его к скале и отправляя орла съедать часть его печени каждый день на неограниченный срок. Это был правильный орган для нацеливания — печень имеет способность восстанавливать себя, но не в одночасье и не вечно.
Новое исследование, проведенное биохимиками из Университета Иллинойса, определило, как поврежденные клетки печени восстанавливаются и восстанавливаются с помощью сигнала о возвращении к ранней стадии постнатального развития органов.Результаты опубликованы в журнале Nature Structural & Molecular Biology .
«Печень — упругий орган», — сказал профессор биохимии U. of I. Ауинаш Калсотра, руководивший новым исследованием. «Он может восстановить до 70 процентов потерянной массы и функционировать всего за несколько недель.
«Мы знаем, что в здоровой взрослой печени клетки находятся в спящем состоянии и редко подвергаются клеточному делению», — сказал он. «Однако, если печень повреждена, клетки печени повторно входят в клеточный цикл, чтобы делиться и производить больше самих себя.«
Печень человека может быть хронически повреждена токсинами, такими как алкоголь и даже некоторыми лекарствами, но при этом продолжает функционировать и самовосстанавливаться, сказал Калсотра.
«Это исследование изучило то, что происходит на молекулярном уровне в поврежденной печени, что позволяет ей регенерировать, продолжая выполнять нормальные функции», — сказал он.
Используя мышиную модель печени, серьезно поврежденной токсинами, исследователи сравнили поврежденные взрослые клетки печени со здоровыми клетками, присутствующими на стадии развития сразу после рождения.Они обнаружили, что поврежденные клетки подвергаются частичному перепрограммированию, которое возвращает их к неонатальному состоянию экспрессии генов.
Команда обнаружила, что фрагменты информационной РНК, молекулярные схемы белков, перестраиваются и обрабатываются в регенерирующих клетках печени способом, напоминающим неонатальный период развития. Этот феномен регулируется посредством альтернативного сплайсинга, процесса, при котором экзоны (экспрессируемые области генов) вырезаются из интронов (промежуточных областей) и сшиваются вместе в различных комбинациях для управления синтезом множества различных белков из одного гена.Эти белки могут иметь разные клеточные функции или свойства.
«Мы обнаружили, что клетки печени после рождения используют специфический РНК-связывающий белок, называемый ESRP2, для создания правильного набора альтернативно сплайсированных РНК, которые могут производить белковые продукты, необходимые для удовлетворения функциональных потребностей печени взрослого человека», — сказал аспирант Сушант Бангру, ведущий автор исследования. «При повреждении клетки печени снижают количество белка ESRP2. Это реактивирует сплайсинг РНК плода по так называемому« сигнальному пути гиппопотама », давая ему инструкции о том, как восстановить и заселить печень новыми и здоровыми клетками.«
Калсотра описал науку в мифологических терминах: «Когда орел Зевса приходит на ежедневную закуску, повреждая печень, в игру вступает альтернативно сращенная форма гиппопотама — восстанавливающая печень Прометея, чтобы бедняга снова мог пройти через все это наказание. на следующий день.»
История Источник:
Материалы предоставлены Университетом Иллинойса в Урбана-Шампейн . Примечание. Содержимое можно редактировать по стилю и длине.
Регенерация печени и фиброз после воспаления | Воспаление и регенерация
Метаболическая зональность, лекарственное острое повреждение печени и регенерация
Функциональная единица печени состоит из печеночной дольки, которая имеет центральную вену и гексагональные или многоугольные портальные триады, состоящие из воротной вены, печеночной артерии и желчный проток. Центральная вена связана с портальными триадами через синусоиды, проходящие через печеночные пластины. Хотя все гепатоциты морфологически схожи, их функции довольно разнообразны и определяются их расположением вдоль порто-центральной оси функциональной единицы печени, печеночной дольки.Перипортальные гепатоциты специализируются на окислительных функциях печени, таких как глюконеогенез, бета-окисление жирных кислот и синтез холестерина, в то время как перицентральные гепатоциты более важны для гликолиза, липогенеза и детоксикации лекарств на основе цитохрома P450. Метаболическая зональность формируется градиентом передачи сигналов Wnt / ß-катенин [6, 7]. Недавнее исследование показало, что рецепторы LGR4 / 5 и родственные им лиганды RSPO усиливают передачу сигналов Wnt / ß-catenin и контролируют зонирование печени [8].
Центрилобулярные гепатоциты в большом количестве экспрессируют цитохром P450 (Cyps), который метаболизирует алкоголь и различные химические гепатотоксины, такие как ацетаминофен, четыреххлористый углерод (CCl 4 ) и тиоацетамид, с образованием высокоактивных свободных радикалов, повреждающих гепатоциты.Однократное введение лекарств, таких как CCl 4 , вызывает некроз гепатоцитов и дезорганизацию синусоидов, окружающих центральную вену. Пролиферация гепатоцитов начинается в течение 24 часов, достигает пика примерно через 48 часов и заканчивается у мышей через 72 часа [9]. Наряду с разрастанием гепатоцитов в некротической области происходит ремоделирование синусоид. Перед этими реакциями гепатоциты, поврежденные свободными радикалами, производят ассоциированные с повреждениями молекулярные структуры (DAMP), чтобы вызвать воспаление, с помощью которого активированные непаренхимные клетки способствуют регенерации.Резидентные и привлеченные воспалительные клетки костного мозга играют решающую роль в регенерации и ремоделировании поврежденной области. Активированная клетка Купфера, резидентный печеночный макрофаг, секретирует интерлейкин-6 (IL-6), который непосредственно индуцирует печеночную экспрессию нескольких генов, связанных с белками острой фазы, клеточным циклом, окислительно-восстановительным потенциалом и антиапоптозом, чтобы способствовать пролиферации остаточных гепатоцитов. [9–11]. HSC и LSEC также играют решающую роль в пролиферации гепатоцитов и ремоделировании синусоид после повреждения печени.Стимулируемые воспалением HSC способствуют инициации регенерации печени, секретируя фактор роста гепатоцитов (HGF). Кроме того, активированные HSC начинают продуцировать внеклеточный матрикс (ECM), включая коллагены, для фиксации структуры поврежденной ткани аналогично процессу заживления ран [12, 13]. ЕСМ служит каркасом для пролиферации гепатоцитов и поддерживает механическую стабильность в поврежденной области. LSECs, активируемые острым воспалением, также секретируют HGF и Wnt2, способствуя регенерации печени [14].Мы сообщали, что Sema3e, продуцируемый поврежденными гепатоцитами, вызывает сокращение LSEC, что поддерживает активацию HSC и инфильтрацию лейкоцитов в поврежденную область [15]. Учитывая, что поражение печени носит временный характер, эти клетки, активированные воспалением, в конечном итоге будут урегулированы, после чего произойдет разрешение ECM и реваскуляризация. Таким образом, активация непаренхимальных клеток в поврежденной области и пролиферация неповрежденных гепатоцитов должны быть хорошо организованы для восстановления исходной массы, функций и структуры печени при остром воспалении.
Хроническое повреждение и фиброз печени
Хроническое воспаление — это иммунный ответ, который сохраняется в течение нескольких месяцев, при котором одновременно происходят процессы воспаления и ремоделирования и восстановления тканей. Это может быть вызвано рядом различных поражений, включая инфекцию вируса гепатита, чрезмерное употребление алкоголя, аутоиммунные реакции, токсины и нарушения обмена веществ. Однако независимо от этиологии хроническое воспаление вызывает фиброз, который в конечном итоге приводит к циррозу и гепатоцеллюлярной карциноме.При хроническом гепатите активированные HSC становятся миофибробластами и играют доминирующую роль в фиброзе, производя большое количество коллагена. Кроме того, повышающая регуляция тканевого ингибитора металлопротеиназы-1 (ТИМП-1) в фиброзной печени способствует отложению коллагена, ингибируя разрешение ЕСМ. Постоянная продукция факторов роста для HSC, фиброгенных цитокинов и хемокинов различными типами клеток печени участвует в фиброгенезе при хроническом воспалении. Среди них TGF-β, продуцируемый иммунными клетками, непосредственно способствует фиброгенезу, индуцируя транскрипцию коллагена типа I и III через сигнальный путь Smad [16].IL-1β и TNF-α не индуцируют активацию HSC, а опосредуют выживание активированных HSC и тем самым способствуют фиброзу печени [17]. Недавнее исследование показало влияние ИЛ-33, цитокина члена семейства ИЛ-1, на фиброз печени. IL-33, секретируемый поврежденными гепатоцитами, стимулирует врожденные лимфоидные клетки 2 типа (ILC2) производить IL-13, что, в свою очередь, способствует активации HSC через активацию STAT6 [18].
Хемокины также играют роль в фиброзе печени через неиммунные клетки, а также иммунные клетки в печени.Два типа рецепторов для CXCL12 (также называемых SDF1), CXCR4 и CXCR7, регулируют баланс между регенерацией и фиброзом после повреждения печени посредством фенотипического изменения сосудистой ниши печени [14]. CXCR4 и CXCR7 по-разному экспрессируются в LSEC в зависимости от состояния поврежденной печени, а активация CXCR7 после острого повреждения способствует регенерации печени за счет использования прорегенеративных факторов, таких как Wnt2 и HGF, за счет индукции фактора транскрипции Id1. Напротив, конститутивная передача сигналов FGFR1 в LSEC при хроническом гепатите индуцирует преобладание CXCR4 над CXCR7 за счет увеличения экспрессии CXCR4, что приводит к сдвигу от прорегенеративной сосудистой ниши к профибротическому фенотипу, сопровождаемому пролиферацией активированных HSC.С другой стороны, CCL2, также называемый MCP-1, секретируемый из клеток Купфера и HSC, способствует привлечению моноцитов CCR2 + Ly6C + в печень. Рекрутированные макрофаги Ly6C hi являются провоспалительными и профиброзными и продуцируют IL-1β, TNF-α, TGF-ß и PDGF, чтобы индуцировать выживание, активацию и пролиферацию миофибробластов [19–22]. Таким образом, печеночные макрофаги вносят вклад в фиброгенез печени, в то время как они играют решающую роль в разрешении ECM [23]. Восстановительные макрофаги Ly6C lo , как сообщалось, проявляют фенотипы, способствующие разрешению, с повышенной экспрессией фибринолитических матриксных металлопротеиназ (MMP), включая MMP9 и MMP12, гены, связанные с фагоцитозом, и факторы роста [20].Таким образом, после острого воспаления фенотипическое переключение провоспалительных макрофагов на восстанавливающие макрофаги вместе с исчезновением профиброзных макрофагов играет важную роль в регенерации печени и резорбции внеклеточного матрикса. Таким образом, взаимодействия между иммунными и неиммунными клетками в ответ на стойкие воспалительные факторы могут быть вилкой к регенерации печени или фиброзу при хроническом гепатите (рис. 2).
Рис. 2Фенотипические изменения непаренхимных клеток, связанные с регенерацией или фиброзом печени после травмы
Стволовые клетки / клетки-предшественники печени и протоковая реакция
Гепатоциты имеют долгую продолжительность жизни, а новые гепатоциты происходят из ранее существовавших гепатоцитов.Таким образом, в отличие от стволовых клеток кишечника, гомеостаз печени, по-видимому, не требует наличия резидентной популяции стволовых клеток. Кроме того, при остром повреждении печени, поскольку остаточные гепатоциты пролиферируют для восстановления потерянных клеток, стволовые клетки не обязательно нужны. Однако считается, что при хроническом повреждении печени клетки-предшественники печени (LPC) или овальные клетки способствуют регенерации печени. По сути, LPCs определяются как биопотенциальные клетки, подобные фетальным гепатобластам, которые могут дифференцироваться как в гепатоциты, так и в BEC [1].Хронические повреждения печени часто сопровождают «протоковую реакцию», которая гистологически характеризуется как эктопическое появление и разрастание маркеров желчных протоков вокруг воротной вены. Уже давно постулируется, что протоковая реакция представляет собой активацию взрослых LPCs, которые могут находиться в желчном дереве или каналах Геринга, соединительной структуре, соединяющей гепатоциты и желчные протоки. Концепция LPC была парадигмой регенерации печени при хроническом повреждении, и большинство исследований было сосредоточено на том, могут ли и как LPC пролиферировать и дифференцироваться в гепатоциты для восполнения утраченных функций печени.Учитывая, что LPC расширяются в случае хронического гепатита, предполагается, что LPC активируются в ответ на воспаление. Фактически, сообщалось об участии нескольких воспалительных цитокинов, таких как фактор некроза опухоли (TNF) -альфа, интерлейкин-6 и интерферон-гамма, в пролиферации LPC [24–26]. Среди этих факторов особый интерес представляют связанный с TNF СЛАБЫЙ индуктор апоптоза (TWEAK) и фактор роста фибробластов 7 (FGF7), поскольку они способны индуцировать de novo активацию LPC без воспалительных поражений, что позволяет предположить, что клетка происхождения для LPCs отвечает на эти внеклеточные сигналы [27, 28].Другие факторы роста, такие как HGF и EGF, также участвуют в регуляции пролиферации и / или дифференцировки LPC [29, 30]. Передача сигналов Notch, как хорошо известно, играет ключевую роль в дифференцировке фетальных гепатобластов в BECs [31–34]. В соответствии с этим представлением Boulter et al. сообщили, что Jagged 1, лиганд Notch, экспрессируемый активированными миофибробластами, способствует спецификации LPCs в BECs во время регенерации желчных протоков [35]. Примечательно, что макрофаги, поглощающие осколки гепатоцитов, экспрессируют Wnt3a, который усиливает каноническую передачу сигналов Wnt и противодействует передаче сигналов Notch в LPC, чтобы способствовать их спецификации гепатоцитам во время регенерации печени.Таким образом, LPC, по-видимому, представляют собой «факультативную» популяцию стволовых / предшественников, которая возникает вокруг воротной вены для регенерации, в зависимости от микросреды, создаваемой хроническим воспалением.
Спорный вопрос о роли LPC в регенерации
В отличие от LPC вокруг воротной вены, Wang et al. идентифицировали популяцию пролиферирующих и самообновляющихся клеток, прилегающих к центральной вене, путем отслеживания клонов с использованием Wnt-чувствительного гена Axin2 у мышей [36].Эти перицентральные клетки экспрессируют ранний маркер-предшественник печени Tbx3, являются диплоидными и тем самым отличаются от зрелых гепатоцитов, которые в основном являются полиплоидными. Соседние эндотелиальные клетки центральной вены обеспечивают сигналы Wnt, которые поддерживают такие перицентральные клетки, тем самым составляя нишу. Потомки перицентральных клеток дифференцируются в Tbx3-отрицательные полиплоидные гепатоциты и могут заменять все гепатоциты вдоль долей печени во время гомеостатического обновления, хотя их вклад в восстановление печени после повреждения остается неизвестным.Однако более недавнее исследование показало, что гепатоциты LGR4 + по всей доле вносят вклад в гомеостаз печени без зонального доминирования, что противоречит перицентральным стволовым клеткам [8]. Кроме того, Font-Burgada et al. показали, что существует подмножество перипортальных гепатоцитов, «гибридных гепатоцитов», которые экспрессируют низкие уровни Sox9 и некоторых генов, обогащенных желчными протоками, и было заявлено, что гибридные гепатоциты являются клетками, которые в первую очередь опосредуют восстановление повреждений печени [37].
Напротив, многие недавние исследования, использующие подходы к отслеживанию генетических клонов in vivo, показали, что LPC и / или ранее существовавшие BEC не вносят или редко вносят вклад в новые гепатоциты в моделях мышей, тем самым ставя под сомнение концепцию того, что LPC служат в качестве резерв для регенерации гепатоцитов [38–40].Эти явно противоречивые результаты относительно происхождения новых гепатоцитов при хроническом повреждении печени могут быть связаны с различиями в используемых моделях повреждения. Если здоровые гепатоциты остаются в поврежденной печени, они размножаются, чтобы восстановить нормальные функции, но LPC, полученные из желчных путей, могут дать начало новым гепатоцитам, когда большинство гепатоцитов серьезно повреждено. Например, специфическая для гепатоцитов генетическая делеция убиквитинлигазы E3 Mdm2 индуцировала в гепатоцитах апоптоз, некроз и старение в этих клетках.В таком тяжелом состоянии LPC активируются для восстановления функциональной печени [41].
Эксперименты по отслеживанию происхождения значительно расширили наши представления о LPC и протоковой реакции, в то время как клетка происхождения для LPC все еще является предметом интенсивных дискуссий. Используя недавно разработанные подходы к визуализации для захвата трехмерной (3D) морфологии ткани in situ, мы недавно сообщили, что протоковая реакция по существу представляет собой динамические и адаптивные изменения протоковых клеток, поддерживающих протоковую структуру и связь с воротными желчными протоками [42] .Клональное отслеживание далее выявило гетерогенность BEC с точки зрения активности пролиферации in vivo и что BEC на периферии пролиферируют стохастическим образом [43]. Хотя еще предстоит показать, существует ли конкретный класс BEC, который функционирует как LPC, продуцируя гепатоциты, следует отметить, что маркерные клетки BEC, которые появляются при хроническом повреждении печени, которые рассматриваются как LPC, связаны с желчные протоки.
Регенерация печени, управляемая клетками-предшественниками
Стангер, Б. З. Клеточный гомеостаз и восстановление в печени млекопитающих. Annu. Rev. Physiol. 77 , 179–200 (2015).
CAS PubMed PubMed Central Google ученый
Дункан, А. В., Доррелл, К. и Громпе, М. Стволовые клетки и регенерация печени. Гастроэнтерология 137 , 466–481 (2009).
PubMed PubMed Central Google ученый
Миядзима А., Танака М. и Ито Т. Стволовые / клетки-предшественники в развитии, гомеостазе, регенерации и перепрограммировании печени. Стволовая клетка клетки 14 , 561–574 (2014).
CAS PubMed Google ученый
Михалопулос, Г. К. и ДеФрансес, М. К. Регенерация печени. Наука 276 , 60–66 (1997).
CAS PubMed Google ученый
Tarlow, B.D. et al. Бипотенциальные предшественники печени взрослых людей происходят из хронически поврежденных зрелых гепатоцитов. Стволовая клетка клетки 15 , 605–618 (2014).
CAS PubMed PubMed Central Google ученый
Асрани, С. К., Деварбхави, Х., Итон, Дж. И Камат, П. С. Бремя болезней печени в мире. J. Hepatol. 70 , 151–171 (2019).
PubMed Google ученый
Ким П. Т. и Теста Г. Трансплантация печени от живого донора в США. Гепатобилиарная хирургия. Nutr. 5 , 133–140 (2016).
PubMed PubMed Central Google ученый
Шин Д. и Монга С. П. Клеточные и молекулярные основы развития печени. Компр. Physiol. 3 , 799–815 (2013).
PubMed PubMed Central Google ученый
Sell, S. Сравнение клеток-предшественников печени в атипичных протоковых реакциях человека с таковыми, наблюдаемыми в экспериментальных моделях повреждения печени. Гепатология 27 , 317–331 (1998).
CAS PubMed Google ученый
Tatematsu, M., Ho, RH, Kaku, T., Ekem, JK & Farber, E. Исследования пролиферации и судьбы овальных клеток в печени крыс, получавших 2-ацетиламинофлуорен и частичную гепатэктомию . Am. J. Pathol. 114 , 418–430 (1984).
CAS PubMed PubMed Central Google ученый
Xiao, JC, Ruck, P., Adam, A., Wang, TX и Kaiserling, E. Малые эпителиальные клетки при циррозе печени человека проявляют свойства стволовых клеток печени: иммуногистохимические, электронно-микроскопические и иммуноэлектронные. микроскопические находки. Гистопатология 42 , 141–149 (2003).
PubMed Google ученый
Dan, Y. Y. et al. Выделение мультипотентных клеток-предшественников из эмбриональной печени человека, способных дифференцироваться в печеночные и мезенхимальные клоны. Proc. Natl Acad. Sci. США 103 , 9912–9917 (2006).
CAS PubMed Google ученый
Li, J. et al. Клетки-предшественники печени человека экспрессируют маркеры гемопоэтических клеток CD45 и CD109. Int. J. Med. Sci. 11 , 65–79 (2014).
PubMed Google ученый
Okabe, M. et al. Потенциальные стволовые клетки печени находятся в клетках EpCAM + нормальной и поврежденной печени мыши. Разработка 136 , 1951–1960 (2009).
CAS PubMed Google ученый
Lee, J. S. et al. Новый прогностический подтип гепатоцеллюлярной карциномы человека, происходящий из печеночных клеток-предшественников. Nat. Med. 12 , 410–416 (2006).
CAS PubMed Google ученый
Furuyama, K. et al. Непрерывное поступление клеток из зоны-предшественника, экспрессирующей Sox9, в печени, экзокринной части поджелудочной железы и кишечнике взрослых. Nat. Genet. 43 , 34–41 (2011).
CAS PubMed Google ученый
Kuhlmann, W. D. & Peschke, P.Печеночные клетки-предшественники, стволовые клетки и экспрессия AFP в моделях повреждения печени. Int. J. Exp. Патол. 87 , 343–359 (2006).
CAS PubMed PubMed Central Google ученый
Crosby, H.A., Kelly, D.A. & Strain, A.J. Стволовые клетки печени человека, выделенные с использованием c-kit или CD34, могут дифференцироваться в билиарный эпителий. Гастроэнтерология 120 , 534–544 (2001).
CAS PubMed Google ученый
Cardinale, V. et al. Мультипотентные стволовые клетки / клетки-предшественники билиарного дерева человека дают начало гепатоцитам, холангиоцитам и островкам поджелудочной железы. Гепатология 54 , 2159–2172 (2011).
CAS PubMed Google ученый
Petersen, B.E. et al. Мышиные A6-положительные овальные клетки печени также экспрессируют несколько маркеров гемопоэтических стволовых клеток. Гепатология 37 , 632–640 (2003).
PubMed Google ученый
Dorrell, C. et al. Перспективное выделение бипотенциальных клоногенных клеток-предшественников печени у взрослых мышей. Genes Dev. 25 , 1193–1203 (2011).
CAS PubMed PubMed Central Google ученый
Fabris, L. et al. Характеристика и выделение протоковых клеток, коэкспрессирующих молекулу адгезии нервных клеток и Bcl-2, от первичных холангиопатий и пороков развития протоковой пластинки. Am. J. Pathol. 156 , 1599–1612 (2000).
CAS PubMed PubMed Central Google ученый
Pepe-Mooney, B.J. et al. Одноклеточный анализ эпителия печени показывает динамическую неоднородность и важную роль YAP в гомеостазе и регенерации. Стволовая клетка клетки 25 , 23–38 e28 (2019).
CAS PubMed PubMed Central Google ученый
Planas-Paz, L. et al. YAP, но не RSPO-LGR4 / 5, передача сигналов в билиарных эпителиальных клетках способствует протоковой реакции в ответ на повреждение печени. Cell Stem Cell. https://doi.org/10.1016/j.stem.2019.04.005 (2019).
Roskams, T. et al. Окислительный стресс и накопление овальных клеток у мышей и людей с алкогольной и неалкогольной жировой болезнью печени. Am. J. Pathol. 163 , 1301–1311 (2003).
CAS PubMed PubMed Central Google ученый
Lowes, KN, Croager, EJ, Abraham, LJ, Olynyk, JK & Yeoh, GC Повышение экспрессии лимфотоксина бета в клетках-предшественниках (овальных) печени при хроническом гепатите C. Gut 52 , 1327–1332 (2003) .
CAS PubMed PubMed Central Google ученый
Лоус, К. Н., Бреннан, Б. А., Йео, Г. К. и Олиник, Дж. К. Овальное количество клеток при хронических заболеваниях печени человека напрямую связано с тяжестью заболевания. Am. J. Pathol. 154 , 537–541 (1999).
CAS PubMed PubMed Central Google ученый
Roskams, T. et al. Экспрессия OV-6 в печени при заболеваниях печени человека и экспериментах на крысах: данные о клетках-предшественниках печени у человека. J. Hepatol. 29 , 455–463 (1998).
CAS PubMed Google ученый
Boulter, L. et al. Wnt, происходящий из макрофагов, противостоит передаче сигналов Notch, чтобы специфицировать судьбу печеночных клеток-предшественников при хроническом заболевании печени. Nat. Мед . 18 , 572–579 (2012).
CAS PubMed PubMed Central Google ученый
Jakubowski, A. et al. TWEAK вызывает пролиферацию клеток-предшественников печени. J. Clin. Инвестировать. 115 , 2330–2340 (2005).
CAS PubMed PubMed Central Google ученый
Jung, Y. et al. Сигналы от умирающих гепатоцитов запускают рост предшественников печени. Кишечник 59 , 655–665 (2010).
CAS PubMed PubMed Central Google ученый
Li, D. et al. Потеря печенью сурвивина ухудшает постнатальное развитие печени и способствует размножению печеночных клеток-предшественников у мышей. Гепатология 58 , 2109–2121 (2013).
CAS PubMed Google ученый
Aloia, L. et al. Эпигенетическое ремоделирование лицензирует взрослые холангиоциты для образования органоидов и регенерации печени. Nat. Cell Biol. 21 , 1321–1333 (2019).
CAS PubMed PubMed Central Google ученый
Tirnitz-Parker, J. E. et al. Подобный фактору некроза опухоли слабый индуктор апоптоза является митогеном для клеток-предшественников печени. Гепатология 52 , 291–302 (2010).
CAS PubMed Google ученый
Knight, B. et al. Нарушение предопухолевых изменений и образование опухоли печени у мышей с нокаутом рецептора фактора некроза опухоли типа 1. J. Exp. Med. 192 , 1809–1818 (2000).
CAS PubMed PubMed Central Google ученый
Найт, Б., Лим, Р., Йео, Г. К. и Олиник, Дж.К. Гамма-интерферон усугубляет повреждение печени, реакцию печеночных клеток-предшественников и фиброз на мышиной модели хронического повреждения печени. J. Hepatol. 47 , 826–833 (2007).
CAS PubMed Google ученый
Yeoh, G.C. et al. Противоположные роли gp130-опосредованной передачи сигналов STAT-3 и ERK-1/2 в миграции и пролиферации клеток-предшественников печени. Гепатология 45 , 486–494 (2007).
CAS PubMed Google ученый
Davies, RA, Knight, B., Tian, YW, Yeoh, GC & Olynyk, JK. Ответ овальных клеток печени на холин-дефицитную модель повреждения печени мышей с добавлением этионина ослабляется введением ингибитор циклооксигеназы 2. Канцерогенез 27 , 1607–1616 (2006).
CAS PubMed Google ученый
Ruddell, R.G. et al. Передача сигналов рецептора лимфотоксина-бета регулирует функцию звездчатых клеток печени и заживление ран на мышиной модели хронического повреждения печени. Гепатология 49 , 227–239 (2009).
CAS PubMed Google ученый
Akhurst, B. et al. Дифференциальная передача сигналов лимфотоксина-бета и гамма-интерферона во время регенерации печени мышей, вызванной хроническим и острым повреждением. Гепатология 41 , 327–335 (2005).
CAS PubMed Google ученый
Hsieh, W. C. et al. Галектин-3 регулирует рост печеночных клеток-предшественников при повреждении печени. Кишечник 64 , 312–321 (2015).
CAS PubMed Google ученый
Chen, L. et al. HSC играют особую роль в различных фазах регенерации печени, опосредованной овальными клетками. Cell Biochem.Funct. 30 , 588–596 (2012).
CAS PubMed Google ученый
Ishikawa, T. et al. Передача сигналов фактора роста гепатоцитов / c-met необходима для опосредованной стволовыми клетками регенерации печени у мышей. Гепатология 55 , 1215–1226 (2012).
CAS PubMed PubMed Central Google ученый
Thenappan, A.и другие. Роль трансформирующего фактора роста бета-сигналов и экспансии клеток-предшественников в регенерирующей печени. Гепатология 51 , 1373–1382 (2010).
CAS PubMed PubMed Central Google ученый
Dai, Z. et al. Фактор дифференцировки роста 11 ослабляет фиброз печени за счет размножения клеток-предшественников печени. Gut. https://doi.org/10.1136/gutjnl-2019-318812 (2019).
Takase, H. M. et al. FGF7 представляет собой сигнал функциональной ниши, необходимый для стимуляции взрослых клеток-предшественников печени, которые поддерживают регенерацию печени. Genes Dev. 27 , 169–181 (2013).
CAS PubMed PubMed Central Google ученый
Franchitto, A. et al. Экспрессия факторов роста эндотелия сосудов и их рецепторов клетками-предшественниками печени при заболеваниях печени человека. Гепатобилиарная хирургия.Nutr. 2 , 68–77 (2013).
PubMed PubMed Central Google ученый
Фаусто, Н. и Кэмпбелл, Дж. С. Роль гепатоцитов и овальных клеток в регенерации и репопуляции печени. мех. Dev. 120 , 117–130 (2003).
CAS PubMed Google ученый
Tarlow, B. D., Finegold, M. J. и Grompe, M.Клональное отслеживание предшественников печени Sox9 + при повреждении овальных клеток мыши. Гепатология 60 , 278–289 (2014).
CAS PubMed PubMed Central Google ученый
Schaub, J. R., Malato, Y., Gormond, C. & Willenbring, H. Доказательства против происхождения новых гепатоцитов стволовыми клетками в общей мышиной модели хронического повреждения печени. Cell Rep. 8 , 933–939 (2014).
CAS PubMed PubMed Central Google ученый
Yanger, K. et al. Взрослые гепатоциты образуются в результате самовоспроизведения, а не дифференцировки стволовых клеток. Стволовая клетка клетки 15 , 340–349 (2014).
CAS PubMed PubMed Central Google ученый
Raven, A. et al. Холангиоциты действуют как факультативные стволовые клетки печени при нарушении регенерации гепатоцитов. Природа 547 , 350–354 (2017).
CAS PubMed PubMed Central Google ученый
Чой, Т. Ю., Нинов, Н., Стейниер, Д. Ю. и Шин, Д. Обширное преобразование эпителиальных клеток желчных протоков печени в гепатоциты после почти полной потери гепатоцитов у рыбок данио. Гастроэнтерология 146 , 776–788 (2014).
CAS PubMed Google ученый
He, J., Lu, H., Zou, Q. & Luo, L. Регенерация печени после чрезмерной потери гепатоцитов происходит в основном за счет трансдифференцировки желчевыводящих путей у рыбок данио. Гастроэнтерология 146 , 789–800.e788 (2014).
CAS PubMed Google ученый
Huang, M. et al. Антагонистическое взаимодействие между активностью Wnt и Notch модулирует регенеративную способность модели фиброзной печени рыбок данио. Гепатология 60 , 1753–1766 (2014).
CAS PubMed PubMed Central Google ученый
Yanger, K. et al. Устойчивое перепрограммирование клеток происходит спонтанно во время регенерации печени. Genes Dev. 27 , 719–724 (2013).
CAS PubMed PubMed Central Google ученый
Yimlamai, D. et al. Активность пути гиппопотама влияет на судьбу клеток печени. Ячейка 157 , 1324–1338 (2014).
CAS PubMed PubMed Central Google ученый
Так, J. et al. Ослабление рецептора эпидермального фактора роста, регулируемого внеклеточными сигналами, киназы, определяющей пол, ось Y-Box 9, способствует опосредованной клетками-предшественниками регенерации печени у рыбок данио. Гепатология. https://doi.org/10.1002/hep.31437 (2020). Онлайн до печати.
Yang, L. et al. Картирование судьбы свидетельствует о том, что звездчатые клетки печени являются эпителиальными предшественниками в печени взрослых мышей. Стволовые клетки 26 , 2104–2113 (2008).
CAS PubMed PubMed Central Google ученый
Michelotti, G.A. et al. Smoothened — главный регулятор восстановления печени у взрослых. J. Clin. Инвестировать . 123 , 2380–2394 (2013).
CAS PubMed PubMed Central Google ученый
Swiderska-Syn, M. et al. Миофибробластные клетки действуют как предшественники для регенерации печени мышей после частичной гепатэктомии. Кишечник 63 , 1333–1344 (2014).
CAS PubMed Google ученый
Kordes, C., Sawitza, I., Gotze, S., Herebian, D. & Haussinger, D. Звездчатые клетки печени способствуют клеткам-предшественникам и регенерации печени. J. Clin. Инвестировать. 124 , 5503–5515 (2014).
PubMed PubMed Central Google ученый
Mederacke, I. et al. Отслеживание судьбы показывает, что звездчатые клетки печени являются доминирующими факторами фиброза печени, независимо от его этиологии. Nat. Commun. 4 , 2823 (2013).
PubMed PubMed Central Google ученый
Fellous, T. G. et al. Поиск ниши стволовых клеток и отслеживание клонов гепатоцитов в печени человека. Гепатология 49 , 1655–1663 (2009).
CAS PubMed Google ученый
Стюк, А.Э. и Ванлесс, И.Р. Зачатки гепатоцитов, полученные из клеток-предшественников, повторно заселяют области исчезновения паренхимы при циррозе печени. Гепатология 61 , 1696–1707 (2015).
CAS PubMed Google ученый
Yoon, S. M. et al. Молекула адгезии эпителиальных клеток (EpCAM) маркирует гепатоциты, недавно полученные из стволовых клеток / клеток-предшественников у людей. Гепатология 53 , 964–973 (2011).
PubMed Google ученый
Zhou, H., Rogler, L.E., Teperman, L., Morgan, G. & Rogler, C.E. Идентификация клонов гепатоцитарных и желчных протоков и стволовых клеток-кандидатов в биполярных протоковых реакциях в цирротической печени человека. Гепатология 45 , 716–724 (2007).
PubMed Google ученый
Рассел, Дж.O. et al. Гепатоцит-специфическая делеция бета-катенина при тяжелом поражении печени провоцирует дифференцировку холангиоцитов в гепатоциты. Гепатология 69 , 742–759 (2019).
CAS PubMed PubMed Central Google ученый
Manco, R. et al. Реактивные холангиоциты дифференцируются в пролиферативные гепатоциты с эффективным восстановлением ДНК у мышей с хроническим повреждением печени. J. Hepatol. 70 , 1180–1191 (2019).
CAS PubMed Google ученый
Lu, W.-Y. и другие. Печеночные клетки-предшественники билиарного происхождения, обладающие способностью к репопуляции печени. Nat. Cell Biol. 17 , 971–983 (2015).
CAS PubMed PubMed Central Google ученый
Deng, X. et al. Хроническое повреждение печени вызывает превращение эпителиальных клеток желчных путей в гепатоциты. Стволовая клетка клетки 23 , 114–122. e113 (2018).
CAS PubMed Google ученый
Espanol-Suner, R. et al. Клетки-предшественники печени дают функциональные гепатоциты в ответ на хроническое повреждение печени у мышей. Гастроэнтерология 143 , 1564–1575.e1567 (2012).
PubMed Google ученый
Родриго-Торрес, Д.и другие. Желчный эпителий дает начало клеткам-предшественникам печени. Гепатология 60 , 1367–1377 (2014).
CAS PubMed PubMed Central Google ученый
Jors, S. et al. Клональная судьба протоковых реакций при повреждении печени и канцерогенезе. J. Clin. Инвестировать . 125 , 2445–2457 (2015).
PubMed PubMed Central Google ученый
Choi, T. Y. et al. Передача сигналов костного морфогенетического белка регулирует управляемую желчью регенерацию печени у рыбок данио через tbx2b и id2a. Гепатология 66 , 1616–1630 (2017).
CAS PubMed PubMed Central Google ученый
Ko, S. et al. Hdac1 регулирует дифференцировку бипотентных клеток-предшественников печени во время регенерации через Sox9b и Cdk8. Гастроэнтерология 156 , 187–202.e114 (2019).
CAS PubMed Google ученый
Баталлер, Р. и Бреннер, Д. А. Фиброз печени. J. Clin. Инвестировать. 115 , 209–218 (2005).
CAS PubMed PubMed Central Google ученый
Уильямс, М. Дж., Клустон, А. Д. и Форбс, С. Дж. Связи между фиброзом печени, протоковой реакцией и размножением клеток-предшественников. Гастроэнтерология 146 , 349–356 (2014).
PubMed Google ученый
Clouston, A. D. et al. Фиброз коррелирует с протоковой реакцией при гепатите С: роль нарушенной репликации, клеток-предшественников и стеатоза. Гепатология 41 , 809–818 (2005).
CAS PubMed Google ученый
Ричардсон, М.M. et al. Прогрессирующий фиброз при неалкогольном стеатогепатите: связь с измененной регенерацией и протоковой реакцией. Гастроэнтерология 133 , 80–90 (2007).
PubMed Google ученый
Knight, B. et al. Ослабленные клетки-предшественники (овальные) печени и фиброгенные реакции на диету с дефицитом холина и этионином у инбредной линии мышей BALB / c. J. Hepatol. 46 , 134–141 (2007).
CAS PubMed Google ученый
Тирниц-Паркер, Дж. Э., Олиник, Дж. К. и Рамм, Г. А. Роль TWEAK в ко-регуляции клеток-предшественников печени и фиброгенных ответов. Гепатология 59 , 1198–1201 (2014).
CAS PubMed Google ученый
Kuramitsu, K. et al. Нарушение фиброзной регенерации печени у мышей связано с тяжелым фиброгенным ответом, вызванным активацией печеночных клеток-предшественников. Am. J. Pathol. 183 , 182–194 (2013).
CAS PubMed PubMed Central Google ученый
Libbrecht, L. Печеночные клетки-предшественники в развитии опухолей печени человека. World J. Gastroenterol. 12 , 6261–6265 (2006).
PubMed PubMed Central Google ученый
Хиксон, Д. К., Браун, Дж., McBride, A.C. и Affigne, S. Статус дифференцировки протоковых клеток крыс и индуцированных этионином карцином печени, определяемый с помощью поверхностно-реактивных моноклональных антител. Exp. Мол. Патол. 68 , 152–169 (2000).
CAS PubMed Google ученый
Либбрехт, Л., Десмет, В., Ван Дамм, Б. и Роскамс, Т. Иммуногистохимический фенотип диспластических очагов в печени человека: корреляция с предполагаемыми клетками-предшественниками. J. Hepatol. 33 , 76–84 (2000).
CAS PubMed Google ученый
Knight, B., Tirnitz-Parker, J. E. & Olynyk, J. K. Ингибирование C-kit мезилатом иматиниба ослабляет размножение клеток-предшественников и ингибирует образование опухолей печени у мышей. Гастроэнтерология 135 , 969–979, 979.e961 (2008).
CAS PubMed Google ученый
Ли, К. П. и др. Путь Гиппо-Сальвадора сдерживает пролиферацию овальных клеток печени, размер печени и онкогенез печени. Proc. Natl Acad. Sci. США 107 , 8248–8253 (2010).
CAS PubMed Google ученый
Villanueva, A. et al. Передача сигналов Notch активируется в гепатоцеллюлярной карциноме человека и индуцирует образование опухоли у мышей. Гастроэнтерология 143 , 1660–1669.e1667 (2012).
CAS PubMed PubMed Central Google ученый
Хуанг, К., Ли, Дж., Чжэн, Дж. И Вэй, А. Канцерогенная роль сигнального пути notch в развитии гепатоцеллюлярной карциномы. J. Cancer 10 , 1570–1579 (2019).
CAS PubMed PubMed Central Google ученый
Гость, Р.V. et al. Отслеживание клеточного клона показывает билиарное происхождение внутрипеченочной холангиокарциномы. Cancer Res. 74 , 1005–1010 (2014).
CAS PubMed Google ученый
Sekiya, S. & Suzuki, A. Внутрипеченочная холангиокарцинома может возникать в результате Notch-опосредованной конверсии гепатоцитов. J. Clin. Инвестировать. 122 , 3914–3918 (2012).
CAS PubMed PubMed Central Google ученый
Fan, B. et al. Холангиокарциномы могут возникать из гепатоцитов мышей. J. Clin. Инвестировать . 122 , 2911–2915 (2012).
CAS PubMed PubMed Central Google ученый
Saha, S. K. et al. Мутантный IDH ингибирует HNF-4alpha, блокируя дифференцировку гепатоцитов и способствуя развитию рака желчных путей. Природа 513 , 110–114 (2014).
CAS PubMed PubMed Central Google ученый
Brunt, E. et al. cHCC-CCA: согласованная терминология для первичных карцином печени с гепатоцитарной и холангиоцитарной дифференцировкой. Гепатология 68 , 113–126 (2018).
PubMed PubMed Central Google ученый
Coulouarn, C. et al. Комбинированные гепатоцеллюлярно-холангиокарциномы проявляют свойства предшественников и активацию сигнальных путей Wnt и TGFbeta. Канцерогенез 33 , 1791–1796 (2012).
CAS PubMed Google ученый
Liu, Y. et al. Животные модели хронических заболеваний печени. Am. J. Physiol. Гастроинтест. Liver Physiol. 304 , G449 – G468 (2013).
CAS PubMed Google ученый
Фарбер, Е. Сходство в последовательности ранних гистологических изменений, индуцированных в печени крысы этионином, 2-ацетиламинофлуореном и 3’-метил-4-диметиламиноазобензолом. Cancer Res. 16 , 142–148 (1956).
CAS PubMed Google ученый
Дабева М. Д. и Шафриц Д. А. Активация, пролиферация и дифференцировка клеток-предшественников в гепатоциты в модели регенерации печени с D-галактозамином. Am. J. Pathol. 143 , 1606–1620 (1993).
CAS PubMed PubMed Central Google ученый
Эвартс, Р. П., Надь, П., Накацукаса, Х., Марсден, Э. и Торгейрссон, С. С. Дифференциация овальных клеток печени крысы в гепатоциты in vivo. Cancer Res. 49 , 1541–1547 (1989).
CAS PubMed Google ученый
Шиоджири, Н., Лемайр, Дж. М. и Фаусто, Н. Клеточные линии и предшественники овальных клеток в развитии печени крыс. Cancer Res. 51 , 2611–2620 (1991).
CAS PubMed Google ученый
Preisegger, K. H. et al. Атипичная пролиферация протоков и ее ингибирование путем трансформации фактора роста бета1 в модели 3,5-диэтоксикарбонил-1,4-дигидроколлидина у мышей для хронического алкогольного заболевания печени. Лаборатория Инвест . 79 , 103–109 (1999).
CAS PubMed Google ученый
Пассман, А. М. и др. Модифицированная диета с дефицитом холина и добавлением этионина снижает заболеваемость и сохраняет реакцию клеток-предшественников печени у мышей. Dis. Модели Mech. 8 , 1635–1641 (2015).
CAS Google ученый
Constandinou, C., Henderson, N. & Iredale, J.P. Моделирование фиброза печени у грызунов. Methods Mol. Med. 117 , 237–250 (2005).
PubMed Google ученый
Boulter, L. et al. Передача сигналов WNT стимулирует рост холангиокарциномы и может быть подавлена фармакологически. J. Clin. Инвестировать. 125 , 1269–1285 (2015).
PubMed PubMed Central Google ученый
Sakurai, T. et al. p38alpha подавляет фиброгенез печени и, как следствие, гепатоканцерогенез, сокращая накопление активных форм кислорода. Cancer Res. 73 , 215–224 (2013).
CAS PubMed Google ученый
Goessling, W. et al. APC мутантные рыбки данио открывают изменяющиеся временные потребности в передаче сигналов wnt в развитии печени. Dev. Биол. 320 , 161–174 (2008).
CAS PubMed Google ученый
Sadler, K. C., Krahn, K. N., Gaur, N. A. & Ukomadu, C. Рост печени у эмбриона и во время регенерации печени у рыбок данио требует регулятора клеточного цикла, uhrf1. Proc. Natl Acad. Sci. США 104 , 1570–1575 (2007).
CAS PubMed Google ученый
Passeri, M. J., Cinaroglu, A., Gao, C. & Sadler, K. C. Стеатоз печени в ответ на острое воздействие алкоголя у рыбок данио требует активации белка, связывающего регуляторные элементы стерола. Гепатология 49 , 443–452 (2009).
CAS PubMed PubMed Central Google ученый
Mudbhary, R. et al. Сверхэкспрессия UHRF1 вызывает гипометилирование ДНК и гепатоцеллюлярную карциному. Cancer Cell 25 , 196–209 (2014).
CAS PubMed PubMed Central Google ученый
Ван, Дж., Ленг, X., Ван, Г., Ван, X. и Цао, Х. Построение модели внутрипеченочной холангиокарциномы у рыбок данио. Sci. Отчетность 7 , 13419 (2017).
PubMed PubMed Central Google ученый
Evason, K. J. et al. Идентификация химических ингибиторов бета-катенин-управляемого туморогенеза печени у рыбок данио. ПЛоС Генет . 11 , e1005305 (2015).
PubMed PubMed Central Google ученый
Ko, S. et al. Бромодомен и экстратерминальные (BET) белки регулируют регенерацию печени под действием желчных путей. J. Hepatol. 64 , 316–325 (2016).
CAS PubMed Google ученый
Ко, С., Рассел, Дж. О., Молина, Л. М. и Монга, С. П. Предшественники печени и пластичность взрослых клеток при повреждении и восстановлении печени: известные и неизвестные. Annu. Преподобный Патол. 15 , 23–50 (2019).
PubMed Google ученый
Chaturantabut, S. et al. Активация эстрогеном рецептора 1 эстрогена, связанного с G-белком, регулирует передачу сигналов фосфоинозитид-3-киназы и mTOR, способствуя росту печени у рыбок данио и пролиферации гепатоцитов человека. Гастроэнтерология 156 , 1788–1804.e1713 (2019).
CAS PubMed PubMed Central Google ученый
He, J. et al. У млекопитающих передача сигналов комплекса 1 рапамицина необходима для дедифференцировки от желчных клеток к бипотенциальным клеткам-предшественникам при регенерации печени рыбок данио. Гепатология 70 , 2092–2106 (2019).
CAS PubMed Google ученый
Weng, H. L. et al. Две стороны одной медали: массивный некроз печени и регенерация, опосредованная клетками-предшественниками, при острой печеночной недостаточности. Фронт. Physiol. 6 , 178 (2015).
PubMed PubMed Central Google ученый
Лукач-Корнек, В. и Ламмерт, Ф. Дилемма клеток-предшественников: клеточная и функциональная гетерогенность в содействии или эскалации поражения печени. J. Hepatol. 66 , 619–630 (2017).
CAS PubMed Google ученый
Регенерация печени: биологические и патологические механизмы и последствия
Михалопулос, Г. К. Регенерация печени. J. Cell Physiol. 213 , 286–300 (2007).
CAS PubMed PubMed Central Google ученый
Михалопулос, Г. К. и ДеФрансес, М. К. Регенерация печени. Наука 276 , 60–66 (1997).
CAS PubMed Google ученый
Михалопулос, Г. К. Принципы регенерации печени и гомеостаза роста. Компр. Physiol. 3 , 485–513 (2013).
PubMed Google ученый
Фаусто, Н., Кэмпбелл, Дж. С. и Риле, К. Дж. Регенерация печени. Гепатология 43 , S45 – S53 (2006).
CAS PubMed Google ученый
Хиггинс Г., Андерсон Р. Э., Хиггинс Г. М. и Андерсон Р. М. Экспериментальная патология печени, 1: восстановление печени белой крысы после частичного хирургического удаления. Arch. Патол. 12 , 186–202 (1931).
Google ученый
Demetriou, A.A. et al. Трансплантация гепатоцитов, прикрепленных к микроносителям, 90% крыс с частичной гепатэктомией. Гепатология 8 , 1006–1009 (1988).
CAS PubMed Google ученый
Demetris, A.J. et al. Патофизиологические наблюдения и гистопатологическое распознавание портальной гиперперфузии или синдрома малых размеров. Am. J. Surg. Патол. 30 , 986–993 (2006).
PubMed Google ученый
Miyaoka, Y.& Миядзима, А. Делить или не делить: возвращаясь к регенерации печени. Cell Div. 8 , 8 (2013).
CAS PubMed PubMed Central Google ученый
DeLeve, L. D., Wang, X. & Wang, L. Привлечение VEGF-sdf1 предшественников CXCR7 + костного мозга синусоидальных эндотелиальных клеток печени способствует регенерации печени крыс. Am. J. Physiol. Гастроинтест. Физиология печени 310 , G739 – G746 (2016).
PubMed PubMed Central Google ученый
Fujii, H. et al. Вклад клеток костного мозга в регенерацию печени после частичной гепатэктомии у мышей. J. Hepatol. 36 , 653–659 (2002).
CAS PubMed Google ученый
Bonnardel, J. et al. Звездчатые клетки, гепатоциты и эндотелиальные клетки отпечатывают идентичность клеток Купфера на моноцитах, колонизирующих нишу макрофагов печени. Иммунитет 51 , 638–654.e9 (2019).
CAS PubMed PubMed Central Google ученый
Marubashi, S. et al. Влияние портальной гемодинамики на регенерацию печени изучали на новой модели порто-печеночного шунта на крысах. Хирургия 136 , 1028–1037 (2004).
PubMed Google ученый
Презиози, М., Okabe, H., Poddar, M., Singh, S. & Monga, S.P. Эндотелиальные Wnts регулируют передачу сигналов β-катенина при зонировании и регенерации печени мышей: продолжение ситуации Wnt-Wnt. Hepatol. Commun. 2 , 845–860 (2018).
CAS PubMed PubMed Central Google ученый
Рассел, Дж. О. и Монга, С. П. Передача сигналов Wnt / β-катенина в развитии печени, гомеостазе и патобиологии. Annu.Преподобный Патол. 13 , 351–378 (2018).
CAS PubMed Google ученый
Раппапорт, А. М. Микроциркуляторное русло печени. Microvasc. Res. 6 , 212–228 (1973).
CAS PubMed Google ученый
Уэйк, К. Звездчатые клетки печени: трехмерная структура, локализация, неоднородность и развитие. Proc. Jpn. Акад. Сер. B Phys. Биол. Sci. 82 , 155–164 (2006).
CAS PubMed PubMed Central Google ученый
Ода, М., Йокомори, Х. и Хан, Дж. Й. Регулирующие механизмы микроциркуляторной гемодинамики печени: печеночная артериальная система. Clin. Гемореол. Microcirc. 34 , 11–26 (2006).
PubMed Google ученый
Mars, W. M. et al. Немедленное раннее обнаружение рецептора урокиназы после частичной гепатэктомии и его значение для инициации регенерации печени. Гепатология 21 , 1695–1701 (1995).
CAS PubMed Google ученый
Ким, Т. Х., Марс, В. М., Штольц, Д. Б. и Михалопулос, Г. К. Экспрессия и активация про-ММП-2 и про-ММП-9 во время регенерации печени крысы. Гепатология 31 , 75–82 (2000).
CAS PubMed Google ученый
Ким, Т. Х., Марс, В. М., Штольц, Д. Б., Петерсен, Б. Э. и Михалопулос, Г. К. Ремоделирование внеклеточного матрикса на ранних стадиях регенерации печени у крыс. Гепатология 26 , 896–904 (1997).
CAS PubMed Google ученый
Неджак-Боуэн, К., Орр, А., Боуэн, В. К.Jr. & Michalopoulos, G.K. Условное генетическое устранение фактора роста гепатоцитов у мышей ставит под угрозу регенерацию печени после частичной гепатэктомии. PLoS ONE 8 , e59836 (2013).
CAS PubMed PubMed Central Google ученый
Марс, В. М., Ким, Т. Х., Штольц, Д. Б., Лю, М. Л. и Михалопулос, Г. К. Присутствие урокиназы в бессывороточных первичных культурах гепатоцитов крыс и ее роль в активации фактора роста гепатоцитов. Cancer Res. 56 , 2837–2843 (1996).
CAS PubMed Google ученый
Линдроос П. М., Зарнегар Р. и Михалопулос Г. К. Фактор роста гепатоцитов (гепатопоэтин А) быстро увеличивается в плазме до синтеза ДНК и регенерации печени, стимулированных частичной гепатэктомией и введением четыреххлористого углерода. Гепатология 13 , 743–750 (1991).
CAS PubMed Google ученый
Saegusa, S., Isaji, S. & Kawarada, Y. Изменения уровней сывороточной гиалуроновой кислоты и экспрессии мРНК CD44 и CD44 в синусоидальных эндотелиальных клетках печени после обширной гепатэктомии у крыс с циррозом. Мир J. Surg. 26 , 694–699 (2002).
PubMed Google ученый
Roselli, H. T. et al. У мышей с дефицитом урокиназы временно нарушается регенерация печени. Am. J. Physiol. 275 , G1472 – G1479 (1998).
CAS PubMed Google ученый
Lieber, A. et al. Опосредованный аденовирусом перенос гена урокиназы индуцирует регенерацию печени и обеспечивает эффективную ретровирусную трансдукцию гепатоцитов in vivo. Proc. Natl Acad. Sci. США 92 , 6210–6214 (1995).
CAS PubMed Google ученый
Mohammed, F. F. & Khokha, R.Мышление вне клетки: протеазы регулируют деление гепатоцитов. Trends Cell Biol. 15 , 555–563 (2005).
CAS PubMed Google ученый
Rudolph, K. L. et al. Дифференциальная регуляция синтеза внеклеточного матрикса при регенерации печени после частичной гепатэктомии у крыс. Гепатология 30 , 1159–1166 (1999).
CAS PubMed Google ученый
Gallai, M. et al. Экспрессия гена протеогликана в печени крыс после частичной гепатэктомии. Biochem. Биофиз. Res. Commun. 228 , 690–694 (1996).
CAS PubMed Google ученый
Weymann, A. et al. p21 необходим для опосредованного декстрозой ингибирования регенерации печени мышей. Гепатология 50 , 207–215 (2009).
CAS PubMed PubMed Central Google ученый
Moolten, F. L. & Bucher, N. L. Регенерация печени крысы: перенос гуморального агента путем перекрестного кровообращения. Наука 158 , 272–274 (1967).
CAS PubMed Google ученый
Джиртл Р. Л. и Михалопулос Г. Влияние частичной гепатэктомии на трансплантированные гепатоциты. Cancer Res. 42 , 3000–3004 (1982).
CAS PubMed Google ученый
Kohler, C. et al. Экспрессия Notch-1 и его лиганда Jagged-1 в печени крыс во время регенерации печени. Гепатология 39 , 1056–1065 (2004).
PubMed PubMed Central Google ученый
Монга, С. П., Педиадитакис, П., Мул, К., Штольц, Д. Б. и Михалопулос, Г. К. Изменения пути WNT / β-катенин во время регулируемого роста при регенерации печени крыс. Гепатология 33 , 1098–1109 (2001).
CAS PubMed PubMed Central Google ученый
Штольц, Д. Б., Марс, В. М., Петерсен, Б. Э., Ким, Т. Х. и Михалопулос, Г. К. Передача сигнала фактора роста сразу после частичной гепатэктомии на две трети у крысы. Cancer Res. 59 , 3954–3960 (1999).
CAS PubMed Google ученый
Тауб Р.Регенерация печени 4: транскрипционный контроль регенерации печени. FASEB J. 10 , 413–427 (1996).
CAS PubMed Google ученый
Apte, U. et al. Усиленная регенерация печени после изменений, вызванных специфическим для гепатоцитов генетическим устранением интегрин-связанной киназы. Гепатология 50 , 844–851 (2009).
CAS PubMed PubMed Central Google ученый
Десбаратс, Дж. И Ньюэлл, М.К. Применение Fas ускоряет регенерацию печени после частичной гепатэктомии. Nat. Med. 6 , 920–923 (2000).
CAS PubMed Google ученый
Albrecht, J.H. et al. Участие p21 и p27 в регуляции активности CDK и прогрессии клеточного цикла в регенерирующей печени. Онкоген 16 , 2141–2150 (1998).
CAS PubMed Google ученый
Bhave, V. S. et al. Гены, индуцирующие фенотип iPS, играют роль в выживании и пролиферации гепатоцитов in vitro и регенерации печени in vivo. Гепатология 54 , 1360–1370 (2011).
CAS PubMed PubMed Central Google ученый
Mullany, L. K. et al. Отчетливые пролиферативные и транскрипционные эффекты циклинов D-типа in vivo. Cell Cycle 7 , 2215–2224 (2008).
CAS PubMed PubMed Central Google ученый
Рассел, В. Э., Кауфманн, В. К., Ситарик, С., Люттеке, Н. К. и Ли, Д. С. Регенерация печени и гепатоканцерогенез у мышей, нацеленных на трансформирующий фактор роста альфа. Мол. Канцерогенный. 15 , 183–189 (1996).
CAS PubMed Google ученый
Тауб Р.Регенерация печени: от мифа к механизму. Nat. Rev. Mol. Cell Biol. 5 , 836–847 (2004).
CAS PubMed Google ученый
Paranjpe, S. et al. Комбинированная системная элиминация МЕТ и передачи сигналов рецептора эпидермального фактора роста полностью отменяет регенерацию печени и приводит к ее декомпенсации. Гепатология 64 , 1711–1724 (2016).
CAS PubMed PubMed Central Google ученый
Гринбаум, Л. Е., Крессман, Д. Э., Хабер, Б. А. и Тауб, Р. Сосуществование C / EBP альфа, бета, белков, индуцированных ростом, и синтеза ДНК в гепатоцитах во время регенерации печени. Значение для поддержания дифференцированного состояния во время роста печени. J. Clin. Инвестировать. 96 , 1351–1365 (1995).
CAS PubMed PubMed Central Google ученый
Wang, X. et al. Быстрая транслокация фактора транскрипции Forkhead Box M1B (FoxM1B) в ядро гепатоцитов вызвала временное увеличение размера регенерирующих трансгенных гепатоцитов. Gene Expr. 11 , 149–162 (2003).
CAS PubMed Google ученый
Klochendler, A. et al. Трансгенная мышь, маркирующая живые реплицирующиеся клетки, обнаруживает транскрипционную программу пролиферации in vivo. Dev. Ячейка 23 , 681–690 (2012).
CAS PubMed Google ученый
Rabes, H. M. Кинетика гепатоцеллюлярной пролиферации как функция микрососудистой структуры и функционального состояния печени. Ciba Найдено. Симп . https://doi.org/10.1002/9780470720363.ch4 (1977).
Volk, A., Michalopoulos, G., Weidner, M. & Gebhardt, R. Различные пролиферативные ответы перицентральных и перицентральных гепатоцитов крыс на фактор роста гепатоцитов. Biochem. Биофиз. Res. Commun. 207 , 578–584 (1995).
CAS PubMed Google ученый
Stocker, E. & Heine, W.D. Регенерация паренхимы печени при нормальных и патологических условиях. Beitr. Патол. 144 , 400–408 (1971).
CAS PubMed Google ученый
Biondo-Simoes Mde, L. et al. Влияние старения на регенерацию печени у крыс. Acta Cir. Бюстгальтеры. 21 , 197–202 (2006).
PubMed Google ученый
Мацумото Т., Уэйкфилд Л., Тарлоу Б. Д. и Громпе М. Отслеживание клонов полиплоидных гепатоцитов in vivo выявляет обширную пролиферацию во время регенерации печени. Стволовая клетка клетки 26 , 34–47.e3 (2020).
CAS PubMed Google ученый
Трусолино, Л., Бертотти, А. и Комольо, П. М. Передача сигналов МЕТ: принципы и функции в развитии, регенерации органов и раке. Nat.Rev. Mol. Cell Biol. 11 , 834–848 (2010).
CAS PubMed Google ученый
Джентиле, А., Трусолино, Л. и Комольо, П. М. Рецептор тирозинкиназы Met в развитии и раке. Cancer Metastasis Rev. 27 , 85–94 (2008).
CAS PubMed Google ученый
Лю М. Л., Марс В. М., Зарнегар Р.И Михалопулос, Г. К. Поглощение и распределение фактора роста гепатоцитов в нормальной и регенерирующей печени взрослых крыс. Am. J. Pathol. 144 , 129–140 (1994).
CAS PubMed PubMed Central Google ученый
Bard-Chapeau, E. A. et al. Согласованные функции Gab1 и Shp2 в регенерации печени и гепатопротекции. Мол. Cell Biol. 26 , 4664–4674 (2006).
CAS PubMed PubMed Central Google ученый
Зарнегар Р., ДеФрансес, М. К., Кост, Д. П., Линдроос, П. и Михалопулос, Г. К. Экспрессия мРНК фактора роста гепатоцитов в регенерирующей печени крысы после частичной гепатэктомии. Biochem. Биофиз. Res. Commun. 177 , 559–565 (1991).
CAS PubMed Google ученый
Коно С., Нагайке М., Мацумото К. и Накамура Т. Заметная индукция мРНК фактора роста гепатоцитов в интактной почке и селезенке в ответ на повреждение отдаленных органов. Biochem. Биофиз. Res. Commun. 186 , 991–998 (1992).
CAS PubMed Google ученый
Yanagita, K. et al. Легкое может выполнять эндокринную функцию, вырабатывая фактор роста гепатоцитов в ответ на повреждение дистальных органов. Biochem. Биофиз. Res. Commun. 182 , 802–809 (1992).
CAS PubMed Google ученый
Broten, J., Michalopoulos, G., Petersen, B. & Cruise, J. Адренергическая стимуляция экспрессии фактора роста гепатоцитов. Biochem. Биофиз. Res. Commun. 262 , 76–79 (1999).
CAS PubMed Google ученый
Пассино, М. А., Адамс, Р. А., Сикорски, С. Л., Акассоглу, К. Регулирование дифференцировки звездчатых клеток печени с помощью рецептора нейротрофина p75NTR. Наука 315 , 1853–1856 (2007).
CAS PubMed Google ученый
Карвер Р. С., Стивенсон М. К., Шевинг Л. А. и Рассел В. Е. Различная экспрессия белков рецептора ErbB во время развития и регенерации печени крысы. Гастроэнтерология 123 , 2017–2027 (2002).
CAS PubMed Google ученый
Paranjpe, S. et al. РНК-интерференция против рецептора эпидермального фактора роста печени оказывает подавляющее действие на регенерацию печени у крыс. Am. J. Pathol. 176 , 2669–2681 (2010).
CAS PubMed PubMed Central Google ученый
Odegard, J. et al. Дифференциальные эффекты лигандов рецептора эпидермального фактора роста (EGF) на связывание рецептора, нижестоящие сигнальные пути и синтез ДНК в гепатоцитах. Факторы роста 35 , 239–248 (2017).
CAS PubMed Google ученый
Olsen, P. S., Poulsen, S. & Kirkegaard, P. Адренергические эффекты на секрецию эпидермального фактора роста железами Бруннера. Кишечник 26 , 920–927 (1985).
CAS PubMed PubMed Central Google ученый
Skov Olsen, P. et al. Влияние эпидермального фактора роста на регенерацию печени после частичной гепатэктомии у крыс. Гепатология 8 , 992–996 (1988).
CAS PubMed Google ученый
Дао, Д. Т., Анез-Бустиллос, Л., Адам, Р. М., Пудер, М. и Биленберг, Д. Р. Гепарин-связывающий эпидермальный фактор роста, подобный фактору роста, как критический медиатор восстановления и регенерации тканей. Am. J. Pathol. 188 , 2446–2456 (2018).
CAS PubMed PubMed Central Google ученый
Webber, EM, FitzGerald, MJ, Brown, PI, Bartlett, MH & Fausto, N. Трансформирующая экспрессия фактора роста-альфа во время регенерации печени после частичной гепатэктомии и токсического повреждения, а также потенциальные взаимодействия между трансформирующим фактором роста-альфа и фактором роста гепатоцитов . Гепатология 18 , 1422–1431 (1993).
CAS PubMed Google ученый
Lee, D. C. et al. Процессинг TACE / ADAM17 лигандов EGFR указывает на их роль в качестве физиологической конвертазы. Ann. NY Acad. Sci. 995 , 22–38 (2003).
CAS PubMed Google ученый
Berasain, C. et al. Амфирегулин: ранний триггер регенерации печени у мышей. Гастроэнтерология 128 , 424–432 (2005).
CAS PubMed Google ученый
Khai, N.C. et al. In vivo трансдукция гена HB-EGF в печени ингибирует Fas-индуцированное повреждение печени и индуцирует регенерацию печени у мышей: сравнительное исследование с HGF. J. Hepatol. 44 , 1046–1054 (2006).
CAS PubMed Google ученый
Mitchell, C. et al. Гепарин-связывающий эпидермальный фактор роста, подобный фактору роста, связывает праймирование гепатоцитов с развитием клеточного цикла во время регенерации печени. J. Biol. Chem. 280 , 2562–2568 (2005).
CAS PubMed Google ученый
Maretti-Mira, A.C, Wang, X., Wang, L. и DeLeve, L.D. Неполная дифференцировка прижившихся эндотелиальных клеток-предшественников костного мозга вызывает фиброз печени у крыс. Гепатология 69 , 1259–1272 (2019).
CAS PubMed PubMed Central Google ученый
Натараджан А., Вагнер Б. и Сибилия М. Рецептор EGF необходим для эффективной регенерации печени. Proc.Natl Acad. Sci. США 104 , 17081–17086 (2007).
CAS PubMed Google ученый
Scheving, LA, Zhang, X., Stevenson, MC, Threadgill, DW & Russell, WE. Потеря EGFR гепатоцитов не имеет никакого эффекта сама по себе, но усугубляет повреждение печени, вызванное тетрахлорметаном, и ухудшает регенерацию гепатоцитов с дефицитом Met мышей. Am. J. Physiol. Гастроинтест. Liver Physiol. 308 , G364 – G377 (2015).
CAS PubMed Google ученый
Normanno, N. et al. Передача сигналов рецептора эпидермального фактора роста (EGFR) при раке. Ген 366 , 2–16 (2006).
CAS PubMed Google ученый
Jo, M. et al. Перекрестное взаимодействие между рецептором эпидермального фактора роста и сигнальными путями c-Met в трансформированных клетках. J. Biol. Chem. 275 , 8806–8811 (2000).
CAS PubMed Google ученый
Tsagianni, A. et al. Комбинированное системное нарушение передачи сигналов MET и рецептора эпидермального фактора роста вызывает печеночную недостаточность у нормальных мышей. Am. J. Pathol. 88 , 2223–2235 (2018).
Google ученый
Limaye, P. B. et al. Механизмы опосредованной факторами роста гепатоцитов и опосредованной эпидермальным фактором роста передачи сигналов при трансдифференцировке гепатоцитов крыс в билиарный эпителий. Гепатология 47 , 1702–1713 (2008).
CAS PubMed PubMed Central Google ученый
Bhushan, B. et al. TCPOBOP-индуцированная гепатомегалия и пролиферация гепатоцитов ослабляются за счет комбинированного нарушения передачи сигналов MET и EGFR. Гепатология 69 , 1702–1718 (2019).
CAS PubMed Google ученый
Хаук, К. А., Зарнегар, Р., Муга, С. Дж. И Михалопулос, Г. К. Кислый фактор роста фибробластов (HBGF-1) стимулирует синтез ДНК в первичных культурах гепатоцитов крыс. J. Cell Physiol. 143 , 129–132 (1990).
CAS PubMed Google ученый
Kan, M. et al. Гепарин-связывающий фактор роста 1 типа (кислый фактор роста фибробластов): потенциальный двухфазный аутокринный и паракринный регулятор регенерации гепатоцитов. Proc. Natl Acad. Sci. USA 86 , 7432–7436 (1989).
CAS PubMed Google ученый
Huang, X. et al. Эктопическая активность рецептора 1 фактора роста фибробластов в гепатоцитах ускоряет гепатоканцерогенез, стимулируя пролиферацию и ангиогенез, индуцированный фактором роста эндотелия сосудов. Cancer Res. 66 , 1481–1490 (2006).
CAS PubMed Google ученый
Luo, Y. et al. Регулятор метаболизма βKlotho взаимодействует с рецептором 4 фактора роста фибробластов (FGFR4), вызывая апоптоз и подавляя пролиферацию опухолевых клеток. J. Biol. Chem. 285 , 30069–30078 (2010).
CAS PubMed PubMed Central Google ученый
Padrissa-Altes, S. et al. Контроль пролиферации и выживания гепатоцитов с помощью рецепторов Fgf важен для регенерации печени у мышей. Кишечник 64 , 1444–1453 (2015).
CAS PubMed Google ученый
Cicione, C., Degirolamo, C. & Moschetta, A. Возникающая роль факторов роста фибробластов 15/19 и 21 как метаболических интеграторов в печени. Гепатология 56 , 2404–2411 (2012).
CAS PubMed Google ученый
Kong, B.и другие. Дефицит фактора роста фибробластов 15 нарушает регенерацию печени у мышей. Am. J. Physiol. Гастроинтест. Физиология печени 306 , G893 – G902 (2014).
CAS PubMed PubMed Central Google ученый
Ямада, Ю., Уэббер, Е.М., Кириллова, И., Пешон, Дж. Дж. И Фаусто, Н. Анализ регенерации печени у мышей, лишенных рецептора фактора некроза опухоли типа 1 или 2: потребность в типе 1, но не рецептор типа 2. Гепатология 28 , 959–970 (1998).
CAS PubMed Google ученый
Кириллова И., Чейссон М. и Фаусто Н. Фактор некроза опухоли индуцирует репликацию ДНК в клетках печени посредством активации ядерного фактора κB. Различия в росте клеток. 10 , 819–828 (1999).
CAS PubMed Google ученый
Cressman, D. E. et al. Печеночная недостаточность и дефектная регенерация гепатоцитов у мышей с дефицитом интерлейкина-6. Наука 274 , 1379–1383 (1996).
CAS PubMed Google ученый
Norris, C.A. et al. Синтез ИЛ-6 гепатоцитами — нормальный ответ на обычные раздражители печени. PLoS ONE 9 , e96053 (2014).
PubMed PubMed Central Google ученый
Фаусто, Н. Регенерация печени. J. Hepatol. 32 , 19–31 (2000).
CAS PubMed Google ученый
Runge, DM, Runge, D., Foth, H., Strom, SC и Michalopoulos, GK STAT 1alpha / 1beta, STAT 3 и STAT 5: экспрессия и связь с c-MET и EGF-рецептором в долговременные культуры гепатоцитов человека. Biochem. Биофиз. Res. Commun. 265 , 376–381 (1999).
CAS PubMed Google ученый
Cruise, J. L., Knechtle, S. J., Bollinger, R. R., Kuhn, C. & Michalopoulos, G. Альфа-1-адренергические эффекты и регенерация печени. Гепатология 7 , 1189–1194 (1987).
CAS PubMed Google ученый
Круз, Дж. Л., Хоук, К. А. и Михалопулос, Г. К. Индукция синтеза ДНК в культивируемых гепатоцитах крыс посредством стимуляции альфа-1-адренорецепторов норадреналином. Наука 227 , 749–751 (1985).
CAS PubMed Google ученый
Han, C., Bowen, WC, Michalopoulos, GK & Wu, T. Альфа-1 адренергический рецептор трансактивирует сигнальный преобразователь и активатор транскрипции-3 (Stat3) посредством активации Src и рецептора эпидермального фактора роста ( EGFR) в гепатоцитах. J. Cell Physiol. 216 , 486–497 (2008).
CAS PubMed PubMed Central Google ученый
Houck, K. A., Cruise, J. L. & Michalopoulos, G. Норэпинефрин модулирует эффект ингибирования роста трансформирующего фактора роста бета в первичных культурах гепатоцитов крыс. J. Cell Physiol. 135 , 551–555 (1988).
CAS PubMed Google ученый
Huang, W. et al. Зависимая от ядерных рецепторов передача сигналов желчной кислоты необходима для нормальной регенерации печени. Наука 312 , 233–236 (2006).
CAS PubMed Google ученый
Borude, P. et al. Гепатоцит-специфическая делеция рецептора фарнезоида X задерживает, но не тормозит регенерацию печени после частичной гепатэктомии у мышей. Гепатология 56 , 2344–2352 (2012).
CAS PubMed PubMed Central Google ученый
Block, G. D. et al. Расширение популяции, клональный рост и специфические паттерны дифференцировки в первичных культурах гепатоцитов, индуцированные HGF / SF, EGF и TGF альфа в химически определенной среде (HGM). J. Cell Biol. 132 , 1133–1149 (1996).
CAS PubMed Google ученый
Francavilla, A. et al. Скрининг кандидатов в факторы роста печени путем селективной инфузии воротной вены после фистулы Экка у собак. Гепатология 14 , 665–670 (1991).
CAS PubMed PubMed Central Google ученый
Fafalios, A. et al. Гибрид рецептора фактора роста гепатоцитов (Met) и рецептора инсулина регулирует метаболизм глюкозы в печени. Nat. Med. 17 , 1577–1584 (2011).
CAS PubMed PubMed Central Google ученый
Planas-Paz, L. et al. Модуль RSPO-LGR4 / 5-ZNRF3 / RNF43 контролирует зонирование и размер печени. Nat. Cell Biol. 18 , 467–479 (2016).
CAS PubMed Google ученый
Capurro, M., Martin, T., Shi, W. & Filmus, J. Glypican-3 связывается с Frizzled и играет прямую роль в стимуляции канонической передачи сигналов Wnt. J. Cell Sci. 127 , 1565–1575 (2014).
CAS PubMed Google ученый
Li, N. et al. Завитый, богатый цистеином домен в глипикане-3 опосредует связывание wnt и регулирует рост опухоли гепатоцеллюлярной карциномы у мышей. Гепатология 70 , 1231–1245 (2019).
CAS PubMed PubMed Central Google ученый
Monga, S.P. et al. Фактор роста гепатоцитов индуцирует Wnt-независимую ядерную транслокацию бета-катенина после диссоциации Met-бета-катенина в гепатоцитах. Cancer Res. 62 , 2064–2071 (2002).
CAS PubMed Google ученый
Tetsu, O. & McCormick, F.Бета-катенин регулирует экспрессию циклина D1 в клетках карциномы толстой кишки. Nature 398 , 422–426 (1999).
CAS PubMed Google ученый
Yang, J. et al. Передача сигналов β-катенина при зонировании и регенерации печени мышей: ситуация Wnt-Wnt! Гепатология 60 , 964–976 (2014).
CAS PubMed PubMed Central Google ученый
Ochoa, B. et al. Передача сигналов Hedgehog имеет решающее значение для нормальной регенерации печени после частичной гепатэктомии у мышей. Гепатология 51 , 1712–1723 (2010).
CAS PubMed PubMed Central Google ученый
Swiderska-Syn, M. et al. Hedgehog регулирует да-ассоциированный белок 1 в регенерирующей печени мыши. Гепатология 64 , 232–244 (2016).
CAS PubMed PubMed Central Google ученый
Liu, B. et al. Подавление регенерации печени и пролиферации гепатоцитов у трансгенных мышей, нацеленных на гепатоциты глипикана 3. Гепатология 52 , 1060–1067 (2010).
CAS PubMed PubMed Central Google ученый
Bhave, V. S. et al. Регулирование роста печени глипиканом 3, CD81, hedgehog и Hhex. Am. J. Pathol. 183 , 153–159 (2013).
CAS PubMed PubMed Central Google ученый
Мачадо, М. В. и Дил, А. М. Передача сигналов ежа в патофизиологии печени. J. Hepatol. 68 , 550–562 (2018).
CAS PubMed Google ученый
Li, W. et al. Гомеостатическое Arid1a-зависимое состояние пермиссивного хроматина лицензирует реакцию гепатоцитов на передачу сигналов YAP, связанную с повреждением печени. Стволовая клетка клетки 25 , 54–68 (2019).
CAS PubMed Google ученый
Septer, S. et al. Да-ассоциированный белок участвует в пролиферации и дифференцировке во время постнатального развития печени. Am. J. Physiol. Гастроинтест. Физиология печени 302 , G493 – G503 (2012).
CAS PubMed Google ученый
Гальдер, Г. и Джонсон, Р. Л. Передача сигналов от гиппопотама: контроль роста и не только. Разработка 138 , 9–22 (2011).
CAS PubMed PubMed Central Google ученый
Патель, С. Х., Камарго, Ф. Д. и Йимламаи, Д. Передача сигналов от гиппопотама в печени регулирует размер органа, судьбу клеток и канцерогенез. Гастроэнтерология 152 , 533–545 (2017).
CAS PubMed Google ученый
Grijalva, J. L. et al. Динамические изменения в сигнальном пути Hippo и активация YAP во время регенерации печени. Am. J. Physiol. Гастроинтест. Физиология печени 307 , G196 – G204 (2014).
CAS PubMed Google ученый
Oh, S. H., Swiderska-Syn, M., Jewell, M. L., Premont, R. T. & Diehl, A. M. Регенерация печени требует Yap1-TGFbeta-зависимого эпителиально-мезенхимального перехода в гепатоцитах. J. Hepatol. 69 , 359–367 (2018).
CAS PubMed PubMed Central Google ученый
Сюэ, Ю.и другие. Вирус гепатита С имитирует эффекты глипикана-3 на CD81 и способствует развитию гепатоцеллюлярной карциномы за счет активации пути гиппопотама в гепатоцитах. Am. J. Pathol. 188 , 1469–1477 (2018).
CAS PubMed PubMed Central Google ученый
Фердоус, З., Вей, В. М., Иоззо, Р., Хук, М., Гранде-Аллен, К. Дж. Взаимодействие с факторами роста, трансформирующими декорин, регулирует матричную организацию и механические характеристики трехмерных коллагеновых матриц. J. Biol. Chem. 282 , 35887–35898 (2007).
CAS PubMed Google ученый
Джиртл Р. Л., Карр Б. И. и Скотт С. Д. Модуляция рецепторов инсулиноподобного фактора роста-II / манноза 6-фосфата и трансформирующий фактор роста бета 1 во время регенерации печени. J. Biol. Chem. 266 , 22444–22450 (1991).
CAS PubMed Google ученый
Jakowlew, S. B. et al. Изоформы трансформирующего фактора роста-бета (TGF-бета) в регенерации печени крыс: экспрессия информационной РНК и активация латентного TGF-бета. Cell Regul. 2 , 535–548 (1991).
CAS PubMed PubMed Central Google ученый
Чари, Р. С., Прайс, Д. Т., Сью, С. Р., Мейерс, В. К. и Джиртл, Р. Л. Снижение регуляции бета-рецепторов трансформирующего фактора роста I, II и III типов во время регенерации печени. Am. J. Surg. 169 , 126–131 (1995).
CAS PubMed Google ученый
Thenappan, A. et al. Потеря трансформирующего фактора роста бета-адаптера белка β-2-спектрина приводит к задержке регенерации печени у мышей. Гепатология 53 , 1641–1650 (2011).
CAS PubMed PubMed Central Google ученый
Пеппер, М. С., Вассалли, Дж. Д., Орчи, Л. и Монтесано, Р. Двухфазный эффект трансформирующего фактора роста-бета 1 на ангиогенез in vitro. Exp. Cell Res. 204 , 356–363 (1993).
CAS PubMed Google ученый
Hu, J. et al. Ангиопоэтин-2, полученный из эндотелиальных клеток, контролирует регенерацию печени как пространственно-временной реостат. Наука 343 , 416–419 (2014).
CAS PubMed Google ученый
Ichikawa, T. et al. Трансформирующий фактор роста бета и активин тонически подавляют синтез ДНК в печени крысы. Гепатология 34 , 918–925 (2001).
CAS PubMed Google ученый
Carpentier, R. et al. Эмбриональные клетки протоковой пластинки дают начало холангиоцитам, перипортальным гепатоцитам и взрослым клеткам-предшественникам печени. Гастроэнтерология 141 , 1432–1438 (2011).
CAS PubMed PubMed Central Google ученый
Clotman, F. et al. Контроль решения судьбы клеток печени с помощью градиента передачи сигналов TGF beta, модулируемого факторами транскрипции Onecut. Гены. Dev. 19 , 1849–1854 (2005).
CAS PubMed PubMed Central Google ученый
Clotman, F. et al. Фактор транскрипции onecut HNF6 необходим для нормального развития желчевыводящих путей. Развитие 129 , 1819–1828 (2002).
CAS PubMed Google ученый
Grisham, J. Морфологическое исследование синтеза дезоксирибонуклеиновой кислоты и пролиферации клеток в регенерирующей печени; авторадиография с тимидином-h4. Cancer Res. 22 , 842–849 (1962).
CAS PubMed Google ученый
Мацумото, К., Фуджи, Х., Михалопулос, Г., Фунг, Дж. Дж. И Деметрис, А. Дж. Эпителиальные клетки желчных путей человека секретируют цитокины и факторы роста гепатоцитов и реагируют на них in vitro: интерлейкин-6, фактор роста гепатоцитов и фактор роста эпидермиса. способствовать синтезу ДНК in vitro. Гепатология 20 , 376–382 (1994).
CAS PubMed Google ученый
Keitel, V. & Haussinger, D. TGR5 в желчном дереве. Dig. Дис. 29 , 45–47 (2011).
PubMed Google ученый
Pean, N. et al. Рецептор TGR5 защищает печень от перегрузки желчной кислотой во время регенерации печени у мышей. Гепатология 58 , 1451–1460 (2013).
CAS PubMed Google ученый
Glaser, S., Han, Y., Francis, H. & Alpini, G.Мелатониновая регуляция желчевыводящих путей. Гепатобилиарная хирургия. Nutr. 3 , 35–43 (2014).
PubMed PubMed Central Google ученый
Johnson, C. et al. Гистамин восстанавливает желчную массу после повреждения, вызванного тетрахлорметаном, на модели холестатических крыс. Dig. Liver Dis. 47 , 211–217 (2015).
CAS PubMed Google ученый
Михалопулос, Г. К., Баруа, Л. и Боуэн, В. С. Трансдифференцировка гепатоцитов крысы в билиарные клетки после перевязки желчных протоков и токсического поражения желчных путей. Гепатология 41 , 535–544 (2005).
CAS PubMed PubMed Central Google ученый
Pepe-Mooney, B.J. et al. Одноклеточный анализ эпителия печени показывает динамическую неоднородность и важную роль YAP в гомеостазе и регенерации. Стволовая клетка клетки 25 , 23–38.e8 (2019).
CAS PubMed PubMed Central Google ученый
Fouassier, L. & Fiorotto, R. Ezrin находит свою бороздку в холангиоцитах. Гепатология 61 , 1467–1470 (2015).
CAS PubMed PubMed Central Google ученый
Росс, М. А., Сандер, К.М., Клиб Т. Б., Уоткинс С. С. и Штольц Д. Б. Пространственно-временная экспрессия рецепторов фактора роста ангиогенеза во время реваскуляризации регенерирующей печени крысы. Гепатология 34 , 1135–1148 (2001).
CAS PubMed Google ученый
LeCouter, J. et al. Независимая от ангиогенеза эндотелиальная защита печени: роль VEGFR-1. Наука 299 , 890–893 (2003).
CAS PubMed Google ученый
Ding, B. S. et al. Индуктивные ангиокринные сигналы от синусоидального эндотелия необходимы для регенерации печени. Природа 468 , 310–315 (2010).
CAS PubMed PubMed Central Google ученый
Rocha, A. S. et al. Ангиокринный фактор rspondin3 является ключевым фактором зонирования печени. Cell Rep. 13 , 1757–1764 (2015).
CAS PubMed Google ученый
Wang, L. et al. Клетки-предшественники синусоидальных эндотелиальных клеток печени способствуют регенерации печени у крыс. J. Clin. Инвестировать. 122 , 1567–1573 (2012).
CAS PubMed PubMed Central Google ученый
Икараси, М.и другие. Различное развитие и функции резидентных и рекрутированных клеток Купфера / макрофагов печени. J. Leukoc. Биол. 94 , 1325–1336 (2013).
PubMed Google ученый
Nishiyama, K. et al. Мышиные CD11b + клетки Купфера, привлеченные из костного мозга, ускоряют регенерацию печени после частичной гепатэктомии. PLoS ONE 10 , e0136774 (2015).
PubMed PubMed Central Google ученый
Ли Н. и Хуа Дж. Иммунные клетки в регенерации печени. Oncotarget 8 , 3628–3639 (2017).
PubMed Google ученый
Oben, J. A. et al. Фиброгенез печени требует наличия симпатических нейромедиаторов. Кишечник 53 , 438–445 (2004).
CAS PubMed PubMed Central Google ученый
Цучида Т.& Фридман, С. Л. Механизмы активации звездчатых клеток печени. Nat. Преподобный Гастроэнтерол. Гепатол. 14 , 397–411 (2017).
CAS PubMed Google ученый
Gkretsi, V. et al. Специфическое для печени устранение интегрин-связанной киназы у мышей приводит к аномальной гистологии, усилению пролиферации клеток и гепатомегалии. Гепатология 48 , 1932–1941 (2008).
PubMed PubMed Central Google ученый
Gkretsi, V., Bowen, W.C., Yang, Y., Wu, C. & Michalopoulos, G.K. Интегрин-связанная киназа участвует в матрикс-индуцированной дифференцировке гепатоцитов. Biochem. Биофиз. Res. Commun. 353 , 638–643 (2007).
CAS PubMed Google ученый
Donthamsetty, S. et al. Роль PINCH и его партнерского опухолевого супрессора Rsu-1 в регулировании размера печени и туморогенеза. PLoS ONE 8 , e74625 (2013).
CAS PubMed PubMed Central Google ученый
Oe, S. et al. Неповрежденная передача сигналов трансформирующим фактором роста бета не требуется для прекращения регенерации печени у мышей. Гепатология 40 , 1098–1105 (2004).
CAS PubMed Google ученый
Yang, J. et al. WNT5A подавляет пролиферацию гепатоцитов и завершает передачу сигналов бета-катенина при регенерации печени. Am. J. Pathol. 185 , 2194–2205 (2015).
CAS PubMed PubMed Central Google ученый
Huck, I., Gunewardena, S., Espanol-Suner, R., Willenbring, H. & Apte, U. Активация ядерного фактора гепатоцитов 4 альфа важна для прекращения регенерации печени у мышей. Гепатология 70 , 666–681 (2019).
CAS PubMed PubMed Central Google ученый
Jin, J. et al. Взаимодействие белков семейства C / EBP и белков ремоделирования хроматина важно для прекращения регенерации печени. Гепатология 61 , 315–325 (2015).
CAS PubMed Google ученый
Михалопулос, Г. К. и Хан, З. Стволовые клетки печени: экспериментальные данные и значение для болезней печени человека. Гастроэнтерология 149 , 876–882 (2015).
PubMed PubMed Central Google ученый
Trautwein, C. et al. 2-ацетаминофлуорен блокирует развитие клеточного цикла после гепатэктомии за счет индукции p21 и отсутствия экспрессии циклина E. Онкоген 18 , 6443–6453 (1999).
CAS PubMed Google ученый
Evarts, R.P. et al. Взаимосвязь предшественник-продукт между овальными клетками и гепатоцитами: сравнение меченного тритием тимидина и бромдезоксиуридина в качестве индикаторов. Канцерогенез 17 , 2143–2151 (1996).
CAS PubMed Google ученый
Lu, W. Y. et al. Печеночные клетки-предшественники билиарного происхождения, обладающие способностью к репопуляции печени. Nat. Cell Biol. 17 , 971–983 (2015).
CAS PubMed PubMed Central Google ученый
Raven, A. et al. Холангиоциты действуют как факультативные стволовые клетки печени при нарушении регенерации гепатоцитов. Природа 547 , 350–354 (2017).
CAS PubMed PubMed Central Google ученый
Deng, X. et al. Хроническое повреждение печени вызывает превращение эпителиальных клеток желчных путей в гепатоциты. Стволовая клетка клетки 23 , 114–122.e3 (2018).
CAS PubMed Google ученый
Russell, J. O. et al.Гепатоцит-специфическая делеция бета-катенина при тяжелом поражении печени провоцирует дифференцировку холангиоцитов в гепатоциты. Гепатология 69 , 742–759 (2019).
CAS PubMed PubMed Central Google ученый
Dorrell, C. et al. Перспективное выделение бипотенциальных клоногенных клеток-предшественников печени у взрослых мышей. Гены. Dev. 25 , 1193–1203 (2011).
CAS PubMed PubMed Central Google ученый
Li, B. et al. Печень взрослой мыши содержит две отдельные популяции холангиоцитов. Stem Cell Rep. 9 , 478–489 (2017).
CAS Google ученый
Isse, K. et al. Существующее ранее эпителиальное разнообразие в нормальной печени человека: тканевый цитометрический анализ портальных / перипортальных эпителиальных клеток. Гепатология 57 , 1632–1643 (2013).
CAS PubMed PubMed Central Google ученый
Aizarani, N. et al. Атлас клеток печени человека обнаруживает гетерогенность и эпителиальных предшественников. Nature 572 , 199–204 (2019).
CAS PubMed PubMed Central Google ученый
Петерсен, Б. Э., Зайак, В. Ф. и Михалопулос, Г. К. Активация овальных клеток печени в ответ на повреждение после химически индуцированного перипортального или перицентрального повреждения у крыс. Гепатология 27 , 1030–1038 (1998).
CAS PubMed Google ученый
Kasprzak, A. et al. Клеточная экспрессия p21 / Wafl / Cipl при хроническом длительном гепатите C: корреляция с белками HCV (C, NS3, NS5A), другими белками, связанными с клеточным циклом, и избранными клиническими данными. Folia Histochem. Cytobiol. 47 , 385–394 (2009).
PubMed Google ученый
Sclair, S.N. et al. Повышенный ответ печеночных клеток-предшественников и протоковая реакция у пациентов с тяжелым рецидивом гепатита С после трансплантации печени. Clin. Транспл. 30 , 722–730 (2016).
Google ученый
Khaliq, M. et al. Stat3 регулирует управляемую клетками-предшественниками печени регенерацию печени у рыбок данио. Gene Expr. 18 , 157–170 (2018).
CAS PubMed PubMed Central Google ученый
Лимай, П. Б., Боуэн, В. К., Орр, А., Апте, У. М. и Михалопулос, Г. К. Экспрессия гепатоцитарных и билиарных факторов транскрипции в регенерирующих желчных протоках во время трансдифференцировки гепатоцитов в билиарные эпителиальные клетки. Комп. Гепатол. 9 , 9 (2010).
CAS PubMed PubMed Central Google ученый
Font-Burgada, J. et al. Гибридные перипортальные гепатоциты регенерируют поврежденную печень, не вызывая рака. Ячейка 162 , 766–779 (2015).
CAS PubMed PubMed Central Google ученый
Michalopoulos, G. K., Bowen, W. C., Mule, K. & Luo, J. HGF-, EGF- и дексаметазон-индуцированные паттерны экспрессии генов во время формирования ткани в культурах печеночных органоидов. Gene Expr. 11 , 55–75 (2003).
CAS PubMed Google ученый
Михалопулос, Г. К., Боуэн, В. К., Мул, К. и Штольц, Д. Б. Гистологическая организация в культурах органоидов гепатоцитов. Am. J. Pathol. 159 , 1877–1887 (2001).
CAS PubMed PubMed Central Google ученый
Schaub, J. R. et al. Формирование желчевыводящей системы de novo путем трансдифференцировки гепатоцитов, опосредованной TGFβ. Природа 557 , 247–251 (2018).
CAS PubMed PubMed Central Google ученый
Йовчев, М. И., Ли, Э. Дж., Родригес-Сильва, В., Локер, Дж. И Эртель, М. Обструкция желчных путей способствует многолинейной дифференцировке стволовых клеток печени. Hepatol. Commun. 3 , 1137–1150 (2019).
CAS PubMed PubMed Central Google ученый
Limaye, P.B. et al. Экспрессия специфических факторов транскрипции гепатоцитов и холангиоцитов при заболеваниях печени и эмбриональном развитии человека. Lab. Инвестировать. 88 , 865–872 (2008).
CAS PubMed PubMed Central Google ученый
Hattoum, A., Rubin, E., Orr, A. & Michalopoulos, GK Экспрессия рецептора эпидермального фактора роста гепатоцитов, FAS и глипикана 3 в EpCAM-положительных регенеративных кластерах гепатоцитов, холангиоцитов и клеток-предшественников при печеночной недостаточности человека. Hum. Патол. 44 , 743–749 (2013).
CAS PubMed Google ученый
Stueck, A.E. & Wanless, I.R. Зачатки гепатоцитов, полученные из клеток-предшественников, повторно заселяют области исчезновения паренхимы при циррозе человека. Гепатология 61 , 1696–1707 (2015).
CAS PubMed Google ученый
Бхушан, Б.& Апте, У. Регенерация печени после гепатотоксичности парацетамола: механизмы и терапевтические возможности. Am. J. Pathol. 189 , 719–729 (2019).
CAS PubMed PubMed Central Google ученый
Bhushan, B. et al. Прорегенеративная передача сигналов после индуцированного ацетаминофеном острого повреждения печени у мышей, идентифицированного с использованием новой модели возрастающей дозы. Am. J. Pathol. 184 , 3013–3025 (2014).
CAS PubMed PubMed Central Google ученый
Bhushan, B. et al. Двойная роль рецептора эпидермального фактора роста в повреждении и регенерации печени после передозировки ацетаминофена у мышей. Toxicol. Sci. 155 , 363–378 (2017).
CAS PubMed Google ученый
Хьюз, Р. Д., Чжан, Л., Цубучи, Х., Дайкухара, Ю.И Уильямс Р. Уровни фактора роста гепатоцитов и билипротеинов в плазме и исход при молниеносной печеночной недостаточности. J. Hepatol. 20 , 106–111 (1994).
CAS PubMed Google ученый
Джеймс, Л. П., Куртен, Р. К., Лэмпс, Л. В., Маккаллоу, С. и Хинсон, Дж. А. Рецептор фактора некроза опухоли 1 и регенерация гепатоцитов при токсичности ацетаминофена: кинетическое исследование экспрессии ядерного антигена пролиферирующих клеток и цитокинов. Basic Clin. Pharmacol. Toxicol. 97 , 8–14 (2005).
CAS PubMed Google ученый
Джеймс, Л. П., Лэмпс, Л. В., Маккалоу, С. и Хинсон, Дж. А. Интерлейкин 6 и регенерация гепатоцитов при токсичности парацетамола у мышей. Biochem. Биофиз. Res. Commun. 309 , 857–863 (2003).
CAS PubMed Google ученый
Donahower, B. et al. Фактор роста эндотелия сосудов и регенерация гепатоцитов при токсичности ацетаминофена. Am. J. Physiol. Гастроинтест. Liver Physiol. 291 , G102 – G109 (2006).
CAS PubMed Google ученый
Kato, T. et al. Передача сигналов рецептора-1 фактора роста эндотелия сосудов способствует восстановлению печени за счет восстановления микрососудов печени после гепатотоксичности ацетаминофена. Toxicol. Sci. 120 , 218–229 (2011).
CAS PubMed Google ученый
Bhushan, B. et al. Роль желчных кислот в повреждении и регенерации печени после передозировки ацетаминофена. Am. J. Pathol. 183 , 1518–1526 (2013).
CAS PubMed PubMed Central Google ученый
Бхушан, Б., Poudel, S., Manley, M. W. Jr. Roy, N. & Apte, U. Ингибирование киназы гликогенсинтазы 3 ускоряет регенерацию печени после индуцированной ацетаминофеном гепатотоксичности у мышей. Am. J. Pathol. 187 , 543–552 (2017).
CAS PubMed PubMed Central Google ученый
Alvarez-Sola, G. et al. Сконструированный фактор роста фибробластов 19 защищает от вызванного ацетаминофеном повреждения печени и стимулирует регенерацию печени у пожилых мышей. Cell Death Dis. 8 , e3083 (2017).
PubMed PubMed Central Google ученый
Берд Т. Г. и др. Ингибирование TGFβ восстанавливает регенеративный ответ при остром повреждении печени путем подавления паракринного старения. Sci. Transl Med. 10 , eaan1230 (2018).
PubMed PubMed Central Google ученый
Borude, P., Bhushan, B. & Apte, U. Реакция на повреждение ДНК регулирует инициирование регенерации печени после передозировки ацетаминофена. Gene Expr. 18 , 115–123 (2018).
CAS PubMed PubMed Central Google ученый
Borude, P. et al. Плейотропная роль p53 в повреждении и регенерации печени после передозировки ацетаминофена. Am. J. Pathol. 188 , 1406–1418 (2018).
CAS PubMed PubMed Central Google ученый
Overturf, K. et al. Гепатоциты, скорректированные с помощью генной терапии, отбирают in vivo на мышиной модели наследственной тирозинемии типа I. Nat. Genet. 12 , 266–273 (1996).
CAS PubMed Google ученый
Overturf, K., al-Dhalimy, M., Ou, C. N., Finegold, M.& Grompe, M. Последовательная трансплантация выявляет регенеративный потенциал гепатоцитов взрослых мышей, подобный стволовым клеткам. Am. J. Pathol. 151 , 1273–1280 (1997).
CAS PubMed PubMed Central Google ученый
Monga, S.P. Последние данные о гомеостазе печени и многих уровнях восстановления гепатобилиарной системы. Nat. Преподобный Гастроэнтерол. Гепатол. 16 , 84–86 (2019).
CAS PubMed Google ученый
Wang, B., Zhao, L., Fish, M., Logan, C. Y. & Nusse, R. Самовосстанавливающиеся диплоидные клетки Axin2 + поддерживают гомеостатическое обновление печени. Природа 524 , 180–185 (2015).
CAS PubMed PubMed Central Google ученый
Kennedy, S., Rettinger, S., Flye, M. W. & Ponder, K. P. Эксперименты на трансгенных мышах показывают, что гепатоциты являются источником постнатального роста печени и не выделяются. Гепатология 22 , 160–168 (1995).
CAS PubMed Google ученый
Lin, S. et al. Распределенные гепатоциты, экспрессирующие теломеразу, повторно заселяют печень при гомеостазе и повреждении. Природа 556 , 244–248 (2018).
CAS PubMed PubMed Central Google ученый
Chen, F. et al. Широкое распространение пролиферации гепатоцитов в гомеостазе и регенерации печени. Стволовая клетка клетки 26 , 27–33.e4 (2020).
CAS PubMed Google ученый
Sun, T. et al. Перицентральные гепатоциты AXIN2 + имеют ограниченный вклад в гомеостаз и регенерацию печени. Стволовая клетка клетки 26 , 97–107.e6 (2019).
PubMed Google ученый
Monga, S.P. Никаких зон: демократичные гепатоциты способствуют гомеостазу и восстановлению печени. Стволовая клетка клетки 26 , 2–3 (2020).
CAS PubMed Google ученый
Михалопулос, Г. К. Гепатостат: регенерация печени и поддержание нормальной ткани печени. Гепатология 65 , 1384–1392 (2017).
PubMed Google ученый
Klaas, M. et al. Изменения в составе внеклеточного матрикса направляют восстановление поврежденной ткани печени. Sci. Отчетность 6 , 27398 (2016).
CAS PubMed PubMed Central Google ученый
Canbay, A. et al. Апоптотическое поглощение тела линией звездчатых клеток человека является профиброгенным. Lab. Инвестировать. 83 , 655–663 (2003).
CAS PubMed Google ученый
Duncan, A. W. et al. Конвейер плоидности зрелых гепатоцитов как источник генетической изменчивости. Природа 467 , 707–710 (2010).
CAS PubMed PubMed Central Google ученый
Anti, M. et al. Паттерн плоидности ДНК при хронических заболеваниях печени и узловых поражениях печени у человека. Проточно-цитометрический анализ при игольчатой биопсии печени под эхонаблюдением. Рак 73 , 281–288 (1994).
CAS PubMed Google ученый
Duncan, A. W. et al. Частая анеуплоидия среди нормальных гепатоцитов человека. Гастроэнтерология 142 , 25–28 (2012).
PubMed Google ученый
Boege, Y. et al. Двойная роль каспазы-8 в запуске и обнаружении связанного с пролиферацией повреждения ДНК, ключевой детерминанты развития рака печени. Cancer Cell 32 , 342–359 (2017).
CAS PubMed PubMed Central Google ученый
Zhu, M. et al. Соматические мутации повышают клональную пригодность и регенерацию печени при хроническом заболевании печени. Ячейка 177 , 608–621 (2019).
CAS PubMed PubMed Central Google ученый
Luo, J. H. et al. Транскриптомный и геномный анализ гепатоцеллюлярных карцином и гепатобластом человека. Гепатология 44 , 1012–1024 (2006).
CAS PubMed PubMed Central Google ученый
Клеточные механизмы регенерации печени и клеточная терапия заболеваний печени
Возникающая область регенеративной медицины предлагает инновационные методы клеточной терапии и тканевой / органной инженерии как новый подход к лечению заболеваний печени.Окончательная научная основа как клеточной терапии заболеваний печени, так и тканевой и органной инженерии печени обеспечивается глубокими исследованиями клеточных и молекулярных механизмов регенерации печени. Клеточные механизмы гомеостатической и вызванной повреждением регенерации печени уникальны. Восстановление массы паренхимы печени достигается за счет компенсаторной гипертрофии и гиперплазии дифференцированных паренхиматозных клеток, гепатоцитов, в то время как экспансия и дифференцировка резидентных стволовых клеток / клеток-предшественников играют второстепенную или незначительную роль.Доказано участие переносимых кровью клеток костномозгового происхождения в регенерации паренхимы печени, но не превышает 1-2% новообразованных гепатоцитов. Регенерация печени активируется спонтанно после травмы и может быть дополнительно стимулирована клеточной терапией гепатоцитами, гемопоэтическими стволовыми клетками или мезенхимальными стволовыми клетками. Дальнейшие исследования, направленные на улучшение результатов клеточной терапии заболеваний печени, продолжаются. В случае печеночной недостаточности трансплантация инженерной печени может стать лучшим вариантом в обозримом будущем.Разработка трансплантируемой печени или ее основной части представляет собой огромную проблему, но быстрый прогресс в исследованиях индуцированной плюрипотентности, тканевой инженерии и биопечати показывает, что это возможно.
1. Введение
Заболевания печени представляют собой серьезную проблему для национальных систем здравоохранения во всем мире [1–4]. Персистирующая инфекция гепатита, алкоголизм и наследственные нарушения обмена веществ в печени являются основной причиной роста случаев острой и хронической печеночной недостаточности, связанной с высокой заболеваемостью и смертностью.В случае печеночной недостаточности используемые в настоящее время клинические подходы неэффективны, за исключением трансплантации органов. Хотя аллогенная трансплантация печени является эффективным методом, ее практическое применение сдерживается ограниченным количеством донорских органов, иммунологическими побочными эффектами и экономическими причинами.
Большим спросом пользуется разработка альтернативных методов лечения патологии печени. Возникающая область регенеративной медицины предлагает новые подходы к лечению заболеваний печени, основанные на значительном прогрессе в фундаментальных биомедицинских исследованиях за последние 20–30 лет.В настоящее время клеточная терапия (инъекция или переливание клеточных суспензий) и тканевая / органная инженерия являются основными методами регенеративной медицины, изучаемыми на экспериментальной установке и апробированными клинически. Трансплантация клеток направлена на повторное заселение ткани печени гепатоцитами, чтобы повысить способность собственной печени реципиента к регенерации и улучшить восстановление ее структуры и функции. По сравнению с трансплантацией органов или органной / тканевой инженерией, клеточная терапия гораздо менее инвазивна и дорога.С другой стороны, органная инженерия может решить проблему нехватки доноров печени.
Очевидно, что окончательное научное обоснование как клеточной терапии заболеваний печени, так и тканевой и органной инженерии печени должно быть обеспечено исследованиями клеточных и молекулярных механизмов регенерации печени, действующих в физиологических условиях (гомеостатическая регенерация), во время повышенной функциональной нагрузки (адаптивная регенерация) или после повреждений, вызванных болезнью, отравлением или травмой (регенерация, вызванная травмой) [5].В классических учебниках гистологии, таких как 9-е издание Гистологии Хэма [6], приводится следующий список типов клеток печени: гепатоциты, холангиоциты (желчные эпителиальные клетки, эпителий желчных протоков), печеночные макрофаги (клетки Купфера), фенестрированный эндотелий. синусоидов сосудов, клеточных элементов других кровеносных сосудов, клеток Ито (звездчатых клеток), стромальных фибробластов, клеток лимфатических сосудов, лимфоцитов и других иммунных клеток, а также нервных элементов. Позже к списку добавились так называемые овальные клетки [7, 8].В печени содержится популяция стволовых клеток / клеток-предшественников, которая у грызунов включает овальные клетки [9]. Эксперименты по клеточной судьбе показали, что звездчатые клетки также могут быть предшественниками эпителиальных клеток печени [10, 11].
Существует два широко изученных механизма регенерации печени: компенсаторная гиперплазия гепатоцитов и регенерация, опосредованная стволовыми клетками / клетками-предшественниками. Молекулярные и клеточные события, происходящие во время компенсаторной гиперплазии, относительно хорошо охарактеризованы, в то время как альтернативный механизм регенерации еще полностью не раскрыт.За исключением резидентных клеток печени, эту роль приписывают переносимым кровью клеткам костного мозга [12–14]. Звездчатые клетки являются важным элементом механизма регенерации печени, являясь частью ниши стволовых клеток печени, поддерживая регенерацию на ранних стадиях за счет секреции факторов роста и вызывая остановку регенерации после восстановления нормальной массы органа [15].
Исследования, проведенные на животных моделях, показали, что методы регенеративной медицины могут обеспечивать положительные эффекты, превосходящие те, которые оказываются любым другим терапевтическим подходом, за исключением трансплантации донорской печени, и что механизмы этих эффектов включают замену поврежденных клеток или тканей и стимуляцию собственной регенеративный потенциал.Экспериментальные результаты послужили прочной основой для первоначальных клинических исследований. Ограниченный опыт работы с пациентами-людьми, кажется, подтверждает некоторые экспериментальные результаты.
Целью данной статьи является обзор механизмов регенерации печени и описание текущих подходов, направленных на усиление регенеративной способности печени и на создание новой искусственной ткани печени и, в конечном итоге, всего искусственного органа.
2. Гистологическая структура ткани печени
Структурная организация ткани печени, схематически представленная на рисунке 1, довольно однородна по всему органу и отражает его метаболические и секреторные функции [6].Гепатоциты — это количественно преобладающие клетки, составляющие около 80% общей массы печени. Они образуют трабекулы, каждая из которых состоит из двух рядов клеток. Пространства между рядами гепатоцитов образуют желчные каналы, заполненные желчью, эвакуированной в желчные протоки через каналы Геринга, выстланные гепатоцитами и эпителиальными клетками желчных протоков. Пространство между трабекулами занято синусоидами крови, образованными фенестрированным эндотелием и выстланными макрофагами печени, называемыми клетками Купфера. Плоское пространство между трабекулами и фенестрированным эндотелием, обеспечивающее максимальный контакт гепатоцитов с кровью, называется пространством Диссе.Среди гепатоцитов и контактирующих с пространством Диссе находятся клетки Ито (звездчатые клетки печени), содержащие липиды и витамин А. Помимо клеток Купфера, печень является хозяином других иммунных клеток, включая резидентные естественные киллеры (пит-клетки), обычные NK-клетки и дендритные клетки.
В печени находится пул клеток с комбинированными характеристиками стволовых клеток и клеток-предшественников [9]. Обычно считается, что стволовые клетки / клетки-предшественники печени (LSPC) участвуют в процессе регенерации после массивного некроза ткани печени, вызванного токсическим воздействием или другими причинами, когда пролиферация гепатоцитов ограничена.В литературе клетки с характеристиками LSPC также называются печеночными стволовыми клетками / клетками-предшественниками (HSPC), клетками-предшественниками печени (LPC) или клетками-предшественниками печени (HPC). LSPC находятся в протоках и каналах Геринга. Хотя их роль в регенерации печени неясна, LSPCs считаются привлекательным исходным материалом для клеточной терапии заболеваний печени и тканевой инженерии печени [16–18].
Печеночные трабекулы расположены в дольках, где трабекулы расходятся от центра, занятого центральной веной, к периферии дольки.Дольки разделены перегородками из соединительной ткани, которые у человека очень тонкие. Каждая долька окружена шестью соседними дольками. Области, где встречаются края прямоугольных граней трех долек, образуют так называемые портальные области, содержащие воротную вену, печеночную артерию и желчный проток. Кровь течет из ветвей воротной вены через синусоиды, где смешивается с кровью из ветвей печеночной артерии. Эта смесь стекает через синусоиды в центральную вену и далее в концевые ветви печеночной вены.Собрав кровь из ее ветвей, печеночная вена переходит в нижнюю полую вену. Метаболизм и другие свойства гепатоцитов зависят от их положения на порто-центральной оси дольки [19]. Нормальная ткань печени содержит относительно небольшое количество внеклеточного матрикса, сосредоточенного в основном во внешней соединительнотканной капсуле органа.
3. Решающая роль пролиферации и гипертрофии гепатоцитов в регенерации печени после частичной гепатэктомии
Печень обладает замечательной способностью восстанавливать свою массу после травмы.Восемьдесят пять лет назад Хиггинс и Андерсон [20] первыми продемонстрировали, что после удаления двух третей печени крысы орган восстанавливает свою первоначальную массу, и на этом этапе возобновление роста останавливается. Этот результат неоднократно подтверждался в экспериментах на лабораторных грызунах [21]. В исследованиях на крысах и мышах восстановление массы органа происходило за счет компенсаторной гипертрофии и гиперплазии гепатоцитов в интактных долях, в то время как удаленные доли и сегменты не восстанавливались. Печень грызунов состоит из пяти долей, три из которых можно легко удалить без значительного повреждения двух других.Оставшиеся две доли увеличиваются в размерах и восстанавливают массу органа. У мышей и крыс это занимает 5–7 дней. В случае частичной гепатэктомии функциональная регенерация не сопровождается полной анатомической регенерацией, что позволяет предположить, что регенерация печени, вызванная удалением ее части, обусловлена функциональным нарушением. Важно отметить, что регенерация органов, происходящая после трансплантации печени от живого донора, у людей, по-видимому, идет по аналогичному пути. Действительно, после операции обе части донорской печени (оставшаяся в теле донора и трансплантированная) растут, восстанавливая нормальный размер органа для обслуживания обоих людей [22].
Регенеративный ответ на частичную гепатэктомию включает множество скоординированных событий, происходящих на молекулярном, клеточном и тканевом уровнях. У мышей и крыс удаление трех долей печени приводит к немедленным изменениям паттерна экспрессии генов гепатоцитов, активации множества факторов транскрипции и рецепторов и секреции ряда сигнальных молекул, способствующих росту, в паренхиму печени и кровообращение [23, 24]. По-видимому, регенерация печени после частичной гепатэктомии является результатом пролиферации и гипертрофии гепатоцитов, но не включает пролиферацию и гепатогенную дифференцировку LSPC [21, 23].Регенерация печени сочетает в себе гипертрофию и гиперплазию гепатоцитов. Гипертрофия гепатоцитов начинается в течение нескольких часов после частичной гепатэктомии и сопровождается гиперплазией гепатоцитов. Полное функциональное восстановление после травмы должно включать восстановление всех функций нормальной печени, включая контроль уровня сахара в крови, производство альбумина, факторов свертывания крови и других жизненно важных белков, секрецию желчи и нейтрализацию ядовитых веществ. У грызунов время, необходимое для функционального восстановления, зависит от условий эксперимента.У людей к числу факторов, влияющих на время восстановления, больше всего относятся степень повреждения печени, заболевания паренхимы печени, возраст и портальное давление [25–27].
В моделях крыс и мышей синтез ДНК начинается через 12–16 часов после частичной гепатэктомии и достигает максимума через 24–48 часов [21]. Первоначальная масса печени восстанавливается примерно через 3–7 дней. На этом этапе гистология регенерированной ткани печени все еще сильно отличается от нормальной, замедляется размножение гепатоцитов и начинается образование новых кровеносных сосудов [21].Клетки Ито секретируют бета-тромбоцитарный фактор роста ( β -PDGFR), тем самым способствуя остановке пролиферации гепатоцитов [28]. Нормальная гистология и функции печени восстанавливаются в течение 8–10 дней.
Относительный вклад пролиферации и гипертрофии гепатоцитов в восстановление размера печени после частичной гепатэктомии широко изучался. Если бы не было гипертрофии, потребовалось бы около 1,6 деления среднего гепатоцита, чтобы восстановить размер органа после удаления 70% его массы.Однако гипертрофия гепатоцитов после частичной гепатэктомии хорошо документирована, и хорошо известно, что во взрослой печени много биядерных гепатоцитов, и их количество уменьшается во время посттравматической регенерации [29, 30]. Используя специально разработанный метод определения размера и плоидности клеток, Miyaoka et al. [31] показали, что у мышей клеточная гипертрофия вносит первый вклад в восстановление массы печени. В их экспериментах регенерация после удаления 30% печени была достигнута исключительно за счет гипертрофии без деления клеток, тогда как после 70% гепатэктомии гипертрофия предшествовала пролиферации.Некоторые гепатоциты претерпевали митоз без цитокинеза и оставались биядерными и диплоидными.
Хотя решающая роль пролиферации и полиплоидии гепатоцитов в регенерации, вызванной частичной гепатэктомией, неоднократно подтверждалась, происхождение новых гепатоцитов в регенерирующей печени все еще остается предметом обсуждения. Было высказано предположение, что некоторые из них происходят не от других гепатоцитов, а от LSPC или даже от клеток, передающихся с кровью. Ранние публикации предоставили доказательства, подтверждающие преобладающую роль дифференцированных гепатоцитов, в то время как позже многие исследователи поддержали «гипотезу потоковой печени», утверждая, что постоянная пролиферация LSPCs во время гомеостаза печени и после усиления процесса регенерации после травмы [32].Однако другие исследователи, применяющие улучшенные методы отслеживания генетических клонов клеток, предоставили дополнительные доказательства, подтверждающие решающую роль пролиферации дифференцированных гепатоцитов в гомеостатических условиях и после частичной гепатэктомии. Malato et al. [33] разработали подход, обеспечивающий стабильную экспрессию усиленного желтого флуоресцентного белка в гепатоцитах взрослых мышей, что позволяет отслеживать судьбу клеток в течение определенного периода времени. Этот подход позволил получить экспериментальные данные, доказывающие, что в нормальных гомеостатических условиях взрослые дифференцированные гепатоциты являются источником всех новых гепатоцитов.Более того, большинство (~ 99%) новых гепатоцитов, возникающих во время регенерации, вызванной частичной гепатэктомией, также происходят из дифференцированных гепатоцитов. Следовательно, гепатоциты можно рассматривать как коммитированные унипотентные клетки, воспроизводящие сами себя, как было предложено Zhang et al. [34], в то время как LSPC, по-видимому, не остается места в гомеостатической регенерации печени мышей и ее регенерации после частичной гепатэктомии. Данные об относительном влиянии гепатоцитов и LSPC на регенерацию печени после других типов повреждений печени будут проанализированы в следующем разделе.
Инициирование регенерации после частичной гепатэктомии может быть связано с гемодинамическими изменениями. Хирургическое удаление двух третей печени приводит примерно к трехкратному увеличению портального давления [35]. Это вызывает пролиферацию нескольких типов клеток печени: гепатоцитов, звездчатых клеток, эпителия желчных протоков, макрофагов печени (клеток Купфера) и фенестрированного эндотелия синусоидов сосудов. Гепатоциты — это клетки первого типа, которые начинают синтез ДНК после частичной гепатэктомии. Гепатоциты, оставшиеся на месте после удаления двух третей печени, проходят один цикл синтеза ДНК, в результате чего восстанавливается 60% массы гепатоцитов [36].Фракция гепатоцитов вступает в дополнительные раунды синтеза ДНК, обеспечивая полное восстановление паренхимы печени. В конце периода синтеза ДНК увеличивается количество апоптотических клеток, что отражает коррекцию избыточного регенеративного ответа [37]. Пролиферация гепатоцитов начинается в портальных областях, содержащих воротную вену, печеночную артерию и желчный проток, и продолжается в направлении центральной вены [38, 39]. Последними реплицируются гепатоциты, окружающие центральную вену [40].Разрастание эпителия желчных протоков начинается позже, чем пролиферация гепатоцитов. Он начинается на 2-3-й день и заканчивается на 4-5-й день после частичной гепатэктомии [40]. Время митоза гепатоцитов во время регенерации печени контролируется циркадными часами [41, 42]. Некоторые авторы обнаружили до четырех волн репликации гепатоцитов [42].
По сравнению с другими органами печень содержит повышенное количество резидентных макрофагов (клеток Купфера). Meijer et al. [43] продемонстрировали участие клеток Купфера и мигрирующих макрофагов, происходящих из моноцитов, в регенерации печени после частичной гепатэктомии.Удаление макрофагов, вызванное липосомным клодронатом, привело к замедлению индуцированной пролиферации гепатоцитов и, как следствие, к неспособности печени полностью восстановить свою массу, что свидетельствует о важной роли продуцируемых макрофагами цитокинов и факторов роста в инициации пролиферации гепатоцитов. Лиганды Wnt, вероятно, наиболее важны для включения пролиферации гепатоцитов [44, 45].
Следует подчеркнуть, что микросреда, включая клетки и внеклеточный матрикс, играет существенную роль в поддержании гомеостаза ткани печени и в регенеративном ответе [23, 46].Ding et al. [47] доказали важную роль эндотелия в поддержке пролиферации гепатоцитов и реконструкции сосудистой сети регенерирующей печени.
4. Доказательства за и против существования альтернативных, LSPC-зависимых механизмов регенерации печени
В течение последних трех десятилетий растет число публикаций, описывающих механизмы регенерации печени, активируемые в случае блокады пролиферации гепатоцитов. Здесь мы называем эти механизмы «альтернативными», чтобы подчеркнуть их отличие от «классических» механизмов регенерации, участвующих в возобновлении роста печени после частичной гепатэктомии и включающих компенсаторную гипертрофию и гиперплазию гепатоцитов.Предполагается, что вместо взрослых гепатоцитов альтернативные механизмы регенерации печени включают LSPCs, способные дифференцироваться в гепатоциты, овальные клетки (которые многие исследователи считают LSPC) и, в меньшей степени, Ito (звездчатые) клетки [48].
Исторически овальные клетки крысы были первым описанным типом клеток печени со свойствами стволовых / предшественников. Было показано, что частичная гепатэктомия в сочетании с повреждением ДНК приводит к пролиферации определенных клеток в конечных ветвях желчного дерева [49].Отслеживание происхождения с помощью 3 H-тимидина показало, что эти размножающиеся «овальные клетки» могут подвергаться гепатогенной дифференцировке, таким образом участвуя в пополнении паренхимы печени. С самого начала существовало две конкурирующих точки зрения: одна рассматривала овальные клетки как гепатогенные предшественники, а другая утверждала, что овальные клетки являются дедифференцированными гепатоцитами. Сторонники первой точки зрения утверждали, что овальные клетки служат в качестве аварийного тканевого отсека, обеспечивающего материал для восстановления паренхиматозных клеток печени, и могут рассматриваться как LSPC.Действительно, было продемонстрировано, что у грызунов ряд печеночных ядов, включая дипин, ретрорсин или галактозамин, снижают репликативную активность большинства гепатоцитов и вызывают размножение овальных клеток и возобновление роста паренхимы печени [50, 51]. У людей острое повреждение печени или хроническое заболевание печени, такое как цирроз на поздней стадии, провоцирует активацию клеток-предшественников [52]. Подобно овальным клеткам, клетки-предшественники человека или LSPC находятся в каналах Геринга [53, 54]. Клиническое исследование, проведенное с биопсиями, взятыми у пациентов с массивным некрозом печени, возникшим после частичной трансплантации печени, продемонстрировало решающую роль LSPC в возобновлении роста паренхимы после острой печеночной недостаточности [55].Значительная роль LSPC в регенерации печени получила дальнейшее экспериментальное и клиническое подтверждение. Например, положительные результаты после вызванного ацетаминофеном повреждения печени, по-видимому, напрямую коррелируют с уровнем альфа-фетопротеина в сыворотке [56]. Поскольку альфа-фетопротеин продуцируется в основном резидентными клетками-предшественниками, его повышенная продукция может отражать их активную пролиферацию. Клиническое значение распространения LSPC у пациентов с поздней стадией цирроза затруднено отсутствием восстановления числа гепатоцитов и функционального восстановления [57, 58].В этом случае слабая пролиферация LSPC была приписана репликативному старению гепатоцитов и исчерпанию их пролиферативного потенциала.
В настоящее время концепция LSPC-зависимых механизмов регенерации печени живет почти в своей первоначальной форме, настаивая на том, что LSPC, расположенные в концевых ветвях желчного дерева, становятся основным источником вновь генерируемых паренхимных клеток, когда стандартная гепатоцит-зависимая регенерация нарушается из-за к необратимому повреждению гепатоцитов [59]. И наоборот, в случае неспособности эпителиальных клеток желчных путей пролиферировать гепатоциты становятся источником факультативных стволовых клеток / клеток-предшественников билиарного эпителия.Было заявлено, что LSPCs обладают высоким пролиферативным потенциалом, экспрессируют маркеры эпителиальных клеток желчных протоков и способны дифференцироваться как в гепатоциты, так и в эпителиальные клетки желчных протоков in vitro (обзор [60]). Однако специфических маркеров LSPC пока не обнаружено. Дифференциация LSPC, по-видимому, обусловлена активностью определенных генов и уникальной комбинацией факторов роста. Критически важные гены включают рецептор 5, связанный с G-белком, содержащий богатые лейцином повторы (LGR5) [61, 62] и цитокиновый фактор некроза опухоли, подобный слабому индуктору апоптоза (TWEAK), член фактора некроза опухоли (TNF). надсемейство [63].Кроме того, значительная роль принадлежит известным митогенным факторам, таким как HGF, эпидермальный фактор роста (EGF), TGF- α и факторы роста фибробластов 1 и 2 (FGF1 и FGF2) [64, 65].
В нормальных клетках печени человека, демонстрирующих смешанный потенциал дифференцировки билиарного эпителия / гепатоцитов, обнаруживаются в дистальных частях каналов Геринга, где эпителий желчных протоков находится в непосредственной близости от гепатоцитов [66]. Исследования на крысах и мышах сообщили о трансдифференцировке гепатоцитов в эпителиальные клетки желчных протоков в условиях, препятствующих обновлению желчного эпителия [67–69].Скорее всего, в этом процессе участвуют перипортальные гепатоциты — обособленная субпопуляция гепатоцитов, происходящая из протоковой пластинки [70, 71]. Во время эмбриогенеза и гепатоциты, и холангиоциты происходят от общих клеток-предшественников, известных как гепатобласты. Разделение клонов гепатоцитов и холангиоцитов происходит довольно поздно в эмбриогенезе грызунов и в середине второго триместра у человека [72–74]. Следовательно, трансдифференцировка клеток желчных протоков в гепатоциты и наоборот действительно выглядит вполне естественной, и эти два типа клеток печени, вероятно, будут действовать как условные стволовые клетки / клетки-предшественники друг друга [59, 67].У людей этот механизм регенерации, вероятно, активируется при молниеносной печеночной недостаточности. При фульминантном гепатите гистологическое исследование ткани печени выявляет скопления регенерации паренхимы, состоящие из клеток, демонстрирующих особенности дифференцировки как в гепатоциты, так и в холангиоциты. Кроме того, в большинстве случаев наблюдается обширная пролиферация клеток желчных протоков, которые начинают экспрессировать биомаркеры гепатоцитов [74–76]. Клинические данные, а также результаты модельных экспериментов с лабораторными грызунами позволяют предположить, что при молниеносной печеночной недостаточности гепатоциты регенерируются посредством трансдифференцировки холангиоцитов [59].
Все эти и многие другие результаты, накопленные за эти годы, полностью согласуются с идеей о факультативных LSPC, служащих источником гепатоцитов после определенных повреждений печени. Однако концепция LSPC, играющих существенную роль в регенерации печени, была почти разрушена несколькими статьями, опубликованными в 2014 году. Четыре исследовательские группы применили инновационные методы отслеживания клонов для определения предшественников новых гепатоцитов, возникающих в процессе регенерации, на стандартных моделях повреждения печени мышей.Schaub и соавторы [77], используя отслеживание клонов цитокератина-19 (CK19) для потомства LSPC и высокоэффективное маркирование гепатоцитов, продемонстрировали, что на модели хронического повреждения печени, вызванного специальной регенерацией диеты с дефицитом холина и этионина (CDE), не вовлекали LSPC, и все новые гепатоциты происходили из гепатоцитов. Отслеживание судьбы клеток с использованием звездчатых (Ito) клеток-потомков у мышей Pdgfrb-cre продемонстрировало, что из этих клеток также не появлялись гепатоциты. Это свидетельство согласуется с данными, представленными Yanger и соавторами [78], показывающими, что независимо от вида повреждения предшествующие гепатоциты, а не LSPC или овальные клетки являются основным, если не единственным источником гепатоцитов, вновь генерируемых во время регенерации печени взрослых.Эксперименты проводились с использованием четырех различных режимов повреждения овальных клеток мышей и трех различных методологических подходов. Первый метод, основанный на использовании специфичной для желчных протоков, индуцируемой тамоксифеном cre-линии, не продемонстрировал никаких гепатоцитов, меченных CK19, ни на одной из четырех моделей повреждения. Высокоэффективное мечение дифференцированных гепатоцитов в сочетании с повреждением овальных клеток и последующее количественное определение немеченых гепатоцитов (2-й метод) не выявило признаков LSPC, отличных от гепатоцитов.Наконец, третий метод с использованием аналогов нуклеозидов для отслеживания быстро делящихся клеток не показал быстро пролиферирующих овальных клеток, подвергающихся гепатогенной дифференцировке. Более того, исследования судьбы клеток у мышей с использованием индикаторов желчных клеток Hnf1 β [79] и протокового транскрипционного фактора Sox9 [80] также продемонстрировали незначительное участие овальных клеток / LPSCs в посттравматической регенерации печени. В совокупности четыре описанные публикации устанавливают первичную роль гепатоцитов в гомеостатическом и особенно посттравматическом самообновлении печени и решительно возражают против участия овальных клеток / LSPC в обновлении или пополнении паренхимы печени.Было показано, что гепатоциты способны к репликации даже в случае очень серьезного повреждения печени. Вскоре после этого было показано, что на модели хронического повреждения печени у мышей новые гепатоциты произошли из так называемых гибридных гепатоцитов, субпопуляции перипортальных гепатоцитов, присутствующих в интактной печени и способных к быстрой пролиферации [81]. Гибридные гепатоциты характеризуются низким уровнем экспрессии Sox9 и нормальной экспрессией ядерного фактора гепатоцитов 4 α (HNF4 α ). Они экспрессируют гены, специфичные для гепатоцитов, и некоторые гены, специфичные для холангиоцитов.
Описанные эксперименты по отслеживанию клонов явно изменили ранее принятую модель регенерации печени. Однако есть сомнения относительно обобщения этих выводов. Эксперименты по точной клеточной судьбе были выполнены только на мышах, и пока не ясно, лишены ли другие виды, включая крыс и людей, LSPCs с способностью пополнять гепатоциты in vivo. Кроме того, несмотря на отсутствие доказательств гепатогенной дифференцировки LSPC in vivo, они определенно могут давать начало гепатоцитоподобным клеткам in vitro [48].Исследования в этой области продолжаются, и есть шанс, что даже у мышей будет обнаружена роль овальных клеток / LSPC в регенерации. Недавно были описаны резидентные клетки-предшественники CD45-TER119-CD31-EpCAM-ICAM-1 +, отличные от обычных овальных клеточно-подобных LSPC [82]. Эти клетки впервые были обнаружены у поздних зародышей мышей и постнатальных щенков, достигают пика к 4-й неделе после рождения и сохраняются на протяжении всей жизни. Было показано, что они дифференцируются в зрелые гепатоциты in vitro. После трансплантации они участвуют в репопуляции печени реципиента после частичной гепатэктомии в сочетании с лечением ретрорсином или после лечения онкостатином М.Они также способствуют клеточному обновлению в нормальной здоровой печени мыши, то есть участвуют в регенерации гомеостатических органов.
Некоторые внепеченочные клетки, включая гемопоэтические стволовые клетки (ГСК) и мезенхимальные стволовые клетки (МСК) костного мозга, могут быть индуцированы к дифференцировке в клетки печени in vitro. Существует несколько линий доказательств, предполагающих, что дифференцировка HSC или MSC костного мозга в клетки печеночного происхождения может также происходить in vivo в физиологических условиях и после повреждения печени.HSC и MSC костного мозга могут легко попасть в печень через кровообращение. В эмбриогенезе кроветворная система и печень тесно взаимодействуют [83]. Печень плода является важным источником HSC [84]. Более того, HSC сохраняются в ткани печени на протяжении всей взрослой жизни [85]. Было показано, что HSCs подвергаются гепатогенной дифференцировке и заселяют печень после внутривенной трансплантации [34, 86, 87]. Подобные данные были получены исследовательскими группами, работающими с МСК, другим основным типом стволовых клеток костного мозга [34, 88, 89] (Таблица 1).
| ||||||||||||||||||||||||||||||||||||||||
Было замечено, что овальные клетки взрослой печени экспрессируют Thy-1, поверхностный маркер, обычно используемый вместе с CD34 для специфической идентификации HSC [90].Блокатор пролиферации гепатоцитов 2-ацетиламинофлуорен в сочетании с повреждением печени, индуцирующий пролиферацию овальных клеток у крыс после трансплантации костного мозга между полами, вызвал появление овальных клеток, несущих трансплантированный генетический маркер костного мозга, Y-хромосому [90]. В аналогичном исследовании самки мышей после кросс-половой трансплантации костного мозга получили более 2% гепатоцитов с Y-хромосомой [91]. Интересно, что относительно высокие уровни репопуляции печени донорскими гепатоцитами в цитируемых отчетах были приписаны блокированию пролиферации резидентных гепатоцитов с помощью облучения [92].Сообщалось, что у мышей HSC представляют собой основной, если не уникальный тип репопулирующих печень клеток костного мозга [86]. Таким образом, данные экспериментов на животных предполагают возможность участия HSC и, возможно, других клеток костного мозга в регенерации печени. Степень их участия в жизни людей остается неясной. Однако косвенные данные свидетельствуют о том, что это может иметь место и играть роль в регенерации [14, 91]. Интерпретация экспериментальных и клинических данных в этой области затруднена из-за сложности задействованных клеточных механизмов.Некоторым исследователям не удалось найти доказательств участия клеток костного мозга в генерации гепатоцитов в процессе регенерации печени мышей после частичной гепатэктомии [93]. Гепатоциты, полученные из костного мозга, обычно составляют менее 1% от общей популяции гепатоцитов трансплантированной печени человека, а иногда вообще не присутствуют (данные приведены в [23]).
Установлено, что только часть HSC участвует в пополнении гепатоцитов. Первоначально было показано, что на модели мышей с дефицитом FAH — / — (фумарилацетоацетатгидролаза) (c-Lin-Sca1 +) — HSC, но не c-Kit-Sca1- или клетки, положительные по клону (Lin +), дифференцировались в гепатоцитоподобные клетки [86].Другие исследовательские группы либо подтвердили эти результаты, либо определили различные фенотипы HSC [94, 95]. В недавней публикации Oh et al. [96] сообщили о выделении энтодермальных клеток-предшественников из субпопуляции Lin-Sca1 + клеток мышиных HSC. Только эти энтодермальные клетки-предшественники участвовали в репопуляции печени гепатоцитами в двух моделях повреждения печени. Это открытие согласуется с предположением, что костный мозг содержит мультипотентные предшественники паренхиматозных клеток различных тканей [97].
Было высказано предположение, что гепатоциты костного мозга образуются путем слияния HSC с гепатоцитами печени, а не путем прямой трансдифференцировки HSC в гепатоциты [98, 99]. Хотя эта гипотеза оспаривается [94], она все еще находит поддержку в некоторых недавних публикациях. Используя мышей с дефицитом фумарилацетоацетатгидролазы (FAH — / -) в качестве модели печеночной недостаточности, Li et al. [100] продемонстрировали, что гепатоциты костного мозга могут быть образованы путем слияния полученных из BM миеломоноцитов CD11b + F4 / 80 + с резидентными FAH — / — гепатоцитами.
Как предположил Прокоп [12], МСК костного мозга обеспечивают пул стволовых клеток для негематопоэтических тканей, включая ткань печени. Подобно HSC, МСК представляют собой очень гетерогенную популяцию клеток. Было показано, что только крошечная фракция МСК костного мозга, так называемые многолинейно дифференцирующиеся стрессоустойчивые (Muse) клетки, участвуют в регенерации печени [101]. После инъекции меченных зеленым флуоресцентным белком клеток Muse из костного мозга человека в частично гепатэктомированных мышей с иммунодефицитом иммуногистохимия, гибридизация in situ и видоспецифическая полимеразная цепная реакция выявили их интеграцию в ткань печени на ранней стадии регенерации [102].Интегрированные человеческие клетки экспрессировали маркеры предшественников печени и впоследствии дифференцировались в следующие типы клеток печени: гепатоциты (≈74,3% GFP-положительных интегрированных клеток Muse), холангиоциты (≈17,7%), синусоидальные эндотелиальные клетки (≈2,0%) и клетки Купфера. (≈6,0%). Эти данные коррелировали с результатами генотипирования 20 трансплантатов печени человека по коротким тандемным повторам, которые выявили наличие реципиентных или химерных генотипов в гепатоцитах (6 из 17, 35,3%), синусоидальных клетках (18 из 18, 100%), холангиоцитах ( 15 из 17, 88.2%) и клетки перипортальных областей (7 из 8, 87,5%) [102].
Другие исследовательские группы охарактеризовали различные субпопуляции культур МСК костного мозга, способные к многолинейной дифференцировке, включая так называемые мультипотентные взрослые клетки-предшественники [103] и очень маленькие эмбрионоподобные стволовые клетки [104]. Еще разные субпопуляции, способные дифференцироваться в клетки печени и другие производные энтодермы, были обнаружены в МСК, выделенных из других источников.
Примечательно, что клетки костного мозга участвуют в регенерации эндотелия печени.Эндотелиальные клетки костномозгового происхождения могут составлять более 20% восполненных эндотелиальных клеток печени после трансплантации печени у человека или после частичной гепатэктомии у грызунов [93].
Данные об участии переносимых кровью клеток костного мозга в регенерации паренхимы печени имеют первостепенное значение для развития клеток и методов клеточной терапии заболеваний печени.
6. Клеточные технологии в гепатологии
Большинство традиционных подходов современной медицины помогают облегчить симптомы заболевания путем устранения биохимических или анатомических аномалий или замены отсутствующих и поврежденных частей протезами.Они не пытаются мобилизовать лечебные возможности собственного тела пациента. Регенеративная медицина — быстро развивающаяся дисциплина, специально занимающаяся этой проблемой [105]. Регенеративная медицина также пытается напрямую заселить поврежденные ткани трансплантированными клетками и заменить неисправные органы с помощью методов тканевой / органной инженерии. Применение методов регенеративной медицины в гепатологии обещает дать положительные результаты, превосходящие результаты, обеспечиваемые другими терапевтическими подходами [106, 107].
В настоящее время большинство технологий регенеративной медицины основано на использовании живых клеток. Другие тактики, такие как стимуляция регенерации лекарствами [108] или использование компонентов клеточного секретома вместо целых целых клеток [109], только появляются. Существует два основных подхода к клиническому применению клеточных технологий в гепатологии: клеточная терапия и тканевая / органная инженерия. Оба они находятся на ранних стадиях своего развития, и необходимы дополнительные доклинические и клинические исследования, прежде чем будут доступны эффективные и безопасные методы лечения.Кроме того, современная регенеративная гепатология лишь частично опирается на достижения в фундаментальных исследованиях регенерации печени. Однако огромные вложения усилий и ресурсов, происходящие в настоящее время, весьма вероятны.
Клеточная терапия включает трансплантацию суспензий клеток различными путями, чаще всего внутривенно. Это относительно недорогой метод, который в некоторых случаях может дать отличные результаты. Обоснование клеточной терапии заболеваний печени двоякое.Во-первых, некоторые клетки, такие как аутологичные гепатоциты, могут напрямую заселять поврежденную ткань печени. Также возможно, что определенные типы клеток могут трансдифференцироваться в клетки печени после перемещения в ткань печени. Во-вторых, трансплантированные клетки производят положительные эффекты, такие как стимуляция регенерации тканей, за счет паракринной секреции сбалансированных комбинаций цитокинов, хемокинов, факторов роста и некодирующих РНК, влияющих на резидентных предшественников, внепеченочные стволовые клетки и другие мишени (рисунок 2).
Тканевая / органная инженерия включает сборку ex vivo ткани печени, доли печени или всей печени с последующей ортотопической имплантацией. Тканевая / органная инженерия может включать переходную стадию гетеротопической имплантации ткани и ее роста in vivo. Инженерия ткани / органа печени с использованием аутологичных или аллогенных клеток может решить проблему нехватки донорской печени. Разработка всей печени человека или ее доли — не только очень сложное, но и очень дорогое мероприятие.Последнее особенно верно в случае создания защищенной от иммунных конфликтов печени из аутологичных клеток. К счастью, недавние научные разработки предлагают ключи к разгадке масштабов процесса производства тканей / органов за счет использования иммунологически нейтральных аллогенных клеток. В этом случае органы, предназначенные для трансплантации, могут быть изготовлены с использованием относительно дешевых крупномасштабных промышленных технологий.
6.1. Клеточная терапия гепатоцитами
Поскольку компенсаторная гиперплазия дифференцированных взрослых гепатоцитов является основным путем регенерации печени после травмы, репопуляция поврежденной ткани печени трансплантированными гепатоцитами или их потомством выглядит логичным.Трансплантация первичных (некультивируемых) гепатоцитов через воротную вену оказалась эффективной на некоторых моделях заболеваний печени животных (обзор см. В [110, 111]) и лечении метаболических и генетических нарушений печени человека, таких как гепатолентикулярная дегенерация (болезнь Вильсона-Коновалова), тирозинемия, Криглер– Синдром Наджара, нарушения цикла мочевины, тяжелая дислипидемия и другие (см. Обзоры в [112, 113]). Хотя считается, что хоутинг в ткани печени и участие в ее репопуляции являются основным механизмом, лежащим в основе эффектов первичной трансплантации гепатоцитов, также задействована стимуляция регенерации ткани за счет паракринного действия.К сожалению, накопленного клинического опыта недостаточно для определения оптимального количества инфузионных клеток, количества трансплантаций и интервалов между трансплантациями, а также степени и продолжительности необходимой иммуносупрессии. Более того, трансплантация первичных гепатоцитов человека практически не дала эффекта при острой печеночной недостаточности или хроническом заболевании печени [114, 115]. Из-за острой нехватки донорских органов гепатоциты человека, предназначенные для клеточной терапии, получают из печени, непригодной для трансплантации органов и, соответственно, худшей по качеству.По этой причине неопределенная эффективность или недостаточная эффективность первичной трансплантации гепатоцитов человека, вероятно, связана с низким качеством инфузированных клеток.
Были попытки использовать первичные гепатоциты плода или клеточные линии гепатомы вместо первичных гепатоцитов взрослых [114, 115]. Клеточная терапия с использованием таких первичных гепатоцитоподобных клеток показала ограниченную эффективность, вероятно, из-за ограниченной функциональности незрелых трансплантированных клеток. Кроме того, плодный материал может вызывать образование тератом, а трансформированные клеточные линии обладают онкогенным потенциалом.Ряд исследовательских групп сообщили об эффективном приживлении ксеногенных гепатоцитов в ткани печени и предложили трансплантацию гепатоцитов свиней человеку [116, 117]. Однако из соображений безопасности этому варианту будет сложно преодолеть нормативные препятствия.
Несмотря на многие трудности, предпринимаются дальнейшие попытки улучшить методы ex vivo экспансии человеческих гепатоцитов, выделенных из печени взрослых, при сохранении их метаболических функций, свойств приживления и потенциала пролиферации in vivo.Достигнут прогресс в изобретении подходов к извлечению жизнеспособных гепатоцитов из трупной [118] и стеатотической [119] печени путем добавления антиоксидантов и других полезных добавок к перфузионному раствору. Недавно Леви и др. [120] сообщили об успешной экспансии первичных гепатоцитов человека, зависимой от онкостатина М, за счет индукции низкой экспрессии генов вируса папилломы человека E6 и E7 в сочетании с ингибированием перехода эпителия в мезенхиму. Huch et al. [121] показали, что бипотентные клетки-предшественники взрослых желчных протоков из печени человека могут быть размножены как эпителиальные органоиды in vitro, а затем дифференцированы в функциональные гепатоциты in vitro и in vivo.
К счастью, прогресс в клеточной биологии открывает новые возможности и альтернативные способы создания гепатоцитов человека, включая аллогенные гепатоциты, для трансплантации без иммуносупрессии. Репрограммирование соматических клеток в индуцированные плюрипотентные стволовые клетки (ИПСК), введенное группой Яманака [122], предоставило уникальную возможность получить аутологичные плюрипотентные клетки для клеточной терапии и тканевой инженерии. Эти клетки представляют собой плюрипотентные клетки, подобные эмбриональным стволовым клеткам, и могут быть преобразованы в любой дифференцированный тип клеток с использованием методов, аналогичных методам, разработанным для эмбриональных стволовых клеток.Сообщения об успешной гепатогенной дифференцировке ИПСК человека, проведенной в три или четыре этапа [123–125], были опубликованы вскоре после внедрения технологии индукции плюрипотентности. Производство гепатоцитов на стадии ИПСК успешно увеличено [126, 127]. Способы крупномасштабного производства иммунологически нейтральных аллогенных гепатоцитов человека из ИПСК будут описаны более подробно далее в «Печеночной органной / тканевой инженерии».
Гепатогенная дифференцировка ИПСК in vitro дает только частично дифференцированные гепатоцитоподобные клетки.Чтобы пройти полную дифференцировку, им нужна правильная микросреда, которую трудно воспроизвести ex vivo. Однако трансплантированные клетки, вероятно, получат все необходимые стимулы дифференцировки из окружающей среды после возвращения в ткань печени.
6.2. Клеточная терапия стволовыми клетками / клетками-предшественниками печени
После гепатоцитов LSPC являются наиболее удобными кандидатами среди всех типов клеток печени для восстановления паренхимы органа и тканевой инженерии. В самом деле, способность LSPCs дифференцироваться в гепатоциты и клетки желчных протоков in vitro хорошо документирована (см. Обзор [60]).Соответственно, вероятно, что после трансплантации часть LSPC будет подвергаться хомингу в печени реципиента и дифференцироваться в гепатоциты и клетки желчных протоков. Сообщалось об успешной экспансии in vitro LSPC мыши [61] или крысы [128], их приживлении в ткани печени и гепатогенной дифференцировке после трансплантации. Также описано эффективное распространение LSPC человека в культуре [62]. Для выяснения лечебного потенциала LSPC необходимы дальнейшие исследования.
Ответ ткани печени на различные стимулы и повреждение включает в себя согласованную реакцию всех типов резидентных клеток.Эффективность методов клеточной терапии в гепатологии будет улучшаться параллельно с увеличением наших знаний о сложности взаимодействия различных отделов ткани печени.
6.3. Клеточная терапия гемопоэтическими стволовыми клетками
Печень является местом нахождения клеток внепеченочного происхождения, таких как HSC, стромальные клетки и иммунные клетки, что предполагает роль переносимых кровью клеток, включая стволовые, в регенерации печени. Следующие два раздела посвящены клеточной терапии с помощью HSC и MSC.
Научная основа клеточной терапии заболеваний печени с трансплантацией HSC двояка. Во-первых, ГСК, происходящие из костного мозга с кровью, предположительно участвуют в регенерации печени [8, 86, 129]. Во-вторых, на животных моделях нарушения функции печени инфузия HSC улучшает результаты [34, 86, 87]. Терапия макрофагами, дифференцирующимися от HSC, улучшает исходы фиброза печени у мышей [130]. Было установлено, что трансплантация гемопоэтических клеток [131] или их производных, таких как макрофаги (проанализировано в [132]), также облегчает симптомы заболеваний печени человека.Степень замещения потерянных или поврежденных гепатоцитов при дифференцировке HSC не превышает 1-2% вновь возникших гепатоцитов [129], что позволяет предположить, что регенерация ткани печени и репопуляция после инфузии HSC в основном индуцируются паракринным действием трансплантированных клеток. Однако возможно, что доля новых гепатоцитов, дифференцирующихся от HSCs, может быть увеличена за счет использования субпопуляции плюрипотентных клеток, присутствующих в популяции HSC костного мозга [94–97]. Однако из-за опасности образования тератомы необходимы дополнительные исследования на животных, прежде чем будут разрешены тесты на людях.
Трансплантация HSC, особенно повторные процедуры, может вызвать неблагоприятные иммунологические реакции и может потребовать иммуносупрессивной терапии. Побочных эффектов можно избежать, используя иммунологически нейтральные аллогенные клетки человека из пуповинной крови или полученные из ИПСК, как описано в Liver Engineering.
6.4. Клеточная терапия с использованием мезенхимальных стволовых клеток
Основание для терапии на основе МСК сходно с основанием для терапии на основе HSC. Прокоп [12] первым предположил, что МСК костного мозга содержат субпопуляции клеток, участвующих в регенерации паренхимы различных органов, в том числе печени.Позже несколько исследовательских групп сообщили о выделении клеток, способных к многолинейной дифференцировке, из культур МСК костного мозга, а также культур МСК, выделенных из других тканей. Клетки, охарактеризованные каждой группой, показали несколько уникальных свойств и получили разные названия. Следующие типы субпопуляций МСК привлекли наибольшее внимание научного сообщества: «мультипотентные взрослые клетки-предшественники» (MAPC) [103], «очень маленькие эмбрионоподобные стволовые клетки» (клетки VSEL) [104] и «стресс, дифференцирующий несколько линий. -прочные »(Muse) клетки [101].Клетки каждого из этих типов могут быть индуцированы к дифференцировке не только в мезодерму, но также и в производные эктодермы и энтодермы, и они способны оседать в паренхиме внутренних органов. Существующие экспериментальные и клинические данные демонстрируют значительное участие Muse клеток в репопуляции печени после травмы [101, 102]. В частности, у мышей с ослабленным иммунитетом трансплантированные клетки Muse человека интегрируются в ткань печени и дифференцируются in vivo в гепатоциты, холангиоциты, синусоидальные эндотелиальные клетки и клетки Купфера, продуцирующие человеческие белки [102].
Помимо непосредственного участия в репопуляции поврежденной ткани печени, МСК также способны стимулировать регенерацию за счет паракринной секреции (обзор [133, 134]). В соответствии со всем, что написано выше в этом разделе, трансплантация МСК вызывает облегчение на животных моделях патологии печени [135, 136] и у пациентов с проблемами печени [137, 138]. МСК могут вызывать полезные изменения в небольших популяциях клеток печени. Например, на модели фиброза печени мышей МСК способны вызывать сдвиг фенотипа от профиброза к разрешению в макрофагах печени, что является ключевым ранним событием, способствующим реверсии фиброза [139].
МСКобладают рядом дополнительных полезных свойств, включая низкую иммуногенность, сродство к участкам повреждения и способность модулировать иммунные ответы [134, 140]. Также они дешевы в производстве. Уникальные свойства МСК делают их удобным клеточным материалом для разработки клеточной терапии, включая клеточную терапию заболеваний печени. По этой причине большая часть доклинических и клинических исследований в области клеточной терапии многих заболеваний человека в настоящее время проводится с использованием МСК.
7. Конструирование органов / тканей печени
Ортотопическая трансплантация аллогенной печени или ее части часто является единственным вариантом спасения жизни пациентов с печеночной недостаточностью. Соответственно, срочно востребованы недорогие и бесконфликтные с точки зрения иммунитета донорские заменители печени. Есть шанс, что проблема производства суррогатной печени может быть решена с помощью тканевой инженерии, инновационной стратегии, объединяющей живые клетки с различными природными и искусственными материалами для создания трансплантируемых функционирующих аналогов ткани или органа (биоискусственные трансплантаты).Хотя для адекватного ответа на проблемы трансплантации органов необходимо гораздо больше исследований, биоинженерная ткань печени уже используется в исследованиях метаболизма лекарств [141].
К настоящему времени экспериментально проверены два подхода к инженерии печени [142]. Первый включает репопуляцию децеллюляризованного каркаса стромы печени гепатоцитами, стволовыми клетками, эндотелиоцитами и другими типами клеток. Децеллюляризация может осуществляться путем перфузии органа через его кровеносные сосуды растворами, содержащими ферменты и детергенты [143].Он предоставляет каркас внеклеточного матрикса, свободный от клеток и иммуногенных белков, детально воспроизводя архитектуру трехмерного каркаса стромы печени, предлагая поддержку репопуляции клеток и размещая растущие кровеносные сосуды и желчные протоки в их правильных положениях. Полученный каркас можно рецеллюляризовать в биореакторе. В экспериментах на животных репопуляция каркаса может быть проведена in vivo после гетеротопической трансплантации. Печень крыс, приготовленная с использованием технологии децеллюляризации / рецеллюляризации, была успешно трансплантирована крысам [144–146], в то время как децеллюляризованный каркас свиной печени, населенный клетками человека, был трансплантирован свинье [147].Однако в этих и всех последующих публикациях сообщалось о выживаемости трансплантированной печени менее недели, что подчеркивает необходимость дальнейших технологических усовершенствований. Одним из полезных усовершенствований описанной методики может быть микрокапсулирование гепатоцитов перед их приживлением в тканевые конструкции, способствующее длительному выживанию функционально интактных клеток [148].
Биопринтинг — это второй экспериментально протестированный подход тканевой инженерии печени. Биопечать сочетает в себе технологию 3D-печати и биологические материалы, включая элементы внеклеточного матрикса и живые клетки, для формирования сложных трехмерных структур тканей и органов, включая сосудистую сеть.В настоящее время биопринтинг уже доставляет метаболически активные трехмерные фрагменты ткани печени, которые могут храниться в биореакторе живыми и функционировать в течение нескольких дней [149, 150].
Ортотопическая трансплантация рецеллюляризованного трансплантата печени пациенту с печеночной недостаточностью еще не проводилась, и до начала клинических испытаний необходимо решить ряд проблем. Помимо биотехнологических проблем, необходимо решить чисто медицинские проблемы, такие как отсутствие подходящей хирургической техники ортотопической трансплантации модифицированной печени.Выбор клеточного материала для инженерии печени также имеет большое значение. Как уже указывалось, аутологичные гепатоциты, взятые у пациентов с циррозом печени, могут быть низкого качества. Аллогенные гепатоциты трудно получить в больших количествах, и обычно они иммунологически несовместимы с реципиентом трансплантата, которому требуется пожизненная иммуносупрессия. Кроме того, изготовление органов под каждого конкретного пациента — очень дорогостоящая и длительная процедура. Последние достижения в области фундаментальных исследований предполагают возможность относительно дешевого, по существу, промышленного производства органов для трансплантации без иммуносупрессии с использованием иммунологически согласованных аллогенных клеток.Подход основан на технологиях индукции плюрипотентности и представлении о статистической распространенности определенных комбинаций генов человеческого лейкоцитарного антигена (HLA) в популяции.
Бессмертные линии ИПСК можно получить из большинства типов дифференцированных клеток, включая такие легкодоступные клетки, как фибробласты кожи и фракцию CD34 переносимых кровью клеток. Подобно эмбриональным стволовым клеткам, полученные плюрипотентные клетки можно дифференцировать практически в любой тип клеток, включая гепатоциты и другие клетки печени [107, 151].Способы получения гепатоцитов из ИПСК включают несколько этапов, воспроизводящих стадии дифференцировки гепатоцитов в онтогенезе. Были разработаны трех- и четырехэтапные протоколы, каждый из которых регулируется определенным набором факторов роста и транскрипции. Четырехэтапный протокол дифференцировки был исторически первым и включал этапы дифференцировки ИПСК в дефинитивную энтодерму, спецификацию гепатоцитов, экспансию гепатобластов и созревание гепатоцитов [123]. Трехэтапные протоколы включают последовательную дифференцировку ИПСК на дефинитивную энтодерму, незрелые гепатоциты и зрелые гепатоциты [124, 125].Гепатоциты, полученные из ИПСК, имеют метаболические и функциональные характеристики, аналогичные первичным гепатоцитам человека [124, 152], и сохраняют основные свойства гепатоцитов в биоискусственных микросредах печени [153].
Кроме гепатоцитов, ткань печени содержит другие клетки, необходимые для обеспечения ее функций. Все они могут отличаться от iPSC, а некоторые из них можно отличить от LSPC. Идеальный состав клеточного коктейля для популяции каркасов печени или биопечати неизвестен.Есть еще много проблем, которые необходимо решить, прежде чем трансплантация сконструированных конструкций печени может перейти в фазу клинических испытаний, и требуется гораздо больше доклинических исследований [154].
Индивидуальная инженерия печени для конкретного пациента будет очень дорогостоящей, и крупномасштабное производство органов из аллогенных клеток — единственный вариант, реальный с экономической точки зрения. Иммунологическая особенность отдельных людей определяется двумя коэкспрессируемыми гаплотипами, каждый из которых представлен генами HLA-A, HLA-B и HLA-DR.Важно отметить, что есть статистически предпочтительные паттерны, потому что комбинации этих трех генов оказались не случайными. Было подсчитано, что можно выбрать ограниченное число HLA-гомозиготных доноров со статистически преобладающими паттернами генов HLA, соответствующими большинству гетерозиготных потенциальных реципиентов трансплантатов клеток и органов [155]. Согласно расчетам, 30 гомозиготных линий ИПСК, полученных от доноров, выбранных из 15 000 японцев, соответствуют 82,2% потенциальных японских реципиентов, в то время как 50 линий от доноров, выбранных из 24 000 человек, предоставляют иммуносовместимый материал 90.7% получателей. Этот вывод дал идею создания национальных или глобальных линейных реестров ИПСК [156–158]. Эти реестры могут предоставить клеточный материал для клеточной терапии без иммуносупрессии и тканевой инженерии. Клетки можно производить в очень больших количествах, что делает их намного дешевле.
Эмбриональные стволовые клетки и ИПСК представляют собой недифференцированные плюрипотентные клетки, приспособленные для преобразования в различные дифференцированные клетки. Как указано в Трансплантации МСК, культуры МСК in vitro содержат другой вид плюрипотентных клеток, которые можно дифференцировать в гепатоциты.Поскольку МСК являются клетками мезодермального происхождения, а гепатоциты принадлежат к энтодермальному клону, гепатогенная дифференцировка субпопуляции МСК получила название «трансдифференцировка». Пока неясно, может ли трансдифференцировка МСК давать полностью функциональные гепатоциты, но исследования в этой области продолжаются.
Фенотип и поведение клеток сильно зависят от разнообразных биохимических сигналов, поступления кислорода, механической нагрузки, топографии ближайшего окружения и многих других параметров.Оптимальные значения этих параметров достижимы в полной мере только в здоровом организме. Полная гепатогенная дифференцировка ИПСК или других клеток и нормальная функциональная активность дифференцированных клеток может быть достигнута только после ортотопической трансплантации биоинженерной печени и установления ее регулярных связей с организмом реципиента через кровоснабжение, лимфу, иннервацию и т. Д. В настоящее время еще не ясно, какие проверки качества следует проводить на сконструированной печени перед трансплантацией.
8. Текущие клинические испытания клеточной терапии заболеваний печени
Клинические испытания нескольких протоколов клеточной терапии, зарегистрированных на сайте «https://www.clinicaltrials.gov/» и направленных на лечение заболеваний печени, продолжаются, хотя они и проводятся. составляют лишь небольшую часть всех текущих клинических испытаний методов клеточной терапии. Еще в 2014 году Мур и соавторы [159] первыми рассмотрели результаты 33 исследований, отобранных по следующим относительно строгим критериям: среднее количество пациентов — 10 и период наблюдения не менее 6 месяцев.Это был первый обзор по данной теме. 16 августа 2016 г. по запросу «Печеночная недостаточность И Клеточная терапия» было выявлено 9 зарегистрированных исследований (этап I / II), а по запросу «Клеточная терапия» — 794 исследования (этапы I / II или III). Интересно, что запрос «Печеночная недостаточность И трансплантация гепатоцитов» показал только 3 испытания, из которых 1 было отозвано, а 2 приостановлены, что указывает на проблемы с получением достаточного количества клеток для трансплантации или неудовлетворительную эффективность. Обзор Мура и результаты нашего поиска показывают, что регулярные клинические испытания клеточной терапии в гепатологии находятся на начальной стадии.Его прогресс во многом зависит от результатов текущих испытаний.
Однако уже ясно, что методы клеточной терапии могут быть усовершенствованы [160, 161]. Стратегии оптимизации могут включать поиск наиболее удобного источника клеточного материала, сравнение первичных и культивируемых клеток с клеточными линиями, комбинирование различных типов клеток, экспериментирование с условиями культивирования: количество пассажей, переменная подача кислорода, использование генетически модифицированных клеток, способных индуцировать фактор роста. высвобождение или усиление дифференцировки in vivo, проба различных путей введения, поиск оптимального количества клеток, оптимального времени и количества трансплантаций, усиление приживления трансплантированных клеток в ткани печени и их пролиферация после приживления.
9. Заключение
Данные, рассмотренные в этом обзоре, демонстрируют, что печень взрослых млекопитающих обладает значительной способностью к гомеостатической регенерации и регенерации, вызванной повреждением. Клеточные механизмы регенерации печени отличаются от таковых в других органах тем, что восстановление массы паренхимы печени достигается за счет компенсаторной гипертрофии и гиперплазии дифференцированных паренхиматозных клеток, гепатоцитов. Фактически, гепатоциты (или их часть) можно рассматривать как бипотентные клетки-предшественники, способные к дедифференцировке, быстрой пролиферации и повторной дифференцировке в новые гепатоциты и холангиоциты.В большинстве внутренних органов резидентные стволовые клетки / клетки-предшественники играют важную роль в гомеостатической регенерации паренхимы и в восстановлении повреждений, вызванных болезнью или травмой. В ткани печени их участие в гомеостатической регенерации и регенерации, вызванной повреждением, все еще остается предметом дискуссий. Доказано участие переносимых кровью стволовых клеток костного мозга в восполнении паренхимы печени, хотя степень их участия ограничена. Экспериментальные исследования регенерации печени служат ценным руководством для ведения пациентов с печеночной недостаточностью и для разработки новых подходов, включая методы регенеративной медицины, то есть клеточную терапию и тканевую инженерию.
Клеточная терапия гепатоцитами направлена на восполнение утраченных паренхиматозных клеток. Пересаженные гепатоциты также вызывают паракринные эффекты. Трансплантация HSC или MSC способствует регенерации многих тканей по всему телу, предполагая, что паракринные сигналы, производимые трансплантированными клетками, аналогичным образом активируют стволовые и определенные дифференцированные клетки различных тканей и органов. На клеточном уровне эти паракринные сигналы могут вызывать пролиферацию стволовых клеток, регулировать переход от мезенхимы к эпителию, подавлять дифференцировку в фиброгенные миофибробласты и стимулировать переход макрофагов к противовоспалительному фенотипу.Кроме того, редкие плюрипотентные клетки, присутствующие в культурах HSC и MSC, могут после трансплантации дифференцироваться в паренхимные клетки различных тканей. Все эти эффекты трансплантации клеток были продемонстрированы на моделях повреждения печени животных.
Перспективы трансплантации модифицированной ткани печени, модифицированной доли печени или целого сконструированного органа кажутся хорошими. Разрабатываются различные подходы к тканевой инженерии печени и внедряются новаторские методы, но пока не ясно, когда могут начаться клинические испытания.
В заключение следует еще раз подчеркнуть, что млекопитающие, в том числе человек, обладают достаточно эффективными механизмами регенерации печени, которые активируются спонтанно и могут быть дополнительно стимулированы клеточной терапией. В случае серьезного повреждения трансплантация печени — лучший вариант. Создание трансплантируемой печени или ее части — огромная проблема, но экспериментальные исследования показывают, что это, вероятно, выполнимо.
Конкурирующие интересы
У авторов нет конфликта интересов, о котором следует раскрывать.
Благодарности
Работа поддержана Российским научным фондом (грант № 14-15-00648).
Заболевание печени: часто задаваемые вопросы
Каковы некоторые симптомы заболевания печени?
Самое важное, что нужно знать о заболевании печени, — это то, что до 50 процентов людей с основным заболеванием печени не имеют симптомов. Наиболее частые симптомы очень неспецифичны и включают усталость или чрезмерную утомляемость, отсутствие движения и иногда зуд.Более заметными признаками заболевания печени являются желтуха или пожелтение глаз и кожи, темная моча, очень бледный или светлый стул, кровотечение из желудочно-кишечного тракта, спутанность сознания и задержка жидкости в брюшной полости или животе.
Какое количество алкоголя считается опасным для печени?
Любое количество алкоголя может вызвать повреждение печени. У здорового человека без проблем с печенью общее практическое правило для мужчин и женщин различно:
- Мужчины усваивают алкоголь и могут избавляться от алкоголя более эффективно, чем женщины, из-за размера тела, жировых отложений и определенных ферментов, поэтому им следует ограничиться тремя-четырьмя порциями алкоголя в день.
- Женщинам по тем же причинам следует ограничиться одной-двумя порциями в день.
Пиво и вино не «безопаснее» виски или спиртных напитков. Один напиток определяется как одна рюмка (1 и 1/4 унции) виски или спиртных напитков, один бокал вина на четыре унции или один стакан пива на 12 унций. Если у человека есть основное заболевание печени, такое как гепатит B или C, или предыдущее повреждение от алкоголя или других заболеваний, печень очень чувствительна к любому количеству алкоголя. В таких условиях единственная безопасная доза алкоголя — нулевая.
Я знаю, что алкоголизм повреждает печень. Какие еще токсические вещества могут повредить печень?
Наиболее распространенным агентом, вероятно, является ацетаминофен (тайленол, хотя он содержится во многих безрецептурных препаратах). Это остается самым безопасным лекарством от лихорадки, болей и болей, но его следует принимать только в небольших рекомендуемых количествах. Количества, превышающие рекомендованные, могут привести к повреждению или отказу печени. Передозировка ацетаминофена — частая причина рассмотрения пересадки печени.
Более серьезная проблема возникает у пациентов, которые употребляют алкоголь ежедневно, особенно более двух порций.В таких ситуациях обычные дозы тайленола три-четыре раза в день могут вызвать серьезное повреждение печени. Та же проблема может возникнуть у пациентов с другими заболеваниями печени, такими как вирусный гепатит. Кроме того, более распространены токсины, которые вдыхаются, такие как чистящие растворители, аэрозольные краски, разбавители и т. Д., Которые более опасны при наличии основного заболевания.
Можно ли обратить вспять повреждение печени?
Печень — уникальный орган. Это единственный орган в организме, способный к регенерации.В большинстве органов, таких как сердце, поврежденная ткань заменяется рубцом, как на коже. Однако печень способна заменять поврежденную ткань новыми клетками. Если от 50 до 60 процентов клеток печени могут быть убиты в течение трех-четырех дней, в крайнем случае, например, при передозировке тайленола, печень полностью восстановится через 30 дней, если не возникнет никаких осложнений.
Осложнения заболевания печени возникают, когда регенерация является неполной или предотвращается прогрессирующим развитием рубцовой ткани в печени.Это происходит, когда повреждающий агент, такой как вирус, наркотик, алкоголь и т. Д., Продолжает атаковать печень и препятствует полной регенерации. Как только рубцовая ткань образовалась, этот процесс очень трудно повернуть вспять. Сильное рубцевание печени — это состояние, известное как цирроз. Развитие цирроза печени указывает на позднюю стадию заболевания печени и обычно сопровождается развитием осложнений.
Как долго я могу продолжать пить каждый день, прежде чем это повлияет на мою печень?
Самый большой фактор риска заболевания печени от алкоголя — это количество и продолжительность употребления алкоголя.У мужчин часто возникают осложнения, которые, по всей видимости, также зависят от пола. Каждый человек совершенно другой. Осложнение может развиться через 5–10 лет, но чаще через 20–30 лет. Многие люди никогда не заболевают терминальной стадией заболевания печени из-за алкоголя. Это невозможно предсказать заранее. И многие другие факторы, такие как другие заболевания, гепатит С, воздействие других токсинов, а также собственная генетическая структура человека играют роль.
Что вызывает гепатит?
Гепатит — это общий термин.Это указывает на воспаление и повреждение клеток печени. Этот ущерб может быть вызван лекарствами, токсинами, алкоголем, наследственными заболеваниями, некоторыми метаболическими заболеваниями и вирусами. Обычно гепатит относится к вирусному гепатиту. Существует множество вирусов, которые могут вызывать гепатит, но, опять же, чаще всего этот термин относится к вирусам, обозначенным A, B, C, D, E и G. В Соединенных Штатах наиболее частыми причинами являются гепатиты A, B. , и C.
Насколько необходимо информировать работодателей о статусе ВГС?
Пациенты с вирусом гепатита С сталкиваются с рядом трудностей из-за досадной стигмы, связанной с этим статусом носителя.Для передачи или передачи этого вируса другим людям необходимо, чтобы они контактировали с кровью или физиологической жидкостью человека, инфицированного вирусом гепатита С. В большинстве профессий это не представляет опасности, и здравый смысл позволяет избежать этого. В ситуациях, когда существует риск заражения из-за травмы, использования игл или ножей или в других ситуациях подобного рода, вероятно, лучше и наиболее целесообразно сообщить об этом работодателю. В большинстве ситуаций, в том числе в сфере здравоохранения, это не причина не нанимать людей.Местные законы могут отличаться, и это необходимо проверять на месте. Если кто-то случайно подвергнет человека воздействию крови или телесной жидкости, возникнет моральное обязательство сообщить об этом другому человеку.
Насколько важны вакцины против гепатита?
Существуют вакцины для предотвращения гепатита A и B. Гепатит B — болезнь, которую можно полностью искоренить с помощью всеобщей вакцинации. Теперь это одна из частей серии вакцинации новорожденных. Продолжаются попытки вакцинировать всех детей к тому времени, когда они достигнут неполного старшего возраста.Взрослые, которые работают в сфере повышенного риска, например, в сфере здравоохранения, или занимаются деятельностью, связанной с повышенным риском, например, употребляют внутривенные наркотики и имеют несколько половых партнеров, также должны быть вакцинированы. Вакцина против гепатита А рекомендуется в ряде детских учреждений, и ее следует обсудить с вашим педиатром. Взрослые или дети, путешествующие в районы мира, где гепатит А очень распространен, включая все слаборазвитые или слаборазвитые страны, должны быть вакцинированы перед отъездом. Любой человек с хроническим заболеванием печени, не вызванным гепатитом В, особенно с гепатитом С или циррозом, должен быть вакцинирован как против гепатита А, так и против гепатита В, если они уже не имеют иммунитета.
Гепатит С вызван только обменом телесной жидкости?
Установлено, что у большинства пациентов с гепатитом С имеется такой фактор риска, как контакт с иглой, контакт с кровью, нанесение татуировок, пирсинг или сексуальное воздействие, которые могут привести к обмену кровью или биологическими жидкостями. В зависимости от исследования у небольшого процента пациентов, от 5 до 30 процентов, нет идентифицируемого фактора риска. Предположительно, они заразились этим заболеванием в результате непреднамеренного заражения. До 50 процентов пациентов с гепатитом С не имеют симптомов.Больший процент не знает, что они являются переносчиками вируса. Есть много возможностей для непреднамеренного воздействия, таких как совместное использование бритвы, зубной щетки, ножниц для стрижки волос или маникюрных инструментов и т. Д.
СТВОЛОВЫХ КЛЕТК МОГУТ ПРЕОБРАЗОВАТЬСЯ В ТКАНЬ ПЕЧЕНИ, ПОМОГАЕТ ВОССТАНОВИТЬ ПОВРЕЖДЕННЫЙ ОРГАН
Johns Hopkins Medicine
Офис по связям с общественностью и связям с общественностью
Контактное лицо для СМИ: Ванесса Васта
410-955-1287; [email protected]
1 июня 2004 г.
Стволовые клетки костного мозга при воздействии на поврежденную ткань печени могут быстро преобразоваться в здоровые клетки печени и помочь восстановить поврежденный орган, согласно новому исследованию из J
| Микрофотография стволовых клеток костного мозга Шаркиса, которые превратились в клетки печени.Преобразованные стволовые клетки, окрашенные желтым красителем, указывают на присутствие альбумина, специфичного для печени белка. В ядре клетки, где находится ДНК клетки, розовая точка — это Х-хромосома, а зеленая точка — Y-хромосома. Стрелки указывают на клетки, содержащие либо две хромосомы (1X и 1 Y хромосома), либо четыре хромосомы (2X и 2 Y хромосомы), что является нормальным для клеток печени. |
В культурах тканей мышей ученые обнаружили, что стволовые клетки в присутствии клеток поврежденной ткани печени
превратились в клетки печени всего за семь часов.Они также заметили, что стволовые клетки, трансплантированные мышам с повреждениями печени, помогли восстановить функцию печени в течение двух-семи дней. Работа опубликована в номере журнала Nature Cell Biology от 1 июня.
Стволовые клетки костного мозга, также известные как гемопоэтические стволовые клетки, обладают способностью дифференцироваться и развиваться во все другие клетки крови и костного мозга. В научном сообществе ведутся споры о том, могут ли эти клетки дифференцироваться в другие типы тканей, такие как печень, говорит Сол Дж.Шаркис, доктор философии, старший автор исследования и профессор онкологии онкологического центра Джонса Хопкинса Киммела. Некоторые исследования предполагают, что клетки костного мозга сливаются с другими типами клеток, приобретая свойства этих клеток. Но в этом исследовании исследователи с помощью тщательного анализа с помощью микроскопа и других тестов обнаружили, что клетки не сливаются, предполагая, что «микросреда», исходящая от существующих клеток печени, вызвала их преобразование.
«Гематопоэтические стволовые клетки были способны принимать многие характеристики типов клеток печени, включая экспрессию специфических генов и / или белков, а также типичные функции», — говорит Шаркис.«Эти события произошли быстро после воздействия травмы и восстановили аномалии печени, что указывает на преобразование клеток».
Этот тип метода стволовых клеток со временем может быть использован для лечения хронических заболеваний, таких как диабет, цирроз печени, болезни сердца и рак, — говорит он. Он предупреждает, что необходимо завершить еще много исследований, прежде чем можно будет протестировать терапию стволовыми клетками на людях.
Для исследования Шаркис и его коллеги культивировали стволовые клетки костного мозга вместе с нормальной или поврежденной тканью печени в чашках для культивирования тканей.Ткань печени была взята у мышей, которые подвергались воздействию лекарств, повреждающих печень. Два типа клеток были разделены тонкой проницаемой стенкой. Исследователи провели несколько тестов, направленных на определение экспрессии белков печени.
Всего через семь или восемь часов после культивирования с поврежденной тканью печени некоторые стволовые клетки экспрессировали типичные белки, присутствующие в клетках печени, цитокератин 18 или альбумин. Через два дня после культивирования эти белки экспрессировались почти 3% всех стволовых клеток.Исследователи также наблюдали экспрессию многих других белков и продуктов, которые обычно вырабатываются клетками печени на самых ранних стадиях — все они обнаруживаются в течение 8-48 часов после культивирования.
Затем команда использовала чувствительный микроскоп для исследования половых хромосом клеток, так как стволовые клетки были взяты у мышей-самцов, а ткань печени — у самок мышей. Они идентифицировали некоторые стволовые клетки мужского донорского происхождения с четырьмя половыми хромосомами, типичными для клеток печени, но не стволовых клеток, что указывает на то, что сами стволовые клетки начали физически изменяться и не сливались с клетками печени.
Наконец, команда трансплантировала стволовые клетки в поврежденную печень самок мышей и изучила степень превращения через два и семь дней после трансплантации. Больше преобразованных клеток наблюдали через семь дней по сравнению с двумя днями, что позволяет предположить, что клетки оставались жизнеспособными и продолжали делиться или превращаться. Функции печени мышей, получавших стволовые клетки, восстановились уже через два дня после трансплантации.
Продолжающиеся исследования Шаркиса будут пытаться определить факторы окружающей среды, ответственные за преобразование клеток, и изучить способность стволовых клеток восстанавливать другие органы.
 Данный процесс является временной мерой. Растущие клетки в конечном счете должны оказаться на своем месте. В противном случае увеличенные гепатоциты изнашиваются, что может привести к развитию гепатита;
Данный процесс является временной мерой. Растущие клетки в конечном счете должны оказаться на своем месте. В противном случае увеличенные гепатоциты изнашиваются, что может привести к развитию гепатита;