PH воды | О воде
рH воды является одним из наиболее важных рабочих показателей, характеризующих качество воды. Это мера активности ионов водорода в растворе, которая количественно выражает его кислотность. От величины pH зависит скорость протекания различных химических реакций, уровень коррозионной агрессивности воды, форма присутствия загрязняющих веществ в воде, что, в конечном счете, в ряде случаев, будет определять степень их токсичности, и т. д.
Типы воды в зависимости от pHВ соответствии с уровнем рН воду можно разделить на несколько типов:
Тип воды | pH |
Сильнокисла | < 3 |
Кислая | 3–5 |
Слабокислая | 5–6,5 |
Нейтральная | 6,5–7,5 |
Слабощелочная | 7,5–8,5 |
Щелочная | 8,5–9,5 |
Сильнощелочная | > 9,5 |
Уровень рН необходимо контролировать на всех этапах водоочистки, так как его отклонение от нормы в одну из сторон, как правило, существенно сказывается на привкусе, запахе и визуальном состоянии воды. Также pH непосредственно влияет на эффективность очистки воды. Оптимальную величину рН сложно определить однозначно, поскольку она может отличаться для различных систем водоочистки и зависит от исходного состава воды, свойств материалов, входящих в состав водоочистных устройств, и от технологии очистки.
Также pH непосредственно влияет на эффективность очистки воды. Оптимальную величину рН сложно определить однозначно, поскольку она может отличаться для различных систем водоочистки и зависит от исходного состава воды, свойств материалов, входящих в состав водоочистных устройств, и от технологии очистки.
Как правило, уровень рН относится к параметрам, которые непосредственно не влияют на потребительские качества воды. Например, речная вода характеризуется величиной рН, находящейся в диапазоне 6,5–8,5, атмосферные осадки – в диапазоне 4,6–6,1, морские воды – в диапазоне 7,9–8,3. Вода с рН 6,5–8,5 является наиболее приемлемой для организма человека. Фильтры для очистки воды Барьер позволяют не только получать питьевую воду с рекомендуемым уровнем рН, но и способны насыщать ее полезными макроэлементами.
Что такое pH и зачем его измерять?
Давайте разберемся, что такое pH, почему он так важен и откуда берутся «магические числа» 5. 5 и 7 — pH нейтрального шампуня и pH нейтрального раствора.
5 и 7 — pH нейтрального шампуня и pH нейтрального раствора. Вода, кислоты и основания.
Обратимся к свойствам воды. Вода — уникальное вещество, которое определяет лицо этого мира. Большое количество процессов, которые проходят на поверхности земли — в быту, в транспорте, в промышленности, в сельском хозяйстве, в природе — происходят в водной среде. В частности, тело человека в среднем на 70% состоит из воды.
Вода — универсальный растворитель. Среди веществ, которые растворяются в воде можно выделить 2 главных класса:
- Кислоты — вещества, которые при растворении в воде способны выделять ион водорода H+.
- Основания — вещества, которые при растворении в воде забирают ион водорода и выделяют отрицательно заряженный гидроксил ион OH-.
Избыток ионов H+ определяет кислотные свойства раствора, в то время как избыток ионов ОН- определяет основные свойства раствора.

Регулируя концентрацию этих ионов, мы можем управлять химическими и биохимическими процессами. Например в пищевой промышленности это: брожение капусты, скисание молока, формирование простокваши, изготовление вина или пива.
Если ионов водорода в растворе слишком много, то это негативно влияет на
жизнедеятельность живых организмов. Практически все живые клетки очень чувствительны к изменениям pH, и даже небольшое окисление для них опасно. Не выдерживают сильных кислотных свойств и некоторые материалы, например, металлы подвергаются лавинной коррозии. Для того, чтобы иметь возможность количественно характеризовать кислотные свойства среды и существует водородный показатель, он же показатель кислотности, он же показатель pH.
Измерение водородного показателя.
В виду того, что ионы очень маленькие, даже в небольшом объеме воды содержится огромное количество частиц. Поэтому в химии концентрацию ионов принято выражать в молях на литр, где 1 моль — это «порция», равная Числу Авогадро = 6. 02*1023 штук.
02*1023 штук.
Концентрация ионов водорода в воде может варьироваться в очень широких пределах —
от 1 моль/л до 10-14 моль/л.
При расчетах результатов измерения работать с такими большими числами неудобно, поэтому для классификации содержания ионов водорода в воде была разработана специальная логарифмическая шкала, или шкала pH. Ее смысл заключается в том, что после вычисления десятичного логарифма от концентрации, получившееся отрицательное число затем необходимо умножить на (-1).
pH = — log(C),
где С — это концентрация ионов водорода H+, выраженная в моль/л.
Что такое щелочная вода?
Кислотно-щелочной баланс организма — это определенное соотношение кислот и щелочей в нем, способствующее его нормальному функционированию. Кислотно-щелочной баланс зависит от сохранения относительно постоянных пропорций между межклеточными и внутриклеточными водами в тканях организма. Если кислотно-щелочное равновесие жидкостей в организме не будет поддерживаться постоянно, нормальное функционирование и сохранение жизни окажутся невозможными.
Человеческий организм состоит на большую часть из воды, поэтому важно контролировать баланс рН. В организме человека находиться две среды: кислая и щелочная.
Кислая среда необходима для химических процессов, например, пищеварения. Но в остальном уровень рН организма слабощелочной.
При закислении организма, в органах и мышцах накапливаются кислотные отходы, а необходимые минералы плохо усваиваются и быстро выводятся. Это приводит к блокировке биохимических и энергетических процессов в клетках, в итоге они погибают. Затвердевшие кислотные отходы заполняют капиллярные сосуды, из-за чего органы не дополучают достаточно крови, а с ней и питательных веществ. Последствием чего является гипертония, заболевание почек, сахарный диабет, онкологические и многие другие заболевания.
Восстановить правильный баланс pH поможет щелочная вода!
Повседневный рацион человека насыщен различными продуктами питания, по большей части образующих кислотную среду, почему, наш организм постоянно и находится в состоянии окисления. Чтобы помочь ему, необходимо дополнительное употребление щелочных продуктов. Основным решением снятия закисления организма является щелочная вода.
Чтобы помочь ему, необходимо дополнительное употребление щелочных продуктов. Основным решением снятия закисления организма является щелочная вода.
Нейтральным ph принято считать при показателе 7,0.
Щелочная вода — это вода, у которой уровень кислотности выше 7.1 рН. Внутренняя среда организма человека, кроме желудка и кожи, имеет щелочную среду, поэтому потребление щелочной воды способствует восстановлению кислотно-щелочного баланса организма.
По данным японских исследователей питьевая вода с pH выше 6,5-7 увеличивает показатели продолжительности жизни населения на 20-30%.
Потребление щелочной воды в значительной степени нейтрализует кислую среду, тем самым стабилизируется рН баланс, необходимый для нормальной работы жизненно важных процессов.
Врачи рекомендуют при ацидозе принимать щелочную воду, потому что это эффективный способ снять окислительный стресс. У нас есть огромное количество разнообразных видов щелочной воды с разным показателем рН, начиная от 7,4 и выше.
Из нашего ассортименте мы рекомендуем Вам попробовать воду таких производителей как Пролом, Русокси и Вера 19л в ПЭТ
Что такое щелочная вода. Польза и вред. Как ее сделать?
pH воды — для большинства людей, это образные цифры, характеризующие насколько вода кислая или щелочная. pH — сложное понятие, но с очень простым трактованием, его невозможно точно предугадать, но можно легко измерить фактически. Почему? Да потому, что рН — может быть вычислен по формуле как величина, противоположная по знаку и равная по модулю десятичному логарифму активности водородных ионов, выраженной в молях на литр.
Многие известные диетологи рекомендуют регулярное употребление в пищу щелочной воды, так как она способна сбалансировать уровень pH в организме человека, а значит, является прекрасным средством для поддержания здоровья и красоты. Щелочную воду в качестве питья можно использовать для профилактики, лечения ряда заболеваний и, несмотря на то, что она не является лекарством и используется в комплексе с лечебными препаратами, на ее употребление тоже существуют строгие правила приема.
Как сделать щелочную воду
Воду с повышенным рН можно банально купить, на каждой бутылке с водой есть описание состава. Теперь рассмотрим как ее сделать. Для приготовления есть общепринятые и надежные методы. Конечно же, за основу нужно брать уже качественную, отфильтрованную воду. Проточные фильтры и системы ультрафильтрации почти не меняют кислотность воды, а вот после систем обратного осмоса — pH зачастую в пределах 5-6 единиц, что бы поднять это значение используют минерализаторы.
В подготовленную воду можно добавлять вещества, повышающие рН, а можно электрохимически разделить нейтральную воду на кислую и щелочную.
Принцип действия щелочной воды
Щелочная вода менее кислая, нежели обычная вода из крана. Ее pH более семи за счет низкой концентрации водородных ионов. Оптимальный pH крови человека равен 7,4 и очень важно поддержание его на этом уровне. Значительные отклонения от данного показателя в сторону более кислой среды повлечет за собой негативные последствия для здоровья. Происходит ослабление всех систем организма, может развиться остеопороз, существенно снижается иммунитет, возрастает риск появления онкологии.
Происходит ослабление всех систем организма, может развиться остеопороз, существенно снижается иммунитет, возрастает риск появления онкологии.
Считается, что щелочная вода делает нашу кровь менее кислой, снижает кислотность в желудке. Когда показатель смещается в щелочную сторону, организм человека быстрей насыщается кислородом, появляется больше энергии, налаживается обмен веществ. Кроме этого щелочная вода является довольно мощным антиоксидантом.
В чем польза щелочной воды
Вода с pH более семи не способна в одиночку управлять молодостью или здоровьем человека, но польза повышенного pH очевидна:
- Щелочная вода стимулирует обменные процессы в организме, способствует его очищению, может использоваться для решения проблемы ожирения.
- Она является неплохим мочегонным средством, благодаря чему показана при цистите и камнях в почках.
- Восстанавливает микроповреждения печени, восстанавливает ее фильтрирующие функции.

- Снижает кислотность среды, тем самым препятствует вымыванию минералов из костей, мышц, волос и так далее. Регулярное употребление щелочного питья позволяет исключить возникновение патологий опорно-двигательной системы.
- Восприимчивость к инсулину возрастает, а значит, из крови выводится избыточный сахар.
- Вода способствует снижению уровня холестерина, считается довольно эффективной профилактикой возникновения тромбофлебита, сгущения крови.
- Положительно влияет на иммунитет.
- Щелочную воду часто назначают при проблемах с желудочно-кишечным трактом. При ее употреблении быстро стабилизируется микрофлора и кислотность в желудке, а поверхность слизистых восстанавливается.
Многие исследования доказали эффективность такой воды в качестве терапии против рака. Щелочная вода в этом случае не может считаться полноценным, самостоятельным лекарством, а лишь средством для дополнительной терапии. В любом случае перед ее употреблением в больших количествах лучше проконсультироваться со специалистами для выявления возможных противопоказаний.
Популярные вопросы про Щелочную воду:
✔️ Что такое щелочная вода?
Это вода в которой ионов ОН- существенно больше чем Н+, что создает необходимый дисбаланс.
✔️ В чем польза щелочной воды?
Щелочная вода стимулирует обменные процессы в организме, является неплохим мочегонным средством, способствует снижению уровня холестерина.
✔️ Как сделать щелочную воду?
Можно добавлять в воду вещества, повышающие рН, а можно электрохимически разделить нейтральную воду на кислую и щелочную.
✔️ Можно ли пить щелочную воду каждый день?
На ее употребление существуют строгие правила приема.
российский корабль остановил нарушение границы эсминцем ВМС США — РТ на русском
Большой противолодочный корабль Тихоокеанского флота «Адмирал Виноградов» остановил нарушение российской границы эсминцем ВМС США John S. McCain. После предупреждения о недопустимости предпринятых американским судном действий и возможности применения таранного манёвра эсминец вернулся в нейтральные воды, заявили в Минобороны. Американская сторона объяснила свои действия проведением операции по «обеспечению свободы судоходства». Эксперты подчёркивают, что речь в первую очередь идёт о нарушении государственной границы американским судном.
McCain. После предупреждения о недопустимости предпринятых американским судном действий и возможности применения таранного манёвра эсминец вернулся в нейтральные воды, заявили в Минобороны. Американская сторона объяснила свои действия проведением операции по «обеспечению свободы судоходства». Эксперты подчёркивают, что речь в первую очередь идёт о нарушении государственной границы американским судном.
Американский эсминец John S. McCain нарушил территориальную границу Россию в заливе Петра Великого. Об этом сообщает пресс-служба Министерства обороны.
«Сегодня в 6:17 мск эскадренный миноносец ВМС США John S. McCain, который уже несколько дней находится в акватории Японского моря, нарушил территориальные воды Российской Федерации в заливе Петра Великого, углубившись за линию морской границы на два километра», — говорится в сообщении ведомства.
После этого большой противолодочный корабль Тихоокеанского флота «Адмирал Виноградов», осуществлявший непосредственное слежение за эсминцем, предупредил экипаж американского судна «о недопустимости таких действий и возможности применения таранного манёвра для вытеснения нарушения».
«После полученного предостережения и смены курса большим противолодочным кораблём ТОФ «Адмирал Виноградов» на эсминец John S. McCain американский корабль сразу вышел в нейтральные воды. Повторных попыток американский эсминец войти в них не предпринимал», — пояснили российские военные.
Отмечается, что «Адмирал Виноградов» продолжает выполнение задач в непосредственной близости от американского боевого корабля, также в этот район направлен корвет «Совершенный».
Залив Петра Великого находится на юге Приморского края. На его берегах расположены Владивосток, Находка, Большой Камень, Фокино и крупнейший российский тихоокеанский порт Восточный. Длина залива с севера на юг составляет 80 км, в самой широкой части он достигает 200 км. Длина береговой линии равна 1500 км, а общая площадь — 9000 км.
Американская сторона позднее объяснила манёвры эсминца John S. McCain проведением операции по «обеспечению свободы судоходства». В опубликованном командованием 7-го флота США заявлении говорится, что таким образом выражено несогласие с заявлением России, что «залив Петра Великого — это исторический залив в соответствии с международным законом.
В США заявили, что «СССР пытался присвоить себе гораздо большую площадь внутренних вод, а также территориального моря дальше от берега, чем они имеют право в соответствии с международным правом».
«Россия продолжила политику СССР в этом вопросе. Проведя эту операцию, США продемонстрировали, что эти воды не являются территориальным морем России и что США не признают притязания России на то, что залив Петра Великого — это «исторический залив» по международному праву», — говорится в заявлении 7-го флота США.
Военный эксперт, полковник в отставке Виктор Литовкин, комментируя инцидент в заливе Петра Великого отметил, что речь идёт о нарушении государственной границы.
«Это было нарушение российских территориальных вод, и они (США. — RT) это знают… Они единственные, кто не признаёт наш суверенитет на залив Петра Великого, так же, как и на другие акватории, и не только российские. К сожалению, американцы всё равно будут делать так, как считают нужным», — сказал эксперт в беседе с RT.
Литовкин обратил внимание на то обстоятельство, что США заявили об «обеспечении свободы судоходства», но для этих целей было использовано не гражданское судно.
«Если это гражданское судно, пожалуйста, заходите, объявите об этом… и тогда вас пропустят, но нарушать территориальные воды никому не позволено», — заключил эксперт.
Научный сотрудник Дипломатической академии МИД РФ и директор программы ПИР-Центра Вадим Козюлин полагает, что подобные ситуации не добавляют позитива в российско-американские отношения. Вместе с тем эксперт обратил внимание на характер российской реакции на инцидент.
Также по теме
«Джон С. Маккейн», которого не ждали: Китай обвинил США в грубом нарушении своего суверенитетаКитайские власти обвинили США в грубом нарушении своего суверенитета и норм международного права после приближения эсминца «Джон С….
«Россия на всех площадках готова действовать активно и не уступать. Такова российская стратегия — отвечать тем же. И на полёты Б-52 вдоль наших границ мы посылаем наши бомбардировщики к британской авиабазе, и на находы судов», — сказал Козюлин RT.
Такова российская стратегия — отвечать тем же. И на полёты Б-52 вдоль наших границ мы посылаем наши бомбардировщики к британской авиабазе, и на находы судов», — сказал Козюлин RT.
Отметим, что США систематически проводят «операции по обеспечению свободы навигации» в разных точках по всему миру. Эсминец John S. McCain уже был участником схожего инцидента в море, когда американское судно в 2017 году приблизилось к спорному архипелагу Спратли, который Китай считает своей территорией.
Власти КНР тогда решительно осудили произошедший инцидент в Южно-Китайском море. В официальном заявлении МИД Китая по поводу этого случая говорилось, что эсминец вошёл в обозначенный район без разрешения правительства КНР и провёл так называемую операцию по обеспечению свободы судоходства.
В ответ Китай направил к островам военные корабли для идентификации и верификации американского судна, а также для его оповещения о необходимости покинуть территориальные воды.
Нарушивший границу американский эсминец ушел в нейтральные воды
https://ria. ru/20201124/granitsa-1586026614.html
ru/20201124/granitsa-1586026614.html
Нарушивший границу американский эсминец ушел в нейтральные воды
Нарушивший границу американский эсминец ушел в нейтральные воды — РИА Новости, 24.11.2020
Нарушивший границу американский эсминец ушел в нейтральные воды
Нарушивший границу эсминец США «Джон Маккейн», получив предостережение от российского корабля о смене курса, сразу вышел в нейтральные воды, сообщило Минобороны РИА Новости, 24.11.2020
2020-11-24T09:52
2020-11-24T09:52
2020-11-24T09:52
военно-морские силы сша
тихоокеанский флот вмф россии
приморский край
сша
в мире
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn23.img.ria.ru/images/07e4/0b/18/1586025841_0:196:2275:1476_1920x0_80_0_0_d6c647b15f14a30d1a244c338475aa28.jpg
МОСКВА, 24 ноя — РИА Новости. Нарушивший границу эсминец США «Джон Маккейн», получив предостережение от российского корабля о смене курса, сразу вышел в нейтральные воды, сообщило Минобороны РФ. Ранее сообщалось, что большой противолодочный корабль Тихоокеанского флота «Адмирал Виноградов» остановил нарушение государственной границы РФ эсминцем ВМС США в заливе Петра Великого на юге Приморского края.»После полученного предостережения и смены курса большим противолодочным кораблем ТОФ «Адмирал Виноградов» на эсминец «Джон Маккейн» американский корабль сразу вышел в нейтральные воды. Повторных попыток американский эсминец войти в них не предпринимал», — говорится в сообщении.Добавляется, что БДК «Адмирал Виноградов» продолжает выполнять задачи в близости от американского боевого корабля. В этот район направлен корвет ТОФ «Совершенный».
Ранее сообщалось, что большой противолодочный корабль Тихоокеанского флота «Адмирал Виноградов» остановил нарушение государственной границы РФ эсминцем ВМС США в заливе Петра Великого на юге Приморского края.»После полученного предостережения и смены курса большим противолодочным кораблем ТОФ «Адмирал Виноградов» на эсминец «Джон Маккейн» американский корабль сразу вышел в нейтральные воды. Повторных попыток американский эсминец войти в них не предпринимал», — говорится в сообщении.Добавляется, что БДК «Адмирал Виноградов» продолжает выполнять задачи в близости от американского боевого корабля. В этот район направлен корвет ТОФ «Совершенный».
https://ria.ru/20201022/perekhvat-1581064500.html
приморский край
сша
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn25.img.ria.ru/images/07e4/0b/18/1586025841_110:124:1999:1541_1920x0_80_0_0_698ba94cd5a8ec36434b1f749284b685.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
военно-морские силы сша, тихоокеанский флот вмф россии, приморский край, сша, в мире
Основные показатели качества воды — техническая информация
Мутность и прозрачность
Мутность – показатель качества воды, обусловленный присутствием в воде нерастворенных и коллоидных веществ неорганического и органического происхождения. Причиной мутности поверхностных вод являются илы, кремниевая кислота, гидроокиси железа и алюминия, органические коллоиды, микроорганизмы и планктон. В грунтовых водах мутность вызвана преимущественно присутствием нерастворенных минеральных веществ, а при проникании в грунт сточных вод – также и присутствием органических веществ. В России мутность определяют фотометрическим путем сравнения проб исследуемой воды со стандартными суспензиями. Результат измерений выражают в мг/дм3 при использовании основной стандартной суспензии каолина или в ЕМ/дм3 (единицы мутности на дм3) при использовании основной стандартной суспензии формазина. Последнюю единицу измерения называют также Единица Мутности по Формазину (ЕМФ) или в западной терминологии FTU (Formazine Turbidity Unit). 1FTU=1ЕМФ=1ЕМ/ дм3. В последнее время в качестве основной во всем мире утвердилась фотометрическая методика измерения мутности по формазину, что нашло свое отражение в стандарте ISO 7027 (Water quality — Determination of turbidity).
Причиной мутности поверхностных вод являются илы, кремниевая кислота, гидроокиси железа и алюминия, органические коллоиды, микроорганизмы и планктон. В грунтовых водах мутность вызвана преимущественно присутствием нерастворенных минеральных веществ, а при проникании в грунт сточных вод – также и присутствием органических веществ. В России мутность определяют фотометрическим путем сравнения проб исследуемой воды со стандартными суспензиями. Результат измерений выражают в мг/дм3 при использовании основной стандартной суспензии каолина или в ЕМ/дм3 (единицы мутности на дм3) при использовании основной стандартной суспензии формазина. Последнюю единицу измерения называют также Единица Мутности по Формазину (ЕМФ) или в западной терминологии FTU (Formazine Turbidity Unit). 1FTU=1ЕМФ=1ЕМ/ дм3. В последнее время в качестве основной во всем мире утвердилась фотометрическая методика измерения мутности по формазину, что нашло свое отражение в стандарте ISO 7027 (Water quality — Determination of turbidity). Согласно этому стандарту, единицей измерения мутности является FNU (Formazine Nephelometric Unit). Агентство по Охране Окружающей Среды США (U.S. EPA) и Всемирная Организация Здравоохранения (ВОЗ) используют единицу измерения мутности NTU (Nephelometric Turbidity Unit). Соотношение между основными единицами измерения мутности следующее: 1 FTU(ЕМФ)=1 FNU=1 NTU.
Согласно этому стандарту, единицей измерения мутности является FNU (Formazine Nephelometric Unit). Агентство по Охране Окружающей Среды США (U.S. EPA) и Всемирная Организация Здравоохранения (ВОЗ) используют единицу измерения мутности NTU (Nephelometric Turbidity Unit). Соотношение между основными единицами измерения мутности следующее: 1 FTU(ЕМФ)=1 FNU=1 NTU.
ВОЗ по показаниям влияния на здоровье мутность не нормирует, однако с точки зрения внешнего вида рекомендует, чтобы мутность была не выше 5 NTU (нефелометрическая единица мутности), а для целей обеззараживания – не более 1 NTU.
Мера прозрачности – высота столба воды, при которой можно наблюдать опускаемую в воду белую пластину определенных размеров (диск Секки) или различать на белой бумаге шрифт определенного размера и типа (шрифт Снеллена). Результаты выражаются в сантиметрах.
Характеристика вод по прозрачности (мутности)
Прозрачность | Еденица измерения, см |
Средней мутности | |
Цветность
Цветность – показатель качества воды, обусловленный главным образом присутствием в воде гуминовых и фульфовых кислот, а также соединений железа (Fe3+). Количество этих веществ зависит от геологических условий в водоносных горизонтах и от количества и размеров торфяников в бассейне исследуемой реки. Так, наибольшую цветность имеют поверхностные воды рек и озер, расположенных в зонах торфяных болот и заболоченных лесов, наименьшую – в степях и степных зонах. Зимой содержание органических веществ в природных водах минимальное, в то время как весной в период половодья и паводков, а также летом в период массового развития водорослей – цветения воды — оно повышается. Подземные воды, как правило, имеют меньшую цветность, чем поверхностные. Таким образом, высокая цветность является тревожным признаком, свидетельствующим о неблагополучии воды. При этом очень важно выяснить причину цветности, так как методы удаления, например, железа и органических соединений отличаются. Наличие же органики не только ухудшает органолептические свойства воды, приводит к возникновению посторонних запахов, но и вызывает резкое снижение концентрации растворенного в воде кислорода, что может быть критично для ряда процессов водоочистки.
Количество этих веществ зависит от геологических условий в водоносных горизонтах и от количества и размеров торфяников в бассейне исследуемой реки. Так, наибольшую цветность имеют поверхностные воды рек и озер, расположенных в зонах торфяных болот и заболоченных лесов, наименьшую – в степях и степных зонах. Зимой содержание органических веществ в природных водах минимальное, в то время как весной в период половодья и паводков, а также летом в период массового развития водорослей – цветения воды — оно повышается. Подземные воды, как правило, имеют меньшую цветность, чем поверхностные. Таким образом, высокая цветность является тревожным признаком, свидетельствующим о неблагополучии воды. При этом очень важно выяснить причину цветности, так как методы удаления, например, железа и органических соединений отличаются. Наличие же органики не только ухудшает органолептические свойства воды, приводит к возникновению посторонних запахов, но и вызывает резкое снижение концентрации растворенного в воде кислорода, что может быть критично для ряда процессов водоочистки. Некоторые в принципе безвредные органические соединения, вступая в химические реакции (например, с хлором), способны образовывать очень вредные и опасные для здоровья человека соединения.
Некоторые в принципе безвредные органические соединения, вступая в химические реакции (например, с хлором), способны образовывать очень вредные и опасные для здоровья человека соединения.
Цветность измеряется в градусах платино-кобальтовой шкалы и колеблется от единиц до тысяч градусов – Таблица 2.
Характеристика вод по цветности
Цветность | Еденица измерения, градус платино-кобальтовой шкалы |
Очень высокая |
Вкус и привкус
Вкус воды определяется растворенными в ней веществами органического и неорганического происхождения и различается по характеру и интенсивности. Различают четыре основных вида вкуса: соленый, кислый, сладкий, горький. Все другие виды вкусовых ощущений называются привкусами (щелочной, металлический, вяжущий и т.п.). Интенсивность вкуса и привкуса определяют при 20 °С и оценивают по пятибалльной системе, согласно ГОСТ 3351-74*.
Различают четыре основных вида вкуса: соленый, кислый, сладкий, горький. Все другие виды вкусовых ощущений называются привкусами (щелочной, металлический, вяжущий и т.п.). Интенсивность вкуса и привкуса определяют при 20 °С и оценивают по пятибалльной системе, согласно ГОСТ 3351-74*.Качественную характеристику оттенков вкусовых ощущений – привкуса – выражают описательно: хлорный, рыбный, горьковатый и так далее. Наиболее распространенный соленый вкус воды чаще всего обусловлен растворенным в воде хлоридом натрия, горький – сульфатом магния, кислый – избытком свободного диоксида углерода и т.д. Порог вкусового восприятия соленых растворов характеризуется такими концентрациями (в дистиллированной воде), мг/л: NaCl – 165; CaCl2 – 470; MgCl2 – 135; MnCl2 – 1,8; FeCl2 – 0,35; MgSO4 – 250; CaSO4 – 70; MnSO4 – 15,7; FeSO4 – 1,6; NaHCO3 – 450.
По силе воздействия на органы вкуса ионы некоторых металлов выстраиваются в следующие ряды:
O катионы: Nh5+ > Na+ > K+; Fe2+ > Mn2+ > Mg2+ > Ca2+;
O анионы: ОН- > NO3- > Cl- > HCO3- > SO42- .
Характеристика вод по интенсивности вкуса
Интенсивность вкуса и привкуса | Характер появления вкуса и привкуса | Оценка интенсивности, балл |
Нет | Вкус и привкус не ощущаются | 0 |
Очень слабая | Вкус и привкус не ощущаются потребителем, но обнаруживаются при лабораторном исследовании | 1 |
Слабая | Вкус и привкус замечаются потребителем, если обратить на это его внимание | 2 |
Заметная | Вкус и привкус легко замечаются и вызывают неодобрительные отзывы о воде | 3 |
Отчетливая | Вкус и привкус обращают на себя внимание и заставляют воздержаться от питья | 4 |
Очень сильная | Вкус и привкус настолько сильные, что делают воду непригодной к употреблению | 5 |
Запах
Запах – показатель качества воды, определяемый органолептическим методом с помощью обоняния на основании шкалы силы запаха. На запах воды оказывают влияние состав растворенных веществ, температура, значения рН и целый ряд прочих факторов. Интенсивность запаха воды определяют экспертным путем при 20 °С и 60 °С и измеряют в баллах, согласно требованиям.
На запах воды оказывают влияние состав растворенных веществ, температура, значения рН и целый ряд прочих факторов. Интенсивность запаха воды определяют экспертным путем при 20 °С и 60 °С и измеряют в баллах, согласно требованиям.Следует также указывать группу запаха по следующей классификации:
По характеру запахи делят на две группы:
- естественного происхождения (живущие и отмершие в воде организмы, загнивающие растительные остатки и др.)
- искусственного происхождения (примеси промышленных и сельскохозяйственных сточных вод).
Запахи второй группы (искусственного происхождения) называют по определяющим запах веществам: хлорный, бензиновый и т.д.
Запахи естественного происхождения
Обозначение запаха | Характер запаха | Примерный род запаха |
А | Ароматический | огуречный, цветочный |
Б | Болотный | илистый, тинистый |
Г | Гнилостный | фекальный, сточный |
Д | Древесный | запах мокрой щепы, древесной коры |
З | Землистый | прелый, запах свежевспаханной земли, глинистый |
П | Плесневый | затхлый, застойный |
Р | Рыбный | запах рыбьегожира, рыбный |
С | Сероводородный | запах тухлых яиц |
Т | Травянистый | запах скошенной травы, сена |
Н | Неопределенный | Запахи естественного происхождения, не попадающие под предыдущие определения |
Интенсивность запаха по ГОСТ 3351-74* оценивают в шестибальной шкале – см.
 следующую страницу.
следующую страницу.Характеристика вод по интенсивности запаха
Интенсивность запаха | Характер появления запаха | Оценка интенсивности, балл |
Нет | Запах не ощущаются | 0 |
Очень слабая | Запах не ощущаются потребителем, но обнаруживаются при лабораторном исследовании | 1 |
Слабая | Запах замечаются потребителем, если обратить на это его внимание | 2 |
Заметная | Запах легко замечаются и вызывают неодобрительные отзывы о воде | 3 |
Отчетливая | Запах обращают на себя внимание и заставляют воздержаться от питья | 4 |
Очень сильная | Запах настолько сильные, что делают воду непригодной к употреблению | 5 |
Водородный показатель (рН)
Водородный показатель (рН) — характеризует концентрацию свободных ионов водорода в воде и выражает степень кислотности или щелочности воды (соотношение в воде ионов Н+ и ОН- образующихся при диссоциации воды) и количественно определяется концентрацией ионов водорода pH = — Ig [H+]Если в воде пониженное содержание свободных ионов водорода (рН>7) по сравнению с ионами ОН-, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН<7)- кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
Определение pH выполняется колориметрическим или электрометрическим методом. Вода с низкой реакцией рН отличается коррозионностью, вода же с высокой реакцией рН проявляет склонность к вспениванию.
В зависимости от уровня рН воды можно условно разделить на несколько групп:
Характеристика вод по рН
Тип воды | Величина рН |
сильнокислые воды | |
слабокислые воды | |
нейтральные воды | |
слабощелочный воды | |
щелочные воды | |
сильнощелочные воды |
Контроль над уровнем рН особенно важен на всех стадиях водоочистки, так как его «уход» в ту или иную сторону может не только существенно сказаться на запахе, привкусе и внешнем виде воды, но и повлиять на эффективность водоочистных мероприятий.
 Оптимальная требуемая величина рН варьируется для различных систем водоочистки в соответствии с составом воды, характером материалов, применяемых в системе распределения, а также в зависимости от применяемых методов водообработки.
Оптимальная требуемая величина рН варьируется для различных систем водоочистки в соответствии с составом воды, характером материалов, применяемых в системе распределения, а также в зависимости от применяемых методов водообработки.Обычно уровень рН находится в пределах, при которых он непосредственно не влияет на потребительские качества воды. Так, в речных водах pH обычно находится в пределах 6.5-8.5, в атмосферных осадках 4.6-6.1, в болотах 5.5-6.0, в морских водах 7.9-8.3. Поэтому ВОЗ не предлагает какой-либо рекомендуемой по медицинским показателям величины для рН. Вместе с тем известно, что при низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, способна вызывать раздражение глаз и кожи. Именно поэтому для питьевой и хозяйственно-бытовой воды оптимальным считается уровень рН в диапазоне от 6 до 9.
Кислотность
Кислотностью называют содержание в воде веществ, способных вступать в реакцию с гидроксид-ионами (ОН-). Кислотность воды определяется эквивалентным количеством гидроксида, необходимого для реакции.
Кислотность воды определяется эквивалентным количеством гидроксида, необходимого для реакции.В обычных природных водах кислотность в большинстве случаев зависит только от содержания свободного диоксида углерода. Естественную часть кислотности создают также гуминовые и другие слабые органические кислоты и катионы слабых оснований (ионы аммония, железа, алюминия, органических оснований). В этих случаях pH воды не бывает ниже 4.5.
В загрязненных водоемах может содержаться большое количество сильных кислот или их солей за счет сброса промышленных сточных вод. В этих случаях pH может быть ниже 4.5. Часть общей кислотности, снижающей pH до величин < 4.5, называется свободной.
Жесткость
Общая (полная) жесткость – свойство, вызванное присутствием растворенных в воде веществ, в основном — солей кальция (Ca2+) и магния (Mg2+), а также других катионов, которые выступают в значительно меньших количествах, таких как ионы: железа, алюминия, марганца (Mn2+) и тяжелых металлов (стронций Sr2+, барий Ba2+).
Но общее содержание в природных водах ионов кальция и магния несравнимо больше содержания всех других перечисленных ионов – и даже их суммы. Поэтому под жесткостью понимают сумму количеств ионов кальция и магния – общая жесткость, складывающаяся из значений карбонатной (временной, устраняемой кипячением) и некарбонатной (постоянной) жесткости. Первая вызвана присутствием в воде гидрокарбонатов кальция и магния, вторая наличием сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов.
В России жесткость воды выражают в мг-экв/дм3 или в моль/л.
Карбонатная жесткость (временная) – вызвана присутствием растворенных в воде бикарбонатов, карбонатов и углеводородов кальция и магния. Во время нагревания бикарбонаты кальция и магния частично оседают в растворе в результате обратимых реакций гидролиза.
Некарбонатная жесткость (постоянная) – вызывается присутствием растворенных в воде хлоридов, сульфатов и силикатов кальция (не растворяются и не оседают в растворе во время нагревания воды).
Характеристика вод по значению общей жесткости
Группа вод | Еденица измерения, ммоль/л |
Средней жесткости | |
Очень жесткая |
Щелочность
Щелочностью воды называется суммарная концентрация содержащихся в воде анионов слабых кислот и гидроксильных ионов (выражена в ммоль/л), вступающих в реакцию при лабораторных исследованиях с соляной или серной кислотами с образованием хлористых или сернокислых солей щелочных и щелочноземельных металлов.Различают следующие формы щелочности воды: бикарбонатная (гидрокарбонатная), карбонатная, гидратная, фосфатная, силикатная, гуматная – в зависимости от анионов слабых кислот, которыми обусловливается щелочность. Щелочность природных вод, рН которых обычно < 8,35, зависит от присутствия в воде бикарбонатов, карбонатов, иногда и гуматов. Щелочность других форм появляется в процессах обработки воды. Так как в природных водах почти всегда щелочность определяется бикарбонатами, то для таких вод общую щелочность принимают равной карбонатной жесткости.
Щелочность природных вод, рН которых обычно < 8,35, зависит от присутствия в воде бикарбонатов, карбонатов, иногда и гуматов. Щелочность других форм появляется в процессах обработки воды. Так как в природных водах почти всегда щелочность определяется бикарбонатами, то для таких вод общую щелочность принимают равной карбонатной жесткости.
Железо, марганец
Железо, марганец — в натуральной воде выступают преимущественно в виде углеводородов, сульфатов, хлоридов, гумусовых соединений и иногда фосфатов. Присутствие ионов железа и марганца очень вредит большинству технологических процессов, особенно в целлюлозной и текстильной промышленности, а также ухудшает органолептические свойства воды.Кроме того, содержание железа и марганца в воде может вызывать развитие марганцевых бактерий и железобактерий, колонии которых могут быть причиной зарастания водопроводных сетей.
Хлориды
Хлориды – присутствие хлоридов в воде может быть вызвано вымыванием залежей хлоридов или же они могут появиться в воде вследствие присутствия стоков. Чаще всего хлориды в поверхностных водах выступают в виде NaCl, CaCl2 и MgCl2, причем, всегда в виде растворенных соединений.
Чаще всего хлориды в поверхностных водах выступают в виде NaCl, CaCl2 и MgCl2, причем, всегда в виде растворенных соединений.Соединения азота
Соединения азота (аммиак, нитриты, нитраты) – возникают, главным образом, из белковых соединений, которые попадают в воду вместе со сточными водами. Аммиак, присутствующий в воде, может быть органического или неорганического происхождения. В случае органического происхождения наблюдается повышенная окисляемость.Нитриты возникают, главным образом, вследствие окисления аммиака в воде, могут также проникать в нее вместе с дождевой водой вследствие редукции нитратов в почве.
Нитраты — это продукт биохимического окисления аммиака и нитритов или же они могут быть выщелочены из почвы.
Сероводород
Сероводород придает воде неприятный запах, приводит к развитию серобактерий и вызывает коррозию. Сероводород, преимущественно присутствующий в подземных водах, может быть минерального, органического или биологического происхождения, причем в виде растворенного газа или сульфидов. То, под каким видом проявляется сероводород, зависит от реакции pH:
То, под каким видом проявляется сероводород, зависит от реакции pH:O при pH < 5 имеет вид h3S;
O при pH > 7 выступает в виде иона HS-;
O при pH = 5 : 7 может быть в виде, как h3S, так и HS-.
воде. Они поступают в воду вследствие вымывания осадочных горных пород, выщелачивания почвы и иногда вследствие окисления сульфидов и серы – продуктов расклада белка из сточных вод. Большое содержание сульфатов в воде может быть причиной болезней пищеварительного тракта, а также такая вода может вызывать коррозию бетона и железобетонных конструкций.
Двуокись углерода
Двуокись углерода (CO2) – в зависимости от реакции pH воды может быть в следующих видах:Сероводород придает воде неприятный запах, приводит к развитию серобактерий и вызывает коррозию. Сероводород, преимущественно присутствующий в подземных водах, может быть минерального, органического или биологического происхождения, причем в виде растворенного газа или сульфидов. То, под каким видом проявляется сероводород, зависит от реакции pH:
- при pH < 5 имеет вид h3S;
- при pH > 7 выступает в виде иона HS-;
- при pH = 5 : 7 может быть в виде, как h3S, так и HS-.

Сульфаты
Сульфаты (SO42-) – наряду с хлоридами являются наиболее распространенными видами загрязнения в воде. Они поступают в воду вследствие вымывания осадочных горных пород, выщелачивания почвы и иногда вследствие окисления сульфидов и серы – продуктов расклада белка из сточных вод. Большое содержание сульфатов в воде может быть причиной болезней пищеварительного тракта, а также такая вода может вызывать коррозию бетона и железобетонных конструкций.Двуокись углерода
Двуокись углерода (CO2) – в зависимости от реакции pH воды может быть в следующих видах:- pH < 4,0 – в основном, как газ CO2;
- pH = 8,4 – в основном в виде иона бикарбоната НСО3- ;
- pH > 10,5 – в основном в виде иона карбоната CO32-.
Агрессивная двуокись углерода – это часть свободной двуокиси углерода (CO2), которая необходима для удержания растворенных в воде углеводородов от разложения. Она очень активна и вызывает коррозию металлов. Кроме того, приводит к растворению карбоната кальция СаСО3 в строительных растворах или бетоне и поэтому ее необходимо удалять из воды, предназначенной для строительных целей.
 При оценке агрессивности воды, наряду с агрессивной концентрацией двуокиси углерода, следует также учитывать содержание солей в воде (солесодержание). Вода с одинаковым содержанием агрессивного CO2, тем более агрессивна, чем выше ее солесодержание.
При оценке агрессивности воды, наряду с агрессивной концентрацией двуокиси углерода, следует также учитывать содержание солей в воде (солесодержание). Вода с одинаковым содержанием агрессивного CO2, тем более агрессивна, чем выше ее солесодержание.Растворенный кислород
Поступление кислорода в водоем происходит путем растворения его при контакте с воздухом (абсорбции), а также в результате фотосинтеза водными растениями. Содержание растворенного кислорода зависит от температуры, атмосферного давления, степени турбулизации воды, минерализации воды и др. В поверхностных водах содержание растворенного кислорода может колебаться от 0 до 14 мг/л. В артезианской воде кислород практически отсутствует.Относительное содержание кислорода в воде, выраженное в процентах его нормального содержания и называется степенью насыщения кислородом. Этот параметр зависит от температуры воды, атмосферного давления и уровня минерализации. Вычисляется по формуле: M = (ax0,1308×100)/NxP, где
М – степень насыщения воды кислородом, %;
а – концентрация кислорода, мг/дм3;
Р – атмосферное давление в данной местности, МПа.
N – нормальная концентрация кислорода при данной температуре и общем давлении 0,101308 МПа, приведенная в следующей таблице:
Растворимость кислорода в зависимости от температуры воды
Температура воды, °С | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
мг О2/дм3 | 14,6 | 11,3 | 9,1 | 7,5 | 6,5 | 5,6 | 4,8 | 2,9 | 0,0 |
Окисляемость
Окисляемость – это показатель, характеризующий содержание в воде органических и минеральных веществ, окисляемых сильным окислителем.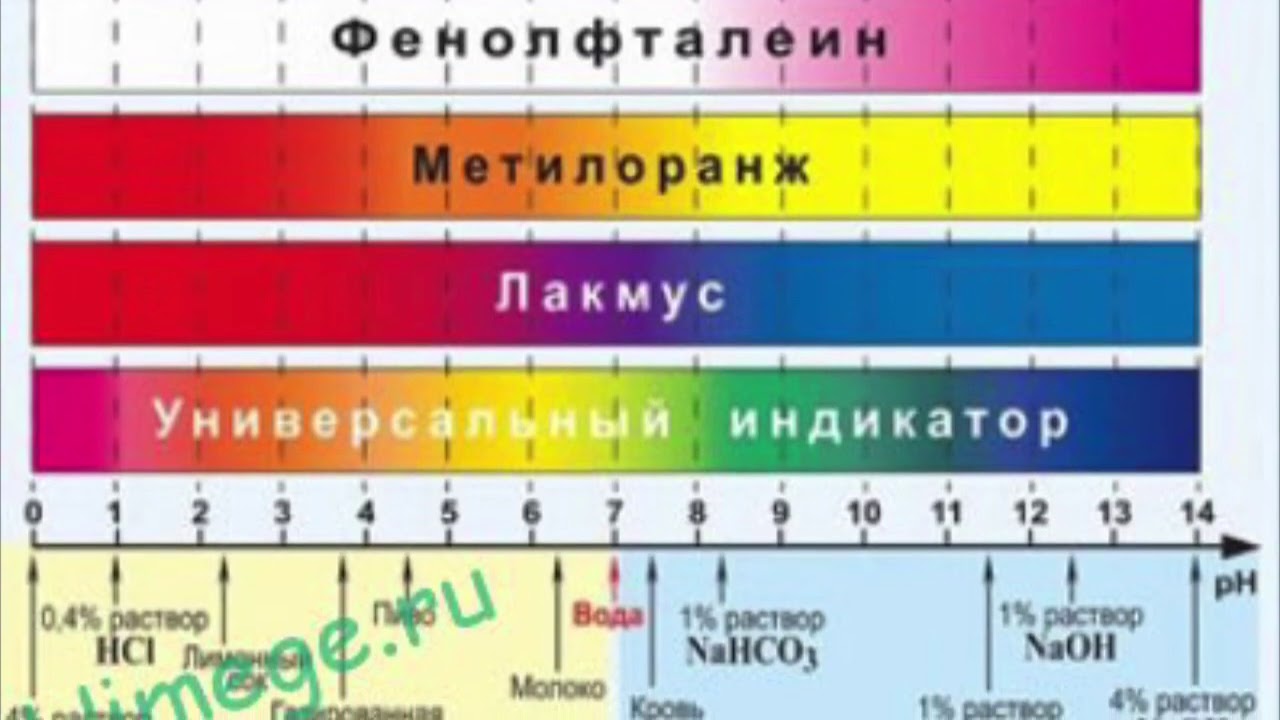 Окисляемость выражается в мгO2 необходимого на окисление этих веществ, содержащихся в 1 дм3 исследованной воды.
Окисляемость выражается в мгO2 необходимого на окисление этих веществ, содержащихся в 1 дм3 исследованной воды.Различают несколько видов окисляемости воды: перманганатную (1 мг KMnO4 соответствует 0,25 мг O2), бихроматную, иодатную, цериевую. Наиболее высокая степень окисления достигается бихроматным и иодатным методами. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах – как правило, бихроматную окисляемость (называемую также ХПК – химическое потребление кислорода). Окисляемость является очень удобным комплексным параметром, позволяющим оценить общее загрязнение воды органическими веществами. Органические вещества, находящиеся в воде весьма разнообразны по своей природе и химическим свойствам. Их состав формируется как под влиянием биохимических процессов протекающих в водоеме, так и за счет поступления поверхностных и подземных вод, атмосферных осадков, промышленных и хозяйственно-бытовых сточных вод. Величина окисляемости природных вод может варьироваться в широких пределах от долей миллиграммов до десятков миллиграммов О2 на литр воды.
Поверхностные воды имеют более высокую окисляемость, а значит в них содержится высокие концентрации органических веществ по сравнению с подземными. Так, горные реки и озера характеризуются окисляемостью 2-3 мг О2/дм3, реки равнинные – 5-12 мг О2/дм3, реки с болотным питанием – десятки миллиграммов на 1 дм3.
Подземные же воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграмма О2/дм3 (исключения составляют воды в районах нефтегазовых месторождений, торфяников, в сильно заболоченных местностях, подземных вод северной части РФ).
Электропроводность
Электропроводность – это численное выражение способности водного раствора проводить электрический ток. Электрическая проводимость природной воды зависит в основном от степени минерализации (концентрации растворенных минеральных солей) и температуры. Благодаря этой зависимости, по величине электропроводности можно с определенной степенью погрешности судить о минерализации воды. Такой принцип измерения используется, в частности, в довольно распространенных приборах оперативного измерения общего солесодержания (так называемых TDS-метрах).
Дело в том, что природные воды представляют собой растворы смесей сильных и слабых электролитов. Минеральную часть воды составляют преимущественно ионы натрия (Na+), калия (K+), кальция (Ca2+), хлора (Cl–), сульфата (SO42–), гидрокарбоната (HCO3–).
Этими ионами и обуславливается в основном электропроводность природных вод. Присутствие же других ионов, например трехвалентного и двухвалентного железа (Fe3+ и Fe2+), марганца (Mn2+), алюминия (Al3+), нитрата (NO3–), HPO4–, h3PO4– и т.п. не столь сильно влияет на электропроводность (конечно при условии, что эти ионы не содержатся в воде в значительных количествах, как например, это может быть в производственных или хозяйственно-бытовых сточных водах). Погрешности же измерения возникают из-за неодинаковой удельной электропроводимости растворов различных солей, а также из-за повышения электропроводимости с увеличением температуры. Однако, современный уровень техники позволяет минимизировать эти погрешности, благодаря заранее рассчитанным и занесенным в память зависимостям.
Электропроводность не нормируется, но величина 2000 мкС/см примерно соответствует общей минерализации в 1000 мг/л.
Окислительно-восстановительный потенциал (редокс-потенциал, Eh)
Окислительно-восстановительный потенциал (мера химической активности) Eh вместе с рН, температурой и содержанием солей в воде характеризует состояние стабильности воды. В частности этот потенциал необходимо учитывать при определении стабильности железа в воде. Eh в природных водах колеблется в основном от -0,5 до +0,7 В, но в некоторых глубоких зонах Земной коры может достигать значений минус 0,6 В (сероводородные горячие воды) и +1,2 В (перегретые воды современного вулканизма).Подземные воды классифицируются:
- Eh > +(0,1–1,15) В – окислительная среда; в воде присутствует растворенный кислород, Fe3+, Cu2+, Pb2+, Mo2+ и др.
- Eh – 0,0 до +0,1 В – переходная окислительно-восстановительная среда, характеризуется неустойчивым геохимическим режимом и переменным содержанием кислорода и cероводорода, а также слабым окислением и слабым восстановлением разных металлов;
- Eh < 0,0 – восстановительная среда; в воде присутствуют сероводород и металлы Fe2+, Mn2+, Mo2+ и др.

Зная значения рН и Eh, можно по диаграмме Пурбэ установить условия существования соединений и элементов Fe2+, Fe3+, Fe(ОН)2, Fe(ОН)3, FeСО3, FeS, (FeOH)2+.
pH и вода
• Школа наук о воде ГЛАВНАЯ • Темы о свойствах воды • Темы о качестве воды •
pH и вода
Нет, вы не часто слышите, как местный новостной телеканал говорит: «Ребята, сегодняшнее значение pH Dryville Creek составляет 6,3!» Но pH — довольно важный показатель воды. Может быть, для научного проекта в школе вы взяли pH воды в образцах на уроке химии … а здесь, в Геологической службе США, мы измеряем pH всякий раз, когда изучается вода.Мало того, что pH ручья влияет на организмы, живущие в воде, изменение pH в ручье может быть индикатором увеличения загрязнения или какого-либо другого фактора окружающей среды.
pH: единицы определения и измерения
Кстати ….. для того, чтобы раствор имел pH, он должен быть водным (содержать воду). Таким образом, у вас не может быть pH растительного масла или алкоголя.
Таким образом, у вас не может быть pH растительного масла или алкоголя.
pH — это показатель кислотности / щелочности воды. Диапазон составляет от 0 до 14, где 7 нейтрально.pH менее 7 указывает на кислотность, тогда как pH более 7 указывает на основание. pH на самом деле является мерой относительного количества свободных ионов водорода и гидроксила в воде. Вода с большим количеством свободных ионов водорода является кислой, тогда как вода с большим количеством свободных гидроксил-ионов является щелочной. Поскольку на pH могут влиять химические вещества в воде, pH является важным показателем химического изменения воды. pH указывается в «логарифмических единицах». Каждое число означает 10-кратное изменение кислотности / щелочности воды.Вода с рН пять в десять раз более кислая, чем вода с рН шесть.
Важность pH
pH воды определяет растворимость (количество, которое может быть растворено в воде) и биологическую доступность (количество, которое может быть использовано водными организмами) химических компонентов, таких как питательные вещества (фосфор, азот и углерод) и тяжелые металлы (свинец , медь, кадмий и др.). Например, помимо влияния на то, сколько и какая форма фосфора наиболее распространена в воде, pH также определяет, могут ли водные организмы использовать его.В случае тяжелых металлов степень их растворимости определяет их токсичность. Металлы имеют тенденцию быть более токсичными при более низком pH, потому что они более растворимы. (Источник: Путеводитель для гражданина по пониманию и мониторингу озер и ручьев)
Диаграмма pH
Как показано на этой диаграмме, pH находится в диапазоне от 0 до 14, где 7 является нейтральным. pH менее 7 является кислым, а pH более 7 — щелочным (основным). Нормальные осадки имеют pH около 5,6 — слабокислый из-за углекислого газа из атмосферы .Вы можете видеть, что кислотный дождь может быть очень кислым и может негативно повлиять на окружающую среду.
Шкала pH варьируется от 0 до 14, 7 — нейтральный. pH менее 7 является кислым, а pH более 7 — щелочным (основным).
Кредит: robin_ph / stock.adobe.com
Измерение pH
Геологическая служба США ежегодно анализирует сотни тысяч проб воды. Многие измерения проводятся прямо в полевых условиях, и еще больше — на пробах воды в лаборатории.pH — важное измерение воды, которое часто измеряется как на месте отбора проб, так и в лаборатории. Есть большие и маленькие модели pH-метров. Доступны портативные модели, которые можно взять с собой в поле, а более крупные модели, такие как эта, используются в лаборатории.
Для использования pH-метра на фотографии ниже образец воды помещается в чашку, а стеклянный зонд на конце выдвижного рычага помещается в воду. Внутри тонкой стеклянной колбы на конце зонда есть два электрода, измеряющих напряжение.Один электрод содержится в жидкости с фиксированной кислотностью или pH. Другой электрод реагирует на кислотность пробы воды. Вольтметр в зонде измеряет разницу между напряжениями двух электродов. Затем измеритель переводит разность напряжений в pH и отображает его на маленьком экране основного блока.
Портативный электронный pH-метр.
Перед измерением pH измеритель должен быть «откалиброван». Зонд погружают в раствор с известным pH, например чистую воду с нейтральным pH 7.0. Ручки на блоке используются для регулировки отображаемого значения pH до известного значения pH раствора, таким образом калибруя измеритель.
Измерение pH дома или в школе
Один из самых популярных школьных научных проектов — измерение pH воды из разных источников. Скорее всего, в вашей школе (и, конечно, не у вас) нет электронного pH-метра, но вы все равно можете получить оценку pH с помощью лакмусовой бумаги. Лакмусовая бумага, которую можно найти в магазинах зоотоваров (для проверки уровня pH в аквариумах), представляет собой просто полоску бумаги, которая при падении на нее образца воды приобретает определенный цвет, что дает приблизительную оценку pH.
pH и качество воды
Чрезмерно высокие и низкие значения pH могут отрицательно сказаться на использовании воды. Высокий pH вызывает горький вкус, водопроводные трубы и водопроводные приборы покрываются отложениями , что снижает эффективность дезинфекции хлора, тем самым вызывая потребность в дополнительном хлоре при высоком pH. Вода с низким pH разъедает или растворяет металлы и другие вещества.
Загрязнение может изменить pH воды, что, в свою очередь, может нанести вред животным и растениям, живущим в воде.Например, вода , выходящая из заброшенной угольной шахты , может иметь pH 2, что является очень кислым и определенно повлияет на любую рыбу, достаточно сумасшедшую, чтобы попытаться жить в ней! Если использовать логарифм, то эта шахтная дренажная вода будет в 100 000 раз более кислой, чем нейтральная вода — так что держитесь подальше от заброшенных шахт .
Изменение pH в США
pH осадков и водоемов сильно различается по территории Соединенных Штатов.Природные и человеческие процессы определяют pH воды. Национальная программа атмосферных отложений разработала карты, показывающие модели pH, такие как приведенная ниже, показывающая пространственную картину pH осадков на полевых участках за 2002 год. Вы должны знать, что эта контурная карта была разработана с использованием измерений pH при конкретном отборе проб. локации; таким образом, контуры и изолинии были созданы с использованием интерполяции между точками данных. Вам не обязательно использовать карту для документирования pH в других конкретных точках карты, а, скорее, использовать карту как общий индикатор pH по всей стране.
Примечание. На этой карте показан один момент времени, и с 2002 года наблюдается общее сокращение количества факторов, вызывающих кислотные дожди. Более новая карта может сильно отличаться от этой. Тем не менее, более низкие значения pH осадков по-прежнему будут наблюдаться на северо-востоке США
.pH воды — системы измерения окружающей среды
Что такое pH?
pH — это определенное значение на основе определенной шкалы, аналогичное температуре. Это означает, что pH воды не является физическим параметром, который можно измерить как концентрацию или количество.Вместо этого это число от 0 до 14, определяющее, насколько кислым или основным является водоем по логарифмической шкале ¹. Чем меньше число, тем более кислая вода. Чем выше число, тем оно более базовое. PH 7 считается нейтральным. Логарифмическая шкала означает, что каждое число ниже 7 в 10 раз более кислое, чем предыдущее при обратном отсчете. Точно так же, если считать выше 7, каждое число в 10 раз больше основного, чем предыдущее число ².
Логарифмическая шкала pH означает, что по мере увеличения pH концентрация H + будет уменьшаться в 10 степени.Таким образом, при pH 0 концентрация H + составляет 1 M. При pH 7 она снижается до 0,0000001 M. При pH 14 концентрация H + составляет всего 0,00000000000001.pH означает «мощность водорода» ³. Числовое значение pH определяется молярной концентрацией ионов водорода (H +) ³. Это делается путем отрицательного логарифма концентрации H + (-log (H +)). Например, если раствор имеет концентрацию H + 10 -3 M, pH раствора будет -log (10 -3 ), что равно 3.
Это определение связано с влиянием ионов водорода (H +) и гидроксильных ионов (OH-) на pH. Чем выше концентрация H +, тем ниже pH, и чем выше концентрация OH-, тем выше pH. При нейтральном pH 7 (чистая вода) концентрация как ионов H +, так и ионов OH- составляет 10⁻⁷ M. Таким образом, ионы H + и OH- всегда спарены — по мере увеличения концентрации одного из них концентрация другого будет уменьшаться; независимо от pH сумма ионов всегда будет равна 10⁻¹⁴ M². Из-за этого влияния H + и OH- относятся к основным определениям кислот и оснований.
Кислоты и основания
Пары кислота-основание могут нейтрализовать друг друга, как H + и OH- в этом уравнении. Согласно рабочему определению, кислота — это вещество, которое снижает pH при добавлении в чистую воду. Таким же образом основа — это вещество, которое увеличивает pH воды ⁴. Для дальнейшего определения этих веществ Аррениус определил в 1884 году, что кислота выделяет ион водорода (H +) при растворении в воде, а основание выделяет ион гидроксила (OH-) в воде ⁴.Однако есть некоторые вещества, которые подходят под рабочее определение (изменение pH), но не подходят под определение Аррениуса (высвобождение иона). Чтобы учесть это, Бренстед и Лоури пересмотрели определение кислот и оснований; кислота выделяет ион водорода или протон (эквивалент H +), а основание принимает ион водорода или протон ⁴. Это означает, что кислоты и основания могут нейтрализовать друг друга, как показано в уравнении воды справа.
Основные или щелочные
Общие примеры щелочей включают молоко магнезии — Mg (OH) 2, едкий калий — KOH, гашеную известь / известковую воду — Ca (OH) 2 и едкий натр (щелок) — NaOH. Термины «щелочной» и «основной» означают примерно одно и то же. Согласно определению Брэнстеда-Лоури, основа описывает любое вещество, которое снижает концентрацию ионов водорода и увеличивает pH воды, или, другими словами, основание. Щелочь происходит от щелочи, которая относится к ионным соединениям (солям), содержащим щелочные или щелочноземельные металлы, которые при растворении в воде образуют гидроксид-ионы ⁵. Щелочные соли очень распространены и легко растворяются. Из-за производимых ими гидроксид-ионов (которые увеличивают pH) все щелочи являются основаниями.Некоторые источники определяют любое растворимое основание как щелочь ⁵. По существу, растворимые основания могут быть описаны как «основные» или «щелочные». Однако нерастворимые основания (такие как оксид меди) следует описывать только как основные, а не щелочные.
Щелочность и pH воды
Щелочность и pH напрямую связаны при 100% -ном насыщении воздухом.Щелочность не относится к щелочам в отличие от щелочей ⁶. Хотя щелочность и pH тесно связаны, между ними есть явные различия. Щелочность воды или раствора — это количественная способность этого раствора буферизовать или нейтрализовать кислоту.Другими словами, щелочность — это показатель способности воды противостоять изменениям pH. Этот термин используется как синоним кислотонейтрализующей способности (ANC) ⁷. Если водоем имеет высокую щелочность, это может ограничить изменения pH из-за кислотных дождей, загрязнения или других факторов ⁸. Щелочность ручья или другого водоема увеличивается за счет богатых карбонатами почв (карбонаты и бикарбонаты), таких как известняк, и уменьшается за счет оттока сточных вод и аэробного дыхания. Из-за присутствия карбонатов щелочность более тесно связана с жесткостью, чем с pH (хотя все же есть явные различия).Однако изменения pH также могут влиять на уровень щелочности (при понижении pH снижается и буферная способность воды) ⁶. pH и щелочность напрямую связаны, когда вода имеет 100% насыщение воздухом ⁹.
Щелочность воды также играет важную роль в ежедневном уровне pH. В процессе фотосинтеза водорослями и растениями используется водород, тем самым повышая уровень pH ¹⁰. Точно так же дыхание и разложение могут снизить уровень pH. Большинство водоемов способны нейтрализовать эти изменения благодаря своей щелочности, поэтому небольшие или локализованные колебания быстро видоизменяются, и их может быть трудно обнаружить ¹⁰.
Единицы измерения pH и щелочности
Значения pH определяются в логарифмической шкале.значения pH указываются в виде числа от 0 до 14 в качестве стандартной единицы pH. Эта единица эквивалентна отрицательному логарифму молярной концентрации ионов водорода (-log (H +)) в растворе. В зависимости от точности измерения значение pH может быть указано с точностью до одного или двух десятичных знаков.
Однако, поскольку шкала pH логарифмическая, попытка усреднить два значения pH была бы математически неверной.Если требуется среднее значение, его можно сообщить как медианное значение или диапазон, а не как простой расчет ¹⁰.
Щелочность может быть выражена в мг / л или в микроэквивалентах на литр (мэкв / л). Когда в мг / л, это относится к концентрациям карбоната (CO3 2- ), бикарбоната (HCO3 — ) или карбоната кальция (CaCO3), хотя карбонат кальция является наиболее распространенным ¹¹.
Щелочность 1 мг / л в пересчете на CaCO3 = 0,01998 мег / л щелочность
Щелочность 1 мг / л в пересчете на CaCO3 = 0,5995 мг / л щелочность в пересчете на CO3 2-
Щелочность 1 мг / л при CaCO3 = 1.2192 мг / л щелочность по HCO3 —
Почему важен pH?
Если pH воды слишком высокий или слишком низкий, водные организмы, живущие в ней, погибнут. pH также может влиять на растворимость и токсичность химических веществ и тяжелых металлов в воде ¹². Большинство водных существ предпочитают диапазон pH 6,5-9,0, хотя некоторые могут жить в воде с уровнем pH за пределами этого диапазона.
Уровни pH в воде. Оптимальный уровень pH для рыб — от 6,5 до 9.0. За пределами оптимальных диапазонов организмы могут подвергнуться стрессу или умереть.По мере того, как уровни pH выходят из этого диапазона (вверх или вниз), это может вызвать стресс у систем животных и снизить показатели вылупления и выживаемости. Чем дальше значение pH выходит за пределы оптимального диапазона, тем выше уровень смертности. Чем более чувствителен вид, тем больше на него влияют изменения pH. Помимо биологических эффектов, экстремальные уровни pH обычно увеличивают растворимость элементов и соединений, делая токсичные химические вещества более «мобильными» и увеличивая риск поглощения их водными организмами ¹³.
Не только водные виды подвержены влиянию pH. Хотя люди имеют более высокую толерантность к уровням pH (уровни для питья колеблются от 4 до 11 с минимальным раздражением желудочно-кишечного тракта), все еще существуют проблемы ¹⁴. Значения pH выше 11 могут вызвать раздражение кожи и глаз, равно как и pH ниже 4. Значение pH ниже 2,5 вызовет необратимое повреждение кожи и внутренних органов ¹⁴. Более низкие уровни pH увеличивают риск мобилизации токсичных металлов, которые могут поглощаться даже людьми, и уровни выше 8.0 нельзя эффективно дезинфицировать хлором, что вызывает другие косвенные риски ¹⁴. Кроме того, уровни pH за пределами 6,5-9,5 могут повредить трубы и другие системы и вызвать коррозию, что еще больше повысит токсичность тяжелых металлов.
Незначительное повышение уровня pH может привести к тому, что олиготрофное (богатое растворенным кислородом) озеро станет эвтрофным (без растворенного кислорода). Даже незначительные изменения pH могут иметь долгосрочные последствия. Небольшое изменение pH воды может увеличить растворимость фосфора и других питательных веществ, что сделает их более доступными для роста растений ¹⁰.В олиготрофном озере или озере с низким содержанием питательных веществ для растений и высоким уровнем растворенного кислорода это может вызвать цепную реакцию. Имея более доступные питательные вещества, водные растения и водоросли процветают, увеличивая потребность в растворенном кислороде. Это создает эвтрофное озеро, богатое питательными веществами и растениями, но с низким содержанием растворенного кислорода. В эвтрофном озере другие организмы, живущие в воде, подвергаются стрессу, даже если уровень pH остается в оптимальном диапазоне.
Факторы, влияющие на pH воды
Есть много факторов, которые могут повлиять на pH в воде, как естественные, так и искусственные.Большинство естественных изменений происходит из-за взаимодействия с окружающими породами (особенно карбонатными формами) и другими материалами. pH также может колебаться в зависимости от осадков (особенно кислотных дождей), сточных вод или горных стоков ¹³. Кроме того, концентрация CO2 может влиять на уровень pH.
Углекислый газ и pH
Уровни pH могут изменяться ежедневно из-за фотосинтеза и дыхания в воде. Степень изменения зависит от щелочности воды.Двуокись углерода — наиболее частая причина кислотности воды ¹⁵.Фотосинтез, дыхание и разложение — все это способствует колебаниям pH из-за своего влияния на уровень CO2. Крайность этих изменений зависит от щелочности воды, но часто наблюдаются заметные суточные (суточные) колебания ¹⁶. Это влияние более ощутимо в водоемах с высокой скоростью дыхания и разложения.
Хотя углекислый газ существует в воде в растворенном состоянии (например, кислород), он также может реагировать с водой с образованием угольной кислоты:
CO2 + h3O <=> h3CO3
h3CO3 может затем потерять один или оба своих иона водорода. :
h3CO3 <=> HCO3 — + H +….HCO3 — <=> CO3 2- + H +
Высвободившиеся ионы водорода снижают pH воды¹⁵. Однако это уравнение может работать в обоих направлениях в зависимости от текущего уровня pH, работая как собственная буферная система. При более высоком pH эта бикарбонатная система будет сдвигаться влево, и CO3 2- улавливает свободный ион водорода.
Эта реакция обычно минимальна, поскольку h3CO3 имеет низкую константу растворимости (закон Генри) ¹⁵. Однако по мере увеличения уровня CO2 во всем мире количество растворенного CO2 также увеличивается, и уравнение будет выполняться слева направо.Это увеличивает h3CO3, что снижает pH. Эффект становится все более очевидным в исследованиях pH океана с течением времени.
Общее изменение годовых уровней pH океана с 1700-х по 1990-е годы. (данные: Атлас Мирового океана 2009; фото: Plumbago; Wikipedia Commons) Углекислый газ в атмосфере снижает pH осадков.Приведенные выше уравнения также объясняют, почему дождь имеет pH примерно 5,65 ¹⁵. Когда капли дождя падают в воздух, они взаимодействуют с молекулами углекислого газа в атмосфере.В результате в каплях дождя образуется h3CO3, что снижает уровень pH дождя ¹⁷. Уровень pH 5,65, хотя и является кислым, не считается кислотным дождем. Ожидается, что естественный, незагрязненный дождь или снег будет иметь уровень pH около 5,6 при стандартной концентрации CO2 в атмосфере 0,0355% ¹⁵. Кислотный дождь требует pH ниже 5,0 ².
5,65 — это также pH воды, которая уравновешивается с воздухом и не контактирует с карбонатными материалами или известняком.
Влияние естественного pH
Карбонатные материалы и известняк — два элемента, которые могут нейтрализовать изменения pH в воде.Карбонат кальция (CaCO3) и другие бикарбонаты могут объединяться как с ионами водорода, так и с гидроксильными ионами для нейтрализации pH¹⁸. Когда в почве присутствуют карбонатные минералы, буферная способность (щелочность) воды увеличивается, поддерживая pH воды близким к нейтральному даже при добавлении кислот или оснований. Дополнительные карбонатные материалы могут сделать нейтральную воду слегка щелочной.
Известняковые карьеры имеют более высокий уровень pH из-за карбонатных материалов в камне. Молния может снизить pH дождя.Как упоминалось ранее, незагрязненный дождь имеет слабокислый характер (pH 5,6). Уровень pH дождя также может быть понижен из-за вулканического пепла, сульфатредуцирующих бактерий на заболоченных территориях, взвешенных в воздухе твердых частиц от лесных пожаров и даже молний ¹⁹. Если дождь выпадает на источник воды с плохой буферностью, он может снизить pH воды поблизости из-за стока.
Разложение хвои может снизить pH. Хвоя сосны или пихты также может снижать pH почвы и воды, протекающей по ней, поскольку они разлагаются ¹⁸. Интенсивный фотосинтез увеличивает pH воды, поскольку она удаляет CO2, хотя это изменение обычно является суточным ²⁰.
Искусственные факторы воздействия на pH
Загрязнения воздуха, почвы или непосредственно в воде могут влиять на pH.Антропогенные причины колебаний pH обычно связаны с загрязнением. Кислотный дождь — один из самых известных примеров влияния человека на pH воды. Любая форма осадков с уровнем pH менее 5,0 известна как кислотный дождь ²¹. Это осаждение происходит в результате реакции воды с оксидами азота, оксидами серы и другими кислотными соединениями, что снижает и без того слабокислый pH.Эти выбросы обычно происходят в результате горнодобывающих и плавильных работ или сжигания ископаемого топлива (сжигание угля и автомобили) ¹⁸. Чрезвычайно высокий уровень CO2 также может еще больше снизить pH дождя ¹⁷.
Загрязнение из точечных источников — распространенная причина, которая может повышать или понижать pH в зависимости от химических веществ ¹⁸. Эти химические вещества могут поступать из сельскохозяйственных стоков, сточных вод или промышленных стоков. Добыча полезных ископаемых (особенно угля) вызывает кислотный сток и просачивание кислых грунтовых вод, если окружающая почва плохо забуферирована ²².Сброс сточных вод, содержащих моющие средства и продукты на основе мыла, может привести к тому, что источник воды станет слишком простым.
Типичные уровни pH
Рекомендуемые минимальные уровни pH для водных организмов.Типичные уровни pH меняются из-за влияния окружающей среды, особенно щелочности. Щелочность воды зависит от наличия растворенных солей и карбонатов, а также от минерального состава окружающей почвы. Как правило, чем выше щелочность, тем выше pH; чем ниже щелочность, тем ниже pH.Рекомендуемый диапазон pH для большинства рыб составляет от 6,0 до 9,0 с минимальной щелочностью 20 мг / л, с идеальным уровнем CaCO3 от 75 до 200 мг / л²⁰.
Океаническим организмам, таким как рыба-клоун и коралл, требуется более высокий уровень pH. Уровень pH ниже 7,6 приведет к разрушению коралловых рифов из-за недостатка карбоната кальция ³⁹. Чувствительные пресноводные виды, такие как лосось, предпочитают уровни pH от 7,0 до 8,0, сильно расстраиваясь и страдая от физиологических повреждений из-за поглощения металлов на уровнях ниже 6.0 ⁴⁰.
Соображения окружающей среды
Естественные осадки, как дождевые, так и снежные, имеют pH около 5,6 из-за контакта с CO2 и других атмосферных воздействий. Большинство злаковых и бобовых культур предпочитают почвы с pH 4,5-7,0, поэтому небольшая кислотность дождя может принести пользу карбонатным почвам ²³.
Кислотность окружающей среды также может влиять на pH воды. Это наиболее очевидно вблизи районов добычи полезных ископаемых, но эффект также может возникать естественным образом. Кислотный сток снижает щелочность воды и снижает pH ниже оптимального уровня.Это может быть терпимо для некоторых водных видов (например, лягушек), но не для большинства рыб. Некоторые лягушки и другие земноводные часто переносят уровень pH ниже 4,0 ². Кислые почвы в Амазонке приводят к тому, что многие озера и реки естественным образом имеют низкие значения pH ³⁸. Из-за растворенных гуминовых веществ от стока и поглощения источники «черной воды» могут иметь pH всего 4,43. Источники «Клируотер» будут иметь немного более высокое, но все же кислое значение pH ³⁸. Вот почему рыбы-ангелы и дискусы из бассейна реки Амазонки могут вполне успешно развиваться в водах с pH всего 5.0 ²⁵.
Морская вода имеет pH около 8,2, хотя он может колебаться от 7,5 до 8,5 в зависимости от местной солености. Уровень pH будет увеличиваться с увеличением солености, пока вода не достигнет насыщения карбонатом кальция (CaCO3) ¹⁶. Океаны обычно имеют более высокую щелочность из-за содержания карбонатов и, таким образом, обладают большей способностью буферизовать свободные ионы водорода ²⁷.
Пресноводные озера, пруды и ручьи обычно имеют pH 6-8 в зависимости от окружающей почвы и коренных пород ²¹. В более глубоких озерах, где происходит расслоение (расслоение), pH воды обычно выше (7.5-8,5) у поверхности и ниже (6,5-7,5) на большей глубине ¹⁰. Некоторые штаты, такие как Аляска, пытаются поддерживать стандарт pH для качества воды. Стандарт качества воды Аляски требует уровней pH от 6,5 до 8,5 для защиты многих популяций лосося в штате ⁴⁰.
Соображения по стратификации
Стратификация может привести к тому, что уровни pH в водоеме будут различаться выше и ниже границы.Стратификация обычно вызывается разницей температур в водоеме, где каждый слой воды не смешивается со слоями выше или ниже ³⁷.Эти слои разделены клинами, известными как термоклины (температурные разницы) или хемоклины (химические градиенты). Хемоклины могут быть основаны на кислороде, солености или других химических факторах, которые не пересекают границу, таких как углекислый газ. Из-за влияния CO2 на pH воды стратификация может привести к тому, что уровни pH будут различаться в зависимости от климата.
Различия в уровнях pH между слоями воды возникают из-за увеличения CO2 в результате дыхания и разложения ниже термоклина. В кратерных озерах, таких как озеро Ниос или озеро Моноун, pH быстро падает с поверхностного уровня примерно с 7 до 5.5 ниже 60 м (на термоклине и хемоклине) ²⁶. Это значительное снижение происходит из-за насыщенного CO2, который накапливается в нижних слоях озера.
Приспособляемость
Хотя идеальные уровни pH для рыб составляют 7-8 (кровь рыб имеет pH 7,4) ²⁰, большинство рыб могут адаптироваться к уровню pH окружающей среды (6,0-9,0), если нет резких колебаний. . Резкое колебание считается сдвигом pH на 1,4 (вверх или вниз) ²². Для морской рыбы pH воды должен оставаться в пределах 7.5 и 8,5.
Необычные уровни pH и последствия
Каменные кораллы начинают обесцвечиваться и портиться по мере падения уровня карбоната и pH.Вредное воздействие становится заметным, когда pH воды падает ниже 5,0 или поднимается выше 9,6. Болезни из-за подкисления более выражены у морских рыб из-за их адаптации к более высокому pH. Когда pH ниже оптимального, рыба становится восприимчивой к грибковым инфекциям и другим физическим повреждениям ¹⁶. Когда pH воды падает, растворимость карбоната кальция снижается, что препятствует росту раковины у водных организмов ¹⁶.В целом, на воспроизводство рыб влияет уровень pH ниже 5,0, и многие виды (например, морская рыба или чувствительная пресноводная рыба, например, малоротый окунь) покидают этот район ²¹. Рыба начинает умирать, когда pH падает ниже 4,0 ².
Низкий уровень pH может способствовать растворимости тяжелых металлов ¹². По мере увеличения уровня ионов водорода катионы металлов, таких как алюминий, свинец, медь и кадмий, попадают в воду, а не поглощаются осадком. По мере увеличения концентрации тяжелых металлов их токсичность также увеличивается.Алюминий может ограничивать рост и размножение, увеличивая уровень смертности при концентрациях всего 0,1-0,3 мг / л²². Кроме того, мобилизованные металлы могут поглощаться организмами во время дыхания, вызывая физиологический ущерб ²². Это особенно пагубно для таких видов, как радужная форель ¹³.
С другой стороны, высокие уровни pH могут повредить жабры и кожу водных организмов и вызвать смерть при уровнях выше 10,0. В то время как некоторые африканские цихлиды хорошо себя чувствуют при высоком уровне pH (до 9.5), большинство рыб их не переносят. Смерть может наступить даже при типичном уровне (9,0), если в воде присутствует аммиак ²¹. При низком и нейтральном уровнях pH аммиак соединяется с водой с образованием иона аммония:
Nh4 + h3O <=> Nh5 + + OH —
Водоросли, устойчивые к низкому pH, могут образовывать цветы, которые могут убить озеро.Аммоний, Nh5⁺, нетоксичен и не влияет на водные организмы. Однако при уровне pH выше 9 уравнение меняется на противоположное, и аммиак попадает в воду ²².Аммиак, Nh4, чрезвычайно токсичен для водных организмов, и по мере увеличения pH уровень смертности увеличивается с увеличением концентрации Nh4.
Со стороны экосистемы мхи могут начать вторгаться в водоем, когда pH воды падает ниже 5. В эвтрофных озерах могут доминировать водоросли, толерантные к pH, доводя уровни pH до дневных высоких и низких экстремальных значений, формируя цветение водорослей может убить озеро ¹⁶.
Щелочные и кислотные озера
По всему миру разбросано множество озер с необычным уровнем pH.Щелочные озера, также известные как содовые озера, обычно имеют уровень pH от 9 до 12. Это часто связано с высоким содержанием соли (хотя не каждое соленое озеро имеет высокий pH). Эти озера имеют высокую концентрацию минералов, особенно растворенных солей: карбонатов и бикарбонатов натрия, кальция, магния ²⁸. В зависимости от озера также могут присутствовать бораты, сульфаты и другие элементы (обычно сильные основные ионы) ²⁹. Щелочные озера образуются, когда единственным выходом для воды является испарение, оставляя минералы для накопления ³.Эти минералы часто образуют колонны минеральных отложений, известные как колонны туфа. Многие щелочные озера являются коммерческим источником кальцинированной соды и поташа, в то время как другие являются популярными туристическими направлениями из-за их «волшебных» целебных свойств (из-за содержания минералов).
Мыльное озеро в Вашингтоне — щелочное озеро, которое, как предполагается, обладает целебными свойствами (Фото предоставлено Стивеном Павловым через Wikipedia Commons) Кальцинированный фламинго, сохранившийся благодаря содовым минералам в озере Натрон. (Фото: © Ник Брандт, 2013 г. Предоставлено галереей Hasted Kraeutler, Нью-Йорк.)Печально известный пример щелочного озера — озеро Натрон в Танзании. Озеро Натрон имеет pH до 10,5 из-за высоких концентраций декагидрата карбоната натрия (кальцинированной соды) и бикарбоната натрия (пищевой соды), которые попадают в воду из окружающей почвы ³¹. В то время как озеро поддерживает процветающую экосистему, в том числе фламинго, щелочную тилапию и водоросли, устойчивые к pH, фотограф Ник Брант создал множество захватывающих изображений животных, погибших в этом озере ³¹. Тела этих животных сохраняются карбонатом натрия, очень похоже на древнеегипетский процесс мумификации.
Кислотные озера обычно образуются возле вулканов, где серная кислота, сероводород, плавиковая кислота, соляная кислота и двуокись углерода могут попадать в воду ³². В невулканических районах кислотные озера могут также образовываться после кислотных отложений в результате таких явлений, как кислотные дожди, загрязнение или кислотный сток от горных работ ³³. Как и их щелочные аналоги, кислотные озера не имеют выхода, кроме испарения, в котором концентрируются сульфаты и кислоты. Кислоты могут попадать в воду в результате атмосферной диффузии в результате сжигания угля, кислотных дождей или после извержения.В вулканических озерах кислоты могут попадать в воду через активную фумаролу или вулканическое отверстие.
Отложения серы и железа на одном из кислых озер Даллола.Кислые озера в Даллоле в Эфиопии являются результатом кислотного выщелачивания из близлежащих вулканов. Сера и железо в воде оставляют желтые и ржавые отложения у кромки воды.
При уровне pH ниже 5,0 некоторые организмы могут жить в кислых озерах. Однако есть одно заметное исключение: ельца Осорезан, или японская ельца.Эта рыба процветает в кислых водах озера Осорезан, комфортно отдыхая при pH 3,5, и плавает в водах с нейтральным pH только для нереста ³⁴.
Окисление океана
По мере увеличения содержания CO2 в атмосфере растворенный CO2 будет увеличиваться, а pH воды снизится. (данные: NOAA / ESRL и Гавайский университет; кредит: SERC EarthLabs)Закисление океана вызвано притоком растворенного диоксида углерода. Поскольку уровни CO2 в атмосфере увеличиваются из-за антропогенных причин, растворенный CO2 также увеличивается, что, в свою очередь, снижает pH воды.
Когда вода насыщается CO2, это не только снижает pH океана, но и истощает источники карбоната кальция ³⁵. Карбонат кальция, CaCO3, является необходимым ингредиентом для построения кораллов, раковин и экзоскелетов многих водных существ. По мере снижения уровня CO3²⁻ морским существам становится все труднее строить свои раковины.
Как упоминалось в разделе «Двуокись углерода и pH», дополнительный CO2 увеличивает количество ионов водорода в воде, снижая pH:
CO2 + h3O <=> h3CO3… h3CO3 <=> (H +) + HCO3⁻
При уровне pH от 6.4 и 10.33, некоторые из этих ионов водорода присоединяются к карбонатным ионам ²²:
(H +) + CO3 2- <=> HCO3 —
Таким образом, по мере увеличения уровня CO2 доступность карбоната CO3 2- уменьшается, уменьшая количество ³⁶, доступное для строительства из ракушек и кораллов.
CO2 + h3O + CO3²⁻ <=> 2HCO3⁻
При pH в океане 8,3 уровень карбонатов достаточно высок для строительства кораллов. По мере увеличения CO2 и снижения pH уровень карбонатов быстро падает ниже оптимального уровня.Высокий уровень CO2 также затрудняет поддержание текущих скорлуп из-за более низкого уровня pH и конкуренции за карбонат ³⁵.
Кроме того, воздухонасыщение воды основано на парциальных давлениях из закона Генри. По мере увеличения уровня CO2 в воздухе увеличивается и их парциальное давление. Это снижает парциальное давление кислорода, снижая уровень его насыщения и способствуя гипоксии (низкий уровень O2) ³⁵.
Хотя океаны никогда не станут «кислыми» (с pH менее 7), даже небольшое понижение pH вызывает стресс у морских организмов и увеличивает уровень смертности.pH является логарифмическим, что означает, что уменьшение на 0,1 эквивалентно почти 30% увеличению кислотности ³⁵.
Процитируйте эту работу
Fondriest Environmental, Inc. «pH воды». Основы экологических измерений. 19 ноября 2013 г. Web.
Дополнительная информация
Имеет ли значение уровень pH питьевой воды
Прогуляйтесь по проходу с напитками в местном продуктовом магазине, и вы, вероятно, будете удивлены количеством различных видов бутилированной воды, которые вы увидите.Все они рекламируют что-то разное, от родниковой воды до обогащенной витаминами и всего остального. Вы также можете заметить, что на некоторых бутылках указан уровень pH в воде и то, как это может принести пользу вашему здоровью.
Но имеет ли значение уровень pH вашей воды?
Что такое pH?
С научной точки зрения, pH измеряет концентрацию иона водорода в растворе. Он основан на шкале, где 7 считается нейтральным. Растворы с более низкой концентрацией ионов водорода имеют более высокий pH (основной), а растворы с более высокой концентрацией — низкий pH (кислый).Например, апельсиновый сок имеет pH 3,3, что означает, что он кислый. Черный кофе имеет pH около 5, пищевая сода — около 9, а отбеливатель — pH 12. Не так много продуктов и напитков, которые потребляются людьми, с нейтральным pH выше 7,0.
Что такое pH воды?
pH воды имеет значение только в том случае, если она достаточно едкая, чтобы навредить вам. Большая часть коммерческой незагрязненной бутилированной воды не сделает вас здоровее или больнее из-за ее pH. В зависимости от источника и обработки, pH большинства бутилированной воды составляет от 5 до 8.
Вашему организму нравится поддерживать pH крови около 7,4, что является почти нейтральным. Уровень pH вашего тела зависит от того, насколько хорошо ваши почки выполняют свою работу. Если ваша вода слишком «кислая» или слишком «щелочная» (то есть она загрязнена едкими очистителями или кислотами), ваш pH может резко снизиться, что может вызвать сильное заболевание, повредить определенные ткани или даже убить вас.
У некоторых брендов воды в бутылках pH почти достигает 8, но чуть более щелочная вода не означает, что вы получите дополнительную пользу для здоровья.Нет никаких убедительных научных доказательств того, что употребление большего количества щелочной пищи или употребление щелочной воды помогает человеку избавиться от болезней, чем тот, кто этого не делает.
Сколько воды нужно пить каждый день?
Большинству людей рекомендуется выпивать 64 унции воды в день, но это всего лишь общая рекомендация. Некоторым людям может потребоваться больше, а некоторым — меньше, в зависимости от того, как проходит их день. Больше усилий в течение дня обычно означает, что вам нужно больше.Кроме того, если на улице более высокая температура, вам, вероятно, понадобится больше воды, чтобы избежать обезвоживания.
Как узнать, нужно ли пить больше воды?
Некоторые признаки обезвоживания:
- Ваша моча от среднего до темно-желтого
- У вас сухость во рту или горле
- Кожа на тыльной стороне ладони разглаживается после защемления
- Небольшая головная боль
Если вы испытываете какие-либо из этих симптомов, вам может потребоваться увеличить потребление воды на еще одну чашку или около того.Другие способы оставаться здоровыми и не иметь болезней — это есть больше фруктов и овощей, контролировать порции, есть больше цельнозерновых, вести активный образ жизни и заниматься физическими упражнениями не менее 30 минут или больше каждый день!
Когда дело доходит до гидратации, лучший совет — заменить питьевую газировку или чрезмерное количество фруктового сока водой — и в большинстве случаев простая водопроводная вода поможет.
Щелочная вода: лечебный напиток или всякая шумиха?
Все мы знаем, что ежедневное употребление большого количества воды может помочь вашему телу развиваться и предотвратить болезни.Фактически, надлежащее увлажнение необходимо почти для каждой функции организма. Однако сейчас продукт, получивший название щелочная вода, вызывает волну, и сторонники утверждают, что он может сбалансировать pH вашего тела, повысить энергию и предотвратить болезни.
Их теория: кислая среда способствует росту бактерий, поэтому, если вы измените свой рацион на более щелочной (менее кислый), вы избавитесь от вредных насекомых. К сожалению, эта теория не выдерживает критики, поскольку кислоты часто используются для уничтожения бактерий.
Так действительно ли полезны эти функциональные воды для здоровья? Здесь зарегистрированный диетолог-диетолог Келли Нол отвечает на часто задаваемые вопросы о последних тенденциях в области h3O в Америке.
В: Что такое щелочная вода?
A: Щелочь относится к части шкалы pH. Эта шкала от 0 до 14, более низкие числа более кислые, а более высокие числа более щелочные, а 7 — нейтральные. Большинство щелочных вод имеют pH 8 или 9, тогда как чистая вода имеет нейтральный pH 7. Идея состоит в том, что питьевая щелочная вода противодействует повышенной кислотности в организме.
В: Изменяет ли щелочная вода естественный уровень pH в организме?
A: Не совсем.В большинстве случаев уровень pH в крови составляет 7; он попадает прямо в середину шкалы pH. То, что вы едите и пьете, меняет только pH вашей мочи. Поэтому, когда вы пьете щелочную воду, вы меняете pH всего содержимого унитаза, а не крови. Кроме того, когда щелочная вода, которую вы пьете, попадает в желудок, кишечные кислоты нейтрализуют ее. По сути, вы платите много денег, чтобы выпить чего-нибудь, что не повлияет на кислотность вашего тела.
В. Является ли обычная водопроводная вода щелочной?
A: Чистая вода имеет pH 7, поэтому, как и ваша кровь, она нейтральна.Уровень pH воды из-под крана обычно колеблется в пределах 6,5-8,5. Он также содержит важные минералы, такие как кальций, магний, калий, бикарбонат и кремнезем. Фактически, в зависимости от того, где добывается водопроводная вода, она может обеспечить от 1 до 20 процентов вашей дневной потребности в кальции и магнии. Жесткая вода более щелочная и содержит больше минералов, чем мягкая.
В: Может ли щелочная вода помочь уменьшить симптомы кислотного рефлюкса?
A: Есть несколько исследований, которые предполагают, что употребление щелочной воды инактивирует пепсин, фермент, ответственный за кислотный рефлюкс.Но эти исследования проводились в чашке Петри, а не на людях, поэтому на самом деле невозможно сказать, как щелочная вода повлияет на пациентов с кислотным рефлюксом.
В: Если питьевая щелочная вода не имеет значения, как мы можем изменить pH нашего тела?
A: Человеческое тело — замечательная и сложная машина. Если у вас есть дисбаланс в уровне pH, ваше тело исправит его, независимо от того, что вы пьете. Например, если ваша кровь станет слишком кислой, вы выдохнете больше углекислого газа.Почки также могут выводить избыток кислоты с мочой.
В: Может ли пить щелочная вода вызывать проблемы?
A: Бутылка щелочной воды через день не сильно повлияет на ваше тело. Однако, если вы ежедневно выпиваете галлон щелочной воды, вашему организму приходится много работать, чтобы поддерживать свой pH, а это означает, что со временем ваше тело будет производить больше желудочного сока и пищеварительных ферментов. У людей, страдающих заболеванием почек или принимающих лекарства, изменяющие их функцию почек, минералы в щелочной воде могут начать накапливаться в их организме.
Если вас беспокоит, что ваша диета слишком кислая, соблюдайте противовоспалительную диету и наполните тарелку фруктами и овощами. В целом продукты животного происхождения, кофеин, соль и сахар являются кислотообразующими, тогда как фрукты, овощи и цельнозерновые продукты являются более щелочными.
Чтобы записаться на прием к зарегистрированному диетологу в Henry Ford, посетите сайт henryford.com или позвоните по телефону 1-855-434-5483 .
Вы также можете прочитать больше советов по питанию и фитнесу в разделах EatWell и MoveWell, так что подпишитесь, чтобы получать все самые свежие советы.
Келли Нол — зарегистрированный диетолог Центра укрепления здоровья и профилактики заболеваний Генри Форда.
Теги: Питание, Келли Нол
Действительно ли щелочная вода лучше для вас?
В. Есть ли польза от употребления щелочной воды, или то, что я читаю, — просто чушь?
A. Несмотря на утверждения, нет никаких доказательств того, что вода, продаваемая как щелочная, лучше для вашего здоровья, чем водопроводная вода.
«Все дело в маркетинге», — сказал Танис Фентон, диетолог и эпидемиолог из Медицинской школы Камминга Университета Калгари. «Нет науки, подтверждающей это».
Шкала pH показывает, является ли жидкость более кислой (более низкий pH) или щелочной (более высокий pH). Чистая вода имеет нейтральный pH 7, в то время как водопроводная вода имеет некоторые естественные вариации в зависимости от содержания минералов. Большая часть бутилированной воды слегка кислая, а газированные напитки и соки — еще более.
Бутилированная вода, продаваемая как щелочная, обычно имеет pH от 8 до 10.Некоторые из них происходят из источников или артезианских скважин и имеют природную щелочность из-за растворенных минералов. Другие изготавливаются с использованием процесса ионизации, и машины для ионизации воды также продаются для домашнего использования.
Компании, производящие щелочную воду, расплывчато заявляют, что она «заряжает энергией» и «выводит токсины» из организма и приводит к «превосходной гидратации». Некоторые утверждают, что ионизированная вода может предотвратить все, от головной боли до рака.
Но нет никаких доказательств того, что питьевая вода с более высоким pH может изменить pH вашего тела, или даже что этот результат принесет пользу.
Уровень pH в крови строго регулируется, около 7,4, в то время как желудок, который выделяет соляную кислоту для переваривания белков и уничтожения пищевых патогенов, очень кислый, с pH от 1,5 до 3,5. По словам доктора Фентона, если вы пьете слабощелочную воду, соляная кислота в желудке быстро нейтрализует ее, прежде чем она попадет в кровь.
Несколько небольших исследований, финансируемых компаниями, которые продают щелочную воду, показывают, что она может улучшить гидратацию у спортсменов, но любые потенциальные преимущества были скромными, и более простой способ улучшить гидратацию — это просто пить больше воды.А обзор исследований доктора Фентона и его коллеги, проведенный в 2016 году, не нашел доказательств того, что щелочная вода или щелочная диета могут лечить или предотвращать рак.
Исследование, опубликованное в прошлом году, показало, что переход на растительную диету и употребление щелочной воды работают так же, как и лекарства для облегчения симптомов ларингофарингеального рефлюкса, тяжелой формы кислотного рефлюкса, при которой желудочная кислота достигает горла. «Я думаю, что это может быть полезным инструментом для пациентов, которые помогут избавиться от симптомов, когда они переходят на более растительную диету», — сказал д-р.Крейг Залван, ведущий автор исследования и ларинголог из больницы Фелпс в Сонной Лощине, штат Нью-Йорк. Но он считает, что большинство улучшений у его пациентов происходит от изменений в питании, а не от щелочной воды. Как только симптомы улучшатся, он говорит, что нет необходимости продолжать пить щелочную воду.
Есть также признаки потенциального риска от щелочной воды. У крысят, получавших щелочную воду, наблюдалось нарушение роста и повреждение сердечной мышцы. В отчете за 2015 год говорилось, что, когда муниципальная водопроводная станция в городе в Германии случайно повысила pH воды до 12, последовали ожоги кожи.Хотя такой высокий pH маловероятен в бутилированной щелочной воде, это напоминание о том, что более высокий pH не обязательно лучше.
«Единственное воздействие на здоровье, о котором мы знаем, — это признаки опасности, поэтому для людей, продолжающих продавать щелочную воду, они действительно так же плохи, как и продавцы змеиного масла в прошлом», — сказал доктор Фентон.
У вас есть вопросы о здоровье? Ask Well
Каков наилучший уровень pH для питьевой воды?
Питьевая вода — важнейший компонент нашего постоянного здоровья, поэтому важно искать лучшие источники питьевой воды.В последние годы возродился интерес к выяснению pH воды, которую мы пьем. Многие заявления о пользе для здоровья были связаны с употреблением сильно щелочной воды, хотя на сегодняшний день отсутствие убедительных исследований поставило под сомнение многие из этих утверждений. Система обратного осмоса может помочь в поддержании чистоты и чистоты вашей воды. Давайте посмотрим, насколько важен pH-баланс воды, и какие шаги вы можете предпринять, чтобы получить максимально чистую воду.Мы также изучим существующий диапазон pH водопроводной воды в большинстве городских систем водоснабжения.
Что такое pH-баланс?
Мы используем баланс pH, чтобы описать кислотность или щелочность вещества. Концентрация ионов водорода в растворе определяет кислотность или основность вещества. Кислые вещества имеют высокую концентрацию ионов водорода и низкий pH, в то время как щелочные вещества имеют низкую концентрацию ионов водорода и более высокий уровень pH.
Шкала pH от 0 до 14, где 0 означает сильную кислоту.Например, кислоты в желудке имеют pH 1, что указывает на их сильную кислотность. На другом конце шкалы находятся основные или щелочные вещества. Примерами щелочных веществ являются отбеливатель, который имеет pH 13 и является сильнощелочным, и пищевая сода, имеющая pH 9 и являющаяся слабощелочной. Вещество со сбалансированным pH будет иметь показатель pH 7 и не считается ни кислым, ни щелочным.
Уровень pH в водопроводной воде также может определять жесткость воды. Жесткая и мягкая вода связаны со шкалой pH.Когда уровень pH выше 8,5, проба воды считается жесткой. Когда уровень pH ниже 6,5, проба воды считается мягкой. Что-нибудь между
Каков уровень pH воды?
Уровень pH чистой воды равен 7, что означает, что вода нейтральна. PH водопроводной воды может варьироваться в зависимости от содержания минералов в воде, но, как правило, она будет слабощелочной, а не нейтральной. Средний pH водопроводной воды в Сан-Диего составляет около 8. Поставщики воды в общинах должны изменять pH воды в своих системах, чтобы уменьшить коррозию своей распределительной сети, поэтому лучший pH для питьевой воды не всегда может отражаться на воде, поступающей из ваш кран.
Что такое щелочная вода?
Щелочная вода — это просто вода с pH выше нормы. Обычно щелочная вода имеет pH 8-9, что придает ей щелочность, аналогичную пищевой соде. Щелочная вода может быть естественного происхождения или производиться различными способами. Природная щелочная вода имеет более высокое содержание минералов, и именно эти минералы изменяют pH воды. Самый распространенный способ производства щелочной воды — это процесс, известный как электролиз, который ионизирует ионы водорода в воде, позволяя удалить их и создать щелочную воду.Часто в ионизированную щелочную воду добавляют дополнительные минералы, чтобы придать ей приятный вкус и дополнительно влиять на ее щелочность.
Полезна ли щелочная вода?
Щелочная вода имеет много положительных преимуществ для здоровья, но на сегодняшний день многие из этих утверждений подкреплены исключительно неподтвержденными данными. Так полезна ли для вас щелочная вода? Щелочная вода рекламируется как обеспечивающая лучшее увлажнение и более красивый вид кожи, что она может помочь при желудочно-кишечных проблемах, таких как кислотный рефлюкс, или поддерживать здоровье костей, и даже что она может помочь минимизировать риск некоторых видов рака.К сожалению, эти утверждения не были подтверждены научными исследованиями. Самым важным шагом для домовладельцев является устранение побочных продуктов дезинфекции и тяжелых металлов, присутствующих в их источниках воды. Независимо от того, есть ли у вас обычная водопроводная вода из городского водопровода или вода из личного колодца, удаление загрязняющих веществ, таких как хлор и фторид, важно для оптимального здоровья.
Заявления о пользе щелочной воды для здоровья основаны на вере в то, что употребление щелочной воды изменит pH вашей крови.Однако наш организм очень хорошо регулирует уровень pH через легкие и почки. PH нашей крови имеет очень стабильный pH около 7,4. Когда мы потребляем кислую или щелочную пищу или напитки, наш организм пытается сбалансировать pH этих веществ до того, как они перевариваются. Из-за этого процесса потребление щелочной воды на самом деле не приводит к значительному изменению внутреннего pH.
Какой самый лучший уровень pH для питьевой воды?
Лучший уровень pH для питьевой воды — нейтральный 7.Однако имейте в виду, что сосредоточение внимания на балансе pH в воде менее продуктивно, чем решение других проблем, которые могут существовать с вашей питьевой водой, таких как наличие загрязняющих веществ. Хотя ваша водопроводная вода обрабатывалась несколькими способами очистки, включая добавление дезинфицирующих средств, таких как хлор, для защиты от микробов, существует множество загрязняющих веществ, которые вы, возможно, не захотите попадать в свое тело. Даже хлор в воде может производить потенциально канцерогенные побочные продукты дезинфекции.
Один из лучших способов сделать свое здоровье приоритетным — это пить чистую фильтрованную питьевую воду каждый день. Установка системы фильтрации воды в вашем доме — один из самых эффективных способов сделать это. Домашняя фильтрация обеспечивает постоянную защиту от загрязняющих веществ, которые в настоящее время находятся в вашей воде, а также защиту в случае неожиданного увеличения количества загрязняющих веществ. Если в вашем доме установлен фильтр для воды, вы также можете выбрать диапазон pH и уровень щелочности воды.
Заключительные мысли
Шкала pH используется для определения кислотности или щелочности вещества. В то время как чистая вода имеет нейтральный pH с pH 7, большая часть воды, текущей из вашего крана, является слабощелочной, чтобы избежать коррозии распределительных систем. Некоторые люди считают, что щелочная вода приносит дополнительную пользу для здоровья. К сожалению, многие из этих преимуществ для здоровья не были окончательно доказаны тщательными научными исследованиями.
Вместо того, чтобы платить больше за высокощелочную воду, более продуктивно сосредоточиться на создании доступного и чистого источника питьевой воды для вашего дома.Это можно сделать путем установки системы фильтрации воды, которая может удалять загрязняющие вещества, дезинфицирующие средства и их побочные продукты из воды, которую вы пьете или в которой принимаете ванну.
Поиск подходящей системы очистки воды может показаться сложной задачей, но это не обязательно! Обратитесь к нашим экспертам Rayne Water за советом. Наши эксперты по качеству воды помогут оценить ваши потребности в очистке воды и помогут выбрать лучшую систему очистки для вашего дома.Вы ищете услуги по смягчению воды в Калифорнии? Мы можем предоставить смягчители воды в Сан-Диего, Лос-Анджелесе, Санта-Барбаре, Сакраменто, районе залива и других городах. Мы также предоставляем услуги в некоторых частях Аризоны и Невады! Позвоните нам сегодня!
Источники:
- https://www.washingtonpost.com/lifestyle/wellness/is-alkaline-water-really-better-for-you/2019/08/27/8c646d26-c462-11e9 -b72f-b31dfaa77212_story.html
- https://www.nytimes.com/2018/04/27/well/eat/alkaline-water-health-benefits.html
- https://www.forbes.com/sites/ninashapiro/2019/08/25/seven-reasons-why-alkaline-water-is-basically-a-waste-of-money/#596a0d6d54b2
- https : //www.cnn.com/2019/01/29/health/alkaline-water-benefits-explainer/index.html
- https://www.fda.gov/food/food-labeling-nutrition/health- Письмо с претензиями-отказ-щелочные-и-щелочно-земельные-цитраты-минимизирующий риск-остеопороз
Нейтральный pH: есть ли у воды вкус?
Если вы посмотрите на любой пример шкалы pH, вы увидите, что вода имеет нейтральный pH 7.Вы также увидите примеры кислых веществ, таких как лимонный, апельсиновый и томатный сок, и щелочных веществ, таких как мыльная вода, нашатырный спирт и пищевая сода. Кислые вещества имеют кислый вкус. В этом есть смысл, правда? Лимоны кислые. Мы знаем это. Основные или щелочные вещества имеют горький вкус. Это немного сложнее квалифицировать, учитывая, что мы не пьем нашатырный спирт или мыльную воду, и определенно не должны. Итак, допустим, они горькие.
Мы сделали пример шкалы pH ниже, используя нашу цветовую таблицу тест-полосок pH 1–14, и мы включили примеры различных веществ по шкале pH.
Итак, мы хотели задать вопрос, может ли вода с нейтральным pH иметь вкус? Иногда можно услышать, как люди говорят, что им нравится одна марка бутилированной воды лучше другой. Или вы можете услышать, как некоторые люди жалуются, что им не нравится вкус воды из-под крана. Если предполагается, что чистая вода безвкусна, почему у разных людей вкус разных источников разный? Давайте взглянем.
Нейтральные веществаВо-первых, давайте начнем с нейтральных веществ.Мы всегда рассматриваем чистую воду как обычный пример на шкале pH при нейтральном pH 7. Но есть ли другие примеры? Да! Сахар и поваренная соль также имеют нейтральный pH. Это сразу кое-что нам говорит: вещество с нейтральным pH не обязательно безвкусное. Очевидно, что мы чувствуем разницу между сахаром, поваренной солью и водой.
Сахар и поваренная соль не являются жидкими, но вы все равно можете добавить их в чистую воду, и это изменит вкус.
Но все же у воды нет вкуса, правда? Так как же он может быть другим на вкус?
Источники водыПервоначальный источник питьевой воды, ее обработка и доставка — все это факторы, влияющие на вкус и запах вашей воды.Например, уровень жесткости воды значительно различается по стране. Люди, получающие воду из источника с верхним пределом шкалы жесткости, вероятно, будут испытывать другой вкус, чем те, кто получает воду из источника с нижним пределом шкалы.
Вы находитесь в центре города или за городом рядом с естественным источником воды, например, родником, озером или прудом? Вы живете в пустыне, как мы в Аризоне, или в Миннесоте, Стране 10 000 озер? Как водоочистные сооружения в вашем городе сокращают количество загрязняющих веществ в системе водоснабжения? Какие методы и методы лечения они используют? По каким типам труб подается вода? Какая сантехника у вас дома? Все эти факторы влияют на вкус воды.
Вода содержит минералы, такие как кальций, железо, натрий и магний. Высокое содержание этих минералов может придать воде другой вкус. Более высокий уровень кальция может вызвать сладкий вкус воды. И наоборот, высокий уровень натрия, очевидно, может придать ему соленый вкус.
Здания со старыми трубами могут быть ржавыми или привести к чрезмерному содержанию микроэлементов в воде. Таким образом, вы можете почувствовать металлический или даже соленый привкус воды из-под крана. В большинстве случаев маловероятно, что ваша вода токсична, но вы всегда можете проверить ее, если вас это беспокоит.
Наконец, поскольку вода имеет нейтральный pH, она приобретет любой привкус, который у вас раньше был во рту. Например, если вы съедите что-нибудь кислое, ваша слюна вырабатывает химические вещества, которые вызывают ощущение сладкого вкуса. Если затем выпить воды, она может быть немного сладкой. Ваше тело может даже сбивать с толку чувства вкуса и запаха, ассоциируя вкус с тем, что вы на самом деле нюхаете.



