Ретровирусы. Вич
Семейство Retroviridae включает три подсемейства:
— Oncovirinae (онковирусы), важнейший представитель которого — T-лимфотропный вирус человека типа 1 ;
— Lentivirinae (лентивирусы), к которому относится ВИЧ;
— Spumavirinae (спумавирусы, или пенящие вирусы).
Подсемейства включают рода:
Alpharetrovirus
Betaretrovirus
Gammaretrovirus
Deltaretrovirus
Epsilonretrovirus
Lentivirus
Spumavirus
Вирионы сферической формы размером 80-100 нм, покрыты внешней липопротеиновой оболочкой, имеющей ворсинки длиной 8 — 10 нм. Внутри икосаэдрического капсида находится спиральная РНК. Наружная оболочка, капсидная мембрана и нуклеотид на разрезе вириона расположены концентрически.
Вирионы типа А, В, С, D различаются морфологически. У вирионов типа А сердцевина кольцевидная с внутренней электронно-оптически пустой полостью. У вирионов типа В сердцевина сдвинута к периферии, капсид неплотно примыкает к нуклеопротеиду, на поверхности отчетливо просматриваются длинные булавовидные отростки. Вирионы типа С имеют плотную центрально расположенную сферическую или овальную сердцевину, отростки более короткие или пуговчатые. У вирионов типа D сердцевина овальной формы, капсид неплотно примыкает к нуклеопротеиду, вместо шипиков обнаруживаются пуговчатые образования; онковирусы бычьего лейкоза сходны с онковирусами типа С, но сердцевина может быть эпицентрической, а сами вирионы часто бывают полиморфны.
Характерной чертой семейства является наличие в составе вириона РНК-зависимой ДНК- полимеразы, иначе называемой обратной транскриптазой. Это и послужило основанием для названия семейства (от лат. retro — обратный).
Вирионы имеют 6 структурных белков, из них 4 внутренних (капсидных) негликолизированных и 2 гликопротеина оболочки.
Капсидные белки несут группоспецифические межвидовые антигены и являются основой для разделения вирусов на роды и подроды. Гликопротеиды являются типоспецифическими антигенами, участвуют в реакции нейтрализации.
Как правило, геномы ретровирусов содержат три открытые считывающие рамки, которые кодируют белки, находящиеся в зрелых вирусах: коды группоспецифического антигена (gag) для ядра и структурных белков вируса; коды полимеразы (pol) для обратной транскриптазы и интегразы; и коды оболочки (env) для белков покрытия ретровируса.
К регуляторным генам относятся: tat (трансактиватор всех вирусных белков), rev (регулятор экспрессии вирионных белков), vif (вирионный инфекционный фактор), vpr (функции остаются неясными), nef (негативный фактор экспрессии), vpx (функции неизвестны)
Генетическая информация ретровирусов представлена в виде РНК. Репродуктивный цикл
Полная копия +РНК способна формировать геномы дочерних популяций, а также транслироваться как мРНК с образованием структурных белков и ферментов, участвующих в сборке вирионов. Эти копии могут быть подвергнуты РНК-сплайсингу — устранению интронов из мРНК-предшественника; в результате образуются малые молекулы мРНК, кодирующие поверхностные, регуляторные и добавочные белки вируса. Самосборка вирусов и созревание вирусных частиц происходит в цитоплазме. Зрелые вирионы выходят из клетки, отделяясь от неё почкованием (высвобождение вируса в окружающую среду может длиться годами).
Нуклеиновая кислота онковирусов имеет гомологию с клеточной ДНК своего вида хозяина. Многие вирусы этого семейства вызывают неопластические процессы, главным образом лейкемии и саркомы ряда видов животных. Нормальные клетки некоторых видов животных содержат интегрированные копии соответствующих видов онковирусов. Они могут никак не проявляться или активируются некоторыми физическими и химическими факторами, а возможно, и при инфекции другими онковирусами. Часто встречаются дефектные вирусы, размножающиеся с помощью вируса-помощника. Передаются вертикально и горизонтально.
Возбудитель ВИЧ- инфекции относится к роду Lentivirus, который включает в себя тех представителей семейства ретровирусов, которые вызывают медленные вирусные инфекции.
По оценке Объединённой программы ООН по ВИЧ/СПИД (ЮНЭЙДС) и Всемирной организации здравоохранения (ВОЗ), с 1981 по 2006 от болезней, связанных с ВИЧ-инфекцией и СПИД умерли 25 миллионов человек.
Таким образом, пандемия ВИЧ-инфекции является одной из наиболее губительных эпидемий в истории человечества. Только в 2006 году ВИЧ-инфекция стала причиной смерти около 2,9 миллиона человек. К началу 2007 года во всем мире около 40 миллионов человек (0,66 % населения Земли) являлись носителями ВИЧ. Две трети из общего числа ВИЧ-инфицированных живут в странах Африки к югу от пустыни Сахары. В наиболее пострадавших от пандемии ВИЧ-инфекции и СПИД странах эпидемия препятствует экономическому росту и увеличивает бедность населения.
studfiles.net
Строение и жизненный цикл вируса иммунодефицита человека (ВИЧ) — Вирусы — Каталог
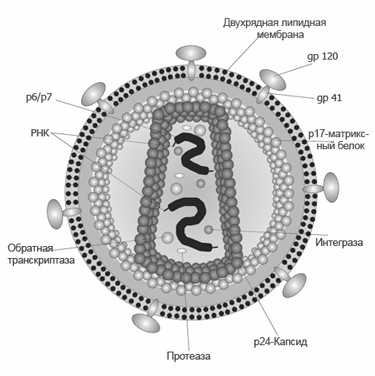
Строение вируса иммунодефицита человека
 |
| Строение вируса иммунодефицита человека |
Вирионы ВИЧ имеют вид сферических частиц, диаметр которых составляет около 100—120 нанометров (это приблизительно в 60 раз меньше диаметра эритроцита).
В состав зрелых вирионов входит несколько тысяч белковых молекул различных типов.
Капсид зрелого вириона, состоящий из примерно 2000 молекул белка р24, имеет форму усечённого конуса.
Внутри капсида находится белково-нуклеиновый комплекс: две нити вирусной РНК, прочно связанные с белком нуклеокапсида p7, ферменты (обратная транскриптаза, протеаза, интеграза).
С капсидом также ассоциированы белки Nef и Vif (7—20 молекул Vif на вирион).
Внутри вириона (и, вероятнее всего, за пределами капсида) обнаружен белок Vpr8-11. Кроме того, с капсидом ВИЧ-1 (но не ВИЧ-2) связазны около 200 копий клеточного фермента пептидилпролилизомеразы, необходимого для сборки вириона.
Капсид окружён оболочкой, образованной примерно 2000 молекул матриксного белка p17. Матриксная оболочка в свою очередь окружена двуслойной липидной мембраной, являющейся наружной оболочкой вируса. Она образована молекулами фосфолипидов, захваченными вирусом во время его отпочковывания от клетки, в которой он сформировался.
В липидную мембрану встроены 72 гликопротеиновых комплекса Env, каждый из которых образован тремя молекулами трансмембранного гликопротеина gp41 (TM), служащего «якорем» комплекса, и тремя молекулами поверхностного гликопротеина gp120 (SU).
С помощью белка gp120 вирус присоединяется к рецептору CD4 и корецептору, находящимся на поверхности Т-лимфоцитов человека. Стехиометрическое соотношение p24:gp120 в вирионе составляет 60—100:1.
Белки gp41 и в особенности gp120 интенсивно изучаются в качестве возможных мишеней для разработки лекарств и вакцины против ВИЧ.
При формировании наружной оболочки вируса также происходит захват некоторого количества мембранных белков клетки, в том числе человеческих лейкоцитарных антигенов (HLA) классов I и II и молекул адгезии.
Функции важных структурных белков ВИЧ-1
Сокращение | Описание | Функции |
gp41 (TM, transmembrane) | Трансмембранный гликопротеин массой 41 кДа | Располагается во внешнем слое липидной мембраны, играет роль «якоря», удерживающего молекулы белка gp120 |
gp120 (SU, surface) | Гликопротеин массой 120 кДа | Наружный белок вириона. Нековалентно связан с трансмембранным белком gp41. С одной молекулой gp41 связаны 3—5 молекул gp120. Способен связывать рецептор CD4. Играет важную роль в процессе проникновения вируса в клетку. |
p24 (CA, capsid) | Белок массой 24 кДа | Образует капсид вируса |
p17 (MA, matrix) | Матриксный белок массой 17 кДа | Около двух тысяч молекул этого белка образуют слой толщиной 5—7 нм, располагающийся между внешней оболочкой и капсидом вируса. |
p7 (NC, nucleocapsid) | Нуклеокапсидный белок массой 7 кДа | Входит в состав капсида вируса. Образует комплекс с вирусной РНК. |
Геном и кодируемые белки
| Геном ВИЧ-1 |
Геном ВИЧ-1
Генетический материал ВИЧ представлен двумя копиями положительно-смысловой (+)РНК. Геном ВИЧ-1 имеет длину 9000 нуклеотидов. Концы генома представлены длинными концевыми повторами (англ. long terminal repeat, LTR), которые управляют продукцией новых вирусов и могут активироваться и белками вируса, и белками инфицированной клетки. 9 генов ВИЧ-1 кодируют, по крайней мере, 15 белков.
Ген pol кодирует ферменты: обратную транскриптазу (RT), интегразу (IN) и протеазу (PR).
Ген gag кодирует полипротеин Gag/p55, расщепляемый вирусной протеазой до структурных белков p6, p7, p17,p24.
Ген env кодирует белок gp160, расщепляемый клеточной эндопротеазой фурином на структурные белки gp41 и gp120.
Другие шесть генов — tat, rev, nef, vif, vpr, vpu (vpx у ВИЧ-2) — кодируют белки, отвечающие за способность ВИЧ-1 инфицировать клетки и производить новые копии вируса. Репликация ВИЧ-1 in vitro возможна без генов nef, vif, vpr, vpu, однако их продукты необходимы для полноценной инфекции in vivo.
Gag: Полипротеин-предшественник Gag/p55 синтезируется с полноразмерной геномной РНК (которая в данном случае служит в качестве мРНК) в процессе стандартной кэп-зависимой трансляции, но возможна и IRES-зависимая трансляция. Предшественники функциональных белков располагаются в составе полипротеина Gag/p55 в следующем порядке: p17…p24…p2…p7…p1…p6 (р1 и р2 — соединительные пептиды; другие продукты расщепления Gag/p55 описаны выше).
Нерасщеплённый протеазой Gag/p55 содержит три основных домена: домен мембранной локализации (М, membrane targeting), домен взаимодействия (I, interaction) и «поздний» домен (L, late).
Домен М, расположенный внутри области p17/МА, миристилируется (присоединяются остатки миристиновой кислоты) и направляет Gag/p55 к плазматической мембране. Домен I, находящийся внутри области p7/NC, отвечает за межмолекулярные взаимодействия отдельных мономеров Gag/p55. Домен L, также локализованный в области p7/NC, опосредует отпочковывание вирионов от плазматической мембраны; в этом процессе участвует также р6 область полипротеина Gag/p55.
Vpu: Двумя важными функциями белка Vpu являются:
1) разрушение клеточного рецептора CD4 в эндоплазматическом ретикулуме путём привлечения убиквитинлигазных комплексов и
2) стимуляция выделения дочерних вирионов из клетки, путём инактивации интерферон-индуцируемого трансмембранного белка CD317/BST-2, получившего также название «tetherin» за его способность подавлять выделение вновь образовавшихся дочерних вирионов посредством их удержания на поверхности клетки.
Vpr: Белок Vpr необходим для репликации вируса в неделящихся клетках, в том числе макрофагах. Этот белок, наряду с другими клеточными и вирусными белками, активирует длинные концевые повторы генома ВИЧ. Белок Vpr играет важную роль в переносе провируса в ядро и вызывает задержку деления клетки в периоде G2.
Vif: Белок Vif играет важную роль в поддержке репликации вируса. Штаммы, лишённые этого белка, не реплицируются в CD4+-лимфоцитах, некоторых линиях T-лимфоцитов («недоступных клетках») и макрофагах. Эти штаммы способны проникать в клетки-мишени и начинать обратную транскрипцию, однако синтез провирусной ДНК остаётся незавершённым.
Nef: Белок Nef выполняет несколько функций. Он подавляет экспрессию молекул CD4 и HLA классов I и II на поверхности инфицированных клеток, и тем самым позволяет вирусу ускользать от атаки цитотоксических T-лимфоцитов и от распознавания CD4+-лимфоцитами. Белок Nef может также угнетать активацию T-лимфоцитов, связывая различные белки-компоненты систем внутриклеточной передачи сигнала.
У инфицированных вирусом иммунодефицита макак-резусов активная репликация вируса и прогрессирование болезни возможны только при интактном гене nef. Делеции гена nef были обнаружены в штаммах ВИЧ, выделенных у группы австралийцев с длительным непрогрессирующим течением инфекции.
Однако у части из них со временем появились признаки прогрессирования инфекции, в том числе снижение числа CD4+-лимфоцитов. Таким образом, хотя делеции гена nef и могут замедлять репликацию вируса, это не гарантирует полной невозможности прогрессирования заболевания.
Tat и Rev: Регуляторные белки Tat (транс-активатор) и Rev накапливаются в ядре клетки и связывают определённые участки вирусной РНК. Белок Tat имеет молекулярную массу около 14-15 кДа, связывает вторичную структуру геномной РНК вблизи 5′-нетранслируемой области активирует обратную транскрипцию геномной РНК ВИЧ, синтез вирусных мРНК, необходим для репликации вируса почти во всех культурах клеток, регулирует выход вирионов из зараженных клеток, нуждается в клеточном кофакторе — циклине T1. Белок Rev регулирует экспрессию белков вириона, связывает мРНК гена env в области RRE (англ. Rev response element) интрона, разделающего экзоны генов Tat и Rev.
Белки Tat и Rev стимулируют транскрипцию провирусной ДНК и транспорт РНК из ядра в цитоплазму, а также необходимы для трансляции. Белок Rev обеспечивает также транспорт компонентов вируса из ядра и переключение синтеза регуляторных белков вируса на синтез структурных.
Жизненный цикл
На схеме показано слияние вирриона ВИЧ и плазматической мембраны Т-лимфоцита человека Этап 1. Взаимодействие вирусного белка gp120 с клеточным рецептором CD4 (указано красной стрелкой) |
Этап 2. Конформационные изменения вирусного белка gp120 обеспечивают связывание с клеточным рецептором CCR5 (указано красной стрелкой) |
Этап 3. Концевые участки вирусного белка gp41 проникают в плазматическую мембрану клетки (указано красной стрелкой) |
Этап 4. Вирусный белок gp41 подвергается значительным конформационным изменениям, складывается пополам (указано красной стрелкой) и образует спираль, что приводит к сближению и слиянию мембран вириона и клетки. Таким образом ВИЧ захватывает Т-лимфоцит с целью дальнейшей репродукции. |
Проникновение в клетку и интеграция
Вирусная инфекция начинается, когда вирион ВИЧ сталкивается с человеческой клеткой, имеющей на своей мембране рецептор CD4. Вирусный гликопротеин gp120 прочно связывает рецептор CD4. В результате такого взаимодействия gp120 претерпевает конформационные изменения, которые позволяют ему также связать молекулу корецептора CXCR4 или CCR5 (экспрессируемых на поверхности Т-лимфоцитов, макрофагов, дендритных клеток и микроглии).
В зависимости от способности связывать эти корецепторы, ВИЧ классифицируют на R5-тропные (связывают только CCR5), X4-тропные (связывают только CXCR4) и R5X4-тропные (могут взаимодействовать с обоими корецепторами). Препараты, блокирующие корецепторы могут быть эффективны против ВИЧ.
После описанных событий мембрана клетки и мембрана вириона ВИЧ сливаются, и содержимое вириона проникает внутрь клетки. Белок gp41 очень важен для слияния мембран, поэтому его рассматривают в качестве мишени для разработки противовирусных препаратов. Внутри клетки вирусная РНК высвобождается из капсида, и происходит обратная транскрипция — синтез ДНК на основе матрицы одноцепочечной геномной РНК вируса, катализируемая обратной транскриптазой.
Большая часть лекарственных препаратов, одобренных для применения при ВИЧ-инфекции, направлена на нарушение работы обратной траскриптазы. Синтезированная ДНК транспортируется внутрь ядра клетки и встраивается в хромосому хозяина под действием интегразы. Несколько препаратов, ингибирующих интегразу, проходят ранние стадии клинических испытаний. Вирусная ДНК, встроившаяся в хромосому клетки, называется провирусом.
Человеческая РНК-полимераза в ядре клетки синтезирует информационную РНК (мРНК), а позднее и геномную РНК вируса. Синтезированные РНК транспортируются обратно в цитоплазму, где на матрице мРНК на рибосомах синтезируются вирусные ферменты, структурные и регуляторные белки.
Сборка и отпочковывание вирионов
Геномная РНК вируса, а также вирусные белки транспортируются к местам сборки вирионов. Сборка вирионов происходит на мембране, куда направляется миристилированный полипротеин Gag/p55. Вирионы первоначально формируются из полипротеинов-предшественников структурных белков и ферментов и на этой стадии не являются инфекционными.
В ходе созревания вирусной частицы вирусная протеаза расщепляет белки-предшественники до функциональных компонентов. Несколько одобренных противовирусных препаратов ингибируют работу протеазы и препятствуют формированию зрелых вирионов.
Новые вирусные частицы отпочковываются от поверхности клетки, захватывая часть её мембраны, и выходят в кровяное русло, а клетка хозяина, несущая рецептор CD4, погибает. Недавние исследования показали, что процесс отпочковывания вирионов может быть более сложным, чем считалось ранее. Так было обнаружено, что благодаря взаимодействию белка Gag с компонентами клетки вирионы накапливаются в особых внутриклеточных мультивезикулярных тельцах, которые обычно служат для экспорта белков. Таким образом вирусные частицы высвобождаются из клетки, эксплуатируя её собственную систему транспорта макромолекул.
Распространение по организму
В период острой фазы ВИЧ-инфекции отсутствие специфического иммунного ответа позволяет вирусу активно реплицироваться и достигать высоких концентраций в крови.
Вирус заселяет органы лимфатической системы, CD4+-лимфоциты, CD8+-лимфоциты и макрофаги, а также другие клетки: альвеолярные макрофаги лёгких,клетки Лангерганса, фолликулярные дендритные клетки лимфатических узлов, клетки олигодендроглии и астроциты мозга и эпителиальные клетки кишки.
В лимфоидной ткани ВИЧ размножается на протяжении всего заболевания, поражая макрофаги, активированные и покоящиеся CD4+-лимфоциты и фолликулярные дендритные клетки. Количество клеток, содержащих провирусную ДНК, в лимфоидной ткани в 5—10 раз выше, чем среди клеток крови, а репликация ВИЧ в лимфоидной ткани на 1—2 порядка выше, чем в крови.
Резервуаром ВИЧ служат лимфатические узлы и конкретно дендритныe клетки, в которых вирус сохраняется длительное время после периода острой виремии.
Для активации CD8+-лимфоцитов и образования антиген-специфических цитотоксических T-лимфоцитов необходима презентация пептидного антигена в комплексе с человеческим лейкоцитарным антигеном класса I.
Дендритные клетки, необходимыe для начала первичных антиген-специфичных реакций, захватывают антигены, перерабатывают и переносят их на свою поверхность, где эти антигены в комплексе с дополнительными стимулирующими молекулами активируют T-лимфоциты.
Заражённые клетки часто не выделяют дополнительных стимулирующих молекул и поэтому не способны вызвать активацию достаточного числа B и T-лимфоцитов, функция которых зависит от дендритных клеток.
После завершения обратной транскрипции в CD4+-лимфоците вирусный геном представлен провирусной невстроенной ДНК. Для встраивания провирусной ДНК в геном клетки-хозяина и для образования новых вирусов необходима активация T-лимфоцитов.
Контакт CD4+-лимфоцитов и антигенпредставляющих клеток в лимфоидной ткани, наличие вирусов на поверхности фолликулярных дендритных клеток и присутствие провоспалительных цитокинов (ИЛ-1, ИЛ-6 и ФНОα) способствуют размножению ВИЧ в инфицированных клетках. Именно поэтому лимфоидная ткань служит самой благоприятной средой для репликации ВИЧ.
На 2014 год ВИЧ-инфекция остаётся неизлечимым заболеванием, так как геном вируса интегрируется в хромосомы клеток и может реактивироваться даже после курса антиретровирусной терапии.
В настоящее время идёт поиск безопасных способов редактирования генома человека и исключения из него провирусной ДНК. В 2014 году был предложен метод удаления генома ВИЧ-1 из заражённых клеток при помощи системы CRISPR/Cas9. С помощью этого метода исследователям удалось вырезать фрагмент провирусной ДНК, заключённый между 5′- и 3′-концевыми LTR-областями из хромосом зарежённых клеток в культуре.
Кроме того, этот метод оказался также эффективным для профилактики заражения неинфицированных клеток. Описанный подход может привести к разработке способа полного избавления от ВИЧ-инфекции.
virusolog.at.ua
строение вируса, взаимодействия с клеткой, патогенез инфекции
Систематика вируса иммунодефицита человека
Царство Вирусы.
Семейство Retroviridae.
Подсемейство Lentivirus.
В настоящее время выделено 2 типа вируса иммунодефицита человека (ВИЧ):
ВИЧ-1 — это основной возбудитель ВИЧ-инфекции; основные места распространения — Северная и Южная Америка, Европа и Азия.
ВИЧ-2 — это менее вирулентный аналог ВИЧ-1, редко вызывает типичные проявления синдрома приобретенного иммунодефицита и не так широко распространен. Впервые выделен Монтанье из крови выходцев из Гвинеи с подтвержденным диагнозом синдрома приобретенного иммунодефицита. В эволюционном плане ВИЧ-2, безусловно, родственен ВИЧ-1. Место распространения — преимущественно Западная Африка.
Кроме того, был обнаружен вирус иммунодефицита обезьян (ВИО). ВИЧ-2 по серологическим (иммунологическим) свойствам занимает промежуточное положение между ВИЧ-1 и ВИО. Возможно, что они произошли от общего предка, а затем эволюционировали самостоятельно.
История открытия вируса иммунодефицита человека
Выявлен вирус синдрома приобретенного иммунодефицита был следующим образом.
5 июня 1981 года в ряде крупных городов США была зарегистрирована вспышка инфекционного заболевания, вызываемого Pneumocystis carinii — грибком, который при нормальном состоянии иммунитета не вызывает заболевания.
В ходе проверки выяснилось, что заболевание распространяется среди лиц, которые имели интимные контакты с инфицированным человеком. В основе ранее неизвестного заболевания лежало резкое ослабление иммунитета. Неизвестную ранее форму подавления работы иммунной системы стали обозначать как синдром приобретенного иммунодефицита.
Ретроспективный анализ сывороток, хранящихся в Национальном Центре контроля за инфекционными заболеваниями, показал, что первые случаи синдрома приобретенного иммунодефицита у человека относятся к 50-м годам нашего столетия, и, что заболевание возникло в Африке, а затем распространилось на территории Европы и США.
По данным Всемирной организации здравоохранения на конец 2000 года со времени открытия вируса иммунодефицита человека от СПИДа умерло почти 22 млн. человек, число инфицированных перевалило за 36 млн. Сейчас можно говорить о пандемии ВИЧ-инфекции.
www.nedug.ru
План рферата.
34
Введение
Новые варианты вируса СПИД
Статистика
Строение вирусной частицы ВИЧ
Строение вирусного генома и экспрессия генов ВИЧ
Гены и белки ВИЧ
Регуляция экспрессии вирусных генов
Теории происхождения ВИЧ
Передача ВИЧ-инфекции
Ко-факторы ВИЧ-инфекции
Патогенез и клиника ВИЧ-инфекции
Патогенез
Механизмы взаимодействия ВИЧ с различными звеньями иммунной системы
Влияние ВИЧ на Т-хелперы
Взаимодействие ВИЧ с Т-супрессорами
Результаты взаимодействия ВИЧ с В-клетками
Макрофаги и ВИЧ
Взаимодействие ВИЧ с моноцитами
Взаимодействие ВИЧ с другими клетками организма
Система интерферона при ВИЧ-инфекции
Клинические проявления
Персистирующая генерализованная лимфаденопатия
СПИД-ассоциированный комплекс
Оппортунистические инфекции и опухоли
Особенности инфицирования и заболевания детей
Вирус иммунодефицита человека типа 2 (ВИЧ 2)
Географическое распространение
Строение вируса
Эпидемиология
Клинические отличия
Лабораторная диагностика
Диагностика ВИЧ-инфекции
Лечение
Возможности разработки вакцин
Заключение
Введение
ВИЧ-инфекция, подобно пожару, охватила сейчас почти все континенты. За необычайно короткое время она стала проблемой номер один для Всемирной организации здравоохранения и ООН, оттеснив на второе место рак и сердечнососудистые заболевания.
Пожалуй, ни одна болезнь не задавала ученым такие серьезные загадки за столь незначительный срок. Война с вирусом СПИДа ведется на планете с нарастающими усилиями. Ежемесячно в мировой научной прессе публикуются новые сведения о ВИЧ-инфекции и ее возбудителе, которые часто заставляют коренным образом менять точку зрения на патологию этого заболевания.
Пока загадок больше…
Прежде всего — неожиданность появления и быстрота распространения ВИЧ. До сих пор не решен вопрос о причинах его возникновения. До сих пор неизвестна средняя и максимальная продолжительность его скрытого периода.
Установлено, что имеется несколько разновидностей возбудителя СПИДа. Изменчивость его уникальна, поэтому есть все основания ожидать, что обнаружатся очередные варианты возбудителя в разных регионах мира, а это может резко осложнить диагностику.
Еще загадки: какова связь СПИДа у человека со СПИД-подобными заболеваниями у животных (обезьян, кошек, овец, крупного рогатого скота) и какова возможность встраивания генов возбудителя СПИДа в наследственный аппарат зародышевых клеток?
Далее. Правомерно ли само название? СПИД расшифровывается как синдром приобретенного иммунодефицита. Иными словами, главный признак болезни — поражение иммунной системы. Но каждым годом накапливается все больше данных, доказывающих, что возбудитель СПИДа поражает не только иммунную, но и нервную систему.
С совершенно непредвиденными трудностями сталкиваются при разработке вакцины против вируса СПИДа.
К особенностям СПИДа относится то, что это, по-видимому, первый в истории медицины приобретенный иммунодефицит, связанный с конкретным возбудителем и характеризующийся эпидемическим распространением. Вторая его особенность — почти “прицельное” поражение Т-хелперов. Третья особенность — это первое эпидемическое заболевание человека, вызванное ретровирусами. В-четвертых, СПИД по клиническим и лабораторным особенностям не похож ни на какие другие приобретенные иммунодефициты.
studfiles.net
ИММУНОДЕФИЦИТА ЧЕЛОВЕКА ВИРУСЫ • Большая российская энциклопедия
В книжной версии
Том 11. Москва, 2008, стр. 140
Скопировать библиографическую ссылку:
Авторы: Э. В. Карамов
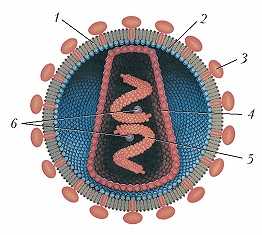
Схема строения вируса иммунодефицита человека: 1 – липопротеиновая оболочка; 2 – белковый матрикс; 3 – гликопротеин; 4 – капсид; 5 – молекула РНК, окружённая нуклеокапсидным белком; 6 – полимеразный к…
ИММУНОДЕФИЦИ́ТА ЧЕЛОВЕ́КА ВИ́РУСЫ (ВИЧ), относятся к сем. ретровирусов, роду лентивирусы (Lentivirus). Вызывают ВИЧ-инфекцию, последней стадией развития которой является СПИД. Описано два типа вирусов: ВИЧ-1, вызвавший всемирную эпидемию во 2-й пол. 20 в., и сходный с ним (40% гомологии), но менее патогенный ВИЧ-2 (распространён преим. в Зап. Африке). Доказано, что к человеку вирус попал в результате межвидовой трансмиссии от обезьян: ВИЧ-1 от шимпанзе, ВИЧ-2 от мангобеев. Осн. пути передачи ВИЧ – половой, через кровь, от заражённой матери ребёнку. ВИЧ характеризуются чрезвычайно высокой изменчивостью генома. Исходя из особенностей структуры генетич. материала, ВИЧ-1 подразделяется на группы N, O и M. Именно вирусы M-группы играют гл. роль в эпидемии; они, в свою очередь, делятся на 9 субтипов (A–D, F–H, J и K) и 36 рекомбинантных форм (CRF 01–36). В России доминирующим субтипом является A1.
Вирион ВИЧ имеет сферич. форму, ок. 100 нм в диаметре; окружён липопротеиновой оболочкой (формируется на основе мембраны клетки-хозяина). На поверхности вириона расположены 72 гликопротеиновых выпячивания, которые связаны с белковым матриксом, расположенным непосредственно под липидной оболочкой. В центр. части вириона находится конусообразный капсид (образован мономерами капсидного белка), в который заключён геном вируса – 2 одинаковые одноцепочечные молекулы РНК (состоят из 9300 нуклеотидов каждая, синтезируются при участии клеточной РНК-полимеразы II). С молекулами РНК связан нуклеокапсидный белок. В состав капсида входит также т. н. полимеразный комплекс, включающий ферменты обратную транскриптазу, интегразу и протеазу (участвует в созревании вириона). Всего гены ВИЧ контролируют синтез 9 структурных и 6 регуляторных белков; часть генов обладает экзон-интронной структурой. Кроме того, в состав вириона входит клеточный белок циклофилин и некоторые другие.
Попав в организм, вирус поражает широкий круг клеток иммунной системы (иммуноцитов), в т. ч. Т-лимфоциты, макрофаги, NK-клетки, а также дендритные клетки, тимоциты, микроглию (глиальные макрофаги) и клетки слизистой эпителия и лимфоидной ткани желудочно-кишечного тракта. Для этого он нуждается в рецепторе СD4 и дополнит. корецепторах (хемокиновых, интегриновых и др.). Гликопротеины вируса распознают рецепторы клеток-мишеней, после чего происходит слияние вирусной и клеточной мембран (фузия) и проникновение капсида внутрь клетки. Уже на ранней стадии инфекции вирионная РНК с помощью обратной транскриптазы (РНК-зависимой ДНК-полимеразы) переписывается в молекулу двухцепочечной ДНК. Вновь синтезированная ДНК транспортируется в ядро инфициров. клетки и при участии интегразы встраивается в хромосомную ДНК, становясь частью клеточного генома (провирусом). Т. о. ВИЧ может существовать в виде двух форм: вирионной одноцепочечной РНК и внутриклеточной двухцепочечной ДНК. В состоянии провируса вирус неактивен до тех пор, пока латентно инфициров. клетка не будет активирована, напр., какими-то микробными антигенами или др. вирусами. В результате активации начинается синтез вирусных РНК и белков, формируются вирионы, распространяющиеся в заражённом организме. Под действием ВИЧ количество СD4+Т-лимфоцитов снижается настолько, что организм становится восприимчивым даже к условно-патогенным (оппортунистическим) инфекциям, которые не опасны (или мало опасны) для людей с нормальной иммунной системой. Делеция Δ32 участка в области гена CCP5, кодирующего хемокиновый рецептор, приводит к невосприимчивости её носителя к ВИЧ (считается, что к ВИЧ устойчив примерно 1% европейцев). Открыты генетич. локусы и факторы врождённого иммунитета, придающие устойчивость и чувствительность к ВИЧ.
bigenc.ru
Строение вируса иммунодефицита человека — Мегаобучалка
Внутри капсида ВИЧ находится белковонуклеиновый комплекс: две нити вирусной РНК, вирусные ферменты (обратная транскриптаза, протеаза, интеграза) и белок p7. С капсидом также ассоциированы белки Nef и Vif (7-20 молекул Vif на вирион). Внутри вириона (и, вероятнее всего, за пределами капсида) обнаружен белок Vpr. Сам капсид образован ~2,000 копий вирусного белка p24. Стехиометрическое соотношение p24:gp120 в вирионе составляет 60-100:1, а p24:Pol примерно 10-20:1. Кроме того, с капсидом ВИЧ-1 (но не ВИЧ-2) связываются ~200 копий клеточного циклофилина А, который вирус заимствует у зараженной клетки.Капсид ВИЧ окружен матриксной оболочкой, образованной ~2,000 копий матриксного белка p17. Матриксная оболочка в свою очередь окружена двуслойной липидной мембраной, являющейся наружной оболочкой вируса. Она образована молекулами, захваченными вирусом во время его отпочковывания из клетки, в которой он сформировался. В липидную мембрану встроены 72 гликопротеиновых комплекса, каждый из которых образован тремя молекулами трансмембранного гликопротеина (gp41 или TM), служащими «якорем» комплекса, и тремя молекулами поверхностного гликопротеина (gp120 или SU). С помощью gp120 вирус присоединяется к CD4 рецептору и корецептору, находящимся на поверхности мембраны клеток. gp41 и в особенности gp120 интенсивно изучаются как цели для разработки лекарств и вакцины против ВИЧ. В липидной мембране вируса также находятся мембранные белки клеток, в том числе человеческие лейкоцитарные антигены (HLA) классов I, II и молекулы адгезии.
Как и все ретровирусы, геном ВИЧ представлен рибонуклеиновой кислотой и подвергается обратной транскрипции. ВИЧ поражает клетки крови человека, имеющие на своей поверхности CD4-рецепторы (CD4+ Т-лимфоциты, макрофаги и дендритные клетки).После того, как число CD4+ T-лимфоцитов становится ниже 200 в одном микролитре (µl) крови, система клеточного иммунитета перестает защищать организм. Острая инфекция со временем переходит в латентную форму, и ранним симптомом ВИЧ-инфекции и далее СПИД является число CD4+ T-лимфоцитов в крови. В отсутствие антиретровирусной терапии средняя продолжительность жизни с ВИЧ-инфекцией составляет от девяти до десяти лет, средняя продолжительность жизни на стадии СПИД составляет около девяти месяцев.Скорость развития инфекции зависит от многих факторов, например, от статуса иммунной системы инфицированного. Пожилые люди имеют более слабую иммунную систему и поэтому имеют повышенный риск быстрого развития заболевания, в сравнении с молодыми людьми.Недостаточный уровень медицинского ухода и наличие сопутствующих инфекционных заболеваний, например, туберкулёза, вызывает предрасположенность к скоротечному развитию заболевания.
Стадии заболевания:
V В I стадии (инкубация) диагноз может носить только предположительный характер, так как основывается исключительно на эпидемиологических данных: половой контакт с инфицированным ВИЧ партнером, переливание крови серопозитивного к ВИЧ донора, использование нестерильных шприцев при групповом введении наркотиков и т.п. Инкубационный период при инфицировании ВИЧ продолжается от 2-3 недель до нескольких месяцев или даже лет. Клинических проявлений болезни нет, сохраняется нормальная активность, антитела к ВИЧ не определяются. Но уже в этот период возможно выявление вируса методом полимеразной цепной реакции.
II стадия (первичных проявлений):
· IIA стадия — острая лихорадочная. Она же начальная (острая) ВИЧ-инфекция. У части зараженных спустя 2-5 мес. после проникновения вируса в организм может развиться острое заболевание, протекающее нередко с повышением температуры тела, выраженной интоксикации, тонзиллитом и мононуклеозоподобным синдромом. Помимо лихорадки в этой фазе болезни часто встречаются кореподобная или краснухоподобная сыпь на коже, миалгия, артралгия, язвы в горле, реже в ротовой полости. Иногда заболевание протекает по типу острой респираторной инфекции, в этих случаях больных беспокоит кашель. У части больных развивается полиаденопатия с увеличением 2-3 групп лимфатических узлов. Увеличение поверхностных лимфатических узлов чаще начинается с затылочных и заднешейных, затем уже увеличиваются подчелюстные, подмышечные и паховые. При пальпации лимфатические узлы эластичные, безболезненные, подвижные, не спаяны между собой и окружающей тканью, размерами от 1 до 5 см, чаще 2-3 см в диаметре. Иногда этим явлениям сопутствуют немотивированные утомляемость, слабость. Кроме того, регистрируются переходящие нарушения деятельности ЦНС — от головных болей до энцефалита.
· Длительность IIБ фазы от 1-2 мес. до нескольких лет, но в среднем около 6 мес. Никаких клинических проявлений заболевания не отмечается, хотя вирус остается в организме и размножается. Иммунный статус при этом сохраняется в пределах нормы, количество лимфоцитов, в том числе CD4+, нормальное. Результаты исследований в ИФА и иммуноблоттинге положительны.
· IIВ фаза — персистирующая генерализованная лимфаденопатия. Единственным клиническим проявлением болезни в этой стадии может быть только увеличение лимфатических узлов, сохраняющееся месяцы и даже годы. Увеличиваются почти все периферические лимфатические узлы, но наиболее характерно увеличение заднешейных, надключичных, подмышечных и локтевых лимфатических узлов. Особенно характерным и настораживающим врача следует считать увеличение подчелюстных лимфатических узлов при отсутствии патологии полости рта. Нередко увеличиваются мезентериальные лимфатические узлы, которые при пальпации болезненны, иногда симулируя картину “острого” живота. Но лимфатические узлы, увеличенные размером до 5 см в диаметре, могут оставаться безболезненными, с тенденцией к слиянию. В 20% у больных выявляются увеличенными печень и селезенка.
megaobuchalka.ru
Вирус СПИДа
РЕФЕРАТ
По курсу: Основы безопасности жизнедеятельности.
Тема: Вирусы. Вирус СПИДа.
План реферата:
1.Введение
2.Место вирусов в биосфере.
Эволюционное происхождение
Строение и свойства
Классификация
3.Вирусы животных и человека
4.СПИД
История открытия ВИЧ
Система иммунитета человека
Действие ВИЧ
Как происходит заражение
Меры профилактики
5.Особенности эволюции вирусов на современном этапе
Влияние загрезнения внешней среды
Последствия массового применения пистицидов
6.Список литературы
1.Введение.
Заболевания растений, животных и человека, вирусная природа которых в настоящее время установлена, в течение многих столетий наносили ущерб хозяйству и вред здоровью человека. Хотя многие из этих болезней были описаны, но попытки установить их причину и обнаружить возбудитель оставались безуспешными.
В результате наблюдений Д.И.Ивановский и В.В.Половцев впервые высказали предположение, что болезнь табака, описанная в 1886 году A.D.Mayer в Голландии под название мозаичной, представляет собой не одно, а два совершенно различных заболевания одного и того же растения: одно из них — рябуха , возбудителем которого является грибок, а другое неизвестного происхождения. Исследование мозаичной болезни табака Д.И.Ивановский продолжает в Никитинском ботаническом саду (под Ялтой) и ботанической лаборатории Академии наук и приходит к выводу, что мозаичная болезнь табака вызывается бактериями, проходящими через фильтры Шамберлана, которые, однако, не способны расти на искусственных субстратах. Возбудитель мозаичной болезни называется Ивановским то “фильтрующимися” бактериями, то микроорганизмами, так как сформулировать сразу существование особого мира вирусов было весьма трудно.
Подчеркивая, что возбудитель мозаичной болезни табака не мог быть обнаружен в тканях больных растений с помощью микроскопа и не культивировался на искусственных питательных средах. Д.И.Ивановский писал, что его предположение о живой и организованной природе возбудителя “сформировано в целую теорию особого рода инфекционных заболеваний”, представителем которых, помимо табачной мозаики, является ящур (использовав тот же метод фильтрации).
Д.И.Ивановский открыл вирусы — новую форму существования жизни. Своими исследованиями он заложил основы ряда научных направлений вирусологии: изучение природы вируса, цитопаталогических вирусных инфекций, фильтрующихся форм микроорганизмов, хронического и латентного вирусоносительства. Один из выдающихся советских фитовирусологов В.Л.Рыжков писал: “Заслуги Д.И.Ивановского не только в том, что он открыл совершенно новый вид заболеваний, но и в том, что он дал методы их изучения”.
В 1935 году У.Стенли из сока табака, пораженного мозаичной болезнью, выделил в кристаллическом виде ВТМ (вирус табачной мозаики). За это в 1946 году ему была вручена Нобелевская премия.
В 1958 году Р.Франклин и К.Холм, исследуя строение ВТМ, открыли, что ВТМ является полым цилиндрическим образованием.
В 1960 году Гордон и Смит установили, что некоторые растения заражаются свободной нуклеиновой кислотой ВТМ, а не целой частицей нуклеотида. В этом же году крупный советский ученый Л.А.Зильбер сформулировал основные положения вирусогенетической теории.
В 1962 году американские ученые А.Зигель, М.Цейтлин и О.И.Зегал экспериментально получили вариант ВТМ, не обладающий белковой оболочкой, выяснили, что у дефектных ВТМ частиц белки располагаются беспорядочно, и нуклеиновая кислота ведет себя, как полноценный вирус.
В 1968 году Р.Шепард обнаружил ДНК-содержащий вирус.
Одним из крупнейших открытий в вирусологии является открытие американских ученых Д.Балтимора и Н.Темина, которые нашли в структуре ретро вируса ген, кодирующий фермент — обратную транскриптазу. Назначение этого фермента — катализировать синтез молекул ДНК на матрице молекулы РНК. За это открытие они получили Нобелевскую премию.
В знак признания выдающихся заслуг Д.И.Ивановского перед вирусологической наукой Институту вирусологии АМН СССР в 1950 году было присвоено его имя, в Академии медицинских наук учреждена премия имени Д.И.Ивановского, присуждаемая один раз в три года.
2.Место вирусов в биосфере.
1.Эволюционное происхождение.
По мере изучения природы вирусов в первом полу столетии после их открытия Д.И.Ивановским (1892) формировались представления о вирусах как о мельчайших организмах. Эпитет “фильтрующийся” со временем был отброшен, так как стали известны фильтрующиеся формы или стадии обычных бактерий, а затем и фильтрующиеся виды бактерий. Наиболее правдоподобной и приемлемой является гипотеза о том, что вирусы произошли из “беглой” нуклеиновой кислоты, т.е. нуклеиновой кислоты, которая приобрела способность реплицироваться независимо от той клетки, из которой она возникла, хотя при этом предусматривается, что такая ДНК реплицируется с использованием структур этой или другой клеток.
На основании опытов фильтрации через градуированные линейные фильтры были определены размеры вирусов. Размер наиболее мелких из них оказался равным 20-30 нм., а наиболее крупных — 300-400 нм.
В процессе дальнейшей эволюции у вирусов менялась больше форма, чем содержание.
Таким образом, вирусы, должно быть, произошли от клеточных организмов, и их не следует рассматривать, как примитивных предшественников клеточных организмов.
2.Строение и свойства.
Размеры вирусов колеблются от 20 до 300 нм. В среднем они в 50 раз меньше бактерий. Их нельзя увидеть в световой микроскоп, так как их длины меньше длины световой волны.
Схематический разрез.
дополнительная
оболочка
капсомер
сердцевина генетический материал
Вирусы состоят яз различных компонентов:
а)сердцевина генетический материал (ДНК или РНК). Генетический аппарат вируса несет информацию о нескольких типах белков, которые необходимы для образования нового вируса: ген, кодирующий обратную транскриптазу и другие.
б)белковая оболочка, которую называют каспидом.
Оболочка часто построена из идентичных, повторяющихся субъедениц — капсомеров. Капсомеры образуют структуры с высокой степенью симметрии.
в) дополнительная липопротеидная оболочка.
Она образована из плазматической мембраны клетки-хозяина. Она встречается только у сравнительно больших вирусов (грипп, герпес).
Полностью сформированная инфекционная частица называется вирионом.
Положение о том, что вирусы представляют собой полноценные организмы, позволило окончательно объединить все три названных группы вирусов — вирусы животных, растений и бактерий — в одну категорию, занимающую определенное место среди живых существ, населяющих нашу планету. Тот факт, что их не удалось выращивать на искусственных питательных средах, вне клеток, не вызывал особого удивления, так как вирусы с самого начала были определены как строгие внутриклеточные паразиты. Это свойство признавалось не уникальным, присущим только вирусам, поскольку внутриклеточные паразиты известны и среди бактерий, и среди простейших. Как и другие организмы, вирусы способны к размножению. Вирусы обладают определенной наследственностью, воспроизводя себе подобных. Наследственные признаки вирусов можно учитывать по спектру поражаемых хозяев и симптомам вызываемых заболеваний, а также по специфичности иммунных реакций естественных хозяев или искусственных иммунизируемых экспериментальных животных. Сумма этих признаков позволяет чет
mirznanii.com