Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Фев
Мар
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Лечение дисбактериоза после антибиотиков по курсу Лаважа Маткевича
ДИСБАКТЕРИОЗ: Восстановление микрофлоры после приема антибиотиков
Приём антибиотиков на протяжении длительного времени (10-14 дней) чреват таким неприятным последствием, как дисбактериоз или дисбаланс микрофлоры кишечника.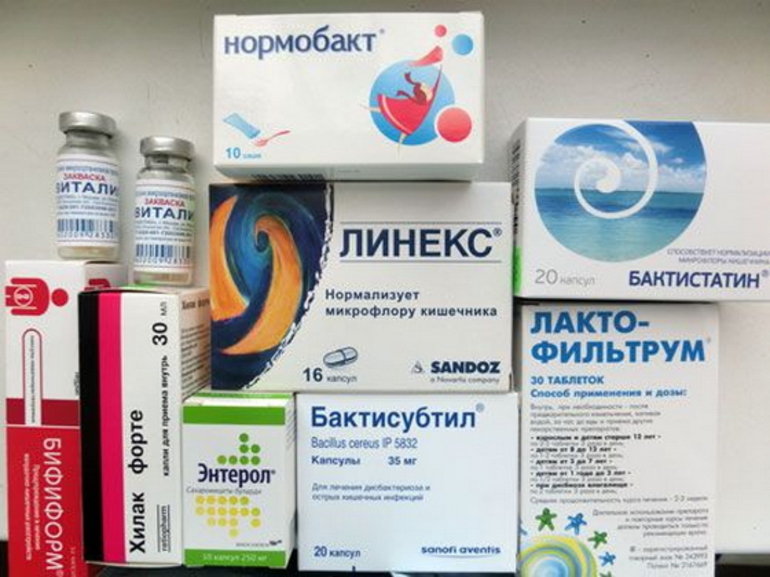 Несмотря на то, что дисбактериоз не считается заболеванием, он сопровождается серьёзным дискомфортом. В некоторых случаях такое состояние проходит самостоятельно, но часто организм требует помощи в восстановлении естественного баланса.
Несмотря на то, что дисбактериоз не считается заболеванием, он сопровождается серьёзным дискомфортом. В некоторых случаях такое состояние проходит самостоятельно, но часто организм требует помощи в восстановлении естественного баланса.
Лечение после антибиотиков часто предусматривает длительный курс пре- и пробиотиков, выпускаемых в виде таблеток, капсул, водорастворимых порошков (например, сюда можно отнести препараты бактистатин или линекс). Во многих случаях такую терапию сопровождает приём ферментных препаратов и энтеросорбентов (активированного и белого угля, диоксида кремния).
Некоторые пациенты, заработавшие дисбактериоз после длительного приема антибиотиков, пытаются лечиться не только аптечными лекарствами, но также кисломолочными продуктами, содержащими лакто- и бифидобактерии. Нередко в ход идут многочисленные народные средства: пивные дрожжи, мёд, травяные настои, растительная клетчатка.
Лечить дисбаланс кишечной микрофлоры у взрослого или ребёнка всегда нужно в комплексе. Назначая препараты после антибиотиков, врач в первую очередь порекомендует позаботиться о детоксикации организма. Эффективным способом очистки кишечника и нормализации флоры станет уникальная авторская процедура «Лаваж Маткевича», позволяющая очистить от токсинов весь желудочно-кишечный тракт от полости рта до прямой кишки, нормализовать обмен веществ и в кратчайшие сроки восстановить кишечный баланс.
Назначая препараты после антибиотиков, врач в первую очередь порекомендует позаботиться о детоксикации организма. Эффективным способом очистки кишечника и нормализации флоры станет уникальная авторская процедура «Лаваж Маткевича», позволяющая очистить от токсинов весь желудочно-кишечный тракт от полости рта до прямой кишки, нормализовать обмен веществ и в кратчайшие сроки восстановить кишечный баланс.
Для лечения дисбактериоза после антибиотиков рекомендован курс из 4-6 процедур «Лаважа Маткевича», предусматривающих прием внутрь специального очищающего раствора.
Положительные эффекты «Лаважа Маткевича»:
Удаляет болезнетворные микроорганизмы, не затрагивая полезные бифидо- и лактобактерии.
Быстро восстанавливает слизистую оболочку и флору кишечника.
Выводит токсины, облегчая работу печени, поджелудочной железы и почек.
Очищает кровь и лимфу.
Улучшает самочувствие, повышает общий тонус и иммунитет.

Нормализует сон.
К нам вы можете обратиться, чтобы заказать лечение у взрослых дерматита в Москве.
Таблетки от дисбактериоза кишечника: список, названия, рейтинг лучших
Часто бывает, что после курса антибиотиков начинаются проблемы с кишечником. И в этом случае нет сомнений относительно развития дисбактериоза. Антибиотики – сильные препараты, которые уничтожают не только патогенную микрофлору, но и полезные бактерии, необходимые для правильной работы этой системы. Выход из сложившейся ситуации один – пропить курс таблеток. От дисбактериоза кишечника разработано огромное количество препаратов, отличающихся между собой по цене, характеристикам и предназначению. Обычно применяется комплексная терапия, включающая в себя несколько разнонаправленных лекарственных средств, так или иначе оказывающих позитивное воздействие на угнетенную полезную микрофлору кишечника.
Что такое дисбактериоз?
Данное состояние представляет собой нарушение микрофлоры, связанное с изменением состава бактерий. Его также называют дисбиозом. Дисбактериоз кишечника не является самостоятельным заболеванием, а возникает только вследствие какой-то другой патологии, то есть бывает исключительно вторичным. Заболевание вызывает массу дискомфортных ощущений в области желудка и кишечника, а потому подлежит лечению специальными препаратами. Их действие направлено на нормализацию баланса полезной микрофлоры путем восполнения недостатка соответствующими группами бактерий.
Его также называют дисбиозом. Дисбактериоз кишечника не является самостоятельным заболеванием, а возникает только вследствие какой-то другой патологии, то есть бывает исключительно вторичным. Заболевание вызывает массу дискомфортных ощущений в области желудка и кишечника, а потому подлежит лечению специальными препаратами. Их действие направлено на нормализацию баланса полезной микрофлоры путем восполнения недостатка соответствующими группами бактерий.
Как составляется правильный терапевтический план?
Перед назначением таблеток от дисбактериоза кишечника врач проводит обследование пациента с целью выявления причины, приведшей к патологическому состоянию. Она кроется не только в приеме антибиотиков, но и может быть связана с кишечными инфекциями (дизентерия, грипп, сальмонеллез), хроническими заболеваниями желудочно-кишечного тракта в остром периоде (гепатит, панкреатит, холецистит), постоянными стрессами, сменой климата, несбалансированным питанием, работой на вредном производстве и так далее. В этом случае важно устранить первопричину. При необходимости назначаются препараты, действие которых направлено на устранение воспалительных процессов в ЖКТ и восстановление моторных функций кишечника. Также могут быть рекомендованы заместительные ферментные препараты.
В этом случае важно устранить первопричину. При необходимости назначаются препараты, действие которых направлено на устранение воспалительных процессов в ЖКТ и восстановление моторных функций кишечника. Также могут быть рекомендованы заместительные ферментные препараты.
Во вторую очередь подбираются таблетки от дисбактериоза кишечника. При их помощи, как уже известно, проводится коррекция состава микрофлоры. В данном случае на основании выводов врача, полученных путем проведения соответствующих анализов, подбираются антибактериальные препараты, бактериофаги, кишечные антисептики, пробиотики и пребиотики. Они способствуют росту нормальной микрофлоры, которая «убивает» патогенную. Дополнительно могут быть назначены иммуномодуляторы, главная цель которых – восстановление и укрепление защитных сил организма.
Как таблетки от дисбактериоза кишечника помогают справиться с этим состоянием?
Как правило, дисбиоз характеризуется рядом неприятных симптомов, таких как диарея или запор, тошнота, рвота, метеоризм, кожные аллергические реакции, а также симптомы интоксикации, выражающиеся головной болью и общей слабостью. Нередко на его фоне возникают другие заболевания. Это связано со снижением защитных сил организма. Все это результат действия патогенных организмов, которые в обычном состоянии уничтожаются полезной микрофлорой. Чтобы вернуть нормальное состояние кишечнику и восстановить его функции, нужно принимать соответствующие препараты. Сегодня их очень много на фармакологическом рынке. В зависимости от группы лекарственного средства препараты оказывают различное терапевтическое действие как на сам кишечник, так и на его бактериальный состав. Одни способствуют нормализации функции стенок тонкой и толстой кишки. Другие населяют микрофлору необходимыми группами полезных бактерий. Третьи выступают в качестве кишечного антисептика, угнетая деятельность болезнетворных микроорганизмов. А четвертая группа препаратов при дисбактериозе кишечника способствует повышению защитной функции организма.
Нередко на его фоне возникают другие заболевания. Это связано со снижением защитных сил организма. Все это результат действия патогенных организмов, которые в обычном состоянии уничтожаются полезной микрофлорой. Чтобы вернуть нормальное состояние кишечнику и восстановить его функции, нужно принимать соответствующие препараты. Сегодня их очень много на фармакологическом рынке. В зависимости от группы лекарственного средства препараты оказывают различное терапевтическое действие как на сам кишечник, так и на его бактериальный состав. Одни способствуют нормализации функции стенок тонкой и толстой кишки. Другие населяют микрофлору необходимыми группами полезных бактерий. Третьи выступают в качестве кишечного антисептика, угнетая деятельность болезнетворных микроорганизмов. А четвертая группа препаратов при дисбактериозе кишечника способствует повышению защитной функции организма.
Пробиотики содержат в своем составе натуральные культуры микроорганизмов, а пребиотики – это пищевые добавки, созданные на основе природных волокон, которые не перевариваются желудком. Они попадают прямо в кишечник, где остаются для того, чтобы существующая «хорошая» микрофлора питалась ими. Антисептики, или антибактериальные препараты, способствуют снижению состава бактерий при повышенном обсеменении кишечника. Все это позитивно сказывается на состоянии данного органа, способствуя его выздоровлению.
Они попадают прямо в кишечник, где остаются для того, чтобы существующая «хорошая» микрофлора питалась ими. Антисептики, или антибактериальные препараты, способствуют снижению состава бактерий при повышенном обсеменении кишечника. Все это позитивно сказывается на состоянии данного органа, способствуя его выздоровлению.
Список таблеток от дисбактериоза кишечника у взрослых
Как уже упоминалось, препаратов, разработанных для лечения такой патологии, много. У каждого своя роль и предназначение. Кроме того, они выпускаются в форме таблеток, порошков, суспензий и капель. Наиболее популярными в разных фармакологических группах являются:
- Ферменты, помогающие переваривать пищу: «Панкреатин», «Мезим», «Креон».
- Пробиотики: «Линекс», «Аципол», «Бактистатин», «Лактофильтрум», «Бифиформ», «Максилак».
- Сорбенты: «Фильтрум», активированный уголь.
- Противомикробные препараты – это антибиотики, цель которых заключается в уничтожении патогенной микрофлоры: «Амоксиклав», «Амоксициллин», «Левомицетин», «Цефтриаксон».

- Антибактериальные средства: «Нистатин», «Метронидазол», «Флуконазол», «Пиобактериофаг», «Бактериофаг».
- Противоязвенные препараты: «Омез» (при повышенной кислотности желудка).
- Спазмолитические средства: «Дюспаталин» (против боли в области кишечника).
- Противодиарейные препараты: «Смекта», «Хилак Форте».
- Сорбенты: «Полисорб».
- Пробиотики: «Бифидумбактерин», «Нормобакт», «Эвиталия».
- Адсорбенты: «Альмагель», «Энтеросгель», «Фосфалюгель».
Как видно, препаратов, которые могут быть назначены при дисбактериозе, много. Назначение осуществляется только врачом и исключительно после получения результатов соответствующих анализов. Подбирается целый комплекс средств и рекомендуется диета (лечебный стол №4 по Певзнеру). Наряду с этим назначаются, чтобы избежать дисбактериоза кишечника от антибиотиков, таблетки-пробиотики, которые нужно принимать на протяжении курса терапии. Обычно врачи рекомендуют «Линекс», «Бифидумбактерин», «Лактофильтрум», «Аципол». Эти препараты очень популярны и заслужили любовь в народе, что видно из отзывов о каждом из них.
Эти препараты очень популярны и заслужили любовь в народе, что видно из отзывов о каждом из них.
Популярные пребиотики
Наряду с пробиотиками, эта группа лекарственных средств остается наиболее часто назначаемой для лечения рассматриваемой патологии. Пребиотики – это лекарственные средства, которые содержат в своем составе природные волокна, попадающие в кишечник и являющиеся пищей для полезной микрофлоры.
Одним из наиболее популярных препаратов данной группы считается «Дюфалак». Он создан на основе лактулозы, поэтому противопоказан тем, у кого имеется индивидуальная непереносимость данного вещества, а также фруктозы. Как и многие другие средства, воздействующие на кишечник, он запрещен при кишечной непроходимости и ректальных кровотечениях. «Дюфалак», попадая в организм, разлагается на дисахариды, превращаясь в низкомолекулярные кислоты. В итоге артериальное давление нормализуется, что приводит к подавлению деятельности патогенной микрофлоры.
Еще один популярный для лечения дисбактериоза кишечника у взрослых препарат – «Хилак Форте». Он создан на основе лактобактерий, молочной кислоты и жирных кислот. Помогает нормализовать показатели кислотности и способствует росту полезной микрофлоры. Также в составе есть энтеросорбенты, которые «блокируют» движение токсических веществ, а затем выводят их.
Он создан на основе лактобактерий, молочной кислоты и жирных кислот. Помогает нормализовать показатели кислотности и способствует росту полезной микрофлоры. Также в составе есть энтеросорбенты, которые «блокируют» движение токсических веществ, а затем выводят их.
Популярные пробиотики
Самыми эффективными, по мнению пациентов, считаются «Линекс» и «Бифидумбактерин». Второй препарат существует уже достаточно длительное время, и имеет в основном только положительные отзывы. Кстати, его стоимость значительно ниже, чем у многих других средств. Таблетки от дисбактериоза кишечника у взрослых и детей «Линекс» и лиофилизат «Бифидумбактерин» относятся к монокомпонентным препаратам, то есть они содержат только один вид бактерий. Зато их в составе – несколько миллионов! Полезные бактерии, попадая в организм, начинают быструю борьбу против патогенных микроорганизмов. Эти препараты безопасны для применения в любом возрасте, рекомендуются даже беременным и грудным малышам, а риска развития аллергической реакции нет.
Популярные антибактериальные препараты
Это средства, которые назначаются в случае инфекционной этиологии заболевания. Препараты при дисбактериозе кишечника, вызванном болезнетворными бактериями, подбираются на основании проведенного лабораторно-бактериологического исследования. Анализ полученных данных помогает определить чувствительность бактерий к конкретному препарату. Например, против энтерококков и протеев хорошо помогают «Эрсефурил» и «Энтерофурил». Со стафилококками успешно борются «Азитромицин» и «Кларитромицин». Синегнойную палочку подавляет «Канамицин», а кандидоз – «Флуконазол». Так как антибактериальных препаратов много, и у каждого своя роль, сложно выбрать лучший в этой группе. Однако все лекарственные средства, перечисленные здесь, являются достаточно эффективными, если подобраны и применяются правильно.
Популярные иммуномодуляторы и энтеросорбенты
Назначаются в дополнение к основной терапии. Энтеросорбенты – это лекарственная группа, характеризующая способностью выводить из организма токсичные вещества. Они тоже вносят свою лепту в лечение дисбактериоза кишечника у взрослых – препараты этой группы будут отличным дополнением к основной терапии. Наиболее популярными считаются «Полисорб», активированный уголь, «Энтеросгель», «Фильтрум». Они назначаются на короткой промежуток времени, не более 14 дней.
Они тоже вносят свою лепту в лечение дисбактериоза кишечника у взрослых – препараты этой группы будут отличным дополнением к основной терапии. Наиболее популярными считаются «Полисорб», активированный уголь, «Энтеросгель», «Фильтрум». Они назначаются на короткой промежуток времени, не более 14 дней.
Иммуномодуляторы помогают ускорить восстановление микрофлоры кишечника. Назначаются исключительно врачом. Рекомендуется отдать предпочтение средствам натурального происхождения: настойки прополиса, эхинацеи, лимонника или элеутерококка, «Иммунал» и «Дибазол». Как можно понять из названия данной группы, они стимулируют повышение защитных сил организма, помогают вырабатывать или же укрепляют уже имеющийся иммунитет к различным инфекциям.
Рейтинг эффективных препаратов от дисбактериоза
Сложно назвать лучший препарат от дисбактериоза кишечника, так как все зависит от этиологии этой патологии. Если говорить про пробиотики и пребиотики, можно рассмотреть вариант применения симбиотиков – группа средств, которая включает в себя лекарства, состоящие и из первых, и из вторых компонентов. Одним из лучших по праву считается «Максилак». Он состоит из 9 микроорганизмов, которые эффективно справляются с дисбактериозом, а также помогают при проблемах в работе иммунной и дыхательной систем. Также в рейтинг лучших симбиотиков входят:
Одним из лучших по праву считается «Максилак». Он состоит из 9 микроорганизмов, которые эффективно справляются с дисбактериозом, а также помогают при проблемах в работе иммунной и дыхательной систем. Также в рейтинг лучших симбиотиков входят:
- «Нормоспектрум»;
- «Мальтидофилюс»;
- «Фильтрум-СТИ Бифидобак»;
- «Бактистатин»;
- «Лактофильтрум».
Что касается пребиотиков, лучшими препаратами от дисбактериоза кишечника у взрослых признаны:
- «Дюфалак»;
- «Портлак»;
- «Ромфалак»;
- «Нормалазе»;
- «Хилак Форте».
Лучшие пробиотики:
- «Линекс»;
- «Бифидумбактерин»;
- «Бифиформ».
Также есть комбинированные пробиотики:
- «Аципол»;
- «Кипацид»;
- «Флорин Форте».
Кроме этого, в этот рейтинг можно включить «Имодиум» и «Лоперамид» как средства, помогающие избавиться от спазмов. А восстановлением перистальтики кишечника занимаются «Смекта» и «Энтеросгель», кроме того, это отличные сорбенты. Все 4 препарата направлены на устранение диареи и ее неприятных симптомов.
Все 4 препарата направлены на устранение диареи и ее неприятных симптомов.
Рекомендации пациентов
Для некоторых людей определяющим фактором могут служить отзывы о препаратах. Лечение дисбактериоза кишечника – нешуточный процесс, к которому нужно подходить серьезно, обращая внимание на каждый нюанс. Кстати, основными противопоказаниями к приему лекарственных средств, направленных на лечение данной патологии, являются аллергические реакции как следствие непереносимости компонентов препарата. Наиболее выраженным таким действием обладают средства в жидкой форме. Зато они считаются эффективнее. А вот препараты в форме таблеток по действию им уступают, зато являются более безопасными.
Многие пациенты рекомендуют к применению именно лиофилизаты для приготовления суспензии для приема внутрь. Это, например, «Бификол» и «Бифидумбактерин». Что касается наиболее дешевых таблеток от дисбактериоза кишечника, список включает в себя «Лактобактерин», «Биовестин», «Пробифор», «Биобактон» и «Флорин Форте». Как уверяют специалисты, по эффективности они не уступают своим дорогим аналогам.
Как уверяют специалисты, по эффективности они не уступают своим дорогим аналогам.
Также в отзывах пациентов можно видеть рекомендации относительно приема препаратов «Хилак Форте», «Наринэ», «Бактисубтил», «Биовестин». В общем-то, все препараты, которые были рассмотрены в статье, пользуются хорошим спросом и оказываются эффективными в борьбе с дисбактериозом, а это главное. Многие из них не вызывают аллергических реакций, а потому могут применяться даже аллергиками в терапии заболевания.
Важно помнить, что лечение дисбактериоза кишечника таблетками, лиофилизатами или суспензиями может затянуться на длительное время, а для стойкого результата требуется комплексный подход. При этом большая часть препаратов не может применяться дольше 14 дней, другие – более месяца. Это еще раз подтверждает, что разработкой терапевтического плана должен заниматься лечащий врач. Он же обязан назначать пациенту соответствующие анализы, а не выбирать препараты «по крутизне», опираясь на собственный опыт и несерьезно относясь к данной патологии. При таком подходе лучше обратиться к другому специалисту.
При таком подходе лучше обратиться к другому специалисту.
В заключение хотелось бы заметить, что хотя дисбактериоз в медицине и не считается заболеванием как таковым, все же требует лечения, хотя бы потому, что доставляет человеку массу неудобств. При этом самолечение в данной ситуации нужно исключить, так как купленный препарат может попросту оказаться неэффективным, если причина кроется, например, в кишечной инфекции. А если и поможет, то в скором времени будет рецидив – первичная патология-то не устранена. В любом случае, чтобы понять, какие таблетки попить при дисбактериозе кишечника, необходимо пройти обследование. Оно позволит выявить причину и нанести удар именно в ее направлении. Бактериологическое исследование также поможет определить, каких именно бактерий не хватает в кишечнике, чтобы осуществить подбор, полагаясь исключительно на эти данные. Тогда терапия будет максимально эффективной и правильной.
Текущие знания и аспекты требуют уточнения
Мир J Гастроэнтерол. 2019 14 июня; 25 (22): 2706–2719.
2019 14 июня; 25 (22): 2706–2719.
Giovanni Bruno
Кафедра внутренних болезней и медицинских специальностей, отделение гастроэнтерологии, Римский университет Сапиенца, Рим 00161, Италия
Piera Zaccari
Кафедра внутренних болезней и медицинских специальностей, отделение гастроэнтерологии, Римский университет Сапиенца, Рим 00161 , Италия
Giulia Rocco
Кафедра внутренних болезней и медицинских специальностей, отделение гастроэнтерологии, Римский университет Сапиенца, Рим 00161, Италия
Giulia Scalese
Кафедра внутренних болезней и медицинских специальностей, отделение гастроэнтерологии, Римский университет Сапиенца, Рим 00161, Италия
Кристина Панетта
Кафедра хирургии, Римский университет Сапиенца, Рим 00161, Италия
Барбара Поровска
Кафедра кардио-торакальной, сосудистой хирургии и трансплантации, Римский университет Сапиенца, Италия1 0016
Карола Севери
Департамент Внутренние болезни и медицинские специальности, отделение гастроэнтерологии, Римский университет Сапиенца, Рим 00161, Италия
Джованни Бруно, отделение внутренних болезней и медицинских специальностей, отделение гастроэнтерологии, Римский университет Сапиенца, Рим 00161, Италия;
Участие авторов: Бруно Г. , Заккари П. и Рокко Г. выполнили поиск литературы и написали рукопись; Поровска Б. критически отредактировала рукопись; Scalese G и Panetta C разработали и создали фигурки; Понтоне С. и Севери С. обеспечили научное руководство и в равной степени внесли свой вклад в рукопись в качестве старших авторов; все авторы пересмотрели и одобрили окончательную версию этой статьи.
, Заккари П. и Рокко Г. выполнили поиск литературы и написали рукопись; Поровска Б. критически отредактировала рукопись; Scalese G и Panetta C разработали и создали фигурки; Понтоне С. и Севери С. обеспечили научное руководство и в равной степени внесли свой вклад в рукопись в качестве старших авторов; все авторы пересмотрели и одобрили окончательную версию этой статьи.Автор, ответственный за переписку: Стефано Понтоне, доктор медицинских наук, доцент кафедры хирургии Римского университета Сапиенца, V.le Regina Elena 324, Рим 00161, Италия. [email protected]
Телефон: +39-06-49975503
Поступила в редакцию 12 марта 2019 г.; Пересмотрено 2 апреля 2019 г.; Принято 19 апреля 2019 г.
Copyright © Авторы, 2019 г. Опубликовано Baishideng Publishing Group Inc. Все права защищены. Эта статья находится в открытом доступе, она была выбрана штатным редактором и полностью проверена внешними рецензентами.Он распространяется в соответствии с некоммерческой лицензией Creative Commons Attribution (CC BY-NC 4. 0), которая позволяет другим распространять, микшировать, адаптировать, использовать эту работу в некоммерческих целях и лицензировать свои производные работы на других условиях при условии, что оригинальная работа правильно цитируется и используется в некоммерческих целях.
0), которая позволяет другим распространять, микшировать, адаптировать, использовать эту работу в некоммерческих целях и лицензировать свои производные работы на других условиях при условии, что оригинальная работа правильно цитируется и используется в некоммерческих целях.
Abstract
Ингибиторы протонной помпы (ИПП) широко используются в гастроэнтерологической практике.Эти препараты, которые действуют посредством необратимого ингибирования водородно-калиевого насоса (Н+/К+-АТФазного насоса) в париетальных клетках желудка, используются при лечении ряда кислотозависимых заболеваний. ИПП, как правило, хорошо переносятся, но из-за длительного снижения секреции желудочного сока могут повышать риск дисбаланса состава кишечной микробиоты (, т.е. , дисбиоз). Микробиота кишечника представляет собой сложную экосистему, в которой микробы сосуществуют и взаимодействуют с человеком-хозяином.Действительно, резидентные кишечные бактерии необходимы для множества жизненно важных функций, таких как метаболизм питательных веществ и лекарств, производство энергии, защита от патогенов, модуляция иммунной системы и поддержание целостности барьера слизистой оболочки кишечника. Бактерии собираются в сообщества, которые различаются по плотности и составу в каждом сегменте желудочно-кишечного тракта (ЖКТ). Таким образом, каждое изменение в экосистеме кишечника было связано с повышенной восприимчивостью или обострением различных желудочно-кишечных расстройств.Цель этого обзора — обобщить недавно полученные данные об изменениях микробиоты, связанных с ИПП, в каждом сегменте желудочно-кишечного тракта и проанализировать возможное участие ИПП в патогенезе некоторых специфических заболеваний ЖКТ.
Бактерии собираются в сообщества, которые различаются по плотности и составу в каждом сегменте желудочно-кишечного тракта (ЖКТ). Таким образом, каждое изменение в экосистеме кишечника было связано с повышенной восприимчивостью или обострением различных желудочно-кишечных расстройств.Цель этого обзора — обобщить недавно полученные данные об изменениях микробиоты, связанных с ИПП, в каждом сегменте желудочно-кишечного тракта и проанализировать возможное участие ИПП в патогенезе некоторых специфических заболеваний ЖКТ.
Ключевые слова: Ингибиторы протонной помпы, Гипохлоридия, Микробиота кишечника, Дисбактериоз, Желудочно-кишечный тракт, Рак, Helicobacter pylori , Желудочно-кишечные инфекции
Основной совет: Микробиота кишечника играет фундаментальную роль в поддержании здоровья человека.Однако некоторые лекарства, в том числе ингибиторы протонной помпы, могут вызывать дисбактериоз, который, в свою очередь, является причиной различных внекишечных и кишечных заболеваний. Был проведен актуальный обзор литературы для выявления изменений в составе кишечной микробиоты, связанных с хронической терапией ингибиторами протонной помпы, и для выявления возможного патогенетического участия дисбактериоза в желудочно-кишечных расстройствах.
Был проведен актуальный обзор литературы для выявления изменений в составе кишечной микробиоты, связанных с хронической терапией ингибиторами протонной помпы, и для выявления возможного патогенетического участия дисбактериоза в желудочно-кишечных расстройствах.
ВВЕДЕНИЕ
Ингибиторы протонной помпы (ИПП) являются кислотоподавляющими агентами и относятся к числу наиболее широко используемых и чрезмерно используемых препаратов в мире[1].ИПП являются препаратами первого выбора для лечения кислотозависимых заболеваний, таких как кровотечения, пептические язвы, гастроэзофагеальный рефлюкс, эрозивный эзофагит (ERD) и некоторые подтипы диспепсии [2-5]. Использование ИПП, как правило, хорошо переносится, хотя их длительное применение подвергает пациентов повышенному риску развития внекишечных расстройств [6-8], вероятно, из-за вызванной ИПП желудочной гипохлоргидрии, которая также может вызывать значительные изменения. в составе микробиоты кишечника [9-11] (рис. ). Микробиота кишечника играет ключевую роль в метаболических, пищевых, физиологических, защитных и иммунологических процессах в организме человека, и ее состав тесно связан со здоровьем людей и болезнями, которые они испытывают [12,13]. Изменения в этом микробном равновесии, то есть дисбиоз, могут способствовать и влиять на течение многих кишечных и внекишечных заболеваний [14-16]. Влияние ИПП на состав микробиоты кишечника в настоящее время является популярной темой, и за прошедшие годы было опубликовано несколько интересных рукописей, расширяющих знания в этой области [17-20].
Изменения в этом микробном равновесии, то есть дисбиоз, могут способствовать и влиять на течение многих кишечных и внекишечных заболеваний [14-16]. Влияние ИПП на состав микробиоты кишечника в настоящее время является популярной темой, и за прошедшие годы было опубликовано несколько интересных рукописей, расширяющих знания в этой области [17-20].
Распределение основных семейств бактерий микробиоты человека в физиологическом состоянии и при лечении ингибиторами протонной помпы. На этом рисунке показано влияние лечения ингибитором протонной помпы (ИПП) на состав семейств кишечной микробиоты.В левой части рисунка показаны основные семейства бактерий в нормальных физиологических условиях; в правой части рисунка показано увеличение (↑) и уменьшение (↓) бактериальных семейств, присутствующих в микробиоте кишечника во время лечения ИПП. ИПП: ингибитор протонной помпы.
Цель настоящего обзора — обобщить последние данные о влиянии ИПП на микробиоту кишечника, сосредоточив внимание на различных областях желудочно-кишечного тракта (ЖКТ), и обсудить возможную роль ассоциированного дисбактериоза в патогенезе нескольких желудочно-кишечных расстройств. При этом это исследование направлено на то, чтобы лучше понять, как ИПП могут изменить гомеостаз человека из-за дисбаланса кишечной микробиоты.
При этом это исследование направлено на то, чтобы лучше понять, как ИПП могут изменить гомеостаз человека из-за дисбаланса кишечной микробиоты.
ПОЛОСТЬ РТА
Несмотря на постоянное занесение различных бактерий из внешней среды человека, микробиота полости рта остается менее изменчивой по сравнению с другими областями желудочно-кишечного тракта. Он в основном состоит из Firmicutes и Bacteroidetes, а также Actino-bacteria, Proteobacteria и Fusobacteria [21]. Что касается родов, наиболее распространенными являются Streptococcus, Neisseria, Prevotella, Gemella, Granulicatella и Veillonella [22,23].Микробиота полости рта помогает обогащать и формировать бактериальные сообщества кишечника за счет постоянного притока пищи и слюны [24-26]. Сообщалось, что воспалительные заболевания, такие как гингивит и пародонтит, которые вызывают сдвиг в составе микробного сообщества ротовой полости, могут способствовать выработке токсичных и канцерогенных метаболитов, цитолитических ферментов и липополисахарида (ЛПС) патогенного происхождения ротовой полости, которые способны для колонизации внеротовых участков из-за транзиторной бактериемии [27-29]. Сообщается, что распространение таких токсичных соединений способствует развитию многих желудочно-кишечных заболеваний, включая синдром раздраженного кишечника (СРК), воспалительные заболевания кишечника (ВЗК) и рак [30-33].
Сообщается, что распространение таких токсичных соединений способствует развитию многих желудочно-кишечных заболеваний, включая синдром раздраженного кишечника (СРК), воспалительные заболевания кишечника (ВЗК) и рак [30-33].
В настоящее время представлено мало данных о взаимосвязи между использованием ИПП и составом микробиоты полости рта. Одно исследование показало, что у здоровых добровольцев четырехнедельный прием ИПП эзомепразола вызывал увеличение Fusobacterium и Leptotrichia в пародонтальном кармане, что ассоциировалось со снижением Neisseria и Veillonella в слюне и параллельным увеличение Streptococcus в образцах фекалий; это говорит о том, что ИПП могут вызывать изменения микробиоты как полости рта, так и кишечника [34].На основании этих данных полость рта может представлять собой потенциальный источник информации о микробиоте, связанной с оральными и неротовыми расстройствами; это также может быть важным индикатором дисбактериоза в других областях желудочно-кишечного тракта.
ПИЩЕВОД
Пищевод имеет отчетливую микробиоту с относительно стабильным бактериальным составом окружающей среды; он не просто содержит транзиторную микробную популяцию, возникающую в результате глотания (, т. е. ., из полости рта) или рефлюкса ( i.е ., из желудка). Дистальный тракт в основном колонизирован Firmicutes, за которым следуют Bacteroidetes, Actinobacteria, Proteobacteria и Fusobacteria, причем наиболее представлены роды Streptococcus , за которыми следуют Prevotella и Veillonella [35]. На основании различий в соотношении родов в пищеводе были идентифицированы два типа микробиоты: тип I, присутствующий у здоровых людей, характеризуется преобладанием грамположительных таксонов (особенно Streptococcus ), тогда как тип II, ассоциированный с ЭРБ и пищеводом Барретта (ПБ), характеризуется преобладанием грамотрицательных таксонов, в том числе Veillonella, Prevotella, Haemophilus, Neisseria, Rothia, Granulicatella, Campylobacter, Porphyromonas, Fusobacterium и Actinomyces , с относительным снижением в обилии стрептококков [36,37]. Вполне вероятно, что это переключение в пользу грамотрицательных бактерий могло вызвать опосредованную ЛПС активацию врожденного иммунитета, вызывая опасный цикл дисбактериоз-воспаление-дисбиоз и повреждение слизистой оболочки [38].
Вполне вероятно, что это переключение в пользу грамотрицательных бактерий могло вызвать опосредованную ЛПС активацию врожденного иммунитета, вызывая опасный цикл дисбактериоз-воспаление-дисбиоз и повреждение слизистой оболочки [38].
С начала 1980-х годов считалось, что воспалительная реакция, опосредованная дисбиозом, и повышенная продукция проканцерогенных бактериальных соединений способствуют канцерогенезу [39]. Недавно эта гипотеза была вновь подтверждена и изучена [40]. И ERD, и BE считаются предвестниками аденокарциномы пищевода (EAC) [41].В обоих этих условиях сообщалось о значительном обогащении Campylobacter concisus [42,43]. Эта бактерия может играть роль в EAC, способствуя метапластическим процессам на ранних стадиях рака за счет увеличения экспрессии интерлейкина (IL)-18 и подавления трансформирующего фактора роста бета 1, ядерного фактора каппа B (NF-κB) и преобразователь сигнала и активатор передачи сигналов транскрипции 3, участвующей в каскаде EAC [42-44]. Более того, присутствие Fusobacterium nucleatum ( F.nucleatum ) был описан при раке пищевода и связан с плохим прогнозом, что предполагает его потенциальную роль в качестве прогностического биомаркера [45]. Наконец, образцы ПБ пищевода с дисплазией высокой степени и EAC демонстрируют снижение разнообразия микробиоты и относительную численность Lactobacillales , которые благодаря своей способности подкислять микросреду и производить вредные вещества, такие как перекись водорода, могут способствовать развитию этих заболеваний[46].
Более того, присутствие Fusobacterium nucleatum ( F.nucleatum ) был описан при раке пищевода и связан с плохим прогнозом, что предполагает его потенциальную роль в качестве прогностического биомаркера [45]. Наконец, образцы ПБ пищевода с дисплазией высокой степени и EAC демонстрируют снижение разнообразия микробиоты и относительную численность Lactobacillales , которые благодаря своей способности подкислять микросреду и производить вредные вещества, такие как перекись водорода, могут способствовать развитию этих заболеваний[46].
В настоящее время исследований, связанных с влиянием ИПП на микробиоту пищевода и их способностью обращать вспять микробное переключение, которое происходит при ЭРБ и ПБ, немного. Лечение ИПП может изменить микробиоту пищевода, вызывая увеличение количества Firmicutes и снижение количества Bacteroidetes и Proteobacteria [47]. Эти данные, полученные как при аспирации, так и при биопсии, позволяют предположить, что некоторые семейства бактерий могут колонизировать пищевод, подверженный воздействию менее кислотных рефлюксов, даже если их роль необходимо установить. Недавнее эпидемиологическое исследование показало, что при отсутствии других факторов риска длительное применение ИПП связано с повышенным риском РАС [48]. Авторы предположили, что терапия ИПП сама по себе может предрасполагать пациентов к РАС, вероятно, за счет колонизации внежелудочными микробами, способными продуцировать нитрозамины, которые, как известно, обладают канцерогенным потенциалом как для РАС, так и плоскоклеточного рака пищевода. Эта концепция противоречит существующим руководствам, которые рекомендуют использование ИПП у пациентов с недиспластическим ПБ [49], поскольку их длительное применение значительно снижает риск прогрессирования дисплазии высокой степени и ЭАК [50-52].Было высказано предположение, что уменьшение желудочного кислотного рефлюкса в пищеводе, вызванное ИПП, позволяет избежать гибели чувствительных к кислоте бактерий, что оказывает благотворное влияние на поддержание микробиоты I типа [53].
Недавнее эпидемиологическое исследование показало, что при отсутствии других факторов риска длительное применение ИПП связано с повышенным риском РАС [48]. Авторы предположили, что терапия ИПП сама по себе может предрасполагать пациентов к РАС, вероятно, за счет колонизации внежелудочными микробами, способными продуцировать нитрозамины, которые, как известно, обладают канцерогенным потенциалом как для РАС, так и плоскоклеточного рака пищевода. Эта концепция противоречит существующим руководствам, которые рекомендуют использование ИПП у пациентов с недиспластическим ПБ [49], поскольку их длительное применение значительно снижает риск прогрессирования дисплазии высокой степени и ЭАК [50-52].Было высказано предположение, что уменьшение желудочного кислотного рефлюкса в пищеводе, вызванное ИПП, позволяет избежать гибели чувствительных к кислоте бактерий, что оказывает благотворное влияние на поддержание микробиоты I типа [53].
Желудок
Желудок
Микробиота желудка состоит в основном из укреплений, бактериоиды, протео-бактерии и актинобактерии, с самыми обильными генерами, являющимися Streptococcus , за которым следует Veellonella , Prevotella , Fusobacterium и Rothia и ROTHIA 54]. Влияние ИПП на pH желудка и микробиоту желудка стало отправной точкой для исследований в этой области, но только недавно были получены данные, продемонстрировавшие важность последствий длительного применения ИПП. ИПП оказывают неблагоприятное воздействие на функции желудка и защитные механизмы хозяина, вызывая задержку опорожнения желудка, снижение вязкости желудочной слизи, увеличение бактериальной нагрузки и усиление бактериальной транслокации [55-57]. Streptococcaceae являются наиболее многочисленным семейством, наблюдаемым во время терапии ИПП, за ним следуют Prevotellaceae, Campylobacteraceae и Leptotrichiaceae [58].Первичная распространенность Streptococceae также была продемонстрирована у пациентов с диспепсией во время лечения ИПП, что позволяет предположить, что этот экологический переход в пользу Streptococceae может быть независимым индикатором желудочного дисбиоза, вызванного этими препаратами [59].
Влияние ИПП на pH желудка и микробиоту желудка стало отправной точкой для исследований в этой области, но только недавно были получены данные, продемонстрировавшие важность последствий длительного применения ИПП. ИПП оказывают неблагоприятное воздействие на функции желудка и защитные механизмы хозяина, вызывая задержку опорожнения желудка, снижение вязкости желудочной слизи, увеличение бактериальной нагрузки и усиление бактериальной транслокации [55-57]. Streptococcaceae являются наиболее многочисленным семейством, наблюдаемым во время терапии ИПП, за ним следуют Prevotellaceae, Campylobacteraceae и Leptotrichiaceae [58].Первичная распространенность Streptococceae также была продемонстрирована у пациентов с диспепсией во время лечения ИПП, что позволяет предположить, что этот экологический переход в пользу Streptococceae может быть независимым индикатором желудочного дисбиоза, вызванного этими препаратами [59].
Важно помнить, что гипохлоргидрия способствует уменьшению микробного разнообразия и росту микробов, обладающих генотоксическим потенциалом, с усилением бактериальных функций нитрат/нитритредуктазы, участвующих в развитии рака[60]. Кроме того, высокие значения pH желудка могут привести к другому бактериальному балансу, характеризующемуся значительным увеличением количества бактерий полости рта, таких как Pepto-streptococcus stomatis, Streptococcus anginosus, Parvimonas micra, Slackia exigua и Dialister pneumosintes . Благодаря индукции различных метаболических путей такие бактерии могут играть роль в прогрессировании рака желудка (РЖ) [61]. Поэтому, чтобы лучше понять способность стимулировать выживание и распространение потенциально генотоксичных бактерий в желудке и других отделах желудочно-кишечного тракта, крайне важно определить влияние ИПП на состав желудочной микробиоты.Тем не менее, роль ИПП в развитии РЖ обсуждается, при этом в некоторых исследованиях и метаанализах сообщается о повышенном риске развития РЖ у длительно принимающих ИПП [62, 63] до 2,4 раз, даже после Helicobacter pylori ( H. pylori) эрадикация, согласно недавнему исследованию [64] и другим метаанализам, не подтверждающим такой риск [65,66].
Кроме того, высокие значения pH желудка могут привести к другому бактериальному балансу, характеризующемуся значительным увеличением количества бактерий полости рта, таких как Pepto-streptococcus stomatis, Streptococcus anginosus, Parvimonas micra, Slackia exigua и Dialister pneumosintes . Благодаря индукции различных метаболических путей такие бактерии могут играть роль в прогрессировании рака желудка (РЖ) [61]. Поэтому, чтобы лучше понять способность стимулировать выживание и распространение потенциально генотоксичных бактерий в желудке и других отделах желудочно-кишечного тракта, крайне важно определить влияние ИПП на состав желудочной микробиоты.Тем не менее, роль ИПП в развитии РЖ обсуждается, при этом в некоторых исследованиях и метаанализах сообщается о повышенном риске развития РЖ у длительно принимающих ИПП [62, 63] до 2,4 раз, даже после Helicobacter pylori ( H. pylori) эрадикация, согласно недавнему исследованию [64] и другим метаанализам, не подтверждающим такой риск [65,66].
Дисбиоз желудка возникает в результате гастрита, связанного с H. pylori . Провоспалительная активность H. pylori влияет на микроокружение просвета и изменяет микробиоту желудка.Во время инфекции микробиота желудка преимущественно состоит из протеобактерий, за которыми следуют Firmicutes, Bacteroidetes и Actinobacteria [54]. Примечательно, что в зависимости от места колонизации H. pylori дисбактериоз может быть связан как с повышением, так и со снижением секреции кислоты, что дополнительно влияет на состав микробиоты желудка. Инфекция H. pylori может привести к гастриту с преобладанием антрального отдела желудка, при котором слизистая оболочка желудка не воспалена, но происходит вызванное гастрином увеличение выделения кислоты наряду с возможным развитием язвы двенадцатиперстной кишки [67,68].Кроме того, когда инфекция распространяется на слизистую оболочку желудка, она вызывает пангастрит, который связан с гипохлоридрией и отвечает за развитие хронического атрофического гастрита, кишечной метаплазии и, наконец, дисплазии и РЖ [69,70]. Несколько исследований показали, что миграция бактерий из антрального отдела в тело и дно желудка чаще происходит при длительном применении ИПП [71]. Таким образом, рекомендуется эрадикация инфекции H. pylori у всех пациентов, которым требуется длительная терапия ИПП, чтобы остановить провоспалительный стимул и при этом снизить риск РЖ [72,73].
Несколько исследований показали, что миграция бактерий из антрального отдела в тело и дно желудка чаще происходит при длительном применении ИПП [71]. Таким образом, рекомендуется эрадикация инфекции H. pylori у всех пациентов, которым требуется длительная терапия ИПП, чтобы остановить провоспалительный стимул и при этом снизить риск РЖ [72,73].
ТОНКАЯ КИШКА
Плотность и состав бактериальной популяции в тонкой кишке ( т.е. ., двенадцатиперстной кишке, тощей и подвздошной кишке) зависят от нескольких факторов, включая время транзита, наличие химических факторов, уровень кислорода и наличие противомикробных веществ, которые модулируют рост бактерий[74]. Что касается двенадцатиперстной кишки и тощей кишки, преобладающими типами являются Firmicutes, Bacteroidetes, Proteobacteria, Actinobacteria и Fusobacteria.Факультативные анаэробы, такие как Streptococcus, Haemophilus, Escherichia, Actinomyces , и облигатные анаэробы, такие как Veillonella, Prevotella и Fusobacterium , являются наиболее распространенными родами [75-77]. Несмотря на использование нескольких методов отбора проб, микробиота подвздошной кишки человека остается плохо охарактеризованной [78]. Ранее данные, основанные на биопсиях, собранных с помощью ретроградной колоноскопии, показали, что основные филогенетические группы сходны между дистальным отделом подвздошной кишки и прямой кишкой [79,80].Напротив, недавнее исследование образцов, собранных хирургическим путем, выявило глубокие различия между микробиотой подвздошной и толстой кишки, предполагая, что микробиота дистального отдела подвздошной кишки, по-видимому, состоит в основном из факультативных анаэробных видов из класса Bacilli (, например, ., Streptococceae). , Lactobacillacae, Aerococcaceae и Carnobacteriaceae ), а не строго анаэробными видами из класса Clostridia . Однако вполне вероятно, что эти результаты не полностью отражают нормальную флору подвздошной кишки из-за нескольких влияющих факторов, таких как пожилой возраст исследованных пациентов, сопутствующие заболевания и использование антибиотиков [78].
Несмотря на использование нескольких методов отбора проб, микробиота подвздошной кишки человека остается плохо охарактеризованной [78]. Ранее данные, основанные на биопсиях, собранных с помощью ретроградной колоноскопии, показали, что основные филогенетические группы сходны между дистальным отделом подвздошной кишки и прямой кишкой [79,80].Напротив, недавнее исследование образцов, собранных хирургическим путем, выявило глубокие различия между микробиотой подвздошной и толстой кишки, предполагая, что микробиота дистального отдела подвздошной кишки, по-видимому, состоит в основном из факультативных анаэробных видов из класса Bacilli (, например, ., Streptococceae). , Lactobacillacae, Aerococcaceae и Carnobacteriaceae ), а не строго анаэробными видами из класса Clostridia . Однако вполне вероятно, что эти результаты не полностью отражают нормальную флору подвздошной кишки из-за нескольких влияющих факторов, таких как пожилой возраст исследованных пациентов, сопутствующие заболевания и использование антибиотиков [78].
Длительное лечение ИПП сильно влияет на микробиоту тонкого кишечника и, в частности, вызывает избыточный бактериальный рост тонкого кишечника (SIBO), вероятно, из-за потери защитного барьера желудочной кислоты [81-83]. SIBO — это состояние, определяемое наличием более 10 5 бактерий на мл аспирата из верхних отделов кишечника и характеризующееся в основном потерей веса, диареей, вздутием живота и мальабсорбцией [84]. В тощей кишки образцов пациентов SIBO, разрастание микроаэрофильных микроорганизмов, таких как стрептококк , Staphylococcus , Escherichia, и Klebsiella и анаэробные бактерии, такие как , Bacteroides , Lactobacillus , Veillonella и клостридий был обнаружен[85].Вероятно, повышенное производство токсических агентов, таких как аммиак, D-лактат, эндогенные бактериальные пептидогликаны, сывороточный эндотоксин и бактериальные соединения, стимулирует секрецию провоспалительных цитокинов, вызывая развитие симптомов и нарушение всасывания жиров и липофильных витаминов путем деконъюгации. желчных кислот[86,87].
желчных кислот[86,87].
Дисбактериоз, вызванный ИПП, может представлять собой фактор риска развития печеночной энцефалопатии (HE) и спонтанного бактериального перитонита (СБП) у пациентов с циррозом [88–90].У таких больных развитие SIBO обусловлено нарушением моторики кишечника и нарушением целостности слизистого барьера, что способствует распространению патогенов и продуктов бактериального метаболизма, таких как азотистые вещества и токсины. Это распространение происходит через кровеносную и лимфатическую системы и приводит к вероятному повышенному риску САД, HE и, в более общем плане, опасных для жизни инфекций [91,92].
Следует отметить, что некоторые микробные изменения, вызванные ИПП, аналогичны изменениям, уже присутствующим у пациентов с циррозом печени и особенно у пациентов с декомпенсированным циррозом, включая относительное увеличение количества потенциально патогенных бактерий, таких как Staphylococcaeae , Enterobacteriaceae и Enterococceae [93]. Было также показано, что этот дисбактериоз связан с возникновением HE и SBP, что подразумевает плохой прогноз и прогрессирование заболевания. По этой причине использование антибиотиков с минимальной абсорбцией, таких как рифаксимин, и пребиотиков, таких как лактулоза, представляет собой краеугольный камень лечения HE [94]. Поэтому у пациентов с заболеваниями печени, независимо от тяжести основной гепатопатии, ИПП могут повышать риск осложнений и должны назначаться только при наличии специфических терапевтических показаний.
Было также показано, что этот дисбактериоз связан с возникновением HE и SBP, что подразумевает плохой прогноз и прогрессирование заболевания. По этой причине использование антибиотиков с минимальной абсорбцией, таких как рифаксимин, и пребиотиков, таких как лактулоза, представляет собой краеугольный камень лечения HE [94]. Поэтому у пациентов с заболеваниями печени, независимо от тяжести основной гепатопатии, ИПП могут повышать риск осложнений и должны назначаться только при наличии специфических терапевтических показаний.
Сообщалось также, что ИПП усугубляют повреждение слизистой оболочки, вызванное нестероидными противовоспалительными препаратами (НПВП) в дистальной части тонкой кишки до связки Трейца [95,96], что контрастирует с защитным действием. влияние ИПП на НПВП-индуцированное повреждение слизистой оболочки верхних отделов ЖКТ [97]. Даже если точный механизм, с помощью которого это происходит, неясен, бактериальный дисбаланс может играть важную роль, и поэтому он изучался в ряде исследований, проведенных на мышиных моделях (рис. 1).У крыс значимое снижение Actinobacteria и Bifidobacteria spp. в тощей кишке усугубляет НПВП-индуцированную энтеропатию [98]. Кроме того, ИПП увеличивали экспрессию бактерий с активностью бета-глюкуронидазы, и этот микробный дисбаланс мог способствовать распространению НПВП в энтерогепатическую циркуляцию, повышая цитотоксичность желчи и впоследствии вызывая язвенные поражения [99, 100]. Роль дисбактериоза в повреждениях слизистой оболочки была дополнительно подтверждена положительными эффектами совместного введения Bifidobacteria -обогащенной суспензии комменсальных бактерий, которая была способна уменьшить повреждение слизистой оболочки [98].Более того, стерильные мыши менее восприимчивы к поражениям кишечника, вызванным НПВП, и было документально подтверждено, что энтеропатия, вызванная НПВП, передается через микробиоту [98, 101, 102]. На основании этих наблюдений необходимо подтверждение роли дисбактериоза у человека.
1).У крыс значимое снижение Actinobacteria и Bifidobacteria spp. в тощей кишке усугубляет НПВП-индуцированную энтеропатию [98]. Кроме того, ИПП увеличивали экспрессию бактерий с активностью бета-глюкуронидазы, и этот микробный дисбаланс мог способствовать распространению НПВП в энтерогепатическую циркуляцию, повышая цитотоксичность желчи и впоследствии вызывая язвенные поражения [99, 100]. Роль дисбактериоза в повреждениях слизистой оболочки была дополнительно подтверждена положительными эффектами совместного введения Bifidobacteria -обогащенной суспензии комменсальных бактерий, которая была способна уменьшить повреждение слизистой оболочки [98].Более того, стерильные мыши менее восприимчивы к поражениям кишечника, вызванным НПВП, и было документально подтверждено, что энтеропатия, вызванная НПВП, передается через микробиоту [98, 101, 102]. На основании этих наблюдений необходимо подтверждение роли дисбактериоза у человека.
Ингибиторы протонной помпы способствуют энтеропатии, вызванной нестероидными противовоспалительными препаратами, через микробиоту. Модели на мышах демонстрируют, что лечение ингибиторами протонной помпы (ИПП) в дополнение к терапии нестероидными противовоспалительными препаратами (НПВП) вызывает обострение повреждения слизистой оболочки тонкой кишки.ИПП вызывают бактериальный дисбаланс, такой как сокращение (↓) Actinobacteria и Bifidobacteria spp., которые ответственны за повреждение слизистой оболочки. В частности, ИПП увеличивают экспрессию бактерий с активностью бета-глюкуронидазы и последующее распространение НПВП в энтерогепатической циркуляции; в конечном итоге цитотоксичность желчи вызывает язвенные поражения кишечника. Совместное введение суспензии, обогащенной Bifidobacteria , восстанавливает микробиоту кишечника и уменьшает повреждение слизистой оболочки.Бесмикробные мыши менее восприимчивы к вредному воздействию НПВП, и у них развивается энтеропатия, вызванная НПВП, в результате переноса микробиоты. ИПП: ингибитор протонной помпы; НПВП: нестероидные противовоспалительные препараты.
Модели на мышах демонстрируют, что лечение ингибиторами протонной помпы (ИПП) в дополнение к терапии нестероидными противовоспалительными препаратами (НПВП) вызывает обострение повреждения слизистой оболочки тонкой кишки.ИПП вызывают бактериальный дисбаланс, такой как сокращение (↓) Actinobacteria и Bifidobacteria spp., которые ответственны за повреждение слизистой оболочки. В частности, ИПП увеличивают экспрессию бактерий с активностью бета-глюкуронидазы и последующее распространение НПВП в энтерогепатической циркуляции; в конечном итоге цитотоксичность желчи вызывает язвенные поражения кишечника. Совместное введение суспензии, обогащенной Bifidobacteria , восстанавливает микробиоту кишечника и уменьшает повреждение слизистой оболочки.Бесмикробные мыши менее восприимчивы к вредному воздействию НПВП, и у них развивается энтеропатия, вызванная НПВП, в результате переноса микробиоты. ИПП: ингибитор протонной помпы; НПВП: нестероидные противовоспалительные препараты.
ТОЛСТАЯ КИШКА
Толстая кишка содержит наибольшее количество микробов на единицу объема всего желудочно-кишечного тракта[103]. В образцах фекалий и биопсии четыре преобладающих типа — это Firmicutes и Bacteroidetes, за которыми следуют Actinobacteria и Proteobacteria [104,105], с дискретной индивидуальной изменчивостью, особенно в отношении видов и штаммов бактерий.Наиболее представленные бактериальные кластеры, называемые энтеротипами , состоят из вариаций уровней одного из этих трех родов: Bacteroides (энтеротип 1), Prevotella (энтеротип 2) и Ruminococcus (энтеротип 3). 106,107]. ИПП, снижая секрецию желудочного сока, могут вызывать глубокие изменения в микробиоте толстой кишки, в основном характеризующиеся уменьшением количества симбиотических бактерий, что связано с уменьшением микробного разнообразия и увеличением количества бактерий полости рта в стуле [108, 109].Поэтому разумно предположить, что дисбактериоз, вызванный ИПП, оказывает существенное влияние на здоровье хозяина.
ИПП могут влиять на возникновение кишечных инфекций, что приводит к повышенному риску инфекции Clostridium difficile (CDI), а также Salmonella , Campylobacter и диареегенной Escherichia coli ( E.6coli) [ E. coli] 110-113]. Даже если это не было полностью выяснено, было высказано предположение, что при CDI наблюдалось снижение альфа-разнообразия и уменьшение численности бактерий Ruminococcoceae , связанное с увеличением Enterobacteriaceae, Enterococcoceae и Lactobacillaceae . при длительном лечении ИПП может способствовать возникновению инфекции [109].Вероятно, это происходит потому, что увеличение членов Proteobacteria способствует индукции и поддержанию провоспалительной среды [114, 115].
Вполне вероятно, что применение ИПП предрасполагает пациентов к развитию СРК[116]. Как указывалось ранее, длительное применение ИПП способствует индукции кишечной инфекции, а за счет вторичных изменений в составе микробиоты эти препараты могут влиять на функции оси кишечник-мозг, вызывая СРК [117,118]. Тот факт, что дисбактериоз играет роль в СРК, и особенно сильная связь между кишечной инфекцией и СРК, была подтверждена несколькими исследованиями [119, 120].Действительно, было обнаружено, что 10-30% пациентов, у которых развился постинфекционный СРК после инфекционного гастроэнтерита, можно считать находящимися в поствоспалительном состоянии, усугубленном острым стрессом [121-124]. Более того, роль состава микробиоты кишечника в патогенезе СРК подтверждается успехом некоторых пробиотиков в улучшении симптомов СРК [125, 126]. Дисбиоз СРК в основном состоит из снижения альфа-разнообразия и дисбаланса между микробными группами, представленными дефицитным количеством Bifidobacteria и Lactobacilli и увеличением потенциально патогенных Enterobacteriaceae , таких как E.coli [127,128]; это похоже на то, что наблюдалось у пациентов, получавших хроническую терапию ИПП [109].
Тот факт, что дисбактериоз играет роль в СРК, и особенно сильная связь между кишечной инфекцией и СРК, была подтверждена несколькими исследованиями [119, 120].Действительно, было обнаружено, что 10-30% пациентов, у которых развился постинфекционный СРК после инфекционного гастроэнтерита, можно считать находящимися в поствоспалительном состоянии, усугубленном острым стрессом [121-124]. Более того, роль состава микробиоты кишечника в патогенезе СРК подтверждается успехом некоторых пробиотиков в улучшении симптомов СРК [125, 126]. Дисбиоз СРК в основном состоит из снижения альфа-разнообразия и дисбаланса между микробными группами, представленными дефицитным количеством Bifidobacteria и Lactobacilli и увеличением потенциально патогенных Enterobacteriaceae , таких как E.coli [127,128]; это похоже на то, что наблюдалось у пациентов, получавших хроническую терапию ИПП [109].
Что касается ВЗК, различные наблюдения привели исследователей к предположению, что длительное применение ИПП может оказывать негативное влияние на такие состояния[129,130]. В настоящее время данные о микробном дисбалансе при ВЗК до конца не выяснены. Некоторые исследования зафиксировали снижение численности Firmicutes и Bacteroidetes, в то время как другие сообщили об увеличении [131, 132].В целом, почти всегда описывалось увеличение количества протеобактерий [133, 134]. Считается, что во время ВЗК сокращение защитных бактерий происходит параллельно с увеличением провоспалительных бактерий. Как при болезни Крона (БК), так и при язвенном колите (ЯК) наблюдались более высокие концентрации E. coli , и особенно варианта, называемого адгезивно-инвазивным E. coli , который способен колонизировать слизистую оболочку подвздошной кишки и отвечает за раннее воспалительное состояние [135,136].В частности, снижение количества противовоспалительных бактерий, таких как Faecalibacterium prausnitzii , Bifidobacterium Teenis и Dialister invisus , наблюдалось при анализе образцов CD, связанных с неизвестными видами Clostridium (особенно кластеры IV и XIVa).
В настоящее время данные о микробном дисбалансе при ВЗК до конца не выяснены. Некоторые исследования зафиксировали снижение численности Firmicutes и Bacteroidetes, в то время как другие сообщили об увеличении [131, 132].В целом, почти всегда описывалось увеличение количества протеобактерий [133, 134]. Считается, что во время ВЗК сокращение защитных бактерий происходит параллельно с увеличением провоспалительных бактерий. Как при болезни Крона (БК), так и при язвенном колите (ЯК) наблюдались более высокие концентрации E. coli , и особенно варианта, называемого адгезивно-инвазивным E. coli , который способен колонизировать слизистую оболочку подвздошной кишки и отвечает за раннее воспалительное состояние [135,136].В частности, снижение количества противовоспалительных бактерий, таких как Faecalibacterium prausnitzii , Bifidobacterium Teenis и Dialister invisus , наблюдалось при анализе образцов CD, связанных с неизвестными видами Clostridium (особенно кластеры IV и XIVa). [137]. При НЯК было зарегистрировано снижение видов Akkermansia muciniphila , Roseburia и Faecalibacterium prausnitzii , наряду с увеличением видов Fusobacterium [138, 139].В контексте дисбиоза ИПП могут привести к кратковременным обострениям течения ВЗК. Вероятно, это связано с тем, что пациенты с ВЗК особенно восприимчивы к развитию бактериальных суперинфекций, особенно вызванных Clostridium difficile , Campylobacter, Salmonella, Shigella и Entamoeba histolytica , которые представляют собой вредные стимулы, которые могут вызвать рецидив заболевания. в уже измененной микросреде[140,141]. Кроме того, экспансия Proteobacteria может способствовать иммунному ответу слизистой оболочки у генетически предрасположенных лиц, что приводит к развитию и продолжению хронического воспаления кишечника [133, 142, 143].
[137]. При НЯК было зарегистрировано снижение видов Akkermansia muciniphila , Roseburia и Faecalibacterium prausnitzii , наряду с увеличением видов Fusobacterium [138, 139].В контексте дисбиоза ИПП могут привести к кратковременным обострениям течения ВЗК. Вероятно, это связано с тем, что пациенты с ВЗК особенно восприимчивы к развитию бактериальных суперинфекций, особенно вызванных Clostridium difficile , Campylobacter, Salmonella, Shigella и Entamoeba histolytica , которые представляют собой вредные стимулы, которые могут вызвать рецидив заболевания. в уже измененной микросреде[140,141]. Кроме того, экспансия Proteobacteria может способствовать иммунному ответу слизистой оболочки у генетически предрасположенных лиц, что приводит к развитию и продолжению хронического воспаления кишечника [133, 142, 143].
Наконец, наш обзор был посвящен колоректальному раку (КРР). В настоящее время хорошо известно, что единственным микроорганизмом, который играет основную и непосредственную роль в развитии опухолей ЖКТ, является H. pylori . Однако сложное и общее действие, которое дисбаланс кишечной микробиоты может играть в кондиционировании микроокружения толстой кишки и благоприятствовании онкогенезу, вызывает большой интерес со стороны исследователей [144-146]. Как указывалось ранее, терапия ИПП способствует присутствию оральных бактерий в стуле [108, 109].В этом контексте следует тщательно проанализировать роль F. nucleatum . F. nucleatum представляет собой комменсальную анаэробную бактерию ротовой полости, связанную с заболеваниями пародонта, и она была обнаружена в больших количествах при КРР [147]. Его провоспалительная активность в слизистой оболочке кишечника хорошо описана, и его присутствие может быть связано с исходом заболевания [148, 149]. Этот микроорганизм имеет два белка адгезии, FapA и FadA, последний из которых опосредует инвазию бактерии в эпителий кишечника.Следствием этой инвазии является усиление передачи сигналов NF-κB и экспрессия нескольких цитокинов, таких как IL-6, IL-8, IL-10, IL-18 и TNF-α.
pylori . Однако сложное и общее действие, которое дисбаланс кишечной микробиоты может играть в кондиционировании микроокружения толстой кишки и благоприятствовании онкогенезу, вызывает большой интерес со стороны исследователей [144-146]. Как указывалось ранее, терапия ИПП способствует присутствию оральных бактерий в стуле [108, 109].В этом контексте следует тщательно проанализировать роль F. nucleatum . F. nucleatum представляет собой комменсальную анаэробную бактерию ротовой полости, связанную с заболеваниями пародонта, и она была обнаружена в больших количествах при КРР [147]. Его провоспалительная активность в слизистой оболочке кишечника хорошо описана, и его присутствие может быть связано с исходом заболевания [148, 149]. Этот микроорганизм имеет два белка адгезии, FapA и FadA, последний из которых опосредует инвазию бактерии в эпителий кишечника.Следствием этой инвазии является усиление передачи сигналов NF-κB и экспрессия нескольких цитокинов, таких как IL-6, IL-8, IL-10, IL-18 и TNF-α. Конечным результатом этих изменений является создание провоспалительной среды для роста опухоли, чему способствует опосредованное FapA подавление цитотоксической активности Т-клеток [147, 150]. Таким образом, исследования показали, что выявление присутствия этой бактерии у пользователей ИПП и особенно у лиц с сопутствующими заболеваниями полости рта является необходимостью.
Конечным результатом этих изменений является создание провоспалительной среды для роста опухоли, чему способствует опосредованное FapA подавление цитотоксической активности Т-клеток [147, 150]. Таким образом, исследования показали, что выявление присутствия этой бактерии у пользователей ИПП и особенно у лиц с сопутствующими заболеваниями полости рта является необходимостью.
Наконец, хроническая гипергастринемия, обычно присутствующая при применении ИПП, может способствовать росту злокачественных эпителиальных клеток толстой кишки, способствуя вредному секвенированию аденомы-карциномы [151-153].Тем не менее важно подчеркнуть, что многие исследования, проведенные в течение многих лет, не обнаружили прямой корреляции между использованием ИПП в клинической практике и повышенным риском развития КРР [154–156].
ЗАКЛЮЧЕНИЕ
В эпоху, когда науке о микробиоте кишечника уделяется большое внимание [157, 158], представляется крайне важным определить, какие типы лекарств влияют на состав микробиоты кишечника. Имеющиеся данные свидетельствуют о том, что широко используемые в гастроэнтерологической клинической практике ИПП, вероятно, благодаря своему кислото-антисекреторному действию, способны модифицировать микробиоту хозяина в каждом сегменте желудочно-кишечного тракта и могут способствовать развитию дисбактериоза; этот дисбактериоз, в свою очередь, может способствовать возникновению определенных желудочно-кишечных расстройств.Более того, желудочная гипохлоргидрия, вызванная ИПП, способствует выживанию и миграции оральных бактерий в нижние отделы желудочно-кишечного тракта с возможным созданием провоспалительной микросреды. Необходимы дальнейшие проспективные исследования, чтобы определить, как микробные изменения, вызванные ИПП, влияют на здоровье человека. Более того, терапевтические стратегии, такие как добавление пробиотиков, могут быть полезным подходом для предотвращения дисбактериоза во время лечения ИПП; однако справедливость этого наблюдения еще предстоит выяснить.В настоящее время использование ИПП рекомендуется только в случае крайней необходимости из-за их возможной способности вызывать дисбактериоз.
Имеющиеся данные свидетельствуют о том, что широко используемые в гастроэнтерологической клинической практике ИПП, вероятно, благодаря своему кислото-антисекреторному действию, способны модифицировать микробиоту хозяина в каждом сегменте желудочно-кишечного тракта и могут способствовать развитию дисбактериоза; этот дисбактериоз, в свою очередь, может способствовать возникновению определенных желудочно-кишечных расстройств.Более того, желудочная гипохлоргидрия, вызванная ИПП, способствует выживанию и миграции оральных бактерий в нижние отделы желудочно-кишечного тракта с возможным созданием провоспалительной микросреды. Необходимы дальнейшие проспективные исследования, чтобы определить, как микробные изменения, вызванные ИПП, влияют на здоровье человека. Более того, терапевтические стратегии, такие как добавление пробиотиков, могут быть полезным подходом для предотвращения дисбактериоза во время лечения ИПП; однако справедливость этого наблюдения еще предстоит выяснить.В настоящее время использование ИПП рекомендуется только в случае крайней необходимости из-за их возможной способности вызывать дисбактериоз.
Сноски
Источник рукописи: приглашенная рукопись
Тип специальности: гастроэнтерология и гепатология
Страна происхождения: Италия B, B
Оценка C (хорошо): C, C
Оценка D (удовлетворительно): 0
Оценка E (плохо): 0
Заявление о конфликте интересов: Нет потенциальных конфликтов интересов, о которых необходимо сообщить.
Рецензирование началось: 13 марта 2019 г.
Первое решение: 27 марта 2019 г.
Статья в печати: 20 апреля 2019 г. S-редактор: Yan JP L-редактор: A E-редактор: Zhang YL
Contributor Information
Giovanni Bruno, кафедра внутренних болезней и медицинских специальностей, отделение гастроэнтерологии, Римский университет Сапиенца, Рим 00161, Италия.
Пьера Дзаккари, кафедра внутренних болезней и медицинских специальностей, отделение гастроэнтерологии, Римский университет Сапиенца, Рим 00161, Италия.
Джулия Рокко, отделение внутренних болезней и медицинских специальностей, отделение гастроэнтерологии, Римский университет Сапиенца, Рим 00161, Италия.
Джулия Скалезе, кафедра внутренних болезней и медицинских специальностей, отделение гастроэнтерологии, Римский университет Сапиенца, Рим 00161, Италия.
Кристина Панетта, отделение хирургии, Римский университет Сапиенца, Рим 00161, Италия.
Барбара Поровска, отделение сердечно-торакальной, сосудистой хирургии и трансплантации, Римский университет Сапиенца, Рим 00161, Италия.
Стефано Понтоне, отделение хирургии, Римский университет Сапиенца, Рим 00161, Италия. [email protected].
Карола Севери, отделение внутренних болезней и медицинских специальностей, отделение гастроэнтерологии, Римский университет Сапиенца, Рим 00161, Италия.
Ссылки
1. Скарпиньято С., Пелосини И., Ди Марио Ф. Кислотно-подавляющая терапия: куда нам двигаться дальше? Копать Дис. 2006; 24:11–46. [PubMed] [Google Scholar]2. Барду М., Тубути Ю., Бенхаберу-Брун Д., Раме Э., Баркун А.Н.Мета-анализ: Ингибирование протонной помпы у пациентов с высоким риском кровотечения из острой пептической язвы. Алимент Фармакол Тер. 2005; 21: 677–686. [PubMed] [Google Scholar]3. DeVault KR, Castell DO Американский колледж гастроэнтерологии. Обновленные рекомендации по диагностике и лечению гастроэзофагеальной рефлюксной болезни. Am J Гастроэнтерол. 2005; 100:190–200. [PubMed] [Google Scholar]4. Шарма В.К., Леонтиадис Г.И., Хауден К.В. Метаанализ рандомизированных контролируемых исследований, сравнивающих стандартные клинические дозы омепразола и лансопразола при эрозивном эзофагите.Алимент Фармакол Тер. 2001; 15: 227–231. [PubMed] [Google Scholar]5. Suzuki H, Okada S, Hibi T. Ингибиторы протонной помпы для лечения функциональной диспепсии. Терапия Adv Гастроэнтерол. 2011;4:219–226. [Бесплатная статья PMC] [PubMed] [Google Scholar]6. Ислам М.М., Поли Т.Н., Вальтер Б.А., Дубей Н.К., Ангрэйни Нингрум Д.Н., Шаббир С.А., Джек Ли Ю.К. Неблагоприятные последствия длительного применения ингибиторов протонной помпы: систематический обзор и метаанализ. Eur J Гастроэнтерол Гепатол. 2018;30:1395–1405. [PubMed] [Google Scholar]7.
Алимент Фармакол Тер. 2005; 21: 677–686. [PubMed] [Google Scholar]3. DeVault KR, Castell DO Американский колледж гастроэнтерологии. Обновленные рекомендации по диагностике и лечению гастроэзофагеальной рефлюксной болезни. Am J Гастроэнтерол. 2005; 100:190–200. [PubMed] [Google Scholar]4. Шарма В.К., Леонтиадис Г.И., Хауден К.В. Метаанализ рандомизированных контролируемых исследований, сравнивающих стандартные клинические дозы омепразола и лансопразола при эрозивном эзофагите.Алимент Фармакол Тер. 2001; 15: 227–231. [PubMed] [Google Scholar]5. Suzuki H, Okada S, Hibi T. Ингибиторы протонной помпы для лечения функциональной диспепсии. Терапия Adv Гастроэнтерол. 2011;4:219–226. [Бесплатная статья PMC] [PubMed] [Google Scholar]6. Ислам М.М., Поли Т.Н., Вальтер Б.А., Дубей Н.К., Ангрэйни Нингрум Д.Н., Шаббир С.А., Джек Ли Ю.К. Неблагоприятные последствия длительного применения ингибиторов протонной помпы: систематический обзор и метаанализ. Eur J Гастроэнтерол Гепатол. 2018;30:1395–1405. [PubMed] [Google Scholar]7. де ла Коба Ортис К., Аргуэльес Ариас Ф., Мартин де Архила де Прадос К., Худес Гутьеррес Х., Линарес Родригес А., Ортега Алонсо А., Родригес де Сантьяго Э., Родригес-Телес М., Вера Мендоса М.И., Агилера Кастро Л., Альварес Санчес А. , Andrade Bellido RJ, Bao Pérez F, Castro Fernández M, Giganto Tomé F. Побочные эффекты ингибиторов протонной помпы: обзор доказательств и заявление о позиции Sociedad Española de Patología Digestiva. Преподобный Эсп Энферм Коп. 2016;108:207–224. [PubMed] [Google Scholar]8. Eom CS, Jeon CY, Lim JW, Cho EG, Park SM, Lee KS.Использование кислотоподавляющих препаратов и риск пневмонии: систематический обзор и метаанализ. CMAJ. 2011; 183:310–319. [Бесплатная статья PMC] [PubMed] [Google Scholar]9. Цуда А., Суда В., Морита Х., Таканаши К., Такаги А., Кога Ю., Хаттори М. Влияние ингибиторов протонной помпы на просветную микробиоту желудочно-кишечного тракта. Клин Трансл Гастроэнтерол. 2015;6:e89. [Бесплатная статья PMC] [PubMed] [Google Scholar]10. Фридберг Д.Э., Туссен Н.
де ла Коба Ортис К., Аргуэльес Ариас Ф., Мартин де Архила де Прадос К., Худес Гутьеррес Х., Линарес Родригес А., Ортега Алонсо А., Родригес де Сантьяго Э., Родригес-Телес М., Вера Мендоса М.И., Агилера Кастро Л., Альварес Санчес А. , Andrade Bellido RJ, Bao Pérez F, Castro Fernández M, Giganto Tomé F. Побочные эффекты ингибиторов протонной помпы: обзор доказательств и заявление о позиции Sociedad Española de Patología Digestiva. Преподобный Эсп Энферм Коп. 2016;108:207–224. [PubMed] [Google Scholar]8. Eom CS, Jeon CY, Lim JW, Cho EG, Park SM, Lee KS.Использование кислотоподавляющих препаратов и риск пневмонии: систематический обзор и метаанализ. CMAJ. 2011; 183:310–319. [Бесплатная статья PMC] [PubMed] [Google Scholar]9. Цуда А., Суда В., Морита Х., Таканаши К., Такаги А., Кога Ю., Хаттори М. Влияние ингибиторов протонной помпы на просветную микробиоту желудочно-кишечного тракта. Клин Трансл Гастроэнтерол. 2015;6:e89. [Бесплатная статья PMC] [PubMed] [Google Scholar]10. Фридберг Д.Э., Туссен Н. К., Чен С.П., Ратнер А.Дж., Уиттьер С., Ван Т.С., Ван Х.Х., Абрамс Дж.А.Ингибиторы протонной помпы изменяют определенные таксоны в желудочно-кишечном микробиоме человека: перекрестное исследование. Гастроэнтерология. 2015;149:883–5.e9. [Бесплатная статья PMC] [PubMed] [Google Scholar]11. Такаги Т., Наито Ю., Иноуэ Р., Касиваги С., Учияма К., Мидзусима К., Цучия С., Окаяма Т., Дохи О., Ёсида Н., Камада К., Исикава Т., Ханда О., Кониси Х., Окуда К., Цудзимото Ю., Оноги Х. , Itoh Y. Влияние длительного использования ингибиторов протонной помпы на микробиоту кишечника: исследование случай-контроль с учетом возраста и пола. J Clin Biochem Nutr.2018;62:100–105. [Бесплатная статья PMC] [PubMed] [Google Scholar]12. Джандхьяла С.М., Талукдар Р., Субраманьям С., Вуйюру Х., Сасикала М., Нагешвар Редди Д. Роль нормальной микробиоты кишечника. Мир J Гастроэнтерол. 2015;21:8787–8803. [Бесплатная статья PMC] [PubMed] [Google Scholar]13. Герритсен Дж., Смидт Х., Рийкерс Г.Т., де Вос В.М. Кишечная микробиота в здоровье и болезни человека: влияние пробиотиков.
К., Чен С.П., Ратнер А.Дж., Уиттьер С., Ван Т.С., Ван Х.Х., Абрамс Дж.А.Ингибиторы протонной помпы изменяют определенные таксоны в желудочно-кишечном микробиоме человека: перекрестное исследование. Гастроэнтерология. 2015;149:883–5.e9. [Бесплатная статья PMC] [PubMed] [Google Scholar]11. Такаги Т., Наито Ю., Иноуэ Р., Касиваги С., Учияма К., Мидзусима К., Цучия С., Окаяма Т., Дохи О., Ёсида Н., Камада К., Исикава Т., Ханда О., Кониси Х., Окуда К., Цудзимото Ю., Оноги Х. , Itoh Y. Влияние длительного использования ингибиторов протонной помпы на микробиоту кишечника: исследование случай-контроль с учетом возраста и пола. J Clin Biochem Nutr.2018;62:100–105. [Бесплатная статья PMC] [PubMed] [Google Scholar]12. Джандхьяла С.М., Талукдар Р., Субраманьям С., Вуйюру Х., Сасикала М., Нагешвар Редди Д. Роль нормальной микробиоты кишечника. Мир J Гастроэнтерол. 2015;21:8787–8803. [Бесплатная статья PMC] [PubMed] [Google Scholar]13. Герритсен Дж., Смидт Х., Рийкерс Г.Т., де Вос В.М. Кишечная микробиота в здоровье и болезни человека: влияние пробиотиков. Гены Нутр. 2011;6:209–240. [Бесплатная статья PMC] [PubMed] [Google Scholar]14. Белизарио Дж. Э., Файнтух Дж., Гарай-Мальпартида М.Дисбиоз микробиома кишечника и иммунометаболизм: новые рубежи лечения метаболических заболеваний. Медиаторы воспаления. 2018;2018:2037838. [Бесплатная статья PMC] [PubMed] [Google Scholar]15. ДеГруттола А.К., Лоу Д., Мизогучи А., Мизогучи Э. Современное понимание дисбиоза при заболеваниях на моделях человека и животных. Воспаление кишечника Dis. 2016;22:1137–1150. [Бесплатная статья PMC] [PubMed] [Google Scholar]16. Кардинг С., Вербеке К., Випонд Д.Т., Корф Б.М., Оуэн Л.Дж. Дисбактериоз микробиоты кишечника при заболеваниях. Microb Ecol Health Дис.2015;26:26191. [Бесплатная статья PMC] [PubMed] [Google Scholar]17. Фридберг Д.Е., Лебволь Б., Абрамс Дж.А. Влияние ингибиторов протонной помпы на микробиом желудочно-кишечного тракта человека. Клин Лаб Мед. 2014; 34: 771–785. [Бесплатная статья PMC] [PubMed] [Google Scholar]18. Сингх А., Креши Г.А., Кирби Д.Ф. Ингибиторы протонной помпы: риски и выгоды, а также возникающие последствия для кишечного микробиома.
Гены Нутр. 2011;6:209–240. [Бесплатная статья PMC] [PubMed] [Google Scholar]14. Белизарио Дж. Э., Файнтух Дж., Гарай-Мальпартида М.Дисбиоз микробиома кишечника и иммунометаболизм: новые рубежи лечения метаболических заболеваний. Медиаторы воспаления. 2018;2018:2037838. [Бесплатная статья PMC] [PubMed] [Google Scholar]15. ДеГруттола А.К., Лоу Д., Мизогучи А., Мизогучи Э. Современное понимание дисбиоза при заболеваниях на моделях человека и животных. Воспаление кишечника Dis. 2016;22:1137–1150. [Бесплатная статья PMC] [PubMed] [Google Scholar]16. Кардинг С., Вербеке К., Випонд Д.Т., Корф Б.М., Оуэн Л.Дж. Дисбактериоз микробиоты кишечника при заболеваниях. Microb Ecol Health Дис.2015;26:26191. [Бесплатная статья PMC] [PubMed] [Google Scholar]17. Фридберг Д.Е., Лебволь Б., Абрамс Дж.А. Влияние ингибиторов протонной помпы на микробиом желудочно-кишечного тракта человека. Клин Лаб Мед. 2014; 34: 771–785. [Бесплатная статья PMC] [PubMed] [Google Scholar]18. Сингх А., Креши Г.А., Кирби Д.Ф. Ингибиторы протонной помпы: риски и выгоды, а также возникающие последствия для кишечного микробиома. Нутр Клин Практ. 2018; 33: 614–624. [PubMed] [Google Scholar] 19. Миналян А., Габриелян Л., Скотт Д., Джейкобс Дж., Писенья Дж. Р. Желудочный и кишечный микробиом: роль ингибиторов протонной помпы.Curr Gastroenterol Rep. 2017; 19:42. [Бесплатная статья PMC] [PubMed] [Google Scholar]20. Imhann F, Vich Vila A, Bonder MJ, Lopez Manosalva AG, Koonen DPY, Fu J, Wijmenga C, Zhernakova A, Weersma RK. Влияние ингибиторов протонной помпы и других часто используемых лекарств на микробиоту кишечника. Кишечные микробы. 2017; 8: 351–358. [Бесплатная статья PMC] [PubMed] [Google Scholar]21. Заура Э., Нику Э.А., Кром Б.П., Кейсер Б.Дж. Приобретение и поддержание нормального микробиома полости рта: современная перспектива. Front Cell Infect Microbiol.2014; 4:85. [Бесплатная статья PMC] [PubMed] [Google Scholar]22. Аас Дж. А., Пастер Б. Дж., Стоукс Л. Н., Олсен И., Дьюхерст Ф. Э. Определение нормальной бактериальной флоры полости рта. Дж. Клин Микробиол. 2005; 43: 5721–5732. [Бесплатная статья PMC] [PubMed] [Google Scholar]23.
Нутр Клин Практ. 2018; 33: 614–624. [PubMed] [Google Scholar] 19. Миналян А., Габриелян Л., Скотт Д., Джейкобс Дж., Писенья Дж. Р. Желудочный и кишечный микробиом: роль ингибиторов протонной помпы.Curr Gastroenterol Rep. 2017; 19:42. [Бесплатная статья PMC] [PubMed] [Google Scholar]20. Imhann F, Vich Vila A, Bonder MJ, Lopez Manosalva AG, Koonen DPY, Fu J, Wijmenga C, Zhernakova A, Weersma RK. Влияние ингибиторов протонной помпы и других часто используемых лекарств на микробиоту кишечника. Кишечные микробы. 2017; 8: 351–358. [Бесплатная статья PMC] [PubMed] [Google Scholar]21. Заура Э., Нику Э.А., Кром Б.П., Кейсер Б.Дж. Приобретение и поддержание нормального микробиома полости рта: современная перспектива. Front Cell Infect Microbiol.2014; 4:85. [Бесплатная статья PMC] [PubMed] [Google Scholar]22. Аас Дж. А., Пастер Б. Дж., Стоукс Л. Н., Олсен И., Дьюхерст Ф. Э. Определение нормальной бактериальной флоры полости рта. Дж. Клин Микробиол. 2005; 43: 5721–5732. [Бесплатная статья PMC] [PubMed] [Google Scholar]23. Арвейлер Н.Б., Нетушил Л. Микробиота полости рта. Adv Exp Med Biol. 2016; 902:45–60. [PubMed] [Google Scholar] 24. Андерссон А.Ф., Линдберг М., Якобссон Х., Бекхед Ф., Нирен П., Энгстранд Л. Сравнительный анализ микробиоты кишечника человека с помощью пиросеквенирования со штрих-кодом.ПЛОС Один. 2008;3:e2836. [Бесплатная статья PMC] [PubMed] [Google Scholar]25. Сегата Н., Хааке С.К., Маннон П., Лемон К.П., Уолдрон Л., Геверс Д., Хаттенхауэр С., Изард Дж. Состав бактериального микробиома пищеварительного тракта взрослого человека на основе семи поверхностей рта, миндалин, горла и образцов стула. Геном биол. 2012;13:R42. [Бесплатная статья PMC] [PubMed] [Google Scholar]26. Дьюхерст Ф.Е., Чен Т., Изард Дж., Пастер Б.Дж., Таннер А.С., Ю В.Х., Лакшманан А., Уэйд В.Г. Микробиом ротовой полости человека. J Бактериол. 2010;192:5002–5017.[Бесплатная статья PMC] [PubMed] [Google Scholar]27. Zhang Y, Wang X, Li H, Ni C, Du Z, Yan F. Микробиота ротовой полости человека и ее влияние на здоровье полости рта.
Арвейлер Н.Б., Нетушил Л. Микробиота полости рта. Adv Exp Med Biol. 2016; 902:45–60. [PubMed] [Google Scholar] 24. Андерссон А.Ф., Линдберг М., Якобссон Х., Бекхед Ф., Нирен П., Энгстранд Л. Сравнительный анализ микробиоты кишечника человека с помощью пиросеквенирования со штрих-кодом.ПЛОС Один. 2008;3:e2836. [Бесплатная статья PMC] [PubMed] [Google Scholar]25. Сегата Н., Хааке С.К., Маннон П., Лемон К.П., Уолдрон Л., Геверс Д., Хаттенхауэр С., Изард Дж. Состав бактериального микробиома пищеварительного тракта взрослого человека на основе семи поверхностей рта, миндалин, горла и образцов стула. Геном биол. 2012;13:R42. [Бесплатная статья PMC] [PubMed] [Google Scholar]26. Дьюхерст Ф.Е., Чен Т., Изард Дж., Пастер Б.Дж., Таннер А.С., Ю В.Х., Лакшманан А., Уэйд В.Г. Микробиом ротовой полости человека. J Бактериол. 2010;192:5002–5017.[Бесплатная статья PMC] [PubMed] [Google Scholar]27. Zhang Y, Wang X, Li H, Ni C, Du Z, Yan F. Микробиота ротовой полости человека и ее влияние на здоровье полости рта. Биомед Фармаколог. 2018; 99: 883–893. [PubMed] [Google Scholar] 30. Фури Н.Х., Ван Д., Эбей С.К., Шервин Л.Б., Джозеф П.В., Рахим-Уильямс Б., Фергюсон Э.Г., Хендерсон В.А. Микробиом слизистой оболочки полости рта при синдроме раздраженного кишечника. Кишечные микробы. 2016;7:286–301. [Бесплатная статья PMC] [PubMed] [Google Scholar]31. Лукас Лопес Р., Гранде Бургос М.Х., Гальвес А., Перес Пулидо Р.Желудочно-кишечный тракт человека и микробиота полости рта при воспалительных заболеваниях кишечника: обзор состояния науки. АПМИС. 2017; 125:3–10. [PubMed] [Google Scholar] 33. Карпинский ТМ. Роль микробиоты полости рта в развитии рака. Микроорганизмы. 2019;7:pii: E20. [Google Академия] 34. Миширо Т., Ока К., Куроки Ю., Такахаши М., Тацуми К., Сайтох Т., Тобита Х., Ишимура Н., Сато С., Исихара С., Секин Дж., Вада К., Киношита Ю. Изменения перорального микробиома здоровых добровольцев с помощью ингибитора протонной помпы. J Гастроэнтерол Гепатол.2018;33:1059–1066. [PubMed] [Google Scholar] 35.
Биомед Фармаколог. 2018; 99: 883–893. [PubMed] [Google Scholar] 30. Фури Н.Х., Ван Д., Эбей С.К., Шервин Л.Б., Джозеф П.В., Рахим-Уильямс Б., Фергюсон Э.Г., Хендерсон В.А. Микробиом слизистой оболочки полости рта при синдроме раздраженного кишечника. Кишечные микробы. 2016;7:286–301. [Бесплатная статья PMC] [PubMed] [Google Scholar]31. Лукас Лопес Р., Гранде Бургос М.Х., Гальвес А., Перес Пулидо Р.Желудочно-кишечный тракт человека и микробиота полости рта при воспалительных заболеваниях кишечника: обзор состояния науки. АПМИС. 2017; 125:3–10. [PubMed] [Google Scholar] 33. Карпинский ТМ. Роль микробиоты полости рта в развитии рака. Микроорганизмы. 2019;7:pii: E20. [Google Академия] 34. Миширо Т., Ока К., Куроки Ю., Такахаши М., Тацуми К., Сайтох Т., Тобита Х., Ишимура Н., Сато С., Исихара С., Секин Дж., Вада К., Киношита Ю. Изменения перорального микробиома здоровых добровольцев с помощью ингибитора протонной помпы. J Гастроэнтерол Гепатол.2018;33:1059–1066. [PubMed] [Google Scholar] 35. Пей З., Бини Э.Дж., Ян Л., Чжоу М., Франсуа Ф., Блазер М.Дж. Бактериальная биота в дистальном отделе пищевода человека. Proc Natl Acad Sci USA. 2004; 101:4250–4255. [Бесплатная статья PMC] [PubMed] [Google Scholar]36. Абрамс Дж.А. Микробиом как потенциальный биомаркер аденокарциномы пищевода. Ланцет Гастроэнтерол Гепатол. 2017;2:4–6. [PubMed] [Google Scholar] 37. Ян Л., Франсуа Ф., Пей З. Молекулярные пути: патогенез и клинические последствия изменения микробиома при эзофагите и пищеводе Барретта.Клин Рак Рез. 2012;18:2138–2144. [Бесплатная статья PMC] [PubMed] [Google Scholar]38. Ди Пилато В., Фрески Г., Рингресси М.Н., Паллекки Л., Россолини Г.М., Бечи П. Микробиота пищевода в норме и при болезни. Энн Н.Ю. Академия наук. 2016; 1381:21–33. [PubMed] [Google Scholar] 39. Лау В.Ф., Вонг Дж., Лам К.Х., Онг ГБ. Микрофлора пищевода при раке пищевода. Aust NZ J Surg. 1981; 51: 52–55. [PubMed] [Google Scholar]40. Баба Ю., Ивацуки М., Йошида Н., Ватанабэ М., Баба Х. Обзор микробиома кишечника и рака пищевода: патогенез и возможные клинические последствия.
Пей З., Бини Э.Дж., Ян Л., Чжоу М., Франсуа Ф., Блазер М.Дж. Бактериальная биота в дистальном отделе пищевода человека. Proc Natl Acad Sci USA. 2004; 101:4250–4255. [Бесплатная статья PMC] [PubMed] [Google Scholar]36. Абрамс Дж.А. Микробиом как потенциальный биомаркер аденокарциномы пищевода. Ланцет Гастроэнтерол Гепатол. 2017;2:4–6. [PubMed] [Google Scholar] 37. Ян Л., Франсуа Ф., Пей З. Молекулярные пути: патогенез и клинические последствия изменения микробиома при эзофагите и пищеводе Барретта.Клин Рак Рез. 2012;18:2138–2144. [Бесплатная статья PMC] [PubMed] [Google Scholar]38. Ди Пилато В., Фрески Г., Рингресси М.Н., Паллекки Л., Россолини Г.М., Бечи П. Микробиота пищевода в норме и при болезни. Энн Н.Ю. Академия наук. 2016; 1381:21–33. [PubMed] [Google Scholar] 39. Лау В.Ф., Вонг Дж., Лам К.Х., Онг ГБ. Микрофлора пищевода при раке пищевода. Aust NZ J Surg. 1981; 51: 52–55. [PubMed] [Google Scholar]40. Баба Ю., Ивацуки М., Йошида Н., Ватанабэ М., Баба Х. Обзор микробиома кишечника и рака пищевода: патогенез и возможные клинические последствия. Энн Гастроэнтерол Хирург. 2017;1:99–104. [Бесплатная статья PMC] [PubMed] [Google Scholar]41. Кук М.Б., Корли Д.А., Мюррей Л.Дж., Ляо Л.М., Камангар Ф., Йе В., Гаммон М.Д., Риш Х.А., Кассон А.Г., Фридман Н.Д., Чоу В.Х., Ву А.Х., Бернстайн Л., Нирен О., Пандея Н., Уайтман Д.К., Воан Т.Л. . Гастроэзофагеальный рефлюкс в связи с аденокарциномами пищевода: объединенный анализ Консорциума аденокарциномы Барретта и пищевода (BEACON) PLoS One. 2014;9:e103508. [Бесплатная статья PMC] [PubMed] [Google Scholar]42. Макфарлейн С., Фурри Э., Макфарлейн Г.Т., Диллон Дж.Ф.Микробная колонизация верхних отделов желудочно-кишечного тракта у больных пищеводом Барретта. Клин Инфекция Дис. 2007; 45:29–38. [PubMed] [Google Scholar]43. Блэкетт К.Л., Сиддхи С.С., Клири С., Стид Х., Миллер М.Х., Макфарлейн С., Макфарлейн Г.Т., Диллон Дж.Ф. Изменения бактериальной биопленки пищевода при гастроэзофагеальной рефлюксной болезни, болезни Барретта и карциноме пищевода: связь или причинно-следственная связь? Алимент Фармакол Тер.
Энн Гастроэнтерол Хирург. 2017;1:99–104. [Бесплатная статья PMC] [PubMed] [Google Scholar]41. Кук М.Б., Корли Д.А., Мюррей Л.Дж., Ляо Л.М., Камангар Ф., Йе В., Гаммон М.Д., Риш Х.А., Кассон А.Г., Фридман Н.Д., Чоу В.Х., Ву А.Х., Бернстайн Л., Нирен О., Пандея Н., Уайтман Д.К., Воан Т.Л. . Гастроэзофагеальный рефлюкс в связи с аденокарциномами пищевода: объединенный анализ Консорциума аденокарциномы Барретта и пищевода (BEACON) PLoS One. 2014;9:e103508. [Бесплатная статья PMC] [PubMed] [Google Scholar]42. Макфарлейн С., Фурри Э., Макфарлейн Г.Т., Диллон Дж.Ф.Микробная колонизация верхних отделов желудочно-кишечного тракта у больных пищеводом Барретта. Клин Инфекция Дис. 2007; 45:29–38. [PubMed] [Google Scholar]43. Блэкетт К.Л., Сиддхи С.С., Клири С., Стид Х., Миллер М.Х., Макфарлейн С., Макфарлейн Г.Т., Диллон Дж.Ф. Изменения бактериальной биопленки пищевода при гастроэзофагеальной рефлюксной болезни, болезни Барретта и карциноме пищевода: связь или причинно-следственная связь? Алимент Фармакол Тер. 2013;37:1084–1092. [PubMed] [Google Scholar]44. Каакуш Н.О., Кастаньо-Родригес Н., Мэн С.М., Митчелл Х.М.Является ли Campylobacter аденокарциномой пищевода так же, как Helicobacter относится к аденокарциноме желудка? Тенденции микробиол. 2015; 23: 455–462. [PubMed] [Google Scholar]45. Ямамура К., Баба Ю., Накагава С., Мима К., Мияке К., Накамура К., Саваяма Х., Киношита К., Ишимото Т., Ивацуки М., Сакамото Ю., Ямасита Ю., Йошида Н., Ватанабэ М., Баба Х. Микробиом человека Fusobacterium Nucleatum в Ткань рака пищевода связана с прогнозом. Клин Рак Рез. 2016;22:5574–5581. [PubMed] [Google Scholar]46. Эллиотт Д.Р.Ф., Уокер А.В., О’Донован М., Паркхилл Дж., Фицджеральд Р.К.Неэндоскопическое устройство для отбора проб микробиоты пищевода: исследование случай-контроль. Ланцет Гастроэнтерол Гепатол. 2017;2:32–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]47. Амир И., Коникофф Ф.М., Оппенгейм М., Гофна Ю., Половина Е.Е. Желудочная микробиота изменяется при эзофагите и пищеводе Барретта и дополнительно модифицируется ингибиторами протонной помпы.
2013;37:1084–1092. [PubMed] [Google Scholar]44. Каакуш Н.О., Кастаньо-Родригес Н., Мэн С.М., Митчелл Х.М.Является ли Campylobacter аденокарциномой пищевода так же, как Helicobacter относится к аденокарциноме желудка? Тенденции микробиол. 2015; 23: 455–462. [PubMed] [Google Scholar]45. Ямамура К., Баба Ю., Накагава С., Мима К., Мияке К., Накамура К., Саваяма Х., Киношита К., Ишимото Т., Ивацуки М., Сакамото Ю., Ямасита Ю., Йошида Н., Ватанабэ М., Баба Х. Микробиом человека Fusobacterium Nucleatum в Ткань рака пищевода связана с прогнозом. Клин Рак Рез. 2016;22:5574–5581. [PubMed] [Google Scholar]46. Эллиотт Д.Р.Ф., Уокер А.В., О’Донован М., Паркхилл Дж., Фицджеральд Р.К.Неэндоскопическое устройство для отбора проб микробиоты пищевода: исследование случай-контроль. Ланцет Гастроэнтерол Гепатол. 2017;2:32–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]47. Амир И., Коникофф Ф.М., Оппенгейм М., Гофна Ю., Половина Е.Е. Желудочная микробиота изменяется при эзофагите и пищеводе Барретта и дополнительно модифицируется ингибиторами протонной помпы. Окружающая среда микробиол. 2014;16:2905–2914. [PubMed] [Google Scholar]48. Брюсселерс Н., Энгстранд Л., Лагергрен Дж. Поддерживающая терапия ингибированием протонной помпы и риск рака пищевода.Эпидемиол рака. 2018;53:172–177. [PubMed] [Google Scholar]49. Шахин Н.Дж., Фальк Г.В., Айер П.Г., Герсон Л.Б. Американский колледж гастроэнтерологии. Клинические рекомендации ACG: диагностика и лечение пищевода Барретта. Am J Гастроэнтерол. 2016;111:30–50; викторина 51. [PubMed] [Google Scholar] 50. де Йонге П.Дж., Штайерберг Э.В., Куйперс Э.Дж., Хонкуп П., Уолтерс Л.М., Керкхоф М., ван Деккен Х., Сиерсема П.Д. Факторы риска развития аденокарциномы пищевода при пищеводе Барретта. Am J Гастроэнтерол. 2006; 101:1421–1429.[PubMed] [Google Scholar]51. Нгуен Д.М., Эль-Сераг Х.Б., Хендерсон Л., Стейн Д., Бхаттачария А., Сэмплинер Р.Э. Использование лекарств и риск неоплазии у пациентов с пищеводом Барретта. Клин Гастроэнтерол Гепатол. 2009; 7: 1299–1304. [Бесплатная статья PMC] [PubMed] [Google Scholar]52.
Окружающая среда микробиол. 2014;16:2905–2914. [PubMed] [Google Scholar]48. Брюсселерс Н., Энгстранд Л., Лагергрен Дж. Поддерживающая терапия ингибированием протонной помпы и риск рака пищевода.Эпидемиол рака. 2018;53:172–177. [PubMed] [Google Scholar]49. Шахин Н.Дж., Фальк Г.В., Айер П.Г., Герсон Л.Б. Американский колледж гастроэнтерологии. Клинические рекомендации ACG: диагностика и лечение пищевода Барретта. Am J Гастроэнтерол. 2016;111:30–50; викторина 51. [PubMed] [Google Scholar] 50. де Йонге П.Дж., Штайерберг Э.В., Куйперс Э.Дж., Хонкуп П., Уолтерс Л.М., Керкхоф М., ван Деккен Х., Сиерсема П.Д. Факторы риска развития аденокарциномы пищевода при пищеводе Барретта. Am J Гастроэнтерол. 2006; 101:1421–1429.[PubMed] [Google Scholar]51. Нгуен Д.М., Эль-Сераг Х.Б., Хендерсон Л., Стейн Д., Бхаттачария А., Сэмплинер Р.Э. Использование лекарств и риск неоплазии у пациентов с пищеводом Барретта. Клин Гастроэнтерол Гепатол. 2009; 7: 1299–1304. [Бесплатная статья PMC] [PubMed] [Google Scholar]52. Сингх С., Гарг С.К., Сингх П.П., Айер П.Г., Эль-Сераг Х.Б. Кислотоподавляющие препараты и риск развития аденокарциномы пищевода у пациентов с пищеводом Барретта: систематический обзор и метаанализ. Кишка. 2014;63:1229–1237.[Бесплатная статья PMC] [PubMed] [Google Scholar]53. Нето А.Г., Уитакер А., Пей З. Микробиом и потенциальные мишени для химиопрофилактики аденокарциномы пищевода. Семин Онкол. 2016;43:86–96. [Бесплатная статья PMC] [PubMed] [Google Scholar]54. Bruno G, Rocco G, Zaccari P, Porowska B, Mascellino MT, Severi C. Инфекция Helicobacter pylori и дисбактериоз желудка: может ли введение пробиотиков быть полезным для лечения этого состояния? Может ли J заразить Dis Med Microbiol. 2018;2018:6237239. [Бесплатная статья PMC] [PubMed] [Google Scholar]55.Scarpignato C, Gatta L, Zullo A, Blandizzi C SIF-AIGO-FIMMG Group; Итальянское общество фармакологии, Итальянская ассоциация больничных гастроэнтерологов и Итальянская федерация врачей общей практики. Эффективная и безопасная терапия ингибиторами протонной помпы при кислотозависимых заболеваниях — документ с изложением позиции, посвященный преимуществам и потенциальному вреду подавления кислотности.
Сингх С., Гарг С.К., Сингх П.П., Айер П.Г., Эль-Сераг Х.Б. Кислотоподавляющие препараты и риск развития аденокарциномы пищевода у пациентов с пищеводом Барретта: систематический обзор и метаанализ. Кишка. 2014;63:1229–1237.[Бесплатная статья PMC] [PubMed] [Google Scholar]53. Нето А.Г., Уитакер А., Пей З. Микробиом и потенциальные мишени для химиопрофилактики аденокарциномы пищевода. Семин Онкол. 2016;43:86–96. [Бесплатная статья PMC] [PubMed] [Google Scholar]54. Bruno G, Rocco G, Zaccari P, Porowska B, Mascellino MT, Severi C. Инфекция Helicobacter pylori и дисбактериоз желудка: может ли введение пробиотиков быть полезным для лечения этого состояния? Может ли J заразить Dis Med Microbiol. 2018;2018:6237239. [Бесплатная статья PMC] [PubMed] [Google Scholar]55.Scarpignato C, Gatta L, Zullo A, Blandizzi C SIF-AIGO-FIMMG Group; Итальянское общество фармакологии, Итальянская ассоциация больничных гастроэнтерологов и Итальянская федерация врачей общей практики. Эффективная и безопасная терапия ингибиторами протонной помпы при кислотозависимых заболеваниях — документ с изложением позиции, посвященный преимуществам и потенциальному вреду подавления кислотности. БМС Мед. 2016;14:179. [Бесплатная статья PMC] [PubMed] [Google Scholar]56. Хуан Дж. К., Хант Р. Х. Фармакологические и фармакодинамические особенности антагонистов Н(2)-рецепторов и ингибиторов протонной помпы для практикующего врача.Best Pract Res Clin Gastroenterol. 2001; 15: 355–370. [PubMed] [Google Scholar]57. Вандалл Дж. Х. Влияние омепразола на хемотаксис нейтрофилов, продукцию супероксида, дегрануляцию и транслокацию цитохрома b-245. Кишка. 1992; 33: 617–621. [Бесплатная статья PMC] [PubMed] [Google Scholar]58. Парсонс Б.Н., Иджаз УЗ, Д’Амор Р., Беркитт М.Д., Экклс Р., Ленци Л., Дакворт К.А., Мур А.Р., Тиславич Л., Варро А., Холл Н., Притчард Д.М. Сравнение микробиоты желудка человека в гипохлоргидрических состояниях, возникающих в результате Helicobacter pylori-индуцированного атрофического гастрита, аутоиммунного атрофического гастрита и применения ингибиторов протонной помпы.PLoS Патог. 2017;13:e1006653. [Бесплатная статья PMC] [PubMed] [Google Scholar]59. Парони Стербини Ф.
БМС Мед. 2016;14:179. [Бесплатная статья PMC] [PubMed] [Google Scholar]56. Хуан Дж. К., Хант Р. Х. Фармакологические и фармакодинамические особенности антагонистов Н(2)-рецепторов и ингибиторов протонной помпы для практикующего врача.Best Pract Res Clin Gastroenterol. 2001; 15: 355–370. [PubMed] [Google Scholar]57. Вандалл Дж. Х. Влияние омепразола на хемотаксис нейтрофилов, продукцию супероксида, дегрануляцию и транслокацию цитохрома b-245. Кишка. 1992; 33: 617–621. [Бесплатная статья PMC] [PubMed] [Google Scholar]58. Парсонс Б.Н., Иджаз УЗ, Д’Амор Р., Беркитт М.Д., Экклс Р., Ленци Л., Дакворт К.А., Мур А.Р., Тиславич Л., Варро А., Холл Н., Притчард Д.М. Сравнение микробиоты желудка человека в гипохлоргидрических состояниях, возникающих в результате Helicobacter pylori-индуцированного атрофического гастрита, аутоиммунного атрофического гастрита и применения ингибиторов протонной помпы.PLoS Патог. 2017;13:e1006653. [Бесплатная статья PMC] [PubMed] [Google Scholar]59. Парони Стербини Ф. , Палладини А., Масуччи Л., Каннистрачи К.В., Пасторино Р., Яниро Г., Бугли Ф., Мартини С., Рикчарди В., Гасбаррини А., Сангинетти М., Каммарота Г., Постераро Б. Влияние ингибиторов протонной помпы на слизистую оболочку желудка. Сопутствующая микробиота у пациентов с диспепсией. Appl Environ Microbiol. 2016; 82: 6633–6644. [Бесплатная статья PMC] [PubMed] [Google Scholar]60. Феррейра Р.М., Перейра-Маркиш Х., Пинту-Рибейро И., Коста Х.Л., Карнейро Ф., Мачадо Х.С., Фигейреду К.Профилирование микробного сообщества желудка выявляет дисбиотическую микробиоту, ассоциированную с раком. Кишка. 2018;67:226–236. [Бесплатная статья PMC] [PubMed] [Google Scholar]61. Coker OO, Dai Z, Nie Y, Zhao G, Cao L, Nakatsu G, Wu WK, Wong SH, Chen Z, Sung JJY, Yu J. Дисбиоз микробиома слизистой оболочки при канцерогенезе желудка. Кишка. 2018;67:1024–1032. [Бесплатная статья PMC] [PubMed] [Google Scholar]62. Ан JS, Eom CS, Jeon CY, Park SM. Подавляющие кислоту препараты и рак желудка: метаанализ обсервационных исследований.
, Палладини А., Масуччи Л., Каннистрачи К.В., Пасторино Р., Яниро Г., Бугли Ф., Мартини С., Рикчарди В., Гасбаррини А., Сангинетти М., Каммарота Г., Постераро Б. Влияние ингибиторов протонной помпы на слизистую оболочку желудка. Сопутствующая микробиота у пациентов с диспепсией. Appl Environ Microbiol. 2016; 82: 6633–6644. [Бесплатная статья PMC] [PubMed] [Google Scholar]60. Феррейра Р.М., Перейра-Маркиш Х., Пинту-Рибейро И., Коста Х.Л., Карнейро Ф., Мачадо Х.С., Фигейреду К.Профилирование микробного сообщества желудка выявляет дисбиотическую микробиоту, ассоциированную с раком. Кишка. 2018;67:226–236. [Бесплатная статья PMC] [PubMed] [Google Scholar]61. Coker OO, Dai Z, Nie Y, Zhao G, Cao L, Nakatsu G, Wu WK, Wong SH, Chen Z, Sung JJY, Yu J. Дисбиоз микробиома слизистой оболочки при канцерогенезе желудка. Кишка. 2018;67:1024–1032. [Бесплатная статья PMC] [PubMed] [Google Scholar]62. Ан JS, Eom CS, Jeon CY, Park SM. Подавляющие кислоту препараты и рак желудка: метаанализ обсервационных исследований. Мир J Гастроэнтерол.2013;19:2560–2568. [Бесплатная статья PMC] [PubMed] [Google Scholar]63. Брюсселерс Н., Валин К., Энгстранд Л., Лагергрен Дж. Поддерживающая терапия ингибиторами протонной помпы и риск рака желудка: общенациональное когортное исследование населения в Швеции. Открытый БМЖ. 2017;7:e017739. [Бесплатная статья PMC] [PubMed] [Google Scholar]64. Cheung KS, Chan EW, Wong AYS, Chen L, Wong ICK, Leung WK. Ингибиторы протонной помпы длительного действия и риск развития рака желудка после лечения Helicobacter pylori: популяционное исследование.Кишка. 2018;67:28–35. [PubMed] [Google Scholar]65. Song H, Zhu J, Lu D. Длительное использование ингибитора протонной помпы (ИПП) и развитие предраковых поражений желудка. Cochrane Database Syst Rev. 2014;(12):CD010623. [PubMed] [Google Scholar]66. Эслами Л., Нассери-Могхаддам С. Мета-анализ: увеличивает ли длительное использование ИПП риск предраковых поражений желудка? Арх Иран Мед. 2013; 16: 449–458. [PubMed] [Google Scholar]68. Грэм Д.
Мир J Гастроэнтерол.2013;19:2560–2568. [Бесплатная статья PMC] [PubMed] [Google Scholar]63. Брюсселерс Н., Валин К., Энгстранд Л., Лагергрен Дж. Поддерживающая терапия ингибиторами протонной помпы и риск рака желудка: общенациональное когортное исследование населения в Швеции. Открытый БМЖ. 2017;7:e017739. [Бесплатная статья PMC] [PubMed] [Google Scholar]64. Cheung KS, Chan EW, Wong AYS, Chen L, Wong ICK, Leung WK. Ингибиторы протонной помпы длительного действия и риск развития рака желудка после лечения Helicobacter pylori: популяционное исследование.Кишка. 2018;67:28–35. [PubMed] [Google Scholar]65. Song H, Zhu J, Lu D. Длительное использование ингибитора протонной помпы (ИПП) и развитие предраковых поражений желудка. Cochrane Database Syst Rev. 2014;(12):CD010623. [PubMed] [Google Scholar]66. Эслами Л., Нассери-Могхаддам С. Мета-анализ: увеличивает ли длительное использование ИПП риск предраковых поражений желудка? Арх Иран Мед. 2013; 16: 449–458. [PubMed] [Google Scholar]68. Грэм Д. Ю. История Helicobacter pylori, язва двенадцатиперстной кишки, язва желудка и рак желудка.Мир J Гастроэнтерол. 2014;20:5191–5204. [Бесплатная статья PMC] [PubMed] [Google Scholar]69. Сон Дж., Ким Н., Ли Дж., Хван Й.Дж., Ким Х.В., Чунг Дж.В., Ким Дж.В., Ли Д.Х. Ассоциации между pH желудочного сока, атрофическим гастритом, кишечной метаплазией и инфекцией Helicobacter pylori. Кишечник Печень. 2018;12:158–164. [Бесплатная статья PMC] [PubMed] [Google Scholar]70. Correa P. Helicobacter pylori и канцерогенез желудка. Ам Дж. Сург Патол. 1995; 19 Приложение 1: S37–S43. [PubMed] [Google Scholar]71. Малфертейнер П., Кандульский А., Венерито М.Ингибиторы протонной помпы: понимание осложнений и рисков. Нат Рев Гастроэнтерол Гепатол. 2017;14:697–710. [PubMed] [Google Scholar]72. Малфертейнер П., Меграуд Ф., О’Морейн К.А., Гисберт Дж.П., Куйперс Э.Дж., Аксон А.Т., Баззоли Ф., Гасбаррини А., Атертон Дж., Грэм Д.Ю., Хант Р., Моайеди П., Роккас Т., Ругге М., Селград М., Суэрбаум С., Сугано К., Эль-Омар Э.
Ю. История Helicobacter pylori, язва двенадцатиперстной кишки, язва желудка и рак желудка.Мир J Гастроэнтерол. 2014;20:5191–5204. [Бесплатная статья PMC] [PubMed] [Google Scholar]69. Сон Дж., Ким Н., Ли Дж., Хван Й.Дж., Ким Х.В., Чунг Дж.В., Ким Дж.В., Ли Д.Х. Ассоциации между pH желудочного сока, атрофическим гастритом, кишечной метаплазией и инфекцией Helicobacter pylori. Кишечник Печень. 2018;12:158–164. [Бесплатная статья PMC] [PubMed] [Google Scholar]70. Correa P. Helicobacter pylori и канцерогенез желудка. Ам Дж. Сург Патол. 1995; 19 Приложение 1: S37–S43. [PubMed] [Google Scholar]71. Малфертейнер П., Кандульский А., Венерито М.Ингибиторы протонной помпы: понимание осложнений и рисков. Нат Рев Гастроэнтерол Гепатол. 2017;14:697–710. [PubMed] [Google Scholar]72. Малфертейнер П., Меграуд Ф., О’Морейн К.А., Гисберт Дж.П., Куйперс Э.Дж., Аксон А.Т., Баззоли Ф., Гасбаррини А., Атертон Дж., Грэм Д.Ю., Хант Р., Моайеди П., Роккас Т., Ругге М., Селград М., Суэрбаум С., Сугано К., Эль-Омар Э. М. Европейская исследовательская группа Helicobacter and Microbiota и панель консенсуса. Ведение инфекции Helicobacter pylori — Консенсусный отчет Maastricht V/Florence.Кишка. 2017;66:6–30. [PubMed] [Google Scholar]73. Ford AC, Forman D, Hunt RH, Yuan Y, Moayyedi P. Эрадикационная терапия Helicobacter pylori для предотвращения рака желудка у здоровых бессимптомных инфицированных: систематический обзор и метаанализ рандомизированных контролируемых исследований. БМЖ. 2014;348:g3174. [Бесплатная статья PMC] [PubMed] [Google Scholar]75. Сундин О.Х., Мендоса-Ладд А., Зенг М., Диас-Аревало Д., Моралес Э., Фаган Б.М., Ордоньес Дж., Велес П., Энтони Н., МакКаллум Р.В. Тощая кишка человека имеет эндогенную микробиоту, которая отличается от таковой в ротовой полости и толстой кишке.БМС микробиол. 2017;17:160. [Бесплатная статья PMC] [PubMed] [Google Scholar]76. Wacklin P, Kaukinen K, Tuovinen E, Collin P, Lindfors K, Partanen J, Mäki M, Mättö J. Состав микробиоты двенадцатиперстной кишки у взрослых пациентов с глютеновой болезнью связан с клиническими проявлениями заболевания.
М. Европейская исследовательская группа Helicobacter and Microbiota и панель консенсуса. Ведение инфекции Helicobacter pylori — Консенсусный отчет Maastricht V/Florence.Кишка. 2017;66:6–30. [PubMed] [Google Scholar]73. Ford AC, Forman D, Hunt RH, Yuan Y, Moayyedi P. Эрадикационная терапия Helicobacter pylori для предотвращения рака желудка у здоровых бессимптомных инфицированных: систематический обзор и метаанализ рандомизированных контролируемых исследований. БМЖ. 2014;348:g3174. [Бесплатная статья PMC] [PubMed] [Google Scholar]75. Сундин О.Х., Мендоса-Ладд А., Зенг М., Диас-Аревало Д., Моралес Э., Фаган Б.М., Ордоньес Дж., Велес П., Энтони Н., МакКаллум Р.В. Тощая кишка человека имеет эндогенную микробиоту, которая отличается от таковой в ротовой полости и толстой кишке.БМС микробиол. 2017;17:160. [Бесплатная статья PMC] [PubMed] [Google Scholar]76. Wacklin P, Kaukinen K, Tuovinen E, Collin P, Lindfors K, Partanen J, Mäki M, Mättö J. Состав микробиоты двенадцатиперстной кишки у взрослых пациентов с глютеновой болезнью связан с клиническими проявлениями заболевания. Воспаление кишечника Dis. 2013; 19: 934–941. [PubMed] [Google Scholar]77. Чжун Л., Шанахан Э.Р., Радж А., Колоски Н.А., Флетчер Л., Моррисон М., Уокер М.М., Талли Н.Дж., Холтманн Г. Диспепсия и микробиом: время сосредоточиться на тонкой кишке.Кишка. 2017;66:1168–1169. [PubMed] [Google Scholar]78. Вильмонес Х.К., Хауг Э.С., Ульвестад Э., Груде Н., Стенстад Т., Халланд А., Коммедаль О. Описание бактериальной микробиоты подвздошной кишки человека на уровне видов. Научный доклад 2018; 8: 4736. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Ван М., Арне С., Джеппссон Б., Молин Г. Сравнение бактериального разнообразия в кишечном тракте человека путем прямого клонирования и секвенирования генов 16S рРНК. FEMS Microbiol Ecol. 2005; 54: 219–231. [PubMed] [Google Scholar]80. Дэйв М., Джонсон Л.А., Уок С.Т., Янг В.Б., Стидхэм Р.В., Чаудхари М.Н., Фаннелл Дж., Хиггинс П.Д.Рандомизированное исследование использования щипцов с оболочкой в сравнении со стандартными для получения незагрязненных образцов биопсии микробиоты из терминального отдела подвздошной кишки.
Воспаление кишечника Dis. 2013; 19: 934–941. [PubMed] [Google Scholar]77. Чжун Л., Шанахан Э.Р., Радж А., Колоски Н.А., Флетчер Л., Моррисон М., Уокер М.М., Талли Н.Дж., Холтманн Г. Диспепсия и микробиом: время сосредоточиться на тонкой кишке.Кишка. 2017;66:1168–1169. [PubMed] [Google Scholar]78. Вильмонес Х.К., Хауг Э.С., Ульвестад Э., Груде Н., Стенстад Т., Халланд А., Коммедаль О. Описание бактериальной микробиоты подвздошной кишки человека на уровне видов. Научный доклад 2018; 8: 4736. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Ван М., Арне С., Джеппссон Б., Молин Г. Сравнение бактериального разнообразия в кишечном тракте человека путем прямого клонирования и секвенирования генов 16S рРНК. FEMS Microbiol Ecol. 2005; 54: 219–231. [PubMed] [Google Scholar]80. Дэйв М., Джонсон Л.А., Уок С.Т., Янг В.Б., Стидхэм Р.В., Чаудхари М.Н., Фаннелл Дж., Хиггинс П.Д.Рандомизированное исследование использования щипцов с оболочкой в сравнении со стандартными для получения незагрязненных образцов биопсии микробиоты из терминального отдела подвздошной кишки. [Google Академия]86. Бурес Дж., Сирани Дж., Кохутова Д., Фёрстль М., Рейхрт С., Кветина Дж., Ворисек В., Копакова М. Синдром избыточного бактериального роста в тонкой кишке. Мир J Гастроэнтерол. 2010;16:2978–2990. [Бесплатная статья PMC] [PubMed] [Google Scholar]87. Фан Х, Селлин Дж. Х. Обзорная статья: Избыточный бактериальный рост в тонком кишечнике, мальабсорбция желчных кислот и непереносимость глютена как возможные причины хронической водянистой диареи. Алимент Фармакол Тер. 2009;29:1069–1077. [PubMed] [Google Scholar]88.Нарделли С., Джоя С., Ридола Л., Фаркомени А., Мерли М., Риджио О. Ингибиторы протонной помпы связаны с минимальной и явной печеночной энцефалопатией и повышенной смертностью у пациентов с циррозом печени. Гепатология. 2018 [PubMed] [Google Scholar]89. Zhu J, Qi X, Yu H, Yoshida EM, Mendez-Sanchez N, Zhang X, Wang R, Deng H, Li J, Han D, Guo X. Ассоциация ингибиторов протонной помпы с риском печеночной энцефалопатии во время госпитализации по поводу печени цирроз.
[Google Академия]86. Бурес Дж., Сирани Дж., Кохутова Д., Фёрстль М., Рейхрт С., Кветина Дж., Ворисек В., Копакова М. Синдром избыточного бактериального роста в тонкой кишке. Мир J Гастроэнтерол. 2010;16:2978–2990. [Бесплатная статья PMC] [PubMed] [Google Scholar]87. Фан Х, Селлин Дж. Х. Обзорная статья: Избыточный бактериальный рост в тонком кишечнике, мальабсорбция желчных кислот и непереносимость глютена как возможные причины хронической водянистой диареи. Алимент Фармакол Тер. 2009;29:1069–1077. [PubMed] [Google Scholar]88.Нарделли С., Джоя С., Ридола Л., Фаркомени А., Мерли М., Риджио О. Ингибиторы протонной помпы связаны с минимальной и явной печеночной энцефалопатией и повышенной смертностью у пациентов с циррозом печени. Гепатология. 2018 [PubMed] [Google Scholar]89. Zhu J, Qi X, Yu H, Yoshida EM, Mendez-Sanchez N, Zhang X, Wang R, Deng H, Li J, Han D, Guo X. Ассоциация ингибиторов протонной помпы с риском печеночной энцефалопатии во время госпитализации по поводу печени цирроз. United European Gastroenterol J. 2018;6:1179–1187.[Бесплатная статья PMC] [PubMed] [Google Scholar]90. Dam G, Vilstrup H, Watson H, Jepsen P. Ингибиторы протонной помпы как фактор риска печеночной энцефалопатии и спонтанного бактериального перитонита у больных циррозом печени с асцитом. Гепатология. 2016;64:1265–1272. [PubMed] [Google Scholar]91. Стерджен Дж. П., Шоукросс Д. Л. Современные взгляды на патогенез печеночной энцефалопатии и методы лечения. Эксперт Преподобный Гастроэнтерол Гепатол. 2014; 8:83–100. [PubMed] [Google Scholar]92. Гупта А., Дхиман Р.К., Кумари С., Рана С., Агарвал Р., Дуседжа А., Чавла Ю.Роль избыточного бактериального роста в тонкой кишке и замедленного времени транзита через желудочно-кишечный тракт у пациентов с циррозом печени и минимальной печеночной энцефалопатией. J Гепатол. 2010;53:849–855. [PubMed] [Google Scholar]93. Баджадж Дж. С., Хьюман Д. М., Хайлемон П. Б., Саньял А. Дж., Уайт М. Б., Монтейт П., Ноубл Н. А., Унсер А. Б., Дайта К., Фишер А. Р., Сикаруди М.
United European Gastroenterol J. 2018;6:1179–1187.[Бесплатная статья PMC] [PubMed] [Google Scholar]90. Dam G, Vilstrup H, Watson H, Jepsen P. Ингибиторы протонной помпы как фактор риска печеночной энцефалопатии и спонтанного бактериального перитонита у больных циррозом печени с асцитом. Гепатология. 2016;64:1265–1272. [PubMed] [Google Scholar]91. Стерджен Дж. П., Шоукросс Д. Л. Современные взгляды на патогенез печеночной энцефалопатии и методы лечения. Эксперт Преподобный Гастроэнтерол Гепатол. 2014; 8:83–100. [PubMed] [Google Scholar]92. Гупта А., Дхиман Р.К., Кумари С., Рана С., Агарвал Р., Дуседжа А., Чавла Ю.Роль избыточного бактериального роста в тонкой кишке и замедленного времени транзита через желудочно-кишечный тракт у пациентов с циррозом печени и минимальной печеночной энцефалопатией. J Гепатол. 2010;53:849–855. [PubMed] [Google Scholar]93. Баджадж Дж. С., Хьюман Д. М., Хайлемон П. Б., Саньял А. Дж., Уайт М. Б., Монтейт П., Ноубл Н. А., Унсер А. Б., Дайта К., Фишер А. Р., Сикаруди М. , Гиллевет П. М. Изменение профиля микробиома кишечника человека связано с циррозом печени и его осложнениями. J Гепатол. 2014;60:940–947. [Бесплатная статья PMC] [PubMed] [Google Scholar]94.Вилструп Х., Амодио П., Баджадж Дж., Кордоба Дж., Ференси П., Маллен К.Д., Вайссенборн К., Вонг П. Печеночная энцефалопатия при хронических заболеваниях печени: Практическое руководство 2014 г. Американской ассоциации изучения заболеваний печени и Европейской ассоциации Исследование печени. Гепатология. 2014;60:715–735. [PubMed] [Google Scholar]95. Марлич В., Лоневски И., Граймс Д.С., Куигли Э.М. Нестероидные противовоспалительные препараты, ингибиторы протонной помпы и желудочно-кишечные травмы: противоположные взаимодействия в желудке и тонком кишечнике.Мэйо Клин Proc. 2014; 89: 1699–1709. [PubMed] [Google Scholar]96. Gwee KA, Goh V, Lima G, Setia S. Совместное назначение ингибиторов протонной помпы с нестероидными противовоспалительными препаратами: риски и преимущества. Джей Боль Рез. 2018;11:361–374.
, Гиллевет П. М. Изменение профиля микробиома кишечника человека связано с циррозом печени и его осложнениями. J Гепатол. 2014;60:940–947. [Бесплатная статья PMC] [PubMed] [Google Scholar]94.Вилструп Х., Амодио П., Баджадж Дж., Кордоба Дж., Ференси П., Маллен К.Д., Вайссенборн К., Вонг П. Печеночная энцефалопатия при хронических заболеваниях печени: Практическое руководство 2014 г. Американской ассоциации изучения заболеваний печени и Европейской ассоциации Исследование печени. Гепатология. 2014;60:715–735. [PubMed] [Google Scholar]95. Марлич В., Лоневски И., Граймс Д.С., Куигли Э.М. Нестероидные противовоспалительные препараты, ингибиторы протонной помпы и желудочно-кишечные травмы: противоположные взаимодействия в желудке и тонком кишечнике.Мэйо Клин Proc. 2014; 89: 1699–1709. [PubMed] [Google Scholar]96. Gwee KA, Goh V, Lima G, Setia S. Совместное назначение ингибиторов протонной помпы с нестероидными противовоспалительными препаратами: риски и преимущества. Джей Боль Рез. 2018;11:361–374. [Бесплатная статья PMC] [PubMed] [Google Scholar]97. Шейман Дж. М. Использование ингибиторов протонной помпы для лечения и профилактики НПВП-индуцированного повреждения слизистой оболочки. Артрит Res Ther. 2013;15 Приложение 3:S5. [Бесплатная статья PMC] [PubMed] [Google Scholar]98. Уоллес Дж.Л., Сайер С., Дену Э., де Пальма Г., Вонг Л., Макнайт В., Джури Дж., Болла М., Берчик П., Коллинз С.М., Верду Э., Онгини Э.Ингибиторы протонной помпы усугубляют вызванное НПВП повреждение тонкой кишки, вызывая дисбактериоз. Гастроэнтерология. 2011;141:1314–1322, 1322.e1-1322.e5. [PubMed] [Google Scholar]99. Блэклер Р.В., Мотта Дж.П., Манко А., Уоркентин М., Берчик П., Сюретт М.Г., Уоллес Дж.Л. Сероводород защищает от НПВП-энтеропатии за счет модуляции желчи и микробиоты. Бр Дж. Фармакол. 2015; 172:992–1004. [Бесплатная статья PMC] [PubMed] [Google Scholar]100. Syer SD, Blackler RW, Martin R, de Palma G, Rossi L, Verdu E, Bercik P, Surette MG, Aucouturier A, Langella P, Wallace JL.НПВП-энтеропатия и бактерии: сложная взаимосвязь.
[Бесплатная статья PMC] [PubMed] [Google Scholar]97. Шейман Дж. М. Использование ингибиторов протонной помпы для лечения и профилактики НПВП-индуцированного повреждения слизистой оболочки. Артрит Res Ther. 2013;15 Приложение 3:S5. [Бесплатная статья PMC] [PubMed] [Google Scholar]98. Уоллес Дж.Л., Сайер С., Дену Э., де Пальма Г., Вонг Л., Макнайт В., Джури Дж., Болла М., Берчик П., Коллинз С.М., Верду Э., Онгини Э.Ингибиторы протонной помпы усугубляют вызванное НПВП повреждение тонкой кишки, вызывая дисбактериоз. Гастроэнтерология. 2011;141:1314–1322, 1322.e1-1322.e5. [PubMed] [Google Scholar]99. Блэклер Р.В., Мотта Дж.П., Манко А., Уоркентин М., Берчик П., Сюретт М.Г., Уоллес Дж.Л. Сероводород защищает от НПВП-энтеропатии за счет модуляции желчи и микробиоты. Бр Дж. Фармакол. 2015; 172:992–1004. [Бесплатная статья PMC] [PubMed] [Google Scholar]100. Syer SD, Blackler RW, Martin R, de Palma G, Rossi L, Verdu E, Bercik P, Surette MG, Aucouturier A, Langella P, Wallace JL.НПВП-энтеропатия и бактерии: сложная взаимосвязь. J Гастроэнтерол. 2015;50:387–393. [PubMed] [Google Scholar] 101. Уэдзима М., Киноути Т., Катаока К., Хираока И., Ониши Ю. Роль кишечных бактерий в образовании язвы подвздошной кишки у крыс, получавших нестероидные противовоспалительные препараты. Микробиол Иммунол. 1996; 40: 553–560. [PubMed] [Google Scholar] 102. Роберт А., Асано Т. Устойчивость стерильных крыс к поражению кишечника, вызванному индометацином. Простагландины. 1977; 14: 333–341. [PubMed] [Google Scholar] 104.Ханна С., Тош П.К. Учебник для клинициста о роли микробиома в здоровье и болезни человека. Мэйо Клин Proc. 2014;89:107–114. [PubMed] [Google Scholar] 105. Ватт Э., Геммел М.Р., Берри С., Глэр М., Фаркухарсон Ф., Луис П., Мюррей Г.И., Эль-Омар Э., Холд Г.Л. Расширение анализа микробиома слизистой оболочки толстой кишки — оценка лаважа толстой кишки в качестве показателя эндоскопической биопсии толстой кишки. Микробиом. 2016;4:61. [Бесплатная статья PMC] [PubMed] [Google Scholar]106. Арумугам М., Раес Дж., Пеллетье Э.
J Гастроэнтерол. 2015;50:387–393. [PubMed] [Google Scholar] 101. Уэдзима М., Киноути Т., Катаока К., Хираока И., Ониши Ю. Роль кишечных бактерий в образовании язвы подвздошной кишки у крыс, получавших нестероидные противовоспалительные препараты. Микробиол Иммунол. 1996; 40: 553–560. [PubMed] [Google Scholar] 102. Роберт А., Асано Т. Устойчивость стерильных крыс к поражению кишечника, вызванному индометацином. Простагландины. 1977; 14: 333–341. [PubMed] [Google Scholar] 104.Ханна С., Тош П.К. Учебник для клинициста о роли микробиома в здоровье и болезни человека. Мэйо Клин Proc. 2014;89:107–114. [PubMed] [Google Scholar] 105. Ватт Э., Геммел М.Р., Берри С., Глэр М., Фаркухарсон Ф., Луис П., Мюррей Г.И., Эль-Омар Э., Холд Г.Л. Расширение анализа микробиома слизистой оболочки толстой кишки — оценка лаважа толстой кишки в качестве показателя эндоскопической биопсии толстой кишки. Микробиом. 2016;4:61. [Бесплатная статья PMC] [PubMed] [Google Scholar]106. Арумугам М., Раес Дж., Пеллетье Э. , Ле Паслье Д., Ямада Т., Менде Д.Р., Фернандес Г.Р., Тап Дж., Брюлс Т., Батто Дж.М., Берталан М., Борруэль Н., Казеллас Ф., Фернандес Л., Готье Л., Хансен Т., Хаттори М., Хаяши Т., Клееребезем М., Курокава К., Леклерк М., Левенес Ф., Маничан С., Нильсен Х.Б., Нильсен Т., Понс Н., Пулен Дж., Цинь Дж., Зихериц-Понтен Т., Тимс С., Торрентс Д., Угарте Э., Зотендаль EG, Wang J, Guarner F, Pedersen O, de Vos WM, Brunak S, Doré J MetaHIT Consortium, Antolín M, Artiguenave F, Blottiere HM, Almeida M, Brechot C, Cara C, Chervaux C, Cultrone A, Delorme C, Денариаз Г., Дервин Р., Ферстнер К.Ю., Фрисс С., ван де Гухте М., Гедон Э., Хаймет Ф., Хубер В., ван Хилкама-Флиг Дж., Джамет А., Жюст С., Качи Г., Кнол Дж., Лахдари О., Лайек С., Ле Ру К., Маген Э., Мерьё А., Мело Минарди Р., М’рини С., Мюллер Дж., Узир Р., Паркхилл Дж., Рено П., Рескиньо М., Санчес Н., Сунагава С., Торрехон А., Тернер К., Вандемелебрук Г., Варела Э., Виноградский Ю., Целлер Г., Вайссенбах Дж., Эрлих С.Д., Борк П.Энтеротипы микробиома кишечника человека.
, Ле Паслье Д., Ямада Т., Менде Д.Р., Фернандес Г.Р., Тап Дж., Брюлс Т., Батто Дж.М., Берталан М., Борруэль Н., Казеллас Ф., Фернандес Л., Готье Л., Хансен Т., Хаттори М., Хаяши Т., Клееребезем М., Курокава К., Леклерк М., Левенес Ф., Маничан С., Нильсен Х.Б., Нильсен Т., Понс Н., Пулен Дж., Цинь Дж., Зихериц-Понтен Т., Тимс С., Торрентс Д., Угарте Э., Зотендаль EG, Wang J, Guarner F, Pedersen O, de Vos WM, Brunak S, Doré J MetaHIT Consortium, Antolín M, Artiguenave F, Blottiere HM, Almeida M, Brechot C, Cara C, Chervaux C, Cultrone A, Delorme C, Денариаз Г., Дервин Р., Ферстнер К.Ю., Фрисс С., ван де Гухте М., Гедон Э., Хаймет Ф., Хубер В., ван Хилкама-Флиг Дж., Джамет А., Жюст С., Качи Г., Кнол Дж., Лахдари О., Лайек С., Ле Ру К., Маген Э., Мерьё А., Мело Минарди Р., М’рини С., Мюллер Дж., Узир Р., Паркхилл Дж., Рено П., Рескиньо М., Санчес Н., Сунагава С., Торрехон А., Тернер К., Вандемелебрук Г., Варела Э., Виноградский Ю., Целлер Г., Вайссенбах Дж., Эрлих С.Д., Борк П.Энтеротипы микробиома кишечника человека. Природа. 2011; 473:174–180. [Бесплатная статья PMC] [PubMed] [Google Scholar]107. Шанахан Ф. Микробиота толстой кишки и заболевания толстой кишки. Curr Gastroenterol Rep. 2012;14:446–452. [PubMed] [Google Scholar] 108. Джексон М.А., Гудрич Дж.К., Максан М.Е., Фридберг Д.Э., Абрамс Дж.А., Пул А.С., Саттер Дж.Л., Велтер Д., Лей Р.Э., Белл Дж.Т., Спектор Т.Д., Стивс С.Дж. Ингибиторы протонной помпы изменяют состав микробиоты кишечника. Кишка. 2016; 65: 749–756. [Бесплатная статья PMC] [PubMed] [Google Scholar]109.Imhann F, Bonder MJ, Vich Vila A, Fu J, Mujagic Z, Vork L, Tigchelaar EF, Jankipersadsing SA, Cenit MC, Harmsen HJ, Dijkstra G, Franke L, Xavier RJ, Jonkers D, Wijmenga C, Weersma RK, Zhernakova A. Ингибиторы протонной помпы влияют на микробиом кишечника. Кишка. 2016; 65: 740–748. [Бесплатная статья PMC] [PubMed] [Google Scholar]110. Джанартанан С., Дита И., Адлер Д.Г., Эринпрейс М.Н. Clostridium difficile-ассоциированная диарея и терапия ингибиторами протонной помпы: метаанализ.
Природа. 2011; 473:174–180. [Бесплатная статья PMC] [PubMed] [Google Scholar]107. Шанахан Ф. Микробиота толстой кишки и заболевания толстой кишки. Curr Gastroenterol Rep. 2012;14:446–452. [PubMed] [Google Scholar] 108. Джексон М.А., Гудрич Дж.К., Максан М.Е., Фридберг Д.Э., Абрамс Дж.А., Пул А.С., Саттер Дж.Л., Велтер Д., Лей Р.Э., Белл Дж.Т., Спектор Т.Д., Стивс С.Дж. Ингибиторы протонной помпы изменяют состав микробиоты кишечника. Кишка. 2016; 65: 749–756. [Бесплатная статья PMC] [PubMed] [Google Scholar]109.Imhann F, Bonder MJ, Vich Vila A, Fu J, Mujagic Z, Vork L, Tigchelaar EF, Jankipersadsing SA, Cenit MC, Harmsen HJ, Dijkstra G, Franke L, Xavier RJ, Jonkers D, Wijmenga C, Weersma RK, Zhernakova A. Ингибиторы протонной помпы влияют на микробиом кишечника. Кишка. 2016; 65: 740–748. [Бесплатная статья PMC] [PubMed] [Google Scholar]110. Джанартанан С., Дита И., Адлер Д.Г., Эринпрейс М.Н. Clostridium difficile-ассоциированная диарея и терапия ингибиторами протонной помпы: метаанализ. Am J Гастроэнтерол. 2012;107:1001–1010.[PubMed] [Google Scholar] 111. Trifan A, Stanciu C, Girleanu I, Stoica OC, Singeap AM, Maxim R, Chiriac SA, Ciobica A, Boiculese L. Терапия ингибиторами протонной помпы и риск инфекции Clostridium difficile: систематический обзор и метаанализ. Мир J Гастроэнтерол. 2017;23:6500–6515. [Бесплатная статья PMC] [PubMed] [Google Scholar]112. Леонард Дж., Маршалл Дж.К., Моайеди П. Систематический обзор риска кишечной инфекции у пациентов, принимающих кислотосупрессивные препараты. Am J Гастроэнтерол. 2007;102:2047–56; викторина 2057.[PubMed] [Google Scholar] 113. Бавиши С, Дюпон ХЛ. Систематический обзор: Применение ингибиторов протонной помпы и повышенная восприимчивость к кишечным инфекциям. Алимент Фармакол Тер. 2011;34:1269–1281. [PubMed] [Google Scholar] 114. Rizzatti G, Lopetuso LR, Gibiino G, Binda C, Gasbarrini A. Протеобактерии: общий фактор заболеваний человека. Биомед Рез Инт. 2017;2017:9351507. [Бесплатная статья PMC] [PubMed] [Google Scholar]116.
Am J Гастроэнтерол. 2012;107:1001–1010.[PubMed] [Google Scholar] 111. Trifan A, Stanciu C, Girleanu I, Stoica OC, Singeap AM, Maxim R, Chiriac SA, Ciobica A, Boiculese L. Терапия ингибиторами протонной помпы и риск инфекции Clostridium difficile: систематический обзор и метаанализ. Мир J Гастроэнтерол. 2017;23:6500–6515. [Бесплатная статья PMC] [PubMed] [Google Scholar]112. Леонард Дж., Маршалл Дж.К., Моайеди П. Систематический обзор риска кишечной инфекции у пациентов, принимающих кислотосупрессивные препараты. Am J Гастроэнтерол. 2007;102:2047–56; викторина 2057.[PubMed] [Google Scholar] 113. Бавиши С, Дюпон ХЛ. Систематический обзор: Применение ингибиторов протонной помпы и повышенная восприимчивость к кишечным инфекциям. Алимент Фармакол Тер. 2011;34:1269–1281. [PubMed] [Google Scholar] 114. Rizzatti G, Lopetuso LR, Gibiino G, Binda C, Gasbarrini A. Протеобактерии: общий фактор заболеваний человека. Биомед Рез Инт. 2017;2017:9351507. [Бесплатная статья PMC] [PubMed] [Google Scholar]116. Шмульсон М.Дж., Frati-Munari AC. Симптомы со стороны кишечника у пациентов, получающих ингибиторы протонной помпы.Результаты многоцентрового исследования в Мексике. Преподобный Гастроэнтерол Мекс. 2019;84:44–51. [PubMed] [Google Scholar] 117. Distrutti E, Monaldi L, Ricci P, Fiorucci S. Роль микробиоты кишечника при синдроме раздраженного кишечника: новые терапевтические стратегии. Мир J Гастроэнтерол. 2016;22:2219–2241. [Бесплатная статья PMC] [PubMed] [Google Scholar]118. Carabotti M, Scirocco A, Maselli MA, Severi C. Ось кишечник-мозг: взаимодействие между кишечной микробиотой, центральной и кишечной нервной системами. Энн Гастроэнтерол. 2015;28:203–209.[Бесплатная статья PMC] [PubMed] [Google Scholar]119. Табане М., Коттаччи Д.Т., Маршалл Дж.К. Систематический обзор и метаанализ: заболеваемость и прогноз постинфекционного синдрома раздраженного кишечника. Алимент Фармакол Тер. 2007; 26: 535–544. [PubMed] [Google Scholar] 120. Маршалл Дж. К., Табейн М., Гарг А. С., Кларк В. Ф., Сальвадори М.
Шмульсон М.Дж., Frati-Munari AC. Симптомы со стороны кишечника у пациентов, получающих ингибиторы протонной помпы.Результаты многоцентрового исследования в Мексике. Преподобный Гастроэнтерол Мекс. 2019;84:44–51. [PubMed] [Google Scholar] 117. Distrutti E, Monaldi L, Ricci P, Fiorucci S. Роль микробиоты кишечника при синдроме раздраженного кишечника: новые терапевтические стратегии. Мир J Гастроэнтерол. 2016;22:2219–2241. [Бесплатная статья PMC] [PubMed] [Google Scholar]118. Carabotti M, Scirocco A, Maselli MA, Severi C. Ось кишечник-мозг: взаимодействие между кишечной микробиотой, центральной и кишечной нервной системами. Энн Гастроэнтерол. 2015;28:203–209.[Бесплатная статья PMC] [PubMed] [Google Scholar]119. Табане М., Коттаччи Д.Т., Маршалл Дж.К. Систематический обзор и метаанализ: заболеваемость и прогноз постинфекционного синдрома раздраженного кишечника. Алимент Фармакол Тер. 2007; 26: 535–544. [PubMed] [Google Scholar] 120. Маршалл Дж. К., Табейн М., Гарг А. С., Кларк В. Ф., Сальвадори М. , Коллинз С. М. Исследователи исследования здоровья Уокертона. Заболеваемость и эпидемиология синдрома раздраженного кишечника после крупной вспышки бактериальной дизентерии, передающейся через воду. Гастроэнтерология.2006;131:445–50; викторина 660. [PubMed] [Google Scholar] 121. Дюпон АВ. Постинфекционный синдром раздраженного кишечника. Клин Инфекция Дис. 2008; 46: 594–599. [PubMed] [Google Scholar] 122. Канадзава М., Фукудо С. Связь между инфекционным гастроэнтеритом и синдромом раздраженного кишечника. Клин Дж. Гастроэнтерол. 2014;7:14–18. [PubMed] [Google Scholar] 124. Kiank C, Taché Y, Laauche M. Связанная со стрессом модуляция воспаления в экспериментальных моделях заболеваний кишечника и постинфекционного синдрома раздраженного кишечника: роль рецепторов фактора, высвобождающего кортикотропин.Мозг Behav Immun. 2010; 24:41–48. [Бесплатная статья PMC] [PubMed] [Google Scholar]125. Моайеди П., Форд А.С., Тэлли Н.Дж., Кремонини Ф., Фокс-Оренстейн А.Е., Брандт Л.Дж., Куигли Э.М. Эффективность пробиотиков при лечении синдрома раздраженного кишечника: систематический обзор.
, Коллинз С. М. Исследователи исследования здоровья Уокертона. Заболеваемость и эпидемиология синдрома раздраженного кишечника после крупной вспышки бактериальной дизентерии, передающейся через воду. Гастроэнтерология.2006;131:445–50; викторина 660. [PubMed] [Google Scholar] 121. Дюпон АВ. Постинфекционный синдром раздраженного кишечника. Клин Инфекция Дис. 2008; 46: 594–599. [PubMed] [Google Scholar] 122. Канадзава М., Фукудо С. Связь между инфекционным гастроэнтеритом и синдромом раздраженного кишечника. Клин Дж. Гастроэнтерол. 2014;7:14–18. [PubMed] [Google Scholar] 124. Kiank C, Taché Y, Laauche M. Связанная со стрессом модуляция воспаления в экспериментальных моделях заболеваний кишечника и постинфекционного синдрома раздраженного кишечника: роль рецепторов фактора, высвобождающего кортикотропин.Мозг Behav Immun. 2010; 24:41–48. [Бесплатная статья PMC] [PubMed] [Google Scholar]125. Моайеди П., Форд А.С., Тэлли Н.Дж., Кремонини Ф., Фокс-Оренстейн А.Е., Брандт Л.Дж., Куигли Э.М. Эффективность пробиотиков при лечении синдрома раздраженного кишечника: систематический обзор. Кишка. 2010;59:325–332. [PubMed] [Google Scholar] 126. Арагон Г., Грэм Д.Б., Борум М., Доман Д.Б. Пробиотическая терапия синдрома раздраженного кишечника. Гастроэнтерол Гепатол (Нью-Йорк) 2010;6:39–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]127. Si JM, Yu YC, Fan YJ, Chen SJ.Микроэкология кишечника и качество жизни больных синдромом раздраженного кишечника. Мир J Гастроэнтерол. 2004; 10: 1802–1805. [Бесплатная статья PMC] [PubMed] [Google Scholar]129. Шах Р., Ричардсон П., Ю. Х., Крамер Дж., Хоу Дж. К. Подавление желудочной кислоты связано с повышенным риском неблагоприятных исходов при воспалительном заболевании кишечника. пищеварение. 2017;95:188–193. [PubMed] [Google Scholar] 130. Джуллера П., Шнеевайс С., Кук Э.Ф., Анантакришнан А.Н., Могун Х., Корзеник Дж.Р. Лекарства, подавляющие секрецию желудочного сока, могут изменить течение воспалительного заболевания кишечника.Алимент Фармакол Тер. 2012; 36: 239–247. [PubMed] [Google Scholar] 131. Ахмед И., Рой Б.К., Хан С.А., Септер С.
Кишка. 2010;59:325–332. [PubMed] [Google Scholar] 126. Арагон Г., Грэм Д.Б., Борум М., Доман Д.Б. Пробиотическая терапия синдрома раздраженного кишечника. Гастроэнтерол Гепатол (Нью-Йорк) 2010;6:39–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]127. Si JM, Yu YC, Fan YJ, Chen SJ.Микроэкология кишечника и качество жизни больных синдромом раздраженного кишечника. Мир J Гастроэнтерол. 2004; 10: 1802–1805. [Бесплатная статья PMC] [PubMed] [Google Scholar]129. Шах Р., Ричардсон П., Ю. Х., Крамер Дж., Хоу Дж. К. Подавление желудочной кислоты связано с повышенным риском неблагоприятных исходов при воспалительном заболевании кишечника. пищеварение. 2017;95:188–193. [PubMed] [Google Scholar] 130. Джуллера П., Шнеевайс С., Кук Э.Ф., Анантакришнан А.Н., Могун Х., Корзеник Дж.Р. Лекарства, подавляющие секрецию желудочного сока, могут изменить течение воспалительного заболевания кишечника.Алимент Фармакол Тер. 2012; 36: 239–247. [PubMed] [Google Scholar] 131. Ахмед И., Рой Б.К., Хан С.А., Септер С. , Умар С. Микробиом, метаболом и воспалительное заболевание кишечника. Микроорганизмы. 2016;4:pii: E20. [Бесплатная статья PMC] [PubMed] [Google Scholar]132. Marchesi JR, Adams DH, Fava F, Hermes GD, Hirschfield GM, Hold G, Quraishi MN, Kinross J, Smidt H, Tuohy KM, Thomas LV, Zoetendal EG, Hart A. Микробиота кишечника и здоровье хозяина: новый клинический рубеж . Кишка. 2016;65:330–339. [Бесплатная статья PMC] [PubMed] [Google Scholar]133.Мухопадья И., Хансен Р., Эль-Омар Э.М., Холд Г.Л. ВЗК – какую роль играют протеобактерии? Нат Рев Гастроэнтерол Гепатол. 2012;9:219–230. [PubMed] [Google Scholar] 135. Дарфей-Мишо А., Будо Дж., Булуа П., Нойт С., Глассер А.Л., Барнич Н., Брингер М.А., Свидсински А., Божери Л., Коломбель Дж.Ф. Высокая распространенность адгезивно-инвазивной кишечной палочки, связанной со слизистой оболочкой подвздошной кишки при болезни Крона. Гастроэнтерология. 2004; 127:412–421. [PubMed] [Google Scholar] 136. Сокол Х., Лепаж П., Сексик П., Доре Ж., Марто П.Гель-электрофорез фекальной 16S рРНК в градиенте температуры выявляет активную кишечную палочку в микробиоте больных язвенным колитом.
, Умар С. Микробиом, метаболом и воспалительное заболевание кишечника. Микроорганизмы. 2016;4:pii: E20. [Бесплатная статья PMC] [PubMed] [Google Scholar]132. Marchesi JR, Adams DH, Fava F, Hermes GD, Hirschfield GM, Hold G, Quraishi MN, Kinross J, Smidt H, Tuohy KM, Thomas LV, Zoetendal EG, Hart A. Микробиота кишечника и здоровье хозяина: новый клинический рубеж . Кишка. 2016;65:330–339. [Бесплатная статья PMC] [PubMed] [Google Scholar]133.Мухопадья И., Хансен Р., Эль-Омар Э.М., Холд Г.Л. ВЗК – какую роль играют протеобактерии? Нат Рев Гастроэнтерол Гепатол. 2012;9:219–230. [PubMed] [Google Scholar] 135. Дарфей-Мишо А., Будо Дж., Булуа П., Нойт С., Глассер А.Л., Барнич Н., Брингер М.А., Свидсински А., Божери Л., Коломбель Дж.Ф. Высокая распространенность адгезивно-инвазивной кишечной палочки, связанной со слизистой оболочкой подвздошной кишки при болезни Крона. Гастроэнтерология. 2004; 127:412–421. [PubMed] [Google Scholar] 136. Сокол Х., Лепаж П., Сексик П., Доре Ж., Марто П.Гель-электрофорез фекальной 16S рРНК в градиенте температуры выявляет активную кишечную палочку в микробиоте больных язвенным колитом. Дж. Клин Микробиол. 2006;44:3172–3177. [Бесплатная статья PMC] [PubMed] [Google Scholar]137. Joossens M, Huys G, Cnockaert M, De Preter V, Verbeke K, Rutgeerts P, Vandamme P, Vermeire S. Дисбиоз фекальной микробиоты у пациентов с болезнью Крона и их здоровых родственников. Кишка. 2011;60:631–637. [PubMed] [Google Scholar] 138. Шэнь ЧЖ, Чжу СХ, Цюань ЮС, Ян Чжи, Ву С, Луо ВВ, Тан Б, Ван Сюй.Связь между кишечной микробиотой и язвенным колитом: механизмы и клиническое применение пробиотиков и трансплантации фекальной микробиоты. Мир J Гастроэнтерол. 2018;24:5–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]139. Махиелс К., Йоссенс М., Сабино Дж., Де Претер В., Арийс И., Экхаут В., Балет В., Клас К., Ван Иммерсил Ф., Вербеке К., Ферранте М., Верхаген Дж., Рутгертс П., Вермейр С. Снижение содержания бутирата- продуцирующие виды Roseburia hominis и Faecalibacterium prausnitzii определяют дисбактериоз у больных язвенным колитом.Кишка. 2014;63:1275–1283. [PubMed] [Google Scholar] 140. Милонаки М.
Дж. Клин Микробиол. 2006;44:3172–3177. [Бесплатная статья PMC] [PubMed] [Google Scholar]137. Joossens M, Huys G, Cnockaert M, De Preter V, Verbeke K, Rutgeerts P, Vandamme P, Vermeire S. Дисбиоз фекальной микробиоты у пациентов с болезнью Крона и их здоровых родственников. Кишка. 2011;60:631–637. [PubMed] [Google Scholar] 138. Шэнь ЧЖ, Чжу СХ, Цюань ЮС, Ян Чжи, Ву С, Луо ВВ, Тан Б, Ван Сюй.Связь между кишечной микробиотой и язвенным колитом: механизмы и клиническое применение пробиотиков и трансплантации фекальной микробиоты. Мир J Гастроэнтерол. 2018;24:5–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]139. Махиелс К., Йоссенс М., Сабино Дж., Де Претер В., Арийс И., Экхаут В., Балет В., Клас К., Ван Иммерсил Ф., Вербеке К., Ферранте М., Верхаген Дж., Рутгертс П., Вермейр С. Снижение содержания бутирата- продуцирующие виды Roseburia hominis и Faecalibacterium prausnitzii определяют дисбактериоз у больных язвенным колитом.Кишка. 2014;63:1275–1283. [PubMed] [Google Scholar] 140. Милонаки М. , Лэнгмид Л., Пантес А., Джонсон Ф., Рэмптон Д.С. Кишечная инфекция при рецидиве воспалительного заболевания кишечника: значение микробиологического исследования стула. Eur J Гастроэнтерол Гепатол. 2004; 16: 775–778. [PubMed] [Google Scholar] 141. Сингх С., Графф Л.А., Бернстайн К.Н. Вызывают ли НПВП, антибиотики, инфекции или стресс обострения ВЗК? Am J Гастроэнтерол. 2009;104:1298–313; викторина 1314. [PubMed] [Google Scholar] 142. Сартор РБ. Патогенез и иммунные механизмы хронических воспалительных заболеваний кишечника.Am J Гастроэнтерол. 1997;92:5С–11С. [PubMed] [Google Scholar] 143. Чо Дж. Х. Генетика и иммунопатогенез воспалительных заболеваний кишечника. Нат Рев Иммунол. 2008; 8: 458–466. [PubMed] [Google Scholar] 145. Ан Дж., Синха Р., Пей З., Доминианни С., Ву Дж., Ши Дж., Гоэдерт Дж.Дж., Хейс Р.Б., Ян Л. Микробиом кишечника человека и риск колоректального рака. J Natl Cancer Inst. 2013; 105:1907–1911. [Бесплатная статья PMC] [PubMed] [Google Scholar]148. Фланаган Л., Шмид Дж.
, Лэнгмид Л., Пантес А., Джонсон Ф., Рэмптон Д.С. Кишечная инфекция при рецидиве воспалительного заболевания кишечника: значение микробиологического исследования стула. Eur J Гастроэнтерол Гепатол. 2004; 16: 775–778. [PubMed] [Google Scholar] 141. Сингх С., Графф Л.А., Бернстайн К.Н. Вызывают ли НПВП, антибиотики, инфекции или стресс обострения ВЗК? Am J Гастроэнтерол. 2009;104:1298–313; викторина 1314. [PubMed] [Google Scholar] 142. Сартор РБ. Патогенез и иммунные механизмы хронических воспалительных заболеваний кишечника.Am J Гастроэнтерол. 1997;92:5С–11С. [PubMed] [Google Scholar] 143. Чо Дж. Х. Генетика и иммунопатогенез воспалительных заболеваний кишечника. Нат Рев Иммунол. 2008; 8: 458–466. [PubMed] [Google Scholar] 145. Ан Дж., Синха Р., Пей З., Доминианни С., Ву Дж., Ши Дж., Гоэдерт Дж.Дж., Хейс Р.Б., Ян Л. Микробиом кишечника человека и риск колоректального рака. J Natl Cancer Inst. 2013; 105:1907–1911. [Бесплатная статья PMC] [PubMed] [Google Scholar]148. Фланаган Л., Шмид Дж. , Эберт М., Соучек П., Куницка Т., Лиска В., Бруха Дж., Нири П., Дезеув Н., Томмазино М., Дженаб М., Прен Дж. Х., Хьюз Д. Д.Fusobacterium nucleatum ассоциированы со стадиями развития колоректальной неоплазии, колоректальным раком и исходом заболевания. Eur J Clin Microbiol Infect Dis. 2014;33:1381–1390. [PubMed] [Google Scholar] 149. Тилг Х., Адольф Т.Е., Гернер Р.Р., Мошен А.Р. Кишечная микробиота при колоректальном раке. Раковая клетка. 2018; 33: 954–964. [PubMed] [Google Scholar] 151. Джоши С.Н., Гарднер Д.Д. Гастрин и рак толстой кишки: объединяющая гипотеза. Копать Дис. 1996; 14: 334–344. [PubMed] [Google Scholar] 152. Thorburn CM, Friedman GD, Dickinson CJ, Vogelman JH, Orentreich N, Parsonnet J.Гастрин и колоректальный рак: проспективное исследование. Гастроэнтерология. 1998; 115: 275–280. [PubMed] [Google Scholar] 153. Георгопулос С.Д., Полимерос Д., Триантафиллоу К., Спилиади С., Ментис А., Караманолис Д.Г., Ладас С.Д. Гипергастринемия связана с повышенным риском развития аденомы дистального отдела толстой кишки.
, Эберт М., Соучек П., Куницка Т., Лиска В., Бруха Дж., Нири П., Дезеув Н., Томмазино М., Дженаб М., Прен Дж. Х., Хьюз Д. Д.Fusobacterium nucleatum ассоциированы со стадиями развития колоректальной неоплазии, колоректальным раком и исходом заболевания. Eur J Clin Microbiol Infect Dis. 2014;33:1381–1390. [PubMed] [Google Scholar] 149. Тилг Х., Адольф Т.Е., Гернер Р.Р., Мошен А.Р. Кишечная микробиота при колоректальном раке. Раковая клетка. 2018; 33: 954–964. [PubMed] [Google Scholar] 151. Джоши С.Н., Гарднер Д.Д. Гастрин и рак толстой кишки: объединяющая гипотеза. Копать Дис. 1996; 14: 334–344. [PubMed] [Google Scholar] 152. Thorburn CM, Friedman GD, Dickinson CJ, Vogelman JH, Orentreich N, Parsonnet J.Гастрин и колоректальный рак: проспективное исследование. Гастроэнтерология. 1998; 115: 275–280. [PubMed] [Google Scholar] 153. Георгопулос С.Д., Полимерос Д., Триантафиллоу К., Спилиади С., Ментис А., Караманолис Д.Г., Ладас С.Д. Гипергастринемия связана с повышенным риском развития аденомы дистального отдела толстой кишки. пищеварение. 2006; 74: 42–46. [PubMed] [Google Scholar] 154. Yang YX, Hennessy S, Propert K, Hwang WT, Sedarat A, Lewis JD. Хроническая терапия ингибиторами протонной помпы и риск колоректального рака. Гастроэнтерология. 2007; 133: 748–754.[PubMed] [Google Scholar] 155. ван Соест Э.М., ван Россум Л.Г., Дилеман Дж.П., ван Ойен М.Г., Сиерсема П.Д., Стуркенбум М.К., Куйперс Э.Дж. Ингибиторы протонной помпы и риск колоректального рака. Am J Гастроэнтерол. 2008; 103: 966–973. [PubMed] [Google Scholar] 156. Робертсон Д.Дж., Ларссон Х., Фриис С., Педерсен Л., Барон Дж.А., Соренсен Х.Т. Использование ингибитора протонной помпы и риск колоректального рака: популяционное исследование случай-контроль. Гастроэнтерология. 2007; 133: 755–760. [PubMed] [Google Scholar] 157. Гарнер Ф. Десятилетие в обзоре микробиоты кишечника: эра микробиоты кишечника продолжается.Нат Рев Гастроэнтерол Гепатол. 2014; 11: 647–649. [PubMed] [Google Scholar] 158. О’Грэйди Дж., О’Коннор Э.М., Шанахан Ф. Обзорная статья: Пищевые волокна в эпоху науки о микробиоме.
пищеварение. 2006; 74: 42–46. [PubMed] [Google Scholar] 154. Yang YX, Hennessy S, Propert K, Hwang WT, Sedarat A, Lewis JD. Хроническая терапия ингибиторами протонной помпы и риск колоректального рака. Гастроэнтерология. 2007; 133: 748–754.[PubMed] [Google Scholar] 155. ван Соест Э.М., ван Россум Л.Г., Дилеман Дж.П., ван Ойен М.Г., Сиерсема П.Д., Стуркенбум М.К., Куйперс Э.Дж. Ингибиторы протонной помпы и риск колоректального рака. Am J Гастроэнтерол. 2008; 103: 966–973. [PubMed] [Google Scholar] 156. Робертсон Д.Дж., Ларссон Х., Фриис С., Педерсен Л., Барон Дж.А., Соренсен Х.Т. Использование ингибитора протонной помпы и риск колоректального рака: популяционное исследование случай-контроль. Гастроэнтерология. 2007; 133: 755–760. [PubMed] [Google Scholar] 157. Гарнер Ф. Десятилетие в обзоре микробиоты кишечника: эра микробиоты кишечника продолжается.Нат Рев Гастроэнтерол Гепатол. 2014; 11: 647–649. [PubMed] [Google Scholar] 158. О’Грэйди Дж., О’Коннор Э.М., Шанахан Ф. Обзорная статья: Пищевые волокна в эпоху науки о микробиоме. Алимент Фармакол Тер. 2019;49:506–515. [PubMed] [Google Scholar]
Алимент Фармакол Тер. 2019;49:506–515. [PubMed] [Google Scholar]Улучшение микробиоты кишечника с помощью лекарств, снижающих уровень холестерина — ScienceDaily
Существует четкая связь между улучшением микробиоты кишечника и одной из наиболее распространенных групп препаратов для снижения уровня холестерина: статинами. Об этом свидетельствует европейское исследование с участием ученых из Гетеборгского университета.
Ученые ранее обнаружили связь между кишечной микробиотой и различными заболеваниями, связанными с обменом веществ, и сердечно-сосудистыми заболеваниями. Теперь текущее исследование, опубликованное в журнале Nature , показывает улучшение микробиоты кишечника в группе участников, принимавших статины.
Непосредственные механизмы не выявлены. Тем не менее, в этой первой крупной публикации MetaCardis (Метагеномика при кардиометаболических заболеваниях), совместном проекте ЕС, в котором участвуют 14 исследовательских групп из шести стран, результаты однозначны.
Одним из авторов является Фредрик Бекхед, профессор молекулярной медицины Сальгренской академии Гетеборгского университета, который занимается изучением роли кишечной микробиоты в обмене веществ.
«Хотя исследование не выявило причинно-следственной связи, — говорит он, — интересно видеть, как хорошо зарекомендовавший себя и клинически используемый препарат может изменить микробиоту кишечника. Время покажет, воздействуют ли статины на бактерии в кишечнике напрямую или лекарства воздействуют как на клетки кишечника, так и на иммунные клетки, что, в свою очередь, помогает изменить микробиоту.»
Цель MetaCardis — выяснить, может ли и каким образом микробиота кишечника быть связана с сердечно-сосудистыми заболеваниями. В рамках проекта были тщательно исследованы более 2000 европейцев с различной степенью метаболических и сердечно-сосудистых заболеваний.
Микробиота кишечника делится на различные основные группы, известные как энтеротипы, которые различаются у разных людей. Один из них, обозначенный как Bact2, содержит меньше бактерий как по количеству, так и по составу. Микробы, которым не хватает Bact2, включают противовоспалительные бактерии, такие как Faecalibacterium, одним из эффектов которых является укрепление иммунной системы.
Один из них, обозначенный как Bact2, содержит меньше бактерий как по количеству, так и по составу. Микробы, которым не хватает Bact2, включают противовоспалительные бактерии, такие как Faecalibacterium, одним из эффектов которых является укрепление иммунной системы.
Bact2 чаще встречается у пациентов с воспалительным заболеванием кишечника (ВЗК), рассеянным склерозом и депрессией. В текущем исследовании ученые обнаружили, что этот энтеротип также значительно чаще встречается у пациентов с ожирением (18%), чем у людей без него (4%) — наблюдение, подтвержденное в независимом бельгийском исследовании.
Положительный и до сих пор неизвестный эффект статинов, обнаруженный исследователями, заключался в том, что доля людей с Bact2 уменьшилась в группе, получавшей терапию статинами, что привело к более нормальной микробиоте кишечника.В совокупности различные результаты исследований открывают новые формы лечения в будущем, в которых можно использовать лекарства для изменения микробиоты кишечника.
«Возможно, такие препараты, как статины, можно использовать для изменения экологии кишечника. Но это требует дальнейших исследований», — отмечает Бекхед.
Источник истории:
Материалы предоставлены Университетом Гётеборга . Оригинал написан Маргаретой Густафссон Кубиста. Примечание. Содержимое можно редактировать по стилю и длине.
Регуляторное действие гаридисана на дисбиоз кишечной микробиоты на мышиной модели язвенного колита, индуцированного декстрансульфатом натрия | BMC Complementary Medicine and Therapies
Farrell RJ, Peppercorn MA. Язвенный колит. Ланцет (Лондон, Англия). 2002;359(9303):331–40.
Артикул Google Scholar
Cui J, Pang ZR, LGM DE, Lu BN, Liu WZ. Клиническое наблюдение за Гаридисаном у 60 больных язвенным колитом.Tianjin J Tradit Chin Med. 2012;29(01):17–8.
Google Scholar
Сексик П., Сокол Х., Лепаж П., Васкес Н., Маничан С., Манжен И., Почарт П., Доре Дж., Марто П. Обзорная статья: роль бактерий в возникновении и сохранении воспалительного заболевания кишечника. Алимент Фармакол Тер. 2006; 24 (Приложение 3): 11–8.
КАС Статья Google Scholar
Ли С., Ван З., Ян И., Ян С., Яо С., Лю К., Цуй С., Цзоу Ц., Сунь Х., Го Г.Сдвиг Lachnospiraceae в микробном сообществе образца фекалий мышей влияет на иммерсионный иммерсионный стресс. АМБ Экспресс. 2017;7(1):82.
Артикул Google Scholar
Окаясу И., Хатакеяма С., Ямада М., Окуса Т., Инагаки Ю., Накая Р. Новый метод индукции надежного экспериментального острого и хронического язвенного колита у мышей. Гастроэнтерология. 1990; 98(3):694–702.
КАС Статья Google Scholar
Wang W, Chen L, Zhou R, Wang X, Song L, Huang S, Wang G, Xia B.
Артикул Google Scholar
Ван Л., Пей Л.И., Ли С.К., Цуй Дж. Роль монгольского гаридисана в лечении язвенного колита у крыс. J Henan Norm Univ (издание по естественным наукам). 2015;43(04):104–9.
Google Scholar
Ван Л., Пэй Л.И., Кэ Ю.С., Цуй Дж., Ли СК. Влияние препарата Монголия-Гариди сан на Th2 и Th27 у крыс с язвенным колитом. J Beijing Univ Tradit Chin Med. 2017;40(05):399–404.
Google Scholar
Ван Л., Лю В.З., Пей Л.И., Ке Ю.С., Цуй Дж., Ли СК. Гаридисан: улучшение качества заживления язв у крыс с язвенным колитом.Комплемент на основе Evid Altern Med. 2017;2017:8721257.
Google Scholar
Chassaing B, Aitken JD, Malleshappa M, Vijay-Kumar M. Колит, вызванный декстрансульфатом натрия (DSS), у мышей. Карр Проток Иммунол. 2014;104:Единица 15.25.
Артикул Google Scholar
Пей Л.И., Ке Ю.С., Чжао Х.Х., Ван Л., Цзя С., Лю В.З., Фу К.Х., Ши М.Н., Цуй Дж., Ли СК. Роль кишечной микробиоты в патогенезе язвенного колита.БМК Гастроэнтерол. 2019;19(1):10.
Артикул Google Scholar
Бороди Т.Дж., Кэмпбелл Дж. Трансплантация фекальной микробиоты: текущее состояние и будущие направления. Эксперт Преподобный Гастроэнтерол Гепатол. 2011;5(6):653–5.
Артикул Google Scholar
Хупер Л.В., Гордон Дж.И. Комменсальные отношения между хозяином и бактериями в кишечнике. Наука (Нью-Йорк, штат Нью-Йорк). 2001;292(5519):1115–8.
КАС Статья Google Scholar

Swidsinski A, Loening-Baucke V, Herber A. Флора слизистой оболочки при болезни Крона и язвенном колите – обзор. J Physiol Pharmacol. 2009; 60 (Приложение 6): 61–71.
ПабМед Google Scholar
Де Круз П., Придо Л., Вагнер Дж., Нг С.К., Максвини С., Кирквуд С., Моррисон М., Камм М.А. Характеристика микробиоты желудочно-кишечного тракта в норме и при воспалительных заболеваниях кишечника.Воспаление кишечника Dis. 2012;18(2):372–90.
Артикул Google Scholar
Tomasello G, Tralongo P, Damiani P, Sinagra E, Di Trapani B, Zeenny MN, Hussein IH, Jurjus A, Leone A. Дисмикробизм при воспалительных заболеваниях кишечника и колоректальном раке: изменения реакции колоцитов. Мир J Гастроэнтерол. 2014;20(48):18121–30.
КАС Статья Google Scholar
Swidsinski A, Ladhoff A, Pernthaler A, Swidsinski S, Loening-Baucke V, Ortner M, Weber J, Hoffmann U, Schreiber S, Dietel M, et al. Слизистая флора при воспалительных заболеваниях кишечника. Гастроэнтерология. 2002;122(1):44–54.
Слизистая флора при воспалительных заболеваниях кишечника. Гастроэнтерология. 2002;122(1):44–54.
Артикул Google Scholar
Li KY, Wang JL, Wei JP, Gao SY, Zhang YY, Wang LT, Liu G. Фекальная микробиота при поухите и язвенном колите. Мир J Гастроэнтерол. 2016;22(40):8929–39.
КАС Статья Google Scholar
Kostic AD, Xavier RJ, Gevers D. Микробиом при воспалительных заболеваниях кишечника: текущее состояние и будущее. Гастроэнтерология. 2014;146(6):1489–99.
КАС Статья Google Scholar
Li G, Yang M, Zhou K, Zhang L, Tian L, Lv S, Jin Y, Qian W, Xiong H, Lin R, et al. Разнообразие микробиоты двенадцатиперстной и прямой кишки в биоптатах и содержимом просвета у здоровых добровольцев. J Microbiol Biotechnol. 2015;25(7):1136–45.
КАС Статья Google Scholar

Каммингс Дж. Х., Помаре Э. В., Бранч В. Дж., Нейлор С. П., Макфарлейн Г. Т. Короткоцепочечные жирные кислоты в толстом кишечнике, портальной, печеночной и венозной крови человека. Кишка. 1987; 28 (10): 1221–127.
КАС Статья Google Scholar
Rasmussen HS, Holtug K, Mortensen B. Короткоцепочечные жирные кислоты в толстой кишке человека. Значение для здоровья и болезней желудочно-кишечного тракта.Угескр Лаегер. 1988;150(44):2635–8.
КАС пабмед Google Scholar
Nishikawa J, Kudo T, Sakata S, Benno Y, Sugiyama T. Разнообразие микробиоты, связанной со слизистой оболочкой, при активном и неактивном язвенном колите. Scand J Гастроэнтерол. 2009;44(2):180–6.
КАС Статья Google Scholar
Kameyama K, Itoh K. Колонизация кишечника бактерией Lachnospiraceae способствует развитию диабета у мышей с ожирением. Микробы Окружающая среда. 2014;29(4):427–30.
Микробы Окружающая среда. 2014;29(4):427–30.
Артикул Google Scholar
Duck LW, Walter MR, Novak J, Kelly D, Tomasi M, Cong Y, Elson CO. Выделение жгутиковых бактерий, вызывающих болезнь Крона. Воспаление кишечника Dis. 2007;13(10):1191–201.
Артикул Google Scholar
Йе Дж., Ли Дж.В., Пресли Л.Л., Бент Э., Вэй Б., Браун Дж., Шиллер Н.Л., Штраус Д.С., Борнеман Дж.Бактерии и гены бактериальной рРНК связаны с развитием колита у мышей IL-10(-/-). Воспаление кишечника Dis. 2008;14(8):1041–50.
Артикул Google Scholar
Крогиус-Курикка Л., Лира А., Малинен Э., Арникуннас Дж., Туимала Дж., Паулин Л., Макивуокко Х., Каяндер К., Палва А. Анализ микробного сообщества выявил высокий уровень филогенетических изменений в общей желудочно-кишечной микробиоте при диарее. -преимущественно страдающие синдромом раздраженного кишечника. БМК Гастроэнтерол. 2009; 9:95.
БМК Гастроэнтерол. 2009; 9:95.
Артикул Google Scholar
Kittelmann S, Seedorf H, Walters WA, Clemente JC, Knight R, Gordon JI, Janssen PH. Одновременное секвенирование ампликонов для изучения моделей совместного присутствия бактериальных, архейных и эукариотических микроорганизмов в микробных сообществах рубца. ПЛОС Один. 2013;8(2):e47879.
КАС Статья Google Scholar
Госальбес М.Дж., Дурбан А., Пигнателли М., Абеллан Дж.Дж., Хименес-Эрнандес Н., Перес-Кобас А.Е., Латорре А., Мойя А. Метатранскриптомный подход к анализу функциональной микробиоты кишечника человека. ПЛОС Один. 2011;6(3):e17447.
КАС Статья Google Scholar
Huws SA, Kim EJ, Lee MR, Scott MB, Tweed JK, Pinloche E, Wallace RJ, Scollan ND. Пока еще некультивируемые бактерии, филогенетически классифицируемые как Prevotella, Lachnospiraceae incertae sedis и неклассифицированные Bacteroidales, Clostridiales и Ruminococcaceae, могут играть преобладающую роль в биогидрогенизации рубца. Окружающая среда микробиол. 2011;13(6):1500–12.
Окружающая среда микробиол. 2011;13(6):1500–12.
КАС Статья Google Scholar
Pryde SE, Duncan SH, Hold GL, Stewart CS, Flint HJ. Микробиология образования бутирата в толстой кишке человека. FEMS Microbiol Lett. 2002;217(2):133–9.
КАС Статья Google Scholar
Hamer HM, Jonkers D, Venema K, Vanhoutvin S, Troost FJ, Brummer RJ. Обзорная статья: роль бутирата в функции толстой кишки.Алимент Фармакол Тер. 2008;27(2):104–19.
КАС Статья Google Scholar
Михан С.Дж., Бейко Р.Г. Филогеномный взгляд на экологическую специализацию Lachnospiraceae, семейства бактерий, связанных с желудочно-кишечным трактом. Геном Биол Эвол. 2014;6(3):703–13.
КАС Статья Google Scholar
Worthley DL, Leu RK, Whitehall VL, Conlon M, Christophersen C, Belobrajdic D, Mallitt KA, Hu Y, Irahara N, Ogino S, et al. Двойное слепое плацебо-контролируемое перекрестное исследование пребиотических, пробиотических и синбиотических добавок на людях: влияние на люминальные, воспалительные, эпигенетические и эпителиальные биомаркеры колоректального рака. Am J Clin Nutr. 2009;90(3):578–86.
Двойное слепое плацебо-контролируемое перекрестное исследование пребиотических, пробиотических и синбиотических добавок на людях: влияние на люминальные, воспалительные, эпигенетические и эпителиальные биомаркеры колоректального рака. Am J Clin Nutr. 2009;90(3):578–86.
КАС Статья Google Scholar
Буэно-Эрнандес Н., Нуньес-Алдана М., Аскано-Гутьеррес I, Ямамото-Фурушо Дж.К. Оценка режима питания, связанного с симптомами мексиканских пациентов с язвенным колитом (ЯК): на основе достоверности анкеты.Нутр Дж. 2015;14:25.
Артикул Google Scholar
Дисбактериоз пищеварения и кишечника – Передовая натуральная медицина Юпитера
Подсчитано, что более 30 миллионов человек в США, преимущественно женщины, страдают от множественных последствий дисбаланса в желудочно-кишечной системе.
Слышали анекдот про борьбу между разными частями тела? Однажды они поспорили, кто из них самый главный. Глава сказал, что это самое важное, потому что оно контролирует все. Сердце сказало, что это потому, что, в конце концов, его биение поддерживает тело. Каждый орган спорил о своем особом вкладе в поддержание жизни тела… и когда они добрались до кишечника, они громко расхохотались, когда кишечник провозгласил его самым важным. При этом кишечник отключился, и через несколько дней все остальные системы организма согласились, это было самое важное!
Глава сказал, что это самое важное, потому что оно контролирует все. Сердце сказало, что это потому, что, в конце концов, его биение поддерживает тело. Каждый орган спорил о своем особом вкладе в поддержание жизни тела… и когда они добрались до кишечника, они громко расхохотались, когда кишечник провозгласил его самым важным. При этом кишечник отключился, и через несколько дней все остальные системы организма согласились, это было самое важное!
Эта небольшая история показывает, как часто недооценивают работу кишечника, также называемого желудочно-кишечным трактом или пищеварительной системой.Но это играет огромную роль в вашем здоровье и благополучии. Когда вы не перевариваете пищу должным образом, могут возникнуть всевозможные проблемы: питательные вещества могут не усваиваться, что приводит к низкому уровню энергии; ваша иммунная система может быть подорвана, что приведет к вирусным и бактериальным инфекциям; другие системы организма могут быть затронуты от кожи до вашей нервной системы; и, наконец, плохое пищеварение может привести к заражению желудочно-кишечного тракта токсичными бактериями, что называется дисбиозом кишечника . Пищеварение обычно нарушается самой медицинской системой, неправильным питанием, гормонами, психологией и привычками образа жизни.
Пищеварение обычно нарушается самой медицинской системой, неправильным питанием, гормонами, психологией и привычками образа жизни.
Желудочно-кишечный тракт среднего мужчины имеет длину около 25 футов и включает в себя всю «санитарную» систему тела, которая начинается со рта и продолжается вниз по горлу, проходит через тонкую кишку в толстую кишку и слепую кишку (прилагается). в аппендикс), толстую и прямую кишку и, наконец, в задний проход, когда твердые отходы выходят из организма. Вся эта система также известна как сокращенный термин «ЖКТ» или просто «Кишка».
Кишечник выполняет три основные функции:
- Переваривание пищи и превращение в витамины
- Поглощение питательных веществ
- Предотвращение попадания токсинов и патогенов в организм
Когда кишечник здоров
Приблизительно 500 видов бактерий, а также многие виды дрожжей и других организмов обитают в желудочно-кишечном тракте человека и составляют «кишечную флору». Эти «дружественные» бактерии жизненно важны для хорошего пищеварения и здоровья кишечника в целом, и в большинстве случаев их названия начинаются с «Lactobacillus» или «Bifidobacteria», что обозначает класс бактерий, к которому они принадлежат. Вы, возможно, замечали продукты питания, такие как йогурт и ацидофильное молоко, которые содержат эти бактерии. Их все чаще добавляют, так же как, например, витамины и минералы часто добавляют в сухие завтраки.
Эти «дружественные» бактерии жизненно важны для хорошего пищеварения и здоровья кишечника в целом, и в большинстве случаев их названия начинаются с «Lactobacillus» или «Bifidobacteria», что обозначает класс бактерий, к которому они принадлежат. Вы, возможно, замечали продукты питания, такие как йогурт и ацидофильное молоко, которые содержат эти бактерии. Их все чаще добавляют, так же как, например, витамины и минералы часто добавляют в сухие завтраки.
Когда кишечная флора находится в здоровом равновесии, это называется «ортобиозом» — термин, введенный в начале 1900-х годов великим микробиологом Эли Мечниковым.Когда наш кишечник выходит из равновесия, говорят, что у нас «дисбактериоз». Мечников настолько беспокоился о дисбактериозе, что придумал выражение «Смерть начинается в кишечнике!»
Что может пойти не так?
Не все из сотен видов организмов, составляющих кишечную флору, являются «дружественными». Есть также ряд организмов, которые не приносят организму никакой пользы или делают это только тогда, когда их количество поддерживается на низком уровне конкурирующими дружественными бактериями. К таким микроорганизмам относятся колиформные бактерии (E.coli и др.), дрожжи/грибы, паразиты и бактероиды.
К таким микроорганизмам относятся колиформные бактерии (E.coli и др.), дрожжи/грибы, паразиты и бактероиды.
Болезнь может возникнуть, когда количество дружественных бактерий уменьшается, а другие организмы могут увеличить свою численность и стать большинством. Существует ряд факторов, которые могут нарушить баланс организмов в кишечнике и привести к чрезмерному росту менее желательных видов. Наиболее важные факторы:
- Использование антибиотиков (злоупотребление)
- Использование противозачаточных таблеток
- Использование других гормонов, особенно иммунодепрессантов, таких как стероиды
- Диета, особенно с высоким содержанием сахара
- Спирт
- Стресс
Состояния, часто вызываемые дисбактериозом, включают синдром раздраженного кишечника, акне, пищевую аллергию, хроническую усталость и депрессию.Но вы можете способствовать повторному заселению полезных бактерий, употребляя в пищу продукты, содержащие натуральные полезные бактерии, включая йогурт и ацидофильное молоко.![]() Вы также можете принимать ацидофильную добавку и что-то под названием фруктоолигосахариды (ФОС), растительную добавку, которая служит «суперпищей» для этих хороших бактерий.
Вы также можете принимать ацидофильную добавку и что-то под названием фруктоолигосахариды (ФОС), растительную добавку, которая служит «суперпищей» для этих хороших бактерий.
Дисбактериоз кишечника может привести к изменениям в слизистой оболочке кишечника, что увеличивает проницаемость кишечника, что приводит к синдрому повышенной проницаемости кишечника .
Синдром повышенной кишечной проницаемости
Слизистая оболочка кишечника представляет собой барьер, который в норме позволяет только правильно переваренным жирам, белкам и крахмалам проходить и попадать в кровоток.Когда эта подкладка подвергается воздействию таких вещей, как аспирин, бактериальные токсины или даже пестициды, распыляемые на нашу еду, она теряет свою целостность. Это когда дверь открыта, чтобы впустить бактерии, вирусы, паразиты и даже непереваренные молекулы пищи! Они активируют иммунную систему и часто гиперстимулируют ее, так что она выбрасывает воспалительные вещества, называемые цитокинами, и ослабляет стенки кишечника. Мы называем эту потерю целостности «синдромом дырявого кишечника». Взволнованная иммунная система также может стать настолько нестабильной, что начнет атаковать ваш собственный организм, вызывая аутоиммунные заболевания.
Мы называем эту потерю целостности «синдромом дырявого кишечника». Взволнованная иммунная система также может стать настолько нестабильной, что начнет атаковать ваш собственный организм, вызывая аутоиммунные заболевания.
Симптомы синдрома повышенной кишечной проницаемости / кишечной непроходимости
Симптомы включают боль в животе, астму, хроническую боль в суставах, хроническую мышечную боль, спутанность сознания, нечеткое или туманное мышление, газы, расстройство желудка, перепады настроения, нервозность, снижение иммунитета, рецидивирующие вагинальные инфекции, кожную сыпь, диарею, ночное недержание мочи, рецидивирующий мочевой пузырь. инфекции, плохая память, одышка, запоры, вздутие живота, агрессивное поведение, тревожность, плохое либидо, усталость и просто ощущение «токсичности».
Синдром повышенной кишечной проницаемости связан со следующими состояниями:
- Вздутие живота и увеличение веса
- Синдром хронической усталости
- Целиакия
- Болезнь Крона
- Экологическая болезнь
- Ульи
- Акне
- Аллергии
- Воспалительные заболевания суставов/артрит
- Кишечные инфекции
- Панкреатическая недостаточность
- Язвенный колит
- Лямблии
- Экзема
- Псориаз
- Пищевая аллергия и чувствительность
- Дисфункция печени
- Ревматоидный артрит
- Синдром раздраженного кишечника
Кандидоз
Когда естественные дрожжи или грибки, обнаруженные в организме, выходят из-под контроля, это может привести к состоянию, называемому Кандидоз, инфекция, вызываемая разновидностью грибков Candida, особенно Candida albicans. Эти грибы встречаются почти везде в окружающей среде, и некоторые из них могут безвредно жить вместе с многочисленными «местными» видами бактерий, которые обычно колонизируют рот, желудочно-кишечный тракт и влагалище. Рост Candida обычно контролируется присутствием местных бактерий и иммунной защитой организма. Если популяция местных бактерий уменьшается, особенно с помощью антибиотиков, или если иммунная защита ослабевает из-за недоедания или приема некоторых лекарств (кортикостероидов или противоопухолевых препаратов), грибы Candida могут размножаться настолько, чтобы вызвать симптомы, извергая много токсинов в кровоток и печень.Он может поражать множество различных частей тела, вызывая либо локальные инфекции, либо тяжелое заболевание, в зависимости от пациента и его или ее основного состояния здоровья.
Эти грибы встречаются почти везде в окружающей среде, и некоторые из них могут безвредно жить вместе с многочисленными «местными» видами бактерий, которые обычно колонизируют рот, желудочно-кишечный тракт и влагалище. Рост Candida обычно контролируется присутствием местных бактерий и иммунной защитой организма. Если популяция местных бактерий уменьшается, особенно с помощью антибиотиков, или если иммунная защита ослабевает из-за недоедания или приема некоторых лекарств (кортикостероидов или противоопухолевых препаратов), грибы Candida могут размножаться настолько, чтобы вызвать симптомы, извергая много токсинов в кровоток и печень.Он может поражать множество различных частей тела, вызывая либо локальные инфекции, либо тяжелое заболевание, в зависимости от пациента и его или ее основного состояния здоровья.
Кандидоз обычно можно обнаружить на открытых и большей части тела, таких как рот и горло (так называемый молочница), влагалище (обычно называется дрожжевой инфекцией), а у детей — в виде опрелостей. Кандидоз может поразить все тело, а у некоторых людей может привести не только к желудочным расстройствам, таким как вздутие живота и газы, но также к усталости, депрессии, беспокойству, кожным высыпаниям и нарушению работы иммунной системы.
Кандидоз может поразить все тело, а у некоторых людей может привести не только к желудочным расстройствам, таким как вздутие живота и газы, но также к усталости, депрессии, беспокойству, кожным высыпаниям и нарушению работы иммунной системы.
Как успокоить расстройство кишечника
Мы лечили пациентов с дисбактериозом кишечника, повышенной кишечной проницаемостью, кандидозом и другими желудочно-кишечными проблемами, и действительно приятно видеть, как их жизнь улучшается! Восстановление обычно занимает от трех до шести месяцев, чтобы достичь максимального улучшения. Тем не менее, на протяжении всего пути люди отмечают улучшенную выносливость, похудение тела, улучшение умственного и эмоционального функционирования, уменьшение мышечных болей, новое понимание жизни и многие другие улучшения. Первым шагом является всесторонний анализ стула, выполняемый в Doctor’s Data, Inc. (образец) – всемирно известной лаборатории, которая проводит специализированное тестирование.
Чтобы связаться с персоналом по поводу назначения личной консультации с доктором Масса , нажмите здесь.
Важно, чтобы вы не уменьшали дозу, не изменяли и не прекращали прием каких-либо лекарств или лечения без предварительной консультации с врачом. Рекомендации этого веб-сайта следует рассматривать только как «общеинформационные», а не как конкретно применимые к медицинским проблемам, проблемам и / или потребностям любого человека.
Раскрытие антимикробного действия антидепрессантов на кишечные симбиотические микробы
Растет интерес к тому, как терапевтические препараты могут влиять и изменять состав и функцию микробиоты кишечника человека 21 . В то время как накапливаются некоторые знания об антимикробном воздействии некоторых антидепрессантов на изолированные штаммы или кишечную микробиоту животных моделей, информация о других классах антидепрессантов и репрезентативных видах из кишечника человека изучена плохо.Существует настоятельная необходимость выяснить реальный вклад противомикробной роли антидепрессантов и последующие последствия для структуры и метаболизма микробиоты кишечника. В этом исследовании мы исследовали in vitro влияние обычно назначаемых антидепрессантов из разных классов на комменсальные бактериальные штаммы микробиоты кишечника человека. Результаты ясно продемонстрировали, что большинство тестируемых антидепрессантов оказывали важное дозозависимое ингибирующее действие (в некоторых случаях бактерицидное) на рост тестируемых бактериальных штаммов.
В этом исследовании мы исследовали in vitro влияние обычно назначаемых антидепрессантов из разных классов на комменсальные бактериальные штаммы микробиоты кишечника человека. Результаты ясно продемонстрировали, что большинство тестируемых антидепрессантов оказывали важное дозозависимое ингибирующее действие (в некоторых случаях бактерицидное) на рост тестируемых бактериальных штаммов.
Дезипрамин, относящийся к классу трициклических антидепрессантов, показал наиболее сильную антибактериальную активность и значительное ( P < 0,05) снижение роста, при этом A. muciniphila (семейство Verrucomicrobia) и E. coli (группа Proteobacteria) являлись наиболее чувствительные микроорганизмы при значениях МИК 75 и 150 мкг/мл соответственно. Информация об антимикробной активности дезипрамина, в частности, в отношении кишечных штаммов человека, в литературе отсутствует.В исследовании in vivo 17 сообщалось, что дезипрамин способен уменьшать богатство и увеличивать бета-разнообразие кишечной микробиоты самцов мышей BALB/c. Кроме того, те же авторы обнаружили снижение численности на уровне рода Ruminococcus , Adlercreutzia и неклассифицированной Alphaproteobacteria у мышей, получавших дезипрамин. Аналогичным образом было показано, что введение дезипрамина вызывает важные побочные эффекты и приводит к более высокой частоте инфекций, вызывающих гингивит и дисбактериоз микробиоты полости рта 19 .Ранее было показано, что другие представители группы трициклических антидепрессантов обладают антимикробным действием in vitro в отношении патогенных для человека видов, например, амитриптилин в отношении Staphylococcus spp., Bacillus spp. и Vibrio cholerae 22 ; и имипрамин, ингибирующий рост E. coli и Yersinia enterocolitica 23 . Другой одобренный FDA препарат ТЦА, мапротилин, продемонстрировал способность снижать тяжесть инфекции Francisella за счет снижения вирулентности без бактерицидного действия 24 .
Кроме того, те же авторы обнаружили снижение численности на уровне рода Ruminococcus , Adlercreutzia и неклассифицированной Alphaproteobacteria у мышей, получавших дезипрамин. Аналогичным образом было показано, что введение дезипрамина вызывает важные побочные эффекты и приводит к более высокой частоте инфекций, вызывающих гингивит и дисбактериоз микробиоты полости рта 19 .Ранее было показано, что другие представители группы трициклических антидепрессантов обладают антимикробным действием in vitro в отношении патогенных для человека видов, например, амитриптилин в отношении Staphylococcus spp., Bacillus spp. и Vibrio cholerae 22 ; и имипрамин, ингибирующий рост E. coli и Yersinia enterocolitica 23 . Другой одобренный FDA препарат ТЦА, мапротилин, продемонстрировал способность снижать тяжесть инфекции Francisella за счет снижения вирулентности без бактерицидного действия 24 . Мапротилин и хлорпромазин обладают сильной антибиопленочной активностью в отношении Francisella 24 . Помимо антибиопленочной ингибирующей активности в отношении Salmonella Typhimurium и Francisella novicida , хлорпромазин сильно ингибирует рост F. novicida 24 . Кроме того, было показано, что TCA амоксапин ресенсибилизирует метициллин-резистентные штаммы S. aureus к оксациллину in vitro 25 . Кроме того, сообщалось, что члены препаратов ТЦА обладают антиплазмидным действием и ингибируют кишечные патогены, такие как E.coli , Yersinia enterocolitica , Giardia lamblia , Plasmodium falciparum и Leishmania spp., рассмотренные в 10 .
Мапротилин и хлорпромазин обладают сильной антибиопленочной активностью в отношении Francisella 24 . Помимо антибиопленочной ингибирующей активности в отношении Salmonella Typhimurium и Francisella novicida , хлорпромазин сильно ингибирует рост F. novicida 24 . Кроме того, было показано, что TCA амоксапин ресенсибилизирует метициллин-резистентные штаммы S. aureus к оксациллину in vitro 25 . Кроме того, сообщалось, что члены препаратов ТЦА обладают антиплазмидным действием и ингибируют кишечные патогены, такие как E.coli , Yersinia enterocolitica , Giardia lamblia , Plasmodium falciparum и Leishmania spp., рассмотренные в 10 .
Интересно, что арипипразол и бупропион, принадлежащие к атипичной группе антидепрессантов, проявляли разные эффекты, при этом арипипразол обладал выраженной антибактериальной активностью, а бупропион не проявлял значительного ингибирования роста. Некоторые предыдущие исследования показали, что арипипразол оказывает ингибирующее действие на микробиоту кишечника 9,21 .Например, Майер и др. 21 продемонстрировал в крупномасштабном исследовании in vitro, что несколько неантибиотических препаратов ингибируют рост кишечных бактерий человека, при этом уровни Akkermansia снижаются в присутствии атипичных нейролептиков (включая арипипразол). Наше исследование выявило высокую антибактериальную чувствительность Akkermansia к арипипразолу и дезипрамину с бактерицидным действием в тестируемом диапазоне концентраций. У крыс введение арипипразола в течение 4 недель ассоциировалось с изменением относительной численности родов фирмикутов, включая Clostridium , Ruminiclostridium , Intestinibacter и Eubacterium coprostanoligens 9
Некоторые предыдущие исследования показали, что арипипразол оказывает ингибирующее действие на микробиоту кишечника 9,21 .Например, Майер и др. 21 продемонстрировал в крупномасштабном исследовании in vitro, что несколько неантибиотических препаратов ингибируют рост кишечных бактерий человека, при этом уровни Akkermansia снижаются в присутствии атипичных нейролептиков (включая арипипразол). Наше исследование выявило высокую антибактериальную чувствительность Akkermansia к арипипразолу и дезипрамину с бактерицидным действием в тестируемом диапазоне концентраций. У крыс введение арипипразола в течение 4 недель ассоциировалось с изменением относительной численности родов фирмикутов, включая Clostridium , Ruminiclostridium , Intestinibacter и Eubacterium coprostanoligens 9
Будучи наиболее часто назначаемым классом антидепрессантов для лечения большого депрессивного расстройства, селективные ингибиторы обратного захвата серотонина (СИОЗС), испытанные в этом исследовании, ( S )-циталопрам оказались более активными в отношении E. rectal и F. prausnitzii, , оба принадлежат к типу Firmicutes. Многие изолированные исследования in vitro, проведенные с препаратами СИОЗС, с использованием эталонных штаммов или клинических изолятов (не обязательно представляющих кишечные микробы), показали антимикробный эффект 10 .Согласно 9, эсциталопрам, энантиомер (S)-циталопрама, и флуоксетин были способны полностью ингибировать рост E. coli APC105 и L. rhamnosus 6118, находящихся в кишечнике человека. в концентрации 600 мкг/мл. Кроме того, сообщалось, что циталопрам оказывает ингибирующее действие на некоторые патогенные штаммы E. coli со значением МИК более 800 мкМ 26,27 и на штаммы P. aeruginosa с МИК в диапазоне 4000–6000 мг/мл. мл 27 .В других исследованиях было продемонстрировано антимикробное действие большего количества препаратов СИОЗС, таких как сертралин, флуоксетин, циталопрам и пароксетин, на штаммы 11,28,29 Enterococcus, Pseudomonas, Pseudomonas, Bacillus и Clostridium .
rectal и F. prausnitzii, , оба принадлежат к типу Firmicutes. Многие изолированные исследования in vitro, проведенные с препаратами СИОЗС, с использованием эталонных штаммов или клинических изолятов (не обязательно представляющих кишечные микробы), показали антимикробный эффект 10 .Согласно 9, эсциталопрам, энантиомер (S)-циталопрама, и флуоксетин были способны полностью ингибировать рост E. coli APC105 и L. rhamnosus 6118, находящихся в кишечнике человека. в концентрации 600 мкг/мл. Кроме того, сообщалось, что циталопрам оказывает ингибирующее действие на некоторые патогенные штаммы E. coli со значением МИК более 800 мкМ 26,27 и на штаммы P. aeruginosa с МИК в диапазоне 4000–6000 мг/мл. мл 27 .В других исследованиях было продемонстрировано антимикробное действие большего количества препаратов СИОЗС, таких как сертралин, флуоксетин, циталопрам и пароксетин, на штаммы 11,28,29 Enterococcus, Pseudomonas, Pseudomonas, Bacillus и Clostridium . Кроме того, в нескольких исследованиях подчеркивается противогрибковый потенциал СИОЗС флуоксетина, сертралина и пароксетина в отношении Aspergillus spp., Candida parapsilosis и Candida albicans 12,13,27 .Сообщалось, что некоторые СИОЗС обладают противомикробными свойствами в высоких концентрациях, а в более низких концентрациях проявляют антимикробные усиливающие свойства. Этот синергетический эффект подтверждается снижением минимальных ингибирующих концентраций антибиотиков при их сочетании с антидепрессантами. Например, было показано, что сертралин влияет на бактериальную транскрипцию и повышает чувствительность Escherichia coli APEC_O2 к тетрациклину in vitro 14 .Тем не менее, лечение высокими дозами сертралина в качестве адъюванта для лечения инфекций, устойчивых к антибиотикам E. coli , усугубляло патологический исход инфекции у кур 30 . Другие исследования с использованием животных моделей предоставили in vivo доказательства противомикробной активности СИОЗС 9,17,31 .
Кроме того, в нескольких исследованиях подчеркивается противогрибковый потенциал СИОЗС флуоксетина, сертралина и пароксетина в отношении Aspergillus spp., Candida parapsilosis и Candida albicans 12,13,27 .Сообщалось, что некоторые СИОЗС обладают противомикробными свойствами в высоких концентрациях, а в более низких концентрациях проявляют антимикробные усиливающие свойства. Этот синергетический эффект подтверждается снижением минимальных ингибирующих концентраций антибиотиков при их сочетании с антидепрессантами. Например, было показано, что сертралин влияет на бактериальную транскрипцию и повышает чувствительность Escherichia coli APEC_O2 к тетрациклину in vitro 14 .Тем не менее, лечение высокими дозами сертралина в качестве адъюванта для лечения инфекций, устойчивых к антибиотикам E. coli , усугубляло патологический исход инфекции у кур 30 . Другие исследования с использованием животных моделей предоставили in vivo доказательства противомикробной активности СИОЗС 9,17,31 .
Венлафаксин из терапевтического класса ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН) не проявлял антибактериального действия на рост протестированных бактериальных штаммов.Этот вывод согласуется с данными 9 , которые тестировали in vitro против L. rhamnosus и E. coli при максимальных концентрациях 600 мкг/мл. Кроме того, было обнаружено, что венлафаксин неактивен при тестировании против E. coli и P. a eruginosa ; однако этот препарат усиливал антибактериальное действие антибиотиков в отношении резистентных штаммов 27 .
Ингибитор моноаминоксидазы (ИМАО) фенелзин , показал заметный антибактериальный эффект на некоторых штаммов, представителей типа Firmicutes ( E.rectale и F. prausnitzii ). Мало что известно об антимикробной активности фенелзина. Это можно объяснить большим вниманием к другим классам антидепрессантов.
В этом исследовании наблюдались различия в антибактериальной активности антидепрессантов между различными терапевтическими классами, что предполагает возможные различия в механизмах их ингибирующего действия. Даже эти последние до конца не изучены, одним из предполагаемых механизмов действия СИОЗС является ингибирование насосов оттока 28 и снижение активности ДНК-гиразы для ТЦА-антидепрессантов 10 .Механизмы, лежащие в основе вызванных лекарственными препаратами изменений микробиоты кишечника, известны лишь частично. Действительно, результаты этой работы подчеркивают вариабельность значений МПК антидепрессантов по отношению к штаммам разных видов, где некоторые антидепрессанты проявляют бактериостатический или бактерицидный эффект. Эти различия в ингибировании микробов могут способствовать изменению численности кишечника за счет отбора одних бактерий и способствовать избыточному росту других, вызывая сдвиг микробных сообществ в сторону дисбактериоза или эубиоза.
Даже эти последние до конца не изучены, одним из предполагаемых механизмов действия СИОЗС является ингибирование насосов оттока 28 и снижение активности ДНК-гиразы для ТЦА-антидепрессантов 10 .Механизмы, лежащие в основе вызванных лекарственными препаратами изменений микробиоты кишечника, известны лишь частично. Действительно, результаты этой работы подчеркивают вариабельность значений МПК антидепрессантов по отношению к штаммам разных видов, где некоторые антидепрессанты проявляют бактериостатический или бактерицидный эффект. Эти различия в ингибировании микробов могут способствовать изменению численности кишечника за счет отбора одних бактерий и способствовать избыточному росту других, вызывая сдвиг микробных сообществ в сторону дисбактериоза или эубиоза.
Противомикробная активность антидепрессанта в отношении микробиоты кишечника может рассматриваться как побочный эффект, но также, возможно, как механизм действия антидепрессанта в кишечнике. В самом деле, в то время как ланицемин не оказывает антидепрессивного действия на резистентных к терапии пациентов с депрессией, кетамин оказывает быстрое и устойчивое антидепрессивное действие, будучи антагонистами NMDAR 20 . Кетамин модулирует фекальный микробиом у восприимчивых мышей после хронического стресса социального поражения, указывая на антидепрессивный механизм, частично опосредованный модуляцией кишечной микробиоты 20 .Таким образом, антимикробный эффект антидепрессантов также может быть важным механизмом облегчения дисбиоза кишечника, наблюдаемого у пациентов с БДР 10 .
Кетамин модулирует фекальный микробиом у восприимчивых мышей после хронического стресса социального поражения, указывая на антидепрессивный механизм, частично опосредованный модуляцией кишечной микробиоты 20 .Таким образом, антимикробный эффект антидепрессантов также может быть важным механизмом облегчения дисбиоза кишечника, наблюдаемого у пациентов с БДР 10 .
Важно также учитывать, что концентрации ниже МИК или субингибирующих МИК, даже если они не подавляли рост кишечных штаммов, задерживали их рост в первый час инкубации, вызывая снижение скорость роста. В случае антибиотиков было доказано, что непрерывный рост в присутствии субингибирующих концентраций может способствовать отбору резистентных бактерий и способствовать развитию резистентности 32 .Более того, антидепрессанты нарушали дифференцированно специфические роды микробиоты, которые обычно коррелируют со здоровьем человека и дисбактериозом. Например, было показано, что B. fragilis , член семейства Bacteroidetes, играет положительную роль, например, стимулирует развитие иммунитета 33 . Бифидобактерии известны своей способностью защищать кишечник, укреплять иммунную систему и контролировать воспалительные реакции 34 .
Бифидобактерии известны своей способностью защищать кишечник, укреплять иммунную систему и контролировать воспалительные реакции 34 .
Важным аспектом текущего исследования является экстраполяция результатов in vitro на уровень кишечника человека, чтобы понять связь между дисбиозом микробиоты, вызванным антипсихотиками, и метаболической дисфункцией.Фактически, очень немногие обсервационные исследования на людях изучали поведение микробиома кишечника после лечения антидепрессантами. Хроническое применение атипичного нейролептика рисперидона у детей постепенно снижало соотношение Bacteroidetes: Firmicutes, что связано с увеличением массы тела 35 . Кроме того, Флауэрс и др. 36 продемонстрировали, что у взрослых субъектов с биполярным расстройством класс атипичных нейролептиков (ААР) значительно увеличивал численность семейства Lachnospiraceae и уменьшал численность рода Akkermansia .Известно, что этот последний вид обладает полезными противовоспалительными свойствами и может защищать от дисфункции кишечного барьера и развития жировой массы 37 . Совсем недавно у пациентов-людей было показано увеличение биоразнообразия фекальной микробиоты, в основном альфа-разнообразия, после шести недель сопутствующей терапии с использованием 5–20 мг эсциталопрама 38 .
Совсем недавно у пациентов-людей было показано увеличение биоразнообразия фекальной микробиоты, в основном альфа-разнообразия, после шести недель сопутствующей терапии с использованием 5–20 мг эсциталопрама 38 .
Чтобы перевести наблюдения in vitro на уровень кишечника человека in vivo, нам необходимо понять, достигают ли нейролептики желудочно-кишечного тракта (ЖКТ) в концентрациях, достаточных для оказания антимикробного действия.Трудно оценить реальные концентрации перорально принимаемых психотропных средств в желудочно-кишечном тракте человека, поскольку на эти препараты влияют многие факторы, такие как доза, растворимость, распределение объема жидкости, время прохождения, а также поглощение и метаболизм клетками человека и бактериями. В этой работе мы сосредоточились на эффективных концентрациях в толстой кишке (в частности, в восходящей ободочной кишке), части ЖКТ, в которой растут самые многочисленные микробные популяции, и важном месте ферментации 39 , а концентрации в толстой кишке оценивались на основе фекальной экскреции. данные, собранные из ранее опубликованных работ и DrugBank 40 , и максимальные суточные дозы для каждого антидепрессанта (см. Таблицу S4).Чтобы рассчитать приблизительные концентрации в толстой кишке, мы приняли объем толстой кишки из двух разных исследований. Шиллер и др. 41 сообщили, что средний объем жидкости в толстой кишке после еды составляет 18 мл, в то время как Pritchard et al. 42 сообщил об объеме 480 мл. Как мы можем видеть из таблицы S4 и согласно 41 , расчетные концентрации выше, чем протестированные концентрации в этом исследовании. Например, если мы предположили, что минимальная дневная концентрация дезипрамина составляет 25 мкг/мл, а оставшееся количество в фекалиях — 30%, приблизительная концентрация в толстой кишке составит 1389 мкг/мл, что в 16 раз выше, чем самая высокая испытанная концентрация. для дезипрамина в этой работе.Несмотря на разницу в объеме толстой кишки, указанную в справочных исследованиях 41,42 , реальная концентрация лекарства зависит от количества свободной воды, доступной для растворения химических веществ, и должна быть где-то посередине, что требует дополнительных исследований.
данные, собранные из ранее опубликованных работ и DrugBank 40 , и максимальные суточные дозы для каждого антидепрессанта (см. Таблицу S4).Чтобы рассчитать приблизительные концентрации в толстой кишке, мы приняли объем толстой кишки из двух разных исследований. Шиллер и др. 41 сообщили, что средний объем жидкости в толстой кишке после еды составляет 18 мл, в то время как Pritchard et al. 42 сообщил об объеме 480 мл. Как мы можем видеть из таблицы S4 и согласно 41 , расчетные концентрации выше, чем протестированные концентрации в этом исследовании. Например, если мы предположили, что минимальная дневная концентрация дезипрамина составляет 25 мкг/мл, а оставшееся количество в фекалиях — 30%, приблизительная концентрация в толстой кишке составит 1389 мкг/мл, что в 16 раз выше, чем самая высокая испытанная концентрация. для дезипрамина в этой работе.Несмотря на разницу в объеме толстой кишки, указанную в справочных исследованиях 41,42 , реальная концентрация лекарства зависит от количества свободной воды, доступной для растворения химических веществ, и должна быть где-то посередине, что требует дополнительных исследований. Еще один момент, который следует принять во внимание, заключается в том, что пропорции, выделяемые с калом для различных антидепрессантов, не отражают реального остаточного количества этих препаратов из-за постепенной растворимости при прохождении из различных отделов толстой кишки.Это означает, что более высокое воздействие будет на восходящий отдел толстой кишки, который представляет собой области, обогащенные микробами 39 . Кроме того, время воздействия и кумулятивный эффект препаратов в толстой кишке могут быть определяющим фактором для повышения риска антимикробной активности, поскольку антидепрессанты принимаются ежедневно и в течение длительного периода времени. Действительно, согласно Pratt et al. 43 , 25% людей в США принимали антидепрессанты более 10 лет в период с 2011 по 2014 год. влияют на структуру и функцию микробиоты кишечника 44 .Помимо антибиотиков, неантибиотические препараты также могут способствовать устойчивости к противомикробным препаратам 21,44 .
Еще один момент, который следует принять во внимание, заключается в том, что пропорции, выделяемые с калом для различных антидепрессантов, не отражают реального остаточного количества этих препаратов из-за постепенной растворимости при прохождении из различных отделов толстой кишки.Это означает, что более высокое воздействие будет на восходящий отдел толстой кишки, который представляет собой области, обогащенные микробами 39 . Кроме того, время воздействия и кумулятивный эффект препаратов в толстой кишке могут быть определяющим фактором для повышения риска антимикробной активности, поскольку антидепрессанты принимаются ежедневно и в течение длительного периода времени. Действительно, согласно Pratt et al. 43 , 25% людей в США принимали антидепрессанты более 10 лет в период с 2011 по 2014 год. влияют на структуру и функцию микробиоты кишечника 44 .Помимо антибиотиков, неантибиотические препараты также могут способствовать устойчивости к противомикробным препаратам 21,44 . Это влияние на профиль резистома кажется вероятным, учитывая длительное использование антидепрессантов.
Это влияние на профиль резистома кажется вероятным, учитывая длительное использование антидепрессантов.
Мало что известно о микробных ферментах, метаболизирующих лекарства в ЖКТ, которые могут влиять как на структуру соединения, так и на профиль микробиома. Микробиота кишечника в целом может метаболизировать ксенобиотики либо напрямую, в основном за счет восстановления или гидролиза, либо косвенно, влияя на метаболизм лекарственных средств хозяина 45 .Известно, что некоторые штаммы бактерий, использованные в нашем исследовании, метаболизируют другие лекарства. Например, Lactobacillus , Bacteroides и Enterococcus spp. были способны метаболизировать сульфасалазин путем восстановления 46 ). Тем не менее, нет никаких данных об их влиянии на деградацию тестируемых антидепрессантов, но мы можем предположить, что бактериально-ксенобиотические перекрестные помехи являются двунаправленными и могут быть применимы к нашему случаю психотропных средств.
Наконец, во многих исследованиях сообщалось об изменениях численности микробиома при депрессии, хотя и сбивающих с толку.Например, Мейсон и др. 47 недавно сообщили об истощении запасов C. leptum и Bacteroides при депрессии и тревоге, но информации о лекарствах не сообщается. Следует отметить, что A. muciniphila , C. leptum и B. fragilis , важные противовоспалительные микробные группы, в нашем исследовании были обнаружены в сильном влиянии тестируемых антидепрессантов. Таким образом, влияние антидепрессантов должно быть включено в уравнение в качестве искажающих факторов при исследовании микробных биомаркеров, зная, что пациентам с БДР обычно назначают длительную терапию антидепрессантами.
|
|
Дисбактериоз может быть связан с лекарственной устойчивостью эпилепсии
- Что уже известно по этой теме
Эпилепсия – хроническое заболевание центральной нервной системы, от которого страдают более 70 миллионов человек во всем мире.Около 30-40% больных эпилепсией устойчивы как минимум к двум и более видам противоэпилептических препаратов. Это состояние известно как лекарственно-резистентная эпилепсия и ложится тяжелым социально-экономическим бременем на семьи и общество. Хотя было открыто много новых лекарств, методы лечения все еще ограничены, поскольку конкретные механизмы, лежащие в основе этого состояния, остаются неизвестными. - Что добавило это исследование
Исследователи проанализировали состав микробиома пациентов, страдающих лекарственно-устойчивой эпилепсией, и отметили, что дисбактериоз может играть жизненно важную роль в патогенезе этого состояния. - Выводы
Исследователи сообщили о связи между дисбиозом и лекарственно-устойчивой эпилепсией. Кишечная флора у пациентов с этим заболеванием характеризовалась значительным богатством редких бактерий и уменьшением нормальных комменсальных бактерий. Bifidobacteria и Lactobacilli можно рассматривать как защитный фактор при эпилепсии, и они также помогают восстановить микробное сообщество кишечника, что можно рассматривать как новый терапевтический подход к лекарственно-устойчивой эпилепсии.
Дисбиоз может быть вовлечен в механизм лекарственно-устойчивой эпилепсии и что восстановление микробного сообщества кишечника может быть новым терапевтическим методом для лекарственно-устойчивой эпилепсии. Это заключение исследования, проведенного Аньцзяо Пэном и его коллегами из Сычуаньского университета в Чэнду в Китае и опубликованного в журнале Epilepsy Research .
Микробиом кишечника и расстройства центральной нервной системы
Многочисленные исследования показали, что микробиом кишечника тесно связан с центральной нервной системой , а дисбактериоз был зарегистрирован при многих расстройствах центральной нервной системы (ЦНС), таких как эпилепсия, болезнь Паркинсона, рассеянный склероз и болезнь Альцгеймера.
Микробиом регулирует ЦНС посредством множества метаболитов, нейротрансмиттеров и воспалительных факторов. ЦНС, в свою очередь, регулирует микробиом кишечника через блуждающий нерв или гормональную ось. Взаимодействие между микробиомом кишечника и ЦНС называется осью кишечник-микроб-мозг.
До сих пор неясно, играет ли микробиом кишечника роль в патогенезе лекарственно-устойчивой эпилепсии. В ранее проведенных исследованиях исследователи обнаружили, что транспортеры ABC (ATP-Binding Cassette) были значительно активны у пациентов с резистентной к лекарствам эпилепсией.Транспортеры ABC (например, гликопротеин P и белки, ассоциированные с множественной лекарственной устойчивостью) постоянно выкачивают лекарство из клетки, полагаясь на разложение АТФ, тем самым противодействуя градиенту концентрации лекарства.
Поскольку метаболические пути транспортеров ABC тесно связаны с Ruminococcus и другими редкими бактериями, было высказано предположение, что измененное микробное сообщество может также играть жизненно важную роль в патогенезе лекарственно-устойчивой эпилепсии, нарушая синтез и дальнейший метаболизм транспортеры.
Противоэпилептические препараты и нарушение микрофлоры кишечника
Исследования показали, что препараты, воздействующие на нервную систему, особенно нейролептики и блокаторы кальциевых каналов, проявляют значительную антикомменсальную активность.
Когда нормальная флора подавляется, это приводит к аномальному чрезмерному росту Ruminococcus и других редких бактерий с высоким уровнем метаболизма переносчиков ABC. И наоборот, нарушение микрофлоры кишечника в дальнейшем приводит к снижению всасывания препаратов , что ослабляет противоэпилептический эффект препарата.Следовательно, в данном случае антикомменсальную активность следует рассматривать как один из побочных эффектов противоэпилептических препаратов, купирование которого должно способствовать терапевтическому лечению заболевания.
Было обнаружено, чтоBifidobacteria и Lactobacilli значительно выше у пациентов с 4 или менее приступами в год, чем у тех, у кого было более 4 приступов. Было обнаружено, что эти флоры способствуют дальнейшему синтезу гамма-аминомасляной кислоты, которая является основным тормозным нейротрансмиттером.Эти результаты показали, что Bifidobacteria и Lactobacilli могут играть важную защитную роль у пациентов с эпилепсией.
В этом исследовании приняли участие в общей сложности 42 пациента с лекарственно-устойчивой эпилепсией (ДР), 49 пациентов с лекарственно-чувствительной эпилепсией (СД) и 65 здоровых людей из контрольной группы (СК). Чтобы еще больше свести к минимуму влияние диеты на кишечную флору, все здоровые контроли были отобраны из семей пациентов. Окскарбазепин был наиболее часто используемым препаратом в обеих группах, за ним следовали леветирацетам и вальпроат.
Исследователи проанализировали состав микробиома с помощью высокопроизводительного секвенирования бактериальной ДНК и сообщили, что дисбактериоз может быть вовлечен в патогенез лекарственно-устойчивой эпилепсии.
Результаты показали, что α-разнообразие у пациентов с 4 или менее приступами в год было сходно с таковым при HC, в то время как у пациентов с более чем 4 припадками α-разнообразие было значительно выше.
Анализ β-разнообразия показал, что микробиомное сообщество образцов в группе DR отличалось от такового в группе DS.
Лекарственно-резистентная эпилепсия и измененная бактериальная микробиота кишечника
Было обнаружено, что общий состав кишечного микробиома сходен между группами HC и DS на уровне типов, при этом Bacteroidetes являются крупнейшим типом, а Firmicutes — вторым по величине.
В группе DR численность Bacteroidetes была сравнительно ниже. Уровень Firmicutes был выше, и он считался самым крупным типом. Напротив, многие другие редкие типы показали повышенную тенденцию в группе DR.Например, Verrucomicrobia также была более распространена в группе DR, чем в группе DS и группе HC.
Различия в структуре бактериального сообщества были дополнительно подтверждены с помощью анализа размера линейного дискриминантного эффекта (LEfSe). Bacteroidetes вместе с двумя его родами, Bacteroides и Barnesiell , в значительной степени присутствовали в группе DS, в то время как флора группы DR, по-видимому, характеризовалась повышенным обилием многочисленных редких бактерий, включая Clostridium XVIII, Atopobium, Holdemania, Dorea, Saccharibacteria, Delftia, Coprobacillus, Araprevotella, Ruminococcus, Gemmiger, Akkermansia, Neisseria, Coprococcus, Fusobacterium, Methanobrevibacter, Phascolarctobacterium и Roseburia и т. д.
Состояние, при котором преобладают редкие бактерии
Метаболические пути, связанные с глюкозой и липидами, подавлялись. Анализ связи между разными видами и путями метаболизма показал, что эти пути были связаны с Ruminococcus и другими редкими бактериями.
Эти результаты предполагают, что дисбиоз может быть вовлечен в механизм лекарственно-устойчивой эпилепсии и что восстановление микробного сообщества кишечника может быть новым терапевтическим методом для лекарственно-устойчивой эпилепсии .
Это исследование также демонстрирует, что у пациентов с лекарственно-устойчивой эпилепсией изменен состав кишечного микробиома, характеризующийся значительно повышенным содержанием многочисленных редких бактерий.
Было обнаружено, что микробиота кишечника у пациентов с лекарственно-чувствительной эпилепсией аналогична таковой у здоровых людей. Богатство микробного сообщества у пациентов с лекарственно-резистентной эпилепсией было значительно увеличено по сравнению с пациентами с лекарственно-чувствительной эпилепсией и здоровым контролем.Это может быть результатом аномального увеличения количества редких бактерий, в основном принадлежащих к типу Firmicutes .
Будущие исследования должны оценить микробные метаболиты и результирующую реакцию хозяина, чтобы дополнительно пролить свет на состав микробиома кишечника у пациентов с лекарственно-устойчивой эпилепсией.
.

 Действительно, очень важно, чтобы наши клетки
получать совершенное питание, но это преимущество не может быть реализовано, если
потребляемое питание не доставляется на клеточный уровень.
Действительно, очень важно, чтобы наши клетки
получать совершенное питание, но это преимущество не может быть реализовано, если
потребляемое питание не доставляется на клеточный уровень. Излишне говорить, что это имело очень ограниченный успех, и его
лечение, а также его концепция быстро приобрели дурную славу.
Тем не менее, концепция Мечникова является важным вкладом в
медицинская история.
Излишне говорить, что это имело очень ограниченный успех, и его
лечение, а также его концепция быстро приобрели дурную славу.
Тем не менее, концепция Мечникова является важным вкладом в
медицинская история.
 Эти нормальные функции включают
метаболизм гормонов, канцерогенов и ксенобиотиков,
синтез витаминов, таких как витамин К, В5, В6 и биотин,
синтез короткоцепочечных жирных кислот (SCFAs), таких как бутират,
вытеснение патогенной флоры, а также стимуляция
антитела к секреторному иммуноглобулину А (SIgA) и интрамуральные антитела
системы. (3-5)
Эти нормальные функции включают
метаболизм гормонов, канцерогенов и ксенобиотиков,
синтез витаминов, таких как витамин К, В5, В6 и биотин,
синтез короткоцепочечных жирных кислот (SCFAs), таких как бутират,
вытеснение патогенной флоры, а также стимуляция
антитела к секреторному иммуноглобулину А (SIgA) и интрамуральные антитела
системы. (3-5) трудный энтероколит (11),
h) и деконъюгация желчных кислот и эстрогенов, которые могут
потенциально вызвать рак кишечника или молочной железы. (12)
трудный энтероколит (11),
h) и деконъюгация желчных кислот и эстрогенов, которые могут
потенциально вызвать рак кишечника или молочной железы. (12)