Повышенная влажность – аналитический портал ПОЛИТ.РУ
Сегодня предлагаю обсудить неаппетитную тему — посев мокроты. На фото именно этот анализ, полюбуйтесь — какая красотища! Посев мокроты на микрофлору и чувствительность к антибиотикам необходим для определения вида микроорганизма и выбора целенаправленной терапии. Основные показания к проведению этого анализа — это воспалительные заболевания респираторного тракта (пневмония, острые и хронические бронхиты, абсцесс легкого, и др.). Никак не горло болит аж два дня или ребенок кашлянул целых три раза.
⠀
Есть несколько вариантов добычи мокроты из пациента, самый простой — отхаркивание мокроты при кашле. Но этот метод, кроме явных достоинств, имеет и скрытые недостатки. Дело в том, что мокрота, проходя через верхние дыхательные пути и полость рта, может контаминироваться вегетирующей в них микрофлорой. Другими словами, путь мокроты до баночки далеко не стерилен, она может повстречать зеленящих стрептококков (Streptococcus viridans group), стафилококков (Staphylococcus еpidermidis), непатогенных нейссерий (Neisseria spр.
⠀
Поэтому дальнейшая работа микробиолога превращается в развлечения Золушки: попробуй отдели микрофлору самой мокроты от этих встреченных по пути бактерий! Порой их бывает так много, что за лесом не видно деревьев. После разделения этиологически значимых микроорганизмов от бактерий-контаминантов проводят количественный метод подсчета выделенных микроорганизмов. При этом учитывают, что возбудитель заболевания находится в исследуемом биологическом образце в существенно больших количествах по сравнению с бактериями-симбиотами. Считается, что для мокроты клинически значимым числом является 10 в 6 – 10 в 7 КОЕ/мл. Для бронхиальных смывов после бронхо-альвеолярного лаважа (не путать с лавашом) — 10 в 4 – 10 в 5 КОЕ/мл.
А еще, уж простите мне больничный снобизм, но все, что пациент делает самостоятельно, а не под присмотром врача, сопряжено с рисками. Велел врач собрать мокроту, пациент сидит с банкой наготове и ждет, когда ж засвербит в глубинах организма. И вот вроде засвербело, закашлял, но в банку попали одни лишь слюни. Поэтому для всех болеющих два совета: первый — выздоравливайте, второй — ждите сгустка, нет смысла сеять ваши слюни. Кроме того, накануне сбора мокроты пейте больше жидкости, чтобы самой мокроты было больше, а непосредственно перед сбором необходимо почистить зубы и прополоскать ротовую полость, чтобы хоть чуточку сократить количество обсеменителей. Есть способ достать мокроту с большим успехом, но и менее приятный для пациента — бронхоскопия. Не буду красочно описывать, стойкие духом могут погуглить. Процедура не самая приятная, врачи стараются избегать ее, пока есть такая возможность.
Велел врач собрать мокроту, пациент сидит с банкой наготове и ждет, когда ж засвербит в глубинах организма. И вот вроде засвербело, закашлял, но в банку попали одни лишь слюни. Поэтому для всех болеющих два совета: первый — выздоравливайте, второй — ждите сгустка, нет смысла сеять ваши слюни. Кроме того, накануне сбора мокроты пейте больше жидкости, чтобы самой мокроты было больше, а непосредственно перед сбором необходимо почистить зубы и прополоскать ротовую полость, чтобы хоть чуточку сократить количество обсеменителей. Есть способ достать мокроту с большим успехом, но и менее приятный для пациента — бронхоскопия. Не буду красочно описывать, стойкие духом могут погуглить. Процедура не самая приятная, врачи стараются избегать ее, пока есть такая возможность.
Обсудите в соцсетях
Стрептококковая инфекция:Причины стрептококковой инфекции,Симптомы,Лечение заболеваний вызванных стрептококковой инфекцией
Стрептококк – род бактериальных организмов, который присутствует в организме человека. Существует больше 15 подтипов бактерии, но самым распространенными являются: альфа, бета и гамма. При допустимом значении альфа и гамма стрептококки являются частью нормальной микрофлоры желудочно-кишечного тракта, ротовой полости, гортани и дыхательной системы человека, вреда организму они не проносят. Опасными для здоровья человека являются бета стрептококки, они и становятся причиной широкого спектра заболеваний человека.
Существует больше 15 подтипов бактерии, но самым распространенными являются: альфа, бета и гамма. При допустимом значении альфа и гамма стрептококки являются частью нормальной микрофлоры желудочно-кишечного тракта, ротовой полости, гортани и дыхательной системы человека, вреда организму они не проносят. Опасными для здоровья человека являются бета стрептококки, они и становятся причиной широкого спектра заболеваний человека.
Гемолитический стрептококк (группа А) – распространенный вид бактерии, которая присутствует в организме. Преимущественное количество инфекций развивается именно благодаря стрептококку группы А. В связи с этим человек имеет высокую восприимчивость к стрептококку и, соответственно, при благоприятных для бактерии условиях, она активно размножается в организме человека. Бактерии группы А чаще всего вызывают:
- ангину;
- фарингит;
- импетиго;
- рожу;
- скарлатину;
- пневмонию;
- гломерулонефрит;
- васкулит;
- ревматизм;
- бронхит;
- пародонтит.

Стрептококк группы B поражает, в основном, мочеполовую систему, поскольку данный вид бактерии содержится у мужчин в уретре, а у женщин – во влагалище.
Причины стрептококковой инфекцииБолезнетворная бактерия передается тремя путями:
- воздушно-капельным – распространение инфекции со слюной и слизью при чихании, крике, кашле;
- контактно-бытовым – непосредственный контакт с носителем инфекции, даже если у него не проявляются симптомы заболеваний, контакт с бытовыми предметами в доме и местах общественного пользования;
- половым – через незащищенный половой акт.
Самый быстрый способ распространения стрептококка – воздушно-капельный путь, поэтому инфицированию очень часто поддаются дети, находящиеся в большой группе (школе, садике, на различных занятиях).
Стрептококковая инфекция у детей развивается чаще всего в холодное время года (конец осени, зима). Из-за того, что дети не всегда соблюдают гигиену рук, они могут заразиться практически в любых условиях окружающей среды.
Часто встречается стрептококковая инфекция у новорожденных, это связано с возможностью стрептококка проникать в ткани и органы. В момент родов заражение может произойти через околоплодные воды. Инфекция развивается в первые несколько часов жизни и приводит к пневмонии, сепсису, менингиту. Процент смертности при таком развитии инфекции составляет более 50%.
У детей в возрасте от 2 до 8 лет стрептококк нередко вызывает пневмонию как осложнение перенесенной ранее инфекции: коклюша, гриппа, кори, ветряной оспы. Подвержены этому заболеванию и дети с ослабленным иммунитетом, перенесшие сильное переохлаждение.
СимптомыВ медицинской практике при заболеваниях, стрептококковая инфекция проявляется разнообразными симптомами. Это зависит от конкретного заболевания, которое вызвал данный вид патогенной бактерии.
Для группы болезней дыхательных путей это:
- болевой синдром в горле;
- повышение температуры;
- образование налета с гноем на миндалинах;
- увеличение лимфатических узлов.

Стрептококковая инфекция кожи обычно сопровождается:воспалительными процессами на кожных покровах;
- зудом;
- покраснением;
- появлением пузырьков, бляшек на коже;
- повышением температуры;
- ознобом;
- слабостью.
Заболевания мочеполовой системы, вызванные гемолитическим стрептококком, чаще всего протекают бессимптомно. Однако могут наблюдаться и симптомы, схожие с симптомами заболеваний этой области:
- зуд;
- выделения;
- болезненность в органах мочеполовой системы.
Для выявление бактерии рода стрептококк проводится ряд исследований, которые позволяют определить конкретный возбудитель инфекции, его тип и чувствительность к медицинским препаратам. Традиционно врачи (специальность которого зависит от пораженого участка или органа) проводят комплексную диагностику:
- бактериологическое исследование (посев биологического материала) – мазок с миндалин, очагов на кожных покровах, исследование мокроты на легких;
- общий анализ мочи, крови;
- микробиологическое исследование на уровень чувствительности к антибиотикам;
- осмотр пораженных органов узким специалистом.

Лечение стрептококковой инфекции требует первоначально правильно поставленного диагноза основного заболевания, дифференциации его от схожих заболеваний.
При диагностировании патогенной бактерии стрептокок, лечение должно проводиться узким специалистом в зависимости от пораженного органа: пульмонологом, дерматологом, гинекологом, урологом и др.
Стрептококк на кожных покровах лечится в основном в домашних условиях под наблюдением врача. В легких формах заболевания, таких как импетиго (пузырьково-гнойное высыпание) применяется лечение наружными средствами: антибактериальными и дезинфицирующими мазями. При тяжелом течении болезни врач назначает пациенту антибиотики, поливитамины, иммуностимуляторы, кроме этого на раны делают примочки из дезинфицирующих средств.
Инфицирование воздушных путей требует лечения конкретных болезней, вызванных бактерией. Стрептококковая инфекция горла чаще всего приводит к развитию тонзиллита и фарингита, для лечения которых назначают антибиотики.
На нашем сайте вы можете найти справочную информацию по лекарственным средствам (инструкции, аналоги), а также забронировать лекарства, что сэкономит вам много времени.
Streptococcus pyogenes, ДНК [реал-тайм ПЦР]
Исследование для выявления возбудителя стрептококковой инфекции (Streptococcus pyogenes), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени определяется генетический материал (ДНК) стрептококка в образце биоматериала.
Синонимы русские
Пиогенный стрептококк, бета-гемолитический стрептококк группы А, БГСА, β-гемолитический стрептококк группы А, β-ГСА [полимеразная цепная реакция в реальном времени, ПЦР в реальном времени].
Синонимы английские
S. pyogenes, Group A streptococcus, GAS, β-hemolytic streptococcus group A, β-hemolytic streptococcus group A.
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Мазок из зева (ротоглотки), мазок из носоглотки, соскоб урогенитальный.
Общая информация об исследовании
S. pyogenes – это грамположительная бактерия шаровидной формы, являющаяся возбудителем острого фарингита и импетиго, а также спектра более тяжелых деструктивных заболеваний, таких как пневмония, сепсис и септический артрит, синдром токсического шока, целлюлит и некротизирующий фасциит.
Традиционно для подтверждения диагноза «стрептококковая инфекция» применяют бактериологический посев биоматериала на специальные среды. В качестве биоматериала может выступать отделяемое миндалин или носоглотки (при подозрении на острый фарингит), мокрота (при пневмонии). Как правило, результат может быть получен лишь через несколько суток, что связано с промедлением в постановке точного диагноза и назначении специфического лечения.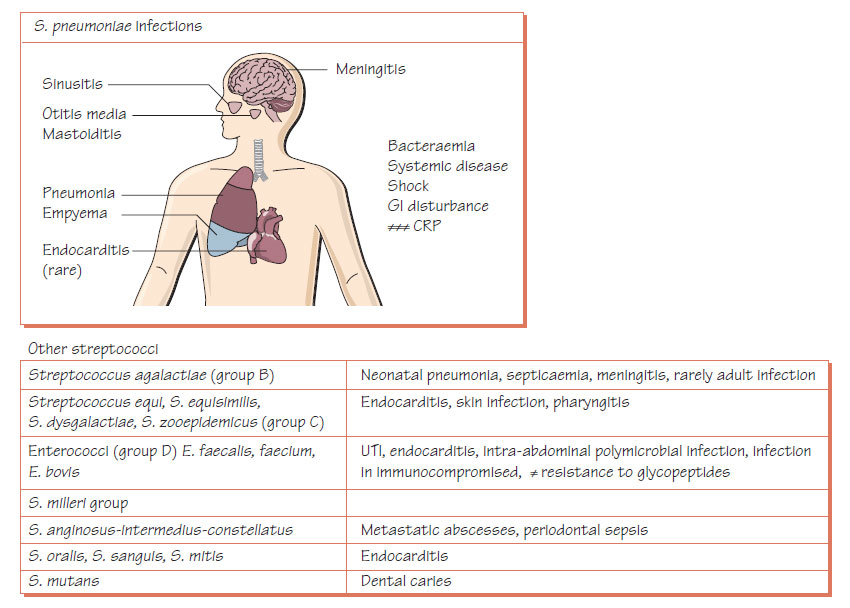 Однако выявлено, что своевременная диагностика и специфическое лечение не только уменьшают продолжительность болезни и интенсивность симптомов, но также снижают риск развития таких осложнений, как паратонзиллярный абсцесс, средний отит, острая ревматическая лихорадка и постстрептококковый гломерулонефрит (при остром фарингите), стрептококковый сепсис (при пневмонии), деструкция сустава и инвалидизация (при септическом артрите). Эмпирическая терапия антибиотиками пенициллинового ряда основана на предпосылке, что S. pyogenes является основным бактериальным возбудителем острого фарингита (5-15 % случаев у взрослых и 20-30 % у детей). Следует отметить, что острый фарингит может быть вызван другими бактериальными или вирусными агентами, при которых назначение такой эмпирической терапии не только не оправдано, но и опасно развитием резистентных штаммов микроорганизмов. Подобные диагностические трудности могут быть преодолены с помощью РТ-ПЦР – полимеразной цепной реакции – этот метод позволяет получить точный результат в более короткие сроки.
Однако выявлено, что своевременная диагностика и специфическое лечение не только уменьшают продолжительность болезни и интенсивность симптомов, но также снижают риск развития таких осложнений, как паратонзиллярный абсцесс, средний отит, острая ревматическая лихорадка и постстрептококковый гломерулонефрит (при остром фарингите), стрептококковый сепсис (при пневмонии), деструкция сустава и инвалидизация (при септическом артрите). Эмпирическая терапия антибиотиками пенициллинового ряда основана на предпосылке, что S. pyogenes является основным бактериальным возбудителем острого фарингита (5-15 % случаев у взрослых и 20-30 % у детей). Следует отметить, что острый фарингит может быть вызван другими бактериальными или вирусными агентами, при которых назначение такой эмпирической терапии не только не оправдано, но и опасно развитием резистентных штаммов микроорганизмов. Подобные диагностические трудности могут быть преодолены с помощью РТ-ПЦР – полимеразной цепной реакции – этот метод позволяет получить точный результат в более короткие сроки.
В реакции РТ-ПЦР применяются специфические праймеры к фрагменту ДНК S. pyogenes. Такая особенность позволяет выявлять только пиогенный стрептококк, а не родственные ему другие стрептококки – представители нормальной микрофлоры зева (Streptococcus mutans, Streptococcus viridians). По специфичности РТ-ПЦР не уступает бактериологическому посеву и значительно превосходит другие методы идентификации возбудителя (например, экспресс-тест для определения антигена).
Достаточно часто биоматериал на исследование берется уже на фоне лечения заболевания. В результате чувствительность методов диагностики снижается и вероятность получить ложноотрицательный результат выше. В такой ситуации метод РТ-ПЦР обладает некоторым преимуществом перед другими видами диагностики. Это объясняется тем, что для идентификации возбудителя в реакции используется генетический материал возбудителя – как геномная ДНК живого микроорганизма, так и фрагменты ДНК бактерии, подвергшейся лизису. При этом становится возможным выявление не только живых, активно размножающихся микроорганизмов, но и убитых в результате лечения бактерий. В отличие от РТ-ПЦР, обязательным условием для осуществления других методов диагностики (иммуноферментного анализа или бактериологического посева) является наличие живых микроорганизмов. Поэтому, если биоматериал сдается уже на фоне лечения, метод РТ-ПЦР следует предпочесть другим методам диагностики.
В отличие от РТ-ПЦР, обязательным условием для осуществления других методов диагностики (иммуноферментного анализа или бактериологического посева) является наличие живых микроорганизмов. Поэтому, если биоматериал сдается уже на фоне лечения, метод РТ-ПЦР следует предпочесть другим методам диагностики.
Высокая чувствительность РТ-ПЦР позволяет использовать этот метод при диагностике осложнений острого фарингита: острой ревматической лихорадки и постстрептококкового гломерулонефрита. Осложнения острого фарингита – это аутоиммунные заболевания, при которых S. pyogenes – ассоциированный фарингит является причинным фактором патологического иммунного ответа, но на момент диагностики этих осложнений он уже проходит (самостоятельно или в результате лечения). Поэтому выявить возбудитель при бактериологическом посеве отделяемого миндалин и носоглотки у пациентов с осложнениями острого фарингита удается лишь в небольшом проценте случаев. С другой стороны, доказательство перенесенной S. pyogenes – инфекции является необходимым критерием постановки диагноза, а также значительно облегчает проведение дифференциальной диагностики заболеваний. Метод РТ-ПЦР характеризуется высокой чувствительностью и поэтому может быть использован при диагностике осложнений острого фарингита.
Метод РТ-ПЦР характеризуется высокой чувствительностью и поэтому может быть использован при диагностике осложнений острого фарингита.
Выявление S. pyogenes в так называемых стерильных средах – это всегда патологический признак. С другой стороны, обнаружение этого микроорганизма в нестерильных средах (мокрота, отделяемое носоглотки) не всегда указывает на наличие заболевания. Выявлено, что около 12-20 % детей школьного возраста и 2,4-3,7 % взрослых людей являются бессимптомными носителями S. pyogenes. В таких случаях трактовку положительного результата исследования следует расценивать с учетом бактериальной нагрузки и в сочетании с некоторыми другими клиническими и лабораторными признаками. Как правило, бессимптомное носительство характеризуется меньшим количеством бактерий по сравнению с активной инфекцией. Поэтому обнаружение высокой бактериальной нагрузки S. pyogenes в мазке из зева у пациента с лихорадкой, болью в горле и болезненным регионарным лимфаденитом подтверждает диагноз «острый стрептококковый фарингит». И, наоборот, обнаружение низкой бактериальной нагрузки этого микроорганизма в мазке из зева при отсутствии жалоб и клинической картины следует расценить как бессимптомное носительство. РТ-ПЦР – это полуколичественный метод, позволяющий косвенно оценить бактериальную нагрузку. Поэтому он оказывается особенно полезным при обследовании «здоровых носителей» стрептококка. Бессимптомное носительство S. pyogenes следует заподозрить у пациента при выявлении стрептококка после адекватного курса антибиотикотерапии, а также у членов семьи пациента с частыми обострениями стрептококкового фарингита.
И, наоборот, обнаружение низкой бактериальной нагрузки этого микроорганизма в мазке из зева при отсутствии жалоб и клинической картины следует расценить как бессимптомное носительство. РТ-ПЦР – это полуколичественный метод, позволяющий косвенно оценить бактериальную нагрузку. Поэтому он оказывается особенно полезным при обследовании «здоровых носителей» стрептококка. Бессимптомное носительство S. pyogenes следует заподозрить у пациента при выявлении стрептококка после адекватного курса антибиотикотерапии, а также у членов семьи пациента с частыми обострениями стрептококкового фарингита.
Для чего используется исследование?
Для диагностики:
- острого фарингита;
- острой ревматической лихорадки и постстрептококкового фарингита у пациентов с указанием на перенесенный эпизод острого фарингита в анамнезе или без него;
- бессимптомного носительства S. pyogenes у пациента с частыми рецидивами фарингита;
- бессимптомного носительства S.
 pyogenes у членов семьи пациента с частыми рецидивами стрептококкового фарингита;
pyogenes у членов семьи пациента с частыми рецидивами стрептококкового фарингита; - внебольничной пневмонии;
- септического артрита.
Когда назначается исследование?
- При симптомах острого фарингита: боль при глотании, отек и эритема слизистой зева, гнойное отделяемое с поверхности миндалин, болезненный регионарный лимфаденит;
- при симптомах острой ревматической лихорадки: мигрирующий полиартрит или артралгия, чувство перебоев в работе сердца, боль в области сердца, немотивированная слабость, кольцевидная эритема и подкожные узелки, а также неврологическая симптоматика в виде хореического гиперкинеза;
- при симптомах постстрептококкового гломерулонефрита: отек (периорбитальной области или генерализованный), макрогематурия, немотивированная слабость, протеинурия менее 3,5 г/сут., артериальная гипертензия;
- при обследовании пациента с рецидивирующим фарингитом;
- при обследовании членов семьи пациента с рецидивирующим фарингитом;
- при обследовании членов семьи пациента с частыми рецидивами острого стрептококкового фарингита;
- при наличии такого фактора риска S.
 pyogenes (ассоциированной пневмонии), как вирус гриппа h2N1;
pyogenes (ассоциированной пневмонии), как вирус гриппа h2N1; - при симптомах внебольничной пневмонии: внезапное начало болезни, лихорадка, одышка, боль в грудной клетке, кашель с отхождением гнойной мокроты;
- при наличии факторов риска септического артрита: младенческий и старческий возраст, иммуносупрессивная терапия, соматические заболевания, гемодиализ;
- при симптомах септического артрита: боли в суставе в покое и при движении, эритема кожных покровов над областью сустава, нарушение подвижности в суставе, повышение температуры тела и немотивированная слабость.
Что означают результаты?
Референсные значения: отрицательно.
Причины положительного результата
В отделяемом носоглотки и миндалин:
- острый фарингит;
- острая ревматическая лихорадка;
- постстрептококковый гломерулонефрит.
В мокроте:
- пневмония;
- острый бронхит, бронхит курильщика.

Что может влиять на результат?
- Применение антибактериальных препаратов пенициллинового ряда (амоксиклав, ампициллин), цефалоспоринов (цефиксим, цефтибутен) и макролидов (азитромицин, кларитромицин) до взятия материала на анализ может привести к получению отрицательного результата.
Важные замечания
- Около 12-20 % детей школьного возраста и 2,4-3,7 % взрослых людей являются бессимптомными носителями S. pyogenes.
- Результат исследования следует оценивать вместе с некоторыми другими лабораторными анализами.
Также рекомендуется
Кто назначает исследование?
Врач общей практики, ЛОР, инфекционист, пульмонолог, эпидемиолог, травматолог.
Литература
- Lee JH, Uhl JR, Cockerill FR 3rd, Weaver AL, Orvidas LJ. Real-time PCR vs standard culture detection of group A beta-hemolytic streptococci at various anatomic sites in tonsillectomy patients.
 Arch Otolaryngol Head Neck Surg. 2008 Nov;134(11):1177-81.
Arch Otolaryngol Head Neck Surg. 2008 Nov;134(11):1177-81. - Uhl JR et al. Comparison of LightCycler PCR, rapid antigen immunoassay, and culture for detection of group Astreptococci from throat swabs. J Clin Microbiol. 2003 Jan;41(1):242-9.
- Chiappini E, Regoli M, Bonsignori F, Sollai S, Parretti A, Galli L, de Martino M. Analysis of different recommendations from international guidelines for the management of acute pharyngitis in adults and children. Clin Ther. 2011 Jan;33(1):48-58.
- Hill HR. Group A streptococcal carrier versus acute infection: the continuing dilemma. Clin Infect Dis. 2010 Feb 15;50(4):491-2.
- García-Arias M, Balsa A, Mola EM. Best Pract Res Clin Rheumatol. Septic arthritis. 2011 Jun;25(3):407-21.
Страница статьи : Российский педиатрический журнал
Баранов А.А., Брико Н.И., Намазова-Баранова Л.С., Ряпис Л.А. Стрептококки и пневмококки. Ростов н/Д: Феникс, 2013.
Doern CD, Burnham CA.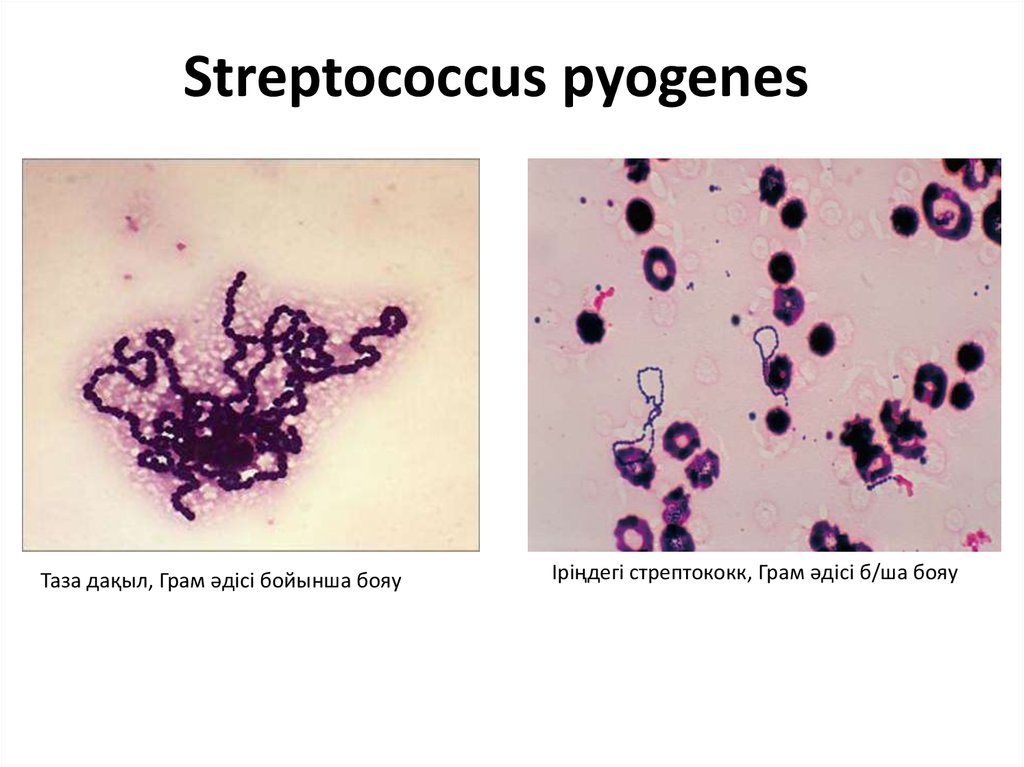 It’s not easy being green: the viridans group streptococci, with a focus on pediatric clinical manifestations. J Clin Microbiol. 2010; 48(11): 3829-35. doi: 10.1128/JCM.01563-10.
It’s not easy being green: the viridans group streptococci, with a focus on pediatric clinical manifestations. J Clin Microbiol. 2010; 48(11): 3829-35. doi: 10.1128/JCM.01563-10.
Brenciani A, Tiberi E, Tili E, Mingoia M, Palmieri C, Varaldo PE, et al. Genetic determinants and elements associated with antibiotic resistance in viridans group streptococci. J Antimicrob Chemother. 2014; 69(5): 1197-204. doi: 10.1093/jac/dkt495.
Facklam R. What happened to the streptococci: overview of taxonomic and nomenclature changes. Clin Microbiol Rev. 2002; 15(4): 613-30.
Spellerberg B, Brandt C. Streptococcus. In: Versalovic J, Carroll KC, Funke G, Jorgensen JH, Landry ML and Warnock DW (ed.), Manual of Clinical Microbiology, 10th ed., ASM Press, Washington, DC, 2011; 331-49.
Póntigo F, Moraga M, Flores SV. Molecular phylogeny and a taxonomic proposal for the genus Streptococcus. Genet Mol Res. 2015; 14(3): 10905-18. doi: 10.4238/2015.
Маянский Н.А., Калакуцкая А.Н., Мотузова О.В., Ломинадзе Г.Г., Крыжановская О.А., Катосова Л.К. MALDI-TOF масс-спектрометрия в рутинной работе микробиологической лаборатории. Вопросы диагностики в педиатрии. 2011; 3(5): 20-5.
Angeletti S, Dicuonzo G, Avola A, Crea F, Dedej E, Vailati F. et al. Viridans Group Streptococci clinical isolates: MALDI-TOF mass spectrometry versus gene sequence-based identification. PLoS One. 2015; 10(3):e0120502. doi: 10.1371/journal.pone.0120502.
Harju I, Lange C, Kostrzewa M, Maier T, Rantakokko-Jalava K, Haanperä M. Improved Differentiation of Streptococcus pneumoniae and Other S. mitis Group Streptococci by MALDI Biotyper Using an Improved MALDI Biotyper Database Content and a Novel Result Interpretation Algorithm. J Clin Microbiol. 2017; 55(3): 914-22. doi: 10.1128/JCM.01990-16.
Su TY, Lee MH, Huang CT, Liu TP, Lu JJ. The clinical impact of patients with bloodstream infection with different groups of Viridans group streptococci by using matrix-assisted laser desorption ionization-time of flight mass spectrometry (MALDI-TOF MS). Medicine (Baltimore). 2018; 97(50):e13607. doi: 10.1097/MD.0000000000013607.
Ioannidou S, Papaparaskevas J, Tassios PT, Foustoukou M, Legakis NJ, Vatopoulos AC. Prevalence and characterization of the mechanisms of macrolide, lincosamide and streptogramin resistance in viridans group streptococci. Int J Antimicrob Agents. 2003; 22(6): 626-9.
Ergin A, Ercis S, Hasçelik G. Macrolide resistance mechanisms and in vitro susceptibility patterns of viridans group streptococci isolated from blood cultures. J Antimicrob Chemother. 2006; 57(1): 139-41.
Chun S, Huh HJ, Lee NY. Species-specific difference in antimicrobial susceptibility among viridans group streptococci. Ann Lab Med. 2015; 35(2): 205-11. doi: 10.3343/alm.2015.35.2.205.
Маянский Н.А., Кварчия А.З., Пономаренко О.А., Лазарева А.В., Куличенко Т.В. Носительство оральных стрептококков, устойчивых к пенициллину и эритромицину, у детей с острыми респираторными инфекциями. Российский педиатрический журнал. 2018; 21(6): 337-44. DOI: http://dx.doi.org/10.18821/1560-9561-2018-21-6-337-44.
Mayanskiy N, Alyabieva N, Ponomarenko O, Pakhomov A, Kulichenko T, Ivanenko A. et al. Bacterial etiology of acute otitis media and characterization of pneumococcal serotypes and genotypes among children in Moscow, Russia. Pediatr Infect Dis J. 2015; 34(3): 255-60. doi: 10.1097/INF.0000000000000554.
CLSI M100 ED29:2019 — Performance Standards for Antimicrobial Susceptibility Testing, 29th Edition.
Маянский Н.А., Алябьева Н.М., Пономаренко О.А., Куличенко Т.В., Артемова И.В., Лазарева А.В. и др. Динамика распространенности серотипов и антибиотикорезистентности носоглоточных пневмококков, выделенных у детей в 2010-2016 гг.: результаты ретроспективного когортного исследования. Вопросы современной педиатрии. 2017; 16 (5): 413-23. doi: 10.15690/vsp.v16i5.1806).
Rodriguez-Avial I, Rodriguez-Avial C, Culebras E, Picazo JJ. Distribution of tetracycline resistance genes tet(M), tet(O), tet(L) and tet(K) in blood isolates of viridans group streptococci harbouring erm(B) and mef(A) genes. Susceptibility to quinupristin/dalfopristin and linezolid. Int J Antimicrob Agents. 2003; 21(6): 536-41.
Smith A, Jackson MS, Kennedy H. Antimicrobial susceptibility of viridans group streptococcal blood isolates to eight antimicrobial agents. Scand J Infect Dis. 2004; 36(4): 259-63.
Rozkiewicz D, Daniluk T, Sciepuk M, Zaremba ML, Cylwik-Rokicka D, Luczaj-Cepowicz E et al. Prevalence rate and antibiotic susceptibility of oral viridans group streptococci (VGS) in healthy children population. Adv Med Sci. 2006; 51 Suppl 1: 191-5.
Nielsen MJ, Claxton S, Pizer B, Lane S, Cooke RP, Paulus S, Carrol ED. Viridans Group Streptococcal Infections in Children After Chemotherapy or Stem Cell Transplantation: A 10-year Review From a Tertiary Pediatric Hospital. Medicine (Baltimore). 2016; 95(9): e2952. doi: 10.1097/MD.0000000000002952.
Süzük S, Kaşkatepe B, Çetin M. Antimicrobial susceptibility against penicillin, ampicillin and vancomycin of viridans group Streptococcus in oral microbiota of patients at risk of infective endocarditis. Infez Med. 2016; 24(3): 190-3.
Hakenbeck R, Brückner R, Denapaite D, Maurer P. Molecular mechanisms of β-lactam resistance in Streptococcus pneumoniae. Future Microbiol. 2012; 7: 395-410.
Chi F, Nolte O, Bergmann C, Ip M, Hakenbeck R. Crossing the barrier: evolution and spread of a major class of mosaic pbp2x in S. pneumoniae, S. mitis and S oralis. Int J Med Microbiol. 2007; 297: 503-12. https://doi.org/10.1016/j.ijmm.
Jensen A, Valdorsson O, Frimodt-Moller N, Hollingshead S, Kilian M. Commensal streptococci serve as a reservoir for beta-lactam resistance genes in Streptococcus pneumoniae. Antimicrob Agents Chemother.2015; 59: 3529 -40. https://doi.org/10.1128/AAC.00429-15.
Leclercq R. Mechanisms of resistance to macrolides and lincosamides: nature of the resistance elements and their clinical implications. Clin Infect Dis. 2002; 34: 482-92.
Schroeder MR, Stephens DS. Macrolide Resistance in Streptococcus pneumoniae. Front Cell Infect Microbiol. 2016; 6: 98.
van der Linden M, Otten J, Bergmann C, Latorre C, Liñares J, Hakenbeck R. Insight into the Diversity of Penicillin-Binding Protein 2x Alleles and Mutations in Viridans Streptococci. Antimicrob Agents Chemother. 2017; 61(5). pii: e02646-16. doi: 10.1128/AAC.02646-16.
Катосова Л.К., Лазарева А.В., Хохлова Т.А., Пономаренко О.А., Алябьева Н.М. Распространение и механизмы устойчивости к макролидам Streptococcus pyogenes, выделенных у детей. Антибиотики и химиотерапия. 2016; 61(3-4): 23-9.
Shaikh N, Leonard E, Martin JM. Prevalence of streptococcal pharyngitis and streptococcal carriage in children: a meta-analysis. Pediatrics. 2010; 126(3): e557-64. doi: 10.1542/peds.2009-2648.
Streptococcus mitis qroup s s 10*6 — Вопрос лору
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 71 направлению: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.23% вопросов.
Оставайтесь с нами и будьте здоровы!
Studying Oxidative Stress Caused by the Mitis Group Streptococci in Caenorhabditis elegans
Члены mitis группы S. mitis, S. oralis и S. gordonii быстро убили червей, в отличие от Streptococcus mutans, S. salivarius и непатогенные E. coli ОР50 (рисA). Медиана выживаемости для S. mitis, S. oralis и S. gordonii составила 300 мин, 300 мин и 345 мин, соответственно. Чтобы определить, если убийство было опосредовано H2O2, каталаза был дополнен для твоего агар. Убийство червей был упразднен присутствии каталазы (рис. 3B). Для дальнейшего подтверждения ли стрептококков производных H2O2 опосредованных убийство червей, выживание на ΔspxB мутантный штамм, штамм WT и дополнения штамм ΔspxB; spxB + S. gordonii было проанализировано. Смерть черви не наблюдалось на мутантный штамм ΔspxB , по сравнению с одичал тип и дополнять штаммов (рис. 3C). Эти данные позволяют предположить, что H2O2 , подготовленный группой mitis опосредует убийства червей. Мы также наблюдали аналогичные убийства кинетики, когда черви подвергаются клинических изолятов стрептококки группы mitis, полученные из крови больных раком (рис. 3D). Основываясь на данных, вызванные H2O2 производимые mitis стрептококки группы патогенности оценивали.
Определить хост генов, которые необходимы в отношении стрептококковых инфекций, СКН-1 был сбит, который Кодирует транскрипционный фактор оксидативного стресса ответ в C. elegans. Затем сравнивали выживания относительно вектор управления лечение глистов. Значительное уменьшение выживания нокдаун червей skn-1 было отмечено, по сравнению с вектор управления лечение глистов (рис. 4A). Эти данные была дополнительно подтверждена с помощью мутантный штамм skn-1 , и ее выживание был по сравнению с червей одичал тип N2. Мы наблюдали аналогичные убийства фенотипом мутанта skn-1 , как видно с СКН-1 нокдаун, демонстрируя, что SKN-1 влияние на выживание червей на группе mitis (Рисунок 4B).
Далее было определено ли H2O2 производится группой mitis, вызвало локализации SKN-1B/C::GFP в глистах. Локализация SKN-1B/C::GFP наблюдалось в черви подвергаются одичал типа и дополнения пятен и не в ответ на ΔspxB мутант штамма S. гордони (рис. 5A, B). Кроме того для определения активации СКН-1, компоненты p38 MAPK путь сбили. Было отмечено снижение локализации SKN-1B/C::GFP в нокдаун черви nsy-1, sek-1, ПМК-1 и СКН-1 относительно вектор управления лечение глистов. Данные предлагает p38 MAPK требуется для активации СКН-1 в ответ на H2O2 подготовленного группой mitis (рис. 5C, D).
Рисунок 1 : Блок с изображением шаги, участвующих в подготовке анализов выживания. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 2 : Блок с изображением шаги, необходимые для локализации СКН-1 во время инфекции. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 3 : H2O2-опосредовано стрептококки группы mitis убийство C. elegans . Каплана-Мейера кривых выживания личинок L4, подвержены S. гордони(A), S. oralis, S. mitis, S. salivarius, S. mutans и E. coli ОР50. (B) S. gordonii, S. oralis, S. mitis, S. salivarius, S. mutans и E. coli ОР50 на твой пластины присутствии 1000 U каталазы. (C) S. gordonii WT, мутантspxB Δ и ΔspxB; spxB + дополняют штаммов на N2 L4 личинки. (D) S. oralis (VGS #3), S. oralis (VGS #4), S. mitis (VGS #10), S. mitis (VGS #13) и E. coli ОР50. Данные являются представитель экспериментов повторяется два или более раз, с n = 60 червей для каждого условия. Ранг анализ Каплана-Мейера журнала был использован для сравнения кривых выживания и рассчитать медиана выживаемости. P значений 15. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 4 : SKN-1 требуется для выживания червей на S. gordonii. (A) выживания переносчиками лечить и СКН-1 нокдаун подвергается S. gordoniiчервей. (B) выживания N2 и мутантов червей skn-1(zu67) кормили на S. gordonii. Данные являются представитель экспериментов повторяется два или более раз, с n = 60 червей для каждого условия. Ранг анализ Каплана-Мейера журнала был использован для сравнения кривых выживания и рассчитать медиана выживаемости. P значений 15. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 5 : P38 MAPK путь зависит от стрептококков H2O2 опосредованной активации СКН-1. (A) представитель образы локализации SKN-1B/C::GFP в глистах, подвержены WT, мутантspxB Δ и ΔspxB; spxB + дополнение штаммов S. gordonii. Крупным планом отображаются в верхнем правом углах каждого изображения. Шкалы бар = 100 µm. (B) степень ядерной локализации SKN-1B/C::GFP и процент червей в каждой категории, кормили на WT, мутантspxB Δ и ΔspxB; spxB + дополнение штаммов S. gordonii. Значительно в ΔspxB мутанта (p spxB; spxB + дополнение штаммов S. gordoniiнаблюдались низкий уровень ядерной локализации SKN-1B/C::GFP. (C) представитель изображения локализации SKN-1B/C::GFP в nsy-1, sek-1, ПМК-1, СКН-1 сногсшибательно и переносчиками лечение червей на S. gordonii. Крупным планом отображаются в верхнем правом углах каждого изображения. Шкалы бар = 100 µm. (D) степень SKN-1B/C::GFP ядерной локализации и процент червей в каждой категории питались nsy-1, sek-1, ПМК-1, СКН-1 сногсшибательно и переносчиками лечение червей на S. gordonii. Значительно в nsy-1 (p sek-1 (p ПМК-1 (p и СКН-1 нокдаун (p S. gordonii. Больше чем 100 червей, подвергается каждый штамм были образы, и этот эксперимент был повторен в три раза. Этот рисунок был изменен и адаптированы с разрешением15. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Subscription Required. Please recommend JoVE to your librarian.
|
Наименование микроорганизмов |
Норма м/о |
Пограничная зона |
Дисбактериоз |
|
Нормальная микрофлора |
|||
|
Зеленящие стрептококки: Str.mitis |
106-108 |
104-105 |
103-0 |
|
Негемолитический стрептококк: S.angemolyticus |
106-108 |
104-105 |
103-0 |
|
Непатогенные нейссерии (Neisseria) |
105-107 |
103-104 |
<103-0 |
|
Факультативная флора |
|||
|
β-гемолитические стрептококки: Str.pyogenes, Str.anginosus |
0-103 |
104-105 |
106-108 |
|
Рневмококк:Str.pneumoniae |
0-103 |
104-105 |
106-108 |
|
Гемофилы:Haemophilus |
0-103 |
104-105 |
106-108 |
|
Staphylococcus aureus |
0-103 |
104-105 |
106-108 |
|
Staphylococcus epidermidis |
0-103 |
104-105 |
106-108 |
|
Staphylococcus saprophyticus |
0-101 |
103-105 |
<105 |
|
Corinebacteriumкоринебактерии |
0-103 |
104-105 |
106-107 |
|
НГОБ: Acinetobacter, Pseudomonas идр. |
0 |
0 |
101-103 |
|
Moraxella |
0-103 |
104-105 |
106-108 |
|
Энтеробактерии: Escherichia coli Klebsiella Citrobacter Enterobacter Serratia Morganella и др. |
0 |
0 |
101-103 |
|
Enterococcus Энтерококки |
0 |
0 |
101-103 |
|
Грибы рода Candida |
0-101 |
102-103 |
<103 |
Генотипическая гетерогенность Streptococcus oralis и отдельные ацидурические субпопуляции в зубном налете человека
Appl Environ Microbiol. 2000 Aug; 66 (8): 3330–3336.
S. Alam
Группа исследования кариеса зубов, Стоматологический институт Гая, Кинга и Сент-Томаса, Лондон SE5 9RW, 1 и Unilever Research, Порт Санлайт, Wirral L63 3JW, 2 Англия
SR Brailsford
Группа исследования кариеса зубов, Стоматологический институт Гая, Кинга и Сент-Томаса, Лондон SE5 9RW, 1 и Unilever Research, Порт Санлайт, Wirral L63 3JW, 2 Англия
S.Adams
Dental Caries Research Group, Стоматологический институт Гая, Кинга и Св. Томаса, Лондон SE5 9RW, 1 и Unilever Research, Порт Санлайт, Wirral L63 3JW, 2 England
C. Allison
Dental Группа исследований кариеса, Стоматологический институт Гая, Кинга и Св. Томаса, Лондон SE5 9RW, 1 и Unilever Research, Порт Санлайт, Виррал L63 3JW, 2 Англия
Э. Шихи
Группа исследований кариеса зубов, Guy’s, King’s и St.Thomas ‘Dental Institute, Лондон SE5 9RW, 1 и Unilever Research, Port Sunlight, Wirral L63 3JW, 2 England
L. Zoitopoulos
Dental Caries Research Group, Guy’s, King’s и Стоматологический институт Св. Томаса , London SE5 9RW, 1 и Unilever Research, Port Sunlight, Wirral L63 3JW, 2 England
EA Kidd
Dental Caries Research Group, Guy’s, King’s and St. Thomas ‘Dental Institute, London SE5 9RW, 1 и Unilever Research, Port Sunlight, Wirral L63 3JW, 2 England
D.Beighton
Группа исследования кариеса зубов, Стоматологический институт Гая, Кинга и Св. Томаса, Лондон SE5 9RW, 1 и Unilever Research, Порт Санлайт, Уиррал L63 3JW, 2 Англия
Группа исследований кариеса зубов, Гай , Стоматологический институт Кинга и Св. Томаса, Лондон SE5 9RW, 1 и Unilever Research, Порт Санлайт, Wirral L63 3JW, 2 England
* Автор, отвечающий за переписку. Почтовый адрес: Отделение микробиологии полости рта, Стоматологический институт GKT, Caldecot Road, Denmark Hill, London SE5 9RW, England.Телефон: 44-0171-346-3272. Факс: 44-0171-346-3073. Электронная почта: [email protected].Получено 3 апреля 2000 г .; Принято 31 мая 2000 г.
Copyright © 2000, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Генотипическая гетерогенность Streptococcus oralis , выделенного из полости рта, была исследована с помощью повторяющейся экстрагенной палиндромной ПЦР. Неродственные субъекты имели уникальные генотипы, при этом многие генотипы были изолированы от человека. S. oralis — преобладающая ацидурическая бактерия, выделенная из некариозных участков зубов. Генотипическое сравнение ацидурических популяций, выделенных при pH 5,2, с популяциями, выделенными из митит-слюнного агара (MSA) (pH 7,0), показало, что ацидурические популяции были генотипически различны у большинства субъектов (χ 2 = 13,09; P = 0,0031). Ни ацидурический, ни выделенный MSA штаммы не были стабильными, и ни один из штаммов, выделенных на исходном уровне, не был выделен через 4 или 12 недель у большинства субъектов.Причина этой нестабильности неизвестна, но аналогична той, о которой сообщалось для Streptococcus mitis . Исследование штаммов S. oralis , выделенных от сожительствующих пар, показало, что в трех из пяти пар генотипически идентичные штаммы были выделены от обоих партнеров, и это было подтверждено с помощью ПЦР с повторяющимся элементом Salmonella enteritidis и ПЦР-типирования энтеробактерий. Эти данные служат дополнительным доказательством физиологической и генотипической гетерогенности стрептококков, не являющихся mutans.Демонстрация различных ацидурических популяций S. oralis подразумевает, что роль этих и других стрептококков, не относящихся к mutans, в процессе кариеса требует переоценки.
Возникновение кариеса связано со способностью зубного налета выделять кислоту из съеденных пищевых продуктов на поверхности зубов, подверженной кариесу. На склонных к кариесу участках, гладких поверхностях зубов, межзубных участках, ямках и трещинах, где накапливается зубной налет (1, 3, 10), и, конечно, внутри кариозных поражений, местный pH является кислым, а бактерии, присутствующие в этих участках, должны быть кислыми, проявляя способность к репликации в преобладающей или кратковременной кислой среде.Зубной налет содержит множество видов ацидогенных и ацидурических микроорганизмов. К ацидогенным бактериям, наиболее тесно связанным с процессом кариеса зубов, относятся стрептококки mutans ( Streptococcus mutans и Streptococcus sobrinus ), лактобациллы и, возможно, Actinomyces spp. Было много дискуссий о роли других бактерий, в частности о роли стрептококков, отличных от mutans (NMS), в инициации и прогрессировании кариеса зубов.Пытаясь понять их потенциальную патогенную роль, ван Хаут и его коллеги изучили ацидогенность NMS, выделенных из здоровых и кариозных участков зубов (29, 35, 36). В этих исследованиях NMS были гетерогенными в отношении ацидогенности. Таким образом, из инфицированного дентина в пределах кариозных поражений и из зубного налета на здоровых поверхностях во рту у пациентов с кариесом, NMS, которые были более ацидогенными, чем NMS, были изолированы от здоровых поверхностей зубов у пациентов без кариеса.О клональности этих штаммов не сообщалось, а кислотность изолятов не исследовалась. Тем не менее, это был первый подробный и сфокусированный отчет о гетерогенности среди отдельных видов NMS детерминанты, которая, как ожидается, будет важной особенностью любого микроорганизма, участвующего в инициировании кариеса зубов. Ацидогенные NMS также были более многочисленными, чем стрептококки mutans, и было высказано предположение, что эти организмы могут играть значительную роль в процессе кариеса.
Кислотность бактерий, выделенных из биопленки зубного налета, была исследована в ряде исследований с использованием различных методов in vitro, в первую очередь путем определения способности изолятов метаболизировать углеводы и выживать при кислых уровнях pH (11, 12, 15 , 18, 23, 31, 32).Эти исследования продемонстрировали, что лактобациллы и стрептококки mutans являются наиболее кислотными бактериями зубного налета, в то время как NMS и Actinomyces spp. менее кислые. Однако все штаммы, испытанные в этих экспериментах, были выделены из обычных селективных и неселективных питательных сред, которые могли повлиять на фенотипы штаммов, выделенных и впоследствии исследованных. Преобладающий ацидурический компонент зубного налета широко не исследовался. В предварительном отчете мы указали, что преобладающими ацидурическими бактериями, выделенными из зубного налета, взятого с некариозных поверхностей, были NMS, причем наиболее часто выделялись Streptococcus oralis , Streptococcus parasanguinis и Streptococcus intermediateus (8).В этой статье мы расширяем эти наблюдения и сообщаем о генотипической характеристике ацидурических штаммов S. oralis из слюны и образцов межзубного налета. Представители ацидурических изолятов от каждого субъекта были генотипированы с помощью повторяющейся экстрагенной палиндромной ПЦР (REP-PCR [2]) и сравнивались с изолятами, выделенными из обычных культуральных сред (pH 7,0). Стабильность популяций S. oralis оценивалась в течение периодов до 12 недель, а трансмиссивность штаммов определялась путем сравнения популяций S.Oralis в бляшечной флоре сожительствующих пар.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение
S. oralis из слюны и межзубного налета с помощью MSA и ацидурической среды.Стимулированная парафиновым воском (Ivoclar-Vivadent, Schaan, Лихтенштейн) слюна была собрана у добровольцев и десятикратно разведена в привередливом бульоне анаэробов (LabM; Salford, Lancs, England), аликвоты по 100 мкл помещены на агар mitis salivarius (MSA ) (Бектон-Дикинсон, Оксфорд, Англия) с добавлением 0.1% теллурит калия (Becton-Dickinson) для выделения стрептококков viridans. Интерпроксимальный зубной налет собирали с одного участка, свободного от кариеса, у каждого субъекта. Образцы зубного налета собирали с помощью стерильных деревянных зубочисток, и каждый образец помещали в 1 мл стерильного PBSTC (1,58 г K 2 HPO 4 · 3H 2 O, 0,34 г KH 2 PO 4 , 8 г NaCl, 1,0 г тиогликолята натрия и 0,001 г бромида цетилтриметиламмония на литр дистиллированной воды).Образцы диспергировали встряхиванием со стерильными стеклянными шариками (BDH), разбавляли в десятичной степени в PBSTC и наносили на MSA. Чашки с MSA инкубировали в анаэробных условиях при 37 ° C в течение 3 дней.
Для выделения достаточного количества штаммов S. oralis из каждого образца, помещенного на MSA, из каждого образца было отобрано 75 колоний, не демонстрирующих продукции внеклеточных полисахаридов, и инокулировано 200 мкл бульона Тодда-Хьюитта (Oxoid, Basingstoke, Hants, England) в планшетах для микротитрования с плоским дном (Griffiths and Neilson, Billinghurst, Kent, England) и выращивали в анаэробных условиях в течение 48 часов.Каждый изолят тестировали на активность сиалидазы (6) переносом 50 мкл суспензии бульона Тодда-Хьюитта в 20 мкл субстрата сиалидазы [200 мкг 2 ‘- (4-метилумбеллиферил) -α-d- N -ацетилнейраминовой кислоты (Sigma, Poole, Dorset, England) в 50 мМ N -трис (гидроксиметил) метил-2-аминоэтансульфоновая кислота (TES) буфер, pH 7,5] в планшете для микротитрования с плоским дном. Ферментные анализы инкубировали в аэробных условиях при 37 ° C в течение 3 часов, и увеличение флуоресценции, демонстрирующее активность сиалидазы, измеряли с помощью флуориметра (Perkin-Elmer, Beaconsfield, Hants, England) при длинах волн излучения и возбуждения 380 и 460. нм соответственно.К остальным культурам добавляли глицерин до конечной концентрации приблизительно 50% (об. / Об.), И планшеты для микротитрования хранили при -80 ° C.
Предварительный скрининг на сиалидаза-положительные стрептококки выявил те изоляты, которые представляли собой S. oralis , Streptococcus mitis , S.medius или Abiotrophia adjaciens (17, 28, 39). Чтобы идентифицировать штаммы S. oralis из коллекции сиалидазоположительных штаммов, все эти изоляты были протестированы на продукцию β-фукозидазы, β- N -ацетилгалактозаминидазы и β- N — ацетилглюкозаминидазы с использованием соответствующего флуорогенного субстрата, как описано ранее (4).Те штаммы, которые были отрицательными по β-фукозидазе, положительными по активности двух гексозаминидаз и положительными по активности сиалидазы, были идентифицированы как S. oralis , и идентификация была подтверждена с помощью дополнительных физиологических тестов, включая ферментацию ряда углеводов и гидролиз аргинина и эскулина (4).
Aciduric Штаммы S. oralis также были выделены из каждого образца межзубных бляшек. Используемая процедура выделения была методом наиболее вероятного числа (MPN).Преобладающие ацидурические бактерии в каждом образце, способные к росту и размножению в кислой среде, были выделены с помощью инфузии мозга и сердца (BHI) (Oxoid), доведенной до pH 5,2 с помощью лимонной кислоты и Na 2 HPO 4 при конечных концентрациях 13 и 26 мМ соответственно. Каждый образец бляшек был десятикратно разведен в PBSTC, чтобы получить серию разведений от 10 -1 до 10 -8 , и были созданы 12 повторов каждого разведения, 15 мкл разведения бляшек в PBSTC и 135 мкл кислого BHI. в стерильных планшетах для микротитрования с плоским дном и инкубировали в анаэробных условиях в течение 5 дней.Конечный pH лунок, демонстрирующих рост, был измерен и оказался равным ± 0,05 единиц pH от исходного pH среды. Конечные лунки, самые низкие разведения, демонстрирующие рост бактерий, пересевали на колумбийский агар (Oxoid) с добавлением 5% (об. / Об.) Лошадиной крови и инкубировали в анаэробных условиях в течение 48 часов. Колонии исследовали окрашиванием по Граму, и были идентифицированы те, которые выглядели как грамположительные кокки. Штаммы Aciduric S. oralis были выделены от каждого субъекта и хранили в глицериновом бульоне при -80 ° C до тех пор, пока они не потребовались для последующего генотипического анализа (2).Для большинства исследований метод MPN использовался в качестве удобной многолуночной процедуры для выделения ацидурических штаммов S. oralis из образцов , но метод MPN использовался для количественного определения доли S. oralis в 18 межзубных промежутках. образцы. Из этих образцов было рассчитано количество ацидурических штаммов S. oralis в процентах от общего количества бактерий, определенного с использованием метода MPN с BHI при pH 7,0, и доля S.Oralis , выделенных из MSA, выражали как процент от общего количества бактерий на неселективной среде (9).
Генотипирование
S. oralis.Индивидуальные штаммы S. oralis были генотипированы с использованием повторяющейся экстрагенной палиндромной ПЦР (REP-ПЦР), которая, как описано ранее, дает в результате образцы ампликонов, уникальные для каждого независимого изолята S. oralis и всех остальных. виды стрептококков viridans (2). В целях подтверждения также использовали ПЦР на энтеробактерии (ERIC-PCR) и ПЦР с повторяющимся элементом Salmonella enteritidis (SERE-PCR), как описано ранее (2).
Визуализация ампликонов.
Продукты амплификации REP-PCR и ERIC-PCR анализировали с использованием 2% Metaphoragarose (Flowgen, Staffordshire, England), содержащего 0,5 мкг бромистого этидия на мл, и разделяли электрофоретически на гелях размером 20х25 см при 140 ° C. V в течение 3 ч в буфере трис-борат-ЭДТА. Продукты SERE-PCR (15 мкл) разделяли на 0,8% агарозе (Sigma), содержащей 0,5 мкг бромистого этидия на мл, путем электрофоретического разделения при 140 В в течение 3 часов. Ко всем образцам по 3 мкл трекингового красителя (0.Добавляли 25% бромфенолового синего, 0,25% ксилолцианола FF, 30% глицерина), и маркер молекулярного размера (pGEM DNA Markers; Promega, Southampton, England) был включен во все гели на трех-четырех отдельных дорожках, чтобы облегчить сравнение дорожки между гелями. Гели исследовали на трансиллюминаторе и фотографировали с использованием положительно-отрицательной пленки Polaroid типа 665 (Sigma).
Компьютерный анализ структур ДНК.
Все образцы изолятов от индивидуума сравнивали с помощью GelCompar версии 4.0 (Прикладная математика, Кортрейк, Бельгия). Отдельные полосы в каждом из паттернов, полученных с помощью различных методов ПЦР, анализировали, применяя коэффициент Дайса к пикам. Для кластеризации использовали метод невзвешенных парных групп с использованием математических средних (UPGMA), а для сравнения паттернов ДНК использовали допуск положения полосы 1,5%. Анализ шаблонов проводился в соответствии с инструкциями производителя. Различия в частоте восстановления генотипов сравнивали статистически с использованием критерия χ 2 (точный критерий Фишера).
Генотипическая гетерогенность
S. oralis , выделенных от особей.Образцы межзубных бляшек были взяты у 15 субъектов, и штамм S. oralis были выделены из каждого образца с использованием MSA и многолуночного метода, как описано выше. Генотипы, присутствующие у каждого субъекта, выделенные на каждой среде, сравнивали с помощью кластерного анализа и определяли сходство штаммов из двух условий культивирования у каждого субъекта.
Устойчивость
S.Oralis генотипа.Стабильность популяций S. oralis в отдельных ртах определялась в двух экспериментах. В первом случае полоскание рта было проведено у каждого из пяти взрослых, не связанных родственниками, в трех отдельных случаях: в начале исследования и через 4 и 12 недель спустя. Компонент S. oralis флоры был выделен из каждого полоскания рта только с использованием MSA. S. oralis изолятов, присутствующих в каждом образце, были идентифицированы, и отдельные штаммы были генотипированы с помощью REP-PCR.Генотипы этих популяций сравнивали с помощью кластерного анализа, и стабильность популяции, присутствовавшей на исходном уровне, определяли в течение 12-недельного периода.
Во втором эксперименте, чтобы оценить стабильность ацидурической популяции S. oralis в интерпроксимальной бляшке, образцы были взяты у 10 взрослых субъектов в двух отдельных случаях с интервалом в 4 недели. Преобладающие ацидурические бактерии в каждом образце были выделены с использованием многолуночного метода, как описано выше. Выделенные таким образом штаммы, в первую очередь стрептококки viridans, были идентифицированы.Изоляты, идентифицированные как S. oralis , были генотипированы с использованием метода REP-ПЦР, описанного выше. Стабильность ацидурических популяций S. oralis у каждого субъекта оценивали с помощью кластерного анализа.
Передача
S. oralis между субъектами.Образцы межзубных бляшек были взяты одновременно у пяти совместно проживающих пар, и из каждого образца были выделены популяции S. oralis с использованием как многолуночного метода, так и метода MSA.Были определены генотипы S. oralis в каждом образце, и генотипы каждой пары были сравнены с помощью кластерного анализа, чтобы установить наличие штаммов, которые, очевидно, были неотличимы друг от друга, в интерпроксимальных образцах каждой пары. . Наличие таких штаммов указывает на передачу S. oralis между парами.
Когда штаммы были выделены из пар, которые нельзя было различить с помощью REP-PCR, эти штаммы были подвергнуты дополнительному генотипированию штаммов с использованием методов SERE-PCR и ERIC-PCR.Это было предпринято, поскольку штаммы, которые различаются с помощью REP-ПЦР, явно различаются, но штаммы, которые демонстрируют один и тот же образец только с помощью одного метода типирования, могут отличаться при использовании других систем типирования. Следовательно, неразличимые штаммы должны давать аналогичные, но разные рисунки полос при исследовании с помощью других методов типирования.
РЕЗУЛЬТАТЫ
Генотипическая гетерогенность
S. oralis у отдельных особей.У большинства из 15 субъектов ацидурия S.Oralis популяции отличались от популяции S. Oralis , выделенной с помощью MSA. Репрезентативные примеры паттернов REP-ПЦР для штаммов S. oralis , выделенных из нескольких лунок и MSA, для отдельных субъектов показаны на рис. Только у 4 из 15 субъектов было штамм S. oralis , выделенные с помощью MSA и многолуночных методов, неотличимых друг от друга посредством REP-ПЦР-типирования. Данные сведены в таблицу, в которой показано количество штаммов, исследованных на одного субъекта, количество генотипов на одного субъекта среди этих исследованных штаммов и те генотипы, полученные от каждого субъекта на MSA и из ацидурической среды.Нулевая гипотеза о том, что каждый субъект имеет только одну популяцию S. oralis , т. Е. Что одни и те же генотипы должны быть восстановлены из обеих сред, была проверена, и было обнаружено, что генотипы, восстановленные из двух сред, значительно различались (χ 2 = 13,09; P = 0,00031). Таким образом, можно сделать вывод, что популяция S. oralis , выделенная из ацидурической среды, отличалась от популяций, выделенных из MSA.
REP-PCR паттернов S.oralis , выделенные из образцов межзубных бляшек с использованием методов (а) MSA и (b) MPN от двух субъектов. Дорожки 1, 9 и 18 содержат маркеры размера молекул.
ТАБЛИЦА 1
Генотипическая гетерогенность штаммов S. oralis , выделенных из межзубных бляшек с использованием MSA и ацидурической среды (MPN) 15 взрослых субъектов
| Субъект | Среда | Количество изолятов Субъект | 9029 специфический S. oralis генотип № а|||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 2210 | 11 | 215 | ||||||||||||||
| 1 | MSA | 15 | 14 | 1 | 9033 | ||||||||||||||||||||||
| MPN | 15 | 10 | 2 | 1 | 1 | 1 | 1 | ||||||||||||||||||||
| 2 | MSA | 9033 9033 9033 9033 9034 1534 15 | 1 | ||||||||||||||||||||||||
| MPN | 5 | 90 338 | 1 | 1 | 1 | 1 | 1 | ||||||||||||||||||||
| 3 | MSA | 15 | 8 | 2 | 1 | 1 | 1|||||||||||||||||||||
| MPN | 15 | 14 | 1 | ||||||||||||||||||||||||
| 4 | 9033 9033 9033 9033 9033 MS | MS15 | 10 | 2 | 1 | 1 | 1 | ||||||||||||||||||||
| 5 | MSA | 14 | 8 | 2 | 1 | 11 | |||||||||||||||||||||
| MPN | 3 | 1 | 1 90 339 | 1 | |||||||||||||||||||||||
| 6 | MSA | 16 | 4 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | ||||||||||||||||
| MPN | 20 | 9033 | MSA | 15 | 6 | 2 | 2 | 1 | 1 | 1 | 1 | 1 | |||||||||||||||
| MPN7 | 90341 | 1 | 1 | 2 | |||||||||||||||||||||||
| MSA | 10 | 10 | |||||||||||||||||||||||||
| MPN | 11 | 4 | 6 | 1 | 9 | 9034 9034 9034 21 | |||||||||||||||||||||
| MPN | 9 | 6 | 1 | 1 | 1 | ||||||||||||||||||||||
| 1 | 1 | 1 | |||||||||||||||||||||||||
| MPN | 11 | 2 | 6 | 9033 MSA | 20 | 20 | |||||||||||||||||||||
| MPN | 20 | 19 | 9 034110 | 4 | 1 | 1 | |||||||||||||||||||||
| 13 | MSA | 13 | 9033 51 | ||||||||||||||||||||||||
| MPN | 16 | 3 | 2 | 11 | 9033 9033 9033 9033 9033 9034 9034 9033 9 9033 9034|||||||||||||||||||||||
| MPN | 10 | 4 | 2 | 2 | 1 | 1 | |||||||||||||||||||||
| 15 | MSA | 11 | 5 | 2 | 2 | 1 | 1 | ||||||||||||||||||||
| MPN 6339 | 1 | 1 | 1 | 1 | 1 | 1 |
Доля ацидурической
S.oralis в образцах межзубных бляшек.Ацидурические изоляты S. oralis составляли 1,9% (± 0,7%) MPN бактерий в образцах, выделенных в BHI при pH 7,0. MPN бактерий при pH 5,2 составляло 3,8% (± 1,2%) от общего MPN бактерий при pH 7,0. Таким образом, в среднем штаммы S. oralis , выделенные в среде с pH 5,2, составляют примерно 50% от общего числа бактерий. Изолятов S. oralis , выделенных из планшетов MSA, составили 11.2% (± 3,6%) от общего количества из неселективной среды.
Стабильность
генотипов S. oralis .Для определения стабильности популяций S. oralis штаммы были выделены с использованием MSA из слюны пяти субъектов, взятых в течение 12-недельного интервала. Наблюдались значительные различия в количестве генотипов S. oralis , присутствующих в популяции S. oralis каждого субъекта. Когда сравнивали генотипы каждого субъекта, было обнаружено, что только у двух субъектов были какие-либо штаммы, демонстрирующие тот же паттерн REP-PCR, выделенные на исходном уровне и через 4 недели.Ни у одного субъекта не было штаммов, которые были бы идентичны штаммам, выделенным в 12-недельной выборке, изолированной в исходной или 4-недельной выборке (таблица). Типичная дендрограмма этих соотношений представлена на рис.
ТАБЛИЦА 2
Количество различных генотипов, выделенных из образцов слюны субъектов на исходном уровне, через 1 месяц и 6 месяцев
| Субъект | Время (ч) | Субъект-специфический генотип № а | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 2210 | 11 | 2215 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 35902 9030 | 1 | 1 | 3 | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 4 | 5 | 1 | 1 | 1 | 1 | 1 | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | 9033 | 1 | 1 | 3 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 1 | 2 | 1 | 1 | 1 | 5 | 1 | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 9033 | 1 | 1 | 2 | 4 | 1 | 1 | 90 338 1||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | 1 | 1 | 1 | 4 | 1 | 1 | 1 | 1 | 1 | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 0 | 1 | 9033 11 | 1 | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 1 | 9033 8 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 9033||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 0 | 1 | 1 | 1 | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 1 | 6 | 1 | 1 | 1 | 1 | 1 | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | 0 | 1 | 1 | 1 | 1 | 4 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 1 | 9033 9033 9033 9033 | 6 | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Субъект | Время (ч) | Субъект-специфический генотип № а | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 2210 | 11 | 2215 | 16 | 17 | |||||||||||||||||||
| 1 | 0 | 7 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 8 | 1 | 1 | |||||||||||||||||||||
| 2 | 0 | 2 | 1 | 9034 1 | 9033 | 1 | 1 | 1 | 1 | |||||||||||||||||||||||||
| 1 | 8 | 9034 4 | 1 | 6 | 1 | 1 | ||||||||||||||||||||||||||||
| 3 | 0 | 1 | 1 | |||||||||||||||||||||||||||||||
| 1 | 12 | 9033 9033 9033 9033 9034 1 | 1 | 1 | 9 | 3 | 2 | 1 | 1 | |||||||||||||||||||||||||
| 1 | 13 | 0 | 4 | 1 | 1 | 1 | ||||||||||||||||||||||||||||
| 1 | 5 | |||||||||||||||||||||||||||||||||
| 6 | 0 | 8 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 3 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 90342 | 3 | 1 | 1 | 1 | |||||||
| 1 | 2 1 | 2 | 1 | 1 | 1 | |||||||||||||||||||||||||||||
| 8 | 0 | 2 | 2 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | ||||||||||||||||||||||||
| 1 | 9034 9034 1 | |||||||||||||||||||||||||||||||||
| 9 | 0 | 2 | 2 | 2 | 1 | 1 | 1 | 1 | 1 | 6 | 1 | 2 | 1 | 3 | 1 | |||||||||||||||||||
| 10 | 0 | 9 | 4 1 | 1|||||||||||||||||||||||||||||||
| 1 | 6 | 2 9 0339 | 2 | 1 | 1 | 1 | 1 | 1 | ||||||||||||||||||||||||||
Трансмиссия
S.оральный.Штаммы S. oralis были выделены из пяти пар с использованием как MSA, так и многолуночного метода. Всего было генотипировано от 40 до 62 изолятов на пару; всего 258 изолятов. При изучении дендрограмм всех штаммов от каждой пары было очевидно, что в трех парах штаммов S. oralis , которые нельзя было различить с помощью REP-ПЦР, были выделены от каждого члена пары (рис.). В одной паре 3 из 16 штаммов из кислой среды от одного партнера были идентичны 10 из 16 штаммов от другого.Во второй паре 15 из 20 штаммов из кислой среды были идентичны 1 из 7 штаммов из кислой среды другого партнера, а в третьей паре 19 из 20 штаммов из кислой среды были идентичны 1 из 5 штаммов. из кислой среды от другого партнера. Когда идентичные штаммы из каждой пары были дополнительно исследованы с помощью SERE-PCR и ERIC-PCR, было очевидно, что штаммы были неотличимы обоими методами (данные не показаны).
Репрезентативные дендрограммы, иллюстрирующие генотипические отношения между S.oralis , выделенные из совместно проживающих пар A и B с партнерами, обозначенными как 1 и 2. В каждой паре первая цифра указывает на индивидуального партнера, MSA и ACID указывают метод культивирования, использованный для выделения штаммов, а последняя цифра указывает на изолят. количество. В паре A штамм 2 ACID 4 был идентичен штамму от другого партнера, а в паре B штаммы 2 ACID 6, 10 и 13 были идентичны штамму от другого партнера. Для сравнения были помечены отдельные ампликоны REP-PCR, и отдельные полосы были проанализированы с использованием коэффициента Дайса и кластеризации с использованием метода UPGMA.
ОБСУЖДЕНИЕ
Это исследование продемонстрировало, что популяция S. oralis у индивидуума является гетерогенной, что ацидурические штаммы S. oralis могут быть генотипически отличными от штаммов, выделенных из того же образца бляшек с помощью MSA, и что Популяции S. oralis нестабильны, но, по-видимому, легко передаются между сожительственными парами. В предыдущих исследованиях сообщалось о гетерогенности популяций других бактерий зубного налета (9, 13, 14, 16, 20–22, 33, 37).Исследования клональности филогенетически родственного вида S. mitis биовара 1 сообщили о разнообразии, аналогичном тому, которое обнаружено в настоящем исследовании для S. oralis . Хоуи и Килиан (16) идентифицировали 106 изолятов S. mitis биовара 1 из 250 стрептококковых изолятов трех членов одного семейства. 106 изолятов представляли 24 различных генотипа по данным рестрикционного эндонуклеазного анализа, при этом от каждого человека было выделено от 6 до 13 типов. Аналогичным образом Фитцсиммонс и др.(13) выделили 101 штамм S. mitis биовара 1 от 40 новорожденных, и при исследовании с помощью риботипирования эти изоляты представляли 93 уникальных типа, снова демонстрируя высокую степень разнообразия внутри этого вида. Из данных, представленных в этом отчете, очевидно, что популяция S. oralis ведет себя аналогичным образом. Такая высокая степень генотипического разнообразия не ограничивается этими двумя видами стрептококков viridans, как мы продемонстрировали в предыдущем исследовании, что неродственные представители каждого из человеческих видов стрептококков viridans демонстрировали значительное разнообразие с помощью REP-PCR, ERIC-PCR или SERE-PCR (2).
Нестабильность популяций S. oralis , о которых здесь сообщается, контрастирует с очевидной стабильностью популяций S. mutans (19) и Prevotella intermedia и Prevotella nigrescens (22) в зубном налете человека, но больше похоже на сообщаемую нестабильность S. mitis биовара 1 у младенцев (13). Скорость генотипического изменения должна быть быстрой и может отражаться в антигенном составе организма, обеспечивая механизм, с помощью которого можно избежать иммунной системы хозяина и последующего устранения.Можно ожидать, что все бактерии полости рта, особенно те, которые находятся на поверхности слизистых оболочек, включая те, которые колонизируют пародонтальный карман, будут вести себя аналогичным образом; однако они не ведут себя подобным образом, о чем свидетельствуют сообщения о стабильности популяций P. nigrescens и P. intermedia (22). Другие механизмы могут лежать в основе быстрых изменений в структуре населения. Мы обнаружили, что после 500 делений in vitro не было изменений в паттерне REP-ПЦР недавно изолированной особи S.oralis (неопубликованные наблюдения). Однако более продолжительные периоды роста, включающие 10000 репликаций Escherichia coli , привели к значительным изменениям генотипа, связанным с перемещением транспозонов внутри генома (24). Кажется маловероятным, что этот механизм модификации генотипов этих стрептококков ответственен за наблюдаемые изменения, учитывая медленное время удвоения бактерий в зубном налете (3) и относительно короткий интервал между взятием образцов.Как S. oralis , так и S. mitis являются высококомпетентными и могут подвергаться трансформации in vivo путем горизонтального переноса генов (25), что, как ожидается, приведет к изменениям в паттернах REP-ПЦР, наблюдаемых здесь у S. oralis . Также было высказано предположение, что быстрое изменение генотипа может быть связано с образованием и потерей сайтов прайминга REP-PCR во время репликации ДНК (34).
В этом исследовании было продемонстрировано, что штамм S. oralis с тем же генотипом были выделены из зубного налета сожительствующих пар.Это неудивительно, поскольку было показано, что другие стрептококки viridans передаются между парами и между матерями и их младенцами (7, 13, 16, 21, 27). Предположительно передача происходит через передачу слюны между партнерами. Следует отметить, что в каждой из трех пар, где передача была очевидна, штамм, который, по-видимому, передавался, был преобладающим у одного из партнеров. Использование других методов генотипирования на основе ПЦР для подтверждения сходства общих генотипов однозначно подтверждает выделение одних и тех же штаммов S.oralis от каждого члена этих трех пар, поскольку сайты прайминга ПЦР различны для каждой реакции (26, 38).
Ранее мы сообщали, что S. oralis является одним из самых многочисленных видов ацидных бактерий в зубном налете (8) и что стрептококки mutans редко выделяются среди преобладающих ацидурических бактерий в зубном налете, связанном с поверхностями зубов без кариеса. В этом отчете мы подвергли популяцию S. oralis обширному генотипическому анализу, и эти результаты значительно расширяют предыдущие наблюдения.Мы показали, что ацидурическая популяция S. oralis , которая генотипически отличается от популяций, выделенных из MSA (исходный pH 7,0), существует в бляшках. Присутствие этой особой популяции является неожиданным, поскольку в других исследованиях было продемонстрировано, что, хотя NMS могут выживать в кислых условиях, их выживание считалось фенотипической адаптацией (32). Настоящие данные подтверждают наличие генетически отличных ацидурических бактерий S. oralis , у которых может быть генетическая основа их выживания и размножения в кислых условиях.
NMS неоднородны в отношении ацидогенности и, в силу своего численного превосходства, эти ацидогенные NMS могут играть значительную роль в процессе образования кариеса (29, 35, 36). Таким же образом можно просмотреть и настоящие данные. Преобладающими ацидурическими бактериями, выделенными с поверхности зубов, свободных от кариеса, являются не стрептококки mutans, а скорее S. oralis и другие стрептококки viridans, включая S. intermediateus , S. parasanguinis и Streptococcus anginosus .Роль этих бактерий в инициации кариеса еще не известна, хотя сообщается, что многие NMS, включая S. oralis , вызывают кариес у лабораторных крыс (40). Представленные здесь данные ясно указывают на то, что S. oralis является генотипически гетерогенным в отношении кислотности, и наше предыдущее исследование показало, что этот вид преобладал среди ацидурической микрофлоры зубного налета.
Это первое сообщение о генотипической гетерогенности среди НМС в отношении кислотности.Значение ацидурического S. oralis и других ацидурических NMS в процессе кариеса требует дальнейшего рассмотрения, и может оказаться, что центральная роль, ранее отведенная S. mutans , потребует переоценки.
БЛАГОДАРНОСТИ
Мы благодарим субъектов, которые дали согласие на участие в исследовании.
Это исследование было поддержано Стоматологическим институтом Гая, Кинга и Св. Томаса и частично Unilever Research, Великобритания.
СПИСОК ЛИТЕРАТУРЫ
1.Алалуусуа С., Мальмивирта Р. Раннее накопление зубного налета: признак риска кариеса у маленьких детей. Community Dent Oral Epidemiol. 1994; 22: 273–276. [PubMed] [Google Scholar] 2. Алам С., Брейлсфорд С. Р., В то время как Р. А., Бейтон Д. Методы на основе ПЦР для генотипирования стрептококков группы viridans. J Clin Microbiol. 1999; 37: 2772–2776. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Бейтон Д., Хейдей Х., Уокер Дж. Связь между количеством бактерии Streptococcus mutans на отдельных участках зубного ряда обезьян-макак ( Macaca fascicularis ) и последующим развитием кариеса зубов.Arch Oral Biol. 1985. 30: 85–88. [PubMed] [Google Scholar] 4. Бейтон Д., Харди Дж. М., В то время как Р. А. Схема идентификации стрептококков viridans. J Med Microbiol. 1991; 35: 367–372. [PubMed] [Google Scholar] 5. Бейтон Д., Смит К., Хейдей Х. Рост бактерий и производство экзогликозидных ферментов в зубном налете обезьян-макак. Arch Oral Biol. 1986; 31: 829–835. [PubMed] [Google Scholar] 6. Бейтон Д., Вайти Р. А. Активность сиалидазы « Streptococcus milleri group» и других стрептококков группы viridans.J Clin Microbiol. 1990; 28: 1431–1433. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Берковиц Р. Дж. Streptococcus mutans — возникновение и передача у младенцев. ASDC (Am Soc Dent Child) J Dent Child. 1976; 43: 192–195. [PubMed] [Google Scholar] 8. Брейлсфорд С. Р., Бирн Р. В., Адамс С., Зойтопулос Л., Эллисон С., Бейтон Д. Исследование ацидурической микрофлоры зубного налета. Caries Res. 1999; 33: 290. [Google Scholar] 9. Brailsford S. R, Leftwich H, Tregaskis R, Beighton D. Преобладающие виды Actinomyces spp.выделен из инфицированного дентина активных поражений корневого кариеса. J Dent Res. 1999; 78: 1525–1534. [PubMed] [Google Scholar] 10. Карвалью Дж. К., Экстранд К. Р., Тильструп А. Зубной налет и кариес на окклюзионных поверхностях первых постоянных моляров в зависимости от стадии прорезывания. J Dent Res. 1989; 68: 773–779. [PubMed] [Google Scholar] 11. Честнатт И. Г., Макфарлейн Т. В., Стивен К. В. Исследование кариесогенного потенциала оральных стрептококков in vitro. Arch Oral Biol. 1994; 39: 589–593. [PubMed] [Google Scholar] 12.де Соет Дж. Дж., ван Ловерен С., Ламменс А. Дж., Павичич М. Дж., Хомбург С. Х., тен Кейт Дж. М., де Граафф Дж. Различия в кариесогенности свежих изолятов Streptococcus sobrinus и Streptococcus mutans . Caries Res. 1991; 25: 116–122. [PubMed] [Google Scholar] 13. Фитцсиммонс С., Эванс М., Пирс С., Шеридан М. Дж., Винцен Р., Боуден Г., Коул М. Ф. Клональное разнообразие изолятов Streptococcus mitis биовара 1 из ротовой полости новорожденных человека. Clin Diagn Lab Immunol. 1996; 3: 517–522.[Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Джордж К. С., Рейнольдс М. А., Фолклер В. А., Младший. Произвольно праймированный фингерпринт полимеразной цепной реакции и клональный анализ оральных изолятов Fusobacterium nucleatum . Oral Microbiol Immunol. 1997. 12: 219–226. [PubMed] [Google Scholar] 15. Гамильтон И. Р., Свенсатер Г. Кислотно-регулируемые белки, индуцированные Streptococcus mutans и другими бактериями полости рта во время кислотного шока. Oral Microbiol Immunol. 1998. 13: 292–300. [PubMed] [Google Scholar] 16.Хохви Дж., Килиан М. Клональное разнообразие популяции Streptococcus mitis биовара 1 в ротовой полости и глотке человека. Oral Microbiol Immunol. 1995; 10: 19–25. [PubMed] [Google Scholar] 17. Кавамура Y, Hou X G, Sultana F, Liu S, Yamamoto H, Ezaki T. Перенос Streptococcus adjacens и Streptococcus defctivus на Abiotrophia gen. ноя as Abiotrophia adiacens comb. ноя и Abiotrophia defctiva comb. nov., соответственно.Int J Syst Bacteriol. 1995; 45: 798–803. [PubMed] [Google Scholar] 18. Колер Б., Биркхед Д., Олссон С. Производство кислоты человеческими штаммами Streptococcus mutans и Streptococcus sobrinus . Caries Res. 1995; 29: 402-406. [PubMed] [Google Scholar] 19. Козай К., Ван Д. С., Сандхэм Х. Дж., Филлипс Х. I. Изменения в штаммах стрептококков mutans, вызванные обработкой хлоргексидиновым лаком. J Dent Res. 1991; 70: 1252–1257. [PubMed] [Google Scholar] 20. Кулкарни Г. В., Чан К. Х., Сандхэм Х. Дж.Исследование использования анализа эндонуклеаз рестрикции для изучения передачи стрептококков mutans. J Dent Res. 1989; 68: 1155–1161. [PubMed] [Google Scholar] 21. Ли Y, Caufield P W. Верность первоначального приобретения стрептококков mutans младенцами от их матерей. J Dent Res. 1995. 74: 681–685. [PubMed] [Google Scholar] 22. Матто Дж., Саарела М., фон Тройл-Линден Б., Кононен Э., Джусимис-Сомер Х., Торкко Н., Алалуусуа С., Асикайнен С. Распространение и генетический анализ орального Prevotella intermedia и Prevotella nigrescens .Oral Microbiol Immunol. 1996; 11: 96–102. [PubMed] [Google Scholar] 23. Милнс А. Р., Боуден Г. Х., Гамильтон И. Р. Влияние NaF и pH на рост и скорость гликолита недавно выделенных штаммов оральных видов Lactobacillus. J Dent Res. 1985; 64: 401–404. [PubMed] [Google Scholar] 24. Пападопулос Д., Шнайдер Д., Мейер-Эйсс Дж., Арбер В., Ленски Р. Э., Блот М. Геномная эволюция во время эксперимента с бактериями для 10 000 поколений. Proc Natl Acad Sci USA. 1999; 96: 3807–3812. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25.Поульсен К., Рейнхольд Дж., Джесперсгаард С., Бой К., Браун Т. А., Хауге М., Килиан М. Комплексное генетическое исследование протеаз стрептококкового иммуноглобулина А1: доказательства рекомбинации внутри и между видами. Infect Immun. 1998; 66: 181–190. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Раджашекара Г., Коут Т., Невил С., Бэк А., Нагараджа К. В., Лупски Дж. Р., Капур В. SERE, широко распространенный бактериальный повторяющийся элемент ДНК. J Med Microbiol. 1998. 47: 489–498. [PubMed] [Google Scholar] 27. Роджерс А. Х. Доказательства трансмиссивности кариеса зубов у человека.Ост Дент Дж. 1977; 22: 53–66. [PubMed] [Google Scholar] 28. Руофф К. Л., В то время как Р. А., Бейтон Д. Стрептококк. В: Мюррей П. М., Барон Э. Дж., Пфаллер М. А., Теновер Ф. К., Йолкен Р. Х., редакторы. Руководство по клинической микробиологии. Вашингтон, округ Колумбия: Американское общество микробиологии; 1999. С. 297–305. [Google Scholar] 29. Сансон С, Ван Хаут Дж., Джошипура К., Кент Р., Марголис Х. С. Ассоциация стрептококков mutans и стрептококков не mutans, способных к ацидогенезу при низком pH, с кариесом зубов на поверхности эмали и корня.J Dent Res. 1993. 72: 508–516. [PubMed] [Google Scholar] 30. Сушетт-Кайе Г., Декорет Д., Барсотти О. Внутрисемейное распределение штаммов Fusobacterium nucleatum в здоровых семьях с оптимальным контролем бляшек. J Clin Periodontol. 1999; 26: 401–404. [PubMed] [Google Scholar] 31. Свенсатер Г., Ларссон Ю. Б., Грейф Е. С., Цвиткович Д. Г., Гамильтон И. Р. Реакция на устойчивость к кислоте и выживание бактерий полости рта. Oral Microbiol Immunol. 1997. 12: 266–273. [PubMed] [Google Scholar] 32. Такахаши Н., Ямада Т.Кислотоустойчивость и ацидогенность стрептококков, отличных от mutans. Oral Microbiol Immunol. 1999; 14: 43–48. [PubMed] [Google Scholar] 33. Теанпайзан Р., Дуглас С. В., Элей А. Р., Уолш Т. Ф. Клональность Porphyromonas gingivalis , Prevotella intermedia и Prevotella nigrescens , выделенных из пораженных пародонтом и здоровых участков. J Periodontal Res. 1996. 31: 423–432. [PubMed] [Google Scholar] 34. ван Белкум А. Роль повторов коротких последовательностей в эпидемиологическом типировании.Curr Opin Microbiol. 1999; 2: 306–311. [PubMed] [Google Scholar] 35. ван Хаут Дж., Лопман Дж., Кент Р. Конечный pH бактерий, составляющих преобладающую флору на здоровых и кариозных поверхностях корня и эмали человека. J Dent Res. 1996; 75: 1008–1014. [PubMed] [Google Scholar] 36. van Houte J, Sansone C, Joshipura K, Kent R. Mutans streptococci и non mutans streptococci ацидогенные при низком pH и ацидогенный потенциал зубного налета in vitro в двух разных областях зубного ряда человека. J Dent Res. 1991; 70: 1503–1507.[PubMed] [Google Scholar] 37. van Steenbergen T. J, Bosch-Tijhof C. J, Petit M. D., Van der Velden U. Внутрисемейная передача и распространение Prevotella intermedia и Prevotella nigrescens . J Periodontal Res. 1997. 32: 345–350. [PubMed] [Google Scholar] 38. Версалович Дж., Коут Т., Лупски Дж. Р. Распределение повторяющихся последовательностей ДНК в эубактериях и применение для снятия отпечатков пальцев бактериальных геномов. Nucleic Acids Res. 1991; 19: 6823–6831. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39.В то время как Р. А., Бейтон Д. Текущая классификация оральных стрептококков. Oral Microbiol Immunol. 1998. 13: 195–216. [PubMed] [Google Scholar] 40. Уиллкокс М. Д., Друкер Д. Б., Грин Р. М. Относительная кариесогенность и бляшкообразующая способность in vivo бактерии Streptococcus oralis у гнотобиотических крыс WAG / RIJ. Arch Oral Biol. 1987. 32: 455–457. [PubMed] [Google Scholar]Комплексное генетическое исследование протеаз стрептококкового иммуноглобулина A1: доказательства рекомбинации внутри и между видами
Анализ 13 генов протеазы иммуноглобулина A1 (IgA1) (iga) штаммов Streptococcus pneumoniae, Streptococcus oralis, Streptococcus mitis и Streptococcus sanguis был проведен для получения информации о структуре, полиморфизме и филогении этой специфической протеазы, что позволяет бактерии, чтобы уклоняться от функций преобладающего изотипа Ig на поверхности слизистой оболочки.Анализ включал клонирование и секвенирование генов iga из S. oralis и S. mitis biovar 1, секвенирование дополнительных семи генов iga из биоваров S. sanguis с 1 по 4 и анализ полиморфизма длины рестрикционных фрагментов (ПДРФ) генов iga другого 10 штаммов S. mitis biovar 1 и 6 штаммов S. oralis. Все 13 секвенированных генов обладают потенциалом кодирования белков с молекулярной массой приблизительно 200 кДа, содержащих мотив последовательности HEMTH и остаток E, расположенный на 20 аминокислот ниже по течению, что характерно для металлопротеиназ Zn.Кроме того, все они имели типичный мотив якоря грамположительной клеточной стенки, LPNTG, который, в отличие от таких мотивов в других известных стрептококковых и стафилококковых белках, располагался в их N-концевых частях. Повторяющиеся структуры, показывающие вариации в количестве и последовательности, присутствовали во всех штаммах и могут иметь отношение к иммуногенности ферментов. Активность протеаз в культурах штаммов стрептококков была связана с видами с различными молекулярными массами от 130 до 200 кДа, что предполагает посттрансляционный процессинг, возможно, в результате автопротеолиза постпролиновых пептидных связей в N-концевых частях молекул.Сравнение выведенных аминокислотных последовательностей выявило 94% сходства между протеазами IgA1 S. oralis и S. mitis и 75-79% сходства между протеазами IgA1 этих видов и протеазами S. pneumoniae и S. sanguis, соответственно. В сочетании с результатами RFLP-анализа с использованием различных фрагментов гена iga в качестве зондов, результаты сравнения нуклеотидных последовательностей свидетельствуют о горизонтальном переносе последовательностей гена iga между отдельными штаммами S. sanguis, а также между S. mitis и двумя видами S.pneumoniae и S. oralis. В то время как гены iga S. sanguis и S. oralis были в высшей степени однородными, гены S. pneumoniae и S. mitis показали обширный полиморфизм, отраженный в разной степени антигенного разнообразия.
Streptococcus Oralis менингит из правой клиновидной кости Менингоэнцефалоцеле и утечка спинномозговой жидкости | BMC Infectious Diseases
58-летняя женщина поступила в отделение неотложной помощи из-за сильных головных болей, измененного психического статуса с минимальной реакцией, ригидности шеи и лихорадки 38.3 C. Она не была внимательной и не ориентировалась на человека, место или время. Ее можно было разбудить от раздражения грудины, и она отслеживала зрительные раздражители. По мнению членов семьи, эти признаки и симптомы появились за 1 день до госпитализации. В анамнезе она имела важное значение для менингоэнцефалоцеле правой клиновидной кости с грыжей правой височной доли через дефект крыши клиновидной впадины. Раньше это никогда не решалось хирургическим путем. Раньше у нее никогда не было травм черепа, опухолей или массовых поражений мозга.У нее также был менингит 10 лет назад, который лечили неизвестным курсом антибиотиков, а также синусит в анамнезе и чистый носовой дренаж, который усиливался при наклоне вперед в течение 3 месяцев. Пациент отрицал контакты с больными и недавние поездки. При поступлении (день 0) количество лейкоцитов составляло 28,5 кубических миллилитров (нормальный диапазон 3,8–10,5 кубических миллилитров) с преобладанием нейтрофилов 91%.
В день 0 было получено 2 набора анаэробных и аэробных культур крови.Хлоргексидин использовался в качестве антисептика в правой переднекубитальной области, и венозная кровь была взята для одного набора аэробных и анаэробных культур крови. Второй набор культур крови был взят в течение 1 часа. Сначала собирали аэробные культуры с помощью флаконов для культивирования Aerobic Bactec plus от Becton, Dickinson and Company. На каждую бутылку было получено 10 мл. Анаэробные культуры собирали вторым с помощью флаконов с литическими анаэробными культурами Bactec от Becton, Dickinson and Company. На каждую бутылку было получено 10 мл.Перед этими наборами культивирования не было никаких манипуляций с полостью рта. Анализ мочи был отрицательным на признаки инфекции мочевыводящих путей. Рентген грудной клетки показал отрицательные признаки пневмонии.
В день 0, MR орбиты, лица и шеи с внутривенным контрастированием гадолинием и без него показало правую клиновидную менингоэнцефалоцеле с грыжей правой височной доли, как показано на рис. 1 и 2. Наблюдалось усиление менингеальной оболочки и желудочковый мусор. Люмбальная пункция была противопоказана из-за предшествующей грыжи, но на 7-й день магнитно-резонансная стереотаксическая визуализация головы с внутривенным введением гадолиния показала обломки в затылочном роге бокового желудочка и утолщение / увеличение твердой мозговой оболочки, соответствующее менингиту.Жесткость шеи, изменение психического статуса и лихорадка также соответствовали менингиту [8]. При поступлении на основании рекомендаций в дополнение к 2 г дексаметазона каждые 2 часа было начато эмпирическое лечение ванкомицином 1 г каждые 12 ч, цефтриаксоном 2 г каждые 12 ч и ампициллином 2 г каждые 6 ч [8].
Рис. 1Магнитный резонанс с внутривенным введением гадолиния в орбиты лица / шеи корональный T2 турбо спин-эхо-синус продемонстрировал грыжу височной доли через дефект крыши клиновидной кости
Фиг.2Магнитный резонанс головы с T2-взвешенной жидко-ослабленной инверсией Восстановление с внутривенным введением гадолиния, показывающим обломки в правом боковом желудочке и усиление твердой мозговой оболочки, соответствующее менингиту
В день 1 оба набора бутылей для аэробных и анаэробных культур были окрашены по Гимзе это было положительным для грамположительных кокков в парах и цепочках. Во всех четырех флаконах с культурами выросло Streptococcus oralis . Изолят был чувствителен к пенициллину и цефтриаксону. На 2-й день отмены ванкомицина и ампициллина.К 4-му дню психическое состояние пациента постепенно восстановилось. На 5-й день количество лейкоцитов составило 9,5 кубических миллилитров (нормальный диапазон 3,8–10,5 кубических миллилитров). На 5 день бета 2 трансферрин из носовых выделений был положительным, что подтверждает утечку спинномозговой жидкости. Несмотря на терапию цефтриаксоном, с момента поступления до 4-го дня у пациента сохранялась субфебрильная температура.
Для исключения эндокардита была проведена чреспищеводная эхокардиограмма. Растительности не наблюдалось. Консультировалась отоларинголога. На 7-е сутки пациенту выполнена эндоназальная эндоскопическая пластика крыши клиновидной кости.За время прохождения курса лечения в больнице у нее улучшилось клиническое состояние, психическое состояние вернулось к исходному уровню. Через три месяца в результате у нее не было никаких осложнений. Магнитно-резонансная томография головного мозга без контраста через 1 месяц лечения дала отрицательный результат на грыжу головного мозга, и пациент оставался без лихорадки без осложнений.
Streptococcus Mitis — обзор
4.2 Подострый и субклинический мастит
Коагулазонегативные стафилококки (ЦНС) и mitis и salivarius стрептококки являются нормальными обитателями экосистемы молочных желез во время лактации.В физиологических условиях они образуют тонкие биопленки, выстилающие эпителий протоков молочных желез, обеспечивая нормальный ток молока (рис. 15.2B). Давление, оказываемое молоком во время его выброса, распространяется по относительно небольшому количеству бактерий, которые впоследствии передаются младенцу (рис. 15.2B). Различные факторы (обсуждаемые ниже) могут способствовать чрезмерному росту таких видов бактерий, что приводит к подостром или субклиническому маститу. Поскольку ЦНС и стрептококки mitis / salivarius не продуцируют токсины, вызывающие острый мастит, системных гриппоподобных симптомов нет, и, как правило, местные симптомы молочной железы менее выражены, а покраснение груди отсутствует.Однако в некоторых случаях эти бактерии способны образовывать толстые биопленки внутри протоков, вызывая воспаление эпителия молочных желез и заставляя молоко проходить через все более узкий просвет. Повышенное давление молока, оказываемое на воспаленный эпителий, приводит к характерной боли, напоминающей иглу или укол, часто сопровождающейся спазмами груди и чувством жжения. В конце концов, бактериальные биопленки могут заполнить некоторые протоки, затрудняя или блокируя поток молока и приводя к нагрубанию груди (рис.15.2B).
К сожалению, в тех немногих случаях, когда проводятся исследования культур грудного молока, ЦНС обычно рассматриваются как «комменсальные» или «сапрофитные» бактерии, независимо от их концентрации. Следовательно, если имеется высокая концентрация (> 3 log 10 КОЕ / мл) ЦНС или стрептококков в молоке, но, например, S. aureus не может быть обнаружен, то случай обычно ошибочно регистрируется как «неинфекционный». мастит. Это означает, что о подостром и субклиническом мастите в значительной степени не сообщается, несмотря на то, что он является наиболее частой причиной мастита, болезненного кормления грудью, а также преждевременного и нежелательного отлучения от груди (Delgado et al., 2009a; Хименес и др., 2009).
Среди ЦНС Streptococcus epidermidis является видом, наиболее часто связанным с лактационным маститом у женщин (Thomsen et al., 1985; Delgado et al., 2008, 2009b; Jiménez et al., 2008a; Arroyo et al., 2010). ). Обычно это комменсальный обитатель здоровой кожи и слизистых оболочек человека, но, кроме того, он является распространенным нозокомиальным патогеном (Otto, 2009). Находясь на грани между комменсализмом и патогенностью, S. epidermidis разработал интересные стратегии трансформации в печально известный патоген (Schoenfelder et al., 2010). Как и у людей, ЦНС стала наиболее частым возбудителем мастита у жвачных и других млекопитающих во многих странах (Zhang and Maddox, 2000; Pyörälä and Taponen, 2009; Thorberg et al., 2009; Park et al., 2011a). . Хотя ЦНС не столь патогенны, как S. aureus , и инфекция в основном остается подострой или субклинической, ЦНС имеют значение, поскольку они могут вызывать стойкие инфекции, которые приводят к увеличению SCC молока, повреждению тканей и снижению качества молока и секреции.
Некоторые виды семейства Micrococcaceae (которое с таксономической точки зрения тесно связано с семейством Staphylococcaceae) могут вызывать мастит. К ним относятся Rothia dentocariosa , Rothia mucilaginosa , Kocuria rosea, и Kocuria kristinae , которые часто вызывают оппортунистические инфекции человека. В последние годы таксономические перестройки, затрагивающие эти семейства, могут быть причиной неправильной идентификации изолятов, принадлежащих к таким видам.Требуются дополнительные исследования, чтобы выяснить их роль в этом состоянии.
Streptococcus spp. связанные с маститом, по-видимому, зависят от хозяина. Стрептококки группы B, такие как Streptococcus uberis или Streptococcus dysgalactiae , часто являются возбудителями мастита у крупного рогатого скота (Keefe, 1997), но редко, если вообще когда-либо, связаны с маститом у человека. Напротив, наиболее распространенные виды стрептококков, поражающие людей, включают Streptococcus mitis, Streptococcus salivarius, и родственные виды (Delgado et al., 2009a; Мартин и др., 2015). Важно отметить, что стрептококки подверглись важным систематическим перестройкам и что за последние годы было описано много новых видов стрептококков и близкородственных родов; поэтому следует тщательно переоценить влияние стрептококков на мастит.
% PDF-1.4 % 1 0 объект > поток конечный поток эндобдж 2 0 obj > поток х +
Необычный возбудитель инфекции мочевыводящих путей
Журнал лабораторных врачей / июль-декабрь 2013 г. / том-5 / выпуск-2 145
S.mitis, система VITEK ‑ 2 также является одним из важных помощников
в условиях нехватки ресурсов. Таким образом, выделение и знание
S. mitis как возбудителя ИМП поможет избежать неправильного распознавания
его как простого контаминанта и обеспечить соответствующее лечение
.
Бичитрананда Суэйн, Сарита Отта
Отделение микробиологии, Медицинский институт
Больница SUM, Siksha O Anusandhan
(S ”O” A) University, Bhubaneswar, Odisha, India
Адрес для корреспонденции:
ДокторБичитрананда Суэйн,
Эл. Почта: [email protected]
СПРАВОЧНАЯ ИНФОРМАЦИЯ
1. Уоррен Дж. У. Клинические проявления и эпидемиология инфекции мочевыводящих путей.
В: Mobley HL, Warren JW, редакторы. Молекулярные инфекции мочевыводящих путей
Патогенез и клиническое ведение. Вашингтон, округ Колумбия: Американское общество
для прессы микробиологии; 1996. стр. 3‑27.
2. Дуглас К.В., Хит Дж., Хэмптон К.К., Престон Ф.И. Идентификационные данные viridans
стрептококков, выделенных при инфекционном эндокардите.J Med Microbiol
1993; 39: 179-82.
3. Вестлинг К., Люнгман П., Талме А., Юландер И. Streptococcus viridans
сепсис: сравнительное исследование пациентов, поступивших в отделения
инфекционных болезней и гематологии университетской больницы. Scand J
Infect Dis 2002; 34: 316‑9.
4. Чжоу Ю.С., Хорнг СТ, Хуанг Х.С., Ху С.К., Чен Дж.Т., Цай М.Л. Реактивный артрит
, вызванный инфекцией мочевыводящих путей Streptococcus viridians.Ocul Immunol Inamm
2010; 18: 52‑3.
Доступ к этой статье в Интернете
Код быстрого ответа:
Веб-сайт:
www.jlponline.org
DOI:
10.4103 / 0974-2727.119876
Бисальбуминемия: редко встречается
в.
Бисальбуминемия или аллоальбуминемия является наследственной или
приобретенной, редко встречающейся аномалией сывороточного белка,
характеризуется наличием двустворчатого электрофоретического паттерна
во фракции альбумина, обнаруженного при электрофорезе сыворотки
.При денситометрии его можно увидеть в виде горы
, где альбумин имеет две головы. Эти мутанты альбумина
, также называемые аллоальбуминами, либо увеличили электрофоретическую подвижность
(варианты быстрого типа), либо уменьшили подвижность
(варианты медленного типа) [1]. Присутствие приобретенной
или транзиторной бисальбуминемии было описано в
различных патологических состояниях, включая сахарный диабет
, макроглобулинемию Вальденстрема, множественную миелому
, саркоидоз, болезнь Альцгеймера, синдром поджелудочной железы
, хроническое заболевание почек,
псориаза.
, а также у пациентов, получавших высокие дозы пенициллина.[1‑5]
Бисальбуминемия встречается нечасто среди индейцев; мы
сообщаем о трех случаях бисальбуминемии «медленного» варианта
, которые были случайно обнаружены при скрининге
образцов сыворотки для электрофореза белков за последние 6 месяцев.
Первый случай — 65-летняя пациентка с сахарным диабетом (СД) II типа
, у которой были нейропатия,
нефропатия, непролиферативная ретинопатия и правая
диабетическая стопа.Второй случай — 50-летний пациент
мужского пола с СД I типа с хронической воспалительной
демиелинизирующей невропатией. Третий пациент поступил
с легкой лихорадкой, артралгией и болями в костях и направил
для исследования множественной миеломы. Электрофорез сывороточного белка
проводили с помощью автоматизированной системы быстрого электрофореза в агарозном геле
(SAS ‑ 1 Serum Protein
SB, Helena Biosciences, Европа).Электрофорез сыворотки
выявил две отчетливые полосы альбумина на анодном конце [Фигуры 1,
,и 2]. Во всех случаях полосы имели неравное относительное количество в
ислучаях. Полосы нового варианта альбумина имели более низкую подвижность
по сравнению с нормальным альбумином. Медленная и нормальная полосы
составляли 20,4 и 25,7% от общего количества белков сыворотки в первом случае
, 28,6 и 25,5% во втором случае и 25,5 и 28,7%
в третьем случае, соответственно. Кроме того, в первом случае также была выявлена
бисальбуминурии.Бисальбуминемия была отмечена как случайное проявление во всех трех случаях при электрофорезе белков сыворотки.
Образцы сыворотки пациентов были повторно исследованы и оставались
бисальбуминемическими через 1 месяц после их первого визита.
Первый случай бисальбуминемии был зарегистрирован у диабетика
немца в 1955 году. С тех пор в литературе было зарегистрировано множество мутаций и
полиморфизмов. На данный момент известно 77 мутаций гена сывороточного альбумина
, 65 из которых приводят к бисальбуминемии.[5]
Приобретенная (или преходящая) форма бисальбуминемии имеет
была обнаружена у пациентов, получавших высокие дозы b ‑ лактама
антибиотиков или страдающих заболеванием поджелудочной железы, обычно
осложненным разрывом псевдокист. Наследственная
бисальбуминемия, передающаяся как аутосомный кодоминантный признак
, является относительно редким генетическим заболеванием (встречается с
с кумулятивной частотой 1: 1000–1: 10 000), которое обычно
выявляется случайно.[2] Причинным генетическим поражением является точечная мутация
гена сывороточного альбумина человека.
Варианты альбумина, приобретенные или унаследованные,
всегда должны быть в поле зрения как клиницистов, так и исследователей
ученых. Такие новые формы, возможно, могут предоставить данные
[Загружается бесплатно с http://www.jlponline.org в понедельник, 2 апреля 2018 г., IP: 181.188.177.20]
Тест на толерантность к соли для видов энтерококков • Microbe Online
Последний обновлено 30 мая 2021 г.
Тест на солеустойчивость используется для идентификации энтерококков группы D Streptococcus на основе их солеустойчивости.Способность бактерий расти в присутствии переменного количества хлорида натрия (NaCl) была использована для характеристики нескольких бактерий, включая стрептококки viridians.
Этот тест особенно полезен для предположительной идентификации энтерококковых организмов группы D, которые обладают специфической способностью расти в присутствии 6,5% NaCl, включенного в бульон или агаровую среду. Этот тест вместе с тестом желчи-эскулина используется во многих лабораториях для отличия видов Enterococcus от стрептококков группы D, Streptococcus bovis и Streptococcus lactis.Энтерококки — серьезная причина эндокардита с высокой степенью смертности.
Для этой цели используется бульон Brain Heart Infusion (BHI) с добавлением 6,5% хлорида натрия и бромкрезолового пурпурного в качестве индикатора pH. Индикатор включен, чтобы облегчить чтение результатов теста. В состав бульона также входит декстроза. Ферментация декстрозы (глюкозы) приводит к образованию кислоты. Это изменяет pH среды, в результате чего среда меняет цвет с пурпурного на желтый.
Процедура теста на солеустойчивость- Выберите не более 2-3 колоний (предпочтительно из ночной культуры) для инокуляции пробирки с бульоном солеустойчивости
Примечание: Важно слегка засеять трубка, иначе вы можете получить ложное срабатывание.
- Снимите крышку и инкубируйте в аэробных условиях в течение 24 часов при 37 ° C.
- Продолжайте инкубацию до 72 часов, если вы получите отрицательный результат через 24 часа.
- Положительный тест — это наличие явного роста бактерий (помутнение жидкой среды) в среде с изменением цвета индикатора или без него. Если организм положителен на желчный эскулин и растет в бульоне с 6,5% NaCl, то это вид Enterococcus .Если организм положителен на желчный эскулин и не может расти в бульоне с 6,5% NaCl, организм относится к стрептококку группы D.
- Отрицательный результат означает отсутствие роста через 72 часа. Enterococcus spp обычно меняет цвет среды в течение 24 часов.
Микроорганизмы и их результаты:
- Положительный рост: Enterococcus faecalis
- Отрицательный рост: Streptococcus bovis
Здравствуйте, спасибо за посещение моего блога. Я Танкешвар Ачарья. Ведение блога — моя страсть. Я работаю ассистентом. Профессор и микробиолог отделения микробиологии и иммунологии Академии медицинских наук Патана, Непал. Если вы хотите, чтобы я писал о каких-либо постах, которые вы сочли запутанными / сложными, укажите в комментариях ниже.
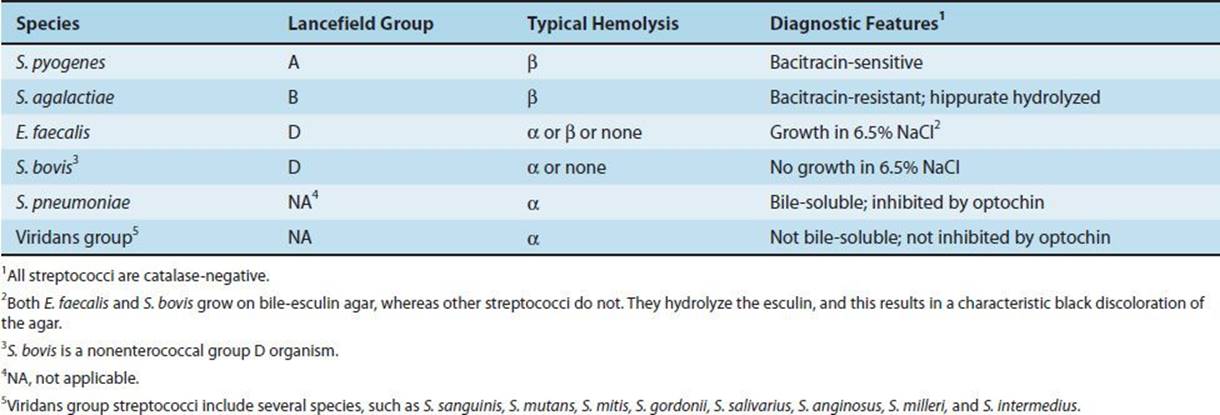


 pyogenes у членов семьи пациента с частыми рецидивами стрептококкового фарингита;
pyogenes у членов семьи пациента с частыми рецидивами стрептококкового фарингита;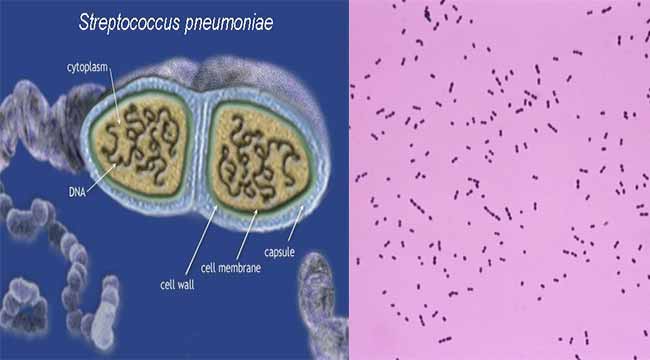 pyogenes (ассоциированной пневмонии), как вирус гриппа h2N1;
pyogenes (ассоциированной пневмонии), как вирус гриппа h2N1;
 Arch Otolaryngol Head Neck Surg. 2008 Nov;134(11):1177-81.
Arch Otolaryngol Head Neck Surg. 2008 Nov;134(11):1177-81.