Инфекции, вызываемые стафилококками
Стафилококки хорошо известны как возбудители гнойно-септических инфекций у человека и животных. Наряду с представителями семейства Enterobacteriaceae они занимают ведущее место в этиологии гнойных заболеваний. Род Staphylococcus включает в себя 35 различных видов. В зависимости от способности продуцировать коагулазу, фермент, вызывающий коагуляцию плазмы крови, они подразделяются на две группы: коагулазопозитивные и коагулазонегативные. Место обитания стафилококков – человек и теплокровных животные, внешняя среда. Локализация у человека – кожа и слизистые оболочки, толстый кишечник. Источником стафилококковых инфекций является больной человек или здоровый носитель. Пути передачи: воздушно-капельный, воздушно-пылевой, контактный, пищевой. Восприимчивость к инфекции зависит от общего состояния организма и возраста. Наиболее восприимчивы дети, особенно новорожденные и грудного возраста. В норме способность стафилококка к инвазии и резистентность хозяина хорошо сбалансированы, поэтому инфекция не развивается, пока не создастся ситуация, когда встречаются высоковирулентный микроорганизм или макроорганизм со сниженной резистентностью.
Наиболее известным представителем коагулазопозитивных стафилококков является S.aureus (золотистый стафилококк). Он встречается в передних отделах носовых ходов у 20–40% здоровых взрослых людей. Приблизительно у 1/3 населения он постоянно выделяется из носа, у 1/3 отмечается транзиторное носительство и 1/3 свободна от носительства. S.aureus наиболее часто выделяется при гнойной патологии, вызывает целый ряд заболеваний: фолликулиты, фурункулы и карбункулы, гидроадениты, маститы, раневые инфекции, бактериемии и эндокардиты, менингиты, перикардиты, легочные инфекции, остеомиелиты и артриты, гнойные миозиты, пищевые отравления, синдром токсического шока. Упомянутые заболевания обусловливаются факторами патогенности: капсульными полисахаридами, пептидогликанами и тейхоевыми кислотами, протеином А, ферментами, гемолизинами, токсинами (эксфолиативный, энтеротоксины от А до Е, Н и I), суперантигеном, который принадлежит к энтеротоксину (TSST-1), вызывающему токсический шок синдром.
Все остальные коагулазопозитивные стафилококки выделяются в основном от животных и редко от человека, но в отдельных случаях могут вызывать у человека гнойно-воспалительные заболевания.
Среди коагулазонегативных стафилококков наиболее значимы в патологии человека S.epidermidis и S.saprophyticus. Они могут вызывать инфекции мочевыводящих путей, остеомиелиты, бактериемии, инфекции у новорожденных детей в палатах интенсивной терапии, заболевания глаз, кожные инфекции, поражают клапаны сердца, вызывают гнойные воспаления при операции по замене сердечных клапанов на искусственные, при шунтирование органов, использование внутривенных катетеров, катетеров при гемодиализе, а также при ангиопластике.
В настоящее время микроорганизмы рода Staphylococcus играют лидирующую роль среди возбудителей внутрибольничных инфекций. До определенного времени пенициллин был основным препаратом выбора при лечении тяжелых гнойных инфекций вызываемых S. aureus. Затем стали появляться штаммы устойчивые к этому антибиотику. Оказалось, что устойчивость к пенициллину была обусловлена продукцией фермента .-лактамазы разрушающей β-лактамное кольцо в молекуле пенициллина. В настоящее время около 80% изолируемых штаммов S.aureus синтезируют β-лактамазу. Вместо пенициллина в случае выделения пенициллин резистентных штаммов применяют полусинтетические пенициллины устойчивые к β-лактамазе. Но с 80-х годов начинают выделяться штаммы S.aureus устойчивые и к этой группе антибиотиков в частности к оксациллину и метициллину. Устойчивость таких штаммов связана с продукцией пенициллин связывающего белка (PBP 2а), синтез которого в свою очередь связан с приобретением стафилококками хромосомного гена mecA. Штаммы S.aureus, обладающие этим геном проявляют устойчивость ко всем β-лактамным антибиотикам включая цефалоспорины. S.aureus с упомянутым механизмом устойчивости присваивается термин метициллин- резистентные штаммы.
aureus. Затем стали появляться штаммы устойчивые к этому антибиотику. Оказалось, что устойчивость к пенициллину была обусловлена продукцией фермента .-лактамазы разрушающей β-лактамное кольцо в молекуле пенициллина. В настоящее время около 80% изолируемых штаммов S.aureus синтезируют β-лактамазу. Вместо пенициллина в случае выделения пенициллин резистентных штаммов применяют полусинтетические пенициллины устойчивые к β-лактамазе. Но с 80-х годов начинают выделяться штаммы S.aureus устойчивые и к этой группе антибиотиков в частности к оксациллину и метициллину. Устойчивость таких штаммов связана с продукцией пенициллин связывающего белка (PBP 2а), синтез которого в свою очередь связан с приобретением стафилококками хромосомного гена mecA. Штаммы S.aureus, обладающие этим геном проявляют устойчивость ко всем β-лактамным антибиотикам включая цефалоспорины. S.aureus с упомянутым механизмом устойчивости присваивается термин метициллин- резистентные штаммы. В ряде случаев устойчивость к полусинтетическим пенициллинам может быть обусловлена гиперпродукцией β-лактамаз. В этом случае устойчивость к полусинтетическим пенициллинам при определении ее в лабораторных условиях характеризуется как умеренная. Метициллин-резистентные штаммы
В ряде случаев устойчивость к полусинтетическим пенициллинам может быть обусловлена гиперпродукцией β-лактамаз. В этом случае устойчивость к полусинтетическим пенициллинам при определении ее в лабораторных условиях характеризуется как умеренная. Метициллин-резистентные штаммы
 В отличие от антибиотиков они не подавляют рост нормальной симбиотической микрофлоры человека и не приводят к дисбактериозам. Тем не менее, нужно имеет в виду, что фаги также вызывают развитие резистентности у стафилококков, поэтому перед их использованием, как и перед применением антибиотиков, необходимо проверять чувствительность к ним у изолируемых штаммах стафилококков.
Показания к обследованию. Признаки гнойно-септической инфекции, обследование медицинского персонала на носительство.
В отличие от антибиотиков они не подавляют рост нормальной симбиотической микрофлоры человека и не приводят к дисбактериозам. Тем не менее, нужно имеет в виду, что фаги также вызывают развитие резистентности у стафилококков, поэтому перед их использованием, как и перед применением антибиотиков, необходимо проверять чувствительность к ним у изолируемых штаммах стафилококков.
Показания к обследованию. Признаки гнойно-септической инфекции, обследование медицинского персонала на носительство.
Материал для исследований. Кровь, СМЖ, гной, раневое отделяемое, грудное молоко, мазки из носа; смывы c медицинского оборудования и инвентаря.
Этиологическая лабораторная диагностика включает выделение возбудителя на питательных средах, выявление его ДНК.
Сравнительная характеристика методов лабораторной диагностики, показания к применению различных лабораторных исследований. Техника выделения возбудителя в настоящее время хорошо отработана.
 aureus и метициллинрезистентных коагулазонегативных стафилококков. Данное исследование отличается простотой и воспроизводимостью, что позволяет оптимизировать эпидемиологический надзор за распространением метициллинрезистентных штаммов, значительно снизив время и трудоемкость исследования. Однако, выявление специфического фрагмента ДНК S.aureus, S.epidermidis, S.haemolyticus, S.saprophyticus методом ПЦР не позволяет выявить жизнеспособные микроорганизмы, а также определить у них чувствительность к антибиотикам.
aureus и метициллинрезистентных коагулазонегативных стафилококков. Данное исследование отличается простотой и воспроизводимостью, что позволяет оптимизировать эпидемиологический надзор за распространением метициллинрезистентных штаммов, значительно снизив время и трудоемкость исследования. Однако, выявление специфического фрагмента ДНК S.aureus, S.epidermidis, S.haemolyticus, S.saprophyticus методом ПЦР не позволяет выявить жизнеспособные микроорганизмы, а также определить у них чувствительность к антибиотикам.
Особенности интерпретации результатов лабораторных исследований. При исследовании стерильного биологического материала (кровь, СМЖ) клиническое значение имеет обнаружение
Стафилококки реферат по медицине — Docsity
Стафилококки Общая характеристика.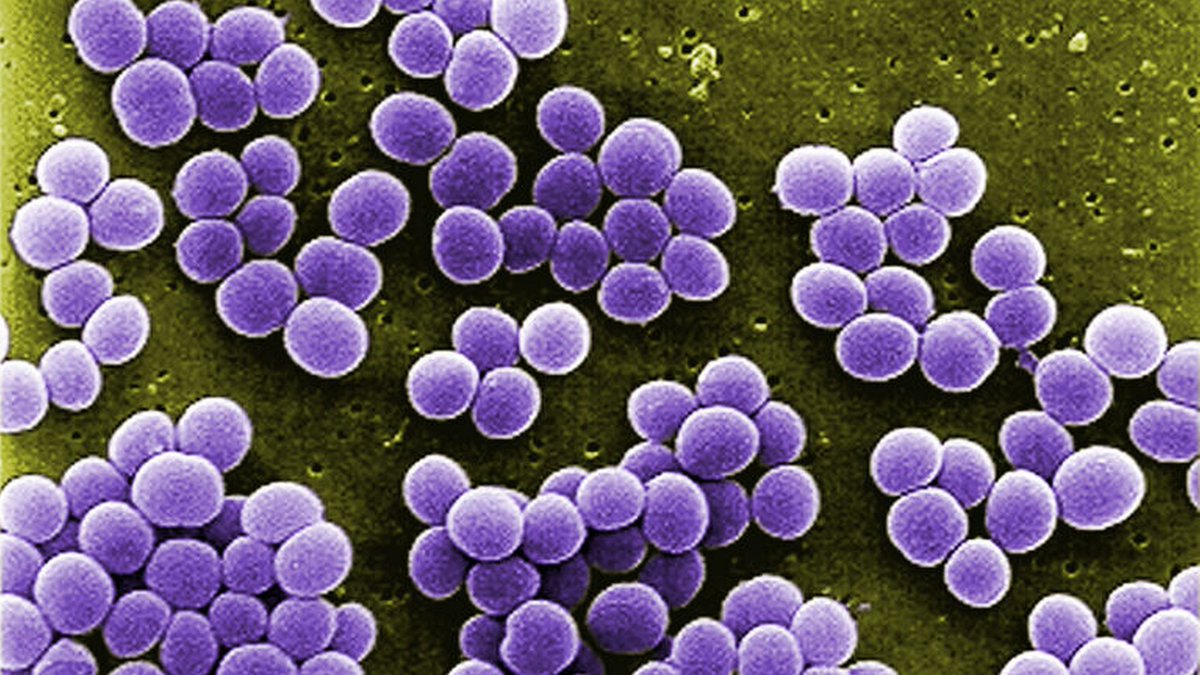 Стафилококки обычно встречаются в виде скоплений, напоминающих виноградную гроздь. Отдельные кокки, приметно 1 мкм в диаметре, имеют тенденцию объединяться в скопления, поскольку их деление происходит в трех взаимно перпендикулярных плоскостях и дочерние клетки сохраняют своеобразное пространственное групповое взаиморасположение. При специальных условиях они могут располагаться поодиночке, попарно, или в виде коротких цепочек. Они грамположительны, неподвижны, не образуют спор и активно растут практически на всех искусственных средах, обычно образуя непрозрачные, гладкие, блестящие колонии. Поскольку стафилококки продуцируют каталазу, перекись водорода, образующаяся как метаболит при аэробных условиях, для них не токсична, и, большей частью, они лучше растут в присутствии кислорода. Однако, они легко переносят отсутствие кислорода, а некоторые из них даже являются строгими анаэробами. Они лучше растут при температуре 25 – 35°С, но могут расти и при 8° и при температуре выше 48°С. При культивировании на кровяном агаре в аэробных условиях образуют пигменты – от золотистого до лимонно желтого и белого цвета.
Стафилококки обычно встречаются в виде скоплений, напоминающих виноградную гроздь. Отдельные кокки, приметно 1 мкм в диаметре, имеют тенденцию объединяться в скопления, поскольку их деление происходит в трех взаимно перпендикулярных плоскостях и дочерние клетки сохраняют своеобразное пространственное групповое взаиморасположение. При специальных условиях они могут располагаться поодиночке, попарно, или в виде коротких цепочек. Они грамположительны, неподвижны, не образуют спор и активно растут практически на всех искусственных средах, обычно образуя непрозрачные, гладкие, блестящие колонии. Поскольку стафилококки продуцируют каталазу, перекись водорода, образующаяся как метаболит при аэробных условиях, для них не токсична, и, большей частью, они лучше растут в присутствии кислорода. Однако, они легко переносят отсутствие кислорода, а некоторые из них даже являются строгими анаэробами. Они лучше растут при температуре 25 – 35°С, но могут расти и при 8° и при температуре выше 48°С. При культивировании на кровяном агаре в аэробных условиях образуют пигменты – от золотистого до лимонно желтого и белого цвета. Золотистый пигмент дал название одному из видов стафилококка – Staphylococcus aureus. Однако, при этом, некоторые штаммы золотистого стафилококка могут продуцировать и белый пигмент. Стафилококки устойчивее других бактерий к действию жара, света, высушивания, экстремальных температур и химических агентов. Они выдерживают 60°С в течение часа, а отдельные штаммы даже 80°С в течение 30 минут, хотя большинство вегетативных форм бактерий погибают при воздействии 60°С в течение 30 минут. Благодаря своей устойчивости к высушиванию стафилококки могут переноситься с частицами пыли, могут недели и месяцы сохраняться в высохшем гное или мокроте. Другой особенностью стафилококков является их устойчивость в солевой среде (не погибают при концентрации NaCl до 15%). В связи с этим способны сохраняться в консервированных продуктах (пресервах). В продуктах питания, сохраняемых путем соления, стафилококки могут расти и продуцировать энтеротоксин. Эти микробы устойчивы к действию фенола и большинству других дезинфектантов, чувствительны к основным красителям.
Золотистый пигмент дал название одному из видов стафилококка – Staphylococcus aureus. Однако, при этом, некоторые штаммы золотистого стафилококка могут продуцировать и белый пигмент. Стафилококки устойчивее других бактерий к действию жара, света, высушивания, экстремальных температур и химических агентов. Они выдерживают 60°С в течение часа, а отдельные штаммы даже 80°С в течение 30 минут, хотя большинство вегетативных форм бактерий погибают при воздействии 60°С в течение 30 минут. Благодаря своей устойчивости к высушиванию стафилококки могут переноситься с частицами пыли, могут недели и месяцы сохраняться в высохшем гное или мокроте. Другой особенностью стафилококков является их устойчивость в солевой среде (не погибают при концентрации NaCl до 15%). В связи с этим способны сохраняться в консервированных продуктах (пресервах). В продуктах питания, сохраняемых путем соления, стафилококки могут расти и продуцировать энтеротоксин. Эти микробы устойчивы к действию фенола и большинству других дезинфектантов, чувствительны к основным красителям. Имеют тенденцию к формированию резистентности к сульфаниламидам и антибиотикам. Около 80% штаммов Staphylococcus aureus резистентны к пенициллину. Род Staphylococcus представлен тремя видами: 1.Staphylococcus aureus; 2.Staphylococcus epidermidis; 3.Staphylococcus saprophyticus. Виды различаются преимущественно по биохимическим свойствам и вырабатываемым ферментам. Staphylococcus aureus ферментирует манит в анаэробных условиях и продуцирует коагулазу, тогда как два других вида лишены этих свойств. Staphylococcus saprophyticus – первично сапрофитический, о чем свидетельствует его название. Он, по-видимому, является потенциально патогенным, обладает ограниченной инвазивностью. Способен вызывать инфекцию мочевого тракта. Токсические продукты. Стафилококк вырабатывает много продуктов с выраженными токсическими свойствами. Вероятно, никакой другой микроб не продуцирует их в таком количестве. Среди них экстрацеллюлярные токсины, гемолизины (стафилолизины), ферменты. Все они, в той или иной степени, обусловливают болезнетворность и вирулентность микроба.
Имеют тенденцию к формированию резистентности к сульфаниламидам и антибиотикам. Около 80% штаммов Staphylococcus aureus резистентны к пенициллину. Род Staphylococcus представлен тремя видами: 1.Staphylococcus aureus; 2.Staphylococcus epidermidis; 3.Staphylococcus saprophyticus. Виды различаются преимущественно по биохимическим свойствам и вырабатываемым ферментам. Staphylococcus aureus ферментирует манит в анаэробных условиях и продуцирует коагулазу, тогда как два других вида лишены этих свойств. Staphylococcus saprophyticus – первично сапрофитический, о чем свидетельствует его название. Он, по-видимому, является потенциально патогенным, обладает ограниченной инвазивностью. Способен вызывать инфекцию мочевого тракта. Токсические продукты. Стафилококк вырабатывает много продуктов с выраженными токсическими свойствами. Вероятно, никакой другой микроб не продуцирует их в таком количестве. Среди них экстрацеллюлярные токсины, гемолизины (стафилолизины), ферменты. Все они, в той или иной степени, обусловливают болезнетворность и вирулентность микроба. Ни один штамм не способен вырабатывать все токсические продукты сразу. Гемолизины – это экзотоксины, действующие непосредственно на клеточную мембрану, вследствие чего происходит лизис эритроцитов, лейкоцитов, тромбоцитов макрофагов и развивается поражение многих тканей. Действием гемолизина, вероятно, объясняются фатальные исходы многих случаев стафилококковых инфекций. При росте культуры стафилококка на кровяном агаре гемолиз проявляется в виде зоны просветления (бета – гемолиз). В отличие от стрептококка, стафилококк не вызывает частичный гемолиз (альфа – гемолиз). Следует отметить, что греческие буквы используются для обозначения иммунологически различающихся типов стафилококковых гемолизинов, в то время как у стрептококков эти буквы обозначают тип гемолиза – полный, или неполный. Например, гемолизин, обозначаемый как альфа – гемолизин (альфа – лизин, альфа – токсин) у стафилококков означает наличие светлой зоны вокруг колоний на кровяном агаре. Цитотоксин – один из наиболее важных факторов вирулентности стафилококков, вызывает аггрегацию тромбоцитов и избирательно действует на гладкую мускулатуру мелких вен.
Ни один штамм не способен вырабатывать все токсические продукты сразу. Гемолизины – это экзотоксины, действующие непосредственно на клеточную мембрану, вследствие чего происходит лизис эритроцитов, лейкоцитов, тромбоцитов макрофагов и развивается поражение многих тканей. Действием гемолизина, вероятно, объясняются фатальные исходы многих случаев стафилококковых инфекций. При росте культуры стафилококка на кровяном агаре гемолиз проявляется в виде зоны просветления (бета – гемолиз). В отличие от стрептококка, стафилококк не вызывает частичный гемолиз (альфа – гемолиз). Следует отметить, что греческие буквы используются для обозначения иммунологически различающихся типов стафилококковых гемолизинов, в то время как у стрептококков эти буквы обозначают тип гемолиза – полный, или неполный. Например, гемолизин, обозначаемый как альфа – гемолизин (альфа – лизин, альфа – токсин) у стафилококков означает наличие светлой зоны вокруг колоний на кровяном агаре. Цитотоксин – один из наиболее важных факторов вирулентности стафилококков, вызывает аггрегацию тромбоцитов и избирательно действует на гладкую мускулатуру мелких вен. Лейкоцидин – негемолитический экзотоксин, разрушающий клетки белой крови. Он вызывает дегрануляцию полиморфонуклеарных нейтрофильных лейкоцитов и макрофагов. Энтеротоксин – внеклеточный токсин, который вырабатывают около 50% коагулазоположительных штаммов и который вызывает большинство случаев пищевого отравления. Токсин действует непосредственно на рвотный центр центральной нервной системы. Продукция токсина обусловлена фаговой конверсией. Различают 5 типов токсина – А, В, С, D, E. Накопление энтеротоксина в зараженной пище приводит к пищевому отравлению с синдромом гастроэнтерита, который не является инфекцией в обычном понимании этого термина, это скорее токсемия. Присутствие токсина в подозреваемой пище можно установить иммунологически, например, в реакции преципитации. Эксфолиатин (эксфолиативный токсин) – это токсин, продукция которого обусловлена плазмидой. Избирательно повреждает некоторые клетки кожи таким образом, что обширные участки кожного покрова могут отслаиваться полностью.
Лейкоцидин – негемолитический экзотоксин, разрушающий клетки белой крови. Он вызывает дегрануляцию полиморфонуклеарных нейтрофильных лейкоцитов и макрофагов. Энтеротоксин – внеклеточный токсин, который вырабатывают около 50% коагулазоположительных штаммов и который вызывает большинство случаев пищевого отравления. Токсин действует непосредственно на рвотный центр центральной нервной системы. Продукция токсина обусловлена фаговой конверсией. Различают 5 типов токсина – А, В, С, D, E. Накопление энтеротоксина в зараженной пище приводит к пищевому отравлению с синдромом гастроэнтерита, который не является инфекцией в обычном понимании этого термина, это скорее токсемия. Присутствие токсина в подозреваемой пище можно установить иммунологически, например, в реакции преципитации. Эксфолиатин (эксфолиативный токсин) – это токсин, продукция которого обусловлена плазмидой. Избирательно повреждает некоторые клетки кожи таким образом, что обширные участки кожного покрова могут отслаиваться полностью. Особенно чувствительны к действию токсина новорожденные и маленькие дети. Это поражение получило название «синдром ошпаренной кожи». Коагулаза, важный экстрацеллюлярный фермент, продуцируемый только некоторыми стафилококками (коагулазоположительные), вызывает образование сгустка плазмы крови. В лаборатории определение коагулазы используется как единственное достоверное доказательство патогенности выделенного штамма. У невирулентных штаммов попытки обнаружить коагулазу обычно заканчиваются неудачей. Эти штаммы обозначают как коагулазоотрицательные. При наличии данного фермента и проявлении его действия отдельные кокки оказываются покрытыми слоем фибрина и, таким образом, они надежно защищены от атаки фагоцитов. Способность к продукции коагулазы коррелирует с наличием у этих штаммов и других токсических продуктов. Коагулазо + стафилококки также могут иметь фактор склеивания – это связанная с клеткой, но антигенно отличающаяся форма коагулазы, вызывающая быстрое склеивание клеток, эмульгированных в капле плазмы.
Особенно чувствительны к действию токсина новорожденные и маленькие дети. Это поражение получило название «синдром ошпаренной кожи». Коагулаза, важный экстрацеллюлярный фермент, продуцируемый только некоторыми стафилококками (коагулазоположительные), вызывает образование сгустка плазмы крови. В лаборатории определение коагулазы используется как единственное достоверное доказательство патогенности выделенного штамма. У невирулентных штаммов попытки обнаружить коагулазу обычно заканчиваются неудачей. Эти штаммы обозначают как коагулазоотрицательные. При наличии данного фермента и проявлении его действия отдельные кокки оказываются покрытыми слоем фибрина и, таким образом, они надежно защищены от атаки фагоцитов. Способность к продукции коагулазы коррелирует с наличием у этих штаммов и других токсических продуктов. Коагулазо + стафилококки также могут иметь фактор склеивания – это связанная с клеткой, но антигенно отличающаяся форма коагулазы, вызывающая быстрое склеивание клеток, эмульгированных в капле плазмы. Липазы стафилококка – это ферменты, которые разрушают липиды клеточных структур и липопротеины крови. Стафилококки утилизируют метаболиты кожных структур и потому способны интенсивно колонизировать (заселять) поверхность кожи. Образование липазы дает этому микробу способность к инвазии здоровой кожи и подкожной клетчатки с формированием локальных абсцессов. Штаммы без липазы чаще связаны с генерализованной инфекцией. Гиалуронидаза (фактор распространения, инвазии), которую вырабатывают более 90% патогенных стафилококков, повышает проницаемость тканей для кокков и их токсических субстанций. Вызывает деградацию гиалуроновой кислоты, которая соединяет клетки тканей. В норме способность стафилококка к инвазии и резистентность хозяина хорошо сбалансированы поэтому инфекция не развивается, пока не создастся ситуация, когда встречаются высоковирулентный микроб или макроорганизм со сниженной резистентностью. Как правило, развивается локальный процесс – абсцесс или фурункул, без распространения инфекции.
Липазы стафилококка – это ферменты, которые разрушают липиды клеточных структур и липопротеины крови. Стафилококки утилизируют метаболиты кожных структур и потому способны интенсивно колонизировать (заселять) поверхность кожи. Образование липазы дает этому микробу способность к инвазии здоровой кожи и подкожной клетчатки с формированием локальных абсцессов. Штаммы без липазы чаще связаны с генерализованной инфекцией. Гиалуронидаза (фактор распространения, инвазии), которую вырабатывают более 90% патогенных стафилококков, повышает проницаемость тканей для кокков и их токсических субстанций. Вызывает деградацию гиалуроновой кислоты, которая соединяет клетки тканей. В норме способность стафилококка к инвазии и резистентность хозяина хорошо сбалансированы поэтому инфекция не развивается, пока не создастся ситуация, когда встречаются высоковирулентный микроб или макроорганизм со сниженной резистентностью. Как правило, развивается локальный процесс – абсцесс или фурункул, без распространения инфекции. Но в части случаев микроб выходит за пределы локальной инфекции, попадает в кровоток и поражает разные ткани и органы тела. Механизм передачи инфекции преимущественно контактный. Например, через руки персонала в больнице. Персонал подвергается риску стать носителями, в этом случае стафилококк может длительно находиться у них на слизистой носа. Носители могут стать источниками инфекции. Бактериологическая диагностика. Бактериологический диагноз стафилококковой инфекции не представляет особых сложностей, если исследуют кровь и другие жидкости организма, в норме стерильные. Выделенную культуру стафилококка необходимо идентифицировать как патогенную, в отличие от обычного микроба, обитающего на коже. Для этого используют ряд тестов. Свежевыделенные культуры стафилококка характеризуются как патогенные по таким признакам как продукция желтого пигмента, гемолизина, ферментация маннита, продукция ДНК-азы и коагулазы. Фаготипирование. Бактериофаги – вирусы, поражающие бактерий и, в некоторых случаях, вызывающие их лизис.
Но в части случаев микроб выходит за пределы локальной инфекции, попадает в кровоток и поражает разные ткани и органы тела. Механизм передачи инфекции преимущественно контактный. Например, через руки персонала в больнице. Персонал подвергается риску стать носителями, в этом случае стафилококк может длительно находиться у них на слизистой носа. Носители могут стать источниками инфекции. Бактериологическая диагностика. Бактериологический диагноз стафилококковой инфекции не представляет особых сложностей, если исследуют кровь и другие жидкости организма, в норме стерильные. Выделенную культуру стафилококка необходимо идентифицировать как патогенную, в отличие от обычного микроба, обитающего на коже. Для этого используют ряд тестов. Свежевыделенные культуры стафилококка характеризуются как патогенные по таким признакам как продукция желтого пигмента, гемолизина, ферментация маннита, продукция ДНК-азы и коагулазы. Фаготипирование. Бактериофаги – вирусы, поражающие бактерий и, в некоторых случаях, вызывающие их лизис. Действие фагов специфично. Только отдельный фаг или группа фагов поражают конкретный штамм бактерий, что позволяет использовать фаги для типирования бактерий (фаготипирование). С этой целью взвесь известного фага вносится в чашку со свежей культурой микроба, подлежащего типированию. Если этот микроб чувствителен к действию данного фага, он лизируется и роста на среде не дает. На чашке появляются прозрачные зоны, так называемые «бляшки» или «негативные колонии». Фаготипирование стафилококков заслуживает специального упоминания. Было установлено, что специфические бактериофаги (стафилофаги, табл.1) реагируют с 60% коагулазо+ 0 0 1 Eстафилококков. Коагулазо стафилококки не так чувствитекльны. Поскольку этот процесс специфический, он используется для определения фаговаров выделенных стафилококков. Для удобства бактериофагам присвоены определенные номера, и штаммы стафилококка, лизирующиеся определенным фагом имеют номер этого фага и обозначаются как соответствующий фаговар. Это касается только штаммов S.
Действие фагов специфично. Только отдельный фаг или группа фагов поражают конкретный штамм бактерий, что позволяет использовать фаги для типирования бактерий (фаготипирование). С этой целью взвесь известного фага вносится в чашку со свежей культурой микроба, подлежащего типированию. Если этот микроб чувствителен к действию данного фага, он лизируется и роста на среде не дает. На чашке появляются прозрачные зоны, так называемые «бляшки» или «негативные колонии». Фаготипирование стафилококков заслуживает специального упоминания. Было установлено, что специфические бактериофаги (стафилофаги, табл.1) реагируют с 60% коагулазо+ 0 0 1 Eстафилококков. Коагулазо стафилококки не так чувствитекльны. Поскольку этот процесс специфический, он используется для определения фаговаров выделенных стафилококков. Для удобства бактериофагам присвоены определенные номера, и штаммы стафилококка, лизирующиеся определенным фагом имеют номер этого фага и обозначаются как соответствующий фаговар. Это касается только штаммов S. aureus. Большинство других стафилококков относятся к нетипирующимся. По решению международного подкомитета по фаготипированию стафилококков, предложена международная классификация фаговаров S.aureus (табл.1) Таблица 1 Международная классификация фаговаров S.aureus Группы Отдельные фаги Общие фаговары S.aureus I 29, 52, 52А, 79, 80 29, 52/52А; 52/52А/80/81; 80 II 3А, 3В, 3С, 55, 71 3А/3В/3С; 3С/55 III 6, 7, 42Е, 47, 53, 54, 75 6/7/47/53/54/75/77 IV 42D Смешанная 81, 187 Фаготипирование используется в эпидемиологических целях для выявления источника инфекции, так как фаготипирование высокоспецифичный процесс. В случаях, например, внутрибольничных инфекций, метод может точно указать на носителя патогенного штамма (один и тот же фаговар). Иммунитет. У людей имеется значительный естественный иммунитет к стафилококкам. Специфические антитела обнаруживаются в сыворотке крови большинства людей. Появление их связано с перенесенными, так называемыми, «малыми» стафилококковыми инфекциями кожи и слизистых. Приобретенный иммунитет может выполнять определенную защитную функцию, но практически не может служить серьезной защитой против стафилококковой инфекции. Особую группу риска составляют лица со сниженными защитными реакциями, например вследствие диабета или вирусных инфекций. Профилактика и контроль за стафилококковой инфекцией. Основу контроля за стафилококковой инфекцией в больницах (и в любом другом месте) является тщательное соблюдение гигиенических стандартов и неукоснительное соблюдение правил асептики. Циркулирующие патогенные штаммы стафилококка так же чувствительны к дезинфицирующим средствам, как и обычные непатогенные штаммы. Важное мероприятие – выявление носителей патогенного стафилококка (на слизистой носа) среди персонала, особенно в отделениях новорожденных. Фаготипирование коагулазо+ стафилококков помогает выявить источник в случае внутрибольничных инфекций. © «МЕдицинский Вестник» № 1`99 (77)
aureus. Большинство других стафилококков относятся к нетипирующимся. По решению международного подкомитета по фаготипированию стафилококков, предложена международная классификация фаговаров S.aureus (табл.1) Таблица 1 Международная классификация фаговаров S.aureus Группы Отдельные фаги Общие фаговары S.aureus I 29, 52, 52А, 79, 80 29, 52/52А; 52/52А/80/81; 80 II 3А, 3В, 3С, 55, 71 3А/3В/3С; 3С/55 III 6, 7, 42Е, 47, 53, 54, 75 6/7/47/53/54/75/77 IV 42D Смешанная 81, 187 Фаготипирование используется в эпидемиологических целях для выявления источника инфекции, так как фаготипирование высокоспецифичный процесс. В случаях, например, внутрибольничных инфекций, метод может точно указать на носителя патогенного штамма (один и тот же фаговар). Иммунитет. У людей имеется значительный естественный иммунитет к стафилококкам. Специфические антитела обнаруживаются в сыворотке крови большинства людей. Появление их связано с перенесенными, так называемыми, «малыми» стафилококковыми инфекциями кожи и слизистых. Приобретенный иммунитет может выполнять определенную защитную функцию, но практически не может служить серьезной защитой против стафилококковой инфекции. Особую группу риска составляют лица со сниженными защитными реакциями, например вследствие диабета или вирусных инфекций. Профилактика и контроль за стафилококковой инфекцией. Основу контроля за стафилококковой инфекцией в больницах (и в любом другом месте) является тщательное соблюдение гигиенических стандартов и неукоснительное соблюдение правил асептики. Циркулирующие патогенные штаммы стафилококка так же чувствительны к дезинфицирующим средствам, как и обычные непатогенные штаммы. Важное мероприятие – выявление носителей патогенного стафилококка (на слизистой носа) среди персонала, особенно в отделениях новорожденных. Фаготипирование коагулазо+ стафилококков помогает выявить источник в случае внутрибольничных инфекций. © «МЕдицинский Вестник» № 1`99 (77)
Стафилококк — частая больничная инфекция
Если верить официальной статистике, количество смертельных случаев от одной из наиболее опасных больничной инфекций — MRSA (метициллин-резистентного золотистого стафилококка) в последние годы значительно увеличилось, а число случаев заражения постоянно растет.
Что такое золотистый стафилококк (MRSA)?
Стафилококки – распространенное семейство бактерий. Они присутствуют у большинства людей и являются частью нормальной микрофлоры кожных покровов, слизистых оболочек и нижнего отдела кишечника. Носительство стафилококка часто встречается и у медицинского персонала.
Заражение стафилококком в больницах и роддомах происходит воздушно-капельным путем и через загрязненные руки медиков. Заразиться можно через открытые раны, ожоги, глаза, кожу, кровь. Возможна передача инфекции с инструментами, катетерами, перевязочным материалом, предметами ухода, а также пищей.
MRSA – это «модификация» золотистого стафилококка (Staphylococcus aureus), устойчивая к одному или более антибиотикам. На сегодняшний день исследователи обнаружили 17 видов MRSA, отличающиеся разной степенью устойчивости к антибиотикам.
Для лечения MRSA необходимо применение более высокой дозы препаратов, увеличение длительности лечения или использование альтернативного антибактериального средства, к которому данный вид MRSA все еще чувствителен.
Инфицированность MRSA может вызывать широкий спектр симптомов в зависимости от органа, подвергшегося заражению. Признаками заражения являются краснота, отечность и болезненность инфицированного участка. Клинические проявления стафилококковых болезней многообразны – от заболеваний кожи и пневмонии до менингита и сепсиса.
Почему MRSA существует?
Естественный отбор до сих пор является основным принципом развития всего живого. А бактерии живут в этом мире намного дольше, чем мы, поэтому они особенно преуспели в этом. Кроме этого, гены бактерий постоянно видоизменяются, чтобы противостоять основному своему врагу — антибиотику.
Более слабые виды бактерий, столкнувшись с антибиотиком, погибают, в то время как более стойкие просто игнорируют лекарство. Это означает, что в следующий раз вы можете столкнуться уже со стафилококком, который удачно пережил встречу с антибиотиком, а, следовательно, приобрел устойчивость к нему.
Именно поэтому врачи всегда советуют пациентам пропивать весь курс антибиотиков до конца. Если пациент не заканчивает курс лечения, то большинство бактерий умирает, но не все. Выжившие приобретают резистентность (то есть устойчивость) к антибиотикам. А каждая последующая мутация только увеличивает способность бактерий к выживанию.
Применение огромного числа антибиотиков в больницах и роддомах вызывает огромное число мутаций стафилококка, тем самым увеличивая его устойчивость к лекарственным препаратам.
Почему это настолько опасно?
Тот факт, что в больницах стафилококком заражаются чаще, чем вне лечебных учреждений, можно объяснить.
- Во-первых, обитатели больниц обычно более слабы, чем остальное население, что делает их более уязвимыми для инфекции.
- Во-вторых, условия в больницах, где находится большое количество людей на небольших площадях, являются прекрасной средой для передачи инфекций. Инфицированность MRSA может быть очень опасна для ослабленных пациентов и новорожденных, особенно если ее вовремя не распознать и не вылечить правильными антибиотиками.
Каковы перспективы?
Сильную обеспокоенность у врачей вызывают сообщения об увеличении количества инфекций и смертельных случаев из-за MRSA. Может случиться так, что сформируется вид стафилококка, устойчивый ко всем антибиотикам. Уже существует VRSA или ванкомицин-резистентный Staphylococcus Aureus, устойчивый к ванкомицину. А в Великобритании зафиксирован GISA или гликопептид-резистентный Staphylococcus aureus, соответственно устойчивый к гликопептидам.
Хотя новые антибиотики разрабатываются постоянно, пессимистично настроенные эксперты полагают, что выработка устойчивости к ним — это только вопрос времени.
Одна из главных причин появления устойчивых к лекарствам микробов — злоупотребление антибиотиками. Сплошь и рядом встречается назначение врачом антибиотиков пациентам с вирусной инфекцией. При этом антибиотики не оказывают никакого эффекта на вирусы. Зато бактерии в организме от применения антибиотиков прекрасно себя чувствуют — мутируют и размножаются. Поэтому сейчас врачам рекомендовано сократить назначение антибиотиков.
Важным фактором в защите пациентов от MRSA является улучшение гигиенических условий больниц. Ручные осмотры в больницах в настоящее время приносят больше вреда, чем пользы, так как благодаря им разносится инфекция. Решением этой проблемы видится тщательная обработка рук после каждого пациента. Есть также предложение ввести в штат больниц специальную должность медсестры, ответственной за чистоту (в российских ЛПУ обычно эти обязанности возлагаются на старшую медсестру отделения).
Хотя вопрос о том, являются ли грязные руки источником размножения стафилококка, достаточно спорный. Некоторые вспоминают, что в предыдущие столетия люди — в большинстве своем — вообще не знали, что такое бактериальная инфекция. Вынул морковку из грядки, в луже прополоскал и съел. И никто от этого не умирал, максимум пару дней донимало расстройство желудка. Это происходило потому, что иммунитет человека стимулировался естественным образом. Сейчас, в «стерильных» условиях роддомов, куда человек попадает сразу после рождения, этого не происходит. Иммунитет снижается, следовательно, увеличивается восприимчивость к различного рода бактериям, которые ранее даже не являлись патогенными.
Пока врачи ищут способ борьбы с MRSA, число инфицированных неуклонно растет. А многие эксперты сходятся во мнении, что может потребоваться очень крупное научное достижение, родственное открытию пенициллина, для того, чтобы люди получили возможность эффективно противостоять устойчивым бактериям.
Источники
- Mahony M., Lean D., Pham L., Horvath R., Suna J., Ward C., Veerappan S., Versluis K., Nourse C. Infective Endocarditis in Children in Queensland, Australia: Epidemiology, Clinical Features and Outcome. // Pediatr Infect Dis J — 2021 — Vol — NNULL — p.; PMID:33902079
- McNeil JC., Joseph M., Sommer LM., Vallejo JG. The Contemporary Epidemiology, Microbiology and Management of Chronic Osteomyelitis in US Children. // Pediatr Infect Dis J — 2021 — Vol — NNULL — p.; PMID:33902075
- Ochi F., Tauchi H., Moritani K., Murakami S., Miyamoto H., Ueda M., Nagai K., Eguchi-Ishimae M., Eguchi M. A Catheter-Related Bloodstream Infection by Brevibacterium casei in a Child with Acute Myeloid Leukemia: Case Report and Literature Review. // Case Rep Pediatr — 2021 — Vol2021 — NNULL — p.6691569; PMID:33898073
- François B., Jafri HS., Chastre J., Sánchez-García M., Eggimann P., Dequin PF., Huberlant V., Viña Soria L., Boulain T., Bretonnière C., Pugin J., Trenado J., Hernandez Padilla AC., Ali O., Shoemaker K., Ren P., Coenjaerts FE., Ruzin A., Barraud O., Timbermont L., Lammens C., Pierre V., Wu Y., Vignaud J., Colbert S., Bellamy T., Esser MT., Dubovsky F., Bonten MJ., Goossens H., Laterre PF., Chochrad D., Dive A., Foret F., Simon M., Spapen H., Creteur J., Bouckaert Y., Biston P., Bourgeois M., Novacek M., Vymazal T., Svoboda P., Pachl J., Sramek V., Hanauer M., Hruby T., Balik M., Suchy T., Lepape A., Argaud L., Dailler F., Desachy A., Guitton C., Mercat A., Meziani F., Navellou JC., Robert R., Souweine B., Tadie JM., Maamar A., Annane D., Tamion F., Gros A., Nseir S., Schwebel C., Francony G., Lefrant JY., Schneider F., Gründling M., Motsch J., Reill L., Rolfes C., Welte T., Cornely O., Bloos F., Deja M., Schmidt K., Wappler F., Meier-Hellmann A., Komnos A., Bekos V., Koulouras V., Soultati I., Baltopoulos G., Filntisis G., Zakynthinos E., Zakynthinos S., Pnevmatikos I., Krémer I., Szentkereszty Z., Sarkany A., Marjanek Z., Moura P., Pintado Delgado MC., Montejo González JC., Ramirez P., Torres Marti A., Valia JC., Lorente J., Loza Vazquez A., De Pablo Sanchez R., Escudero D., Ferrer Roca R., Pagani JL., Maggiorini M. Efficacy and safety of suvratoxumab for prevention of Staphylococcus aureus ventilator-associated pneumonia (SAATELLITE): a multicentre, randomised, double-blind, placebo-controlled, parallel-group, phase 2 pilot trial. // Lancet Infect Dis — 2021 — Vol — NNULL — p.; PMID:33894131
- Påhlman LI., Manoharan L., Aspelund AS. Divergent airway microbiomes in lung transplant recipients with or without pulmonary infection. // Respir Res — 2021 — Vol22 — N1 — p.118; PMID:33892717
- Jones SU., Chua KH., Chew CH., Yeo CC., Abdullah FH., Othman N., Kee BP., Puah SM. spa diversity of methicillin-resistant and -susceptible Staphylococcus aureus in clinical strains from Malaysia: a high prevalence of invasive European spa-type t032. // PeerJ — 2021 — Vol9 — NNULL — p.e11195; PMID:33889447
- Alshaya MA., Almutairi NS., Shaath GA., Aldosari RA., Alnami SK., Althubaiti A., Abu-Sulaiman RM. Original Article—Surgical site infections following pediatric cardiac surgery in a tertiary care hospital: Rate and risk factors. // J Saudi Heart Assoc — 2021 — Vol33 — N1 — p.1-8; PMID:33880325
- Saltoglu N., Surme S., Ezirmik E., Kadanali A., Kurt AF., Sahin Ozdemir M., Ak O., Altay FA., Acar A., Cakar ZS., Tulek N., Kinikli S. The Effects of Antimicrobial Resistance and the Compatibility of Initial Antibiotic Treatment on Clinical Outcomes in Patients With Diabetic Foot Infection. // Int J Low Extrem Wounds — 2021 — Vol — NNULL — p.15347346211004141; PMID:33856261
- Bläckberg A., Morenius C., Olaison L., Berge A., Rasmussen M. Infective endocarditis caused by HACEK group bacteria-a registry-based comparative study. // Eur J Clin Microbiol Infect Dis — 2021 — Vol — NNULL — p.; PMID:33852103
- Gupta G., Shah MM., Raibagkar S., Shah A., Rabbi Q. Reconstruction of post-osteomyelitis 1st ray phalangeal loss by reverse dermis cross toe flap and fibula bone grafting: A rare case report. // Foot (Edinb) — 2021 — Vol — NNULL — p.101782; PMID:33849758
Ученые выяснили, как бактерии золотистого стафилококка противостоят действию антибиотиков — Газета.Ru
Сотрудники Казанского федерального университета и Страсбургского университета установили, каким образом бактерии золотистого стафилококка противостоят действию антибиотиков. В этом им помогают рибосомы — органоиды клетки, отвечающие за синтез белков. Ученые определили структуру рибосом и механизм, благодаря которому развивается устойчивость к противомикробным препаратам. Работа была выполнена в рамках проекта, поддержанного Российским научным фондом, а ее результаты были опубликованы в журналах The EMBO Journal и Nucleic Acids Research.
Золотистый стафилококк Staphylococcus aureus — шарообразная грамположительная бактерия. Это значит, что после окраски микроорганизмов по методу Грама и при последующем промывании спиртом она сохраняет фиолетовую окраску. Стафилококки сохраняются на кожных покровах и в слизистых оболочках верхних дыхательных путей и вызывают как легкие кожные инфекции, например, фурункул или угри, так и смертельно опасные заболевания, такие как менингит и пневмония.
Ученые исследовали штамм метициллин-устойчивого золотистого стафилококка — культуру микроорганизмов, изолированную и размноженную на специальной питательной среде. Этот штамм обладает повышенной устойчивостью к антибиотикам, пенициллинам и цефалоспоринам, поэтому необходимо искать новые противомикробные агенты — действующие вещества новых лекарств. Одна из мишеней для антибиотиков — бактериальная рибосома — органоид, синтезирующий белок в клетке. Более 40% клинически используемых антибиотиков нацелены против активности рибосомы.
Ученые выяснили, что в стрессовых для клеток бактерий условиях, например в присутствии антибиотика, происходит замедление биосинтеза белка за счет того, что рибосомы переходят в «спящее» состояние. Делают они это путем связывания белка стресса SaHPF (который синтезирует клетка) с рибосомами. В результате связывания белок SaHPF и рибосома образуют димер. В таком состоянии бактериальные клетки способны противостоять внешним стрессовым условиям, что обеспечивает их устойчивость к антибиотику.
«Впервые, с высоким разрешением, были определены структуры полной рибосомы грамположительной бактерии золотистого стафилококка S. Aureus и димера «спящих» рибосом. Полученные результаты на молекулярном уровне с атомарным разрешением объясняют природу механизма устойчивости к антибиотикам золотистого стафилококка и открывают путь к изучению природы стресс-ответа у других патогенных для человека бактерий, что предоставляет возможности для разработки препаратов нового поколения с повышенной селективностью», — рассказал один из авторов статьи Константин Усачев, кандидат физико-математических наук, ведущий научный сотрудник Казанского (Приволжского) федерального университета.
Для определения структур рибосом и димеров ученые использовали методы криоэлектронной микроскопии и спектроскопии ядерного магнитного резонанса (ЯМР) высокого разрешения. Ученые уничтожили клеточную стенку и удалили все ее содержимое за исключением интересующих их объектов. Авторы заморозили раствор с рибосомами в жидком этане и сделали несколько десятков тысяч снимков этих объектов в разных ракурсах. С помощью суперкомпьютера эти снимки были преобразованы в трехмерные модели рибосом и димеров. После этого исследователи провели сравнительный анализ полученной структуры 70S рибосомы золотистого стафилококка со структурами 70S рибосом других бактерий. Результаты показали наличие нескольких специфичных для золотистого стафилококка участков, которые могут быть вовлечены в процесс трансляции — синтеза белка из аминокислот на информационной, или матричной, РНК (мРНК).
«В рамках данной работы на молекулярном уровне был показан один из механизмов устойчивости этого патогена к антибиотикам, что открывает путь к разработке препаратов против стафилококка нового поколения. Полученная информация о структуре рибосомы золотистого стафилококка с высоким разрешением позволяет широкому кругу исследователей приступить к поиску новых противомикробных агентов, которые разрабатываются на основе установленных особенностей и различий в структуре аппарата синтеза белка у патогенов», — заключил ученый.
Убийца стафилококка: российские ученые разработали зубной ополаскиватель нового поколения
Материаловеды НИТУ «МИСиС» под руководством доцента кафедры физической химии Георгия Фролова совместно со специалистами Вятского государственного университета разработали уникальный состав зубного ополаскивателя, существенно меняющего состав микрофлоры зубов, уничтожающего бактерии зубного налета до 83% и снижающего воспаление десен. Клиническая апробация раствора ополаскивателя была проведена на добровольцах, на кафедре стоматологии Кировского государственного медицинского университета.
Стоматологи сегодня активно решают задачу профилактики кариеса с использованием растворов, не содержащих фтора (избыток NaF вреден как для зубов, так и для всего организма в целом). При этом зубная щетка с пастой очищает максимум 61% налета и только с жевательных, язычных и щечных поверхностей. Не многие пациенты используют зубную нить, мотивируя это отсутствием времени. Наиболее популярными становятся ополаскиватели, т.к. их частицы проникают в межзубные промежутки. Российские ученые из НИТУ «МИСиС» в партнерстве с медицинскими специалистами разработали новый тип ополаскивателя для полости рта на основе наночастиц металлов, который при регулярном использовании подавляет рост патогенных бактерий в зубной полости на 83%, снижая риск развития кариеса и заболеваний парадонта.
Ученые НИТУ «МИСиС» под руководством доцента кафедры физической химии Георгия Фролова совместно с Вятским государственным университетом провели ряд экспериментов на культурах бактерий зубного налета. Уже в течение первых 24 часов происходило ингибирование (подавление) роста бактерий зубного налета при использовании различных растворов наночастиц металлов.
Клиническая апробация раствора ополаскивателя была проведена на добровольцах, на кафедре стоматологии Кировского государственного медицинского университета, с определением гигиенических и парадонтальных индексов до начала применения ополаскивателя, и через 14 и 30 дней его использования. Опыты выявили чувствительность налета к различным растворам, содержащим наночастицы оксидов металлов, полученных инновационным способом в лаборатории университета. Снижение противовоспалительных свойств было подтверждено микробиологически. Выявлено проникновение раствора в межзубные промежутки, куда не проникают щетинки зубной щетки с зубной пастой. Данные клинических исследований показали и снижение адгезии (склеивания) микроорганизмов на поверхности зубов на 20%. При большем разведении раствора 1:100, к 30 дню снижается количество грибковой флоры, что говорит о нормализации рН ротовой жидкости.
«Гибель клетки патогенного микроорганизма происходит в результате химической деструкции стенок клетки и различных мембран, в том числе и мембран органелл клетки. Химическая деструкция происходит в результате взаимодействия дисперсной системы „магнетит в водном растворе цетилпиридиния хлорида“ с биополимерами клетки микроба. В результате этого происходит лизис (выход) содержимого клетки в окружающую среду. По-видимому, наночастицы оксида металла являются биокатализаторами ферментов гидролиза пептидной и гликозидной связей в полимерных молекулах клеточной стенки и мембран. В отношении золотистого стафилококка и большинства кокков бактерицидные и бактериостатические свойства препарата иногда значительно превосходят по своей выраженности действие антибиотиков» — сообщила соавтор проекта декан стоматологического факультета Кировского ГМУ, к.м.н. Светлана Громова.
Руководитель научной группы Георгий Фролов рассказал о научных выводах экспериментов: «Безионные коллоидные растворы оксидов металлов являются для человека не токсичными. Являясь одновременно источником микроэлементов, они проявляют долговременные антибактериальные свойства в отношении микроорганизмов зубного налета. Мы зафиксировали в ходе исследования, что при использовании ополаскивателя на основе оксидов металлов значительно снижается количество мягкого зубного налета на поверхностях зубов (до 83%), снижается количество патогенной микрофлоры вплоть до полного её уничтожения. Соответственно снижается воспаление десны. Все процессы более выражены при разведении раствора 1:10 Растворы с содержанием наночастиц рекомендуется использовать в ополаскивателях для полости рта в сочетании с традиционными средствами гигиены».
В настоящее время первые опытные партии препарата создаются в лаборатории НИТУ «МИСиС», разработчики занимаются регистрацией состава и официальным патентованием его в качестве ополаскивателя.
В РФ создадут антибиотик против золотистого стафилококка на основе бактерий жука-кожееда
Ученые Центра компетенций НТИ на базе Института биоорганической химии (ИБХ) имени академиков М.М. Шемякина и Ю.А. Овчинникова РАН разрабатывают антибиотик на основе бактерий жука-кожееда, который позволит бороться с устойчивой к существующим антибиотикам бактерией золотистого стафилококка. Об этом во вторник ТАСС сообщил Иван Смирнов, возглавляющий лабораторию высокопроизводительного скрининга биологических объектов.
Золотистый стафилококк (Staphylococcus aureus) — бактерия, которая может вызывать ряд опасных заболеваний. В их числе — пневмония, менингит, эндокардит, сепсис и др. Она также способна быстро адаптироваться к антибиотикам, вырабатывая устойчивость (резистентность) к препаратам. Эксперты отмечают, что сроки между разработкой нового лекарства и выработки у бактерий устойчивости к ним сокращаются с каждым годом, что делает исследования в этой области особенно актуальными.
«Жук-кожеед питается органическими останками теплокровных, находящихся на разных стадиях разложения. Таким образом он вынужденно сталкивается с различными бактериями, которые присутствуют в этих гниющих останках. Мы полагаем, что насекомое имеет симбиотическую микробиоту, которая позволяет ему бороться с патогенными бактериями. Препараты, которые будут разработаны на основе бактерий, защищающих иммунитет жука, могут применяться для борьбы с золотистым стафилококком — бактерией, способной вырабатывать устойчивость к антибиотикам», — сказал ученый.
Жук-кожеед (Dermestes maculatus) — также выступает опасным вредителем, повреждающим кожевенное сырье, меха и продукты питания. В некоторых музеях жука используют для очистки костей от мягких тканей.
«К концу 2020 года мы планируем установить точную химическую структуру антибиотика и определить его биологическую мишень. На основании этих знаний возможна направленная химическая модификация антибиотика с целью усиления его антибиотических свойств или снижения риска образования резистентности к нему», — сказал собеседник агентства.
Антибиотики из пасти медведя
Ранее ученые ИБХ РАН разработали технологию изучения бактериальной и грибковой среды живых организмов, позволяющую изучать свойства отдельных клеток за счет их «упаковки» в отдельные капли водно-жировой эмульсии. Изучив при помощи нового метода бактериальную среду в пасти бурого медведя, они обнаружили антибиотик амикумацин, эффективно подавлявший рост бактерий золотистого стафилококка.
Авторы научной работы изучили механизмы биосинтеза вещества и спектр его активности, подтвердив потенциал амикумацина в качестве эффективного убийцы антибиотикорезистентных бактерий. Сейчас в ИБХ работают над повышением эффективности вещества.
«Мы завершаем работу над аналогом амикумацина, который был получен в результате разработки нового способа его биосинтеза. Технология позволяет модифицировать структуру вещества, что позволит повысить ее эффективность в будущем», — пояснил Смирнов.
НТИ
Центр компетенций НТИ ИБХ РАН является одним из 14 центров компетенций Национальной технологической инициативы, занимается вопросами развития биотехнологий. Каждый из центров объединяет университеты, исследовательские центры и инновационные предприятия для создания сквозных технологий, которые будут востребованы на новых глобальных рынках через 15–20 лет. Оператором проекта создания Центров компетенций НТИ является Российская венчурная компания (РВК).
Подписывайтесь на наш телеграм-канал, чтобы первыми быть в курсе новостей венчурного рынка и технологий!
Опасными видами стафилококков заражаются в больницах и роддомах | ЗДОРОВЬЕ: Медицина | ЗДОРОВЬЕ
Давайте жить дружно
Как ни странно, само по себе наличие у человека стафилококка не означает, что его надо непременно лечить. «В нашем организме их много. Например, на коже среди различных микробов стафилококков насчитывается больше всего, — говорит Сергей ЯКОВЛЕВ, профессор кафедры госпитальной терапии Первого МГМУ им. Сеченова. — Эти микробы считаются условнопатогенными — могут вызывать заболевание только в случае предрасполагающих факторов, к примеру, при нарушениях в работе иммунной системы, повреждениях кожи и т. д. Скажем, если стафилококки попадут в кровь, то могут вызвать генерализованную инфекцию (сепсис). А в обычной ситуации для человека с хорошим иммунитетом стафилококки могут быть даже полезны.
Ведь они защищают от проникновения извне чужих, более опасных микробов. На конкретном участке кожи их определённое количество — столько, сколько есть пищи. И они уже настолько сжились с другими микробами, например стрептококками, что никого другого на свою территорию не пускают». Помимо кожи стафилококк может также мирно обитать во рту, в носу, в кишечнике. Но кроме мирных особей есть и по-настоящему опасные. Более того, устойчивые ко многим известным сегодня антибиотикам. К ним, например, относятся некоторые штаммы всем известного золотистого стафилококка. Причём самые смертельные и непобедимые его виды находятся в больницах и роддомах. Именно стафилококк входит в первую тройку возбудителей госпитальных инфекций, приводящих к смерти. Попасть в организм зловредный микроб может, как и любая другая инфекция: через ранки на коже и слизистых оболочках, в результате хирургических вмешательств, при нанесении татуировок и пирсинге, нарушении обычных правил гигиены (там, где пот и грязь, микробы активно размножаются).
Никуда от них не деться
Золотистый стафилококк может навредить везде. На коже он способен вызывать гнойные прыщи и фурункулы, в дыхательных путях — пневмонию, в глазах — конъюнктивит, в сердце — эндокардит (воспаление), в суставах — инфекционный артрит, у женщин после родов нередко вызывает сепсис. Размножаясь в продуктах (консервах, жирных салатах, тортах и даже в твёрдом сыре, копчёной колбасе, которые мы считаем долго непортящимися), золотистый стафилококк выделяет яды, которые вызывают серьёзные пищевые отравления. При кулинарной обработке сама бактерия гибнет, но её токсины остаются.
Борьба с микробом
«То, что инфекцию вызвал стафилококк, можно только предположить, — объясняет Сергей Яковлев. — А чтобы поставить точный диагноз, нужно взять на анализ кровь, мокроту и т.д., сделать посев на специальную питательную среду и посмотреть, какие микробы вырастут (такой анализ делается в бактериологической лаборатории. — Ред.). Далее определяется чувствительность выявленных микробов к антибактериальным препаратам. Сегодня по отношению к антибиотикам существует две группы стафилококков: одни чувствительны к оксициллину, а значит, и практически ко всем другим антибиотикам, другие устойчивы. Последние называются оксициллинрезистентными или метициллинрезистентными стафилококками. Они очень опасны и распространены в больницах.
Сегодня у врачей есть всего четыре антибиотика (из нескольких десятков), которыми можно вылечить таких больных. В тяжёлых, экстренных случаях антибиотики могут назначаться сразу, а потом уже проводиться необходимые исследования». И учтите, что нужно обязательно пройти весь назначенный врачом курс антибиотикотерапии до конца. Иначе бактерия не погибнет, а только приспособится, станет нечувствительной к лекарству. И в следующий раз вылечить инфекцию будет гораздо сложнее.
Смотрите также:
Постинвазионные события после заражения Staphylococcus aureus сильно зависят как от типа клетки-хозяина, так и от заражающего штамма S. aureus
Инвазия клеток-хозяев является основной особенностью Staphylococcus aureus и способствует развитию инфекции. Внутриклеточные метаболически активные бактерии могут вызывать активацию и гибель клеток-хозяев, но они также могут сохраняться в течение длительных периодов времени. В этом исследовании был проведен сравнительный анализ различных хорошо охарактеризованных S.aureus в их взаимодействии с различными типами клеток-хозяев. Сравнивали инвазию Staphylococcus aureus (штаммы 6850, USA300, LS1, Sh2000, Cowan1) в различные типы клеток человека (эпителиальные и эндотелиальные клетки, кератиноциты, фибробласты, остеобласты). Определяли количество внутриклеточных бактерий, исследовали клеточное воспаление, а также гибель клеток и фагосомный выход бактерий. Для объяснения штамм-зависимых различий секретома был использован протеомный подход.Барьерные клетки поглотили большое количество бактерий и были убиты агрессивными штаммами. Эти штаммы экспрессировали высокие уровни токсинов и обладали способностью ускользать из фаголизосом. Остеобласты и кератиноциты поглощали меньше бактерий и не погибали, хотя первичные остеобласты были сильно активированы S. aureus. Во всех типах клеток S. aureus смог сохраниться. Сильные различия в захвате, цитотоксичности и воспалительной реакции наблюдались между первичными клетками и соответствующими им клеточными линиями, демонстрируя, что клеточные линии лишь частично отражают функции и физиологию первичных клеток.Это исследование вносит вклад в лучшее понимание патомеханизма инфекций S. aureus. Протеомные данные предоставляют важные базовые знания о штаммах, обычно используемых при анализе взаимодействия S. aureus с клеткой-хозяином.
Ключевые слова: Цитотоксичность; Вторжение клеток-хозяев; Воспалительная реакция; Упорство; Протеомика; Золотистый стафилококк.
Бактериемия золотистого стафилококка у пациентов, инфицированных COVID-19: серия случаев | Открытый форум по инфекционным болезням
Аннотация
Предпосылки
Предыдущие вирусные пандемии показали, что вторичные бактериальные инфекции приводят к более высокой заболеваемости и смертности, при этом Staphylococcus aureus является первичным возбудителем.Влияние вторичной бактериемии S. aureus на смертность пациентов, инфицированных тяжелым острым респираторным синдромом, вызванным коронавирусом 2 (SARS-CoV-2), остается неизвестным.
Методы
Это была серия ретроспективных наблюдений пациентов с коронавирусной болезнью 2019 г. (COVID-19), у которых развилась вторичная бактериемия S. aureus в 2 больницах Нью-Йорка. Первичная конечная точка заключалась в описании 14-дневной и 30-дневной госпитальной смертности пациентов с COVID-19 и S.aureus бактериемия. Вторичные конечные точки включали предикторы 14-дневной и 30-дневной госпитальной смертности у пациентов с бактериемией COVID-19 и S. aureus .
Результаты
Выявлено 42 пациента, госпитализированных по поводу COVID-19 с вторичной бактериемией S. aureus . Из этих пациентов 23 (54,8%) и 28 (66,7%) умерли через 14 и 30 дней, соответственно, после их первого положительного посева крови. Многофакторный анализ выявил бактериемию, начавшуюся в больнице (≥4 дней с даты госпитализации), и возраст как значимые предикторы 14-дневной госпитальной летальности, а показатель бактериемии Питта — как значимый предиктор 30-дневной госпитальной летальности (отношение шансов [OR], 11.9; 95% ДИ 2,03–114,7; P = 0,01; ИЛИ, 1,10; 95% ДИ 1,03–1,20; P = 0,02; и OR 1,56; 95% ДИ 1,19–2,18; P = 0,003 соответственно).
Выводы
Бактериемия S. aureus связана с высоким уровнем смертности пациентов, госпитализированных с COVID-19. Необходимы дальнейшие исследования, чтобы понять влияние COVID-19 и вторичной бактериемии, вызванной S. aureus , S. aureus.
Быстрое распространение коронавируса 2 (SARS-CoV-2) тяжелого острого респираторного синдрома привело к всемирной пандемии коронавирусной болезни 2019 года (COVID-19).Клинические проявления COVID-19 существенно различаются [1, 2]. К тяжелым осложнениям COVID-19 относятся острый респираторный дистресс-синдром (ОРДС), сердечно-сосудистые осложнения, тромбоэмболические осложнения, септический шок и полиорганная недостаточность [3, 4]. В настоящее время сообщается об осложнениях бактериальной инфекции, особенно бактериемии. В одном исследовании описано, что частота бактериемии составляет 1,6–3,8%, причем на Staphylococcus aureus приходится 13,3% случаев бактериемии [5]. Удар вторичный С.aureus о смертности пациентов, инфицированных SARS-CoV-2, остается неизвестным.
S. aureus ранее был описан как основной возбудитель вторичных бактериальных инфекций во время предыдущих вирусных пандемий [6, 7]. Начало вторичных бактериальных инфекций при гриппе обычно наблюдается в течение первых 6 дней заражения гриппом, когда вирусное выделение является самым высоким [7]. Среди пациентов, инфицированных гриппом, бактериемия ассоциировалась со смертностью, приближающейся к 50% по сравнению с 1.4% у больных гриппом, но без бактериемии [8].
Начало вторичных бактериальных инфекций, особенно S. aureus , у пациентов, инфицированных SARS-CoV-2, остается неизвестным. Наша работа направлена на описание клинических характеристик, показателей смертности и факторов риска смертности взрослых, госпитализированных по поводу COVID-19, у которых есть вторичная бактериемия S. aureus .
МЕТОДЫ
Дизайн исследования и определения
Это было ретроспективное исследование серии наблюдений пациентов с заболеванием COVID-19, госпитализированных либо в больницу Mount Sinai, либо в Mount Sinai Queens в Нью-Йорке (Нью-Йорк).Взрослые пациенты включались в исследование, если они были госпитализированы в период с 1 марта 2020 г. по 31 мая 2020 г., имели положительный результат теста на SARS-CoV-2 с помощью мазка из носоглотки с ПЦР во время этого госпитализации и имели как минимум 1 положительный посев крови на S. aureus во время же приема. Пациенты были исключены, если начало бактериемии было> 24 часов до положительного результата ПЦР SARS-CoV-2. Идентификация и восприимчивость микроорганизмов были определены Лабораторией клинической микробиологии больницы Mount Sinai. Предварительная идентификация организмов была выполнена с помощью ePlex, и идентификация была подтверждена с помощью лазерной десорбции / ионизации с использованием матрицы по времени пролета (MALDI-TOF).Тестирование чувствительности проводилось с помощью Microscan в соответствии с критериями Института клинических и лабораторных стандартов (CLSI) [9].
Исходные характеристики пациента, включая демографические характеристики, сопутствующие заболевания, лабораторные показатели, результаты посева крови и полученное лечение, были получены из хранилища данных Mount Sinai и подтверждены ручным просмотром карт. Лабораторные показатели регистрировались со дня поступления. Источник бактериемии был специально получен из записок врача-инфекциониста и подтвержден двумя независимыми врачами.Пациенты классифицировались как имеющие центральную линию, если она присутствовала в течение 48 часов до положительного посева крови. Снимки грудной клетки получали во время положительного посева крови. Полученные антибиотики классифицировались как эмпирические (в течение первых 5 дней после сбора культуры крови) или окончательная терапия (> 5 дней после сбора культуры крови). Степень бактериемии определялась по шкале бактериемии Питта [10–13]. Начало бактериемии было классифицировано как бактериемия, начавшаяся в больнице, определялась как положительный посев крови на четвертый день после госпитализации или позже, в соответствии с критериями Национальной сети безопасности здравоохранения [14].Бактериемия также была классифицирована как полимикробная у пациентов с положительным посевом крови на 1 или более микроорганизмов, кроме S. aureus, в течение того же 24-часового периода.
Первичной конечной точкой были показатели 14-дневной и 30-дневной госпитальной смертности пациентов с бактериемией COVID-19 и S. aureus . Смертность измерялась от даты первого положительного посева крови до даты смерти в больнице. Вторичные конечные точки включали предикторы 14-дневной и 30-дневной госпитальной смертности, связанной с S.aureus у пациентов, инфицированных SARS-CoV-2.
Статистический анализ
Различия в характеристиках пациентов оценивались с помощью критерия хи-квадрат или точного критерия Фишера для категориальных переменных, критерия t для параметрических непрерывных переменных или теста Краскела-Уоллиса для непараметрических непрерывных переменных. Предикторы 14-дневной или 30-дневной госпитальной смертности были определены с помощью одномерной логистической регрессии. Переменные, дающие значение P ≤.20 из результатов одномерного анализа были включены в обратную пошаговую модель многомерной логистической регрессии. Дисперсия инфляции также оценивалась для начального включения переменных, чтобы устранить коллинеарность между переменными. Статистическая значимость была измерена значением P <0,05. Все статистические анализы были выполнены с использованием R (версия 4.0.0).
Заявление о согласии пациента
Эту ретроспективную серию случаев одобрил институциональный контрольный совет Медицинской школы Икана.Информированное согласие не требовалось, поскольку общие преимущества исследования перевешивали минимальные риски для субъектов, поскольку никаких вмешательств не проводилось, а информация о пациентах была защищена.
РЕЗУЛЬТАТЫ
В 2 больницах Нью-Йорка у 42 из 2679 (1,57%) пациентов, госпитализированных по поводу COVID-19 в период с 1 марта 2020 г. по 31 мая 2020 г., была выявлена бактериемия S. aureus . Общие исходные демографические данные, сопутствующие заболевания и лабораторные показатели, а также полученные методы лечения представлены в таблице 1.Средний возраст составлял 65,6 ± 13,7 года, 21 (50,0%) — мужчины. Средний индекс массы тела (ИМТ; межквартильный размах [IQR]) составлял 27,5 (23,8–33,0). Двадцать девять (69,0%) пациентов имели исходную гипертензию, 19 (45,2%) имели сердечно-сосудистые заболевания и 21 (50,0%) пациент страдали диабетом. Медиана исходных воспалительных маркеров, включая С-реактивный белок, D-димер, ферритин и интерлейкин-6, была повышена на исходном уровне.
Таблица 1. Исходные демографические данные и сопутствующие заболевания пациентов| . | Всего случаев (n = 42) . | |||
|---|---|---|---|---|
| Возраст, среднее ± стандартное отклонение, лет | 65,6 ± 13,7 | |||
| Мужской, № (%) | 21 (50,0) | |||
| ИМТ, медиана [IQR], кг / м 2 | 27,5 [23,8–33,0] | |||
| Раса,% | ||||
| Афроамериканец | 7 (16,7) | |||
| Белый | 8 (19,0) | Другое27 (64.3) | ||
| Этническая принадлежность, кол-во (%) | ||||
| Латиноамериканцы | 17 (40,5) | |||
| Не латиноамериканцы | 21 (50,0) | |||
| История болезни, № (%) | ||||
| Сердечно-сосудистые заболевания a | 19 (45,2) | |||
| Гипертония | 29 (69,0) | |||
| Хроническая болезнь почек | 6 (14,3) | |||
| Злокачественная опухоль | 5 (11,9) | |||
| Стадия болезни легких b | 7 (16,7) | |||
| Конечная болезнь почек | 4 (9,5) | |||
| Трансплантат | 3 (7,1) | |||
| Болезнь печени | 1 (2,4) | |||
| Базовые приемные лаборатории, медиана [IQR] | 18 , × 10 3 / L | 10.3 [7,48–13,2] | ||
| Количество тромбоцитов, × 10 3 / л | 228,0 [160,1–306,5] | |||
| Креатинин сыворотки, мг / дл | 0,98 [0,75–2,36] | 0,66 [0,45–0,94] | ||
| Прокальцитонин, нг / мл c | 0,42 [0,19–1,36] | |||
| C-реактивный белок c, 155,1 [88,2–244,2] | ||||
| D-димер, мкг / мл c | 1.65 [1,21–3,83] | |||
| Ферритин, нг / мл c | 1045 [462,6–2521] | |||
| Интерлейкин-6, пг / мл c | 151,23 [74,8118349] |
| . | Всего случаев (n = 42) . | |
|---|---|---|
| Возраст, среднее ± стандартное отклонение, лет | 65,6 ± 13,7 | |
| Мужской, № (%) | 21 (50,0) | |
| ИМТ, медиана [IQR], кг / м 2 | 27.5 [23,8–33,0] | |
| Раса,% (%) | ||
| Афроамериканец | 7 (16,7) | |
| Белый | 8 (19,0) | |
| Другое | (64,3) | |
| Этническая принадлежность, количество (%) | ||
| Латиноамериканцы | 17 (40,5) | |
| Не латиноамериканцы | 21 (50,0) | |
| .5) | ||
| История болезни, № (%) | ||
| Сердечно-сосудистые заболевания a | 19 (45,2) | |
| Гипертония | 29 (69,0) | (50,0) |
| Хроническая болезнь почек | 6 (14,3) | |
| Злокачественная опухоль | 5 (11,9) | |
| Заболевание легких b | 7 (16.7) | |
| Терминальная стадия почечной недостаточности | 4 (9,5) | |
| Трансплантат | 3 (7,1) | |
| Заболевание печени | 1 (2,4) | |
| Исходный уровень госпитализации IQR] | ||
| Лейкоциты, × 10 3 / л | 10,3 [7,48–13,2] | |
| Число тромбоцитов, × 10 3 / л | 228,0 [16011–306,5] | |
| Креатинин сыворотки, мг / дл | 0.98 [0,75–2,36] | |
| Билирубин, мг / дл | 0,66 [0,45–0,94] | |
| Прокальцитонин, нг / мл c | 0,42 [0,19–1,33 C | реактивный белок, мг / л c155,1 [88,2–244,2] |
| D-димер, мкг / мл c | 1,65 [1,21–3,83] | |
| Ферритин, нг13 / мл 901 | 1045 [462,6–2521] | |
| Интерлейкин-6, пг / мл c | 151.2 [74,8–349,9] |
пациентов
| . | Всего случаев (n = 42) . | |
|---|---|---|
| Возраст, среднее ± стандартное отклонение, лет | 65,6 ± 13,7 | |
| Мужской, № (%) | 21 (50,0) | |
| ИМТ, медиана [IQR], кг / м 2 | 27,5 [23,8–33,0] | |
| Гонка, №(%) | ||
| Афроамериканец | 7 (16,7) | |
| Белый | 8 (19,0) | |
| Другое | 27 (64,3) | |
| Этническая принадлежность (%) | ||
| Латиноамериканец | 17 (40,5) | |
| Не латиноамериканец | 21 (50,0) | |
| Неизвестно | 4 (9,5) | История болезни, №(%) |
| Сердечно-сосудистые заболевания a | 19 (45,2) | |
| Гипертония | 29 (69,0) | |
| Диабет | 21 (50,0) | Хроническая болезнь почек6 (14,3) |
| Злокачественная опухоль | 5 (11,9) | |
| Болезнь легких b | 7 (16,7) | |
| Терминальная стадия почечной недостаточности | 4 (9.5) | |
| Трансплантат | 3 (7,1) | |
| Болезнь печени | 1 (2,4) | |
| Исходные лаборатории при госпитализации, медиана [IQR] | ||
| Белые клетки крови 3 / л | 10,3 [7,48–13,2] | |
| Количество тромбоцитов, × 10 3 / л | 228,0 [160,1–306,5] | |
| Креатинин сыворотки, мг / дл | 0,75–7 0,98 [ 2.36]||
| Билирубин, мг / дл | 0.66 [0,45–0,94] | |
| Прокальцитонин, нг / мл c | 0,42 [0,19–1,36] | |
| C-реактивный белок, мг / л c | 155,1 [88,2–24 | |
| D-димер, мкг / мл c | 1,65 [1,21–3,83] | |
| Ферритин, нг / мл c | 1045 [462,6–2521] | 6 Интерлейкин |
| 151,2 [74,8–349,9] |
| . | Всего случаев (n = 42) . | |||
|---|---|---|---|---|
| Возраст, среднее ± стандартное отклонение, лет | 65,6 ± 13,7 | |||
| Мужской, № (%) | 21 (50,0) | |||
| ИМТ, медиана [IQR], кг / м 2 | 27,5 [23,8–33,0] | |||
| Раса,% | ||||
| Афроамериканец | 7 (16,7) | |||
| Белый | 8 (19,0) | Другое27 (64.3) | ||
| Этническая принадлежность, кол-во (%) | ||||
| Латиноамериканцы | 17 (40,5) | |||
| Не латиноамериканцы | 21 (50,0) | |||
| История болезни, № (%) | ||||
| Сердечно-сосудистые заболевания a | 19 (45,2) | |||
| Гипертония | 29 (69,0) | |||
| Хроническая болезнь почек | 6 (14,3) | |||
| Злокачественная опухоль | 5 (11,9) | |||
| Стадия болезни легких b | 7 (16,7) | |||
| Конечная болезнь почек | 4 (9,5) | |||
| Трансплантат | 3 (7,1) | |||
| Болезнь печени | 1 (2,4) | |||
| Базовые приемные лаборатории, медиана [IQR] | 18 , × 10 3 / L | 10.3 [7,48–13,2] | ||
| Количество тромбоцитов, × 10 3 / л | 228,0 [160,1–306,5] | |||
| Креатинин сыворотки, мг / дл | 0,98 [0,75–2,36] | 0,66 [0,45–0,94] | ||
| Прокальцитонин, нг / мл c | 0,42 [0,19–1,36] | |||
| C-реактивный белок c, 155,1 [88,2–244,2] | ||||
| D-димер, мкг / мл c | 1.65 [1,21–3,83] | |||
| Ферритин, нг / мл c | 1045 [462,6–2521] | |||
| Интерлейкин-6, пг / мл c | 151,23 [74,8118349] |
У 23 из 42 пациентов была бактериемия S. aureus (54,8%) с метициллин-чувствительным S. aureus (MSSA) (Таблица 2). Не было значительных различий в характеристиках и исходах между бактериемией с MSSA и метициллин-резистентным S.aureus (MRSA). Семь (16,7%) пациентов были отнесены к категории пациентов с полимикробной инфекцией. Эти организмы включали Enterococcus faecalis (n = 3), Candida spp. (n = 2), Klebsiella spp. (n = 2), Escherichia coli (n = 1) , Bacillus spp. (n = 1) , Micrococcus spp. (n = 1) , Staphylococcus epidermidis (n = 1) и Proteus mirabilis (n = 1). Источник бактериемии был неизвестен или не задокументирован для 29 (69.0%) пациентов. Из 13 пациентов с известным источником бактериемии наиболее частым источником была пневмония (n = 8, 19,0%). Шесть пациентов с источником пневмонии имели бактериемию в стационаре с началом от 9 до 48 дней (медиана [IQR], 32,7 [16,3–45,3] дня).
Таблица 2. Характеристики и методы лечения, связанные с бактериемией
| . | Всего случаев (n = 42) . | 14-дневное выживание (n = 19) . | 14-дневная смертность (n = 23) . | P Значение . | 30-дневное выживание (n = 14) . | 30-дневная смертность (n = 28) . | P Значение . | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MSSA, No. (%) | 23 (54,8) | 8 (42,1) | 15 (65,2) | ,24 | 5 (35,7) | 18 (64,3) | . 15 | ||||||||
| Полимикробное средство, №(%) a | 7 (16,7) | 1 (5,3) | 6 (26,1) | ,11 | 1 (7,1) | 6 (21,4) | 0,39 | ||||||||
| Источник бактериемия, Кол-во (%) | |||||||||||||||
| Сосудистые b | 3 (7,1) | 2 (10,5) | 2 (10,5) | 191 (7,1) | 2 (7.1) | .31 | |||||||||
| Остеомиелит | 1 (2,4) | 1 (5,3) | 0 | 1 (7,1) | 0 | Кожа | 1 (5,3) | 0 | 1 (7,1) | 0 | |||||
| Пневмония | 8 (19,0) | 5 (26,3) | 3 (13,0) | 3 (13,0) | (21,4)5 (17.9) | ||||||||||
| Неизвестно | 29 (69,0) | 10 (52,6) | 19 (82,6) | 8 (57,1) | 21 (75,0) | ||||||||||
| Бактериемия, начавшаяся в больнице, c Кол-во (%) | 28 (66,7) | 10 (5211,6) | 3)0,15 | 8 (57,1) | 20 (71,4) | ,56 | |||||||||
| Время от поступления до начала бактериемии, медиана [IQR], д | 8,0 [0,02–21,0] | 4,5 [0–14,0] | 13,0 [5,5–23,5] | .06 | 5,2 [0,25–14,3] | 11,0 [0,06–22,0] | .30 | ||||||||
| Посев крови без госпитализации, № (% ) | 6 (14,3) | 4 (21,1) | 2 (8,7) | .38 | 2 (14,3) | 4 (14,3) | 1,0 | ||||||||
| Характеристики, собранные во время посева крови | белые клетки крови [IQR], × 10 3 / L | 14,7 [9,20–20,2] | 12,3 [8,20–20,5] | 15,8 [12,6–20,0] | ,27 | 12,3 [8,38–18,8] | 15,6 [11.8–21.2] | ,21 | |||||||
| Прокальцитонин, медиана [IQR], нг / мл | 1,02 [0,28–3,47] | 1,16 [0,34–5,09] | 1,02 [0,28–2,04] | 90 0,87 [0,33–3,29] | 1,04 [0,30–3,33] | .89 | |||||||||
| Температура, среднее ± стандартное отклонение, ° C | 38,0 ± 0,98 | 38,1 ± 0,84 | 38,0 ± 1,10 | .64 | .6438,0 ± 0,94 | 38,1 ± 1,02 | 0,86 | ||||||||
| Патологический рентген грудной клетки, №(%) | 36 (85,7) | 17 (89,5) | 19 (82,6) | 0,67 | 13 (92,9) | 23 (82,1) | ,65 | ||||||||
| Балл бактериемии Питта, средний [IQR] | 5,0 [2,0–7,0] | 3,0 [0,50–5,0] | 7,0 [4,5–7,0] | 0,004 | 2,0 [0,25–5,0] | 6,5 [4,0–7,0] | . 001 | ||||||||
| ИВЛ, Кол-во (%) | 31 (73,8) | 13 (68.4) | 18 (78,3) | ,71 | 9 (64,3) | 22 (78,6) | ,54 | ||||||||
| Центральный венозный катетер, d Кол-во (%) | 19 (45,2) | 5 (26,3) | 14 (60,9) | 0,05 | 3 (21,4) | 16 (57,1) | 0,05 | ||||||||
| Полученные эмпирические антибиотики, № (%) e | |||||||||||||||
| Ванкомицин / цефепим | 24 (58.5) | 12 (63,2) | 12 (52,2) | 0,76 | 9 (64,3) | 15 (53,6) | ,28 | ||||||||
Ванкомицин / другие бета-лактам f| 9 | | (22,0)3 (15,8) | 6 (26,1) | 1 (7,1) | 8 (28,6) | ||||||||||
| Ванкомицин | 7 (17,1) | 3 (15117) 4 (17,4) | 3 (21,4) | 4 (14.3) | |||||||||||
| Пиперациллин / тазобактам | 1 (2,4) | 1 (5,3) | 0 | 1 (7,1) | 0 | Антибиотик , медиана [IQR], h | 0 [0–24,0] | 0 [0–23,6] | 0 [0–23,4] | 0,90 | 1,0 [0–23,8] | 0 [0–22,8 ] | .90 |
| . | Всего случаев (n = 42) . | 14-дневное выживание (n = 19) . | 14-дневная смертность (n = 23) . | P Значение . | 30-дневное выживание (n = 14) . | 30-дневная смертность (n = 28) . | P Значение . | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MSSA, No. (%) | 23 (54,8) | 8 (42,1) | 15 (65.2) | ,24 | 5 (35,7) | 18 (64,3) | ,15 | ||||||||
| Полимикробный, Кол-во (%) a | 7 (16,7) | 1 (5,3) | 6 (26,1) | ,11 | 1 (7,1) | 6 (21,4) | ,39 | ||||||||
| Источник бактериемии, Кол. (%) | |||||||||||||||
| Сосудистые b | 3 (7.1) | 2 (10,5) | 1 (4,3) | ,19 | 1 (7,1) | 2 (7,1) | ,31 | ||||||||
| Остеомиелит | 1 (2,4) | 1 (5,3 ) | 0 | 1 (7,1) | 0 | ||||||||||
| Кожа | 1 (2,4) | 1 (5,3) | 0 | 1 (7,1) | |||||||||||
| Пневмония | 8 (19.0) | 5 (26,3) | 3 (13,0) | 3 (21,4) | 5 (17,9) | ||||||||||
| Неизвестно | 29 (69,0) | 10 (5211,6) 19118 (82,6) | 8 (57,1) | 21 (75,0) | |||||||||||
| Определения бактериемии | больница №(%) | 28 (66,7) | 10 (52,6) | 18 (78,3) | ,15 | 8 (57,1) | 20 (71,4) | ,56 | |||||||
| Время от поступления до бактериемии начало, медиана [IQR], d | 8,0 [0,02–21,0] | 4,5 [0–14,0] | 13,0 [5,5–23,5] | 0,06 | 5,2 [0,25–14,3] | 11,0 [0,06– 22,0] | .30 | ||||||||
| Посев крови без поступления, № (%) | 6 (14.3) | 4 (21,1) | 2 (8,7) | 0,38 | 2 (14,3) | 4 (14,3) | 1,0 | ||||||||
| Характеристики, собранные во время посева крови | |||||||||||||||
| Лейкоцитов, медиана [IQR], × 10 3 / L | 14,7 [9,20–20,2] | 12,3 [8,20–20,5] | [12,6117 15,8117] 20,0].27 | 12,3 [8,38–18,8] | 15,6 [11,8–21,2] | ,21 | |||||||||
| Прокальцитонин, медиана [IQR], нг / мл | 1,02 [0,28–3,47] | 1,16 [0,39–3,47] ] | 1,02 [0,28–2,04] | 0,65 | 0,87 [0,33–3,29] | 1,04 [0,30–3,33] | ,89 | ||||||||
| Температура, среднее ± стандартное отклонение, ° C | 38,0 ± 0,98 | 38,1 ± 0,84 | 38,0 ± 1,10 | ,64 | 38.0 ± 0,94 | 38,1 ± 1,02 | 0,86 | ||||||||
| Аномальная рентгенограмма грудной клетки, № (%) | 36 (85,7) | 17 (89,5) | 19 (82,6) | 0,67 | 13 (92,9) | 23 (82,1) | 0,65 | ||||||||
| Оценка бактериемии Питта, медиана [IQR] | 5,0 [2,0–7,0] | 3,0 [0,50–5,0] | 7,0 [4,5–7,0 ] | .004 | 2,0 [0,25–5,0] | 6,5 [4,0–7,0] | .001 | ||||||||
| Механическая вентиляция, No. (%) | 31 (73,8) | 13 (68,4) | 18 (78,3) | ,71 | 9 (64,3) | 22 (78,6) | . 54 | ||||||||
| Центральный венозный катетер, d Кол-во (%) | 19 (45,2) | 5 (26,3) | 14 (60,9) | 0,05 | 3 (21,4) | 16 (57,1 ) | .05 | ||||||||
| Полученные эмпирические антибиотики, №(%) e | |||||||||||||||
| Ванкомицин / цефепим | 24 (58,5) | 12 (63,2) | 12 (63,2) | 12 (63,2) | 9 (64,3) | 15 (53,6) | ,28 | ||||||||
| Ванкомицин / другой бета-лактам f | 9 (22,0) | 3 (15,8) | 6 (26,1) | 1 (7.1) | 8 (28,6) | ||||||||||
| Ванкомицин | 7 (17,1) | 3 (15,8) | 4 (17,4) | 3 (21,4) | 4 (14,3) | 4 (14,3) | |||||||||
| Пиперациллин / тазобактам | 1 (2,4) | 1 (5,3) | 0 | 1 (7,1) | 0 | ||||||||||
| Время от инициации посева крови до антибиотика. , h | 0 [0–24.0] | 0 [0–23,6] | 0 [0–23,4] | .90 | 1,0 [0–23,8] | 0 [0–22,8] | .90 |
Характеристики и методы лечения, связанные с бактериемией
| . | Всего случаев (n = 42) . | 14-дневное выживание (n = 19) . | 14-дневная смертность (n = 23) . | P Значение . | 30-дневное выживание (n = 14) . | 30-дневная смертность (n = 28) . | P Значение . | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MSSA, No. (%) | 23 (54,8) | 8 (42,1) | 15 (65,2) | ,24 | 5 (35,7) | 18 (64,3) | . 15 | ||||||||||
| Полимикробный, No. (%) a | 7 (16,7) | 1 (5,3) | 6 (26.1) | .11 | 1 (7.1) | 6 (21.4) | .39 | ||||||||||
| Источник бактериемии, Кол. (%) | |||||||||||||||||
| Сосудистый b | 3 (7,1) | 2 (10,5) | 1 (4,3) | ,19 | 1 (7,1) | 2 (7,1) | ,31 | ||||||||||
| 1 (2.4) | 1 (5,3) | 0 | 1 (7,1) | 0 | |||||||||||||
| Кожа | 1 (2,4) | 1 (5,3) | 0 | 9011 7,1) | 0 | ||||||||||||
| Пневмония | 8 (19,0) | 5 (26,3) | 3 (13,0) | 3 (21,4) | 5 (17,9) | Неизвестный | 29 (69.0) | 10 (52,6) | 19 (82,6) | 8 (57,1) | 21 (75,0) | ||||||
| Определения бактериемии | |||||||||||||||||
| Бактериемия в больнице, c Кол-во (%) | 28 (66,7) | 10 (52,6) | 18 (78,3) | ,15 | 8 (57,1) | 20 (71,4 ) | .56 | ||||||||||
| Время от поступления до начала бактериемии, медиана [IQR], d | 8,0 [0,02–21,0] | 4,5 [0–14,0] | 13,0 [5,5–23,5] | 0,06 | 5,2 [ 0,25–14,3] | 11,0 [0,06–22,0] | .30 | ||||||||||
| Посев крови без госпитализации, № (%) | 6 (14,3) | 4 (21,1) | 2 (8,7) | 0,38 | 2 (14,3) | 4 (14,3) | 1,0 | ||||||||||
| Характеристики, собранные во время посева крови | медиана [IQR], × 10 3 / L | 14.7 [9,20–20,2] | 12,3 [8,20–20,5] | 15,8 [12,6–20,0] | ,27 | 12,3 [8,38–18,8] | 15,6 [11,8–21,2] | ,21 | |||||||||
| Прокальцитонин, медиана [IQR], нг / мл | 1,02 [0,28–3,47] | 1,16 [0,34–5,09] | 1,02 [0,28–2,04] | ,65 | 0,87 [0,33–3,29] | 1,04 [ 0,30–3,33] | .89 | ||||||||||
| Температура, среднее ± стандартное отклонение, ° C | 38.0 ± 0,98 | 38,1 ± 0,84 | 38,0 ± 1,10 | 0,64 | 38,0 ± 0,94 | 38,1 ± 1,02 | ,86 | ||||||||||
| Патологический рентген грудной клетки, № (%) | 36 ( 85,7) | 17 (89,5) | 19 (82,6) | 0,67 | 13 (92,9) | 23 (82,1) | 0,65 | ||||||||||
| Оценка бактериемии Питта, медиана [IQR] 5,0 [IQR] | 2,0–7,0] | 3,0 [0,50–5,0] | 7,0 [4.5–7,0] | 0,004 | 2,0 [0,25–5,0] | 6,5 [4,0–7,0] | 0,001 | ||||||||||
| ИВЛ, № (%) | 31 (73,8) | 13 ( 68,4) | 18 (78,3) | ,71 | 9 (64,3) | 22 (78,6) | ,54 | ||||||||||
| Центральный венозный катетер, d Кол-во (%) | 19 (45,2) | 5 (26,3) | 14 (60,9) | 0,05 | 3 (21.4) | 16 (57,1) | .05 | ||||||||||
| Полученные эмпирические антибиотики, кол-во (%) e | ce | 24 (58,5) | 12 (63,2) | 12 (52,2) | 0,76 | 9 (64,3) | 15 (53,6) | ,28 | |||||||||
| Ванкомицин / другой β-лактам f f | 9 (22.0) | 3 (15,8) | 6 (26,1) | 1 (7,1) | 8 (28,6) | ||||||||||||
| Ванкомицин | 7 (17,1) | 3 (15,8) 4 (17,4) | 3 (21,4) | 4 (14,3) | |||||||||||||
| Пиперациллин / тазобактам | 1 (2,4) | 1 (5,3) | 0 | 0 | |||||||||||||
| Время от посева крови до начала приема антибиотика, медиана [IQR], ч | 0 [0–24.0] | 0 [0–23,6] | 0 [0–23,4] | .90 | 1,0 [0–23,8] | 0 [0–22,8] | .90 |
| . | Всего случаев (n = 42) . | 14-дневное выживание (n = 19) . | 14-дневная смертность (n = 23) . | P Значение . | 30-дневное выживание (n = 14) . | 30-дневная смертность (n = 28) . | P Значение . | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MSSA, No. (%) | 23 (54,8) | 8 (42,1) | 15 (65,2) | ,24 | 5 (35,7) | 18 (64,3) | . 15 | ||||||||||||
| Полимикробный, No. (%) a | 7 (16,7) | 1 (5,3) | 6 (26,1) | .11 | 1 (7,1) | 6 (21,4) | ,39 | ||||||||||||
| Источник бактериемии, №(%) | |||||||||||||||||||
| Сосудистые b | 3 (7,1) | 2 (10,5) | (7.1) | 2 (7.1) | .31 | ||||||||||||||
| Остеомиелит | 1 (2,4) | 1 (5,3) | 0 | 1 (7,1) | 0 | Кожа | 1 (2.4) | 1 (5,3) | 0 | 1 (7,1) | 0 | ||||||||
| Пневмония | 8 (19,0) | 5 (26,3) | 3 (13,0) | 3 (21,4) | 5 (17,9) | ||||||||||||||
| Неизвестно | 29 (69,0) | 10 (52,6) | 19 (82,6) | 8 (57,1) | 21 | ||||||||||||||
| Определения бактериемии | |||||||||||||||||||
| Больничная бактериемия, c No.(%) | 28 (66,7) | 10 (52,6) | 18 (78,3) | ,15 | 8 (57,1) | 20 (71,4) | ,56 | ||||||||||||
| Время от поступления до бактериемии начало, медиана [IQR], d | 8,0 [0,02–21,0] | 4,5 [0–14,0] | 13,0 [5,5–23,5] | 0,06 | 5,2 [0,25–14,3] | 11,0 [0,06– 22,0] | .30 | ||||||||||||
| Посев крови без поступления, № (%) | 6 (14.3) | 4 (21,1) | 2 (8,7) | 0,38 | 2 (14,3) | 4 (14,3) | 1,0 | ||||||||||||
| Характеристики, собранные во время посева крови | |||||||||||||||||||
| Лейкоцитов, медиана [IQR], × 10 3 / L | 14,7 [9,20–20,2] | 12,3 [8,20–20,5] | [12,6117 15,8117] 20,0].27 | 12,3 [8,38–18,8] | 15,6 [11,8–21,2] | ,21 | |||||||||||||
| Прокальцитонин, медиана [IQR], нг / мл | 1,02 [0,28–3,47] | 1,16 [0,39–3,47] ] | 1,02 [0,28–2,04] | 0,65 | 0,87 [0,33–3,29] | 1,04 [0,30–3,33] | ,89 | ||||||||||||
| Температура, среднее ± стандартное отклонение, ° C | 38,0 ± 0,98 | 38,1 ± 0,84 | 38,0 ± 1,10 | ,64 | 38.0 ± 0,94 | 38,1 ± 1,02 | 0,86 | ||||||||||||
| Аномальная рентгенограмма грудной клетки, № (%) | 36 (85,7) | 17 (89,5) | 19 (82,6) | 0,67 | 13 (92,9) | 23 (82,1) | 0,65 | ||||||||||||
| Оценка бактериемии Питта, медиана [IQR] | 5,0 [2,0–7,0] | 3,0 [0,50–5,0] | 7,0 [4,5–7,0 ] | .004 | 2,0 [0,25–5,0] | 6,5 [4,0–7,0] | .001 | ||||||||||||
| Механическая вентиляция, No. (%) | 31 (73,8) | 13 (68,4) | 18 (78,3) | ,71 | 9 (64,3) | 22 (78,6) | . 54 | ||||||||||||
| Центральный венозный катетер, d Кол-во (%) | 19 (45,2) | 5 (26,3) | 14 (60,9) | 0,05 | 3 (21,4) | 16 (57,1 ) | .05 | ||||||||||||
| Полученные эмпирические антибиотики, №(%) e | |||||||||||||||||||
| Ванкомицин / цефепим | 24 (58,5) | 12 (63,2) | 12 (63,2) | 12 (63,2) | 9 (64,3) | 15 (53,6) | ,28 | ||||||||||||
| Ванкомицин / другой бета-лактам f | 9 (22,0) | 3 (15,8) | 6 (26,1) | 1 (7.1) | 8 (28,6) | ||||||||||||||
| Ванкомицин | 7 (17,1) | 3 (15,8) | 4 (17,4) | 3 (21,4) | 4 (14,3) | 4 (14,3) | |||||||||||||
| Пиперациллин / тазобактам | 1 (2,4) | 1 (5,3) | 0 | 1 (7,1) | 0 | ||||||||||||||
| Время от инициации посева крови до антибиотика. , h | 0 [0–24.0] | 0 [0–23,6] | 0 [0–23,4] | .90 | 1,0 [0–23,8] | 0 [0–22,8] | .90 |
Среднее количество лейкоцитов и прокальцитонин во время посева крови (IQR) были повышены при поступлении (лейкоциты: 14,7 [9,20–20,2]; прокальцитонин: 1,02 [0,28–3,47]). Пациенты обычно имели лихорадку во время посева крови со средней температурой 38,0 ° C ± 0,98 ° C. Средний балл бактериемии Питта (IQR) был повышен до 5,0 (2,0–7.0). Тридцать один пациент (73,8%) получил искусственную вентиляцию легких, а 19 (45,2%) имели центральный венозный катетер в течение 48 часов до положительного результата посева крови. Центральные венозные катетеры были удалены / заменены у 12 (63,2%) пациентов с центральными венозными катетерами. 41 (97,6%) обратились за консультацией по инфекционному заболеванию. Трансторакальная эхокардиограмма была получена у 29 (47,6%) пациентов, и только 1 был положительным для вегетации.
Наиболее распространенными эмпирическими антимикробными препаратами были ванкомицин и цефепим (n = 24, 58.5%) (таблица 2). Среднее время от сбора культуры крови до начала приема антибиотиков (IQR) составляло 0 (0–24) часов. Основными противомикробными препаратами, полученными пациентами с бактериемией MRSA, был преимущественно ванкомицин (n = 13), при этом 3 пациента одновременно получали β-лактам (например, цефазолин, меропенем или пиперациллин / тазобактам), линезолид (n = 1) или даптомицин (n = 1). = 1). В качестве окончательной терапии у пациентов с бактериемией MSSA преобладали цефазолин (n = 10), затем цефтриаксон (n = 3), нафциллин (n = 2), а также 1 пациент, получавший линезолид по поводу полимикробной бактериемии.Окончательная терапия не была доступна для лиц, умерших в течение 2 дней после посева.
Считалось, что у 28 (66,7%) пациентов бактериемия возникла в стационаре. Среднее время от поступления до начала бактериемии (IQR) составило 8,0 (0,02–21,0) дня. У 41 пациента был положительный результат ПЦР SARS-CoV-2 в течение первых 2 дней госпитализации, и у 1 пациента был положительный результат на 4-й день больницы.
У 23 (54,8%) и 28 (66,7%) пациентов был госпитальная смертность через 14 и 30 дней, соответственно, с момента их первого положительного посева крови.Среднее время от посева крови до смерти (IQR) составляло 7,88 (2,00–18,5) дней. Средняя продолжительность пребывания в больнице выживших на отметке 30-дневной смертности (IQR) составляла 22,5 (10,3–35,8) дней. Время от поступления до посева крови (IQR) было больше у пациентов со смертностью через 14 дней по сравнению с пациентами, выжившими через 14 дней (13,0 [5,5–23,5] дней против 4,5 [0,0–14,0] дней; P = 0,06). ).
Средний балл по шкале бактериемии Питта (IQR) был значительно выше у пациентов с 14-дневной и 30-дневной госпитальной летальностью по сравнению с пациентами, выжившими через 14 и 30 дней (3.0 [0,50–5,0] против 7,0 [4,5–7,0] дней; P = 0,004; и 2,0 [0,25–5,0] против 6,5 [4,0–7,0] дня; P = 0,001 соответственно) (Таблица 2). При однофакторной логистической регрессии было обнаружено, что каждое увеличение показателя бактериемии Питта на 1 единицу предсказывало повышение риска смертности на 44% и 56% для 14-дневной и 30-дневной смертности, соответственно (Таблица 3). Пациенты с центральными венозными катетерами, установленными в течение 48 часов после положительного посева крови, также с большей вероятностью имели 14-дневную и 30-дневную смертность (26.3% против 60,9%; P = 0,05; и 21,4% против 57,1%; P = 0,05 соответственно) (Таблица 2). При однофакторной логистической регрессии наличие центрального венозного катетера увеличивало шансы 14-дневной и 30-дневной смертности на 4,36 и 4,89 (Таблица 3).
Таблица 3.Предикторы смертности с помощью одномерной логистической регрессии a
| . | Смертность в стационаре за 14 дней . | Смертность в больницах за 30 дней . | ||||
|---|---|---|---|---|---|---|
| Предиктор . | OR [95% ДИ] . | P Значение . | OR [95% ДИ] . | P Значение . | ||
| Демографические данные и характеристики пациента | ||||||
| Возраст | 1.04 [1.00–1.10] | .09 | 1.02 [0.98–1,08] | ,34 | ||
| ИМТ, кг / м 2 | 1,05 [0,97–1,15] | ,23 | 1,02 [0,94–1,12] | ,60 | ||
| 1,99 [0,57–7,38] | ,29 | 2,17 [0,57–9,45] | ,27 | |||
| Оценка бактериемии Питта | 1,44 [1,12–1,93] | 0,01 | 1,5 | .003 | ||
| Механическая вентиляция | 1.66 [0,41–6,93] | 0,47 | 2,04 [0,48–8,58] | 0,33 | ||
| Патологический рентген грудной клетки | 0,56 [0,07–3,25] | ,53 | 0,35 [0,02–2,5] ] | .37 | ||
| Центральный венозный катетер | 4,36 [1,22–17,6] | 0,03 | 4,89 [1,21–25,3] | .04 | ||
| Характеристики бактериемии | 8 | |||||
| Бактериемия MSSA | 2.58 [0,75–9,38] | ,14 | 3,24 [0,88–13,2] | ,09 | ||
| Источник пневмонии | 0,42 [0,08–1,99] | ,28 | 0,80 [ | 90,4117] .78|||
| Время от посева крови до начала приема антибиотиков | 1,00 [0,96–1,04] | .94 | 1,00 [0,97–1,05] | .82 | ||
| Бактериемия в больнице 8 3,24 [0,88–13,2] | .09 | 1,87 [0,48–7,28] | ,36 | |||
| . | Смертность в стационаре за 14 дней . | Смертность в больницах за 30 дней . | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Предиктор . | OR [95% ДИ] . | P Значение . | OR [95% ДИ] . | P Значение . | ||||||
| Демографические данные и характеристики пациента | ||||||||||
| Возраст | 1.04 [1.00–1.10] | .09 | 1.02 [0,98] | ИМТ, кг / м 2 | 1,05 [0,97–1,15] | ,23 | 1,02 [0,94–1,12] | ,60 | ||
| Латиноамериканцы | 1,99 [0,57–7118] | .292,17 [0,57–9,45] | 0,27 | |||||||
| Оценка бактериемии Питта | 1,44 [1,12–1,93] | 0,01 | 1,56 [1,19–2,18] | .003 | Механическая вентиляция1,66 [0,41–6,93] | 0,47 | 2,04 [0,48–8,58] | ,33 | ||
| Патологический рентген грудной клетки | 0,56 [0,07–3,25] | .53 | –2,52] | ,37 | ||||||
| Центральный венозный катетер | 4.36 [1,22–17,6] | .03 | 4,89 [1,21–25,3] | .04 | ||||||
| Характеристики бактериемии | ||||||||||
| ,14 | 3,24 [0,88–13,2] | ,09 | ||||||||
| Источник пневмонии | 0,42 [0,08–1,99] | ,28 | 0,80 [0,16–4,45] | . Время от посева крови до начала приема антибиотика | 1.00 [0,96–1,04] | ,94 | 1,00 [0,97–1,05] | ,82 | ||
| Бактериемия, начавшаяся в больнице b | 3,24 [0,88–13,2] | .09 | 0,48117 –7,28],36 | |||||||
Одномерная логистическая регрессия Предикторы смертности a
| . | Смертность в стационаре за 14 дней . | Смертность в больницах за 30 дней . | ||||
|---|---|---|---|---|---|---|
| Предиктор . | OR [95% ДИ] . | P Значение . | OR [95% ДИ] . | P Значение . | ||
| Демографические данные и характеристики пациента | ||||||
| Возраст | 1.04 [1.00–1.10] | .09 | 1.02 [0.98–1,08] | ,34 | ||
| ИМТ, кг / м 2 | 1,05 [0,97–1,15] | ,23 | 1,02 [0,94–1,12] | ,60 | ||
| 1,99 [0,57–7,38] | ,29 | 2,17 [0,57–9,45] | ,27 | |||
| Оценка бактериемии Питта | 1,44 [1,12–1,93] | 0,01 | 1,5 | .003 | ||
| Механическая вентиляция | 1.66 [0,41–6,93] | 0,47 | 2,04 [0,48–8,58] | 0,33 | ||
| Патологический рентген грудной клетки | 0,56 [0,07–3,25] | ,53 | 0,35 [0,02–2,5] ] | .37 | ||
| Центральный венозный катетер | 4,36 [1,22–17,6] | 0,03 | 4,89 [1,21–25,3] | .04 | ||
| Характеристики бактериемии | 8 | |||||
| Бактериемия MSSA | 2.58 [0,75–9,38] | ,14 | 3,24 [0,88–13,2] | ,09 | ||
| Источник пневмонии | 0,42 [0,08–1,99] | ,28 | 0,80 [ | 90,4117] .78|||
| Время от посева крови до начала приема антибиотиков | 1,00 [0,96–1,04] | .94 | 1,00 [0,97–1,05] | .82 | ||
| Бактериемия в больнице 8 3,24 [0,88–13,2] | .09 | 1,87 [0,48–7,28] | ,36 | |||
| . | Смертность в стационаре за 14 дней . | Смертность в больницах за 30 дней . | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Предиктор . | OR [95% ДИ] . | P Значение . | OR [95% ДИ] . | P Значение . | ||||||
| Демографические данные и характеристики пациента | ||||||||||
| Возраст | 1.04 [1.00–1.10] | .09 | 1.02 [0,98] | ИМТ, кг / м 2 | 1,05 [0,97–1,15] | ,23 | 1,02 [0,94–1,12] | ,60 | ||
| Латиноамериканцы | 1,99 [0,57–7118] | .292,17 [0,57–9,45] | 0,27 | |||||||
| Оценка бактериемии Питта | 1,44 [1,12–1,93] | 0,01 | 1,56 [1,19–2,18] | .003 | Механическая вентиляция1,66 [0,41–6,93] | 0,47 | 2,04 [0,48–8,58] | ,33 | ||
| Патологический рентген грудной клетки | 0,56 [0,07–3,25] | .53 | –2,52] | ,37 | ||||||
| Центральный венозный катетер | 4.36 [1,22–17,6] | .03 | 4,89 [1,21–25,3] | .04 | ||||||
| Характеристики бактериемии | ||||||||||
| ,14 | 3,24 [0,88–13,2] | ,09 | ||||||||
| Источник пневмонии | 0,42 [0,08–1,99] | ,28 | 0,80 [0,16–4,45] | . Время от посева крови до начала приема антибиотика | 1.00 [0,96–1,04] | ,94 | 1,00 [0,97–1,05] | ,82 | ||
| Бактериемия, начавшаяся в больнице b | 3,24 [0,88–13,2] | .09 | 0,48117 –7,28],36 | |||||||
Более высокий средний возраст также чаще встречался у пациентов с 14-дневной и 30-дневной смертностью по сравнению с выжившими пациентами (69,0 ± 10,6 против 61,58 ± 16,11; P = 0,08; и 67,0 ± 13,4 против 62,8 ± 14,3; P =.35 соответственно). Возраст был определен как значимый предиктор 14-дневной госпитальной смертности при многомерном логистическом регрессионном анализе, где на каждый год увеличения возраста возрастал на 10% риск 14-дневной смертности (Таблица 4). Также были более высокие показатели 14-дневной и 30-дневной смертности у пациентов с бактериемией в стационаре (52,6% против 78,3%; P = 0,15; и 57,1% против 71,4%; P = 0,56 соответственно. ) (Таблица 3). Многофакторный анализ выявил бактериемию, возникшую в стационаре, как значимый предиктор 14-дневной госпитальной летальности (11.9; 95% ДИ 2,03–114,7; P = 0,01). Показатель бактериемии Питта был значимым предиктором 30-дневной госпитальной летальности (OR 1,56; 95% ДИ 1,19–2,18; P = 0,003) (Таблица 4). Средний балл бактериемии Питта (IQR) был повышен у пациентов с бактериемией в стационаре по сравнению с пациентами без бактериемии в стационаре (6 [5-7] против 2 [2-3,75]; P = 0,01).
Таблица 4. Модель многомерной логистической регрессииПредикторы смертности a
| 14-дневная госпитальная летальность . | 30-дневная госпитальная смертность . | ||||
|---|---|---|---|---|---|
| Предиктор . | OR [95% ДИ] . | P Значение . | Предиктор . | OR [95% ДИ] . | P Значение . |
| Бактериемия в больнице b | 11,9 [2,03–114,7] | 0,01 | Оценка бактериемии Питта | 1.56 [1.19–2.18] | .003 |
| Возраст | 1,10 [1.03–1.20] | .02 | |||
| 30-дневная госпитальная смертность . | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Предиктор . | OR [95% ДИ] . | P Значение . | Предиктор . | OR [95% ДИ] . | P Значение . | ||||
| Бактериемия, возникшая в больнице b | 11,9 [2,03–114,7] | 0,01 | Оценка бактериемии Питта | 1,56 [1,19–2,18] | 0,003 [1.03–1.20] | .02 | |||
Предикторы смертности a
| Смертность в стационаре в течение 14 дней . | 30-дневная госпитальная смертность . | ||||
|---|---|---|---|---|---|
| Предиктор . | OR [95% ДИ] . | P Значение . | Предиктор . | OR [95% ДИ] . | P Значение . |
| Бактериемия в больнице b | 11,9 [2,03–114,7] | 0,01 | Оценка бактериемии Питта | 1.56 [1.19–2.18] | .003 |
| Возраст | 1,10 [1.03–1.20] | .02 | |||
| 30-дневная госпитальная смертность . | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Предиктор . | OR [95% ДИ] . | P Значение . | Предиктор . | OR [95% ДИ] . | P Значение . | ||||
| Бактериемия, возникшая в больнице b | 11,9 [2,03–114,7] | 0,01 | Оценка бактериемии Питта | 1,56 [1,19–2,18] | 0,003 [1.03–1.20] | .02 | |||
ОБСУЖДЕНИЕ
Мы сообщаем о 42 случаях S.aureus у пациентов, поступивших с COVID-19 в 2 больницы Нью-Йорка в то время, когда город был эпицентром пандемии в Соединенных Штатах. S. aureus бактериемия во время госпитализации COVID-19 наблюдалась только у 1,6% (42/2679) пациентов, но была связана с высоким уровнем смертности. 14-дневная госпитальная летальность от первого положительного посева крови составила 54,8%, а 30-дневная госпитальная смертность — 66,7%. Эти показатели намного выше, чем зарегистрированные показатели смертности пациентов, госпитализированных по поводу COVID-19, и составляют до 25% у пациентов, которым была выполнена искусственная вентиляция легких [4, 15, 16].Зарегистрированные показатели смертности пациентов с бактериемией S. aureus составляют до 30% [17–19]. Поскольку среднее время от момента получения положительного результата посева крови до смерти было <8, вероятно, причиной смерти была бактериемия S. aureus .
Инфекции, вызванные S. aureus , являются известным осложнением других вирусных пандемий, таких как испанский грипп в 1918–1919 годах и пандемия гриппа h2N1 в 2009–2010 годах [8, 20]. S. aureus , как известно, действует синергетически во все сезоны гриппа, увеличивая смертность и тяжесть заболевания [7, 21, 22].Предлагаемые механизмы вирусно-индуцированных бактериальных коинфекций включают вирусную модификацию структур дыхательных путей, а также инициирование иммуносупрессивных реакций [23–25]. Вирусы могут активировать лиганды для прикрепления бактерий к инфицированным вирусом клеткам дыхательных путей [23, 24] и могут инициировать иммуносупрессивные цитокины, чтобы уменьшить рекрутирование нейтрофилов [25]. Было установлено, что восемь пациентов в нашей серии случаев имели источник пневмонии, и только 2 пациента имели внебольничную пневмонию S. aureus .Мы также обнаружили, что у большинства пациентов была бактериемия, начавшаяся в больнице, что позволяет предположить, что взаимодействие S. aureus с SARS CoV-2 не похоже на грипп. Необходимы дальнейшие клинические и трансляционные исследования для дальнейшего определения этой взаимосвязи.
Сообщалось о бактериальных инфекциях у пациентов с COVID-19 [26]. Систематический обзор и метаанализ 30 исследований пациентов, инфицированных SARS-CoV-2, выявил, что из 3834 пациентов 7% имели сопутствующие бактериальные инфекции [27].Авторы провели объединенный анализ и обнаружили повышенный риск смерти от сопутствующих бактериальных инфекций (OR, 5,82; 95% ДИ, 3,4–9,9; I 2 = 85,4%), но они не исследовали конкретные места заражения. инфекции или патогены, такие как S. aureus [27]. Из других центров Нью-Йорка поступило 2 сообщения о бактериемии у пациентов с COVID-19. Sepulveda et al. сообщили, что до 31 марта 1,6% пациентов с COVID-19 имели бактериемию, при этом S. aureus являлись вторым по частоте патогеном, на который приходилось 13% бактериемий [5].Nori et al. сообщили об аналогичных результатах: 1,9% пациентов с COVID-19 с бактериемией с S. aureus в качестве наиболее распространенной этиологии, что составляет 44% бактериемии [26]. Ни в одном из этих исследований не оценивалось время бактериемии с инфекцией COVID-19 или связь со смертностью [5, 26]. По сравнению с этими исследованиями, в нашей серии случаев был обнаружен больший процент пациентов, у которых конкретно было S. aureus бактериемии, что может быть объяснено более длительным временем наблюдения, которое включало всю госпитализацию пациента.
У большинства наших пациентов также была обнаружена бактериемия в стационаре. Больничная бактериемия была предиктором 14-дневной смертности при многомерном анализе, но не 30-дневной смертности. Ранее сообщалось, что бактериемия в больнице связана с повышенной смертностью [28–30]. Мы также определили возраст как предиктор 14-дневной госпитальной смертности с помощью многофакторного анализа, который согласуется с предыдущими выводами о том, что пожилые пациенты с COVID-19 имеют более высокий риск смерти [31].
У наших пациентов также был повышенный показатель бактериемии Питта, который был предиктором 14-дневной и 30-дневной смертности при однофакторном анализе и 30-дневной смертности при многомерном анализе. Хотя шкала бактериемии Питта была впервые разработана для прогнозирования смертности от грамотрицательной бактериемии, показатель ≥2 указывает на значительный риск смерти для S. aureus [12, 13]. Для сравнения, наша средняя оценка бактериемии Питта (IQR) 5,0 (2,0–7,0) выше, чем ранее опубликованные S.aureus исследования бактериемии [13, 32]. Одно исследование показало, что средний балл бактериемии Питта (IQR) равен 0 (0–2), тогда как другое исследование показало, что средний балл бактериемии Питта равен 4 [13, 32]. Мы обнаружили, что средний балл бактериемии Питта был повышен у пациентов с бактериемией в стационаре, что, вероятно, способствовало ассоциации между бактериемией в больнице и 14-дневной смертностью.
Наше исследование ограничено ретроспективным дизайном и небольшим размером выборки, что ограничивало наши возможности по обнаружению всех предикторов S.aureus смертность. Переменные, относящиеся к нескольким категориям, таким как полученная антимикробная терапия и источник инфекции, не могли быть должным образом изучены. Было показано, что эти переменные влияют на смертность и потенциально искажают наши результаты [33, 34]. Наконец, немногим пациентам в нашей популяции была сделана трансторакальная эхокардиограмма, и никому не была сделана чреспищеводная эхокардиограмма. Ограниченное количество пациентов, которым была сделана эхокардиограмма, могло ограничить адекватный контроль источника и повлиять на исход смертности.
Чтобы ограничить неопределенность в отношении сроков активного заболевания COVID-19, наше исследование было ограничено госпитализацией, во время которой пациенту был поставлен диагноз COVID-19. Таким образом, в этом исследовании измерялась только внутрибольничная смертность, что означает, что смерти после выписки, которые все еще находились в пределах 30-дневного пост-положительного посевного диапазона, не учитывались. Однако средняя продолжительность пребывания в больнице выживших составляла 22,5 дня. Точно так же пациенты с COVID-19, повторно госпитализированные с бактериемией S. aureus , не были включены.
ВЫВОДЫ
Это одно из первых описаний бактериемии S. aureus у пациентов, инфицированных SARS-CoV-2, и первое описание предикторов смертности. S. aureus была обнаружена нечасто, но ассоциировалась с высокой смертностью пациентов, госпитализированных с COVID-19. Факторы риска, связанные с более высокой смертностью, включали бактериемию в стационаре, пожилой возраст и повышенный показатель бактериемии Питта. Необходимы дальнейшие исследования связи между COVID-19 и вторичным S.aureus бактериемия.
Благодарности
Мы хотели бы поблагодарить хранилище данных Mount Sinai за сбор данных о пациентах, инфицированных COVID-19.
Финансовая поддержка. Работа не финансировалась.
Возможный конфликт интересов. Все авторы: о конфликтах интересов не сообщалось. Все авторы подали форму ICMJE для раскрытия информации о потенциальных конфликтах интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Список литературы
1.Guan
WJ
,Ni
ZY
,Hu
Y
и др.Клиническая характеристика коронавирусной болезни 2019 г. в Китае
.N Engl J Med
.2020
;382
:1708
—20
.2.Redd
WD
,Zhou
JC
,Hathorn
KE
и др.Распространенность и характеристики желудочно-кишечных симптомов у пациентов с тяжелым острым респираторным синдромом, инфицированным коронавирусом 2, в США: многоцентровое когортное исследование
.Гастроэнтерология
2020
;159
:765
—7.e2
.3.Klok
FA
,Kruip
MJHA
,van der Meer
NJM
и др.Частота тромботических осложнений у тяжелобольных пациентов ОИТ с COVID-19
.Thromb Res
2020
;191
:145
—7
.4.Ричардсон
S
,Hirsch
JS
,Нарасимхан
M
и др.;Исследовательский консорциум Northwell COVID-19
.Представление характеристик, сопутствующих заболеваний и исходов среди 5700 пациентов, госпитализированных с COVID-19 в районе
Нью-Йорка.JAMA
2020
;323
:2052
—9
. 5.Sepulveda
J
,Westblade
LF
,Whittier
S
и др.Бактериемия и посев крови во время всплеска COVID-19 в Нью-Йорке
.Дж. Клин Микробиол
.2020
;58
:e00875
—20
.6.Tasher
D
,Stein
M
,Simoes
EA
и др.Инвазивные бактериальные инфекции в связи со вспышками гриппа, 2006–2010 гг.
.Clin Infect Dis
2011
;53
:1199
—207
.7.Chertow
DS
,Memoli
MJ
.Бактериальная коинфекция при гриппе: общий обзор
.JAMA
2013
;309
:275
—82
.8.Леунг
CH
,Tseng
HK
,Wang
WS
и др.Клиническая характеристика детей и взрослых, госпитализированных по поводу вирусной инфекции гриппа
.J Microbiol Immunol Infect
2014
;47
:518
—25
.9.Институт клинических и лабораторных стандартов
.Стандарты эффективности испытаний на чувствительность к противомикробным препаратам. 30-е изд (М100)
.Уэйн, Пенсильвания
:CLSI
;2020
.10.Henderson
H
,Luterbach
CL
,Cober
E
и др.Оценка бактериемии Питта позволяет прогнозировать смертность от небактериемических инфекций
.Clin Infect Dis
2020
;70
:1826
—33
.11.Al-Hasan
MN
,Lahr
BD
,Eckel-Passow
JE
,Baddour
LM
.Модель прогнозной оценки смертности от грамотрицательных инфекций кровотока
.Clin Microbiol Infect
2013
;19
:948
—54
.12.Чау
JW
,Yu
VL
.Комбинированная антибактериальная терапия в сравнении с монотерапией грамотрицательной бактериемии: комментарий
.Int J Antimicrob Agents
1999
;11
:7
—12
. 13.Холм
PC
,Береза
M
,Камеры
S
и др.Проспективное исследование 424 случаев бактериемии Staphylococcus aureus: определение факторов, влияющих на заболеваемость и смертность
.Intern Med J
2001
;31
:97
—103
. 14.Центры по контролю и профилактике заболеваний
.Организм с множественной лекарственной устойчивостью и модуль Clostridioides difficile Инфекция (MDRO / CDI).
Атланта
:Центры по контролю и профилактике заболеваний
;2018
.15.Уточнение уровня смертности и данных в аннотации, результатах и таблице 2
.JAMA
2020
;323
:2098
.16.Zhou
F
,Yu
T
,Du
R
и др.Клиническое течение и факторы риска смертности взрослых стационарных пациентов с COVID-19 в Ухане, Китай: ретроспективное когортное исследование
.Ланцет
2020
;395
:1054
—62
. 17.Dupper
AC
,Sullivan
MJ
,Chacko
KI
и др.Размытые молекулярные эпидемиологические границы между двумя доминирующими метициллин-устойчивыми клонами Staphylococcus aureus
.Открытый форум Infect Dis
2019
;6
:ofz302
. 18.van Hal
SJ
,Jensen
SO
,Vaska
VL
и др.Предикторы смертности Staphylococcus aureus бактериемия
.Clin Microbiol Ред.
2012
;25
:362
—86
.19.Klevens
RM
,Morrison
MA
,Nadle
J
и др.;Активный надзор за бактериальным ядром (ABC) MRSA Investigators
.Инвазивные метициллинрезистентные Staphylococcus aureus инфекции в США
.JAMA
2007
;298
:1763
—71
.20.Morens
DM
,Taubenberger
JK
,Fauci
AS
.Преобладающая роль бактериальной пневмонии как причины смерти при пандемическом гриппе: последствия для обеспечения готовности к пандемическому гриппу
.J Infect Dis
2008
;198
:962
—70
. 21.Моррис
DE
,Клири
DW
,Кларк
SC
.Вторичные бактериальные инфекции, связанные с пандемиями гриппа
.Передний микробиол
2017
;8
:1041
.22.Гончева
MI
,Conceicao
C
,Туфы
SW
и др.Staphylococcus aureus липаза 1 усиливает репликацию вируса гриппа А.
.млнBio
2020
;11
:e00975
—20
. 23.Plotkowski
MC
,Puchelle
E
,Beck
G
и др.Прилипание типа I Streptococcus pneumoniae к эпителию трахеи мышей, инфицированных вирусом гриппа A / PR8
.Am Rev Respir Dis
1986
;134
:1040
—4
.24.Navarini
AA
,Recher
M
,Lang
KS
и др.Повышенная восприимчивость к бактериальной суперинфекции как следствие врожденного противовирусного ответа
.Proc Natl Acad Sci U S A
2006
;103
:15535
—9
. 25.Didierlaurent
A
,Goulding
J
,Patel
S
и др.Устойчивая десенсибилизация к лигандам бактериальных Toll-подобных рецепторов после излечения респираторной инфекции гриппа
.J Exp Med
2008
;205
:323
—9
. 26.Nori
P
,Cowman
K
,Chen
V
и др.Бактериальные и грибковые коинфекции у пациентов с COVID-19, госпитализированных во время пандемии в Нью-Йорке
.Инфекционный контроль Hosp Epidemiol
.2020
;1
—5
.27.Lansbury
L
,Lim
B
,Baskaran
V
,Lim
WS
.Сопутствующие инфекции у людей с COVID-19: систематический обзор и метаанализ
.J Заражение
2020
;81
:266
—75
. 28.Wang
JT
,Hsu
LY
,Lauderdale
TL
и др.Сравнение результатов среди взрослых пациентов с внутрибольничной бактериемией, вызванной метициллин-чувствительной и метициллин-резистентной Staphylococcus aureus : ретроспективное когортное исследование
.PLoS One
2015
;10
:e0144710
. 29.Smit
J
,Søgaard
M
,Schønheyder
HC
и др.Классификация связанной со здравоохранением бактериемии Staphylococcus aureus : влияние различных определений на распространенность, характеристики пациентов и исход
.Инфекционный контроль Hosp Epidemiol
2016
;37
:208
—11
. 30.Kontula
KS
,Skogberg
K
,Ollgren
J
и др.Ранняя смерть при инфекциях кровотока: популяционная серия случаев
.Infect Dis (Lond)
2016
;48
:379
—85
. 31.Hagg
S
,Jylhava
J
,Wang
Y
и др.Возраст, слабость и сопутствующие заболевания как прогностические факторы краткосрочных исходов у пациентов с коронавирусной болезнью 2019 в гериатрической помощи
.J Am Med Dir Assoc
.2020
;21
:1555
—1559.e2
.32.Чанг
FY
,MacDonald
BB
,Peacock
JE
Jr, et al.Проспективное многоцентровое исследование бактериемии Staphylococcus aureus : частота эндокардита, факторы риска смертности и клиническое влияние устойчивости к метициллину
.Медицина (Балтимор)
2003
;82
:322
—32
. 33.McDanel
JS
,Perencevich
EN
,Diekema
DJ
и др.Сравнительная эффективность бета-лактамов по сравнению с ванкомицином для лечения метициллин-чувствительных Staphylococcus aureus инфекций кровотока в 122 больницах
.Clin Infect Dis
2015
;61
:361
—7
.34.Beganovic
M
,Cusumano
JA
,Lopes
V
, et al.Сравнительная эффективность исключительного воздействия нафциллина или оксациллина, цефазолина, пиперациллина / тазобактама и фторхинолонов среди национальной когорты ветеранов с метициллин-чувствительной инфекцией кровотока Staphylococcus aureus
.Открытый форум Infect Dis
2019
;6
:из 270
.Заметки автора
© Автор (ы) 2020. Опубликовано Oxford University Press от имени Общества инфекционных болезней Америки.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-NoDerivs (http://creativecommons.org/licenses/by-nc-nd/4.0/), которая разрешает некоммерческое воспроизведение и распространение. работы на любом носителе при условии, что оригинальная работа не была изменена или преобразована каким-либо образом, и что произведение правильно процитировано.По вопросам коммерческого повторного использования обращайтесь по адресу [email protected].Уход за инфекцией, вызванной Staphylococcus aureus
На этой странице:
Уход за собой
У себя дома
Берегите инфекции!
- Гной или выделения из ран очень заразны.
Забота о себе
Вымойте руки
- Часто мойте руки водой с антибактериальным мылом или спиртосодержащим средством для рук, особенно после смены повязок или прикосновения к дренажу.
- Важно, как вы моете руки.
- При использовании воды с мылом необходимо тереть руки не менее 20 секунд, чтобы избавиться от бактерий.
- При использовании дезинфицирующего средства для рук на спиртовой основе нанесите столько, чтобы покрыть все поверхности рук.
- Вымойте руки! Плакат
На этом плакате 11×17 показаны шесть этапов мытья рук с мылом или два этапа очистки с помощью дезинфицирующих средств для рук на спиртовой основе.
Принятие душа и уход за собой
- Часто принимайте ванну или душ, обязательно используйте мыло для мытья тела во время душа или ванны.
- Не используйте совместно полотенца, тряпки для мытья посуды, бритвы или другие личные вещи.
Уход за больными
- Если вы получили порез или царапину на коже, промойте ее водой с мылом, а затем наложите повязку.
- Не трогайте язвочки; если вы дотронетесь до язвы, немедленно вымойте руки.
- Накройте инфицированную область чистой сухой повязкой.
- Закройте инфицированные язвы повязкой и вымойте руки сразу после наложения повязки.
- По возможности носите одежду, закрывающую повязки и язвы.
- Быстро выбрасывайте использованные повязки.
Бинты сменные
Спорт и спортзал
- Не занимайтесь контактными видами спорта, пока ваши язвы не заживут.
- Не ходите в общественный тренажерный зал, сауну, гидромассажную ванну или бассейн, пока не заживут язвы.
У вас дома
Прачечная
При стирке нужно быть осторожным. Грязная одежда и постельное белье могут распространять стафилококк или бактерии MRSA.
- Прикасаясь к белью или меняя простыни, держите грязное белье подальше от тела и одежды, чтобы на одежду не попали бактерии.
- Надевайте одноразовые перчатки, чтобы прикасаться к белью, которое загрязнено биологическими жидкостями, такими как дренаж из язвы, моча или кал.
- Немедленно положите белье в стиральную машину или в пластиковый пакет, чтобы его можно было постирать.
- Стирайте белье теплой или горячей водой, по возможности используйте отбеливатель.
- Сушите в теплой или горячей сушилке и убедитесь, что одежда полностью высохла.
- Мойте руки после прикосновения к грязным простыням или одежде и перед тем, как прикасаться к чистому белью, даже если вы были в перчатках.
- Выбросьте перчатки после их снятия (не используйте их повторно) и вымойте руки.
Одежда и постельные принадлежности
- Меняйте простыни и полотенца не реже одного раза в неделю.
- Меняйте одежду ежедневно.
- Не кладите грязную одежду или одежду, которую вы только что надели, обратно в шкаф или ящики, пока они не выстираны.
Уборка дома
- Ежедневно очищайте часто используемые области вашего дома (ванные комнаты, столешницы и т. Д.) С помощью бытового дезинфицирующего средства или раствора отбеливателя.
- Обращайте внимание на предметы, к которым часто прикасаются — выключатели, дверные ручки, телефоны, туалеты, раковины, ванны и душевые, а также кухонные стойки.
- Протрите поверхность или предмет дезинфицирующим средством и дайте им высохнуть.
Дезинфицирующие средства, используемые:
- Вы можете использовать любое купленное в продуктовом магазине чистящее средство со словом «дезинфицирующее средство», не забудьте прочитать этикетку и следовать инструкциям
- Приготовьте собственный раствор из отбеливателя и воды:
- Смешайте две чайные ложки отбеливателя с одним литром воды в бутылке с распылителем и промаркируйте это «отбеливающий раствор».
- Делайте его свежим каждый раз, когда планируете чистку, потому что отбеливатель испаряется из воды, что снижает его эффективность
- Никогда не смешивайте отбеливатель с другими чистящими средствами, особенно с аммиаком
- Храните раствор отбеливателя в недоступном для детей месте и не разливайте его в бутылки, которые можно принять за напиток.
- Важно чистить ежедневно. Особенно предметы или поверхности, к которым вы часто прикасаетесь.
Acapsular Staphylococcus aureus с нефункциональным agr восстанавливает экспрессию капсулы после прохождения через кровоток в модели мыши с бактериемией
Tong, SYCC, Davis, JS, Eichenberger, E., Holland, TL & Fowler, VG Staphylococcus aureus Инфекции: эпидемиология, патофизиология, клинические проявления и лечение. Clin. Microbiol. Ред. 28 , 603–661 (2015).
CAS PubMed PubMed Central Google ученый
Goetghebeur, M., Landry, P. A., Han, D. & Vicente, C. Устойчивый к метициллину Staphylococcus aureus : проблема общественного здравоохранения с экономическими последствиями. банка. J. Infect. Дис. Med. Microbiol. 18 , 27–34 (2007).
PubMed PubMed Central Google ученый
Престинаци Ф., Пеццотти П. и Пантости А. Устойчивость к противомикробным препаратам: глобальное многогранное явление. Pathog. Glob. Здоровье 109 , 309–318 (2015).
PubMed PubMed Central Google ученый
Howden, B. P. et al. Различные паттерны экспрессии бактериальных генов и ослабленные иммунные ответы хозяина связаны с развитием низкой устойчивости к ванкомицину во время стойкой метициллин-резистентной Staphylococcus aureus бактериемии. BMC Microbiol. 8 , 39. https://doi.org/10.1186/1471-2180-8-39 (2008).
CAS Статья PubMed PubMed Central Google ученый
Kallen, A. J. et al. Инвазивные инфекции MRSA, связанные с оказанием медицинской помощи, 2005–2008 гг. JAMA 304 , 641–648 (2010).
ADS CAS PubMed Google ученый
Дэвид М. З. и Даум Р. С. Связанный с сообществом устойчивый к метициллину Staphylococcus aureus : эпидемиология и клинические последствия возникающей эпидемии. Clin. Microbiol. Ред. 23 , 616–687 (2010).
CAS PubMed PubMed Central Google ученый
Fernandez, S. et al. Высокая вирулентность метициллин-устойчивого Staphylococcus aureus ST30-SCCmecIVc-spat019, доминирующий клон, связанный с сообществами в Аргентине. Внутр. J. Med. Microbiol. 307 , 191–199 (2017).
CAS PubMed Google ученый
Tuchscherr, L., Loffler, B., Buzzola, F. R. & Sordelli, D. O. Staphylococcus aureus адаптация к хозяину и устойчивость: роль потери экспрессии капсульного полисахарида. Future Microbiol. 5 , 1823–1832 (2010).
CAS PubMed Google ученый
Suligoy, C.M. et al. Мутация Agr связана с адаптацией Staphylococcus aureus к хозяину во время хронического остеомиелита. Фронт. Клетка. Заразить. Microbiol. 8 , 18. https://doi.org/10.3389/fcimb.2018.00018 (2018).
CAS Статья PubMed PubMed Central Google ученый
Vandenesch, F., Lina, G. & Henry, T. Staphylococcus aureus гемолизины, двухкомпонентные лейкоцидины и цитолитические пептиды: избыточный арсенал факторов вирулентности, повреждающих мембраны? 2 , 12.https://doi.org/10.3389/fcimb.2012.00012 (2012).
Tuchscherr, L. & Loffler, B. Staphylococcus aureus динамически адаптирует глобальные регуляторы и экспрессию фактора вирулентности в процессе от острой до хронической инфекции. Curr. Genet. 62 , 15–17 (2016).
CAS PubMed Google ученый
Proctor, R.A. et al. Варианты небольших колоний: патогенная форма бактерий, способствующая хроническим и рецидивирующим инфекциям. Nat. Rev. Microbiol. 4 , 295–305 (2006).
CAS PubMed Google ученый
Garofalo, A. et al. Длина белка Staphylococcus aureus , полиморфная область регулирует воспаление: влияние на острую и хроническую инфекцию. J. Infect. Дис. 206 , 81–90 (2012).
CAS PubMed Google ученый
Das, S. et al. Естественные мутации в регуляторе вирулентности Staphylococcus aureus ослабляют цитотоксичность, но допускают бактериемию и образование абсцесса. Proc. Natl. Акад. Sci. 113 , E3101 – E3110 (2016).
CAS PubMed Google ученый
Lattar, S. M. et al. Экспрессия в капсулах и генотипические различия между изолятами Staphylococcus aureus от пациентов с хроническим или острым остеомиелитом. Заражение. Иммун. 77 , 1968–1975 (2009).
CAS PubMed PubMed Central Google ученый
Риордан, К. О. и Ли, Дж. С. Staphylococcus aureus капсульные полисахариды. Clin. Microbiol. Ред. 17 , 218–234 (2004).
Google ученый
Cocchiaro, J. L. et al. Молекулярная характеристика локуса капсулы из нетипируемого Staphylococcus aureus . Mol. Microbiol. 59 , 948–960 (2006).
CAS PubMed Google ученый
Nanra, J. S. et al. Капсульные полисахариды являются важным механизмом уклонения от иммунитета для Staphylococcus aureus . Hum. Вакцин. Immunother. 9 , 480–487 (2013).
CAS PubMed Google ученый
Thakker, M., Park, J. S., Carey, V. & Lee, J. C. Staphylococcus aureus капсульный полисахарид серотипа 5 является антифагоцитарным и усиливает бактериальную вирулентность в модели бактериемии на мышах. Заражение. Иммун. 66 , 5183–5189 (1998).
CAS PubMed PubMed Central Google ученый
Mohamed, N. et al. Молекулярная эпидемиология и экспрессия капсульных полисахаридов в клинических изолятах Staphylococcus aureus в США. PLoS ONE 14 , e0208356. https://doi.org/10.1371/journal.pone.0208356 (2019).
CAS Статья PubMed PubMed Central Google ученый
Дастгейб С. и Отто М. Адаптация стафилококков к различным физиологическим нишам: обзор транскриптомных и фенотипических изменений в различных биологических средах. Future Microbiol. 10 , 1981–1995 (2015).
CAS PubMed PubMed Central Google ученый
Tan, X. et al. Хроническая инфекция легких Staphylococcus aureus коррелирует с протеогеномными и метаболическими адаптациями, ведущими к повышенной внутриклеточной персистенции. Clin. Заразить. Дис. 69 , 1937–1945 (2019).
PubMed Google ученый
Tuchscherr, L. et al. Клинические изоляты S. aureus различаются по своей вирулентности, что способствует адаптации к хозяину. Токсины (Базель) 11 , 1. https://doi.org/10.3390/toxins11030135 (2019).
CAS Статья Google ученый
Kahl, B.C. et al. Динамика популяции стойких Staphylococcus aureus , выделенных из дыхательных путей пациентов с муковисцидозом в ходе 6-летнего проспективного исследования. J. Clin. Microbiol. 41 , 4424–4427 (2003).
CAS PubMed PubMed Central Google ученый
Traber, K. E. et al. Функция agr в клинических изолятах Staphylococcus aureus . Микробиология 154 , 2265–2274. https://doi.org/10.1099/mic.0.2007/011874-0 (2008).
CAS Статья PubMed PubMed Central Google ученый
Shopsin, B. et al. Распространенность дисфункции agr среди колонизирующих штаммов Staphylococcus aureus . J. Infect. Дис. 198 , 1171–1174 (2008).
PubMed Google ученый
Fischer, J., Lee, J.C., Peters, G. & Kahl, B.C. Акапсулярный клинический Изолят Staphylococcus aureus не имеет функции agr . Clin. Microbiol. Заразить. 20 , O414 – O417 (2014).
CAS PubMed Google ученый
Проктор, Р. А. Последние разработки вакцины Staphylococcus aureus : проблемы клинической и фундаментальной науки. Eur. Клетка. Матер. 30 , 315–326 (2015).
CAS PubMed Google ученый
Anderson, A. S. et al. Разработка многокомпонентной вакцины Staphylococcus aureus , предназначенной для противодействия множественным факторам бактериальной вирулентности. Hum. Вакцин. Immunother. 8 , 1585–1594 (2012).
CAS PubMed PubMed Central Google ученый
Lattar, S. M. et al. Белковые антигены увеличивают защитную эффективность капсульной вакцины против Staphylococcus aureus в модели остеомиелита у крыс. Заражение. Иммун. 82 , 83–91 (2014).
PubMed PubMed Central Google ученый
Park, S., Gerber, S. & Lee, J. C. Антитела к капсулярному полисахариду Staphylococcus aureus серотипа 8 реагируют с изолятами серотипа 5 и 8 и защищают от них. Заражение. Иммун. 82 , 5049–5055 (2014).
PubMed PubMed Central Google ученый
Boyle-Vavra, S. et al. USA300 и USA500 клональные линии Staphylococcus aureus не продуцируют капсульный полисахарид из-за консервативных мутаций в локусе cap5 . мБио 6 , e02585-e2614. https://doi.org/10.1128/mBio.02585-14.1-10 (2015).
Артикул PubMed PubMed Central Google ученый
Jenul, C. & Horswill, A.R. Регулирование вирулентности Staphylococcus aureus . Microbiol. Спектр. 6 , 1. https://doi.org/10.1128/microbiolspec.GPP3-0031-2018 (2018).
Артикул Google ученый
Ballal, A., Ray, B. & Manna, A. C. sarZ , ген семейства sarA , транскрипционно активируется MgrA и участвует в регуляции генов, кодирующих экзопротеины в Staphylococcus aureus . J. Bacteriol. 191 , 1656–1665 (2009).
CAS PubMed Google ученый
Moisan, H. et al. Транскрипция факторов вирулентности в Staphylococcus aureus варианта малых колоний, выделенных от пациентов с муковисцидозом, находится под влиянием SigB. J. Bacteriol. 188 , 64–76 (2006).
CAS PubMed PubMed Central Google ученый
Keinhörster, D. et al. Возвращаясь к регуляции кластера генов биосинтеза капсульного полисахарида в Staphylococcus aureus . Mol. Microbiol. 112 , 1083–1099 (2019).
PubMed Google ученый
Muller, M. et al. Делеция ассоциированного с мембраной Asp23 ведет к усиленной регуляции генов стресса клеточной стенки у Staphylococcus aureus . Mol. Microbiol. 93 , 1259–1268 (2014).
PubMed Google ученый
Liu, H. et al. Новая мутация SigB (Q225P) в Staphylococcus aureus сохраняет вирулентность, но способствует образованию биопленок. Emerg. Микробы заражают. 7 , 72. https://doi.org/10.1038/s41426-018-0078-1 (2018).
CAS Статья PubMed PubMed Central Google ученый
Marbach, H. et al. Эволюция крупного рогатого скота внутри хозяина Staphylococcus aureus отбирает SigB-дефицитный патотип, характеризующийся пониженной вирулентностью, но повышенной протеолитической активностью и образованием биопленок. Sci. Реп. 9 , 13479.https://doi.org/10.1038/s41598-019-49981-6 (2019).
ADS CAS Статья PubMed PubMed Central Google ученый
Малахова Н. и ДеЛео Ф. Р. Мобильные генетические элементы Staphylococcus aureus . Cell. Мол. Life Sci. 67 , 3057–3071 (2010).
CAS PubMed PubMed Central Google ученый
Giulieri, S. G. et al. Геномное исследование последовательных клинических изолятов выявило отличительную молекулярную подпись стойкой бактериемии Staphylococcus aureus . Genome Med. 10 , 65. https://doi.org/10.1186/s13073-018-0574-x (2018).
CAS Статья PubMed PubMed Central Google ученый
Botelho, A. M. N. et al. Полная последовательность генома изолята MRSA HC1335 из линии ST239, демонстрирующая усеченный рецептор гистидинкиназы AgrC. Genome Biol. Evol. 8 , 3187–3192 (2016).
CAS PubMed PubMed Central Google ученый
Senn, M. M. et al. Молекулярный анализ и организация оперона sigmaB в Staphylococcus aureus . J. Bacteriol. 187 , 8006–8019 (2005).
CAS PubMed PubMed Central Google ученый
Альтман, Д. Р. и др. Пластичность генома agr- дефектный Staphylococcus aureus во время клинической инфекции. Заражение. Иммун. 86 , e00331-e418. https://doi.org/10.1128/IAI.00331-18 (2018).
CAS Статья PubMed PubMed Central Google ученый
Shopsin, B. et al. Мутации в agr не сохраняются в естественных популяциях метициллин-резистентных Staphylococcus aureus . J. Infect. Дис. 202 , 1593–1599 (2010).
CAS PubMed Google ученый
Клаудитц, А., Реш, А., Виланд, К. П., Пешель, А. и Гётц, Ф. Стафилоксантин играет роль в приспособленности Staphylococcus aureus и его способности справляться с окислительным стрессом. Заражение. Иммун. 74 , 4950–4953 (2006).
CAS PubMed PubMed Central Google ученый
Hall, J. W., Yang, J., Guo, H. & Ji, Y. Двухкомпонентная система Staphylococcus aureus AirSR опосредует резистентность активных форм кислорода посредством регуляции транскрипции продукции стафилоксантина. Заражение. Иммун. 85 , e00838-e916. https://doi.org/10.1128/IAI.00838-16 (2017).
CAS Статья PubMed PubMed Central Google ученый
Liu, G. Y. et al. Staphylococcus aureus Золотой пигмент снижает уничтожение нейтрофилов и способствует вирулентности благодаря своей антиоксидантной активности. J. Exp. Med. 202 , 209–215 (2005).
CAS PubMed PubMed Central Google ученый
Mishra, N. N. et al. Связанное с каротиноидами изменение текучести клеточной мембраны влияет на чувствительность Staphylococcus aureus к защитным пептидам хозяина. Антимикробный. Агенты Chemother. 55 , 526–531 (2011).
CAS PubMed Google ученый
Martineau, F. et al. Видоспецифические анализы на основе повсеместной ДНК для быстрой идентификации Staphylococcus aureus . J. Clin. Microbiol. 36 , 618–623 (1998).
CAS PubMed PubMed Central Google ученый
Lattar, S.M. et al. Молекулярный фингерпринт Staphylococcus aureus , выделенного от пациентов с остеомиелитом в Аргентине, и клональное распределение генов cap5 (8) и других выбранных генов вирулентности. Eur. J. Clin. Microbiol. Заразить. Дис. 31 , 2559–2566 (2012).
CAS PubMed PubMed Central Google ученый
Hawkins, P. et al. Руководство по определению и внедрению протоколов оценки благополучия лабораторных животных: одиннадцатый отчет совместной рабочей группы BVAAWF / FRAME / RSPCA / UFAW по уточнению. Lab. Anim. 45 , 1. https://doi.org/10.1258/la.2010.010031 (2011).
CAS Статья PubMed Google ученый
Банкевич А. и др. SPAdes: новый алгоритм сборки генома и его приложения для секвенирования отдельных клеток. J. Comput. Биол. 19 , 455–477 (2012).
MathSciNet CAS PubMed PubMed Central Google ученый
Seemann, T. Prokka: быстрая аннотация прокариотического генома. Биоинформатика 30 , 2068–2069 (2014).
CAS PubMed Google ученый
Koren, S. et al. Canu: масштабируемая и точная сборка с длинным считыванием за счет адаптивного взвешивания k-mer и разделения повторов. Genome Res. 27 , 722–736 (2017).
CAS PubMed PubMed Central Google ученый
Вик, Р. Р., Джадд, Л. М., Горри, К. Л. и Холт, К. Э. Unicycler: определение сборок бактериального генома из коротких и длинных считываний секвенирования. PLoS Comput. Биол. 13 , e1005595. https://doi.org/10.1371/journal.pcbi.1005595 (2017).
ADS CAS Статья PubMed PubMed Central Google ученый
Ли, Х. Миникарта и миниазм: быстрое отображение и сборка de novo для зашумленных длинных последовательностей. Биоинформатика 32 , 2103–2110 (2016).
CAS PubMed PubMed Central Google ученый
Vaser, R., Sovic, I., Nagarajan, N. & Sikic, M. Быстрая и точная сборка генома de novo из длинных неисправленных считываний. Genome Res. 27 , 737–746 (2017).
CAS PubMed PubMed Central Google ученый
Walker, B.J. et al. Pilon: интегрированный инструмент для комплексного обнаружения вариантов микробов и улучшения сборки генома. PLoS ONE 9 , e112963. https://doi.org/10.1371/journal.pone.0112963 (2014).
ADS CAS Статья PubMed PubMed Central Google ученый
Сеппи, М., Манни, М. и Здобавов, Э. М. БУСКО: оценка сборки генома и полноты аннотаций. Methods Mol. Биол. 1962 , 227–245 (2019).
CAS PubMed Google ученый
Галата В., Фельманн Т., Бэкес С. и Келлер А. PLSDB: ресурс полных бактериальных плазмид. Nucleic Acids Res. 47 , D195 – D202 (2019).
CAS PubMed Google ученый
Ли, Дж. К., Лю, М.-Дж., Parsonnet, J. & Arbeit, R. D. Экспрессия капсульного полисахарида типа 8 и выработка токсина 1 синдрома токсического шока связаны между вагинальными изолятами Staphylococcus aureus . J. Clin. Microbiol. 28 , 2612–2615 (1990).
CAS PubMed PubMed Central Google ученый
Morikawa, K. et al. Сверхэкспрессия сигма-фактора, сигма (B), побуждает Staphylococcus aureus утолщать клеточную стенку и сопротивляться бета-лактамам. Biochem. Биофиз. Res. Commun. 288 , 385–389 (2001).
CAS PubMed Google ученый
Dotto, C. et al. Активный компонент аспирина, салициловая кислота, Staphylococcus aureus способствует формированию биопленки зависимым от мягких пузырей образом. 8, 4. https://doi.org/10.3389/fmicb.2017.00004 (2017).
Ливак К. Дж. И Шмитген Т.D. Анализ данных относительной экспрессии генов с использованием количественной ПЦР в реальном времени и метода 2 -ΔΔC T . Методы 25 , 402–408 (2001).
CAS Google ученый
Mendoza Bertelli, A. et al. Протеин A Staphylococcus aureus усиливает остеокластогенез посредством передачи сигналов TNFR1 и EGFR. Biochim. Биофиз. Acta 1862 , 1975–1983 (2016).
CAS PubMed Google ученый
Giai, C. et al. Золотистый стафилококк индуцирует выделение IL-1RII в моноциты и нейтрофилы. J. Врожденный иммунитет. 8 , 284–298 (2016).
CAS PubMed PubMed Central Google ученый
Золотистый стафилококк (инфекция стафилококка) — MotherToBaby
В этом листе рассказывается о воздействии золотистого стафилококка и инфекций стафилококка во время беременности и грудного вскармливания.Эта информация не должна заменять медицинскую помощь и советы вашего лечащего врача.
Что такое золотистый стафилококк / стафилококковая инфекция?
Staphylococcus aureus (Staph) — это разновидность бактерий (микробов). Бактерии стафилококка обычно находятся на коже или в носу.
В большинстве случаев у людей не будет проблем с этими бактериями. Однако, если Staph попадает внутрь тела через порез или рану, это может привести к инфекции Staph.Инфекция стафилококка может вызвать фурункулы или волдыри на коже; или инфекции в легких (пневмония), кровоток (сепсис) или в ране.
К людям с более высоким шансом заразиться стафилококковой инфекцией относятся больные в больницах, люди, восстанавливающиеся после операций или других медицинских процедур, люди, живущие в условиях перенаселенности (приюты или тюрьмы), дети в детских садах, потребители инъекционных наркотиков, люди с ослабленной иммунной системой, люди с хроническими заболеваниями (например, диабет или рак), спортсмены и военнослужащие.
Употребление в пищу продуктов, зараженных бактериями Staph, также может вызвать пищевое отравление. Симптомами могут быть сильная рвота и диарея с болью в животе, которая начнется в течение нескольких часов после заражения. Этот тип инфекции, вызываемой бактериями Staph, обычно не является серьезным и длится не более суток.
Я беременна. Если у моего партнера, другого члена семьи или друга подтверждена кожная инфекция, вызванная стафилококком, что я могу сделать, чтобы снизить свои шансы заразиться инфекцией?
- Не дотрагивайтесь до ран, порезов или повязок человека.
- Часто мойте руки с мылом и всегда мойте руки после прямого контакта с кем-либо, у кого есть кожная инфекция.
- Не используйте совместно полотенца, мыло, бритвы, пинцеты или другие личные вещи.
- Если вам нужно постирать белье для человека, инфицированного Staph, постирайте его при самой теплой температуре, рекомендованной производителем, и тщательно высушите одежду.
У меня инфекция стафилококка. Может ли мне сложнее забеременеть?
На основании имеющихся данных неизвестно, может ли инфекция Staph затруднить беременность.
Увеличивает ли заражение стафилококком вероятность выкидыша?
Выкидыш может произойти при любой беременности. На основании имеющихся данных неизвестно, увеличивает ли инфекция стафилококка вероятность выкидыша.
Повышает ли / заражение стафилококковой инфекцией риск врожденных дефектов?
Каждая беременность начинается с 3-5% вероятности наличия врожденного порока. Это называется фоновым риском. Инфекции стафилококка не связаны с повышенным риском врожденных дефектов.Однако инфекции Staph, которые достигают крови, могут вызвать лихорадку, а температура 101 градус и более может увеличить вероятность некоторых врожденных дефектов. См. Наш информационный бюллетень о гипертермии по адресу https://mothertobaby.org/fact-sheets/hyperthermia-pregnancy/ для получения дополнительной информации о лихорадке.
Может ли инфекция стафилококка вызвать другие осложнения беременности?
Если околоплодные воды (жидкость вокруг ребенка) инфицированы стафилококком, это может вызвать преждевременные роды (рождение ребенка до 37 недель).Младенцы также могут заразиться стафилококком от матери во время рождения. В большинстве случаев это не вызывает проблем у ребенка, но иногда может вызвать заболевание у новорожденного.
Вызывает ли наличие / заражение стафилококковой инфекцией во время беременности долгосрочные проблемы для ребенка?
Неизвестно, может ли инфекция стафилококка во время беременности вызвать у ребенка долгосрочные проблемы.
Могу ли я кормить грудью, если у меня инфекция стафилококка?
Инфекции, вызванные стафилококком, являются частой причиной мастита в груди.По данным Американской академии педиатрии, молоко безопасно для ребенка, и люди, страдающие маститом, могут продолжать кормить грудью.
Вполне возможно, что инфекция стафилококка может распространиться на грудного ребенка во время грудного вскармливания при прямом контакте с кожей. Если у вас инфекция кожи, вызванная Staph, важно, чтобы рана была закрыта повязкой, чтобы ребенок не касался раны или выделений из нее. Это важно, даже если в настоящее время вы не кормите грудью. Ребенок также может заразиться при контакте с одеждой, постельным бельем или другими материалами, на которых есть бактерии.
Кроме того, есть сообщения о том, что младенцы заразились стафилококком через сцеженное (сцеженное) грудное молоко, которое было заражено из насосного оборудования или контейнеров для хранения. Поэтому важно тщательно мыть и стерилизовать насосное оборудование и емкости для хранения, а также руки при сцеживании грудного молока.
Не все инфекции Staph требуют лечения. Однако, если вы проходите лечение, вы можете связаться с MotherToBaby, чтобы обсудить ваши конкретные лекарства во время кормления грудью.Обязательно обсудите вопросы, связанные с грудным вскармливанием, со своим врачом.
У меня инфекция стафилококка. Может ли мне осложнить беременность моей партнерши или увеличить вероятность врожденных дефектов?
Некоторые исследования показали, что инфекция Staph может повлиять на сперму и фертильность. В общем, воздействие отцов или доноров спермы вряд ли повысит риск беременности. Для получения дополнительной информации см. Информационный бюллетень MotherToBaby «Отцовские воздействия» по адресу https: // mothertobaby.орг / фактологические бюллетени / отцовские-разоблачения-беременность /.
Щелкните здесь, чтобы получить ссылки.
OTIS / MotherToBaby признает, что не все люди идентифицируют себя как «мужчины» или «женщины». Когда мы используем термин «мать», мы подразумеваем источник яйцеклетки и / или матки, а под «отцом» мы подразумеваем источник спермы, независимо от гендерной идентичности человека.
Просмотреть в PDF Информационный бюллетень
MRSA — NHS
MRSA — это тип бактерий, устойчивых к нескольким широко используемым антибиотикам.Это означает, что инфекции MRSA лечить труднее, чем другие бактериальные инфекции.
Полное название MRSA — метициллин-устойчивый золотистый стафилококк. Вы, наверное, слышали, что это называется «супербактерий».
Инфекции MRSA в основном поражают людей, находящихся в больнице. Они могут быть серьезными, но обычно их можно лечить антибиотиками, которые действуют против MRSA.
Как получить MRSA
MRSA безвредно обитает на коже примерно у 1 из 30 человек, обычно в носу, подмышках, паху или ягодицах.Это известно как «колонизация» или «перенос» MRSA.
Вы можете заразиться MRSA на коже:
- прикоснувшись к тому, у кого он есть
- , поделившись такими вещами, как полотенца, простыни и одежда, с кем-то, у кого на коже есть MRSA
- прикоснувшись к поверхностям или предметам, на которых есть MRSA
Попадание MRSA на кожу не вызовет у вас заболевания, и он может пройти через несколько часов, дней, недель или месяцев без вашего ведома. Но это может вызвать инфекцию, если проникнет глубже в ваше тело.
Люди, находящиеся в больнице, подвергаются наибольшему риску этого, потому что:
- у них часто есть способ проникновения бактерий в их тело, например, рана, ожог, зонд для кормления, капание в вену или мочевой катетер.
- у них могут быть другие серьезные проблемы со здоровьем, которые означают, что их тело менее способно бороться с бактериями
- они находятся в тесном контакте с большим количеством людей, поэтому бактерии могут легче распространяться
Здоровые люди, в том числе дети и беременные женщины обычно не подвержены риску заражения MRSA.
Симптомы MRSA
Наличие MRSA на коже не вызывает никаких симптомов и не вызывает болезни.
Обычно вы не узнаете, есть ли он у вас, если не пройдете скрининговый тест перед госпитализацией.
Если MRSA проникает глубже в кожу, это может вызвать:
- отек
- тепло
- боль
- гной
- покраснение, но это может быть менее заметно на более темной коже
Если он проникает дальше в ваше тело , это также может вызвать:
Сообщите сотруднику, если у вас появятся эти симптомы во время пребывания в больнице.
Позвоните терапевту или в NHS 111, если у вас появятся эти симптомы вне больницы.
Скрининг и тестирование на MRSA
Если вам нужно лечь в больницу и, скорее всего, вы останетесь на ночь, вы можете пройти простой скрининговый тест, чтобы проверить свою кожу на MRSA перед поступлением.
Обычно это делается в поликлинике или у терапевта. Медсестра проведет по коже ватной палочкой (тампоном), чтобы проверить ее на MRSA.
Мазки можно брать из нескольких мест, например из носа, горла, подмышек, паха или любой поврежденной кожи.Это безболезненно и занимает всего несколько секунд.
Результаты будут доступны в течение нескольких дней.
Если у вас нет MRSA, маловероятно, что с вами свяжутся по поводу результата, и вам следует следовать инструкциям в больнице.
Если у вас есть MRSA, вам сообщат об этом в больнице или у терапевта.
Вам может потребоваться лечение для удаления бактерий, чтобы снизить риск заражения или распространения бактерий.
Лечение MRSA
Удаление MRSA с кожи
Если скрининг обнаруживает MRSA на коже, вам может потребоваться лечение для его удаления.Это называется деколонизацией.
Обычно это включает:
- нанесение антибактериального крема внутрь носа 3 раза в день в течение 5 дней
- мытье антибактериальным шампунем каждый день в течение 5 дней
- смена полотенца, одежды и постельного белья каждый день во время лечения — прачечная следует мыть отдельно от других людей и при высокой температуре.
Лечение обычно проводится дома, но может быть начато после госпитализации, если вам нужно быстро попасть в больницу.
Лечение инфекции MRSA
Если вы заразились инфекцией MRSA, вы обычно будете лечиться антибиотиками, которые действуют против MRSA.
Их можно принимать в виде таблеток или вводить в виде инъекций. Лечение может длиться от нескольких дней до нескольких недель.
Во время лечения вам может потребоваться оставаться в своей комнате или в палате с другими людьми, у которых есть инфекция MRSA, чтобы помочь остановить ее распространение.
Обычно к вам все еще могут приходить посетители, но важно, чтобы они приняли меры для предотвращения распространения MRSA.
Предотвращение MRSA
Если вы остаетесь в больнице, вы можете предпринять несколько простых действий, чтобы снизить риск заражения или распространения MRSA.
Вам следует:
- часто мыть руки (также эффективны салфетки для рук и спиртовой гель для рук) — особенно до и после еды и после посещения туалета.
- Следуйте вашим советам по уходу за раной и уходу за ней. устройства, которые могут привести к инфекции (например, мочевые катетеры или капельницы)
- сообщать персоналу о любых нечистотах — не бойтесь разговаривать с персоналом, если вас беспокоит гигиена
Если вы навещаете кого-то в больнице, мойте руки до и после входа в палату, а также перед тем, как прикасаться к человеку.Гель или салфетки часто кладут у кроватей пациентов и у входа в палаты.
Также рекомендуется наложить повязку на любые повреждения кожи, такие как язвы или порезы, чтобы предотвратить попадание MRSA в ваше тело.
Получите дополнительную консультацию по поводу посещения больницы
Видео: MRSA
В этом видео рассказывается, как заражается MRSA, что происходит, когда он у вас есть, и как предотвратить заражение.
Последний раз просмотр СМИ: 12 января 2021 г.
Срок сдачи обзора СМИ: 12 января 2024 г.
Последняя проверка страницы: 24 марта 2020 г.
Срок следующей проверки: 24 марта 2023 г.
границ | Золотистый стафилококк, усваиваемый кератиноцитами кожи, не убивает антибиотики
Введение
Золотистый стафилококк ( S.aureus ) колонизирует кожу у 20–30% населения и вызывает 80–90% всех инфекций кожи и мягких тканей у людей во всем мире (Tong et al., 2015; Dayan et al., 2016; Peterson and Schora, 2016). ). В Соединенных Штатах частота госпитализаций по поводу инфекции S. aureus увеличилась более чем вдвое с 57 на 100 000 населения в 2001 году до 117 на 100 000 населения в 2009 году (Suaya et al., 2014). Большая многоцентровая ретроспективная когорта из 50 миллионов застрахованных лиц, базирующаяся в США, обнаружила, что в период с 2005 по 2010 год их было двое.3 миллиона амбулаторных и стационарных обращений пациентов в возрасте 0–65 лет с инфекциями кожи и мягких тканей (Miller et al., 2015b; Kaye et al., 2019). Инфекции более опасны у пациентов с поврежденным роговым слоем эпидермиса, что является обычным явлением при атопическом дерматите, когда колонизация достигает почти 100% (Kobayashi et al., 2015; Tauber et al., 2016; Meylan et al., 2017).
Рецидивирующие кожные инфекции S. aureus регистрируются у 39% пациентов в течение 3 месяцев и> 50% в течение 6 месяцев после первоначального инфицирования, что требует повторных курсов антибиотиков и увеличивает риск устойчивости к антибиотикам (Miller et al., 2015а; Geoghegan et al., 2018). Причины повторного заражения многофакторны, и важной причиной является перекрестное и повторное заражение от членов семьи, медицинских работников, домашних животных и фомитов (Montgomery et al., 2015). MRSA также представляет собой серьезную проблему, поскольку с момента первоначального выявления в 1961 году они быстро распространились как в сообществе, так и в больницах. Уровень колонизации MRSA варьируется от 0,2 до 7,4% в сообществе с последующим распространением среди двух третей контактов в домохозяйстве. Пациенты больниц имеют гораздо более высокую распространенность MRSA — от 20 до 40% (Bassetti et al., 2017; Turner et al., 2019).
Основной вопрос, который мы ставили перед собой задачу решить в этом исследовании, заключается в том, почему у некоторых пациентов развиваются хронические или рецидивирующие инфекции с тем же клоном S. aureus , даже после явно адекватных курсов антибиотиков для проверенных метициллин-чувствительных штаммов и соответствующих мер по борьбе с перекрестными инфекциями. -загрязнение (Byrd et al., 2017; O’Gara, 2017). Мы предположили, что интернализация S. aureus кератиноцитами позволяет бактериям уклоняться как от нормального иммунитета хозяина, так и от антистафилококковых антибиотиков.Данные исследований на животных и людях ранее продемонстрировали, что S. aureus не только фагоцитируется нейтрофилами и макрофагами, но также может интернализоваться эпидермальными кератиноцитами (Mempel et al., 2002; Kintarak et al., 2004; Bur et al. ., 2013). Однако у этих непрофессиональных фагоцитов отсутствуют цитоплазматические органеллы, необходимые для уничтожения S. aureus (Kubica et al., 2008). Чтобы проверить нашу гипотезу, мы используем ряд методов визуализации, чтобы продемонстрировать, что S.aureus , но не S. epidermidis (SE), не только интернализуются первичными нормальными эпидермальными кератиноцитами человека (NHEK), но и не вызывают цитотоксичность или воспалительную реакцию. Важно отметить, что мы продемонстрировали, что большинство стандартных антистафилококковых антибиотиков, которые способны убивать чувствительный к метициллину S. aureus в культуральной среде для выращивания, не способны убивать микробы, однажды усвоенные кератиноцитами.
Материалы и методы
Материалы
С.aureus и S. epidermidis Виды и штаммыStaphylococcus aureus (Clin-SA) был выделен из хронической кожной раны (любезно предоставлено профессором А. МакБейном, Университет Манчестера, Соединенное Королевство). Лабораторный штамм S. aureus Sh2000 (Lab1-SA-Sh2000) и его изогенный мутант fnbA fnbB были любезно предоставлены профессором Дж. Геогеганом, Дублинский университет, Ирландия. S. aureus NCTC 2669 был приобретен в Службе общественного здравоохранения Англии. S. aureus -Lab2-SA-GFP (зеленый флуоресцентный белок), устойчивый к хлорамфениколу штамм был предоставлен профессором А. Хорсвиллом, Университет Колорадо, США. SE был подарком доктора Г. Ся, Манчестерский университет, Манчестер, Великобритания.
Получение и флуоресцентная маркировка
S. aureus и S. epidermidisКоличество бактерий оценивали спектрофотометрией (600 нм) и методом Майлза и Мисры. Для маркировки FITC S.aureus и SE выращивали на питательном агаре и инкубировали при 37 ° C в течение 18 ч. Одну колонию инокулировали в 13 мл питательного бульона и инкубировали при 37 ° C в течение ночи до достижения 10 10 КОЕ / мл. Десять миллилитров ночной культуры промывали фосфатно-солевым буфером (PBS), центрифугировали (1600 × г , 5 мин) и ресуспендировали в 10 мл 0,1 М карбонатного буфера (pH 9), содержащего 100 мг / л изомера FITC ( Sigma – Aldrich, Великобритания) в течение 1 ч при комнатной температуре в соответствии с инструкциями производителя.Бактериальные культуры центрифугировали при 600 × g в течение 5 минут, промывали PBS, ресуспендировали в 1% глицерине и хранили при -80 ° C до тех пор, пока они не понадобились.
Культура первичных нормальных эпидермальных кератиноцитов человека
Нормальные эпидермальные кератиноциты человека (PromoCell, Гейдельберг, Германия) выращивали до 80% слияния перед пассацией в полной среде для роста кератиноцитов (с добавками) (PromoCell, Гейдельберг, Германия) при 37 ° C, 5% CO 2 . Клетки отделяли с помощью TrypLE (Thermo Fisher Scientific, Великобритания) в соответствии с инструкциями производителя.Первичные клетки использовали между первым и четвертым пассажем перед удалением.
Оценка бактериальной интернализации
Культура клеток
нормальных эпидермальных кератиноцитов человека высевали в 24-луночные планшеты (1 × 10 6 клеток / мл) и инкубировали с 10 7 КОЕ / мл меченных FITC или GFP бактерий в полной среде для роста кератиноцитов в течение 1 часа. (37 ° C, 5% CO 2 ). Затем в каждую лунку добавляли два процента пенициллина / стрептомицина (2% P / S) и оставляли на 30 минут для уничтожения внеклеточных бактерий.Клетки анализировали между 1 и 24 часами после интернализации.
Как для проточной цитометрии, так и для экспериментов с Amnis ® NHEK промывали PBS и отделяли с использованием 0,025% трипсина / 0,01% EDTA (PromoCell, Гейдельберг, Германия) в течение 5 минут при 37 ° C, 5% CO 2 , затем нейтрализация трипсина (0,05% ингибитор трипсина из сои и 0,1% бычий сывороточный альбумин).
Проточная цитометрия
Первоначально интернализацию бактерий NHEK изучали с помощью стандартной проточной цитометрии (BD FACS Canto II, BD Biosciences, Великобритания) и анализировали с помощью программного обеспечения FlowJo (Tree Star V10).Клетки получали, как описано выше. Присущая NHEK автофлуоресценция была исключена с использованием ворот (PerCP) -Cy5 + / FITC + . Отдельные клетки FITC + , представляющие зеленый флуоресцентный белок (GFP) — положительный NHEK S. aureus , были взяты для анализа.
Аннексин V и DAPI использовали для оценки гибели клеток. Клетки инкубировали с аннексином V-APC (eBioscience, Великобритания) в буфере для окрашивания клеток (Biolegend, Великобритания) в течение 20 мин. Затем клетки промывали и добавляли DAPI (New England Biolabs, Великобритания) до конечной концентрации 0.25 мкг / мл перед анализом проточной цитометрии.
Интернализация также оценивалась с помощью Amnis ® (проточный цитометр ImageStream ® Mark II Imaging, Merck, Великобритания), который позволяет визуализировать клетки, управляемые проточной цитометрией, под микроскопом. NHEK были приготовлены, как описано выше. После обработки P / S клетки инкубировали в среде для полного роста кератиноцитов в течение 4 часов (37 ° C, 5% CO 2 ), затем фиксировали 4% параформальдегидом (10 минут, RT) и делали проницаемыми (0,1% Triton-X, 10 минут).NHEK ресуспендировали с 1 мкг / мл мышиного антитела Alexa Fluor ® 647 против человеческого цитокератина 14/15/16/19 (клон KA4, BD Bioscience, Соединенное Королевство) в буфере для пермеабилизации для идентификации первичных кератиноцитов (20 мин, RT в темноту), промыли и ресуспендировали. Что касается анализа проточной цитометрии, собственная автофлуоресценция NHEK была исключена с использованием ворот (PerCP) -Cy5 + / FITC + . Цитокератин 14/15/16/19 + / Клетки S. aureus- FITC + были селектированы и отсортированы для анализа Amnis ® с использованием IDEAS 6.2.
Конфокальная микроскопия
Конфокальная микроскопия была также выполнена для подтверждения интернализации Lab2-SA-GFP посредством NHEK. 1 × 10 6 клеток / мл инкубировали с 10 7 КОЕ / мл Lab2-SA-GFP (1 час, 37 ° C, 5% CO 2 ), затем промывали, обрабатывали 2% P / S ( 30 мин) и инкубировали в среде в течение 4 ч (37 ° C, 5% CO 2 ). NHEK фиксировали 4% PFA и повышали проницаемость с помощью 0,1% Triton-X. Клетки окрашивали красителем CellMask Deep Red в соответствии с инструкциями производителя (Thermo Fisher Scientific, Великобритания).Изображения были получены на инвертированном конфокальном объективе Leica TCS SP5 AOBS с использованием иммерсионного масляного объектива 100 × / 1,40 и 4-кратного конфокального увеличения. Конфокальные настройки были следующими: пинхол 1 эри-блок, скорость сканирования 400 Гц, двунаправленный, формат 512 × 512. Изображения были собраны с использованием детекторов HyD со следующими настройками детектирующего зеркала; FITC 493-589 нм, техасский красный 599-615 нм с использованием лазерных линий 488 (10) и 594 нм (1%) соответственно. Когда невозможно было устранить перекрестные помехи между каналами, изображения собирались последовательно.При получении трехмерных оптических стеков конфокальное программное обеспечение использовалось для определения оптимального количества Z-сечений. В разделе «Результаты» показаны только проекции максимальной интенсивности этих трехмерных стеков. Для анализа данных использовалось программное обеспечение для анализа изображений Imaris X64 9.2.1 (Bitplane, Великобритания).
Подавление интернализации
Для оценки ингибирования интернализации S. aureus клетки получали, как описано выше. Среду из каждой лунки удаляли, а клетки промывали PBS.Если подробно описано в тексте, NHEK предварительно обрабатывали антителом против интегрина α5β1 (клон JBS5, Sigma-Aldrich, Великобритания) в течение 30 минут (37 ° C, 5% CO 2 ) в полной кератиноцитарной среде. Предварительно обработанные NHEK затем инфицировали S. aureus (10 7 КОЕ / мл) в присутствии ингибитора в течение 1 часа. Среду, содержащую S. aureus и ингибиторы, отбрасывали, и клетки обрабатывали 2% P / S в течение 30 мин. Затем клетки промывали PBS и отделяли для анализа проточной цитометрии, как описано выше.
Определение МИК антибиотика
Были оценены бактерицидные свойства флуклоксациллина (Wockhardt Ltd., Великобритания), клиндамицина, тейкопланина, линезолида и рифампицина (все Sigma – Aldrich, Великобритания). Минимальную ингибирующую концентрацию (МИК) для каждого антибиотика определяли как с помощью полосок с реагентами Etest (bioMérieux Ltd., Бейзингсток, Великобритания), так и с помощью метода разбавления микротитровального бульона, как описано ранее (Wiegand et al., 2008). Конкретная МИК для каждого антибиотика подробно описана в тексте.
In vitro Заражение NHEK S. aureus и анализ антибиотиковнормальных клеток эпидермального кератиноцита человека высевали в 24-луночные планшеты (5 × 10 4 клеток / мл). После слияния клетки инфицировали 10 7 КОЕ / мл S. aureus (разведенным в среде для роста кератиноцитов из ночной культуры) в течение 1 часа при 37 ° C с последующей обработкой 2% P / S в течение 1 часа для устранения внеклеточный S. aureus . Клетки промывали PBS и инкубировали в среде с полным кератиноцитом в течение 4 ч (37 ° C, 5% CO 2 ).Затем среду заменяли антистафилококковыми антибиотиками или без них в полной среде в течение следующих 24 часов, как указано в тексте. Затем 50 микролитров супернатанта удаляли для культивирования на чашках с питательным агаром для количественного определения внеклеточного S. aureus . Затем клетки трижды промывали PBS, обрабатывали 2% P / S в течение 1 ч и лизировали в 300 мкл PBS с использованием мини-скребков (VWR International, Великобритания) и интенсивного перемешивания. Лизаты клеток культивировали на питательном агаре с использованием серийных разведений для оценки количества внутриклеточных S.aureus . Для количественного определения КОЕ для каждой лунки были выполнены три технических повтора.
Ex vivo Культура органов кожи человека и инфицирование GFP- S. aureusКожа человека была получена в результате процедур липоскульптуры, проведенных на здоровых взрослых пациентах. Исследование было одобрено Комитетом по этике исследований Северо-Запада (номер REC 14 / NW / 0185), и все пациенты дали письменное информированное согласие. Пробойник для биопсии диаметром 4 мм (Integra TM Miltex TM , Fisher Scientific) помещали во вставку для культивирования клеток Thincert с размером пор 0.4 мкм (Greiner Bio-One, Великобритания) и культивировали в шестилуночном планшете, создавая поверхность раздела воздух-жидкость. Культуральная среда состояла из среды William’s E (Thermo Fisher) с добавлением 1% (об. / Об.) L -глютамина, 0,02% (об. / Об.) Гидрокортизона и 0,1% (об. / Об.) Инсулина. На поверхность биопсии наносили 3 мкл 10 7 КОЕ / мл Lab2-SA-GFP и инкубировали при 37 ° C, 5% CO 2 в течение 3 часов. После культивирования биопсии мгновенно замораживали в жидком азоте и хранили при -80 ° C до использования.
Иммунофлуоресцентное окрашивание
Блоки кожной ткани вырезали на глубину 5 мкм (-20 ° C, OFT Cryostat; Bright Instruments, Великобритания) в трех экземплярах на слайды Superfrost TM Ultra Plus Adhesion (Thermo Fisher Scientific, Великобритания). Срезы промаркировали и хранили при -20 ° C до тех пор, пока они не понадобились.
Замороженные срезы сушили на воздухе (10 мин, КТ), затем фиксировали смесью метанол: ацетон (50:50 об. / Об.) В течение 20 мин при -20 ° C. Предметные стекла промывали трис-буферным физиологическим раствором (TBS) три раза (по 5 мин каждый), затем повышали проницаемость с помощью 0.1% Triton-X100 (5 мин, КТ). 10% нормальной козьей сыворотки (NGS, Vector Laboratories Inc., США) использовали в качестве разбавителя и для блокирования неспецифического связывания (1 час, RT). Срезы окрашивали Claudin-I (кроличьи поликлональные антитела против человека, Mh35, Thermo Fisher Scientific, Великобритания), разведенные 1:50 в разбавителе, и инкубировали в течение ночи при 4 ° C. Срезы промывали TBS-0,05% твин-20 и инкубировали с антителом красной козы Texas TM против кролика (Life Technologies Corporation, Thermo Fisher), разведенным 1: 100 в блоке, и инкубировали в темноте в течение 1 ч при комнатной температуре перед отмывкой. опять таки.Наконец, срезы закрепляли с помощью монтажной среды VETASHIELD ® HardSet TM (Vector Laboratories Inc., США).
Статистический анализ
Статистические сравнения были выполнены с использованием однофакторного дисперсионного анализа ANOVA с апостериорным тестом Даннета с использованием GraphPad Prism. P <0,05 считалось статистически значимым.
Результаты
S. aureus , но не S. epidermidis усваиваются кератиноцитами кожи человека (NHEK)Предыдущая работа показала, что S.aureus может интернализоваться иммортализованными кератиноцитами HaCaT человека (Mempel et al., 2002; Bur et al., 2013). Здесь мы расширяем эти наблюдения, используя как меченые FITC, так и экспрессирующие GFP бактерии.
Во-первых, с помощью проточной цитометрии мы продемонстрировали, что FITC- S. aureus , но не FITC-SE, совместно локализуются с первичным NHEK. В этих экспериментах NHEK инкубировали с 10 7 КОЕ бактерий в течение 1 часа перед инкубацией с P / S для уничтожения внеклеточных бактерий. Инкубация продолжалась в течение 1 или 24 часов (рис. 1А).Окрашивание не было связано с собственной автофлуоресценцией, как показывает линейная совместная локализация PerCP-Cy5 / FITC. Совместная локализация S. aureus с NHEK была значительно выше (7,5 ± 2,2%, p <0,01), чем в контрольных лунках. Значимой совместной локализации SE с NHEK не было.
Рисунок 1. Интернализация живого S. aureus , но не живого SE, в первичные нормальные эпидермальные кератиноциты человека (NHEK) через α5β1-интегрин. (A) NHEK культивировали совместно с FITC-меченным живым S.aureus ( FITC LiSA) или SE ( FITC LiSE) при 37 ° C в течение 1 ч с последующей промывкой пенициллином / стрептомицином для уничтожения внеклеточных бактерий. Культивирование продолжали в течение 1 или 24 часов, и совместную локализацию определяли с помощью проточной цитометрии. Автофлуоресценция показана на дважды положительной популяции PerCp-Cy5 / FITC. Контроли представляют собой NHEK без совместного культивирования бактерий. Диаграммы разброса и изображения проточной цитометрии представляют три независимых эксперимента с тремя техническими повторами. (B) Интернализация GFP S.aureus от NHEK было подтверждено с помощью трехмерной конфокальной микроскопии NHEK после совместного культивирования с 10 7 КОЕ / мл GFP S. aureus в течение 1 часа при 37 ° C. Типичные виды с воздуха и поперечный разрез внеклеточного (синие пятна) и внутриклеточного (розовые пятна) S. aureus . (Ci) FITC-меченные клинические (Clin1-SA и Clin2-SA-NCTC2669) и лабораторные (Lab1-SA-Sh2000 и Lab2-SA-GFP) изоляты S. aureus были интернализованы в аналогичной степени NHEK. . (Cii) Фибронектин-связывающий белок Мутанты S. aureus были менее эффективно интернализованы, чем Lab1-SA-Sh2000 дикого типа. Интернализация меченного FITC Clin2-SA-NCTC2669 ингибировалась блокирующим антителом против α5β1-интегрина. Все эксперименты проводили в трех повторностях. Статистическое сравнение по сравнению с WT проводили с помощью однофакторного дисперсионного анализа. ∗∗ p <0,0001.
Во-вторых, мы объединили эти результаты, используя по своей природе флуоресцентный GFP-экспрессирующий S.aureus , продемонстрировав, что совместная локализация S. aureus и NHEK, наблюдаемая с помощью проточной цитометрии, была обусловлена интернализацией с использованием изображений Amnis ® и конфокальной микроскопии (рисунки 1B, 2 и дополнительное видео S1). Конфокальные микрофотографии ясно показывают присутствие бактерий не только на поверхности клетки, но также в процессе интернализации (белая стрелка, рис. 1B) и глубоко внутри цитоплазмы кератиноцитов человека (синяя стрелка, рис. 1B и дополнительное видео S1).
Рисунок 2. Интернализация GFP S. aureus нормальными эпидермальными кератиноцитами человека (NHEK). (A) Представитель Amnis ® Анализ потока изображений NHEK, совместно культивируемых с 10 7 КОЕ / мл FITC LiSA в течение 1 часа при 37 ° C, затем обрабатывая в течение 30 минут 2% пенициллина / стрептомицина ( P / S) для удаления внеклеточных бактерий и культивировали еще 4 часа перед окрашиванием и анализом. Красное окрашивание: Alexa Fluor ® 647 мышиное антитело против человеческого цитокератина 14/15/16/19.Зеленая окраска: FITC S. aureus. (B) Репрезентативное двухмерное изображение NHEK после конфокальной микроскопии после совместного культивирования с 10 7 КОЕ / мл GFP S. aureus в течение 1 часа при 37 ° C. (C) Репрезентативное иммунофлуоресцентное окрашивание эксплантата здоровой кожи человека через 3 часа инфицирования GFP S. aureus (10 7 КОЕ / мл) при 37 ° C. Красный: антитело против клаудина-1 кролика. Зеленый: GFP S. aureus. Желтая рамка (левая панель) выделяет увеличенную область правой панели. Все данные являются репрезентативными для трех независимых экспериментов. Снимки сделаны с 40-кратным увеличением. Масштабные линейки представляют 100 мкм.
Наконец, чтобы подтвердить, что интернализация NHEK не является уникальной для конкретного штамма S. aureus , мы продемонстрировали отсутствие значительных различий в интернализации NHEK между двумя клиническими штаммами (Clin1-SA и Clin2SA: NCTC2669) и двумя лабораторными штаммы (Lab1-SA: Sh2000 и Lab2 SA: GFP-SA) (рисунок 1Ci) ( P <0.0001). Кроме того, NHEK не обнаружил обнаруживаемой интернализации SE. Эти данные убедительно подтверждают предположение, что кератиноциты кожи человека интернализируют S. aureus , но не SE, и что интернализация не специфична для какого-либо одного штамма S. aureus .
Чтобы подтвердить, что интернализация была активным процессом с участием пути фибронектин-связывающий белок (FnBP) — интегрин α5β1, мы продемонстрировали, что интернализация мутанта FnBP S. aureus снижена более чем на 50% ( P <0.0001). Кроме того, совместная инкубация S. aureus с нейтрализующим интегрин антителом FnBP-α5β1 снижает интернализацию на 80% ( P <0,0001), как ранее было показано на клетках HaCaT (Classen et al., 2011; Рисунок 1Cii).
Для того, чтобы S. aureus был интернализован in vivo кератиноцитами более глубокого эпидермиса, бактерии должны иметь возможность проходить через поверхностный роговой слой. Чтобы продемонстрировать клиническую значимость наших результатов, мы подтвердили предыдущие исследования (Mempel et al., 2002; Sayedyahossein et al., 2015; Josse et al., 2017), что GFP S. aureus можно найти глубоко в эпидермисе интактной культуры органов кожи человека (рис. 2C).
Интернализация
S. aureus с помощью NHEK не вызывает цитотоксичность в клетках-хозяевах или высвобождение сигнала опасности IL-33Последующие эффекты интернализованного S. aureus плохо изучены. Опубликованные данные свидетельствуют о том, что инвазия кератиноцитов S.aureus может вызывать цитотоксичность и вызывать воспалительные реакции, предполагая, что интернализация является частью патогенного репертуара S. aureus (Mempel et al., 2002). Вопреки этим предыдущим результатам, мы продемонстрировали, что S. aureus не только интернализуется NHEK, но и что интернализация не вызывает заметного цитотоксического эффекта в течение последующих 24 часов, как измерено с помощью окрашивания аннексином V и DAPI; FITC-положительные кератиноциты не являются ни аннексином V, ни DAPI-положительными (рис. 3А).Кроме того, в то время как внеклеточный S. aureus индуцирует высвобождение большого количества ИЛ-33 (фиг. 3B, серые столбцы), интернализованный S. aureus не вызывает высвобождение этого алармина (фиг. 3B, черные столбцы). SE не интернализовался и не индуцировал высвобождение IL-33 посредством NHEK.
Рисунок 3. Интернализация S. aureus в кератиноцитах человека не вызывает цитотоксичности или высвобождения IL-33 клетками-хозяевами. (Ai) NHEK, инкубированный с S.aureus в течение 1 ч перед удалением внеклеточных бактерий не приводило к усилению окрашивания апоптоза (Аннексин V) или некроза (DAPI). Типичные графики проточной цитометрии, показывающие Контроль: кератиноциты, инкубированные только в среде, и кератиноциты, инкубированные с S. aureus в течение 1 часа, обработанные пенициллином / стрептомицином, а затем инкубированные только в среде в течение следующих 24 часов. Гейт показывает клетки DAPI — / Annexin V —. (Aii) Столбчатые диаграммы, объединяющие данные трех независимых экспериментов, каждый из которых был проведен в трех экземплярах.Черные столбцы: 1 час, серые столбцы: 24 часа инкубации интернализованных S. aureus и NHEK. Не было значительных различий между контрольной группой и группами NHEK- S. aureus (SA). (B) Высвобождение IL-33, индуцированное в NHEK внеклеточными, но не внутриклеточными клиническими и лабораторными изолятами S. aureus . Серые столбики: 24-часовое совместное культивирование S. aureus и NHEK. Черные столбцы: совместное культивирование в течение 1 часа с последующей обработкой P / S. Двадцать четыре супернатанта были собраны и проанализированы с помощью ELISA.Данные представляют три независимых эксперимента, каждый из которых был проведен в трех экземплярах. Среднее ± стандартная ошибка среднего. ∗∗ P <0,001, P -значения определяли двухфакторным дисперсионным анализом с апостериорным тестом Даннета или Тьюки .
Чувствительность интернализованного
S. aureus к распространенным стафилококковым антибиотикамСуть нашего исследования заключалась в оценке способности рутинно доступных антистафилококковых антибиотиков уничтожать метициллин-чувствительный S.aureus , который был поглощен кератиноцитами кожи. После поглощения S. aureus NHEK в течение 1 часа и затем уничтожения оставшихся внеклеточных бактерий путем инкубации культуры в течение еще одного часа с P / S, лизис кератиноцитов после следующих 24 часов культивирования привел к высвобождению жизнеспособных бактерии, которые могут быть количественно определены в агаровой культуре (рис. 4А). Мы подтвердили, что клеточный супернатант перед лизисом был стерильным при предварительной инкубации с 2% P / S в течение 1 ч (рис. 4A).После лизирования NHEK были выпущены жизнеспособных S. aureus , которые можно было культивировать. Морфология S. aureus , высвобожденного из лизированного NHEK, была аналогична морфологии неинтернализованных бактерий (рис. 4В).
Рисунок 4. Чувствительность к антибиотикам S. aureus , интернализируемого кератиноцитами человека. (A) NHEK совместно культивировали с 10 7 КОЕ / мл Clin1-SA в течение 1 ч при 37 ° C. Затем клетки промывали и обрабатывали 2% пенициллина / стрептомицина (P / S) в течение 1 часа для уничтожения внеклеточных бактерий перед дальнейшим культивированием в течение 24 часов.Количество КОЕ бактерий из супернатанта (черные столбцы) или лизированного NHEK (серые столбцы) определяли количественно на питательном агаре. (B) Представитель рост S. aureus на чашке с питательным агаром из супернатанта (левая панель) и лизированного NHEK (правая панель). (C) Бактерицидное действие антистафилококковых антибиотиков (флуклоксациллин, тейкопланин, клиндамицин, линезолид и рифампицин) на интернализованный S. aureus через 24 часа лечения антибиотиками. Данные представляют три независимых эксперимента, проведенных в трех экземплярах.Среднее ± стандартная ошибка среднего. Значения P- определяли односторонним дисперсионным анализом с помощью апостериорного теста Даннета . ∗∗ P <0,001 по сравнению с 2% P / S через 24 часа.
Затем мы оценили способность пяти антистафилококковых антибиотиков различных классов [β-лактам P (флуклоксациллин), полусинтетический гликопептид (тейкопланин), полусинтетический линкозамид (клиндамицин), оксазолидинон (линезолид) и ансамицин (рифампицин)]. в клинической практике для уничтожения внутриклеточного S.aureus . Все пять испытанных стафилококковых антибиотиков были бактерицидными в отношении внеклеточного метициллин-чувствительного S. aureus в концентрациях от 0,1 до 2 мг / мл (Таблица 1). Однако флуклоксациллин, тейкопланин, клиндамицин и линезолид мало влияли на рост S. aureus , который был интернализован даже при 20-кратном МПК (рис. 4С). Напротив, рифампицин почти полностью подавлял рост интернализованных бактерий при МИК неинтернализованных бактерий (рис. 4С).
Таблица 1. Сравнительное уничтожение внеклеточного и внутриклеточного S. aureus антистафилококковыми антибиотиками.
Обсуждение
Хотя концепция интернализации S. aureus не нова (Mempel et al., 2002; Sayedyahossein et al., 2015; Nakatsuji et al., 2016), ранее предполагалось, что интернализация действует как очаг для рецидивирующих инфекций. (Kubica et al., 2008; Marbach et al., 2019), ключевой концептуальный прогресс нашего исследования состоит в том, чтобы показать, что большинство антистафилококковых антибиотиков, используемых в клинической практике, неспособны эффективно убить эти бактерии после того, как они были усвоены кератиноцитами.Исключение составляет рифампицин. Мы сознательно выбрали метициллин-чувствительный и избегали метициллин-устойчивых S. aureus в наших экспериментах, чтобы можно было сравнить широкий спектр антибиотиков, включая флуклоксациллин, которые в противном случае были бы исключены из-за присущей MRSA бактериальной устойчивости к антибиотикам.
Мы также ясно демонстрируем, что интернализация не является повсеместной особенностью всех стафилококков кожи, хотя как клинические, так и лабораторные S.aureus были захвачены первичными кератиноцитами кожи посредством FnBP-α5β1 интегрин-зависимого пути, кожная комменсальная SE, которая не экспрессирует FNBP, не была интернализована (Sinha et al., 2000). Это контрастирует с предыдущими исследованиями, которые предполагают, что SE может захватываться трансформированными HaCaT, анеуплоидными, иммортализованными кератиноцитами (N’Diaye et al., 2016). Кроме того, в отличие от предыдущих исследований, которые предполагают, что S. aureus может вызывать цитокиновые ответы после интернализации кератиноцитами HaCaT (Strobel et al., 2016), мы продемонстрировали, что S. aureus , интернализованный в первичные кератиноциты человека, не вызывает ни цитотоксичности, ни высвобождения IL-33. Таким образом, наши данные предполагают, что кератиноциты HaCaT не могут быть надежной моделью для изучения взаимодействия микробов и хозяев в коже. В целом, наше исследование подчеркивает, как интернализация обеспечивает убежище для S. aureus внутри клеток кожи, где они сосуществуют в симбиозе с кератиноцитами кожи, в то же время избегая убийства антибиотиками.
Концепция метаболически спящих и полудремящих бацилл, находящихся во внутриклеточных нишах хозяина, не нова. Neisseria meningitidis , как известно, интернализуется эпителиальными клетками дыхательных путей человека посредством механизма, также частично зависящего от полимеризации актина (Toussi et al., 2016). Mycobacteria tuberculosis выживают и растут внутри макрофагов, которые обеспечивают убежище, защищающее эти бактерии от бактерицидного действия некоторых противотуберкулезных антибиотиков (Jindani et al., 2003). Точно так же, хотя МИК предсказывает прямые антибактерицидные свойства антибиотиков, важных для первоначальной выбраковки внеклеточных M. tuberculosis , МИК менее полезна для определения бактерицидного потенциала антибиотиков против интернализованных бактерий.
Рифампицин рекомендуется для искоренения менингококкового носительства и для борьбы с внутриклеточными микобактериями (Deal and Sanders, 1969). Несмотря на свою эффективность, одиночное применение рифампицина быстро приводит к устойчивости к антибиотикам (Riedel et al., 2008; Thwaites et al., 2018). Таким образом, следует избегать его единственного использования для лечения бактериальных инфекций. При туберкулезе рифампицин используется в сочетании с другими антибиотиками, и аналогичная стратегия может быть рассмотрена для пациентов с рецидивирующими стафилококковыми кожными инфекциями. Период полувыведения рифампицина составляет всего 3 часа. Необходимы дальнейшие исследования, чтобы определить, является ли высокая пиковая концентрация или продолжительность лечения наиболее важными для уничтожения внутриклеточных бактерий (Gumbo et al., 2007).
Тот факт, что даже в 20 раз более высокие концентрации некоторых антистафилококковых антибиотиков неэффективны для уничтожения интернализованных бактерий, является важным сообщением для клиницистов, лечащих пациентов с этими инфекциями. Стандартный анализ МИК плохо определяет чувствительность к антибиотикам против этих интернализованных микробов, за исключением рифампицина, который имеет схожую МИК как для внеклеточных, так и для интернализованных бактерий. Наиболее вероятное объяснение эффективного убийства неинтернализованного S.aureus , но не интернализованный S. aureus представляет собой неспособность антибиотика проникать через клеточную мембрану NHEK в достаточно высокой концентрации. На эту возможность ранее указывало различное проникновение антибиотиков в нейтрофилы (Sandberg et al., 2010; Bongers et al., 2019). Наночастицы могут обеспечить систему доставки для более эффективного уничтожения внутриклеточного S. aureus (Yang et al., 2018).
Текущая противомикробная стратегия кожных инфекций включает трехсторонний подход: (1) тщательная антисептика и гигиена, (2) контроль над антибиотиками и (3) разработка новых лекарств (Cox and Worthington, 2017).Наше исследование подчеркивает четвертый терапевтический подход к контролю и искоренению S. aureus , вызывающего острые кожные инфекции. Повторная колонизация кожи S. aureus может быть вызвана не только перекрестной инфекцией, но также высвобождением жизнеспособных внутриклеточных бактерий из кератиноцитов. S. aureus следует рассматривать как один из микробов, которые ведут себя как Призрак в Машине. Эффективное уничтожение как внутриклеточных, так и внеклеточных микробов, вероятно, будет важным фактором предотвращения рецидивирующих инфекций и развития устойчивости к антибиотикам.
Заявление о доступности данныхНаборы данных, проанализированные в этой рукописи, не являются общедоступными. Запросы на доступ к наборам данных следует направлять в PA, [email protected].
Авторские взносы
PA, JP, CO’N и AAK разработали и разработали исследование. AAK, MN, AA и CE-C провели экспериментальную работу. Все авторы внесли свой вклад в составление и доработку рукописи.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
AAK получил стипендию от правительства Султаната Оман. Мы с благодарностью отмечаем основные возможности биовизуализации и проточной цитометрии на факультете биологии, медицины и здравоохранения Манчестерского университета, Манчестер, Соединенное Королевство. Мы также благодарим доктора Г. Ся (Манчестерский университет), профессора А. МакБейна за добрые подарки SE, S. aureus Clin1-SA, GFP- S. aureus , Sh2000 и его изогенный мутант FnBP ( Манчестерский университет), профессор А.Хорсвилл (Университет Колорадо) и профессор Дж. Геогеган (Университет Дублина), соответственно.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmicb.2019.02242/full#supplementary-material
ВИДЕО S1 | Трехмерное вращающееся видеоизображение NHEK с внутриклеточным S. aureus (розовый) и внеклеточным S. aureus (синий). Вид с воздуха, показывающий поперечное сечение клеток NHEK, содержащих GFP- S.aureus . Изображение искусственно окрашено. Анимация создана с использованием Imaris X64 9.2.1 (Bitplane, Оксфорд, Великобритания).
Список литературы
Бассетти, М., Карнелутти, А., Риги, Э. (2017). Роль метициллин-резистентного золотистого стафилококка в инфекциях кожи и мягких тканей. Curr. Opin. Заразить. Dis 30, 150–157. DOI: 10.1097 / QCO.0000000000000353
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бонгерс, С., Хеллебрекерс, П., Линен, Л. П. Х., Кендерман, Л., и Хитбринк, Ф. (2019). Внутриклеточное проникновение и эффекты антибиотиков на Staphylococcus aureus Внутри нейтрофилов человека: всесторонний обзор. Антибиотики (Базель). 8, 2. doi: 10.3390 / antibiotics8020054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бур С., Прейсснер К. Т., Херрманн М. и Бишофф М. (2013). Белок внеклеточной адгезии Staphylococcus aureus способствует интернализации бактерий кератиноцитами независимо от связывающих фибронектин белков. J. Invest. Дерматол. 133, 2004–2012. DOI: 10.1038 / jid.2013.87
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Берд, А. Л., Деминг, К., Кэссиди, С. К., Харрисон, О. Дж., Нг, В. И., Конлан, С. и др. (2017). Staphylococcus aureus и Staphylococcus epidermidis разнообразие штаммов, лежащих в основе детского атопического дерматита. Sci Transl Med 9, 397. doi: 10.1126 / scitranslmed.aal4651
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Классен, А., Kalali, B. N., Schnopp, C., Andres, C., Aguilar-Pimentel, J. A., Ring, J., et al. (2011). Рецептор I TNF на кератиноцитах человека является партнером по связыванию стафилококкового белка A, что приводит к активации NF каппа B, AP-1 и транскрипции нижележащих генов. Exp. Дерматол. 20, 48–52. DOI: 10.1111 / j.1600-0625.2010.01174.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Даян, Г. Х., Мохамед, Н., Скалли, И. Л., Купер, Д., Бегье, Э., Эйден, Дж., и другие. (2016). Staphylococcus aureus : современное состояние болезни, патофизиология и стратегии профилактики. Expert Rev. Vaccines 15, 1373–1392. DOI: 10.1080 / 14760584.2016.1179583
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Геогеган, Дж. А., Ирвин, А. Д., Фостер, Т. Дж. (2018). золотистый стафилококк и атопический дерматит: сложная и развивающаяся взаимосвязь. Trends Microbiol 26, 484–497. DOI: 10.1016 / j.tim.2017.11.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гамбо Т., Луи А., Дезиэль М. Р., Лю В., Парсонс Л. М., Салфингер М. и др. (2007). Концентрационно-зависимый Mycobacterium tuberculosis Уничтожение и предотвращение устойчивости с помощью рифампицина. Антимикробный. Агенты Chemother. 51, 3781–3788. DOI: 10.1128 / aac.01533-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джиндани, А., Доре, К.Дж. И Митчисон Д. А. (2003). Бактерицидное и стерилизующее действие противотуберкулезных препаратов в течение первых 14 дней. Am. J. Respir. Крит. Care Med. 167, 348–354.
PubMed Аннотация | Google Scholar
Хосе Дж., Лоран Ф. и Диот А. (2017). Стафилококковая адгезия и инвазия клеток-хозяев: связывание фибронектина и другие механизмы. Передний микробиол 8: 2433. DOI: 10.3389 / fmicb.2017.02433
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэй, К.С., Петти, Л. А., Шорр, А. Ф., и Зильберберг, М. Д. (2019). Текущая эпидемиология, этиология и бремя острых кожных инфекций в США. Clin. Заразить. Dis 68, S193 – S199. DOI: 10.1093 / cid / ciz002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кинтарак С., Уэуэлл С. А., Спейт П. М., Пакер С. и Наир С. П. (2004). Интернализация золотистого стафилококка кератиноцитами человека. Заражение. Иммун. 72, 5668–5675.DOI: 10.1128 / iai.72.10.5668-5675.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кобаяши Т., Глатц М., Хориучи К., Кавасаки Х., Акияма Х., Каплан Д. Х. и др. (2015). Дисбиоз и колонизация золотистого стафилококка вызывает воспаление при атопическом дерматите. Иммунитет 42, 756–766. DOI: 10.1016 / j.immuni.2015.03.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кубица, М., Гузик, К., Козель, Дж., Заребски, М., Рихтер, В., Гайковска, Б. и др. (2008). Потенциальный новый путь распространения Staphylococcus aureus : молчаливое выживание S. aureus, фагоцитированного человеческими макрофагами , происходящими из моноцитов. PLoS One 3: e1409. DOI: 10.1371 / journal.pone.0001409
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Marbach, H., Vizcay-Barrena, G., Memarzadeh, K., Otter, J. A., Pathak, S., Allaker, R.P., et al. (2019). Толерантность MRSA ST239-TW к деколонизации на основе хлоргексидина: доказательства инвазии кератиноцитов как механизма уклонения от биоцидов. J. Infect. 78, 119–126. DOI: 10.1016 / j.jinf.2018.10.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mempel, M., Schnopp, C., Hojka, M., Fesq, H., Weidinger, S., Schaller, M., et al. (2002). Инвазия кератиноцитов человека Staphylococcus aureus и бактериальная персистенция представляют собой независимые от гемолизина механизмы вирулентности, за которыми следуют признаки некротической и апоптотической гибели клеток кератиноцитов. Br. J. Dermatol. 146,
.PubMed Аннотация | Google Scholar
Meylan, P., Lang, C., Mermoud, S., Johannsen, A., Norrenberg, S., Hohl, D., et al. (2017). Колонизация кожи золотистым стафилококком предшествует клиническому диагнозу атопического дерматита в младенчестве. J. Invest. Дерматол. 137, 2497–2504. DOI: 10.1016 / j.jid.2017.07.834
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миллер, Л. Г., Иеллс, С. Дж., Дэвид, М. З., Ортис, Н., Тейлор, А.Р., Кумар Н. и др. (2015a). Staphylococcus aureus Рецидивы кожной инфекции среди членов домохозяйства: исследование предикторов на уровне хозяина, поведения и патогенов. Clin. Заразить. Dis 60, 753–763. DOI: 10.1093 / cid / ciu943
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миллер, Л. Г., Айзенберг, Д. Ф., Лю, Х., Чанг, К. Л., Ван, Ю., Лутра, Р. и др. (2015b). Заболеваемость инфекциями кожи и мягких тканей в амбулаторных и стационарных условиях, 2005-2010 гг. BMC Infect. Дис. 15: 362. DOI: 10.1186 / s12879-015-1071-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Монтгомери К. П., Дэвид М. С. и Даум Р. С. (2015). Факторы хозяина, которые способствуют рецидивирующим стафилококковым кожным инфекциям. Curr. Opin. Заразить. Dis 28, 253–258. DOI: 10.1097 / QCO.0000000000000156
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Накацудзи, Т., Чен, Т. Х., Два, А. М., Чун, К.А., Нарала, С., Геха, Р. С. и др. (2016). Золотистый стафилококк использует дефекты эпидермального барьера при атопическом дерматите для запуска экспрессии цитокинов. J. Invest. Дерматол. 136, 2192–2200. DOI: 10.1016 / j.jid.2016.05.127
PubMed Аннотация | CrossRef Полный текст | Google Scholar
N’Diaye, A.R., Leclerc, C., Kentache, T., Hardouin, J., Poc, C.D., Konto-Ghiorghi, Y., et al. (2016). Связь между кожными бактериями: участие нейрогормона, связанного с геном кальцитонина, пептида (CGRP) в регуляции вирулентности Staphylococcus epidermidis. Научный представитель 6, 35379. DOI: 10.1038 / srep35379
PubMed Аннотация | CrossRef Полный текст | Google Scholar
О’Гара, Дж. П. (2017). В шторм: преследование условно-патогенного микроорганизма Staphylococcus aureus от колонизации кожи до опасных для жизни инфекций. Environ. Microbiol. 19, 3823–3833. DOI: 10.1111 / 1462-2920.13833
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Петерсон, Л. Р., Шора, Д. М. (2016).Метициллин-устойчивый Staphylococcus aureus : Контроль в 21 веке: участие лабораторий, влияющее на воздействие болезни и экономическую выгоду от крупных популяционных исследований. J. Clin. Microbiol. 54, 2647–2654. DOI: 10.1128 / jcm.00698-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ридель Д. Дж., Уикс Э. и Форрест Г. Н. (2008). Добавление рифампицина к стандартной терапии для лечения инфекционного эндокардита нативного клапана, вызванного Staphylococcus aureus . Антимикробный. Агенты Chemother. 52, 2463–2467. DOI: 10.1128 / AAC.00300-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sandberg, A., Jensen, K. S., Baudoux, P., Van Bambeke, F., Tulkens, P.M, and Frimodt-Møller, N. (2010). Внутри- и внеклеточная активность линезолида против золотистого стафилококка in vivo и in vitro. J Antimicrob Chemother 65, 962–973. DOI: 10.1093 / jac / dkq052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sayedyahossein, S., Сюй, С. X., Рудковская, А., Макгэвин, М. Дж., Маккормик, Дж. К., и Дагнино, Л. (2015). Инвазия кератиноцитов Staphylococcus aureus опосредуется интегрин-связанной киназой и Rac1. FASEB J. 29, 711–723. DOI: 10.1096 / fj.14-262774
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sinha, B., Francois, P., Que, Y.A., Hussain, M., Heilmann, C., Moreillon, P., et al. (2000). Гетерологически экспрессируемые фибронектин-связывающие белки Staphylococcus aureus достаточны для инвазии клеток-хозяев. Заражение. Иммун. 68, 6871–6878. DOI: 10.1128 / iai.68.12.6871-6878.2000
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Strobel, M., Pförtner, H., Tuchscherr, L., Völker, U., Schmidt, F., Kramko, N., et al. (2016). Постинвазионные события после заражения Staphylococcus aureus сильно зависят как от типа клетки-хозяина, так и от заражающего штамма S. aureus . Clin Microbiol Infect 22, 799–809. DOI: 10.1016 / j.cmi.2016.06.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Суая, Дж. А., Мера, Р. М., Кэссиди, А., О’Хара, П., Амрин-Мэдсен, Х., и Бурстин, С. (2014). Частота и стоимость госпитализаций, связанных с Staphylococcus aureus, инфекциями кожи и мягких тканей в США с 2001 по 2009 год. BMC Infect. Дис. 14: 296. DOI: 10.1186 / 1471-2334-14-296
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Таубер, М., Balica, S., Hsu, C.Y., Jean-Decoster, C., Lauze, C., Redoules, D., et al. (2016). Staphylococcus aureus Плотность пораженной и неповрежденной кожи тесно связана с тяжестью заболевания при атопическом дерматите. J. Allergy Clin. Иммунол. 137, 1272–1274.
Google Scholar
Туэйтс, Г. Э., Скарборо, М., Шуберт, А., Нсутебу, Э., Тилли, Р., Грейг, Дж. И др. (2018). Дополнительный рифампицин для лечения бактериемии Staphylococcus aureus (ARREST): многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет 391, 668–678. DOI: 10.1016 / S0140-6736 (17) 32456-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тонг, С. Ю., Дэвис, Дж. С., Эйхенбергер, Э., Холланд, Т. Л., и Фаулер, В. Г. (2015). Staphylococcus aureus Инфекции: эпидемиология, патофизиология, клинические проявления и лечение. Clin. Microbiol. Ред. 28, 603–661. DOI: 10.1128 / cmr.00134-14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тусси, Д.Н., Ветцлер Л. М., Лю X., Массари П. (2016). Интернализация Neisseriae эпителиальными клетками усиливается стимуляцией TLR2. Microbes Infect. 18, 627–638. DOI: 10.1016 / j.micinf.2016.06.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тернер, Н. А., Шарма-Куинкель, Б. К., Маскаринек, С. А., Эйхнебергер, Э. М., Шах, П. П., Каругати, М. и др. (2019). Метициллин-устойчивый золотистый стафилококк: обзор фундаментальных и клинических исследований. Nat Rev Microbiol 17, 203–218. DOI: 10.1038 / s41579-018-0147-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Виганд И., Хильперт К. и Хэнкок Р. Э. (2008). Методы разбавления агара и бульона для определения минимальной ингибирующей концентрации (МИК) антимикробных веществ. Nat Protoc 459, 163–175. DOI: 10.1038 / nprot.2007.521
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ян С., Хань Х., Ян Ю., Qiao, H., Yu, Z., Liu, Y., et al.