Стафилококк в горле как причина болезни – Medaboutme.ru
С бактериями под названием «стафилококк» каждый из нас сталкивается множество раз в жизни. Более того, незначительное их количество может присутствовать в микрофлоре здорового человека. Чаще всего микроб обнаруживается на коже и в верхних дыхательных путях. Чем опасно присутствие золотистого стафилококка в горле и как правильно лечить инфекцию, если она уже есть, расскажет MedAboutMe.
Золотистый стафилококк в горле
Среди всех видов патогенных стафилококков именно золотистый может представлять наибольшую опасность. Это достаточно агрессивная бактерия, которая выделяет опасные токсины и ферменты, способные разрушать ткани. Болезни, вызванные золотистым стафилококком в горле, очень сложно лечить — микроб быстро приспосабливается к новым условиям, является устойчивым ко многим лекарствам, в том числе к антибиотикам пенициллиновой группы прошлых поколений.
При этом по статистике каждый пятый человек на планете является носителем данной бактерии.
Еще один путь заражения — воздушно-капельный. Бактерия легко распространяется по воздуху от человека с развитой стафилококковой инфекцией — через кашель, чихание и прочее.
Также стафилококк может передаваться от матери к ребенку через грудное молоко. В таком случае очень велика вероятность оседания бактерии не только в горле, но и в кишечнике.
Симптомы стафилококка в горле
Повсеместная распространенность разных видов стафилококка все же не вызывает эпидемий различных заболеваний. Связано это с тем, что наша иммунная система успешно контролирует размножение и активность бактерий, не дает им становиться угрозой для здоровья человека.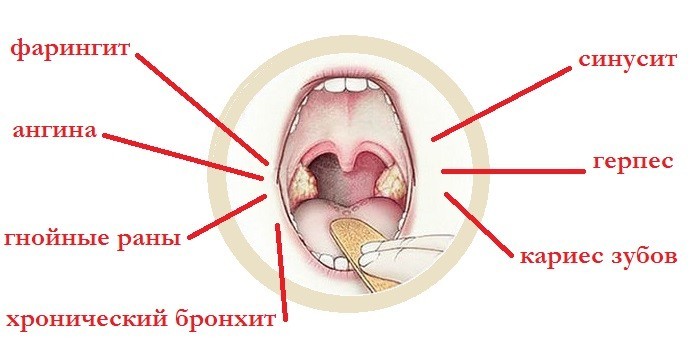
Болезнь характеризуется следующимипризнаками:
- Воспаление миндалин или ротоглотки.
- Бугристая поверхность слизистой с возникновением гнойных очагов — «белого налета».
- Першение в горле, осиплый голос.
- Сильная боль в горле, из-за которой человеку сложно глотать.
- Повышенная температура, иногда до 40°С.
- Общая интоксикация организма: слабость, сонливость, потеря аппетита, головные боли.
Стафилококковая инфекция отличается от обычной ОРВИ тем, что не сопровождается насморком и локализуется на миндалинах. Однако, учитывая, что бактерии активизируются при пониженном иммунитете, золотистый стафилококк в горле может проявляться как осложнение вирусного заболевания. Поэтому, если на фоне простуды вы замечаете перечисленные выше симптомы, скорее всего, к ОРВИ присоединилась бактериальная инфекция.
Однако, учитывая, что бактерии активизируются при пониженном иммунитете, золотистый стафилококк в горле может проявляться как осложнение вирусного заболевания. Поэтому, если на фоне простуды вы замечаете перечисленные выше симптомы, скорее всего, к ОРВИ присоединилась бактериальная инфекция.
Стафилококк у детей: фарингит, тонзиллит
Поскольку микроб вызывает заражения лишь в случае ослабленного иммунитета, стафилококк у детей — явление достаточно частое. Дело в том, что иммунная система ребенка еще только формируется, а в первые годы малыш, как правило, часто болеет вирусными заболеваниями, которые ослабляют организм.
Чаще всего у детей развивается фарингит, тонзиллит, ларингит. Сопровождается бактериальная инфекция отделением бело-желтой мокроты и заметными гнойничками. Лечение ребенка с такими диагнозами требует обязательного контроля со стороны педиатра, поскольку стафилококк может серьезно навредить детскому здоровью и даже привести к опасным для жизни состояниям. При неправильной или недостаточной терапии золотистый стафилококк в горле может распространяться дальше — на легкие, сердце, попадать в кровь. Бактерия способна поражать любой орган и ткань.
При неправильной или недостаточной терапии золотистый стафилококк в горле может распространяться дальше — на легкие, сердце, попадать в кровь. Бактерия способна поражать любой орган и ткань.
В результате стафилококк у детей, вызвавший тонзиллит или фарингит, грозит следующими осложнениями:
- Пневмония (поражение легких).
- Эндокардит (поражение сердца).
- Менингит (воспаление оболочек головного мозга).
- Остеомиелит (поражение костей).
Сепсис (заражение крови, которое приводит к генерализованной инфекции).
Если ребенок часто болеет бактериальными тонзиллитами, необходимо укреплять его иммунитет — обеспечить разнообразное витаминизированное питание, физическую активность, чередовать занятия и отдых, стараться как можно чаще гулять на свежем воздухе. Также необходимо обратить внимание и устранить возможные очаги распространения стафилококка — аденоиды, воспаленные гайморовы пазухи, кариес.
Лечение стафилококковой инфекции
Стафилококк — одна из самых устойчивых бактерий, поэтому и вызванная ею инфекция лечится крайне сложно. Недопустимо самолечение или отсрочка визита к врачу. Если правильное лечение на начато своевременно, это может привести к распространению инфекции — золотистый стафилококк из горла перейдет на легкие, оболочки мозга, попадет в кровь.
Основой терапии являются антибиотики пенициллинового ряда. Однако необходимо учитывать, что именно эта бактерия более всего известна своей устойчивостью к медикаментам, и такие лекарства, как например, Ампициллин сейчас помогают редко. Правильно подобрать препарат может только врач, в идеале для этого необходимо провести тесты на чувствительность к антибиотикам. Особенно это актуально при стафилококковой инфекции у детей — такая диагностика поможет сразу остановиться на подходящем лекарстве.
Сами гнойные очаги необходимо вскрыть и обработать антибактериальными лекарствами. Эти процедуры также проводит исключительно врач. В дальнейшем горло часто обрабатывают хлорофиллиптом, к которому стафилококк по-прежнему остается чувствительным.
Эти процедуры также проводит исключительно врач. В дальнейшем горло часто обрабатывают хлорофиллиптом, к которому стафилококк по-прежнему остается чувствительным.
Терапия дополняется мерами, направленными на повышение иммунитета. В некоторых случаях для этого могут быть прописаны специфические препараты и витамины. Но чаще речь идет о правильном питании, отказе от вредных привычек, обильном питье (для снятия интоксикации).
Здоровый образ жизни и соблюдение правил гигиены являются лучшей профилактикой развития стафилококковой инфекции в горле, а также необходимой базой ее лечения.
Стафилококк в горле и в носу
Стафилококк в горле представляет собой наличие на слизистой этой области определенного вида бактерий, способных вызывать разнообразные гнойно-воспалительные процессы. Науке известно более 20 разновидностей этих бактерий, причем значительная их часть постоянно присутствует в микрофлоре каждого человека на слизистых оболочках, в частности горла и носа.
Многие стафилококки при этом абсолютно безвредны, и лишь три их вида способны спровоцировать развитие каких-либо заболеваний. Самой распространенной из них считается такая бактерия как золотистый стафилококк. Она не представляет никакой опасности для человека до тех пор, пока не произойдет ослабление иммунной защиты организма.
Лечение стафилококковых заболеваний горла и носа напрямую зависит от симптомов, и заключается в использовании антибактериальных лекарственных препаратов, а также бактериофагов и иммуномодуляторов.
Почему возникает стафилококк в горле?
Причины возникновения стафилококковой инфекции в горле и носу
В окружающей среде живет огромное множество различных патогенных и непатогенных бактерий, часть из которых обитает на коже человека. На первых минутах жизни (сразу после рождения) кожу, пищеварительный тракт и органы дыхания ребенка заселяет различная микрофлора, в основном та, которая присутствует у матери.
Золотистый стафилококк считается самым патогенным микроорганизмом.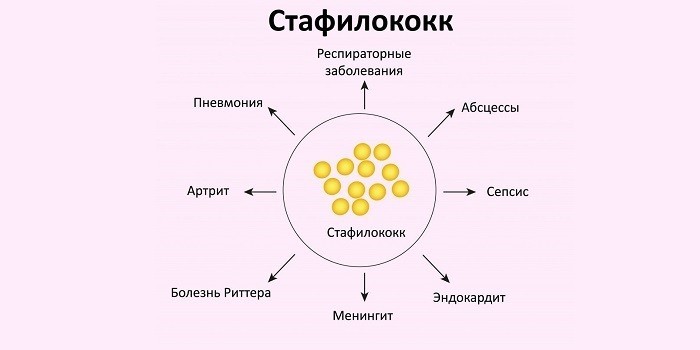 Однако это не мешает ему обитать на человеческой коже, слизистой оболочке и в кишечнике.
Однако это не мешает ему обитать на человеческой коже, слизистой оболочке и в кишечнике.
Золотистый стафилококк в горло проникает из внешней среды через дыхательные пути либо из внутренних очагов инфекции при хроническом тонзиллите, хроническом синусите, хроническом бронхите и трахеите, при кариесе, зубном камне.
Пути заражения золотистым стафилококком
Заразиться данным видом инфекции возможно несколькими способами, к которым относятся:
- Контактный путь заражения, когда стафилококк попадает в горло через предметы гигиены или грязные руки.
- Воздушно-капельно, когда патологические бактерии ауреус проникает в носоглотку посредством дыхательной деятельности, с воздухом, содержащим данную бактерию. Золотистый стафилококк в подобных случаях в больших количествах выделяется больными людьми либо носителями в процессе кашля, разговора или чихания.
- Воздушно-пылевым путем, когда в носоглотке стафилококк оседает вместе с частичками пыли, которая находится в воздухе и в предметах окружающего пространства, особенно на полу, предметах мебели, одежде, где данная бактерия сохраняет свои болезнетворные свойства в период до полугода.
 Как еще возникает золотистый стафилококк в горле?
Как еще возникает золотистый стафилококк в горле? - Пищевой путь, когда данный микроорганизм проникает внутрь человеческого организма при употреблении некоторых продуктов питания. Развитию стафилококковых инфекций способствует недостаточная термообработка мясных блюд, некачественно вымытая посуда и грязные руки во время приготовления либо употребления пищи. Поэтому необходимо тщательно соблюдать правила гигиены при кормлении грудью детей, а также санировать очаги инфекции в организме, чтобы не заразить ребенка стафилококком.
- Вертикальный путь, когда стафилококковая инфекция проникает в носоглотку ребенка при заглатывании околоплодных вод, инфицированных данным возбудителем, либо при прохождении по родовым путям.
- Ятрогенный, когда стрептококки и стафилококки в горле и носу оказываются из-за несоблюдения санитарных норм при проведении разнообразных инвазивных диагностических либо лечебных манипуляций.
Аутоинфекция
Кроме этого, существует так называемая аутоинфекция, которая представляет собой переход от бессимптомного носительства возбудителя в заболевание при воздействии некоторых неблагоприятных факторов. Эти факторами могут являться:
Эти факторами могут являться:
- Ослабление функций иммунной защиты организма.
- Самостоятельно применение антибактериальных медикаментозных препаратов, следствие которого стал дисбактериоз кишечника либо слизистой носоглотки.
- Микротравмы данной области.
- Общее переохлаждение.
- Психоэмоциональное перенапряжение.
- Голодание и т. д.
Итак, способов заражения различными видами инфекций, поражающих носоглотку, немало, тем не менее избежать инфицирования возможно, если соблюдать элементарные правила, касающиеся осуществления личной гигиены и здорового образа жизни. Немаловажным аспектом здесь является иммунитет, который способен устранить любое вредоносное вторжение в организм извне, поэтому крайне важно его укреплять.
Симптомы
Стафилококк в горле можно заметить по некоторым основным симптомам, которые наиболее характерны при заболеваниях, которые он вызывает. Основными проявлениями этого является:
- Першение и ощущение сухости в полости носоглотки.

- Болевой синдром в горле, который нарастает в процессе глотания.
- Охриплость голоса и легкий невыраженный кашель.
- Сильное повышение температуры.
Разновидности стафилококковой инфекции
Развитие стафилококка в носу и горле может происходить абсолютно бессимптомно, однако в большинстве случаев наблюдаются различные формы воспаления в верхних дыхательных путях. К ним относятся:
- Тонзиллит — воспалительный процесс, развивающийся в тканях миндалин.
- Фарингит – воспаление слизистой оболочки гортани и носа.
- Ларингит – патологический процесс, который характеризуется воспалением голосовых связок.
Каждая из вышеперечисленных форм заболевания проявляется в виде отдельного комплекса симптомов, которые имеют более выраженный характер в детском возрасте, чем во взрослом.
Стафилококковый тонзиллит
Данное заболевание протекает в виде следующих явлений:
- Выраженный красный цвет миндалин.
- Образование гнойных наслоений на миндалинах белого или желтого цвета.

- Болевой синдром. Боль может переходить в ушные ходы или шею и резко усиливается во время глотания, что может вызвать снижение аппетита.
- Выраженная лихорадка и головная боль, сильное недомогание, озноб и другие проявления интоксикации.
- Лимфоаденопатия, затрагивающая шейные лимфоузлы.
Стафилококковый фарингит
Стафилококк в горле и данное заболевание соответственно проявляется следующим образом:
- Покраснение и отечность задней стенки носоглотки.
- Наслоения на ней в виде слизистого либо гнойного налета.
- Першение в горле.
- Сухой кашель.
- Охриплость.
- Повышение температуры, слабость, явления озноба и лихорадки.
Стафилококковый ларингит
Во время развития данной патологии больные могут жаловаться на следующие симптомы:
- Боли в груди.
- Сухость слизистой в области гортани и першение.
- Потеря голоса либо выраженная охриплость.
- Повышение температуры до субфебрильных показателей, озноб, интоксикация.

Диагностика стафилококковых инфекций
Симптомы размножения в носоглотке стафилококков не считаются специфическими, поэтому невозможно поставить диагноз «стафилококковая инфекция» без специальных исследований. Из-за лечить подобные заболевания носоглотки следует только после того, как возбудитель патологии будет идентифицирован. С этой целью применяются бактериоскопические, бактериологические и серологические методы лабораторной диагностики.
Самым распространенным методом определения стафилококка у взрослых в горле является мазок. Биологический материал подвергается исследованию под микроскопом, потом осуществляется высевание на питательную среду с целью получения колонии бактерий. Если стафилококк присутствует через сутки после данного посева, появляются специфические колонии бактерий бело-желтого цвета.
При серологических исследованиях используют бактериофаги, которые подразделяются на четыре основных группы. При положительном тесте стафилококк убивает бактериофаг. Он применяется редко в силу своей неточности и низкой информативности.
Он применяется редко в силу своей неточности и низкой информативности.
Лечение стафилококка в горле
Терапевтические методы по устранению подобного патологического процесса, протекающего в области носоглотки, должны определяться исключительно специалистами, поскольку некомпетентное лечение может привести к возникновению устойчивости стафилококковой инфекции к определенным антибактериальным лекарственным препаратам.
При лечении стафилококка в горле у взрослого необходимо добиться следующих целей:
- Подавить активность возбудителя заболевания, в частности, стафилококка.
- Восстановить структурные характеристики слизистой оболочки полости носа и глотки.
- Стимулировать функционирование иммунной защиты организма.
Для подавления размножения стафилококковой инфекции используются, как правило, различные противомикробные медикаментозные средства, а именно:
- Системные антибиотики – «Кларитромицин», «Клиндамицин», «Цефотаксим», «Амоксиклав» и другие, применение которых возможно при распространении стафилококковой инфекции в другие отделы организма, а также при тяжелом ее течении.

- Противостафилококковый либо комплексные бактериофаги, которые дополняют основную антибактериальную терапию. Подобные лекарственные препараты представляют собой вирусы, которые способны поражать стафилококки. К примеру, комплексный бактериофаг содержит в себе вирусы от стафилококка, стрептококка и клебсиеллеза. В качестве монотерапии данное средство может применяться в детском возрасте. Что еще предполагает лечение стафилококка в носу и горле?
- Иммуномодуляторы, применение которых является важной частью противостафилококкового лечения. К таким медикаментам относятся: «Противостафилококковый иммуноглобулин», «ИРС-19», «Тактивин», «Рибомунал», «Полудан» и другие.
Прием всех данных лекарственных средств проводится, как правило, в течение острого периода инфекционного заболевания, а после этого – в уменьшенных дозах на протяжении двух недель после исчезновения симптомов.
Можно ли вылечить золотистый стафилококк у взрослого в горле средствами народной медицины?
Лечение народными средствами
Вылечить патологии, вызванные данным возбудителем, только при помощи народных методов невозможно. Тем не менее, они могут эффективно дополнить классическую терапию, облегчив симптомы и значительно ускорив выздоровление.
Тем не менее, они могут эффективно дополнить классическую терапию, облегчив симптомы и значительно ускорив выздоровление.
К таким средствам можно отнести:
- Абрикосы и смородину, которые содержат аскорбиновую кислоту, антиоксиданты, пектин и многие другие полезные вещества.
- Настой шиповника.
- Отвар корней лопуха либо эхинацеи. Средство применяется, как правило, для полоскания горла.
- Настой тимьяна, почек березы и листьев тысячелистника.
Местное лечение заболеваний, вызванных стафилококком
Локально бороться со стафилококковой инфекцией носоглотки помогают следующие медикаментозные средства:
- «Хлорофиллипт»;
- «Хлоргексидин»;
- «Тантум Верде»;
- «Гексорал»;
- «Мирамистин».
Таким образом, мы разобрались в том, какие заболевания в горле и носу вызывает стафилококк. Также рассмотрели медикаментозные средства и народные методы для борьбы с инфекцией. Важно понимать, что при возникновении первых симптомов болезни необходимо сразу же обращаться к врачу. Самолечение чревато последствиями.
Самолечение чревато последствиями.
Золотистый стафилококк в горле: причины и лечение (фото)
Золотистый стафилококк — представитель условно-патогенной флоры. Обитает в человеческом организме почти с рождения ввиду высокой степени вирулентности (способности поражать потенциального носителя).
Определяется как пиогенный (гноеродный) грамположительный микроорганизм аэробного типа (требуется кислород для жизнедеятельности). Распространенность патогенной структуры широка: как показывает медицинская статистика, инфицирован почти каждый или около 98% людей в популяции.
Золотистый стафилококк легко передается от человека к человеку. Обнаруживается в окружающей среде, на предметах обихода, на продуктах питания, в слизистом секрете человеческого организма и т.д.
Свое название организм получил благодаря схожести с гроздью винограда (staphyle означает гроздь). Бактерия имеет шарообразную форму и лишена способности передвигаться. Никаких органелл для транспортировки не предусмотрено.
Несмотря на отсутствие способности к движению, это крайне опасный организм, который провоцирует разнообразные заболевания отоларингологического, пульмонологического и иного профиля.
Об опасностях поражения горла стафилококком
Горло человека, как и ротоглотка в целом сталкивается со стафилококком в первую очередь (почему так — описано ниже). Описанная патогенная структура заразна, провоцирует опасные для жизни и здоровья болезни, вроде ангин (тонзиллитов), фарингитов, ларингитов.
При нисходящем пути транспортировки инфекции возможны более сложные поражения организма, в том числе нижних дыхательных путей (пневмонии, бронхиты).
Опасности подобного соседства множественны:
- Во-первых, микроорганизм устойчив к большинству антисептических препаратов. Наблюдается подобное по причине создания крупных конгломератов себе подобных. При воздействии лекарственного препарата поражается лишь верхний слой кокков, нижние же остаются нетронутыми и продолжают активную репликацию (размножение).

- Стафилококк продуцирует эндотоксины. При обширных поражениях горла это ведет к отравлениям. Если же бактерии находятся в латентной, спящей фазе, высока вероятность развития гастритов, рефлюкс-эзофагитов и язв желудка (не стоит заблуждаться, гастрит далеко не всегда провоцируется хиликобактер пилори).
- Наконец, микроорганизм синтезирует липазу и пенициллиназу. Это особые ферментативные вещества. Первое помогает расплавлять кожные покровы и слизистые, проникать все глубже и глубже в анатомические структуры, второе вещество делает золотистый стафилококк в горле невосприимчивым к пенициллинам и некоторым другим антибактериальным средствам.
Все это делает столь ничтожную на первый взгляд бактерию серьезнейшим противником. Лечение стафилококка в горле возможно только под контролем специалиста, но и этого недостаточно.
Требуется постоянно следить за лабораторными показателями (общим анализом крови, бактериологическим анализом слизистого отделяемого глотки и носа).
Причины возникновения стафилококка у человека
Как правило, речь идет о двух группах факторов. Первый фактор — это проникновение в организм патогенных микроорганизмов.
Учитывая высокую вирулентность золотистого стафилококка, присутствие агента в глотке — почти гарантированный факт.
Второй весомый фактор — снижение интенсивности работы иммунной системы и приобретение иммунодефицита (вне связи этого термина с одноименным вирусом, в этом случае требуется широкая трактовка).
Почему же снижаются защитные силы организма человека:
- Прием антибиотиков. Особенно бесконтрольный. Принимая столь опасные для жизни и здоровья препараты, пациент рискует на корню угробить иммунную систему с туманными перспективами восстановления защитных функций тела. Особенно опасны фторхинолоны и макролиды. Это препараты «тяжелой артиллерии». Они назначаются в крайних случаях.
- Употребление гормональных препаратов. Как правило, речь идет о представительницах слабого пола, которые пьют оральные контрацептивы на основе синтетических заместителей эстрогена.
 Подобные лекарства принимают только по назначению специалиста.
Подобные лекарства принимают только по назначению специалиста. - Стрессовые ситуации, избыточные физические нагрузки. Вызывают чрезмерный синтез гормонов коры надпочечников. Адреналин, норадреналин, кортизол. Кортикостероиды угнетают выработку Т-лимфоцитов и лейкоцитов (иммунных клеток).
- Авитаминоз, гиповитаминоз, спровоцированный алиментарными факторами. Неправильное или недостаточное питание — фактор риска становления стафилококка в носу и горле, а также на дермальных покровах.
- Дисбактериоз кишечных структур. Это дисбаланс кишечной флоры, когда условно-патогенные и патогенные микроорганизмы превалируют над полезными. Встречается подобное чаще всего у детей или у больных людей. Сказываются патологии эндокринной сферы, сердечнососудистой системы и др.
- Наличие в анамнезе инфекционных очагов. Они «перетягивают внимание» иммунитета на себя. В итоге защитная система не может адекватно среагировать на наступающую угрозу.
- Переохлаждения.
- Злоупотребление алкоголем.

- Употребление цитостатиков в рамках химиотерапии при онкологии.
- Частые острые респираторные вирусные инфекции.
Причины развития стафилококковой инфекции у детей
- Недоношенность ребенка.
Также сказывается на работе его иммунитета. При рождении у детей с недостаточной массой тела защитная система практически не работает, что вынуждает помещать подобных маленьких пациентов в «тепличные» условия.
- Позднее прикладывание к молочным железам, если речь идет о грудном ребенке.
Как показывает практика, многие младенцы (почти четверть всей популяции на Земле) страдают заболеваниями носоглотки. Почти всегда эти болезни провоцируются стафилококком золотистого типа.
Позднее прикладывание груди играет в этом не последнюю роль. Дело в том, что материнское молоко требуется новорожденному с первых же дней жизни. Причина — необходимость получения важных иммуностимулирующих веществ. Они в своем роде уникальны и по концентрации, и по качеству.
Потому матерям можно дать совет — прикладывать младенца к груди как можно раньше. Это повысит резистентность структур организма ко всей патогенной и условно-патогенной флоре.
- Искусственное вскармливание.
Если ребенок не получает материнского молока, его иммунитет формируется в разы медленнее (данные европейских исследований). Это неблагоприятный сценарий становления организма ребенка.
Однако искусственные смеси просты в приготовлении, доступны, что делает их якобы достойной заменой естественному молоку. Это не так. Всеми силами искусственного вскармливания нужно избегать.
Перечень факторов, снижающих иммунитет неполный. Его можно продолжать и дальше.
Как инфекция проникает в организм?
Пути транспортировки инфекционного агента разнообразны. Выделяют следующие способы передачи стафилококка от человека к человеку:
- Воздушно-капельный путь. Встречается наиболее часто. Речь идет о выходе бактерии в окружающую среду при дыхании, кашле, чихании.
 Достаточно некоторое время побеседовать с инфицированным человеком, чтобы стать новым носителем инфекции.
Достаточно некоторое время побеседовать с инфицированным человеком, чтобы стать новым носителем инфекции. - Контактный или контактно-бытовой путь транспортировки. При физических контактах неполового характера. Рукопожатия с дальнейшим касание слизистых, поцелуи в особенности сказываются на состоянии горла. В некоторых случаях транспортировка инфекционного агента возможна при контакте с предметами обихода, игрушками.
- Следующий путь — половой. При простом генитальном контакте «подхватить» стафилококк не так просто, а при орально-генитальном — проще простого. Потому практикам нетрадиционных сексуальных связей рекомендуется предохраняться.
- Трансмиссионный путь транспортировки инфекции при взаимодействии с кровью инфицированного (при переливании, например).
- Возможен перинатальный способ передачи микроорганизма. Иначе говоря, внутриутробное инфицирование. Стафилококк, благодаря высоким вирулентным способностям может проникать сквозь плацентарный барьер, что негативно сказывается на состоянии плода.

- Родовой путь. При прохождении по зараженным половым путям матери (естественное родоразрешение).
По организму золотистый стафилококк передвигается с током крови и лимфатической жидкости. Возможен нисходящий или восходящий путь движения инфекции к горлу и носоглотке.
Характерные симптомы
Тонзиллит (ангина стафилококкового свойства) всегда начинается остро.
Симптомы стафилококка в горле следующие:
- Повышается температура тела до фебрильных отметок и даже выше (39-40 градусов, в исключительных случаях показатели термометра больше). Гипертермия обусловлена интенсивным делением стафилококков в организме.
- Головная боль, головокружение, слабость, чувство «ватности тела», разбитости — проявления общей интоксикации. Обусловлены развитием токсического поражения, когда микроорганизмы вырабатывают избыточное количество вредных веществ.
- Гиперемия слизистых оболочек горла и гортани. Иначе говоря, интенсивный приток крови к пораженному участку.
 Обусловлен воспалением и попыткой организма таким образом избавиться от микроорганизмов.
Обусловлен воспалением и попыткой организма таким образом избавиться от микроорганизмов. - Лимфаденит. Воспаление лимфоузлов, локализованных в области шеи. Подобное заболевание само по себе дает множество симптомов: боль, отечность шеи, явное пораженного выпячивание лимфатического узла. В таком случае вылечить стафилококк в горле изолированно не получится.
- Гнойное отделяемое из горла. Миндалины приобретают рыхлую структуру, могут кровоточить, изъязвляться. На гландах появляется характерный признак — белый налет. Экссудация (выделение слизи) активная. Цвет отделяемого варьируется от беловато-желтого до грязно-желтого и даже зеленого.
- Болевой синдром интенсивного характера. Дискомфорт крайне силен, характеризуется жжением, першением, пульсирующими ощущениями. Иррадиирует (отдает) в уши, челюсти, шею.
- Озноб. Ощущение бегания мурашек по телу.
- Ортостатические приступы (потемнение в глазах при попытках резко подняться).
- Чувство нехватки воздуха по причине отека глотки.
 Возможна асфиксия. Это опасное осложнение. Требуется неотложная медицинская помощь.
Возможна асфиксия. Это опасное осложнение. Требуется неотложная медицинская помощь.
Это основные и наиболее часто встречающиеся симптомы. Фарингит развивается только в 5% клинических ситуаций. Как показывает практика, симптоматика идентична за тем исключением, что дополнительно возможны нарушения голоса, чувство першения в горле и сильный кашель.
Если экссудация при кашлевом рефлексе отсутствует, это означает, что поражены только верхние дыхательные пути. Прогноз благоприятный.
Если в патологический процесс вовлекаются нижние органы дыхания прогноз существенно хуже. Лечение стафилококкового поражения у взрослых и тем более детей потребует госпитализации.
Что нужно обследовать?
Диагностикой стафилококка в горе занимаются специалисты по отоларингологии (ЛОР-врачи). Необходима визуальная оценка состояния носоглотки инструментальными методами, но наибольшая роль отводится методикам лабораторным.
- Общий анализ крови. Неинформативен в большинстве случаев.
 Однако показывает воспалительный процесс со смещением лейкоцитарной формулы в сторону увеличения, повышением скорости оседания эритроцитов.
Однако показывает воспалительный процесс со смещением лейкоцитарной формулы в сторону увеличения, повышением скорости оседания эритроцитов. - Посев биологического материала на питательные среды. Назначается всегда. Позволяет разработать четкую терапевтическую модель и определить чувствительность флоры к антибиотикам.
- Серологические исследования (коагулазный тест и другие). Дают возможность отграничить золотистый стафилококк от стрептококка и других микроорганизмов пиогенного рода.
- Необходимо взять мазок из зева для оценки количества патогенной флоры.
В комплексе указанных исследований достаточно для постановки диагноза.
Норма золотистого стафилококка у взрослых
Стафилококк относится к условно-патогенной флоре, потому существует усредненный показатель нормы его концентрации в горле. Он определяется числом 10 в 3 степени – 10 в 4 степени КОЭ/мл. В крайне редких случаях возможно отсутствие патогенной флоры в носоглотке.
Методы лечения стафилококковой инфекции
Лечение стафилококка в носу и горле проводится в системе. Требуется применение препаратов сразу нескольких групп:
Требуется применение препаратов сразу нескольких групп:
- Антисептиков. Применяются в первую очередь. Помогают уничтожить патогенную флору в горле. Назначается Хлоргексидин, Мирамистин, Хлорофилипт, Гексорал. Это равнозначные препараты.
- Противовоспалительные нестероидного происхождения. Помогают справиться с воспалительным процессом. Показаны такие средства, как Кетопрофен, Найз, Ибупрофен.
- Антибактериальные фармацевтические препараты. Назначаются строго после исследования флоры на чувствительность, а также серологического анализа, который позволяет выявить тип возбудителя и его агрессивность. Как правило используются препараты устойчивые к действию ферментов стафилококка из групп линкозамидов и бета-лактамов, реже макролидов. Самостоятельный выбор антибиотиков запрещен, поскольку велик риск развития супербактерии.
- Бактериофаги стафилококковые. Используются в качестве стимуляторов выработки собственных антител против конкретного возбудителя. Список включает: Стафилококковый антифагин, Стафилококковый анатоксин, Сектафаг.
 Препараты выпускаются в форме инъекций.
Препараты выпускаются в форме инъекций. - Жаропонижающие. Требуются далеко не всегда. В большинстве случаев их применение необоснованно. Сбивать температуру нужно при повышении показателей термометра до 38 градусов и выше.
Большинство вышеперечисленных средств используются для полосканий, приема внутрь, ингаляций. Конкретные названия препаратов и форму выпуска подбирает только врач.
Лечение золотистого стафилококка в горле — сложный и комплексный вопрос. Требуется систематический подход, только так можно рассчитывать на благоприятный исход терапии. Самолечением заниматься строго воспрещается. Нужно обратиться к врачу.
Стафилококк — Школа доктора Комаровского
Вконтакте
Одноклассники
Мой мир
Золотистый стафилококк в горле: симптомы, лечение бактериофагом, фото
В горле каждого человека живет золотистый стафилококк. Он относится к условно-патогенной микрофлоре. Это значит, что при отсутствии негативных факторов не причиняет вред организму.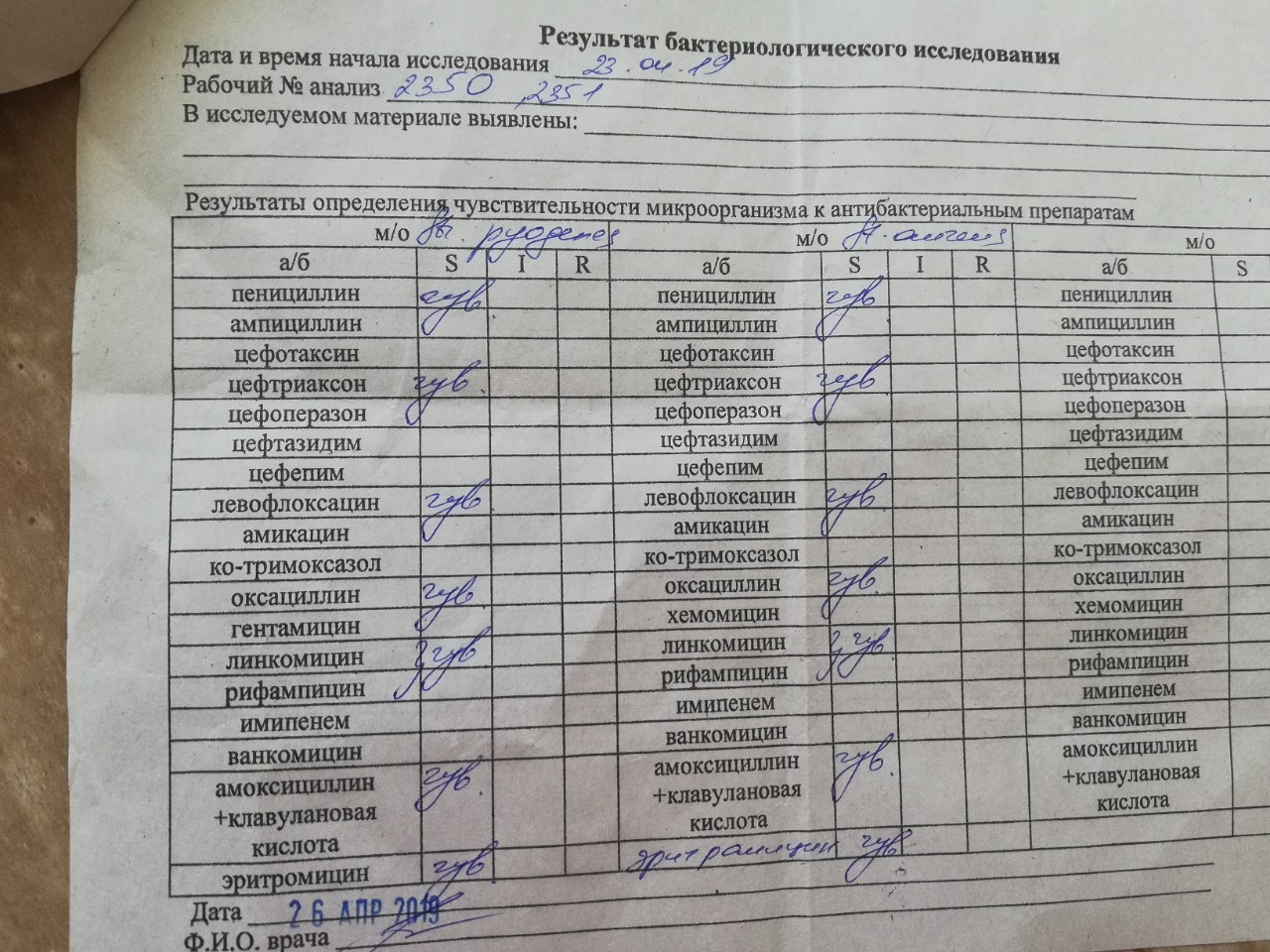 Но как только человек сталкивается со сниженным иммунитетом или переохлаждением, стафилококк начинает активно размножаться.
Но как только человек сталкивается со сниженным иммунитетом или переохлаждением, стафилококк начинает активно размножаться.
Что такое золотистый стафилококк?
Это шарообразная бактерия, которая способна быть в воздухе. Свое название «золотистый» приобрел из-за золотистого свечения, которое появляется при посеве в питательную среду. По своей форме стафилококк под микроскопом похож на гроздь винограда.Впервые бактерия была обнаружена в 1800 году в Шотландском городе Абердине в гное абсцессов. Она является возбудителем многих инфекционных заболеваний. Стафилококк:
- Самый патогенный для человеческого организма.
- Устойчив к неблагоприятным факторам.
- Хорошо переносит нагрев и воздействие перекисью водорода.
- Способен находиться в потовых железах человека.
Как происходит заражение
Чаще всего заражение происходит в больницах при проведении внутривенных процедур, например, при использовании катетеров. Проникнуть может и через продукты. Хорошей средой для размножения является молоко, торты, консервы.
Хорошей средой для размножения является молоко, торты, консервы.
У взрослых заражение может происходить и при интимной близости с инфицированным человеком. Через слизистые бактерия проникает в мочеполовую систему.Обитают золотистые стафилококки и на ручках домов, мебели.
Как происходит заражение золотистым стафилококком, смотрите в нашем видео:
Симптомы
Симптоматика зависит от того, какое именно заболевание возникло на фоне заражения золотистым стафилококком. Если речь идет о тонзиллите, то температура тела повышается до 40 градусов.
В 50% случаев при размножении патогенной микрофлоры начинается фарингит. Для него характерным являются:
- осиплость голоса,
- повышение утомляемости и общего недомогания,
- увеличение температуры тела.
Может наблюдаться скопление слизи на задней стенке и повышение температуры тела.
При ларингите к болезненным ощущениям в горле часто присоединяется развитие трахеита и появление гнойного отделяемого. Изменяется тембр, высота и сила голоса. Иногда это доходит до полной его потери. Во время откашливания происходит отделение мокроты.
На фото горло, пораженное стафилококком
Причины
Избавиться от стафилококка в горле полностью можно, но он опять появится. Есть определенное количество бактерий, присутствие которых считается нормой. Но при появлении провоцирующих факторов происходит резкое увеличение микрофлоры. К ним относится:
- недостаток витаминов в организме ребенка или взрослого,
- снижение иммунных сил организма,
- развитие кариеса,
- наличие хронического бронхита,
- инфекции придаточных пазух носа.
Диагностика инфекции в горле
Окончательный диагноз ставится только после проведения исследований.Одним из эффективных является микробиологический способ, когда делается мазок из горла.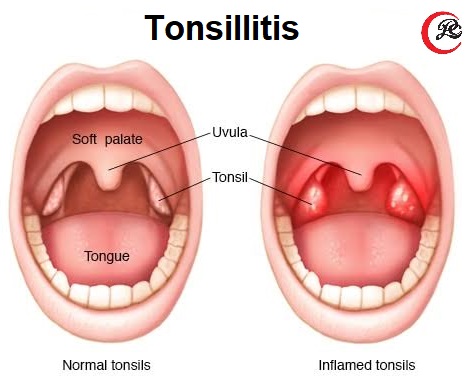 Бактерии помещаются в питательную среду.
Бактерии помещаются в питательную среду.
Через 18-24 часа золотистый стафилококк начинается образовывать колонии.
Если результат нужно получить быстро, применяется коагулазный тест, который выявляет наличие инфекции в организме быстрее.
Результат готов через 4 часа, но при отрицательном ответе исследование продлевается.
Если говорить о серологическом способе, то используются наборы из 23 бактериофагов. Один штамм убивает 1 фаг или группу. Этот способ в последние годы используется только в качестве дополнительного, поскольку не обладает высокой точностью.
Методы лечения
Главная цель лечение – повышение иммунитета и сопротивляемости организма. Обычно используются медикаментозные методы, которые дополняются народными средствами.
Как избавиться от золотистого стафилококка:
Медикаментозно
Простимулировать иммунную систему на естественное сопротивление легко с помощью иммуностимуляторов. Считается, если концентрация стафилококка слишком повышена, это свидетельствует об угнетении защитных сил организма.
Считается, если концентрация стафилококка слишком повышена, это свидетельствует об угнетении защитных сил организма.
Иммуномодуляторы содержат деактивированные фрагменты бактерий. Благодаря этому организм запускает усиленную выработку интерферона, которая и приводит к улучшению иммунного ответа. Такие лекарства обычно используются местного действия. Популярными являются Имудон и ИРС-19.
В некоторых случаях не обойтись без антибактериальных препаратов. Стафилококки устойчивы к некоторым таблеткам, но остается чувствительной к Азитромицину, Цефриаксону и некоторым другим. В совокупности с такими препаратами назначаются полоскания настойкой календулы или Хлорфиллиптом. Для восстановления иммунитета могут использоваться растительные адаптогены, народные средства, минеральные комплексы.
Популярные препараты для лечения стафилококка
Народными средствами
Можно проводить лечение свежими ягодами. В течение 10 дней нужно съедать большое количество абрикосов и черной смородины. После этого запрещается есть и пить. Полезными свойствами обладает отвар шиповника. Он пагубно воздействует на стафилококк и укрепляет собственные силы организма. Достаточно пить по 100 мл дважды в день перед едой.
После этого запрещается есть и пить. Полезными свойствами обладает отвар шиповника. Он пагубно воздействует на стафилококк и укрепляет собственные силы организма. Достаточно пить по 100 мл дважды в день перед едой.
Если хотите сразу провести профилактику бронхита и пневмонии, то используйте стакан эхинацеи и лопуха. Сделайте из них отвар из двух чайных ложек смеси и 800 мл воды.
Лечение с использованием медикаментов и методов народной медицины следует сочетать с диетой. Нужно максимально уменьшить количество углеводов, особенно от фастфуда.
Чем опасен
Золотистый стафилококк часто становится причиной развития самых тяжелых осложнений. У новорожденных, например, может привести к развитию пузырчатки. Патогенные клетки проникают в мягкие ткани, поэтому на слизистой появляются болезнетворные язвы и эрозии. Со временем ткани могут загнить, а их лечение проводится только хирургическим путем.
Золотистый стафилококк продуцирует ядовит фермент, легко проникающий в системный кровоток. Это приводит к появлению признаком отравления. Если уровень токсиннейтрализующих антител низкий, может возникнуть токсический шок. Вероятность его появления увеличивается у женщин в период менструации, при перенесенных хирургических операциях и у детей.
Это приводит к появлению признаком отравления. Если уровень токсиннейтрализующих антител низкий, может возникнуть токсический шок. Вероятность его появления увеличивается у женщин в период менструации, при перенесенных хирургических операциях и у детей.
Патогенная микрофлора легко преодолевает межтканевые барьеры. Поэтому при наличии стафилококка в горле может перейти инфекция в придаточные пазухи и среднее ухо. Если не лечить, то это приводит к внутричерепным инфекциям.
Отзывы доктора Комаровского о лечении стафилококковой инфекции:
Профилактика
Вероятность заболеть снизиться, если питание будет сбалансированным и правильным, содержать необходимые витамины. Нужно тщательно мыть руки перед едой и полноценно отдыхать.
Часто переход микроба в патогенную флору происходит на фоне простуды, особое внимание уделяется профилактическим мерам в период эпидемий. Можно принимать в целях профилактики противовирусные препараты дважды в год.
Можно принимать в целях профилактики противовирусные препараты дважды в год.
Прогноз
При правильном лечении прогноз благоприятный. При частых рецидивах рекомендована консультация иммунолога и проведение исследования на определение иммунного статуса. Золотистый стафилококк является проблемой в семьях, где есть маленькие дети. Он может стать причиной развития хронических болезней, поэтому только лечение, основанное на проведении анализов, поможет сохранить здоровье семьи.
ДНК золотистого стафилококка | ПолиКлиника Отрадное
Что такое золотистый стафилококк
Золотистый стафилококк — грамположительная бактерия из рода Стафилококков. Около 40% населения — носители этой бактерии. При неблагоприятных условиях инфекция активизируется, выделяет токсины, которые нарушают жизнедеятельность клеток, снижают защитные свойства иммунной системы.
К активизации стафилококковой инфекции предрасполагает местное и общее переохлаждение, регулярные стрессовые ситуации, алкогольная интоксикация, курение, хронический недосып, употребление просроченных молочных и кисломолочных продуктов.
Золотистый стафилококк вызывает широкий спектр заболеваний, начиная с аллергических реакций, кожных инфекций до смертельно-опасных состояний: менингита, остеомиелита, пневмонии, эндокардита. Сложность заключается в том, что стафилококк выживает в самых неблагоприятных условиях, устойчив к действию многих антибактериальных препаратов, высокой температуры. Это одна из самых частых бактерий, которой заражаются после посещения медицинских учреждений, операций.
Справка! Свое название золотистый стафилококк получил благодаря внешнему виду: в отличие от большей части бактерий, которые бесцветны под микроскопом, он имеет желтый цвет из-за наличия пигмента каротиноида.
В группу риска заражения золотистым стафилококком входят:
- беременные и кормящие,
- лица преклонного возраста,
- новорожденные,
- сотрудники медицинских учреждений,
- лица с ослабленным иммунитетом,
-
пациенты с сахарным диабетом, онкологическими заболеваниями, ВИЧ-инфекциями.

Основные пути передачи — воздушно-капельный, контактный, гемоконтактный (с кровью).
Позвоните прямо сейчас Сдать анализ на ДНК трихомонады вагиналисТипы анализов на выявление стафилококка
Попадая в организм бактерия начинает размножаться, что проявляется клиническими симптомами, которые, в зависимости от места колонизации стафилококка, могут быть похожи на другие заболевания. Для того, чтобы свести диагноз к единственной вероятной болезни, в комплексное обследование включают анализ на золотистый стафилококк.
Исследование востребовано в гастроэнтерологии, педиатрии, отоларингологии, гинекологии, урологии, эндокринологии, дерматологии, кардиологии, акушерстве, нефрологии, ревматологии, хирургии. При небольшом содержании бактерии в биологическом материале (до 10³) фармакотерапию не назначают.
Посев мазка из зева и носоглотки
Исследование микрофлоры слизистой оболочки рото- и носоглотки даёт возможность выявить и идентифицировать стафилококковую инфекцию, её количество, определить чувствительность к антибактериальным препаратам.
Анализ проводят при наличии:
- хронического тонзиллита,
- дифтерии,
- скарлатины,
- при подозрении на ревматизм,
- частых ОРВИ.
Бакпосев назначают при жалобах на постоянный насморк и заложенность носа, беспричинную непроходящую боль в горле, субфебрильную температуру.
Сбор биоматериал преимущественно проводят в утреннее время натощак. Перед сдачей анализа нельзя чистить зубы, есть и пить. За 24–36 часов не используют противовирусные или антибактериальные препараты.
Микроскопическое исследование мазка из влагалища
При микроскопическом исследовании отделяемого из урогенитального тракта определяют состояние микрофлоры, наличие воспалительных процессов, бактерий и их количество, антибиотикорезистентность.
Анализ на золотистый стафилококк в гинекологии назначают при плановых гинекологических осмотрах, в период беременности, при подозрении на инфекционные заболевания мочеполовой системы.
Исследование требует специальной подготовки пациента:
- За 2–3 дня прекратить применение вагинальных свечей.
- За 36 часов ограничить половой контакт, спринцевания.
- Накануне анализа разрешается только туалет наружных половых органов.
- Минимум за два часа не рекомендовано мочиться.
Наиболее информативно исследование на 5–7 день после менструального цикла. Во время менструации соскоб не берут.
Биохимический анализ крови на золотистый стафилококк
Кровь берут в утреннее время натощак до 11.00. Чтобы результаты исследования были информативными, необходимо соблюдать несколько правил:
- Не есть 8–10 часов.
- За два дня отказаться от алкоголя.
- Накануне ограничить жирную пищу, чай, кофе, кондитерские изделия.
-
Избегать эмоционального, физического переутомления.

- За полчаса до процедуры не курить.
Если вы принимаете какие-либо препараты, об этом необходимо сообщить врачу.
Анализ мочи и кала
Исследование кала на стафилококк наиболее востребовано в педиатрии, гастроэнтерологии и эндокринологии. Анализ показан для подтверждения заболеваний органов пищеварительной системы, оценки функций печени и поджелудочной железы, при различных заболеваниях кожи, частых ОРВИ, аллергии.
Материал для исследования — кал после самостоятельной дефекации, при этом важно, чтобы в него не попала урина. Собирают в стерильный, герметично закрывающийся контейнер, и в течение суток перенаправляют в лабораторию. Собранный биоматериал хранят в холоде при температуре +4–8°С.
Важно! Перед сбором материала за три дня не используют ректальные суппозитории, слабительные средства и другие препараты, которые влияют на работу ЖКТ.
Анализ мочи — универсальное исследование при первичной диагностики инфекций, заболеваний пищеварительной, дыхательной, сердечно-сосудистой системы
Подготовка и сбор мочи:
-
За 2 дня отменить прием мочегонных препаратов.

- За день исключить алкоголь, соль, продукты, которые окрашивают мочу.
- За 24 часа избегать физических нагрузок, стресса.
- Мочу собирать утром. После пробуждения тщательно обмыть наружные половые органы без гигиенической косметики, насухо вытереть. Первую порцию слить. Для исследования использовать среднюю порцию мочи
Женщины не производят сбор мочи во время менструального цикла и спустя 1–2 дня. Противопоказан анализ в течение нескольких дней после оперативных вмешательств на мочевом пузыре.
Где сдать анализ на золотистый стафилококк
Поликлиника Отрадное выполняет все виды лабораторных исследований, направленных на идентификацию стафилококковой инфекции, предоставляет квалифицированную помощь узких специалистов. Узнать сколько стоит анализ на золотистый стафилококк можно по телефону +7(499)283–34–16. Работаем ежедневно с 8.00 до 21.00.
Инфекция золотистого стафилококка: основы практики, справочная информация, патофизиология
Харамильо Д. Инфекция: скелетно-мышечная. Педиатр Радиол . 2011 май. 41 Приложение 1:S127-34. [Медлайн].
Чоу Х., Тео Х.Е., Дубей Н., Пех В.К. Тропический пиомиозит и некротизирующий фасциит. Семин Опорно-двигательный аппарат Радиол .2011 15 ноября (5): 489-505. [Медлайн].
Lane JW, Tang J, Taggard D, Byun R. Успешное использование даптомицина и линезолида без хирургического вмешательства при лечении обширного эпидурального абсцесса и бактериемии из-за метициллин-резистентного золотистого стафилококка (MRSA). Infect Dis Clin Pract . сентябрь 2011 г. 19(5):362-364.
McNeil JC, Hulten KG, Kaplan SL, Mahoney DH, Mason EO. Инфекции Staphylococcus aureus у пациентов детской онкологии: высокие показатели устойчивости к противомикробным препаратам, толерантность к антисептикам и осложнения. Pediatr Infect Dis J . 2012, 11 сентября. [Medline].
Elliott DJ, Zaoutis TE, Troxel AB, Loh A, Keren R. Эмпирическая антимикробная терапия детских инфекций кожи и мягких тканей в эпоху метициллин-резистентного золотистого стафилококка. Педиатрия . 2009 г., июнь 123 (6): e959-66. [Медлайн].
Lee S, Choe PG, Song KH, Park SW, Kim HB, Kim NJ и др. Чем цефазолин уступает нафциллину в лечении бактериемии, вызванной метициллин-чувствительным золотистым стафилококком? Антимикробные агенты Chemother .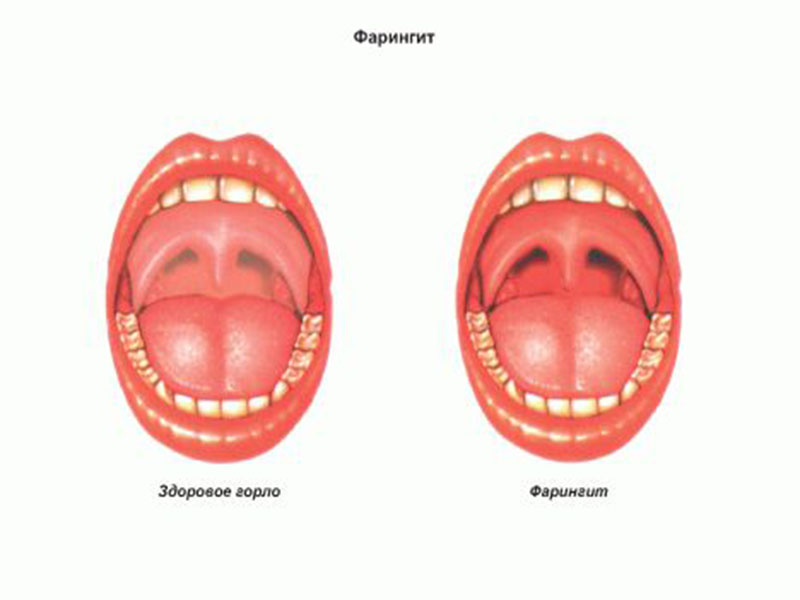 2011 ноябрь 55 (11): 5122-6. [Медлайн]. [Полный текст].
2011 ноябрь 55 (11): 5122-6. [Медлайн]. [Полный текст].
Williams DJ, Cooper WO, Kaltenbach LA, Dudley JA, Kirschke DL, Jones TF, et al. Сравнительная эффективность стратегий лечения антибиотиками детских инфекций кожи и мягких тканей. Педиатрия . 2011, 15 августа. [Medline].
[Руководство] Liu C, Bayer A, Cosgrove SE, et al. Клинические практические рекомендации Американского общества инфекционистов по лечению инфекций, вызванных устойчивым к метициллину золотистым стафилококком, у взрослых и детей. Клин Infect Dis . 2011 1 февраля. 52(3):e18-e55. [Медлайн].
Кемпер А.Р., Долор Р.Дж., Фаулер В.Г. мл. Лечение абсцессов кожи педиатрами первичного звена. Clin Pediatr (Фила) . 2011 июнь 50 (6): 525-8. [Медлайн].
Sreeramoju P, Porbandarwalla NS, Arango J, Latham K, Dent DL, Stewart RM, et al. Рецидивирующие инфекции кожи и мягких тканей, вызванные метициллинрезистентным золотистым стафилококком, требующие оперативного лечения. Am J Surg . 2011 фев. 201(2):216-20. [Медлайн].
Рецидивирующие инфекции кожи и мягких тканей, вызванные метициллинрезистентным золотистым стафилококком, требующие оперативного лечения. Am J Surg . 2011 фев. 201(2):216-20. [Медлайн].
Пяакконен М., Каллио П.Е., Каллио М.Дж., Пелтола Х. Лечение костно-суставных инфекций, вызванных золотистым стафилококком, аналогично лечению других этиологий: анализ 199 стафилококковых инфекций костей и суставов. Pediatr Infect Dis J . 2012 май. 31(5):436-8. [Медлайн].
Boggs W. Даптомицин лечит бактериемию S. aureus без нефротоксичности. Медицинские новости Medscape. 8 января 2013 г. Доступно на http://www.medscape.com/viewarticle/777276. Доступ: 15 января 2013 г.
von Eiff C, Becker K, Machka K, Stammer H, Peters G. Назальное носительство как источник бактериемии Staphylococcus aureus. Исследовательская группа. N Английский J Med . 2001 4 января.344(1):11-6. [Медлайн].
N Английский J Med . 2001 4 января.344(1):11-6. [Медлайн].
ван Белкум А., Веркаик Н.Дж., де Фогель С.П., Боэленс Х.А., Вервир Дж., Ноувен Дж.Л. Реклассификация типов назального носительства Staphylococcus aureus. J Заразить Dis . 2009 15 июня. 199(12):1820-6. [Медлайн].
Wenzel RP, Perl TM. Значение назального носительства золотистого стафилококка и частота послеоперационной раневой инфекции. Джей Хосп Заражение . 1995 г. 31 сентября (1): 13-24. [Медлайн].
Руми Р., Анжебо С., Джоссу Ф. и др.Является ли генетика хозяина преобладающей детерминантой персистирующего назального носительства Staphylococcus aureus у людей? J Заразить Dis . 2010 15 сентября. 202(6):924-34. [Медлайн].
Чен С.Дж., Хсу К.Х., Лин Т. И., Хван К.П., Чен П.Ю., Хуан Ю.К. Факторы, связанные с назальной колонизацией метициллин-резистентным золотистым стафилококком среди здоровых детей на Тайване. Дж Клин Микробиол . 2011 янв. 49 (1): 131-7. [Медлайн]. [Полный текст].
И., Хван К.П., Чен П.Ю., Хуан Ю.К. Факторы, связанные с назальной колонизацией метициллин-резистентным золотистым стафилококком среди здоровых детей на Тайване. Дж Клин Микробиол . 2011 янв. 49 (1): 131-7. [Медлайн]. [Полный текст].
Нерби Дж. М., Горвиц Р., Лешер Л., Джуни Б., Джавахир С., Линфилд Р.Факторы риска бытовой передачи внебольничного метициллин-резистентного золотистого стафилококка. Pediatr Infect Dis J . 2011 30 ноября (11): 927-32. [Медлайн].
Fritz SA, Krauss MJ, Epplin EK, Burnham CA, Garbutt J, Dunne WM, et al. Естественная история современной назальной колонизации Staphylococcus aureus у детей из общины. Pediatr Infect Dis J . 2011 30 апреля (4): 349-51. [Медлайн]. [Полный текст].
Джезуальдо Ф., Бонджорно Д., Риццо С., Белла А., Меникелла Д., Стефани С. и др.Назальная колонизация MRSA у детей: метаанализ распространенности, обзор факторов риска и молекулярной генетики. Pediatr Infect Dis J . 2013 21 января. [Medline].
и др.Назальная колонизация MRSA у детей: метаанализ распространенности, обзор факторов риска и молекулярной генетики. Pediatr Infect Dis J . 2013 21 января. [Medline].
Peters PJ, Brooks JT, McAllister SK, Limbago V, Lowery HK, Fosheim G, et al. Колонизация метициллин-резистентным золотистым стафилококком паховой области и риск клинической инфекции среди ВИЧ-инфицированных взрослых. Внезапное заражение Dis . Апрель 2013 г. 19(4):623-629.
Faden H, Lesse AJ, Trask J, Hill JA, Hess DJ, Dryja D.Значение места колонизации в текущей эпидемии стафилококковых абсцессов кожи. Педиатрия . 2010, 15 февраля. [Medline].
Lee CJ, Sankaran S, Mukherjee DV, Apa ZL, Hafer CA, Wright L. Орофарингеальное носительство Staphylococcus aureus у заключенных. Клин Infect Dis . 2011 15 марта. 52(6):775-8. [Медлайн].
52(6):775-8. [Медлайн].
Новрузян Ф.Л., Даувальдер О., Менье Х., Бес М., Этьен Дж., Ванденеш Ф. и др. Гены адгезина и суперантигена и способность золотистого стафилококка колонизировать детский кишечник. J Заразить Dis . 2011 сен. 204(5):714-21. [Медлайн].
Milstone AM, Song X, Coffin S, Elward A. Выявление и ликвидация колонизации метициллин-резистентного золотистого стафилококка в отделении интенсивной терапии новорожденных: результаты национального исследования. Infect Control Hosp Epidemiol . 2010 г. 31 июля (7): 766-8. [Медлайн]. [Полный текст].
Накамура М.М., МакАдам А.Дж., Сандора Т.Дж., Морейра К.Р., Ли Г.М. Более высокая распространенность фарингеального, чем носового, носительства Staphylococcus aureus в детских отделениях интенсивной терапии. Дж Клин Микробиол . 2010 авг. 48 (8): 2957-9. [Медлайн].
2010 авг. 48 (8): 2957-9. [Медлайн].
Matheson EM, Mainous AG 3rd, Everett CJ, King DE. Потребление чая и кофе и назальное носительство MRSA. Энн Фам Мед . 2011 июль-авг. 9(4):299-304. [Медлайн].
Зангер П., Нурджади Д., Гейле М., Габриш С., Кремснер П.Г. Использование гормональных контрацептивов и стойкое носовое носительство золотистого стафилококка. Клин Infect Dis . 2012 Декабрь 55 (12): 1625-32. [Медлайн].
Бартлет А.Х., Халтен К.Г. Патогенез золотистого стафилококка: системы секреции, адгезины и инвазины. Pediatr Infect Dis J . 2010 Сентябрь 29 (9): 860-1. [Медлайн].
Tuchscherr L, Heitmann V, Hussain M, Viemann D, Roth J, von Eiff C, et al. Варианты небольших колоний Staphylococcus aureus представляют собой адаптированные фенотипы для внутриклеточной персистенции. J Заразить Dis . 2010 1 октября. 202(7):1031-40. [Медлайн].
J Заразить Dis . 2010 1 октября. 202(7):1031-40. [Медлайн].
Verkaik NJ, Dauwalder O, Antri K, Boubekri I, de Vogel CP, Badiou C.Иммуногенность токсинов при стафилококковой инфекции. Клин Infect Dis . 2010 1 января. 50 (1): 61-8. [Медлайн].
Алфс А.С., Октарина Д.А., Диркс Г.Ф., Йонкман М.Ф., Пас Х.Х. Синдром стафилококковой обожженной кожи: потеря десмоглеина 1 в коже пациента. Евро J Дерматол . 2010 июль-авг. 20(4):451-6. [Медлайн].
Bassetti M, Nicco E, Mikulska M. Почему внебольничный MRSA распространяется по всему миру и как это изменит клиническую практику?. Противомикробные агенты Int J . 34 июля 2009 г. Приложение 1: S15-9. [Медлайн].
Дэвид М.З., Даум Р.С. Внебольничный метициллин-резистентный золотистый стафилококк: эпидемиология и клинические последствия возникающей эпидемии. Clin Microbiol Rev . 2010 г. 23 июля (3): 616-87. [Медлайн].
Clin Microbiol Rev . 2010 г. 23 июля (3): 616-87. [Медлайн].
Pickett A, Wilkinson M, Menoch M, Snell J, Yniguez R, Bulloch B. Изменение заболеваемости метициллин-резистентными абсцессами кожи золотистого стафилококка в педиатрическом отделении неотложной помощи. Детская неотложная помощь . 2009 г. 25 декабря (12): 831-4. [Медлайн].
Кайрам Н., Сильверман М.Э., Сало Д.Ф., Баорто Э., Ли Б., Амато К.С. Кожный метициллин-резистентный золотистый стафилококк в педиатрическом отделении неотложной помощи пригородной городской больницы. J Emerg Med . 2011 ноябрь 41 (5): 460-5. [Медлайн].
Буше Х.В., Кори Г.Р. Эпидемиология метициллин-резистентного золотистого стафилококка. Клин Infect Dis . 2008 1 июня.46 Приложение 5:S344-9. [Медлайн].
Талан Д.А., Кришнадасан А., Горвиц Р.Дж., Фошейм Г.Э., Лимбаго Б., Альбрехт В. и др. Сравнение золотистого стафилококка при инфекциях кожи и мягких тканей у пациентов отделений неотложной помощи США, 2004 и 2008 гг. Clin Infect Dis .2011 июль 53 (2): 144-149. [Медлайн].
Лонг CB, Madan RP, Herold BC. Диагностика и лечение внебольничных инфекций MRSA у детей. Expert Rev Anti Infect Ther . 2010 8 февраля (2): 183-95. [Медлайн].
Лоуи ФД. Как золотистый стафилококк приспосабливается к хозяину. N Английский J Med . 2011 26 мая. 364(21):1987-90. [Медлайн].
Ритц Н., Кертис Н. Роль лейкоцидина Пантона-Валентайна при инфекциях опорно-двигательного аппарата, вызванных золотистым стафилококком у детей. Pediatr Infect Dis J . 2012 май. 31(5):514-8. [Медлайн].
Мендес Р.Е., Дешпанде Л.М., Смит Д.С., Шопсин Б., Фаррелл Д.Дж., Джонс Р.Н. Характеристика метициллин-резистентных штаммов Staphylococcus aureus, полученных в результате клинического испытания IV фазы линезолида по сравнению с ванкомицином для лечения нозокомиальной пневмонии. Дж Клин Микробиол . 2012 50 ноября (11): 3694-702. [Медлайн]. [Полный текст].
Hermos CR, Yoong P, Pier GB. Высокий уровень антител к пантон-валентиновому лейкоцидину не связан с резистентностью к Staphylococcus aureus-ассоциированной инфекции кожи и мягких тканей. Клин Infect Dis . 2010 15 ноября. 51(10):1138-46. [Медлайн].
Высокий уровень антител к пантон-валентиновому лейкоцидину не связан с резистентностью к Staphylococcus aureus-ассоциированной инфекции кожи и мягких тканей. Клин Infect Dis . 2010 15 ноября. 51(10):1138-46. [Медлайн].
Grundmeier M, Tuchscherr L, Bruck M, Viemann D, Roth J, Willscher E. Стафилококковые штаммы сильно различаются по своей способности вызывать воспалительную реакцию в эндотелиальных клетках. J Заразить Dis . 2010 15 марта. 201(6):871-80. [Медлайн].
Страндберг К.Л., Ротшафер Дж.Х., Веттер С.М., Буонпане Р.А., Кранц Д.М., Шливерт П.М. Стафилококковые суперантигены вызывают смертельную болезнь легких у кроликов. J Заразить Dis . 2010 1 декабря. 202(11):1690-7. [Медлайн].
Li M, Cheung GY, Hu J, Wang D, Joo HS, Deleo FR и др. Сравнительный анализ вирулентности и экспрессии токсина устойчивых к метициллину штаммов Staphylococcus aureus, связанных с глобальным сообществом. J Заразить Dis . 2010 15 декабря. 202(12):1866-76. [Медлайн].
J Заразить Dis . 2010 15 декабря. 202(12):1866-76. [Медлайн].
Торрес В.Дж., Штауфф Д.Л., Пищаны Г., Безбрадика Дж.С., Горди Л.Е., Итурреги Дж. и др. Регуляторная система Staphylococcus aureus, которая реагирует на гем хозяина и модулирует вирулентность. Микроб-хозяин клетки . 2007 19 апреля. 1(2):109-19. [Медлайн]. [Полный текст].
Пищаны Г., Маккой А.Л., Торрес В.Дж., Краузе Дж.С., Кроу Дж.Е. младший, Фабри М.Е. и др. Специфичность к человеческому гемоглобину усиливает инфекцию Staphylococcus aureus. Микроб-хозяин клетки . 2010 16 декабря. 8(6):544-50. [Медлайн]. [Полный текст].
Кобаяши С.Д., Малахова Н., Уитни А.Р., Браутон К.Р., Гарднер Д.Дж., Лонг Д. и др. Сравнительный анализ детерминант вирулентности USA300 в кроличьей модели инфекции кожи и мягких тканей. J Заразить Dis . 2011 сен. 204(6):937-41. [Медлайн]. [Полный текст].
2011 сен. 204(6):937-41. [Медлайн]. [Полный текст].
Хота Б., Лайлс Р., Рим Дж., Попович К.Дж., Райс Т., Аруччева А. Предикторы клинической вирулентности при внебольничных инфекциях, вызванных устойчивым к метициллину золотистым стафилококком: важность USA300 и пневмонии. Клин Infect Dis . 2011 Октябрь 53 (8): 757-65. [Медлайн].
Пейрани П., Аллен М., Вимкен Т.Л., Хак Н.З., Зервос М.Дж., Форд К.Д. и др. Тяжесть заболевания и клинические исходы у пациентов с внутрибольничной пневмонией, вызванной метициллин-резистентными штаммами Staphylococcus aureus, не зависят от наличия гена лейкоцидина Пантон-Валентин. Клин Infect Dis . 2011 Октябрь 53 (8): 766-71. [Медлайн].
Кебайер С., Чемберленд Р.Р., Аллен И.С., Гао X, Бройль П.М., Холл Д.Д.Staphylococcus aureus a-гемолизин опосредует вирулентность в мышиной модели тяжелой пневмонии посредством активации воспалительной сомы NLRP3.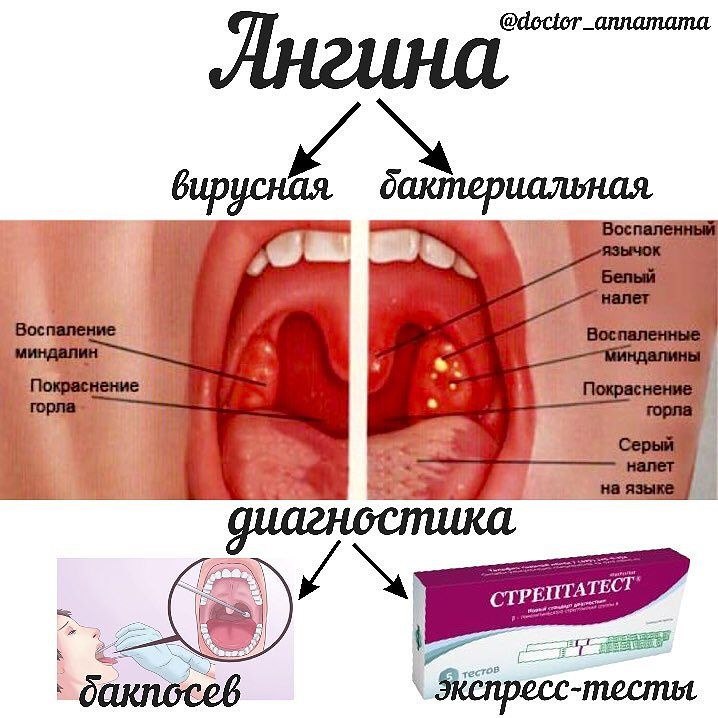 J Заразить Dis . 2012 март 205(5):807-17. [Медлайн].
J Заразить Dis . 2012 март 205(5):807-17. [Медлайн].
Рудкин Дж.К., Эдвардс А.М., Боуден М.Г., Браун Э.Л., Поцци С., Уотерс Э.М. Устойчивость к метициллину снижает вирулентность связанного с оказанием медицинской помощи метициллин-резистентного золотистого стафилококка за счет вмешательства в систему определения кворума agr. J Заразить Dis . 2012 март.205(5):798-806. [Медлайн].
Шарма-Куинкель Б.К., Ан С.Х., Руд Т.Х., Чжан Ю., Тонг С.И., Раффин Ф. и др. Наличие генов, кодирующих пантон-валентиновый лейкоцидин, не является основной детерминантой исхода у пациентов с внутрибольничной пневмонией, вызванной Staphylococcus aureus. Дж Клин Микробиол . 2012 март 50 (3): 848-56. [Медлайн]. [Полный текст].
Soong G, Chun J, Parker D, Prince A. Staphylococcus aureus Активация каспазы 1/Calpain Signaling опосредует инвазию через кератиноциты человека. J Заразить Dis . 2012 май. 205(10):1571-9. [Медлайн].
J Заразить Dis . 2012 май. 205(10):1571-9. [Медлайн].
Отто М. Как золотистый стафилококк проникает в нашу кожу и вызывает инфекцию. J Заразить Dis . 2012 май. 205(10):1483-5. [Медлайн].
Wehrhahn MC, Robinson JO, Pascoe EM, Coombs GW, Pearson JC, O’Brien FG. Тяжесть заболевания при внебольничной инвазивной инфекции Staphylococcus aureus и наличие генов вирулентности. J Заразить Dis . 2012 июнь 205(12):1840-8.[Медлайн].
Гарофало А., Гиай С., Латтар С., Гарделла Н., Моллерах М., Каль Б.К. Длина полиморфной области белка A Staphylococcus aureus регулирует воспаление: влияние на острую и хроническую инфекцию. J Заразить Dis . 2012 июль 206(1):81-90. [Медлайн].
Шаллкросс Л.Дж., Фрагаси Э., Джонсон А.М. , Хейворд А.С. Роль лейкоцидинового токсина Пантона-Валентина в стафилококковой инфекции: систематический обзор и метаанализ. Ланцет Infect Dis . 2013 13 января (1): 43-54. [Медлайн]. [Полный текст].
, Хейворд А.С. Роль лейкоцидинового токсина Пантона-Валентина в стафилококковой инфекции: систематический обзор и метаанализ. Ланцет Infect Dis . 2013 13 января (1): 43-54. [Медлайн]. [Полный текст].
Сурьядевара М., Кларк А.Е., Волк Д.М., Карман А., Розенбаум П.Ф. Молекулярная характеристика инвазивной инфекции Staphylococcus aureus у детей в центре Нью-Йорка: важность двух клональных групп и непостоянное присутствие отдельных детерминант вирулентности. J Pediatr Infect Dis Soc . март 2013 г. 2(1):30-39.
Шнайдер-Линднер В., Квач С., Хэнли Дж. А., Суисса С.Антибактериальные препараты и риск внебольничного метициллин-резистентного золотистого стафилококка у детей. Arch Pediatr Adolesc Med . 2011 авг. 1. [Medline].
Смит Т.Л., Пирсон М.Л., Уилкокс К.Р. и др. Возникновение устойчивости к ванкомицину у Staphylococcus aureus. Рабочая группа по гликопептидному промежуточному золотистому стафилококку. N Английский J Med . 1999 г., 18 февраля. 340(7):493-501. [Медлайн].
Рабочая группа по гликопептидному промежуточному золотистому стафилококку. N Английский J Med . 1999 г., 18 февраля. 340(7):493-501. [Медлайн].
Чжэн С., Ци С., Арриета М., О’Лири А., Ван Д., Шульман С.Т.Отсутствие увеличения резистентности к ванкомицину педиатрических изолятов, устойчивых к метициллину Staphylococcus aureus, с 2000 по 2007 год. Pediatr Infect Dis J . 2010 Сентябрь 29 (9): 882-4. [Медлайн].
Кэмерон Д.Р., Уорд Д.В., Костулиас Х., Хауден Б.П., Меллеринг Р.К. мл., Элиопулос Г.М. Серин/треонинфосфатаза Stp1 способствует снижению чувствительности к ванкомицину и вирулентности золотистого стафилококка. J Заразить Dis . 2012 июнь 205(11):1677-87. [Медлайн].
Cheung A, Duclos B. Stp1 и Stk1: Инь и Ян чувствительности и вирулентности ванкомицина в штаммах Staphylococcus aureus, промежуточных по отношению к ванкомицину. J Заразить Dis . 2012 июнь 205(11):1625-7. [Медлайн].
J Заразить Dis . 2012 июнь 205(11):1625-7. [Медлайн].
Shore AC, Deasy EC, Slickers P и др. Обнаружение стафилококковой кассетной хромосомы mec типа XI, кодирующей сильно дивергентные гены mecA, mecI, mecR1, blaZ и ccr, в клиническом клональном комплексе человека 130 метициллин-резистентного золотистого стафилококка. Антимикробные агенты Chemother . 2011 2 июня. [Medline].
Гарсия-Альварес Л., Холден М.Т., Линдси Х. и др. Метициллин-резистентный золотистый стафилококк с новым гомологом mecA в популяциях человека и крупного рогатого скота в Великобритании и Дании: описательное исследование. Ланцет Infect Dis . 2011 2 июня. [Medline].
Кэмерон Д.Р., Хауден Б.П., Пелег А.Ю. Взаимодействие между устойчивостью к антибиотикам и вирулентностью золотистого стафилококка и его влияние на клинические исходы. Клин Infect Dis . 2011 сен. 53 (6): 576-82. [Медлайн].
Клин Infect Dis . 2011 сен. 53 (6): 576-82. [Медлайн].
[Руководство] CDC. Временные рекомендации по профилактике и контролю стафилококковой инфекции, связанной со сниженной чувствительностью к ванкомицину. MMWR Morb Mortal Wkly Rep . 1997 г., 11 июля. 46(27):626-8, 635. [Medline].
Ивамото М., Му Ю., Линфилд Р., Буленс С.Н., Надле Дж., Арагон Д. и др. Тенденции инвазивных инфекций, вызванных устойчивым к метициллину золотистым стафилококком. Педиатрия . 2013 г., октябрь 132 (4): e817-e824. [Медлайн].
Laidman J. Рост числа случаев внебольничной заболеваемости MRSA среди детей. Medscape [сериал онлайн]. Доступно на http://www.medscape.com/viewarticle/811483. Доступ: 30 сентября 2013 г.
Helwick C. Рост MRSA у детей с мышечно-скелетными инфекциями. Medscape [сериал онлайн]. Доступно на http://www.medscape.com/viewarticle/813484. Доступ: 4 ноября 2013 г.
Medscape [сериал онлайн]. Доступно на http://www.medscape.com/viewarticle/813484. Доступ: 4 ноября 2013 г.
Сараволац Л.Д., Павляк Дж., Джонсон Л.Б.Чувствительность in vitro и молекулярный анализ ванкомицин-промежуточных и ванкомицин-резистентных изолятов Staphylococcus aureus. Клин Infect Dis . 2012 авг. 55 (4): 582-6. [Медлайн].
Frei CR, Makos BR, Daniels KR, Oramasionwu CU. Появление внебольничных инфекций кожи и мягких тканей, вызванных метициллин-резистентным метициллин-резистентным золотистым стафилококком, как частая причина госпитализации детей в США. J Pediatr Surg . 2010 Октябрь 45 (10): 1967-74.[Медлайн].
Хадлер Дж.Л., Пети С., Мандур М., Карттер М.Л. Тенденции инвазивной инфекции метициллин-резистентным золотистым стафилококком, Коннектикут, США, 2001-2010 гг. Внезапное заражение Dis . 2012 18 июня (6): 917-24. [Медлайн]. [Полный текст].
2012 18 июня (6): 917-24. [Медлайн]. [Полный текст].
Сурьядевара М., Моро М.Р., Розенбаум П.Ф., Киска Д., Ридделл С., Вайнер Л.Б. Заболеваемость инвазивной внебольничной инфекцией Staphylococcus aureus у детей в Центральном Нью-Йорке. J Педиатр .2010 янв. 156(1):152-154.e1. [Медлайн].
Landrum ML, Neumann C, Cook C, Chukwuma U, Ellis MW, Hospenthal DR. Эпидемиология инфекций, вызванных золотистым стафилококком, инфекций крови, кожи и мягких тканей в системе военного здравоохранения США, 2005-2010 гг. Staphylococcus aureus в вооруженных силах США. ЯМА . 4 июля 2012 г. 308 (1): 50-9. [Медлайн].
Сян М.С., Шиау Р., Надле Дж., Чан Л., Ли Б., Чемберс Х.Ф. и другие. Эпидемиологическое сходство метициллин-резистентного и метициллин-чувствительного золотистого стафилококка, связанного с педиатрическим сообществом, в районе залива Сан-Франциско. J Pediatr Infect Dis Soc . Сентябрь 2012 г. 1(3):200-211.
J Pediatr Infect Dis Soc . Сентябрь 2012 г. 1(3):200-211.
Рейес Дж., Ринкон С., Диас Л. и др. Распространение метициллин-резистентного штамма Staphylococcus aureus USA300 типа 8 в Латинской Америке. Клин Infect Dis . 2009 15 декабря. 49 (12): 1861-7. [Медлайн]. [Полный текст].
Саттер Д.Э., Милберн Э., Чуквума У., Дзялови Н., Маранич А.М., Хоспенталь Д.Р. Изменение восприимчивости к золотистому стафилококку в детской популяции США. Педиатрия . 2016 1 марта. [Medline].
Смит Дж., Согаард М., Шёнхейдер Х.К., Нильсен Х., Фрослев Т., Томсен Р.В. Диабет и риск внебольничной бактериемии, вызванной золотистым стафилококком: популяционное исследование случай-контроль. Евро J Эндокринол . 2016 10 марта. [Medline].
Саксена С., Томпсон П., Биргер Р., Бутылка А., Спиридис Н., Вонг И. Увеличение количества кожных инфекций и осложнений, вызванных золотистым стафилококком, у детей, Англия, 1997–2006 гг. Внезапное заражение Dis . 2010 16 марта (3): 530-533. [Медлайн].
Оттер JA, французский GL. Молекулярная эпидемиология внебольничного метициллин-резистентного золотистого стафилококка в Европе. Ланцет Infect Dis . 2010 апр.10(4):227-239. [Медлайн].
Lessa FC, Mu Y, Davies J, Murray M, Lillie M, Pearson A. Сравнение частоты заражения кровотока метициллин-резистентным золотистым стафилококком в Англии и США, 2006–2007 гг. Клин Infect Dis . 2010 15 октября. 51(8):925-8. [Медлайн].
Клин Infect Dis . 2010 15 октября. 51(8):925-8. [Медлайн].
Голдинг Г.Р., Леветт П.Н., Макдональд Р.Р., Ирвин Дж., Куинн Б., Нсунгу М. Высокий уровень инфекции Staphylococcus aureus USA400, Северная Канада. Внезапное заражение Dis . 17 апреля 2011 г. (4): 722-5. [Медлайн].
Голдинг Г.Р., Леветт П.Н., Макдональд Р.Р., Ирвин Дж., Нсунгу М., Вудс С. и др. Сравнение факторов риска, связанных с внебольничными метициллин-резистентными и чувствительными к метициллину инфекциями золотистого стафилококка в отдаленных населенных пунктах. Эпидемиол Инфекция . 2010 май. 138(5):730-7. [Медлайн].
Kim J, Ferrato C, Golding GR, Mulvey MR, Simmonds KA, Svenson LW, et al.Изменение эпидемиологии метициллин-резистентного золотистого стафилококка в Альберте, Канада: эпиднадзор за населением, 2005–2008 гг. Эпидемиол Инфекция . 2010 21 сентября. 1-10. [Медлайн].
Эпидемиол Инфекция . 2010 21 сентября. 1-10. [Медлайн].
Матлоу А., Форги С., Пелюд Л., Эмбри Дж., Гравель Д., Лэнгли Дж. М. и др. Национальный эпиднадзор за метициллин-резистентным золотистым стафилококком среди педиатрических пациентов, госпитализированных в отделения неотложной помощи Канады, 1995-2007 гг. Pediatr Infect Dis J . 2012 г. 31 августа (8): 814-20.[Медлайн].
Алесана-Слейтер Дж., Ричи С.Р., Хеффернан Х., Кэмп Т., Ричардсон А., Хербисон П. Метициллин-резистентный золотистый стафилококк, Самоа, 2007–2008 гг. Внезапное заражение Dis . 2011 17 июня (6): 1023-9. [Медлайн].
Судзуки М., Ямада К., Нагао М., Аоки Э., Мацумото М., Хираяма Т. и др. Противомикробные мази и метициллин-резистентный золотистый стафилококк USA300. Внезапное заражение Dis . 2011 17 (10): 1917-20 октября. [Медлайн].
[Медлайн].
Тонг С.Ю., Бишоп Э.Дж., Лиллибридж Р.А. и др. Связанные с населением штаммы метициллин-резистентного Staphylococcus aureus и метициллин-чувствительного S. aureus в коренной Северной Австралии: эпидемиология и исходы. J Заразить Dis . 2009 15 мая. 199(10):1461-70. [Медлайн].
Салменлинна С., Лиитикайнен О., Вайнио А., Мюллиниеми А.Л., Рауло С., Канерва М. и др. Человеческие случаи метициллин-резистентного золотистого стафилококка CC398, Финляндия. Внезапное заражение Dis . 2010 16 октября (10): 1626-9. [Медлайн].
Tappe D, Schulze MH, Oesterlein A, Turnwald D, Müller A, Vogel U, et al. Инфекции, вызванные лейкоцидином Пантона-Валентайна Staphylococcus aureus, у возвращающихся путешественников. Am J Trop Med Hyg . 2010 Октябрь 83 (4): 748-50. [Медлайн]. [Полный текст].
Чуа К., Лоран Ф., Кумбс Г., Грейсон М.Л., Хауден Б.П. Не внебольничный метициллин-резистентный золотистый стафилококк (CA-MRSA)! Руководство для клиницистов по MRSA в сообществе — его развивающаяся устойчивость к противомикробным препаратам и значение для терапии. Клин Infect Dis . 2011 янв. 52(1):99-114. [Медлайн].
Nickerson EK, Wuthiekanun V, Kumar V, Amornchai P, Wongdeethai N, Chheng K. Возникновение внебольничного носительства метициллин-резистентного золотистого стафилококка у детей в Камбодже. Am J Trop Med Hyg . 2011 фев. 84(2):313-7. [Медлайн].
Hamdan-Partida A, Sainz-Espuñes T, Bustos-Martínez J. Характеристика и устойчивость штаммов Staphylococcus aureus, выделенных из передних носовых ходов и глотки здоровых носителей в мексиканском сообществе. Дж Клин Микробиол . 2010 май. 48(5):1701-5. [Медлайн].
2010 май. 48(5):1701-5. [Медлайн].
Muttaiyah S, Coombs G, Pandey S, Reed P, Ritchie S, Lennon D, et al. Заболеваемость, факторы риска и исходы лейкоцидин-положительных по Пантону-Валентайну метициллин-чувствительных инфекций золотистого стафилококка в Окленде, Новая Зеландия. Дж Клин Микробиол . 2010 Октябрь 48 (10): 3470-4. [Медлайн]. [Полный текст].
Адлер А., Гивон-Лави Н., Мозес А.Е., Блок С, Даган Р. Носительство внебольничного метициллин-резистентного золотистого стафилококка в когорте младенцев на юге Израиля: факторы риска и молекулярные особенности. Дж Клин Микробиол . 2010 фев. 48 (2): 531-8. [Медлайн]. [Полный текст].
Васька В.Л., Гримвуд К., Голе Г.А., Ниммо Г.Р., Патерсон Д.Л., Ниссен М.Д. Внебольничный метициллин-резистентный золотистый стафилококк, вызывающий орбитальный целлюлит у австралийских детей. Pediatr Infect Dis J . 2011 30 ноября (11): 1003-1006. [Медлайн].
Pediatr Infect Dis J . 2011 30 ноября (11): 1003-1006. [Медлайн].
Марра Ф., Патрик Д.М., Чонг М., Маккей Р., Хоанг Л., Боуи В.Р. Популяционное исследование увеличения частоты инфекций кожи и мягких тканей и связанного с этим применения противомикробных препаратов. Антимикробные агенты Chemother . 2012 Декабрь 56 (12): 6243-9. [Медлайн]. [Полный текст].
Jenkins TC, Sabel AL, Sarcone EE, Price CS, Mehler PS, Burman WJ. Инфекции кожи и мягких тканей, требующие госпитализации в академический медицинский центр: возможности управления противомикробными препаратами. Клин Infect Dis . 2010 15 октября. 51(8):895-903. [Медлайн].
Spellberg B. Инфекции кожи и мягких тканей: современная эволюция древней проблемы. Клин Infect Dis . 2010 15 октября. 51 (8): 904-6. [Медлайн]. [Полный текст].
[Полный текст].
Каррильо-Маркес М.А., Халтен К.Г., Хаммерман В., Ламберт Л., Мейсон Э.О., Каплан С.Л. Staphylococcus aureus Pneumonia у детей в эпоху внебольничной устойчивости к метициллину в Техасской детской больнице. Pediatr Infect Dis J . 2011 г. 30 июля (7): 545-50. [Медлайн].
Вандер Хав К.Л., Кармазин Б., Верма М., Кэрд М.С., Хенсингер Р.Н., Фарли Ф.А.Внебольничный метициллин-резистентный золотистый стафилококк при острой скелетно-мышечной инфекции у детей: переломный момент. J Pediatr Orthop . 2009 г. 29 декабря (8): 927-31. [Медлайн].
Fretzayas A, Moustaki M, Tsagris V, Brozou T, Nicolaidou P. MRSA пузырчатый дистальный дактилит и обзор зарегистрированных случаев. Педиатр Дерматол . 2011 июль-авг. 28(4):433-5. [Медлайн].
Каррильо-Маркес М.А., Халтен К.Г., Мейсон Э.О., Каплан С.Л. Клиническая и молекулярная эпидемиология катетер-ассоциированной бактериемии Staphylococcus aureus у детей. Pediatr Infect Dis J . 2010 май. 29(5):410-4. [Медлайн].
Джейкобсон Дж.А., Касворм Э., Дейли Дж.А. Риск развития синдрома токсического шока, связанного с токсином синдрома токсического шока 1 после негенитальной стафилококковой инфекции. Rev Infect Dis . 1989 январь-февраль. 11 Приложение 1:S8-13. [Медлайн].
Джон К.С., Нирманн М., Шарон Б., Петерсон М.Л., Кранц Д. М., Шливерт П.М. Стафилококковая эритродермия при синдроме токсического шока связана с суперантигенностью и гиперчувствительностью. Клин Infect Dis . 2009 15 декабря. 49 (12): 1893-6. [Медлайн]. [Полный текст].
М., Шливерт П.М. Стафилококковая эритродермия при синдроме токсического шока связана с суперантигенностью и гиперчувствительностью. Клин Infect Dis . 2009 15 декабря. 49 (12): 1893-6. [Медлайн]. [Полный текст].
Рамирес-Шремпп Д., Дорфман Д.Х., Бейкер В.Е., Литепло А.С. Ультразвуковые аппликации мягких тканей в педиатрическом отделении неотложной помощи: дренировать или не дренировать? Детская неотложная помощь . 2009 25 января (1): 44-8. [Медлайн].
Сивиц А.Б., Лам С.Х., Рамирез-Шремпп Д., Валенте Д.Х., Нагдев А.Д. Влияние прикроватного ультразвука на лечение инфекций мягких тканей у детей. J Emerg Med . 2010 ноябрь 39 (5): 637-43. [Медлайн].
Кори ГР. Бактериемия золотистого стафилококка и эндокардит: роль диагностической оценки. Infect Dis Clin Pract . 2011/09. 19(5):307-312.
19(5):307-312.
Kaasch AJ, Fowler VG Jr, Rieg S, Peyerl-Hoffmann G, Birkholz H, Hellmich M, et al.Использование набора простых критериев для проведения эхокардиографии при нозокомиальной бактериемии, вызванной золотистым стафилококком. Клин Infect Dis . 2011 1 июля. 53 (1): 1–9. [Медлайн]. [Полный текст].
Soriano A, Mensa J. Является ли чреспищеводная эхокардиография необязательным при внутрибольничной бактериемии, вызванной золотистым стафилококком? Клин Infect Dis . 2011 1 июля. 53 (1): 10-2. [Медлайн].
Шоулер А., Берри Л., Бай А.Д., Стейнберг М., Риччиуто Д.Р., Фернандес Т. и другие.Использование трансторакальной эхокардиографии в лечении бактериемии Staphylococcus aureus низкого риска: результаты ретроспективного многоцентрового когортного исследования. JACC Cardiovasc Imaging . 8 июля 2015 г. [Medline].
8 июля 2015 г. [Medline].
Boggs W. Трансторакальная эхокардиография, достаточная для исключения инфекционного эндокардита. http://www.medscape.com/viewarticle/848780. Доступно на http://www.medscape.com/viewarticle/848780. 30 июля 2015 г.; Доступ: 7 августа 2015 г.
Патель Уайли Ф., Каплан С.Л., Мейсон Э.О., Аллен Ч.Игольная аспирация для этиологической диагностики целлюлита у детей в эпоху внебольничного метициллинрезистентного золотистого стафилококка. Clin Pediatr (Фила) . 2011 июнь 50 (6): 503-7. [Медлайн].
Thwaites GE, Scarborough M, Szubert A,. Дополнительный рифампицин при бактериемии, вызванной золотистым стафилококком (ARREST): многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое исследование. Ланцет . 2018 17 февраля. 391 (10121): 668-678. [Медлайн].
Дуонг М., Марквелл С., Питер Дж., Баренкамп С. Рандомизированное контролируемое исследование антибиотиков при лечении внебольничных абсцессов кожи у детей. Энн Эмерг Мед . 2010 май. 55(5):401-7. [Медлайн].
Lee MC, Rios AM, Aten MF, Mejias A, Cavuoti D, McCracken GH Jr, et al. Ведение и исходы у детей с абсцессами кожи и мягких тканей, вызванными внебольничным метициллинрезистентным золотистым стафилококком. Pediatr Infect Dis J . 2004 г. 23 февраля (2): 123-7. [Медлайн].
Rajendran PM, Young D, Maurer T, Chambers H, Perdreau-Remington F, Ro P. Рандомизированное двойное слепое плацебо-контролируемое исследование цефалексина для лечения неосложненных кожных абсцессов у населения с риском внебольничного метициллина -резистентная инфекция золотистого стафилококка. Антимикробные агенты Chemother . 2007 ноябрь 51 (11): 4044-8. [Медлайн].
2007 ноябрь 51 (11): 4044-8. [Медлайн].
Руэ Дж.Дж., Смит Н., Брэдшер Р.В., Менон А.Инфекции кожи и мягких тканей, вызванные резистентным к метициллину золотистым стафилококком внебольничного происхождения: влияние антимикробной терапии на исход. Клин Infect Dis . 2007 15 марта. 44(6):777-84. [Медлайн].
Карчмер AW. Бактериемия золотистого стафилококка и эндокардит нативного клапана: роль антимикробной терапии. Infect Dis Clin Pract . март 2012 г. 20(2):100-108.
Чен А.Э., Кэрролл К.С., Динер-Уэст М., Росс Т., Ордун Дж., Гольдштейн М.А. и др.Рандомизированное контролируемое исследование цефалексина по сравнению с клиндамицином при неосложненных инфекциях кожи у детей. Педиатрия . 2011 март 127(3):e573-80. [Медлайн].
Келлер DM. Схема Staph aureus сокращает хирургическую инфекцию.Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/833457. Доступ: 19 октября 2014 г.
Schweizer M, et al. Многоцентровое вмешательство для снижения инфекций в области хирургического вмешательства у пациентов, перенесших операции на сердце и тотальное эндопротезирование суставов (STOP SSI STUDY). Документ представлен на IDWeek; 8-12 октября 2014 г.; Филадельфия, Пенсильвания. [Полный текст].
Смит Дж., Лопес-Кортес Л.Е., Томсен Р.В., Шёнхейдер Х.К., Нильсен Х., Фрослев Т. и др. Использование статинов и риск внебольничной бактериемии золотистого стафилококка: популяционное исследование случай-контроль. Mayo Clin Proc . 2017 Октябрь 92 (10): 1469-1478. [Медлайн].
Использование статинов и риск внебольничной бактериемии золотистого стафилококка: популяционное исследование случай-контроль. Mayo Clin Proc . 2017 Октябрь 92 (10): 1469-1478. [Медлайн].
Брукс М. Статины могут помочь защититься от бактериемии S. aureus. Медскейп Новости. Доступно на https://www.medscape.com/viewarticle/887676#vp_1. 26 октября 2017 г.; Доступ: 1 ноября 2017 г.
Нейлор, доктор медицинских наук, Собел, доктор медицинских наук. Антибиотики для грамположительных бактериальных инфекций: ванкомицин, тейкопланин, хинупристин/дальфопристин, оксазолидиноны, даптомицин, далбаванцин и телаванцин. Infect Dis Clin N Am . декабрь 2009 г. 23(4):965-82.
Thwaites GE, Edgeworth JD, Gkrania-Klotsas E, Kirby A, Tilley R, Török ME. Клиническое лечение бактериемии золотистого стафилококка. Ланцет Infect Dis . 2011 11 марта (3): 208-222. [Медлайн].
Ланцет Infect Dis . 2011 11 марта (3): 208-222. [Медлайн].
Weisman LE, Thackray HM, Steinhorn RH, Walsh WF, Lassiter HA, Dhanireddy R, et al. Рандомизированное исследование моноклональных антител (пагибаксимаб) для профилактики стафилококкового сепсиса. Педиатрия . 2011 авг. 128(2):271-9. [Медлайн].
Хименес-Труке Н., Томсен И., Сэй Э., Крич CB. Следует ли назначать более высокие минимальные уровни ванкомицина при инвазивных внебольничных метициллин-резистентных инфекциях Staphylococcus aureus у детей? Pediatr Infect Dis J . 2010 29 апреля (4): 368-70. [Медлайн].
Агуадо Х.М., Сан-Хуан Р., Лалуэса А., Санс Ф., Родригес-Отеро Х., Гомес-Гонсалес С. и др. Высокая МИК ванкомицина и осложненная бактериемия, вызванная метициллин-чувствительным золотистым стафилококком. Внезапное заражение Dis . 2011 17 июня (6): 1099-102. [Медлайн].
2011 17 июня (6): 1099-102. [Медлайн].
Любин А.С., Снидман Д.Р., Рутазер Р., Биде П., Голан Ю. Прогнозирование высокой минимальной ингибирующей концентрации ванкомицина при инфекциях кровотока, устойчивых к метициллину Staphylococcus aureus. Клин Infect Dis . 2011 15 апреля. 52(8):997-1002. [Медлайн].
Куллар Р., Дэвис С.Л., Левин Д.П., Рыбак М.Дж. Влияние воздействия ванкомицина на исходы у пациентов с метициллин-резистентной бактериемией Staphylococcus aureus: поддержка согласованных рекомендаций, предлагаемых целей. Клин Infect Dis . 2011 15 апреля. 52(8):975-81. [Медлайн].
Патель Н., Пай М.П., Родволд К.А., Ломаэстро Б., Друсано Г.Л., Лодисе Т.П. Ванкомицин: отсюда нам туда не добраться. Клин Infect Dis . 2011 15 апреля. 52(8):969-74. [Медлайн].
Дерезински С. Метициллин-резистентный золотистый стафилококк и ванкомицин: значение минимальной ингибирующей концентрации. Клин Infect Dis . 2012 март 54 (6): 772-4. [Медлайн].
Вундеринк Р.Г., Нидерман М.С., Коллеф М.Х., Шорр А.Ф., Кункель М.Дж., Барух А. и др. Линезолид при лечении метициллин-резистентного золотистого стафилококка внутрибольничной пневмонии: рандомизированное контролируемое исследование. Клин Infect Dis . 2012 март 54 (5): 621-9. [Медлайн].
Ramirez P, Fernández-Barat L, Torres A. Новые варианты терапии MRSA с респираторной инфекцией/пневмонией. Curr Opin Infect Dis . 2012 г. 25 апреля (2): 159–65. [Медлайн].
Curr Opin Infect Dis . 2012 г. 25 апреля (2): 159–65. [Медлайн].
Morales G, Picazo JJ, Baos E, Candel FJ, Arribi A, Pelaez B. Устойчивость к линезолиду опосредована геном cfr в первом сообщении о вспышке устойчивого к линезолиду Staphylococcus aureus. Клин Infect Dis . 2010 15 марта. 50(6):821-5. [Медлайн].
Санчес Гарсия М., Де ла Торре М.А., Моралес Г. и др. Клиническая вспышка резистентного к линезолиду золотистого стафилококка в отделении интенсивной терапии. ЯМА . 2010 9 июня. 303(22):2260-4. [Медлайн].
Prokocimer P, De Anda C, Fang E, Mehra P, Das A. Тедизолид фосфат по сравнению с линезолидом для лечения острых бактериальных инфекций кожи и кожных структур: рандомизированное исследование ESTABLISH-1. ЯМА . 2013 13 февраля. 309(6):559-69. [Медлайн].
Прокоцимер П., Де Анда С., Фанг Э., Мехра П., Дас А.Сравнение тедизолида фосфата и линезолида при лечении острых бактериальных инфекций кожи и кожных покровов: рандомизированное исследование ESTABLISH-1. ЯМА . 2013 13 февраля. 309(6):559-69. [Медлайн].
Moran GJ, Fang E, Corey GR, Das AF, De Anda C, Prokocimer P. Тедизолид в течение 6 дней по сравнению с линезолидом в течение 10 дней при острых бактериальных инфекциях кожи и кожных структур (ESTABLISH-2): рандомизированное, двойное слепое, фаза 3, исследование не меньшей эффективности. Ланцет Infect Dis .2014 5 июня. [Medline].
Ланцет Infect Dis .2014 5 июня. [Medline].
Lowes, R. Новый антибиотик тедизолид (Sivextro), одобренный FDA. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/827168. Доступ: 26 июня 2014 г.
Сараволац Л.Д., Штейн Г.Э., Джонсон Л.Б. Телаванцин: новый липогликопептид. Клин Infect Dis . 2009 15 декабря. 49(12):1908-14. [Медлайн].
Brooks M. FDA одобрило оритаванцин (Orbactiv) для лечения кожных инфекций. Медицинские новости Medscape . 7 августа 2014 г. [Полный текст].
Меллеринг Р.С., младший, Ферраро М.Дж. Оритаванцин для лечения серьезных грамположительных инфекций. Клин Infect Dis . 15 апреля 2012 г. 54 (Приложение 3): S201-S243.
Сараволац Л.Д., Штейн Г.Э., Джонсон Л.Б. Цефтаролин: новый цефалоспорин с активностью против метициллин-резистентного золотистого стафилококка. Клин Infect Dis . 2011 май. 52(9):1156-63. [Медлайн].
Десны JG. Цефтаролин фосамил: цефалоспорин широкого спектра действия с активностью метициллин-резистентного золотистого стафилококка. Infect Dis Clin Pract .март 2012 г. 20(2):122-130.
Фаррелл Д.Дж., Кастанейра М., Мендес Р. Э., Садер Х.С., Джонс Р.Н. Активность цефтаролина in vitro в отношении штаммов Staphylococcus aureus и Streptococcus pneumoniae с множественной лекарственной устойчивостью: обзор опубликованных исследований и программа наблюдения AWARE (2008–2010). Клин Infect Dis . 2012 Сентябрь 55 Дополнение 3:S206-14. [Медлайн].
Э., Садер Х.С., Джонс Р.Н. Активность цефтаролина in vitro в отношении штаммов Staphylococcus aureus и Streptococcus pneumoniae с множественной лекарственной устойчивостью: обзор опубликованных исследований и программа наблюдения AWARE (2008–2010). Клин Infect Dis . 2012 Сентябрь 55 Дополнение 3:S206-14. [Медлайн].
Сэдер Х.С., Фламм Р.К., Фаррелл Д.Дж., Джонс Р.Н. Анализы активности стафилококковых изолятов у детей, взрослых и пожилых пациентов: программа наблюдения за цефтаролином AWARE. Клин Infect Dis . 2012 Сентябрь 55 Дополнение 3:S181-6. [Медлайн].
Джонс Р.Н., Мендес Р.Е., Садер Х.С., Кастанхейра М. Антимикробные результаты in vitro для фузидовой кислоты, протестированные против современных (2008–2009 гг.) грамположительных организмов, собранных в Соединенных Штатах. Клин Infect Dis . 52 июня 2011 г. Приложение 7: S477-86. [Медлайн].
Крафт Дж. К., Мориарти С. Р., Кларк К., Скотт Д., Дегенхардт Т. П., Стилл Дж. Г. Рандомизированное двойное слепое исследование фазы 2, сравнивающее эффективность и безопасность перорального режима нагрузочной дозы фузидиевой кислоты с пероральным линезолидом для лечения острых бактериальных инфекций кожи и кожных структур. Клин Infect Dis . 52 июня 2011 г. Дополнение 7:S520-6. [Медлайн].
Фернандес П., Перейра Д. Усилия по поддержке разработки фузидиевой кислоты в США. Клин Infect Dis . 52 июня 2011 г. Дополнение 7: S542-6. [Медлайн].
Ли А.С., Маседо-Винас М., Франсуа П., Ренци Г., Шренцель Дж., Верназ Н. Влияние комбинированной устойчивости низкого уровня мупироцина и генотипической устойчивости к хлоргексидину на персистирующее носительство метициллин-резистентного золотистого стафилококка после деколонизирующей терапии: исследование случай-контроль . Клин Infect Dis . 2011 15 июня. 52(12):1422-30. [Медлайн].
Клин Infect Dis . 2011 15 июня. 52(12):1422-30. [Медлайн].
Джейн Р., Кралович С.М., Эванс М.Е. и др. Инициатива по делам ветеранов по предотвращению инфекций, вызванных устойчивым к метициллину золотистым стафилококком. N Английский J Med . 2011 14 апреля. 364(15):1419-30. [Медлайн].
Robotham JV, Graves N, Cookson BD, Barnett AG, Wilson JA, Edgeworth JD. Стратегии скрининга, изоляции и деколонизации в борьбе с устойчивым к метициллину золотистым стафилококком в отделениях интенсивной терапии: оценка экономической эффективности. БМЖ . 2011. 343:d5694. [Медлайн].
Симор АЭ. Стафилококковая деколонизация: эффективная стратегия профилактики инфекции? Ланцет Infect Dis . 2011 Декабрь 11 (12): 952-62. [Медлайн].
Миллер Л.Г. Что мы можем сказать нашим пациентам? Клин Infect Dis . 2012 март 54 (6): 752-4. [Медлайн].
Kling J. ПЦР-скрининг снижает внутрибольничную инфекцию. Медицинские новости Medscape . 14 мая 2013 г. [Полный текст].
Milstone AM, Goldner BW, Ross T, Shepard JW, Carroll KC, Perl TM.Колонизация метициллин-резистентного золотистого стафилококка и риск последующей инфекции у детей в критическом состоянии: важность профилактики нозокомиальной передачи метициллин-резистентного золотистого стафилококка. Клин Infect Dis . 2011 ноябрь 53 (9): 853-9. [Медлайн]. [Полный текст].
Клин Infect Dis . 2011 ноябрь 53 (9): 853-9. [Медлайн]. [Полный текст].
Хуанг С.С., Септимус Э., Клейнман К., Муди Дж., Хикок Дж., Эйвери Т.Р. и др. Целенаправленная и универсальная деколонизация для предотвращения заражения в отделении интенсивной терапии. N Английский J Med . 2013 29 мая.[Медлайн].
Эдмон МБ, Венцель Р.П. Скрининг стационарных пациентов на MRSA — дело закрыто. N Английский J Med . 2013 29 мая. [Медлайн].
Laidman J. MRSA: всеобщая деколонизация превосходит скрининг и изоляцию. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/805005. Доступ: 11 июня 2013 г.
Шеной Э.С., Ким Дж., Розенберг Э.С., Коттер Дж.А., Ли Х., Валенский Р.П. и др. Прекращение контактных мер предосторожности для метициллин-резистентного золотистого стафилококка: рандомизированное контролируемое исследование, сравнивающее пассивный и активный скрининг с посевом и полимеразной цепной реакцией. Клин Infect Dis . 2013 г., июль 57 (2): 176–84. [Медлайн]. [Полный текст].
Клин Infect Dis . 2013 г., июль 57 (2): 176–84. [Медлайн]. [Полный текст].
Лин Ю.С., Петерсон М.Л. Новые взгляды на профилактику стафилококковых инфекций и синдрома токсического шока. Expert Rev Clin Pharmacol . 2010. 3:753-767.
Худа Т., Наир Х., Теодорату Э., Згага Л., Фаттом А., Эль Арифин С. и др. Оценка новых вакцин и иммунотерапии против стафилококковой пневмонии у детей. BMC Общественное здравоохранение .2011 13 апр. 11 Приложение 3:S27. [Медлайн]. [Полный текст].
Даум Р.С., Спеллберг Б. Прогресс в разработке вакцины против золотистого стафилококка. Клин Infect Dis . 2012 фев. 54 (4): 560-7. [Медлайн].
Theilacker C, Kropec A, Hammer F, Sava I, Wobser D, Sakinc T. Защита от Staphylococcus aureus с помощью антител к полиглицеролфосфатной основе гетерологичной липотейхоевой кислоты. J Заразить Dis . 2012 г., апрель 205(7):1076-85.[Медлайн].
J Заразить Dis . 2012 г., апрель 205(7):1076-85.[Медлайн].
Проктор Р.А. Проблемы универсальной вакцины против золотистого стафилококка. Клин Infect Dis . 2012 апр. 54(8):1179-86. [Медлайн].
Андерсон А.С., Скалли И.Л., Тимофеева Ю., Мерфи Э., Макнил Л.К., Мининни Т. и др. Марганцевый транспортный белок Staphylococcus aureus C представляет собой высококонсервативный белок клеточной поверхности, который вызывает защитный иммунитет против S. aureus и Staphylococcus epidermidis. J Заразить Dis .2012 июнь 205(11):1688-96. [Медлайн]. [Полный текст].
Fritz SA, Tiemann KM, Hogan PG, Epplin EK, Rodriguez M, Al-Zubeidi DN, et al. Серологический коррелят защитного иммунитета против внебольничной инфекции Staphylococcus aureus. Клин Infect Dis . 2013 июнь 56 (11): 1554-61. [Медлайн]. [Полный текст].
[Медлайн]. [Полный текст].
McNeil JC, Hulten KG, Kaplan SL, Mahoney DH, Mason EO. Инфекции Staphylococcus aureus у пациентов детской онкологии: высокие показатели устойчивости к противомикробным препаратам, толерантность к антисептикам и осложнения. Pediatr Infect Dis J . 2013 г. 32 февраля (2): 124-8. [Медлайн].
Крил А.М., Дарем С.Х., Беннер К.В., Альтен Дж.А., Винклер М.К. Тяжелая инвазивная внебольничная метициллин-резистентная инфекция Staphylococcus aureus у ранее здоровых детей. Pediatr Crit Care Med . 2009 май. 10(3):323-7. [Медлайн].
Vergnano S, Menson E, Smith Z, Kennea N, Embleton N, Clarke P. Характеристики инвазивного золотистого стафилококка в неонатальных отделениях Соединенного Королевства. Pediatr Infect Dis J . 2011 30 октября (10): 850-4. [Медлайн].
Генрих Н., Мюллер А., Бартманн П., Саймон А., Бирбаум Г., Энгельхарт С. Успешное лечение вспышки MRSA в отделении интенсивной терапии новорожденных. Eur J Clin Microbiol Infect Dis . 2011 г. 30 июля (7): 909-13. [Медлайн].
Вудлиф Р.С., Марковиц Дж.Е. Нераспознанная инвазивная инфекция у новорожденного, колонизированного метициллинрезистентным золотистым стафилококком. J Педиатр . 2009 г., декабрь 155(6):943-943.e1. [Медлайн].
Арора П., Калра В.К., Паппас А. Множественные абсцессы головного мозга у новорожденного после заражения кровотока метициллин-резистентным золотистым стафилококком. J Педиатр .2012 сен. 161(3):563-563.e1. [Медлайн].
J Педиатр .2012 сен. 161(3):563-563.e1. [Медлайн].
Niemann S, Ehrhardt C, Medina E, Warnking K, Tuchscherr L, Heitmann V, et al. Комбинированное действие вируса гриппа и пантон-валентинового лейкоцидина Staphylococcus aureus провоцирует выраженное поражение легочного эпителия. J Заразить Dis . 2012 1 октября. 206(7):1138-48. [Медлайн]. [Полный текст].
Faden H, Gill S, Lesse A. Влияние лечения и бактериальной геномики на исходы бактериемии Staphylococcus aureus у детей. Clin Pediatr (Фила) . 2011 17 июня. [Medline].
Мейер Н., Вест Х., Шёнхейдер Х.К., Дженсен А.Г., Ларсен А.Р., Сков Р. и др. Стабильная заболеваемость и постоянное улучшение краткосрочной смертности от бактериемии Staphylococcus aureus в период с 1995 по 2008 год. BMC Infect Dis . 2012 17 окт. 12:260. [Медлайн]. [Полный текст].
[Медлайн]. [Полный текст].
Сенгупта А., Рэнд С., Perl TM, Milstone AM. Знания, осведомленность и отношение к метициллинорезистентному золотистому стафилококку среди лиц, осуществляющих уход за госпитализированными детьми. J Педиатр . 2011 март 158 (3): 416-21. [Медлайн].
Возникновение устойчивости к метициллину предшествует клиническому использованию антибиотиков
Davies, J. & Davies, D. Происхождение и эволюция устойчивости к антибиотикам. Микробиолог. Мол. биол. 74 , 417–433 (2010).
КАС пабмед ПабМед Центральный Google Scholar
Европейский центр профилактики и контроля заболеваний, Европейские агентства по лекарственным средствам. Бактериальный вызов: время реагировать. Призыв сократить разрыв между бактериями с множественной лекарственной устойчивостью в ЕС и разработкой новых антибактериальных агентов 2009).
Jevons, M. P. «Целбенин» — устойчивые стафилококки. руб. Мед. J. 1 , 124–125 (1961).
Центральный пабмед Google Scholar
Harkins, C.P. et al. Метициллин-резистентный Staphylococcus aureus появился задолго до внедрения метициллина в клиническую практику. Геном Биол. 18 , 130 (2017).
ПабМед ПабМед Центральный Google Scholar
Chambers, H. F. & DeLeo, F. R. Волны резистентности: Staphylococcus aureus в эпоху антибиотиков. Нац. Преподобный Микробиолог. 7 , 629–641 (2009).
КАС пабмед ПабМед Центральный Google Scholar
Прайс, Л.Б. и др. Staphylococcus aureus CC398: адаптация хозяина и появление резистентности к метициллину у домашнего скота. mBio 3 , e00305-11 (2012).
ПабМед ПабМед Центральный Google Scholar
Глобальный приоритетный список устойчивых к антибиотикам бактерий для руководства исследованиями, открытием и разработкой новых антибиотиков http://www.who.int/medicines/publications/WHO-PPL-Short_Summary_25Feb-ET_NM_WHO.pdf?ua=1 (ВОЗ, 2017).
Rasmussen, S.L. et al. Европейские ежи ( Erinaceus europaeus ) как естественный резервуар метициллин-резистентного Staphylococcus aureus , несущего mecC в Дании. PLoS ONE 14 , e0222031 (2019).
КАС пабмед ПабМед Центральный Google Scholar
Бенгтссон, Б. и др. Высокая распространенность mecC -MRSA у диких ежей ( Erinaceus europaeus ) в Швеции. Вет. микробиол. 207 , 103–107 (2017).
ПабМед Google Scholar

Гарсия-Альварес, Л. и др. Метициллин-резистентный Staphylococcus aureus с новым гомологом mecA в популяциях человека и крупного рогатого скота в Великобритании и Дании: описательное исследование. Ланцет Заражение. Дис. 11 , 595–603 (2011).
ПабМед ПабМед Центральный Google Scholar
Патерсон, Г. К., Харрисон, Э. М. и Холмс, М. А. Появление mecC , устойчивого к метициллину Staphylococcus aureus . Тенденции микробиол. 22 , 42–47 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Марплс, М.Дж. и Смит, Дж.М.Б. Еж как источник стригущего лишая человека. Природа 188 , 867–868 (1960).
ОБЪЯВЛЕНИЯ КАС пабмед Google Scholar
English, M.P., Evans, C.D., Hewitt, M. & Warin, R. P. «Стригущий лишай ежа». руб. Мед. J. 1 , 149–151 (1962).
P. «Стригущий лишай ежа». руб. Мед. J. 1 , 149–151 (1962).
КАС пабмед ПабМед Центральный Google Scholar
Смит, Дж. М. Б. и Марплс, М. Дж. Естественный резервуар устойчивых к пенициллину штаммов Staphylococcus aureus . Природа 201 , 844 (1964).
ОБЪЯВЛЕНИЯ КАС пабмед Google Scholar
Smith, J. M. B. & Marples, M. J. Дерматофитные поражения у ежа как резервуар устойчивых к пенициллину стафилококков. Дж. Хиг. 63 , 293–303 (1965).
КАС пабмед ПабМед Центральный Google Scholar
Smith, JMB Штаммы Staphylococcus aureus , ассоциированные с ежом Erinaceus europaeus . Дж. Хиг. Камб . 63 , 293–303 (1965).
КАС пабмед ПабМед Центральный Google Scholar

Morris, P. & English, M. P. Trichophyton mentagrophytes var. erinacei у британских ежей. Сабураудиа 7 , 122–128 (1969).
КАС пабмед Google Scholar
Ле Барзик, К. и др. Выявление и борьба с дерматофитозом у диких европейских ежей (Erinaceus europaeus), госпитализированных во французский центр реабилитации диких животных. J. Fungi 7 , 74 (2021).
Google Scholar
Дубе, Ф., Седерлунд, Р., Саломонссон, М.Л., Труэль, К. и Берьессон, С.Бензилпенициллин-продуцирующий Trichophyton erinacei и устойчивый к метициллину Staphylococcus aureus , несущий ген mecC , на европейских ежах: экспериментальное исследование. ВМС микробиол. 21 , 212 (2021).
КАС пабмед ПабМед Центральный Google Scholar

Хьюитт Г. Генетическое наследие четвертичных ледниковых периодов. Природа 405 , 907–913 (2000).
ОБЪЯВЛЕНИЯ КАС пабмед Google Scholar
Броки, Р. Э. Распространение и численность ежа ( Erinaceus europaeus ) L. в Новой Зеландии, 1869–1973 гг. NZ J. Zool. 2 , 445–462 (1975).
Google Scholar
van den Berg, M.A. et al. Секвенирование и анализ генома мицелиального гриба Penicillium chrysogenum . Нац. Биотехнолог. 26 , 1161–1168 (2008).
КАС пабмед Google Scholar
Ullán, R. V., Campoy, S., Casqueiro, J., Fernández, F. J. & Martin, J. F. Производство деацетилцефалоспорина C в Penicillium chrysogenum путем экспрессии генов эпимеризации изопенициллина N, расширения кольца и ацетилирования Хим. биол. 14 , 329–339 (2007).
биол. 14 , 329–339 (2007).
ПабМед Google Scholar
Китано, К. и др. Новый пенициллин, продуцируемый штаммами рода Paecilomyces. Дж. Фермент. Технол. 54 , 705–711 (1976).
КАС Google Scholar
Petersen, A. et al. Эпидемиология метициллин-резистентного Staphylococcus aureus , несущего новый ген mecC в Дании, подтверждает зоонозный резервуар с передачей человеку. клин. микробиол. Заразить. 19 , E16–E22 (2013).
КАС пабмед Google Scholar
Richardson, E.J. et al. Обмен генами способствует экологическому успеху бактериального патогена с несколькими хозяевами. Нац. Экол. Эвол. 2 , 1468–1478 (2018).
ПабМед ПабМед Центральный Google Scholar

Holden, M.T.G. et al. Геномный портрет возникновения, эволюции и глобального распространения пандемии метициллин-резистентного штамма Staphylococcus aureus . Рез. генома. 23 , 653–664 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Straus, L. et al. Происхождение, эволюция и глобальная передача внебольничного Staphylococcus aureus ST8. Проц. Натл акад. науч. США 114 , E10596–E10604 (2017).
ПабМед ПабМед Центральный Google Scholar
Nübel, U. et al. Частое появление и ограниченное географическое распространение метициллин-резистентного Staphylococcus aureus . Проц. Натл акад. науч. США 105 , 14130–14135 (2008 г.).
ОБЪЯВЛЕНИЯ пабмед ПабМед Центральный Google Scholar
Расмуссен С. Л., Нильсен Дж.Л., Джонс О.Р., Берг Т.Б. и Пертольди С. Генетическая структура европейского ежа ( Erinaceus europaeus ) в Дании. PLoS ONE 15 , e0227205 (2020).
Л., Нильсен Дж.Л., Джонс О.Р., Берг Т.Б. и Пертольди С. Генетическая структура европейского ежа ( Erinaceus europaeus ) в Дании. PLoS ONE 15 , e0227205 (2020).
КАС пабмед ПабМед Центральный Google Scholar
Hansen, J.E. et al. LA-MRSA CC398 на молочных фермах и фермах по разведению телят указывает на распространение от свиноводства. Перед. микробиол. 10 , 2733 (2019).
ПабМед ПабМед Центральный Google Scholar
Эрикссон Дж.Espinosa-Gongora, C., Stamphøj, I., Larsen, A.R. & Guardabassi, L. Частота носительства, разнообразие и устойчивость к метициллину у датских мелких жвачных животных. Вет. микробиол. 163 , 110–115 (2013).
КАС пабмед Google Scholar
Датская комплексная программа исследований и мониторинга устойчивости к противомикробным препаратам. DANMAP 2019: Использование противомикробных агентов и возникновение устойчивости к противомикробным препаратам у бактерий из продуктов питания животных, продуктов питания и людей в ДАНИИ https://www.danmap.org/-/media/Sites/danmap/Downloads/Reports/2019/DANMAP_2019.ashx?la=da&hash=AA1939EB449203EF0684440AC1477FFCE2156BA5 (2020).
DANMAP 2019: Использование противомикробных агентов и возникновение устойчивости к противомикробным препаратам у бактерий из продуктов питания животных, продуктов питания и людей в ДАНИИ https://www.danmap.org/-/media/Sites/danmap/Downloads/Reports/2019/DANMAP_2019.ashx?la=da&hash=AA1939EB449203EF0684440AC1477FFCE2156BA5 (2020).
Управление ветеринарных препаратов. Ветеринарная устойчивость к антибиотикам и отчет о надзоре за продажами в Великобритании https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/6/UK-VARSS_2019_Report__2020-TPaccessible.pdf (2020).
Harrison, E. M. et al. Полногеномное секвенирование идентифицирует зоонозную передачу изолятов MRSA с помощью нового гомолога mecA mecC . EMBO Мол. Мед. 5 , 509–515 (2013).
КАС пабмед ПабМед Центральный Google Scholar

Loncaric, I. et al. Характеристика mecC , несущего ген коагулазонегативного Staphylococcus spp. выделены от различных животных. Вет. микробиол. 230 , 138–144 (2019).
КАС пабмед Google Scholar
Гомес П. и др. Обнаружение MRSA ST3061-t843- mecC и ST398-t011- mecA у птенцов белого аиста, контактировавших с человеческими остатками. Дж. Антимикроб. Чемотер. 71 , 53–57 (2016).
ПабМед Google Scholar
Kim, C. et al. Свойства нового гомолога белка PBP2A из штамма LGA251 Staphylococcus aureus и его вклад в фенотип устойчивости к β-лактамам. Дж. Биол. хим. 287 , 36854–36863 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Tahlan, K. & Jensen, S.E. Происхождение β-лактамных колец в натуральных продуктах. Дж. Антибиот. 66 , 401–419 (2013).
Дж. Антибиот. 66 , 401–419 (2013).
КАС Google Scholar
Pantůček, R. et al. Staphylococcus edaphicus sp.ноябрь выделенный в Антарктиде, содержит ген mecC и геномные островки с предполагаемой ролью в адаптации к экстремальным условиям окружающей среды. Заяв. Окружающая среда. микробиол. 84 , e01746-17 (2018).
ПабМед ПабМед Центральный Google Scholar
Д’Коста, В. М., и др. Устойчивость к антибиотикам возникла давно. Природа 477 , 457–461 (2011).
ОБЪЯВЛЕНИЯ пабмед Google Scholar
Allen, H.K., Moe, L.A., Rodbumrer, J., Gaarder, A. & Handelsman, J. Функциональная метагеномика выявляет разнообразные бета-лактамазы в отдаленной почве Аляски. ISME J. 3 , 243–251 (2009).
КАС Google Scholar

Forsberg, K.J. et al. Общий антибиотический резистом почвенных бактерий и патогенов человека. Наука 337 , 1107–1111 (2012).
ОБЪЯВЛЕНИЯ КАС пабмед ПабМед Центральный Google Scholar
Forsberg, K.J. et al. Бактериальная филогения структурирует почвенные резистомы в разных средах обитания. Природа 509 , 612–616 (2014).
ОБЪЯВЛЕНИЯ КАС пабмед ПабМед Центральный Google Scholar
Coll, F. et al. Определение порога генетического родства для исключения недавней передачи метициллин-резистентного Staphylococcus aureus : геномный эпидемиологический анализ. Lancet Microbe 1 , e328–e335 (2020 г.).
КАС пабмед ПабМед Центральный Google Scholar
Банкевич А. и др. SPAdes: новый алгоритм сборки генома и его применение для секвенирования отдельных клеток. Дж. Вычисл. биол. 19 , 455–477 (2012).
Дж. Вычисл. биол. 19 , 455–477 (2012).
MathSciNet КАС пабмед ПабМед Центральный Google Scholar
Enright, M.C., Day, N.P., Davies, C.E., Peacock, SJ, Spratt, BG. Многолокусное типирование последовательности для характеристики устойчивых к метициллину и восприимчивых к метициллину клонов Staphylococcus aureus . Дж. Клин. микробиол. 38 , 1008–1015 (2000).
КАС пабмед ПабМед Центральный Google Scholar
Van Wamel, WJ, Rooijakkers, SH, Ruyken, M. van Kessel, KP & Strijp, JA Врожденные иммуномодуляторы, стафилококковый ингибитор комплемента и белок, ингибирующий хемотаксис Staphylococcus aureus , расположены на бета-гемолизина- конвертирующие бактериофаги. J. Бактериол. 188 , 1310–1315 (2006).
ПабМед ПабМед Центральный Google Scholar
Виана, Д. и др. Адаптация Staphylococcus aureus к жвачным и лошадиным хозяевам включала переносимые SaPI варианты белка, связывающего фактор фон Виллебранда. Мол. Микробиол . 77 , 1583–1594 (2010).
Rooijakkers, S.H.M. et al. Стафилококковый ингибитор комплемента: структура и активные центры. Дж. Иммунол. 179 , 2989–2998 (2007 г.).
КАС пабмед Google Scholar
Arndt, D. et al. PHASTER: улучшенная и более быстрая версия инструмента поиска фагов PHAST. Рез. нуклеиновых кислот. 44 , W16–W21 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Бортолая В. и др. ресфиндер 4.0 для прогнозов фенотипов по генотипам. Дж. Антимикроб. Чемотер. 75 , 3491–3500 (2020).
КАС пабмед ПабМед Центральный Google Scholar

Clausen, P.T.L.C., Aarestrup, F.M. & Lund, O. Быстрое и точное сопоставление необработанных чтений с избыточной базой данных с помощью KMA. БМС Биоинформ. 19 , 397 (2018).
Google Scholar
Sahl, J.W. et al. NASP: точный и быстрый метод идентификации SNP в наборах данных WGS, который поддерживает гибкие форматы ввода и вывода. Микроб. Геном. 2 , e000074 (2016).
ПабМед ПабМед Центральный Google Scholar
Li, H. & Durbin, R. Быстрое и точное выравнивание коротких считываний с преобразованием Барроу-Уилера. Биоинформатика 25 , 1754–1760 (2009).
КАС пабмед ПабМед Центральный Google Scholar
McKenna, A. et al. Набор инструментов для анализа генома: платформа MapReduce для анализа данных секвенирования ДНК нового поколения. Рез. генома. 20 , 1297–1303 (2010).
Рез. генома. 20 , 1297–1303 (2010).
КАС пабмед ПабМед Центральный Google Scholar
DePristo, M.A. et al. Основа для обнаружения вариаций и генотипирования с использованием данных секвенирования нового поколения. Нац. Жене. 43 , 491–498 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Делчер А. Л., Филлиппи А., Карлтон Дж. и Зальцберг С. Л. Быстрые алгоритмы крупномасштабного выравнивания и сравнения геномов. Рез. нуклеиновых кислот. 30 , 2478–2483 (2002).
ПабМед ПабМед Центральный Google Scholar
Курц, С. и др. Универсальное и открытое программное обеспечение для сравнения больших геномов. Геном Биол. 5 , R12 (2004).
Google Scholar
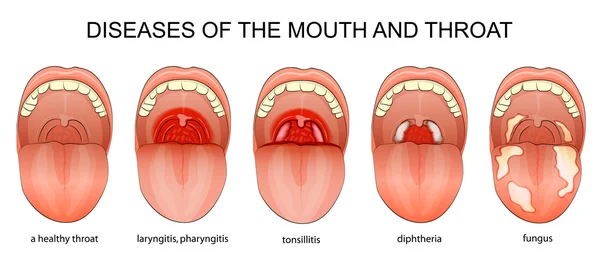
Guindon, S. & Gasquel, O. Простой, быстрый и точный алгоритм для оценки больших филогений по максимальному правдоподобию. Сист. биол. 52 , 696–704 (2003).
ПабМед Google Scholar
Guindon, S. et al. Новые алгоритмы и методы для оценки филогений максимального правдоподобия: оценка производительности PhyML 3.0. Сист. биол. 59 , 307–321 (2010).
КАС Google Scholar
Didelot, X. & Wilson, D.J. ClonalFrameML: эффективное определение рекомбинации во всем бактериальном геноме. PLoS вычисл. биол. 11 , e1004041 (2015).
ОБЪЯВЛЕНИЯ пабмед ПабМед Центральный Google Scholar
Didelot, X. et al. Байесовский вывод дат предков на бактериальных филогенетических деревьях. Рез. нуклеиновых кислот. 46 , e134 (2018).
ПабМед ПабМед Центральный Google Scholar
Диделот X., Сиверони И. и Волц Э. М. Аддитивные некоррелированные модели расслабленных часов для датирования геномных эпидемиологических филогений. Мол. биол. Эвол. 38 , 307–317 (2021).
КАС пабмед Google Scholar
Пламмер, М., Бест, Н., Коулз, К. и Вайнс, К. CODA: диагностика конвергенции и анализ результатов для MCMC. R News 6 , 7–11 (2006).
Google Scholar
Volz, E.M. & Frost, S.D. Масштабируемое филогенетическое датирование расслабленных часов. Эволюция вируса. 3 , vex025 (2017).
Google Scholar
Ван, М.и другие. Обмен данными масс-спектрометрии и курирование их сообществом с помощью социальной молекулярной сети Global Natural Products. Нац. Биотехнолог. 34 , 828–837 (2016).
Нац. Биотехнолог. 34 , 828–837 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Адусумилли, Р. и Маллик, П. Преобразование данных с помощью ProteoWizard msConvert. Методы Мол. биол. 1550 , 339–368 (2017).
КАС пабмед Google Scholar
| Распечатать эту страницу
|
Метициллин-резистентный золотистый стафилококк | Nature Reviews Disease Primers
Wertheim, H.Ф. и др. Роль назального носительства в инфекциях Staphylococcus aureus . Ланцет Заражение. Дис. 5 , 751–762 (2005).
ПабМед Google Scholar
Becker, K. et al. Staphylococcus aureus из общей популяции Германии весьма разнообразен. Междунар. Дж. Мед. микробиол. 307 , 21–27 (2017).
КАС пабмед Google Scholar
Кюнерт, М.Дж. и др. Распространенность назальной колонизации Staphylococcus aureus в США, 2001–2002 гг. Дж. Заразить. Дис. 193 , 172–179 (2006).
Дж. Заразить. Дис. 193 , 172–179 (2006).
КАС пабмед Google Scholar
Lowy, F.D. Staphylococcus aureus инфекции. N. Engi J. Med. 339 , 520–532 (1998).
КАС Google Scholar
Джевонс, М.Целбенин-резистентные стафилококки. BMJ 1 , 124–125 (1961).
Google Scholar
Дзинтарс, К. в Kucers’ The Use of Antibiotics (под редакцией Grayson, M. et al.) 136–142 (CRC Press, 2018).
Google Scholar
Chambers, H. F. & Deleo, F. R. Волны резистентности: Staphylococcus aureus в эпоху антибиотиков. Нац. Преподобный Микробиолог. 7 , 629–641 (2009). Это подробный обзор клинической и молекулярной эпидемиологии S. aureus , , включая MRSA, с акцентом на CA-MRSA.
КАС пабмед ПабМед Центральный Google Scholar
Faoagali, J.L., Thong, M.L. & Grant, D. Десятилетний опыт лечения метициллин-резистентного штамма Staphylococcus aureus в крупной австралийской больнице. Дж. Хосп. Заразить. 20 , 113–119 (1992).
КАС пабмед Google Scholar
Фридкин С.К. и др. Метициллин-резистентный штамм Staphylococcus aureus в трех сообществах. Н. англ. Дж. Мед. 352 , 1436–1444 (2005).
КАС пабмед Google Scholar
Восс А., Лоффен Ф., Баккер Дж., Klaassen, C. & Wulf, M. Устойчивый к метициллину Staphylococcus aureus в свиноводстве. Аварийный. Заразить. Дис. 11 , 1965–1966 (2005).
ПабМед ПабМед Центральный Google Scholar
Tenover, F. C. et al. Интерпретация рестрикционных паттернов хромосомной ДНК, полученных с помощью гель-электрофореза в пульсирующем поле: критерии типирования бактериальных штаммов. Дж. Клин. микробиол. 33 , 2233–2239 (1995).
C. et al. Интерпретация рестрикционных паттернов хромосомной ДНК, полученных с помощью гель-электрофореза в пульсирующем поле: критерии типирования бактериальных штаммов. Дж. Клин. микробиол. 33 , 2233–2239 (1995).
КАС пабмед ПабМед Центральный Google Scholar
Ито, Т., Катаяма, Ю. и Хирамацу, К. Клонирование и определение нуклеотидной последовательности всей ДНК mec пре-метициллин-резистентного штамма Staphylococcus aureus N315. Антимикроб. Агенты Chemother 43 , 1449–1458 (1999).
КАС пабмед ПабМед Центральный Google Scholar
Харкинс, К.П. и др. Метициллин-резистентный Staphylococcus aureus появился задолго до внедрения метициллина в клиническую практику. Геном Биол. 18 , 130 (2017).
ПабМед ПабМед Центральный Google Scholar
Diekema, D. J. et al. Обзор инфекций, вызванных видами Staphylococcus: частота встречаемости и чувствительность к противомикробным препаратам изолятов, собранных в США, Канаде, Латинской Америке, Европе и регионе Западной части Тихого океана для программы SENTRY Antimicrobial Surveillance Program, 1997–1999 гг. клин. Заразить. Дис. 32 (Приложение 2), S114–S132 (2001).
J. et al. Обзор инфекций, вызванных видами Staphylococcus: частота встречаемости и чувствительность к противомикробным препаратам изолятов, собранных в США, Канаде, Латинской Америке, Европе и регионе Западной части Тихого океана для программы SENTRY Antimicrobial Surveillance Program, 1997–1999 гг. клин. Заразить. Дис. 32 (Приложение 2), S114–S132 (2001).
КАС пабмед Google Scholar
Enright, M.C., Day, N.P., Davies, C.E., Peacock, S.J. & Spratt, B.G. Многолокусное типирование последовательности для характеристики метициллин-устойчивых и метициллин-чувствительных клонов Staphylococcus aureus. Дж. Клин. микробиол. 38 , 1008–1015 (2000).
КАС пабмед ПабМед Центральный Google Scholar
Монеке С.и другие. Полевое руководство по пандемическим, эпидемическим и спорадическим клонам метициллин-резистентного золотистого стафилококка. PLoS ONE 6 , e17936 (2011 г.).
PLoS ONE 6 , e17936 (2011 г.).
КАС пабмед ПабМед Центральный Google Scholar
[Авторы не указаны.] Европейская сеть по надзору за устойчивостью к противомикробным препаратам (EARS-Net). Европейский центр профилактики и контроля заболеваний http://ecdc.europa.eu/en/activities/surveillance/EARS-Net/Pages/index.aspx (2018).
Кок, Р. и др. Метициллин-резистентный штамм Staphylococcus aureus (MRSA): бремя болезни и проблемы борьбы с ней в Европе. Евронаблюдение 15 , 19688 (2010).
КАС пабмед Google Scholar
Nielsen, K.L. et al. Стоимость фитнеса: бактериологическое объяснение прекращения первой международной эпидемии устойчивых к метициллину Staphylococcus aureus . Дж. Антимикроб. Чемотер. 67 , 1325–1332 (2012).
КАС пабмед Google Scholar
Ролен, Дж. М., Абат, К., Бруки, П. и Рауль, Д. Снижение метициллин-резистентного золотистого стафилококка во всем мире: мы что-то понимаем? клин. микробиол. Заразить. 21 , 515–517 (2015).
ПабМед Google Scholar
Гарсия-Альварес, Л., Доусон С., Куксон Б. и Хоуки П. Работа в ветеринарии и здравоохранении. Дж. Антимикроб. Чемотер. 67 (Прил. 1), Н37–Н49 (2012).
Google Scholar
ван Ален, С. и др. В центре эпидемии: пятнадцать лет LA-MRSA CC398 в Университетской больнице Мюнстера. Вет. микробиол. 200 , 19–24 (2017).
КАС пабмед Google Scholar
Лосано, К.и другие. Высокая распространенность спа-типов, связанных с клональной линией CC398, среди устойчивых к тетрациклину метициллин-устойчивых штаммов Staphylococcus aureus в испанской больнице. Дж. Антимикроб. Чемотер. 67 , 330–334 (2012).
КАС пабмед Google Scholar
van Cleef, B. A. et al. Связанный с домашним скотом метициллин-резистентный Staphylococcus aureus у людей, Европа. Аварийный. Заразить. Дис. 17 , 502–505 (2011).
ПабМед ПабМед Центральный Google Scholar
Ларсен, Дж. и др. Метициллин-резистентный Staphylococcus aureus CC398 является растущей причиной заболевания у людей, не контактирующих с домашним скотом в Дании, с 1999 по 2011 год.
Google Scholar
Хетем Д.J., Bootsma, M.C., Troelstra, A. & Bonten, MJ. Трансмиссивность метициллин-резистентного Staphylococcus aureus, связанного с домашним скотом. Эмердж. Заразить. Дис. 19 , 1797–1802 (2013).
ПабМед Google Scholar
Styers, D., Sheehan, D. J., Hogan, P. & Sahm, D. F. Лабораторный надзор за текущими моделями и тенденциями устойчивости к противомикробным препаратам среди Staphylococcus aureus: статус 2005 года в Соединенных Штатах. Энн. клин. микробиол. Антимикроб. 5 , 2 (2006).
ПабМед ПабМед Центральный Google Scholar
Талан, Д. А. и др. Сравнение Staphylococcus aureus при инфекциях кожи и мягких тканей у пациентов отделений неотложной помощи США, 2004 и 2008 гг. Clin. Заразить. Дис. 53 , 144–149 (2011).
ПабМед Google Scholar
Моран Г.Дж. и др. Метициллин-резистентные инфекции S. aureus среди пациентов отделения неотложной помощи. Н. англ. Дж. Мед. 355 , 666–674 (2006).
КАС пабмед Google Scholar
Seybold, U. et al. Появление внебольничного метициллин-резистентного генотипа Staphylococcus aureus USA300 как основной причины инфекций кровотока, связанных с оказанием медицинской помощи. клин.Заразить. Дис. 42 , 647–656 (2006).
КАС пабмед Google Scholar
Попович, К. Дж., Вайнштейн, Р. А. и Хота, Б. Являются ли внебольничные устойчивые к метициллину штаммы Staphylococcus aureus (MRSA) заменой традиционных внутрибольничных штаммов MRSA? клин. Заразить. Дис. 46 , 787–794 (2008).
ПабМед Google Scholar
Планета, п.Дж. и др. Параллельные эпидемии внебольничной метициллин-резистентной инфекции Staphylococcus aureus USA300 в Северной и Южной Америке. Дж. Заразить. Дис. 212 , 1874–1882 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Von Dach, E. et al. Сравнительная геномика метициллин-резистентного Staphylococcus aureus , ассоциированного с сообществом, показывает появление клона ST8-USA300 в Женеве, Швейцария. Дж. Заразить. Дис. 213 , 1370–1379 (2016).
КАС пабмед Google Scholar
Дантес, Р. и др. Национальное бремя инвазивных метициллин-резистентных инфекций Staphylococcus aureus , США, 2011 г. JAMA Intern. Мед. 173 , 1970–1978 (2013).
ПабМед Google Scholar
Джейн Р.и другие. Инициатива по делам ветеранов по предотвращению метициллин-резистентных инфекций Staphylococcus aureus . Н. англ. Дж. Мед. 364 , 1419–1430 (2011).
КАС пабмед Google Scholar
Lee, G.M. et al. Влияние неуплаты за предотвратимые инфекции в больницах США. Н. англ. Дж. Мед. 367 , 1428–1437 (2012).
КАС пабмед Google Scholar
Чен, К.J. & Huang, YC. Новая эпидемиология инфекции Staphylococcus aureus в Азии. клин. микробиол. Заразить. 20 , 605–623 (2014).
КАС пабмед Google Scholar
Mendes, R. E. et al. Результаты региональной программы наблюдения за устойчивостью для 12 стран Азиатско-Тихоокеанского региона (2011 г.). Антимикроб. Агенты Чемотер. 57 , 5721–5726 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Лай, К.C., Lin, S.H., Sheng, WH & Hsueh, P.R. Снижение заболеваемости внутрибольничными инфекциями кровотока, устойчивыми к метициллину Staphylococcus aureus , на Тайване. Междунар. Дж. Антимикроб. Агенты 41 , 591–592 (2013).
КАС пабмед ПабМед Центральный Google Scholar
[Авторы не указаны.] Австралийская группа по устойчивости к противомикробным препаратам (AGAR). Группа АГАР http://www.agargroup.org.au/ (2018).
Митчелл, Б. Г., Коллинон, П. Дж., Макканн, Р., Уилкинсон, И. Дж. и Уэллс, А. Значительное снижение госпитальной Staphylococcus aureus бактериемии в Австралии — 12 лет прогресса: обсервационное исследование. клин. Заразить. Дис. 59 , 969–975 (2014).
ПабМед Google Scholar
Уильямсон Д. А., Кумбс Г. В. и Ниммо Г. Р. Staphylococcus aureus «Внизу»: современная эпидемиология S. aureus в Австралии, Новой Зеландии и юго-западной части Тихого океана. клин. микробиол. Заразить. 20 , 597–604 (2014).
КАС пабмед Google Scholar
Falagas, M.E., Karageorgopoulos, D.E., Leptidis, J. & Korbila, I.P. MRSA в Африке: заполнение глобальной карты устойчивости к противомикробным препаратам. PLoS ONE 8 , e68024 (2013 г.).
ПабМед ПабМед Центральный Google Scholar
Бринк А., Мулман Дж., да Силва М.С., Бота М. и Национальный форум по надзору за антибиотиками. Профиль чувствительности к противомикробным препаратам отдельных бактериальных патогенов из частных учреждений в Южной Африке. С. Афр. Мед. J. 97 , 273–279 (2007).
КАС Google Scholar
Янсен ван Ренсбург, М.J., Whitelaw, A.C. & Elisha, B.G. Генетическая основа устойчивости к рифампицину у метициллин-резистентного Staphylococcus aureus предполагает клональную экспансию в больницах Кейптауна, Южная Африка. ВМС микробиол. 12 , 46 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Зервоу, Ф. Н., Захариудакис, И. М., Зиакас, П. Д., Рич, Дж. Д. и Милонакис, Э. Распространенность и факторы риска метициллин-резистентной колонизации Staphylococcus aureus при ВИЧ-инфекции: метаанализ. клин. Заразить. Дис. 59 , 1302–1311 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Kluytmans, J., van Belkum, A. & Verbrugh, H. Назальное носительство Staphylococcus aureus: эпидемиология, основные механизмы и сопутствующие риски. клин. микробиол. 10 , 505–520 (1997). Это всесторонний обзор стафилококковой колонизации носа, включая ее клиническую значимость.
КАС пабмед ПабМед Центральный Google Scholar
Sim, B.L., McBryde, E., Street, A.C. & Marshall, C. Культуры для эпиднадзора в нескольких местах как предиктор метициллин-резистентных инфекций Staphylococcus aureus . Заразить. Хосп. Эпидемиол. 34 , 818–824 (2013).
ПабМед Google Scholar
Эриксен Н.H., Espersen, F., Rosdahl, V.T. & Jensen, K. Носительство Staphylococcus aureus среди 104 здоровых людей в течение 19-месячного периода. Эпидемиол. Заразить. 115 , 51–60 (1995).
КАС пабмед ПабМед Центральный Google Scholar
Hoffler, U., Bulanda, M., Heczko, P.B. & Pulverer, G. Сравнение частоты носителей стафилококков в Германии и Польше. Мед. микробиол.Иммунол. 164 , 285–290 (1978).
КАС пабмед Google Scholar
Эмонтс, М. и др. Полиморфизм хозяина в интерлейкине 4, факторе комплемента Н и С-реактивном белке связан с назальным носительством Staphylococcus aureus и возникновением фурункулов. Дж. Заразить. Дис. 197 , 1244–1253 (2008).
КАС пабмед Google Scholar
Люсет, Дж.С. и др. Носительство метициллин-резистентного Staphylococcus aureus в условиях домашнего ухода: распространенность, продолжительность и передача членам домохозяйства. Арх. Стажер Мед. 169 , 1372–1378 (2009).
ПабМед Google Scholar
Буриан М. и др. Временная экспрессия факторов адгезии и активности глобальных регуляторов при установлении носовой колонизации Staphylococcus aureus . Дж. Заразить. Дис. 201 , 1414–1421 (2010).
КАС пабмед Google Scholar
Weidenmaier, C. et al. Дифференциальные роли поверхностных белков, заякоренных в сортазе, и стеночной тейхоевой кислоты в колонизации носа Staphylococcus aureus . Междунар. Дж. Мед. микробиол. 298 , 505–513 (2008).
КАС пабмед Google Scholar
Вертхайм, Х.Ф. и др. Ключевая роль фактора слипания B в носовой колонизации человека Staphylococcus aureus . PLoS Мед. 5 , e17 (2008 г.).
ПабМед ПабМед Центральный Google Scholar
O’Brien, L.M., Walsh, E.J., Massey, R.C., Peacock, S.J. & Foster, T.J. Фактор слипания Staphylococcus aureus B (ClfB) способствует прилипанию к человеческому цитокератину I типа 10: значение для носовой колонизации. Сотовый. микробиол. 4 , 759–770 (2002).
ПабМед Google Scholar
Liu, C.M. et al. Staphylococcus aureus и экология назального микробиома. наук. Доп. 1 , e1400216 (2015).
ПабМед ПабМед Центральный Google Scholar
Лемон, К.П. и др. Сравнительный анализ бактериальной микробиоты ноздрей и ротоглотки человека. mBio 1 , e00129–10 (2010).
ПабМед ПабМед Центральный Google Scholar
Krismer, B. et al. Ограничение питательных веществ регулирует метаболизм Staphylococcus aureus и адаптацию ниши в носу человека. PLoS Патог. 10 , e1003862 (2014).
ПабМед ПабМед Центральный Google Scholar
Зипперер, А.и другие. Человеческие комменсалы, продуцирующие новый антибиотик, нарушают колонизацию патогенов. Природа 535 , 511–516 (2016).
КАС пабмед Google Scholar
Kaspar, U. et al. Культуром среды обитания человека выявляет индивидуальные образцы бактериальных отпечатков пальцев. Окружающая среда. микробиол. 18 , 2130–2142 (2016).
КАС пабмед Google Scholar
Крисмер Б., Weidenmaier, C., Zipperer, A. & Peschel, A. Комменсальный образ жизни Staphylococcus aureus и его взаимодействие с назальной микробиотой. Нац. Преподобный Микробиолог. 15 , 675–687 (2017). В этом обзоре подробно рассматривается сложное взаимодействие между S. aureus и другими организмами, которые являются частью микробиоты носа.
КАС пабмед Google Scholar
Бойл-Вавра, С.и другие. Клональные линии USA300 и USA500 Staphylococcus aureus не продуцируют капсульный полисахарид из-за консервативных мутаций в локусе cap5. mBio 6 , e02585–14 (2015).
ПабМед ПабМед Центральный Google Scholar
Spaan, A.N., van Strijp, J.A.G. & Torres, VJ. Лейкоцидины: стафилококковые двухкомпонентные порообразующие токсины находят свои рецепторы. Нац. преп.микробиол. 15 , 435–447 (2017). Это всесторонний обзор различных порообразующих белковых токсинов и родственных им рецепторов-хозяев.
КАС пабмед ПабМед Центральный Google Scholar
Лаабей, М. и др. Прогнозирование вирулентности MRSA по последовательности его генома. Рез. генома. 24 , 839–849 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Таммавонгса, В., Kim, HK, Missiakas, D. & Schneewind, O. Стафилококковые манипуляции с иммунными реакциями хозяина. Нац. Преподобный Микробиолог. 13 , 529–543 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Recker, M. et al. Клональные различия в смертности, связанной с бактериемией Staphylococcus aureus . Нац. микробиол. 2 , 1381–1388 (2017). В этом документе показано, насколько разные S.aureus использовали разные стратегии для преодоления реакции хозяина и вызывания тяжелой патологии.
КАС пабмед Google Scholar
Kluytmans, J. A. et al. Назальное носительство Staphylococcus aureus как основной фактор риска раневых инфекций после операций на сердце. Дж. Заразить. Дис. 171 , 216–219 (1995).
КАС пабмед Google Scholar
фон Эйфф, К., Becker, K., Machka, K., Stammer, H. & Peters, G. Назальное носительство как источник бактериемии Staphylococcus aureus . Н. англ. Дж. Мед. 344 , 11–16 (2001).
КАС пабмед Google Scholar
Фостер, Т.Дж., Геогеган, Дж.А., Ганеш, В.К. и Хук, М. Адгезия, инвазия и уклонение: многие функции поверхностных белков Staphylococcus aureus. Нац. Преподобный Микробиолог. 12 , 49–62 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Vanhommerig, E. et al. Сравнение образования биопленок между основными клональными линиями метициллин-резистентного золотистого стафилококка. PLoS ONE 9 , e104561 (2014).
ПабМед ПабМед Центральный Google Scholar
Спаан, А.N., Surewaard, B.G., Nijland, R. & van Strijp, J.A. Нейтрофилы против золотистого стафилококка: биологическое перетягивание каната. год. Преподобный Микробиолог. 67 , 629–650 (2013).
КАС пабмед Google Scholar
Hanzelmann, D. et al. Активация Toll-подобного рецептора 2 зависит от выделения липопептидов бактериальными поверхностно-активными веществами. Нац. коммун. 7 , 12304 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Ченг А.G., DeDent, AC, Schneewind, O. & Missiakas, D. Пьеса в четырех действиях: Staphylococcus aureus образование абсцесса. Тенденции микробиол. 19 , 225–232 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Laarman, A., Milder, F., van Strijp, J. & Rooijakkers, S. Ингибирование комплемента грамположительными патогенами: молекулярные механизмы и терапевтические последствия. Дж.Мол. Мед. 88 , 115–120 (2010).
КАС пабмед ПабМед Центральный Google Scholar
Stapels, D. A. et al. Staphylococcus aureus секретирует уникальный класс нейтрофильных ингибиторов сериновой протеазы. Проц. Натл акад. науч. США 111 , 13187–13192 (2014).
КАС пабмед Google Scholar
Пешель А.и Сахл, Х. Г. Коэволюция катионных антимикробных пептидов хозяина и резистентность микробов. Нац. Преподобный Микробиолог. 4 , 529–536 (2006).
КАС пабмед Google Scholar
Лоффлер, Б. и др. Staphylococcus aureus лейкоцидин пантона-валентина является очень мощным цитотоксическим фактором для нейтрофилов человека. PLoS Патог. 6 , e1000715 (2010 г.).
ПабМед ПабМед Центральный Google Scholar
Сполдинг А.Р. и др. Стафилококковые и стрептококковые суперантигенные экзотоксины. клин. микробиол. 26 , 422–447 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Chavakis, T., Wiechmann, K., Preissner, KT & Herrmann, M. Staphylococcus aureus взаимодействие с эндотелием: роль бактериальных «секретируемых адгезивных молекул с расширенным репертуаром» (SERAM) в нарушении защиты хозяина системы. Тромб. Гемост. 94 , 278–285 (2005).
КАС пабмед Google Scholar
Weidenmaier, C. et al. Отсутствие стеночных тейхоевых кислот у Staphylococcus aureus приводит к уменьшению взаимодействия с эндотелиальными клетками и ослаблению вирулентности в модели эндокардита у кроликов. Дж. Заразить. Дис. 191 , 1771–1777 (2005 г.).
КАС пабмед Google Scholar
Лоффлер, Б., Tuchscherr, L., Niemann, S. & Peters, G. Staphylococcus aureus персистенция в непрофессиональных фагоцитах. Междунар. Дж. Мед. микробиол. 304 , 170–176 (2014).
ПабМед Google Scholar
Thomer, L., Schneewind, O. & Missiakas, D. Патогенез Staphylococcus aureus инфекций кровотока. год. Преподобный Патол. 11 , 343–364 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Ле, К.Y. & Otto, M. Регуляция восприятия кворума у стафилококков — обзор. Перед. микробиол. 6 , 1174 (2015).
ПабМед ПабМед Центральный Google Scholar
Cheung, G.Y., Wang, R., Khan, B.A., Sturdevant, D.E. & Otto, M. Роль регулятора дополнительного гена agr в патогенезе ассоциированного с сообществом метициллин-резистентного Staphylococcus aureus . Заразить. Иммун. 79 , 1927–1935 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Kaito, C. et al. Мобильный генетический элемент, кодируемый SCCmec, РНК psm-mec подавляет трансляцию agrA и ослабляет вирулентность MRSA. PLoS Патог. 9 , e1003269 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Пейнтер К.Л., Кришна А., Вигнешверарадж С.и Эдвардс, А. М. Какую роль система регуляторов вспомогательных генов, чувствительных к кворуму, играет во время бактериемии Staphylococcus aureus ? Тенденции микробиол. 22 , 676–685 (2014).
КАС пабмед Google Scholar
Crisostomo, M. I. et al. Эволюция устойчивости к метициллину у Staphylococcus aureus: сходство генетического фона у исторически ранних метициллин-чувствительных и устойчивых изолятов и современных эпидемических клонов. Проц. Натл акад. науч. США 98 , 9865–9870 (2001).
КАС пабмед Google Scholar
Международная рабочая группа по классификации элементов хромосомной кассеты стафилококков (IWG-SCC). Классификация стафилококковой кассетной хромосомы mec (SCCmec): рекомендации по сообщению о новых элементах SCCmec. Антимикроб. Агенты Чемотер. 53 , 4961–4967 (2009). В этом документе описываются основные типы SCCmec и номенклатура, которой необходимо следовать при наименовании новых типов SCC mec.
Google Scholar
Бал, А. М. и др. Геномный взгляд на появление и распространение международных клонов устойчивых к метициллину Staphylococcus aureus, связанных со здравоохранением, населением и домашним скотом: размытие традиционных определений. Дж. Глоб. Антимикроб. Сопротивление 6 , 95–101 (2016).
КАС пабмед Google Scholar
Хартман Б.J. & Tomasz, A. Белок, связывающий пенициллин с низким сродством, связанный с устойчивостью к бета-лактамам у Staphylococcus aureus. J. Бактериол. 158 , 513–516 (1984).
КАС пабмед ПабМед Центральный Google Scholar
Garcia-Alvarez, L. et al. Метициллин-резистентный штамм Staphylococcus aureus с новым гомологом mecA в популяциях человека и крупного рогатого скота в Великобритании и Дании: описательное исследование. Ланцет Заражение. Дис. 11 , 595–603 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Kim, C. et al. Свойства нового гомолога белка PBP2A из штамма LGA251 Staphylococcus aureus и его вклад в фенотип устойчивости к бета-лактамам. Дж. Биол. хим. 287 , 36854–36863 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Мильейрико, К., de Lencastre, H. & Tomasz, A. Полногеномное секвенирование идентифицирует в генетическом фоне несколько детерминант, которые модулируют фенотип устойчивости у устойчивых к метициллину штаммов Staphylococcus aureus , несущих новый ген mecC. Антимикроб. Агенты Чемотер. 61 , e02500–16 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Becker, K. et al. Кодируемая плазмидой переносимая mecB-опосредованная резистентность к метициллину у Staphylococcus aureus.Эмердж. Заразить. Дис. 24 , 242–248 (2018).
КАС пабмед Google Scholar
Hiramatsu, K., Asada, K., Suzuki, E., Okony, K. & Yokota, T. Молекулярное клонирование и определение последовательности нуклеотидов регуляторной области гена mecA у метициллин-резистентного Staphylococcus aureus (МРЗС). FEBПисьмо. 298 , 133–136 (1992).
КАС Google Scholar
Ареде, П., Milheirico, C., de Lencastre, H. & Oliveira, D.C. Антирепрессор MecR2 способствует протеолизу репрессора mecA и обеспечивает оптимальное выражение устойчивости к бета-лактамам у MRSA. PLoS Патог. 8 , e1002816 (2012 г.).
КАС пабмед ПабМед Центральный Google Scholar
Чжан, Х.З., Хакбарт, С.Дж., Чански, К.М. и ≈Чемберс, Х.Ф. Протеолитический трансмембранный сигнальный путь и устойчивость к бета-лактамам у стафилококков. Наука 291 , 1962–1965 (2001).
КАС пабмед Google Scholar
De Lencastre, H. et al. Устойчивость к антибиотикам как реакция на стресс: полное секвенирование большого количества хромосомных локусов в штамме COL Staphylococcus aureus , которые влияют на экспрессию устойчивости к метициллину. Микроб. Устойчивость к лекарствам 5 , 163–175 (1999).
ПабМед Google Scholar
Ким, К.и другие. Механизм гетерогенной резистентности к бета-лактамам при MRSA: ключевая роль жесткой реакции на стресс. PLoS ONE 8 , e82814 (2013 г.).
ПабМед ПабМед Центральный Google Scholar
Boyle-Vavra, S., Yin, S. & Daum, R. S. Двухкомпонентная регуляторная система VraS/VraR, необходимая для устойчивости к оксациллину у внебольничного устойчивого к метициллину Staphylococcus aureus. FEMS микробиол.лат. 262 , 163–171 (2006).
КАС пабмед Google Scholar
Jousselin, A. et al. Шаперон PrsA Staphylococcus aureus является новым вспомогательным фактором устойчивости к оксациллину, влияющим на пенициллин-связывающий белок 2А. Антимикроб. Агенты Chemother 60 , 1656–1666 (2015).
ПабМед Google Scholar
Ким, К.K., Milheirico, C., de Lencastre, H. & Tomasz, A. Устойчивость к антибиотикам как реакция на стресс: восстановление высокого уровня устойчивости к оксациллину у устойчивых к метициллину Staphylococcus aureus «Вспомогательных» (fem) мутантов путем индукции жесткая реакция на стресс. Антимикроб. Агенты Chemother 61 , e00313-17 (2017).
ПабМед ПабМед Центральный Google Scholar
Гардете С. и Томаш А.Механизмы устойчивости к ванкомицину у Staphylococcus aureus. Дж. Клин. Вкладывать деньги. 124 , 2836–2840 (2014). Это всесторонний обзор механизмов устойчивости к ванкомицину у S. aureus.
ПабМед Google Scholar
Клевенс, Р. М. и др. Инвазивная метициллин-резистентная инфекция Staphylococcus aureus в США. JAMA 298 , 1763–1771 (2007 г.).
КАС пабмед Google Scholar
Эпштейн Л. и др. Факторы риска инвазивной метициллин-резистентной инфекции Staphylococcus aureus после недавней выписки из отделения неотложной помощи, 2011–2013 гг. клин. Заразить. Дис. 62 , 45–52 (2016).
ПабМед Google Scholar
Дэвис, К. А., Стюарт, Дж.J., Crouch, H.K., Florez, C.E. & Hospenthal, D.R. Устойчивый к метициллину Staphylococcus aureus (MRSA) колонизация носа при поступлении в больницу и его влияние на последующую инфекцию MRSA. клин. Заразить. Дис. 39 , 776–782 (2004).
ПабМед Google Scholar
Francis, J.S. et al. Тяжелая внебольничная пневмония у здоровых взрослых, вызванная устойчивым к метициллину Staphylococcus aureus , несущим гены лейкоцидина Пантона-Валентайна. клин. Заразить. Дис. 40 , 100–107 (2005).
ПабМед Google Scholar
Miller, L.G. et al. Некротизирующий фасциит, вызванный внебольничным метициллин-резистентным Staphylococcus aureus в Лос-Анджелесе. Н. англ. Дж. Мед. 352 , 1445–1453 (2005).
КАС пабмед Google Scholar
Казакова С.В. и др. Клон метициллин-резистентного Staphylococcus aureus среди профессиональных футболистов. Н. англ. Дж. Мед. 352 , 468–475 (2005).
КАС пабмед Google Scholar
Айелло, А. Э., Лоуи, Ф. Д., Райт, Л. Н. и Ларсон, Э. Л. Метициллин-резистентный штамм Staphylococcus aureus среди заключенных и военнослужащих США: обзор и рекомендации для будущих исследований. Ланцет Заражение. Дис. 6 , 335–341 (2006).
ПабМед Google Scholar
Другка Э. и др. 12-летний обзор метициллин-резистентных инфекций Staphylococcus aureus в Греции: эпидемия ST80-IV? клин. микробиол. Заразить. 20 , O796–803 (2014).
КАС пабмед Google Scholar
Институт клинических и лабораторных стандартов. М100-С23. Стандарты эффективности для тестирования чувствительности к противомикробным препаратам; Двадцать третье информационное приложение (CLSI, 2013 г.).
Ryffel, C., Strassle, A., Kayser, F.H. & Berger-Bachi, B. Механизмы гетерорезистентности у метициллин-резистентного золотистого стафилококка. Антимикроб. Агенты Чемотер. 38 , 724–728 (1994).
КАС пабмед ПабМед Центральный Google Scholar
Пенн, К.и другие. Раневые инфекции, вызванные индуцируемыми метициллинорезистентными штаммами Staphylococcus aureus . Дж. Глоб. Антимикроб. Сопротивление 1 , 79–83 (2013).
ПабМед Google Scholar
Winstanley, T. & Courvalin, P. Экспертные системы в клинической микробиологии. клин. микробиол. 24 , 515–556 (2011). Этот справочник представляет собой хороший обзор автоматизированных систем для обнаружения механизмов резистентности с критическим обзором опубликованных оценок производительности каждой системы.
ПабМед ПабМед Центральный Google Scholar
Бхоумик, Т. и др. Контролируемая многоцентровая оценка основанного на бактериофагах метода экспресс-обнаружения Staphylococcus aureus в положительных культурах крови. Дж. Клин. микробиол. 51 , 1226–1230 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Опота О., Croxatto, A., Prod’hom, G. & Greub, G. Диагностика бактериемии на основе культуры крови: современное состояние. клин. микробиол. Заразить. 21 , 313–322 (2015).
КАС пабмед Google Scholar
Romero-Gomez, M.P., Cendejas-Bueno, E., Garcia Rodriguez, J. & Mingorance, J. Влияние быстрой диагностики Staphylococcus aureus бактериемии из положительных культур крови на ведение пациентов. евро. Дж. Клин. микробиол. Заразить. Дис. 36 , 2469–2473 (2017).
КАС пабмед Google Scholar
Малхотра-Кумар, С. и др. Современные тенденции экспресс-диагностики метициллин-резистентных Staphylococcus aureus и гликопептидрезистентных видов энтерококков. Дж. Клин. микробиол. 46 , 1577–1587 (2008).
ПабМед ПабМед Центральный Google Scholar
Малхотра-Кумар, С.и другие. Оценка молекулярных анализов для быстрого обнаружения метициллин-резистентного золотистого стафилококка. Дж. Клин. микробиол. 48 , 4598–4601 (2010).
Google Scholar
Блашке, А. Дж. и др. Быстрая идентификация патогенов из положительных культур крови с помощью мультиплексной полимеразной цепной реакции с использованием системы FilmArray. Диагност. микробиол. Заразить. Дис. 74 , 349–355 (2012).
КАС Google Scholar
Альмухаяви, М., Алтун, О., Стралин, К. и Озенчи, В. Идентификация микроорганизмов с помощью FilmArray и масс-спектрометрии с лазерной десорбцией с использованием матрицы и ионизацией и времяпролетной масс-спектрометрией до получения положительного результата в системе гемокультуры . Дж. Клин. микробиол. 52 , 3230–3236 (2014).
КАС пабмед ПабМед Центральный Google Scholar
Цао, М.Д. и др. Потоковые алгоритмы для идентификации патогенов и потенциала устойчивости к антибиотикам на основе секвенирования MinION™ в реальном времени. GigaScience 5 , 32 (2016).
ПабМед ПабМед Центральный Google Scholar
Ааненсен, Д. М. и др. Полногеномное секвенирование для рутинного эпиднадзора за патогенами в сфере общественного здравоохранения: снимок популяции инвазивного Staphylococcus aureus в Европе. mBio 7 , e00444-16 (2016).
ПабМед ПабМед Центральный Google Scholar
Koser, C.U. et al. Быстрое полногеномное секвенирование для расследования вспышки MRSA у новорожденных. Н. англ. Дж. Мед. 366 , 2267–2275 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Миллар, Э. В. и др. Геномная характеристика метициллин-резистентного штамма Staphylococcus aureus (MRSA) USA300 для оценки внутриклассовой передачи и рецидивов инфекции кожи и мягких тканей (ИКМТ) среди военнослужащих из группы высокого риска. клин. Заразить. Дис. 65 , 461–468 (2017).
ПабМед ПабМед Центральный Google Scholar
Мерлино, Дж., Леруа, М., Брэдбери, Р., Вил, Д. и Харбор, К. Новая хромогенная идентификация и обнаружение Staphylococcus aureus и метициллин-резистентного S. aureus . Дж. Клин. микробиол. 38 , 2378–2380 (2000).
КАС пабмед ПабМед Центральный Google Scholar
Перри, Дж.Д. А. Десятилетие развития хромогенных питательных сред для клинической микробиологии в эпоху молекулярной диагностики. клин. микробиол. 30 , 449–479 (2017). Tqhis — это всеобъемлющий справочник, в котором рассматриваются методы быстрого посева для обнаружения MRSA и других микроорганизмов с множественной лекарственной устойчивостью.
КАС пабмед ПабМед Центральный Google Scholar
Газин М. и др. Обнаружение метициллин-резистентного Staphylococcus aureus на основе посева сетью европейских лабораторий: исследование внешней оценки качества. евро. Дж. Клин. микробиол. Заразить. Дис. 31 , 1765–1770 (2012).
КАС пабмед Google Scholar
Luthje, P. et al. Идентификация микроорганизмов, выращенных на хромогенных средах, методом MALDI-TOF MS. J. Microbiol. Методы 136 , 17–20 (2017).
КАС пабмед Google Scholar
Фарон М.Л.и другие. Автоматизированный подсчет хромогенных сред для обнаружения метициллин-резистентного Staphylococcus aureus с использованием программного обеспечения для анализа изображений WASPLab. Дж. Клин. микробиол. 54 , 620–624 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Cunningham, R. et al. Влияние на передачу MRSA быстрого ПЦР-тестирования пациентов, поступивших в отделения интенсивной терапии. Дж. Хосп. Заразить. 65 , 24–28 (2007).
КАС пабмед Google Scholar
Derde, L. P. G. et al. Вмешательства по уменьшению колонизации и передачи устойчивых к противомикробным препаратам бактерий в отделениях интенсивной терапии: исследование прерывистых временных рядов и кластерное рандомизированное исследование. Ланцет Заражение. Дис. 14 , 31–39 (2014).
ПабМед ПабМед Центральный Google Scholar
Ву П.J., Jeyaratnam, D., Tosas, O., Cooper, B.S. & French, G.L. Универсальный скрининг по месту оказания медицинской помощи на устойчивый к метициллину Staphylococcus aureus: кластерно-рандомизированное перекрестное исследование. Дж. Хосп. Заразить. 95 , 245–252 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Calfee, D. P. et al. Стратегии по предотвращению передачи и инфекции устойчивых к метициллину штаммов Staphylococcus aureus в больницах неотложной помощи: обновление 2014 г. Заразить. Хосп. Эпидемиол. 35 , 772–796 (2014). Этот документ представляет собой экспертное руководство с оценкой качества доказательств по контролю MRSA в учреждениях неотложной помощи.
ПабМед Google Scholar
Всемирная организация здравоохранения. Руководство ВОЗ по гигиене рук в здравоохранении. Всемирный альянс за безопасность пациентов (WHO Press, Женева, 2009 г.).
Саксофон, Х.и другие. «Мои пять моментов по гигиене рук»: подход к дизайну, ориентированный на пользователя, чтобы понимать, обучать, контролировать и сообщать о гигиене рук. Дж. Хосп. Заразить. 67 , 9–21 (2007).
КАС пабмед Google Scholar
Питте, Д. и др. Эффективность общебольничной программы по улучшению соблюдения гигиены рук. Ланцет 356 , 1307–1312 (2000).
КАС пабмед Google Scholar
Стоун, С.П. и др. Оценка национальной кампании Cleanyourhands по снижению бактериемии Staphylococcus aureus и инфекции Clostridium difficile в больницах Англии и Уэльса за счет улучшения гигиены рук: четырехлетнее, проспективное, экологическое, прерывистое исследование временных рядов. БМЖ 344 , е3005 (2012).
ПабМед ПабМед Центральный Google Scholar
Salgado, C.D. & Farr, B.M. Какая доля пациентов больниц, колонизированных метициллин-резистентным штаммом Staphylococcus aureus , идентифицируется клиническими микробиологическими культурами? Заразить.Хосп. Эпидемиол. 27 , 116–121 (2006).
ПабМед Google Scholar
Robicsek, A. et al. Всеобщий эпиднадзор за метициллин-резистентным штаммом Staphylococcus aureus в 3 дочерних больницах. Энн. Стажер Мед. 148 , 409–418 (2008).
ПабМед Google Scholar
Harbarth, S. et al.Универсальный скрининг на метициллин-резистентный Staphylococcus aureus при поступлении в стационар и внутрибольничную инфекцию у хирургических больных. JAMA 299 , 1149–1157 (2008 г.).
КАС пабмед Google Scholar
Lee, A. S. et al. Сравнение стратегий по снижению показателей резистентности к метициллину Staphylococcus aureus у хирургических больных: контролируемое многоцентровое интервенционное исследование. BMJ Open 3 , e003126 (2013).
ПабМед ПабМед Центральный Google Scholar
Robotham, J.V. et al. Экономическая эффективность общенационального обязательного скрининга всех госпитализаций в больницы Национальной службы здравоохранения Англии на наличие метициллин-резистентного золотистого стафилококка: исследование математического моделирования. Ланцет Заражение. Дис. 16 , 348–356 (2016).
ПабМед Google Scholar
Хаскинс, В.С. и др. Вмешательство для снижения передачи резистентных бактерий в отделениях интенсивной терапии. Н. англ. Дж. Мед. 364 , 1407–1418 (2011).
ПабМед ПабМед Центральный Google Scholar
Derde, L. P. et al. Вмешательства по уменьшению колонизации и передачи устойчивых к противомикробным препаратам бактерий в отделениях интенсивной терапии: исследование прерывистых временных рядов и кластерное рандомизированное исследование. Ланцет Заражение.Дис. 14 , 31–39 (2014).
ПабМед ПабМед Центральный Google Scholar
Harris, A.D. et al. Универсальное использование перчаток и халатов и приобретение устойчивых к антибиотикам бактерий в отделении интенсивной терапии: рандомизированное исследование. JAMA 310 , 1571–1580 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Сепеда, Дж.А. и др. Изоляция пациентов в отдельных палатах или группах для снижения распространения MRSA в отделениях интенсивной терапии: проспективное двухцентровое исследование. Ланцет 365 , 295–304 (2005).
ПабМед Google Scholar
Fatkenheuer, G., Hirschel, B. & Harbarth, S. Скрининг и изоляция для борьбы с устойчивым к метициллину Staphylococcus aureus: смысл, бессмыслица и доказательства. Ланцет 385 , 1146–1149 (2015). В этом комментарии представлена обновленная информация о растущем количестве доказательств за и против роли активного эпиднадзора в борьбе с MRSA.
ПабМед Google Scholar
Леб, М., Мейн, К., Уокер-Дилкс, К. и Иди, А. Противомикробные препараты для лечения метициллин-резистентной колонии Staphylococcus aureus . Кокрановская система базы данных. Ред. 4 , CD003340 (2003 г.).
Google Scholar
Поовеликуннель, Т., Gethin, G. & Humphreys, H. Устойчивость к мупироцину: клинические последствия и потенциальные альтернативы ликвидации MRSA. Дж. Антимикроб. Чемотер. 70 , 2681–2692 (2015).
КАС пабмед Google Scholar
Landelle, C. et al. Рандомизированное плацебо-контролируемое двойное слепое клиническое исследование по оценке эффективности полигексанида для местной деколонизации носителей MRSA. Дж.Антимикроб. Чемотер. 71 , 531–538 (2016).
КАС пабмед Google Scholar
Bode, L.G. et al. Профилактика инфекций в области хирургического вмешательства у назальных носителей Staphylococcus aureus. Н. англ. Дж. Мед. 362 , 9–17 (2010).
КАС пабмед Google Scholar
ван Райен, М. М., Боде, Л. Г., Баак, Д.A., Kluytmans, J.A. & Vos, M.C. Снижение затрат на носителей Staphylococcus aureus , получавших профилактическое лечение мупироцином и хлоргексидином в кардиоторакальной и ортопедической хирургии. PLoS ONE 7 , e43065 (2012 г.).
КАС пабмед ПабМед Центральный Google Scholar
Huang, S. S. et al. Целенаправленная и всеобщая деколонизация для предотвращения инфекции в отделении интенсивной терапии. Н. англ. Дж.Мед. 368 , 2255–2265 (2013).
КАС пабмед Google Scholar
Ammerlaan, H.S. et al. Ликвидация носительства метициллинрезистентного золотистого стафилококка: эффективность национального руководства. Дж. Антимикроб. Чемотер. 66 , 2409–2417 (2011).
КАС пабмед Google Scholar
Аммерлаан Х.С. и др. Эрадикация носительства метициллинрезистентного золотистого стафилококка: детерминанты неэффективности лечения. Дж. Антимикроб. Чемотер. 66 , 2418–2424 (2011).
КАС пабмед Google Scholar
Талан, Д. А. и др. Триметоприм-сульфаметоксазол по сравнению с плацебо при неосложненном абсцессе кожи. Н. англ. Дж. Мед. 374 , 823–832 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Даум Р.С. и др. Плацебо-контролируемое исследование антибиотиков при небольших абсцессах кожи. Н. англ. Дж. Мед. 376 , 2545–2555 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Лю, К. и др. Клинические практические рекомендации Американского общества инфекционистов по лечению метициллин-резистентных инфекций Staphylococcus aureus у взрослых и детей. клин.Заразить. Дис. 52 , e18–55 (2011). Этот документ представляет собой важное и актуальное руководство по лечению инфекции MRSA.
ПабМед Google Scholar
Gould, I.M. et al. Новое понимание патогенеза, лечения и резистентности метициллин-резистентного штамма Staphylococcus aureus (MRSA). Междунар. Дж. Антимикроб. Агенты 39 , 96–104 (2012).
КАС пабмед Google Scholar
Светицкий С., Leibovici, L. & Paul, M. Сравнительная эффективность и безопасность ванкомицина по сравнению с тейкопланином: систематический обзор и метаанализ. Антимикроб. Агенты Чемотер. 53 , 4069–4079 (2009).
КАС пабмед ПабМед Центральный Google Scholar
Vandecasteele, SJ, De Vriese, A.S. & Tacconelli, E. Фармакокинетика и фармакодинамика ванкомицина в клинической практике: доказательства и неопределенности. Дж. Антимикроб. Чемотер. 68 , 743–748 (2013).
КАС пабмед Google Scholar
Lodise, T. P., Patel, N., Lomaestro, B. M., Rodvold, K. A. & Drusano, G. L. Взаимосвязь между начальной концентрацией ванкомицина и нефротоксичностью у госпитализированных пациентов. клин. Заразить. Дис. 49 , 507–514 (2009).
КАС пабмед Google Scholar
Катальдо, М.A., Tacconelli, E., Grilli, E., Pea, F. & Petrosillo, N. Непрерывная и прерывистая инфузии ванкомицина для лечения грамположительных инфекций: систематический обзор и метаанализ. Дж. Антимикроб. Чемотер. 67 , 17–24 (2012).
КАС пабмед Google Scholar
Bradley, J. S. Какой антибиотик для резистентных грамположительных и почему? Дж. Заразить. 68 (доп.1), С63–75 (2014).
ПабМед Google Scholar
Falagas, M.E. & Vardakas, K.Z. Оценка пользы и риска линезолида при серьезных грамположительных бактериальных инфекциях. ДругСаф. 31 , 753–768 (2008).
КАС Google Scholar
Cosgrove, S. E. et al. Сравнение смертности, связанной с метициллин-резистентной и метициллин-чувствительной бактериемией Staphylococcus aureus : метаанализ. клин. Заразить. Дис. 36 , 53–59 (2003).
ПабМед Google Scholar
Фаулер В. Г. мл. и др. Клинические признаки осложненной бактериемии Staphylococcus aureus . Арх. Стажер Мед. 163 , 2066–2072 (2003).
ПабМед Google Scholar
Thwaites, G.E. et al. Клиническое лечение бактериемии Staphylococcus aureus . Ланцет Заражение. Дис. 11 , 208–222 (2011). Это важный справочник для всех, кто интересуется оптимальным лечением S. aureus бактериемии.
ПабМед Google Scholar
Houlihan, H.H., Mercier, RC & Rybak, MJ. Фармакодинамика ванкомицина отдельно и в комбинации с гентамицином при различных интервалах дозирования против метициллин-резистентных Staphylococcus aureus, инфицированных фибрин-тромбоцитарными сгустками в модели инфекции in vitro. Антимикроб. Агенты Чемотер. 41 , 2497–2501 (1997).
КАС пабмед ПабМед Центральный Google Scholar
Tsuji, B. T. & Rybak, M. J. Краткосрочный курс гентамицина в комбинации с даптомицином или ванкомицином против Staphylococcus aureus в фармакодинамической модели in vitro с имитацией эндокардиальных вегетаций. Антимикроб. Агенты Чемотер. 49 , 2735–2745 (2005).
КАС пабмед ПабМед Центральный Google Scholar
Rehm, S.J. et al. Даптомицин по сравнению с ванкомицином плюс гентамицин для лечения бактериемии и эндокардита, вызванного Staphylococcus aureus: анализ подмножества пациентов, инфицированных метициллин-резистентными изолятами. Дж. Антимикроб. Чемотер. 62 , 1413–1421 (2008).
КАС пабмед ПабМед Центральный Google Scholar
Фаулер, В.Г. мл. и соавт. Сравнение даптомицина и стандартной терапии бактериемии и эндокардита, вызванного Staphylococcus aureus. Н. англ. Дж. Мед. 355 , 653–665 (2006).
КАС пабмед Google Scholar
Bayer, A. S. & Murray, B. E. Начальные низкие дозы аминогликозидов при бактериемии Staphylococcus aureus : хорошая наука, городская легенда или просто токсичность? клин. Заразить. Дис. 48 , 722–724 (2009).
ПабМед Google Scholar
Forrest, G. N. & Tamura, K. Комбинированная терапия рифампином при немикобактериальных инфекциях. клин. микробиол. 23 , 14–34 (2010).
КАС пабмед ПабМед Центральный Google Scholar
Thwaites, G.E. et al. Дополнительный рифампицин при бактериемии Staphylococcus aureus (ARREST): многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое исследование. Ланцет 391 , 668–678 (2018).
КАС пабмед ПабМед Центральный Google Scholar
Davis, J. S. et al. Комбинация ванкомицина и бета-лактамной терапии при метициллин-резистентной бактериемии Staphylococcus aureus : экспериментальное многоцентровое рандомизированное контролируемое исследование. клин. Заразить. Дис. 62 , 173–180 (2016).
КАС пабмед Google Scholar
Сакулас Г.и другие. Антимикробная спасительная терапия персистирующей стафилококковой бактериемии с использованием даптомицина и цефтаролина. клин. тер. 36 , 1317–1333 (2014).
КАС пабмед Google Scholar
Роуз, У. Э., Берти, А. Д., Хэтч, Дж. Б. и Маки, Д. Г. Взаимосвязь синергизма in vitro и результатов лечения даптомицином плюс рифампицин у пациентов с инвазивными инфекциями, устойчивыми к метициллину Staphylococcus aureus . Антимикроб. Агенты Чемотер. 57 , 3450–3452 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Косими, Р. А., Бейк, Н., Кубиак, Д. В. и Джонсон, Дж. А. Цефтаролин для лечения тяжелых метициллин-резистентных инфекций Staphylococcus aureus : систематический обзор. Открыть форум Infect. Дис. 4 , офх084 (2017).
ПабМед ПабМед Центральный Google Scholar
Татевин П., Basuino, L., Bauer, D., Diep, B.A. & Chambers, H.F. Цефтобипрол превосходит ванкомицин, даптомицин и линезолид при лечении экспериментального эндокардита у кроликов, вызванного метициллин-резистентным Staphylococcus aureus. Антимикроб. Агенты Чемотер. 54 , 610–613 (2010).
КАС пабмед Google Scholar
Oltolini, C. et al. Метициллин-резистентный эндокардит Staphylococcus aureus : первое сообщение о комбинации даптомицина и цефтобипрола в качестве терапии спасения. Междунар. Дж. Антимикроб. Агенты 47 , 502–504 (2016).
КАС пабмед Google Scholar
Андрей Д.О. и др. Противомикробная активность цефтаролина в отношении устойчивых к метициллину изолятов Staphylococcus aureus (MRSA), собранных в 2013–2014 годах в университетских больницах Женевы. евро. Дж. Клин. микробиол. Заразить. Дис. 36 , 343–350 (2017).
КАС пабмед Google Scholar
Лонг, С.В. и др. Мутации PBP2a, вызывающие высокую устойчивость к цефтаролину у клинических метициллин-резистентных штаммов Staphylococcus aureus . Антимикроб. Агенты Чемотер. 58 , 6668–6674 (2014).
ПабМед ПабМед Центральный Google Scholar
Mendes, R. E. et al. Характеристика метициллин-резистентного Staphylococcus aureus , демонстрирующего повышенные МИК цефтаролина. Дж.Антимикроб. Чемотер. 67 , 1321–1324 (2012).
КАС пабмед Google Scholar
Жанель Г.Г. и др. Новые липогликопептиды: сравнительный обзор далбаванцина, оритаванцина и телаванцина. Наркотики 70 , 859–886 (2010).
КАС пабмед Google Scholar
Маккарди, С. П., Джонс, Р. Н., Мендес, Р.Э., Путтагунта С. и Данн М.В. Активность далбаванцина in vitro против лекарственно-устойчивых изолятов Staphylococcus aureus в рамках глобальной программы наблюдения. Антимикроб. Агенты Чемотер. 59 , 5007–5009 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Werth, B.J. et al. Появление нечувствительного к далбаванцину промежуточного ванкомицина Staphylococcus aureus (VISA) после лечения инфекции кровотока, связанной с центральной линией MRSA, с помощью схемы, содержащей далбаванцин и ванкомицин. клин. микробиол. Заразить. 24 , 429.e1–429.e5 (2018).
КАС Google Scholar
Yaw, L. K., Robinson, J. O. & Ho, K. M. Сравнение отдаленных результатов после метициллин-резистентной и метициллин-чувствительной Staphylococcus aureus бактериемии: обсервационное когортное исследование. Ланцет Заражение. Дис. 14 , 967–975 (2014).
ПабМед Google Scholar
Фаткенхойер, Г.и Кааш, А. Дж. Насколько смертоносен устойчивый к метициллину штамм Staphylococcus aureus? Ланцет Заражение. Дис. 14 , 905–907 (2014).
Google Scholar
Де Анджелис, Г. и др. Моделирование нескольких состояний для оценки избыточной продолжительности пребывания, связанной с колонизацией и инфекцией устойчивых к метициллину Staphylococcus aureus у хирургических пациентов. Дж. Хосп. Заразить. 78 , 86–91 (2011).
КАС пабмед Google Scholar
Де Анджелис, Г., Мурти, А., Бейерсманн, Дж. и Харбарт, С. Оценка влияния инфекций, связанных с оказанием медицинской помощи, на продолжительность пребывания и затраты. клин. микробиол. Заразить. 16 , 1729–1735 (2010).
КАС пабмед Google Scholar
Stewardson, A.J. et al. Медицинское и экономическое бремя инфекций кровотока, вызванных чувствительными и нечувствительными к противомикробным препаратам Enterobacteriaceae и Staphylococcus aureus в европейских больницах, 2010 и 2011: многоцентровое ретроспективное когортное исследование. Евронадзор 21 , 30319 (2016). Это методологически обоснованный анализ избыточной продолжительности пребывания бактериемии MRSA.
Центральный пабмед Google Scholar
Haessler, S., Mackenzie, T. & Kirkland, K.B. Отдаленные результаты после заражения метициллинорезистентным или метициллиночувствительным Staphylococcus aureus. Дж. Хосп. Заразить. 69 , 39–45 (2008).
КАС пабмед Google Scholar
Pendleton, A. & Kocher, M.S. Метициллин-резистентный Staphylococcus aureus инфекции костей и суставов у детей. Дж. Ам. акад. Ортоп. Surg. 23 , 29–37 (2015).
ПабМед Google Scholar
Salgado, C.D., Dash, S., Cantey, J.R. & Marculescu, C.E. Более высокий риск неудачи метициллин-резистентных Staphylococcus aureus инфекций протезных суставов. клин. Ортоп. Относ. Рез. 461 , 48–53 (2007).
ПабМед Google Scholar
Глисон, А., Ларкин, П. и О’Салливан, Н. Воздействие метициллин-резистентного Staphylococcus aureus на пациентов с распространенным раком и членов их семей: качественное исследование. Паллиат. Мед. 30 , 382–391 (2016).
ПабМед Google Scholar
ван Клиф, Б.А. и др. Здоровье и качество жизни, связанное со здоровьем, у свиноводов, несущих связанный с домашним скотом метициллин-резистентный золотистый стафилококк. Эпидемиол. Заразить. 144 , 1774–1783 (2016).
КАС пабмед Google Scholar
Ammerlaan, H. S. et al. Вековые тенденции внутрибольничных инфекций кровотока: устойчивые к антибиотикам бактерии увеличивают общее бремя инфекции. клин. Заразить. Дис. 56 , 798–805 (2013). Скорее всего, это лучший документ, в котором оценивается вопрос о том, увеличивает ли MRSA общее бремя внутрибольничных инфекций.
КАС пабмед Google Scholar
Jones, B. E. et al. Различия в эмпирическом охвате по сравнению с выявлением метициллин-резистентного Staphylococcus aureus и Pseudomonas aeruginosa при госпитализации по поводу внебольничной пневмонии в 128 медицинских центрах по делам ветеранов США. Заразить. Хосп. Эпидемиол. 38 , 937–944 (2017).
ПабМед Google Scholar
Herr, CE, Heckrodt, TH, Hofmann, FA, Schnettler, R. & Eikmann, TF Дополнительные расходы на предотвращение распространения метициллин-резистентного Staphylococcus aureus и стратегия снижения этих расходов в хирургическом отделении . Заразить. Хосп. Эпидемиол. 24 , 673–678 (2003).
ПабМед Google Scholar
Wertheim, H. F. et al. Риск и исход внутрибольничной бактериемии Staphylococcus aureus у назальных носителей по сравнению с неносителями. Ланцет 364 , 703–705 (2004).
ПабМед Google Scholar
Pozzi, C. et al. Вакцины против Staphylococcus aureus и целевых групп населения. Курс. Вверх. микробиол. Иммунол. 409 , 491–528 (2017).
КАС пабмед Google Scholar
Fowler, V.G. et al. Влияние экспериментальной вакцины на предотвращение инфекций Staphylococcus aureus после кардиоторакальной хирургии: рандомизированное исследование. JAMA 309 , 1368–1378 (2013).
КАС пабмед Google Scholar
Шайнфилд, Х.и другие. Использование конъюгированной вакцины Staphylococcus aureus у пациентов, находящихся на гемодиализе. Н. англ. Дж. Мед. 346 , 491–496 (2002).
ПабМед Google Scholar
Фаулер, В. Г. мл. и Проктор, Р. А. Где стоит вакцина Staphylococcus aureus ? клин. микробиол. Заразить. 20 (Приложение 5), 66–75 (2014).
ПабМед ПабМед Центральный Google Scholar
Стенцель, С.и другие. Специфический сывороточный IgG при диагностике инвазии Staphylococcus aureus в кровоток коррелирует с прогрессированием заболевания. Дж. Протеом. 128 , 1–7 (2015).
КАС Google Scholar
Kurokawa, K., Takahashi, K. & Lee, B.L. Стафилококковая поверхностно-гликополимерная стенка тейхоевой кислоты (WTA) имеет решающее значение для активации комплемента и иммунологической защиты от инфекции Staphylococcus aureus . Иммунобиология 221 , 1091–1101 (2016).
КАС пабмед Google Scholar
Bekeredjian-Ding, I. Расшифровка значения Т-клеточного ответа на золотистый стафилококк. Будущее микробиол. 12 , 1023–1026 (2017).
КАС пабмед Google Scholar
Лехар, С. М. и др. Новый конъюгат антитело-антибиотик устраняет внутриклеточный S.золотистый . Природа 527 , 323–328 (2015).
КАС пабмед Google Scholar
Всемирная организация здравоохранения. Приоритизация патогенов для открытия, исследования и разработки новых антибиотиков для лекарственно-устойчивых бактериальных инфекций, включая туберкулез (ВОЗ, Женева, 2017 г.).
Иделевич Е.А. и др. Активность in vitro в отношении Staphylococcus aureus нового противомикробного агента, PRF-119, рекомбинантного химерного эндолизина бактериофага. Антимикроб. Агенты Чемотер. 55 , 4416–4419 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Hiramatsu, K. et al. Метициллин-резистентный клинический штамм Staphylococcus aureus со сниженной чувствительностью к ванкомицину. Дж. Антимикроб. Чемотер. 40 , 135–136 (1997).
КАС пабмед Google Scholar
Мванги, М.М. и др. Отслеживание эволюции множественной лекарственной устойчивости in vivo у Staphylococcus aureus с помощью полногеномного секвенирования. Проц. Натл акад. науч. США 104 , 9451–9456 (2007 г.).
КАС пабмед Google Scholar
Howden, BP, Davies, JK, Johnson, PD, Stinear, TP & Grayson, ML Снижение чувствительности к ванкомицину у Staphylococcus aureus, включая ванкомицин-промежуточные и гетерогенные ванкомицин-промежуточные штаммы: механизмы резистентности, лабораторное обнаружение и клинические подразумеваемое. клин. микробиол. 23 , 99–139 (2010).
КАС пабмед ПабМед Центральный Google Scholar
Хатиб Р. и др. Актуальность ванкомицин-промежуточной чувствительности и гетерорезистентности при метициллин-резистентной бактериемии Staphylococcus aureus . Дж. Антимикроб. Чемотер. 66 , 1594–1599 (2011).
КАС пабмед Google Scholar
Сатола С.В. и др. Клинические и лабораторные характеристики инвазивных инфекций, вызванных устойчивыми к метициллину изолятами Staphylococcus aureus , демонстрирующими МИК ванкомицина 2 микрограмма на миллилитр: отсутствие эффекта гетерорезистентного ванкомицина-промежуточного фенотипа S. aureus . Дж. Клин. микробиол. 49 , 1583–1587 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Зиверт, Д.М. и др. Устойчивый к ванкомицину штамм Staphylococcus aureus в США, 2002–2006 гг. клин. Заразить. Дис. 46 , 668–674 (2008).
КАС пабмед Google Scholar
Weigel, L.M. et al. Генетический анализ изолята Staphylococcus aureus с высоким уровнем устойчивости к ванкомицину. Наука 302 , 1569–1571 (2003).
КАС пабмед Google Scholar
Фуко, М.L., Courvalin, P. & Grillot-Courvalin, C. Стоимость пригодности устойчивости к ванкомицину VanA-типа у устойчивого к метициллину Staphylococcus aureus. Антимикроб. Агенты Чемотер. 53 , 2354–2359 (2009).
КАС пабмед Google Scholar
Стефани, С. и др. Метициллин-резистентный штамм Staphylococcus aureus (MRSA): глобальная эпидемиология и гармонизация методов типирования. Междунар. Дж. Антимикроб.Агенты 39 , 273–282 (2012).
КАС пабмед Google Scholar
Carlet, J. et al. Французская национальная программа профилактики внутрибольничных инфекций и устойчивости к противомикробным препаратам, 1992–2008 гг.: положительные тенденции, но требуется настойчивость. Заразить. Хосп. Эпидемиол. 30 , 737–745 (2009).
ПабМед Google Scholar
Дюрден, Б., Фрай С., Джонсон А. П. и Уилкокс М. Х. Борьба с инфекциями кровотока, устойчивыми к метициллину Staphylococcus aureus , в Англии. Открыть форум Infect. Дис. 2 , оф.035 (2015).
ПабМед ПабМед Центральный Google Scholar
[Авторы не указаны.] PubMLST. Оксфордский университет https://pubmlst.org/ (2018).
Терлоу, Л. Р., Джоши, Г.С. и Ричардсон, А. Р. Стратегии вирулентности доминирующей линии USA300 внебольничного устойчивого к метициллину Staphylococcus aureus (CA-MRSA). ФЭМС Иммунол. Мед. микробиол. 65 , 5–22 (2012).
КАС пабмед ПабМед Центральный Google Scholar
Пешель, А. и Отто, М. Фенолрастворимые модулины и стафилококковая инфекция. Нац. Преподобный Микробиолог. 11 , 667–673 (2013).
КАС пабмед ПабМед Центральный Google Scholar
Райт, Г. Д. Вопросы и ответы: Устойчивость к антибиотикам: откуда она берется и что мы можем с этим поделать? БМС Биол. 8 , 123 (2010).
ПабМед ПабМед Центральный Google Scholar
McCarthy, A.J. & Lindsay, J.A. Staphylococcus aureus Уклонение от врожденного иммунитета зависит от происхождения: исследование биоинформатики. Заразить. Жене. Эвол. 19 , 7–14 (2013).
КАС пабмед Google Scholar
Markowitz, N., Quinn, E.L. & Saravolatz, L.D. Триметоприм-сульфаметоксазол в сравнении с ванкомицином для лечения инфекции Staphylococcus aureus . Энн. Стажер Мед. 117 , 390–398 (1992).
КАС пабмед Google Scholar
Ландерсдорфер, К.Б., Булитта, Дж. Б., Кинциг, М., Хольцграбе, У. и Зоргель, Ф. Проникновение антибактериальных препаратов в кости: фармакокинетические, фармакодинамические и биоаналитические соображения. клин. Фармакокинетика. 48 , 89–124 (2009).
КАС пабмед Google Scholar
Sakoulas, G., Alder, J., Thauvin-Eliopoulos, C., Moellering, R.C. Jr & Eliopoulos, G.M. Индукция гетерогенной чувствительности к даптомицину у Staphylococcus aureus при воздействии ванкомицина. Антимикроб. Агенты Чемотер. 50 , 1581–1585 (2006).
КАС пабмед ПабМед Центральный Google Scholar
Pertel, P. E. et al. Влияние предшествующей эффективной терапии на эффективность даптомицина и цефтриаксона для лечения внебольничной пневмонии. клин. Заразить. Дис. 46 , 1142–1151 (2008).
КАС пабмед Google Scholar
Фентон, К., Китинг, Г. М. и Карран, М. П. Даптомицин. Наркотики 64 , 445–455 (2004).
КАС пабмед Google Scholar
Пи, Ф. и др. Терапевтический лекарственный мониторинг может улучшить показатели безопасности при длительном лечении линезолидом у взрослых пациентов. Дж. Антимикроб. Чемотер. 67 , 2034–2042 (2012).
КАС пабмед Google Scholar
Итани, К.М. и др. Эффективность и безопасность линезолида по сравнению с ванкомицином при лечении осложненных инфекций кожи и мягких тканей, вызванных метициллинрезистентным золотистым стафилококком. утра. Дж. Сур. 199 , 804–816 (2010).
КАС пабмед Google Scholar
Кори, Г. Р. и др. CANVAS 1: первое рандомизированное двойное слепое исследование III фазы по оценке применения цефтаролина фозамила для лечения пациентов с осложненными инфекциями кожи и кожных структур. Дж. Антимикроб. Чемотер. 65 (Приложение 4), iv41–iv51 (2010).
КАС пабмед Google Scholar
Wilcox, M.H. et al. CANVAS 2: вторая фаза III, рандомизированное, двойное слепое исследование, оценивающее цефтаролин фозамил для лечения пациентов с осложненными инфекциями кожи и кожных структур. Дж. Антимикроб. Чемотер. 65 (Приложение 4), iv53–iv65 (2010).
КАС пабмед Google Scholar
Драйден, М., Zhang, Y., Wilson, D., Iaconis, JP & Gonzalez, JA Фаза III, рандомизированное контролируемое исследование не меньшей эффективности цефтаролина фосамила 600 мг каждые 8 часов по сравнению с ванкомицином плюс азтреонам у пациентов с осложненной инфекцией кожи и мягких тканей с системной воспалительной реакцией или сопутствующими заболеваниями. Дж. Антимикроб. Чемотер. 71 , 3575–3584 (2016).
КАС пабмед ПабМед Центральный Google Scholar
Ноэль, Г.J., Bush, K., Bagchi, P., Ianus, J. & Strauss, R.S. Рандомизированное двойное слепое исследование, сравнивающее цефтобипрол медокарил с ванкомицином плюс цефтазидим для лечения пациентов с осложненными инфекциями кожи и кожных структур. клин. Заразить. Дис. 46 , 647–655 (2008).
ПабМед Google Scholar
[Авторы не указаны.] Вибатив (телаванцин) [информация по применению]. Астеллас http://www.astellas.us/docs/us/VIBATIV_PI_Final.pdf (2009 г.).
Рубинштейн, Э. и др. Телаванцин в сравнении с ванкомицином при внутрибольничной пневмонии, вызванной грамположительными возбудителями. клин. Заразить. Дис. 52 , 31–40 (2011).
КАС пабмед ПабМед Центральный Google Scholar
Stryjewski, M.E. et al. Рандомизированное исследование фазы 2 телаванцина по сравнению со стандартной терапией у пациентов с неосложненной бактериемией Staphylococcus aureus : исследование ASSURE. BMC Заражение. Дис. 14 , 289 (2014).
ПабМед ПабМед Центральный Google Scholar
Nord, C.E., Rasmanis, G. & Wahlund, E. Влияние далбаванцина на нормальную микрофлору кишечника. Дж. Антимикроб. Чемотер. 58 , 627–631 (2006).
КАС пабмед Google Scholar
Рамдин С. и Буше Х.W. Dalbavancin для лечения острых бактериальных инфекций кожи и кожных структур. Экспертное заключение. Фармацевт. 16 , 2073–2081 (2015).
ПабМед ПабМед Центральный Google Scholar
Мессина, Дж. А., Фаулер, В. Г. младший и Кори, Г. Р. Оритаванцин для лечения острых бактериальных инфекций кожи и кожных структур. Экспертное заключение. Фармацевт. 16 , 1091–1098 (2015).
КАС пабмед ПабМед Центральный Google Scholar
Биденбах, Д.Дж., Архин Ф.Ф., Моек Г., Линч Т.Ф. и Сам Д.Ф. Активность оритаванцина и препаратов сравнения in vitro против стафилококков, стрептококков и энтерококков при клинических инфекциях в Европе и Северной Америке, 2011–2014 гг. Междунар. Дж. Антимикроб. Агенты 46 , 674–681 (2015).
КАС пабмед Google Scholar
Prokocimer, P., De Anda, C., Fang, E., Mehra, P. & Das, A. Тедизолид фосфат по сравнению с линезолидом для лечения острых бактериальных инфекций кожи и кожных структур: ESTABLISH-1, рандомизированный пробный. JAMA 309 , 559–569 (2013).
КАС пабмед Google Scholar
Moran, G.J. et al. Тедизолид в течение 6 дней по сравнению с линезолидом в течение 10 дней при острых бактериальных инфекциях кожи и подкожных тканей (ESTABLISH-2): рандомизированное двойное слепое исследование фазы 3, не меньшей эффективности. Ланцет Заражение. Дис. 14 , 696–705 (2014).
КАС пабмед Google Scholar
Ван Бамбеке, Ф.Делафлоксацин, нецвиттер-ионный фторхинолон, находящийся в III фазе клинической разработки: оценка его фармакологии, фармакокинетики, фармакодинамики и клинической эффективности. Будущее микробиол. 10 , 1111–1123 (2015).
КАС пабмед Google Scholar
Kingsley, J. et al. Рандомизированное двойное слепое исследование фазы 2 для оценки субъективных и объективных результатов у пациентов с острыми бактериальными инфекциями кожи и подкожных структур, получавших делафлоксацин, линезолид или ванкомицин. Дж. Антимикроб. Chemother 71 , 821–829 (2016).
КАС пабмед Google Scholar
Pullman, J. et al. Эффективность и безопасность делафлоксацина по сравнению с ванкомицином плюс азтреонам при острых бактериальных инфекциях кожи и кожных покровов: двойное слепое рандомизированное исследование фазы 3. Дж. Антимикроб. Чемотер. 72 , 3471–3480 (2017).
КАС пабмед ПабМед Центральный Google Scholar
Staphylococcus aureus адаптируется к пищевому ландшафту хозяина, чтобы преодолеть тканеспецифическую потребность в жирных кислотах с разветвленной цепью
Значение
Липоилирование — это посттрансляционная модификация, имеющая решающее значение для функции нескольких метаболических ферментов.У бактериального патогена Staphylococcus aureus дефицит липоилирования ставит под угрозу рост и вызывает тканеспецифические дефекты вирулентности. Нарушение липоилирования вызывает затухание частично из-за разрушения ферментного комплекса, необходимого для синтеза жирных кислот с разветвленной цепью, основного компонента мембраны S. aureus . S. aureus преодолевает ауксотрофию жирных кислот с разветвленной цепью в коже, приобретая ненасыщенные жирные кислоты хозяина. Эта работа подчеркивает адаптивность S.aureus при нехватке питательных веществ и важности достаточного количества липоевой кислоты во время инфекции. Наши результаты подтверждают мнение о том, что универсальность биогенеза мембран S. aureus необходимо учитывать при разработке терапевтических средств.
Abstract
Во время инфекции патогенные микробы адаптируются к питательной среде хозяина посредством метаболического перепрограммирования и удаления питательных веществ. Для бактериального патогена Staphylococcus aureus вирулентность в различных очагах инфекции обусловлена способностью поглощать множество питательных веществ хозяина, включая липоевую кислоту, кофактор, необходимый для функционирования нескольких критических комплексов метаболических ферментов. S. aureus перемещает липоевую кислоту между этими ферментными комплексами посредством амидотрансферазы, LipL. Здесь мы обнаруживаем, что приобретение липоевой кислоты или ее присоединение через LipL к ферментным комплексам, необходимым для образования ацетил-КоА и жирных кислот с разветвленной цепью, необходимо для бактериемии, но не требуется при кожных инфекциях у мышей. Мутант lipL является ауксотрофным по предшественникам карбоновых кислот, необходимых для синтеза жирных кислот с разветвленной цепью, важного компонента липидов мембран стафилококков и агента текучести мембран.Однако кожа лишена жирных кислот с разветвленной цепью. Мы показали, что S. aureus вместо этого удаляет из кожи ненасыщенные жирные кислоты хозяина, используя секретируемую липазу, Geh, и белок, связывающий ненасыщенные жирные кислоты, FakB2. Более того, мышиные инфекции продемонстрировали значимость ассимиляции липидов хозяином для выживания стафилококков. В целом, эти исследования дают представление об адаптивном признаке, который обходит синтез липидов de novo, чтобы способствовать персистенции S. aureus во время поверхностной инфекции.Полученные данные также усиливают неотъемлемые проблемы, связанные с нацеливанием на бактериальный липогенез в качестве антибактериальной стратегии, и поддерживают одновременное ингибирование спасения жирных кислот хозяина во время лечения.
Грамположительная бактерия Staphylococcus aureus печально известна своей способностью вызывать широко распространенную патологию почти во всех органах и тканях во время инфекции (1). Во многом этот успех можно объяснить способностью S. aureus извлекать необходимые питательные вещества из среды хозяина (2).Следовательно, понимание адаптивных признаков, которые позволяют S. aureus использовать ресурсы in situ для выживания, имеет решающее значение для разработки эффективных методов лечения стафилококковых заболеваний.
Липоевая кислота представляет собой сероорганическое соединение, полученное из промежуточного продукта ранней стадии биосинтеза жирных кислот, который необходим для перемещения углерода в центральном метаболизме через чувствительное к окислительно-восстановительному потенциалу дитиолановое кольцо на его дистальном конце (3). В предыдущем исследовании мы обнаружили, что перенос липоевой кислоты в комплексы метаболических ферментов с помощью амидотрансферазы, LipL, имеет первостепенное значение для S.aureus в мышиной модели бактериемии, но не инфекции кожи (4). Как минимум, LipL, по-видимому, необходим для переноса липоевой кислоты на субъединицы E2 комплексов пируватдегидрогеназы (PDH) и α-кетокислоты с разветвленной цепью (BCODH) (4, 5). Отсутствие липоевой кислоты делает каждый комплекс нефункциональным (4, 5). Несоответствие потребности в прикреплении липоевой кислоты в этих двух местах инфекции предполагает, что питательная среда кожи снижает потребность в метаболических процессах, зависящих от липоевой кислоты, особенно тех, которые требуют активности комплекса PDH или BCODH.PDH отвечает за образование ацетил-КоА после выхода из гликолиза, в то время как BCODH необходима для синтеза насыщенных жирных кислот с разветвленной цепью (BCFAs), основного компонента фосфолипидов мембран стафилококков (6). Подобно ненасыщенным жирным кислотам (НЖК), BCFA обеспечивают текучесть мембран стафилококкам, которые не синтезируют НЖК и не кодируют десатуразу жирных кислот (ЖК), которая превращает насыщенные жирные кислоты (НЖК) в ненасыщенные продукты (7). Поскольку недостаток текучести мембран вызывает гибель клеток в результате разделения липидной фазы и сегрегации белков, выживание бактерий зависит от тонкой настройки липидного состава мембраны для адаптации к изменчивым условиям окружающей среды (8).
Учитывая важность синтеза ЖК de novo для обеспечения целостности бактериальной мембраны, ферменты, участвующие в этом метаболическом процессе, служат привлекательными мишенями для открытия антибактериальных препаратов. Один из таких препаратов, триклозан, связывается с редуктазой белка-носителя еноилацила, FabI, ключевым ферментом в системе синтеза ЖК типа II (FASII), обнаруживаемой у архей и бактерий (9). Ограничение FASII вызывает дефицит ЖК и инициирует строгий ответ, при котором высокие концентрации алармона (p)ppGpp ингибируют синтез субстрата FASII малонил-КоА (10).Тем не менее, все больше данных свидетельствует о том, что S. aureus может устранять интерференцию триклозана путем включения НЖК хозяина в свою мембрану (11⇓–13). Во время анти-FASII-адаптивного роста диссипация уровней (p)ppGpp пополняет пул малонил-КоА и искажает распределение субстрата FASII в пользу связывания с FapR, глобальным репрессором генов синтеза фосфолипидов в S. aureus (10) . В конечном счете, это взаимодействие изолирует FapR, позволяя экспрессировать plsX и plsC , которые кодируют ферменты, использующие НЖК хозяина для синтеза фосфолипидов (10, 14).У позвоночных НЖК обычно этерифицированы в виде триглицеридов и эфиров холестерина (15). У людей оба соединения образуют липидное ядро пяти основных групп липопротеинов (хиломикроны, ЛПОНП, ЛПНП, ЛПНП и ЛПВП), которые транспортируют липиды по всему телу (15). Триглицериды также являются основными составляющими адипоцитов и присутствуют в меньшей степени в нежировых клетках (16, 17). Было высказано предположение, что S. aureus секретирует гидролазу глицеринового эфира Geh для высвобождения этерифицированных ЖК из триглицеридов и ЛПНП для использования в качестве субстрата ЖК в качестве стратегии усвоения питательных веществ, хотя это явление еще не было проверено in vivo (18, 19). .
Несмотря на растущее понимание обхода FASII с помощью S. aureus в последние годы, общий механизм спасения продолжает исследоваться. Здесь мы опираемся на информацию, полученную в результате изучения синтеза и приобретения липоевой кислоты S. aureus , чтобы установить связь между синтезом BCFA и выживанием бактерий во время инфекции. Мы сообщаем, что синтез de novo BCFA с помощью S. aureus является первичным ферментативным процессом, который требует липоевой кислоты in vitro и во время кожной инфекции.Однако потребность в синтезе BCFA в коже обходится за счет ассимиляции НЖК из ткани хозяина. Мы также предоставляем генетические, in vivo и химические доказательства посредством лечения безрецептурным ингибитором липазы, орлистатом, которые предполагают, что приобретение НЖК зависит от секретируемой липазы, Geh, и белка, связывающего НЖК, FakB2. Наконец, мы демонстрируем, что удаление как синтеза BCFA, так и экзогенного поглощения FA значительно улучшает исход стафилококковой инфекции у мышей.
Результаты
Тканеспецифическая потребность в липоевой кислоте в течение
S.aureus Инфекция у мышей.Ранее мы охарактеризовали предполагаемую амидотрансферазу S. aureus , LipL, и продемонстрировали, что она способна перемещать липоевую кислоту между белками, содержащими липоилдомен, которым требуется кофактор для функционирования (рис. 1 A ) (4) . Кроме того, мы показали, что мутант Δ lipL сильно ослаблен для почечной колонизации в мышиной модели сепсиса, но демонстрирует умеренное снижение инфекционности в мышиной модели инфекции кожи и мягких тканей (4).Поэтому мы задались вопросом, отражает ли эта разница в бактериальной нагрузке различную потребность в липоевой кислоте между участками ткани. С этой целью мы инфицировали мышей внутривенно или внутрикожно либо штаммом дикого типа (WT), Δ lipL, , либо Δ lipA Δ lplA1 Δ lplA2 мутантным штаммом, в котором отсутствует липоилсинтаза, LipA и оба фермента спасения липоевой кислоты, LplA1 и LplA2 (5, 20). Через 96 ч после внутривенной инфекции в почках животных, инфицированных мутантами Δ lipL и Δ lipA Δ lplA1 Δ lplA2 , было примерно в 10 000–100 000 раз меньше колониеобразующих единиц (WFUT), чем у инфицированных WFUT Инжир.1 В ). Через 120 часов после внутрикожного заражения из абсцессов Δ lipL было извлечено примерно в пять раз меньше КОЕ, и не наблюдалось разницы в КОЕ для Δ lipA Δ lplA1 Δ lplA2 , инфицированных мутантами WT (по сравнению с инфицированными мутантами WT). Рис. 1 C ). Таким образом, мутант Δ lipA Δ lplA1 Δ lplA2 не аттенуирован, а мутант Δ lipL умеренно аттенуирован в коже, тогда как оба штамма заметно аттенуированы в почках, что позволяет предположить, что S.aureus в значительной степени устойчив к дефициту липоевой кислоты в коже мышей, но не в почках.
Рис. 1.Дифференциальная потребность в липоевой кислоте у S. aureus во время инфекции. ( A ) Синтез липоевой кислоты и пути утилизации в S. aureus . Синтез липоевой кислоты de novo с помощью S. aureus требует октаноилтрансферазы, LipM, и липоилсинтазы, LipA. Амидотрансфераза, LipL, переносит липоильный фрагмент к субъединицам E2 комплексов α-кетокислоты дегидрогеназы, которым для функционирования требуется кофактор. S. aureus также кодирует два спасательных фермента, LplA1 и LplA2, для удаления свободной липоевой кислоты из окружающей среды. ACP, белок-носитель ацила; GcvH, комплекс расщепления глицина H-субъединицы; E2-PDH, комплекс пируватдегидрогеназы субъединицы E2; E2-OGDH, комплекс 2-оксоглутаратдегидрогеназы субъединицы E2; E2-BCODH, комплекс дегидрогеназы α-кетокислоты с разветвленной цепью. ( B ) Бактериальная нагрузка (log 10 КОЕ) в почках мышей через 96 ч после заражения 1 × 10 7 КОЕ WT ( n = 12), Δ lipL ( n 04 n 04 n lipL и lipA lplA1 lplA2 ( n = 8).( C ) Бактериальная нагрузка (log 10 КОЕ) в абсцессах кожи мышей через 120 ч после заражения 1 × 10 7 КОЕ WT ( n = 16), Δ lipL (
5 ) и Δ
lipA Δ lplA1 Δ lplA2 ( n = 14). Значения P были определены с помощью непараметрического однофакторного дисперсионного анализа (критерий Крускала-Уоллиса) с посттестом Данна. * Р < 0,05, ** Р < 0,01, **** Р < 0.0001 и NS, не имеет значения.Ауксотрофия BCFA ответственна за дефект роста штамма с дефицитом липоевой кислоты.
Мы предположили, что отсутствие липоилирования субъединицы E2 одного или нескольких комплексов метаболических ферментов вызывает снижение выживаемости мутантных штаммов Δ lipL и Δ lipA Δ lplA1 Δ lplA2 . Чтобы оценить способность этих штаммов к липоилированию, мы провели иммуноблот против липоевой кислоты на лизатах цельных клеток из каждого штамма, выращенного в среде обхода липоевой кислоты, которая состоит из среды Мемориального института Розуэлл-Парк (RPMI) с добавлением ацетата натрия (NaAc). и карбоновые кислоты с разветвленной цепью, которые являются предшественниками BCFA (BCFAP).Дополненные предшественники включают 2-метилмасляную кислоту (2MB), изовалериановую кислоту (IV) и изомасляную кислоту (IB) (21, 22). Мутант Δ lipL был неспособен липоилировать E2-PDH и E2-BCODH, тогда как мутант Δ lipA Δ lplA1 Δ lplA2 не мог липоилировать субъединицу E2 2-оксоглутаратдегидрогеназы белок, GcvH, в дополнение к E2-PDH и E2-BCODH (рис. 2 A ). Добавление экзогенной липоевой кислоты или NaAc не смогло восстановить рост мутантных штаммов Δ lipA Δ lplA1 Δ lplA2 и Δ lipL в RPMI (рис.2 B и 4, 5, 20). Однако добавления любого одного BCFAP (2MB, IV или IB) было достаточно для восстановления жизнеспособности обоих штаммов (рис. 2 B ). Взятые вместе, эти наблюдения позволяют предположить, что недостаток lipoyl-E2-BCODH, который участвует в синтезе BCFA, делает штамм с дефицитом липоевой кислоты нежизнеспособным в среде, лишенной этого кофактора.
Рис. 2.Дефицит липоевой кислоты вызывает ауксотрофию BCFA у S. aureus . ( A ) в профилях липоилирования Vivo WT, Δ Lipl , δ Lipl + Lipl и δ Lipa δ LPLA1 δ LPLA2 Штаммы после 9 H роста субкультуры в RPMI + BCFAP 10 мМ IB, 9 мМ 2MB, 9 мМ IV + 10 мМ NaAc], с 5 мкМ липоевой кислоты (LA) или без нее, оценивали с помощью иммуноблотинга лизатов цельных клеток, разрешенных в SDS-PAGE, с кроличьим антителом к α-липоевой кислоте.Представленный блот является репрезентативным как минимум для трех независимых экспериментов. ( B ) Рост (LOG 10 CFU / ML) WT, δ LIPL , δ LIPL + LIPL и δ LIPA δ LPLA1 δ LPLA2 Штаммы после 24 ч рост только в RPMI или RPMI + 10 мМ NaAc или любой один BCFAP (9 мМ 2MB, 9 мМ IV или 10 мМ IB).
НЖК, полученные из организма-хозяина, снижают потребность в липоевой кислоте у
S. aureus .Полученные нами результаты привели нас к гипотезе о том, что среда кожи мышей обогащена определенными питательными веществами, которые могут восстановить жизнеспособность штаммов Δ lipL и Δ lipA Δ lplA1 Δ lplA2 .Поскольку эти штаммы являются ауксотрофными по BCFA, что обеспечивает текучесть стафилококковой мембраны, мы предполагаем, что вероятным субстратом являются либо BCFA, либо UFA. BCFA присутствуют в незначительном количестве на коже мышей, в то время как НЖК, которые способствуют текучести мембран у многих других бактерий, включая Escherichia coli , присутствуют в большом количестве (23). Следовательно, чтобы выяснить, могут ли НЖК восстанавливать рост мутанта Δ lipL в RPMI, мы добавили в среду одну из трех НЖК [пальмитолеиновую кислоту (16:1), олеиновую кислоту (18:1) или линолевую кислоту (18:1). :2)] и оценивали рост мутанта по сравнению со штаммом WT путем количественного определения КОЕ.Все три НЖК успешно восстанавливали рост мутанта Δ lipL , а также мутанта Δ lipA Δ lplA1 Δ lplA2 до уровней WT (рис. 3, A и
4 B 90). И наоборот, добавление НЖК [пальмитиновая кислота (16:0) или стеариновая кислота (18:0)] не восстанавливало рост бактерий (рис. 3
C ). Учитывая, что большинство НЖК в организме хозяина происходят из запасов триглицеридов и эфиров холестерина (16, 17), мы также оценили способность насыщенных и ненасыщенных триглицеридов [глицерилтрипальмитат (ГТФ, 16:0) и глицерилтриолеат (ГТО, 18:1)] или липопротеины низкой плотности человека (LDL) в качестве субстратов FA при RPMI.Как и ожидалось, GTO и LDL, но не насыщенный триглицерид, GTP, успешно восстановили жизнеспособность этих штаммов (рис. 3 D ). Фрагменты FA из GTO и LDL этерифицируются до глицерина и глицерина/холестерина, соответственно, хотя некоторое количество свободных FA может присутствовать в очищенных человеческих LDL. Таким образом, мы пришли к выводу, что для получения НЖК из GTO и ЛПНП потребуется основная секретируемая липаза, Geh, для высвобождения свободных ЖК перед использованием. Мы создали двойной мутант Δ geh Δ lipL и комплементарный штамм Δ geh Δ lipL + geh и отслеживали рост в RPMI или RPMI с добавлением GTP, GTO и LDL.Как и предполагалось, рост двойного мутанта Δ geh Δ lipL больше не восстанавливался добавлением GTO или LDL, в то время как добавление geh частично восстанавливало рост в присутствии этих субстратов (рис. 3 E ). ). Чтобы установить роль Geh в высвобождении НЖК для обеспечения выживания in vivo, мы внутрикожно инфицировали мышей штаммами WT, Δ geh , Δ lipL и Δ lipL Δ geh и определяли количество КОЕ в абсцессах через 1 год. .Мутант Δ geh не был аттенуирован в какой-либо измеримой степени в коже через 120 часов, тогда как мутант Δ lipL был умеренно аттенуирован (рис. 1 C и 3 F ). По сравнению с мутантом Δ lipL заражение двойным мутантом Δ lipL Δ geh приводило к восстановлению в 10 раз меньше КОЕ. Эти результаты позволяют предположить, что активность липазы частично отвечает за обход потребности кожи в липоевой кислоте. Рис. 3. СубстратыUFA обходят потребность в липоевой кислоте с помощью S.золотистый. ( a и b ) 24 h, рост субкультуры (log 10 CFU / мл) ( a ) δ lipl и ( b ) δ lipa δ lpla1 δ lpla2 штаммов только в RPMI или RPMI с добавлением 50 мкМ каждой пальмитолеиновой кислоты (16:1), олеиновой кислоты (18:1) или линолевой кислоты (18:2). ( C и D ) 24-часовой рост субкультуры (log 10 КОЕ/мл) штамма Δ lipL в RPMI с добавлением ( C ) насыщенных ЖК [50 мкМ пальмитиновой кислоты (16:0) или 50 мкМ стеариновой кислоты (18:0)] или ( D ) ковалентно связанные субстраты FA (16.67 мкМ GTP, 16,67 мкМ GTO или 0,34 мг/мл ЛПНП человека). ( E ) Рост субкультуры 24 H (Log 10 CFU / ML) δ GEH δ Lipl и δ GEH δ Lipl + Lipl штаммов в RPMI, дополненные GTP, GTO или LDL, как указано в ( D ). WT δ GEH , δ LIPL , δ GEH δ LIPL и δ GEH δ Штаммы на гек δ в RPMI были выращены в RPMI без липидных добавок в качестве контроля.( F ) Бактериальная нагрузка (log 10 КОЕ) в абсцессах кожи мышей через 120 ч после заражения 1 × 10 7 КОЕ WT ( n = 24), Δ geh ( ), Δ lipL ( n = 24) и Δ geh Δ lipL ( n = 24). Значения P были определены с помощью непараметрического однофакторного дисперсионного анализа (критерий Крускала-Уоллиса) с посттестом Данна. * P < 0,05, *** P < 0.001 и **** P < 0,0001.
Освобождение НЖК облегчает ауксотрофию BCFA.
Чтобы подтвердить, что поглощение НЖК S. aureus обходит потребность в синтезе BCFA, мы создали мутант Δ bmfBB :: kan , в котором отсутствует субъединица E2 BCODH, и проверили способность мутанта штамм использовать свободные ЖК (18:0, 18:1 и 18:2) в качестве субстрата для роста в RPMI. Подобно мутанту Δ lipL , мутант Δ bmfBB :: kan рос в RPMI с добавлением UFA, но не субстратов SFA (рис.4 А ). Удаление pdhC , который кодирует E2-PDH, не изменило требования USFA для роста мутанта Δ bmfBB :: kan (фиг. 4 B ). Мы также оценили способность ненасыщенных триглицеридов, GTO (18:1) или LDL человека служить субстратами для мутанта Δ bmfBB :: kan в RPMI. Подобно мутанту Δ lipL , мутант Δ bmfBB :: kan рос в RPMI с добавлением GTO и LDL (рис.4 А ). Чтобы проверить роль Geh в освобождении 18:1 от GTO, мы попытались создать двойной мутант Δ bmfBB Δ geh , но безуспешно после многочисленных попыток. Вместо этого мы приобрели безрецептурный ингибитор панкреатической липазы человека, орлистат, который недавно был совместно кристаллизован с S. aureus Geh (24) и проверил его способность ингибировать активность Geh и предотвращать восстановление роста до Δ bmfBB . :: мутант kan в присутствии GTO.Когда очищенный рекомбинантный Geh совместно инкубировали с орлистатом и GTO, он был неспособен гидролизовать этерифицированную 18:1 FA, тогда как только Geh был способен полностью гидролизовать GTO (рис. 4 C ). В соответствии с его успешным ингибированием активности Geh, орлистат предотвращал рост мутанта Δ bmfBB :: kan в присутствии GTO (рис. 4 D ). Чтобы установить релевантность межштаммовой изменчивости, которая, как предполагалось, влияет на ассимиляцию НЖК при ингибировании FASII (10⇓⇓–13, 25⇓⇓–28), мы создали Δ мутаций bmfBB :: kan в штаммы, использованные в этих исследованиях, а также устойчивый к метициллину штамм S.aureus , которые либо несут аллель geh WT , либо природное разрушение фага в пределах аллеля geh ( SI Приложение , таблица S1) и отслеживали рост в присутствии 18:1 и GTO. Наши данные показывают, что мутанты Δ bmfBB :: kan всех штаммов были способны расти на 18:1 к 24 ч, в то время как мутанты Δ bmfBB :: kan штаммов Newman и COL (оба содержат фаговые нарушения в geh ) не могли расти на GTO (рис.4 Д ). RN6390 Δ bmfBB :: kan медленнее адаптировался к 18:1 и GTO, о чем свидетельствует его ограниченный рост через 8 часов, но достиг аналогичного конечного КОЕ через 24 часа, что согласуется с предыдущими исследованиями ингибирования FASII (рис. 4 ). Д ). Таким образом, эти наблюдения демонстрируют, что UFA, связанные со сложным эфиром хозяина, высвобождаются Geh-опосредованным гидролизом эфира и могут функционально компенсировать ауксотрофию BCFA в штаммах с интактным аллелем geh .
Рис. 4. СубстратыUFA спасают ауксотрофию BCFA.( A ) 8-часовой рост субкультуры (log 10 КОЕ/мл) штамма Δ bmfBB :: kan в среде RPMI с добавлением различных 18-углеродных субстратов FA [50 мкМ стеариновой кислоты (18: 0), 50 мкМ олеиновой кислоты (18:1), 50 мкМ линолевой кислоты (18:2), или 16,67 мкМ GTO, или 0,34 мг/мл ЛПНП человека]. ( B ) 8-часовой рост субкультуры (log 10 КОЕ/мл) штамма Δ bmfBB Δ pdhC :: kan только в RPMI или RPMI с добавлением 50 мкМ 18:1 или 50 : 1 :2.( C ) ТСХ анализов активности липазы in vitro, содержащих 400 мкМ субстратов FA [олеиновая кислота (18:1) или GTO] в присутствии или в отсутствие 1 мкМ Geh ± 400 мкМ орлистата. ( D ) Влияние 50 мкМ орлистата на 8-часовой рост субкультур (log 10 КОЕ/мл) штаммов WT и Δ bmfBB :: kan в RPMI с добавлением 50 мкМ GTO или 50 мкМ 18: 1. ( E ) Рост пересева через 8 и 24 ч (log 10 КОЕ/мл) указанных штаммов Δ bmfBB :: kan (Δ bmfBB ) в RPMI с добавлением 50 мкМ олеиновой кислоты :1) или 16.67 мкМ ГТО.
FakB2 требуется для зависимого от UFA роста ауксотрофа BCFA.
S. aureus кодирует два FA-связывающих белка, FakB1 и FakB2 (29). FA, связанные с любым белком, служат субстратом для FA kinase FakA, которая фосфорилирует ацильные цепи FA (29). Эти активированные ацилфосфаты в конечном итоге включаются в мембранные фосфолипиды (14). Хотя оба FA-связывающих белка могут связывать SFA, только FakB2 может связывать UFA (29, 30). Следовательно, мы предсказываем, что Δ bmfBB :: kan мутант нуждается в FakB2 для UFA-зависимого роста в RPMI.Чтобы определить потребность в FA-связывающих белках для роста в RPMI с добавлением 18:1 или 18:2 UFA, мы удалили fakB1 или fakB2 из мутантного штамма Δ bmfBB . Штамм Δ bmfBB :: kan Δ fakB2 , но не Δ bmfBB :: kan :: fakB1 , не реплицировался в субстратах UFA с добавлением RPMI (рис. 5 А ). Этот дефект роста был реверсирован в штамме Δ bmfBB :: kan Δ fakB2 + fakB2 (рис.5 А ). Двойной мутант Δ bmfBB :: kan Δ fakB2 также не реплицировался в среде RPMI с добавлением GTO или LDL (рис. 5 B ). Вместе эти находки подтверждают роль FakB2 в очистке экзогенных НЖК для поддержки роста ауксотрофов BCFA.
Рис. 5.Для использования подложек UFA требуется FakB2. ( A ) Рост субкультуры 8 H (LOG 10 CFU / ML) WT, δ BMFBB :: KAN , δ BMFBB :: KAN Δ FAKB1 , δ BMFBB :: kan Δ fakB2 и Δ bmfBB :: kan Δ fakB2 + fakB2 штаммы только в RPMI или RPMI с добавлением 50 мкМ олеиновой кислоты (18:1) или :2).( B ) 8-часовой рост субкультуры (log 10 КОЕ/мл) Δ bmfBB :: kan и Δ bmfBB :: kan с добавлением штамма Δ0 fakMI 10 мМ IB, 9 мМ 2MB, 9 мМ IV), 0,34 мг/мл ЛПНП человека или 16,67 мкМ GTO.
S. aureus Отображает тканеспецифическую зависимость BCFA во время инфекции у мышей.Мы показали, что мутант Δ bmfBB :: kan дефектен для роста в RPMI, но что рост клеток может быть восстановлен Geh- и FakB2-зависимым образом путем добавления НЖК и триглицеридов, содержащих НЖК.Учитывая, что мутант Δ bmfBB :: kan фенокопирует мутант Δ lipL в отношении дефектов жизнеспособности в бульонной культуре, мы предположили, что мутант Δ bmfBB :: kan также будет скомпрометирован в отношении системных дефектов. поверхностная кожная инфекция у мышей, поскольку FakB2 будет иметь решающее значение для этого преимущества выживания в коже за счет поглощения UFA. С этой целью мы первоначально инфицировали мышей внутривенно или внутрикожно мутантными штаммами WT, Δ fakB1 и Δ fakB2 и отслеживали инфекцию в почках (системные) или поверхностные абсцессы (кожа).Никаких различий в извлеченных КОЕ не наблюдалось (рис. 6 A ). Затем мы заражали мыши внутривенно или внутрикормично с WT, δ BMFBB :: KAN , δ BMFBB :: KAN Δ FAKB2 , а δ BMFBB :: Kan Δ Fakb2 + штаммы fakB2 . Через 96 часов после внутривенной инфекции в почках Δ bmfBB :: kan инфицированных мутантом животных было примерно в 10 000 раз меньше КОЕ, чем у инфицированных WT, в то время как почечные КОЕ Δ bmfBB :: kan Δ Δ Δ Δ Δ Δ Δ инфицированных мутантами животных сократились еще примерно в 10 раз (рис.6 В ). Комплементация двойного мутанта fakB2 восстанавливала почечные КОЕ почти до уровней WT (фиг. 6 B ). Через 120 ч после внутрикожного инфицирования штаммы WT и Δ bmfBB :: kan инфицированы до аналогичных уровней (рис. 6 C ). Однако примерно в 100 раз меньше КОЕ было извлечено из абсцессов животных, инфицированных мутантами Δ bmfBB :: kan Δ fakB2 (рис. 6 C ). Комплементация двойного мутанта fakB2 восстанавливала КОЕ до уровня штаммов WT и Δ bmfBB :: kan (рис.6 С ). Различия в инфекционной эффективности этих четырех штаммов отражались в степени тяжести абсцесса через 96 часов после инфицирования (рис. 6 C ). В то время как мы наблюдали четко очерченные дермонекротические абсцессы у животных, инфицированных WT, штаммы Δ bmfBB :: kan и Δ bmfBB :: kan Δ fakB2 + fakB2 , инфекция с the the 9 Штамм : kan Δ fakB2 не вызывал образования абсцесса и проявлял лишь незначительное покраснение в месте инъекции (рис.6 С ). Таким образом, мутант Δ bmfBB :: kan имитирует мутант Δ lipL с точки зрения его дифференциальной инфекционности в моделях мышиного сепсиса и кожных заболеваний. Эти результаты также дополнительно подтверждают важность FakB2 в поддержании инфекции S. aureus , когда синтез BCFA затруднен.
Рис. 6. FakB2 важен для обхода потребности в BCFA во время инфекции S. aureus . ( A ) Бактериальная нагрузка (log 10 КОЕ) в почках мышей через 96 ч после заражения 1 × 10 7 КОЕ WT ( n = 12), Δ fakB1 ( n ) и Δ fakB2 ( n = 12) штаммов; и бактериальная нагрузка (log 10 КОЕ) в абсцессах кожи мышей через 120 ч после заражения 1 × 10 7 КОЕ WT ( n = 8), Δ fakB1 ( n = 8) и Δ fakB2 ( n = 8) штаммов.( B ) Бактериальная нагрузка (log 10 КОЕ) в почках мышей через 96 ч после заражения 1 × 10 7 КОЕ WT ( n = 16), Δ bmfBB :: 4 кан N = 18), δ BMFBB :: KAN δ FAKB2 ( N = 12), а δ BMFBB :: Kan δ FAKB2 + FAKB2 ( N = 8) штаммы. ( C ) Бактериальная нагрузка (log 10 КОЕ) в абсцессах кожи мышей через 120 ч после заражения 1 × 10 7 КОЕ WT ( n = 8), Δ bmfBB 5 0 ::4 kan
N = 8), δ BMFBB :: KAN δ FAKB2 ( N = 8), а δ BMFBB :: Kan δ FAKB2 + FAKB2 ( N = 8 ) штаммов и репрезентативных соответствующих изображений поражений кожи.Значения P были определены с помощью непараметрического однофакторного дисперсионного анализа (критерий Крускала-Уоллиса) с посттестом Данна. *** P < 0,001 и **** P < 0,0001.
Обсуждение
Появляется все больше данных, подтверждающих связь между метаболизмом липоевой кислоты и вирулентностью бактериальных патогенов (31). Действительно, ранее мы определили, что синтез и спасение липоевой кислоты поддерживает колонизацию S. aureus во время инфекции кровотока мышей (5) и ограничивает образование макрофагами активных форм азота и активных форм кислорода в модели инфекции перитонита (32).Мы также обнаружили, что зависимое от автолиза высвобождение S. aureus lipoyl E2-PDH подавляет активацию макрофагов, противодействуя передаче сигналов Toll-подобного рецептора (TLR) 1/2 (33). Тем не менее, относительный вклад метаболических процессов, зависящих от липоевой кислоты, в инфекцию S. aureus не изучался. Здесь мы представляем доказательства того, что BCODH, который превращает трансаминированные аминокислоты с разветвленной цепью в предшественники для синтеза BCFA, возможно, является наиболее важным ферментным комплексом для оптимального S.aureus у мышей во время системного заболевания, но не инфекции кожи и мягких тканей. Подобная тканеспецифическая потребность в LipL привела нас к выводу, что НЖК хозяина могут восстанавливать ауксотрофию BCFA в коже и, в более широком смысле, обходить потребность в липоевой кислоте для эффективной инфекции S. aureus .
Ранее мы обнаружили, что штамм S. aureus , дефектный по спасению липоевой кислоты (Δ lplA1 Δ lplA2 ), заметно ослаблен в почках системно инфицированных мышей (5).Таким образом, спасение липоевой кислоты играет важную роль для выживания в этом органе, несмотря на интактный путь синтеза de novo. Возможно, это связано с более низкой экспрессией ферментов синтеза липоевой кислоты или более высокой потребностью в липоиловых белках в почках. Тем не менее, учитывая результаты этого исследования, мы постулируем, что липоевая кислота необходима в почках для увеличения активности BCODH, поскольку S. aureus , по-видимому, не может получать достаточное количество НЖК из почечной среды. Однако наши данные не исключают альтернативной возможности того, что другие ферменты, содержащие липоевую кислоту, также могут быть необходимы для выживания в почках, а именно E2-PDH.В настоящее время мы проверяем эту гипотезу.
Для получения BCFA синтезированные BCODH предшественники в виде ацил-КоА с короткой разветвленной цепью удлиняются с помощью FASII. Поскольку этот путь не обнаружен у млекопитающих, которые используют FASI (34), ферменты FASII считались отличными мишенями для антибактериальных препаратов. К ним относятся ингибиторы FabI (триклозан, AFN-1252 и MUT056399) (9, 35, 36), FabF (платенсимицин и фазамицины A и B) (37, 38) и FabH (амикомицин) (39). В то время как препараты против FASII остаются мощными антимикобактериальными агентами из-за нехватки экзогенных ЖК с очень длинной цепью, специфичных для представителей этого рода (40), позже было обнаружено, что Firmicutes, такие как стафилококки и стрептококки, способны использовать НЖК хозяина для уклонения от FASII. ингибирование (11⇓–13).Таким образом, наши результаты еще больше подчеркивают сложную адаптивную черту приобретения отказоустойчивой системы для поддержания мембранного гомеостаза в отсутствие BCFA.
В этом исследовании мы продемонстрировали, что свободная или триглицеридная форма НЖК и ЛПНП человека способна оживлять клетки с дефицитом BCFA в бульонной среде. Однако предыдущие исследования показывают, что большинство НЖК проявляют мощную противомикробную активность в отношении S. aureus , искажая структуру мембраны (18, 41, 42). Например, в то время как 18:1 можно напрямую включить в S.aureus , позволяя бактериям обходить FASII, 16:1 и 18:2 запускают деполяризацию мембраны и высвобождение низкомолекулярных белков из клеток (41). Чтобы противодействовать этим вредным эффектам, S. aureus гидратирует 16:1 и 18:2 до нетоксичных гидрокси-16:0 и гидрокси-18:1, соответственно, с олеатгидратазой, OhyA (43), или удлиняет 16:1. двумя углеродными единицами для ассимиляции в мембранные липиды (41). Продукция поверхностного белка IsdA S. aureus также снижает его клеточную гидрофобность, что, в свою очередь, придает устойчивость к бактерицидному действию кожных ЖК (44).Кроме того, S. aureus секретирует ферменты, модифицирующие ЖК, которые этерифицируют свободные ЖК холестерином или короткоцепочечными спиртами для инактивации этих цитотоксических соединений (45). Кроме того, сопутствующее присоединение НЖК к липопротеинам делает S. aureus восприимчивыми к иммунному ответу TLR2 (46). Такие механизмы детоксикации, вероятно, задействованы в наших исследованиях, что позволяет включать менее вредные НЖК, такие как 18:1 и гидрокси-18:1, чтобы способствовать выживанию кожи.
Предыдущие исследования по адаптации к антибиотикам против FASII выявили штаммозависимую изменчивость в ассимиляции ЖК хозяина (10⇓⇓–13, 25⇓⇓–28).Используя ауксотрофные мутанты BCFA, мы не наблюдали таких изменений после добавления свободных НЖК, но обнаружили дефекты роста при добавлении GTO при использовании штаммов, которые содержат фаговое разрушение в гене geh . Приблизительно 15% секвенированных изолятов содержат это нарушение, поэтому наше текущее исследование предполагает, что присутствие или отсутствие geh может иметь биологически значимые последствия для пищевой адаптации в дополнение к ранее описанным эффектам на иммунную функцию (47).RN6390, производное штамма 8325 (48, 49), был единственным штаммом, демонстрирующим заметную задержку утилизации НЖК после делеции bmfBB . Это может быть связано с известными генетическими вариациями в этой линии, которые влияют на fakB1 , среди других регуляторных и метаболических локусов (10, 11, 49). Тем не менее, наши результаты утверждают, что ассимиляция свободных НЖК ауксотрофами S. aureus BCFA, вероятно, сохраняется, тогда как способность использовать триглицериды предсказывается статусом гена geh .
Наш комбинированный подход генетических исследований и исследований на животных подтверждает модель, согласно которой FakB2 отвечает за связывание экзогенных НЖК, что позволяет S. aureus переносить лечение против FASII (11, 29, 30). Мы резюмировали эффекты этого класса препаратов, ориентируясь на синтез BCFA и генетически нарушая активность BCODH, и определили, что делеция fakB2 отменяет компенсаторную роль НЖК хозяина в поддержании роста и инфекционности клеток с дефицитом BCFA.Примечательно, что в то время как хромосомная комплементация fakB2 в мутанте Δ bmfBB :: kan Δ fakB2 восстанавливала колонизацию до уровней WT во время мышиной кожной инфекции (рис. 6 C ), комплементированный мутантный мутант почек лучше, чем мутант Δ bmfBB при системной инфекции (фиг. 6 B ). Мы приписываем этот результат конститутивной экспрессии комплементарного fakB2 , что, вероятно, повышает включение НЖК хозяина и усиливает почечную инфекцию.Поскольку для синтеза 12-метилтетрадекановой кислоты (антеизо-15:0), основного вида BCFA, обнаруженного в мембране S. aureus , требуется BCODH, способность мутанта Δ bmfBB расти в присутствии НЖК подтверждает эту точку зрения. что предпочтительное занятие anteiso-15:0 в положении sn -2 фосфатидилглицерина может быть преодолено, чтобы подорвать эффективность против FASII (11–13, 27, 28, 50). Таким образом, результаты наших исследований подчеркивают важность среды хозяина в создании адаптивной ниши для выживания и синергический потенциал блокирования включения FA хозяина и синтеза FA de novo в качестве терапевтического подхода к стафилококковым инфекциям.
Материалы и методы
Бактериальные штаммы и условия роста.
Все бактериальные штаммы, используемые в этой рукописи, перечислены в SI, Приложение , Таблица S1. штамма E. coli обычно выращивали в лизогенном бульоне Миллера (BD), тогда как штамма S. aureus выращивали либо в трипсиново-соевом бульоне (BD), либо в среде RPMI (Corning) с добавлением 1% казаминокислот (VWR). . При необходимости в культуры добавляли следующие агенты для селекции: 100 мкг ⋅ мл -1 ампициллин (GoldBio), 10 мкг ⋅ мл -1 хлорамфеникол (Amresco), 150 мкг ⋅ мл -1 канамицин (Amresco). ), и 0.1 мМ хлорид кадмия (Alfa Aesar). Следующие субстраты FA использовались для различных анализов на протяжении всего исследования: 10 мМ IB (Sigma-Aldrich), 9 мМ 2-метилмасляной кислоты (Alfa Aesar), 9 мМ IV (Sigma-Aldrich), 50 мкМ пальмитиновой кислоты (MP Biomedicals). , 50 мкМ пальмитолеиновой кислоты (Sigma-Aldrich), 50 мкМ стеариновой кислоты (MP Biomedicals), 50 мкМ олеиновой кислоты (Sigma-Aldrich), 50 мкМ линолевой кислоты (VWR), 16,67 мкМ глицерилтрипальмитата (Sigma-Aldrich), 16,67 мкМ глицерилтриолеат (Sigma Aldrich), 0,34 мкг/мкл очищенного ЛПНП человека (Kalen Biomedical) и 50 мкМ орлистата (Alli, GlaxoSmithKline).
Модели мышиной инфекции.
Мышиные инфекции и инфекции кожи и мягких тканей были выполнены как описанные ранее (5, 51) с WT, δ Lipl , δ GEH , δ Lipl δ GEH , δ Lipa δ lpla1 Δ lpla2 , δ fakb1 , δ fakb2 , δ bmfbb , δ bmfbb :: kan , δ bmfbb :: kan δ fakb2 , а δ bmfbb :: kan δ fakB2 + fakB2 штаммов.
Определение липоилирования белков.
Белки из лизатов цельных клеток, нормализованных по оптической плотности (OD), разделяли с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) в 12% полиакриламидных гелях при 120 В. Разделенные белки переносили из гелей в поливинилидендифторид Immobilon 0,2 мкм. мембран (Millipore Sigma) при 100 В в течение 30 мин в блоттере Criterion (Bio-Rad). После переноса мембраны инкубировали в течение 1 ч в трис-буферном солевом растворе + 0.1% TWEEN 20 (Amresco) (TBST) с добавлением 5% бычьего сывороточного альбумина (BSA) (GoldBio). К мембранам добавляли кроличье поликлональное антитело к α-липоевой кислоте (Calbiochem) в разведении 1:7500 с последующей инкубацией в течение 1 часа и тремя последующими 15-минутными промываниями в ~20 мл TBST. Затем добавляли конъюгированный щелочной фосфатазой (AP) козий антикроличий IgG (H+L) (Invitrogen) в разведении 1:5000 в 5% BSA в TBST на 45 минут с последующими тремя 15-минутными промываниями в ~20 мл TBST. и еще 5 минут промывают буфером AP (100 мМ трис, pH 9.5, 100 мМ NaCl, 5 мМ MgCl 2 ). Мембраны проявляли с субстратом для проявления цвета 5-бром-4-хлор-3-индоилфосфат/нитросиний тетразолий (GoldBio).
Поколение штаммов Δ
bmfBB::kan и Δ bmfBB .Кассету устойчивости к канамицину, aphA3 , амплифицировали из плазмиды pBTK (52) с парами праймеров kanF-KasI и kanR-KasI ( SI, Приложение , таблица S2) с последующим субклонированием в pIMAY, содержащую ~500- пары оснований выше и ниже области гомологии, которые фланкируют ген bmfBB с использованием сайта рестрикции KasI, введенного между двумя фланкирующими областями (53).Мутагенез проводили, как описано ранее (5). Неотмеченное внутрикадровое удаление bmfBB также было сгенерировано тем же методом, но без использования aphA3. Отсутствие каких-либо вторичных мутаций подтверждено полногеномным секвенированием.
Поколение штаммов Δ
lipL Δ geh и Δ bmfBB Δ pdhC .отмечены δ GEH :: KAN и δ PDHC и δ PDHC :: kan Мутации были переведены в δ штаммы и δ BMFBB , соответственно, как описано ранее (5), для генерации δ lipL Δ geh и Δ bmfBB Δ pdhC .
Поколение Δ
lipL Δ geh + Geh Штаммы.Конструкцию pJC1112- geh (47) трансдуцировали в штамм Δ lipL Δ geh , как описано ранее (5).
Поколение штаммов Δ
fakB1 и Δ fakB2 .В общей сложности из геномной ДНК WT S. aureus было амплифицировано около 500 пар оснований гомологии выше и ниже генов fakB1 и fakB2 (список праймеров приведен в SI Приложение , Таблица S2).Ампликоны использовали в ПЦР сплайсинга путем удлинения с перекрытием (SOE) для получения конечного ампликона, который субклонировали в плазмиду pIMAY (53). Мутагенез проводили, как описано ранее (5).
Генерация RN4220 δ
BMFBB :: Kan :: Kan , RN6390 δ BMFBB :: Kan , Newman Δ BMFBB :: Kan , Col Δ BMFBB :: Kan , BK2395 Δ bmfBB :: kan , Δ bmfBB :: kan Δ fakB1 , and Δ bmfBB :: kan Δ 0Мутацию Δ bmfBB :: kan трансдуцировали в указанные штаммы S. aureus , как описано ранее (5).
Генерация Δ
bmfBB :: kan Δ fakB2 + fakB2 Штамм.Штамм Δ bmfBB :: kan Δ fakB2 + fakB2 был получен с использованием плазмиды pJC1111 (54). Используя праймеры, перечисленные в SI Приложение , Таблица S2, ген fakB2 был амплифицирован из WT S.aureus , а конститутивный промотор P HELP амплифицировали из плазмиды pIMAY (53). Полученные ампликоны подвергали SOE-ПЦР с получением P HELP — fakB2 , который был клонирован в pJC1111 по сайтам рестрикции PstI и SalI. Рекомбинантную конструкцию размножали в штамме E. coli DH5-α и трансформировали в штамм S. aureus (RN9011), экспрессирующий SaPI-1-интегразу, для обеспечения однокопийной интеграции сайта SaPI-1 в хромосому (54, 55).Бактериофаг Φ-11 использовали для упаковки интегрированной комплементационной плазмиды из RN9011 и впоследствии трансдуцировали в штамм Δ bmfBB :: kan Δ fakB2 . Трансдуктанты Δ bmfBB :: kan Δ fakB2 + fakB2 были выбраны на основе устойчивости к хлориду кадмия и подтверждены с помощью ПЦР.
Анализ жизнеспособности бактерий.
Штаммы S. aureus выращивали в среде RPMI, содержащей BCFAP и 10 мМ NaAc (Sigma-Aldrich), в течение ночи при 37 °C при встряхивании.Бактерии трижды промывали и ресуспендировали в том же объеме свежей RPMI перед пересевом 1:100 в 990 мкл той же среды с добавлением любого из вышеупомянутых субстратов ЖК в 15-мл коническую пробирку при 37°С при встряхивании в течение 24 ч. . Жизнеспособность бактерий оценивали путем подсчета КОЕ на трипсиново-соевом агаре.
Очистка Geh-6xHis.
Geh-6xHis очищали, как описано ранее (47).
Анализ активности орлистата.
Для оценки ингибирующей активности орлистата в отношении Geh проводили реакции 500 мкл при 37 °C в фосфатно-солевом буфере с 400 мкМ субстрата FA (олеиновая кислота или глицерилтриолеат), 1 мкМ Geh-6xHis и 400 мкМ орлистат в течение 6 часов.Всего 5 мкл каждой реакции наносили на тонкослойную хроматографию (ТСХ) Silica gel 60 с концентрирующей зоной 20 × 2,5 см (Merck). Пластину для ТСХ проявляли смесью гексан (Fisher): этиловый эфир (VWR): уксусная кислота (Fisher) (80:20:2), как описано ранее (56).
Заявление об этике.
Все эксперименты проводились в соответствии с этическими стандартами Институционального комитета по биобезопасности и Институционального комитета по уходу и использованию животных (IACUC) Отделения медицинских наук Чикагского университета Лойолы.Учреждение одобрено Службой общественного здравоохранения (PHS; A3117-01 до 28.02.2022), полностью аккредитовано Международной ассоциацией по оценке и аккредитации по уходу за лабораторными животными (000180, сертификация от 17.11.2016) и зарегистрирован/лицензирован Министерством сельского хозяйства США (USDA) (33-R-0024 до 24.08.2023). Все эксперименты на животных проводились в помещениях с уровнем биобезопасности животных 2 с протоколами, утвержденными IACUC (IACUC № 2017028) под руководством Управления по защите лабораторных животных в соответствии с политикой и рекомендациями Министерства сельского хозяйства США и PHS по гуманному уходу и использованию лабораторных животных.
Количественный и статистический анализ.
Все эксперименты были повторены не менее трех раз независимо друг от друга. Для анализов роста in vitro представленные данные представляют собой репрезентативные эксперименты, проведенные в трех повторностях, которые повторялись как минимум в трех независимых случаях. Вся статистическая значимость была проанализирована с использованием GraphPad Prism версии 9.0 со статистическими тестами, указанными в подписях к рисункам. Все исследования на животных включают объединенные данные как минимум двух независимых экспериментов.
Доступность данных
Все данные исследования включены в статью и/или Приложение SI .
Благодарности
Мы благодарим сотрудников лаборатории за полезные обсуждения и критический обзор рукописи. Это исследование было поддержано грантами NIH R01 AI120994 и премией Burroughs Wellcome Fund Investigators in the Pathogenesis of Infectious Disease Award для FA, AHA19POST34380259 для WPT и AHA19PRE34400022 для XC.
Сноски
Вклад авторов: В.PT, XC и FA разработали исследование; WPT, XC, IL и FA провели исследование; В.П.Т. и Ф.А. проанализировали данные; и W.P.T. и Ф.А. написал статью.
Авторы заявляют об отсутствии конкурирующих интересов.
Эта статья является прямой отправкой PNAS.
Эта статья содержит вспомогательную информацию в Интернете по адресу https://www.pnas.org/lookup/suppl/doi:10.1073/pnas.2022720118/-/DCSupplemental.
Метициллин-резистентный золотистый стафилококк (MRSA) | Фонд муковисцидоза
MRSA и CF
Метициллин-резистентный Staphylococcus aureus может ухудшить заболевание легких.В исследовании 2010 года, опубликованном в Журнале Американской медицинской ассоциации (JAMA), рассматривались легочные инфекции MRSA у людей с муковисцидозом. Исследователи обнаружили, что наличие MRSA в легких более двух лет может повлиять на выживаемость. Однако многое еще предстоит узнать о MRSA. Это включает в себя то, как он влияет на людей с муковисцидозом, и лучшие методы лечения инфекций легких, вызванных MRSA.
Как это распространяется
MRSA может передаваться от одного человека к другому через случайный контакт или через контакт с предметами, которые были покрыты бактериями.
Если MRSA находится в легких, он может распространяться через крошечные капли жидкости, когда человек кашляет, чихает или смеется. Он также может распространяться от предметов, которые касаются рта.
Если MRSA находится на коже, он может распространяться через кожный контакт с другими людьми, например, со спортсменами, играющими в футбол или борющимися.
Снижение риска
Лучший способ защитить себя или своего ребенка от MRSA — это использовать основные методы профилактики и контроля инфекций, включая следующие.
- Держите руки в чистоте, часто мойте их. Используйте мыло и воду или гель для рук на спиртовой основе.
- Кожные инфекции, вызванные MRSA, распространяются в основном при контакте кожа-к-коже и при прикосновении к поверхностям, которые соприкасались с чужой инфекцией. Вот почему так важно тщательно мыть руки, чтобы не заразиться MRSA.
- Кашель в салфетку. Выброси это. Затем тщательно вымойте руки, чтобы предотвратить распространение микробов.
- Не делитесь личными вещами.К ним относятся предметы, которые соприкасаются с вашим ртом или голой кожей, в том числе:
- Чашки
- Небулайзеры
- Зубные щетки
- Полотенца
- Бритвы
- Закрывайте царапины или порезы кожи чистой сухой повязкой до заживления.
- При использовании тренажеров:
- Очистите поручни, поручни, панели управления и другие детали оборудования до и после использования. Очистите дезинфицирующим средством или чистящим средством на спиртовой основе.Многие тренажерные залы предоставляют материалы, чтобы вы могли почистить оборудование.
- Используйте барьер. Поместите одежду или полотенце между кожей и общим тренажером.
Диагностика MRSA
Ваша команда по уходу за муковисцидозом может сообщить вам, есть ли у вас или у вашего ребенка MRSA в легких. MRSA может быть одним из микробов, которые лаборатория может обнаружить, исследуя культуру мокроты определенным образом. Спросите у своей лечащей бригады о результатах последнего посева из горла или мокроты.
Большинство кожных инфекций представляют собой несерьезные фурункулы и абсцессы. Однако случаются более серьезные инфекции, которые могут быть вызваны MRSA. Если у вас незаживающая кожная инфекция, как можно скорее обратитесь к своему лечащему врачу.
Если у вас или у вашего ребенка есть MRSA, поговорите со своей командой по уходу за CF о том, следует ли вам уведомлять об этом свое рабочее место или школу.
Загрузите последнюю версию реестра пациентов Фонда CF, чтобы узнать, сколько людей с муковисцидозом инфицированы MRSA.
Исследование MRSA
Среди бактерий, вызывающих инфекцию легких у людей с муковисцидозом, MRSA становится все более распространенным среди больных муковисцидозом.В настоящее время он обнаруживается примерно у 25% людей с этим заболеванием. MRSA устойчив ко многим антибиотикам, и легочные инфекции, вызванные бактериями, часто становятся длительными.
Чтобы решить эту серьезную проблему, фонд CF Foundation в течение ряда лет отслеживал количество людей с муковисцидозом, инфицированных MRSA. Фонд CF также ужесточил свои правила инфекционного контроля, чтобы ограничить распространение этих бактерий.
Фонд поддерживает клинические исследования для оценки новых методов лечения, которые могут быть нацелены на MRSA.Эта работа включает исследования нового ингаляционного антибиотика для лечения людей с муковисцидозом, которые имеют длительную инфекцию MRSA.
Успешное лечение хронических дерматозов, связанных с золотистым стафилококком, с помощью местного эндолизина Staphefekt SA.100: отчет о 3 случаях — полный текст — отчеты о клинических случаях в дерматологии 2017, Vol. 9, № 2
Аннотация
Staphylococcus aureus играет важную роль в инфекциях кожи и мягких тканей и способствует патофизиологии сложных кожных заболеваний, таких как атопический дерматит.Резистентность бактерий к обычно используемым антибиотикам значительно возросла за последние десятилетия, что требует альтернативных подходов к лечению. Мы представляем 3 случая успешного лечения пациентов с хроническими и рецидивирующими S. aureus дерматозами, вызванными S. aureus , с помощью Staphefekt SA.100. Staphefekt SA.100 представляет собой рекомбинантный фаговый эндолизин для местного применения на коже, который целенаправленно воздействует как на метициллин-чувствительные, так и на метициллин-резистентные штаммы S. aureus. Вследствие его специфического механизма действия маловероятно развитие бактериальной резистентности.В наших 3 случаях индукции резистентности не наблюдалось. Наши результаты показывают, что целенаправленное лечение Staphefekt может быть привлекательной альтернативой (долгосрочной) классической антибиотикотерапии, и необходимы подтверждающие рандомизированные контролируемые исследования для оценки его клинической эффективности и безопасности.
© 2017 Автор(ы). Опубликовано S. Karger AG, Базель
Введение
Staphylococcus aureus является наиболее распространенным микробом, вызывающим инфекции кожи и мягких тканей, и вносит вклад в патофизиологию сложных кожных заболеваний, таких как атопический дерматит [1-3].Поскольку устойчивость к классическим антибиотикам быстро развивается, крайне необходимы альтернативные варианты лечения [4-6]. Staphefekt SA.100 представляет собой рекомбинантный фаговый эндолизин для местного применения на коже, который специфически связывается с клеточной стенкой S. aureus и расщепляет связи в стенке пептидогликана, что приводит к гибели бактериальной клетки [7]. Исследования in vitro показали, что Staphefekt нацелен исключительно на S. aureus , не затрагивая другие (комменсальные) кожные бактерии.Индукции резистентности не наблюдалось и также не ожидается из-за его специфического механизма действия [7-9]. Staphefekt в настоящее время зарегистрирован как медицинское устройство (класса 1) в Европе и доступен в виде крема на основе цетомакрогола и в виде геля для безрецептурного лечения. Доказательства его клинической эффективности в настоящее время основаны только на анкетных исследованиях и отзывах пациентов (таблица 1) [8–10]. В этом сообщении мы описываем 3 случая трудно поддающихся лечению хронических или рецидивирующих дерматозов, связанных с S. aureus , требующих антибактериальной терапии, которые были успешно вылечены с помощью Staphefekt SA.100 в нашей клинике.
Таблица 1.
Обзор исследований in vitro и клинических исследований Staphefekt
Описание случая
Случай 1
Первый пациент — мужчина 23 лет с остеосаркомой в 16 лет и вульгарными угрями в анамнезе. лица и туловища. У него была обширная папуло-пустулезная сыпь на туловище, соответствующая бактериальному фолликулиту. Последовательное эмпирическое лечение кларитромицином в дозе 500 мг один раз в день в сочетании со скрабом с бетадином привело к умеренному улучшению.Однако после прекращения лечения симптомы рецидивировали в течение 3 дней. Принимая во внимание нежелание пациента постоянно использовать пероральные антибиотики и после обсуждения альтернативных вариантов лечения (как по показаниям, так и не по назначению), наш пациент решил попробовать короткий курс Staphefekt. Он наносил крем два раза в день на пораженные участки кожи в течение 2 недель. При повторном посещении он сообщил о сильном уменьшении воспалительных симптомов, которые начались в течение нескольких дней. Это побудило нас к дальнейшему исследованию клинического эффекта Staphefekt с использованием клинических фотографий и бактериальных культур в этом и двух других случаях.Через неделю после того, как он прекратил лечение Staphefekt, папулы и пустулы возобновились и были похожи на исходные (посещение 1; рис. 1a). Staphefekt возобновляли два раза в день, что снова приводило к явному уменьшению количества папул и пустул, наблюдаемому через 4 недели (посещение 2). Это улучшение продолжалось до визита 3 еще через 4 недели (рис. 1b). Посев из носа показал стойкое носительство S. aureus . Посев кожи брали только при 2-м и 3-м посещениях с положительным результатом при 3-м посещении.Через 2 месяца (посещение 4) была взята дополнительная культура кожи для определения минимальных ингибирующих концентраций Staphefekt. Минимальные ингибирующие концентрации культивируемого штамма S. aureus на визитах 3 и 4 были стабильными, что свидетельствует об отсутствии резистентности при длительной ежедневной терапии.
Рис. 1.
Фолликулит. и Базовый уровень; обширные фолликулярные папулы и пустулы. b Через 8 недель; несколько фолликулярных папул, поствоспалительная гиперпигментация и рубцевание.
Случай 2
У второго пациента, 63-летнего мужчины, была диагностирована вторичная бактериальная инфекция (импетиго) нуммулярной экземы, преимущественно на лице и конечностях. Диагноз был подтвержден гистопатологией и культивированием S. aureus из очага поражения. Лечение кларитромицином по 250 мг 2 раза в сутки в течение 7 дней в сочетании с местным кремом с фузидиевой кислотой не привело к клиническому улучшению. Пероральный прием преднизолона по 30 мг 1 раз в сутки в течение 2 недель в сочетании с флуклоксациллином по 500 мг 4 раза в сутки в течение 7 дней привел к клиническому улучшению.Однако через 2 дня после прекращения лечения симптомы возобновились (рис. 2а). После обсуждения альтернативных вариантов лечения на пораженные участки кожи лица и конечностей наносили 2 раза в сутки крем Стафефект, дополнительно 1 раз в сутки конечности обрабатывали бетаметазоновой мазью. Пациент сообщил об улучшении суперинфекции в течение 1 недели. Его симптомы не повторялись в течение периода лечения более 12 недель (рис. 2b), и он не сообщал о каких-либо побочных эффектах.Хотя суперинфекция исчезла, основная экзема на конечностях осталась. Его экзема постепенно улучшилась после того, как лечение бетаметазоновой мазью было заменено мазью такролимуса 0,1% в дегте 10% (solutio carbonis detergens) через 1 месяц. Культуры с поражений кожи лица и носа, собранные в начале исследования, а также через 6 и 12 недель лечения, были положительными на S. aureus.
Рис. 2.
Нумулярная экзема с вторичной инфекцией. и Базовый уровень; эритематозно-сквамозные нуммулярные поражения с образованием сливных бляшек, покрытых корками и отечностью уха. б Шесть недель спустя; очень легкая эритематозная макула с минимальным шелушением.
Случай 3
Третий случай — 23-летний мужчина с бактериальным фолликулитом нижних конечностей. S. aureus был выделен из пустулы, а также из его носа и промежности. У больного диагностирована нуммулярная экзема преимущественно на конечностях, которая на момент обращения была активной.Его история болезни включала атрезию желчевыводящих путей, за которой последовала трансплантация печени и хроническое использование пероральных иммунодепрессантов. Для лечения экземы были назначены местные кортикостероиды класса 2–3, местный такролимус и смягчающее средство. Фолликулит лечили кремом с фуцидовой кислотой для местного применения, пероральным флуклоксациллином в течение 1 недели и скрабом с бетадином, что привело к улучшению симптомов. Обострение 6 месяцев спустя с фолликулярными пустулами на голенях было снова пролечено флуклоксациллином, но через 2 месяца фолликулит снова рецидивировал, включая расширенные перифолликулярные пустулы, которые превратились в большие сливающиеся бляшки на голенях (посещение 1).После обсуждения альтернативных вариантов лечения мы начали местное применение Staphefekt два раза в день. Три недели спустя (посещение 2) он сообщил о значительном улучшении своих симптомов, начавшемся через 4 дня после начала лечения. Клиническое обследование в это время показало оставшиеся обширные экзематозные поражения, но пустулы явно отсутствовали, а покраснение поражений значительно уменьшилось. При продолжении лечения сообщалось о дальнейшем улучшении состояния экземы и отсутствии пустул через 1 месяц.При посещении через 3, 2 месяца было сообщено об усилении экземы. Вероятно, это было связано с отсутствием приверженности лечению, поскольку наш пациент непоследовательно использовал кортикостероидный крем, мазь такролимуса и эмоленты. На ногах были выявлены сухие экзематозные поражения и поствоспалительная гиперпигментация. Однако пустул по-прежнему не было. Культуры кожи, взятые при визитах 1, 2 и 3, были положительными на S. aureus .
Обсуждение
В этой серии случаев описывается успешное лечение S.aureus-, связанные с дерматозами, с антибактериальным эндолизином, который в настоящее время доступен в качестве безрецептурного медицинского устройства. У всех 3 пациентов были рецидивирующие инфекции S. aureus , несмотря на адекватное лечение антибиотиками. Атопическая предрасположенность и назальное носительство S. aureus , вероятно, способствовали хронизации их симптомов [2, 3, 11]. Несмотря на улучшение симптомов у этих пациентов, S. aureus все еще культивировались с их кожи во время и после лечения Staphefekt.Мы считаем, что Staphefekt вызывает клинически значимое снижение S. aureus , а не полную эрадикацию. Кроме того, хорошо известно, что поражения кожи могут быстро реколонизироваться из-за постоянного воздействия S. aureus из носа и окружающей среды. По-видимому, полная и устойчивая эрадикация не является необходимой для достижения клинически значимого улучшения при местном лечении на основе эндолизина. Поскольку результаты наших культур носят только качественный характер, будущие исследования должны дополнительно изучить влияние Staphefekt на S.aureus и состав микробиома с использованием количественных методов и технологий секвенирования.
Клинические симптомы быстро возобновились как после прекращения приема антибиотиков (случаи 1 и 2), так и после прекращения приема антибиотиков (случаи 1), вероятно, из-за быстрой реколонизации S. aureus до клинически значимого состояния. Положительный клинический эффект после возобновления подавления S. aureus с помощью Staphefekt в случае 1 подтверждает эту гипотезу. Параллельная обработка ноздрей в сочетании с обработкой всей поверхности кожи потенциально может еще больше снизить реколонизацию.
Следует отметить, что и импетигинизированная экзема, и фолликулит имеют естественно флюктуирующее течение заболевания, что затрудняет интерпретацию полученных нами данных. Однако все 3 пациента обращались в нашу поликлинику часто с рецидивирующими и непрекращающимися симптомами (несмотря на адекватное лечение) в течение длительного времени еще до начала лечения Стафефектом (10, 3,5 и 13 мес). Это говорит о том, что ремиссия, скорее всего, связана с применением Стафефекта, а не случайностью.
Хотя эта серия случаев ограничена неконтролируемым дизайном, она иллюстрирует местную терапию Staphefekt SA.100 для постоянного подавления S. aureus может привести к уменьшению и предотвращению клинических симптомов в 3 случаях кожных заболеваний, связанных с S. aureus-, фолликулита и импетигинизированного дерматита. Важно отметить, что Staphefekt нацелен как на метициллин-чувствительные, так и на метициллин-резистентные S. aureus , но не взаимодействует с комменсальными микробами кожи, а также не ожидается, что он вызовет бактериальную резистентность из-за своего специфического механизма действия [8, 9]. Поэтому его можно рассматривать как достойную альтернативу S.aureus , связанные с поверхностными инфекциями кожи, поскольку классическая (длительная) антибактериальная терапия явно связана с индукцией бактериальной резистентности и другими побочными эффектами [4, 5]. Наблюдаемый положительный клинический эффект Staphefekt в этих случаях обнадеживает, и необходимы дальнейшие исследования его эффективности и безопасности в рандомизированных контролируемых клинических исследованиях.
Заявление об этике
Пациенты, описанные в этом клиническом случае, дали информированное согласие.
Заявление о раскрытии информации
Отделение дерматологии Медицинского центра Университета Эразма MC в Роттердаме получило неограниченный грант от Micreos Human Health, Нидерланды, на проведение клинических исследований с Staphefekt SA.100. Компания Micreos Human Health предоставила пациентам Staphefekt SA.100.
Каталожные номера
- McCaig LF, McDonald LC, Mandal S, Jernigan DB: Staphylococcus aureus-ассоциированные инфекции кожи и мягких тканей при амбулаторном лечении.Emerg Infect Dis 2006; 12: 1715–1723.
- Laureano AC, Schwartz RA, Cohen PJ: Бактериальные инфекции лица: фолликулит. Клин Дерматол 2014; 32: 711–714.
- Брюссов Х. Выворачивая наизнанку: микробиология атопического дерматита.Энвайрон Микробиол 2016; 18: 2089–2102.
- van Bijnen EM, Paget WJ, den Heijer CD, Stobberingh EE, Bruggeman CA, Schellevis FG и др.: Руководящие принципы первичной медико-санитарной помощи при кожных инфекциях в Европе: соответствие с устойчивостью к противомикробным препаратам, обнаруженной у комменсального золотистого стафилококка в сообществе.BMC Fam Pract 2014; 15: 175.
- Всемирная организация здравоохранения: Устойчивость к противомикробным препаратам. Глобальный отчет о эпиднадзоре: Всемирная организация здравоохранения (ВОЗ). 2014 г. http://www.who.int/drugresistance/documents/surveillancereport/en/.
- Hepburn L, Hijnen DJ, Sellman BR, Mustelin T, Sleeman MA, May RD и др.: Комплексная биология и вклад золотистого стафилококка в атопический дерматит, современные и будущие методы лечения.Br J Dermatol 2016, Epub перед печатью.
- Пастагия М., Шух Р., Фишетти В.А., Хуанг Д.Б.: Лизины: появление противоинфекционных средств, направленных против патогенов. J Med Microbiol 2013; 62: 1506–1516.
- Herpers BL, Badoux P, Pietersma F, Eichenseher F, Loessner MJ: Специфический лизис метициллин-чувствительного и устойчивого золотистого стафилококка эндолизином Staphefekt SA.100 тм. Аннотация R144. 24-й Европейский конгресс по клинической микробиологии и инфекционным заболеваниям (ECCMID), Барселона, Испания, 2014 г.
- Herpers BL, Badoux P, Totte JEE, Pietersma F, Eichenseher F, Loessner MJ: Специфический лизис Staphylococcus aureus бактериофагом эндолизином Staphefekt SA.100: исследования in vitro и серия случаев на людях. В: Реферативная книга конференции EuroSciCon, посвященной альтернативам антибиотикам в новом тысячелетии, 5–7 ноября 2014 г., Лондон, Великобритания, стр. 8–9 (по состоянию на 17 мая 2017 г.). Доступно по адресу: http://lifescienceevents.com/wp-content/uploads/AntibioticAlternatives5-7thNovABSTRACTS2014.pdf.
- Totte JEE, van den Boogaard M, Pardo Cortes LM, Pasmans SGMA: Специфическое местное лечение розацеа и акне Staphylococcus aureus с помощью эндолизина Staphefekt SA.100. Аннотация P1212. 24-й Конгресс Европейской академии дерматологии и венерологии, Копенгаген, Дания, 2015 г.
- Wertheim HF, Melles DC, Vos MC, van Leeuwen W, van Belkum A, Verbrugh HA и др.: Роль назального носительства в инфекциях Staphylococcus aureus. Ланцет Infect Dis 2005; 5: 751–762.
- Клинические испытания.gov. Влияние Гладскина на тяжесть заболевания и микробиом кожи, включая золотистый стафилококк, у больных атопическим дерматитом. Идентификатор NCT02840955. Bethesda, Национальная медицинская библиотека, 11 июля 2016 г. (цитируется 17 мая 2017 г.). Доступно по адресу: https://www.Clinictrials.gov/show/NCT02840955.
Автор Контакты
Joan E.E. Totté
Кафедра дерматологии, Медицинский центр Университета Erasmus MC, Роттердам
Burgemeester s’ Jacobplein 51
NL–3015 CA Rotterdam (Нидерланды)
Электронная почта [email protected]
Сюзанна Г.М.А. Pasmans
Отделение детской дерматологии, Детская больница Софии
Университетский медицинский центр Erasmus MC Rotterdam
Wytemaweg 80, NL–3015 CN Rotterdam (The Netherlands)
E-Mail [email protected]
Детали статьи/публикации
Получено: 23 февраля 2017 г.
Принято: 31 марта 2017 г.
Опубликовано онлайн: 22 мая 2017 г.
Дата выхода выпуска: май — август 9000 г.
Количество печатных страниц: 7
Количество фигурок: 2
Количество столов: 1
eISSN: 1662-6567 (в сети)
Для получения дополнительной информации: https://www.karger.com/CDE
Лицензия открытого доступа / Дозировка препарата / Отказ от ответственности
Эта статья находится под лицензией Creative Commons Attribution-NonCommercial 4.0 International License (CC BY-NC). Использование и распространение в коммерческих целях требует письменного разрешения. Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством. Отказ от ответственности: заявления, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и участникам, а не издателям и редакторам.
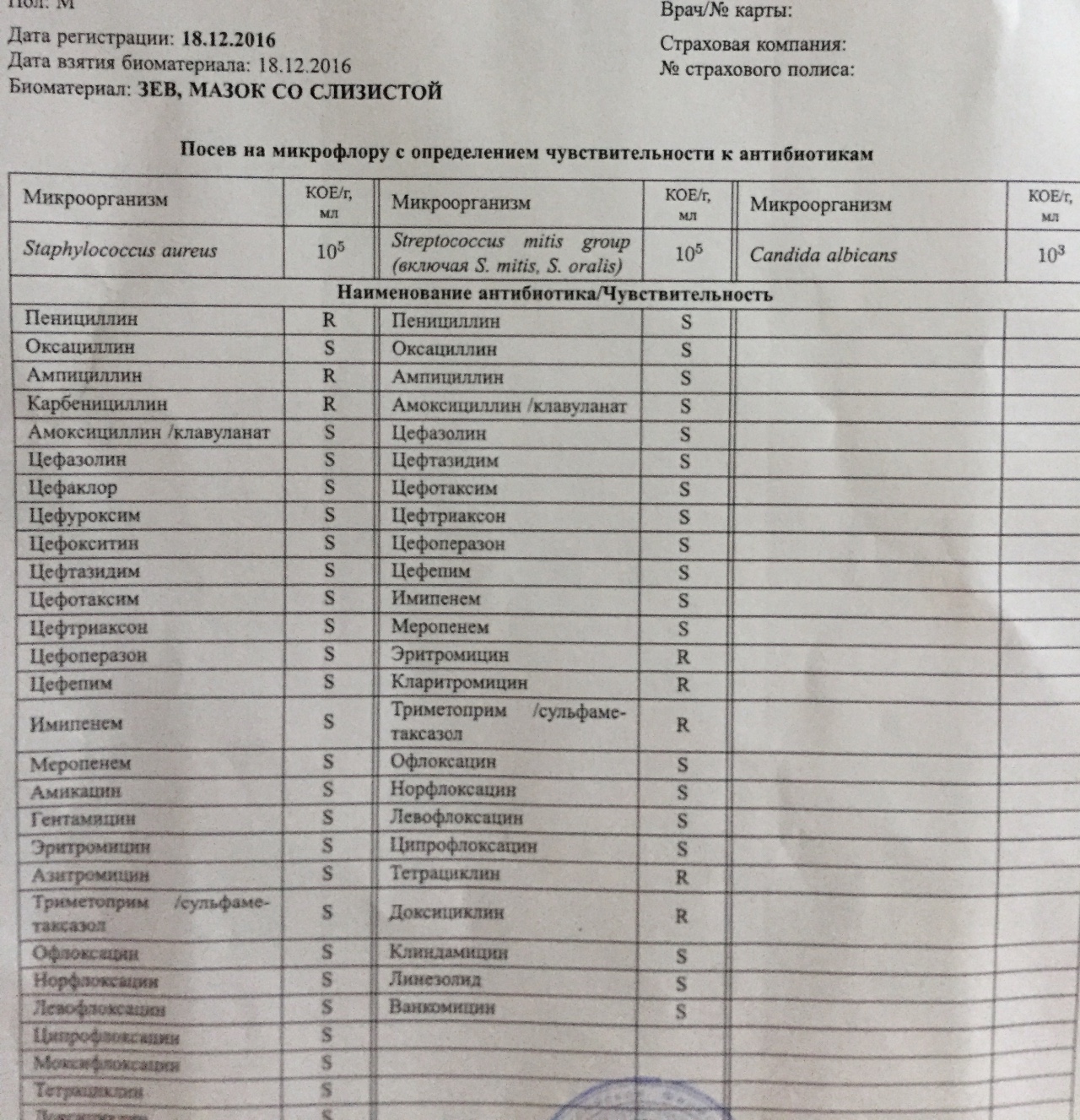 Как еще возникает золотистый стафилококк в горле?
Как еще возникает золотистый стафилококк в горле?




 Подобные лекарства принимают только по назначению специалиста.
Подобные лекарства принимают только по назначению специалиста.
 Достаточно некоторое время побеседовать с инфицированным человеком, чтобы стать новым носителем инфекции.
Достаточно некоторое время побеседовать с инфицированным человеком, чтобы стать новым носителем инфекции.
 Обусловлен воспалением и попыткой организма таким образом избавиться от микроорганизмов.
Обусловлен воспалением и попыткой организма таким образом избавиться от микроорганизмов. Возможна асфиксия. Это опасное осложнение. Требуется неотложная медицинская помощь.
Возможна асфиксия. Это опасное осложнение. Требуется неотложная медицинская помощь. Однако показывает воспалительный процесс со смещением лейкоцитарной формулы в сторону увеличения, повышением скорости оседания эритроцитов.
Однако показывает воспалительный процесс со смещением лейкоцитарной формулы в сторону увеличения, повышением скорости оседания эритроцитов. Препараты выпускаются в форме инъекций.
Препараты выпускаются в форме инъекций.


 Род: стафилококк
Род: стафилококк  1)
1) Хотя описано более 20 видов Staphylococcus в Руководстве Берджи (2001 г.) только Staphylococcus aureus и Staphylococcus epidermidis играют важную роль в их взаимодействии с людьми. S. aureus колонизирует в основном носовые ходы, но может обнаруживаться регулярно в большинстве других анатомических локализаций, включая кожу, ротовую полость и желудочно-кишечный тракт. S epidermidis – обитатель кожи.
Хотя описано более 20 видов Staphylococcus в Руководстве Берджи (2001 г.) только Staphylococcus aureus и Staphylococcus epidermidis играют важную роль в их взаимодействии с людьми. S. aureus колонизирует в основном носовые ходы, но может обнаруживаться регулярно в большинстве других анатомических локализаций, включая кожу, ротовую полость и желудочно-кишечный тракт. S epidermidis – обитатель кожи. Листериевые тоже соседняя семья.
Листериевые тоже соседняя семья. epidermidis отсутствует этот фермент. S. aureus всегда следует рассматривать как потенциальный патоген; большинство штаммов S. epidermidis непатогенны и могут даже играют защитную роль в организме человека как нормальная флора. Стафилококк epidermidis может быть патогеном в больничной среде. Стафилококки представляют собой идеально сферические клетки размером около 1 микрометра. диаметр. Стафилококки растут группами, потому что клетки последовательно делятся в трех перпендикулярных плоскостях, при этом сестринские клетки остаются прикрепленными друг к другу после каждого последующего деления.Поскольку точная точка прикрепления сестринских клеток может не находиться в плоскости деления, и клетки могут немного менять положение, оставаясь прикрепленными, в результате образуется нерегулярное скопление клеток.
epidermidis отсутствует этот фермент. S. aureus всегда следует рассматривать как потенциальный патоген; большинство штаммов S. epidermidis непатогенны и могут даже играют защитную роль в организме человека как нормальная флора. Стафилококк epidermidis может быть патогеном в больничной среде. Стафилококки представляют собой идеально сферические клетки размером около 1 микрометра. диаметр. Стафилококки растут группами, потому что клетки последовательно делятся в трех перпендикулярных плоскостях, при этом сестринские клетки остаются прикрепленными друг к другу после каждого последующего деления.Поскольку точная точка прикрепления сестринских клеток может не находиться в плоскости деления, и клетки могут немного менять положение, оставаясь прикрепленными, в результате образуется нерегулярное скопление клеток.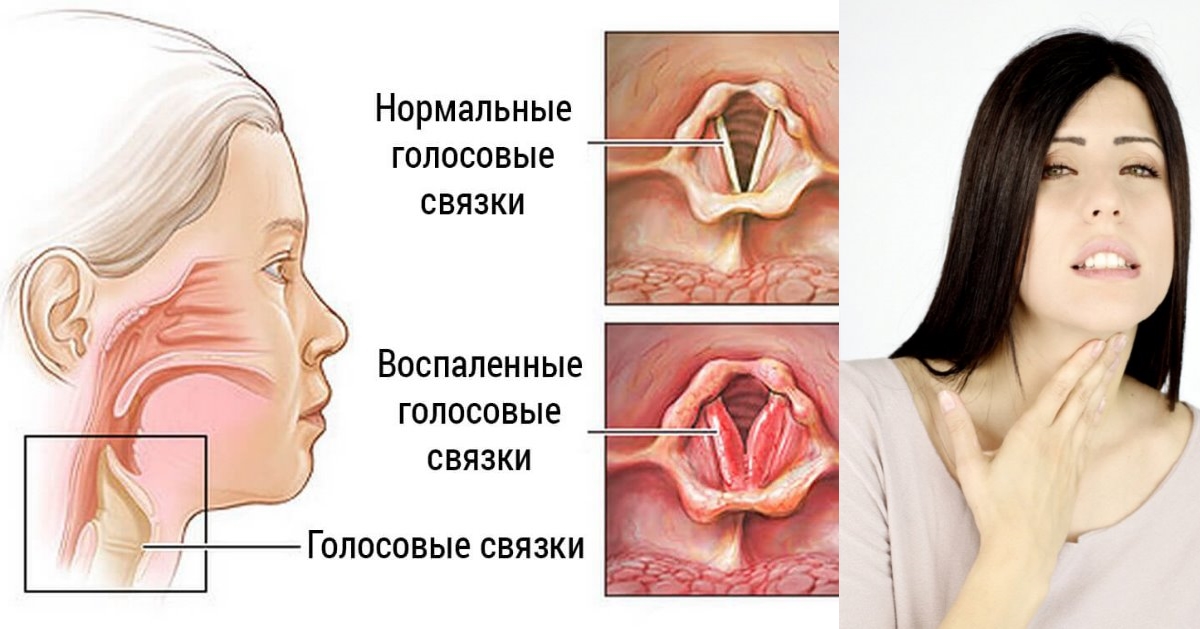
 эпидермальный)
эпидермальный)  textbookofbacteriology.net
textbookofbacteriology.net