Системные васкулиты | Клиническая ревматологическая больница №25
Системные васкулиты – разнородная группа заболевания, в основекоторых лежит воспаление сосудистой стенки. При этом в зависимости от типа пораженного сосуда и характера воспаления, имеет место особенная клиническая симптоматика с поражением разных органов и тканей.
В первую очередь, васкулиты делят на первичные и вторичные.
К вторичным относят то поражение сосудов, которое возникает как
осложнение на фоне активно текущих инфекционных или онкологических заболеваний.
При этом лечение данных форм васкулитов рекомендовано проводить у инфекциониста или онколога до снятия обострения основного процесса. К примеру, часто возникает вторичный васкулит на фоне обострения вирусного гепатита, который
может регрессировать на фоне противовирусной терапии, проводимой инфекционистом. Если успешное лечение основного заболевания не подействовало на проявления васкулита, то тогда необходимо обратиться к ревматологу для дообследования.
Если успешное лечение основного заболевания не подействовало на проявления васкулита, то тогда необходимо обратиться к ревматологу для дообследования.
Первичным же называют то поражение сосудов, которое происходит как самостоятельный процесс. При этом в случаях, когда имеется вариант изолированного поражения кожного покрова (геморрагическая сыпь, пятна, язвы и т.д.) при отсутствии каких-либо других признаков воспаления, необходимо изначально обратиться к дерматологу, который даст все необходимые рекомендации и, при необходимости, направит Вас на обследование к другим специалистам.
Во всех других случаях проявления системных васкулитов необходимо наблюдение у ревматолога.
Этиология системных васкулитов в настоящее время не ясна, однако предполагаемыми факторами риска являются, в первую очередь, инфекции (вирусные, бактериальные и др.), профессиональные вредности. У большинства васкулитов выявлена генетическая предрасположенность.
В зависимости от калибра пораженного сосуда васкулиты подразделяются на три группы:
1. Васкулиты с преимущественным поражением мелкого калибра (капилляры, артериолы, венулы): гранулематозный полиангиит
Васкулиты с преимущественным поражением мелкого калибра (капилляры, артериолы, венулы): гранулематозный полиангиит
(гранулематоз Вегенера), эозинофильный гранулематозный полиангиит (синдром Черджа-Стросс), микроскопический полиангиит, васкулит гиперчувствительности, пурпура Шенлейна — Геноха, болезнь Бехчета, криоглобулинемический васкулит, васкулит при ревматических заболеваниях (СКВ, РA, ССД, болезнь Шегрена), кожный лейкоцитокластический васкулит.
2. Васкулиты с преимущественным поражением среднего калибра: болезнь Кавасаки, узелковый полиартериит.
3. Васкулиты с преимущественным поражением сосудов крупного калибра: гигантоклеточный артериит (болезнь Хортона), артериит Такаясу (неспецифический аортоартериит, синдром дуги аорты).
Соответственно, в зависимости от калибра пораженных сосудов, их локализации и типа поражения возникает определенная клиническая картина.
При этом поражение органов и систем может сопровождаться разнообразными симптомами:
— легкие (кашель, одышка, кровохарканье, эпизоды удушья),
— почки (отеки, повышение артериального давления),
— кожа (высыпания, язвы, побеление и посинение пальцев, язвы в области гениталий, гангрена),
— слизистые (язвочки во рту, высыпания)
— опорно-двигательный аппарат (боли и припухания суставов, мышечные боли),
— глаза (покраснения, боли и рези в глазах, потеря зрения),
— ЛОР-органы (выделения из носа и ушей, снижение слуха и обоняния, носовые кровотечения, осиплость голоса, деформация спинки носа),
— нервная система (судороги, головные боли и головокружение, эпилептические припадки, инсульты, изменения чувствительности, нарушение двигательной функции),
— желудочно-кишечный тракт (боли в животе, диарея, кровь в стуле),
— сердечно-сосудистой системы (боли за грудиной, перебои в работе сердца, повышение АД, отсутствие пульса на руках или ногах) и т.
Также часто встречается повышение температуры тела, похудание, общая слабость. Иногда диагностика системных васкулитов занимает длительное время, так как клинические проявления могут медленно развиваться и быть стертыми.
При лабораторном исследовании часто выявляется ускорение СОЭ, повышение С-реактивного белка, фибриногена, возможен лейкоцитоз. По анализам крови и мочи можно выявить поражение почек (чаще повышение белка, эритроцитов и цилиндров в моче; повышение креатинина и мочевины в сыворотке крови, снижение клубочовой фильтрации).
При иммунологическом исследовании крови при некоторых васкулитах (гранулематозный полиангиит,эозинофильный гранулематозный полиангиит, микроскопический полиангиит) выявляются антинейтрофильные цитоплазматические антитела (АНЦА), что значимо помогает в уточнении диагноза.
Также важное значение имеют инструментальные методы обследования (рентгенография, ультразвуковое исследование, эхокардиография и др.).
Для подтверждения диагноза в большинстве случаев (если это выполнимо) проводят биопсию пораженного органа или ткани с последующим гистологическим и иммуногистохимическим исследованиями.
Для лечения системных васкулитов чаще всего используются
глюкокортикостероиды и цитостатики. При этом для достижения ремиссии проводят курсы «классической» пульс-терапии (3 внутривенных инфузии преднизолона по 1000мг и одна инфузия циклофосфана 1000мг), сеансы плазмафереза, инфузии внутривенного иммуноглобулина. В некоторых случаях используются генно-инженерные биологические препараты, которые назначаются при неэффективности стандартного лечения.
Для постановки диагноза системный васкулит консультация ревматолога является обязательной. При этом самолечение может привести к прогрессированию заболевания и серьезным осложнениям, угрожающим жизни.
Пройти консультацию врача-ревматолога для уточнения диагноза и определения дальнейшей тактики ведения Вы можете у нас в «Клинической ревматологической больнице №25»
Подробности о работе врача-ревматолога и процедуру обращения можно уточнить на сайте.
Евгений Жиляев: «Все системные заболевания, если их не лечить, укорачивают жизнь» | BrandVoice
Системные воспалительные болезни условно делятся на аутовоспалительные и аутоиммунные. При аутоиммунных заболеваниях иммунная система целенаправленно атакует собственные системы организма. При аутовоспалительных заболеваниях возникает воспаление, которое не может само остановиться. Воспаление — как огонь, это самоподдерживающийся процесс. У нашего организма есть специфические механизмы для его автоматического тушения. Если эти механизмы нарушены, то воспалительный процесс может принимать системный характер, при котором он может саморазгораться, но не тушиться. В таком случае возникает группа болезней, которые называются аутовоспалительными. Эти болезни весьма разнообразные, большинство из них проявляются в детском возрасте. Они поддаются лечению, но не всегда это просто.
При аутоиммунных заболеваниях иммунная система целенаправленно атакует собственные системы организма. При аутовоспалительных заболеваниях возникает воспаление, которое не может само остановиться. Воспаление — как огонь, это самоподдерживающийся процесс. У нашего организма есть специфические механизмы для его автоматического тушения. Если эти механизмы нарушены, то воспалительный процесс может принимать системный характер, при котором он может саморазгораться, но не тушиться. В таком случае возникает группа болезней, которые называются аутовоспалительными. Эти болезни весьма разнообразные, большинство из них проявляются в детском возрасте. Они поддаются лечению, но не всегда это просто.
О распространенных болезнях
Чаще всего ревматологу приходится заниматься остеоартрозами и остеопорозами. По своей распространенности они могут сравниться с гипертонической болезнью. Остеоартроз — это маловоспалительная хроническая болезнь суставов. Она появляется по ряду причин: это и микроорганизмы, которые проникают в суставы, и анатомические повреждения суставов, и любой перенесенный тяжелый воспалительный процесс в суставе. Все неблагоприятные процессы в суставе ведут к остеоартрозу. С остеопорозом обычно не обращаются к врачу. Как и с гипертонической болезнью — врачам самим приходится находить ее. Гипертонию лечат не потому, что она мучает людей, а чтобы избежать тяжелых осложнений. С остеопорозом такая же ситуация. Эту болезнь необходимо активно выявлять и лечить для того, чтобы предотвратить переломы.
Все неблагоприятные процессы в суставе ведут к остеоартрозу. С остеопорозом обычно не обращаются к врачу. Как и с гипертонической болезнью — врачам самим приходится находить ее. Гипертонию лечат не потому, что она мучает людей, а чтобы избежать тяжелых осложнений. С остеопорозом такая же ситуация. Эту болезнь необходимо активно выявлять и лечить для того, чтобы предотвратить переломы.
О специфике лечения
К сожалению, многие ревматологические заболевания лечатся пожизненно. Но мы значительно продвинулись в их лечении. Скажем, лет 15 назад при самом тяжелом виде артрита, ревматоидном, мы ставили своей целью замедлить наступление инвалидизации. Это заболевание приводит к быстрому разрушению суставов. Сейчас наша цель — увеличить количество ремиссий, по возможности безмедикаментозных. То есть у таких пациентов остается риск рецидива заболевания, но мы полностью снимаем симптомы артрита, и человек живет без лекарств. Залог успеха в лечении — ранняя диагностика и, соответственно, ранняя терапия.
О работе с другими специалистами
Мы тесно взаимодействуем с неврологами, ортопедами, гастроэнтерологами, дерматологами, гематологами, онкологами. Например, системные воспалительные заболевания часто возникают как реакция на опухоль. У нас были случаи, когда пациенты приходили к нам с системными воспалительными заболеваниями, и мы параллельно выявляли у них онкозаболевание. Особенно часто это случается с гематологическими патологиями: лимфомами, миелопролиферативными заболеваниями. Это наиболее сложные пациенты, потому что у них, как правило, нетипичная картина системного воспалительного заболевания.
Однажды к нам обратилась пациентка с лихорадкой и болью в суставах. Это так называемая лихорадка неясного генеза. Мы сделали компьютерную томографию грудной клетки и брюшной полости. Нашли подозрительный лимфоузел возле бронхов. Затем сделали бронхоскопию с биопсией этого лимфоузла и подтвердили лимфому. Поскольку это заболевание выявили на ранней стадии, мы быстро достигли ремиссии.
О сложных заболеваниях
Одна из самых сложных клинических ситуаций — лихорадка неясного генеза. Самая частая причина такого заболевания — инфекции, злокачественные опухоли и системно-воспалительные заболевания. Обычно, если у пациента с лихорадкой нет очевидной инфекции или подозрения на опухоль, то его направляют к нам. Еще одна сложная группа заболеваний — васкулиты (воспаление сосудов). Их бывает сложно диагностировать, особенно некоторые их виды.
О сложных случаях
К нам поступила женщина с подозрением на инсульт. МРТ подтвердила диагноз, но невролог обратил внимание на изменения в лабораторных анализах и повышенную температуру у пациентки. Все это наводило на мысль, что инсульт произошел не сам по себе. Мы предположили, что это гигантоклеточный артериит — воспалительное заболевание артерий. Эта болезнь встречается преимущественно у пожилых людей. Наша пациентка была старше 80 лет. Мы сделали ей биопсию височной артерии, после которой диагноз подтвердился. При таком заболевании риск инсульта в 7–10 раз выше среднестатистического. Гигантоклеточный артериит — непростая болезнь, которая тяжело поддается лечению, но нам удалось достигнуть безмедикаментозной ремиссии. Пациентка в свои почти 90 лет продолжает вести активный образ жизни. Из сложных случаев могу также вспомнить пациента, у которого был нарушен отток мочи из обеих почек и не проходила лихорадка. Урологи стентировали мочеточники и при обследовании выявили рак мочевого пузыря, провели лечение. Несмотря на то, что отток из почек нормализовался, функция почек продолжала ухудшаться. После очередной компьютерной томографии обнаружилось образование вокруг аорты. Пациента направили к нам. Мы диагностировали IgG4-ассоциированное заболевание. Оперативно назначили лечение, после которого у пациента нормализовалась температура, стабилизировалась работа почек и восстановилась проходимость мочеточника. Но когда мы снизили дозу препарата, появились непонятные изменения в легких. Мы сделали биопсию — оказалось, что в легких было проявление того же заболевания, что при этой болезни случается весьма редко. В судьбе этого пациента участвовали ведущие пульмонологи России, потому что история с легкими была непростая.
Пациентка в свои почти 90 лет продолжает вести активный образ жизни. Из сложных случаев могу также вспомнить пациента, у которого был нарушен отток мочи из обеих почек и не проходила лихорадка. Урологи стентировали мочеточники и при обследовании выявили рак мочевого пузыря, провели лечение. Несмотря на то, что отток из почек нормализовался, функция почек продолжала ухудшаться. После очередной компьютерной томографии обнаружилось образование вокруг аорты. Пациента направили к нам. Мы диагностировали IgG4-ассоциированное заболевание. Оперативно назначили лечение, после которого у пациента нормализовалась температура, стабилизировалась работа почек и восстановилась проходимость мочеточника. Но когда мы снизили дозу препарата, появились непонятные изменения в легких. Мы сделали биопсию — оказалось, что в легких было проявление того же заболевания, что при этой болезни случается весьма редко. В судьбе этого пациента участвовали ведущие пульмонологи России, потому что история с легкими была непростая. За два года мы ввели пациента в ремиссию. Что интересно, при IgG4-ассоциированном заболевании существует малоизученная связь с онкологией. Причем часто с перенесенной в прошлом. Видимо, есть какие-то общие иммунные дефекты. При этом заболевании удаление опухоли не влияет на течение болезни.
За два года мы ввели пациента в ремиссию. Что интересно, при IgG4-ассоциированном заболевании существует малоизученная связь с онкологией. Причем часто с перенесенной в прошлом. Видимо, есть какие-то общие иммунные дефекты. При этом заболевании удаление опухоли не влияет на течение болезни.
Об опасности системных болезней
Есть огромный блок болезней — первичные системные васкулиты, при которых источник воспаления связан с сосудами. Самая опасная группа — АНЦА-ассоциированные васкулиты. Это смертельные заболевания. Если их не лечить, они убивают человека быстрее практически любой опухоли. Средняя продолжительность жизни — 5–7 месяцев. Если вовремя обратиться к специалисту, интенсивная медикаментозная терапия спасает человеку жизнь. Все системные аутоиммунные заболевания опасны. Как и аутовоспалительные. Даже те болезни, которые не смертельны сами по себе, могут создавать серьезные проблемы. К примеру, для жизни опасен не сам ревматоидный артрит, а его осложнения. Еще 10 лет назад пациенты с этим заболеванием жили на 10 лет меньше. Умирали они от сердечно-сосудистых осложнений или инфекций, которые случаются намного чаще, чем у людей, не страдающих этим заболеванием. Та же системная красная волчанка в среднем укорачивала жизнь на 20 лет. При некоторых системных васкулитах еще недавно пациенты жили несколько месяцев. Все нелеченые системные воспалительные заболевания в той или иной степени сокращают человеку жизнь. Поэтому так важно вовремя обратиться к врачу.
Еще 10 лет назад пациенты с этим заболеванием жили на 10 лет меньше. Умирали они от сердечно-сосудистых осложнений или инфекций, которые случаются намного чаще, чем у людей, не страдающих этим заболеванием. Та же системная красная волчанка в среднем укорачивала жизнь на 20 лет. При некоторых системных васкулитах еще недавно пациенты жили несколько месяцев. Все нелеченые системные воспалительные заболевания в той или иной степени сокращают человеку жизнь. Поэтому так важно вовремя обратиться к врачу.
ФГБНУ НИИР им. В.А. Насоновой
Что такое панникулиты?Панникулиты (Пн) — это группа воспалительных заболеваний, характеризующихся поражением подкожной жировой клетчатки (ПЖК), и нередко протекающих с вовлечением в процесс опорно — двигательного аппарата и внутренних органов. Болезнь встречается во всех возрастных группах, но чаще страдают женщины трудоспособного возраста от 18 до 30 лет и 45-60 лет, ограничивая их физическую активность. Без эффективного лечения через 5 -10 лет около трети больных становятся инвалидами. Очень часто больные чувствуют себя беспомощными из-за боли, слабости, неспособности к самообслуживанию. Это нередко приводит к хроническому стрессу и депрессии.
Без эффективного лечения через 5 -10 лет около трети больных становятся инвалидами. Очень часто больные чувствуют себя беспомощными из-за боли, слабости, неспособности к самообслуживанию. Это нередко приводит к хроническому стрессу и депрессии.
Следует отметить, что единая общепринятая классификация Пн на сегодняшний день отсутствует. Рядом авторов предложено группировать Пн в зависимости от этиологии и гистоморфологической картины. Принято выделять два вида панникулитов: преимущественно септальный (СПн) и преимущественно лобулярный (ЛПн) панникулит.
Преимущественно СПн без васкулита: узловатая эритема, склеродерма-Пн, липоидный некробиоз, эозинофильный фасциит, синдром эозинофилии-миалгии.
Преимущественно СПн с васкулитом: поверхностный мигрирующий тромбофлебит, узелковый полиартрит, кожная форма узелкового полиартериита.
Преимущественно ЛПн без васкулита: идиопатический ЛПн (болезнь Вебера-Крисчена), цитофагифеский гистиоцитарный Пн, липодерматосклероз, физический (посттравматический) Пн, неонатальный Пн, постстероидный Пн, Пн связанный с системными заболеваниями – панкреатический, люпус-Пн, подкожный саркоид, кальцифилаксия, лейкемия и лимфома, инфекционный Пн, Пн. -дефицит алфа1-антитрипсина.
-дефицит алфа1-антитрипсина.
Преимущественно ЛПн с васкулитом: узелковый васкулит, индуративная эритема Базена, лепрозная узловатая эритема, феномен Люцио (диффузная лепроматозная лепра), нейтрофильный ЛПн, ассоциированный с ревматоидным артритом.
До сих пор неясно, почему развивается заболевание. Вероятно, это связано с действием многих факторов. Известно, что некоторые люди генетически предрасположены к Пн, но важно знать, что болезнь не передается от родителей к детям. У некоторых пациентов панникулит начинается после перенесенной инфекции. Другие существенные факторы, которые могут провоцировать развитие заболевания: переохлаждение, сильный эмоциональный стресс, травма, прием лекарственных препаратов.
Доказано также, что при ревматических болезнях, заболеваниях поджелудочной железы, злокачественных новообразованиях и др., увеличивается риск развития Пн. Однако у большинства больных первые симптомы появляются без видимой причины, на фоне полного здоровья.
Основной клинический признак панникулитов
Болезненные изолированные друг от друга четко отграниченные от окружающей ткани узлы, которые имеют различную окраску (от телесной до синюшно-розовой) и размером до 5 см в диаметре. Уплотнения локализуются, как правило, на нижних конечностях. Иногда узел вскрывается с выделением маслянисто-пенистой массы, и формированием плохо заживающих изъязвлений и атрофичных рубцов.
Учитывая многообразие клинических проявлений Пн, иногда заболевшему человеку довольно трудно сориентироваться, к какому врачу обратиться в начале болезни. При любых изменениях самочувствия рекомендуется обращаться к терапевту. После проведения анализов он сможет предположить диагноз и направит больного к ревматологу. Дополнительно может потребоваться консультация пульмонолога, дерматолога, флеболога, гематолога, онколога, эндокринолога.
Если вам выставили диагноз панникулит, то это не значит, что жизнь закончилась. Старайтесь победить болезнь, может быть, не в прямом смысле. Да, вероятно, вы будете в чем-то ограничены. Но миллионы людей и с более тяжелыми заболеваниями живут яркой, полной впечатлений жизнью! Значит, сможете и вы. Примите свой диагноз, изучите все про болезнь, расспросите у врача все, что Вам непонятно и вздохните спокойно.
Да, вероятно, вы будете в чем-то ограничены. Но миллионы людей и с более тяжелыми заболеваниями живут яркой, полной впечатлений жизнью! Значит, сможете и вы. Примите свой диагноз, изучите все про болезнь, расспросите у врача все, что Вам непонятно и вздохните спокойно.
Панникулит сегодня – не приговор. Приходите к нам в ФГБНУ НИИР им. В.А. Насоновой и мы вместе будем бороться с Вашим недугом! Специалисты лаборатории изучения коморбидных инфекций и мониторинга безопасности лекарственной терапии являются главными экспертами в лечении и диагностике панникулитов.
Запишитесь на приём к специалисту:
Ошибка
Перейти на. ..
Перейти на…Системные требования для ЭУМКОбъявленияСПИСОК СТУДЕНТОВ, НЕ СДАВШИХ И НЕ ЯВИВШИХСЯ НА ЭКЗАМЕНРАСПИСАНИЕ ЭКЗАМЕНОВСТУДЕНТЫ, ОСВОБОЖДЕННЫЕ ОТ УСТНОЙ ЧАСТИ ЭКЗАМЕНАЭЛЕКТРОННЫЙ ЖУРНАЛТиповая программаУчебная программаТематический план Пояснительная запискаПоложение о рейтинговой оценке знанийКРИТЕРИИ ОЦЕНКИРасписание тестированияКалендарно-тематический план лекцийГрафик отработок и консультаций расписание с изм. 29.04.2021вопросы к экзаменуТема 1 Острый и хронический гломерулонефритТЕМА 2 Инфекция мочевых путей. Тубулоинтерстициальные болезни почекИнфекции мочевых путей (УСР, 2 ч.)Тест — Инфекции мочевых путейТЕМА 3 Нефротический синдром. Амилоидоз почек. Хроническая болезнь почек и хроническая почечная недостаточностьЛекция: Нефротический синдром. Амилоидоз почек. ХБП. УСР 2 ч. доц. Солодкова И.В.Лекция: Анемии (УСР 2 часа)Тест — АнемииТЕМА 4. Геморрагические диатезы. Гемолитические анемииГеморрагические диатезыТЕМА 5. Гемобластозы. Острые лейкозы. АгранулоцитозЛЕКЦИЯ: ОСТРЫЙ ЛЕЙКОЗ (УСР 2 ЧАСА)Тест — ЛейкозыТЕМА 6.
..
Перейти на…Системные требования для ЭУМКОбъявленияСПИСОК СТУДЕНТОВ, НЕ СДАВШИХ И НЕ ЯВИВШИХСЯ НА ЭКЗАМЕНРАСПИСАНИЕ ЭКЗАМЕНОВСТУДЕНТЫ, ОСВОБОЖДЕННЫЕ ОТ УСТНОЙ ЧАСТИ ЭКЗАМЕНАЭЛЕКТРОННЫЙ ЖУРНАЛТиповая программаУчебная программаТематический план Пояснительная запискаПоложение о рейтинговой оценке знанийКРИТЕРИИ ОЦЕНКИРасписание тестированияКалендарно-тематический план лекцийГрафик отработок и консультаций расписание с изм. 29.04.2021вопросы к экзаменуТема 1 Острый и хронический гломерулонефритТЕМА 2 Инфекция мочевых путей. Тубулоинтерстициальные болезни почекИнфекции мочевых путей (УСР, 2 ч.)Тест — Инфекции мочевых путейТЕМА 3 Нефротический синдром. Амилоидоз почек. Хроническая болезнь почек и хроническая почечная недостаточностьЛекция: Нефротический синдром. Амилоидоз почек. ХБП. УСР 2 ч. доц. Солодкова И.В.Лекция: Анемии (УСР 2 часа)Тест — АнемииТЕМА 4. Геморрагические диатезы. Гемолитические анемииГеморрагические диатезыТЕМА 5. Гемобластозы. Острые лейкозы. АгранулоцитозЛЕКЦИЯ: ОСТРЫЙ ЛЕЙКОЗ (УСР 2 ЧАСА)Тест — ЛейкозыТЕМА 6. Хронические лейкозыХРОНИЧЕСКИЕ ЛЕЙКОЗЫТема 7. Полицитемия. Множественная миеломаМНОЖЕСТВЕННАЯ МИЕЛОМА, ПОЛИЦЕТЕМИЯТЕМА 1. Болезни костно-мышечной системы и соединительной ткани. Острая ревматическая лихорадка. Хроническая ревматическая болезнь сердца. Приобретенные пороки сердца. Пролабирование створок митрального клапана.ЛЕКЦИЯ ОРЛТЕСТ ОРЛ ЛЕКЦИЯ. Пороки сердцаТЕСТ 1. Пороки сердцаТЕСТ 2. Приобретенные пороки сердца.ЛЕКЦИЯ Пролапс митрального клапанаТЕМА 2. Болезни костно-мышечной системы и соединительной ткани. Заболевания суставов. Ревматоидный артрит. Остеоартрит. Подагра Лекция 1. Ревматоидный артрит (УСР, 2 ч)Тест — Ревматоидный артритТест — Остеоартрит, подаграТема 3. Болезни костно-мышечной системы и соединительной ткани. Системная красная волчанка. Системный склероз. Дерматомиозит/полимиозит Лекция Системные заболевания соединительной ткани (УСР, 2 ч)Тест — Системные заболевания соединительной ткани Тема 4. Болезни костно-мышечной системы и соединительной ткани. Системные васкулитыСистемные васкулиты (УСР, 2 ч)Тест — Системные васкулиты Тема 5.
Хронические лейкозыХРОНИЧЕСКИЕ ЛЕЙКОЗЫТема 7. Полицитемия. Множественная миеломаМНОЖЕСТВЕННАЯ МИЕЛОМА, ПОЛИЦЕТЕМИЯТЕМА 1. Болезни костно-мышечной системы и соединительной ткани. Острая ревматическая лихорадка. Хроническая ревматическая болезнь сердца. Приобретенные пороки сердца. Пролабирование створок митрального клапана.ЛЕКЦИЯ ОРЛТЕСТ ОРЛ ЛЕКЦИЯ. Пороки сердцаТЕСТ 1. Пороки сердцаТЕСТ 2. Приобретенные пороки сердца.ЛЕКЦИЯ Пролапс митрального клапанаТЕМА 2. Болезни костно-мышечной системы и соединительной ткани. Заболевания суставов. Ревматоидный артрит. Остеоартрит. Подагра Лекция 1. Ревматоидный артрит (УСР, 2 ч)Тест — Ревматоидный артритТест — Остеоартрит, подаграТема 3. Болезни костно-мышечной системы и соединительной ткани. Системная красная волчанка. Системный склероз. Дерматомиозит/полимиозит Лекция Системные заболевания соединительной ткани (УСР, 2 ч)Тест — Системные заболевания соединительной ткани Тема 4. Болезни костно-мышечной системы и соединительной ткани. Системные васкулитыСистемные васкулиты (УСР, 2 ч)Тест — Системные васкулиты Тема 5. Заболевания толстого кишечника. Синдром раздраженного кишечника.Аутоиммунные заболевания кишечника (УСР, 2 ч.)Тест — Аутоиммунные заболевания кишечникаСиндром раздраженного кишечника«Воспалительные заболевания кишечника. Синдром раздраженного кишечника» ТЕМА 6. Болезни органов пищеварения Функциональные билиарные расстройства. Хронический панкреатит.Дискинезия желчевыводящих путейХронический панкреатит«Функциональные билиарные расстройства. Хронический панкреатит»Методические указания для студентов IX семестрМетодические указания для студентов X семестрОбщий анализ крови (для интерпретации)Стернальный пунктатБиохимический анализ кровиДиагностика аутоиммунных заболеванийФормулы расчета СКФИнтерпретация иммунологического тестаПример клинической ситуационной задачи 1Пример клинической ситуационной задачи 2Методические рекомендации для преподавателей 10 семТесты к экзаменуВопросы к экзамену (практика)Экзаменационное тестирование (для изолированных)Протоколы МЗ РБ по гастроэнтерологииКлинический протокол диагностики и лечения пациентов с нефрологическими заболеваниямиКлинический протокол диагностики и лечения пациентов с урологическими заболеваниямиАнемия хронического заболевания Учебник «Внутренние болезни» Т 1 под ред.
Заболевания толстого кишечника. Синдром раздраженного кишечника.Аутоиммунные заболевания кишечника (УСР, 2 ч.)Тест — Аутоиммунные заболевания кишечникаСиндром раздраженного кишечника«Воспалительные заболевания кишечника. Синдром раздраженного кишечника» ТЕМА 6. Болезни органов пищеварения Функциональные билиарные расстройства. Хронический панкреатит.Дискинезия желчевыводящих путейХронический панкреатит«Функциональные билиарные расстройства. Хронический панкреатит»Методические указания для студентов IX семестрМетодические указания для студентов X семестрОбщий анализ крови (для интерпретации)Стернальный пунктатБиохимический анализ кровиДиагностика аутоиммунных заболеванийФормулы расчета СКФИнтерпретация иммунологического тестаПример клинической ситуационной задачи 1Пример клинической ситуационной задачи 2Методические рекомендации для преподавателей 10 семТесты к экзаменуВопросы к экзамену (практика)Экзаменационное тестирование (для изолированных)Протоколы МЗ РБ по гастроэнтерологииКлинический протокол диагностики и лечения пациентов с нефрологическими заболеваниямиКлинический протокол диагностики и лечения пациентов с урологическими заболеваниямиАнемия хронического заболевания Учебник «Внутренние болезни» Т 1 под ред. Моисеева В.С.Учебник Внутренние болезни Т 2 под ред Моисеева В.С.Список литературыУчебник «Внутренние болезни» Маколкин
Моисеева В.С.Учебник Внутренние болезни Т 2 под ред Моисеева В.С.Список литературыУчебник «Внутренние болезни» Маколкин
Рекомендации по лечению гигантоклеточного артериита французской группы по изучению васкулитов крупных сосудов. Клиническая фармакология и терапия
Гигантоклеточный артериит (ГКА) – это самый распространенный системный васкулит в мире. В некоторых северно-европейских странах распространенность ГКС достигает 10-20 случаев на 100 000 населения. Данных о заболеваемости ГКА в нашей стране нет, однако можно предположить, что это заболевание часто остается недиагностированным у пожилых людей с «необъяснимым» повышением СОЭ, лихорадкой неясного генеза или впервые возникшей головной болью. За последние 3 года в мировой медицинской литературе отмечается информационный бум, связанный с появлением большого количества исследований, касающихся различных аспектов ГКА. Одним из знаковых событий информационной волны стали рекомендации французской группы по изучению васкулитов крупных сосудов (GEFA), которые остаются современными и хорошо освещают актуальную для многих специалистов (ревматологов, терапевтов, офтальмологов, неврологов) проблему ГКА [1]. Еще одним важным событием стала регистрация тоцилизумаба для лечения ГКА в США (май 2017 г.) и Европе (сентябрь 2017 г.) на основании результатов крупного международного исследования GiACTA [2], которые были опубликованы уже после выхода в свет рекомендаций GEFA.
Еще одним важным событием стала регистрация тоцилизумаба для лечения ГКА в США (май 2017 г.) и Европе (сентябрь 2017 г.) на основании результатов крупного международного исследования GiACTA [2], которые были опубликованы уже после выхода в свет рекомендаций GEFA.
Мы хотели бы познакомить читателя с рекомендациями GEFA по диагностике и лечению ГКА, а также прокомментировать некоторые позиции наших французских коллег и обсудить возможности биологической терапии у пациентов с ГКА.
Терминология
В прошлом ГКА часто именовали «височным» или «краниальным» артериитом, однако в настоящее время эти названия неактуальны. Термин «болезнь Хортона» (по имени американского невролога, который описал этот васкулит в 1932 г.) нередко используется в Европе, особенно Франции. Однако сегодня наиболее популярен (почти 70% публикаций) термин «ГКА», который был одобрен на Международной согласительной конференции в Чапел-Хилле, а также указан в классификации васкулитов Американской коллегии ревматологов. Этот термин можно использовать не только в случае морфологической верификации диагноза. Он является синонимом «болезни Хортона» даже в тех случаях, когда при биопсии височной артерии не было выявлено типичных для ГКА изменений.
Этот термин можно использовать не только в случае морфологической верификации диагноза. Он является синонимом «болезни Хортона» даже в тех случаях, когда при биопсии височной артерии не было выявлено типичных для ГКА изменений.
Номенклатура и классификация
ГКА относится к васкулитам, поражающим крупные сосуды, в том числе аорту и отходящие от нее ветви, преимущественно внешние сонные и позвоночные артерии и, в отличие от артериита Такаясу, развивается в возрасте старше 50 лет. Ревматическая полимиалгия отличается от ГКА отсутствием клинических и гистологических признаков поражения краниальных сосудов и органа зрения. В соответствии с критериями Аме риканской коллегии ревматологов системный васкулит может быть классифицирован как ГКА при наличии «краниальной» симптоматики (новые головные боли, пальпаторные изменения височных артерий или положительные результаты биопсии). Эти критерии позволяют дифференцировать ГКА от других системных васкулитов с чувствительностью 94% и специфичностью 91% [3].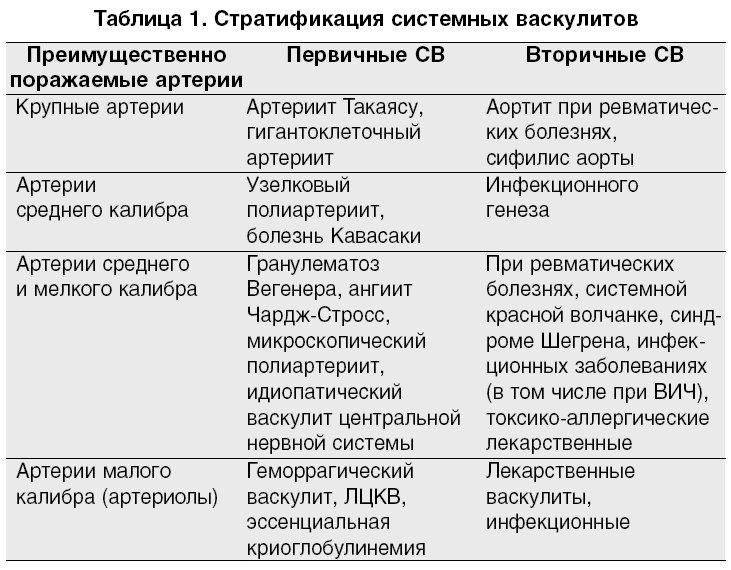
Комментарий авторов рекомендаций: при отсутствии верифицированного васкулита классифицировать болезнь как ГКА затруднительно. Определенное диагностическое значение имеют косвенные признаки, такие как ответ на лечение глюкокортикостероидами и течение болезни.
Клинический диагноз
Существуют достаточно специфичные для ГКА признаки. По данным мета-анализа [4], самыми сильными предикторами гистологического подтверждения диагноза были «хромота» нижней челюсти (34% больных) и диплопия (9%). В другом исследовании было показано, что вероятность гистологически подтвержденного ГКА значительно увеличивалась при наличии головной боли (86%), «хромоты» нижней челюсти (42%) и пальпируемой височной артерии (44%) [5]. Сочетание ревматической полимиалгии с «новой» головной болью, «хромотой»нижней челюсти и изменениями височных артерий (по данным осмотра) позволяло установить диагноз с точностью 97%, а начало болезни после 70 лет увеличивало предсказательное значение положительного результата до 100%, однако такое сочетание отмечали только у 27% больных с ревматической полимиалгией [6].
Комментарий: некроз языка или волосистой части головы, а также острые нарушения зрения, вероятно, также имеют высокое диагностическую значение, хотя оно не доказано результатами исследований.
Биопсия височной артерии
Диагноз ГКА может быть подтвержден при биопсии височной артерии. К характерным гистологическим признакам данного васкулита относятся воспалительный инфильтрат, содержащий гигантский клетки, в мышечной оболочке артерии, а также эластофагия [7], хотя оба указанных признака наблюдаются не всегда [8]. Изолированный воспалительный инфильтрат вокруг адвентиция или васкулит мелких сосудов, окружающих височную артерию (редко некротизирующий), встречаются реже и могут быть признаком вовлечения в патологический процесс височной артерии при другом системном васкулите.
Диагноз ГКА подтверждается результатами биопсии височной артерии у 49-85% больных [9-12]. Значи тельная вариабельность результатов, возможно, отражает различия в клинических и гистологических определениях ГКА, а также технические особенности проведения биопсии. Повысить диагностическую информативность исследования позволяет использование биоптатов длиной не менее 0,5–1 см, а также скольких образцов. При односторонней биопсии височной артерии диагностируют 88% случаев ГКА, верифицированных гистологически [13]. Значение допплеровского ультразвукового сканирования для выбора места биопсии остается спорным. Гистологические изменения можно выявить в течение по крайней мере 15 дней после начала лечения глюкокортикоидами. Осложнения биопсии височной артерии встречаются редко [14].
Значи тельная вариабельность результатов, возможно, отражает различия в клинических и гистологических определениях ГКА, а также технические особенности проведения биопсии. Повысить диагностическую информативность исследования позволяет использование биоптатов длиной не менее 0,5–1 см, а также скольких образцов. При односторонней биопсии височной артерии диагностируют 88% случаев ГКА, верифицированных гистологически [13]. Значение допплеровского ультразвукового сканирования для выбора места биопсии остается спорным. Гистологические изменения можно выявить в течение по крайней мере 15 дней после начала лечения глюкокортикоидами. Осложнения биопсии височной артерии встречаются редко [14].
Комментарий: в настоящее время не существует единых гистологических критериев диагноза ГКА.
Визуализация височной артерии
Визуализацию височной артерии, прежде всего с помощью допплеровского ультразвукового сканирования линейным датчиком, считают возможным методом подтверждения диагноза ГКА. При наличии гипоэхогенного ореола (гало) чувствительность ультразвукого исследования составляет 68%, а специфичность достигает 91% [15], особенно если указанные изменения определяются с двух сторон. Чувствительность повышается, если ореол исследуют в подмышечных и общих сонных артериях [16]. Роль магнитно-резонансной томографии (МРТ) в диагностике ГКА изучена в меньшей степени. Диагноз ГКА позволяют предположить утолщение сосудистой стенки с накоплением контраста в средней оболочке и сужением просвета [17]. В самых крупных исследованиях, в которых учитывали поражение височных и затылочных артерий, чувствительность составляла 78%, а специфичность – 90% [18]. По информативности допплеровское ультразвуковое сканирование и МРТ существенно не отличались.
При наличии гипоэхогенного ореола (гало) чувствительность ультразвукого исследования составляет 68%, а специфичность достигает 91% [15], особенно если указанные изменения определяются с двух сторон. Чувствительность повышается, если ореол исследуют в подмышечных и общих сонных артериях [16]. Роль магнитно-резонансной томографии (МРТ) в диагностике ГКА изучена в меньшей степени. Диагноз ГКА позволяют предположить утолщение сосудистой стенки с накоплением контраста в средней оболочке и сужением просвета [17]. В самых крупных исследованиях, в которых учитывали поражение височных и затылочных артерий, чувствительность составляла 78%, а специфичность – 90% [18]. По информативности допплеровское ультразвуковое сканирование и МРТ существенно не отличались.
Комментарии: визуализация височной артерии является менее надежным методом диагностики ГКА по сравнению с биопсией. Учитывая вариабельность результатов исследований и их зависимость от навыка специалиста, практическое значение допплеровского ультразвукового сканирования оценить достаточно трудно. Во Франции этот метод используется ограничено. МРТ изучена еще в меньшей степени, а также существенно дороже и менее доступна, чем ультразвуковое исследование.
Во Франции этот метод используется ограничено. МРТ изучена еще в меньшей степени, а также существенно дороже и менее доступна, чем ультразвуковое исследование.
Роль визуализации аорты и ее ветвей в диагностике ГКА
Выявление аортита или артериита ветви аорты с помощью КТ-ангиографии, МР-ангиографии или позитронно-эмиссионной томографии с использованием 18-фтордезоксиглюкозы (ПЭТ) позволяет предположить диагноз ГКА. Признаком аортита считают равномерное кольцевидное утолщение стенки ≥2 или 3 мм по данным КТ-ангиографии, накопление гадолиния в сосудистой стенке при МР-ангиографии или 18-фтордезоксиглюкозы при ПЭТ. Частота аортита по данным КТ-ангиографии или МР-ангиографии составляет от 33 до 65%. По данным 2 мета-анализов, чувствительность и специфичность ПЭТ в диагностике аортоартериита при ГКА составили 80-89% и 90-98%, соответственно [19]. По чувствительности ПЭТ незначительно превосходила МРТ, а также КТ-ангиографию. При допплеровском сканировании можно выявить гало в общих сонных, подмышечных, подвздошных и бедренных артериях.
Комментарии: данные литературы неоднозначны, однако они свидетельствуют о том, что визуализация аорты и ее ветвей менее специфична в диагностике ГКА, чем биопсия височной артерии. Не вполне понятно диагностическое значение небольшого увеличения толщины стенки или незначительного накопления контрастного вещества.
Биомаркеры
Увеличение СОЭ ≥50 мм/ч (по методу Вестергрена) является одним из классификационных критериев Американской коллегии ревматологов. Воспалительные маркеры почти всегда повышены в дебюте ГКА, при этом среднее значение СОЭ составляет 93 мм/ч, концентрации С-реактивного белка (СРБ) – 94 мг/л [20]. Также может повышаться уровень других воспалительных белков – фибриногена, гаптоглобина, орозомукоида. Анемия отмечается у 55% больных, тромбоцитоз – у 49% [20]. Тем не менее, у 11% больных СОЭ не превышает 50 мм/ч [21], а нормальные уровни воспалительных маркеров не исключают диагноз ГКА. Описана связь между небольшим повышением cодержания воспалительных маркеров и развитием ишемических поражений органа зрения [22].
Описана связь между небольшим повышением cодержания воспалительных маркеров и развитием ишемических поражений органа зрения [22].
Комментарии: в настоящее время не существует специфических для ГКА биомаркеров, позволяющих определить вариант болезни и прогнозировать ее течение.
Аневризма аорты при ГКА
Аневризма аорты, особенно в восходящем отделе грудной аорты, развивается у пациентов с ГКА чаще, чем в популяции, и ассоциируется со снижением выживаемости [23]. По данным когортных исследований, частота аневризмы и/или расслоения стенки аорты у больных ГКА составляет 19 на 1000 в год [24,25]. Аневризма может быть выявлена спустя несколько лет после установления диагноза ГКА, однако у 15% пациентов с аортитом аневризма или дилатация грудного отдела аорты отмечается уже при установлении диагноза [26].
Комментарии: в настоящее время не установлены факторы риска развития аневризмы аорты у пациентов с ГКА и не определены возможности скрининга (способ визуализации, частота исследований). При КТ и МРТ для оценки диаметра аорты контрастирование медии не требуется, однако оно позволяет оценить состояние сосудистой стенки и просвет сосуда. Возможности обычной рентгенографии органов грудной клетки в диагностике патологии аорты крайне ограничены.
При КТ и МРТ для оценки диаметра аорты контрастирование медии не требуется, однако оно позволяет оценить состояние сосудистой стенки и просвет сосуда. Возможности обычной рентгенографии органов грудной клетки в диагностике патологии аорты крайне ограничены.
Глюкокортикоистероиды в лечении неосложненного ГКА (без поражения органа зрения, аорты и ее ветвей)
Глюкокортикоиды остаются «золотым стандартом» лечения ГКА. Начальная доза у пациентов с неосложненным ГКА составляет от 0,3 до 1 мг/кг/сут в пересчете на преднизолон. В некоторых исследованиях показано, что дозы 0,5-0,7 мг/кг/сут обычно достаточно для подавления активности болезни, при этом они удовлетворительно переносятся. В рандомизированных клинических исследованиях пульс-терапия метилпреднизолоном (15 мг/кг/сут) до назначения пероральных глюкокортикостероидов обеспечивала дополнительное снижение частоты обострений и оказывала стероидосберегающее действия [27]. Прием препарата в стартовой дозе продолжают в течение 2-4 недель в зависимости от скорости разрешения воспалительных изменений. Снижение дозы глюкокортикоcтероидов начинают быстро, чтобы достичь дозы 15-20 мг/сут за 6-10 недель. Проспективные и ретроспективные исследования показали, что примерно у половины пациентов удается снизить дозу до 7,5-10 мг/сут за 6 месяцев [28]. В то же время прекращение приема глюкокортикостероидов через 6 мес в 77% случаев сопровождалось развитием обострений в течение последующего года [29]. Медиана длительности лечения в когортных исследованиях составляла около 24 мес, однако она варьировалась в широких пределах и иногда достигала нескольких лет.
Снижение дозы глюкокортикоcтероидов начинают быстро, чтобы достичь дозы 15-20 мг/сут за 6-10 недель. Проспективные и ретроспективные исследования показали, что примерно у половины пациентов удается снизить дозу до 7,5-10 мг/сут за 6 месяцев [28]. В то же время прекращение приема глюкокортикостероидов через 6 мес в 77% случаев сопровождалось развитием обострений в течение последующего года [29]. Медиана длительности лечения в когортных исследованиях составляла около 24 мес, однако она варьировалась в широких пределах и иногда достигала нескольких лет.
Комментарии: в настоящее время нет общего мнения по поводу выбора стартовой дозы глюкокортикостероидов у пациентов с неосложненным ГКА. Пульс-терапия у пожилых людей или пациентов с сопутствующими заболеваниями может быть рискованной.
Лечение ГКА с поражением органа зрения
Поражение органа зрения – наиболее частое тяжелое осложнение ГКА, которое в 13-19% случаев приводит к необратимому снижению остроты зрения или слепоте вследствие окклюзии ветвей зрительной артерии или, реже, инсульта в бассейне задней затылочной артерии. В трети случаев отмечается поражение обоих глаз. У 95% пациентов нарушение зрения развивается до начала лечения глюкокортикоидами, а у 20% больных представляет собой первое проявление васкулита. У небольшой части больных терапия глюкокортикостероидами, начатая в течение первых 72 ч после ухудшения зрения, позволяет добиться частичного его восстановления. Лучших результатов удавалось добиться при назначении преднизолона внутрь в дозе как минимум 60 мг/сут [30,31] или метилпреднизолона в дозе 500 мг внутривенно [32,33]. По данным двух ретроспективных исследований высказано предположение, что низкие дозы аспирина позволяют предотвратить ишемические поражения органа зрения и центральной нервной системы [34,35], хотя этот вопрос остается спорным, учитывая отсутствие адекватных исследований.
В трети случаев отмечается поражение обоих глаз. У 95% пациентов нарушение зрения развивается до начала лечения глюкокортикоидами, а у 20% больных представляет собой первое проявление васкулита. У небольшой части больных терапия глюкокортикостероидами, начатая в течение первых 72 ч после ухудшения зрения, позволяет добиться частичного его восстановления. Лучших результатов удавалось добиться при назначении преднизолона внутрь в дозе как минимум 60 мг/сут [30,31] или метилпреднизолона в дозе 500 мг внутривенно [32,33]. По данным двух ретроспективных исследований высказано предположение, что низкие дозы аспирина позволяют предотвратить ишемические поражения органа зрения и центральной нервной системы [34,35], хотя этот вопрос остается спорным, учитывая отсутствие адекватных исследований.
Комментарии:в настоящее время недостаточно данных проспективных или контролируемых клинических исследований, чтобы определить оптимальный режим глюкокортикоидной терапии или целесообразность использования низких доз аспирина для лечения ГКА с поражением органа зрения.
Лечение ГКА с поражением аорты и ее ветвей
Воспаление аорты или ее ветвей может осложниться развитием дилатации, аневризмы или расслоения стенки аорты, а также стенозом или окклюзией ее крупной ветви. В ретроспективных или проспективных исследованиях эффективность различных режимов терапии глюкокортикоидами или стероидосберегающих препаратов при ГКА с поражением крупных артерий не изучалась. Аортит или поражение подключичных артерий, независимо от тяжести, может ассоциироваться с повышенным риском обострения, стероидной зависимости и смертности от сердечно-сосудистых событий [36,37], хотя это убедительно не доказано [38]. Аневризма или расслоение стенки аорты (но не стеноз ее крупной ветви) сопровождаются повышенной сердечно-сосудистой смертностью [23]. Эмпирически пациентам с признаками ишемии конечностей назначают преднизолон в дозе 1 мг/кг/сут. Эндоваскулярные или хирургические вмешательства по поводу аневризмы аорты проводят по тем же принципам, что и пациентам без ГКА. Острое расслоение стенки аорты – это неотложное хирургическое состояние.
Острое расслоение стенки аорты – это неотложное хирургическое состояние.
Комментарии: остается открытым вопрос о том, требуется ли пациентам с ГКА и бессимптомным аортоартериитом более интенсивное медикаментозное лечение.
Применение иммуносупрессивных препаратов
Целесообразность присоединения иммуносупрессивных препаратов к лечению глюкокортикостероидами с целью достижения стероидосберегающего эффекта или снижения риска обострений в настоящее время яв ляется предметом исследований. Эффективность метотрексата изучалась в 3 рандомизированных плацебо-контролируемых исследованиях [29,39,40] и метаанализах [41,42]. По данным одного мета-анализа, применение метотрексата внутрь в дозе 7,5-15 мг/нед снижало риск обострения и кумулятивную дозу глюкокортикоидов [41]. В небольшом плацебо-контролируемом исследовании у пациентов с ГКА или ревматической полимиалгией азатиоприн (150 мг/сут) также оказывал стероидосберегающее действие через 12 мес [43]. В то же время рандомизированные клинические исследования не подтвердили пользу назначения циклоспорина, гидроксихлорохина или дапсона. Данные неконтролируемых ретроспективных исследований свидетельствуют о возможной эффективности циклофосфамида, лефлуномида и микофенолата мофетила у пациентов с активным ГКА.
Комментарии:в настоящее время у нас нет достаточных данных в пользу назначения какого-либо дополнительного иммуносупрессивного или иммуномодулирующего препарата, кроме метотрексата. Эффективность метотрексата представляется невысокой.
Генно-инженерные биологические препараты
В трех рандомизированных исследованиях у пациентов с ГКА не была подтверждена эффективность ингибиторов фактора некроза альфа, в том числе инфликсимаба, этанерцепта и адалимумаба [44-46], хотя в одном из них применение этанерцепта привело к снижению кумулятивной дозы глюкокортикоидов в течение 12 мес [46]. Другие генно-инженерные препараты изучались в неконтролируемых исследованиях у пациентов с обострением или рефрактерным течением ГКА, обычно после использования метотрексата. Наиболее перспективным препаратом представляется тоцилизумаб (см. ниже результаты исследования GiACTA). Также сообщалось об эффективности анакинры и ритуксимаба у нескольких пациентов с ГКА.
Аспирин, антикоагулянты и статины
Увеличение риска острых ишемических поражений органа зрения, центральной нервной и сердечно-сосудистой систем у пациентов с ГКА как в ближайшем, так и отдаленном периоде ставит вопрос о необходимости профилактики сосудистой патологии. Данные нескольких когортных и ретроспективных исследований, а также мета-анализа [47] свидетельствуют о том, что у пациентов с ГКА, принимающих глюкокортикоиды, низкие дозы аспирина (≤100 мг/cут) снижают риск острых мозговых или зрительных ишемических событий, а также в целом риск сердечно-сосудистых катастроф. Другое ретроспективное исследование продемонстрировало протективный эффект низких доз аспирина в отношении риска обострений системного васкулита [48]. Возможные преимущества антикоагулянтной терапии не доказаны. В 3 ретроспективных когортных исследованиях [49-51] статины не оказывали стероидосберегающее действие, в то время как обсервационное популяционное исследование показало способность статинов снижать продолжительность лечения глюкокортикостероидами [52].
Комментарии:профилактическое назначение низких доз аспирина и статинов должно соответствовать текущим рекомендациям по профилактике осложнений атеросклероза.
Лечение обострений и рецидивирующего ГКА
Несмотря на достигнутую ранее медикаментозную ремиссию, как минимум у трети пациентов с ГКА отмечаются обострения или рецидивы заболевания. Некоторые авторы различают обострение, которое развивается на фоне лечения, и рецидив, который происходит через некоторое время после отмены стероидной терапии. Для выявления обострения обычно недостаточно изолированного повышения уровня воспалительных маркеров. В контролируемых исследованиях тактика ведения пациентов с обострением или рецидивом ГКА не изучалась. Результаты мета-анализа пациентов с впервые установленным ГКА, участвовавших в 3 рандомизированных плацебо-контролируемых исследованиях, показали, что метотрексат существенно снижает риск обострений, в то время как возможная польза других препаратов, таких как циклофосфамид, лефлуномид или микофенолата мофетил у пациентов с ГКА, требующим применения высоких доз глюко кортикостероидов, или рецидивирующим течением васкулита показана только в неконтролируемых исследованиях.
Комментарии:подходы к лечению ГКА рецидивирующего течения определены недостаточно, в частности остается неясным, следует ли назначать дополнительные иммуносупрессивные препараты в таких случаях.
Обсуждение
Особенностью рекомендаций GEFA является несколько консервативный взгляд на ключевые проблемы диагностики и лечения ГКА. Как это принято в последние годы, данные рекомендации были построены на анализе многочисленной информации, полученной в результате самых разных по дизайну исследований, и голосования экспертов по ключевым позициям. На наш взгляд, эти рекомендации не только представляют собой результат огромной аналитической работы, но и предполагает поиск разумного баланса между традиционными взглядами и новой информацией по проблеме ГКА. По мере накопления новых данных некоторые положения будут обновляться. В чем заключается консерватизм данных рекомендаций?
Сохранение концепции биопсии поверхностной височной артерии как «золотого стандарта» диагностики ГКА. Несмотря на высокую чувствительность биопсии височной артерии (49-85%) в диагностике ГКА, которую указывают авторы данных рекомендаций, нужно помнить, что в реальной клинической практике информативность биопсии может быть значительно ниже, в особенности в тех медицинских центрах, где эта процедура «не поставлена на поток» и нет достаточного опыта в выборе участка биопсии, техники биопсии и морфологического исследования. В настоящее время редко публикуются исследования, демонстрирующие низкую частоту обнаружения морфологически измененной височной артери у пациентов с предполагаемым ГКА, но тем не менее они имеются [53,54]. В этих исследованиях чувствительность биопсии височной артерии при ГКА составляла около 18-30%.
Классификационные критерии Американской коллегии ревматологов 1990 г. сохранили свою актуальность. Прошло уже более 25 лет с момента разработки классификационных критериев ГКА Американской коллегией ревматологов. За этот срок накопился большой опыт использования различных методов визуализации, помогающих в диагностике этого заболевания. Речь идет не только об ультразвуковом исследовании, но и КТангиографии, МР-ангиографии и позитронно-эмиссионной томографии. До настоящего времени ревматическая полимиалгия не рассматривалась как один из возможных диагностических критериев ГКА, хотя включение ее в классификационные критерии ГКА в исследовании GiACTA позволяет обсуждать эту позицию для реальной клинической практики. Важно помнить, что текущие критерии ГКА были разработаны для классической (краниальной) формы ГКА, помимо которой существуют так называемые генерализованные (Такаясу-подобные или LVV-GCA) формы заболевания без краниальной симптоматики, артериит, ассоциированный с ревматической полимиалгией, изолированный аортит у пожилых людей. Пока мы будем опираться на критерии Американской коллегии ревматологов 1990 года, эти формы васкулитов крупных сосудов у пожилых людей будут оставаться за рамками диагностической (и лечебной) концепции ГКА.
Низкие дозы метотрексата для лечения ГКА. Данные, подтверждающие эффективность метотрексата в лечении ГКА, ограничены и отчасти противоречивые. Без сомнения, все исследования, на которых основываются рекомендации по использованию метотрексата в дозе 10-15 мг/нед, относятся к эре «низких доз метотрексата в ревматологии». Нам представляется возможным обсуждать использование метотрексата в дозах 15-20 мг/нед и возможно выше в тех случаях, когда это клинически оправдано.
Ограничение использования аспирина и статинов при ГКА. На наш взгляд, утверждение о целесообразности применения аспирина только в группе пациентов с поражением органа зрения весьма спорное. Офталь мологические проблемы имеют ишемический генез и могут быть связаны как с васкулитом, так и тромбозом, которые нередко сочетаются друг с другом. У ряда пациентов подобные осложнения возникают внезапно, поэтому если рекомендовать назначать антиагреганты только по факту свершившихся офтальмологических осложнений, то это может привести к увеличению риска тромбозов мелких сосудов глаз и головного мозга. Более того у некоторых пациентов даже без краниальной симптоматики наблюдается латентное поражение височной артерии [55]. В нашей клинической практике мы используем антиагреганты (аспирин в дозе 75-150 мг/сут) у всех пациентов с краниальной симптоматикой и у пациентов с генерализованными формами ГКА без краниальных проявлений в первые 6-12 месяцев терапии (при отсутствии противопоказаний). В дальнейшем целесообразность продолжения антиагрегантной терапии зависит от соотношения польза и риска у конкретного пациента.
Антигиперлипидемическая терапии у пациентов в возрасте старше 80 лет с дислипидемией, вызванной длительным приемом преднизолона, вероятно, не улучшит общую выживаемость, однако у пациентов более молодого возраста лечение статинами нам представляется оправданным. Более того, в последнее время во французских же популяционных исследованиях был описан положительный эффект статинов у пациентов с ГКА [56].
Новые и клинически значимые рекомендации. На не ко торых аспектах рекомендаций хотелось бы остановиться подробнее и подчеркнуть их важность.
Применение ультразвукового исследования, КТ-ангиографии, МР-ангиографии и ПЭТ. В рекомендациях впервые были упомянуты дополнительные (к «золотому стандарту», которым авторы считают биопсию поверх ностной височной артерии) методы диагностики ГКА, а именно ультразвуковое исследование, КТ-ангиографию, МР-ангиографию и ПЭТ, что, несомненно, создает основу для изменения текущих классификационных критериев ГКА. В конце 2016 г. были опубликованы данные крупного британского исследования, продемонстрировавшего большое диагностическое значение ультразвукового метода у пациентов с ГКА [57]. Нередко в реальной клинической практики именно результаты визуализации стенки аорты и ее ветвей дают клиницисту необходимую информацию для своевременной постановки диагноза ГКА.
Стратифицированный подход к начальной терапии ГКА и отсутствие необходимости всегда проводить пульс-терапию. Следует обратить особое внимание на дифференцированный подход к выбору начальной дозы глюкокортикостероидов у пациентов с ГКА. В реко мендациях подчеркивается необходимость избегать злоупотребления сверхвысокими дозами глюкокортикостероидов, в том числе в виде пульс-терапии. Необходимо также подчеркнуть, что через 3 мес после начала терапии следует стремиться снизить дозу преднизолона до 15-20 мг/сут с дальнейшим последующим снижением.
Не злоупотреблять цитостатиками при ГКА. Целе со образность использования циклофосфамида, азатио прина, микофенолата мофетила и других иммуносупрессантов (за исключением метотрексата) при ГКА остается под большим вопросом с учетом недоказанной эффективности и сомнительного профиля безопасности у людей пожилого и старческого возраста.
Не применять ингибиторы ФНО-α при ГКА. В рекомендациях GEFA подчеркивается неэффективность ингибиторов ФНО-α (инфликсимаба, этанерцепта и адалимумаба) в лечении ГКА. Поэтому применять их не имеет смысла даже в качестве стероидосберегающих средств.
Тоцилизумаб в лечении ГКА. В настоящее время самым перспективным лекарственным средством из группы генно-инженерных биологических препаратов для лечения ГКА является тоцилизумаб (антитела к рецептору интерлейкина-6), который был зарегистрирован по этому показанию в США и Европейском Союзе. Рекомендуемая схема лечения предполагает еженедельное подкожное введение препарата в дозе 162 мг. Эффективность и безопасность тоцилизумаба у пациентов с ГКА были установлены в 12-месячном рандомизированном, плацебо-контролируемом исследовании GiACTA (Giant-Cell Arteritis Actemra), которое проводилось в разных странах Европы и США [2]. Пациентов, включенных в это исследование (n=251), рандомизировали на 4 группы (2:1:1:1). В первые двух группах больные получали тоцилизумаб подкожно в дозе 162 мг еженедельно или через неделю в сочетании с глюкокортикостероидами, которые постепенно отменяли в течение 26 недель. Пациенты двух других групп получали плацебо подкожно в сочетании с глюкокортикостероидами, которые также отменяли в течение 26 или 52 недель. Примерно у половины пациентов имелся впервые диагностированный ГКА, а у половины – рецидив системного васкулита. Около половины пациентов принимали глюкокортикостероиды в дозе ≥30 мг/сут, а остальные – в более низкой дозе.Через 52 недели стойкая ремиссия ГКА была отмечена у 53-56% больных групп тоцилизумаба и только 14-18% групп плацебо (p<0,001 для сравнения тоцилизумаба и плацебо; рис. 1). Лечение тоцилизумабом сопровождалось снижением риска развития обострения ГКА на 72-77%, а также кумулятивной дозы преднизона с 3296-3818 мг до 1862 мг (p<0,001). У пациентов с впервые выявленным ГКА обе схемы введения тоцилизумаба имели достоверное преимущество перед плацебо. У больных с рецидивом системного васкулита, получавших тоцилизумаб еженедельно, риск развития рецидива достоверно снизился, в то время как при применении препарата через неделю снижение риска не достигло статистической значимости. Частота серьезных нежелательных явлений оказалась даже выше в группах плацебо.
Рис. 1. Доля пациентов без обострения ГКА (%) при лечении тоцилизумабом или плацебо в сочетании с глюкокортикостероидамиТоцилизумаб фактически стал первым иммуносупрессивным препаратом, эффективность которого (включая выраженное стероидосберегающее действие) в профилактике рецидивов ГКА была столь убедительно доказана в рандомизированном плацебо-контролируемом исследовании. При применении тоцилизумаба следует соблюдать осторожность и учитывать риск развития нежелательных явлений. Несомненный интерес представляют отдаленные результаты лечения тоцилизумабом, которые в настоящее изучаются в рамках 2-летнего наблюдения пациентов, включенных в исследование GiACTA.
Заключение
Диагноз ГКА, развивающегося у людей пожилого и старческого возраста, нередко устанавливают с опозданием, что может привести к тяжелым последствиям, в частности потере зрения. В связи с этим французские рекомендации по диагностике и лечению этого заболевания имеют важное значение для врачей различных специальностей, в том числе ревматологов, терапевтов, офтальмологов и неврологов. Следует отметить, что подходы к диагностике и лечению ГКА постепенно меняются. Сегодня многие эксперты признают возможность использования ультразвукового сканирования и других неинвазивных визуализирующих методов как альтернативы биопсии височной артерии, которая в нашей стране проводится значительно реже, чем в зарубежных клиниках. Например, в исследовании GiACTA признаки васкулита крупной артерии, выявленные при ангиографии, КТ- или МР-ангиографии или ПЭТ/КТ, служили самостоятельным критерием диагноза ГКА (т.е. в этом случае не требовалось его подтверждение при гистологическом исследовании). Возможный алгоритм диагностики ГКА, разработанный на основе исследования GiACTA и мнения авторов данной статьи, приведен на рис. 2. Основой лечения ГКА остаются глюкокортикостероиды, однако с учетом результатов исследования GiACTA можно ожидать расширения показаний к назначению тоцилизумаба пациентам с этим системным васкулитом (тяжелое или рецидивирующее течение, серьезные осложения, например, потеря зрения, сохранение активности несмотря на лечение глюкокортикостероидами, осложнения глюкокортикостероидной терапии, требующие применения стероидосберегающих препаратов).
Рис. 2. Алгоритм диагностики ГКА. *Алгоритмотражаетмнениеавторовданнойстатьи.Осложнения и причины летальности при АНЦА-ассоциированных системных васкулитах
В статье проанализированы особенности течения, а также основные осложнения АНЦА-ассоциированных системных васкулитов (гранулематоза с полиангиитом, микроскопического полиангиита, эозинофильного гранулематоза с полиангиитом) и узелкового полиартериита в первые три года от начала заболевания. Продемонстрирована связь между развитием осложнений и длительной глюкокортикостероидной терапией. Показана важность изучения особенностей поражения органов и систем при системных васкулитах для совершенствования алгоритмов диагностики и лечения.Таблица 1. Частота, характер сердечно-сосудистых и цереброваскулярных осложнений у пациентов с ПСВ, %
Таблица 2. Осложнения со стороны органов зрения у больных ГПА
Рис. 1. Время, прошедшее от дебюта ПСВ до назначения патогенетической терапии, Me [LQ; HQ]
Рис. 2. Среднее значение BVAS в момент назначения патогенетической терапии ПСВ
Таблица 3. Назначение цитостатических препаратов в дебюте ПСВ, %
Рис. 3. Среднее значение VDI через 12 и 36 месяцев от дебюта ПСВ
Таблица 4. Осложнения, ассоциированные с длительным приемом ГКС, %
Таблица 5. Причины летальных исходов при ПСВ
Введение
Первичные системные васкулиты (ПСВ) представляют собой группу аутоиммунных заболеваний, при которых развивается некротизирующее воспаление сосудов, приводящее к ишемическим изменениям в органах и тканях, снабжение кровью которых осуществляется по пораженным сосудам [1]. К группе ПСВ с поражением сосудов мелкого и среднего калибра относятся гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА), эозинофильный гранулематоз с полиангиитом (ЭГПА), узелковый полиартериит (УП) [2]. Гранулематоз с полиангиитом – аутоиммунное заболевание, характеризующееся гранулематозным воспалением респираторного тракта и некротизирующим васкулитом сосудов мелкого калибра. Распространенность патологии достигает 2,3 случая на 100 тыс. [3]. Микроскопический полиангиит – малоиммунный некротизирующий васкулит сосудов мелкого калибра. Чаще отмечаются признаки некротизирующего гломерулонефрита, реже – легочного капиллярита [4]. Эозинофильный гранулематоз с полиангиитом, или синдром Черджа – Стросса, – эозинофильное гранулематозное воспаление респираторного тракта с некротизирующим васкулитом. Последний часто сочетается с бронхиальной астмой, аллергическим ринитом и экстравазальными эозинофильными гранулемами [5]. Узелковый полиартериит представляет собой некротизирующий васкулит сосудов среднего калибра без гломерулонефрита. Однако при данной форме заболевания часто формируются микроаневризмы и тромбозы, что приводит к ишемии и инфаркту разных органов [6].
Некротизирующее воспаление сосудов мелкого и среднего калибра обусловливает тяжесть и полиорганность поражений при ПСВ.
В связи со сказанным представляется актуальным изучение особенностей клинического течения ПСВ для проведения ранней диагностики и своевременного назначения адекватной патогенетической терапии.
Цель нашего исследования – выявить особенности клинического течения, характер осложнений и причины летальности в первые три года от начала ПСВ.
Материал и методы
В исследование включено 232 пациента с первичными системными васкулитами. Больные находились на стационарном лечении в клинической ревматологической больнице № 25 г. Санкт-Петербурга с 2010 по 2018 г.
Критериями включения в исследование стали:
- дебют заболевания в возрасте более 18 лет;
- соответствие диагноза критериям Американской коллегии ревматологов (American College of Rheumatology – ACR) 1990 г.;
- морфологическое подтверждение диагноза в отсутствие АНЦА-позитивности;
- длительность заболевания на момент поступления больного в стационар менее одного года.
Основную группу составили 209 пациентов с системными васкулитами, ассоциированными с антинейтрофильными цитоплазматическими антителами (АНЦА-СВ). Она в свою очередь была разделена на три подгруппы: ГПА – 94 человек, МПА – 46, ЭГПА – 69 человек. В группу сравнения вошли 23 больных УП.
Среди участников исследования было 134 женщины.
Длительность заболевания на момент включения пациентов в исследование в среднем составляла 6,7 ± 1,3 месяца.
Оценивался характер поражений ЛОР-органов, легких, кожи, почек, центральной и периферической нервной системы, органов зрения, желудочно-кишечного тракта, опорно-двигательного аппарата, сердечно-сосудистой системы в течение первых трех лет заболевания.
Определялось влияние проводимой терапии на течение ПСВ и наиболее частые осложнения такого лечения.
Анализировались случаи летальных исходов.
Для обработки данных с помощью SPSS 22.0 использовались методы описательной статистики, однофакторный дисперсионный анализ с поправкой Бонферрони, t-критерий Стьюдента, U-критерий Манна – Уитни, χ2 с поправкой Йейтса, корреляционный анализ Пирсона.
Результаты
При изучении частоты и характера поражения органов и систем у больных ПСВ установлено, что в подгруппе ГПА превалировало поражение ЛОР-органов – 87% случаев. Доля синуситов составляла 57%, отитов – 39%, субглоточного стеноза гортани – 16%, язвенно-некротического ринита – 63%, в сочетании с деформацией носовой перегородки – 9%. Развитие гнойного отита, потребовавшее госпитализации в ЛОР-стационар, зафиксировано у 7% больных. При ЭГПА поражение ЛОР-органов отмечалось реже – в 50% случаев, при МПА и УП – почти не определялось.
Поражение сердечно-сосудистой системы (преимущественно в виде коронарита и перикардита) чаще наблюдалось при ЭГПА и МПА – 38 и 35% пациентов. При ГПА и УП таковое отмечалось в 21,0 и 27,5% случаев. Формирование венозных тромбозов выявлено у трех (7,1%) пациентов с МПА, у шести (9,2%) с ЭГПА, у двух (8,2%) с УП и у пяти (4,7%) больных ГПА.
Поражение центральной нервной системы в виде церебрального васкулита в основной группе отмечалось чаще, чем в группе сравнения. Так, оно диагностировано у 22% пациентов с МПА, у 17% – с ГПА, у 13% – с ЭГПА и только у 4% больных УП.
Аналогичная закономерность прослеживалась при оценке частоты развития инсультов (табл. 1).
Поражение периферической нервной системы в виде ишемической полинейропатии наиболее часто отмечалось в группе сравнения – 83% случаев. В основной группе ишемическая полинейропатия обнаружена у 65% пациентов с МПА и у такого же количества больных ЭГПА. При ГПА патология зафиксирована только в одной трети случаев.
В течение первых трех лет патология легких развилась практически у всех (99%) больных ЭГПА. Наиболее часто встречался синдром бронхиальной астмы – 97%, реже – мигрирующие эозинофильные инфильтраты – 64%. При ГПА легкие поражались достоверно чаще, чем при МПА – 84 против 59% случаев (p
При ГПА в отличие от трех других нозологий чаще фиксировались случаи кровохарканья, иногда с легочным кровотечением, – 28 и менее 4% случаев соответственно (p
Пурпуры и язвенно-некротические изменения кожи отмечались у 83% больных УП, что достоверно превышало частоту таковых в когорте пациентов с АНЦА-СВ – 56% (p
К характерным особенностям течения ГПА следует отнести поражение органов зрения – 36% больных. При этом 16% случаев приходилось на ретробульбарную гранулему, столько же – на конъюнктивит, 13% – на увеит, 11% случаев – на эписклерит. У семи (8%) пациентов с ГПА для верификации диагноза проводилась биопсия тканей орбиты. В таблице 2 приведены наиболее часто встречающиеся у пациентов с ГПА осложнения со стороны органов зрения.
Патология органов зрения у больных МПА, ЭГПА и УП диагностировалась значительно реже.
Поражение почек в виде малоиммунного гломерулонефрита с полулуниями обнаружено у 96% больных МПА и 78% больных ГПА. Быстропрогрессирующий гломерулонефрит в когорте пациентов с МПА отмечался достоверно чаще, чем в когорте больных ГПА – 48 против 19% случаев (p
При МПА также чаще развивалась хроническая болезнь почек (ХБП) – 61% случаев. Этот показатель был достоверно выше показателя при ГПА и ЭГПА – 12 и 24% случаев (p
Изменения со стороны желудочно-кишечного тракта обнаружены у 21% пациентов основной группы и 4% пациентов группы сравнения (p
Поражение опорно-двигательного аппарата чаще встречалось при УП и МПА (83 и 80% соответственно), реже – при ГПА и ЭГПА (50 и 52% соответственно). Гнойный артрит осложнял течение заболевания у 2,3% больных основной группы. Асептический некроз головки бедренной кости сформировался у 5% больных УП, а также у 2% лиц с АНЦА-СВ. У 2% пациентов с ГПА развился остеомиелит.
Инфекционные осложнения, потребовавшие госпитализации пациентов, фиксировали при всех нозологиях: при МПА – в 23% случаев, при ГПА – в 19%, при УП – в 15%, при ЭГПА – в 13% случаев. Формирование сепсиса зафиксировано у трех пациентов с ГПА и одного больного МПА. Внегоспитальные пневмонии на фоне иммуносупрессивной терапии в первые три года болезни выявлялись при всех формах ПСВ. Частота случаев составляла 4,5%.
При оценке проводимой патогенетической терапии установлено, что период времени от дебюта заболевания до назначения глюкокортикостероидов (ГКС) был наибольшим в подгруппе ГПА – пять месяцев. В подгруппах МПА, ЭГПА и УП он составлял три – три с половиной месяца. Аналогичная тенденция прослеживалась и при назначении цитостатической терапии (рис. 1). Необходимо отметить, что в течение первого года заболевания цитостатическая терапия назначалась в 93% случаев при ГПА, в 85% – при МПА, в 47% – при ЭГПА и в 78% – при УП (табл. 3). Для индукции ремиссии чаще назначали циклофосфамид.
В одном случае при ГПА в качестве препарата первой линии использовали блокатор пролиферации В-клеток ритуксимаб. За время исследования терапию ритуксимабом получали 12 пациентов с ГПА и два больных МПА. Один пациент с ГПА применял белимумаб. Терапия внутривенными иммуноглобулинами была назначена восьми больным ГПА и одному пациенту с МПА.
При индукции ремиссии у 4% пациентов с ГПА развился геморрагический цистит как осложнение терапии циклофосфамидом.
При назначении патогенетической терапии у всех пациентов был рассчитан Бирмингемский индекс активности васкулита (Birmingham Vasculitis Activity Score – BVAS) (третья версия). Наиболее высоким он оказался в когорте больных ГПА и МПА. Различие показателей между подгруппами ГПА и МПА и подгруппой ЭГПА и группой УП было достоверным (p
Рефрактерность к первоначально назначенной патогенетической терапии (отсутствие регресса клинических проявлений в течение шести недель) отмечалась у 39% больных УП, у 28 пациентов с ГПА, у 27% пациентов с МПА и 7% больных ЭГПА.
Такие осложнения, как стероидный диабет, остеопороз и компрессионные переломы позвонков, кандидоз, как правило, ассоциировались с длительным приемом высоких доз ГКС в связи с рефрактерным течением заболевания (табл. 4).
В первые три года от начала заболевания зафиксировано всего 11 (4,7%) летальных исходов: при ГПА – пять (5,3%), при МПА – четыре (8,7%), при ЭГПА – один (1,4%), при УП – один (4,3%). В двух (0,9%) случаях (один при ГПА и один при МПА) причиной смерти была полиорганная недостаточность, развившаяся вследствие высокой активности ПСВ после самостоятельной отмены патогенетической терапии. Инфекционные осложнения стали причиной летального исхода в трех (1,3%) случаях, тромбоэмболические (инсульт, инфаркт миокарда, тромбоэмболия легочной артерии) – в пяти (2,2%) (табл. 5).
Следует отметить, что на момент назначения патогенетической терапии группы с летальным исходом и без такового статистически значимо не различались по возрасту, полу, варианту цитостатической терапии, активности заболевания. В то же время через год от дебюта заболевания у первых достоверно чаще развивалась ХБП – 71 против 24% случаев (p
Индекс повреждения при васкулитах (Vasculitis Damage Index – VDI) определялся через 12 и 36 месяцев заболевания (рис. 3) [7]. Через 36 месяцев среднее значение VDI в подгруппе ГПА было наибольшим и достоверно превосходило средние значения в подгруппах МПА, ЭГПА и группе УП – 4,7, 3,8, 2,7 и 3,1 балла. Эти данные свидетельствуют о прогностически неблагоприятном течении ГПА и высоком риске инвалидизации.
Обсуждение результатов
Наиболее часто осложнения при ПСВ возникают в первый год заболевания в связи с поздним назначением патогенетической иммуносупрессивной терапии. Одна из основных причин несвоевременности получения лечения –трудность дифференциальной диагностики вследствие вариабельности дебюта и недостаточной информированности врачей первичного звена об особенностях течения ПСВ.
Для гранулематоза с полиангиитом характерно поражение зрительного нерва, развитие легочного кровотечения, гнойного отита и стероидного диабета. При этом осложнения связаны как с поздним назначением патогенетической терапии, так и с активно проводимой иммуносупрессивной терапией. Несвоевременное применение цитостатиков приводит не только к более быстрому прогрессированию воспалительного процесса, но и к более длительному приему высоких доз ГКС. Как следствие, увеличивается риск развития инфекций, стероидного диабета и компрессионных переломов на фоне стероидного остеопороза.
Известно, что легочные кровотечения – самая частая причина острой летальности в дебюте системных некротизирующих васкулитов. Данное осложнение часто встречалось при ГПА и значительно реже при МПА. Анализ зарубежной литературы свидетельствует, что пятилетняя выживаемость при ГПА составляет 61–75%, при МПА – 45–75%, при УП – 60–80%, при ЭГПА – 68–100%. Предикторами высокой летальности являются пожилой возраст, ХБП и максимально высокий уровень креатинина уже в первые месяцы болезни [8, 9]. Результаты нашего исследования подтверждают эти данные.
Клиническое течение МПА определялось поражением почек с частым формированием ХБП, нередко с исходом в терминальную стадию.
Среди тромбоэмболических осложнений необходимо отметить высокую частоту ишемических инсультов при МПА и инфаркта миокарда при УП. Поэтому в дебюте заболевания таким пациентам требуется агрессивное вмешательство с применением высокодозных схем пульс-терапии ГКС и цитостатиками.
В настоящее время при высокой активности и полиорганности поражения в дебюте ГПА и МПА показаны блокаторы пролиферации В-клеток, в частности ритуксимаб.
В нашем исследовании такую терапию получали 14 пациентов, что позволило существенно снизить активность и повреждения васкулита через 36 месяцев.
Высокая частота ишемического повреждения конечностей при УП требует проведения более агрессивной патогенетической терапии, обязательного использования антитромботических препаратов, особенно при появлении первых признаков заболевания.
Заключение
В настоящее время перед клиницистами стоит непростая задача – в максимально ранние сроки уточнять диагноз и начинать активную иммуносупрессивную терапию. При выборе базисных препаратов следует учитывать варианты дебюта ПСВ, превалирующее поражение тех или иных органов, а также сопутствующую патологию.
К факторам риска развития значимых осложнений относятся длительный прием высоких доз ГКС, позднее назначение цитостатиков, ХБП. Поэтому в максимально ранние сроки после уточнения диагноза необходимо начать индукционную терапию.
Причинами летальности в первые годы болезни являются полиорганная недостаточность, инфекционные и тромбоэмболические осложнения. Мониторинг и их профилактика являются неотъемлемой задачей курирования таких пациентов.
Ранняя диагностика и активная стратегия лечения позволят минимизировать риск развития осложнений и смерти, а также сохранить высокое качество жизни больных.
Врач ревматолог: Многие из наших пациентов лечатся и работают, живут нормальной жизнью — Новости Якутии
YAKUTIA.INFO. Отделения Якутской Республиканской клинической больницы, перепрофилированные в инфекционные в связи с пандемией коронавируса, понемногу возвращаются к своей обычной работе, узкие специалисты, пока в усеченном варианте, начинают плановый прием и лечение своих «родных» пациентов. Со съемочной группой информационной программы «Якутия 24» мы направляемся в ревматологическое отделение больницы, и наши визави сегодня — врачи-ревматологи Галина Саввина и Ольга Иванова.
Отделение ревматологии ЯРКБ было открыто в 1991 году, в этом году ему исполнилось тридцать лет. Отделение рассчитано на пятьдесят коек, в данное время у ревматологов получает лечение тридцать человек. Средний возраст их – 30-40 лет. Врачей в отделении пять, с октября все пятеро работали в ковидных корпусах, сейчас отделение возобновило свою работу и с пациентами работают пока два врача.
Идем с докторами по отделению и по ходу знакомства с их работой беседуем.
Галина Робинзоновна Саввина, врач-ревматолог
высшей категории, отличник здравоохранения республики. Окончила Благовещенский медицинский институт и ординатуру по ревматологии в Санкт-Петербурге, стаж работы двадцать лет.
Ольга Сергеевна Иванова, врач-ревматолог, окончила Медицинский институт СВФУ, специализацию по ревматологии прошла в Санкт-Петербурге, работает по специальности три года.
— К вам в отделение поступают со всей республики. С какими заболеваниями поступают больные?
Г.С.: В основном наши пациенты – это люди с воспалительными заболеваниями позвоночника, болезнью Бехтерева, ревматоидным артритом, системной красной волчанкой и другими ревматологическими заболеваниями.
В одной из палат доктора подходят к кровати пожилой женщины, справляются о ее состоянии. У Александры Васильевны поздняя стадия ревматоидного артрита, в течение двадцати лет она живет с постоянной болью. «Наши заболевания – хронические, больные страдают ими пожизненно, — скажет нам потом Галина Робинзоновна, — поэтому мы назначаем им базисное лечение, базисные препараты. Воспалительные заболевания сопровождаются сильными болями в позвоночнике, выраженной скованностью, деформацией, разрушением суставов, Состояние пациентки подавляется не полностью, но благодаря базисному лечению нам удается держать болезнь под контролем, сейчас у нее нет ярко выраженного ограничения движения». Александра Васильевна тепло благодарит врачей отделения за лечение и заботу.
— Чем вызваны, на ваш взгляд, ревматологические заболевания?
О.С.: Есть факторы, которые предшествуют ревматологическим заболеваниям. Считается, что это стресс, причем, не только психоэмоциональный, стресс может быть вызван климатическими условиями, характером питания. Стресс провоцируют также переохлаждение, какие-то профессиональные особенности, условия жизни, курение (влияние никотина на организм), генетика.
— Ревматологические заболевания — удел пожилых людей?
Г.С.: Абсолютно нет. Это скорее гены, холодный климат, недостаток солнца.
О.И.: Кстати, многими системными ревматологическими заболеваниями (красная волчанка, геморрагический васкулит, болезнь Бехтерева, склеродермия) болеют в основном молодые люди.
— Можно ли ревматологические заболевания считать сезонными?
Г.С.: Нет, сезонности у наших заболеваний нет.
— А по гендерному признаку?
Г.С.: Болезнью Бехтерева чаще страдают мужчины, а вот ревматоидным артритом – больше женщины. В некоторых случаях ревматологические заболевания — заболевания профессиональные. Чаще всего подвержены им повара, парикмахеры, которые вынуждены много времени проводить на ногах, люди, работа которых связана с поднятием тяжестей, профессиональные спортсмены — все они входят в группу риска.
Воспалительные заболевания сопровождаются сильными болями в позвоночнике, выраженной скованностью, деформацией, разрушением суставов. Это заметно по тому, как двигаются пациенты ревматологов. В процедурном кабинете старшая медсестра отделения Лера ПЕТРОВА готовит пациентку с ревматоидным артритом к внутрисуставному уколу. Женщина кладет на валик обе руки и спокойно сидит в ожидании процедуры. Укол делает Галина Робинзоновна, для нас она комментирует свои действия.
— Ревматоидный артрит чаще всего поражает мелкие суставы кистей и стоп. При правильном лечении можно добиться низкой активности заболевания, но лечение проводится пожизненно. Антонина Ивановна болеет уже двадцать лет, у нас в отделении она впервые, От долгого воспаления у больной начинает разрушаться хрящ, разрушается сустав. Я делаю ей сейчас противовоспалительный препарат, чтобы снять местное воспаление.
— Имеются ли в арсенале ревматологов какие-то инновационные методы?
Г.С.: Безусловно, да. Мы с 2014 года используем инновационные генно-инженерные биологические препараты, способные эффективно влиять на состояние пациентов. Эти препараты начали использовать именно в ревматологии. Это высокие технологии, настоящий прорыв в медицине. Такое программное лечение получают бесплатно инвалиды, а те, у кого нет инвалидности, — по муниципальной программе. У нас в отделении есть кабинет генно-инженерной биологической терапии, где мы проводим инфузии (капельницы), подкожные инъекции. Раньше ревматологические больные были вынуждены лежать скованные болезнью, не вставали с кровати, а благодаря генно-инженерной биологической терапии снимается воспаление, отек суставов, качество жизни человека достоверно меняется. Многие из наших пациентов лечатся и работают, живут нормальной жизнью.
— Как проявляется ревматологическое заболевание?
Г.С.: Артрит – это воспаление суставов, то есть отек, припухшие суставы, через несколько лет – за счет разрушения костной ткани — деформация суставов. Болезнь Бехтерева – это постоянные боли и скованность по ходу позвоночника, больные еле встают с кровати, и это продолжается годами.
— Есть понятие «онкологическая настороженность». Наверное, нужна и ревматологическая настороженность?
О.И.: Конечно! У всех хронических болезней есть общая закономерность: чем раньше поставлен диагноз, тем лучше прогноз. Тяжелые ревматологические заболевания поначалу, подобно опухолям, незаметны, появляются без симптомов. Их чрезвычайно сложно выявить. Причины развития ревматологических заболеваний чрезвычайно разнообразны, так что настороженность нужна обязательно.
Г.Р.: Очень полезны для профилактики двигательная активность, лечебная физкультура.
Численность пациентов с ревматологическими заболеваниями, говорят врачи, постоянно растет. Большинство ревматологических болезней, которые расстраивают все органы и системы организма, характеризуются тяжелыми осложнениями и по оценке аналитиков дают до 70% инвалидности. Если вы заметили у себя боли, отеки, дискомфорт в суставах при ходьбе, при передвижении по лестнице, утреннюю скованность, повышение температуры тела, нарушение общего самочувствия, поражение кожи, боли в мышцах, резкое снижение массы тела, врачи рекомендуют не медлить и обратиться к специалисту. Мотивация простая — ревматологические болезни редко заканчиваются выздоровлением.
Источник: minzdrav.sakha.gov.ru
поперечное исследование 27 пациентов
Acta Med Litu. 2017; 24 (2): 107–112.
Язык: английский | Литовская
Йоланта Дадонене
1 Медицинский факультет Вильнюсского университета, Вильнюс, Литва
Гинтаре Кумжайте
1 Медицинский факультет Вильнюсского университета, Вильнюс, Литва
9000 9000 9000 Rimvyd Медицина, Вильнюсский университет, Вильнюс, Литва
Даля Милтинене
2 Центр ревматологии, Вильнюсская университетская больница Santaros klinikos, Вильнюс, Литва
1 Медицинский факультет Вильнюсского университета, Вильнюс
2 Центр ревматологии Вильнюсской университетской больницы Santaros klinikos, Вильнюс, ЛитваПоступила в редакцию 3 февраля 2017 г .; Принят в печать 1 июня 2017 г.
Copyright © Lietuvos mokslų akademija, 2017Реферат
Цель.
Целью данного исследования было описать долгосрочную выживаемость пациентов и возможные прогностические факторы группы пациентов с диагнозом гранулематоз с полиангиитом (GPA) и микроскопическим полиангиитом (MPA), госпитализированных в третичный центр ревматологии в Вильнюсе.
Материалы и методы.
Было проведено поперечное исследование 27 пациентов, госпитализированных в ревматологический центр Santaros klinikos Вильнюсской университетской больницы с 1 января 2001 г. по 31 декабря 2015 г. с диагнозами GPA и MPA.Были собраны данные о демографии, клинических характеристиках, лабораторных данных и показателях активности бирмингемского васкулита.
Результаты.
Семь (25,9%) пациентов в начале заболевания получали только пероральные глюкокортикоиды, а 20 (74,1%) пациентов принимали дополнительные лекарства. Медиана BVAS составила 7 (минимум [мин] — 2; максимум [максимум] — 23). Средний возраст составил 52 года (минимум — 12; максимум — 75). Общая летальность составила 18,5%. Средняя продолжительность жизни составила 126,6 месяцев (95% доверительный интервал [ДИ] = 104.От 5 до 148,6), ограниченное 154,6 месяцами для наиболее долго выжившего пациента.
Выводы.
Ожидаемая продолжительность жизни пациентов с AAV за последние 15 лет увеличилась с 99,4 до 126,6 месяцев. Высокий показатель BVAS в начале заболевания является плохим прогностическим фактором, связанным с более короткой продолжительностью жизни. Рост Staphylococcus aureus из носоглотки может быть связан с более высокими показателями смертности и рецидивов у пациентов с AAV.
Ключевые слова: ANCA-ассоциированный васкулит, исходы, микроскопический полиангиит, гранулематоз с полиангиитом, оценка BVAS, ожидаемая продолжительность жизни
Реферат
KLINIKINĖS CHARAKTERISTIKOS IR IŠGYVENAMUMO SKIRTUMAI ANCOT2
Тикслас. Tyrimo tikslas buvo įvertinti ilgalaikį išgyvenamumą ir galimus prognostinius veiksnius ligonių, sergančių mikroskopiniu poliangitu ir granulomatoze su poliangitu bei hospitalizuotų į tretinio lygio Reumatologue.Tyrimo metodai. Tai skerspjūvio studija, atlikta tiriant 27 ligonius, kurie buvo hospitalizuoti Vilniaus university ligoninėje Santariški klinikose nuo 2001 m. sausio 1 д. ики 2015 г. gruodžio 31 д. Surinkti ligonių demografiniai, klinikiniai, labratoriniai, BVAS (Оценка активности бирмингемского васкулита) duomenys.
Результат. Septyni (25,9%) ligoniai ligos pradžioje gydyti tik geriamaisiais gliukokortikosteroidais, или 20 (74,1%) gavo papildomą imunosupresinį gydymą. BVAS mediana buvo 7 (mažiausia — 2; daugiausia — 23). Visos kohortos amžiaus mediana — 52 мета (mažiausia — 12; daugiausia — 75). Бендрас мирштамумас 18,5%. Visos kohortos išgyvenamumo vidurkis 126,6 mėnesiai (95% pasikliautinasis intervalas = 104,5 и 148,6). Ilgiausiai tyrimo metu išgyvenęs ligonis — 154,6 месяца.
Ишвадос. Ligonių išgyvenamumas per pastaruosius 15 metų AAV ligonių grupėje prailgėjo nuo 99,4 iki 126,6 mėnesių. Aukštas BVAS rezultatas ligos pradžioje yra blogas prognostinis veiksnys, susijęs su trumpesniu išgyvenamumu. Staphylococcus aureus augimas iš nosiaryklės gali būti susijęs su aukštesniu mirtingumo lygiu bei recidyvu AAV ligonių grupėje.
Raktažodžiai: ANCA-asocijuotas vaskulitas, baigtys, mikroskopinis poliangitas, granulomatozė su poliangitu, BVAS, išgyvenamumas
ВВЕДЕНИЕ
В соответствии с пересмотренным полиангиологическим полиангиотомом A (полиангиопластический энцефаломиелит) и микропульмонозом с полиангиопатией (GP) 2012 г. относятся к группе ANCA-ассоциированных васкулитов (AAV) (1).Это редкая группа заболеваний с общей годовой заболеваемостью 11,3 на миллион для GPA и 5,9 на миллион для MPA (2). Первичные системные васкулиты вызывают воспаление кровеносных сосудов, приводящее к окклюзионным, стенотическим или аневризматическим изменениям, ведущим к ишемическим или геморрагическим событиям (3, 4). И MPA, и GPA преимущественно поражают мелкие сосуды и связаны с антинейтрофильными цитоплазматическими аутоантителами (ANCA), специфичными для миелопероксидазы (MPO-ANCA) или протеиназы 3 (PR3-ANCA) (1).MPA и GPA — это некротический васкулит, который вызывает гломерулонефрит и / или легочный капиллярит (1, 5). Более того, они могут поражать огромное количество других органов, включая дополнительные органы глаза, центральную нервную систему, верхние дыхательные пути или даже гениталии (4, 6–8). Могут присутствовать такие системные признаки, как лихорадка, артралгии, недомогание, потеря веса и утомляемость (4). Лечение ААВ за последние годы значительно изменилось (3, 9, 10). Однако, несмотря на недавние достижения в диагностике и лечении, пациенты с AAV по-прежнему имеют значительно более высокую смертность, чем соответствующая популяция в целом (11).Целью исследования было описать долгосрочную выживаемость пациентов и возможные прогностические факторы группы пациентов с ГПД и МПА в начале заболевания, которые были госпитализированы в третичный центр ревматологии в Вильнюсе.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено поперечное исследование пациентов, госпитализированных в ревматологический центр Santaros klinikos Вильнюсской университетской больницы с 1 января 2001 г. по 31 декабря 2015 г. с диагнозами гранулематоза с полиангиитом (Вегенера) и микроскопическим полиангиитом.Диагнозы были подтверждены путем сочетания клинической оценки, серологических тестов на ANCA и гистологического анализа. Мы включили 24 пациента с диагнозом гранулематоз с полиангиитом и 3 пациента с диагнозом микроскопический полиангиит. Все пациенты получали лечение с самого начала заболевания; в курс лечения входили пероральные глюкокортикоиды. Данные о демографических данных (пол, возраст, дата первого и последнего посещения или смерти), клинических характеристиках (поражение органов в начале заболевания и иммуносупрессивная терапия) и лабораторных данных (C-реактивный белок, скорость оседания эритроцитов, лейкоциты (количество тромбоцитов, уровень гемоглобина, cANCA, уровень креатинина и рост Staphylococcus aureus из носоглотки).BVAS (показатель активности бирмингемского васкулита) был рассчитан для каждого пациента во время первого посещения. По результатам мы разделили пациентов на две категории (оценка <10 и ≥10).
Мы определили легочную недостаточность как состояние, когда пациент чувствовал одышку при минимальной психической активности, а почечную недостаточность как состояние, когда пациенту требовался гемодиализ.
Мы посчитали, что пациент выздоровел, когда его / ее состояние здоровья оставалось стабильным без глюкокортикоидов и иммунодепрессантов в течение как минимум одного года.
СТАТИСТИЧЕСКИЕ МЕТОДЫ
Описательная статистика использовалась для оценки демографических и клинических характеристик. Выживаемость оценивали с помощью кривых Каплана-Майера. Регрессия Кокса была проведена для оценки различий между группами BVAS. Статистический анализ выполняли с использованием IBM SPSS (Статистический пакет для социальных наук) версии 22. Для определения уровня статистической значимости использовали значение 0,05 p .
РЕЗУЛЬТАТЫ
Клинические и демографические характеристики представлены в.Количество дел представлено в.
Таблица 1.
Клинические и демографические характеристики в начале заболевания
| n = 27 | ||
|---|---|---|
| Возраст: | ||
| лет < 20 (74,1%) | ||
| ≥65 лет | 7 (25,9%) | |
| Пол: | ||
| Мужской | 9 (33.3%) | |
| Женский | 18 (66,7%) | |
| BVAS: | ||
| <10 | 18 (66,7%) | |
| ≥10 | 9 ( | |
| cANCA: | ||
| Положительный | 15 (55,6%) | |
| Отрицательный | 12 (44,4%) | |
| S. 11 (40.7%) | ||
| Отрицательно | 13 (48,1%) | |
| Нет данных | 3 (11,1%) | |
| Результат на 31 декабря 2015 г. | ||
| Смерть 5 ( %) | ||
| Выздоровел | 4 (14,8%) | |
| Все еще лечился | 18 (66,7%) | |
| Почечная недостаточность в начале заболевания: | Почечная недостаточность 4 (14.8%) | |
| Поражение почек без недостаточности | 9 (33,3%) | |
| Не задействовано | 14 (51,9%) | |
| Дыхательная недостаточность в начале заболевания: | ||
| Легочная недостаточность | 3 (11,1%) | |
| Поражение легких без недостаточности | 15 (55,6%) | |
| Не задействовано | 9 (33,3%) | |
| Другие симптомы: 2 | Артралгии4 (14.8%) | |
| Поражение верхних дыхательных путей | 16 (59,3%) | |
| Поражение желудочно-кишечного тракта | 1 (3,7%) | |
Рис. Центр ревматологии Вильнюсской клиники Santaros с 2001 г.
Семь (25,9%) пациентов в начале заболевания получали только глюкокортикоиды перорально, а 20 (74,1%) пациентов принимали дополнительные препараты ().
Таблица 2.
Лечение в течение первого года болезни
| AZA | 3 (11.1%) | |
| PGT | 4 (14,8%) | |
| CYC | 4 (14,8%) | |
| CYC + AZA | 2 (7,4%) | |
| CYC + PGT | 2 (7,4%) | |
| CYC + AZA + PGT | 3 (11,1%) | |
| CYC + MTX | 1 (3,7%) | 1 (3,7%) |
Медиана BVAS составила 7 (минимум (минимум) — 2; максимум (максимум) — 23). Медиана возраста составила 52 года (мин. — 12; макс. — 75).Результаты лабораторных исследований при первом посещении представлены в.
Таблица 3.
Результаты лабораторных исследований во время первого визита