процесс ресинтеза и биосинтеза происходит в клетке
Профилактика атеросклероза, как и терапия заболевания, напрямую связаны с контролем уровня липидных структур в организме. Особое внимание уделяется холестерину (ХС), молекула которого представляет собой липофильный спирт. Отсюда происходит непривычное на бытовом уровне, но химически корректное название вещества – холестерол. Именно окисление неиспользованных организмом липидов свободными радикалами – первый этап в последовательности формирования атеросклеротических бляшек. С другой стороны, соединения липидных структур с протеинами, создают биологические комплексы, способные очищать сосуды. Это липопротеины высокой плотности – ЛПВП. Таким образом, синтез и биосинтез липидов важен применительно к общему здоровью человека. Процесс непосредственно влияет на уровень холестерина в организме.
Что включает класс липидов
Категория объединяет жиры и подобные им вещества. На молекулярном уровне, липид формируется на двух базовых элементах: спирт и жирная кислота. Также допускается вхождение дополнительных компонентов. Подобные структуры относят к классу сложных липидов. Наибольший интерес, с точки зрения профилактики атеросклероза, привлекают следующие представители этого класса:
- Жирные спирты, а именно холестерин.
- Триглицериды.
Определенного внимания заслуживали бы жирные кислоты (ЖК), в частности полиненасыщенные – Омега-3. Вещество способствует снижению ХС. Однако организмом человека их синтез не осуществляется.
Общий принцип биосинтеза липидов
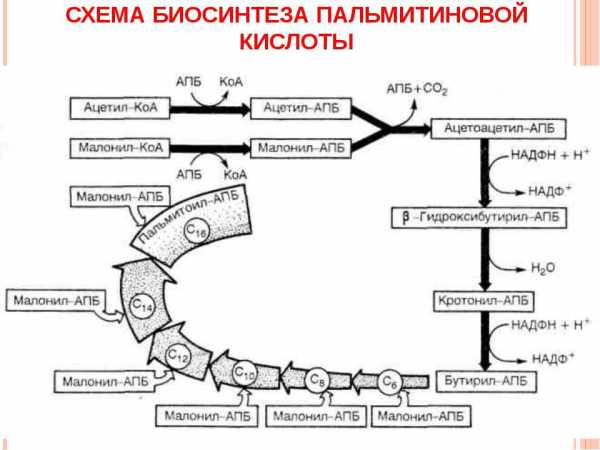
Образование ЖК и их производных начинается с цитоплазмы. Вторая часть биосинтеза – удлинение молекулярной цепи также продолжается в клетке, однако «производственная мастерская смещается» внутрь митохондрии. На каждом этапе, соединение обогащается двумя атомами C, что напоминает процесс бета-окисления, только в его обратной интерпретации.
Говоря более развернуто, в цитоплазме непосредственно и происходит синтез, например пальмитиновой кислоты. Митохондрии же, используют уже готовый «полуфабрикат», для производства полноценных жирных кислот, состоящих из 18-и и более атомов углерода. Выполнить весь биосинтез самостоятельно от «А» до «Я», митохондрии не в состоянии. Причина банальна – «низкий уровень квалификации». Возвращаясь к технической терминологии, митохондрии обладают очень низкой способностью включать меченые уксусные кислоты в длинную цепь липидных структур.
Базовый внемитохондриальный биосинтез ЖК, напротив, не имеет общих пересечений с процессом их окисления. Его механизм, требует трех компонент:
- ацетил-КоА – первичный метаболит;
- CO2 – тут без комментариев, вещество общеизвестное;
- ионов бикарбоната – HCO3-.
Метаболит представляет собой строительный фундамент. Изначально ацетил-КоА образуется именно в митохондрии. Его синтез – следствие процесса окислительного декарбоксилирования. Просочиться напрямую в цитоплазму, соединение не может в силу непроницаемости для него митохондриальной мембраны. Удается осуществить проникновение путем обходного маневра:
- Митохондриальный метаболит производит цитрат, посредством взаимодействия с оксалоацетатом.
- Для синтезированного цитрата митохондриальная мембрана прозрачна. Поэтому его молекулы с легкостью пробиваются в цитоплазму.
- Далее происходит обратная трансформация. Едва преодолев мембрану, цитрат расщепляется на исходные компоненты – ацетил-КоА и оксалоацетат.
Таким образом, метаболит передается от митохондрии. В цитоплазме непосредственного получения соединения не происходит. Альтернативный вариант переноса ацетил-КоА возможен при участии карнитина. Однако, в процессе синтеза ЖК, – это своеобразный «бронепоезд, стоящий на запасном пути». Данный канал используется значительно реже.
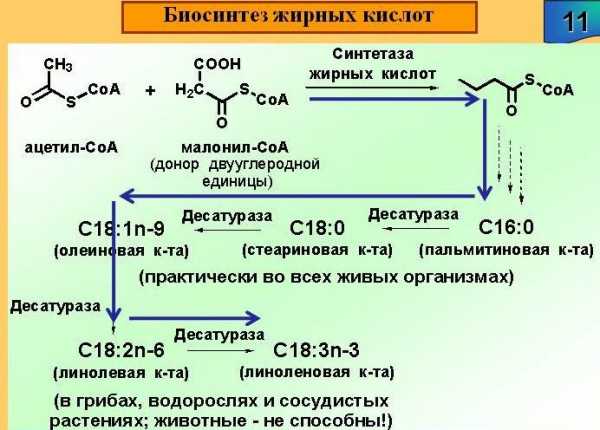
Заключительный этап биосинтеза
Оказавшись в цитоплазме метаболит готов к производству прекурсора ЖК – малонил-КоА. Для этого ацетил-КоА и требуется двуокись углерода. Катализатором процесс выступает фермент ацетил-КоА-карбоксилазы. Биосинтез распределяется на два периода:
- Карбоксилирование биотин-энзима. Протекает в присутствии CO2 и АТФ.
- Перенос карбоксильной группы на метаболит.
Результирующий малонил-КоА в дальнейшем быстро трансформируется в ЖК. Процесс происходит с участием определенной ферментной системы. Фактически, это комплекс взаимосвязанных ферментов. Он именуется синтетаза жирных кислот, имеет 6 различных ферментов и связующий элемент – ацилпереносящий белок (осуществляют роль, аналогичную КоА).
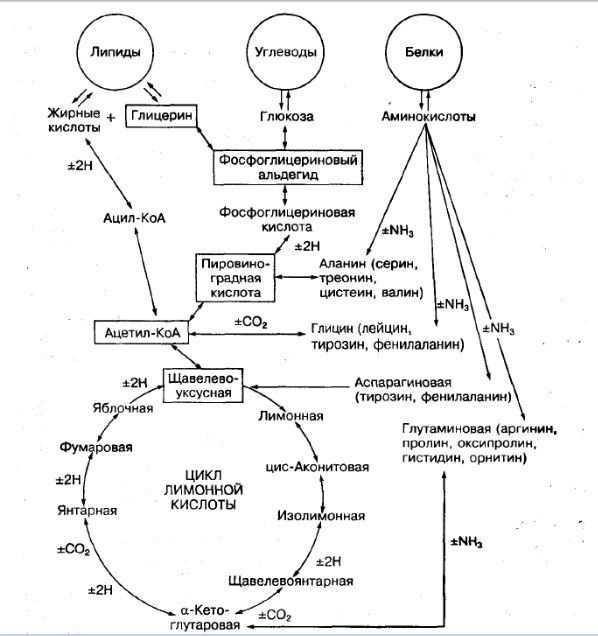
Разобравшись с биосинтезом липидов на общем уровне, самое время перейти к конкретным примерам.
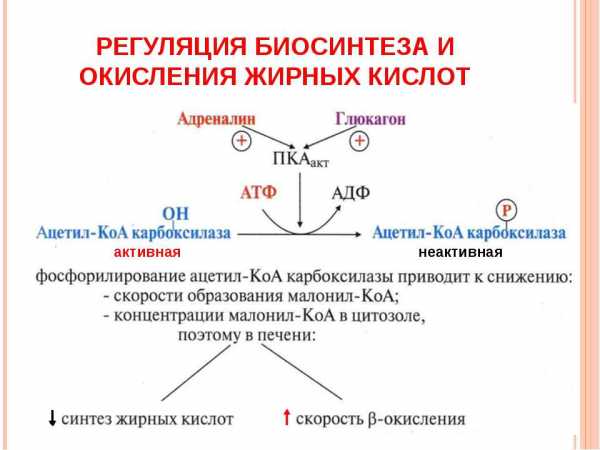
Биосинтез триглицеридов
Эффект особенно проявляется при истощении. Вследствие этого, образуется недостаток глюкозы, что приводит к резкому снижению производства глицерол-3-фосфата. Как результат свободные ЖК не используются на ресинтез липидов, просто покидая ткань.
Еще одним источником промежуточного синтеза глицерол-3-фосфат выступает печень. Орган может производить вещество обоими способами, с использованием как глицерина, так и глюкозы, в качестве базового соединения. Впрочем, для синтеза глицерол-3-фосфат главное, что события произошли, поскольку в дальнейшем соединение ацилируется. То есть происходит процесс введения RCO- остатка при помощи молекул ЖК (КоА производные).
Это приводит к синтезу фосфатидной кислоты. В дальнейшем от полученного соединения отщепляется остаток фосфорной кислоты. Реакция дефосфорилирования протекает с участием фосфатидатфосфатазы. Ее продуктом выступает 1,2-диглицерид. До получения триглицерида остается единственный шаг. Он состоит в этерификации. Кислотой выступает 1,2-диглицерид, заместителем спирта – фермент ацил-КоА.
Биосинтез холестерина
Ферментативный процесс образования ХС – достаточно сложная «многоходовая комбинация», насчитывающая более 35 энзиматических реакций. Очевидно, что охватить подобный объем преобразований не под силу даже Остапу Бендеру. Поэтому проще рассмотреть базовые стадии биосинтеза холестерола:
- Получение мевалоновой кислоты. Происходит в эукариоте – домене живых организмов. Требует три молекулы активного ацетата.
- Формирование сквалена. Прекурсором выступает ранее произведенная мевалоновая кислота. Изначально соединение трансформируется в активный изопреноид, из 6 молекул которого и образуется сквален.
- Синтез холестерина. Процесс осуществляется циклизацией сквалена. Синтезируется своеобразный прекурсор – ланостерин, переход которого в ХС все еще находится под изучением.
Первоначально биосинтез инициируется формированием ацетоацетил-КоА. Далее, структура подвергается конденсации с 3-ей молекулой активного ацетата. Полученное производное вещество вступает в реакцию восстановления, что и приводит к формированию мевалоната.
Следующий шаг в биосинтезе ХС – превращение мевалоната в сквален. Изначально, соединение подвергается переносу остатка фосфорной кислоты при помощи фермента АТФ. Продуктом реакции выступает 5′-пирофосфорный эфир. Впрочем, соединение не долговечно. Оно практически моментально трансформируется, в эфир мевалоната. Цепочка последующих преобразований достаточно запутана, поэтому проще ограничиться фактом. Результатом этих процессов становится образование сквалена. Реакция циклизации соединения приводит к формированию ланостерина, с последующим биосинтезом холестерола.
Остается добавить, что преимущественно процесс протекает в печени. Поэтому дисфункции органа, способны вызывать нарушения липидного баланса. При нормальной работе, печень производит ежесуточную норму холестерина, с учетом вещества, поступающего с продуктами. Этот факт еще раз опровергает распространенное заблуждение о вреде пищи с высоким содержанием холестерина. Здоровая печень, способна самостоятельно контролировать уровень вещества.
sosudportal.ru
— ресинтез липидов — Биохимия
Всасывание липидов
После расщепления полимерных липидных молекул полученные мономеры всасываются в верхнем отделе тонкого кишечника в начальные 100 см. В норме всасывается 98% пищевых липидов.
1. Короткие жирные кислоты (не более 10 атомов углерода) всасываются и переходят в кровь без каких-либо особенных механизмов. Этот процесс важен для грудных детей, т.к. молоко содержит в основном коротко- и среднецепочечные жирные кислоты. Глицерол тоже всасывается напрямую.
2. Другие продукты переваривания (длинноцепочечные жирные кислоты, холестерол, моноацилглицеролы) образуют с желчными кислотами мицеллы с гидрофильной поверхностью и гидрофобным ядром. Их размеры в 100 раз меньше самых мелких эмульгированных жировых капелек. Через водную фазу мицеллы мигрируют к щеточной каемке слизистой оболочки. Здесь мицеллы распадаются и липидные компоненты диффундируют внутрь клетки, после чего транспортируются в эндоплазматический ретикулум.
Желчные кислоты также здесь могут попадать в энтероциты и далее уходить в кровь воротной вены, однако бóльшая их часть остается в химусе и достигает подвздошной кишки, где всасывается при помощи активного транспорта.
Ресинтез липидов в энтероцитах
Ресинтез липидов – это синтез липидов в стенке кишечника из поступающих сюда экзогенных жиров, иногда могут использоваться и эндогенные жирные кислоты. Основная задача этого процесса – связать поступившие с пищей средне- и длинноцепочечные жирные кислоты со спиртом – глицеролом или холестеролом. Это ликвидирует их детергентное действие на мембраны и позволяет переносить по крови в ткани.
Активация жирной кислоты
Поступившая в энтероцит (как и в любую другую клетку) жирная кислота обязательно активируется через присоединение коэнзима А. Образовавшийся ацил-SКоА участвует в реакциях синтеза эфиров холестерола, триацилглицеролов и фосфолипидов.
Реакция активации жирной кислоты
Ресинтез эфиров холестерола
Холестерол этерифицируется с использованием ацил-SКоА и фермента ацил-SКоА:холестерол-ацилтрансферазы
Реэтерификация холестерола напрямую влияет на его всасывание в кровь. В настоящее время ищутся возможности подавления этой реакции для снижения концентрации ХС в крови.
Реакция ресинтеза холестерола
Ресинтез триацилглицеролов
Для ресинтеза ТАГ есть два пути:
Первый путь, основной – 2-моноацилглицеридный – происходит при участии экзогенных 2-МАГ и ЖК в гладком эндоплазматическом ретикулуме энтероцитов: мультиферментный комплекс триацилглицерол-синтазы формирует ТАГ.
Моноацилглицеридный путь образования ТАГ
Поскольку 1/4 часть ТАГ в кишечнике полностью гидролизуется, а глицерол в энтероцитах не задерживается и быстро переходит в кровь, то возникает относительный избыток жирных кислот для которых не хватает глицерола. Поэтому существует второй, глицеролфосфатный, путь в шероховатом эндоплазматическом ретикулуме. Источником глицерол-3-фосфата служит окисление глюкозы. Здесь можно выделить следующие реакции:
- Образование глицерол-3-фосфата из глюкозы.
- Превращение глицерол-3-фосфата в фосфатидную кислоту.
- Превращение фосфатидной кислоты в 1,2-ДАГ.
- Синтез ТАГ.
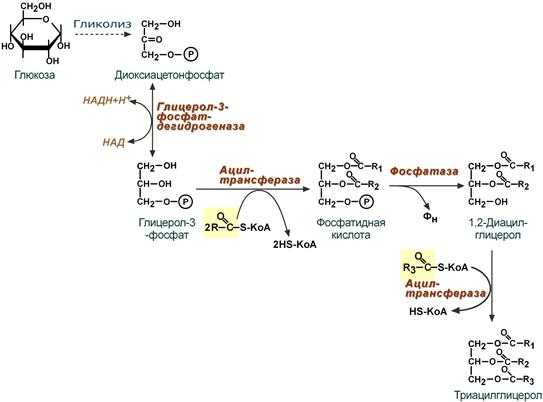
Глицеролфосфатный путь образования ТАГ
Ресинтез фосфолипидов
Фосфолипиды синтезируются также, как и в остальных клетках организма (см «Cинтез фосфолипидов»). Для этого есть два способа:
Первый путь – с использованием 1,2-ДАГ и активных форм холина и этаноламина для синтеза фосфатидилхолина или фосфатидилэтаноламина.
Ресинтез фосфолипидов из ДАГ на примере фосфатидилхолина
Второй путь – на основе синтезируемой in situ фосфатидной кислоты.
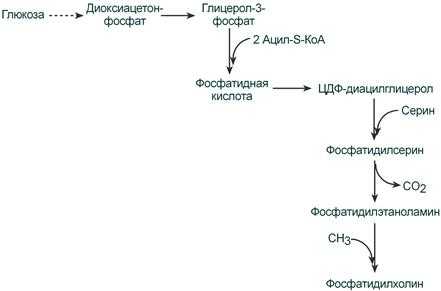
Схема ресинтеза фосфолипидов из фосфатидной кислоты
После ресинтеза фосфолипиды, триацилглицеролы, холестерол и его эфиры упаковываются в особые транспортные формы липидов – липопротеины и только в такой форме они способны покинуть энтероцит и транспортироваться в крови. В кишечнике формируются два вида липопротеинов – хиломикроны и липопротеины высокой плотности (ЛПВП), другие типы липопротеинов здесь не образуются.biokhimija.ru
Введение в клеточную биологию :: Теория и практика :: Эукариотическая клетка :: Эндоплазматический ретикулум
ЭПС, или ЭПР (reticulum — сеточка), имеется во всех эукариотических клетках. Мембраны ЭПС составляют более половины общего количества всех мембран клетки. Они чрезвычайно извилисты, образуют непрерывную поверхность с многочисленными складками и изгибами, которая ограничивает единое внутреннее пространство – полость ЭПС – от цитозоля. Полость ЭПС составляет более 10% общего объема животной клетки.ЭПС была открыта с помощью электронного микроскопа в 1945 г., когда Портер, Клод и Фуллман обнаружили в фибробластах цыпленка и некоторых других клетках, фиксированных четырехокисью осмия, тончайшую сеточку. Она представляла собой систему взаимосвязанных каналов, пузырьков, цистерн. Слово «сеть» отражает ее главную особенность – непрерывность. ЭПС не выражена в яйцеклетках, меристематических, эмбриональных и других недифференцированных клетках. В сперматоцитах она представлена лишь отдельными пузырьками. Полностью отсутствует в зрелых эритроцитах, в бактериях и сине-зеленых водорослях.
Детальный анализ показал, что ЭПС в разных клетках и даже в разных участках одной клетки имеет морфологические различия. Первый тип ЭПС – шероховатая, второй – гладкая. Гранулярная или шероховатая ЭПС Это система плоских слоев и цистерн, часто расположенных параллельно друг другу и покрытых рибосомами. Просвет полостей шероховатой ЭПС составляет от 20 до 30 нм. Шероховатые микросомы содержат более 20 белков, отсутствующих в гладких микросомах. Одни из них связывают рибосомы, являются местом прикрепления в период синтеза белка. ЭПС играет важнейшую роль в процессах биосинтеза.
Шероховатая ЭПС – это место синтеза всех белков клетки и формирования внеклеточного матрикса. Белковая цепочка синтезируется на рибосомах в цитозоле. Затем включается механизм переноса, с помощью которого одни белки полностью переносятся через мембрану ЭПС и освобождаются в ее полость. В дальнейшем они или переносятся к другим органоидам, или выводятся из клетки, секретируются. Другие белки лишь частично переносятся через мембрану, остаются заключены в нее, за их счет пополняются или восстанавливаются мембраны.
Гладкая ЭПС имеет выраженное трубчатое строение, это сеть тонких трубочек диаметром от 30 до 60 нм, лишенная прикрепленных рибосом. В большей части клеток гладкий тип ЭПС присутствует в малых количествах. Однако существуют клетки, в которых гладкая ЭПС хорошо развита. Они специализируются на синтезе липидов и углеводов. К ним относятся, например, клетки печени-гепатоциты, клетки коркового вещества надпочечников, синтезирующих стероиды. В мембранах гладкой ЭПС образуются почти все липиды, необходимые для построения новых клеточных мембран, включая фосфолипиды и холестерол. Синтез липидов протекает на цитоплазматической стороне мембраны и катализируется ферментами, которые также включены в мембраны ЭПС, их активные центры обращены в цитозоль. Вновь образованные липидные молекулы включаются первоначально только в тот слой липидных молекул, который обращен к цитозолю. Затем происходит перенос и распределение вновь синтезированных липидов во внутреннем липидном слое мембраны. В этом процессе переноса — “флиппинге” – участвуют специальные белки-переносчики. В результате происходит равномерный рост мембраны. Однако ферменты избирательно узнают и переносят лишь некоторые типы липидов, поэтому липидный бислой ассиметричен. В частности, один из липидных слоев обогащен фосфатидилхолином.
Кроме синтеза липидов и углеводов гладкая ЭПС участвует в процессах детоксикации. Так, в клетках печени за счет активности и увеличения поверхности гладкой ЭПС разрушаются такие соединения как фенобарбитал. После детоксикации, примерно через 5 суток, избыток гладкой ЭПС исчезает. Таким образом, ЭПС – это фабрика, производящая белки, углеводы и липиды, необходимые клетке. Она является также местом сборки мембран для всех клеточных мембранных органоидов.
media.ls.urfu.ru
Синтез липидов из углеводов
Если количество углеводов, поглощенных с пищей за один прием, больше того, чем может быть запасено в виде гликогена, то избыток углеводов превращается в жиры. Начальная последовательность реакций совпадает при этом с обычным окислительным путем, т.е. сначала из глюкозы образуется ацетил-КоА, который используется в цитоплазме клетки для синтеза длинноцепочечных жирных кислот. Затем жирные кислоты запасаются в виде нейтральных жиров (триглицеридов), которые откладываются в разных частях тела. Когда требуется энергия, нейтральные жиры подвергаются гидролизу и жирные кислоты поступают в кровь, адсорбируются молекулами плазменных белков (альбуминов и глобулинов) и затем поглощаются различными клетками.
Циклы Кори и аланина
В клетках, не содержащих митохондрий (например, в эритроцитах), или в тканях при недостаточном снабжении кислородом (например, в активно работающих мышцах) АТФ (АТР) синтезируется за счет процесса превращений глюкозы в лактат (анаэробного гликолиза).
Лактат переносится кровью в печень, где в процессе глюконеогенеза с затратой АТФ вновь конвертируется в глюкозу (цикл Кори).
При интенсивной работе мышц максимально активируется гликолиз. Продукт гликолиза, пировиноградная кислота (пируват) накапливается в цитоплазме и недостаточно быстро поступает в митохондрии, если они из-за недостатка кислорода не готовы к окислению пирувата. В анаэробных условиях пируват в реакции, катализируемой лактатдегидрогеназой (заключительный этап гликолиза) восстанавливается до лактата. Одновременно НАДН (NADH), кофермент лактатдегидрогеназы, окисляется до НАД+ (NAD+), который вновь используется на окислительном этапе гликолитического пути. Этой реакции способствует относительно высокое отношение НАДН/НАД+ в мышечной ткани. Лактат диффундирует в кровь и поступает в печень, где конвертируется в глюкозу. Таким образом, образование лактата временно заменяет аэробный метаболизм глюкозы и частично переносит этот процесс из мышц в печень.
Обратная связь, подобная циклу Кори, существует в глюкозо-аланиновом цикле, в котором также участвует пируват. Глюкозо-аланиновый цикл берет начало с протеолиза белков. Образующиеся аминокислоты в результате трансаминирования в присутствии ферментов превращаются в α-кетокислоты, которые в основном включаются в цикл трикарбоновых кислот (цитратный цикл). Одновременно в реакции, катализируемой аланинтрансаминазой, аминогруппы из разных аминокислот переносятся на имеющийся субстрат, пируват. Образующийся аланин поступает в кровь и переносится в печень. Таким образом, цикл аланина служит каналом передачи азота и предшественников глюкозы в печень, которая является местом синтеза конечных продуктов азотистого обмена, например мочевины.
Роль инсулина в регуляции обмена веществ
Инсулин участвует в регуляции всех видов обмена веществ. Это основной гормон, обладающий гипогликемическим действием (снижению сахара крови также способствует соматостатин).
Он является полипептидным гормоном, образующимся в β-клетках поджелудочной железы. Главным стимулятором синтеза и секреции инсулина является глюкоза. Образующийся инсулин поступает в сосудистое русло, где он частично остается в свободном виде, а частично образует комплексы с белками крови.
Инсулин опосредует поступление и метаболизм глюкозы в ткани, имеющие рецепторы к инсулину (инсулинзависимые ткани), рис. 7.
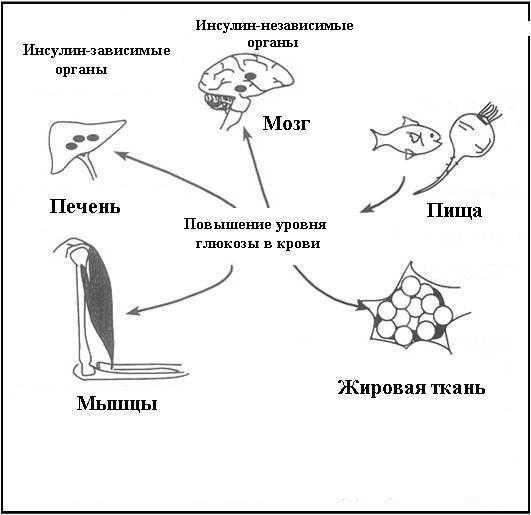
Рис. 7. Инсулин-зависимые и инсулин-независимые органы.
К инсулинзависимым тканям относятся мышечная, жировая ткань, печень и островковый аппарат поджелудочной железы. В эти ткани глюкоза поступает путем пассивного переноса или облегченной диффузии. Остальные ткани являются инсулиннезависимыми и поступление глюкозы в них происходит без участия инсулина по градиенту концентрации.
Активируя гексокиназу, в клетках инсулинзависимых тканей инсулин обеспечивает фосфорилирование глюкозы, превращение ее в Гл-6-фосфат и дальнейшее превращение. Инсулин стимулирует гликолиз, цикл Кребса, пентозофосфатный путь обмена глюкозы и угнетает глюконеогенез. Инсулин усиливает гликогенез в результате активации гликоген-синтетазы и тормозит гликогенолиз.
Кроме глюкозы инсулин также опосредует поступление в клетки аминокислот и электролитов. Он активирует синтез белка, жира и тормозит их распад, препятствует избыточному холестерол- и кетообразованию. Инсулин также участвует в регуляции водно-электролитного обмена (обладает водо- и солесберегающим действием), участвует в регуляции кислотно-основного состояния (препятствует развитию ацидоза).
Суточная потребность в инсулине – 40 единиц, а его содержание в поджелудочной железе здорового человека составляет 150-250 Ед. Инактивация инсулина происходит преимущественно в печени и почках под влиянием инсулиназы.
По влиянию на уровень глюкозы другие гормоны (глюкагон, соматотропный гормон (СТГ), пролактин, адреналин и норадреналин, глюкокортикоиды) относятся к группе контринсулярных гормонов. Глюкагон синтезируется в α-клетках поджелудочной железы. Механизм гипергиликемического действия глюкагона связан с усилением гликогенолиза в печени. Аналогичным действием обладают СТГ, пролактин, адреналин и норадреналин. Гипергликемическое действие глюкокортикоидов преимущественно связано с их стимулирующим влиянием на глюконеогенез.
studfiles.net
2. Синтез, транспорт и утилизация липидов в организме.
Классификация липопротеинов:
Экзогенные ЛП — хиломикроны. Основные апопротеины: В-48, Cs, Е, AI, АII. Переносят, главным образом, ТГ. Хиломикронами обусловлена молочность плазмы крови после приема пищи, в течение первых 8 часов они расщепляются периферическими ферментами (ТГ-липазой). Именно поэтому, во избежание хилеза сыворотки крови, забор крови рекомендуется проводить через 12 часов после еды.
ЛПОНП. Их основными компонентами являются эндогенные ТГ, а также апопротеины В-100, Cs, E.
ЛПНП содержат апопротеин В-100 и транспортируют эфиры ХС.
ЛПВП состоят из апопротеинов AI, All, E, Cs и эфиров ХС.
Принципиальная схема синтеза, транспорта и утилизации липидов представлена на слайде 1.
Синтезиразрушение липидовпроисходят практически во всех тканях организма. Вместе с тем, ряд тканей выполняют специализированные функции. Так, поглощение экзогенных липидов происходит в стенкахтонкого кишечника; запасание – вжировой ткани; выведение продуктов распада липидов — вкишечнике,почках,легких(слайд 2). Центральное место в метаболизме липидов занимаетпечень, в которой происходит пересечение путей метаболизма липидов, углеводов и белков. Здесь же синтезируется основная масса белковтранспорта липидов, а также продукты деградации липидов, выводящиеся из организма.
Основные ключевые моменты транспорта липидов отражены на слайдах 3 и 4.
Различают два пути транспорта липидов.
Экзогенный путь. В стенке кишечника триглицериды и холестерин, находящиеся в составе пищи, включаются в большие липопротеиды (хиломикроны), которые попадают через лимфу в кровоток. Хиломикроны содержат апопротеин СП, активирующий липопротеидлипазу в капиллярах, высвобождая, таким образом, жирные кислоты и моноглицериды из хиломикрона. Жирные кислоты проходят через клетки эндотелия в жировые или мышечные клетки. Остатки хиломикрона захватываются из крови печенью. В результате триглицериды доставляются в жировую ткань, а холестерин — в печень.
Эндогенный путь. Печень синтезирует триглицериды и выделяет их в кровь вместе с холестерином в форме липопротеидов очень низкой плотности (ЛПОНП). ЛПОНП — крупные частицы, они переносят в 5-10 раз больше триглицеридов, чем сложных эфиров холестерина; связанные с апопротеинами ЛПОНП переносят их в ткани, где липопротеидлипаза гидролизует триглицериды. Остатки ЛПОНП либо возвращаются в печень для повторного использования, либо преобразуются в липопротеиды низкой плотности (ЛПНП). ЛПНП доставляют холестерин в клетки, расположенные вне печени (клетки кортикального слоя надпочечников, лимфоциты, а также миоциты и клетки почки). ЛПНП связываются специфическими рецепторами, локализованными на поверхности клеток, а затем подвергаются эндоцитозу и перевариванию в лизосомах. Освобожденный холестерин участвует в синтезе мембран и метаболизме. Кроме того, некоторое количество ЛПНП разрушается фагоцитами-«мусорщиками» в ретикулоэндотелиальной системе. В то время как в клеточных мембранах происходит обмен веществ, неэстерифицированный холестерин высвобождается в плазму, где связывается с липопротеидами высокой плотности (ЛПВП) и эстерифицируется жирными кислотами с помощью лецитин-холестерин-ацетилтрансферазы (ЛХAT). Сложные эфиры холестерина ЛПВП превращаются в ЛПОНП и, в итоге, в ЛПНП. Посредством этого цикла ЛПНП доставляет холестерин в клетки, а холестерин возвращается из внепеченочных зон с помощью ЛПВП.
studfiles.net
Где происходит синтез липидов в клетке
Взаимосвязь между состоянием печени и повышенным уровнем холестерина
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для снижения холестерина наши читатели успешно используют Aterol. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Холестерин – продукт жирового обмена, который большей частью синтезируется в организме человека. Его количество определяется питанием и работой печени. Как взаимосвязаны холестерин и печень? Почему здоровье пищеварительного органа определяет количество липидных молекул в крови человека?
Для начала рассмотрим, для чего нужны холестерины (липиды), и какая роль печени в их синтезе.
Для чего нужен холестерин: желчь, гормоны, витамины
15% холестерина расходуется на строительство мембран новых клеток. Те молекулы, которые не пошли на  строительство, синтезируется в желчь. По медицинской терминологии холестерин в печени человека синтезируется в желчные кислоты. Какое количество холестерина синтезируется в печени?
строительство, синтезируется в желчь. По медицинской терминологии холестерин в печени человека синтезируется в желчные кислоты. Какое количество холестерина синтезируется в печени?
В желчь перерабатывается основная часть липидов, которая была синтезирована печенью (до 80%). Остальные 20% расходуются на построение оболочек клеток и синтез гормонов, витаминов D3 (соответственно 15% и 5%).
Синтез и действие холестерина в организме
Как уже говорили выше, липидные молекулы выполняют несколько функций. Поэтому он должен обязательно присутствовать в организме — поступать извне и образовываться внутри. Где синтезируется холестерин?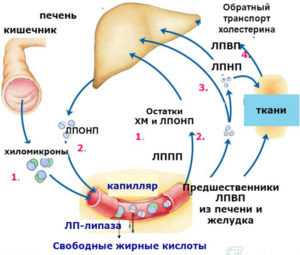
Основной синтез холестерина происходит в печени (здесь образуется 45 общего количества липидных молекул). Меньшее их количество синтезируется в других клетках (в почках, кишечнике, потовых железах – в них образуется до 15 липидов).
Всего в течение дня организм взрослого человека синтезирует около 1 г холестерина. После его использования (переработки в желчь, обустройства новых мембран, синтеза витаминов и гормонов) избыток выводится. Это составляет около 100 мг в день или 110 от синтезированного количества. Таким образом, поступление и расход липидов уравновешивают друг друга без образования свободного холестерина в крови.
Проблемы начинаются тогда, когда человек употребляет слишком много жирной пищи или когда нарушается работа печени. Тогда в крови и сосудах начинают накапливаться свободные липопротеины низкой плотности. При этом не только формируется ожирение. Липопротеины оседают на сосудистых стенках, сужают их просвет, и становятся причиной стойкого повышения давления (гипертонии).
Кругооборот холестерина
Мы уже говорили о непосредственной взаимосвязи печени и холестерина. Большая часть липидных молекул синтезируется клетками печени. Сырьём для синтеза являются углеводы, жиры и белки, которые поступают с пищей. При этом количество жиров и углеводов определяет скорость образования новых молекул и их количество в крови человека.
Как холестерин разносится по организму: липопротеины
Взаимосвязь холестерина и печени определяет процесс образования желчи. Желчные кислоты синтезируются в печёночных проходах из липидных молекул. Далее они двигаются вместе в кишечник. Здесь — соединяются с белковыми молекулами (покрываются белковой оболочкой). И только после — всасываются в кровь и разносятся с кровотоком. Небольшая часть липидов (их избыток) возвращается в печень, где снова разлагается, выводится в толстый кишечник, и после – наружу.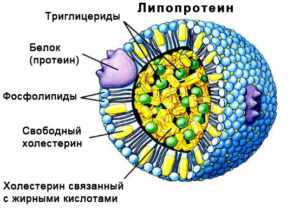
Соединение липидов с белковыми веществами необходимо для транспортировки по крови. Сам по себе жир не растворяется в водном солевом растворе (в крови). Для движения по сосудистому руслу шарики холестерина покрываются слоем белка. Получившийся белково-холестериновый комплекс называется липопротеином.
Различают липопротеины низкой и высокой плотности. Вещества с низкой плотностью работают в транспортировке холестерина к разным тканям. Именно эта форма липопротеинов может оседать на сосудистых стенках, поэтому её называют «низкой» и «плохой».
Высокоплотный липопротеин работает для переноса избытка холестерина в печень. Он не способен оседать на стенках сосудов, его называют «высоким» и «хорошим».
На заметку: вредными для человека являются липопротеины низкой плотности. Именно они окисляются и оседают на снетках внутри сосудов.
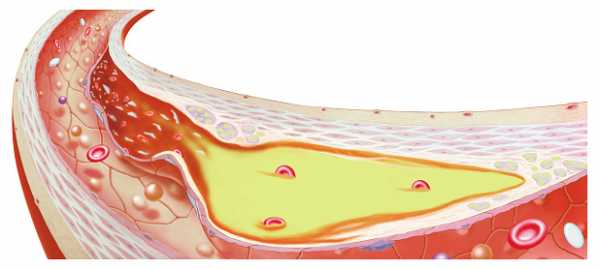
Где хранится холестерин
В организме человека запас липидов находится в различных тканях. В стенках сосудов — их только 10%. Остальные 90% — располагаются в клетках других тканей человека. При этом 30% липидных молекул хранится в мозге.
Поступление, синтез, усваивание и выведение холестерина обеспечивают организм необходимым его количеством. При этом сбой в любом звене цепочки (при синтезе в печени, или при образовании клеточных мембран, витаминов, гормонов) приводит к нарушениям взаимосвязей и обменных процессов. У человека развиваются серьёзные болезни – атеросклероз сосудов, гипертония и ожирение.
Главными факторами нарушения усвоения липидов являются – неправильное питание и болезни печени.
Больная печень и синтез/утилизация холестерина
Различные заболевания печени приводят к нарушению синтеза холестерина. Что происходит, если печень человека – воспалена или инфицирована?
- Клетки печени перестают синтезировать холестерин и вырабатывать желчь в нужных количествах.

- Количество липопротеинов в крови резко возрастает.
- Увеличение количества липопротеинов в крови делает кровь вязкой и густой. В процессе движения липопротеины оседанию на внутренних стенках сосудов, формируют холестериновые бляшки и сужают сосудистый просвет. Так развивается атеросклероз сосудов, повышенное давление.
- В желчных протоках образуется застой.
- Застой желчи приводит к её накоплению в печени, пузыре и желчных протоках. В результате чего она уплотняется и выпадает в осадок, формирует камни разного размера и плотности. Так развивается желчекаменная болезнь, которая сопровождается воспалением желчных протоков и пузыря.
- Застой желчи становится причиной застоя пищевого комка в кишечнике (не достаточно ферментов и желчи для переваривания еды). Застоявшаяся еда является благоприятной средой для размножения патогенных бактерий. В кишечнике формируются гнилостные процессы, развивается дисбактериоз. Патогенные бактерии перерабатывают желчь в токсины, которые всасываются в кровь, поступают в печень и ещё более нарушают её работу.
Таким образом, пустяковые на первый взгляд проблемы с выработкой и усваиванием липидов формируют серьёзные заболевания разных органов человека.
На заметку: застой желчи и увеличению концентрации холестерина в крови также способствует алкоголь.

Много холестерина: почему это плохо
Большое количество липидов в организме человека образуется при болезнях печени. Оно также появляется при излишнем употреблении жиров и углеводов. Как проявляется избыток холестерина в организме человека:
- Для построения клеточных оболочек требуется определённое количество холестерина. Если в клеточной мембране оказывается слишком много липидов, она становится непроницаемой, клетка стареет.
- Излишнее присутствие холестерина в крови формирует проблемы в печени, желчном пузыре, поджелудочной железе. Сосуды человека покрываются холестериновыми отложениями (формируется атеросклероз).
Существует взаимосвязь между процессами выработки холестерина в печени и его поступлением извне. При увеличении количества жиров в пище усиливается его синтез в печени. И наоборот. Таким образом, два процесса взаимно влияют друг на друга. Несбалансированное питание может стать причиной болезней печени и ожирения. А заболевания печени, в свою очередь, могут вызвать нарушения жирового обмена, увеличение количества липидов в крови человека.
Как нормализовать липиды в крови
Для того чтобы привести холестерин в норму, необходимо ограничить его поступление с пищей и наладить работу печени. Для контроля пище важно соблюдать диету, исключить из меню продукты с большим количеством жиров. Рекомендуется составить завтраки, обеды и ужины из фруктов, овощей, круп, нежирных сортов мяса. Исключить сдобу, сладости, жирные сорта мяса (свинину, баранину, сало).
Для того чтобы нормализовать работу печени, необходимо устранить застой желчи, стимулировать её движение по протокам. А также обеспечить своевременную очистку кишечника от каловых масс. Для желчегонного эффекта можно обратиться к тюбажам, желчегонным травам, а также делать массаж зоны печени. Стимулирующее действие массажа объясняется разогревом подкожных тканей и воздействием на рецепторы, которые взаимосвязаны с больным органом.
Массаж печени для вывода холестерина выполняется по зоне правого подреберья (в нижней части рёбер справа). В ходе массажа кожу поглаживают и растирают, а также обрабатывают аппликаторами (игольчатые аппликаторы Ляпко и Кузнецова).
Такой массаж усиливает движение крови в зоне печени и движение желчи по протокам. Он также может стимулировать движение камней, поэтому при желчекаменной болезни массаж делают мягко и аккуратно, слабыми движениями, поглаживаниями.
Если же камней в желчном пузыре нет, то можно позволить более активное растирание кожи, точечное игольчатое воздействие. Это будет стимулировать очистку печени, налаживать выработку желчи, а также снизит количество свободного холестерина в крови человека.
krov.holesterin-lechenie.ru
Синтез белков углеводов и липидов в клетке происходит в
Нарушения липидного обмена при сахарном диабете: влияние инсулина
Многие годы безуспешно боретесь с ХОЛЕСТЕРИНОМ?
Глава Института: «Вы будете поражены, насколько просто можно снизить холестерин просто принимая каждый день…
Читать далее »
Инсулин принимает участие в регуляции метаболизма, трансмембранного переноса ионов, аминокислот. Влияние инсулина на углеводный обмен трудно переоценить. У людей с сахарным диабетом также проявляются признаки нарушений различных видов метаболизма.
Сахарный диабет в последнее время диагностируется все больше. Заболевания вызывает различные нарушения обмена веществ. Сахарный диабет, патологическая физиология которого может сильно различаться, находится на третьем месте после онкологии и сердечно-сосудистых заболеваний. В мире насчитывается около 100 миллионов людей, больных диабетом. Каждые 10 лет количество диабетиков становится больше в 2 раза.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для снижения холестерина наши читатели успешно используют Aterol. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Самому большому риску заболеть подвержены люди из развивающихся стран и маргинальные элементы в развитых государствах. Нарушение обмена веществ при сахарном диабете, ведет к различным патологиям. Диабетом 2 типа чаще заболевают люди после 45 лет.
Механизм действия инсулина
В 1869 году Лангерганс нашел в поджелудочной железе островки, которые позже назвали его именем. Стало известно, что сахарный диабет может появиться после удаления железы.
Инсулин это белок, то есть полипептид, который состоит из А и Б цепей. Они соединены двумя дисульфидными мостами. Сейчас известно, что инсулин формируется и запасается бета-клетками. Инсулин нарушается под воздействием ферментов, которые восстанавливают дисульфидные связи и носят название «инсулиназа». Далее протеолитические ферменты занимаются гидролизацией цепей до низкомолекулярных частей.
Считается, что основным ингибитором секреции инсулина выступает сам инсулин в крови, и еще гипергликемические гормоны:
- адреналин,
- АКТГ,
- кортизол.
ТТГ, катехоламины, АКТГ, СТГ и глюкагон разными путями активируют в клеточной мембране аденилциклазу. Последняя активизирует формирование циклического 3,5 аденозин-монофосфата, он активирует другое элемент – протеинкиназу, она фосфолирирует микротрубочки бета-островков, что ведет к замедлению высвобождения инсулина.
Микротрубочки являются каркасом бета-клетки, по которой раньше синтезированный инсулин двигается в везикулах к клеточной мембране.
Самым сильным стимулятором формирования инсулина является глюкоза крови.
Механизм действия инсулина заключается также в антагонистических отношениях внутриклеточных посредников 3,5 – ГМФ и 3,5 АМФ.
Механизм нарушения обмена углеводов
Инсулин воздействует на обмен углеводов при сахарном диабете. Ключевым звеном при этом заболевании является недостаточность данного вещества. Оказывается большое влияние инсулина на обмен углеводов, а также на другие виды обменов, поскольку уменьшается секреция инсулина, снижается его активность либо нарушается рецепция клетками инсулинзависимых тканей.
Вследствие нарушения углеводного обмена при сахарном диабете понижается активность поступления глюкозы в клетки, возрастает ее объем в крови и активируются способы усвоения глюкозы, которые не зависят от инсулина.
Сорбитоловый шунт это состояние, когда глюкоза восстанавливается в сорбит, после чего окисляется во фруктозу. Но окисление ограничено инсулинзависисым ферментом. При активизации полиолового шунта возникает накопление в тканях сорбитола, это способствует появлению:
- нейропатии,
- катарайта,
- микроангиопатии.
Происходит внутреннее образование глюкозы из белка и гликогена, но и этот вид гоюкозы клетки не усваивают, поскольку есть недостаток инсулина. Аэробный гликолиз и пентозофосфатный шунт угнетаются, появляется гипоксия клеток и энергетическая недостаточность. Возрастает объем гликированного гемоглобина, он не является носителем кислорода, что усиливает гипоксию.
Белковый обмен при сахарном диабете может быть нарушен:
- гиперазотемией (увеличение уровня остаточного азота),
- гиперазотемией (увеличение объема азотистых соединений в крови).
Норма азота белка – 0,86 ммоль/л, а общий азот должен составлять 0,87 ммоль/л.
Причинами патофизиологии становятся:
- увеличение катаболизма белка,
- активизиация дезаминирования аминокислоты в печени,
- остаточный азот.
Небелковый азот это азот:
- аминокислот,
- мочевины,
- аммиака,
- креатинина.
Это происходит вследствие усиления деструкции белков, в основном, в печени и мышцах.
В моче при сахарном диабете увеличивается объем азотистых соединений. Азотурия имеет следующие причины:
- увеличение концентрации продуктов с азотом в крови, их секреция с мочой,
- нарушенный жировой обмен характеризуется кетонемией, гиперлипидемией, кетонурией.
При диабете развивается гиперлипидемия, что является увеличением объема в крови уровня липидов. Их количество больше нормы, то есть больше 8 г/л. Существуют следующие гиперлипидемии:
- активация в тканях липолиза,
- торможение уничтожения липидов клетками,
- усиление синтеза холестерина,
- торможение доставки ВЖК в клетки,
- понижение активности ЛПЛазы,
- кетонемия – увеличение объема в крови кетоновых тел.
В группе кетоновых тел:
- ацетон,
- ацетоуксусная кислота,
- р-оксималярная кислота.
Суммарный объем кетоновых тел в крови может быть выше 30-50 мг%. На это есть такие причины:
- активация липолиза,
- усиление окисления в клетках ВЖК,
- приостановка синтеза липидов,
- снижение окисления ацетил — КоА в гепатоцитах с формированием кетоновых тел,
Выделение кетоновых тел вместе с мочой это проявления сахарного диабета неблагоприятного течения.
Причина кетонурии:
- много кетоновых тел, которые проходят фильтрацию в почках,
- нарушения водного обмена при сахарном диабете, проявляющееся полидипсией и полиурией,
Полиурия это патология, которая выражена в образовании и выделении мочи в объеме, который превышает нормальные показатели. В обычных условиях выделяется от 1000 до 1200 мл за одни сутки.
При сахарном диабете суточный диурез составляет 4000-10 000 мл. Причинами является:
- Гиперосмия мочи, которая возникает из-за выведения избытка глюкозы, ионов, КТ и азотистых соединений. Таким образом, стимулируется фильтрация жидкости в клубочках и тормозит реабсорцию,
- Нарушение реабсорбции и экскреции, которые вызваны диабетической невропатией,
- Полидипсия.
Инсулин и жировой обмен
Печень под воздействием инсулина может запасать только определенный объем гликогена. Излишки глюкозы, которая поступила в печень, начинает фосфорилироваться и таким образом удерживаться в клетке, но затем они трансформируются в жир, а не в гликоген.
Эта трансформация в жир выступает результатом прямого воздействия инсулина, а формирующиеся при этом жирные кислоты кровь транспортирует в жировую ткань. В крови жиры входят в состав липопротеинов, которые играют важную роль в формировании атеросклероза. Вследствие этой патологии может начаться:
- эмболия,
- инфаркт.
Действие инсулина на клетки жировой ткани похоже на его действие на клетки печени, но в печени формирование жирных кислот проходит более активно, поэтом они переносятся из нее в жировую ткань. Жирные кислоты в клетках хранятся в виде триглицеридов.
Под воздействием инсулина снижается распад триглицеридов в жировой ткани, благодаря ингибированию липазы. Кроме этого, инсулин активизирует синтез жирных кислот клетками и участвует в их снабжении глицеролом, который нужен для синтеза триглицеридов. Таким образом, со временем накапливается жир, в том числе и в этом заключается физиология сахарного диабета.
Действие инсулина на жировой обмен может быть обратимо, при его низком уровне триглицериды вновь расщепляются на жирные кислоты и глицерол. Это связано с тем, что инсулин ингибирует липазу и при снижении его объема активируется липолиз.
Жирные свободные кислоты, которые формируются при гидролизе триглицеридов, одновременно поступают в кровь и применяются как источник энергии для тканей. Окисление этих кислот может быть во всех клетках, исключая нервные.
Большее количество жирных кислот, которые освобождаются при нехватке инсулина из жировых блоков, вновь поглощается печенью. Клетки печени могут синтезировать триглицериды и при отсутствии инсулина. При нехватке этого вещества, освобождающиеся из блоков жирные кислоты, собираются в печени в триглицеридовом виде.
По этой причине у людей с нехваткой инсулина, несмотря на общую тенденцию к сбросу веса, формируется ожирение печени.
Нарушение метаболизма липидов и углеводов
При диабете инсулинглюкагоновый индекс понижен. Это объясняется снижением секреции инсулина, а также увеличением выработки глюкагона.
Нарушения липидного обмена при сахарном диабете выражается в слабой стимуляции складирования и увеличении стимуляции мобилизации запасов. После употребления еды, в режиме постабсорбтивного состояния находятся:
- печень,
- мышцы,
- жировая ткань.
Продукты переваривания и их метаболиты, вместо того, чтобы откладываться как жиры и гликоген, циркулируют в крови. В определенной мере возникают и циклические процессы, например, одновременно протекающие процессы глюконеогенеза и гликолиза, а также процесс распада жиров и синтеза.
Все формы сахарного диабета отличаются сниженной толерантностью к глюкозе, то есть, гиперглюкоземия после употребления пищи или даже на голодный желудок.
Основными причинами гиперглюкоземии является:
- употребление жировой тканью и мышцами ограничено, поскольку при отсутствии инсулина ГЛБТ-4 не экспонируется на поверхности адипоцитов и миоцитов. Глюкоза не может быть запасена в виде гликогена,
- глюкоза в печени не применяется для запасания в виде гликогена, поскольку при низком объеме инсулина и высокого объема глюкагона гликогенсинтаза пребывает в неактивной форме,
- глюкоза в печени не используется для синтеза жиров. Ферменты гликолиза и пируватдегидрогеназа пребывают в пассивной форме. Заторможено превращение глюкозы в ацетил -СоА, который нужен для синтеза жирных кислот,
- путь глюконеогенеза при небольшой концентрации инсулина и высокой глюкагона активирован и возможен синтез глюкозы из глицерина и аминокислот.
Еще одним характерным проявлением сахарного диабета выступает повышенный уровень в крови липопротеинов, кетоновых тел и свободных жирных кислот. Пищевые жиры не депонируются в жировой ткани, поскольку липаза адипоцитов пребывает в активной форме.
Появляется высокое содержание жирных свободных кислот в крови. Жирные кислоты поглощает печень, их часть трансформируется в триацилглицерины, они в составе ЛОНП попадают в кровь. Определенное количество жирных кислот вступает в β-окисление в митохондриях печени, а формирующийся ацетил-СоА применяется для синтеза кетоновых тел.
Влияние инсулина на обмен веществ заключается также в том, что при введении инсулина в разных тканях организма происходит ускорение синтеза жиров и распад триглицеридлипидов. Нарушение обмена липидов это запасание жира, который служит удовлетворению энергетических потребностей при неблагоприятных ситуациях.
Чрезмерное появление цАМФ ведет к снижению синтеза белков и понижению ЛВП и ЛОНП. В результате снижения ЛВП понижается выведение холестерина из мембран клеток в плазму крови. Холестерин начинает откладываться в стенках мелких сосудов, что приводит к формированию диабетической ангиопатии и атеросклероза.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для снижения холестерина наши читатели успешно используют Aterol. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
В результате снижения ЛОНП – в печени накапливается жир, он в норме выводится в составе ЛОНП. Белковый синтез подавляется, что вызывает понижение формирования антител, а затем, и недостаточную устойчивость больных диабетом к инфекционным заболеваниям. Известно, что люди, имеющие нарушения белкового обмена страдают фурункулезом.
Возможные осложнения
Микроангиопатия представляет собой диабетический гломерулонефрит. Из-за диабетической ретинопатии, люди с сахарным диабетом теряют зрение в 70-90% случаев. В частности, у диабетиков развивается катаракта.
Вследствие нехватки ЛВП возникает избыточный холестерин в клеточных мембранах. Поэтому может появиться ишемическая болезнь сердца или облитерирующий эндартериит. Вместе с этим формируется микроангиопатия с нефритом.
При диабете формируется пародонтоз с гингивитом – пародонтитом – пародонтозом. У диабетиков нарушаются структуры зубов и поражаются опорные ткани.
Причинами патологии микрососудов в этих случаях, скорее всего, является формирование необратимых сшивок глюкозы с белками стенки сосудов. Тромбоциты при этом выделяют фактор, который стимулирует рост гладкомышечных составляющих сосудистой стенки.
Нарушения жирового обмена выражаются также в том, что жировая инфильтрация печени увеличивается в печени ресинтез липидов. В норме их выводят в виде ЛОНП, формирование которых зависит от объема белка. Для этого нужны донаторы группы СНЗ, то есть холин или метионин.
Синтез холина стимулирует липокаин, который вырабатывается эпителием протоков поджелудочной. Нехватка его приводит к ожирению печени и формированию тотального и островкового видов диабета.
Инсулиновая недостаточность ведет к низкой устойчивости к инфекционным заболеваниям. Таким образом, формируется фурункулез.
О влиянии инсулина на организм расскажет видео в этой статье.
holesterino.ru