ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ РЕВМАТОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ — «ИнфоМедФармДиалог»
Часто у пациентов выявляется повышенный уровень антител к антистрептолизину О, которые выделяются бета‑гемолитическим стрептококком группы А. Однако без соответствующей клинической картины повышение уровня этих антител не может служить диагностическим признаком, и отправлять таких пациентов на консультацию к ревматологу нецелесообразно.
Второй блок обследований, которые необходимо проводить пациентам с подозрением на ревматологические заболевания, – анализы на выявление дополнительных маркеров воспаления: ферритин, кальпротектин, прокальцитонин и D‑димер. И основное внимание традиционно уделяется ферритину.
Ферритин отражает уровень депонирования железа и одновременно служит показателем острой фазы воспаления. Как уже говорилось выше, его повышение более чем в 10 раз в сочетании с лейкоцитозом – характерный признак болезни Стилла. Он также может свидетельствовать о риске синдрома активации макрофагов при болезни Стилла и СКВ.
Повышение прокальцитонина (>0,5 нг/мл) также должно заставить задуматься об инфекционном процессе.
Рост креатининфосфокиназы в сочетании с небольшим повышением трансаминаз и лактатдегидрогиназы (АЛТ и АСТ) говорит о распаде продольно‑поперечных мышечных волокон, что встречается, например, при воспалительных миопатиях, дерматополимиозитах.
Синдром холестаза, который может наблюдаться у ревматологических больных, включает повышение щелочной фосфатазы и гамма‑глутамилтрансферазы, холестерина и прямого билирубина. Он может возникать на фоне приема ГКС, а также в рамках аутоиммунных заболеваний печени.
Д‑димер – это в первую очередь показатель тромбоэмболических событий, но также и неспецифический маркер, который может повышаться на фоне инфекционных заболеваний, у лиц старшей возрастной группы, при онкологических и воспалительных процессах.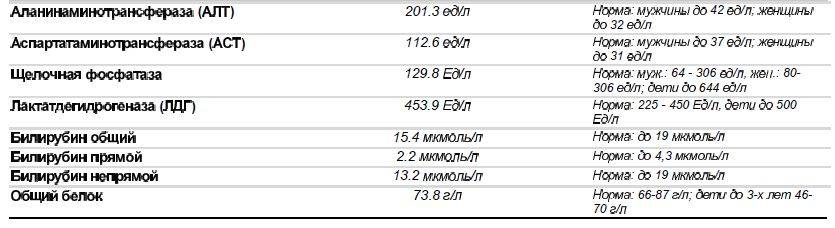
Мочевой синдром – комплекс различных изменений в составе мочевого осадка, служит очень важным показателем для диагностики ревматологических болезней. Однако он всегда требует исключения бактериальной инфекции и оценки степени вовлечения почек в воспалительный процесс.
С этой целью необходимо проанализировать два синдрома – нефротический и нефритический. Нефротический синдром, который характеризуется протеинурией >3,5 г/сут, гравитационно распределительными отеками, может выявляться у пациентов с СКВ и васкулитами, а также при амилоидозе и паранеопластических нефритах. При этом у пациентов не наблюдается эритроцитурия. А вот микро- и макрогематурия появляются при нефритическом синдроме, который также сопровождается протеинурией и развитием острой почечной недостаточности. Этот симптомокомплекс характерен при волчаночном нефрите, ANCA‑ассоциированных нефритах и васкулитах.
Соматотропный гормон (СТГ)
Соматотропный гормон (СТГ, гормон роста) синтезируется клетками передней доли гипофиза (соматотрофами), которые занимают 35-45 % всех клеток гипофиза. Соматотропный гормон нестойкий. Время его полураспада равно 20-25 минутам.
Соматотропный гормон нестойкий. Время его полураспада равно 20-25 минутам.
В крови присутствуют 2 формы соматотропного гормона: «big»-СТГ и «little»-СТГ. «Little»-СТГ обладает повышенной биологической активностью. Именно за счет этой формы проявляются все эффекты соматотропного гормона.
Синтез соматотропного гормона контролируется гипоталамусом. В нем вырабатываются так называемые рилизинг факторы. Соматолиберин стимулирует синтез СТГ, а соматостатин блокирует.
Сам соматотропный гормон оказывает свое действие на организм не напрямую, а через гормоны-посредники. Их называют инсулиноподобными факторами роста (ИФР, соматомедины). Именно ИФР-1, который образуется в печени, является одним из маркеров при заболеваниях, связанных с соматотропным гормоном.
Синтез и секреция соматотропного гормона увеличиваются в следующих случаях:
- Физические нагрузки
- Стресс
- Прием белковой пищи
- Введение аминокислот (аргинина и лейцина)
- Продолжительное голодание
- Нарушение всасывания пищи
Снижают секрецию соматотропного гормона:
- Повышенный уровень сахара в крови
- Повышенный уровень холестерина в крови
Когда повышен соматотропный гормон
Имеются заболевания, которые характеризуются повышением уровня соматотропного гормона в крови.
Гигантизм развивается у детей и подростков до периода пубертата, пока не закроются эпифизы костей (зоны роста костей). У них кости растут в длину. Патологически высокими людьми считаются мужчины ростом больше 200 см и женщины ростом выше 190 см. Когда у таких пациентов закрываются зоны роста костей, в дальнейшем кости уже растут в ширину. В этом случае заболевание называется акромегалией. Происходит это потому, что причина вызвавшая гигантизм, не была устранена.
Акромегалия развивается у взрослых людей, у которых уже закрыты зоны роста. И костям ничего не остается, как расти в ширину. Причем происходит рост не только костей, но и мягких тканей и органов, нарушается обмен веществ. Такой рост в ширину характеризуется непропорциональностью, т. е. размеры увеличившихся конечностей, то есть, например, непропорциональны относительно остального тела человека.
Акромегалией болеют примерно 50-70 человек на 1 млн населения.
 Каждый год регистрируются 3-4 новых случая на 1 млн жителей страны. Мужчины и женщины заболевают с одинаковой частотой.
Каждый год регистрируются 3-4 новых случая на 1 млн жителей страны. Мужчины и женщины заболевают с одинаковой частотой.В самом начале заболевание, как правило, не диагностируется. Это происходит в среднем через 8-10 лет после начала болезни, когда проявляются внешние проявления заболевания. Потому средний возраст пациентов с акромегалией составляет 40-50 лет.
При повышенном уровне соматотропного гормона отмечается высокая смертность (больше в 2-4 раза, чем в общей популяции). Если вовремя не начать лечение, в 50 % случаев пациенты не доживают и до 50 лет.
Причины повышения соматотропного гормона
Основной причиной повышения уровня соматотропного гормона является аденома гипофиза (соматотропинома), которая встречается в 98 % всех случаев акромегалии. Причем ¾ всех опухолей — это макроаденомы, которые распространяются за пределы турецкого седла, а ¼ всех опухолей – микроаденомы, которые не превышают 10 мм в диаметре.
В основном это моноклональные опухоли, т. е. продуцируют только соматотропный гормон. Но встречаются и смешанные аденомы, которые наряду с СТГ могут синтезировать также пролактин, ТТГ, АКТГ, ЛГ, ФСГ. Чаще всего из смешанных опухолей встречается аденома, синтезирующая соматотропный гормон и пролактин. Примерно 2 % от всех случаев повышения соматотропного гормона занимает эктопическая опухоль, т. е. не связанная с гипофизом. Опухоли, синтезирующие избыток СТГ, могут находиться как внутри черепа (эндокраниальные), так и вне черепа в других органах (экзокраниальные).
К первым можно отнести опухоль глоточного и сфеноидального синуса. Ко вторым относят опухоли легких, средостения, поджелудочной железы, кишечника, яичников и яичек. Причем эти опухоли могут синтезировать как сам соматотропный гормон, так и соматолиберин (гормон гипоталамуса, стимулирующий синтез СТГ).
Примерно около 1 % от всех случаев акромегалии приходится на семейные формы и наследственные заболевания, при которых одним из симптомов является акромегалия.

К таким заболеваниям относят:
- Синдром Мак-Кьюна-Олбрайта
- Синдром Вермера (мэн-1)
- Изолированная семейная акромегалия
- Комплекс Карней
Кроме того выделяют парциальную акромегалию, при которой увеличиваются отдельные части скелета или органов. Такая акромегалия обусловлена не избытком соматотропного гормона, а повышенной чувствительностью тканей этих органов к СТГ.
Симптомы при повышенном соматотропном гормоне
Симптомы акромегалии, вызванной аденомой гипофиза можно разделить на 3 группы:
- Симптомы, обусловленные избытком СТГ.
- Симптомы, обусловленные ростом аденомы в головном мозге.
- Симптомы, обусловленные снижением секреции других гормонов.
Симптомы, обусловленные избытком СТГ
Внешний вид
Прежде всего обращает на себя внешний вид пациента. Когда заболевание развилось до стадии изменения внешности, то диагноз акромегалии можно ставить уже с порога. Такой характерный внешний вид имеют пациенты с повышенной секрецией соматотропного гормона.
Когда заболевание развилось до стадии изменения внешности, то диагноз акромегалии можно ставить уже с порога. Такой характерный внешний вид имеют пациенты с повышенной секрецией соматотропного гормона.
Наблюдается укрупнение черт лица, которое проявляется увеличением надбровных дуг, скуловых костей, носа, губ, ушей, нижней челюсти (она выдвигается вперед — прогнатизм). Пациенты вынуждены постоянно менять головные уборы, перчатки и обувь на больший размер, т. к. эти части тела также увеличиваются.
Кожа становится плотной, утолщенной, с множеством складок и морщин, особенно на волосистой части головы. В местах трения с одеждой и в складках отмечается гиперпигментация (потемнение). Нередко отмечаются повышенное оволосение, акне, повышенная сальность и потливость кожи за счет увеличения количества потовых и сальных желез.
Увеличение размеров органов
Изменение размеров органов проявляется увеличением языка, слюнных желез, легких, сердца, печени, почек, кишечника.
 Поначалу отмечается увеличение мышечной силы и выносливости, но со временем в мышцах начинают происходить склеротические процессы, которые приводят к атрофии и слабости мышц.
Поначалу отмечается увеличение мышечной силы и выносливости, но со временем в мышцах начинают происходить склеротические процессы, которые приводят к атрофии и слабости мышц.Разрастание хрящевой ткани приводит к деформации суставов. В них появляются боль и нарушение подвижности. У пациентов с повышенным содержанием гормона роста очень часто имеется стойкая артериальная гипертензия (в 4-5 раз чаще, чем в общей популяции).
Изменение обмена веществ
Изменение обмена веществ заключается в развитии инсулинорезистентности (у 100 % пациентов), сахарного диабета (у 25-30 % пациентов). Также наблюдается нарушение липидного обмена (в 100 % случаев). У таких пациентов повышено содержание холестерина.
При повышении СТГ происходит усиленная потеря кальция с мочой, но в то же время он хорошо всасывается в желудке, поэтому уровень кальция остается в норме.
 Но в ответ на потерю кальция в крови происходит накопление избытка фосфора. Все эти изменения приводят к образованию камней в почках (в 45 % случаев).
Но в ответ на потерю кальция в крови происходит накопление избытка фосфора. Все эти изменения приводят к образованию камней в почках (в 45 % случаев).Неврологические нарушения
Неврологические нарушения связаны не только с интенсивным ростом опухоли и давлением на близлежащие ткани мозга. Изменения имеются и на периферии. Происходит сдавливание периферических нервов увеличенными и отечными тканями.
Это проявляется туннельными синдромами, например, карпальным синдромом, который развивается при сдавливании срединного нерва верхней конечности. При этом утрачивается тактильная и болевая чувствительности, а также возникают парестезии (ощущение ползания мурашек по коже).
Синдром апное во сне
Синдром апноэ (остановка дыхания) во сне связан с разрастанием мягких тканей верхних дыхательных путей и поражением дыхательных центров.
Симптомы, обусловленные ростом аденомы гипофиза
В основном аденома гипофиза больших размеров (макроаденома). Череп является довольно маленьким закрытым пространством и потому любое образование приводит к смещению и сдавливанию тканей головного мозга. А такое воздействие не проходит бесследно. Все симптомы зависят от того, в какую сторону растет опухоль и какую зону мозга сдавливает.
Череп является довольно маленьким закрытым пространством и потому любое образование приводит к смещению и сдавливанию тканей головного мозга. А такое воздействие не проходит бесследно. Все симптомы зависят от того, в какую сторону растет опухоль и какую зону мозга сдавливает.
Симптомы следующие:
- Головные боли. Они носят упорный характер.
- Нарушение зрения. Выпадение полей зрения, снижение остроты зрения.
- Исчезновение обоняния.
- Появление эпилепсии.
- Необоснованные лихорадки.
- Нарушение сна, аппетита.
- Двоение в глазах в результате поражения черепных нервов, а также опущение верхнего века, снижение слуха, неподвижность глаза, потеря чувствительности кожи лица.
Симптомы, обусловленные снижением секреции других гормонов
При разрастании опухоли в первую очередь происходит сдавливание в первую очередь здоровой ткани гипофиза, где еще вырабатываются и другие гормоны.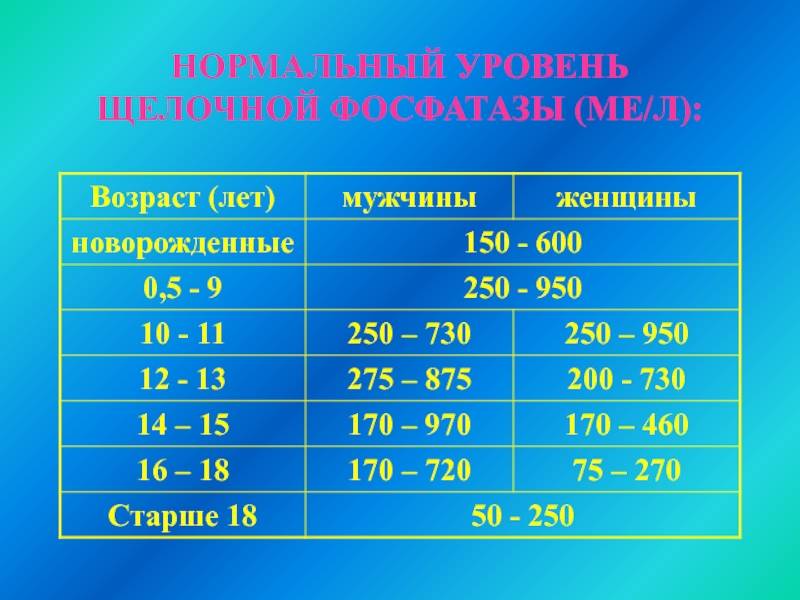
Очень часто у пациентов развиваются:
- Вторичный гипотиреоз (15-25 %)
- Вторичный гипогонадизм (у 60 % женщин нарушение менструального цикла, галакторея, бесплодие, у 40 % мужчин развивается гинекомастия, снижение либидо, эректильная дисфункция)
- Несахарный диабет
Необходимо воздержаться от приема пищи в течение 2-3 часов. За 3 дня до взятия крови исключить спортивные тренировки, за один час до взятия крови не курить, в течении 30 минут до взятия крови – находиться в полном покое.
после 50 лет у мужчин
Норма у женщин щелочной фосфатазы подтверждает, что в клетках внутренних органов без перебоев протекают разного рода биохимические процессы. На самом деле ферменты, которые объединяются под данным названием, участвуя в фосфорно-кальциевом обмене, выполняют очень важную работу — они транспортируют фосфор сквозь мембранные перегородки. В каких же случаях женщине назначают анализ на выявление уровня щелочной фосфатазы и какие показатели укладываются в нормативы, а какие сигнализируют о нарушениях?
В каких же случаях женщине назначают анализ на выявление уровня щелочной фосфатазы и какие показатели укладываются в нормативы, а какие сигнализируют о нарушениях?
Разновидности белков данной группы
Так как фосфатаза щелочная (щф) — это целый набор ферментов (белков), каждый из них занимается своей деятельностью. Они есть практически во всех тканях организма, и различают 11 видов этих белков.
Конечно, все они важны, но для оценки результатов анализов учитывают показатели следующих ферментов:
- Костной LPL — эта фосфатаза появляется в молодых клетках костей, так называемых остеобластах. Естественно, что любые изменения, в том числе патологического характера (болезни, повреждения), в костной ткани влияют на ее уровень.
- Печеночной ALPL — располагается в печеночных клетках, которые называются гепатоцитами. И если клетки разрушаются, то фосфатаза попадает в кровяное русло.
- Почечной ALPL — она находится в клетках почечных канальцев.

- Кишечной ALPl — ее место — слизистые поверхности кишечника.
- Плацентарной (ALPP) — вырабатывается в мембранах плаценты. Ее уровень в крови у женщин возрастает с увеличением срока беременности, во время лактации.
- Онкологической — подобный изофермент синтезируется в клетках образований злокачественного характера.
В каких случаях направляют на анализ сыворотки крови, чтобы выяснить, сколько в ней фосфатазы? Существует ряд показаний, согласно которым проводят исследование, выявляющее повышение или понижение количества фосфатазы:
- при подготовке пациента к оперативному вмешательству;
- во время планового обследования;
- при заборе биоматериала для печеночных проб.
Анализ крови может быть назначен, если пациент жалуется на хроническую усталость, тошноту, потерю аппетита или болезненные ощущения в области правого подреберья.
Кроме того, показатель исследования бывает очень полезен при диагностировании различных повреждений или поражений костных тканей.
Как происходит забор биоматериала
Современные методы исследования в условиях лаборатории позволяют выявлять показания анализа в течение нескольких часов. А процедура забора займет всего несколько минут. Как уже было отмечено, обнаружить щелочную фосфатазу можно в большинстве тканей. При изучении анализа производят измерение определенной разновидности данного белка. Существует несколько правил, которым надо следовать перед сдачей анализа:
- кровь сдается натощак;
- запрещено пить воду, так как она приводит к усиленной выработке фермента;
- не пить и не есть следует минимум за 6 часов до сдачи;
- ряд лекарственных препаратов (содержащих мужские гормоны, НПВП, антибиотики, противозачаточные таблетки и др.) может повлиять на синтез щелочной фосфатазы, поэтому следует проконсультироваться с врачом.
Главное, о чем сигнализирует активность щелочной фосфатазы, — скорость, с которой растут костные ткани.
Количество фермента в здоровом организме
Уровень этого фермента в сыворотке крови зависит от различных факторов — это возраст, пол, определенные периоды жизни, причем диапазон нормального показателя довольно широкий. Естественное повышение щелочной фосфатазы может происходить в ряде случаев:
Естественное повышение щелочной фосфатазы может происходить в ряде случаев:
- во время беременности — это происходит из-за перестройки систем организма и роста плаценты;
- в подростковом возрасте, когда происходит интенсивное половое созревание, так как в это время начинают активно расти ткани, в том числе костные.
Кроме того, норма щелочной фосфатазы может зависеть от типа реагента, который применяют в лабораторных условиях.
Дело в том, что единый стандарт в данной методике пока не принят.
Цифры могут изменяться, но колеблются в небольшом диапазоне, поэтому все же существует ряд усредненных показателей:
- У младенцев в возрасте до 15 дней уровень щелочной фосфатазы в крови варьируется от 83 до 248 МЕ/л, причем независимо от пола.
- У малышей от 2 недель до года этот показатель составляет от 122 до 469 МЕ/л (опять же пол не имеет значения).
- У детей от 1 до 9 лет (у мальчиков и девочек) в норме количество фермента находится от 145 до 420 МЕ/л.

- С 10 до 11 лет диапазон несколько расширяется — от 130 до 560 МЕ/л.
- С 12 лет происходит разделение показателей по половому признаку: с 12 до 13 лет у мальчиков норма составляет 200-495 МЕ/л, у девочек — 105-420 МЕ/л; с 14 до 15 лет норма у девочек от 70 до 230 МЕ/л, у мальчиков — от 130 до 525 МЕ/л.
- В период от 15 до 17 лет у молодых людей диапазон составляет 82-331 МЕ/л, у девушек — 50-117 МЕ/л.
- С 17 до 19 лет показатель несколько изменяется: в женском организме должно содержаться от 45 до 87 МЕ/л щелочной фосфатазы, у мужчин — от 55 до 149 МЕ/л.
- После 19 лет нормальный показатель практически не изменяется — у женщин он варьируется от 35 до 105 МЕ/л, у мужчин — от 40 до 130 МЕ/л.
Кроме того, существует особый период у женщин, когда уровень фермента может изменяться на фоне гормональной перестройки, — это время менопаузы, когда менструации прекращаются. В среднем это происходит в 50 лет, и специалист рассматривает изменения в каждом случае индивидуально.
Несмотря на имеющиеся данные, по которым определяется количество щелочной фосфатазы, все же последнее слово остается за специалистом. Только врач, оценивая ряд дополнительных показателей, выявит, нормальный ли уровень фермента у пациента или он за пределами нормы.
Почему происходит повышение показателей
Условно все причины можно разделить на 4 группы:
- Патологические изменения в костных тканях. Сюда относят процессы, возникающие в костях из-за кальциевого дефицита, вызывающего рахиты, остеомаляцию и другие изменения. Высокий уровень фермента наблюдается при травмировании костей, опухолевых образованиях в костной ткани и при метастазах других опухолей в кости.
- Количество щелочной фосфатазы увеличивается, когда у пациента имеются болезни печени, желчевыводящей системы, в том числе гепатиты и образование камней.
- В третью группу входят болезни другого происхождения, которые не относятся ни к печеночным, ни к костным тканям. Среди распространенных недугов, влияющих на рост фосфатазы, чаще встречаются инфаркты миокарда, язвенные колиты и их осложнения, которые выражаются в виде кишечной перфорации.

- Сюда не относятся причины, которые можно назвать болезнями. Показатель фосфатазы может измениться в в период вынашивания ребенка, во время климакса, у подростков, у молодых людей. Если девушка до 20 лет получила результат выше нормы, то это тоже не повод беспокоиться. Фермент может повышаться на фоне регулярного приема определенных лекарств, у женщин это может быть связано с использованием ОКИ — оральных контрацептивных средств.
Но показатели могут не только возрастать, но и понижаться. С чем же связаны подобные изменения?
Почему количество ферментов снижается
Щелочная фосфатаза в крови понижается в следующих случаях:
- При дефиците некоторых витаминных компонентов — в данном состоянии затруднена выработка фермента и развивается анемичное состояние.
- При дефиците цинка и магния — их недостаток приводит к разного рода патологиям.
- Если пациентка страдает гипотиреозом — заболеванием, которое вызвано сбоем выработки гормонов щитовидкой.
 Значительные нарушения в работе этой железы могут привести к развитию кретинизма, тяжелой болезни, негативно влияющей на физическое и умственное состояние пациента.
Значительные нарушения в работе этой железы могут привести к развитию кретинизма, тяжелой болезни, негативно влияющей на физическое и умственное состояние пациента. - Цинга — еще одна причина уменьшения уровня фосфатазы. Недуг возникает из-за недостатка витамина С, сопровождается кровоточивостью десен, появлением сыпи и ломкостью стенок сосудов.
- Анемия — это состояние вызывает ряд симптомов, которые объединяет то, что все они вызваны снижением в крови гемоглобина.
- Квашиоркор — дистрофическая патология, развивающаяся на фоне дефицита в рационе протеиновой пищи. Чаще проявляется у маленьких детей, но и взрослые не застрахованы, особенно женщины, увлекающиеся диетами.
- Ахондроплазия — болезнь наследственного характера, при которой длинные кости недостаточно развиваются, что приводит к карликовости.
Если при нормальном течении беременности уровень фермента повышается, то при снижении показателя в данный период можно говорить о том, что развивается недостаточность плаценты. В этом случае происходит нарушение связки матери с плодом, что грозит кислородным голоданием для малыша и даже может привести к летальному исходу. Если состояние обнаруживается своевременно, то тяжелых последствий можно избежать.
В этом случае происходит нарушение связки матери с плодом, что грозит кислородным голоданием для малыша и даже может привести к летальному исходу. Если состояние обнаруживается своевременно, то тяжелых последствий можно избежать.
Как видно, уровень щелочной фосфатазы в женском организме может быть очень важным показателем, поэтому при некоторых признаках пациенткам настоятельно советуют сдавать этот анализ. Не стоит пренебрегать рекомендациями специалистов, ведь раннее диагностирование заболеваний ведет к скорому излечению болезни, а кроме того, речь может идти не только о женщине, но и о здоровье ее ребенка.
Вконтакте
Google+
Одноклассники
Биохимический анализ крови у женщин: какая норма?
Железо необходимо нашему организму для кислородного обмена. Женская норма у девочек-подростков и взрослых женщин — 9-30 мкмоль/л. Если уровень железа ниже нормы — это признак анемии. Повышенный уровень железа — пора проверять работу кишечника.
Фосфор — с его помощью работают нервно-мышечная и костная системы организма. Интересно, что до 60 лет значения мужской и женской норм совпадают. И лишь после шестого десятка они меняются — женская норма составляет 0,90-1,32 ммоль/л. Когда результат анализа демонстрирует повышенное количество фосфора — это признак, что вы увлекаетесь фастфудом и газированными напитками. А вот дефицит фосфора — спутник депрессии и нервного истощения.
Как экология влияет на здоровье человека
Анорексия у подростка: как обнаружить и помочь
Низкомолекулярные азотистые вещества
Женская норма креатинина — 53-97 мкмоль/л. Если значение ниже — это признак голодания и снижения мышечной массы. Повышенный результат — «звоночек» о том, что надо уделить внимание работе почек и щитовидной железы.
Мочевая кислота. У мальчиков и девочек значение нормы совпадают — 120-320 мкмоль/л, а вот с возрастом появляются отличия. Женская норма мочевой кислоты в крови — 150-350 мкмоль/л. Если показатель ниже нормы, пациентка неправильно питается, выше — сигнал о патологии печени и почек, а также подагре и алкоголизме.
Женская норма мочевой кислоты в крови — 150-350 мкмоль/л. Если показатель ниже нормы, пациентка неправильно питается, выше — сигнал о патологии печени и почек, а также подагре и алкоголизме.
Мочевина — вещество, токсичное для организма, так как образуется после распада аммиака. Женская норма — 2,2-6,7 ммоль/л. По повышенному показателю врачи диагностируют у пациентки либо почечную недостаточность, либо высокобелковое питание. Пониженное значение может говорить об отказе от мясных продуктов, а еще о беременности или даже циррозе печени.
Ферменты
Аланинаминотрансфераза (АлАт) — незаменима при аминокислотном обмене. Женская норма — до 31 Ед/л. Если уровень выше — это сигнал о проблемах в работе печени, сердца и кровеносных сосудов.
Лактатдегидрогеназа (ЛДГ) — влияет на образование лактата, поэтому его повышенный уровень считается безопасным только у беременных женщин. В остальных случаях отклонение от нормы — повод проверить работу кровеносной системы, печени и почек. Нормальное значение этого показателя для тех, кто не ждет ребенка, совпадает с детской и мужской нормой — 250 Ед/л.
Нормальное значение этого показателя для тех, кто не ждет ребенка, совпадает с детской и мужской нормой — 250 Ед/л.
Фосфатаза щелочная — норма для женщин 0-240 Ед/л. Отклонения от этого показателя — признак патологии почек, проблем с печенью, желчевыводящими путями и костной системой.
Холинэстераза — нормальная концентрация этого фермента в крови у женщины — 5860-11 800 Ед/л. Если уровень снижен — это тревожный «звоночек» об инфаркте миокарда, заболеваниях печени, злокачественных опухолях. Если повышен — необходимо искать причину в сахарном диабете, ожирении или артериальной гипертонии.
Беременность по плану: как подготовиться к материнству
По годам рассчитайсь! Собираем детскую аптечку
Как правильно сдавать биохимический анализ крови
изучение населенности от Непала
здоровья женщин Int J. 2017; 9: 781–788.
Bashu Dev Pardhe
Отделение лабораторной медицины, Мемориальный институт медицинских наук Манмохана, Катманду, Непал
Sabala Pathak
Отделение лабораторной медицины, Мемориальный институт медицинских наук Манмохана, Катманду, Непал
Anjeela Bhetwal
25 Отделение Лабораторная медицина, Мемориальный институт медицинских наук Манмохана, Катманду, Непал
Сумитра Гимире
Кафедра лабораторной медицины, Мемориальный институт медицинских наук Манмохана, Катманду, Непал
Шрина Шакья
Кафедра лабораторной медицины, Мемориальный институт Манмохана Медицинские науки, Катманду, Непал
Puspa Raj Khanal
Кафедра лабораторной медицины, Мемориальный институт медицинских наук Манмохана, Катманду, Непал
Sujan Babu Marahatta
Кафедра лабораторной медицины, Мемориальный институт медицинских наук Манмохана, Катманду, Непал 90 003
Кафедра лабораторной медицины, Мемориальный институт медицинских наук Манмохана, Катманду, Непал
Для корреспонденции: Башу Дев Пардхе, Кафедра лабораторной медицины, Мемориальный институт медицинских наук Манмохана, почтовый ящик № 15201, Катманду, Непал, тел. +977 1 403 0781, электронная почта тел[email protected]Авторское право © 2017 Pardhe et al. Эта работа опубликована и лицензирована Dove Medical Press Limited. Полные условия этой лицензии доступны по адресу https://www.dovepress.com/terms.php и включают Creative Commons Attribution — Non Commercial (непортированная версия 3.0) Лицензия (http://creativecommons.org/licenses/by-nc/3.0/). Получая доступ к работе, вы тем самым принимаете Условия. Некоммерческое использование работы разрешено без каких-либо дополнительных разрешений от Dove Medical Press Limited при условии, что работа правильно указана.Эта статья была процитирована другими статьями в PMC.
+977 1 403 0781, электронная почта тел[email protected]Авторское право © 2017 Pardhe et al. Эта работа опубликована и лицензирована Dove Medical Press Limited. Полные условия этой лицензии доступны по адресу https://www.dovepress.com/terms.php и включают Creative Commons Attribution — Non Commercial (непортированная версия 3.0) Лицензия (http://creativecommons.org/licenses/by-nc/3.0/). Получая доступ к работе, вы тем самым принимаете Условия. Некоммерческое использование работы разрешено без каких-либо дополнительных разрешений от Dove Medical Press Limited при условии, что работа правильно указана.Эта статья была процитирована другими статьями в PMC.- Заявление о доступности данных
В этом документе представлены все данные, полученные в ходе этого исследования. Первичные необработанные данные будут предоставлены заинтересованным исследователям соответствующим автором этой статьи по запросу.
Резюме
Исходная информация
Остеопороз, широко распространенное во всем мире заболевание, характеризуется низкой костной массой и структурным ухудшением костной ткани, что приводит к повышенной хрупкости костей и повышению риска переломов. И менопауза, и старение являются взаимосвязанными факторами, ведущими к повышенному риску заболеваний костей, особенно среди женщин в постменопаузе. Таким образом, основной целью данного исследования было изучение различий в биохимических маркерах метаболизма костной ткани и оценка связи гормонов и возрастных факторов с биохимическими маркерами у женщин в пре- и постменопаузе.
И менопауза, и старение являются взаимосвязанными факторами, ведущими к повышенному риску заболеваний костей, особенно среди женщин в постменопаузе. Таким образом, основной целью данного исследования было изучение различий в биохимических маркерах метаболизма костной ткани и оценка связи гормонов и возрастных факторов с биохимическими маркерами у женщин в пре- и постменопаузе.
Методы
Описательное перекрестное исследование проводилось в течение 6 месяцев среди женского населения общины Дхолахити, Лалитпур, Непал.Всего на основе стратегии анкетирования было отобрано 496 здоровых женщин. Среди них 244 женщины в пременопаузе и 252 женщины в постменопаузе. Различные костные маркеры оценивали в соответствии с руководством, предоставленным производителем реагентов, а гормональный анализ, в частности, оценку уровня эстрадиола, выполняли методом иммунохемилюминесцентного анализа.
Результаты
Значительное снижение уровня кальция в сыворотке крови и уровня эстрадиола наблюдалось у женщин в постменопаузе по сравнению с женщинами в пременопаузе, тогда как значительное повышение уровней фосфора в сыворотке и щелочной фосфатазы (ЩФ) наблюдалось у женщин в постменопаузе ( p <0 . 001). Возраст достоверно коррелировал с костными маркерами (ЩФ и кальцием) в постменопаузальной группе ( p <0,005), в то время как в пременопаузальной группе значимой корреляции не было. Кроме того, наблюдалась значительная положительная корреляция между кальцием и эстрадиолом у женщин в постменопаузе, в то время как ЩФ отрицательно коррелировала с эстрадиолом в этой группе. Кроме того, не было продемонстрировано значительной корреляции между эстрадиолом и костными маркерами у женщин в постменопаузе по индексу массы тела и частичному корреляционному анализу с поправкой на возраст.
001). Возраст достоверно коррелировал с костными маркерами (ЩФ и кальцием) в постменопаузальной группе ( p <0,005), в то время как в пременопаузальной группе значимой корреляции не было. Кроме того, наблюдалась значительная положительная корреляция между кальцием и эстрадиолом у женщин в постменопаузе, в то время как ЩФ отрицательно коррелировала с эстрадиолом в этой группе. Кроме того, не было продемонстрировано значительной корреляции между эстрадиолом и костными маркерами у женщин в постменопаузе по индексу массы тела и частичному корреляционному анализу с поправкой на возраст.
Заключение
Своевременная диагностика остеопороза у женщин будет иметь большое значение для эффективной помощи нуждающимся группам населения и поможет минимизировать смертность и финансовое бремя нашей страны.
Ключевые слова: постменопауза, остеопороз, костные маркеры, эстрадиол, Непал. смертность. 1 Заболевание характеризуется низкой костной массой и нарушением структуры костной ткани, что приводит к повышенной хрупкости костей и последующему увеличению риска переломов. 2 , 3 Около 200 миллионов человек во всем мире страдают этим хроническим нарушением обмена веществ. 4 Женский пол, индекс массы тела (ИМТ) и факторы, связанные с образом жизни, являются установленными причинами повышенного остеопороза. 5
2 , 3 Около 200 миллионов человек во всем мире страдают этим хроническим нарушением обмена веществ. 4 Женский пол, индекс массы тела (ИМТ) и факторы, связанные с образом жизни, являются установленными причинами повышенного остеопороза. 5
Возраст также является важным фактором, влияющим на костный метаболизм.В детском и подростковом возрасте образование новой кости происходит быстрее, чем резорбция старой кости. Формирование кости опережает резорбцию до тех пор, пока пик костной массы не будет достигнут приблизительно в возрасте 30 лет, после чего резорбция кости постепенно начинает превышать формирование кости, 6 , а риск остеопоротических переломов удваивается в течение 7–8 лет после 50 лет. 5
Менопауза возникает, когда существует дисбаланс между скоростью образования и резорбции кости, а чрезмерная резорбция приводит к отрицательному балансу ремоделирования, что приводит к остеопорозу и другим метаболическим заболеваниям костей. 7 С наступлением менопаузы наблюдается быстрая потеря костной массы, составляющая приблизительно 2-3% в течение следующих 5-10 лет, и она наиболее высока в первые годы постменопаузы. 1 Гормональные изменения, происходящие во время менопаузального перехода, играют решающую роль в развитии этого заболевания. 8 Среди различных гормонов тестостерон и эстроген помогают поддерживать структуру костей на протяжении всей жизни. Эстроген, лучший стимулятор роста костей, отвечает за поддержание костной массы у женщин.Тем не менее, после менопаузы уровень эстрогена снижается, что создает риск заболевания костей у женщин в постменопаузе. 9
7 С наступлением менопаузы наблюдается быстрая потеря костной массы, составляющая приблизительно 2-3% в течение следующих 5-10 лет, и она наиболее высока в первые годы постменопаузы. 1 Гормональные изменения, происходящие во время менопаузального перехода, играют решающую роль в развитии этого заболевания. 8 Среди различных гормонов тестостерон и эстроген помогают поддерживать структуру костей на протяжении всей жизни. Эстроген, лучший стимулятор роста костей, отвечает за поддержание костной массы у женщин.Тем не менее, после менопаузы уровень эстрогена снижается, что создает риск заболевания костей у женщин в постменопаузе. 9
В Европе и Америке около 30 % мужчин и 40 % женщин в постменопаузе проведут остаток своей жизни, страдая от остеопороза. 4 Однако уровень заболеваемости остеопорозом намного выше среди азиатского населения, и было подсчитано, что к 2050 году около 50% людей будут страдать от остеопороза. 10 сельские районы, и большинство населения Непала живет в таких сообществах, где люди с остеопорозом остаются невыявленными. В частности, в нашей стране 50% всего населения составляют женщины, и среди них более 50% составляют пожилые люди, 11 , и это группа с высоким риском развития остеопороза.
В частности, в нашей стране 50% всего населения составляют женщины, и среди них более 50% составляют пожилые люди, 11 , и это группа с высоким риском развития остеопороза.
Несколько исследований, доступных на сегодняшний день, задокументировали информацию об остеопорозе среди женщин в постменопаузе из разных частей мира. Тем не менее, в литературе мало доказательств, основанных на данных сообщества непальских женщин в постменопаузе. Поэтому в этом исследовании мы стремились изучить состояние метаболизма костной ткани и связанные с ним заболевания у женщин в постменопаузе с высоким риском.
Методы
Описательное перекрестное исследование проводилось в течение 6 месяцев среди женского населения общины Дхолахити, Лалитпур, Непал. Выбор 496 здоровых женщин был основан на стратегии анкетирования. Среди них 244 женщины в пременопаузе и 252 женщины в постменопаузе. Информация о демографии пациентки (возраст и пол), продолжительности менопаузы, возрасте менархе, гистерэктомии в анамнезе, приеме костно-связанных препаратов и любой гормональной терапии была собрана и записана в форме клинического профиля.
У каждой женщины было взято около 5 мл венозной крови для оценки биохимических показателей. Уровни сывороточного кальция, сывороточного фосфора и сывороточной щелочной фосфатазы (ЩФ) оценивались как биохимические маркеры метаболизма костной ткани. Стандартные методы анализов были основаны на рекомендациях производителя реагентов (Human Gm Bh, Германия) полностью автоматизированного анализатора HumaStar 300. Референтным диапазоном для кальция в сыворотке считали 8,1–10,4 мг/дл, для фосфора в сыворотке – 2.5–5,0 мг/дл, а нормальная активность ЩФ в сыворотке крови составляла 44–174 МЕ/л. Гормональный анализ, в частности оценка уровня эстрадиола, у каждого человека был выполнен с помощью метода иммунохемилюминесцентного анализа с использованием MAGLUMI 1000 plus в отделении лабораторной медицины Мемориальной клинической больницы Манмохан. Нормальным диапазоном эстрадиола считается 10–66 пг/мл в постменопаузальную фазу и 236–251 пг/мл в пременопаузальную фазу, как указано в рекомендациях производителя. Аналитическая чувствительность анализа составила менее 8 пг/мл.Коэффициент вариации внутри анализа (CV) оценивался производителем в трех разных уровнях контрольной сыворотки, повторно измеренных 20 раз в одном цикле, и CV% составлял 8,20 для уровня 1 (138,25 ± 11,33 пг/мл), 4,82 для уровня 2 (215,54±10,39 пг/дл) и 5,13 для уровня 3 (995,35±51,06), в то время как CV между анализами оценивался производителем для трех разных партий наборов. Три разных уровня контрольной сыворотки были повторно измерены 21 раз, и CV% составил 9,66 для уровня 1 (132,54±12.80 пг/мл), 9,11 для уровня 2 (205,78±18,75 пг/дл) и 7,95 для уровня 3 (985,57±78,35).
Аналитическая чувствительность анализа составила менее 8 пг/мл.Коэффициент вариации внутри анализа (CV) оценивался производителем в трех разных уровнях контрольной сыворотки, повторно измеренных 20 раз в одном цикле, и CV% составлял 8,20 для уровня 1 (138,25 ± 11,33 пг/мл), 4,82 для уровня 2 (215,54±10,39 пг/дл) и 5,13 для уровня 3 (995,35±51,06), в то время как CV между анализами оценивался производителем для трех разных партий наборов. Три разных уровня контрольной сыворотки были повторно измерены 21 раз, и CV% составил 9,66 для уровня 1 (132,54±12.80 пг/мл), 9,11 для уровня 2 (205,78±18,75 пг/дл) и 7,95 для уровня 3 (985,57±78,35).
Критерии включения и исключения
В исследование были включены практически здоровые участники. Письменное информированное согласие было получено от каждого человека, и люди были сгруппированы в пре- и постменопаузе на основе результатов опроса. Женщины, у которых была аменорея из-за гистерэктомии или любых других известных причин, кроме естественных причин, женщины с ревматоидным артритом, женщины, принимающие заместительную гормональную терапию или какие-либо лекарства, связанные с костями, женщины с сахарным диабетом в анамнезе, нарушениями щитовидной железы, желтухой и заболевания печени, а заядлые курильщики и/или алкоголики были исключены из исследования.
Этическое одобрение
Письменное одобрение (ссылка 006/072-073/MMIHS) было получено от институционального контрольного комитета MMIHS после подачи и представления предложения комитету.
Анализ данных
Данные были проанализированы с использованием SPSS версии 20.0 (IBM Corp., Армонк, штат Нью-Йорк, США) и Microsoft Excel 2013. Тест Стьюдента t был использован для анализа различий биохимических маркеров костного обмена между пре- и женщин в постменопаузе. Аналогичным образом, коэффициент корреляции Пирсона использовался для оценки связи гормонов и возрастных факторов с биохимическими маркерами метаболизма костной ткани у женщин в постменопаузе.
Результаты
Из 496 здоровых женщин, проживающих в сообществе в Непале, 244 были в пременопаузе со средним возрастом 26±7,5 лет, а остальные 252 были в постменопаузе со средним возрастом 68±11,5 лет. Средний возраст наступления менархе составил 12,90 ± 1,15 года, а средний возраст менопаузы — 47,02 ± 4,44 года в исследуемой популяции. Большинство женщин были из общины браминов (26,2%), за ними следовали невары и манголы (22,4%), а остальные были из других этнических групп. Около 70,9% женщин имели нормальный ИМТ, а 29.1% страдали ожирением, и частота ожирения была выше в постменопаузальной группе, чем в пременопаузальной группе (2).
Большинство женщин были из общины браминов (26,2%), за ними следовали невары и манголы (22,4%), а остальные были из других этнических групп. Около 70,9% женщин имели нормальный ИМТ, а 29.1% страдали ожирением, и частота ожирения была выше в постменопаузальной группе, чем в пременопаузальной группе (2).
Таблица 1
Таблица 1
Распределение частоты демографических характеристик общего изучения изучения
| Характеристики | Premenopausal | Premenopausaul (N = 244) | Postmanopausal (n = 252) | Всего | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| статус | ||||||||||
| Нормальный вес | 198 (39. 9) 9) | 154 (31) | 352 (70.9) | |||||||
| 98 (9.3) | 98 (19.8) | 144 (29.1) | ||||||||
| Этническая принадлежность | ||||||||||
| Брахмин | 92 (18. 5) 5) | 88 (17.7) | 180 (26.2) | |||||||
| Newar | 60155 (12.1) | 6012 (10.5) | 52 (22.6) | |||||||
| Мангольский | 56 (11,3) | 56 (11.3) | 112 (22.6) | |||||||
| Другие | 36 (7.3) | 56 (11.3) | 92 (18. 6) 6) |
В нашем исследовании мы наблюдали значительное снижение уровня кальция в сыворотке и уровни эстрадиола у женщин в постменопаузе по сравнению с женщинами в пременопаузе ( p <0,001). Однако у женщин в постменопаузе наблюдалось значительное повышение уровней фосфора и ЩФ в сыворотке по сравнению с женщинами в пременопаузе ( p <0.001) ().
Таблица 2
Среднее сравнение костных маркеров в предварительном и постменопаузе женщин
| Характеристики | Premenopause | Premenopause | (среднее ± SD) PostMenopause (среднее ± SD) | P -Value P -Value 2 |
|---|---|---|---|---|
| BMI (кг / м 2 ) | 22. 1 ± 4.0 1 ± 4.0 | 24,4 ± 4,4 | 24,4- 4,4 | <0,05 |
| Сывороточный кальций (мг / дл) | 8,3 ± 0,9 | 7,7 ± 1.0 | <0.001 | |
| сывороточный фосфор (мг / дл) | 3.4 ± 0,6 | 3,7 ± 0.5 | 3,7 ± 0.5 | <0,001 |
| сывороточный ALP (U / L) | 198. 8 ± 53,0 8 ± 53,0 | 259 ± 91.0 | <0.001 | <0.001 |
| Сыворотка эстрадиол (стр. / Мл) | 176.28 ± 73,63 | 39.63 | 32.48 ± 13.02 | <0.001 |
Было значительное снижение уровня средних уровней сыворотки кальция и эстрадиол в постменопаузе группе (II группа) по сравнению с постменопаузально-ранней группой (I группа), при этом уровень ЩФ был значительно повышен у женщин в постменопаузе II группы ( p <0.05). Среди женщин в постменопаузе уровень эстрадиола был значительно снижен во II группе, чем в I группе ( p <0,01). Фосфор в сыворотке был значительно снижен ( p <0,001) в группе с ожирением по сравнению с группой с нормальной массой тела. Не было ни значительного повышения уровня кальция в сыворотке, ни снижения уровня ЩФ у женщин с ожирением в постменопаузе по сравнению с женщинами в постменопаузе с нормальным ИМТ. Прежде всего, уровень эстрадиола был значительно выше, а уровень фосфора значительно ниже ( p <0.001) у женщин с ожирением, чем у женщин с нормальным весом в постменопаузальной группе ().
Фосфор в сыворотке был значительно снижен ( p <0,001) в группе с ожирением по сравнению с группой с нормальной массой тела. Не было ни значительного повышения уровня кальция в сыворотке, ни снижения уровня ЩФ у женщин с ожирением в постменопаузе по сравнению с женщинами в постменопаузе с нормальным ИМТ. Прежде всего, уровень эстрадиола был значительно выше, а уровень фосфора значительно ниже ( p <0.001) у женщин с ожирением, чем у женщин с нормальным весом в постменопаузальной группе ().
Таблица 3
Связь между демографическими и клиническими характеристиками с различными костными маркерами у женщин в постменопаузе
| Переменные | Кальций (мг/дл) | Фосфор (мг/дл) | ЩФ (МЕ/л) | Эстрадиол (пг/мл) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Среднее ± SD | SD | P -Value | P — Value | ||||||||||||
| MenoPause Статус | |||||||||||||||
| Группа I | 8. 1 ± 0,4 1 ± 0,4 | 0,012 0,012 | 3.7 ± 0,6 | 0,95 | 224,9 ± 83.2 | | 45.9 ± 13.1 | < 0.001 | | |||||||
| Группа II | 7.6 ± 0,9 | 3.7 ± 0.5 | 266. 8 ± 91.8 8 ± 91.8 | ||||||||||||
| Нормальный вес | 7.5 ± 0,9 | 0. 11 11 | 0.11 | 3.8 ± 0.5 | < 0,001 | 262,5 ± 84.1 | 0,69 | 30.4 ± 12.3 | 0,028 | ||||||
| 3.5 ± 0.5 | 254.6 ± 101.9 | ||||||||||||||
| Brahmins | 7. 7 ± 0,8 7 ± 0,8 | 0.04 0,04 | 3.7 ± 0.5 | 0,9 | 249,8 ± 115.6 | 0.3 | 37,5 ± 13,3 | < 0.001 | |||||||
| Janajati | 8.6 ± 0,9 | 3.7 ±0,5 | 264,5±75,6 | 29,7±12,2 | |||||||||||
Кроме того, наблюдалось снижение уровня кальция в сыворотке с возрастом. Достоверной отрицательной корреляции между возрастом и кальцием среди женщин в пременопаузе не наблюдалось, но наблюдалась значимая отрицательная корреляция между возрастом и кальцием у женщин в постменопаузе ( p =0.002). Точно так же возраст не имел отрицательной корреляции с содержанием фосфора в пременопаузальной группе и не имел положительной корреляции в постменопаузальной группе. Среди женщин в пременопаузе была недостоверная отрицательная корреляция между возрастом и ЩФ, но у женщин в постменопаузе возраст положительно коррелировал с ЩФ ( p = 0,026) ().
Достоверной отрицательной корреляции между возрастом и кальцием среди женщин в пременопаузе не наблюдалось, но наблюдалась значимая отрицательная корреляция между возрастом и кальцием у женщин в постменопаузе ( p =0.002). Точно так же возраст не имел отрицательной корреляции с содержанием фосфора в пременопаузальной группе и не имел положительной корреляции в постменопаузальной группе. Среди женщин в пременопаузе была недостоверная отрицательная корреляция между возрастом и ЩФ, но у женщин в постменопаузе возраст положительно коррелировал с ЩФ ( p = 0,026) ().
Таблица 4
Корреляция возраста с маркерами кости у женщин в пре- и постменопаузе
| Маркеры кости | Пременопауза | Постменопауза | ||
|---|---|---|---|---|
| Alp | -0. 053 053 | 0,561 | 0,0198 | 0,026 |
| кальция -0,060 0,513 | — 0,279 | |||
| Фосфор -0,130 | 0,152 | 0,059 | 0,514 | |
Регрессионный анализ показал сильную отрицательную корреляцию между уровнями кальция и эстрадиола у женщин в пременопаузе, в то время как их корреляция с женщинами в постменопаузе была положительной (). Уровень фосфора достоверно положительно коррелировал с эстрадиолом у женщин в пременопаузе, в то время как в постменопаузальной группе наблюдалась незначительная отрицательная корреляция. Наконец, ЩФ значительно положительно коррелирует с эстрадиолом у женщин в пременопаузе, тогда как у женщин в постменопаузе ЩФ имеет отрицательную корреляцию без статистической значимости. Кроме того, была проведена частичная корреляция между уровнем эстрадиола и костными маркерами с поправкой на возраст и ИМТ. В анализе все костные маркеры коррелировали на незначительных уровнях у женщин в постменопаузе, при этом уровни кальция и ЩФ достоверно коррелировали с уровнем эстрадиола в предыдущем нескорректированном анализе.Уровни ЩФ и кальция достоверно коррелировали с уровнями эстрадиола у женщин в пременопаузе при скорректированном анализе, тогда как все костные маркеры достоверно коррелировали при нескорректированном анализе в той же группе (1).
Уровень фосфора достоверно положительно коррелировал с эстрадиолом у женщин в пременопаузе, в то время как в постменопаузальной группе наблюдалась незначительная отрицательная корреляция. Наконец, ЩФ значительно положительно коррелирует с эстрадиолом у женщин в пременопаузе, тогда как у женщин в постменопаузе ЩФ имеет отрицательную корреляцию без статистической значимости. Кроме того, была проведена частичная корреляция между уровнем эстрадиола и костными маркерами с поправкой на возраст и ИМТ. В анализе все костные маркеры коррелировали на незначительных уровнях у женщин в постменопаузе, при этом уровни кальция и ЩФ достоверно коррелировали с уровнем эстрадиола в предыдущем нескорректированном анализе.Уровни ЩФ и кальция достоверно коррелировали с уровнями эстрадиола у женщин в пременопаузе при скорректированном анализе, тогда как все костные маркеры достоверно коррелировали при нескорректированном анализе в той же группе (1).
Корреляция между сывороточным эстрадиолом и сывороточным кальцием у женщин в пре- и постменопаузе.
Корреляция между сывороточным эстрадиолом и сывороточным фосфором у женщин в пре- и постменопаузе.
Корреляция между сывороточным эстрадиолом и сывороточной ЩФ у женщин в пре- и постменопаузе.
Сокращение: ЩФ, щелочная фосфатаза. Таблица 5
1 R -Value -Value -Value -Value -Value
1 R -Value R -TValue -Value P -Value
 880 0.330
880 0.330Обсуждение
Фактором риска, наиболее тесно связанным с остеопорозом у женщин в постменопаузе, считался дефицит эстрогена. Кроме того, возрастные факторы также способствуют риску остеопоротических переломов. 12 Остеопороз у женщин в постменопаузе может длительное время оставаться бессимптомным, при этом единственным признаком являются изменения биохимических маркеров костного метаболизма. 13 В Непале женщины составляют более 50% населения, и среди них большая часть населения старше 50 лет. физической активности и столкнулись с плохим питанием в нашей экономически бедной стране.Это говорит о том, что большинство непальских женщин, вероятно, подвержены риску развития заболеваний, связанных с костями, что вызывает озабоченность. Следовательно, это требует непрекращающихся усилий по исследованию качества костей у женщин в постменопаузе.
В этом исследовании число женщин с ожирением было выше в постменопаузальной группе по сравнению с женщинами в пременопаузе. Это может быть связано с ухудшением метаболизма липидов в результате снижения эффекта эстрогена у женщин в постменопаузе. 14
Это может быть связано с ухудшением метаболизма липидов в результате снижения эффекта эстрогена у женщин в постменопаузе. 14
Постменопаузальный остеопороз провоцируется снижением влияния эстрогенов на костную ткань, что приводит к резкому ускорению костного обмена с дисбалансом в сторону избыточной активности остеокластов. 15 Плотность массы тела (МПКТ) и оценка биохимических параметров являются наиболее распространенными и простыми инструментами для оценки активности остеокластов. Измерение степени минерализации, размера кристаллов гидроксиапетита, связности трабукул и микроповреждений кости затруднено, 5 или даже невозможно в диагностике и прогнозе остеопороза в нашей стране.Таким образом, мониторинг маркеров биохимического метаболизма костной ткани является основным направлением нашего исследования. Среднее значение сывороточного кальция было значительно снижено ( p <0,05), в то время как уровни фосфора и ЩФ были значительно повышены ( p <0,05) у женщин в постменопаузе по сравнению с женщинами в пременопаузе. Подобные исследования уже были проведены Akshya Lekhi et al 13 из западной части Непала и Bhattarai et al 7 из средней части нашей страны.Их наблюдаемые закономерности для уровней кальция и ЩФ были аналогичны нашему исследованию, и оба сообщили о значительном снижении уровня кальция, но значительном повышении уровня ЩФ в сыворотке у женщин в постменопаузе по сравнению с женщинами в пременопаузе. 13 Хотя результаты были аналогичны результатам нашего исследования, эти исследования в больницах контрастировали с этим исследованием, поскольку наше исследование проводилось по месту жительства и охватывало только здоровое население. Это может помочь исключить смешанные факторы, связанные с ремоделированием костной ткани.Как и в этом исследовании, практически одинаковая тенденция биохимических изменений маркеров костного метаболизма была отмечена в разных частях земного шара. 2 , 4 , 5 , 16 .
Подобные исследования уже были проведены Akshya Lekhi et al 13 из западной части Непала и Bhattarai et al 7 из средней части нашей страны.Их наблюдаемые закономерности для уровней кальция и ЩФ были аналогичны нашему исследованию, и оба сообщили о значительном снижении уровня кальция, но значительном повышении уровня ЩФ в сыворотке у женщин в постменопаузе по сравнению с женщинами в пременопаузе. 13 Хотя результаты были аналогичны результатам нашего исследования, эти исследования в больницах контрастировали с этим исследованием, поскольку наше исследование проводилось по месту жительства и охватывало только здоровое население. Это может помочь исключить смешанные факторы, связанные с ремоделированием костной ткани.Как и в этом исследовании, практически одинаковая тенденция биохимических изменений маркеров костного метаболизма была отмечена в разных частях земного шара. 2 , 4 , 5 , 16 . Onyeukwu et al. 17 продемонстрировали значительное снижение уровня кальция в сыворотке у женщин в постменопаузе по сравнению с женщинами в пременопаузе, но не было существенной разницы в уровнях сывороточного фосфора и ЩФ среди этих групп.Это может быть связано со снижением уровня эстрогена, который вызывает резорбцию костей у женщин в постменопаузе, препятствуя абсорбции и утилизации кальция в костях, вызывая риск остеопороза. 18 В целом сообщалось, что женщины теряют около 1% плотности костной ткани в год во время и после менопаузы. 19
Onyeukwu et al. 17 продемонстрировали значительное снижение уровня кальция в сыворотке у женщин в постменопаузе по сравнению с женщинами в пременопаузе, но не было существенной разницы в уровнях сывороточного фосфора и ЩФ среди этих групп.Это может быть связано со снижением уровня эстрогена, который вызывает резорбцию костей у женщин в постменопаузе, препятствуя абсорбции и утилизации кальция в костях, вызывая риск остеопороза. 18 В целом сообщалось, что женщины теряют около 1% плотности костной ткани в год во время и после менопаузы. 19
Влияние гормонов на снижение МПКТ четко проиллюстрировано благодаря быстрой резорбции костей после последней менструации. Потеря костной массы достигает пика через 3–4 года после наступления менопаузы, затем постепенно снижается в течение нескольких лет, и, наконец, потеря костной массы в год остается на уровне от 1% до 1.5%. 5 Система Stages of Reproductive Aging Workshop +10 используется для оценки репродуктивного старения в период постменопаузы независимо от возраста, демографических характеристик, ИМТ и образа жизни. Harlow et al. 20 определяют период менопаузы в 5-6 лет как раннюю менопаузу и более 5 лет менопаузы как постменопаузу. Настоящее исследование показало, что уровень кальция в сыворотке был значительно снижен, а уровни ЩФ были значительно выше у женщин в период ранней постменопаузы по сравнению с поздним периодом постменопаузы (между группой I и группой II).Подобный результат был также получен в исследовании, проведенном Indumati et al., 1 , которое показывает, что костная масса продолжает снижаться с возрастом, но более медленными темпами в поздней постменопаузе, чем в ранней постменопаузе. 21 Это может быть результатом ингибирующего действия эстрогена на скорость обновления костной ткани, которая зависит от возраста и ИМТ. 16 Также наблюдалось значительное снижение уровня эстрадиола в сыворотке в группе поздней постменопаузы по сравнению с группой ранней постменопаузы.Менопаузальный переход связан со значительными гормональными изменениями, наиболее важным из которых является снижение уровня эстрадиола примерно на 60%.
Harlow et al. 20 определяют период менопаузы в 5-6 лет как раннюю менопаузу и более 5 лет менопаузы как постменопаузу. Настоящее исследование показало, что уровень кальция в сыворотке был значительно снижен, а уровни ЩФ были значительно выше у женщин в период ранней постменопаузы по сравнению с поздним периодом постменопаузы (между группой I и группой II).Подобный результат был также получен в исследовании, проведенном Indumati et al., 1 , которое показывает, что костная масса продолжает снижаться с возрастом, но более медленными темпами в поздней постменопаузе, чем в ранней постменопаузе. 21 Это может быть результатом ингибирующего действия эстрогена на скорость обновления костной ткани, которая зависит от возраста и ИМТ. 16 Также наблюдалось значительное снижение уровня эстрадиола в сыворотке в группе поздней постменопаузы по сравнению с группой ранней постменопаузы.Менопаузальный переход связан со значительными гормональными изменениями, наиболее важным из которых является снижение уровня эстрадиола примерно на 60%. Напротив, некоторые исследователи сообщают об отсутствии значительных изменений уровней кальция, фосфора и ЩФ между ранним и поздним периодами постменопаузы. 17 Результат такого типа может быть вызван разницей в исследуемой популяции и географическими различиями.
Напротив, некоторые исследователи сообщают об отсутствии значительных изменений уровней кальция, фосфора и ЩФ между ранним и поздним периодами постменопаузы. 17 Результат такого типа может быть вызван разницей в исследуемой популяции и географическими различиями.
Подобно результатам нашего исследования, различные другие исследования показали значительное снижение ( p <0.05) уровня эстрадиола в сыворотке крови в постменопаузальной группе по сравнению с пременопаузальной группой. 22 После менопаузы яичники перестают вырабатывать значительное количество эстрадиола; поэтому симптомы и заболевания, связанные с дефицитом эстрадиола, имеют большее значение для здоровья женщины. 22 В целом уровень эстрадиола снижается от 7 до 10 раз между пре- и постменопаузой. 14 Ashuma et al 23 сообщили, что старение и менопауза приводят к снижению выработки эстрадиола и прогестерона, что приводит к снижению уровня кальция у женщин в постменопаузе.
После корректировки факторов риска, связанных с потерей костной массы, включая корректировку на ревматоидный артрит, употребление алкоголя и табака и терапию глюкокортикоидами, уровень эстрадиола значительно положительно коррелировал с уровнем кальция в сыворотке (потеря костной массы) у женщин в постменопаузе ( p <0,05). Но после корректировки ИМТ и возраста снижение потери костной массы (сывороточный кальций) не коррелировало на значимом уровне. Это объясняет, что с возрастом и после менопаузы происходит быстрое снижение уровня кальция наряду с уровнем эстрадиола.Недавние подходы различных исследований объясняют мощную роль эстрогена в регуляции кальция и фосфора. Этот эстроген-зависимый механизм регуляции кальция предполагает важный механизм патогенеза как постменопаузального, так и возрастного остеопороза. 24 Одно исследование сравнило равную роль эстрогена в регуляции кальция и фосфора в почках с хорошо известным эффектом паратгормона у пожилых женщин. 25 После менопаузы происходит снижение выработки эстрогена яичниками.Это напрямую влияет на состояние костей в этой группе населения. Таким образом, добавки кальция могут уменьшить потерю костной массы у женщин в постменопаузе, которые хорошо характеризуются дефицитом эстрогена и несбалансированным механизмом взаимодействия кальция. 25
25 После менопаузы происходит снижение выработки эстрогена яичниками.Это напрямую влияет на состояние костей в этой группе населения. Таким образом, добавки кальция могут уменьшить потерю костной массы у женщин в постменопаузе, которые хорошо характеризуются дефицитом эстрогена и несбалансированным механизмом взаимодействия кальция. 25
Наблюдалась положительная значимая корреляция ЩФ с эстрадиолом у женщин в пременопаузе, в то время как отрицательная корреляция наблюдалась у женщин в постменопаузе в исследовании, и после поправки на возраст и ИМТ не было обнаружено сильной связи ЩФ с эстрадиолом после менопаузы.Хотя ЩФ является хорошо зарекомендовавшим себя маркером заболеваний костей, к сожалению, она специфична не только для костей. Измерение костно-специфического ЩФ (БАТ) полезно для того, чтобы дифференцировать заболевание печени от остеопоротической активности. 26
Костная масса уменьшается с возрастом, и в настоящее время хорошо известно, что низкая костная масса является основной детерминантой всех остеопоротических переломов. 27 Распространенность остеопороза увеличивается с возрастом для всех локализаций, и, согласно определению Всемирной организации здравоохранения, до 70% женщин старше 80 лет страдают остеопорозом. 1 В нашем исследовании обмен костной ткани был положительно связан с возрастом как в пре-, так и в постменопаузальных группах. Что касается биохимических маркеров обмена костной ткани, кальций значительно отрицательно коррелировал, в то время как ЩФ значительно положительно коррелировал с возрастом у женщин в постменопаузе. ( p <0,005) Это показание четко демонстрирует прогрессирующую потерю костной массы с увеличением возраста. Возрастные факторы потери костной массы у женщин в постменопаузе могут быть связаны с неадекватным уровнем витамина D и прогрессирующим увеличением паратиреоидного гормона с возрастом. 12 , 28 Недостаточный уровень витамина D является наиболее распространенной причиной остеопороза у женщин, а прогрессирующий дефицит этого гормона может привести к вторичному гиперпаратиреозу.
27 Распространенность остеопороза увеличивается с возрастом для всех локализаций, и, согласно определению Всемирной организации здравоохранения, до 70% женщин старше 80 лет страдают остеопорозом. 1 В нашем исследовании обмен костной ткани был положительно связан с возрастом как в пре-, так и в постменопаузальных группах. Что касается биохимических маркеров обмена костной ткани, кальций значительно отрицательно коррелировал, в то время как ЩФ значительно положительно коррелировал с возрастом у женщин в постменопаузе. ( p <0,005) Это показание четко демонстрирует прогрессирующую потерю костной массы с увеличением возраста. Возрастные факторы потери костной массы у женщин в постменопаузе могут быть связаны с неадекватным уровнем витамина D и прогрессирующим увеличением паратиреоидного гормона с возрастом. 12 , 28 Недостаточный уровень витамина D является наиболее распространенной причиной остеопороза у женщин, а прогрессирующий дефицит этого гормона может привести к вторичному гиперпаратиреозу. 28 Haugen et al 29 также сообщили о высокой распространенности недостаточности (59,8%) и дефицита витамина D (14,0%) у молодых женщин из нашей страны. Следовательно, оценка дефицита/недостаточности витамина D становится обязательной перед отчетом о состоянии костей у молодых женщин, а также у женщин в постменопаузе.
28 Haugen et al 29 также сообщили о высокой распространенности недостаточности (59,8%) и дефицита витамина D (14,0%) у молодых женщин из нашей страны. Следовательно, оценка дефицита/недостаточности витамина D становится обязательной перед отчетом о состоянии костей у молодых женщин, а также у женщин в постменопаузе.
Это иллюстрирует высокий риск переломов у женщин в постменопаузе, так как с возрастом увеличивается потеря костной массы, что чаще встречается у женщин в результате гормональных изменений. Наш подход к исследованию показал, что возраст является более важным фактором, чем уровень эстрадиола, для увеличения обмена костей у женщин в постменопаузе. Оценка статуса витамина D и его связи с повышенным метаболизмом костной ткани является темой для дальнейшего изучения в нашей популяции. Однако это исследование, ориентированное на одно сообщество, было ограничено оценкой всех дополнительных потенциальных этиологий остеопороза у женщин в постменопаузе.
Заключение
Это исследование показывает, что оценка гормональных и биохимических маркеров, которая может быть легко выполнена и удобна для повторной оценки, полезна для наблюдения за обновлением костной ткани у женщин в постменопаузе. Эти типы исследований на уровне местных сообществ должны проводиться в большем масштабе на национальном уровне для определения политики и заявлений в области развития, которые помогут в диагностике, лечении и прогнозировании остеопороза у женщин в постменопаузе. Своевременная диагностика остеопороза у женщин будет иметь большое значение для эффективного лечения необходимого населения и поможет свести к минимуму уровень смертности и финансовое бремя в Непале.Дополнительные баллы
Наличие данных и материалов
Все данные, полученные в ходе этого исследования, представлены в этой статье. Первичные необработанные данные будут предоставлены заинтересованным исследователям соответствующим автором этой статьи по запросу.
Благодарности
Мы благодарим всех участников, руководителей и сотрудников лабораторий MMTHS и MMIHS за то, что это исследование стало возможным.
Сноски
Вклад авторов
BDP и SP разработали план исследования, проанализировали литературу, выполнили необходимые вмешательства, включая лабораторные исследования, и проанализировали данные.SP, SG, AB, SS и PRK участвовали в сборе данных сообщества, лабораторных процедурах и анализе данных. BDP и SBM подготовили рукопись. Все авторы внесли свой вклад в анализ данных, составление проекта и критический пересмотр документа и соглашаются нести ответственность за все аспекты работы. Все авторы прочитали окончательную версию рукописи и одобрили ее для представления.
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Каталожные номера
1.Индумати В., Патил В.С., Джаилхани Р. Больница на основе предварительного исследования остеопороза у женщин в постменопаузе. Индиан Дж. Клин Биохим. 2007;22(2):96–100. [Бесплатная статья PMC] [PubMed] [Google Scholar]2. Гарнеро П. , Дельмас П.Д. 4 маркера костей. Клинический ревматолог Байьера. 1997;11(3):517–537. [PubMed] [Google Scholar]3. Лэнхэм-Нью С.А. Значение кальция, витамина D и витамина К для профилактики и лечения остеопороза. Proc Nutr Soc. 2008;67(2):163–176. [PubMed] [Google Scholar]5. Общество НАМ. NAMS Непрерывное медицинское образование; Ведение остеопороза у женщин в постменопаузе: заявление о позиции 2010 г.Менопауза. 2010;17(1):23–56. [Google Академия]6. Дин Дж. Экспрессия генов, специфичных для ооцитов: роль в фолликулогенезе, оплодотворении и раннем развитии. Кембридж, Великобритания: Издательство Кембриджского университета; 2003. [Google Академия]7. Бхаттараи Т., Бхаттачарья К., Чаудхури П., Сенгупта П. Корреляция общих биохимических маркеров обмена костей, кальция в сыворотке и щелочной фосфатазы у женщин в постменопаузе. Малайцы J Med Sci. 2014;21(1):58. [Бесплатная статья PMC] [PubMed] [Google Scholar]8. Coxam V. Фитоэстрогены и здоровье костей.Proc Nutr Soc. 2008;67(2):184–195. [PubMed] [Google Scholar]9.
, Дельмас П.Д. 4 маркера костей. Клинический ревматолог Байьера. 1997;11(3):517–537. [PubMed] [Google Scholar]3. Лэнхэм-Нью С.А. Значение кальция, витамина D и витамина К для профилактики и лечения остеопороза. Proc Nutr Soc. 2008;67(2):163–176. [PubMed] [Google Scholar]5. Общество НАМ. NAMS Непрерывное медицинское образование; Ведение остеопороза у женщин в постменопаузе: заявление о позиции 2010 г.Менопауза. 2010;17(1):23–56. [Google Академия]6. Дин Дж. Экспрессия генов, специфичных для ооцитов: роль в фолликулогенезе, оплодотворении и раннем развитии. Кембридж, Великобритания: Издательство Кембриджского университета; 2003. [Google Академия]7. Бхаттараи Т., Бхаттачарья К., Чаудхури П., Сенгупта П. Корреляция общих биохимических маркеров обмена костей, кальция в сыворотке и щелочной фосфатазы у женщин в постменопаузе. Малайцы J Med Sci. 2014;21(1):58. [Бесплатная статья PMC] [PubMed] [Google Scholar]8. Coxam V. Фитоэстрогены и здоровье костей.Proc Nutr Soc. 2008;67(2):184–195. [PubMed] [Google Scholar]9. Росс, Уилсон А.В., Грант А. Скелетно-мышечная система. 10-е изд. Эльзевир Лимитед; 2006. С. 384–387. [Google Академия] 10. Тулкар Дж., Сингх С., Шарма С., Талкар Т. Предотвратимые факторы риска остеопороза у женщин в постменопаузе: систематический обзор и метаанализ. J Здоровье среднего возраста. 2016;7(3):108. [Бесплатная статья PMC] [PubMed] [Google Scholar]11. Пардхе Б.Д., Гимире С., Шакья Дж. и др. Повышенные сердечно-сосудистые риски среди женщин в постменопаузе: исследование случай-контроль на базе сообщества из Непала.Биохим Рез Инт. 2017;2017:3824903. [Бесплатная статья PMC] [PubMed] [Google Scholar]12. Хосла С., Аткинсон Э.Дж., Мелтон Л.Дж., 3-й, Риггс Б.Л. Влияние возраста и статуса эстрогена на уровень паратиреоидного гормона в сыворотке крови и биохимические маркеры обмена костной ткани у женщин: популяционное исследование 1. J Clin Endocrinol Metab. 1997;82(5):1522–1527. [PubMed] [Google Scholar] 13. Лехи А., Лехи М., Сатьян Б., Миттал А. Роль биохимических маркеров в раннем выявлении остеопороза у женщин: сравнительное исследование в западном регионе Непала.
Росс, Уилсон А.В., Грант А. Скелетно-мышечная система. 10-е изд. Эльзевир Лимитед; 2006. С. 384–387. [Google Академия] 10. Тулкар Дж., Сингх С., Шарма С., Талкар Т. Предотвратимые факторы риска остеопороза у женщин в постменопаузе: систематический обзор и метаанализ. J Здоровье среднего возраста. 2016;7(3):108. [Бесплатная статья PMC] [PubMed] [Google Scholar]11. Пардхе Б.Д., Гимире С., Шакья Дж. и др. Повышенные сердечно-сосудистые риски среди женщин в постменопаузе: исследование случай-контроль на базе сообщества из Непала.Биохим Рез Инт. 2017;2017:3824903. [Бесплатная статья PMC] [PubMed] [Google Scholar]12. Хосла С., Аткинсон Э.Дж., Мелтон Л.Дж., 3-й, Риггс Б.Л. Влияние возраста и статуса эстрогена на уровень паратиреоидного гормона в сыворотке крови и биохимические маркеры обмена костной ткани у женщин: популяционное исследование 1. J Clin Endocrinol Metab. 1997;82(5):1522–1527. [PubMed] [Google Scholar] 13. Лехи А., Лехи М., Сатьян Б., Миттал А. Роль биохимических маркеров в раннем выявлении остеопороза у женщин: сравнительное исследование в западном регионе Непала. J Clin Diagnos Res. 2012;6(2):274–277. [Google Академия] 14. Акахоши М., Сода М., Накашима Э. и др. Влияние индекса массы тела на возраст наступления менопаузы. Int J Ожирение. 2002;26(7):961. [PubMed] [Google Scholar] 16. Дипти С., Нараян Г., Найду Дж. Изучение биохимических маркеров обмена костной ткани у женщин в постменопаузе, ведущих к остеопорозу. Int J Appl Biol Pharm Technol. 2012;3(3):301–305. [Google Академия] 17. Оньюкву КУ, Нсонву АС. Биохимические маркеры метаболизма костной ткани у женщин в постменопаузе в муниципалитете Калабар.Азиатский J Biochem. 2007;2(1):130–135. [Google Академия] 18. Риггс БЛ. Возрастной остеопороз. Нутр Старение. 2012;207 [Google Scholar]19. Кумари С.Н., Росарио С.Б., Гауда К.Д. Измененная функция печени и статус кальция у женщин в постменопаузе в Мангалоре и его окрестностях. Аль Амин J Med Sci. 2010;3:115–119. [Google Академия] 20. Харлоу С.Д., Гасс М., Холл Дж.Е. и др. Резюме семинара по стадиям репродуктивного старения +10: рассмотрение незавершенной повестки дня по стадированию репродуктивного старения.
J Clin Diagnos Res. 2012;6(2):274–277. [Google Академия] 14. Акахоши М., Сода М., Накашима Э. и др. Влияние индекса массы тела на возраст наступления менопаузы. Int J Ожирение. 2002;26(7):961. [PubMed] [Google Scholar] 16. Дипти С., Нараян Г., Найду Дж. Изучение биохимических маркеров обмена костной ткани у женщин в постменопаузе, ведущих к остеопорозу. Int J Appl Biol Pharm Technol. 2012;3(3):301–305. [Google Академия] 17. Оньюкву КУ, Нсонву АС. Биохимические маркеры метаболизма костной ткани у женщин в постменопаузе в муниципалитете Калабар.Азиатский J Biochem. 2007;2(1):130–135. [Google Академия] 18. Риггс БЛ. Возрастной остеопороз. Нутр Старение. 2012;207 [Google Scholar]19. Кумари С.Н., Росарио С.Б., Гауда К.Д. Измененная функция печени и статус кальция у женщин в постменопаузе в Мангалоре и его окрестностях. Аль Амин J Med Sci. 2010;3:115–119. [Google Академия] 20. Харлоу С.Д., Гасс М., Холл Дж.Е. и др. Резюме семинара по стадиям репродуктивного старения +10: рассмотрение незавершенной повестки дня по стадированию репродуктивного старения. J Clin Endocrinol Metab.2012;97(4):1159–1168. [Бесплатная статья PMC] [PubMed] [Google Scholar]21. Brandão CM, Lima MG, Silva AL, Silva GD, Guerra AA, Jr, Acúrcio Fde A. Лечение постменопаузального остеопороза у женщин: систематический обзор. Cad Saúde Pública. 2008; 24 (Приложение 4): s592–s606. [PubMed] [Google Scholar] 22. Килим СР, Чандала СР. Сравнительное исследование липидного профиля и эстрадиола у женщин в пре- и постменопаузе. J Clin Diagnos Res. 2013;7(8):1596. [Бесплатная статья PMC] [PubMed] [Google Scholar]23. Ашума С., Шаши С., Сачдева С.Биохимические маркеры костного обмена: диагностические и терапевтические принципы. Остеопороз. 2005; 332:305–311. [Google Академия] 24. Принц Р., Дик И. Влияние эстрогена на транспорт кальция через мембрану: новый взгляд на взаимосвязь между дефицитом эстрогена и возрастным остеопорозом. Остеопороз Интерн. 1997;7(3):150–154. [PubMed] [Google Scholar] 25. Дик И.М., Дивайн А., Бейлби Дж., Принц Р.Л. Влияние эндогенного эстрогена на почечный обмен кальция и фосфата у пожилых женщин.
J Clin Endocrinol Metab.2012;97(4):1159–1168. [Бесплатная статья PMC] [PubMed] [Google Scholar]21. Brandão CM, Lima MG, Silva AL, Silva GD, Guerra AA, Jr, Acúrcio Fde A. Лечение постменопаузального остеопороза у женщин: систематический обзор. Cad Saúde Pública. 2008; 24 (Приложение 4): s592–s606. [PubMed] [Google Scholar] 22. Килим СР, Чандала СР. Сравнительное исследование липидного профиля и эстрадиола у женщин в пре- и постменопаузе. J Clin Diagnos Res. 2013;7(8):1596. [Бесплатная статья PMC] [PubMed] [Google Scholar]23. Ашума С., Шаши С., Сачдева С.Биохимические маркеры костного обмена: диагностические и терапевтические принципы. Остеопороз. 2005; 332:305–311. [Google Академия] 24. Принц Р., Дик И. Влияние эстрогена на транспорт кальция через мембрану: новый взгляд на взаимосвязь между дефицитом эстрогена и возрастным остеопорозом. Остеопороз Интерн. 1997;7(3):150–154. [PubMed] [Google Scholar] 25. Дик И.М., Дивайн А., Бейлби Дж., Принц Р.Л. Влияние эндогенного эстрогена на почечный обмен кальция и фосфата у пожилых женщин. Am J Physiol Endocrinol Metab.2005; 288(2):E430–E435. [PubMed] [Google Scholar] 26. Бикле ДД. Биохимические маркеры в оценке заболеваний костей. Am J Med. 1997;103(5):427–436. [PubMed] [Google Scholar] 27. Саджанар Д.С., Саджанар С.Л. Изучение сывороточной щелочной фосфатазы, кальция и мочевого гидроксипролина в качестве костных биомаркеров у женщин в постменопаузе. Int J Basic Appl Med Sci. 2014;4(1):223–229. Доступно по адресу: http://www.cibtech.org/jms.htm. [Google Академия] 28. Липс П., Хоскинг Д., Липпунер К. и др. Распространенность недостаточности витамина D среди женщин с остеопорозом: международное эпидемиологическое исследование.J Интерн Мед. 2006;260(3):245–254. [PubMed] [Google Scholar] 29. Хауген Дж., Улак М., Чандио Р.К. и др. Низкая распространенность недостаточности витамина D среди непальских младенцев, несмотря на высокую распространенность недостаточности витамина D среди их матерей. Питательные вещества. 2016;8(12):825. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Am J Physiol Endocrinol Metab.2005; 288(2):E430–E435. [PubMed] [Google Scholar] 26. Бикле ДД. Биохимические маркеры в оценке заболеваний костей. Am J Med. 1997;103(5):427–436. [PubMed] [Google Scholar] 27. Саджанар Д.С., Саджанар С.Л. Изучение сывороточной щелочной фосфатазы, кальция и мочевого гидроксипролина в качестве костных биомаркеров у женщин в постменопаузе. Int J Basic Appl Med Sci. 2014;4(1):223–229. Доступно по адресу: http://www.cibtech.org/jms.htm. [Google Академия] 28. Липс П., Хоскинг Д., Липпунер К. и др. Распространенность недостаточности витамина D среди женщин с остеопорозом: международное эпидемиологическое исследование.J Интерн Мед. 2006;260(3):245–254. [PubMed] [Google Scholar] 29. Хауген Дж., Улак М., Чандио Р.К. и др. Низкая распространенность недостаточности витамина D среди непальских младенцев, несмотря на высокую распространенность недостаточности витамина D среди их матерей. Питательные вещества. 2016;8(12):825. [Бесплатная статья PMC] [PubMed] [Google Scholar]Неоднократно низкий уровень щелочной фосфатазы в плазме у 56-летней женщины.
 Случай гипофосфатазии, диагностированный во взрослом возрасте
Случай гипофосфатазии, диагностированный во взрослом возрастеPract Lab Med. 2018 июль; 11: 19–22.
Pia Bükmann Larsen
a Отделение клинической биохимии, больница Slagelse, Slagelse, Дания
Ole Bjørn Skausig
b Kalundborg Psychiatrists, KalundborgJensen
A
A Департамент клинической биохимии, Больница Слагельс, Слагельс, Дания
A Департамент клинической биохимии, Больница Слагельс, Слагельс, Дания
B Kalundborg Psychiatristers, Kalundborg, Дания
⁎ Соответствие : Отделение клинической биохимии, больница Слагельсе, Ingemannsvej 52, 4200 Slagelse, Дания. [email protected]Поступила в редакцию 18 декабря 2017 г.; Пересмотрено 14 февраля 2018 г .; Принято 14 февраля 2018 г.
Сокращения: HPP, гипофосфатазия; ALP, щелочная фосфатаза; P-ALP, щелочная фосфатаза плазмы; TNSALP – ген, кодирующий тканенеспецифический изофермент щелочной фосфатазы; ALPL, синоним TNSALP; PPi, неорганический пирофосфат; PLP, пиридоксаль-5’-фосфат
Ключевые слова: Гипофосфатазия, Щелочная фосфатаза, Белок ALPL, Пиридоксальфосфат, Перелом плюсневых костей
Это статья в открытом доступе под лицензией CC BY-NC-ND (http://creativecommons. org/licenses/by-nc-nd/4.0/).
org/licenses/by-nc-nd/4.0/).
В клинике щелочную фосфатазу (ЩФ) в первую очередь измеряют для выявления высокой активности фермента. Ряд клинических состояний связан с низким уровнем ЩФ, в том числе редкая болезнь минерализации костей гипофосфатазия (ГПЗ) [1]. HPP имеет чрезвычайно широкий клинический спектр, и его следует учитывать при обнаружении постоянно низкой активности ALP.
1. Описание случая
У 56-летней женщины регулярно брали образцы крови для контроля терапии литием при биполярном аффективном расстройстве.Уровень щелочной фосфатазы плазмы (P-ALP) неоднократно был ниже 10 МЕ/л, и психиатр-консультант (OBS) связался с лабораторией, чтобы исключить ошибочные измерения. P-ALP анализировали на приборе Dimension Vista® (Siemens Healthineers, Ballerup, Дания), регулярно калибруемом и обеспечивающем качество с помощью сертифицированных материалов для внутреннего и внешнего контроля качества. За предыдущие пять лет только у этого пациента более одного измерения P-ALP <10 МЕ/л, и ошибочные результаты не подозревались.
Были исключены медицинские причины гипофосфатаземии и рассмотрены возможные объяснения по алгоритму, предложенному Фрейзером [2].У пациентки не было анемии, она не принимала добавки эстрогена, бисфосфонаты, клофибрат, омепразол или лансопразол. Она также не придерживалась какой-либо определенной диеты. Ранее у нее был диагностирован гипотиреоз, и она хорошо принимала левотироксин. В анамнезе не было операций на сердце или искусственного кровообращения [1]. Повторные лабораторные анализы плазмы выявили стабильно низкую активность P-ALP, повышение пиридоксаль-5´-фосфата (PLP) (основной формы витамина B6 [3]) более чем в десять раз по сравнению с верхним контрольным уровнем и низкую концентрацию фосфата.Уровень тиреотропина (ТТГ) и цинка был в пределах соответствующих референсных диапазонов (1). Витамин D не измеряли, хотя это было бы актуально.
Таблица 1
Биохимические показатели в плазме больного.
| Analyte (единицы) | 5 концентрация 5|||||
|---|---|---|---|---|---|
| щелочная фосфатаза (U / L) | <10 | 35-105 | 1 ммоль/л) 0. 55-0.67 55-0.67 | 0.76-1.41 | 0.76-1.41 |
| Pyridoxal 5-фосфат (NMOL / L) | 1590 | 20-120 | |||
| аскорбат (μMol / L) | 58.4 | 26.1-84.6 | |||
| цинк (μMol / l) | 12.7 | 12.7 | 10.0-19.0 | ||
| Cobalamin (PMOL / L) | 697 | 150-800 | |||
| Folate (NMOL / L) | > 45 | > 45 | > 45 | 6 | |
| Тиротропин (ТТГ) (мМЕ/л) | 2.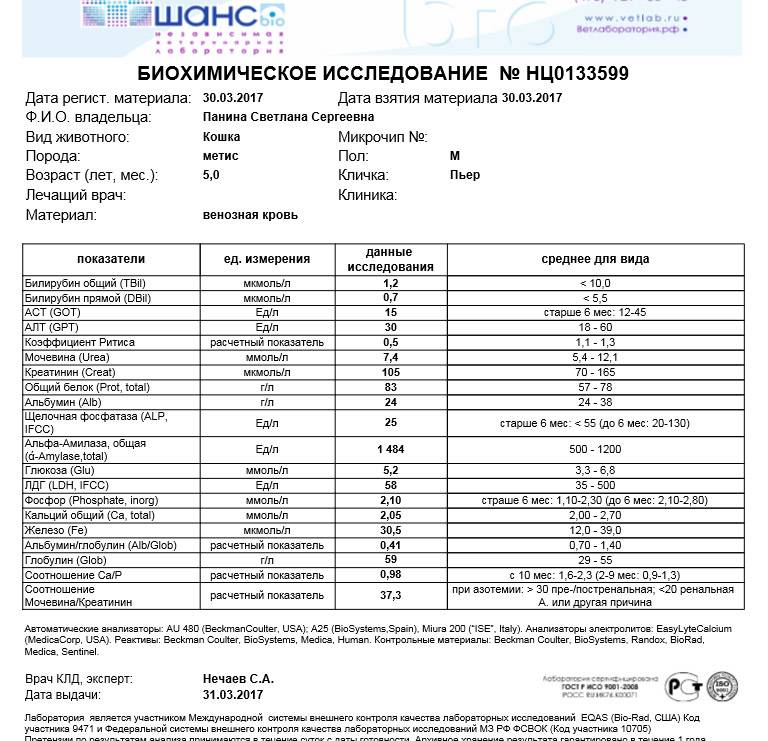 8 8 | 0,3–4,0 |
В анамнезе был двусторонний перелом плюсневых костей. В обоих случаях переломы были вызваны легкими травмами. В возрасте 50 лет она поскользнулась на лестнице и получила перелом дистального отдела левой четвертой плюсневой кости. Год спустя она носила сабо нестандартного размера и сломала правую пятую плюсневую кость (перелом Джонса). Оба перелома были подтверждены рентгенологически, как и длительное заживление. Переломы лечили консервативно.Как в годы до рентгенологического подтверждения переломов плюсневых костей, так и в последующем пациент страдал от постоянных болей в обеих стопах, разлитых, но дистально локализующихся и провоцируемых при наступании, например, на ноги. галька. Кроме того, она сообщила о двустороннем дискомфорте в коленях и бедрах. Пациент был среднего роста, преждевременной потери молочных зубов не было. Дополнительных переломов в анамнезе не было. На вопрос о своем детстве пациентка сообщила, что не может заниматься никакими видами спорта (бег, прыжки, катание на роликах и т. ), из-за дискомфорта или боли в обеих стопах. Фаза взлета/пронации цикла походки была особенно болезненной. Врачи объяснили ее симптомы рахитом и «слабостью костей» и больше ее не обследовали.
), из-за дискомфорта или боли в обеих стопах. Фаза взлета/пронации цикла походки была особенно болезненной. Врачи объяснили ее симптомы рахитом и «слабостью костей» и больше ее не обследовали.
1.1. Тестирование на гипофосфатазию
На основании лабораторных анализов и клинического анамнеза было заподозрено ГПП. Пациент согласился на генетическое тестирование, и в Centogene AG (Росток, Германия) было проведено секвенирование гена ALPL, выявившее два гетерозиготных варианта гена ALPL.Эти две мутации были локализованы в экзоне 6: c.571G>A (p. Glu191Lys), ранее описанная как болезнетворная [4], и c.512A>G (p. His171Arg) пока неопубликованный, но известный вариант () . Обе мутации перечислены в базе данных Tissue Nonspecific Alkaline Phosphatase Gene Mutations [5]. Было рекомендовано тестирование соответствующих членов семьи.
Генетическая родословная. У больного обнаружена сложная гетерозиготность (черный кружок). Ее мать (черно-белые полукруги) была носительницей c.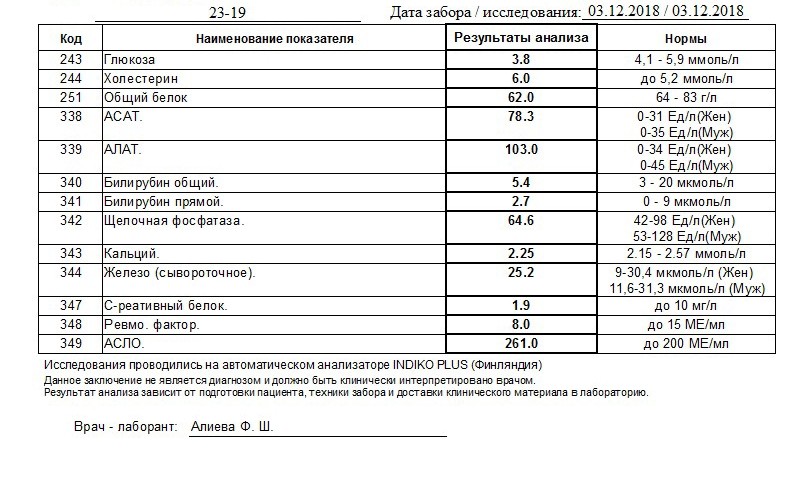 571G>A (p.Glu191Lys)-мутация.
571G>A (p.Glu191Lys)-мутация.
У больного не было детей, один брат, племянниц и племянников. Ее отец скончался в возрасте 57 лет из-за инфаркта миокарда, и у него не было никаких известных симптомов, которые можно было бы отнести к HPP. Ее брат (1967 г.р.) не интересовался генетическим тестированием. По словам пациентки, ее брату был поставлен диагноз ГПП в младенчестве, но это не привело к диагностике его сестры. У матери был самопроизвольный аборт на ранних сроках беременности, между рождением пациентки и ее брата.Мать страдала артритом и согласилась пройти тестирование на те же мутации, что и у основного пациента. У нее был нормальный уровень P-ALP, и было обнаружено, что она является носителем мутации c.571G>A (p. Glu191Lys).
Мутация c.571G>A (p. Glu191Lys), обнаруженная как у основной пациентки, так и у ее матери, была описана как умеренная (не тяжелая) мутация и часто наблюдается у пациентов с HPP европейского происхождения. Фоверт и др. [6] установили, что многие случаи умеренного HPP являются компаунд-гетерозиготными по умеренному и тяжелому аллелю или гетерозиготными по миссенс-мутации с доминантно-негативным эффектом.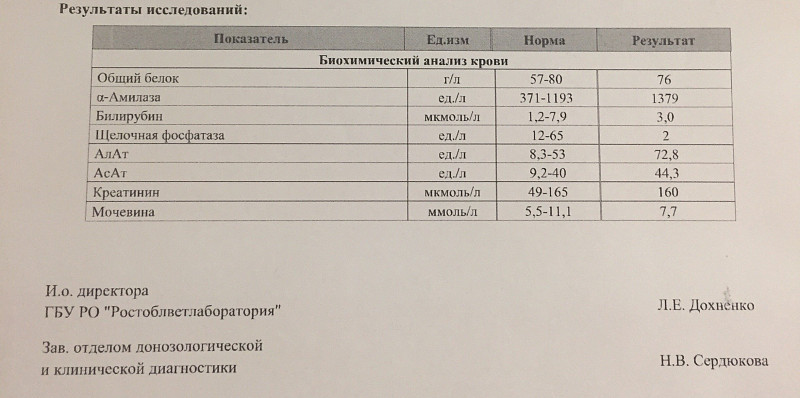 В той же публикации авторы сообщают, что многие случаи HPP встречаются у пациентов, которые либо являются компаунд-гетерозиготами, либо являются носителями двух миссенс-мутаций с доминантно-негативным эффектом [6]. Описанный здесь пациент является сложной гетерозиготой по известному патологическому аллелю и аллелю неизвестного значения (по данным лаборатории, проводившей секвенирование). Тот факт, что мать является носительницей мутации c.571G>A (p. Glu191Lys) и имеет нормальный уровень P-ALK, свидетельствует о патологическом влиянии c.512A>G (p. His171Arg)-мутация. В противном случае мы бы ожидали, что у пациентки-индекса будет нормальный уровень P-ALP, как и у ее матери. Мы не подтверждали и не исследовали возможный патогенный эффект второй мутации.
В той же публикации авторы сообщают, что многие случаи HPP встречаются у пациентов, которые либо являются компаунд-гетерозиготами, либо являются носителями двух миссенс-мутаций с доминантно-негативным эффектом [6]. Описанный здесь пациент является сложной гетерозиготой по известному патологическому аллелю и аллелю неизвестного значения (по данным лаборатории, проводившей секвенирование). Тот факт, что мать является носительницей мутации c.571G>A (p. Glu191Lys) и имеет нормальный уровень P-ALK, свидетельствует о патологическом влиянии c.512A>G (p. His171Arg)-мутация. В противном случае мы бы ожидали, что у пациентки-индекса будет нормальный уровень P-ALP, как и у ее матери. Мы не подтверждали и не исследовали возможный патогенный эффект второй мутации.
2. Обсуждение
Фермент ЩФ был открыт в 1923 г., а спустя 15 лет ГПП была зарегистрирована как заболевание [3]. ЩФ широко распространена в организме, особенно в скелете, печени, почках и развивающихся зубах [3], и катализирует гидролиз ряда субстратов [7].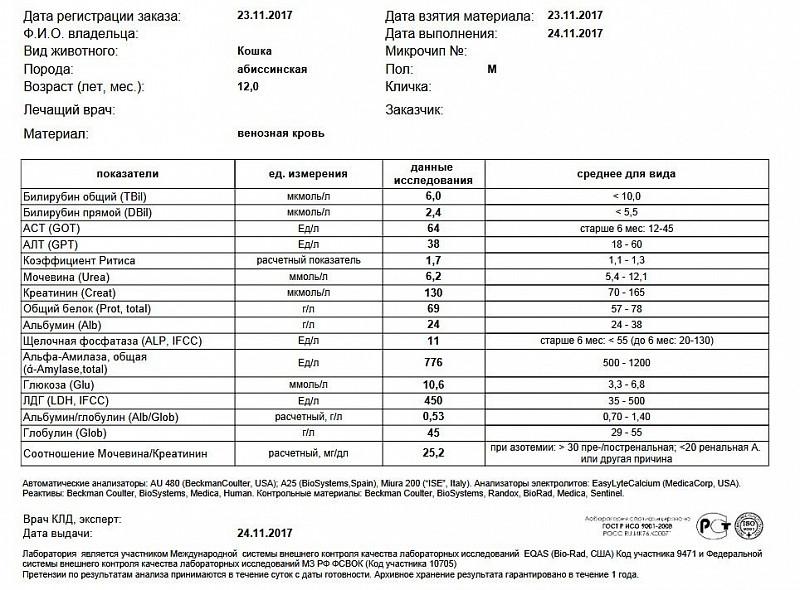 Костяная изоформа щелочной фосфатазы гидролизует неорганический пирофосфат (PPi) в фосфат, участвующий в образовании гидроксиапатита и нормальном формировании кости [8]. Как уже упоминалось, в клинической практике мало внимания уделяется низкой активности Р-ЩФ [1]. Этот случай подчеркивает, что активность P-ALP ниже нижнего предела референтного интервала имеет потенциальное клиническое значение.
Костяная изоформа щелочной фосфатазы гидролизует неорганический пирофосфат (PPi) в фосфат, участвующий в образовании гидроксиапатита и нормальном формировании кости [8]. Как уже упоминалось, в клинической практике мало внимания уделяется низкой активности Р-ЩФ [1]. Этот случай подчеркивает, что активность P-ALP ниже нижнего предела референтного интервала имеет потенциальное клиническое значение.
HPP — высокогетерогенное генетическое заболевание, вызываемое мутациями с потерей функции в гене, кодирующем тканеспецифический (печень/кость/почка) изофермент или ALP – ген ALPL или TNSALP [5].Фенотипические проявления варьируют от состояния со смертельным исходом внутриутробно до более легких форм остеопении и плохого заживления переломов. ГПП можно разделить на различные формы: взрослая; мягкое детство; тяжелое детство; инфантильный; перинатальный, а также одонтологический ГПП. Ранее, до генетического подтверждения заболевания, ГПП считали синдромом стойко низкого уровня P-ALP, соответствующего анамнеза и параклинических (рентгенологических и дополнительных биохимических) данных.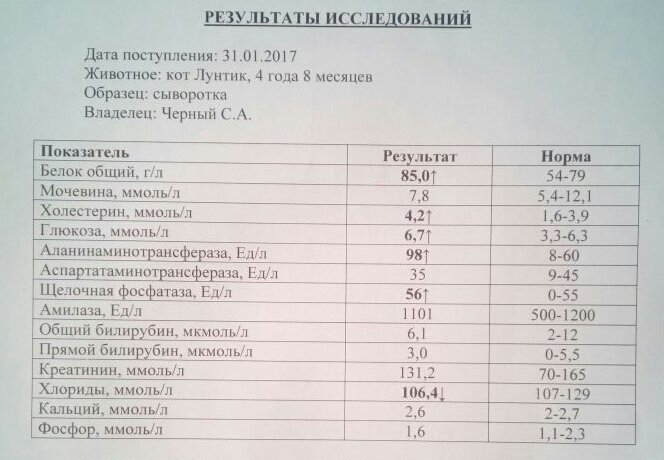 Тридцать лет назад, в 1988 г., был секвенирован ген тканенеспецифического изофермента щелочной фосфатазы (TNSALP), и в настоящее время выявлено более 300 генетических изменений [3].
Тридцать лет назад, в 1988 г., был секвенирован ген тканенеспецифического изофермента щелочной фосфатазы (TNSALP), и в настоящее время выявлено более 300 генетических изменений [3].
Помимо низкого уровня ЩФ, у пациентов с ГПП регулярно наблюдается повышение ПЛП, причем концентрация часто коррелирует с тяжестью заболевания [3]. У пациента, описанного в этой статье, концентрация PLP более чем в десять раз превышала верхний предел. У нее не было истории преждевременной потери молочных зубов, но состояние ее зубов было плохим. Ее остеогенные симптомы были пожизненными, но умеренными по сравнению с более тяжелыми фенотипами HPP. В базе данных Tissue Nonspecific Alkaline Phosphatase Gene Mutations [5] случай с подобными мутациями указан как страдающий HPP у взрослых.Случай не опубликован, фенотип не указан. Интересно, что у пациента, описанного в этом случае, с детства были симптомы, связанные с HPP.
HPP является последней формой остеомаляции, которую необходимо лечить с помощью медицинских препаратов [3]. В 2015 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США и Европейское агентство по лекарственным средствам одобрили рекомбинантную заместительную терапию TNSALP человека асфотазой альфа (Stensiq®, Alexion) для лечения HPP у детей [9], [10]. Асфотаза альфа также была одобрена для лечения взрослых с симптомами ГПП в детстве.Однако руководства по лечению взрослых асфотазой альфа отсутствуют [11]. Бисфосфонаты относительно противопоказаны при HPP, поскольку считается, что лечение ухудшает несбалансированное состояние с повышенным PPi [12]. Взрослые с HPP могут иметь переломы и низкую костную массу. У пациентов с этими симптомами и находками, а также с низким уровнем P-ALP необходимо исключить HPP до начала терапии бисфосфонатами [13]. Пациент, описанный в этом случае, в настоящее время получил генетическую консультацию и будет направлен на дальнейшую консультацию ортопеда и эндокринолога.Пациент находится в менопаузе, но для более молодых пациенток с HPP важно планирование семьи.
В 2015 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США и Европейское агентство по лекарственным средствам одобрили рекомбинантную заместительную терапию TNSALP человека асфотазой альфа (Stensiq®, Alexion) для лечения HPP у детей [9], [10]. Асфотаза альфа также была одобрена для лечения взрослых с симптомами ГПП в детстве.Однако руководства по лечению взрослых асфотазой альфа отсутствуют [11]. Бисфосфонаты относительно противопоказаны при HPP, поскольку считается, что лечение ухудшает несбалансированное состояние с повышенным PPi [12]. Взрослые с HPP могут иметь переломы и низкую костную массу. У пациентов с этими симптомами и находками, а также с низким уровнем P-ALP необходимо исключить HPP до начала терапии бисфосфонатами [13]. Пациент, описанный в этом случае, в настоящее время получил генетическую консультацию и будет направлен на дальнейшую консультацию ортопеда и эндокринолога.Пациент находится в менопаузе, но для более молодых пациенток с HPP важно планирование семьи.
2.1. В заключение
мы сообщаем о случае ГПП, диагностированном во взрослом возрасте, в связи с осознанием низкой активности Р-ЩФ. Этот случай иллюстрирует важность критического и любопытного подхода к обычным клиническим биохимическим лабораторным тестам.
Пациентка и ее мать дали письменное информированное согласие на публикацию этого клинического случая.
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов.
Сноски
☆ Случай гипофосфатазии, диагностированный во взрослом возрасте.
Ссылки
1. Lum G. Значение низкой активности щелочной фосфатазы в сыворотке преимущественно у взрослых мужчин. клин. хим. 1995; 41: 515–518. [PubMed] [Google Scholar]2. Фрейзер В. Д. Костно-минеральный обмен. В: Рифаи Н., Хорват А.Р., Виттвер К.Т., редакторы. Учебник Тица по клинической химии и молекулярной диагностике. 6-е изд. Эльзевир; Сент-Луис, Миссури, США: 2018. стр. 1422–1480.[Google Академия]3. Уайт М.П. Гипофосфатазия: обзор за 2017 год. Кость. 2017;102:15–25. [PubMed] [Google Scholar]4. Хенторн П.С., Радуча М., Федде К.Н., Лафферти М.А., Уайт М.П. Различные миссенс-мутации в локусе тканеспецифического гена щелочной фосфатазы при аутосомно-рецессивно наследуемых формах легкой и тяжелой гипофосфатазии. проц. Натл. акад. науч. США. 1992; 89: 9924–9928. [Бесплатная статья PMC] [PubMed] [Google Scholar]6. Фоверт Д., Брун-Хит И., Лия-Бальдини А.С., Беллази Л., Тайландье А., Serre J.L. Легкие формы гипофосфатазии чаще всего возникают в результате доминантно-негативного действия тяжелых аллелей или в результате сложной гетерозиготности по тяжелым и умеренным аллелям. БМС Мед. Жене. 2009;10:51. [Бесплатная статья PMC] [PubMed] [Google Scholar]7. Пантегини М., Баис Р. Ферменты сыворотки. В: Burtis CAA, Ashwood ER, Bruns DE, редакторы. Учебник Тица по клинической химии и молекулярной диагностике. 5-е изд. Эльзевир Сондерс; Сент-Луис, Миссури, США: 2012. стр. 565–598. [Google Академия]8.
Уайт М.П. Гипофосфатазия: обзор за 2017 год. Кость. 2017;102:15–25. [PubMed] [Google Scholar]4. Хенторн П.С., Радуча М., Федде К.Н., Лафферти М.А., Уайт М.П. Различные миссенс-мутации в локусе тканеспецифического гена щелочной фосфатазы при аутосомно-рецессивно наследуемых формах легкой и тяжелой гипофосфатазии. проц. Натл. акад. науч. США. 1992; 89: 9924–9928. [Бесплатная статья PMC] [PubMed] [Google Scholar]6. Фоверт Д., Брун-Хит И., Лия-Бальдини А.С., Беллази Л., Тайландье А., Serre J.L. Легкие формы гипофосфатазии чаще всего возникают в результате доминантно-негативного действия тяжелых аллелей или в результате сложной гетерозиготности по тяжелым и умеренным аллелям. БМС Мед. Жене. 2009;10:51. [Бесплатная статья PMC] [PubMed] [Google Scholar]7. Пантегини М., Баис Р. Ферменты сыворотки. В: Burtis CAA, Ashwood ER, Bruns DE, редакторы. Учебник Тица по клинической химии и молекулярной диагностике. 5-е изд. Эльзевир Сондерс; Сент-Луис, Миссури, США: 2012. стр. 565–598. [Google Академия]8.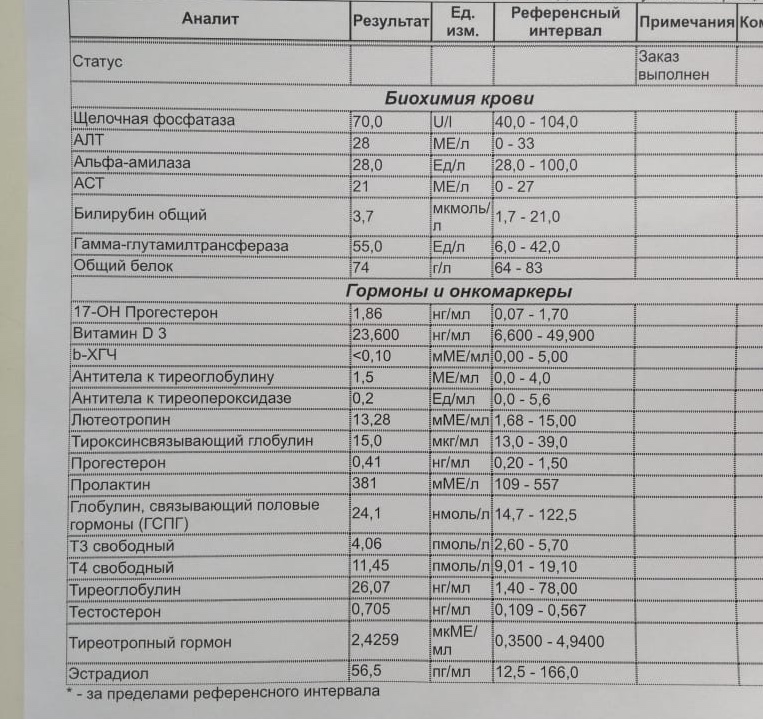 Ристели Дж., Винтер В.Э., Клеэрекопер М., Ристели Л. Костный и минеральный обмен. В: Burtis CAA, Ashwood ER, Bruns DE, редакторы. Учебник Тица по клинической химии и молекулярной диагностике. 5-е изд. Эльзевир Сондерс; Сент-Луис, Миссури, США: 2012. стр. 1781–1782. [Google Scholar]
Ристели Дж., Винтер В.Э., Клеэрекопер М., Ристели Л. Костный и минеральный обмен. В: Burtis CAA, Ashwood ER, Bruns DE, редакторы. Учебник Тица по клинической химии и молекулярной диагностике. 5-е изд. Эльзевир Сондерс; Сент-Луис, Миссури, США: 2012. стр. 1781–1782. [Google Scholar]9. Пресс-релиз FDA — FDA одобряет новое лечение редкого нарушения обмена веществ [пресс-релиз]. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, Министерство здравоохранения и социальных служб США, 10–23, 2015 г.
10. Первое лечение, рекомендованное при редком заболевании костей [пресс-релиз].Европейское агентство по лекарственным средствам, Европейский Союз, 06-26, 2015.
11. Шапиро Дж. Р., Левицкий Е. М. Гипофосфатазия у взрослых: клиническая оценка и рекомендации по лечению. Дж. Боун Шахтер. Рез. 2017; 32:1977–1980. [PubMed] [Google Scholar]Щелочная фосфатаза — обзор
Щелочная фосфатаза
Щелочная фосфатаза представляет собой широко распространенный фермент (например, в печени, желчных протоках, кишечнике, костях, почках, плаценте и лейкоцитах), который катализирует высвобождение ортофосфата.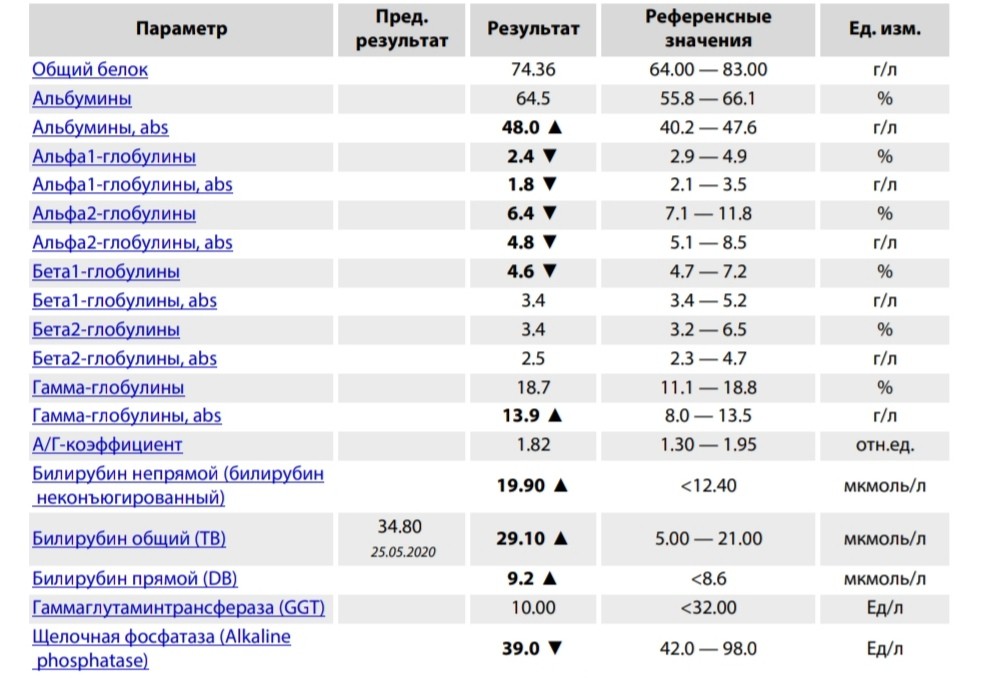 из сложноэфирных субстратов при щелочном рН.Нормальный уровень активности в сыворотке взрослых сильно зависит от метода измерения, возраста и пола. Два широко используемых современных метода имеют верхние пределы нормы для взрослых 85 и 110 МЕ/л (см. Приложение). Уровни в сыворотке выше референтного диапазона являются нормальными для детей и беременных. В кости щелочная фосфатаза участвует в отложении гидроксиапатита в остеоиде. В других местах, включая печень, его фосфатазная активность может способствовать перемещению молекул через клеточные мембраны.Активность щелочной фосфатазы в сыворотке главным образом отражает вклад печеночных и костных изоформ; кишечная форма может составлять от 20 до 60% от общего количества после жирной пищи, и устойчивое увеличение можно наблюдать у лиц с группой крови B или O. Существует значительный вклад плаценты в уровень щелочной фосфатазы на поздних сроках беременности; изофермент Regan, вариант, идентичный плацентарной форме, связан с гепатоцеллюлярным раком (глава 186), раком легкого (глава 182) и другими новообразованиями.
из сложноэфирных субстратов при щелочном рН.Нормальный уровень активности в сыворотке взрослых сильно зависит от метода измерения, возраста и пола. Два широко используемых современных метода имеют верхние пределы нормы для взрослых 85 и 110 МЕ/л (см. Приложение). Уровни в сыворотке выше референтного диапазона являются нормальными для детей и беременных. В кости щелочная фосфатаза участвует в отложении гидроксиапатита в остеоиде. В других местах, включая печень, его фосфатазная активность может способствовать перемещению молекул через клеточные мембраны.Активность щелочной фосфатазы в сыворотке главным образом отражает вклад печеночных и костных изоформ; кишечная форма может составлять от 20 до 60% от общего количества после жирной пищи, и устойчивое увеличение можно наблюдать у лиц с группой крови B или O. Существует значительный вклад плаценты в уровень щелочной фосфатазы на поздних сроках беременности; изофермент Regan, вариант, идентичный плацентарной форме, связан с гепатоцеллюлярным раком (глава 186), раком легкого (глава 182) и другими новообразованиями.
Повышение активности щелочной фосфатазы в сыворотке крови при холестатическом гепатобилиарном заболевании обусловлено двумя различными механизмами: усилением синтеза и секреции фермента и солюбилизацией с апикальной (каналикулярной) поверхности гепатоцитов и люминальной поверхности билиарных эпителиальных клеток за счет повышения локальных концентраций желчных кислот, возникающих при холестазе. Активность щелочной фосфатазы сыворотки также может повышаться при заболеваниях костей (например, при болезни Педжета [глава 233], остеомаляции [глава 231], метастазах в кости [глава 192]), при быстром росте костей у детей, на поздних сроках беременности, при хроническая почечная недостаточность (глава 121) и, иногда, при наличии злокачественных новообразований, не затрагивающих кости или печень.Источник часто очевиден, но когда это не так, методы фракционирования могут отличить гепатобилиарную щелочную фосфатазу от других форм. Альтернативой является измерение сывороточных уровней ГГТ или 5′-нуклеотидазы (5′-НТ), которые имеют тенденцию к параллельным уровням щелочной фосфатазы при гепатобилиарных заболеваниях, но обычно не повышаются при заболеваниях костей. При периоде полувыведения из сыворотки примерно 1 неделя уровни щелочной фосфатазы в сыворотке могут оставаться повышенными в течение нескольких дней или недель после разрешения обструкции желчевыводящих путей.Эта задержка может вводить в заблуждение, когда она сопровождается длительной гипербилирубинемией прямого действия из-за замедленного клиренса дельта-билирубина.
При периоде полувыведения из сыворотки примерно 1 неделя уровни щелочной фосфатазы в сыворотке могут оставаться повышенными в течение нескольких дней или недель после разрешения обструкции желчевыводящих путей.Эта задержка может вводить в заблуждение, когда она сопровождается длительной гипербилирубинемией прямого действия из-за замедленного клиренса дельта-билирубина.
Умеренное повышение активности щелочной фосфатазы в сыворотке крови (<3 раз от нормы) наблюдается при многих заболеваниях паренхимы печени, включая гепатит и цирроз. При отсутствии заболевания костей большее увеличение (в 3-10 раз выше нормы) обычно указывает на обструкцию оттока желчи. Хотя самые высокие уровни обычно отражают обструкцию общего желчного протока, повышение также может наблюдаться при обструкции внутрипеченочных желчных протоков из-за инфильтративных состояний, возникающих в результате гранулематозных процессов (саркоидоз [Глава 89], микобактериальная инфекция [Глава 308 и 309]), злокачественных новообразований (лимфома , холангиокарцинома или метастатический рак) или амилоидоз (Глава 179).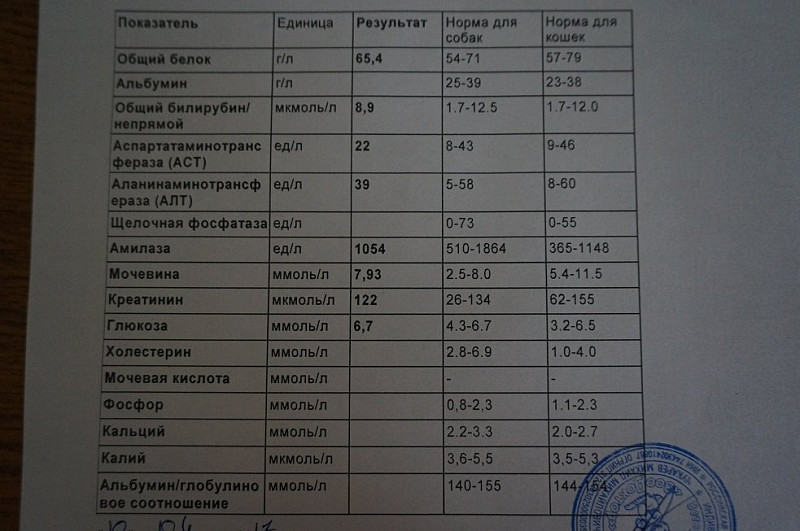
Жир печени, печеночные ферменты, щелочная фосфатаза и риск возникновения диабета 2 типа: проспективное исследование 132 377 взрослых
Chan, J. C. et al . Диабет в Азии: эпидемиология, факторы риска и патофизиология. ДЖАМА 301 , 2129–2140, doi:10.1001/jama.2009.726 (2009).
КАС Статья пабмед Google Scholar
Новые факторы риска, C. и др. . Сахарный диабет, уровень глюкозы натощак и риск смерти от конкретных причин. N Английский J Med 364 , 829–841, doi: 10.1056/NEJMoa1008862 (2011).
Knowler, W.C. и др. . Снижение заболеваемости диабетом 2 типа с помощью изменения образа жизни или метформина. Новый Английский J Мед 346 , 393–403 (2002).
КАС Статья пабмед Google Scholar
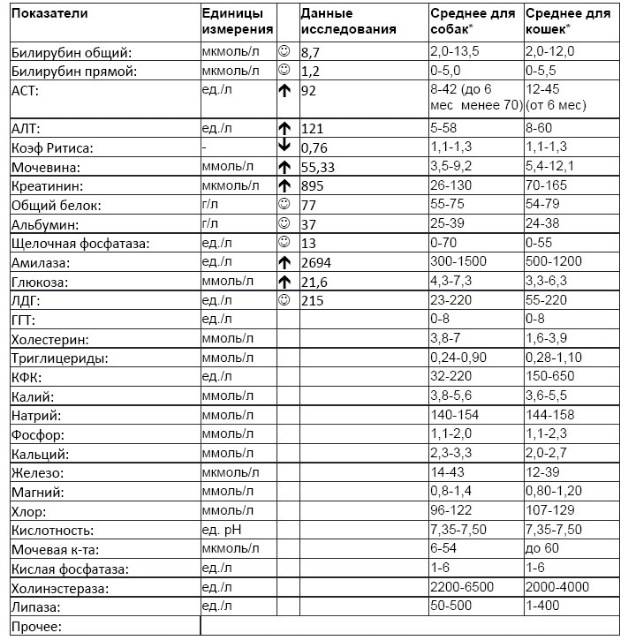
Фрейзер, А. и др. . Аланинаминотрансфераза, гамма-глутамилтрансфераза и диабет: исследование сердца и здоровья британских женщин и метаанализ. Лечение диабета 32 , 741–750, doi:10.2337/dc08-1870 (2009).
КАС Статья пабмед ПабМед Центральный Google Scholar
Хэнли, А. Дж. и др. . Повышение маркеров повреждения печени и риск развития диабета 2 типа: исследование атеросклероза с резистентностью к инсулину. Диабет 53 , 2623–2632 (2004).
КАС Статья пабмед Google Scholar
Ohlson, L. O. и др. . Факторы риска сахарного диабета 2 типа (инсулинозависимого). Тринадцать с половиной лет наблюдения за участниками исследования шведских мужчин, родившихся в 1913 году. Диабетология 31 , 798–805 (1988).
КАС Статья пабмед Google Scholar
Саттар, Н. и др. . Повышенный уровень аланинаминотрансферазы предсказывает впервые возникший диабет 2 типа независимо от классических факторов риска, метаболического синдрома и С-реактивного белка в исследовании коронарной профилактики на западе Шотландии. Диабет 53 , 2855–2860 (2004).
КАС Статья пабмед Google Scholar
Возарова Б. и др. . Высокий уровень аланинаминотрансферазы связан со снижением чувствительности печени к инсулину и предсказывает развитие сахарного диабета 2 типа. Диабет 51 , 1889–1895 (2002).
КАС Статья пабмед Google Scholar
Wannamethee, S.G., Shaper, A.G., Lennon, L. & Whincup, P.H. Печеночные ферменты, метаболический синдром и риск диабета 2 типа у пожилых мужчин. Лечение диабета 28 , 2913–2918, doi:10.2337/diacare.28.12.2913 (2005).
Лечение диабета 28 , 2913–2918, doi:10.2337/diacare.28.12.2913 (2005).
КАС Статья пабмед Google Scholar
Андре, П. и др. . Печеночные маркеры и развитие сахарного диабета 2 типа у мужчин и женщин среднего возраста: трехлетнее наблюдение — исследование DESIR (данные эпидемиологического исследования синдрома резистентности к инсулину). Диабет и обмен веществ 31 , 542–550, doi:10.1016/S1262-3636(07)70229-Х (2005).
КАС Статья Google Scholar
Schneider, A.L.C. и др. . Ферменты печени, раса, пол и риск диабета: исследование риска атеросклероза в сообществах (ARIC). Диабетическая медицина 30 , 926–933, doi:10.1111/dme.12187 (2013).
КАС Статья пабмед ПабМед Центральный Google Scholar
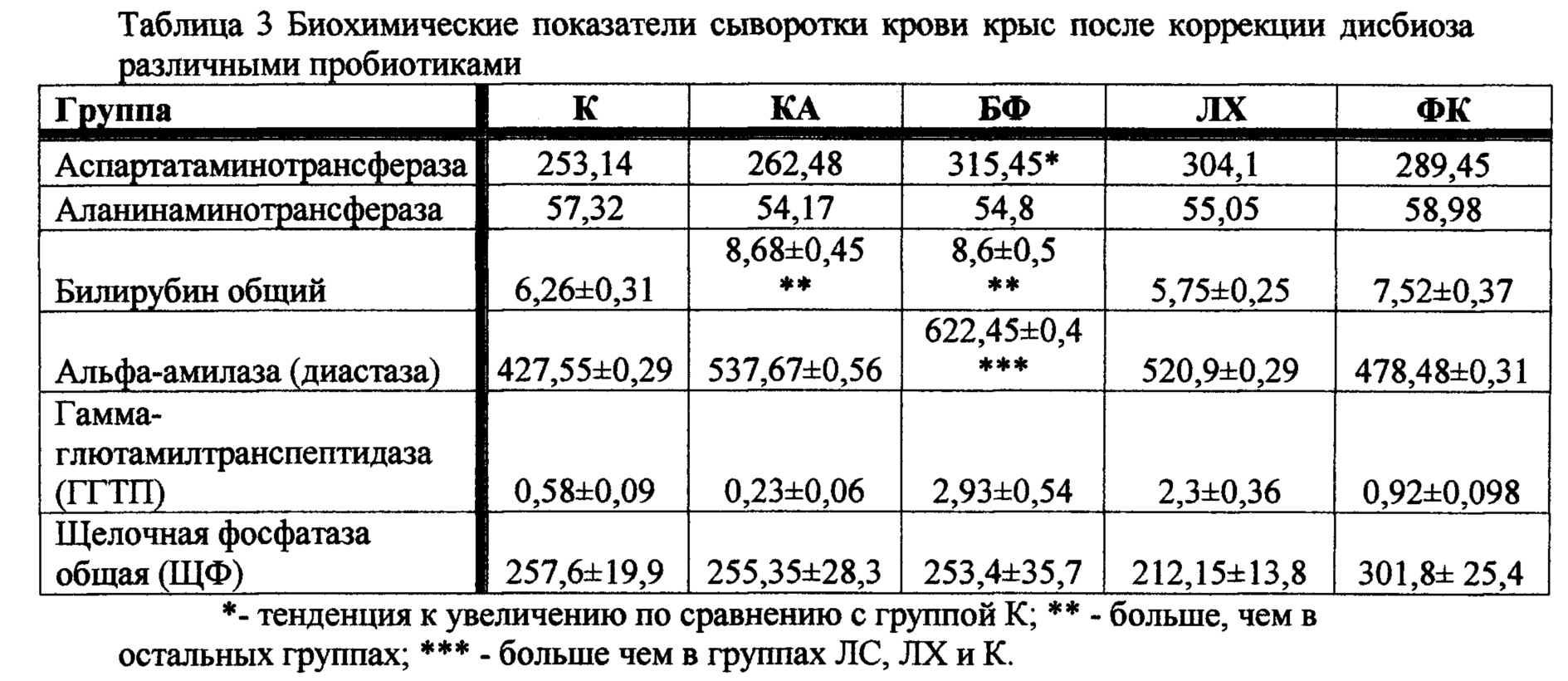
Кунуцор, С. К., Аббаси, А. и Апей, Т. А. Аспартатаминотрансфераза — маркер риска сахарного диабета 2 типа или отвлекающий маневр? Передний эндокринол (Лозанна) 5 , 189, doi:10.3389/fendo.2014.00189 (2014).
Центральный пабмед Google Scholar
Liu, J., Au Yeung, S.L., Lin, S.L., Leung, G.M. & Schooling, C.M. Ферменты печени и риск ишемической болезни сердца и сахарного диабета 2 типа: менделевское рандомизированное исследование. Научный представитель 6 , 38813, doi:10.1038/srep38813 (2016).
ОБЪЯВЛЕНИЕ КАС Статья пабмед ПабМед Центральный Google Scholar
Noordam, R., Smit, RA, Postmus, I., Trompet, S. & van Heemst, D. Оценка причинно-следственной связи между сывороточной гамма-глутамилтрансферазой и сахарным диабетом 2 типа с использованием общедоступных данных: менделевская исследование рандомизации. Int J Epidemiol .doi: 10.1093/ije/dyw306 (2016).
Int J Epidemiol .doi: 10.1093/ije/dyw306 (2016).
ПабМед Google Scholar
Ли, Ю. С. и др. . Гамма-глутамилтрансфераза в сыворотке и риск развития диабета 2 типа у населения Кореи в целом: рандомизированное исследование по Менделю. Хум Мол Жене 25 , 3877–3886, doi:10.1093/hmg/ddw226 (2016).
КАС Статья пабмед Google Scholar
Сеппала-Линдроос, А. и др. . Накопление жира в печени связано с дефектами подавления инсулином продукции глюкозы и свободных жирных кислот в сыворотке, независимо от ожирения у нормальных мужчин. J Clin Endocr Metab 87 , 3023–3028, doi:10.1210/jc.87.7.3023 (2002).
КАС Статья пабмед Google Scholar
Бхатт, Х. Б. и Смит, Р. Дж.Жировая болезнь печени при сахарном диабете. Гепатобилиарный Surg Nutr 4 , 101–108, doi:10.3978/j.issn.2304-3881.2015.01.03 (2015).
Дж.Жировая болезнь печени при сахарном диабете. Гепатобилиарный Surg Nutr 4 , 101–108, doi:10.3978/j.issn.2304-3881.2015.01.03 (2015).
ПабМед ПабМед Центральный Google Scholar
Кастуриратне А. и др. . Влияние неалкогольной жировой болезни печени на развитие сахарного диабета. J Гастроэн Гепатол 28 , 142–147, doi:10.1111/j.1440-1746.2012.07264.x (2013).
Артикул Google Scholar
Kim, C.H., Park, J.Y., Lee, K.U., Kim, J.H. & Kim, H.K. Ожирение печени является независимым фактором риска развития диабета 2 типа у взрослых корейцев. Диабет Мед 25 , 476–481, doi:10.1111/j.1464-5491.2008.02410.x (2008).
КАС Статья пабмед Google Scholar
Li, W.D. и др. . Сравнение влияния ожирения и неалкогольной жировой болезни печени на заболеваемость сахарным диабетом 2 типа. World J Гастроэнтерол 21 , 9607–9613, doi:10.3748/wjg.v21.i32.9607 (2015).
Артикул пабмед ПабМед Центральный Google Scholar
Шибата М., Кихара Ю., Тагучи М., Таширо М. и Оцуки М. Неалкогольная жировая болезнь печени является фактором риска развития диабета 2 типа у японских мужчин среднего возраста. Лечение диабета 30 , 2940–2944, doi:10.2337/dc07-0792 (2007).
КАС Статья пабмед Google Scholar
Сун, К. К., Чжон, В. С., Уайлд, С. Х. и Бирн, К. Д. Комбинированное влияние инсулинорезистентности, избыточного веса/ожирения и ожирения печени как факторов риска диабета 2 типа. Лечение диабета 35 , 717–722, doi:10. 2337/dc11-1853 (2012).
2337/dc11-1853 (2012).
КАС Статья пабмед ПабМед Центральный Google Scholar
Сунг, К. С., Уайлд, С. Х. и Бирн, К. Д. Разрешение жировой дистрофии печени и риска возникновения диабета. J Clin Endocr Metab 98 , 3637–3643, doi:10.1210/jc.2013-1519 (2013).
КАС Статья пабмед Google Scholar
Ямадзаки, Х., Цубоя, Т., Цудзи, К., Дохке, М. и Магучи, Х. Независимая связь между улучшением неалкогольной жировой болезни печени и снижением заболеваемости диабетом 2 типа. Лечение диабета 38 , 1673–1679, doi: 10.2337/dc15-0140 (2015).
КАС Статья пабмед Google Scholar
Westerbacka, J. et al . Женщины и мужчины имеют одинаковое количество печени и внутрибрюшного жира, несмотря на большее количество подкожного жира у женщин: последствия для половых различий в маркерах сердечно-сосудистого риска. Диабетология 47 , 1360–1369, doi:10.1007/s00125-004-1460-1 (2004).
Диабетология 47 , 1360–1369, doi:10.1007/s00125-004-1460-1 (2004).
КАС Статья пабмед Google Scholar
Тиби, Л., Кольер, А., Патрик, А.В., Кларк, Б.Ф. и Смит, А.Ф. Изоферменты щелочной фосфатазы плазмы при сахарном диабете. Клин Чим Acta 177 , 147–155 (1988).
КАС Статья пабмед Google Scholar
Перри, И. Дж., Ваннамети, С. Г. и Шейпер, А. Г. Проспективное исследование сывороточной гамма-глутамилтрансферазы и риска NIDDM. Лечение диабета 910
КАС Статья пабмед Google Scholar
Наннипьери, М. и др. . Ферменты печени, метаболический синдром и диабет: исследование диабета в Мехико. Лечение диабета 28 , 1757–1762, doi:10.2337/diacare.28.7.1757 (2005).
Лечение диабета 28 , 1757–1762, doi:10.2337/diacare.28.7.1757 (2005).
КАС Статья пабмед Google Scholar
Jiang, Y.D., Chang, C.H., Tai, T.Y., Chen, J.F. & Chuang, L.M. Уровень заболеваемости и распространенности сахарного диабета на Тайване: анализ общенациональной базы данных медицинского страхования за 2000–2009 гг. J Formos Med Assoc 111 , 599–604, doi:10.1016/j.jfma.2012.09.014 (2012).
Артикул пабмед Google Scholar
Lin, C.C. и др. . Анализ временных тенденций распространенности и заболеваемости диагностированным диабетом 2 типа среди взрослых на Тайване с 2000 по 2007 год: популяционное исследование. BMC Общественное здравоохранение 13 , doi: 10.1186/1471-2458-13-318 (2013).

Читтури, С. и др. .Неалкогольная жировая болезнь печени в Азиатско-Тихоокеанском регионе: определения и обзор предлагаемых рекомендаций. J Гастроэн Гепатол 22 , 778–787, doi:10.1111/j.1440-1746.2007.05001.x (2007).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Лазо М. и др. . Распространенность неалкогольной жировой болезни печени в Соединенных Штатах: Третье национальное обследование состояния здоровья и питания, 1988–1994 гг. Am J Эпидемиол 178 , 38–45, doi:10.1093/aje/kws448 (2013).
Артикул пабмед ПабМед Центральный Google Scholar
Riley, T. R. & Kahn, A. Факторы риска и ультразвуковое исследование могут предсказать хронический гепатит, вызванный неалкогольной жировой болезнью печени. Дайджест науки 51 , 41–44, doi: 10. 1007/s10620-006-3082-6 (2006).
1007/s10620-006-3082-6 (2006).
Артикул пабмед Google Scholar
Малхолл, Б.П., Онг, Дж.П. и Юносси, З.М. Неалкогольная жировая болезнь печени: обзор. J Гастроэн Гепатол 17 , 1136–1143, doi:10.1046/j.1440-1746.2002.02881.x (2002).
КАС Статья Google Scholar
Райан, С. К., Джонсон, Л. А., Гермин, Б.И. и Маркос, А. Сто последовательных биопсий печени при обследовании живых доноров для трансплантации правой доли печени. Трансплантация печени 8 , 1114–1122, doi:10.1053/jlts.2002.36740 (2002).
Артикул Google Scholar
Перес, Северная Каролина и др. . Ультразвуковая диагностика жировой дистрофии печени у больных с хроническими заболеваниями печени — Ретроспективное обсервационное исследование. Дж Клин Гастроэнтерол 910
Дж Клин Гастроэнтерол 910
Артикул пабмед Google Scholar
Толман К.Г., Фонсека В., Далпиаз А. и Тан М.Х. Спектр заболеваний печени при диабете 2 типа и ведение пациентов с диабетом и заболеваниями печени. Лечение диабета 30 , 734–743, doi:10.2337/dc06-1539 (2007).
КАС Статья пабмед Google Scholar
Озыилкан Э. и Арслан М. Повышенная распространенность сахарного диабета у пациентов с хронической инфекцией, вызванной вирусом гепатита С. Am J Гастроэнтерол 91 , 1480–1481 (1996).
КАС пабмед Google Scholar
О, С.В., Хан, К. Х. и Хан, С. Ю. Связь между почечной гиперфильтрацией и сывороточной щелочной фосфатазой. Плос Один 10 , doi:10.1371/journal.pone.0122921 (2015).
Х. и Хан, С. Ю. Связь между почечной гиперфильтрацией и сывороточной щелочной фосфатазой. Плос Один 10 , doi:10.1371/journal.pone.0122921 (2015).
Вора, Дж. П. и др. . Почечная гемодинамика при впервые выявленном инсулиннезависимом сахарном диабете. Почки Int 41 , 829–835 (1992).
КАС Статья пабмед Google Scholar
Наканиши, Н. и др. . Сывороточная гамма-глутамилтрансфераза и развитие нарушений уровня глюкозы натощак или диабета 2 типа у японских мужчин среднего возраста. J Интерн Мед 254 , 287–295, doi:10.1046/j.1365-2796.2003.01198.x (2003).
КАС Статья пабмед Google Scholar
Лазо, М., Селвин, Э. и Кларк, Дж. М. Краткое сообщение: Клинические последствия краткосрочной изменчивости результатов тестов функции печени. Энн Стажер Мед 148 , 348–W376 (2008).
Энн Стажер Мед 148 , 348–W376 (2008).
Артикул пабмед Google Scholar
Wang, M.L. MJ Записи об использовании и замене оборудования для скрининга здоровья. Технический отчет MJ Health Research Foundation MJHRF-TR-06 (2016 г.).
Вэнь, С. П. и др. . Минимальное количество физической активности для снижения смертности и увеличения продолжительности жизни: проспективное когортное исследование. Ланцет 378 , 1244–1253, doi:10.1016/S0140-6736(11)60749-6 (2011).
Артикул пабмед Google Scholar
Влияние возраста и эстрогена на биохимические маркеры метаболизма костной ткани у
Bashu Dev Pardhe, Sabala Pathak, Anjeela Bhetwal, Sumitra Ghimire, Shreena Shakya, Puspa Raj Khanal, Sujan Babu Marahatta
Отделение лабораторной медицины, Мемориальный институт Манмохана of Health Sciences, Kathmandu, Nepal
История вопроса: Остеопороз, широко распространенное во всем мире заболевание, характеризуется низкой костной массой и нарушением структуры костной ткани, что приводит к повышенной хрупкости костей и повышению риска переломов.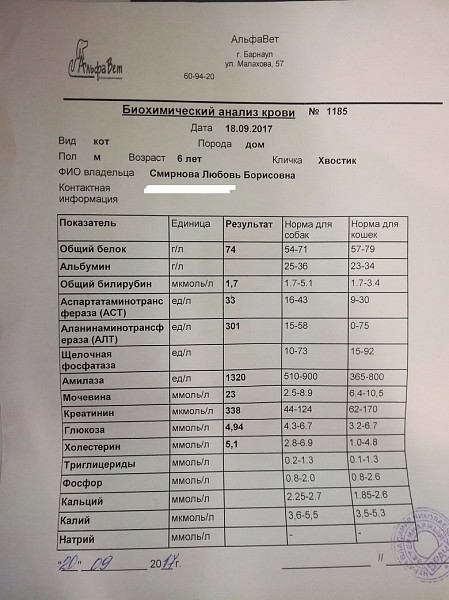 И менопауза, и старение являются взаимосвязанными факторами, ведущими к повышенному риску заболеваний костей, особенно среди женщин в постменопаузе. Таким образом, основной целью данного исследования было изучение различий в биохимических маркерах метаболизма костной ткани и оценка связи гормонов и возрастных факторов с биохимическими маркерами у женщин в пре- и постменопаузе.
И менопауза, и старение являются взаимосвязанными факторами, ведущими к повышенному риску заболеваний костей, особенно среди женщин в постменопаузе. Таким образом, основной целью данного исследования было изучение различий в биохимических маркерах метаболизма костной ткани и оценка связи гормонов и возрастных факторов с биохимическими маркерами у женщин в пре- и постменопаузе.
Методы: Описательное кросс-секционное исследование проводилось в течение 6 месяцев среди женского населения общины Дхолахити, Лалитпур, Непал.Всего на основе стратегии анкетирования было отобрано 496 здоровых женщин. Среди них 244 женщины в пременопаузе и 252 женщины в постменопаузе. Различные костные маркеры оценивали в соответствии с руководством, предоставленным производителем реагентов, а гормональный анализ, в частности, оценку уровня эстрадиола, выполняли методом иммунохемилюминесцентного анализа.
Результаты: Значительное снижение уровня кальция в сыворотке крови и уровня эстрадиола наблюдалось у женщин в постменопаузе по сравнению с женщинами в пременопаузе, тогда как у женщин в постменопаузе наблюдалось значительное повышение уровней фосфора и щелочной фосфатазы в сыворотке ( p <0 .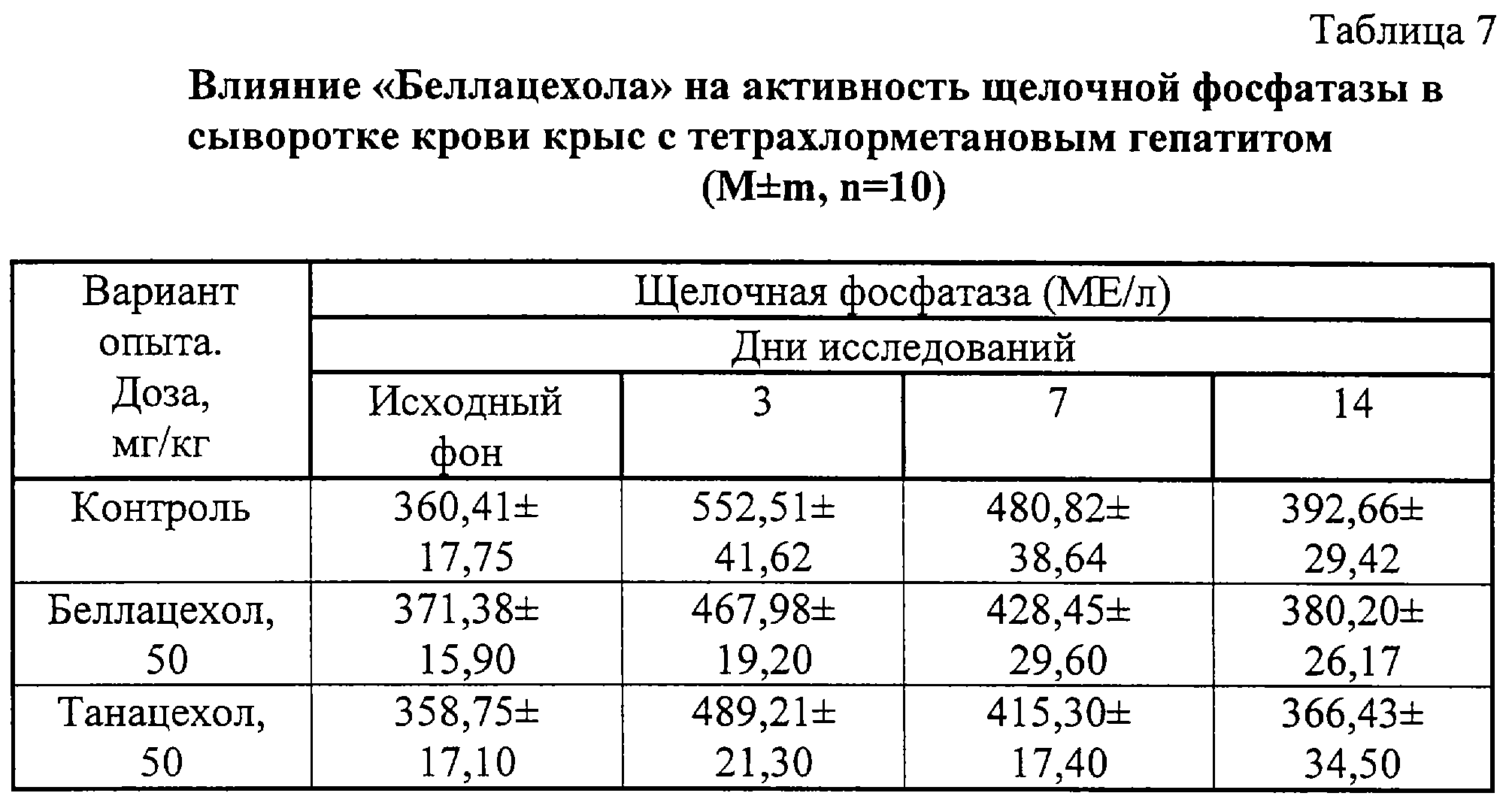 001). Возраст достоверно коррелировал с костными маркерами (ЩФ и кальцием) в постменопаузальной группе ( p <0,005), в то время как в пременопаузальной группе значимой корреляции не было. Кроме того, наблюдалась значительная положительная корреляция между кальцием и эстрадиолом у женщин в постменопаузе, в то время как ЩФ отрицательно коррелировала с эстрадиолом в этой группе. Кроме того, не было продемонстрировано значительной корреляции между эстрадиолом и костными маркерами у женщин в постменопаузе по индексу массы тела и частичному корреляционному анализу с поправкой на возраст.
001). Возраст достоверно коррелировал с костными маркерами (ЩФ и кальцием) в постменопаузальной группе ( p <0,005), в то время как в пременопаузальной группе значимой корреляции не было. Кроме того, наблюдалась значительная положительная корреляция между кальцием и эстрадиолом у женщин в постменопаузе, в то время как ЩФ отрицательно коррелировала с эстрадиолом в этой группе. Кроме того, не было продемонстрировано значительной корреляции между эстрадиолом и костными маркерами у женщин в постменопаузе по индексу массы тела и частичному корреляционному анализу с поправкой на возраст.
Заключение: Своевременная диагностика остеопороза у женщин будет иметь большое значение для эффективной помощи нуждающимся группам населения и поможет минимизировать смертность и финансовое бремя нашей страны.
Фон
Во всем мире остеопороз встречается с угрожающей скоростью и становится серьезной проблемой для здоровья, особенно среди женщин в постменопаузе, что приводит к высокой заболеваемости и смертности.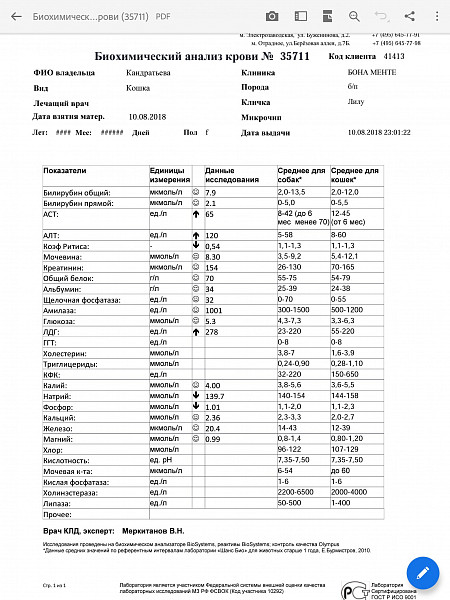 1 Заболевание характеризуется низкой костной массой и нарушением структуры костной ткани, что приводит к повышенной хрупкости костей и последующему увеличению риска переломов. 2,3 Около 200 миллионов человек во всем мире страдают этим хроническим нарушением обмена веществ. 4 Женский пол, индекс массы тела (ИМТ) и факторы, связанные с образом жизни, являются установленными причинами повышенного остеопороза. 5
1 Заболевание характеризуется низкой костной массой и нарушением структуры костной ткани, что приводит к повышенной хрупкости костей и последующему увеличению риска переломов. 2,3 Около 200 миллионов человек во всем мире страдают этим хроническим нарушением обмена веществ. 4 Женский пол, индекс массы тела (ИМТ) и факторы, связанные с образом жизни, являются установленными причинами повышенного остеопороза. 5
Возраст также является важным фактором, влияющим на костный метаболизм. В детском и подростковом возрасте образование новой кости происходит быстрее, чем резорбция старой кости. Формирование кости опережает резорбцию до тех пор, пока пик костной массы не будет достигнут примерно в возрасте 30 лет, после чего резорбция кости постепенно начинает превышать формирование кости, 6 , а риск остеопоротических переломов удваивается в течение 7–8 лет после 50 лет. 5
Менопауза возникает, когда существует дисбаланс между скоростью образования и резорбции кости, а чрезмерная резорбция приводит к отрицательному балансу ремоделирования, что приводит к остеопорозу и другим метаболическим заболеваниям костей.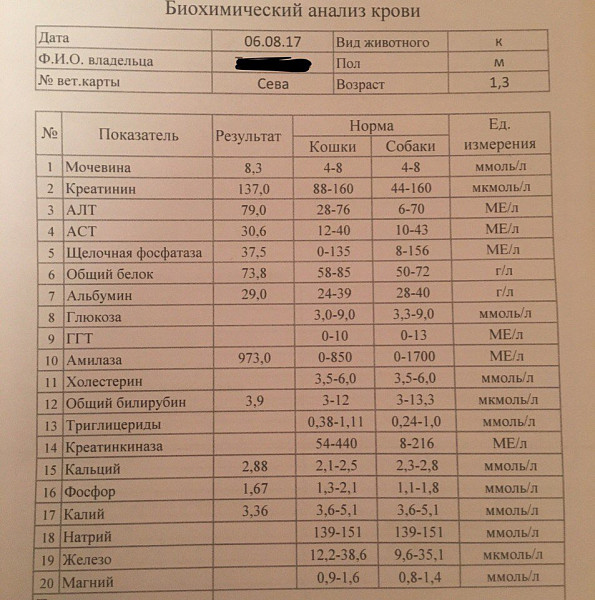 7 С наступлением менопаузы наблюдается быстрая потеря костной массы, составляющая приблизительно 2-3% в течение следующих 5-10 лет, и она наиболее высока в первые годы постменопаузы. 1 Гормональные изменения, происходящие во время менопаузального перехода, играют решающую роль в развитии этого заболевания. 8 Среди различных гормонов тестостерон и эстроген помогают поддерживать структуру костей на протяжении всей жизни. Эстроген, лучший стимулятор роста костей, отвечает за поддержание костной массы у женщин. Тем не менее, после менопаузы уровень эстрогена снижается, что создает риск заболевания костей у женщин в постменопаузе. 9
7 С наступлением менопаузы наблюдается быстрая потеря костной массы, составляющая приблизительно 2-3% в течение следующих 5-10 лет, и она наиболее высока в первые годы постменопаузы. 1 Гормональные изменения, происходящие во время менопаузального перехода, играют решающую роль в развитии этого заболевания. 8 Среди различных гормонов тестостерон и эстроген помогают поддерживать структуру костей на протяжении всей жизни. Эстроген, лучший стимулятор роста костей, отвечает за поддержание костной массы у женщин. Тем не менее, после менопаузы уровень эстрогена снижается, что создает риск заболевания костей у женщин в постменопаузе. 9
Согласно прогнозам, в Европе и Америке около 30% мужчин и 40% женщин в постменопаузе проведут остаток своей жизни, страдая от остеопороза. 4 Однако уровень заболеваемости остеопорозом намного выше среди азиатского населения, и было подсчитано, что к 2050 году около 50% людей будут страдать от остеопороза. 10 сельские районы, и большинство населения Непала живет в таких сообществах, где люди с остеопорозом остаются невыявленными. В частности, в нашей стране 50% всего населения составляют женщины, и среди них более 50% составляют пожилые люди, 11 , и это группа с высоким риском развития остеопороза.
10 сельские районы, и большинство населения Непала живет в таких сообществах, где люди с остеопорозом остаются невыявленными. В частности, в нашей стране 50% всего населения составляют женщины, и среди них более 50% составляют пожилые люди, 11 , и это группа с высоким риском развития остеопороза.
Несколько исследований, доступных на сегодняшний день, задокументировали информацию об остеопорозе среди женщин в постменопаузе из разных частей мира. Тем не менее, в литературе мало доказательств, основанных на данных сообщества непальских женщин в постменопаузе. Поэтому в этом исследовании мы стремились изучить состояние метаболизма костной ткани и связанные с ним заболевания у женщин в постменопаузе с высоким риском.
Методы
Описательное кросс-секционное исследование проводилось в течение 6 месяцев среди женского населения общины Дхолахити, Лалитпур, Непал.Выбор 496 здоровых женщин был основан на стратегии анкетирования. Среди них 244 женщины в пременопаузе и 252 женщины в постменопаузе.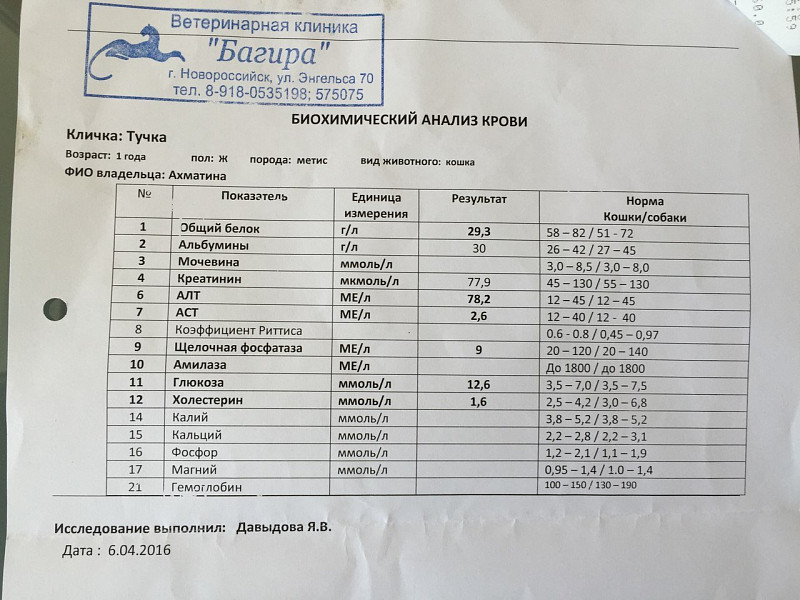 Информация о демографии пациентки (возраст и пол), продолжительности менопаузы, возрасте менархе, гистерэктомии в анамнезе, приеме костно-связанных препаратов и любой гормональной терапии была собрана и записана в форме клинического профиля.
Информация о демографии пациентки (возраст и пол), продолжительности менопаузы, возрасте менархе, гистерэктомии в анамнезе, приеме костно-связанных препаратов и любой гормональной терапии была собрана и записана в форме клинического профиля.
У каждой женщины было взято около 5 мл венозной крови для оценки биохимических показателей.Уровни сывороточного кальция, сывороточного фосфора и сывороточной щелочной фосфатазы (ЩФ) оценивались как биохимические маркеры метаболизма костной ткани. Стандартные методы анализов были основаны на рекомендациях производителя реагентов (Human Gm Bh, Германия) полностью автоматизированного анализатора HumaStar 300. Референтным диапазоном для кальция в сыворотке считали 8,1–10,4 мг/дл, фосфора в сыворотке — 2,5–5,0 мг/дл, а нормальная активность ЩФ в сыворотке — 44–174 МЕ/л. Гормональный анализ, в частности оценка уровня эстрадиола, у каждого человека был выполнен с помощью метода иммунохемилюминесцентного анализа с использованием MAGLUMI 1000 plus в отделении лабораторной медицины Мемориальной клинической больницы Манмохан. Нормальным диапазоном эстрадиола считается 10–66 пг/мл в постменопаузальную фазу и 236–251 пг/мл в пременопаузальную фазу, как указано в рекомендациях производителя. Аналитическая чувствительность анализа составила менее 8 пг/мл. Коэффициент вариации внутри анализа (CV) оценивался производителем в трех разных уровнях контрольной сыворотки, повторно измеренных 20 раз в одном цикле, и CV% составлял 8,20 для уровня 1 (138,25 ± 11,33 пг/мл), 4,82 для уровня 2 (215,54±10,39 пг/дл) и 5,13 для уровня 3 (995.35±51,06), в то время как CV между анализами оценивался производителем для трех разных партий наборов. Три разных уровня контрольной сыворотки были повторно измерены 21 раз, и CV% составил 9,66 для уровня 1 (132,54 ± 12,80 пг/мл), 9,11 для уровня 2 (205,78 ± 18,75 пг/дл) и 7,95 для уровня 3 (985,57 ± 78.35).
Нормальным диапазоном эстрадиола считается 10–66 пг/мл в постменопаузальную фазу и 236–251 пг/мл в пременопаузальную фазу, как указано в рекомендациях производителя. Аналитическая чувствительность анализа составила менее 8 пг/мл. Коэффициент вариации внутри анализа (CV) оценивался производителем в трех разных уровнях контрольной сыворотки, повторно измеренных 20 раз в одном цикле, и CV% составлял 8,20 для уровня 1 (138,25 ± 11,33 пг/мл), 4,82 для уровня 2 (215,54±10,39 пг/дл) и 5,13 для уровня 3 (995.35±51,06), в то время как CV между анализами оценивался производителем для трех разных партий наборов. Три разных уровня контрольной сыворотки были повторно измерены 21 раз, и CV% составил 9,66 для уровня 1 (132,54 ± 12,80 пг/мл), 9,11 для уровня 2 (205,78 ± 18,75 пг/дл) и 7,95 для уровня 3 (985,57 ± 78.35).
Критерии включения и исключения
В исследование были включены практически здоровые участники. Письменное информированное согласие было получено от каждого человека, и люди были сгруппированы в пре- и постменопаузе на основе результатов опроса. Женщины, у которых была аменорея из-за гистерэктомии или любых других известных причин, кроме естественных причин, женщины с ревматоидным артритом, женщины, принимающие заместительную гормональную терапию или какие-либо лекарства, связанные с костями, женщины с сахарным диабетом в анамнезе, нарушениями щитовидной железы, желтухой и заболевания печени, а заядлые курильщики и/или алкоголики были исключены из исследования.
Женщины, у которых была аменорея из-за гистерэктомии или любых других известных причин, кроме естественных причин, женщины с ревматоидным артритом, женщины, принимающие заместительную гормональную терапию или какие-либо лекарства, связанные с костями, женщины с сахарным диабетом в анамнезе, нарушениями щитовидной железы, желтухой и заболевания печени, а заядлые курильщики и/или алкоголики были исключены из исследования.
Этическое одобрение
Письменное одобрение (ref 006/072-073/MMIHS) было получено от институционального наблюдательного комитета MMIHS после подачи и представления предложения комитету.
Анализ данных
Данные были проанализированы с использованием SPSS версии 20.0 (IBM Corp., Армонк, штат Нью-Йорк, США) и Microsoft Excel 2013. Тест Стьюдента t был использован для анализа различий в биохимических маркерах метаболизма костной ткани у женщин в пре- и постменопаузе. Аналогичным образом, коэффициент корреляции Пирсона использовался для оценки связи гормонов и возрастных факторов с биохимическими маркерами метаболизма костной ткани у женщин в постменопаузе.
Результаты
Из 496 здоровых женщин, проживающих в сообществе в Непале, 244 были в пременопаузе со средним возрастом 26±7 лет.5 и остальные 252 были в постменопаузе со средним возрастом 68±11,5 лет. Средний возраст наступления менархе составил 12,90 ± 1,15 года, а средний возраст менопаузы — 47,02 ± 4,44 года в исследуемой популяции. Большинство женщин были из общины браминов (26,2%), за ними следовали невары и манголы (22,4%), а остальные были из других этнических групп. Около 70,9% женщин имели нормальный ИМТ, а 29,1% страдали ожирением, причем частота ожирения была выше в постменопаузальной группе, чем в пременопаузальной (табл. 1).
Таблица 1 Частотное распределение демографических характеристик всего исследуемого населения |
В нашем исследовании мы наблюдали значительное снижение уровня кальция в сыворотке крови и уровня эстрадиола у женщин в постменопаузе по сравнению с женщинами в пременопаузе ( p <0,001). Однако у женщин в постменопаузе наблюдалось значительное повышение уровней фосфора и ЩФ в сыворотке по сравнению с женщинами в пременопаузе ( p <0,001) (таблица 2).
Однако у женщин в постменопаузе наблюдалось значительное повышение уровней фосфора и ЩФ в сыворотке по сравнению с женщинами в пременопаузе ( p <0,001) (таблица 2).
Таблица 2 Среднее сравнение костных маркеров у женщин в пре- и постменопаузе |
Наблюдалось значительное снижение среднего уровня кальция и эстрадиола в сыворотке в постменопаузальной группе (группа II) по сравнению с постменопаузальным ранним периодом (группа I), в то время как уровень ЩФ был значительно повышен у женщин в постменопаузе II группы ( p < 0,05). Среди женщин в постменопаузе уровень эстрадиола был значительно снижен во II группе, чем в I группе ( p <0,01). Фосфор в сыворотке был значительно снижен ( p <0.001) в группе с ожирением по сравнению с группой с нормальной массой тела. Не было ни значительного повышения уровня кальция в сыворотке, ни снижения уровня ЩФ у женщин с ожирением в постменопаузе по сравнению с женщинами в постменопаузе с нормальным ИМТ.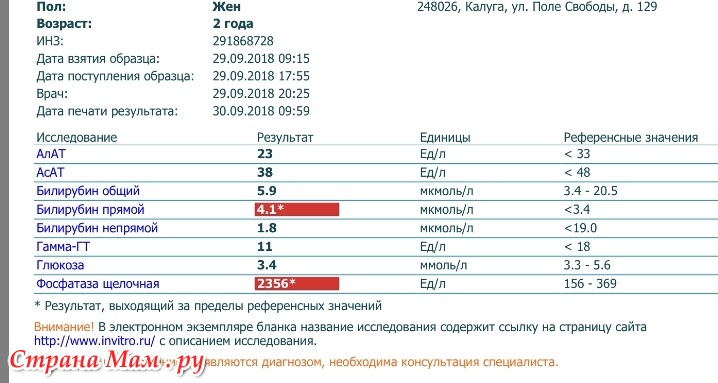 Прежде всего, уровень эстрадиола был значительно выше, а уровень фосфора был значительно ниже ( p <0,001) у женщин с ожирением, чем у женщин с нормальным весом в постменопаузальной группе (таблица 3).
Прежде всего, уровень эстрадиола был значительно выше, а уровень фосфора был значительно ниже ( p <0,001) у женщин с ожирением, чем у женщин с нормальным весом в постменопаузальной группе (таблица 3).
Таблица 3 Взаимосвязь демографических и клинических характеристик с различными костными маркерами у женщин в постменопаузе |
Кроме того, с возрастом наблюдалось снижение уровня кальция в сыворотке крови. Достоверной отрицательной корреляции между возрастом и кальцием среди женщин в пременопаузе не наблюдалось, но наблюдалась значимая отрицательная корреляция между возрастом и кальцием у женщин в постменопаузе ( p = 0,002).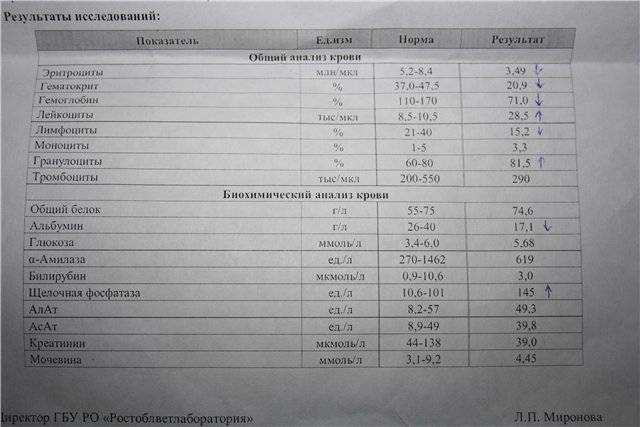 Точно так же возраст не имел отрицательной корреляции с содержанием фосфора в пременопаузальной группе и не имел положительной корреляции в постменопаузальной группе.Среди женщин в пременопаузе между возрастом и ЩФ была недостоверная отрицательная корреляция, а у женщин в постменопаузе возраст положительно коррелировал с ЩФ ( p =0,026) (табл. 4).
Точно так же возраст не имел отрицательной корреляции с содержанием фосфора в пременопаузальной группе и не имел положительной корреляции в постменопаузальной группе.Среди женщин в пременопаузе между возрастом и ЩФ была недостоверная отрицательная корреляция, а у женщин в постменопаузе возраст положительно коррелировал с ЩФ ( p =0,026) (табл. 4).
Таблица 4 Корреляция возраста с костными маркерами у женщин в пре- и постменопаузе |
Регрессионный анализ показал сильную отрицательную корреляцию между уровнями кальция и эстрадиола у женщин в пременопаузе, в то время как их корреляция с женщинами в постменопаузе была положительной (рис. 1). Уровень фосфора достоверно положительно коррелировал с эстрадиолом у женщин в пременопаузе, в то время как в постменопаузальной группе наблюдалась незначительная отрицательная корреляция (рис. 2). Наконец, ЩФ значительно положительно коррелировала с эстрадиолом у женщин в пременопаузе, тогда как у женщин в постменопаузе ЩФ имела отрицательную корреляцию без статистической значимости (рис. 3).Кроме того, была проведена частичная корреляция между уровнем эстрадиола и костными маркерами с поправкой на возраст и ИМТ. В анализе все костные маркеры коррелировали на незначительных уровнях у женщин в постменопаузе, при этом уровни кальция и ЩФ достоверно коррелировали с уровнем эстрадиола в предыдущем нескорректированном анализе. Уровни ЩФ и кальция достоверно коррелировали с уровнями эстрадиола у женщин в пременопаузе при скорректированном анализе, тогда как все костные маркеры достоверно коррелировали при нескорректированном анализе в той же группе (таблица 5).
2). Наконец, ЩФ значительно положительно коррелировала с эстрадиолом у женщин в пременопаузе, тогда как у женщин в постменопаузе ЩФ имела отрицательную корреляцию без статистической значимости (рис. 3).Кроме того, была проведена частичная корреляция между уровнем эстрадиола и костными маркерами с поправкой на возраст и ИМТ. В анализе все костные маркеры коррелировали на незначительных уровнях у женщин в постменопаузе, при этом уровни кальция и ЩФ достоверно коррелировали с уровнем эстрадиола в предыдущем нескорректированном анализе. Уровни ЩФ и кальция достоверно коррелировали с уровнями эстрадиола у женщин в пременопаузе при скорректированном анализе, тогда как все костные маркеры достоверно коррелировали при нескорректированном анализе в той же группе (таблица 5).
Рисунок 1 Корреляция между сывороточным эстрадиолом и сывороточным кальцием у женщин в пре- и постменопаузе. |
Рисунок 2 Корреляция между сывороточным эстрадиолом и сывороточным фосфором у женщин в пре- и постменопаузе. |
Рисунок 3 Корреляция между сывороточным эстрадиолом и сывороточной ЩФ у женщин в пре- и постменопаузе. |
Таблица 5 ИМТ и скорректированная по возрасту частичная корреляция эстрадиола с костными маркерами у женщин в пре- и постменопаузе |
Обсуждение
Фактором риска, наиболее тесно связанным с остеопорозом у женщин в постменопаузе, считался дефицит эстрогена.Кроме того, возрастные факторы также способствуют риску остеопоротических переломов. 12 Остеопороз у женщин в постменопаузе может длительное время оставаться бессимптомным, при этом единственным признаком являются изменения биохимических маркеров костного метаболизма. 13 В Непале женщины составляют более 50% населения, и среди них большая часть населения старше 50 лет. физической активности и столкнулись с плохим питанием в нашей экономически бедной стране.Это говорит о том, что большинство непальских женщин, вероятно, подвержены риску развития заболеваний, связанных с костями, что вызывает озабоченность. Следовательно, это требует непрекращающихся усилий по исследованию качества костей у женщин в постменопаузе.
13 В Непале женщины составляют более 50% населения, и среди них большая часть населения старше 50 лет. физической активности и столкнулись с плохим питанием в нашей экономически бедной стране.Это говорит о том, что большинство непальских женщин, вероятно, подвержены риску развития заболеваний, связанных с костями, что вызывает озабоченность. Следовательно, это требует непрекращающихся усилий по исследованию качества костей у женщин в постменопаузе.
В этом исследовании число женщин с ожирением было выше в постменопаузальной группе по сравнению с пременопаузальными женщинами. Это может быть связано с ухудшением метаболизма липидов в результате снижения эффекта эстрогена у женщин в постменопаузе. 14
Постменопаузальный остеопороз провоцируется снижением влияния эстрогенов на костную ткань, что приводит к резкому ускорению метаболизма костной ткани с дисбалансом в сторону чрезмерной активности остеокластов. 15 Плотность массы тела (МПКТ) и оценка биохимических параметров являются наиболее распространенными и простыми инструментами для оценки активности остеокластов.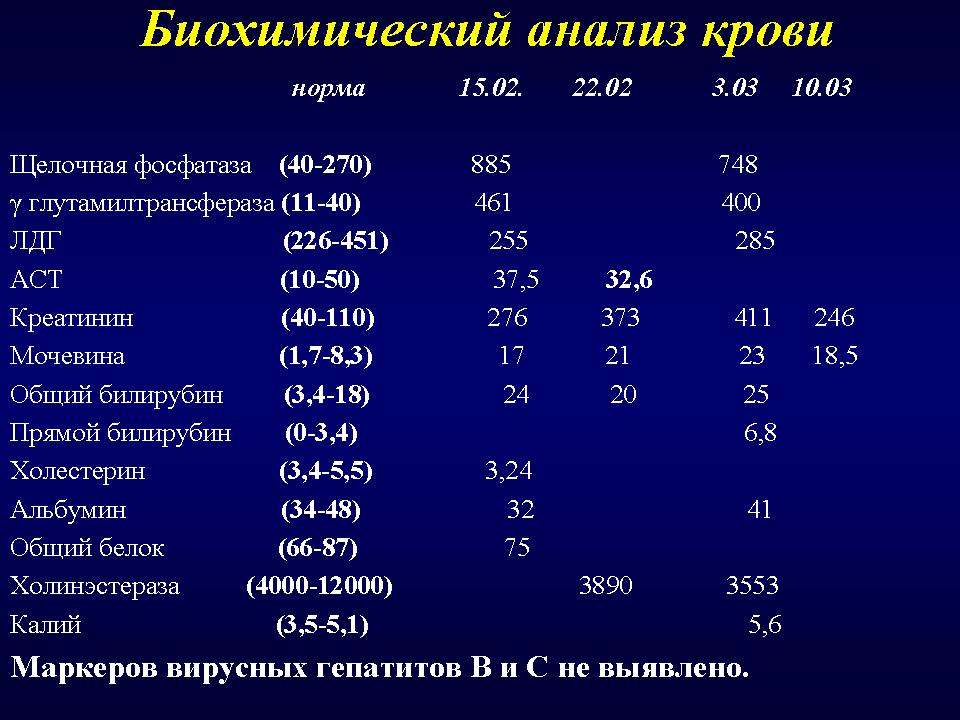 Измерение степени минерализации, размера кристаллов гидроксиапетита, связности трабукул и микроповреждений кости затруднено, 5 или даже невозможно в диагностике и прогнозе остеопороза в нашей стране.Таким образом, мониторинг маркеров биохимического метаболизма костной ткани является основным направлением нашего исследования. Среднее значение сывороточного кальция было значительно снижено ( p <0,05), в то время как уровни фосфора и ЩФ были значительно повышены ( p <0,05) у женщин в постменопаузе по сравнению с женщинами в пременопаузе. Подобные исследования уже были проведены Akshya Lekhi et al 13 из западной части Непала и Bhattarai et al 7 из средней части нашей страны.Их наблюдаемые закономерности для уровней кальция и ЩФ были аналогичны нашему исследованию, и оба сообщили о значительном снижении уровня кальция, но значительном повышении уровня ЩФ в сыворотке у женщин в постменопаузе по сравнению с женщинами в пременопаузе. 13 Хотя результаты были аналогичны результатам нашего исследования, эти исследования в больницах контрастировали с этим исследованием, поскольку наше исследование проводилось по месту жительства и охватывало только здоровое население.
Измерение степени минерализации, размера кристаллов гидроксиапетита, связности трабукул и микроповреждений кости затруднено, 5 или даже невозможно в диагностике и прогнозе остеопороза в нашей стране.Таким образом, мониторинг маркеров биохимического метаболизма костной ткани является основным направлением нашего исследования. Среднее значение сывороточного кальция было значительно снижено ( p <0,05), в то время как уровни фосфора и ЩФ были значительно повышены ( p <0,05) у женщин в постменопаузе по сравнению с женщинами в пременопаузе. Подобные исследования уже были проведены Akshya Lekhi et al 13 из западной части Непала и Bhattarai et al 7 из средней части нашей страны.Их наблюдаемые закономерности для уровней кальция и ЩФ были аналогичны нашему исследованию, и оба сообщили о значительном снижении уровня кальция, но значительном повышении уровня ЩФ в сыворотке у женщин в постменопаузе по сравнению с женщинами в пременопаузе. 13 Хотя результаты были аналогичны результатам нашего исследования, эти исследования в больницах контрастировали с этим исследованием, поскольку наше исследование проводилось по месту жительства и охватывало только здоровое население. Это может помочь исключить смешанные факторы, связанные с ремоделированием костной ткани.Как и в этом исследовании, практически одинаковая тенденция биохимических изменений маркеров костного метаболизма была отмечена в разных частях земного шара. 2,4,5,16 В отличие от этих результатов, в некоторых исследованиях также не было выявлено значительных изменений уровня фосфора и ЩФ в сыворотке у женщин в пре- и постменопаузе. Onyeukwu et al. 17 продемонстрировали значительное снижение уровня кальция в сыворотке у женщин в постменопаузе по сравнению с женщинами в пременопаузе, но не было существенной разницы в уровнях сывороточного фосфора и ЩФ среди этих групп.Это может быть связано со снижением уровня эстрогена, который вызывает резорбцию костей у женщин в постменопаузе, препятствуя абсорбции и утилизации кальция в костях, вызывая риск остеопороза. 18 В целом сообщалось, что женщины теряют около 1% плотности костной ткани в год во время и после менопаузы.
Это может помочь исключить смешанные факторы, связанные с ремоделированием костной ткани.Как и в этом исследовании, практически одинаковая тенденция биохимических изменений маркеров костного метаболизма была отмечена в разных частях земного шара. 2,4,5,16 В отличие от этих результатов, в некоторых исследованиях также не было выявлено значительных изменений уровня фосфора и ЩФ в сыворотке у женщин в пре- и постменопаузе. Onyeukwu et al. 17 продемонстрировали значительное снижение уровня кальция в сыворотке у женщин в постменопаузе по сравнению с женщинами в пременопаузе, но не было существенной разницы в уровнях сывороточного фосфора и ЩФ среди этих групп.Это может быть связано со снижением уровня эстрогена, который вызывает резорбцию костей у женщин в постменопаузе, препятствуя абсорбции и утилизации кальция в костях, вызывая риск остеопороза. 18 В целом сообщалось, что женщины теряют около 1% плотности костной ткани в год во время и после менопаузы. 19
19
Гормональное влияние на снижение МПКТ четко проиллюстрировано благодаря быстрой резорбции кости после последней менструации. Потеря костной массы достигает пика через 3–4 года после наступления менопаузы, затем постепенно снижается в течение нескольких лет, и, наконец, потеря костной массы в год остается на уровне от 1% до 1.5%. 5 Система Stages of Reproductive Aging Workshop +10 используется для оценки репродуктивного старения в период постменопаузы независимо от возраста, демографических характеристик, ИМТ и образа жизни. Harlow et al. 20 определяют период менопаузы в 5-6 лет как раннюю менопаузу и более 5 лет менопаузы как постменопаузу. Настоящее исследование показало, что уровень кальция в сыворотке был значительно снижен, а уровни ЩФ были значительно выше у женщин в период ранней постменопаузы по сравнению с поздним периодом постменопаузы (между группой I и группой II).Подобный результат был также получен в исследовании, проведенном Indumati et al.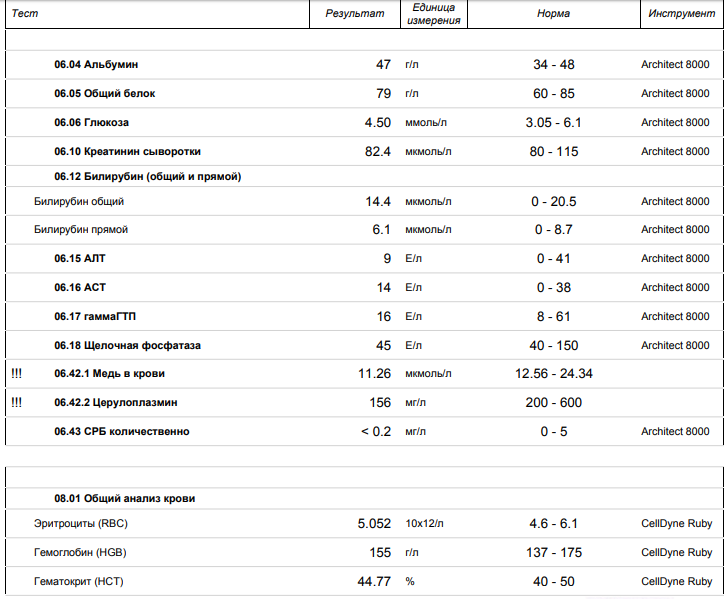 , 1 , которое показывает, что костная масса продолжает снижаться с возрастом, но более медленными темпами в поздней постменопаузе, чем в ранней постменопаузе. 21 Это может быть результатом ингибирующего действия эстрогена на скорость обновления костной ткани, которая зависит от возраста и ИМТ. 16 Также наблюдалось значительное снижение уровня эстрадиола в сыворотке в группе поздней постменопаузы по сравнению с группой ранней постменопаузы.Менопаузальный переход связан со значительными гормональными изменениями, наиболее важным из которых является снижение уровня эстрадиола примерно на 60%. Напротив, некоторые исследователи сообщают об отсутствии значительных изменений уровней кальция, фосфора и ЩФ между ранним и поздним периодами постменопаузы. 17 Результат такого типа может быть вызван разницей в исследуемой популяции и географическими различиями.
, 1 , которое показывает, что костная масса продолжает снижаться с возрастом, но более медленными темпами в поздней постменопаузе, чем в ранней постменопаузе. 21 Это может быть результатом ингибирующего действия эстрогена на скорость обновления костной ткани, которая зависит от возраста и ИМТ. 16 Также наблюдалось значительное снижение уровня эстрадиола в сыворотке в группе поздней постменопаузы по сравнению с группой ранней постменопаузы.Менопаузальный переход связан со значительными гормональными изменениями, наиболее важным из которых является снижение уровня эстрадиола примерно на 60%. Напротив, некоторые исследователи сообщают об отсутствии значительных изменений уровней кальция, фосфора и ЩФ между ранним и поздним периодами постменопаузы. 17 Результат такого типа может быть вызван разницей в исследуемой популяции и географическими различиями.
Подобно результатам нашего исследования, различные другие исследования показали значительное снижение ( p <0. 05) уровня эстрадиола в сыворотке крови в постменопаузальной группе по сравнению с пременопаузальной группой. 22 После менопаузы яичники перестают вырабатывать значительное количество эстрадиола; поэтому симптомы и заболевания, связанные с дефицитом эстрадиола, имеют большее значение для здоровья женщины. 22 В целом уровень эстрадиола снижается от 7 до 10 раз между пре- и постменопаузой. 14 Ashuma et al 23 сообщили, что старение и менопауза приводят к снижению выработки эстрадиола и прогестерона, что приводит к снижению уровня кальция у женщин в постменопаузе.
05) уровня эстрадиола в сыворотке крови в постменопаузальной группе по сравнению с пременопаузальной группой. 22 После менопаузы яичники перестают вырабатывать значительное количество эстрадиола; поэтому симптомы и заболевания, связанные с дефицитом эстрадиола, имеют большее значение для здоровья женщины. 22 В целом уровень эстрадиола снижается от 7 до 10 раз между пре- и постменопаузой. 14 Ashuma et al 23 сообщили, что старение и менопауза приводят к снижению выработки эстрадиола и прогестерона, что приводит к снижению уровня кальция у женщин в постменопаузе.
После корректировки факторов риска, связанных с потерей костной массы, включая корректировку на ревматоидный артрит, употребление алкоголя и табака и терапию глюкокортикоидами, уровень эстрадиола значительно положительно коррелировал с уровнем кальция в сыворотке (потеря костной массы) у женщин в постменопаузе ( p <0,05). Но после корректировки ИМТ и возраста снижение потери костной массы (сывороточный кальций) не коррелировало на значимом уровне. Это объясняет, что с возрастом и после менопаузы происходит быстрое снижение уровня кальция наряду с уровнем эстрадиола.Недавние подходы различных исследований объясняют мощную роль эстрогена в регуляции кальция и фосфора. Этот эстроген-зависимый механизм регуляции кальция предполагает важный механизм патогенеза как постменопаузального, так и возрастного остеопороза. 24 Одно исследование сравнило равную роль эстрогена в регуляции кальция и фосфора в почках с хорошо известным эффектом паратгормона у пожилых женщин. 25 После менопаузы происходит снижение выработки эстрогена яичниками.Это напрямую влияет на состояние костей в этой группе населения. Таким образом, добавки кальция могут уменьшить потерю костной массы у женщин в постменопаузе, которые хорошо характеризуются дефицитом эстрогена и несбалансированным механизмом взаимодействия кальция. 25
Это объясняет, что с возрастом и после менопаузы происходит быстрое снижение уровня кальция наряду с уровнем эстрадиола.Недавние подходы различных исследований объясняют мощную роль эстрогена в регуляции кальция и фосфора. Этот эстроген-зависимый механизм регуляции кальция предполагает важный механизм патогенеза как постменопаузального, так и возрастного остеопороза. 24 Одно исследование сравнило равную роль эстрогена в регуляции кальция и фосфора в почках с хорошо известным эффектом паратгормона у пожилых женщин. 25 После менопаузы происходит снижение выработки эстрогена яичниками.Это напрямую влияет на состояние костей в этой группе населения. Таким образом, добавки кальция могут уменьшить потерю костной массы у женщин в постменопаузе, которые хорошо характеризуются дефицитом эстрогена и несбалансированным механизмом взаимодействия кальция. 25
Наблюдалась положительная значимая корреляция ЩФ с эстрадиолом у женщин в пременопаузе, в то время как отрицательная корреляция наблюдалась у женщин в постменопаузе в исследовании, и после поправки на возраст и ИМТ не было обнаружено сильной связи ЩФ с эстрадиолом после менопаузы. Хотя ЩФ является хорошо зарекомендовавшим себя маркером заболеваний костей, к сожалению, она специфична не только для костей. Измерение костно-специфического ЩФ (БАТ) полезно для того, чтобы дифференцировать заболевание печени от остеопоротической активности. 26
Хотя ЩФ является хорошо зарекомендовавшим себя маркером заболеваний костей, к сожалению, она специфична не только для костей. Измерение костно-специфического ЩФ (БАТ) полезно для того, чтобы дифференцировать заболевание печени от остеопоротической активности. 26
Костная масса уменьшается с возрастом, и в настоящее время хорошо известно, что низкая костная масса является основной детерминантой всех остеопоротических переломов. 27 Распространенность остеопороза увеличивается с возрастом для всех локализаций, и, согласно определению Всемирной организации здравоохранения, до 70% женщин старше 80 лет страдают остеопорозом. 1 В нашем исследовании обмен костной ткани был положительно связан с возрастом как в пре-, так и в постменопаузальных группах. Что касается биохимических маркеров обмена костной ткани, кальций значительно отрицательно коррелировал, в то время как ЩФ значительно положительно коррелировал с возрастом у женщин в постменопаузе. ( p <0,005) Это показание четко демонстрирует прогрессирующую потерю костной массы с увеличением возраста. Возрастные факторы потери костной массы у женщин в постменопаузе могут быть связаны с неадекватным уровнем витамина D и прогрессирующим увеличением паратиреоидного гормона с возрастом. 12,28 Недостаточный уровень витамина D является наиболее частой причиной остеопороза у женщин, а прогрессирующий дефицит этого гормона может привести к вторичному гиперпаратиреозу. 28 Haugen et al 29 также сообщили о высокой распространенности недостаточности (59,8%) и дефицита витамина D (14,0%) у молодых женщин из нашей страны. Следовательно, оценка дефицита/недостаточности витамина D становится обязательной перед отчетом о состоянии костей у молодых женщин, а также у женщин в постменопаузе.
Возрастные факторы потери костной массы у женщин в постменопаузе могут быть связаны с неадекватным уровнем витамина D и прогрессирующим увеличением паратиреоидного гормона с возрастом. 12,28 Недостаточный уровень витамина D является наиболее частой причиной остеопороза у женщин, а прогрессирующий дефицит этого гормона может привести к вторичному гиперпаратиреозу. 28 Haugen et al 29 также сообщили о высокой распространенности недостаточности (59,8%) и дефицита витамина D (14,0%) у молодых женщин из нашей страны. Следовательно, оценка дефицита/недостаточности витамина D становится обязательной перед отчетом о состоянии костей у молодых женщин, а также у женщин в постменопаузе.
Это иллюстрирует высокий риск переломов у женщин в постменопаузе, поскольку с возрастом увеличивается потеря костной массы и чаще встречается у женщин в результате гормональных изменений. Наш подход к исследованию показал, что возраст является более важным фактором, чем уровень эстрадиола, для увеличения обмена костей у женщин в постменопаузе. Оценка статуса витамина D и его связи с повышенным метаболизмом костной ткани является темой для дальнейшего изучения в нашей популяции. Однако это исследование, ориентированное на одно сообщество, было ограничено оценкой всех дополнительных потенциальных этиологий остеопороза у женщин в постменопаузе.
Оценка статуса витамина D и его связи с повышенным метаболизмом костной ткани является темой для дальнейшего изучения в нашей популяции. Однако это исследование, ориентированное на одно сообщество, было ограничено оценкой всех дополнительных потенциальных этиологий остеопороза у женщин в постменопаузе.
Заключение
Это исследование показало, что оценка гормональных и биохимических маркеров, которую легко выполнить и которая удобна для повторной оценки, полезна для наблюдения за ремоделированием костной ткани у женщин в постменопаузе. Эти типы исследований на уровне местных сообществ должны проводиться в большем масштабе на национальном уровне для определения политики и заявлений в области развития, которые помогут в диагностике, лечении и прогнозировании остеопороза у женщин в постменопаузе. Своевременная диагностика остеопороза у женщин будет иметь большое значение для эффективного лечения необходимого населения и поможет свести к минимуму уровень смертности и финансовое бремя в Непале. Дополнительные баллы
Дополнительные баллы
Наличие данных и материалов
Все данные, полученные в ходе этого исследования, представлены в этой статье. Первичные необработанные данные будут предоставлены заинтересованным исследователям соответствующим автором этой статьи по запросу.
Благодарности
Мы благодарим всех участников, руководителей и сотрудников лабораторий MMTHS и MMIHS за то, что это исследование стало возможным.
Авторские вклады
BDP и SP разработали дизайн исследования, проанализировали литературу, выполнили необходимые вмешательства, включая лабораторные исследования, и проанализировали данные.SP, SG, AB, SS и PRK участвовали в сборе данных сообщества, лабораторных процедурах и анализе данных. BDP и SBM подготовили рукопись. Все авторы внесли свой вклад в анализ данных, составление проекта и критический пересмотр документа и соглашаются нести ответственность за все аспекты работы. Все авторы прочитали окончательную версию рукописи и одобрили ее для представления.
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Ссылки
1. | Индумати В., Патил В.С., Джаилхани Р. Предварительное исследование остеопороза у женщин в постменопаузе на основе больницы. Indian J Clin Biochem . 2007;22(2):96–100. | |
2. | Гарнеро П., Делмас П.Д. 4 маркера костей. Baillère’s Clin Rheumatol . 1997;11(3):517–537. | |
3. | Lanham-New SA. Значение кальция, витамина D и витамина К для профилактики и лечения остеопороза. Proc Nutr Soc . 2008;67(2):163–176. | |
4. | Созен Т., Озисик Л., Басаран Н.С. Обзор и лечение остеопороза. Eur J Ревматол . 2017;4(1):46–56. | |
5. | Общество ДН. | |
6. | Дин Дж. Экспрессия генов, специфичных для ооцитов: роль в фолликулогенезе, оплодотворении и раннем развитии. Кембридж, Великобритания: Издательство Кембриджского университета; 2003. | |
7. | Бхаттараи Т., Бхаттачарья К., Чаудхури П., Сенгупта П. Корреляция общих биохимических маркеров обмена костей, сывороточного кальция и щелочной фосфатазы у женщин в постменопаузе. Малайский J Med Sci .2014;21(1):58. | |
8. | Коксам В. Фитоэстрогены и здоровье костей. Proc Nutr Soc . 2008;67(2):184–195. | |
9. | Росс и Уилсон А.В., Грант А. Скелетно-мышечная система . 10-е изд. Эльзевир Лимитед; 2006: 384–387. | |
10. | Thulkar J, Singh S, Sharma S, Thulkar T. Предотвратимые факторы риска остеопороза у женщин в постменопаузе: систематический обзор и метаанализ. J Здоровье среднего возраста . 2016;7(3):108. | |
11. | Пардхе Б.Д., Гимире С., Шакья Дж. и др. Повышенные сердечно-сосудистые риски среди женщин в постменопаузе: исследование случай-контроль на базе сообщества из Непала. Биохим Рез Инт . 2017;2017:3824903. | |
12. | Хосла С., Аткинсон Э.Дж., Мелтон Л.Дж. 3-й, Риггс Б.Л. Влияние возраста и статуса эстрогена на уровни паратиреоидного гормона в сыворотке крови и биохимические маркеры обмена костной ткани у женщин: популяционное исследование 1. J Clin Endocrinol Metab . 1997;82(5):1522–1527. | |
13. | Лехи А., Лехи М., Сатьян Б., Миттал А. Роль биохимических маркеров в раннем выявлении остеопороза у женщин: сравнительное исследование в западном регионе Непала. J Clin Diagnos Res . 2012;6(2):274–277. | |
14. | Акахоши М., Сода М., Накашима Э. и др. Влияние индекса массы тела на возраст наступления менопаузы. Int J Ожирение . 2002;26(7):961. | |
15. | Кларк Б. Нормальная анатомия и физиология костей. Clin J Am Soc Нефрол . 2008;3(3):04151206. | |
16. | Deepthi S, Narayan G, Naidu J. Исследование биохимических маркеров метаболизма костной ткани у женщин в постменопаузе, ведущих к остеопорозу. Int J Appl Biol Pharm Technol . 2012;3(3):301–305. | |
17. | Onyeukwu CU, Nsonwu AC. Биохимические маркеры метаболизма костной ткани у женщин в постменопаузе в муниципалитете Калабар. Азиатский J Biochem . 2007;2(1):130–135. | |
18. | Риггс БЛ. Возрастной остеопороз. Nutr Старение . 2012:207. | |
19. | Кумари С.Н., Росарио С.Б., Гауда К.Д. Измененная функция печени и статус кальция у женщин в постменопаузе в Мангалоре и его окрестностях. Al Ameen J Med Sci . 2010;3:115–119. | |
20. | Harlow SD, Gass M, Hall JE, et al. Резюме семинара по стадиям репродуктивного старения +10: рассмотрение незавершенной повестки дня по стадированию репродуктивного старения. J Clin Endocrinol Metab . 2012;97(4):1159–1168. | |
21. | Brandão CM, Lima MG, Silva AL, Silva GD, Guerra AA Jr, Acúrcio Fde A.Лечение постменопаузального остеопороза у женщин: систематический обзор. Cad Saúde Pública . 2008; 24 (Приложение 4): s592–s606. | |
22. | Килим СР, Чандала СР. Сравнительное исследование липидного профиля и эстрадиола у женщин в пре- и постменопаузе. J Clin Diagnos Res . 2013;7(8):1596. | |
23. | Ашума С., Шаши С., Сачдева С. Биохимические маркеры метаболизма костной ткани: диагностические и терапевтические принципы. Остеопороз . 2005; 332:305–311. | |
24. | Принц Р., Дик И. Влияние эстрогенов на мембранный транспорт кальция: новый взгляд на взаимосвязь между дефицитом эстрогена и возрастным остеопорозом. Остеопороз Int . 1997;7(3):150–154. | |
25. | Дик И.М., Дивайн А., Бейлби Дж., Принц Р.Л. Влияние эндогенного эстрогена на почечный обмен кальция и фосфата у пожилых женщин. Am J Physiol Endocrinol Metab . 2005; 288(2):E430–E435. | |
26. | Велосипед ДД. Биохимические маркеры в оценке заболеваний костей. Am J Med . 1997;103(5):427–436. | |
27. | Саджанар Д.С., Саджанар С.Л. Изучение сывороточной щелочной фосфатазы, кальция и мочевого гидроксипролина в качестве костных биомаркеров у женщин в постменопаузе. Int J Basic Appl Med Sci .2014;4(1):223–229. Доступно по адресу: http://www.cibtech.org/jms.htm . | |
28. | Липс П., Хоскинг Д., Липпунер К. и др. Распространенность недостаточности витамина D среди женщин с остеопорозом: международное эпидемиологическое исследование. Дж Интерн Мед . 2006;260(3):245–254. | |
29. | Haugen J, Ulak M, Chandyo RK, et al. Низкая распространенность недостаточности витамина D среди непальских младенцев, несмотря на высокую распространенность недостаточности витамина D среди их матерей. Питательные вещества . 2016;8(12):825. |
Повышение уровня щелочной фосфатазы (ЩФ) в сыворотке крови у женщин в постменопаузе связано с повышенным метаболизмом костной ткани.
Aging Clin Exp Res DOI 10.1007/s40520-014-0296-xОРИГИНАЛЬНАЯ СТАТЬЯ
Повышение уровня щелочной фосфатазы в сыворотке крови у женщин в постменопаузе вызвано повышенным костным метаболизмом Кейджиро Мукаяма • Микио Камимура Шигехару Утияма • Юта Икегамура • • Hiroyuki Kato
•
Получено: 15 октября 2014 г. / Принято: 17 ноября 2014 г. Ó Springer International Publishing Switzerland 2014
Резюме Предыстория Большинство изоферментов щелочной фосфатазы (ЩФ) получают из костей и печени.Высокие уровни ЩФ часто встречаются при рутинном исследовании крови у пожилых пациентов. Однако, поскольку ЩФ включает различные изоферменты из других тканей, точный диагноз обычно невозможен только на основании повышения ЩФ. Цели. Выявить причину повышения ЩФ у женщин в постменопаузе. Методы. Мы измерили ЩФ в сыворотке в группе из 626 женщин с остеопорозом в постменопаузе до и после лечения бисфосфонатом (алендронатом или ризедронатом). Мы проанализировали корреляции между уровнями ЩФ и маркерами метаболизма костей или маркерами функции печени.Результаты Уровни ALP и BAP у людей в возрасте 80 лет были значительно выше, чем у людей в возрасте 60 лет. На фоне терапии бисфосфонатами БАТ снижался, а повышенный ЩФ снижался до нормального уровня. ЩФ высоко и значимо коррелировала с БАТ как до, так и после лечения. Изменения уровня ЩФ хорошо коррелировали с изменениями уровня БАТ до и после терапии бисфосфонатами. Маркеры функции печени
K. Mukaiyama (&) S. Uchiyama S. Ikegami Y.Накамура Х. Като Кафедра ортопедической хирургии, Медицинский факультет Университета Синсю, 3-1-1 Асахи, город Мацумото, Нагано 390-8621, Япония Электронная почта: [email protected] Клиника М. Камимура Камимура, 595-17 Котобукитоёка, Город Мацумото, Нагано 399-0021, Япония
коррелировал с общей ЩФ (p < 0,01), но корреляция была намного меньше, чем между ЩФ и БАТ. Обсуждение Лечение бисфосфонатами снижало уровни ЩФ, и это снижение сильно коррелировало со снижением БАТ.Среди данных анализов крови снижение БАТ имело наибольшую корреляцию со снижением ЩФ. Заключение Для лечения остеопороза ЩФ является приемлемой альтернативой БАТ. Повышение ЩФ у женщин в постменопаузе в основном связано с высоким метаболизмом костной ткани. Ключевые слова Щелочная фосфатаза Женщины в менопаузе Остеопороз Костный обмен
Введение Общая щелочная фосфатаза (ЩФ) является одним из наиболее часто и рутинно изучаемых биомаркеров в клинических лабораторных исследованиях. ЩФ часто считают печеночным маркером, но сыворотка человека содержит смесь изоферментов ЩФ из костей, печени и кишечника.Общая концентрация ALP представляет собой сумму различных эффектов этих изоферментов. Большинство изоферментов ALP происходят из костей и печени, и на каждый из них приходится почти 50 % общего эффекта всех изоферментов в каждом органе. Когда ЩФ в сыворотке превышает нормальные пределы при отсутствии явных заболеваний печени или костей, точный диагноз на основании самого повышения ЩФ невозможен из-за его низкой специфичности. Исследования показали, что концентрация ЩФ увеличивается в детстве [1–3].В некоторых исследованиях сообщается, что активность ЩФ из кишечника и печени происходит независимо от возраста, а изменения общей ЩФ с возрастом в основном обусловлены костными изоферментами [4-6]. В исследованиях также сообщалось об изменении уровня ЩФ в среднем возрасте
123
Aging Clin Exp Res
[7, 8]. Постменопаузальное повышение ЩФ редко встречается [9], но повышение ЩФ было зарегистрировано у пациенток с остеомаляцией. Хотя общая ЩФ не является специфическим костным маркером, уровень ЩФ повышается у пациентов с заболеваниями костей, такими как болезнь Педжета или остеомаляция.Уровни костно-специфической ЩФ (BSAP), определяемые с помощью иммуноанализа, могут предоставить клиницистам более селективные данные о формировании кости, чем данные, полученные при измерении общей активности ферментов. Точная функция BSAP остается неизвестной, но считается, что этот фермент участвует в формировании или минерализации костей и может использоваться в качестве показателя скорости общего костного метаболизма. Однако измерение BSAP является дорогостоящей процедурой и не часто используется в качестве диагностического измерения. При высокой концентрации ЩФ необходимо дифференцировать причину от заболеваний печени, остеомаляции, вторичного остеопороза или опухоли кости [10, 11].Вторичный остеопороз обычно подозревают, если уровень ЩФ ненормальный. Высокие уровни ЩФ часто встречаются у пожилых пациентов, хотя во многих случаях функция печени (по оценке АСТ, АЛТ или ц-ГТФ) находится в пределах нормы. Поскольку ЩФ включает различные изоферменты из других тканей, точный диагноз не может быть поставлен только на основании высокого уровня ЩФ. Однако нет сообщений об изменении уровня ЩФ у пожилых женщин с остеопорозом. Наши гипотезы заключаются в следующем: (1) увеличение ЩФ в сыворотке у пожилых женщин с остеопорозом связано со старением и вызвано повышенным метаболизмом костной ткани, связанным с остеопорозом.(2) Повышенный ALP снижается до нормальных пределов одновременно со снижением BSAP во время подавления ремоделирования кости терапией бисфосфонатами. (3) У пожилых женщин вместо BSAP в качестве маркера формирования кости можно использовать ЩФ. В этом исследовании женщин в постменопаузе с остеопорозом лечили бисфосфонатами. ЩФ и другие маркеры метаболизма кости измерялись и коррелировали с возрастом или метаболизмом кости. Дизайн исследования Это было ретроспективное исследование. Все субъекты дали информированное согласие и прошли измерения нескольких переменных, связанных с костным метаболизмом, до начала лечения остеопороза.Протокол данного исследования был одобрен локальным этическим комитетом нашего института.
Материалы и методы Группу исследования составили 626 женщин с остеопорозом в постменопаузе в возрасте от 50 до 94 лет, которые
123
обратились в наше лечебное учреждение в период с апреля 2005 г. по август 2009 г. с основными жалобами на люмбаго или артралгию. Мы провели исследование плотности костной ткани с помощью веерного костного денситометра DXA (Lunar Prodigy; GE Healthcare, Waukesha, WI, USA), когда диагноз не мог быть поставлен с помощью рентгенографии.Ни один из испытуемых не проходил обследование или лечение остеопороза до их визита. Субъекты, которые принимали лекарства от остеопороза, такие как бисфосфонат, селективные модуляторы рецепторов эстрогена, витамин D или кальций, были исключены из этого исследования. Остеопороз диагностировали в соответствии с последними японскими рекомендациями по профилактике и лечению остеопороза, пересмотренными в 2006 г. [12]. Диагностическими критериями первичного остеопороза в японских рекомендациях являются низкая МПКТ (<70 % от среднего значения у молодых людей) или наличие в анамнезе маломощных переломов.Нормальные значения BSAP для женщин в пременопаузе без остеопороза составляют 7,9–29,0 ЕД/л [9], а нормальные значения ЩФ для здоровых взрослых составляют 124–367 ЕД/л [13, 14]. Все пациенты были разделены на две группы: группа hy-ALP с повышенной ЩФ (>368 Ед/л) и группа n-ALP с ЩФ в пределах нормы. Переменные измерения Маркеры костного метаболизма, маркеры функции печени и МПК оценивались для каждого пациента. BSAP и ALP в сыворотке измеряли с помощью твердофазного иммуноферментного анализа (ELISA) (MicroVue BSAP; Quidel Corporation, Сан-Диего, Калифорния, США).N-концевой сшитый телопептид коллагена I типа (uNTX) в моче измеряли как маркер резорбции костей (Osteomark; Inverness Medical Innovations, Inc., Уолтем, Массачусетс, США). В качестве маркеров функции печени измеряли сывороточную аланинаминотрансферазу (АЛТ), аспартатаминотрансферазу (АСТ) и с-глутамилтранспептидазу (ц-ГТФ). Для исключения остеомаляции у пожилых пациентов также измеряли сывороточные уровни фосфора (iP) и кальция (Ca). Иммуноанализы были выполнены SRL Inc. (Токио, Япония).Все пациенты получали бисфосфонаты в среднем в течение 4,0 месяцев (диапазон 3–6 месяцев), после чего повторно измеряли ЩФ, САД и другие параметры. Статистические методы Был проведен простой регрессионный анализ между количеством ALP и BSAP и между изменениями ALP (DALP) и BSAP (DBSAP) после лечения. Изменение каждого маркера после лечения определяли с помощью t-критерия Уилкоксона. Корреляции между ALP и BSAP, DALP и DBSAP определяли с использованием корреляционных тестов Спирмена
Aging Clin Exp Res
.Был проведен множественный линейный регрессионный анализ, чтобы выявить фактор, наиболее влияющий на скорость изменения ALP до и после лечения (%DALP). Кроме того, отбор переменных проводился по информационному критерию Акаике.
Результаты Средний возраст был значительно выше в группе hy-ALP (73,6 ± 9,55 года), чем в группе n-ALP (68,7 ± 8,78 года). Хотя AST, Ca и iP были в пределах нормы для обеих групп, они были несколько выше в группе hy-ALP. АЛТ существенно не отличалась между двумя группами.Уровни BSAP и uNTX были значительно выше в группе hy-ALP (51,7 ± 21,0 и 74,7 ± 37,8 соответственно), чем в группе n-ALP (28,9 ± 8,24 и 52,3 ± 22,0 соответственно) (таблица 1). Концентрация ЩФ, как правило, выше у пожилых пациентов, при этом отмечается значительная разница между пациентами в возрасте 60 и 80 лет. BSAP также увеличивается с возрастом. Как общий ALP, так и BSAP значительно различались у пациентов в возрасте 60 и 80 лет (p < 0,01). Маркеры функции печени (АСТ и ц-ГТФ) существенно не отличались между этими возрастными группами.Фактически, АЛТ значительно снижалась с возрастом (таблица 2). Концентрация ЩФ у 84 (13,7 %) пациентов была выше нормы (>368 МЕ/л). После лечения бисфосфонатами количество пациентов с повышенным уровнем ЩФ уменьшилось с 84 (14,2 %) до 19 (3,1 %). В группе hy-ALP как ALP, так и BSAP значительно снизились по сравнению с исходными показателями в среднем через 3 месяца после терапии бисфосфонатами (p < 0,01) (ALP:
до лечения, 457,3 ± 137,9 МЕ/л; после лечения, 313,0 ± 71,5). МЕ/л; BSAP: до лечения, 51.7 ± 21,1 МЕ/л; после лечения 31,1 ± 10,2 МЕ/л). Отношение BSAP к общей ALP (BSAP/ALP) также значительно снизилось (до лечения 0,113 ± 0,003; после лечения 0,103 ± 0,002; p < 0,01). Средний уровень BSAP также был повышен (52,9 ± 2,1) до лечения и, хотя и снижался после лечения, оставался значительно повышенным (33,5 ± 1,8 МЕ/л; p < 0,01) (рис. 1). ALP сильно и достоверно коррелировал с BSAP как до, так и после лечения. Однако коэффициент вклада после лечения был ниже, чем до лечения (рис.2). До лечения маркеры функции печени (такие как АСТ, АЛТ и ц-ГТФ) коррелировали с общей ЩФ (p < 0,01), но коэффициент корреляции (АСТ 0,09; АЛТ 0,10; ц-ГТФ 0,20) был небольшим. . После лечения коэффициент корреляции несколько увеличился (АСТ 0,14; АЛТ 0,12; ц-ГТФ 0,24), но все еще оставался достаточно низким. Напротив, АСТ и АЛТ не коррелировали с BSAP до или после лечения. Только c-GTP коррелировал с ALP и BSAP как до, так и после лечения. Корреляции между ALP, BSAP и Ca не наблюдалось.До лечения ALP, BSAP и iP имели отрицательную, но значительную корреляцию. Корреляция ALP и iP не была значимой после лечения. Параметрами, наиболее значимо коррелировавшими с ЩФ, были маркеры метаболизма костной ткани, такие как BSAP и uNTX (таблицы 3, 4). BSAP также значительно коррелировал (r = 0,50, p < 0,01) с uNTX, как и ALP. Был проведен множественный линейный регрессионный анализ, чтобы выявить наиболее влияющий фактор на скорость изменения ALP до и после лечения (%DALP), а выбор переменных был выполнен с использованием информационного критерия Акаике.На скорость изменения ЩФ до и после лечения (%DALP) больше всего влиял %DBSAP. %DcGTP влиял на скорость %DALP, но коэффициент частичной регрессии был небольшим (таблица 5).
Таблица 1 Фоновые характеристики предметов Всего
HY-ALP
N-ALP
P 0
N
626
89 20026
89
537
Возраст
694 ± 9,05
73,6 ± 9.55
68,7 ± 8,78
<0,01**
ИМТ БАТ
21.9-3,04 32,1 ± 13,5
22,3 ± 3,43 51,7-21,3 ± 3,43 51,7 ± 21,0
21,9 ± 2,97 2002 21,9 ± 2,
28.9 ± 8.240.514 \ 0,01 **
0,514 \ 0,01 **
NTX
55,4 ± 26,00
74,7 ± 37,8
74,7 ± 37,8
52,3 ± 22,0
\ 0,01 **
AST
23.9 ± 10.4
26,8 ± 11,70003
26,8 ± 11,7
23,4 ± 10,1
0,03 *
ALT
20,1 ± 12,9
20,1 ± 12,9
23,7-18,3
19,5 ± 11,7
0,07
C- ГТП
24,9 ± 22,1
36.9 ± 40,1
23.0,1
23.0 ± 16.7
0,0006 **
0,0006 **
Ca
9.4 ± 0,34
9,3 ± 0,34
9.4 ± 0,34
9,4 ± 0,34
0,0053 **
0,0053 **
IP
3,3 ± 0,44
3,2 ± 0,49
3,4 ± 0,43
0,0019**
Hy-ALP гипер-ALP группа концентрата, n-ALP нормальная группа концентрации ALP среднее ± SD * p < 0,05; ** p < 0,01
Обсуждение В целом ЩФ увеличивается, а иФ снижается при дефиците витамина D. До лечения ALP, BSAP и iP имели небольшую, но значимую отрицательную корреляцию.Однако после лечения корреляция между ALP и iP не была значимой. Это говорит о том, что после лечения бисфосфонатами уровень ЩФ менее подвержен влиянию метаболизма костной ткани. Напротив, коэффициент корреляции между ALP и BSAP после лечения был ниже, чем до лечения. Кроме того, коэффициент корреляции между ЩФ и печеночными маркерами, такими как АЛТ, АСТ и ц-ГТФ, несколько увеличился после лечения бисфосфонатами. Это говорит о том, что влияние печени на ЩФ относительно увеличивается после лечения бисфосфонатами.Однако
123
Aging Clin Exp Res Таблица 2 ЩФ и БАТ в сыворотке у пациентов до лечения
* p < 0,05; ** p \ 0,01
Возрастная группа (лет)
-59 (n = 75)
60–69 (n = 236)
70–79 (n = 212)
80? (n = 88)
Всего
320,0 ± 15.4 **
320,0 ± 15.4 **
287,5 ± 4,503
287,5 ± 4,5 ±
280,5 ± 15,6
270,9-9 ± 4,5 **
270,9 ± 4,5 **
290,3 ± 8.1
BAP
33,0 ± 2.8
30,2 ± 0,6
30,2 ± 0,6
32,2 ± 1,0
32,2 ± 1,0
37,6 ± 2,5
АСТ
23,5 ± 11,2
23,5 ± 11,2
23.9 ± 12.3 **
23.9 ± 12,3 **
23,5 ± 7,6
23,6 ± 9.3 **
alt
23.2 ± 17,8 **
21,1 ± 14,8 *
21,1 ± 14,8 *
19,2 ± 9.9
16.2 ± 7.6 **, *
C-GTP
31,9-8-80,3
24,4 ± 19,6
24,3 ± 20.4
24,8 ± 24.7.
600
80 **
70
p
SULM – Швейцарский союз лабораторной медицины | Union Suisse de Médecine de Laboratoire | Швейцарский союз лабораторной медицины
| Конгресс-центр | до 14.4.2016 | аб 15.04.2016 | На месте |
| 1 бирка, | швейцарских франков80.– | 120.– | 180.– |
| 3 номера, | швейцарских франков240.– | 360.– | 540.– |
| 3 Tage SGM-Студент, | швейцарских франков160.– | 160.– | нихт мёглих |
| Торжественный ужин, | швейцарских франков120.– | 120.– | 120.– |
Ноябрь 6. Июнь 2016 г. ist die Anmeldung nur noch vor Ort (Halle G1, 2. Stock), сразу на Конгрессе в Берне, möglich. Es kann nur in CHF bezahlt werden.
> Zur Kongress-Anmeldung
> Zur Hotelreservation
> Download der Hotelbeschriebe
> Excel-File zur Anmeldung von Gruppen ab 5 Personen
Информационный бюллетень
Sind Sie interessiert daran, regelmässige Updates zu unserem Kongress zu erhalten?
Hier können Sie sich für den Swiss MedLab Newsletter anmelden.
Регистрация vor Ort
BERNEXPO Bern, Halle G1, 2. Склад
Öffnungszeiten
Montag bis Donnerstag, 13–16. июнь 2012 г., 08.00–18.00
Teilnahmezertifikat / CME-Credits
Das Teilnahmezertifikat wird an ordentlich angelmeldete Teilnehmer, für deren Dauer der effektiven Teilnahme am Kongress, ausgegeben. Das Zertifikat ist ausschliesslich an der Kongressregistration vor Ort erhältlich. CME-Credits werden bei den betreffenden Fachgesellschaften angefragt, die genaue Anzahl wird fortlaufend bekannt gegeben.



 Значительные нарушения в работе этой железы могут привести к развитию кретинизма, тяжелой болезни, негативно влияющей на физическое и умственное состояние пациента.
Значительные нарушения в работе этой железы могут привести к развитию кретинизма, тяжелой болезни, негативно влияющей на физическое и умственное состояние пациента.
 NAMS Непрерывное медицинское образование; Ведение остеопороза у женщин в постменопаузе: заявление о позиции 2010 г. Менопауза . 2010;17(1):23–56.
NAMS Непрерывное медицинское образование; Ведение остеопороза у женщин в постменопаузе: заявление о позиции 2010 г. Менопауза . 2010;17(1):23–56.