ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ
«Живая и мертвая вода — против свободных радикалов и старения».
«Его величество окислительно-восстановительный потенциал (ОВП).»
Редокс-потенциал определяет свойства живой воды
На Западе распространено мнение, что многие антиоксиданты нейтрализуют свободные радикалы путем отдачи им своего электрона. В результате такой реакции они сами превращаются в свободный радикал, но более слабый и не способный наносить вред, а затем путем сложных биохимических превращений выводятся из организма.
Вполне возможно объяснить таким образом и механизм антиоксидантного действия живой воды, учитывая ее отрицательный редокс-потенциал, указывающий на преобладание восстановителей и, в частности, активного отрицательного водорода и электронов.
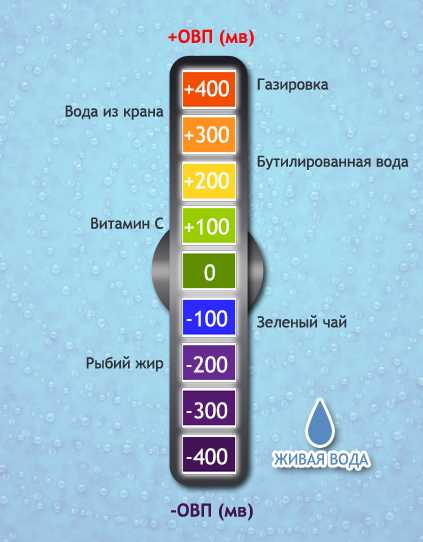
Редокс-потенциал живой воды (относительно хлор-серебряного электрода сравнения) — от –70 до –200 мВ
Для измерения редокс-потенциала используют аппарат иономер, единица измерения — милливольт. При измерении аппарат показывает определенное числовое значение со знаком плюс или минус, это и является редокс-потенциалом раствора.
Человеческий организм — водный раствор
Как уже было сказано выше, редокс-потенциал характеризует активность восстановителей или окислителей любого раствора (то есть способность этого раствора отдавать или принимать электроны).
Восстановители и окислители всегда присутствуют в любом водном растворе (кроме дистиллированной воды).
Человеческий организм как раз и является (как ни парадоксально это звучит) ярким примером сложного, живого водного раствора.
Водяными существами мы являемся в полном смысле этого слова. Наше тело состоит из воды на 65%, мозг — на 85%, стекловидное тело глаза — на 99%. В крови содержится 83% воды, в жировой ткани — 29%, в скелете — 22% и даже в зубной эмали — 0,2%.
Так как во всех водных растворах присутствуют окислители и восстановители, то мы являемся (хотя это очень трудно представить) своеобразным набором окислителей и восстановителей, постоянно находящихся во взаимодействии (реакции) друг с другом.
Таким образом, редокс-потенциал играет огромную роль в нашей жизни. Роль, которую современная медицина еще не совсем поняла, но зато все больше понимают биологи и биофизики.
Технические возможности измерения редокс-потенциала в живых организмах пока ограничены по многим довольно объективным причинам. Так, при измерении редокс-потенциала крови или клетки невозможно избежать контакта с кислородом воздуха и электродами. К тому же измерения приходится вести путем внедрения электродов и нарушения целостности тканей, что само по себе искажает значение редокс-потенциала. Пожалуй, наиболее полная информация по измерению и расчетным данным редокс-потенциала крови и внутренних тканей содержится в книге В. И. Прилуцкого и В. М. Бахира «Электрохимически активированная вода: аномальные свойства, механизм биологического действия» (Москва, 1997).
Редокс-потенциал для конкретных окислительно-восстановительных пар можно рассчитать по формуле Нернста с учетом рН-показателя. Эти вычисления дали для артериальной крови с показателем рН = 7,4 теоретическое значение редокс-потенциала +200 мВ, а для венозной крови примерно +150 мВ (расчеты проведены в системе водородного потенциала).
Измерения водородным электродом очень неудобны. Поэтому во всем мире пользуются хлорсеребряными электродами, с помощью которых и сделаны все измерения, результаты которых приведены в этой книге. Для перехода в эту систему из значений водородной системы отнимают 201–207 мВ в зависимости от температуры. Переводя данные теоретически рассчитанных значений редокс-потенциала в привычные милливольты и систему хлорсеребряного электрода, получаем:
· артериальная кровь имеет расчетный редокс-потенциал примерно –7 мВ;
· венозная кровь имеет расчетный редокс-потенциал примерно –57 мВ.
Расчетные данные редокс-потенциала крови подтверждаются измерениями, проведенными группой ученых в Германии (Сталлер, Хоффман и другие).
Редокс-потенциал продуктов
Но не только «человеческий раствор» характеризуется редокс-потенциалом.
Каждая жидкость, которую мы пьем, имеет редокс-потенциал. А значит, вместе с жидкостью (водой, соком, минералкой) мы получаем не только набор витаминов, минералов или микроэлементов, но окислители и восстановители, протоны и электроны.
И поэтому, известную фразу «Ты есть то, что ты ешь» с позиции современной науки вполне правомерно заменить другим высказыванием: «Ты есть то, что ты пьешь».
Я провела более сотни измерений редокс-потенциала напитков — так сказать, жидких продуктов питания. Измерения проводились с помощью серебряного хлорсеребряного электрода на иономере фирмы «GREISING»
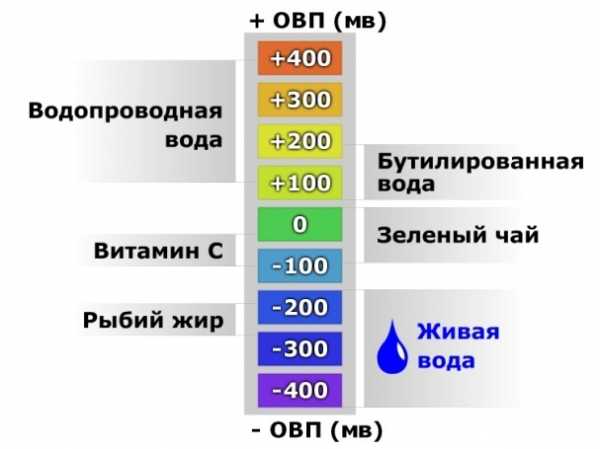
Редокс-потенциал кока-колы — 300±25 мВ
Редокс-потенциал зеленого чая с ванильной добавкой — 85±10 мВ
Редокс-потенциал томатного сока — 36±15 мВ
Редокс-потенциал красного вина — 49±15 мВ
|
Продукт |
Редокс-потенциал |
|
Сок яблочный |
+112±15 мВ |
|
Сок виноградный |
+150±15 мВ |
|
Кофе растворимый |
+70±15 мВ |
|
Сок томатный |
+36±15 мВ |
|
Чай черный |
+65±15 мВ |
|
Чай зеленый |
+50±15 мВ |
|
Кока-кола |
+300+350 мВ |
|
Уксусная 5-процентная кислота |
+400±15 мВ |
|
Красное вино |
+50±15 мВ |
|
Вода водопроводная |
+150+350 мВ |
Измерения показывают, что напитки, которые мы употребляем, имеют различный редокс-потенциал, дающий представление о том, окислители или восстановители в нем преобладают. Эти измерения подтверждают уже имеющиеся знания: так, например, широко известны антиоксидантные свойства зеленого чая (он имеет довольно низкий редокс-потенциал), красное вино также обладает антиоксидантными свойствами и в небольших (внимание!) количествах снижает риск возникновения сердечно-сосудистых заболеваний. Томаты обладают антиоксидантными и противоопухолевыми свойствами (наиболее низкий редокс-потенциал среди всех жидкостей).
Редокс-потенциалы продуктов отличаются в зависимости от того, где они были произведены. Профессор Хоффманн, один из известных авторитетов Германии в области измерения редокс-потенциалов продуктов питания, на основании тысячи измерений пришел к выводу, что экологически чистые соки, которые в Германии называют «био», имеют более низкий редокс-потенциал, чем обычные соки, полученные в результате массового производства.
А вот кока-кола широко известна своими окислительными и оксидантными свойствами (она имеет очень высокий редокс-потенциал, он только немного ниже потенциала 5%-процентной уксусной кислоты!).
О Кока-коле хотелось бы сказать особо.
«Ода» кока-коле.
Кока-кола — самый популярный и доступный напиток, продающийся на каждом перекрестке. Она относится к группе лимонадов-газировок и состоит из сахара, воды, красителей, вкусовых добавок,ароматизаторов и консервантов.
Эта «питательная» смесь насыщается под давлением углекислым газом (тем самым, который мы выдыхаем), что отнюдь не придает напитку полезные качества, но создает массу неудобств: через некоторое время из-за повышения температуры в желудке газ начинает расширяться и выделяется в пищеводе. Поэтому газированные напитки так часто вызывают изжогу и отрыжку.
Утолить жажду таким напитком невозможно — содержание сахара в нем высокое, и после первого ощущения утоления жажды через некоторое время опять хочется пить.
Почти все лимонады содержат кофеин — и в немалых дозах. Как известно, кофеин — это слабый наркотик, вызывающий привыкание, что делает потребление лимонадов потребностью, особенно у детей. А кока-кола содержит еще и экстракт растения кока — традиционного наркотического средства американских индейцев.
Попробуйте сами дома провести эксперимент: возьмите кусочек мяса, залейте его кока-колой и следите, за какое количество времени она его полностью растворит — «съест». А теперь представьте на минуту, что кока-кола делает с эмалью зубов или слизистой желудка.
Вода — продукт питания номер один
Редокс-потенциал водопроводной воды зависит от ее минерального состава и хлорирования.
Редокс-потенциал водопроводной воды — от 150 до 350 мВ
Хлорирование воды. Хлорирование, применяемое для дезинфекции воды, конечно, огромное благо. Благодаря ему человечество избавилось от эпидемий холеры и других инфекционных заболеваний, уносивших миллионы жизней. Но сейчас мы платим за это довольно высокую цену.
При анализе хлорированной водопроводной воды среди прочего обнаруживаются соединения хлора, от одних названий которых уже можно впасть в уныние. Например:
· хлороформ — анестезирующий агент;
· четыреххлористый углерод — пятновыводитель;
· трихлорэтилен — токсическое соединение;
· дихлорэтан — клей для органического стекла.
Успокоительная информация: в тех концентрациях, в которых эти вещества содержатся в питьевой воде, они не могут вызвать отравления.
Тревожная информация: согласно последним токсикологическим исследованиям, эти и ряд других хлорпроизводных соединений обладают канцерогенными и мутагенными свойствами. В последнее время обнаружена связь потребления хлорированной воды с увеличением риска возникновения рака прямой кишки, мочевого пузыря, мочевыводящих путей, мозга .
Это происходит потому, что хлорсодержащие соединения образуют с органическими соединениями, содержащимися в воде, так называемые тpихлоpметаны, относящиеся к соединениям канцерогенной опасности, то есть вызывающие образование злокачественных опухолей. Согласно данным Национального онкологического института США, на счет хлора, содержащегося в питьевой воде, можно отнести около 2% случаев заболеваний раком почек и печени. Кроме того, хлорирование повышает редокс-потенциал воды, то есть ее окисляющую способность.
Нетрудно заметить, что редокс-потенциалы большинства жидких продуктов лежат в области, намного превышающей физиологические значения организма, и являются по отношению к нему окислителями, которые, попадая в организм, окисляют его.
Методика ежедневного употребления живой воды
Рекомендуемый редокс-потенциал живой воды для ежедневного питья — от 50 до –70 мВ, максимально приближенный к физиологическим значениям редокс-потенциала крови и тканей организма.
Пить ее рекомендуется:
— больным хроническими заболеваниями, протекающими на фоне оксидативных нарушений — по 250–300 мл в день;
— практически здоровым людям — по 150 мл в день для коррекции дисбаланса окислителей, поступающих с напитками, делая перерыв на 2 недели через каждый месяц питья.
Здоровья Вам и благополучия!
Из книги Ашбах Д. С.
«Живая и мертвая вода — против свободных радикалов и старения».
akvalife.club
Окислительно-восстановительный потенциал
«Живая и мертвая вода — против свободных радикалов и старения».
«Его величество окислительно-восстановительный потенциал (ОВП).»
Редокс-потенциал определяет свойства живой воды
На Западе распространено мнение, что многие антиоксиданты нейтрализуют свободные радикалы путем отдачи им своего электрона. В результате такой реакции они сами превращаются в свободный радикал, но более слабый и не способный наносить вред, а затем путем сложных биохимических превращений выводятся из организма.
Вполне возможно объяснить таким образом и механизм антиоксидантного действия живой воды, учитывая ее отрицательный редокс-потенциал, указывающий на преобладание восстановителей и, в частности, активного отрицательного водорода и электронов.
Редокс-потенциал живой воды (относительно хлор-серебряного электрода сравнения) — от –70 до –200 мВ
Для измерения редокс-потенциала используют аппарат иономер, единица измерения — милливольт. При измерении аппарат показывает определенное числовое значение со знаком плюс или минус, это и является редокс-потенциалом раствора.
Человеческий организм — водный раствор
Как уже было сказано выше, редокс-потенциал характеризует активность восстановителей или окислителей любого раствора (то есть способность этого раствора отдавать или принимать электроны).
Восстановители и окислители всегда присутствуют в любом водном растворе (кроме дистиллированной воды).
Человеческий организм как раз и является (как ни парадоксально это звучит) ярким примером сложного, живого водного раствора.
Водяными существами мы являемся в полном смысле этого слова. Наше тело состоит из воды на 65%, мозг — на 85%, стекловидное тело глаза — на 99%. В крови содержится 83% воды, в жировой ткани — 29%, в скелете — 22% и даже в зубной эмали — 0,2%.
Так как во всех водных растворах присутствуют окислители и восстановители, то мы являемся (хотя это очень трудно представить) своеобразным набором окислителей и восстановителей, постоянно находящихся во взаимодействии (реакции) друг с другом.
Таким образом, редокс-потенциал играет огромную роль в нашей жизни. Роль, которую современная медицина еще не совсем поняла, но зато все больше понимают биологи и биофизики.
Технические возможности измерения редокс-потенциала в живых организмах пока ограничены по многим довольно объективным причинам. Так, при измерении редокс-потенциала крови или клетки невозможно избежать контакта с кислородом воздуха и электродами. К тому же измерения приходится вести путем внедрения электродов и нарушения целостности тканей, что само по себе искажает значение редокс-потенциала. Пожалуй, наиболее полная информация по измерению и расчетным данным редокс-потенциала крови и внутренних тканей содержится в книге В. И. Прилуцкого и В. М. Бахира «Электрохимически активированная вода: аномальные свойства, механизм биологического действия» (Москва, 1997).
Редокс-потенциал для конкретных окислительно-восстановительных пар можно рассчитать по формуле Нернста с учетом рН-показателя. Эти вычисления дали для артериальной крови с показателем рН = 7,4 теоретическое значение редокс-потенциала +200 мВ, а для венозной крови примерно +150 мВ (расчеты проведены в системе водородного потенциала).
Измерения водородным электродом очень неудобны. Поэтому во всем мире пользуются хлорсеребряными электродами, с помощью которых и сделаны все измерения, результаты которых приведены в этой книге. Для перехода в эту систему из значений водородной системы отнимают 201–207 мВ в зависимости от температуры. Переводя данные теоретически рассчитанных значений редокс-потенциала в привычные милливольты и систему хлорсеребряного электрода, получаем:
— артериальная кровь имеет расчетный редокс-потенциал примерно –7 мВ;
— венозная кровь имеет расчетный редокс-потенциал примерно –57 мВ.
Расчетные данные редокс-потенциала крови подтверждаются измерениями, проведенными группой ученых в Германии (Сталлер, Хоффман и другие).
Редокс-потенциал продуктов
Но не только «человеческий раствор» характеризуется редокс-потенциалом.
Каждая жидкость, которую мы пьем, имеет редокс-потенциал. А значит, вместе с жидкостью (водой, соком, минералкой) мы получаем не только набор витаминов, минералов или микроэлементов, но окислители и восстановители, протоны и электроны.
И поэтому, известную фразу «Ты есть то, что ты ешь» с позиции современной науки вполне правомерно заменить другим высказыванием: «Ты есть то, что ты пьешь».
Я провела более сотни измерений редокс-потенциала напитков — так сказать, жидких продуктов питания. Измерения проводились с помощью серебряного хлорсеребряного электрода на иономере фирмы «GREISING»
Редокс-потенциал кока-колы — 300±25 мВ
Редокс-потенциал зеленого чая с ванильной добавкой — 85±10 мВ
Редокс-потенциал томатного сока — 36±15 мВ
Редокс-потенциал красного вина — 49±15 мВ
Редокс-потенциалы некоторых напитков
|
Продукт |
Редокс-потенциал |
|
Сок яблочный |
+112±15 мВ |
|
Сок виноградный |
+150±15 мВ |
|
Кофе растворимый |
+70±15 мВ |
|
Сок томатный |
+36±15 мВ |
|
Чай черный |
+65±15 мВ |
|
Чай зеленый |
+50±15 мВ |
|
Кока-кола |
+300+350 мВ |
|
Уксусная 5-процентная кислота |
+400±15 мВ |
|
Красное вино |
+50±15 мВ |
|
Вода водопроводная |
+150+350 мВ |
Измерения показывают, что напитки, которые мы употребляем, имеют различный редокс-потенциал, дающий представление о том, окислители или восстановители в нем преобладают. Эти измерения подтверждают уже имеющиеся знания: так, например, широко известны антиоксидантные свойства зеленого чая (он имеет довольно низкий редокс-потенциал), красное вино также обладает антиоксидантными свойствами и в небольших (внимание!) количествах снижает риск возникновения сердечно-сосудистых заболеваний. Томаты обладают антиоксидантными и противоопухолевыми свойствами (наиболее низкий редокс-потенциал среди всех жидкостей).
Редокс-потенциалы продуктов отличаются в зависимости от того, где они были произведены. Профессор Хоффманн, один из известных авторитетов Германии в области измерения редокс-потенциалов продуктов питания, на основании тысячи измерений пришел к выводу, что экологически чистые соки, которые в Германии называют «био», имеют более низкий редокс-потенциал, чем обычные соки, полученные в результате массового производства.
А вот кока-кола широко известна своими окислительными и оксидантными свойствами (она имеет очень высокий редокс-потенциал, он только немного ниже потенциала 5%-процентной уксусной кислоты!).
О Кока-коле хотелось бы сказать особо.
«Ода» кока-коле.
Кока-кола — самый популярный и доступный напиток, продающийся на каждом перекрестке. Она относится к группе лимонадов-газировок и состоит из сахара, воды, красителей, вкусовых добавок,ароматизаторов и консервантов.
Эта «питательная» смесь насыщается под давлением углекислым газом (тем самым, который мы выдыхаем), что отнюдь не придает напитку полезные качества, но создает массу неудобств: через некоторое время из-за повышения температуры в желудке газ начинает расширяться и выделяется в пищеводе. Поэтому газированные напитки так часто вызывают изжогу и отрыжку.
Утолить жажду таким напитком невозможно — содержание сахара в нем высокое, и после первого ощущения утоления жажды через некоторое время опять хочется пить.
Почти все лимонады содержат кофеин — и в немалых дозах. Как известно, кофеин — это слабый наркотик, вызывающий привыкание, что делает потребление лимонадов потребностью, особенно у детей. А кока-кола содержит еще и экстракт растения кока — традиционного наркотического средства американских индейцев.
Попробуйте сами дома провести эксперимент: возьмите кусочек мяса, залейте его кока-колой и следите, за какое количество времени она его полностью растворит — «съест». А теперь представьте на минуту, что кока-кола делает с эмалью зубов или слизистой желудка.
Вода — продукт питания номер один
Редокс-потенциал водопроводной воды зависит от ее минерального состава и хлорирования.
Редокс-потенциал водопроводной воды — от 150 до 350 мВ
Хлорирование воды. Хлорирование, применяемое для дезинфекции воды, конечно, огромное благо. Благодаря ему человечество избавилось от эпидемий холеры и других инфекционных заболеваний, уносивших миллионы жизней. Но сейчас мы платим за это довольно высокую цену.
При анализе хлорированной водопроводной воды среди прочего обнаруживаются соединения хлора, от одних названий которых уже можно впасть в уныние. Например:
— хлороформ — анестезирующий агент;
— четыреххлористый углерод — пятновыводитель;
— трихлорэтилен — токсическое соединение;
— дихлорэтан — клей для органического стекла.
Успокоительная информация: в тех концентрациях, в которых эти вещества содержатся в питьевой воде, они не могут вызвать отравления.
Тревожная информация: согласно последним токсикологическим исследованиям, эти и ряд других хлорпроизводных соединений обладают канцерогенными и мутагенными свойствами. В последнее время обнаружена связь потребления хлорированной воды с увеличением риска возникновения рака прямой кишки, мочевого пузыря, мочевыводящих путей, мозга .
Это происходит потому, что хлорсодержащие соединения образуют с органическими соединениями, содержащимися в воде, так называемые тpихлоpметаны, относящиеся к соединениям канцерогенной опасности, то есть вызывающие образование злокачественных опухолей. Согласно данным Национального онкологического института США, на счет хлора, содержащегося в питьевой воде, можно отнести около 2% случаев заболеваний раком почек и печени. Кроме того, хлорирование повышает редокс-потенциал воды, то есть ее окисляющую способность.
Нетрудно заметить, что редокс-потенциалы большинства жидких продуктов лежат в области, намного превышающей физиологические значения организма, и являются по отношению к нему окислителями, которые, попадая в организм, окисляют его.
Когда жидкости, имеющие намного больший редокс-потенциал, чем кровь и внутренняя среда человека, проникают в ткани человеческого организма, они отнимают электроны от клеток и тканей, которые на 70–80% состоят из воды. В результате этого биологические структуры организма (клеточные мембраны, органоиды клеток, нуклеиновые кислоты и другие) подвергаются окислительному разрушению. Процессы окисления биологических объектов ведут к свободному радикальному окислению и лежат в основе возникновения и развития многих болезней.
Из книги «Живая и мертвая вода — против свободных радикалов и старения» — Дины Семеновна Ашбах. Кандидат медицинских наук, ведущий ученный в сфере ионизации воды, руководитель немецкой клиники.
Методика ежедневного употребления живой воды
Здоровья Вам и благополучия!
spaaqua.ru
ОВП воды (редокс-потенциал, RedOx — Reduction/Oxidation)
Здравствуйте! Прочитала статьи про ОВП на вашем сайте, очень интересно! А можно дополнительно осветить вот такие вопросы:
какое обычно бывает значение ОВП для разных видов природных вод
Почему в некоторых сравнительно чистых водах прибор показывает отрицательные значения ОВП. Например, недавно отбирали воду высоко в горах, и в некоторых точка в бурных горных реках ОВП было отрицательным (вода была чистой и прозрачной, минерализация низкая). Помогите разобраться
Здравствуйте Анна!
Как уже сообщалось на нашем сайте окислительно-восстановительный потенциал (ОВП), называемый также редокс-потенциал (от английского RedOx — Reduction/Oxidation), характеризует способность химического вещества присоединять и отдавать электроны в окислительно-восстановительных реакциях, т.е. реакциях, связанных с присоединением или передачей электронов и выражается в милливольтах.
Во время окислительных или восстановительных реакций изменяется и электрический потенциал окисляемого или восстанавливаемого вещества: одно вещество, отдавая свои электроны и заряжаясь положительно, окисляется, другое, приобретая электроны и заряжаясь отрицательно,— восстанавливается. Разность электрических потенциалов между ними и есть окислительно-восстановительный потенциал (ОВП).
Окислительно-восстановительный потенциал, таким образом, является мерой химической активности элементов в обратимых окислительно-восстановитльных процессах, связанных с изменением заряда ионов в растворах.
В организме человека энергия, выделяемая в ходе окислительно-восстановительных реакций, расходуется на поддержание гомеостаза (динамического постоянства состава и свойств внутренней среды и устойчивости основных физиологических функций организма) и регенерацию клеток организма, а также на обеспечение процессов жизнедеятельности организма. Поэтому очень важно принимать воду с заданным значением ОВП.
ОВП внутренней среды организма человека, измеренный на платиновом электроде относительно хлорсеребряного электрода сравнения, в норме имеет отрицательные значения, которые обычно находятся в пределах от -100 до -200 милливольт.
ОВП питьевой воды, измеренный таким же способом практически обычно находится в пределах от +100 до +400 мВ. Это справедливо практически для всех типов питьевой воды – как водопроводной так и бутилированной.
Данные различия ОВП внутренней среды организма человека и питьевой воды означают, что активность электронов во внутренней среде организма человека намного выше, чем активность электронов в питьевой воде.
Когда обычная питьевая вода проникает в ткани организма, она отнимает электроны от клеток и тканей, которые на 80 — 90% состоят из воды. В результате этого биологические структуры организма (клеточные мембраны, органоиды клеток, нуклеиновые кислоты и другие) подвергаются окислительному разрушению. Организм изнашивается, стареет, жизненно-важные органы теряют свою функцию. Но эти негативные процессы могут быть замедлены, если в организм поступает вода с заданным значением ОВП.
Для того, чтобы организм оптимальным образом использовал в обменных процессах питьевую воду с положительным значением окислительно-восстановительного потенциала, ее ОВП должен соответствовать значению ОВП внутренней среды организма. Необходимое изменение ОВП воды в организме происходит за счет затраты электрической энергии клеточных мембран, т.е. энергии самого высокого уровня, энергии, которая фактически является конечным продуктом биохимической цепи трансформации питательных веществ.
Если поступающая в организм питьевая вода имеет ОВП близкий к значению ОВП внутренней среды организма человека, то электрический потенциал клеточных мембран не расходуется на коррекцию активности электронов воды и вода лучше усваивается, поскольку обладает биологической совместимостью по этому параметру. Если питьевая вода имеет ОВП более отрицательный, чем ОВП внутренней среды организма, то она подпитывает его этой энергией, которая используется клетками.
Поэтому для того, чтобы организм оптимальным образом использовал в обменных процессах питьевую воду с положительным значением окислительно-восстановительного потенциала, ее ОВП должен соответствовать значению ОВП внутренней среды организма. Необходимое изменение ОВП воды в организме происходит за счет затраты электрической энергии клеточных мембран, т.е. энергии самого высокого уровня, энергии, которая фактически является конечным продуктом биохимической цепи трансформации питательных веществ.
В биохимии, в отличие от электрохимии, величины редокс-потенциала выражаются не в милливольтах, а в условных единицах rH (reduction Hydrogenii). Перевод результатов измерения ОВП при помощи прибора в условные единицы можно провести используя формулу Нернста или специальные таблицы.
«0» — означает чистый водород
«42» — чистый кислород
«28» — нейтральная среда
pH и rH тесно взаимосвязаны друг с другом. Окислительные процессы понижают показатель кислотно-щелочного равновесия (чем выше rH, тем ниже pH), восстановительные — способствуют повышению pH. В свою очередь показатель pH влияет на величину rH.
В природной воде значение ОВП колеблется от — 400 до + 700 мВ, что определяется совокупностью происходящих в ней окислительных и восстановительных процессов, наличия тех или иных солей, катионов металлов, растворённых в ней газов и прежде всего кислорода, температуры, значения рН.
В условиях равновесия значение ОВП определенным образом характеризует водную среду, и его величина позволяет делать некоторые общие выводы о химическом составе воды. В зависимости от значения ОВП различают несколько основных ситуаций, встречающихся в природных водах:
Окислительная:
Характеризуется значениями ОВП > + (100 — 150) мВ, присутствием в воде свободного кислорода, а также целого ряда элементов в высшей форме своей валентности (Fe3+, Mo6+, As5-, V5+, U6+, Sr4+, Cu2+, Pb2+). Такая ситуация, наиболее часто встречается в поверхностных и водах.
Вода, обладающая ярко выраженными кислотными свойствами называется «мертвой» водой. Ее ОВП может достигать +800+1000 мВ. Вода с положительными значениями ОВП называется «мертвой» водой и является сильнейшим окислителем, чем и объясняются ее дезинфецирующие и бактерицидные свойства.
«Мертвая» вода используется для лечения и профилактики простудных заболеваний, ангины, гриппа. «Мертвая» вода имеет широкий спектр воздействия на организм: снижает кровяное давление, улучшает сон, успокаивает нервную систему. «Мертвая» вода растворяет камни на зубах, прекращает кровотечение десен, помогает при лечении пародонтоза. Снижает боли в суставах, помогает при расстройствах кишечника.
Переходная окислительно-восстановительная:
Определяется величинами ОВП от 0 до + 100 мВ, неустойчивым геохимическим режимом и переменным содержанием сероводорода и кислорода. В этих условиях протекает как слабое окисление, так и слабое восстановление целого ряда металлов.
Восстановительная:
Характеризуется значениями ОВП < 0. Типична для подземных вод, где присутствуют металлы низких степеней валентности (Fe2+, Mn2+, Mo4+, V4+, U4+), а также сероводород. Это типично для подземных горных источников, талой воды.
Вода с отрицательными значениями ОВП получила название «живой» воды. «Живая» вода (щелочная) является отличным стимулятором, тонизатором, источником энергии, придает бодрость, стимулирует регенерацию клеток, улучшает обмен веществ, нормализует кровяное давление. «Живая» вода способна заживлять раны, ожоги, язвы (в т.ч. желудка и 12перстной кишки). «Живая» вода используется для лечения и профилактики остеохондроза, атеросклероза, аденомы предстательной железы, полиартрита и других заболеваний.
Окислительно-восстановительный потенциал также зависит от температуры, количества растворённого в воде кислорода и значения рН водной среды.
Обычно ОВП организма человека колеблется от -90 мВ до -200 мВ, а ОВП обычной питьевой воды практически всегда значительно выше нуля:
водопроводная вода от +80 мВ до +300 мВ;
вода в пластиковых бутылках от +100 мВ до +300 мВ;
колодезная, родниковая вода от +120 мВ до +300 мВ.
Отрицательный ОВП природной воды — явление не частое и характерно для вод подземных горных источников, где присутствуют металлы низких степеней валентности (Fe2+, Mn2+, Mo4+, V4+, U4+), а также сероводород и талой воды.
Cчитается, что отрицательный ОВП питьевой воды дает энергетическую зарядку клеткам, органам, системам. Электрическая энергия клеточных мембран не расходуется на коррекцию активности электронов воды и вода тотчас же усваивается, т.к. обладает биологической совместимостью по этому параметру. Именно поэтому питьевая вода с отрицательным ОВП — идеальный антиоксидант.
Вода с отрицательным окислительно-восстановительным потенциалом (ОВП) и обладающая восстановительными свойствами обычно называется «активированной«. Активированной называется также вода с большим положительным ОВП, обладающая заметно выраженными окислительными свойствами. Основной технологией получения таких видов воды является электролиз. Католит и анолит обладают соответственно отрицательным и большим положительным ОВП.
ОВП, мВ | |
Внутренняя среда здорового организма человека | -70 |
Свежий сок (с грядки) | +30 — +70 |
Свежевыжатый сок после суток хранения плодов | +50 — +100 |
Вода природная в местах проживания долгожителей | +30 — +70 |
Вода с микрогидрином | -200 |
Вода водопроводная | +220 — +380 |
Вода бутилированная | +210 — +400 |
Оптимальная среда для подвижности сперматозоидов | -130 |
Оптимальная среда для роста полезных бактерий (кишечная палочка, бифидобактерии) | +50 — -200 |
Молоко матери | -70 |
Более подробно о том, от каких параметров зависит показатель ОВП воды читайте в статье:
www.ikar.udm.ru/sb46-2.htm
C уважением,
К.х.н. О. В. Мосин
www.o8ode.ru
11. Редокс – потенциалы и направление окислительно – восстановительных реакций.
Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода: Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:
Aox + n·e− → Ared,
то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста.
Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией[2] и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях.
8.3. Направление окислительно-восстановительных реакцийО направлении ОВР можно судить по изменению энергии Гиббса ∆G. Если ∆G < 0 – реакция возможна, если ∆G > 0 — невозможна. Из термодинамики известно, что ∆G = -n·F·E; E = φок-ля -φв-ля или φок-ля > φв-ля, что возможно при Е > 0 и ∆G < 0
Рассмотрим реакцию:
Она состоит из двух полуреакций:
Т.к. φок-ля > φв-ля, то возможно самопроизвольное протекание реакции слева направо.
2FeCl3 + 2KJ → 2FeCl2 + J2 + 2KCl
Из всех возможных при данных условиях О.В.Р. в первую очередь протекает та, которая имеет наибольшую разность окислительно – восстановительных потенциалов.
О.В.Р. протекают в сторону образования более слабых окислителей и восстановителей из более сильных.
Роль окислительно-восстановительных процессов. О.В.Р. играют важную роль в природе и технике. О.В.Р. – это процессы фотосинтеза у растений, процессы дыхания у животных и человека, процессы горения топлива. Иногда О.В.Р. наносят ущерб природе и человеку, например, при коррозии металлов, лесных пожарах, образовании токсичных диоксинов.
При помощи О.В.Р. получают металлы, органические и неорганические соединения, проводят анализ различных веществ, очищают природные и сточные воды, газовые выбросы.
12. Сущность титриметрического анализа и классификация его методов.
Ответ: .
1.Сущность титриметрического анализа
В титриметричееком анализе определение количества вещества производится по объему раствора известной концентрации, затраченного на реакцию с определяемым веществом.
Процесс определения количества вещества или точной концентрации раствора объемно-аналитическим путем называется титрованием. Эта/важнейшая операция титриметрического анализа заключается в том, что к исследуемому раствору приливают другой раствор точно известной концентрации до окончания реакции. При титровании прибавляют не избыточное количество реактива, а точно отвечающее уравнению реакции. Следовательно, такое определение возможно только в том случае, если количество прибавленного реактива эквивалентно количеству определяемого соединения.
Известно, что объемы растворов, количественно реагирующих между собой, обратно пропорциональны нормальным концентрациям этих растворов:
V, N.
ТГ-= дг- или ^ = v2.v2,
* 2 ‘1
где V — объем реагирующего раствора; N — нормальная концентрация.
Это положение и легло в основу титриметрического определения. Для того чтобы определить концентрацию одного из (растворов, надо знать точно объемы реагирующих растворов, точную концентрацию другого раствора и момент, когда два вещества прореагируют в эквивалентных количествах. Следовательно, важнейшими моментами титриметрических определений являются:
1) точное измерение объемов реагирующих растворов;
2) приготовление растворов точно известной концентрации, с помощью которых проводится титрование, так называемых рабочих растворов; 3) определение конца реакции.
Титриметрическое определение занимает гораздо меньшее время, чем гравиметрическое. Вместо многих длительных операций гравиметрического анализа — осаждение, фильтрование, взвешивание и пр. при титриметрическом определении проводят всего одну операцию — титрование.
Точность титриметрических определений несколько меньше точности гравиметрического анализа, однако разница невелика. И поэтому там, где возможно, стараются вести определение более быстрым методом.
Для того, чтобы та или иная реакция могла служить основой для титрования, она должна удовлетворять ряду требований.
Реакция должна проходить количественно по определенному уравнению без побочных реакций. Необходимо быть уверенным, что прибавляемый реактив расходуется исключительно на реакцию с определенным веществом.
Окончание реакции необходимо точно фиксировать, так как количество реактива должно быть эквивалентно количеству определяемого вещества. На эквивалентности реагирующих веществ основано вычисление результатов анализа.
Реакция должна протекать с достаточной скоростью и быть практически необратимой. Точно фиксировать точку эквивалентности при медленно идущих реакциях почти невозможно.
2. Классификация методов титриметрического анализаМетоды титриметрического анализа можно классифицировать по характеру химической реакции, лежащей в основе определения веществ, и по способу титрования
По своему характеру реакции, используемые в титриметрическом анализе, относятся к различным типам — реакциям соединения ионов и реакциям окисления — восстановления. В соответствии с этим титриметрические определения можно подразделять на следующие основные методы: метод кислотно-основного титрования (нейтрализации), методы осаждения и комплексообразования, метод окисления — восстановления. Метод кислотно-основного титрования (нейтрализации). Сюда относятся определения, основанные на взаимодействии кислот и оснований, т.е. на реакции нейтрализации:
H++ ОН» ч=* h3O Методом кислотно-основного титрования (нейтрализации) определяют количество кислот (алкалиметрия) или оснований (ациди-метрия) в данном растворе, количество солей слабых кислот и слабых оснований, а также веществ, которые реагируют с этими солями. Применение неводных растворителей (спирты, ацетон и т. п.) позволило расширить круг веществ, которые можно определять данным методом.
Методы осаждения и комплексообразования. Сюда относятся титриметрические определения, основанные на осаждении того или иного иона в виде малорастворимого соединения или связывания его в малодиссоциированный комплекс. Например, аргенто-метрия, которая применяется для количественного определения галогенидов или серебра и основана на реакциях осаждения гало-генидов серебра: Ag+ + X» —> AgX| (где X—Cl-, Br-, I-, SCN-) или фторометрия, основанная на реакциях комплексообразования, в которых лигандом является F_-hoh.
Методы окисления — восстановления (редоксиметрия). Эти методы основаны на реакциях окисления и восстановления. Их называют обычно по применяемому титрованному раствору реагента, например: перманганатометрия, в которой используются реакции окисления перманганатом калия KMnO4;
иодометрия, в которой используются реакции окисления иодом или восстановления 1_-ионами;
бихроматометрия, в которой используются реакции окисления бихроматом калия К2СГ2О7;
броматометрия, в которой используются реакции окисления броматом калия КВЮз.
К методам окисления — восстановления относятся также цери-
метрия (окисление Се4+-ионами), ванадатометрия (окисление VO3-ионами), титанометрия (восстановление Т13+-ионами). По способу титрования различают следующие методы.
Метод прямого титрования. В этом случае определяемый ион титруют раствором реагента (или наоборот).
Метод замещения. Этот метод применяют тогда, когда по тем или иным причинам трудно определить точку эквивалентности, например при работе с неустойчивыми веществами и т. п. Так, при определении Cr2+, который легко окисляется кислородом воздуха и который при непосредственном титровании окислителем определить трудно, поступают следующим образом: к определенному •объему соли хрома(II) прибавляют избыток титрованного раствора соли железа (III), происходит реакция:
Cr2++ Fe3+ —V Cr3++ Fe2+
В результате реакции образуется эквивалентное содержанию Cr2+ количество Fe2+, титрование которого окислителями не встречает затруднений. Таким образом, Cr2+ замещают на Fe2+, которое оттитровывают, и тем самым определяют содержание Cr2+.
Метод обратного титрования (титрование по остатку). Этот метод применяют, когда нет подходящего индикатора или когда основная реакция протекает не очень быстро. Например, для определения CaCO3 навеску вещества обрабатывают избытком титрованного раствора соляной кислоты:
CaCO3+ 2H+ —> Ca2++ h3O + C02f
Оставшуюся после реакции HCI титруют раствором щелочи и тем самым определяют ее количество, не вошедшее в реакцию с CaCO3. Зная взятое количество HCl, рассчитывают содержание CaCO3 в пробе.
Каким бы из методов ни проводилось определение, всегда предполагается:
1) точное измерение объемов одного или обоих реагирующих растворов;
2) наличие титрованного раствора, при помощи которого проводят титрование;
3) вычисление результатов анализа.
В соответствии с этим, прежде чем переходить к рассмотрению отдельных методов титриметрического анализа, остановимся на измерении объемов, расчете концентраций и приготовлении титрованных растворов, а также на вычислениях при титриметрических определениях.
studfiles.net
В справочнике по гидрохимии на сайте методического центра «Эколайн» дано следующее определение: «Окислительно-восстановительный потенциал (ОВП) является мерой химической активности элементов или их соединений в обратимых химических процессах, связанных с изменением заряда ионов в растворах». В переводе на более понятный неспециалисту язык это означает, что ОВП, называемый также редокс-потенциал (от английского RedOx — Reduction/Oxidation), характеризует степень активности электронов в окислительно-восстановительных реакциях, т.е. реакциях, связанных с присоединением или передачей электронов. Значение окислительно-восстановительного потенциала для каждой окислительно-восстановительной реакции вычисляется по довольно сложной формуле, выражается в милливольтах и может иметь как положительное, так и отрицательное значение. В природной воде значение Eh колеблется от — 400 до + 700 мВ, что определяется всей совокупностью происходящих в ней окислительных и восстановительных процессов. В условиях равновесия значение ОВП определенным образом характеризует водную среду, и его величина позволяет делать некоторые общие выводы о химическом составе воды. В зависимости от значения ОВП различают несколько основных ситуаций, встречающихся в природных водах:
Окислительно-восстановительный потенциал зависит от температуры и взаимосвязан с рН. В некоторых применениях (например, в обработке воды для бассейнов) ОВП является одним из основных параметров контроля качества воды. В частности потому, что позволяет оценить эффективность обеззараживания воды. Для иллюстрации приводим таблицу зависимости продолжительности жизни типичных микроорганизмов от величины редокс-потенциала.
|
www.water.ru
Окислительно-восстановительный потенциал (Eh)

Окислительно-восстановительные реакции – это главные процессы, которые поддерживают жизнедеятельность каждого организма. Иначе говоря, эти реакции всегда связаны с прикреплением или передачей электронов. Когда осуществляется восстановительный или окислительный процесс, то электрический ресурс вещества видоизменяется: одно вещество отдает электроны, получает положительный заряд и окисляется, а второе, соответственно получает электроны, отрицательно заряжается и восстанавливается. В результате получается разность потенциалов между веществами или окислительно-восстановительный потенциал (Eh). ОВП, который также называют редокс-потенциалом (redox — Reduction/Oxidation) считается своеобразным рубежом химической активности элементов (соединений) в обратимых химических реакциях, имеющих отношение к изменению заряда ионов в растворах.
Окислительно-восстановительный потенциал воды является степенью ее кислотных или щелочных свойств. В том случае, если потенциал окисления/восстановления имеет положительный статус, то вода присоединяет электроны тех веществ, которые окисляет. При отрицательном ОВП она наоборот отдает электроны, то есть восстанавливает.

Стандартные окислительно-восстановительные потенциалы выражают в милливольтах и обозначают как Eh. «Взаимоотношения» веществ-окислителей и компонентов-восстановителей устанавливаются индексом ОВП, зависящим от такого соотношения. Кислород относится к самым сильным окислителям, а наибольший эффект восстановления оказывает водород, правда данные элементы не единственные участники реакций окисления и восстановления. Значения окислительно-восстановительных потенциалов для каждой отдельной реакции могут быть положительными и отрицательными. ОВП взаимосвязан с уровнем активности ионов водорода, который выражает количество его кислотности и зависит от температуры.
Измерение окислительно восстановительного потенциала воды подразумевает использование специального приспособления — редокс-метра (ОВП-метра). Это устройство отличается небольшими габаритами, быстро функционирует и имеет достаточно демократичную стоимость, что позволяет быстро и удобно рассчитать окислительно восстановительный потенциал. При помощи редокс-метра можно оперативно выяснить число милливольт (мВ), которые были использованы для отсоединения от исследуемой жидкости. Чем больше была восстановлена вода, тем меньше она сопротивляется отдаче электронов, а это уменьшает значение потенциала. ОВП воды активнее сдвигается в положительную сторону, если для осуществления реакции применяют разнообразные типы структуризаторов. Они могут быть абсолютно натуральными (кварц, живица хвойных растений) или целиком «синтетическими» (к примеру, матричными).
Влияние окислительно-восстановительного потенциала питьевой воды на здоровье
Природная вода может иметь потенциалы окислительно-восстановительных реакций положительного характера или отрицательного значения. Значение редокс-потенциала варьируется отминус 400 милливольт до плюс 700 милливольт. Положительная величина окислительно-восстановительного потенциала способствует тому, что качества воды становятся окислительными. Подобные значения чаще всего присущи в водах на поверхности.
Когда вода обладает сильными кислотными качествами, то ее принято называть «мертвой».
Показатели ОВП такой жидкости иногда зашкаливают (доплюс 800-1000 милливольт). «Мертвая» вода – это очень сильный окислитель, что объясняет ее бактерицидные и дезинфицирующие особенности. Зачастую, ее применяют в целебной и профилактической областях (лечение и профилактика простудных болезней, гриппа, ангины и тому подобного). Положительный окислительно-восстановительный потенциал среды приносит немалую пользу организму в целом: понижается кровяное давление, успокаивает ЦНС, значительно улучшает сон, минимизирует боли в суставах, устраняет пародонтоз, избавляет от зубного камня и кровотечений в ротовой полости, лечит кишечные расстройства.
Если потенциал окислительно-восстановительного электрода отрицательный, то вода приобретает восстановительные качества (это свойственно талой воде, подземным источникам и так далее). Вода с «минусовым» редокс-потенциалом называется «живой» или щелочной. Она прекрасно тонизирует организм, считается стимулятором, кладезем бодрости и энергии. «Живая» вода имеет множество преимуществ: активизирует восстановление клеток, нормализует давление, существенно улучшает обмен веществ, залечивает ожоги, раны, язвы (в том числе 12-перстной кишки и желудка), пролежни. Вдобавок к этому, она используется для предупреждения и лечения полиартрита, остеохондроза, аденомы простаты, атеросклероза.
Прибор для расчёта окислительно-восстановительного потенциала показывает, что обычно редокс-потенциал человеческого организма составляет от минус 90 до минус 200 милливольт. Питьевая вода в большинстве случаев имеет ОВП намного выше нуля:
- вода из под крана от +80 до +300 милливольт;
- вода из пластиковой тары от 100 до 300 «плюсовых» мВ;
- родниковая вода от +120 до +300 милливольт.
Природная вода с отрицательным окислительно-восстановительным потенциалом практически не встречается, это очень редкое явление. Что это значит? В процессе употребления обычной питьевой воды электроны человеческого организма ведут себя значительно активнее, чем ее электроны. Другими словами, такая разновидность воды «крадет» свободные электроны из организма, выступая в роли оксиданта. Применение такой воды для питья приводит к появлению хронических заболеваний, преждевременному старению.
Но, отрицательный окислительно восстановительный потенциал системы(воды) напротив подзаряжает клетки и органы большим количеством энергии. Электроэнергия мембран клеток организма не тратится на исправление активности водных электронов, поэтому жидкость моментально усваивается. Можно смело утверждать, что наилучшим антиоксидантом является питьевая вода с «минусовым» редокс-потенциалом. Учеными было доказано, что постоянное употребление воды с отрицательным ОВП омолаживает организм и даже продляет годы жизни. Учитывая информацию, опубликованную выше, желательно использовать ОВП-метр, чтобы знать, как изменится окислительно восстановительный потенциал под влиянием различных факторов и каким образом это отразиться на здоровье.
Нередко можно встретить заявления по поводу того, что какое-то вещество относится к сильнейшим антиоксидантам. Такая панацея существует — устройство под названием БСЛ-МЕД-1. Питьевая вода, прошедшая электрохимическую обработку этим водоочистительным прибором становится идеально чистой и приобретает свойства мощного антиоксиданта.
oskada.ru
Редокс потенциал воды и дезинфекция озоном
Окислительно-восстановительный или редокс потенциал (ORP) отражает количество окислителя в воде. Отметим, что он не является мерой концентрации самого окислителя, однако используется как надежный и универсальный показатель окислительного потенциала воды в точке измерения. Окислителями выступают кислород, хлор, перекиси, озон и другие вещества.
Единицей измерения редокс потенциала являются милливольты. Полный диапазон измерений составляет от -2000 до +2000 мВ. Большинство ORP-метров работают в диапазоне от -1200 до +1200 мВ, и этого достаточно в области обработки воды. Значения выше 0 мВ свидетельствуют о доступной энергии для окисления молекулы или связывания её с атомом кислорода.
В природе редокс потенциал является мерой того, насколько озеро и реки способны самоочищаться и расщеплять различные продукты, загрязнения и омертвевшие части растений и животных. Когда значения потенциала высокие, в воде избыток кислорода. Это означает, что аэробные бактерии, перерабатывающие мертвые ткани и загрязнения, работают более эффективно. В общем, более высокие значения потенциала свидетельствуют о здоровом состоянии водоемов. Однако, даже благополучные озера и реки около дна и донных отложений имеют более низкие концентрации кислорода и, соответственно, значения ORP. Это связано с большим количеством бактерий, которые напряженно разлагают органику и потребляют много кислорода. Фактически, кислород быстро исчезает в грязи на дне (часто на глубине 1-2 см), и ORP также падает. Регистрация окислительно-восстановительного потенциала, помимо измерения концентрации растворенного кислорода, дает более полную информацию о качестве воды и степени загрязнения. Кроме того, существуют другие элементы, которые подобно кислороду, вносят вклад в повышение ORP.
Окислительный потенциал ряда веществБиологическое значение редокс потенциала воды
Окислительно-восстановительный потенциал природных водоемов, в значительной степени, зависит от концентрации растворенного в воде кислорода, а также количества других элементов, функционально схожих с кислородом. Говоря проще, кислород и другие элементы, повышающие ORP, помогают утилизировать нежелательные загрязнения и органику в воде. Когда окислительно-восстановительный потенциал низкий, концентрация кислорода низкая, возрастает токсичность определенных металлов и загрязнений, и большинство омертвевшей, гниющей материи нельзя переработать. Очевидно, загрязненная среда вредна для рыб и насекомых. В благополучной среде значение ORP находится в диапазоне 300-500 мВ.
Озон как средство дезинфекции
Свойства кислорода и озона. Сравнительная таблицаОзон в воде реагирует с загрязнением и микроорганизмами, либо переходит обратно в кислород. Если озон встречает микроорганизм прежде, чем окисляет загрязнение, он убивает патоген и, соответственно, выступает дезинфектором. С другими химическими веществами, например, хлором, ситуация сложнее и менее предсказуема. Эти химикаты реагируют с микроорганизмами гораздо медленнее озона и чаще окисляют загрязнения. Кроме того, на эффективность многих окисляющих агентов влияет pH среды.
 Свойства хлора и озона. Сравнение в области дезинфекции
Свойства хлора и озона. Сравнение в области дезинфекции
Использование хлора для дезинфекции зависит от pH среды. Традиционные системы мониторинга измеряют потенциал в частях на миллион с использованием титрования или тест-полосок. Однако эти методы нужно совмещать с измерением pH и концентрации хлорноватистой кислоты (HClO). Значение pH важная переменная, потому что тестовые полоски в равной степени определяют кислоту HClO и ионы (OCl-). При pH 7.5 соотношение недиссоциированной кислоты HClO и ионов (OCl-) эквивалентно (50:50). Снижение pH приводит к возрастанию HClO и редокс потенциала, что свидетельствует об окислительном потенциале. Недавние исследования в коммерческих и модельных водных системах «после сбора урожая» показал, что если необходимо, ORP критерий может использоваться для определения потенциала уничтожения бактерий. Иными словами, среда ORP 700 мВ при pH 6.5 имеет такой же потенциал дезинфекции, что и среда ORP 700 мВ при pH 8.5. Хотя для достижения такого же значения ORP при pH 8.5 требуется гораздо больше гипохлорита. Это связано с тем, что доля хлорноватистой кислоты (HClO) составляет всего 15% от общего свободного хлора. Измерения свободного хлора (частей на миллион) при двух данных значениях pH (при постоянной концентрации гипохлорита) покажут одинаковые результаты, что дает ошибочное представление о высоком потенциале дезинфекции при pH 8.5.
Когда в воде присутствуют окисляющие агенты (ORP положительный), при достаточном времени и области контакта, они реагируют с какими-либо веществами или распадаются. Конечно, более высокая концентрация этих агентов приводит к более активному окислению и эффективной дезинфекции. Прогнозирование результата дезинфекции зависит от равномерного перемешивания воды и температуры, потому что в теплой среде молекулы взаимодействуют быстрее. Существуют и другие факторы, такие как тип окислителя, течение, световой режим и т.д..
Преимуществом озона является переход его в форму свободного радикала и кислород. Этот свободный радикал обладает потрясающим потенциалом дезинфекции. Распад озона на кислород и радикал ускоряется при посредничестве энергии УФ-излучения, либо добавлением перекиси водорода в раствор.
В муниципальных водах редокс потенциал составляет 200-300 мВ. Эта вода подверглась дезинфекции, но её потенциал дезинфекции невысок. Значение 650 мВ воды в очистных сооружениях свидетельствует о том, что любой окисляемый объект будет уничтожен. Задачей дезинфекции является достижение точки реакции, когда обработанная вода безопасна для потребления растениями, человеком и животными.
Большинство коммерческих моделей генерируют озон под воздействием коронного разряда или ультрафиолета. В первом случае коронный разряд порождает высокоэнергетическое поле между двумя металлическими пластинами, через которое проходит сухой воздух, при этом образуется озон. Ультрафиолетовое излучение (140-190 нм) используется для распада молекул кислорода и образования озона. Излучение дешевле коронного разряда, но менее эффективный.
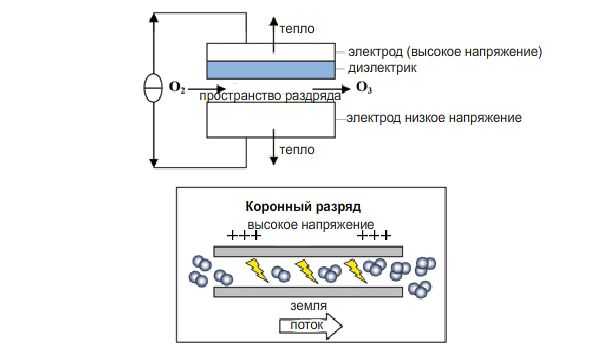 Генератор озона с коронным разрядом
Генератор озона с коронным разрядом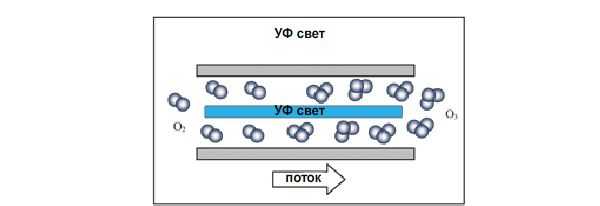 Генератор озона с УФ-излучателем
Генератор озона с УФ-излучателемКонструкция реактора и контактной камеры озонатора очень важно для успеха дезинфекции. Тип реакторов разнообразен, например, распылитель пузырьков, турбинная контактная камера, инъектор, глубокие u-трубчатые реакторы, статические смесители камеры с распылителем.
Важны эффективность переноса озона, конструкция без утечки озона, стойкий к окислению материал озонатора.
Материалы должны инертны к этому газу. Долговременное использование некоторых пластиков, например, ПВХ и поликарбонатов, и гальванической стали не рекомендовано.
В качестве материала контактной камеры и труб подойдет нержавеющая сталь. Краны изготавливаются из нержавеющей стали с мембранами из тефлона.
Режимы обработки озонированием
Озон применяют непрерывно, сериями, одиночно. В большинстве случаев, выбор режима обусловлен стратегиями кормления в системе культивирования. От трех до четырех часов после кормления рыбы концентрация аммония, растворенных органических веществ достигает максимума. Если рыбу кормят несколько раз в день, после каждого кормления запускают озонирование. Если кормление ведется непрерывно, качество воды ухудшается непрерывно, и озон необходимо вводить непрерывно. Одиночное озонирование применяется для планового снижения загрязнений в системе, связанных с умеренным кормлением, либо для обработки вносимой в систему свежей воды.
Непрерывное введение озона предпочтительно, потому что качество воды остается стабильным.
Концентрация необходимого озона рассчитывается на основе норм кормления. Обычно с целью снижения органических загрязнений рекомендуют вносить 10-15 г газа на 1 кг корма.
С другой стороны, дезинфекция воды требует более высоких концентраций озона, с учетом её загрязнения органическими веществами. В грязной воде остаточная концентрация O3 — 0.01-0.1 мг/л в течение 15 секунд достаточна для эффективного снижения бактериальной нагрузки. Однако в среде с высокой органической нагрузкой остаточная концентрация и/или время контакта с газом должно возрастать. Для дезинфекции, сопровождаемой окислением органических веществ, естественных вод (морская, солоноватая и пресная) обычно требуется остаточной концентрации 0.1-0.2 мг/л и время контакта 1-5 минут.
Оптимальные дозы O3 для дезинфекции изменчивы и представляют совокупность его затрат на окисление органических веществ, коллоидных частиц, нитратов и саму дезинфекцию. Как правило, в условиях УЗВ стоимость озонирования для полной дезинфекции слишком высока. Тем не менее, некоторое снижение нагрузки патогенных организмов и улучшения качества воды достигают умеренным использованием озона.
Дезинфекция вносимой воды и стоков более целесообразна, чем обработка всей системы. Озонирование источника воды в совокупности с карантинными мероприятиями поступающего посадочного материала, существенно снижают риск возникновения инфекции.
Место приложения
Озон в остаточной концентрации 0.01-0.1 мг/л токсичен для большинства пресноводных и морских организмов. Точка его приложения должна выбираться аккуратно. Существует несколько мест УЗВ, где вводят озон:
— Место подачи кислорода. Традиционно озон вносят в систему оксигенатор, после биофильтра, но перед культуральным бассейном. Вследствие близости бассейна, этот метод создает умеренный риск отравления рыб остаточным озоном. Его снижают удержанием газа в течение нескольких минут в контактной камере. Преимуществами метода являются дезинфекция и снижение нитрита.
— Место перед биофильтром. Озон вводят перед биофильтром. Этот метод сравнительно безопасен для рыб. Любые остаточные концентрации газа вначале проходят через биофильтр и используются для окисления биопленок. Таким образом, фильтр становится эффективным буфером пред бассейнами с рыбой. Однако слишком высокая остаточная концентрация озона снизит скорость нитрификации. Преимуществом такого озонирования является повышение концентрации кислорода в биофильтре, что особенно актуально для погруженного неорошаемого биофильтра. В свою очередь, в орошаемом аппарате любые формы кислорода улетучиваются в атмосферу.
— Обработка поступающей воды. Для УЗВ, использующих поверхностные воды, эта мера обязательна.
— Обработка стоков. Проводится с целью охраны окружающей среды от инфекций и загрязнений. Более эффективно накапливать сточные воды в емкости и затем озонировать их.
Не рекомендуется:
— Обрабатывать воду до этапа грубой механической очистки. Это ведет к необоснованному расходу озона.
— Обрабатывать культуральные бассейны. Опасно для рыб.
Озонирование солоноватой и морской воды ведет к появлению побочных продуктов. Озон реагирует с хлором, бромом и образует стабильные окислы, токсичные для гидробионтов. Применение озонатора в морской системе обычно ограничивается обработкой в ваннах, обособленных от основного потока. Активированный уголь эффективно удаляет остаточный озон из морской воды.
Измерение концентрации озона в УЗВ
Обычно прямое измерение озона в воде проводят колориметрическим методом или спектрофотометрией. Однако эти методы слишком грубые для регистрации низких остаточных концентраций озона, летальных для рыб, и непригодны для непрерывного мониторинга. Традиционно для этих целей используют ORP-датчики. Они не измеряют напрямую уровень газа, а регистрируют общую способность раствора окислять электрод (мВ). Таким образом, можно контролировать уровень окислителей и, соответственно, косвенно контролировать уровень озона. Для пресноводной УЗВ безопасно значение редокс потенциала 300 мВ.
Многие озонаторы связаны с датчиками и автоматически прекращают подачу озона. Как только его уровень вышел за допустимые пределы. Стоит отметить, что ORP датчики делают измерения несколько минут, поэтому концентрацию озона можно контролировать приблизительно. Параллельно с измерением озона необходимо поводить мониторинг других параметров, особенно, нитрита.
Риски озонирования воды
Озон очень эффективный окислитель. Именно это создает большие риски для систем УЗВ:
— Снижение нитрита в ходе его окисления озоном и перехода в нитрат приводит к нехватке нитрита в биофильтре. Количество нитрифицирующих бактерий снижается. После прекращения подачи озона может наступить подъем уровня нитрита.
— Высокая остаточная концентрация озона создает риск рыбе, вызывает серьезные повреждения тканей и смертность.
— Высокая остаточная концентрация озона создает риск бактериальной пленке биофильтра. Нарушается функция фильтра, что ведет к повышению аммония и нитрита. Это отражается на рыбе, снижает темпы роста, ухудшает здоровье.
Рекомендуется устанавливать деозонаторы для удаления остаточного озона. Простейшая конструкция включает камеру, в которой задерживается вода и где улетучивается озон. В капельных фильтрах этот газ также активно улетучивается.
Для человека безопасна концентрация озона в воздухе 0.05-0.1 мг/л в течение 8 часов, 0.3 мг/л в течение 10 минут.
Электроды для регистрации редокс потенциала
ORP-электроды аналитические датчики для измерения окислительно-восстановительного потенциала. Они входят в состав ORP-метра.
Окислительно-восстановительные реакции являются типом химической реакции, когда электроны от одного атома переходят к другому. Окисленный атом теряет электроны, а восстановленный – приобретает. Редокс реакция сопровождается обменом электронов. Окисление связано с потерей электронов, поэтому раствор положительный. Восстановление сопровождается приобретением электронов, поэтому раствор имеет отрицательный заряд. Для протекания реакции должны присутствовать оба участника. Скорость реакции, происходящая на электроде ORP-метра, напрямую связана с плотностью тока обмена, производного от концентрации раствора, окислительно-восстановительной системы и электрода. Скорость снижается, когда редокс потенциал образца подобен редокс потенциалу на электроде ORP-метра. Кроме того, излишний ток обмена также является проблемой при проверке сильных окислителей и восстановителей. Последнее решается ополаскиванием электродов перед замерами.
ORP-метр нельзя использовать как непосредственный индикатор остаточного окислителя или восстановителя, потому что в системе наблюдаются флуктуации, вследствие влияния pH и температуры. Тем не менее, прибор можно привести в соответствие с измеряемой средой за счет регистрации потенциала в спокойном состоянии. Состояние покоя достигается замерами pH и другими тестами. Таким образом, можно добиться высокой степени корреляции показаний ORP-метра и состояния системы.
Когда измерительный электрод находится в контакте с окислителями или восстановителями, электроны непрерывно перемещаются навстречу или прочь от его поверхности, что порождает крошечное напряжение. Измерительный электрод сделан из платины, золота или графита. Электрод сравнения связан с солевым водным раствором, с заданным потенциалом полуэлемента – 0.0 мВ. Этот электрод сделан их хлорида серебра или растворенного хлорида ртути (каломельный электрод), которые обеспечивают стабильные и надежные показатели. ORP электроды регистрируют напряжение в цепи, состоящей из двух электродов. Это напряжение можно измерить интерфейсом милливольтметра или pH метра. Положительные значения указывают на присутствие окислителя, тогда как негативные значения — восстановителя.
Регистрация ORP должна проводиться в нескольких точках, а не фиксированной точке. В реальной системе датчики редко устанавливают в фиксированной точке. Различия значений у датчика, в зависимости от того, подвижен он или в стационарном положении, могут превышать 25 мВ, особенно, портативных приборов. Размер проверяемой поверхности также влияет на флуктуации считывания: лучшие датчики имеют большую зону считывания. Хорошей практикой является стандартизация измерений и установка порогов окна считывания, что обеспечит удовлетворительное снижение концентрации бактерий. Для портативных приборов рекомендуют погружать датчик в проточную воду на 30 секунд. Если вода имеет сильное течение, образец набирают в чистый стакан (предварительно дважды ополаскивают дистиллированной водой). Аккуратно в течение 30 секунд размешивают содержимое стакана датчиком, а затем измеряют 30 секунд.
——
www.dramm.com/media/DRAMMwater/Understanding%20ORP%20&%20Ozone.pdf
www.globalspec.com/learnmore/sensors_transducers_detectors/chemical_sensors/oxidation_reduction_potential_orp_electrodes
www.dpi.nsw.gov.au/fishing/aquaculture/publications/water-quality-management/ozone-in-recirculating-aquaculture-systems
aquavitro.org