Cтроение ВИЧ-клетки под микроскопом, основные особенности вируса
Определение сущности ВИЧ-инфекции, ее происхождение, строение ВИЧ-клетки, пути передачи вируса, характерные симптомы и терапевтические методы – основные аспекты, интересующие высокие умы современного человечества. В обзоре пойдет речь о трех первых пунктах актуальной темы.
Что значит ВИЧ

Вирус иммунодефицита человека (ВИЧ) – провокатор ВИЧ-инфекции, вызывающей вторичные заболевания и приводящей к СПИДу. Выделяют 5 стадий недуга, по завершении которых пациент умирает.
Провоцирует болезнь вирус, находящийся в биологическом материале больного (крови, семенной жидкости, влагалищной секреции, грудном молоке). Оказавшись в организме здорового человека, инфекция некоторое время находится в «режиме ожидания». Этот период называют инкубационным. С выработкой антител к вирусу возможны проявления первых признаков заболевания, далее запускается процесс атаки иммунитета, больной медленно, но уверенно приближается к термальной стадии.
Открытие вируса
В 1980-1981 году в госпитале Нью-Йорка оказалось несколько пациентов с нестандартной формой саркома Капоши. Несмотря на относительно положительный прогноз этого вида заболевания, был выявлен злокачественный характер недуга у большинства больных. В это же время в Лос-Анджелесе были зарегистрированы случаи злокачественного течения пневмоцистной пневмонии.
Клинические картины указывали на уже известный в те времена синдром иммунодефицита. Однако, что именно вызывает инфекцию и каковы стадии инфекционного процесса, было неизвестно. Вирус, который в настоящее время провоцирует СПИД, открыли только 1983 году.
Впервые дать название вирусу попробовали группы Галло под руководством одноименного инфекциониста. Ученые в 70-х годах открыли ретровирус, стимулирующий лейкоз (рост) Т-лимфоцитов, назвав его HTLV-1. Вскоре был выделен альтернативный вирус этой же группы, который вызывал редкую патологию крови. Его обозначили HTLV-2.
Французские ученые под руководством Люка Монтанье объединились для изучения ретровирусов. В ходе исследований был выявлен вирус, который не провоцировал злокачественное перерождение клеток, а приводил к гибели Т-лимфоцитов с началом выработки организмом антител к ВИЧ. Вирус назвали HTLV-3. В 1985 году возбудителю СПИДа дали общее название – HIV/ВИЧ.
Прежде чем перейти к структуре ВИЧ, познакомимся с гипотезами происхождения инфекции.
Гипотезы происхождения ВИЧ
Согласно одной из теорий, вирус существовал на планете еще в древности. Предполагают, что изначально недуг проявлялся в эндемических заболеваниях СПИДом в запущенных районах Центральной Африки. Поскольку люди в тех краях часто умирали до 30-ти лет, больных СПИДом было не так много – они просто не доживали.
Сторонники альтернативной версии полагают, что синдром приобретенного иммунодефицита возник из безобидного вируса, подвергшегося воздействию радиоизотопов стронция и прочих веществ, которые выделились в результате взрыва водородной бомбы. Эта версия выдвинута не только на основе предположений, но и факта совпадения места появления первых больных и локации происшествия.
Более обоснованно звучит гипотеза о том, что СПИД передался человеку от обезьян. В древности вирусные мутанты, «обитающие» в организме мартышки, претерпели трансформацию и обрели другой «дом» — человека, который позже передал вирус своим потомкам, посредством незамысловатого процесса инфицирования плода.
Теперь пришло время рассмотреть СПИД под микроскопом.
Внимательно разглядываем вирус
Вирус, являющийся провокатором ВИЧ-инфекции – ретровирус, имеющий форму сферы. Внешняя оболочка, посредством которой происходит взаимодействие вируса с иммунными клетками организма, частично состоит из белков.

Основу вирусных агентов составляет геном, представленный парой молекул, каждая из которых выражается девятью генами. Эти самые гены содержат информацию о строении вируса, о методах заражения (при контакте с несколькими тысячами клеток, имеющих определенный уровень СD4- лимфоцитов).
Интересно! Со временем контактируемые клетки погибают. При достижении концентрации Т-лимфоцитов менее 200 в 1 мкл иммунный статус больного резко снижается – развивается СПИД. Это значит, что к этому моменту первые симптомы и диагностика недуга оказываются позади.
Строение ВИЧ
Строение вируса можно описать в двух составляющих: ядре (нуклеокапсиде), включающем РНК и ферменты, а также оболочке (мембране).
Строение нуклеокапсида ВИЧ
В составе ВИЧ вирусные РНК и тройка ферментов: ревертаза, интеграза и протеаза – все они в упаковке с белками. Снаружи – молекулы матриксного р-17- белка. Место их расположения – пространство между капсидом и мембраной. Внутри клетки располагается белок Vhr.
Строение оболочки ВИЧ
Расшифровка некоторых упомянутых обозначений
- Ревертаза – фермент, принимающий участие в процессе синтеза ДНК на матрице РНК;
- Интеграза – составляющая вируса ВИЧ, способствующая ускорению процесса соединения ДНК вируса с хромосомой пораженного организма;
- Протеаза – фермент, занимающийся расщеплением интеграций между белками и аминокислотами.
Вместе ферменты образуют комплекс «рабочих инструментов» клетки вируса.
Белки ВИЧ и их «работа»
Как только микроскопические вирусные частицы СПИДа оказываются в организме «хозяина», посредством фермента обратной транскриптазы осуществляется синтез ДНК-копии, которая контактирует с геном «хозяйской» клетки. Затем при помощи других ферментов (ревертаза, интеграза) осуществляется синтез новых молекул вирусных РНК и белков, ответственных за сборку и структурирование вирусов. С капсидой также ассоциированы белки Nef. Белок VPR выступает в роли вспомогательного.

Структурные белки ВИЧ
Эти белки ВИЧ синтезируются за счет гена Gag. Находятся в составе самой вирусной зоны. Они участвуют в формировании капсид и мембраны.
Капсидные белки ВИЧ
Этот вид белков образует сосуд для нуклеиновой кислоты, сформировывает ферменты, находится в составе геномного белка. Однако капсидная мембрана – это не отдельные белки, а субъединицы.
Суперкапсидные белки
Речь идет об основных структурных элементах суперкапсидной оболочки. За их синтез отвечает ген Env.
Неструктурные белки
В ответе за неструктурные элементы ген Pol. Эти белки отвечают за репродуктивные процессы вируса в различные этапы его жизни в организме здорового человека.
Остальные гены ВИЧ
Вирионы ВИЧ-типа имеют в своем составе также такие гены, как Tat, Nef, Vpu, Vpr и ряд других, отвечающих за размножение и сборку вирусов.
Геном ВИЧ
Геном – это основа вируса и инфицированных клеток, представлен парой нитей РНК. Именно на основе одной из них происходит синтез ДНК (молекулы ДНК) при обратной транскриптазе. В его составе имеются также структурные, регуляторные, функциональные гены.
Изучаем вирус: «озвучиваем» интересные факты
- Как выглядит вирус? Под микроскопом визуализируется образование в виде сферы.
- ВИЧ «обитает» в крови, грудном молоке, сперме и вагинальном секрете – в других биологических жидкостях концентрация вируса очень мала.
- После заражения антитела в организме больного начинают вырабатываться только через 3 недели минимум.
- Слияние вируса и здоровой клетки происходит посредством оболочки вируса, а именно с помощью поверхностного гликопротеина g
- Именно за счет обратной транскриптазы вируса происходит синтез ДНК на базе одной из нитей РНК собственной.
- «Привлекательной» для вируса оказывается клетка «хозяина», несущая рецепторы CD
- Если концентрация Т-лимфоцитов составляет менее 200 в 1 мкл, речь заходит о термальной стадии заболевания.
- При диагностике недуга у детей, родившихся у больных матерей, положительный результат на ВИЧ может сохраняться в течение 18 месяцев.
Ключевая особенность вируса
Пожалуй, самой важной и неприятной особенностью ВИЧ является его «замаскированное» пребывание в организме человека. Инкубационный период болезни может протекать в течение 3-х недель (иногда 3-х месяцев). В некоторых случаях первые признаки патологии и вовсе отсутствуют – пациент сразу сталкивается с яркими проявлениями клинической картины заболевания.
medsito.ru
Научная иллюстрация вируса иммунодефицита человека (ВИЧ)
Процесс присоединения вирусной частицы к поверхности клетки-мишени и последующее слияние вирусной и клеточной мембран происходит при помощи гликопротеидного комплекса gp120/gp41. Оба белка, входящие в состав этого комплекса, кодируются вирусным геном env и синтезируются сначала в виде белка-предшественника gp160, который по остаткам аспарагина гликозилируется богатыми маннозой олигосахаридами, а затем процессируется с образованием двух субъединиц [1].
Гликопротеидные поверхностные комплексы gp120/gp41 формируют тримеры. На поверхности среднего вириона насчитывается около 20 таких тримеров [2, 3]. В зрелом комплексе субъединицы gp120 и gp41 связаны нековалентно. Белок gp41 является трансмембранным, а gp120 связывается на стадии инфекции с рецептором CD4, расположенном на мембране T-лимфоцитов [4].
В результате взаимодействия gp120 с рецептором CD4 конформация вирусного белка меняется, что дает ему возможность впоследствии связаться с одним из двух корецепторов на поверхности Т-лимфоцита: CCR5 или CXCR4. Это событие влечет за собой конформационные изменения уже в субъединице gp41, которые и провоцируют последующее слияние вирусной и клеточной мембраны [5].
Вместе с клеточной мембраной вирусная частица захватывает и некоторые поверхностные белки заражаемых клеток [6]. В данной модели представлены три белка, захваченные вирионом из клетки-хозяина: ICAM-1, HLA-DR1 и DAF.
HLA-DR1 (Human Leukocyte Antigen) — это одна из молекул главного комплекса гистосовместимости класса II. Молекулы этого класса участвуют в презентации антигенов CD4+ Т-лимфоцитам и могут связываться с рецепторами CD4 на их поверхности. Наличие молекул HLA в мембране вириона ВИЧ повышает его вирулентность [9].
ICAM-1 (Intercellular Adhesion Molecule 1), также известный как CD54) в организме человека участвует в межклеточных взаимодействиях и формировании иммунологических синапсов [7]. Молекула ICAM — это гомодимер, структурно сходный с иммуноглобулинами. Наличие ICAM в оболочке ВИЧ также увеличивает его вирулентность [8].
CD55 (также известный как DAF, Decay-accelerating factor) в человеческих клетках участвует в негативной регуляции клеточной системы комплемента, блокируя сборку мембраноатакующего комплекса. Считается, что этот белок в мембране ВИЧ может предохранять вирион от уничтожения иммунной системой [10].
Мембраны вирусных частиц ВИЧ формируются из мембран зараженных вирусом клеток. При этом вирусная и клеточная мембраны отличаются по соотношению входящих в их состав липидов. Благодаря этому вирусная мембрана оказывается менее пластичной и отличается от клеточной по ряду других свойств [11].
В сравнении с мембраной Т-лимфоцитов, в липидной оболочке ВИЧ содержится существенно больше сфингомиелинов (на), фосфатидилсерина и холестерина, тогда как уровень типичных для клеток млекопитающих фосфатидилхолина и фосфатидилэтаноламина в вирусной мембране ниже в 2–3 раза [12]. Состав вирусной мембраны имеет принципиальное значение для жизнедеятельности ВИЧ. Так, например, ингибирование биосинтеза сфинголипидов может снижать инфекционную способность вируса [13].
Вирусные частицы ВИЧ отпочковываются от сравнительно плотных участков клеточной мембраны со специфическим липидным составом — липидных рафтов. Считается, что эти участки выполняют функции доставочных или концентрационных платформ в таких процессах как передача клеточных сигналов, сортировка мембранных белков или формирование клеточной полярности [14].
Матрикс, образованный структурным белком MA (matrix protein, также обозначаемый как p17)расположен непосредственно под липидной оболочкой вириона, который, как и три других белка ВИЧ (CA, NC и p6), формирующих капсид, нуклеокапсид и участвующих в сборке и nbsp;созревании вириона, кодируется вирусным геном Gag [15].
В зрелом вирионе матрикс состоит из тримеров MA [16]. Каждая из субъединиц тримера связана с молекулой миристиновой кислоты, за счет которой они заякориваются в вирусной мембране [17].
visual-science.com
Вирус иммунодефицита человека (вич)
ВИЧ, возбудитель СПИДА, относится к подсемейству Lentivirinae семейства Retroviridae. Подсемейство Lentivirinae (от L. lentus = медленно) включает возбудителей медленных вирусных инфекций висна/мэди овец и др. Помимо ВИЧ в эту группу включены также вирусы иммунодефицита животных.
Структура. ВИЧ – оболочечный вирус сферической формы размером 90 -120 нм (рис. 1).
Р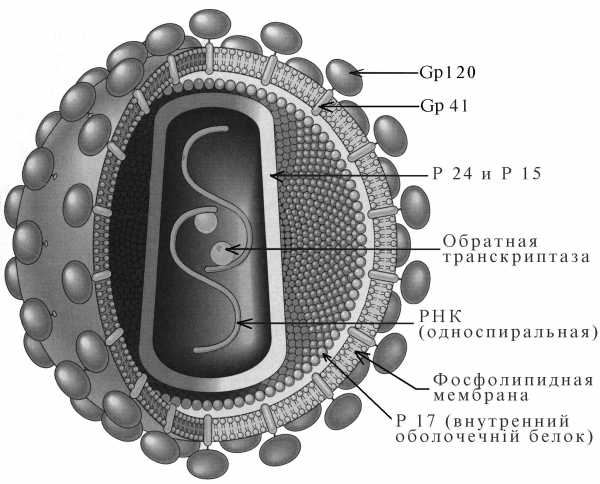 ис.
1.Вирион
ВИЧ
ис.
1.Вирион
ВИЧ
Нуклеокапсид имеет наружную оболочку икосаэдрической формы и внутреннее конусообразное ядро, окружающее рибонуклеопротеид. Геном — диплоидный, состоящий из двух одинаковых спиралей плюс-нитей РНК. В ассоциации с вирусной РНК находится фермент обратная транскриптаза, которая является характерной особенностью ретровирусов. Когда вирус инфицирует клетку, вирусная РНК транскрибируется ферментом сначала в односпиральную ДНК, а затем в двухспиральную ДНК (провирус), которая интегрируется в хромосому клетки — хозяина. Провирус может оставаться в скрытом состоянии в течение длительного времени, хотя это и влияет на функции клетки — хозяина. Время от времени, в ответ на действие факторов, активирующих вирус, провирус индуцирует репликацию вируса путем управления синтезом вирусной РНК и других компонентов вируса.
Во время репликации вируса, когда лишенные оболочки отпочковующиеся вирусы проходят через оболочку клетки, они приобретают липопротеидную оболочку, состоящую из липидов оболочки клетки-хозяина и гликопротеидов, кодируемых вирусом. Большинство кодируемых вирусом протеинов в проекции имеют вид поверхностно расположенных кнопкообразных шипов с закрепляющими их трансмембранными ножками. Шипы, являются основным поверхностным компонентом вируса, который связывается с CD4 рецепторами на восприимчивых клетках.
Вирусные гены и антигены. Геном ВИЧ содержит три структурных гена (gag, pol и env) характерные для всех ретровирусов, также как и другие неструктурные и регуляторные гены, специфичные для вирусов. Продукты этих генов, структурных и неструктурных, являются антигенами. Сыворотки инфицированных людей содержат антитела к ним. Обнаружение этих антигенов и антител имеет большое значение для диагностики и прогноза ВИЧ-инфекции.
A. Кодирующие гены для структурных белков:
1. Ген gag определяет сердцевину и оболочку вируса. Его продуктов является белок-предшественник p55. (Белки и гликопротеиды обозначаются по их молекулярной массе, выраженной в килодальтонах.). Этот белок- предшественник расщепляется на три белка, pl5, pl8 и p24, которые составляют сердцевину вируса и оболочку. Главный сердцевинный антиген — p24 может быть обнаружен в сыворотке в ранней стадии ВИЧ инфекции, прежде, чем появляются антитела. Позднее в течение инфекции исчезновение из кровотока свободных anti-p24 антител указывает на отягощение болезни и служит показанием для активного антивирусного лечения.
2. Ген env определяет синтез гликопротеида оболочки gp l60, который расщепляется на два компонента оболочки — gp l20, который образует поверхностные шипы, и gp 41, являющийся трансмембранным прикрепляющим белком. Гликопротеид шипов gp l20 — главный антиген оболочки, и антитела к gpl20 появляются первыми после инфицирования.
3. pol ген кодирует обратную транскриптазу и другие вирусных ферменты, типа протеазы и эндонуклеазы. Он экспрессируется как белок-предшественник, который расщепляется на белки p31, p51 и p66.
B. Неструктурные и регуляторные гены.
1. tat (trans activating gene — транс-активирующий ген) усиливающий экспрессию всех вирусных генов.
2. nef (negative factor gene — ген негативного фактора) подавляющий репликацию вируса.
3. rev (regulator of virus gene — регулятор вирусного гена) увеличивающий синтез структурных белков.
4. vif (viral infectivity factor gene — ген фактора инфекциозности вируса) влияющий на инвазионную способность вирусных частиц.
5. vpu (у ВИЧ-1) и vpx (у ВИЧ-2) вероятно увеличивающие созревание и выход вирусного потомства из клетки. (Обнаружение типоспецифических последовательностей vpu и vpx – существенно для дифференциации инфекции ВИЧ-1 от ВИЧ-2.).
6. vpr – имеются сообщения, что он активирует область промотора вируса.
7. LTR (long terminal repeat) последовательности (длинные концевые повторы), по одному с обоих концов, содержащие последовательности, дающие промотору усиливающие и интегрирующие сигналы.
Антигенные варианты и разнообразие ВИЧ.
ВИЧ – высоко изменчивый вирус. У него обнаруживаются как частые антигенные изменения, также и изменения других свойств, таких как нуклеотидные последовательности, клеточный тропизм, особенности роста и цитопатологии. Различия наблюдаются не только между изолятами из различных регионов или разных лиц, но и между повторными изолятами от одного и того же человека и даже между изолятами из разных мест одного человека в одно и то же время. Эта большая вариабельность ВИЧ, как полагают, является следствием ошибок, присущих природе обратной транскрипции.
Антигенные вариации наиболее часто отмечаются в отношении белков оболочки, но обнаруживаются реже в отношении других антигенов. На основании антигенных различий выделено два типа ВИЧ. Первоначально выделенный ВИЧ и родственные штаммы, распространенные во всем мире, принадлежат ВИЧ типа 1. Штаммы ВИЧ, вначале изолированные в Западной Африке в 1985 г., которые очень слабо или вообще не реагируют с иммунной сывороткой против ВИЧ-1, были названы ВИЧ типа 2. Антигены оболочки двух типов различны, хотя их основные полипептиды обнаруживают некоторую перекрестную реактивность. ВИЧ-2 имеет генетическую идентичность с ВИЧ-1 только на 40 процентов. Он более близко родственен вирусу иммунодефицита обезьян, чем ВИЧ-1. Он, как полагают, намного менее вирулентен, чем ВИЧ-1. Он в большей мере встречается в Западной Африке, хотя имеются сообщения о выделении его из других областей, включая западную и южную Индию.
ВИЧ-1 штаммы классифицировались в по крайней мере девять подтипов, основанные на секвенировании их gag и env генов. Эти подтипы обозначены как буквами от A до I.
В то время как все известные подтипы обнаруживаются в Африке, только один подтип B был найден в США. Доминирующий подтип в Западной Индии – C, в Таиланде — E. Подтипы, по-видимому, различаются при инфицировании из различных. Подтипы, обычные в Азии и Африке, более часто передаются при гетеросексуальном контакте, чем американские штаммы (подтип B), которые распространяются преимущественно при ведении крови и гомосексуальном контакте (гомосексуальная передача рассматривается в качестве кровяного пути, так как вирус, вероятно, проникает непосредственно в кровь через незначительные разрывы.
Некоторые штаммы ВИЧ-1, выделенные недавно в Камеруне, которые выпадают из диапазона подтипов от A до I, были названы подтипом 0 («0» от «outliers» – «выбросы»). Инфекция этими штаммами не обнаруживается тест-системами для ВИЧ-1 и 2. Подтип 0- штаммов в настоящее время ограничен Камеруном, но, хотя есть сообщения о случаях камерунского происхождения из Габона и Франции. Широкое распространение этих штаммов может создавать серьезные проблемы в серодиагностике ВИЧ инфекций.
Обычно наблюдаются различия в характеристике роста между ВИЧ, изолированных от бессимптомных носителей и от больных СПИДом. Первые растут медленно и инфицируют только лимфоциты периферической крови, в то время как последние растут быстрее и дают высокие титры на перевиваемых линиях клеток лимфоидного и моноцитоидного происхождения. Различия в штаммах могут объяснять различия в клиническом течении процесса у ВИЧ-инфицированных людей.
Устойчивость.
ВИЧ термолабилен, инактивируется за 10 мин при 50 C и за секунды при 100 С. При комнатной температуре (20-25 C), в высохшей крови может сохраняться до семи дней. Это устойчив при лиофилизации. В лиофилизированных продуктах крови вирус может быть инактивирован прогреванием при 68 C в течение 72 часов и в жидкой плазме – при 60 C в течение 10 часов
ВИЧ инактивируется в течение 10 минут обработкой 50 % этиловым спиртом, 35 % изопропиловым спиртом, 0,5 % лизолом, 0,5 % параформальдегидом, 0,3 % перекисью водорода или 10 % бытовых отбеливающих веществ (например – хлорной извести). Он также инактивируется при крайних значениях рН (1,0 и 13,0). Отбеливающие порошки или хлорная известь эффективны для обеззараживания поверхностей. Для обработки зараженных медицинских инструментов применяется 2 % раствор глутаральдегида.
Патогенез.
Рецептор для вируса — антиген CD4, и поэтому вирус может инфицировать любую клетку, несущую на поверхности антиген CD4. Это — прежде всего T4 (хелпер/индуктор) лимфоцит. Некоторые другие иммунные клетки также обладают CD4 антигеном на поверхности и также восприимчивы к инфекции. Таким образом, восприимчиво приблизительно 5 — 10 процентов B лимфоцитов и 10 -20 процентов моноцитов и макрофагов, включая специализированные макрофаги типа альвеолярных макрофагов в легких и клетки Лангерганса кожи. Также доказана инфицированность глиальных клеток и микроглии в центральной нервной системе. Фолликулярные дендритные клетки миндалин могут инфицироваться ВИЧ без участия CD4.
Специфическое прикрепление вируса к CD4 осуществляется гликопротеидом оболочки gp 120. Однако, для инфекции существенно слияние. Это обеспечивается трансмембранным gp 41.
Инфекция передается, когда вирус поступает в кровь или ткани человека и входит в контакт с подходящей клеткой — хозяином, преимущественно T4 лимфоцитом. Инфекция, вероятно, более часто развивается после введения клеток, инфицированных ВИЧ (при переливании крови или половом контакте), чем свободного от клеток вируса (как при введении продуктов крови).
Двухспиральная ДНК — транскрипт вирусной ДНК интегрируется в геном инфицированной клетки, вызывая латентную инфекцию. Время от времени индуцируется литическая инфекция с выходом вирусного потомства, которые инфицируют другие клетки. Длительный и меняющийся инкубационный период при ВИЧ инфекции связан с латентностью. От инфицированного человека ВИЧ может быть выделен из крови, лимфоцитов, освобожденной от клеток плазмы, спермы, цервикального секрета, слюны, слез, мочи и грудного молока.
Самый ранний патогенетический механизм при ВИЧ инфекции – повреждение T4 лимфоцитов. T4 клетки уменьшаются в количестве и соотношение T4 : T8 (хелперы : супрессоры) изменяется. Вирусная инфекция может подавлять функцию инфицированных клеток без структурных повреждений. Инфицированные T4 клетки не выделяют нормального количества интерлейкина-2, гамма-интерферона и других лимфокинов. Это приводит к выраженному эффекту подавления клеточного иммунного ответа.
осново000000000000000000000000000000000000000Хотя поражается в основном клеточный иммунитет, повреждается также целый ряд других механизмов. Активность Т хелперов существенна для оптимальной функции B клетки, особенно в ответе на тимусзависимые антигены. Больные СПИДом неспособны давать ответ на новые антигены. Важная особенность ВИЧ инфекции – поликлональная активация B лимфоцитов, приводящая к гипергаммаглобулинемии. Увеличивается содержание иммуноглобулинов всех классов, но особенно повышается уровень IgG и IgA. У младенцев и детей повышается уровень IgM. Гипериммуноглобулинемия в большей мере мешает, чем помогает, так как это главным образом «бесполезный иммуноглобулин» это составлено главным образом «бесполезный иммуноглобулин» к ненужным антигенам, а также аутоантитела. Это может также быть причиной иммунокомплексных аллергических реакций (гиперчувствительность III типа).
Функция моноцитов-макрофагов также нарушается, очевидно, из-за недостатка секреции T4 лимфоцитами факторов активации. В результате хемотаксис, презентация антигена и внутриклеточный киллинг моноцитами/макрофагами снижается. Поражается также активность NK клеток и цитотоксических Т-лимфоцитов.
Клинические проявления при ВИЧ инфекции обусловлены в первую очередь не вирусными цитопатологическими механизмами, а являются вторичными вследствие недостаточности иммунного ответа. Это делает больного восприимчивым к оппортунистическим инфекциям и злокачественным новообразованиям. Исключением может быть деменция (слабоумие) и другие дегенеративные неврологические поражения обнаруживаемые при СПИДе. Предполагается, что они могут быт следствием прямого поражения ВИЧ на центральную нервную систему.
СИНДРОМ ПРИОБРЕТЕННОГО ИММУНОДЕФИЦИТА (СПИД)
Клинические особенности ВИЧ инфекции. СПИД — только последняя стадия в широком спектре клинических особенностей ВИЧ инфекции.
Естественное развитие ВИЧ инфекции может рассматриваться по следующим стадиям:
1. Острая ВИЧ инфекция. В пределах нескольких недель ВИЧ инфекции примерно у 10-15 процентов лиц наблюдается невысокая температура, недомогание, головная боль, лимфаденопатия, иногда с высыпаниями и артропатия, напоминающие инфекционный мононуклеоз. Редко, может наблюдаться острая энцефалопатия. Спонтанное разрешение происходит в течение нескольких недель. В начале болезни тесты на антитела к ВИЧ обычно отрицательны, но становятся позитивными в течении заболевания. Поэтому этот синдром был назван «болезнь сероконверсии», хотя у большинства ВИЧ-инфицированных сероконверсия происходит без каких-либо видимых проявлений болезни. В начале этой фазы может наблюдаться антигенемия ВИЧ (антиген p24). Патогенез болезни сероконверсии, как полагают, обусловлен иммунными комплеками, а также прямым эффектом вирусной репродукции.
2. Бессимптомная инфекция. Все лица, инфицированные ВИЧ, испытывают ли они болезнь сероконверсии или нет, проходят через фазу бессимптомного течения инфекции на протяжении нескольких месяцев или лет. У них выявляются положительные тесты на ВИЧ антитела в течение этой фазы и они заразны. У некоторых инфекция может дальше не прогрессировать, в то время как у других это может приводить к полному развитию СПИДа, или непосредственно, или через цитопению, малые оппортунистические инфекции, персистирующую генерализованную лимфаденопатию или СПИД-ассоциированный комплекс (ARC), как описано ниже.
studfiles.net
Вирус СПИДа
Попав в организм человека, вирус СПИДа избирательно прикрепляется к иммунным клеткам, на поверхности которых находятся CD 4-моделулы – именно их и распознает вирус.
ВИЧ относится к лентивирусам, которые еще называют «медленными вирусами» — это значит, что с момента заражения до проявления первых симптомом (а тем более синдрома приобретённого иммунодефицита) проходит значительное количество времени. Еще до формирования иммунного ответа вирусы успевают распространиться по всему организму.
Клетки, отвечающие за иммунитет, постепенно поражаются, при снижении числа лимфоцитов-CD4 до значения 200/мкл и ниже, говорят о синдроме приобретённого иммунодефицита.
Как выглядит вирус СПИДа?
Строение вируса СПИДа достаточно сложное. ВИЧ обладает суперкапсидом сферической формы, который образован двойным липидным слоем с гликопротеиновыми «шипами». На поверхности ВИЧ находится тысячи белковых молекул (gp41, gp120, p24, p17, p7). Белки gp 120 и gp 41 обуславливает особенности строения вируса СПИДа – именно с их помощью ВИЧ находит и поражает свою «мишень» — клетки иммунной системы человека. Установлено, что размер вируса СПИДа примерно в 60 раз меньше, чем диаметральное сечение эритроцита и составляет 100-120 нанометров.
Как долго живет вирус СПИДа?
Вирус иммунодефицита человека жизнеспособен лишь в жидких средах организма. Заразиться ВИЧ-инфекцией можно через кровь и ее компоненты при переливании (факторы свертывания, замороженная плазма, тромбоцитарная масса). Также небезопасен половой контакт (в том числе и оральный) с больным ВИЧ. В слюне, слезах, поте, кале и моче содержание ВИЧ крайне мало – инфицирование возможно, лишь если эти жидкости содержат примеси крови.
Заражение бытовым путем невозможно, так как вирус СПИДа погибает на воздухе в течение нескольких секунд.
Как себя уберечь от ВИЧ?
К сожалению, стопроцентной гарантии профилактика СПИДа не дает – вирусы иммунодефицита могут попасть в организм даже с соблюдением мер предосторожности. Нередко инфицирование происходит в салонах красоты, где не соблюдаются требования гигиены (нестерильные инструменты), а также при переливании крови и ее компонентов (в последнее время число случаев уменьшилось, так как донорский материал стали подвергать обязательной проверке на ВИЧ).
Важно воздерживаться от незащищенных контактов с незнакомыми партнерами: гарантия их неинфицированности – анализ на ВИЧ и ЗППП, а не «честное слово». В маникюрные салоны лучше брать свои инструменты, так как кроме ВИЧ на нестерильных ножничках и пинцетах могут быть возбудители гепатита, сифилиса и др.
Как нельзя заразиться ВИЧ?
Вопреки мифам и страхам, инфицирование вирусом иммунодефицита невозможно через:
- рукопожатие;
- поцелуй;
- общую пищу и напитки;
- укус комара;
- пользование банями, бассейнами, саунами;
- «уколы» в общественных местах инфицированными иглами (на поверхности иглы вирус быстро погибает).
Не передается вирус СПИДа при чихании и кашле.
Анализ на ВИЧ
Инкубационный период при заражении ВИЧ длится около 6 месяцев, потому выявить инфекцию возможно лишь по истечении этого срока с момента предполагаемого заражения (переливание, небезопасный секс, инъекция нестерильным шприцем). Сдать анализ необходимо также, если партнер относится к группе риска (посторонние связи, наркозависимость, ЗППП).
womanadvice.ru
Лекция № 24. Ретровирусы. Вирус иммунодефицита человека
Лекция №24. Ретровирусы. Вирус иммунодефицита человека.
Вирус иммунодефицита человека (ВИЧ или HIV) относится к семейству ретровирусов, подсемейству лентивирусов (медленных вирусов). Геном ретровирусов уникален — он представлен двумя идентичными молекулами позитивной РНК, т.е. это РНК — вирусы с диплоидным геномом. Свое название ретровирусы получили за отличительные особенности репродукции (РНК ДНК иРНК геномная РНК). Особенности репродукции связаны с функциями фермента обратной транскриптазы (ревертазы или РНК — зависимой ДНК — полимеразы), обладающей тремя видами активности — обратной транскриптазы, РНК — азы и ДНК — полимеразы.
Семейство Retroviridae включает три подсемейства.
1. Lentivirinae — возбудители медленных вирусных инфекций, в т.ч. ВИЧ.
2. Oncovirinae — онкогенные вирусы, с которыми связано превращение клеток в опухолевые. Раньше не знали, как РНК — вирусы могут встраиваться в геном клетки и способствовать опухолевому росту (не были известна возможность обратной транскрипции у вирусов), что тормозило научную разработку вирусологии опухолевого роста.
3. Spumavirinae — “пенящие” вирусы, название которых связано с характерным “вспененным” видом инфицированных ими клеточных культур как результатом интенсивного симпластообразования.
Первыми открытыми в конце 70- х годов ретровирусами были HTLV-1 и HTLV-2 (от “human T- lymphotropic virus) — возбудители Т — клеточных лейкозов и лимфом. Наиболее известны обладающие лимфотропным и цитопатическим действием вирусы ВИЧ-1 (HIV-1 в английском варианте) и ВИЧ-2, вирус иммунодефицита обезьян (ВИО или SIV), к которому по ряду свойств ближе (чем к ВИЧ-1) ВИЧ-2. К настоящему времени имеется информация уже о нескольких сотнях ретровирусов, интегрированных с геномом человека и практически очень мало об их роли в патологии.
История изучения и происхождения ВИЧ.
Синдром приобретенного иммунодефицита (СПИД) впервые выделен как самостоятельное заболевание в США в 1981г. Возбудитель (ВИЧ-1) был описан почти одновременно в 1983г. французом Л.Монтанье и американцем Р.Галло. Эпидемиология нового вида патологии поражала своей необычностью. Почти 100% больных были мужчинами в возрасте 25-49 лет, 94% — гомо- или бисексуалами, отмечалась высокая летальность. У больных были выявлены дефекты клеточного иммунитета, развитие пневмоцистозной пневмонии, кандидоза и саркомы Капоши у них было расценено как оппортунистические заболевания. СПИД окрестили болезнью четырех “H”— по первым буквам английских вариантов слов гомосексуалы, гемофилия, гаитяне и героин. В 1986г. был идентифицирован еще один вирус — ВИЧ-2.
Окончательного ответа на вопрос о месте, времени и условиях возникновения ВИЧ нет. Ретроспективные исследования показали циркуляцию этого вируса по крайней мере с конца 50-х — начала 60-х годов. Прародительницей ВИЧ считают тропическую Африку, где широко распространен ВИО (близкородственный ВИЧ-2) среди обезьян. Первые известные серологические находки ВИЧ отмечены в Африке, здесь же — наибольшая интенсивность передачи ВИЧ наиболее естественным гетеросексуальным путем. Однако эпидемическое распространение ВИЧ — инфекция получила с конца 70-х — начала 80-х годов. В 1987г. выявлен первый случай в России, в настоящее время счет идет на десятки тысяч инфицированных в год. В мире регистрируют десятки миллионов инфицированных ВИЧ в год, ежегодно число вновь инфицированных увеличивается, т.е. налицо пандемия ВИЧ — инфекции.
Структура вириона ВИЧ.
ВИЧ имеет сферическую форму и размеры 100-120 нм в диаметре. Наружная оболочка образована двойным липидным слоем с гликопротеиновыми “шипами”, состоящими из трансмембранного белка gp41 (пронизывает липидный слой) и наружного белка gp120. Эти оболочечные белки кодируются геном env и участвуют в прикреплении вириона к мембранам клеток хозяина. С внутренней стороны липидной оболочки находится матричный каркас, образованный белком р17. Он окружает внутреннюю структуру вириона — нуклеокапсид или сердцевину (англ. — core). Собственная оболочка сердцевины образована “коровским” белком р24. Внутри нуклеокапсида находится геном вируса в виде двух цепочек, связанных белками р7 и р9, полимеразный комплекс ревертазы, протеаза, интеграза (эндонуклеаза), затравочная т — РНК. Наиболее распространен ВИЧ-1, который в зависимости от строения гена env имеет субтипы. Субтипы A-H составляют доминирующую группу M (major), наиболее распространены субтипы С и Е.
Жизненный цикл ВИЧ.
Инфекционный процесс при заражении ВИЧ носит последовательный фазовый характер и начинается с проникновения вируса через слизистую оболочку половых путей или с непосредственного поступления в кровоток. Проникнув в организм, вирус в первую очередь атакует клетки, имеющие специфичный для него рецептор CD4. Этот рецептор имеют в большом количестве Т — хелперы, в меньшем — макрофаги и моноциты, нейроны, клетки нейроглии и некоторые другие клетки (см. лекции по общей иммунологии). Вирус распознает CD4 — рецепторы с помощью своего белка gp120. Процесс инфицирования клетки вирусом осуществляется в два этапа : прикрепления и слияния. Прикрепленный через белок gp120 к рецептору CD4 клетки — мишени вирус белком оболочки gp41 сливается с мембраной клетки. Белок gp41 обеспечивает не только слияние вирусной и клеточной мембран, но и слияние мембран клеток с образованием синцития (многоядерных клеток), обреченного на гибель. Нуклеокапсид, освобожденный от суперкапсида при слиянии мембран, попадает в цитоплазму. На пути к ядру освобождается геномная РНК и ассоциированные с ней компоненты сердцевины. Обратная транскриптаза синтезирует на вирионной РНК минус — цепь ДНК, РНК-аза разрушает вирионную РНК, а вирусная ДНК — полимераза синтезирует на минус — цепи плюс — цепь ДНК.
Двунитевая ДНК транспортируется в ядро клетки, где приобретает кольцевую форму и интегрируется под действием эндонуклеазы (интегразы) с ядром клетки, превращаясь в ДНК — провирус.Последующие этапы жизненного цикла ВИЧ — латентная фаза, фаза активации транскрипции с ДНК- провируса и последующая трансляция белков вируса, наработка компонентов вируса и формирование новых вирионов, их выход из клетки, сопровождающийся цитопатическим эффектом для клетки — мишени.
ДНК — провирус может длительно находиться в неактивном состоянии (персистентное инфицирование). В этот период вирус можно выявить только с помощью ПЦР. Активация транскрипции особым ядерным фактором в результате действия иммунокомпетентных клеток или микробных антигенов приводит к продуктивной фазе — активному размножению ВИЧ. Факторы экспрессии генов ВИЧ — специфические антигены (прежде всего — герпес — вирусы), неспецифические митогены (фитогемагглютинин), цитокины (фактор некроза опухолей, интерфероны, гамма — интерферон), бактериальные иммуномодуляторы (фосфолипиды сальмонелл), глюкокортикостероиды.
Антигенные свойства ВИЧ.
Функция обратной транскриптазы не подвергается контролю, что обусловливает высокую частоту генетических ошибок при репликации и мутации структурных белков вируса. С учетом частоты изменчивости ни один ВИЧ не производит при репликации вирион, в точности соответствующий родительскому. Высокая генетическая изменчивость реализуется в вариабельности антигенных и биологических свойств ВИЧ. Высокой изменчивостью характеризуется продукт гена env — оболочечный белок gp120, особенно петлеобразный V3 — домен (из 35 аминокислот), к которому образуется до 90-95% всех вируснейтрализующих антител.
ВИЧ-1 и ВИЧ-2 имеют существенные отличия в строении, гомология первичной структуры геномов составляет только около 42%, перекрестного иммунитета между этими вирусами нет. Антигенными свойствами обладают все основные структурные элементы вириона, прежде всего — белки. Исключительная генетическая и антигенная изменчивость позволяет вирусу выживать в инфицированном организме.
Наряду с генетическими особенностями, ВИЧ-1 имеет фенотипические различия по ряду свойств — эффективности репликации, характеру цитопатического действия и способности образовывать синцитий (этот признак связан с вирулентностью), преимущественному тропизму к клеткам — моноцитотропные изоляты (начальные этапы болезни) и лимфотропные изоляты (разгар болезни).
Патогенез СПИДа.
Рецептором для ВИЧ является дифференцировочный антиген CD4, имеющий гомологичные участки с иммуноглобулинами и белком gp120 ВИЧ. Расположенный на мембранах Т- хелперов и Т- индукторов, рецептор CD4 в комплексе с белками HLA II класса выполняет функцию распознавания антигенов. Фиксация вируса через gp120 ВИЧ-1 (или gp105 ВИЧ-2) с мембранным рецептором CD4 блокирует основную функцию этих иммунокомпетентных клеток — восприятие сигналов от антиген- представляющих клеток. Последующая репликация вируса ведет к гибели этих клеток и выпадению их функций, т.е. к развитию иммунодефицита. Чем активнее CD4+ клетки, тем активнее процесс репродукции вируса. ВИЧ угнетает преимущественно Т- хелперы -1 (связанные с многими цитокинами клеточного иммунитета), что способствует развитию вирусных инфекций и опухолей.
Сродство вирусного gp120 (gp105 в случае ВИЧ-2) к этому рецептору определяет высокую избирательность поражения клеток. В патологический процесс вовлекаются в первую очередь и в наибольшей степени CD4+ лимфоциты, моноциты крови и макрофаги тканей, дендритные клетки крови, лимфоузлов, селезенки, кожи, альвеолярные и интерстициальные макрофаги легких, микроглия и другие клетки нервной системы, имеющие CD4+ рецепторы. Поражаются также В- и 0- лимфоциты, ретикулярные клетки, эпителиальные клетки кишечника. Большое значение в распространении ВИЧ и длительному сохранению в организме придают клеткам Лангерганса.
В патогенезе ВИЧ — инфекции большое значение имеют механизмы иммунного повреждения. Наличие сходных участков в структуре белков gp120, HLA класса II и CD4 — рецепторов определяет перекрестное реагирование антител к ВИЧ с этими структурами с рядом патологических эффектов (блокада кооперации CD4+ лимфоцитов и HLA класса II, неадекватная стимуляция CD4+ клеток и др.).
Поражение иммунной системы при ВИЧ — инфекции носит системный характер, проявляясь глубокой супрессией Т- и В- звеньев иммунитета. Происходят изменения гиперчувствительности немедленного и замедленного типа, гуморального иммунитета и факторов неспецифической защиты. Наряду с дефицитом CD4+ лимфоцитов в динамике болезни нарастает функциональная недостаточность CD8+ лимфоцитов, NK клеток, нейтрофилов. Нарушение иммунного статуса проявляется рядом синдромов — инфекционным, аллергическим, аутоиммунным, лимфопролиферативным.
Манифестный синдром приобретенного иммунодефицита (СПИД) проявляется в трех основных клинических формах: нейроСПИД, онкоСПИД, инфектоСПИД (оппортунистические инфекции). Это зависит от путей внедрения ВИЧ, его преимущественного тропизма к CD4 Т- лимфоцитам или макрофагам, наличия кофакторов (цитомегаловирус, вирус Эпштейна- Барр), дозы инфекта, иммунного статуса организма и др.
В динамике ВИЧ- инфекции можно выделить следующие основные стадии: заражение, латентный период, появление лабораторных признаков инфекции, первичная клиника острой вирусной (ретровирусной) инфекции (эта стадия может отсутствовать), клинический СПИД (иммунодефицит плюс индикаторные болезни). Особое значение имеет выявление лабораторных признаков ВИЧ- инфекции.
Можно выделить три типа инкубации:
— вирусологическую ( от инфицирования до определения в крови вируса или его антигенов) — в среднем 2 — 4 недели;
— серологическую (от заражения до сероконверсии — появления положительных серологических результатов) — в среднем 8 — 12 недель;
— СПИД — инкубацию (равно или более 10 лет). Безусловный иммунологический критерий СПИДа — снижение CD4+ лимфоцитов до 200 клеток в микролитре.
Лабораторная диагностика.
Лабораторная диагностика ВИЧ — инфекции методически базируется на ИФА, иммуноблоте и ПЦР. Основными ее направлениями являются:
— выявление антител к ВИЧ;
— выявление ВИЧ или его антигенов;
— определение изменений в иммунном статусе.
Для выявления антител применяют ИФА с различными тест — системами (лизатными, рекомбинантными, пептидными антигенами ВИЧ-1 и ВИЧ-2). Основная проблема — ложноположительные результаты (перекрестная реактивность gp120, CD4+ рецепторов, белков HLA II класса и др.). Поэтому исследования в ИФА проводят как правило с использованием параллельно нескольких различных тест — систем.
Иммуноблот чаще применяют как подтверждающий тест для выявления антител к отдельным белкам ВИЧ. Антитела к основным внутренним белкам (р17, р24) обнаруживают у 70% инфицированных и примерно у половины больных СПИДом. В иммуноблоте чаще всего выявляются антитела к gp41 (до 85%) и gp160 (до 100%).
В ранние сроки используют выявление в ИФА антигена р24. Наиболее чувствительным методом выявления ВИЧ является ПЦР — диагностика.
Основным клинико — лабораторным показателем диагностики СПИДа у ВИЧ — инфицированных является определение количества CD4+ лимфоцитов. Уровень ниже 200 клеток/мкл является основным критерием СПИДа.
Лечение является одним из наиболее актуальных и до настоящего времени не решенных проблем ВИЧ — инфекции. Теоретически наиболее оправдано применение препаратов, ингибирующих обратную транскрипцию — зидовудин, азидотимидин, диданозин, ставудин и др. Вакцины против ВИЧ находятся в стадии разработки. С учетом высокой изменчивости вируса это очень сложная задача.
studfiles.net
Вирус иммунодефицита человека (ВИЧ) — Вирусы — Каталог
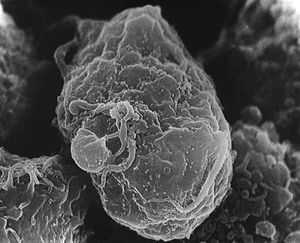 |
Изображение, сделанное растровым электронным микроскопом. В центре кадра находится заражённый T-лимфоцит. Многочисленные светлые круглые выпуклости на его поверхности — места сборки и отпочковывания вирионов вируса иммунодефицита человека |
Вирус иммунодефицита человека (ВИЧ) — ретровирус из рода лентивирусов, вызывающий ВИЧ-инфекцию.
ВИЧ поражает клетки иммунной системы, имеющие на своей поверхности рецепторы CD4: Т-хелперы, моноциты, макрофаги, клетки Лангерганса, дендритные клетки, клетки микроглии.
В результате работа иммунной системы угнетается и развивается синдром приобретённого иммунного дефицита(СПИД), организм больного теряет возможность защищаться от инфекций и мение опасных вирусов, возникают вторичные оппортунистические заболевания, которые не характерны для людей с нормальным иммунным статусом. Таким образом организм инфицированного человека становится полностью не способным к защите от внешних угроз, ввиду отсутствия реакции иммунитета.
Эти заболевания вызывают смерть пациента в среднем через 9—11 лет после заражения (в зависимости от подтипа вируса), но только в случае если не проводится антиретровирусная терапия.
Открытие ВИЧ
Не так давно в 1981 году появились две научные статьи о необычных случаях развития пневмоцистной пневмонии и саркомы Капоши у гомосексуальных мужчин. До этого оба заболевания встречались редко и были характерны для совершенно разных групп пациентов: саркомой Капоши в основном болели пожилые мужчины средиземноморского происхождения, а пневмоцистной пневмонией — пациенты с лейкозом после интенсивной химиотерапии.
Появление этих заболеваний, свидетельствующих о тяжёлом иммунодефицитном состоянии, у молодых людей, не входящих в соответствующие группы риска, наблюдалось впервые. Затем обнаружили такие же симптомы среди наркопотребителей, больных гемофилией A и гаитян. Также было обнаружено, что все пациенты имели очень низкое количество CD4-положительных иммунных клеток.
А уже в июле 1982 года для обозначения этого состояния был предложен термин синдро приобретённого иммунного дефицита (СПИД, AIDS). В сентябре 1982 года СПИДу было дано полноценное определение на основании наблюдения ряда оппортунистических инфекций у четырёх групп пациентов, указанных выше.
В период с 1981 по 1984 год вышло несколько работ, связывающих вероятность развития СПИДа с анальным сексом или с влиянием наркотиков. Параллельно велись работы над гипотезой о возможной инфекционной природе СПИДа.
Вирус иммунодефицита человека независимо открыли в 1983 году в двух лабораториях: Институте Пастера во Франции под руководством Люка Монтанье и Национальном институт рака в США под руководством Роберта Галло.
Результаты исследований, в которых из тканей пациентов впервые удалось выделить новый ретровирус, были опубликованы 20 мая 1983 года в журнале Science. В этих статьях исследователи сообщили об обнаружении нового вируса, который французская группа исследователей назвала LAV («вирус, ассоциированный с лимфаденопатией»), а американская группа назвала его HTLV-III, ошибочно отнеся его к группе HTLV-вирусов. Исследователи выдвинули предположение, что вирус может вызывать синдром приобретенного иммуного дефицита.
4 мая 1984 года исследователи сообщили о выделении вируса, носившего на тот момент название HTLV-III, из лимфоцитов 26 из 72 обследованных больных в стадии СПИДа и 18 из 21 больного в стадии пре-СПИДа. Ни у кого из 115 здоровых гетеросексуальных индивидов контрольной группы вирус обнаружить не удалось.
Исследователи отметили, что малый процент выделения вируса из крови больных вызван малым количеством Т4-лимфоцитов, в которых размножается вирус. Были обнаружены антитела против вируса HTLV-III, в структуре HTLV-III были идентифицированы антигены, ранее описанные для HTLV-I и HTLV-II, также в структуре HTLV-III были обнаружены антигены, не характерные для HTLV-I и HTLV-II. Было показано размножение вируса HTLV-III в популяции лимфоцитов.
В 1986 году было обнаружено, что вирусы, открытые в 1983 французскими и американскими исследователями, генетически идентичны. Первоначальные названия вирусов были упразднены и предложено одно общее название — вирус иммунодефицита человека.
В 2008 году Люк Монтанье и Франсуаза Барр-Синусси были удостоены Нобелевской премии в области физиологии или медицины «за открытие вируса иммунодефицита человека».
Классификация
Как уже упоминалось вирус иммунодефицита человека относят к семейству ретровирусов (Retroviridae), роду лентивирусов (Lentivirus). Название Lentivirus происходит от латинского слова lente — медленный.
Такое название отражает одну из особенностей вирусов этой группы, а именно — медленную и неодинаковую скорость развития инфекционного процесса в макроорганизме. Для лентивирусов также характерен длительный инкубационный период.
Для вируса иммунодефицита человека характерна высокая частота генетических изменений, возникающих в процессе самовоспроизведения.
Размер генома ВИЧ составляет примерно 104 нуклеотидов. Из этого следует, что практически каждый вирион вируса хотя бы на один нуклеотид отличается от своего предшественника.
В природе ВИЧ существует в виде множества квазивидов, являясь при этом одной таксономической единицей. В процессе исследования ВИЧ были обнаружены варианты, которые значительно отличались друг от друга по структуре генома.
В современной классификации различают два основных типа — ВИЧ-1 и ВИЧ-2.
Эти вирусы предположительно возникли в результате независимой передачи людям SIV (вируса иммунодефицита обезьян) шимпанзе и мангабеев соответственно.
И ВИЧ-1, и ВИЧ-2 способны вызывать серьёзный иммунодефицит, однако клиническое течение болезни несколько различается. Известно, что ВИЧ-2 менее патогенен и передается с меньшей вероятностью, чем ВИЧ-1. Вероятно, это связано с тем, что ВИЧ-2-инфекция характеризуется более низким числом вирусных частиц на миллилитр крови. Отмечено, что инфекция ВИЧ-2 обеспечивает носителю небольшую защиту от заражения ВИЧ-1.
Однако описаны случаи двойной инфекции, причём заражение может происходить в любом порядке. Инфекция ВИЧ-2 реже заканчивается развитием СПИД. Есть сведения о несколько большей частоте развития саркомы Капоши, кандидоза ротовой полости и хронической лихорадки при ВИЧ-1/СПИД. При ВИЧ-2/СПИД чаще развивается энцефалит, хроническая или бактериальная диарея, серьёзные цитомегаловирусные инфекции и холангит.
ВИЧ-1
ВИЧ-1 описан в 1983 году и является наиболее распространённым и патогенным типом ВИЧ. ВИЧ-1 классифицируют на главную группу М и несколько побочных групп. Считается, что группы M, N, O, P образовались в результате независимых случаев передачи SIV от обезьяны к человеку, и последующей мутации вируса до ВИЧ.
- Вирусы группы М являются причиной более 90 % случаев ВИЧ-инфекции. Группу М классифицируют на несколько клад, называемых подтипами, также обозначаемых буквами:
- Подтип A широко распространён в Западной Африке;
- Подтип B доминирует в Европе, Северной и Южной Америке, Японии, Тайланде, Австралии;
- Подтип C преобладает в Южной и Восточной Африке, Индии, Непале, некоторых частях Китая;
- Подтип D обнаружен только в Восточной и Центральной Африке;
- Подтип E не был выявлен в нерекомбинантном виде, лишь совместно с подтипом А как CRF01_AE.;
- Подтип F выявлен в Центральной Африке, Южной Америке и Восточной Европе;
- Подтип G и рекомбинантная форма CRF02_AG выявлены в Африке и Центральной Европе;
- Подтип H обнаружен только в Центральной Африке;
- Подтип I был предложен для описания штамма-продукта множественной рекомбинации CRF04_cpx нескольких подтипов;
- Подтип J распространён в Северной, Центральной и Западной Африке и Карибском бассейне;
- Подтип K обнаружен только в Конго и Камеруне.
- Группа N обозначает штаммы не М и не О, описана в 1998 году и обнаружена только в Камеруне. С 2006 года выявлены лишь 10 заражений вирусами группы N.
- Группа O (англ. Outlier) обнаружена в Центральной и Западной Африке. Наиболее распространена в Камеруне, где в 1997 году более 2 % пациентов были заражены вирусом группы О. Вирусы этой группы не определялись ранними версиями тест-систем на ВИЧ-1, современные тесты определяют вирусы и группы О, и группы N.
- Группа P — в 2009 году была определена нуклеотидная последовательность РНК ВИЧ, значительно сходная с вирусом иммунодефицита обезьян, описанным у горилл (SIVgor), но не с SIV, характерным для шимпанзе (SIVcpz). Вирус был выделен из образцов, полученных от женщины камерунского происхождения, проживающей во Франции.
ВИЧ-2
ВИЧ-2 идентифицирован в 1986 году, генетически очень близок к T-лимфотропному вирусу SIVsmm мангабеев, и в меньшей степени к вирусу ВИЧ-1. Геномы ВИЧ-1 и ВИЧ-2 имеют гомологию консервативных генов gag и pol около 60 %, и до 45 % генов белков оболочки.
По состоянию на 2010 год, описано 8 групп ВИЧ-2, лишь группы A и B являются эпидемическими. Вирусы группы А распространены в Западной Африке, Анголе, Мозамбик, Бразилии, Индии и малораспространены в США и Европе. Вирусы группы В распространены в Западной Африке.
В 1986—88 годы были описаны редкие разновидности ВИЧ (ВИЧ-3 и ВИЧ-4), которые в настоящее время не классифицируют как самостоятельные типы или штаммы. ВИЧ-3 не реагировал с антителами против других известных групп, а также обладал значительными отличиями в структуре генома, современное наименование этой разновидности — ВИЧ-1 группа O.
Глобальная эпидемия ВИЧ-инфекции главным образом обусловлена распространением ВИЧ-1. В подавляющем большинстве случаев, если не оговорено иначе, под ВИЧ подразумевают ВИЧ-1.
Происхождение
 |
Филогенетическое дерево вирусов: |
Методом молекулярной филогении показано, что вирус иммунодефицита человека образовался в конце девятнадцатого или в начале двадцатого века.
Оба типа вируса иммунодефицита человека ВИЧ-1 и ВИЧ-2 возникли в Западной и Центральной Африке южнее Сахары и передались от обезьян к людям в результате зоонозиса.
ВИЧ-1 возник на юге Камеруна в результате эволюции эндемичного вируса иммунодефицита обезьян SIV-cpz, который заражает диких шимпанзе подвида Pan troglodytes troglodytes.
ВИЧ-1, как полагают, перешёл видовой барьер по крайней мере трижды и породил три группы вирусов: M, N и О.
ВИЧ-2 возник на территории Западной Африки (от южного Сенегала до запада Берега Слоновой Кости) в результате эволюции вируса иммунодефицита обезьян SIV-smm, который заражает тёмно-коричневых мангабеев (Cercocebus atys) и узконосых обезьян.
Существует доказательство того, что охотники на диких животных (обезьян) или поставщики мяса в Западной и Центральной Африке подвергаются заражению вирусом иммунодефицита обезьян, причём вероятность заражения коррелирует с частотой взаимодействия с обезьянами и их мясом.
Однако вирус иммунодефицита обезьян — слабый вирус, и, как правило, подавляется иммунной системой человека в течение недели после заражения. Считается, что необходимо несколько передач вируса от человека к человеку в быстрой последовательности, чтобы вирусу хватило времени мутировать в ВИЧ.
Хотя передача вируса иммунодефицита обезьян от человека к человеку происходит редко, определённые социальные факторы могут существенно влиять на частоту заражений. Предполагают, что условия для распространения вируса были неблагоприятны в Африке до XX века. Сопоставление периодов ускоренной эволюции ВИЧ с социо-экономическими изменениями позволяет делать предположения о природе факторов, ускоривших распространение ВИО и ВИЧ.
Генетические исследования показывают, что последний общий предок ВИЧ-1 группы М существовал около 1910 года. Сторонники этой даты связывают распространение ВИЧ с развитием колониализма в Африке и ростом больших городов. Эти факторы привели к таким социальным изменениям в обществе, как увеличение частоты беспорядочных половых связей, распространение проституции и заболеваний, передающихся половым путём (ЗППП).
ЗППП, такие как сифилис, могут сопровождаться генитальными язвами. Исследования показывают, что вероятность передачи ВИЧ во время вагинального полового акта, достаточно низкая при обычных условиях, может быть увеличена в десятки, если не в сотни раз, если один из партнёров страдает от генитальных язв.
О степени распространённости ЗППП в колониальных городах в начале 1900-х можно судить по следующим цифрам: в 1928 году по меньшей мере 45 % жительниц восточного Леопольдвиля (ныне —Киншаса, ранний центр распространия ВИЧ группы М) были проститутками, а в 1933 году около 15 % всех жителей этого же города были заражены одной из форм сифилиса. Ретроспективный анализ показал, что начало эпидемии ВИЧ-инфекции в Киншасе совпало с пиком эпидемии генитальных язв в середине 1930-х годов.
Альтернативная точка зрения гласит, что основным фактором, способствовавшим адаптации ВИЧ к людям и его распространению, была небезопасная медицинская практика в Африке в годы после Второй мировой войны, такая как использование нестерильных многоразовых шприцов при массовых вакцинациях, инъекциях антибиотиков и противомалярийных средств.
В результате ретроанализа образцов крови взятых после Второй мировой войны зафиксирован самый ранний документальный случай наличия ВИЧ в организме человека, кровь у которого взяли в 1959 году. Вирус, возможно, присутствовал в Соединённых Штатах уже в 1966 году, но подавляющее большинство случаев заражения ВИЧ, идентифицированных за пределами тропической Африки, можно проследить до одного неустановленного человека, который заразился ВИЧ на Гаити, а затем перенес инфекцию в США около 1969 года.
Устойчивость к ВИЧ
Описаны случаи устойчивости людей к ВИЧ. Проникновение вируса в клетку иммунной системы связано с его взаимодействием с поверхностным рецептором, белком CCR5, делеция (утеря участка гена) CCR5-дельта32 приводит к невосприимчивости её носителя к ВИЧ.
Предполагается, что эта мутация возникла примерно две с половиной тысячи лет назад и со временем распространилась в Европе.
Сейчас к ВИЧ фактически устойчив в среднем 1 % жителей Европы, 10—15 % европейцев имеют частичную сопротивляемость к ВИЧ.
Учёные Ливерпульского университета объясняют распространение мутации гена CCR5 тем, что она усиливает сопротивляемость к бубонной чуме. Эпидемия «чёрной смерти» 1347 года (а в Скандинавии ещё и 1711 года) способствовала увеличению частоты этого генотипа в Европе. Мутация в гене CCR2 также уменьшает шанс проникновения ВИЧ в клетку и приводит к задержке развития СПИДа.
Существует небольшой процент ВИЧ-положительных людей (около 10 %), у которых СПИД не развивается в течение долгого времени. Их называют нонпрогрессорами.
Обнаружено, что одним из главных элементов антивирусной защиты человека и других приматов является белок TRIM5a, способный распознавать капсид вирусных частиц и препятствовать размножению вируса в клетке.
TRIM5a человека и шимпанзе несколько отличаются друг от друга и эффективны против разных вирусов: этот белок защищает шимпанзе от ВИЧ и родственных ему вирусов, а человека — от вируса PtERV1. Обезьяны Нового Света, за исключением мирикины, которая имеет химерный ген TRIM5-CypA, устойчивостью к ВИЧ не обладают.
Другой важный элемент антивирусной защиты — интерферон-индуцируемый трансмембранный белок CD317/BST-2 (англ. bone marrow stromal antigen 2) CD317 — трансмембранный белок 2го типа с необычной топологией — трансмембранный домен рядом с N-концом и гликозилфосфатидилинозитол (GPI) на С-конце; между ними расположен внеклеточный домен.
Показано, что CD317 непосредственно взаимодействует со зрелыми дочерними вирионами, «привязывая» их к поверхности клетки. Для объяснения механизма такого «привязывания» предложено четыре альтернативных модели, согласно которым две молекулы CD317 формируют параллельный гомодимер; один или два гомодимера связываются одновременно с одним вирионом и клеточной мембраной. При этом с мембраной вириона взаимодействуют либо оба мембранных «якоря» (трансмембранный домен и GPI) одной из молекул CD317, либо один из них.
Спектр активности CD317 включает, по крайней мере, четыре семейства вирусов: ретровирусы, филовирусы, аренавирусы и герпесвирусы. Активность данного клеточного фактора ингибируется белками Vpu ВИЧ-1, Env ВИЧ-2 и SIV, Nef SIV, гликопротеином оболочки вируса Эбола и белком К5 герпесвируса саркомы Капоши.
Обнаружен кофактор белка CD317 — клеточный белок ВСА2 (Breast cancer-associated gene 2; Rabring7, ZNF364, RNF115) — Е3 убиквитин-лигаза класса RING. BCA2 усиливает интернализацию вирионов ВИЧ-1, «привязанных» белком CD317 к клеточной поверхности, в CD63+ внутриклеточные везикулы с их последующим разрушением в лизосомах.
Ретроциклин — это кольцевой 18-звенные пептид, обладающий антимикробной активностью. У человека этот пептид закодирован псевдогеном тета-дефензина и его экспрессия невозможна из-за наличия стоп-кодона в сигнальной последовательности. Пептид, соответствующий ретроциклину, синтезирован искусственно и обладает интересными биологическими свойствами — ингибирует репликацию штаммов R5 и X4 ВИЧ-1, специфически блокируя попадание вирусных частиц в клетку. Ретроциклин может иметь потенциал в качестве ингибитора слияния.
Лечение
Из 35 миллионов человек, живущих с ВИЧ-инфекцией, часть остаётся в живых благодаря антиретровирусной терапии.
В случае отсутствия антиретровирусной терапии ВИЧ-инфекции, смерть наступает в среднем через 9—11 лет после заражения. Антиретровирусные препараты мешают ВИЧ размножаться в клетках иммунной системы человека, блокируя внедрение вирионов в клетки и нарушая на разных этапах процесс сборки новых вирионов.
Своевременно начатое лечение антиретровирусными препаратами в сотни раз снижает риск развития СПИД и последующей смерти. Антиретровирусные препараты у части пациентов вызывают побочные эффекты, в некоторых случаях даже требующие сменить схему лечения (набор принимаемых лекарств).
Терапию назначают при снижении иммунитета и/или высокой вирусной нагрузке. В случае, если число CD4+ лимфоцитов велико и вирусная нагрузка низкая, терапию не назначают.
После назначения терапии лекарства нужно принимать ежедневно в одно и то же время и пожизненно, что создает неудобства для пациентов. Также следует учитывать высокую стоимость месячного курса лекарств. В 2014 необходимые лекарства получали менее половины из 9,5 млн человек, нуждающихся в противовирусной терапии.
По данным рандомизированных контролируемых исследований, все беременные женщины с острой фазой ВИЧ-инфекции, должны начинать незамедлительную ВААРТ для предотвращения передачи ВИЧ плоду.
Согласно рекомендациям ВОЗ, ВААРТ следует незамедлительно начинать всем ВИЧ-инфицированным детям до полутора лет. Начало терапии у детей, получивших ВИЧ от матери, в течение 3 месяцев после родов, снижает смертность на 75%. В отсутствие лечения, треть ВИЧ-инфицированных детей умирает в течение первого года жизни и 50% в течение второго года. В случае, когда диагостика ВИЧ невозможна, лечение следует начинать в возрасте 9 месяцев, либо ранее, в случае появления симптомов.
Хотелось бы обратить внимание на то, что до сегодняшнего дня не найдено методоа полного излечения от ВИЧ или СПИДа, так что будьте бдительны. Как избежать заражения смотрите в следующей статье.
virusolog.at.ua
Свойства вируса, пути передачи ВИЧ инфекции, первые симптомы заражения
 Аббревиатура ВИЧ обозначает – вирус иммунодефицита человека. Этот вирус является основной причиной приобретенной недостаточности функциональной активности иммунной системы, а именно ее клеточного звена. На сегодняшний день эта инфекция является очень распространенной и имеет тенденцию к дальнейшему увеличению числа случаев инфицирования.
Аббревиатура ВИЧ обозначает – вирус иммунодефицита человека. Этот вирус является основной причиной приобретенной недостаточности функциональной активности иммунной системы, а именно ее клеточного звена. На сегодняшний день эта инфекция является очень распространенной и имеет тенденцию к дальнейшему увеличению числа случаев инфицирования.
Вирус ВИЧ, виды и свойства
Вирус иммунодефицита человека является ретровирусом и относится к роду лентивирусов. Это РНК-содержащий вирус, его основной особенностью является процесс обратной транскрипции. Это означает, что при попадании в клетку, молекула РНК вируса под влиянием фермента обратной транскриптазы (ревертазы) превращается в ДНК, которое встраивается в геном. В процессе жизнедеятельности, клетка с вирусным ДНК в геноме начинает синтезировать новые РНК и капсулы вирусов, которые выходят из нее и заражают новые клетки.
Причем встроенный участок вирусной ДНК остается в клетке навсегда, длительное время ничем себя не проявляет и при этом не приводит к ее гибели. Эта особенность обуславливает то, что ВИЧ относится к медленным инфекциям, с прогрессированием инфекционного процесса в течение длительного периода (не менее 10 лет). Главным отличительным свойством ВИЧ является избирательность. Он способен поражать клетки, которые имеют на своей поверхности специфические рецепторы CD4, которые содержатся в клетках иммунитета – Т-лимфоциты, дендритные клетки (выполняют защитные функции в тканях нервной системы), тканевые макрофаги. Зараженные клетки с течением времени утрачивают способность к выполнению своей основной биологической функции – поддержке клеточного звена иммунитета. Выделяют 2 типа вируса иммунодефицита:
- Тип 1 – распространен на всех континентах.
- Тип 2 – встречается преимущественно в странах Центральной Африки.
Вирус иммунодефицита имеет сложное строение. Его генетический материал РНК покрыт белковой капсулой, которая укрыта слоем фосфолипидов (суперкапсид). Внутри вирусной капсулы находится фермент транскриптаза, который катализирует процесс превращения вирусной РНК в ДНК внутри клетки. Во внешней среде ВИЧ нестоек, быстро погибает под действием высоких и низких температур, солнечных лучей, дезинфицирующих растворов (перекись водорода, хлорная известь, спирт).
укрыта слоем фосфолипидов (суперкапсид). Внутри вирусной капсулы находится фермент транскриптаза, который катализирует процесс превращения вирусной РНК в ДНК внутри клетки. Во внешней среде ВИЧ нестоек, быстро погибает под действием высоких и низких температур, солнечных лучей, дезинфицирующих растворов (перекись водорода, хлорная известь, спирт).
Открытие вируса датируется 1981 годом, его обнаружили в Африке. На сегодняшний день существует несколько гипотез его появления – воздействие на непатогенный вирус предшественник неблагоприятной экологии с его последующей мутацией в ВИЧ, формирование вируса во время разработки биологического оружия. Мутация вируса под действием радиации, которая повышена в некоторых странах Африки в связи с большим количеством урановых руд, происхождение ВИЧ от вируса иммунодефицита обезьяны. Все эти гипотезы пытаются объяснить отсутствие упоминаний о заболевании, похожем на СПИД на протяжении всей истории человечества.
Что такое ВИЧ СПИД
ВИЧ инфекция – это заражение вирусом иммунодефицита, без развития основного заболевания. Состояние ВИЧ-инфицирования может длиться достаточно долго, без каких-либо клинических проявлений. СПИД – это синдром приобретенной недостаточности иммунитета (иммунодефицита), он развивается в разгар инфекции и характеризуется поражением значительного количества иммунокомпетентных клеток (макрофаги, лимфоциты). Признаки СПИДа заключаются в снижении активности иммунной системы, что проявляется развитием заболеваний, вызванных представителями условно-патогенной флоры или другими возбудителями, которые в нормальном состоянии иммунитет подавляет (оппортунистические инфекции). К таким инфекциям относятся:
- Кандидоз (молочница), вызванный условно-патогенным грибком рода Candida.
- Цитомегаловирусная инфекция.
- Инфекционный процесс, вызванный вирусом Эпштейна-Барр.
- Поражения кожи (множественные гнойнички).
- Пневмоцистная пневмония.
ВИЧ и СПИД разница заключается именно в наличии снижения иммунитета и развитии оппортунистических инфекций и другой патологии, связанной с иммунодефицитом (онкологический процесс).
Как заражаются ВИЧ инфекцией
Вирус иммунодефицита является парентеральной инфекцией. Пути заражения ВИЧ инфекцией включают:
- Половой путь передачи – вирус попадает в организм здорового человека при непосредственном контакте слизистых половых органов с зараженным партнером. Причем риск заражения выше у принимающей стороны, поэтому женщины во время классического полового контакта заражаются чаще. Еще выше риск при занятии анальным сексом, так как дополнительно происходит микроповреждение слизистой прямой кишки. Более безопасным является оральный секс, заражение возможно только при наличии травм или эрозий слизистой полости рта.
- Попадание вируса в кровь через шприц при использовании инъекционных наркотиков.
- Заражение во время выполнения различных медицинских процедур и манипуляций, сопряженных с нарушением целостности кожи или слизистых оболочек не продезинфицированным инструментарием.
- Переливание зараженной крови или ее компонентов.
- Вертикальный путь передачи – вирус передается от инфицированной матери плоду во время беременности (реже) или заражение ребенка происходит во время родов и последующего кормления грудным молоком.
 Фактором передачи ВИЧ являются биологические жидкости человека – сперма, грудное молоко, влагалищные выделения, кровь. Со слюной человека вирус не выделяется. Источник инфекции – больной (СПИД) человек или вирусоноситель (ВИЧ-инфицированный).
Фактором передачи ВИЧ являются биологические жидкости человека – сперма, грудное молоко, влагалищные выделения, кровь. Со слюной человека вирус не выделяется. Источник инфекции – больной (СПИД) человек или вирусоноситель (ВИЧ-инфицированный).
Разработка одноразового стерильного медицинского инструментария была продиктована необходимостью свести к минимуму возможности заражения ВИЧ во время выполнения различных медицинских манипуляций.
Вероятность заражения
Основным условием, которое способствует заражению, является количество вирусных частиц в биологической жидкости, с которой произошел контакт внутренней среды человека. Также на вероятность заражения влияют пути передачи:
Путь передачи | Вероятность заражения |
Анальный секс | 1% для принимающей стороны |
prof-med.info