Купити препарати для відновлення мікрофлори кишечника
Не всі мікроорганізми шкодять нашому організму, і доказ цьому — корисна мікрофлора кишечника. Вона сприяє перетравленню їжі і впливає на імунітет, допомагаючи організму відновитися після різних захворювань. Підібрати необхідний саме вам препарат може тільки лікар, враховуючи особливості вашого організму, щоб не погіршити ситуацію. Важливо пам’ятати, що деякі з цих бактерій все ж умовно патогенні, і в разі перевищення кількості, необхідного для правильного функціонування кишечника, теж можуть викликати хворобливі стани.
З чого складається мікрофлора кишечника
По всій травній системі розподілено кілька видів бактерій, які допомагають травленню і перешкоджають попаданню в організм патогенних мікробів. У кишечнику проживають кілька типів мікроорганізмів, але більшу частину з них займають такі три групи:
Основна:
- біфідобактерії. Захищають організм від колонізації і розмноження патогенних мікроорганізмів, поліпшують травлення, прискорюють обмінні процеси;
- лактобактерії.
 Проводять ферменти, які покращують розщеплення їжі, прискорюють відновлення слизової, беруть участь в синтезі вітамінів та інших обмінних процесах, виробляють речовини, що перешкоджають росту патогенних мікроорганізмів;
Проводять ферменти, які покращують розщеплення їжі, прискорюють відновлення слизової, беруть участь в синтезі вітамінів та інших обмінних процесах, виробляють речовини, що перешкоджають росту патогенних мікроорганізмів; - бактероїди. Знешкоджують токсичні речовини, стимулюють перистальтику кишечника, сприяють всмоктуванню води, перешкоджають поселенню шкідливих бактерій.
Супутня:
- ентерококи. Мають противірусну і протипухлинну активність, стимулюють імунну систему, знижують рівень холестеролу. Умовно патогенні, досить стійкі до антибіотиків, але не передають свій захист інших видів;
- кишкова паличка (різні штами).
Остаточна:
- стафілококи;
- протеї;
- гриби.
Причини дисбалансу кишкової мікрофлори:
- неправильне харчування;
- частий прийом алкоголю;
- неврози, стресовий стан;
- захворювання травної системи;
- прийом антибіотиків;
- деякі медичні маніпуляції.

Якими бувають препарати для відновлення мікрофлори
Для відновлення мікрофлори кишечника застосовують два типи речовин — пробіотики і пребіотики, а також їх всілякі комбінації. Пробіотики — це набір корисних мікроорганізмів, які повинні розмножуватися в організмі пацієнта, нормалізує його стан. Пребіотики — це харчові волокна, які людським організмом не засвоюються, але стають середовищем проживання корисної мікрофлори.
За складом можна виділити такі групи цих препаратів:
- Монокомпонентні (біфідумбактерин, діалакт, колибактерин). Складаються з одного конкретного штаму мікроорганізму, в якому зараз потребує кишечник.
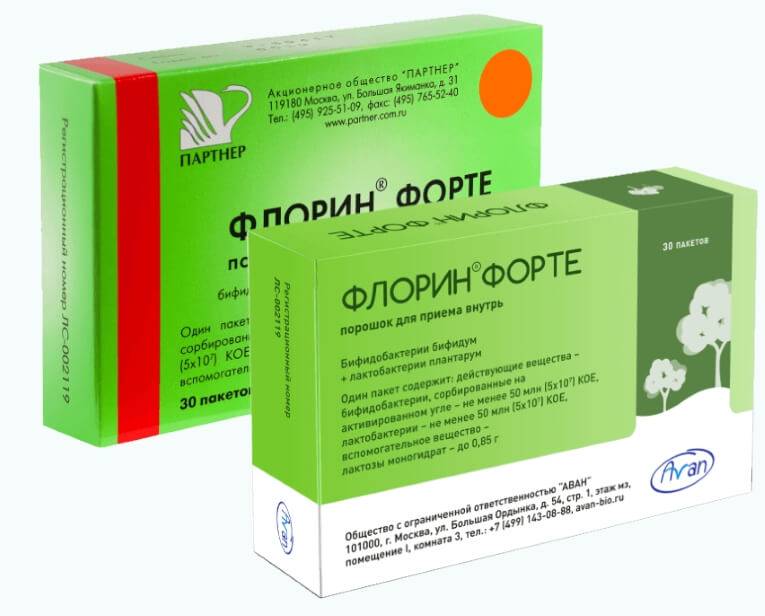
- Полікомпонентні-симбіотики (лінекс, біфікол, йогулакт). У їх складі скомбіновано кілька штамів мікрофлори, які підсилюють дію один одного.
- Комбіновані (біфіліз, аципол, кіпацид). Крім корисної мікрофлори містять речовини, що володіють імуномодулюючими властивостями.
- Пробіотики-антагоністи (бактисубтил, ентерожерміна, ентерол).
 Містять мікроорганізми, які в нормальному стані не знаходяться в організмі людини, проте перешкоджають розмноженню в ньому патогенних мікробів.
Містять мікроорганізми, які в нормальному стані не знаходяться в організмі людини, проте перешкоджають розмноженню в ньому патогенних мікробів. - Метаболічні пробіотики (хілак-форте, біофлор, гастрофарм). Містять продукти життєдіяльності корисної мікрофлори, які сприяють правильному травленню.
- Синбіотики (лінекс-форте, лактон-форте). У їх складі поєднуються пробіотики і пребіотики.
Іноді для відновлення організму одних цих препаратів недостатньо. Також можуть бути призначені вітаміни, гепатопротектори, в складних випадках — імуностимулятори.
Як замовити пробіотики в Аптеці Доброго Дня
Щоб замовити потрібні вам медикаменти, потрібно ввести назву препарату в рядку пошукати або вибрати зі списку на відповідній сторінці. Потім вибрати потрібну лікарську форму, дозування, кількість і оформити покупку. Після цього з вами зв’яжеться менеджер і уточнить всі деталі. На сайті діють регулярні акції. Замовити ліки в нашій аптеці по абсолютно доступними цінами можна з будь-якої точки України — Сум, Чернівців, Києва.
Линекс® экспертный подход к решению любых ситуаций для восстановления баланса микрофлоры
Москва. 30 июля 2015 г. Компания «Сандоз» расширяет линейку препаратов Линекс® — лидера безрецептурного портфеля компании и пробиотика №1 в России.*
Пробиотики являются одной из наиболее динамично развивающихся категорий на мировом фармацевтическом рынке. Связано это с тем, что характер питания населения развитых стран изменился: в рационе большинства современных горожан преобладают продукты, подвергшиеся рафинированию, термической обработке или замораживанию, генной модификации для улучшения вкусовых качеств и продления срока годности. Поэтому пробиотики – препараты, позволяющие поддерживать в норме состояние микрофлоры и здоровье желудочно-кишечного тракта – все чаще используются как в лечебных, так и в профилактических целях. Мировой рынок производства пробиотиков растет ежегодно на 7%.
Линекс® хорошо известен российским врачам и потребителям благодаря высочайшему качеству и широкой линейке препаратов, в которой каждый сможет найти для себя оптимальный вариант пробиотика. В июле 2015 году, помимо всеми любимого Линекс® и Линекс для детей®, линейка пополнилась новинкой — Линекс® Форте. Новинка содержит комплекс из 2-х наиболее изученных бактерий BB-12 и LA-5 в высокой концентрации,что позволяет принимать от одной капсулы в день. что особенно удобно для проведения курсов лечения.Входящие в состав препарата пробиотические штаммы подавляют рост патогенных бактерий и оказывают благотворное влияние на состав кишечной микробиоты (микрофлоры).
Нормальная микрофлора снижая активность болезнетворных микроорганизмов, подавляет патогенные, гнилостные и газообразующие бактерии. Кроме того представители кишечной микробиоты принимают участие в жировом и пигментном обмене, стимулируют иммунную систему, принимают активное участие в переваривании пищи.
По словам директора по корпоративным связям компании «Сандоз» Юрия Головатчика, новинка станет значимым подспорьем в лечении ряда болезней:
«В состав пробиотика Линекс® Форте в суточной дозировке входят 2 хорошо изученные бактерии, являющие представителями нормальной микрофлоры кишечника — лакто- и бифидобактерии. Бактерии, содержащиеся в капсулах Линекс® Форте, нормализуют и поддерживают физиологический баланс кишечной микрофлоры во всех отделах кишечника. Линекс® Форте показан для профилактики и лечения дисбактериоза кишечника, симптомами которого могут быть диарея, запоры, нарушение пищеварения, тошнота, метеоризм, отрыжка и кожные аллергические реакции».
Бактерии, содержащиеся в капсулах Линекс® Форте, нормализуют и поддерживают физиологический баланс кишечной микрофлоры во всех отделах кишечника. Линекс® Форте показан для профилактики и лечения дисбактериоза кишечника, симптомами которого могут быть диарея, запоры, нарушение пищеварения, тошнота, метеоризм, отрыжка и кожные аллергические реакции».
Д.м.н., профессор, заведующая кафедрой пропедевтики детских болезней Педиатрического факультета Первого Московского государственного медицинского университета (Первого МГМУ) им. И.М. Сеченова, Светлана Ильинична Эрдес отметила: «Кишечник не напрасно называют «вторым мозгом» человека. Наше здоровое состояние во многом зависит от микрофлоры кишечника, основы основ слаженной работы организма. Именно поэтому пробиотики препараты, дающие возможность поддерживать в норме бактериальный состав кишечника – так важны в жизни современного человека. Погрешности в питании, стресс, прием антибиотиков и множество других факторов могут привести к нарушению состава кишечной микробиоты. Широкая линейки Линекс® позволяет подобрать каждому пациенту подходящий для него робиотик в любой ситуации нарушения микрофлоры!
Широкая линейки Линекс® позволяет подобрать каждому пациенту подходящий для него робиотик в любой ситуации нарушения микрофлоры!
О компании «Сандоз»
Компания «Сандоз», дженериковое подразделение группы компаний «Новартис», является лидером в отрасли воспроизведенных лекарственных средств и постоянно стремится к повышению уровня доступности высококачественной медицинской помощи для пациентов. «Сандоз» располагает штатом свыше 26 000 сотрудников по всему миру. Компания поставляет широкий спектр доступных по цене лекарственных препаратов пациентам в разных странах мира.
Достигнув объема продаж в 9,6 млрд. долларов США в 2014 г. и обладая портфелем лекарственных средств, состоящим из более чем 1100 химических соединений, компания «Сандоз» занимает лидирующую позицию в мире как в области биоаналогов, так и на рынке противоинфекционных и офтальмологических дженериков, а также дженериков применяемых в трансплантологии. Кроме того, компания «Сандоз» является одним из мировых лидеров на рынке дженериков в таких ключевых терапевтических областях как: инъекционные и дерматологические препараты, препараты для лечения заболеваний дыхательной, центральной нервной, сердечно-сосудистой и пищеварительной систем, метаболических нарушений и болевых синдромов.
Компания «Сандоз» разрабатывает, производит и продает лекарственные средства, а также фармацевтические и биотехнологические активные субстанции действующих веществ. Около половины портфеля препаратов «Сандоз» состоит из различных категорий лекарственных средств, более сложных в разработке и производстве, чем стандартные дженерики.
Начиная с 2003 года, когда компания консолидировала различные направления производства дженериков под брендом «Сандоз», мы наблюдаем высокий естественный рост бизнеса за счет увеличения продаж. В дополнение к этому, рост обусловлен рядом целевых приобретений, которые компания «Сандоз» осуществила в различных регионах и направлениях бизнеса, в том числе «Гексал» (Германия), «Эбеве Фарма» (Австрия) и «Фуджера Фармасьютикалс» (США).
Компания «Сандоз» представлена в Twitter. Подписывайтесь на новости компании по ссылке http://twitter.com/Sandoz_Global.
**По продажам в упаковках по данным ООО “АЙ ЭМ ЭС Хэлс”, январь-декабрь 2014
Amann R, Fuchs BM.
 Nat Rev Microbiol 2008; 6:339.
Nat Rev Microbiol 2008; 6:339.Zhao L. Nature Review. Microbiology, Sept 2013; 11:639-47
O’Hara AM&Shanahan F. Best Practice / Research Clinical Gastroenterology 2014; 28:585-97
Приказ N 231 от 9 июня 2003 г. Об утверждении отраслевого стандарта «Протокол ведения больных. Дисбактериоз кишечника»
Пре- и пробиотики для здорового пищеварения
В педиатрической практике детские пребиотики и пробиотики назначают для достижения лечебной и профилактической цели. Лекарства имеют схожие названия, но характеризуются некоторыми отличиями в своем воздействии на пищеварительный тракт. Пробиотики и пребиотики назначают для восстановления активности органов ЖКТ. При наличии показаний, препараты этой группы рекомендуют принимать детям, начиная с первых дней жизни. Назначение дает педиатр, неонатолог, гастроэнтеролог или инфекционист, что зависит от вида нарушения пищеварения, первопричины развития такового.
Что такое пробиотики и пребиотики
Пробиотики – это препараты, необходимые для нормального функционирования незрелого детского пищеварительного тракта. Они заселяют кишечник микрофлорой извне, обеспечивают временный эффект, не всегда совместимы с эндогенной микрофлорой. Всего 10% от принятой дозировки пробиотиков достигает кишечника, преодолевая кислотность желудочного сока и ферменты пищеварительного тракта. Состав – живые клетки полезной микрофлоры кишечника.
Они заселяют кишечник микрофлорой извне, обеспечивают временный эффект, не всегда совместимы с эндогенной микрофлорой. Всего 10% от принятой дозировки пробиотиков достигает кишечника, преодолевая кислотность желудочного сока и ферменты пищеварительного тракта. Состав – живые клетки полезной микрофлоры кишечника.
Пребиотики стимулируют рост естественной кишечной микрофлоры, содержат компоненты, которые служат пищей для полезных микроорганизмов, присутствующих в органах ЖКТ. Попадая в пищеварительный тракт, вещества этой лекарственной группы не перевариваются. Они депонируются внутри кишечника, характеризуются более стойким клиническим и бактериологическим эффектом.
Пребиотики выполняют такие действия:
- Способствуют очищению стенок кишечника от патогенной слизи.
- Ускоряют процесс размножения кишечной микрофлоры.
- Способствуют регенерации стенок кишечника.
- Предотвращают развитие запора, невзирая на первопричину такового.

- Удерживают кислотность желудка в норме.
- Купируют процесс размножения, роста патогенных микроорганизмов (холерных вибрионов, сальмонелл).
- Нормализуют кишечную перистальтику.
Действуя совместно, пробиотики и пребиотики для детей представляют ценность относительно восстановления пищеварения и нормализации общего состояния здоровья.
Пробиотики усиливают барьерную функцию кишечника. Они модифицируют токсические компоненты, которые продуцируют патогенные микроорганизмы. Пробиотики изменяют уровень кислотности в кишечнике, создают неблагоприятные условия для активности болезнетворных возбудителей.
Виды пробиотиков
Пробиотики для детей до года и детей постарше классифицируются по поколениям:
1. Препараты 1 поколения: в эту группу входят варианты, содержащие бактерии только одного вида – лакто- или бифидобактерии.
2. Препараты 2 поколения: к этой категории относятся варианты, изготовленные на основе споровых бактерий и дрожжеподобных грибков, хотя эти микроорганизмы нетипичны для кишечника.
3. Препараты 3 поколения: в этой группе находятся средства, которые содержат одновременно несколько вариантов полезных бактерий.
4. Препараты 4 поколения: к этой категории пробиотиков относятся варианты, закрепленные на сорбенте.
Также в педиатрической практике пробиотики классифицируют с учетом их состава. Он может содержать бактерию Escherichia Coli, энтерококки, дрожжеподобные грибки, лактобактерии, бифидобактерии, сахаромицеты.
Пробиотики разделяются в зависимости от формы выпуска. Лекарства этого вида изготавливают в виде капсул, раствора или порошка, предназначенного для приготовления суспензии. Также существуют детские молочные смеси, содержащие пробиотики и пребиотики. Такое питание можно употреблять новорожденным до 1 года, которые страдают нарушениями пищеварения, сопряженными с развитием дисбактериоза.
Показания к назначению пробиотиков и пребиотиков детям
Прием пробиотиков назначают в тех случаях, когда возникли следующие состояния:
- Запор, вызванный нарушением кишечной микрофлоры.
- Глистная инвазия.
- Пищевая аллергия.
- Кишечная инфекция.
- Отравление.
- Колит (воспаление толстой кишки).
- Энтерит (поражение тонкой кишки).
Также препараты этой группы назначают в рамках детского лечения от анемии, ферментопатии, синдрома раздраженного кишечника. Пробиотики восстанавливают защитные силы организма, выполняют выраженное иммуномодулирующее действие. Лекарства, насыщенные полезными бактериями, хорошо восстанавливают кишечную микрофлору, пострадавшую вследствие длительной и/или интенсивной терапии антибиотиками. В педиатрической практике назначают детское питание с пробиотиками и пребиотиками или рекомендуют прием полезных бактерий в виде препаратов.
Пробиотики и пребиотики для новорожденных
Для восстановления кишечной микрофлоры у детей, специалисты назначают такие препараты:
- Ротабиотик-бэби. Прием этого средства рекомендован в тех случаях, когда нужно выбрать наиболее подходящие пробиотики для кишечника для детей до года. Лекарство изготовлено с добавлением экстракта ромашки лекарственной и фенхеля. Также в составе присутствуют живые лакто- и бифидобактерии. Свойства препарата – нормализующее (кишечную микрофлору), антисептическое, ветрогонное (способствует безболезненному отхождению газов).
- Бифиформ Бэби. Хороший препарат, действие которого направлено на устранение дисбактериоза у малышей с аллергией на лактозу. Имеет форму маслянистого раствора, в крышке флакона находится порошок с полезными бактериями. Упаковка с препаратом дополняется мерной пипеткой, предназначенной для точного расчета разовой дозировки. Состав средства – бифидобактерии, молочнокислый стрептококк.
 Лимонная кислота, сахар, подсолнечное масло, красители, ароматизаторы – отсутствуют. Бифиформ Бэби входит в группу пробиотиков 5 поколения, его назначают для лечения малышей, начиная с первых дней жизни.
Лимонная кислота, сахар, подсолнечное масло, красители, ароматизаторы – отсутствуют. Бифиформ Бэби входит в группу пробиотиков 5 поколения, его назначают для лечения малышей, начиная с первых дней жизни. - Нормофлорин. Биодобавка обладает выраженным терапевтическим эффектом. Входит в список эффективных пробиотиков, поскольку восстанавливает кишечную микрофлору, нарушенную вследствие воспаления органов пищеварительного тракта. Новорожденным это средство следует принимать по 0,5 ч. л., 3 раза в сутки. Детям до 6 лет Нормофлорин нужно употреблять принимать по 1 ч. л.
- Линекс детский. Имеет форму капсул, содержит бифидо- и лактобактерии, а также вещества, которые стимулируют процесс их размножения. Средство можно принимать одновременно с антибиотиками, поскольку на фоне антибактериального лечения всегда нарушается кишечная микрофлора. Средство относится к группе пробиотиков 3 поколения.
- Колибактерин. Купирует активность патогенной микрофлоры, улучшает функцию органов пищеварительного тракта.
 Препарат не используют в педиатрической практике, когда возраст малыша не превышает полугода. Колибактерин относится к пробиотикам 1 поколения.
Препарат не используют в педиатрической практике, когда возраст малыша не превышает полугода. Колибактерин относится к пробиотикам 1 поколения. - Энтерол. Средство предназначено для приема детьми старше 1 года, содержит сахаромицеты. Имеет положительные отзывы, характеризуется терапевтической эффективностью в отношении устранения детской диареи, что объясняется уникальным составом препарата. Если возраст малыша не превышает 3 лет, Энтерол нужно принимать по 1 пакетику в сутки, на протяжении 3-5 дней.
- Хилак Форте. Полезный препарат, действие которого направлено на восстановление кишечной микрофлоры, улучшение состояния пищеварения. Средство выпускают в форме раствора. Приятный вишневый вкус консистенции предотвращает потенциально возможные неудобства, связанные с нежеланием малыша проходить лечение. Показания к назначению – кандидоз кишечника, сальмонеллез, отравление. Лекарство рассчитано на прием 3 раза в сутки, по 15-30 капель, если терапию проходит новорожденный, и по 20-40 капель, когда кишечную микрофлору нужно восстановить детям до 6 лет.

- Максилак Бэби. Синбиотик, который содержит 9 полезных пробиотических бактерий и пребиотик. Максилак Бэби можно принимать детям старше 4 месяцев. Средство имеет форму гранул, предназначенных для приготовления суспензии. Средняя продолжительность курса – 10 дней, за 1 день можно принимать не более 2 пакетиков препарата (зависит от возраста малыша).
- Лактобаланс. Пробиотик предназначен для приема детьми старше 3 лет. Содержит бифидо- и лактобактерии. Препарат следует принимать по 1 капсуле, продолжительность употребления средства зависит от причины, по которой назначен этот вид лечения. Особенность Лактобаланса заключается в грамотном, безопасном составе пробиотика. Он не содержит производные казеина и молока, что делает средство приемлемым для употребления в тех случаях, когда у малыша непереносимость лактозы.
- Бифидум БАГ. Средство предназначено для употребления детьми, начиная с первого дня жизни. Быстро устраняет кишечные колики и другие проблемы, связанные с пищеварением.
 Состав пробиотика – автолизат дрожжей, бифидобактерии, аминокислоты, анаэробные микроорганизмы. Бифидум БАГ можно принимать при расстройстве пищеварения, которое вызвано аллергией, поскольку препарат не содержит лактозу, казеин, синтетические добавки. Новорожденным пробиотик назначают по 2 мл в сутки для лечения, по 1 мл – для профилактики. Для детей до 6 лет оптимальная дозировка – от 2 до 10 мл.
Состав пробиотика – автолизат дрожжей, бифидобактерии, аминокислоты, анаэробные микроорганизмы. Бифидум БАГ можно принимать при расстройстве пищеварения, которое вызвано аллергией, поскольку препарат не содержит лактозу, казеин, синтетические добавки. Новорожденным пробиотик назначают по 2 мл в сутки для лечения, по 1 мл – для профилактики. Для детей до 6 лет оптимальная дозировка – от 2 до 10 мл. - Аципол Малыш. Препарат назначают для восстановления процесса пищеварения, устранения диареи, нормализации дефекации. Дополнительное свойство – уменьшение степени выраженности симптомов пищевой аллергии у ребенка. Средство характеризуется комплексным составом, который представлен высокой концентрацией бифидо- и лактобактерий. Аципол Малыш не содержит лактозы, глютена. Препарат имеет форму раствора, разовую и суточную дозировку нужно рассчитывать по каплям. Средний терапевтический курс – 2 недели, но на этот показатель влияет возраст малыша и причина, по которой назначен прием пробиотиков.

Конкретный пробиотик и пребиотик может назначить педиатр. Он учтет возраст ребенка, причину появления проблем с пищеварением, степень их выраженности и стадию развития, особенности состояния детского организма. Важно не прекращать терапевтический курс при первичном улучшении состояния здоровья малыша – нужно пройти полный курс лечения.
Правила приема пробиотиков для детей
Чтобы восстановить кишечную микрофлору и достичь терапевтического эффекта, препараты с полезными бактериями и детские смеси с пробиотиками нужно принимать правильно:
- Прием препарата не должен противоречить особенностям состояния детского организма.
- Пробиотики противопоказано запивать горячей водой, поскольку при высокой температуре каждый полезный микроорганизм лекарства погибает.
- Лечебный продукт допустимо употреблять от 1 до 6 раз, что зависит от особенностей принимаемого средства.
- Пробиотик должен соответствовать возрасту малыша.

- Во время курса восстановления кишечной микрофлоры, родителям нужно контролировать стул ребенка. Это позволит оценить эффективность проводимого лечения, пользу конкретного средства.
- Для закрепления терапевтического эффекта, детский рацион также нужно наполнить продуктами, насыщенными пробиотиками.
- Когда малыш проходит курс, направленный на восстановление кишечной микрофлоры, в его рацион нельзя вводить новые продукты, в случае с питанием новорожденных – прикормы.
- Самые полезные пробиотики – те, которые содержат живые культуры.
Родителям нужно понимать, что если ребенок проходит курс восстановления кишечной микрофлоры, рацион должен быть максимально легким – переедание противопоказано.
Пробиотики и пребиотики – это уникальные препараты, которые гарантированно восстанавливают кишечную микрофлору, независимо от причины ее нарушения. Несмотря на положительные свойства этих средств, их нельзя принимать без получения назначения от специалиста.
Неприятное знакомство с дисбактериозом: как правильно восстановить микрофлору кишечника?
Человеческий организм подобен дереву, корни которого находятся… в кишечнике! А ведь дерево вряд ли будет здоровым, если его корни больны. Так и организм не может функционировать нормально при плохой работе кишечника. От его состояния зависит иммунитет, обмен веществ и оптимальный режим работы органов и систем. Стремительный современный ритм жизни, стрессы на работе, еда на ходу, малоподвижный образ жизни, самолечение антибиотиками часто приводят к нарушению работы желудочно-кишечного тракта. Жертвой благ цивилизации становится в том числе кишечник, развивается дисбактериоз. Сегодня этот термин означает изменение баланса в составе нормальной микрофлоры толстого кишечника. Простыми словами, нарушение этого баланса приводит к тому, что полезных микроорганизмов в кишечнике становится меньше, а вредных — больше. О том, как правильно восстановить это хрупкое равновесие и пойдет речь далее.
В кишечнике здорового человека обитает более 500 видов микроорганизмов: бифидобактерии, лактобактерии, непатогенная кишечная палочка и многие другие, формирующие сложную самоорганизующуюся, саморегулирующуюся и саморазвивающуюся экосистему. Среди основных функций нормальной кишечной микрофлоры выделяют: защитную — предупреждение колонизации кишечника патогенной и условно-патогенной микрофлорой; ферментопродуцирующую — осуществление гидролиза клетчатки, крахмала, белков, жиров, деконъюгации желчных кислот и др.; синтетическую — синтез витаминов группы В, аскорбиновой кислоты, холестерина, мочевой кислоты, органических кислот и др.; иммунизирующую — поддерживание синтеза иммуноглобулинов, опосредованного созревания и функционирования иммунокомпетентных органов (Кривущев Б.И., 2010).
При нарушении равновесия микрофлоры в кишечнике развивается дисбактериоз. Ведущая роль в его формировании принадлежит нарушению популяционного уровня бифидо- и лактобактерий. Условно-патогенные бактерии, колонизирующие слизистую оболочку кишечника, при этом вызывают нарушение всасывания углеводов, жирных кислот, аминокислот, азота, витаминов, конкурируют с микроорганизмами полезной флоры за участие в ферментации и усвоении питательных веществ, поступающих с пищей. Продукты метаболизма и токсины, продуцируемые условно-патогенными бактериями, снижают детоксикационную способность печени, усугубляют симптомы интоксикации, подавляют регенерацию слизистой оболочки, угнетают перистальтику и обусловливают развитие диспептического синдрома (Юлиш Е.И., Кривущев Б.И., 2011). Ввиду вышесказанного восстановление микрофлоры кишечника — актуальная и важная задача, с которой под силу справиться пробиотикам. Однако их ассортимент в аптеках сегодня весьма широк. Какому же препарату отдать предпочтение?
ЛАКТОВИТ ФОРТЕ — РАЦИОНАЛЬНОЕ РЕШЕНИЕ ПРИ ДИСБАКТЕРИОЗЕ
Среди лекарственных средств, применяющихся для лечения дисбактериоза кишечника, особое место занимает ЛАКТОВИТ ФОРТЕ от компании «Мили Хелскере Лтд.» (Великобритания). В 1 капсуле ЛАКТОВИТ ФОРТЕ содержится 120 млн спор Lactic Acid Bacillus (Bacillus coagulans (Lactobacillus sporogenes)), а также витамины: 1,5 мг фолиевой кислоты (витамин В9) и 15 мкг цианокобаламина (витамин В12). Следует отметить, что на украинском фармацевтическом рынке отсутствуют аналоги ЛАКТОВИТ ФОРТЕ по составу. Среди особенностей данного лекарственного средства стоит выделить следующие.
Устойчивость бактерий к кислой среде желудка. Благодаря тому, что L. sporogenes, входящие в состав ЛАКТОВИТ ФОРТЕ, находятся в форме спор, они выживают и сохраняют активность после прохождения через агрессивную среду желудка, в отличие от других форм лактобактерий, и успешно доходят до двенадцатиперстной кишки, где трансформируются в живые вегетативные формы, способные восполнить дефицит нормальной микрофлоры (Юлиш Е.И., Кривущев Б.И., 2011).
Препятствие размножению патогенных бактерий и стимуляция развития полезной микрофлоры. Терапевтический эффект ЛАКТОВИТ ФОРТЕ определяют L. sporogenes, вырабатывающие L(+)-молочную кислоту и способствующие угнетению роста и размножения патогенной флоры (сальмонеллы, шигеллы, клостридии, стрептококки). L(+)-молочная кислота создает оптимальную кислотность среды для развития нормальной микрофлоры кишечника и обладает антибактериальными свойствами (Аряев Н.Л., Кожевин Р.В., 2011). Из-за высокой концентрации маннозы на клеточной мембране L. sporogenes потенциально патогенные и патогенные бактерии прочно прилипают к ним благодаря лектиновым рецепторам (адгезинам), что обеспечивает антимикробный антагонизм к Helicobacter pylori, Clostridium difficile, Pseudomonas aeruginosa, Salmonela spp., Klebsiela spp . и др. Этот механизм также предупреждает прилипание микроорганизмов к слизистой оболочке желудка и кишечника, а значит, обеспечивает профилактику развития хеликобактериоза, антибиотикассоциированной диареи и инфекционноассоциированых расстройств пищеварения различного генеза (Бекетова Г.В., Ибрагим К.М.А., 2012). Следует отметить, что L. sporogenes также обладают иммуномодулирующим свойством (Юлиш Е.И., Кривущев Б.И., 2011).
Восстановление слизистой оболочки кишечника. L. sporogenes, содержащиеся в препарате ЛАКТОВИТ ФОРТЕ, активируют ферментативное расщепление белков, жиров и сложных углеводов и благодаря выделению витаминов группы В и L(+)- молочной кислоты способствуют улучшению репаративных процессов в слизистой оболочке кишечника (Юлиш Е.И., Кривущев Б.И., 2011). Дополнительное содержание витаминов В12 и В9 в составе ЛАКТОВИТ ФОРТЕ также обусловливает восстановление слизистой оболочки желудочно-кишечного тракта, кроме того, обеспечивая устранение анемии, часто встречающейся при инфекционных процессах.
Пролонгированный эффект.L. sporogenes не колонизируют слизистую оболочку кишечника и постепенно выводятся из желудочно-кишечного тракта, оказывая пролонгированный терапевтический эффект после окончания их приема (Аряев Н.Л., Кожевин Р.В., 2011). В то же время тот факт, что вегетативные формы L. sporogenes, будучи факультативными анаэробами, не остаются в кишечнике во время репарации нормальной микрофлоры человека, позволяет избежать риска внедрения в эубиоз (состояние динамического равновесия) генетически чужеродных штаммов бактерий (Квашнина Л.В., Родионов В.П., 2012).
Удобство применения. У взрослых и детей в возрасте старше 6 мес препарат применяют 2 раза в сутки за 40 мин до еды. Разовая и суточная дозы определяются в зависимости от возраста пациента, как правило, кратность применения — 1 капсула 2 раза в день.
КОМУ РЕКОМЕНДОВАТЬ ЛАКТОВИТ ФОРТЕ?
ЛАКТОВИТ ФОРТЕ рекомендован для лечения взрослых и детей в возрасте старше 6 мес, у которых отмечают хронические колиты различной этиологии, заболеваний, сопровождающихся дисбактериозами, которые возникли на фоне применения антибиотиков, сульфаниламидных препаратов. Препарат также предназначен для лечения пациентов с нарушениями со стороны кишечника, которые перенесли острые кишечные инфекции, вызванные патогенными и условно-патогенными бактериями.
Поэтому ЛАКТОВИТ ФОРТЕ подойдет прежде всего тем, кто жалуется на такие распространенные симптомы дисбактериоза, как вздутие живота (метеоризм), периодическая режущая или тянущая боль в животе, тяжесть и дискомфорт после еды, тошнота, отрыжка, горечь во рту, расстройства стула (диарея или запор), урчание в животе. Его применение также будет особо актуальным при возникновении дисбактериоза после приема антибиотиков, которые оказывают токсическое воздействие на слизистую оболочку кишечника.
Ввиду того, что осенне-зимний период по праву считается сезоном острых респираторных инфекций, на фоне которых многие прибегают к антибиотикотерапии, следует побеспокоиться о пополнении товарного запаса лекарственного средства ЛАКТОВИТ ФОРТЕ на аптечной полке.
Пресс-служба «Еженедельника АПТЕКА»
ЛактовитЦікава інформація для Вас:
Как восстановить микрофлору кишечника • Причины, симптомы и признаки нарушения микрофлоры
Миллиарды полезных бактерий, живущих в ЖКТ человека, делают незаметную, но нужную работу. От чего возникает дисбактериоз и можно ли восстановить микрофлору кишечника?
«Миллиарды» – это не преувеличение, а преуменьшение. Биологи подсчитали, что в кишечнике здорового человека проживает примерно 50 триллионов микроорганизмов. Хотя человек может жить с нарушениями микрофлоры ЖКТ или даже при полном ее отсутствии, это считается отклонением от нормы. Также нежелателен дисбаланс между разными микроорганизмами или преобладание патогенных видов. Поэтому важно поддерживать здоровье кишечника и его обитателей – и речь здесь не столько о лечении, сколько о правильном питании и образе жизни.
Что такое микрофлора кишечника
Микрофлора кишечника – это совокупность всех микроорганизмов, которые живут в ЖКТ здорового человека. При этом в желудке их намного меньше, поскольку кислая среда неблагоприятна для большинства бактерий. Большая часть микрофлоры сосредоточена в тонком и толстом кишечнике. В основном это – лактобациллы, бифидобактерии и бактероиды. Полезные бактерии в кишечнике помогают организму усвоить питательные вещества, которые не переварились в желудке. Кроме этого, микрофлора кишечника тренирует иммунную систему человека
Причины нарушения микрофлоры кишечника
В очень редких случаях микрофлора кишечника исчезает полностью. Гораздо чаще врачи сталкиваются с уменьшением количества нужных видов микроорганизмов и ростом патогенной флоры. Произойти это может по нескольким причинам:
- пищевое или химическое отравление;
- хронические заболевания ЖКТ;
- инфекционное заболевание;
- лечение антибиотиками или иными подавляющими микрофлору препаратами.
Это состояние врачи называют дисбактериозом или дисбиозом кишечника. Важно понимать, что это не самостоятельная болезнь, а синдром. Поэтому правильнее лечить первопричину, а не сам дисбактериоз.
Симптомы и признаки нарушения микрофлоры кишечника
Даже сегодня микрофлора кишечника изучена недостаточно. Например, ученые до сих пор не могут ответить на вопрос: почему нарушение ее состава у одних людей протекает тяжело, а у других – бессимптомно и без ухудшения самочувствия. Так или иначе, предположить нарушение микрофлоры ЖКТ можно по следующим клиническим проявлениям:
- боль или чувство распирания в животе;
- диарея и/или метеоризм;
- ухудшение аппетита.
Диагностировать нарушение микрофлоры кишечника сложно, поскольку у каждого человека она уникальна. Поэтому врач будет в первую очередь искать причину дисбактериоза, а именно – заболевание, которое могло к этому привести.
Как восстановить микрофлору кишечника народными средствами
К сожалению, достоверных исследований, которые бы показали действенность альтернативной медицины в данном случае, нет. Нормализовать микрофлору кишечника можно лишь опосредованно: улучшая качество жизни. Речь идет не только о правильном питании, но и о физических активностях, отказе от вредных привычек и др. В частности, рацион с высоким содержанием растительных волокон (фрукты, овощи, злаки) благоприятно влияет на микрофлору кишечника, поскольку некоторые бактерии питаются клетчаткой.
Восстановление микрофлоры после антибиотиков
После приема некоторых лекарств (в частности, антибиотиков) в микрофлоре кишечника может наблюдаться дисбаланс. Например, место убитых лекарствами лактобактерий могут занять грибковые культуры или протеи, на которых антибиотики не действуют. Непосредственного лечения, позволяющего быстро восстановить микрофлору кишечника, современная медицина предложить не может. Чаще всего микрофлора приходит в норму самостоятельно, через некоторое время после отмены антибиотиков. Как долго придется ждать? Как правило, несколько недель. По результатам анализов врач дополнительно может назначить средства, подавляющие патогенную флору (например, противогрибковые препараты).
К сожалению, широко рекламируемые пробиотики и препараты с лакто– и бифидобактериями не имеют доказанной эффективности. Проблема в том, что полезные микроорганизмы невозможно доставить туда, где они нужны, живыми. Так, двенадцатиперстная кишка человека содержит агрессивные пищеварительные ферменты, которые убивают большинство микроорганизмов. Поэтому до кишечника «полезные бактерии в капсулах» просто не доходят.
Какие продукты восстанавливают микрофлору кишечника
Важно понимать, что какими бы полезными не были продукты, в кишечник они попадают в полностью переваренном состоянии. И однозначно говорить, например, что кефир улучшает микрофлору за счет содержания полезных бактерий, не совсем верно. Поэтому после отравления, диареи или иного расстройства ЖКТ необходимо, в первую очередь, снизить нагрузку на организм, придерживаясь определенной диеты.
Вот пример лечебного питания, назначаемого при заболеваниях кишечника:
| Можно | Нельзя |
|---|---|
| Сухари из белого хлеба (без добавления сахара, соли и специй) | Сдобные мучные изделия, черный хлеб, пирожные |
| Супы на обезжиренном бульоне или овощном отваре | Наваристые мясные бульоны, грибные супы |
| Нежирные сорта мяса и птицы в виде отварных и паровых блюд | Жирное мясо и рыбу, жареные блюда, колбасы, соленая рыба и икра |
| Каши на воде (рис, греча, овсянка, манка) | Перловка, макароны, бобовые |
| Творог и кисломолочные продукты | Цельное молоко и сливки |
| Свежие или печеные фрукты без кожуры (в том числе в виде пюре) | Фрукты и овощи, содержащие много грубой клетчатки (капуста, морковь, груши, абрикосы) |
| Кисели, желе, отвар шиповника, разбавленные ягодные соки | Газированные напитки, алкоголь, кофе |
Несмотря на то, что сырые фрукты и овощи надо вводить в меню аккуратно, полностью отказываться от них нельзя. Помимо содержания необходимых витаминов, клетчатка стимулирует перистальтику, что может уберечь от запора. А вот отвары лечебных трав без рекомендации врача принимать не стоит.
Читайте также:
Идеи для быстрого и здорового перекуса
Как правильно выбрать хороший мед
Кролик с овощами: рецепт для пароварки
Дисбактериоз кишечника: симптомы, коррекция и лечение дисбиоза у взрослых и детей, степени, анализы и профилактика
Дисбактериозом (дисбиоз) называют симптоматическое состояние, характеризующееся нарушением микрофлоры кишечника. В кишечнике в этот момент размножаются патологические бактерии, и нарушается естественный микробный баланс.
Причины дисбактериоза
Существуют различные предпосылки и состояния, которые способны привести к развитию дисбактериоза:
- заболевания органов ЖКТ,
- прием лекарственных препаратов, нарушающих микрофлору кишечника (антибиотики),
- неправильное питание,
- физиологические возрастные изменения,
- прием гормональных препаратов,
- курсы лучевой и химиотерапии,
- стрессы и неправильный режим дня,
- пищевые отравления,
- инфекционные процессы в организме.
Банальные респираторные инфекции или аллергические заболевания могут стать причиной нарушения микрофлоры кишечника, так как в этот период пациенту могут назначаться различные лекарственные препараты, негативно влияющие на микробный баланс.
Как понять, что у вас дисбиоз?
На разных стадиях заболевания симптоматика дисбактериоза различна. Специалисты рекомендуют обращать внимание на следующие проявления:
- отрыжка,
- тошнота,
- урчащие звуки в животе,
- вздутие и метеоризм,
- ноющие или режущие боли в области живота,
- запоры либо диарея и жидкий стул,
- сухость кожных покровов,
- неприятный привкус и запах изо рта,
- утомляемость и нарушение сна.
Наличие одного или нескольких перечисленных симптомов – повод обратиться к врачу.
Диагностика дисбактериоза
Самостоятельно диагностировать состояние дисбактериоза невозможно. Поставить точный диагноз способен только опытный специалист, который обследует пациента при помощи лабораторных методов и специальной аппаратуры. Обратившись за медицинской помощью, пациент проходит обследование, которое включает:
- исследования мочи и кала,
- ПЦР-диагностику микрофлоры,
- визуальный осмотр кожных покровов.
Профилактика дисбактериоза
Развитие заболевания можно предотвратить, если внимательно следить за питанием, избегать стрессовых состояний, соблюдать режим сна и отдыха, не употреблять необоснованных лекарственных препаратов, занимаясь самолечением, контролировать состояние органов желудочно-кишечного тракта.
Что будет, если не лечить дисбактериоз?
Если не лечить дисбиоз, заболевание может перейти в более тяжелую форму, и не исключено появление осложнений. В результате этих процессов в кишечнике будут образовываться токсические вещества, которые с кровотоком будут разнесены по всем органам и тканям. Всасывание и усвоение минералов и витаминов будет нарушено, иммунитет организма ослабнет, и защитные свойства значительно снизятся. Пациент будет легко подвержен различным инфекциям, банальное расстройство кишечника может привести к серьезным заболеваниям, лечение которых нередко требует оперативного вмешательства.
Как вылечить дисбактериоз?
При лечении дисбактериоза важнейшим шагом становится лечение основного заболевания, которое вызвало патологию в кишечнике пациента. Затем проводится терапия по восстановлению микрофлоры кишечника, наиболее правильно подбирать препараты на основе лабораторных исследований посева.
Диета при дисбактериозе
В период лечения и для предупреждения рецидивов необходимо исключить употребление жирного, острого, соленого, жареного, не пить алкоголь. Питание должно быть сбалансированным и щадящим, в рационе должны присутствовать кисломолочные продукты.
Проконсультироваться о диагностике и лечении дисбактериоза и записаться к специалисту вы можете, позвонив в нашу клинику или записавшись через форму на сайте.
УЗНАТЬ ЦЕНЫ
новинки от «Эвалар» для поддержания баланса микрофлоры
Здоровый кишечник – здоровый организм: новинки от «Эвалар» для поддержания баланса микрофлоры
Что, нужно, чтобы быть здоровым? Крепкий иммунитет? Смотрите глубже!
И наш иммунитет, и здоровье всего организма в целом зачастую зависят всего от одной вещи: состояния микрофлоры кишечника.
Помимо иммунитета, баланс микрофлоры влияет на работу желудочно-кишечного тракта и других внутренних органов, усвоение витаминов, обмен веществ и набор лишнего веса, состояние и внешний вид кожи и волос и даже – на наше настроение!«Привести в порядок» организм, поддержать оптимальный баланс микрофлоры кишечника и сохранить здоровье помогут новые препараты от компании «Эвалар».
«Примасорб»: очищение и поддержание иммунитета
«Примасорб» — уникальный1 комплексный препарат, сочетающий в себе свойства энтеросорбента и пребиотика. Он способствует не только очищению от токсинов и аллергенов, которые каждый день накапливаются в нашем организме, но и поддержанию здоровой микрофлоры.
«Примасорб» содержит:
- Диоксид кремния – природное вещество, натуральный сорбент. Проходит через желудочно-кишечный тракт в неизменном виде, «захватывая» и надежно удерживая вредные вещества и токсины. Затем полностью выводится из организма.
- Яблочный пектин и инулин – растворимые пищевые волокна. Действуют и как сорбенты, и как пребиотики, то есть способствуют росту собственной полезной микрофлоры кишечника, а также снижению уровня холестерина в крови.
Преимущества «Примасорб»
1. Усиленная формула: три сорбента (диоксид кремния, инулин, пектин) работают более эффективно, чем препараты на основе одного действующего компонента
2. Не содержит ароматизаторов, красителей, консервантов
3. Короткий курс приема: 5 дней, 1-2 пакета на прием
4. Жидкая форма препарата позволяет решить сразу 2 проблемы: очистить организм и поддержать водный баланс
5. Выгодная цена по сравнению с аналогами2
6. Высокое качество ингредиентов, изготовленных в Германии, Бельгии и Франции
«Мультифлора»: симбиотик нового поколения
«Мультифлора» — это симбиотический препарат нового поколения для поддержания здоровой микрофлоры кишечника. Он содержит и пробиотик (инулин) для роста собственной микрофлоры, и пребиотики – 7 видов живых бифидо- и лактобактерий для увеличения массы полезных микроорганизмов в кишечнике.
Благодаря своему комплексному составу, «Мультифлора» способствует:
- устранению симптомов диареи и раздраженного кишечника
- улучшению пищеварения
- укреплению иммунитета
- поддержанию и восстановлению микрофлоры
Чем еще отличается «Мультифлора»?
- Не нужно хранить в холодильнике – инновационная оболочка позволяет сохранять живые бактерии при температуре до 25ºС
- Подходит для всей семьи – взрослым и детям с 3-х лет
- Удобство применения – 1 раз в день
- Экономичность — 1 упаковки хватает на 2-4 недели приема
Произведено «Эвалар» по международному стандарту GMP: гарантия высокого качества, соответствующего строжайшим мировым требованиям.
1 В ассортименте ЗАО «Эвалар».2 По данным apteka.ru. Для сравнения выбраны препараты, схожие по действию и основным действующим компонентам.
Влияние подготовки кишечника на микробиом и метаболом кишечника человека
Дизайн исследования, условия и участники
Восемь субъектов (5 мужчин; средний возраст 32,8 года; средний индекс массы тела (ИМТ) 21,1), которым была назначена подготовка к кишечнику были набраны из Национального центра глобального здравоохранения и медицины (NCGM), Токио, Япония. Данные с образцами ДНК 23 контрольных субъектов, которые не подвергались процедуре (5 мужчин; средний возраст 22,0 года; средний ИМТ 20,2), были получены из опубликованной статьи 13 .Исходные характеристики показаны в дополнительной таблице 4. Ни у одного из субъектов не было какого-либо основного заболевания, или он не лечился антибиотиками, иммунодепрессантами или антацидами в течение предшествующих 3 месяцев. Это исследование было одобрено этическим комитетом Национального центра глобального здравоохранения и медицины Японии (разрешение № 2014) и было выполнено в соответствии с положениями Хельсинкской декларации. Письменное информированное согласие было получено от всех участников этого исследования.
Сбор образцов в группе подготовки кишечника и контрольной группе
В группе подготовки кишечника мы собрали 24 образца кала до, во время и после подготовки кишечника (рис. 5). Все образцы в группе подготовки кишечника были собраны в нашей больнице с использованием полипропиленовых пробирок и сохранены при -80 ° C в течение 15 минут после дефекации до момента проведения анализа. Вкратце, образцы фекалий собирали перед введением слабительных и подготовкой кишечника (день 0). Затем испытуемые ели коммерческую пищу с низким содержанием остатков и принимали слабительные, в составе которых 0.67–1,0 мл гидрата пикосульфата натрия (Laxoberon; Teijin Pharma Co., Ltd., Токио, Япония) и 12 мг сеннозида (Sennoside; Sawai Pharma Co., Ltd., Осака, Япония) на ночь за один день до подготовки кишечника (Day 0). Утром следующего дня (день 1) испытуемые прошли подготовку кишечника с помощью 2-литрового раствора для лаважа большого объема (Magcorol P; Horii Pharma Industries, Ltd., Осака, Япония, содержащий цитрат магния 68 г) 14 , выпить в течение 4 ч. Образцы фекалий собирали сразу же при первой дефекации после перорального приема большого объема лаважа (день 1).Колоноскопию планировалось провести после 13:00. Образцы кала были собраны через 14 дней после подготовки кишечника.
Рисунок 5Время взятия пробы кала в группе подготовки кишечника и контрольной группе.
В контрольной группе было собрано 46 образцов кала в день 0 и день 14 (рис. 5). Свежесобранные фекалии транспортировали в лабораторию в анаэробных условиях в AnaeroPack (Mitsubishi Gas Chemical Company, Inc., Токио, Япония) при 4 ° C, немедленно замораживали в жидком азоте в фосфатно-солевом буфере, содержащем 20% глицерина, и хранили. при −80 ° C до анализа 13 .
В обеих группах испытуемых специально просили не менять свою диету, и ни один из испытуемых не принимал никаких антибиотиков, антацидов или пробиотиков в течение периода исследования.
Экстракция бактериальной ДНК и секвенирование ампликона гена 16S рРНК
Для выделения фекальной бактериальной ДНК мы использовали метод ферментативного лизиса с лизоцимом (Sigma-Aldrich Co., Сент-Луис, Миссури) и ахромопептидазой (Wako Pure Chemical Industries, Ltd, Осака, Япония) для всех субъектов, как описано ранее 13 .Для амплификации участков V3 – V4 бактериального гена 16S рРНК мы использовали прямой праймер для ПЦР ампликона 16S (5′-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG-3 ‘) и последовательность обратного праймера 16S ампликона PCRATGATGATGATGATGATGATGATGATGATGAT (5′-GTGACGTCGACTGACT для последовательностей 5’-GTGCGTCGCCGACT для ампликона 16S) Индексирование Illumina. ПЦР проводили в течение 25 циклов с использованием набора KAPA HiFi HotStart ReadyMix PCR Kit (Nippon Genetics Co., Ltd, Токио, Япония). Ампликоны очищали с помощью гранул для магнитной очистки AMPure ® XP (Beckman Coulter, Inc., Бреа, Калифорния) и количественно определено с помощью 4200 TapeStation (Agilent Technologies Japan, Ltd., Токио, Япония). Равные количества ампликонов из всех образцов секвенировали с помощью системы MiSeq (Illumina, Inc., Tokyo Japan) в соответствии с инструкциями производителя 13 . В контрольной группе мы повторно проанализировали последовательность 16S рРНК в области V3-V4 таким же образом, как и для группы подготовки кишечника из консервированных образцов ДНК, и не использовали какие-либо ранее полученные данные 13 .
Метаболомный анализ
Мы провели времяпролетную масс-спектрометрию с капиллярным электрофорезом (CE-TOF-MS), как описано ранее 15 .Образцы фекалий лиофилизировали с использованием лиофилизатора VD-800R (TAITEC, Сайтама, Япония) в течение 24 часов. Сублимированные фекалии разрушали с помощью 3,0-мм циркониевых шариков (Bio Medical Science, Токио, Япония) путем энергичного встряхивания (1500 об / мин в течение 10 минут) с использованием Shake Master (Bio Medical Science). Метаболиты фекалий экстрагировали с использованием протокола экстракции метанол: хлороформ: вода. Эксперименты CE-TOF-MS проводились с использованием системы CE, системы G3250AA LC / MSD TOF, двоичного насоса HPLC серии 1,100, адаптера CE-MS G1603A и распылителя G1607A CE-ESI-MS (все Agilent Technologies, Санта-Клара, Калифорния).У нас не было никакого контроля в метаболическом анализе, и мы анализировали только метаболические изменения до и после подготовки кишечника.
Анализ данных
Весь анализ данных был выполнен таким же образом, как описано для установленного трубопровода 13,16 . После того, как качество прочтений, прошедших фильтр, со средним значением качества, превышающим 25, было проверено на химеры, таксономия высококачественных чтений была назначена с использованием трех общедоступных баз данных: Ribosomal Database Project версии 10.27, CORE (http://microbiome.osu.edu/) и эталонная база данных последовательностей генома, полученная с FTP-сайта Национального центра биотехнологической информации (ftp://ftp.ncbi.nih.gov/genbank/, декабрь 2011 г. ). Затем мы отобрали те чтения с совпадениями BLAST, превышающими 90%, с репрезентативной последовательностью в одной из трех баз данных. Из считываний, прошедших фильтр, было случайным образом выбрано 3000 высококачественных считываний на образец, чтобы свести к минимуму переоценку видового богатства в кластеризации из-за внутренней ошибки секвенирования, как ранее сообщалось 13 .Индекс охвата Гуда, составляющий 95,2%, показал, что 3000 считываний было достаточно для оценки общего видового богатства и разнообразия. Среднее (стандартное отклонение) индекса охвата Гуда было высоким в каждой группе: 94,9 (1,70) в контрольных образцах в день 0, 95,7 (1,18) в контрольных образцах дня 14, 94,2 (1,84) в образцах для подготовки кишечника в день 0, 94,6 (1,62) в образцах кишечника первого дня. образцы для подготовки и 93,6 (2,03) в образцах для подготовки кишечника на 14-й день. После удаления обеих последовательностей праймеров считанные данные были отсортированы и сгруппированы в рабочие таксономические единицы (OTU) с порогом идентичности последовательностей 97%.Таксономическое присвоение каждой OTU было выполнено с помощью программы GLSEARCH. Таксономические группы с относительной численностью, превышающей 0,1% у любого субъекта, были включены в последующий анализ. Из 70 образцов кала было получено 898 035 высококачественных считываний, в диапазоне от 9 152 до 9840 считываний на образец. Все 3000 прошедших фильтр прочтений последовательностей 16S V3 – V4, проанализированных в этом исследовании, были депонированы в базе данных DDBJ / GenBank / EMBL под номерами доступа DRA 007110.
α-разнообразие микробных сообществ в каждом образце оценивали с использованием метода Шеннона. индекс разнообразия.Коэффициенты корреляции Спирмена использовались для сравнения общих бактериальных и метаболомных составов между различными временами сбора образцов. Для анализа расстояния UniFrac использовались показатели на основе филогенетического дерева для измерения различий в общем бактериальном составе в разное время сбора образцов 17 . Для оценки различий в бактериальном и метаболическом составе внутри субъектов в разное время сбора образцов (например,грамм. Расстояние или коэффициент UniFrac между образцами дня 0 и дня 1 по сравнению с образцами дня 0 и дня 14). Тест суммы рангов Вилкоксона использовался для оценки разницы в бактериальном составе между групповыми различиями внутри субъектов (например, расстояние или коэффициент UniFrac между группой подготовки кишечника и контрольной группой). PCoA применяли для анализа микробных и метаболических данных. Мы использовали шкалу единичной дисперсии в качестве меры описания данных для метаболитов 18 со стандартным отклонением в качестве масштабного коэффициента 18 .Статистически значимыми считались значения p <0,05. Все статистические анализы были выполнены с помощью программного пакета R (v3.2.2).
Границы | Автопробиотики как подход к восстановлению персонализированной микробиоты
Введение
Микробиота человека представляет собой сложный консорциум, состоящий из множества видов бактерий, архей, вирусов, грибов и простейших (только в кишечнике более 500 видов бактерий). Сейчас он рассматривается как дополнительный орган в организме человека (Суворов, 2013).Микробиота является важным фактором, влияющим почти на все функции организма при здоровье и болезнях. Применение технологии секвенирования следующего поколения (NGS) повысило интерес к роли микробиоты в здоровье и болезнях. Этот интерес быстро вырос с появлением нескольких международных научных инициатив, таких как проект NIH Human Microbiome Project (https://hmpdacc.org) и MetaHit Consortium (http://www.metahit.eu). Полное секвенирование генома сотен бактериальных геномов микробиоты человека и разработка новых методов биоинформатического анализа микробиома позволили сделать несколько важных научных открытий.Было установлено, что микробиота тканеспецифична и в то же время обладает особенностями, характерными для каждого человека (Qin et al., 2010). Кишечная микробиота, являющаяся наиболее многочисленным микробным сообществом в организме, очень индивидуальна, но обычно предпочитает ограниченное количество композиций, известных как энтеротипы (Arumugam et al., 2011).
Еще одно важное открытие связано с установлением врожденной иммунной системы. Недавно было установлено, что микробный состав кишечника претерпевает наиболее значительные изменения в течение первых 3 лет жизни.Это позволяет установить иммунную толерантность к местной микробиоте и дифференцировать автохтонную (личную) микробиоту от аллохтонных (чужеродных) бактерий, грибов и вирусов (Wopereis et al., 2014). Эти открытия позволили лучше понять корни многочисленных заболеваний, связанных с дисбактериозом, включая воспалительные заболевания кишечника, рассеянный склероз, диабет (типы 1 и 2), атопию, астму, аутизм и рак (Lloyd-Price et al., 2016) . В большинстве случаев исход лечения многих инфекционных или неинфекционных заболеваний связан с восстановлением состава микробиоты до исходного здорового состояния.Этот факт повлиял на многочисленные исследования эффектов бактериальной терапии, включая пробиотики или трансплантацию фекальной микробиоты (FMT), когда микробиота трансплантируется от здорового донора (Vuotto et al., 2014; Gupta et al., 2016). Основным ограничением этих подходов является то, что микробы, полученные экзогенно, могут быть чужеродными для иммунной системы реципиента. Другой подход к лечению дисбактериоза основан на использовании аутопробиотиков. Автопробиотики используют другую стратегию микробной терапии.Он включает культивирования in vitro и индивидуальных штаммов микробиоты и приготовление персонализированной пищи или лекарства для использования в восстановлении микробиома (Суворов, 2013). Общая цель настоящей работы — оценить терапевтический потенциал различных бактериальных вариантов автопробиотиков, используя экспериментальную модель антибиотико-индуцированного дисбиоза с последующим метагеномным и иммунологическим анализом.
Материалы и методы
Животные
крыс-самцов линии Вистар (200–250 г, возраст 6–7 недель) были получены из Центра разведения животных, Рапполово, Россия.Крыс содержали в отдельных клетках в постоянных условиях при комнатной температуре (18–22 ° C), при 12-часовом цикле свет / темнота, с уровнем шума не более 85 дБ, при влажности 50–60% и обеспечивали свободный доступ. на воду и стандартные гранулы для крыс (полнорационные комбикорма для лабораторных крыс и мышей ПК-120 ш. 1492, ГОСТ Р 50258-92 в гранулах диаметром 14 мм, Россия). Это исследование было проведено в строгом соответствии с необходимыми этическими требованиями и в соответствии с принципами гуманности (Европейского сообщества № 86/609 ЕС).Исследование одобрено локальным этическим комитетом ФГБУН «ИЭМ».
Схема эксперимента
Крысы были разделены на шесть опытных и две контрольные группы по 8 животных в каждой. Все экспериментальные (LB, BI, EN, MIX, AN и FE) и контрольные группы, обозначенные как 3AB, получали антибиотики в течение 3 дней в соответствии с ранее опубликованным протоколом (Ermolenko et al., 2013). За некоторыми животными из группы 3AB наблюдали в течение дополнительных 5 дней после сбора фекальной микробиоты.Эти животные были сгруппированы как 8AB. После приема антибиотиков в течение 3 дней крыс из шести экспериментальных групп кормили различными препаратами автопробиотиков — лактобациллами, бифидобактериями, энтерококками, смесью трех штаммов, анаэробно выращенной микробиотой фекалий или местными фекалиями, предварительно приготовленными из их собственных образцов фекалий. Вторая контрольная группа (C) получала воду вместо антибиотиков и PBS вместо автопробиотиков (таблица 1).
Таблица 1 .Экспериментальная дизайн.
Автопробиотические штаммы
Аборигенные энтерококки, лактобациллы или бифидобактерии были выделены из фекалий крыс до лечения животных антибиотиками и выращивались отдельно. Анализ образцов стула и идентификация отдельных клонов бактерий ( Enterococcus spp., Lactobacillus spp. Или Bifidobacterium spp.) Проводились с использованием селективных сред или с помощью ПЦР.
Генетическая характеристика штаммов LAB (энтерококков или лактобацилл), используемых в исследовании, была проведена с использованием количественной ПЦР (кПЦР) с видоспецифичными праймерами и праймерами для идентификации генов, связанных с вирулентностью (Таблица S1). Enterococcus faecium был единственным энтерококковым аутопробиотиком, выбранным с помощью генетического анализа. Энтерококки были протестированы на наличие генов, связанных с вирулентностью (Таблица S1), и штаммы, несущие эти маркеры, были исключены из исследования. Аборигенные штаммы лактобацилл, бифидобактерий и энтерококков были включены в соответствующую группу автопробиотиков (LB, BI и EN) и выращены в бульоне MRS (HiMedia, Индия), бульоне Blaurock (питательная среда, Россия) и бульоне Brain Heart Infusion Broth. (Gibco Diagnostics, США) соответственно.Затем их собирали центрифугированием при 3000 г в течение 10 м, трижды промывали стерильным фосфатным буферным солевым раствором (PBS-8,00 г / л NaCl, 0,20 г / л KCl, 1,44 г / л Na 2 HPO 4 , 0,24 г / л KH 2 PO 4 , pH 7,4, pH 7,2), суспендированный в стерильном PBS с сахарозой (20%) и желатином (10%) в концентрации 5,5 × 10 8 КОЕ / мл и хранят при -20 ° C до использования.
Группа MIX получала смесь выбранных аборигенных энтерококков, лактобацилл и бифидобактерий в равных количествах в концентрации 5.5 × 10 8 КОЕ / мл.
Бактерии из группы AN были получены путем анаэробного выращивания сложного сообщества фекальных бактерий, первоначально взятых от каждой отдельной крысы и скармливаемых одному и тому же животному. Для этого фекалии, собранные у крыс, разводили в PBS и культивировали анаэробно в тиогликолятном бульоне (HiMedia, Индия) с 10% стерильным фекальным экстрактом в течение 72 ч.
Group FE получала собственные фекалии, разведенные в PBS. (Экспериментальные группы перечислены в таблице 1).
Исследование микробиоты и иммунологический анализ
пробы фекалий собирали на 4 и 9 день и анализировали с помощью метагеномного анализа на основе кПЦР и гена 16S рРНК. На 9-й день брали образцы крови и биопсию селезенки для иммунологических исследований.
ДНКиз фекалий выделяли с использованием мини-набора QIAamp DNA Stool Mini (Qiagen) в соответствии с протоколом производителя. Образцы инкубировали в буфере для лизиса при 90 ° C в течение 10 м для оптимального бактериального лизиса. Для секвенирования микробиома библиотеки ДНК были подготовлены с использованием набора для подготовки образцов Illumina Nextera с праймерами ДНК, соответствующими участкам V3 – V4 гена 16S рРНК, перечисленным в таблице S1.Illumina MiSeq использовался для секвенирования библиотек. Секвенирование проводили в Ресурсном центре СПбГУ «Биобанк».
Поколение ОТУ
Fastqc (http://www.bioinformatics.babraham.ac.uk/projects/fastqc) использовался для оценки качества необработанного чтения. CD-HIT-OTU-Miseq (Li and Chang, 2017) использовался для поиска OTU. CD-HIT-OTU-Miseq позволяет извлекать OTU из парных операций чтения без объединения парных последовательностей. Это было достигнуто путем сопоставления результатов кластеризации для чтений R1 и R2.CD-HIT-OTU-Miseq может использовать только высококачественные области чтения для кластеризации. Кластеризация была выполнена с использованием следующих параметров — длины высококачественных областей чтения R1 и R2 200 и 180 п.н. соответственно, 97% сходство чтения для отсечки кластеризации и 0,00001 для отсечения изобилия. OTU были аннотированы с использованием базы данных Greengenes версии 13.5 (DeSantis et al., 2006).
Анализ разнообразия микробиома
OTU, присутствовавших менее чем в 5% выборок, были отброшены для фильтрации шума.R-пакет phyloseq (McMurdie and Holmes, 2013) использовался для построения графиков численности филумов. Функция R prcomp () использовалась для анализа главных компонент (PCA). Векторы для PCA соответствовали содержанию OTU, отфильтрованному на шум и нормализованному по относительному содержанию. Пороговое значение фильтрации шума было увеличено для PCA, чтобы исключить OTU, присутствующие менее чем в 25% образцов. Это было сделано для увеличения процента дисперсии, объясняемой 1-й и 2-й главными компонентами, и для получения более представительного 2D-изображения.
КПЦР-анализ для выявления бактерий в толстой кишке проводили с использованием набора Colonoflor (ExPlana, Россия) на приборе RT-PCR Mini-Opticon, BioRad. Данные RT-qPCR для некоторых видов бактерий были подтверждены классическим бактериологическим исследованием.
Определение цитокинов в сыворотке крови
Уровни MCP-1, IL-10 и TGF-β в сыворотке крови оценивали с помощью ELISA с наборами Bender MedSystems (eBioscience, США) в соответствии с инструкциями производителя. Все образцы были протестированы в двух экземплярах и прочитаны в iMark, BioRad, США.
Проточная цитометрия
Фенотип клеток крови и селезенки определяли на 9 день анализом проточной цитометрии, следуя стандартным процедурам окрашивания антител. Клетки окрашивали комбинацией следующих антител: CD3, CD4, CD8, CD161, CD25, FOXP3 и CD45RA. Клетки окрашивали тремя различными комбинациями флуоресцентно меченных ДНК-моноклональных антител. Все антитела были получены от BioLegend и использовались в соответствии с инструкциями производителя.Первые две комбинации антител использовали для окрашивания клеточной поверхности, третья — для окрашивания клеточной поверхности и внутриклеточного окрашивания.
Первая комбинация состояла из конъюгированных с FITC мышиных анти-крысиных CD3 (клон 1F4), PE-конъюгированных мышиных анти-крысиных анти-CD8a (клон OX-8), PE / Cy7-конъюгированных мышиных анти-крысиных анти-CD4 (W3 / 25 клон), и APC-конъюгированные мышиные антитела против CD161 крысы (клон 3.2.3, который распознал общий эпитоп NKR-1P1a (CD161a) и NKR-P1b (CD161b). Вторая комбинация включала конъюгированные с FITC мышиные антитела крысы анти-CD3 и PE-конъюгированные мышиные анти-CD45RA крысы (клон OX-33).Смеси антител добавляли к 50 мкл цельной крови крысы с антикоагулянтом K3-EDTA, осторожно перемешивали и инкубировали в течение 15 м при комнатной температуре в темноте. Затем добавляли 250 мкл лизирующего раствора OptiLyse C (Beckman Coulter), перемешивали и инкубировали в течение 10 м при комнатной температуре в темноте. После инкубации добавляли 250 мкл PBS. Через 10 мин образцы дважды промывали промывочным буфером (PBS, содержащим 2% FCS (Sigma Aldrich) и анализировали проточной цитометрией.
Третья комбинация состояла из двух антител для окрашивания клеточной поверхности — FITC — также конъюгированных мышиных анти-крысиных анти-CD25 (клон OX-33) и PE-Cy7 / конъюгированных мышиных анти-крысиных CD4 (клон W3 / 25). в виде конъюгированного с РЕ мыши антимышиного / крысиного / человеческого FOXP3 (150 d клон) для внутриклеточного окрашивания.Внутриклеточное окрашивание проводили с использованием набора буферов FOXP3 Fix / Perm (BioLegend). Все образцы анализировали с помощью проточного цитометра Navios ™ (Beckman Coulter), оборудованного двумя диодными лазерами (488 и 635 нм). Данные анализировали с помощью программного обеспечения Navios Software v.1.2 и Kaluza ™ v.1.2 (Beckman Coulter).
Статистический анализ
Статистический анализ проводился с использованием пакета программ Statistica 8.0. (StatSoft, США). Различия между группами сравнивали с использованием тестов ANOVA и Краскела – Уоллиса. P ≤ 0,05 считалось значимым.
Результаты
Метагеномный анализ
Для характеристики состава микробиома считывания были сгруппированы с порогом 97%. Виды микробов, соответствующие кластерам последовательностей 16S рРНК, были идентифицированы на основе результатов предыдущих исследований (Li and Chang, 2017). Одновременная кластеризация прочтений всех проанализированных выборок дала 7782 OTU. Большинство ОТЕ присутствовали как в небольших количествах образцов, так и в низких абсолютных количествах, что является общей чертой образцов микробиома кишечника (Quince et al., 2009). OTU, присутствующие менее чем в 5% выборок, были отброшены для фильтрации шума. Большинство низко-распространенных OTU не соответствовали никаким последовательностям из базы данных Greengenes 13.5. Количество аннотированных OTU составило 534 с 22,4% неклассифицированных чтений.
Было отмечено, что все группы, кроме 3ab, которые состояли преимущественно из протеобактерий, характеризовались значительной степенью бактериальной гетерогенности. Это продемонстрировало положительный эффект автопробиотиков на микробиом, делая его похожим на контрольную группу C (рис. 1).Высокое количество протеобактерий в группе 3AB было связано с действием коктейля антибиотиков. Бактериальный состав группы 8AB, получавшей только PBS без аутопробиотиков в течение 5 дней после антибиотиков, стал более разнообразным по сравнению с 3AB, но все еще оставался богатым протеобактериями. Обобщенные и статистически оцененные результаты анализа данных метагенома на уровне типа представлены в таблице 2. Аналогичные результаты были получены после анализа метагенома на уровне класса или семьи (рисунки S1, S2 и таблицы S2, S3).
Рисунок 1 . Таксономическое распределение (уровень филума) кишечной микробиоты у разных групп крыс. Подсчеты OTU, соответствующие различным группам, были суммированы, и относительные доли обнаруженных типов были нанесены на график.
Таблица 2 . Результаты сравнения представителей кишечной микробиоты в экспериментальных группах с контрольной группой C (уровень Phylum).
Аналогичный результат был получен после PCA образцов составов OTU.Метагеномные композиции групп животных, содержащие бифидобактериальные (фиг. 2A) или энтерококковые (фиг. 2B) автопробиотики, колокализованные с микробиотой контрольной группы C. Напротив, метагеномы групп 8AB и 3AB сгруппированы в противоположной части графиков.
Рисунок 2 . Анализ главных компонентов (PCA) двух групп. (A) PCA представление контрольных групп и группы BI. (B) PCA — представление контрольных групп и группы EN.
Анализ данных метагенома выявил значительные различия в составе микробиома в «нормальном» состоянии контрольных животных, что можно было увидеть по широкому распределению точек в PCA. Точки, представляющие микробиом после лечения антибиотиками (3AB), сформировали более компактную группу, чем точки, представляющие нормальные состояния микробиома (контрольная группа, которая получала физиологический раствор в течение всех 8 дней эксперимента). Это показало, что нормальный микробиом животных без лечения антибиотиками был более разнообразным, чем микробиом животных после дисбактериоза, вызванного антибиотиками.Группы «нормальный» и «дисбактериоз» были наиболее удаленными, и все автопробиотики смещали состояние микробиома от «дисбактериоза» ближе к контрольной группе. Группа естественного восстановления (8AB) также двигалась к восстановлению микробиома, хотя и менее очевидна по сравнению с группами автопробиотиков. PCA, представляющий микробиомы, полученные из групп, имеющих другие автопробиотики, также следовали той же тенденции. Результаты, полученные с использованием других типов автопробиотиков, были аналогичными, но менее очевидными (Рисунок S3).
Анализ микробиоты методом КПЦРпоказал, что лечение антибиотиками избирательно истощило большинство маркерных бактерий в кишечнике. Мы также отслеживали значительный рост грамотрицательных условно-патогенных бактерий, включая Proteus vulgaris, Klebsiella, Enterobacter и E. coli (рис. 3). Введение автопробиотиков вызвало значительную степень восстановления микробиоты. Однако полной реституции добиться не удалось ни в одной группе. Среди используемых автопробиотиков аутобифидобактерии (BI) и анаэробная смесь (AN) обеспечили наибольшее увеличение F.prausnitzii (рис. 3). Общие результаты анализа количественной ПЦР приведены в Таблице 3.
Рисунок 3 . Содержание бактерий в образцах кала крыс разных групп. Популяция различных бактерий в опытных группах относительно контрольной группы C. * p <0,05.
Таблица 3 . Содержание бактерий в разных экспериментальных группах по сравнению с контрольной группой C.
Иммунологический анализ
Проточная цитометрия клеток крови и селезенки выявила существенные различия между группами.Лечение антибиотиками вызвало иммунологические изменения, типичные для воспаления кишечника — истощение NKT-клеток в крови и увеличение CD4 + T-клеток. Мы также смогли определить значительное увеличение количества В-клеток в сыворотке крови (рисунок 4, таблица 4).
Рисунок 4 . Содержание (%) различных иммунных клеток в крови (А) и селезенке (Б) крыс опытных групп и контроля. * P <0.05.
Таблица 4 . Сравнение иммунологических маркеров в исследуемых группах.
ELISA для цитокинов в крови выявил снижение продукции IL-10 и MCP-1 и небольшую стимуляцию TGF-b в группе 8AB. В группах, получавших аутопробиотики EN, LB, AN и BI, мы наблюдали увеличение продукции IL-10 и MCP-1 в клетках FOXP3 + CD25 + . Иммунологические изменения в FE и MIX показали тенденцию, аналогичную группе 8AB (Рисунок 5, Рисунки S4A, B, Таблица 4).
Рисунок 5 . Концентрация ИЛ-10 в сыворотке крови опытных групп по сравнению с контрольной группой С. * p <0,05.
Обсуждение
Хорошо известно, что здоровье человека зависит от состояния микробиоты и что с дисбактериозом связаны многочисленные заболевания. Также хорошо известно, что различные антибиотики или коктейли с антибиотиками могут значительно снизить численность бактерий и изменить состав микробиоты (Morgun et al., 2015).
Однако, несмотря на множество экспериментальных исследований, в которых антибиотики являются основной причиной дисбактериоза, об эффективных стратегиях восстановления микробиоты известно очень мало. Бактериальная терапия с использованием пробиотиков или трансплантации фекалий имеет очевидный недостаток из-за чужеродной природы микроорганизмов, введенных в организм хозяина. Российский микробиолог Борис Шендеров первым начал использовать местные бактерии для лечения дисбактериоза. Он разработал и запатентовал подход, основанный на личных лактобациллах и бифидобактериях, для восстановления микробиоты (Шендеров и Манвелова, 1999).
Недавно мы продемонстрировали другую стратегию лечения дисбактериоза, используя генетически протестированные бактерии, полученные от пациентов, выращенные в лабораторных условиях и предоставленные пациентам в виде кисломолочных продуктов. Индивидуально подобранные и культивируемые пробиотические штаммы лактобацилл или энтерококков были успешно протестированы в клинике на пациентах с синдромом раздраженного кишечника (СРК) и пневмонией (Суворов, 2013). Автопробиотические молочные ферментированные бактериальные продукты на основе энтерококков или лактобацилл были способны восстанавливать микробиоту при различных клинических состояниях, включая заболевания раздраженного кишечника (ВЗК) и язвенный колит (ЯК) (Суворов и др., 2011; Соловьева и др., 2017). Это лечение также было эффективным при восстановлении микробиоты у космонавтов (Ильин и др., 2013). В этом исследовании побочных эффектов не наблюдалось.
В настоящем исследовании мы рассмотрели вопрос о выборе оптимального штамма автопробиотиков или наилучшего бактериального состава автопробиотиков. В экспериментах, проведенных на модели дисбактериоза на крысах, мы тестировали различных представителей бактерий, выращенных из одного выбранного клона аборигенных бифидобактерий, лактобактерий или энтерококков, выделенных из фекалий того же животного.Вместе с моноштаммовыми автопробиотиками мы протестировали три варианта бактериальных композиций (фекальная биомасса, анаэробно выращенная индивидуальная микробиота и смесь трех различных штаммов автопробиотиков). Введение антибиотиков (ампициллин и метронидазол) привело к истощению численности и богатства микробиоты. У 90% экспериментальных крыс в кишечнике преобладали гамма-протеобактерии.
Естественное восстановление после лечения антибиотиками только физиологическим раствором в течение 5 дней (группа 8AB) показало положительную динамику, хотя состав микробиома не изменился так существенно, как в группах, получавших автопробиотики.Микробиомный анализ кала, полученного от животных без обработки автопробиотиками, выявил значительную степень вариабельности микробиома. Однако они всегда находились далеко от контрольных животных, которые не получали антибиотики. Интересно, что бактериальный состав в микробиоме групп, получавших автопробиотики, был одинаковым независимо от вводимых автопробиотиков.
Данные, полученные с помощью кПЦР, выявили значительное увеличение количества протеобактерий, таких как Proteus spp., Klebsiella spp., E. coli и Enterobacter spp. вместе с резким снижением количества F. prausnitzii, Enterococcus spp. и Bacteroides spp. после лечения антибиотиками (Таблица 3). Эти негативные тенденции в составе микробиоты обычно отражают воспаление в кишечнике. Прием автопробиотиков снял воспаление. Различные виды автопробиотиков изменяли бактериальный состав микробиоты в зависимости от индивидуальных особенностей каждого животного и типа используемого автопробиотического препарата.Однако можно было определить разные тенденции среди групп. Например, автопробиотики на основе бифидобактерий или микробиоты, выращенной в анаэробных условиях, смогли уменьшить количество протеобактерий, представленных Proteus spp. В то же время автопробиотические бифидобактерии обладали очень низкой антагонистической активностью в отношении Klebsiella spp. в отличие от других автопробиотиков, таких как местные энтерококки.
Сравнение микробиоты показало, что лечение мультиштаммовыми препаратами не имело преимущества перед моноштаммовыми автопробиотиками.Это соответствовало предыдущему исследованию с использованием репараций на основе аутоэнтерококковых штаммов в клинике. Состав микробиоты животных, получавших препараты аборигенных энтерококков и бифидобактерий, был наиболее близок к контрольной микробиоте. Другой группой, которая обеспечила быстрое восстановление, была группа AN, которая получала смесь бактерий, выращенных в анаэробных условиях.
Иммунологические изменения в крови животных, получавших антибиотики, характеризовались провоспалительными тенденциями, типичными для дисбиотических состояний.Все автопробиотики в определенной степени улучшали иммунологические параметры. Но между группами были существенные различия. Иммунологическое исследование было сосредоточено на основных иммунологически установленных ориентирах, представляющих состояние воспаления слизистой оболочки кишечника — маркерах Т-клеток, таких как FoxP3 + CD 25 в селезенке и крови, B, NKT-клетках и содержании регуляторных цитокинов IL-10 в крови. Известно, что эти иммунологические параметры претерпевают значительные изменения как в клинических случаях воспалительных заболеваний кишечника, так и в экспериментальных моделях воспаления, вызванного антибиотиками (Olszak et al., 2014; Цейссиг и Блумберг, 2014). Эти иммунологические эффекты после приема антибиотиков коррелировали с уменьшением присутствия основного продуцента бутирата F. prausnitzii , что могло отражать уменьшение количества короткоцепочечных жирных кислот, продуцируемых в кишечнике.
Интересно, что в группах аутопробиотиков наблюдались отчетливые иммунологические изменения. Группы FE и MIX характеризовались наибольшим увеличением B-клеток и уменьшением NKT-клеток в крови, аналогично группе без каких-либо автопробиотиков — 8AB.Такая иммунологическая реакция типична для адаптивной иммунной системы после воспаления.
Напротив, моноштаммовые автопробиотики из групп BI, LB и EN вместе с группой AN характеризовались значительным увеличением регуляторных цитокинов IL-10 и CD 25 + FoxP3 + Т-клеток, что отражает характерную особенность противовоспалительное направление. В этом отношении использование анаэробных аборигенных бактерий в качестве пробиотиков выглядит очень многообещающим (El Enshasy et al., 2016). По-видимому, разные препараты аутопробиотиков могут быть полезными при разных патологических состояниях, связанных с разными вариантами дисбактериоза. Однако необходимы дальнейшие исследования, чтобы полностью понять влияние автопробиотиков на контроль дисбактериоза.
Заключение
Автопробиотический подход, основанный на использовании личных бактериальных штаммов, был оценен для восстановления микробиоты на модели антибиотико-ассоциированного дисбиоза. Лечение различными штаммами автопробиотиков привело к быстрому восстановлению микробиоты по сравнению с животными, не получавшими лечения автопробиотиками.Метагеномные данные и данные количественной ПЦР отражали значительные изменения в составе микробиоты и численности бактерий после приема автопробиотиков. Однако полного восстановления микробиоты добиться не удалось. Иммунологические изменения после лечения автопробиотиками характеризовались общей тенденцией к восстановлению иммунного статуса. Характерные противовоспалительные реакции наблюдались при приеме автопробиотиков на основе бифидобактерий, энтерококков или смеси бактерий. Анаэробно выращенная фекальная микробиота обеспечила наиболее многообещающий пробиотический эффект.
Авторские взносы
AS руководила проектом и написала статью. АК подготовил ДНК метагенома и провел предварительный анализ ДНК. МК участвовал во всех этапах работы с экспериментальными животными и собирал образцы для секвенирования метагенома. YK провел анализ PCA и помог в редактировании статьи. NL взял образцы крови у животных и собрал фекальную микробиоту. AK помог в проведении анализа биоинформации и дизайна праймеров ДНК. ПК выполнил значительную часть биоинформационного анализа фекальной микробиоты.TK собрал кровь у экспериментальных животных и подготовил образцы для ELISA и иммунного флуориметрического анализа. GL провела все иммунологические исследования и эксперименты ELISA. IK провела все иммунофлуориметрические исследования. DG участвовал в пересмотре текущей публикации, критически важном для интеллектуального содержания, и интерпретации данных для работы. А.Л. руководил всей биоинформационной работой и участвовал в редактировании рукописи. Е.Е. руководил всеми экспериментами, подготовил большинство рисунков и таблиц и лично работал с экспериментальными животными.
Финансирование
Работа поддержана Российским научным фондом 16-15-10085.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим профессора М. Арумугама из Копенгагенского университета, Дания, за его ценные предложения и помощь в редактировании рукописи.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmicb.2018.01869/full#supplementary-material
Ссылки
Arumugam, M., Raes, J., Pelletier, E., Le Paslier, D., Yamada, T., Mende, D. R., et al. (2011). Энтеротипы микробиома кишечника человека. Природа 473, 174–180. DOI: 10.1038 / nature09944
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ДеСантис, Т.Z., Hugenholtz, P., Larsen, N., Rojas, M., Brodie, E.L., Keller, K, et al. (2006) Greengenes, проверенная химерами рабочая среда базы данных генов 16S рРНК, совместимая с ARB. Заявл. Environ. Microbiol . 72, 5069–5072. DOI: 10.1128 / AEM.03006-05.
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эль-Эншаси, Х., Малик, К., Малек, Р. А., Осман, Н. З., Эльсайед, Э. А., и Вадаан, М. (2016). «Анаэробные пробиотики: ключевые микробы для здоровья человека», в Anaerobes in Biotechnology , ред.Хатти-Каул, Г. Мамо и Б. Маттиассон (Чам: Спрингер), 397–431.
Google Scholar
Ермоленко Е., Громова Л., Борщев Ю., Воейкова А., Ермоленко К., Груздков А. и др. (2013). Влияние различных пробиотических молочнокислых бактерий на микробиоту и метаболизм крыс с дисбактериозом. Biosci. Microbiota Food Health 32, 41–49. DOI: 10.12938 / bmfh.32.41
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ильин В.К., Суворов А.Н., Кирюхина Н. В., Усанова Н. А., Старкова Л. В., Бояринцев В. В. и др. (2013). Автохтонные пробиотики в профилактике инфекционно-воспалительных заболеваний человека в измененных местообитаниях. Вестн. Росс. Акад. Med. НАУК . 68, 56–62. DOI: 10.15690 / vramn.v68i2.550
CrossRef Полный текст
Мак-Мерди, П. Дж., И Холмс, С. (2013). Phyloseq: пакет R для воспроизводимого интерактивного анализа и графики данных переписи микробиома. PLoS ONE 8: e61217.DOI: 10.1371 / journal.pone.0061217
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моргун А., Дзуцев А., Донг X., Грир Р. Л., Секстон Д. Дж., Равель Дж. И др. (2015). Выявление эффектов антибиотиков на хозяина и микробиоту с использованием генных сетей транскингдома. Кишечник 64, 1732–1743. DOI: 10.1136 / gutjnl-2014-308820
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ольшак, Т., Невес, Дж. Ф., Даудс, К. М., Бейкер, К., Glickman, J., Davidson, N.O, et al. (2014) Защитный иммунитет слизистой оболочки, опосредованный эпителиальным CD1d IL-10. Природа 509, 497–502. DOI: 10,1038 / природа13150.
CrossRef Полный текст | Google Scholar
Qin, J., Li, R., Raes, J., Arumugam, M., Burgdorf, K. S., Manichanh, C., et al. (2010). Каталог микробных генов кишечника человека, созданный путем метагеномного секвенирования. Природа 464, 59–65. DOI: 10.1038 / nature08821
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Айва, К., Лансен, А., Кертис, Т. П., Давенпорт, Р. Дж., Холл, Н., Хед, И. М. и др. (2009) Точное определение микробного разнообразия по 454 данным пиросеквенирования. Nat. Методы 6, 639–641. DOI: 10,1038 / Nmeth.1361.
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Соловьева О. И., Симаненков В. И., Суворов А. Н., Ермоленко Е. И., Шумихина И. А., Свиридов Д. А. (2017). Использование пробиотиков и аутопробиотиков при лечении синдрома раздраженного кишечника. Exp. Clin. Гастроэнтерол . 7, 115–120.
Суворов А., Симаненков В., Громова Л., Колоджиева В., Цапиева А., Черныш А. и др. (2011). «Энтерококки как пробиотики или автопробиотики», в Пребиотики и пробиотический потенциал для здоровья человека, , ред. И. Иванова (София: Софийский университет «Св. Климента Охридского»), 104–112.
Google Scholar
Вуотто, К., Лонго, Ф., и Донелли, Г. (2014). Пробиотики для противодействия инфекциям, связанным с биопленками: многообещающие и противоречивые данные. Внутр. J. Oral Sci . 6, 189–194. DOI: 10.1038 / ijos.2014.52
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wopereis, H., Oozeer, R., Knipping, K., Belzer, C., and Knol, J. (2014). Первая тысяча дней — кишечная микробиология молодости: установление симбиоза. Pediatr. Аллергия Иммунол . 25, 428–438. DOI: 10.1111 / pai.12232
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zeissig, S., and Blumberg, R.С. (2014). Комменсальная микробная регуляция естественных Т-клеток-киллеров на границах иммунной системы слизистой оболочки. FEBS Lett . 588, 4188–4194. DOI: 10.1016 / j.febslet.2014.06.042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14 советов по восстановлению кишечной флоры за 7 дней (естественные и научные)
У каждого из нас в кишечнике около 100 триллионов микробов. Флора кишечника, также известная как микробиом кишечника, представляет собой живое сообщество, которое содержит бактерии, вирусы, дрожжи и другие микробы.
До недавнего времени большинство людей считали бактерии — или «микробы» — врагами, которых необходимо убить, но по мере того, как ученые все больше и больше узнают о нашей кишечной флоре, мы постепенно осознаем, насколько важно заботиться о ней.
Мы знаем, что наш микробиом способствует нашему здоровью, вырабатывая витамины и борясь с инфекциями. Это может даже помочь нам активировать лекарства (Источник: NCBI). Все, что нарушает баланс микробов в нашем кишечнике, может вызвать болезнь.
К несчастью для наших кишечных клопов, современная жизнь подвергает их критике.Антибиотики убивают как вредные, так и полезные бактерии, и они не разделяют нашу любовь к обработанным пищевым продуктам. Добавьте к этому наш страх перед грязью и нашу продезинфицированную сидячую жизнь в помещении, и вы получите среду, сильно отличающуюся от той, в которой наш микробиом эволюционировал вместе с нами.
Результат? Отсутствие разнообразия. Это означает, что у многих из нас — хотя общее количество микробов в кишечнике примерно одинаковое — их видов меньше. Поскольку каждый вид имеет разные свойства и функции, связанные с разными аспектами здоровья человека, это не идеально.
Можно ли восстановить баланс кишечника?
К началу
Содержание
14 советов по восстановлению кишечной флоры за 7 дней (естественные и научно обоснованные)
7-дневный план для начала восстановления здоровья кишечника
Основные выводы
14 простых советов по восстановлению здоровой микрофлоры кишечника
Лучший способ восстановить гармонию кишечника — это диета, богатая клетчаткой и питательными веществами.
Хорошая новость заключается в том, что вы можете начать изменять флору кишечника во время следующего приема пищи.Исследования показывают, что наши кишечные бактерии очень чувствительны к тому, что мы едим, и сообщества начинают меняться почти сразу после того, как мы меняем свой рацион (Источник: NCBI).
Однако ученые также обнаружили, что при значительном повреждении кишечника повторными курсами антибиотиков некоторые бактериальные сообщества исчезают и вряд ли вернутся (Источник: NCBI).
Трудно сказать, восстановили ли вы свой микробиом, потому что практически невозможно определить, что такое здоровый.Флора кишечника людей очень разнообразна во всем мире и в зависимости от нашей продолжительности жизни. Например, в кишечнике младенцев обычно преобладают бифидобактерии (Источник: NCBI). пока они не начнут есть твердую пищу. Это отсутствие разнообразия — по сравнению со взрослым микробиомом — именно то, что им нужно, чтобы получить максимальную пользу от их особого рациона: молоко!
Исследования снова и снова подтверждают, что разнообразие является ключевым фактором. Чем больше семейств бактерий в вашем кишечнике, тем вы будете здоровее.
Существуют анализы стула, которые могут открыть окно в ваш кишечник.Они показывают уровни определенных семейств бактерий, которые, по мнению ученых, помогают или мешают вашему здоровью, а также наличие определенных паразитов, дрожжей и уровни воспаления.
Итак, хотя на самом деле вы не можете «восстановить» микробиом кишечника, вы определенно можете его улучшить. Вот как:
1. Положите в тарелку продукты, богатые полифенолами
Полифенолы — это соединения, содержащиеся в растительной пище, которые не полностью всасываются в нашем тонком кишечнике. Это означает, что они становятся пищей для микробов в нашей толстой кишке (Источник: NCBI), которые превращают их в вещества с пребиотическими, противовоспалительными, антиоксидантными, антиканцерогенными и антимикробными свойствами (Источник: NCBI).
2. Регулярно спите
Последние пять лет исследований микробиома показали, что микробные обитатели нашего кишечника имеют собственный распорядок сна. Одно исследование показало, что микрофлора кишечника людей с нарушением биоритмов показывает большее количество бактерий, связанных с ожирением и метаболическими заболеваниями (Источник: NCBI). Другие исследования показали, что разнообразный микробиом кишечника способствует более здоровому сну (Источник: PLOS).
3. Отказаться от стандартной западной диеты
Доказательства разрушительного воздействия современной диеты с высоким содержанием сахара и низким содержанием клетчатки на наше здоровье продолжают расти.Недавнее исследование описало нашу диету 21-го века как «эволюционно уникальную почву для отбора микробов, которые могут способствовать развитию различных форм воспалительных заболеваний» (Источник: NCBI). Это означает, что вредные бактерии в нашем кишечнике, похоже, любят нашу недостаточную диету, в то время как наиболее важные хорошие бактерии не так сильно увлечены.
4. Делайте упражнения, но не слишком много
Наука об этом действительно ускорилась за последнее десятилетие. Теперь мы знаем, что упражнения имеют прямое влияние на наши кишечные бактерии, которые, в свою очередь, улучшают метаболизм тканей, кардиореспираторную подготовку и резистентность к инсулину (Источник: NCBI).Однако наш организм воспринимает слишком много тяжелых упражнений как угрозу, которая вызывает реакцию на стресс, тем самым уменьшая разнообразие кишечной флоры (Источник: NCBI).
5. Удвойте потребление клетчатки
Клетчатка для нас совсем не пища: в отличие от лошадей, слонов или коров, мы не можем извлекать из нее какие-либо питательные вещества. Но наша кишечная флора процветает благодаря этому. Исследования, подтверждающие пользу диеты с высоким содержанием клетчатки, многочисленны. Одно исследование показало, что диета с низким содержанием клетчатки может вызвать существенное сокращение разнообразия нашей кишечной флоры, увеличивая риск метаболического синдрома и заболеваний, связанных с ожирением, болезни Крона, язвенного колита печени, болезней и колоректального рака (Источник: NCBI ).
6. Запретить добавлять сахар из своей жизни
Добавленный сахар подобен ракетному топливу для вашего микробиома. Это звучит неплохо, но, к сожалению, похоже, что это побуждает определенные семейства бактерий «захватить», вытеснить другие и склонить сбалансированный кишечник к дисбактериозу. В одном исследовании мыши, получавшие диету с высоким содержанием сахара, потеряли микробное разнообразие кишечника и развили более протекающий кишечник: плотные соединения в стенках кишечника фактически открылись шире из-за воспаления, вызванного высоким потреблением сахара (Источник: NCBI).
7. Брожение
Люди ферментировали пищу и питье в течение тысяч лет. Процесс ферментации активирует иммуноглобулины, антибактериальные пептиды, антимикробные белки, олигосахариды, липиды и короткие аминокислотные последовательности (в зависимости от конкретной пищи). Вместе они, по-видимому, обладают антиоксидантным, антигипертензивным, противомикробным и другими биологически активными эффектами (Источник: NCBI).
8. Играйте со своим питомцем
Большинству из нас сказали, что мы должны мыть руки после игры с нашими пушистыми друзьями.Но похоже, что наличие домашнего животного — и обмен их микробами — на самом деле может быть полезно для нашего микробиома, снижая риск аллергии и ожирения (Источник: NCBI).
9. Испачкаться
Исследования показывают, что рост в среде, богатой микробами, например на ферме, может защитить детей от хронических заболеваний по мере взросления (Источник: NCBI).
10. Выбросьте искусственные подсластители
Искусственные подсластители — плохая новость. Некоторые исследования показали, что они не опасны, но недавняя исследовательская работа показала, что они вызывают непереносимость глюкозы у некоторых групп людей, изменяя микробиом кишечника (Источник: NCBI).
11. Прекратите так много чистить (да, правда)
Наша ненависть к бактериям — большой бизнес. Нам предлагается бесконечный запас антибактериальных чистящих средств, чтобы пропитать себя и наши дома. Хотя неразумно есть обед на грязном кухонном полу, нет необходимости дезинфицировать руки или рабочую поверхность каждые пять минут. .
12. Сделайте свою жизнь проще
Разве не невероятно, как эмоция может повлиять на живые существа в нашем теле? Когда мы в стрессе, наши тела выделяют коктейль из гормонов, который готовит нас к борьбе, полету или замерзанию, который затем влияет на наш микробиом (Источник: NCBI).Стресс полезен для бегства от львов, но в долгосрочной перспективе губителен для нашей кишечной флоры.
13. Быстро
Кажется странным, что мы можем помочь нашей кишечной флоре не есть и, следовательно, голодать, но одно исследование на мышах показало, что изменения в микробиоме в результате голодания были связаны с увеличением кишечной слизи (что хорошо), бокаловидные клетки (клетки, производящие слизь) и длину ворсинок (пальцеобразные структуры на слизистой оболочке кишечника, которые помогают усваивать питательные вещества) (Источник: DIABETES JOURNALS).Скорее всего, голодание оказывает аналогичное влияние на людей.
14. Выясните, есть ли у вас какие-либо инфекции или дисбалансы, и устраните их.
Есть много типов червей, паразитов и одноклеточных патогенов, которые могут инфицировать наш кишечник. Иногда они не вызывают никаких симптомов, но в других случаях они могут доставить бесконечные неприятности. Например, было обнаружено, что простейшие под названием Giardia оказывают сильное влияние на нашу кишечную флору (Источник: NCBI). Здесь вы можете узнать больше о паразитарных инфекциях.
SIBO — это чрезмерный рост бактерий в тонком кишечнике (где уровень бактерий должен быть очень низким), что может повлиять на баланс бактерий в толстом кишечнике.Если вы подозреваете, что у вас СИБР, вы можете узнать больше о симптомах, тестировании и лечении здесь.
К началу
7-дневный план восстановления здоровья кишечника
«Старт» — ключевое слово здесь.
Как упоминалось ранее, кишечные бактерии быстро реагируют на изменения в диете, но полное восстановление кишечной флоры а) трудно определить и б) еще сложнее доказать.
В идеале мы все должны иметь микробиомы обществ охотников-собирателей, в которых жили наши предки.Вероятно, это невозможно в западном мире. Но не отчаивайтесь! Мы можем начать восстанавливать здоровые бактерии в кишечнике с помощью нескольких изменений.
День 1
Начало брожения . Хлеб на закваске приготовить проще, чем вы думаете, и квашеная капуста (традиционная немецкая маринованная капуста) также дает вам преимущества крестоцветных овощей, содержащих клетчатку и полифенолы. Многие люди говорят, что ферментация собственной пищи имеет терапевтический эффект, поэтому, возможно, восстановление кишечных бактерий тоже может быть хорошим способом расслабиться!
День 2
Жарьте огромную партию из овощей , храните их в холодильнике и ешьте в течение следующих нескольких дней.Максимальное воздействие клетчатки и полифенолов, минимум усилий. Попробуйте обжарить цветную капусту, брокколи, красный лук и свеклу на оливковом масле.
День 3
Сажайте собственные овощи или зелени . Хорошо, вы не будете есть их какое-то время, но даже если мы засыпаем землю руками, это полезно для нашего кишечника.
Мы знаем, что контакт с почвой очень полезен для микробиома нашей кожи (да, у вашей кожи тоже есть микробиом) (Источник: NCBI). Мы также знаем, что контакт с землей и почвой был основным фактором в эволюции кишечного микробиома наших предков, и исследования показали, что у людей, ведущих традиционный сельский образ жизни, в результате более разнообразная кишечная флора (Источник: NCBI).
День 4
Замените любые белые очищенные зерна в своем рационе в шкафах на цельных коричневых версий . В коричневом рисе, цельнозерновом хлебе и макаронах гораздо больше клетчатки, чем в их белых аналогах. Если вы замочите коричневый рис на 24 часа перед его приготовлением, он будет легче усваиваться, а питательные вещества станут доступнее (Источник: NCBI).
Вы можете попробовать натуральные цельнозерновые продукты без глютена, такие как киноа, гречка, просо или амарант. Разнообразие — ключ к здоровью кишечника.Если вы можете его найти и переносите глютен, коричневый или ржаной хлеб на закваске отлично подходит для вашего кишечника, потому что в процессе медленного брожения вместо дрожжей используются пробиотические бактерии, чтобы хлеб поднялся.
День 5
Выйти на природу . Мы уже узнали, что стресс вреден для кишечных микробов, и один из наиболее доступных и эффективных способов снять стресс — просто выйти на улицу. Недавнее исследование показало, что посетители естественной среды сообщают о значительно более низком уровне стресса и более низком уровне гормона стресса кортизола, чем их сверстники, посещающие более урбанизированные места на открытом воздухе (Источник: NCBI).
День 6
Попробуйте пробиотическую добавку . В то время как ферментированные продукты, такие как йогурт, квашеная капуста, хлеб на закваске и традиционно приготовленные соленые огурцы, являются пробиотическими продуктами (в процессе ферментации используются полезные бактерии), пробиотики также выпускаются в форме добавок, таких как таблетки, порошки и жидкости. Некоторые из них были чрезвычайно хорошо исследованы и имеют множество доказательств, подтверждающих их положительный эффект.
Было обнаружено, что добавки с пробиотиками «реконструируют» кишечник после курса антибиотиков (Источник: NCBI), а также «Мутафлор», который содержит полезный штамм E.coli — привела к ремиссии у людей с язвенным колитом (Источник: NCBI).
День 7
Попробуйте пребиотиков . Не путать с пробиотиками — хотя они действительно наслаждаются обществом друг друга — пребиотики также бывают как в форме пищевых продуктов, так и в виде добавок.
Пребиотики — это пища для бактерий, потому что они проходят через тонкий кишечник, не перевариваясь, и становятся пищей для бактерий в толстом кишечнике. В случае пребиотических продуктов некоторые части этой пищи будут легкоусвояемыми: например, банан содержит простые сахара, которые мы можем переваривать, и олигосахариды, которые мы не можем переваривать (но наши бактерии могут).
Пребиотические добавки обычно намного эффективнее пребиотических продуктов. Возвращаясь к этому банану: он обычно содержит 0,21 грамма фруктоолигосахаридов (ФОС), в то время как большинство производителей добавок рекомендуют начальную дозу 5 граммов в день. Хотя исследования показали, что он помогает разнообразить микробиом (Источник: NCBI), снизить уровень холестерина (Источник: NCBI) и облегчить запор (Источник: NCBI), если у вас СРК, используйте FOS с осторожностью, так как это может усугубить диарею и газы (Источник : NCBI).
К началу
Ключевые выносы
- Хотя невозможно узнать, сможем ли мы полностью восстановить нашу кишечную флору — или даже что это будет значить (к какой точке нашей жизни или прошлого мы стремимся ее восстановить?) — мы, безусловно, можем помочь этому.
- Мы знаем, что наша кишечная флора меняется при изменении диеты. Исследования показали, что это может произойти быстро.
- Если вы хотите восстановить свой микробиом, лучше всего кормить его цельными продуктами с высоким содержанием клетчатки, установить хороший режим сна, выйти на природу и упростить свою повседневную жизнь.Пребиотические и пробиотические добавки тоже могут помочь.
К началу
Автор
Александра Фалконер MA (Dist) DipCNM mBANT — сертифицированный диетолог, специализирующийся на СРК и родственных состояниях. Выпускница Брайтонского колледжа натуропатической медицины, она стремится бороться с первопричинами хронических заболеваний и предоставлять функциональную медицину всем, кто в ней нуждается.
До своей естественной оздоровительной карьеры Алекс была журналистом и копирайтером.Она продолжает писать для журналов и медиа-агентств, и теперь объединяет свои две великие страсти — писательство и здоровье — создавая контент, который дает людям возможность отстаивать свое право на здоровое тело и разум.
К началу
Микробиота кишечника, потенциальная новая мишень для китайских лекарственных трав при лечении сахарного диабета
Микробиота кишечника, как важный фактор, влияющий на здоровье хозяина, играет значительную роль в возникновении и развитии сахарного диабета (СД), и механизм может быть связаны с избытком эндотоксинов, измененными короткоцепочечными жирными кислотами (SCFA) и нарушением метаболизма желчных кислот.Традиционная китайская медицина (ТКМ) имеет долгую историю лечения СД, но ее механизм не очень ясен. Недавние исследования показали, что китайская фитотерапия может улучшить метаболизм глюкозы за счет ремоделирования микробиоты кишечника, что открывает новые возможности для дальнейших исследований механизмов гипогликемии. В этом обзоре представлен недавний прогресс китайских трав, травяных экстрактов и препаратов растительных соединений в лечении СД за счет регулирования микробиоты кишечника и обобщены основные задействованные механизмы, а именно противовоспалительные и антиоксидантные эффекты, защита кишечного барьера и ингибирование липотоксичности.Кроме того, предлагаются некоторые предложения по улучшению.
1. Введение
Сахарный диабет (СД) — серьезная проблема для здоровья, которая угрожает людям во всем мире. В 2017 году Международная федерация диабета (IDF) выпустила восьмое издание «Карты диабета IDF», которая показала, что примерно 425 миллионов взрослых (20-79 лет) во всем мире страдают от СД, и это число может достигнуть 629 миллионов. к 2045 году. В Китае примерно 114,4 миллиона человек (20-79 лет) живут с DM; таким образом, Китай занимает первое место в мире (http: // www.diabatlas.org). В последние несколько лет люди постепенно осознали, что функция метаболизма человека определяется не только нами, но и тесно связана с нашим «вторым геномом» — кишечной микробиотой, которая открыла еще одну дверь для лучшего понимания DM. [1–3]. Чтобы найти лучший лечебный эффект от СД, были разработаны и постепенно внедрены в клиническую практику множество пробиотических, пребиотических и синбиотических препаратов [4].
Традиционная китайская медицина (ТКМ) лечит СД более 2000 лет.В последние годы накопление доказательств подтвердило, что традиционная китайская медицина может улучшить СД с помощью различных молекулярных механизмов [5], а ремоделирование кишечной микробиоты является важным направлением исследований [6]. Помимо специфических изменений в некоторых кишечных бактериях после приема лекарственных трав, исследователи также обращают внимание на то, как улучшенная микробиота кишечника влияет на метаболизм хозяина. В этом обзоре мы обобщаем соответствующую литературу, пытаемся выделить несколько основных путей, связывающих кишечную микробиоту и гликометаболизм, а затем предлагаем потенциальные будущие направления, которые могут улучшить ограничения текущих исследований.
Был проведен поиск литературы с использованием баз данных PubMed, CNKI, Chinese Biomedical Literature, Wanfang и VIP. Ключевые слова для поиска включали «диабет», «кишечная микробиота», «кишечная микрофлора», «кишечная флора», «кишечная микрофлора», «традиционная китайская медицина», «фитотерапия» и «травы». Мы также провели поиск связанные ссылки.
2. Взаимосвязь между DM и кишечной микробиотой
Кишечная микробиота не только влияет на кишечник, но также оказывает глубокое влияние на метаболическую функцию хозяина через различные механизмы [1].В последние десятилетия накопленные данные свидетельствуют о тесной связи между сахарным диабетом и микробиотой кишечника. Два когортных исследования с участием людей в Китае и Европе показали, что в микробиоте кишечника пациентов с сахарным диабетом 2 типа (СД2) наблюдаются композиционные и функциональные изменения. Например, количество бактерий-продуцентов бутирата Roseburia и Faecalibacterium prausnitzii было ниже [7, 8]. Кроме того, исследование, основанное на китайской популяции хань, показало, что по сравнению со здоровыми людьми, люди с сахарным диабетом 1 типа (СД1) имели совершенно другую микробиоту кишечника, а численность Bacteroides положительно коррелировала с аутоантителами [9].
Как нарушенная микробиота кишечника влияет на углеводный обмен в организме хозяина? Согласно текущим исследованиям, причины могут быть связаны со следующими факторами: (1) липополисахариды (ЛПС): ЛПС являются жизненно важным компонентом внешней мембраны грамотрицательных бактерий, в то время как они могут вызывать легкое воспаление, связанное с СД, когда чрезмерное попадание ЛПС в кровоток [10]; (2) короткоцепочечные жирные кислоты (SCFAs): SCFAs, в основном включающие уксусную кислоту, пропионовую кислоту и масляную кислоту, являются основными продуктами ферментации, производимыми из неперевариваемой клетчатки и полисахаридов, а снижение уровня SCFA может нарушить метаболический гомеостаз хозяина, поскольку они связаны с энергетическим обменом, секрецией GLP-1 и целостностью слизистой оболочки кишечника [11]; (3) желчные кислоты (ЖК): ЖК продуцируются деградацией холестерина и метаболизируются микробиотой кишечника, а нарушенный метаболизм ЖК может влиять на экспрессию рецепторов желчных кислот в кишечнике, а затем нарушать соответствующие пути метаболизма глюкозы [12]; (4) проницаемость кишечника: нарушенная микробиота кишечника может нарушить белки плотных контактов кишечника, повысить проницаемость кишечника и привести к постоянной утечке ЛПС, что, в свою очередь, вызывает системное воспаление низкой степени [13]; (5) сбор энергии: кишечная микробиота, связанная с ожирением, более эффективно использует энергию, получаемую с пищей, что приводит к перегрузке энергии в организме хозяина, что формирует решающую основу для возникновения инсулинорезистентности и СД2 [14]; (6) кишечная иммунная система: микробиота кишечника имеет решающее значение для развития и модуляции иммунной системы слизистой оболочки кишечника, а дисфункциональное взаимодействие между кишечной микробиотой и иммунной системой связано с возникновением СД1 [15].И наоборот, улучшенная микробиота кишечника может регулировать один или несколько из указанных выше путей, оказывая комплексное терапевтическое воздействие на СД.
3. Доказательства того, что китайские лекарственные травы лечат СД путем регулирования кишечной микробиоты
3.1. Травы и экстракты трав
Folium Mori для лечения Xiaoke (название DM в TCM) зарегистрировано в Compendium of Materia Medica [16], и его гипогликемический эффект был подтвержден в экспериментах на животных [ 17] и клинические испытания [18].Скармливание диабетическим крысам диеты, содержащей 20% силы Folium Mori , в течение 8 недель может подавить сигнальный путь неэстерифицированных жирных кислот (NEFA) и уменьшить гипергликемию. В то же время доля Bacteroidetes в кишечных бактериях восстанавливается после обработки Folium Mori [19]. Другое исследование подтвердило, что Folium Mori может способствовать производству SCFAs и регулировать метаболизм стероидов и ЖК [20]. В дополнение к Folium Mori , Dendrobium Candidum может облегчить окислительный стресс в печени [21], а Rhizoma Dioscoreae способствует снижению уровня глюкозы в крови пациентов с СД2 [22].Их подробности приведены в Таблице 1.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Сокращения .NEFA: неэтерифицированная жирная кислота; Ж / Б: Firmicutes / Bacteroidetes; GLP-2: глюкагоноподобный пептид-2; GLP-1: глюкагоноподобный пептид-1; SCFA: жирные кислоты с короткой цепью; N / A: не применимо. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Берберин является основным биологически активным алкалоидом некоторых очищающих тепло трав, таких как Coptis chinensis [23]. Недавние исследования показали, что берберин является отличным модулятором кишечной микробиоты у животных и людей с СД. Например, он может способствовать пролиферации Bifidobacterium и Lactobacillus , подавлять рост Escherichia coli, и снижать уровни ЛПС в кишечнике, тем самым снимая хроническое системное воспаление [24].Кроме того, поврежденная слизистая оболочка кишечника и иммунный барьер также могут быть восстановлены с помощью берберина, который способствует предотвращению попадания кишечных эндотоксинов в кровь и поддержанию метаболического гомеостаза хозяина [25, 26]. Кроме того, многие другие фитохимические вещества, такие как реин [27], белок облепихи [28], алкиламиды Zanthoxylum [29] и полифенолы из Fructus MoriL . [30], также обладают гипогликемическим эффектом, регулируя микробиоту кишечника (Таблица 1).
Кроме того, полисахариды, извлеченные из лекарственных растений, также являются потенциальными пребиотиками. Qixing Nie и его коллеги [31] подтвердили, что полисахариды из семян Plantago asiatica L. могут снижать массу тела, снижать уровень глюкозы в крови и восстанавливать поврежденную функцию почек у крыс с диабетом. Кроме того, он также может увеличить количество бактерий, таких как Bacteroides vulgatus , Lactobacillus fermentum , Prevotella loescheii и Bacteroides ovatus , и способствовать производству SCFAs.Более того, полисахариды экстрагированы из Ganoderma atrum [32], Maydis stigma [33], Radix Pseudostellariae [34], Morus nigra [35] и Momordica charantia L ). ферментированный Lactobacillus plantarum NCU116 [36], также может лечить СД, регулируя кишечную микроэкологию (Таблица 1).
3.2. Препараты на основе трав
Формула TCM представляет собой комбинацию нескольких трав, и совместимость трав является ключом к синергетической терапевтической роли [37].Xiexin Tang, включающий три травы: Rhei rhizome , Scutellaria radix и Coptidis rhizome , демонстрирует идеальные противовоспалительные, гипогликемические и гиполипидемические эффекты у крыс с T2DM. Кроме того, Xiexin Tang может увеличивать количество некоторых противовоспалительных бактерий, таких как Adlercreutzia, Alloprevotella, , и концентрацию SCFAs в кале. Корреляционный анализ предполагает, что увеличение количества кишечных бактерий может быть прямым регулятором метаболической функции [38].Помимо экспериментов на животных, соответствующие доказательства также подтверждаются клиническими рандомизированными контролируемыми исследованиями. Классическая формула Gegen Qinlian Decoction и современная травяная формула AMC обладают значительными гипогликемическими эффектами, а структура кишечной микробиоты оптимизируется после 12 недель приема. Например, уровни Faecalibacterium , бактерии с противовоспалительным действием, значительно увеличиваются двумя формулами; бактерии, продуцирующие SCFA, Roseburia и Blautia , также развиваются после обработки AMC [39, 40].Кроме того, гипогликемический эффект отвара Gegen Qinlian (эксперимент на животных) [41], отвара Huanglian Jiedu [42, 43], смеси Qijian [44], отвара Banxia Xiexin [45] и трех инновационных препаратов трав [46–48] также способствует регулированию микробиоты кишечника, и их подробности перечислены в Таблице 2.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Сокращения .SCFA: жирные кислоты с короткой цепью; GLP-1: глюкагоноподобный пептид-1; GLP-2: глюкагоноподобный пептид-2; ЛПС: липополисахариды; N / A: не применимо. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3. Резюме
Согласно существующей литературе, эффекты противодиабетических лекарственных трав на микробиоту кишечника имеют следующие правила: (1) регулирование структуры микробиоты путем увеличения микробного разнообразия и уменьшения соотношения Firmicutes / Bacteroidetes (F / B); (2) увеличение противовоспалительных бактерий, таких как Bifidobacterium , Lactobacillus , Akkermansia, и Faecalibacterium ; (3) увеличение количества SCFAs, продуцирующих бактерии, таких как Roseburia и Eubacterium , и стимулирование концентрации SCFAs в кишечнике; (4) снижение численности патогенных бактерий, таких как Escherichia coli и Enterococcus .Эти изменения в микробиоте кишечника могут вызвать серию цепных реакций, которые затем могут улучшить метаболизм глюкозы в организме хозяина. Конкретные механизмы обсуждаются ниже.
4. Механизмы лечения СД китайскими лекарственными травами путем регулирования кишечной микробиоты
4.1. Противовоспалительный эффект
Хроническое воспаление средней степени тяжести признано характеристикой некоторых метаболических заболеваний, таких как сахарный диабет и ожирение, и состояние микробиоты кишечника тесно связано с этим типом воспаления [49]. Lactobacillus , пробиотики, широко используемые в различных областях, обладают функцией уменьшения воспаления, связанного с метаболизмом, как у крыс, получавших СТЗ [50], так и у людей с СД [51]. Bifidobacterium также может снижать высвобождение провоспалительных цитокинов за счет восстановления баланса между регуляторными Т-клетками (Treg) и В-лимфоцитами и обращением процесса бактериальной транслокации из кишечника в ткани [52, 53]. Как мы уже представили выше, китайские лечебные травы берберин [24], протеин облепихи [28], Zanthoxylum алкиламиды [29], полисахариды Radix Pseudostellariae [34], отвар Gegen Qinlian [39, 41] и так далее — все промоторы пролиферации Lactobacillus и Bifidobacterium , что может быть важной причиной того, что они оказывают лучшее терапевтическое действие.Помимо стимулирования роста пробиотиков, уменьшение побочных эффектов ЛПС также может ослабить воспалительную реакцию. Нарушение микробиоты может повышать уровень ЛПС в кишечнике, а затем усугублять воспалительное повреждение кишечного эпителия. Когда чрезмерное количество ЛПС попадает в кровь через поврежденную слизистую кишечника, может возникнуть системное воспаление слабой степени [54]. В вышеперечисленных лечебных травах отвар Gegen Qinlian [41] и отвар Banxia Xiexin [45] могут уменьшить утечку LPS и уменьшить воспалительные факторы в сыворотке; Отвар Huanglian Jiedu [42] может подавлять экспрессию LPS-связанных воспалительных белков и улучшать барьерную функцию слизистой оболочки кишечника.
Вместе взятые, увеличение количества противовоспалительных бактерий, уменьшение выработки и утечки ЛПС и подавление воспалительных факторов, связанных с ЛПС, являются ключевыми звеньями противовоспалительного действия традиционной китайской медицины.
4.2. Антиоксидантный эффект
Окислительный стресс играет важную роль в патологическом процессе СД и не только разрушает клетки островка β и сигнальные пути инсулина, но также может способствовать серьезным осложнениям, таким как диабетическое сердечно-сосудистое заболевание и диабетическая нефропатия [55] .Недавние исследования показывают, что некоторые кишечные бактерии обладают антиоксидантной активностью. Во-первых, пробиотики снижают уровень окислительного стресса кишечника за счет собственных антиоксидаз и метаболитов антиоксидантов; с другой стороны, они также могут активировать антиоксидантную систему хозяина и улучшать окислительный стресс различными путями [56]. Здоровая кишечная микробиота является основой для поддержания окислительно-восстановительного гомеостаза, в то время как неупорядоченный состав микробиоты может индуцировать образование активных форм кислорода (АФК) в эпителиальном эпителии кишечника, вызывая повреждения кишечника или даже системные заболевания [57, 58].В последние годы исследователи подтвердили, что некоторые про- и пребиотики могут улучшить состояние окислительного стресса [59]. Точно так же вышеупомянутые гипогликемические ТКМ, такие как Dendrobium Candidum [21], полифенолы из Fructus Mori L . [30], и некоторые полисахариды трав [31, 32, 34–36] также обладают антиоксидантной активностью. В диабетическом состоянии энтерогенный эндотоксин не только является источником воспаления, но и может вызывать окислительный стресс в некоторых органах, таких как поджелудочная железа [60] и печень [61].Регулируя микробиоту кишечника и восстанавливая барьер слизистой оболочки кишечника, лекарственные травы могут уменьшить повреждение эндотоксином и избежать ряда проблем, вызванных им. Кроме того, накапливающиеся данные указывают на то, что некоторые бактерии, такие как Lactobacillus , Bifidobacterium и Akkermansia , а также бактериальный метаболит бутират также обладают потенциальными антиоксидантными свойствами [56, 62–64]; как указано выше, их увеличению может способствовать множество лекарственных трав.
Таким образом, некоторые лекарственные травы, особенно полисахариды трав, могут играть антиоксидантную роль, способствуя росту пробиотиков и ингибируя повреждение энтерогенными эндотоксинами.
4.3. Защита кишечного барьера
В 1986 году исследователи уже наблюдали повышенную кишечную проницаемость у пациентов с диабетом [65], а в последние годы люди были обеспокоены «второй атакой» на организм, вызванной повреждением кишечного барьера. В физиологическом состоянии слизистая оболочка кишечника поглощает питательные вещества и предотвращает проникновение патогенных бактерий или эндотоксинов в кровь. Однако под влиянием диеты с высоким содержанием жиров, воспалительной стимуляции, окислительного стресса и других факторов структура и функция слизистой оболочки кишечника могут быть нарушены, что может привести к повреждению кишечника и системным заболеваниям, таким как СД [66].Несмотря на то, что кишечный барьер играет важную роль для здоровья, существует лишь несколько препаратов, направленных на его устранение [67]. Регулируя микробный состав и увеличивая количество SCFA, некоторые растительные лекарственные средства могут улучшить барьерную функцию кишечника и подавить повреждение LPS. В частности, адгезивно-инвазивный вирус Escherichia coli может вызвать воспалительную реакцию и нарушить гомеостаз слизистой оболочки [68]. Напротив, Akkermansia и Lactobacillus могут восстанавливать целостность кишечного эпителия за счет снижения провоспалительных цитокинов [69, 70], а Bifidobacterium могут поддерживать здоровье кишечника, способствуя секреции глюкагоноподобного пептида-2 (GLP- 2) [71]; SCFAs, как топливо для слизистой оболочки кишечника, не только обеспечивают энергией эпителиальные клетки [72], но также способствуют сборке плотных контактов [73].Как упоминалось выше, берберин [24–26] может эффективно регулировать микробиоту кишечника, улучшать проницаемость кишечника за счет ингибирования сигнального пути TLR4 / MyD88 / NF-kB и увеличивать секрецию GLP-2. Составной препарат, содержащий фруктоолигосахарид лопуха GF13 и Lactobacillus plantarum Sc 52 [47], может значительно стимулировать продукцию SCFA и восстанавливать нарушенный кишечный барьер, что может быть потенциальным пребиотическим продуктом для лечения DM.
Короче говоря, поврежденный кишечный барьер является скрытым убийцей метаболического гомеостаза, и лекарственные травы могут улучшить это патологическое состояние, уменьшая количество патогенных бактерий, увеличивая количество защитных бактерий слизистой оболочки и способствуя выработке SCFAs.
4.4. Ингибирование липотоксичности
Липотоксичность относится к дисфункции или гибели клеток, вызванной избыточным накоплением липидов в нежировых тканях [74], что не только еще больше усугубляет прогрессирование СД [75, 76], но также приводит к диабетическим осложнениям, таким как кардиомиопатия [77] и ангиопатия [78]. Недавние исследования показывают, что микробиота кишечника играет множество фундаментальных ролей в поддержании метаболического гомеостаза липидов и может быть потенциальной мишенью для улучшения дислипидемии [79].Прежде всего, регулирование микробного соотношения кишечника является эффективным подходом. В целом, у людей с ожирением соотношение Firmicutes / Bacteroidetes (F / B) выше, чем у людей с нормальным весом [80, 81]. После обработки реином [27], полифенолами из Fructus Mori L . [30] и полисахариды Morus nigra [35], наблюдается более низкое соотношение F / B. Кроме того, лекарственные травы, такие как Zanthoxylum алкиламиды [29], полисахариды из семян Plantago asiatica L.[31] и ферментированный Momordica charantia L . [36] может подавлять липотоксичность, способствуя выработке ацетата и бутирата метаболитов кишечной микробиоты. В частности, ацетат может регулировать экспрессию генов, связанных с бежевым адипогенезом, в белой жировой ткани, тем самым способствуя выделению тепла [82]. Бутират полезен для усиления митохондриальной функции скелетных мышц и бурого жира, а также для увеличения расхода энергии [83]. Кроме того, у лиц с абдоминальным ожирением липополисахаридсвязывающий белок (LBP) сыворотки и NEFA сильно коррелируют, что позволяет предположить, что LPS также приводят к нарушению липидного обмена [84].Как обсуждалось выше, некоторые лекарственные травы могут подавлять ЛПС, регулируя микробиоту. Наконец, бактериальные метаболиты БА могут модулировать системный метаболизм липидов через ядерный фарнезоидный X-рецептор (FXR) и рецептор 5, связанный с G-белком (GPR5) [85], и это может быть потенциально важной мишенью для лекарственных трав, в то время как соответствующие доказательства отсутствуют, и необходимы дальнейшие исследования.
В целом, TCM снижает липотоксичность, главным образом за счет снижения соотношения F / B, регулирования микробных метаболитов ацетата, бутирата и уменьшения повреждения LPS.
4.5. Резюме
Таким образом, лекарственные травы могут оказывать множество полезных терапевтических эффектов на СД, регулируя микробиоту кишечника, а противовоспалительные и антиоксидантные эффекты, защита кишечного барьера и ингибирование липотоксичности являются основными механизмами. Более того, стимулирование секреции GLP-1 и ингибирование глюконеогенеза в печени также может быть связано с регуляцией микробиоты. Помимо восстановления функции островков и улучшения инсулинорезистентности, эти механизмы также способствуют предотвращению развития осложнений, связанных с диабетом.Одним словом, действие лекарственных средств на травах на микробиоту кишечника является всеобъемлющим и далеко идущим (рис. 1).
5. Обсуждение и перспективы на будущее
Данные многочисленных исследований подтверждают важную роль кишечной микробиоты в процессе лечения СД традиционной китайской медициной, но у большого числа видов бактерий, которые могут оказывать наиболее важные эффекты? Необходимо обратить внимание на ключевую микробиоту. Хотя на видов Lactobacillus приходится всего 0 видов.От 01 до 0,06 для всех видов бактерий, он играет важную роль в защите эпителиального барьера, продуцирует антипатогенные соединения и регулирует иммунитет [86]. Недавно накопленные данные показывают, что пробиотические штаммы Lactobacillus могут играть вспомогательную роль в лечении СД [87], в то время как другие исследования показывают, что численность Lactobacillus положительно коррелирует с уровнем глюкозы в крови [8, 88], поэтому Перекрестная связь между Lactobacillus и метаболизмом глюкозы требует дальнейшего изучения.Бифидобактерии являются одними из доминирующих представителей желудочно-кишечного тракта грудного ребенка [89], и избирательное увеличение количества бифидобактерий может улучшить сахарный диабет, вызванный диетой с высоким содержанием жиров, и метаболическую эндотоксемию у мышей [90]. Akkermansia muciniphila считается полезным микробом следующего поколения, который может активировать сигнальные пути Toll-подобного рецептора 2 и способствовать выработке IL-10, тем самым играя защитную роль для барьера слизистой оболочки кишечника [91]. Roseburia обладает высокой способностью продуцировать бутират, который может обеспечивать энергией эпителиальные клетки кишечника и подавлять высвобождение провоспалительных цитокинов [92].Обычно численность Bifidobacterium , Akkermansia, и Roseburia отрицательно коррелирует с уровнем глюкозы в крови [91–93]. Как показано выше, большая часть TCM может способствовать росту этих полезных бактерий, которые затем вызывают многоцелевые терапевтические эффекты для лечения DM.
Однако мы должны признать, что на микробиоту кишечника может влиять множество факторов [94]. Чтобы лучше использовать TCM, необходимо обсудить его в реальном мире, а не только в лаборатории.Среди факторов, влияющих на микробиоту взрослого человека, факторы питания могут составлять до 57% изменений микробиоты кишечника [95], и в последнее время диета, нацеленная на микробиоту кишечника для лечения СД, стала предметом всеобщего беспокойства [96]. Липин Чжао и его коллеги [97] обнаружили, что диета, богатая клетчаткой, может оптимизировать микробиоту кишечника, производить больше SCFA и помочь более эффективно контролировать уровень глюкозы в крови, что представляет собой новый экологический подход к управлению СД2. Кроме того, влияние диеты на микробиоту может быть связано с эффективностью лечебных трав.Кишечные бактерии могут преобразовывать химические вещества трав в различные биоактивные вещества, тем самым способствуя лучшему всасыванию и использованию [98], в то время как нарушенная микробиота может в некоторой степени влиять на нормальный метаболизм лекарств [99]. Итак, мы предполагаем, что микробиота кишечника, сформированная здоровым питанием, повысит эффективность традиционной китайской медицины, но эта гипотеза требует дальнейшего изучения.
Дальнейшие перспективы могут включать, но не ограничиваются следующими направлениями: прежде всего, следует применять более продвинутые технические средства, такие как метагеномное секвенирование и стерилизация животных, чтобы лучше выявить взаимосвязь между TCM и микробиотой кишечника.Кроме того, текущие исследования в основном сосредоточены на кишечных бактериях, LPS и SCFA, а дальнейшие исследования могут быть нацелены на кишечные грибы и другие бактериальные метаболиты, такие как BA. Кроме того, результаты исследований на мышах / крысах трудно применить в клинической практике напрямую, и срочно необходимы исследования микробиоты кишечника человека. И последнее и самое важное: больше внимания следует переключить от механизма к применению. С одной стороны, вводить новшества и улучшать традиционную китайскую медицину в направлении индивидуализированной целевой терапии; с другой стороны, попытайтесь объединить лекарственные травы с пробиотиками, пробиотиками или здоровой пищей и разработать новые и более эффективные составные препараты.
6. Заключение
Китайские лекарственные травы, используемые для лечения СД, тесно связаны с регулированием микробиоты кишечника, а оптимизированная микробиота кишечника улучшает метаболизм глюкозы у хозяев, в основном за счет противовоспалительного и антиоксидантного действия, защищая кишечный барьер. и подавление липотоксичности. На следующем этапе необходимо провести дополнительные исследования микробиоты человека и принять индивидуализацию, точность и междисциплинарную интеграцию в качестве целей развития.Короче говоря, микробиота кишечника предоставляет новую возможность выяснить механизм TCM при лечении DM; в то же время фитотерапия — это кладезь потенциальных пребиотиков и требует более глубокого изучения.
Disclosure
Boxun Zhang и Rensong Yue являются соавторами.
Конфликт интересов
Авторы заявляют, что нет никаких конфликтов интересов относительно публикации этой статьи.
Вклад авторов
Все авторы несли ответственность за дизайн исследования. Boxun Zhang и Rensong Yue внесли равный вклад в эту работу. Документ подготовили Boxun Zhang и Rensong Yue . Юань Чен , Маойи Ян и Сяоин Хуан участвовали в поиске литературы; Jiacheng Shui , Yuliang Peng, и Jiawei Chin контролировали исследование; все авторы одобрили итоговую статью.
Благодарности
Работа поддержана Национальным фондом естественных наук Китая (№81774279) и ключевой научно-исследовательский проект провинции Сычуань (№ 2018SZ0068).
Измененные бактерии могут уменьшить воспаление и облегчить воспалительные заболевания кишечника
Дисбаланс бактерий в кишечнике может вызвать воспаление, являющееся причиной таких состояний, как колит, болезнь Крона и рак толстой кишки. Теперь ученые из Университета здравоохранения Флориды в сотрудничестве с исследователями из Университета штата Северная Каролина обнаружили белок, который может минимизировать эту реакцию, открывая способ восстановить баланс кишечных бактерий и потенциально изменить эти условия.
Исследователи начинают подготовку к фазе 1 клинических испытаний, чтобы проверить, может ли прием протеина в форме таблеток уменьшить воспаление в их пищеварительном тракте.
Группа работает с генетически измененной формой пробиотической бактерии Lactobacillus acidophilus. В предыдущих исследованиях ученые удалили ген, ответственный за поверхностный компонент клетки, который потенциально увеличивает воспаление кишечника. Они продемонстрировали, что Lactobacillus acidophilus, лишенный этого гена, может уменьшить воспаление кишечника, облегчая колит на моделях мышей.Согласно результатам, опубликованным в феврале в журнале EMBO Journal, группа обнаружила специфический белок, ответственный за значительное уменьшение воспаления.
«Мы считаем, что если вы можете взять под контроль воспаление, вы сможете контролировать прогрессирование заболевания толстой кишки», — сказал Мансур Мохамадзада, доктор философии, профессор медицинского факультета Медицинского колледжа UF и Ветеринарного колледжа UF. Лечебное отделение инфекционных болезней и патологии.«Если вы можете ослабить местные воспалительные реакции толстой кишки, вы сможете контролировать системные эффекты в периферических органах».
В то время как некоторые виды воспалений помогают бороться с вредными бактериями, потребляемыми с пищей, повреждающие ткани последствия чрезмерного воспаления могут быть устранены путем передачи кишечных бактерий от здорового человека больным людям для восстановления баланса системы, — сказала Яима Лайтфут, доктор философии. , докторант кафедры инфекционных болезней и патологии УФ-колледжа ветеринарной медицины.Но исследователи UF в сотрудничестве с Тоддом Кленхаммером, доктором философии, профессором кафедры пищевой науки, микробиологии и генетики Университета штата Северная Каролина, ищут более простое решение.
«Было доказано, что у людей, страдающих воспалительным заболеванием кишечника, в кишечнике присутствует ненормальный состав бактерий. Состав обладает провоспалительным действием », — сказал Лайтфут. «Вместо того, чтобы пытаться заменить плохой состав кишечных бактерий на хороший состав, наша цель — добавить один микроорганизм, который может помочь восстановить баланс в кишечнике.”
Лайтфут, ведущий автор статьи, сказал, что передача бактерий нуждающемуся в них человеку может вызвать нежелательное воспаление в зависимости от реакции получателя на эти конкретные бактерии.
«Вместо этого мы добавляем один белок, который, как мы знаем, не вызывает воспаления и который, как мы знаем, вызывает защитный иммунитет», — сказала она.
Lactobacillus acidophilus содержит три белка поверхностного слоя в дополнение к молекуле, увеличивающей воспаление. Эти молекулы клеточной поверхности взаимодействуют с иммунными клетками, вызывая определенные реакции.Исследователи генетически изменили бактерию так, что она создала только внешний поверхностный слой, названный поверхностным слоем
, протеином A.
Работая на моделях мышей, исследователи обнаружили, что белок А поверхностного слоя связывается с рецептором на клетках иммунной системы, который контролирует воспаление, сказал Лайтфут. Когда они удалили этот рецептор у мышей, бактерия больше не уменьшала воспаление в кишечнике.
Затем исследователи планируют определить, как долго длится защитный эффект белка, что поможет им подготовиться к клиническим испытаниям.
«Плохой парень — это патогенное воспаление, которое может привести к колиту или раку толстой кишки», — сказал Мохамадзаде. «Наша цель — успокоить этого плохого парня».
Стабильное приживление микробиоты человека мышам с помощью однократного введения через желудочный зонд после кондиционирования антибиотиками | Микробиом
Перенос микробиоты человека мышам, свободным от микробов
Эффективность переноса криоконсервированной замороженной фекальной микробиоты донора человека первоначально оценивалась на стерильных мышах C57BL / 6 с использованием одного донора (No.41) и подтверждены по сравнению с контролем, состоящим из стерильного PBS. Секвенирование фекальных гранул без микробов мыши перед вмешательством выявило низкое количество считываний последовательностей (в среднем 3028 ± 297) по сравнению с образцами после введения донора через желудочный зонд (167 967 ± 44 543). Из-за небольшого числа считываний последовательностей до вмешательства и после желудочного зондирования с помощью PBS, данные о не разреженных последовательностях были использованы для расчета несходства Брея-Кертиса для ординации с помощью анализа главных координат (PCoA) (рис. 1a). Сообщества контрольных мышей показали небольшое отклонение от временной точки T 0 , в то время как сообщества мышей, которым был введен зонд с донорской микробиотой, показали отчетливое разделение по T 3 после введения через зонд и имели аналогичное положение с сообществами людей-доноров вдоль x -ось.
Рис. 1Состав сообщества стерильных мышей с донорской фекальной микробиотой через зонд. a Анализ основных координат не разреженных образцов от донора ( алмаз ) и образцов мышей ( кружков ) ( r 2 = 0,78). Обозначения: серый — T 0 мыши, открытые — контрольные мыши, черные — мыши с введенным через зонд. b Индексы Шеннона бактериальных сообществ у доноров и мышей, которым был введен зонд, уменьшены до 50 456 считываний последовательностей на образец.Индексы Шеннона были усреднены для всех повторностей ( n = 3) и были значительно выше в донорских образцах, чем у мышей ( P ≤ 0,001), согласно апостериорному тесту Тьюки. c Состав многочисленных семейств в сообществах доноров и мышей, которым вводили зонд. Сообщества были разрежены до 50 456 последовательностей на образец, а численность семейств была усреднена среди всех повторов в каждый момент времени ( n = 3). Планки ошибок отражают SEM среди повторов. Сходство доноров относится к проценту сообщества, относящемуся к сообществу доноров, как определено SourceTracker
.Бактериальные сообщества были разрежены путем случайной подвыборки до 50 456 считываний последовательностей на образец для статистических сравнений, что позволило удалить T 0 и контрольных мышей из набора данных.Процент приживления донора определялся с использованием алгоритма байесовского SourceTracker [21], который присваивает процент сообщества мышей (сток) донорским (исходным) сообществам на основе наличия общих операционных таксономических единиц (OTU).
Индексы Шеннона среди сообществ людей-доноров были значительно выше (4,31 ± 0,03, среднее ± SEM), чем у мышей, которым был введен зонд через зонд (3,23 ± 0,06; post hoc Тьюки P ≤ 0,001), и разнообразие Шеннона среди микробных сообществ мышей не различались по времени (рис.1б). Оценка состава микробного сообщества на уровне семьи у колонизированных мышей выявила более высокую относительную численность семейств Porphyromonadaceae и Bacteroidaceae , но более низкую численность Lachnospiraceae и Ruminococcaceae в сообществах мышей по сравнению с людьми (рис. 1c).
Колонизированные сообщества фекальных микробов мышей состоят примерно из 65% донорских таксонов (процент от общего числа считываний последовательностей) на T 3, , и эти OTU расширились, чтобы занять примерно 70% сообщества в течение 3-недельного наблюдения. -вверх (рис.1в). Было обнаружено, что только три OTU присутствуют во всех образцах доноров и донорских мышей в T 21 , и они были классифицированы как две OTU в пределах Bacteroides и одна в пределах рода Subdoligranulum . Одна OTU в каждой из Barnesiella , Bacteroides и Subdoligranulum совместно использовалась в T 14 , причем последние две также использовались в образцах T 21 . Только одна и две OTU были обнаружены среди всех образцов доноров и всех образцов T 7 и T 14 соответственно.Оценка состава сообщества с помощью анализа сходства (ANOSIM) с использованием различий Брея-Кертиса, рассчитанного на основе численности OTU, показала отсутствие значительных различий (при скорректированном по Бонферрони α = 0,005) в бета-разнообразии между донорскими сообществами и донорскими сообществами. — мышей, которым вводили желудочный зонд, в отдельные моменты времени после введения через желудочный зонд.
Минимальный перенос микробиоты человека к мышам с измененной флорой Шедлера
Последующий эксперимент был проведен на мышах-гнотобиотах, выведенных с измененной флорой Шедлера (АЧС) [22], известным консорциумом восьми штаммов, чтобы определить, колонизируется ли небольшое количество штаммов. микроорганизмы были разрешены для передачи микробиоты человека.В то время как сообщества мышей, охарактеризованные секвенированием следующего поколения, были более сложными, чем ожидалось, со средним значением 236 ± 22 OTU среди всех образцов T 0 , только 7 OTU были общими. Эти ОТЕ были классифицированы как таксоны в пределах Barnesiella (2 ОТЕ), Clostridium XIVa, Lactobacillus , Xylanibacter , Parabacteroidetes и Sporobacterium .
Каждой из двух экспериментальных клеток с мышами C57BL / 6 ASF через желудочный зонд вводили микробиоту от отдельного человека-донора (No.23 или № 41B, партия отличается от той, что использовалась в экспериментах с стерильными мышами). Одна дополнительная клетка с мышами ASF содержалась без желудочного зондирования. Индексы Шеннона существенно не различались по ANOVA среди образцов доноров и мышей по временным точкам в данной клетке или между клетками (рис. 2a – c; Fisher F = 0,593). Более того, сообщества мышей таксономически отличались от сообществ их соответствующих доноров (Fig. 2d-f).
Рис. 2Состав сообщества мышей АЧС. a — c Индексы Шеннона мышей, получавших фекальную микробиоту человека от донора 23, донора 41 или без желудочного зондирования, соответственно. Донорские образцы представляли собой единичные повторы. Индексы Шеннона представляют собой средние значения для 4, 3 и 5 мышей, соответственно, и столбцов ошибок, отражают SEM. d — f Обилие преобладающих семей в фекальных сообществах от мышей, получавших донора 23, 41 или без желудочного зондирования, соответственно. Относительная численность отражает средние значения среди повторов, а планки ошибок отражают SEM среди повторов.Сходство донора и мыши относится к анализу SourceTracker, где сообщество исходных мышей было взято за точку времени T 0 . Сходство доноров (0%) не было обнаружено в контроле
без желудочного зондирования.Распределение различий по Брею-Кертису среди образцов выявило некоторое расхождение среди мышей с АЧС, которые получали донорский материал от контроля, но сообщества этих мышей, как правило, не становились значительно более похожими на сообщества доноров (дополнительный файл 1: рисунок S1).Анализ ANOSIM, группирующий все временные точки после желудочного зондирования по полученному донорскому материалу, выявил значительные различия в составе сообществ между сообществами контрольных мышей и сообществами доноров ( P = 0,001). Мыши, получившие микробиоту донора 23, сохранили сообщества, которые значительно отличались от таковых в выборке донора ( P = 0,002), но эти сообщества не отличались от таковых у контрольных мышей или мышей, получивших донор 41B ( P = 0,044 и 0 .230, исправлено α = 0,005). Напротив, у мышей, получивших донорскую микробиоту 41, произошел сдвиг в составе сообщества, что привело к значительным отличиям от контроля ( P = 0,003), но не от сообщества доноров ( P = 0,012).
SourceTracker обнаружил низкий процент сходства (<10%) микробных сообществ у мышей после желудочного зондирования по сравнению с таковыми у донора 23 или 41B (рис. 2d – f). T 0 сообществ использовались для определения процента сообщества, которое SourceTracker отнесло к местной микробиоте мышей, и взятие этой пропорции с той, которая приписывалась донору, составило примерно 90% сообщества во всех клетках.Используя это программное обеспечение, оставшуюся часть микробного сообщества нельзя было окончательно отнести к категории источников.
Первичные таксоны, которые наблюдались для передачи от доноров мышам с АЧС, также были обнаружены у мышей с АЧС, которые не получали донорский желудочный зонд (рис. 2d – f). Среди мышей, получавших донора 23, преобладающими семьями, которые были отнесены к донору по T 3 и T 7 , когда наблюдалось максимальное сходство с донором, были Bacteroidaceae (2.58 ± 0,81% считываний последовательностей) и Porphyromonadaceae (0,79 ± 0,27%). Для мышей, получивших донор 41, преобладающими переселенными семьями были Bacteroidaceae (2,21 ± 1,11%), Clostridiaceae 1 (1,77 ± 1,94%) и Porphyromonadaceae (0,94 ± 0,44%). OTU не был обычным среди всех образцов мышей и донорских сообществ, когда оценки проводились во время наибольшего наблюдаемого сходства с донором. Однако три из первоначально общих OTU (в пределах Barnesiella , Clostridium XIVa и Lactobacillus ) все еще были общими для 10 из 12 образцов на T 26 .
Ограниченный перенос микробиоты человека мышам SPF, предварительно обработанным однократным курсом антибиотиков
Поскольку кишечные микробные сообщества мышей с АЧС были устойчивы к переносу фекальной микробиоты человека, в качестве кондиционирования использовалось лечение антибиотиками в течение 1 недели. схемы, разрушающие предполагаемую нишевую специализацию, вызывающую сопротивление приживления. Были протестированы два разных курса лечения антибиотиками: антибиотики, которые могут всасываться системно (ампициллин, цефоперазон и клиндамицин), или те, которые не могут всасываться (эртапенем, неомицин и ванкомицин).Кроме того, некоторых мышей лечили 2-дневным кишечным слабительным средством для облегчения выведения остаточных антибиотиков и местной микробиоты; всем мышам вводили через зонд один и тот же донорский материал, используемый для мышей, свободных от микробов (донор 41A).
Все виды лечения антибиотиками значительно снижали индексы разнообразия сообщества Шеннона по сравнению с теми, которые были до воздействия антибиотиков или среди донорских образцов (апостериорная оценка Тьюки P <0,0001). Комбинация системных антибиотиков оказывала различное влияние на альфа-разнообразие и состав бактериального сообщества (дополнительный файл 1: рисунки S2 и S3), но в целом не затрагивала представителей клад Paenibacillaceae 1 и Clostridiaceae 1.Напротив, неабсорбируемый коктейль пощадил семейство Lactobacillaceae . Для обоих коктейлей с антибиотиками слабительное вымывание также соответствовало увеличению количества менее распространенных таксонов (дополнительный файл 1: Рисунок S3), и этот эффект был значительно более выражен с коктейлем системных антибиотиков.
Фекальные сообщества мышей, получавших системные антибиотики, со слабительным или без него, после желудочного зондирования с тем же препаратом донорского материала, который использовался для стерильных мышей, имели индексы Шеннона, аналогичные донорским сообществам (среднее значение 3.От 63 до 3,96 для мышей и 4,29 ± 0,03 для донора, по Тьюки post hoc P > 0,05) на T 21 и T 14 соответственно. Сообщества мышей, получавших системные антибиотики со слабительным средством, имели значительно более низкие индексы Шеннона, чем другие группы мышей при T 4 и T 7 после желудочного зондирования (2,48 ± 0,17 и 3,00 ± 0,21, соответственно, по сравнению со средними значениями от 3,14 до 3,63. в остальных группах — P <0,05). В отличие от этого, разнообразие Шеннона существенно не отличалось среди других исследованных групп.
Мыши, получавшие системные антибиотики, имели сообщества со значительно более высокими относительными пропорциями членов изобильных семейств Lachnospiraceae , Bacteroidaceae , Clostridiaceae 1 и Enterobacteriaceae и более низкими численностями Lactobacillaceae , чем те, которые получали не те, что получали Lactobacillaceae . -абсорбируемый коктейль ( P <0,05; Таблица 1, Рис. 3). Точно так же мыши, которым вводили слабительное, имели более высокие относительные количества Bacteroidaceae , Clostridiaceae 1 и Enterobacteriaceae , с более низкими относительными количествами Lactobacillaceae и Lachnospiraceae ( P <0.05).
Таблица 1 Распределение обильных семейств в образцах фекалий мышей, получавших однократный курс антибиотиков. Численность семей была усреднена по всем временным точкам после желудочного зондирования и представлена как среднее значение ± стандартная ошибка. ANOVA был выполнен для каждой семьи, и там, где наблюдались значительные различия, буквы обозначают значимые различия с помощью апостериорного теста Тьюки ( P <0,05) Рис. 3Численность преобладающих семей в фекальных сообществах мышей, получающих однократное лечение антибиотиками. a Мыши получали системные антибиотики с последующим слабительным ( n = 4). b Мыши получали системный антибиотик без слабительного ( n = 5). c Мыши получали неабсорбируемые антибиотики, а затем слабительное ( n = 4). d Мыши получали невсасывающиеся антибиотики без слабительного ( n = 4). Относительная численность отражает средние значения ± SEM для всех повторностей. Сходство донора и мыши относится к анализу SourceTracker, где исходное сообщество мышей принималось за точку времени до применения антибиотика.Все мыши получали замороженную фекальную микробиоту от того же донорского препарата, который использовался в эксперименте на обезжиренных мышах
Процент сходства донорского сообщества среди всех групп лечения, определенный с помощью SourceTracker, был аналогичен тому, который наблюдался для свободных от микробов мышей при T 4 (среднее от 56,7 до 67,2% сходства доноров, апостериорный тест Тьюки P ≥ 0,999 ; Рис.3). Однако после T 14 и T 21 дней после желудочного зондирования сходство доноров было значительно ниже среди мышей, получавших системные антибиотики ( P <0.05) по сравнению с колонизированными реципиентами, свободными от микробов. Среди мышей, которым вводили коктейль из невсасывающихся антибиотиков, сходство доноров немного снизилось, примерно до 55%, но существенно не отличалось от временной точки T 4 . Различия в перенесенных родах также варьировали между группами, леченными антибиотиками, и колонизированными стерильными мышами (таблица 2). При Т 21 колонизированные мыши без микробов имели тенденцию иметь большее относительное количество представителей Bacteroides , в то время как мыши, леченные антибиотиками, имели большее количество Parabacteroides среди других перенесенных родов.Однако при T 21 с помощью ANOVA наблюдалось значительно большее сходство доноров у колонизированных стерильных мышей (Fisher’s F = 0,026), чем в других группах мышей. Не было обнаружено, что специфические OTU обычно переносятся среди всех мышей SPF. Кроме того, оценка эффектов использованного коктейля антибиотиков или включения слабительного показала, что ни один из параметров существенно не влиял на степень приживления донорской микробиоты ( F = 0,136 и 0,802, соответственно).
Таблица 2 Относительная численность (среднее значение ± стандартная ошибка,%) преобладающих родов, перенесенных мышам, получавшим однократный курс антибиотиков, или мышам, свободным от микробов. Только роды, переданные при ≤1,00% считываний последовательностей, показаны в момент времени T 21 . ANOVA был выполнен для каждой семьи, и там, где наблюдались значительные различия, буквы обозначают значимые различия с помощью апостериорного теста Тьюки ( P <0,05)Улучшенное приживление микробиоты человека у мышей SPF после многократного последовательного лечения антибиотиками
Для более тщательного нарушения естественной микробиоты кишечника мышей подвергали трех курсам антибиотиков (по 7 дней каждый), чередуя неабсорбируемые, системные и невсасываемые антибиотики. -рассасывающиеся коктейли с антибиотиками.Лечение антибиотиками хорошо переносилось и не сопровождалось какими-либо наблюдаемыми негативными клиническими признаками, такими как отвращение к питьевой воде или потеря веса. Для экспериментальных групп использовались три разных донора: замороженные препараты фекалий от доноров № 36, 41A (та же партия, что использовалась в экспериментах с стерильными мышами) и 42 (дополнительный файл 1: Рисунок S4). Кроме того, поддерживали контрольные клетки, в которые включали мышей, получавших либо лечение антибиотиками, без донорского желудочного зондирования, либо донорский зонд без лечения антибиотиками (дополнительный файл 1: рисунок S4).
Среди экспериментальных клеток сообщества, охарактеризованные в T 0 , день введения через желудочный зонд, имели значительно более низкие индексы Шеннона, чем у доноров или образцов из более поздних временных точек (апостериорная точка Тьюки P ≤ 0,001; рис. 4a). Индексы Шеннона были значительно выше при T 3 , чем при T 0 ( P = 0,015). Однако к T 7 различия в альфа-разнообразии существенно не отличались от донорских сообществ ( P ≥ 0.983). Подобно мышам, получавшим однократный курс антибиотиков, процент сходства доноров при T 3 был высоким, в пределах от 63,4 до 87,9% (средние значения; рис. 4b – d). Хотя эти проценты немного снизились с течением времени, высокий уровень сходства сохранялся в течение 3-недельного периода времени, в отличие от снижения сходства, наблюдаемого при однократном лечении антибиотиками. При Т 21 у мышей, которые получали последовательный коктейль, как правило, был больший процент донорского приживления, чем у мышей, которые получали однократные курсы системных или невсасывающихся антибиотиков ( F = 0.050), хотя различия в приживлении между мышами, получавшими однократный нерассасывающийся коктейль, не отличались от тех, которые получали последовательный коктейль (Tukey’s P = 1.000).
Рис. 4Разнообразие и численность преобладающих семей в фекальных сообществах мышей, получавших многоразовую терапию антибиотиками. a Средние индексы Шеннона фекальных сообществ мышей, получавших антибиотики и донорский желудочный зонд. Столбцы с одной и той же буквой существенно не различались по результатам апостериорного теста Тьюки ( P <0.05). b Преобладающие семьи от мышей, которым вводили желудочный зонд от донора 36. c Преобладающие семьи от мышей, которым вводили желудочный зонд от донора 41. d Преобладающие семьи от мышей, которым вводили желудочный зонд от донора 42. Все значения были усреднены среди реплик от доноров ( n = 3, каждая), и мыши, получавшие зонд от доноров 36, 41 и 42 ( n = 4, 5 и 2, соответственно). Сходство донора и мыши относится к анализу SourceTracker, где исходное сообщество мышей было принято в качестве временной точки до применения антибиотика только для донора 41 (та же партия, что использовалась в эксперименте без микробов)
Распределение несходства Брея-Кертиса с помощью PCoA выявило разделение донорской и экспериментальной групп от контроля и образцов T 0 (дополнительный файл 1: Рисунок S4).Это разделение, оцененное с помощью анализа молекулярной дисперсии, было значительным ( P <0,001), как и различия в составе сообществ, оцененные с помощью ANOSIM ( P <0,001). Более того, сообщества доноров и сообщества соответствующих им экспериментальных мышей не различались достоверно ни в одном из тестов ( P = 0,002–0,006, скорректированный по Бонферрони α = 0,0009). Однако микробные сообщества у колонизированных мышей-реципиентов, свободных от микробов и леченных антибиотиками, которые получали фекальный материал от донора 41A, значительно различались в обоих тестах ( P <0.001, Дополнительный файл 1: Таблица S1).
Сходство с донорской микробиотой было сопоставимо для обработанных антибиотиками и колонизированных стерильных мышей во все моменты времени, за исключением того, что мыши, получавшие материал от донора 36, показали значительно больший процент сходства при T 3 , чем у других мышей. группы ( P ≤ 0,018). Напротив, очень низкие уровни сходства (≤12% от сообщества) наблюдались среди контрольных групп (дополнительный файл 1: рисунок S5). Анализ SourceTracker определил, что представители рода Bacteroides являются одними из наиболее распространенных таксонов, передаваемых в группы стерилизации и лечения антибиотиками (Дополнительный файл 1: Рисунок S6), и Parabacteroides (в семействе Porphyromonadaceae ) также были распространены. .Представители рода Barnesiella (в пределах Porphyromonadaceae ) были общими для обеих групп, получивших материал от донора 41, в то время как представители рода Akkermansia (в пределах Verrucomicrobiaceae ) были среди наиболее распространенных, переданных от донора 36.
Устойчивость местного сообщества мышей SPF была дополнительно исследована, и было обнаружено, что она плохо восстанавливается после лечения антибиотиками (дополнительный файл 1: рисунок S7). Контрольные мыши, которым вводили только донорский зонд без антибиотиков, показали гораздо большее сходство с исходным сообществом мышей (89.4–95,0%) во все временные точки после желудочного зондирования. Напротив, согласно T 21 , только приблизительно 30% считываний последовательностей в контрольном сообществе (только антибиотики) можно было отнести к сообществу мышей до применения антибиотиков с помощью анализа SourceTracker, и большинство этих считываний (25,52 ± 4,56%) были классифицированы как представители рода Anaeroplasma , а все остальные роды вносили лишь незначительный (<0,50%) вклад. Более того, восстановление коренной общины, похоже, стабилизировалось примерно в этот последний момент времени.Среди экспериментальной группы небольшой процент аборигенного сообщества мышей, по-видимому, выздоровел (~ 10%) и не изменился с T 14 на T 21 временных точек. Основные таксоны, связанные с восстановлением местной микробиоты, были отнесены к членам рода Sporobacterium (3,28 ± 1,38%) и группе Clostridium XIVa (1,14 ± 1,04%) в момент времени T 21 .
Приживление микробиоты человека у мышей SPF, получавших лечение антибиотиками, не приводит к активации иммунной системы
Колонизация стерильных мышей комменсальной микробиотой запускает массивную активацию иммунной системы и созревание желудочно-кишечного тракта [23,24,25].Это может быть потенциальным смешивающим фактором в исследованиях, которые пытаются выяснить различия в функциональности между разными прижившимися микробными сообществами. Однако иммунная система взрослых мышей, содержащихся в высокогигиеничных барьерных помещениях SPF, также относительно незрелая и напоминает иммунную систему новорожденных людей [26]. В частности, взрослые мыши SPF имеют заметно меньшее количество Т-клеток, подвергшихся воздействию антигена, при почти полном отсутствии терминально дифференцированных эффекторных Т-клеток памяти по сравнению со взрослыми дикими мышами или мышами из зоомагазинов.Таким образом, мы охарактеризовали фенотип Т-клеток у мышей-реципиентов SPF через 1 месяц после приживления микробиоты человека. Обилие антиген-испытанных и высокодифференцированных CD8 и CD4 Т-клеток в селезенке (стратегия стробирования, показанная в дополнительном файле 1: Рисунок S8), как определено экспрессией CD44, CD62L и лектин-подобных рецепторов клеток-киллеров член 1 подсемейства G (KLRG1), не был изменен лечением антибиотиками или приживлением микробиоты человека (дополнительный файл 1: рис. S9A-C). Точно так же не было эффекта от лечения антибиотиками, с приживлением или без приживления человеческой микробиоты, на количество циркулирующих гранулоцитов, включая нейтрофилы, в периферической крови (дополнительный файл 1: рис.S9D и E). Кроме того, на количество гемопоэтических (CD45 + ) клеток, включая CD8α + Т-клетки в интраэпителиальном отделе и компартменте собственной пластинки тонкой кишки, также не влияло приживление микробиоты человека (дополнительный файл 1: рис. S9F и ГРАММ). Таким образом, это ограниченное иммунологическое исследование не выявило доказательств того, что прививаемая человеческая микробиота у мышей SPF приводила к системной иммунной активации или активации слизистых оболочек или обеспечивала новые родственные антигены для развития эффекторных Т-клеток или Т-клеток памяти.
Подготовка кишечника в колоректальной хирургии: время расплаты уже наступило | Британский журнал хирургии
Идея проведения первичного анастомоза толстой кишки у пациента с острой перфорацией толстой кишки и септическим абдоменом с неподготовленной толстой кишкой кажется анафемой для здравого смысла хирургического вмешательства. Тем не менее, согласно нескольким отчетам, такая практика не только приемлема, но и считается рентабельной и безопасной 1 , 2 . Что-то изменилось? Была ли наша культура безопасности узурпирована нашей уверенностью в том, что сегодня, независимо от осложнений, с большинством опасных для жизни послеоперационных инфекций можно успешно справиться и «спасти» пациентов с помощью ранней визуализации, чрескожного дренирования и лапаротомии для контроля повреждений 3 , 4 ?
Некоторые из наиболее спорных аспектов колоректальной хирургии связаны с наибольшим исследовательским интересом и наиболее сильными мнениями и расхождениями на уровне отдельных практикующих врачей; примеры включают использование защитной стомы, использование механической подготовки кишечника (MBP) и первичный анастомоз по сравнению с колостомой .Однако другие, возможно, более простые методы используются повсеместно без проблем. Например, независимо от риска инфекции в месте хирургического вмешательства (ИОХВ), парентеральные антибиотики назначаются рутинно всем пациентам, несмотря на то, что лишь незначительное меньшинство подвержено риску или разовьется инфекцией. В этой ситуации парентеральное введение антибиотиков просто и, по крайней мере, на данный момент, считается безвредным. Эта логика также применяется к рутинному проведению химиопрофилактики венозной тромбоэмболии (ВТЭ); хотя, возможно, это считается более рискованным, все пациенты проходят лечение для предотвращения очень небольшого риска ВТЭ у большинства пациентов.В отсутствие метода индивидуальной корректировки риска и выборочного применения этих профилактических мер их применение ко всем пациентам исключает возможность предположений из выборочных подходов и потенциальную ловушку исключения любого пациента, который потенциально может получить пользу. Тем не менее, при избирательном подходе нужно бороться с этикой того, допустимо ли даже у одного пациента развить опасное для жизни осложнение, когда процесс отбора не может быть определен как точный на 100 процентов.Ободрили ли нас системные улучшения в выявлении и лечении осложнений до такой степени, что наша уверенность в том, что они смогут вылечить пациентов с серьезными осложнениями (SSI, несостоятельность анастомоза), сделала очищающий раствор для кишечника и пероральные антибиотики больше не нужными? Здесь я предполагаю, что, возможно, стоит рассмотреть научную предпосылку использования MBP, прежде чем проводить еще одно сравнительное клиническое исследование, которое можно критиковать из-за предвзятости отбора, выбора антибиотиков, несогласованных групп пациентов и недостаточно мощного анализа, который затем становится еще один пример медицинского обращения 5 .
Наука, лежащая в основе MBP, заключается в том, что он значительно снижает микробную нагрузку, присутствующую в просвете толстой кишки и слизистой оболочке, тем самым предотвращая прямое микробное заражение операционного поля. 6–8 . Обоснование необходимости как слабительного очищения, так и пероральных антибиотиков основано на идее, что эта комбинация наилучшим образом распределяет эффективную дозу пероральных антибиотиков в толстой кишке, чего якобы невозможно достичь с помощью одних только внутривенных антибиотиков, независимо от их спектра активности 8 , 9 .Несмотря на то, что недавно возникла проблема с необходимостью очищения слабительным, в таких исследованиях изучались только общие показатели клинических исходов и практически отсутствовали какие-либо значимые результаты культивирования, которые могли бы указать, как такой подход эффективно воздействует на болезнетворные микроорганизмы, оставаясь при этом экологически нейтральным в отношении организмов, которые становятся выгодными 10 . Необходимость получения этой информации может быть критически важной, учитывая появляющиеся данные, свидетельствующие о том, что некоторые трудноизлечимые патогены, такие как Enterococcus faecalis и Pseudomonas aeruginosa , не только обычно выделяются из мест утечки анастомоза у людей, но также были показано, что он играет причинную роль в развитии несостоятельности анастомоза 11–14 .Наконец, недавние сообщения предполагают, что многие, если не большинство, ИОХВ после плановой операции на самом деле возникают не из-за прямого заражения операционного поля во время операции, а скорее после операции 15 . Была выдвинута гипотеза, что механизм SSI «троянский конь» возникает после операции, когда кишечные патогены проникают в иммунную клетку, бесшумно циркулируют, а затем попадают в операционную рану и заражают ее 16 , 17 . Если такие механизмы действительно подтверждены, отмена пероральных антибиотиков до операции на толстой кишке может быть нецелесообразной.
Принимая во внимание нашу готовность применять внутривенные антибиотики и профилактику ВТЭ у всех пациентов до операции, кажется, что стимул к отмене MBP за день до операции больше связан с его неприятным и громоздким характером, чем с его основным научным обоснованием. Одной из проблем может быть растущая путаница в эпоху постантибиотиков в отношении точного механизма действия, посредством которого патогены, находящиеся в микробиоме кишечника, вызывают SSI и анастомотические утечки. Новые знания в области микробиомных наук заставляют нас задуматься о том, нужна ли перезагрузка текущих формулировок MBP, вместо того, чтобы их вообще пропускать 9 .Здесь я утверждаю, что пришло время использовать технологии следующего поколения, чтобы точно понять, что мы делаем с микробиомом кишечника, когда клинические результаты оказываются ожидаемыми, а когда нет, и соответствующим образом корректировать наши действия 18 .
Эмпирические испытания режима X по сравнению с режимом Y или испытания раннего защитного закрытия стомы без получения данных с высоким разрешением биологии одного подхода по сравнению с другим, больше не должны быть приемлемыми.Если бы существовал более научно обоснованный, экологически нейтральный и менее неприятный способ сдерживания вредоносности кишечных бактерий во время колоректальной хирургии, вероятно, было бы мало сопротивления предлагать его всем пациентам, как мы это делаем с внутривенными профилактическими антибиотиками или ВТЭ. химиопрофилактика. Так как же этого достичь, пока мы не станем свидетелями еще одного эмпирически обоснованного исследования по этой проблеме, которое снова не дает никаких значимых дискриминирующих данных, за исключением грубых критериев клинических исходов и значения P ? На мой взгляд, следует сформировать рабочую группу, в которую войдут хирурги, специалисты по инфекционным заболеваниям, ученые-микробиомы и специалисты по клиническим испытаниям, которые разработают механизм для сбора информации, необходимой для восходящего (каламбурного) подхода, чтобы определить наиболее эффективный и безопасный метод ограничения вредоносности кишечных бактерий во время и после колоректальной хирургии, который также приемлем для пациента.В конце концов, я не знаю зрелых колоректальных хирургов, у которых не было бы утечки анастомоза или ИОХВ после операции, которая по всем параметрам, казалось, прошла, как ожидалось. День расплаты настал, и наши пациенты заслуживают самого пристального внимания к этому вопросу.
Раскрытие информации. Автор заявляет об отсутствии конфликта интересов.
Список литературы
1Гачабеков
М
,Оберкофлер
CE
,Туеч
JJ
,Hahnloser
D
,Бергамаски
р.
Резекция с первичным анастомозом vs невосстановительная резекция перфоративного дивертикулита с перитонитом: систематический обзор и метаанализ
.Colorectal Dis
2018
;20
:753
—770
2Гачабеков
М
,Туеч
JJ
,Тулина
И
,Coget
J
,Бриду
В
,Бергамаски
р.
Первичный анастомоз и невосстановительная резекция при перфорированном дивертикулите с перитонитом: метаанализ рандомизированных исследований
.Colorectal Dis
2020
;22
:1245
—1257
3Tevis
SE
,Карчмен
EH
,Фолей
EF
,Heise
CP
,Хармс
BA
,Kennedy
GD.
Способствует ли несостоятельность анастомоза высокой частоте неудач спасения?
Ann Surg
2016
;263
:1148
—1151
4Спенс
RT
,Хирпара
DH
,Доши
S
,Кереши
FA
,Чади
SA.
Выживет ли мой пациент при несостоятельности анастомоза? Прогнозирование неудач при спасении с использованием модифицированного индекса уязвимости
.Ann Surg Oncol
2020
. DOI: 10.1245 / s10434-020-09221-y.5Эррера-Перес
D
,Haslam
A
,Crain
T
,Gill
J
,Ливингстон
C
,Kaestner
V
и другие.Всесторонний обзор рандомизированных клинических испытаний в трех медицинских журналах выявил 396 медицинских отклонений
.eLife
2019
;8
: e45183. DOI: 10.7554 / eLife.45183.6Линдси
JT
,Смит
JW
,McClugage
SG
Jr ,Николс
RL.
Влияние обычно используемых препаратов кишечника на микрофлору слизистой оболочки толстой кишки и микрофлору просвета крысы модели
.Dis Colon Rectum
1990
;33
:554
—560
7Zelhart
MD
,Hauch
AT
,Слейки
DP
,Николс
RL.
Предоперационная подготовка толстой кишки антибиотиками: всегда ли мы знали ответ?
J Am Coll Surg
2014
;219
:1070
—1077
8Николс
RL
,Choe
EU
,Велдон
CB.
Механическая и антибактериальная подготовка кишечника в хирургии толстой кишки и прямой кишки
.Химиотерапия
2005
;51
:115
—121
9Алверди
JC
,Хайман
Н.
Подготовка кишечника при осаде
.Br J Surg
2020
;107
:167
—170
10Нельсон
RL
,Хасан
M
,Грант
MD.
Антибиотикопрофилактика при колоректальной хирургии: лучше всего перорально, внутривенно или и то, и другое, и нужна ли механическая подготовка кишечника?
Тех Колопроктол
2020
;24
:1233
—1246
11Ли
DS
,Ryu
JA
,Чанг
CR
,Ян
Дж
,Jeon
K
,Suh
GY
и другие.Факторы риска приобретения бактерий с множественной лекарственной устойчивостью у пациентов с несостоятельностью анастомоза после хирургического вмешательства при колоректальном раке
.Int J Colorectal Dis
2015
;30
:497
—504
12Olivas
AD
,Shogan
BD
,Валуцкайте
В
,Заборина
А
,Белогорцева
N
,Musch
M
и другие.Ткани кишечника вызывают мутацию SNP в Pseudomonas aeruginosa , которая усиливает ее вирулентность: возможная роль в несостоятельности анастомоза
.PLoS One
2012
;7
:e44326
13Shogan
BD
,Белогорцева
N
,Луонг
PM
,Заборина
А
,Lax
S
,Вефиль
Ц
и другие.Распад коллагена и активация MMP9 Enterococcus faecalis способствуют утечке кишечного анастомоза
.Sci Transl Med
2015
;7
:286ra68
14Вигеринк
M
,Хёджу
SK
,Мао
Дж
,Заборина
А
,Adriaansens
C
,Зальцман
E
и др. .Novel de novo синтезированный фосфатный носитель ABA-PEG20k-Pi20 подавляет выработку коллагеназы в Enterococcus faecalis и предотвращает утечку из анастомоза толстой кишки в экспериментальной модели
.Br J Surg
2018
;105
:1368
—1376
15Алверди
JC
,Хайман
N
,Гилберт
Дж.
Пересмотр причин инфекций в области хирургического вмешательства после плановых операций в эпоху асептики
.Lancet Infect Dis
2020
;20
:e38
—e43
16Крезалек
MA
,Хёдзю
S
,Заборина
А
,Окафор
Е
,Чандрасекар
L
,Биндокас
В
и другие.Может ли метициллин-устойчивый Staphylococcus aureus незаметно перемещаться из кишечника в рану и вызывать послеоперационную инфекцию? Моделирование «гипотезы троянского коня»
.Ann Surg
2018
;267
:749
—758
17Чжу
H
,Джин
H
,Чжан
C
,юаней
т.
Кишечник, устойчивый к метициллину Staphylococcus aureus вызывает инфекцию протеза по механизму «троянского коня»: данные из крысиной модели
.Bone Joint Res
2020
;10
:152
—161
18Прибыль
S
,Шао
С
,Хайман
N
,Алверды
JC.
Кишечный микробиом влияет на несостоятельность анастомоза и рецидив после хирургического вмешательства при колоректальном раке
.Br J Surg
2018
;105
:e131
—e141
© Автор (ы) 2021. Опубликовано Oxford University Press от имени BJS Society Ltd. Все права защищены. Для получения разрешений обращайтесь по электронной почте: journals.permissions@oup.
 Проводять ферменти, які покращують розщеплення їжі, прискорюють відновлення слизової, беруть участь в синтезі вітамінів та інших обмінних процесах, виробляють речовини, що перешкоджають росту патогенних мікроорганізмів;
Проводять ферменти, які покращують розщеплення їжі, прискорюють відновлення слизової, беруть участь в синтезі вітамінів та інших обмінних процесах, виробляють речовини, що перешкоджають росту патогенних мікроорганізмів; Містять мікроорганізми, які в нормальному стані не знаходяться в організмі людини, проте перешкоджають розмноженню в ньому патогенних мікробів.
Містять мікроорганізми, які в нормальному стані не знаходяться в організмі людини, проте перешкоджають розмноженню в ньому патогенних мікробів. Nat Rev Microbiol 2008; 6:339.
Nat Rev Microbiol 2008; 6:339. Лимонная кислота, сахар, подсолнечное масло, красители, ароматизаторы – отсутствуют. Бифиформ Бэби входит в группу пробиотиков 5 поколения, его назначают для лечения малышей, начиная с первых дней жизни.
Лимонная кислота, сахар, подсолнечное масло, красители, ароматизаторы – отсутствуют. Бифиформ Бэби входит в группу пробиотиков 5 поколения, его назначают для лечения малышей, начиная с первых дней жизни. 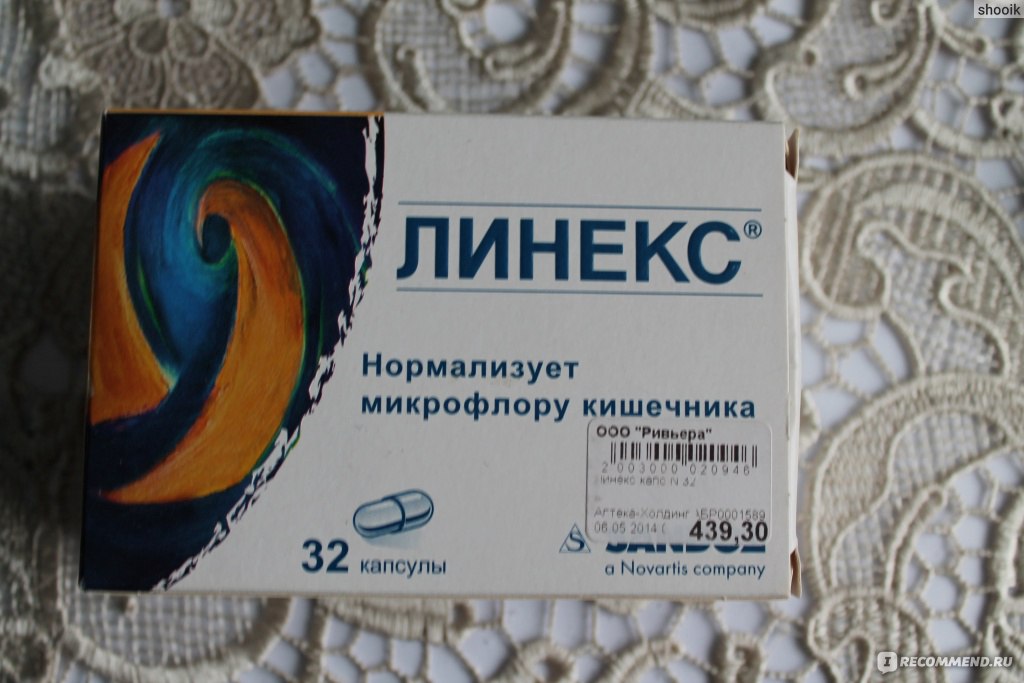 Препарат не используют в педиатрической практике, когда возраст малыша не превышает полугода. Колибактерин относится к пробиотикам 1 поколения.
Препарат не используют в педиатрической практике, когда возраст малыша не превышает полугода. Колибактерин относится к пробиотикам 1 поколения.  Состав пробиотика – автолизат дрожжей, бифидобактерии, аминокислоты, анаэробные микроорганизмы. Бифидум БАГ можно принимать при расстройстве пищеварения, которое вызвано аллергией, поскольку препарат не содержит лактозу, казеин, синтетические добавки. Новорожденным пробиотик назначают по 2 мл в сутки для лечения, по 1 мл – для профилактики. Для детей до 6 лет оптимальная дозировка – от 2 до 10 мл.
Состав пробиотика – автолизат дрожжей, бифидобактерии, аминокислоты, анаэробные микроорганизмы. Бифидум БАГ можно принимать при расстройстве пищеварения, которое вызвано аллергией, поскольку препарат не содержит лактозу, казеин, синтетические добавки. Новорожденным пробиотик назначают по 2 мл в сутки для лечения, по 1 мл – для профилактики. Для детей до 6 лет оптимальная дозировка – от 2 до 10 мл.