Онкомаркеры щитовидной железы — CMD
Термин «Опухолевые маркеры», или онкомаркеры (ОМ), объединяет широкий спектр различных высокомолекулярных веществ, продуцируемых опухолевыми клетками. Сюда могут входить фетальные белки, гормоны, ферменты, антигенные детерминанты, определяемые с помощью моноклональных антител, фрагменты молекул иммуноглобулинов и т.д. ОМ формируются внутри или на поверхности опухолевых клеток, или же под действием опухоли происходит их индукция в других клетках. Так или иначе ОМ попадают в кровеносное русло и могут быть количественно определены в периферической крови или в другой биологической жидкости (моча, спинномозговая жидкость, плевральная жидкость, содержимое кист, асцит и т.д.).
В настоящее время известно более 200 ОМ, но лишь некоторые из них представляют интерес для клинической практики. Единой классификации ОМ нет. С клинической точки зрения их удобно подразделять в соответствии с локализацией и гистологическим строением опухоли.
ОМ находят широкое применение в клинике. В сочетании с другими методами исследования они оказывают реальную помощь в диагностике злокачественного новообразования, оценке прогноза течения заболевания и радикальности операции, раннем выявлении рецидивов, контроле эффективности терапии, а также в получении дополнительной информации.
Диагностика онкологических заболеваний. В идеале ОМ должны продуцироваться только клетками злокачественной опухоли, и поэтому не должны присутствовать у здоровых людей и у лиц с доброкачественными патологиями. В действительности не найдено ни одного маркера, специфичного только для опухоли.
Диагностическая значимость ОМ определяется тремя характеристиками: диагностической чувствительностью, диагностической специфичностью и дискриминационным уровнем или дискриминационной концентрацией (ДУ, ДК) (Рис. 7).
ДУ – допустимая верхняя граница концентрации ОМ у здоровых людей и у пациентов с доброкачественными заболеваниями. Все значения маркера, которые превышают ДУ, считаются положительными или патологически повышенными.
Все значения маркера, которые превышают ДУ, считаются положительными или патологически повышенными.
Диагностическая специфичность ОМ – частота истинно отрицательных результатов теста в группе здоровых индивидуумов и/или лиц с доброкачественными патологиями, выраженная в процентах. В идеальном варианте она должна составлять 100% (рис.7, а), однако в действительности (рис. 7, б) всегда имеет место выявление ОМ у некоторой доли лиц, не имеющих онкопатологии, т.е. регистрация ложноположительных результатов. Чем ниже процент таких результатов, тем выше специфичность.
Диагностическая чувствительность ОМ – частота истинно положительных результатов теста в группе онкологических больных, выраженная в процентах. Чем выше чувствительность, тем реже отмечают ложноотрицательные результаты.
| Локализация опухоли | Гистологическое строение опухоли | Опухолевые маркеры |
|---|---|---|
| Печень | Гепатоцеллюлярная карцинома, гепатобластома | АФП |
| Холангиоцеллюлярная карцинома |
СА19. 9 9
|
|
| Ободочная и прямая кишка | Аденокарцинома | РЭА, СА19.9 |
| Анальный канал | Плоскоклеточная карцинома | SСС, CYFRA21.1 |
| Желудок | Аденокарцинома | РЭА, СА19.9, СА72.4, пепсиногены I и II |
| Поджелудочная железа | Аденокарцинома | СА19.9, СА242 |
| Пищевод | Плоскоклеточная карцинома | SСС, РЭА , CYFRA21.1 |
| Молочная железа | Аденокарцинома | СА15.3, РЭА |
| Яичник | Эпителиальные опухоли | СА125, СА199, НЕ4 |
| Герминогенные опухоли | АФП+ХГЧ | |
| Гранулезоклеточные опухоли | Ингибины | |
| Аденокарцинома | СА125, РЭА, НЕ4 | |
| Хориокарцинома | ХГЧ | |
| Шейка матки | Плоскоклеточная карцинома |
SСС , CYFRA21. 1 1
|
| Яичко | Несеминома | АФП+ХГЧ |
| Семинома | ЛДГ, ХГЧ, НСЕ | |
| Щитовидная железа | Медуллярная карцинома | |
| Фолликулярная, папиллярная карцинома | Тиреоглобулин, ТТГ, РЭА | |
| Легкое | Аденокарцинома | РЭА |
| Плоскоклеточная карцинома | CYFRA21.1, SСС | |
| Мелкоклеточный рак | НСЕ, Pro-GRP | |
| Предстательная железа | Аденокарцинома |
ПСАобщ. , ПСАсвоб./ПСАобщ. , ПСАсвоб./ПСАобщ.
|
| Кожа | Меланома | S100 |
| Мочевой пузырь и мочевыводящие пути | Плоскоклеточная карцинома; Переходно-клеточная карцинома | UBC, CYFRA21.1, TPS, TPА |
Чувствительность и специфичность – не постоянные значения. Их можно изменять в соответствии с поставленными задачами. Например, если необходимо увеличить выявляемость соответствующей патологии в данной группе людей, следует повысить чувствительность маркера. Для этого нужно снизить ДУ (сместить ДУ влево на рис. б). При этом чувствительность повысится, но за счет снижения специфичности. Наоборот, если нужно повысить специфичность, (снизить долю ложноположительных значений ОМ в контрольной группе), следует увеличить ДУ (сместить ДУ вправо на рис. б). При этом специфичность повысится, но в ущерб чувствительности, за счет увеличения числа “пропущенных” онкологических больных.
Использование ОМ в диагностических целях весьма ограничено. Большинство циркулирующих ОМ по причине недостаточной чувствительности и специфичности непригодно для выявления онкопатологии в бессимптомной популяции. И хотя чувствительность многих маркеров превышает 80%, это значение относится в большинстве случаев к поздним стадиям заболевания. При ранних стадиях, когда лечение может быть эффективным, чувствительность большинства ОМ не достигает 50%. Однако в группах с повышенным риском того или иного злокачественного новообразования, а также у пациентов с соответствующей симптоматикой (т. е. в случаях, когда частота данного заболевания значительно превосходит общепопуляционную) использование ОМ дает возможность раннего выявления ряда опухолей.
е. в случаях, когда частота данного заболевания значительно превосходит общепопуляционную) использование ОМ дает возможность раннего выявления ряда опухолей.
При использовании ОМ в диагностических целях следует принимать во внимание, что:
- ОМ никогда не используются для постановки диагноза самостоятельно, но лишь как дополнение к другим диагностическим процедурам и обязательно с учетом клинических данных;
- диагностическое значение могут иметь только ОМ, обладающие чувствительностью не ниже 50%.
Оценка прогноза заболевания. При выявлении злокачественного новообразования прогнозирование течения болезни является важной клинической задачей. Использование различных прогностических факторов и расчет прогноза приносят реальную пользу в лечении рака. Они представляют большой интерес не только для вычисления выживаемости, но служат для подразделения пациентов на группы риска, в соответствии с которыми назначается дополнительная к оперативному лечению терапия (химио-, гормональная или лучевая), призванная разрушить не обнаруженные при операции опухолевые образования, которые могут привести к появлению метастазов.
Оценка радикальности операции. После радикального удаления опухоли концентрация ОМ в крови должна снижаться в соответствии с его периодом полужизни. T1/2 – время, необходимое для снижения концентрации ОМ вдвое после радикального удаления опухоли. T1/2 значительно варьирует у разных ОМ – от нескольких часов для β -ХГЧ до нескольких суток для РЭА. Эти данные могут быть важны при оценке эффективности лечения.
Мониторинг в период ремиссии. По окончании лечения пациент должен находиться под наблюдением онколога с обязательным регулярным определением ОМ. При отрицательных значениях ОМ рецидива не наблюдается. Повышение ОМ с высокой степенью вероятности свидетельствует о рецидиве, клинические симптомы которого могут быть замечены лишь 3-6 месяцев спустя. Поэтому в некоторых случаях, например, при герминогенных опухолях, повышение уровня ОМ является достаточным основанием для начала химиотерапии, что позволяет улучшить отдаленные результаты.
Оценка эффективности лечения. Многочисленные литературные данные свидетельствуют о том, что регрессия опухоли сопровождается снижением уровня соответствующего маркера в сыворотке крови до нормальных значений. Отсутствие изменений или нарастание значений ОМ дает основание думать о резистентности опухоли к проводимой терапии и является основанием для пересмотра ее тактики.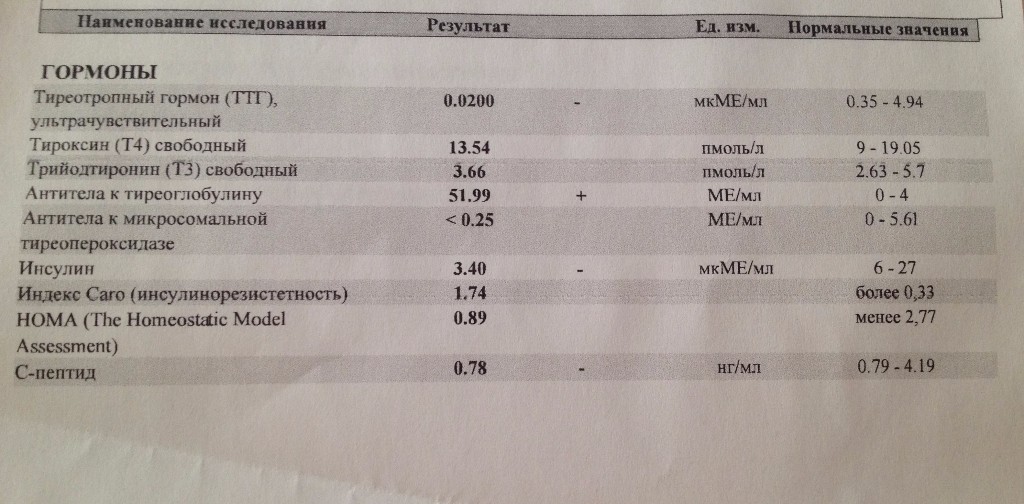
При интерпретации результатов следует учитывать множество факторов, способных влиять на уровень ОМ: наследственные, расовые, пол, возраст, физиологическое состояние, циркадные ритмы и суточные изменения, вредные привычки, проводимые диагностические исследования (неинвазивные и инвазивные), течение послеоперационного периода, доброкачественные патологии, лекарства.
Для определения ОМ используются различные иммунохимические методы – РИА, ИФА, ИХЛА, ЭХЛА и др. При трактовке результатов важно учитывать, каким методом определялся ОМ, а при необходимости динамического определения ОМ в течение длительного времени анализы рекомендуется проводить в одной и той же лаборатории. Это важно потому, что иммунологические методы, основанные на использовании моноклональных антител, определяют отдельные эпитопы, количество которых на одной молекуле может широко варьировать у разных людей. Экспрессия эпитопов может значительно изменяться в зависимости от физических условий и структурных особенностей молекулы. Многие современные методы распознают отщепленные от молекулы эпитопы, в результате чего можно получить трудно сравнимые как с клинической, так и с аналитической точек зрения результаты. При рутинном определении ОМ в разных лабораториях отличающиеся результаты могут быть функцией используемого метода. Например, при определении ХГЧ могут быть использованы анти-бета, анти-альфа и анти-бета/альфа антитела. В любом случае необходимо учитывать метод и факторы, которые могут вызывать ложноположительные результаты.
Многие современные методы распознают отщепленные от молекулы эпитопы, в результате чего можно получить трудно сравнимые как с клинической, так и с аналитической точек зрения результаты. При рутинном определении ОМ в разных лабораториях отличающиеся результаты могут быть функцией используемого метода. Например, при определении ХГЧ могут быть использованы анти-бета, анти-альфа и анти-бета/альфа антитела. В любом случае необходимо учитывать метод и факторы, которые могут вызывать ложноположительные результаты.
Содержание большинства ОМ определяют в крови, некоторые – в моче. Для определения условий взятия и хранения биопроб следует руководствоваться инструкцией к используемому набору реагентов.
Анализ на антитела к Тиреоглобулину со скидкой 50% в Lab4U
Интерпретация результатов исследования «Антитела к тиреоглобулину»
Интерпретация результатов анализов носит информационный характер, не является диагнозом и не
заменяет консультации врача. Референсные значения могут отличаться от указанных в
зависимости от используемого оборудования, актуальные значения будут указаны на бланке
результатов.
Референсные значения могут отличаться от указанных в
зависимости от используемого оборудования, актуальные значения будут указаны на бланке
результатов.
Определение титра антител к ТГ по клинической значимости уступает исследованию уровня антител к ТПО (тиреопероксидазе). При отсутствии антител к ТПО очень редко удается обнаружить антитела к ТГ, в тоже время, изолированное носительство антител к ТПО встречается достаточно часто.
Определение титра антител к ТГ является незаменимым исследованием в рамках мониторинга уровня тиреоглобулина у пациентов, получавших лечение по поводу высоко дифференцированного рака щитовидной железы.
Единица измерения: МЕ/мл
Референсные значения: < 5 МЕ/мл
Повышение:
- Тиреоидит Хашимото.

- Болезнь Грейвса.
- Рак щитовидной железы.
- Идиопатическая микседема.
- Аутоиммунный тиреоидит.
Снижение:
- Диагностического значения не имеет.
Гормональные исследования
Гормональные исследования Описание услуги Услуги и ценыОписание услуги
Гормональные исследования — анализ содержания тех или иных гормонов в крови и моче.
Данные виды исследований определяют не только общее состояние организма, но и состояние отдельных органов и систем.
Повышенный уровень гормонов или их недостаток вызывают в организме изменения, что может привести к серьезным заболеваниям.
Услуги и цены
Обратный звонок
Мы дорожим вашим мнением и учитываем все сообщения наших клиентов. После модерации обращения сотрудник компании ответит на него. Предельный срок ответа 7 календарных дней.
Задать вопрос
Мы дорожим вашим мнением и учитываем все сообщения наших клиентов. После модерации обращения сотрудник компании ответит на него. Предельный срок ответа 7 календарных дней.
Отправить заявку
Мы дорожим вашим мнением и учитываем все сообщения наших клиентов. После модерации обращения сотрудник компании ответит на него.
После модерации обращения сотрудник компании ответит на него.
Оставить отзыв
Мы дорожим вашим мнением и учитываем все сообщения наших клиентов. После модерации обращения сотрудник компании ответит на него. Предельный срок ответа 7 календарных дней.
Для наилучшего представления сайта мы используем файлы Cookie. Если Вы продолжите использовать сайт, мы будем считать что Вы с этим согласны, в противном случае покиньте данный сайт. Да, меня все устраивает!избыточное образование гормонов щитовидной железы.: причины, жалобы, диагностика и методы лечения на сайте клиники «Альфа-Центр Здоровья»
Тиреотоксикоз – заболевание, связанное с избыточным образованием гормонов щитовидной железы, проявляется тахикардией, потерей веса, тремором, повышенной потливостью, нарушением внимания, ухудшением памяти.
Тиреотоксикоз (синоним — гипертиреоз) — это состояние, обусловленное повышением концентраций свободных T4 и T3 — гормонов щитовидной железы. Причиной тиреотоксикоза служат самые разные заболевания.
Самая частая причина тиреотоксикоза — диффузный токсический зоб; на его долю приходится от 60 до 90% случаев (частота зависит от возрастной группы и местности). На втором месте по частоте стоят многоузловой токсический зоб и токсическая аденома щитовидной железы, на долю которых приходится 10—40% случаев тиреотоксикоза. Оба заболевания чаще встречаются у пожилых. От 5 до 20% случаев тиреотоксикоза обусловлены тиреоидитом (подострым гранулематозным и подострым лимфоцитарным). Прочие причины тиреотоксикоза, в том числе передозировка левотироксина (препарата, применяемого при обратном тиреотоксикозу состоянии — гипотиреозе) встречаются гораздо реже.
Жалобы
Клиническая картина и тяжесть тиреотоксикоза зависят от возраста больного, сопутствующих заболеваний и скорости развития болезни. Симптомы могут нарастать постепенно либо волнообразно и по выраженности колебаться от едва заметных до тяжелейших.
Симптомы могут нарастать постепенно либо волнообразно и по выраженности колебаться от едва заметных до тяжелейших.
Типичные жалобы: повышенная возбудимость, раздражительность, суетливость, бессонница, тремор рук, потливость, сердцебиение. Часто наблюдаются похудание и непереносимость жары, зуд. Больным зачастую бывает трудно подниматься по лестнице и вставать со стула: так проявляется слабость мышц. Усиление работы кишечника может привести к учащению стула, а в некоторых случаях — к нарушениям всасывания и поносу. Может обостриться стенокардия. У женщин встречаются нарушения менструального цикла, у мужчин — снижение полового влечения и импотенция.
Реже отмечаются тошнота, рвота и нарушения глотания. Одышка при физической нагрузке обусловлена повышенным потреблением кислорода и слабостью дыхательных мышц. Изредка ее причиной служит сдавление трахеи большим зобом.
У большинства больных диффузным токсическим зобом обе доли щитовидной железы увеличены равномерно, плотные и безболезненные. При хроническом лимфоцитарном тиреоидите железа бывает особенно плотной. При многоузловом токсическом зобе железа обычно асимметричная, бугристая, с неоднородной консистенцией. Токсическая аденома — это, как правило, одиночный узел диаметром более 3 см. Болезненность щитовидной железы при пальпации заставляет заподозрить подострый гранулематозный тиреоидит.
При хроническом лимфоцитарном тиреоидите железа бывает особенно плотной. При многоузловом токсическом зобе железа обычно асимметричная, бугристая, с неоднородной консистенцией. Токсическая аденома — это, как правило, одиночный узел диаметром более 3 см. Болезненность щитовидной железы при пальпации заставляет заподозрить подострый гранулематозный тиреоидит.
Сердечная симптоматика обусловлена как прямым действием тиреоидных гормонов на сердечно-сосудистую систему, так и повышением основного обмена и потребления кислорода. Характерны синусовая тахикардия, повышение систолического (верхнего) артериального давления. Помимо синусовой тахикардии — самого частого нарушения ритма сердца при тиреотоксикозе — у 10—25% больных отмечаются другие аритмии, особенно мерцательная. Мерцательная аритмия чаще всего встречается у пожилых и бывает основным проявлением тиреотоксикоза.
Лабораторные и инструментальные исследования
Признаки тиреотоксикоза — повышенные уровни тиреоидных гормонов и пониженный уровень тиреотропного гормона (ТТГ). Повышены как общие, так и свободные T4 и T3; иногда наблюдается повышение уровня только одного из гормонов. Увеличение концентрации тироксинсвязывающего глобулина или его сродства к T4, что бывает при беременности и заместительной терапии эстрогенами, может повысить общий T4 до уровня, характерного для тиреотоксикоза.
Повышены как общие, так и свободные T4 и T3; иногда наблюдается повышение уровня только одного из гормонов. Увеличение концентрации тироксинсвязывающего глобулина или его сродства к T4, что бывает при беременности и заместительной терапии эстрогенами, может повысить общий T4 до уровня, характерного для тиреотоксикоза.
Антитиреоидные антитела (к тиреоглобулину и к йодидпероксидазе) обнаруживаются примерно у 70% больных диффузным токсическим зобом. Определение титра антител не является необходимым, но оно помогает поставить диагноз, особенно в отсутствие поражения глаз (офтальмопатии).
Лечение
Течение тиреотоксикоза при диффузном токсическом зобе характеризуется сменой обострений и ремиссий, хотя бывают и неуклонно прогрессирующее течение, и одиночные приступы. Лечения, направленного на причину болезни нет, и по-настоящему излечить диффузный токсический зоб невозможно. Поэтому лечение направлено на снижение уровней тиреоидных гормонов в крови — либо за счет подавления их синтеза, либо путем разрушения ткани щитовидной железы. Есть три основных пути достижения этой цели: 1) антитиреоидные средства, 2) радиоактивный йод, 3) хирургическое вмешательство. Антитиреоидные средства, подавляя синтез тиреоидных гормонов, позволяют изменить течение болезни и вызвать ремиссию тиреотоксикоза. Лечение радиоактивным йодом и операция уменьшают количество ткани щитовидной железы. Выбор лечения должен быть индивидуальным; он определяется пожеланиями больного и наличием опытных хирургов.
Есть три основных пути достижения этой цели: 1) антитиреоидные средства, 2) радиоактивный йод, 3) хирургическое вмешательство. Антитиреоидные средства, подавляя синтез тиреоидных гормонов, позволяют изменить течение болезни и вызвать ремиссию тиреотоксикоза. Лечение радиоактивным йодом и операция уменьшают количество ткани щитовидной железы. Выбор лечения должен быть индивидуальным; он определяется пожеланиями больного и наличием опытных хирургов.
Антитиреоидные средства. Обычная начальная доза тиамазола (Мерказолила) — 20—40 мг/сутки внутрь в один прием, пропилтиоурацила (Пропицила) — 300—450 мг/сутки внутрь в 2—3 приема. При тяжелом тиреотоксикозе, а также при очень большом зобе могут потребоваться большие дозы. По достижении эутиреоидного состояния (нормализации уровней тиреоидных гормонов), обычно через 12 недель, дозу антитиреоидного средства можно снизить. Поддерживающие дозы составляют 5—10 мг/сутки для тиамазола и 50—200 мг/сутки для пропилтиоурацила. Затем рекомендуются повторные визиты к врачу каждые 3 месяца.
Через год после отмены антитиреоидного средства ремиссия сохраняется у 10—90% больных (в среднем у 50%). Чем дольше длится лечение, тем более вероятна ремиссия.
Рецидив диффузного токсического зоба обычно происходит в первые несколько месяцев после отмены антитиреоидного средства. В таких случаях лучше прибегнуть к радикальному лечению, но можно назначить и повторный курс антитиреоидного средства. Многолетнее применение антитиреоидных средств считается безопасным у больных, которые не способны сохранить ремиссию после отмены препарата и не соглашаются лечиться радиоактивным йодом или подвергаться операции. Больные, у которых наступила ремиссия, должны обследоваться на предмет рецидива каждые 3—6 месяцев или при появлении симптомов.
Самый тяжелый побочный эффект антитиреоидных средств — агранулоцитоз (критическое снижение количества нейтрофилов в крови), который обычно (но не всегда) развивается в первые 3 месяца лечения. Пропилтиоурацил и тиамазол вызывают агранулоцитоз с одинаковой частотой — 0,1—0,5%. Риск агранулоцитоза, вызванного тиамазолом, зависит от его дозы; при дозах менее 30 мг/сут этот побочный эффект наблюдается редко. Для пропилтиоурацила зависимость от дозы не отмечена. Каждого больного предупреждают, что при появлении лихорадки или боли в горле нужно прекратить прием антитиреоидного средства и срочно обратиться к врачу.
Риск агранулоцитоза, вызванного тиамазолом, зависит от его дозы; при дозах менее 30 мг/сут этот побочный эффект наблюдается редко. Для пропилтиоурацила зависимость от дозы не отмечена. Каждого больного предупреждают, что при появлении лихорадки или боли в горле нужно прекратить прием антитиреоидного средства и срочно обратиться к врачу.
Лечение радиоактивным йодом. Радиоактивный йод захватывается щитовидной железой и разрушает ее клетки. Многие врачи предпочитают этот способ лечения, особенно у пожилых. Радиоактивный йод не назначают детям, беременным и кормящим женщинам.
Нормализация функции щитовидной железы и уровня ТТГ обычно происходит через 1—2 месяца, но может наступить и через год. За редкими исключениями повторную дозу радиоактивного йода назначают не раньше чем через 3—6 месяцев после первой.
Хирургическое лечение. Субтотальную резекцию щитовидной железы проводят: 1) больным с большим зобом, 2) детям, страдающим аллергией к антитиреоидным средствам, 3) беременным, страдающим аллергией к антитиреоидным средствам (обычно во II триместре), 4) больным, которые предпочитают операцию лечению антитиреоидными средствами и радиоактивным йодом.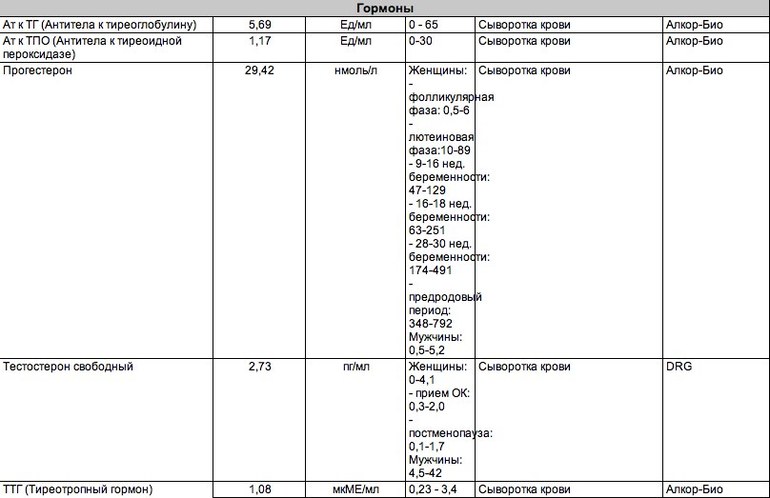
Самые частые осложнения субтотальной резекции щитовидной железы — огрубление голоса из-за повреждения возвратного гортанного нерва и гипопаратиреоз. Если операцию проводит опытный хирург, частота этих осложнений низка (менее 1%). Примерно у 5% больных возникает рецидив тиреотоксикоза, примерно у 60% развивается гипотиреоз.
Кальцитонин! Диагностика рака щитовидной железы
Если случаются какие-либо неполадки в работе организма, то врачи для определения причины просят сдать кровь на анализы. При этом иногда выявляется содержание большого количества такого элемента, как кальцитонин.
Что это такое?
Кальцитонин -это гормон щитовидной железы, вырабатываемый в ее С–клетках. Он является онкомаркером, позволяющим диагностировать рак щитовидной железы и исследовать обмен кальция и фосфора в организме.
Щитовидная железа вырабатывает этот гормон в незначительных количествах, и его содержание в крови никогда не бывает большим.
Для чего необходимо проводить анализ на кальцитонин?
Из С–клеток, которые вырабатывают этот гормон, вырастает злокачественная опухоль щитовидной железы – медуллярный рак. Рост такой опухоли происходит медленно, но очень упорно, распространяя метастазы в лимфатические узлы шеи и многие другие органы. Она очень трудно поддается химиотерапии.
Резкое повышение кальцитонина в крови может указывать на наличие медуллярного рака щитовидной железы. Ранняя диагностика этого заболевания спасла большое количество человеческих жизней.
В каких случаях сдается кровь на кальцитонин?
Медуллярный рак щитовидной железы часто носит наследственный характер. Кроме этого такую диагностику используют для выявления рецидива злокачественной опухоли. Также с помощью кальцитонина можно выявить недуги, возникшие из-за нарушения обмена кальция, остеопороз, определить продуцирующие опухоли.
Каковы же нормы кальцитонина?
В разных лабораториях норма кальцитонина в крови может различаться. Объясняется это тем, что для исследования применяются разные реактивы и специализированное оборудование. Кроме этого результат зависит от возраста и пола.
Объясняется это тем, что для исследования применяются разные реактивы и специализированное оборудование. Кроме этого результат зависит от возраста и пола.
В клинико-диагностической лаборатории Астраханской клинической больницы ФГБУЗ ЮОМЦ ФМБА России проводится иммуноферментный метод определения, который имеет следующие референтные значения кальцитонина: норма у женщин – 0,1–10,9 пг/мл; у мужчин – 0,2–27,2 пг/мл; у детей — до 70 пг/мл. Результат анализа у женщин может меняться во время беременности и при кормлении грудью.
При своевременном обращении к врачу и раннем выявлении заболеваний лечение их будет успешным .
Стоимость анализа -1060 руб ( + 80 руб забор крови )
Забор крови осуществляется по адресам:
ул. Чкалова, 80. Стационар №2 (Правобережная б-ца). тел. 50-87-53
ул. Капитанская, 22. Поликлиника №3 (р-он «Десятка»), тел. 58-51-39
Заводская пл., 17. Поликлиника №2 (ост. з-д им. Ленина), тел. 45-15-99
45-15-99
ул. Каунасская, 47. Поликлиника №4 (III Интернационал), тел. 60-66-14
Бесплатный звонок на горячую линию: 8 800 700 02 45
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ.
ПРОКОНСУЛЬТИРУЙТЕСЬ С ВРАЧОМ
Тиреоглобулин для мониторинга рецидива рака щитовидной железы | Эндокринология | ДЖАМА
Некоторые виды рака щитовидной железы могут вернуться после удаления, поэтому важно следить за рецидивами.
Щитовидная железа расположена в нижней передней части шеи над грудиной и регулирует обмен веществ за счет выработки тиреоидных гормонов (Т 3 и Т 4 ). Рак щитовидной железы – это злокачественная опухоль щитовидной железы.Папиллярный и фолликулярный рак щитовидной железы являются наиболее распространенными типами и известны как дифференцированный рак щитовидной железы, поскольку они перерабатывают йод аналогично нормальной ткани щитовидной железы. Хирургия является начальным лечением папиллярного или фолликулярного рака щитовидной железы.
Хирургия является начальным лечением папиллярного или фолликулярного рака щитовидной железы.
После первоначального лечения необходим долгосрочный мониторинг для выявления рецидива рака. Это делается путем повторных ультразвуковых исследований шеи, радиоактивного сканирования и измерения уровня тиреоглобулина в крови.
Тиреоглобулин представляет собой белок, вырабатываемый фолликулярными клетками щитовидной железы. Он используется щитовидной железой для производства Т 3 и Т 4 . Нормальное значение тиреоглобулина составляет от 3 до 40 нанограммов на миллилитр у здорового человека. Если уровень тиреоглобулина у пациента повышается после удаления всей щитовидной железы, у пациента может быть рецидив дифференцированного рака щитовидной железы. Очень высокие уровни тиреоглобулина могут свидетельствовать о метастатическом или рецидивирующем заболевании.Около четверти пациентов с раком щитовидной железы имеют антитела к тиреоглобулину.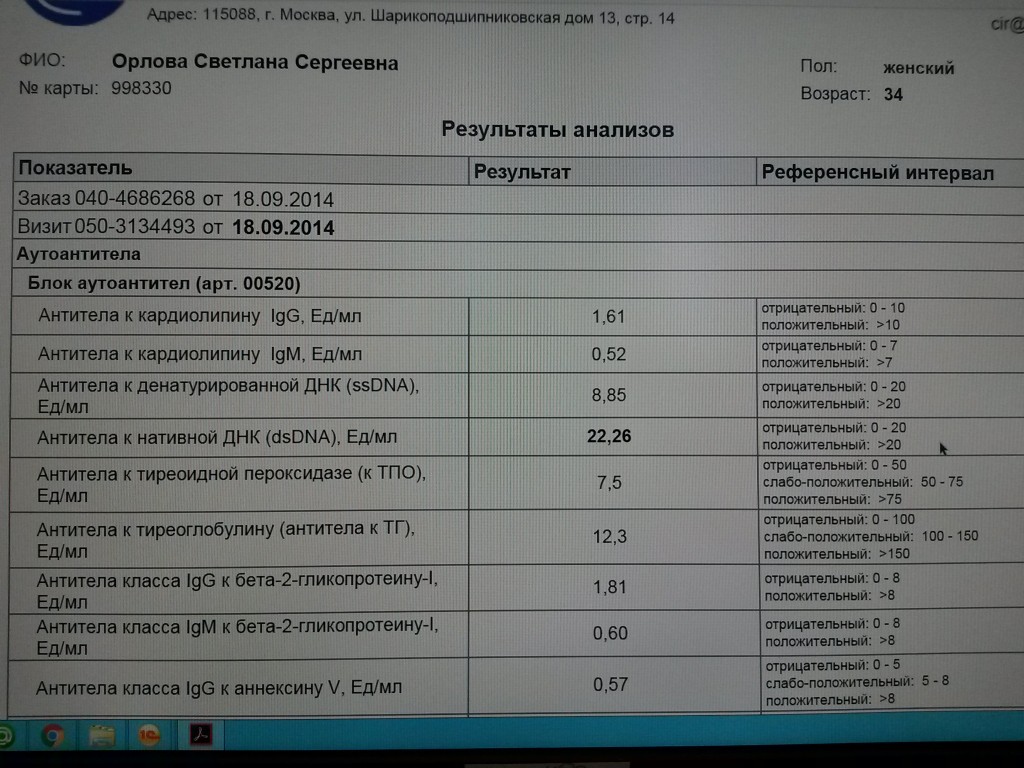 Антитела следует проверять вместе с тиреоглобулином, потому что, если они присутствуют, они могут помешать измерению тиреоглобулина. Уровни тиреоглобулина после лобэктомии (удаление половины щитовидной железы) должны коррелировать с размером щитовидной железы, оставшейся после операции. Ложно высокие значения тиреоглобулина могут возникать после частичной тиреоидэктомии, поскольку оставшаяся щитовидная железа может увеличиваться в размерах.После удаления щитовидной железы может быть проведена абляция (разрушение) остаточной ткани щитовидной железы радиоактивным йодом, чтобы уменьшить вероятность рецидива и сделать мониторинг тиреоглобулина более надежным.
Антитела следует проверять вместе с тиреоглобулином, потому что, если они присутствуют, они могут помешать измерению тиреоглобулина. Уровни тиреоглобулина после лобэктомии (удаление половины щитовидной железы) должны коррелировать с размером щитовидной железы, оставшейся после операции. Ложно высокие значения тиреоглобулина могут возникать после частичной тиреоидэктомии, поскольку оставшаяся щитовидная железа может увеличиваться в размерах.После удаления щитовидной железы может быть проведена абляция (разрушение) остаточной ткани щитовидной железы радиоактивным йодом, чтобы уменьшить вероятность рецидива и сделать мониторинг тиреоглобулина более надежным.
Как измеряется тиреоглобулин?
Тиреоглобулин измеряется с помощью твердофазного иммуноферментного анализа ( ELISA ).Точность теста зависит от того, насколько сильно связывание между тиреоглобулином и используемым антителом. Если значение тиреоглобулина кажется ненормальным, следует провести тест ELISA еще раз, чтобы убедиться, что результаты точны. Существуют и другие тесты на тиреоглобулин; результаты тестов зависят от того, какой тип теста был проведен. При сравнении результатов анализов важно, чтобы тесты были одного типа и проводились в одной и той же лаборатории.
Если значение тиреоглобулина кажется ненормальным, следует провести тест ELISA еще раз, чтобы убедиться, что результаты точны. Существуют и другие тесты на тиреоглобулин; результаты тестов зависят от того, какой тип теста был проведен. При сравнении результатов анализов важно, чтобы тесты были одного типа и проводились в одной и той же лаборатории.
Уровни тиреоглобулина следует измерять каждые 3–6 месяцев в течение 2 лет после тиреоидэктомии и каждые 6–12 месяцев после этого.В зависимости от обстоятельств конкретного пациента объем тестирования может различаться. Если уровень тиреоглобулина увеличивается, возможно, рак вернулся. При повышении уровня тиреоглобулина тестирование следует проводить чаще. Когда уровни снижаются, рак, вероятно, отступает. При рецидиве рака уровень тиреоглобулина может снижаться одновременно с повышением уровня антител к тиреоглобулину.
Идентификатор ссылки на коробку Раскрытие информации о конфликте интересов: Не сообщалось.
Источники: Американская ассоциация щитовидной железы
Holsinger FC, Ramaswamy U, Cabanillas ME, et al. Измерение степени тотальной тиреоидэктомии при дифференцированной карциноме щитовидной железы с использованием визуализации радиоактивным йодом. JAMA Otolaryngol Head Neck Surg . 2014;140(5):410-415. дои: 10.1001/jamaoto.2014.264
Тиреоглобулин: нормальный диапазон, высокий уровень и рак щитовидной железы
Тиреоглобулин — это белок, используемый для производства гормонов щитовидной железы. Врачи в основном проверяют его уровень, чтобы определить, не вернулся ли рак щитовидной железы после операции и облучения.Антитела к тиреоглобулину могут указывать на аутоиммунные заболевания щитовидной железы, такие как болезнь Хашимото и болезнь Грейвса. Узнайте больше о тиреоглобулинах, нормальных пределах анализа крови и причинах высоких/низких уровней.
Что такое Тиреоглобулин? Тиреоглобулин — крупный белок, используемый щитовидной железой для выработки тиреоидных гормонов (Т4 и Т3) и хранения йода в организме [1].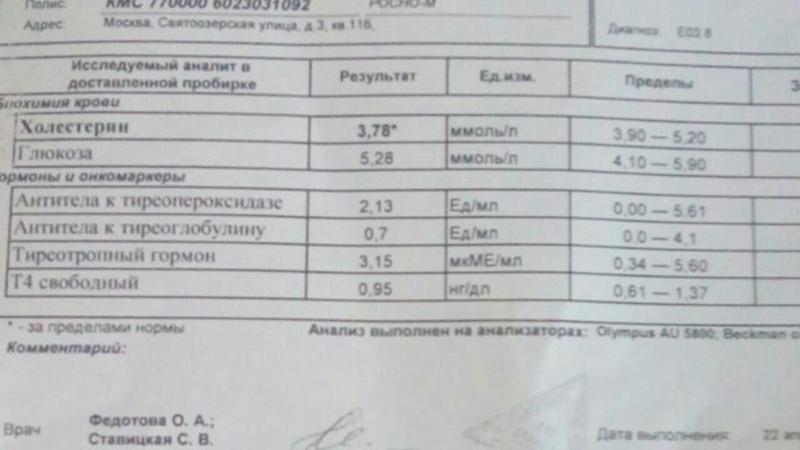
Тиреоглобулин вырабатывается в щитовидной железе так называемыми фолликулярными клетками. Когда щитовидная железа стимулируется тиреотропным гормоном (ТТГ), она объединяет йод с тиреоглобулином для создания гормонов Т4 и Т3 («4» и «3» относятся к числу присоединенных атомов йода) [2].
Хотя большая часть тиреоглобулина остается в щитовидной железе, небольшое его количество просачивается в кровоток. Уровни в крови прямо пропорциональны размеру щитовидной железы. Например, раковые клетки щитовидной железы увеличивают железу и вырабатывают тиреоглобулин в больших количествах.
На самом деле, любое заболевание, которое увеличивает размер щитовидной железы (рак, аутоиммунное заболевание, узлы и т. д.), может повышать уровень тиреоглобулина [2].
Тест на тиреоглобулин – Когда его заказывают? Врачи обычно назначают анализ на тиреоглобулин после операции по поводу рака щитовидной железы, чаще всего в сочетании с УЗИ шеи . Это помогает определить, вернулся ли рак.
Это помогает определить, вернулся ли рак.
Определяемый уровень тиреоглобулина, который продолжает повышаться через год после операции, свидетельствует о рецидиве рака. Подтвердить это помогает УЗИ шеи [3, 2].
Если уровень не определяется в течение года после операции, риск рецидива рака низкий. Однако, если у вас был рак щитовидной железы, ваши уровни будут контролироваться ежегодно на протяжении всей жизни, чтобы убедиться, что у вас все еще нет рака [2].
Антитела к тиреоглобулину (TgAb) могут мешать измерению тиреоглобулина и приводить к ложно заниженным или неопределяемым уровням.Вот почему тест TgAb всегда заказывают одновременно с тестом на тиреоглобулин [4].
Нормальные уровни Нормальный уровеньНормальный диапазон для тиреоглобулина:
- 1.40 — 29,2 нг / мл (мкг / л) для мужчин
- 1,50 — 38,5 нг / мл для женщин
в странах, где дефицит йода обычно (не в США) референтный диапазон может быть выше [5, 6, 7].
Уровень тиреоглобулина у женщин несколько выше, чем у мужчин [8].
Беременные женщины обычно имеют высокий уровень тиреоглобулина в третьем триместре [9].
Не следует принимать биотин (витамин В7) за 12 часов до сдачи образца крови, так как это может повлиять на результаты [10].
АнтителаАнтитела к тиреоглобулину (TgAb) обычно обнаруживаются у людей с аутоиммунным гипотиреозом (тиреоидит Хашимото и атрофический тиреоидит) и гипертиреозом (болезнь Грейвса). Более 50% людей с этими заболеваниями дают положительный результат на TgAb [11, 12].
Однако у 2-5% людей с нормальной функцией щитовидной железы также могут быть антитела к тиреоглобулину, которые имеют тенденцию к увеличению с возрастом.Женщины в два раза чаще, чем мужчины, имеют положительный результат теста на TgAb [11, 12, 13].
Антитела к тиреоглобулину также обнаруживаются при других аутоиммунных заболеваниях, включая ревматоидный артрит (12–23% пациентов), диабет 1 типа (30%) и целиакию (11–32%) [11].
Тиреоглобулиновые антитела ошибочно маркируют тиреоглобулин как вредное вещество, что вызывает аутоиммунный ответ организма на него [14].
Причины высокого уровня тиреоглобулинаУровень тиреоглобулина является маркером здоровья щитовидной железы.Низкий или высокий уровень не обязательно указывает на проблему, если нет симптомов или если ваш врач говорит вам не беспокоиться об этом.
1) Рак щитовидной железы Дифференцированный рак щитовидной железыДифференцированный рак щитовидной железы (ДРЩЖ) — это рак фолликулярных клеток щитовидной железы. Это наиболее распространенный вид рака гормон-высвобождающих желез (эндокринный), и на приходится 85-95% всех случаев рака щитовидной железы . ДТК продуцирует тиреоглобулин, вызывая существенное повышение его уровня в крови [15, 16].
ДТК лечится путем хирургического удаления щитовидной железы. После операции большинству людей вводят радиоактивный йод, чтобы разрушить любую оставшуюся ткань щитовидной железы [16]./20/20.jpg)
Тиреоглобулин очень полезен после операции , чтобы определить, вернулся ли рак или распространился на другие части тела. Тем не менее, это не хороший маркер для диагностики DTC, так как некоторые другие заболевания вызывают высокие уровни. Он также бесполезен у пациентов с ДРЩЖ, у которых до операции был нормальный уровень, или у тех, у кого после операции сохранилась остаточная ткань щитовидной железы [2, 17, 18].
Измеряется через 9-12 месяцев после операции. Если уровень не определяется, а УЗИ шеи отрицательно, у пациента нет рака и риск рецидива рака низкий [16, 17, 3].
Если уровни поддаются обнаружению, то уровни будут контролироваться каждые 3-6 месяцев для выявления тенденций. Если он уменьшается, рак, вероятно, не вернулся, в то время как тенденция к увеличению предполагает, что рак вернулся или распространился [17, 3].
Около 20-30% людей с ДРЩЖ дают положительный результат на тиреоглобулиновые антитела .В этих случаях тиреоглобулин бесполезен для определения рецидива или распространения рака.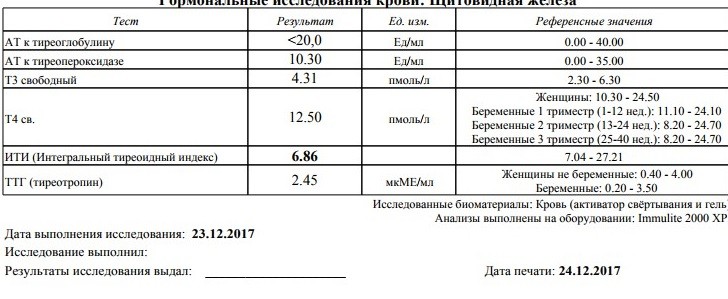 Вместо этого врачам придется полагаться на другие методы визуализации, такие как ПЭТ или КТ [3].
Вместо этого врачам придется полагаться на другие методы визуализации, такие как ПЭТ или КТ [3].
Тиреоглобулин также может быть высоким при низкодифференцированном раке щитовидной железы (PDTC), менее распространенной и более агрессивной форме рака щитовидной железы [2].
Однако он не используется для мониторинга рецидива рака у пациентов с PDTC, поскольку его эффективность не подтверждена.Первоначальные исследования действительно предполагают, что обнаруживаемые уровни тиреоглобулина после лечения этого типа рака увеличивают риск рецидива рака и смерти в течение пяти лет [19, 20].
2) Доброкачественные опухоли щитовидной железыБольшинство доброкачественных (незлокачественных) опухолей щитовидной железы способны продуцировать тиреоглобулин. В этих случаях уровень тиреоглобулина обычно несколько выше нормального уровня [21].
3) Узлы щитовидной железы Узлы представляют собой твердые участки ткани или жидкости под кожей. Они могут быть вызваны низким или высоким уровнем щитовидной железы, но иногда встречаются и у людей с нормальной функцией щитовидной железы. Большинство узелков доброкачественные, но небольшой процент может быть раковым [22].
Они могут быть вызваны низким или высоким уровнем щитовидной железы, но иногда встречаются и у людей с нормальной функцией щитовидной железы. Большинство узелков доброкачественные, но небольшой процент может быть раковым [22].
Одно исследование показало, что у 58 из 61 человека с узлами щитовидной железы был высокий уровень тиреоглобулина. Средний уровень тиреоглобулина составил 205,4 нг/мл [23].
4) Низкая активность щитовидной железыБольшинство людей с недостаточной активностью щитовидной железы имеют высокий уровень ТТГ, что увеличивает выработку тиреоглобулина.В исследовании 18 человек с гипотиреозом у 12 был чрезвычайно повышенный уровень тиреоглобулина [24, 25].
4) Болезнь ГрейвсаБолезнь Грейвса – это аутоиммунное заболевание, вызывающее гиперактивность щитовидной железы. Антитела, обнаруженные у людей с болезнью Грейвса, активируют рецептор ТТГ, повышая уровень тиреоглобулина [26, 3].
5) Дефицит и избыток йода Дефицит йода заставляет организм выделять больше ТТГ. В свою очередь, щитовидная железа вырабатывает больше тиреоглобулина [27].
В свою очередь, щитовидная железа вырабатывает больше тиреоглобулина [27].
Прием слишком большого количества йода также может повысить уровень тиреоглобулина. Избыток йода снижает высвобождение гормонов щитовидной железы, что повышает уровень ТТГ и тиреоглобулина [28].
6) Цирроз печениЦирроз печени – это рубцевание печени, вызванное алкоголем, гепатитом или неалкогольной жировой болезнью печени. В исследовании с участием 134 человек у пациентов с циррозом уровень тиреоглобулина был на 84% выше, чем у здоровых людей [29].
7) АкромегалияАкромегалия – это заболевание, вызванное перепроизводством гормона роста гипофизом.У людей с акромегалией увеличена щитовидная железа, вырабатывающая более высокий уровень тиреоглобулина [30].
8) ЛекарстваСледующие лекарства могут повышать уровень тиреоглобулина:
- Лекарства, используемые для лечения повышенной активности щитовидной железы, такие как метимазол (тапазол) и карбимазол (неомерказол) [31, 32] 9008 Nexterone, Pacerone), йодсодержащий препарат, используемый для лечения нерегулярного сердцебиения [33]
Повышение уровня тиреоглобулина не обязательно приведет к улучшению функции щитовидной железы, но его можно использовать в качестве биомаркера здоровья щитовидной железы.
Ниже приведен список дополнительных подходов к поддержке щитовидной железы, которые также могут сбалансировать высокие уровни ТГ. Хотя исследования показывают, что различные факторы питания и образа жизни могут снижать уровень ТГ, необходимы дополнительные крупномасштабные исследования.
Не забудьте поговорить со своим врачом, прежде чем вносить какие-либо существенные изменения в свой распорядок дня.
1) Бросить куритьВ исследовании с участием более 400 человек 47% курильщиков имели высокий уровень тиреоглобулина по сравнению с 18% некурящих.Это увеличение было связано с повышенным риском отека щитовидной железы (зоба). Соединение в табачном дыме, называемое тиоцианатом, препятствует правильному использованию йода щитовидной железой, что вызывает ее увеличение [34, 35].
По данным большого обсервационного исследования с участием 10 000 человек связь между курением и повышенным уровнем тиреоглобулина была очевидна.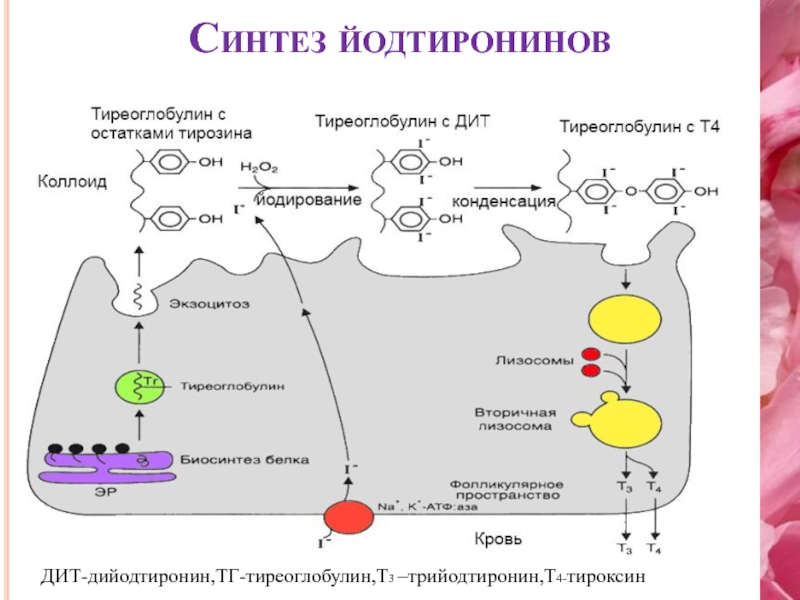 В исследовании с участием 140 человек средний уровень тиреоглобулина у курильщиков составил 40 нг/мл, тогда как средний уровень у некурящих — 24,4 нг/мл [36, 8].
В исследовании с участием 140 человек средний уровень тиреоглобулина у курильщиков составил 40 нг/мл, тогда как средний уровень у некурящих — 24,4 нг/мл [36, 8].
Если вы хотите снизить уровень тиреоглобулина, бросьте курить и избегайте воздействия табака .
2) ЙодЙодсодержащие добавки помогут снизить уровень тиреоглобулина, только если у вас дефицит йода. Дозировка йода будет варьироваться в зависимости от тяжести дефицита.
Исследование 100 человек с легким дефицитом йода показало, что прием 80 мкг йода в день снижает уровень тиреоглобулина на 24% [37].
Другое исследование с участием 112 человек с дефицитом йода показало, что добавление 150 мкг йода в день снижает уровень тиреоглобулина на 27% через 24 недели.Более высокая доза йода (200 мкг/день) в течение шести месяцев снижала уровень тиреоглобулина на 32% у 163 человек с дефицитом йода [38, 39].
Однако имейте в виду, что добавки с йодом могут быть неэффективными или даже опасными, если ваш уровень йода в норме.
В исследовании 18 человек с гипотиреозом 20-60 мг/день селена снижали уровень тиреоглобулина [40].
4) Витамин АВитамин А поможет снизить уровень тиреоглобулина, только если у вас дефицит витамина А.
У 404 человек с дефицитом витамина А прием 400 000 МЕ витамина А в течение шести месяцев снизил уровень тиреоглобулина на 25%. В другом исследовании с участием 138 человек с дефицитом витамина А прием 400 000 МЕ витамина А в течение 10 месяцев снизил уровень тиреоглобулина [41, 42].
Причины низкого уровня тиреоглобулинаУровень тиреоглобулина является маркером здоровья щитовидной железы. Низкий или высокий уровень не обязательно указывает на проблему, если нет симптомов или если ваш врач говорит вам не беспокоиться об этом.
1) Слишком много синтетических гормонов Т4 Тиреотоксикоз (ТФ) – это состояние, вызванное приемом слишком большого количества синтетических гормонов Т4 (левотироксина). Это имитирует чрезвычайно гиперактивную щитовидную железу. Уровни тиреоглобулина у людей с этим заболеванием очень низкие или не определяются [43].
Это имитирует чрезвычайно гиперактивную щитовидную железу. Уровни тиреоглобулина у людей с этим заболеванием очень низкие или не определяются [43].
Тиреоглобулин может помочь врачам определить, вызвана ли гиперактивность щитовидной железы TF или другими причинами [44].
Обязательно используйте левотироксин только в том случае, если его прописал ваш врач, и строго следуйте его инструкциям по дозировке.
2) Удаление щитовидной железыТиреоглобулин вырабатывается только в щитовидной железе или раковыми клетками щитовидной железы. Это означает, что у людей без щитовидной железы будет неопределяемый уровень тиреоглобулина (при отсутствии рака щитовидной железы) [44].
3) Препараты 3) ПрепаратыСледующие препараты могут снизить уровень тиреоглобулина:
- левотироксин (синтед) [45]
- Синтетический TSH (тироген) [46]
- Octreotide (SandoStatin), синтетический соматостатинский гормон [47 ]
- Салицилат (аспирин) [48]
- Преднизолон (омнипред), противовоспалительный кортикостероид [48]
Повышение уровня тиреоглобулина не обязательно приведет к улучшению функции щитовидной железы, но его можно использовать в качестве биомаркера здоровья щитовидной железы.
Ниже приведен список дополнительных подходов к поддержке щитовидной железы, которые также могут сбалансировать низкий уровень ТГ. Хотя исследования показывают, что различные факторы питания и образа жизни могут повышать уровень ТГ, необходимы дополнительные крупномасштабные исследования.
Не забудьте поговорить со своим врачом, прежде чем вносить какие-либо существенные изменения в свой распорядок дня.
1) Воздействие холодаВоздействие холода активирует бурую жировую ткань (БЖТ), тип жировой ткани, который вырабатывает тепло и сохраняет тепло.Гормоны щитовидной железы необходимы для активации бурой жировой ткани. По существу, низких температур повышают активность щитовидной железы, чтобы согреть тело, что приводит к увеличению выработки тиреоглобулина в результате [49].
Исследование 535 человек, проживающих в Гренландии, показало, что у охотников, подвергающихся ежедневному воздействию холода, уровень тиреоглобулина на 46% выше, чем у горожан [49].
В исследовании 12 человек, живущих в Антарктиде, уровень тиреоглобулина увеличился на 24% через семь месяцев (из-за повышения уровня ТТГ на 43%) [50].
2) Ограничьте потребление насыщенных жировУ крыс, получавших рацион с высоким содержанием насыщенных жиров, наблюдалось снижение уровня тиреоглобулина и снижение активности щитовидной железы в результате ее повреждения и отека. Если вы боретесь с недостаточной активностью щитовидной железы, попробуйте ограничить потребление насыщенных жиров [51].
Однако это было обнаружено только в исследованиях на животных, и для каких-либо выводов необходимы клинические испытания.
Генетика Существует не менее 52 мутаций в гене тиреоглобулина, которые коррелируют с низким уровнем тиреоглобулина или тиреоглобулином неправильной формы.Многие мутации приводят к наследственному (врожденному) гипотиреозу, который вызывает снижение активности щитовидной железы у новорожденных [52, 53].
SNP в гене тироглобулина, которые могут быть связаны с болезнью Грейвс, включают [54]:
- RS2256366
- RS2687836
- RS37836
- RS3739266
- RS2253035
SNPS в гене тиреоглобулина, которые могут быть связаны с болезнью Hashimoto [ 55, 56, 54]:
Takeaway
Тиреоглобулин важно контролировать, если у вас был рак щитовидной железы и вы перенесли операцию в прошлом.Тест поможет вашему врачу определить, есть ли у рака высокая или низкая вероятность рецидива, более низкие уровни указывают на лучший результат.
Этот маркер увеличивается пропорционально размеру щитовидной железы, а это означает, что доброкачественные опухоли, узлы, гипофункция щитовидной железы и болезнь Грейвса также могут повышать его уровень в крови.
Некоторые дополнительные подходы, которые могут поддержать щитовидную железу, что измеряется более низким уровнем тиреоглобулина, включают отказ от курения, добавки селена и йод для людей с дефицитом. С другой стороны, воздействие холода может поддерживать пониженную активность щитовидной железы и повышать уровень ТГ.
С другой стороны, воздействие холода может поддерживать пониженную активность щитовидной железы и повышать уровень ТГ.
Поговорите со своим врачом перед применением любого из этих подходов.
Повышенный уровень тиреоглобулина связан с дисфункцией регуляторных Т-клеток у пациентов с узлами щитовидной железы
Endocr Connect. 2019 апрель; 8(4): 309–317.
, 1, 2, * , * , * * , 3 , 1 , 1 , 1 , 4 , 1 , 1 , 1 , 2 , 2 9 9 и 1Yun Hu
1 1 1 Департамент эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай 2 Отдел иммунологии, Нанкин Медицинский университет , Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Медицинский университет Нанкина, Цзянсу, Китай 3 Первое отделение хирургии щитовидной железы и молочной железы, Нанкин Университет, Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай На Ли
Пэн Цзян
Лян Ченг
Бо Дин
Сяо-Мей Лю
Yun-Qing Zhu
1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
Bing-076 li Liu1 Отделение эндокринологии Первой больницы Нанкина Медицинского университета Нанкина, Цзянсу, Китай
Xin Cao
1 Отделение эндокринологии Первой больницы Нанкина Медицинского университета Нанкина, Цзянсу03 90 90
2 Кафедра иммунологии, Нанкинский медицинский университет, Цзянсу, Китай
Xi ao-Ming Mao
1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
Отделение иммунологии, Нанкинский медицинский университет, Цзянсу, Китай3 Отделение хирургии щитовидной железы и молочной железы, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
4 Отделение эндокринологии, больница Уси, филиал Нанкинского китайского университета Medicine, Jiangsu, China
*(Y Hu и N Li внесли равный вклад в эту работу)
Поступила в редакцию 11 февраля 2019 г. ; Принято 1 марта 2019 г.
; Принято 1 марта 2019 г.
Abstract
Объектив
Узлы щитовидной железы обычно сопровождаются повышенным уровнем тиреоглобулина (ТГ) и аутоиммунными заболеваниями щитовидной железы (АЗИТ). Однако взаимосвязь между Tg и AITD до конца не изучена. Дисфункция регуляторных Т-клеток (Treg) играет важную роль в развитии АИТ. Мы стремились оценить влияние Tg на функцию Treg у пациентов с узлами щитовидной железы.
Методы
Оценивались уровни Tg и функции Treg в периферической крови и тканях щитовидной железы у пациентов с узлами щитовидной железы из Первой больницы Нанкина.Эффекты Tg на функцию Tregs здоровых доноров также оценивались 90–113 in vitro 90–114 . Функцию Treg определяли как ингибирующее действие Treg на скорость пролиферации эффекторных Т-клеток (CD4 + CD25 — Т-клеток).
Результаты
Уровень Tg в периферической крови отрицательно коррелировал с ингибирующей функцией Treg ( R = 0,398, P = 0,03), и функция Tregs значительно снизилась в группе с высоким уровнем Tg (Tg >77 мкг/ L) по сравнению с группой с нормальным Tg (11. 4 ± 3,9% против 27,5 ± 3,5%, P < 0,05). По сравнению с периферической кровью функция Treg в щитовидной железе значительно снизилась ( P < 0,01), но доля Treg FOXP3 + в щитовидной железе увеличилась ( P < 0,01). Высокая концентрация Tg (100 мкг/мл) ингибировала функцию Treg и подавляла экспрессию мРНК FOXP3 , TGF-β и IL-10 в Treg in vitro .
4 ± 3,9% против 27,5 ± 3,5%, P < 0,05). По сравнению с периферической кровью функция Treg в щитовидной железе значительно снизилась ( P < 0,01), но доля Treg FOXP3 + в щитовидной железе увеличилась ( P < 0,01). Высокая концентрация Tg (100 мкг/мл) ингибировала функцию Treg и подавляла экспрессию мРНК FOXP3 , TGF-β и IL-10 в Treg in vitro .
Выводы
Повышенный уровень ТГ может нарушать функцию Трег, что может увеличить риск АИТ у пациентов с узлами щитовидной железы.
Ключевые слова: тиреоглобулин, регуляторные Т-клетки, узел щитовидной железы
Введение
Узлы щитовидной железы встречаются очень часто; до 65% населения в целом имеют хотя бы один узел щитовидной железы (1), но у большинства из них симптомы отсутствуют, и продолжительность жизни не изменяется (2). Недавние исследования были сосредоточены в основном на связи между узлами щитовидной железы и раком щитовидной железы (3, 4). Узлы щитовидной железы обычно сопровождаются повышением уровня тиреоглобулина (ТГ) (5, 6) и аутоиммунными заболеваниями щитовидной железы (АИТЗ), особенно тиреоидитом Хашимото (ГТ) (7, 8).Интересно, что уровни ТГ у больных раком щитовидной железы всегда значительно выше, чем у больных с доброкачественными узлами щитовидной железы (9, 10). При этом частота ГТ у больных раком щитовидной железы также была выше, чем у больных с доброкачественными узлами щитовидной железы (11, 12, 13). Эти исследования подразумевают, что могут быть некоторые взаимодействия между повышенным уровнем ТГ и ГТ.
Узлы щитовидной железы обычно сопровождаются повышением уровня тиреоглобулина (ТГ) (5, 6) и аутоиммунными заболеваниями щитовидной железы (АИТЗ), особенно тиреоидитом Хашимото (ГТ) (7, 8).Интересно, что уровни ТГ у больных раком щитовидной железы всегда значительно выше, чем у больных с доброкачественными узлами щитовидной железы (9, 10). При этом частота ГТ у больных раком щитовидной железы также была выше, чем у больных с доброкачественными узлами щитовидной железы (11, 12, 13). Эти исследования подразумевают, что могут быть некоторые взаимодействия между повышенным уровнем ТГ и ГТ.
Tg составляет примерно 75–80% общего белка щитовидной железы и служит предшественником гормонов щитовидной железы (14).Предыдущие исследования показали, что Tg может индуцировать лимфоцитарный тиреоидит, повышая титры Tg-Ab у крыс BB/Wor (15) путем активации Т-клеток (16). Кроме того, в ряде исследований подчеркивается важная роль регуляторных Т-клеток (Treg) в профилактике тиреоидита на животных моделях. Истощение Tregs позволило вызвать тиреоидит мышиным Tg у традиционно устойчивых мышей, а также йодидом у мышей NOD-h3h5 (17, 18). Кроме того, клинические исследования показали, что числовые и/или функциональные нарушения Treg были обнаружены у пациентов с АГ (19, 20, 21, 22, 23).Мы задались вопросом, может ли повышенный уровень Tg нарушать функцию Tregs.
Истощение Tregs позволило вызвать тиреоидит мышиным Tg у традиционно устойчивых мышей, а также йодидом у мышей NOD-h3h5 (17, 18). Кроме того, клинические исследования показали, что числовые и/или функциональные нарушения Treg были обнаружены у пациентов с АГ (19, 20, 21, 22, 23).Мы задались вопросом, может ли повышенный уровень Tg нарушать функцию Tregs.
Tregs являются важными подтипами Т-клеток, которые участвуют в модуляции иммунного ответа и играют важную роль в профилактике аутоиммунных заболеваний (24, 25). Естественные Treg (nTreg) развиваются в тимусе и составляют примерно 5–10% от общего числа периферических CD4 + Т-клеток (25). Они характеризуются высокой экспрессией CD25 и транскрипционного фактора forkhead box P3 (FOXP3).Tregs могут подавлять пролиферацию и активность аутореактивных Т-клеток (26).
Целью нашего исследования было оценить влияние Tg на функцию Treg и понять роль Tg в индукции тиреоидита у пациентов с узлами щитовидной железы.
Материалы и методы
Реагенты
Tg-белок человека был приобретен у Fitzgerald Industries International (Актон, Массачусетс, США), чистота >98% подтверждена с помощью SDS-PAGE. Антитела против человеческого CD3 (кат. № 555336) и против человеческого CD28 (кат. № 555725) были приобретены у eBioscience.Антитела к CD25 человека, конъюгированные с аллофикоцианином (APC) (кат. № 555434), конъюгированные с PerCP-Cyanine5.5 антитела к CD4 человека (кат. № 560650), конъюгированные с PE антитела к CD25 человека (кат. № 555432) и -человеческие антитела FOXP3 (Cat# 560045) были приобретены у BD Biosciences (Сан-Хосе, Калифорния, США), и все они были мышиного происхождения. Наборы для определения Tg были приобретены у Siemens Healthcare Diagnostics Inc.
Антитела против человеческого CD3 (кат. № 555336) и против человеческого CD28 (кат. № 555725) были приобретены у eBioscience.Антитела к CD25 человека, конъюгированные с аллофикоцианином (APC) (кат. № 555434), конъюгированные с PerCP-Cyanine5.5 антитела к CD4 человека (кат. № 560650), конъюгированные с PE антитела к CD25 человека (кат. № 555432) и -человеческие антитела FOXP3 (Cat# 560045) были приобретены у BD Biosciences (Сан-Хосе, Калифорния, США), и все они были мышиного происхождения. Наборы для определения Tg были приобретены у Siemens Healthcare Diagnostics Inc.
Информация о пациенте и лабораторные методы
Кровь была собрана у здоровых доноров с нормальными уровнями свободного тироксина (FT4), тиреотропного гормона (TSH), антител к тиреопероксидазе (TPO-Ab). ) и антитело к тиреоглобулину (TG-Ab) для эксперимента in vitro .Исключались доноры с узлами щитовидной железы (по данным УЗИ), аутоиммунными заболеваниями, инфекциями или принимающие какие-либо лекарства. Кровь и нормальные ткани щитовидной железы, окружающие узел щитовидной железы или аденому, у пациентов, перенесших операцию на щитовидной железе, также собирали в Первой больнице Нанкина; они были подтверждены патологией. Показания к операции соответствуют Китайским рекомендациям по ведению пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы (2012 г.) (27). Помимо пациентов, перенесших операции на щитовидной железе, также собирали кровь у пациентов с доброкачественными узлами щитовидной железы, а диагнозы узлов подтверждали тонкоигольной аспирационной биопсией.Пациенты с узлами щитовидной железы были исключены, если у них было какое-либо системное заболевание или они принимали лекарства, которые могут повлиять либо на уровень ТГ, либо на иммунный баланс (например, инфекции и аутоиммунные заболевания). Биоэтический комитет Первой больницы Нанкина одобрил это исследование, и от каждого пациента и здорового донора было получено письменное информированное согласие.
Кровь и нормальные ткани щитовидной железы, окружающие узел щитовидной железы или аденому, у пациентов, перенесших операцию на щитовидной железе, также собирали в Первой больнице Нанкина; они были подтверждены патологией. Показания к операции соответствуют Китайским рекомендациям по ведению пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы (2012 г.) (27). Помимо пациентов, перенесших операции на щитовидной железе, также собирали кровь у пациентов с доброкачественными узлами щитовидной железы, а диагнозы узлов подтверждали тонкоигольной аспирационной биопсией.Пациенты с узлами щитовидной железы были исключены, если у них было какое-либо системное заболевание или они принимали лекарства, которые могут повлиять либо на уровень ТГ, либо на иммунный баланс (например, инфекции и аутоиммунные заболевания). Биоэтический комитет Первой больницы Нанкина одобрил это исследование, и от каждого пациента и здорового донора было получено письменное информированное согласие.
Ткань щитовидной железы гомогенизировали и центрифугировали при 380 g в течение 10 мин. Затем собирали супернатант (фолликулярную жидкость щитовидной железы) для измерения уровней ТГ.Уровни Tg в крови и щитовидной железе измеряли с помощью хемилюминесцентных иммунометрических анализов (Elecsys TG II, Roche Diagnostics GmbH) на анализаторе Modular Analytics E170 (Roche Diagnostics GmbH), и нормальный референтный диапазон составлял 3,5–77 нг/мл, как описано в предыдущем исследовании. 6). Общее содержание белка в фолликулярной жидкости щитовидной железы и образцах плазмы измеряли с использованием набора для анализа белка BCA (Sigma Aldrich) в соответствии с инструкциями производителя. Объем щитовидной железы до операции был получен путем вычисления объемов обеих долей (доля (мл) = длина (см) × ширина (см) × глубина (см) × 0.479). Узлы и/или кистозные области были включены в объем щитовидной железы (референтные значения, 18 мл для женщин и 25 мл для пациентов мужского пола) (28).
Выделение Tregs периферической крови и щитовидной железы
Мононуклеарные клетки периферической крови (РВМС) выделяли с использованием центрифугирования в градиенте плотности Ficoll-Paque (Sigma Aldrich). Для выделения мононуклеарных клеток щитовидной железы образцы щитовидной железы гомогенизировали и пропускали через стальную сетку с размером пор 75 мкм, а затем выделяли мононуклеарные клетки с помощью центрифугирования Ficoll-Paque.После двукратной промывки 10 мл PBS клетки ресуспендировали в среде Roswell Park Memorial Institute (RPMI)-1640, содержащей пенициллин (80 Ед/мл), стрептомицин (1,38 × 10 -4 моль/л), l- глутамина (2,05 × 10 -3 моль/л), l-глюкозы (0,01 моль/л) и бикарбоната натрия (0,02 моль/л), с добавлением 10% эмбриональной бычьей сыворотки (FBS; Invitrogen).
Treg были выделены из мононуклеарных клеток с использованием набора для сортировки магнитно-активированных клеток человека (MACS) (Miltenyi Biotec).Эффекторные Т-клетки (Teffs, CD4+CD25- Т-клетки) также собирали после выделения Treg с помощью антитела к CD25. После разделения клетки ресуспендировали в 2 мл среды RPMI-1640 с добавлением 10% FBS. Чистоту периферической крови и Treg щитовидной железы проверяли с помощью проточной цитометрии, и было установлено, что чистота клеток постоянно превышает 95%.
После разделения клетки ресуспендировали в 2 мл среды RPMI-1640 с добавлением 10% FBS. Чистоту периферической крови и Treg щитовидной железы проверяли с помощью проточной цитометрии, и было установлено, что чистота клеток постоянно превышает 95%.
Иммунофлуоресцентное окрашивание
Срезы ткани щитовидной железы, инкубированные с моноклональным кроличьим анти-FOXP3 (Cell Signaling Technology, разведение 1:500), затем инкубировали в течение 30 мин с антителами козьего антикроличьего иммуноглобулина, конъюгированными с Alexa-Fluor 488 (DAKO).DAPI (4′,6-диамино-2-фенилиндол, KEYGEN, Jiangsu, CN) использовали для мечения ядерной ДНК. Антитела соответствующего изотипа использовали в качестве отрицательного контроля. Меченые срезы визуализировали с помощью флуоресцентного микроскопа.
Функциональный анализ Treg
Основной функцией Treg было ингибирование пролиферации Teffs. Мы проверили функцию Treg, как описано ранее (23, 29): Treg (чистота >97%) культивировали с постоянным количеством клеток Teffs в различных соотношениях (Treg:Teffs = 1:2, 1:4 и 1:8). или 1:10) в среде, содержащей 10 % FBS, при 37°C и 5 % CO 2 .К культурам добавляли антитела против человеческого CD3 (5 × 10 -8 мкмоль/л) и против человеческого CD28 (2,27× 10 -8 мкмоль/л). Клетки одновременно обрабатывали Тг в разных концентрациях (0, 0,1, 1, 10 и 100 мкг/мл) и культивировали в течение 3 дней в 24-луночных планшетах (5 × 10 5 клеток/лунку). Thyroid Treg также совместно культивировали с гомологичными Teffs периферической крови. Для определения пролиферации клеток к суспензии Т-клеток в среде RPMI-1640 добавляли сукцинимидиловый эфир карбоксифлуоресцеина (CFSE; BD Biosciences, Сан-Хосе, Калифорния, США) в конечной концентрации 5× 10 -6 моль/л.Клетки инкубировали в течение 15 мин при 37°С, а затем обрабатывали АРС-анти-CD25 еще 30 мин при 4°С. Пролиферацию Т-клеток анализировали с использованием FACS Canto™ II (BD Biosciences). Степень ингибирования (%) рассчитывали по формуле: ((только пролиферация Teffs - пролиферация Teffs с Treg)/только пролиферация Teffs) × 100%.
или 1:10) в среде, содержащей 10 % FBS, при 37°C и 5 % CO 2 .К культурам добавляли антитела против человеческого CD3 (5 × 10 -8 мкмоль/л) и против человеческого CD28 (2,27× 10 -8 мкмоль/л). Клетки одновременно обрабатывали Тг в разных концентрациях (0, 0,1, 1, 10 и 100 мкг/мл) и культивировали в течение 3 дней в 24-луночных планшетах (5 × 10 5 клеток/лунку). Thyroid Treg также совместно культивировали с гомологичными Teffs периферической крови. Для определения пролиферации клеток к суспензии Т-клеток в среде RPMI-1640 добавляли сукцинимидиловый эфир карбоксифлуоресцеина (CFSE; BD Biosciences, Сан-Хосе, Калифорния, США) в конечной концентрации 5× 10 -6 моль/л.Клетки инкубировали в течение 15 мин при 37°С, а затем обрабатывали АРС-анти-CD25 еще 30 мин при 4°С. Пролиферацию Т-клеток анализировали с использованием FACS Canto™ II (BD Biosciences). Степень ингибирования (%) рассчитывали по формуле: ((только пролиферация Teffs - пролиферация Teffs с Treg)/только пролиферация Teffs) × 100%.
Стимуляция РВМС с помощью Tg
Изолированные РВМС подсчитывали и культивировали в среде RPMI-1640 с добавлением 10% FBS при 37°C и 5% CO 2 .Добавляли различные концентрации Tg (0, 0,1, 1, 10 и 100 мкг/мл); затем клетки инкубировали в течение 3 дней. Как и в более ранних экспериментах, в лунки также добавляли антитела против человеческого CD3 (5 × 10 -8 мкмоль/л) и против человеческого CD28 (2,27× 10 -8 мкмоль/л). Через 3 дня Treg выделяли из мононуклеарных клеток с использованием набора MACS для человеческих Treg клеток, а затем выделяли РНК для дальнейшего анализа.
Выделение РНК и ПЦР в реальном времени
Клетки гомогенизировали в реагенте TRIzol (Sigma-Aldrich), и экстракцию РНК проводили с использованием реагента TaKaRa RNAiso (TaKaRa).Для обратной транскрипции кДНК синтезировали с использованием PrimeScipt™ RT Master Mix (TaKaRa). Эффективность ПЦР в реальном времени для каждой пары праймеров рассчитывали с использованием стандартных кривых, полученных путем серийного разведения кДНК из Treg. Последовательности праймеров показаны на . Реакции ПЦР проводили с использованием детектора последовательностей ABI PRISM 7500 (Applied Biosystems). Условия ПЦР были установлены следующим образом: начальный этап инкубации в течение 30 с при 95°С, затем 40 циклов по 5 с при 95°С и 34 с при 60°С. Нормализованные значения экспрессии для каждого транскрипта рассчитывали как количества мРНК FOXP3 , TGF-β и IL-10 по отношению к количеству мРНК β-ACTIN с использованием метода 2 -ΔΔCt .Все реакции проводили независимо не менее трех раз.
Последовательности праймеров показаны на . Реакции ПЦР проводили с использованием детектора последовательностей ABI PRISM 7500 (Applied Biosystems). Условия ПЦР были установлены следующим образом: начальный этап инкубации в течение 30 с при 95°С, затем 40 циклов по 5 с при 95°С и 34 с при 60°С. Нормализованные значения экспрессии для каждого транскрипта рассчитывали как количества мРНК FOXP3 , TGF-β и IL-10 по отношению к количеству мРНК β-ACTIN с использованием метода 2 -ΔΔCt .Все реакции проводили независимо не менее трех раз.
Таблица 1
Последовательности праймеров для ПЦР в реальном времени.
+ Джин| вперед (5′-3 ‘) | Обратный (5′-3′) | |
|---|---|---|
| β-актина | ATCTGCTGGAAGGTGGACAGCGA CCCAGCACAATGAAGATCAAGATCAT | |
| FOXP3 | GTGGCCCGGATGTGAGAAG | GGAGCCCTTGTCGGATGATG |
| TGF-β | AACGAACTGGCTGTCTGC | CCTCTGCTCATTCCGCTTAG |
| ИЛ-10 | GCTGGAGGACTTTAAGGGTTAC | ATGTCTGGGTCTTGGTTC |
проточной цитометрии анализ фенотипов Treg клеток
РВМС обрабатывали с помощью или без Tg (100 мкг/мл) в течение 3 дней. Затем клетки промывали и окрашивали PerCP-Cyanine5.5-анти-CD4, PE-анти-CD25 и APC-анти-FOXP3. Клетки анализировали с использованием FACS Canto™ II (BD Biosciences).
Затем клетки промывали и окрашивали PerCP-Cyanine5.5-анти-CD4, PE-анти-CD25 и APC-анти-FOXP3. Клетки анализировали с использованием FACS Canto™ II (BD Biosciences).
Статистический анализ
Статистический анализ был выполнен с использованием программного обеспечения SPSS 16.0 (SPSS, Inc.). Различия между двумя группами анализировали с помощью теста Стьюдента t . Взаимосвязь между уровнями Tg в крови и функциональностью Treg-клеток анализировали с помощью множественной линейной регрессии. Различия в функциональности Treg у одного человека анализировали с помощью парного теста Стьюдента t -test.Результаты были представлены как среднее ± sem или как медиана (IQR), а значение P < 0,05 считалось статистически значимым.
Результаты
Взаимосвязь функций Трег и уровней Тг в периферической крови
Одновременно выявлены функции Трег и уровней Тг в периферической крови у 30 больных с доброкачественными узлами щитовидной железы. Линейный регрессионный анализ показал, что уровень ТГ отрицательно коррелировал с ингибирующей функцией Трег в периферической крови ( R = -0.398, P = 0,03, ). Эта связь оставалась значимой при половой принадлежности; возраст; уровни ТТГ, FT3, FT4 и TG-Ab; размер и количество узлов, а также объем щитовидной железы были включены в пошаговый множественный регрессионный анализ (стандартизированный β = -0,398, P = 0,03). Мы также сравнили функцию Treg в группах с высоким (Tg >77 мкг/л, в соответствии с нормальным диапазоном) и нормальным (Tg ≤77 мкг/л) Tg и обнаружили значительное снижение функции Tregs в группе с высоким Tg ( 11.4 ± 3,9% против 27,5 ± 3,5%, P < 0,05, ). Клинические характеристики пациентов в двух группах показаны на рис., а уровни антител к рецептору тиротрофина (TR-Ab), TPO-Ab и Tg-Ab были несколько выше в группе с высоким уровнем Tg, чем в группе с нормальным Tg, хотя уровни этих антител в двух группах были в пределах нормы.
Линейный регрессионный анализ показал, что уровень ТГ отрицательно коррелировал с ингибирующей функцией Трег в периферической крови ( R = -0.398, P = 0,03, ). Эта связь оставалась значимой при половой принадлежности; возраст; уровни ТТГ, FT3, FT4 и TG-Ab; размер и количество узлов, а также объем щитовидной железы были включены в пошаговый множественный регрессионный анализ (стандартизированный β = -0,398, P = 0,03). Мы также сравнили функцию Treg в группах с высоким (Tg >77 мкг/л, в соответствии с нормальным диапазоном) и нормальным (Tg ≤77 мкг/л) Tg и обнаружили значительное снижение функции Tregs в группе с высоким Tg ( 11.4 ± 3,9% против 27,5 ± 3,5%, P < 0,05, ). Клинические характеристики пациентов в двух группах показаны на рис., а уровни антител к рецептору тиротрофина (TR-Ab), TPO-Ab и Tg-Ab были несколько выше в группе с высоким уровнем Tg, чем в группе с нормальным Tg, хотя уровни этих антител в двух группах были в пределах нормы. Более того, размер и количество узлов, а также объем щитовидной железы в двух группах были одинаковыми ( P > 0,05 для всех, ).
Более того, размер и количество узлов, а также объем щитовидной железы в двух группах были одинаковыми ( P > 0,05 для всех, ).
Взаимосвязь между уровнями Tg в крови и функцией Treg-клеток.(A) Измерены концентрации Tg в крови у 30 пациентов с доброкачественными узлами щитовидной железы. Treg от этих пациентов культивировали совместно с CD4 + CD25 — Т-клетками (Teffs) в соотношении 1:10 и определяли их иммуномодулирующую функцию. Ингибирующую функцию Treg анализировали с использованием скорости ингибирования (%) пролиферации Teffs и рассчитывали по уравнению: ((пролиферация Teffs - пролиферация Teffs плюс Treg)/скорость пролиферации только Teffs) × 100%. Корреляцию между концентрацией Tg и степенью ингибирования (%) пролиферации Teffs (представляющую функцию клеток Treg) анализировали с помощью линейной регрессии.(B) Пациенты были разделены на группу с высоким уровнем Tg (Tg >77 мкг/л) и нормальную группу (Tg≤77 мкг/л). Функцию Tregs сравнивали между двумя группами.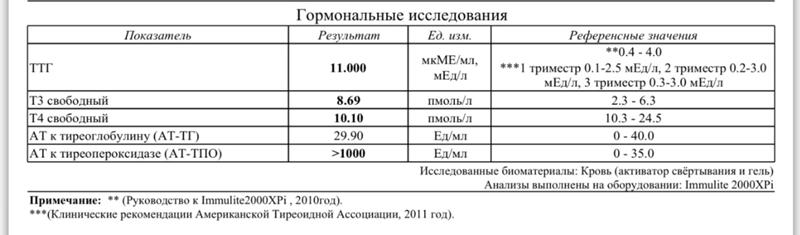 * P < 0,05.
* P < 0,05.
Таблица 2
Клиническая характеристика больных с доброкачественными узлами щитовидной железы.
| Нормальная Тд группы | высокой Тд группы | Р значение | Нормальный диапазон | |||
|---|---|---|---|---|---|---|
| н | 21 | 9 | — | |||
| Пол (мужчины, %) | 23.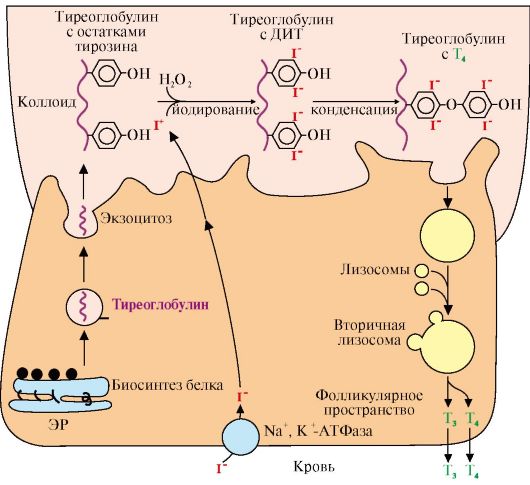 8 8 | 2 | 22.2 | 1.000 | — | — |
| Возраст (год) | 49,0 ± 2.4 | 52.7 ± 43 | — | |||
| TSH (MU / L) | 2,1 ± 0,2 | 2.0 ± 0.3 | 0.770 | 0. 35-4.94 35-4.94 | ||
| FT3 (PMOL / L) | 4,4 ± 0,1 | 4,0 ± 0,3 | 0,161 | 0.161 | 2.63-5.70 | |
| FT4 (PMOL / L) | 15,7 ± 0,4 | 15.5 ± 1 | 0,792 | 9.0-19.0 | 9.0-19.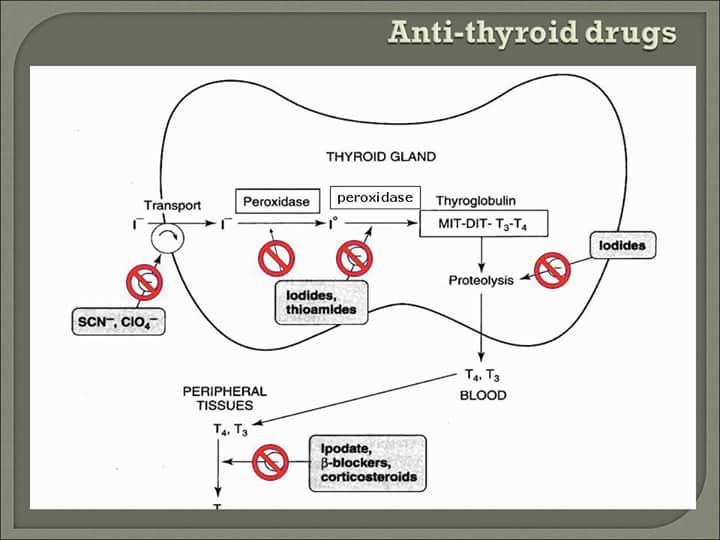 0 0 | |
| Tr-AB (IU / L) | <0.3 | 0.3 (0,4, 0,5) | — | — | <1,75 | |
| TPO-AB ( IU / L) | 5.0 (5.0, 7.7) | 7.1 (5.0, 12.7) | 0.255 | <34.0 | <34.0 | |
11.2 (10.0, 20. 4) 4) | 21.3 (11,3, 24,9) | 0,095 | <115,0 | |||
| Размер узла (мм) | 17.9 ± 4.1 | 20.9 ± 6.8 | 0,695 | — | ||
| Узел № | 1,8 ± 0,1 | 1,8 ± 0,1 | 0,1 | — | ||
| Объем щитовидной железы (мл) | 11. 00 ± 1,2 00 ± 1,2 | 38.59 ± 23.45 | 0.274 | Самки <18 мл мужской <25 мл |
ингибирующие функции и доля щитовидной железы
Уровни TG и соотношение TG до общего белка в фолликулярной жидкости щиты значительно выше, чем в периферической крови ( P < 0.001, ). Мы обнаружили, что FOXP3 + Treg были сконцентрированы в нескольких фолликулах щитовидной железы (11). Доля FOXP3 + Treg среди CD4 + Т-клеток в ткани щитовидной железы была выше, чем в периферической крови ( P < 0,01, ). Мы задались вопросом, может ли повышенный уровень ТГ повлиять на функцию Трег в щитовидной железе. Thyroid Treg совместно культивировали с Teffs периферической крови того же пациента в течение 3 дней в различных соотношениях (1:2, 1:4 и 1:8). В качестве контроля тестировали функцию Tregs периферической крови.Результаты показали, что ингибирующая функция Treg щитовидной железы была слабее, чем Treg периферической крови ( P < 0,01 и ).
В качестве контроля тестировали функцию Tregs периферической крови.Результаты показали, что ингибирующая функция Treg щитовидной железы была слабее, чем Treg периферической крови ( P < 0,01 и ).
ТГ и Трег в ткани щитовидной железы. Ткани щитовидной железы были взяты у семи пациентов, перенесших операцию по поводу доброкачественных узлов щитовидной железы. Концентрацию Тг (А) и отношение Тг/общий белок в тиреоидной фолликулярной жидкости и периферической крови определяли с помощью хемилюминесцентного иммунометрического анализа. (B) Иммунофлуоресцентная микроскопия нормальных срезов щитовидной железы.DAPI использовали для маркировки ядерной ДНК, а FOXP3 использовали для маркировки Treg. Оригинальное увеличение ×200. (C) Мононуклеарные клетки щитовидной железы окрашивали анти-CD4-PerCP-Cyanine5.5, анти-CD25-PE и анти-FOXP3-APC, а также РВМС. Долю клеток CD4 + CD25 + FOXP3 + в популяции Т-клеток CD4 + определяли методом проточной цитометрии.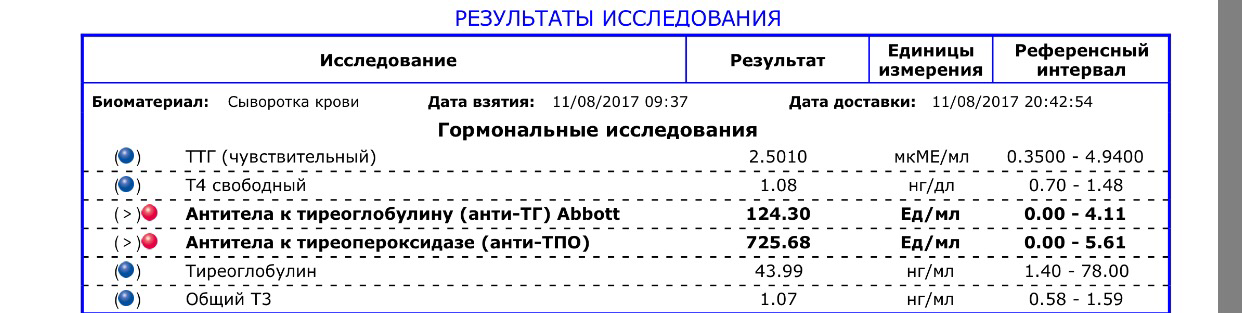 Эксперимент был проведен семь раз независимо друг от друга. ** P < 0,01.
Эксперимент был проведен семь раз независимо друг от друга. ** P < 0,01.
Подавляющая функциональность Treg щитовидной железы.(A) Ткани щитовидной железы были взяты у шести пациентов, перенесших операцию по поводу доброкачественных узлов щитовидной железы. Thyroid Tregs совместно культивировали с эффекторными Т-клетками периферической крови (Teffs, CD4 + CD25 — Т-клетками) в различных соотношениях (1:2, 1:4 и 1:8) в течение 3 дней. Teffs метили CFSE и анализировали с помощью проточной цитометрии. (B) Ингибирующую функцию Treg анализировали с использованием степени ингибирования (%) пролиферации Teffs и рассчитывали по уравнению: ((пролиферация Teffs - пролиферация Teffs плюс Treg)/скорость пролиферации только Teffs) × 100%.Эксперимент проводился независимо шесть раз.
Влияние Tg на функцию Treg
Для определения влияния Tg на функцию Treg, Treg и Teff из периферической крови здоровых доноров совместно культивировали в течение 3 дней в различных соотношениях (1:2, 1: 4 и 1:8) с разными концентрациями Tg (). Мы обнаружили, что высокая концентрация Tg (100 мкг/мл) значительно подавляла ингибирующую функцию Treg по сравнению с контролем ( P < 0,05). И наоборот, низкая концентрация Tg (1 мкг/мл) способствовала ингибирующей функции Treg по сравнению с контролем ( P < 0.01 с Treg/Teff = 1/2 и P < 0,05 с Treg/Teff = 1/4 и 1/8, ). Для дальнейшего изучения основных механизмов действия Tg на функцию Treg мы выделили Tregs из периферической крови здоровых доноров и обрабатывали их различными концентрациями Tg (0, 0,1, 1, 10 и 100 мкг/мл) в течение 3 дней. . Мы обнаружили, что низкая концентрация Tg (1 мкг/мл) значительно стимулировала экспрессию мРНК FOXP3 , TGF-β и IL-10 ; P для всех был <0.01 (). Однако более высокие концентрации Tg (100 мкг/мл) ингибировали экспрессию мРНК FOXP3 , TGF-β и IL-10 ( P < 0,01) (). Чтобы изучить прямое влияние Tg на пролиферацию Teffs, мы также добавили 100 мкг/мл Tg к Teffs без Treg.
Мы обнаружили, что высокая концентрация Tg (100 мкг/мл) значительно подавляла ингибирующую функцию Treg по сравнению с контролем ( P < 0,05). И наоборот, низкая концентрация Tg (1 мкг/мл) способствовала ингибирующей функции Treg по сравнению с контролем ( P < 0.01 с Treg/Teff = 1/2 и P < 0,05 с Treg/Teff = 1/4 и 1/8, ). Для дальнейшего изучения основных механизмов действия Tg на функцию Treg мы выделили Tregs из периферической крови здоровых доноров и обрабатывали их различными концентрациями Tg (0, 0,1, 1, 10 и 100 мкг/мл) в течение 3 дней. . Мы обнаружили, что низкая концентрация Tg (1 мкг/мл) значительно стимулировала экспрессию мРНК FOXP3 , TGF-β и IL-10 ; P для всех был <0.01 (). Однако более высокие концентрации Tg (100 мкг/мл) ингибировали экспрессию мРНК FOXP3 , TGF-β и IL-10 ( P < 0,01) (). Чтобы изучить прямое влияние Tg на пролиферацию Teffs, мы также добавили 100 мкг/мл Tg к Teffs без Treg. Скорость пролиферации Teff в группе 100 мкг/мл Tg и пустой группе составила 56,2 ± 6,8% против 65,7 ± 9,1% соответственно, P = 0,055.
Скорость пролиферации Teff в группе 100 мкг/мл Tg и пустой группе составила 56,2 ± 6,8% против 65,7 ± 9,1% соответственно, P = 0,055.
Двунаправленные эффекты Tg на функцию клеток Treg.(A) Tregs были выделены из периферической крови здоровых доноров и совместно культивированы с CD4 + CD25 — Т-клетками, меченными CFSE в различных соотношениях (1:2, 1:4 и 1:8), и одновременно обработаны с ТГ в различных концентрациях (0, 0,1, 1, 10 и 100 мкг/мл) в течение 3 дней. К культурам также добавляли антитела против CD3 человека (5 × 10 -8 мкмоль/л) и антитела против CD28 человека (2,27× 10 -8 мкмоль/л). Скорость пролиферации Teffs анализировали с помощью проточной цитометрии.(B) Ингибирующая функция Treg, представленная степенью ингибирования (%) пролиферации Teffs, рассчитывалась с использованием уравнения: ((пролиферация Teffs - пролиферация Teffs плюс Treg)/скорость пролиферации только Teffs) × 100%. Эксперимент проводился независимо 11 раз. * P < 0,05, ** P < 0,01.
* P < 0,05, ** P < 0,01.
Влияние Tg на FOXP3 и экспрессию цитокинов в Treg. РВМС выделяли из периферической крови здоровых доноров и инкубировали с различными концентрациями Tg (0, 0.1, 1, 10 и 100 мкг/мл) в течение 3 дней. Затем Treg выделяли с помощью MACS, и уровни экспрессии мРНК (A) FOXP-3 , (B) TGF-β и (C) IL-10 определяли с помощью ПЦР в реальном времени. Эксперимент проводили не менее трех раз независимо друг от друга. ** P < 0,01.
Обсуждение
В настоящем исследовании мы обнаружили коррелированную дисфункцию Treg с уровнем Tg у пациентов с доброкачественными узлами щитовидной железы и значительно сниженную функцию Treg в группе с высоким уровнем Tg (Tg >77 мкг/л) по сравнению с нормальным Группа ТГ.Уровни Tg в сыворотке могут быть повышены при большинстве пролиферативных заболеваний щитовидной железы (5, 30), и было показано, что количественные и/или функциональные нарушения Treg участвуют в патогенезе AITD у людей (18, 23, 31, 32). Механизм такой высокой заболеваемости AITD может быть связан с высоким уровнем Tg, который нарушает функцию Treg в узлах щитовидной железы и раке.
Механизм такой высокой заболеваемости AITD может быть связан с высоким уровнем Tg, который нарушает функцию Treg в узлах щитовидной железы и раке.
Мы также подтвердили, что высокие уровни Tg могут влиять на функцию Treg in vitro со снижением экспрессии FOXP3, IL-10 и TGF-β.FOXP3 был не только молекулярным маркером и фактором спецификации клеточной линии для Treg, но также имел решающее значение для регуляторной активности Treg (33). Более высокие уровни экспрессии FOXP3 подавляют активность нерегуляторных Т-клеток у грызунов (34). У людей мутации в гене FOXP3 связаны с дефицитом Treg, вызывая тяжелое системное аутоиммунное заболевание, называемое иммунной дисрегуляцией, полиэндокринопатией, энтеропатией и синдромом, сцепленным с Х-хромосомой (35). IL-10 и TGF-β являются растворимыми факторами, которые экспрессируются Treg, и они оказывают прямое супрессивное действие на Teffs (36, 37).Высокие уровни Tg, влияющие на функцию Treg, могут быть связаны с ингибирующим действием Tg на экспрессию FOXP3, IL-10 и TGF-β в Treg. И наоборот, низкие уровни Tg могут улучшать функцию Treg и стимулировать экспрессию мРНК FOXP3, TGF-β и IL-10. Предыдущие исследования показали, что у 100% мышей CBA/J развился тиреоидит с положительными Tg-Ab при внутривенном введении высоких концентраций Tg (100 мкг). один раз (17), но только у 17% мышей развился тиреоидит после инъекции низкой концентрации ТГ (40 мкг в день) в течение 10 дней (38).Ни у одной из мышей не развился тиреоидит, когда им вводили низкие концентрации ТГ (20 мкг в день) и ТТГ (0,25 МЕ в день) (38). Результаты этих исследований могут быть связаны с влиянием различных концентраций Tg на Treg.
И наоборот, низкие уровни Tg могут улучшать функцию Treg и стимулировать экспрессию мРНК FOXP3, TGF-β и IL-10. Предыдущие исследования показали, что у 100% мышей CBA/J развился тиреоидит с положительными Tg-Ab при внутривенном введении высоких концентраций Tg (100 мкг). один раз (17), но только у 17% мышей развился тиреоидит после инъекции низкой концентрации ТГ (40 мкг в день) в течение 10 дней (38).Ни у одной из мышей не развился тиреоидит, когда им вводили низкие концентрации ТГ (20 мкг в день) и ТТГ (0,25 МЕ в день) (38). Результаты этих исследований могут быть связаны с влиянием различных концентраций Tg на Treg.
Хотя высокие концентрации Tg подавляли функцию Treg-клеток, низкие концентрации оказывали противоположный эффект in vitro , что свидетельствует о том, что Tg может по-разному регулировать функцию Treg-клеток в зависимости от того, находится ли он в ткани щитовидной железы или в периферической крови.Двунаправленные эффекты Tg на Treg-клетки были аналогичны эффектам Tg на рост фолликулярных эпителиальных клеток щитовидной железы (39, 40). Индукция роста клеток щитовидной железы отмечалась только при более низких концентрациях ТГ, тогда как ингибирование роста клеток и функции фолликулов индуцировалось в зависимости от дозы при более высоких концентрациях ТГ. Сузуки и др. . предположили, что за эту двухфазную активность в росте клеток щитовидной железы ответственны разные системы распознавания, а не два разных домена белка Tg (39).
Индукция роста клеток щитовидной железы отмечалась только при более низких концентрациях ТГ, тогда как ингибирование роста клеток и функции фолликулов индуцировалось в зависимости от дозы при более высоких концентрациях ТГ. Сузуки и др. . предположили, что за эту двухфазную активность в росте клеток щитовидной железы ответственны разные системы распознавания, а не два разных домена белка Tg (39).
ТГ продуцируется исключительно фолликулярными клетками щитовидной железы, и концентрация ТГ в щитовидной железе намного выше, чем в периферической крови, особенно у пациентов с узлами щитовидной железы. Настоящее исследование показало, что иммунорегуляторная функция Treg в ткани щитовидной железы была значительно ниже, чем в периферической крови. Среди пациентов с узлами щитовидной железы лишь небольшое число лиц склонны к развитию АИТ. Должен существовать механизм для поддержания иммунного гомеостаза в щитовидной железе.Хотя функция Tregs уменьшилась, доля Tregs в щитовидной железе увеличилась. Повышенная доля Tregs могла компенсировать снижение функции Tregs. Определенные факторы, такие как дефекты генов, вирусная инфекция, потребление йода, стресс или разрушение фолликулов щитовидной железы, вызванное узлами щитовидной железы (например, у пациентов с высоким уровнем ТГ в настоящем исследовании) и раком, могут привести к повышению уровня ТГ (30). , 41, 42). Мы предполагаем, что если концентрация Tg будет увеличиваться до уровней выше, чем те, которые могут быть уравновешены компенсаторным механизмом у некоторых пациентов с узлами щитовидной железы, иммунный гомеостаз может нарушиться и может развиться AITD.
Повышенная доля Tregs могла компенсировать снижение функции Tregs. Определенные факторы, такие как дефекты генов, вирусная инфекция, потребление йода, стресс или разрушение фолликулов щитовидной железы, вызванное узлами щитовидной железы (например, у пациентов с высоким уровнем ТГ в настоящем исследовании) и раком, могут привести к повышению уровня ТГ (30). , 41, 42). Мы предполагаем, что если концентрация Tg будет увеличиваться до уровней выше, чем те, которые могут быть уравновешены компенсаторным механизмом у некоторых пациентов с узлами щитовидной железы, иммунный гомеостаз может нарушиться и может развиться AITD.
В заключение, мы впервые обнаружили, что высокий уровень ТГ может нарушать функцию Трег у пациентов с узлами щитовидной железы, что может объяснить высокую частоту ГТ у таких пациентов. Механизмы дисфункции Treg могут быть связаны с ингибирующим действием Tg на экспрессию FOXP3, TGF-β и IL-10. Настоящее исследование дает новый взгляд на лечение узлов щитовидной железы, особенно тех, которые возникают с повышенным уровнем ТГ.
Заявление об интересах
Авторы заявляют об отсутствии конфликта интересов, который мог бы быть воспринят как наносящий ущерб беспристрастности опубликованного исследования.
Финансирование
Эта работа была поддержана Национальным фондом естественных наук Китая (номер гранта 81570710), Национальным фондом естественных наук провинции Цзянсу (номер гранта SBK2015042970) и Научным фондом Бюро общественного здравоохранения Нанкина (номер гранта ZKX15026 и YKK16137) .
Благодарности
Авторы выражают благодарность д-ру Bang-shun He (Центральная лаборатория Первой больницы Нанкина) за помощь в проведении проточной цитометрии и Xiu-ping Wang (Отделение эндокринологии Первой больницы Нанкина) за сбор образцов крови.
Ссылки
1. Durante C, Grani G, Lamartina L, Filetti S, Mandel SJ, Cooper DS. Диагностика и лечение узлов щитовидной железы: обзор. ДЖАМА 2018. 319 914–924. (10.1001/jama.2018.0898) [PubMed] [CrossRef] [Google Scholar]2. Раго Т., Чиовато Л., Агини-Ломбарди Ф., Грассо Л., Пинчера А., Витти П.
Непальпируемые узлы щитовидной железы в пограничной йододефицитной зоне: обнаружение с помощью УЗИ и последующее наблюдение. Журнал эндокринологических исследований
2001.
24
770–776. (10.1007/BF03343926) [PubMed] [CrossRef] [Google Scholar]3.Фишер С.Б., Перье Н.Д.
Случайный узел щитовидной железы. CA: Раковой журнал для клиницистов
2018.
68
97–105. (10.3322/caac.21447) [PubMed] [CrossRef] [Google Scholar]4. Burch HB, Burman KD, Cooper DS, Hennessey JV, Vietor NO.
Обзор клинических моделей лечения узлов щитовидной железы, проведенный в 2015 г. Журнал клинической эндокринологии и обмена веществ
2016.
101
2853–2862. (10.1210/jc.2016-1155) [PubMed] [CrossRef] [Google Scholar]5. Джурика С., Джорджевич Д., Синадинович Дж.
Долгосрочное наблюдение за уровнями тиреоглобина в сыворотке и его клиническими последствиями у субъектов после хирургического удаления «холодного» узла щитовидной железы.Экспериментальная и клиническая эндокринология
1992.
Раго Т., Чиовато Л., Агини-Ломбарди Ф., Грассо Л., Пинчера А., Витти П.
Непальпируемые узлы щитовидной железы в пограничной йододефицитной зоне: обнаружение с помощью УЗИ и последующее наблюдение. Журнал эндокринологических исследований
2001.
24
770–776. (10.1007/BF03343926) [PubMed] [CrossRef] [Google Scholar]3.Фишер С.Б., Перье Н.Д.
Случайный узел щитовидной железы. CA: Раковой журнал для клиницистов
2018.
68
97–105. (10.3322/caac.21447) [PubMed] [CrossRef] [Google Scholar]4. Burch HB, Burman KD, Cooper DS, Hennessey JV, Vietor NO.
Обзор клинических моделей лечения узлов щитовидной железы, проведенный в 2015 г. Журнал клинической эндокринологии и обмена веществ
2016.
101
2853–2862. (10.1210/jc.2016-1155) [PubMed] [CrossRef] [Google Scholar]5. Джурика С., Джорджевич Д., Синадинович Дж.
Долгосрочное наблюдение за уровнями тиреоглобина в сыворотке и его клиническими последствиями у субъектов после хирургического удаления «холодного» узла щитовидной железы.Экспериментальная и клиническая эндокринология
1992. 99
137–142. (10.1055/s-0029-1211155) [PubMed] [CrossRef] [Google Scholar]6. Du Y, Gao YH, Feng ZY, Meng FG, Fan LJ, Sun DJ.
Сывороточный тиреоглобулин — чувствительный биомаркер йодного статуса питания и влияния на аномалии и заболевания щитовидной железы у взрослого населения. Биомедицинские науки и науки об окружающей среде
2017.
30
508–516. (10.3967/bes2017.067) [PubMed] [CrossRef] [Google Scholar]7. Кескин М., Савас-Эрдеве С., Айкан З.
Сосуществование узла щитовидной железы и рака щитовидной железы у детей и подростков с тиреоидитом Хашимото: одноцентровое исследование.Гормональные исследования в педиатрии
2016.
85
181–187. (10.1159/000443143) [PubMed] [CrossRef] [Google Scholar]8. Руджери Р.М., Кампенни А., Синдони А., Балдари С., Тримарчи Ф., Бенвенга С.
Ассоциация автономно функционирующих узлов щитовидной железы с тиреоидитом Хашимото: исследование большой группы пациентов. Экспериментальная и клиническая эндокринология и диабет
2011.
119
621–627. (10.1055/s-0031-1279705) [PubMed] [CrossRef] [Google Scholar]9.
99
137–142. (10.1055/s-0029-1211155) [PubMed] [CrossRef] [Google Scholar]6. Du Y, Gao YH, Feng ZY, Meng FG, Fan LJ, Sun DJ.
Сывороточный тиреоглобулин — чувствительный биомаркер йодного статуса питания и влияния на аномалии и заболевания щитовидной железы у взрослого населения. Биомедицинские науки и науки об окружающей среде
2017.
30
508–516. (10.3967/bes2017.067) [PubMed] [CrossRef] [Google Scholar]7. Кескин М., Савас-Эрдеве С., Айкан З.
Сосуществование узла щитовидной железы и рака щитовидной железы у детей и подростков с тиреоидитом Хашимото: одноцентровое исследование.Гормональные исследования в педиатрии
2016.
85
181–187. (10.1159/000443143) [PubMed] [CrossRef] [Google Scholar]8. Руджери Р.М., Кампенни А., Синдони А., Балдари С., Тримарчи Ф., Бенвенга С.
Ассоциация автономно функционирующих узлов щитовидной железы с тиреоидитом Хашимото: исследование большой группы пациентов. Экспериментальная и клиническая эндокринология и диабет
2011.
119
621–627. (10.1055/s-0031-1279705) [PubMed] [CrossRef] [Google Scholar]9. Тримболи П., Треглия Г., Джованелла Л.
Предоперационное измерение тиреоглобулина в сыворотке для прогнозирования злокачественных новообразований щитовидной железы: систематический обзор.Гормоны и метаболические исследования
2015.
47
247–252. (10.1055/s-0034-1395517) [PubMed] [CrossRef] [Google Scholar]10. Kim HJ, Mok JO, Kim CH, Kim YJ, Kim SJ, Park HK, Byun DW, Suh K, Yoo MH.
Предоперационный тиреоглобулин сыворотки и изменения тиреоглобулина сыворотки во время супрессии ТТГ независимо предсказывают фолликулярную карциному щитовидной железы в узлах щитовидной железы с цитологическим диагнозом фолликулярного поражения. Эндокринные исследования
2017.
42
154–162. (10.1080/07435800.2016.1262395) [PubMed] [CrossRef] [Google Scholar]11.Азизи Г., Келлер Дж. М., Льюис М., Пайпер К., Пуэтт Д., Ривенбарк К. М., Мальчофф К. Д.
Ассоциация тиреоидита Хашимото с раком щитовидной железы. Эндокринный рак
2014.
21
845–852. (10.1530/ERC-14-0258) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]12.
Тримболи П., Треглия Г., Джованелла Л.
Предоперационное измерение тиреоглобулина в сыворотке для прогнозирования злокачественных новообразований щитовидной железы: систематический обзор.Гормоны и метаболические исследования
2015.
47
247–252. (10.1055/s-0034-1395517) [PubMed] [CrossRef] [Google Scholar]10. Kim HJ, Mok JO, Kim CH, Kim YJ, Kim SJ, Park HK, Byun DW, Suh K, Yoo MH.
Предоперационный тиреоглобулин сыворотки и изменения тиреоглобулина сыворотки во время супрессии ТТГ независимо предсказывают фолликулярную карциному щитовидной железы в узлах щитовидной железы с цитологическим диагнозом фолликулярного поражения. Эндокринные исследования
2017.
42
154–162. (10.1080/07435800.2016.1262395) [PubMed] [CrossRef] [Google Scholar]11.Азизи Г., Келлер Дж. М., Льюис М., Пайпер К., Пуэтт Д., Ривенбарк К. М., Мальчофф К. Д.
Ассоциация тиреоидита Хашимото с раком щитовидной железы. Эндокринный рак
2014.
21
845–852. (10.1530/ERC-14-0258) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]12. Гуль К., Дирикоч А., Кияк Г., Эрсой П.Е., Уграс Н.С., Эрсой Р., Чакир Б.
Связь между карциномой щитовидной железы и тиреоидитом Хашимото: ультразвуковые и гистопатологические характеристики злокачественных узлов. Щитовидная железа
2010.
20
873–878.(10.1089/thy.2009.0118) [PubMed] [CrossRef] [Google Scholar] 13. Азизи Г., Мальхофф КД.
Аутоиммунное заболевание щитовидной железы: фактор риска рака щитовидной железы. Эндокринная практика
2011.
17
201–209. (10.4158/EP10123.OR) [PubMed] [CrossRef] [Google Scholar] 15. Луепрасицакул В., Алекс С., Фанг С.Л., Аппель М.С., Браверман Л.Е.
Тиреоглобулин-индуцированный лимфоцитарный тиреоидит у двух подлиний крыс BB/Wor. Аутоиммунитет
1991.
9
55–60. (10.3109/0897124) [PubMed] [CrossRef] [Google Scholar] 16. Аллен Э.М., Тупари Дж.Н.Тиреоглобулин-реактивные Т-лимфоциты у склонных к тиреоидиту крыс BB/Wor. Журнал эндокринологических исследований
1995.
18
45–49. (10.1007/BF03349697) [PubMed] [CrossRef] [Google Scholar] 17. Моррис Г.П., Браун Н.
Гуль К., Дирикоч А., Кияк Г., Эрсой П.Е., Уграс Н.С., Эрсой Р., Чакир Б.
Связь между карциномой щитовидной железы и тиреоидитом Хашимото: ультразвуковые и гистопатологические характеристики злокачественных узлов. Щитовидная железа
2010.
20
873–878.(10.1089/thy.2009.0118) [PubMed] [CrossRef] [Google Scholar] 13. Азизи Г., Мальхофф КД.
Аутоиммунное заболевание щитовидной железы: фактор риска рака щитовидной железы. Эндокринная практика
2011.
17
201–209. (10.4158/EP10123.OR) [PubMed] [CrossRef] [Google Scholar] 15. Луепрасицакул В., Алекс С., Фанг С.Л., Аппель М.С., Браверман Л.Е.
Тиреоглобулин-индуцированный лимфоцитарный тиреоидит у двух подлиний крыс BB/Wor. Аутоиммунитет
1991.
9
55–60. (10.3109/0897124) [PubMed] [CrossRef] [Google Scholar] 16. Аллен Э.М., Тупари Дж.Н.Тиреоглобулин-реактивные Т-лимфоциты у склонных к тиреоидиту крыс BB/Wor. Журнал эндокринологических исследований
1995.
18
45–49. (10.1007/BF03349697) [PubMed] [CrossRef] [Google Scholar] 17. Моррис Г.П., Браун Н. К., Конг Ю.К.
Существующие в природе регуляторные Т-клетки CD4(+)CD25(+)Foxp3(+) необходимы для устойчивости к экспериментальному аутоиммунному тиреоидиту, индуцированному либо экзогенным, либо эндогенным аутоантигеном. Журнал аутоиммунитета
2009.
33
68–76. (10.1016/j.jaut.2009.03.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]18.Нагаяма Й, Хориэ И, Сайто О, Накахара М, Абиру Н.
CD4+CD25+ природные регуляторные Т-клетки, а не лимфопения, играют роль в патогенезе йод-индуцированного аутоиммунного тиреоидита у мышей NOD-h3h5. Журнал аутоиммунитета
2007.
29
195–202. (10.1016/j.jaut.2007.07.008) [PubMed] [CrossRef] [Google Scholar] 19. Li C, Yuan J, Zhu YF, Yang XJ, Wang Q, Xu J, He ST, Zhang JA.
Дисбаланс Th27/Treg при различных подтипах аутоиммунных заболеваний щитовидной железы. Клеточная физиология и биохимия
2016.40
245–252. (10.1159/000452541) [PubMed] [CrossRef] [Google Scholar] 20. Рамос-Леви А.М., Марасуэла М.
Патогенез аутоиммунных заболеваний щитовидной железы: роль клеточных механизмов.
К., Конг Ю.К.
Существующие в природе регуляторные Т-клетки CD4(+)CD25(+)Foxp3(+) необходимы для устойчивости к экспериментальному аутоиммунному тиреоидиту, индуцированному либо экзогенным, либо эндогенным аутоантигеном. Журнал аутоиммунитета
2009.
33
68–76. (10.1016/j.jaut.2009.03.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]18.Нагаяма Й, Хориэ И, Сайто О, Накахара М, Абиру Н.
CD4+CD25+ природные регуляторные Т-клетки, а не лимфопения, играют роль в патогенезе йод-индуцированного аутоиммунного тиреоидита у мышей NOD-h3h5. Журнал аутоиммунитета
2007.
29
195–202. (10.1016/j.jaut.2007.07.008) [PubMed] [CrossRef] [Google Scholar] 19. Li C, Yuan J, Zhu YF, Yang XJ, Wang Q, Xu J, He ST, Zhang JA.
Дисбаланс Th27/Treg при различных подтипах аутоиммунных заболеваний щитовидной железы. Клеточная физиология и биохимия
2016.40
245–252. (10.1159/000452541) [PubMed] [CrossRef] [Google Scholar] 20. Рамос-Леви А.М., Марасуэла М.
Патогенез аутоиммунных заболеваний щитовидной железы: роль клеточных механизмов. Эндокринология и питание
2016.
63
421–429. (10.1016/j.endonu.2016.04.003) [PubMed] [CrossRef] [Google Scholar]21. Лю И, Тан С, Тянь Дж, Чжу С, Пэн Х, Руи К, Ван Ю, Мао С, Ма Дж, Лу Л.
и другие.
Дисбаланс клеток Th27/Treg и профиль GITRL у пациентов с тиреоидитом Хашимото. Международный журнал молекулярных наук
2014.15
21674–21686. (10.3390/ijms151221674) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Глик А.Б., Водзински А., Фу П., Левин А.Д., Вальд Д.Н.
Нарушение регуляторной функции Т-клеток при аутоиммунных заболеваниях щитовидной железы. Щитовидная железа
2013.
23
871–878. (10.1089/thy.2012.0514) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23. Hu Y, Tian W, Zhang LL, Liu H, Yin GP, He BS, Mao XM.
Функция регуляторных Т-клеток улучшилась под действием дексаметазона при болезни Грейвса. Европейский журнал эндокринологии
2012.166
641–646. (10.1530/EJE-11-0879) [PubMed] [CrossRef] [Google Scholar] 25. Сакагучи С.
Возникающие в природе Foxp3-экспрессирующие CD25+CD4+ регуляторные Т-клетки с иммунологической толерантностью к своим и чужим.
Эндокринология и питание
2016.
63
421–429. (10.1016/j.endonu.2016.04.003) [PubMed] [CrossRef] [Google Scholar]21. Лю И, Тан С, Тянь Дж, Чжу С, Пэн Х, Руи К, Ван Ю, Мао С, Ма Дж, Лу Л.
и другие.
Дисбаланс клеток Th27/Treg и профиль GITRL у пациентов с тиреоидитом Хашимото. Международный журнал молекулярных наук
2014.15
21674–21686. (10.3390/ijms151221674) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Глик А.Б., Водзински А., Фу П., Левин А.Д., Вальд Д.Н.
Нарушение регуляторной функции Т-клеток при аутоиммунных заболеваниях щитовидной железы. Щитовидная железа
2013.
23
871–878. (10.1089/thy.2012.0514) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23. Hu Y, Tian W, Zhang LL, Liu H, Yin GP, He BS, Mao XM.
Функция регуляторных Т-клеток улучшилась под действием дексаметазона при болезни Грейвса. Европейский журнал эндокринологии
2012.166
641–646. (10.1530/EJE-11-0879) [PubMed] [CrossRef] [Google Scholar] 25. Сакагучи С.
Возникающие в природе Foxp3-экспрессирующие CD25+CD4+ регуляторные Т-клетки с иммунологической толерантностью к своим и чужим. Иммунология природы
2005.
6
345–352. (10.1038/ni1178) [PubMed] [CrossRef] [Google Scholar]26. Романьяни С.
Регуляторные Т-клетки: какая роль в патогенезе и лечении аллергических заболеваний?
аллергия
2006.
61
3–14. (10.1111/j.1398-9995.2006.01005.x) [PubMed] [CrossRef] [Google Scholar]27. Китайское общество эндокринологов, 2012 г. Руководство по ведению пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы.Китайский журнал эндокринологии и обмена веществ
28
779–797. (10.3760/cma.j.issn.1000-6699.2012.10.002) [CrossRef] [Google Scholar]28. Мао XM, Li HQ, Li Q, Li DM, Xie XJ, Yin GP, Zhang P, Xu XH, Wu JD, Chen SW.
и другие.
Профилактика рецидива болезни Грейвса путем внутритиреоидной инъекции дексаметазона. Журнал клинической эндокринологии и обмена веществ
2009.
94
4984–4991. (10.1210/jc.2009-1252) [PubMed] [CrossRef] [Google Scholar]29. Марасуэла М., Гарсия-Лопес М.А., Фигероа-Вега Н., де ла Фуэнте Х., Альварадо-Санчес Б., Монсивайс-Уренда А., Санчес-Мадрид Ф.
Иммунология природы
2005.
6
345–352. (10.1038/ni1178) [PubMed] [CrossRef] [Google Scholar]26. Романьяни С.
Регуляторные Т-клетки: какая роль в патогенезе и лечении аллергических заболеваний?
аллергия
2006.
61
3–14. (10.1111/j.1398-9995.2006.01005.x) [PubMed] [CrossRef] [Google Scholar]27. Китайское общество эндокринологов, 2012 г. Руководство по ведению пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы.Китайский журнал эндокринологии и обмена веществ
28
779–797. (10.3760/cma.j.issn.1000-6699.2012.10.002) [CrossRef] [Google Scholar]28. Мао XM, Li HQ, Li Q, Li DM, Xie XJ, Yin GP, Zhang P, Xu XH, Wu JD, Chen SW.
и другие.
Профилактика рецидива болезни Грейвса путем внутритиреоидной инъекции дексаметазона. Журнал клинической эндокринологии и обмена веществ
2009.
94
4984–4991. (10.1210/jc.2009-1252) [PubMed] [CrossRef] [Google Scholar]29. Марасуэла М., Гарсия-Лопес М.А., Фигероа-Вега Н., де ла Фуэнте Х., Альварадо-Санчес Б., Монсивайс-Уренда А., Санчес-Мадрид Ф. , Гонсалес-Амаро Р.Регуляторные Т-клетки при аутоиммунном заболевании щитовидной железы человека. Журнал клинической эндокринологии и обмена веществ
2006.
91
3639–3646. (10.1210/jc.2005-2337) [PubMed] [CrossRef] [Google Scholar]30. Окамото Т., Канбэ М., Иихара М., Ямадзаки К., Окамото Дж., Ямасита Т., Ито Й., Каваками М., Обара Т.
Измерение сывороточного тиреоглобулина у пациентов с фолликулярным узлом щитовидной железы: его диагностическое значение. Эндокринный журнал
1997.
44
187–193. (10.1507/endocrj.44.187) [PubMed] [CrossRef] [Google Scholar] 31. Сайто О, Нагаяма Ю.Регуляция гипертиреоза Грейвса с помощью встречающихся в природе регуляторных Т-клеток CD4+CD25+ в мышиной модели. Эндокринология
2006.
147
2417–2422. (10.1210/en.2005-1024) [PubMed] [CrossRef] [Google Scholar]32. Wei WZ, Jacob JB, Zielinski JF, Flynn JC, Shim KD, Alsharabi G, Giraldo AA, Kong YC.
Одновременная индукция противоопухолевого иммунитета и аутоиммунного тиреоидита у мышей с истощением регуляторных Т-клеток CD4+ CD25+.
, Гонсалес-Амаро Р.Регуляторные Т-клетки при аутоиммунном заболевании щитовидной железы человека. Журнал клинической эндокринологии и обмена веществ
2006.
91
3639–3646. (10.1210/jc.2005-2337) [PubMed] [CrossRef] [Google Scholar]30. Окамото Т., Канбэ М., Иихара М., Ямадзаки К., Окамото Дж., Ямасита Т., Ито Й., Каваками М., Обара Т.
Измерение сывороточного тиреоглобулина у пациентов с фолликулярным узлом щитовидной железы: его диагностическое значение. Эндокринный журнал
1997.
44
187–193. (10.1507/endocrj.44.187) [PubMed] [CrossRef] [Google Scholar] 31. Сайто О, Нагаяма Ю.Регуляция гипертиреоза Грейвса с помощью встречающихся в природе регуляторных Т-клеток CD4+CD25+ в мышиной модели. Эндокринология
2006.
147
2417–2422. (10.1210/en.2005-1024) [PubMed] [CrossRef] [Google Scholar]32. Wei WZ, Jacob JB, Zielinski JF, Flynn JC, Shim KD, Alsharabi G, Giraldo AA, Kong YC.
Одновременная индукция противоопухолевого иммунитета и аутоиммунного тиреоидита у мышей с истощением регуляторных Т-клеток CD4+ CD25+. Исследования рака
2005.
65
8471–8478. (10.1158/0008-5472.CAN-05-0934) [PubMed] [CrossRef] [Google Scholar]33.Фонтено Д.Д., Гэвин М.А., Руденски А.Ю.
Foxp3 программирует развитие и функцию CD4+CD25+ регуляторных Т-клеток. Иммунология природы
2003.
4
330–336. (10.1038/ni904) [PubMed] [CrossRef] [Google Scholar]34. Сакагути С., Ямагути Т., Номура Т., Оно М.
Регуляторные Т-клетки и иммунная толерантность. Клетка
2008.
133
775–787. (10.1016/j.cell.2008.05.009) [PubMed] [CrossRef] [Google Scholar] 35. Bennett CL, Christie J, Ramsdell F, Brunkow ME, Ferguson PJ, Whitesell L, Kelly TE, Saulsbury FT, Chance PF, Ochs HD.Иммунная дисрегуляция, полиэндокринопатия, энтеропатия, Х-сцепленный синдром (IPEX) обусловлены мутациями FOXP3. Генетика природы
2001.
27
20–21. (10.1038/83713) [PubMed] [CrossRef] [Google Scholar] 36. Аннакер О., Ассеман С., Рид С., Поури Ф.
Интерлейкин-10 в регуляции Т-клеточного колита. Журнал аутоиммунитета
2003.
20
277–279. (10.1016/S0896-8411(03)00045-3) [PubMed] [CrossRef] [Google Scholar]37.
Исследования рака
2005.
65
8471–8478. (10.1158/0008-5472.CAN-05-0934) [PubMed] [CrossRef] [Google Scholar]33.Фонтено Д.Д., Гэвин М.А., Руденски А.Ю.
Foxp3 программирует развитие и функцию CD4+CD25+ регуляторных Т-клеток. Иммунология природы
2003.
4
330–336. (10.1038/ni904) [PubMed] [CrossRef] [Google Scholar]34. Сакагути С., Ямагути Т., Номура Т., Оно М.
Регуляторные Т-клетки и иммунная толерантность. Клетка
2008.
133
775–787. (10.1016/j.cell.2008.05.009) [PubMed] [CrossRef] [Google Scholar] 35. Bennett CL, Christie J, Ramsdell F, Brunkow ME, Ferguson PJ, Whitesell L, Kelly TE, Saulsbury FT, Chance PF, Ochs HD.Иммунная дисрегуляция, полиэндокринопатия, энтеропатия, Х-сцепленный синдром (IPEX) обусловлены мутациями FOXP3. Генетика природы
2001.
27
20–21. (10.1038/83713) [PubMed] [CrossRef] [Google Scholar] 36. Аннакер О., Ассеман С., Рид С., Поури Ф.
Интерлейкин-10 в регуляции Т-клеточного колита. Журнал аутоиммунитета
2003.
20
277–279. (10.1016/S0896-8411(03)00045-3) [PubMed] [CrossRef] [Google Scholar]37. Джоэтам А., Такеда К., Таубе С., Мияхара Н., Мацубара С., Коя Т., Ра Ю.Х., Дахама А., Гельфанд Э.В.Естественная регуляция легочных CD4(+)CD25(+) T-клеток аллергических реакций дыхательных путей зависит от индукции IL-10 TGF-бета. Журнал иммунологии
2007.
178
1433–1442 гг. (10.4049/jimmunol.178.3.1433) [PubMed] [CrossRef] [Google Scholar]38. Конг Ю.М., Браун Н.К., Моррис Г.П., Флинн Д.К.
Существенная роль циркулирующего тиреоглобулина в поддержании доминирования естественной регуляторной функции Т-клеток для предотвращения аутоиммунного тиреоидита. Гормоны и метаболические исследования
2015.
47
711–720. (10.1055/s-0035-1548872) [PubMed] [CrossRef] [Google Scholar]39.Судзуки К., Кавасима А., Йошихара А., Акама Т., Сью М., Йошида А., Кимура Х.Дж.
Роль тиреоглобулина в ауторегуляции функции и роста фолликулов щитовидной железы с отрицательной обратной связью. Журнал эндокринологии
2011.
209
169–174. (10.1530/JOE-10-0486) [PubMed] [CrossRef] [Google Scholar]40. Ногучи Ю., Харии Н., Джулиани С.
Джоэтам А., Такеда К., Таубе С., Мияхара Н., Мацубара С., Коя Т., Ра Ю.Х., Дахама А., Гельфанд Э.В.Естественная регуляция легочных CD4(+)CD25(+) T-клеток аллергических реакций дыхательных путей зависит от индукции IL-10 TGF-бета. Журнал иммунологии
2007.
178
1433–1442 гг. (10.4049/jimmunol.178.3.1433) [PubMed] [CrossRef] [Google Scholar]38. Конг Ю.М., Браун Н.К., Моррис Г.П., Флинн Д.К.
Существенная роль циркулирующего тиреоглобулина в поддержании доминирования естественной регуляторной функции Т-клеток для предотвращения аутоиммунного тиреоидита. Гормоны и метаболические исследования
2015.
47
711–720. (10.1055/s-0035-1548872) [PubMed] [CrossRef] [Google Scholar]39.Судзуки К., Кавасима А., Йошихара А., Акама Т., Сью М., Йошида А., Кимура Х.Дж.
Роль тиреоглобулина в ауторегуляции функции и роста фолликулов щитовидной железы с отрицательной обратной связью. Журнал эндокринологии
2011.
209
169–174. (10.1530/JOE-10-0486) [PubMed] [CrossRef] [Google Scholar]40. Ногучи Ю., Харии Н., Джулиани С. , Тацуно И., Судзуки К., Кон Л.Д.
Тиреоглобулин (Tg) индуцирует рост клеток щитовидной железы в зависимости от концентрации с помощью механизма, отличного от стимуляции тиреотропином/цАМФ. Коммуникации в области биохимических и биофизических исследований
2010.391
890–894. (10.1016/j.bbrc.2009.11.158) [PubMed] [CrossRef] [Google Scholar]41. Стефан М., Якобсон Э.М., Хубер А.К., Гринберг Д.А., Ли К.В., Скрабанек Л., Концепшн Э., Фадлалла М., Хо К., Томер Ю.
Новый вариант промотора тиреоглобулина запускает аутоиммунитет щитовидной железы посредством эпигенетического интерферон-альфа-модулируемого механизма. Журнал биологической химии
2011.
286
31168–31179. (10.1074/jbc.M111.247510) [PMC free article] [PubMed] [CrossRef] [Google Scholar]
, Тацуно И., Судзуки К., Кон Л.Д.
Тиреоглобулин (Tg) индуцирует рост клеток щитовидной железы в зависимости от концентрации с помощью механизма, отличного от стимуляции тиреотропином/цАМФ. Коммуникации в области биохимических и биофизических исследований
2010.391
890–894. (10.1016/j.bbrc.2009.11.158) [PubMed] [CrossRef] [Google Scholar]41. Стефан М., Якобсон Э.М., Хубер А.К., Гринберг Д.А., Ли К.В., Скрабанек Л., Концепшн Э., Фадлалла М., Хо К., Томер Ю.
Новый вариант промотора тиреоглобулина запускает аутоиммунитет щитовидной железы посредством эпигенетического интерферон-альфа-модулируемого механизма. Журнал биологической химии
2011.
286
31168–31179. (10.1074/jbc.M111.247510) [PMC free article] [PubMed] [CrossRef] [Google Scholar]Повышенный уровень тиреоглобулина связан с дисфункцией регуляторных Т-клеток у пациентов с узлами щитовидной железы
Endocr Connect.2019 апрель; 8(4): 309–317.
, 1, 2, * , * , * * , 3 , 1 , 1 , 1 , 4 , 1 , 1 , 1 , 2 , 2 9 9 и 1Yun Hu
1 1 1 Департамент эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай 2 Отдел иммунологии, Нанкин Медицинский университет , Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Медицинский университет Нанкина, Цзянсу, Китай 3 Первое отделение хирургии щитовидной железы и молочной железы, Нанкин Университет, Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай На Ли
Пэн Цзян
Лян Ченг
Бо Дин
Сяо-Мей Лю
Yun-Qing Zhu
1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
Bing-076 li Liu1 Отделение эндокринологии Первой больницы Нанкина Медицинского университета Нанкина, Цзянсу, Китай
Xin Cao
1 Отделение эндокринологии Первой больницы Нанкина Медицинского университета Нанкина, Цзянсу03 90 90
2 Кафедра иммунологии, Нанкинский медицинский университет, Цзянсу, Китай
Xi ao-Ming Mao
1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
Отделение иммунологии, Нанкинский медицинский университет, Цзянсу, Китай3 Отделение хирургии щитовидной железы и молочной железы, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
4 Отделение эндокринологии, больница Уси, филиал Нанкинского китайского университета Medicine, Jiangsu, China
*(Y Hu и N Li внесли равный вклад в эту работу)
Поступила в редакцию 11 февраля 2019 г. ; Принято 1 марта 2019 г.
; Принято 1 марта 2019 г.
Abstract
Объектив
Узлы щитовидной железы обычно сопровождаются повышенным уровнем тиреоглобулина (ТГ) и аутоиммунными заболеваниями щитовидной железы (АЗИТ). Однако взаимосвязь между Tg и AITD до конца не изучена. Дисфункция регуляторных Т-клеток (Treg) играет важную роль в развитии АИТ. Мы стремились оценить влияние Tg на функцию Treg у пациентов с узлами щитовидной железы.
Методы
Оценивались уровни Tg и функции Treg в периферической крови и тканях щитовидной железы у пациентов с узлами щитовидной железы из Первой больницы Нанкина.Эффекты Tg на функцию Tregs здоровых доноров также оценивались 90–113 in vitro 90–114 . Функцию Treg определяли как ингибирующее действие Treg на скорость пролиферации эффекторных Т-клеток (CD4 + CD25 — Т-клеток).
Результаты
Уровень Tg в периферической крови отрицательно коррелировал с ингибирующей функцией Treg ( R = 0,398, P = 0,03), и функция Tregs значительно снизилась в группе с высоким уровнем Tg (Tg >77 мкг/ L) по сравнению с группой с нормальным Tg (11. 4 ± 3,9% против 27,5 ± 3,5%, P < 0,05). По сравнению с периферической кровью функция Treg в щитовидной железе значительно снизилась ( P < 0,01), но доля Treg FOXP3 + в щитовидной железе увеличилась ( P < 0,01). Высокая концентрация Tg (100 мкг/мл) ингибировала функцию Treg и подавляла экспрессию мРНК FOXP3 , TGF-β и IL-10 в Treg in vitro .
4 ± 3,9% против 27,5 ± 3,5%, P < 0,05). По сравнению с периферической кровью функция Treg в щитовидной железе значительно снизилась ( P < 0,01), но доля Treg FOXP3 + в щитовидной железе увеличилась ( P < 0,01). Высокая концентрация Tg (100 мкг/мл) ингибировала функцию Treg и подавляла экспрессию мРНК FOXP3 , TGF-β и IL-10 в Treg in vitro .
Выводы
Повышенный уровень ТГ может нарушать функцию Трег, что может увеличить риск АИТ у пациентов с узлами щитовидной железы.
Ключевые слова: тиреоглобулин, регуляторные Т-клетки, узел щитовидной железы
Введение
Узлы щитовидной железы встречаются очень часто; до 65% населения в целом имеют хотя бы один узел щитовидной железы (1), но у большинства из них симптомы отсутствуют, и продолжительность жизни не изменяется (2). Недавние исследования были сосредоточены в основном на связи между узлами щитовидной железы и раком щитовидной железы (3, 4). Узлы щитовидной железы обычно сопровождаются повышением уровня тиреоглобулина (ТГ) (5, 6) и аутоиммунными заболеваниями щитовидной железы (АИТЗ), особенно тиреоидитом Хашимото (ГТ) (7, 8).Интересно, что уровни ТГ у больных раком щитовидной железы всегда значительно выше, чем у больных с доброкачественными узлами щитовидной железы (9, 10). При этом частота ГТ у больных раком щитовидной железы также была выше, чем у больных с доброкачественными узлами щитовидной железы (11, 12, 13). Эти исследования подразумевают, что могут быть некоторые взаимодействия между повышенным уровнем ТГ и ГТ.
Узлы щитовидной железы обычно сопровождаются повышением уровня тиреоглобулина (ТГ) (5, 6) и аутоиммунными заболеваниями щитовидной железы (АИТЗ), особенно тиреоидитом Хашимото (ГТ) (7, 8).Интересно, что уровни ТГ у больных раком щитовидной железы всегда значительно выше, чем у больных с доброкачественными узлами щитовидной железы (9, 10). При этом частота ГТ у больных раком щитовидной железы также была выше, чем у больных с доброкачественными узлами щитовидной железы (11, 12, 13). Эти исследования подразумевают, что могут быть некоторые взаимодействия между повышенным уровнем ТГ и ГТ.
Tg составляет примерно 75–80% общего белка щитовидной железы и служит предшественником гормонов щитовидной железы (14).Предыдущие исследования показали, что Tg может индуцировать лимфоцитарный тиреоидит, повышая титры Tg-Ab у крыс BB/Wor (15) путем активации Т-клеток (16). Кроме того, в ряде исследований подчеркивается важная роль регуляторных Т-клеток (Treg) в профилактике тиреоидита на животных моделях. Истощение Tregs позволило вызвать тиреоидит мышиным Tg у традиционно устойчивых мышей, а также йодидом у мышей NOD-h3h5 (17, 18). Кроме того, клинические исследования показали, что числовые и/или функциональные нарушения Treg были обнаружены у пациентов с АГ (19, 20, 21, 22, 23).Мы задались вопросом, может ли повышенный уровень Tg нарушать функцию Tregs.
Истощение Tregs позволило вызвать тиреоидит мышиным Tg у традиционно устойчивых мышей, а также йодидом у мышей NOD-h3h5 (17, 18). Кроме того, клинические исследования показали, что числовые и/или функциональные нарушения Treg были обнаружены у пациентов с АГ (19, 20, 21, 22, 23).Мы задались вопросом, может ли повышенный уровень Tg нарушать функцию Tregs.
Tregs являются важными подтипами Т-клеток, которые участвуют в модуляции иммунного ответа и играют важную роль в профилактике аутоиммунных заболеваний (24, 25). Естественные Treg (nTreg) развиваются в тимусе и составляют примерно 5–10% от общего числа периферических CD4 + Т-клеток (25). Они характеризуются высокой экспрессией CD25 и транскрипционного фактора forkhead box P3 (FOXP3).Tregs могут подавлять пролиферацию и активность аутореактивных Т-клеток (26).
Целью нашего исследования было оценить влияние Tg на функцию Treg и понять роль Tg в индукции тиреоидита у пациентов с узлами щитовидной железы.
Материалы и методы
Реагенты
Tg-белок человека был приобретен у Fitzgerald Industries International (Актон, Массачусетс, США), чистота >98% подтверждена с помощью SDS-PAGE. Антитела против человеческого CD3 (кат. № 555336) и против человеческого CD28 (кат. № 555725) были приобретены у eBioscience.Антитела к CD25 человека, конъюгированные с аллофикоцианином (APC) (кат. № 555434), конъюгированные с PerCP-Cyanine5.5 антитела к CD4 человека (кат. № 560650), конъюгированные с PE антитела к CD25 человека (кат. № 555432) и -человеческие антитела FOXP3 (Cat# 560045) были приобретены у BD Biosciences (Сан-Хосе, Калифорния, США), и все они были мышиного происхождения. Наборы для определения Tg были приобретены у Siemens Healthcare Diagnostics Inc.
Антитела против человеческого CD3 (кат. № 555336) и против человеческого CD28 (кат. № 555725) были приобретены у eBioscience.Антитела к CD25 человека, конъюгированные с аллофикоцианином (APC) (кат. № 555434), конъюгированные с PerCP-Cyanine5.5 антитела к CD4 человека (кат. № 560650), конъюгированные с PE антитела к CD25 человека (кат. № 555432) и -человеческие антитела FOXP3 (Cat# 560045) были приобретены у BD Biosciences (Сан-Хосе, Калифорния, США), и все они были мышиного происхождения. Наборы для определения Tg были приобретены у Siemens Healthcare Diagnostics Inc.
Информация о пациенте и лабораторные методы
Кровь была собрана у здоровых доноров с нормальными уровнями свободного тироксина (FT4), тиреотропного гормона (TSH), антител к тиреопероксидазе (TPO-Ab). ) и антитело к тиреоглобулину (TG-Ab) для эксперимента in vitro .Исключались доноры с узлами щитовидной железы (по данным УЗИ), аутоиммунными заболеваниями, инфекциями или принимающие какие-либо лекарства. Кровь и нормальные ткани щитовидной железы, окружающие узел щитовидной железы или аденому, у пациентов, перенесших операцию на щитовидной железе, также собирали в Первой больнице Нанкина; они были подтверждены патологией. Показания к операции соответствуют Китайским рекомендациям по ведению пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы (2012 г.) (27). Помимо пациентов, перенесших операции на щитовидной железе, также собирали кровь у пациентов с доброкачественными узлами щитовидной железы, а диагнозы узлов подтверждали тонкоигольной аспирационной биопсией.Пациенты с узлами щитовидной железы были исключены, если у них было какое-либо системное заболевание или они принимали лекарства, которые могут повлиять либо на уровень ТГ, либо на иммунный баланс (например, инфекции и аутоиммунные заболевания). Биоэтический комитет Первой больницы Нанкина одобрил это исследование, и от каждого пациента и здорового донора было получено письменное информированное согласие.
Кровь и нормальные ткани щитовидной железы, окружающие узел щитовидной железы или аденому, у пациентов, перенесших операцию на щитовидной железе, также собирали в Первой больнице Нанкина; они были подтверждены патологией. Показания к операции соответствуют Китайским рекомендациям по ведению пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы (2012 г.) (27). Помимо пациентов, перенесших операции на щитовидной железе, также собирали кровь у пациентов с доброкачественными узлами щитовидной железы, а диагнозы узлов подтверждали тонкоигольной аспирационной биопсией.Пациенты с узлами щитовидной железы были исключены, если у них было какое-либо системное заболевание или они принимали лекарства, которые могут повлиять либо на уровень ТГ, либо на иммунный баланс (например, инфекции и аутоиммунные заболевания). Биоэтический комитет Первой больницы Нанкина одобрил это исследование, и от каждого пациента и здорового донора было получено письменное информированное согласие.
Ткань щитовидной железы гомогенизировали и центрифугировали при 380 g в течение 10 мин. Затем собирали супернатант (фолликулярную жидкость щитовидной железы) для измерения уровней ТГ.Уровни Tg в крови и щитовидной железе измеряли с помощью хемилюминесцентных иммунометрических анализов (Elecsys TG II, Roche Diagnostics GmbH) на анализаторе Modular Analytics E170 (Roche Diagnostics GmbH), и нормальный референтный диапазон составлял 3,5–77 нг/мл, как описано в предыдущем исследовании. 6). Общее содержание белка в фолликулярной жидкости щитовидной железы и образцах плазмы измеряли с использованием набора для анализа белка BCA (Sigma Aldrich) в соответствии с инструкциями производителя. Объем щитовидной железы до операции был получен путем вычисления объемов обеих долей (доля (мл) = длина (см) × ширина (см) × глубина (см) × 0.479). Узлы и/или кистозные области были включены в объем щитовидной железы (референтные значения, 18 мл для женщин и 25 мл для пациентов мужского пола) (28).
Выделение Tregs периферической крови и щитовидной железы
Мононуклеарные клетки периферической крови (РВМС) выделяли с использованием центрифугирования в градиенте плотности Ficoll-Paque (Sigma Aldrich). Для выделения мононуклеарных клеток щитовидной железы образцы щитовидной железы гомогенизировали и пропускали через стальную сетку с размером пор 75 мкм, а затем выделяли мононуклеарные клетки с помощью центрифугирования Ficoll-Paque.После двукратной промывки 10 мл PBS клетки ресуспендировали в среде Roswell Park Memorial Institute (RPMI)-1640, содержащей пенициллин (80 Ед/мл), стрептомицин (1,38 × 10 -4 моль/л), l- глутамина (2,05 × 10 -3 моль/л), l-глюкозы (0,01 моль/л) и бикарбоната натрия (0,02 моль/л), с добавлением 10% эмбриональной бычьей сыворотки (FBS; Invitrogen).
Treg были выделены из мононуклеарных клеток с использованием набора для сортировки магнитно-активированных клеток человека (MACS) (Miltenyi Biotec).Эффекторные Т-клетки (Teffs, CD4+CD25- Т-клетки) также собирали после выделения Treg с помощью антитела к CD25. После разделения клетки ресуспендировали в 2 мл среды RPMI-1640 с добавлением 10% FBS. Чистоту периферической крови и Treg щитовидной железы проверяли с помощью проточной цитометрии, и было установлено, что чистота клеток постоянно превышает 95%.
После разделения клетки ресуспендировали в 2 мл среды RPMI-1640 с добавлением 10% FBS. Чистоту периферической крови и Treg щитовидной железы проверяли с помощью проточной цитометрии, и было установлено, что чистота клеток постоянно превышает 95%.
Иммунофлуоресцентное окрашивание
Срезы ткани щитовидной железы, инкубированные с моноклональным кроличьим анти-FOXP3 (Cell Signaling Technology, разведение 1:500), затем инкубировали в течение 30 мин с антителами козьего антикроличьего иммуноглобулина, конъюгированными с Alexa-Fluor 488 (DAKO).DAPI (4′,6-диамино-2-фенилиндол, KEYGEN, Jiangsu, CN) использовали для мечения ядерной ДНК. Антитела соответствующего изотипа использовали в качестве отрицательного контроля. Меченые срезы визуализировали с помощью флуоресцентного микроскопа.
Функциональный анализ Treg
Основной функцией Treg было ингибирование пролиферации Teffs. Мы проверили функцию Treg, как описано ранее (23, 29): Treg (чистота >97%) культивировали с постоянным количеством клеток Teffs в различных соотношениях (Treg:Teffs = 1:2, 1:4 и 1:8). или 1:10) в среде, содержащей 10 % FBS, при 37°C и 5 % CO 2 .К культурам добавляли антитела против человеческого CD3 (5 × 10 -8 мкмоль/л) и против человеческого CD28 (2,27× 10 -8 мкмоль/л). Клетки одновременно обрабатывали Тг в разных концентрациях (0, 0,1, 1, 10 и 100 мкг/мл) и культивировали в течение 3 дней в 24-луночных планшетах (5 × 10 5 клеток/лунку). Thyroid Treg также совместно культивировали с гомологичными Teffs периферической крови. Для определения пролиферации клеток к суспензии Т-клеток в среде RPMI-1640 добавляли сукцинимидиловый эфир карбоксифлуоресцеина (CFSE; BD Biosciences, Сан-Хосе, Калифорния, США) в конечной концентрации 5× 10 -6 моль/л.Клетки инкубировали в течение 15 мин при 37°С, а затем обрабатывали АРС-анти-CD25 еще 30 мин при 4°С. Пролиферацию Т-клеток анализировали с использованием FACS Canto™ II (BD Biosciences). Степень ингибирования (%) рассчитывали по формуле: ((только пролиферация Teffs - пролиферация Teffs с Treg)/только пролиферация Teffs) × 100%.
или 1:10) в среде, содержащей 10 % FBS, при 37°C и 5 % CO 2 .К культурам добавляли антитела против человеческого CD3 (5 × 10 -8 мкмоль/л) и против человеческого CD28 (2,27× 10 -8 мкмоль/л). Клетки одновременно обрабатывали Тг в разных концентрациях (0, 0,1, 1, 10 и 100 мкг/мл) и культивировали в течение 3 дней в 24-луночных планшетах (5 × 10 5 клеток/лунку). Thyroid Treg также совместно культивировали с гомологичными Teffs периферической крови. Для определения пролиферации клеток к суспензии Т-клеток в среде RPMI-1640 добавляли сукцинимидиловый эфир карбоксифлуоресцеина (CFSE; BD Biosciences, Сан-Хосе, Калифорния, США) в конечной концентрации 5× 10 -6 моль/л.Клетки инкубировали в течение 15 мин при 37°С, а затем обрабатывали АРС-анти-CD25 еще 30 мин при 4°С. Пролиферацию Т-клеток анализировали с использованием FACS Canto™ II (BD Biosciences). Степень ингибирования (%) рассчитывали по формуле: ((только пролиферация Teffs - пролиферация Teffs с Treg)/только пролиферация Teffs) × 100%.
Стимуляция РВМС с помощью Tg
Изолированные РВМС подсчитывали и культивировали в среде RPMI-1640 с добавлением 10% FBS при 37°C и 5% CO 2 .Добавляли различные концентрации Tg (0, 0,1, 1, 10 и 100 мкг/мл); затем клетки инкубировали в течение 3 дней. Как и в более ранних экспериментах, в лунки также добавляли антитела против человеческого CD3 (5 × 10 -8 мкмоль/л) и против человеческого CD28 (2,27× 10 -8 мкмоль/л). Через 3 дня Treg выделяли из мононуклеарных клеток с использованием набора MACS для человеческих Treg клеток, а затем выделяли РНК для дальнейшего анализа.
Выделение РНК и ПЦР в реальном времени
Клетки гомогенизировали в реагенте TRIzol (Sigma-Aldrich), и экстракцию РНК проводили с использованием реагента TaKaRa RNAiso (TaKaRa).Для обратной транскрипции кДНК синтезировали с использованием PrimeScipt™ RT Master Mix (TaKaRa). Эффективность ПЦР в реальном времени для каждой пары праймеров рассчитывали с использованием стандартных кривых, полученных путем серийного разведения кДНК из Treg. Последовательности праймеров показаны на . Реакции ПЦР проводили с использованием детектора последовательностей ABI PRISM 7500 (Applied Biosystems). Условия ПЦР были установлены следующим образом: начальный этап инкубации в течение 30 с при 95°С, затем 40 циклов по 5 с при 95°С и 34 с при 60°С. Нормализованные значения экспрессии для каждого транскрипта рассчитывали как количества мРНК FOXP3 , TGF-β и IL-10 по отношению к количеству мРНК β-ACTIN с использованием метода 2 -ΔΔCt .Все реакции проводили независимо не менее трех раз.
Последовательности праймеров показаны на . Реакции ПЦР проводили с использованием детектора последовательностей ABI PRISM 7500 (Applied Biosystems). Условия ПЦР были установлены следующим образом: начальный этап инкубации в течение 30 с при 95°С, затем 40 циклов по 5 с при 95°С и 34 с при 60°С. Нормализованные значения экспрессии для каждого транскрипта рассчитывали как количества мРНК FOXP3 , TGF-β и IL-10 по отношению к количеству мРНК β-ACTIN с использованием метода 2 -ΔΔCt .Все реакции проводили независимо не менее трех раз.
Таблица 1
Последовательности праймеров для ПЦР в реальном времени.
+ Джин| вперед (5′-3 ‘) | Обратный (5′-3′) | |
|---|---|---|
| β-актина | ATCTGCTGGAAGGTGGACAGCGA CCCAGCACAATGAAGATCAAGATCAT | |
| FOXP3 | GTGGCCCGGATGTGAGAAG | GGAGCCCTTGTCGGATGATG |
| TGF-β | AACGAACTGGCTGTCTGC | CCTCTGCTCATTCCGCTTAG |
| ИЛ-10 | GCTGGAGGACTTTAAGGGTTAC | ATGTCTGGGTCTTGGTTC |
проточной цитометрии анализ фенотипов Treg клеток
РВМС обрабатывали с помощью или без Tg (100 мкг/мл) в течение 3 дней. Затем клетки промывали и окрашивали PerCP-Cyanine5.5-анти-CD4, PE-анти-CD25 и APC-анти-FOXP3. Клетки анализировали с использованием FACS Canto™ II (BD Biosciences).
Затем клетки промывали и окрашивали PerCP-Cyanine5.5-анти-CD4, PE-анти-CD25 и APC-анти-FOXP3. Клетки анализировали с использованием FACS Canto™ II (BD Biosciences).
Статистический анализ
Статистический анализ был выполнен с использованием программного обеспечения SPSS 16.0 (SPSS, Inc.). Различия между двумя группами анализировали с помощью теста Стьюдента t . Взаимосвязь между уровнями Tg в крови и функциональностью Treg-клеток анализировали с помощью множественной линейной регрессии. Различия в функциональности Treg у одного человека анализировали с помощью парного теста Стьюдента t -test.Результаты были представлены как среднее ± sem или как медиана (IQR), а значение P < 0,05 считалось статистически значимым.
Результаты
Взаимосвязь функций Трег и уровней Тг в периферической крови
Одновременно выявлены функции Трег и уровней Тг в периферической крови у 30 больных с доброкачественными узлами щитовидной железы.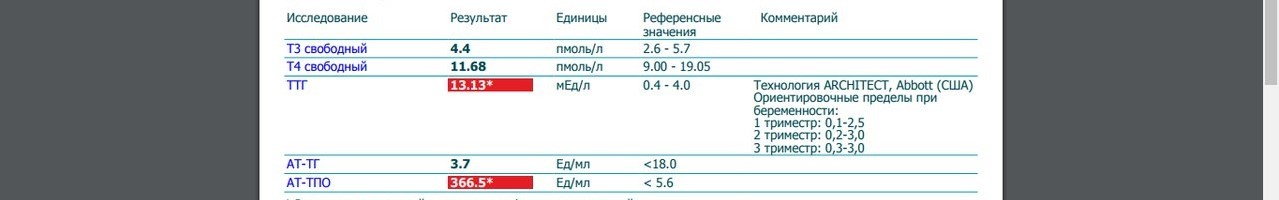 Линейный регрессионный анализ показал, что уровень ТГ отрицательно коррелировал с ингибирующей функцией Трег в периферической крови ( R = -0.398, P = 0,03, ). Эта связь оставалась значимой при половой принадлежности; возраст; уровни ТТГ, FT3, FT4 и TG-Ab; размер и количество узлов, а также объем щитовидной железы были включены в пошаговый множественный регрессионный анализ (стандартизированный β = -0,398, P = 0,03). Мы также сравнили функцию Treg в группах с высоким (Tg >77 мкг/л, в соответствии с нормальным диапазоном) и нормальным (Tg ≤77 мкг/л) Tg и обнаружили значительное снижение функции Tregs в группе с высоким Tg ( 11.4 ± 3,9% против 27,5 ± 3,5%, P < 0,05, ). Клинические характеристики пациентов в двух группах показаны на рис., а уровни антител к рецептору тиротрофина (TR-Ab), TPO-Ab и Tg-Ab были несколько выше в группе с высоким уровнем Tg, чем в группе с нормальным Tg, хотя уровни этих антител в двух группах были в пределах нормы.
Линейный регрессионный анализ показал, что уровень ТГ отрицательно коррелировал с ингибирующей функцией Трег в периферической крови ( R = -0.398, P = 0,03, ). Эта связь оставалась значимой при половой принадлежности; возраст; уровни ТТГ, FT3, FT4 и TG-Ab; размер и количество узлов, а также объем щитовидной железы были включены в пошаговый множественный регрессионный анализ (стандартизированный β = -0,398, P = 0,03). Мы также сравнили функцию Treg в группах с высоким (Tg >77 мкг/л, в соответствии с нормальным диапазоном) и нормальным (Tg ≤77 мкг/л) Tg и обнаружили значительное снижение функции Tregs в группе с высоким Tg ( 11.4 ± 3,9% против 27,5 ± 3,5%, P < 0,05, ). Клинические характеристики пациентов в двух группах показаны на рис., а уровни антител к рецептору тиротрофина (TR-Ab), TPO-Ab и Tg-Ab были несколько выше в группе с высоким уровнем Tg, чем в группе с нормальным Tg, хотя уровни этих антител в двух группах были в пределах нормы. Более того, размер и количество узлов, а также объем щитовидной железы в двух группах были одинаковыми ( P > 0,05 для всех, ).
Более того, размер и количество узлов, а также объем щитовидной железы в двух группах были одинаковыми ( P > 0,05 для всех, ).
Взаимосвязь между уровнями Tg в крови и функцией Treg-клеток.(A) Измерены концентрации Tg в крови у 30 пациентов с доброкачественными узлами щитовидной железы. Treg от этих пациентов культивировали совместно с CD4 + CD25 — Т-клетками (Teffs) в соотношении 1:10 и определяли их иммуномодулирующую функцию. Ингибирующую функцию Treg анализировали с использованием скорости ингибирования (%) пролиферации Teffs и рассчитывали по уравнению: ((пролиферация Teffs - пролиферация Teffs плюс Treg)/скорость пролиферации только Teffs) × 100%. Корреляцию между концентрацией Tg и степенью ингибирования (%) пролиферации Teffs (представляющую функцию клеток Treg) анализировали с помощью линейной регрессии.(B) Пациенты были разделены на группу с высоким уровнем Tg (Tg >77 мкг/л) и нормальную группу (Tg≤77 мкг/л). Функцию Tregs сравнивали между двумя группами. * P < 0,05.
* P < 0,05.
Таблица 2
Клиническая характеристика больных с доброкачественными узлами щитовидной железы.
| Нормальная Тд группы | высокой Тд группы | Р значение | Нормальный диапазон | |||
|---|---|---|---|---|---|---|
| н | 21 | 9 | — | |||
| Пол (мужчины, %) | 23. 8 8 | 2 | 22.2 | 1.000 | — | — |
| Возраст (год) | 49,0 ± 2.4 | 52.7 ± 43 | — | |||
| TSH (MU / L) | 2,1 ± 0,2 | 2.0 ± 0.3 | 0.770 | 0. 35-4.94 35-4.94 | ||
| FT3 (PMOL / L) | 4,4 ± 0,1 | 4,0 ± 0,3 | 0,161 | 0.161 | 2.63-5.70 | |
| FT4 (PMOL / L) | 15,7 ± 0,4 | 15.5 ± 1 | 0,792 | 9.0-19.0 | 9.0-19. 0 0 | |
| Tr-AB (IU / L) | <0.3 | 0.3 (0,4, 0,5) | — | — | <1,75 | |
| TPO-AB ( IU / L) | 5.0 (5.0, 7.7) | 7.1 (5.0, 12.7) | 0.255 | <34.0 | <34.0 | |
11.2 (10.0, 20. 4) 4) | 21.3 (11,3, 24,9) | 0,095 | <115,0 | |||
| Размер узла (мм) | 17.9 ± 4.1 | 20.9 ± 6.8 | 0,695 | — | ||
| Узел № | 1,8 ± 0,1 | 1,8 ± 0,1 | 0,1 | — | ||
| Объем щитовидной железы (мл) | 11. 00 ± 1,2 00 ± 1,2 | 38.59 ± 23.45 | 0.274 | Самки <18 мл мужской <25 мл |
ингибирующие функции и доля щитовидной железы
Уровни TG и соотношение TG до общего белка в фолликулярной жидкости щиты значительно выше, чем в периферической крови ( P < 0.001, ). Мы обнаружили, что FOXP3 + Treg были сконцентрированы в нескольких фолликулах щитовидной железы (11). Доля FOXP3 + Treg среди CD4 + Т-клеток в ткани щитовидной железы была выше, чем в периферической крови ( P < 0,01, ). Мы задались вопросом, может ли повышенный уровень ТГ повлиять на функцию Трег в щитовидной железе. Thyroid Treg совместно культивировали с Teffs периферической крови того же пациента в течение 3 дней в различных соотношениях (1:2, 1:4 и 1:8). В качестве контроля тестировали функцию Tregs периферической крови.Результаты показали, что ингибирующая функция Treg щитовидной железы была слабее, чем Treg периферической крови ( P < 0,01 и ).
В качестве контроля тестировали функцию Tregs периферической крови.Результаты показали, что ингибирующая функция Treg щитовидной железы была слабее, чем Treg периферической крови ( P < 0,01 и ).
ТГ и Трег в ткани щитовидной железы. Ткани щитовидной железы были взяты у семи пациентов, перенесших операцию по поводу доброкачественных узлов щитовидной железы. Концентрацию Тг (А) и отношение Тг/общий белок в тиреоидной фолликулярной жидкости и периферической крови определяли с помощью хемилюминесцентного иммунометрического анализа. (B) Иммунофлуоресцентная микроскопия нормальных срезов щитовидной железы.DAPI использовали для маркировки ядерной ДНК, а FOXP3 использовали для маркировки Treg. Оригинальное увеличение ×200. (C) Мононуклеарные клетки щитовидной железы окрашивали анти-CD4-PerCP-Cyanine5.5, анти-CD25-PE и анти-FOXP3-APC, а также РВМС. Долю клеток CD4 + CD25 + FOXP3 + в популяции Т-клеток CD4 + определяли методом проточной цитометрии. Эксперимент был проведен семь раз независимо друг от друга. ** P < 0,01.
Эксперимент был проведен семь раз независимо друг от друга. ** P < 0,01.
Подавляющая функциональность Treg щитовидной железы.(A) Ткани щитовидной железы были взяты у шести пациентов, перенесших операцию по поводу доброкачественных узлов щитовидной железы. Thyroid Tregs совместно культивировали с эффекторными Т-клетками периферической крови (Teffs, CD4 + CD25 — Т-клетками) в различных соотношениях (1:2, 1:4 и 1:8) в течение 3 дней. Teffs метили CFSE и анализировали с помощью проточной цитометрии. (B) Ингибирующую функцию Treg анализировали с использованием степени ингибирования (%) пролиферации Teffs и рассчитывали по уравнению: ((пролиферация Teffs - пролиферация Teffs плюс Treg)/скорость пролиферации только Teffs) × 100%.Эксперимент проводился независимо шесть раз.
Влияние Tg на функцию Treg
Для определения влияния Tg на функцию Treg, Treg и Teff из периферической крови здоровых доноров совместно культивировали в течение 3 дней в различных соотношениях (1:2, 1: 4 и 1:8) с разными концентрациями Tg (). Мы обнаружили, что высокая концентрация Tg (100 мкг/мл) значительно подавляла ингибирующую функцию Treg по сравнению с контролем ( P < 0,05). И наоборот, низкая концентрация Tg (1 мкг/мл) способствовала ингибирующей функции Treg по сравнению с контролем ( P < 0.01 с Treg/Teff = 1/2 и P < 0,05 с Treg/Teff = 1/4 и 1/8, ). Для дальнейшего изучения основных механизмов действия Tg на функцию Treg мы выделили Tregs из периферической крови здоровых доноров и обрабатывали их различными концентрациями Tg (0, 0,1, 1, 10 и 100 мкг/мл) в течение 3 дней. . Мы обнаружили, что низкая концентрация Tg (1 мкг/мл) значительно стимулировала экспрессию мРНК FOXP3 , TGF-β и IL-10 ; P для всех был <0.01 (). Однако более высокие концентрации Tg (100 мкг/мл) ингибировали экспрессию мРНК FOXP3 , TGF-β и IL-10 ( P < 0,01) (). Чтобы изучить прямое влияние Tg на пролиферацию Teffs, мы также добавили 100 мкг/мл Tg к Teffs без Treg.
Мы обнаружили, что высокая концентрация Tg (100 мкг/мл) значительно подавляла ингибирующую функцию Treg по сравнению с контролем ( P < 0,05). И наоборот, низкая концентрация Tg (1 мкг/мл) способствовала ингибирующей функции Treg по сравнению с контролем ( P < 0.01 с Treg/Teff = 1/2 и P < 0,05 с Treg/Teff = 1/4 и 1/8, ). Для дальнейшего изучения основных механизмов действия Tg на функцию Treg мы выделили Tregs из периферической крови здоровых доноров и обрабатывали их различными концентрациями Tg (0, 0,1, 1, 10 и 100 мкг/мл) в течение 3 дней. . Мы обнаружили, что низкая концентрация Tg (1 мкг/мл) значительно стимулировала экспрессию мРНК FOXP3 , TGF-β и IL-10 ; P для всех был <0.01 (). Однако более высокие концентрации Tg (100 мкг/мл) ингибировали экспрессию мРНК FOXP3 , TGF-β и IL-10 ( P < 0,01) (). Чтобы изучить прямое влияние Tg на пролиферацию Teffs, мы также добавили 100 мкг/мл Tg к Teffs без Treg. Скорость пролиферации Teff в группе 100 мкг/мл Tg и пустой группе составила 56,2 ± 6,8% против 65,7 ± 9,1% соответственно, P = 0,055.
Скорость пролиферации Teff в группе 100 мкг/мл Tg и пустой группе составила 56,2 ± 6,8% против 65,7 ± 9,1% соответственно, P = 0,055.
Двунаправленные эффекты Tg на функцию клеток Treg.(A) Tregs были выделены из периферической крови здоровых доноров и совместно культивированы с CD4 + CD25 — Т-клетками, меченными CFSE в различных соотношениях (1:2, 1:4 и 1:8), и одновременно обработаны с ТГ в различных концентрациях (0, 0,1, 1, 10 и 100 мкг/мл) в течение 3 дней. К культурам также добавляли антитела против CD3 человека (5 × 10 -8 мкмоль/л) и антитела против CD28 человека (2,27× 10 -8 мкмоль/л). Скорость пролиферации Teffs анализировали с помощью проточной цитометрии.(B) Ингибирующая функция Treg, представленная степенью ингибирования (%) пролиферации Teffs, рассчитывалась с использованием уравнения: ((пролиферация Teffs - пролиферация Teffs плюс Treg)/скорость пролиферации только Teffs) × 100%. Эксперимент проводился независимо 11 раз. * P < 0,05, ** P < 0,01.
* P < 0,05, ** P < 0,01.
Влияние Tg на FOXP3 и экспрессию цитокинов в Treg. РВМС выделяли из периферической крови здоровых доноров и инкубировали с различными концентрациями Tg (0, 0.1, 1, 10 и 100 мкг/мл) в течение 3 дней. Затем Treg выделяли с помощью MACS, и уровни экспрессии мРНК (A) FOXP-3 , (B) TGF-β и (C) IL-10 определяли с помощью ПЦР в реальном времени. Эксперимент проводили не менее трех раз независимо друг от друга. ** P < 0,01.
Обсуждение
В настоящем исследовании мы обнаружили коррелированную дисфункцию Treg с уровнем Tg у пациентов с доброкачественными узлами щитовидной железы и значительно сниженную функцию Treg в группе с высоким уровнем Tg (Tg >77 мкг/л) по сравнению с нормальным Группа ТГ.Уровни Tg в сыворотке могут быть повышены при большинстве пролиферативных заболеваний щитовидной железы (5, 30), и было показано, что количественные и/или функциональные нарушения Treg участвуют в патогенезе AITD у людей (18, 23, 31, 32). Механизм такой высокой заболеваемости AITD может быть связан с высоким уровнем Tg, который нарушает функцию Treg в узлах щитовидной железы и раке.
Механизм такой высокой заболеваемости AITD может быть связан с высоким уровнем Tg, который нарушает функцию Treg в узлах щитовидной железы и раке.
Мы также подтвердили, что высокие уровни Tg могут влиять на функцию Treg in vitro со снижением экспрессии FOXP3, IL-10 и TGF-β.FOXP3 был не только молекулярным маркером и фактором спецификации клеточной линии для Treg, но также имел решающее значение для регуляторной активности Treg (33). Более высокие уровни экспрессии FOXP3 подавляют активность нерегуляторных Т-клеток у грызунов (34). У людей мутации в гене FOXP3 связаны с дефицитом Treg, вызывая тяжелое системное аутоиммунное заболевание, называемое иммунной дисрегуляцией, полиэндокринопатией, энтеропатией и синдромом, сцепленным с Х-хромосомой (35). IL-10 и TGF-β являются растворимыми факторами, которые экспрессируются Treg, и они оказывают прямое супрессивное действие на Teffs (36, 37).Высокие уровни Tg, влияющие на функцию Treg, могут быть связаны с ингибирующим действием Tg на экспрессию FOXP3, IL-10 и TGF-β в Treg. И наоборот, низкие уровни Tg могут улучшать функцию Treg и стимулировать экспрессию мРНК FOXP3, TGF-β и IL-10. Предыдущие исследования показали, что у 100% мышей CBA/J развился тиреоидит с положительными Tg-Ab при внутривенном введении высоких концентраций Tg (100 мкг). один раз (17), но только у 17% мышей развился тиреоидит после инъекции низкой концентрации ТГ (40 мкг в день) в течение 10 дней (38).Ни у одной из мышей не развился тиреоидит, когда им вводили низкие концентрации ТГ (20 мкг в день) и ТТГ (0,25 МЕ в день) (38). Результаты этих исследований могут быть связаны с влиянием различных концентраций Tg на Treg.
И наоборот, низкие уровни Tg могут улучшать функцию Treg и стимулировать экспрессию мРНК FOXP3, TGF-β и IL-10. Предыдущие исследования показали, что у 100% мышей CBA/J развился тиреоидит с положительными Tg-Ab при внутривенном введении высоких концентраций Tg (100 мкг). один раз (17), но только у 17% мышей развился тиреоидит после инъекции низкой концентрации ТГ (40 мкг в день) в течение 10 дней (38).Ни у одной из мышей не развился тиреоидит, когда им вводили низкие концентрации ТГ (20 мкг в день) и ТТГ (0,25 МЕ в день) (38). Результаты этих исследований могут быть связаны с влиянием различных концентраций Tg на Treg.
Хотя высокие концентрации Tg подавляли функцию Treg-клеток, низкие концентрации оказывали противоположный эффект in vitro , что свидетельствует о том, что Tg может по-разному регулировать функцию Treg-клеток в зависимости от того, находится ли он в ткани щитовидной железы или в периферической крови.Двунаправленные эффекты Tg на Treg-клетки были аналогичны эффектам Tg на рост фолликулярных эпителиальных клеток щитовидной железы (39, 40). Индукция роста клеток щитовидной железы отмечалась только при более низких концентрациях ТГ, тогда как ингибирование роста клеток и функции фолликулов индуцировалось в зависимости от дозы при более высоких концентрациях ТГ. Сузуки и др. . предположили, что за эту двухфазную активность в росте клеток щитовидной железы ответственны разные системы распознавания, а не два разных домена белка Tg (39).
Индукция роста клеток щитовидной железы отмечалась только при более низких концентрациях ТГ, тогда как ингибирование роста клеток и функции фолликулов индуцировалось в зависимости от дозы при более высоких концентрациях ТГ. Сузуки и др. . предположили, что за эту двухфазную активность в росте клеток щитовидной железы ответственны разные системы распознавания, а не два разных домена белка Tg (39).
ТГ продуцируется исключительно фолликулярными клетками щитовидной железы, и концентрация ТГ в щитовидной железе намного выше, чем в периферической крови, особенно у пациентов с узлами щитовидной железы. Настоящее исследование показало, что иммунорегуляторная функция Treg в ткани щитовидной железы была значительно ниже, чем в периферической крови. Среди пациентов с узлами щитовидной железы лишь небольшое число лиц склонны к развитию АИТ. Должен существовать механизм для поддержания иммунного гомеостаза в щитовидной железе.Хотя функция Tregs уменьшилась, доля Tregs в щитовидной железе увеличилась.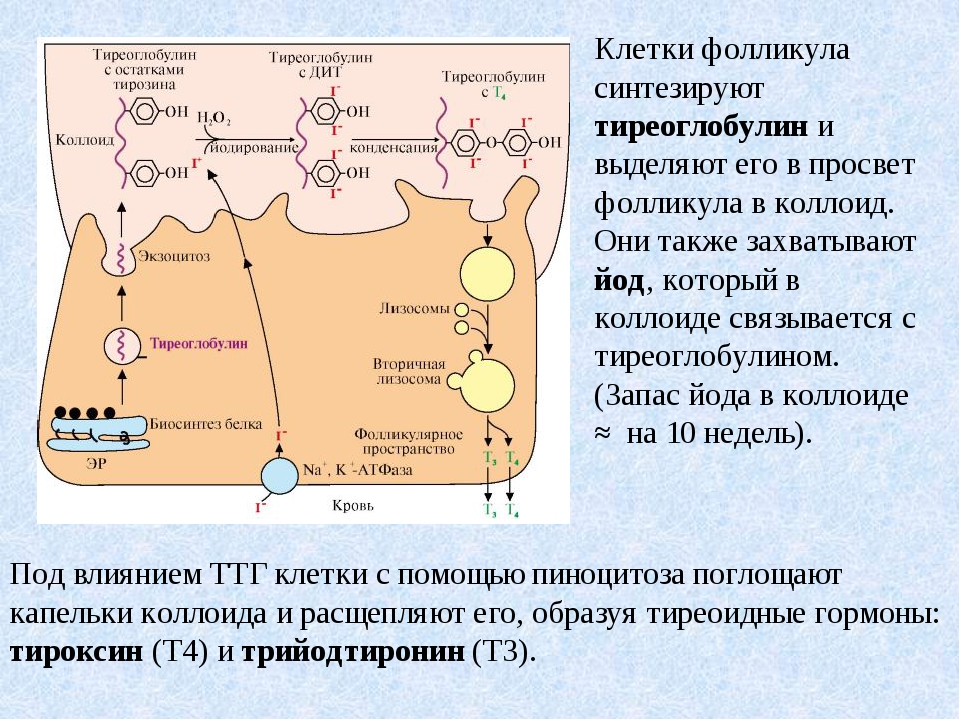 Повышенная доля Tregs могла компенсировать снижение функции Tregs. Определенные факторы, такие как дефекты генов, вирусная инфекция, потребление йода, стресс или разрушение фолликулов щитовидной железы, вызванное узлами щитовидной железы (например, у пациентов с высоким уровнем ТГ в настоящем исследовании) и раком, могут привести к повышению уровня ТГ (30). , 41, 42). Мы предполагаем, что если концентрация Tg будет увеличиваться до уровней выше, чем те, которые могут быть уравновешены компенсаторным механизмом у некоторых пациентов с узлами щитовидной железы, иммунный гомеостаз может нарушиться и может развиться AITD.
Повышенная доля Tregs могла компенсировать снижение функции Tregs. Определенные факторы, такие как дефекты генов, вирусная инфекция, потребление йода, стресс или разрушение фолликулов щитовидной железы, вызванное узлами щитовидной железы (например, у пациентов с высоким уровнем ТГ в настоящем исследовании) и раком, могут привести к повышению уровня ТГ (30). , 41, 42). Мы предполагаем, что если концентрация Tg будет увеличиваться до уровней выше, чем те, которые могут быть уравновешены компенсаторным механизмом у некоторых пациентов с узлами щитовидной железы, иммунный гомеостаз может нарушиться и может развиться AITD.
В заключение, мы впервые обнаружили, что высокий уровень ТГ может нарушать функцию Трег у пациентов с узлами щитовидной железы, что может объяснить высокую частоту ГТ у таких пациентов. Механизмы дисфункции Treg могут быть связаны с ингибирующим действием Tg на экспрессию FOXP3, TGF-β и IL-10. Настоящее исследование дает новый взгляд на лечение узлов щитовидной железы, особенно тех, которые возникают с повышенным уровнем ТГ.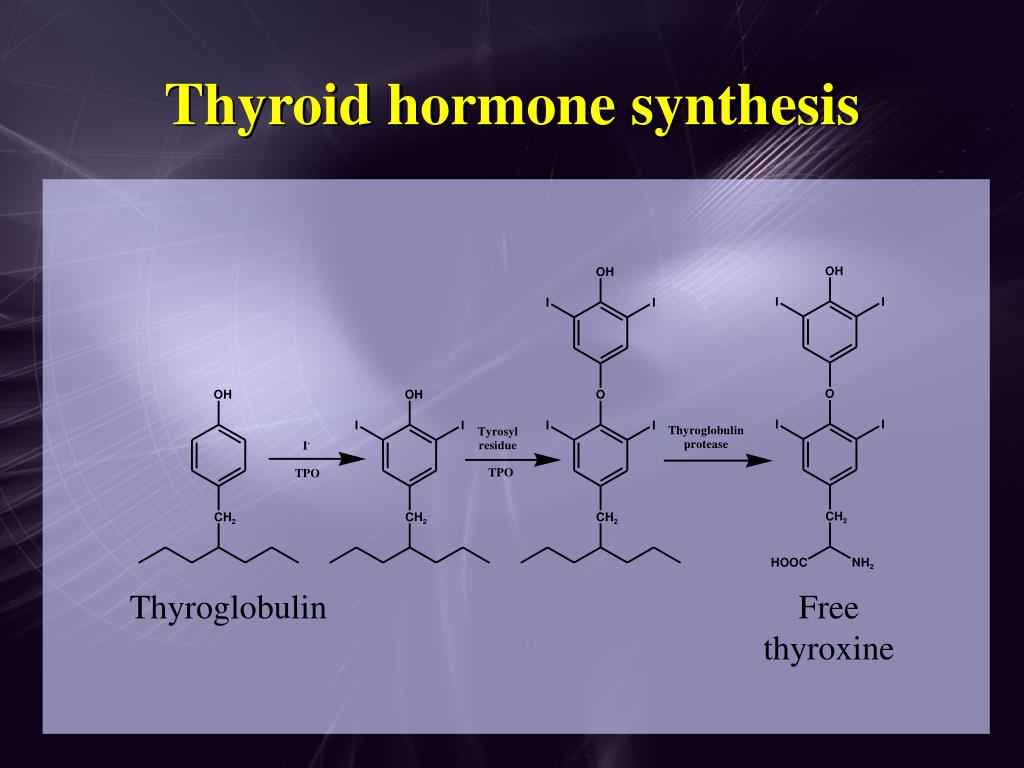
Заявление об интересах
Авторы заявляют об отсутствии конфликта интересов, который мог бы быть воспринят как наносящий ущерб беспристрастности опубликованного исследования.
Финансирование
Эта работа была поддержана Национальным фондом естественных наук Китая (номер гранта 81570710), Национальным фондом естественных наук провинции Цзянсу (номер гранта SBK2015042970) и Научным фондом Бюро общественного здравоохранения Нанкина (номер гранта ZKX15026 и YKK16137) .
Благодарности
Авторы выражают благодарность д-ру Bang-shun He (Центральная лаборатория Первой больницы Нанкина) за помощь в проведении проточной цитометрии и Xiu-ping Wang (Отделение эндокринологии Первой больницы Нанкина) за сбор образцов крови.
Ссылки
1. Durante C, Grani G, Lamartina L, Filetti S, Mandel SJ, Cooper DS. Диагностика и лечение узлов щитовидной железы: обзор. ДЖАМА 2018. 319 914–924. (10.1001/jama.2018.0898) [PubMed] [CrossRef] [Google Scholar]2. Раго Т., Чиовато Л., Агини-Ломбарди Ф., Грассо Л., Пинчера А., Витти П.
Непальпируемые узлы щитовидной железы в пограничной йододефицитной зоне: обнаружение с помощью УЗИ и последующее наблюдение. Журнал эндокринологических исследований
2001.
24
770–776. (10.1007/BF03343926) [PubMed] [CrossRef] [Google Scholar]3.Фишер С.Б., Перье Н.Д.
Случайный узел щитовидной железы. CA: Раковой журнал для клиницистов
2018.
68
97–105. (10.3322/caac.21447) [PubMed] [CrossRef] [Google Scholar]4. Burch HB, Burman KD, Cooper DS, Hennessey JV, Vietor NO.
Обзор клинических моделей лечения узлов щитовидной железы, проведенный в 2015 г. Журнал клинической эндокринологии и обмена веществ
2016.
101
2853–2862. (10.1210/jc.2016-1155) [PubMed] [CrossRef] [Google Scholar]5. Джурика С., Джорджевич Д., Синадинович Дж.
Долгосрочное наблюдение за уровнями тиреоглобина в сыворотке и его клиническими последствиями у субъектов после хирургического удаления «холодного» узла щитовидной железы.Экспериментальная и клиническая эндокринология
1992.
Раго Т., Чиовато Л., Агини-Ломбарди Ф., Грассо Л., Пинчера А., Витти П.
Непальпируемые узлы щитовидной железы в пограничной йододефицитной зоне: обнаружение с помощью УЗИ и последующее наблюдение. Журнал эндокринологических исследований
2001.
24
770–776. (10.1007/BF03343926) [PubMed] [CrossRef] [Google Scholar]3.Фишер С.Б., Перье Н.Д.
Случайный узел щитовидной железы. CA: Раковой журнал для клиницистов
2018.
68
97–105. (10.3322/caac.21447) [PubMed] [CrossRef] [Google Scholar]4. Burch HB, Burman KD, Cooper DS, Hennessey JV, Vietor NO.
Обзор клинических моделей лечения узлов щитовидной железы, проведенный в 2015 г. Журнал клинической эндокринологии и обмена веществ
2016.
101
2853–2862. (10.1210/jc.2016-1155) [PubMed] [CrossRef] [Google Scholar]5. Джурика С., Джорджевич Д., Синадинович Дж.
Долгосрочное наблюдение за уровнями тиреоглобина в сыворотке и его клиническими последствиями у субъектов после хирургического удаления «холодного» узла щитовидной железы.Экспериментальная и клиническая эндокринология
1992. 99
137–142. (10.1055/s-0029-1211155) [PubMed] [CrossRef] [Google Scholar]6. Du Y, Gao YH, Feng ZY, Meng FG, Fan LJ, Sun DJ.
Сывороточный тиреоглобулин — чувствительный биомаркер йодного статуса питания и влияния на аномалии и заболевания щитовидной железы у взрослого населения. Биомедицинские науки и науки об окружающей среде
2017.
30
508–516. (10.3967/bes2017.067) [PubMed] [CrossRef] [Google Scholar]7. Кескин М., Савас-Эрдеве С., Айкан З.
Сосуществование узла щитовидной железы и рака щитовидной железы у детей и подростков с тиреоидитом Хашимото: одноцентровое исследование.Гормональные исследования в педиатрии
2016.
85
181–187. (10.1159/000443143) [PubMed] [CrossRef] [Google Scholar]8. Руджери Р.М., Кампенни А., Синдони А., Балдари С., Тримарчи Ф., Бенвенга С.
Ассоциация автономно функционирующих узлов щитовидной железы с тиреоидитом Хашимото: исследование большой группы пациентов. Экспериментальная и клиническая эндокринология и диабет
2011.
119
621–627. (10.1055/s-0031-1279705) [PubMed] [CrossRef] [Google Scholar]9.
99
137–142. (10.1055/s-0029-1211155) [PubMed] [CrossRef] [Google Scholar]6. Du Y, Gao YH, Feng ZY, Meng FG, Fan LJ, Sun DJ.
Сывороточный тиреоглобулин — чувствительный биомаркер йодного статуса питания и влияния на аномалии и заболевания щитовидной железы у взрослого населения. Биомедицинские науки и науки об окружающей среде
2017.
30
508–516. (10.3967/bes2017.067) [PubMed] [CrossRef] [Google Scholar]7. Кескин М., Савас-Эрдеве С., Айкан З.
Сосуществование узла щитовидной железы и рака щитовидной железы у детей и подростков с тиреоидитом Хашимото: одноцентровое исследование.Гормональные исследования в педиатрии
2016.
85
181–187. (10.1159/000443143) [PubMed] [CrossRef] [Google Scholar]8. Руджери Р.М., Кампенни А., Синдони А., Балдари С., Тримарчи Ф., Бенвенга С.
Ассоциация автономно функционирующих узлов щитовидной железы с тиреоидитом Хашимото: исследование большой группы пациентов. Экспериментальная и клиническая эндокринология и диабет
2011.
119
621–627. (10.1055/s-0031-1279705) [PubMed] [CrossRef] [Google Scholar]9. Тримболи П., Треглия Г., Джованелла Л.
Предоперационное измерение тиреоглобулина в сыворотке для прогнозирования злокачественных новообразований щитовидной железы: систематический обзор.Гормоны и метаболические исследования
2015.
47
247–252. (10.1055/s-0034-1395517) [PubMed] [CrossRef] [Google Scholar]10. Kim HJ, Mok JO, Kim CH, Kim YJ, Kim SJ, Park HK, Byun DW, Suh K, Yoo MH.
Предоперационный тиреоглобулин сыворотки и изменения тиреоглобулина сыворотки во время супрессии ТТГ независимо предсказывают фолликулярную карциному щитовидной железы в узлах щитовидной железы с цитологическим диагнозом фолликулярного поражения. Эндокринные исследования
2017.
42
154–162. (10.1080/07435800.2016.1262395) [PubMed] [CrossRef] [Google Scholar]11.Азизи Г., Келлер Дж. М., Льюис М., Пайпер К., Пуэтт Д., Ривенбарк К. М., Мальчофф К. Д.
Ассоциация тиреоидита Хашимото с раком щитовидной железы. Эндокринный рак
2014.
21
845–852. (10.1530/ERC-14-0258) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]12.
Тримболи П., Треглия Г., Джованелла Л.
Предоперационное измерение тиреоглобулина в сыворотке для прогнозирования злокачественных новообразований щитовидной железы: систематический обзор.Гормоны и метаболические исследования
2015.
47
247–252. (10.1055/s-0034-1395517) [PubMed] [CrossRef] [Google Scholar]10. Kim HJ, Mok JO, Kim CH, Kim YJ, Kim SJ, Park HK, Byun DW, Suh K, Yoo MH.
Предоперационный тиреоглобулин сыворотки и изменения тиреоглобулина сыворотки во время супрессии ТТГ независимо предсказывают фолликулярную карциному щитовидной железы в узлах щитовидной железы с цитологическим диагнозом фолликулярного поражения. Эндокринные исследования
2017.
42
154–162. (10.1080/07435800.2016.1262395) [PubMed] [CrossRef] [Google Scholar]11.Азизи Г., Келлер Дж. М., Льюис М., Пайпер К., Пуэтт Д., Ривенбарк К. М., Мальчофф К. Д.
Ассоциация тиреоидита Хашимото с раком щитовидной железы. Эндокринный рак
2014.
21
845–852. (10.1530/ERC-14-0258) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]12. Гуль К., Дирикоч А., Кияк Г., Эрсой П.Е., Уграс Н.С., Эрсой Р., Чакир Б.
Связь между карциномой щитовидной железы и тиреоидитом Хашимото: ультразвуковые и гистопатологические характеристики злокачественных узлов. Щитовидная железа
2010.
20
873–878.(10.1089/thy.2009.0118) [PubMed] [CrossRef] [Google Scholar] 13. Азизи Г., Мальхофф КД.
Аутоиммунное заболевание щитовидной железы: фактор риска рака щитовидной железы. Эндокринная практика
2011.
17
201–209. (10.4158/EP10123.OR) [PubMed] [CrossRef] [Google Scholar] 15. Луепрасицакул В., Алекс С., Фанг С.Л., Аппель М.С., Браверман Л.Е.
Тиреоглобулин-индуцированный лимфоцитарный тиреоидит у двух подлиний крыс BB/Wor. Аутоиммунитет
1991.
9
55–60. (10.3109/0897124) [PubMed] [CrossRef] [Google Scholar] 16. Аллен Э.М., Тупари Дж.Н.Тиреоглобулин-реактивные Т-лимфоциты у склонных к тиреоидиту крыс BB/Wor. Журнал эндокринологических исследований
1995.
18
45–49. (10.1007/BF03349697) [PubMed] [CrossRef] [Google Scholar] 17. Моррис Г.П., Браун Н.
Гуль К., Дирикоч А., Кияк Г., Эрсой П.Е., Уграс Н.С., Эрсой Р., Чакир Б.
Связь между карциномой щитовидной железы и тиреоидитом Хашимото: ультразвуковые и гистопатологические характеристики злокачественных узлов. Щитовидная железа
2010.
20
873–878.(10.1089/thy.2009.0118) [PubMed] [CrossRef] [Google Scholar] 13. Азизи Г., Мальхофф КД.
Аутоиммунное заболевание щитовидной железы: фактор риска рака щитовидной железы. Эндокринная практика
2011.
17
201–209. (10.4158/EP10123.OR) [PubMed] [CrossRef] [Google Scholar] 15. Луепрасицакул В., Алекс С., Фанг С.Л., Аппель М.С., Браверман Л.Е.
Тиреоглобулин-индуцированный лимфоцитарный тиреоидит у двух подлиний крыс BB/Wor. Аутоиммунитет
1991.
9
55–60. (10.3109/0897124) [PubMed] [CrossRef] [Google Scholar] 16. Аллен Э.М., Тупари Дж.Н.Тиреоглобулин-реактивные Т-лимфоциты у склонных к тиреоидиту крыс BB/Wor. Журнал эндокринологических исследований
1995.
18
45–49. (10.1007/BF03349697) [PubMed] [CrossRef] [Google Scholar] 17. Моррис Г.П., Браун Н. К., Конг Ю.К.
Существующие в природе регуляторные Т-клетки CD4(+)CD25(+)Foxp3(+) необходимы для устойчивости к экспериментальному аутоиммунному тиреоидиту, индуцированному либо экзогенным, либо эндогенным аутоантигеном. Журнал аутоиммунитета
2009.
33
68–76. (10.1016/j.jaut.2009.03.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]18.Нагаяма Й, Хориэ И, Сайто О, Накахара М, Абиру Н.
CD4+CD25+ природные регуляторные Т-клетки, а не лимфопения, играют роль в патогенезе йод-индуцированного аутоиммунного тиреоидита у мышей NOD-h3h5. Журнал аутоиммунитета
2007.
29
195–202. (10.1016/j.jaut.2007.07.008) [PubMed] [CrossRef] [Google Scholar] 19. Li C, Yuan J, Zhu YF, Yang XJ, Wang Q, Xu J, He ST, Zhang JA.
Дисбаланс Th27/Treg при различных подтипах аутоиммунных заболеваний щитовидной железы. Клеточная физиология и биохимия
2016.40
245–252. (10.1159/000452541) [PubMed] [CrossRef] [Google Scholar] 20. Рамос-Леви А.М., Марасуэла М.
Патогенез аутоиммунных заболеваний щитовидной железы: роль клеточных механизмов.
К., Конг Ю.К.
Существующие в природе регуляторные Т-клетки CD4(+)CD25(+)Foxp3(+) необходимы для устойчивости к экспериментальному аутоиммунному тиреоидиту, индуцированному либо экзогенным, либо эндогенным аутоантигеном. Журнал аутоиммунитета
2009.
33
68–76. (10.1016/j.jaut.2009.03.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]18.Нагаяма Й, Хориэ И, Сайто О, Накахара М, Абиру Н.
CD4+CD25+ природные регуляторные Т-клетки, а не лимфопения, играют роль в патогенезе йод-индуцированного аутоиммунного тиреоидита у мышей NOD-h3h5. Журнал аутоиммунитета
2007.
29
195–202. (10.1016/j.jaut.2007.07.008) [PubMed] [CrossRef] [Google Scholar] 19. Li C, Yuan J, Zhu YF, Yang XJ, Wang Q, Xu J, He ST, Zhang JA.
Дисбаланс Th27/Treg при различных подтипах аутоиммунных заболеваний щитовидной железы. Клеточная физиология и биохимия
2016.40
245–252. (10.1159/000452541) [PubMed] [CrossRef] [Google Scholar] 20. Рамос-Леви А.М., Марасуэла М.
Патогенез аутоиммунных заболеваний щитовидной железы: роль клеточных механизмов. Эндокринология и питание
2016.
63
421–429. (10.1016/j.endonu.2016.04.003) [PubMed] [CrossRef] [Google Scholar]21. Лю И, Тан С, Тянь Дж, Чжу С, Пэн Х, Руи К, Ван Ю, Мао С, Ма Дж, Лу Л.
и другие.
Дисбаланс клеток Th27/Treg и профиль GITRL у пациентов с тиреоидитом Хашимото. Международный журнал молекулярных наук
2014.15
21674–21686. (10.3390/ijms151221674) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Глик А.Б., Водзински А., Фу П., Левин А.Д., Вальд Д.Н.
Нарушение регуляторной функции Т-клеток при аутоиммунных заболеваниях щитовидной железы. Щитовидная железа
2013.
23
871–878. (10.1089/thy.2012.0514) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23. Hu Y, Tian W, Zhang LL, Liu H, Yin GP, He BS, Mao XM.
Функция регуляторных Т-клеток улучшилась под действием дексаметазона при болезни Грейвса. Европейский журнал эндокринологии
2012.166
641–646. (10.1530/EJE-11-0879) [PubMed] [CrossRef] [Google Scholar] 25. Сакагучи С.
Возникающие в природе Foxp3-экспрессирующие CD25+CD4+ регуляторные Т-клетки с иммунологической толерантностью к своим и чужим.
Эндокринология и питание
2016.
63
421–429. (10.1016/j.endonu.2016.04.003) [PubMed] [CrossRef] [Google Scholar]21. Лю И, Тан С, Тянь Дж, Чжу С, Пэн Х, Руи К, Ван Ю, Мао С, Ма Дж, Лу Л.
и другие.
Дисбаланс клеток Th27/Treg и профиль GITRL у пациентов с тиреоидитом Хашимото. Международный журнал молекулярных наук
2014.15
21674–21686. (10.3390/ijms151221674) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Глик А.Б., Водзински А., Фу П., Левин А.Д., Вальд Д.Н.
Нарушение регуляторной функции Т-клеток при аутоиммунных заболеваниях щитовидной железы. Щитовидная железа
2013.
23
871–878. (10.1089/thy.2012.0514) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23. Hu Y, Tian W, Zhang LL, Liu H, Yin GP, He BS, Mao XM.
Функция регуляторных Т-клеток улучшилась под действием дексаметазона при болезни Грейвса. Европейский журнал эндокринологии
2012.166
641–646. (10.1530/EJE-11-0879) [PubMed] [CrossRef] [Google Scholar] 25. Сакагучи С.
Возникающие в природе Foxp3-экспрессирующие CD25+CD4+ регуляторные Т-клетки с иммунологической толерантностью к своим и чужим. Иммунология природы
2005.
6
345–352. (10.1038/ni1178) [PubMed] [CrossRef] [Google Scholar]26. Романьяни С.
Регуляторные Т-клетки: какая роль в патогенезе и лечении аллергических заболеваний?
аллергия
2006.
61
3–14. (10.1111/j.1398-9995.2006.01005.x) [PubMed] [CrossRef] [Google Scholar]27. Китайское общество эндокринологов, 2012 г. Руководство по ведению пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы.Китайский журнал эндокринологии и обмена веществ
28
779–797. (10.3760/cma.j.issn.1000-6699.2012.10.002) [CrossRef] [Google Scholar]28. Мао XM, Li HQ, Li Q, Li DM, Xie XJ, Yin GP, Zhang P, Xu XH, Wu JD, Chen SW.
и другие.
Профилактика рецидива болезни Грейвса путем внутритиреоидной инъекции дексаметазона. Журнал клинической эндокринологии и обмена веществ
2009.
94
4984–4991. (10.1210/jc.2009-1252) [PubMed] [CrossRef] [Google Scholar]29. Марасуэла М., Гарсия-Лопес М.А., Фигероа-Вега Н., де ла Фуэнте Х., Альварадо-Санчес Б., Монсивайс-Уренда А., Санчес-Мадрид Ф.
Иммунология природы
2005.
6
345–352. (10.1038/ni1178) [PubMed] [CrossRef] [Google Scholar]26. Романьяни С.
Регуляторные Т-клетки: какая роль в патогенезе и лечении аллергических заболеваний?
аллергия
2006.
61
3–14. (10.1111/j.1398-9995.2006.01005.x) [PubMed] [CrossRef] [Google Scholar]27. Китайское общество эндокринологов, 2012 г. Руководство по ведению пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы.Китайский журнал эндокринологии и обмена веществ
28
779–797. (10.3760/cma.j.issn.1000-6699.2012.10.002) [CrossRef] [Google Scholar]28. Мао XM, Li HQ, Li Q, Li DM, Xie XJ, Yin GP, Zhang P, Xu XH, Wu JD, Chen SW.
и другие.
Профилактика рецидива болезни Грейвса путем внутритиреоидной инъекции дексаметазона. Журнал клинической эндокринологии и обмена веществ
2009.
94
4984–4991. (10.1210/jc.2009-1252) [PubMed] [CrossRef] [Google Scholar]29. Марасуэла М., Гарсия-Лопес М.А., Фигероа-Вега Н., де ла Фуэнте Х., Альварадо-Санчес Б., Монсивайс-Уренда А., Санчес-Мадрид Ф. , Гонсалес-Амаро Р.Регуляторные Т-клетки при аутоиммунном заболевании щитовидной железы человека. Журнал клинической эндокринологии и обмена веществ
2006.
91
3639–3646. (10.1210/jc.2005-2337) [PubMed] [CrossRef] [Google Scholar]30. Окамото Т., Канбэ М., Иихара М., Ямадзаки К., Окамото Дж., Ямасита Т., Ито Й., Каваками М., Обара Т.
Измерение сывороточного тиреоглобулина у пациентов с фолликулярным узлом щитовидной железы: его диагностическое значение. Эндокринный журнал
1997.
44
187–193. (10.1507/endocrj.44.187) [PubMed] [CrossRef] [Google Scholar] 31. Сайто О, Нагаяма Ю.Регуляция гипертиреоза Грейвса с помощью встречающихся в природе регуляторных Т-клеток CD4+CD25+ в мышиной модели. Эндокринология
2006.
147
2417–2422. (10.1210/en.2005-1024) [PubMed] [CrossRef] [Google Scholar]32. Wei WZ, Jacob JB, Zielinski JF, Flynn JC, Shim KD, Alsharabi G, Giraldo AA, Kong YC.
Одновременная индукция противоопухолевого иммунитета и аутоиммунного тиреоидита у мышей с истощением регуляторных Т-клеток CD4+ CD25+. Исследования рака
2005.
65
8471–8478. (10.1158/0008-5472.CAN-05-0934) [PubMed] [CrossRef] [Google Scholar]33.Фонтено Д.Д., Гэвин М.А., Руденски А.Ю.
Foxp3 программирует развитие и функцию CD4+CD25+ регуляторных Т-клеток. Иммунология природы
2003.
4
330–336. (10.1038/ni904) [PubMed] [CrossRef] [Google Scholar]34. Сакагути С., Ямагути Т., Номура Т., Оно М.
Регуляторные Т-клетки и иммунная толерантность. Клетка
2008.
133
775–787. (10.1016/j.cell.2008.05.009) [PubMed] [CrossRef] [Google Scholar] 35. Bennett CL, Christie J, Ramsdell F, Brunkow ME, Ferguson PJ, Whitesell L, Kelly TE, Saulsbury FT, Chance PF, Ochs HD.Иммунная дисрегуляция, полиэндокринопатия, энтеропатия, Х-сцепленный синдром (IPEX) обусловлены мутациями FOXP3. Генетика природы
2001.
27
20–21. (10.1038/83713) [PubMed] [CrossRef] [Google Scholar] 36. Аннакер О., Ассеман С., Рид С., Поури Ф.
Интерлейкин-10 в регуляции Т-клеточного колита. Журнал аутоиммунитета
2003.
20
277–279. (10.1016/S0896-8411(03)00045-3) [PubMed] [CrossRef] [Google Scholar]37. Джоэтам А., Такеда К., Таубе С., Мияхара Н., Мацубара С., Коя Т., Ра Ю.Х., Дахама А., Гельфанд Э.В.Естественная регуляция легочных CD4(+)CD25(+) T-клеток аллергических реакций дыхательных путей зависит от индукции IL-10 TGF-бета. Журнал иммунологии
2007.
178
1433–1442 гг. (10.4049/jimmunol.178.3.1433) [PubMed] [CrossRef] [Google Scholar]38. Конг Ю.М., Браун Н.К., Моррис Г.П., Флинн Д.К.
Существенная роль циркулирующего тиреоглобулина в поддержании доминирования естественной регуляторной функции Т-клеток для предотвращения аутоиммунного тиреоидита. Гормоны и метаболические исследования
2015.
47
711–720. (10.1055/s-0035-1548872) [PubMed] [CrossRef] [Google Scholar]39.Судзуки К., Кавасима А., Йошихара А., Акама Т., Сью М., Йошида А., Кимура Х.Дж.
Роль тиреоглобулина в ауторегуляции функции и роста фолликулов щитовидной железы с отрицательной обратной связью. Журнал эндокринологии
2011.
209
169–174. (10.1530/JOE-10-0486) [PubMed] [CrossRef] [Google Scholar]40. Ногучи Ю., Харии Н., Джулиани С., Тацуно И., Судзуки К., Кон Л.Д.
Тиреоглобулин (Tg) индуцирует рост клеток щитовидной железы в зависимости от концентрации с помощью механизма, отличного от стимуляции тиреотропином/цАМФ. Коммуникации в области биохимических и биофизических исследований
2010.391
890–894. (10.1016/j.bbrc.2009.11.158) [PubMed] [CrossRef] [Google Scholar]41. Стефан М., Якобсон Э.М., Хубер А.К., Гринберг Д.А., Ли К.В., Скрабанек Л., Концепшн Э., Фадлалла М., Хо К., Томер Ю.
Новый вариант промотора тиреоглобулина запускает аутоиммунитет щитовидной железы посредством эпигенетического интерферон-альфа-модулируемого механизма. Журнал биологической химии
2011.
286
31168–31179. (10.1074/jbc.M111.247510) [PMC free article] [PubMed] [CrossRef] [Google Scholar]
, Гонсалес-Амаро Р.Регуляторные Т-клетки при аутоиммунном заболевании щитовидной железы человека. Журнал клинической эндокринологии и обмена веществ
2006.
91
3639–3646. (10.1210/jc.2005-2337) [PubMed] [CrossRef] [Google Scholar]30. Окамото Т., Канбэ М., Иихара М., Ямадзаки К., Окамото Дж., Ямасита Т., Ито Й., Каваками М., Обара Т.
Измерение сывороточного тиреоглобулина у пациентов с фолликулярным узлом щитовидной железы: его диагностическое значение. Эндокринный журнал
1997.
44
187–193. (10.1507/endocrj.44.187) [PubMed] [CrossRef] [Google Scholar] 31. Сайто О, Нагаяма Ю.Регуляция гипертиреоза Грейвса с помощью встречающихся в природе регуляторных Т-клеток CD4+CD25+ в мышиной модели. Эндокринология
2006.
147
2417–2422. (10.1210/en.2005-1024) [PubMed] [CrossRef] [Google Scholar]32. Wei WZ, Jacob JB, Zielinski JF, Flynn JC, Shim KD, Alsharabi G, Giraldo AA, Kong YC.
Одновременная индукция противоопухолевого иммунитета и аутоиммунного тиреоидита у мышей с истощением регуляторных Т-клеток CD4+ CD25+. Исследования рака
2005.
65
8471–8478. (10.1158/0008-5472.CAN-05-0934) [PubMed] [CrossRef] [Google Scholar]33.Фонтено Д.Д., Гэвин М.А., Руденски А.Ю.
Foxp3 программирует развитие и функцию CD4+CD25+ регуляторных Т-клеток. Иммунология природы
2003.
4
330–336. (10.1038/ni904) [PubMed] [CrossRef] [Google Scholar]34. Сакагути С., Ямагути Т., Номура Т., Оно М.
Регуляторные Т-клетки и иммунная толерантность. Клетка
2008.
133
775–787. (10.1016/j.cell.2008.05.009) [PubMed] [CrossRef] [Google Scholar] 35. Bennett CL, Christie J, Ramsdell F, Brunkow ME, Ferguson PJ, Whitesell L, Kelly TE, Saulsbury FT, Chance PF, Ochs HD.Иммунная дисрегуляция, полиэндокринопатия, энтеропатия, Х-сцепленный синдром (IPEX) обусловлены мутациями FOXP3. Генетика природы
2001.
27
20–21. (10.1038/83713) [PubMed] [CrossRef] [Google Scholar] 36. Аннакер О., Ассеман С., Рид С., Поури Ф.
Интерлейкин-10 в регуляции Т-клеточного колита. Журнал аутоиммунитета
2003.
20
277–279. (10.1016/S0896-8411(03)00045-3) [PubMed] [CrossRef] [Google Scholar]37. Джоэтам А., Такеда К., Таубе С., Мияхара Н., Мацубара С., Коя Т., Ра Ю.Х., Дахама А., Гельфанд Э.В.Естественная регуляция легочных CD4(+)CD25(+) T-клеток аллергических реакций дыхательных путей зависит от индукции IL-10 TGF-бета. Журнал иммунологии
2007.
178
1433–1442 гг. (10.4049/jimmunol.178.3.1433) [PubMed] [CrossRef] [Google Scholar]38. Конг Ю.М., Браун Н.К., Моррис Г.П., Флинн Д.К.
Существенная роль циркулирующего тиреоглобулина в поддержании доминирования естественной регуляторной функции Т-клеток для предотвращения аутоиммунного тиреоидита. Гормоны и метаболические исследования
2015.
47
711–720. (10.1055/s-0035-1548872) [PubMed] [CrossRef] [Google Scholar]39.Судзуки К., Кавасима А., Йошихара А., Акама Т., Сью М., Йошида А., Кимура Х.Дж.
Роль тиреоглобулина в ауторегуляции функции и роста фолликулов щитовидной железы с отрицательной обратной связью. Журнал эндокринологии
2011.
209
169–174. (10.1530/JOE-10-0486) [PubMed] [CrossRef] [Google Scholar]40. Ногучи Ю., Харии Н., Джулиани С., Тацуно И., Судзуки К., Кон Л.Д.
Тиреоглобулин (Tg) индуцирует рост клеток щитовидной железы в зависимости от концентрации с помощью механизма, отличного от стимуляции тиреотропином/цАМФ. Коммуникации в области биохимических и биофизических исследований
2010.391
890–894. (10.1016/j.bbrc.2009.11.158) [PubMed] [CrossRef] [Google Scholar]41. Стефан М., Якобсон Э.М., Хубер А.К., Гринберг Д.А., Ли К.В., Скрабанек Л., Концепшн Э., Фадлалла М., Хо К., Томер Ю.
Новый вариант промотора тиреоглобулина запускает аутоиммунитет щитовидной железы посредством эпигенетического интерферон-альфа-модулируемого механизма. Журнал биологической химии
2011.
286
31168–31179. (10.1074/jbc.M111.247510) [PMC free article] [PubMed] [CrossRef] [Google Scholar]Повышенный уровень тиреоглобулина связан с дисфункцией регуляторных Т-клеток у пациентов с узлами щитовидной железы
Endocr Connect.2019 апрель; 8(4): 309–317.
, 1, 2, * , * , * * , 3 , 1 , 1 , 1 , 4 , 1 , 1 , 1 , 2 , 2 9 9 и 1Yun Hu
1 1 1 Департамент эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай 2 Отдел иммунологии, Нанкин Медицинский университет , Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Медицинский университет Нанкина, Цзянсу, Китай 3 Первое отделение хирургии щитовидной железы и молочной железы, Нанкин Университет, Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай На Ли
Пэн Цзян
Лян Ченг
Бо Дин
Сяо-Мей Лю
Yun-Qing Zhu
1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
Bing-076 li Liu1 Отделение эндокринологии Первой больницы Нанкина Медицинского университета Нанкина, Цзянсу, Китай
Xin Cao
1 Отделение эндокринологии Первой больницы Нанкина Медицинского университета Нанкина, Цзянсу03 90 90
2 Кафедра иммунологии, Нанкинский медицинский университет, Цзянсу, Китай
Xi ao-Ming Mao
1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
Отделение иммунологии, Нанкинский медицинский университет, Цзянсу, Китай3 Отделение хирургии щитовидной железы и молочной железы, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
4 Отделение эндокринологии, больница Уси, филиал Нанкинского китайского университета Medicine, Jiangsu, China
*(Y Hu и N Li внесли равный вклад в эту работу)
Поступила в редакцию 11 февраля 2019 г.; Принято 1 марта 2019 г.
Эта статья была процитирована другими статьями в PMC.Abstract
Объектив
Узлы щитовидной железы обычно сопровождаются повышенным уровнем тиреоглобулина (ТГ) и аутоиммунными заболеваниями щитовидной железы (АЗИТ). Однако взаимосвязь между Tg и AITD до конца не изучена. Дисфункция регуляторных Т-клеток (Treg) играет важную роль в развитии АИТ. Мы стремились оценить влияние Tg на функцию Treg у пациентов с узлами щитовидной железы.
Методы
Оценивались уровни Tg и функции Treg в периферической крови и тканях щитовидной железы у пациентов с узлами щитовидной железы из Первой больницы Нанкина.Эффекты Tg на функцию Tregs здоровых доноров также оценивались 90–113 in vitro 90–114 . Функцию Treg определяли как ингибирующее действие Treg на скорость пролиферации эффекторных Т-клеток (CD4 + CD25 — Т-клеток).
Результаты
Уровень Tg в периферической крови отрицательно коррелировал с ингибирующей функцией Treg ( R = 0,398, P = 0,03), и функция Tregs значительно снизилась в группе с высоким уровнем Tg (Tg >77 мкг/ L) по сравнению с группой с нормальным Tg (11.4 ± 3,9% против 27,5 ± 3,5%, P < 0,05). По сравнению с периферической кровью функция Treg в щитовидной железе значительно снизилась ( P < 0,01), но доля Treg FOXP3 + в щитовидной железе увеличилась ( P < 0,01). Высокая концентрация Tg (100 мкг/мл) ингибировала функцию Treg и подавляла экспрессию мРНК FOXP3 , TGF-β и IL-10 в Treg in vitro .
Выводы
Повышенный уровень ТГ может нарушать функцию Трег, что может увеличить риск АИТ у пациентов с узлами щитовидной железы.
Ключевые слова: тиреоглобулин, регуляторные Т-клетки, узел щитовидной железы
Введение
Узлы щитовидной железы встречаются очень часто; до 65% населения в целом имеют хотя бы один узел щитовидной железы (1), но у большинства из них симптомы отсутствуют, и продолжительность жизни не изменяется (2). Недавние исследования были сосредоточены в основном на связи между узлами щитовидной железы и раком щитовидной железы (3, 4). Узлы щитовидной железы обычно сопровождаются повышением уровня тиреоглобулина (ТГ) (5, 6) и аутоиммунными заболеваниями щитовидной железы (АИТЗ), особенно тиреоидитом Хашимото (ГТ) (7, 8).Интересно, что уровни ТГ у больных раком щитовидной железы всегда значительно выше, чем у больных с доброкачественными узлами щитовидной железы (9, 10). При этом частота ГТ у больных раком щитовидной железы также была выше, чем у больных с доброкачественными узлами щитовидной железы (11, 12, 13). Эти исследования подразумевают, что могут быть некоторые взаимодействия между повышенным уровнем ТГ и ГТ.
Tg составляет примерно 75–80% общего белка щитовидной железы и служит предшественником гормонов щитовидной железы (14).Предыдущие исследования показали, что Tg может индуцировать лимфоцитарный тиреоидит, повышая титры Tg-Ab у крыс BB/Wor (15) путем активации Т-клеток (16). Кроме того, в ряде исследований подчеркивается важная роль регуляторных Т-клеток (Treg) в профилактике тиреоидита на животных моделях. Истощение Tregs позволило вызвать тиреоидит мышиным Tg у традиционно устойчивых мышей, а также йодидом у мышей NOD-h3h5 (17, 18). Кроме того, клинические исследования показали, что числовые и/или функциональные нарушения Treg были обнаружены у пациентов с АГ (19, 20, 21, 22, 23).Мы задались вопросом, может ли повышенный уровень Tg нарушать функцию Tregs.
Tregs являются важными подтипами Т-клеток, которые участвуют в модуляции иммунного ответа и играют важную роль в профилактике аутоиммунных заболеваний (24, 25). Естественные Treg (nTreg) развиваются в тимусе и составляют примерно 5–10% от общего числа периферических CD4 + Т-клеток (25). Они характеризуются высокой экспрессией CD25 и транскрипционного фактора forkhead box P3 (FOXP3).Tregs могут подавлять пролиферацию и активность аутореактивных Т-клеток (26).
Целью нашего исследования было оценить влияние Tg на функцию Treg и понять роль Tg в индукции тиреоидита у пациентов с узлами щитовидной железы.
Материалы и методы
Реагенты
Tg-белок человека был приобретен у Fitzgerald Industries International (Актон, Массачусетс, США), чистота >98% подтверждена с помощью SDS-PAGE. Антитела против человеческого CD3 (кат. № 555336) и против человеческого CD28 (кат. № 555725) были приобретены у eBioscience.Антитела к CD25 человека, конъюгированные с аллофикоцианином (APC) (кат. № 555434), конъюгированные с PerCP-Cyanine5.5 антитела к CD4 человека (кат. № 560650), конъюгированные с PE антитела к CD25 человека (кат. № 555432) и -человеческие антитела FOXP3 (Cat# 560045) были приобретены у BD Biosciences (Сан-Хосе, Калифорния, США), и все они были мышиного происхождения. Наборы для определения Tg были приобретены у Siemens Healthcare Diagnostics Inc.
Информация о пациенте и лабораторные методы
Кровь была собрана у здоровых доноров с нормальными уровнями свободного тироксина (FT4), тиреотропного гормона (TSH), антител к тиреопероксидазе (TPO-Ab). ) и антитело к тиреоглобулину (TG-Ab) для эксперимента in vitro .Исключались доноры с узлами щитовидной железы (по данным УЗИ), аутоиммунными заболеваниями, инфекциями или принимающие какие-либо лекарства. Кровь и нормальные ткани щитовидной железы, окружающие узел щитовидной железы или аденому, у пациентов, перенесших операцию на щитовидной железе, также собирали в Первой больнице Нанкина; они были подтверждены патологией. Показания к операции соответствуют Китайским рекомендациям по ведению пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы (2012 г.) (27). Помимо пациентов, перенесших операции на щитовидной железе, также собирали кровь у пациентов с доброкачественными узлами щитовидной железы, а диагнозы узлов подтверждали тонкоигольной аспирационной биопсией.Пациенты с узлами щитовидной железы были исключены, если у них было какое-либо системное заболевание или они принимали лекарства, которые могут повлиять либо на уровень ТГ, либо на иммунный баланс (например, инфекции и аутоиммунные заболевания). Биоэтический комитет Первой больницы Нанкина одобрил это исследование, и от каждого пациента и здорового донора было получено письменное информированное согласие.
Ткань щитовидной железы гомогенизировали и центрифугировали при 380 g в течение 10 мин. Затем собирали супернатант (фолликулярную жидкость щитовидной железы) для измерения уровней ТГ.Уровни Tg в крови и щитовидной железе измеряли с помощью хемилюминесцентных иммунометрических анализов (Elecsys TG II, Roche Diagnostics GmbH) на анализаторе Modular Analytics E170 (Roche Diagnostics GmbH), и нормальный референтный диапазон составлял 3,5–77 нг/мл, как описано в предыдущем исследовании. 6). Общее содержание белка в фолликулярной жидкости щитовидной железы и образцах плазмы измеряли с использованием набора для анализа белка BCA (Sigma Aldrich) в соответствии с инструкциями производителя. Объем щитовидной железы до операции был получен путем вычисления объемов обеих долей (доля (мл) = длина (см) × ширина (см) × глубина (см) × 0.479). Узлы и/или кистозные области были включены в объем щитовидной железы (референтные значения, 18 мл для женщин и 25 мл для пациентов мужского пола) (28).
Выделение Tregs периферической крови и щитовидной железы
Мононуклеарные клетки периферической крови (РВМС) выделяли с использованием центрифугирования в градиенте плотности Ficoll-Paque (Sigma Aldrich). Для выделения мононуклеарных клеток щитовидной железы образцы щитовидной железы гомогенизировали и пропускали через стальную сетку с размером пор 75 мкм, а затем выделяли мононуклеарные клетки с помощью центрифугирования Ficoll-Paque.После двукратной промывки 10 мл PBS клетки ресуспендировали в среде Roswell Park Memorial Institute (RPMI)-1640, содержащей пенициллин (80 Ед/мл), стрептомицин (1,38 × 10 -4 моль/л), l- глутамина (2,05 × 10 -3 моль/л), l-глюкозы (0,01 моль/л) и бикарбоната натрия (0,02 моль/л), с добавлением 10% эмбриональной бычьей сыворотки (FBS; Invitrogen).
Treg были выделены из мононуклеарных клеток с использованием набора для сортировки магнитно-активированных клеток человека (MACS) (Miltenyi Biotec).Эффекторные Т-клетки (Teffs, CD4+CD25- Т-клетки) также собирали после выделения Treg с помощью антитела к CD25. После разделения клетки ресуспендировали в 2 мл среды RPMI-1640 с добавлением 10% FBS. Чистоту периферической крови и Treg щитовидной железы проверяли с помощью проточной цитометрии, и было установлено, что чистота клеток постоянно превышает 95%.
Иммунофлуоресцентное окрашивание
Срезы ткани щитовидной железы, инкубированные с моноклональным кроличьим анти-FOXP3 (Cell Signaling Technology, разведение 1:500), затем инкубировали в течение 30 мин с антителами козьего антикроличьего иммуноглобулина, конъюгированными с Alexa-Fluor 488 (DAKO).DAPI (4′,6-диамино-2-фенилиндол, KEYGEN, Jiangsu, CN) использовали для мечения ядерной ДНК. Антитела соответствующего изотипа использовали в качестве отрицательного контроля. Меченые срезы визуализировали с помощью флуоресцентного микроскопа.
Функциональный анализ Treg
Основной функцией Treg было ингибирование пролиферации Teffs. Мы проверили функцию Treg, как описано ранее (23, 29): Treg (чистота >97%) культивировали с постоянным количеством клеток Teffs в различных соотношениях (Treg:Teffs = 1:2, 1:4 и 1:8). или 1:10) в среде, содержащей 10 % FBS, при 37°C и 5 % CO 2 .К культурам добавляли антитела против человеческого CD3 (5 × 10 -8 мкмоль/л) и против человеческого CD28 (2,27× 10 -8 мкмоль/л). Клетки одновременно обрабатывали Тг в разных концентрациях (0, 0,1, 1, 10 и 100 мкг/мл) и культивировали в течение 3 дней в 24-луночных планшетах (5 × 10 5 клеток/лунку). Thyroid Treg также совместно культивировали с гомологичными Teffs периферической крови. Для определения пролиферации клеток к суспензии Т-клеток в среде RPMI-1640 добавляли сукцинимидиловый эфир карбоксифлуоресцеина (CFSE; BD Biosciences, Сан-Хосе, Калифорния, США) в конечной концентрации 5× 10 -6 моль/л.Клетки инкубировали в течение 15 мин при 37°С, а затем обрабатывали АРС-анти-CD25 еще 30 мин при 4°С. Пролиферацию Т-клеток анализировали с использованием FACS Canto™ II (BD Biosciences). Степень ингибирования (%) рассчитывали по формуле: ((только пролиферация Teffs - пролиферация Teffs с Treg)/только пролиферация Teffs) × 100%.
Стимуляция РВМС с помощью Tg
Изолированные РВМС подсчитывали и культивировали в среде RPMI-1640 с добавлением 10% FBS при 37°C и 5% CO 2 .Добавляли различные концентрации Tg (0, 0,1, 1, 10 и 100 мкг/мл); затем клетки инкубировали в течение 3 дней. Как и в более ранних экспериментах, в лунки также добавляли антитела против человеческого CD3 (5 × 10 -8 мкмоль/л) и против человеческого CD28 (2,27× 10 -8 мкмоль/л). Через 3 дня Treg выделяли из мононуклеарных клеток с использованием набора MACS для человеческих Treg клеток, а затем выделяли РНК для дальнейшего анализа.
Выделение РНК и ПЦР в реальном времени
Клетки гомогенизировали в реагенте TRIzol (Sigma-Aldrich), и экстракцию РНК проводили с использованием реагента TaKaRa RNAiso (TaKaRa).Для обратной транскрипции кДНК синтезировали с использованием PrimeScipt™ RT Master Mix (TaKaRa). Эффективность ПЦР в реальном времени для каждой пары праймеров рассчитывали с использованием стандартных кривых, полученных путем серийного разведения кДНК из Treg. Последовательности праймеров показаны на . Реакции ПЦР проводили с использованием детектора последовательностей ABI PRISM 7500 (Applied Biosystems). Условия ПЦР были установлены следующим образом: начальный этап инкубации в течение 30 с при 95°С, затем 40 циклов по 5 с при 95°С и 34 с при 60°С. Нормализованные значения экспрессии для каждого транскрипта рассчитывали как количества мРНК FOXP3 , TGF-β и IL-10 по отношению к количеству мРНК β-ACTIN с использованием метода 2 -ΔΔCt .Все реакции проводили независимо не менее трех раз.
Таблица 1
Последовательности праймеров для ПЦР в реальном времени.
+ Джин| вперед (5′-3 ‘) | Обратный (5′-3′) | |
|---|---|---|
| β-актина | ATCTGCTGGAAGGTGGACAGCGA CCCAGCACAATGAAGATCAAGATCAT | |
| FOXP3 | GTGGCCCGGATGTGAGAAG | GGAGCCCTTGTCGGATGATG |
| TGF-β | AACGAACTGGCTGTCTGC | CCTCTGCTCATTCCGCTTAG |
| ИЛ-10 | GCTGGAGGACTTTAAGGGTTAC | ATGTCTGGGTCTTGGTTC |
проточной цитометрии анализ фенотипов Treg клеток
РВМС обрабатывали с помощью или без Tg (100 мкг/мл) в течение 3 дней.Затем клетки промывали и окрашивали PerCP-Cyanine5.5-анти-CD4, PE-анти-CD25 и APC-анти-FOXP3. Клетки анализировали с использованием FACS Canto™ II (BD Biosciences).
Статистический анализ
Статистический анализ был выполнен с использованием программного обеспечения SPSS 16.0 (SPSS, Inc.). Различия между двумя группами анализировали с помощью теста Стьюдента t . Взаимосвязь между уровнями Tg в крови и функциональностью Treg-клеток анализировали с помощью множественной линейной регрессии. Различия в функциональности Treg у одного человека анализировали с помощью парного теста Стьюдента t -test.Результаты были представлены как среднее ± sem или как медиана (IQR), а значение P < 0,05 считалось статистически значимым.
Результаты
Взаимосвязь функций Трег и уровней Тг в периферической крови
Одновременно выявлены функции Трег и уровней Тг в периферической крови у 30 больных с доброкачественными узлами щитовидной железы. Линейный регрессионный анализ показал, что уровень ТГ отрицательно коррелировал с ингибирующей функцией Трег в периферической крови ( R = -0.398, P = 0,03, ). Эта связь оставалась значимой при половой принадлежности; возраст; уровни ТТГ, FT3, FT4 и TG-Ab; размер и количество узлов, а также объем щитовидной железы были включены в пошаговый множественный регрессионный анализ (стандартизированный β = -0,398, P = 0,03). Мы также сравнили функцию Treg в группах с высоким (Tg >77 мкг/л, в соответствии с нормальным диапазоном) и нормальным (Tg ≤77 мкг/л) Tg и обнаружили значительное снижение функции Tregs в группе с высоким Tg ( 11.4 ± 3,9% против 27,5 ± 3,5%, P < 0,05, ). Клинические характеристики пациентов в двух группах показаны на рис., а уровни антител к рецептору тиротрофина (TR-Ab), TPO-Ab и Tg-Ab были несколько выше в группе с высоким уровнем Tg, чем в группе с нормальным Tg, хотя уровни этих антител в двух группах были в пределах нормы. Более того, размер и количество узлов, а также объем щитовидной железы в двух группах были одинаковыми ( P > 0,05 для всех, ).
Взаимосвязь между уровнями Tg в крови и функцией Treg-клеток.(A) Измерены концентрации Tg в крови у 30 пациентов с доброкачественными узлами щитовидной железы. Treg от этих пациентов культивировали совместно с CD4 + CD25 — Т-клетками (Teffs) в соотношении 1:10 и определяли их иммуномодулирующую функцию. Ингибирующую функцию Treg анализировали с использованием скорости ингибирования (%) пролиферации Teffs и рассчитывали по уравнению: ((пролиферация Teffs - пролиферация Teffs плюс Treg)/скорость пролиферации только Teffs) × 100%. Корреляцию между концентрацией Tg и степенью ингибирования (%) пролиферации Teffs (представляющую функцию клеток Treg) анализировали с помощью линейной регрессии.(B) Пациенты были разделены на группу с высоким уровнем Tg (Tg >77 мкг/л) и нормальную группу (Tg≤77 мкг/л). Функцию Tregs сравнивали между двумя группами. * P < 0,05.
Таблица 2
Клиническая характеристика больных с доброкачественными узлами щитовидной железы.
| Нормальная Тд группы | высокой Тд группы | Р значение | Нормальный диапазон | |||
|---|---|---|---|---|---|---|
| н | 21 | 9 | — | |||
| Пол (мужчины, %) | 23.8 | 2 | 22.2 | 1.000 | — | — |
| Возраст (год) | 49,0 ± 2.4 | 52.7 ± 43 | — | |||
| TSH (MU / L) | 2,1 ± 0,2 | 2.0 ± 0.3 | 0.770 | 0.35-4.94 | ||
| FT3 (PMOL / L) | 4,4 ± 0,1 | 4,0 ± 0,3 | 0,161 | 0.161 | 2.63-5.70 | |
| FT4 (PMOL / L) | 15,7 ± 0,4 | 15.5 ± 1 | 0,792 | 9.0-19.0 | 9.0-19.0 | |
| Tr-AB (IU / L) | <0.3 | 0.3 (0,4, 0,5) | — | — | <1,75 | |
| TPO-AB ( IU / L) | 5.0 (5.0, 7.7) | 7.1 (5.0, 12.7) | 0.255 | <34.0 | <34.0 | |
| 11.2 (10.0, 20.4) | 21.3 (11,3, 24,9) | 0,095 | <115,0 | |||
| Размер узла (мм) | 17.9 ± 4.1 | 20.9 ± 6.8 | 0,695 | — | ||
| Узел № | 1,8 ± 0,1 | 1,8 ± 0,1 | 0,1 | — | ||
| Объем щитовидной железы (мл) | 11.00 ± 1,2 | 38.59 ± 23.45 | 0.274 | Самки <18 мл мужской <25 мл |
ингибирующие функции и доля щитовидной железы
Уровни TG и соотношение TG до общего белка в фолликулярной жидкости щиты значительно выше, чем в периферической крови ( P < 0.001, ). Мы обнаружили, что FOXP3 + Treg были сконцентрированы в нескольких фолликулах щитовидной железы (11). Доля FOXP3 + Treg среди CD4 + Т-клеток в ткани щитовидной железы была выше, чем в периферической крови ( P < 0,01, ). Мы задались вопросом, может ли повышенный уровень ТГ повлиять на функцию Трег в щитовидной железе. Thyroid Treg совместно культивировали с Teffs периферической крови того же пациента в течение 3 дней в различных соотношениях (1:2, 1:4 и 1:8). В качестве контроля тестировали функцию Tregs периферической крови.Результаты показали, что ингибирующая функция Treg щитовидной железы была слабее, чем Treg периферической крови ( P < 0,01 и ).
ТГ и Трег в ткани щитовидной железы. Ткани щитовидной железы были взяты у семи пациентов, перенесших операцию по поводу доброкачественных узлов щитовидной железы. Концентрацию Тг (А) и отношение Тг/общий белок в тиреоидной фолликулярной жидкости и периферической крови определяли с помощью хемилюминесцентного иммунометрического анализа. (B) Иммунофлуоресцентная микроскопия нормальных срезов щитовидной железы.DAPI использовали для маркировки ядерной ДНК, а FOXP3 использовали для маркировки Treg. Оригинальное увеличение ×200. (C) Мононуклеарные клетки щитовидной железы окрашивали анти-CD4-PerCP-Cyanine5.5, анти-CD25-PE и анти-FOXP3-APC, а также РВМС. Долю клеток CD4 + CD25 + FOXP3 + в популяции Т-клеток CD4 + определяли методом проточной цитометрии. Эксперимент был проведен семь раз независимо друг от друга. ** P < 0,01.
Подавляющая функциональность Treg щитовидной железы.(A) Ткани щитовидной железы были взяты у шести пациентов, перенесших операцию по поводу доброкачественных узлов щитовидной железы. Thyroid Tregs совместно культивировали с эффекторными Т-клетками периферической крови (Teffs, CD4 + CD25 — Т-клетками) в различных соотношениях (1:2, 1:4 и 1:8) в течение 3 дней. Teffs метили CFSE и анализировали с помощью проточной цитометрии. (B) Ингибирующую функцию Treg анализировали с использованием степени ингибирования (%) пролиферации Teffs и рассчитывали по уравнению: ((пролиферация Teffs - пролиферация Teffs плюс Treg)/скорость пролиферации только Teffs) × 100%.Эксперимент проводился независимо шесть раз.
Влияние Tg на функцию Treg
Для определения влияния Tg на функцию Treg, Treg и Teff из периферической крови здоровых доноров совместно культивировали в течение 3 дней в различных соотношениях (1:2, 1: 4 и 1:8) с разными концентрациями Tg (). Мы обнаружили, что высокая концентрация Tg (100 мкг/мл) значительно подавляла ингибирующую функцию Treg по сравнению с контролем ( P < 0,05). И наоборот, низкая концентрация Tg (1 мкг/мл) способствовала ингибирующей функции Treg по сравнению с контролем ( P < 0.01 с Treg/Teff = 1/2 и P < 0,05 с Treg/Teff = 1/4 и 1/8, ). Для дальнейшего изучения основных механизмов действия Tg на функцию Treg мы выделили Tregs из периферической крови здоровых доноров и обрабатывали их различными концентрациями Tg (0, 0,1, 1, 10 и 100 мкг/мл) в течение 3 дней. . Мы обнаружили, что низкая концентрация Tg (1 мкг/мл) значительно стимулировала экспрессию мРНК FOXP3 , TGF-β и IL-10 ; P для всех был <0.01 (). Однако более высокие концентрации Tg (100 мкг/мл) ингибировали экспрессию мРНК FOXP3 , TGF-β и IL-10 ( P < 0,01) (). Чтобы изучить прямое влияние Tg на пролиферацию Teffs, мы также добавили 100 мкг/мл Tg к Teffs без Treg. Скорость пролиферации Teff в группе 100 мкг/мл Tg и пустой группе составила 56,2 ± 6,8% против 65,7 ± 9,1% соответственно, P = 0,055.
Двунаправленные эффекты Tg на функцию клеток Treg.(A) Tregs были выделены из периферической крови здоровых доноров и совместно культивированы с CD4 + CD25 — Т-клетками, меченными CFSE в различных соотношениях (1:2, 1:4 и 1:8), и одновременно обработаны с ТГ в различных концентрациях (0, 0,1, 1, 10 и 100 мкг/мл) в течение 3 дней. К культурам также добавляли антитела против CD3 человека (5 × 10 -8 мкмоль/л) и антитела против CD28 человека (2,27× 10 -8 мкмоль/л). Скорость пролиферации Teffs анализировали с помощью проточной цитометрии.(B) Ингибирующая функция Treg, представленная степенью ингибирования (%) пролиферации Teffs, рассчитывалась с использованием уравнения: ((пролиферация Teffs - пролиферация Teffs плюс Treg)/скорость пролиферации только Teffs) × 100%. Эксперимент проводился независимо 11 раз. * P < 0,05, ** P < 0,01.
Влияние Tg на FOXP3 и экспрессию цитокинов в Treg. РВМС выделяли из периферической крови здоровых доноров и инкубировали с различными концентрациями Tg (0, 0.1, 1, 10 и 100 мкг/мл) в течение 3 дней. Затем Treg выделяли с помощью MACS, и уровни экспрессии мРНК (A) FOXP-3 , (B) TGF-β и (C) IL-10 определяли с помощью ПЦР в реальном времени. Эксперимент проводили не менее трех раз независимо друг от друга. ** P < 0,01.
Обсуждение
В настоящем исследовании мы обнаружили коррелированную дисфункцию Treg с уровнем Tg у пациентов с доброкачественными узлами щитовидной железы и значительно сниженную функцию Treg в группе с высоким уровнем Tg (Tg >77 мкг/л) по сравнению с нормальным Группа ТГ.Уровни Tg в сыворотке могут быть повышены при большинстве пролиферативных заболеваний щитовидной железы (5, 30), и было показано, что количественные и/или функциональные нарушения Treg участвуют в патогенезе AITD у людей (18, 23, 31, 32). Механизм такой высокой заболеваемости AITD может быть связан с высоким уровнем Tg, который нарушает функцию Treg в узлах щитовидной железы и раке.
Мы также подтвердили, что высокие уровни Tg могут влиять на функцию Treg in vitro со снижением экспрессии FOXP3, IL-10 и TGF-β.FOXP3 был не только молекулярным маркером и фактором спецификации клеточной линии для Treg, но также имел решающее значение для регуляторной активности Treg (33). Более высокие уровни экспрессии FOXP3 подавляют активность нерегуляторных Т-клеток у грызунов (34). У людей мутации в гене FOXP3 связаны с дефицитом Treg, вызывая тяжелое системное аутоиммунное заболевание, называемое иммунной дисрегуляцией, полиэндокринопатией, энтеропатией и синдромом, сцепленным с Х-хромосомой (35). IL-10 и TGF-β являются растворимыми факторами, которые экспрессируются Treg, и они оказывают прямое супрессивное действие на Teffs (36, 37).Высокие уровни Tg, влияющие на функцию Treg, могут быть связаны с ингибирующим действием Tg на экспрессию FOXP3, IL-10 и TGF-β в Treg. И наоборот, низкие уровни Tg могут улучшать функцию Treg и стимулировать экспрессию мРНК FOXP3, TGF-β и IL-10. Предыдущие исследования показали, что у 100% мышей CBA/J развился тиреоидит с положительными Tg-Ab при внутривенном введении высоких концентраций Tg (100 мкг). один раз (17), но только у 17% мышей развился тиреоидит после инъекции низкой концентрации ТГ (40 мкг в день) в течение 10 дней (38).Ни у одной из мышей не развился тиреоидит, когда им вводили низкие концентрации ТГ (20 мкг в день) и ТТГ (0,25 МЕ в день) (38). Результаты этих исследований могут быть связаны с влиянием различных концентраций Tg на Treg.
Хотя высокие концентрации Tg подавляли функцию Treg-клеток, низкие концентрации оказывали противоположный эффект in vitro , что свидетельствует о том, что Tg может по-разному регулировать функцию Treg-клеток в зависимости от того, находится ли он в ткани щитовидной железы или в периферической крови.Двунаправленные эффекты Tg на Treg-клетки были аналогичны эффектам Tg на рост фолликулярных эпителиальных клеток щитовидной железы (39, 40). Индукция роста клеток щитовидной железы отмечалась только при более низких концентрациях ТГ, тогда как ингибирование роста клеток и функции фолликулов индуцировалось в зависимости от дозы при более высоких концентрациях ТГ. Сузуки и др. . предположили, что за эту двухфазную активность в росте клеток щитовидной железы ответственны разные системы распознавания, а не два разных домена белка Tg (39).
ТГ продуцируется исключительно фолликулярными клетками щитовидной железы, и концентрация ТГ в щитовидной железе намного выше, чем в периферической крови, особенно у пациентов с узлами щитовидной железы. Настоящее исследование показало, что иммунорегуляторная функция Treg в ткани щитовидной железы была значительно ниже, чем в периферической крови. Среди пациентов с узлами щитовидной железы лишь небольшое число лиц склонны к развитию АИТ. Должен существовать механизм для поддержания иммунного гомеостаза в щитовидной железе.Хотя функция Tregs уменьшилась, доля Tregs в щитовидной железе увеличилась. Повышенная доля Tregs могла компенсировать снижение функции Tregs. Определенные факторы, такие как дефекты генов, вирусная инфекция, потребление йода, стресс или разрушение фолликулов щитовидной железы, вызванное узлами щитовидной железы (например, у пациентов с высоким уровнем ТГ в настоящем исследовании) и раком, могут привести к повышению уровня ТГ (30). , 41, 42). Мы предполагаем, что если концентрация Tg будет увеличиваться до уровней выше, чем те, которые могут быть уравновешены компенсаторным механизмом у некоторых пациентов с узлами щитовидной железы, иммунный гомеостаз может нарушиться и может развиться AITD.
В заключение, мы впервые обнаружили, что высокий уровень ТГ может нарушать функцию Трег у пациентов с узлами щитовидной железы, что может объяснить высокую частоту ГТ у таких пациентов. Механизмы дисфункции Treg могут быть связаны с ингибирующим действием Tg на экспрессию FOXP3, TGF-β и IL-10. Настоящее исследование дает новый взгляд на лечение узлов щитовидной железы, особенно тех, которые возникают с повышенным уровнем ТГ.
Заявление об интересах
Авторы заявляют об отсутствии конфликта интересов, который мог бы быть воспринят как наносящий ущерб беспристрастности опубликованного исследования.
Финансирование
Эта работа была поддержана Национальным фондом естественных наук Китая (номер гранта 81570710), Национальным фондом естественных наук провинции Цзянсу (номер гранта SBK2015042970) и Научным фондом Бюро общественного здравоохранения Нанкина (номер гранта ZKX15026 и YKK16137) .
Благодарности
Авторы выражают благодарность д-ру Bang-shun He (Центральная лаборатория Первой больницы Нанкина) за помощь в проведении проточной цитометрии и Xiu-ping Wang (Отделение эндокринологии Первой больницы Нанкина) за сбор образцов крови.
Ссылки
1. Durante C, Grani G, Lamartina L, Filetti S, Mandel SJ, Cooper DS. Диагностика и лечение узлов щитовидной железы: обзор. ДЖАМА 2018. 319 914–924. (10.1001/jama.2018.0898) [PubMed] [CrossRef] [Google Scholar]2. Раго Т., Чиовато Л., Агини-Ломбарди Ф., Грассо Л., Пинчера А., Витти П. Непальпируемые узлы щитовидной железы в пограничной йододефицитной зоне: обнаружение с помощью УЗИ и последующее наблюдение. Журнал эндокринологических исследований 2001. 24 770–776. (10.1007/BF03343926) [PubMed] [CrossRef] [Google Scholar]3.Фишер С.Б., Перье Н.Д. Случайный узел щитовидной железы. CA: Раковой журнал для клиницистов 2018. 68 97–105. (10.3322/caac.21447) [PubMed] [CrossRef] [Google Scholar]4. Burch HB, Burman KD, Cooper DS, Hennessey JV, Vietor NO. Обзор клинических моделей лечения узлов щитовидной железы, проведенный в 2015 г. Журнал клинической эндокринологии и обмена веществ 2016. 101 2853–2862. (10.1210/jc.2016-1155) [PubMed] [CrossRef] [Google Scholar]5. Джурика С., Джорджевич Д., Синадинович Дж. Долгосрочное наблюдение за уровнями тиреоглобина в сыворотке и его клиническими последствиями у субъектов после хирургического удаления «холодного» узла щитовидной железы.Экспериментальная и клиническая эндокринология 1992. 99 137–142. (10.1055/s-0029-1211155) [PubMed] [CrossRef] [Google Scholar]6. Du Y, Gao YH, Feng ZY, Meng FG, Fan LJ, Sun DJ. Сывороточный тиреоглобулин — чувствительный биомаркер йодного статуса питания и влияния на аномалии и заболевания щитовидной железы у взрослого населения. Биомедицинские науки и науки об окружающей среде 2017. 30 508–516. (10.3967/bes2017.067) [PubMed] [CrossRef] [Google Scholar]7. Кескин М., Савас-Эрдеве С., Айкан З. Сосуществование узла щитовидной железы и рака щитовидной железы у детей и подростков с тиреоидитом Хашимото: одноцентровое исследование.Гормональные исследования в педиатрии 2016. 85 181–187. (10.1159/000443143) [PubMed] [CrossRef] [Google Scholar]8. Руджери Р.М., Кампенни А., Синдони А., Балдари С., Тримарчи Ф., Бенвенга С. Ассоциация автономно функционирующих узлов щитовидной железы с тиреоидитом Хашимото: исследование большой группы пациентов. Экспериментальная и клиническая эндокринология и диабет 2011. 119 621–627. (10.1055/s-0031-1279705) [PubMed] [CrossRef] [Google Scholar]9. Тримболи П., Треглия Г., Джованелла Л. Предоперационное измерение тиреоглобулина в сыворотке для прогнозирования злокачественных новообразований щитовидной железы: систематический обзор.Гормоны и метаболические исследования 2015. 47 247–252. (10.1055/s-0034-1395517) [PubMed] [CrossRef] [Google Scholar]10. Kim HJ, Mok JO, Kim CH, Kim YJ, Kim SJ, Park HK, Byun DW, Suh K, Yoo MH. Предоперационный тиреоглобулин сыворотки и изменения тиреоглобулина сыворотки во время супрессии ТТГ независимо предсказывают фолликулярную карциному щитовидной железы в узлах щитовидной железы с цитологическим диагнозом фолликулярного поражения. Эндокринные исследования 2017. 42 154–162. (10.1080/07435800.2016.1262395) [PubMed] [CrossRef] [Google Scholar]11.Азизи Г., Келлер Дж. М., Льюис М., Пайпер К., Пуэтт Д., Ривенбарк К. М., Мальчофф К. Д. Ассоциация тиреоидита Хашимото с раком щитовидной железы. Эндокринный рак 2014. 21 845–852. (10.1530/ERC-14-0258) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]12. Гуль К., Дирикоч А., Кияк Г., Эрсой П.Е., Уграс Н.С., Эрсой Р., Чакир Б. Связь между карциномой щитовидной железы и тиреоидитом Хашимото: ультразвуковые и гистопатологические характеристики злокачественных узлов. Щитовидная железа 2010. 20 873–878.(10.1089/thy.2009.0118) [PubMed] [CrossRef] [Google Scholar] 13. Азизи Г., Мальхофф КД. Аутоиммунное заболевание щитовидной железы: фактор риска рака щитовидной железы. Эндокринная практика 2011. 17 201–209. (10.4158/EP10123.OR) [PubMed] [CrossRef] [Google Scholar] 15. Луепрасицакул В., Алекс С., Фанг С.Л., Аппель М.С., Браверман Л.Е. Тиреоглобулин-индуцированный лимфоцитарный тиреоидит у двух подлиний крыс BB/Wor. Аутоиммунитет 1991. 9 55–60. (10.3109/0897124) [PubMed] [CrossRef] [Google Scholar] 16. Аллен Э.М., Тупари Дж.Н.Тиреоглобулин-реактивные Т-лимфоциты у склонных к тиреоидиту крыс BB/Wor. Журнал эндокринологических исследований 1995. 18 45–49. (10.1007/BF03349697) [PubMed] [CrossRef] [Google Scholar] 17. Моррис Г.П., Браун Н.К., Конг Ю.К. Существующие в природе регуляторные Т-клетки CD4(+)CD25(+)Foxp3(+) необходимы для устойчивости к экспериментальному аутоиммунному тиреоидиту, индуцированному либо экзогенным, либо эндогенным аутоантигеном. Журнал аутоиммунитета 2009. 33 68–76. (10.1016/j.jaut.2009.03.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]18.Нагаяма Й, Хориэ И, Сайто О, Накахара М, Абиру Н. CD4+CD25+ природные регуляторные Т-клетки, а не лимфопения, играют роль в патогенезе йод-индуцированного аутоиммунного тиреоидита у мышей NOD-h3h5. Журнал аутоиммунитета 2007. 29 195–202. (10.1016/j.jaut.2007.07.008) [PubMed] [CrossRef] [Google Scholar] 19. Li C, Yuan J, Zhu YF, Yang XJ, Wang Q, Xu J, He ST, Zhang JA. Дисбаланс Th27/Treg при различных подтипах аутоиммунных заболеваний щитовидной железы. Клеточная физиология и биохимия 2016.40 245–252. (10.1159/000452541) [PubMed] [CrossRef] [Google Scholar] 20. Рамос-Леви А.М., Марасуэла М. Патогенез аутоиммунных заболеваний щитовидной железы: роль клеточных механизмов. Эндокринология и питание 2016. 63 421–429. (10.1016/j.endonu.2016.04.003) [PubMed] [CrossRef] [Google Scholar]21. Лю И, Тан С, Тянь Дж, Чжу С, Пэн Х, Руи К, Ван Ю, Мао С, Ма Дж, Лу Л. и другие. Дисбаланс клеток Th27/Treg и профиль GITRL у пациентов с тиреоидитом Хашимото. Международный журнал молекулярных наук 2014.15 21674–21686. (10.3390/ijms151221674) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Глик А.Б., Водзински А., Фу П., Левин А.Д., Вальд Д.Н. Нарушение регуляторной функции Т-клеток при аутоиммунных заболеваниях щитовидной железы. Щитовидная железа 2013. 23 871–878. (10.1089/thy.2012.0514) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23. Hu Y, Tian W, Zhang LL, Liu H, Yin GP, He BS, Mao XM. Функция регуляторных Т-клеток улучшилась под действием дексаметазона при болезни Грейвса. Европейский журнал эндокринологии 2012.166 641–646. (10.1530/EJE-11-0879) [PubMed] [CrossRef] [Google Scholar] 25. Сакагучи С. Возникающие в природе Foxp3-экспрессирующие CD25+CD4+ регуляторные Т-клетки с иммунологической толерантностью к своим и чужим. Иммунология природы 2005. 6 345–352. (10.1038/ni1178) [PubMed] [CrossRef] [Google Scholar]26. Романьяни С. Регуляторные Т-клетки: какая роль в патогенезе и лечении аллергических заболеваний? аллергия 2006. 61 3–14. (10.1111/j.1398-9995.2006.01005.x) [PubMed] [CrossRef] [Google Scholar]27. Китайское общество эндокринологов, 2012 г. Руководство по ведению пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы.Китайский журнал эндокринологии и обмена веществ 28 779–797. (10.3760/cma.j.issn.1000-6699.2012.10.002) [CrossRef] [Google Scholar]28. Мао XM, Li HQ, Li Q, Li DM, Xie XJ, Yin GP, Zhang P, Xu XH, Wu JD, Chen SW. и другие. Профилактика рецидива болезни Грейвса путем внутритиреоидной инъекции дексаметазона. Журнал клинической эндокринологии и обмена веществ 2009. 94 4984–4991. (10.1210/jc.2009-1252) [PubMed] [CrossRef] [Google Scholar]29. Марасуэла М., Гарсия-Лопес М.А., Фигероа-Вега Н., де ла Фуэнте Х., Альварадо-Санчес Б., Монсивайс-Уренда А., Санчес-Мадрид Ф., Гонсалес-Амаро Р.Регуляторные Т-клетки при аутоиммунном заболевании щитовидной железы человека. Журнал клинической эндокринологии и обмена веществ 2006. 91 3639–3646. (10.1210/jc.2005-2337) [PubMed] [CrossRef] [Google Scholar]30. Окамото Т., Канбэ М., Иихара М., Ямадзаки К., Окамото Дж., Ямасита Т., Ито Й., Каваками М., Обара Т. Измерение сывороточного тиреоглобулина у пациентов с фолликулярным узлом щитовидной железы: его диагностическое значение. Эндокринный журнал 1997. 44 187–193. (10.1507/endocrj.44.187) [PubMed] [CrossRef] [Google Scholar] 31. Сайто О, Нагаяма Ю.Регуляция гипертиреоза Грейвса с помощью встречающихся в природе регуляторных Т-клеток CD4+CD25+ в мышиной модели. Эндокринология 2006. 147 2417–2422. (10.1210/en.2005-1024) [PubMed] [CrossRef] [Google Scholar]32. Wei WZ, Jacob JB, Zielinski JF, Flynn JC, Shim KD, Alsharabi G, Giraldo AA, Kong YC. Одновременная индукция противоопухолевого иммунитета и аутоиммунного тиреоидита у мышей с истощением регуляторных Т-клеток CD4+ CD25+. Исследования рака 2005. 65 8471–8478. (10.1158/0008-5472.CAN-05-0934) [PubMed] [CrossRef] [Google Scholar]33.Фонтено Д.Д., Гэвин М.А., Руденски А.Ю. Foxp3 программирует развитие и функцию CD4+CD25+ регуляторных Т-клеток. Иммунология природы 2003. 4 330–336. (10.1038/ni904) [PubMed] [CrossRef] [Google Scholar]34. Сакагути С., Ямагути Т., Номура Т., Оно М. Регуляторные Т-клетки и иммунная толерантность. Клетка 2008. 133 775–787. (10.1016/j.cell.2008.05.009) [PubMed] [CrossRef] [Google Scholar] 35. Bennett CL, Christie J, Ramsdell F, Brunkow ME, Ferguson PJ, Whitesell L, Kelly TE, Saulsbury FT, Chance PF, Ochs HD.Иммунная дисрегуляция, полиэндокринопатия, энтеропатия, Х-сцепленный синдром (IPEX) обусловлены мутациями FOXP3. Генетика природы 2001. 27 20–21. (10.1038/83713) [PubMed] [CrossRef] [Google Scholar] 36. Аннакер О., Ассеман С., Рид С., Поури Ф. Интерлейкин-10 в регуляции Т-клеточного колита. Журнал аутоиммунитета 2003. 20 277–279. (10.1016/S0896-8411(03)00045-3) [PubMed] [CrossRef] [Google Scholar]37. Джоэтам А., Такеда К., Таубе С., Мияхара Н., Мацубара С., Коя Т., Ра Ю.Х., Дахама А., Гельфанд Э.В.Естественная регуляция легочных CD4(+)CD25(+) T-клеток аллергических реакций дыхательных путей зависит от индукции IL-10 TGF-бета. Журнал иммунологии 2007. 178 1433–1442 гг. (10.4049/jimmunol.178.3.1433) [PubMed] [CrossRef] [Google Scholar]38. Конг Ю.М., Браун Н.К., Моррис Г.П., Флинн Д.К. Существенная роль циркулирующего тиреоглобулина в поддержании доминирования естественной регуляторной функции Т-клеток для предотвращения аутоиммунного тиреоидита. Гормоны и метаболические исследования 2015. 47 711–720. (10.1055/s-0035-1548872) [PubMed] [CrossRef] [Google Scholar]39.Судзуки К., Кавасима А., Йошихара А., Акама Т., Сью М., Йошида А., Кимура Х.Дж. Роль тиреоглобулина в ауторегуляции функции и роста фолликулов щитовидной железы с отрицательной обратной связью. Журнал эндокринологии 2011. 209 169–174. (10.1530/JOE-10-0486) [PubMed] [CrossRef] [Google Scholar]40. Ногучи Ю., Харии Н., Джулиани С., Тацуно И., Судзуки К., Кон Л.Д. Тиреоглобулин (Tg) индуцирует рост клеток щитовидной железы в зависимости от концентрации с помощью механизма, отличного от стимуляции тиреотропином/цАМФ. Коммуникации в области биохимических и биофизических исследований 2010.391 890–894. (10.1016/j.bbrc.2009.11.158) [PubMed] [CrossRef] [Google Scholar]41. Стефан М., Якобсон Э.М., Хубер А.К., Гринберг Д.А., Ли К.В., Скрабанек Л., Концепшн Э., Фадлалла М., Хо К., Томер Ю. Новый вариант промотора тиреоглобулина запускает аутоиммунитет щитовидной железы посредством эпигенетического интерферон-альфа-модулируемого механизма. Журнал биологической химии 2011. 286 31168–31179. (10.1074/jbc.M111.247510) [PMC free article] [PubMed] [CrossRef] [Google Scholar]Повышенный уровень тиреоглобулина связан с дисфункцией регуляторных Т-клеток у пациентов с узлами щитовидной железы
Endocr Connect.2019 апрель; 8(4): 309–317.
, 1, 2, * , * , * * , 3 , 1 , 1 , 1 , 4 , 1 , 1 , 1 , 2 , 2 9 9 и 1Yun Hu
1 1 1 Департамент эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай 2 Отдел иммунологии, Нанкин Медицинский университет , Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Медицинский университет Нанкина, Цзянсу, Китай 3 Первое отделение хирургии щитовидной железы и молочной железы, Нанкин Университет, Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай 1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай На Ли
Пэн Цзян
Лян Ченг
Бо Дин
Сяо-Мей Лю
Yun-Qing Zhu
1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
Bing-076 li Liu1 Отделение эндокринологии Первой больницы Нанкина Медицинского университета Нанкина, Цзянсу, Китай
Xin Cao
1 Отделение эндокринологии Первой больницы Нанкина Медицинского университета Нанкина, Цзянсу03 90 90
2 Кафедра иммунологии, Нанкинский медицинский университет, Цзянсу, Китай
Xi ao-Ming Mao
1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
1 Отделение эндокринологии, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
Отделение иммунологии, Нанкинский медицинский университет, Цзянсу, Китай3 Отделение хирургии щитовидной железы и молочной железы, Первая больница Нанкина, Нанкинский медицинский университет, Цзянсу, Китай
4 Отделение эндокринологии, больница Уси, филиал Нанкинского китайского университета Medicine, Jiangsu, China
*(Y Hu и N Li внесли равный вклад в эту работу)
Поступила в редакцию 11 февраля 2019 г.; Принято 1 марта 2019 г.
Эта статья была процитирована другими статьями в PMC.Abstract
Объектив
Узлы щитовидной железы обычно сопровождаются повышенным уровнем тиреоглобулина (ТГ) и аутоиммунными заболеваниями щитовидной железы (АЗИТ). Однако взаимосвязь между Tg и AITD до конца не изучена. Дисфункция регуляторных Т-клеток (Treg) играет важную роль в развитии АИТ. Мы стремились оценить влияние Tg на функцию Treg у пациентов с узлами щитовидной железы.
Методы
Оценивались уровни Tg и функции Treg в периферической крови и тканях щитовидной железы у пациентов с узлами щитовидной железы из Первой больницы Нанкина.Эффекты Tg на функцию Tregs здоровых доноров также оценивались 90–113 in vitro 90–114 . Функцию Treg определяли как ингибирующее действие Treg на скорость пролиферации эффекторных Т-клеток (CD4 + CD25 — Т-клеток).
Результаты
Уровень Tg в периферической крови отрицательно коррелировал с ингибирующей функцией Treg ( R = 0,398, P = 0,03), и функция Tregs значительно снизилась в группе с высоким уровнем Tg (Tg >77 мкг/ L) по сравнению с группой с нормальным Tg (11.4 ± 3,9% против 27,5 ± 3,5%, P < 0,05). По сравнению с периферической кровью функция Treg в щитовидной железе значительно снизилась ( P < 0,01), но доля Treg FOXP3 + в щитовидной железе увеличилась ( P < 0,01). Высокая концентрация Tg (100 мкг/мл) ингибировала функцию Treg и подавляла экспрессию мРНК FOXP3 , TGF-β и IL-10 в Treg in vitro .
Выводы
Повышенный уровень ТГ может нарушать функцию Трег, что может увеличить риск АИТ у пациентов с узлами щитовидной железы.
Ключевые слова: тиреоглобулин, регуляторные Т-клетки, узел щитовидной железы
Введение
Узлы щитовидной железы встречаются очень часто; до 65% населения в целом имеют хотя бы один узел щитовидной железы (1), но у большинства из них симптомы отсутствуют, и продолжительность жизни не изменяется (2). Недавние исследования были сосредоточены в основном на связи между узлами щитовидной железы и раком щитовидной железы (3, 4). Узлы щитовидной железы обычно сопровождаются повышением уровня тиреоглобулина (ТГ) (5, 6) и аутоиммунными заболеваниями щитовидной железы (АИТЗ), особенно тиреоидитом Хашимото (ГТ) (7, 8).Интересно, что уровни ТГ у больных раком щитовидной железы всегда значительно выше, чем у больных с доброкачественными узлами щитовидной железы (9, 10). При этом частота ГТ у больных раком щитовидной железы также была выше, чем у больных с доброкачественными узлами щитовидной железы (11, 12, 13). Эти исследования подразумевают, что могут быть некоторые взаимодействия между повышенным уровнем ТГ и ГТ.
Tg составляет примерно 75–80% общего белка щитовидной железы и служит предшественником гормонов щитовидной железы (14).Предыдущие исследования показали, что Tg может индуцировать лимфоцитарный тиреоидит, повышая титры Tg-Ab у крыс BB/Wor (15) путем активации Т-клеток (16). Кроме того, в ряде исследований подчеркивается важная роль регуляторных Т-клеток (Treg) в профилактике тиреоидита на животных моделях. Истощение Tregs позволило вызвать тиреоидит мышиным Tg у традиционно устойчивых мышей, а также йодидом у мышей NOD-h3h5 (17, 18). Кроме того, клинические исследования показали, что числовые и/или функциональные нарушения Treg были обнаружены у пациентов с АГ (19, 20, 21, 22, 23).Мы задались вопросом, может ли повышенный уровень Tg нарушать функцию Tregs.
Tregs являются важными подтипами Т-клеток, которые участвуют в модуляции иммунного ответа и играют важную роль в профилактике аутоиммунных заболеваний (24, 25). Естественные Treg (nTreg) развиваются в тимусе и составляют примерно 5–10% от общего числа периферических CD4 + Т-клеток (25). Они характеризуются высокой экспрессией CD25 и транскрипционного фактора forkhead box P3 (FOXP3).Tregs могут подавлять пролиферацию и активность аутореактивных Т-клеток (26).
Целью нашего исследования было оценить влияние Tg на функцию Treg и понять роль Tg в индукции тиреоидита у пациентов с узлами щитовидной железы.
Материалы и методы
Реагенты
Tg-белок человека был приобретен у Fitzgerald Industries International (Актон, Массачусетс, США), чистота >98% подтверждена с помощью SDS-PAGE. Антитела против человеческого CD3 (кат. № 555336) и против человеческого CD28 (кат. № 555725) были приобретены у eBioscience.Антитела к CD25 человека, конъюгированные с аллофикоцианином (APC) (кат. № 555434), конъюгированные с PerCP-Cyanine5.5 антитела к CD4 человека (кат. № 560650), конъюгированные с PE антитела к CD25 человека (кат. № 555432) и -человеческие антитела FOXP3 (Cat# 560045) были приобретены у BD Biosciences (Сан-Хосе, Калифорния, США), и все они были мышиного происхождения. Наборы для определения Tg были приобретены у Siemens Healthcare Diagnostics Inc.
Информация о пациенте и лабораторные методы
Кровь была собрана у здоровых доноров с нормальными уровнями свободного тироксина (FT4), тиреотропного гормона (TSH), антител к тиреопероксидазе (TPO-Ab). ) и антитело к тиреоглобулину (TG-Ab) для эксперимента in vitro .Исключались доноры с узлами щитовидной железы (по данным УЗИ), аутоиммунными заболеваниями, инфекциями или принимающие какие-либо лекарства. Кровь и нормальные ткани щитовидной железы, окружающие узел щитовидной железы или аденому, у пациентов, перенесших операцию на щитовидной железе, также собирали в Первой больнице Нанкина; они были подтверждены патологией. Показания к операции соответствуют Китайским рекомендациям по ведению пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы (2012 г.) (27). Помимо пациентов, перенесших операции на щитовидной железе, также собирали кровь у пациентов с доброкачественными узлами щитовидной железы, а диагнозы узлов подтверждали тонкоигольной аспирационной биопсией.Пациенты с узлами щитовидной железы были исключены, если у них было какое-либо системное заболевание или они принимали лекарства, которые могут повлиять либо на уровень ТГ, либо на иммунный баланс (например, инфекции и аутоиммунные заболевания). Биоэтический комитет Первой больницы Нанкина одобрил это исследование, и от каждого пациента и здорового донора было получено письменное информированное согласие.
Ткань щитовидной железы гомогенизировали и центрифугировали при 380 g в течение 10 мин. Затем собирали супернатант (фолликулярную жидкость щитовидной железы) для измерения уровней ТГ.Уровни Tg в крови и щитовидной железе измеряли с помощью хемилюминесцентных иммунометрических анализов (Elecsys TG II, Roche Diagnostics GmbH) на анализаторе Modular Analytics E170 (Roche Diagnostics GmbH), и нормальный референтный диапазон составлял 3,5–77 нг/мл, как описано в предыдущем исследовании. 6). Общее содержание белка в фолликулярной жидкости щитовидной железы и образцах плазмы измеряли с использованием набора для анализа белка BCA (Sigma Aldrich) в соответствии с инструкциями производителя. Объем щитовидной железы до операции был получен путем вычисления объемов обеих долей (доля (мл) = длина (см) × ширина (см) × глубина (см) × 0.479). Узлы и/или кистозные области были включены в объем щитовидной железы (референтные значения, 18 мл для женщин и 25 мл для пациентов мужского пола) (28).
Выделение Tregs периферической крови и щитовидной железы
Мононуклеарные клетки периферической крови (РВМС) выделяли с использованием центрифугирования в градиенте плотности Ficoll-Paque (Sigma Aldrich). Для выделения мононуклеарных клеток щитовидной железы образцы щитовидной железы гомогенизировали и пропускали через стальную сетку с размером пор 75 мкм, а затем выделяли мононуклеарные клетки с помощью центрифугирования Ficoll-Paque.После двукратной промывки 10 мл PBS клетки ресуспендировали в среде Roswell Park Memorial Institute (RPMI)-1640, содержащей пенициллин (80 Ед/мл), стрептомицин (1,38 × 10 -4 моль/л), l- глутамина (2,05 × 10 -3 моль/л), l-глюкозы (0,01 моль/л) и бикарбоната натрия (0,02 моль/л), с добавлением 10% эмбриональной бычьей сыворотки (FBS; Invitrogen).
Treg были выделены из мононуклеарных клеток с использованием набора для сортировки магнитно-активированных клеток человека (MACS) (Miltenyi Biotec).Эффекторные Т-клетки (Teffs, CD4+CD25- Т-клетки) также собирали после выделения Treg с помощью антитела к CD25. После разделения клетки ресуспендировали в 2 мл среды RPMI-1640 с добавлением 10% FBS. Чистоту периферической крови и Treg щитовидной железы проверяли с помощью проточной цитометрии, и было установлено, что чистота клеток постоянно превышает 95%.
Иммунофлуоресцентное окрашивание
Срезы ткани щитовидной железы, инкубированные с моноклональным кроличьим анти-FOXP3 (Cell Signaling Technology, разведение 1:500), затем инкубировали в течение 30 мин с антителами козьего антикроличьего иммуноглобулина, конъюгированными с Alexa-Fluor 488 (DAKO).DAPI (4′,6-диамино-2-фенилиндол, KEYGEN, Jiangsu, CN) использовали для мечения ядерной ДНК. Антитела соответствующего изотипа использовали в качестве отрицательного контроля. Меченые срезы визуализировали с помощью флуоресцентного микроскопа.
Функциональный анализ Treg
Основной функцией Treg было ингибирование пролиферации Teffs. Мы проверили функцию Treg, как описано ранее (23, 29): Treg (чистота >97%) культивировали с постоянным количеством клеток Teffs в различных соотношениях (Treg:Teffs = 1:2, 1:4 и 1:8). или 1:10) в среде, содержащей 10 % FBS, при 37°C и 5 % CO 2 .К культурам добавляли антитела против человеческого CD3 (5 × 10 -8 мкмоль/л) и против человеческого CD28 (2,27× 10 -8 мкмоль/л). Клетки одновременно обрабатывали Тг в разных концентрациях (0, 0,1, 1, 10 и 100 мкг/мл) и культивировали в течение 3 дней в 24-луночных планшетах (5 × 10 5 клеток/лунку). Thyroid Treg также совместно культивировали с гомологичными Teffs периферической крови. Для определения пролиферации клеток к суспензии Т-клеток в среде RPMI-1640 добавляли сукцинимидиловый эфир карбоксифлуоресцеина (CFSE; BD Biosciences, Сан-Хосе, Калифорния, США) в конечной концентрации 5× 10 -6 моль/л.Клетки инкубировали в течение 15 мин при 37°С, а затем обрабатывали АРС-анти-CD25 еще 30 мин при 4°С. Пролиферацию Т-клеток анализировали с использованием FACS Canto™ II (BD Biosciences). Степень ингибирования (%) рассчитывали по формуле: ((только пролиферация Teffs - пролиферация Teffs с Treg)/только пролиферация Teffs) × 100%.
Стимуляция РВМС с помощью Tg
Изолированные РВМС подсчитывали и культивировали в среде RPMI-1640 с добавлением 10% FBS при 37°C и 5% CO 2 .Добавляли различные концентрации Tg (0, 0,1, 1, 10 и 100 мкг/мл); затем клетки инкубировали в течение 3 дней. Как и в более ранних экспериментах, в лунки также добавляли антитела против человеческого CD3 (5 × 10 -8 мкмоль/л) и против человеческого CD28 (2,27× 10 -8 мкмоль/л). Через 3 дня Treg выделяли из мононуклеарных клеток с использованием набора MACS для человеческих Treg клеток, а затем выделяли РНК для дальнейшего анализа.
Выделение РНК и ПЦР в реальном времени
Клетки гомогенизировали в реагенте TRIzol (Sigma-Aldrich), и экстракцию РНК проводили с использованием реагента TaKaRa RNAiso (TaKaRa).Для обратной транскрипции кДНК синтезировали с использованием PrimeScipt™ RT Master Mix (TaKaRa). Эффективность ПЦР в реальном времени для каждой пары праймеров рассчитывали с использованием стандартных кривых, полученных путем серийного разведения кДНК из Treg. Последовательности праймеров показаны на . Реакции ПЦР проводили с использованием детектора последовательностей ABI PRISM 7500 (Applied Biosystems). Условия ПЦР были установлены следующим образом: начальный этап инкубации в течение 30 с при 95°С, затем 40 циклов по 5 с при 95°С и 34 с при 60°С. Нормализованные значения экспрессии для каждого транскрипта рассчитывали как количества мРНК FOXP3 , TGF-β и IL-10 по отношению к количеству мРНК β-ACTIN с использованием метода 2 -ΔΔCt .Все реакции проводили независимо не менее трех раз.
Таблица 1
Последовательности праймеров для ПЦР в реальном времени.
+ Джин| вперед (5′-3 ‘) | Обратный (5′-3′) | |
|---|---|---|
| β-актина | ATCTGCTGGAAGGTGGACAGCGA CCCAGCACAATGAAGATCAAGATCAT | |
| FOXP3 | GTGGCCCGGATGTGAGAAG | GGAGCCCTTGTCGGATGATG |
| TGF-β | AACGAACTGGCTGTCTGC | CCTCTGCTCATTCCGCTTAG |
| ИЛ-10 | GCTGGAGGACTTTAAGGGTTAC | ATGTCTGGGTCTTGGTTC |
проточной цитометрии анализ фенотипов Treg клеток
РВМС обрабатывали с помощью или без Tg (100 мкг/мл) в течение 3 дней.Затем клетки промывали и окрашивали PerCP-Cyanine5.5-анти-CD4, PE-анти-CD25 и APC-анти-FOXP3. Клетки анализировали с использованием FACS Canto™ II (BD Biosciences).
Статистический анализ
Статистический анализ был выполнен с использованием программного обеспечения SPSS 16.0 (SPSS, Inc.). Различия между двумя группами анализировали с помощью теста Стьюдента t . Взаимосвязь между уровнями Tg в крови и функциональностью Treg-клеток анализировали с помощью множественной линейной регрессии. Различия в функциональности Treg у одного человека анализировали с помощью парного теста Стьюдента t -test.Результаты были представлены как среднее ± sem или как медиана (IQR), а значение P < 0,05 считалось статистически значимым.
Результаты
Взаимосвязь функций Трег и уровней Тг в периферической крови
Одновременно выявлены функции Трег и уровней Тг в периферической крови у 30 больных с доброкачественными узлами щитовидной железы. Линейный регрессионный анализ показал, что уровень ТГ отрицательно коррелировал с ингибирующей функцией Трег в периферической крови ( R = -0.398, P = 0,03, ). Эта связь оставалась значимой при половой принадлежности; возраст; уровни ТТГ, FT3, FT4 и TG-Ab; размер и количество узлов, а также объем щитовидной железы были включены в пошаговый множественный регрессионный анализ (стандартизированный β = -0,398, P = 0,03). Мы также сравнили функцию Treg в группах с высоким (Tg >77 мкг/л, в соответствии с нормальным диапазоном) и нормальным (Tg ≤77 мкг/л) Tg и обнаружили значительное снижение функции Tregs в группе с высоким Tg ( 11.4 ± 3,9% против 27,5 ± 3,5%, P < 0,05, ). Клинические характеристики пациентов в двух группах показаны на рис., а уровни антител к рецептору тиротрофина (TR-Ab), TPO-Ab и Tg-Ab были несколько выше в группе с высоким уровнем Tg, чем в группе с нормальным Tg, хотя уровни этих антител в двух группах были в пределах нормы. Более того, размер и количество узлов, а также объем щитовидной железы в двух группах были одинаковыми ( P > 0,05 для всех, ).
Взаимосвязь между уровнями Tg в крови и функцией Treg-клеток.(A) Измерены концентрации Tg в крови у 30 пациентов с доброкачественными узлами щитовидной железы. Treg от этих пациентов культивировали совместно с CD4 + CD25 — Т-клетками (Teffs) в соотношении 1:10 и определяли их иммуномодулирующую функцию. Ингибирующую функцию Treg анализировали с использованием скорости ингибирования (%) пролиферации Teffs и рассчитывали по уравнению: ((пролиферация Teffs - пролиферация Teffs плюс Treg)/скорость пролиферации только Teffs) × 100%. Корреляцию между концентрацией Tg и степенью ингибирования (%) пролиферации Teffs (представляющую функцию клеток Treg) анализировали с помощью линейной регрессии.(B) Пациенты были разделены на группу с высоким уровнем Tg (Tg >77 мкг/л) и нормальную группу (Tg≤77 мкг/л). Функцию Tregs сравнивали между двумя группами. * P < 0,05.
Таблица 2
Клиническая характеристика больных с доброкачественными узлами щитовидной железы.
| Нормальная Тд группы | высокой Тд группы | Р значение | Нормальный диапазон | |||
|---|---|---|---|---|---|---|
| н | 21 | 9 | — | |||
| Пол (мужчины, %) | 23.8 | 2 | 22.2 | 1.000 | — | — |
| Возраст (год) | 49,0 ± 2.4 | 52.7 ± 43 | — | |||
| TSH (MU / L) | 2,1 ± 0,2 | 2.0 ± 0.3 | 0.770 | 0.35-4.94 | ||
| FT3 (PMOL / L) | 4,4 ± 0,1 | 4,0 ± 0,3 | 0,161 | 0.161 | 2.63-5.70 | |
| FT4 (PMOL / L) | 15,7 ± 0,4 | 15.5 ± 1 | 0,792 | 9.0-19.0 | 9.0-19.0 | |
| Tr-AB (IU / L) | <0.3 | 0.3 (0,4, 0,5) | — | — | <1,75 | |
| TPO-AB ( IU / L) | 5.0 (5.0, 7.7) | 7.1 (5.0, 12.7) | 0.255 | <34.0 | <34.0 | |
| 11.2 (10.0, 20.4) | 21.3 (11,3, 24,9) | 0,095 | <115,0 | |||
| Размер узла (мм) | 17.9 ± 4.1 | 20.9 ± 6.8 | 0,695 | — | ||
| Узел № | 1,8 ± 0,1 | 1,8 ± 0,1 | 0,1 | — | ||
| Объем щитовидной железы (мл) | 11.00 ± 1,2 | 38.59 ± 23.45 | 0.274 | Самки <18 мл мужской <25 мл |
ингибирующие функции и доля щитовидной железы
Уровни TG и соотношение TG до общего белка в фолликулярной жидкости щиты значительно выше, чем в периферической крови ( P < 0.001, ). Мы обнаружили, что FOXP3 + Treg были сконцентрированы в нескольких фолликулах щитовидной железы (11). Доля FOXP3 + Treg среди CD4 + Т-клеток в ткани щитовидной железы была выше, чем в периферической крови ( P < 0,01, ). Мы задались вопросом, может ли повышенный уровень ТГ повлиять на функцию Трег в щитовидной железе. Thyroid Treg совместно культивировали с Teffs периферической крови того же пациента в течение 3 дней в различных соотношениях (1:2, 1:4 и 1:8). В качестве контроля тестировали функцию Tregs периферической крови.Результаты показали, что ингибирующая функция Treg щитовидной железы была слабее, чем Treg периферической крови ( P < 0,01 и ).
ТГ и Трег в ткани щитовидной железы. Ткани щитовидной железы были взяты у семи пациентов, перенесших операцию по поводу доброкачественных узлов щитовидной железы. Концентрацию Тг (А) и отношение Тг/общий белок в тиреоидной фолликулярной жидкости и периферической крови определяли с помощью хемилюминесцентного иммунометрического анализа. (B) Иммунофлуоресцентная микроскопия нормальных срезов щитовидной железы.DAPI использовали для маркировки ядерной ДНК, а FOXP3 использовали для маркировки Treg. Оригинальное увеличение ×200. (C) Мононуклеарные клетки щитовидной железы окрашивали анти-CD4-PerCP-Cyanine5.5, анти-CD25-PE и анти-FOXP3-APC, а также РВМС. Долю клеток CD4 + CD25 + FOXP3 + в популяции Т-клеток CD4 + определяли методом проточной цитометрии. Эксперимент был проведен семь раз независимо друг от друга. ** P < 0,01.
Подавляющая функциональность Treg щитовидной железы.(A) Ткани щитовидной железы были взяты у шести пациентов, перенесших операцию по поводу доброкачественных узлов щитовидной железы. Thyroid Tregs совместно культивировали с эффекторными Т-клетками периферической крови (Teffs, CD4 + CD25 — Т-клетками) в различных соотношениях (1:2, 1:4 и 1:8) в течение 3 дней. Teffs метили CFSE и анализировали с помощью проточной цитометрии. (B) Ингибирующую функцию Treg анализировали с использованием степени ингибирования (%) пролиферации Teffs и рассчитывали по уравнению: ((пролиферация Teffs - пролиферация Teffs плюс Treg)/скорость пролиферации только Teffs) × 100%.Эксперимент проводился независимо шесть раз.
Влияние Tg на функцию Treg
Для определения влияния Tg на функцию Treg, Treg и Teff из периферической крови здоровых доноров совместно культивировали в течение 3 дней в различных соотношениях (1:2, 1: 4 и 1:8) с разными концентрациями Tg (). Мы обнаружили, что высокая концентрация Tg (100 мкг/мл) значительно подавляла ингибирующую функцию Treg по сравнению с контролем ( P < 0,05). И наоборот, низкая концентрация Tg (1 мкг/мл) способствовала ингибирующей функции Treg по сравнению с контролем ( P < 0.01 с Treg/Teff = 1/2 и P < 0,05 с Treg/Teff = 1/4 и 1/8, ). Для дальнейшего изучения основных механизмов действия Tg на функцию Treg мы выделили Tregs из периферической крови здоровых доноров и обрабатывали их различными концентрациями Tg (0, 0,1, 1, 10 и 100 мкг/мл) в течение 3 дней. . Мы обнаружили, что низкая концентрация Tg (1 мкг/мл) значительно стимулировала экспрессию мРНК FOXP3 , TGF-β и IL-10 ; P для всех был <0.01 (). Однако более высокие концентрации Tg (100 мкг/мл) ингибировали экспрессию мРНК FOXP3 , TGF-β и IL-10 ( P < 0,01) (). Чтобы изучить прямое влияние Tg на пролиферацию Teffs, мы также добавили 100 мкг/мл Tg к Teffs без Treg. Скорость пролиферации Teff в группе 100 мкг/мл Tg и пустой группе составила 56,2 ± 6,8% против 65,7 ± 9,1% соответственно, P = 0,055.
Двунаправленные эффекты Tg на функцию клеток Treg.(A) Tregs были выделены из периферической крови здоровых доноров и совместно культивированы с CD4 + CD25 — Т-клетками, меченными CFSE в различных соотношениях (1:2, 1:4 и 1:8), и одновременно обработаны с ТГ в различных концентрациях (0, 0,1, 1, 10 и 100 мкг/мл) в течение 3 дней. К культурам также добавляли антитела против CD3 человека (5 × 10 -8 мкмоль/л) и антитела против CD28 человека (2,27× 10 -8 мкмоль/л). Скорость пролиферации Teffs анализировали с помощью проточной цитометрии.(B) Ингибирующая функция Treg, представленная степенью ингибирования (%) пролиферации Teffs, рассчитывалась с использованием уравнения: ((пролиферация Teffs - пролиферация Teffs плюс Treg)/скорость пролиферации только Teffs) × 100%. Эксперимент проводился независимо 11 раз. * P < 0,05, ** P < 0,01.
Влияние Tg на FOXP3 и экспрессию цитокинов в Treg. РВМС выделяли из периферической крови здоровых доноров и инкубировали с различными концентрациями Tg (0, 0.1, 1, 10 и 100 мкг/мл) в течение 3 дней. Затем Treg выделяли с помощью MACS, и уровни экспрессии мРНК (A) FOXP-3 , (B) TGF-β и (C) IL-10 определяли с помощью ПЦР в реальном времени. Эксперимент проводили не менее трех раз независимо друг от друга. ** P < 0,01.
Обсуждение
В настоящем исследовании мы обнаружили коррелированную дисфункцию Treg с уровнем Tg у пациентов с доброкачественными узлами щитовидной железы и значительно сниженную функцию Treg в группе с высоким уровнем Tg (Tg >77 мкг/л) по сравнению с нормальным Группа ТГ.Уровни Tg в сыворотке могут быть повышены при большинстве пролиферативных заболеваний щитовидной железы (5, 30), и было показано, что количественные и/или функциональные нарушения Treg участвуют в патогенезе AITD у людей (18, 23, 31, 32). Механизм такой высокой заболеваемости AITD может быть связан с высоким уровнем Tg, который нарушает функцию Treg в узлах щитовидной железы и раке.
Мы также подтвердили, что высокие уровни Tg могут влиять на функцию Treg in vitro со снижением экспрессии FOXP3, IL-10 и TGF-β.FOXP3 был не только молекулярным маркером и фактором спецификации клеточной линии для Treg, но также имел решающее значение для регуляторной активности Treg (33). Более высокие уровни экспрессии FOXP3 подавляют активность нерегуляторных Т-клеток у грызунов (34). У людей мутации в гене FOXP3 связаны с дефицитом Treg, вызывая тяжелое системное аутоиммунное заболевание, называемое иммунной дисрегуляцией, полиэндокринопатией, энтеропатией и синдромом, сцепленным с Х-хромосомой (35). IL-10 и TGF-β являются растворимыми факторами, которые экспрессируются Treg, и они оказывают прямое супрессивное действие на Teffs (36, 37).Высокие уровни Tg, влияющие на функцию Treg, могут быть связаны с ингибирующим действием Tg на экспрессию FOXP3, IL-10 и TGF-β в Treg. И наоборот, низкие уровни Tg могут улучшать функцию Treg и стимулировать экспрессию мРНК FOXP3, TGF-β и IL-10. Предыдущие исследования показали, что у 100% мышей CBA/J развился тиреоидит с положительными Tg-Ab при внутривенном введении высоких концентраций Tg (100 мкг). один раз (17), но только у 17% мышей развился тиреоидит после инъекции низкой концентрации ТГ (40 мкг в день) в течение 10 дней (38).Ни у одной из мышей не развился тиреоидит, когда им вводили низкие концентрации ТГ (20 мкг в день) и ТТГ (0,25 МЕ в день) (38). Результаты этих исследований могут быть связаны с влиянием различных концентраций Tg на Treg.
Хотя высокие концентрации Tg подавляли функцию Treg-клеток, низкие концентрации оказывали противоположный эффект in vitro , что свидетельствует о том, что Tg может по-разному регулировать функцию Treg-клеток в зависимости от того, находится ли он в ткани щитовидной железы или в периферической крови.Двунаправленные эффекты Tg на Treg-клетки были аналогичны эффектам Tg на рост фолликулярных эпителиальных клеток щитовидной железы (39, 40). Индукция роста клеток щитовидной железы отмечалась только при более низких концентрациях ТГ, тогда как ингибирование роста клеток и функции фолликулов индуцировалось в зависимости от дозы при более высоких концентрациях ТГ. Сузуки и др. . предположили, что за эту двухфазную активность в росте клеток щитовидной железы ответственны разные системы распознавания, а не два разных домена белка Tg (39).
ТГ продуцируется исключительно фолликулярными клетками щитовидной железы, и концентрация ТГ в щитовидной железе намного выше, чем в периферической крови, особенно у пациентов с узлами щитовидной железы. Настоящее исследование показало, что иммунорегуляторная функция Treg в ткани щитовидной железы была значительно ниже, чем в периферической крови. Среди пациентов с узлами щитовидной железы лишь небольшое число лиц склонны к развитию АИТ. Должен существовать механизм для поддержания иммунного гомеостаза в щитовидной железе.Хотя функция Tregs уменьшилась, доля Tregs в щитовидной железе увеличилась. Повышенная доля Tregs могла компенсировать снижение функции Tregs. Определенные факторы, такие как дефекты генов, вирусная инфекция, потребление йода, стресс или разрушение фолликулов щитовидной железы, вызванное узлами щитовидной железы (например, у пациентов с высоким уровнем ТГ в настоящем исследовании) и раком, могут привести к повышению уровня ТГ (30). , 41, 42). Мы предполагаем, что если концентрация Tg будет увеличиваться до уровней выше, чем те, которые могут быть уравновешены компенсаторным механизмом у некоторых пациентов с узлами щитовидной железы, иммунный гомеостаз может нарушиться и может развиться AITD.
В заключение, мы впервые обнаружили, что высокий уровень ТГ может нарушать функцию Трег у пациентов с узлами щитовидной железы, что может объяснить высокую частоту ГТ у таких пациентов. Механизмы дисфункции Treg могут быть связаны с ингибирующим действием Tg на экспрессию FOXP3, TGF-β и IL-10. Настоящее исследование дает новый взгляд на лечение узлов щитовидной железы, особенно тех, которые возникают с повышенным уровнем ТГ.
Заявление об интересах
Авторы заявляют об отсутствии конфликта интересов, который мог бы быть воспринят как наносящий ущерб беспристрастности опубликованного исследования.
Финансирование
Эта работа была поддержана Национальным фондом естественных наук Китая (номер гранта 81570710), Национальным фондом естественных наук провинции Цзянсу (номер гранта SBK2015042970) и Научным фондом Бюро общественного здравоохранения Нанкина (номер гранта ZKX15026 и YKK16137) .
Благодарности
Авторы выражают благодарность д-ру Bang-shun He (Центральная лаборатория Первой больницы Нанкина) за помощь в проведении проточной цитометрии и Xiu-ping Wang (Отделение эндокринологии Первой больницы Нанкина) за сбор образцов крови.
Ссылки
1. Durante C, Grani G, Lamartina L, Filetti S, Mandel SJ, Cooper DS. Диагностика и лечение узлов щитовидной железы: обзор. ДЖАМА 2018. 319 914–924. (10.1001/jama.2018.0898) [PubMed] [CrossRef] [Google Scholar]2. Раго Т., Чиовато Л., Агини-Ломбарди Ф., Грассо Л., Пинчера А., Витти П. Непальпируемые узлы щитовидной железы в пограничной йододефицитной зоне: обнаружение с помощью УЗИ и последующее наблюдение. Журнал эндокринологических исследований 2001. 24 770–776. (10.1007/BF03343926) [PubMed] [CrossRef] [Google Scholar]3.Фишер С.Б., Перье Н.Д. Случайный узел щитовидной железы. CA: Раковой журнал для клиницистов 2018. 68 97–105. (10.3322/caac.21447) [PubMed] [CrossRef] [Google Scholar]4. Burch HB, Burman KD, Cooper DS, Hennessey JV, Vietor NO. Обзор клинических моделей лечения узлов щитовидной железы, проведенный в 2015 г. Журнал клинической эндокринологии и обмена веществ 2016. 101 2853–2862. (10.1210/jc.2016-1155) [PubMed] [CrossRef] [Google Scholar]5. Джурика С., Джорджевич Д., Синадинович Дж. Долгосрочное наблюдение за уровнями тиреоглобина в сыворотке и его клиническими последствиями у субъектов после хирургического удаления «холодного» узла щитовидной железы.Экспериментальная и клиническая эндокринология 1992. 99 137–142. (10.1055/s-0029-1211155) [PubMed] [CrossRef] [Google Scholar]6. Du Y, Gao YH, Feng ZY, Meng FG, Fan LJ, Sun DJ. Сывороточный тиреоглобулин — чувствительный биомаркер йодного статуса питания и влияния на аномалии и заболевания щитовидной железы у взрослого населения. Биомедицинские науки и науки об окружающей среде 2017. 30 508–516. (10.3967/bes2017.067) [PubMed] [CrossRef] [Google Scholar]7. Кескин М., Савас-Эрдеве С., Айкан З. Сосуществование узла щитовидной железы и рака щитовидной железы у детей и подростков с тиреоидитом Хашимото: одноцентровое исследование.Гормональные исследования в педиатрии 2016. 85 181–187. (10.1159/000443143) [PubMed] [CrossRef] [Google Scholar]8. Руджери Р.М., Кампенни А., Синдони А., Балдари С., Тримарчи Ф., Бенвенга С. Ассоциация автономно функционирующих узлов щитовидной железы с тиреоидитом Хашимото: исследование большой группы пациентов. Экспериментальная и клиническая эндокринология и диабет 2011. 119 621–627. (10.1055/s-0031-1279705) [PubMed] [CrossRef] [Google Scholar]9. Тримболи П., Треглия Г., Джованелла Л. Предоперационное измерение тиреоглобулина в сыворотке для прогнозирования злокачественных новообразований щитовидной железы: систематический обзор.Гормоны и метаболические исследования 2015. 47 247–252. (10.1055/s-0034-1395517) [PubMed] [CrossRef] [Google Scholar]10. Kim HJ, Mok JO, Kim CH, Kim YJ, Kim SJ, Park HK, Byun DW, Suh K, Yoo MH. Предоперационный тиреоглобулин сыворотки и изменения тиреоглобулина сыворотки во время супрессии ТТГ независимо предсказывают фолликулярную карциному щитовидной железы в узлах щитовидной железы с цитологическим диагнозом фолликулярного поражения. Эндокринные исследования 2017. 42 154–162. (10.1080/07435800.2016.1262395) [PubMed] [CrossRef] [Google Scholar]11.Азизи Г., Келлер Дж. М., Льюис М., Пайпер К., Пуэтт Д., Ривенбарк К. М., Мальчофф К. Д. Ассоциация тиреоидита Хашимото с раком щитовидной железы. Эндокринный рак 2014. 21 845–852. (10.1530/ERC-14-0258) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]12. Гуль К., Дирикоч А., Кияк Г., Эрсой П.Е., Уграс Н.С., Эрсой Р., Чакир Б. Связь между карциномой щитовидной железы и тиреоидитом Хашимото: ультразвуковые и гистопатологические характеристики злокачественных узлов. Щитовидная железа 2010. 20 873–878.(10.1089/thy.2009.0118) [PubMed] [CrossRef] [Google Scholar] 13. Азизи Г., Мальхофф КД. Аутоиммунное заболевание щитовидной железы: фактор риска рака щитовидной железы. Эндокринная практика 2011. 17 201–209. (10.4158/EP10123.OR) [PubMed] [CrossRef] [Google Scholar] 15. Луепрасицакул В., Алекс С., Фанг С.Л., Аппель М.С., Браверман Л.Е. Тиреоглобулин-индуцированный лимфоцитарный тиреоидит у двух подлиний крыс BB/Wor. Аутоиммунитет 1991. 9 55–60. (10.3109/0897124) [PubMed] [CrossRef] [Google Scholar] 16. Аллен Э.М., Тупари Дж.Н.Тиреоглобулин-реактивные Т-лимфоциты у склонных к тиреоидиту крыс BB/Wor. Журнал эндокринологических исследований 1995. 18 45–49. (10.1007/BF03349697) [PubMed] [CrossRef] [Google Scholar] 17. Моррис Г.П., Браун Н.К., Конг Ю.К. Существующие в природе регуляторные Т-клетки CD4(+)CD25(+)Foxp3(+) необходимы для устойчивости к экспериментальному аутоиммунному тиреоидиту, индуцированному либо экзогенным, либо эндогенным аутоантигеном. Журнал аутоиммунитета 2009. 33 68–76. (10.1016/j.jaut.2009.03.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]18.Нагаяма Й, Хориэ И, Сайто О, Накахара М, Абиру Н. CD4+CD25+ природные регуляторные Т-клетки, а не лимфопения, играют роль в патогенезе йод-индуцированного аутоиммунного тиреоидита у мышей NOD-h3h5. Журнал аутоиммунитета 2007. 29 195–202. (10.1016/j.jaut.2007.07.008) [PubMed] [CrossRef] [Google Scholar] 19. Li C, Yuan J, Zhu YF, Yang XJ, Wang Q, Xu J, He ST, Zhang JA. Дисбаланс Th27/Treg при различных подтипах аутоиммунных заболеваний щитовидной железы. Клеточная физиология и биохимия 2016.40 245–252. (10.1159/000452541) [PubMed] [CrossRef] [Google Scholar] 20. Рамос-Леви А.М., Марасуэла М. Патогенез аутоиммунных заболеваний щитовидной железы: роль клеточных механизмов. Эндокринология и питание 2016. 63 421–429. (10.1016/j.endonu.2016.04.003) [PubMed] [CrossRef] [Google Scholar]21. Лю И, Тан С, Тянь Дж, Чжу С, Пэн Х, Руи К, Ван Ю, Мао С, Ма Дж, Лу Л. и другие. Дисбаланс клеток Th27/Treg и профиль GITRL у пациентов с тиреоидитом Хашимото. Международный журнал молекулярных наук 2014.15 21674–21686. (10.3390/ijms151221674) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Глик А.Б., Водзински А., Фу П., Левин А.Д., Вальд Д.Н. Нарушение регуляторной функции Т-клеток при аутоиммунных заболеваниях щитовидной железы. Щитовидная железа 2013. 23 871–878. (10.1089/thy.2012.0514) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23. Hu Y, Tian W, Zhang LL, Liu H, Yin GP, He BS, Mao XM. Функция регуляторных Т-клеток улучшилась под действием дексаметазона при болезни Грейвса. Европейский журнал эндокринологии 2012.166 641–646. (10.1530/EJE-11-0879) [PubMed] [CrossRef] [Google Scholar] 25. Сакагучи С. Возникающие в природе Foxp3-экспрессирующие CD25+CD4+ регуляторные Т-клетки с иммунологической толерантностью к своим и чужим. Иммунология природы 2005. 6 345–352. (10.1038/ni1178) [PubMed] [CrossRef] [Google Scholar]26. Романьяни С. Регуляторные Т-клетки: какая роль в патогенезе и лечении аллергических заболеваний? аллергия 2006. 61 3–14. (10.1111/j.1398-9995.2006.01005.x) [PubMed] [CrossRef] [Google Scholar]27. Китайское общество эндокринологов, 2012 г. Руководство по ведению пациентов с узлами щитовидной железы и дифференцированным раком щитовидной железы.Китайский журнал эндокринологии и обмена веществ 28 779–797. (10.3760/cma.j.issn.1000-6699.2012.10.002) [CrossRef] [Google Scholar]28. Мао XM, Li HQ, Li Q, Li DM, Xie XJ, Yin GP, Zhang P, Xu XH, Wu JD, Chen SW. и другие. Профилактика рецидива болезни Грейвса путем внутритиреоидной инъекции дексаметазона. Журнал клинической эндокринологии и обмена веществ 2009. 94 4984–4991. (10.1210/jc.2009-1252) [PubMed] [CrossRef] [Google Scholar]29. Марасуэла М., Гарсия-Лопес М.А., Фигероа-Вега Н., де ла Фуэнте Х., Альварадо-Санчес Б., Монсивайс-Уренда А., Санчес-Мадрид Ф., Гонсалес-Амаро Р.Регуляторные Т-клетки при аутоиммунном заболевании щитовидной железы человека. Журнал клинической эндокринологии и обмена веществ 2006. 91 3639–3646. (10.1210/jc.2005-2337) [PubMed] [CrossRef] [Google Scholar]30. Окамото Т., Канбэ М., Иихара М., Ямадзаки К., Окамото Дж., Ямасита Т., Ито Й., Каваками М., Обара Т. Измерение сывороточного тиреоглобулина у пациентов с фолликулярным узлом щитовидной железы: его диагностическое значение. Эндокринный журнал 1997. 44 187–193. (10.1507/endocrj.44.187) [PubMed] [CrossRef] [Google Scholar] 31. Сайто О, Нагаяма Ю.Регуляция гипертиреоза Грейвса с помощью встречающихся в природе регуляторных Т-клеток CD4+CD25+ в мышиной модели. Эндокринология 2006. 147 2417–2422. (10.1210/en.2005-1024) [PubMed] [CrossRef] [Google Scholar]32. Wei WZ, Jacob JB, Zielinski JF, Flynn JC, Shim KD, Alsharabi G, Giraldo AA, Kong YC. Одновременная индукция противоопухолевого иммунитета и аутоиммунного тиреоидита у мышей с истощением регуляторных Т-клеток CD4+ CD25+. Исследования рака 2005. 65 8471–8478. (10.1158/0008-5472.CAN-05-0934) [PubMed] [CrossRef] [Google Scholar]33.Фонтено Д.Д., Гэвин М.А., Руденски А.Ю. Foxp3 программирует развитие и функцию CD4+CD25+ регуляторных Т-клеток. Иммунология природы 2003. 4 330–336. (10.1038/ni904) [PubMed] [CrossRef] [Google Scholar]34. Сакагути С., Ямагути Т., Номура Т., Оно М. Регуляторные Т-клетки и иммунная толерантность. Клетка 2008. 133 775–787. (10.1016/j.cell.2008.05.009) [PubMed] [CrossRef] [Google Scholar] 35. Bennett CL, Christie J, Ramsdell F, Brunkow ME, Ferguson PJ, Whitesell L, Kelly TE, Saulsbury FT, Chance PF, Ochs HD.Иммунная дисрегуляция, полиэндокринопатия, энтеропатия, Х-сцепленный синдром (IPEX) обусловлены мутациями FOXP3. Генетика природы 2001. 27 20–21. (10.1038/83713) [PubMed] [CrossRef] [Google Scholar] 36. Аннакер О., Ассеман С., Рид С., Поури Ф. Интерлейкин-10 в регуляции Т-клеточного колита. Журнал аутоиммунитета 2003. 20 277–279. (10.1016/S0896-8411(03)00045-3) [PubMed] [CrossRef] [Google Scholar]37. Джоэтам А., Такеда К., Таубе С., Мияхара Н., Мацубара С., Коя Т., Ра Ю.Х., Дахама А., Гельфанд Э.В.Естественная регуляция легочных CD4(+)CD25(+) T-клеток аллергических реакций дыхательных путей зависит от индукции IL-10 TGF-бета. Журнал иммунологии 2007. 178 1433–1442 гг. (10.4049/jimmunol.178.3.1433) [PubMed] [CrossRef] [Google Scholar]38. Конг Ю.М., Браун Н.К., Моррис Г.П., Флинн Д.К. Существенная роль циркулирующего тиреоглобулина в поддержании доминирования естественной регуляторной функции Т-клеток для предотвращения аутоиммунного тиреоидита. Гормоны и метаболические исследования 2015. 47 711–720. (10.1055/s-0035-1548872) [PubMed] [CrossRef] [Google Scholar]39.Судзуки К., Кавасима А., Йошихара А., Акама Т., Сью М., Йошида А., Кимура Х.Дж. Роль тиреоглобулина в ауторегуляции функции и роста фолликулов щитовидной железы с отрицательной обратной связью. Журнал эндокринологии 2011. 209 169–174. (10.1530/JOE-10-0486) [PubMed] [CrossRef] [Google Scholar]40. Ногучи Ю., Харии Н., Джулиани С., Тацуно И., Судзуки К., Кон Л.Д. Тиреоглобулин (Tg) индуцирует рост клеток щитовидной железы в зависимости от концентрации с помощью механизма, отличного от стимуляции тиреотропином/цАМФ. Коммуникации в области биохимических и биофизических исследований 2010.391 890–894. (10.1016/j.bbrc.2009.11.158) [PubMed] [CrossRef] [Google Scholar]41. Стефан М., Якобсон Э.М., Хубер А.К., Гринберг Д.А., Ли К.В., Скрабанек Л., Концепшн Э., Фадлалла М., Хо К., Томер Ю. Новый вариант промотора тиреоглобулина запускает аутоиммунитет щитовидной железы посредством эпигенетического интерферон-альфа-модулируемого механизма. Журнал биологической химии 2011. 286 31168–31179. (10.1074/jbc.M111.247510) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]MON-458 Повышенный уровень тиреоглобулина в доброкачественном узле щитовидной железы | Journal of the Endocrine Society
Предыстория: Повышенные уровни тиреоглобулина чаще всего связаны с дифференцированной карциномой щитовидной железы, и эти уровни часто используются для мониторинга рецидивов заболевания.Уровни антител к тиреоглобулину могут быть повышены как при тиреоидите Хашимото, так и при болезни Грейвса, и эти антитела могут влиять на уровни тиреоглобулина, как подробно описано Spencer, Wang (1). При доброкачественных узлах щитовидной железы имеется ограниченное количество исследований уровней тиреоглобулина, как это изучалось в исследовании Chinnappa et al (2).
Клинический случай: 31-летняя женщина поступила с пальпируемым узлом щитовидной железы и дисфагией. Ее лечащий врач назначил анализы щитовидной железы, включая нормальный уровень ТТГ (1,3 мМЕ/л, n0,4-4 мМЕ/л), нормальный уровень антител к тиреопероксидазе (56 единиц, n<250 единиц), нормальный уровень антител к тиреоглобулину (<1 МЕ/мл, n<1 МЕ/мл) и повышенный уровень тиреоглобулина (469.1 нг/мл, n2,8–40,9 нг/мл). Уровень тиреоглобулина оставался повышенным при повторном тестировании (224,4 нг/мл, n2,8-40,9) через месяц. Кроме того, ее лабораторные исследования тиреоглобулина были повторены с лечением НАМА и остались повышенными (277,7 нг/мл, n2,8-40,9). Офисное УЗИ показало, что самый длинный размер узла составляет 5 см, и пациенту была проведена биопсия FNA. Результаты биопсии были зарегистрированы как доброкачественный узел, и было рекомендовано повторное наблюдение через 12 месяцев. Через шесть месяцев пациент сообщил о нарастающей дисфагии.Ей сделали глотание бария, которое не показало отклонений. У нее было увеличение роста на 35% при повторной визуализации наряду с увеличением давления на шею и дискомфортом, и она была направлена к ЛОРу для операции. Окончательная патология после тиреоидэктомии левой щитовидной железы и перешейка была описана как «Многоузловая гиперплазия на фоне паренхимы щитовидной железы, гистологически ничем не примечательная. Отрицательный результат на злокачественность». Уровни тиреоглобулина впоследствии вернулись к нормальному диапазону, и дисфагия пациента исчезла.
Вывод: Уровни тиреоглобулина могут быть заметно повышены при доброкачественных узлах щитовидной железы, что может ввести врачей в заблуждение и увеличить вероятность рака щитовидной железы.
