Первичное обследование, диагностика и постановка диагноза у пациентов с подозрением на рак легкого
Своевременная диагностика рака легкого – серьезная и сложная задача для клиницистов. Заболевание, которое является одной из основных причин смертности во всем мире, в подавляющем большинстве случаев диагностируется на поздних стадиях [1], что сопряжено с неблагоприятным прогнозом и высокой летальностью.
Общие цели и принципы диагностики рака легкого
Важнейшей целью работы с пациентом с подозрением на рак легкого является своевременная диагностика и точная постановка диагноза в ранние сроки, позволяющие как можно раньше начать терапию заболевания. Исходя из ведущих международных рекомендаций по диагностике и лечению рака легкого, в том числе рекомендаций NCCN и Американской коллегии торакальных врачей ACCP [2-4], основными задачами на первых этапах обследования пациента с подозрением на рак легкого являются:
- Определение точной локализации первичного опухолевого очага и выполнение биопсии опухоли
- Определение конкретного гистологического подтипа опухоли
- Оценка распространения опухоли, то есть клинической стадии заболевания
- Диагностика сопутствующих заболеваний, возможных осложнений основного заболевания и паранеопластических синдромов, которые могут оказывать влияние на терапию и ответ на нее
- Учет предпочтений пациентов в отношении диагностической и терапевтической тактики лечения
Подозрение на рак легкого, как правило, возникает на основании клинической симптоматики, характерной для этого заболевания, или изменений при рентгенологическом исследовании. Согласно рекомендациям Американской коллегии торакальных врачей [3], в подобных случаях для подтверждения диагноза необходимо проведение инвазивной диагностики (трансторакальная биопсия, бронхоскопия и т.д.). По возможности, подтверждение диагноза и оценка стадии заболевания должны быть проведены параллельно с биопсией. Тем не менее, в некоторых случаях требуется серия исследований, в том числе и инвазивных.
Согласно рекомендациям Американской коллегии торакальных врачей [3], в подобных случаях для подтверждения диагноза необходимо проведение инвазивной диагностики (трансторакальная биопсия, бронхоскопия и т.д.). По возможности, подтверждение диагноза и оценка стадии заболевания должны быть проведены параллельно с биопсией. Тем не менее, в некоторых случаях требуется серия исследований, в том числе и инвазивных.
Необходимо отметить, что строгого алгоритма диагностики рака легкого не существует, поскольку заболевание имеет слишком много различных форм. Несмотря на это, первоначальная оценка пациентов с подозрением на рак легкого должна проводиться своевременно и наиболее эффективно. Как показывает практика, в большинстве случаев диагностические мероприятия могут быть проведены в амбулаторных условиях, однако нередко, особенно при наличии сопутствующей патологии, целесообразна госпитализация больного. Предпочтительно, чтобы срок выполнения первоначальных диагностических мероприятий у пациентов с невыраженной клинической картиной и отсутствием осложнений составлял не более шести недель [3].
Необходимо учитывать, что у некоторых пациентов с НМРЛ отмечается настолько быстрый рост опухоли, что ее характеристики за время длительной диагностики могут измениться [5]. Поэтому может быть целесообразной повторная оценка стадии заболевания с помощью рентгенологических методик в случаях, когда установка диагноза занимает 8 и более недель.
Клиническое обследование пациента с подозрением на рак легкого
Каждый пациент с подозрением на рак легкого должен быть подвергнут тщательному клиническому осмотру. Наличие явных признаков или симптомов заболевания, как правило, свидетельствует о прогрессирующей опухоли, что сопряжено с неблагоприятным прогнозом [6].
Наиболее распространенные симптомы рака легкого:
- Кашель (50-75% случаев)
- Кровохарканье (25-50% случаев)
- Одышка, примерно у 25% больных
- Боль в груди – 20% случаев [7-10]
Рак легкого следует подозревать у курильщика (как в прошлом, так и в настоящем) с внезапно возникшим эпизодом кровохарканья или длительного непроходящего кашля.
Особенно пристальную клиническую оценку необходимо дать внелегочным симптомам, поскольку они могут свидетельствовать о метастазировании опухоли (таблица 1) [11].
Таблица 1. Симптомы, сопряженные с метастатическим раком легкого [11].
Симптомы, выявляемые во время сбора анамнеза:
|
Симптомы, выявляемые во время физического осмотра:
|
Лабораторные признаки:
|
Лабораторное обследование пациентов с подозрением на рак легкого
При подозрении на рак легкого целесообразно проведение следующих лабораторных исследований [12]:
- Общий развернутый анализ крови
- Кислотно-щелочное состояние крови
- Биохимический анализ крови развернутый
- Общий анализ мочи
- Коагулограмма
На основании тщательного физического обследования в комбинации с данными лабораторных тестов можно прогнозировать вероятность метастазирования у пациентов, страдающих раком легкого, особенно немелкоклеточным раком [11].
Радиографическое исследование
Рентгенография
При подозрении на рак легкого прежде всего проводят рентгенографическую диагностику [2], при этом зачастую основанием для ее назначения становятся патологические изменения, которые были обнаружены на флюорограмме. При центральном раке легкого на рентгенограмме могут визуализироваться проявления стеноза бронха, причем раньше их обнаруживают, как правило, при эндобронхиальном росте опухоли [13]. При экзобронхиальном росте выявляются рентгенологические признаки нарушения бронхиальной проходимости [13].
Периферический рак легкого на рентгенограмме имеет шаровидную форму при условии, что ее диаметр превышает 3-4 см. Менее крупные опухоли чаще визуализируются в форме полигональной тени с разными по протяженности сторонами и напоминают звездчатый рубец. Редко опухоль изначально имеет правильную круглую или овальную форму. Края опухоли нечеткие, размытые. Вследствие опухолевой инфильтрации окружающей ткани вокруг узла появляется «лучистость» (corona maligna) [13].
Компьютерная томография (КТ)
Обязательное исследование при подозрении на рак легкого – КТ грудной клетки с внутривенным контрастированием. Контрастирование является обязательным условием проведения диагностического КТ и позволяет в том числе различить первичную опухоль медиастинальной локализации или метастатическое поражение лимфатических узлов от сосудистых структур. Целесообразно провести также КТ исследование печени и надпочечников одновременно с первичной КТ грудной клетки.
Основное преимущество КТ – способность анатомически наиболее точно оценить расположение опухоли в грудной клетке, что дает возможность планировать прицельную биопсию с целью установки гистопатологического диагноза и стадирования.
Американская коллегия торакальных врачей предложила дифференцировать пациентов по вероятности вовлечения лимфатических узлов на основании данных КТ на 4 группы [2]:
- А – больные с массивными опухолями, в том числе с вовлечением средостения, и не дающими возможности дифференцировать изолированные лимфатические узлы от первичной опухоли
- B – пациенты с дискретным увеличением лимфоузла более 1 см, при этом лимфатический узел можно отличить от первичной опухоли
- C – пациенты с центральной опухолью и высоким риском наличия поражения лимфатических узлов, несмотря на нормальный размер лимфатических узлов на КТ
- D – пациенты с низким риском вовлечения лимфатических узлов или отдаленного метастазирования
Распределение пациентов на категории по результатам КТ позволяет врачу максимально точно определиться с выбором варианта биопсии. Так, для пациентов категории А, которым может быть не показано хирургическое лечение, главной задачей является проведение биопсии наиболее безопасным методом. А вот, например, для больных группы B решающее значение имеет как можно более точный забор материала с целью уточнения факта вовлечения лимфоузлов.
Так, для пациентов категории А, которым может быть не показано хирургическое лечение, главной задачей является проведение биопсии наиболее безопасным методом. А вот, например, для больных группы B решающее значение имеет как можно более точный забор материала с целью уточнения факта вовлечения лимфоузлов.
Преимуществом КТ является высокая разрешающая способность, позволяющая диагностировать центральный рак еще до появления признаков нарушения вентиляции ткани легкого, а также выявлять начальные формы рака, в том числе и расположенные перибронхиально. Считается, что информативность КТ при центральном раке легкого сопоставима с информативностью бронхоскопии, а при перибронхиальном расположении опухоли в разы превышает последнюю [13].
Так называемая лимфогенная дорожка, расположенная к корню легкого или плевре, визуализируется не всегда. Также только примерно у 30% больных на снимках можно обнаружить втяжение плевры, которое считается относительным признаком первичного рака легкого [13].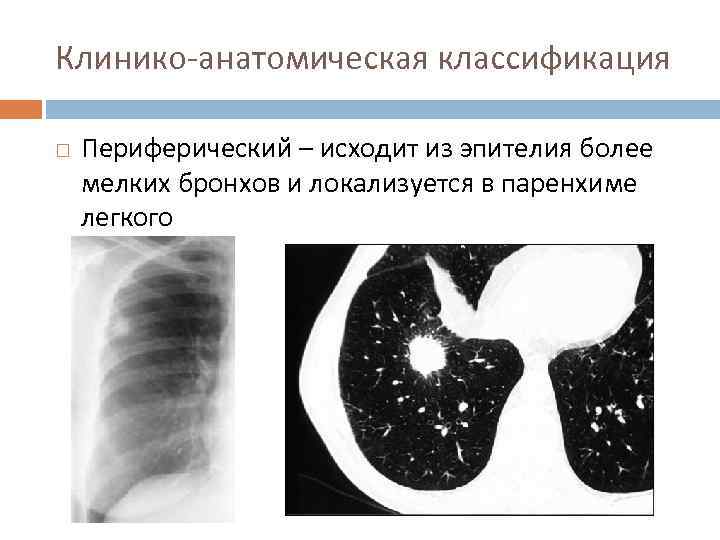
При опухолях, превышающих в диаметре 3 см, часто выявляется новообразование неправильной округлой или многоузловой формы, с крупнобугристыми очертаниями и неоднородной структурой, обусловленными участками некроза или распада опухоли.
Основное ограничение КТ грудной клетки заключается в низкой точности идентификации метастазов средостения [2]. При подозрении на опухоли средостения (за исключением крупных образований), как правило, требуются дополнительные исследования. Чувствительность и специфичность КТ составляет 55% и 81% соответственно [2].
Позитронно-эмиссионная томография (ПЭТ)
ПЭТ всего тела
В то время как ПЭТ всего тела широко используется для диагностики рака, единого мнения о целесообразности его проведения при подозрении на рак легкого нет [14].
Преимущество ПЭТ, в частности, заключается в высокой чувствительности, позволяющей с высокой степенью точности визуализировать как первичный опухолевый очаг, так и регионарные и отдаленные метастазы.
Недостатки ПЭТ прежде всего связаны с отсутствием возможности четкого отображения анатомических структур и пространственного расположения изменений по отношению к окружающим тканям. Их можно компенсировать путем совмещения ПЭТ с КТ, что позволяет повысить точность диагностики [15].
ПЭТ/КТ может быть очень информативным при оценке подозрительных или патологически доказанных случаев рака легкого. Наиболее распространенными показаниями для исследования являются [16]:
- Морфологическая и функциональная характеристика легочных лимфатических узлов
- Стадирование в соответствии с системой TNM и скрининг метастазов, которые не могут быть обнаружены только КТ
- Планирование лучевой терапии
- Повторное стадирование заболевания
Кроме того, ПЭТ/КТ может помочь в гистологической оценке исследуемого поражения [16].
Крупный системный обзор и мета-анализ, в котором изучались данные 19 исследований с участием 2014 пациентов с подозрением на НМРЛ, продемонстрировал, что чувствительность, специфичность, положительная и отрицательная прогностическая ценность метода ПЭТ/КТ составила 62%, 90% ,63% и 90% соответственно, в то время как чувствительность и специфичность только ПЭТ составляет 80% и 88% [2]. Необходимо отметить, что причины этой тенденции неизвестны.
В еще одном масштабном ревью, изучавшем результаты 56 исследований с участием 8699 пациентов [17], было показано, что чувствительность и специфичность ПЭТ/КТ при стадировании опухолей средостения составила 72% и 91%, внутригрудных опухолей – 78% и 90%, при обнаружении отдаленных метастазов – 77% и 95%, а метастазов в кости – 91% и 98%. Данные метаанализа также подтвердили, что при стадировании НМРЛ чувствительность и специфичность ПЭТ/КТ гораздо выше, чем КТ с контрастированием, а только чувствительность выше, чем ПЭТ [17].
Тем не менее, относительно низкая чувствительность и специфичность как только ПЭТ и КТ, так и ПЭТ/КТ могут способствовать получению ложноотрицательных результатов при скрытом (оккультном) раке и, как следствие, привести к упущенным возможностям потенциально курабельной торакотомии [18].
Список литературы
- Torre L.A., et al. Global cancer statistics, 2012. CA. Cancer J. Clin. 2015. Vol.65, №2, P. 87-108.
- Silvestri G.A., et al. Methods for Staging Non-small Cell Lung Cancer. Chest. 2013. Vol.143, №5, P. e211S-e250S.
- Rivera M.P., Mehta A.C., Wahidi M.M. Establishing the Diagnosis of Lung Cancer. Chest. 2013. Vol.143, №5, P. e142S–e165S.
- Ost D.E., et al. Clinical and Organizational Factors in the Initial Evaluation of Patients With Lung Cancer. Chest. 2013. Vol.143, №5, P. e121S-e141S.
- Mohammed N., et al. Rapid Disease Progression With Delay in Treatment of Non-Small-Cell Lung Cancer. Int.
 J. Radiat. Oncol. 2011. Vol.79, №2, P. 466-472.
J. Radiat. Oncol. 2011. Vol.79, №2, P. 466-472. - Feinstein A.R., Wells C.K. A clinical-severity staging system for patients with lung cancer. Medicine (Baltimore). 1990. Vol.69, №1, P. 1-33.
- Chute C.G., et al. Presenting conditions of 1539 population-based lung cancer patients by cell type and stage in new hampshire and vermont. Cancer. Wiley Subscription Services, Inc., A Wiley Company, 1985. Vol.56, №8, P. 2107-2111.
- Kuo C., Chen Y., Chao J. Non-small cell lung cancer in very young and very old patients. Chest. 2000.
- Hirshberg B., et al. Hemoptysis: Etiology, Evaluation, and Outcome in a Tertiary Referral Hospital. Chest. 1997. Vol.112, №2, P. 440-444.
- Lepper P.M., et al. Superior Vena Cava Syndrome in Thoracic Malignancies. Respir. Care. 2012. Vol.56, №5.
- Silvestri G.A., Littenberg B., Colice G.L. The clinical evaluation for detecting metastatic lung cancer. A meta-analysis. Am. J. Respir. Crit. Care Med.
 American Public Health Association, 1995. Vol.152, №1, P. 225-230.
American Public Health Association, 1995. Vol.152, №1, P. 225-230. - Ettinger D.S., et al. Non-Small Cell Lung Cancer, Version 5.2017, NCCN Clinical Practice Guidelines in Oncology. J. Natl. Compr. Canc. Netw. Harborside Press, LLC, 2017. Vol.15, №4, P. 504-535.
- Амиралиев А.М. и соавт. Федеральные клинические рекомендации по диагностике и лечению больных раком легкого. Москва, 2014.
- De Wever W. Role of Integrated PET/CT in the Staging of Non-Small Cell Lung Cancer. 2008.
- De Wever W., et al. Additional value of PET-CT in the staging of lung cancer: comparison with CT alone, PET alone and visual correlation of PET and CT. Eur. Radiol. Springer-Verlag, 2007. Vol.17, №1, P. 23-32.
- Hochhegger B., et al. PET/CT imaging in lung cancer: indications and findings. J. Bras. Pneumol. Sociedade Brasileira de Pneumologia e Tisiologia (Brazilian Thoracic Society), 2015. Vol.41, №3, P. 264-274.
- Wu Y., et al. Diagnostic value of fluorine 18 fluorodeoxyglucose positron emission tomography/computed tomography for the detection of metastases in non-small-cell lung cancer patients.
 Int. J. Cancer. Wiley Subscription Services, Inc., A Wiley Company, 2013. Vol.132, №2, P. E37-E47.
Int. J. Cancer. Wiley Subscription Services, Inc., A Wiley Company, 2013. Vol.132, №2, P. E37-E47. - Fischer B., et al. Preoperative Staging of Lung Cancer with Combined PET-CT. N. Engl. J. Med. Massachusetts Medical Society, 2009. Vol.361, №1, P. 32-39.
Рак легких 3 стадия — симптомы, лечение, химиотерапия, операция, прогноз.
Как проявляется рак легкого 3 стадии
Кашель, отхождение мокроты, одышка — эти симптомы встречаются и при любых других заболеваниях легких. Настороженность должна вызывать длительность проявлений и отсутствие эффекта от лечения традиционными средствами. Также характерным для рака легкого 3 стадии является:
- Кровохарканье — появление крови в мокроте, возникающее при распаде опухоли; процесс сопровождается изнурительной слабостью и внезапными перепадами температуры.
- Прогрессирующая одышка — возникает вследствие блокировки бронха или сдавления дыхательных путей увеличившимся лимфоузлом; характерна при поражении плевры метастазами, при этом возможно развитие плеврита.

- Боль — появляется при прорастании опухоли в грудную стенку, а также при распространении процесса на плевру. Особенно интенсивными боли являются при локализации опухоли в верхушке легкого, поскольку там расположены крупные нервные структуры. Вовлечение в процесс межреберных нервов, метастазирование на ребра или позвоночник также сопровождается сильной болью, которая не поддается обычным способам обезболивания.
Локализация опухоли также влияет на клиническую картину. Периферический рак легких 3 стадии нередко выявляется лишь на этапе осложнений, когда функция органа нарушается, возникает кровотечение и интоксикация. Прорастание опухоли в структуры плечевого сплетения приводит к уменьшению глаза в размерах со стороны поражения, возможно опущение века, боль в шее, плече, нарушение подвижности руки.
Сдавление опухолью блуждающего нерва может стать причиной осиплости голоса вследствие паралича голосовых мышц. Прорастание в перикард приводит к болям в сердце. Отечность лица с цианотичностью, набухание вен на шее, зрительные расстройства возникают при опухоли большого размера, затрагивающей верхнюю полую вену, вследствие чего нарушается венозный отток.
Отечность лица с цианотичностью, набухание вен на шее, зрительные расстройства возникают при опухоли большого размера, затрагивающей верхнюю полую вену, вследствие чего нарушается венозный отток.
Лечение
Возможность операции при раке легких на 3 стадии зависит от размера опухоли, ее локализации и вовлечении в процесс других структур. В ходе операции удалению подлежит либо все легкое, либо проводится резекция части органа с очагом болезни вместе с лимфоузлами. В этом случае оперативное вмешательство сочетается с химиотерапией, при раке легких 3 стадии курс назначается до операции и в послеоперационный период. Введение лекарственных препаратов, подавляющих рост клеток опухоли, до операции способствует уменьшению опухоли, снижению риска рецидива в дальнейшем — речь идет о неоадъювантной терапии. Назначение химиопрепаратов после операции — адъювантная терапия — рекомендовано для уничтожения оставшихся раковых клеток и предотвращения рецидива.
Сегодня появились препараты для уничтожения злокачественных клеток, активирующие противоопухолевый иммунитет. Иммунотерапия при раке легких 3 стадии эффективна, даже если традиционная химиотерапия не работает. Однако ее эффективность зависит от наличия в тканях опухоли молекул-мишеней. В этом случае необходимо сделать молекулярно-генетический анализ, что дает возможность подобрать терапию, эффективную для конкретного пациента.
При наличии противопоказаний к операции назначается облучение в сочетании с химиотерапией. Лучевая терапия при раке легких 3 стадии в сочетании с лекарственной может использоваться также в качестве единственного метода лечения при мелкоклеточном раке. Сегодня, кроме классического облучения, проводится брахитерапия — воздействие непосредственно на клетки опухоли, когда здоровые ткани практически не затрагиваются.
Прогноз
Пятилетняя выживаемость на 3 стадии рака легких составляет 20%. Однако прогноз также зависит от распространенности метастаз, при раке легких 3 стадии лечение будет более эффективным, если использовался весь спектр возможных методов: операция, химио- и лучевая терапия. Немаловажную роль играет локализация опухоли, более высокие шансы имеют пациенты с очагом на периферии. Сколько живут с раком легких 3 стадии, если опухоль расположена вблизи крупных сосудов, нервных узлов, дыхательных путей? Прогноз зависит от своевременности лечения и комплексного подхода, хотя шансы у таких пациентов не столь высоки, как при опухоли с локализацией на периферии.
Можно ли победить рак легкого
Ассоциация исследователей легочных заболеваний Соединенных Штатов Америки утверждает, что в 80-90 % случаев причиной развития рака легкого является курение. Уже на протяжении нескольких десятилетий табакозависимость считается одним из смертельных пороков человечества.
Вредная привычка, которая за короткое время переросла в настоящую пандемию, за последние 50 лет погубила более 60 миллионов человек в мире.
После того, как курение перестало быть прерогативой светского общества, это «развлечение» превратилось в социальную болезнь. Ведь табак пагубно влияет не только на здоровье курящего, но и оказывает вредное воздействие на окружающих. Можно ли избавить общество от табачной зависимости: об этом рассуждает заведующий отделом организации противораковой борьбы Республиканского научно-практического центра онкологии и медицинской радиологии им. Н. Н. Александрова, кандидат медицинских наук Павел Моисеев.
Павел Иванович, каждый из нас знает, что курение вредно для здоровья, так как оно приводит к развитию различных заболеваний. Влияет ли эта информация на людей — количество курящих людей в Беларуси становится меньше?
Рак легкого — это одна из самых древних опухолей, которая известна человечеству. Не забывайте, что данное заболевание появилось задолго до того, как Колумб открыл Америку и привез табак в Европу. Интересно, что в Старом Свете изначально за курение человеку грозила смертная казнь. Люди уже тогда понимали: табак вреден для здоровья.
На славянских землях это зелье прижилось с подачи реформатора Петра I: в то время курение насаждалось практически насильно. Несмотря на информированность современного общества, распространение курения с каждым годом набирает обороты. Если раньше среди молодых людей старше 18 лет курящих было не более 10%, то сегодня это цифра увеличилась в два раза. А ведь уже давно доказано, что практически 30% онкозаболеваний связано именно с курением (остальные — это воздействие стресса, экологии, внешнего дыхания, вируса папилломы человека, генетические проблемы и др.). Кстати, табак приводит не только к развитию рака легкого, но и к раку молочной железы, гортани, мочевого пузыря.
Почему сигарета так долго остается популярным «развлечением» у нас, в Беларуси? Мы привыкли перенимать опыт Запада, однако там уже давно прошла никотиновая мода. Если раньше сигарета в руках у женщины считалась признаком самодостаточности, а у мужчины — мужественности, то сегодня все знают, что табак — это смерть замедленного действия. И курящий человек не вызывает уважения.
В Европе каждый пятый случай смерти от злокачественных новообразований связан с раком легкого (в Беларуси — 27,2%, то есть каждый четвертый).
Наихудшие последствия «табачной эпидемии» еще впереди, особенно среди женщин: когда сегодняшние молодые курильщики достигнут среднего или пожилого возраста, ежегодно в мире будут регистрировать около 10 млн. смертей.
У кого чаще диагностируют рак легкого: у мужчин или женщин?
Если 25 лет назад число женщин среди больных раком легкого составляло достаточно небольшой процент, то сегодня их число неуклонно растет. Статистика показывает, что только за последние 10 лет заболеваемость женщин раком легкого увеличилась с 8,2 на 100 тыс. до 10,9. Количество курящих женщин растет с небывалой скоростью — это еще одна проблема нашего общества. Правда до мужчин им пока далеко: заболеваемость раком легкого среди них составляет 84,7 на 100 тыс. случаев.
Какие существуют разновидности рака?
По морфологической структуре рак легкого принципиально делится на две группы: немелкоклеточный и мелкоклеточный (10-15 % от всех случаев рака легкого). Немелкоклеточный отличается более медленным развитием. С момента зарождения раковой клетки до образования опухоли, которую можно диагностировать с помощью рентгенограммы, проходит более 10 лет.
Мелкоклеточный рак характеризуется очень быстрым и бурным прогрессированием. Маленькая опухоль, не превышающая в диаметре 1 см, способна давать метастазы, поражающие печень, головной и косный мозг. Время удвоения объема данной опухоли (промежуток времени, в течение которого объем опухоли увеличивается в два раза) составляет в среднем 33 дня. Очень часто мелкоклеточный рак выявляется, когда в организме уже есть метастазы.
Также рак легкого делят по локализации на периферический и центральный. Периферический рак зачастую имеет шаровидную форму, исходит из мелких бронхов и локализуется в легочной ткани. Центральная опухоль поражает бронх крупного диаметра. Когда происходит полное его закрытие, часть легкого перестает дышать. Это можно диагностировать с помощью рентгенографии — на снимке часть легкого или все целиком будет затемнено. Если же в легких проходимость воздуха еще не потеряна, то увидеть опухоль на обычных рентгенограммах достаточно сложно. В таких случаях помогает бронхоскопия, компьютерная томография.
Вообще, человек, который несколько раз перенес пневмонию в одном и том же легком, обязательно должен сделать бронхоскопическое исследование, так как повторяющаяся пневмония, чаще всего, является признаком нарушения вентиляции легкого. Возможно, в этом месте растет опухоль.
Известны ли другие виды диагностики рака?
Сегодня оптимальным вариантом диагностики рака легкого является компьютерная томография. Есть специальные низкодозные компьютерные томографы, предлагаемые в качестве скрининга рака легкого, однако данные по поводу их эффективности и рационального соотношения затрат и реальной отдачи еще находятся в стадии обработки. Вообще же, рентгенологическое исследование человек обязательно должен делать хотя бы раз в год.
Можно перечислить симптомы развития рака легкого?
К сожалению, рак легкого, как и многие другие онкологические заболевания, не имеет специфических симптомов. Те симптомы, которые описаны в старых учебниках (кровохарканье, одышка, кашель, боль в грудной клетке), уже указывают на рак легкого как минимум III стадии. И в данном случае говорить об успехе лечения не приходится.
В Беларуси был период, когда существовала система флюорографических исследований.
Однако сейчас от нее отказались. Хотя программа и была задумана для выявления туберкулеза, она давала определенные результаты и в онкологической сфере. В результате сегодня у нас растет не только заболеваемость туберкулезом, но и рак легкого поздно диагностируется.
Опишите, что происходит в организме человека при каждой из четырех стадий онкозаболевания.
При первой стадии рака легкого опухоль имеет небольшие размеры — до 3 см в диаметре, без метастазов. В качестве лечения используется хирургическое вмешательство (удаляется только одна доля легкого). После этого человек может вернуться к полноценной жизни. Пятилетняя выживаемость пациентов приближается к 80%.
При второй стадии опухоль поражает близлежащие лимфоузлы. Когда заболевание достигает третей стадии, метастазы поражают все лимфоузлы грудной клетки и опухоль может прорастать в окружающие структуры. Кроме хирургического вмешательства, во время которого практически всегда удаляется легкое целиком, для лечения пациента понадобится провести лучевую и химиотерапию. С точки зрения трудоспособности, человек уже не будет считаться физически полноценным: он сможет выполнять только легкий физический труд.
При четвертой стадии опухоль дает отдаленные метастазы по всему организму (головной мозг, печень и т.д.), выживаемость пациентов в таких случаях не превышает 5%.
Каждый год в Беларуси выявляют более 4200 человек, заболевших раком легкого и, к сожалению, почти в 64% случаев болезнь находится на III-IV стадиях.
— В каком возрасте человек чаще заболевает раком легкого?
На данный момент онкопатологию чаще всего диагностируют у пациентов, достигнувших 60-70 лет и старше. Именно в этом возрасте происходит реализация эффекта от воздействия никотина и табачных смол на человека. До 39 лет заболевает 1 из 58 мужчин и 1 из 52 женщин; в возрасте 40-59 лет — 1 из 13 мужчин и 1 из 11 женщин, в возрасте 60-79 лет — 1 из 3 мужчин и 1 из 4 женщин. Но ведь курение — это не только рак легкого, но и, например, сердечнососудистые болезни. Ежегодно по причине употребления табака погибает 5 млн. человек. Ни одна прибыль от продажи сигарет не стоит такого «эффекта».
Как часто развивается рак легкого у пассивных курильщиков?
Часто слышу от обывателей утверждение: пассивное курение не влияет на здоровье. Если бы это соответствовало действительности, то сегодня медицинское сообщество не обсуждало бы тему о недоношенных детях, о развитии различных заболеваний у новорожденных. Наверняка каждый из нас неоднократно наблюдал, как молодые папа или мама курят возле коляски с ребенком. Так вот: у членов семьи курильщика рак легкого возникает в 1,5-2 раза чаще, чем в некурящих семьях. Пассивное курение при контакте с курильщиком на работе повышает риск развития онкозаболевания на 17%.
Между прочим, американцы уже давно столкнулись с такой проблемой, как развитие рака легкого у домашних животных, владельцами которых являются курильщики. Если пассивное курение пагубно влияет на здоровье питомцев, то на людей тем более.
В последнее время помимо привычных нам сигарет, люди стали курить и кальян. Насколько он вреден для здоровья?
Кальян — очень интересный прибор даже с точки зрения общественной гигиены. Ведь он не проходит санобработку после каждого использования. Откуда вы знаете, какой человек только что курил, используя этот кальян. Конечно, в барах, кафе никто не требует у посетителей справку о состоянии здоровья. Не удивлюсь, если внутри этого прибора мы обнаружим весь микробный спектр.
Во-вторых, кальян можно сравнить с курением трубки. Поскольку человек постоянно раздражает слизистую, трубка вызывает рак губы раньше, чем рак легкого. При курении кальяна происходит примерно то же самое.
Как предохранить себя от рака легкого: существует ли его профилактика?
Табак — единственный товар народного потребления, убивающий большинство своих потребителей! Чтобы решить данную проблему, государство должно проводить более жесткую антитабачную политику (один из шагов в этом направлении — закон о запрете курения в общественных местах). Не стоит оставлять без внимания и общественную культуру: если человек сам не понимает, что курение приводит к раку легкого и сигареты в принципе вредны для здоровья, то Министерство здравоохранения тут не поможет.
Пару лет назад во время одного интервью я сказал, что сигареты должны продаваться в магазинах химреактивов, потому что весь спектр таблицы Менделеева, включая самые вредные вещества, есть в сигаретах. Вообще я курильщиков сравниваю с самоубийцами: обычно человек не спрыгивает с окна — он знает, что может разбиться. А вот табак люди употребляют осознанно лишь потому, что рак легкого возникает не сразу, а спустя 20-30 лет после начала курения.
Если говорить об антитабачной программе в широком смысле слова, то она должна быть комплексной и межотраслевой и содержать следующие последовательные действия:
- Запрет курения в общественных местах и на работе (на остановках, в кафе, ресторанах, гостиницах и т.д.).
- Повышение цены на сигареты.
- Изъятие сигарет из мест общей торговли (особенно у касс).
- Проведение экологических мероприятий, направленных на снижение выброса газов в атмосферу и общее улучшение экологической обстановки и условий труда.
- Переход на использование экологически безопасного транспорта.
- Ограничение въезда автомобилей в центр города.
- Развитие велотранспортной инфраструктуры.
Заболеваемость злокачественными новообразованиями в странах Европейского Союза за последние 10-15 лет снизилась на 15% в результате воплощения в жизнь программы «Европа против рака».
Но главное — воспитание физической культуры (в полном смысле этого слова) у людей с раннего детства. Ее отсутствие — вот одна из причин терпимости по отношению к табакокурению. Если в семье родители курят, то глупо надеяться на то, что дети не будут этого делать.
Кстати, стоит обратить внимание общественности на электронные сигареты — они помогают избавиться от табачной зависимости.
Хирургическое лечение рака лёгкого
Хирургическая резекция (удаление части лёгкого, пораженной опухолью) является одним из наиболее эффективных методов лечения немелкоклеточного рака легкого. Такая операция подходит не всем. Для оценки возможности хирургического лечения рака легкого необходимо определить стадию заболевания (с помощью ПЭТ/КТ) и спрогнозировать переносимость операции (оценить степень проявления сопутствующих заболеваний, функцию легких и сердца, а также реабилитационный потенциал пациента). Всестороннее обследование имеет большое значение при подготовке к операции!
Методы хирургического лечения рака лёгкого:
Выбор метода радикального хирургического лечения рака легкого зависит от локализации опухоли, ее размеров, признаков прорастания соседних структур и поражения лимфатических узлов. По объему можно выделить следующие хирургические операции:
- Лобэктомия – удаление одной доли легкого. Является основной выполняемой при периферическом раке легкого операцией. Позволяет сохранить большую часть легочной ткани, поэтому, как правило, не влияет на функцию дыхания в последующем. В то же время, обеспечивает хорошую радикальность вмешательства в большинстве случаев периферического рака легкого ранних стадий.
- Пневмонэктомия – удаление всего легкого. Выполняется при центральном расположении опухоли, вовлечении в процесс главного бронха или крупных сосудов. Может приводить к ограничению переносимости физических нагрузок в отдаленном периоде после операции, что, однако, оправдано, если в результате операции достигается полное удаление опухоли.
- Билобэктомия и лобэктомия с бронхопластикой или ангиопластикой – хирургические операции, занимающие по объему промежуточное положение между двумя предыдущими видами операций. Целью их является сохранение максимально возможного объема легочной ткани при удалении распространенных опухолей легкого. Данный объем операции может позволить избежать пневмонэктомии и сохранить хорошую дыхательную функцию при достаточной радикальности операции.
- Сегментэктомия – удаление сегмента – части доли легкого. Данная операция возможна только при малых размерах опухоли (1 стадия) и используется у пациентов со значительно сниженной функцией легких при опасности выполнения им лобэктомии. В последние годы появились данные о достаточной радикальности этой операции у пациентов с ранней стадией аденокарциномы in situ.
- снизить травматичность хирургического вмешательства,
- ускорить восстановление физической активности,
- уменьшить выраженность болевого синдрома,
- значительно сократить сроки лечения,
- добиться хорошего косметического эффекта.
Преимущества ЕМС:
В EMC операции выполняют опытные торакальные хирурги-онкологи, владеющие всеми современными хирургическими методиками. Это:
- главный внештатный специалист-торакальный хирург Департамента здравоохранения города Москвы, к.м.н. Евгений Тарабрин;
- руководитель Хирургической клиники EMC, к.м.н. Андрей Волобуев.
В ЕМС доступны все современные методики лечения рака лёгкого:
- Хирургическое вмешательство. Этому виду лечения отдается предпочтение в случае рака легкого I или II стадии.
- Послеоперационная адъювантная химиотерапия. Улучшает выживаемость у пациентов с II стадией заболевания, в некоторых случаях может быть рекомендована пациентам с IB стадией заболевания.
- Стереотаксическая лучевая терапия (SBRT) или традиционная лучевая терапия. Проводится пациентам с I или II стадией заболевания, которым не может быть выполнена хирургическая резекция.
- Фотодинамическая терапия также может быть полезной в качестве первичного лечения у пациентов с поверхностными поражениями дыхательных путей.
- Комбинированная химиолучевая терапия. Применяется в случае гистологически подтвержденной III стадией заболевания.
Прогнозирование объема операции проводится по результатам обследования и совместным решением междисциплинарного консилиума EMC.
Рак легких — прогноз выживаемости
Заведующая онкологическим отделением в клинике Ихилов.
Онколог с 20-летним стажем.
Задать вопрос
Содержание
Как пройти дистанционное лечение рака в Израиле во время эпидемии коронавируса?
Выживаемость в отношении рака легких – это очень серьезная тема. Большинство людей, получивших диагноз “рак легких”, понимают, что существует вероятность не пережить это заболевание.
По статистике, приблизительно 25% пациентов с данным диагнозом являются потенциальными кандидатами на полное излечение с точки зрения хирургического вмешательства. У оставшихся 75% больных обнаруживаются неоперабельные опухоли, так как рак уже перешел в позднюю стадию развития или распространился в лимфатические узлы.
Прогноз при операбельных опухолях
Итак, 25% больных приходят к врачу с локализованной опухолью. Это, как правило, рак 1-й или 2-й стадии, при котором заболевание ограничивается пределами легкого. В некоторых случаях патология распространяется в местные – но не отдаленные по сравнению с первичной опухолью – лимфатические узлы. Таким пациентам обычно назначают хирургическую операцию.
Уточнить цену у специалиста
При раке легких могут быть выполнены:
- удаление доли легкого;
- полное удаление легкого.
При небольших опухолях хирург удаляет примерно половину легкого – так называемую “долю”. Оперативное вмешательство в данной ситуации носит название “лобэктомия” и подразумевает удаление сегмента легкого, содержащего опухоль, вместе с близрасположенными небольшими лимфатическими узлами.
Около 50% пациентов, перенесших лобэктомию, полностью вылечиваются от рака легких. У другой половины, к сожалению, наблюдается рецидив. Поэтому даже среди 25% пациентов с локализованной опухолью рак рецидивирует примерно у половины больных.
Прогноз при неоперабельном раке легких
75% пациентов с неоперабельными опухолями пройдут курс лечения, включая, к сожалению, лечение достаточно тяжелыми препаратами. Им назначают химиотерапию, облучение радиацией. Примерно у 10% таких больных отмечается длительная выживаемость.
Итак, подавляющее большинство – около 70% – пациентов с раком легких, к сожалению, рано или поздно умирают от этого заболевания. Тем не менее, в последнее время показатели выживаемости возросли. Пусть даже у 70% пациентов выживаемость не превышает 5 лет, общая статистика значительно улучшилась. Сейчас даже больные метастатическим раком легких живут 1 или 2 года. Сейчас достигнута точка в развитии медицины, когда примерно 50% всех пациентов с метастатическим раком легких живут приблизительно 1 год начиная с момента постановки диагноза. Между тем, в прошлом данный показатель составлял лишь 10-20%.
В целом, за последние несколько десятилетий показатели выживаемости увеличились в 2 раза. Хотя рак легких остается тяжелым заболеванием, плохо поддающимся лечению – особенно в случаях, когда хирургическая операция противопоказана или нецелесообразна, – статистика выживаемости значительно улучшилась благодаря изобретению более эффективных методов лечения рака в Израиле.
Как качество препаратов влияет на излечение от рака
Медикаментозное лечение (химиотерапия, таргетная и иммунная терапия) является основным на поздних стадиях рака легких. В этом случае успех лечения зависит главным образом от качества лекарств. Оптимальный вариант – приобрести израильские препараты, соответствующие самым высоким мировым стандартам.
- Подделка медикаментов в Израиле полностью исключена.Законом предусмотрена уголовная ответственность аптеки и фармацевта за продажу некачественного препарата. Израильский Минздрав постоянно организует контрольные закупки лекарств в аптеках.
- В Израиле инновационные лекарства быстро проходят лицензирование.В отличие от некоторых других стран, например США, здесь нет долгой бюрократической процедуры утверждения новых препаратов.
- В Израиле работает крупнейшая фармацевтическая компания – TEVA. Продукцию этой компании используют в 60 странах мира.
Где можно приобрести лекарства израильского производства?
- В Израиле. Пройдя обследование в онкоцентре Ихилов, вы сможете приобрести назначенные вам препараты в израильской аптеке.
- По месту жительства. Онкоцентр предоставляет пациентам медицинские услуги онлайн – в рамках телемедицины. В этом случае вы сможете заказать на дом лекарства, которые выпишет вам израильский онколог после дистанционной консультации.
Узнать правильно ли назначено лечение
5 советов израильского врача по лечению рака легких
- Убедитесь в правильности поставленного вам диагноза.Примерно в 30% случаев у пациентов с постсоветского пространства, которые приезжают в Израиль для лечения рака легких, неправильно определен вид опухоли. Поэтому имеет смысл привезти в израильскую клинику стекла или блоки с материалом биопсии – и израильские патологи выполнят их проверку (ревизию).
- Поинтересуйтесь, показана ли вам ПЭТ-КТ. Это исследование позволяет точно определить распространенность онкологического процесса в легких и обнаружить все очаги опухоли.
- Узнайте, можно ли в вашем случае заменить открытую операцию торакоскопической. Такое вмешательство не требует вскрытия грудной клетки – оно выполняется через небольшие разрезы между ребрами. Это облегчает послеоперационное восстановление пациента. Торакальные хирурги онкоцентра Ихилов имеют большой опыт проведения таких операций.
- Выясните у специалиста, какие новые методы лечения вашего вида опухоли появились в последнее время. Израильские онкологи знают, что инновационные протоколы лечения, включающие таргетные и иммунные препараты, внедряются в клиническую практику постоянно. Такое лечение будет более эффективным и безопасным.
- Если вам назначена дистанционная лучевая терапия, узнайте, есть ли возможность применить технологию IGRT (радиотерапию под визуальным контролем). Этот метод, широко используемый в Израиле, позволяет более точно облучить опухоль, расположенную в движущемся органе – в том числе в легких, которые смещаются при дыхании. В этом случае радиация не повредит окружающие здоровые органы и ткани.
Стоимость лечения рака легких в Израиле
Приведем расценки на некоторые диагностические и лечебные процедуры при раке легких в онкоцентре Ихилов.
| Вид диагностики или лечения | Стоимость |
| Компьютерная томография | 423$ |
| Прием онколога | 511$ |
| Лабораторное исследование на мутацию гена KRAS | 124$ |
| Лабораторное исследование на онкомаркер CEA | 16$ |
| МРТ | 708$ |
| Молекулярный анализ генотипа опухоли | 2844$ |
| Операция по удалению опухоли | 9461$ |
| ПЭТ-КТ | 1533$ |
Бесплатный Онкотест Онкоцентра Ихилов
НачатьПочему стоит лечить рак легкого в Израиле, в онкоцентре Ихилов?
- Персонализированный подход. Лечение рака легких в Израиле проводится с учетом молекулярно-генетического профиля опухоли. Это значит, что протоколы лечения подбираются индивидуально для каждого больного, после тщательной диагностики. В результате каждый пациент получает те препараты, которые наиболее эффективны именно для него.
- Врачи с мировым именем. В онкоцентре Ихилов лечением рака легких занимается профессор Офер Меримский – автор более 200 научных работ, всемирно известный онколог. Он проводит терапию по уникальным авторским протоколам.
- Новейшее оборудование. Онкоцентр располагает современным оборудованием для диагностики и лечения рака легких:
- Электромагнитная навигационная система SuperDimension Bronchus system дает возможность взять биопсию даже из труднодоступных участков легких.
- Линейный ускоритель Novalis TrueBeam STХ позволяет с максимальной точностью облучать опухоли легких высокими дозами радиации, не повреждая здоровые ткани.
Как начать лечение в Израиле?
Чтобы пройти лечение рака лёгких, вам нужно обратиться в онкологический центр, позвонив по номеру +7-495-777-6953 или +972-3-376-03-58. А также Вы можете оставить заявку на сайте, заполнив нужные поля. Наши консультанты перезвонят вам в течение 2 часов.
Вскоре вы получите план лечения рака лёгких в Израиле с предварительной ценой. Составление данного документа не обязует вас ни к каким действиям и является полностью бесплатным. К тому же нами гарантируется конфиденциальность всей предоставленной информации и соблюдение врачебного этикета.
[starbox]
Рак легкого 1 стадии | Лечение в Москве на системе Кибер-Нож
Особенности рака 1-й степени
Для определения стадии рака необходимо учитывать его гистологию. При мелкоклеточном раке степень распространения опухоли на другие органы и системы может быть:
- ограниченной,
- обширной.
В первом случае раковые клетки локализируются лишь в одном легком и расположенных рядом тканях. Во втором злокачественная опухоль выходит за пределы легкого, в котором образовалась изначально, и поражает отдаленные органы или ткани груди.
Немелкоклеточный рак легкого имеет шесть стадий развития, каждая из которых отличается индивидуальными особенностями.
Скрытая стадия. Опухоль, как таковая, в легком еще не образовалась. Раковые клетки могут быть обнаружены в мокроте или в жидкости, взятой для бронхоскопии.
Нулевая стадия. Раковые клетки находятся только в слизистой оболочке легкого. На данном этапе у больного диагностируется карцинома.
Первая стадия. Опухоль разрастается по всему легкому, поражая его глубокие ткани.
Вторая стадия. Злокачественное новообразование метастазирует в лимфатические узлы.
Третья стадия. Клетки опухоли обнаруживаются в соседних органах, диафрагме, стенке грудной клетки, сосудах, лимфатических узлах, а также в удаленных частях организма.
Четвертая стадия. Опухоль поражает более одной доли легкого или второе легкое, дает метастазы в удаленные органы – головной, мозг печень, кости.
Злокачественная опухоль при первой стадии рака имеет размеры от 3 до 5 сантиметров. Если ее клетки локализированы в одном сегменте легкого, то подобное заболевание называется периферическим раком, если же в пределах области бронха – то центральным раком. На данном этапе заболевания метастазы отсутствуют, так же, как и поражение опухолью лимфоузлов.
Рак легкого 1-й стадии имеет две степени.
Степень 1 А характеризуется максимальным размером опухоли до 3-х сантиметров. Пятилетняя выживаемость на данном этапе заболевания составляет 60 – 75 % при немелкоклеточном раке и около 40 % при мелкоклеточном.
Степень 1 В характеризуется наибольшим диаметром опухоли от 3 до 5 сантиметров, неповреждением лимфатических узлов и других частей тела больного. Пятилетняя выживаемость на данном этапе составляет от 45 до 60 % при немелкоклеточном раке и около 25 % при мелкоклеточном.
Как показывает практика, рак на 1-й стадии диагностируется лишь у 15 % больных, так как он протекает бессимптомно. Именно поэтому нельзя забывать о регулярных медицинских проверках и обследованиях, особенно тем, кто попадает в группу риска. К ним в первую очередь относятся курильщики.
К обследованиям, способным выявить рак легкого на 1-й стадии относятся:
- флюорография грудной клетки,
- рентгенография легкого,
- компьютерная томография (для диагностики рака проводится спирально-винтовой срез),
- анализ на мокроту,
- бронхоскопия.
Последние два вида исследований особенно рекомендованы для курильщиков. Анализ на мокроту может выявить нахождение в ней атипичных клеток, что может означать наличие опухоли легкого.
Бронхоскопия позволяет обнаружить опухоль зрительно и провести ее биопсию.
Лечение рака 1-й степени
Основным способом лечения рака на 1-й стадии является хирургическое вмешательство. Наряду с ним врач-онколог может назначить химиотерапию, лучевую терапию и различные медикаменты.
Прогноз для больных раком легкого на 1-й стадии весьма благоприятен, если, конечно, лечение начато своевременно.
В каждом отдельном случае стоимость определяется на основании показаний к лечению, необходимого количества фракций и плана лечения разработанного врачом радиационным онкологом и медицинским физиком.
Подробную информацию о лечении рака легкого 1-й стадии на системе «КиберНож» Вы можете получить у наших специалистов центра лучевой терапии «Онкостоп» по телефону +7 (495) 085-79-02
Рак легких — не приговор! История пациентки Клиники Спиженко
Рак легких. По статистике, курение предопределяет до 90% случаев этого заболевания. Курение — главный фактор развития злокачественной опухоли легкого, но не единственный.
По словам доктора Олега ЯРМАКА, заведующего департаментом лучевой терапии Клиники Спиженко, довольно часто рак легких развивается у людей, которые ведут здоровый образ жизни. Факторами риска для возникновения этого заболевания могут послужить также негативное влияние загрязненного воздуха, окружающей среды и генетическая предрасположенность.
Более 11-ти лет назад у нашей пациентки Екатерины был диагностирован рак — умеренно дифференцированная аденокарцинома легкого. Опасная опухоль, которая увеличивается в объеме и метастазирует в другие органы в считанные месяцы. Путь Екатерины к выздоровлению был долгим, по сути, борьба не прекращалась никогда, но современные технологии лечения рака и раннее диагностирование опухоли дали свой результат.
Екатерина прошла через хирургическое лечение, химиотерапию, “операции” на системе КиберНож, лучевую терапию… Пускай эта история, рассказанная супругом нашей пациентки, станет примером бережной заботы о своем здоровье для тех, кто еще не осознал важность регулярных профилактических осмотров, а также вдохновением и поддержкой тем, кто борется с онкологическим заболеванием.
Врач обнаружил маленькую опухоль легкого на флюроограмме…
Мы живем в Одессе, оба — врачи. Я — хирург, жена — гинеколог, оба на пенсии. Жена заболела в 2007-м году. Даже у врачей в медицинских учреждениях есть медицинские профосмотры. Моя супруга работала в стационаре достаточно крупной больницы, в декабре 2007-го года у них проходил ежегодный медпрофосмотр, который также включал флюорографию органов грудной клетки.
На флюроограмме врач обнаружил маленькую опухоль легкого, новообразование небольшого размера, после чего последовали рентгенограмма и компьютерная томография.
В то время в Украине не было КиберНожа, но по своим параметрам — размерам, гистологическому диагнозу (умеренно дифференцированная аденокарцинома), опухоль могла быть пролечена КиберНожом. Но тогда в нашей стране такой технологии не было и, по правде говоря, мы мало что знали о ней — это был 2007-й, а ваша клиника открылась в 2009-м.
Поэтому было принято решение об оперативном лечении. Супруге удалили целое легкое, и мы в течении 5-ти лет жили тихо и спокойно.
В январе 2013 года на контрольном исследовании у нас диагностировали метастазы основного заболевания в головной мозг и позвоночник.
Мы, как врачи, знали о том, что несколько лет назад в Киеве открылась Клиника Спиженко, где был единственный на тот момент робот КиберНож не только в Украине, но и в Восточной Европе. Опять же как врачи мы знали, что КиберНож дает хороший результат. Поэтому, когда у нас обнаружили осложнения основного заболевания, я сразу же зашел на сайт, нашел телефон и позвонил в клинику.
Пообщавшись с врачом-координатором, который осведомился о размере метастазов и локализации новообразований, в ответ я услышал: “Приезжайте, вы наш пациент”. И через день-два мы приехали в клинику.
Тогда мы прошли лечение на системе КиберНож: 2 сеанса на головной мозг и 5-ть сеансов — на позвоночник.
Персональная благодарность нашему постоянному лечащем врачу Олегу Григорьевичу Ярмаку, с которым мы остаемся на связи вот уже на протяжении 5-ти лет. После лечения первичного заболеваний мы регулярно, каждые три месяца, проходим контрольные исследования (МРТ головного мозга с контрастом и КТ органов грудной клетки и органов брюшной полости) у себя в Одессе и отправляем диски в клинику, где врачи смотрят их и дают нам свои рекомендации.
Мы в клинике четвертый раз…
Мы в клинике четвертый раз. Второй раз здесь мы были в 2015-м году, когда у нас был метастаз в позвоночник (новая локализация) и мы прошли лечение на КиберНоже.
В феврале 2017-го, спустя два года, нам сказали, что есть необходимость приехать на лечение. Олег Григорьевич посмотрел диски, собрал врачей на консилиум, где обсудили нашу ситуацию. Тогда у нас выявили новые метастазы в левом легком. Лечение состояло из 25-ти сеансов на линейном ускорителе. На КиберНоже лечение не требовалось, так как не было новообразований ни в головном мозге, ни в позвоночнике.
Ну и вот, буквально в сентябре 2018-го, мы снова пошли на контроль и снова обнаружили новый, небольшой единственный метастаз в головной мозг. После первого лечения на КиберНоже прошло 5,5 лет, головной мозг ничего не требовал. Это новый метастаз, величиной менее 1 сантиметра. В конце августа у супруги опять появились боли в спине, там также обнаружили новые очаги заболевания. Сейчас мы проходим лечение: 1 сеанс КиберНожа на головной мозг и 10 сеансов лучевой терапии на позвоночник. Мы в процессе лечения.
До появления КиберНожа рак легкого был приговором…
Мы безусловно довольны результатами лечения, потому что будучи врачами, отдаем себе полный отчет о тяжести этого заболевания. И раньше такие варианты были невозможны, до появления КиберНожа рак легкого был приговором. КиберНож — это суперсовременный метод лечения, который, с моей точки зрения, эффективный.
От супруги персональная благодарность врачам Клиники Спиженко, которые все эти годы вместе с нами: Олегу Григорьевичу Ярмаку, Юлии Павловне Копаневой, Татьяне Ильиничне Чеботаревой, Олегу Анатольевичу Шараевскому.”
О.Г. Ярмак, зав. департаментом лучевой терапии Клиники Спиженко, лучевой терапевт, врач высшей категории:
Олег Григорьевич Ярмак
Рак легких — одно из наиболее агрессивных онкологических заболеваний. Аденокарцинома легких составляет 40-50% случаев немелкоклеточного рака легких. Чаще всего опухоль локализуется в периферических отделах и имеет высокую склонность к метастазированию (часто — в головной мозг).
Основными методами лечения на I-II-й стадиях являются оперативное и химиолучевое лечение. В запущенных III-IV-й стадиях, которые наиболее часто диагностируются у наших пациентов, основной метод лечения — химиолучевая терапия.
Среднестатистическая выживаемость при метастазах в головной мозг составляет от 3-х до 9-ти месяцев…
Данные по выживаемости. Рак легких
КТ, гистопатологические характеристики и прогностическое значение
Визуализация рака. 2011; 11 (1): 237–246.
, a , a, b , a , c , a , a , a и aОтделение Zhi-gang Chu
a9000 радиологии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, China; b Государственная ключевая лаборатория биотерапии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; c Кафедра патологии Западно-Китайского стоматологического колледжа Сычуаньского университета, No.14, раздел 3, People’s South Road, Chengdu, Sichuan 610041, China
Zhi-gang Yang
a Отделение радиологии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; b Государственная ключевая лаборатория биотерапии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; c Кафедра патологии Западно-Китайского стоматологического колледжа Сычуаньского университета, No.14, раздел 3, People’s South Road, Chengdu, Sichuan 610041, China
Heng Shao
a Отделение радиологии, Западно-Китайская больница, Университет Сычуани, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; b Государственная ключевая лаборатория биотерапии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; c Кафедра патологии Западно-Китайского стоматологического колледжа Сычуаньского университета, No.14, раздел 3, People’s South Road, Chengdu, Sichuan 610041, China
Zhi-yu Zhu
a Отделение радиологии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; b Государственная ключевая лаборатория биотерапии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; c Кафедра патологии Западно-Китайского стоматологического колледжа Сычуаньского университета, No.14, раздел 3, People’s South Road, Chengdu, Sichuan 610041, China
Wen Deng
a Отделение радиологии, Западно-Китайская больница, Университет Сычуани, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; b Государственная ключевая лаборатория биотерапии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; c Кафедра патологии Западно-Китайского стоматологического колледжа Сычуаньского университета, No.14, раздел 3, People’s South Road, Chengdu, Sichuan 610041, China
Shi-si Tang
a Отделение радиологии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, China; b Государственная ключевая лаборатория биотерапии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; c Кафедра патологии Западно-Китайского стоматологического колледжа Сычуаньского университета, No.14, раздел 3, People’s South Road, Chengdu, Sichuan 610041, China
Jing Chen
a Отделение радиологии, Западно-Китайская больница, Университет Сычуани, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; b Государственная ключевая лаборатория биотерапии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; c Кафедра патологии Западно-Китайского стоматологического колледжа Сычуаньского университета, No.14, раздел 3, People’s South Road, Chengdu, Sichuan 610041, China
Yuan Li
a Отделение радиологии, Западно-Китайская больница, Университет Сычуани, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; b Государственная ключевая лаборатория биотерапии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; c Кафедра патологии Западно-Китайского стоматологического колледжа Сычуаньского университета, No.14, секция 3, People’s South Road, Чэнду, Сычуань 610041, Китай
a Отделение радиологии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; b Государственная ключевая лаборатория биотерапии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, Китай; c Кафедра патологии Западно-Китайского стоматологического колледжа, Сычуаньский университет, № 14, секция 3, People’s South Road, Чэнду, Сычуань 610041, Китай
Автор, отвечающий за переписку.Корректный адрес: Чжи-ган Ян. Отделение радиологии, Западно-Китайская больница, Сычуаньский университет, 37 # Guo Xue Xiang, Chengdu, Sichuan 610041, China. Электронная почта: nc.moc.oohay@7111gzgnay Авторские права © 2011 Международное общество визуализации рака Эта статья цитируется в других статьях в PMC.Abstract
С момента появления компьютерной томографии (КТ) обнаружение малого рака легких, особенно небольшой периферической аденокарциномы, стало обычным явлением. В последнее время были тщательно изучены морфологические характеристики, включая КТ тонких срезов и патологические данные, а также прогноз малых периферических аденокарцином легких.Рентгенологические и микроскопические данные хорошо коррелируют друг с другом и тесно связаны с прогнозом опухоли. Что наиболее важно, некоторые подтипы аденокарциномы легких со специфическими КТ или патологическими особенностями излечимы. Следовательно, все определяющие характеристики (КТ, патологические и прогностические) этого вида опухоли должны быть интегрированы, чтобы улучшить наше понимание, предоставить рекомендации по лечению и точно оценить его прогноз.
Ключевые слова: Новообразования легких, аденокарцинома, КТ, гистопатология, прогноз
Введение
Рак легкого — одно из наиболее распространенных злокачественных новообразований и проблема общественного здравоохранения во всем мире, которая часто проявляется на поздней стадии диагностики, быстро и быстро прогрессирует. имеет плачевный клинический исход.Эти характеристики особенно характерны для периферических опухолей, у которых отсутствуют общие признаки и другие контрольные симптомы рака легких на стадии лечения. В свете этого было предложено раннее обследование на рак легких с надеждой на снижение смертности. Рентгенография грудной клетки (CXR) первоначально использовалась для скрининга, но ее эффективность не была доказана из-за ограничений в обнаружении опухолей меньшего размера [ 1 , 2 ] . В последние годы компьютерная томография (КТ) с низкой дозой широко используется для скрининга рака легких, и было подтверждено, что она чувствительна к небольшим легочным узелкам [ 3–12 ] .Кроме того, ежегодный КТ-скрининг выявляет излечимый рак легких и существенно улучшает 10-летнюю выживаемость пациентов с раком легких [ 13 , 14 ] .
Среди периферических форм рака легких наиболее распространенным гистологическим типом является аденокарцинома, заболеваемость которой в последние годы заменила плоскоклеточный рак [ 15–17 ] . При КТ-скрининге большинство обнаруженных периферических раковых заболеваний легких представляли собой аденокарциномы размером 2 см или менее в диаметре (также известные как небольшие аденокарциномы периферических легких) [ 4 , 18–22 ] .Скорость метастазов в лимфатические узлы в этих небольших аденокарциномах была значительно ниже, чем в аденокарциномах размером от 2,1 до 3 см [ 20 ] . Кроме того, некоторые были вылечены ранним вмешательством [ 7 , 23 ] . По этим причинам очень важны диагностика и оценка этих опухолей. В недавних исследованиях КТ и гистопатологические данные, а также прогноз небольших аденокарцином периферических легких были хорошо изучены [ 15 , 16 , 21–32 ] .В результате был идентифицирован ряд радиологических и патологических характеристик, которые более ценны, чем стадия TNM для оценки прогноза опухоли.
Результаты предыдущих исследований показали, что понимание особенностей визуализации и соответствующей гистопатологической основы малых аденокарцином периферических легких может быть очень полезным для ранней диагностики, вмешательства и прогнозирования послеоперационного прогноза. Кроме того, такие данные послужили основой для адекватного хирургического лечения таких опухолей.Таким образом, все определяющие характеристики (КТ, патологические и прогностические) этого вида опухоли должны быть объединены, чтобы улучшить наше понимание, предоставить рекомендации по лечению и точно оценить его прогноз.
КТ с низкой дозой как предпочтительный инструмент для обнаружения небольших периферических форм рака легких
Ключом к снижению смертности пациентов с раком легкого является раннее обнаружение, диагностика и резекция. Однако ранний рак легких (стадия I или II) обычно протекает бессимптомно и выявляется случайно при визуализации грудной клетки, выполняемой по другим причинам [ 33 ] , после чего возможен и проводится эффективный скрининг на опухоли.В течение 1980-х годов в трех крупных медицинских центрах США было проведено крупное популяционное рандомизированное контролируемое исследование с целью выявления рака легких с помощью рентгенографии. Хотя были обнаружены некоторые виды рака легких и пациенты прошли агрессивное лечение, рентгенография не улучшила 5-летнюю выживаемость [ 1 , 2 ] . Кроме того, последующие исследования подтвердили этот вывод и выявили ограничения рентгенографии при скрининге [ 34–36 ] .Существенные недостатки рентгенографии, включая ограниченную визуализацию поражений и наложение структур, сделали невозможным повышение скорости обнаружения малого периферического рака легкого [ 37 ] . Следовательно, необходимо разработать другой, более чувствительный метод скрининга.
КТ с малой дозой и уменьшенным током через трубку был разработан и используется недавно. Это существенно снижает дозу облучения без существенной потери качества изображения. Он имеет относительно высокую клиническую ценность для широкого применения с наибольшим преимуществом в обнаружении небольших узелков в легких.Узелки, часто обнаруживаемые при КТ с низкой дозой, были разделены на 2 типа: кальцинированные и не кальцинированные. Кальцинированные узелки считались доброкачественными, тогда как некальцинированные узелки, включая помутнения из матового стекла (GGO), а также частично твердые и твердые узелки () были рекомендованы для дальнейшего исследования в зависимости от размера, поскольку их природа не могла быть определена [ 7 ] . Несколько исследований показали, что КТ с низкой дозой является наиболее эффективным методом выявления рака легких на ранних стадиях [ 4 , 5 , 7–9 , 18 , 19 , 38–40 ] .Частота обнаружения, достигнутая с помощью КТ с низкой дозой, была значительно выше, чем с использованием традиционной рентгенографии, и варьировалась от 0,43% до 2,7% в скрининговых популяциях, и большинство обнаруженных опухолей находились на стадии I [ 4 , 5 , 7 , 18 , 39 , 41 ] . Количество исследований небольших периферических аденокарцином легких увеличилось, предположительно, из-за увеличения частоты выявления рака легких с использованием КТ с низкой дозой, и мы получили глубокое понимание их радиологических и патологических особенностей, а также связанного с ними прогноза. .
Различные типы узелков, которые часто обнаруживаются с помощью КТ с низкой дозой при скрининге на рак легких. (а) Узелок GGO не закрывает паренхиму легких. (b) Частично твердый узелок частично скрывает паренхиму легкого. (c) Твердый узелок с короткими шипами полностью закрывает паренхиму легкого.
Факторы, влияющие на видимость малых форм рака легких при обычном рентгеновском исследовании
Обычный рентгеновский снимок не подходит для скрининга рака легких из-за его неспособности обнаруживать узелки меньшей или меньшей плотности.Этот дефект тесно связан с характеристиками опухоли [ 3 , 42-44 ] . Выявление небольших периферических форм рака легких на рентгенографии напрямую зависит от размера опухоли, оптического контраста и градиента, а также плотности [ 3 , 44 ] . Как правило, видимые опухоли больше невидимых. Лишь небольшая часть узелков (≤20 мм) была видна на CXR [ 3 ] .Для видимости узелков на рентгенографии также требуется оптическая плотность 0,1–0,3 OD и градиент 0,03–0,11 OD мм -1 [ 44 ] . Плотность и разница в плотности между узелком и его периферией, измеренные на КТ, были выше для видимых опухолей, чем для невидимых опухолей [ 44 ] . Патологически контраст, градиент и плотность КТ опухолей зависят от типа опухоли. Опухоли с более высокой степенью локализованной бронхиолоальвеолярной карциномы (BAC), проявляющейся как GGO на КТ, были менее заметны на CXR [ 45 ] ; это было связано с тем, что остаточный газ в BAC уменьшал плотность опухолей.Кроме того, опухоли с плохо очерченными краями и опухоли, расположенные в верхней доле или в скрытых зонах легких с перекрывающимися грудными компонентами, было труднее обнаружить [ 3 , 46 ] .
Гистопатологические особенности малой аденокарциномы периферического легкого
Наряду с увеличением заболеваемости малой аденокарциномой периферического легкого при КТ, было проведено исследование ее гистопатологических и биологических характеристик, которые могут быть связаны с прогнозом опухоли, и были получены некоторые очень полезные прогностические показатели идентифицированы.Основываясь на характеристиках роста, характер роста небольших аденокарцином периферических легких был разделен на лепидный (замещающий) рост и гилический (незамещающий) рост [ 38 ] . Noguchi et al. [ 47 ] рассмотрел гистологию небольших периферических аденокарцином и сгруппировал их по 6 отличительным подтипам: тип A, хорошо дифференцированный локализованный BAC; тип В — локализованная БАХ с очагами структурного коллапса альвеол; тип С — локализованный БАК с очагами активной пролиферации фибробластов; тип D, низкодифференцированная аденокарцинома, демонстрирующая в основном плотный рост и незначительные папиллярные или тубулярные структуры роста; тип E, тубулярная аденокарцинома; и тип F, папиллярная аденокарцинома с экспансивным и деструктивным типом роста.Типы A, B и C демонстрируют структуру роста замещающей опухоли; типы D, E и F демонстрируют образец роста опухоли без замены [ 48 ] . Участки с лепидным и хиликовым типом роста были замечены с нетвердыми и твердыми компонентами, соответственно. Помимо компонента BAC, главными компонентами аденокарцином [ 49 ] были разрушенные альвеолы, разрушенные альвеолы с BAC, опухолевые клетки, пролиферированные фибробласты и слизь.
При периферических аденокарциномах легких очень часто встречается центральный фиброз.Стромальный эластоз имел 2 гистоморфологических образца: сохранившийся каркас, состоящий из равномерно толстой стромы из-за сокращения и утолщения альвеолярных стенок, и разрушенный каркас, указывающий на инвазию стромы при центральном фиброзе [ 29 ] . Различные паттерны стромального эластоза были связаны с различной скоростью роста и клиническим исходом.
КТ с тонкими срезами аденокарцином малых периферических легких
Поскольку гистологические особенности малых аденокарцином периферических легких различаются, понятно, что характеристики КТ, которые они отражают, также различаются.Как правило, некальцинированные узелки на КТ имеют 3 основных вида: плотный тип, полностью скрывающий всю паренхиму легкого внутри него; нетвердый тип без затемнения с вовлечением паренхимы легких; и частично твердый тип, состоящий как из твердых, так и из нетвердых областей. При КТ-скрининге на рак легких обычно выявлялись нетвердые или частично твердые узелки с GGO, которые с большей вероятностью были злокачественными, чем твердые узелки [ 50 ] . Помимо карциномы легких, GGO также наблюдается при очаговом интерстициальном фиброзе, воспалении и кровотечении.Однако сохранение GGO с течением времени, особенно когда узелок или включенный твердый компонент увеличился в размере, может сильно указывать на злокачественную опухоль на ранней стадии [ 51 ] .
Ян и др. . [ 42 , 43 ] классифицировал небольшие аденокарциномы периферического легкого на четыре типа на тонких срезах КТ-изображений на основе распределения плотности в узелках и характера роста опухоли. Тип I представлял собой четко выраженный узелок чистого GGO, показывающий лепидный рост без альвеолярного коллапса () [ 52 , 53 ] .Тип II представлял собой гетерогенный узелок низкой аттенюации, демонстрирующий лепидный рост, сопровождающийся пролиферацией эластических волокон и рассеянными очагами альвеолярного коллапса (). Тип III представлял собой нечетко очерченный узелок с высокой плотностью центральной зоны в GGO, показывающий лепидный рост на периферии и спавшиеся альвеолы с поврежденными эластическими волокнами в центре (). Это указывает на то, что чем выше доля GGO в опухолях, тем больше степень BAC. Тип IV представлял собой узелок однородной плотности мягких тканей, демонстрирующий рост хилика без остаточного газа, но с разрастанием эластичных волокон ().Каркас стромы в опухолях I и II типа сохранился, но в опухолях IV типа и в центре опухолей III типа был нарушен. Аналогичным образом, другая новая классификация, основанная на наличии твердых тел и GGO на тонких срезах CT, разделила небольшие аденокарциномы периферических легких на следующие 6 подтипов: тип 1, простой GGO; тип 2 — промежуточное однородное увеличение плотности; тип 3, нимб; тип 4, смешанная зона GGO и солидная опухоль; тип 5, солидная опухоль с GGO (), и тип 6, чисто солидная опухоль [ 54 ] .Типы I и 1, типы II и 4, типы III и 3 и типы IV и 6 имели похожий внешний вид.
КТ на тонком срезе показывает чистый узелок GGO (1,4 × 1,8 см), который оказался хорошо дифференцированной аденокарциномой у 56-летнего мужчины. Никаких твердых компонентов, кроме кровеносных сосудов, не видно. Микрофотография гистологического образца показывает рост опухолевых клеток в выстилке альвеол без альвеолярного коллапса (гематоксилин и эозин (H и E), × 40).
КТ на тонком срезе показывает неоднородный узелок с низким затуханием (1.3 × 1,6 см) с четкими краями, что оказалось аденокарциномой у 58-летней женщины. Микрофотография гистологического образца показывает рост опухолевых клеток в выстилке альвеол с отдельными участками альвеолярного коллапса (H и E, × 40).
КТ на тонком срезе показывает плохо очерченный частично твердый узелок (1,9 × 1,8 см) с более высокой плотностью центральной зоны, который оказался аденокарциномой у 56-летнего мужчины. На микрофотографии гистологического образца видна фиброзная ткань неправильной формы, окруженная утолщенными альвеолярными перегородками и спавшимися альвеолами в центральной зоне.(H и E, × 10).
КТ с тонким срезом показывает твердый узел неправильной формы (1,8 × 1,6 см), частично окруженный GGO (наконечник стрелки) с короткими спикуляциями, которые оказались аденокарциномой у 65-летнего мужчины. Микрофотография гистологического образца показывает рост солидной опухоли, окруженный ростом опухолевых клеток в альвеолярной выстилке без альвеолярного коллапса (H и E, × 10).
КТ на тонком срезе показывает обычный однородный твердый узел (1,1 × 1,5 см) со спикуляциями, который оказался аденокарциномой у 76-летнего мужчины.На микрофотографии гистологического образца показаны опухолевые клетки и сопровождающийся десмопластический ответ, включающий солидную опухоль (H и E, × 1).
КТ-картины небольших периферических аденокарцином на тонких срезах КТ в некоторой степени соответствовали патологической классификации, выдвинутой Ногучи (50% для типа C; 100% для типов D – F) [ 42 ] . Поскольку характеристики КТ некоторых патологических подтипов не являются исключительными, при их дифференциации следует также учитывать другие аспекты.Степень GGO может быть использована для дифференциации локального BAC от небольших аденокарцином, демонстрирующих нелепидный характер роста [ 53 ] , который рассматривался как единственный значимый фактор для различения типа C от типов A и B (Noguchi’s классификации) [ 55 ] . Кроме того, воздушная бронхограмма и пузырьковые области чаще наблюдались при опухолях типа C, чем при опухолях типа D – F [ 48 ] . Опухоли типа А также следует дифференцировать от атипичной аденоматозной гиперплазии (ААГ), которая также проявляется как узелок GGO на КТ и рассматривается как предшественник аденокарциномы периферического легкого [ 42 , 56–62 ] .AAH чаще всего встречается в случаях аденокарциномы, особенно при подтипе BAC. Тем не менее, ААГ нельзя отличить от небольших периферических аденокарцином на основании только изображений компьютерной томографии.
За исключением приведенных выше классификаций, аденокарциномы легких на КТ также подразделяются на воздухосодержащие и плотные типы в зависимости от того, были ли области непрозрачности опухоли на изображениях окна средостения вдвое меньше или больше половины размера отмеченные на изображениях окна легких [ 21 , 63 ] .Патологически области непрозрачности опухоли на изображениях окна средостения в аденокарциномах воздухосодержащего типа преимущественно демонстрировали коллапс альвеолярных структур и / или коллапс с BAC; области типа плотной плотности преимущественно демонстрируют опухолевые клетки и / или фибробласты [ 49 ] . Пропорция непрозрачности опухоли на изображениях средостенного окна в узелках имеет потенциал для оценки прогноза опухоли.
Корреляция между патологическими характеристиками изображения и прогнозом аденокарциномы малых периферических легких
КТ-скрининг может иметь потенциал для выявления рака легких с хорошими прогностическими факторами, не ограничиваясь ранним обнаружением [ 64 ] .Доказано, что размер опухоли при раке легкого является ненадежным прогностическим индикатором [ 65 , 66 ] . В недавних исследованиях небольших периферических аденокарцином легких изучалась корреляция между КТ или патологическими характеристиками и клиническим прогнозом. В фокусе исследования были GGO и твердые компоненты, отмеченные на тонком сечении — CT, а также соответствующие послеоперационные исходы небольших периферических аденокарцином. Доля BAC (GGO) или твердых компонентов в небольших аденокарциномах легких и лимфоваскулярная инвазия рассматривались как надежные прогностические факторы для прогноза опухоли [ 67 ] .Кроме того, микроскопический некроз, индекс мечения Ki-67 и уровень карциноэмбрионального антигена в сыворотке также были предикторами послеоперационного прогноза [ 68 ] .
Корреляция между GGO / BAC в узелках и прогнозом опухоли
Степень роста опухолевых клеток вдоль альвеолярных стенок отрицательно коррелировала с метастазами в лимфатические узлы [ 31 ] , что указывает на долю GGO (или BAC) в узелках был тесно связан со стадией опухоли и прогнозом [ 54 , 66 , 69 , 70 ] .Соотношения GGO варьировались среди различных патологических подтипов небольших периферических аденокарцином, самые высокие в типах A и B, но самые низкие в опухолях типа D – F (классификация Ногучи) [ 42 , 48 ] . Соответственно, опухоли типа A и B не показывают лимфатических метастазов и имеют лучший прогноз; тип C имел случайные лимфатические метастазы и относительно плохой прогноз; типы D, E и F с наименьшим GGO прогрессировали с наихудшим клиническим исходом.В смешанных аденокарциномах с компонентом BAC доля BAC была более надежным прогностическим фактором, чем метастазы в лимфатические узлы [ 71 ] . Кроме того, воздух — , содержащий тип аденокарцином, редко имел микроскопические метастазы и рецидивы, тогда как твердый тип — плотности часто выявлял микроскопические метастазы и часто рецидивировал [ 49 , 63 , 72 ] .Другое исследование также показало, что не было метастазов в лимфатические узлы или послеоперационных рецидивов в опухолях с долей GGO выше 50% [ 23 ] . Таким образом, степень GGO (или BAC) в узелках может рассматриваться как полезный независимый индикатор для прогнозирования риска рецидива у пациентов с небольшими аденокарциномами периферических легких [ 72–74 ] .
Корреляция между солидным компонентом и фиброзом в узелках и прогнозом опухоли
Солидный компонент в узелках, показанный на КТ, также был связан с исходом при небольших периферических аденокарциномах легких.Солидный тип (GGO% <10%) на КТ рассматривался как важный прогностический фактор при периферической аденокарциноме стадии IA, которая была тесно связана с поражением лимфатических узлов и плохим послеоперационным исходом [ 75 ] . Это указывает на то, что пациенты с солидными аденокарциномами должны принять новую стратегию лечения, даже если она находится на ранней стадии. Кроме того, Sakao et al. [ 76 ] подтвердил, что чем больше максимальный размер опухоли в окне средостения, тем ниже 5-летняя выживаемость без заболевания.Таким образом, отношение размеров опухоли в окне средостения к размеру опухоли в окне легких также можно считать полезным прогностическим фактором для прогноза. За исключением степени твердого компонента в узелках, центральный фиброз, развившийся в опухолях, также был подтвержден как важный прогностический фактор для аденокарцином легких, главным образом из-за его связи с ангиогенезом и лимфангиогенезом [ 77 , 78 ] . Поскольку фиброзные очаги увеличивались по мере прогрессирования опухоли, казалось разумным, что область высокого ослабления в опухолях на КТ была отрицательным прогностическим фактором [ 73 ] .
Корреляция между скоростью роста опухоли и прогнозом
Прогноз рака легких также хорошо коррелировал со временем удвоения объема опухоли (TVDT), которое, в свою очередь, коррелировало с гистопатологическим типом [ 79–81 ] . TVDT аденокарцином легких был намного дольше, чем у плоскоклеточных и мелкоклеточных карцином [ 82 ] . Среди различных типов рака легких на КТ среднее значение TVDT для несолидных опухолей было значительно дольше, чем для солидных опухолей [ 14 , 78 , 82 , 83 ] .Он показал, что доля GGO в узелках имела некоторую корреляцию со скоростью роста опухоли, и что наиболее быстро растущие опухоли демонстрировали сплошную структуру роста [ 82 , 84 ] . Таким образом, радиологическая классификация предоставила информацию не только для идентификации опухолей, но и для определения надлежащих интервалов между контрольными обследованиями. Кроме того, изменения эластического каркаса стромы в узелках также влияли на скорость роста периферических аденокарцином легких.Опухоли с сохраненным каркасом обычно демонстрировали постепенное увеличение плотности, но без значительного изменения размера и имели лучший прогноз, тогда как опухоли с нарушенным каркасом при центральном фиброзе часто увеличивались в течение короткого периода и часто рецидивировали [ 29 ] .
Существуют различные прогностические показатели малых периферических карцином легких, выявленные при КТ и патологических исследованиях. Опухоли с большой долей GGO на тонких срезах КТ или компонентом BAC без локальной инвазии и с низкой скоростью роста обычно имеют лучший клинический исход после операции.
Ведение небольшой аденокарциномы периферического легкого
Немедленная биопсия узелков легких, обнаруженных с помощью КТ, оправдана, если вероятность рака высока, хотя период наблюдения с помощью КТ подходит, если вероятность низкая или средняя [ 85 ] . После подтверждения диагноза малого периферического рака легких следует провести соответствующее хирургическое лечение, направленное непосредственно на различные подтипы опухолей. В зависимости от результатов предоперационной компьютерной томографии, ограниченная торакоскопическая хирургия с использованием видеосъемки может быть осуществима и уместна при раннем раке легких в настоящее время [ 86 ] .Лобэктомия и сегментарная, клиновидная или подлобарная резекция являются вариантами лечения небольших периферических аденокарцином легких. Лобэктомия считалась подходящей для немелкоклеточного рака легкого на клинической стадии IA [ 87 ] , но вопрос о том, подходит ли она для всех типов малых аденокарцином, остается спорным вопросом [ 88 ] . Сегментэктомия может быть приемлемой для опухолей диаметром 2,0 см и менее, а клиновидная резекция — для опухолей размером 1 см и менее [ 89–91 ] .Для опухолей Ногучи типа A и B, особенно чистого GGO типа A, может быть достаточно сегментарной или клиновидной резекции, которая может быть безопасно выполнена из-за их минимально инвазивной природы , 91–95 ] . После операции 5-летняя выживаемость очень хороша для небольших BAC и аденокарцином смешанного типа с преобладающим типом BAC. Что касается субдолевой резекции, первоначальные данные показали, что она может быть приемлемой для лечения небольших аденокарцином легких воздухосодержащего типа [ 96 ] .Что касается чистых BAC менее 2 см в диаметре, субдольная резекция эквивалентна лобэктомии; систематическая лимфодиссекция может быть ненужной, если нет метастазов в лимфатические узлы [ 21 , 23 , 97 ] . Хотя в нескольких исследованиях была высказана мысль о пригодности ограниченной резекции без диссекции лимфатических узлов для аденокарциномы небольшого размера, эта процедура должна быть подтверждена в будущих клинических испытаниях.
Заключение
Применение КТ с низкой дозой в качестве инструмента скрининга небольших периферических форм рака легких побудило к серии исследований опухолей на ранних стадиях.КТ и патологические характеристики часто обнаруживаемых небольших периферических аденокарцином легких были различны и хорошо отражали друг друга, и все они были тесно связаны с прогнозом опухоли. Понимание этих морфологических и прогностических данных может быть чрезвычайно полезным для раннего выявления и диагностики этих злокачественных новообразований, для направления хирургического лечения и оценки послеоперационного результата, как макроскопически, так и микроскопически.
Сноски
Этот документ доступен в Интернете по адресу http: // www.Canceimaging.org. В случае изменения URL-адреса используйте предоставленный DOI, чтобы найти документ.
Ссылки
1. Heelan RT, Flehinger BJ, Melamed MR, et al. Немелкоклеточный рак легкого: результаты программы скрининга в Нью-Йорке. Радиология. 1984; 151: 289–93. [PubMed] [Google Scholar] 2. Меламед М.Р., Флехингер Б.Дж., Заман М.Б., Хилан Р.Т., Перчик В.А., Мартини Н. Скрининг на ранний рак легких: результаты исследования Мемориала Слоуна-Кеттеринга в Нью-Йорке. Грудь. 1984. 86: 44–53.DOI: 10.1378 / сундук.86.1.44. [PubMed] [CrossRef] [Google Scholar] 3. Sone S, Li F, Yang ZG и др. Характеристики малых форм рака легких не видны при обычной рентгенографии грудной клетки и обнаруживаются популяционным скринингом с использованием спиральной компьютерной томографии. Br J Radiol. 2000. 73: 137–45. [PubMed] [Google Scholar] 4. Sone S, Li F, Yang ZG и др. Результаты трехлетней программы массового обследования рака легких с использованием передвижного низкодозного спирального компьютерного томографа. Br J Рак. 2001; 84: 25–32. DOI: 10.1054 / bjoc.2000.1531. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 5. Дидерих С., Ворманнс Д., Семик М. и др. Скрининг на ранний рак легких с помощью спиральной КТ в низких дозах: распространенность среди 817 бессимптомных курильщиков. Радиология. 2002; 222: 773–81. DOI: 10.1148 / radiol.2223010490. [PubMed] [CrossRef] [Google Scholar] 6. Менезес Р.Дж., Робертс Х.С., Пол Н.С. и др. Скрининг рака легких с использованием низкодозовой компьютерной томографии у лиц из группы риска: опыт Торонто. Рак легких. 2010. 67: 177–83. DOI: 10.1016 / j.lungcan.2009.03.030. [PubMed] [CrossRef] [Google Scholar] 7. Хеншке К.И., Макколи Д.И., Янкелевиц Д.Ф. и др. Проект действий по борьбе с раком легких на ранней стадии: общий дизайн и результаты базового скрининга. Ланцет. 1999; 354: 99–105. DOI: 10.1016 / S0140-6736 (99) 06093-6. [PubMed] [CrossRef] [Google Scholar] 8. Свенсен С.Дж., Джетт Дж. Р., Слоан Дж. А. и др. Скрининг рака легких с помощью спиральной компьютерной томографии с низкой дозой облучения. Am J Respir Crit Care Med. 2002; 165: 508–13. [PubMed] [Google Scholar] 9. Свенсен С.Дж., Джетт Дж. Р., Хартман Т.Э. и др.Скрининг рака легких с помощью КТ: опыт клиники Мэйо. Радиология. 2003. 226: 756–61. DOI: 10.1148 / radiol.2263020036. [PubMed] [CrossRef] [Google Scholar] 11. Хеншке CI, Янкелевиц DF. КТ-скрининг рака легких: обновленная информация 2007 г. Онколог. 2008; 13: 65–78. DOI: 10.1634 / теонколог.2007-0153. [PubMed] [CrossRef] [Google Scholar] 12. Сюй Д.М., Гитема Х., де Конинг Х. и др. Протокол рандомизированного скринингового исследования рака легких NELSON. Рак легких. 2006. 54: 177–84. DOI: 10.1016 / j.lungcan.2006.08.006. [PubMed] [CrossRef] [Google Scholar] 13. Хеншке К.И., Янкелевиц Д.Ф. и др. Исследователи Международной программы действий по борьбе с раком легких. Выживаемость пациентов с раком легкого I стадии, выявленным при КТ. N Engl J Med. 2006; 355: 1763–71. [PubMed] [Google Scholar] 14. Sone S, Nakayama T, Honda T и др. Долгосрочное последующее исследование программы массового обследования населения на рак легких в 1996–1998 гг. С использованием мобильной спиральной компьютерной томографии с низкой дозой облучения. Рак легких. 2007. 58: 329–41. DOI: 10.1016 / j.lungcan.2007.06.022. [PubMed] [CrossRef] [Google Scholar] 15. Брукс Д. Р., Остин Дж. Х., Хилан Р. Т. и др. Периферический и центральный рак легких: влияние типа сигареты. Биомаркеры эпидемиологии рака Пред. 2005; 14: 576–81. DOI: 10.1158 / 1055-9965.EPI-04-0468. [PubMed] [CrossRef] [Google Scholar] 16. Трэвис У.Д., Трэвис Л.Б., Девеса СС. Рак легких. Рак. 1995; 75: 191–202. DOI: 10.1002 / 1097-0142 (19950101) 75: 1+ <191 :: AID-CNCR2820751307> 3.0.CO; 2-Y. [PubMed] [CrossRef] [Google Scholar] 17. Ауэрбах О., Гарфинкель Л.Изменение картины рака легкого. Рак. 1991; 68: 1973-7. DOI: 10.1002 / 1097-0142 (191) 68: 9 <1973 :: AID-CNCR2820680921> 3.0.CO; 2-Z. [PubMed] [CrossRef] [Google Scholar] 18. Соне С., Такашима С., Ли Ф. и др. Массовый скрининг рака легких с помощью мобильного спирального компьютерного томографа. Ланцет. 1998; 351: 1242–5. DOI: 10.1016 / S0140-6736 (97) 08229-9. [PubMed] [CrossRef] [Google Scholar] 19. Наката М., Саеки Х., Таката И. и др. Фокальная непрозрачность матового стекла, обнаруженная с помощью спиральной КТ с малой дозой. Грудь.2002; 121: 1464. DOI: 10.1378 / сундук.121.5.1464. [PubMed] [CrossRef] [Google Scholar] 20. Сагава М., Сайто Ю., Такахаши С. и др. Клинико-прогностическая оценка пациентов с удаленными небольшими поражениями периферического рака легкого. Рак. 1990; 66: 2653–7. DOI: 10.1002 / 1097-0142 (195) 66:12 <2653 :: AID-CNCR2820661231> 3.0.CO; 2-U. [PubMed] [CrossRef] [Google Scholar] 21. Кондо Т., Ямада К., Нода К., Накаяма Х., Камеда Ю. Радиолого-прогностическая корреляция у пациентов с небольшими аденокарциномами легких.Рак легких. 2002; 36: 49–57. DOI: 10.1016 / S0169-5002 (01) 00448-2. [PubMed] [CrossRef] [Google Scholar] 22. Сакураи Х., Маэшима А., Ватанабе С. и др. Степень инвазии стромы при небольшой аденокарциноме легкого: минимальная гистопатологическая инвазия и прогноз. Am J Surg Path. 2004. 28: 198–206. [PubMed] [Google Scholar] 23. Аоки Т., Томода Й, Ватанабе Х и др. Аденокарцинома периферического легкого: корреляция результатов КТ тонких срезов с гистологическими прогностическими факторами и выживаемостью. Радиология. 2001; 220: 803–809.DOI: 10.1148 / radiol.2203001701. [PubMed] [CrossRef] [Google Scholar] 24. Mountain CF. Изменения в международной системе диагностики рака легких. Грудь. 1997; 111: 1710–17. DOI: 10.1378 / сундук.111.6.1710. [PubMed] [CrossRef] [Google Scholar] 25. Такисе А., Кодама Т., Симосато Ю., Ватанабе С., Суэмасу К. Гистопатологические прогностические факторы при аденокарциномах периферических легких менее 2 см в диаметре. Рак. 1988. 61: 2083–8. DOI: 10.1002 / 1097-0142 (19880515) 61:10 <2083 :: AID-CNCR2820611025> 3.0.CO; 2-U. [PubMed] [CrossRef] [Google Scholar] 26. Прочтите RC, Schaefer R, North N, Walls R. Диаметр, тип клеток и выживаемость при первичном немелкоклеточном раке легкого I стадии. Arch Surg. 1988. 123: 446–9. [PubMed] [Google Scholar] 27. Судзуки К., Йокосе Т., Ёсида Дж. И др. Прогностическое значение размера центра фиброза при периферической аденокарциноме легкого. Ann Thorac Surg. 2000; 69: 893–7. DOI: 10.1016 / S0003-4975 (99) 01331-4. [PubMed] [CrossRef] [Google Scholar] 28. Патц Е.Ф., младший, Росси С., Харпол Д.Х., младший, Херндон Дж. Э., Гудман ПК.Корреляция размера опухоли и выживаемости у пациентов с немелкоклеточным раком легкого IA стадии. Грудь. 2000; 117: 1568–71. DOI: 10.1378 / сундук.117.6.1568. [PubMed] [CrossRef] [Google Scholar] 29. Это Т., Сузуки Х., Хонда А., Нагашима Ю. Изменения стромального эластотического каркаса при росте аденокарцином периферических легких. Рак. 1996. 77: 646–56. DOI: 10.1002 / (SICI) 1097-0142 (19960215) 77: 4 <646 :: AID-CNCR10> 3.3.CO; 2-Q. [PubMed] [CrossRef] [Google Scholar] 30. Ким EA, Johkoh T, Lee KS и др. Количественная оценка непрозрачности матового стекла на КТ с высоким разрешением небольшой периферической аденокарциномы легкого: патологические и прогностические последствия.AJR Am J Roentgenol. 2001; 177: 1417–22. [PubMed] [Google Scholar] 31. Хигасияма М., Кодама К., Йокучи Х. и др. Прогностическое значение компонента бронхиолоальвеолярной карциномы аденокарциномы малого легкого. Ann Thorac Surg. 1999; 68: 2069–73. DOI: 10.1016 / S0003-4975 (99) 01064-4. [PubMed] [CrossRef] [Google Scholar] 32. Ватанабе С., Ватанабе Т., Араи К., Касаи Т., Харатаке Дж., Ураяма Х. Результаты клиновидной резекции фокальной бронхиолоальвеолярной карциномы, показывающие чистое затухание матового стекла на компьютерной томографии.Ann Thorac Surg. 2002; 73: 1071–5. DOI: 10.1016 / S0003-4975 (01) 03623-2. [PubMed] [CrossRef] [Google Scholar] 33. Джетт JR, Midthun DE. Комментарий: КТ-скрининг рака легких — будьте осторожны. Онколог. 2008; 13: 439–44. DOI: 10.1634 / теонколог.2008-0027. [PubMed] [CrossRef] [Google Scholar] 34. Бах ПБ, Келли MJ, Тейт RC, МакКрори, округ Колумбия. Скрининг рака легких: обзор современной литературы. Грудь. 2003; 123: 72С – 82С. DOI: 10.1378 / сундук.123.1_suppl.72S. [PubMed] [CrossRef] [Google Scholar] 36. Сода Х, Томита Х, Коно С, Ока М.Ограничение ежегодной скрининговой рентгенографии грудной клетки для диагностики рака легких. Рак. 1993; 72: 2341–6. DOI: 10.1002 / 1097-0142 (19931015) 72: 8 <2341 :: AID-CNCR2820720809> 3.0.CO; 2-A. [PubMed] [CrossRef] [Google Scholar] 37. Ян З.Г., Соне С., Ли Ф и др. Обнаружение небольшого периферического рака легких с помощью цифровой рентгенографии грудной клетки: сравнение необработанных изображений с нерезкими изображениями, обработанными по маске. Acta Radiol. 1999; 40: 505–9. DOI: 10.3109 / 028418595575. [PubMed] [CrossRef] [Google Scholar] 38. Heitzman ER, Markarian B, Raasch BN, Carsky EW, Lane EJ, Berlow ME.Пути распространения опухоли в легком: рентгенологические корреляции с анатомией и патологией. Радиология. 1982; 144: 3–14. [PubMed] [Google Scholar] 39. Канеко М., Эгути К., Омацу Х. и др. Периферический рак легких: скрининг и обнаружение с помощью спиральной компьютерной томографии с низкой дозой по сравнению с рентгенографией. Радиология. 1996; 201: 798–802. [PubMed] [Google Scholar] 40. Takashima S, Sone S, Li F, Maruyama Y, Hasegawa M, Kadoya M. Неопределенные одиночные легочные узелки, выявленные при популяционном КТ-скрининге легких: использование первой контрольной диагностической КТ для дифференциации доброкачественных и злокачественных образований.AJR Am J Roentgenol. 2003; 180: 1255–63. [PubMed] [Google Scholar] 41. Исследователи Нью-Йоркского проекта действий по борьбе с раком легких. КТ-скрининг рака легких: диагнозы, полученные в результате Нью-Йоркского проекта действий по борьбе с раком легких. Радиология. 2007; 243: 239–49. [PubMed] [Google Scholar] 42. Ян З.Г., Соне С., Такашима С. и др. КТ высокого разрешения малых периферических аденокарцином легких, выявленных при скрининговой спиральной КТ. AJR Am J Roentgenol. 2001; 176: 1399–407. [PubMed] [Google Scholar] 43. Ян З, Соне С, Такашима С, Ли Ф, Хонда Т, Яманда Т.Малые периферические карциномы легкого: КТ тонких срезов и патологическая корреляция. Eur Radiol. 1999; 9: 1819–25. DOI: 10.1007 / s003300050929. [PubMed] [CrossRef] [Google Scholar] 44. Ян З.Г., Соне С., Ли Ф и др. Видимость малых периферических опухолей легких на рентгенограммах грудной клетки: влияние денситометрических параметров, значений компьютерной томографии и типа опухоли. Br J Radiol. 2001; 74: 32–41. [PubMed] [Google Scholar] 45. Цубамото М., Курияма К., Кидо С. и др. Обнаружение рака легких на рентгенограммах грудной клетки: анализ на основе размера и степени непрозрачности матового стекла при КТ тонких срезов.Радиология. 2002; 224: 139–44. DOI: 10.1148 / radiol.2241001445. [PubMed] [CrossRef] [Google Scholar] 46. Остин Дж. Х., Ромни Б. М., Голдсмит Л. С.. Пропущенная бронхогенная карцинома: рентгенологические данные у 27 пациентов с потенциально резектабельным поражением, очевидным в ретроспективе. Радиология. 1992; 182: 115–22. [PubMed] [Google Scholar] 47. Ногучи М., Морикава А., Кавасаки М. и др. Малая аденокарцинома легкого. Гистологические характеристики и прогноз. Рак. 1995; 75: 2844–52. DOI: 10.1002 / 1097-0142 (19950615) 75:12 <2844 :: AID-CNCR2820751209> 3.0.CO; 2- #. [PubMed] [CrossRef] [Google Scholar] 48. Наказоно Т., Сакао Ю., Ямагути К., Имаи С., Кумазоэ Х., Кудо С. Подтипы периферической аденокарциномы легкого: дифференциация с помощью КТ тонких срезов. Eur Radiol. 2005; 15: 1563–8. DOI: 10.1007 / s00330-004-2595-7. [PubMed] [CrossRef] [Google Scholar] 49. Сайто Х., Камеда Й., Масуи К. и др. Корреляция между результатами КТ тонких срезов, гистопатологическими и клиническими данными малых аденокарцином легких. Рак легких. 2011; 71: 137–43. DOI: 10.1016 / j.Lungcan.2010.04.018. [PubMed] [CrossRef] [Google Scholar] 50. Хеншке К.И., Янкелевиц Д.Ф., Мирчева Р. и др. КТ-скрининг рака легких: частота и значение частичных и нетвердых узелков. AJR Am J Roentgenol. 2002; 178: 1053–7. [PubMed] [Google Scholar] 51. Пак CM, Goo JM, Ли HJ, Lee CH, Chun EJ, Im JG. Узловатая непрозрачность матового стекла при КТ тонких срезов: гистологическая корреляция и оценка изменений при последующем наблюдении. Рентгенография. 2007. 27: 391–408. DOI: 10.1148 / rg.272065061. [PubMed] [CrossRef] [Google Scholar] 52.Jang HJ, Lee KS, Kwon OJ, Rhee CH, Shim YM, Han J. Бронхиолоальвеолярная карцинома: очаговая область ослабления матового стекла при КТ тонких срезов как ранний признак. Радиология. 1996; 199: 485–8. [PubMed] [Google Scholar] 53. Непрозрачность матового стекла на тонких срезах КТ: значение для дифференциации подтипов аденокарциномы легкого. AJR Am J Roentgenol. 1999; 173: 465–9. [PubMed] [Google Scholar] 54. Судзуки К., Кусумото М., Ватанабе С., Цучия Р., Асамура Х. Радиологическая классификация малой аденокарциномы легкого: радиолого-патологическая корреляция и ее прогностическое влияние.Ann Thorac Surg. 2006; 81: 413–9. DOI: 10.1016 / j.athoracsur.2005.07.058. [PubMed] [CrossRef] [Google Scholar] 55. Такашима С., Ли Ф, Маруяма Ю. и др. Распознавание подтипов малой аденокарциномы легкого с помощью КТ тонких срезов. Рак легких. 2002; 36: 175–82. DOI: 10.1016 / S0169-5002 (01) 00461-5. [PubMed] [CrossRef] [Google Scholar] 56. Nakahara R, Yokose T., Nagai K, Nishiwaki Y, Ochiai A. Атипичная аденоматозная гиперплазия легкого: клинико-патологическое исследование 118 случаев, включая случаи с множественной атипичной аденоматозной гиперплазией.Грудная клетка. 2001; 56: 302–5. DOI: 10.1136 / thorax.56.4.302. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 57. Каваками С., Соне С., Такашима С. и др. Атипичная аденоматозная гиперплазия легкого: корреляция между результатами КТ высокого разрешения и гистопатологическими особенностями. Eur J Radiol. 2001; 11: 811–13. [PubMed] [Google Scholar] 58. Картер Д., Васкес М., Флидер Д. Б. и др. Сравнение патологических данных исходных и ежегодных повторных онкологических заболеваний, диагностированных при КТ-скрининге. Рак легких. 2007; 56: 193–9.DOI: 10.1016 / j.lungcan.2006.12.001. [PubMed] [CrossRef] [Google Scholar] 59. Кэри Ф.А., Уоллес В.А., Фергюссон Р.Дж., Керр К.М., Лэмб Д. Альвеолярная атипичная гиперплазия в сочетании с первичной аденокарциномой легких: клинико-патологическое исследование 10 случаев. Грудная клетка. 1992; 47: 1041–3. DOI: 10.1136 / thx.47.12.1041. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 60. Кодама Т., Биядзима С., Ватанабе С., Шимосато Ю. Морфометрическое исследование аденокарцином и гиперпластических эпителиальных поражений в периферическом легком.Am J Clin Pathol. 1986; 85: 146–51. [PubMed] [Google Scholar] 61. Такигава Н., Сегава Ю., Наката М. и др. Клиническое исследование атипичной аденоматозной гиперплазии легкого. Рак легких. 1999; 25: 115–21. DOI: 10.1016 / S0169-5002 (99) 00055-0. [PubMed] [CrossRef] [Google Scholar] 62. Weng SY, Tsuchiya E, Kasuga T., Sugano H. Заболеваемость атипичной гиперплазией бронхиолоальвеолярных клеток легкого: связь с гистологическими подтипами рака легкого. Арка Вирхова Патол Анат Гистопатол. 1992; 420: 463–71. DOI: 10.1007 / BF01600250. [PubMed] [CrossRef] [Google Scholar] 63. Симидзу К., Ямада К., Сайто Х. и др. Хирургически излечимая периферическая карцинома легкого: корреляция результатов КТ тонких срезов с гистологическими прогностическими факторами и выживаемостью. Грудь. 2005; 127: 871–8. DOI: 10.1378 / сундук.127.3.871. [PubMed] [CrossRef] [Google Scholar] 64. Фудзикава А., Такигучи Ю., Мизуно С. и др. Скрининг рака легких — сравнение компьютерной томографии и рентгенографии. Рак легких. 2008. 61: 195–201. DOI: 10.1016 / j.lungcan.2007.12.010. [PubMed] [CrossRef] [Google Scholar] 65.Гейл М.Х., Иган Р.Т., Фелд Р. и др. Факторы прогноза у пациентов с резектированным немелкоклеточным раком легкого I стадии: отчет группы исследования рака легкого. Рак. 1984; 54: 1802–13. DOI: 10.1002 / 1097-0142 (19841101) 54: 9 <1802 :: AID-CNCR2820540908> 3.0.CO; 2-4. [PubMed] [CrossRef] [Google Scholar] 66. Сакао Й., Миямото Х., Сакураба М. и др. Прогностическое значение гистологического подтипа малой аденокарциномы легкого: влияние компонентов небронхиолоальвеолярной карциномы. Ann Thorac Surg.2007; 83: 209–14. DOI: 10.1016 / j.athoracsur.2006.07.051. [PubMed] [CrossRef] [Google Scholar] 67. Маэшима AM, Точиги Н., Йошида А., Асамура Х., Цута К., Цуда Х. Гистологическая оценка аденокарциномы легких диаметром 2 см или меньше: надежный прогностический индикатор. J Thorac Oncol. 2010; 5: 333–9. DOI: 10.1097 / JTO.0b013e3181c8cb95. [PubMed] [CrossRef] [Google Scholar] 68. Иноуэ М., Такакува Т., Минами М. и др. Клинико-патологические факторы, влияющие на послеоперационный прогноз у пациентов с аденокарциномой легких малых размеров.J Thorac Cardiovasc Surg. 2008. 135: 830–6. DOI: 10.1016 / j.jtcvs.2007.10.034. [PubMed] [CrossRef] [Google Scholar] 69. Охта Й, Симидзу Й, Кобаяши Т. и др. Патологическая и биологическая оценка опухолей легких, показывающая непрозрачность матового стекла. Ann Thorac Surg. 2006; 81: 1194–7. DOI: 10.1016 / j.athoracsur.2005.10.037. [PubMed] [CrossRef] [Google Scholar] 70. Ohde Y, Nagai K, Yoshida J и др. Отношение консолидации к матовому стеклу на КТ высокого разрешения является хорошим предиктором для определения популяции неинвазивной периферической аденокарциномы.Рак легких. 2003; 42: 303–10. DOI: 10.1016 / j.lungcan.2003.07.001. [PubMed] [CrossRef] [Google Scholar] 71. Анами Ю., Иидзима Т., Сузуки К. и др. Компонент бронхиолоальвеолярной карциномы (лепидного разрастания) является более полезным прогностическим фактором, чем метастазирование в лимфатические узлы. J Thorac Oncol. 2009; 4: 951–8. DOI: 10.1097 / JTO.0b013e3181ad8631. [PubMed] [CrossRef] [Google Scholar] 72. Кодама К., Хигасияма М., Йокучи Х. и др. Прогностическая ценность матового стекла, обнаруженного при небольшой аденокарциноме легкого при компьютерной томографии высокого разрешения.Рак легких. 2001; 33: 17–25. DOI: 10.1016 / S0169-5002 (01) 00185-4. [PubMed] [CrossRef] [Google Scholar] 73. Такашима С., Маруяма Ю., Хасегава М. и др. Прогностическое значение результатов КТ высокого разрешения при небольшой периферической аденокарциноме легкого: ретроспективное исследование с участием 64 пациентов. Рак легких. 2002; 36: 289–95. DOI: 10.1016 / S0169-5002 (01) 00489-5. [PubMed] [CrossRef] [Google Scholar] 74. Васкес М., Картер Д., Брамбилла Е. и др. Исследователи Международной программы действий по борьбе с раком легких. Одиночные и множественные резецированные аденокарциномы после КТ-скрининга рака легких: гистопатологические особенности и их прогностическое значение.Рак легких. 2009. 64: 148–54. DOI: 10.1016 / j.lungcan.2008.08.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 75. Сакао Ю., Наказоно Т., Сакураги Т., Нацуаки М., Ито Т. Факторы прогнозирования выживаемости при хирургически удаленной клинической периферической аденокарциноме ИА легкого. Ann Thorac Surg. 2004. 77: 1157–61. DOI: 10.1016 / j.athoracsur.2003.09.055. [PubMed] [CrossRef] [Google Scholar] 76. Сакао Ю., Наказоно Т., Томимицу С. и др. Аденокарциному легкого можно разделить на подтипы в соответствии с размером опухоли с помощью настройки окна средостения на компьютерной томографии.Дополнительные критерии размера для клинической аденокарциномы T1. Eur J Cardiothorac Surg. 2004; 26: 1211–15. DOI: 10.1016 / j.ejcts.2004.08.021. [PubMed] [CrossRef] [Google Scholar] 77. Симосато Ю., Сузуки А., Хашимото Т. и др. Прогностические значения фиброзного очага (рубца) при небольших периферических раках легких. Am J Surg Pathol. 1980; 4: 365–73. DOI: 10.1097 / 00000478-198008000-00005. [PubMed] [CrossRef] [Google Scholar] 78. Окудера К., Камата Ю., Таканаши С. и др. Малая аденокарцинома легкого: прогностическое значение центрального фиброза в основном из-за его связи с ангиогенезом и лимфангиогенезом.Pathol Int. 2006; 56: 494–502. DOI: 10.1111 / j.1440-1827.2006.01997.x. [PubMed] [CrossRef] [Google Scholar] 79. Усуда К., Сайто Ю., Сагава М. и др. Время удвоения опухоли и прогностическая оценка пациентов с первичным раком легкого. Рак. 1994; 74: 2239–44. DOI: 10.1002 / 1097-0142 (19941015) 74: 8 <2239 :: AID-CNCR2820740806> 3.0.CO; 2-P. [PubMed] [CrossRef] [Google Scholar] 80. Араи Т., Куроиси Т., Сайто Ю., Курита Ю., Наруке Т., Канеко М. Время удвоения опухоли и прогноз у пациентов с раком легких: оценка на основе снимков грудной клетки и последующего клинического исследования.Японская исследовательская группа по скринингу рака легких. Jpn J Clin Oncol. 1994; 24: 199–204. [PubMed] [Google Scholar] 81. Geddes DM. Естественная история рака легких: обзор, основанный на скорости роста опухоли. Br J Dis Chest. 1979; 73: 1–17. DOI: 10.1016 / 0007-0971 (79)-0. [PubMed] [CrossRef] [Google Scholar] 82. Хасегава М., Соне С., Такашима С. и др. Скорость роста малых форм рака легких, выявленных при массовом КТ-сканировании. Br J Radiol. 2000; 73: 1252–9. [PubMed] [Google Scholar] 83. Аоки Т., Наката Х., Ватанабе Х. и др.Развитие аденокарциномы периферических легких: результаты КТ коррелировали с гистологией и временем удвоения опухоли. AJR Am J Roentgenol. 2000; 174: 763–8. [PubMed] [Google Scholar] 84. Ван Дж. К., Соне С., Фенг Л. и др. Быстрорастущие мелкие периферические опухоли легких, обнаруженные с помощью скрининговой компьютерной томографии: корреляция между рентгенологическим внешним видом и патологическими особенностями. Br J Radiol. 2000; 73: 930–7. [PubMed] [Google Scholar] 85. Либби Д.М., Смит Д.П., Алторки Н.К., Пазмантье М.В., Янкелевиц Д., Хеншке С.И. Лечение небольшого легочного узелка, обнаруженного при КТ.Грудь. 2004; 125: 1522–9. DOI: 10.1378 / сундук.125.4.1522. [PubMed] [CrossRef] [Google Scholar] 86. Суги К., Кобаяси С., Судоу М., Сакано Х., Мацуда Э., Окабе К. Долгосрочный прогноз ограниченного хирургического вмешательства с видео-ассистированием при раннем раке легких. Eur J Cardiothorac Surg. 2010; 37: 456–60. [PubMed] [Google Scholar] 87. Гинзберг Р.Дж., Рубинштейн Л.В. Рандомизированное испытание лобэктомии в сравнении с ограниченной резекцией при немелкоклеточном раке легкого T1 N0. Группа изучения рака легких. Ann Thorac Surg. 1995; 60: 615–23. DOI: 10.1016 / 0003-4975 (95) 00537-U.[PubMed] [CrossRef] [Google Scholar] 88. Фукуи Т., Сакакура Н., Мори С. и др. Споры о небольших аденокарциномах периферических легких: как с ними бороться? J Thorac Oncol. 2007; 2: 546–52. DOI: 10.1097 / JTO.0b013e318060d30d. [PubMed] [CrossRef] [Google Scholar] 89. Йошикава К., Цубота Н., Кодама К., Аябе Х., Таки Т., Мори Т. Проспективное исследование расширенной сегментэктомии при малых опухолях легких: окончательный отчет. Ann Thorac Surg. 2002; 73: 1055–8. DOI: 10.1016 / S0003-4975 (01) 03466-X. [PubMed] [CrossRef] [Google Scholar] 90.Окада М., Нисио В., Сакамото Т. и др. Влияние размера опухоли на прогноз у пациентов с немелкоклеточным раком легкого: роль сегментэктомии как типа малой резекции. J Thorac Cardiovasc Surg. 2005; 129: 87–93. DOI: 10.1016 / j.jtcvs.2004.04.030. [PubMed] [CrossRef] [Google Scholar] 91. Yamato Y, Koike T, Yoshiya K, Shinohara H, Toyabe S. Результаты хирургического лечения небольших (2 см или меньше) аденокарцином легкого. Хирург сегодня. 2008; 38: 109–14. DOI: 10.1007 / s00595-007-3594-5. [PubMed] [CrossRef] [Google Scholar] 92.Накамура Х., Саджи Х., Огата А., Сайджо Т., Окада С., Като Х. Пациенты с раком легких, показывающие непрозрачность матового стекла на компьютерной томографии, являются хорошими кандидатами на клиновидную резекцию. Рак легких. 2004; 44: 61–8. DOI: 10.1016 / j.lungcan.2003.09.025. [PubMed] [CrossRef] [Google Scholar] 93. Сагава М., Хигаси К., Усуда К. и др. Лечебная клиновидная резекция при неинвазивной бронхиолоальвеолярной карциноме. Tohoku J Exp Med. 2009; 217: 133–7. DOI: 10.1620 / tjem.217.133. [PubMed] [CrossRef] [Google Scholar] 94. Ямада С., Коно Т.Видео-ассистированная торакальная хирургия для чистых помутнений матового стекла диаметром 2 см или менее. Ann Thorac Surg. 2004; 77: 1911–15. DOI: 10.1016 / j.athoracsur.2003.12.040. [PubMed] [CrossRef] [Google Scholar] 95. Ohtsuka T, Watanabe K, Kaji M, Naruke T., Suemasu K. Клинико-патологическое исследование резецированных легочных узелков с очаговой прозрачностью матового стекла. Eur J Cardiothorac Surg. 2006; 30: 160–3. DOI: 10.1016 / j.ejcts.2006.03.058. [PubMed] [CrossRef] [Google Scholar] 96. Накаяма Х., Ямада К., Сайто Х. и др.Сублобарная резекция у пациентов с периферическими небольшими аденокарциномами легкого: результат операции связан с особенностями компьютерной томографии. Ann Thorac Surg. 2007; 84: 1675–9. DOI: 10.1016 / j.athoracsur.2007.03.015. [PubMed] [CrossRef] [Google Scholar] 97. Рами-Порта Р., Цубои М. Сублобарная резекция рака легкого. Eur Respir J. 2009; 33: 426–35. DOI: 10.1183 / 036.00099808. [PubMed] [CrossRef] [Google Scholar] Рак легкого в целом подразделяется на два типа: мелкоклеточный рак легкого (SCLC) и немелкоклеточный рак легкого (NSCLC).Эта классификация основана на микроскопическом виде опухолевых клеток. Эти два типа рака растут, распространяются и лечатся по-разному, поэтому важно проводить различие между этими двумя типами. SCLC составляет около 10-15% случаев рака легких. Этот вид рака легких является наиболее агрессивным и быстрорастущим из всех. SCLC сильно связан с курением сигарет. SCLC быстро метастазируют во многие участки тела и чаще всего обнаруживаются после того, как они широко распространились. NSCLC — наиболее распространенный рак легких, на который приходится около 85% всех случаев. НМРЛ имеет три основных типа, определяемых типом клеток, обнаруженных в опухоли. Это: Другие виды рака могут возникать в легких; эти типы гораздо реже, чем NSCLC и SCLC, и вместе составляют лишь 5-10% случаев рака легких: Как обсуждалось ранее, метастатический рак из других первичных опухолей в организме часто обнаруживается в легких. Опухоли из любой части тела могут распространяться в легкие через кровоток, лимфатическую систему или непосредственно из близлежащих органов. Метастатические опухоли чаще всего множественные, разбросаны по всему легкому и сконцентрированы во внешних областях, а не в центральных областях органа. Как и другие виды рака, рак легких развивается, когда нормальные процессы деления и роста клеток нарушаются, уступая место ненормальному неконтролируемому росту. Клетки превращаются в массу или опухоль. Любой аномальный рост в организме, который напрямую поражает окружающие ткани и органы, распространяется на другие части тела или может снова вырасти после удаления, называется «злокачественным» или злокачественным. Рак легкого может развиться через несколько лет.Курение сигарет — самый распространенный фактор риска развития рака легких. Многие люди, подвергающиеся воздействию сигаретного дыма или некоторых его компонентов, в конечном итоге имеют необратимые аномальные изменения в легких. Эти изменения могут вызвать развитие раковой опухоли в легком. Рак легких является вторым по распространенности злокачественным новообразованием в стране, но он является самым смертоносным, поскольку вызывает наибольшее количество смертей среди всех видов рака. Ожидается, что в 2019 году в США будет диагностировано около 228 150 новых случаев рака легких, а в 2019 году ожидается 142 670 случаев смерти. Этап позволяет врачу полностью понять степень рака пациента, чтобы принять решение о лечении и спрогнозировать ожидаемые результаты.Врачи используют специальные термины для описания стадий рака, но простой способ описания стадии может быть следующим: Большинство видов рака легких начинаются со слизистой оболочки бронхов (дыхательные пути, отходящие от трахеи или дыхательной трубки).Рак легких также может образовываться в железах под оболочкой бронхов, часто во внешних областях легких. Эти виды рака легких относятся к одному из двух основных типов: мелкоклеточный или немелкоклеточный рак легкого, каждый из которых растет и распространяется по-разному: Немелкоклеточный рак легкого встречается гораздо чаще и обычно растет и распространяется медленнее, чем мелкоклеточный рак легкого. Существует три основных типа немелкоклеточного рака легкого, названные в честь типа клеток, из которых развивается рак: Мелкоклеточный рак легкого встречается реже, чем немелкоклеточный рак легкого, на него приходится около 15 процентов всех случаев рака легких.Этот тип рака легких быстро растет, к моменту постановки диагноза он, вероятно, будет прогрессировать и быстро распространяется на другие части тела. Существует более десятка видов необычных опухолей, которые могут развиваться в груди, которые могут возникать или не возникать в легких. Некоторые из менее распространенных типов включают карциноидные опухоли (часто расположенные в крупных дыхательных путях) и злокачественную мезотелиому, которая развивается из плевры или слизистой оболочки легкого. Мезотелиома — это рак, поражающий мезотелий, защитную мембрану, покрывающую большую часть внутренних органов тела.Этот редкий рак поражает только около 3000 человек ежегодно, обычно в части мезотелия, окружающей легкие (плевра), но иногда в перикарде, покрывающем сердце. Мезотелиома обычно возникает через десятилетия после контакта с асбестом. Признаки и симптомы рака легких не всегда проявляются, пока болезнь не прогрессирует.Однако у некоторых людей симптомы появляются на ранней стадии. К ним относятся: Расширенные симптомы рака легких включают кашель, одышку, боль в груди, усталость и / или непреднамеренную потерю веса.Признаки и симптомы, которые могут появиться, если рак распространился на другие места, включают боль в костях, головную боль, мышечную слабость и / или опущение век. Обычно беспокойство о том, что у пациента может быть рак легких, начинается с аномального обнаружения при визуализирующем исследовании грудной клетки (рентген грудной клетки или компьютерной томографии) или когда болезнь развивается достаточно далеко, чтобы вызвать такие симптомы, как кашель, одышка, грудная клетка. боль, усталость и / или потеря веса. Для диагностики требуется биопсия или удаление клеток или тканей из подозрительной массы. Биопсию можно проводить через камеру, питаемую через дыхательные трубки (так называемая бронхоскопия), или с помощью иглы, вводимой через кожу в опухоль легкого. Если эти подходы не увенчались успехом, для постановки правильного диагноза может потребоваться операция. Биопсия важна для определения того, является ли это рак, а также для определения типа рака легких. Для некоторых пациентов участие в клинических испытаниях может быть выбором лечения.Клинические испытания проводятся, чтобы выяснить, являются ли новые методы лечения рака безопасными и эффективными, или чтобы увидеть, лучше ли они стандартного лечения. Многие из современных стандартных методов лечения рака основаны на ранее проведенных клинических испытаниях. Пациенты, принимающие участие в клиническом исследовании, могут получать стандартное лечение или быть одними из первых, кто получит новое проспективное лечение. Пациенты, принимающие участие в клинических испытаниях, также помогают улучшить методы лечения рака в будущем. Даже когда клинические испытания не приводят к созданию новых эффективных методов лечения, они часто отвечают на важные вопросы и развивают медицинские знания. Скрининг рака легких — это тестирование здорового человека с высоким риском развития рака легких, у которого нет симптомов рака легких, для выявления рака легких на стадии, на которой его можно лучше лечить. Было обнаружено, что скрининг на основе низкодозной КТ грудной клетки снижает количество людей, умирающих от рака легких с приемлемым риском, при проведении в высококачественных условиях. В клинике Кливленда у нас есть комплексная программа скрининга рака легких для людей с высоким риском развития рака легких (в возрасте от 55 до 77 лет, курение более 30 лет, курение в течение последних 15 лет). Вся необходимая информация о пациенте, включая его или ее состояние здоровья, вид опухоли и степень ее распространения, объединяется для разработки наиболее подходящей терапии рака этого человека. Рак легких — это очень сложный вид рака. Тип и стадия клеток являются наиболее важными факторами при определении выживаемости на стадии во время постановки диагноза. Те, что диагностированы на локализованном этапе, могут быть излечимы. К сожалению, у большинства людей диагноз ставится, когда болезнь распространилась за пределы грудной клетки (далеко или далеко) или затрагивает узлы в груди (региональные). Кроме того, легкие — очень чувствительные органы, и некоторые формы лечения могут быть нелегкими. Эта комбинация объясняет, почему у рака легких один из самых низких показателей выживаемости среди всех видов рака.Общая двухлетняя выживаемость тех, у кого диагностирован рак легких, составляет 25%. К пяти годам выживаемость снижается до 15%. Важно обсудить с врачом цели лечения рака легких. Некоторые методы лечения могут использоваться для борьбы с раком. Другие используются для улучшения качества жизни и / или уменьшения симптомов. Эти методы лечения можно использовать по отдельности или в комбинации. Химиотерапия — это использование препаратов, предназначенных для уничтожения быстрорастущих клеток, например, раковых.Химиотерапию можно вводить непосредственно в вену (внутривенно или внутривенно) или вводить через катетер, который представляет собой тонкую трубку, помещенную в большую вену и удерживаемую там до тех пор, пока в ней больше нет необходимости. Некоторые химиотерапевтические препараты принимают внутрь в виде таблеток. Целевые агенты — это новый класс лекарств, которые предназначены для действия против определенных слабых мест в раковых клетках или окружающих поддерживающих тканях, таких как кровеносные сосуды. Эти препараты также можно принимать перорально или внутривенно. Они наиболее эффективны при раке со специфическими изменениями в генах или клеточных рецепторах. На ранних стадиях немелкоклеточного рака химиотерапия может использоваться в сочетании с хирургическим вмешательством для повышения выживаемости. На более поздних стадиях немелкоклеточного рака и на всех стадиях мелкоклеточного рака для облегчения симптомов и продления жизни могут использоваться химиотерапия и таргетная терапия. Химиотерапия влияет как на нормальные, так и на раковые клетки. Ваши врачи постараются максимально предотвратить побочные эффекты при правильном лечении рака. Побочные эффекты во многом зависят от конкретного типа лекарства и введенного количества.Они могут быть разными для каждого человека и носить временный характер. Общие побочные эффекты химиотерапии включают тошноту и рвоту, выпадение волос, язвы во рту и / или усталость. Ваш лечащий врач может посоветовать способы уменьшения побочных эффектов и облегчения симптомов, которые могут возникнуть во время и после процедур. Лучевая терапия — это форма высокоэнергетического рентгеновского излучения, убивающего раковые клетки. Его можно использовать в качестве основного лечения или в сочетании с химиотерапией (с хирургическим вмешательством или без него).Он часто может играть важную роль у пациентов с запущенным раком, облегчая боль, блокировку дыхательных путей, одышку или кашель. Лучевая терапия — это «целенаправленное» лечение, то есть оно предназначено для максимального воздействия на раковые клетки при минимальном повреждении нормальных клеток. Радиация для лечения рака легких чаще всего исходит от машины (внешнее облучение). Иногда радиация может быть доставлена внутрь с помощью трубок, которые помещают радиоактивное семя непосредственно рядом с опухолью (внутреннее облучение или брахитерапия). Побочные эффекты лучевой терапии зависят в основном от обрабатываемой части тела и лечебной дозы. Общие побочные эффекты лучевой терапии грудной клетки — это сухость, боль в горле; Трудность глотания; усталость; изменения кожи в месте обработки; и / или потеря аппетита. Область особых инноваций в лучевой терапии — это высокотехнологичный подход, иногда называемый «радиохирургией». Для очень избранных пациентов с небольшими опухолями, для которых операция нежелательна или небезопасна, радиохирургия с использованием очень высоких доз точно сфокусированного излучения, направленного только на небольшую опухоль в легком, является эффективной альтернативой. Хирургия до сих пор считается «золотым стандартом» лечения рака легких на ранних стадиях. Удаление опухоли и окружающей легочной ткани дает наилучшие шансы на выздоровление пациентам с локализованным заболеванием. Хирургическое вмешательство должно выполняться специализированными торакальными хирургами, имеющими особый опыт в лечении рака легких и других злокачественных новообразований грудной клетки. Ваш хирург определит, можно ли удалить опухоль. Не все опухоли операбельны из-за их расположения вблизи жизненно важных структур или их поражения. Для пациентов с множественными заболеваниями или плохой функцией легких операция может быть не лучшим вариантом. Это тщательно определяется нашей многопрофильной командой, в которую входят пульмонологи, медицинские онкологи и онкологи-радиологи, которые ежедневно работают вместе. Сколько легочной ткани будет удалено и какой хирургический подход будет использоваться, зависит от того, где опухоль расположена в легком, ее размера, типа тела / веса пациента и любых предыдущих операций на груди.При необходимости резекции рассматриваются минимально инвазивные подходы. Квалифицированные торакальные хирурги могут регулярно выполнять торакальную хирургию с видеосвязью (VATS) и лобэктомию VATS, а также роботизированную хирургию. Хирургическая резекция рака легкого обычно выполняется как: Восстановление после торакальной операции зависит от объема операции, малоинвазивно она или нет, а также от возраста и общей физической формы пациента. Многие пациенты возвращаются домой в течение трех-четырех дней после операции. Пациенты, перенесшие малоинвазивную операцию, обычно могут вернуться к работе через три недели после операции. Хронические заболевания и нарушения легких и дыхательных путей, а также некоторые инвазивные методы их лечения могут сказаться на здоровье и качестве жизни. В программах легочной реабилитации используется множество тактик — от обучения и физических упражнений до поощрения изменения образа жизни — чтобы помочь нашим пациентам управлять своим состоянием. Боль может быть серьезной проблемой для людей, проходящих лечение от рака.Различные методы лечения рака, а также сам рак могут вызывать боль. Эффективное обезболивание может помочь сохранить или улучшить качество жизни и снизить риск депрессии, связанной с болью. Курение — основная причина рака легких, но бросить курить может оказаться сложной задачей для некоторых хронических курильщиков. Поскольку характер курения варьируется от человека к человеку, не существует «наилучшего» способа бросить курить. Наиболее успешные программы отказа от курения предлагают курильщикам ряд стратегий. Не существует абсолютного способа предотвратить рак легких. Однако есть вещи, которые снизят ваш риск. Ваш лечащий врач поможет вам понять, чего ожидать после лечения рака с точки зрения последующего ухода, изменения образа жизни и принятия важных решений, связанных со здоровьем. Если рак легкого является локализованным или региональным и было проведено лечение с целью излечения от рака, будет проведено последующее обследование, чтобы убедиться, что рак не рецидивирует. Вы также будете оценены на предмет побочных эффектов, связанных с полученным лечением, и вам будет предложено лечение, чтобы помочь с любыми сопутствующими симптомами. Наблюдение за пациентами с метастатическим раком легких и / или лечение направлено на улучшение качества жизни и продление жизни. Исследования, проводимые с течением времени, позволят определить, как рак реагирует на лечение, и отслеживать побочные эффекты терапии.Продолжительность лечения или необходимость смены терапии будет определяться этими контрольными обследованиями. Как и другие виды рака, рак легких развивается, когда нормальные процессы деления и роста клеток нарушаются, уступая место ненормальному неконтролируемому росту. Клетки превращаются в массу или опухоль. Любой аномальный рост в организме, который напрямую поражает окружающие ткани и органы, распространяется на другие части тела или может снова вырасти после удаления, называется «злокачественным» или злокачественным. Рак легкого может развиться через несколько лет.Курение сигарет — самый распространенный фактор риска развития рака легких. Многие люди, подвергающиеся воздействию сигаретного дыма или некоторых его компонентов, в конечном итоге имеют необратимые аномальные изменения в легких. Эти изменения могут вызвать развитие раковой опухоли в легком. Рак легких является вторым по распространенности злокачественным новообразованием в стране, но он является самым смертоносным, поскольку вызывает наибольшее количество смертей среди всех видов рака. Ожидается, что в 2019 году в США будет диагностировано около 228 150 новых случаев рака легких, а в 2019 году ожидается 142 670 случаев смерти. Этап позволяет врачу полностью понять степень рака пациента, чтобы принять решение о лечении и спрогнозировать ожидаемые результаты.Врачи используют специальные термины для описания стадий рака, но простой способ описания стадии может быть следующим: Большинство видов рака легких начинаются со слизистой оболочки бронхов (дыхательные пути, отходящие от трахеи или дыхательной трубки).Рак легких также может образовываться в железах под оболочкой бронхов, часто во внешних областях легких. Эти виды рака легких относятся к одному из двух основных типов: мелкоклеточный или немелкоклеточный рак легкого, каждый из которых растет и распространяется по-разному: Немелкоклеточный рак легкого встречается гораздо чаще и обычно растет и распространяется медленнее, чем мелкоклеточный рак легкого. Существует три основных типа немелкоклеточного рака легкого, названные в честь типа клеток, из которых развивается рак: Мелкоклеточный рак легкого встречается реже, чем немелкоклеточный рак легкого, на него приходится около 15 процентов всех случаев рака легких.Этот тип рака легких быстро растет, к моменту постановки диагноза он, вероятно, будет прогрессировать и быстро распространяется на другие части тела. Существует более десятка видов необычных опухолей, которые могут развиваться в груди, которые могут возникать или не возникать в легких. Некоторые из менее распространенных типов включают карциноидные опухоли (часто расположенные в крупных дыхательных путях) и злокачественную мезотелиому, которая развивается из плевры или слизистой оболочки легкого. Мезотелиома — это рак, поражающий мезотелий, защитную мембрану, покрывающую большую часть внутренних органов тела.Этот редкий рак поражает только около 3000 человек ежегодно, обычно в части мезотелия, окружающей легкие (плевра), но иногда в перикарде, покрывающем сердце. Мезотелиома обычно возникает через десятилетия после контакта с асбестом. Признаки и симптомы рака легких не всегда проявляются, пока болезнь не прогрессирует.Однако у некоторых людей симптомы появляются на ранней стадии. К ним относятся: Расширенные симптомы рака легких включают кашель, одышку, боль в груди, усталость и / или непреднамеренную потерю веса.Признаки и симптомы, которые могут появиться, если рак распространился на другие места, включают боль в костях, головную боль, мышечную слабость и / или опущение век. Обычно беспокойство о том, что у пациента может быть рак легких, начинается с аномального обнаружения при визуализирующем исследовании грудной клетки (рентген грудной клетки или компьютерной томографии) или когда болезнь развивается достаточно далеко, чтобы вызвать такие симптомы, как кашель, одышка, грудная клетка. боль, усталость и / или потеря веса. Для диагностики требуется биопсия или удаление клеток или тканей из подозрительной массы. Биопсию можно проводить через камеру, питаемую через дыхательные трубки (так называемая бронхоскопия), или с помощью иглы, вводимой через кожу в опухоль легкого. Если эти подходы не увенчались успехом, для постановки правильного диагноза может потребоваться операция. Биопсия важна для определения того, является ли это рак, а также для определения типа рака легких. Для некоторых пациентов участие в клинических испытаниях может быть выбором лечения.Клинические испытания проводятся, чтобы выяснить, являются ли новые методы лечения рака безопасными и эффективными, или чтобы увидеть, лучше ли они стандартного лечения. Многие из современных стандартных методов лечения рака основаны на ранее проведенных клинических испытаниях. Пациенты, принимающие участие в клиническом исследовании, могут получать стандартное лечение или быть одними из первых, кто получит новое проспективное лечение. Пациенты, принимающие участие в клинических испытаниях, также помогают улучшить методы лечения рака в будущем. Даже когда клинические испытания не приводят к созданию новых эффективных методов лечения, они часто отвечают на важные вопросы и развивают медицинские знания. Скрининг рака легких — это тестирование здорового человека с высоким риском развития рака легких, у которого нет симптомов рака легких, для выявления рака легких на стадии, на которой его можно лучше лечить. Было обнаружено, что скрининг на основе низкодозной КТ грудной клетки снижает количество людей, умирающих от рака легких с приемлемым риском, при проведении в высококачественных условиях. В клинике Кливленда у нас есть комплексная программа скрининга рака легких для людей с высоким риском развития рака легких (в возрасте от 55 до 77 лет, курение более 30 лет, курение в течение последних 15 лет). Вся необходимая информация о пациенте, включая его или ее состояние здоровья, вид опухоли и степень ее распространения, объединяется для разработки наиболее подходящей терапии рака этого человека. Рак легких — это очень сложный вид рака. Тип и стадия клеток являются наиболее важными факторами при определении выживаемости на стадии во время постановки диагноза. Те, что диагностированы на локализованном этапе, могут быть излечимы. К сожалению, у большинства людей диагноз ставится, когда болезнь распространилась за пределы грудной клетки (далеко или далеко) или затрагивает узлы в груди (региональные). Кроме того, легкие — очень чувствительные органы, и некоторые формы лечения могут быть нелегкими. Эта комбинация объясняет, почему у рака легких один из самых низких показателей выживаемости среди всех видов рака.Общая двухлетняя выживаемость тех, у кого диагностирован рак легких, составляет 25%. К пяти годам выживаемость снижается до 15%. Важно обсудить с врачом цели лечения рака легких. Некоторые методы лечения могут использоваться для борьбы с раком. Другие используются для улучшения качества жизни и / или уменьшения симптомов. Эти методы лечения можно использовать по отдельности или в комбинации. Химиотерапия — это использование препаратов, предназначенных для уничтожения быстрорастущих клеток, например, раковых.Химиотерапию можно вводить непосредственно в вену (внутривенно или внутривенно) или вводить через катетер, который представляет собой тонкую трубку, помещенную в большую вену и удерживаемую там до тех пор, пока в ней больше нет необходимости. Некоторые химиотерапевтические препараты принимают внутрь в виде таблеток. Целевые агенты — это новый класс лекарств, которые предназначены для действия против определенных слабых мест в раковых клетках или окружающих поддерживающих тканях, таких как кровеносные сосуды. Эти препараты также можно принимать перорально или внутривенно. Они наиболее эффективны при раке со специфическими изменениями в генах или клеточных рецепторах. На ранних стадиях немелкоклеточного рака химиотерапия может использоваться в сочетании с хирургическим вмешательством для повышения выживаемости. На более поздних стадиях немелкоклеточного рака и на всех стадиях мелкоклеточного рака для облегчения симптомов и продления жизни могут использоваться химиотерапия и таргетная терапия. Химиотерапия влияет как на нормальные, так и на раковые клетки. Ваши врачи постараются максимально предотвратить побочные эффекты при правильном лечении рака. Побочные эффекты во многом зависят от конкретного типа лекарства и введенного количества.Они могут быть разными для каждого человека и носить временный характер. Общие побочные эффекты химиотерапии включают тошноту и рвоту, выпадение волос, язвы во рту и / или усталость. Ваш лечащий врач может посоветовать способы уменьшения побочных эффектов и облегчения симптомов, которые могут возникнуть во время и после процедур. Лучевая терапия — это форма высокоэнергетического рентгеновского излучения, убивающего раковые клетки. Его можно использовать в качестве основного лечения или в сочетании с химиотерапией (с хирургическим вмешательством или без него).Он часто может играть важную роль у пациентов с запущенным раком, облегчая боль, блокировку дыхательных путей, одышку или кашель. Лучевая терапия — это «целенаправленное» лечение, то есть оно предназначено для максимального воздействия на раковые клетки при минимальном повреждении нормальных клеток. Радиация для лечения рака легких чаще всего исходит от машины (внешнее облучение). Иногда радиация может быть доставлена внутрь с помощью трубок, которые помещают радиоактивное семя непосредственно рядом с опухолью (внутреннее облучение или брахитерапия). Побочные эффекты лучевой терапии зависят в основном от обрабатываемой части тела и лечебной дозы. Общие побочные эффекты лучевой терапии грудной клетки — это сухость, боль в горле; Трудность глотания; усталость; изменения кожи в месте обработки; и / или потеря аппетита. Область особых инноваций в лучевой терапии — это высокотехнологичный подход, иногда называемый «радиохирургией». Для очень избранных пациентов с небольшими опухолями, для которых операция нежелательна или небезопасна, радиохирургия с использованием очень высоких доз точно сфокусированного излучения, направленного только на небольшую опухоль в легком, является эффективной альтернативой. Хирургия до сих пор считается «золотым стандартом» лечения рака легких на ранних стадиях. Удаление опухоли и окружающей легочной ткани дает наилучшие шансы на выздоровление пациентам с локализованным заболеванием. Хирургическое вмешательство должно выполняться специализированными торакальными хирургами, имеющими особый опыт в лечении рака легких и других злокачественных новообразований грудной клетки. Ваш хирург определит, можно ли удалить опухоль. Не все опухоли операбельны из-за их расположения вблизи жизненно важных структур или их поражения. Для пациентов с множественными заболеваниями или плохой функцией легких операция может быть не лучшим вариантом. Это тщательно определяется нашей многопрофильной командой, в которую входят пульмонологи, медицинские онкологи и онкологи-радиологи, которые ежедневно работают вместе. Сколько легочной ткани будет удалено и какой хирургический подход будет использоваться, зависит от того, где опухоль расположена в легком, ее размера, типа тела / веса пациента и любых предыдущих операций на груди.При необходимости резекции рассматриваются минимально инвазивные подходы. Квалифицированные торакальные хирурги могут регулярно выполнять торакальную хирургию с видеосвязью (VATS) и лобэктомию VATS, а также роботизированную хирургию. Хирургическая резекция рака легкого обычно выполняется как: Восстановление после торакальной операции зависит от объема операции, малоинвазивно она или нет, а также от возраста и общей физической формы пациента. Многие пациенты возвращаются домой в течение трех-четырех дней после операции. Пациенты, перенесшие малоинвазивную операцию, обычно могут вернуться к работе через три недели после операции. Хронические заболевания и нарушения легких и дыхательных путей, а также некоторые инвазивные методы их лечения могут сказаться на здоровье и качестве жизни. В программах легочной реабилитации используется множество тактик — от обучения и физических упражнений до поощрения изменения образа жизни — чтобы помочь нашим пациентам управлять своим состоянием. Боль может быть серьезной проблемой для людей, проходящих лечение от рака.Различные методы лечения рака, а также сам рак могут вызывать боль. Эффективное обезболивание может помочь сохранить или улучшить качество жизни и снизить риск депрессии, связанной с болью. Курение — основная причина рака легких, но бросить курить может оказаться сложной задачей для некоторых хронических курильщиков. Поскольку характер курения варьируется от человека к человеку, не существует «наилучшего» способа бросить курить. Наиболее успешные программы отказа от курения предлагают курильщикам ряд стратегий. Не существует абсолютного способа предотвратить рак легких. Однако есть вещи, которые снизят ваш риск. Ваш лечащий врач поможет вам понять, чего ожидать после лечения рака с точки зрения последующего ухода, изменения образа жизни и принятия важных решений, связанных со здоровьем. Если рак легкого является локализованным или региональным и было проведено лечение с целью излечения от рака, будет проведено последующее обследование, чтобы убедиться, что рак не рецидивирует. Вы также будете оценены на предмет побочных эффектов, связанных с полученным лечением, и вам будет предложено лечение, чтобы помочь с любыми сопутствующими симптомами. Наблюдение за пациентами с метастатическим раком легких и / или лечение направлено на улучшение качества жизни и продление жизни. Исследования, проводимые с течением времени, позволят определить, как рак реагирует на лечение, и отслеживать побочные эффекты терапии.Продолжительность лечения или необходимость смены терапии будет определяться этими контрольными обследованиями. Рак легких — это тип рака, который начинается в легких. Рак начинается, когда клетки тела начинают бесконтрольно расти. Чтобы узнать больше о том, как возникает и распространяется рак, см. Что такое рак? Ваши легкие — это два губчатых органа в груди.Правое легкое состоит из 3 частей, называемых долей . У вашего левого легкого 2 доли. Левое легкое меньше, потому что сердце занимает больше места на этой стороне тела. Когда вы вдыхаете, воздух входит через рот или нос и попадает в легкие через трахею (дыхательное горло). Трахея делится на трубки, называемые , бронхи и , которые входят в легкие и делятся на более мелкие бронхи. Они разделяются, образуя более мелкие ветви, называемые бронхиолами .В конце бронхиол находятся крошечные воздушные мешочки, известные как альвеол . Альвеолы поглощают кислород в вашу кровь из вдыхаемого воздуха и удаляют углекислый газ из крови при выдохе. Поглощение кислорода и избавление от углекислого газа — основные функции ваших легких. Рак легких обычно начинается в клетках, выстилающих бронхи и части легких, такие как бронхиолы или альвеолы. Тонкий слой подкладки, называемый плеврой, окружает легкие.Плевра защищает ваши легкие и помогает им скользить вперед и назад по грудной стенке, поскольку они расширяются и сжимаются во время дыхания. Под легкими тонкая куполообразная мышца, называемая диафрагмой , отделяет грудную клетку от брюшной полости. Когда вы дышите, диафрагма движется вверх и вниз, заставляя воздух входить и выходить из легких. Существует 2 основных типа рака легких, и их лечат по-разному. Около 80–85% случаев рака легких являются НМРЛ.Основными подтипами НМРЛ являются аденокарцинома, плоскоклеточный рак и крупноклеточный рак. Эти подтипы, которые начинаются с разных типов клеток легких, объединены в группу НМРЛ, поскольку их лечение и прогнозы (прогнозы) часто схожи. Аденокарцинома: Аденокарциномы возникают в клетках, которые обычно выделяют такие вещества, как слизь. Этот тип рака легких встречается в основном у нынешних или бывших курильщиков, но он также является наиболее распространенным типом рака легких у некурящих.Он чаще встречается у женщин, чем у мужчин, и чаще встречается у молодых людей, чем другие типы рака легких. Аденокарцинома обычно обнаруживается во внешних частях легких и с большей вероятностью будет обнаружена до того, как она распространилась. Люди с типом аденокарциномы, называемым аденокарциномой in situ (ранее называвшейся бронхиолоальвеолярной карциномой ), как правило, имеют лучший прогноз, чем люди с другими типами рака легких. Плоскоклеточный рак: Плоскоклеточный рак начинается в плоскоклеточных клетках, которые представляют собой плоские клетки, выстилающие внутреннюю часть дыхательных путей в легких.Они часто связаны с курением в анамнезе и, как правило, обнаруживаются в центральной части легких, рядом с главными дыхательными путями (бронхами). Крупноклеточная (недифференцированная) карцинома: Крупноклеточная карцинома может появиться в любой части легкого. Он имеет тенденцию быстро расти и распространяться, что затрудняет лечение. Подтип крупноклеточной карциномы, известный как крупноклеточная карцинома нейроэндокринная карцинома , представляет собой быстрорастущий рак, очень похожий на мелкоклеточный рак легкого. Другие подтипы: Несколько других подтипов НМРЛ, такие как аденосквамозная карцинома и саркоматоидная карцинома, встречаются гораздо реже. Приблизительно от 10% до 15% всех случаев рака легких являются SCLC, и его иногда называют раком овсяных клеток . Этот тип рака легких имеет тенденцию расти и распространяться быстрее, чем НМРЛ. Около 70% людей с МРЛ будут иметь рак, который уже распространился на момент постановки диагноза.Поскольку этот рак быстро растет, он хорошо поддается химиотерапии и лучевой терапии. К сожалению, для большинства людей в какой-то момент рак вернется. Наряду с основными видами рака легких в легких могут возникать и другие опухоли. Карциноидные опухоли легких: Карциноидные опухоли легких составляют менее 5% опухолей легких. Большинство из них растут медленно. Для получения дополнительной информации об этих опухолях см. Карциноидная опухоль легких. Другие опухоли легких: Другие типы рака легких, такие как аденоидно-кистозные карциномы, лимфомы и саркомы, а также доброкачественные опухоли легких, такие как гамартомы, встречаются редко. Они лечатся иначе, чем более распространенные виды рака легких, и здесь не обсуждаются. Рак, который распространяется на легкие: Рак, который начинается в других органах (например, в груди, поджелудочной железе, почках или коже), иногда может распространяться (метастазировать) в легкие, но это не рак легких.Например, рак, который начинается в груди и распространяется на легкие, по-прежнему является раком груди, а не раком легких. Лечение метастатического рака в легкие зависит от того, где он начался (первичный очаг рака). Типы мелкоклеточного и немелкоклеточного рака легких
Какие бывают типы рака легких?
Рак легкого: симптомы, лечение
Обзор
ДокторСудиш Мурти Что такое рак легких?
Насколько распространен рак легких?
Какие типы рака легких? Немелкоклеточный рак легкого
Мелкоклеточный рак легкого
Редкие виды рака грудной клетки
Мезотелиома
Симптомы и причины
Какие симптомы рака легких? Диагностика и тесты
Как диагностировать и лечить рак легких? Ведение и лечение
Как лечится рак легких? Легочная реабилитация
Обезболивание
Отказ от курения
Профилактика
Как предотвратить рак легких? Перспективы / Прогноз
Каковы перспективы для людей с раком легких? Рак легкого: симптомы, лечение
Обзор
ДокторСудиш Мурти Что такое рак легких?
Насколько распространен рак легких?
Какие типы рака легких? Немелкоклеточный рак легкого
Мелкоклеточный рак легкого
Редкие виды рака грудной клетки
Мезотелиома
Симптомы и причины
Какие симптомы рака легких? Диагностика и тесты
Как диагностировать и лечить рак легких? Ведение и лечение
Как лечится рак легких? Легочная реабилитация
Обезболивание
Отказ от курения
Профилактика
Как предотвратить рак легких? Перспективы / Прогноз
Каковы перспективы для людей с раком легких? Что такое рак легких? | Типы рака легких
Нормальное строение и функция легких
Типы рака легких
Немелкоклеточный рак легкого (НМРЛ)
Мелкоклеточный рак легкого (SCLC)
Другие виды опухолей легких
типов рака легкого: общие, редкие и другие разновидности
Немелкоклеточный рак легкого
Немелкоклеточный рак легкого — наиболее распространенный тип рака легкого. На него приходится почти девять из каждых 10 случаев, и он обычно растет медленнее, чем SCLC.Чаще всего он развивается медленно и вызывает незначительные симптомы или не вызывает их вовсе, пока не разовьется.
Существует три основных типа немелкоклеточного рака легкого:
Аденокарцинома легкого: Аденокарцинома легкого — самая распространенная форма рака легкого, на которую приходится 30 процентов всех случаев в целом и около 40 процентов всех случаев немелкоклеточного рака легкого. Аденокарциномы обнаруживаются при нескольких распространенных формах рака, включая рак груди, простаты и колоректальный рак. Аденокарциномы легких обнаруживаются во внешней области легких, в железах, которые выделяют слизь и помогают нам дышать.Симптомы включают кашель, охриплость голоса, потерю веса и слабость.
Аденокарциномы образуются в клетках, которые обычно производят слизь, и диагностируются в основном у нынешних и бывших курильщиков.
Другие ключевые факты об аденокарциноме:
- Это самый распространенный вид рака среди людей, которые никогда не курили.
- Это наиболее распространенная форма рака легких среди молодежи.
- Женщины более склонны к развитию этого рака, чем мужчины.
- Врачи часто обнаруживают аденокарциному еще до того, как она распространится.
- Для аденокарциномы in situ (когда врачи обнаруживают аномальные клетки в железистой ткани, выстилающей легкие) прогноз часто намного лучше по сравнению с другими типами рака легких.
Подробнее об аденокарциноме легкого
Плоскоклеточный: Этот тип рака легкого обнаруживается в центре легкого, где более крупные бронхи соединяются с трахеей и легким, или в одной из основных ветвей дыхательных путей. Плоскоклеточный рак легкого является причиной около 30 процентов всех немелкоклеточных форм рака легкого и, как правило, связан с курением.
Крупноклеточная недифференцированная карцинома: Крупноклеточная недифференцированная карцинома Рак легких быстро растет и распространяется и может быть обнаружен в любом месте легких. На этот тип рака легких обычно приходится от 10 до 15 процентов всех случаев НМРЛ. Крупноклеточная недифференцированная карцинома имеет тенденцию к быстрому росту и распространению.
Другие ключевые факты о крупноклеточной недифференцированной карциноме включают:
- Этот тип рака легких может быстро разрастаться и распространяться, что затрудняет лечение.
- Другой быстрорастущий подтип, называемый крупноклеточной нейроэндокринной карциномой, имеет сходство с мелкоклеточным раком легкого.
К другим менее распространенным подтипам НМРЛ относятся саркоматоидная карцинома и аденосквамозная карцинома.
Врачи определяют тяжесть НМРЛ с помощью процесса определения стадии, который показывает, распространился ли рак на легкие или на другие части тела.
НМРЛ классифицируется по следующим стадиям:
- Оккультизм, или скрытая стадия
- Этап 0
- 1 этап
- 2 этап
- 3 этап
- 4 этап
Для диагностики и определения стадии НМРЛ врачи используют ряд тестов, в том числе:
Лечение немелкоклеточного рака легкого включает:
Мелкоклеточный рак легкого
Мелкоклеточный рак легких также известен как «овсяно-клеточный» рак, потому что под микроскопом клетки выглядят как овес.Он часто начинается в бронхах, затем быстро растет и распространяется на другие части тела, включая лимфатические узлы. Этот тип рака легких составляет менее 20 процентов всех случаев рака легких и обычно вызывается курением табака.
SCLC часто растет и распространяется быстрее, чем NSCLC, но обычно хорошо поддается химиотерапии и лучевой терапии. SCLC часто рецидивирует у многих людей, у которых он развивается.
Мелкоклеточный рак легкого делится на два типа, названных в честь типов клеток, обнаруженных в раке, и того, как эти клетки выглядят под микроскопом:
- Мелкоклеточный рак (рак овса)
- Комбинированная мелкоклеточная карцинома
Врачи могут использовать эти тесты для диагностики и определения стадии SCLC:
- Сканирование костей
- Компьютерная томография
- МРТ)
- ПЭТ сканирование
Мелкоклеточный рак легкого может быть очень агрессивным и требует немедленного лечения.Лечение мелкоклеточного рака легкого включает:
- Химиотерапия
- Иммунотерапия
- Лазерная терапия
- Лучевая терапия
- Хирургия
Карциноидные опухоли легких
Карциноидные опухоли легких, или карциноиды легких, представляют собой необычный тип рака легких, который, по данным ACS, обычно растет медленнее и составляет от 1 до 2 процентов всех случаев рака легких.
Обычно они образуются в клетках легких, называемых нейроэндокринными клетками.
Двумя основными подтипами карциноидных опухолей легких являются типичные карциноиды и атипичные карциноиды:
- Типичные карциноиды, которые обычно растут медленно, составляют 90 процентов случаев карциноидов легких. Они не часто распространяются через легкие и не связаны с курением. Средний возраст для этого диагноза — 45 лет.
- Атипичные карциноиды растут быстрее, могут иметь больше шансов на распространение на другие органы и могут быть связаны с курением.Они встречаются реже, чем типичные карциноиды, и имеют клетки, напоминающие клетки быстрорастущей опухоли. Средний возраст для этого диагноза — 55 лет.
Врачи иногда классифицируют карциноидные опухоли легких на основе того места, где они впервые появились в легких:
- Центральные карциноиды составляют большинство случаев карциноидов легких. Эти опухоли развиваются в бронхах, которые представляют собой большие дыхательные пути около середины легких. Большинство центральных карциноидов являются типичными карциноидами.
- Периферические карциноиды развиваются в бронхиолах, которые представляют собой меньшие дыхательные пути около внешних областей легких. Большинство периферических карциноидов также являются типичными карциноидами.
Поскольку при раке легких симптомы не всегда развиваются, рак часто дает метастазы до того, как его диагностируют. Даже если рак мог образовать опухоль в новом месте тела,
Подробнее о метастатическом раке легких
Редкие формы рака легких
Несколько типов и подтипов рака легких очень редки.В их числе:
- Аденосквамозная карцинома легкого, гибрид аденокарциномы и плоскоклеточного рака легкого
- Крупноклеточная нейроэндокринная карцинома, агрессивный подтип немелкоклеточного рака легкого
- Карцинома легких по типу слюнных желез, которая чаще всего обнаруживается в центральных дыхательных путях легких
- Карциноиды легких, редкий тип рака, часто обнаруживаемый у пациентов с раком легких моложе среднего
- Мезотелиома, редкий тип рака, который развивается в тонкой ткани, называемой мезотелием, которая выстилает легкие и брюшную полость
Опухоли средостения также редки и развиваются в средостении, которое разделяет легкие в центре грудной клетки.
Трахея (или трахея), пищевод, сердце, соединительные ткани и другие органы являются частью средостения. У взрослых большинство опухолей средостения формируются в передней части средостения и обычно относятся к одной из следующих категорий:
- Опухоли зародышевых клеток
- Злокачественные или раковые лимфомы
- Тимома
К другим чрезвычайно редким формам рака легких относятся саркоматоидная карцинома легкого и злокачественные гранулярно-клеточные опухоли легких.
Следующая тема: Что такое аденокарцинома рака легкого?
Рак легкого: диагностика, принципы лечения и обследование
1. Heron M. Смерти: основные причины в 2010 г. Natl Vital Stat Rep . 2013; 62 (6): 1–96 ….
2. Центры по контролю и профилактике заболеваний. Статистика рака легких. http://www.cdc.gov/cancer/lung/statistics. Проверено 5 июля 2014 г.
3. Американское онкологическое общество. Рак легких (немелкоклеточный). http: // www.Cancer.org/cancer/lungcancer-non-smallcell/detailedguide/non-small-cell-lung-cancer-key-statistics. По состоянию на 5 июля 2014 г.
4. Howlader N, Noone AM, Krapcho M, et al., Eds. Обзор статистики рака SEER (CSR) 1975–2011. Обновлено 10 сентября 2014 г. http://seer.cancer.gov/csr/1975_2011. По состоянию на 5 июля 2014 г.
5. Henley SJ, Ричардс ТБ, Андервуд Дж. М., Эхеман ЧР, Плеща М, McAfee TA; Центры по контролю и профилактике заболеваний.Тенденции заболеваемости раком легких среди мужчин и женщин — США, 2005–2009 гг. [Опубликованные поправки представлены в MMWR Morb Mortal Wkly Rep. 2014; 63 (2): 45]. MMWR Morb Mortal Wkly Rep . 2014; 63 (1): 1–5.
6. Джемал А, Тун MJ, Рис Лос-Анджелес, и другие. Ежегодный отчет для страны о состоянии рака, 1975–2005 гг., С указанием тенденций в отношении рака легких, употребления табака и борьбы против табака. Национальный институт рака . 2008. 100 (23): 1672–1694.
7. Альберг А.Дж., Брок М.В., Ford JG, Самет Дж. М., Spivack SD. Эпидемиология рака легких: диагностика и лечение рака легких, 3-е изд: Руководящие принципы клинической практики Американского колледжа грудных врачей, основанные на фактических данных. Сундук . 2013; 143 (5 доп.): E1S – e29S.
8. Асоманинг К, Миллер Д.П., Лю Г, и другие. Пассивное курение, возраст воздействия и риск рака легких. Рак легких .2008. 61 (1): 13–20.
9. Национальный институт рака. Профилактика рака легких. Факторы экологического риска. http://www.cancer.gov/cancertopics/pdq/prevention/lung/Patient/page3#Keypoint9. По состоянию на 5 января 2014 г.
10. Ferreccio C, Юань Y, Calle J, и другие. Мышьяк, табачный дым и род занятий: связь нескольких агентов с раком легких и мочевого пузыря. Эпидемиология . 2013; 24 (6): 898–905.
11. Hubaux R, Беккер-Сантос Д. Д., Энфилд KS, Лам С, Лам В.Л., Мартинес В.Д.Мышьяк, асбест и радон: новые игроки в онкогенезе легких. Здоровье окружающей среды . 2012; 11: 89.
12. Агентство по охране окружающей среды США. Справочник по радону для гражданина. http://www.epa.gov/radon/pubs/citguide.html. По состоянию на 5 июля 2014 г.
13. Геологическое общество США. Геологический радоновый потенциал США. http://energy.cr.usgs.gov/radon/rnus.html. По состоянию на 5 июля 2014 г.
14. Travis LB, Gospodarowicz M, Кертис Р. Э., и другие.Рак легких после химиотерапии и лучевой терапии болезни Ходжкина. Национальный институт рака . 2002. 94 (3): 182–192.
15. Аманн Дж., Калянкришна С, Массион П.П., и другие. Аберрантная передача сигналов рецепторами эпидермального фактора роста и повышенная чувствительность к ингибиторам EGFR при раке легких. Cancer Res . 2005. 65 (1): 226–235.
16. Трэвис В.Д., Брамбилла Э, Ногучи М, и другие.Международная ассоциация по изучению рака легких / Американское торакальное общество / Европейское респираторное общество — международная мультидисциплинарная классификация аденокарциномы легких. J Торак Онкол . 2011; 6 (2): 244–285.
17. Беклз М.А., Спиро СГ, Colice GL, Rudd RM. Первоначальная оценка пациента с раком легких. Сундук . 2003; 123 (1 доп.): 97С – 104С.
18. Гамильтон В, Питерс Т.Дж., Раунд А, Шарп Д.Каковы клинические признаки рака легких до постановки диагноза? Популяционное исследование случай-контроль. Грудь . 2005. 60 (12): 1059–1065.
19. Гамильтон В, Шарп Д. Диагностика рака легких в первичной медико-санитарной помощи: структурированный обзор. Фам Прак . 2004. 21 (6): 605–611.
20. Прокладка J, Тигровый L, Саймон М, Джордж С. Систематический обзор симптоматической диагностики рака легких. Фам Прак .2014. 31 (2): 137–148.
21. Шепли М, Мэнселл Дж., Иордания JL, Иордания КП. Положительная прогностическая ценность 35% в первичной медико-санитарной помощи при раке: систематический обзор Br J Gen Pract . 2010; 60 (578): e366 – e377.
22. Ривера МП, Мехта AC, Вахиди ММ. Установление диагноза рака легких: диагностика и лечение рака легких, 3-е изд .: Руководящие принципы клинической практики Американского колледжа грудных врачей, основанные на доказательствах. Сундук . 2013; 143 (5 доп.): E142–165S.
23. Lamprecht B, Порш П, Пирич С, Студницкая М. Электромагнитная навигационная бронхоскопия в сочетании с ПЭТ-КТ и быстрым цитопатологическим обследованием на месте для диагностики периферических поражений легких. Легкое . 2009. 187 (1): 55–59.
24. Herth FJ, Эберхардт Р, Вильманн П., Красник М, Эрнст А. Эндобронхиальная трансбронхиальная игольчатая аспирация под контролем эндобронхиального ультразвука в режиме реального времени для отбора проб средостенных лимфатических узлов. Грудь . 2006. 61 (9): 795–798.
25. Деттербек, Постмус ЧП, Tanoue LT. Классификация стадий рака легких: диагностика и лечение рака легких, 3-е изд. Американского колледжа грудных врачей, руководящие принципы клинической практики, основанные на фактических данных. Сундук . 2013; 143 (5 приложений): e191S – e210S.
26. Собин Л.Х., Господарович М.К., Виттекинд С; Международный союз борьбы с раком. Классификация злокачественных опухолей TNM. 7-е изд.Оксфорд, Соединенное Королевство: Wiley-Blackwell; 2009.
27. Mirsadraee S, Осваль Д., Ализаде Y, Кауло А, ван Бик Э. младший 7-я система классификации и определения стадии рака легкого TNM: Обзор изменений и последствий. World J Radiol . 2012. 4 (4): 128–134.
28. Стахель Р.А., Гинзберг Р., Хавеманн К, и другие. Стадия и прогностические факторы мелкоклеточного рака легкого: консенсусный отчет. Рак легких . 1989. 5 (4–6): 119–326.
29. Окен М.М., Крич RH, Торми округ Колумбия, и другие. Критерии токсичности и ответа Восточной совместной онкологической группы. Ам Дж. Клин Онкол . 1982. 5 (6): 649–655.
30. Деттербек ФК, Льюис С.З., Дикемпер Р, Аддризцо-Харрис Д., Альбертс WM. Резюме: диагностика и лечение рака легких, 3-е изд: Руководящие принципы клинической практики Американского колледжа грудных врачей, основанные на фактических данных. Сундук . 2013; 143 (5 доп.): 7С – 37С.
31. Howington JA, Блюм МГ, Чанг AC, Балекян А.А., Murthy SC. Лечение немелкоклеточного рака легкого I и II стадии: диагностика и лечение рака легких, 3-е изд: Руководящие принципы клинической практики Американского колледжа грудных врачей, основанные на фактических данных. Сундук . 2013; 143 (5 доп.): E278S – e313S.
32. Ramnath N, Диллинг Т.Дж., Харрис LJ, и другие.Лечение немелкоклеточного рака легкого стадии III: диагностика и лечение рака легких, 3-е изд: Руководящие принципы клинической практики Американского колледжа грудных врачей, основанные на фактических данных. Сундук . 2013; 143 (5 приложений): e314S – e340S.
33. Temel JS, Грир Дж. А., Музиканский А, и другие. Ранняя паллиативная помощь пациентам с метастатическим немелкоклеточным раком легкого. N Engl J Med . 2010. 363 (8): 733–742.
34.Джетт-младший, Schild SE, Кеслер К.А., Калемкерян Г.П. Лечение мелкоклеточного рака легких: диагностика и лечение рака легких, 3-е изд: Руководящие принципы клинической практики Американского колледжа грудных врачей, основанные на фактических данных. Сундук . 2013 г .; 143 (5 дополн.): E400S – e419S.
35. Целевая группа превентивных служб США. Рак легких: скрининг. Декабрь 2013 г. http://www.uspreventiveservicestaskforce.org/Page/Document/RecommendationStatementFinal/lung-cancer-screening.По состоянию на 24 марта 2014 г.
36. Aberle DR, Адамс А.М., Берг CD, и другие.; Национальная исследовательская группа по скринингу легких. Снижение смертности от рака легких с помощью низкодозовой компьютерной томографии. N Engl J Med . 2011; 365 (5): 395–409.
37. de Koning HJ, Меза Р, Плеврит СК, и другие. Преимущества и вред компьютерной томографии стратегии скрининга рака легких: сравнительное модельное исследование для U.S. Целевая группа по профилактическим услугам. Энн Интерн Мед. . 2014; 160 (5): 311–320.
38. Американская академия семейных врачей. Рекомендации клинико-профилактической службы. Рак легких. 2013. https://www.aafp.org/patient-care/clinical-recommendations/all/lung-cancer.html. По состоянию на 24 марта 2014 г.
39. Целевая группа по профилактическим услугам США. Консультации и мероприятия по профилактике употребления табака и болезней, вызванных табаком, у взрослых и беременных женщин. Энн Интерн Мед. .2009. 150 (8): 551–555.
40. Larzelere MM, Williams DE. Содействие отказу от курения.
 J. Radiat. Oncol. 2011. Vol.79, №2, P. 466-472.
J. Radiat. Oncol. 2011. Vol.79, №2, P. 466-472. American Public Health Association, 1995. Vol.152, №1, P. 225-230.
American Public Health Association, 1995. Vol.152, №1, P. 225-230. Int. J. Cancer. Wiley Subscription Services, Inc., A Wiley Company, 2013. Vol.132, №2, P. E37-E47.
Int. J. Cancer. Wiley Subscription Services, Inc., A Wiley Company, 2013. Vol.132, №2, P. E37-E47.