Парастернальные лимфоузлы — увеличение лимфоузлов грудной клетки
Воспалительная и невоспалительная реакция лимфатической системы на локализированные или системные заболевания является одним из ключевых симптомов, которые позволяют заподозрить патологию. Диагностика заболеваний в грудной клетке обусловлена плотным реберным и мышечным каркасом, что препятствует доступной пальпации и вызывает необходимость использования инструментальных методов. Увеличенные парастернальные лимфоузлы на рентгеновских снимках или томограммах – вероятный симптом патологий стенки или органов грудной стенки, которые требуют адекватной терапии.
Лимфоузлы грудной клетки: анатомия, классификация и функции
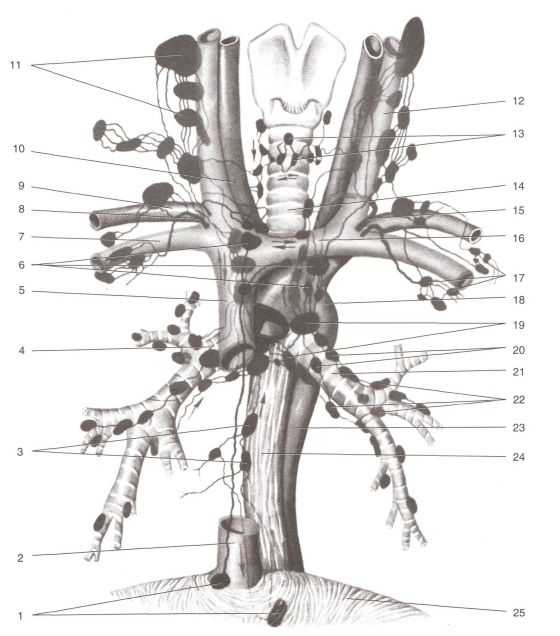
Расположение висцеральной группы лимфатических узлов грудной полости (фото: www.metodich.ru)
Отток жидкости, лимфы от органов грудной клетки осуществляется помощью комплекса структур лимфатической системы. Последняя представлена совокупностью сосудов, которые слепо заканчиваются у тканей, по ходу перерываются лимфатическими узлами и соединяются с венозным руслом кровеносной системы.
Структуры данной системы обеспечивают иммунную и механическую защиту, используя ретикулярное строение лимфоидной ткани узла как биологический фильтр. Кроме того, в лимфоузлах происходит образование иммунных клеток, которые увеличивают выработку антител в ответ на поступающие из внешней среды антигены (вирусы, бактерии, простейшие, грибки).
Общее количество лимфоузлов в грудной клетке составляет от 40 до 70 образований. Разделяют две большие группы:
- Внутренностные (висцеральные) – собирают лимфу от сердца, легких, бронхов, пищевода и других органов.
- Пристеночные (париетальные) – от мышц, фасций, кожи стенки грудной клетки.
Анатомическая классификация и область лимфооттока каждой группы представлены в таблице.
|
|
Группа |
Забирают лимфу |
|
Висцеральные |
|
|
|
Париетальные (располагаются небольшим кольцом вокруг полых органов – пищевода, трахеи, ворот легких) |
|
|
Лимфатические узлы представляют собой округлые образования размером до 3 мм, располагаются симметрично с обеих сторон, и в норме не вызывают никаких дискомфортных ощущений в грудной клетке. При обзорной рентгенографии органов грудной полости – лимфатические узлы не определяются.
Важно! При значительном увеличении в размерах группа парастернальных лимфоузлов пальпируется по краю грудины.
Причины увеличения лимфатических узлов грудной клетки
Наиболее распространенным признаком вовлечения в патологический процесс лимфатических узлов является увеличение органа в размерах.
Существует несколько механизмов возникновения патологического разрастания ткани грудных лимфоузлов:
- Патологическое разрастание ткани узла без признаков воспаления (лимфаденопатия). Чаще всего данное состояние возникает при нарушении процесса деления клеток, что характерно для злокачественных новообразований.
- Метастатическое поражение – разрастание лимфоузла возникает вследствие занесения опухолевой ткани с первичного очага и дальнейшего деления атипичных клеток.
- Воспалительная реакция (лимфаденит). При наличии локального или системного воспалительного процесса с повышенной концентрацией медиаторов в крови, возникает повышение проницаемости сосудистой стенки. Проникающая в ткань лимфоузла плазма вызывает отек и увеличение органа в размерах. Наиболее характерный механизм для инфекционных заболеваний.
Кроме того, длительное сохранение в размерах увеличенного лимфоузла может возникать после перенесенного заболевания вследствие замещения лимфоидной ткани – плотной соединительной, или кальцинозом (отложение солей кальция).
Важно! Вероятно, вовлечение в процесс пристеночных лимфоузлов грудной клетки (межреберных, парастернальных и других) при дерматологических заболеваниях или гнойных хирургических патологиях мягких тканей грудной клетки.
Клинические проявления лимфаденопатии в грудной клетке
Пациенты с увеличенными грудными лимфатическими узлами чаще всего страдают от непрямого воздействия лимфаденопатии (через сдавливание соседних структур):
- Кашель – при вовлечении в процесс трахеобронхиальных или легочных лимфоузлов.
- Одышка.
- Тяжесть в грудной клетке при значительном увеличении одной группы узлов или системном поражении лимфоидных структур.
- Дисфагия и нарушение глотание при поражении околопищеводной группы лимфоузлов.
- Боль в области сердца – при нарушении оттока крови через поврежденные передперикардиальные лимфатические узлы.
- Отеки нижних конечностей через сдавливание полых вен, которые находятся рядом с передпозвоночной группой лимфоузлов.
В случае возникновения воспалительного процесса, клиническая картина сопровождается повышением температуры (от 38°С), общей слабостью, головной болью, отеком мягких тканей грудной стенки.
Заболевания, протекающие с увеличением внутригрудных лимфоузлов
При инфицировании легочной ткани микобактерией туберкулеза воспаляются внутригрудные лимфоузлы (фото: www.medicine-wiki.net)
Существует множество патологий, которые вызывают реактивные изменения в лимфатических узлах грудной клетки. Наиболее распространенные заболевания, при которых в процесс втягиваются внутригрудные лимфоузлы:
- Пневмония – воспаление легких. Терапевтическая патология, вызванная инфицированием легочной ткани бактериями (Str. pneumoniae) или вирусами. Сопровождается повышением температуры, высокой интоксикацией, кашлем и ослабленным дыханием.
- Плеврит – заболевание, при котором воспаляется серозная оболочка, выстилающая грудную стенку – плевра. Различают сухой и экссудативный вариант (с накоплением свободной жидкости). Чаще всего патология является осложнением гнойно-воспалительных процессов в легочной ткани.
- Бронхоэктатическая болезнь – состояние, характеризующиеся нарушением эластичности бронхиол и патологическим выпячиванием последних. В расширенных пространствах нарушается дренаж жидкости, развиваются гнойно-воспалительные процессы.
- Туберкулез легких – инфекционная патология, вызванная M.tuberculosis, которая передается воздушно-капельным путем. Наиболее часто поражается легочная ткань с образованием первичного туберкулезного комплекса – очаг в легком, лимфангоит (воспаляется лимфатический сосуд) и лимфаденит.
- Пневмокониозы (силикоз, антракоз, асбестоз) – патологическое накопление ив легочной ткани инородных пылевых частиц, которые попадают в дыхательные пути работающих во вредных условиях труда. Наиболее часто данное состояние регистрируется у мужчин возрастом от 25 до 50 лет, работающих на угольных и железно-рудных шахтах.
- Мастит – гнойно-воспалительная патология молочной железы, которая возникает у женщин репродуктивного возраста вследствие проникновения бактериальной флоры в благоприятные условия (например, при лактостазе – застое молока).
Увеличение лимфоузлов грудной полости без признаков воспаления чаще всего возникает при злокачественных новообразованиях:
- Рак легких: центральный, периферический, атипический.
- Рак пищевода.
- Рак молочной железы.
- Мезотелиома – злокачественное новообразование плевры.
- Метастазы при первичной опухоли желудка, печени или костей.
- Лимфогранулематоз – системное онкологическое заболевание с поражением системы лимфоцитов и лимфоидной ткани узлов. Характеризуется генерализированным распространением с постепенным вовлечением всех групп лимфоузлов (постановка стадии заболевания – по количеству групп).
Важно! Миокардит, перикардит и абсцессы печени также могут сопровождаться воспалением лимфоузлов на груди.
Необходимые исследования и консультации специалистов при увеличенных грудных лимфоузлах
Пациентам, у которых воспалились лимфатические узлы грудной клетки, рекомендовано комплексное обследование специалистов в зависимости от клинической картины и особенностей течения заболевания:
- Терапевта – при наличии высокой температуры, кашля, одышки, которые возникли остро.
- Кардиолога – при наличии боли в сердце, ощущения сдавливания, одышки, отеков на нижних конечностях.
- Фтизиатра – в случае подозрения на туберкулез: субфебрильная температура (37-38°С), длительный кашель.
- Хирурга – при наличии покраснения, повышения местной температуры кожи над молочной железой. Кроме того, врач занимается вопросами оперативного лечения бронхоэктатической болезни, удаления плеврального выпота при экссудативном плеврите.
- Онколога – в случае длительной субфебрильной температуры, похудения, медленно нарастающих симптомов вдавливания в грудной клетке.
С целью постановки диагноза и установления первичной причины лимфаденопатии или лимфаденита необходимо проведение следующих клинических исследований:
- Общего анализа крови (определить количество лейкоцитов, формулу крови и значение СОЭ, которое увеличивается при воспалительных и онкологических процессах).
- Биохимический анализ крови на онкомаркеры для исключения злокачественных новообразований.
- Фиброгастродуоденоскопия – с целью исключения патологий пищевода как причины реактивного воспаления лимфоузлов.
- Рентгенография или компьютерная томография (КТ) органов грудной клетки – метод визуализирует первичный очаг при опухолевых заболеваниях, пневмонии, бронхоэктатической болезни, туберкулезе и пневмокониозах.
- Биопсия лимфоузла (во время операции) – с целью верификации диагноза злокачественного новообразования или метастатического поражения.
Назначение адекватной терапии проводится лечащим врачом после анализа полученных данных, проведения дифференциальной диагностики и постановки клинического диагноза. Методы лечения отличаются для каждой патологии, поэтому не рекомендуется заниматься самолечением, что может ухудшить общее состояние пациента.
simptomyinfo.ru
Лимфатические узлы молочных желез | Компетентно о здоровье на iLive
Строение лимфатических узлов молочных желез
Парамаммарные лимфатические узлы расположены на большой грудной мышце, по ее наружному краю. Именно они являются основными узлами первого этапа. Выносящие сосуды, которые составляют основу строения лимфатических узлов молочных желез, впадают в аксиллярные лимфатические узлы. Они же в свою очередь являются лимфатическими узлами первого этапа. Локализуются на четвертом зубце, иногда называются узлом Бартельса.
Основной и самой крупной группой лимфатических узлов являются подмышечные группы. Часть их находится на поверхности, они разделены на три подгруппы. Сюда включают наружные, центральные и подлопаточные узлы. Наружные или латеральные подмышечные узлы расположены возле боковой грудной артерии. Центральные узлы находятся вдоль подмышечной вены. К ним происходит отток лимфы от наружных квадрантов молочной железы. Задние подмышечные узлы имеют несколько другое расположение и проходят вдоль подлопаточной артерии.
Еще одна группа лимфатических узлов включает в себя лимфоузлы расположенные под ключицей. Располагаются они в области под ключицей. Их относят к узлам первого этапа, которые включаются в верхние квадранты молочных желез. В них впадают лимфатические сосуды. Одновременно они относятся к узлам первого этапа верхнего отдела молочной железы.
Парастернальные лимфатические узлы расположились по внутренней грудной артерии. Находятся они в первом-седьмом межреберном промежутках. Самое большое скопление их наблюдается в пределах второго-четвертого промежутков. Парастернальные лимфатические узлы, расположены на втором-четвертом межреберье. Их относят к числу узлов первого этапа оттока от молочной железы. К узлам второго этапа относят выносящие сосуды подмышечных лимфатических узлов.
Железы лимфатических сосудов от своего основания следуют к лимфатическим узлам ретромаммарного пространства. После чего они пронизывают большую грудную мышцу и проходят в межпекторальные узлы. С этого участка лимфа начинает оттекать в центральные подмышечные лимфатические узлы.
Некоторая часть сосудов проходит не только через большую, но и малую грудную мышцы. Затем через ребра они проникают к парастернальным лимфатическим узлам, то бишь первому этапу. В молочной железе имеются и непостоянные лимфатические узлы. Они располагаются в области между малой и большой грудной мышцей.
Регионарные лимфатические узлы молочной железы
Молочная железа характеризуется своим сложным строением. В ее «состав» входит масса лимфатических узлов различных этапов. К регионарным лимфатическим узлам, располагающимся в молочной железе, относят целую группу подмышечных узлов. Подразделяется она на три основных уровня. Первый уровень это нижние подмышечные узлы. Расположены они сбоку к боковой границе с малой грудной мышцей. Второй уровень представляет собой средние подмышечные узлы. Располагаются они в области между медиальным и латеральным краями малой грудной мышцы. Третий уровень представлен апикальными подмышечными узлами. Располагаются они по центру, относительно к медиальному краю малой грудной мышцы. В их число включают подключичные и апикальные лимфоузлы.
К регионарным лимфатическим узлам относят и внутренние. Находятся они на стороне поражения, то бишь чаще всего страдают при раке груди. Более того, их обозначают даже специальным символом М.
Аксиллярные лимфатические узлы в молочной железе
Иногда эти лимфатические узлы обнаруживают путем маммографии на латеральном отделе, который располагается вверху квадранта молочной железы. Он способствует появлению небольшой округлой тени. Благодаря такой особенности аксиллярных лимфатических узлов в молочной железе можно заметить участки просветления. Заметны они из-за скопления жира.
Аксиллярная лимфаденопатия представляет собой нарушенное функционирование подмышечных узлов. Этот процесс влечет за собой увеличение лимфоузлов. При пальпации ощущается неприятная боль. Данное явление может быть признаком развития серьезного заболевания. В том числе рака молочной железы, туберкулеза и многих других болезней. Аксиллярные лимфоузлы страдают чаще остальных. Поэтому при их увеличении необходимо приступить к поиску причины, которая вызвала этот процесс. Самым простым способом осмотра в данном случае является проведение биопсии.
[9], [10], [11], [12], [13], [14], [15]
Интрамаммарный лимфатический узел молочной железы
Под интрамаммарными лимфатическими узлами кодируют аксиллярные или подмышечные лимфоузлы. В виду своего расположения они чаще всего страдают от серьезных заболеваний, в том числе и рака груди. При подозрении на поражение молочной железы интрамаммарные лимфатические узел исследуется первым. Обследование проводят по средствам маммографии.
Как упоминалось выше, интрамаммарный узел относится к числу подмышечных. Они же в свою очередь делятся на несколько уровней, разделяющихся по-своему расположению. Подробная информация о подмышечных лимфатических узлах была представлена выше.
При нарушении функциональности интрамаммарного лифатического узла происходит значительное его увеличение. В некоторых случаях процесс сопровождается болью. Увеличение лимфоузла является серьезной проблемой, и требует немедленного обследования. Для исследования этого лимфатического узла прибегают к помощи биопсии.
Исследование лимфатических узлов молочной железы
На сегодняшний день можно выделить массу методов для исследования. Первым делом проводится клиническая диагностика. Такой способ исследования лимфатических узлов молочной железы позволяет собрать все данные о пациентке, а также провести осмотр и пальпацию. При сборе анамнеза необходимо особое внимание уделять длительности течения заболевания, а также развитию симптоматики.
Физикальное обследование представляет собой осмотр и пальпацию молочной железы. Проводить процедуру нужно при дневном свете. Особое внимание уделяется симметричности молочных желез, наличию деформаций вокруг сосков и ареол. После осмотра и пальпации прибегают к морфологической диагностике. Верификация диагноза с помощью данного исследования является важным мероприятием, если есть риск развития злокачественного процесса в молочной железе.
- Цитологическое исследование чаще всего используют в онкологии. Для него характерно проведение диагностической пункции с помощью тонких игл. Кончиком иглы определяют самое уплотненное место на груди и прокалывают его. Шприцем производится набор исследуемого материала, после чего он переносится на стекло. Данный метод исследования позволят определить характер процесса, а также степень дифференцировки клеток. Методика не так распространена, ее применяют только лишь для уточнения лимфогенного распространения рака.
- Лучевая диагностика. На сегодняшний день этот вид исследования играет ведущую роль. Основными методами лучевой диагностики считают рентгенологический и ультразвуковой способ осмотра. Включают сюда и другие мероприятия, такие как компьютерную томографию, магнитно-резонансную томографию, термографию и радионуклидный метод. Используют их исключительно по специальным показаниям.
- Рентгенологическое исследование. Этот способ позволит сделать снимки пораженного участка и по затемнениям на них понять расположение патологического процесса. В некоторых случаях прибегают к помощи рентгенограммы в нестандартных проекциях.
- Аксиллография. Это способ исследования позволяет выявить поражения лимфатические узлов. Он дает полную картинку происходящего.
- Дуктография проводится в случае подозрения наличия патологической секреции из соска. Для этого в млечные протоки молочной железы вводит 0,5-2 мо водорастворимого контрастного вещества на основе йода.
- Пневмокистография. Эта методика заключается в проведении пункции кисты, в результате которой можно заметить ее очертания.
- УЗИ. Этот метод исследования является самым распространенным. Он обладает рядом преимуществ и позволяет в точности определить наличие патологического процесса. Причем исследование является безвредным и безопасным.
- Термография. Этот принцип заключается в дистанционной регистрации с поверхности тела человека тепловизоров инфракрасного излучения. Они отражают степень биоэнергетических процессов которые происходят в различных участках того или иного органа. Результат исследования можно получить в виде термограммы.
- Компьютерная томография. Это способ исследования применяют для обнаружения метастазов при раке молочной железы, а также для оценки распространенности патологического процесса.
- Магнитно — резонансная томография. Этот метод исследования обладает скромными возможностями. Его редко применяют как отдельный способ диагностирования заболевания.
- Радионуклидное исследование молочной железы. Даная методика применяется в качестве дополнительной. Она позволяет определить злокачественность патологического процесса, а также оценить эффективность назначенного противоопухолевого лечения. Этот способ исследования является высокоэффективным.
УЗИ молочных желез и лимфатических узлов
Применяют данный метод исследования из-за его эффективности и безопасности. Он не имеет никаких противопоказаний и считается абсолютно безвредным. На сегодняшний день узи молочных желез и лимфатических узлов применяют довольно часто. Его рекомендуют при общем обследовании женщины с жалобами на болезненность молочных желез. Узи безопасно даже для беременных и пациенток молодого возраста.
Этот способ позволяет определить точную причину болезненности и провести наблюдение за состоянием молочных желез в целом. На ранних стадиях оно позволяет выявить рак и начать его своевременное лечение. Прибегать к помощи Узи необходимо при постоянной болезненности молочных желез, особенно в период предменструальной фазы. При выделениях из соска, изменении цвета кожи и увеличение подмышечных лимфатических узлов обследование нужно обязательно проводить. Рекомендуется делать УЗИ не реже 2-х раз в год. Проведение процедуры не требует особой подготовки. Приходить на осмотр желательно в первой фазе менструального цикла.
ilive.com.ua
К вопросу диагностики метастатического поражения парастернального коллектора при раке молочной железы | Маслянкин Д.Б., Чистяков С.С., Триголосов А.В.
Резюме. В настоящее время существует несколько методов диагностики и лечебного воздействия на парастернальные лимфатические узлы при раке молочной железы. В связи с развитием и активным внедрением в хирургическую практику методов видео–ассистированных вмешательств возникла идея применить их в лечении рака молочной железы, а именно для диагностики метастатического поражения парастернального лимфатического коллектора и лечебного воздействия на данную зону. Учитывая опыт немногочисленных выполненных вмешательств, дополненных видеоторакоскопической парастернальной лимфодиссекцией, по поводу рака молочной железы различных локализаций и стадий, остается нерешенным ряд вопросов, касающихся роли данного метода в диагностике и лечении рака молочной железы.
Резюме. В настоящее время существует несколько методов диагностики и лечебного воздействия на парастернальные лимфатические узлы при раке молочной железы. В связи с развитием и активным внедрением в хирургическую практику методов видео–ассистированных вмешательств возникла идея применить их в лечении рака молочной железы, а именно для диагностики метастатического поражения парастернального лимфатического коллектора и лечебного воздействия на данную зону. Учитывая опыт немногочисленных выполненных вмешательств, дополненных видеоторакоскопической парастернальной лимфодиссекцией, по поводу рака молочной железы различных локализаций и стадий, остается нерешенным ряд вопросов, касающихся роли данного метода в диагностике и лечении рака молочной железы.Ключевые слова: рак молочной железы, метастазирование, видеоторакоскопическая парастернальная лимфодиссекция.
Целью настоящего исследования является анализ современных возможностей диагностики парастернальных метастазов рака молочной железы.
Анатомия парастернальной зоны. Анатомически эта регионарная зона представлена треугольной щелью с основанием у края грудины и вершиной, обращенной к месту перехода хрящевой части ребер в костную. Спереди она ограничена реберными хрящами и межреберными мышцами, выстланными фасциальной пластиной, а сзади – внутренней грудной фасцией и париетальной плеврой. Содержимым парастернального пространства являются внутренняя грудная артерия (ветвь подключичной артерии), внутренняя грудная вена, лимфатические узлы и сосуды, окруженные жировой тканью. По сводным данным разных авторов, количество лимфатических узлов вариабельно и колеблется от 1 до 10 на каждой стороне.
История развития диагностики
поражения парастернального
лимфатического коллектора
при раке молочной железы
В 1952 году Н. Fischgold предложил метод чрезгрудинной флебографии. Данное исследование проводится путем введения рентгеноконтрастного вещества в губчатое вещество грудины под давлением. Далее контраст проникает через грудинные вены во внутренние грудные вены парастернальных областей. На флебограммах фиксируются и анализируются изменения топографии, калибра внутренних грудных вен, их конфигурации и т.д., обусловленные тесным прилеганием увеличенных парастернальных лимфатических узлов. Таким образом можно судить об их метастатическом поражении, что не только позволяет установить стадию заболевания, но и выявить поражение контралатеральной группы лимфатических узлов.
В 1968 году С.А. Холдин и Л.Ю. Дымарский выполнили чрезгрудинную флебографию 114 больным и в 90% случаев получили верное заключение. Эти же авторы в 1975 году провели исследование операционных препаратов парастернального коллектора после 165 расширенных мастэктомий с предоперационной чрезгрудинной флебографией. Исследование показало, что в 15,6% случаях лимфатические узлы располагались на значительном расстоянии от внутренних грудных сосудов и явились причиной отсутствия изменений на флебограммах.
B.C. Даценко (1981) были проанализированы результаты 1211 чрезгрудинных флебографий. Метастатическое поражение в парастернальной зоне, по его данным, выявлено в 20,2% наблюдений. При сопоставлении данных гистологического исследования и трансстернальной флебографии у 147 больных ложноотрицателъные результаты получены в 8,6%, а ложноположительные в 45% случаев. Несмотря на полученные данные, автор отмечает высокую значимость данной методики для выбора метода лучевого воздействия на парастернальную зону. Для контроля эффективности лучевой терапии он рекомендует повторную флебографию после окончания облучения.
Недостатком чрезгрудинной флебографии является инвазивность метода и, как следствие – наличие противопоказаний. К ним относятся заболевания почек, печени, миокарда, поливалентная аллергия, непереносимость препаратов йода и др. Это привело к поиску более безопасных и информативных методов исследования парастернальной зоны.
С широким внедрением в клиническую практику радиоизотопных методов исследования, основанных на отсутствии накопления радиоактивного изотопа в пораженной ткани, представилась возможность использования этих методик для изучения состояния парастернального лимфатического коллектора.
Метод непрямой радиоизотопной лимфосцинтиграфии парастернальной зоны, впервые предложенный R. Rossi (1962), заключается в следующем. В клетчатку под мечевидный отросток грудины вводят коллоидное золото 198Au. Задержка коллоидных частиц в лимфатических узлах парастернальной зоны обусловливает их визуализацию на скеннограммах через 24 часа после введения. При отсутствии метастатического поражения лимфатических узлов происходит равномерное накопление препарата, в то время как в случае развития метастазов накопления препарата не происходит.
Этот метод легко переносится больными, не имеет побочных реакций и осложнений. Однако полидисперсность радиоактивного коллоидного золота приводит к атипичности его распределения, снижая достоверность получаемых данных.
Помимо коллоидного золота 198Au, для проведения лимфосцинтиграфии используется радиоактивный технеций 99mTc. Этот препарат обладает преимуществом более быстрого накопления в лимфатических узлах (2–3 часа), что позволяет сократить время исследования.
E.N. Gunes (1977) проанализировал 1072 больных раком молочной железы, которым в предоперационном периоде было проведена парастернальная лимфосцинтиграфия 99mTc. Метастатическое поражение этой группы лимфатических узлов выявлено 16% больных с I стадией заболевания. Эти данные подтверждены гистологическим исследованием.
Высокую эффективность радиоизотопного метода в выявлении парастерналных метастазов доказал Osborne M.P. (1979), который вводил 99mTc во влагалища прямых мышц живота 34 больным раком молочной железы I стадии. Поражение парастернального коллектора выявлено у 13 больных. Из них в 12 случаях данные лимфосцинтиграфии совпадали с данными гистологического исследования.
По данным Л.Д. Островцева и В.З. Аграната (1983), из 112 больных с центральной и медиальной локализацией опухоли молочной железы метастазы в парастернальные лимфатические узлы, подтвержденные в последующем гистологически, выявлены в 64,7% случаев с помощью лимфосцинтиграфии. Авторы подчеркивают диагностическую ценность данной методики при раке молочной железы центральной и медиальной локализации, особенно в сочетании с чрезгрудинной флебографией. Данное сочетание методов исследования позволило повысить правильность оценки состояния парастернального коллектора у исследуемой группы больных до 82,3%.
В целом, по данным различных исследователей, достоверность радиоизотопной лимфосцинтиграфии колеблется в пределах 50–98%. Разброс показателей обусловлен отсутствием четкой сцинтиграфической семиотики патологически измененных лимфатических узлов, сходность данных при реактивной гиперплазии, липоматозе, фиброзе лимфатического узла с его метастатическим поражением. Также лимфосцинтиграфии недоступно микрометастатическое поражение парастернального лимфатического аппарата.
Имеются сообщения об успешном использовании компьютерной томографии как для диагностики метастатического поражения парастернальной зоны, так и для более точного расчета дозы лучевой терапии во избежание лучевых повреждений органов средостения. Однако теснота прилегания парастернального лимфоколлектора к передней грудной стенке не позволяет достоверно дифференцировать как нормальные анатомические структуры, так и поражение этой области.
КТ–признаки, характерные для метастатического поражения регионарных лимфатических узлов при раке молочной железы, разработаны Т.Н. Шишмаревой (1997) и включают:
— увеличение размеров лимфатических узлов более чем 1,5 см;
— увеличение количества лимфатических узлов на стороне поражения;
— слияние лимфатических узлов в конгломераты;
— нарушение четкости контуров лимфатических узлов или их конгломератов.
В.П. Летягиным и соавт. (1996) разработан и внедрен способ визуального осмотра парастернального пространства – ретростерноскопия. Методика заключается в следующем. При выполнении радикальной мастэктомии во II межреберье рассекаются межреберные мышцы и обнажается парастернальное пространство. По ходу внутренних грудных сосудов в клетчатку вводится детский бронхоскоп, с помощью которого визуализируются парастернальные лимфатические узлы. В случае выявления увеличенный лимфоузел либо извлекается, либо пунктируется для морфологического исследования. При определенном навыке основное оперативное вмешательство на молочной железе удлиняется не более чем на 5–10 минут. К возможным осложнениям этого метода следует отнести высокую вероятность повреждений внутренних грудных сосудов и сосудов парастернальной клетчатки, развитие пневмоторакса вследствие ранения париетальной плевры. Кроме того, через сформированный тоннель удается осмотреть лишь часть парастернального пространства по одну из сторон от цепочки внутренних грудных сосудов, что снижает достоверность этого метода.
Таким образом, известные на сегодняшний день методы исследования не отвечают всем требованиям полноты визуализации и диагностики изменений в парастернальной зоне, безопасности и анатомически обоснованной доступности. Частота ошибок на этапе дооперационной диагностики метастазов в регионарные лимфатические узлы достигает 25–30%. Анализируя вышеизложенное, можно сделать заключение о необходимости совершенствования методов биопсии и прижизненной морфологической идентификации поражения парастернального лимфатического коллектора.
Факторы, влияющие на частоту
метастазирования рака молочной
железы в парастернальные
лимфатические узлы
Анатомические исследования доказали, что лимфатический коллектор принимает лимфу преимущественно из медиальных и центральных отделов молочной железы. Эти исследования были подтверждены и клиническими наблюдениями. Действительно, анализируя данные литературы 50–70–х годов прошлого века, базирующиеся на результатах расширенных мастэктомий, можно сделать вывод о безусловном влиянии локализации опухоли в молочной железе на частоту метастазирования в парастернальный коллектор.
По данным M. Margottini (1948), после 57 радикальных мастэктомий с удалением парастернальных лимфатических узлов в I и II межреберье метастазы в этом коллекторе встретились в 40,5% случаев при опухолях внутренней локализации и в 27,7% – при наружной, а в 5% наблюдалось их изолированное поражение без поражений других регионарных лимфатических узлов (подключичной, подмышечной и подлопаточной областей).
Согласно исследованиям E. Caceres (1962) из 500 оперированных больных с расположением опухоли в медиальной части железы метастазы в парастернальный коллектор встречались в 26,5% случаев, при поражении центральной части железы – в 19%, при поражении латеральных частей – в 13%, при этом в 16% метастазы в парастернальных лимфоузлах обнаруживались наряду с поражением аксиллярного коллектора в 2,4% случаев изолированно. I и II межреберные промежутки поражались в 57,7% случаев, III – в 34,7% и IV – в 7,6%.
J. Urban (1962) сообщил о результатах свыше 460 радикальных мастэктомий, выполненных больным с медиальной и центральной локализацией опухоли в молочной железе. Метастазы во внутренние грудные лимфоузлы выявлены в 33,5%, подмышечные – в 49% случаев. У 8% пациентов были только парастернальные метастазы.
Результаты лечения 350 больных представил U. Veronesi (1962). Метастазы в парастернальные лимфатические узлы выявлены в 20,6% случаев, причем при наружной локализации опухоли частота метастазирования составила 20%, при внутренней – 16,7%, при центральной – 22,5%, при тотальном поражении – 57,1%. Таким образом, влияние локализации опухоли в молочной железе было поставлено под сомнение. Безусловное влияние на частоту парастернального метастазирования оказывало поражение подмышечных лимфоузлов (41,6% против 6,2% без поражения аксиллярного коллектора). Автор объясняет этот факт задержкой тока лимфы, идущей через подмышечную область, вследствие образования здесь метастазов, что ведет к усилению лимфооттока к парастернальным лимфоузлам. Эти данные подтверждены экспериментальными исследованиями Д.С. Цывъян–Шелагиновой (1962). Автор показала, что после перевязки подмышечных лимфатических узлов у собак через 3,5 часа парастернальные узлы набухают, в синусах определяется отложение туши. Через 6 недель лимфатические узлы гипертрофируются, а синусы переполняются лимфой. Спустя 2–3 недели формируются новые лимфатические узлы.
На VIII международном противораковом конгрессе наибольший опыт удаления парастернальных лимфатических узлов представил M. Margottini (1962). Расширенной радикальной мастэктомии подвергнуто 924 больных. Метастазы в парастернальный коллектор выявлены у 199 (21,5%) больных. При наружной локализации – 18,5%, при внутренней – 26,2%, при центральной – 21,6%. Как видно из представленных данных, разница в частоте поражения парастернального коллектора невелика. Группу риска составили больные с большими опухолями (метастазы выявлены в 60,6%). Как и в предыдущих сообщениях, наглядной оказалась зависимость от поражения аксиллярных лимфатических узлов. При поражении менее половины подмышечных лимфоузлов метастазы в парастернальный коллектор обнаруживались у 25,9% больных, при поражении половины лимфоузлов – у 28,3%, более половины – у 46,2% и при тотальном поражении аксиллярного коллектора – у 55,2% больных.
С.А. Холдин и Л.Ю. Дымарский (1975) сообщили результаты 405 расширенных мастэктомий. В 33% случаев выявлены метастазы в парастернальный коллектор, из них в 14,5% случаев это поражение встретилось при интактных подмышечных лимфоузлах. По данным авторов, эта операция позволила повысить 5–летнюю выживаемость на 10–12%.
Из 289 больных, радикально оперированных в НИИ онкологии им. П.А. Герцена с 1960 г. по 1981 г., метастазы в парастернальные лимфатические узлы выявлены в 18% случаев. Наблюдалась прямо пропорциональная зависимость согласно возрастанию стадии заболевания. Преобладало поражение коллектора при локализации опухоли в верхне–внутреннем квадранте молочной железы (30%). Изолированное поражение наблюдалось в 7,3% случаев.
В 1985 году U. Veronesi с соавт. опубликовали результаты исследований, проведенных на 1119 пациентах с операбельным раком молочной железы в Национальном онкологическом институте Милана с 1965 по 1979 гг. Все больные перенесли расширенную радикальную мастэктомию. Метастатическое поражение парастернальных лимфатических узлов выявлено в 19,1% случаев. Вопреки общепринятым взглядам не выявлено зависимости частоты метастазирования в парастернальный коллектор от локализации первичной опухоли в молочной железе. Метастазы в лимфатические узлы парастернального коллектора были обнаружены у 19,1% больных с внутренней локализацией опухоли, у 22,1% – с центральной и у 18,0% с расположением рака в наружных квадрантах. Очевидным было влияние размеров первичной опухоли на частоту парастернального метастазирования. Так, при диаметре опухоли менее 2 см это поражение встретилось в 16,1% случаев, а при размерах более 2 см – в 24,5%. Молодой возраст пациента явился неблагоприятным фактором поражения парастернального коллектора. У больных моложе 41 года метастазы выявлены в 27,6% наблюдений, от 41 до 50 лет – в 19,7%, старше 51 года – в 15,6% случаев. Поражение подмышечного лимфатического аппарата оказывало существенное влияние на частоту поражения парастернальных узлов. У больных с непораженными аксиллярными узлами метастазы выявлены в 18,6%, а при метастазах в аксиллярные лимфатические узлы – в 26,2% наблюдений. Гистологическая структура опухоли и уровень рецепторов эстрогенов при поражении парастернальных лимфатических узлов существенного прогностического значения не имели.
Авторами были обозначены основные прогностические факторы, влияющие на частоту метастатического поражения парастернального лимфатического коллектора: возраст больного, размеры первичной опухоли, наличие или отсутствие метастазов в подмышечных лимфоузлах. Эти же параметры оказали существенное влияние на 10–летнюю безрецидивную и общую выживаемость.
M. Noguchi (1991) на основании многофакторного анализа результатов лечения 144 больных пришел к заключению, что общая выживаемость зависит от размеров опухоли, состояния подмышечного лимфатического аппарата, соотношения пораженных подмышечных и парастернальных лимфатических узлов, а также ДНК–плоидностью. Наиболее важным прогностическим фактором явилось поражение парастернального лимфатического аппарата, особенно среди групп пациентов, где соотношение пораженных парастернальных лимфатических узлов и подмышечных составляет 1:3.
H.S. Cody и J.A. Urban (1995) проанализировали 10–летнюю выживаемость 195 больных, перенесших расширенные мастэктомии по поводу рака молочной железы центральной и медиальной локализации. При метастазах в аксиллярные лимфоузлы поражение парастернальных наблюдалось в 36% случаев, а без метастазов – в 18% (р=0,0023). Метастазы в парастернальные лимфоузлы наблюдались одинаково часто у пациентов с размерами опухоли как менее, так и более 2 см и не зависели от возраста больных. Среди пациентов с T1NO стадией заболевания парастернальные метастазы встретились в 19,6% наблюдений. Десятилетняя выживаемость была вдвое ниже в группе с поражением парастернального коллектора. Авторы отмечают, что недооценка состояния парастернальной зоны у пациентов с малыми размерами опухоли молочной железы может привести к установлению заниженной стадии рака и неадекватному лечению этой группы больных.
Анализируя вышеизложенное, можно сделать вывод о том, что метастатическое поражение парастернального коллектора, безусловно, ухудшает прогноз течения заболевания. Однако единого мнения об анатомических и патофизиологических факторах, влияющих на частоту метастазирования рака молочной железы в парастернальные лимфатические узлы, не существует. Эта позиция требует дальнейшего изучения.
Методы хирургического воздействия на парастернальный лимфатический коллектор
Прижизненное морфологическое исследование (биопсия) состояния парастернального коллектора проводилось с 1922 года. W.S. Handley сообщал об удалении парастернальных лимфатических узлов у 5 прооперированных им больных. В 1947 г. и 1954 г. R.S Handley и A.C. Thackray при выполнении радикальной мастэктомии иссекали клетчатку с лимфоузлами во II межреберье парастернальной зоны у 125 больных. На основании биопсийного материала в 34% случаев выявлено метастатическое поражение лимфоузлов.
M. Margottini (1948) иссекал и удалял по 2 см хрящей II и III ребер вместе с внутренними грудными сосудами и клетчаткой; при этом автор подчеркивал диагностическое и терапевтическое значение этого вмешательства.
Интраоперационную биопсию парастернального лимфоколлектора в первых трех межреберьях проводил E. Dahl–Iversen в 1951–52 гг. У 57 больных метастатическое поражение выявлено в 19% случаев.
Несмотря на первоначальные успехи, парастернальная биопсия в одном межреберье не могла отражать целостной картины состояния коллектора ввиду ограниченности взятия материала и большой вероятности ложноотрицательных результатов. Это привело исследователей к выводу о необходимости полного удаления содержимого парастернального пространства.
Расширенная радикальная мастэктомия, впервые предложенная J. Urban в 1951 году, открыла новую эру хирургического лечения рака молочной железы. Интраплевральный способ этого вмешательства заключается в следующем. Из разреза Холстеда молочную железу выделяют одним блоком с подключичной, подмышечной, подлопаточной клетчаткой и лимфатическими узлами вместе с костно–хрящевой частью передней грудной стенки, с включением клетчатки, внутригрудных сосудов, лимфатических узлов и париетальной плевры. При этом производится резекция части грудины и хрящевой части I–V ребер, вследствие чего образуется обширный дефект передней грудной стенки, который закрывался свободным лоскутом широкой фасции бедра или участком ключичной части большой грудной мышцы. Иногда использовали консервированную фасцию быка.
Вариант интраплевральной сверхрадикальной расширенной подмышечно–надключично–средостенной мастэктомии, предложенной O.H. Wangensteen в 1952 г., не нашел широкого применения ввиду высокой летальности и большого количества послеоперационных осложнений.
При экстраплевральном способе, после перевязки внутренних грудных сосудов в первом межреберье, часть грудины и II–V реберные хрящи резецируют вместе с парастернальной клетчаткой без париетальной плевры. Дефект передней грудной стенки закрывали так же, как и при интраплевральном способе.
До середины 70–х годов ХХ века расширенная мастэктомия была операцией выбора при раке молочной железы центральной и медиальной локализации. Однако ввиду относительно высокой травматичности и сложности, связанной с удалением части грудины и реберных хрящей, многими авторами производился поиск более простых способов удаления парастернальной лимфатической цепочки.
Так, А.П. Баженовой и соавт. (1985) предложен способ удаления парастернального коллектора без удаления костного каркаса грудной стенки. На первом этапе производится радикальная мастэктомия по Холстеду. Если в подмышечной клетчатке не обнаруживаются увеличенные лимфатические узлы или они единичны, приступают к парастернальной лимфодиссекции. Производится отсечение реберных хрящей II–V ребер от грудины, перевязка проксимальной и дистальной частей внутренних грудных сосудов. Свободные края ребер оттягивают кверху и внеплеврально удаляют парастернальную клетчатку с лимфатическими узлами и сосудами. Реберные хрящи удаляют в редких случаях при выявлении увеличенных лимфатических узлов в межреберных мышцах. Возможные дефекты париетальной плевры не ушивают. По окончании лимфодиссекции грудную стенку возвращают в исходное положение и фиксируют к грудине. Авторы указывают на удачное выполнение подобных операций у 289 больных, при этом подчеркивают, что наличие большого количества пораженных подмышечных лимфатических узлов явилось противопоказанием к расширенной мастэктомии. У этих пациентов проводилась стандартная мастэктомия Холстеда с последующей химио– и лучевой терапией, включающей облучение парастернальной зоны.
Следуя общей тенденции перехода от мастэктомии Холстеда к менее травматичным по Пейти–Дайсону и Маддену, Б.К. Дружков в 1988 году предложил способ удаления парастернальной клетчатки при радикальных операциях с сохранением большой грудной мышцы. При этом производится пересечение порции большой грудной мышцы в проекции внутренних грудных сосудов, перевязка последних, резекция грудины и хрящевых концов II–IV ребер и собственно парастернальная лимфодиссекция. Дефект закрывается подшиванием большой грудной мышцы к грудине.
В целом сторонники расширенной мастэктомии показывают увеличение показателя 5–летней выживаемости по сравнению с группами больных, перенесших операцию Холстеда, на 7–26%.
Следует отметить тот факт, что вмешательство в парастернальном пространстве при расширенных операциях на молочной железе чревато большим количеством послеоперационных осложнений по сравнению с операциями без парастернальной лимфаденэктомии, выраженным болевым синдромом. Кроме того, существенно удлиняется время оперативного вмешательства. Следствием этого стал практически полный отказ хирургов–онкологов от открытой парастернальной лимфаденэктомии и переход к более функционально выгодным операциям с сохранением большой грудной мышцы по Пейти–Дайсону и обеих грудных мышц по Маддену, а также радикальным резекциям молочной железы с послеоперационной лучевой терапией на парастернальную зону. Многочисленные рандомизированные исследования отечественных и зарубежных авторов подчеркивают отсутствие статистически достоверной разницы в 5–летней выживаемости, количестве рецидивов и метастазов у больных, перенесших операцию Холстеда и Пейти.
Возможности видеоторакоскопии
для вмешательства
на парастернальной зоне
Как диагностическая манипуляция, торакоскопия известна с 1910 года, когда шведский исследователь Н.С. Jacobaeus впервые предложил использовать цистоскоп для осмотра плевральной полости. В качестве лечебной процедуры до 50–х годов торакоскопия применялась в основном во фтизиатрии для искусственного коллабирования легкого.
В дальнейшем малая травматичность и хорошая переносимость процедуры торакоскопии стала причиной ее более широкого использования и для лечебных манипуляций.
В последнее десятилетие значительно расширился спектр лечебных и диагностических торакальных процедур с развитием комплексов видеоэндоскопической аппаратуры, включающих эндовидеокамеры, мониторы, манипуляторы и сшивающие аппараты. Особая роль видеоторакоскопии отводится в дифференциальной диагностике онкологических заболеваний легких, плевры и средостения. В настоящее время до 70% торакальных операций могут выполняться с помощью видеоторакоскопического оборудования.
Большое значение придается видеоторакоскопии для выполнения атипической резекции легких и сегментэктомии при I стадии рака легкого или его метастатическом поражении. Авторами подчеркивается, что эти операции целесообразно выполнять больным преклонного возраста с выраженными сопутствующими заболеваниями, когда выполнение торакотомии противопоказано [М.И. Нечушкин, А.В. Триголосов, И.Ю. Сихарулидзе]. Кроме того, изучение отдаленных результатов показывает адекватность такого объема оперативного вмешательства.
Среди показаний к торакоскопическим операциям на органах средостения относятся невриномы заднего средостения, опухоли вилочковой железы, тератомы, лимфопролиферативные заболевания и другие. Техника эндохирургического выполнения данных операций не представляет особой сложности, а травматичность и косметический эффект намного выше обычной торако– или стернотомии [М.И. Нечушкин, А.В. Триголосов, И.Ю. Сихарулидзе].
Сравнивая непосредственные результаты видеоторакоскопических операций при онкологических заболеваниях грудной клетки, все исследователи отмечают более низкие показатели послеоперационных осложнений и летальности, малые сроки пребывания в стационаре, хороший косметический эффект и быструю реабилитацию больных.
Впервые использовать видеоторакоскопические технологии для выполнения парастернальной лимфаденэктомии при радикальной мастэктомии по поводу рака молочной железы предложили Е.И. Сигал с соавт. в 1996 году. Операция проводится в полубоковом положении больной на здоровом боку с использованием валика оригинальной конструкции. После выполнения радикальной мастэктомии в V межреберье по среднеключичной линии, в IV межреберье по передне–подмышечной линии и в V межреберье по средней подмышечной линии вводится видеокамера и манипуляционные инструменты. Производится клипирование и резекция внутренних грудных сосудов с I по IV межреберье. Иссечение производят моноблочно с включением парастернальной клетчатки с лимфатическими узлами.
До 1998 года выполнено 70 таких вмешательств у больных с медиальной и центральной локализацией опухоли. До сегодняшнего времени выполнено 227 таких вмешательств у больных с наружной локализацией опухоли. Летальных исходов не было. Специфические послеоперационные осложнения, связанные непосредственно с видеоторакоскопией, встретились в 2 (2,8%) случаях (1–экссудативный плеврит и 1– кровотечение из культи внутренней грудной артерии). Метастазы в парастернальный коллектор выявлены в 23,3% случаев, причем ни размеры, ни гистологическая структура опухоли на частоту выявления парастернальных метастазов существенного влияния не оказывали. Наблюдалась зависимость метастатического поражения парастернальной зоны от степени поражения подмышечных лимфатических узлов. Кроме того, оценивая степень снижения показателей кардиоинтервалографии и пневмотахометрии, а также количество использованных наркотических анальгетиков в послеоперационном периоде, исследователи убедительно показали, что видеоторакоскопическая парастернальная лимфодиссекция – менее травматичное вмешательство, чем традиционная расширенная мастэктомия по Урбану–Холдину [М.И. Нечушкин, А.В. Триголосов, И.Ю. Сихарулидзе]. Недостатком данной работы, на наш взгляд, является исключение из групп исследования больных с наружным расположением опухоли, так как влияние локализации опухолевого процесса в молочной железе на частоту метастазирования в парастернальные лимфатические узлы остается дискутабельным. Кроме того, методические аспекты выполнения собственно парастернальной лимфодиссекции, такие как точки введения торакопортов, удобство использования валика, весьма спорны. Также не проведен детальный морфологический анализ препарата парастернальной зоны (внутренняя грудная артерия, вена, клетчатка, лимфатические щели и т.д.) раздельно по межреберьям для качественной оценки поражения коллектора.
К сожалению, в зарубежной литературе мы не встретили публикаций, посвященных видеоторакоскопическим вмешательствам на парастернальном лимфатическом коллекторе у больных раком молочной железы при наружной локализации опухоли.
Перспективы видеоторакоскопической парастернальной лимфаденэктомии при наружной локализации опухоли очевидны. Эта манипуляция имеет огромное диагностическое и лечебное значение, а также определяет показания к проведению дополнительных лечебных процедур. Дальнейшему изучению методологических аспектов выполнения этой операции, а также расширению анализа операционного материала и посвящена настоящая работа.
Основные положения
планируемого исследования
Предметом планируемого исследования станут клинические материалы пациентов, страдающих раком молочной железы наружной локализации, перенесших радикальную мастэктомию или радикальную резекцию молочной железы с одномоментным удалением парастернального лимфатического коллектора видеоторакоскопическим способом. Исследование планируется провести на базе отделения радиохирургии НИИ клинической онкологии ГУ Российского онкологического научного центра им. Н.Н. Блохина РАМН.
В задачи, поставленные перед исследованием, войдут: изучение и отработка технических приемов видеоторакоскопической лимфодиссекции при раке молочной железы наружной локализации I–III C стадий; оценка адекватности данного метода, как способа удаления объема тканей парастернальной зоны, путем прямого подсчета количества удаляемых лимфоузлов по межреберьям и проведением сцинтимаммографии 99mTc–технетрилом в пред– и послеоперационном периоде; изучение факторов прогноза, влияющих на частоту поражения парастернальных лимфатических узлов; изучение влияния локализации и размеров первичной опухоли, особенностей метастатического поражения аксиллярных лимфатических узлов, степени злокачественности опухоли на частоту и распространенность поражения парастернального лимфатического аппарата; изучение результатов лечения больных раком молочной железы, перенесших видеоторакоскопическую парастернальную лимфодиссекцию; оценка возможных интраоперационных проблем и осложнений в послеоперационном периоде.
Литература
1. Баженова А.П., Марморштейн С.Я., Едемский Ю.И. Рентгено–анатомические параллели при изучении парастернальных метастазов рака молочной железы//Мат.XXV научной сессии МНИОИ им. П.А.Герцена.– М., 1967.– С. 171–173.
2. Баженова А.П., Островцев Л.Д., Хаханишвили Г.Н. Рак молочной железы.– М.: Медицина, 1985.
3. Баженова А.П.* Радикальная мастэктомия с парастернальной лимфаденэктомией при раке молочной железы.//Диагностика и лечение рака молочной железы: Сб. статей МНИОИ им. П.А. Герцена.– Москва, 1985.– С. 149–153.
4. Брежнева Л.Э., Важенин А.В., Нечушкин М.И. Анализ эффективности различных методик облучения парастернальных лимфоузлов при раке молочной железы I–II стадий медиальной и центральной локализации// Материалы 7 Всероссийского конгресса рентгенологов и радиологов.– М., 1996.– С. 149–150.
5. Вишневецкая Е.М. Расширенная радикальная ампутация грудной железы с удалением лимфатической парастернальной цепочки при раке (непосредственные результаты)//Хирургия.– М., 1962.–№ 8.– С. 52–55.
6. Влахов Н., Мирчев В., Коев Ч., Генов Г. Сцинтиграфия парастернальных лимфатических узлов при раке молочной железы//Мед. радиол.– М.,1983.–№ 1.– С. 79–80.
7. Дружков О.Б., Дружков Б.К., Малыгин Н.В. Наш способ расширенной мастэктомии//Тез. доклада VIII республиканской научно– практической конференции по актуальным вопросам диагностики и лечения злокачественных новообразований.– Казань, 1995.– С. 172–174.
8. Дымарский Л.Ю. Рак молочной железы. – Москва, Медицина, 1980.
9. Летягин В.П., Лактионов К.П., Высоцкая И.В., Котов В.А. Рак молочной железы.– Москва, 1996.– С. 25–28.
10. Ловягин Е.В. Методика флебографии средостения и особенности интрепретации флебограмм этой области//Методическое письмо–Л., 1970.
11. Оджарова А.А., Габуния Р.И., Ширяев С.В. Радионуклидная диагностика опухолей молочной железы с 99mTc–технетрилом// Медицинская визуализация.– июль–сентябрь 1998.– С.50–52.
12. Островцев Л.Д., Агранат В.З. Сцинтиграфия парастернальных лимфатических узлов при раке молочной железы//Сов.мед.–1983.–№ 12.– С. 22–25.
13. Павлов А.С., Даценко В.С. Чрезгрудинная флебография при раке молочной железы// Вопр.онкол.– 1971.–Т.7.–№ 9.– С. 16–20.
14. Сигал Е.И., Хамидуллин Р.Г., Дружков Б.К. и др. Видеоторакоскопическая парастернальная лимфаденэктомия при раке молочной железы//Материалы 1 съезда онкологов стран СНГ.– М., 1996.– С. 515 – 516.
15. Сигал Е.И., Хамидуллин Р.Г., Дружков Б.К. и др. Расширенная мастэктомия по Урбану – Холдину с использованием видеоторакоскопии//Эндоскопическая хирургия.– 1996.–№ 4.– С.29.
16. Холдин С.А. Расширенная подмышечно–грудинная мастэктомия при раке молочной железы//В сб. Проблемы онкологии. Труды инстит. Онкологии АМН СССР.–Л., 1960.–Т.3.–С. 14–25.
17. Холдин С.А., Дымарский Л.Ю. Частота поражения и топография метастазов в парастернальных лимфатических узлах при раке грудной железы (анализ 80 расширенных подмышечно–грудинных мастэктомий)//Хирургия.– М., 1962.–№ 8– С. 44–51.
18. Холдин С.А., Дымарский Л.Ю. Опыт применения расширенных подмышечно–грудинных мастэктомий при раке молочной железы//Вест. хир.– 1968.– Т.101.,№ 9.– С.34–39.
19. Холдин С.А., Дымарский Л.Ю. Расширенные операции при раке молочной железы.– Л.: Медицина, 1975.– 231 с.
20. Caceres E. Incendence of metastases in the internal mammary chain of operable cancer of the breast//Surg.Gynec.Obstetr.–1959.–Vol.108.–N 6.– P.715–720.
21. Gunes E.N. Internal mammary lymphoscintigrafy in breast carcinoma: study of 1072 patients //Int. J. Radiat. Oncol. Biol. Phys.– 1977.–Vol. 2.– №7– Р. 455–471.
22. Dahl–Iversen E., Soerensen B. Recherches sur les metastases microscopiques des ganglions lymphatiques parasternaux dans le cancer du sein (recherches histologiques de 54 cas operes radicalement) et rexherches sur la localisation des ganglions lymphatiques parasternaux par rapport aux espaces intereosteaux//J.Intern.Chir.–1951.–N 11.– P. 502–509.
23. Dahl–Iversen E. Recherches sur les metastases microscopiques des`cancer cancer du sein. Dans ganglions lymphatiques parasternaux et sus– elaviculaires// Mem.Acad.Chir.–1952.–N 78.–P. 651–652.
24. Fischgold H., Reboue H., Piequet J., Ecoiffier J. Phlebografie mammare par voie sternale// Radiol. d,electrol.–1952.– №33.– C.38.
25. Handly W.S. Cancer of the breast and its treatment.– New–York, 1922.
26. Handly W.S. Parasternal invasion of the thorax in breast cancer and its suppression by use of radium tubes as an operative precantion//Surg.Gynec.Obstetr.–1927.–N 45.– P. 721–728.
27. Handly R.S., Thackray A.C. Invasion of internal mammary lymph glands in carcinoma of breast//Brit.J.Cancer.–1947.– № 1.– P. 15–20.
28. Handly R.S., Thackray A.C. Invasion of internal mammary lymph nodes in carcinoma of breast//Brit.Med.J.–1954.–T.4853.– P. 61–63.
29. Margottini M., Jacobelli G., Cau M. Отдаленные результаты расширенной радикальной мастэктомии// Труды VIII Международного противоракового конгресса.– М., 1963.–Т.1.–С.385–388.
30. Osborne M.P., Teyasingh K., Tewkes R.F., Burn T. The preoperative detection of internal mammary lymph nodes metastases in breast cancer// Brit.J.Surg.–1979.–Vol.66, № 11.– С. 813–818.
31. Rossi R., Ferri O., Irivellini G. La Limfoscintigrafia mammaria interna con 198Au. Ricerca Sperimentale ed impiego clinica//Arch.Ital.Chir.–1968.–Vol.94, № 1.– P. 33–51.
32. Urban J.A. Radical excision of the chest wall for mammary cancer//Cancer.–1951.–Vol.4, № 6.– Р. 1263–1285.
33. Urban J.A. Clinical experience and results of excision of the internal mammary breast cancer//Cancer.– 1959.– Vol. 12, № 1.– P. 14–22.
34. Urban J.A. Extended radical mastectomy for breast cancer//Am. J. Cancer.– 1963.– Vol. 106, № 3.– P.399–404.
35. Veronesi U.Удаление парастернальных лимфатических узлов при раке молочной железы. Сообщение о 350 случаях// Труды VIII Международного противоракового конгресса.– М., 1963.–Т.1.–С.389–391.
36. Veronesi U. New trends in the treatment of breast cancer at the Cancer Institute of Milan//Am.J.Roentgenol.–1977.–Vol.128, N 2.– P. 287–289.
37. Veronesi U.,Cascinelli N.,Greco M. et al. Prognosis of breast cancer patients after mastectomy and dissection of internal mammary nodes// Ann. Surg.–1985.–Vol.202, N 6.– Р. 702–707.
38. Veronesi U., Goldhisch A., Yarnold J. Brest cancer// Oxford text book of oncology. Ed. By M. Peckham, H. Pinedo, U.Veronesi. Oxford University Press.–1995.– P. 1241–1292.
www.rmj.ru
Паратрахеальные лимфоузлы увеличены: причины и лечение
Паратрахеальные лимфоузлы – это группа лимфатических узлов средостения. Они расположены в грудной клетке, отличаются малыми размерами и могут увеличиваться и воспаляться в ответ на различные патологические процессы, протекающие в организме, и заболевания органов грудной клетки. Увеличение лимфатических узлов этой группы является опасным признаком, указывающим на тяжелые заболевания. Необходимо своевременно выявить развитие нарушения в лимфоузлах, в чем поможет знание специфической симптоматики лимфаденопатии и лимфаденита, а также особенностей расположения и функций паратрахеальных узлов.
Особенности паратрахеальных лимфоузлов
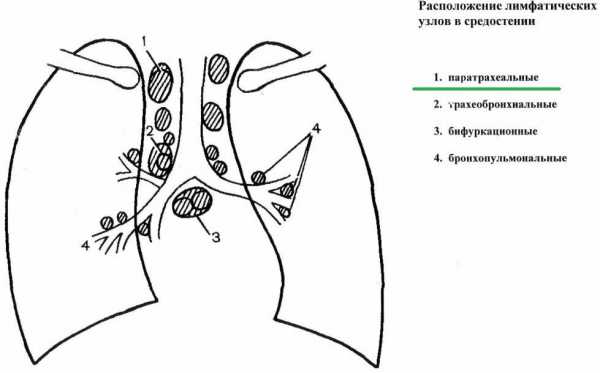
Паратрахеальные лимфатические узлы располагаются в средостении грудной клетки (в верхней части)
Средостение – это область в середине грудной клетке. В этой зоне расположено множество лимфатических узлов, по разным данным – от 100 до 300, в зависимости от физиологических особенностей. В целом, в человеческом организме располагается от 300 до 800 лимфатических узлов, выполняющих важнейшую функцию поддержания иммунитета за счет фильтрации межклеточной жидкости.
Паратрахеальные лимфоузлы расположены в верхней части средостения. Главной их особенностью является глубокое расположение, из-за чего патологии лимфоузлов этой зоны достаточно сложно диагностируются.
Если заподозрить начало патологического процесса в поверхностных лимфоузлах, например, подмышечных или шейных, достаточно просто по характерному отеку и увеличению их размеров, нарушения в работе паратрахеальных лимфоузлов часто ошибочно принимаются за другие заболевания, из-за чего лечатся неправильно, либо человек вообще не обращает внимание на дискомфорт.
В то же время, нарушения работы партархеальных лимфоузлов представляют серьезную опасность. Лимфатические узлы являются своеобразным маркером здоровья организма, так как реагируют на инфекции и раковые клетки. Увеличение лимфоузлов в области трахеи или бронхов свидетельствует о местных воспалительных или злокачественных заболеваниях, поэтому важно своевременно обнаружить тревожные симптомы и пройти комплексное обследование для выявления потенциальных угроз здоровью.
Расположение и функции
Для начала следует разобраться, что собой представляет паратрахеальный узел и в чем состоит его функция. Лимфатические узлы представляют собой небольшие образования округлой или бобовидной формы, с четкими краями и однородной структурой. Строение узла сложное и включает два слоя, капсулу органа, клапаны, по которым осуществляется приток лимфы по лимфатическим сосудам.
Партрахеальные лимфоузлы располагаются вдоль трахеи. Этот орган находится между гортанью и бронхами. Лимфатические узлы этой зоны отличаются малыми размерами и располагаются симметрично по обе стороны от трахеи. Паратрахеальные лимфоузлы относятся к глубоким узлам, поэтому не пальпируются, а визуализация возможна только с помощью ультразвукового обследования или магнитно-резонансной томографии.
Основные функции этих лимфатических узлов такие же, как и у других органов лимфатической системы – это обеспечение фильтрации межклеточной жидкости, поступающей от окружающих органов, в данном случае трахеи и верхней части бронхов. Межклеточная жидкость проникает в узел, затем очищается от токсинов, инфекций и воспалительных клеток, насыщается иммунными клетками, а затем выводится в общий кровоток.
Лимфоузлы трахеи остро реагируют на любые патологические процессы расположенных рядом органов. При снижении иммунитета, они не могут справляться со своей функцией, поэтому токсины и инфекции, поступающие с межклеточной жидкостью, могут накапливаться в теле лимфоузла, провоцируя его воспаление.
Нормальные размеры
В норме лимфоузлы или увеличены – можно определить с помощью магнитно-резонансной томографии
Нормальные размеры паратрахеальных лимфоузлов не превышают 7-10 мм. Тем не менее нормы размеров паратрахеальных лимфоузлов, как и любых других лимфатических узлов, лишь приблизительны и зависят от физиологических особенностей человека. В целом, диаметр лимфоузла зависит от его расположения. Поверхностные лимфоузлы могут достигать 22-25 мм (например, паховые), а глубокие узлы, расположенные в средостении или брюшной полости, редко превышают 10 мм в диаметре. При этом в подавляющем большинстве случаев размер глубоких лимфоузлов составляет всего 3-5 мм.
Обнаружить увеличение паратрахеальных лимфоузлов без специальных обследований невозможно.
Определить размеры лимфатических узлов у конкретного человека можно с помощью УЗИ, МРТ и других исследований.
Причины увеличения и воспаления лимфоузлов
Разобравшись, что собой представляет паратрахеальный лимфатический узел, следует знать о возможных нарушениях со стороны этих органов.
Выделяют два заболевания – лимфаденопатию и лимфаденит. Увеличение лимфоузлов, в том числе и паратрахеальных, называется лимфаденитом. Это заболевание не считается самостоятельным нарушением, так как увеличению размеров лимфоузла предшествуют различные инфекции и воспалительные заболевания в рядом расположенных органах.
Лимфаденитом называют воспаление лимфатического узла. Эта патология является опасным заболеванием и возникает из-за проникновения инфекции в капсулу лимфоузла.
Нарушения со стороны паратрахеальных лимфоузлов всегда связаны с патологиями трахеи и органов, расположенных в верхней части средостения. Увеличение паратрахеальных лимфоузлов может быть вызвано следующими причинами:
- бронхит и бронхиальная астма;
- саркоидоз;
- туберкулез;
- плеврит;
- пневмония;
- рак.
Саркоидоз – это доброкачественное поражение ткани легких с образованием гранулематозных очагов. При туберкулезе первыми увеличиваются узлы средостения, в том числе и паратрахеальные. Причем лимфаденопатия достаточно часто выступает первым симптомом, который проявляется на ранней стадии болезни, до кашля.
Увеличение лимфоузлов нередко ассоциируют с раком. При лимфаденопатии паратрахеальных лимфатических узлов следует исключить рак легких, трахеи, гортани, молочных желез. Кроме того, увеличение лимфоузлов этой области наблюдается при лимфоме – злокачественном поражении лимфатической системы.
Точно разобраться, почему увеличиваются паратрахеальные лимфоузлы, сможет только врач после обследования.
Воспаление лимфатических узлов, или лимфаденит, развивается из-за проникновения инфекции в лимфоузлы при падении иммунитета. Следует отметить, что лимфаденит паратрахеальных лимфоузлов относится к редким патологиям. Воспаление может возникать на фоне пневмонии, туберкулеза, грибкового поражения гортани и других местных воспалительных процессов инфекционной природы.
Симптомы

Высокая температура тела, слабость и упадок сил – симптоматическая картина при воспалении лимфатических узлов
Патологии паратрахеальных лимфатических узлов сложно выявить самостоятельно из-за отсутствия специфических симптомов. Так как лимфоузлы этой группы расположены глубоко, типичный симптом лимфаденопатии или лимфаденита, такой как заметное увеличение узла, отсутствует. Заподозрить лимфаденопатию можно по следующим признакам:
- хрипящее дыхание;
- дискомфорт в горле;
- ночная потливость;
- слабость и общее недомогание.
Повышения температуры тела в этом случае может не наблюдаться, болевой синдром для лимфаденопатии нехарактерен.
При воспалении лимфатических узлов симптоматика более острая:
- болевой синдром в верхней части грудной клетки, под ключицами и вокруг трахеи;
- высокая температура тела;
- симптомы общей интоксикации;
- увеличение печени и селезенки;
- слабость и упадок сил.
При инфекционном воспалении температура может повышаться свыше 38 градусов. Симптомы интоксикации проявляются тошнотой, упадком сил, головной болью, потерей аппетита. Болевой синдром присутствует постоянно, усиливается при резких движениях.
Диагностика
Так как увеличение и воспаление паратрахеальных лимфоузлов легко принять за инфекции дыхательных путей, грипп и ОРВИ, следует проконсультироваться с врачом при появлении первых признаков недомогания. В первую очередь, следует посетить терапевта. В дальнейшем этот специалист может направить к фтизиатру.
Необходимые обследования:
- общий осмотр;
- общий и биохимический анализы крови;
- флюорография;
- рентгенография грудной клетки.
Важной частью диагностики является биохимический анализ крови. По характеру изменения количества лейкоцитов и лимфоцитов врач может поставить предварительный диагноз. Флюорография помогает исключить патологии легких, включая туберкулез, пневмонию, саркоидоз, а рентгенография грудной клетки необходимо для получения точной картины изменений в лимфатических узлах. Дальнейшее лечение будет зависеть от причины патологий лимфоузлов, которую необходимо выявить.
Принцип лечения

При воспалении лимфоузлов выбор препарата осуществляется врачом индивидуально для каждого пациента
Лечение направлено, в первую очередь, на ликвидацию причины нарушения работы лимфоузлов. При увеличении паратрахеальных лимфатических узлов необходимо устранить основное заболевание. Лимфаденопатия не требует лечения, размеры лимфоузлов приходят в норму спустя несколько недель или месяцев после излечения от основного заболевания.
К примеру, пневмония лечится с помощью антибиотиков, а в терапии саркоидоза применяют глюкокортикостероиды. При туберкулезе пациенту назначают длительную антибактериальную терапию сразу несколькими препаратами из разных групп. Лечение туберкулеза длится не меньше полугода.
При воспалении лимфоузлов необходимо правильно подобрать антибиотики для устранения патогенных микроорганизмов, вызвавших лимфаденит. Выбор препарата осуществляется врачом индивидуально для каждого пациента. Помимо антибиотиков, могут применяться противовоспалительные таблетки для устранения симптомом и иммуностимуляторы для укрепления иммунитета.
‘; blockSettingArray[1][«setting_type»] = 6; blockSettingArray[1][«elementPlace»] = 10; blockSettingArray[2] = []; blockSettingArray[2][«minSymbols»] = 1000; blockSettingArray[2][«minHeaders»] = 0; blockSettingArray[2][«text»] = ‘
‘; blockSettingArray[2][«setting_type»] = 6; blockSettingArray[2][«elementPlace»] = 30; blockSettingArray[3] = []; blockSettingArray[3][«minSymbols»] = 2000; blockSettingArray[3][«minHeaders»] = 0; blockSettingArray[3][«text»] = ‘
‘; blockSettingArray[3][«setting_type»] = 6; blockSettingArray[3][«elementPlace»] = 50; blockSettingArray[4] = []; blockSettingArray[4][«minSymbols»] = 1000; blockSettingArray[4][«minHeaders»] = 0; blockSettingArray[4][«text»] = ‘
‘; blockSettingArray[4][«setting_type»] = 6; blockSettingArray[4][«elementPlace»] = 80; var jsInputerLaunch = 15;
limfouzel.ru
Лечение больных раком молочной железы с метастазами в парастернальные лимфатические узлы
выводы
1. Частота метастазирования в парастернальную зону зависит от локализации опухоли, степени поражения аксиллярной зоны и размера опухоли. Локализация опухоли на границе верхних и нижних наружне -внутренних квадрантов, во внутренних квадрантах и центральной зоне, наличие аксиллярных метастазов и размер опухоли более Т1 достоверно повышают риск поражения парастернальной зоны.
2. При ВТПЛ + ЛТ парастернальной зоны и ВТПЛ наблюдается тенденция к лучшим показателям 5-летней общей выживаемости (64,0% в обоих случаях) по сравнению с биопсией + ЛТ парастернальной зоны (49,0%) и достоверно лучшая безрецидивная выживаемость при ВТПЛ + ЛТ по сравнению с биопсией + ЛТ, 55,0% и 38,0% (р=0,05; %2=3,9\ соответственно.
3. При наличии метастазов в парастернальной зоне необходимо дополнительное воздействие на неё хирургическим или лучевым методом, поскольку только при диагностической биопсии показатели общей и безрецидивной выживаемости достоверно ниже по сравнению с обоими методами лечения, составляя 41,0% и 29,0% (р<0,05), соответственно.
4. Включение парастернальной зоны в объем облучаемых тканей после ВТПЛ не приводит к улучшению результатов лечения больных. Показатели общей выживаемости при ВТПЛ + ЛТ и ВТПЛ составляют 64,0% в обоих случаях и безрецидивной 55,0% и 60,0%, соответственно.
5. Использование в качестве адыовантной химиотерапии антрациклинсодержащих схем (РАС) приводит к достоверному улучшению показателей общей выживаемости по сравнению с СМЗ% составив 64,0% и 48,0% (р=0,006;х2=7,5), соответственно.
6. Метастатическое поражение двух регионарных зон является плохим прогностическим фактором, достоверно ухудшающим результаты лечения. Общая и безрецидивная выживаемость при поражении только парастерналыюй зоны составляют 82,0% и 48,0%, при поражении парастернальной и аксиллярной — 71,0% и 39,0% (р=0,003 % =8,7; р=0,003 л
X =8,9), соответственно. 7. Степень поражения парастернальной зоны влияет на результаты лечения. Увеличение количества парастернальных метастазов в группе больных с ВТПЛ ± ЛТ до 3 и 4 и более приводит к достоверному снижению общей выживаемости до 55,0%, 32,0% и безрецидивной — до 32,0%, 15,0% (р<0,05), соответственно.
ЗАКЛЮЧЕНИЕ
Парастернальные лимфатические узлы является одним из важнейших барьеров на пути оттока лимфы из ткани молочной железы. По литературным данным их метастатическое поражение при раке молочной железы наблюдается в 16,0% — 55,0% случаев. Кроме того, в 6,0-15,0% случаев авторы наблюдают изолированное поражение парастернальных лимфатических узлов, без поражения подмышечных [3, 9, 16, 17]. Поэтому интерес, предъявляемый к этой группе лимфатических узлов при лечении больных раком молочной железы не случаен. По данным исследований, факторами, способствующими метастазированию в парастернальную зону, являются локализация опухоли в молочной железе, состояние аксиллярной зоны и размер опухоли [26, 30, 38, 50, 52, 66, 70, 77, 79]. Однако мнения авторов относительно лидирующей роли какого либо фактора расходятся. Так, частота поражения парастернальной зоны при отрицательных аксиллярных узлах составляет 6,0-9,0% и при положительных — 28,0-52,0%. Поражение парастернальной зоны при интактных аксиллярных лимфоузлах и внутреннем расположении опухоли составляет 12,0-14,0%, а при наружной локализации — 3,0-8,0%. При наличии метастазов в аксиллярных лимфоузлах и внутренней локализации опухоли поражение составляет 44,0-65,0% по сравнению с 19,0-42,0% при латеральной локализации [26, 30, 38, 50, 52, 70].
Надо сказать, что большинство публикаций, касающихся частоты поражения парастернальной зоны основаны на данных ранних исследований, когда отмечались запущенные формы болезни с большими размерами первичной опухоли и большим количеством пораженных аксиллярных лимфоузлов. Эти данные не приемлемы для современной популяции больных, которым рак молочной железы диагностируется на более ранних стадиях. По современным литературным данным поражение парастернальных лимфатических узлов при малых размерах первичной опухоли и положительных аксиллярных лимфоузлах составляет 5 — 15% [36].
Текущие исследования сторожевого лимфоузла показывают, что показатель может быть менее 5,0%, при опухолях малых размеров, локализованных в наружных квадрантах, и при наличии не более 1-3 положительных аксиллярных лимфоузлов [36].
Начиная с конца XIX века диссекция аксиллярных лимфатических узлов при хирургическом лечении рака молочной железы всегда входила в объем операции. Что касается парастернальных лимфатических узлов, то в течение длительного времени они игнорировались. Только в 50-ых годах прошлого века вопрос удаления парастернальных лимфатических узлов вызвал интерес у нескольких хирургов, и были разработаны расширенные операции, включающие наряду с классической мастэктомией Холстеда удаление лимфатических узлов парастернальной зоны [78]. Для изучения роли увеличения объема лимфодиссекции на результаты лечения было проведено множество рандомизированных исследований, которые в целом не показали улучшения результатов при проведении парастернальной лимфодиссекции, хотя предполагалось улучшение выживаемости в подгруппах больных с медиальной локализацией опухоли и положительными аксиллярными лимфатическими узлами [50, 55, 79]. Надо сказать, что в данных исследованиях частота поражения парастернальной зоны при расширенных операциях составляла 20,0-40,0%, а в остальных случаях парастернальная лимфодиссекция носила профилактический характер, чем и можно объяснить отсутствие эффекта при данной операции. Лишь в подгруппах больных с медиальным расположением опухоли и наличием большого количества аксиллярных метастазов, т.е. с высоким риском поражения парастернальной зоны, авторы получили улучшение выживаемости при расширенных операциях [50, 55]. Было отмечено большое прогностическое значение состояния парастернальных лимфатических узлов, так как наличие метастазов в данной зоне значительно ухудшало выживаемость больных [78]. Однако, расширенные операции характеризовались большой травматизмом и значительно ухудшали качество жизни больных, поэтому они уступили место лучевой терапии парастернальной зоны, которая в качестве дополнения к радикальной мастэктомии, не уступала по эффективности расширенным операциям [5, 7, 10, 21]. Однако и вопрос лучевой терапии парастернальной зоны также оказался спорным. Большинство проведенных рандомизированных исследований не показали улучшения общей выживаемости и при включении парастернальной зоны в объем облучаемых тканей. Снижение выживаемости при этом ассоциировалось с побочным влиянием лучевой терапии на ткань легких и миокарда, которые неизбежно попадали в поле облучения, и приводили к увеличению смертности от кардиоваскулярных осложнений [27]. Это послужило поводом для поиска более безопасных методик, таких, как облучение парастернальной зоны тангенциальными полями и внутритканевое облучение парастернальной зоны, которые в меньшей степени воздействовали на здоровые ткани [64]. Появление эффективных схем химиотерапии и вероятность развития серьезных осложнений со стороны сердца при облучении парастернальной зоны привели к снижению ее использования в течение прошедших десятилетий. Однако последние публикации результатов Danish и British Columbia trails, опубликованные в 1999 году и показавшие эффективность послеоперационной лучевой терапии, которая включала в себя и парастернальную зону, заново породили интерес к избирательному лечению парастернальной зоны [36]. Как указывают Thomas et al. (2000г.) исследования, касающиеся роли лучевой терапии парастернальной зоны, требуют аккуратного планирования лечения и высококачественного исполнения. При облучении грудной клетки часто в поле облучения случайно попадают парастернальные лимфатические узлы, а дополнительное поле, которое создается для облучения парастернальной зоны, может не захватить соответствующие лимфатические узлы, если при планировании не используется компьютерная томография [68]. Общим недостатком всех методов лучевой терапии является отсутствие морфологической идентификации метастатического поражения парастернальной зоны, что приводит к завышению показаний к ее проведению.
Для диагностики состояния парастернальной зоны НапсЛеу и
ТЬаскгеу А. Б. еще в 1947 году предложили методику биопсии парастернальных лимфатических узлов, которая широко используется в нашем отделении. Однако данная методика имеет свои недостатки. Она не позволяет точно определить состояние парастернальной зоны, поскольку изучению подвергается лишь фрагмент ткани парастернальной клетчатки [9].
Развитие эндоскопической техники способствовало появлению методики торакоскопической парастернальной лимфодиссекции. Данная методика позволяет с минимальным травматизмом провести диссекцию парастернальных лимфатических узлов, адекватную таковой при расширенной мастэктомии [9, 16]. Это позволяет повысить качество стадирования, обеспечить надлежащий хирургический радикализм при наличии метастазов в парастернальной зоне и тем самым оптимизировать дальнейшую тактику лечения.
Как отмечалось выше, прогностическая роль состояния парастернальных лимфатических узлов велика. Одновременное поражение аксиллярной и парастернальной зоны приводит к значительному ухудшению результатов лечения. По данным Тапака М е! а1. (1990г.) 5 летняя выживаемость больных без метастазов в парастернальных лимфатических узлах составляет 89,0% по сравнению с 45,0% при наличии метастазов в соответствующей зоне. Поэтому выработка правильных подходов к лечению больных данной группы, является одной из актуальных проблем современной онкомаммологии. Роль дополнительного хирургического или лучевого лечения парастернальной зоны до сегодняшнего дня является не до конца ясным и дискутабельным. Большинство авторов отмечают необходимость проведения дальнейших исследований в этой области для внесения ясности данного вопроса.
Исходя из этих противоречивых данных, имея большой клинический материал, мы поставили перед собой цель изучить эффективность различных методов лечения больных раком молочной железы при наличии метастазов в парастернальных лимфатических узлах для оптимизации дальнейшей тактики лечения. Для этого перед настоящей работой были поставлены следующие задачи:
1. Определить факторы, способствующие метастазированию рака молочной железы в парастернальную область.
2. Изучить выживаемость больных и факторы прогноза при поражении парастернальных лимфатических узлов независимо от методов лечения.
3. Сравнить между собой эффективность различных методов воздействия на парастернальную зону на фоне системной химиотерапии: г) радикальная мастэктомия/резекция + внутритканевая лучевая терапия парастернальной зоны + химиотерапия по схеме CMF. д) радикальная мастэктомия/резекция + биопсия парастернальных лимфоузлов ± дистанционная лучевая терапия на парастернальную зону + химиотерапия по схеме FAC. е) радикальная мастэктомия/резекция + видеоторакоскопическая парастернальная лимфодиссекция ± дистанционная лучевая терапия на парастернальную зону + химиотерапия по схеме FAC.
4. Определить прогноз и оптимальные методы лечения в зависимости от количества пораженных парастернальных лимфатических узлов.
5. Оценить эффективность лучевой терапии парастернальной зоны.
Для решения поставленных нами задач мы исследовали и сравнили между собой результаты лечения 254 больных раком молочной железы с метастазами в парастернальные лимфатические узлы, которым в разные периоды времени проводилось лечение вышеприведенными методами. Лечение проводилось на базе отделения радиохирургии РОНЦ им. H.H. Блохина РАМН в периоды с октября 1981г. по декабрь 1992г. и с июня 1998г. по декабрь 2002г. Из 254 больных в 52 (21,0%) случаях поражение парастернальной зоны было установлено в период с 1981 по 1992 гг. Данным больным при радикальной операции на уровне I или П межреберья проводилась катетеризация внутренней грудной артерии для проведения на следующий день внутритканевой лучевой терапии парастернальной зоны радиоактивными источниками б0Со или 252С£ Для изучения состояния парастернальной зоны при этом в этих же межреберьях делалась биопсия парастернальных лимфатических узлов. После окончания курса внутритканевой лучевой терапии (экспозиция в течение 48 часов) дополнительно проводилось по показаниям дистанционное облучение подмышечной, подключичной и надключичной зон в СОД 45 Гр. Всем больным, оперированным в данный промежуток времени, в качестве стандарта проводилась адъювантная химиотерапия по схеме СМЕ7 в количестве 6 курсов и по показаниям назначалась гормонотерапия тамоксифеном 20 мг в течение 5 лет. С 1998 по 2002 гг. поражение парастернальной зоны было установлено в 79 (31,0%) случаях при помощи биопсии парастернальных лимфатических узлов из I, П и Ш межреберий. Данным больным в 58 (73,4%) случаях после операции проводилась дистанционная лучевая терапия оставшейся части молочной железы или грудной стенки СОД — 50 Гр и подмышечной, подключичной, надключичной и парастернальной зон в СОД — 45 Гр. В 21 (26,6%) случаях облучения парастернальной зоны не проводилось. В 123 (48,4%) случаях поражение парастернальной зоны было установлено при помощи видеоторакоскопической парастернальной лимфодиссекции. При этом в 80 (65,0%) случаях проводилось послеоперационное дистанционное облучение регионарных зон, включая парастернальную, и в 43 (35,0%) случаях парастернальная зона не облучалась. Все больные, пролеченные в данный промежуток времени, в качестве стандарта получили адъювантную химиотерапию по схеме ГАС 4 — 6 курсов, за исключением 6, которым она не проводилась из-за различных противопоказаний. По показаниям назначалась гормонотерапия тамоксифеном 20 мг в течение 5 лет. Всего 37-ми больным с сохраненным менструальным циклом и рецепторположительной опухолью была выполнена лучевая или хирургическая кастрация с последующим назначением тамоксифена. В 62 (24,4%) случаях из 254 больным проводилось предоперационное лечение, большая часть которого пришлась на период с 1981 по 1992 гг. — 40 (64,5%) случаев, по сравнению с 22 (35,5%) случаями в период с 1998 по 2002 гг.
Мы не остановимся на описании методик выполнения вышеприведенных операций и лучевой терапии, так как они подробно описаны в соответствующих главах.
Частоту поражения парастернальной зоны в зависимости от различных факторов мы рассмотрели в группе больных, оперированных в период 1998 — 2002гг., поскольку у данной категории больных биопсия парастернальных лимфатических узлов и видеоторакоскопическая парастернальная лимфодиссекция проводились независимо от локализации опухоли в молочной железе. Всего в данный промежуток времени ВТПЛ и биопсия парастернальных лимфатических узлов были проведены в 1219 случаях. Из них в 202 (16,6%) случаях отмечалось поражение парастернальной зоны, соответственно в 1017 (83,4%) случаях данный фактор не отмечался.
Метастазирование в парастернальную зону при локализации опухоли в наружных квадрантах наблюдалось в 12,2%, во внутренних — в 17,5%, на границе верхних и нижних наружне-внутренних квадрантов — в 19,6% и центральной зоне — в 25,2% случаев. Используя точный тест Фишера, мы отмечали достоверную зависимость частоты метастазирования в парастернальную зону от локализации опухоли в молочной железе. Опухоли, локализованные в центральной зоне и на границе верхних и нижних наружне-внутренних квадрантов, достоверно чаще метастазировали в парастернальную зону (р < 0,01) по сравнению с опухолями, локализованными в наружных квадрантах. При внутренней локализации разница приближалась к статистически достоверной (р=0,04). Поэтому, в целом можно сказать, что при латеральной локализации опухоли шанс метастазирования в парастернальную зону достоверно ниже.
Состояние аксиллярной зоны также оказывает влияние на вероятность метастазирования в парастернальную зону. При отсутствии аксиллярных метастазов частота поражения парастернальной зоны составила 4,7%. С появлением метастазов в аксиллярной зоне отмечалось достоверное увеличение частоты поражения парастернальной зоны в каждой подгруппе по сравнению с подгруппой без метастазов в аксиллярной зоне, составив при 1-3 аксиллярных метастазах 18,6%, при 4-9 — 38,0%, при 10 и более — 39,2% (р=0,000 во всех случаях). Кроме того, статистически достоверные различия наблюдались и между подгруппами с 1-3 и 4-9; 1-3 и 10 и более аксиллярными метастазами (р=0,000). Таким образом, наличие и увеличение количества пораженных аксиллярных лимфоузлов приводит к достоверному увеличению вероятности метастазирования в парастернальную зону.
Мы также наблюдали зависимость метастазирования в парастернальную зону от размеров опухоли. Менее всего поражение парастернальной зоны отмечалось при показателе Т1, составив 9,2%. При Т2 и Тз частота поражения составила 19,7% и 19,8%, соответственно, и наиболее часто парастернальная зона поражалась при показателе Т4, составив 31,6%. Статистическая достоверность наблюдалось во всех случаях с увеличением показателя Т по сравнению с Т]. При размерах Т1 и Т2 она составила р=0,000; Т[ и Тз -р=0,004; Т1 и Т4 — р=0,000. Достоверная разница отмечалась и между группами больных с Т2 и Т4 (р=0,01). Следовательно, рост размера опухоли, так же, как и количества аксиллярных метастазов, приводит к достоверному увеличению частоты поражения парастернальной зоны. Особенно повышается риск поражения парастернальной зоны с наложение этих факторов друг на друга. Исследуя частоту поражения парастернальной зоны в зависимости от ТЫМ классификации (5 издание, 1997г.), мы пользовались значением р1М, характеризующего состояние аксиллярной зоны после гистологического исследования, не учитывая состояние парастернальной зоны. При этом наименее часто метастазирование в парастернальную зону отмечалось при pTjNoMo, составив 2,6%, при pT2NiM0 она составила 28,2%, и наиболее часто метастазирование в парастернальную зону отмечалось при pT3N2M0-75,0%.
Таким образом, факторами, достоверно влияющими на метастазирование в парастернальную зону, являются локализация опухоли в молочной железе, состояние аксиллярной зоны и размер опухоли, что соответствует литературным данным. Больные с центральной и медиальной локализацией опухоли, а так же при расположении опухоли на границе верхних и нижних наружне — внутренних квадрантов, наличием метастазов в аксиллярной зоне и размером опухоли Т24, относятся к группе высокого риска поражения парастернальных лимфатических узлов. Причем с увеличением двух последних факторов, риск поражения парастернальной зоны значительно возрастает.
Рассматривая результаты лечения больных, надо сказать, что из 202 больных с метастазами в парастернальной зоне, оперированных в период с 1998 до 2003 гг., прослежены 186 (92,0%). Данные 16 (8,0%) больных после проведенного лечения полностью отсутствовали, поэтому мы исключили их из дальнейшего исследования. Больные, пролеченные в 1981-1992 гг., прослежены во всех 52 случаях. Поэтому, в дальнейшем, приводя показатели выживаемости, мы будем опираться на данных 238 прослеженных больных. Минимальный срок наблюдения составил 5 месяцев, максимальный — 160 месяцев. Выживаемость больных определяли со дня операции до дня окончания срока исследования, потери связи с больным или летального исхода. Результаты лечения обрабатывались при помощи компьютерной программы SPSS 12.0, выживаемость рассчитана по методу Kaplan-Meier. Для сравнения показателей выживаемости использовался log-rank test. При сравнении характеристики разных групп больных использовался непараметрический тест Kolmogorov-Smirnov. Нами рассчитаны 5-летние показатели общей и безрецидивной выживаемости.
Сравнивая выживаемость больных в общей группе (независимо от проведенного лечения) в зависимости от размеров опухоли, в каждом случае с увеличением Т мы отмечали достоверное (р<0,05) снижение общей и безрецидивной выживаемости (кроме Тз с Т4), составив при Т] 84,0% и 73,0%, при Т2 — 58,0% и 48,0%, при Т3 — 35,0% и 31,0% и при Т4 — 39,0 и 9,0%, соответственно. Таким образом, полученные данные еще раз подтвердили большую прогностическую значимость размера первичной опухоли на результаты лечения, что соответствует данным литературы.
Одним из факторов, влияющих на выживаемость больных, является степень поражения аксиллярной зоны. При отсутствии поражения аксиллярной зоны показателей общей и безрецидивной выживаемости составили 82,0% и 71,0%. При появлении 1-3 аксиллярных метастазов отмечалась тенденция к снижению выживаемости до 65,0% и 57,0%, соответственно. Увеличение количества аксиллярных метастазов до 4-9 и 10 и более привело к достоверному снижению общей выживаемости до 33,0%
2 2 (р=0,0001; х =15,1) и 35,0% (р=0,003; % =8,8) и безрецидивной выживаемости до 27,0% (р=0,001; %2=15,9) и 11,0% (р=0,0004; х2=12,6), соответственно, по сравнению с больными без аксиллярных метастазов. Статистически достоверные различия наблюдались и между группами больных с 1-3 и 4-9 аксиллярными метастазами в показателях общей (р=0,001; х =10,8) и
•у безрецидивной (р=0,0004; х =12,6) выживаемости и в показателях безрецидивной выживаемости между группами с 1-3 и 10 и более метастазами (р=0,002; % =9,8). При прорастании капсулы аксиллярных лимфатических узлов и наличии раковых эмболов в аксиллярной клетчатке и кровеносных сосудах наблюдалась тенденция к снижению общей выживаемости с 70,0% до 51,0% (р=0,08; у?=2,9) и статистически достоверное снижение безрецидивной выживаемости с 61,0% до 33,0% (р=0,01; х =6,6). Анализируя полученные данные, мы не получили во всех случаях достоверного снижения выживаемости с ростом степени поражения аксиллярной зоны, однако так как она наблюдалась в большинстве случаев,
80 данный фактор можно отнести к прогностическим фактором, влияющих на результаты лечения. Наличие более 4-ех аксиллярных метастазов приводит к достоверному ухудшению выживаемости больных.
Одним из интересных вопросов является влияние степени поражения парастернальной зоны на выживаемость. Данный вопрос мы рассмотрели в группе больных, которым проводилась ВТПЛ ± ЛТ, так как данная методика позволяет в полном объеме изучить состояние парастернальной зоны, в отличие от метода биопсии. С увеличением количества парастернальных метастазов отмечалось снижение общей выживаемости. При 1 пораженном лимфоузле общая выживаемость составила 73,0%, при 2 — 82,0%, при 3 — 55,0% и при 4 и более 32,0%. Достоверное снижение при этом отмечалось при наличии 3-ех парастернальных метастазов по сравнению с подгруппой, где имелся 1 метастаз (р=0,02; х =5,5). При наличии 4 и более парастернальных метастазов разница приближалась к статистически л достоверной (р=0,06; % =3,5). Что касается безрецидивной выживаемости, то при 1 и 2-ух метастазах показатели были практически одинаковыми, составив 70,0% и 73,0%, соответственно. При 3-ёх и 4 и более метастазах они достоверно уменьшились до 32,0% и 15,0%, соответственно. Статистическая достоверность между подгруппами с 1 и 3 метастазами составила р=0,0005
2 2 X =12,1; с 1 и 4 и более метастазами — р=0,0002 х =13,7; с 2 и 3 метастазами
2 о р=0,03 х =4,9; с 2 и 4 и более парастернальными метастазами — р=0,01 % =6,4. Прорастание капсулы парастернальных лимфатических узлов и наличие раковых эмболов в клетчатке и кровеносных сосудах парастернальной области привело к достоверному снижению общей выживаемости с 78,0% до 40,0% (р=0,006; х2==7,6) и безрецидивной выживаемости с 67,0% до 37,0% (р=0,005; х2=8,0). Таким образом, не только наличие, но и степень поражения парастернальной зоны оказывает влияние на результаты лечения. Наличие 3-ех и более метастазов, а также и раковых эмболов в парастернальной клетчатке приводит к достоверному ухудшению результатов лечения.
Важнейшим фактором, определяющим прогноз и тактику лечения при раке молочной железы, является рецепторный статус опухоли. В нашем исследовании общая и безрецидивная выживаемости больных с гормоноположительными опухолями оказались статистически достоверно лучшими по сравнению с гормоноотрицательными, составив 66,0% против 35,0% (р=0,0002; и 56,0% против 35,0% (р=0,001; %2=10,2), соответственно. Таким образом, еще раз подтверждена роль рецепторного статуса опухоли, как одного из важнейших прогностических факторов, влияющих на выживаемость больных.
Мы постарались оценить эффективность различных схем химиотерапии и количества проведенных курсов. Для этого мы сравнили между собой вылей ваемость больных, которым проводилась различные схемы химиотерапия и выживаемость больных, которым адъювантная химиотерапия не проводилась. В 174 случаях химиотерапия проводилась по схеме БАС в количестве 4-6 курсов, в 58 случаях проводился СМР 6 курсов, и 6 больным химиотерапия не проводилась из-за различных противопоказаний. Статистически достоверно лучшие результаты общей выживаемости отмечались в группе больных, получивших БАС по сравнению с СМБ, составив 64,0% против 48,0%, соответственно (р=0,006; X =7,5). В показателях безрецидивной выживаемости отмечались практически одинаковые результаты, составив 47,0% и 45,0%. Наиболее плохие показатели общей и безрецидивной выживаемости отмечались у больных без адъювантной химиотерапии, составив 17,0% и 0%, соответственно. При этом достоверные различия в показателях общей выживаемости наблюдались по сравнению с больными, которые получали как ¥АС (р=0,000 х2=21,1), ^ и СМБ (р=0,004 х2=8,1), и в показателях безрецидивной выживаемости наблюдались по сравнению с больными, л получившими БАС (р=0,004; % =8,3). Таким образом, неоспорима роль адъювантной химиотерапии в улучшении результатов лечения больных данной категории. Использование в адъювантном режиме химиотерапии по схеме БАС достоверно улучшает результаты лечения по сравнению с СМБ». Однако мы не наблюдали достоверного улучшения результатов лечения при увеличении количества курсов БАС с 4 до 6. Показатели общей выживаемости при 4 и 6 курсах составили 66,0% и 74,0% и показатели безрецидивной выживаемости составили 48,0% и 53,0%, соответственно. Как было отмечено выше, поражение парастернальной зоны является тяжелым прогностическим фактором и вероятно, необходим поиск более мощных схем химиотерапии для улучшения результатов лечения больных данной категории.
Одним из спорных вопросов в лечении рака молочной железы является влияние роли парастернальной лимфодиссекции и лучевой терапии парастернальной зоны на выживаемость больных. Пытаясь ответить на данный вопрос, мы изучили выживаемость больных в зависимости от методов воздействия на парастернальную зону: I. Операция + видеоторакоскопическая парастернальная лимфодиссекция + дистанционная лучевая терапия парастернальной зоны + БАС + тамоксифен по показаниям — 74 (31,0%) больных.
П. Операция + видеоторакоскопическая парастернальная лимфодиссекция + РАС + тамоксифен по показаниям — 36 (15,0%) больных.
Ш. Операция + биопсия парастернальных лимфатических узлов с внутритканевой или дистанционной лучевой терапией парастернальной зоны + СМБ или РАС + тамоксифен по показаниям — 107 (45,0%) больных.
IV. Операция + биопсия парастернальных лимфатических узлов + БАС + тамоксифен 20 мг по показаниям — 21 (9,0%) больных.
Сравнивая характеристик больных, отметим, что в группе, где проводилась биопсия парастернальных лимфатических узлов с или без последующей лучевой терапией, наблюдалось больше больных в возрасте более 50 лет и в менопаузе (р<0,01). Не было получено статистически достоверных различий между группами больных в зависимости от размера опухоли, степени поражения аксиллярной зоны, рецепторного статуса, степени злокачественности и предоперационного лечения.
Наиболее высокие результаты отмечались при проведении ВТПЛ + ЛТ и только ВТПЛ, составив в показателях общей выживаемости 64,0% и 63,7% и безрецидивной — 55,0% и 60,0%, соответственно. При облучении парастернальной зоны после биопсии отмечалась тенденция к снижению показателей общей выживаемости до 49,0% и статистически достоверное снижение безрецидивной выживаемости до 38,0% (р=0,05; % =3,9) по сравнению с результатами при ВТПЛ + ЛТ. И наихудшие показатели общей и безрецидивной выживаемости отмечались при отсутствии какого либо лечебного воздействия на парастернальную зону, то есть только при диагностической биопсии парастернальных лимфоузлов, составив 41,0% и 29,0%. При этом достоверная разница в показателях общей выживаемости по сравнению с ВТПЛ + ЛТ составила р=0,007 % =7,4, безрецидивной — р=0,007 Х2=7,3 и по сравнению с ВТПЛ — р=0,006; и р-0,02; %2=5,8, соответственно. Не отмечалось преимущества какого либо метода воздействия на парастернальную зону в зависимости от размеров опухоли и количества пораженных аксиллярных лимфоузлов. При размерах опухоли Ti достоверно худшие показатели общей и безрецидивной выживаемости по отношению ко всем остальным подгруппам отмечались при только биопсии, составив 0% в обоих случаях. Однако в данной подгруппе наблюдалось всего 2 больных. При проведении ВТПЛ + ЛТ, ВТПЛ и биопсии + ЛТ показатели общей выживаемости составили 88,0%, 100,0% и 88,0% и безрецидивной -68,0%, 89,0% и 80,0%, соответственно, и не различались достоверно друг от друга. Особенно надо отметить, что даже в подгруппе больных без наличия аксиллярных метастазов в показателях общей выживаемости при проведении ВТПЛ + ЛТ, ВТПЛ, биопсии + ЛТ и только биопсии не отмечались статистически достоверные различия, составив 86,0%, 100,0%, 87,0% и 60,0%, соответственно. И в данном случае прослеживается тенденция к более слабым результатам только при биопсии. В показателях безрецидивной выживаемости наблюдалась тенденция к лучшим результатам при ВТПЛ + ЛТ и ВТПЛ, составив 86,0% и 100,0% по сравнению с 66,0% при биопсии + ЛТ. И при только биопсии безрецидивная выживаемость достоверно ухудшилась по сравнению с ВТПЛ + ЛТ, составив 40,0% (р=0,03 % =5,9). В дальнейшем, с ростом размеров опухоли и увеличением количества аксиллярных метастазов, отмечалось снижение выживаемости во всех случаях, но в большинстве случаев наблюдалась тенденция к лучшим показателям при парастернальной лимфодиссекции с или без лучевой терапией.
Важным прогностическим фактором, влияющим на эффективность того или иного метода воздействия на парастернальную зону, оказалось прорастание капсулы аксиллярных лимфатических узлов и наличие раковых эмболов в аксиллярной клетчатке и сосудах. Отсутствие данного фактора привело к статистически достоверному улучшению общей выживаемости при ВТПЛ + ЛТ по сравнению с биопсией + ЛТ и только биопсией, составив 86,0% против 43,0% (р=0,007; г =1,2) и 46,0% (р=0,01; %2=6,6), соответственно. При только ВТПЛ общая выживаемость составила 88,0% и была достоверно лучшей по сравнению с биопсией + ЛТ (р=0,04; % =4,2) и приближалась к статистической достоверности по сравнению с только биопсией (р=0,056; х =3,7). Такая же ситуация наблюдалась в показателях безрецидивной выживаемости, составив при ВТПЛ + ЛТ и только ВТПЛ 81,0% и 73,0% и при биопсии + ЛТ и только биопсии — 38,0% и 21,0%, соответственно. Статистическая достоверность при ВТПЛ + ЛТ по сравнению с биопсией + ЛТ и только биопсией составила р=0,008 %=7Л и р=0,0001 х =15,9. При проведении ВТПЛ достоверная разница по сравнению с больными, которым проводилась только биопсия составила р=0,01; %2=6,0. С появлением раковых эмболов в аксиллярной клетчатке показатели общей выживаемости снизились до 46,0%, 59,0%, 55,0% и 35,0%, и безрецидивной выживаемости — до 29,0%, 50,0%, 27,0% и 25,0%, соответственно, и мало зависели от проведенного воздействия на парастернальную зону. Таким
85 образом, при отсутствии такого неблагоприятного прогностического фактора, как наличие раковых эмболов в клетчатке и сосудах аксиплярной области, молено говорить о преимуществе парастернальной лимфодиссекции по сравнению с облучением парастернальной зоны и отсутствием лучевой терапии.
Суммируя вышесказанное, можно сказать, что в общей группе больных отмечаются более благоприятные результаты лечения при проведении парастернальной лимфодиссекции с или без лучевой терапией. Показатели выживаемости при облучении парастернальной зоны после биопсии соответствующих лимфоузлов уступают результатам данных методов лечения, однако разница статистически недостоверна. И достоверно худшие результаты по сравнению с парастернальной лимфодиссекцией с или без последующей лучевой терапией наблюдаются при отсутствии какого либо лечебного воздействия на парастернальную зону, то есть при проведении только биопсии парастернальных лимфатических узлов. Не отмечалось преимущества того или иного метода лечения в зависимости от размеров опухоли и количества аксиллярных метастазов. Более значимым фактором, влияющим на эффективность методов лечения, оказалось наличие раковых эмболов в аксиплярной клетчатке и сосудах. При отсутствии данного фактора парастернальная лимфодиссекция с или без лучевой терапией приводит к достоверному улучшению общей выживаемости по сравнению с облучением парастернальной зоны после биопсии. С увеличением размеров опухоли, появлением аксиллярных метастазов и увеличением их количества, наличием раковых клеток в аксиллярной клетчатке показатели выживаемости уменьшаются и в меньшей степени зависят от метода лечения.
Более детально изучив роль лучевой терапии парастернальной зоны, мы не получили улучшения результатов лечения при дистанционном облучении парастернальной зоны после ВТПЛ. Показатели общей выживаемости составили 64,0% в обоих случаях. Показатели безрецидивной выживаемости при облучении и без неё составили 55,0% и 60,0%, соответственно.
Дистанционное облучение парастернальной зоны после ВТПЛ не привело к улучшению результатов лечения и в зависимости от количества метастазов в парастернальной зоне. В большинстве случаев наблюдалась тенденция к лучшим показателям выживаемости в подгруппе больных без дополнительного облучения парастернальной зоны. Даже при прорастании капсулы парастернальных лимфатических узлов и наличии раковых эмболов в соответствующей клетчатке наблюдалась всего лишь тенденция к более благоприятным результатам при облучении парастернальной зоны после ВТПЛ в показателях общей — 48,0% против 0% без неё, и безрецидивной выживаемости, составив 37,0% и 0%, соответственно.
В группе больных, которым делалась биопсия, облучение парастернальной зоны проводилось двумя методами — (55 случаев) и внутритканевым (52 случая). В данной группе больных дистанционное облучение парастернальной зоны привело к достоверному улучшению общей выживаемости, по сравнению с подгруппой без лучевой терапии (21 больной), составив 52,0% против 41,0% (р=0,04; % =4,2), соответственно. Однако безрецидивная выживаемости была одинаковой, составив 29,0% в обоих случаях. Тенденция к улучшению общей и безрецидивной выживаемости отмечалась и при внутритканевом облучении, составив 47,0% и 43,0%, соответственно. Причиной более низких показателей общей выживаемости при внутритканевом облучении парастернальной зоны, по сравнению с дистанционной, может быть применение у данной группы больных более слабой схемы химиотерапии (СМТ7).
Оценивая эффективность лучевой терапии, можно сказать, что включение парастернальной зоны в объем облучаемых тканей после ВТПЛ не приводит к улучшению результатов лечения больных. Кроме того, поскольку результаты лечения только при парастернальной лимфодиссекции не только не уступают, но и наблюдается тенденция к более лучшим показателям по сравнению с облучением парастернальной зоны после биопсии, молено говорить, что ВТПЛ может быть альтернативой облучению парастернальной зоны. Это приведет к снижению лучевой нагрузки на органы средостения и, следовательно, снизит количество осложнений лучевой терапии. Что касается облучения парастернальной зоны после биопсии соответствующих лимфоузлов, отмечается достоверное улучшение общей выживаемости при дистанционном и тенденция к более благоприятным результатам при внутритканевом облучении. Таким образом, отсутствие хирургического или лучевого воздействия на парастернальную зону при её метастатическом поражении приводит к достоверному ухудшению общей выживаемости по сравнению с больными, которым проводилась ВТПЛ + ДЛТ, ВТПЛ и биопсия + ДЛТ парастернальной зоны. Все это позволяет нам рекомендовать добавление видеоторакоскопической парастернальной лимфодиссекции к радикальной операции или включение парастернальной зоны в объем облучаемых тканей при её метастатическом поражении.
В заключение хочется отметить, что одновременное метастатическое поражение аксиллярной и парастернальной зон является плохим прогностическим фактором, значительно ухудшающим результаты лечения. Больные с наличием метастазов в аксиллярных и парастернальных лимфатических узлах одновременно, относятся к группе с плохим прогнозом. Так, показатели 5-ти летней общей и безрецидивной выживаемости 238 больных независимо от проведенного лечения составили 54,0% и 45,0%, соответственно. Из них одновременное поражение аксиллярных и парастернальных лимфатических узлов наблюдалось в 203 (85,3%) случаях и только парастернальных лимфоузлов — в 35 (14,7%) случаях. По сравнению с поражением только парастернальной зоны, одновременное поражение обоих зон привело к статистически достоверному снижению общей выживаемости с 82,0% до 48,0% (р=0,003; £2=8,7) и безрецидивной с 71,0% до 39,0% (р=0,003; х2=8,9). Поэтому необходим поиск правильных подходов к лечению данной группы больных, что требует проведения дальнейших исследований в этой области на большем количестве и более однородной группе больных.
medical-diss.com
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: VII РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
VII РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
МОРФОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛИМФОУЗЛОВ ПАРАСТЕРНАЛЬНОЙ ЗОНЫ В АЛГОРИТМЕ ДИАГНОСТИКИ РАСПРОСТРАНЕННОСТИ И ЛЕЧЕНИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
М.И. Нечушкин, А.В. Триголосов, А.В. Петровский, В.А. Уйманов, Я.В. Вишневская
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
На протяжении многих лет рак молочной железы занимает первое место в структуре онкологических заболеваний у женщин [1].
Современные тенденции в лечении этого заболевания смещают акцент в пользу сокращения объема оперативных вмешательств, как на молочной железе, так и регионарных лимфатических коллекторах. Этому во многом способствует повсеместно внедряемый маммографический скрининг, а также постоянное совершенствование методов диагностики лимфогенной распространенности рака молочной железы, позволяющие начать лечение на ранних стадиях развития опухоли. Но если обследование подмышечной группы лимфоузлов является относительно несложной процедурой вследствие её доступности физикальному осмотру и многим методам исследования (лимфосцинтиграфия, ультразвуковое исследование (УЗИ), компьютерная томография (КТ), позитронно-эмиссионная томография (ПЭТ) и пр.), то диагностика состояния парастернального лимфоколлектора представляет большую проблему из-за особенностей топографии этой зоны лимфооттока. Вместе с тем, частота метастазирования в парастернальные лимфатические узлы (N3) колеблется, по данным литературы, в пределах 12,0–55,0%, а в 4,0-8,0% это поражение встречается при отсутствии метастазов в аксиллярный коллектор, что подчеркивает важность изучения состояния этой группы лимфоузлов [5, 7, 13, 14].
Современные исследования, основанные на биопсии «сторожевых» лимфоузлов, подтверждают, что последние вполне могут локализоваться и в парастернальном лимфоколлекторе [3, 8, 9].
К сожалению, чувствительность и специфичность методов современной диагностики (сцинтимаммография с 99mTc-sestamibi, ПЭТ, КТ, МРТ, биопсия «сторожевого» лимфоузла и пр.) не превышает 75,0–95,0% [11], а частота ложных выводов достигает 14,0–16,0% [8]. Кроме того, сложность аппаратуры, используемой при этих исследованиях, не позволяет отнести их к разряду рутинных.
Таким образом, наиболее достоверным методом диагностики поражения парастернального лимфатического коллектора остается морфологическое изучение всей цепочки удаленных лимфоузлов.
В последние годы развитие видеоэндохирургической техники предоставило возможность обеспечивать надлежащий радикализм хирургического лечения рака молочной железы путем дополнения традиционных операций видеоторакоскопической парастернальной лимфаденэктомией. Это вмешательство, пришедшее на смену расширенной мастэктомии Урбана-Холдина, относительно легко переносится больными, не ухудшает течение послеоперационного периода и не сопровождается функциональными и косметическими дефектами [2, 4, 6, 12, 15].
С июня 1998 г. по июнь 2003 г. включительно на базе отделения радиохирургии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России внедрена и усовершенствована методика одномоментной видеоторакоскопической парастернальной лимфодиссекции (ВТПЛ) в хирургическом лечении больных операбельным раком молочной железы, предложенная Сигалом Е.И в 1996 г. [4] При наличии противопоказаний к вышеуказанной операции используется метод открытой биопсии парастернальных лимфатических узлов, который также позволяет получить материал для морфологического исследования парастернального лимфатического коллектора.
Техника операции. Вмешательство проводится под эндотрахеальным наркозом с раздельной интубацией легких. На первом этапе выполняется радикальное вмешательство на молочной железе и подмышечном коллекторе в типичном положении больной на операционном столе. После завершения этого этапа производится поворот больной на здоровую сторону в полубоковое положение (500-600). По задне- и переднеподмышечной линиям в 3-5 межреберьях устанавливаются торакопорты для видеокамеры и манипуляторов.
С помощью эндохирургических инструментов производится резекция внутренних грудных сосудов на стороне поражения с моноблочным широким иссечением окружающей клетчатки, содержащей лимфоколлектор, с I по IV межреберье. Через один из портов в плевральную полость устанавливается активный дренаж и, после расправления легкого, восстановления его вентиляции, производится ушивание троакарных отверстий и операционной раны. Длительность торакального этапа вмешательства в среднем составляет 30 мин. В послеоперационном периоде дренаж из плевральной полости извлекается, как правило, на 1-2 сутки после рентгенологически доказанного расправления легкого. Дальнейшая курация послеоперационного периода не отличается от таковой у больных, перенесших стандартное вмешательство.
Открытая биопсия парастернальных лимфоузлов проводится больным во время радикальной мастэктомии либо радикальной резекции с медиальным расположением опухолевого узла. При этом по окончании основного этапа тупым путем вдоль волокон расслаивается большая грудная мышца поэтапно в каждом межреберье и пересекаются I-III межреберные мышцы по краю грудины на стороне поражения. После вскрытия внутренней грудной фасции обнажаются внутренние грудные сосуды. Внутренние грудные сосуды перевязываются, окружающая их клетчатка c лимфатическими узлами направляется на гистологическое исследование, большая грудная мышца ушивается. В целом оперативное вмешательство удлиняется на 10-15 мин. Тактика ведения больных в послеоперационном периоде не отличается от таковой у пациентов, перенесших радикальное вмешательство на молочной железе без открытой биопсии парастернальных лимфатических узлов.
Результаты исследования. Торакоскопическая парастернальная лимфодиссекция проведена 710 женщинам в возрасте от 24 до 66 лет (средний возраст 46,3±7,1 лет). У 376 (53,0%) больных опухоль локализовалась в левой молочной железе, у 334 (47,0%) – в правой.
Открытая биопсия проводилась у 378 женщин в возрасте от 32 до 82 лет (средний возраст 60,1±10,7 лет). У 196 больных (52,7%) опухоль локализовалась в левой молочной железе, у 182 (47,3%) – в правой.
Признаки отдаленного метастазирования не были обнаружены ни в одном наблюдении.
Все больные, перенесшие открытую биопсию парастернальных лимфоузлов, имели противопоказания к проведению видеоторакоскопической парастернальной лимфатической диссекции. Заболеваниями сердечно-сосудистой системы страдали 64,4% женщин. В 18,9% случаях видеоторакоскопический этап операции не мог быть произведен из-за проблем со стороны дыхательных путей. У 12,5% пациенток наблюдалась патология органов эндокринной системы, а 4,2% больных страдали ожирением III-IV стадий.
Во всех случаях производился морфологический анализ операционного материала с определением гистологической формы, размеров и степени злокачественности первичной опухоли, чувствительности опухоли к рецепторам эстрогенов, подсчетом количества удаленных лимфатических узлов аксиллярной области и парастернальной зоны по межреберьям.
При проведении ВТПЛ интраоперационные осложнения возникли у 11 (1,5%) больных. В одном случае в связи с ранением восходящего отдела аорты и тампонадой сердца выполнена торакотомия с ушиванием дефекта. Ранение легкого наблюдалось в 5 случаях, ранение внутренней грудной артерии — также у 5 больных. С этими осложнениями удалось справиться с помощью эндоскопического инструментария, не прибегая к торакотомии.
При проведении открытой биопсии в 1 случае (0,3%) произошло интраоперационное ранение внутренней грудной артерии на этапе отработки методики. Это обстоятельство потребовало пересечения ребра и перевязки артерии. Однако это событие не сказалось каким-либо образом на длительности и тяжести послеоперационного периода.
Послеоперационные осложнения, связанные с торакоскопическим этапом, имели место у 6 (0,8%) больных (в 1 случае — экссудативный плеврит, в 3 –пневмония, в 1- длительный коллапс легкого (4 суток), в 1 — позиционный плексит). Все осложнения купированы консервативными мероприятиями.
Послеоперационных осложнений, связанных с открытой биопсией парастернальных лимфоузлов, отмечено не было.
У 133 (18,7%) из 710 больных, перенесших ВТПЛ, морфологически выявлены метастазы в парастернальный лимфатический коллектор.
У 77 (20,4%) из 378 больных, перенесших открытую биопсию, морфологически выявлены метастазы в парастернальный лимфатический коллектор.
Распределение больных по стадиям заболевания представлено в таблице 1.
Таблица 1.
Распределение больных по стадиям.
| Стадия | Количество больных | Метастазы в парастернальную зону Количество больных (%) |
||
|---|---|---|---|---|
| ВТПЛ | Биопсия | ВТПЛ | Биопсия | |
| Tis | 6 | — | — | — |
| I | 193 | 51 | 4 (2,1%) | 2 (3,9%) |
| IIA | 220 | 121 | 37 (16,8%) | 13 (10,7%) |
| IIБ | 151 | 82 | 36 (23,8%) | 10 (12,2%) |
| IIIА | 101 | 76 | 43 (42,6%) | 31 (40,8%) |
| IIIБ | 39 | 48 | 13 (33,3) | 21 (43,9%) |
| Всего | 710 | 378 | 133 (18,7%) | 77 (20,4%) |
*- N-без учета поражения парастернальной зоны
По уточненной локализации первичной опухоли эти наблюдения распределились следующим образом (табл. 2).
Таблица 2.
Уточненная локализация первичной опухоли.
| Локализация | Количество больных | Метастазы в парастернальную зону Количество больных (%) |
||
|---|---|---|---|---|
| ВТПЛ | Биопсия | ВТПЛ | Биопсия | |
| Внутренняя | 139 | 84 | 33 (23,7%) | 17 (20,2%) |
| Центральная | 57 | 53 | 21 (36,8%) | 11 (20,8%) |
| Наружная | 339 | 156 | 40 (11,8%) | 30 (19,2%) |
| Граница верхних квадрантов | 140 | 68 | 30 (21,4%) | 14 (20,6%) |
| Граница нижних квадрантов | 35 | 17 | 9 (25,7%) | 5 (29,4%) |
| Всего | 710 | 378 | 133 (18,7%) | 77 (20,4%) |
Статистически достоверно различие у больных с ВТПЛ с центральной и наружной локализациями. Между остальными группами достоверных различий нет.
Частота поражения парастернальной зоны в зависимости от критерия Т отражена в табл. 3.
Таблица 3.
Частота поражения парастернальной зоны в зависимости от критерия Т.
| Критерий Т | Количество больных | Метастазы в парастернальную зону Количество больных (%) |
||
|---|---|---|---|---|
| ВТПЛ | Биопсия | ВТПЛ | Биопсия | |
| Tis | 6 | — | — | — |
| Т1 | 322 | 95 | 32 (9,95) | 12 (12,6%) |
| Т2 | 290 | 204 | 73 (25,2%) | 39 (19,1%) |
| Т3 | 53 | 31 | 15 (28,3%) | 5 (16,1%) |
| Т4 | 39 | 48 | 13 (33,3%) | 21 (43,8%) |
| Всего | 710 | 378 | 133 (18,7%) | 77 (20,4%) |
В табл. 4 представлены данные о влиянии состояния подмышечных лимфоузлов на частоту поражения парастернального коллектора.
Таблица 4.
Влияние состояния подмышечных лимфоузлов на частоту поражения парастернального коллектора.
| Метастазы в подмышечные лимфоузлы (N) | Количество больных | Метастазы в парастернальную зону Количество больных (%) |
||
|---|---|---|---|---|
| ВТПЛ | Биопсия | ВТПЛ | Биопсия | |
| N0 | 348 | 159 | 18 (5,2%) | 9 (5,7%) |
| N1 | 258 | 130 | 65 (25,2%) | 25 (19,2%) |
| N2 | 104 | 89 | 50 (48,1%) | 43(48,3%) |
| Всего | 710 | 378 | 133 (18,7%) | 77 (20,4%) |
Влияние гистологической структуры на поражение парастернальной зоны опухоли представлено в табл. 5.
Таблица 5. Влияние гистологической структуры опухоли на поражение парастернальной зоны.
| Стадия рака | Количество больных | Метастазы в парастернальную зону Количество больных (%) |
||
|---|---|---|---|---|
| ВТПЛ | Биопсия | ВТПЛ | Биопсия | |
| Carcinoma in situ | 6 | — | — | — |
| Инфильтрирующий | 10 | — | — | — |
| Инфильтративно–протоковый | 431 | 231 | 78 (18,1%) | 44 (19,0%) |
| Инфильтративно–дольковый | 147 | 83 | 26 (17,7%) | 20 (24,1%) |
| Смешанный дольково–протоковый | 60 | 33 | 23 (38,3%) | 12 (36,4%) |
| Тубулярный | 23 | 11 | 3 (13,0%) | 1 (9,1%) |
| Редкие формы рака | 30 | 20 | 3 (10,0%) | — |
| Полный лечебный патоморфоз | 3 | — | — | |
| Всего | 710 | 378 | 133 (18,7%) | 77 (20,4%) |
Следует отметить, что 31 больная перенесла неоадъювантное химиолучевое лечение. Из них в 9 (29,0%) случаях выявлены метастазы в парастернальный коллектор. Полный лечебный патоморфоз опухоли достигнут у 3 (9,7%) пациенток.
Степень злокачественности первичной опухоли определена у 331 человек, перенесших ВТПЛ, и у 132 больных из 378 после открытой биопсии. Табл. 6 наглядно демонстрирует увеличение частоты поражения парастернального лимфоколлектора с возрастанием этого критерия:
Таблица 6.
Частота поражения парастернального лимфоколлектора в зависимости от степени злокачественности первичной опухоли.
| Степень злокачественности | Количество больных | Метастазы в парастернальную зону Количество больных (%) |
||
|---|---|---|---|---|
| ВТПЛ | Биопсия | ВТПЛ | Биопсия | |
| G0 | 15 | 5 | — | — |
| G1 | 208 | 66 | 31 (14,9%) | (18,2%) |
| G2 | 108 | 61 | 31 (28,7%) | (27,9%) |
| Всего | 331 | 132 | 62 (18,7%) | (22,0%) |
Из приведенных данных видно, что частота поражения парастернальных лимфоузлов достоверно (р<0,05) повышается при увеличении степени злокачественности опухоли.
При морфологическом анализе парастернального коллектора по межреберьям выявлена закономерная тенденция к уменьшению частоты поражения в дистальном направлении, в том числе и при изолированном поражении того или иного межреберья (табл. 7).
Таблица 7.
Частота поражения парастернального коллектора в различных межреберьях.
| Межреберье | Частота поражения | |
|---|---|---|
| Всего | Изолированное поражение | |
| I | 82 (61,7%) | 26 (19,5%) |
| II | 72 (54,1%) | 18 (13,5 %) |
| III | 66 (49,6%) | 15 (11,3%) |
| IY | 29 (21,8%) | 5 (3,8%) |
| Всего | 133 (100%) | |
Кроме того, в 6 (4,5%) наблюдениях были обнаружены раковые эмболы в просвете кровеносных сосудов и лимфатических щелях, а также раковые комплексы в клетчатке парастернальной зоны без поражения лимфатических узлов. Эти изменения вряд ли могли бы быть доступны другим методам диагностики.
Во всех случаях при наличии метастазов в регионарные лимфатические узлы в рамках комплексного лечения проводились 4-6 курсов адъювантной полихимиотерапии по схеме FАС (Доксорубицин 50 мг/м2, Циклофосфан 500 мг/м2, 5-фторурацил 500 мг/м2 однократно в 1 день). Всем больным с морфологически подтвержденным поражением парастернальной зоны проводилась дистанционная гамма–терапия на эту область. Облучение проводилось в режиме 5 фракций в неделю при разовой очаговой дозе 2 Гр (до суммарной очаговой дозы 50 Гр). Все больные перенесли лечение удовлетворительно. Побочных эффектов не отмечено.
Выводы. В группе больных, перенесших ВТПЛ и открытую биопсию парастернальных лимфоузлов, на основании анализа 1088 (710+378) наблюдений выявлено достоверное (p<0.05) возрастание частоты поражения парастернального лимфатического коллектора в зависимости от таких значимых критериев как стадия заболевания, размеры и локализация (в группе с ВТПЛ) первичного очага, степень поражения аксиллярного лимфоколлектора, степень злокачественности первичной опухоли. Показано, что метастазирование в парастернальную зону происходит практически при любом расположении опухоли в молочной железе. Неблагоприятным фактором является наличие смешанного инфильтрирующего дольково–протокового рака.
Метастазы рака обнаруживаются во всех (с I по IV) межреберьях, значительно реже – в IV. Кроме того, в 6 случаях выявлены опухолевые изменения в парастернальном лимфоколлекторе, не связанные с поражением лимфоузлов (раковые эмболы в просвете кровеносных сосудов и лимфатических щелях, а также раковые комплексы в клетчатке парастернальной зоны).
Важным является факт метастазирования в парастернальный коллектор при отсутствии поражения аксиллярных узлов, так как в группе больных с начальными формами рака при отсутствии информации о поражении парастернального лимфоколлектора лечение ограничивается лишь хирургическим вмешательством и адъювантной лучевой терапией на молочную железу[10].
В целом видеоторакоскопическая парастернальная лимфодиссекция незначительно удлиняет время оперативного вмешательства, имеет малое количество осложнений и относительно легко переносится больными. Эта операция может считаться «золотым стандартом» в диагностике поражения парастернального лимфоколлектора и занять прочное место в лечении рака молочной железы между избыточно травматичной операцией Урбана-Холдина и пока недостаточно информативными неинвазивными методами диагностики. Лечебная функция этой манипуляции пока находится в стадии изучения и будет отражена в последующих публикациях.
При наличии противопоказаний к проведению видеоторакоскопической парастернальной лимфодиссекции открытая биопсия парастернальных лимфоузлов может быть использована в комбинированном и комплексном лечении рака молочной железы. Благодаря своей технической несложности, быстроте и дешевизне, эта методика может быть рекомендована для использования в лечебных учреждениях с диагностической целью, и ее результаты должны являться показанием к проведению адъювантного лечения.
Результаты морфологического исследования удаленных парастернальных лимфатических узлов позволяют повысить качество диагностики реальной распространенности опухолевого процесса, оптимизировать показания для проведения полихимиотерапии и лучевой терапии на парастернальную зону в послеоперационном периоде у больных раком молочной железы и более объективно судить об эффективности лечения больных с учетом более точного стадирования.
Список литературы:
1. Аксель Е.М., Давыдов М.И. Статистка заболеваемости и смертности от злокачественных новообразований в 2000году.//в сб. «Злокачественные новообразования в России и странах СНГ в 2000г.» — М.: ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.- 2002.- с 85-106.
2. Перепелицын В.Н., Нагаев А.С., Хорев К.А., Цепаев Г.Н. и др. Применение видеоторакоскопа в диагностике и лечении образований легких, средостения и плевры//Тез. Доклада юбилейной научной конференции к 50-летию онкослужбы Пермской области. — Пермь, 1997.- с. 18-19.
3. Семиглазов В.Ф. Хирургическое лечение рака молочной железы (история и современность)//Практическая онкология.- Т.3, № 1. – 2002г.- С. 21 — 28.
4. Сигал Е.И. и др. Видеоторакоскопическая парастернальная лимфаденэктомия при раке молочной железы//Материалы 1 съезда онкологов стран СНГ.- М.1996.- с 515 — 516.
5. Холдин С.А., Дымарский Л.Ю. Расширенные радикальные операции при раке молочной железы.–Л., Медицина, 1975.- с. 231.
6. Шнитко С.Н., Пландовский В.А., Троянов А.А., Анисимовец А.А. Видеоторакоскопическая хирургия: настоящее и возможные перспективы развития метода//Тезисы доклада международной конференции: Новые возможности и перспективы развития эндоскопической хирургии. — С.-П. 1995.- с. 83 – 84.
7. Aaronson N.K. et al Evaluation of breast conserving therapy: clinical methodological and psychosocial perspectives//Europ. J. Surg. Oncol.- 1988.- Vol.14 – p. 133 – 140.
8. Chao C., Wong S. L., Woo C. et al. Reliable lymphatic drainage to axillary sentinel lymph nodes regardless of tumor location within the breast//Am.J.Surg.-Vol.182.-№4.-2001.
9. Cox С. Е., Salud C. J., Harrington M. A. The role of selective sentinel lymph node dissection in breast cancer// Surg. Clin. North Am.-Vol.80.- №6-2000.
10. Goldhirch A., Glick G.H., Gelber R. D. et al. Meeting highlights: International Consensus Panel on the Treatment of Primary Breast Cancer//J. Clin. Oncol.- 2001.- Vol. 19.- P. 3817-3827.
11. Leung J.W.T. New modalities in breast imaging: digital mammography, positron emission tomography, and sestamibi scintimammography// Radiologic Clinics of North America.- Vol. 40.-№ 3.-2002.
12. Ogawa Y., Ishikawa T., Ikeda K., The thoracoscopic approach for internal mammary nodes in breast cancer//Surg. Endosc. — 14(12). — 2000. — P.1149-1152.
13. Urban J.A. Extended radical mastectomy for breast cancer//Am. J. Cancer.- 1963.- Vol. 106., № 3. – p.399 – 344.
14. Veronesi U. Удаление парастернальных лимфатических узлов при раке молочной железы. Сообщение о 350 случаях//Труды VIII международного противоракового конгресса. — М., 1963. Т.1.- с. 389 – 391.
15. Weatheford D., Stephenson J., Taylor S., Blackhurst D. Thopracoscopy versus thoracotomy: indications and advantages//Am. Surg.- 1995.- Vol. 61.- p.83 – 86.
rosoncoweb.ru
Периферические лимфоузлы
Патологические процессы в периферических лимфоузлах организма – один из вероятных признаков внутренней патологии. Более 80% людей в течение жизни сталкивались с воспалением лимфатических узлов при острых респираторных инфекциях. Реакция иммунной системы с воспалением или разрастанием лимфоидной ткани свидетельствует о серьезных системных или местных заболеваниях. Грамотный подход к пальпации и оценке состояния лимфоузлов при клиническом осмотре позволяет определить правильную диагностическую тактику.
Какие лимфатические узлы считаются периферическими
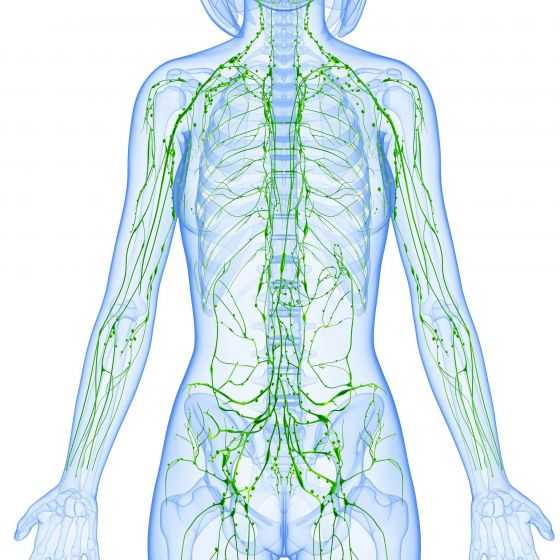
Расположение органов лимфатической системы в человеческом организме (фото: www.youtube.com)
Иммунная система человека обеспечивает специфическую и неспецифическую защиту организма от проникновения инфекционных возбудителей и развития патологических процессов. В создании активного и пассивного иммунитета принимают участие различные структуры, которые разделены на две группы:
- Центральные органы иммуногенеза: красный костный мозг и тимус (вилочковая, загрудинная железа) – которые принимают участие в непосредственном синтезе иммунокомпетентных клеток (лейкоциты, Т-лимфоциты).
- Периферические органы: лимфатическая система, в которой происходит дифференцирование клеток, синтезированных в костном мозге. Особенностью данного процесса считается приобретение клеткой способности уничтожать каждый конкретный тип «антигена».
Чаще всего в клинике проводится оценка иммунной функции организма через структуры лимфатической системы. К последней относятся мелкие сосуды (капилляры), лимфатические протоки и узлы, которыми перекрывается ход сосудов.
Лимфатические узлы расположены по всему организму и, чаще всего, сопровождают кровеносные сосуды или находятся у «ворот» органов (печень, легкие, селезенка). В зависимости от расположения различают:
- Внутренние: находятся у корня брыжейки, около печени, почек, сердца и легких. Оценка состояния этих структур проводится во время инструментальных методов исследования, поскольку костный каркас грудной клетки или шар кожи и подкожной клетчатки на животе.
- Периферические: расположенные поверхностно в области головы, шеи, верхних и нижних конечностей (поднижнечелюстные, аксиллярные, паховые и др.). Особенности локализации данных групп лимфоузлов делают их доступными пальпаторному исследованию.
Важно! Пальпация периферических лимфатических узлов – один из наиболее распространенных методов клинического исследования пациентов
Группы периферических лимфоузлов: локализация и характеристика
Лимфатические узлы представляют собой небольшие округлые образования из неоднородной лимфоидной ткани, заключенной в капсулу. К данной структуре подходит несколько лимфатических сосудов, доставляющих лимфу (производное плазмы) для фильтрации. Ретикулярная (сетеобразная) структура ткани узла позволяет проводить «фильтрацию» патологических частиц, что препятствует проникновению последних в системный кровоток.
Классификация и область дренажа периферических лимфоузлов представлены в таблице:
|
Область тела |
Группа лимфоузлов |
Зона лимфотока |
|
Голова и шея |
|
|
|
Верхняя конечность |
|
|
|
Нижняя конечность |
|
|
Важно! Во время клинического обследования врачи также пальпируют мезентеральные лимфоузлы, расположенные в брюшной полости
Количество лимфоузлов каждой группы индивидуально, в среднем 3-4 узла. При пальпации образования безболезненны, подвижны, не спаяны между собой и с окружающими тканями, мягко-эластической консистенции.
Методы исследования периферических лимфоузлов
Методика пальпации поднижнечелюстных лимфоузлов (фото: www.mrt-rentgen.ru)
Оценка состояния поверхностно расположенных лимфатических узлов проводится по такому алгоритму:
- Осмотр области лимфатического узла: наличие отека тканей, деформации контуров области, патологических выпячиваний, сыпи, или покраснения кожи.
- Пальпация – обследование с помощью прощупывания структур через кожу. Техника пальпации отличается для каждой группы лимфоузлов.
Затылочные пальпируются на задней поверхности шеи у места прикрепления трапециевидной мышцы. Поднижнечелюстные – при заведении 3-х пальцев под край нижней челюсти при наклоне головы вперед.
Подмышечные – пальцы заводятся в подмышечную ямку при отведенной руке, а непосредственно пальпация – при опущенной руке вниз.
Паховые – пальпируются у медиальной части паховой связки. Подколенные – по задней поверхности ноги, согнутой в колене.
- Ультразвуковое исследование (УЗИ) – инструментальный не инвазивный метод визуализации структуры лимфатического узла при подозрениях на патологический процесс. Позволяет оценить плотность, структуру и отношение органа к соседним тканям.
- Компьютерная томография (КТ) – рентгенологический метод, который чаще всего применяется для диагностики патологии, вызвавшей изменения в лимфатических узлах.
- Биопсия – забор части или целого лимфоузла для лабораторной диагностики (проводится как самостоятельное исследование или часть операции по удалению пораженной структуры). Данный метод используется в диагностике злокачественных новообразований с метастазированием в лимфоидную ткань.
Важно! Пальпация аксиллярных лимфатических узлов у женщины проводится в первую фазу менструального цикла, поскольку гормональные изменения влияют на состояние молочной железы и подмышечных лимфоузлов
Патологии периферических лимфатических узлов
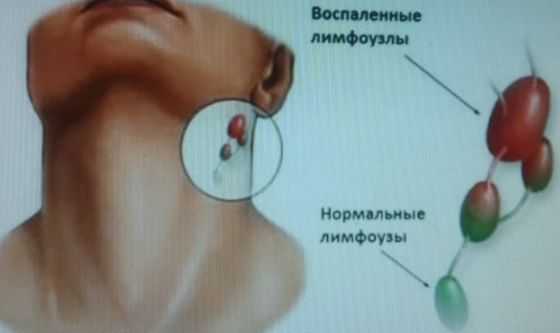
Сравнительный рисунок нормального и воспаленного лимфоузла (фото: www.lechiprirodoyu.ru)
Изменения, возникающие в лимфатических узлах чаще всего – вторичные, вызванные реакцией организма на патологический процесс. В зависимости от особенностей основного заболевания и патоморфологических изменений в структуре лимфатических узлов, различают такие патологии:
- Воспаление (лимфаденит) – состояние, которое характеризуется усиленным кровотоком, отеком, увеличенными размерами и болезненностью лимфоузла. Лимфаденит возникает вследствие гнойных или серозных воспалительных процессов в зоне лимфодренажа определенной группы. После выделения медиаторов, усиливается кровообращения в пораженном участке. Части отмершей ткани проникают в лимфатические капилляры, после чего – в узлы, где задерживаются лимфоидной тканью и вызывают воспаление (в зависимости от морфологического субстрата – гнойное или серозное).
- Кальциноз – отложение солей кальция в лимфоидной ткани узла. Данный процесс чаще всего развивается на фоне хронического воспалительного процесса, например, при туберкулезе.
- Гиперплазия (лимфаденопатия) – увеличение органа в размерах без признаков воспаления. Разрастание лимфоидной ткани чаще всего развивается при неконтролируемом размножении клеток (при злокачественных процессах или метастатическом поражении).
Осложненные варианты лимфаденита способствуют развитию нежелательных последствий: абсцесса (формирование гнойной полости) или свища – образования патологического соединения лимфоидной ткани с наружной средой или полым органом. Особенностью данных состояний является обязательное хирургическое вмешательство и интенсивная антибиотикотерапия.
Какие специалисты занимаются патологиями периферических лимфоузлов
С целью эффективной диагностики и назначения адекватной терапии необходима консультация специалистов. Общим осмотром и пальпацией периферических лимфатических узлов занимаются врачи всех профилей, однако наличие специфических симптомов требует обращения к следующим:
- Терапевт, оториноларинголог (ЛОР), пульмонолог – при увеличении лимфоузлов головы и шеи с анамнезом острой респираторной вирусной инфекции (ОРВИ), боли в горле, повышенная температура, кашель и общая слабость.
- Фтизиатр – при увеличении любой из групп лимфоузлов (или нескольких сразу) на фоне длительного кашля (более 2-х месяцев), невысокой температуры 37-38 ̊С и контакта с больным в анамнезе.
- Хирург – при высокой температуре, покраснении кожи в области лимфоузла, интенсивных болях и наличии гнойных ран или травм, заболеваниях молочной железы.
- Гинеколог, уролог – при болях в малом тазе, нарушении мочеиспускания, патологических изменениях прозрачности и цвета мочи, выделений из половых органов.
В случае невыясненной причины увеличения лимфатического узла в размерах, на фоне длительного процесса и неспецифических симптомов (слабость, утомляемость, похудение) рекомендуется консультация онколога с целью исключения злокачественных новообразований.
simptomyinfo.ru