Блог в Центральной поликлинике Литфонда
О.А.Романова, Н.Г.Артемьева, Ю.А. Сотникова.
Меланома кожи – довольно редкая злокачественная опухоль, которая возникает из меланоцитов эпидермиса. Опухоль отличается поздней диагностикой и высокой смертностью, что диктует необходимость направить усилия на выявление и удаление предшественников меланомы – диспластических невусов. Эти невусы, впервые выделенные Кларком в 1978 году, характеризуются наличием лентигинозной меланоцитарной дисплазии (ЛМД), с которой связана их способность к трансформации в меланому. В 1982 году Гольберт З.А выделила 3 степени ЛМД и показала, что 3-я степень дисплазии приближается к меланоме in-situ.
В ЗАО «Центральная поликлиника Литфонда» с 2009 по январь 2020 года удалено 178 пигментных образований с клиническим диагнозом прогрессирующий диспластический невус (ЛМД 3 степени). Пациенты направлялись к онкологу терапевтами, дерматологами и другими специалистами поликлиники.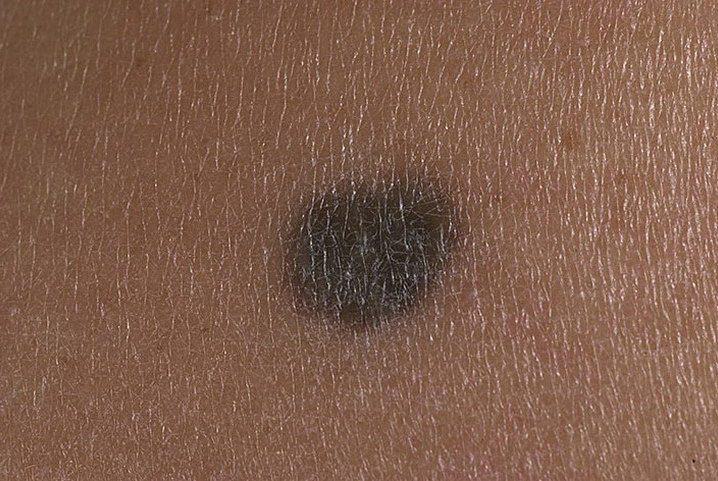
При гистологическом исследовании выявлено 133 диспластических невуса, из которых в 28 случаях установлена ЛМД 3 степени (15,7%).У 17 больных (9,5%) выявлена ранняя меланома, развившаяся в 7 случаях на фоне ЛМД.
Авторы полагают, что врачи поликлиник должны активно выявлять прогрессирующие диспластические невусы (ЛМД 3 степени), удаление которых будет в итоге способствовать профилактике и раннему выявлению меланомы, и снижению смертности от этого заболевания.
Меланома кожи – злокачественная опухоль, берущая начало из меланоцита эпидермиса, клетки нейро-эктодермального происхождения. В большинстве случаев опухоль поражает кожу, хотя может встречаться на слизистых влагалища, прямой кишки, полости рта, в оболочках глаза.
В 70-е годы прошлого столетия симптомами этой злокачественной опухоли считались изъязвление и кровотечение, которые, как оказалось в дальнейшем, свидетельствуют о поздней стадии заболевания.
Ранняя диагностика в наши дни стала основным оружием в борьбе с этим заболеванием. В Австралии и США благодаря ранней диагностике смертность от меланомы снизилась до 10 – 15 %. В России смертность от меланомы по-прежнему остается высокой, что связано с поздней диагностикой опухоли. По данным МНИОИ им. П.А.Герцена в 2018 году заболеваемость меланомой кожи составила 7,76, смертность – 2,53 на 100 000[1].
Большинство меланом (70%) на первых этапах развивается в пределах эпидермиса (фаза горизонтального роста), а затем прорастает в дерму (фаза вертикального роста) [2,3]. Оставаясь в пределах эпидермиса, меланома пока еще не способна давать метастазы, поскольку путями их распространения служат кровеносные и лимфатические сосуды, расположенные в дерме.
Меланома может возникать как на неизмененной коже, так и на фоне различных типов меланоцитарных дисплазий, таких, как меланоз Дюбрея и диспластический невус. Согласно статистике, на фоне диспластического невуса развивается 30% спорадических и 90% семейных меланом [3].
Диспластический невус – предшественник меланомы. Диспластические невусы (синоним – невусы Кларка, лентигинозная меланоцитарная дисплазия) были выделены Кларком с соавторами в 1978 году как вариант приобретенных меланоцитарных невусов, которые характеризуются повышенным риском малигнизации вследствие сохранения пролиферативной активности незрелых меланоцитов в эпидермисе [4]. Диспластические изменения меланоцитов можно рассматривать как последовательные этапы нарастания атипии, вплоть до развития меланомы. Патоморфолог Гольберт З.В. с соавторами в 1982 году выделила 3 степени лентигинозной меланоцитарной дисплазии (ЛМД) и показала, что 3 степень дисплазии приближается к меланоме in-situ [5].
Диспластические невусы так же, как и обычные невусы представляют собой пигментные пятна или слега возвышающиеся образования с плоским компонентом, но отличаются от обычных характером развития. Обычные невусы, как правило, появляются в детстве и проходят этапы развития от пограничного и смешанного до внутридермального и в дальнейшем превращаются в фиброзную папулу. Диспластические невусы появляются позже – в подростковом периоде а также в последующей жизни, они могут быть внутриэпидермальными и смешанными, но никогда не превращаются во внутридермальные и не фиброзируются. Количество диспластических невусов может быть различным– от нескольких образований до 100 и более, рассеянных по всему кожному покрову с предпочтительной локализацией на туловище. Большинство диспластических невусов имеют один или несколько клинических признаков ABCDE (асимметрия формы, неровные края, неравномерная окраска, размеры 0,4 см и более, изменения невуса на протяжении 1-5 лет), которые косвенно отражают неравномерную пролиферацию меланоцитов эпидермиса.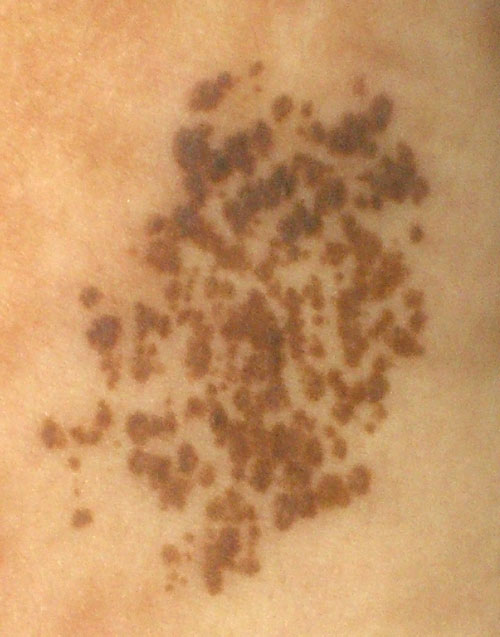
Диспластические невусы в подавляющем большинстве остаются стабильными в течение всей жизни или регрессируют, но в отдельных случаях могут трансформироваться в меланому. Причины трансформации невуса в меланому точно не установлены, но известно, что определенную роль в патогенезе меланомы играет ультрафиолетовое облучение. За всеми диспластическими невусами необходимо наблюдение, а прогрессирующие диспластические невусы (ЛМД 3 степени, тяжелая дисплазия) — подлежат удалению.
В ЗАО «Центральная поликлиника Литфонда» мы с 2009 года удаляем пигментные образования, которые имеют клиническую симптоматику прогрессирующего диспластического невуса — выраженные признаки ABCDE [7,8].
Всего с 2009 года по январь 2020 года было удалено 178 пигментных образований. При гистологическом исследовании в 133 случаях подтвержден диспластический невус, в том числе в 28 (15,7%) случаях установлен прогрессирующий диспластический невус — ЛМД 3 степени. В 17 (9,5%) случаях выявлена ранняя меланома, из них в 7 случаях – меланома in-situ, в остальных – инвазивная меланома толщиной 1 мм и менее, с уровнем инвазии – 2-3.
Наш опыт показывает, что прогрессирующий диспластический невус может иметь 1, 2 или 3 признака ABCDE. Подозрение обычно вызывает неравномерная, асимметричная окраска или наличие темных участков на фоне ровной окраски. Неровные, волнистые края также могут свидетельствовать о неравномерной пролиферации меланоцитов. Должны привлекать внимание крупные диспластические невусы — 0,8 см и более. Уже в начале наших наблюдений мы отметили, что изменения невуса, то есть признак «Е», является наиболее значимым признаком прогрессирующего диспластического невуса (7,8). Дальнейшие наблюдения подтвердили это предположение. Нам встречались невусы с выраженными признаками ABCD, которые оставались без динамики на протяжении последних 5 – 10 лет, при гистологическом исследовании в них обнаруживалась ЛМД 1 – 2 степени, то есть они были доброкачественными.
Необходимо иметь ввиду, что прогрессирующий диспластический невус и ранняя меланома имеют схожую клиническую симптоматику и только гистологическое исследование может установить диагноз меланомы [9]. Так из 178 удаленных образований с клиническим диагнозом «прогрессирующий диспластический невус» в 17 случаях выявлена ранняя меланома, что составило 9,5 %.
Необходимо отметить, что до настоящего времени врачи первичного звена чаще обращают внимание на выпуклые пигментные невусы и не замечают плоские, которые как раз и являются подозрительными в отношении прогрессирующих диспластических невусов. Нередко диспластические невусы располагаются на видных местах (грудная стенка, спина) и вполне могут быть вовремя замечены врачами первичного звена, если последние будут знать симптомы данного образования. Задача состоит в том, чтобы как можно больше врачей первичного звена были знакомы с этой проблемой. Необходимо иметь ввиду, что больные с множественными диспластическими невусами должны наблюдаться онкологом или дерматологом, имеющим опыт диагностики меланомы кожи, так риск развития меланомы у них очень высок и при наличии меланомы у родственников достигает 90% — 100%.
Задача состоит в том, чтобы как можно больше врачей первичного звена были знакомы с этой проблемой. Необходимо иметь ввиду, что больные с множественными диспластическими невусами должны наблюдаться онкологом или дерматологом, имеющим опыт диагностики меланомы кожи, так риск развития меланомы у них очень высок и при наличии меланомы у родственников достигает 90% — 100%.
Для выявления образований, подозрительных на прогрессирующий диспластический невус, желательно иметь перед глазами памятку с изображением диспластических невусов и ранних меланом. При наличии образований, подозрительных на прогрессирующий диспластическимй невус больного необходимо направить на консультацию к онкологу или дерматологу, при отсутствии указанных специалистов — к хирургу для выполнения эксцизионной биопсии.
Учитывая тяжелый прогноз запущенной меланомы кожи, выявление предшественников этой опухоли — прогрессирующих диспластических невусов должно стать обязанностью всех врачей первичного звена. Удаление этих образований будет способствовать профилактике, а также ранней диагностике меланомы, что в итоге приведет к уменьшению смертности от этого заболевания.
Удаление этих образований будет способствовать профилактике, а также ранней диагностике меланомы, что в итоге приведет к уменьшению смертности от этого заболевания.
Ниже приведены фото прогрессирующих диспластических невусов (ЛМД 2-3 степени) – предшественников меланомы.
Фото 1. Множественные диспластические невусы туловища у женщины 45 лет. В анамнезе – удаление диспластического невуса с ЛМД 2 степени.
Фото 2. Средний диспластический невус правой ягодичной области 0,4 х 0,3 см у женщины 22 лет, появился 6 месяцев назад в виде точечного образования. Обращает на себя внимание черный цвет и неровные края невуса. Гистологическое исследование – ЛМД 2 степени.
Фото 3. Средний диспластический невус правой ягодичной области 0,5 х 0,4 см у женщины 29 лет, появился 7 месяцев назад. Обращает на себя внимание черный цвет и смазанный нижний край. Гистологическое исследование – ЛМД 3 степени.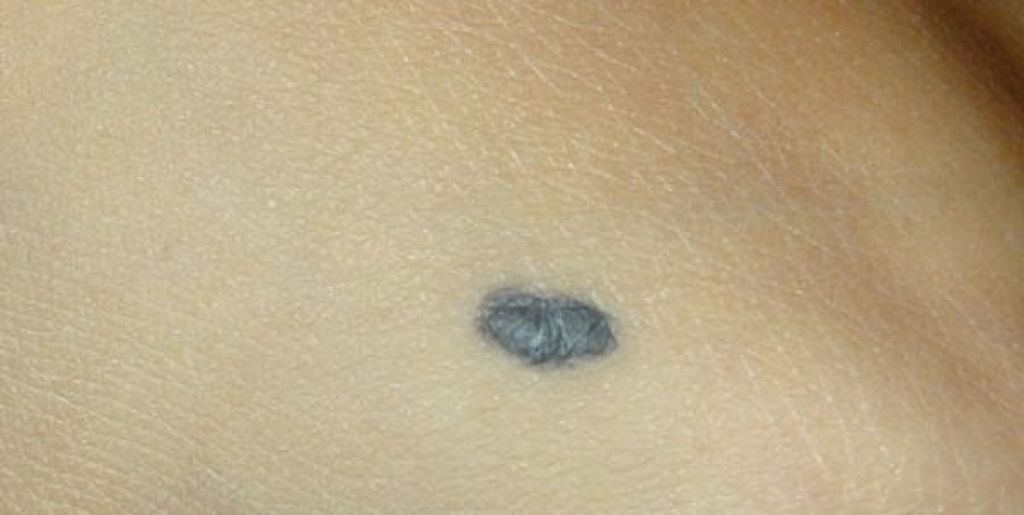
Фото 4. Крупный диспластический невус поясничной области слева 1,0 х 0,5 см у женщины лет 39 лет, появился около 1 года назад. Отмечается неправильная, асимметричная форма невуса, волнистые края, большие размеры – более 0,8 см. Гистологическое исследование – ЛМД 2 – 3 степени.
Фото 5. Крупный диспластический невус межлопаточной области 1,0 х 0,7 см у женщины 40 лет, увеличился за последние 8 месяцев. Обращают на себя внимание размеры – более 0,8 см, неравномерная, асимметричная окраска невуса. Гистологическое исследование – ЛМД 2 степени.
Фото 6.Крупный диспластический невус левой лопаточной области 1,0 х 0,5 см у женщины 44 лет, появился около 7 лет назад, медленно увеличивался. Обращает на себя внимание неправильная форма, большие размеры невуса, черный цвет. Гистологическое исследование – ЛМД 3 степени.
Литература.
1. А.Д. Каприн, В.В. Старинский, Г. В.Петрова Злокачественные новообразования в России в 2018году (заболеваемость и смертность). Москва 2019. [ A.D.Kaprin, V.V.Starinskiy, G.V.Petrova. ZlokachestvennienovoobrazovaniyavRossiiv 2018 godu..Moscow,2015. (InRuss)].
В.Петрова Злокачественные новообразования в России в 2018году (заболеваемость и смертность). Москва 2019. [ A.D.Kaprin, V.V.Starinskiy, G.V.Petrova. ZlokachestvennienovoobrazovaniyavRossiiv 2018 godu..Moscow,2015. (InRuss)].
2. О.А.Романова.Ранняя диагностика и профилактика меланомы кожи. Руководство-атлас,МИА, Москва, 2012, 22-25.[O.A.Romanova.Ranniyadiagnostikaiprofilaktikamelanomakogi.Guide-Atlas, MIA, Moscow,2012,22-25 (In Russ)].
3.ФицпатрикТ., ДжонсонР., ВульфК., ПоланоМ., СюрмондД. «Диспластическийневус». Дерматология, атлас — справочник, 1999, стр.190- 194. [T.B.Fitzpatrick, R.A.Jonson, K.Wolff, K.Polano, D.Suurmond. DisplasticNevus. Dermatology. Color Atlas and Synopsis of Clinical Dermatology. Third Edition, 1999, p 190 -194].
4. ClarkW.H., ReimerR.R., GreeneM., AinsworthA.M., MastrangeloM.J. « Origin of Familial Malignant Melanomas from Heritable Melanocytic Lesions. The B – K mole Syndrom». Archives of Dermatology, 1978. vol. 114, № 5, 732-739.
vol. 114, № 5, 732-739.
5. ГольбертЗ.В., ЧервоннаяЛ.В., КлепиковВ.А., РомановаО.А. « Лентигинознаямеланоцитарнаядисплазиякакпредшественникразвитиязлокачественноймеланомы». Архивпатологии , 1982;12: 36 — 41. [Golbert Z.V., Chervonnaya L.V., Klepikov V.A., Romanova O.A. Lentiginous melanocityc dysplasia as a precursor of malignant melanoma. Arkhivpatologii,1982,12, 36 – 41 (InRuss)].
6 .Л.В.Червонная. Пигментные опухоли кожи, Издательская группа ГЕОТАР – Медиа, Москва. 2016, стр. 71 – 86. [L.V. Chervonnaya. Pigmentnieopukholikogi Moscow, 2016, 71-86 (In Russ)].
7. Романова О.А., Артемьева Н.Г. Хирургическая профилактика меланомы кожи. Онкохирургия, 2013; 3: 12-18.[RomanovaO.A., ArtemievaN.G. Surgicalpreventionofcutaneousmelanoma. Onkokhirurgiya,, 2013,№ 3,p 12-18 (InRuss)].
8. О.Романова. Н.Г.Артемьева, М.Г.Солохина. ПризнакиABCDЕвдиагностикедиспластичекогоневусаспризнакамипрогрессированияиначальноймеланомы. Лечащийврач, 2016; 9: 92.[O.A. Romanova, N. G. Artemieva, M. G. Solokhina. Signs of ABCDE in the diagnosis of dysplastic nevus with signs of progression and initial melanoma. Lechashiy vrach, 2016; 9: 92 – 95 (In Russ)].
Лечащийврач, 2016; 9: 92.[O.A. Romanova, N. G. Artemieva, M. G. Solokhina. Signs of ABCDE in the diagnosis of dysplastic nevus with signs of progression and initial melanoma. Lechashiy vrach, 2016; 9: 92 – 95 (In Russ)].
9. О.А.Романова, Н.Г.Артемьева, М.Г.Солохина, В.Н.Марычева, А.А.Вещевайлов, С.А.Купчиков. Клинико-морфологические параллели в диагностике прогрессирующего диспластического невуса и ранней меланомы кожи.Онкология, 2019, №1, 26 – 31. [O. A. Romanova, N. G. Artemieva, M. G. Solokhina, V. N. Marycheva, A. A. Veschevailov, S. A. Kupchikov. Clinical and morphological parallels in the diagnosis of progressive dysplastic nevus and early skin melanoma.Onkologiya, 2019, №1, 26 – 31 (In Russ)].
Опубликовано с метками:
Поделиться записью:
Онкология: Невус — диагностика и лечение в СПб, цена
Все новообразования кожи, синтезирующие пигмент меланин, происходят из одной общей клетки – меланоцита. Невус — это новообразование меланоцитарного происхождения, имеющее доброкачественный характер. Обыватели невус именуют «РОДИНКОЙ». Обобщая их разновидности, можно выделить основные виды: простой невус, ювенильный невус, голубой невус, Саттон невус, врождённый гигантский невус, диспластический невус, невус Рида, меланоз Дюбрейля.
Невус — это новообразование меланоцитарного происхождения, имеющее доброкачественный характер. Обыватели невус именуют «РОДИНКОЙ». Обобщая их разновидности, можно выделить основные виды: простой невус, ювенильный невус, голубой невус, Саттон невус, врождённый гигантский невус, диспластический невус, невус Рида, меланоз Дюбрейля.
Давайте теперь более подробно рассмотрим хотя бы часть из них, наиболее часто встречающиеся и занимающие наши мысли, а главное, рождающие вопросы.
Простой невус
Наиболее частое из всех пигментообразующих образований кожи. Он видоизменяется по мере старения организма. В детском возрасте он обычно плоский и цветной (различные оттенки коричневой окраски). После 30-35 лет невус, как правило, начинает увеличиваться и по площади, и в высоту, а также, что немаловажно, теряет свою яркую окраску, приобретая телесный цвет. Визуально же, мы с вами в зеркале с возрастом отмечаем перерождение коричневого пятнышка в плотное, объёмное образование телесного цвета, иногда в виде «тутовой ягоды». Такие невусы чаще всего удаляют только из косметических соображений, либо из-за постоянной травматизации в случае их больших размеров или уязвимой локализации.
Такие невусы чаще всего удаляют только из косметических соображений, либо из-за постоянной травматизации в случае их больших размеров или уязвимой локализации.
Чаще всего, при гистологическом исследовании, мы с вами видим не просто термин «простой невус», а различные варианты его: интрадермальный, сложный, смешанный, пограничный и т.д…. Эти термины зависят от расположения невусных клеток в структурах кожи. Простой невус можно удалять как лазером, так и радиоволновым скальпелем или электрокоагуляцией. Вариантов предостаточно, и выбор зависит от того, каким вариантом техники владеет Ваш врач.
Используются:
-
Лазер Аппарат «Латус».
-
Радиоволновой метод аппарат «Сургитрон».
-
Электрокоагулятор.
Голубой невус
Очередной интересный вид невусов – голубой. Описан впервые ещё в 1906 году. Как его только не «обзывали» — и «доброкачественная меланома» и «меланосаркома с лучшим прогнозом». Однако дальнейшее исследование доказали, что это всего лишь – невус.
Как его только не «обзывали» — и «доброкачественная меланома» и «меланосаркома с лучшим прогнозом». Однако дальнейшее исследование доказали, что это всего лишь – невус.
Данный вид невусов единственный не связан с эпидермисом и залегает в дерме (глубоко в коже). Так как меланоциты в этом невусе очень активны, они продуцируют столько пигмента, что он, просвечивая сквозь толщу дермы, создаёт такой оптический эффект, что мы видим с вами голубой цвет кожи над поверхностью невуса.
Голубому невусу все возрасты покорны, но чаще всего он определяется у женщин, преимущественно на лице, кистях, стопах. Визуально мы с вами определяем в коже либо пятно, либо бляшку, выбухающую из толщи голубого, а то и синего цвета. Поверхность кожи над невусом не изменена, но волос мы не увидим. Размеры образования до 1.5 см. Крайне редко из голубого невуса возникают меланомы. Но! Из — за схожести клинической картины меланомы и голубого невуса их предпочитают удалять. Помогут в диагностике сроки возникновения. Чем дольше история развития, тем больше вероятность, что это голубой невус. Он может существовать десятками лет без какой-либо динамики. Так как голубой невус лежит глубоко, удаляют его хирургическим путём.
Чем дольше история развития, тем больше вероятность, что это голубой невус. Он может существовать десятками лет без какой-либо динамики. Так как голубой невус лежит глубоко, удаляют его хирургическим путём.
Невус Саттона (гало — невус)
Наиболее часто диагностируется у детей. Имеют характерную клиническую картину: вокруг пигментного пятна с течением времени начинает появляться белесоватый (депигментированный) венчик. Этот венчик растёт, а пятно уменьшается, до полного его исчезновения со временем. Саттон — невус чаще всего локализуется на коже туловища и конечностей. Пациенты иногда могут даже иметь субъективные ощущения в зоне венчика — чувство распирания и зуд. Почему? А потому, что в этой области формируется массивный инфильтрат из иммунных клеток. Клетки невуса в этой области поглощаются иммунокомпетентными клетками — так происходит самопроизвольная резорбция пигментного невуса (это иммунная реакция организма на невус). В 1972 году была статья Lewis и Copeman, которые расценили этот феномен как синдром «крушения» развития меланомы в начальной стадии — как выраженный иммунный ответ организма. Однако, дальнейшиих полномасштабных исследований не проводилось.
Однако, дальнейшиих полномасштабных исследований не проводилось.
В любом случае — невус Саттона — новообразование доброкачественное, удалять его не надо, потерпите — само пройдёт. Пройдет время и белесоватое пятно приобретет цвет обычной кожи и не будет выделяться по цвету.
Ювенильный невус
Очень редко может встречаться у взрослых, обычно его диагностируют у детей, потому он и называется ювенильный.
Клиническая картина: визуально напоминает бляшку с розовато-красным оттенком коричневого цвета. Чёткий контур, диаметром до 0.8 см в большинстве случаев. Кожный рисунок на поверхности невуса сохранен. При травме невуса возникает бурая корка. Чаще всего располагается на коже лица, крайне медленно растёт. Не является меланомоопасным. Хотя в названиях, в интернете, мы часто видим термин ювенильная меланома. Это название связано с трудностями гистологической диагностики — их выраженной схожести. В случае, когда специалист сомневается в диагнозе целесообразно удаление данного невуса с обязательной гистологической верификацией. Хотя, учитывая возраст и клиническую картину, чаще всего эти новообразования просто динамически наблюдаются.
Хотя, учитывая возраст и клиническую картину, чаще всего эти новообразования просто динамически наблюдаются.
Меланомоопасные невусы
Помимо часто встречающихся невусов, которые можно просто наблюдать, существуют и меланомоопасные невусы — их нужно не столько наблюдать, сколько удалять для исследования. В связи с этим и особое к ним отношение. Кто предубеждён, тот предупреждён. Группа пациентов с данными диагнозами нуждается в профилактическом удалении этих образований. В случае множественного характера — постоянное динамическое наблюдение. Давайте рассмотрим их подробнее.
Из всех доброкачественных меланоцитарных образований предшественниками меланомы можно назвать 3 вида невусов:
-
Меланоз Дюбрейля. Данное образование появляется у пожилых людей и лиц старческого возраста, чаще у женщин на открытых участках тела. Клиническая картина представлена в виде желтовато-коричневого пятна с равномерным окрасом всей поверхности.
 Крайне медленно, в течение многих лет оно увеличивается по площади, приобретая все более размытые очертания, приобретая пестроту (полихромию) в окраске — коричневые, серые, белесоватые цвета. На фоне этого пятна, иногда прослеживается единичный волосяной покров. Однако в 30-40 % случаев происходит озлокачествление этого пятна и переход из меланоза в меланому… Визуально, мы с вами это определим по появлению бляшек более тёмного цвета и более плотной консистенции на поверхности пятна. С момента появления желтоватого пятна до развития меланомы может пройти несколько десятков лет. Но, в связи с ухудшением экологической ситуации на планете, появление меланоза Дюбрейля всё чаще регистрируется у лиц среднего возраста. Это заболевание требует хирургического лечения, но при больших размерах иногда ставится вопрос о проведении близкофокусной рентгентерапии.
Крайне медленно, в течение многих лет оно увеличивается по площади, приобретая все более размытые очертания, приобретая пестроту (полихромию) в окраске — коричневые, серые, белесоватые цвета. На фоне этого пятна, иногда прослеживается единичный волосяной покров. Однако в 30-40 % случаев происходит озлокачествление этого пятна и переход из меланоза в меланому… Визуально, мы с вами это определим по появлению бляшек более тёмного цвета и более плотной консистенции на поверхности пятна. С момента появления желтоватого пятна до развития меланомы может пройти несколько десятков лет. Но, в связи с ухудшением экологической ситуации на планете, появление меланоза Дюбрейля всё чаще регистрируется у лиц среднего возраста. Это заболевание требует хирургического лечения, но при больших размерах иногда ставится вопрос о проведении близкофокусной рентгентерапии.
-
Невус Рида. Впервые невус описан Ричардом Ридом в 1975 году, почему и назван в честь него.
 Обнаруживается обычно у детей в возрасте от 6 до 17 лет. Его излюбленная локализация на лице, шее и груди. Имеет единичный характер. Обычно выглядит как бляшка или пятно темно-коричневого цвета, мягко-эластической консистенции, поверхность его гладкая, блестящая. Довольно часто имеет более темный фестончатый край. По периметру невуса иногда можно увидеть розового цвета папулы или выступы в виде лучей. Диаметр невуса обычно не превышает 1 сантиметра. Довольно часто по периметру виден розовый венчик. Лечебная тактика при обнаружении этого образования достаточно однозначна — эксцизионная биопсия — это хирургическое удаление новообразования в пределах здоровых тканей и их гистологическое исследование.
Обнаруживается обычно у детей в возрасте от 6 до 17 лет. Его излюбленная локализация на лице, шее и груди. Имеет единичный характер. Обычно выглядит как бляшка или пятно темно-коричневого цвета, мягко-эластической консистенции, поверхность его гладкая, блестящая. Довольно часто имеет более темный фестончатый край. По периметру невуса иногда можно увидеть розового цвета папулы или выступы в виде лучей. Диаметр невуса обычно не превышает 1 сантиметра. Довольно часто по периметру виден розовый венчик. Лечебная тактика при обнаружении этого образования достаточно однозначна — эксцизионная биопсия — это хирургическое удаление новообразования в пределах здоровых тканей и их гистологическое исследование.
-
Диспластический невус. У него есть другие названия невус Кларка, либо лентигинозная маланоцитарная дисплазия и последнее, более современное название, клинически атипичный невус. Патология достаточно неоднозначная из-за сложности его дифференциальной диагностики.
 Этот невус диагностируют в более молодом и среднем возрасте у людей на туловище, обычно на закрытых участках кожи, как это не парадоксально. На вид это пятна, имеющие темно-коричневую окраску, неоднородную, но с четкими фестончатыми краями. Поверхность невуса обычно гладкая, может быть немного приподнятая, «зернистая». Как правило диспластические невусы имеют множественный характер, но бывают и единичные. Самое неприятное в этом диагнозе, что при наличии множественных диспластических невусов характерен высокий риск развития меланомы. Этот риск возрастает, если меланомы диагностировались у ближайших родственников.
Этот невус диагностируют в более молодом и среднем возрасте у людей на туловище, обычно на закрытых участках кожи, как это не парадоксально. На вид это пятна, имеющие темно-коричневую окраску, неоднородную, но с четкими фестончатыми краями. Поверхность невуса обычно гладкая, может быть немного приподнятая, «зернистая». Как правило диспластические невусы имеют множественный характер, но бывают и единичные. Самое неприятное в этом диагнозе, что при наличии множественных диспластических невусов характерен высокий риск развития меланомы. Этот риск возрастает, если меланомы диагностировались у ближайших родственников.
Важно
Сочетание меланомы с большим количеством (более 50-ти) диспластических невусов у самого пациента и наличие диспластических невусов у его ближайших родственников объединено в так называемый FAMMсиндром. Риск же появления меланомы на фоне множественных диспластических невусов у следующих поколений по разным литературным данным равен от 90 до 100%.
Поэтому, пациенты, имеющие более 50 невусов на коже и меланому у родственников должен наблюдаться у онколога всю жизнь. Почему? Потому, что очень часто невусы, визуально определяемые как диспластические, гистологически могут ими и не быть. Так и в обратном порядке — невусы удаляемые как сложные, смешанные, пограничные (варианты простого невуса) являются диспластическими при гистологическом исследовании.
Диспластический невус — это в первую очередь именно ГИСТОЛОГИЧЕСКИЙ диагноз.
Но, далеко не каждый диспластический невус перейдёт в меланому. По рекомендациям ВОЗ при множественном характере невуса целесообразно наблюдение и только в случае изменений невуса или его роста более чем на 1-2 мм в год следует его удалять. Удалять его следует с обязательным морфологическим исследованием и в пределах здоровых тканей. Лучше делать это в специализированном учреждении в виду большого числа ложноположительных гистологических диагнозов в связи с трудностями морфологической диагностики. Уж очень схожи диспластический невус и меланома.
Уж очень схожи диспластический невус и меланома.
Давайте подведём итог. Если мы видим с Вами признаки меланомоопасного невуса — то в этом случае его обязательно надо показать онкологу и рассмотреть возможность его удаления с морфологическим изучением патоморфологом. Если Ваш доктор сообщил при осмотре, что этот вид невуса, с которым вы обратились не является опасным, то удалять его следует когда он травмируется или с косметической целью.
Вопросы и ответы:
1. В чем причина превращения знакомой родинки в злокачественную опухоль?
-
Главной причиной все исследователи называют ультрафиолетовое излучение. Даже одно «обгорание» в жизни может запустить механизм появление той первой «злой» клетки. А уж солярий — это зло в квадрате для кожи.
-
Второй, но не менее важной причиной мы можем назвать травму невуса. Хроническую травму! Если вдруг, Вы травмировали (содрали, срезали, сковырнули) невус, это не повод для паники.
 Меланомы за сутки не образуются — это не пожар. Меланоме нужно достаточно много времени и условий для развития.
Меланомы за сутки не образуются — это не пожар. Меланоме нужно достаточно много времени и условий для развития.
-
К причинам мы можем с вами отнести еще и наследственность и плохую экологию. Рост заболеваемости меланомой растёт из-за плохой экологии, а мы с вами передаём мутации в генах нашим детям. Что же тут удивляться.
- Ведите здоровый образ жизни.
2.Есть ли разница между родинкой и невусом?
- Нет, это одно и то же… И в начале текста мы с вами это уже обсудили.
3. Нужно ли обращаться к специалисту, если родинок много?
- Нужно не только обращаться, но и наблюдаться постоянно у него.
4. В каком случае нужно обращаться к врачу?
-
В случае, если Вы заподозрили у себя меланомоопасный невус, либо саму меланому.

-
В случае травмы невуса, но не ранее 2-3 недель после травмы, чтобы специалист увидел реальную картину невуса, а не воспаление на месте травмы.
5. Родинка отвалилась сама, опасно ли это?
- Родинки сами не отваливаются. При кератомах, иногда при повреждении фрагменты бляшки могут отваливаться. Так что, нет, это не опасно.
6. Нужно ли удалять родинки?
- Нужно, если это меланомоопасный невус, нет, если подозрений он не вызывает. В любом случае, прежде, чем удалить родинку — проконсультируйтесь у специалиста дерматоонколога, чтобы по незнанию не удалить меланому — неадекватно и несвоевременно.
7. Можно ли самостоятельно определить опасны ли Ваши родинки ?
- Нет, это не возможно…Только имея диплом врача, большой опыт, знания, ну и конечно дерматоскоп.

8. Какие родинки самые опасные — большие, выпуклые, тёмного цвета?
- Нет, иногда, на теле много больших и выпуклых, а врач Вам скажет — ерунда. Зато обратит внимание на маленькую и плоскую родинку, светло -коричневого цвета. Жизнь вообще штука сложная, а наши болячки крайне многолики. Поэтому без словаря (онколога) разобраться очень сложно.
Лечение диспластического меланоцитарного невуса в Москве. Цены. Отзывы. Фото. Удаление невуса Кларка лазером.
Ультразвуковое диагностическое сканирование – хорошо известная и отработанная методика, которая в настоящее время составляет более 1/3 объема всех диагностических процедур в медицинской практике. Современные приборы уже достаточно просты в применении и доступны для многих клиник.
Однако в дерматологии эти исследования ранее не применялись, что было связано с трудностью технического решения данной задачи. В обычных приборах датчики имеют частоту 3-10 МГц, при которой было невозможно получить изображение структур эпидермиса, дермы и гиподермы.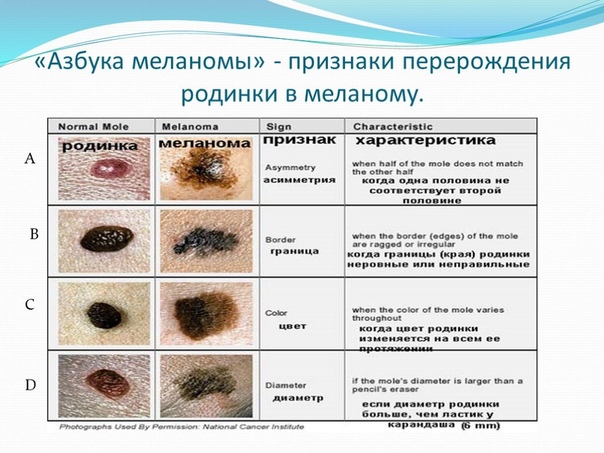
Немецкая компания TPM создала уникальные приборы с частотой датчиков 20-100 МГц. Такая методика называется цифровой ультразвуковой визуализацией высокого разрешения с возможностью изучения наиболее поверхностных слоев кожи.
По материалам исследований, проведенным при помощи аппарата DUB TPM (список прилагается отдельно), опубликовано множество статей и 2 монографии.
До настоящего времени основным методом изучения морфологии кожи было гистологическое и патоморфологическое исследование. Эта методика довольно трудоемкая и затратная, кроме того, исследуется биоптат, уже обработанный различными химическими реагентами.
Ультразвуковая диагностика кожи заполняет пробел, который существовал ранее между наружными методами исследований и гистологией, так как этот неинвазивный метод позволяет изучать кожу in vivo.
Значение ультразвукового сканирования для диагностики кожи трудно переоценить. Этот метод обладает целым рядом неоспоримых преимуществ – неинвазивность, безболезненность, безопасность и высокая точность измерений. Все исследования проводятся без повреждения тканей и могут повторяться на одном и том же участке кожи многократно.
Все исследования проводятся без повреждения тканей и могут повторяться на одном и том же участке кожи многократно.
Новый инструмент, позволяет увидеть срез кожи и подкожно-жировой клетчатки до мышечной фасции. Мы можем исследовать кожу в различные интервалы времени, документируя все особенности. Данные оцифровываются и помещаются в базу данных. Легко проводится сравнительный анализ снимков полученных в динамике, изображения сохраняются на любых цифровых носителях и данные передаются в общедоступных форматах через сеть Internet.
Ультразвуковое исследование кожи должно стать «золотым стандартом» в диагностике кожи, как в акушерстве, гинекологии и кардиологии.
Отличительные особенности системы DUB
- TPM впервые разработала и освоила серийный выпуск УЗ для кожи, а также установила стандарты ультразвукового исследования кожи во всем мире.
- Только аппараты DUB оснащаются датчиками с максимально высокой частотой до 100 МГц и разрешением до 8-10 мкм.
- Режимы сканирования A,B,C.

- Трехмерное сканирование.
- Кинопетля без ограничения длительности съемки.
- Оцифровка сигнала, следовательно, изображение более детальное и четкое.
- Цифровая обработка данных.
- Просмотр нескольких изображений полученных в разное время.
- Инновационные алгоритмы обработки изображений.
- Сохранение необработанных данных.
- Расширенный пакет программного обеспечения.
- Применение открытой системы с водой позволяет получать на 10-20% информации больше, чем использование системы с пленкой.
- В данный момент прибор не имеет аналогов во всем мире.
Возможности прибора:
- 1) Изучение состояния, структуры и размеров всех слоев кожи и кожных образований.
- 2) Углубленная диагностика морфологических и функциональных изменений при острых и хронических заболеваниях кожи, в том числе при рубцовых изменениях и липодистрофиях.
- 3) Оценка динамики состояния кожи в норме и патологии.
- 4) Облегчение диагностики малых высыпаний на коже.

- 5) Своевременная ранняя диагностика, так как с помощью ультразвукового сканирования можно не только выявить характерные признаки кожных проявлений на самых ранних стадиях, но и провести доклиническую диагностику, профилактику или своевременное лечение.
- 6) Диагностика состояний кожи в случае каких-либо трудно определяемых невооруженным глазом проявлений.
- 7) Визуализация, определение размеров, объема и глубины инвазии, а также оценка новообразований кожи и метастазов в кожу, выбор методов лечения, установка параметров и контроль эффективности.
- 8) Предоперационное измерение глубины распространения и объема опухолей при проведении хирургических вмешательств, в том числе и электрохирургии, криохирургии, лазерной или лучевой терапии.
- 9) Исследование возрастных изменений кожи.
- 10) Определение глубины, интенсивности и длительности лечебного воздействия, выбор метода.
- 11) Оценка эффективности и контроль терапевтических, физиотерапевтических и хирургических методов лечения, в том числе и косметологических процедур (например, таких как мезотерапия, пилинги, пластические операции, удаление татуировок, аппаратные процедуры и т.
 п.).
п.). - 12) Предварительная диагностика и оценка результатов введения филлеров, препаратов гиалуроновой кислоты, коллагена, синтетических или полусинтетических гелей и т.д.
- 13) Ранняя диагностика остеопороза.
- 14) Исследование эластичности кожи.
- 15) Исследование слизистых оболочек.
Преимущества использования этого метода:
- 1) Неинвазивная методика визуализации внутренних структур кожи in vivo, которая позволяет получать важную информацию, недоступную при других методах исследования.
- 2) Метод незаменим для оценки динамики состояния кожи в дерматологии, косметологии и дермато-онкологии. Позволяет проводить наблюдение за состоянием кожных проявлений и использовать данные при первичной диагностике, профилактике и лечении большинства заболеваний кожи.
- 3) Возможность сохранения данных в памяти компьютера и на любых электронных носителях, распечатка фотографий для историй болезни, пересылка по internet для консультаций с коллегами.

- 4) Объективная оценка динамики состояния кожи пациента – важный юридический аспект в разрешении конфликтных ситуаций.
- 5) Наглядная визуализация состояния внутренних структур кожи и ее рельефа – сильный психологический фактор при разъяснении пациентам необходимости проведения лечебных мероприятий.
- 6) При помощи DUB легко доказывать эффективность лечения в доступной для клиента форме. Это мощный маркетинговый инструмент для привлечения новых клиентов.
- 7) Наличие этого метода повышает рейтинг учреждения и свидетельствует о высокой оснащенности и использовании передовых технологий.
- 8) В дополнение к гистологической картине, повышает точность патоморфологического диагноза.
- 9) Проведение научных и образовательных программ.
- 10) Проведение консилиумов и консультационно-диагностических мероприятий.
Новым аспектом использования данного метода для производителей является проведение оценки воздействия на кожу различной продукции, в том числе косметических, лекарственных препаратов, приборов.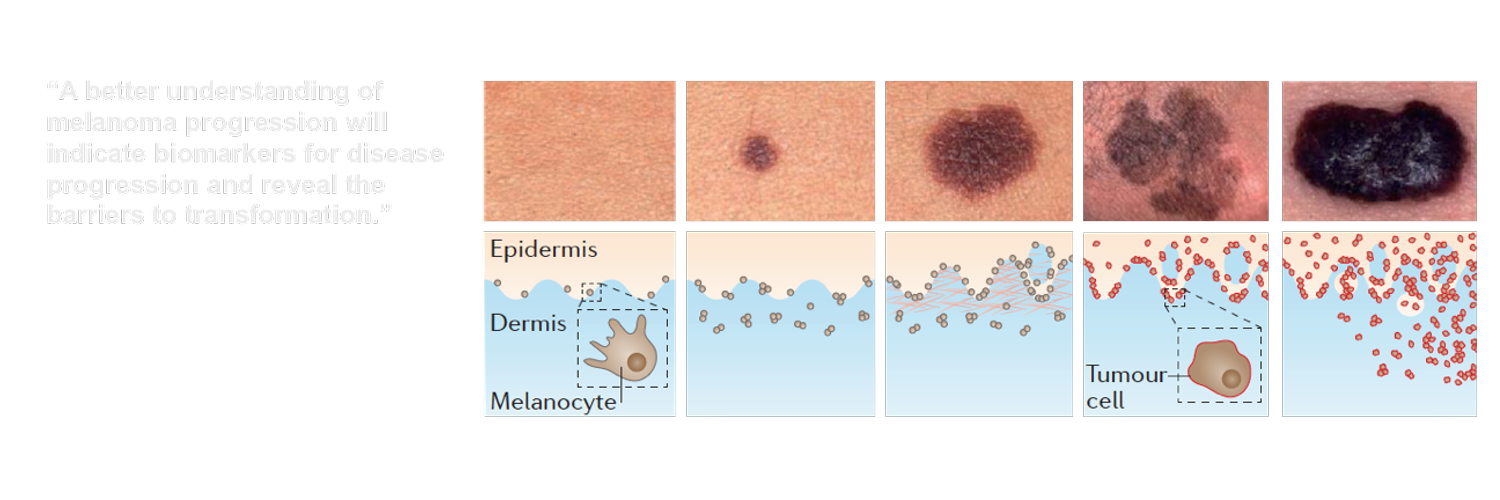
Хирургическая профилактика меланомы кожи
Романова О.А., Артемьева Н.Г.
ЗАО Центральная поликлиника Литфонда, Москва
Контакты: Романова О.А.
Цель: изучить ближайшие и отдаленные результаты лечения больных раком желчного пузыря.
В статье представлены данные сопоставления клинических признаков удаленных диспластических невусов с результатами гистологического исследования.
Материалы и методы
Диспластическиий невус (лентигинозная меланоцитарная дисплазия, ЛМД) является предшественником поверхностно распространяющейся меланомы кожи. Профессор З.В. Гольберт в 1982 г. выделила 3 степени развития ЛМД и показала, что 3-я степень развития ЛМД приближается к картине меланомы insitu. В целях профилактики меланомы мы стали предлагать больным иссечение имеющихся диспластических невусов.
С 2009 по 2012 г. были иссечены 43 пигментных образования, которые были расценены как диспластические невусы. Пигментные образования не возвышались над уровнем кожи или возвышались не более чем на 0,1 см, размеры их составляли от 0,3 до 1,2 см в диаметре. Иссечение производили под местной анестезией, отступя от видимых границ 0,4–0,5 см.
Пигментные образования не возвышались над уровнем кожи или возвышались не более чем на 0,1 см, размеры их составляли от 0,3 до 1,2 см в диаметре. Иссечение производили под местной анестезией, отступя от видимых границ 0,4–0,5 см.
Результаты
При гистологическом исследовании удаленных пигментных образований в 6 наблюдениях выявлен внутридермальный невус, в 8 – смешанный невус, в 28 – ЛМД, в т. ч. 1 степени – 10, 1-2 степени – 4, 2 степени – 6, 2-3 степени – 1. В 7 наблюдениях степень развития лентигинозной меланоцитарной дисплазии не указана. У одного пациента выявлена меланома insitu, развившаяся на фоне ЛМД 3 степени.
При сопоставлении клинических признаков удаленных диспластических невусов с морфологической картиной установлено, что выраженность клинических признаков невуса (асимметрия формы, неровности границ, неравномерная окраска) соответствовала степени развития ЛМД.
Выводы
Наиболее важными признаки развития ЛМД – изменения размеров, формы или окраски невуса за последние несколько месяцев или лет, а также появление диспластического невуса на неизмененной коже и дальнейшее его развитие у лиц старше 17 лет, что является показанием для иссечения диспластического невуса в целях профилактики меланомы. Иссечение диспластического невуса следует производить, отступив от видимых границ 0,4–0,5 см.
Иссечение диспластического невуса следует производить, отступив от видимых границ 0,4–0,5 см.
Данный объем операции будет достаточным для полного излечения выявленной при гистологическом исследовании поверхностно распространяющейся меланомы 1–2 уровней инвазии толщиной менее 0,1 см («тонкой» меланомы). Гистологическое исследование удаленного невуса должен проводить патоморфолог, имеющий достаточный опыт исследования меланоцитарных образований, чтобы установить степень ЛМД и возможный переход ЛМД в меланому. При отказе больного от операции необходимо осматривать диспластические невусы 1 раз в 6–12 мес.
Ключевые слова: лентигинозная меланоцитарная дисплазия; диспластический невус; поверхностно распространяющаяся меланома.
Среди разнообразных пигментных образований, встречающихся у лиц белой расы, большинство составляют доброкачественные невоклеточные невусы, которые проходят этапы развития от пограничного к смешанному и внутридермальному невусу, подвергаясь с возрастом инволюции [8]. Но есть и другие меланоцитарные образования – диспластические невусы, которым инволюция не свойственна. Эти пигментные образования способны трансформироваться в меланому.
Но есть и другие меланоцитарные образования – диспластические невусы, которым инволюция не свойственна. Эти пигментные образования способны трансформироваться в меланому.
Впервые меланотические образования, способные трансформироваться в меланому, были описаны W.H. Clark с соавт. в 1978 г. [5]. При обследовании больных наследственной меланомой и их родственников авторы выявили особые невусы, которые гистологически представляли собой атипическую меланоцитарную гиперплазию, лимфоидную инфильтрацию, нежную фиброплазию и новообразованные кровеносные сосуды. Был документально зафиксирован переход этих невусов в меланому у 2 больных. Наличие множества особых невусов у больных меланомой кожи и их родственников авторы обозначили как «В-К моль синдром» (по начальным буквам 2 больных, у которых наблюдалось развитие меланомы из этих невусов). Они делают вывод, что невусы этого синдрома гистогенетически являются предшественниками некоторых наследственных меланом.
Со слов авторов, термином меланоцитарная дисплазия они обозначают ситуацию, когда отдельные меланоциты или их небольшие группы имеют некоторые структурные черты злокачественных меланоцитов, тенденция развития которых пока не ясна. Авторы проводят аналогию с дисплазией шейки матки, когда очаги эпителиальных клеток имеют признаки злокачественности, но могут оставаться вялотекущими, регрессировать или прогрессировать в явный рак.
Авторы проводят аналогию с дисплазией шейки матки, когда очаги эпителиальных клеток имеют признаки злокачественности, но могут оставаться вялотекущими, регрессировать или прогрессировать в явный рак.
В 1980 г. D.E. Elder с соавт. [6], продолжая иcследования W.H. Clark, выявили невусы с меланоцитарной дисплазией у больных спорадической меланомой. В 5 наблюдениях спорадической меланомы они обнаружили остаточные элементы меланоцитарной дисплазии в первичной опухоли. Авторы подчеркнули, что невусы В-К моль синдрома и невусы с меланоцитарной дисплазией у больных спорадической меланомой были идентичны и назвали их «диспластическими невусами». Авторы показали, что диспластический невусный синдром, как и наследственный «В-К синдром», является фактором риска развития меланомы кожи.
При гистологическом исследовании диспластических невусов эти авторы обнаружили 2 типа нарушения роста внутриэпидермальных меланоцитов. Наиболее частый тип – лентигинозная меланоцитарная дисплазия – наблюдался во всех диспластических образованиях и напоминал изменения, происходящие в lentigo simplex. Второй тип нарушений роста – эпителиоидно-клеточная меланоцитарная дисплазия – был найден в 2 образованиях в дополнение к лентигинозной дисплазии. Этот тип роста напоминал классическую поверхностно распространяющуюся меланому.
Второй тип нарушений роста – эпителиоидно-клеточная меланоцитарная дисплазия – был найден в 2 образованиях в дополнение к лентигинозной дисплазии. Этот тип роста напоминал классическую поверхностно распространяющуюся меланому.
В 1982 г. профессор МНИОИ им. П.А. Герцена З.В. Гольберт, расценивая лентигинозную меланоцитарую дисплазию (ЛМД) как вариант меланоза Дюбрея, аналогично стадиям развития этого заболевания [1] выделила 3 степени развития ЛМД [2]. При 1 степени отмечалось увеличение числа меланоцитов в базальном слое эпидермиса и некоторая их атипия (атипия расположения, увеличение размеров, укрупнение ядра, в отдельных клетках – гиперхромия, полиморфизм ядер).
При 2 степени имелась более выраженная пролиферация меланоцитов, местами полностью замещающих базальный ряд кератиноцитов, и нарастание признаков их анаплазии. Для этой стадии характерны наличие удлиненных акантотических тяжей и склонность меланоцитов собираться в группы и скопления, особенно в акантотических тяжах, что создавало их колбообразное утолщение. Последние структуры особенно характерны для 3 степени ЛМД: здесь имелась тенденция к врастанию меланоцитов в выше расположенные слои эпидермиса, а также к врастанию атипичных меланоцитов вглубь, в сосочковый слой дермы.
Последние структуры особенно характерны для 3 степени ЛМД: здесь имелась тенденция к врастанию меланоцитов в выше расположенные слои эпидермиса, а также к врастанию атипичных меланоцитов вглубь, в сосочковый слой дермы.
Эта картина приближается к картине меланомы in situ. З.В. Гольберт подчеркивала, что отличительной особенностью всех образований типа ЛМД, как и меланозы Дюбрея, является лимфо-плазмоцитарная инфильтрация подлежащей дермы. С самого начала пролиферации меланоцитов, еще без заметных признаков их атипии и анаплазии, имелись реактивная лимфо-плазмоклеточная инфильтрация и ангиоматоз в основе дермы, указывающие на уже существующий очаг пролиферации меланоцитов [2].
Клинически диспластический невус имеет сходство с пограничным невусом, однако есть и отличия [3, 8]. Так, диспластический невус представляет собой гладкое пигментное пятно, в то время как пограничный несколько возвышается над уровнем кожи. Последний чаще имеет правильную форму (круглую или овальную), в то время как диспластический часто бывает неправильной формы.
Окраска пограничного невуса чаще однородна, цвет варьирует от светло-коричневого до темно-коричневого, в диспластическом невусе нередко отмечается более темная окраска или точечное образование в центре, напоминающее мишень [9]. Невоклеточные невусы никогда не появляются у пожилых, а те, которые есть, в пожилом возрасте фиброзируются или исчезают.
Диспластические невусы, наоборот, продолжают появляться до самой старости [8]. На рисунках 1–6 представлены диспластические невусы, а также поверхностно распространяющаяся меланома 1–2 уровней инвазии, развившаяся из диспластического невуса.
Рис. 1. Диспластический невус (коричневого цвета)
грудной стенки
Рис. 2. Папиломатозный невус (розового цвета)
спины
Рис. 3. Диспластический невус
молочной железы
Рис. 4. Диспластический невус
левого предплечья
Рис. 5а,б. Диспластический невус
левого плеча
Рис. 5а
Рис.
 5б
5бРис. 6а,б. Поверхностно распространяющаяся меланома 1–2 уровней инвазии,
развившаяся на фоне диспластического невуса.
Рис. 6а
Рис. 6б
Окончательный диагноз диспластического невуса устанавливают только при гистологическом исследовании. В связи с определенными трудностями дифференциальной диагностики невоклеточного и диспластического невусов исследование должен проводить патоморфолог, имеющий достаточный опыт диагностики меланоцитарных образований.
Осматривая больных в хирургическом отделении Центральной поликлиники Литфонда, мы обнаруживали диспластические невусы у 5–10% здоровых лиц. Клинически мы выделили 2 варианта диспаластических невусов.
В первом варианте (этих пациентов было меньше) диспластические невусы появлялись в подростковом возрасте, и после 17–20 лет количество их оставалось неизменным Носители этих невусов были, как правило, белокожие, плохо загорающие лица, со светлыми или рыжими волосами, со светлыми глазами. Диспластические невусы у этих пациентов были крупные (0,5–1,0 см в диаметре), располагались как на открытых, так и на закрытых участках тела (ягодицы, живот), часто сочетались с папилломатозными невусами.
Диспластические невусы у этих пациентов были крупные (0,5–1,0 см в диаметре), располагались как на открытых, так и на закрытых участках тела (ягодицы, живот), часто сочетались с папилломатозными невусами.
Цвет невусов у одного и того же больного мог варьировать от розового до темно-коричневого, иногда наблюдалась пестрая окраска: темные участки на розовом или светло-коричневом фоне. Из анамнеза следовало, что невусы нередко имели также близкие родственники, т. е. они были наследственными.
Подобная картина была описана W.H. Clark с соавт. [5] и D.E. Elder с соавт. [6] как «диспластический невусный синдром». После периода полового созревания новые невусы в этой группе больных не появлялись. Это можно объяснить тем, что белокожие люди ограничивали свое пребывание на солнце, т. к. быстро обгорали, а также были информированы о вредном воздействии ультрафиолетового облучения.
Во втором варианте в подростковом возрасте диспластические невусы были немногочисленны, большинство из них появлялись в дальнейшей жизни и были связаны с длительным пребыванием на солнце. Диспластические невусы в этом варианте были мелкие (от 0,1 до 0,4 см в диаметре), многочисленные, правильной округлой формы, однородной окраски.
Диспластические невусы в этом варианте были мелкие (от 0,1 до 0,4 см в диаметре), многочисленные, правильной округлой формы, однородной окраски.
У белокожих блондинов невусы были светло-коричневого, у русых – коричневого и темно-коричневого цветов. Наибольшее их количество располагалось на открытых участках тела: лице, шее, верхних конечностях, верхней половине туловища (у женщин – по типу «широкого декольте»).
Диспластические невусы часто сочетались с множественными веснушками и пигментными пятнами типа «лентиго», которые также располагались на открытых участках тела.
Появление диспластических невусов в результате солнечного воздействия указывает на их сходство с меланозом Дюбрея. Морфологически сходство лентигинозной меланоцитарной дисплазии с меланозом Дюбрея отметила З.В. Гольберт [2].
О влиянии солнечной радиации на возникновение поверхностно распространяющейся меланомы кожи сообщают многие исследователи.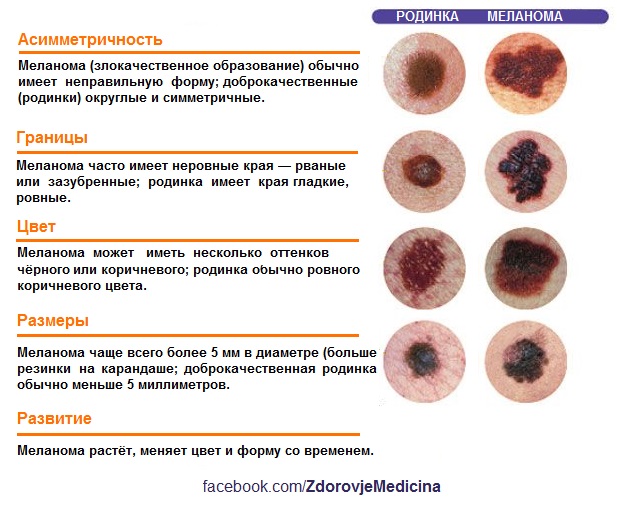 Так, К.А. Кларк из Стэндфордского университета и Калифорнийского центра по предотвращению рака сообщила, что молодые жительницы богатых районов на 70% чаще остальных страдали от меланомы.
Так, К.А. Кларк из Стэндфордского университета и Калифорнийского центра по предотвращению рака сообщила, что молодые жительницы богатых районов на 70% чаще остальных страдали от меланомы.
Это объясняют тем, что молодые состоятельные женщины часто проводят каникулы в тропических странах или посещают солярии, однако у них есть страховка, что влияет на показатели выявления опухоли на ранней стадии.
Учитывая тот факт, что появление диспластических невусов и дальнейшее развитие ЛМД стимулируется ультрафиолетовым облучением, мы всем больным с диспластическими невусами рекомендовали ограничить время пребывания на солнце с 11 до 15 часов, защищать кожу туловища и конечностей одеждой, использовать головной убор, солнцезащитные кремы.
Материалы и методы
В целях предупреждения перехода диспластического невуса в меланому мы стали предлагать пациентам иссечение невусов, которые имели признаки выраженной лентигинозной меланоцитарной дисплазии, для проведения гистологического исследования.
Исходя из опыта предыдущих лет, выбирали для иссечения невусы, которые представляли собой пигментные пятна, не возвышающиеся над поверхностью или возвышающиеся не более чем на 0,1 см, имеющие неправильную форму (в виде ромба, треугольника, капли, полулуния и пр.), неравномерную окраску, неровные края.
Показанием к иссечению служили также изменения невуса за последние 1–5 лет или появление невуса на неизмененной коже и дальнейший его рост. Осмотр невусов проводили при хорошем освещении, без применения диагностического оборудования. Чтобы уточнить характер изменений невуса, тщательно собирали анамнез, задавая наводящие вопросы.
Дерматоскоп применяли при необходимости дифференцировать невус от немеланоцитарных образований кожи – кератомы, гемангиомы, дерматофибромы и др.
Нередко больные воздерживались от операции, поскольку невус их не беспокоил: зуда, воспаления, болезненности они не отмечали.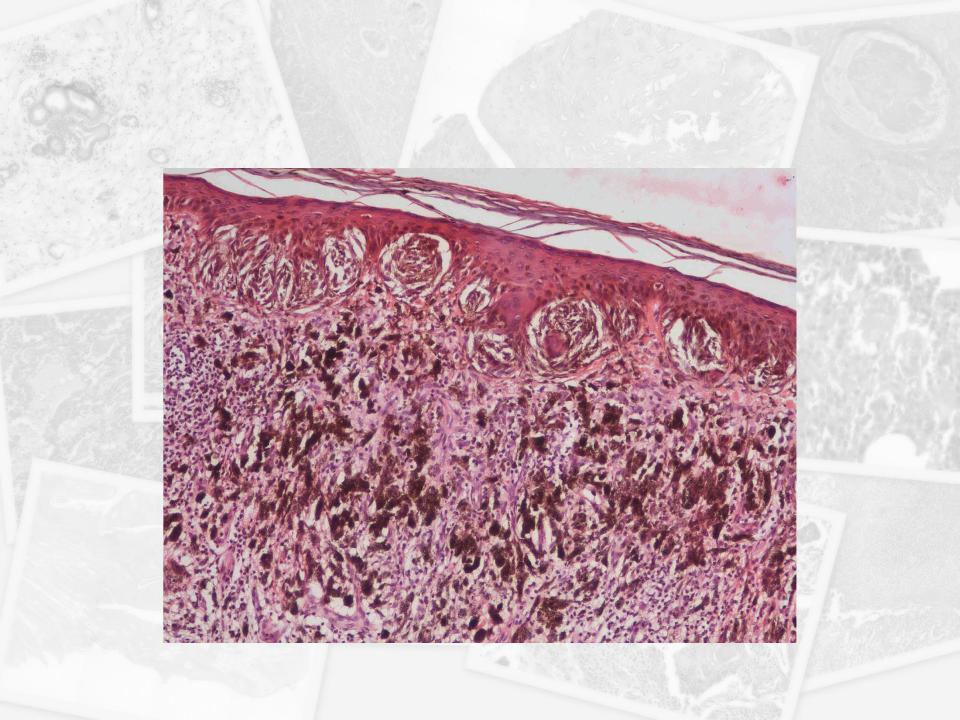 Таким пациентам мы назначали осмотр через 6 мес. При обнаружении изменений невуса за этот период повторно предлагали операцию, при отсутствии изменений–- дальнейшее наблюдение.
Таким пациентам мы назначали осмотр через 6 мес. При обнаружении изменений невуса за этот период повторно предлагали операцию, при отсутствии изменений–- дальнейшее наблюдение.
Иссечение невусов производили в амбулаторных условиях, под местной анестезией, отступя от видимых границ 0,4–0,5 см. Наименьшие размеры образований составляли 0,3 см, наибольшие – 1,2 см. Гистологическое исследование проводили в Городской клинической больнице № 52, а с 2010 г. – в Клинико-диагностическом отделении ОАО «Медицина», при необходимости препараты консультировали в МНИОИ им. П.А. Герцена.
Результаты
С 2009 по 2012 г. были иссечены 43 пигментных образования у больных с клиническим диагнозом диспластический невус. При гистологическом исследовании в 6 наблюдениях выявлен внутридермальный невус, в 8 – смешанный невус, в 28 – ЛМД, т. е. диспластический невус, в одном – поверхностно распространяющаяся меланома 1 уровня инвазии, развившаяся на фоне ЛМД 3 степени.
Из 28 морфологически подтвержденных диспластических невусов они были удалены у 22 пациентов, в т. ч. у одного – 4, у одного – 3, у одного – 2, у 19 – по одному невусу. У одной пациентки из 22 кроме диспластического невуса была также удалена меланома.
При гистологическом исследовании в 10 наблюдениях из 28 была установлена 1 степень развития лентигинозной меланоцитарной дисплазии, в 4 – 1–2 степень, в 6 – 2 степень, в 1 – 2–3 степень, в 7 степень развития ЛМД не указана. В одного пациента выявлена поверхностно распространяющаяся меланомы 1 уровня инвазии, развившаяся на фоне ЛМД 3 степени.
По возрасту 22 пациента распределились следующим образом: 20–29 лет – 6 человек, 30–39 лет – 10, 40–49 лет – 4, 50–59 лет – 0, 60–69 лет – 2. Женщин было 18, мужчин – 4. Контингент поликлиники составляют в основном лица женского пола, молодого и зрелого возраста, что и отразилось на половом и возрастном составе оперированных больных. Возраст пациентки с удаленной меланомой – 49 лет.
Возраст пациентки с удаленной меланомой – 49 лет.
Поводом для обращения к онкологу у 5 пациентов были изменение невуса или появление его на неизмененной коже, при этом никаких субъективных ощущений в области невуса не отмечалось. У 9 пациентов диспластические невусы выявлены при профилактическом осмотре онкологом, хирургом или дерматологом, 8 человек (в т. ч. пациентка с меланомой), были направлены терапевтом в связи с наличием множественных невусов. Таким образом, у большинства больных диспластические невусы выявлены при профилактическом осмотре кожных покровов.
Диспластические невусы локализовались на шее у 1 пациента, плече – у 2, предплечье – у 1, бедре – у 4, голени – у 3, спине – у 4, поясничной области – у 3, грудной стенке – у 2, брюшной стенке – у 8. Меланома локализовалась в области предплечья.
В 25 наблюдениях форма удаленных образований была неправильной, напоминала треугольник, полулуние, ромб, в 3 – правильной (округлая или овальная).
Размеры пигментных образований были следующие: 0,3 см в наибольшем измерении – 2 наблюдения, 0,4 см – 6, 0,5 см – 5, 0,6 см – 2, 0,7 см – 6, 0,8 – 1, 1,0–1,2 см – 6. Меланома имела размеры 0,5 х 0,4 см.
Окраска диспластических невусов в 25 наблюдениях была равномерной, цвет от коричневого до темно-коричневого и черного. Невусы светло-коричневого цвета иссечению не подлежали. Неравномерная окраска отмечалась в 3 наблюдениях, когда один край или одна половины невуса были темнее другой. У всех з больных при гистологическом исследовании выявлена 2 степень развития ЛМД. Меланома имела неоднородную окраску коричневого цвета.
Неровные края диспластического невуса (волнистые или зубчатые) отмечены у 3 пациентов из 28. При гистологическом исследовании у всех 3 установлена ЛМД 2 степени развития.
Изменение диспластического невуса отмечено у 4 больных: у 2 – за последние 8–12 мес., у 2 – за последние 2 и 5 лет. Локализация невусов в местах, доступных для самонаблюдения (средняя треть плеча, нижняя треть голени, брюшная стенка), была у 3 пациентов. Эти больные заметили изменения невуса и обратились по этому поводу к врачу.
Локализация невусов в местах, доступных для самонаблюдения (средняя треть плеча, нижняя треть голени, брюшная стенка), была у 3 пациентов. Эти больные заметили изменения невуса и обратились по этому поводу к врачу.
У пациентки с невусом поясничной области изменения выявлены онкологом при динамическом наблюдении. Гистологическое исследование у одного больного выявило 2 степень развития ЛМД, еще у одного – 2–3 степень. В одном наблюдении отмечена «выраженная лентигинозная меланоцитарная дисплазия» без указания степени.
Появление диспластического невуса на неизмененной коже отметили 4 пациента. Пигментные образования у них локализовались на передней поверхности шеи, в нижней трети плеча, в области предплечья, на брюшной стенке, т. е. в местах, доступных для самонаблюдения.
Гистологическое исследование у одного больного выявило ЛМД 2 степени, у одном – 2–3 степени, у 2 степень ЛМД не указана.
Таким образом, при сопоставлении клинических данных с результатами гистологического исследования установлено, что выраженность клинических признаков диспластического невуса соответствует степени развития ЛМД. Наиболее важными признаками развития ЛМД являются: асимметрия окраски, когда одна половина невуса темнее другой, неровные краев, (волнистые, зубчатые), а также изменения невуса за последние несколько месяцев или лет, или появление невуса на неизмененной коже и дальнейший его рост у лиц старше 17 лет.
Наиболее важными признаками развития ЛМД являются: асимметрия окраски, когда одна половина невуса темнее другой, неровные краев, (волнистые, зубчатые), а также изменения невуса за последние несколько месяцев или лет, или появление невуса на неизмененной коже и дальнейший его рост у лиц старше 17 лет.
Диспластические невусы с перечисленными признаками подлежат иссечению в целях предупреждения дальнейшего развития ЛМД. В некоторых случаях удаление диспластического невуса может явиться ранней диагностикой и излечением поверхностно-распространяющейся меланомы.
Приводим клинические наблюдения.
При профилактическом осмотре у пациента 62 лет обнаружен невус на боковой поверхности шеи размером 0,8 х 0,5 см, неравномерной окраски: нижняя половина – светло-коричневого цвета, верхняя — коричневого. Со слов больного, невус появился 8 мес. назад. Гистологическое исследование удаленного невуса выявило ЛМД 2 степени.
Пациентка 39 лет обратилась по поводу невуса в области брюшной стенки черного цвета, размером 0,4 х 0,4 см. Невус появился на неизмененной коже 5 лет назад. Гистологическое исследование удаленного невуса выявило ЛМД 2–3 степени.
Невус появился на неизмененной коже 5 лет назад. Гистологическое исследование удаленного невуса выявило ЛМД 2–3 степени.
Пациентка 37 лет, обратилась по поводу невуса в надлобковой области 1,0 х 1,0 см, коричневого цвета, более темной окраски у правого края. Со слов больной, невус в течение последних 2–3 лет увеличился в размерах. При гистологическом исследовании удаленного невуса выявлена ЛМД 2 степени.
Пациентка 29 лет, обратилась по поводу невуса в области левого плеча, 0,4 х 0,3 см, окраска которого изменилась в течение последнего года: на фоне розового цвета появился участок коричневого цвета. При гистологическом исследовании первоначально была установлена меланома 1–2 уровней инвазии, однако при пересмотре препарата в МНИОИ им. П.А. Герцена диагноз меланомы не подтвердился, установлен диагноз: диспластический невус с выраженной ЛМД.
Пациентка 49 лет, обратилась по поводу множественных пигментных невусов. При осмотре: на туловище и конечностях – множественные мелкие диспластические невусы коричневого цвета от 0,2 до 0,5 см диаметре, однородной окраски. В средней трети правого предплечья обнаружен слегка возвышающийся невус телесного цвета, к которому примыкает и частично располагается на его поверхности пигментное пятно неправильной формы, темно-коричневого цвета, 0,5 х 0,4 см. Образование иссечено, отступя от видимых границ 0,4 см.
При осмотре: на туловище и конечностях – множественные мелкие диспластические невусы коричневого цвета от 0,2 до 0,5 см диаметре, однородной окраски. В средней трети правого предплечья обнаружен слегка возвышающийся невус телесного цвета, к которому примыкает и частично располагается на его поверхности пигментное пятно неправильной формы, темно-коричневого цвета, 0,5 х 0,4 см. Образование иссечено, отступя от видимых границ 0,4 см.
При гистологическом исследовании в ГКБ № 52 выявлена меланома с инвазией в ретикулярный слой дермы (3 уровень инвазии). Препарат пересмотрен в МНИОИ им. П.А. Герцена патоморфологом к.м.н. Ягубовой Э.А. Было сделано заключение: на фоне смешанного невуса имеется лентигинозная меланоцитарная дисплазия 3 степени с микрофокусом поверхностно распространяющейся неизъязвленной пигментной меланомы 1 уровня инвазии по Кларку, с минимальной (в пределах плоскоэпителиального покрова ) толщиной по Бреслау.
Таким образом, у больной была диагностирована меланома insitu. При осмотре пациентки через 1 год у нее был удален диспластический невус левой голени с ЛМД 1–2 степени развития. Пациентка осмотрена через 3,5 года после удаления меланомы, признаков рецидива не выявлено.
При осмотре пациентки через 1 год у нее был удален диспластический невус левой голени с ЛМД 1–2 степени развития. Пациентка осмотрена через 3,5 года после удаления меланомы, признаков рецидива не выявлено.
Наши наблюдения показали также, что установить степень лентигинозной меланоцитарной дисплазии и выявить ее переход в поверхностно-распространяющуюся меланому может только опытный патоморфолог. При гистологическом исследовании нередко выявляется сочетание смешанного или внутридермального невуса с лентигинозной меланоцитарной дисплазией, что также представляет трудности для патоморфолога. Клинически подобное сочетание представляет собой папилломатозный невус, на котором располагается, или к которому примыкает пятно темно-коричневого цвета, неправильной формы.
Как показали наши исследования, большинство диспластических невусов, подлежащих удалению, были обнаружены при профилактическом осмотре онкологом, хирургом или дерматологом. Чтобы повысить выявляемость диспластических невусов, необходимо чтобы все практические врачи — терапевты, хирурги, гинекологи, и узкие специалисты обращали внимание на пигментные образования кожи.
Выявление диспластических невусов будет способствовать их своевременному удалению, что позволит снизить высокую смертность от меланомы кожи. По данным J.F. Аitken с соавт., проведенный в Австралии осмотр кожных покровов (скрининг) в 2000–2003 гг. позволил увеличить количество выявляемых «тонких» меланом, т. е. меланом на ранней стадии развития и снизить смертность от этого заболевания [4].
Больным следует также рекомендовать периодический самостоятельный осмотр имеющихся невусов, чтобы во-время заметить изменение размеров, формы или окраски невуса. A. Sapadin с соавт. справедливо отмечают, что у большинства пациентов имеется неправильное представление о невусах, имеющих высокий риск перехода в меланому. Необходимо разъяснять больным, что плоские пигментные невусы более опасны в этом плане, чем возвышающиеся [7], и если они соответствуют критериям АВСD (А – асимметрия, В – неровные края, С – неравномерная окраска, D – размер более 0,6 см ), необходимо обратиться к специалисту.
Выводы
1. Иссечение диспластического невуса с признаками выраженной лентигинозной меланоцитарной дисплазии является профилактикой, а в некоторых случаях – ранней диагностикой и излечением поверхностно распространяющейся меланомы.
2. Диспластический невус с выраженной лентигинозной меланоцитарной дисплазией имеет неправильную форму, неровные края, асимметричную окраску. Наиболее важным признаком развития лентигинозной меланоцитарной дисплазии следует считать замеченные за последние несколько месяцев или лет изменения невуса или появление невуса на неизмененной коже и его дальнейший рост у лиц старше 17 лет. Указанные признаки являются показанием к иссечению невуса для гистологического исследования. При отказе пациента от операции необходимо наблюдать больных 1 раз в 6–12 мес. При наличии изменений невуса за этот период показано его иссечение, при отсутствии изменений – дальнейшее наблюдение.
3. Иссечение диспластического невуса, представляющего собой пигментное пятно, возвышающееся над уровнем кожи не более чем на 0,1 см, следует производить, отступя от видимых границ 0,4–0,5 см. Такое иссечение при выявлении поверхностно распространяющейся меланомы 1–2 уровня инвазии будет достаточным для полного излечения заболевания.
Иссечение диспластического невуса, представляющего собой пигментное пятно, возвышающееся над уровнем кожи не более чем на 0,1 см, следует производить, отступя от видимых границ 0,4–0,5 см. Такое иссечение при выявлении поверхностно распространяющейся меланомы 1–2 уровня инвазии будет достаточным для полного излечения заболевания.
4. Гистологическое исследование диспластических невусов должен проводить опытный патоморфолог, способный отличить диспластический невус от пограничного и смешанного, определить степень лентигинозной меланоцитарной дисплазии и дать правильное заключение об уровне инвазии при обнаружении поверхностно распространяющейся меланомы.
5. Чтобы выявлять диспластические невусы, подлежащие удалению, необходимо, чтобы терапевты, хирурги, гинекологи, а также узкие специалисты при осмотре кожных покровов пациента обращали внимание на пигментные образования кожи и своевременно направляли больных к онкологу.
6. Больным с множественными диспластическими невусами необходимо рекомендовать избегать длительного пребывания на солнце, защищать кожу от солнца одеждой, пользоваться солнцезащитными кремами, а также посещать врача 1 раз в год и периодически осматривать имеющиеся пигментные невусы, чтобы своевременно заметить изменения размеров, формы, цвета или краев пигментного образования.
Больным с множественными диспластическими невусами необходимо рекомендовать избегать длительного пребывания на солнце, защищать кожу от солнца одеждой, пользоваться солнцезащитными кремами, а также посещать врача 1 раз в год и периодически осматривать имеющиеся пигментные невусы, чтобы своевременно заметить изменения размеров, формы, цвета или краев пигментного образования.
Литература/References
- Гольберт З.В. Гистогенез, гистология, классификация пигментных (меланоцитарных) опухолей кожи. В кн.: Пигментные опухоли человека. Серия Онкология. Том 7. Под общей ред. А.И. Шнирельмана. М.: ВИНИТИ, 1975.
- Гольберт З.В., Червонная Л.В., Клепиков В.А., Романова О.А. Лентигинозная меланоцитарная дисплазия как предшественник развития злокачественной меланомы. Архив патологии 1982; 12: 36–41.
- Романова О.А. Ранняя диагностика и профилактика меланомы кожи: Руководство–атлас. М.:МИА, 2012; 20–25.
- Aitken JF, Elwood M, Baade PD, Youl P, English D.
 Clinical whole-body examination reduces the incidence of thick melanomas. Intern J Cancer 2010; 126(2): 450–8.
Clinical whole-body examination reduces the incidence of thick melanomas. Intern J Cancer 2010; 126(2): 450–8. - Clark WH, Reimer RR, Greene M, Ainsworth AM, Mastrangelo MJ. Origin of familial malignant melanomas from heritable melanocytic lesions. The B–K mole syndrom. Arch Dermatol 1978; 114(5): 732–9.
- Elder DE, Leonardi J, Goldman J, Goldman SC, Greene MH, Clark WH. Displastic nevus syndrome. A phenotypic association of sporadic cutaneous melanoma. Cancer 1980; 8.
- Saparadin A, Bronstein M, Saparadin S. Prevalence of patient misperceptions regarding melanoma. Dermatology 2012; 66(4, suppl. 1): AB–147.
- Фицпатрик Т., Джонсон Р., Вульф К., Полано М., Сюрмонд Д. Диспластический невус. Дерматология: Атлас–справочник, 1999; 190–4.
- Мерта Дж. Справочник врача общей практики. Глава 97. Пигментные образования. Пер. с англ. Италия: Мак-Гроу-хилл Либри, 1998.
Эксцизионная биопсия диспластического невуса в условиях районной поликлиники – путь к раннему выявлению меланомы кожи
Журнал «Стационарозамещающие технологии: Амбулаторная хирургия» №3–4/2020
DOI: 10. 21518/1995-1477-2020-3-4-66-72
21518/1995-1477-2020-3-4-66-72
Н.Г. Артемьева, ORCID: 0000-0001-7996-0415, О.А. Романова*, ORCID: 0000-0003-2381-6478, Центральная поликлиника Литфонда; 125319, Россия, Москва, ул. 1-я Аэропортовская, д. 5
Введение. В России отмечается высокая смертность от меланомы кожи – 2,5 на 100 000 населения при заболеваемости 7,7 на 100 000 населения, т. е. умирает каждый третий заболевший. В зарубежных странах – в США, Австралии смертность от меланомы составляет 10–15%. Данная статистика объясняется тем, что пациенты в ранней стадии заболевания к врачам не обращаются, поскольку опухоль в начальной стадии не беспокоит больного и напоминает обычную родинку.
Цель исследования – подтвердить целесообразность удаления прогрессирующего диспластического невуса (ЛМД 3-й ст.) в целях профилактики и ранней диагностики меланомы кожи.
Материалы и методы. В хирургическом отделении ЗАО «Центральная поликлиника Литфонда» с 2009 г. по март 2020 г. авторы удалили 180 пигментных образований с клиническим диагнозом «прогрессирующий диспластический невус». Больные были направлены в хирургическое отделение терапевтами, дерматологами и другими специалистами поликлиники. После консультации онколога под местной анестезией выполнялась эксцизионная биопсия невуса.
по март 2020 г. авторы удалили 180 пигментных образований с клиническим диагнозом «прогрессирующий диспластический невус». Больные были направлены в хирургическое отделение терапевтами, дерматологами и другими специалистами поликлиники. После консультации онколога под местной анестезией выполнялась эксцизионная биопсия невуса.
Результаты. При гистологическом исследовании выявлено 29 (16%) диспластических невусов с ЛМД 3-й ст. и 18 (10%) ранних меланом.
Выводы. Если эксцизионная биопсия диспластического невуса станет рутинной в практике поликлинического хирурга, то это приведет к увеличению ранней выявляемости меланомы и значительно уменьшит смертность от этого заболевания. При эксцизионной биопсии авторы рекомендуют отступление от границ образования 0,5–1,0 см, поскольку клинически отличить прогрессирующий диспластический невус от ранней меланомы не представляется возможным.
Для цитирования: Артемьева Н. Г., Романова О.А. Эксцизионная биопсия диспластического невуса в условиях районной поликлиники – путь к раннему выявлению меланомы кожи. Амбулаторная хирургия. 2020;(3-4):66-72. https://doi.org/10.21518/1995-1477-2020-3-4-66-72
Г., Романова О.А. Эксцизионная биопсия диспластического невуса в условиях районной поликлиники – путь к раннему выявлению меланомы кожи. Амбулаторная хирургия. 2020;(3-4):66-72. https://doi.org/10.21518/1995-1477-2020-3-4-66-72
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Excisional biopsy of a dysplastic nevus in a district polyclinic is a path to early detection of skin melanoma
Nadezhda G. Artemeva, ORCID: 0000-0001-7996-0415, Olga A. Romanova*, ORCID: 0000-0003-2381-6478, Central Polyclinic of Literary Fund; 5, 1st Аeroportovskaya St., Moscow, 125319, Russia
Introduction. Russia has a high mortality rate of cutaneous melanoma – 2.5 per 100,000 population whereas the incidence rate is 7.7 per 100,000 population, i.e. one in every three patients dies. In the foreign countries (the USA, Australia), melanoma mortality rate is 10-15%. Such high rates are explained by the fact that patients with early-stage disease do not seek medical advice, as in early stages a tumour does not cause inconvenience to a patient and looks like an ordinary mole.
Such high rates are explained by the fact that patients with early-stage disease do not seek medical advice, as in early stages a tumour does not cause inconvenience to a patient and looks like an ordinary mole.
The purpose of the study was to confirm the advisability of removing a progressive dysplastic nevus (grade 3 lentiginous melanocytic dysplasia) with a view to prevent and make early diagnosis of cutaneous melanoma.
Materials and methods. The authors removed 180 pigmented lesions that were clinically diagnosed as a progressive dysplastic nevus in the Surgery Department of Central Polyclinic of Literary Fund from 2009 to March 2020. The patients were referred to the Surgery Department by physicians, dermatologists and other specialists of the polyclinic. Following an oncologist consultation, excisional biopsy of a nevus was performed under local anesthesia.
Results. Histological examination revealed 29 (16%) dysplastic nevi with grade 3 LMD and 18 (10%) early-stage melanomas.
Histological examination revealed 29 (16%) dysplastic nevi with grade 3 LMD and 18 (10%) early-stage melanomas.
Conclusions. If excisional biopsy of a dysplastic nevus becomes routine in Ambulatory Surgery practice, it will increase the early diagnosis of melanoma and significantly reduce mortality rates of this disease. For excisional biopsy, the authors recommend to excise at a distance of 0.5 to 1.0 cm from the lesion boundaries, since it is not possible to clinically distinguish a progressive dysplastic nevus from early melanoma.
For citation: Artemeva N.G., Romanova O.A. Excisional biopsy of a dysplastic nevus in a district polyclinic is a path to early detection of skin melanoma. Ambulatornaya khirurgiya = Ambulatory Surgery (Russia). 2020;(3-4):66-72. (In Russ.) https://doi.org/10.21518/1995-1477-2020-3-4-66-72
Conflict of interest: the authors declare no conflict of interest.
Введение
В 1969 г. W.H. Clark выделил 3 основные формы меланомы кожи, которые отличаются характером развития, темпом прогрессирования и прогнозом [1]. Узловая форма, которая составляет 20% опухолей, отличается быстрым ростом и плохим прогнозом, 2 другие формы – лентиго-меланома и поверхностно-распространяющаяся меланома имеют 2 фазы развития – фазу горизонтального и вертикального роста. Диагностика меланомы в фазе горизонтального роста обеспечивает излечение в 90–98% случаев, наступление 2-й фазы резко ухудшает прогноз. Лентиго-меланома развивается на фоне меланоза Дюбрея и имеет длительную фазу горизонтального роста 15–20 лет (злокачественное лентиго). Поверхностно-распространяющаяся меланома возникает на фоне диспластического невуса или на неизмененной коже, фаза горизонтального роста у нее намного короче – от нескольких месяцев до 5–10 лет.
Актуальность проблемы
В России отмечается высокая смертность от меланомы кожи – 2,5 на 100 000 населения при заболеваемости 7,7 на 100 000 населения, то есть умирает каждый третий заболевший [2]. В зарубежных странах – в США, Австралии смертность от меланомы составляет 10–15% [3]. Такая ситуация объясняется тем, что пациенты в ранней стадии заболевания к врачам не обращаются, поскольку опухоль в начальной стадии не беспокоит больного и напоминает обычную родинку. Поводом для обращения к врачу является, как правило, изъязвление и кровотечение опухоли, что свидетельствует о поздней стадии заболевания. Ранняя меланома должна выявляться врачом активно, при эксцизионной биопсии подозрительного пигментного образования, которое выявляется врачом при осмотре кожи больных, обратившихся по поводу различных заболеваний. Поверхностно-распространяющаяся меланома, которая имеет фазу горизонтального роста, составляет 60–70% меланом и может развиваться как на неизмененной коже, так и на фоне диспластического невуса.
В зарубежных странах – в США, Австралии смертность от меланомы составляет 10–15% [3]. Такая ситуация объясняется тем, что пациенты в ранней стадии заболевания к врачам не обращаются, поскольку опухоль в начальной стадии не беспокоит больного и напоминает обычную родинку. Поводом для обращения к врачу является, как правило, изъязвление и кровотечение опухоли, что свидетельствует о поздней стадии заболевания. Ранняя меланома должна выявляться врачом активно, при эксцизионной биопсии подозрительного пигментного образования, которое выявляется врачом при осмотре кожи больных, обратившихся по поводу различных заболеваний. Поверхностно-распространяющаяся меланома, которая имеет фазу горизонтального роста, составляет 60–70% меланом и может развиваться как на неизмененной коже, так и на фоне диспластического невуса.
Диспластический невус (невус Кларка, лентигинозная меланоцитарная дисплазия) – это приобретенное меланоцитарное образование, которое отличается от обычного невуса наличием пролиферативной активности незрелых меланоцитов, что может привести к развитию меланомы. Диспластический невус впервые бал описан W.H. Clark et al. в 1978 г. [4]. Авторы документально показали переход данного невуса в меланому. В 1980 г. D.E. Elder ввел понятие лентигинозная меланоцитарная дисплазия (ЛМД), что является синонимом диспластического невуса [5]. Подобные невусы были описаны нами в 1982 г. в статье «Лентигинозная меланоцитарная дисплазия как предшественник злокачественной меланомы» [6]. В данной статье профессор МНИОИ им. П.А. Герцена З.В. Гольберт впервые выделила 3 степени ЛМД и показала, что 3-я степень дисплазии приближается к картине меланомы in situ. В настоящее время зарубежные авторы выделяют легкую, умеренную и тяжелую меланоцитарную дисплазию (mild, moderate, severe) [7]. Высокий риск развития меланомы на фоне тяжелой меланоцитарной дисплазии в настоящее время отмечают многие авторы [8–11].
Диспластический невус впервые бал описан W.H. Clark et al. в 1978 г. [4]. Авторы документально показали переход данного невуса в меланому. В 1980 г. D.E. Elder ввел понятие лентигинозная меланоцитарная дисплазия (ЛМД), что является синонимом диспластического невуса [5]. Подобные невусы были описаны нами в 1982 г. в статье «Лентигинозная меланоцитарная дисплазия как предшественник злокачественной меланомы» [6]. В данной статье профессор МНИОИ им. П.А. Герцена З.В. Гольберт впервые выделила 3 степени ЛМД и показала, что 3-я степень дисплазии приближается к картине меланомы in situ. В настоящее время зарубежные авторы выделяют легкую, умеренную и тяжелую меланоцитарную дисплазию (mild, moderate, severe) [7]. Высокий риск развития меланомы на фоне тяжелой меланоцитарной дисплазии в настоящее время отмечают многие авторы [8–11].
Цель исследования – определить выявляемость диспластического невуса с тяжелой меланоцитарной дисплазией (ЛМД 3-й ст.) и ранней меланомы при эксцизионной биопсии пигментных образований с клиническим диагнозом «прогрессирующий диспластический невус».
Материалы и методы
В хирургическом отделении ЗАО «Центральная поликлиника Литфонда» мы с 2009 г. удаляем пигментные образования с клиническим диагнозом «прогрессирующий диспластический невус», что обозначает тяжелую меланоцитарную дисплазию (3-я ст.). Диспластические невусы находят врачи первичного контакта – терапевты, дерматологи и другие специалисты поликлиники при осмотре кожных покровов пациента и направляют его к онкологу. При установлении диагноза «прогрессирующий диспластический невус» пациент направляется к хирургу для выполнения эксцизионной биопсии. Диагноз устанавливается на основании клинико-анамнестических данных, т. е. по признакам ABCDE: неправильная форма невуса (А), неровные края (В), неоднородная окраска (С), диаметр более 0,4 см (D), изменение невуса (E) [12–14]. Эти признаки видны на рис. 1–4.
Рисунок 1. Диспластический невус грудной стенки у женщины 45 лет с лентигинозной меланоцитарной дисплазией 2-й ст.
Рисунок 2. Поверхностно-распространяющаяся меланома брюшной стенки у женщины 34 лет
Рисунок 3. Лентигинозный невус поясничной области у мужчины 77 лет, с очаговой лентигинозной меланоцитарной дисплазией 3-й ст.
Рисунок 4. Меланома in situ на фоне диспластического невуса у женщины 35 лет
В литературе отмечено, что при малых размерах пигментного образования признаки ABCD могут отсутствовать [15, 16]. В этих случаях решающую роль играет признак E – изменение невуса. На рис. 5 и 6 представлено пигментное образование без явных признаков ABCD, однако из анамнеза было известно, что оно существовало длительно, а в последний месяц значительно увеличилось.
Рисунок 5, 6. Меланома правой голени у мужчины 34 лет, 2-й уровень инвазии по Кларку, толщина по Бреслоу 0,75 мм
Меланома правой голени у мужчины 34 лет, 2-й уровень инвазии по Кларку, толщина по Бреслоу 0,75 мм
На рис. 7 также представлено образование без явных признаков ADCD, однако оно появилось 3 мес. назад на неизмененной коже и быстро увеличилось. Эксцизионная биопсия невусов выполняется под местной анестезией, иссекается лоскут кожи с подкожной клетчаткой до фасции, отступление от видимых границ составляет 0,5–1,0 см. Гистологическое исследование проводится в ОАО «Медицина», все препараты диспластических невусов и меланом консультируются в МНИОИ им. П.А. Герцена к.м.н. Э.А. Ягубовой.
Рисунок 7. Поверхностно-распространяющаяся меланома левого предплечья 0,4 см в диаметре у женщины 52 лет
Результаты
Всего с 2009 г. по март 2020 г. было удалено 180 образований с клиническим диагнозом «прогрессирующий диспластический невус». При гистологическом исследовании в 134 случаях выявлен диспластический невус. В 29 случаях установлена тяжелая меланоцитарная дисплазия (ЛМД 3-й ст.), таким образом, диагноз «прогрессирующий диспластический невус» был подтвержден в 16%. В 18 случаях выявлена ранняя меланома, что составило 10%. В 7 случаях из 18 установлена меланома in situ, в остальных – ранняя инвазивная меланома, толщиной по Бреслоу – 1 мм и менее, с уровнем инвазии по Кларку 2–3. В 8 случаях из 18 (44%) установлено развитие меланомы на фоне ЛМД, т. е. из диспластического невуса.
В 29 случаях установлена тяжелая меланоцитарная дисплазия (ЛМД 3-й ст.), таким образом, диагноз «прогрессирующий диспластический невус» был подтвержден в 16%. В 18 случаях выявлена ранняя меланома, что составило 10%. В 7 случаях из 18 установлена меланома in situ, в остальных – ранняя инвазивная меланома, толщиной по Бреслоу – 1 мм и менее, с уровнем инвазии по Кларку 2–3. В 8 случаях из 18 (44%) установлено развитие меланомы на фоне ЛМД, т. е. из диспластического невуса.
Обсуждение результаты
В наших наблюдениях отмечен довольно высокий процент выявляемости диспластического невуса с тяжелой меланоцитарной дисплазией и ранней меланомы при удалении образований с клиническим диагнозом «прогрессирующий диспластический невус». Это говорит о том, что выявление диспластических невусов врачом первичного контакта с последующей эксцизионной биопсией в хирургическом отделении может значительно повысить раннюю выявляемость меланомы. К такому же выводу в настоящее время приходит ряд отечественных авторов [17, 18]. Мы полагаем, что следует значительно увеличить число эксцизионных биопсий диспластических невусов, выполняемых хирургами поликлиник. Для этого необходимо, чтобы все врачи первичного звена при осмотре больных обращали внимание на пигментные невусы с признаками ABCDE и направляли пациентов к хирургу для выполнения эксцизионной биопсии. Удаление диспластических невусов должно стать рутинным в практике поликлинического хирурга, который должен удалять 20–30 диспластических невусов в год. При удалении диспластического невуса хирургам необходимо иметь ввиду, что прогноз меланомы определяется толщиной опухоли, определяемой при гистологическом исследовании, которая измеряется не в сантиметрах, как при других опухолях, а в миллиметрах. Так, при толщине опухоли 1 мм и менее пятилетняя выживаемость составляет 95–98%, при толщине 3 мм и более – 40–50%. Учитывая вышесказанное, хирург, удаляя диспластический невус, должен убедиться, что пигментное пятно не возвышается над уровнем кожи более чем на 1 мм.
Мы полагаем, что следует значительно увеличить число эксцизионных биопсий диспластических невусов, выполняемых хирургами поликлиник. Для этого необходимо, чтобы все врачи первичного звена при осмотре больных обращали внимание на пигментные невусы с признаками ABCDE и направляли пациентов к хирургу для выполнения эксцизионной биопсии. Удаление диспластических невусов должно стать рутинным в практике поликлинического хирурга, который должен удалять 20–30 диспластических невусов в год. При удалении диспластического невуса хирургам необходимо иметь ввиду, что прогноз меланомы определяется толщиной опухоли, определяемой при гистологическом исследовании, которая измеряется не в сантиметрах, как при других опухолях, а в миллиметрах. Так, при толщине опухоли 1 мм и менее пятилетняя выживаемость составляет 95–98%, при толщине 3 мм и более – 40–50%. Учитывая вышесказанное, хирург, удаляя диспластический невус, должен убедиться, что пигментное пятно не возвышается над уровнем кожи более чем на 1 мм.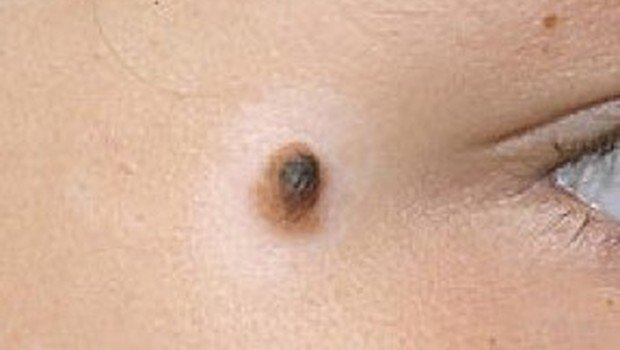 В этом случае при выявлении меланомы опухоль будет иметь толщину 1 мм и менее, что определяет хороший прогноз. Если пальпаторно установлено, что диспластический невус возвышается над уровнем кожи более чем на 0,1 см, необходимо направлять пациента к онкологу, так как при выявлении меланомы опухоль будет иметь толщину 2–4 мм и потребует дополнительного лечения. В зарубежной практике при выполнении эксцизионной биопсии диспластического невуса рекомендовано отступать от видимых границ образования 0,2–0,3 см, а при выявлении меланомы производить реоперацию [19].
В этом случае при выявлении меланомы опухоль будет иметь толщину 1 мм и менее, что определяет хороший прогноз. Если пальпаторно установлено, что диспластический невус возвышается над уровнем кожи более чем на 0,1 см, необходимо направлять пациента к онкологу, так как при выявлении меланомы опухоль будет иметь толщину 2–4 мм и потребует дополнительного лечения. В зарубежной практике при выполнении эксцизионной биопсии диспластического невуса рекомендовано отступать от видимых границ образования 0,2–0,3 см, а при выявлении меланомы производить реоперацию [19].
Некоторые авторы считают, что реоперацию необходимо производить также и при тяжелой меланоцитарной дисплазии, если имеется положительный край резекции [20]. В случае выявления меланомы in situ ВОЗ считает радикальным отступ от границ образования 0,5 см, при удалении ранней инвазивной меланомы – 1,0 см. Многие авторы отмечают, и мы с ними согласны, что отличить прогрессирующий диспластический невус от ранней меланомы, даже при использовании дерматоскопии, не представляется возможным, точный диагноз устанавливается только при эксцизионной биопсии [10, 19]. Учитывая этот факт, мы считаем предпочтительным отступ от границ образования не менее 0,5 см, а в ряде случаев 1,0 см, чтобы не потребовалась реоперация при выявлении инвазивной меланомы.
Учитывая этот факт, мы считаем предпочтительным отступ от границ образования не менее 0,5 см, а в ряде случаев 1,0 см, чтобы не потребовалась реоперация при выявлении инвазивной меланомы.
В наших исследованиях у 17 больных меланомой из 18 образование было иссечено с отступом 1,0 см, в одном случае – 0,5 см, после чего больной с ранней инвазивной меланомой был направлен к онкологу по месту жительства (рис. 5, 6) После проведенной консультации в онкодиспансере реоперация не была рекомендована. Пациент наблюдается 4,5 года без признаков заболевания. На рис. 1, 3 представлены пигментные образования, которые были иссечены с отступом 1,0 см, при гистологическом исследовании выявлены диспластические невусы 2-й и 3-й ст. дисплазии (рис. 1, 3), меланома in situ (рис. 4) и ранняя инвазивная меланома (рис. 2, 7). В случае обнаружения диспластического невуса (рис. 1, 3) такой отступ не требовался, однако после предупреждения, что при меньшем отступе может потребоваться реоперация в случае обнаружения меланомы, больные давали согласие на отступ 1,0 см. Необходимо отметить, что гистологическое исследование удаленного диспластического невуса должен проводить патоморфолог с достаточным опытом диагностики меланоцитарных образований, так как отличить тяжелую меланоцитарную дисплазию (3-й ст.) от меланомы in situ представляет определенные трудности [21, 22]. Следует подчеркнуть, что установление 3-й ст. ЛМД является важным для клинициста, поскольку свидетельствует о высоком риске развития опухоли у данного пациента.
Необходимо отметить, что гистологическое исследование удаленного диспластического невуса должен проводить патоморфолог с достаточным опытом диагностики меланоцитарных образований, так как отличить тяжелую меланоцитарную дисплазию (3-й ст.) от меланомы in situ представляет определенные трудности [21, 22]. Следует подчеркнуть, что установление 3-й ст. ЛМД является важным для клинициста, поскольку свидетельствует о высоком риске развития опухоли у данного пациента.
Заключение
Наш десятилетний опыт эксцизионной биопсии диспластических невусов в хирургическом отделении Центральной поликлиники Литфонда показывает, что выявление прогрессирующих диспластических невусов в поликлинике врачом первичного контакта с последующей эксцизионной биопсией в хирургическом отделении приводит не только к профилактике, но и к раннему выявлению меланомы. Распространение этой практики по всей России позволит снизить смертность от меланомы кожи в нашей стране до уровня зарубежных стран. Эксцизионная биопсия диспластического невуса в поликлинике должна стать рутинной практикой поликлинического хирурга. Чем больше будет выполнено эксцизионных биопсий диспластических невусов, тем больше будет выявлено ранних меланом.
Эксцизионная биопсия диспластического невуса в поликлинике должна стать рутинной практикой поликлинического хирурга. Чем больше будет выполнено эксцизионных биопсий диспластических невусов, тем больше будет выявлено ранних меланом.
Список литературы / References
- Clark W.H., From L., Bernardino E., Mihm C.M. The histogenesis and Biologic Behavior of Primary Human Malignant Melanoma of Skin. Cancer Research. 1969;29(3):705-726. Available at: https://cancerres.aacrjournals.org/content/29/3/705.full-text.2. pdf.
- Каприн А.Д., Старинский В.В., Петрова Г.В. (ред.) Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М.; 2019. 250 с. Available at: https://glavonco.ru/cancer_register/Забол_2018_Электр.pdf.
- Меланома. В: Усатине Р.П., Смит М.A., Мэйе Э.Дж., Шамли Х., Тайсингер Дж. Атлас-справочник практикующего врача. Дерматология. М.: Изд-во Панфилова; БИНОМ. Лаборатория знаний; 2012. 536 с.

- Clark W.H., Reimer R.R., Greene M., Ainsworth A.M., Mastrangelo M.J. Origin of Familial Malignant Melanomas from Heritable Melanocytic Lesions. “The B-K mole Syndrom”. Arch Dermatol. 1978;114(5):732-739. Available at: https://pubmed.ncbi.nlm.nih.gov/646394
- Elder D.E., Goldman L.I., Goldman S.C., Green N.M., Clark W.H. Jr. Displastic nevus syndrome: A phenotypic assotiation of sporadic cutaneous melanoma. Cancer. 1980;46(8):1787-1794. https://doi.org/10.1002/1097-0142(19801015)46:8<1787::aidcncr2820460816>3.0.co;2-s.
- Гольберт З.В., Червонная Л.В., Клепиков В.А., Романова О.А. Лентигинозная меланоцитарная дисплазия как предшественник развития злокачественной меланомы. Архив патологии. 1982;(12):36-41.
- Hale C.S. Dysplastic nevus. PathologyOutlines.com. 2020. Available at: http://www.pathologyoutlines.com/topic/skintumormelanocyticdysplasticnevus.html.
- Меньшикова Н.В., Шишкина Ю.В., Григоренко А.А., Макаров И.
 Ю., Левченко Н.Р., Ефимцева А.Ф. и др. Лентигиозная меланоцитарная дисплазия. В: Клиническая и патоморфологическая диагностика редко встречающихся повреждений и заболеваний. Случаи из практики. Благовещенск; 2015.
Ю., Левченко Н.Р., Ефимцева А.Ф. и др. Лентигиозная меланоцитарная дисплазия. В: Клиническая и патоморфологическая диагностика редко встречающихся повреждений и заболеваний. Случаи из практики. Благовещенск; 2015. - Артамонова И.И., Малютина Е.В. Клинико-морфологические особенности невусов. Известия Российской Военно- медицинской академии. 2019;1(S1):16-18. Режим доступа: https://elibrary.ru/item.asp?id=38164229.
- Damjanov I., Dotlic´ S., Fenderson B.A., Gatalica Z., Morovic A., Nola M. What are dysplastic nevi? In: Damjanov I. (ed.) Pathology Secrets. 3rd ed. Mosby; 2009. https://doi.org/10.1016/B978-0-323-05594-9.X0001-3.
- Hurt M.A., Weedon D. Weedon D. Weedon’s Skin Pathology. 3rd ed. London: Churchill Livingstone Elsevier; 2010. Dermatol Pract Concept. 2012;2(1):79-82. https://doi.org/10.5826/dpc.0201a15.
- Романова О.А., Артемьева Н.Г. Хирургическая профилактика меланомы кожи. Онкохирургия. 2013;(3):12-18. Режим доступа: http://oncosurgery.
 oncology.ru/archive/2013/03/3.htm.
oncology.ru/archive/2013/03/3.htm. - Романова О.А., Артемьева Н.Г., Ягубова Э.А., Рудакова И.М., Марычева В.Н., Вещевайлов Э.А. Тактика ведения пациента с диспластическим невусом. Клиническая дерматология и венерология. 2015;14(2):92-97. https://doi.org/10.17116/klinderma201514292-97.
- Романова О.А., Артемьева Н.Г., Солохина М.Г., Марычева В.Н., Вещевайлов А.А., Купчиков С.А. Клинико-морфологические параллели в диагностике прогрессирующего диспластического невуса и ранней меланомы кожи. Онкология. Журнал им. П.А. Герцена. 2019;(1):26-31. https://doi.org/10.17116/onkolog2019801126.
- Сергеев Ю.Ю., Мордовцева В.В. Опыт диагностики меланомы кожи диаметром менее 6 мм. Клиническая дерматология и венерология 2018;17(4):97-105. https://doi.org/10.17116/klinderma20181704197.
- Соколова А.В., Малишевская Н.П. Ошибки в диагностике меланоцитарных новообразований кожи. Современные проблемы науки и образования. 2018;(2). Режим доступа: https://science-education.
 ru/ru/article/view?id=27502.
ru/ru/article/view?id=27502. - Гаранина О.Е., Лебедева О.Е., Шливко И.Ф., Клеменова И.А., Донченко Е.В., Дардык М.В. и др. Ранняя диагностика злокачественных новообразований кожи: новый взгляд на решение проблемы. Клиническая дерматология и венерология. 2018;17(5):101-108. https://doi.org/10.17116/klinderma/201817051101.
- Эберт М.А., Гафтон Г.И., Зиновьев Г.В., Гафтон И.Г. Современный взгляд на диагностику меланомы кожи. Вопросы онкологии. 2019;65(5):638-644. Режим доступа: https://elibrary.ru/item.asp?id=41271925.
- Диспластический невус. В: Усатине Р.П., Смит М.A., Мэйе Э.Дж., Шамли Х., Тайсингер Дж. Атлас-справочник практикующего врача. Дерматология. М.: Изд-во Панфилова; БИНОМ. Лаборатория знаний; 2012. 536 с.
- Reddy K.K., Farber M.J., Bhavan J., Geronemus R.G., Rogers G.S. Atypical (dysplastic) nevi. Outcomes of surgical excision and association with melanoma. JAMA Dermatol. 2013;149(8):924-934. https://doi.org/10.1001/jamadermatol.
 2013.4440.
2013.4440. - Червонная Л.В. Пигментные опухоли кожи. М.: ГЭОТАР-Медиа; 2016. 81 с.
- Gerami P. 31 — Clinical, Dermoscopic, Pathologic and Molecular Correlation. In: Busam K., Gerami P., Scolyer R. Pathology of Melanocytic Tumors. Elsevier; 2019, pp. 374-384. https://doi.org/10.1016/B978-0-323-37457-6.00031-6.
Публикации в СМИ
Невусы (родинки, родимые пятна) — гамартомоподобные пороки развития кожи, могут развиваться как из элементов эпидермиса, так и собственно дермы (соединительной ткани, сосудистых элементов или меланоцитов). Невусы — пигментированные образования, как правило, выступают над поверхностью кожи. Родинки имеются практически у каждого человека, они могут быть врождёнными или возникать на протяжении всей жизни, особенно в пубертатном периоде, у женщин во время беременности, гормональных дисфункций. Клиническая картина характеризуется чрезвычайным разнообразием числа, размеров, морфологического типа и степени пигментации отдельных элементов — пятен, узелков, бляшек — вплоть до субтотального поражения кожного покрова при так называемых гигантских невусах. Крупными врождёнными невусами считают элементы >20 см или занимающие 2,5% поверхности тела, они рассматриваются как фактор риска малигнизации.
Крупными врождёнными невусами считают элементы >20 см или занимающие 2,5% поверхности тела, они рассматриваются как фактор риска малигнизации.
• Эпидермальные невусы (бородавчатые или по типу родинок) обнаруживаются чаще при рождении, хотя могут развиваться и в детском возрасте (очень редко у взрослых). Внешне могут быть похожи на папилломы (вирусного генеза), но обычно представлены большими линейными бляшками или массивом мелких папул. Эпидермальные невусы чаще бессимптомные. Малигнизация наблюдается редко, за исключением невусов сальных желёз (в 5% случаев возникает базалиома). Гистологически характеризуются акантозом и гиперкератозом. Для невуса сальных желёз характерно также наличие большого числа сальных и апокриновых желёз. Клеточная атипия не наблюдается. Лечение, в основном, с косметической целью. Профилактическое удаление невуса сальных желёз выполняется из-за клинических проявлений (на нём не растут волосы), а не опасности малигнизации.
• Дермальные невусы •• Соединительнотканные невусы преимущественно врождённые, представлены чаще плотными, одиночными папулами и бляшками телесного цвета. Количество волосяных фолликулов в них может быть значительным («свиная кожа»). Этот вариант невусов является идиопатическим и не связан с другими заболеваниями, за исключением «шагреневой кожи» при туберозном склерозе. Гистологически состоят из плотных конгломератов коллагеновых и эластических волокон. Прогностически безопасны и удаляются исключительно по косметическим показаниям •• Сосудистые невусы (гемангиомы) — выстланные эндотелием сосудистые образования, в основном капиллярные, но могут встречаться и кавернозные структуры, особенно в крупных невусах. Типичными считаются 3 клинических типа: клубничный невус, вишнёвый невус и кавернозная гемангиома. Клубничный невус и кавернозные гемангиомы чаще подвергаются спонтанной регрессии, а вишнёвый невус продолжает расти на протяжении жизни. Оперативное лечение проводится по косметическим показаниям, при функциональных нарушениях (локализация в зоне конъюнктивы, губ) или тромбозе вишнёвого невуса (из-за подозрения на малигнизацию) •• Меланоцитарные невусы отличаются наибольшей клинической важностью, учитывая необходимость дифференциальной диагностики с меланомой •• Патогистология.
Количество волосяных фолликулов в них может быть значительным («свиная кожа»). Этот вариант невусов является идиопатическим и не связан с другими заболеваниями, за исключением «шагреневой кожи» при туберозном склерозе. Гистологически состоят из плотных конгломератов коллагеновых и эластических волокон. Прогностически безопасны и удаляются исключительно по косметическим показаниям •• Сосудистые невусы (гемангиомы) — выстланные эндотелием сосудистые образования, в основном капиллярные, но могут встречаться и кавернозные структуры, особенно в крупных невусах. Типичными считаются 3 клинических типа: клубничный невус, вишнёвый невус и кавернозная гемангиома. Клубничный невус и кавернозные гемангиомы чаще подвергаются спонтанной регрессии, а вишнёвый невус продолжает расти на протяжении жизни. Оперативное лечение проводится по косметическим показаниям, при функциональных нарушениях (локализация в зоне конъюнктивы, губ) или тромбозе вишнёвого невуса (из-за подозрения на малигнизацию) •• Меланоцитарные невусы отличаются наибольшей клинической важностью, учитывая необходимость дифференциальной диагностики с меланомой •• Патогистология. Невусные клетки располагаются в виде гнёздных скоплений различного размера и конфигурации в дерме, субэпидермально и между клеточными комплексами. Иногда скопления приобретают диффузный характер и располагаются очень близко к эпидермису вдоль базальной мембраны, при этом отмечаются атрофические изменения эпидермиса. Клетки крупные, различной формы и величины, с чётко видимым ядром, иногда несколькими гиперхромными ядрами, расположенными в виде «розеток» или комковатых скоплений. В некоторых элементах форма клеток веретеновидная, что придаёт невусу сходство с нейрофибромой. Содержание пигмента может быть различным. В «молодых» невусах стромальный компонент выражен слабо, со временем соединительнотканная строма начинает преобладать, такой невус рассматривают как «фиброэпителиальный». Локализация невусных клеток среди базальных кератиноцитов и в зоне базальной мембраны без её нарушения характерна для пограничного невуса, а в сочетании с внутридермальным компонентом — для смешанного невуса.
Невусные клетки располагаются в виде гнёздных скоплений различного размера и конфигурации в дерме, субэпидермально и между клеточными комплексами. Иногда скопления приобретают диффузный характер и располагаются очень близко к эпидермису вдоль базальной мембраны, при этом отмечаются атрофические изменения эпидермиса. Клетки крупные, различной формы и величины, с чётко видимым ядром, иногда несколькими гиперхромными ядрами, расположенными в виде «розеток» или комковатых скоплений. В некоторых элементах форма клеток веретеновидная, что придаёт невусу сходство с нейрофибромой. Содержание пигмента может быть различным. В «молодых» невусах стромальный компонент выражен слабо, со временем соединительнотканная строма начинает преобладать, такой невус рассматривают как «фиброэпителиальный». Локализация невусных клеток среди базальных кератиноцитов и в зоне базальной мембраны без её нарушения характерна для пограничного невуса, а в сочетании с внутридермальным компонентом — для смешанного невуса.
Клинические виды невусов
• Базальноклеточный невус — наследственное заболевание (109400, 601309, ген BCNS, 9q22.3, Â) — характеризуется (обычно доброкачественными) поражениями кожи век, носа, щёк, шеи, верхней челюсти, выглядит как папула телесного цвета, без признаков эрозирования, гистологически не отличается от базальноклеточного рака.
• Бородавчатый невус — поражение эпидермиса, имеющее цвет кожи (или темнее), похожее на бородавку, часто линейное, появляющееся при рождении или в раннем детском возрасте; может быть разных размеров и локализации, единичным или множественным « невус веррукозный.
• Волосатый невус — родинка, покрытая большим количеством растущих волос.
• Гигантский пигментный невус — большой врождённый, с выраженным оволосением, пигментированный невус с преимущественной локализацией на нижних конечностях « пигментно-волосяной невус.
• Голубой невус представляет собой папулу или бляшку на широком основании, различного оттенка серо голубого цвета. Гистологически в дерме находят скопления отростчатых меланоцитов с высоким содержанием пигмента, располагающиеся параллельно эпидермису, что и обусловливает оптический эффект голубизны при падении лучей видимого спектра « Ядассона–Тише невус.
Гистологически в дерме находят скопления отростчатых меланоцитов с высоким содержанием пигмента, располагающиеся параллельно эпидермису, что и обусловливает оптический эффект голубизны при падении лучей видимого спектра « Ядассона–Тише невус.
• Интрадермальный невус — невус с локализацией гнёзд меланоцитов в дерме, а не на границе между эпидермисом и дермой.
• Ито невус — пигментация участка кожи, иннервируемого латеральными ветвями надключичного нерва и латеральным кожным нервом плеча; беспорядочно лежащие в дерме невусные клетки.
• Клубничный невус — небольшой сосудистый невус, сходный по размеру, форме и цвету с клубникой — ярко-красное солитарное образование губчатой плотности. Наблюдается у 3% новорождённых и часто спонтанно облитерируется к 6-7 годам жизни. « кавернозная гемангиома « кавернома « пещеристая гемангиома.
• Односторонний невус — врождённый линейный невус, который располагается по ходу нерва либо на одной стороне тела, либо на части конечности также с одной стороны невус линейный.
• Ота невус (окулодермальный меланоз) — пигментация кожи в зоне иннервации тройничного нерва и конъюнктивы глаза в виде синевато-серых пятен; встречается в Азии, чаще у женщин. Лечение косметическое.
• Невус тёмно-синий глазнично-верхнечелюстной.
• Пограничный невус — невус, состоящий из гнёзд невусных клеток вблизи базального слоя, границы эпидермиса и дермы, выглядит как маленькая, слегка возвышающаяся, плоская, без оволосения, пигментированная (тёмно-коричневая или чёрная) опухоль эпидермо-дермальный невус.
• Приобретённый невус — меланоцитарный невус, который не обнаруживается в первое время после рождения, но появляется в детском возрасте или у взрослых.
• Пылающий невус (пятно портвейна) — большой васкуляризованный невус, имеющий пурпурную окраску, обычно расположен на голове и шее. В отличие от других сосудистых невусов, в этом случае не наблюдается пролиферации большого количества сосудистых элементов, а отмечается расширение нормального числа сосудов кожи. С прогрессированием размера сосудов, появляется выпячивание и изменение цвета невуса с розового до пурпурно-красного. См. также Стёрджа–Уэбера синдром в приложении к этой статье.
С прогрессированием размера сосудов, появляется выпячивание и изменение цвета невуса с розового до пурпурно-красного. См. также Стёрджа–Уэбера синдром в приложении к этой статье.
• Сальный невус (Ядассона) — врождённая гиперплазия сальных желёз с папиллярным акантозом эпидермиса.
• С густыми курчавыми волосами невус — врождённые очаги роста спирально закрученных волос в волосистой части головы « ограниченная [симметричная] аллотрихия.
• Синдром атипического невуса (МКБ–10: D22 Меланоформный невус; *155600, #155601 [мутация гена CDKN2A ингибитора 2А циклин зависимой киназы, OMIM 600160.0001]) — наследуемое заболевание (Â)) выраженного семейного характера. Распространённость: в США до 5% общей популяции, в конце 90-х годов зарегистрировано около 40 тыс семейных случаев и 4,6 млн спорадических форм. Синоним: диспластический меланоцитарный невус •• Клиническая картина. Обычно пятнистые элементы, но встречаются папулёзные, бляшковидные с центральной папулой или микропапулами, овальной или неправильной формы, иногда с отростками, размером 5 мм и более, с мелкофестончатым чётким контуром, разной интенсивности коричневого цвета (вплоть до чёрного), с эритематозным венчиком по периферии •• Патогистология. Общепринятых критериев диагностики диспластического невуса не существует. Архитектоника диспластического невуса предполагает неравномерную гиперплазию эпидермальных отростков с гипертрофией концевых отделов. Ячейки меланоцитов соседних выростов часто соединяются. Среди эпидермальных меланоцитов отмечается спектр цитологических изменений: от умеренного плеоморфизма до явной атипии. Выраженная степень последней может трактоваться как меланома in situ.
Общепринятых критериев диагностики диспластического невуса не существует. Архитектоника диспластического невуса предполагает неравномерную гиперплазию эпидермальных отростков с гипертрофией концевых отделов. Ячейки меланоцитов соседних выростов часто соединяются. Среди эпидермальных меланоцитов отмечается спектр цитологических изменений: от умеренного плеоморфизма до явной атипии. Выраженная степень последней может трактоваться как меланома in situ.
• Синдром красно-голубого пузырчатого невуса (*112200, Â)). Пузыревидные гемангиомы кожи, особенно туловища и верхних конечностей, ночная боль, регионарный гипергидроз, кровоточащие желудочно-кишечные гемангиомы, ангиоматозный гигантизм, медуллобластома мозжечка.
• Слизистой оболочки губчатый белый невус — врождённый кератоз слизистых, проявляющийся утолщённой белой губчатой складкой слизистой оболочки полости рта.
• Сосудистый невус — врождённое неравномерное окрашивание кожи красного цвета из-за разрастания кожных капилляров « невус сосудистый « гемангиома.
• Шпитца (Спитц) невус — доброкачественная ювенильная меланома (см. далее Ювенильный невус).
• Эластический Левандовского невус — скопления гладких или бугристых папул цвета слоновой кости или телесного цвета, встречаются симметрично на туловище и конечностях « коллагенозный невус.
• Ювенильный невус •• Веретеноклеточный и/или эпителиоидно клеточный невус (ювенильная меланома, доброкачественная ювенильная меланома, невус Спитц) — доброкачественный меланоцитарный невус, как правило, приобретённый, имеющий характерное гистологическое строение, отличное от меланоцитарных невусов других типов. Первоначально полагали, что возникает преимущественно у детей, но в настоящее время показано, что ювенильный невус чаще (до 60%) встречается у взрослых •• Клиническая картина. Обычно экзофитное образование полушаровидной формы, реже — плоское; плотной эластической консистенции, с чёткими границами; цвет — от светло красного до тёмно коричневого, иногда чёрного; поверхность гладкая или папилломатозная •• Патогистология.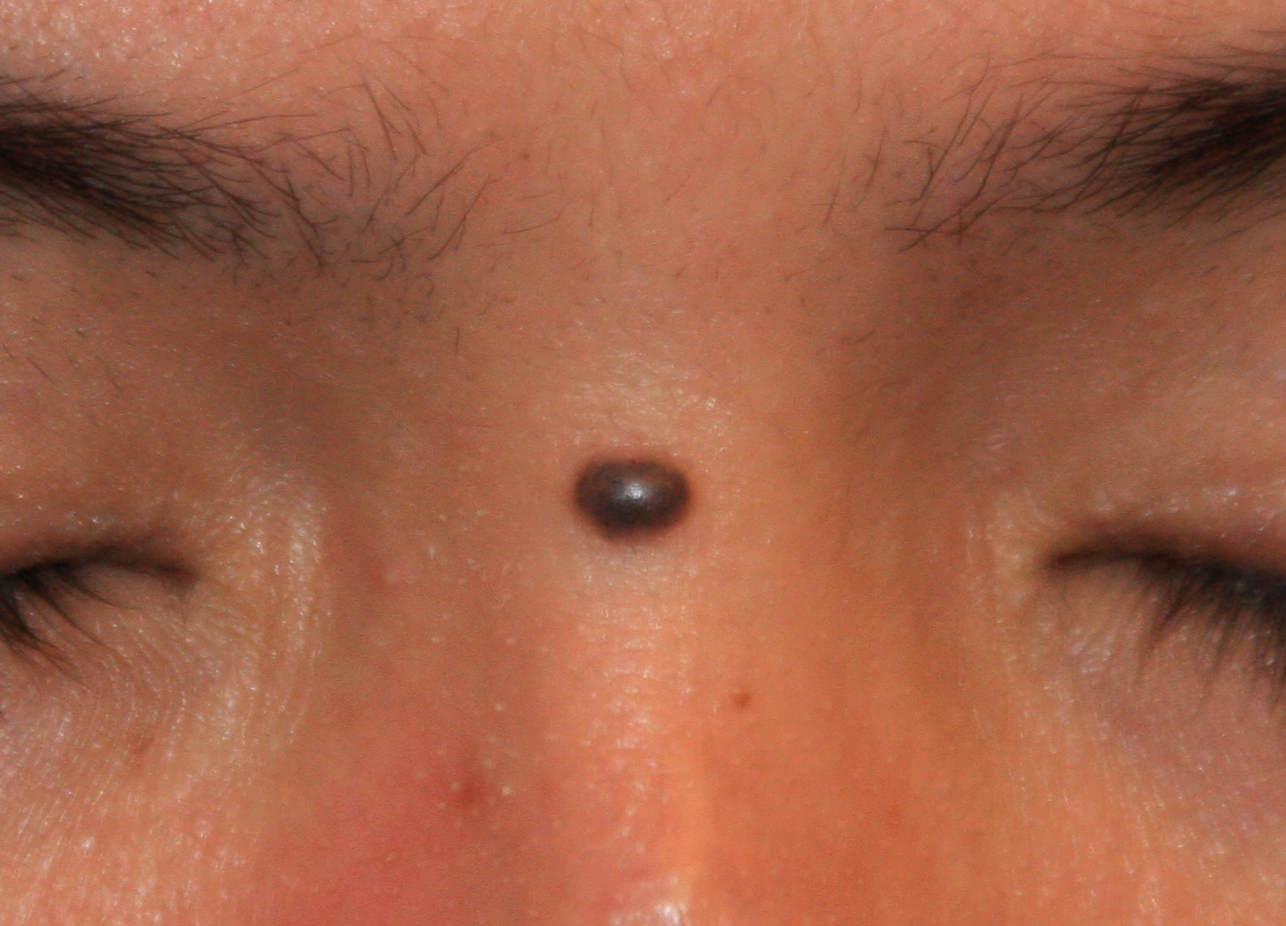 По своей архитектонике невус может быть пограничным, смешанным (наиболее часто), внутридермальным. По клеточному составу может быть веретеновидным, эпителиоидно клеточным и чаще смешанным. Содержание пигмента в меланоцитах вариабельно. Характерно наличие эозинофильных скоплений — фрагментов базальной мембраны (так называемые тельца Камино). Веретенообразные меланоциты вытянутой формы с удлинённым ядром и крупным эозинофильным ядрышком. В эпидермисе меланоциты имеют длинные цитоплазматические отростки и формируют крупные эллипсовидные гнёзда, длинная ось которых обычно перпендикулярна к поверхности кожи. В дерме веретеновидные клетки чаще расположены параллельно друг другу в виде пучков или тяжей. Полигональные или округлые эпителиоидные клетки с обильной мелкозернистой, сетчатой или вакуолизированной цитоплазмой. Часто встречаются гигантские многоядерные клетки.
По своей архитектонике невус может быть пограничным, смешанным (наиболее часто), внутридермальным. По клеточному составу может быть веретеновидным, эпителиоидно клеточным и чаще смешанным. Содержание пигмента в меланоцитах вариабельно. Характерно наличие эозинофильных скоплений — фрагментов базальной мембраны (так называемые тельца Камино). Веретенообразные меланоциты вытянутой формы с удлинённым ядром и крупным эозинофильным ядрышком. В эпидермисе меланоциты имеют длинные цитоплазматические отростки и формируют крупные эллипсовидные гнёзда, длинная ось которых обычно перпендикулярна к поверхности кожи. В дерме веретеновидные клетки чаще расположены параллельно друг другу в виде пучков или тяжей. Полигональные или округлые эпителиоидные клетки с обильной мелкозернистой, сетчатой или вакуолизированной цитоплазмой. Часто встречаются гигантские многоядерные клетки.
Лечение показано при диспластических, узловатых и гигантских пигментированных невусах из-за их возможной малигнизации • Показания к иссечению любого пигментированного образования •• Изменение цвета, размера, формы и консистенции •• Болевой синдром •• Регионарная лимфаденопатия • Дальнейшую терапию после эксцизионной биопсии с участком здоровой кожи назначают, исходя из результатов гистологического исследования и локализации образования.
МКБ-10 • D22 Меланоформный невус • I78.1 Невус неопухолевый • Q82.5 Врождённый неопухолевый невус
Приложение. Стёрджа–Уэбера синдром (185300) относят к факоматозам, характерна триада: врождённая кожная ангиома (пылающий невус), обычно по ходу тройничного нерва, чаще односторонняя; гомолатеральная менингеальная ангиома с кальцинозом и неврологическими признаками; ангиомы сосудистой оболочки глаза, часто с вторичной глаукомой; при неполных формах возможны любые два или более признаков, иногда с ангиомами другой локализации « энцефалотригеминальный ангиоматоз « Стёрджа–Уэбера болезнь « невоидная аменция.
Лазерное удаление сосудистых звездочек по доступной цене в Долгопрудном
РОДИНКИ (ПИГМЕНТНЫЕ ИЛИ МЕЛАНОЦИТАРНЫЕ НЕВУСЫ)
Родинки (пигментные или меланоцитарные невусы) это доброкачественные опухоли кожи, состоящие из невусных клеток и меланоцитов. Распространены они повсеместно и встречаются одинаково часто у мужчин и женщин.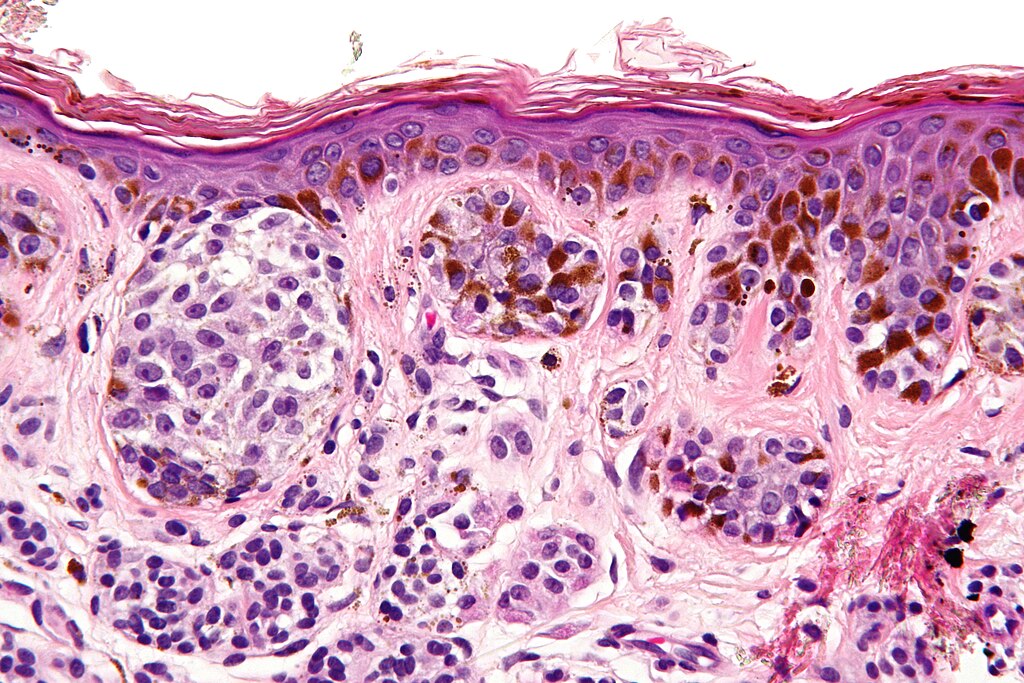 1-2% невусов являются врожденными (то есть появляются с рождения и в первые 2 года жизни). Более 90% невусов появляются до 30 лет. Приобретенные после 30 лет невусы, возникающие на защищенных от воздействия солнца участках тела, должны считаться подозрительными (риск озлокачествления) и наблюдаться.
1-2% невусов являются врожденными (то есть появляются с рождения и в первые 2 года жизни). Более 90% невусов появляются до 30 лет. Приобретенные после 30 лет невусы, возникающие на защищенных от воздействия солнца участках тела, должны считаться подозрительными (риск озлокачествления) и наблюдаться.Если пациент обратился в клинику с целью лазерного удаление родинки (невуса), на консультации врач дерматоонколог проводит дерматоскопическое исследование родинки. Дерматоскопия — это метод нетравматичной микроскопии кожи, позволяющий увидеть внутрикожные изменения эпидермиса и дермы, не прибегая к биопсии кожи. Коротко говоря, дерматокопия позволяет «заглянуть» под роговой слой эпидермиса и рассмотреть кожное образование более детально. Что позволяет принять решение о возможности лазерного удаления родинки. Зачастую различные по своей сути образования внешне выглядят одинаково, при осмотре же в дерматоскоп врач выявляет важные особенности и определяет свою дальнейшую тактику.
Дерматоскопическое исследование позволяет выявлять на ранних стадиях злокачественные опухоли кожи и диспластические невусы (потенциально опасные в плане озлокачествления).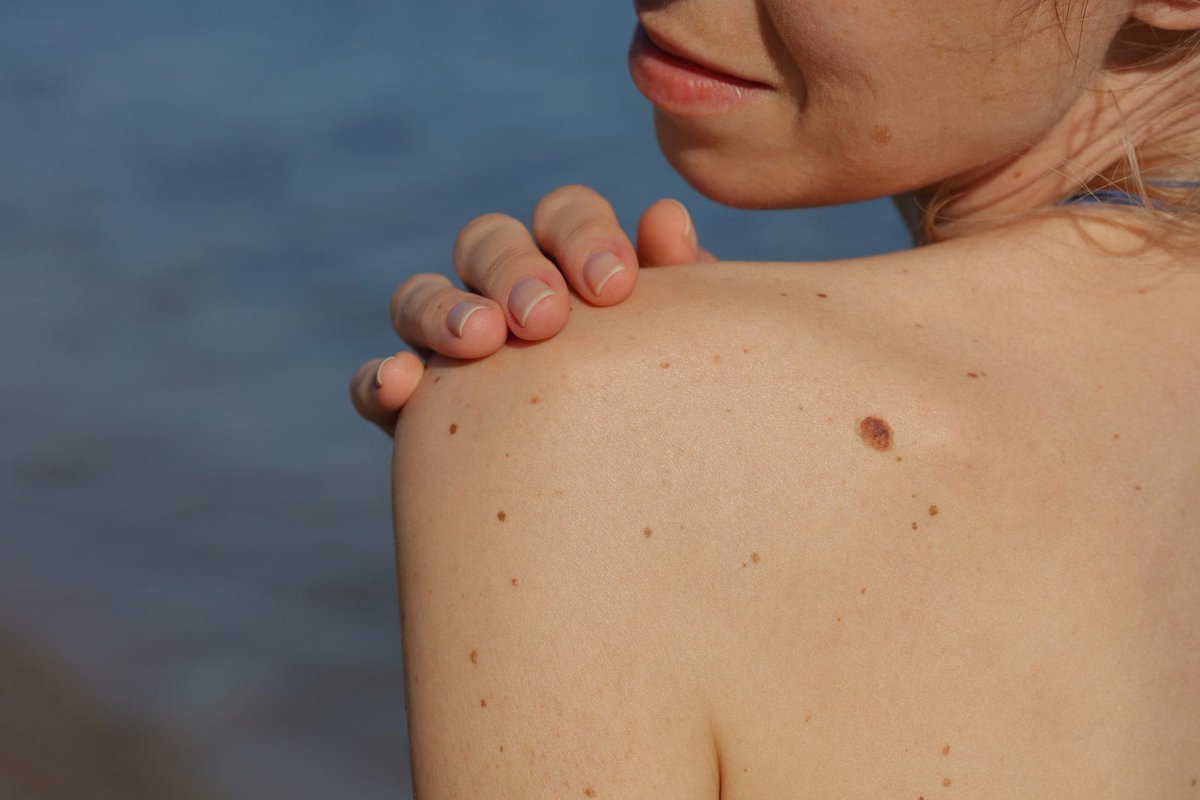 После осмотра с помощью дерматоскопа врач может дать рекомендации: динамическое наблюдение; лазерное удаление родинки; удаление родинки у хирурга с захватом окружающих тканей с последующим гистологическим исследованием; или рекомендовать обратиться к онкологу.
После осмотра с помощью дерматоскопа врач может дать рекомендации: динамическое наблюдение; лазерное удаление родинки; удаление родинки у хирурга с захватом окружающих тканей с последующим гистологическим исследованием; или рекомендовать обратиться к онкологу.Лазерное удаление родинок с косметическими целями допустимо только в том случае, если доброкачественность родинки не вызывает сомнений. В остальных случаях иссечение родинок производится с захватом 1,5-2 мм окружающей ткани с последующим обязательным гистологическим исследованием материала. Такое удаление возможно произвести только хирургическим путем. Преимуществом лазерного удаления родинок на лице является минимальное рубцевание, в отличие от других методов удаления.
Лазерное удаление родинок цена
В связи с внешним сходством невусов (родинок) с некоторыми формами злокачественной меланомы, удаление невусов производится строго после дерматоскопии
| Услуга | Время | Цена |
|---|---|---|
| Консультация врача дерматолога-косметолога, дерматоонколога (дерматоскопия одного кожного новообразования и рекомендации при обращении с целью удаления) | 20 мин | 1100р |
| Дерматоскопия дополнительных кожных новообразований (цена за один элемент) | 10 мин | 400р |
Прием врача дерматоонколога первичный при множественных невусах (родинках): осмотр всего тела, консультация, дерматоскопия невусов.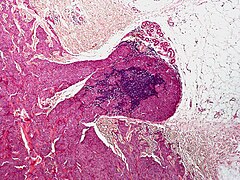 | 45 мин | 3500р |
| Прием врача дерматоонколога повторный: осмотр после удаления новообразования, дерматоскопия (при необходимости), консультация. | 10 мин | 600р |
Удаление новообразований на коже лица, шеи, туловища, конечностей (кроме ладоней и стоп) | ||
| Лазерное удаление кожного новообразования до 1 мм | 200р | |
| Лазерное удаление кожного новообразования до 5 мм | 800р | |
| Лазерное удаление кожного новообразования 10 мм | 1800р | |
Удаление новообразований на коже век, волосистой части головы, интимных областей | ||
| Лазерное удаление кожного новообразования до 1 мм | 500р | |
| Лазерное удаление кожного новообразования до 5 мм | 1000р | |
| Лазерное удаление кожного новообразования до 10 мм | 2500р | |
Обезболивание | ||
| Артикаин | 500р | |
Гистологическое исследование удалённого новообразования (исследование проводит лаборатория Бион) | ||
| Гистологическое исследование удалённого новообразования (одно новообразование) | 1 неделя | 2500р |
Записывайтесь на прием
Родинки (невусы) могут визуально изменяться со временем.
 Существующие невусы могут увеличиваться в размерах, приобретать более сильную окраску в подростковом возрасте и во время беременности. Воздействие солнца и солярия доказано являются стимулом для роста невусных клеток. У большинства взрослых имеется от 12 до 20 родинок. Большее количество может быть семейной особенностью.
Существующие невусы могут увеличиваться в размерах, приобретать более сильную окраску в подростковом возрасте и во время беременности. Воздействие солнца и солярия доказано являются стимулом для роста невусных клеток. У большинства взрослых имеется от 12 до 20 родинок. Большее количество может быть семейной особенностью.Приобретенные невусы вначале появляются в виде плоских, круглых и равномерно окрашенных папул. Невусы могут быть лишь немного темнее окружающей кожи и слегка приподнятыми в центре.
Прежде всего, за состоянием родинок нужно наблюдать самостоятельно. Если вы отметили какие-либо видимые изменения или чувствуете дискомфорт в области родинки, обратитесь к онкологу.
Поводом для обращения к онкологу являются следующие замеченные пациентом признаки:
- Появление невуса после 30 лет, особенно на защищённых от воздействия солнца участках кожи.
- Появление асимметрии, «фестончатости» очертаний, изменение форм (неправильная форма: напоминающая географическую карту, с «заливами» и «полуостровами»).

- Заметное увеличение или уменьшение размера невуса, а также необычно быстрый рост.
- Появление зуда и жжения.
- Шелушение поверхности невуса с образованием сухих корочек.
- Изменение окраски невуса (неравномерный цвет: беспорядочное смешение различных оттенков красного, серого, синего с вкраплениями коричневого или чёрного цвета).
- Исчезновение кожного рисунка на поверхности невуса.
- Появление блестящей, глянцевой поверхности невуса.
- Появление дополнительных узелков на поверхности невуса или рядом с ним.
- Изъязвление поверхности невуса.
- Появление венчика покраснения вокруг невуса.
- Мокнутие поверхности невуса.
- Кровоточивость (спонтанная или при минимальной травматизации).
Невус, не имеющий вышеперечисленных признаков, желательно удалять в случае, если он располагается в заведомо травмируемых местах (пряжка ремня, бюстгалтер, волосистая часть головы, воротниковая, паховая и поясничная области) или подвергается частой инсоляции (воздействию солнечных лучей). Так как частая травматизация и воздействие ультрафиолета могут способствовать озлокачествлению.
Так как частая травматизация и воздействие ультрафиолета могут способствовать озлокачествлению.
Приходя к специалисту на процедуру необходимо понимать, что на месте удаленного образования в любом случае остаются рубчики. Удаленные невусы иногда могут рецидивировать.
В завершение хочется сказать — до сих пор вопрос тщательного изучения невусов остается открытым. До конца не ясны точные причины и механизмы их появления и развития, рецидивирования и озлокачествления. Каждая невусная клетка обладает «клональностью»- способностью давать прогрессирующий рост под воздействием различных факторов. Решение об удаление невуса в косметических целях должно быть взвешенным и обдуманным.
Материал подготовлен: врач дерматолог-косметолог, дерматоонколог Ратникова С.В.
Почему Вам следует обратиться к нам:
- Врачи дерматоонкологи клиники Code Beauty Medicine обязательно проводят дерматоскопию перед лазерным удалением родинок.
- В клинике косметологии Code Beauty Medicine имеется единственный в Долгопрудном эрбиевый лазер для удаления кожных новообразований.

- Удаление родинок эрбиевым лазером практически безболезненно и часто не требует анестезии.
- Лазерное удаление родинок оставляет минимальный рубчик, в сравнении с другими методами удаления, такими, как удаление электрокоагулятором или радиоволновым методом.
- Удаление родинок эрбиевым лазером позволяет сохранить неповрежденный материал для дальнейшего гистологического исследования.
* Имеются противопоказания. Требуется консультация врача.
Поделиться:
С вами работают:
Не знаете, какую процедуру выбрать?
Пройдите онлайн-тестирование и получите индивидуальный план косметологических процедур!
Меланоцитарные невусы — StatPearls — NCBI Bookshelf
Продолжение обучения
Для улучшения результатов лечения пациентов крайне важно тщательное обследование кожи. Этот осмотр должен включать в себя часто упускаемые из виду поверхности, в том числе подошвенные поверхности конечностей, межбровные пространства и акральные области, включая кожу головы.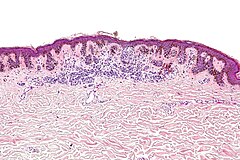 Подошвенные меланомы обычно поздно диагностируются, хуже реагируют на лечение и имеют значительно более высокий уровень смертности по сравнению с более проксимальными меланомами.Таким образом, важна простая клиническая оценка, направленная на выявление асимметрии, неровных границ, изменения цвета, диаметра более 6 мм и изменения во времени или высоты поражения. Если есть сомнения в поражении кожи, следует провести биопсию. В этом задании описывается патофизиология, оценка и лечение меланоцитарных невусов, а также подчеркивается роль межпрофессиональной команды в лечении пострадавших пациентов.
Подошвенные меланомы обычно поздно диагностируются, хуже реагируют на лечение и имеют значительно более высокий уровень смертности по сравнению с более проксимальными меланомами.Таким образом, важна простая клиническая оценка, направленная на выявление асимметрии, неровных границ, изменения цвета, диаметра более 6 мм и изменения во времени или высоты поражения. Если есть сомнения в поражении кожи, следует провести биопсию. В этом задании описывается патофизиология, оценка и лечение меланоцитарных невусов, а также подчеркивается роль межпрофессиональной команды в лечении пострадавших пациентов.
Цели:
Определите факторы риска меланоцитарного невуса.
Опишите клиническую картину пациента с меланоцитарными невусами.
Ознакомьтесь с вариантами лечения меланоцитарных невусов.
Опишите стратегии межпрофессиональной команды для улучшения координации помощи и коммуникации, чтобы улучшить лечение меланоцитарных невусов и улучшить результаты.

Введение
Пигментные поражения кожи обычно называют веснушками.К ним относятся солнечное лентиго, врожденные невусы, невусы слизистых оболочек и особые невусы ладоней и подошв. Эта деятельность поможет клинически дифференцировать различные невусы стопы от акральной лентигинозной меланомы. Подошвенные меланомы обычно поздно диагностируются, хуже реагируют на лечение и имеют значительно более высокий уровень смертности по сравнению с более проксимальными меланомами.
Этиология
Тяжелый детский ожог тесно связан с повышенным риском меланомы, в то время как более продолжительное профессиональное воздействие не вызывает повышенного риска.Эти результаты подтверждают гипотезу о том, что на риск развития меланомы в первую очередь влияет периодическое интенсивное пребывание на солнце, которое парализует нормальный иммунный надзор и разрушает аномальные меланоциты. Солнечные ожоги в подростковом возрасте нарушают пожизненный иммунный надзор и нарушают нормальный апоптоз опухолевых клеток.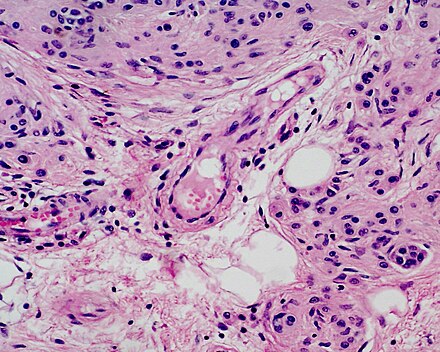 Генетическая предрасположенность также может помочь объяснить меланому в затененных областях. Целых 1 из 10 случаев меланомы может быть связан с унаследованными дефектными генами.[2]
Генетическая предрасположенность также может помочь объяснить меланому в затененных областях. Целых 1 из 10 случаев меланомы может быть связан с унаследованными дефектными генами.[2]
Эпидемиология
Фактический рост заболеваемости меланомой, скорее всего, связан с общим увеличением воздействия ультрафиолетового (УФ) света.Хотя меланома в целом считается редким заболеванием, заболеваемость меланомой во всем мире резко возрастает, и, несмотря на увеличение усилий по скринингу, показатели смертности заметно не улучшились. В Соединенных Штатах меланома занимает пятое место среди онкологических заболеваний у мужчин и седьмое у женщин, и ее заболеваемость удвоилась за последние десять лет. При изучении данных (с 1992 по 2004 год) исследователи обнаружили, что фактическая заболеваемость меланомой (всей толщины и среди всех социально-экономических уровней) увеличивает бремя случаев.Увеличение составляет от 4,7 до 7,7 случаев на 100 000 пожилых мужчин и с 5,5 до 13,9 случаев на 100 000 женщин.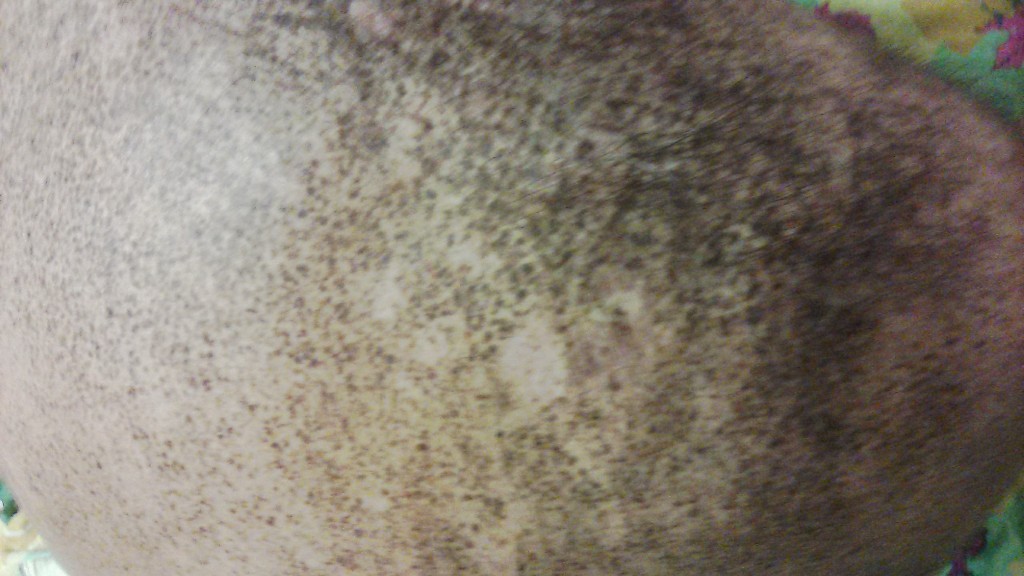 Хотя 5% всех меланом локализуются на ногах, меланома стоп относительно редко встречается у белых. Среди выходцев из Восточной Азии и людей с темной пигментацией акральная лентигинозная меланома является наиболее распространенным подтипом.[3]
Хотя 5% всех меланом локализуются на ногах, меланома стоп относительно редко встречается у белых. Среди выходцев из Восточной Азии и людей с темной пигментацией акральная лентигинозная меланома является наиболее распространенным подтипом.[3]
Патофизиология
Меланоциты представляют собой особые дендритные клетки, происходящие из нервного гребня и обладающие способностью распространяться по всей поверхности тела. Эта способность к распространению может помочь объяснить способность меланомы метастазировать через тканевые равнины и через кровеносные сосуды, нервы и лимфатические сосуды.Этот метастатический паспорт помогает сделать меланому более смертоносной, чем другие виды рака кожи, которые ограничены смежным распространением. Хотя ступня подвергается меньшему солнечному облучению, меланома стопы более смертельна, чем меланома проксимального отдела бедра. Хотя 5-летняя выживаемость при меланоме голени составляет 94%, 5-летняя выживаемость при меланоме стопы составляет 77%. Акральная меланома имеет значительно худший прогноз, чем другие подтипы меланомы.
Акральная меланома имеет значительно худший прогноз, чем другие подтипы меланомы.
Анамнез и физикальное исследование
Пациенты могут иметь изменяющуюся подошвенную родинку.Однако акральные меланомы обычно обнаруживаются только при целенаправленном осмотре подошв и перепонок пальцев ног. Анатомически на ладонях и подошвах отсутствуют волосяные фолликулы и сальные железы, но имеется много потовых протоков. Ладони и подошвы намного толще, а регулярные узоры искажаются при ходьбе и хватательном давлении. Важна простая клиническая оценка, направленная на выявление асимметрии, неровных границ, вариации цвета, диаметра более 6 мм и изменений с течением времени или высоты поражения. Дополнение этих клинических наблюдений дерматоскопией может увеличить диагностическую проницательность на 20%.Полное обследование подошв, межпальцевых пространств и ногтевых единиц является важным компонентом обследования нижних конечностей.
Оценка
В дополнение к оценке характеристик пигментного поражения от А до Е, существуют определенные дерматоскопические картины, которыми можно руководствоваться при обследовании.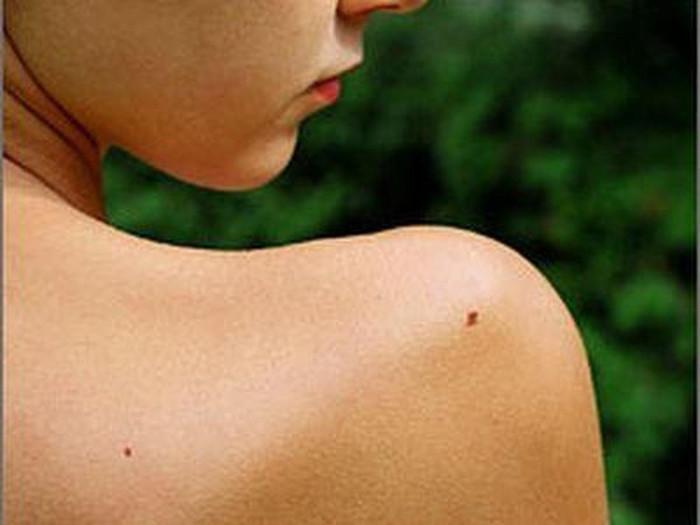 Следует учитывать три доброкачественных паттерна и один злокачественный дерматоскопический паттерн. Параллельные борозды линейной пигментации являются доброкачественными более чем в 93,2% случаев. Фибриллярный рисунок с пигментированными бороздами и тонкими угловатыми перекрещивающимися нитями, а также решетчатый пигмент являются доброкачественными узорами.Что наиболее важно, параллельный рисунок гребней с широкой диффузной пигментацией гребней предсказывает меланому в 93,7% случаев. Нарушение нормального рисунка параллельных борозд указывает на биопсию.[7]
Следует учитывать три доброкачественных паттерна и один злокачественный дерматоскопический паттерн. Параллельные борозды линейной пигментации являются доброкачественными более чем в 93,2% случаев. Фибриллярный рисунок с пигментированными бороздами и тонкими угловатыми перекрещивающимися нитями, а также решетчатый пигмент являются доброкачественными узорами.Что наиболее важно, параллельный рисунок гребней с широкой диффузной пигментацией гребней предсказывает меланому в 93,7% случаев. Нарушение нормального рисунка параллельных борозд указывает на биопсию.[7]
Лечение/управление
Атипичный невус на подошве можно подвергнуть биопсии с помощью простого 2-миллиметрового пробойника. Если изначально выбрано широкое иссечение, рекомендуется 1-2 мм обод нормальной кожи вместе с манжетой подкожного жира. Как только меланома обнаружена с помощью пункционной или тотальной биопсии, выполняется более широкое иссечение с хирургическими полями 1 см для опухолей толщиной от 0 до 2 мм и до 5 см для опухолей толщиной более 2 мм.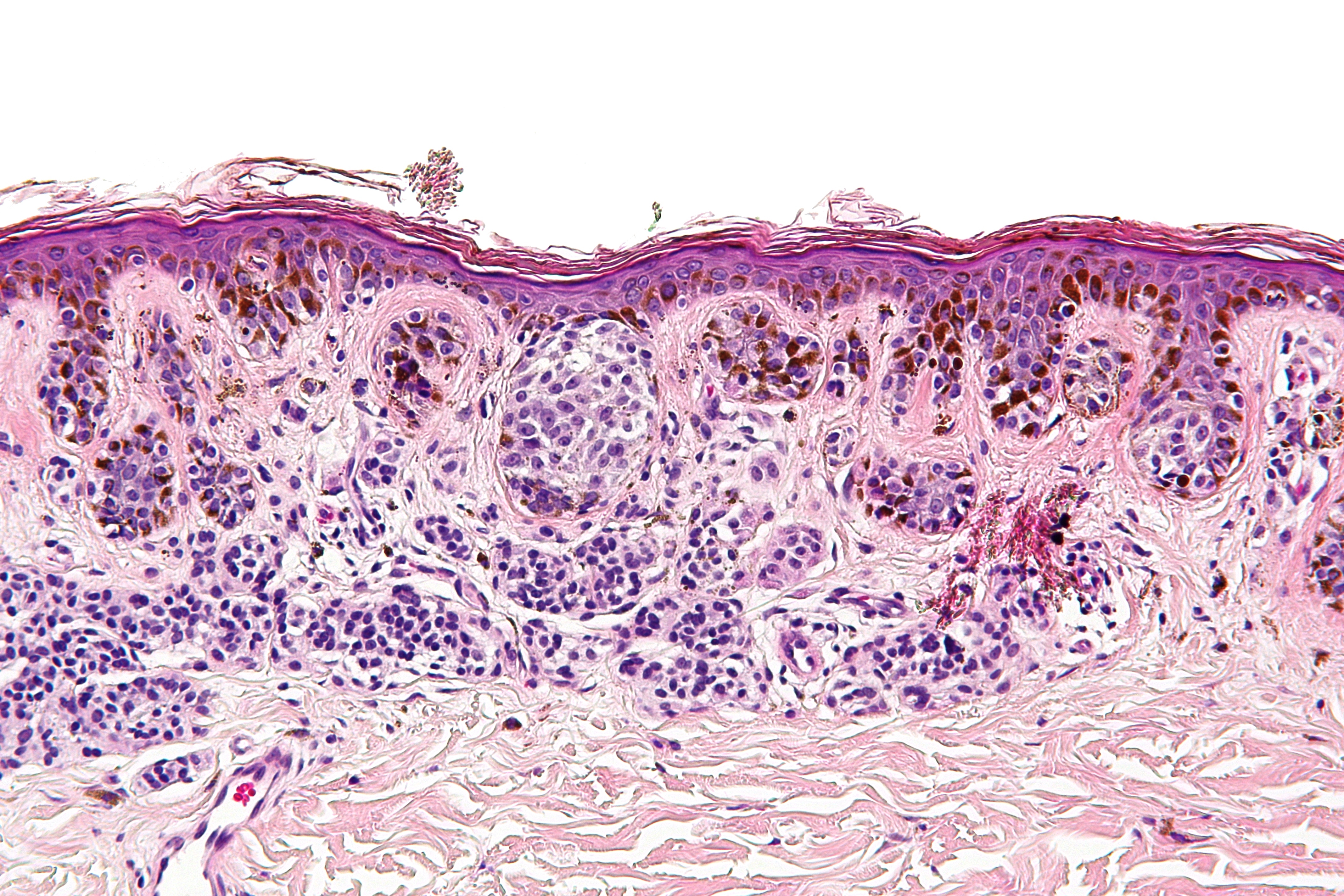 Толщина 1 мм может быть запланирована. Это может привести к обширной потере ткани, что может потребовать ампутации. Как правило, небольшие участки иссечения подошвенной меланомы могут гранулироваться. После первичного заживления можно использовать пластику кожи и лоскуты для восстановления опорной функции. Микрохирургия Мооса используется для минимизации потери тканей. Опытная онкологическая команда важна для улучшения результатов. База данных по стадированию меланомы основана на клиническом опыте более 38 900 пациентов с меланомой и включает систему опухоли, узлов, метастазов (TNM).Он основан на оценке первичной опухоли (T), регионарных лимфатических узлов (N) и мест отдаленного метастазирования (M). Толщина Бреслоу в первую очередь определяет T и зависит от скорости митоза опухоли. 10-летняя выживаемость постепенно снижается: с 96% при толщине первичных поражений <0,5 мм до 54% при толщине очагов от 4,01 до 6 мм [8]. Обозначение N или лимфатического узла оценивает распространение регионарных лимфатических узлов и оказывает серьезное негативное влияние на долгосрочную выживаемость.
Толщина 1 мм может быть запланирована. Это может привести к обширной потере ткани, что может потребовать ампутации. Как правило, небольшие участки иссечения подошвенной меланомы могут гранулироваться. После первичного заживления можно использовать пластику кожи и лоскуты для восстановления опорной функции. Микрохирургия Мооса используется для минимизации потери тканей. Опытная онкологическая команда важна для улучшения результатов. База данных по стадированию меланомы основана на клиническом опыте более 38 900 пациентов с меланомой и включает систему опухоли, узлов, метастазов (TNM).Он основан на оценке первичной опухоли (T), регионарных лимфатических узлов (N) и мест отдаленного метастазирования (M). Толщина Бреслоу в первую очередь определяет T и зависит от скорости митоза опухоли. 10-летняя выживаемость постепенно снижается: с 96% при толщине первичных поражений <0,5 мм до 54% при толщине очагов от 4,01 до 6 мм [8]. Обозначение N или лимфатического узла оценивает распространение регионарных лимфатических узлов и оказывает серьезное негативное влияние на долгосрочную выживаемость. Биопсия сторожевого лимфатического узла (СЛУ) рекомендуется при опухолях, равных или превышающих 0.толщиной 75мм. В случае положительного результата рекомендуется полная диссекция лимфатических узлов. Затем пациентам с ожидаемой продолжительностью жизни более десяти лет рекомендуется адъювантный интерферон-альфа. Терапия, нацеленная на антигены Т-лимфоцитов, может индуцировать противоопухолевый иммунный ответ. Ипилимумаб является ингибитором иммунных контрольных точек и имеет увеличенную выживаемость. Осложнения включают обострение ранее существовавших иммунных нарушений. Моноклональные антитела против запрограммированной клеточной гибели (PD-1), такие как ниволумаб и пембролизумаб, продемонстрировали более эффективные результаты, чем обычные препараты, в клинических испытаниях при различных распространенных солидных опухолях, включая меланому, немелкоклеточную карциному легкого и карциному почки.Пятилетняя выживаемость при подошвенной меланоме составляет 82% при поражениях до 1,49 мм и 0% при поражениях более 3,5 мм [9].
Биопсия сторожевого лимфатического узла (СЛУ) рекомендуется при опухолях, равных или превышающих 0.толщиной 75мм. В случае положительного результата рекомендуется полная диссекция лимфатических узлов. Затем пациентам с ожидаемой продолжительностью жизни более десяти лет рекомендуется адъювантный интерферон-альфа. Терапия, нацеленная на антигены Т-лимфоцитов, может индуцировать противоопухолевый иммунный ответ. Ипилимумаб является ингибитором иммунных контрольных точек и имеет увеличенную выживаемость. Осложнения включают обострение ранее существовавших иммунных нарушений. Моноклональные антитела против запрограммированной клеточной гибели (PD-1), такие как ниволумаб и пембролизумаб, продемонстрировали более эффективные результаты, чем обычные препараты, в клинических испытаниях при различных распространенных солидных опухолях, включая меланому, немелкоклеточную карциному легкого и карциному почки.Пятилетняя выживаемость при подошвенной меланоме составляет 82% при поражениях до 1,49 мм и 0% при поражениях более 3,5 мм [9].
Дифференциальный диагноз
0ATYPICAL MOLE
BASAL CARCINOMA
Café Au Lait Spots
Cockade Nevus
кожная меланома
Nevi OTA и ITO
Невус spilus
Узловые поражения
Пиогенная гранулема
Жемчуг и другие проблемы
Консультация пациентов по использованию солнцезащитных кремов, выполнение всех видов меланатом и предотвращение самообследования кроватей.Раннее выявление путем полного обследования нижних конечностей с помощью дерматоскопии должно сократить время диагностики акральной меланомы и улучшить выживаемость.
Улучшение результатов работы бригады здравоохранения
Диагностика и лечение меланоцитарных невусов лучше всего выполняются межпрофессиональной командой, в которую также входят фармацевт и медсестры; последние два играют роль в просвещении общественности по вопросам профилактики.
Если меланоцитарный невус не диагностирован, прогноз неблагоприятный.Таким образом, для улучшения результатов лечения жизненно важно тщательное обследование кожи. Пациенты могут иметь изменяющуюся подошвенную родинку. Акральные меланомы обычно обнаруживаются только при целенаправленном осмотре подошв и перепонок пальцев ног. Важна простая клиническая оценка, направленная на выявление асимметрии, неровных границ, вариации цвета, диаметра более 6 мм и изменений с течением времени или высоты поражения. Если есть сомнения в поражении кожи, следует провести биопсию.
Рисунок
Атипичный меланоцитарный невус.Предоставлено DermNetNZ
Рисунок
Дерматоскопия невуса левой дуги с параллельными гребнями. Предоставлено Майроном Бодманом DPM
Рисунок
Часть ABCD для обнаружения меланомы. На левой стороне сверху вниз: меланомы с (A) асимметрией, (B) неровной, рваной или зазубренной границей, (C) окрашиванием в различные оттенки коричневого, черного или коричневого и (D) диаметром, который изменился (подробнее. ..)
..)
Рисунок
Меланоцитарный невус на правой пятке у 62-летнего мужчины с диабетом.Предоставлено Майроном Бодманом, DPM
Ссылки
- 1.
- Ван М., Сюй И., Ван Дж., Цуй Л., Ван Дж., Ху Х.Б., штаб-квартира Цзяна, Хун З.Дж., Юань С.М. Хирургическое лечение подошвенной меланомы: ретроспективное исследование в одном центре. J Foot Хирургия лодыжки. 2018 июль — август; 57 (4): 689-693. [PubMed: 29631972]
- 2.
- Wang B, Qu XL, Chen Y. Идентификация потенциальных прогностических генов меланомы человека. J Cell Physiol. 2019 июнь; 234 (6): 9810-9815. [PubMed: 30500072]
- 3.
- Бартош В., Куллова М. Злокачественные меланомы кожи, возникающие на стопах. Клин Онкол. 2018 Лето; 31(4):289-292. [PubMed: 30541312]
- 4.
- Palicka GA, Rhodes AR. Акральные меланоцитарные невусы: распространенность и распределение грубых морфологических признаков у белых и черных взрослых. Арка Дерматол. 2010 г., октябрь; 146 (10): 1085-94.
 [PubMed: 20956637]
[PubMed: 20956637] - 5.
- Бристоу I, Бауэр С. Меланома стопы. Clin Podiatr Med Surg. 2016 июль;33(3):409-22. [PubMed: 27215160]
- 6.
- Лаллас А., Киргидис А., Кога Х., Москарелла Э., Чандл П., Апалла З., Ди Стефани А., Иоаннидес Д., Киттлер Х., Кобаяши К., Лазариду Э., Лонго К., Фан А., Саида Т., Танака М., Томас Л. , Zalaudek I, Argenziano G. Контрольный список BRAAFF: новый дерматоскопический алгоритм диагностики акральной меланомы. Бр Дж Дерматол. 2015 г., октябрь; 173 (4): 1041-9. [PubMed: 26211689]
- 7.
- Bristow IR, de Berker DA, Acland KM, Turner RJ, Bowling J. Клинические рекомендации по распознаванию меланомы стопы и ногтевого ложа.J Foot Res. 2010 01 ноября; 3:25. [Бесплатная статья PMC: PMC2987777] [PubMed: 21040565]
- 8.
- Crompton JG, Gilbert E, Brady MS. Клинические последствия восьмого издания Американского объединенного комитета по стадированию меланомы рака. Дж. Хирург Онкол. 2019 Январь; 119 (2): 168-174.
 [PubMed: 30575031]
[PubMed: 30575031] - 9.
- Richtig E. Конгресс ASCO 2018: лечение меланомы. Памятка. 2018;11(4):261-265. [Бесплатная статья PMC: PMC6280769] [PubMed: 30595751]
- 10.
- Nevares-Pomales OW, Sarriera-Lazaro CJ, Barrera-Llaurador J, Santiago-Vazquez M, Lugo-Fagundo N, Sanchez JE, Sanchez JL.Пигментные поражения ногтевого ложа. Am J Дерматопатол. 2018 ноябрь;40(11):793-804. [PubMed: 30339563]
Скорость трансформации родинок (меланоцитарных невусов) в меланому кожи: популяционная оценка | Дерматология | JAMA Дерматология
Фон Родинки, или меланоцитарные невусы, являются как маркерами повышенного риска меланомы кожи, так и прямыми предвестниками поражений. Недавние стратегии по снижению бремени распространенного заболевания были сосредоточены на раннем выявлении и постоянном наблюдении за родинками на предмет злокачественного перерождения.Неотъемлемым элементом этого подхода является представление о том, что родинки имеют определенный риск трансформации в меланому; однако этот риск неизвестен.
Объектив Оценить риск трансформации родинок в меланому кожи.
Дизайн Сначала мы построили модель трансформации, основанную на предположении, что минимальное количество родинок, превращающихся в кожную меланому в год, примерно эквивалентно количеству ежегодно диагностируемых меланом с ассоциированными невическими компонентами.Затем годовой риск рассчитывали как количество меланом, ассоциированных с родинками, диагностированных за 1 год (стратифицированных по 10-летним возрастным группам), деленное на количество родинок в той же 10-летней возрастной группе. Мы также оценили кумулятивный риск в течение жизни отдельного крота, используя модификацию стандартного метода таблицы выживаемости.
Результаты Ежегодная скорость трансформации любой одиночной родинки в меланому колеблется от 0,0005% или менее (т.е. ≤1 на 200 000) как у мужчин, так и у женщин моложе 40 лет до 0.003% (около 1 из 33 000) у мужчин старше 60 лет. Этот показатель одинаков у мужчин и женщин моложе 40 лет, но становится значительно выше у мужчин старше 40 лет. Для 20-летнего человека пожизненный риск трансформации любой выбранной родинки в меланому к 80 годам составляет примерно 0,03% (1 из 3164) для мужчин и 0,009% (1 из 10 800) для женщин.
Выводы Риск превращения какой-либо конкретной родинки в меланому невелик, особенно у молодых людей.Однако, поскольку родинки могут исчезнуть, те, которые сохраняются до старости, имеют повышенный риск злокачественного перерождения. Для молодых людей с бесчисленным количеством родинок и отсутствием других сопутствующих факторов риска систематическое иссечение доброкачественных образований будет иметь ограниченную пользу.
ХОТЯ ЧАСТОТА меланомы кожи (КМ) резко возросла за последние несколько десятилетий, более раннее обнаружение поражений привело к увеличению процента излечимых поражений.В 2002 г. Американское онкологическое общество оценило 53 600 случаев ВМ, из которых только 7400 случаев смерти были связаны с этим заболеванием. 1 Текущие стратегии по минимизации заболеваемости и смертности, связанных с ВМ, сосредоточены на солнцезащитном поведении и тщательном обследовании лиц с идентифицируемыми предшественниками и маркерами риска, такими как родинки, также известные как меланоцитарные невусы (МН).
Было показано, что наличие множественных родинок связано с повышенным риском ВМ. Ретроспективные исследования случай-контроль 2 -9 выявили прямую связь между количеством родинок и риском ВМ (примерно в 2-14 раз).Многие из текущих усилий по сдерживанию роста меланомы сосредоточены на выявлении ранних изменений в этих меланоцитарных невусах. Было показано, что доброкачественные и атипичные родинки гистологически соседствуют с кавернозными мальформациями, что позволяет предположить, что эти меланоцитарные пролиферации также подвержены злокачественной трансформации. 10 -13 Кампания ABCD (асимметрия, неравномерность/изменение границ, вариация/изменение цвета, увеличение диаметра) и подходы к картированию родинок основываются на фундаментальном предположении, что родинки со временем могут трансформироваться в КМ.Однако на сегодняшний день эта скорость трансформации не рассчитана. Учитывая огромное количество невусов в общей популяции и сравнительно ограниченную заболеваемость КМ, проспективное когортное исследование для оценки скорости трансформации невусов в беспристрастной популяции было бы трудным с точки зрения времени и ресурсов. Таким образом, мы решили рассчитать скорость трансформации невусов в ВМ с помощью популяционных оценок заболеваемости ВМ и количества родинок.
Для аппроксимации скорости трансформации мы разработали модель, показанную на рисунке 1.Мы оценили годовую скорость трансформации (τ) как τ = ( MN Ty / MN US ), где MN Ty представляет количество MN, трансформирующихся в CM в год в США, а MN US , общее количество MN в США. В этом расчете мы делаем 2 допущения. Во-первых, количество родинок относительно стабильно в течение 1 года. Во-вторых, предполагаемое количество КМ, возникающих в МН в год, такое же, как и количество МН, трансформирующихся в КМ в год.Это может быть заниженной оценкой, так как некоторые МН, которые становятся CM, облитерируются в процессе и больше не обнаруживаются при гистологическом исследовании. Таким образом, MN T-y = CM MN-y = ϕ MN/CM × CM US-y , где CM MN-y — количество ВМ, возникающих в MN в год в США; ϕ MN/CM , доля всех КМ, имеющих ассоциированную моль; и CM US-y , количество CM в год в Соединенных Штатах.
Мы стратифицированы по полу и возрастным группам (т.е. <20 лет, 20-29 лет, 30-39 лет, 40-49 лет, 50-59 лет, 60-69 лет, ≥70 лет), так как количество МН и риск ВМ различаются по отношению к этим двум факторам.Поскольку частота родинок не была тщательно задокументирована среди небелого населения, мы ограничили наш анализ белым населением.
Чтобы вычислить ϕ MN/CM , мы выполнили компьютерный поиск на естественном языке (SURGE Anatomic Pathology Software; Computer Trust Corporation, Бостон, Массачусетс) всех последовательных кавернозных мальформаций, диагностированных в общей дерматопатологической практике (Pathology Services Inc.). [PSI], Кембридж, Массачусетс) в период с 1993 по 1997 год. За эти годы в PSI было оценено 339 886 образцов, включая 1615 инвазивных кавернозных мальформаций.Критерии диагностики диспластических меланоцитарных невусов (ДМН) и отличия мелких клеток меланомы от клеток невуса приведены в Таблице 1 и Таблице 2 соответственно. В качестве стандарта практики большинство кавернозных мальформаций, диагностированных в PSI, оцениваются как минимум двумя обученными дерматопатологами. В случае разногласий для постановки окончательного диагноза следует проконсультироваться со старшим дерматопатологом (Теренсом Харристом, доктором медицины или Уоллесом Кларком-младшим, доктором медицины). Тестовый набор из 346 случайно выбранных случаев меланомы, которые были рассмотрены 2 патологоанатомами в PSI, показал только 5 несоответствий в диагнозе (<2%).Дискордантные диагнозы и опухоли, при которых предвестники поражения явно не присутствовали или отсутствовали, были исключены. Мы выбрали местную службу общей дерматопатологии, чтобы свести к минимуму предвзятость направления, которая может существовать в центрах третичной помощи. Мы включили в текущий анализ только инвазивные КМ, с ассоциированным МН или без него, поскольку точные популяционные возрастные показатели меланомы in situ недоступны. Более того, в 2 недавних исследованиях была поставлена под сомнение надежность диагностики меланомы in situ.Brochez et al. 15 сообщили, что DMN является наиболее распространенным пигментным поражением, которое ошибочно принимают за меланому, особенно меланому in situ. Кроме того, Megahed et al. 16 недавно провели иммуногистохимический анализ 104 меланом in situ и обнаружили, что почти треть поражений на самом деле были инвазивными меланомами.
Чтобы получить CM US-y по полу и возрастным группам, мы использовали данные о заболеваемости CM в зависимости от пола и возраста среди белого населения, доступные в исследовании Surveillance, Epidemiology, and End Result (1973–1997; доступно по адресу : http://провидец.Cancer.gov) и количество лиц в разбивке по полу и возрасту среди белого населения на 1 июля 1997 г., согласно прогнозу Бюро переписи населения США на основе переписи 1990 г. (доступно на: http://factfinder.census.gov/ servlet/BasicFactsServlet; статистика доступна по запросу у авторов). Поскольку наши оценки основаны на 10-летних возрастных группах, в то время как заболеваемость эпидемиологическим надзором, эпидемиологией и конечными результатами сообщается в 5-летних возрастных группах, мы рассчитали общее количество CM в год для каждой возрастной группы (CM возрастная группа ) по см AGEGROUP = [σ ( см SubageGroup × P Субжагрупп )] / 100 000, где см Субкагрупп — это заболеваемость см в каждой подраздельной группе и P подвозрастная группа — количество белых людей в подвозрастной группе.
Мы использовали опубликованные популяционные подсчеты MN, стратифицированные по возрасту и полу, для оценки MN US . MacKie et al. 17 обследовали 432 (204 мужчины, 228 женщины) здоровых британских добровольцев, не госпитализированных без госпитализации, у которых не было личного или семейного анамнеза ВМ. Четыре дерматолога подсчитали количество родинок (определяемых как «коричневые пигментные поражения диаметром 3 мм и более, которые присутствуют в течение года даже при отсутствии солнечной стимуляции»). Nicholls 18 исследовал 1518 (948 мужчин, 570 женщин) человек из Сиднея, Австралия, и подсчитал пигментные поражения диаметром «2 или более мм, которые либо пальпировались, либо деформировали структуру поверхности кожи при осмотре по касательной в сильном поле зрения. светлый»; при обнаружении себорейного кератоза исключали.В обоих исследованиях среднее количество MN было стратифицировано по 10-летним возрастным группам, что совместимо с нашей стратификацией. Для некоторых возрастных групп, которые были дополнительно субстратифицированы (например, возрастные группы <20 лет и ≥70 лет), мы рассчитали среднее число MN ( MN возрастная группа ) в этих возрастных группах на MN возрастную группу = [Σ ( MN Субаудка × N Субаума )] / Σ N Субаума , где Mn Субкагруппа и N SUBAGEGROUP — это среднее значение Mn и отдельных лиц внутри подвозрастных групп соответственно.Затем мы рассчитали MN US с разбивкой по полу и возрастным группам путем умножения специфических для пола и возраста MN MN возрастной группы на соответствующее количество белых мужчин и женщин в этой возрастной группе среди населения США. Коэффициент трансформации был рассчитан как для мужчин, так и для женщин в каждой возрастной группе.
Поскольку среднее количество невусов на человека со временем уменьшается, у любого человека определенное количество родинок, вероятно, исчезает с возрастом.Для расчета вероятности развития индивидуальной родинки в ВМ мы сделали следующие допущения. Во-первых, отдельные родинки у мужчин исчезают с постоянной скоростью 2388 на 100 000 родинок в год, начиная с 20-летнего возраста, а отдельные родинки у женщин исчезают с постоянной скоростью 3320 на 100 000 родинок в год, также начиная с 20-летнего возраста. . Во-вторых, скорость, с которой отдельные родинки превращаются в ВМ, постоянна в течение 10-летних возрастных интервалов. Скорость исчезновения родинок была оценена на основе данных с использованием совокупного среднего количества родинок для разных возрастных групп из 2 исследований. 17 ,18 Затем была рассчитана вероятность того, что отдельная родинка превратится в ВМ к определенному возрасту, отдельно для мужчин и женщин, с использованием модификации метода стандартной таблицы дожития. Начиная с гипотетической популяции в 100 000 родинок в возрасте 20 лет, для каждой последующей возрастной группы количество существующих родинок оценивается как 100 000 минус совокупное число, которое, по оценкам, исчезло к этому возрасту, минус совокупное число, которое, по оценкам, развилось. в СМ к этому возрасту.Чтобы оценить количество родинок, которые развиваются в ВМ в каждом возрасте, мы затем умножили расчетную годовую скорость, с которой родинки превращаются в ВМ для этой возрастной группы, на ожидаемое количество родинок, оставшихся в этом возрасте. Кумулятивный показатель на 100 000 — это совокупное количество родинок, которые превратились в ВМ к определенному возрасту.
Мы идентифицировали 1615 инвазивных КМ в базе данных патологии (863 мужчины, 752 женщины; таблица 3), которые демонстрировали недвусмысленный статус предшественника.В целом примерно 26% (28% у мужчин и 25% у женщин) всех инвазивных кавернозных мальформаций имели распознаваемый при гистологическом исследовании МН. Как и ожидалось, общее количество кавернозных мальформаций увеличивалось с возрастом; однако ϕ МН/СМ с возрастом уменьшалось. Поскольку количество КМ от лиц моложе 20 лет было ограниченным (всего 11), оценки для этой возрастной группы могут быть нестабильными. Тем не менее, наблюдается четкая тенденция к снижению ϕ MN/CM с возрастом. Существует также общая тенденция у мужчин иметь больше ВМ, связанных с ЗН, чем у женщин.В возрастной группе 70 лет и старше мы обнаружили, что 20% КМ у мужчин и только 9% КМ у женщин имеют предвестник поражения МН. Мы не различали гистологические подтипы ЗН, поскольку популяционные исследования подсчета родинок 90–189 17 90–190 90–189, 18–90–190 не позволили клинически дифференцировать подтипы ЗН.
Используя ϕ MN/CM , полученный в результате нашего гистологического исследования, мы оценили скорость трансформации MN в CM с нашей моделью (таблица 4). Мы использовали показатели эпиднадзора, эпидемиологии и конечных результатов за период с 1993 по 1997 год (белое население), поскольку этот набор данных предоставил наиболее полные данные для всех возрастных групп.Мы также использовали прогнозы 1997 года для белого населения, полученные от Бюро переписи населения США. Для среднего общего количества родинок мы использовали оценки MacKie et al 17 (Глазго, Шотландия) и Nicholls 18 (Сидней, Австралия). В целом, оба отчета сходятся во мнении, что у детей и молодых людей количество MN выше, чем у пожилых людей, а пиковое среднее количество родинок приходится на третье десятилетие. В обоих исследованиях наблюдалось снижение числа родинок после третьего десятилетия жизни.Около 16% здорового населения не имеют никаких признаков ЗН. 17 С возрастом наблюдается четкая обратная связь между количеством МЯ и частотой ВМ (табл. 4).
Предполагаемая годовая скорость преобразования любого отдельного MN в CM очень низка (рис. 2). Скорость трансформации увеличивается с возрастом и колеблется от 0,0005% или менее (т.е. ≤1 на 200 000) как у мужчин, так и у женщин моложе 40 лет, до 0,003% (около 1 на 33 000) у мужчин старше 60 лет.Этот показатель одинаков у мужчин и женщин моложе 40 лет, но становится значительно выше у мужчин после 40 лет.
Затем мы оценили кумулятивный риск трансформации любой родинки в ВМ. Это было сделано, исходя из предположения, что количество родинок и заболеваемость меланомой различаются по 10-летним возрастным группам, но существенно не колеблются внутри 10-летних блоков. Например, как показано в Таблице 5, риск трансформации родинки (у 20-летнего человека) в ВМ к 80 годам составляет примерно 0.03% (1 из 3164) для мужчин и 0,009% (1 из 10 800) для женщин. Предполагаемый пожизненный риск злокачественного новообразования является самым высоким (примерно 0,05%, или 1 случай на 2000 г.) для родинок, обнаруженных у пациента мужского пола на пятом десятилетии жизни.
Мы представляем оценки годовой скорости и кумулятивного риска трансформации кротов в ВМ. Эти показатели меняются в зависимости от возраста из-за 3 динамических переменных: доли меланом, связанных с ЗН, заболеваемости ВМ и среднего числа ЗНО.Ежегодный риск малигнизации любого одного МН составляет примерно 0,0005% (или менее 1 случая на 200 000) в возрасте до 40 лет. Этот ежегодный показатель значительно увеличивается в последующие десятилетия и достигает пика примерно в 0,003% (или 1 случай на 30 000) у мужчин старше 60 лет. Хотя предшественники МН распространены при ВМ у более молодых пациентов, низкая частота ВМ среди более молодого населения и более высокое общее количество МН способствует более низкой расчетной скорости трансформации у лиц моложе 40 лет.Для пожилых мужчин увеличение рассчитанной скорости трансформации является результатом значительного увеличения заболеваемости ВМ и значительного уменьшения количества МН с лишь частичным уменьшением доли ВМ, связанных с предшествовавшим МН (таблица 4).
Для 20-летнего человека предполагаемый пожизненный риск превращения любой родинки в меланому к 80 годам составляет примерно 1 к 3165 (100 000/31,6) для мужчин и 1 к 10 800 (100 000/9,26) для женщин. (таблица 5). Поскольку некоторые родинки с возрастом исчезают, не все родинки «доживают» до реализации злокачественного потенциала.Это уменьшение приводит к небольшому увеличению кумулятивного риска обнаружения родинок у лиц в возрасте от 40 до 60 лет.
Гистологически предшественники МН могут быть идентифицированы в 28% и 25% кавернозных мальформаций у мужчин и женщин соответственно. Эти проценты могут быть недооценкой фактической частоты предшественников, поскольку предшественники МН могут быть уничтожены во время роста опухоли. Тем не менее, они совместимы с несколькими другими отчетами, в которых наблюдаются частоты в диапазоне от 21% до 35%. 10 ,13 ,19 Однако интересно взаимодействие между возрастом и предшественниками ЗН. Мы обнаружили, что у пациентов моложе 30 лет процент ВМ, связанных с предшественником ЗНО, составляет 50% и более, тогда как у пациентов старше 60 лет этот процент снижается примерно до 20%. Более высокая распространенность ЗН среди более молодого населения 13 ,17 ,18 согласуется с большим процентом ВМ, возникающих при ЗН.Однако, поскольку большинство КМ в популяции возникают у пожилых людей без предшественников ЗНО, наши результаты также указывают на возможный этиологический механизм, при котором раннее начало заболевания связано с измененным субстратом, таким как ЗНО или врожденный невус, тогда как заболевание с поздним началом является результатом от кумулятивного солнечного повреждения не-MN меланоцитов. С этой гипотезой согласуется обнаружение онкогенных генетических повреждений, таких как мутации N- ras , в невусах, не связанных с ВМ. 20 Однако для подтверждения этой гипотезы необходимы более точные анализы, такие как генетическая характеристика опухолей.
Мы разделили наш анализ как по возрасту, так и по полу, поскольку количество ЗНО и риск развития меланомы значительно различаются в зависимости от этих демографических характеристик. Однако другие факторы, которые могут влиять на скорость трансформации, не были включены в нашу модель. Во-первых, кумулятивное воздействие солнца может влиять на количество MN. Недавнее исследование предполагает, что генетические влияния могут определять появление ЗН, но воздействие солнца может влиять на среднее число. 21 В 2 исследованиях, использованных в нашем анализе, оценивались группы населения, сходные по происхождению (т. е. жители Северной Европы и Соединенного Королевства), но сильно различающиеся по воздействию солнца (т. е. Глазго, Шотландия, и Сидней, Австралия).Окружающий солнечный свет может объяснить более высокое среднее количество MN, наблюдаемое у мужчин моложе 20 лет в Австралии 18 по сравнению с молодежью в Соединенном Королевстве. 17 Поскольку количество пребывания на солнце в Соединенных Штатах, скорее всего, находится в пределах диапазона, определенного Глазго и Сиднеем, а среднее общее количество MN сходно (диапазон 5-33) между двумя исследованиями, мы считаем, что оценки подходит для здорового, не отобранного белого населения США. Во-вторых, анатомические вариации молярной плотности могут влиять на вероятность злокачественного перерождения.Хотя в некоторых исследованиях сообщается о более высокой плотности ЗН на периодически подвергающихся воздействию солнца участках (предплечья, верхняя часть спины) по сравнению с защищенными от солнца участками (нижняя часть спины, ягодицы) и хронически облученными участками (голова и шея), 18 ,22 -24 Связь между плотностью МЯ и развитием ВМ неясна. Например, нижние конечности женщин имеют относительно низкую плотность MN 22 ,23 , несмотря на более высокий риск ВМ по сравнению с другими участками.Смешивающие факторы, которые могут объяснить наблюдаемую неравномерную корреляцию, включают возможность биологически различных подмножеств ЗН, различия в характере воздействия солнца и несоответствия в количестве солнцезащитного крема, наносимого на различные участки тела. Более того, в нашей собственной гистологической оценке образцов анатомические обозначения часто неоднозначны (например, правое плечо). Таким образом, мы не проводили стратификацию по анатомическому участку, чтобы свести к минимуму введение этих смешанных факторов.
Вполне вероятно, что скорость трансформации различных типов родинок, особенно DMN, не одинакова.Мы разработали нашу первоначальную модель с использованием беспристрастного общего подсчета родинок, поскольку суждения о неравномерности границ или цвета, используемые для клинической идентификации и подсчета DMN, подлежат интерпретации. Однако наши результаты, наряду с другими опубликованными отчетами, 10 ,11,19 ,25 , позволяют предположить, что злокачественная трансформация не ограничивается DMN, поскольку доброкачественные и врожденные невусы можно наблюдать почти в половине случаев меланомы. с ассоциированными невусами. Из 425 CM с фрагментом MN мы обнаружили, что 43% этих предшественников MN (или 11% всех инвазивных меланом) имели гистологические данные, соответствующие DMN (см. Таблицу 1 для критериев).Хотя о распространенности диспластических невусов или атипичных родинок сообщалось в общей популяции, фактическая возрастная плотность DMN у конкретного человека не была точно задокументирована. Таким образом, в нашей модели невозможно рассчитать коэффициенты трансформации в разбивке по 10-летним возрастным группам. Тем не менее, 2 исследования определили общее среднее количество DMN примерно 0,7 на человека в здоровой контрольной популяции в рамках серии случай-контроль, изучающей риск меланомы среди людей с DMN. 2 ,26 Используя 0,7 в качестве грубого среднего количества DMN на человека (мужчину или женщину) и 0,11 в качестве доли инвазивных меланом, связанных с DMN (ϕ DMN/CM ), мы оцениваем ежегодную скорость трансформации DMN 1 на 30 089 родинок у мужчин и 1 на 39 809 родинок у женщин. Мы также можем модифицировать ϕ DMN/CM на основе опубликованных данных. В серии не менее 100 случаев диапазон зарегистрированных значений ϕ DMN/CM находится между 0,05 27 и 0.34. 28 Одним из потенциальных источников несоответствия между этими двумя цифрами ϕ DMN/CM является интерпретация патологических данных. Например, Massi et al. 27 интерпретировали наличие повышенного количества атипичных меланоцитов на периферии меланомы как часть опухоли, в то время как другие, включая нас, считают эти изменения остаточным DMN. Независимо от интерпретации, эти значения, скорее всего, отражают возможный диапазон ϕ DMN/CM и применительно к нашей модели (без возрастной стратификации, но как общая популяция) дают высокую оценку трансформации DMN, равную 1 на 9735 и 1 на 12 880 родинок в год для мужчин и женщин соответственно и низкая оценка 1 из 66 196 и 1 из 87 580 родинок в год для мужчин и женщин соответственно.
Таким образом, клиницисты, занимающиеся наблюдением за родинками для раннего выявления ВМ, часто сталкиваются с вопросом о том, насколько вероятно, что любая данная родинка превратится в меланому. Теперь мы можем сказать, что для молодого пациента этот показатель составляет примерно 1 на 3165 для мужчин и 1 на 10 800 для женщин в течение его или ее жизни. Наши результаты имеют важное клиническое значение. Некоторые здоровые люди требуют неразборчивого удаления МН, чтобы свести к минимуму вероятность ВМ.Учитывая наши расчеты, общее снижение риска такой хирургической эрадикации, вероятно, ограничено, поскольку очень немногие вырезанные поражения когда-либо прогрессировали до кавернозной мальформации. Кроме того, при попытке обнаружить злокачественное перерождение в пределах ЗНО фотографическое документирование («картирование родинок») всех родинок у молодых людей с низким уровнем риска, вероятно, будет связано с высокой стоимостью и низкой эффективностью обнаружения. Целевое картирование пожилых людей (по крайней мере, старше 30 лет) и пациентов с факторами, традиционно связанными с повышенным риском ВМ (например, чрезмерное пребывание на солнце, семейный анамнез, меланомы в анамнезе или атипичные МН), может быть более эффективным.
Ответственный автор и оттиски: Хенсин Цао, доктор медицинских наук, отделение дерматологии Массачусетской больницы общего профиля, Бартлетт 622, 48 Блоссом-стрит, Бостон, Массачусетс 02114.
Принято к публикации 25 июля 2002 г.
Это исследование было частично поддержано грантом CRTG 99-249-01-CCE Американского онкологического общества, Атланта, Джорджия (д-р Цао).
1.Джемаль АТомас Мюррей TTun M Статистика рака, 2002 г. CA Cancer J Clin. 2002;5223- 47Google ScholarCrossref 2.Холли ЭАКелли Дж.В.Шпалл С.Н.Чиу SH Количество меланоцитарных невусов как основного фактора риска злокачественной меланомы. J Am Acad Dermatol. 1987;17459- 468Google ScholarCrossref 3.Garbe СКрюгер Стадлер Р. Гугенмоос-Хольцманн Орфанос Маркеры CE и относительный риск развития злокачественной меланомы в немецкой популяции. Int J Дерматол. 1989;28517- 523Google ScholarCrossref 4.Макки Р.М.Фройденбергер Т.И.Читчисон TC Индивидуальная таблица факторов риска меланомы кожи. Ланцет. 1989;2487- 490Google ScholarCrossref 5.Augustsson AStierner Усууркула Росдаль I Распространенность обыкновенных и диспластических невусов в шведской популяции. Br J Дерматол. 1991;124152- 156Google ScholarCrossref 6.Augustsson AStierner Росдаль И.Сууркула M Распространенные и диспластические невусы как факторы риска злокачественной меланомы кожи у населения Швеции. Acta Derm Venereol. 1991;71518- 524Google Scholar7.Augustsson AStierner Росдаль И.Сууркула M Меланоцитарный невус на коже, подвергающейся воздействию солнца и защищенной, у пациентов с меланомой и в контрольной группе. Acta Derm Venereol. 1991;71512- 517Google Scholar8.Garbe Си Баттнер Пвайс Дж и другие. Факторы риска развития меланомы кожи и критерии выявления лиц, входящих в группу риска: многоцентровое исследование «случай-контроль» Центрального реестра злокачественных меланом Немецкого дерматологического общества. J Invest Дерматол. 1994;102695- 699Google ScholarCrossref 9.Tucker М.А.Халперн Холли советник и другие. Клинически распознанные диспластические невусы: центральный фактор риска меланомы кожи. ЯМА. 1997;2771439- 1444Google ScholarCrossref 10.Gruber СББарнхилл RLStenn KSRoush GC Невомеланоцитарная пролиферация в сочетании со злокачественной меланомой кожи: многомерный анализ. J Am Acad Dermatol. 1989;21773- 780Google ScholarCrossref 11.Скендер-Калненас TMАнглийский DRHeenan PJ Доброкачественные меланоцитарные поражения: маркеры риска или предшественники меланомы кожи? J Am Acad Dermatol. 1995;331000- 1007Google ScholarCrossref 12.Hstrup НОстерлинд АДжевецкий KTHou-Дженсен K Наличие остатков диспластических невусов при злокачественных меланомах: популяционное исследование 551 злокачественной меланомы. Am J Дерматопатология. 1991;13378- 385Google ScholarCrossref 13.Kruger Сгарбе Си Баттнер ПШтадлер Р. Гугенмоос-Хольцманн Орфанос CE Эпидемиологические доказательства роли меланоцитарных невусов в качестве маркеров риска и прямых предшественников злокачественной меланомы кожи: результаты исследования случай-контроль у пациентов с меланомой и контрольных субъектов без меланомы. J Am Acad Dermatol. 1992;26920- 926Google ScholarCrossref 14.Elder ДЕМерфи GF Меланоцитарные опухоли кожи. Вашингтон, Институт патологии вооруженных сил округа Колумбия, 1991; Росай Дж.Собин LHeds. Атлас опухолевой патологии; 3-я серия, часть 2Google Scholar15.Brochez LVerhaeghe EGrosshans Е и другие. Различия между наблюдателями в гистопатологической диагностике клинически подозрительных пигментных поражений кожи. Дж. Патол. 2002;196459- 466Google ScholarCrossref 16.Megahed МШон Селимович ДШон MP Надежность диагностики меланомы in situ. Ланцет. 2002;3591921- 1922Google ScholarCrossref 17.MacKie RMАнглийский Джейчисон TCFitzsimons CPWilson P Количество и распределение доброкачественных пигментных родинок (меланоцитарных невусов) у здорового населения Великобритании. Br J Дерматол. 1985;113167-174Google ScholarCrossref 18.Николлс EM Развитие и устранение пигментированных родинок и анатомическое распределение первичной злокачественной меланомы. Рак. 1973;32191- 195Google ScholarCrossref 19.Marks РДоревич АПМейсон G Все ли меланомы происходят от «родинок»? исследование гистологической связи между меланоцитарными невусами и меланомой. Австралия J Дерматол. 1990;3177- 80Google ScholarCrossref 20.Carr Джей Маки Точечные мутации RM в онкогене N-ras при злокачественной меланоме и врожденных невусах. Br J Дерматол. 1994;13172- 77Google ScholarCrossref 21.Wachsmuth RCGaut Р.М.Барретт ДХ и другие. Наследственность и взаимодействие генов и окружающей среды для плотности меланоцитарного невуса изучены в исследовании близнецов-подростков в Великобритании. J Invest Дерматол. 2001;117348- 352Google ScholarCrossref 22.Augustsson AStierner Росдаль И.Сууркула M Региональное распределение меланоцитарных невусов в зависимости от воздействия солнца и местно-специфические подсчеты, позволяющие прогнозировать общее количество невусов. Acta Derm Venereol. 1992;72123- 127Google Scholar23.Gallagher RPMcLean Диян КП и другие. Анатомическое распределение приобретенных меланоцитарных невусов у белых детей: сравнение с меланомой: Ванкуверское исследование родинок. Арка Дерматол. 1990;126466- 471Google ScholarCrossref 24.Harrison С.Л.Бюттнер П.Г.МакЛеннан R Распределение меланоцитарных невусов на теле у маленьких австралийских детей. Арка Дерматол. 1999;13547- 52Google ScholarCrossref 25.Сагебиэль RW Меланоцитарные невусы в гистологической ассоциации с первичной меланомой кожи поверхностно-распространяющегося и узлового типов: влияние толщины опухоли. J Invest Дерматол. 1993;100322S-325SGoogle ScholarCrossref 26.Nordlund Дж. Дж. Кирквуд JЗабыть БМ и другие. Демографическое исследование клинически атипичных (диспластических) невусов у пациентов с меланомой и субъектов сравнения. Рак Res. 1985;451855- 1861Google Scholar27.Massi Д.Карли PFranchi АСантуччи Меланомы, связанные с M Nevus: причина или случайность? Рес. меланомы. 1999;985- 91Google ScholarCrossrefДоброкачественный меланоцитарный невус — обзор
Сложные невусы имеют как соединительные гнезда, так и внутридермальный компонент клеток невуса ( рис. 32.5 ). В то время как клетки в верхних слоях дермы обычно кубовидные, с меланиновым пигментом в цитоплазме, более глубокие клетки часто меньше и содержат меньше меланина. Апоптоз иногда наблюдается в более глубоких клетках. 244 Клетки невуса расположены в виде упорядоченных гнезд или тяжей. Покрывающий эпидермис может быть плоским, с некоторым акантозом или иметь вид, напоминающий себорейный кератоз, даже при наличии роговых кист.Эти невусы получили название «кератотические меланоцитарные невусы». 245 Эти папилломатозные невусы чаще встречаются у женщин; клетки невуса в этом варианте часто экспрессируют индуцируемый эстрогеном белок pS2. 246
Исследование, проведенное в 2005 г., показало, что некоторые признаки, используемые для диагностики меланомы, часто обнаруживаются в доброкачественных меланоцитарных невусах. Они включают плохую очерченность, преобладание одиночных меланоцитов, асимметрию и нерегулярные сливные гнезда. 247 Цитологическая атипия также может быть обнаружена в небольшом числе доброкачественных невусов. 247 Митозы и некроз не были обнаружены в доброкачественных образованиях, 247 , но митозы были обнаружены в доброкачественных невусах другими исследователями. 248
Невус пуантилистов (см. выше) показывает либо дискретные, густо пигментированные соединительные меланоцитарные гнезда, изолированные дермальные пигментированные гнезда, либо дискретные скопления меланофагов в папиллярной дерме. 242
Исследование травмированных невусов показало, что паракератоз, изъязвление, кожные телеангиэктазии и, реже, меланин в роговом слое являются обычными гистологическими признаками. 249 Педжетоидное распространение меланоцитов обычно ограничивается местом травмы. 250 Митозы встречаются редко. 249
Ackerman предложил обозначать невус Унны для этих экзофитных папилломатозных невусов и невус Мишера для куполообразных экзоэндофитных невусов, которые простираются далеко в ретикулярную дерму. 251 В то время как невус Унны является почти чисто адвентициальным поражением, ограниченным расширенной папиллярной дермой, а часто также и перифолликулярной дермой, невус Мишера имеет невомеланоциты, диффузно инфильтрирующие как адвентициальную, так и ретикулярную дерму в виде клиновидного узора. 252 Недавно было высказано предположение, что невус Унны является «поздним врожденным невусом». 253
Варианты локализации
Доброкачественные меланоцитарные невусы в определенных анатомических областях могут иметь необычные гистопатологические признаки. 254 Наиболее известными из них являются невусы вульвы и акральной области. Невусы в других местах, таких как ухо, грудь, скальп и места сгибов, могут иметь сходные черты. 255 Невусы на дистальных отделах нижних конечностей (лодыжках) — это последняя из выделенных групп атипичных невусов. 256
Некоторые невусов вульвы у женщин в пременопаузе имеют атипичные гистологические признаки, характеризующиеся увеличением узловых меланоцитарных гнезд с вариабельностью размера, формы и положения гнезд. 257–259 Часто наблюдается педжетоидное распространение меланоцитов. 260 Эти атипичные поражения были названы атипичными меланоцитарными невусами генитального типа . 261,262 В одном исследовании шести случаев рецидивов при длительном наблюдении не зарегистрировано. 261 В дополнение к уже упомянутым особенностям, это исследование прокомментировало заметную соединительную активность, созревание дермы и отсутствие ядерной атипии или митозов в дерме. 261 В недавнем исследовании 56 случаев только одно поражение рецидивировало при последующем наблюдении, но повторного рецидива этого поражения не произошло через 11 лет после его повторного иссечения. 263 Невусы у беременных также могут проявлять некоторую «активацию» с увеличением базальных меланоцитов и повышением митотической активности в этих клетках. 264 Изменения обычно легкие и никогда не достигают достаточной степени, чтобы привести к диагностической путанице. 264
Невусы из ушной области также могут иметь атипичные черты. Как указано в последнем издании этой книги, автор получил в качестве второго мнения гистологические препараты многих атипичных невусов, удаленных из ушей подростков мужского пола. Эти атипичные невусы могут возникать и у женщин. Они часто показывают плохую очерченность, латеральное расширение соединительного компонента за пределы дермального компонента и удлинение сетчатых гребней с перемычками между ними. 265 Педжетоидное распространение и цитологическая атипия также могут присутствовать. 266 Митозы и апоптотические невомеланоциты встречаются редко. Во многих случаях выявляется умеренная лимфоцитарная инфильтрация. 266
Невусы груди также имеют нетипичные признаки как у мужчин, так и у женщин. 267 Иногда обнаруживаются легкое педжетоидное распространение, меланоцитарная атипия и кожная фиброплазия. 262,267
Изгибные невусы могут иметь гнездовой и дисгезионный рисунок с некоторой вариабельностью размера и расположения гнезд. 268
Невусы конъюнктивы являются еще одним примером невусов в особых местах, которые могут иметь тревожные признаки. 262,269 Как упоминалось в Главе 2 (стр. 31), автор всегда следовал совету, данному ему более 35 лет назад, о том, что можно безопасно «понизить» атипию, которая часто наблюдается в невусах конъюнктивы. Невусы конъюнктивы необходимо отличать от меланоза конъюнктивы, при котором наблюдается повышенная пигментация или умеренное увеличение нормальных меланоцитов. 270 Также может присутствовать атипия этих меланоцитов. Этот вопрос был рассмотрен в 2007 году. 270
Меланоцитарные поражения ладоней и подошв также могут вызывать трудности диагностики. 271 По-видимому, это частично связано с наличием кожных отметин (дерматоглифов) в этих местах. 272–274 Если срезы срезаны перпендикулярно, а не параллельно дерматоглифам, чаще наблюдаются симметрия и очерченность. 272 McCalmont и соавт. обратили внимание на трудности диагностики акральных невусов, демонстрирующих некоторое распространение педжетоида.Они ввели термин «МАНИАК» (меланоцитарный акральный невус с внутриэпидермальным подъемом клеток) для таких поражений. 275 Это пример педжетоидного меланоцитоза, процесса, наблюдаемого во многих невусах в особых местах. 250 Дерматоскопические признаки акральных невусов вариабельны и могут измениться при краткосрочном наблюдении. 276–278 Изменения, по-видимому, отражают уникальные анатомические и гистопатологические характеристики акральной кожи. 279–281 Агминированные невусы подошвы встречаются крайне редко. 282 Также сообщалось об эруптивных невусах. 283 Подногтевые невусы иногда включают в эту категорию атипичных невусов ладоней и подошв. 284 При доброкачественных невусах иногда наблюдается трансэпидермальная элиминация четко очерченных гнезд клеток невуса, но педжетоидную инфильтрацию эпидермиса единичными атипичными клетками или небольшими группами атипичных клеток с бледной цитоплазмой следует рассматривать с подозрением. 260,285,286 Лимфоцитарный инфильтрат в дерме является подозрительным, но не диагностическим признаком меланомы. 285 Существует уникальный вариант невуса на коже подошвы – акрально-лентигинозный невус. 287 По внешнему виду это поражение имеет некоторое сходство с диспластическим (атипичным) невусом, хотя у него отсутствует цитологическая атипия и ламеллярная фиброплазия. 287
Невусы на волосистой части головы у подростков могут иметь атипичные черты, но после полного удаления они, по-видимому, ведут себя доброкачественно. 288 Около 10% невусов, удаленных с этого участка в одном учреждении, имели нетипичные черты. 288 По переходной зоне беспорядочно разбросаны большие гнезда причудливой формы. Фолликулярное поражение было. Имелось некоторое педжетоидное распространение и легкая цитологическая атипия. В соединительных гнездах было несколько «дискогезионных меланоцитов». 288
Невусы на дистальных отделах нижней конечности (лодыжки) могут иметь архитектурную атипию от умеренной до тяжелой, но только цитологическую атипию от легкой до умеренной. 256 Таким образом, они имеют общие черты с акральными невусами, диспластическими невусами и меланомой in situ. 256 Средний возраст пациентов в исследовании составил 47 лет. Их лечили простым иссечением. Рецидива не было. Авторы признали, что эти поражения могут быть ранними диспластическими невусами. Они также заявили, что, хотя их можно сгруппировать с другими акральными невусами, их отличительные особенности заслуживают отдельного рассмотрения. 256
Еще одна особая группа невусов – матричные невусы . 289 Большинство из них имеют соединительный тип, но при сложном созревании клеток в дерме обычно наблюдается незначительное созревание.Распределение меланоцитов в базальном слое может быть несимметричным. Педжетоидное распространение меланоцитов приурочено к супрабазальному слою. Поражения проявляются клинически как продольная меланонихия. 289
Разделенные или «целующиеся» невусы представляют собой составные или внутрикожные невусы, обычно обнаруживаемые на веках, но они также могут встречаться на половом члене и вульве. 290 Считается, что они развиваются во время эмбриогенеза в результате разделения первоначально соединенных структур.
Границы | Клинико-патологический анализ меланоцитарных невусов: ретроспективная серия
Введение
Меланоцитарные невусы — доброкачественные опухоли из меланоцитов; эти наросты включают распространенные приобретенные меланоцитарные невусы и другие доброкачественные меланоцитарные новообразования, такие как голубой невус, невус гало, врожденный невомеланоцитарный невус, «диспластический» меланоцитарный невус и невус Шпица (1–3). Распространенные приобретенные меланоцитарные невусы являются наиболее частыми новообразованиями. В рутинном удалении меланоцитарных невусов нет необходимости, но они должны быть удалены при наличии любого из следующих условий: изменения кожных поражений, нетипичный клинический вид, подозрительный на меланому, косметические потребности или повторная стимуляция (4).
На самом деле, исследования показали, что распространенные приобретенные меланоцитарные невусы трудно отличить в клинической практике от других доброкачественных меланоцитарных новообразований, таких как врожденный невомеланоцитарный невус и голубой невус, или даже от опухолей, таких как меланома (5). Более того, важность меланоцитарных невусов связана с меланомой. Большая часть меланомы возникает в той же области, что и давно существовавшие ранее меланоцитарные невусы (1). Гистологическое исследование показало, что примерно 30% случаев меланомы связаны с остаточным невусом (6).Поэтому, чтобы оказать поддержку клиницистам в диагностике и лечении меланоцитарных невусов, наше исследование фокусируется на пациентах с клиническим диагнозом меланоцитарных невусов, которые переклассифицированы после гистопатологического исследования, и оценивает, влияют ли клинические характеристики пациентов на ошибочную классификацию.
Пациенты и методы
Это ретроспективный обзор данных 4561 пациента с клиническим диагнозом меланоцитарных невусов за 5 лет, с 2014 по 2019 год, направленных в отделение дерматологии больницы Сянъя Центрального Южного университета.Всем пациентам в этом исследовании был проведен первоначальный клинический диагноз, иссечение и гистопатологический диагноз. Причины удаления меланоцитарных невусов включали атипичные клинические признаки, изменения кожных поражений, косметические требования или повторную стимуляцию (например, места трения или повторяющиеся травмы) (4). Для обеспечения точности два независимых дерматопатолога рассмотрели препараты, окрашенные гематоксилином и эозином, и поставили диагноз. Если между ними возникали разногласия, другой дерматопатолог просматривал предметное стекло, и три дерматопатолога вместе ставили диагноз.Клинические данные по каждому случаю, включая возраст и пол пациента, а также местонахождение поражения, были получены из историй болезни пациентов. Это исследование было одобрено комитетами по этике больницы Сянъя Центрального Южного Университета, Чанша, Хунань, Китай, и от всех субъектов было получено информированное согласие.
Диагноз и классификацию поражений кожи проводили в соответствии с Четвертым изданием Dermatology (под редакцией Bolognia, J.L.) (7). Гистопатологическая конкордантность, которая означает согласованность клинического и гистопатологического диагнозов, оценивалась для новообразований, диагностированных клинически как меланоцитарные невусы и гистопатологически диагностированных как распространенные приобретенные меланоцитарные невусы или другие доброкачественные меланоцитарные новообразования, такие как врожденный невомеланоцитарный невус, голубой невус, лентиго, «диспластический» меланоцитарный невус, рецидивирующий невус, невус Шпица и галоневус.Гистопатологическая дискордантность, означающая несоответствие между клиническим и гистопатологическим диагнозами, включала клинический диагноз как меланоцитарный невус и гистопатологический диагноз как себорейный кератоз, базально-клеточный рак, сосудистая опухоль, фиброма, эпидермоидная киста, бородавка, меланома, болезнь Боуэна, плоскоклеточный рак, кератоакантома. , и другие новообразования.
Были проанализированы записи 4561 пациента для оценки демографических и клинических факторов, причин удаления и гистопатологического диагноза.Сначала мы сравнили клинический диагноз с гистопатологическим, чтобы установить уровень гистопатологической конкордантности, а затем исследовали влияние клинических характеристик и причин исключения на ошибочную классификацию. Статистический анализ проводили с использованием критерия χ 2 и точного критерия Фишера. Двусторонний P <0,05 считался статистически значимым. Все статистические анализы проводились с использованием статистического пакета SPSS 23.0 (IBM SPSS, Чикаго, Иллинойс, США).
Результаты
Гистопатологический обзор
В общей сложности у 4561 пациента был клинически диагностирован меланоцитарный невус в соответствии с кожными поражениями (рис. 1). Характеристики пациентов приведены в таблице 1. Мужчин было 1459 (31,99%), женщин 3102 (68,01%). Возраст варьировал от 2 до 86 лет, средний возраст составил 31 год. Пациенты были разделены на четыре группы в зависимости от возраста: <20, 20–39, 40–59 и ≥60 лет. Наиболее распространен возрастной диапазон от 20 до 39 лет (54,5 года).70%), за которыми следуют <20 лет (21,75%), в то время как наименее распространенный возраст был ≥60 лет (4,71%). Голова и шея (66,24%) были наиболее распространенными местами поражения, тогда как руки (1,43%) и ягодицы (0,75%) были наименее распространенными местами поражения. Кроме того, наиболее частыми причинами удаления меланоцитарных невусов были косметические потребности (48,78%) и атипичные клинические признаки (47,18%).
Рисунок 1 . Методология исследования.
Таблица 1 .Клинические характеристики 3745 пациентов с клиническим диагнозом меланоцитарных невусов с гистопатологическим соответствием.
После гистопатологического исследования у 3745 пациентов был окончательно диагностирован меланоцитарный невус (общий уровень гистопатологической конкордантности 82,11%), а у 816 пациентов с клиническим диагнозом меланоцитарный невус был реклассифицирован как другие заболевания (общий уровень гистопатологического несоответствия 17,89%; рисунок 1; таблица 1). , 2).
Таблица 2 .Распределение гистопатологического диагноза 816 пациентов, у которых клинический диагноз не соответствовал гистопатологическому диагнозу.
Гистопатологическая конкордантность и ее клинические характеристики
Гистопатологически конкордантные случаи включали распространенные приобретенные меланоцитарные невусы ( n = 3380, 90,25%) и другие доброкачественные меланоцитарные новообразования (365, 9,75%; таблица 1). Распространенные приобретенные меланоцитарные невусы делились на внутрикожные невусы ( n = 2,598, 76.86%), соединительный невус ( n = 238, 7,04%) и сложный невус (544, 16,09%; таблица 1). Соотношение самцов и самок было примерно одинаковым во всех трех типовых группах (всего 981:2399; 29,02:70,98%). Наиболее распространен возрастной диапазон от 20 до 39 лет (61,04%), за которым следуют <20 лет (24,47%). Наиболее частыми местами поражения внутрикожных и сложных невусов были голова и шея (79,56 и 61,58% соответственно), затем туловище (14,43 и 13,42% соответственно). Однако наиболее частым местом поражения в группе соединительных невусов были стопы (55.04%), за которыми следуют голова и шея (13,45%) и туловище (13,45%). Основными причинами удаления распространенных приобретенных меланоцитарных невусов были косметические требования и нетипичные клинические признаки. Интересно, что в группе пограничных невусов 27,73% поражений были удалены из-за повторной стимуляции, что было значительно выше, чем соответствующие показатели в группах внутрикожных невусов и сложных невусов (0,89 и 6,99% соответственно).
Другие доброкачественные меланоцитарные новообразования включали врожденный невомеланоцитарный невус (3.04%), голубой невус (2,40%), лентиго (1,71%), «диспластический» меланоцитарный невус (1,04%), рецидивирующий невус (0,45%), невус шпица (0,37%), галоневус (0,32%) и другие меланоцитарные невусы (0,40%). Мы оценили клинические характеристики, которые потенциально могут повлиять на классификацию других доброкачественных меланоцитарных новообразований. Младший возраст был значительно связан с гистопатологическим диагнозом врожденных невомеланоцитарных невусов и невусов Шпица по сравнению с обычными приобретенными меланоцитарными невусами.Наиболее частая возрастная группа при классификации врожденных невомеланоцитарных невусов и невусов Шпица составляла <20 лет (54,39 и 85,71% соответственно) по сравнению с 20–39 годами (61,04%) у пациентов с гистопатологическим диагнозом распространенных приобретенных меланоцитарных невусов ( Таблица 1). Кроме того, расположение поражения значительно коррелировало с диагнозом голубого невуса, лентиго и «диспластического» меланоцитарного невуса (таблица 1). Процент голубых невусов на верхних конечностях и кистях, лентиго на стопах и «диспластических» меланоцитарных невусов на нижних конечностях был выше, чем у пациентов с гистопатологическим диагнозом распространенных приобретенных меланоцитарных невусов (таблица 1). .Причины удаления меланоцитарных невусов также повлияли на классификацию врожденных невомеланоцитарных невусов, голубых невусов, лентиго, рецидивирующих невусов и галоневусов. В группах лентиго и рецидивирующих невусов, в дополнение к атипичным клиническим признакам, процент поражений, удаленных из-за изменений очага и повторной стимуляции, был значительно выше для поражений, гистопатологически диагностированных как распространенные приобретенные меланоцитарные невусы (таблица 1).
Клинические характеристики могут повлиять на ошибочную классификацию
Гистопатологический обзор привел к изменению диагноза в общей сложности у 816 из 4561 пациента (17.89%; 1 и табл. 2), в том числе себорейный кератоз ( n = 470, 10,30%), базальноклеточный рак ( n = 64, 1,40%), сосудистая опухоль ( n = 53, 1,16%), фиброма ( n = 43, 0,94%), эпидермоидная киста ( n = 34, 0,75%), бородавка ( n = 30, 0,66%), меланома ( n = 24, 0,53%), болезнь Боуэна ( n = 16, 0,35%), плоскоклеточный рак ( n = 4, 0,09%), кератоакантома ( n = 2, 0,04%) и другие новообразования ( n = 76, 1).67%).
Мы оценили клинические характеристики, которые потенциально могут повлиять на ошибочную классификацию. Среди пациентов с клиническим диагнозом меланоцитарных невусов мужской пол был в значительной степени связан с изменением диагноза (общая гистопатологическая согласованность по сравнению с общей гистопатологической дискордантностью, p <0,001; таблица 3). Кроме того, пожилой возраст также был значимо связан с изменением диагноза (90–203 p 90–204 < 0,001; табл. 3). Средний возраст пациентов с ошибочной классификацией составил 45 лет (диапазон 2–86 лет) по сравнению с 27 годами (диапазон 2–80 лет) у пациентов с гистопатологической конкордантностью.Интересно, что расположение поражения значительно коррелировало с гистопатологической дискордантностью ( p <0,001; таблица 3). Процент ошибочно классифицированных поражений туловища и конечностей, а также промежности и ягодиц составил 40,69 и 7,11% соответственно по сравнению с 20,00 и 2,22% соответственно при поражениях без изменения диагноза (таблица 3). Причины удаления меланоцитарных невусов также повлияли на изменение диагноза. Доля ошибочно классифицированных поражений, удаленных из-за атипичных клинических признаков, составила 71.81% по сравнению с 41,82% среди поражений с гистопатологической конкордантностью ( p <0,001; таблица 3). Таким образом, пол, возраст, местонахождение поражения и причины удаления — все это потенциально влияет на ошибочную классификацию.
Таблица 3 . Клинические характеристики пациентов с гистопатологической конкордантностью или гистопатологической дискордантностью.
Более подробно, мужской пол был значительно связан с изменением диагноза себорейного кератоза, базально-клеточной карциномы, болезни Боуэна и бородавок ( p < 0.001; Таблица 3 и дополнительная таблица 1). Однако пол не влиял на смену диагноза на меланому (табл. 3). Пожилой возраст значительно коррелировал с изменениями диагноза себорейного кератоза, базально-клеточной карциномы, меланомы, болезни Боуэна, плоскоклеточной карциномы, кератоакантомы, эпидермоидной кисты и бородавки ( p <0,001; таблица 3 и дополнительная таблица 1). Кроме того, поражения на туловище и конечностях были в значительной степени связаны с изменением диагноза на себорейный кератоз (48.51%), поражения на голове и шее были достоверно связаны с изменением диагноза на базально-клеточную карциному (92,19%), поражения на руках и ногах были достоверно связаны с изменением диагноза на меланому (62,50%), а поражения на промежности и ягодицах были в значительной степени связаны с изменением диагноза болезни Боуэна (62,50%) и бородавок (26,67%), по сравнению с 20,00, 70,17, 7,61 и 2,22% соответственно у пациентов с гистопатологической конкордантностью (таблица 3 и дополнительная таблица). Таблица 1).Что еще более важно, в дополнение к атипичным клиническим признакам, процент поражений, удаленных из-за изменений поражения (16,76%) и повторной стимуляции (12,50%), был значительно выше среди поражений с изменением диагноза на меланому, чем среди поражений с гистопатологической конкордантностью. 0,48 и 3,90% соответственно (табл. 3). Таким образом, клинические характеристики и причины исключения потенциально могут повлиять на ошибочную классификацию.
Обсуждение
Меланоцитарные невусы являются наиболее распространенными доброкачественными новообразованиями кожи, а также кожными заболеваниями, которые чаще всего неправильно диагностируются (5).В нашем исследовании были собраны вырезанные очаги с клинически диагностированным меланоцитарным невусом у китайской популяции в течение 5 лет подряд. Результаты показали, что согласованность клинического и гистопатологического диагнозов меланоцитарных невусов после гистопатологического исследования составила 82,11%. Среди них 90,25 % были обычными приобретенными меланоцитарными невусами, а 9,75 % — другими доброкачественными меланоцитарными новообразованиями, такими как врожденные невомеланоцитарные невусы, голубые невусы и лентиго. Что еще более важно, 17,89% пациентов были реклассифицированы как имеющие другие заболевания после гистопатологического исследования.Наиболее частым диагностическим изменением был себорейный кератоз, за которым следовал базально-клеточный рак. В целом 24 (0,53%) пациента были реклассифицированы как больные меланомой. Кроме того, на ошибочную классификацию потенциально влияют клинические характеристики, такие как пол, возраст и местонахождение поражения, а также причины удаления.
Морфологически распространенные приобретенные меланоцитарные невусы трудно отличить от других доброкачественных меланоцитарных новообразований (8). Наше исследование показало, что среди случаев с гистопатологической конкордантностью 9.75% были другими видами доброкачественных меланоцитарных новообразований. Кроме того, результаты показали, что более молодой возраст был значительно связан с гистопатологическим диагнозом врожденных невомеланоцитарных невусов и невусов Шпица по сравнению с обычными приобретенными меланоцитарными невусами. Причиной клинической значимости врожденных невомеланоцитарных невусов (ВМН) является риск малигнизации (9). Злокачественный потенциал CMN хорошо охарактеризован для врожденных меланоцитарных гигантских невусов (10). Однако возможность развития меланомы также была четко подтверждена для средних и малых невусов (11).Невус шпиц преимущественно наблюдается у детей и подростков. У детей невус Шпица представляет собой изолированные куполообразные узелки с гладкой поверхностью и от ярко-красного до коричневого цвета. У взрослых невус Шпица обычно темного цвета с коричневыми или черными папулами, узелками и узлами (12–14). Из-за сложности клинической диагностики невуса Шпица необходимо гистопатологическое исследование (15, 16). Таким образом, у пациентов необходимо собрать подробный анамнез, а поражения у более молодых пациентов следует дифференцировать от врожденного невомеланоцитарного невуса и невуса Шпица.«Диспластический» меланоцитарный невус, также известный как атипичный меланоцитарный невус, является необычно большим и изменчивым по форме и демонстрирует атипичную асимметрию, размер, границы и окраску (7). Более того, «диспластический» меланоцитарный невус сложно отличить от обычных приобретенных меланоцитарных невусов и меланомы (17). Важно отметить, что меланома может развиваться в «диспластических» меланоцитарных невусах с вероятностью от 1:200 до 1:500 и что наличие нескольких «диспластических» меланоцитарных невусов увеличивает риск меланомы (3).Наши данные показали, что процент «диспластических» меланоцитарных невусов, возникающих на нижних конечностях, был выше, чем у пациентов с гистопатологическим диагнозом распространенных приобретенных меланоцитарных невусов. Таким образом, поражения на нижних конечностях с атипичными клиническими признаками должны подвергаться тщательному физикальному обследованию и тщательно дифференцироваться от обычных приобретенных меланоцитарных невусов.
В этом исследовании 17,89% поражений были реклассифицированы как другие заболевания после гистопатологического исследования.Наиболее частым диагностическим изменением был себорейный кератоз, распространенная доброкачественная эпидермальная опухоль (18). Себорейный кератоз обычно представляет собой округлое, чешуйчатое поражение от красноватого до коричневатого цвета; это чаще всего встречается у лиц старше 50 лет (19, 20). Клинически себорейный кератоз может имитировать появление меланоцитарных опухолей (21). Наше исследование показало, что мужской пол, пожилой возраст и расположение поражений на туловище и конечностях потенциально влияют на неправильную классификацию себорейного кератоза. Таким образом, кожные поражения с вышеперечисленными признаками следует дифференцировать с себорейным кератозом.Что еще более важно, после гистопатологического исследования 1,89% пациентов были реклассифицированы как имеющие немеланомный рак кожи (НМРК), в том числе 64 с базальноклеточным раком, 16 с болезнью Боуэна, четыре с плоскоклеточным раком и два с кератоакантомой. НМРК является наиболее распространенным раком человека, и воздействие солнца является важным фактором риска для этого заболевания (22). Кроме того, сообщалось, что заболеваемость НМРК выше у мужчин, чем у женщин, и 80% случаев приходится на людей в возрасте 60 лет и старше (23).Базально-клеточные карциномы обычно маленькие и имеют полупрозрачный или перламутровый вид (24, 25). Примерно 80% всех базально-клеточных карцином возникают на голове и шее. В отличие от базальноклеточной карциномы, плоскоклеточная карцинома может иметь предшествующие поражения, такие как актинический кератоз и болезнь Боуэна (26), и обычно развивается на участках, подверженных воздействию солнца. Эти исследования подтверждают наши выводы. Наше исследование показало, что мужской пол был в значительной степени связан с изменениями в диагнозе базально-клеточной карциномы и болезни Боуэна.Пожилой возраст и участки, подверженные воздействию солнца (голова и шея), потенциально могут повлиять на неправильную классификацию НМРК, за исключением болезни Боуэна. Поражения промежности и ягодиц были достоверно связаны с изменением диагноза на болезнь Боуэна. Таким образом, меланоцитарные невусоподобные поражения у пожилых и/или мужчин, а также на коже, подвергающейся воздействию солнца, следует тщательно дифференцировать от базально-клеточной карциномы и плоскоклеточного рака, а поражения на промежности и ягодицах следует дифференцировать от болезни Боуэна.
Наиболее важной задачей в диагностике меланоцитарных невусов является дифференциация этих поражений от меланомы. Мы обнаружили, что 24 пациента были реклассифицированы как имеющие меланому после гистопатологического исследования. Пол не влиял на ошибочную классификацию. Однако пожилой возраст и поражения на руках и ногах были в значительной степени связаны с изменением диагноза на меланому, что может быть связано с характеристиками меланомы в Китае. Заболеваемость меланомой кожи растет быстрее, чем любой другой солидной опухолью (27, 28).Поверхностно распространяющаяся меланома является наиболее распространенным типом меланомы кожи у представителей европеоидной расы (29). Тем не менее, акральная меланома является распространенным подтипом меланомы у пациентов из Китая и редко встречается у пациентов европеоидной расы (30–33). Меланома может развиться из ранее существовавших невусов примерно в 20–40% случаев (34). Ранняя диагностика является ключом к повышению выживаемости (35). Правила ABCDE (асимметрия, неравномерность границ, пестрота цвета, диаметр и эволюция) полезны для ранней идентификации меланомы (36).Кроме того, дерматоскопия повышает точность диагностики, особенно при дифференциальной диагностике между доброкачественными и злокачественными меланоцитарными опухолями. Кроме того, результаты показали, что, в дополнение к атипичным клиническим признакам, процент очагов, удаленных из-за изменений очага и повторной стимуляции, был значительно выше в очагах, диагноз которых был изменен на меланому, чем в очагах с гистопатологической конкордантностью. Таким образом, наше исследование показывает, что меланоцитарные невусы следует дифференцировать от меланомы у пациентов пожилого возраста, когда поражения находятся в местах, подверженных нагрузкам и трению, или в случае изменений или повторной стимуляции.
Таким образом, наши данные показывают, что гистопатологический обзор приводит к изменению диагноза у 17,89% пациентов с клиническим диагнозом меланоцитарных невусов. Кроме того, клинические характеристики имеют потенциальное влияние на ошибочную классификацию. В дополнение к атипичным клиническим проявлениям, поражения у пожилых пациентов, поражения в местах, подверженных воздействию солнца, нагрузок или трения, а также поражения с изменениями или повторной стимуляцией должны вызвать клиническое подозрение и быть тщательно дифференцированными от злокачественных опухолей.
Заявление о доступности данных
Оригинальные материалы, представленные в исследовании, включены в статью/дополнительный материал, дальнейшие запросы можно направлять соответствующему автору/авторам.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены комитетами по этике больницы Сянъя Центрального Южного Университета, Чанша, Хунань, Китай. Письменное информированное согласие на участие в этом исследовании было предоставлено законным опекуном/ближайшим родственником участников.
Вклад авторов
PL выполнила дизайн исследования, анализ данных и написание рукописи. XZ, MC, XC, JL и CP внесли свой вклад в сбор и проверку данных. YK, MC и XC выполнили клиническую диагностику и сбор образцов. JS, YK и WZ были клиническими экспертами и выполнили пересмотр рукописи. Все авторы прочитали и одобрили окончательный вариант рукописи.
Финансирование
Эта работа была поддержана Национальным фондом естественных наук Китая (81430075, 81773329 и 81974479) и Инновационным фондом аспирантов провинции Хунань (2020zzts251).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Примечание издателя
Все претензии, изложенные в этой статье, принадлежат исключительно авторам и не обязательно представляют претензии их дочерних организаций или издателя, редакторов и рецензентов. Любой продукт, который может быть оценен в этой статье, или претензии, которые могут быть сделаны его производителем, не гарантируются и не поддерживаются издателем.
Благодарности
Авторы хотели бы искренне поблагодарить всех координаторов, дерматологов и исследователей, принимавших участие в этом исследовании.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmed.2021.681668/full#supplementary-material
.Ссылки
2. Plasmeijer EI, Nguyen TM, Olsen CM, Janda M, Soyer HP, Green AC. Естественная история распространенных меланоцитарных невусов: систематический обзор лонгитюдных исследований в общей популяции. J Инвест Дерматол. (2017) 137:2017–8. doi: 10.1016/j.jid.2017.03.040
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
4. Солеймани Т., Светтер С.М., Холлмиг С.Т., Ааси С.З. Адекватность консервативных хирургических краев от 2 до 3 мм для полного удаления подтвержденных биопсией тяжелых диспластических невусов: серия ретроспективных случаев в высшем академическом учреждении. J Am Acad Дерматол. (2020) 83: 254–5. doi: 10.1016/j.jaad.2019.12.077
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
5.Пипкорн М.В., Лонгтон Г.М., Райш Л.М., Элдер Д.Е., Пепе М.С., Керр К.Ф. и др. Оценка стратегий второго мнения для диагностики кожных меланоцитарных поражений. Сеть JAMA открыта. (2019) 2:e1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
7. Болонья Дж.Л., Шаффер Дж.В., Черрони Л. Электронная книга по дерматологии . Elsevier Health Sciences (2017), Китай: Elsevier.
8. Ши К., Ким Д., Мохан Л.С., Гарфилд Э.М., Цюань В.Л., Чжан Б. и соавт.Ретроспективное когортное исследование диагностической ценности различных подтипов атипичной пигментной сети при дерматоскопии. J Am Acad Дерматол. (2020) 83:1028–34. doi: 10.1016/j.jaad.2020.05.080
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
9. Polubothu S, McGuire N, Al-Olabi L, Baird W, Bulstrode N, Chalker J, et al. Имеет ли значение ген? Ассоциации генотип-фенотип и генотип-исход при врожденных меланоцитарных невусах. Бр Ж Дерматол. (2020) 182:434–43.doi: 10.1111/bjd.18106
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
10. Oei W, Fledderus AC, Spuls PI, Eggen CAM, Kottner J, van der Horst CMAM, et al. Разработка международного основного набора доменов для средних, крупных и гигантских врожденных меланоцитарных невусов в качестве первого шага к основному набору результатов для клинической практики и исследований. Бр Дж Дерматол . (2020). дои: 10.1111/bjd.19694
Полнотекстовая перекрестная ссылка | Академия Google
11.Иллиг Л., Вайднер Ф., Хундайкер М., Гартманн Х., Бисс Б., Лейх Ф. и др. Врожденные невусы менее или равные 10 см как предвестники меланомы. 52 случая, обзор и новая концепция. Арка Дерматол. (1985) 121:1274–81. doi: 10.1001/archderm.121.10.1274
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
14. Soura E, Plaka M, Stefanaki C, Chasapi V, Christofidou E, Antoniou C, et al. Характеристики невусов шпиц, атипичных невусов шпиц и меланом у пациентов моложе 20 лет. J Eur Acad Dermatol Venereol. (2017) 31:e384–5. doi: 10.1111/jdv.14208
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
15. Скальвенци М., Коста С., Де Фата Сальваторес Г., Каппелло М., Виллани А. Клинические и дерматоскопические особенности невуса шпица по полу, возрасту и анатомической локализации: исследование 913 родинок шпица. Бр Ж Дерматол. (2018) 179:769–70. doi: 10.1111/bjd.16564
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
16.Soura E, Dimitrakopoulou A, Christofidou E, Katoulis A, Antoniou C, Stratigos A. Пациенты с невусами шпица в греческой популяции: эпидемиологические, клинические и гистопатологические характеристики. J Eur Acad Dermatol Venereol. (2018) 32:1128–37. doi: 10.1111/jdv.14702
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
17. Sondermann W, Utikal JS, Enk AH, Schadendorf D, Klode J, Hauschild A, et al. Прогнозирование развития меланомы в меланоцитарных невусах с помощью искусственного интеллекта : запрос проспективных данных. Евро J Рак. (2019) 119:30–4. doi: 10.1016/j.ejca.2019.07.009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
20. Браун Р.П., Людвиг С., Маргхуб А.А. Дифференциальный диагноз себорейного кератоза: клинические и дерматоскопические особенности. J Препараты Дерматол. (2017) 16:835–42.
Реферат PubMed | Академия Google
26. Фания Л., Дидона Д., Ди Пьетро Ф.Р., Верховская С., Морезе Р., Паолино Г. и соавт. Плоскоклеточный рак кожи: от патофизиологии к новым терапевтическим подходам. Биомедицинские препараты. (2021) 9:171. doi: 10.3390/биомедицины
71Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
29. Susok L, Gambichler T. У представителей европеоидной расы с акральной лентигинозной меланомой исход такой же, как и у пациентов с поверхностно распространяющейся меланомой, соответствующей стадии и конечности. J Cancer Res Clin Oncol . (2021). doi: 10.1007/s00432-021-03630-6
Полнотекстовая перекрестная ссылка | Академия Google
30. Хуан К., Сюй Ю., Габриэль Э.М., Мишра С., Чен Ю., Багариа С.П.Сравнительный анализ акральной меланомы у пациентов из Китая и европеоидной расы. J Рак кожи. (2020) 2020:5169051. doi: 10.21203/rs.2.22789/v1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
31. Коллинз Р.Дж. Меланома у китайцев Гонконга. Акцент на ладонных и подногтевых участках. Рак. (1984) 54:1482–8. doi: 10.1002/1097-014254:7<1482::AID–CNCR2820540745>3.0.CO;2-O
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
33.Yu J, Luo X, Huang H, Zhai Z, Shen Z, Lin H. Клинические характеристики злокачественной меланомы на юго-западе Китая: одноцентровая серия из 82 последовательных случаев и метаанализ 958 зарегистрированных случаев. ПЛОС ОДИН. (2016) 11:e0165591. doi: 10.1371/journal.pone.0165591
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
36. Специальная рабочая группа Американской академии дерматологии по ABCDE меланомы Цао Х. Олазагасти Дж. М. Кордоро К. М. Брюэр Дж. Д. Тейлор С. С. .Раннее выявление меланомы: обзор ABCDE. J Am Acad Дерматол. (2015) 72:717–23. doi: 10.1016/j.jaad.2015.01.025
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Врожденный меланоцитарный невус (ВМН)
Когда требуется лечение CMN?
Признаки того, что ВМН может нуждаться в лечении, включают:
- Боль, зуд или жжение родинки
- Красная или раздраженная кожа вокруг родинки
- Кровь или гной из родинки
- Изменение цвета на черный, синий или красный
- Быстрый рост родинки
- Неправильные или неровные границы вокруг родинки
- Значительное изменение текстуры гигантского CMN .
Очень большие CMN с большей вероятностью перерастут в рак кожи.Детям с так называемым «гигантским» CMN может потребоваться лечение раньше, чем другим, чтобы снизить риск развития рака кожи в областях, пораженных CMN.
Хорошо заметные родинки, например, на лице, шее или руках, также можно лечить, если они сильно беспокоят детей.
Наконец, случаи нейрокожного меланоза обычно требуют лечения, чтобы избежать проблем со здоровьем, затрагивающих мозг и позвоночник.
Как лечится ЦМН?
В большинстве случаев ВМН наблюдение и работа по предотвращению рака кожи являются единственным необходимым лечением.Это включает в себя регулярные проверки кожи у родителя и врача. Это также означает принятие мер, чтобы избежать повреждения кожи. К ним относятся:
- Используйте водостойкий солнцезащитный крем широкого спектра действия (UVA/UVB) на улице. Это означает SPF 30 или выше, когда ваш ребенок находится на улице с 10:00 до 16:00.
- Повторно наносите солнцезащитный крем каждые 2 часа, а также после плавания или потоотделения.
- Носите защитную одежду, солнцезащитные очки и головные уборы, чтобы избежать воздействия солнечных лучей и солнечных ожогов. По возможности оставайтесь в тени.
- Не разрешайте ребенку пользоваться солярием.
- Если вы заметили какие-либо изменения в родинках вашего ребенка, обратитесь к врачу.
Если родинка считается высоким риском развития рака — и в некоторых случаях, когда родинка вызывает значительный эмоциональный стресс — ее можно удалить хирургическим путем. Это помогает снизить риск развития рака и улучшить внешний вид. Большой или гигантский CMN часто требует нескольких этапов операции, чтобы удалить как можно больше пораженной кожи. Обычно это делается с помощью процесса, называемого расширением ткани.
CMN также можно осветлить лазерной терапией или химическим пилингом. Однако эти методы лечения не могут быть постоянными. Кроме того, осветленные родинки также труднее отслеживать на предмет риска рака кожи. Единственным истинным «лекарством» от риска рака кожи при ВМН является удаление родинки.
Новые и развивающиеся концепции меланоцитарных невусов и меланоцитом
Pollock PM, Harper UL, Hansen KS, et al. Высокая частота мутаций BRAF в невусах. Нат Жене. 2003; 33:19–20.
КАС пабмед Статья Google Scholar
Ван Рамсдонк К.Д., Безруков В., Грин Г. и др. Частые соматические мутации GNAQ при увеальной меланоме и голубых невусах. Природа. 2009; 457: 599–602.
ПабМед Статья КАС Google Scholar
Йех И., фон Даймлинг А., Бастиан Б.К. Клональные мутации BRAF в меланоцитарных невусах и инициирующая роль BRAF в меланоцитарной неоплазии.J Natl Cancer Inst. 2013; 105:917–9.
КАС пабмед ПабМед Центральный Статья Google Scholar
Van Raamsdonk CD, Griewank KG, Crosby MB, et al. Мутации в GNA11 при увеальной меланоме. N Engl J Med. 2010;363:2191–9.
ПабМед ПабМед Центральный Статья Google Scholar
Wiesner T, He J, Yelensky R, et al. Слияния киназ часто встречаются в опухолях шпица и шпицоидной меланоме.Нац коммун. 2014;5:3116.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Ханахан Д., Вайнберг Р.А. Отличительные признаки рака: следующее поколение. Клетка. 2011; 144:646–74.
КАС пабмед ПабМед Центральный Статья Google Scholar
Батай В., Като Б.С., Фальчи М. и др. Размер и количество невусов связаны с длиной теломер и представляют собой потенциальные маркеры замедления старения in vivo.Рак Эпидемиол Биомарк Пред. 2007; 16:1499–502.
КАС Статья Google Scholar
Даффи Д.Л., Чжу Г., Ли Х и др. Новые плейотропные локусы риска для меланомы и плотности невуса связаны с множественными биологическими путями. Нац коммун. 2018;9:4774.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Wachsmuth RC, Turner F, Barrett JH, et al.Влияние пребывания на солнце на определение плотности невуса у подростков-близнецов в Великобритании. Джей Инвест Дерматол. 2005; 124:56–62.
КАС пабмед Статья Google Scholar
Newton-Bishop JA, Chang Y-M, Iles MM, et al. Меланоцитарные невусы, гены невусов и риск меланомы в большом исследовании случай-контроль в Соединенном Королевстве. Рак Эпидемиол Биомарк Пред. 2010;19:2043–54.
КАС Статья Google Scholar
Li W-Q, Cho E, Weinstock MA, et al.Невусы кожи и риск смерти от меланомы у женщин и мужчин: проспективное исследование. J Am Acad Дерматол. 2019;80:1284–91.
ПабМед Статья Google Scholar
Massi G, LeBoit PE. Гистологическая диагностика невусов и меланомы. Берлин, Гейдельберг: Springer; 2014.
Книга Google Scholar
Ронджолетти Ф., Урсо С., Батоло Д. и др. Меланоцитарные невусы молочной железы: гистологическое исследование случай-контроль.Джей Кутан Патол. 2004; 31: 137–40.
КАС пабмед Статья Google Scholar
Ронджолетти Ф., Болл Р.А., Маркус Р. и др. Гистопатологические особенности изгибающих меланоцитарных невусов: исследование 40 случаев. Джей Кутан Патол. 2000; 27: 215–7.
КАС пабмед Статья Google Scholar
Фабрици Г., Пальярелло К., Паренте П. и др. Атипичные невусы волосистой части головы у подростков.Джей Кутан Патол. 2007; 34: 365–9.
ПабМед Статья Google Scholar
Clark WH Jr., Hood AF, Tucker MA, et al. Атипичные меланоцитарные невусы генитального типа с обсуждением реципрокных паренхиматозно-стромальных взаимодействий в биологии неоплазии. Хум Патол. 1998; 29: С1–24.
ПабМед Статья Google Scholar
Керл Х., Трау Х., Акерман А.Б.Дифференциация меланоцитарных невусов от злокачественных меланом ладоней, подошв и ногтевых лож исключительно по признакам в ороговевом слое эпидермиса. Am J Дерматопатол. 1984; 6 (Прил.:): 159–60.
ПабМед Google Scholar
Бойд А.С., Рапини Р.П. Акральные меланоцитарные новообразования: гистологический анализ 158 поражений. J Am Acad Дерматол. 1994; 31:740–5.
КАС пабмед Статья Google Scholar
Requena C, Requena L, Kutzner H, et al.Невус шпица: клинико-патологическое исследование 349 случаев. Am J Dermatopathol 2009;31:107–16.
ПабМед Статья Google Scholar
Herreid PA, Shapiro PE. Возрастное распределение невуса шпица по сравнению со злокачественной меланомой. Арка Дерматол. 1996; 132:352–3.
КАС пабмед Статья Google Scholar
Паниаго-Перейра С., Кукуруза Дж.С., Аккерман АБ. Невус из крупных веретенообразных и/или эпителиоидных клеток (невус Шпица).Арка Дерматол. 1978; 114: 1811–23.
КАС пабмед Статья Google Scholar
Уидон Д., Литтл Дж.Х. Веретенообразные и эпителиоидно-клеточные невусы у детей и взрослых. Обзор 211 случаев невуса шпица. Рак. 1977; 40: 217–25.
КАС пабмед Статья Google Scholar
Шпиц С. Меланомы детского возраста. Ам Джей Патол. 1948; 24: 591–609.
КАС пабмед ПабМед Центральный Google Scholar
Bastian BC, LeBoit PE, Pinkel D.Мутации и увеличение количества копий HRAS в невусах шпица с характерными гистопатологическими особенностями. Ам Джей Патол. 2000; 157:967–72.
КАС пабмед ПабМед Центральный Статья Google Scholar
Боттон Т., Йех И., Нельсон Т. и др. Рецидивирующие слияния киназ BRAF в меланоцитарных опухолях открывают возможность для таргетной терапии. Пигментно-клеточная меланома Res. 2013; 26:845–51.
КАС пабмед Статья Google Scholar
Йех И., Боттон Т., Талевич Э. и др.Активация перегруппировок киназы МЕТ в меланоме и опухолях шпица. Нац коммун. 2015;6:7174.
ПабМед ПабМед Центральный Статья Google Scholar
Yeh I, Tee MK, Botton T и др. Слияния киназы NTRK3 в опухолях шпица. Джей Патол. 2016; 240:282–90.
КАС пабмед ПабМед Центральный Статья Google Scholar
ВанденБум Т., Цюань В.Л., Чжан Б. и др.Геномные слияния в пигментированном веретеноклеточном невусе тростника. Am J Surg Pathol 2018; 42: 1042–51.
ПабМед Статья Google Scholar
Цюань В.Л., Чжан Б., Мохан Л.С. и др. Активирующие структурные изменения в генах MAPK являются различными генетическими факторами в уникальной подгруппе шпицоидных новообразований. Am J Surg Pathol 2019. https://doi.org/10.1097/PAS.0000000000001213.
ПабМед Статья Google Scholar
Ньюман С., Фан Л., Прибнов А. и др.Клиническое секвенирование генома обнаруживает потенциально целевые усечения и слияния MAP3K8 при шпицоидной и других меланомах. Nat Med 2019; 25: 597–602.
КАС пабмед Статья Google Scholar
Busam KJ, Kutzner H, Cerroni L, et al. Клинические и патологоанатомические данные о невусах шпица и атипичных опухолях шпица со слияниями ALK. Ам Дж. Сург Патол. 2014; 38: 925–33.
ПабМед ПабМед Центральный Статья Google Scholar
Yeh I, de la Fouchardiere A, Pissaloux D, et al.Клинические, гистопатологические и геномные особенности опухолей шпица со слияниями ALK. Ам Дж. Сург Патол. 2015; 39: 581–91.
ПабМед ПабМед Центральный Статья Google Scholar
Амин С.М., Хо А.М., Ли С.И. и др. Сравнение морфологических и молекулярных особенностей слитых шпицоидных новообразований BRAF, ALK и NTRK1. Ам Дж. Сург Патол. 2017;41:491–8.
ПабМед Статья Google Scholar
Yeh I, Busam KJ, McCalmont TH, et al.Филигранноподобные сетчатые гребни, дольчатые гнезда, розетоподобные структуры и преувеличенное созревание характеризуют опухоли шпица со слиянием NTRK1. Ам Дж. Сург Патол. 2019;43:737–46.
ПабМед Статья Google Scholar
Мёллер И., Мурали Р., Мюллер Х. и др. Мутации активации цистеиниллейкотриенового рецептора 2 (CYSLTR2) в голубых невусах. Mod Pathol 2016. https://doi.org/10.1038/modpathol.2016.201.
ПабМед ПабМед Центральный Статья КАС Google Scholar
Griewank KG, Müller H, Jackett LA, et al.Мутации SF3B1 и BAP1 при меланоме, подобной голубому невусу. Мод Патол. 2017;30:928.
КАС пабмед ПабМед Центральный Статья Google Scholar
Бастиан Британская Колумбия. Молекулярная патология меланомы: комплексная таксономия меланоцитарной неоплазии. Анну Рев Патол. 2014; 9: 239–71.
КАС пабмед ПабМед Центральный Статья Google Scholar
Baykal C, Yılmaz Z, Sun GP, et al.Спектр доброкачественных дермальных дендритных меланоцитарных пролифераций. J Eur Acad Dermatol Venereol. 2019;33:1029–41.
КАС пабмед Статья Google Scholar
Карвонен С.Л., Вааялахти П., Маренк М. и др. Родинки у 4346 финских новорожденных. Акта Дерм Венерол. 1992; 72: 55–7.
КАС пабмед Google Scholar
Castilla EE, da Graça Dutra M, Orioli-Parreiras IM.Эпидемиология врожденных пигментных невусов: II. Факторы риска. Бр Дж Дерматол. 1981; 104: 421–7.
КАС пабмед Статья Google Scholar
Krengel S, Scope A, Dusza SW, et al. Новые рекомендации по классификации кожных особенностей врожденных меланоцитарных невусов. J Am Acad Дерматол. 2013;68:441–51.
ПабМед Статья Google Scholar
Бауэр Дж., Кертин Дж. А., Пинкель Д. и др.Врожденные меланоцитарные невусы часто содержат мутации NRAS, но не мутации BRAF. Джей Инвест Дерматол. 2007; 127:179–82.
КАС пабмед Статья Google Scholar
Сальгадо С.М., Басу Д., Никифорова М. и др. Мутации BRAF также связаны с нейрокожным меланоцитозом и большими/гигантскими врожденными меланоцитарными невусами. Педиатр Дев Патол. 2015;18:1–9.
ПабМед Статья Google Scholar
Зарин К.Ю., Сан Б.К., Бангс К.Д. и др.Активирующая мутация hras в невусах шпица, возникающих в невусах spilus. ДЖАМА Дерматол. 2013; 149:1077–81.
КАС пабмед Статья Google Scholar
Dessars B, De Raeve LE, El Housni H, et al. Хромосомные транслокации как механизм активации BRAF в двух случаях крупных врожденных меланоцитарных невусов. Джей Инвест Дерматол. 2007; 127:1468–70.
КАС пабмед Статья Google Scholar
Мартинс да Силва В., Мартинес-Барриос Э., Телль-Марти Г. и др.Генетические аномалии в больших и гигантских врожденных невусах: помимо мутаций NRAS. J Investig Dermatol 2018. https://doi.org/10.1016/j.jid.2018.07.045.
КАС пабмед Статья Google Scholar
Балтрес А., Салхи А., Улье А. и др. Злокачественная меланома с участками рабдомиосаркоматозной дифференцировки, возникающая в гигантском врожденном невусе со слиянием гена RAF1. Пигментно-клеточная меланома Res 2019. https://doi.org/10.1111/pcmr.12785.
Radentz WH, Vogel P. Врожденный обыкновенный голубой невус. Арка Дерматол. 1990; 126:124–5.
КАС пабмед Статья Google Scholar
Кавасаки Т., Цубои Р., Уэки Р. и др. Врожденный гигантский обыкновенный голубой невус. J Am Acad Дерматол. 1993; 28: 653–4.
КАС пабмед Статья Google Scholar
Бусам К.Дж., Ломанн К.М.Врожденный маломеланотический клеточный голубой невус. Джей Кутан Патол. 2004; 31: 312–7.
ПабМед Статья Google Scholar
Lee MY, Jin S, Lee K-H и др. Клеточный голубой невус с пигментированным эпителиоидным меланоцитомоподобным рисунком на ипсилатеральном плече, связанный с врожденным бляшечным голубым невусом на руке. Джей Кутан Патол. 2019;46:383–8.
ПабМед Статья Google Scholar
Findler G, Hoffman HJ, Thomson HG, et al.Гигантский невус волосистой части головы, связанный с внутричерепной пигментацией. История болезни. Дж Нейрохирург. 1981; 54: 108–12.
КАС пабмед Статья Google Scholar
Marano SR, Brooks RA, Spetzler RF, et al. Гигантский врожденный клеточный голубой невус волосистой части головы новорожденного с сопутствующим дефектом черепа и прорастанием твердой мозговой оболочки. Нейрохирургия. 1986; 18:85–89.
КАС пабмед Статья Google Scholar
Мадари А., Рамдиал П.К., Дю Треву М.Гигантский врожденный невус кожи головы и черепа: клинический случай и обзор литературы. Бр Дж Пласт Хирург. 1997; 50:20–5.
КАС пабмед Статья Google Scholar
Микали Г., Инноченци Д., Наска М.Р. Клеточный голубой невус кожи головы, инфильтрирующий нижележащую кость: клинический случай и обзор. Педиатр Дерматол. 1997; 14:199–203.
КАС пабмед Статья Google Scholar
Курокава Р., Ким П., Кавамото Т. и др.Интрамедуллярная и ретроперитонеальная меланоцитарная опухоль, связанная с врожденным голубым невусом и пламенным невусом: необычная комбинация нейрокожного меланоза и пигментно-васкулярного факоматоза. Нейрол Мед Чир. 2013;53:730–4.
Артикул Google Scholar
Küsters-Vandevelde HVN, van Engen-van Grunsven IACH, Coupland SE, et al. Мутации в генах, кодирующих g-белок, и хромосомные изменения при первичных лептоменингеальных меланоцитарных новообразованиях.Патол Онкол Рез. 2015; 21: 439–47.
ПабМед Статья КАС Google Scholar
Томас А.С., Зенг З., Ривьер Ж.-Б. и др. Мозаичные активирующие мутации в GNA11 и GNAQ связаны с пигментным факоматозом и обширным кожным меланоцитозом. J Расследуя дерматол. 2016; 136:770–8.
КАС пабмед Статья Google Scholar
Кумар А., Застров Д.Б., Кравец Е.Ю. и др.Внекожные проявления при факоматозе цезиофламмеа и цезиомармората: серия случаев и обзор литературы. Am J Med Genet, часть A. 2019; 179: 966–77.
ПабМед Статья Google Scholar
Ширли, доктор медицинских наук, Танг Х., Галлион С.Дж. и др. Синдром Стерджа-Вебера и винные пятна, вызванные соматической мутацией в GNAQ. N Engl J Med. 2013; 368:1971–9.
КАС пабмед ПабМед Центральный Статья Google Scholar
Гроссер Л., Петергоф Э., Эверт М. и др.Мутации BRAF и RAS при спорадической и вторичной пиогенной гранулеме. Джей Инвест Дерматол. 2016; 136:481–6.
КАС пабмед Статья Google Scholar
Liau J-Y, Lee J-C, Tsai J-H, et al. Высокая частота мутаций GNA14, GNAQ и GNA11 при гемангиоме вишни: гистопатологическое и молекулярное исследование 85 случаев, указывающих на то, что GNA14 является наиболее часто мутировавшим геном в сосудистых новообразованиях. Мод Патол 2019. https://doi.org/10.1038/с41379-019-0284-у.
КАС пабмед Статья Google Scholar
Элдер Д.Э., Масси Д., Сколер Р. и др. Классификация ВОЗ опухолей кожи. 4-е изд. Лион, Франция: IARC Press; 2018.
Зембович А., Карни Дж. А., Михм М. С. Пигментная эпителиоидная меланоцитома: меланоцитарная опухоль низкой степени злокачественности с метастатическим потенциалом, неотличимая от меланомы животного типа и эпителиоидного голубого невуса. Ам Дж. Сург Патол.2004; 28:31–40.
ПабМед Статья Google Scholar
Zembowicz A, Knoepp SM, Bei T, et al. Потеря экспрессии протеинкиназы регуляторной субъединицы 1альфа при пигментированной эпителиоидной меланоцитоме, но не при меланоме или других меланоцитарных поражениях. Ам Дж. Сург Патол. 2007; 31: 1764–75.
ПабМед Статья Google Scholar
Мандал Р.В., Мурали Р., Лундквист К.Ф. и др.Пигментно-эпителиоидная меланоцитома: благоприятный исход после 5-летнего наблюдения. Ам Дж. Сург Патол. 2009; 33: 1778–82.
ПабМед Статья Google Scholar
Cohen JN, Joseph NM, North JP, et al. Геномный анализ пигментированных эпителиоидных меланоцитом выявляет повторяющиеся изменения в генах PRKAR1A и PRKCA. Ам Дж. Сург Патол. 2017;41:1333–46.
ПабМед Статья Google Scholar
Isales MC, Mohan LS, Quan VL и др.Различные геномные паттерны в пигментированной эпителиоидной меланоцитоме: молекулярный и гистологический анализ 16 случаев. Ам Дж. Сург Патол. 2019;43:480–8.
ПабМед Статья Google Scholar
Kirschner LS, Carney JA, Pack SD, et al. Мутации гена, кодирующего регуляторную субъединицу протеинкиназы А типа I-альфа, у пациентов с комплексом Карнея. Нат Жене. 2000; 26: 89–92.
КАС пабмед Статья Google Scholar
Сиаб Дж. А., Грэм Дж. Х., Хелвиг Э. Б.Глубоко проникающий невус. Ам Дж. Сург Патол. 1989; 13:39–44.
ПабМед Статья Google Scholar
Yeh I, Lang UE, Durieux E, et al. Комбинированная активация пути MAP-киназы и передачи сигналов β-катенина вызывает глубоко проникающие невусы. Нац коммун. 2017;8:644.
ПабМед ПабМед Центральный Статья КАС Google Scholar
High WA, Alanen KW, Golitz LE.Является ли меланоцитарный невус с очаговыми атипичными эпителиоидными компонентами (клональный невус) поверхностным вариантом глубоко проникающего невуса? J Am Acad Дерматол. 2006; 55: 460–6.
ПабМед Статья Google Scholar
Дадрас С.С., Лу Дж., Зембович А. и др. Гистологические особенности и исход инвертированных меланоцитарных невусов типа А. Дж. Кутан Патол, 2018 г. https://doi.org/10.1111/cup.13106.
ПабМед Статья Google Scholar
Черрони Л., Барнхилл Р., старейшина Д. и др.Меланоцитарные опухоли неопределенного злокачественного потенциала. Ам Дж. Сург Патол. 2010;34:314–26.
ПабМед Статья Google Scholar
Wiesner T, Obenauf AC, Murali R, et al. Мутации зародышевой линии в BAP1 предрасполагают к меланоцитарным опухолям. Нат Жене. 2011;43:1018–21.
КАС пабмед ПабМед Центральный Статья Google Scholar
Busam KJ, Sung J, Wiesner T, et al.Комбинированные BRAF(V600E)-положительные меланоцитарные поражения с крупными эпителиоидными клетками, лишенными экспрессии BAP1, и обычными невомеланоцитами. Ам Дж. Сург Патол. 2013;37:193–9.
ПабМед Статья Google Scholar
Yeh I, Mully TW, Wiesner T, et al. Неоднозначные меланоцитарные опухоли с потерей 3p21. Ам Дж. Сург Патол. 2014; 38:1088–95.
ПабМед ПабМед Центральный Статья Google Scholar
Wiesner T, Murali R, Fried I, et al.Отдельная подгруппа атипичных опухолей шпица характеризуется мутацией BRAF и потерей экспрессии BAP1. Ам Дж. Сург Патол. 2012;36:818–30.
ПабМед ПабМед Центральный Статья Google Scholar
Abdel-Rahman MH, Pilarski R, Cebulla CM, et al. Мутация зародышевой линии BAP1 предрасполагает к увеальной меланоме, аденокарциноме легкого, менингиоме и другим видам рака. J Med Genet 2011. https://doi.org/10.1136/jmedgenet-2011-100156.
КАС пабмед Статья Google Scholar
Карбоне М., Ян Х., Пасс Х.И. и др.BAP1 и рак. Нат Рев Рак. 2013;13:153–159.
КАС пабмед ПабМед Центральный Статья Google Scholar
Попова Т., Хеберт Л., Жакмен В. и др. Мутации зародышевой линии BAP1 предрасполагают к почечно-клеточному раку. Am J Hum Genet 2013. https://doi.org/10.1016/j.ajhg.2013.04.012.
КАС пабмед Статья Google Scholar
Harvell JD, Meehan SA, LeBoit PE.Невусы Шпица с гало-реакцией: гистопатологическое исследование 17 случаев. Джей Кутан Патол. 1997; 24:611–9.
КАС пабмед Статья Google Scholar
Рекена С., Санс В., Нагоре Э. и др. BAP1-дефицитная и VE1-отрицательная атипичная опухоль шпица. Джей Кутан Патол. 2015;42:564–7.
ПабМед Статья Google Scholar
Бусам К.Дж., Мурали Р., Пулитцер М. и др.Атипичные шпицоидные меланоцитарные опухоли с положительными сигнальными лимфатическими узлами у детей и подростков и сравнение с гистологически однозначными и летальными меланомами. Ам Дж. Сург Патол. 2009; 33:1386–95.
ПабМед Статья Google Scholar
Дункан Л.М. Атипичные опухоли шпица и сигнальные лимфатические узлы. Ланцет Онкол. 2014;15:377–378.
ПабМед Статья Google Scholar
Fullen DR, Poynter JN, Lowe L, et al.Мутации BRAF и NRAS при шпицоидных меланоцитарных поражениях. Мод Патол. 2006;19:1324–32.
КАС пабмед Статья Google Scholar
Da Forno PD, Pringle JH, Fletcher A, et al. Мутации BRAF, NRAS и HRAS в шпицоидных опухолях и их возможное патогенетическое значение. Бр Дж Дерматол. 2009; 161:364–72.
ПабМед Статья КАС Google Scholar
Лазова Р., Порнпуттапонг Н., Халабан Р. и др.Шпиц-невусы и шпицоидные меланомы: секвенирование экзома и сравнение с обычными меланоцитарными невусами и меланомами. Mod Pathol 2017. https://doi.org/10.1038/modpathol.2016.237.
КАС пабмед ПабМед Центральный Статья Google Scholar
Gerami P, Scolyer RA, Xu X, et al. Оценка риска атипичных шпицоидных меланоцитарных новообразований с использованием FISH для выявления аберраций числа копий хромосом. Ам Дж. Сург Патол. 2013; 37: 676–84.
ПабМед Статья Google Scholar
Ли С., Барнхилл Р.Л., Даммер Р. и др. Мутации промотора TERT предсказывают агрессивное клиническое поведение у пациентов со шпицоидными меланоцитарными новообразованиями. Научный доклад 2015; 5:11200.
КАС пабмед ПабМед Центральный Статья Google Scholar
Джерами П., Купер С., Баджадж С. и др. Исходы атипичных опухолей шпица с хромосомными аберрациями числа копий и обычных меланом у детей.Ам Дж. Сург Патол. 2013; 37:1387–94.
ПабМед Статья Google Scholar
Шаин А.Х., Е И., Ковалишин И. и др. Генетическая эволюция меланомы из предшествующих поражений. New Engl J Med. 2015; 373:1926–36.
ПабМед Статья КАС Google Scholar
Кинслер В.А., О’Хара П., Булстроуд Н. и др. Меланома при врожденных меланоцитарных невусах. Бр Дж Дерматол.2017; 176:1131–43.
КАС пабмед ПабМед Центральный Статья Google Scholar
Bastian BC, Xiong J, Frieden IJ, et al. Генетические изменения в новообразованиях, возникающих при врожденных меланоцитарных невусах: отличия узловых пролифераций от меланом. Ам Джей Патол. 2002; 161:1163–9.
КАС пабмед ПабМед Центральный Статья Google Scholar
Мерфи М.Дж., Джен М., Чанг М.В. и др.Молекулярная диагностика доброкачественного пролиферативного узла, развивающегося на фоне врожденного меланоцитарного невуса у 3-месячного ребенка. J Am Acad Дерматол. 2008; 59: 518–23.
ПабМед Статья Google Scholar
Рокас Д., Кастильо С., Ламарка С. и др. Непигментированный узелок с потерей экспрессии BAP1 в врожденном невусе среднего размера. Евр Дж Дерматол. 2015;25:201–2.
ПабМед Google Scholar
Различие между доброкачественными и злокачественными меланоцитарными невусами с помощью многофотонной микроскопии in vivo | Исследование рака
Мы визуализировали 5 пациентов, у которых была диагностирована меланома, соответствующая двум подтипам меланомы: поверхностно распространяющаяся меланома (3) и злокачественное лентиго (2).
При поверхностно распространяющихся очагах меланомы мы визуализировали пролиферацию атипичных меланоцитов (высоко плеоморфных меланоцитов) на всех уровнях эпидермиса и Педжетоидное распространение (наличие меланоцитов в верхней части эпидермиса по отдельности или группами). Дополнительный рисунок S3). При поражениях злокачественного типа меланомы лентиго мы визуализировали атипичные меланоциты в верхних слоях эпидермиса и инвазию клеток меланомы в дерму.Средние значения F и S для очагов меланомы колебались в пределах 0,58–0,8. и 0,06–0,38 соответственно. Средние значения D варьировались от 8500 до 78000 дендритов/мм 3 (таблица 1).
MPM и гистологические изображения одной из поверхностно распространяющихся меланом показаны на рис. 4. MPM изображения поражения показали наличие меланоцитарных дендритов в верхних слоях эпидермиса (рис.4C), пролиферация атипичных меланоцитов и архитектурное нарушение в базальном слое (рис. 4D-F). Клетки меланомы и предполагаемые меланофаги можно визуализировать в дерме (рис. 4F). Эти признаки хорошо коррелируют с признаками, обнаруженными в соответствующих гистологических срезах поражения (рис. 4В). Значения F для изображений, которые были включены в количественный анализ, и значение S для стека, к которому принадлежат изображения, приведены в подписи к рис. 4. Среднее значение D для этого поражения составило 63 878 дендритов/ мм 3 .
Диапазоны средних значений F , S и D , соответствующих пигментным поражениям на разных стадиях, сведены в табл. 1. Распределение средних значений количественных параметров F , S и D изображены на рис. 5A–C. Достоверные различия между средними значениями для каждой группы оценивали с помощью теста Манна-Уитни U .Нулевая гипотеза заключалась в том, что средние параметры F , S и D были одинаковыми для двух разных групп. Мы отвергли нулевую гипотезу для значения U ≤ 2 (критическое значение для наших экспериментальных условий), что соответствует P < 0,05. Оценивая значения U для каждой пары групп, мы обнаружили (i) средние значения параметра F , соответствующего меланоме, значительно отличались от средних значений для диспластических и обыкновенных невусов ( P = 0.016 и 0,009 соответственно). Обычные и диспластические невусы не различались по среднему параметру F ( P = 0,5). (ii) Средние значения параметра S для каждой группы значительно отличались от значений двух других групп ( P = 0,009–0,016). (iii) Параметр D отделял меланому от обычных и диспластических невусов ( P = 0,009), но не различал обычные и диспластические невусы ( P = 0.3).
Корреляция между каждым из параметров F , S и D показана на рис. 5E-G. На этом рисунке комбинация (цвет, маркер) соответствует отдельному поражению. Можно отметить, например, что диспластический невус с максимальным значением D (синий треугольник, сплошные стрелки) — ближайший к меланоме — также имеет минимальное значение S и значение F , близкое к меланоме. минимум.Фактически, из диспластических невусов, которые мы визуализировали, это был единственный невус с диагнозом «умеренная или тяжелая» дисплазия. Одно из поражений с диагнозом «злокачественное лентиго» соответствует красному кругу на рис. 5E-G (пунктирные стрелки). В этом поражении мы визуализировали только случайные восходящие меланоциты в верхних слоях эпидермиса (низкое значение D), но тяжелую пролиферацию атипичных меланоцитов в EDJ и инвазию в дерму. Меланоцитарная пролиферация привела к высокой степени однородности интенсивности изображений TPEF (низкое значение F ) из-за более однородной повышенной пигментации.Значение S (показатель кожной инвазии) для этого поражения было низким, но не минимальным. 5E и F и рассчитанные коэффициенты корреляции Пирсона ( ρ ) показывают, что параметры S и F слабо коррелируют с D ( ρ = −0,47, P S = для и D ; ρ = −0,5, P = 0,057 для F и D ), тогда как на рис. ρ = 0.71, P = 0,0032). Взаимосвязь между S и F неудивительна, учитывая тот факт, что они отбирают сходные области и комплементарные процессы вокруг EDJ. Среди трех параметров S является единственным, который может полностью разрешить все три состояния (т. е. доброкачественное, диспластическое, злокачественное). Однако комбинация всех трех параметров улучшает показатели за счет увеличения разделения между диспластическими и меланомными группами, что нас больше всего беспокоит (значение P уменьшено с 0.016 до 0,009). Поэтому, чтобы повысить эффективность показателей F , S и D , мы присвоили каждому из этих критериев гистологическую оценку от 0 до 3 на основе визуализации средних значений, как показано на рис. 5А. –C и Таблица 2. Для каждого поражения баллы по трем критериям суммировались, чтобы получить окончательный непрерывный индекс MMI в диапазоне от 0 до 9. При использовании этого подхода общие невусы оценивались от 0 до 1, диспластические невусы от 1 до 4 и меланома между 5 и 8.Распределение этих баллов для трех групп показано на рис. 5D. Тест Манна-Уитни U показывает, что показатели MMI, соответствующие группе меланомы, значительно отличаются от двух других групп ( P = 0,009). Разница в баллах MMI для обыкновенных и диспластических невусов незначительно ( P = 0,03).
. Крайне медленно, в течение многих лет оно увеличивается по площади, приобретая все более размытые очертания, приобретая пестроту (полихромию) в окраске — коричневые, серые, белесоватые цвета. На фоне этого пятна, иногда прослеживается единичный волосяной покров. Однако в 30-40 % случаев происходит озлокачествление этого пятна и переход из меланоза в меланому… Визуально, мы с вами это определим по появлению бляшек более тёмного цвета и более плотной консистенции на поверхности пятна. С момента появления желтоватого пятна до развития меланомы может пройти несколько десятков лет. Но, в связи с ухудшением экологической ситуации на планете, появление меланоза Дюбрейля всё чаще регистрируется у лиц среднего возраста. Это заболевание требует хирургического лечения, но при больших размерах иногда ставится вопрос о проведении близкофокусной рентгентерапии.
Крайне медленно, в течение многих лет оно увеличивается по площади, приобретая все более размытые очертания, приобретая пестроту (полихромию) в окраске — коричневые, серые, белесоватые цвета. На фоне этого пятна, иногда прослеживается единичный волосяной покров. Однако в 30-40 % случаев происходит озлокачествление этого пятна и переход из меланоза в меланому… Визуально, мы с вами это определим по появлению бляшек более тёмного цвета и более плотной консистенции на поверхности пятна. С момента появления желтоватого пятна до развития меланомы может пройти несколько десятков лет. Но, в связи с ухудшением экологической ситуации на планете, появление меланоза Дюбрейля всё чаще регистрируется у лиц среднего возраста. Это заболевание требует хирургического лечения, но при больших размерах иногда ставится вопрос о проведении близкофокусной рентгентерапии.
 Обнаруживается обычно у детей в возрасте от 6 до 17 лет. Его излюбленная локализация на лице, шее и груди. Имеет единичный характер. Обычно выглядит как бляшка или пятно темно-коричневого цвета, мягко-эластической консистенции, поверхность его гладкая, блестящая. Довольно часто имеет более темный фестончатый край. По периметру невуса иногда можно увидеть розового цвета папулы или выступы в виде лучей. Диаметр невуса обычно не превышает 1 сантиметра. Довольно часто по периметру виден розовый венчик. Лечебная тактика при обнаружении этого образования достаточно однозначна — эксцизионная биопсия — это хирургическое удаление новообразования в пределах здоровых тканей и их гистологическое исследование.
Обнаруживается обычно у детей в возрасте от 6 до 17 лет. Его излюбленная локализация на лице, шее и груди. Имеет единичный характер. Обычно выглядит как бляшка или пятно темно-коричневого цвета, мягко-эластической консистенции, поверхность его гладкая, блестящая. Довольно часто имеет более темный фестончатый край. По периметру невуса иногда можно увидеть розового цвета папулы или выступы в виде лучей. Диаметр невуса обычно не превышает 1 сантиметра. Довольно часто по периметру виден розовый венчик. Лечебная тактика при обнаружении этого образования достаточно однозначна — эксцизионная биопсия — это хирургическое удаление новообразования в пределах здоровых тканей и их гистологическое исследование.
 Этот невус диагностируют в более молодом и среднем возрасте у людей на туловище, обычно на закрытых участках кожи, как это не парадоксально. На вид это пятна, имеющие темно-коричневую окраску, неоднородную, но с четкими фестончатыми краями. Поверхность невуса обычно гладкая, может быть немного приподнятая, «зернистая». Как правило диспластические невусы имеют множественный характер, но бывают и единичные. Самое неприятное в этом диагнозе, что при наличии множественных диспластических невусов характерен высокий риск развития меланомы. Этот риск возрастает, если меланомы диагностировались у ближайших родственников.
Этот невус диагностируют в более молодом и среднем возрасте у людей на туловище, обычно на закрытых участках кожи, как это не парадоксально. На вид это пятна, имеющие темно-коричневую окраску, неоднородную, но с четкими фестончатыми краями. Поверхность невуса обычно гладкая, может быть немного приподнятая, «зернистая». Как правило диспластические невусы имеют множественный характер, но бывают и единичные. Самое неприятное в этом диагнозе, что при наличии множественных диспластических невусов характерен высокий риск развития меланомы. Этот риск возрастает, если меланомы диагностировались у ближайших родственников.
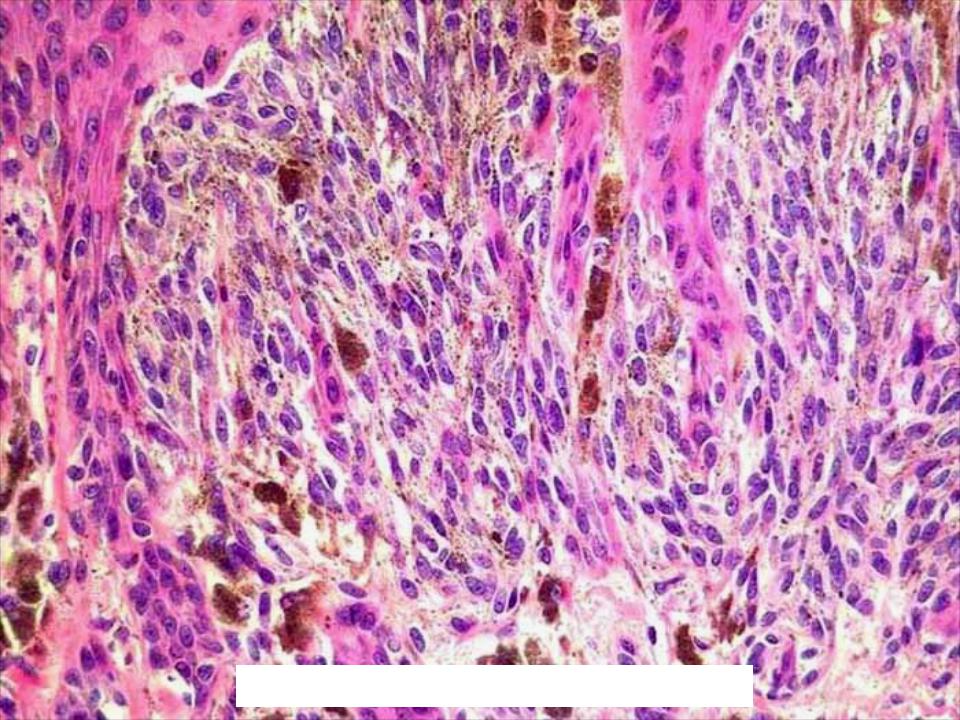 Меланомы за сутки не образуются — это не пожар. Меланоме нужно достаточно много времени и условий для развития.
Меланомы за сутки не образуются — это не пожар. Меланоме нужно достаточно много времени и условий для развития.
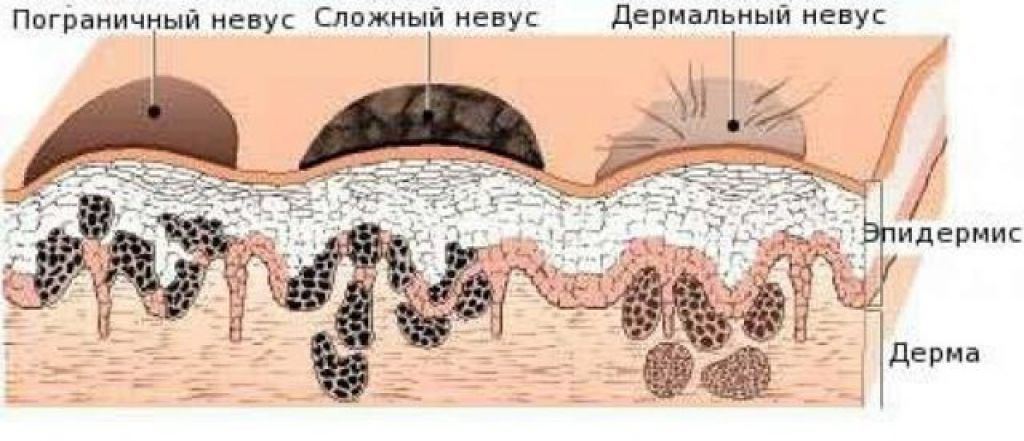
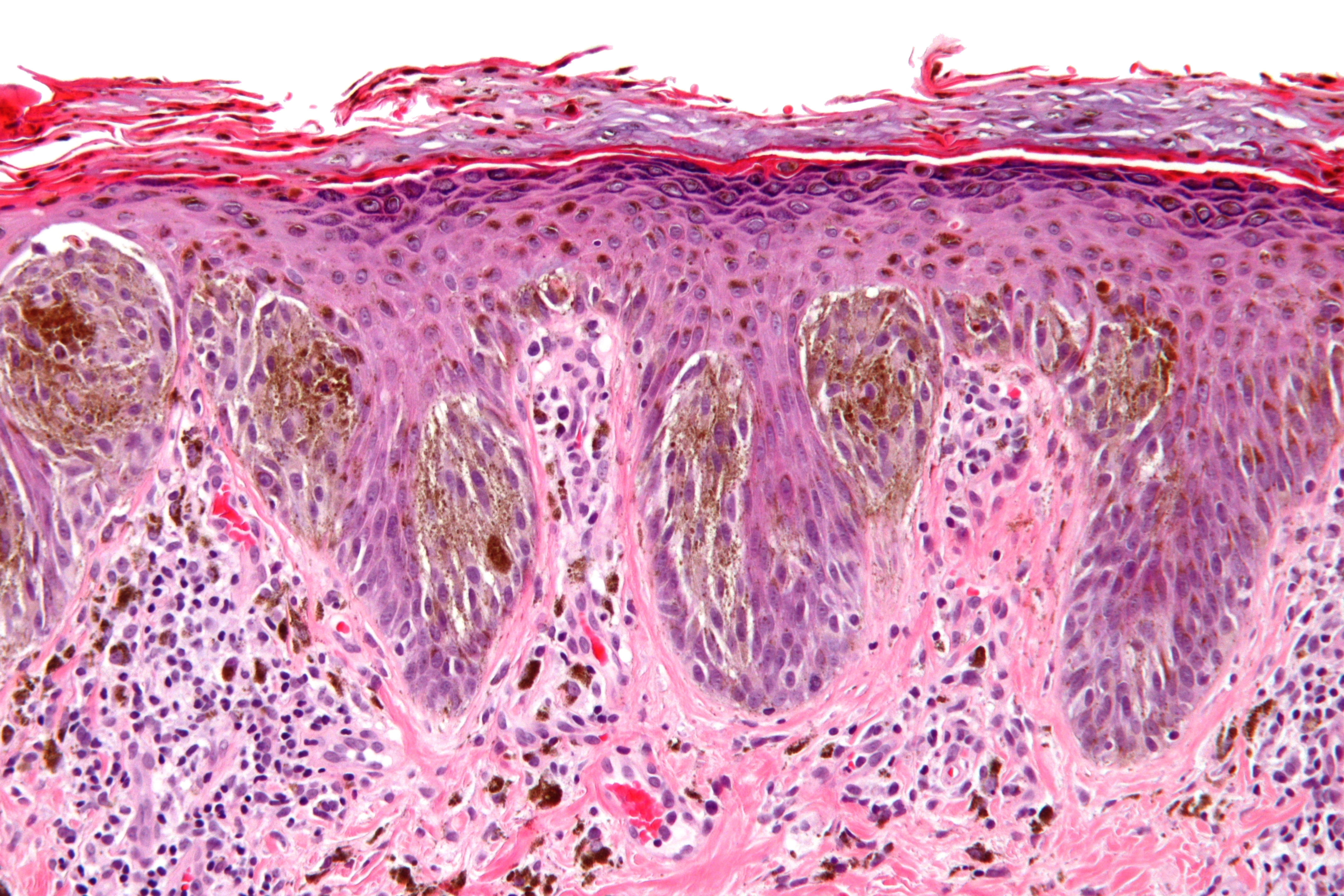

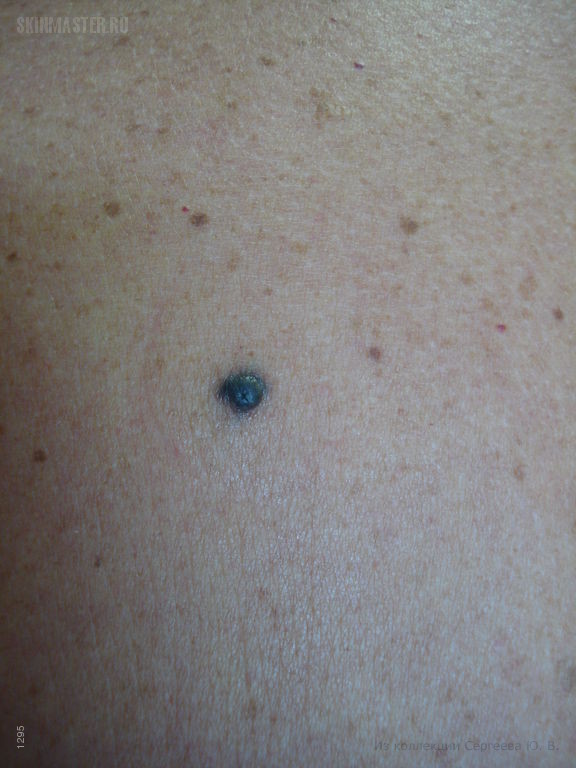 п.).
п.).
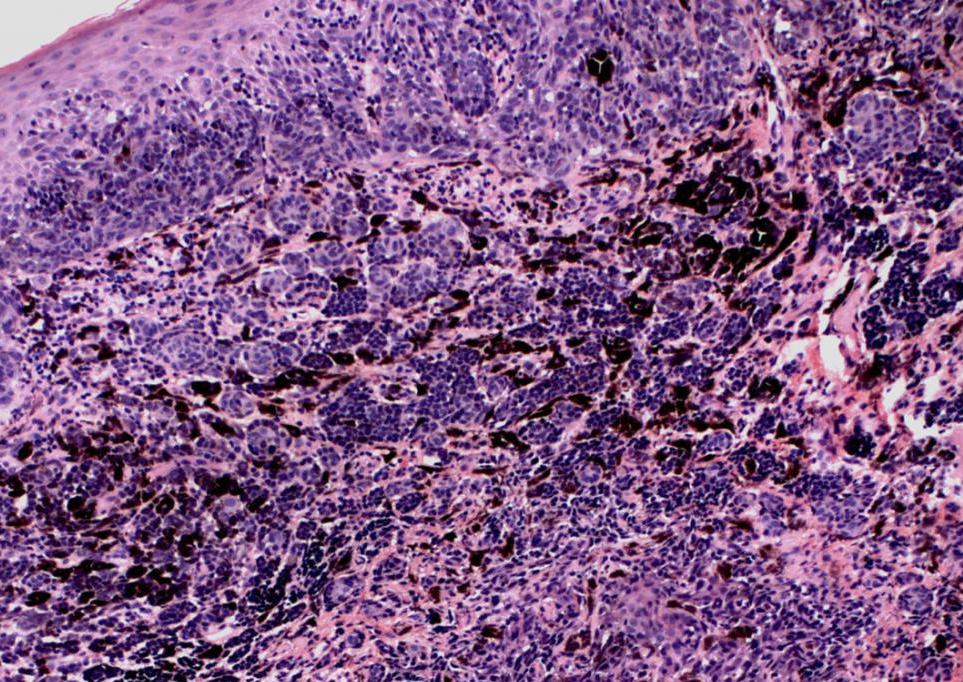 Clinical whole-body examination reduces the incidence of thick melanomas. Intern J Cancer 2010; 126(2): 450–8.
Clinical whole-body examination reduces the incidence of thick melanomas. Intern J Cancer 2010; 126(2): 450–8.
 Ю., Левченко Н.Р., Ефимцева А.Ф. и др. Лентигиозная меланоцитарная дисплазия. В: Клиническая и патоморфологическая диагностика редко встречающихся повреждений и заболеваний. Случаи из практики. Благовещенск; 2015.
Ю., Левченко Н.Р., Ефимцева А.Ф. и др. Лентигиозная меланоцитарная дисплазия. В: Клиническая и патоморфологическая диагностика редко встречающихся повреждений и заболеваний. Случаи из практики. Благовещенск; 2015.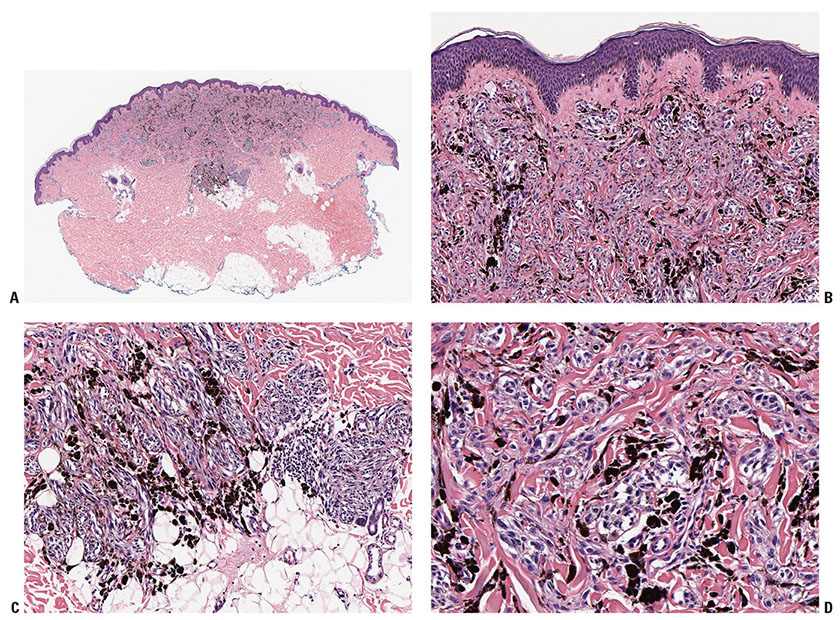 oncology.ru/archive/2013/03/3.htm.
oncology.ru/archive/2013/03/3.htm. ru/ru/article/view?id=27502.
ru/ru/article/view?id=27502. 2013.4440.
2013.4440.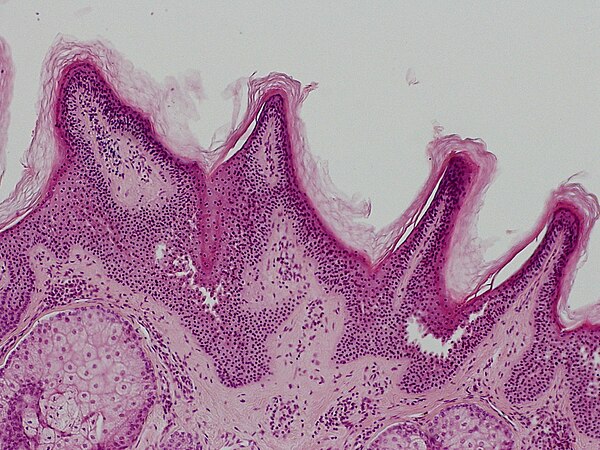

 [PubMed: 20956637]
[PubMed: 20956637] [PubMed: 30575031]
[PubMed: 30575031]