Стафилококкозы собак | Ветеринария и жизнь
Поэтому, необходимо знать, как проявляются признаки заражения теми или иными микроорганизмами, в частности, патогенными стафилококками, и как лечить отдельно взятую инфекцию. Особенно распространены среди собак стафилококкозы.
Стафилококкозы — это группа заболеваний, причиной которых являются патогенные стафилококки видов: Staphylococcus aureus, Staphylococcus haemolyticus, Staphylococcus intermedius, Staphylococcus pseudintermedius, Staphylococcus epidermidis. Патология может развиваться по двум основным путям. Первый заключается в том, что стафилококк самостоятельно вызывает заболевание. В том случае, если он присоединяется к уже существующей проблеме, речь ведут о вторичной форме. Таким образом, стафилококк у собак может поражать различные органы (кожу, глаза, уши, слизистые оболочки носовой и ротовой полостей, мочеполовую систему, кровь и др.), но благодаря тому, что имеются характерные симптомы, можно вовремя заметить заболевание и начать лечение.
Стафилококк относится к грамположительным микроорганизмам. Он имеет шаровидную форму и определяется в виде скоплений, напоминающих гроздь винограда. Название бактерий возникло от лат. Staphylococcus, от греч. σταφυλή — «гроздь винограда» и греч. κόκκος — «зерно, ягода».
У каждой собаки имеется своя предрасположенность к возбудителю или же напротив, устойчивость.
При высокой сопротивляемости организма для инфицирования необходима огромная доза заражения.
В то же время, следует выделить основные предрасполагающие факторы, способствующие заболеванию:
— высокий уровень углеводов в организме собак;
— нарушение иммунитета;
— авитаминозы, а точнее недостаток витаминов A, E, группы В;
— отравление организма;
— заболевания кожи, в частности, клещи,блохи, аллергические реакции и пр.;
— настроенность иммунной системы в виде отсутствия устойчивости именно к этому возбудителю.
Практически все симптомы, которые вызывает стафилококк, связаны с состоянием кожи. Возможно, это объясняется тем, что у животного кожа не способна выполнять защитную функцию также эффективно, как, например, кожа человека. Наиболее часто регистрируется пиодермия, вызвать которую могут: золотистый стафилококк, гемолитический, псевдоинтермедиус и интермедиус, иногда эпидермальный стафилококк. Данная патология классифицируется в зависимости от того, на какую глубину распространяется патологический процесс. Поверхностная форма выражается в виде появления неглубоких эрозий и не сильно выраженного зуда. Прикосновение к ним вызывает болевые ощущения. Данная форма может быть с появлением влажных эрозий. Их провоцирует травма кожи или постоянное расчесывание вследствие наличия паразитов на коже собаки. Наиболее часто при этом золотистый стафилококк выявляется в области хвоста, на шее, под грудью и на лапах, в тех местах, где кожа наиболее тонкая и, следовательно, более уязвимая. Обострение заболевания может быть летом или весной, то есть в теплое время года.
Возможно, это объясняется тем, что у животного кожа не способна выполнять защитную функцию также эффективно, как, например, кожа человека. Наиболее часто регистрируется пиодермия, вызвать которую могут: золотистый стафилококк, гемолитический, псевдоинтермедиус и интермедиус, иногда эпидермальный стафилококк. Данная патология классифицируется в зависимости от того, на какую глубину распространяется патологический процесс. Поверхностная форма выражается в виде появления неглубоких эрозий и не сильно выраженного зуда. Прикосновение к ним вызывает болевые ощущения. Данная форма может быть с появлением влажных эрозий. Их провоцирует травма кожи или постоянное расчесывание вследствие наличия паразитов на коже собаки. Наиболее часто при этом золотистый стафилококк выявляется в области хвоста, на шее, под грудью и на лапах, в тех местах, где кожа наиболее тонкая и, следовательно, более уязвимая. Обострение заболевания может быть летом или весной, то есть в теплое время года.
Кроме этого пиодермия с поверхностным поражением кожи может регистрироваться у собак с выраженными кожными складками.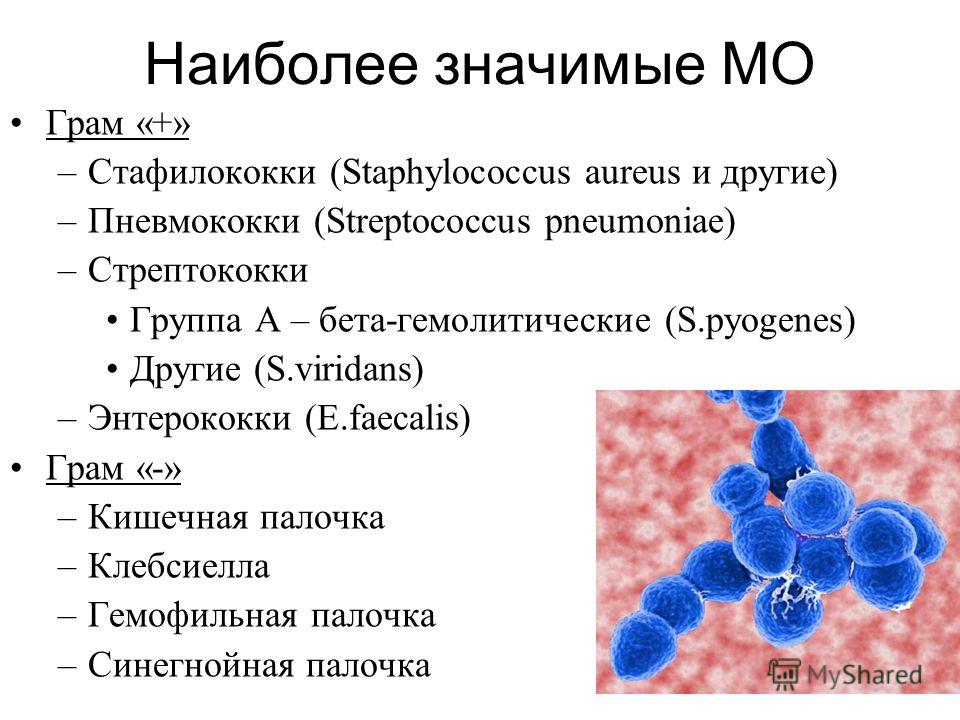 В процессе жизнедеятельности в них скапливаются различные выделения и остатки корма. При отсутствии проветривания присоединяется инфекция, которой, как правило, и являются патогенные виды стафилококков.
В процессе жизнедеятельности в них скапливаются различные выделения и остатки корма. При отсутствии проветривания присоединяется инфекция, которой, как правило, и являются патогенные виды стафилококков.
Помимо кожного покрова, у собак стафилококк может поражать и слизистые оболочки ротовой полости, глаз, репродуктивных органов; уши.
Есть еще один симптом, который часто регистрируется у собак и не всегда владельцы догадываются, что его причиной также является стафилококк. Речь идет об отитах. Это может быть скрытое течение или бурно протекающая болезнь. В некоторых случаях патология поражает даже ткани внутреннего уха, что проявляется в виде язв и эрозий. Если данную патологию вовремя не вылечить, то может присоединиться конъюнктивит и ринит.
Чтобы распознать у собаки стафилококкоз, необходимо как можно раньше обратиться к врачу при появлении первых симптомов.
Основой диагностики стафилококкоза является бактериологический анализ.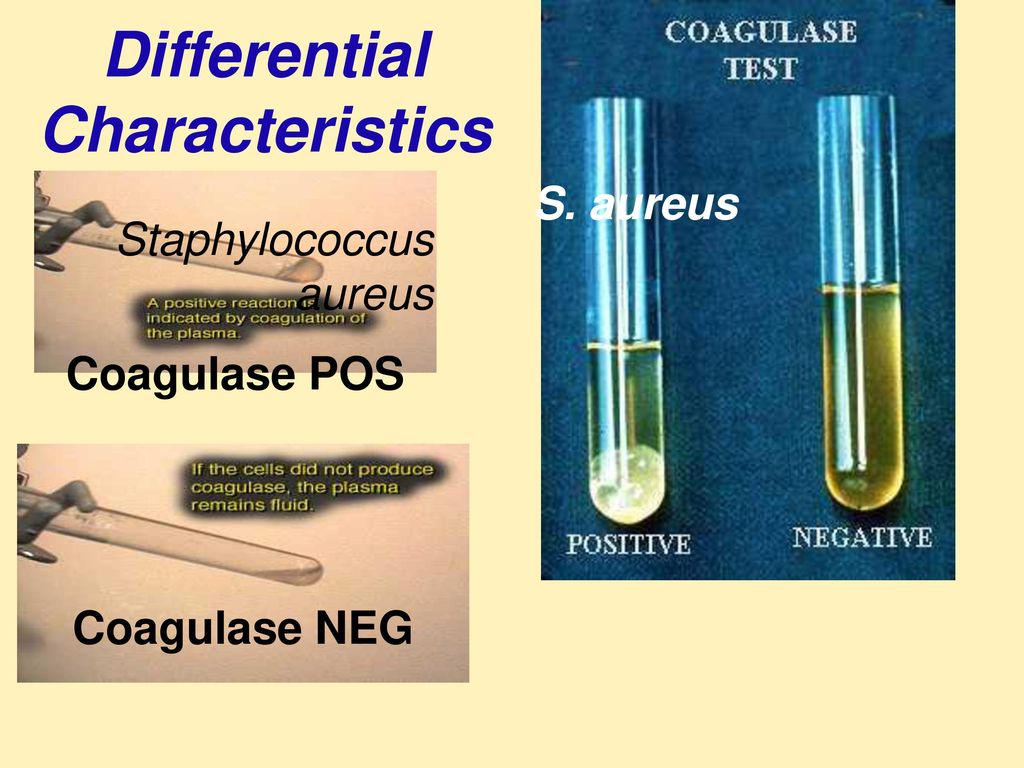 В качестве патологического материала в лабораторию направляют: пробы гноя, мокроты, смывы из носа, рта, дёсен, ушей и конъюнктивы, кровь, испражнения, пунктат из уха, соскобы с кожи, материалом для бактериологического исследования могут также служить пробы корма.
В качестве патологического материала в лабораторию направляют: пробы гноя, мокроты, смывы из носа, рта, дёсен, ушей и конъюнктивы, кровь, испражнения, пунктат из уха, соскобы с кожи, материалом для бактериологического исследования могут также служить пробы корма.
Специалисты ФГБУ «Краснодарская МВЛ» проводят диагностику стафилококкозов собак при помощи классических бактериологических методов, а также импортных тест-систем. Срок исследования составляет 4-5 дней.
Своевременно поставленный диагноз позволит грамотно провести лечение с учётом чувствительности выделенной культуры стафилококка к антибактериальным препаратам, получить лечебный эффект.
Источник: пресс-служба ФГБУ «Краснодарская МВЛ»
Стафилококковый мастит коров — Светич
Маститы коров являются серьезной проблемой для молочного производства во всем мире. Заболевание принимает различные формы, каждая из которых имеет свои особенности на любой отдельно взятой молочной ферме. Причиной столь разнообразного проявления мастита является то, что он вызывается более 140 видами бактерий, степень патогенности и скорость распространения которых зависит от целого ряда факторов внешней среды, а также действующих в самом организме коровы. Одним из самых опасных для молочных стад является стафилококковый мастит.
Причиной столь разнообразного проявления мастита является то, что он вызывается более 140 видами бактерий, степень патогенности и скорость распространения которых зависит от целого ряда факторов внешней среды, а также действующих в самом организме коровы. Одним из самых опасных для молочных стад является стафилококковый мастит.
Данные о распространения заболевания в различных странах:
В Норвегии были заражены маститом S. aureus 10,6 % коров.
В 1989 г. в Нидерландах было установлено, что в стадах с низким содержанием в молоке соматических клеток (менее 150 000 кл/мл) случаи клинического мастита с присутствием S. aureus составляли 9,6 %.
В Хорватии 3295 коров тестировали на субклинический мастит с 1994 по 1996 г. Инфекцию обнаружили в 29,39 % случаях, при этом наиболее распространенной бактерией был S. aureus (23,01 %).
В Италии между январем 2000 г. и декабрем 2001 г. в 41 молочном стаде был собран 74 651 образец молока из, при этом наиболее часто среди бактерий были коагулазо-отрицательные стафилококки (33 %), а S.aureus оказался наиболее часто выделяемым патогеном (20 %).
В Ирландии в образцах молока из 15 молочных стад доминирующими бактериями были S. aureus и S. uberis, которые составляли 21 % и 19 % соответственно.
В Польше из 4560 образцов, взятых в 2005 году у 2907 коров в 118 стадах, частота проб, положительных на S. aureus, составила 15,6 %.
Подобная информация приводится также и по странам Северной и Южной Америки, Океании и свидетельствует о широком распространении и высокой степени патогенности стафилококкового мастита.
Широкая распространенность обуславливается в первую очередь биологическими особенностями данного микроорганизма. Во внешней среде (пол, подстилка, пастбища, инвентарь) стафилококк относительно устойчив и способен сохранять свою патогенность до 60 и даже 100 суток. При нагревании до 75 °С он погибает за 20-25 мин.
При нагревании до 75 °С он погибает за 20-25 мин.
Бактерии быстро вырабатывают устойчивость к антимикробным препаратам.
Staphylococcus aureus обладает гемолитическими и дерматонекротическими свойствами, коагулирует плазму и образует энтеротоксины.
Основное его отличие от других микроорганизмов, участвующих в воспалительных процессах молочной железы коров, – контагиозность (заразность).
Болеют животные в период лактации; в сухостойный период отмечают субклиническую (скрытую) форму инфекции, которая у коров отмечается в 70 % случаев и более. Источники возбудителя инфекции — больные животные и микробоносители, у которых патогенные микроорганизмы могут длительное время (до 8-10мес) находиться в инфицированных долях вымени.
Выделяется возбудитель через сосковый канал при доении. Заражение вымени происходит, в подавляющем большинстве случаев, галактогенным (через молочный канал), также лимфогенным (через раны сосков и вымени), реже — гематогенным (из других органов) путями.
В неблагополучных хозяйствах заболевание носит стационарный характер.
Предрасполагающие факторы возникновения маститов — снижение резистентности организма животных, неполноценное кормление, плохая гигиена и нарушение техники доения, неправильная работа доильной аппаратуры, травмы вымени, повреждения и загрязнения сосков вымени, наличие патогенных микроорганизмов в окружающей среде.
Размер стада животных и его характеристики могут влиять на распространение S. aureus, но не на его присутствие. Патология вымени, вызванная данной бактерией, приводит к потерям производства молока и повышению в нем количества соматических клеток, резко снижая качество.
Поскольку мастит, вызванный S. aureus, считается хроническим, он приводит к более значительным экономическим последствиям, чем случаи обычного мастита.
Стафилококк является источником многих токсинов, которые оказывают отрицательное воздействие на иммунную систему как самой коровы, так и потребителя молока — человека.
При этом, энтеротоксины способны вызывать пищевое отравление у человека, так как пастеризация или термическая обработка их не инактивирует. Заражение молочной железы S. aureus может быть источником заражения молока и молочных продуктов.
Стафилококк хорошо передается в период лактации, не размножается на коже, обнаруживая себя непосредственно при заражении вымени.
Данный возбудитель обладает хорошей сцепляемостью, поэтому наносит ткани вымени вред куда больший, чем Str. аgalactia.
При этом, сначала заражаются соски и цистерны вымени, затем стафилококк проникает в молочные каналы и образует глубоко в молокообразующих клетках очаги инфекции. Этот процесс приводит к образованию абсцессов, которые впоследствии инкапсулируются.
С одной стороны, это хорошо, так как бактерии нейтрализуются, и прекращается их дальнейшее распространение.
С другой стороны – снижается эффективность антибиотикотерапии, возникает длительное бактерионосительство, повышается вероятность рецидивов.
В результате, учащаются случаи хронического заражения, при котором инфекция распространяется только на небольших участках четверти вымени.
Зараженные сегменты молочной железы становятся непродуктивными или дают мизерное количество молока. При этом, ткань может дегенерировать и вместе с лейкоцитами закупоривать молочные каналы.Это приводит к атрофии альвеол.
Если молочные каналы открываются снова, то стафилококки проникают в другие части четверти вымени и процесс повторяется. В результате, цикл инфекции возобновляется.
Деятельность стафилококков часто приводит к образованию твердых узлов в результате инкапсулирования микроабсцессов и замещения альвеолярной ткани на фибринозную. Такие уплотнения прощупываются даже при пальпации.
Возбудитель, размножаясь в молочной железе, по лимфатическим путям проникает в паренхиму вымени, вызывая разлитый воспалительный отек. В стадах со стафилококковым маститом у 50 % и более коров выявляют хроническую и субклиническую инфекцию.
Способность Staphylococcus aureus производить токсины, вызывающие сужение кровеносных сосудов и образование тромбов, приводит к нарушению кровоснабжения ткани вымени, обуславливает сверхострую, в том числе, гангренозную форму мастита (когда ткани приобретаю зелено — синий цвет, становятся холодными на ощупь, появляются сыворотка и кровь, выпотевающие через кожу вымени, кожа четверти и сосок отторгаются). При этом отмечается сильнейшая интоксикация организма.
Хроническая инфекция может длиться месяцами, результаты лечения часто неудовлетворительные, так как формируется пограничный тканевый барьер, препятствующий проникновению антибиотиков в пораженные зоны.
Стафилококковые маститы трудно поддаются лечению вследствие выраженной устойчивости стафилококков к антибиотикам, часто встречаются полирезистентные штаммы.
Диагноз на инфекционный мастит устанавливают на основании эпизоотологических данных, результатов клинических и патологоанатомических исследований, специальных тестов для диагностики субклинических маститов.
При этом, определяющим является проведение бактериологических исследований проб секрета вымени и молока, полученных до начала лечения. В данном случае, обязательны микроскопия и идентификация выделенных культур, серологическая типизация и определение их антимикробной чувствительности, что позволяет принять оптимальные решения по лечению и контролю болезни в каждом неблагополучном стаде.
Основные мероприятия по профилактике и контролю маститов заключаются в следующем:
— Контроль за работой молочного оборудования в процессе эксплуатации. Своевременные периодические сервисное обслуживание и замена изношенных узлов и агрегатов. Обеспечение хорошего освещения в доильном зале.
— Соблюдение правил гигиены при доении, в том числе: использование чистой спецодежды, включая обязательное применение резиновых перчаток операторами по доению, которые служат в данном случае, в первую очередь, для защиты коров.
— Сдаивание первых струй молока.
— Санитарная обработка вымени — соски молочной железы должны быть обработаны до дойки специальным раствором и насухо вытерты, по окончанию доения погружены в дезраствор, обеспечивающий образование защитной пленки.
Значительно снижает загрязненность молока подпаливание волосков вымени. Подмывание водой, особенно всей части вымени, резко повышает механическую и бактериальную загрязненность молока, заболеваемость маститами.
— Периодические исследования животных при помощи лабораторных тестов на субклинический мастит, подсчет числа соматических клеток, бактериологическое исследование проб молока.
— Регулярные клинические осмотры, изоляция больных животных или доение их в последнюю очередь.
— Своевременное лечение животных с клиническими и субклиническими маститами.
— Выбраковка животных с агалактией, а также предрасположенных к многократным заболеваниям маститом, плохо реагирующих на лечение или имеющих постоянное высокое содержание соматических клеток в молоке.
— Клинический осмотр и пальпация вымени всех вновь поступающих животных с исследованием на субклинические формы болезни, карантинирование.
— Обязательный регулярный контроль за состоянием кончиков сосков вымени, так как стафилококк постоянно находится на коже вымени и проникает внутрь вымени по причине потери упругости сфинктера соска.
В первую очередь, благодаря эластичности и степени смыкаемости сфинктеров сосков вымени корова может успешно противостоять маститам, что наглядно подтверждается следующими фотографиями.
Высокая резистентность к маститу Низкая сопротивляемость к маститу
Удобнее и быстрее всего осуществлять оценку состояния сосков вымени у коров на дойке, используя балльную оценку.
Рисунок № 1 Оценка состояния сфинктеров сосков вымени
На рисунке №1 изображено 5 состояний сфинктеров сосков, каждое из которых, слева направо, соответствует по нарастающей от 1-го до 5 баллов.
Соски коров в норме оцениваются на 1 балл и характеризуются гладким и ровным низом, без наплыва или кольца.
По мере деформации сосков и укорочения, а также снижения эластичности сфинктера, образуются рельефные наплывы и, или кольца, которые в дальнейшем осложняются трещинами и эрозиями, образованием струпов.
Оценка сосков вымени в 2-3 балла свидетельствуют о негативном воздействии нарушений технологии доения на молочную железу, при своевременном устранении которых лактирующие животные могут в дальнейшем эксплуатироваться без значительного ущерба.
По состоянию кончиков сосков в 4-5 баллов можно судить о продолжительном и системном отрицательном влиянии сбоев в работе доильного оборудования и неотлаженной технологии получения молока.
При этом, имеют место необратимые изменения в тканях вымени, не позволяющие в будущем эффективно использовать животных.
Балльная оценка состояния сфинктеров сосков необходима, в первую очередь, для своевременного принятия мер по устранению причин их поражения, основной из которых является «сухое доение», во время которого смыкаются и соответственно деформируются стенки соска.
Возникает оно при несоблюдении оптимальной паузы между стимуляцией сосков и подключением аппарата (45-90 сек.).
Также это явление имеет место при передаивании животных в конце дойки.Основной причиной этого является следующее: молоко заканчивается неравномерно во всех четырех четвертях вымени.
Ключевое значение при этом имеет выбранное значение скорости молокоотдачи, при снижении до которого происходит автоматическое отделение аппарата. В силу того, что емкость различных четвертей вымени у коров может значительно варьировать, возникают ситуации, когда в 1 или 2 частях молочной железы молока уже нет, а из остальных оно продолжает выделяться в количестве, достаточном для неотключения оборудования.
В данном случае очень важно правильно отрегулировать скорость молоокоотдачи, при которой отсоединяется аппарат, в зависимости от уровня продуктивности животных.
У высокопродуктивных животных этот показатель устанавливается даже на уровне 1литрмин.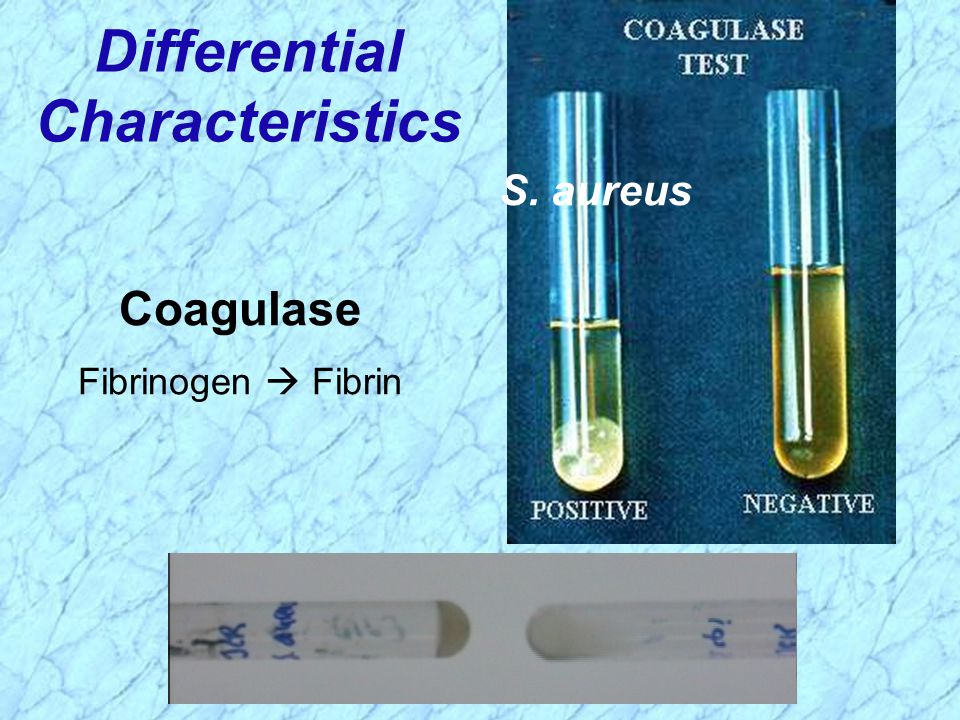 , в то время, как средние его значения находятся в пределах 300-400 млмин.
, в то время, как средние его значения находятся в пределах 300-400 млмин.
Такая тактика оправдана, так как недополучение от коровы 300-500мл молока за дойку – гораздо меньшее зло по сравнению с возникновением мастита.
— Полное выдаивание и сбор молока от больных животных в отдельную тару и утилизация его.
— Влажная системная дезинфекция поверхностей помещений, соблюдение ветеринарно-санитарных правил и требований.
— При переболевании стафилококковым маститом формируется достаточно напряженный иммунитет, поэтому возможно применение вакцин.
Прогноз при лечении стафилококковых маститов по сравнению с вызванными другой микрофлорой самый неутешительный:
Таблица №1
Терапевтическая эффективность лечения маститов, вызванных различными патогенами
| Возбудители мастита | Процент выздоровления |
S. aureus aureus |
15%-40% |
| Str. uberis | 70% |
| Str. аgalactiae, Str. dysgalactiae | 80%-90% |
| S.hyiscus, S.Chromogenes | 80%-90% |
При стафилококковом мастите животные длительное время остаются микробоносителями, поэтому больных следует изолировать до выздоровления.
Учитывая высокую контагиозность стафилококкового мастита, при наличии более 10 % зараженных коров, молочное стадо должно быть разделено на две части: здоровые животные и больные, в том числе, находящиеся на лечении.
Переход в здоровую часть возможен только при полном излечении, подтвержденном результатами лабораторных исследований секрета вымени.
Все коровы, находящиеся в группе здоровых, должны ежемесячно подвергаться тестам на мастит, включая лабораторные исследования на наличие в молоке золотистого стафилококка.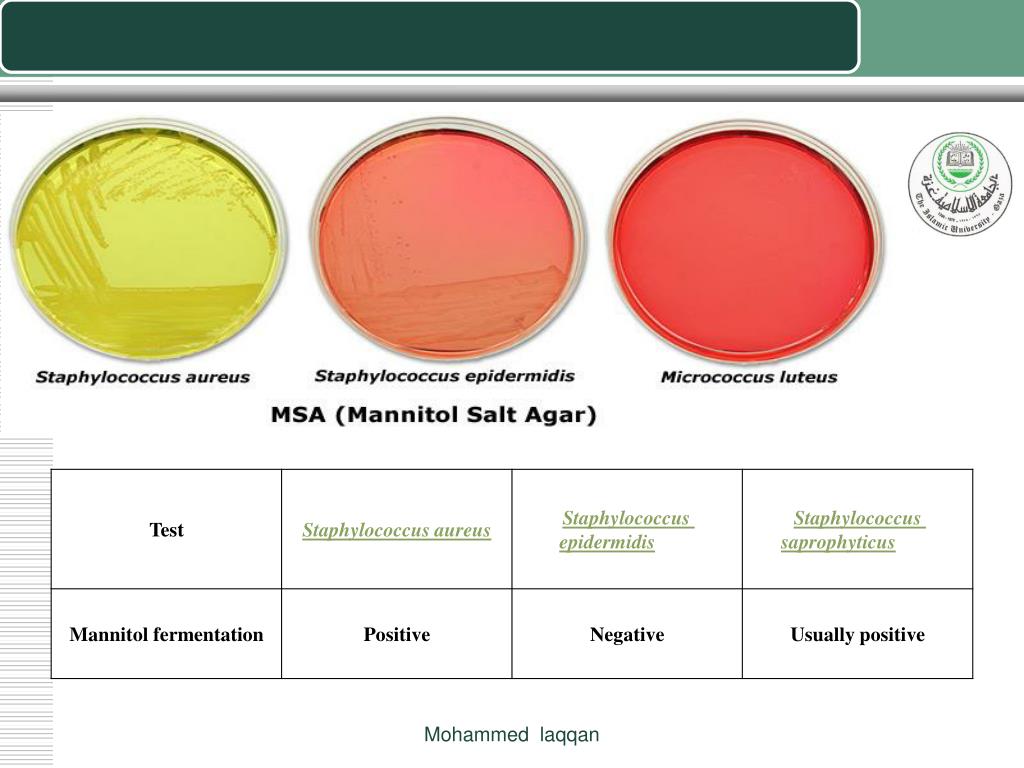
Эффективность лечения в сухостойном периоде значительно выше, чем в лактационном, особенно, при мастите стафилококковой этиологии.
Обработка вымени в сухостойном периоде имеет следующие преимущества:
1) нет опасности попадания лекарственных препаратов в сборное молоко;
2) нет необходимости многократного введения лекарственных препаратов, так как они обладают пролонгированным действием;
3) для достижения наилучших результатов можно применять большие дозы лечебных препаратов, обеспечивая их длительное действие.
Внутривыменные противомаститные препараты для лечения коров в сухостойный период должны:
• Не раздражать тканей молочной железы
• Обладать бактерицидным действием
• Обеспечивать пролонгированное действие
В то же время при парентеральной антибиотикотерапии также можно добиться неплохих результатов.
В настоящее время имеется в продаже немало эффективных антимикробных препаратов, однако, в связи в возрастной резистентностью стафилококков, лабораторные тесты определения чувствительности выделенных культур к антибиотикам необходимо проводить в каждом стаде.
При лечении стафилококковых маститов применяется широкий диапазон препаратов, в том числе: Ампиклокс L.C., Синулокс L.C., Амоксициллин, Абиклокс QR, Диоксидин, Кобактан LC, Лазин, Мамексин, Мастивекс, Мастиет-форте, Мастириф, Мультилакт, Нафпензал DC, Стапенор ретард, Тетра-Дельта.
Очень важно следовать определенным требованиям для интрацистернальных вливаний, так как неправильно исполненная процедура может повредить первичный защитный слой внутри соскового канала и способствовать попаданию болезнетворных микроорганизмов в сосок из окружающий среды.
Как показывает практика, стафилококковый мастит крупного рогатого скота в силу своей контагиозности и стационарности является серьезной проблемой в молочном животноводстве. Оздоровление продуктивных стад при возникновении данного заболевания может быть успешным только в случае системного и комплексного выполнения всех организационных, технологических и зооветеринарных мероприятий с учетом особенностей, характерных для каждого из сельхозпредприятий.
Никулин Д.М., кандидат ветеринарных наук,
генеральный директор ООО Молочная Компания Генетика
НИВЫ ЗАУРАЛЬЯ №6(128) ИЮЛЬ 2015
Rinara Pharma | KENACEF
KENACEF
СОСТАВ :
Активное вещество – цефтриаксон 0,5 г; 1,0 г
Растворитель: 1 % лидокаин гидрохлорид.
ФАРМАКОТЕРАПЕВТИЧЕСКАЯ ГРУППА: цефалоспориновый антибиотик III поколения.
АТС КОД: J01DD04
ФАРМАКОЛОГИЧЕСКОЕ ДЕЙСТВИЕ:
ФАРМАКОДИНАМИКА:
KENACEF – цефалоспориновый антибиотик широкого спектра действия. Оказывает бактерицидное действие за счет угнетения синтеза клеточной стенки бактерий. Активен в отношении большинства грамотрицательных, многих грамположительных возбудителей и некоторых анаэробов. Устойчив к действию бета–лактамаз, продуцируемых бактериями.
Устойчив к действию бета–лактамаз, продуцируемых бактериями.
Грамположительные аэробы: Staphylococcus aureus (метициллиночувствительный), коагулазо-отрицательные стафилококки, Streptococcus pyogenes (бета-гемолитический, группы А), Streptococcus agalactiae (бета-гемолитический, группы B), (3-гемолитическиe стрептококки (группы ни А, ни В), Streptococcus viridans, Streptococcus pneumoniae.
Грамотрицательные аэробы: Acinetobacter lwoffi, Acinetobacter anitratus (главным образом, A. baumanii), Aeromonas hydrophila, Alcaligenes faecalis, Alcaligenes odorans, алкалигеноподобные бактерии, Borrelia burgdorferi, Capnocytophaga spp., Citrobacter diversus (в том числе, С. amalonaticus), Citrobacter freundii, Escherichia coli, Enterobacter aerogenes, Enterobacter cloacae, Enterobacter spp. (прочие), Haemophilus ducreyi, Haemophilus influenzae, Haemophilus parainfluenzae, Hafnia alvei, Klebsiella oxytoca, Klebsiella pneumoniae, Moraxella catarrhalis (ранее называвшаяся Branhamella catarrhalis), Moraxella osloensis, Moraxella spp. (прочие), Morganella morganii, Neisseria gonorrhoeae, Neisseria meningitidis, Pasteurella multocida, Plesiomonas shigelloides, Proteus mirabilis, Proteus penneri, Proteus vulgaris, Pseudomonas fluorescens, Pseudomonas spp. (прочие), Providentia rett-geri Providentia spp. (прочие), Salmonella typhi, Salmonella spp . (нетифоидные), Serratia marcescens Serra-tia spp. (прочие), Shigella spp., Vibrio spp., Yersinia enterocolitica, Yersinia spp. (прочие).
(прочие), Morganella morganii, Neisseria gonorrhoeae, Neisseria meningitidis, Pasteurella multocida, Plesiomonas shigelloides, Proteus mirabilis, Proteus penneri, Proteus vulgaris, Pseudomonas fluorescens, Pseudomonas spp. (прочие), Providentia rett-geri Providentia spp. (прочие), Salmonella typhi, Salmonella spp . (нетифоидные), Serratia marcescens Serra-tia spp. (прочие), Shigella spp., Vibrio spp., Yersinia enterocolitica, Yersinia spp. (прочие).
Анаэробы: Bacteroides spp., Clostridium spp. (кромеC. difficile), Fusobacterium nucleatum, Fusobacterium spp. (прочие), Gaffkia anaerobica Peptostreptococcus spp.
ФАРМАКОКИНЕТИКА: Биодоступность при внутримышечном введении составляет 100%.
При внутримышечном/внутривенном введении цефтриаксон хорошо проникает в ткани и жидкости организма. Максимальная концентрация в плазме крови при внутримышечном введении, достигается через 2 – 3 часа. Обратимо связывается с альбуминами плазмы крови на 85-95% и это связывание обратно пропорционально его концентрации в крови.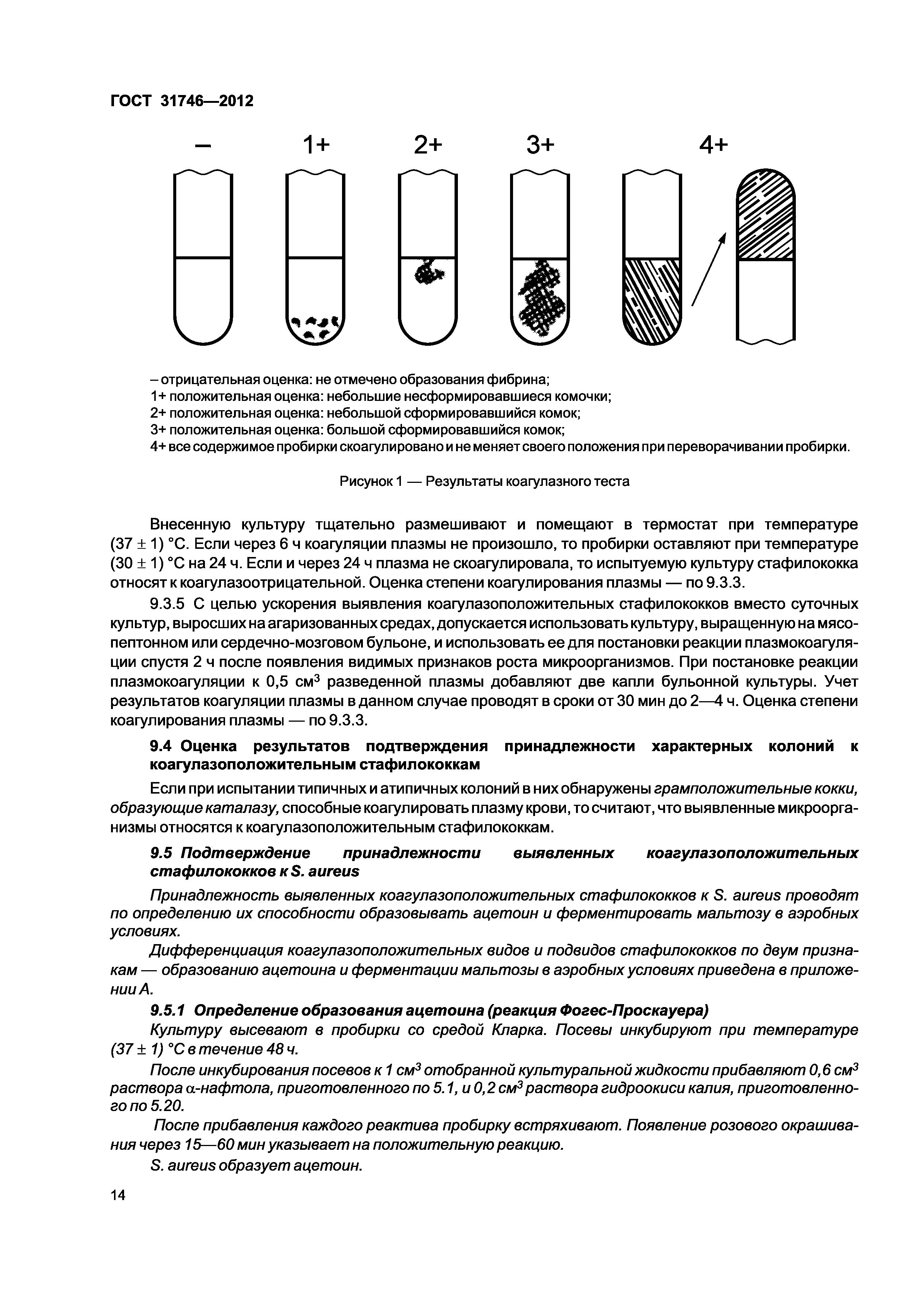 Цефтриаксон хорошо проникает через гематоэнцнфалический барьер.
Цефтриаксон хорошо проникает через гематоэнцнфалический барьер.
У взрослых 50 – 60% цефтриаксона выводится в неизмененном виде с мочой, 40-50% с желчью.
ПОКАЗАНИЯ:
- Инфекции органов брюшной полости, перитонит, инфекции желчных путей и желудочно-кишечного тракта (в том числе холангит, эмпиема желчного пузыря)
- Инфекции дыхательных путей (пневмония, абсцесс легких, эмпиема плевры) и инфекции лор-органов
- Инфекции костей, суставов, мягких тканей, кожи, а также раневые инфекции
- Инфекции почек и мочевыводящих путей(в том числе пиелонефрит)
- Инфекции половых органов, включая гонорею
- Инфицированные раны и ожоги
- Инфекции у больных с ослабленным иммунитетом
- Менингит, сепсис
- Профилактика послеоперационных инфекций
ПРОТИВОПОКАЗАНИЯ:
Повышенная чувствительность к цефалоспоринам.
ПОБОЧНЫЕ ДЕЙСТВИЯ:
Со стороны ЖКТ- диарея, тошнота, рвота, стоматит, псевдомамбранозный колит.
Со стороны кожи – экзантема, аллергический дерматит, сыпь.
Гемолитическая реакция – тромбоцитоз, эозинофилия, лейкопения, тромбоцитопения, гемолитическая анемия.
Местная реакция – флебит, болезненность на месте инъекции.
РЕЖИМ ДОЗИРОВАНИЯ:
Взрослым: одноразовая доза для внутримышечного применения – 1,0 г. Суточная доза 1-2 г.
Новорожденным до 2 недель – 20-50 мг / кг / день. У детей – суточная доза составляет 20-80 мг/кг. Максимальная суточная доза не должна превышать 2,0 г.
При менингитах каждые 12 часов по 100 мкг/кг. Максимальная суточная доза не должна превышать 4,0г.
За 30 -120 минут до оперативных вмешательств разовая доза 1,0 г.
При острой гонорее – разовая доза 250 мг.
При лечении заболеваний, вызванных бета-гемолитическим стрептококком курс лечения должна быть не менее 10 дней.
Способ готовки инъекции:
1,0 г препарата растворяют в 1 % лидокаина.
ФОРМА ВЫПУСКА: Цефтриаксон во флаконе и растворитель в ампуле.
KENACEF 1,0 выпускается вместе с растворителем.
KENACEF 0,5 выпускается во флаконе вместе с растворителем.
Стафилококковый мастит коров | EcoLab
Никулин Д.М., кандидат ветеринарных наук
Маститы коров являются серьезной проблемой для молочного производства во всем мире. Данное заболевание принимает различные формы, каждая из которых имеет свои особенности на любой отдельно взятой молочной ферме. Причиной столь разнообразного проявления мастита является то, что он вызывается более 140 видами бактерий, степень патогенности и скорость распространения которых зависит от целого ряда факторов внешней среды, а также действующих в самом организме коровы.
Одним из самых опасных для молочных стад является стафилококковый мастит. Об этом свидетельствуют данные распространения его в различных странах. Так, в Норвегии были заражены маститом S. aureus 10,6% коров. В 1989 г. в Нидерландах было установлено, что в стадах с низким содержанием в молоке соматических клеток (менее 150 000 кл/мл) случаи клинического мастита с присутствием S. aureus составляли 9,6 %. В Хорватии 3295 коров тестировали на субклинический мастит с 1994 по 1996 г. Инфекцию обнаружили в 29,39 % случаях, при этом наиболее распространенной бактерией был S. aureus (23,01 %). В Италии между январем 2000 г. и декабрем 2001 г. в 41 молочном стаде был собран 74 651 образец молока, при этом наиболее часто среди бактерий были коагулазо-отрицательные стафилококки (33 %), а S. aureus оказался наиболее часто выделяемым патогеном (20 %). В Ирландии в образцах молока из 15 молочных стад доминирующими бактериями были S. aureus и S. uberis, которые составляли 21 % и 19 % соответственно. В Польше из 4560 образцов, взятых в 2005 году у 2907 коров в 118 стадах, частота проб, положительных на S. aureus, составила 15,6 %.
aureus составляли 9,6 %. В Хорватии 3295 коров тестировали на субклинический мастит с 1994 по 1996 г. Инфекцию обнаружили в 29,39 % случаях, при этом наиболее распространенной бактерией был S. aureus (23,01 %). В Италии между январем 2000 г. и декабрем 2001 г. в 41 молочном стаде был собран 74 651 образец молока, при этом наиболее часто среди бактерий были коагулазо-отрицательные стафилококки (33 %), а S. aureus оказался наиболее часто выделяемым патогеном (20 %). В Ирландии в образцах молока из 15 молочных стад доминирующими бактериями были S. aureus и S. uberis, которые составляли 21 % и 19 % соответственно. В Польше из 4560 образцов, взятых в 2005 году у 2907 коров в 118 стадах, частота проб, положительных на S. aureus, составила 15,6 %.
Подобная информация приводится также и по странам Северной и Южной Америки, Океании и свидетельствует о широком распространении и высокой степени патогенности стафилококкового мастита. Это обуславливается в первую очередь биологическими особенностями данного микроорганизма. Во внешней среде (пол, подстилка, пастбища, инвентарь) стафилококк относительно устойчив и способен сохранять свою патогенность до 60… 100 сут. При нагревании до 75 °С он погибает за 20…25 мин. Бактерии быстро вырабатывают устойчивость к антимикробным препаратам. Staphylococcus aureus обладает гемолитическими и дерматонекротическими свойствами, коагулирует плазму и образует энтеротоксины. Основное его отличие от других микроорганизмов, участвующих в воспалительных процессах молочной железы коров – контагиозность (заразность). Болеют животные в период лактации, в сухостойный период отмечают субклиническую (скрытую) форму инфекции, которая у коров отмечается в 70 % случаев и более. Источники возбудителя инфекции — больные животные и микробоносители, у которых патогенные микроорганизмы могут длительное время (до 8…10 мес.) находиться в инфицированных долях вымени. Выделяется возбудитель через сосковый канал при доении. Заражение вымени происходит в подавляющем большинстве случаев галактогенным (через молочный канал), также лимфогенным (через раны сосков и вымени), реже гематогенным (из других органов) путями.
Во внешней среде (пол, подстилка, пастбища, инвентарь) стафилококк относительно устойчив и способен сохранять свою патогенность до 60… 100 сут. При нагревании до 75 °С он погибает за 20…25 мин. Бактерии быстро вырабатывают устойчивость к антимикробным препаратам. Staphylococcus aureus обладает гемолитическими и дерматонекротическими свойствами, коагулирует плазму и образует энтеротоксины. Основное его отличие от других микроорганизмов, участвующих в воспалительных процессах молочной железы коров – контагиозность (заразность). Болеют животные в период лактации, в сухостойный период отмечают субклиническую (скрытую) форму инфекции, которая у коров отмечается в 70 % случаев и более. Источники возбудителя инфекции — больные животные и микробоносители, у которых патогенные микроорганизмы могут длительное время (до 8…10 мес.) находиться в инфицированных долях вымени. Выделяется возбудитель через сосковый канал при доении. Заражение вымени происходит в подавляющем большинстве случаев галактогенным (через молочный канал), также лимфогенным (через раны сосков и вымени), реже гематогенным (из других органов) путями. В неблагополучных хозяйствах заболевание носит стационарный характер.
В неблагополучных хозяйствах заболевание носит стационарный характер.
Предрасполагающие факторы возникновения маститов — снижение резистентности организма животных, неполноценное кормление, плохая гигиена и нарушение техники доения, неправильная работа доильной аппаратуры, травмы вымени, повреждения и загрязнения сосков вымени, наличие патогенных микроорганизмов в окружающей среде. Размер стада животных и его характеристики могут влиять на распространение S. aureus, но не на его присутствие. Патология вымени, вызванная данной бактерией, приводит к потерям производства молока и повышению в нем количества соматических клеток, резко снижая качество. Поскольку мастит, вызванный S. aureus, считается хроническим, он приводит к более значительным экономическим последствиям, чем случаи обычного мастита. Стафилококк является источником многих токсинов, которые оказывают отрицательное воздействие на иммунную систему как самой коровы, так и потребителя молока – человека. При этом энтеротоксины способны вызывать пищевое отравление у человека, так как пастеризация или термическая обработка их не инактивирует. Заражение молочной железы S. aureus может быть источником заражения молока и молочных продуктов. Стафилококк хорошо передается в период лактации, не размножается на коже, обнаруживая себя непосредственно при заражении вымени. Данный возбудитель обладает хорошей сцепляемостью, поэтому наносит ткани вымени вред куда больший, чем Str. аgalactia. При этом сначала заражаются соски и цистерны вымени, затем стафилококк проникает в молочные каналы и образует глубоко в молокообразующих клетках очаги инфекции. Этот процесс приводит к образованию абсцессов, которые впоследствии инкапсулируются. С одной стороны это хорошо, так как бактерии нейтрализуются, и прекращается их дальнейшее распространение. С другой стороны – снижается эффективность антибиотикотерапии, возникает длительное бактерионосительство, повышается вероятность рецидивов. В результате учащаются случаи хронического заражения, при котором инфекция распространяется только на небольших участках четверти вымени. Зараженные сегменты молочной железы становятся непродуктивными или дают мизерное количество молока.
Заражение молочной железы S. aureus может быть источником заражения молока и молочных продуктов. Стафилококк хорошо передается в период лактации, не размножается на коже, обнаруживая себя непосредственно при заражении вымени. Данный возбудитель обладает хорошей сцепляемостью, поэтому наносит ткани вымени вред куда больший, чем Str. аgalactia. При этом сначала заражаются соски и цистерны вымени, затем стафилококк проникает в молочные каналы и образует глубоко в молокообразующих клетках очаги инфекции. Этот процесс приводит к образованию абсцессов, которые впоследствии инкапсулируются. С одной стороны это хорошо, так как бактерии нейтрализуются, и прекращается их дальнейшее распространение. С другой стороны – снижается эффективность антибиотикотерапии, возникает длительное бактерионосительство, повышается вероятность рецидивов. В результате учащаются случаи хронического заражения, при котором инфекция распространяется только на небольших участках четверти вымени. Зараженные сегменты молочной железы становятся непродуктивными или дают мизерное количество молока. При этом ткань может дегенерировать и вместе с лейкоцитами закупоривать молочные каналы. Это приводит к атрофии альвеол. Если молочные каналы открываются снова, то стафилококки проникают в другие части четверти вымени и процесс повторяется. В результате цикл инфекции возобновляется. Деятельность стафилококков часто приводит к образованию твердых узлов в результате инкапсулирования микроабсцессов и замещения альвеолярной ткани на фибринозную. Такие уплотнения прощупываются даже при пальпации. Возбудитель, размножаясь в молочной железе, по лимфатическим путям проникает в паренхиму вымени, вызывая разлитый воспалительный отек. В стадах со стафилококковым маститом у 50 % и более коров выявляют хроническую и субклиническую инфекцию. Способность Staphylococcus aureus производить токсины, вызывающие сужение кровеносных сосудов и образование тромбов, приводит к нарушению кровоснабжения ткани вымени, обуславливает сверхострую, в том числе гангренозную форму мастита (когда ткани приобретают зелено-синий цвет, становятся холодными на ощупь, появляются сыворотка и кровь, выпотевающие через кожу вымени, кожа четверти и сосок отторгаются).
При этом ткань может дегенерировать и вместе с лейкоцитами закупоривать молочные каналы. Это приводит к атрофии альвеол. Если молочные каналы открываются снова, то стафилококки проникают в другие части четверти вымени и процесс повторяется. В результате цикл инфекции возобновляется. Деятельность стафилококков часто приводит к образованию твердых узлов в результате инкапсулирования микроабсцессов и замещения альвеолярной ткани на фибринозную. Такие уплотнения прощупываются даже при пальпации. Возбудитель, размножаясь в молочной железе, по лимфатическим путям проникает в паренхиму вымени, вызывая разлитый воспалительный отек. В стадах со стафилококковым маститом у 50 % и более коров выявляют хроническую и субклиническую инфекцию. Способность Staphylococcus aureus производить токсины, вызывающие сужение кровеносных сосудов и образование тромбов, приводит к нарушению кровоснабжения ткани вымени, обуславливает сверхострую, в том числе гангренозную форму мастита (когда ткани приобретают зелено-синий цвет, становятся холодными на ощупь, появляются сыворотка и кровь, выпотевающие через кожу вымени, кожа четверти и сосок отторгаются). При этом отмечается сильнейшая интоксикация организма. Хроническая инфекция может длиться месяцами, результаты лечения часто неудовлетворительные, так как формируется пограничный тканевый барьер, препятствующий проникновению антибиотиков в пораженные зоны. Стафилококковые маститы трудно поддаются лечению вследствие выраженной устойчивости стафилококков к антибиотикам, часто встречаются полирезистентные штаммы. Диагноз на инфекционный мастит устанавливают на основании эпизоотологических данных, результатов клинических и патологоанатомических исследований, специальных тестов для диагностики субклинических маститов. При этом определяющим является проведение бактериологических исследований проб секрета вымени, полученных до начала лечения. В данном случае обязательны микроскопия и идентификация выделенных культур, серологическая типизация и определение их антимикробной чувствительности, что позволяет принять оптимальные решения по лечению и контролю болезни в каждом неблагополучном стаде.
При этом отмечается сильнейшая интоксикация организма. Хроническая инфекция может длиться месяцами, результаты лечения часто неудовлетворительные, так как формируется пограничный тканевый барьер, препятствующий проникновению антибиотиков в пораженные зоны. Стафилококковые маститы трудно поддаются лечению вследствие выраженной устойчивости стафилококков к антибиотикам, часто встречаются полирезистентные штаммы. Диагноз на инфекционный мастит устанавливают на основании эпизоотологических данных, результатов клинических и патологоанатомических исследований, специальных тестов для диагностики субклинических маститов. При этом определяющим является проведение бактериологических исследований проб секрета вымени, полученных до начала лечения. В данном случае обязательны микроскопия и идентификация выделенных культур, серологическая типизация и определение их антимикробной чувствительности, что позволяет принять оптимальные решения по лечению и контролю болезни в каждом неблагополучном стаде.
Основные мероприятия по профилактике и контролю маститов заключаются в следующем:
1. Контроль за работой молочного оборудования в процессе эксплуатации. Своевременные периодические сервисное обслуживание и замена изношенных узлов и агрегатов. Обеспечение хорошего освещения в доильном зале.
Контроль за работой молочного оборудования в процессе эксплуатации. Своевременные периодические сервисное обслуживание и замена изношенных узлов и агрегатов. Обеспечение хорошего освещения в доильном зале.
2. Соблюдение правил гигиены при доении, в том числе:
- Использование чистой спецодежды, включая обязательное применение резиновых перчаток операторами по доению, которые служат в данном случае в первую очередь для защиты коров
- Сдаивание первых струй молока
- Санитарная обработка вымени — соски молочной железы должны быть обработаны до дойки специальным раствором и насухо вытерты, по окончанию доения погружены в дезраствор, обеспечивающий образование защитной пленки. Значительно снижает загрязненность молока подпаливание волосков вымени. Подмывание водой, особенно всей части вымени, резко повышает механическую и бактериальную загрязненность молока, заболеваемость маститами
3. Периодические исследования животных при помощи лабораторных тестов на субклинический мастит, подсчет числа соматических клеток, бактериологическое исследование проб молока.
4. Регулярные клинические осмотры, изоляция больных животных или доение их в последнюю очередь.
5. Своевременное лечение животных с клиническими и субклиническими маститами.
6. Выбраковка животных с агалактией, а также предрасположенных к многократным заболеваниям маститом, плохо реагирующих на лечение или имеющих постоянное высокое содержание соматических клеток в молоке.
7. Клинический осмотр и пальпация вымени всех вновь поступающих животных с исследованием на субклинические формы болезни, карантинирование.
8. Обязательный регулярный контроль за состоянием кончиков сосков вымени, так как стафилококк постоянно находится на коже вымени и проникает внутрь вымени по причине потери упругости сфинктера соска. В первую очередь благодаря эластичности и степени смыкаемости сфинктеров сосков вымени корова может успешно противостоять маститам. Оценка состояния сфинктеров сосков необходима в первую очередь для своевременного принятия мер по устранению причин их поражения, основной из которых является «сухое доение», во время которого смыкаются и соответственно деформируются стенки соска. Возникает оно при несоблюдении оптимальной паузы между стимуляцией сосков и подключением аппарата (45-90 сек.). Также это явление имеет место при передаивании животных в конце дойки. Основной причиной этого является следующее. Молоко заканчивается неравномерно во всех четырех четвертях вымени. Ключевое значение при этом имеет выбранное значение скорости молокоотдачи, при снижении до которого происходит автоматическое отделение аппарата. В силу того, что емкость различных четвертей вымени у коров может значительно варьировать, возникают ситуации, когда в 1 или 2 частях молочной железы молока уже нет, а из остальных оно продолжает выделяться в количестве, достаточном для неотключения оборудования. В данном случае очень важно правильно отрегулировать скорость молоокоотдачи, при которой отсоединяется аппарат, в зависимости от уровня продуктивности животных. У высокопродуктивных животных этот показатель уста- навливается даже на уровне 1литр\мин., в то время как средние его значения находятся в пределах 300-400 мл\мин.
Возникает оно при несоблюдении оптимальной паузы между стимуляцией сосков и подключением аппарата (45-90 сек.). Также это явление имеет место при передаивании животных в конце дойки. Основной причиной этого является следующее. Молоко заканчивается неравномерно во всех четырех четвертях вымени. Ключевое значение при этом имеет выбранное значение скорости молокоотдачи, при снижении до которого происходит автоматическое отделение аппарата. В силу того, что емкость различных четвертей вымени у коров может значительно варьировать, возникают ситуации, когда в 1 или 2 частях молочной железы молока уже нет, а из остальных оно продолжает выделяться в количестве, достаточном для неотключения оборудования. В данном случае очень важно правильно отрегулировать скорость молоокоотдачи, при которой отсоединяется аппарат, в зависимости от уровня продуктивности животных. У высокопродуктивных животных этот показатель уста- навливается даже на уровне 1литр\мин., в то время как средние его значения находятся в пределах 300-400 мл\мин. Такая тактика оправдана, так как недополучение от коровы 300-500 мл молока за дойку – гораздо меньшее зло по сравнению с возникновением мастита.
Такая тактика оправдана, так как недополучение от коровы 300-500 мл молока за дойку – гораздо меньшее зло по сравнению с возникновением мастита.
9. Полное выдаивание и сбор молока от больных животных в отдельную тару и утилизация его.
10. Влажная системная дезинфекция поверхностей помещений, соблюдение ветеринарно-санитарных правил и требований.
11. При переболевании стафилококковым маститом формируется достаточно напряженный иммунитет, поэтому возможно применение вакцин. Прогноз при лечении стафилококковых маститов по сравнению с вызванными другой микрофлорой самый неутешительный:
При стафилококковом мастите животные длительное время остаются микробоносителями, поэтому больных следует изолировать до выздоровления. Учитывая высокую контагиозность стафилококкового мастита, при наличии более 10 % зараженных коров молочное стадо должно быть разделено на две части: здоровые животные и больные, в том числе находящиеся на лечении. Переход в здоровую часть возможен только при полном излечении, подтвержденном результатами лабораторных исследований секрета вымени. Все коровы, находящиеся в группе здоровых, должны ежемесячно подвергаться тестам на мастит, включая лабораторные исследования на наличие в молоке золотистого стафилококка. Эффективность лечения в сухостойном периоде значи-тельно выше, чем в лактационном, особенно при мастите стафилококковой этиологии.
Все коровы, находящиеся в группе здоровых, должны ежемесячно подвергаться тестам на мастит, включая лабораторные исследования на наличие в молоке золотистого стафилококка. Эффективность лечения в сухостойном периоде значи-тельно выше, чем в лактационном, особенно при мастите стафилококковой этиологии.
Обработка вымени в сухостойном периоде имеет следующие преимущества:
- нет опасности попадания лекарственных препаратов в сборное молоко
- нет необходимости многократного введения лекарственных препаратов, так как они обладают пролонгированным действием
- для достижения наилучших результатов можно применять большие дозы лечебных препаратов, обеспечивая их длительное действие.
Внутривыменные противомаститные препараты для лечения коров в сухостойный период должны:
- Не раздражать тканей молочной железы
- Обладать бактерицидным действием
- Обеспечивать пролонгированное действие
В то же время при парентеральной антибиотикотерапии также можно добиться неплохих результатов. В настоящее время имеется в продаже немало эффективных антимикробных препаратов, однако в связи в возрастной резистентностью стафилококков, лабораторные тесты определения чувствительности выделенных культур к антибиотикам необходимо проводить в каждом стаде. При лечении стафилококковых маститов применяется широкий диапазон препаратов, в том числе: Ампиклокс L.C., Синулокс L.C., Амоксициллин, Абиклокс QR, Диоксидин, Кобактан LC, Лазин, Мамексин, Мастивекс, Мастиет-форте, Мастириф, Мультилакт, Нафпензал DC, Стапенорретард, Тетра-Дельта. Очень важно следовать определенным требованиям для интрацистернальных вливаний, так как неправильно исполненная процедура может повредить первичный защитный слой внутри соскового канала и способствовать попаданию болезнетворных микроорганизмовв сосок из окружающий среды.
В настоящее время имеется в продаже немало эффективных антимикробных препаратов, однако в связи в возрастной резистентностью стафилококков, лабораторные тесты определения чувствительности выделенных культур к антибиотикам необходимо проводить в каждом стаде. При лечении стафилококковых маститов применяется широкий диапазон препаратов, в том числе: Ампиклокс L.C., Синулокс L.C., Амоксициллин, Абиклокс QR, Диоксидин, Кобактан LC, Лазин, Мамексин, Мастивекс, Мастиет-форте, Мастириф, Мультилакт, Нафпензал DC, Стапенорретард, Тетра-Дельта. Очень важно следовать определенным требованиям для интрацистернальных вливаний, так как неправильно исполненная процедура может повредить первичный защитный слой внутри соскового канала и способствовать попаданию болезнетворных микроорганизмовв сосок из окружающий среды.
В связи с этим при введении антибиотиков внимание должно быть сконцентрировано на следующих деталях:
- Обозначьте животных для лечения и зарегистрируйте эти данные до лечения, чтобы вы не смогли об этом забыть.

- Помойте руки или лучше наденьте одноразовые перчатки.
- Полностью выдойте вымя (2-3 мл окситоцина могут помочь, если четверть поражена клиническим маститом).
- Погрузите соски в раствор для санитарной обработки после доения, подождите 30 секунд и вытрите насухо полотенцем.
- Далее продезинфицируйте конец соска тампоном, пропитанным 70 % раствором спирта, используйте отдельные тампоны для каждого соска
- Если на тампоне, пропитанном спиртом, остается грязь после обработки, возьмите другой тампон и повторяйте процедуру до тех пор, пока тампон не будет чистым.
- При терапии в фазе лактации возьмите образец молока для посева и выращивания микроорганизмов в питательной среде перед лечением.
- При терапии в сухостойный период продезинфицируйте ближайший к вам сосок последним, чтобы предотвратить загрязнение рукавом между дезинфекциями.
- По причине, указанной в п.8, лечите ближайший сосок первым.
- Не позволяйте соприкасаться стерильной игле до чего-либо до введения.
 Используйте короткую иглу; чтобы защитить кератин, игла должна входить в сосковый канал не глубже 3 мм.
Используйте короткую иглу; чтобы защитить кератин, игла должна входить в сосковый канал не глубже 3 мм. - После введения используйте сосковый дезинфектант или защитный раствор на весь сосок.
- Уведите пролеченную корову, чтобы убедиться, что ее не начнут доить. Убедитесь, что эта корова не будет отдыхать на участках с навозом в течение нескольких часов.
Как показывает практика, стафилококковый мастит крупного рогатого скота в силу своей контагиозности и стационарности является серьезной проблемой в молочном животноводстве. Оздоровление продуктивных стад при возникновении данного заболевания может быть успешным только в случае системного и комплексного выполнения всех организационных, технологических и зооветеринарных мероприятий с учетом особенностей, характерных для каждого из сельхозпредприятий.
Молекулярное определение генов цитотоксинов и энтеротоксинов
Токсины (Базель). 2015 сен; 7 (9): 3688–3699.
Юкако Фудзинага, научный редактор
† Умер 8 сентября 2013 г.
Поступило 6 мая 2015 г .; Принято к печати 6 июля 2015 г.
Авторские права © 2015 г. Авторы; лицензиат MDPI, Базель, Швейцария. Эта статья цитировалась в других статьях в PMC.Abstract
Хотя условно-патогенные микроорганизмы, коагулазонегативные стафилококки (CoNS), включая Staphylococcus epidermidis и Staphylococcus haemolyticus , долгое время считались авирулентными организмами. Роль токсинов в развитии инфекций, вызванных CoNS, до сих пор остается спорной. Целью данного исследования было охарактеризовать присутствие генов энтеротоксина и цитотоксина в изолятах S. epidermidis и S. haemolyticus , полученных из культур крови.Гены цитотоксинов были обнаружены с помощью ПЦР с использованием новых видоспецифичных праймеров. Среди 85 изолятов S. epidermidis и 84 S. haemolyticus 95,3% и 79,8%, соответственно, несли по крайней мере один ген энтеротоксина. Наиболее частыми генами энтеротоксинов были seg (53,3%), seg (64,5%) и sei (67,5%). Ген seg был положительно связан с S. epidermidis ( p = 0,02), и этот вид был более токсигенным, чем S.Геммолитик . Ген hla / yidD был обнаружен в 92,9% изолятов S. epidermidis и ген hla в 91,7% изолятов S. haemolyticus ; hlb был обнаружен в 92,9% изолятов S. epidermidis и hld в 95,3%. Нозокомиальные изоляты Staphylococcus epidermidis и S. haemolyticus проявляли высокий токсигенный потенциал, в основном содержащие неклассические гены энтеротоксинов seg и sei .Ранее не сообщаемое обнаружение hla / yidD и hlb в S. epidermidis и S. haemolyticus с использованием видоспецифичных праймеров показало, что эти гены гемолизина различаются между видами CoNS и что они очень часто встречаются в изолятах культур крови.
Наиболее частыми генами энтеротоксинов были seg (53,3%), seg (64,5%) и sei (67,5%). Ген seg был положительно связан с S. epidermidis ( p = 0,02), и этот вид был более токсигенным, чем S.Геммолитик . Ген hla / yidD был обнаружен в 92,9% изолятов S. epidermidis и ген hla в 91,7% изолятов S. haemolyticus ; hlb был обнаружен в 92,9% изолятов S. epidermidis и hld в 95,3%. Нозокомиальные изоляты Staphylococcus epidermidis и S. haemolyticus проявляли высокий токсигенный потенциал, в основном содержащие неклассические гены энтеротоксинов seg и sei .Ранее не сообщаемое обнаружение hla / yidD и hlb в S. epidermidis и S. haemolyticus с использованием видоспецифичных праймеров показало, что эти гены гемолизина различаются между видами CoNS и что они очень часто встречаются в изолятах культур крови. .
.
Ключевые слова: Staphylococcus epidermidis , Staphylococcus haemolyticus , энтеротоксины, цитотоксины
1. Справочная информация
Коагулазонегативные стафилококки (CoNcusS), включая клинически значимые виды haemolylocus и Staphylocochylocos 18 хорошо зарекомендовали себя как важные внутрибольничные возбудители инвазивных инфекций, связанных с медицинскими изделиями [1].Энтеротоксины являются хорошо изученными факторами вирулентности в Staphylococcus aureus , а их гены и синтез описаны в CoNS [2,3], включая CoNS, вызывающие инфекции [4,5]. Энтеротоксины — это суперантигены, которые стимулируют иммунную систему вызывать усиленный ответ, вызывая высвобождение цитокинов, клональную экспансию и клональную делецию части этих лимфоцитов посредством апоптоза [6]. Высвобождение провоспалительных цитокинов отвечает за быстрое начало высокой температуры, утечку капилляров и полиорганную дисфункцию.Внезапность и величина выброса цитокинов определяют тяжесть и исход болезни пациента [7].
Цитотоксины или гемолизины являются важными молекулами, участвующими в патогенезе S. aureus , но их роль в инфекциях CoNS все еще неизвестна. α-гемолизин оказывает гемолитическое, дермонекротическое и нейротоксическое действие [8], тогда как β-токсин обладает фосфорилазной активностью и высоким сродством к клеточной мембране различных типов клеток, вызывая нестабильность мембран [9]. δ-гемолизин вызывает лизис множества клеток млекопитающих, включая эритроциты и внутриклеточные структуры, такие как органеллы с оболочкой [8].Ген δ-токсина, hld , расположен в локусе RNAIII, транскрипте оперона P3, который действует как эффектор системы восприятия кворума agr [10]. Однако его конкретная роль в развитии стафилококковых инфекций четко не установлена. В S. aureus δ-гемолизин представляет собой полипептид, образованный 26 аминокислотами, тогда как в S. epidermidis он состоит из 25 аминокислот с высокой гомологией с δ-токсином S. aureus [11] .
aureus [11] .
Несколько сообщений описывают присутствие генов, кодирующих цитотоксин, и их экспрессию в CoNS [12]. Хотя есть сообщения о наличии генов hla и hld , кодирующих α- и δ-гемолизин, соответственно, у S. epidermidis [13], исследования с участием других видов CoNS, которые проявляют слабую или умеренную гемолитическую активность в Эритроциты человека и крупного рогатого скота, а также кровь овцы или кролика, особенно S. haemolyticus , немногочисленны [14]. Насколько нам известно, не существует метода, который мог бы эффективно обнаружить генетические детерминанты α- и β-токсинов в S.epidermidis и S. haemolyticus .
Ген α-гемолизина был описан только в одном штамме S. epidermidis ( S. epidermidis {«type»: «entrez-нуклеотид», «attrs»: {«text»: «W23144″, » term_id «:» 1299977 «}} W23144 (GenBank: {» type «:» entrez-нуклеотид «,» attrs «: {» text «:» ACJC01000124.1 «,» term_id «:» 224999876 «}} ACJC01000124. 1 ) и затем обозначен как « yidD » Этот ген кодирует белок с 82 аминокислотами, мембранный белок, обладающий активностью α-гемолизина [15,16].Шестьдесят восемь из этих аминокислот идентичны гемолитическому домену белка, обнаруженного в штамме S. epidermidis (NCBI: {«type»: «entrez-protein», «attrs»: {«text»: «AIR83523) .1 «,» term_id «:» 6
1 ) и затем обозначен как « yidD » Этот ген кодирует белок с 82 аминокислотами, мембранный белок, обладающий активностью α-гемолизина [15,16].Шестьдесят восемь из этих аминокислот идентичны гемолитическому домену белка, обнаруженного в штамме S. epidermidis (NCBI: {«type»: «entrez-protein», «attrs»: {«text»: «AIR83523) .1 «,» term_id «:» 6
236 «}} AIR83523.1), называемый« предполагаемый коэффициент эффективности вставки мембранного белка »[17].
Таким образом, целью настоящего исследования было охарактеризовать присутствие генов энтеротоксинов и генов, кодирующих цитотоксин hla , hlb и hld с использованием видоспецифичных праймеров в S.epidermidis и S. haemolyticus изолятов культуры крови.
2. Результаты
2.1. Обнаружение генов энтеротоксинов
Всего было изучено 169 изолятов, в том числе 85 S. epidermidis и 84 S. haemolyticus .
иллюстрирует обнаружение генов энтеротоксина в изолятах S. haemolyticus и S. epidermidis . Доля положительных изолятов была выше у последних видов, за исключением seb и seh (34% и 15% соответственно), которые чаще встречались у S.Геммолитик . Гены sed, и see. встречались редко (2% и 3% соответственно), тогда как гены sei , seg и sea были наиболее частыми генами у обоих видов. Обнаружение гена seg было достоверно связано с S. epidermidis ( p = 0,02).
haemolyticus и S. epidermidis . Доля положительных изолятов была выше у последних видов, за исключением seb и seh (34% и 15% соответственно), которые чаще встречались у S.Геммолитик . Гены sed, и see. встречались редко (2% и 3% соответственно), тогда как гены sei , seg и sea были наиболее частыми генами у обоих видов. Обнаружение гена seg было достоверно связано с S. epidermidis ( p = 0,02).
Обнаружение генов энтеротоксинов sea — sei в изолятах S. epidermidis и S. haemolyticus . * Значительно положительная ассоциация с S. epidermidis .
Гены sea и seb были одновременно обнаружены в 20% ( n = 34) изолятов, включая 17,6% изолятов S. epidermidis и 21,4% из S. haemolyticus , а seg. и sei одновременно присутствовали у 52,7% ( n = 89) (61,2% из S. epidermidis и 44% из S. haemolyticus ).Среди изученных штаммов 87,6% ( n = 148) несли по крайней мере один ген энтеротоксина, в том числе 95,3% ( n = 81) изолятов S. epidermidis и 79,8% ( n = 67) С. haemolyticus .
epidermidis и 44% из S. haemolyticus ).Среди изученных штаммов 87,6% ( n = 148) несли по крайней мере один ген энтеротоксина, в том числе 95,3% ( n = 81) изолятов S. epidermidis и 79,8% ( n = 67) С. haemolyticus .
2.2. Молекулярное и фенотипическое определение цитотоксинов
Гены гемолизина hla / yidD , hlb и hld были обнаружены в S. epidermidis с использованием видоспецифичных праймеров.Праймеры hlb и hld из S. epidermidis не смогли идентифицировать гены β- и δ-токсинов в S. haemolyticus . Новые праймеры были разработаны для идентификации гена hla в S. haemolyticus . Однако праймеры для генов S. haemolyticus hlb и hld не могут быть сконструированы, поскольку эти гены еще не описаны для этого вида.
Скорость обнаружения гла / годD была аналогичной в S. epidermidis и S. haemolyticus (92,9% и 91,7% соответственно). В S. epidermidis hlb были обнаружены в 92,9% изолятов и hld — в 95,3%. Гены hla и hlb одновременно присутствовали в 89,4% изолятов S. epidermidis . β-токсин был обнаружен в 81% изолятов S. haemolyticus , а δ-токсин — в 40,5%. Тридцать процентов изолятов S. haemolyticus продуцировали как β-, так и δ-токсин ().
epidermidis и S. haemolyticus (92,9% и 91,7% соответственно). В S. epidermidis hlb были обнаружены в 92,9% изолятов и hld — в 95,3%. Гены hla и hlb одновременно присутствовали в 89,4% изолятов S. epidermidis . β-токсин был обнаружен в 81% изолятов S. haemolyticus , а δ-токсин — в 40,5%. Тридцать процентов изолятов S. haemolyticus продуцировали как β-, так и δ-токсин ().
Таблица 1
Обнаружение генов α-, β- и δ-цитотоксинов и их продукция.
| Организмы ( n ) | гл * | глб | hld | α-токсин | β-токсин | δ-токсин | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | n | % | |||||||||||||||||||||||||
S. Epidermidis (85) Epidermidis (85) | 79 | 92,9 | 79 | 92,9 | 81 | 95,3 | 24 | 28,2 | 25 | 29,4 | — | — | (84)77 | 91,7 | — | — | — | — | 70 | 83,3 | 68 | 81 | 34 | 40,5 | 92. 3 3 | 79 | 92,9 | 81 | 95,3 | 94 | 55,6 | 93 | 55 | 34 | 40,5 | |
 epidermidis несли hla / yidD и hlb гены и продуцировали соответствующие цитотоксины.Расхождения наблюдались в случае пяти изолятов S. haemolyticus , которые были отрицательными для hla , но показали фенотипическое производство, и одного изолята S. epidermidis , который был отрицательным для hlb и продуцента β- токсин.
epidermidis несли hla / yidD и hlb гены и продуцировали соответствующие цитотоксины.Расхождения наблюдались в случае пяти изолятов S. haemolyticus , которые были отрицательными для hla , но показали фенотипическое производство, и одного изолята S. epidermidis , который был отрицательным для hlb и продуцента β- токсин.Таблица 2
Сравнение частоты генов hla и hlb и фенотипической продукции α- и β-токсинов.
| Staphylococcus haemolyticus | Staphylococcus epidermidis | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Гены | Гены | Гены | ||||||||
| Гены | ||||||||||
| 9017 9017 hla + * | hla — * | Всего | Токсин | hlb + | hlb — | Всего | ||||
| n (%) | )n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | |||
| α-Toxin + | 65 (78) | 5 (6) | 70 (84) | 24 (28) | 0 | 24 (28) 9 0356 | β-токсин + | 24 (28) | 1 (1) | 25 (29) |
| α-токсин — | 12 (14) | 2 (2) | 14 (16) | 55 (65) | 6 (7) | 61 (72) | β-токсин — | 55 (65) | 5 (6) | 60 (71) |
| Всего | 77 (92) | 7 (8) | 84 (100) | 79 (93) | 6 (7) | 85 (100) | Всего | 79 (93) | 6 ( 7) | 85 (100) |
Профиль токсинового гена и фенотипическая продукция токсина для каждого изолята показаны в дополнительной таблице S1.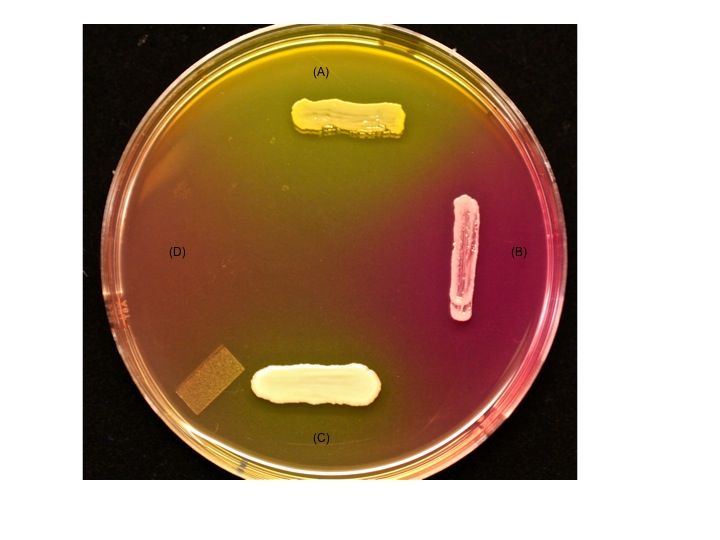
3. Обсуждение
Staphylococcus epidermidis и S. haemolyticus — основные виды CoNS, колонизирующие нос человека [18], наиболее распространенные виды, выделенные из посевов крови [19] и часто связанные с катетер-ассоциированным кровотоком. инфекции [20]. Помимо того, что они являются основной причиной пищевых отравлений, стафилококковые энтеротоксины играют важную роль в патологических процессах, таких как сепсис, остеомиелит и респираторный дистресс-синдром [21].Однако энтеротоксигенный потенциал CoNS неоднозначен.
Настоящее исследование показало высокую частоту генов энтеротоксинов в изолятах культур крови: 95,3% изолятов S. epidermidis и 79,8% изолятов S. haemolyticus несут хотя бы один ген токсина. Наиболее частыми обнаруженными генами классического энтеротоксина были sea , seb и sec , а среди всех генов энтеротоксинов наиболее распространенными были seg и sei .Другое исследование [22] также показало более высокий процент sea , seb и sec в CoNS, выделенных из коровьего молока. Кроме того, сообщалось о продукции энтеротоксина А изолятами человеческого CoNS [23]. Описана продукция классических энтеротоксинов SEA, SEB и SEC клиническими изолятами S. epidermidis и SEC S. haemolyticus [5,24], при этом высокий процент изолятов, продуцирующих комбинацию двух или больше токсинов [25].Как и в настоящем исследовании, также сообщалось о наличии генов SEE, SEG, SEH и SEI и продукции этих энтеротоксинов [26], но исследования, показывающие отсутствие или низкую частоту этих генов в CoNS, преобладают в литературе. . Эти различия между исследованиями могут быть связаны с систематической ошибкой в используемом методе и в изученных изолятах, включая количество, природу и географическое происхождение штаммов. Нозокомиальные изоляты могут быть лучше оснащены факторами вирулентности, полученными путем облегченного переноса посредством селективного давления.
Кроме того, сообщалось о продукции энтеротоксина А изолятами человеческого CoNS [23]. Описана продукция классических энтеротоксинов SEA, SEB и SEC клиническими изолятами S. epidermidis и SEC S. haemolyticus [5,24], при этом высокий процент изолятов, продуцирующих комбинацию двух или больше токсинов [25].Как и в настоящем исследовании, также сообщалось о наличии генов SEE, SEG, SEH и SEI и продукции этих энтеротоксинов [26], но исследования, показывающие отсутствие или низкую частоту этих генов в CoNS, преобладают в литературе. . Эти различия между исследованиями могут быть связаны с систематической ошибкой в используемом методе и в изученных изолятах, включая количество, природу и географическое происхождение штаммов. Нозокомиальные изоляты могут быть лучше оснащены факторами вирулентности, полученными путем облегченного переноса посредством селективного давления.
В настоящем исследовании 20% штаммов были положительными как для sea , так и для seb . Частое присутствие этих двух генов у одной и той же бактерии объясняется тем, что они занимают один и тот же хромосомный локус [27]. Кроме того, 61,2% из S. epidermidis и 44% из S. haemolyticus оказались положительными как для seg , так и для sei . Несколько исследований [28,29] показали систематическую ассоциацию между seg и sei и высокую частоту этих генов у S.aureus , что также может встречаться при CoNS. Ожидается одновременное присутствие генов seg и sei , поскольку эти два гена обнаружены в кластере egc , который также содержит гены, кодирующие другие стафилококковые энтеротоксины [30].
Частое присутствие этих двух генов у одной и той же бактерии объясняется тем, что они занимают один и тот же хромосомный локус [27]. Кроме того, 61,2% из S. epidermidis и 44% из S. haemolyticus оказались положительными как для seg , так и для sei . Несколько исследований [28,29] показали систематическую ассоциацию между seg и sei и высокую частоту этих генов у S.aureus , что также может встречаться при CoNS. Ожидается одновременное присутствие генов seg и sei , поскольку эти два гена обнаружены в кластере egc , который также содержит гены, кодирующие другие стафилококковые энтеротоксины [30].
Staphylococcus epidermidis был указан как CoNS с наивысшим токсигенным потенциалом в некоторых исследованиях [25]. Фактически, этот вид показал более высокий уровень генов энтеротоксина по сравнению с S.haemolyticus (95,3% против ,79,8% соответственно). Остров патогенности, экспрессирующий несколько генов энтеротоксинов, был недавно описан в клиническом изоляте S. epidermidis [31].
epidermidis [31].
Данных о наличии гемолизинов и генов гемолизина в CoNS пока немного. Хотя 81% изолятов S. haemolyticus проявляют β-гемолитическую активность и 40% продуцируют δ-токсин, секвенирование генома не позволило идентифицировать гены, ответственные за гемолиз у этих видов; продемонстрирован только ген α-гемолизина.Праймеры гемолизина, разработанные для S. aureus [32] и S. epidermidis , а также праймеры hld , разработанные из последовательности hld S. simulans (номер доступа GenBank {«type»: «entrez- нуклеотид «,» attrs «: {» text «:» AJ223775.1 «,» term_id «:» 3687333 «}} AJ223775.1; вперед: AAGGGGCAATACACATGRC; обратный: CCGAACGCTTCATTTCCGAT), не удалось обнаружить эти гены в S. haemolyticus . Huseby et al. [33] продемонстрировал видоспецифические различия в β-токсине S . schleiferi и S. epidermidis , белки которых показали 72% и 52% гомологию с β-токсином S. aureus соответственно. Эти различия между β-гемолизинами разных видов CoNS могут быть результатом бактериальной адаптации к широкому кругу потенциальных хозяев [34]. Поскольку праймеры hlb и hld для S. epidermidis не могли идентифицировать эти гены в S. haemolyticus , а гены hlb и hld еще не были описаны у последних видов, хотя они и являются произведенные, как продемонстрировано методом фенотипического обнаружения, могут существовать значительные различия в их последовательностях, что позволяет предположить, что эти токсины имеют различную структуру и, следовательно, разные функции у видов CoNS.
aureus соответственно. Эти различия между β-гемолизинами разных видов CoNS могут быть результатом бактериальной адаптации к широкому кругу потенциальных хозяев [34]. Поскольку праймеры hlb и hld для S. epidermidis не могли идентифицировать эти гены в S. haemolyticus , а гены hlb и hld еще не были описаны у последних видов, хотя они и являются произведенные, как продемонстрировано методом фенотипического обнаружения, могут существовать значительные различия в их последовательностях, что позволяет предположить, что эти токсины имеют различную структуру и, следовательно, разные функции у видов CoNS.
Насколько нам известно, это первое исследование по обнаружению гена hla с использованием специфических праймеров для S. epidermidis и S. haemolyticus . Ген, использованный для конструирования праймера штамма S. epidermidis {«type»: «entrez-nucleotide», «attrs»: {«text»: «W23144», «term_id»: «1299977»}} W23144 был обозначается в GenBank как «α-гемолизин» до июня 2013 года. В тот день авторы изменили обозначение этого гена на « yidD » и классифицировали его как мембранный белок.Согласно предыдущим исследованиям, некоторые члены семейства yidD были аннотированы как гемолизины, что явилось результатом неопубликованного наблюдения, опубликованного в GenBank {«type»: «entrez-nucleotide», «attrs»: {«text»: «L36462″, » term_id «:» 2537795 «}} L36462, что ген hlyA , который является гомологом yidD из Aeromonas hydrophila , обладает активностью α-гемолизина [15,16]. Некоторые базы данных показывают, что yidD является ортологом белков с гемолитической функцией SE1462 из S.epidermidis ATCC 12228 и SERP1356 из S. epidermidis RP62A (http://www.xbase.ac.uk/genome/buchnera-aphidicola-str-sg-schizaphis-graminum/NC_004061/BUsg015;yidD/super/orthologues) .
В тот день авторы изменили обозначение этого гена на « yidD » и классифицировали его как мембранный белок.Согласно предыдущим исследованиям, некоторые члены семейства yidD были аннотированы как гемолизины, что явилось результатом неопубликованного наблюдения, опубликованного в GenBank {«type»: «entrez-nucleotide», «attrs»: {«text»: «L36462″, » term_id «:» 2537795 «}} L36462, что ген hlyA , который является гомологом yidD из Aeromonas hydrophila , обладает активностью α-гемолизина [15,16]. Некоторые базы данных показывают, что yidD является ортологом белков с гемолитической функцией SE1462 из S.epidermidis ATCC 12228 и SERP1356 из S. epidermidis RP62A (http://www.xbase.ac.uk/genome/buchnera-aphidicola-str-sg-schizaphis-graminum/NC_004061/BUsg015;yidD/super/orthologues) .
Ген, кодирующий α-токсин / yidD , был обнаружен в 92,9% изолятов S. epidermidis
и ген hla в 91,7% изолятов S. haemolyticus , в то время как hlb был обнаружен с такой же частотой (92,9%) у S. epidermidis .С другой стороны, другое исследование [13] обнаружило hlb только в 20% из изолятов S. epidermidis и отсутствие hlb во всех штаммах. β-токсин описан в 75% случаев CoNS, а α-гемолиз — в 57% [35]. Натаро и др. [36] наблюдали 61% положительности для β-токсина в CoNS, в то время как в настоящем исследовании продукция β-гемолизина наблюдалась у 81% изолятов S. haemolyticus . Moraveji et al. [37] наблюдали вдвое большую частоту генов и продукции гемолизина в человеческих линиях по сравнению со штаммами животных.Важность hlb и β-токсина обусловлена способностью этого белка способствовать ускользанию бактерий от иммунной системы хозяина и его участием в поглощении питательных веществ [33], обеспечивая выживание патогена.
haemolyticus , в то время как hlb был обнаружен с такой же частотой (92,9%) у S. epidermidis .С другой стороны, другое исследование [13] обнаружило hlb только в 20% из изолятов S. epidermidis и отсутствие hlb во всех штаммах. β-токсин описан в 75% случаев CoNS, а α-гемолиз — в 57% [35]. Натаро и др. [36] наблюдали 61% положительности для β-токсина в CoNS, в то время как в настоящем исследовании продукция β-гемолизина наблюдалась у 81% изолятов S. haemolyticus . Moraveji et al. [37] наблюдали вдвое большую частоту генов и продукции гемолизина в человеческих линиях по сравнению со штаммами животных.Важность hlb и β-токсина обусловлена способностью этого белка способствовать ускользанию бактерий от иммунной системы хозяина и его участием в поглощении питательных веществ [33], обеспечивая выживание патогена. Дивергенция гена hld настолько велика среди видов, что она не может быть амплифицирована в некоторых CoNS [12]. Это разнообразие демонстрируется тем фактом, что частичная идентичность гена этого токсина между S. aureus и S. epidermidis составляет всего 83% [12].То же самое может относиться к S. haemolyticus и может объяснять отсутствие амплификации этого гена праймерами S. epidermidis в настоящем исследовании. δ-гемолизин кодируется регуляторной РНКIII в S. aureus , связанной с системой agr [38], системой, описанной у нескольких видов стафилококков, включая S. epidermidis и S. haemolyticus [39,40] . В настоящем исследовании ген hld был обнаружен у 95,3% из S.epidermidis , а δ-гемолизин продуцировался 40,5% изолятов S. haemolyticus . Согласно Gemmel [41], δ-гемолизин чаще экспрессируется CoNS, изолированным от клинически значимых инфекций, по сравнению с неявными инфекциями человека.
Это разнообразие демонстрируется тем фактом, что частичная идентичность гена этого токсина между S. aureus и S. epidermidis составляет всего 83% [12].То же самое может относиться к S. haemolyticus и может объяснять отсутствие амплификации этого гена праймерами S. epidermidis в настоящем исследовании. δ-гемолизин кодируется регуляторной РНКIII в S. aureus , связанной с системой agr [38], системой, описанной у нескольких видов стафилококков, включая S. epidermidis и S. haemolyticus [39,40] . В настоящем исследовании ген hld был обнаружен у 95,3% из S.epidermidis , а δ-гемолизин продуцировался 40,5% изолятов S. haemolyticus . Согласно Gemmel [41], δ-гемолизин чаще экспрессируется CoNS, изолированным от клинически значимых инфекций, по сравнению с неявными инфекциями человека.
Несмотря на высокую частоту гена hla , наблюдаемую в настоящем исследовании у S. epidermidis и S. haemolyticus , фенотипическая продукция токсина, кодируемого hla , кажется более частой у последних видов, с наибольшим гл, -положительный с.haemolyticus (85%), экспрессирующие α-токсин. Напротив, несмотря на высокую частоту hla / yidD и hlb в S. epidermidis , менее одной трети (30%) изолятов, несущих эти гены, также экспрессировали их. Отсутствие гена и присутствие токсина, наблюдаемые в пяти изолятах S. haemolyticus
epidermidis и S. haemolyticus , фенотипическая продукция токсина, кодируемого hla , кажется более частой у последних видов, с наибольшим гл, -положительный с.haemolyticus (85%), экспрессирующие α-токсин. Напротив, несмотря на высокую частоту hla / yidD и hlb в S. epidermidis , менее одной трети (30%) изолятов, несущих эти гены, также экспрессировали их. Отсутствие гена и присутствие токсина, наблюдаемые в пяти изолятах S. haemolyticus
Одним из ограничений настоящего исследования является тот факт, что распространенность токсигенных генов не эквивалентна распространенности экспрессии этих генов. Однако в этом исследовании экспрессия была продемонстрирована гемолизом на кровяном агаре. Необходимы дальнейшие исследования с использованием других методов для оценки экспрессии этих генов, таких как вестерн-блоттинг. Кроме того, секвенирование генома некоторых из этих положительных штаммов будет важным для идентификации этих генов в геномах S.epidermidis и S. haemolyticus .
Кроме того, секвенирование генома некоторых из этих положительных штаммов будет важным для идентификации этих генов в геномах S.epidermidis и S. haemolyticus .
4. Материалы и методы
4.1. Изоляты
Штаммы были выделены из посевов крови пациентов, поступивших в университетскую больницу Медицинской школы Ботукату (Hospital das Clínicas, Faculdade de Medicina de Botucatu (HC-FMB)), Государственный университет Паулиста (Universidade Estadual Paulista (UNESP)) , Botucatu Campus, между 2000 и 2011 годами. В исследование был включен только один изолят на пациента. Штаммы были выделены, как описано Koneman et al. [42].
4.2. Идентификация видов
Род Staphylococcus был идентифицирован, как описано Koneman et al. [42]. Staphylococcus epidermidis и S. haemolyticus были идентифицированы упрощенным методом, предложенным Cunha et al. [43]. Идентификация видов была генетически подтверждена с помощью ПЦР-амплификации области внутреннего транскрибируемого спейсера (ITS) 16S-23S, как описано Couto et al. [44] после экстракции ДНК с помощью набора Illustra (GE Healthcare, Little Chalfont, Buckinghamshire, UK).Следующие международные эталонные штаммы использовали в качестве контролей: S. epidermidis (ATCC 12228), S. epidermidis (ATCC 35983) и S. haemolyticus (ATCC 29970).
[44] после экстракции ДНК с помощью набора Illustra (GE Healthcare, Little Chalfont, Buckinghamshire, UK).Следующие международные эталонные штаммы использовали в качестве контролей: S. epidermidis (ATCC 12228), S. epidermidis (ATCC 35983) и S. haemolyticus (ATCC 29970).
4.3. Обнаружение генов энтеротоксинов
ПЦР для обнаружения генов энтеротоксинов выполняли с использованием праймеров и параметров, описанных Johnson et al. [45] и Cunha et al. [4]. Международные эталонные штаммы были включены во все реакции как положительные ( S.aureus Американская коллекция типовых культур — ATCC 13565 ( sea ), ATCC 14458 ( seb ), ATCC 19095 ( sec ), ATCC 23235 ( sed ), ATCC 27664 ( см. ), ATCC 51811 ( seh ), S. aureus Food Research Institute — FRI 361 ( seg и sei )) и отрицательные ( S. xylosus ATCC 29971) контроли. Последовательности праймеров показаны в.
Таблица 3
Последовательность праймеров и размер ампликона.
| Название | Продукт | Последовательность | Ссылка | Размер ампликона (bp) |
|---|---|---|---|---|
| море-1 | Энтеротоксин A | TTGGAAACGGTTAAAACGAA | [29] | 120 |
| море-2 | GAACCTTCCCATCAAAAACA | |||
| СБ-1 | Энтеротоксин B | TCGCATCAAACTGACAAACG | [29] | 478 |
| СБ-2 | GCAGGTACTCTATAAGTGCC | |||
| сек-1 | Энтеротоксин C | GACATAAAAGCTAGGAATTT | [29] | 257 |
| сек-2 | AAATCGGATTAACATTATCC | |||
| сед-1 | Энтеротоксин D | CTAGTTTGGTAATATCTCCT | [29] | 317 |
| сед-2 | TAATGCTATATCTTATAGGG | |||
| см-1 | Энтеротоксин E | CAAAGAAATGCTTTAAGCAATCTTAGGCCAC | [29] | 170 |
| см-2 | CTTACCGCCAAAGCTG | |||
| сег-1 | Энтеротоксин G | AATTATGTGAATGCTCAACCCGATC | [36] | 642 |
| сег-2 | AAACTTATATGGAACAAAAGGTACTAGTTC | |||
| sei-1 | Энтеротоксин H | CAATCACATCATATGCGAAAGCAG | [36] | 376 |
| seh-2 | CATCTACCCAAACATTAGCACC | |||
| sei-1 | Энтеротоксин I | CTCAAGGTGATATTGGTGTAGG | [36] | 576 |
| sei-2 | AAAAAACTTACAGGCAGTCCATCTC | |||
| гл / yidD_epid-1 | α-гемолизин / жидД | TTTCKCCACTTACACCMCC | Это исследование | 160 |
| гл / yidD_epid-2 | GGAACAGGATCAAAGCCACCT | |||
| hlb_epid-1 | β-гемолизин | TGGTGGCGTTGGTATTGTGA | Это исследование | 541 |
| hlb_epid-2 | ACCCCAAGATTTCACGGACC | |||
| hla_haem-1 | α-гемолизин | TGGGCCATAAACTTCAATCGC | Это исследование | 72 |
| гла-гем-2 | ACGCCACCTACATGCAGATTT | |||
| hld-epid-1 | δ-гемолизин | ATGGCAGCAGATATCATTTC | [30] | 444 |
| hld-epid-2 | CGTGAGCTTGGGAGAGAC |
4.4. Обнаружение генов гемолизина
Ген δ-гемолизина, hld , был обнаружен с использованием праймеров и параметров, описанных Marconi et al. [46].
Ген hla / yidD был обнаружен в изолятах S. epidermidis с использованием праймеров, разработанных с помощью NCBI-PrimerBlast, 2008, и последовательностей штамма S. epidermidis {«type»: «entrez-нуклеотид», «attrs»: {«text»: «W23144», «term_id»: «1299977»}} W23144 (GenBank: {«type»: «entrez-нуклеотид», «attrs»: {«text»: «ACJC01000124.1 «,» term_id «:» 224999876 «}} ACJC01000124.1) (hla / yidD_epid). Ген hla был обнаружен в изолятах S. haemolyticus с использованием праймеров, созданных с помощью PrimerBlast и последовательности штамма JCSC1435 (NCBI : {«type»: «entrez-нуклеотид», «attrs»: {«text»: «NC_007168.1», «term_id»: «70725001»}} NC_007168.1) (hla_haem). Праймеры для hlb ген в S. epidermidis были сконструированы с использованием PrimerBlast и последовательности S. epidermidis RP62A (NCBI: {«type»: «entrez-нуклеотид», «attrs»: {«text»: «NC_002976.3 «,» term_id «:» 57865352 «}} NC_002976.3) (hlb_epid). Праймеры для гена hlb в S. haemolyticus не могли быть сконструированы, поскольку этот ген не был описан у этого вида в База данных NCBI-GenBank. Реакционная смесь содержала 2,0 ед. Полимеразы Taq, 1 × буфер для ПЦР, содержащий 0,75 мМ MgCl 2 , 100 мкМ трифосфат дезоксирибонуклеотидов, 1 М каждого праймера и 150 нг нуклеиновой кислоты. Условия ПЦР были следующими: для гл , один шаг при 94 ° C в течение 4 минут; 35 циклов при 94 ° C в течение 1 минуты, 60 ° C в течение 1 минуты, 72 ° C в течение 1 минуты и 72 ° C в течение 5 минут; для hlb , один шаг при 94 ° C в течение 4 минут, 35 циклов при 94 ° C в течение 1 минуты, 60 ° C в течение 1 минуты, 72 ° C в течение 1.5 мин и 72 ° C в течение 6 мин. Эталонные штаммы были включены во все реакции: гл / йидD _epid: S. epidermidis ATCC 12228; hla _haem: S. haemolyticus ATCC 29970; hlb _epid: S. epidermidis ATCC 12228. Последовательности праймеров показаны на фиг.
4.5. Фенотипическая продукция β- и δ-цитотоксинов
Продукция α-токсина определялась на чашках с кровяным агаром, содержащим 5% кроличьей крови, инкубированных при 37 ° C в течение 24 часов.О положительном результате свидетельствовало образование зон гемолиза вокруг изолированных колоний.
Продукция β- и δ-токсинов в изолятах S. haemolyticus была обнаружена, как описано Hébert и Hancock [47]. β-гемолиз наблюдали по наличию зоны неполного гемолиза на чашке с агаром с бараньей кровью, инкубированной при 37 ° C в течение 24 ч, а затем в течение ночи при 4 ° C [48]. Присутствие δ-токсина подтверждалось синергизмом с β-гемолизином S. aureus ATCC 25923.Для этого изолят наносили штрихами перпендикулярно штамму S. aureus на чашку с агаром с овечьей кровью. Планшет инкубировали при 37 ° C в течение 24 ч, и образование δ-токсина наблюдали по образованию зоны гемолиза в форме стрелки [47].
4.6. Статистический анализ
Тест хи-квадрат использовался для проверки связи между переменными, принимая уровень значимости <0,05.
5. Выводы
Клинические изоляты S.epidermidis и S. haemolyticus проявляют высокий токсигенный потенциал, особенно продуцируя энтеротоксины G и I. Использование новых видоспецифичных праймеров для hla / yidD и hlb для S. epidermidis и для hla из S. haemolyticus выявили высокую частоту этих генов в нозокомиальных изолятах этих видов. Полученные данные демонстрируют важную роль этих генов цитотоксина в становлении этих видов и, возможно, в развитии инфекций, вызванных CoNS.
Благодарности
Эта работа была поддержана государственным финансовым агентством Сан-Паулу Research Foundation (FAPESP — Fundação de Amparo à Pesquisa do Estado de São Paulo; Grant 2011 / 15396-1) и Национальным советом по технологическому и научному развитию (CNPq— Conselho Nacional de Desenvolvimento Científico e Tecnológico; Grant 304729 / 2014-0).
Вклад авторов
Л.П .: задумал исследование, участвовал в его разработке, проводил эксперименты, анализировал данные и составлял рукопись.C.I.B .: участвовал в разработке концепции исследования и в лабораторных экспериментах. А.О .: участвовал в лабораторных экспериментах. P.Y.F.M .: участвовал в разработке праймеров. V.C.P .: участвовал в молекулярных экспериментах. M.L.R.S.C .: задумал исследование, участвовал в его разработке и координации, а также отредактировал рукопись. Все авторы прочитали и одобрили окончательную рукопись.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1.Вуонг К., Отто М. Эпидермальные инфекции, вызванные стафилококком. Микробы заражают. 2002; 4: 481–489. DOI: 10.1016 / S1286-4579 (02) 01563-0. [PubMed] [CrossRef] [Google Scholar] 2. Ирлингер Ф. Оценка безопасности молочных микроорганизмов: Коагулазонегативные стафилококки. Int. J. Food Microbiol. 2008. 126: 302–310. DOI: 10.1016 / j.ijfoodmicro.2007.08.016. [PubMed] [CrossRef] [Google Scholar] 3. Подковик М., Быстронь Я., Баня Дж. Генотипы, устойчивость к антибиотикам и факторы вирулентности стафилококков из готовой к употреблению пищи.Пищевой патогенный микроорганизм. Дис. 2012; 9: 91–93. DOI: 10.1089 / fpd.2011.0962. [PubMed] [CrossRef] [Google Scholar] 4. Cunha M.L.R.S., Calsolari R.A.O., Araújo-Júnior J.P. Выявление генов токсина 1 энтеротоксина и синдрома токсического шока в Staphylococcus с акцентом на коагулазонегативные стафилококки. Microbiol. Иммунол. 2007; 51: 381–390. DOI: 10.1111 / j.1348-0421.2007.tb03925.x. [PubMed] [CrossRef] [Google Scholar] 5. Барретти П., Монтелли А.К., Баталья Дж. Э., Карамори Дж. К., Кунья М.Л.Р.С. Роль факторов вирулентности в исходе стафилококкового перитонита у пациентов с ХПНП.BMC Infect. Дис. 2009; 9: 212. DOI: 10.1186 / 1471-2334-9-212. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Тейлор А.Л., Ллевелин М.Дж. Суперантиген-индуцированная пролиферация CD4 + CD25- Т-клеток человека сопровождается переключением на функциональный регуляторный фенотип. J. Immunol. 2010; 185: 6591–6598. DOI: 10.4049 / jimmunol.1002416. [PubMed] [CrossRef] [Google Scholar] 7. Frase J.D., Proft T. Бактериальный суперантиген и суперантиген-подобные белки. Иммунол. Ред. 2008; 225: 226–243. DOI: 10.1111 / j.1600-065X.2008.00681.x. [PubMed] [CrossRef] [Google Scholar] 9. Коэльо С.М.О., Рейносо Э., Перейра И.А., Соарес Л.С., Демо М., Богни К., Соуза М.М.С. Факторы вирулентности и устойчивость к противомикробным препаратам Staphylococcus aureus , выделенного от мастита крупного рогатого скота в Рио-де-Жанейро. Pesq. Вет. Бюстгальтеры. 2009. 29: 369–374. DOI: 10.1590 / S0100-736X20000002. [CrossRef] [Google Scholar] 10. Пенг Х.Л., Новик Р.П., Крейсвирт Б., Корнблюм Дж., Шливерт П. Клонирование, характеристика и секвенирование дополнительного регулятора гена ( agr ) в Staphylococcus aureus .J. Bacteriol. 1988; 170: 4365–4372. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. МакКевитт А.И., Бьорнсон Г.Л., Маурахер К.А., Шайфеле Д.В. Аминокислотная последовательность дельтоподобного токсина из Staphylococcus epidermidis . Заразить. Иммун. 1990; 58: 1473–1475. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Эвен С., Лерой С., Шарлье К., Закур Н.Б., Чакорнак Дж. П., Леберт И., Жамет Э., Десмонтс М. Х., Котон Э., Почет С. и др. Низкий уровень опасности для безопасности при коагулазонегативных стафилококках, выделенных из ферментированных пищевых продуктов.Int. J. Food Microbiol. 2010; 139: 87–95. DOI: 10.1016 / j.ijfoodmicro.2010.02.019. [PubMed] [CrossRef] [Google Scholar] 13. Оки М.С., Йолоба М.Л., Окелло М., Наджука Ф.С., Катабази Ф.А., Бванга Ф., Нантеза А., Катите Д.П. Распространенность детерминант вирулентности у Staphylococcus epidermidis от пациентов интенсивной терапии в Кампале, Уганда. J. Infect. Dev. Ctries. 2012; 6: 242–250. [PubMed] [Google Scholar] 14. Schleifer K.H., Kloos W.E. Выделение и характеристика стафилококков из кожи человека. Int.J. Syst. Бактериол. 1975; 25: 50–61. DOI: 10.1099 / 00207713-25-1-50. [CrossRef] [Google Scholar] 15. Радд К.Е., Хамфери-Смит И., Васингер В.С., Байроч А. Низкомолекулярные белки: проблема для постгеномных исследований. Электрофорез. 1998. 19: 536–544. DOI: 10.1002 / elps.11501Молекулярное обнаружение генов цитотоксинов и энтеротоксинов
токсинов (Базель). 2015 сен; 7 (9): 3688–3699.
Юкако Фудзинага, научный редактор
† Умер 8 сентября 2013 г.
* Автор, которому следует направлять корреспонденцию; Электронная почта: rb.psenu.bbi@rlmahnuc; Тел .: + 55-14-3880-0428.Поступило 6 мая 2015 г .; Принято к печати 6 июля 2015 г.
Авторские права © 2015 г. Авторы; лицензиат MDPI, Базель, Швейцария.Эта статья цитировалась в других статьях в PMC.Abstract
Хотя условно-патогенные микроорганизмы, коагулазонегативные стафилококки (CoNS), включая Staphylococcus epidermidis и Staphylococcus haemolyticus , долгое время считались авирулентными организмами. Роль токсинов в развитии инфекций, вызванных CoNS, до сих пор остается спорной. Целью данного исследования было охарактеризовать наличие генов энтеротоксинов и цитотоксинов у S.epidermidis и S. haemolyticus , полученные из посевов крови. Гены цитотоксинов были обнаружены с помощью ПЦР с использованием новых видоспецифичных праймеров. Среди 85 изолятов S. epidermidis и 84 S. haemolyticus 95,3% и 79,8%, соответственно, несли по крайней мере один ген энтеротоксина. Наиболее частыми генами энтеротоксинов были seg (53,3%), seg (64,5%) и sei (67,5%). Ген seg был положительно связан с S.epidermidis ( p = 0,02), и этот вид был более токсигенным, чем S. haemolyticus . Ген hla / yidD был обнаружен в 92,9% изолятов S. epidermidis и ген hla в 91,7% изолятов S. haemolyticus ; hlb был обнаружен в 92,9% изолятов S. epidermidis и hld в 95,3%. Нозокомиальные изоляты Staphylococcus epidermidis и S. haemolyticus проявляли высокий токсигенный потенциал, в основном содержащие неклассические гены энтеротоксинов seg и sei .Ранее не сообщаемое обнаружение hla / yidD и hlb в S. epidermidis и S. haemolyticus с использованием видоспецифичных праймеров показало, что эти гены гемолизина различаются между видами CoNS и что они очень часто встречаются в изолятах культур крови. .
Ключевые слова: Staphylococcus epidermidis , Staphylococcus haemolyticus , энтеротоксины, цитотоксины
1. Справочная информация
Коагулазонегативные стафилококки (CoNcusS), включая клинически значимые виды haemolylocus и Staphylocochylocos 18 хорошо зарекомендовали себя как важные внутрибольничные возбудители инвазивных инфекций, связанных с медицинскими изделиями [1].Энтеротоксины являются хорошо изученными факторами вирулентности в Staphylococcus aureus , а их гены и синтез описаны в CoNS [2,3], включая CoNS, вызывающие инфекции [4,5]. Энтеротоксины — это суперантигены, которые стимулируют иммунную систему вызывать усиленный ответ, вызывая высвобождение цитокинов, клональную экспансию и клональную делецию части этих лимфоцитов посредством апоптоза [6]. Высвобождение провоспалительных цитокинов отвечает за быстрое начало высокой температуры, утечку капилляров и полиорганную дисфункцию.Внезапность и величина выброса цитокинов определяют тяжесть и исход болезни пациента [7].
Цитотоксины или гемолизины являются важными молекулами, участвующими в патогенезе S. aureus , но их роль в инфекциях CoNS все еще неизвестна. α-гемолизин оказывает гемолитическое, дермонекротическое и нейротоксическое действие [8], тогда как β-токсин обладает фосфорилазной активностью и высоким сродством к клеточной мембране различных типов клеток, вызывая нестабильность мембран [9]. δ-гемолизин вызывает лизис множества клеток млекопитающих, включая эритроциты и внутриклеточные структуры, такие как органеллы с оболочкой [8].Ген δ-токсина, hld , расположен в локусе RNAIII, транскрипте оперона P3, который действует как эффектор системы восприятия кворума agr [10]. Однако его конкретная роль в развитии стафилококковых инфекций четко не установлена. В S. aureus δ-гемолизин представляет собой полипептид, образованный 26 аминокислотами, тогда как в S. epidermidis он состоит из 25 аминокислот с высокой гомологией с δ-токсином S. aureus [11] .
Несколько сообщений описывают присутствие генов, кодирующих цитотоксин, и их экспрессию в CoNS [12]. Хотя есть сообщения о наличии генов hla и hld , кодирующих α- и δ-гемолизин, соответственно, у S. epidermidis [13], исследования с участием других видов CoNS, которые проявляют слабую или умеренную гемолитическую активность в Эритроциты человека и крупного рогатого скота, а также кровь овцы или кролика, особенно S. haemolyticus , немногочисленны [14]. Насколько нам известно, не существует метода, который мог бы эффективно обнаружить генетические детерминанты α- и β-токсинов в S.epidermidis и S. haemolyticus .
Ген α-гемолизина был описан только в одном штамме S. epidermidis ( S. epidermidis {«type»: «entrez-нуклеотид», «attrs»: {«text»: «W23144″, » term_id «:» 1299977 «}} W23144 (GenBank: {» type «:» entrez-нуклеотид «,» attrs «: {» text «:» ACJC01000124.1 «,» term_id «:» 224999876 «}} ACJC01000124.1 ) и затем обозначен как « yidD » Этот ген кодирует белок с 82 аминокислотами, мембранный белок, обладающий активностью α-гемолизина [15,16].Шестьдесят восемь из этих аминокислот идентичны гемолитическому домену белка, обнаруженного в штамме S. epidermidis (NCBI: {«type»: «entrez-protein», «attrs»: {«text»: «AIR83523) .1 «,» term_id «:» 6
236 «}} AIR83523.1), называемый« предполагаемый коэффициент эффективности вставки мембранного белка »[17].
Таким образом, целью настоящего исследования было охарактеризовать присутствие генов энтеротоксинов и генов, кодирующих цитотоксин hla , hlb и hld с использованием видоспецифичных праймеров в S.epidermidis и S. haemolyticus изолятов культуры крови.
2. Результаты
2.1. Обнаружение генов энтеротоксинов
Всего было изучено 169 изолятов, в том числе 85 S. epidermidis и 84 S. haemolyticus .
иллюстрирует обнаружение генов энтеротоксина в изолятах S. haemolyticus и S. epidermidis . Доля положительных изолятов была выше у последних видов, за исключением seb и seh (34% и 15% соответственно), которые чаще встречались у S.Геммолитик . Гены sed, и see. встречались редко (2% и 3% соответственно), тогда как гены sei , seg и sea были наиболее частыми генами у обоих видов. Обнаружение гена seg было достоверно связано с S. epidermidis ( p = 0,02).
Обнаружение генов энтеротоксинов sea — sei в изолятах S. epidermidis и S. haemolyticus . * Значительно положительная ассоциация с S. epidermidis .
Гены sea и seb были одновременно обнаружены в 20% ( n = 34) изолятов, включая 17,6% изолятов S. epidermidis и 21,4% из S. haemolyticus , а seg. и sei одновременно присутствовали у 52,7% ( n = 89) (61,2% из S. epidermidis и 44% из S. haemolyticus ).Среди изученных штаммов 87,6% ( n = 148) несли по крайней мере один ген энтеротоксина, в том числе 95,3% ( n = 81) изолятов S. epidermidis и 79,8% ( n = 67) С. haemolyticus .
2.2. Молекулярное и фенотипическое определение цитотоксинов
Гены гемолизина hla / yidD , hlb и hld были обнаружены в S. epidermidis с использованием видоспецифичных праймеров.Праймеры hlb и hld из S. epidermidis не смогли идентифицировать гены β- и δ-токсинов в S. haemolyticus . Новые праймеры были разработаны для идентификации гена hla в S. haemolyticus . Однако праймеры для генов S. haemolyticus hlb и hld не могут быть сконструированы, поскольку эти гены еще не описаны для этого вида.
Скорость обнаружения гла / годD была аналогичной в S.epidermidis и S. haemolyticus (92,9% и 91,7% соответственно). В S. epidermidis hlb были обнаружены в 92,9% изолятов и hld — в 95,3%. Гены hla и hlb одновременно присутствовали в 89,4% изолятов S. epidermidis . β-токсин был обнаружен в 81% изолятов S. haemolyticus , а δ-токсин — в 40,5%. Тридцать процентов изолятов S. haemolyticus продуцировали как β-, так и δ-токсин ().
Таблица 1
Обнаружение генов α-, β- и δ-цитотоксинов и их продукция.
| Организмы ( n ) | гл * | глб | hld | α-токсин | β-токсин | δ-токсин | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | n | % | |||||||||||||||||||||||||
| S.Epidermidis (85) | 79 | 92,9 | 79 | 92,9 | 81 | 95,3 | 24 | 28,2 | 25 | 29,4 | — | — | (84)77 | 91,7 | — | — | — | — | 70 | 83,3 | 68 | 81 | 34 | 40,5 | 92.3 | 79 | 92,9 | 81 | 95,3 | 94 | 55,6 | 93 | 55 | 34 | 40,5 | |
Таблица 2
Сравнение частоты генов hla и hlb и фенотипической продукции α- и β-токсинов.
| Staphylococcus haemolyticus | Staphylococcus epidermidis | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Гены | Гены | Гены | ||||||||
| Гены | ||||||||||
| 9017 9017 hla + * | hla — * | Всего | Токсин | hlb + | hlb — | Всего | ||||
| n (%) | )n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | |||
| α-Toxin + | 65 (78) | 5 (6) | 70 (84) | 24 (28) | 0 | 24 (28) 9 0356 | β-токсин + | 24 (28) | 1 (1) | 25 (29) |
| α-токсин — | 12 (14) | 2 (2) | 14 (16) | 55 (65) | 6 (7) | 61 (72) | β-токсин — | 55 (65) | 5 (6) | 60 (71) |
| Всего | 77 (92) | 7 (8) | 84 (100) | 79 (93) | 6 (7) | 85 (100) | Всего | 79 (93) | 6 ( 7) | 85 (100) |
Профиль токсинового гена и фенотипическая продукция токсина для каждого изолята показаны в дополнительной таблице S1.
3. Обсуждение
Staphylococcus epidermidis и S. haemolyticus — основные виды CoNS, колонизирующие нос человека [18], наиболее распространенные виды, выделенные из посевов крови [19] и часто связанные с катетер-ассоциированным кровотоком. инфекции [20]. Помимо того, что они являются основной причиной пищевых отравлений, стафилококковые энтеротоксины играют важную роль в патологических процессах, таких как сепсис, остеомиелит и респираторный дистресс-синдром [21].Однако энтеротоксигенный потенциал CoNS неоднозначен.
Настоящее исследование показало высокую частоту генов энтеротоксинов в изолятах культур крови: 95,3% изолятов S. epidermidis и 79,8% изолятов S. haemolyticus несут хотя бы один ген токсина. Наиболее частыми обнаруженными генами классического энтеротоксина были sea , seb и sec , а среди всех генов энтеротоксинов наиболее распространенными были seg и sei .Другое исследование [22] также показало более высокий процент sea , seb и sec в CoNS, выделенных из коровьего молока. Кроме того, сообщалось о продукции энтеротоксина А изолятами человеческого CoNS [23]. Описана продукция классических энтеротоксинов SEA, SEB и SEC клиническими изолятами S. epidermidis и SEC S. haemolyticus [5,24], при этом высокий процент изолятов, продуцирующих комбинацию двух или больше токсинов [25].Как и в настоящем исследовании, также сообщалось о наличии генов SEE, SEG, SEH и SEI и продукции этих энтеротоксинов [26], но исследования, показывающие отсутствие или низкую частоту этих генов в CoNS, преобладают в литературе. . Эти различия между исследованиями могут быть связаны с систематической ошибкой в используемом методе и в изученных изолятах, включая количество, природу и географическое происхождение штаммов. Нозокомиальные изоляты могут быть лучше оснащены факторами вирулентности, полученными путем облегченного переноса посредством селективного давления.
В настоящем исследовании 20% штаммов были положительными как для sea , так и для seb . Частое присутствие этих двух генов у одной и той же бактерии объясняется тем, что они занимают один и тот же хромосомный локус [27]. Кроме того, 61,2% из S. epidermidis и 44% из S. haemolyticus оказались положительными как для seg , так и для sei . Несколько исследований [28,29] показали систематическую ассоциацию между seg и sei и высокую частоту этих генов у S.aureus , что также может встречаться при CoNS. Ожидается одновременное присутствие генов seg и sei , поскольку эти два гена обнаружены в кластере egc , который также содержит гены, кодирующие другие стафилококковые энтеротоксины [30].
Staphylococcus epidermidis был указан как CoNS с наивысшим токсигенным потенциалом в некоторых исследованиях [25]. Фактически, этот вид показал более высокий уровень генов энтеротоксина по сравнению с S.haemolyticus (95,3% против ,79,8% соответственно). Остров патогенности, экспрессирующий несколько генов энтеротоксинов, был недавно описан в клиническом изоляте S. epidermidis [31].
Данных о наличии гемолизинов и генов гемолизина в CoNS пока немного. Хотя 81% изолятов S. haemolyticus проявляют β-гемолитическую активность и 40% продуцируют δ-токсин, секвенирование генома не позволило идентифицировать гены, ответственные за гемолиз у этих видов; продемонстрирован только ген α-гемолизина.Праймеры гемолизина, разработанные для S. aureus [32] и S. epidermidis , а также праймеры hld , разработанные из последовательности hld S. simulans (номер доступа GenBank {«type»: «entrez- нуклеотид «,» attrs «: {» text «:» AJ223775.1 «,» term_id «:» 3687333 «}} AJ223775.1; вперед: AAGGGGCAATACACATGRC; обратный: CCGAACGCTTCATTTCCGAT), не удалось обнаружить эти гены в S. haemolyticus . Huseby et al. [33] продемонстрировал видоспецифические различия в β-токсине S . schleiferi и S. epidermidis , белки которых показали 72% и 52% гомологию с β-токсином S. aureus соответственно. Эти различия между β-гемолизинами разных видов CoNS могут быть результатом бактериальной адаптации к широкому кругу потенциальных хозяев [34]. Поскольку праймеры hlb и hld для S. epidermidis не могли идентифицировать эти гены в S. haemolyticus , а гены hlb и hld еще не были описаны у последних видов, хотя они и являются произведенные, как продемонстрировано методом фенотипического обнаружения, могут существовать значительные различия в их последовательностях, что позволяет предположить, что эти токсины имеют различную структуру и, следовательно, разные функции у видов CoNS.
Насколько нам известно, это первое исследование по обнаружению гена hla с использованием специфических праймеров для S. epidermidis и S. haemolyticus . Ген, использованный для конструирования праймера штамма S. epidermidis {«type»: «entrez-nucleotide», «attrs»: {«text»: «W23144», «term_id»: «1299977»}} W23144 был обозначается в GenBank как «α-гемолизин» до июня 2013 года. В тот день авторы изменили обозначение этого гена на « yidD » и классифицировали его как мембранный белок.Согласно предыдущим исследованиям, некоторые члены семейства yidD были аннотированы как гемолизины, что явилось результатом неопубликованного наблюдения, опубликованного в GenBank {«type»: «entrez-nucleotide», «attrs»: {«text»: «L36462″, » term_id «:» 2537795 «}} L36462, что ген hlyA , который является гомологом yidD из Aeromonas hydrophila , обладает активностью α-гемолизина [15,16]. Некоторые базы данных показывают, что yidD является ортологом белков с гемолитической функцией SE1462 из S.epidermidis ATCC 12228 и SERP1356 из S. epidermidis RP62A (http://www.xbase.ac.uk/genome/buchnera-aphidicola-str-sg-schizaphis-graminum/NC_004061/BUsg015;yidD/super/orthologues) .
Ген, кодирующий α-токсин / yidD , был обнаружен в 92,9% изолятов S. epidermidis
и ген hla в 91,7% изолятов S. haemolyticus , в то время как hlb был обнаружен с такой же частотой (92,9%) у S. epidermidis .С другой стороны, другое исследование [13] обнаружило hlb только в 20% из изолятов S. epidermidis и отсутствие hlb во всех штаммах. β-токсин описан в 75% случаев CoNS, а α-гемолиз — в 57% [35]. Натаро и др. [36] наблюдали 61% положительности для β-токсина в CoNS, в то время как в настоящем исследовании продукция β-гемолизина наблюдалась у 81% изолятов S. haemolyticus . Moraveji et al. [37] наблюдали вдвое большую частоту генов и продукции гемолизина в человеческих линиях по сравнению со штаммами животных.Важность hlb и β-токсина обусловлена способностью этого белка способствовать ускользанию бактерий от иммунной системы хозяина и его участием в поглощении питательных веществ [33], обеспечивая выживание патогена.Дивергенция гена hld настолько велика среди видов, что она не может быть амплифицирована в некоторых CoNS [12]. Это разнообразие демонстрируется тем фактом, что частичная идентичность гена этого токсина между S. aureus и S. epidermidis составляет всего 83% [12].То же самое может относиться к S. haemolyticus и может объяснять отсутствие амплификации этого гена праймерами S. epidermidis в настоящем исследовании. δ-гемолизин кодируется регуляторной РНКIII в S. aureus , связанной с системой agr [38], системой, описанной у нескольких видов стафилококков, включая S. epidermidis и S. haemolyticus [39,40] . В настоящем исследовании ген hld был обнаружен у 95,3% из S.epidermidis , а δ-гемолизин продуцировался 40,5% изолятов S. haemolyticus . Согласно Gemmel [41], δ-гемолизин чаще экспрессируется CoNS, изолированным от клинически значимых инфекций, по сравнению с неявными инфекциями человека.
Несмотря на высокую частоту гена hla , наблюдаемую в настоящем исследовании у S. epidermidis и S. haemolyticus , фенотипическая продукция токсина, кодируемого hla , кажется более частой у последних видов, с наибольшим гл, -положительный с.haemolyticus (85%), экспрессирующие α-токсин. Напротив, несмотря на высокую частоту hla / yidD и hlb в S. epidermidis , менее одной трети (30%) изолятов, несущих эти гены, также экспрессировали их. Отсутствие гена и присутствие токсина, наблюдаемые в пяти изолятах S. haemolyticus
и в одном изоляте S. epidermidis , могут быть связаны с мутациями в последовательностях этих генов, такими как последовательности вставки, которые мешают амплификации. гена методом ПЦР.Одним из ограничений настоящего исследования является тот факт, что распространенность токсигенных генов не эквивалентна распространенности экспрессии этих генов. Однако в этом исследовании экспрессия была продемонстрирована гемолизом на кровяном агаре. Необходимы дальнейшие исследования с использованием других методов для оценки экспрессии этих генов, таких как вестерн-блоттинг. Кроме того, секвенирование генома некоторых из этих положительных штаммов будет важным для идентификации этих генов в геномах S.epidermidis и S. haemolyticus .
4. Материалы и методы
4.1. Изоляты
Штаммы были выделены из посевов крови пациентов, поступивших в университетскую больницу Медицинской школы Ботукату (Hospital das Clínicas, Faculdade de Medicina de Botucatu (HC-FMB)), Государственный университет Паулиста (Universidade Estadual Paulista (UNESP)) , Botucatu Campus, между 2000 и 2011 годами. В исследование был включен только один изолят на пациента. Штаммы были выделены, как описано Koneman et al. [42].
4.2. Идентификация видов
Род Staphylococcus был идентифицирован, как описано Koneman et al. [42]. Staphylococcus epidermidis и S. haemolyticus были идентифицированы упрощенным методом, предложенным Cunha et al. [43]. Идентификация видов была генетически подтверждена с помощью ПЦР-амплификации области внутреннего транскрибируемого спейсера (ITS) 16S-23S, как описано Couto et al. [44] после экстракции ДНК с помощью набора Illustra (GE Healthcare, Little Chalfont, Buckinghamshire, UK).Следующие международные эталонные штаммы использовали в качестве контролей: S. epidermidis (ATCC 12228), S. epidermidis (ATCC 35983) и S. haemolyticus (ATCC 29970).
4.3. Обнаружение генов энтеротоксинов
ПЦР для обнаружения генов энтеротоксинов выполняли с использованием праймеров и параметров, описанных Johnson et al. [45] и Cunha et al. [4]. Международные эталонные штаммы были включены во все реакции как положительные ( S.aureus Американская коллекция типовых культур — ATCC 13565 ( sea ), ATCC 14458 ( seb ), ATCC 19095 ( sec ), ATCC 23235 ( sed ), ATCC 27664 ( см. ), ATCC 51811 ( seh ), S. aureus Food Research Institute — FRI 361 ( seg и sei )) и отрицательные ( S. xylosus ATCC 29971) контроли. Последовательности праймеров показаны в.
Таблица 3
Последовательность праймеров и размер ампликона.
| Название | Продукт | Последовательность | Ссылка | Размер ампликона (bp) |
|---|---|---|---|---|
| море-1 | Энтеротоксин A | TTGGAAACGGTTAAAACGAA | [29] | 120 |
| море-2 | GAACCTTCCCATCAAAAACA | |||
| СБ-1 | Энтеротоксин B | TCGCATCAAACTGACAAACG | [29] | 478 |
| СБ-2 | GCAGGTACTCTATAAGTGCC | |||
| сек-1 | Энтеротоксин C | GACATAAAAGCTAGGAATTT | [29] | 257 |
| сек-2 | AAATCGGATTAACATTATCC | |||
| сед-1 | Энтеротоксин D | CTAGTTTGGTAATATCTCCT | [29] | 317 |
| сед-2 | TAATGCTATATCTTATAGGG | |||
| см-1 | Энтеротоксин E | CAAAGAAATGCTTTAAGCAATCTTAGGCCAC | [29] | 170 |
| см-2 | CTTACCGCCAAAGCTG | |||
| сег-1 | Энтеротоксин G | AATTATGTGAATGCTCAACCCGATC | [36] | 642 |
| сег-2 | AAACTTATATGGAACAAAAGGTACTAGTTC | |||
| sei-1 | Энтеротоксин H | CAATCACATCATATGCGAAAGCAG | [36] | 376 |
| seh-2 | CATCTACCCAAACATTAGCACC | |||
| sei-1 | Энтеротоксин I | CTCAAGGTGATATTGGTGTAGG | [36] | 576 |
| sei-2 | AAAAAACTTACAGGCAGTCCATCTC | |||
| гл / yidD_epid-1 | α-гемолизин / жидД | TTTCKCCACTTACACCMCC | Это исследование | 160 |
| гл / yidD_epid-2 | GGAACAGGATCAAAGCCACCT | |||
| hlb_epid-1 | β-гемолизин | TGGTGGCGTTGGTATTGTGA | Это исследование | 541 |
| hlb_epid-2 | ACCCCAAGATTTCACGGACC | |||
| hla_haem-1 | α-гемолизин | TGGGCCATAAACTTCAATCGC | Это исследование | 72 |
| гла-гем-2 | ACGCCACCTACATGCAGATTT | |||
| hld-epid-1 | δ-гемолизин | ATGGCAGCAGATATCATTTC | [30] | 444 |
| hld-epid-2 | CGTGAGCTTGGGAGAGAC |
4.4. Обнаружение генов гемолизина
Ген δ-гемолизина, hld , был обнаружен с использованием праймеров и параметров, описанных Marconi et al. [46].
Ген hla / yidD был обнаружен в изолятах S. epidermidis с использованием праймеров, разработанных с помощью NCBI-PrimerBlast, 2008, и последовательностей штамма S. epidermidis {«type»: «entrez-нуклеотид», «attrs»: {«text»: «W23144», «term_id»: «1299977»}} W23144 (GenBank: {«type»: «entrez-нуклеотид», «attrs»: {«text»: «ACJC01000124.1 «,» term_id «:» 224999876 «}} ACJC01000124.1) (hla / yidD_epid). Ген hla был обнаружен в изолятах S. haemolyticus с использованием праймеров, созданных с помощью PrimerBlast и последовательности штамма JCSC1435 (NCBI : {«type»: «entrez-нуклеотид», «attrs»: {«text»: «NC_007168.1», «term_id»: «70725001»}} NC_007168.1) (hla_haem). Праймеры для hlb ген в S. epidermidis были сконструированы с использованием PrimerBlast и последовательности S. epidermidis RP62A (NCBI: {«type»: «entrez-нуклеотид», «attrs»: {«text»: «NC_002976.3 «,» term_id «:» 57865352 «}} NC_002976.3) (hlb_epid). Праймеры для гена hlb в S. haemolyticus не могли быть сконструированы, поскольку этот ген не был описан у этого вида в База данных NCBI-GenBank. Реакционная смесь содержала 2,0 ед. Полимеразы Taq, 1 × буфер для ПЦР, содержащий 0,75 мМ MgCl 2 , 100 мкМ трифосфат дезоксирибонуклеотидов, 1 М каждого праймера и 150 нг нуклеиновой кислоты. Условия ПЦР были следующими: для гл , один шаг при 94 ° C в течение 4 минут; 35 циклов при 94 ° C в течение 1 минуты, 60 ° C в течение 1 минуты, 72 ° C в течение 1 минуты и 72 ° C в течение 5 минут; для hlb , один шаг при 94 ° C в течение 4 минут, 35 циклов при 94 ° C в течение 1 минуты, 60 ° C в течение 1 минуты, 72 ° C в течение 1.5 мин и 72 ° C в течение 6 мин. Эталонные штаммы были включены во все реакции: гл / йидD _epid: S. epidermidis ATCC 12228; hla _haem: S. haemolyticus ATCC 29970; hlb _epid: S. epidermidis ATCC 12228. Последовательности праймеров показаны на фиг.
4.5. Фенотипическая продукция β- и δ-цитотоксинов
Продукция α-токсина определялась на чашках с кровяным агаром, содержащим 5% кроличьей крови, инкубированных при 37 ° C в течение 24 часов.О положительном результате свидетельствовало образование зон гемолиза вокруг изолированных колоний.
Продукция β- и δ-токсинов в изолятах S. haemolyticus была обнаружена, как описано Hébert и Hancock [47]. β-гемолиз наблюдали по наличию зоны неполного гемолиза на чашке с агаром с бараньей кровью, инкубированной при 37 ° C в течение 24 ч, а затем в течение ночи при 4 ° C [48]. Присутствие δ-токсина подтверждалось синергизмом с β-гемолизином S. aureus ATCC 25923.Для этого изолят наносили штрихами перпендикулярно штамму S. aureus на чашку с агаром с овечьей кровью. Планшет инкубировали при 37 ° C в течение 24 ч, и образование δ-токсина наблюдали по образованию зоны гемолиза в форме стрелки [47].
4.6. Статистический анализ
Тест хи-квадрат использовался для проверки связи между переменными, принимая уровень значимости <0,05.
5. Выводы
Клинические изоляты S.epidermidis и S. haemolyticus проявляют высокий токсигенный потенциал, особенно продуцируя энтеротоксины G и I. Использование новых видоспецифичных праймеров для hla / yidD и hlb для S. epidermidis и для hla из S. haemolyticus выявили высокую частоту этих генов в нозокомиальных изолятах этих видов. Полученные данные демонстрируют важную роль этих генов цитотоксина в становлении этих видов и, возможно, в развитии инфекций, вызванных CoNS.
Благодарности
Эта работа была поддержана государственным финансовым агентством Сан-Паулу Research Foundation (FAPESP — Fundação de Amparo à Pesquisa do Estado de São Paulo; Grant 2011 / 15396-1) и Национальным советом по технологическому и научному развитию (CNPq— Conselho Nacional de Desenvolvimento Científico e Tecnológico; Grant 304729 / 2014-0).
Вклад авторов
Л.П .: задумал исследование, участвовал в его разработке, проводил эксперименты, анализировал данные и составлял рукопись.C.I.B .: участвовал в разработке концепции исследования и в лабораторных экспериментах. А.О .: участвовал в лабораторных экспериментах. P.Y.F.M .: участвовал в разработке праймеров. V.C.P .: участвовал в молекулярных экспериментах. M.L.R.S.C .: задумал исследование, участвовал в его разработке и координации, а также отредактировал рукопись. Все авторы прочитали и одобрили окончательную рукопись.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1.Вуонг К., Отто М. Эпидермальные инфекции, вызванные стафилококком. Микробы заражают. 2002; 4: 481–489. DOI: 10.1016 / S1286-4579 (02) 01563-0. [PubMed] [CrossRef] [Google Scholar] 2. Ирлингер Ф. Оценка безопасности молочных микроорганизмов: Коагулазонегативные стафилококки. Int. J. Food Microbiol. 2008. 126: 302–310. DOI: 10.1016 / j.ijfoodmicro.2007.08.016. [PubMed] [CrossRef] [Google Scholar] 3. Подковик М., Быстронь Я., Баня Дж. Генотипы, устойчивость к антибиотикам и факторы вирулентности стафилококков из готовой к употреблению пищи.Пищевой патогенный микроорганизм. Дис. 2012; 9: 91–93. DOI: 10.1089 / fpd.2011.0962. [PubMed] [CrossRef] [Google Scholar] 4. Cunha M.L.R.S., Calsolari R.A.O., Araújo-Júnior J.P. Выявление генов токсина 1 энтеротоксина и синдрома токсического шока в Staphylococcus с акцентом на коагулазонегативные стафилококки. Microbiol. Иммунол. 2007; 51: 381–390. DOI: 10.1111 / j.1348-0421.2007.tb03925.x. [PubMed] [CrossRef] [Google Scholar] 5. Барретти П., Монтелли А.К., Баталья Дж. Э., Карамори Дж. К., Кунья М.Л.Р.С. Роль факторов вирулентности в исходе стафилококкового перитонита у пациентов с ХПНП.BMC Infect. Дис. 2009; 9: 212. DOI: 10.1186 / 1471-2334-9-212. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Тейлор А.Л., Ллевелин М.Дж. Суперантиген-индуцированная пролиферация CD4 + CD25- Т-клеток человека сопровождается переключением на функциональный регуляторный фенотип. J. Immunol. 2010; 185: 6591–6598. DOI: 10.4049 / jimmunol.1002416. [PubMed] [CrossRef] [Google Scholar] 7. Frase J.D., Proft T. Бактериальный суперантиген и суперантиген-подобные белки. Иммунол. Ред. 2008; 225: 226–243. DOI: 10.1111 / j.1600-065X.2008.00681.x. [PubMed] [CrossRef] [Google Scholar] 9. Коэльо С.М.О., Рейносо Э., Перейра И.А., Соарес Л.С., Демо М., Богни К., Соуза М.М.С. Факторы вирулентности и устойчивость к противомикробным препаратам Staphylococcus aureus , выделенного от мастита крупного рогатого скота в Рио-де-Жанейро. Pesq. Вет. Бюстгальтеры. 2009. 29: 369–374. DOI: 10.1590 / S0100-736X20000002. [CrossRef] [Google Scholar] 10. Пенг Х.Л., Новик Р.П., Крейсвирт Б., Корнблюм Дж., Шливерт П. Клонирование, характеристика и секвенирование дополнительного регулятора гена ( agr ) в Staphylococcus aureus .J. Bacteriol. 1988; 170: 4365–4372. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. МакКевитт А.И., Бьорнсон Г.Л., Маурахер К.А., Шайфеле Д.В. Аминокислотная последовательность дельтоподобного токсина из Staphylococcus epidermidis . Заразить. Иммун. 1990; 58: 1473–1475. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Эвен С., Лерой С., Шарлье К., Закур Н.Б., Чакорнак Дж. П., Леберт И., Жамет Э., Десмонтс М. Х., Котон Э., Почет С. и др. Низкий уровень опасности для безопасности при коагулазонегативных стафилококках, выделенных из ферментированных пищевых продуктов.Int. J. Food Microbiol. 2010; 139: 87–95. DOI: 10.1016 / j.ijfoodmicro.2010.02.019. [PubMed] [CrossRef] [Google Scholar] 13. Оки М.С., Йолоба М.Л., Окелло М., Наджука Ф.С., Катабази Ф.А., Бванга Ф., Нантеза А., Катите Д.П. Распространенность детерминант вирулентности у Staphylococcus epidermidis от пациентов интенсивной терапии в Кампале, Уганда. J. Infect. Dev. Ctries. 2012; 6: 242–250. [PubMed] [Google Scholar] 14. Schleifer K.H., Kloos W.E. Выделение и характеристика стафилококков из кожи человека. Int.J. Syst. Бактериол. 1975; 25: 50–61. DOI: 10.1099 / 00207713-25-1-50. [CrossRef] [Google Scholar] 15. Радд К.Е., Хамфери-Смит И., Васингер В.С., Байроч А. Низкомолекулярные белки: проблема для постгеномных исследований. Электрофорез. 1998. 19: 536–544. DOI: 10.1002 / elps.11501Молекулярное обнаружение генов цитотоксинов и энтеротоксинов
токсинов (Базель). 2015 сен; 7 (9): 3688–3699.
Юкако Фудзинага, научный редактор
† Умер 8 сентября 2013 г.
* Автор, которому следует направлять корреспонденцию; Электронная почта: rb.psenu.bbi@rlmahnuc; Тел .: + 55-14-3880-0428.Поступило 6 мая 2015 г .; Принято к печати 6 июля 2015 г.
Авторские права © 2015 г. Авторы; лицензиат MDPI, Базель, Швейцария.Эта статья цитировалась в других статьях в PMC.Abstract
Хотя условно-патогенные микроорганизмы, коагулазонегативные стафилококки (CoNS), включая Staphylococcus epidermidis и Staphylococcus haemolyticus , долгое время считались авирулентными организмами. Роль токсинов в развитии инфекций, вызванных CoNS, до сих пор остается спорной. Целью данного исследования было охарактеризовать наличие генов энтеротоксинов и цитотоксинов у S.epidermidis и S. haemolyticus , полученные из посевов крови. Гены цитотоксинов были обнаружены с помощью ПЦР с использованием новых видоспецифичных праймеров. Среди 85 изолятов S. epidermidis и 84 S. haemolyticus 95,3% и 79,8%, соответственно, несли по крайней мере один ген энтеротоксина. Наиболее частыми генами энтеротоксинов были seg (53,3%), seg (64,5%) и sei (67,5%). Ген seg был положительно связан с S.epidermidis ( p = 0,02), и этот вид был более токсигенным, чем S. haemolyticus . Ген hla / yidD был обнаружен в 92,9% изолятов S. epidermidis и ген hla в 91,7% изолятов S. haemolyticus ; hlb был обнаружен в 92,9% изолятов S. epidermidis и hld в 95,3%. Нозокомиальные изоляты Staphylococcus epidermidis и S. haemolyticus проявляли высокий токсигенный потенциал, в основном содержащие неклассические гены энтеротоксинов seg и sei .Ранее не сообщаемое обнаружение hla / yidD и hlb в S. epidermidis и S. haemolyticus с использованием видоспецифичных праймеров показало, что эти гены гемолизина различаются между видами CoNS и что они очень часто встречаются в изолятах культур крови. .
Ключевые слова: Staphylococcus epidermidis , Staphylococcus haemolyticus , энтеротоксины, цитотоксины
1. Справочная информация
Коагулазонегативные стафилококки (CoNcusS), включая клинически значимые виды haemolylocus и Staphylocochylocos 18 хорошо зарекомендовали себя как важные внутрибольничные возбудители инвазивных инфекций, связанных с медицинскими изделиями [1].Энтеротоксины являются хорошо изученными факторами вирулентности в Staphylococcus aureus , а их гены и синтез описаны в CoNS [2,3], включая CoNS, вызывающие инфекции [4,5]. Энтеротоксины — это суперантигены, которые стимулируют иммунную систему вызывать усиленный ответ, вызывая высвобождение цитокинов, клональную экспансию и клональную делецию части этих лимфоцитов посредством апоптоза [6]. Высвобождение провоспалительных цитокинов отвечает за быстрое начало высокой температуры, утечку капилляров и полиорганную дисфункцию.Внезапность и величина выброса цитокинов определяют тяжесть и исход болезни пациента [7].
Цитотоксины или гемолизины являются важными молекулами, участвующими в патогенезе S. aureus , но их роль в инфекциях CoNS все еще неизвестна. α-гемолизин оказывает гемолитическое, дермонекротическое и нейротоксическое действие [8], тогда как β-токсин обладает фосфорилазной активностью и высоким сродством к клеточной мембране различных типов клеток, вызывая нестабильность мембран [9]. δ-гемолизин вызывает лизис множества клеток млекопитающих, включая эритроциты и внутриклеточные структуры, такие как органеллы с оболочкой [8].Ген δ-токсина, hld , расположен в локусе RNAIII, транскрипте оперона P3, который действует как эффектор системы восприятия кворума agr [10]. Однако его конкретная роль в развитии стафилококковых инфекций четко не установлена. В S. aureus δ-гемолизин представляет собой полипептид, образованный 26 аминокислотами, тогда как в S. epidermidis он состоит из 25 аминокислот с высокой гомологией с δ-токсином S. aureus [11] .
Несколько сообщений описывают присутствие генов, кодирующих цитотоксин, и их экспрессию в CoNS [12]. Хотя есть сообщения о наличии генов hla и hld , кодирующих α- и δ-гемолизин, соответственно, у S. epidermidis [13], исследования с участием других видов CoNS, которые проявляют слабую или умеренную гемолитическую активность в Эритроциты человека и крупного рогатого скота, а также кровь овцы или кролика, особенно S. haemolyticus , немногочисленны [14]. Насколько нам известно, не существует метода, который мог бы эффективно обнаружить генетические детерминанты α- и β-токсинов в S.epidermidis и S. haemolyticus .
Ген α-гемолизина был описан только в одном штамме S. epidermidis ( S. epidermidis {«type»: «entrez-нуклеотид», «attrs»: {«text»: «W23144″, » term_id «:» 1299977 «}} W23144 (GenBank: {» type «:» entrez-нуклеотид «,» attrs «: {» text «:» ACJC01000124.1 «,» term_id «:» 224999876 «}} ACJC01000124.1 ) и затем обозначен как « yidD » Этот ген кодирует белок с 82 аминокислотами, мембранный белок, обладающий активностью α-гемолизина [15,16].Шестьдесят восемь из этих аминокислот идентичны гемолитическому домену белка, обнаруженного в штамме S. epidermidis (NCBI: {«type»: «entrez-protein», «attrs»: {«text»: «AIR83523) .1 «,» term_id «:» 6
236 «}} AIR83523.1), называемый« предполагаемый коэффициент эффективности вставки мембранного белка »[17].
Таким образом, целью настоящего исследования было охарактеризовать присутствие генов энтеротоксинов и генов, кодирующих цитотоксин hla , hlb и hld с использованием видоспецифичных праймеров в S.epidermidis и S. haemolyticus изолятов культуры крови.
2. Результаты
2.1. Обнаружение генов энтеротоксинов
Всего было изучено 169 изолятов, в том числе 85 S. epidermidis и 84 S. haemolyticus .
иллюстрирует обнаружение генов энтеротоксина в изолятах S. haemolyticus и S. epidermidis . Доля положительных изолятов была выше у последних видов, за исключением seb и seh (34% и 15% соответственно), которые чаще встречались у S.Геммолитик . Гены sed, и see. встречались редко (2% и 3% соответственно), тогда как гены sei , seg и sea были наиболее частыми генами у обоих видов. Обнаружение гена seg было достоверно связано с S. epidermidis ( p = 0,02).
Обнаружение генов энтеротоксинов sea — sei в изолятах S. epidermidis и S. haemolyticus . * Значительно положительная ассоциация с S. epidermidis .
Гены sea и seb были одновременно обнаружены в 20% ( n = 34) изолятов, включая 17,6% изолятов S. epidermidis и 21,4% из S. haemolyticus , а seg. и sei одновременно присутствовали у 52,7% ( n = 89) (61,2% из S. epidermidis и 44% из S. haemolyticus ).Среди изученных штаммов 87,6% ( n = 148) несли по крайней мере один ген энтеротоксина, в том числе 95,3% ( n = 81) изолятов S. epidermidis и 79,8% ( n = 67) С. haemolyticus .
2.2. Молекулярное и фенотипическое определение цитотоксинов
Гены гемолизина hla / yidD , hlb и hld были обнаружены в S. epidermidis с использованием видоспецифичных праймеров.Праймеры hlb и hld из S. epidermidis не смогли идентифицировать гены β- и δ-токсинов в S. haemolyticus . Новые праймеры были разработаны для идентификации гена hla в S. haemolyticus . Однако праймеры для генов S. haemolyticus hlb и hld не могут быть сконструированы, поскольку эти гены еще не описаны для этого вида.
Скорость обнаружения гла / годD была аналогичной в S.epidermidis и S. haemolyticus (92,9% и 91,7% соответственно). В S. epidermidis hlb были обнаружены в 92,9% изолятов и hld — в 95,3%. Гены hla и hlb одновременно присутствовали в 89,4% изолятов S. epidermidis . β-токсин был обнаружен в 81% изолятов S. haemolyticus , а δ-токсин — в 40,5%. Тридцать процентов изолятов S. haemolyticus продуцировали как β-, так и δ-токсин ().
Таблица 1
Обнаружение генов α-, β- и δ-цитотоксинов и их продукция.
| Организмы ( n ) | гл * | глб | hld | α-токсин | β-токсин | δ-токсин | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | n | % | |||||||||||||||||||||||||
| S.Epidermidis (85) | 79 | 92,9 | 79 | 92,9 | 81 | 95,3 | 24 | 28,2 | 25 | 29,4 | — | — | (84)77 | 91,7 | — | — | — | — | 70 | 83,3 | 68 | 81 | 34 | 40,5 | 92.3 | 79 | 92,9 | 81 | 95,3 | 94 | 55,6 | 93 | 55 | 34 | 40,5 | |
Таблица 2
Сравнение частоты генов hla и hlb и фенотипической продукции α- и β-токсинов.
| Staphylococcus haemolyticus | Staphylococcus epidermidis | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Гены | Гены | Гены | ||||||||
| Гены | ||||||||||
| 9017 9017 hla + * | hla — * | Всего | Токсин | hlb + | hlb — | Всего | ||||
| n (%) | )n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | |||
| α-Toxin + | 65 (78) | 5 (6) | 70 (84) | 24 (28) | 0 | 24 (28) 9 0356 | β-токсин + | 24 (28) | 1 (1) | 25 (29) |
| α-токсин — | 12 (14) | 2 (2) | 14 (16) | 55 (65) | 6 (7) | 61 (72) | β-токсин — | 55 (65) | 5 (6) | 60 (71) |
| Всего | 77 (92) | 7 (8) | 84 (100) | 79 (93) | 6 (7) | 85 (100) | Всего | 79 (93) | 6 ( 7) | 85 (100) |
Профиль токсинового гена и фенотипическая продукция токсина для каждого изолята показаны в дополнительной таблице S1.
3. Обсуждение
Staphylococcus epidermidis и S. haemolyticus — основные виды CoNS, колонизирующие нос человека [18], наиболее распространенные виды, выделенные из посевов крови [19] и часто связанные с катетер-ассоциированным кровотоком. инфекции [20]. Помимо того, что они являются основной причиной пищевых отравлений, стафилококковые энтеротоксины играют важную роль в патологических процессах, таких как сепсис, остеомиелит и респираторный дистресс-синдром [21].Однако энтеротоксигенный потенциал CoNS неоднозначен.
Настоящее исследование показало высокую частоту генов энтеротоксинов в изолятах культур крови: 95,3% изолятов S. epidermidis и 79,8% изолятов S. haemolyticus несут хотя бы один ген токсина. Наиболее частыми обнаруженными генами классического энтеротоксина были sea , seb и sec , а среди всех генов энтеротоксинов наиболее распространенными были seg и sei .Другое исследование [22] также показало более высокий процент sea , seb и sec в CoNS, выделенных из коровьего молока. Кроме того, сообщалось о продукции энтеротоксина А изолятами человеческого CoNS [23]. Описана продукция классических энтеротоксинов SEA, SEB и SEC клиническими изолятами S. epidermidis и SEC S. haemolyticus [5,24], при этом высокий процент изолятов, продуцирующих комбинацию двух или больше токсинов [25].Как и в настоящем исследовании, также сообщалось о наличии генов SEE, SEG, SEH и SEI и продукции этих энтеротоксинов [26], но исследования, показывающие отсутствие или низкую частоту этих генов в CoNS, преобладают в литературе. . Эти различия между исследованиями могут быть связаны с систематической ошибкой в используемом методе и в изученных изолятах, включая количество, природу и географическое происхождение штаммов. Нозокомиальные изоляты могут быть лучше оснащены факторами вирулентности, полученными путем облегченного переноса посредством селективного давления.
В настоящем исследовании 20% штаммов были положительными как для sea , так и для seb . Частое присутствие этих двух генов у одной и той же бактерии объясняется тем, что они занимают один и тот же хромосомный локус [27]. Кроме того, 61,2% из S. epidermidis и 44% из S. haemolyticus оказались положительными как для seg , так и для sei . Несколько исследований [28,29] показали систематическую ассоциацию между seg и sei и высокую частоту этих генов у S.aureus , что также может встречаться при CoNS. Ожидается одновременное присутствие генов seg и sei , поскольку эти два гена обнаружены в кластере egc , который также содержит гены, кодирующие другие стафилококковые энтеротоксины [30].
Staphylococcus epidermidis был указан как CoNS с наивысшим токсигенным потенциалом в некоторых исследованиях [25]. Фактически, этот вид показал более высокий уровень генов энтеротоксина по сравнению с S.haemolyticus (95,3% против ,79,8% соответственно). Остров патогенности, экспрессирующий несколько генов энтеротоксинов, был недавно описан в клиническом изоляте S. epidermidis [31].
Данных о наличии гемолизинов и генов гемолизина в CoNS пока немного. Хотя 81% изолятов S. haemolyticus проявляют β-гемолитическую активность и 40% продуцируют δ-токсин, секвенирование генома не позволило идентифицировать гены, ответственные за гемолиз у этих видов; продемонстрирован только ген α-гемолизина.Праймеры гемолизина, разработанные для S. aureus [32] и S. epidermidis , а также праймеры hld , разработанные из последовательности hld S. simulans (номер доступа GenBank {«type»: «entrez- нуклеотид «,» attrs «: {» text «:» AJ223775.1 «,» term_id «:» 3687333 «}} AJ223775.1; вперед: AAGGGGCAATACACATGRC; обратный: CCGAACGCTTCATTTCCGAT), не удалось обнаружить эти гены в S. haemolyticus . Huseby et al. [33] продемонстрировал видоспецифические различия в β-токсине S . schleiferi и S. epidermidis , белки которых показали 72% и 52% гомологию с β-токсином S. aureus соответственно. Эти различия между β-гемолизинами разных видов CoNS могут быть результатом бактериальной адаптации к широкому кругу потенциальных хозяев [34]. Поскольку праймеры hlb и hld для S. epidermidis не могли идентифицировать эти гены в S. haemolyticus , а гены hlb и hld еще не были описаны у последних видов, хотя они и являются произведенные, как продемонстрировано методом фенотипического обнаружения, могут существовать значительные различия в их последовательностях, что позволяет предположить, что эти токсины имеют различную структуру и, следовательно, разные функции у видов CoNS.
Насколько нам известно, это первое исследование по обнаружению гена hla с использованием специфических праймеров для S. epidermidis и S. haemolyticus . Ген, использованный для конструирования праймера штамма S. epidermidis {«type»: «entrez-nucleotide», «attrs»: {«text»: «W23144», «term_id»: «1299977»}} W23144 был обозначается в GenBank как «α-гемолизин» до июня 2013 года. В тот день авторы изменили обозначение этого гена на « yidD » и классифицировали его как мембранный белок.Согласно предыдущим исследованиям, некоторые члены семейства yidD были аннотированы как гемолизины, что явилось результатом неопубликованного наблюдения, опубликованного в GenBank {«type»: «entrez-nucleotide», «attrs»: {«text»: «L36462″, » term_id «:» 2537795 «}} L36462, что ген hlyA , который является гомологом yidD из Aeromonas hydrophila , обладает активностью α-гемолизина [15,16]. Некоторые базы данных показывают, что yidD является ортологом белков с гемолитической функцией SE1462 из S.epidermidis ATCC 12228 и SERP1356 из S. epidermidis RP62A (http://www.xbase.ac.uk/genome/buchnera-aphidicola-str-sg-schizaphis-graminum/NC_004061/BUsg015;yidD/super/orthologues) .
Ген, кодирующий α-токсин / yidD , был обнаружен в 92,9% изолятов S. epidermidis
и ген hla в 91,7% изолятов S. haemolyticus , в то время как hlb был обнаружен с такой же частотой (92,9%) у S. epidermidis .С другой стороны, другое исследование [13] обнаружило hlb только в 20% из изолятов S. epidermidis и отсутствие hlb во всех штаммах. β-токсин описан в 75% случаев CoNS, а α-гемолиз — в 57% [35]. Натаро и др. [36] наблюдали 61% положительности для β-токсина в CoNS, в то время как в настоящем исследовании продукция β-гемолизина наблюдалась у 81% изолятов S. haemolyticus . Moraveji et al. [37] наблюдали вдвое большую частоту генов и продукции гемолизина в человеческих линиях по сравнению со штаммами животных.Важность hlb и β-токсина обусловлена способностью этого белка способствовать ускользанию бактерий от иммунной системы хозяина и его участием в поглощении питательных веществ [33], обеспечивая выживание патогена.Дивергенция гена hld настолько велика среди видов, что она не может быть амплифицирована в некоторых CoNS [12]. Это разнообразие демонстрируется тем фактом, что частичная идентичность гена этого токсина между S. aureus и S. epidermidis составляет всего 83% [12].То же самое может относиться к S. haemolyticus и может объяснять отсутствие амплификации этого гена праймерами S. epidermidis в настоящем исследовании. δ-гемолизин кодируется регуляторной РНКIII в S. aureus , связанной с системой agr [38], системой, описанной у нескольких видов стафилококков, включая S. epidermidis и S. haemolyticus [39,40] . В настоящем исследовании ген hld был обнаружен у 95,3% из S.epidermidis , а δ-гемолизин продуцировался 40,5% изолятов S. haemolyticus . Согласно Gemmel [41], δ-гемолизин чаще экспрессируется CoNS, изолированным от клинически значимых инфекций, по сравнению с неявными инфекциями человека.
Несмотря на высокую частоту гена hla , наблюдаемую в настоящем исследовании у S. epidermidis и S. haemolyticus , фенотипическая продукция токсина, кодируемого hla , кажется более частой у последних видов, с наибольшим гл, -положительный с.haemolyticus (85%), экспрессирующие α-токсин. Напротив, несмотря на высокую частоту hla / yidD и hlb в S. epidermidis , менее одной трети (30%) изолятов, несущих эти гены, также экспрессировали их. Отсутствие гена и присутствие токсина, наблюдаемые в пяти изолятах S. haemolyticus
и в одном изоляте S. epidermidis , могут быть связаны с мутациями в последовательностях этих генов, такими как последовательности вставки, которые мешают амплификации. гена методом ПЦР.Одним из ограничений настоящего исследования является тот факт, что распространенность токсигенных генов не эквивалентна распространенности экспрессии этих генов. Однако в этом исследовании экспрессия была продемонстрирована гемолизом на кровяном агаре. Необходимы дальнейшие исследования с использованием других методов для оценки экспрессии этих генов, таких как вестерн-блоттинг. Кроме того, секвенирование генома некоторых из этих положительных штаммов будет важным для идентификации этих генов в геномах S.epidermidis и S. haemolyticus .
4. Материалы и методы
4.1. Изоляты
Штаммы были выделены из посевов крови пациентов, поступивших в университетскую больницу Медицинской школы Ботукату (Hospital das Clínicas, Faculdade de Medicina de Botucatu (HC-FMB)), Государственный университет Паулиста (Universidade Estadual Paulista (UNESP)) , Botucatu Campus, между 2000 и 2011 годами. В исследование был включен только один изолят на пациента. Штаммы были выделены, как описано Koneman et al. [42].
4.2. Идентификация видов
Род Staphylococcus был идентифицирован, как описано Koneman et al. [42]. Staphylococcus epidermidis и S. haemolyticus были идентифицированы упрощенным методом, предложенным Cunha et al. [43]. Идентификация видов была генетически подтверждена с помощью ПЦР-амплификации области внутреннего транскрибируемого спейсера (ITS) 16S-23S, как описано Couto et al. [44] после экстракции ДНК с помощью набора Illustra (GE Healthcare, Little Chalfont, Buckinghamshire, UK).Следующие международные эталонные штаммы использовали в качестве контролей: S. epidermidis (ATCC 12228), S. epidermidis (ATCC 35983) и S. haemolyticus (ATCC 29970).
4.3. Обнаружение генов энтеротоксинов
ПЦР для обнаружения генов энтеротоксинов выполняли с использованием праймеров и параметров, описанных Johnson et al. [45] и Cunha et al. [4]. Международные эталонные штаммы были включены во все реакции как положительные ( S.aureus Американская коллекция типовых культур — ATCC 13565 ( sea ), ATCC 14458 ( seb ), ATCC 19095 ( sec ), ATCC 23235 ( sed ), ATCC 27664 ( см. ), ATCC 51811 ( seh ), S. aureus Food Research Institute — FRI 361 ( seg и sei )) и отрицательные ( S. xylosus ATCC 29971) контроли. Последовательности праймеров показаны в.
Таблица 3
Последовательность праймеров и размер ампликона.
| Название | Продукт | Последовательность | Ссылка | Размер ампликона (bp) |
|---|---|---|---|---|
| море-1 | Энтеротоксин A | TTGGAAACGGTTAAAACGAA | [29] | 120 |
| море-2 | GAACCTTCCCATCAAAAACA | |||
| СБ-1 | Энтеротоксин B | TCGCATCAAACTGACAAACG | [29] | 478 |
| СБ-2 | GCAGGTACTCTATAAGTGCC | |||
| сек-1 | Энтеротоксин C | GACATAAAAGCTAGGAATTT | [29] | 257 |
| сек-2 | AAATCGGATTAACATTATCC | |||
| сед-1 | Энтеротоксин D | CTAGTTTGGTAATATCTCCT | [29] | 317 |
| сед-2 | TAATGCTATATCTTATAGGG | |||
| см-1 | Энтеротоксин E | CAAAGAAATGCTTTAAGCAATCTTAGGCCAC | [29] | 170 |
| см-2 | CTTACCGCCAAAGCTG | |||
| сег-1 | Энтеротоксин G | AATTATGTGAATGCTCAACCCGATC | [36] | 642 |
| сег-2 | AAACTTATATGGAACAAAAGGTACTAGTTC | |||
| sei-1 | Энтеротоксин H | CAATCACATCATATGCGAAAGCAG | [36] | 376 |
| seh-2 | CATCTACCCAAACATTAGCACC | |||
| sei-1 | Энтеротоксин I | CTCAAGGTGATATTGGTGTAGG | [36] | 576 |
| sei-2 | AAAAAACTTACAGGCAGTCCATCTC | |||
| гл / yidD_epid-1 | α-гемолизин / жидД | TTTCKCCACTTACACCMCC | Это исследование | 160 |
| гл / yidD_epid-2 | GGAACAGGATCAAAGCCACCT | |||
| hlb_epid-1 | β-гемолизин | TGGTGGCGTTGGTATTGTGA | Это исследование | 541 |
| hlb_epid-2 | ACCCCAAGATTTCACGGACC | |||
| hla_haem-1 | α-гемолизин | TGGGCCATAAACTTCAATCGC | Это исследование | 72 |
| гла-гем-2 | ACGCCACCTACATGCAGATTT | |||
| hld-epid-1 | δ-гемолизин | ATGGCAGCAGATATCATTTC | [30] | 444 |
| hld-epid-2 | CGTGAGCTTGGGAGAGAC |
4.4. Обнаружение генов гемолизина
Ген δ-гемолизина, hld , был обнаружен с использованием праймеров и параметров, описанных Marconi et al. [46].
Ген hla / yidD был обнаружен в изолятах S. epidermidis с использованием праймеров, разработанных с помощью NCBI-PrimerBlast, 2008, и последовательностей штамма S. epidermidis {«type»: «entrez-нуклеотид», «attrs»: {«text»: «W23144», «term_id»: «1299977»}} W23144 (GenBank: {«type»: «entrez-нуклеотид», «attrs»: {«text»: «ACJC01000124.1 «,» term_id «:» 224999876 «}} ACJC01000124.1) (hla / yidD_epid). Ген hla был обнаружен в изолятах S. haemolyticus с использованием праймеров, созданных с помощью PrimerBlast и последовательности штамма JCSC1435 (NCBI : {«type»: «entrez-нуклеотид», «attrs»: {«text»: «NC_007168.1», «term_id»: «70725001»}} NC_007168.1) (hla_haem). Праймеры для hlb ген в S. epidermidis были сконструированы с использованием PrimerBlast и последовательности S. epidermidis RP62A (NCBI: {«type»: «entrez-нуклеотид», «attrs»: {«text»: «NC_002976.3 «,» term_id «:» 57865352 «}} NC_002976.3) (hlb_epid). Праймеры для гена hlb в S. haemolyticus не могли быть сконструированы, поскольку этот ген не был описан у этого вида в База данных NCBI-GenBank. Реакционная смесь содержала 2,0 ед. Полимеразы Taq, 1 × буфер для ПЦР, содержащий 0,75 мМ MgCl 2 , 100 мкМ трифосфат дезоксирибонуклеотидов, 1 М каждого праймера и 150 нг нуклеиновой кислоты. Условия ПЦР были следующими: для гл , один шаг при 94 ° C в течение 4 минут; 35 циклов при 94 ° C в течение 1 минуты, 60 ° C в течение 1 минуты, 72 ° C в течение 1 минуты и 72 ° C в течение 5 минут; для hlb , один шаг при 94 ° C в течение 4 минут, 35 циклов при 94 ° C в течение 1 минуты, 60 ° C в течение 1 минуты, 72 ° C в течение 1.5 мин и 72 ° C в течение 6 мин. Эталонные штаммы были включены во все реакции: гл / йидD _epid: S. epidermidis ATCC 12228; hla _haem: S. haemolyticus ATCC 29970; hlb _epid: S. epidermidis ATCC 12228. Последовательности праймеров показаны на фиг.
4.5. Фенотипическая продукция β- и δ-цитотоксинов
Продукция α-токсина определялась на чашках с кровяным агаром, содержащим 5% кроличьей крови, инкубированных при 37 ° C в течение 24 часов.О положительном результате свидетельствовало образование зон гемолиза вокруг изолированных колоний.
Продукция β- и δ-токсинов в изолятах S. haemolyticus была обнаружена, как описано Hébert и Hancock [47]. β-гемолиз наблюдали по наличию зоны неполного гемолиза на чашке с агаром с бараньей кровью, инкубированной при 37 ° C в течение 24 ч, а затем в течение ночи при 4 ° C [48]. Присутствие δ-токсина подтверждалось синергизмом с β-гемолизином S. aureus ATCC 25923.Для этого изолят наносили штрихами перпендикулярно штамму S. aureus на чашку с агаром с овечьей кровью. Планшет инкубировали при 37 ° C в течение 24 ч, и образование δ-токсина наблюдали по образованию зоны гемолиза в форме стрелки [47].
4.6. Статистический анализ
Тест хи-квадрат использовался для проверки связи между переменными, принимая уровень значимости <0,05.
5. Выводы
Клинические изоляты S.epidermidis и S. haemolyticus проявляют высокий токсигенный потенциал, особенно продуцируя энтеротоксины G и I. Использование новых видоспецифичных праймеров для hla / yidD и hlb для S. epidermidis и для hla из S. haemolyticus выявили высокую частоту этих генов в нозокомиальных изолятах этих видов. Полученные данные демонстрируют важную роль этих генов цитотоксина в становлении этих видов и, возможно, в развитии инфекций, вызванных CoNS.
Благодарности
Эта работа была поддержана государственным финансовым агентством Сан-Паулу Research Foundation (FAPESP — Fundação de Amparo à Pesquisa do Estado de São Paulo; Grant 2011 / 15396-1) и Национальным советом по технологическому и научному развитию (CNPq— Conselho Nacional de Desenvolvimento Científico e Tecnológico; Grant 304729 / 2014-0).
Вклад авторов
Л.П .: задумал исследование, участвовал в его разработке, проводил эксперименты, анализировал данные и составлял рукопись.C.I.B .: участвовал в разработке концепции исследования и в лабораторных экспериментах. А.О .: участвовал в лабораторных экспериментах. P.Y.F.M .: участвовал в разработке праймеров. V.C.P .: участвовал в молекулярных экспериментах. M.L.R.S.C .: задумал исследование, участвовал в его разработке и координации, а также отредактировал рукопись. Все авторы прочитали и одобрили окончательную рукопись.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1.Вуонг К., Отто М. Эпидермальные инфекции, вызванные стафилококком. Микробы заражают. 2002; 4: 481–489. DOI: 10.1016 / S1286-4579 (02) 01563-0. [PubMed] [CrossRef] [Google Scholar] 2. Ирлингер Ф. Оценка безопасности молочных микроорганизмов: Коагулазонегативные стафилококки. Int. J. Food Microbiol. 2008. 126: 302–310. DOI: 10.1016 / j.ijfoodmicro.2007.08.016. [PubMed] [CrossRef] [Google Scholar] 3. Подковик М., Быстронь Я., Баня Дж. Генотипы, устойчивость к антибиотикам и факторы вирулентности стафилококков из готовой к употреблению пищи.Пищевой патогенный микроорганизм. Дис. 2012; 9: 91–93. DOI: 10.1089 / fpd.2011.0962. [PubMed] [CrossRef] [Google Scholar] 4. Cunha M.L.R.S., Calsolari R.A.O., Araújo-Júnior J.P. Выявление генов токсина 1 энтеротоксина и синдрома токсического шока в Staphylococcus с акцентом на коагулазонегативные стафилококки. Microbiol. Иммунол. 2007; 51: 381–390. DOI: 10.1111 / j.1348-0421.2007.tb03925.x. [PubMed] [CrossRef] [Google Scholar] 5. Барретти П., Монтелли А.К., Баталья Дж. Э., Карамори Дж. К., Кунья М.Л.Р.С. Роль факторов вирулентности в исходе стафилококкового перитонита у пациентов с ХПНП.BMC Infect. Дис. 2009; 9: 212. DOI: 10.1186 / 1471-2334-9-212. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Тейлор А.Л., Ллевелин М.Дж. Суперантиген-индуцированная пролиферация CD4 + CD25- Т-клеток человека сопровождается переключением на функциональный регуляторный фенотип. J. Immunol. 2010; 185: 6591–6598. DOI: 10.4049 / jimmunol.1002416. [PubMed] [CrossRef] [Google Scholar] 7. Frase J.D., Proft T. Бактериальный суперантиген и суперантиген-подобные белки. Иммунол. Ред. 2008; 225: 226–243. DOI: 10.1111 / j.1600-065X.2008.00681.x. [PubMed] [CrossRef] [Google Scholar] 9. Коэльо С.М.О., Рейносо Э., Перейра И.А., Соарес Л.С., Демо М., Богни К., Соуза М.М.С. Факторы вирулентности и устойчивость к противомикробным препаратам Staphylococcus aureus , выделенного от мастита крупного рогатого скота в Рио-де-Жанейро. Pesq. Вет. Бюстгальтеры. 2009. 29: 369–374. DOI: 10.1590 / S0100-736X20000002. [CrossRef] [Google Scholar] 10. Пенг Х.Л., Новик Р.П., Крейсвирт Б., Корнблюм Дж., Шливерт П. Клонирование, характеристика и секвенирование дополнительного регулятора гена ( agr ) в Staphylococcus aureus .J. Bacteriol. 1988; 170: 4365–4372. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. МакКевитт А.И., Бьорнсон Г.Л., Маурахер К.А., Шайфеле Д.В. Аминокислотная последовательность дельтоподобного токсина из Staphylococcus epidermidis . Заразить. Иммун. 1990; 58: 1473–1475. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Эвен С., Лерой С., Шарлье К., Закур Н.Б., Чакорнак Дж. П., Леберт И., Жамет Э., Десмонтс М. Х., Котон Э., Почет С. и др. Низкий уровень опасности для безопасности при коагулазонегативных стафилококках, выделенных из ферментированных пищевых продуктов.Int. J. Food Microbiol. 2010; 139: 87–95. DOI: 10.1016 / j.ijfoodmicro.2010.02.019. [PubMed] [CrossRef] [Google Scholar] 13. Оки М.С., Йолоба М.Л., Окелло М., Наджука Ф.С., Катабази Ф.А., Бванга Ф., Нантеза А., Катите Д.П. Распространенность детерминант вирулентности у Staphylococcus epidermidis от пациентов интенсивной терапии в Кампале, Уганда. J. Infect. Dev. Ctries. 2012; 6: 242–250. [PubMed] [Google Scholar] 14. Schleifer K.H., Kloos W.E. Выделение и характеристика стафилококков из кожи человека. Int.J. Syst. Бактериол. 1975; 25: 50–61. DOI: 10.1099 / 00207713-25-1-50. [CrossRef] [Google Scholar] 15. Радд К.Е., Хамфери-Смит И., Васингер В.С., Байроч А. Низкомолекулярные белки: проблема для постгеномных исследований. Электрофорез. 1998. 19: 536–544. DOI: 10.1002 / elps.11501Молекулярное обнаружение генов цитотоксинов и энтеротоксинов
токсинов (Базель). 2015 сен; 7 (9): 3688–3699.
Юкако Фудзинага, научный редактор
† Умер 8 сентября 2013 г.
* Автор, которому следует направлять корреспонденцию; Электронная почта: rb.psenu.bbi@rlmahnuc; Тел .: + 55-14-3880-0428.Поступило 6 мая 2015 г .; Принято к печати 6 июля 2015 г.
Авторские права © 2015 г. Авторы; лицензиат MDPI, Базель, Швейцария.Эта статья цитировалась в других статьях в PMC.Abstract
Хотя условно-патогенные микроорганизмы, коагулазонегативные стафилококки (CoNS), включая Staphylococcus epidermidis и Staphylococcus haemolyticus , долгое время считались авирулентными организмами. Роль токсинов в развитии инфекций, вызванных CoNS, до сих пор остается спорной. Целью данного исследования было охарактеризовать наличие генов энтеротоксинов и цитотоксинов у S.epidermidis и S. haemolyticus , полученные из посевов крови. Гены цитотоксинов были обнаружены с помощью ПЦР с использованием новых видоспецифичных праймеров. Среди 85 изолятов S. epidermidis и 84 S. haemolyticus 95,3% и 79,8%, соответственно, несли по крайней мере один ген энтеротоксина. Наиболее частыми генами энтеротоксинов были seg (53,3%), seg (64,5%) и sei (67,5%). Ген seg был положительно связан с S.epidermidis ( p = 0,02), и этот вид был более токсигенным, чем S. haemolyticus . Ген hla / yidD был обнаружен в 92,9% изолятов S. epidermidis и ген hla в 91,7% изолятов S. haemolyticus ; hlb был обнаружен в 92,9% изолятов S. epidermidis и hld в 95,3%. Нозокомиальные изоляты Staphylococcus epidermidis и S. haemolyticus проявляли высокий токсигенный потенциал, в основном содержащие неклассические гены энтеротоксинов seg и sei .Ранее не сообщаемое обнаружение hla / yidD и hlb в S. epidermidis и S. haemolyticus с использованием видоспецифичных праймеров показало, что эти гены гемолизина различаются между видами CoNS и что они очень часто встречаются в изолятах культур крови. .
Ключевые слова: Staphylococcus epidermidis , Staphylococcus haemolyticus , энтеротоксины, цитотоксины
1. Справочная информация
Коагулазонегативные стафилококки (CoNcusS), включая клинически значимые виды haemolylocus и Staphylocochylocos 18 хорошо зарекомендовали себя как важные внутрибольничные возбудители инвазивных инфекций, связанных с медицинскими изделиями [1].Энтеротоксины являются хорошо изученными факторами вирулентности в Staphylococcus aureus , а их гены и синтез описаны в CoNS [2,3], включая CoNS, вызывающие инфекции [4,5]. Энтеротоксины — это суперантигены, которые стимулируют иммунную систему вызывать усиленный ответ, вызывая высвобождение цитокинов, клональную экспансию и клональную делецию части этих лимфоцитов посредством апоптоза [6]. Высвобождение провоспалительных цитокинов отвечает за быстрое начало высокой температуры, утечку капилляров и полиорганную дисфункцию.Внезапность и величина выброса цитокинов определяют тяжесть и исход болезни пациента [7].
Цитотоксины или гемолизины являются важными молекулами, участвующими в патогенезе S. aureus , но их роль в инфекциях CoNS все еще неизвестна. α-гемолизин оказывает гемолитическое, дермонекротическое и нейротоксическое действие [8], тогда как β-токсин обладает фосфорилазной активностью и высоким сродством к клеточной мембране различных типов клеток, вызывая нестабильность мембран [9]. δ-гемолизин вызывает лизис множества клеток млекопитающих, включая эритроциты и внутриклеточные структуры, такие как органеллы с оболочкой [8].Ген δ-токсина, hld , расположен в локусе RNAIII, транскрипте оперона P3, который действует как эффектор системы восприятия кворума agr [10]. Однако его конкретная роль в развитии стафилококковых инфекций четко не установлена. В S. aureus δ-гемолизин представляет собой полипептид, образованный 26 аминокислотами, тогда как в S. epidermidis он состоит из 25 аминокислот с высокой гомологией с δ-токсином S. aureus [11] .
Несколько сообщений описывают присутствие генов, кодирующих цитотоксин, и их экспрессию в CoNS [12]. Хотя есть сообщения о наличии генов hla и hld , кодирующих α- и δ-гемолизин, соответственно, у S. epidermidis [13], исследования с участием других видов CoNS, которые проявляют слабую или умеренную гемолитическую активность в Эритроциты человека и крупного рогатого скота, а также кровь овцы или кролика, особенно S. haemolyticus , немногочисленны [14]. Насколько нам известно, не существует метода, который мог бы эффективно обнаружить генетические детерминанты α- и β-токсинов в S.epidermidis и S. haemolyticus .
Ген α-гемолизина был описан только в одном штамме S. epidermidis ( S. epidermidis {«type»: «entrez-нуклеотид», «attrs»: {«text»: «W23144″, » term_id «:» 1299977 «}} W23144 (GenBank: {» type «:» entrez-нуклеотид «,» attrs «: {» text «:» ACJC01000124.1 «,» term_id «:» 224999876 «}} ACJC01000124.1 ) и затем обозначен как « yidD » Этот ген кодирует белок с 82 аминокислотами, мембранный белок, обладающий активностью α-гемолизина [15,16].Шестьдесят восемь из этих аминокислот идентичны гемолитическому домену белка, обнаруженного в штамме S. epidermidis (NCBI: {«type»: «entrez-protein», «attrs»: {«text»: «AIR83523) .1 «,» term_id «:» 6
236 «}} AIR83523.1), называемый« предполагаемый коэффициент эффективности вставки мембранного белка »[17].
Таким образом, целью настоящего исследования было охарактеризовать присутствие генов энтеротоксинов и генов, кодирующих цитотоксин hla , hlb и hld с использованием видоспецифичных праймеров в S.epidermidis и S. haemolyticus изолятов культуры крови.
2. Результаты
2.1. Обнаружение генов энтеротоксинов
Всего было изучено 169 изолятов, в том числе 85 S. epidermidis и 84 S. haemolyticus .
иллюстрирует обнаружение генов энтеротоксина в изолятах S. haemolyticus и S. epidermidis . Доля положительных изолятов была выше у последних видов, за исключением seb и seh (34% и 15% соответственно), которые чаще встречались у S.Геммолитик . Гены sed, и see. встречались редко (2% и 3% соответственно), тогда как гены sei , seg и sea были наиболее частыми генами у обоих видов. Обнаружение гена seg было достоверно связано с S. epidermidis ( p = 0,02).
Обнаружение генов энтеротоксинов sea — sei в изолятах S. epidermidis и S. haemolyticus . * Значительно положительная ассоциация с S. epidermidis .
Гены sea и seb были одновременно обнаружены в 20% ( n = 34) изолятов, включая 17,6% изолятов S. epidermidis и 21,4% из S. haemolyticus , а seg. и sei одновременно присутствовали у 52,7% ( n = 89) (61,2% из S. epidermidis и 44% из S. haemolyticus ).Среди изученных штаммов 87,6% ( n = 148) несли по крайней мере один ген энтеротоксина, в том числе 95,3% ( n = 81) изолятов S. epidermidis и 79,8% ( n = 67) С. haemolyticus .
2.2. Молекулярное и фенотипическое определение цитотоксинов
Гены гемолизина hla / yidD , hlb и hld были обнаружены в S. epidermidis с использованием видоспецифичных праймеров.Праймеры hlb и hld из S. epidermidis не смогли идентифицировать гены β- и δ-токсинов в S. haemolyticus . Новые праймеры были разработаны для идентификации гена hla в S. haemolyticus . Однако праймеры для генов S. haemolyticus hlb и hld не могут быть сконструированы, поскольку эти гены еще не описаны для этого вида.
Скорость обнаружения гла / годD была аналогичной в S.epidermidis и S. haemolyticus (92,9% и 91,7% соответственно). В S. epidermidis hlb были обнаружены в 92,9% изолятов и hld — в 95,3%. Гены hla и hlb одновременно присутствовали в 89,4% изолятов S. epidermidis . β-токсин был обнаружен в 81% изолятов S. haemolyticus , а δ-токсин — в 40,5%. Тридцать процентов изолятов S. haemolyticus продуцировали как β-, так и δ-токсин ().
Таблица 1
Обнаружение генов α-, β- и δ-цитотоксинов и их продукция.
| Организмы ( n ) | гл * | глб | hld | α-токсин | β-токсин | δ-токсин | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | n | % | |||||||||||||||||||||||||
| S.Epidermidis (85) | 79 | 92,9 | 79 | 92,9 | 81 | 95,3 | 24 | 28,2 | 25 | 29,4 | — | — | (84)77 | 91,7 | — | — | — | — | 70 | 83,3 | 68 | 81 | 34 | 40,5 | 92.3 | 79 | 92,9 | 81 | 95,3 | 94 | 55,6 | 93 | 55 | 34 | 40,5 | |
Таблица 2
Сравнение частоты генов hla и hlb и фенотипической продукции α- и β-токсинов.
| Staphylococcus haemolyticus | Staphylococcus epidermidis | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Гены | Гены | Гены | ||||||||
| Гены | ||||||||||
| 9017 9017 hla + * | hla — * | Всего | Токсин | hlb + | hlb — | Всего | ||||
| n (%) | )n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | |||
| α-Toxin + | 65 (78) | 5 (6) | 70 (84) | 24 (28) | 0 | 24 (28) 9 0356 | β-токсин + | 24 (28) | 1 (1) | 25 (29) |
| α-токсин — | 12 (14) | 2 (2) | 14 (16) | 55 (65) | 6 (7) | 61 (72) | β-токсин — | 55 (65) | 5 (6) | 60 (71) |
| Всего | 77 (92) | 7 (8) | 84 (100) | 79 (93) | 6 (7) | 85 (100) | Всего | 79 (93) | 6 ( 7) | 85 (100) |
Профиль токсинового гена и фенотипическая продукция токсина для каждого изолята показаны в дополнительной таблице S1.
3. Обсуждение
Staphylococcus epidermidis и S. haemolyticus — основные виды CoNS, колонизирующие нос человека [18], наиболее распространенные виды, выделенные из посевов крови [19] и часто связанные с катетер-ассоциированным кровотоком. инфекции [20]. Помимо того, что они являются основной причиной пищевых отравлений, стафилококковые энтеротоксины играют важную роль в патологических процессах, таких как сепсис, остеомиелит и респираторный дистресс-синдром [21].Однако энтеротоксигенный потенциал CoNS неоднозначен.
Настоящее исследование показало высокую частоту генов энтеротоксинов в изолятах культур крови: 95,3% изолятов S. epidermidis и 79,8% изолятов S. haemolyticus несут хотя бы один ген токсина. Наиболее частыми обнаруженными генами классического энтеротоксина были sea , seb и sec , а среди всех генов энтеротоксинов наиболее распространенными были seg и sei .Другое исследование [22] также показало более высокий процент sea , seb и sec в CoNS, выделенных из коровьего молока. Кроме того, сообщалось о продукции энтеротоксина А изолятами человеческого CoNS [23]. Описана продукция классических энтеротоксинов SEA, SEB и SEC клиническими изолятами S. epidermidis и SEC S. haemolyticus [5,24], при этом высокий процент изолятов, продуцирующих комбинацию двух или больше токсинов [25].Как и в настоящем исследовании, также сообщалось о наличии генов SEE, SEG, SEH и SEI и продукции этих энтеротоксинов [26], но исследования, показывающие отсутствие или низкую частоту этих генов в CoNS, преобладают в литературе. . Эти различия между исследованиями могут быть связаны с систематической ошибкой в используемом методе и в изученных изолятах, включая количество, природу и географическое происхождение штаммов. Нозокомиальные изоляты могут быть лучше оснащены факторами вирулентности, полученными путем облегченного переноса посредством селективного давления.
В настоящем исследовании 20% штаммов были положительными как для sea , так и для seb . Частое присутствие этих двух генов у одной и той же бактерии объясняется тем, что они занимают один и тот же хромосомный локус [27]. Кроме того, 61,2% из S. epidermidis и 44% из S. haemolyticus оказались положительными как для seg , так и для sei . Несколько исследований [28,29] показали систематическую ассоциацию между seg и sei и высокую частоту этих генов у S.aureus , что также может встречаться при CoNS. Ожидается одновременное присутствие генов seg и sei , поскольку эти два гена обнаружены в кластере egc , который также содержит гены, кодирующие другие стафилококковые энтеротоксины [30].
Staphylococcus epidermidis был указан как CoNS с наивысшим токсигенным потенциалом в некоторых исследованиях [25]. Фактически, этот вид показал более высокий уровень генов энтеротоксина по сравнению с S.haemolyticus (95,3% против ,79,8% соответственно). Остров патогенности, экспрессирующий несколько генов энтеротоксинов, был недавно описан в клиническом изоляте S. epidermidis [31].
Данных о наличии гемолизинов и генов гемолизина в CoNS пока немного. Хотя 81% изолятов S. haemolyticus проявляют β-гемолитическую активность и 40% продуцируют δ-токсин, секвенирование генома не позволило идентифицировать гены, ответственные за гемолиз у этих видов; продемонстрирован только ген α-гемолизина.Праймеры гемолизина, разработанные для S. aureus [32] и S. epidermidis , а также праймеры hld , разработанные из последовательности hld S. simulans (номер доступа GenBank {«type»: «entrez- нуклеотид «,» attrs «: {» text «:» AJ223775.1 «,» term_id «:» 3687333 «}} AJ223775.1; вперед: AAGGGGCAATACACATGRC; обратный: CCGAACGCTTCATTTCCGAT), не удалось обнаружить эти гены в S. haemolyticus . Huseby et al. [33] продемонстрировал видоспецифические различия в β-токсине S . schleiferi и S. epidermidis , белки которых показали 72% и 52% гомологию с β-токсином S. aureus соответственно. Эти различия между β-гемолизинами разных видов CoNS могут быть результатом бактериальной адаптации к широкому кругу потенциальных хозяев [34]. Поскольку праймеры hlb и hld для S. epidermidis не могли идентифицировать эти гены в S. haemolyticus , а гены hlb и hld еще не были описаны у последних видов, хотя они и являются произведенные, как продемонстрировано методом фенотипического обнаружения, могут существовать значительные различия в их последовательностях, что позволяет предположить, что эти токсины имеют различную структуру и, следовательно, разные функции у видов CoNS.
Насколько нам известно, это первое исследование по обнаружению гена hla с использованием специфических праймеров для S. epidermidis и S. haemolyticus . Ген, использованный для конструирования праймера штамма S. epidermidis {«type»: «entrez-nucleotide», «attrs»: {«text»: «W23144», «term_id»: «1299977»}} W23144 был обозначается в GenBank как «α-гемолизин» до июня 2013 года. В тот день авторы изменили обозначение этого гена на « yidD » и классифицировали его как мембранный белок.Согласно предыдущим исследованиям, некоторые члены семейства yidD были аннотированы как гемолизины, что явилось результатом неопубликованного наблюдения, опубликованного в GenBank {«type»: «entrez-nucleotide», «attrs»: {«text»: «L36462″, » term_id «:» 2537795 «}} L36462, что ген hlyA , который является гомологом yidD из Aeromonas hydrophila , обладает активностью α-гемолизина [15,16]. Некоторые базы данных показывают, что yidD является ортологом белков с гемолитической функцией SE1462 из S.epidermidis ATCC 12228 и SERP1356 из S. epidermidis RP62A (http://www.xbase.ac.uk/genome/buchnera-aphidicola-str-sg-schizaphis-graminum/NC_004061/BUsg015;yidD/super/orthologues) .
Ген, кодирующий α-токсин / yidD , был обнаружен в 92,9% изолятов S. epidermidis
и ген hla в 91,7% изолятов S. haemolyticus , в то время как hlb был обнаружен с такой же частотой (92,9%) у S. epidermidis .С другой стороны, другое исследование [13] обнаружило hlb только в 20% из изолятов S. epidermidis и отсутствие hlb во всех штаммах. β-токсин описан в 75% случаев CoNS, а α-гемолиз — в 57% [35]. Натаро и др. [36] наблюдали 61% положительности для β-токсина в CoNS, в то время как в настоящем исследовании продукция β-гемолизина наблюдалась у 81% изолятов S. haemolyticus . Moraveji et al. [37] наблюдали вдвое большую частоту генов и продукции гемолизина в человеческих линиях по сравнению со штаммами животных.Важность hlb и β-токсина обусловлена способностью этого белка способствовать ускользанию бактерий от иммунной системы хозяина и его участием в поглощении питательных веществ [33], обеспечивая выживание патогена.Дивергенция гена hld настолько велика среди видов, что она не может быть амплифицирована в некоторых CoNS [12]. Это разнообразие демонстрируется тем фактом, что частичная идентичность гена этого токсина между S. aureus и S. epidermidis составляет всего 83% [12].То же самое может относиться к S. haemolyticus и может объяснять отсутствие амплификации этого гена праймерами S. epidermidis в настоящем исследовании. δ-гемолизин кодируется регуляторной РНКIII в S. aureus , связанной с системой agr [38], системой, описанной у нескольких видов стафилококков, включая S. epidermidis и S. haemolyticus [39,40] . В настоящем исследовании ген hld был обнаружен у 95,3% из S.epidermidis , а δ-гемолизин продуцировался 40,5% изолятов S. haemolyticus . Согласно Gemmel [41], δ-гемолизин чаще экспрессируется CoNS, изолированным от клинически значимых инфекций, по сравнению с неявными инфекциями человека.
Несмотря на высокую частоту гена hla , наблюдаемую в настоящем исследовании у S. epidermidis и S. haemolyticus , фенотипическая продукция токсина, кодируемого hla , кажется более частой у последних видов, с наибольшим гл, -положительный с.haemolyticus (85%), экспрессирующие α-токсин. Напротив, несмотря на высокую частоту hla / yidD и hlb в S. epidermidis , менее одной трети (30%) изолятов, несущих эти гены, также экспрессировали их. Отсутствие гена и присутствие токсина, наблюдаемые в пяти изолятах S. haemolyticus
и в одном изоляте S. epidermidis , могут быть связаны с мутациями в последовательностях этих генов, такими как последовательности вставки, которые мешают амплификации. гена методом ПЦР.Одним из ограничений настоящего исследования является тот факт, что распространенность токсигенных генов не эквивалентна распространенности экспрессии этих генов. Однако в этом исследовании экспрессия была продемонстрирована гемолизом на кровяном агаре. Необходимы дальнейшие исследования с использованием других методов для оценки экспрессии этих генов, таких как вестерн-блоттинг. Кроме того, секвенирование генома некоторых из этих положительных штаммов будет важным для идентификации этих генов в геномах S.epidermidis и S. haemolyticus .
4. Материалы и методы
4.1. Изоляты
Штаммы были выделены из посевов крови пациентов, поступивших в университетскую больницу Медицинской школы Ботукату (Hospital das Clínicas, Faculdade de Medicina de Botucatu (HC-FMB)), Государственный университет Паулиста (Universidade Estadual Paulista (UNESP)) , Botucatu Campus, между 2000 и 2011 годами. В исследование был включен только один изолят на пациента. Штаммы были выделены, как описано Koneman et al. [42].
4.2. Идентификация видов
Род Staphylococcus был идентифицирован, как описано Koneman et al. [42]. Staphylococcus epidermidis и S. haemolyticus были идентифицированы упрощенным методом, предложенным Cunha et al. [43]. Идентификация видов была генетически подтверждена с помощью ПЦР-амплификации области внутреннего транскрибируемого спейсера (ITS) 16S-23S, как описано Couto et al. [44] после экстракции ДНК с помощью набора Illustra (GE Healthcare, Little Chalfont, Buckinghamshire, UK).Следующие международные эталонные штаммы использовали в качестве контролей: S. epidermidis (ATCC 12228), S. epidermidis (ATCC 35983) и S. haemolyticus (ATCC 29970).
4.3. Обнаружение генов энтеротоксинов
ПЦР для обнаружения генов энтеротоксинов выполняли с использованием праймеров и параметров, описанных Johnson et al. [45] и Cunha et al. [4]. Международные эталонные штаммы были включены во все реакции как положительные ( S.aureus Американская коллекция типовых культур — ATCC 13565 ( sea ), ATCC 14458 ( seb ), ATCC 19095 ( sec ), ATCC 23235 ( sed ), ATCC 27664 ( см. ), ATCC 51811 ( seh ), S. aureus Food Research Institute — FRI 361 ( seg и sei )) и отрицательные ( S. xylosus ATCC 29971) контроли. Последовательности праймеров показаны в.
Таблица 3
Последовательность праймеров и размер ампликона.
| Название | Продукт | Последовательность | Ссылка | Размер ампликона (bp) |
|---|---|---|---|---|
| море-1 | Энтеротоксин A | TTGGAAACGGTTAAAACGAA | [29] | 120 |
| море-2 | GAACCTTCCCATCAAAAACA | |||
| СБ-1 | Энтеротоксин B | TCGCATCAAACTGACAAACG | [29] | 478 |
| СБ-2 | GCAGGTACTCTATAAGTGCC | |||
| сек-1 | Энтеротоксин C | GACATAAAAGCTAGGAATTT | [29] | 257 |
| сек-2 | AAATCGGATTAACATTATCC | |||
| сед-1 | Энтеротоксин D | CTAGTTTGGTAATATCTCCT | [29] | 317 |
| сед-2 | TAATGCTATATCTTATAGGG | |||
| см-1 | Энтеротоксин E | CAAAGAAATGCTTTAAGCAATCTTAGGCCAC | [29] | 170 |
| см-2 | CTTACCGCCAAAGCTG | |||
| сег-1 | Энтеротоксин G | AATTATGTGAATGCTCAACCCGATC | [36] | 642 |
| сег-2 | AAACTTATATGGAACAAAAGGTACTAGTTC | |||
| sei-1 | Энтеротоксин H | CAATCACATCATATGCGAAAGCAG | [36] | 376 |
| seh-2 | CATCTACCCAAACATTAGCACC | |||
| sei-1 | Энтеротоксин I | CTCAAGGTGATATTGGTGTAGG | [36] | 576 |
| sei-2 | AAAAAACTTACAGGCAGTCCATCTC | |||
| гл / yidD_epid-1 | α-гемолизин / жидД | TTTCKCCACTTACACCMCC | Это исследование | 160 |
| гл / yidD_epid-2 | GGAACAGGATCAAAGCCACCT | |||
| hlb_epid-1 | β-гемолизин | TGGTGGCGTTGGTATTGTGA | Это исследование | 541 |
| hlb_epid-2 | ACCCCAAGATTTCACGGACC | |||
| hla_haem-1 | α-гемолизин | TGGGCCATAAACTTCAATCGC | Это исследование | 72 |
| гла-гем-2 | ACGCCACCTACATGCAGATTT | |||
| hld-epid-1 | δ-гемолизин | ATGGCAGCAGATATCATTTC | [30] | 444 |
| hld-epid-2 | CGTGAGCTTGGGAGAGAC |
4.4. Обнаружение генов гемолизина
Ген δ-гемолизина, hld , был обнаружен с использованием праймеров и параметров, описанных Marconi et al. [46].
Ген hla / yidD был обнаружен в изолятах S. epidermidis с использованием праймеров, разработанных с помощью NCBI-PrimerBlast, 2008, и последовательностей штамма S. epidermidis {«type»: «entrez-нуклеотид», «attrs»: {«text»: «W23144», «term_id»: «1299977»}} W23144 (GenBank: {«type»: «entrez-нуклеотид», «attrs»: {«text»: «ACJC01000124.1 «,» term_id «:» 224999876 «}} ACJC01000124.1) (hla / yidD_epid). Ген hla был обнаружен в изолятах S. haemolyticus с использованием праймеров, созданных с помощью PrimerBlast и последовательности штамма JCSC1435 (NCBI : {«type»: «entrez-нуклеотид», «attrs»: {«text»: «NC_007168.1», «term_id»: «70725001»}} NC_007168.1) (hla_haem). Праймеры для hlb ген в S. epidermidis были сконструированы с использованием PrimerBlast и последовательности S. epidermidis RP62A (NCBI: {«type»: «entrez-нуклеотид», «attrs»: {«text»: «NC_002976.3 «,» term_id «:» 57865352 «}} NC_002976.3) (hlb_epid). Праймеры для гена hlb в S. haemolyticus не могли быть сконструированы, поскольку этот ген не был описан у этого вида в База данных NCBI-GenBank. Реакционная смесь содержала 2,0 ед. Полимеразы Taq, 1 × буфер для ПЦР, содержащий 0,75 мМ MgCl 2 , 100 мкМ трифосфат дезоксирибонуклеотидов, 1 М каждого праймера и 150 нг нуклеиновой кислоты. Условия ПЦР были следующими: для гл , один шаг при 94 ° C в течение 4 минут; 35 циклов при 94 ° C в течение 1 минуты, 60 ° C в течение 1 минуты, 72 ° C в течение 1 минуты и 72 ° C в течение 5 минут; для hlb , один шаг при 94 ° C в течение 4 минут, 35 циклов при 94 ° C в течение 1 минуты, 60 ° C в течение 1 минуты, 72 ° C в течение 1.5 мин и 72 ° C в течение 6 мин. Эталонные штаммы были включены во все реакции: гл / йидD _epid: S. epidermidis ATCC 12228; hla _haem: S. haemolyticus ATCC 29970; hlb _epid: S. epidermidis ATCC 12228. Последовательности праймеров показаны на фиг.
4.5. Фенотипическая продукция β- и δ-цитотоксинов
Продукция α-токсина определялась на чашках с кровяным агаром, содержащим 5% кроличьей крови, инкубированных при 37 ° C в течение 24 часов.О положительном результате свидетельствовало образование зон гемолиза вокруг изолированных колоний.
Продукция β- и δ-токсинов в изолятах S. haemolyticus была обнаружена, как описано Hébert и Hancock [47]. β-гемолиз наблюдали по наличию зоны неполного гемолиза на чашке с агаром с бараньей кровью, инкубированной при 37 ° C в течение 24 ч, а затем в течение ночи при 4 ° C [48]. Присутствие δ-токсина подтверждалось синергизмом с β-гемолизином S. aureus ATCC 25923.Для этого изолят наносили штрихами перпендикулярно штамму S. aureus на чашку с агаром с овечьей кровью. Планшет инкубировали при 37 ° C в течение 24 ч, и образование δ-токсина наблюдали по образованию зоны гемолиза в форме стрелки [47].
4.6. Статистический анализ
Тест хи-квадрат использовался для проверки связи между переменными, принимая уровень значимости <0,05.
5. Выводы
Клинические изоляты S.epidermidis и S. haemolyticus проявляют высокий токсигенный потенциал, особенно продуцируя энтеротоксины G и I. Использование новых видоспецифичных праймеров для hla / yidD и hlb для S. epidermidis и для hla из S. haemolyticus выявили высокую частоту этих генов в нозокомиальных изолятах этих видов. Полученные данные демонстрируют важную роль этих генов цитотоксина в становлении этих видов и, возможно, в развитии инфекций, вызванных CoNS.
Благодарности
Эта работа была поддержана государственным финансовым агентством Сан-Паулу Research Foundation (FAPESP — Fundação de Amparo à Pesquisa do Estado de São Paulo; Grant 2011 / 15396-1) и Национальным советом по технологическому и научному развитию (CNPq— Conselho Nacional de Desenvolvimento Científico e Tecnológico; Grant 304729 / 2014-0).
Вклад авторов
Л.П .: задумал исследование, участвовал в его разработке, проводил эксперименты, анализировал данные и составлял рукопись.C.I.B .: участвовал в разработке концепции исследования и в лабораторных экспериментах. А.О .: участвовал в лабораторных экспериментах. P.Y.F.M .: участвовал в разработке праймеров. V.C.P .: участвовал в молекулярных экспериментах. M.L.R.S.C .: задумал исследование, участвовал в его разработке и координации, а также отредактировал рукопись. Все авторы прочитали и одобрили окончательную рукопись.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1.Вуонг К., Отто М. Эпидермальные инфекции, вызванные стафилококком. Микробы заражают. 2002; 4: 481–489. DOI: 10.1016 / S1286-4579 (02) 01563-0. [PubMed] [CrossRef] [Google Scholar] 2. Ирлингер Ф. Оценка безопасности молочных микроорганизмов: Коагулазонегативные стафилококки. Int. J. Food Microbiol. 2008. 126: 302–310. DOI: 10.1016 / j.ijfoodmicro.2007.08.016. [PubMed] [CrossRef] [Google Scholar] 3. Подковик М., Быстронь Я., Баня Дж. Генотипы, устойчивость к антибиотикам и факторы вирулентности стафилококков из готовой к употреблению пищи.Пищевой патогенный микроорганизм. Дис. 2012; 9: 91–93. DOI: 10.1089 / fpd.2011.0962. [PubMed] [CrossRef] [Google Scholar] 4. Cunha M.L.R.S., Calsolari R.A.O., Araújo-Júnior J.P. Выявление генов токсина 1 энтеротоксина и синдрома токсического шока в Staphylococcus с акцентом на коагулазонегативные стафилококки. Microbiol. Иммунол. 2007; 51: 381–390. DOI: 10.1111 / j.1348-0421.2007.tb03925.x. [PubMed] [CrossRef] [Google Scholar] 5. Барретти П., Монтелли А.К., Баталья Дж. Э., Карамори Дж. К., Кунья М.Л.Р.С. Роль факторов вирулентности в исходе стафилококкового перитонита у пациентов с ХПНП.BMC Infect. Дис. 2009; 9: 212. DOI: 10.1186 / 1471-2334-9-212. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Тейлор А.Л., Ллевелин М.Дж. Суперантиген-индуцированная пролиферация CD4 + CD25- Т-клеток человека сопровождается переключением на функциональный регуляторный фенотип. J. Immunol. 2010; 185: 6591–6598. DOI: 10.4049 / jimmunol.1002416. [PubMed] [CrossRef] [Google Scholar] 7. Frase J.D., Proft T. Бактериальный суперантиген и суперантиген-подобные белки. Иммунол. Ред. 2008; 225: 226–243. DOI: 10.1111 / j.1600-065X.2008.00681.x. [PubMed] [CrossRef] [Google Scholar] 9. Коэльо С.М.О., Рейносо Э., Перейра И.А., Соарес Л.С., Демо М., Богни К., Соуза М.М.С. Факторы вирулентности и устойчивость к противомикробным препаратам Staphylococcus aureus , выделенного от мастита крупного рогатого скота в Рио-де-Жанейро. Pesq. Вет. Бюстгальтеры. 2009. 29: 369–374. DOI: 10.1590 / S0100-736X20000002. [CrossRef] [Google Scholar] 10. Пенг Х.Л., Новик Р.П., Крейсвирт Б., Корнблюм Дж., Шливерт П. Клонирование, характеристика и секвенирование дополнительного регулятора гена ( agr ) в Staphylococcus aureus .J. Bacteriol. 1988; 170: 4365–4372. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. МакКевитт А.И., Бьорнсон Г.Л., Маурахер К.А., Шайфеле Д.В. Аминокислотная последовательность дельтоподобного токсина из Staphylococcus epidermidis . Заразить. Иммун. 1990; 58: 1473–1475. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Эвен С., Лерой С., Шарлье К., Закур Н.Б., Чакорнак Дж. П., Леберт И., Жамет Э., Десмонтс М. Х., Котон Э., Почет С. и др. Низкий уровень опасности для безопасности при коагулазонегативных стафилококках, выделенных из ферментированных пищевых продуктов.Int. J. Food Microbiol. 2010; 139: 87–95. DOI: 10.1016 / j.ijfoodmicro.2010.02.019. [PubMed] [CrossRef] [Google Scholar] 13. Оки М.С., Йолоба М.Л., Окелло М., Наджука Ф.С., Катабази Ф.А., Бванга Ф., Нантеза А., Катите Д.П. Распространенность детерминант вирулентности у Staphylococcus epidermidis от пациентов интенсивной терапии в Кампале, Уганда. J. Infect. Dev. Ctries. 2012; 6: 242–250. [PubMed] [Google Scholar] 14. Schleifer K.H., Kloos W.E. Выделение и характеристика стафилококков из кожи человека. Int.J. Syst. Бактериол. 1975; 25: 50–61. DOI: 10.1099 / 00207713-25-1-50. [CrossRef] [Google Scholar] 15. Радд К.Е., Хамфери-Смит И., Васингер В.С., Байроч А. Низкомолекулярные белки: проблема для постгеномных исследований. Электрофорез. 1998. 19: 536–544. DOI: 10.1002 / elps.11501Молекулярное обнаружение генов цитотоксинов и энтеротоксинов
токсинов (Базель). 2015 сен; 7 (9): 3688–3699.
Юкако Фудзинага, научный редактор
† Умер 8 сентября 2013 г.
* Автор, которому следует направлять корреспонденцию; Электронная почта: rb.psenu.bbi@rlmahnuc; Тел .: + 55-14-3880-0428.Поступило 6 мая 2015 г .; Принято к печати 6 июля 2015 г.
Авторские права © 2015 г. Авторы; лицензиат MDPI, Базель, Швейцария.Эта статья цитировалась в других статьях в PMC.Abstract
Хотя условно-патогенные микроорганизмы, коагулазонегативные стафилококки (CoNS), включая Staphylococcus epidermidis и Staphylococcus haemolyticus , долгое время считались авирулентными организмами. Роль токсинов в развитии инфекций, вызванных CoNS, до сих пор остается спорной. Целью данного исследования было охарактеризовать наличие генов энтеротоксинов и цитотоксинов у S.epidermidis и S. haemolyticus , полученные из посевов крови. Гены цитотоксинов были обнаружены с помощью ПЦР с использованием новых видоспецифичных праймеров. Среди 85 изолятов S. epidermidis и 84 S. haemolyticus 95,3% и 79,8%, соответственно, несли по крайней мере один ген энтеротоксина. Наиболее частыми генами энтеротоксинов были seg (53,3%), seg (64,5%) и sei (67,5%). Ген seg был положительно связан с S.epidermidis ( p = 0,02), и этот вид был более токсигенным, чем S. haemolyticus . Ген hla / yidD был обнаружен в 92,9% изолятов S. epidermidis и ген hla в 91,7% изолятов S. haemolyticus ; hlb был обнаружен в 92,9% изолятов S. epidermidis и hld в 95,3%. Нозокомиальные изоляты Staphylococcus epidermidis и S. haemolyticus проявляли высокий токсигенный потенциал, в основном содержащие неклассические гены энтеротоксинов seg и sei .Ранее не сообщаемое обнаружение hla / yidD и hlb в S. epidermidis и S. haemolyticus с использованием видоспецифичных праймеров показало, что эти гены гемолизина различаются между видами CoNS и что они очень часто встречаются в изолятах культур крови. .
Ключевые слова: Staphylococcus epidermidis , Staphylococcus haemolyticus , энтеротоксины, цитотоксины
1. Справочная информация
Коагулазонегативные стафилококки (CoNcusS), включая клинически значимые виды haemolylocus и Staphylocochylocos 18 хорошо зарекомендовали себя как важные внутрибольничные возбудители инвазивных инфекций, связанных с медицинскими изделиями [1].Энтеротоксины являются хорошо изученными факторами вирулентности в Staphylococcus aureus , а их гены и синтез описаны в CoNS [2,3], включая CoNS, вызывающие инфекции [4,5]. Энтеротоксины — это суперантигены, которые стимулируют иммунную систему вызывать усиленный ответ, вызывая высвобождение цитокинов, клональную экспансию и клональную делецию части этих лимфоцитов посредством апоптоза [6]. Высвобождение провоспалительных цитокинов отвечает за быстрое начало высокой температуры, утечку капилляров и полиорганную дисфункцию.Внезапность и величина выброса цитокинов определяют тяжесть и исход болезни пациента [7].
Цитотоксины или гемолизины являются важными молекулами, участвующими в патогенезе S. aureus , но их роль в инфекциях CoNS все еще неизвестна. α-гемолизин оказывает гемолитическое, дермонекротическое и нейротоксическое действие [8], тогда как β-токсин обладает фосфорилазной активностью и высоким сродством к клеточной мембране различных типов клеток, вызывая нестабильность мембран [9]. δ-гемолизин вызывает лизис множества клеток млекопитающих, включая эритроциты и внутриклеточные структуры, такие как органеллы с оболочкой [8].Ген δ-токсина, hld , расположен в локусе RNAIII, транскрипте оперона P3, который действует как эффектор системы восприятия кворума agr [10]. Однако его конкретная роль в развитии стафилококковых инфекций четко не установлена. В S. aureus δ-гемолизин представляет собой полипептид, образованный 26 аминокислотами, тогда как в S. epidermidis он состоит из 25 аминокислот с высокой гомологией с δ-токсином S. aureus [11] .
Несколько сообщений описывают присутствие генов, кодирующих цитотоксин, и их экспрессию в CoNS [12]. Хотя есть сообщения о наличии генов hla и hld , кодирующих α- и δ-гемолизин, соответственно, у S. epidermidis [13], исследования с участием других видов CoNS, которые проявляют слабую или умеренную гемолитическую активность в Эритроциты человека и крупного рогатого скота, а также кровь овцы или кролика, особенно S. haemolyticus , немногочисленны [14]. Насколько нам известно, не существует метода, который мог бы эффективно обнаружить генетические детерминанты α- и β-токсинов в S.epidermidis и S. haemolyticus .
Ген α-гемолизина был описан только в одном штамме S. epidermidis ( S. epidermidis {«type»: «entrez-нуклеотид», «attrs»: {«text»: «W23144″, » term_id «:» 1299977 «}} W23144 (GenBank: {» type «:» entrez-нуклеотид «,» attrs «: {» text «:» ACJC01000124.1 «,» term_id «:» 224999876 «}} ACJC01000124.1 ) и затем обозначен как « yidD » Этот ген кодирует белок с 82 аминокислотами, мембранный белок, обладающий активностью α-гемолизина [15,16].Шестьдесят восемь из этих аминокислот идентичны гемолитическому домену белка, обнаруженного в штамме S. epidermidis (NCBI: {«type»: «entrez-protein», «attrs»: {«text»: «AIR83523) .1 «,» term_id «:» 6
236 «}} AIR83523.1), называемый« предполагаемый коэффициент эффективности вставки мембранного белка »[17].
Таким образом, целью настоящего исследования было охарактеризовать присутствие генов энтеротоксинов и генов, кодирующих цитотоксин hla , hlb и hld с использованием видоспецифичных праймеров в S.epidermidis и S. haemolyticus изолятов культуры крови.
2. Результаты
2.1. Обнаружение генов энтеротоксинов
Всего было изучено 169 изолятов, в том числе 85 S. epidermidis и 84 S. haemolyticus .
иллюстрирует обнаружение генов энтеротоксина в изолятах S. haemolyticus и S. epidermidis . Доля положительных изолятов была выше у последних видов, за исключением seb и seh (34% и 15% соответственно), которые чаще встречались у S.Геммолитик . Гены sed, и see. встречались редко (2% и 3% соответственно), тогда как гены sei , seg и sea были наиболее частыми генами у обоих видов. Обнаружение гена seg было достоверно связано с S. epidermidis ( p = 0,02).
Обнаружение генов энтеротоксинов sea — sei в изолятах S. epidermidis и S. haemolyticus . * Значительно положительная ассоциация с S. epidermidis .
Гены sea и seb были одновременно обнаружены в 20% ( n = 34) изолятов, включая 17,6% изолятов S. epidermidis и 21,4% из S. haemolyticus , а seg. и sei одновременно присутствовали у 52,7% ( n = 89) (61,2% из S. epidermidis и 44% из S. haemolyticus ).Среди изученных штаммов 87,6% ( n = 148) несли по крайней мере один ген энтеротоксина, в том числе 95,3% ( n = 81) изолятов S. epidermidis и 79,8% ( n = 67) С. haemolyticus .
2.2. Молекулярное и фенотипическое определение цитотоксинов
Гены гемолизина hla / yidD , hlb и hld были обнаружены в S. epidermidis с использованием видоспецифичных праймеров.Праймеры hlb и hld из S. epidermidis не смогли идентифицировать гены β- и δ-токсинов в S. haemolyticus . Новые праймеры были разработаны для идентификации гена hla в S. haemolyticus . Однако праймеры для генов S. haemolyticus hlb и hld не могут быть сконструированы, поскольку эти гены еще не описаны для этого вида.
Скорость обнаружения гла / годD была аналогичной в S.epidermidis и S. haemolyticus (92,9% и 91,7% соответственно). В S. epidermidis hlb были обнаружены в 92,9% изолятов и hld — в 95,3%. Гены hla и hlb одновременно присутствовали в 89,4% изолятов S. epidermidis . β-токсин был обнаружен в 81% изолятов S. haemolyticus , а δ-токсин — в 40,5%. Тридцать процентов изолятов S. haemolyticus продуцировали как β-, так и δ-токсин ().
Таблица 1
Обнаружение генов α-, β- и δ-цитотоксинов и их продукция.
| Организмы ( n ) | гл * | глб | hld | α-токсин | β-токсин | δ-токсин | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | n | % | |||||||||||||||||||||||||
| S.Epidermidis (85) | 79 | 92,9 | 79 | 92,9 | 81 | 95,3 | 24 | 28,2 | 25 | 29,4 | — | — | (84)77 | 91,7 | — | — | — | — | 70 | 83,3 | 68 | 81 | 34 | 40,5 | 92.3 | 79 | 92,9 | 81 | 95,3 | 94 | 55,6 | 93 | 55 | 34 | 40,5 | |
Таблица 2
Сравнение частоты генов hla и hlb и фенотипической продукции α- и β-токсинов.
| Staphylococcus haemolyticus | Staphylococcus epidermidis | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Гены | Гены | Гены | ||||||||
| Гены | ||||||||||
| 9017 9017 hla + * | hla — * | Всего | Токсин | hlb + | hlb — | Всего | ||||
| n (%) | )n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | |||
| α-Toxin + | 65 (78) | 5 (6) | 70 (84) | 24 (28) | 0 | 24 (28) 9 0356 | β-токсин + | 24 (28) | 1 (1) | 25 (29) |
| α-токсин — | 12 (14) | 2 (2) | 14 (16) | 55 (65) | 6 (7) | 61 (72) | β-токсин — | 55 (65) | 5 (6) | 60 (71) |
| Всего | 77 (92) | 7 (8) | 84 (100) | 79 (93) | 6 (7) | 85 (100) | Всего | 79 (93) | 6 ( 7) | 85 (100) |
Профиль токсинового гена и фенотипическая продукция токсина для каждого изолята показаны в дополнительной таблице S1.
3. Обсуждение
Staphylococcus epidermidis и S. haemolyticus — основные виды CoNS, колонизирующие нос человека [18], наиболее распространенные виды, выделенные из посевов крови [19] и часто связанные с катетер-ассоциированным кровотоком. инфекции [20]. Помимо того, что они являются основной причиной пищевых отравлений, стафилококковые энтеротоксины играют важную роль в патологических процессах, таких как сепсис, остеомиелит и респираторный дистресс-синдром [21].Однако энтеротоксигенный потенциал CoNS неоднозначен.
Настоящее исследование показало высокую частоту генов энтеротоксинов в изолятах культур крови: 95,3% изолятов S. epidermidis и 79,8% изолятов S. haemolyticus несут хотя бы один ген токсина. Наиболее частыми обнаруженными генами классического энтеротоксина были sea , seb и sec , а среди всех генов энтеротоксинов наиболее распространенными были seg и sei .Другое исследование [22] также показало более высокий процент sea , seb и sec в CoNS, выделенных из коровьего молока. Кроме того, сообщалось о продукции энтеротоксина А изолятами человеческого CoNS [23]. Описана продукция классических энтеротоксинов SEA, SEB и SEC клиническими изолятами S. epidermidis и SEC S. haemolyticus [5,24], при этом высокий процент изолятов, продуцирующих комбинацию двух или больше токсинов [25].Как и в настоящем исследовании, также сообщалось о наличии генов SEE, SEG, SEH и SEI и продукции этих энтеротоксинов [26], но исследования, показывающие отсутствие или низкую частоту этих генов в CoNS, преобладают в литературе. . Эти различия между исследованиями могут быть связаны с систематической ошибкой в используемом методе и в изученных изолятах, включая количество, природу и географическое происхождение штаммов. Нозокомиальные изоляты могут быть лучше оснащены факторами вирулентности, полученными путем облегченного переноса посредством селективного давления.
В настоящем исследовании 20% штаммов были положительными как для sea , так и для seb . Частое присутствие этих двух генов у одной и той же бактерии объясняется тем, что они занимают один и тот же хромосомный локус [27]. Кроме того, 61,2% из S. epidermidis и 44% из S. haemolyticus оказались положительными как для seg , так и для sei . Несколько исследований [28,29] показали систематическую ассоциацию между seg и sei и высокую частоту этих генов у S.aureus , что также может встречаться при CoNS. Ожидается одновременное присутствие генов seg и sei , поскольку эти два гена обнаружены в кластере egc , который также содержит гены, кодирующие другие стафилококковые энтеротоксины [30].
Staphylococcus epidermidis был указан как CoNS с наивысшим токсигенным потенциалом в некоторых исследованиях [25]. Фактически, этот вид показал более высокий уровень генов энтеротоксина по сравнению с S.haemolyticus (95,3% против ,79,8% соответственно). Остров патогенности, экспрессирующий несколько генов энтеротоксинов, был недавно описан в клиническом изоляте S. epidermidis [31].
Данных о наличии гемолизинов и генов гемолизина в CoNS пока немного. Хотя 81% изолятов S. haemolyticus проявляют β-гемолитическую активность и 40% продуцируют δ-токсин, секвенирование генома не позволило идентифицировать гены, ответственные за гемолиз у этих видов; продемонстрирован только ген α-гемолизина.Праймеры гемолизина, разработанные для S. aureus [32] и S. epidermidis , а также праймеры hld , разработанные из последовательности hld S. simulans (номер доступа GenBank {«type»: «entrez- нуклеотид «,» attrs «: {» text «:» AJ223775.1 «,» term_id «:» 3687333 «}} AJ223775.1; вперед: AAGGGGCAATACACATGRC; обратный: CCGAACGCTTCATTTCCGAT), не удалось обнаружить эти гены в S. haemolyticus . Huseby et al. [33] продемонстрировал видоспецифические различия в β-токсине S . schleiferi и S. epidermidis , белки которых показали 72% и 52% гомологию с β-токсином S. aureus соответственно. Эти различия между β-гемолизинами разных видов CoNS могут быть результатом бактериальной адаптации к широкому кругу потенциальных хозяев [34]. Поскольку праймеры hlb и hld для S. epidermidis не могли идентифицировать эти гены в S. haemolyticus , а гены hlb и hld еще не были описаны у последних видов, хотя они и являются произведенные, как продемонстрировано методом фенотипического обнаружения, могут существовать значительные различия в их последовательностях, что позволяет предположить, что эти токсины имеют различную структуру и, следовательно, разные функции у видов CoNS.
Насколько нам известно, это первое исследование по обнаружению гена hla с использованием специфических праймеров для S. epidermidis и S. haemolyticus . Ген, использованный для конструирования праймера штамма S. epidermidis {«type»: «entrez-nucleotide», «attrs»: {«text»: «W23144», «term_id»: «1299977»}} W23144 был обозначается в GenBank как «α-гемолизин» до июня 2013 года. В тот день авторы изменили обозначение этого гена на « yidD » и классифицировали его как мембранный белок.Согласно предыдущим исследованиям, некоторые члены семейства yidD были аннотированы как гемолизины, что явилось результатом неопубликованного наблюдения, опубликованного в GenBank {«type»: «entrez-nucleotide», «attrs»: {«text»: «L36462″, » term_id «:» 2537795 «}} L36462, что ген hlyA , который является гомологом yidD из Aeromonas hydrophila , обладает активностью α-гемолизина [15,16]. Некоторые базы данных показывают, что yidD является ортологом белков с гемолитической функцией SE1462 из S.epidermidis ATCC 12228 и SERP1356 из S. epidermidis RP62A (http://www.xbase.ac.uk/genome/buchnera-aphidicola-str-sg-schizaphis-graminum/NC_004061/BUsg015;yidD/super/orthologues) .
Ген, кодирующий α-токсин / yidD , был обнаружен в 92,9% изолятов S. epidermidis
и ген hla в 91,7% изолятов S. haemolyticus , в то время как hlb был обнаружен с такой же частотой (92,9%) у S. epidermidis .С другой стороны, другое исследование [13] обнаружило hlb только в 20% из изолятов S. epidermidis и отсутствие hlb во всех штаммах. β-токсин описан в 75% случаев CoNS, а α-гемолиз — в 57% [35]. Натаро и др. [36] наблюдали 61% положительности для β-токсина в CoNS, в то время как в настоящем исследовании продукция β-гемолизина наблюдалась у 81% изолятов S. haemolyticus . Moraveji et al. [37] наблюдали вдвое большую частоту генов и продукции гемолизина в человеческих линиях по сравнению со штаммами животных.Важность hlb и β-токсина обусловлена способностью этого белка способствовать ускользанию бактерий от иммунной системы хозяина и его участием в поглощении питательных веществ [33], обеспечивая выживание патогена.Дивергенция гена hld настолько велика среди видов, что она не может быть амплифицирована в некоторых CoNS [12]. Это разнообразие демонстрируется тем фактом, что частичная идентичность гена этого токсина между S. aureus и S. epidermidis составляет всего 83% [12].То же самое может относиться к S. haemolyticus и может объяснять отсутствие амплификации этого гена праймерами S. epidermidis в настоящем исследовании. δ-гемолизин кодируется регуляторной РНКIII в S. aureus , связанной с системой agr [38], системой, описанной у нескольких видов стафилококков, включая S. epidermidis и S. haemolyticus [39,40] . В настоящем исследовании ген hld был обнаружен у 95,3% из S.epidermidis , а δ-гемолизин продуцировался 40,5% изолятов S. haemolyticus . Согласно Gemmel [41], δ-гемолизин чаще экспрессируется CoNS, изолированным от клинически значимых инфекций, по сравнению с неявными инфекциями человека.
Несмотря на высокую частоту гена hla , наблюдаемую в настоящем исследовании у S. epidermidis и S. haemolyticus , фенотипическая продукция токсина, кодируемого hla , кажется более частой у последних видов, с наибольшим гл, -положительный с.haemolyticus (85%), экспрессирующие α-токсин. Напротив, несмотря на высокую частоту hla / yidD и hlb в S. epidermidis , менее одной трети (30%) изолятов, несущих эти гены, также экспрессировали их. Отсутствие гена и присутствие токсина, наблюдаемые в пяти изолятах S. haemolyticus
и в одном изоляте S. epidermidis , могут быть связаны с мутациями в последовательностях этих генов, такими как последовательности вставки, которые мешают амплификации. гена методом ПЦР.Одним из ограничений настоящего исследования является тот факт, что распространенность токсигенных генов не эквивалентна распространенности экспрессии этих генов. Однако в этом исследовании экспрессия была продемонстрирована гемолизом на кровяном агаре. Необходимы дальнейшие исследования с использованием других методов для оценки экспрессии этих генов, таких как вестерн-блоттинг. Кроме того, секвенирование генома некоторых из этих положительных штаммов будет важным для идентификации этих генов в геномах S.epidermidis и S. haemolyticus .
4. Материалы и методы
4.1. Изоляты
Штаммы были выделены из посевов крови пациентов, поступивших в университетскую больницу Медицинской школы Ботукату (Hospital das Clínicas, Faculdade de Medicina de Botucatu (HC-FMB)), Государственный университет Паулиста (Universidade Estadual Paulista (UNESP)) , Botucatu Campus, между 2000 и 2011 годами. В исследование был включен только один изолят на пациента. Штаммы были выделены, как описано Koneman et al. [42].
4.2. Идентификация видов
Род Staphylococcus был идентифицирован, как описано Koneman et al. [42]. Staphylococcus epidermidis и S. haemolyticus были идентифицированы упрощенным методом, предложенным Cunha et al. [43]. Идентификация видов была генетически подтверждена с помощью ПЦР-амплификации области внутреннего транскрибируемого спейсера (ITS) 16S-23S, как описано Couto et al. [44] после экстракции ДНК с помощью набора Illustra (GE Healthcare, Little Chalfont, Buckinghamshire, UK).Следующие международные эталонные штаммы использовали в качестве контролей: S. epidermidis (ATCC 12228), S. epidermidis (ATCC 35983) и S. haemolyticus (ATCC 29970).
4.3. Обнаружение генов энтеротоксинов
ПЦР для обнаружения генов энтеротоксинов выполняли с использованием праймеров и параметров, описанных Johnson et al. [45] и Cunha et al. [4]. Международные эталонные штаммы были включены во все реакции как положительные ( S.aureus Американская коллекция типовых культур — ATCC 13565 ( sea ), ATCC 14458 ( seb ), ATCC 19095 ( sec ), ATCC 23235 ( sed ), ATCC 27664 ( см. ), ATCC 51811 ( seh ), S. aureus Food Research Institute — FRI 361 ( seg и sei )) и отрицательные ( S. xylosus ATCC 29971) контроли. Последовательности праймеров показаны в.
Таблица 3
Последовательность праймеров и размер ампликона.
| Название | Продукт | Последовательность | Ссылка | Размер ампликона (bp) |
|---|---|---|---|---|
| море-1 | Энтеротоксин A | TTGGAAACGGTTAAAACGAA | [29] | 120 |
| море-2 | GAACCTTCCCATCAAAAACA | |||
| СБ-1 | Энтеротоксин B | TCGCATCAAACTGACAAACG | [29] | 478 |
| СБ-2 | GCAGGTACTCTATAAGTGCC | |||
| сек-1 | Энтеротоксин C | GACATAAAAGCTAGGAATTT | [29] | 257 |
| сек-2 | AAATCGGATTAACATTATCC | |||
| сед-1 | Энтеротоксин D | CTAGTTTGGTAATATCTCCT | [29] | 317 |
| сед-2 | TAATGCTATATCTTATAGGG | |||
| см-1 | Энтеротоксин E | CAAAGAAATGCTTTAAGCAATCTTAGGCCAC | [29] | 170 |
| см-2 | CTTACCGCCAAAGCTG | |||
| сег-1 | Энтеротоксин G | AATTATGTGAATGCTCAACCCGATC | [36] | 642 |
| сег-2 | AAACTTATATGGAACAAAAGGTACTAGTTC | |||
| sei-1 | Энтеротоксин H | CAATCACATCATATGCGAAAGCAG | [36] | 376 |
| seh-2 | CATCTACCCAAACATTAGCACC | |||
| sei-1 | Энтеротоксин I | CTCAAGGTGATATTGGTGTAGG | [36] | 576 |
| sei-2 | AAAAAACTTACAGGCAGTCCATCTC | |||
| гл / yidD_epid-1 | α-гемолизин / жидД | TTTCKCCACTTACACCMCC | Это исследование | 160 |
| гл / yidD_epid-2 | GGAACAGGATCAAAGCCACCT | |||
| hlb_epid-1 | β-гемолизин | TGGTGGCGTTGGTATTGTGA | Это исследование | 541 |
| hlb_epid-2 | ACCCCAAGATTTCACGGACC | |||
| hla_haem-1 | α-гемолизин | TGGGCCATAAACTTCAATCGC | Это исследование | 72 |
| гла-гем-2 | ACGCCACCTACATGCAGATTT | |||
| hld-epid-1 | δ-гемолизин | ATGGCAGCAGATATCATTTC | [30] | 444 |
| hld-epid-2 | CGTGAGCTTGGGAGAGAC |
4.4. Обнаружение генов гемолизина
Ген δ-гемолизина, hld , был обнаружен с использованием праймеров и параметров, описанных Marconi et al. [46].
Ген hla / yidD был обнаружен в изолятах S. epidermidis с использованием праймеров, разработанных с помощью NCBI-PrimerBlast, 2008, и последовательностей штамма S. epidermidis {«type»: «entrez-нуклеотид», «attrs»: {«text»: «W23144», «term_id»: «1299977»}} W23144 (GenBank: {«type»: «entrez-нуклеотид», «attrs»: {«text»: «ACJC01000124.1 «,» term_id «:» 224999876 «}} ACJC01000124.1) (hla / yidD_epid). Ген hla был обнаружен в изолятах S. haemolyticus с использованием праймеров, созданных с помощью PrimerBlast и последовательности штамма JCSC1435 (NCBI : {«type»: «entrez-нуклеотид», «attrs»: {«text»: «NC_007168.1», «term_id»: «70725001»}} NC_007168.1) (hla_haem). Праймеры для hlb ген в S. epidermidis были сконструированы с использованием PrimerBlast и последовательности S. epidermidis RP62A (NCBI: {«type»: «entrez-нуклеотид», «attrs»: {«text»: «NC_002976.3 «,» term_id «:» 57865352 «}} NC_002976.3) (hlb_epid). Праймеры для гена hlb в S. haemolyticus не могли быть сконструированы, поскольку этот ген не был описан у этого вида в База данных NCBI-GenBank. Реакционная смесь содержала 2,0 ед. Полимеразы Taq, 1 × буфер для ПЦР, содержащий 0,75 мМ MgCl 2 , 100 мкМ трифосфат дезоксирибонуклеотидов, 1 М каждого праймера и 150 нг нуклеиновой кислоты. Условия ПЦР были следующими: для гл , один шаг при 94 ° C в течение 4 минут; 35 циклов при 94 ° C в течение 1 минуты, 60 ° C в течение 1 минуты, 72 ° C в течение 1 минуты и 72 ° C в течение 5 минут; для hlb , один шаг при 94 ° C в течение 4 минут, 35 циклов при 94 ° C в течение 1 минуты, 60 ° C в течение 1 минуты, 72 ° C в течение 1.5 мин и 72 ° C в течение 6 мин. Эталонные штаммы были включены во все реакции: гл / йидD _epid: S. epidermidis ATCC 12228; hla _haem: S. haemolyticus ATCC 29970; hlb _epid: S. epidermidis ATCC 12228. Последовательности праймеров показаны на фиг.
4.5. Фенотипическая продукция β- и δ-цитотоксинов
Продукция α-токсина определялась на чашках с кровяным агаром, содержащим 5% кроличьей крови, инкубированных при 37 ° C в течение 24 часов.О положительном результате свидетельствовало образование зон гемолиза вокруг изолированных колоний.
Продукция β- и δ-токсинов в изолятах S. haemolyticus была обнаружена, как описано Hébert и Hancock [47]. β-гемолиз наблюдали по наличию зоны неполного гемолиза на чашке с агаром с бараньей кровью, инкубированной при 37 ° C в течение 24 ч, а затем в течение ночи при 4 ° C [48]. Присутствие δ-токсина подтверждалось синергизмом с β-гемолизином S. aureus ATCC 25923.Для этого изолят наносили штрихами перпендикулярно штамму S. aureus на чашку с агаром с овечьей кровью. Планшет инкубировали при 37 ° C в течение 24 ч, и образование δ-токсина наблюдали по образованию зоны гемолиза в форме стрелки [47].
4.6. Статистический анализ
Тест хи-квадрат использовался для проверки связи между переменными, принимая уровень значимости <0,05.
5. Выводы
Клинические изоляты S.epidermidis и S. haemolyticus проявляют высокий токсигенный потенциал, особенно продуцируя энтеротоксины G и I. Использование новых видоспецифичных праймеров для hla / yidD и hlb для S. epidermidis и для hla из S. haemolyticus выявили высокую частоту этих генов в нозокомиальных изолятах этих видов. Полученные данные демонстрируют важную роль этих генов цитотоксина в становлении этих видов и, возможно, в развитии инфекций, вызванных CoNS.
Благодарности
Эта работа была поддержана государственным финансовым агентством Сан-Паулу Research Foundation (FAPESP — Fundação de Amparo à Pesquisa do Estado de São Paulo; Grant 2011 / 15396-1) и Национальным советом по технологическому и научному развитию (CNPq— Conselho Nacional de Desenvolvimento Científico e Tecnológico; Grant 304729 / 2014-0).
Вклад авторов
Л.П .: задумал исследование, участвовал в его разработке, проводил эксперименты, анализировал данные и составлял рукопись.C.I.B .: участвовал в разработке концепции исследования и в лабораторных экспериментах. А.О .: участвовал в лабораторных экспериментах. P.Y.F.M .: участвовал в разработке праймеров. V.C.P .: участвовал в молекулярных экспериментах. M.L.R.S.C .: задумал исследование, участвовал в его разработке и координации, а также отредактировал рукопись. Все авторы прочитали и одобрили окончательную рукопись.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1.Вуонг К., Отто М. Эпидермальные инфекции, вызванные стафилококком. Микробы заражают. 2002; 4: 481–489. DOI: 10.1016 / S1286-4579 (02) 01563-0. [PubMed] [CrossRef] [Google Scholar] 2. Ирлингер Ф. Оценка безопасности молочных микроорганизмов: Коагулазонегативные стафилококки. Int. J. Food Microbiol. 2008. 126: 302–310. DOI: 10.1016 / j.ijfoodmicro.2007.08.016. [PubMed] [CrossRef] [Google Scholar] 3. Подковик М., Быстронь Я., Баня Дж. Генотипы, устойчивость к антибиотикам и факторы вирулентности стафилококков из готовой к употреблению пищи.Пищевой патогенный микроорганизм. Дис. 2012; 9: 91–93. DOI: 10.1089 / fpd.2011.0962. [PubMed] [CrossRef] [Google Scholar] 4. Cunha M.L.R.S., Calsolari R.A.O., Araújo-Júnior J.P. Выявление генов токсина 1 энтеротоксина и синдрома токсического шока в Staphylococcus с акцентом на коагулазонегативные стафилококки. Microbiol. Иммунол. 2007; 51: 381–390. DOI: 10.1111 / j.1348-0421.2007.tb03925.x. [PubMed] [CrossRef] [Google Scholar] 5. Барретти П., Монтелли А.К., Баталья Дж. Э., Карамори Дж. К., Кунья М.Л.Р.С. Роль факторов вирулентности в исходе стафилококкового перитонита у пациентов с ХПНП.BMC Infect. Дис. 2009; 9: 212. DOI: 10.1186 / 1471-2334-9-212. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Тейлор А.Л., Ллевелин М.Дж. Суперантиген-индуцированная пролиферация CD4 + CD25- Т-клеток человека сопровождается переключением на функциональный регуляторный фенотип. J. Immunol. 2010; 185: 6591–6598. DOI: 10.4049 / jimmunol.1002416. [PubMed] [CrossRef] [Google Scholar] 7. Frase J.D., Proft T. Бактериальный суперантиген и суперантиген-подобные белки. Иммунол. Ред. 2008; 225: 226–243. DOI: 10.1111 / j.1600-065X.2008.00681.x. [PubMed] [CrossRef] [Google Scholar] 9. Коэльо С.М.О., Рейносо Э., Перейра И.А., Соарес Л.С., Демо М., Богни К., Соуза М.М.С. Факторы вирулентности и устойчивость к противомикробным препаратам Staphylococcus aureus , выделенного от мастита крупного рогатого скота в Рио-де-Жанейро. Pesq. Вет. Бюстгальтеры. 2009. 29: 369–374. DOI: 10.1590 / S0100-736X20000002. [CrossRef] [Google Scholar] 10. Пенг Х.Л., Новик Р.П., Крейсвирт Б., Корнблюм Дж., Шливерт П. Клонирование, характеристика и секвенирование дополнительного регулятора гена ( agr ) в Staphylococcus aureus .J. Bacteriol. 1988; 170: 4365–4372. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. МакКевитт А.И., Бьорнсон Г.Л., Маурахер К.А., Шайфеле Д.В. Аминокислотная последовательность дельтоподобного токсина из Staphylococcus epidermidis . Заразить. Иммун. 1990; 58: 1473–1475. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Эвен С., Лерой С., Шарлье К., Закур Н.Б., Чакорнак Дж. П., Леберт И., Жамет Э., Десмонтс М. Х., Котон Э., Почет С. и др. Низкий уровень опасности для безопасности при коагулазонегативных стафилококках, выделенных из ферментированных пищевых продуктов.Int. J. Food Microbiol. 2010; 139: 87–95. DOI: 10.1016 / j.ijfoodmicro.2010.02.019. [PubMed] [CrossRef] [Google Scholar] 13. Оки М.С., Йолоба М.Л., Окелло М., Наджука Ф.С., Катабази Ф.А., Бванга Ф., Нантеза А., Катите Д.П. Распространенность детерминант вирулентности у Staphylococcus epidermidis от пациентов интенсивной терапии в Кампале, Уганда. J. Infect. Dev. Ctries. 2012; 6: 242–250. [PubMed] [Google Scholar] 14. Schleifer K.H., Kloos W.E. Выделение и характеристика стафилококков из кожи человека. Int.J. Syst. Бактериол. 1975; 25: 50–61. DOI: 10.1099 / 00207713-25-1-50. [CrossRef] [Google Scholar] 15. Радд К.Е., Хамфери-Смит И., Васингер В.С., Байроч А. Низкомолекулярные белки: проблема для постгеномных исследований. Электрофорез. 1998. 19: 536–544. DOI: 10.1002 / elps.11501Staphylococcus Epidermidis — обзор
Стафилококковые инфекции
Staphylococcus aureus и Staphylococcus epidermidis являются естественными патогенами, обнаруживаемыми на коже, и поэтому являются наиболее частой причиной ожоговых инфекций. Эти микробы обычно производят пенициллиназы, которые разрушают кольцо β-лактама пенициллина и делают природные пенциллины неэффективными против этих бактерий.
Эти типы инфекций лечили пенициллинами, устойчивыми к пенициллиназе, которые были названы «чувствительными к метициллину».Эти антибиотики включали парентеральные антибиотики, нафциллин, метициллин и оксациллин, а также пероральные антибиотики, клоксациллин, диклоксациллин, нафциллин и оксациллин. Пенициллины, устойчивые к пенициллиназе, имеют механизм действия, аналогичный другим пенициллинам. Они препятствуют синтезу бактериальной клеточной стенки во время активного размножения, связываясь с одним или несколькими пенициллин-связывающими белками. Они ингибируют заключительную стадию транспептидации синтеза пептидогликана, вызывая гибель клеточной стенки и, как следствие, бактерицидную активность против чувствительных бактерий.Однако структура устойчивости стафилококковых бактерий стала такой, что этот устойчивый к пенициллиназе пенициллин больше не очень эффективен против этих организмов. В 2005 г. только 31% из изолятов S. aureus для ожоговой раны в больнице Shriners Burns, Галвестон, Техас (SBH-G) были чувствительны к оксациллину, и ни один из изолятов S. epidermidis и S. haemolyticus не был чувствителен к оксациллину. Стафилококковые инфекции, устойчивые к пенициллинам, устойчивым к пенициллиназе, называются MRSA (метициллин-устойчивый Staphylococcus aureus ) или MRSE (метициллин-устойчивый Staphylococcus epidermidis ).
Ванкомицин отдельно или в сочетании с другими противоинфекционными средствами обычно считается препаратом выбора для лечения инфекций, вызванных устойчивыми к метициллину стафилококками. В 2005 г. 100% всех изолятов стафилококков были чувствительны к ванкомицину в SBH-G. Ванкомицин обладает бактерицидным действием и, по-видимому, связывается со стенкой бактериальной клетки, вызывая блокировку полимеризации гликопептидов. Этот эффект, который возникает в месте, отличном от того, на которое воздействуют пенициллины, вызывает немедленное подавление синтеза клеточной стенки и вторичное повреждение цитоплазматической мембраны. 72 Однако ванкомицин является зависящим от времени противомикробным средством, для которого требуется, чтобы уровень этого препарата в сыворотке всегда оставался выше минимальной ингибирующей концентрации (МИК) для обеспечения адекватной бактерицидной активности.
У пациента с гиперметаболическим ожогом наблюдается повышенная скорость клубочковой фильтрации и повышенная экскреция почечно очищенного препарата ванкомицина. Из-за большой вариабельности элиминации ванкомицина у ожогового пациента у разных пациентов, дозировка должна быть индивидуальной, чтобы обеспечить оптимальную зависящую от времени концентрацию в сыворотке.Эффективные пиковые и минимальные уровни выводятся из МПК для конкретного бактериального организма. Терапевтический пиковый уровень приблизительно эквивалентен 5-8-кратному МИК, а минимальная концентрация эквивалентна 1-2-кратному МИК. Так называемый терапевтический диапазон, наиболее часто указываемый для мониторинга ванкомицина, — это пиковые уровни 30–40 мкг / мл и минимальные уровни 5–10 мкг / мл. Поскольку ванкомицин является антибиотиком, не зависящим от концентрации или зависящим от времени, и поскольку существуют практические проблемы, связанные с определением точной пиковой концентрации в сыворотке с помощью этого многокомпонентного антибиотика, большинство клиницистов отказались от рутинной практики определения пиковых концентраций в сыворотке.
Общее значение AUC / MIC может быть фармакодинамическим параметром, который лучше всего коррелирует с успешным результатом, связанным с использованием ванкомицина. Продолжительное воздействие сывороточных уровней, близких к MIC, связано с возникновением резистентности; поэтому важно поддерживать адекватные концентрации в сыворотке у пациентов с быстро или быстро меняющимся клиренсом креатинина, таких как ожоговые пациенты. Есть также определенные части тела, в которые проникновение затруднено, например, легкие и ЦНС.Также было бы разумно не допускать субоптимальных концентраций у пациентов с пневмонией или менингитом, а также у пациентов, получающих диализ по поводу почечной недостаточности. Американское торакальное общество недавно опубликовало рекомендации по лечению внутрибольничной, вентиляторной и медицинской пневмонии. Эти рекомендации рекомендуют минимальные концентрации ванкомицина 15–20 мкг / мл для лечения метициллин-резистентной пневмонии Staphylococcus aureus . 74 Эти более высокие концентрации могут потребоваться при изолированной инфекции или в ситуациях, когда документально подтверждено, что проникновение ванкомицина является недостаточным.Некоторые врачи рекомендуют, чтобы эти более высокие концентрации ванкомицина также были необходимы при лечении стафилококковых инфекций. Недавнее тестирование показало, что «МИК ванкомицина снижается», что может потребовать более высоких концентраций ванкомицина в сыворотке крови для уничтожения этих микроорганизмов при инфекциях ожоговой раны. 74
Ванкомицин получен из бактерий Streptomyces orientalis и раньше назывался «Миссисипская грязь» из-за коричневого цвета неочищенного продукта.Считается, что эти белковые примеси вызвали ототоксичность и нефротоксичность, которые наблюдались с более ранними продуктами в 1950-х годах. Однако, когда в 1970-х годах были повторно испытаны более новые, более чистые препараты, они не показали ототоксичности и незначительной нефротоксичности на животных моделях, если только их не вводили в комбинации с аминогликозидами. 74 В одном из крупнейших на сегодняшний день расследований Pestotnik et al. сообщили, что частота нефротоксичности среди 1750 пациентов составила 1,4%. 74 Однако у ожоговых пациентов ванкомицин часто используется не только в комбинации с другими ототоксическими и нефротоксическими агентами, такими как аминогликозиды, петлевой диуретик, фуросемид и противогрибковый препарат амфотерицин.Нефротоксичность проявляется кратковременным повышением уровня азота мочевины в сыворотке крови (АМК) или креатинина сыворотки и снижением скорости клубочковой фильтрации и клиренса креатинина. Гиалиновые и зернистые цилиндры и альбумин также могут быть обнаружены в моче.
Ванкомицин вводят только путем медленной внутривенной инфузии в течение не менее 1 часа. Хотя инъекция ванкомицина намного чище, она все же может вызвать анафилактоидную реакцию, известную как «синдром красного человека» или «синдром красной шеи». Эта реакция характеризуется внезапным снижением артериального давления, которое может быть серьезным и может сопровождаться приливом крови и гиперемией. / или пятнисто-папулезная или эритематозная сыпь на лице, шее, груди и верхних конечностях; последнее проявление может возникать и при отсутствии гипотонии.Поскольку это не настоящая «аллергическая реакция», пациента можно предварительно обработать ацетаминофеном и дифенгидрамином перед продолжительной инфузией ванкомицина продолжительностью не менее 90–120 минут.
Пероральное лечение MRSA и MRSE может стать более сложной задачей для ожогового врача. Рифампицин является бактерицидным антибиотиком и эффективен при лечении этих организмов. В 2005 г. чувствительность к рифампицину S. aureus составляла 64%, S. epidermidis — 74% и S. haemolyticus — 76%.Рифампин оказывает свое действие путем ингибирования синтеза РНК в бактериях, связывания с субъединицей b ДНК-зависимой РНК-полимеразы и блокирования транскрипции РНК. 72 Однако он должен использоваться в сочетании с другими противоинфекционными средствами при лечении MRSA и MRSE из-за его высокой устойчивости при использовании отдельно. Другие противоинфекционные препараты с другим механизмом действия против MRSA и MRSE снижают устойчивость к рифампицину. Пероральные антибиотики, такие как Бактрим® (сульфаметоксазол и триметоприм) или левофлоксацин, часто используются вместе с рифампицином.В 2005 г. в SBH-G чувствительность S. aureus была на 64%, S. epidermidis — на 71%, а S. haemolyticus — только на 29% к комбинированному антибиотику сульфаметоксазол / триметоприм.
Сульфаметоксазол препятствует синтезу и росту бактериальной фолиевой кислоты за счет ингибирования образования дигидрофолиевой кислоты из парааминобензойной кислоты; триметоприм ингибирует восстановление дигидрофолиевой кислоты до тетрагидрофолата, что приводит к последовательному ингибированию ферментов пути фолиевой кислоты. 72
В 2005 г. в SBH-G S. aureus показали 47% чувствительность, S. epidermidis — 49% чувствительность и S. haemolyticus — 24% чувствительность к левофлоксацину. Левофлоксацин оказывает антибактериальное действие, ингибируя ДНК-гиразу в восприимчивых организмах. Таким образом, это действие препятствует релаксации сверхспиральной ДНК и способствует разрыву цепей бактериальной ДНК. 72
Линезолид — синтетический антибактериальный агент нового класса антибиотиков, оксазолидинонов, который пополнил арсенал против MRSA и MRSE.Линезолид подавляет синтез бактериального белка путем связывания с сайтом бактериальной 23S рибосомной РНК 50S субъединицы и предотвращает образование функционального инициирующего комплекса 70S, который является важным компонентом процесса бактериальной трансляции. 72 Результаты исследований тайм-килла показали, что линезолид обладает бактериостатическим действием в отношении энтерококков и стафилококков. Для стрептококков линезолид оказался бактерицидным для большинства штаммов. Исследования in vitro , однако, показывают, что точечные мутации в 23S рибосомной РНК связаны с устойчивостью к линезолиду и были зарегистрированы с некоторыми штаммами Enterococcus faecium и Staphylococcus aureus . 72 В 2005 г. в SBH-G S. aureus и S. epidermidis показали 96% чувствительность, а S. haemolyticus продемонстрировали 99% чувствительность к линезолиду.
Неблагоприятные эффекты препарата для линезолида включают миелосупрессию (например, лейкопению, анемию, панцитопению и тромбоцитопению), которая обычно обратима после отмены препарата, и колит, ассоциированный с Clostridium difficile и . Линезолид также является слабым, неселективным, обратимым ингибитором моноаминоксидазы (МАО) и может вызывать повышение уровня серотонина в сыворотке и серотониновый синдром у пациентов, принимающих различные ингибиторы обратного захвата серотонина, такие как флуоксетин и сертралин.
Стафилококковые инфекции также можно лечить хинупристином / далфопристином (Синерцид®). Хинупристин / далфопристин обладает бактерицидным действием и подавляет синтез бактериального белка, связываясь с различными участками 50S рибосомной субъединицы, тем самым подавляя синтез белка в бактериальной клетке. 72 В 2005 г. в SBH-G чувствительность S. aureus составила 97%, S. epidermidis — 99%, а S. haemolyticus — 100%.
Серьезные неблагоприятные сердечно-сосудистые эффекты наблюдаются при одновременном применении хинупристина / далфопристина с субстратами изофермента 3А4 цитохрома P-450, такими как циклоспорин, мидазолам и нифедипин, которые могут вызывать удлинение интервала QT. 72 Сопутствующее введение приводит к увеличению сывороточных концентраций этих субстратов и потенциально пролонгированному / усиленному терапевтическому или побочному эффекту. Clostridium difficile -ассоциированные с этим препаратом диарея и колит, варьирующиеся по степени тяжести от легкой до опасной для жизни, также были зарегистрированы.Возможны побочные эффекты со стороны вен (например, тромбофлебит); поэтому рекомендуется промывать инфузионные линии инъекцией 5% декстрозы после завершения периферических инфузий. Не промывайте инъекцией хлорида натрия или гепарином из-за возможной несовместимости. Сообщалось об артралгии и миалгии, в некоторых случаях тяжелой степени неизвестной этиологии. У некоторых пациентов улучшение произошло при уменьшении частоты дозирования до 12 часов. 72
Staph
StaphОкраска по Граму: Окраска по Граму — это лабораторный метод окрашивания, который различает две группы бактерий, которые имеют различия в структура их клеточных стенок.Стандартная бактериальная систематика делает различие между грамотрицательными бактериями, окрашивающими красный / розовый цвет и грамположительные бактерии, окрашивающие в синий / фиолетовый цвет. Другой противомикробные препараты направлены именно на грамположительные бактерии и грамотрицательные бактерии.
Грамм + кластеры кокков Слайд-тест на коагулазу : Слайд-тест на коагулазу обнаруживает связанную коагулазу (фактор слипания). Этот тип коагулазы прикрепляется к стенкам (поверхности) бактериальных клеток.Этот тест обычно выполняется на предметном стекле. Пробирка на коагулазный тест : Используется коагулазный тест для дифференциации Staphylococcus aureus от коагулазонегативного стафилококки. В тесте используется кроличья плазма, инокулированная стафилококковая колония. Затем пробирку инкубируют при 37 градусах. Цельсия на 1-1 / 2 часа. Если отрицательный, то инкубация продолжается до 24 часа. Этот тест обнаруживает свободную коагулазу (коагулазу, которая высвобождается бактериальными клетками в культуру).Положительный результат (т.е. подозреваемая колония — S. aureus ). Сыворотка будет коагулируют, в результате чего образуется сгусток (иногда сгусток настолько выражен, что жидкость полностью застынет).
Отрицательный, плазма остается жидкой. Отрицательный результат может быть S. epidermidis . Тест каталазы : Каталаза тест используется для дифференциации некоторых видов бактерий.Тест сделан поместив каплю перекиси водорода на предметное стекло микроскопа. Используя аппликатор, небольшая часть колонии затем добавляется к капле капля перекиси водорода.
- Если образуются пузырьки или пена, организм считается каталазоположительным. Стафилококки и микрококки являются каталазоположительными
- Если пузырьки не образуются, организм отрицательный по каталазе. Стрептококки и энтерококки отрицательны по каталазе
Положительный результат (т.е. подозреваемая колония — S. aureus ). Сыворотка будет коагулируют, в результате чего образуется сгусток (иногда сгусток настолько выражен, что жидкость полностью застынет).
Отрицательный, плазма остается жидкой. Отрицательный результат может быть S. epidermidis . Тест PYR : тест PYR является качественным процедура определения способности стрептококков ферментативно гидролизуют L-пирролидонил-β-нафтиламид (PYR). Положительный тест PYR позволяет предположительно идентифицировать стрептококки группы А ( Streptococcus pyogenes ) и энтерококки группы D. Негемолитический (γ-гемолиз) : Если организм не вызывает гемолиза на пластине кровяного агара, говорят, что отображать гамму или нет гемолиза. Агар под колонией и вокруг нее без изменений. Альфа гемолиз (α-гемолиз) : Альфа-гемолиз — это неполный лизис эритроцитов вокруг и под колониями на чашке с кровяным агаром.Эта область кажется темной и зеленоватый. Streptococcus pneumoniae и группа стрептококков ( Streptococcus viridans или viridans streptococci), обнаруженные в флоре полости рта, показывают альфа гемолиз.
Бета гемолиз (β-гемолиз) : Бета-гемолиз — это полный лизис эритроциты вокруг и под колониями на пластине с кровяным агаром. Эта область кажется прозрачной. Streptococcus pyogenes дисплеев бета-гемолиз и часто называют бета-гемолитическим стрептококком группы А (GABHS). Тест PYR : тест PYR является качественным процедура определения способности стрептококков ферментативно гидролизуют L-пирролидонил-β-нафтиламид (PYR). Положительный тест PYR позволяет предположительно идентифицировать стрептококки группы А ( Streptococcus pyogenes ) и энтерококки группы D. .

 Используйте короткую иглу; чтобы защитить кератин, игла должна входить в сосковый канал не глубже 3 мм.
Используйте короткую иглу; чтобы защитить кератин, игла должна входить в сосковый канал не глубже 3 мм.