Что такое инфекционный мононуклеоз — как развивается заболевание и чем лечится
Инфекционный мононуклеоз — болезнь вирусной этиологии, которая проявляется острым воспалением миндалин, повышением температуры тела, увеличением печени, селезёнки и лимфоузлов. Специфическим признаком патологии является появление в крови особых клеток — атипичных мононуклеаров.
Инкубационный период мононуклеоза составляет от 14 до 40 дней. Это значит, что в этот период человек уже инфицирован, но любые клинические проявления болезни у него отсутствуют. Заболевание может протекать бессимптомно, но даже в этот период человек выделяет вирус и способен заразить других. Дети болеют чаще взрослых.
Причины заболевания и пути передачи инфекции
Мононуклеоз, причиной которого является инфицирование вирусом Эпштейна-Барр, передаётся воздушно-капельным путём через слюну.
Заболевание происходит только при тесном контакте. Возможна передача вируса при переливании крови или пересадке органов, но это встречается крайне редко.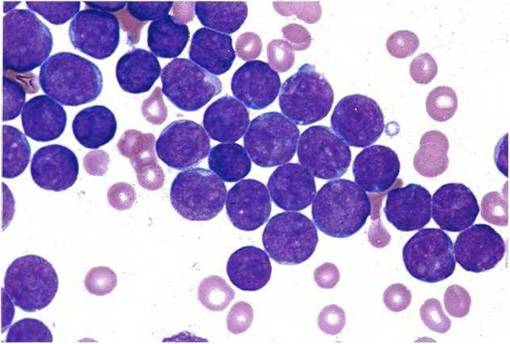
Часто инфекция протекает бессимптомно или с неспецифическими симптомами (особенно у младенцев и детей младшего возраста, а также людей пожилого возраста).
Основными симптомами являются:
1. Фрингит, тонзиллит, ангина.
2. Высокая температура.
3. Увеличение лимфоузлов.
4. Гепатоспленомегалия. Синдром, характеризующийся одновременным увеличением селезёнки и печени.
Для диагностика мононуклеоза используют лабораторные методы исследования, инструментальные методы. Например, ультразвуковое исследование (УЗИ) брюшной полости для визуализации печени и селезёнки.
1.Общий анализ крови (ОАК). Для первых дней заболевания характерно снижение уровня лейкоцитов. Затем их уровень повышается за счёт увеличения числа лимфоцитов и моноцитов.
 Наиболее специфическим признаком при диагностике инфекционного мононуклеоза является выявление атипичных мононуклеаров (вироцитов). Их количество достигает 15-20% от всего числа лейкоцитов. При выявлении вироцитов в крови другие методы диагностики могут не применяться.
Наиболее специфическим признаком при диагностике инфекционного мононуклеоза является выявление атипичных мононуклеаров (вироцитов). Их количество достигает 15-20% от всего числа лейкоцитов. При выявлении вироцитов в крови другие методы диагностики могут не применяться.2.Иммуноферментный анализ (ИФА). Используется в том случае, если в ОАК не выявлены атипичные мононуклеары, а клинические проявления указывают на мононуклеоз. При помощи этого метода выявляются антитела к ВЭБ. При острой форме появляются IgM-антитела, которые исчезают через 3-4 месяца после болезни. Они не появляются после реинфекции или рецидива. Выявление IgG-антител свидетельствует о перенесённом заболевании. Антитела этого класса сохраняются всю жизнь.
4.Биохимический анализ крови (печеночные пробы).
Лечение мононуклеоза направлено на обезвреживание его возбудителя — вируса Эпштейна-Барра.
 Для этого назначаются специальные препараты, антибиотики, кортикостероиды (в особых случаях) и проводят симптоматическую терапию. Лечение направляется и на восстановление печени.
Для этого назначаются специальные препараты, антибиотики, кортикостероиды (в особых случаях) и проводят симптоматическую терапию. Лечение направляется и на восстановление печени.Один из часто задаваемых вопросов «Может ли повториться заражение мононуклеозом?» Заразиться повторно мононуклеозом нельзя, так как после первой встречи с инфекцией (неважно, возникло заболевание или нет) человек становится ее носителем на всю жизнь.
Профилактика:
• Закаливание
• Здоровый образ жизни
Материал подготовила:
ГБУ РО «ОКБ им.Н.А.Семашко»
Клинико-диагностическая лаборатория
Врач КДЛ Матюхина Д.И.
Инфекционный мононуклеоз у детей. Симптомы и лечение
Инфекционный мононуклеоз у детей вызывается вирусом Эпштейн-Бара (ВЭБ). Это заболевание может протекать в различных формах. Заболевают дети в возрасте от 2 – 3 х лет и старше, как правило при контакте в организованных коллективах (детский сад, ясли, школа). Вирус от человека к человеку передается с инфицированной слюной от больного ребенка или носителя. Поэтому, иногда инфекционный мононуклеоз еще называют болезнью поцелуев.
Вирус от человека к человеку передается с инфицированной слюной от больного ребенка или носителя. Поэтому, иногда инфекционный мононуклеоз еще называют болезнью поцелуев.
Маленькие дети заражаются через игрушки в игровых комнатах. Чаще отмечается острое начало заболевания следующими симптомами:
- повышение температуры тела,
- головная боль,
- боли в мышцах и суставах,
- беспокоят боли в горле, значительно усиливающиеся при глотании,
- затрудненное носовое дыхание,
- увеличение лимфатических узлов шеи, реже в других локализациях (пах, подмышечные впадины).
Острота заболевания нарастает к 4–6-му дню, в ряде наиболее тяжелых случаев инфекционного мононуклеоза к 3–4-му дню отмечается увеличение живота у ребенка за счет увеличения размеров печени и селезенки (гепатоспленомегалия). В некоторых случаях возможно подострое начало болезни с невыраженными симптомами. Основными симптомами инфекционного мононуклеоза являются: лихорадка (повышение температуры тела до 39), тонзиллит, генерализованная лимфаденопатия (увеличение лимфоузлов всего тела), гепатоспленомегалия, кожная сыпь (у 30% больных — эритематозные, розеолезные, папулезные и др. высыпания).
высыпания).
Помимо клинических симптомов для постановки диагноза необходимо лабораторное исследование. С первых дней болезни в анализе крови лейкопения и нейтропения, лимфоцитоз, плазматические клетки. Характерные изменения в периферической крови появляются после 5-го дня болезни: развивается лейкоцитоз до 10–13 × 109/л (возможен гиперлейкоцитоз до 18–20 × 109/л), лимфомоноцитоз, возрастает количество плазматических клеток, появляются атипичные монолимфоциты (10–60% и выше).
Иммунологическое исследование крови показывает нарастание уровня антител к вирусу Эпштейн-Бара, так же этот вирус появляется в слюне ребенка при исследовании методом ПЦР диагностики. На УЗИ брюшной полости выявляются увеличенные печень и селезенка и мезентеральные лимфатические узлы. Диагноз инфекционного мононуклеоза выставляется врачом педиатром по совокупности клинических и лабораторно-инструментальных данных. При правильно назначенном лечении врачом педиатром выздоровление наступает через 2–4 недели, но могут сохраняться признаки лимфоаденопатии (увеличение аденоидов и небных миндалин, лимфоузлов), гепатоспленомегалия, атипичные мононуклеары в крови, что указывает на затяжное течение ВЭБ инфекции. При хроническом инфекционном мононуклеозе отмечаются персистирующая лимфоаденопатия, гепатит, спленомегалия, гипоплазия костного мозга, интерстициальная пневмония. Пациенты с такими формами заболевания должны лечиться при непосредственном участии врача иммунолога.
При хроническом инфекционном мононуклеозе отмечаются персистирующая лимфоаденопатия, гепатит, спленомегалия, гипоплазия костного мозга, интерстициальная пневмония. Пациенты с такими формами заболевания должны лечиться при непосредственном участии врача иммунолога.
Инфекционный мононуклеоз у детей (болезнь поцелуев). Симптомы и диагностика.
Инфекционный мононуклеоз — это острое инфекционное вирусное заболевание, которое впервые было описано в 1885 году Н.Ф.Филатовым. При данном заболевании происходит увеличение размеров селезенки и печени (гепатоспленомегалия), появляются атипичные мононуклеары в крови, увеличиваются лимфатические узлы.
Инфекционный мононуклеоз вызывает вирус Эпштейн-Барр — это вирус герпеса 4 типа. Вирус в организм чаще всего попадает воздушно-капельным путем, особенно при поцелуе, кашле, чихание, также его второе название «болезнь поцелуев». Возможен еще контактный путь, например, когда пользуются общей посудой и через кровь при переливании крови.
Чаще болеют дети до 5 лет (около 50% зараженных в этой возрастной группе). Вирусом также заражено большинство и взрослых людей (около 80%), но активация вируса, то есть само заболевание встречается не так часто.
Инкубационный период заболевания от 5 до 15 дней, но бывает и до 45 дней.
Заболевание может начинаться, как ОРВИ, то есть слабость, недомогание, болит горло, повышается температура. В разгар болезни температура может повышаться до 39 градусов и выше, появляется отечность век, кашель, насморк, увеличение печени, селезенки, лимфоузлов. Увеличенные лимфоузлы прощупываются в любой группе, однако чаще страдают подчелюстные, затылочные и заднешейные зоны. Лимфоузлы определяются как плотные подвижные образования, болезненность которых выражается слабо либо отсутствует вообще.
Иногда встречается кишечная форма инфекционного мононуклеоза — неоформленный стул, боли в животе, слабость. Часто инфекционный мононуклеоз протекает скрыто, только чувство усталости и общего недомогания.
Диагностика инфекционного мононуклеоза.
Первым этапом в диагностике является посещение врача — педиатра или семейного врача.
Вторым этапом — сдача анализов : клинический анализ крови (КАК) для выявления атипичных мононуклеаров, увеличения СОЭ и лейкоцитов. Также для более точной диагностики требуется сдать кровь на антитела.
Третьим этапом являются дополнительные методы диагностики — ультразвуковая диагностика: увеличение печени и селезенки можно при УЗИ брюшной полости. Вы можете пройти обследование в клинике «Заботливый Доктор»
В клинике «Заботливый Доктор» в Колпино Вы можете пройти полное обследование на инфекционный мононуклеоз.
Если у Вас есть вопросы, звоните по телефону: 604-22-00, 8951-661-77-44.
Инфекционный мононуклеоз — Кабинет инфекционных заболеваний — Отделения
Клиника. Инкубационный период 5-14 дней, в редких случаях удлиняется до 1 мес. Клинические проявления при инфекционном мононуклеозе очень многообразны.
В ряде случаев может иметь место и подострое начало заболевания с продромальными явлениями: на фоне общего недомогания отмечаются субфебрильная температура тела, нерезко выраженные катаральные изменения со стороны верхних дыхательных путей.
У отдельных больных ведущей жалобой является боль в животе, чаще в правой подвздошной области, иногда наблюдаются тошнота и рвота, вздутие живота, задержка стула или понос.
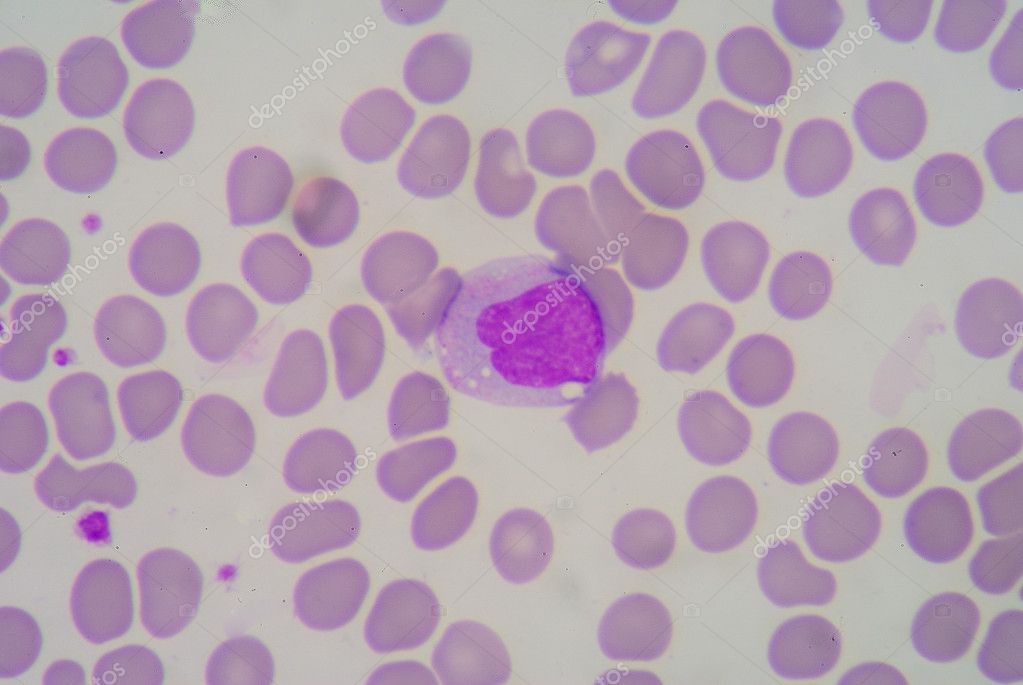
Заболевание может развиваться и незаметно; при этом первым симптомом, который заставляет больного обратиться к врачу, является увеличение лимфатических узлов
Однако наиболее характерными для инфекционного мононуклеоза симптомами являются: лихорадка, тонзиллит, генерализованная лимсраденопатия и гепатосппеномеаалия.
Температурная реакция очень вариабельнаи может сохраняться от 1-2 дней до 3 нед и дольше. У 1/3 больных в первые дни температура тела субфебрильная и отчетливо повышается до 38 «С и выше только к концу первой недели заболевания. Более высокая и продолжительная лихорадка отмечается у взрослых и детей старшего возраста. У отдельных больных наблюдается двух- и трехволновая лихорадка с периодами апирексии в несколько дней. В среднем длительность лихорадки составляет 6-10 дней.
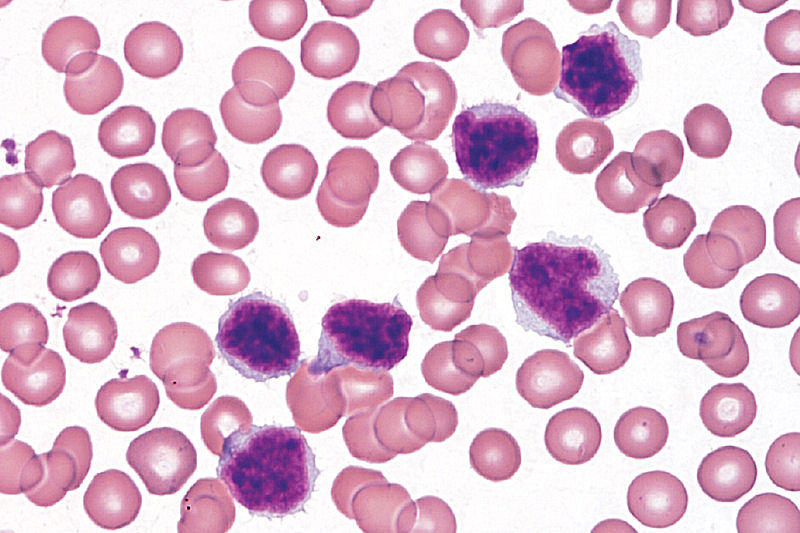 Необходимо отметить, что после основной волны лихорадки часто сохраняется субфебрильная температура тела.
Необходимо отметить, что после основной волны лихорадки часто сохраняется субфебрильная температура тела.Температурная реакция сочетается с другими симптомами, в первую очередь — с изменениями в глотке. Небольшая гиперемия в зеве и гиперплазия миндалин наблюдаются у многих больных с первых дней болезни. Нередко эти изменения сочетаются с поражением носоглотки. Клинически это проявляется затрудненным носовым дыханием и гнусавым оттенком голоса. Одновременно отмечается значительная отечность небных миндалин, которые могут соприкасаться друг с другом. Если удастся осмотреть заднюю стенку глотки, то обнаруживают ее отек и гиперемию с явлениями гиперплазии лимфоидной ткани; у части больных задняя стенка глотки может быть покрыта густой слизью. Через 3-4 дня после начала болезни на миндалинах появляются различной величины рыхлые, творожи стовидные налеты, легко снимаемые шпателем. В отдельных случаях налеты могут локализоваться на задней стенке глотки, у корня языка и даже на надгортаннике.
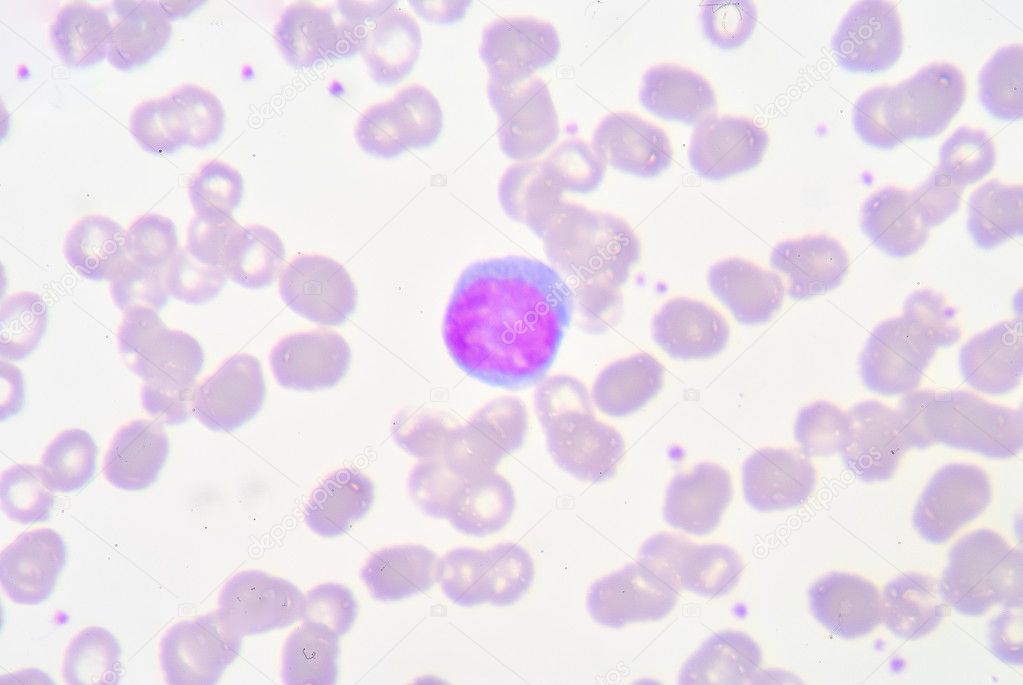 Изменения в зеве сопровождаются лихорадкой. Длительность поражения глотки составляет 10-15 дней; при своевременном и адекватном лечении ангина проходит быстрее.
Изменения в зеве сопровождаются лихорадкой. Длительность поражения глотки составляет 10-15 дней; при своевременном и адекватном лечении ангина проходит быстрее.У больных с удаленными миндалинами реакция лимфоидной ткани глотки проявляется в виде увеличения боковых валиков и гранул задней стенки глотки.
Температурная реакция и изменения в глотке сочетаются с развитием лимфаденопатии. Часто увеличены все лимфатические узлы, но наиболее выражено увеличение шейных лимфоузлов, особенно тех, которые располагаются по заднему краю грудино-ключично-сосцевидной мышцы; они могут иметь вид цепочки или пакета. У детей младшего дошкольного возраста лимфатические узлы могут образовывать большие конгломераты диаметром до 4-6 см. У детей школьного возраста и у взрослых лимфатические узлы увеличиваются до 2-3 см, создавая «фестончатое» очертание контуров шеи. Иногда у взрослых может быть небольшое увеличение лимфатических узлов, которое остается незамеченным.
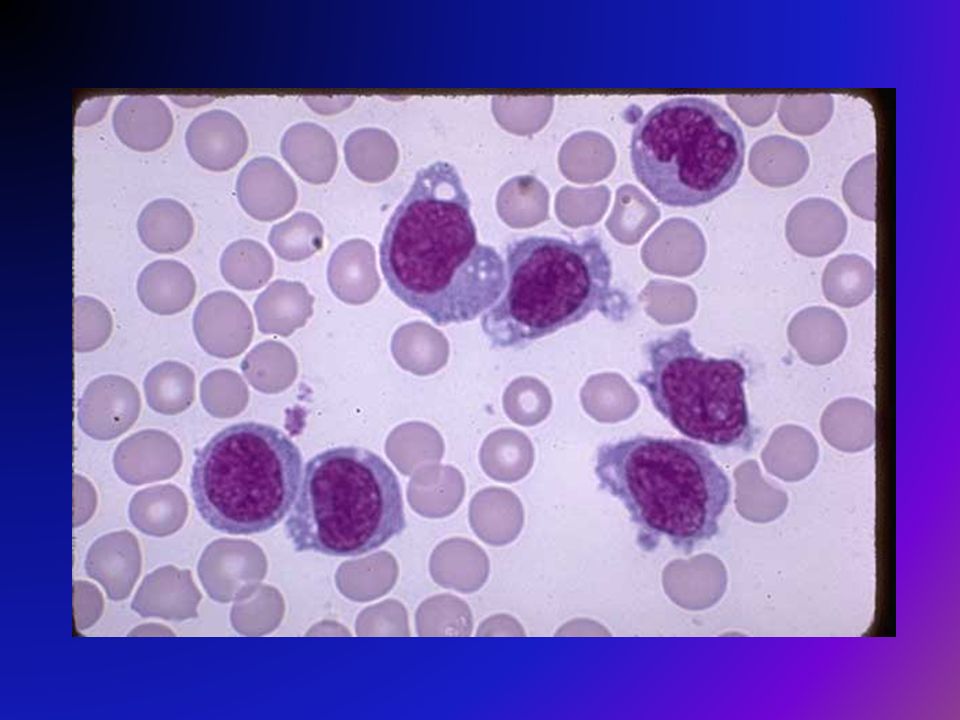 При пальпации они «сочные», плотновато-эластичные, подвижные. Периаденит, покраснение кожи и нагноительные процессы никогда не наблюдаются. Увеличение лимфатических узлов может быть первым признаком болезни. Улиц, страдающих хроническим тонзиллитом, рано увеличиваются лимфоузлы, расположенные у угла нижней челюсти.
При пальпации они «сочные», плотновато-эластичные, подвижные. Периаденит, покраснение кожи и нагноительные процессы никогда не наблюдаются. Увеличение лимфатических узлов может быть первым признаком болезни. Улиц, страдающих хроническим тонзиллитом, рано увеличиваются лимфоузлы, расположенные у угла нижней челюсти.Одновременно могут быть увеличены и другие группы лимфатических узлов — подмышечных, кубитальных и паховых (реже — мезентериальныхили медиастинальных). При увеличении медиастинальных лимфатических узлов больных может беспокоить кашель, боли в области сердца разной интенсивности и продолжительности.
Увеличение лимфоузлов сохраняется в течение 1-2 нед, а иногда умеренная лимфаденопатия наблюдается 1,5-2 меси более.
На З-4-ый день болезни увеличиваются печень и селезенка. Гепатомегалия сопровождается чувством тяжести в правом подреберье, слабостью, снижением аппетита, иногда тошнотой, реже рвотой. Нередко отмечаются умеренные гипербилирубинемия, повышение активности АлАТ, тимоловой пробы.
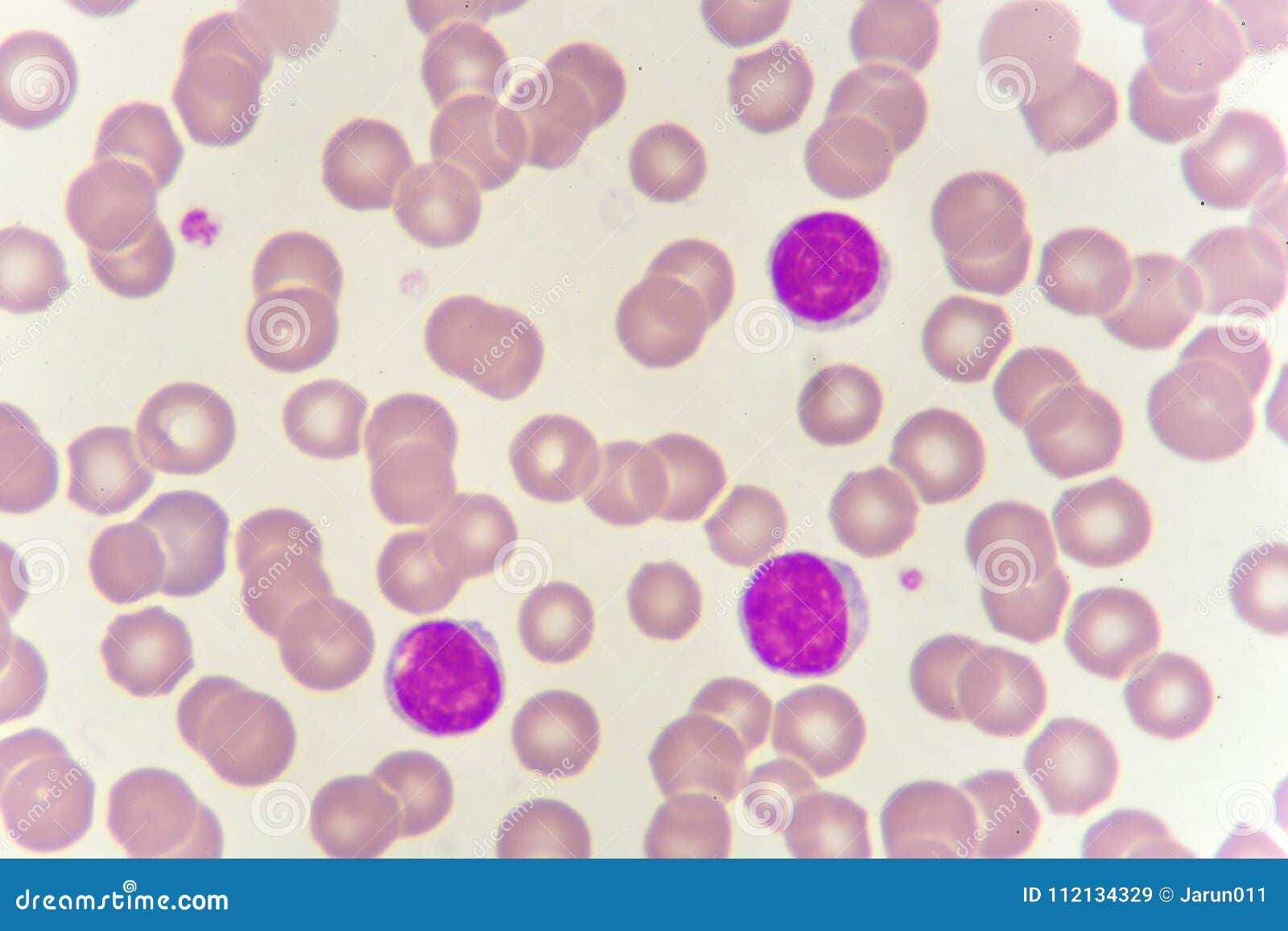 л, увеличивается количество лимфоцитов, моноцитов и плазматических клеток, появляются своеобразные атипичные мононуклеары, отличающиеся большим полиморфизмом по форме и структуре.
л, увеличивается количество лимфоцитов, моноцитов и плазматических клеток, появляются своеобразные атипичные мононуклеары, отличающиеся большим полиморфизмом по форме и структуре.В большинстве случаев атипичные мононуклеары обнаруживают в крови в первые дни болезни, но особенно их число увеличивается в разгар болезни. Реже появление мононуклеаров может быть отмечено на 8-11-й дни болезни. Эти клетки сохраняются на протяжении нескольких недель, но постепенно их количество уменьшается.
Среди клеток «белой крови» доля мононуклеаров колеблется от 10 до 50% и выше. В отдельных случаях в разгар болезни все мононуклеары могут быть атипичными, причем их количество коррелирует с тяжестью болезни.
Инфекционный мононуклеоз у большинства больных заканчивается выздоровлением через 2-4 нед. Однако у некоторых пациентов длительно сохраняются лимфаденопатия, гепатоспленомегалия, атипичные мононуклеары в крови, что свидетельствует о затяжном, а, возможно, и хроническом течение инфекции. Для последнего характерны: персистирующие лимфаденопатия и ВЭБ-гепатит, спленомегалия, интерстициальная пневмония, гипоплазия костного мозга, иногда — увеит.
Для последнего характерны: персистирующие лимфаденопатия и ВЭБ-гепатит, спленомегалия, интерстициальная пневмония, гипоплазия костного мозга, иногда — увеит.
Диссеминированная (септическая) ВЭБ-инфекция встречается на фонетяжелой иммуносупрессии у больных СПИДом, при трансплантации органов и характеризуется неблагоприятными исходами.
Осложнения инфекционного мононуклеоза, протекающего на фоне иммунодефицита, могут быть по своей природе: гематологическими (аутоиммунная гемолитическая анемия, тромбоцитопения, гранулоцитопения, разрыв селезенки), кардиологическими (перикардит, миокардит) и неврологическими (менингит, менингоэнцефалит, миелит, нейропатии).
Диагностика. Клиническая диагностика инфекционного мононуклеоза с использованием данных гемограммы не позволяет окончательно верифицировать этиологию заболевания. Для этого в настоящее время применяют иммунохимический (ИФА) и молекулярно-биологические (ПЦР, РТ-ПЦР, гибридизация) методы диагностики. Широко использовавшиеся ранее реакции гетероагглютинации — Пауля-Буннеля, Гоффа-Бауера, Ловрика-Вольнера во многом утратили свое значение.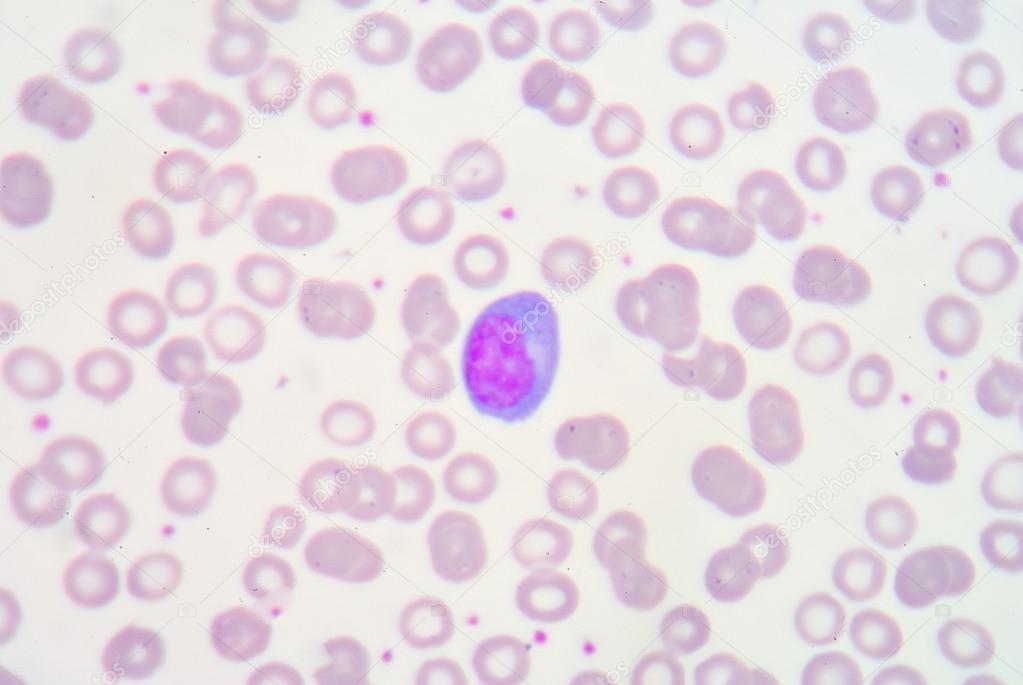
Лечение. Больных со среднетяжелыми, тяжелыми и осложненными формами инфекции госпитализируют в инфекционный стационар.
Больным, находящимся на амбулаторном лечении, рекомендуется полу постельный режим, щадящая диета, уход за полостью рта (полоскание раствором фурацилина, йодинолом, бикарбонатом натрия и др.), поливитамины с микроэлементами, фитосредства с антиоксидантным и иммуностимулирующим действием (эхинацея, корень солодки, цетрария исландская, гербам арин).
При фебрильной температуре тел а назначают жаропонижающие препараты (панадол, парацетамол и др.). Проводят десенсибилизирующую терапию. Антибиотики применяют только при осложнении вторичной бактериальной инфекцией (фолликулярный, лакунарный тонзиллит, пневмония). Антибактериальную терапию назначайте учетом предполагаемого возбудителя. В случае инфекции ротовой полости используютмакролиды, пенициллины, тетрациклины, при необходимости в сочетании с трихополом с учетом возможной стрептококковой и анаэробной природы осложнения.
Не рекомендуется использовать левомицетин и сульфаниламидные препараты из-за их неблагоприятного действия на костномозговое кроветворение.
Из противовирусных препаратов, активных в отношении ВЭБ, используют ацикловир в дозе 800 мг 5 раз в сутки перорально или по 5 мг/кг каждые 8 ч внутривенно капельно.
При неэффективности Ац в тяжелых случаях заболевания назначаются видарабин в дозе 7,5-15 мг/кг/сут внутривенно капельно в большом объеме изотонического раствора (1,5-2,5 л) или фоскарнет по 60 мг/кг 3 раза в сутки внутривенно капельно с последующим переходом на введение препаратав дозе 90-120 мг/ кг/сут.
Изучается возможность использования при данной инфекции лобукавира, бривудинаи цидофовира.
Назначение корти костер оидных гормонов нежелательно.
Профилактика. Госпитализация больных проводится по клиническим показаниям. Противоэпидемические мероприятия в очаге не осуществляют. После перенесенного инфекционного мононуклеоза больной подл ежит диспансер ном у наблюдению инфекциониста и гематолога в течение 6 мес, с обязательным лабораторным обследованием (гемограмма, функциональные пробы печени).
Поскольку острая фаза ВИЧ-инфекции имеет сходный с инфекционным мононуклеозом симптомокомплекс, рекомендуется тестирование реконвалесцентов на ВИЧ через 3 и 6 мес.
Инфекционный мононуклеоз
Дата публикации: .
Врач лабораторной диагностики (заведующий)
клинико – диагностической лаборатории
Евтух И.И.
Инфекционный мононуклеоз — это заболевание, возбудителем которого является вирус Эпштейна-Барр.
Вирус Эпштейна-Барр относится к семейству герпесвирусов. Основной источник инфекции —люди, зараженные вирусом Эпштейна-Барр. Вирус выделяется во внешнюю среду со слюной, и передача происходит воздушно-капельным путем. При заражении вирус попадает в ротоглотку, проникает в ее слизистую оболочку и лимфоциты, в которых размножается и разносится по всему организму, вызывая заболевание. После перенесенного заболевания в организме вырабатывается стойкий иммунитет.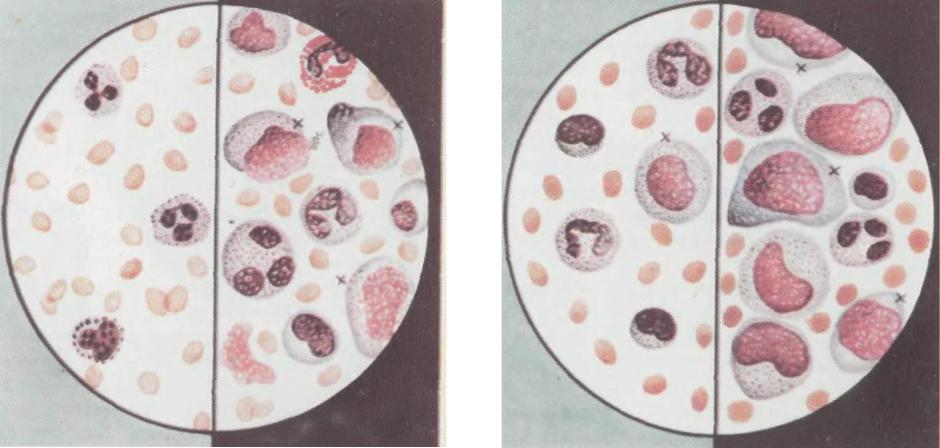
Чаще всего заражение происходит в детском и юношеском возрасте. По статистике около 90% взрослых людей имеют антитела к вирусу Эпштена-Барр, и следовательно, они хотя бы один раз в жизни сталкивались с этой инфекцией.
Инкубационный период продолжается от 4 до 6 недель.
Заболевание начинается остро. У больного появляются слабость, головная боль, боли в мышцах и суставах, боль в горле при глотании, нарушаются сон и аппетит, повышается температура тела до 38-39 о С. Затем отмечается увеличение шейных лимфатических узлов и небных миндалин (ангина). В процессе заболевания всегда в той или иной мере увеличивается печень и селезенка. Заболевание продолжается около 2-4 недель, затем начинается постепенное выздоровление.
Диагностика инфекционного мононуклеоза основана на клинической картине и результатах лабораторных исследований.
- Основной признак поражения вирусом Эпштейна-Барр – это появление в крови атипичных мононуклеаров (это стимулированные вирусом лимфоциты).
 В типичных случаях инфекционного мононуклеоза, при подсчете лейкоцитарной формулы, их количество от 15 до 70% .
В типичных случаях инфекционного мононуклеоза, при подсчете лейкоцитарной формулы, их количество от 15 до 70% .
До появления методов обнаружения возбудителя это был основной диагностический критерий.
Необходимо помнить, что при некоторых бактериальных и вирусных инфекциях (корь, ветрянка, цитомегаловирусная инфекция), могут встречаться такие же клетки, но их процент менее 15 и их называют реактивные лимфоциты.
На сегодняшний день разработаны более точные способы диагностики, позволяющие установить диагноз даже в том случае, если клиническая картина не характерна для поражения вирусом Эпштейна-Барр. К ним относятся:
- ПЦР-диагностика – выделение ДНК возбудителя из слюны, биоптата лимфоузлов, крови человека;
- ИФА-диагностика – обнаружение специфических противовирусных антител в крови больного.
Специфическая терапия не разработана. Лечение симптоматическое, общеукрепляющее. Из-за риска разрыва селезенки рекомендовано ограничение физической нагрузки в первые 1-1,5 месяца. Госпитализируются больные со среднетяжелым и тяжелым течением болезни. Больные с легким течением могут лечиться на дому. Переболевшие после перенесенного инфекционного мононуклеоза находятся под наблюдением у инфекциониста в течение 6 месяцев с проведением повторных исследований крови.
Госпитализируются больные со среднетяжелым и тяжелым течением болезни. Больные с легким течением могут лечиться на дому. Переболевшие после перенесенного инфекционного мононуклеоза находятся под наблюдением у инфекциониста в течение 6 месяцев с проведением повторных исследований крови.
Вирус Эпштейна-Барр | МРТ Эксперт
От него не скроешься. Рано или поздно с ним встречается каждый человек. Надо ли его бояться? А может, инфекция совсем безобидна? Паниковать не стоит, но и легкомысленное отношение – ошибка.
О вирусе Эпштейна-Барр рассказала врач-инфекционист «Клиники Эксперт» Тула Елена Геннадьевна Королёва.
— Елена Геннадьевна, что такое вирус Эпштейна-Барр?
— Среди герпес-вирусов насчитывают 8 типов, вызывающих патологии у вида Homo sapiens, то есть у людей. Вирус Эпштейна-Барр – герпес-вирус IV типа. После заражения вирусом Эпштейна-Барр инфекция остаётся в организме навсегда и никогда его не покидает.
Вирус Эпштейна-Барр – один из самых распространённых герпес-вирусов у людей. Восприимчивость к нему человека высока. Многие дети инфицируются до достижения годовалого возраста, а к 40-50 годам инфекция есть в организме практически у каждого.
Восприимчивость к нему человека высока. Многие дети инфицируются до достижения годовалого возраста, а к 40-50 годам инфекция есть в организме практически у каждого.
— Как происходит заражение вирусом Эпштейна-Барр?
— Источник инфекции – вирусоносители, а также больные с типичными (манифестными) и стёртыми формами заболевания. Наиболее распространённый путь передачи – воздушно-капельный: с частицами слюны при разговоре, чихании, кашле. Возможна передача вируса при поцелуе (именно поэтому в некоторых источниках вызванный им инфекционный мононуклеоз называют «болезнью поцелуев»). Возможен и контактный путь заражения (например, через предметы домашнего обихода).
Вирус Эпштейна-Барр проникает в организм через верхние дыхательные пути, и уже оттуда распространяется в лимфоидную ткань, вызывая поражения лимфоузлов, миндалин, селезёнки и печени.
При размножении в организме вирус Эпштейна-Барр воздействует на иммунную систему. Механизм воздействия сложен, но в конечном результате за счёт поражения В-лимфоцитов и угнетения Т-клеточного иммунитета происходит подавление выработки интерферона – белка, отвечающего за противовирусную защиту организма.
В современном мире у детей отмечается всплеск заболеваемости, особенно в городах. Наиболее высока вероятность заразиться в местах скопления людей.
— А бессимптомный носитель может быть опасен?
— Чаще всего источником инфекции становится человек в острой стадии болезни. Но передача от бессимптомного носителя не исключена.
— Какую болезнь вызывает вирус Эпштейна-Барр?
— Классическое проявление – инфекционный мононуклеоз. Для него характерны общие интоксикационные симптомы: высокая температура тела, сонливость, вялость, головные боли, боль в горле, увеличение лимфоузлов (или лимфопролиферативный синдром).
Лимфопролиферативный синдром сочетает:
- Поражение рото-, носоглотки: острый фарингит с гипертрофией (увеличением) лимфоидной ткани носоглотки, острые аденоидит и тонзиллит. Это проявляется затруднённым носовым дыханием, храпом во сне.
- Поражение периферических лимфатических узлов (часто поражаются переднешейные, подчелюстные и заднешейные).
Выраженное увеличение шейных лимфоузлов может сопровождаться одутловатостью лица, пастозностью век. - Увеличение печени и селезёнки.
В общем анализе крови определяется наличие атипичных мононуклеаров. Что это такое? Атипичные мононуклеары (другое их название – «вироциты») – это изменённые одноядерные клетки крови. При течении инфекционного мононуклеоза количество атипичных мононуклеаров в крови повышается значительно (больше 10 %). Может снижаться общее количество тромбоцитов и лейкоцитов, что говорит о тяжести переносимой инфекции.
Есть особенности проявления вируса Эпштейна-Барр у детей. Инфицированные попадают в такую категорию, как «часто болеющие дети». Из-за ослабления иммунитета регулярно возникают заболевания ЛОР-органов, трудности при выздоровлении (подкашливание, постоянно красное горло), бывает храп (из-за разрастания миндалин). При таком течении к взрослому возрасту иммунитет учится противостоять инфекции, взрослые болеют уже не так часто. Показания к оперативному удалению аденоидов у детей практически всегда связаны с непролеченным вирусом Эпштейна-Барр. И это очень печально: ничего лишнего в организме нет, а при своевременном лечении удаления можно было бы избежать.
Читайте материалы по теме:
Часто – это сколько? На приёме у педиатра — часто болеющий ребёнок
Аденоиды у детей: удалять или нет?
Знать, что ребёнок инфицирован, важно и по другой причине. Вирус Эпштейна-Барр может изменить реакцию на некоторые антибиотики, спровоцировать токсикоаллергическую реакцию. Поэтому следует обязательно своевременно выявлять вирус и сообщать о нём лечащим врачам, они будут подбирать антибиотики с учётом этого факта.
Тяжёлые последствия возникают, если первичное заражение происходит у женщины в период беременности. Вирус Эпштейна-Барр преодолевает плацентарный барьер, это грозит гибелью плода или значительными дефектами развития.
«После первичного инфицирования некоторые из этих инфекций организм не покидают. Они «спят» в определенных клетках, если с иммунной системой все в порядке и она хорошо контролирует их «сон». Цитата из материала «Чем опасны ТОРЧ-инфекции»
— Есть мнение, что вирус Эпштейна-Барр вызывает гепатит и даже лимфому. Это правда?
— Герпетические вирусы кровотоком разносятся по всему организму, поражают все группы лимфатических узлов. И печень, и селезёнка при остром течении мононуклеоза увеличены. При этом течение болезни обычно благоприятное, здоровье печени полностью восстанавливается.
Утверждать, что вирус Эпштейна-Барр непременно приводит к лимфоме, нельзя. Обнаружить вирус недостаточно: если инфицировано практически всё население планеты, естественно, анализы обнаружат наличие вируса в организме, но ведь лимфомой заболевает далеко не каждый. Конечно, хроническое подавление иммунной системы может приводить к разным нарушениям, в том числе к онкологическим заболеваниям. Но достоверной связи нет. А скомпенсировать иммунные нарушения современная медицина в силах.
Паниковать точно не стоит. Но и надеяться на самостоятельное излечение не надо. Когда ребёнок постоянно болеет, родители зачастую впадают в отчаяние. И хотя избавиться от герпес-вирусов навсегда невозможно, вполне можно облегчить состояние и в разы уменьшить частоту заболеваний. Лечиться можно и нужно.
Подробнее о гепатитах читайте в наших статьях:
«Тихий убийца» современников
Как уберечься от болезни Боткина
Щит и меч от гепатита С. Как защитить себя и своих близких?
— Какими методами можно проверить, присутствует ли в организме вирус Эпштейна-Барр? Какие анализы его выявляют?
— В нашем арсенале два метода: иммуноферментный анализ (ИФА) и полимеразная цепная реакция (ПЦР). Преимущество метода ПЦР – возможность определить ДНК вируса в слюне, соскобе из носоглотки. Благодаря этому можно не брать кровь и не нервировать ребёнка. Но если нет обострения, такой анализ может дать ложноотрицательный результат. Это значит, что вирус в организме есть, но он «спит», и, соответственно, в мазке из носоглотки может отсутствовать. А поскольку с помощью ПЦР ищут сам вирус, точнее, его нуклеиновые кислоты (ДНК), то и анализ будет отрицательным. Нередки также искажения из-за того, что мазок взят неправильно.
Метод ИФА точнее, он в любом случае покажет и наличие инфекции, и выраженность инфекционного процесса. Выводы в данном случае делают по присутствию в крови специфических иммуноглобулинов (антител) к вирусу. Например, если обнаружены иммуноглобулины класса М (IgM), можно говорить об острой фазе инфекции (первичном заражении либо реактивации вируса, когда-то попавшего в организм). Если найдена определённая фракция иммуноглобулина класса G (IgG), это свидетельствует, что организм в прошлом уже сталкивался с инфекцией. Поэтому для определения диагностического метода нужна консультация врача.
— Какими методами лечения вируса Эпштейна-Барр располагает современная медицина?
— Это сложная задача. Если для герпес-вирусов I и II типа (вирусов простого герпеса) есть специфические противовирусные средства, то для вируса Эпштейна-Барр и цитомегаловируса специфической терапии пока не разработали. При лёгком течении болезнь может пройти сама, но при тяжёлом течении с поражением костного мозга медицинская помощь необходима. Лечение направлено на стимуляцию иммунитета, применяются интерфероны. Схему лечения выбирают, исходя из множества факторов, определять её должен только врач.
После излечения вирус продолжает жить в организме. Периодически могут возникать обострения: из-за переохлаждения, длительного пребывания под солнцем, стресса и т. д. Проявления инфекции – всегда повод идти к врачу.
Беседовала Дарья Ушкова
Редакция рекомендует:
Герпес: как распознать и вылечить?
ИФА-анализ крови: когда применяется?
Диагностика инфекций методом ПЦР: что это такое?
Для справки:
Королёва Елена Геннадьевна
В 1992 году окончила педиатрический факультет Киргизского государственного медицинского института.
С 1992 по 1993 г. — интернатура по детским инфекционным болезням.
Работала в республиканской инфекционной больнице (г. Бишкек) сперва детским инфекционистом, после реаниматологом в отделении интенсивной терапии для инфекционных больных.
В Туле более 10 лет работала в областной детской больнице, 7 лет заведовала отделением реанимации.
В настоящее время — детский инфекционист в «Клиника Эксперт» Тула. Принимает по адресу: г. Тула, ул. Болдина, 74.
ОБЩИЙ АНАЛИЗ КРОВИ: ОТ А ДО Я
Общий анализ крови: от А до Я
Представьте: вы пришли к врачу и рассказываете обо всем, что вас беспокоит, — постоянно устаете, плохо спите, периодически подхватываете «мутированные» вирусы и вам просто плохо. Что дальше? Хороший врач (а только такие работают в поликлинике «Медикавер») посоветует вам для начала сдать общий анализ крови. «Для чего? – подумаете вы. – Неужели не проще выписать горсть «волшебных таблеток» и с удовольствием отпустить меня домой?». Да, проще, потому что не нужно интерпретировать полученный результат, ставить себе вопрос: «Почему именно так?». Но правильный ли такой подход? О том, что дает знать общий анализ крови рассказывает Татьяна Береза, работник клинико-диагностической лаборатории поликлиники Медикавер.
Существует несколько названий одного и того же исследования: общий анализ крови (сокращенно ОАК), клинический или развернутый анализ крови. В нашем медицинском центре «развернутый» и «общий» анализ крови – синонимы, потому что подсчет лейкоцитарной формулы осуществляется для всех пациентов без исключения. Еще со школы вам, наверное, известно, что кровь состоит с плазмы и форменных элементов (эритроцитов, лейкоцитов, тромбоцитов). Именно общий анализ крови определяет количественные и качественные свойства форменных элементов крови, которые характеризуют состояние здоровья человека.
Когда вам или вашему ребенку советуют сдать общий анализ крови?
- Во время беременности: в соответствии с изменениями количества эритроцитов, тромбоцитов, лейкоцитов, соотношения их разновидностей, уровня гемоглобина, скорости оседания эритроцитов в крови можно определить состояние организма беременной женщины.
- Перед прививкой: для того, чтобы убедиться в отсутствии воспалительного процесса организма.
- Когда врач имеет подозрение на гематологическую патологию.
- При ОРВИ для дифференциации бактериальной и вирусной инфекции.
- При условии подозрения на глистную инвазию.
- Во время очередного медосмотра.
Забор крови для общего анализа и определение показателей вашего организма – это европейская норма, что является совершенно обыденным явлением в европейской поликлинике Медикавер. С этими показателями стан вашего организма для врача – как на ладони. Анализ содержится на одном бланке и в одном документе, который доступен для пациента онлайн.
Сдавать общий анализ крови в поликлинике Медикавер можно каждый день с 8 до 17 часов, желательно на голодный желудок. Если вы не можете выйти из дому или у вас заболел ребенок, которого не хочется везти в клинику, медсестра может взять кровь у вас дома.
Как именно делается ОАК?
Кровь можно сдать как с вены, так и с пальца, получая венозную или капиллярную кровь соответственно. Теоретически, между ними есть отличие, но на практике – оно небольшое. Но, если вы сдаете кровь несколько раз несколько раз в течении одного заболевания (например, до и после лечения ОРВИ), желательно придерживаться одинаковых условий во время забора. Кстати, не стоит сдавать кровь во время критических дней, это искажает результат.
Что происходит после того, как вы сдали кровь? Маркированная пробирка с вашей кровью попадает в лабораторию, где практически все показатели, кроме РОЕ и лейкоцитарной формулы, выполняет гематологический анализатор. Почему мы доверяем ему вашу кровь? Потому что в клинике существует многоуровневая система качества, и каждый день правильность и точность работы этой машины тщательно проверяют.
И вот результат готов. Вы можете получить его в поликлинике или же, если вам не хочется выходить из дому, то вы найдете результат в вашей собственной карте в Интернете. Что вы видите в этом бланке?
В первой графе – перечень показателей, что входят в ОАК: лейкоциты (WBC), эритроциты (RBC), гемоглобин (HGB), гематокрит (HCT), средний объем эритроцита (MCV), среднее содержание гемоглобина в эритроците (MCH), средняя концентрация гемоглобина в эритроците (MCHC), тромбоциты (PLT), ширина распределения эритроцитов (RDW-CV), скорость оседания эритроцитов – СОЭ (ESR), лейкоцитарная формула (палочкоядерные нейтрофилы – BAND, сегментоядерные нейтрофилы – NEUT, лимфоциты – LYMPH, моноциты – MONO, эозинофилы – EO, базофилы – BASO). В графе «Нормальные показатели» прописано границы нормы соответственно с возрастом пациента и полом. Исключение могут составлять только беременные женщины. Дело в том, что беременность в каждой женщины проходит по-разному, поэтому не существует определенных разработанных норм. Пусть вас это не пугает. Каждый врач знает какие отклонения можно ожидать, а на какие стоит обратить внимание.
Часто пациенты спрашивают можно ли делать анализ на мононуклеары? Исследуем ли мы кровь на лейкоз?
Атипичные мононуклеары (вироциты) и другие патологические клетки крови выявляются или не выявляются во время подсчета лейкоцитарной формулы, о чем обязательно делается запись в бланк результата анализа.
Входят ли ретикулоциты в общий анализ крови? Нет, но вы также можете определить их количество, по вашему желанию, в нашем МЦ.
Один мудрый человек сказал: «Относитесь к пациентам так, как будто это ваши родные, и от вашего анализа может зависеть их длинная счастливая жизнь». Мы пытаемся воплотить этот слоган в реальность, любить свою работу и начинать свой день с улыбки и хорошего настроения.
Mononuclear Cell — обзор
4.1 Дополнительные доклинические исследования с использованием MNC
Было продемонстрировано, чтоMNC пересекают ГЭБ (Eglitis and Mezey, 1997) и быстро попадают в области ишемического повреждения (Shyu et al., 2006a). Введение экзогенных МНК изучается на животных моделях инсульта с 2000 г. (Chen et al., 2000). Текущие доклинические данные показывают, что наиболее вероятный механизм действия МНК включает трофические, противовоспалительные и иммуномодулирующие действия, которые оказывают не только острое, но и стойкое воздействие на мозг (Barnabe et al., 2009; Bliss et al., 2007; Гесс и Борлонган, 2008 г .; Mendez-Otero et al., 2007). Долгосрочное выживание клеток и приживление клеток в головном мозге может не быть необходимым для терапевтического эффекта (Bliss et al., 2007; Hess and Borlongan, 2008; Mendez-Otero et al., 2007). MNCs может даже не нуждаться в проникновении в мозг, чтобы вызвать эффект, а скорее действуют на периферии, чтобы увеличить экспрессию трофических факторов в мозге (Borlongan et al., 2004; Sarnowska et al., 2009).
Сообщалось о функциональном улучшении и снижении гибели клеток в ишемических областях как после внутриклеточной, так и внутрисосудистой доставки МНК (Li and Chopp, 2009; Таблица 2).Сообщается, что в нейрозащитных эффектах лечения МНК после MCAo у крыс участвуют множественные механизмы, включая индукцию ангиогенеза и секрецию цитокинов (Chen et al., 2001a, b; Iihoshi et al., 2004; Li et al., 2002) . Как показано в таблице 2, сообщалось о положительных эффектах, когда инъекция клеток происходила от 12 часов до 7 дней после инфаркта.
Было показано, что как аутологические, так и аллогенные МНК уменьшают размер поражения и улучшают функциональное восстановление в модели церебральной ишемии у крыс MCAo (Таблица 2).Доклинические модели включали преходящие или постоянные MCAo или тандемные обратимые окклюзии общей сонной артерии (CCA) и MCA. Каждая модель отличается по своему влиянию на проницаемость ГЭБ, локализацию и тип повреждений и вызванных неврологических нарушений (Zea Longa et al., 1989).
Исследования аутологичных МНК также различались по времени сбора костного мозга: в первых исследованиях костный мозг собирали за 1–72 ч до окклюзии, обрабатывали и повторно вводили через 1,5–12 ч после окклюзии (Baker et al., 2007; Iihoshi et al., 2004; Камия и др., 2008). Более поздние исследования отразили более обоснованный клинический сценарий, когда клетки костного мозга будут извлекаться после ишемии (Brenneman et al., 2010; Kamiya et al., 2008; Yang et al., 2011a).
Возможность острого забора аутологичного костного мозга и повторного введения в течение 1 дня после окклюзии была недавно установлена в ходе доклинического исследования. Сообщалось, что внутриартериальная (IA; сонная) инфузия МНК крысам молодого и среднего возраста уменьшала объем инфаркта у обработанных крыс по сравнению с группой, получавшей носитель (Brenneman et al., 2010). Наблюдалось значительное снижение фактора некроза опухоли-α, интерлейкина (IL) -1α, IL-1β, IL-6 и значительное повышение уровня IL-10. Меченые МНК были обнаружены в периинфарктной области через 1 час после введения, но быстро уменьшались в течение нескольких часов и почти не определялись через 7 дней после инфузии. Функциональное тестирование с использованием цилиндрического теста и теста углов показало значительное улучшение через 1 неделю после инфаркта у обработанных животных по сравнению с нелеченными животными (Brenneman et al., 2010).
Острое внутривенное (IV) введение аутологичных МНК, извлеченных из костного мозга через 24–72 часа после окклюзии, уменьшало неврологический дефицит у крыс по сравнению с контрольной группой, получавшей физиологический раствор (Yang et al., 2010). Улучшение неврологического исхода зависело от количества введенных МНК. Через 4 недели после инсульта у животных, которым вводили 10 миллионов клеток / кг или более, наблюдалось значительное снижение неврологических нарушений; однако те, кто получал наивысшую дозу (30 миллионов клеток / кг) или более низкую дозу (1 миллион клеток / кг), не показали значительного улучшения по сравнению с контрольными группами с физиологическим раствором. Дозы, использованные в Yang et al. исследования (2010) были выбраны на основании ожидаемого выхода клеток при ограниченной аспирации костного мозга у пациентов.
| Артикул | Описание изделия | Ед. / М | Цена |
|---|---|---|---|
| SER-PBMC-F | Мононуклеарные клетки нормальной периферической крови человека (PBMC), криоконсервированные, 15 миллионов клеток / флакон | флакон | 127,00 $ |
| SER-PBMC-PF | Нормальные мононуклеарные клетки периферической крови человека (PBMC), криоконсервированные, (ОБЪЕДИНЕННЫЕ) 15 миллионов клеток / флакон | флакон | $ 127.00 |
| SER-PBMC | Нормальные мононуклеарные клетки периферической крови человека (PBMC), СВЕЖИЕ 15 миллионов клеток / флакон (сбор / отправка в тот же день *, ожидание тестирования — требуется подписанный отказ в файле — свяжитесь с нами для получения более подробной информации) | Флакон | $ 163,00 |
| SER-PBMC-200-F | Нормальные мононуклеарные клетки периферической крови человека (PBMC), криоконсервированные, 100 миллионов клеток / флакон | Флакон | $ 359,00 |
| SER-PBMC- 200P-F | Нормальные мононуклеарные клетки периферической крови человека (PBMC), криоконсервированные, (POOLED) 100 миллионов клеток / флакон | флакон | 359 долларов США.00 |
| SER-PBMC-200 | Нормальные мононуклеарные клетки периферической крови человека, СВЕЖИЕ (PBMC), 200 миллионов клеток / флакон, (сбор / отправка в тот же день *, ожидание тестирования — требуется подписанный отказ в файле — свяжитесь с нами для подробнее) | Флакон | 380,00 $ |
| SER-D-PBMC-F | Человек, ДИАБЕТ ТИПА 2, Мононуклеарные клетки периферической крови (PBMC), 15 миллионов клеток / флакон | Флакон | $ 178,00 |
| SER-CBMNC-100-F | Мононуклеарные клетки (МНК) пуповинной крови человека, криоконсервированные, ОДИН донор, минимум 100 миллионов клеток / флакон | флакон | $ 1237.00 |
| SER-BMMNC-F | Мононуклеарные клетки (МНК) костного мозга человека, CRYOPRESERVED, ОДИН донор, минимум 10 миллионов клеток / флакон | Флакон | $ 294,00 |
| SER-CD19-F | В-клетки нормальной периферической крови человека, CD19, криоконсервированные, 1 миллион клеток / флакон | флакон | $ 178,00 |
| SER-PBCD56 NK-F | Криоконсервированные естественные клетки-киллеры (NK) нормальной периферической крови человека, CD56, 5 млн клеток / флакон | флакон | 647 $.00 |
| SER-PBCD56-UNT-F | Нормальные естественные клетки-киллеры периферической крови человека, CD56, НЕПРОКАЧЕННЫЕ, криоконсервированные, 5 миллионов клеток / флакон. CD56 NK-клетки | Флакон | 946,00 $ |
| SER-PMN | Нормальные полиморфноядерные клетки человека (PMN), криоконсервированные, 15 миллионов клеток / флакон | Флакон | $ 148,00 |
| LYMPH-1 | Среда лимфоцита для размораживания, покрытия и краткосрочного обслуживания [для использования со всеми клетками крови] | 100 мл | 103 $.00 |
| LYMPH-1-50 | Среда для лимфоцитов для размораживания, посева и краткосрочного обслуживания [для использования со всеми клетками, полученными из крови] | 50 мл | $ 61,00 |
| LYMPH-100 | Среда для криоконсервации лимфоцитов , 100 мл | 100 мл | 182,00 $ |
| SER-PBMC-CUSTOM-F | Мононуклеарные клетки периферической крови человека, криоконсервированные, сбор доноров, изготовленных по индивидуальному заказу. * Узнать о доступных образцах * | Флакон | Запросить |
Мононуклеарные клетки человека (hMNC) | PromoCell
Мононуклеарные клетки PromoCell (MNC) представляют собой фракцию лимфоцитов и моноцитов, выделенную из пуповинной крови или периферической крови.Их получают путем оптимизированного центрифугирования в градиенте низкой плотности, которое эффективно снижает содержание гранулоцитов. Эритроциты мягко, но тщательно истощаются с помощью запатентованных методов вместо осмотического лизиса. В результате получаются сверхчистые мононуклеарные клетки с превосходной жизнеспособностью и неизменной биологической функцией. Кроме того, клетки не слипаются после размораживания, что упрощает работу с ними и обеспечивает воспроизводимые результаты.
МНК можно использовать непосредственно для экспериментов или в качестве исходного материала для выделения нескольких типов клеток, например.g., гемопоэтические и эндотелиальные предшественники, моноциты и субпопуляции лимфоцитов.
НОВИНКА: наши hMNC теперь также доступны от доноров с типом HLA.
Доступные форматы:
- Криоконсервировано: криогенный флакон, содержащий 25 000 000 жизнеспособных клеток.
- Осадок клеток: 1 миллион клеток растворяют в 200 мкл RNAlater © для последующего анализа РНК, ДНК или белка. Клеточные гранулы не могут быть восстановлены.
Обратите внимание: криоконсервированные мононуклеарные клетки человека не подходят для создания макрофагов in vitro с использованием нашей среды для генерации макрофагов XF.Для этого всегда используйте свежевыделенные человеческие мононуклеарные клетки или человеческие моноциты.
| Рекомендуемая плотность покрытия | 1000000 клеток на мл |
|---|---|
| Протестированные маркеры | CD31 отрицательный, CD34 отрицательный, CD105 положительный, CD146 положительный |
границ | Перспективы системного моделирования мононуклеарных клеток периферической крови человека
Введение
Мононуклеарные клетки периферической крови человека (PBMC) — это клетки периферической крови, несущие одно круглое ядро.PBMC состоят из нескольких классов иммунных клеток, включая Т-клетки (~ 70%), B-клетки (~ 15%), моноциты (~ 5%), дендритные клетки (~ 1%) и естественные киллеры (NK) клетки (~ 10%) (Autissier et al., 2010; Kleiveland, 2015). Корецептор Т-клеток (CD3 + , экспрессирующие Т-лимфоциты) можно разделить на цитотоксические клетки CD4 + и CD8 + , которые присутствуют в PBMC примерно в соотношении 2: 1 (Kleiveland, 2015). Активированные CD4 + Т-клетки далее подразделяются на подмножества Th2, Th3, Th27, Th9, Th32, фолликулярных вспомогательных (Tfh) клеток и регуляторных Т-клеток (Treg) на основе панели продуцируемых цитокинов, факторов транскрипции и экспрессируемых поверхностных маркеров. (Stockinger, Veldhoen, 2007; Sakaguchi et al., 2008; Broere et al., 2011; Кротти, 2011; Акдис и др., 2012; Luckheeram et al., 2012; Тан и Гери, 2012; Клейвеланд, 2015; Голубовская, Ву, 2016). Клетки Treg могут быть естественными клетками (nTreg), генерируемыми в тимусе, или индуцибельными клетками Treg (iTreg) при активации на периферии (Wing and Sakaguchi, 2010). Аналогичным образом активированные Т-клетки CD8 + (цитотоксические Т-клетки) могут быть разделены на субпопуляции Tc1 или Tc2 на основе их сигнатурных цитокинов (Croft et al., 1994). Различные подмножества Т-клеток, их механизмы активации, дифференцировки и их функции были подробно рассмотрены (Broere et al., 2011; Luckheeram et al., 2012).
B-клетки или B-лимфоциты представляют собой клетки, происходящие из костного мозга, которые экспрессируют рецептор B-клеток и связываются со специфическими антигенами, против которых они инициируют ответы антител, тем самым формируя ядро адаптивной гуморальной иммунной системы (Cooper, 2015). В-клетки созревают в плазмобласты и плазматические клетки, В-клетки памяти, фолликулярные В-клетки, В-клетки маргинальной зоны, В-регуляторные и В-1-клетки. Цитотоксические естественные клетки-киллеры (NK-клетки), в отличие от Т- и В-клеток, являются критическими компонентами врожденной иммунной системы и могут напрямую уничтожать инфицированные патогеном клетки.Кроме того, NK-клетки секретируют лимфокины и взаимодействуют с другими иммунными клетками и, таким образом, участвуют в иммунных ответах посредством иных средств, кроме прямой цитотоксичности (Yuan et al., 1994).
Системные подходы, применяемые к PBMC
Системная биология вместе с биоинформатикой стала важным инструментом в иммунологических исследованиях. Интеграция сложных наборов данных multi-omics позволила выявить несколько биомаркеров и прояснить их физиологическую роль (Buonaguro et al., 2011; Li et al., 2013, 2014b, 2017b; Олафсдоттир и др., 2016). PBMC, большой набор воспалительных клеток, который легко и недорого приобрести, могут обеспечить более полный обзор состояния иммунной системы, чем маркеры циркулирующей сыворотки или плазмы. PBMC широко использовались для изучения нескольких аутоиммунных заболеваний, таких как сахарный диабет 1 типа (TIDM) (Foss-Freitas et al., 2008), астма (Iikura et al., 2011; Falcai et al., 2015), многочисленные аллергии и рак (Payne et al., 2013). Ниже мы приводим примеры омических и системных подходов применительно к PBMC, особенно к Т-хелперам (рис. 1).
Рисунок 1 . (A) Общая иллюстрация активации и дифференцировки Т-клеток. (B) Несколько подходов, основанных на омиксах, применялись к образцам, полученным от больных и здоровых людей (контроль). (C) Стратификация людей на основе метаболического фенотипа. (D) Идентификация и проверка биомаркеров. (E) Последующий анализ наборов данных omics для выявления и обогащения дифференциальных путей.
Транскриптомика
Глобальный анализ транскриптомики PBMC успешно использовался для выяснения воспалительных механизмов, лежащих в основе различных аутоиммунных заболеваний (Bennett et al., 2003; Crow et al., 2003; Greenberg et al., 2005; Achiron et al., 2007; Edwards et al. др., 2007). Провоспалительная транскрипционная сигнатура семейства цитокинов интерлейкина-1 была отмечена у пациентов с недавно начавшимся TIDM (Wang et al., 2008; Levy et al., 2012). Профили экспрессии генов PBMC с использованием массива олигонуклеотидов использовали для идентификации 330 транскриптов, которые дифференциально экспрессировались у пациентов с ревматоидным артритом (RA) по сравнению со здоровыми контрольными пациентами (Edwards et al., 2007).
Данные транскриптомики PBMC в нескольких исследованиях были использованы для характеристики нескольких типов диабета, которые показали, что гестационный и TIDM связаны на уровне транскриптома (Collares et al., 2013). Мета-анализ наборов данных микрочипов на основе PBMC был использован для выявления дисрегулируемых путей у пациентов с системной красной волчанкой (СКВ). Исследование показало, что передача сигналов толл-подобного рецептора (TLR), окислительное фосфорилирование, диапедез и регуляторные сети адгезии дифференцированно регулируются в PBMC пораженных индивидуумов (Kröger et al., 2016).
транскриптомов из PBMC также использовались для характеристики фенотипов ВИЧ. Отчетливые сигнатуры транскриптомики с несколькими дисрегулируемыми генами, участвующими в апоптозе, были идентифицированы у быстро прогрессирующих ВИЧ. Было обнаружено, что экспрессия пяти miRNAs (miR-31, 200c, 526a, 99a и 503) также изменена (Zhang et al., 2013). В другом исследовании профили экспрессии генов PBMC, полученных от курильщиков, продемонстрировали признаки хронической обструктивной болезни легких (ХОБЛ) и эмфиземы, характеризующиеся множественной дифференцированной регуляцией генов FOXP1, TCF7 и ASAh2 , участвующих в метаболизме сфинголипидов (церамидов).Метаболомика плазмы подтвердила идентичность гликокерамида как маркера эмфиземы (Bahr et al., 2013).
Кроме того, интеграция профилей транскриптомики и экспрессии белков PBMC, полученных в большой когорте исследований, позволила предположить связь между снижением уровня IL-16 и эмфиземой; он также идентифицировал цис-eQTL IL-16 как новый биомаркер заболевания (Bowler et al., 2013). PBMC также были проанализированы в контексте рака. Исследование микроматрицы кДНК полного генома образцов PBMC от 26 пациентов с раком поджелудочной железы и 33 подобранных здоровых контролей выявило набор предикторов из восьми генов, включающий SSBP2, Ube2b-rs1, CA5B, F5, TBC1D8, ANXA3, ARG1 и ADAMTS20 (Baine et al. ., 2011). Сходным образом, значительные различия наблюдались в транскриптомах PBMC, полученных от пациентов с почечно-клеточной карциномой и нормальных добровольцев (Twine et al., 2003; Burczynski et al., 2005).
Наборы данных транскриптомики на основеRNA-Seq и микрочипов были использованы для характеристики различных подмножеств Т-хелперных клеток. Транскриптомика дифференцированных подмножеств (Ciofani et al., 2012; Hu et al., 2013) характеризует различия между клетками Th27 и Th0 (TCR-стимулированные CD4 + Т-клетки), в то время как функциональный анализ, основанный на этих транскриптомах, предполагает различия в контроле. регуляции клеточного цикла (Simeoni et al., 2015). В другом исследовании анализ транскриптома наивных предшественников Т-клеток, полученных из пуповинной крови, был использован для идентификации нескольких клоноспецифичных генов, участвующих в ранней дифференцировке подмножеств Th2 и Th3 (Kanduri et al., 2015). Более того, сравнительная транскриптомика клеток Th27 мыши и человека пометила новые транскрипты, связанные с поляризацией Th27. Несколько длинных некодирующих РНК человека были идентифицированы в ответ на цитокины, стимулирующие дифференцировку клеток Th27 (Tuomela and Lahesmaa, 2013; Tuomela et al., 2016).
Эпигеномика
Эпигенетика играет ключевую роль в регуляции экспрессии генов и наследования генетической информации. Для оценки влияния цис-генетических и эпигенетических факторов были проведены исследования ассоциации трех типов иммунных клеток человека на уровне всего эпигенома (моноциты CD14 + , нейтрофилы CD16 + и наивные Т-клетки CD4 + ), полученные от 197 субъектов. Основным результатом этого исследования стала идентификация 345 QTL молекулярных признаков (локусов количественных признаков), которые локализованы совместно с локусами, специфичными для иммунных заболеваний (Chen et al., 2016). Эпигенетические механизмы в наивных CD4 + Т-клетках подробно рассмотрены (Lee et al., 2006; Sanders, 2006; Aune et al., 2009; Hirahara et al., 2011; Oestreich and Weinmann, 2012).
Протеомика
Протеомное профилирование PBMC было выполнено в основном для двух целей: (а) для идентификации белковых биомаркеров (ов), связанных со специфическими патофизиологическими процессами, и (б) для характеристики различных подмножеств иммунных клеток на основе их протеомов. Недавно сравнительная протеомика с использованием тандемной масс-спектрометрии (МС) была применена к образцам PBMC, полученным из биопсий почек 40 реципиентов почечного аллотрансплантата, либо со здоровыми трансплантатами, либо с теми, кто страдает острым отторжением.В общей сложности 344 белка были идентифицированы, каталогизированы и сопоставлены с 2905 протеоформами (Savaryn et al., 2016). Сравнительный протеомный анализ также выявил различия между необработанными и воспалительными активированными PBMC человека (Т-клетки и моноциты) с использованием 2D-PAGE и LC-MS / MS. Некоторые клеточно-специфические протеомные сигнатуры активации и воспаления были идентифицированы как NAMPT и PAI2 (PBMC), IRF-4 и GBP1 (Т-клетки), PDCD5, IL1RN и IL1B (моноциты) (Haudek-Prinz et al., 2012).
Профилирование протеома Th2-клеток, индуцированных наивными Т-клетками путем стимуляции интерлейкином 12 (IL-12), было использовано для идентификации 42 гена, регулируемых IL-12, из которых 22 были активированы, а 20 — подавлены.Функциональная характеристика активированных белков помогла идентифицировать многофункциональный цитокиновый фактор ингибирования миграции макрофагов и новый ген-мишень для IL-12 (Rosengren et al., 2005). В другом исследовании профилирование протеома клеточной поверхности на основе MS (метка стабильных изотопов аминокислотами в культуре клеток, SILAC ) использовалось для идентификации белков, по-разному экспрессируемых между Th2 и Th3 клетками человека. Было обнаружено, что среди дифференциально экспрессируемых белков BST2 (стромальный белок 2 костного мозга) и TRIM (молекула, взаимодействующая с Т-клеточными рецепторами) значительно по-разному регулируются (Loyet et al., 2005). Более того, глобальный анализ высокоочищенных первичных наивных протеомов Т- и Th2-клеток с использованием ЖХ-МС / МС выявил дифференциальную регуляцию пути убиквитинирования при дифференцировке Т-клеток (Pagani et al., 2015). Количественная протеомика Th-клеток с использованием ICAT-мечения и ЖХ-МС / МС идентифицировала (557) и количественно (304) ИЛ-4-регулируемые белки из микросомальных фракций клеток CD4 + , экстрагированных из пуповинной крови. Среди них небольшие GTPases, в основном GIMAP1 и GIMAP4, подавлялись IL-4 во время дифференцировки Th3 (Filén et al., 2009).
Метаболомика
Циркулирующие PBMC представляют собой сложную смесь различных подмножеств иммунных клеток, находящихся на разных стадиях их жизни. В дополнение к естественной генетической изменчивости и иммунным проблемам, эта неоднородность формируется множеством окружающих их условий окружающей среды. В свете современного понимания ключевая роль клеточного метаболизма в функционировании иммунных клеток также подчеркивает потенциальное влияние метаболитов на прямое или косвенное регулирование иммунной системы (Buck et al., 2015). Например, известно, что внешние нарушения ключевых метаболических процессов, таких как гликолиз, энергетический метаболизм, метаболизм жирных кислот и аминокислот, влияют на активацию и дифференцировку Т-клеток и ухудшают их (Berod et al., 2014; Almeida et al., 2016; Geiger et al. др., 2016; Ма и др., 2017).
Метаболомика PBMC, полученных от пораженных или здоровых мышей и людей, была использована для идентификации метаболических маркеров при различных патологических состояниях. Например, газовая хроматография в сочетании с целевой метаболомикой на основе МС (ГХ-МС) использовалась для количественного определения метаболитов, полученных из глюкозы, в РВМС здоровых людей в контрольной группе, при шизофрении и больших депрессиях.Было обнаружено, что большинство этих метаболитов значительно изменены, особенно у пациентов с шизофренией. Кроме того, рибозо-5-фосфат продемонстрировал высокую диагностическую эффективность у лиц, не имевших лекарств в первом эпизоде шизофрении (Liu et al., 2015). Аналогичным образом, ГХ-МС использовался для идентификации метаболитов, таких как яблочная кислота, орнитин, L-лизин, стигмастерин, олеиновая кислота, аденозин и N-ацетил-D-глюкозамин, которые были значительно изменены у устойчивых крыс, в то время как статистический анализ метаболических путей показал отклонения от нормы. энергетический обмен (Li et al., 2017а).
Состав жирных кислот фосфолипидов PBMC, полученных от 150 субъектов, был оценен и связан с функциями иммунных клеток. Доли общих полиненасыщенных жирных кислот (ПНЖК) в фосфолипидах PBMC положительно коррелировали с фагоцитозом нейтрофилами и моноцитами, окислительным взрывом нейтрофилов, пролиферацией лимфоцитов и продукцией интерферона-γ. Исследование также показало, что вариации в составе жирных кислот фосфолипидов PBMC могут вызывать незначительные изменения функций иммунных клеток, наблюдаемые у здоровых людей (Kew et al., 2003). Поскольку фосфолипиды в основном включены в клеточные мембраны, этот эффект может быть опосредован измененными свойствами мембран, такими как текучесть и боковое давление, из-за их измененного состава фосфолипидов (Mouritsen, 2011).
МС высокого разрешения недавно был использован для создания динамических профилей метаболома и протеома первичных наивных Т-клеток человека после активации. В исследовании сообщается о резком снижении внутриклеточной концентрации L-аргинина, что влияет на метаболическую пригодность и выживаемость Т-клеток, связанных с противоопухолевыми ответами (Geiger et al., 2016). Метаболизм Т-клеток во время наивных, активированных, пролиферативных и дифференцированных состояний подробно изучен (Gerriets and Rathmell, 2012; MacIver et al., 2013; Pearce and Pearce, 2013; Pearce et al., 2013; Buck et al., 2015). ; Dimeloe et al., 2017).
Кишечные микробы и иммунные клетки
В настоящее время хорошо известна связь между диетой, микробиотой кишечника и иммунным ответом. Известно, что иммунная система играет важную роль в регуляции микробиоты кишечника, и, в свою очередь, микробиота способствует развитию, обучению и настройке иммунных ответов (Round and Mazmanian, 2009; Belkaid and Hand, 2014).Дисбаланс микробного состава или взаимодействия с хозяином были связаны с воспалительными и аутоиммунными заболеваниями (Brugman et al., 2006; Wen et al., 2008; Roesch et al., 2009; Kostic et al., 2015). Было продемонстрировано, что состав микробиоты кишечника может изменяться у лиц с риском развития СД1 (Brown et al., 2011; Giongo et al., 2011; de Goffau et al., 2013; Murri et al., 2013) . Это явление впервые наблюдалось в когорте финских детей с высоким HLA-ассоциированным риском развития СД1, где образцы фекалий людей, серопозитивных с множественными антигенспецифическими аутоантителами к островкам поджелудочной железы, сравнивались с серонегативными здоровыми контрольными людьми (Giongo et al., 2011; Kostic et al., 2015). Кроме того, Kostic et al. Изучили взаимосвязь между динамикой микробиома кишечника человека в младенчестве в когорте из 33 детей, генетически предрасположенных к TIDM. Исследование показало снижение альфа-разнообразия у прогрессирующих СД1 между сероконверсией и диагнозом СД1; с последующим увеличением количества видов микробов, которые способствуют воспалению, изменению функций генов и метаболитов стула (Kostic et al., 2015). Связь между диетой, кишечной микробиотой и расстройствами, связанными с Т-клетками, была рассмотрена в другом месте (Kosiewicz et al., 2014; Мехиа-Леон и Барса, 2015 г .; Книп и Сильяндер, 2016).
Исчерпывающий список омических подходов, применяемых к подмножествам PBMC и T-хелперов, представлен в (Таблица 1).
Таблица 1 . Список исследований, выполненных с использованием PBMC и Т-клеток в качестве модельных систем.
Модели метаболизма в масштабе генома как инструмент изучения метаболизма
С быстрым развитием передовых технологий в исследованиях PBMC растет потребность в разработке интегративных методов и вычислительных моделей для работы с растущими объемами данных.Эти подходы при применении на системном уровне могут механически связывать такие сущности, как ген, белки и метаболиты, которые могут раскрывать маркеры болезни и связанные процессы на системном уровне (Sen et al., 2016).
Метаболическое моделирование в масштабе генома (GSMM) — это основанный на ограничениях подход к математическому моделированию, который объединяет биохимическую, генетическую и геномную информацию в вычислительной структуре (Price et al., 2004; Orth et al., 2010; Bordbar et al., 2014). ; О’Брайен и др., 2015). Он используется для изучения метаболических генотип-фенотипических взаимоотношений организма. GSMM постоянно развивалась на протяжении последних 30 лет. Метаболические модели в масштабе генома (GEM) использовались в метаболической инженерии in silico для разработки исследований, таких как существенность реакции / гена (Patil et al., 2005; Suthers et al., 2009), релевантность чужеродного пути ( s) (Pharkya et al., 2004) и сверхэкспрессии или подавления метаболитов и метаболических путей (Pharkya and Maranas, 2006).Они являются эффективными инструментами для прогнозирования роста живых клеток / тканей, подвергающихся воздействию различных питательных веществ (Förster et al., 2003; O’Brien et al., 2013).
За последние годы компоненты и функции GEM были расширены для изучения метаболизма человека. Первая in silico глобальная реконструкция метаболической сети человека Recon 1 ( 1905 генов, 3742 реакции и 2766 метаболитов) была построена с целью интеграции и анализа наборов биологических данных (Duarte et al., 2007). Впоследствии была разработана Эдинбургская метаболическая сеть человека (EHMN) ( 2322 гена, 2823 реакции и 2671 метаболит, ) (Ma et al., 2007), эти модели были экономными и обеспечивали частичные знания о метаболизме человека. После этого Recon 2 (, 2194 гена, 7440 реакций и 5063 метаболита, ) (Thiele et al., 2013), Recon 2.2 (, 1675 генов, 7785 реакций и 5324 метаболита, ) (Swainston et al., 2016), консенсусная реконструкция метаболизма человека и метаболическая реакция человека (HMR) ( 3668 генов, 8181 реакция и 9 311 метаболитов ) (Mardinoglu et al., 2013, 2014) были разработаны, чтобы всесторонне охарактеризовать метаболизм человека. Метаболические реконструкции человека использовались для изучения специфического метаболизма клеток, тканей и органов (Agren et al., 2012; Wang et al., 2012) в контексте различных заболеваний, таких как рак (Yizhak et al., 2015), не -алкогольная жировая болезнь печени (НАЖБП) (Mardinoglu et al., 2014; Hyötyläinen et al., 2016), диабет (Väremo et al., 2016). Кроме того, GEM в качестве интегративного инструмента использовались для моделирования диетической ткани (Sen et al., 2017) и взаимодействия между тканями у человека (Bordbar et al., 2011).
Структура GEM обеспечивает каркас для интеграции различных типов омических данных, таких как транскриптом, протеом и метаболом / флуксом (Blazier and Papin, 2012). Было разработано несколько алгоритмов, которые позволяют интегрировать и контекстуализировать GEM на основе наборов данных выражений. GIMME, разработанный Беккером и Палссоном, рассматривает единый набор данных экспрессии гена и сравнивает его с определенным порогом, а затем перечисляет активные и неактивные реакции в рамках модели GEM (Becker and Palsson, 2008).С другой стороны, iMAT разделяет набор данных экспрессии на гены с низкой, умеренной и высокой экспрессией и классифицирует реакции GEM на низкие, умеренные и активные наборы (Shlomi et al., 2008; Zur et al., 2010). MADE позволяет интегрировать несколько наборов данных выражений, он был разработан для преодоления заданного пользователем порога выражения, который может быть нереалистичным (Jensen and Papin, 2011). MADE разлагает данные экспрессии генов в двоичное состояние и определяет наборы низко- или высокоактивных реакций. E-flux — это метод, основанный на пороге, который не переводит данные выражения в двоичные состояния, а преобразует данные выражения в некоторые подходящие ограничения, которые устанавливают верхний и нижний пределы реакций (Colijn et al., 2009). Алгоритм INIT ( Integrative Network Inference for Tissues ) использует обилие специфичных для клеток белков для создания активных метаболических сетей в масштабе генома (Agren et al., 2012).
GEM были использованы для моделирования каталогизированных кишечных микробов человека (Qin et al., 2010; Li et al., 2014a) на основе их метаболических функций (El-Semman et al., 2014; Shoaie and Nielsen, 2014; Bauer et al. ., 2015; Magnúsdóttir et al., 2016). Магнусдоттир и др. Представили AGORA ( Сборка кишечных организмов посредством реконструкции и анализа, ), которая включает полуавтоматически реконструированные GEM 773 кишечных бактерий человека (205 родов, 605 видов).Реконструкция может включать наборы данных метагеномики или секвенирования 16S рРНК, которые можно использовать для изучения метаболического разнообразия среди микробных сообществ (Magnúsdóttir et al., 2016). Кроме того, GEM, полученные из микробиома кишечника человека, использовались для расшифровки взаимодействий микроб-микроб, диета-микроб и микроб-хозяин. Другая комплексная вычислительная платформа на основе GEM, CASINO (интерактивная оптимизация на уровне сообщества и систем) , была разработана для изучения влияния диеты на микробные сообщества (Shoaie et al., 2015).
Метаболические модели в масштабе генома, применяемые к PBMC, и заключительные замечания
Наличие последовательностей генома линий клеток человека вместе с существующими реконструкциями метаболизма человека (Duarte et al., 2007; Agren et al., 2012; Wang et al., 2012; Mardinoglu et al., 2013, 2014; Thiele et al., al., 2013; Swainston et al., 2016; Väremo et al., 2016) и большой объем данных PBMC дает возможность разработать специфичные для PBMC GEM (рисунок 2). Эти метаболические сети могут быть уточнены экспериментальными данными, такими как интенсивность метаболитов, потоки, содержание ферментов и экспрессия генов / транскриптов.Уточнение сети добавляет больше уверенности к метаболическим реакциям и связанным с ними объектам и, таким образом, устраняет ложноположительные результаты (Becker et al., 2007; Schellenberger et al., 2011). Интеграция данных omics с этими сетями делает их зависящими от условий, по которым можно проводить различные анализы. Одним из таких анализов является идентификация репортерных метаболитов (RM), то есть метаболита в метаболической сети, вокруг которой происходят значительные транскрипционные изменения (Patil and Nielsen, 2005).RM активно участвуют в одной или нескольких метаболических реакциях, регулируемых экспрессией генов и / или количеством ферментов. RM могут также информировать о регуляции метаболических путей / подсистем (например, гликолиза).
Рисунок 2 . (A) Он показывает больных и здоровых людей (контроль), от которых берут образцы PBMC для анализа на омикс. (B) Дифференциальное выражение омики и анализ для контекстуализации. (C) Реконструкция и контекстуализация конкретных условий метаболических моделей в масштабе генома. (D) Компоненты реакции (R) метаболических моделей в масштабе генома: S, субстраты; Е, ферменты; П, продукты. (E) Стехиометрическая матрица (S) метаболитов M n и реакций R n , направленность каждого метаболита, потребляемого (-1), продуцируемого (+1) или не участвующего в реакции (0). (F) Анализ баланса потока (FBA) для моделирования модели, оптимизации и оценки фенотипа потока (v) в устойчивом состоянии. (G – I) На панели показаны функциональные возможности моделей метаболизма в масштабе генома, такие как регуляция метаболического пути, идентификация метаболических маркеров и идентификация дифференциальных путей.
Аналогичным образом, данные omics могут использоваться для контекстуализации сетей, специфичных для PBMC, в здоровых и болезненных состояниях. Анализ RM может идентифицировать метаболические горячие точки, модули и подсети, что может улучшить наши знания и понимание иммунометаболизма в конкретных условиях. Более того, интеграция данных метаболомики может помочь охарактеризовать репортерную реакцию (ы), то есть реакции, отмеченные значительными и скоординированными изменениями в окружающих метаболитах после экологических / генетических пертурбаций.Комбинируя данные транскриптомов, можно сделать вывод, регулируются ли реакции иерархически или метаболически (Cakir et al., 2006). Кроме того, потоки, оцененные с помощью PBMC-специфичных GEM с использованием анализа баланса потока (FBA) (Orth et al., 2010), могут помочь понять значимость множественных путей, участвующих в метаболизме глюкозы, энергии, аргинина и серина и биосинтезе убихинона с более высокой эффективностью, чем ранее возможно (Liu et al., 2015; Almeida et al., 2016; Ma et al., 2017).
Точно так же GEM могут быть реконструированы для специфических иммунных клеток. Линия клеток RAW 264.7, GEM для макрофагов, была разработана путем интеграции наборов данных транскриптомики, протеомики и метаболомики (Bordbar et al., 2012). Модель была использована для оценки метаболических функций, которые имеют решающее значение для активации макрофагов. Его также использовали для определения метаболических модуляторов клеточной активации. В другом исследовании GEM для наивных Т-клеток (CD4T1670) были реконструированы путем интеграции наборов данных транскриптомики и метаболомики.Эта модель использовалась для изучения углеводного обмена, метаболизма жирных кислот и глутаминолиза (Han et al., 2016). Доступность данных omics для субпопуляций иммунных клеток, в частности CD4 + Т-хелперных клеток (Th2, Th3, Th27) (Kanduri et al., 2015; Tuomela et al., 2016), дает возможность реконструировать GEM, специфичные для T-хелперов, которые могут быть используется для характеристики метаболических фенотипов подмножеств Th и прогнозирования различий между ними.
Появляется все больше доказательств того, что метаболизм может регулироваться эпигенетическими модификациями (Lu and Thompson, 2012).Этому способствует нарушение метаболического гена (ов) в подходящих условиях (Colyer et al., 2012; Yun et al., 2012). Салехзаде-Язди и др. Включили эпигенетические ограничения в GEM, чтобы показать влияние мутировавших гистоновых хвостов на метаболические реакции, тем самым оценив их общее влияние на метаболизм дрожжей. Топология сети была проанализирована с предположением, что метаболические гены с пониженной регуляцией, предположительно, находятся под эпигенетическим контролем и, таким образом, влияют на метаболизм всего организма (Salehzadeh-Yazdi et al., 2014). Подобная стратегия может быть принята при моделировании влияния эпигенетической модификации на метаболизм Т-клеток. Предполагаемые эпигенетические ограничения для генов с пониженной регуляцией (предположительно, находящиеся под эпигенетическим контролем) могут быть добавлены в качестве дополнительного ограничения (оценка реакции или вес) к ассоциированной метаболической реакции (ям) внутри GEM.
GEM можно использовать для моделирования и изучения метаболических взаимодействий между иммунными клетками и кишечными микробами в масштабе генома. Это позволяет идентифицировать ключевые регуляторы (метаболиты / субстраты, гены и ферменты), которые модулируют иммунные ответы.Их также можно использовать для идентификации резидентных микробов, которые выполняют специализированные метаболические функции. Более того, GEM могут обеспечить механистический обзор распределения субстратов, конкуренции микробов и микробов за ресурсы и модуляции иммунных ответов хозяина с помощью микробов. Моделирование метаболических взаимодействий между клетками и тканевоспецифичными GEM с использованием клеточного компартмента и / или метаболических промежуточных продуктов было возможно ранее (Bordbar et al., 2011; Shoaie et al., 2015; Magnúsdóttir et al., 2016; Bauer et al., 2017).
Хотя GEM механически связывают метаболические генотипы и фенотипы, в то же время они обрабатывают множество ограничений и переменных, которые, в свою очередь, могут повысить неопределенность прогнозов. Следовательно, четкие стандарты для реконструкции GEM, интеграции решателя и удобства использования должны быть определены до моделирования (Orth et al., 2010; Chindelevitch et al., 2014; Ebrahim et al., 2015; Ravikrishnan and Raman, 2015). Доступность экспериментальных данных может помочь улучшить качество GEM и, таким образом, привести к более точным прогнозам.Важно, чтобы прогнозы GEM многократно подтверждались экспериментальными данными.
Как указано в этом обзоре, транскриптом, протеом, эпигеном и передача сигналов PBMC и Th-субпопуляций хорошо изучены. Для сравнения, метаболизм подмножеств Th и лежащие в его основе регуляции пока плохо изучены. Известно, что метаболизм циркулирующих Т-клеток претерпевает драматические изменения под воздействием экологического стресса, который стимулирует иммунитет (Gerriets and Rathmell, 2012; Pearce and Pearce, 2013; Pearce et al., 2013; Бак и др., 2015). В настоящее время мы предпринимаем несколько попыток охарактеризовать метаболический фенотип и регуляцию PBMC, полученных от детей с преддиабетическим риском развития TIDM. Мы считаем, что согласование прогнозов, основанных на GEM, и экспериментальных данных может заполнить пробелы в «больших данных», полученных в результате исследований PBMC. Кроме того, GEM PBMC могут расширить наши знания о метаболизме иммунных клеток и позволить лучше охарактеризовать PBMC как модельную систему для изучения иммунных ответов в метаболически аберрантных условиях.
Авторские взносы
PS: подготовил рукопись; EK и MO: предоставили критические комментарии и правки к рукописи; Все авторы одобрили окончательный вариант рукописи.
Финансирование
Эта работа была поддержана Академией Финляндии (Центр передового опыта в области иммунологии молекулярных систем и физиологических исследований 2012–2017 гг., Решение № 250114, МО) и Фондом исследований ювенильного диабета (2-SRA-2014-159-QR to МО).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим Alex Dickens, Santosh Lamichhane и Riitta Lahesmaa за полезные обсуждения, касающиеся метаболизма Th-клеток и развития TIDM.
Список литературы
Ахирон А., Фельдман А., Мандель М. и Гуревич М. (2007). Нарушение экспрессии транскриптов гена апоптоза периферической крови при рецидиве острого рассеянного склероза. Ann. Акад. Sci. 1107, 155–167. DOI: 10.1196 / анналы.1381.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Агрен, Р., Бордель, С., Мардиноглу, А., Порнопуттапонг, Н., Нукау, И., и Нильсен, Дж. (2012). Реконструкция активных метаболических сетей в масштабе генома для 69 типов клеток человека и 16 типов рака с использованием INIT. PLoS Comput. Биол. 8: e1002518. DOI: 10.1371 / journal.pcbi.1002518
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Акдис, М., Паломарес, О., ван де Вин, В., ван Сплантер, М., и Акдис, К. А. (2012). Клетки T H 17 и T H 22: смешение антимикробного ответа с воспалением ткани по сравнению с защитой. J. Allergy Clin. Иммунол. 129, 1438–1449. DOI: 10.1016 / j.jaci.2012.05.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Алмейда, Л., Лохнер, М., Берод, Л., и Спарвассер, Т. (2016). Метаболические пути активации Т-клеток и дифференцировки клонов. Семин. Иммунол. 28, 514–524. DOI: 10.1016 / j.smim.2016.10.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Анжелин, А., Хиль-де-Гомес, Л., Дахия, С., Jiao, J., Guo, L., Levine, M. H., et al. (2017). Foxp3 перепрограммирует метаболизм Т-клеток для функционирования в средах с низким содержанием глюкозы и высоким содержанием лактата. Cell Metab. 25, 1282–1293. e1287. DOI: 10.1016 / j.cmet.2016.12.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аутисье П., Сулас К., Бурдо Т. Х. и Уильямс К. К. (2010). Оценка панели проточной цитометрии с 12 цветами для изучения субпопуляций лимфоцитов, моноцитов и дендритных клеток у людей. Цитометрия А .77, 410–419. DOI: 10.1002 / cyto.a.20859
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бахр, Т. М., Хьюз, Г. Дж., Армстронг, М., Рейсдорф, Р., Колдрен, К. Д., Эдвардс, М. Г. и др. (2013). Экспрессия гена мононуклеарных клеток периферической крови при хронической обструктивной болезни легких. Am. J. Respir. Cell Mol. Биол. 49, 316–323. DOI: 10.1165 / rcmb.2012-0230OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бейн, М.Дж., Чакраборти, С., Смит, Л. М., Малля, К., Сассон, А. Р., Бранд, Р. Е. и др. (2011). Транскрипционное профилирование мононуклеарных клеток периферической крови у пациентов с раком поджелудочной железы позволяет идентифицировать новые гены с потенциальной диагностической полезностью. PLoS ONE 6: e17014. DOI: 10.1371 / journal.pone.0017014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бауэр, Э., Лацни, К. К., Магнусдоттир, С., Вильмс, П., и Тиле, И. (2015). Фенотипическая дифференциация желудочно-кишечных микробов отражается в их закодированных метаболических репертуарах. Микробиом 3:55. DOI: 10.1186 / s40168-015-0121-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бауэр, Э., Циммерманн, Дж., Бальдини, Ф., Тиле, И., и Калета, К. (2017). BacArena: индивидуальное метаболическое моделирование гетерогенных микробов в сложных сообществах. PLoS Comput. Биол. 13: e1005544. DOI: 10.1371 / journal.pcbi.1005544
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беккер, С.А., Файст, А.М., Мо, М. Л., Ханнум, Г., Палссон, Б. О., и Херргард, М. Дж. (2007). Количественное прогнозирование клеточного метаболизма с помощью моделей на основе ограничений: COBRA Toolbox. Нат. Protoc. 2, 727–738. DOI: 10.1038 / nprot.2007.99
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беннетт Л., Палука А.К., Арсе Э., Кантрелл В., Борвак Дж., Банчеро Дж. И др. (2003). Интерферон и признаки гранулопоэза в крови системной красной волчанки. Дж.Exp. Med. 197, 711–723. DOI: 10.1084 / jem.20021553
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Берод, Л., Фридрих, К., Нандан, А., Фрейтаг, Дж., Хагеманн, С., Хармольфс, К., и др. (2014). De novo синтез жирных кислот контролирует судьбу регуляторных Т- и Т-хелперных 17-клеток. Нат. Med. 20, 1327–1333. DOI: 10,1038 / нм. 3704
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бордбар А., Файст А.М., Усайте-Блэк, Р., Вудкок, Дж., Палссон, Б. О., и Фамили, И. (2011). Мульти-тканевая метаболическая сеть в масштабе генома для анализа физиологии систем всего тела. BMC Syst. Биол. 5: 180. DOI: 10.1186 / 1752-0509-5-180
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бордбар А., Мо, М. Л., Накаясу, Э. С., Шримп-Ратледж, А. К., Ким, Ю. М., Мец, Т. О. и др. (2012). Управляемый моделями многомерный анализ данных проливает свет на метаболические иммуномодуляторы активации макрофагов. Мол. Syst. Биол. 8: 558. DOI: 10.1038 / msb.2012.21
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бордбар А., Монк Дж. М., Кинг З. А. и Палссон Б. О. (2014). Модели на основе ограничений предсказывают метаболические и связанные с ними клеточные функции. Нат. Преподобный Жене. 15, 107–120. DOI: 10.1038 / nrg3643
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bowler, R.P., Bahr, T.M., Hughes, G., Lutz, S., Kim, Y.-I., Coldren, C.D., et al. (2013). Подход интегративной омики определяет интерлейкин-16 как биомаркер эмфиземы. Омикс 17, 619–626. DOI: 10.1089 / omi.2013.0038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Броэ, Ф., Апасов, С. Г., Ситковский, М. В., и ван Иден, В. (2011). «Подмножества Т-клеток A2 и опосредованный Т-клетками иммунитет», в Принципах иммунофармакологии: 3-е пересмотренное и расширенное издание , ред. Ф. П. Нийкамп и М. Дж. Парнхэм (Базель: Birkhäuser Basel), 15–27.
Google Scholar
Браун, К. Т., Дэвис-Ричардсон, А. Г., Гионго, А., Гано, К. А., Крабб, Д. Б., Мукерджи, Н. и др. (2011). Анализ метагеномики кишечного микробиома предлагает функциональную модель развития аутоиммунитета при диабете 1 типа. PLoS ONE 6: e25792. DOI: 10.1371 / journal.pone.0025792
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бругман, С., Клаттер, Ф., Виссер, Дж., Вильдебур-Вело, А., Хармсен, Х., Розинг, Дж., и другие. (2006). Лечение антибиотиками частично защищает от диабета 1 типа у склонных к диабету крыс Bio-Breeding. Участвует ли кишечная флора в развитии диабета 1 типа? Diabetologia 49, 2105–2108. DOI: 10.1007 / s00125-006-0334-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Буонагуро, Л., Ван, Э., Торнеселло, М. Л., Буонагуро, Ф. М., и Маринкола, Ф. М. (2011). Системная биология в применении к разработке вакцин и иммунотерапии. BMC Syst.Биол. 5: 146. DOI: 10.1186 / 1752-0509-5-146
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Burczynski, M. E., Twine, N. C., Dukart, G., Marshall, B., Hidalgo, M., Stadler, W. M., et al. (2005). Профили транскрипции в мононуклеарных клетках периферической крови для прогнозирования клинических исходов у пациентов с запущенной почечно-клеточной карциномой. Clin. Cancer Res. 11, 1181–1189.
PubMed Аннотация | Google Scholar
Чакир Т., Патил К.Р., Онсан, З., Ульген, К. О., Кирдар, Б., и Нильсен, Дж. (2006). Интеграция данных метаболома с метаболическими сетями выявляет репортерные реакции. Мол. Syst. Биол. 2:50. DOI: 10,1038 / msb4100085
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чауссабель, Д., Куинн, К., Шен, Дж., Патель, П., Глейзер, К., Болдуин, Н. и др. (2008). Модульная структура анализа для исследований геномики крови: приложение к системной красной волчанке. Иммунитет 29, 150–164.DOI: 10.1016 / j.immuni.2008.05.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chen, L., Ge, B., Casale, F. P., Vasquez, L., Kwan, T., Garrido-Martin, D., et al. (2016). Генетические факторы эпигенетической и транскрипционной изменчивости иммунных клеток человека. Ячейка 167, 1398–1414 e1324. DOI: 10.1016 / j.cell.2016.10.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чинделевич, Л., Тригг, Дж., Регев, А., и Бергер, Б.(2014). Набор инструментов для точной арифметики для последовательного и воспроизводимого структурного анализа моделей метаболических сетей. Нат. Commun. 5: 4893. DOI: 10.1038 / ncomms5893
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чофани М., Мадар А., Галан К., Селларс М., Мейс К., Паули Ф. и др. (2012). Проверенная нормативная сеть для спецификации клеток Th27. Ячейка 151, 289–303. DOI: 10.1016 / j.cell.2012.09.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Colijn, C., Brandes, A., Zucker, J., Lun, D. S., Weiner, B., Farhat, M. R., et al. (2009). Интерпретация данных экспрессии с помощью моделей метаболического потока: прогноз Mycobacterium tuberculosis продукции миколиновой кислоты. PLoS Comput. Биол. 5: e1000489. DOI: 10.1371 / journal.pcbi.1000489
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Collares, C., Evangelista, A., Xavier, D., Takahashi, P., Almeida, R., Macedo, C., et al. (2013). Транскриптомный метаанализ периферических лимфомононуклеарных клеток показывает, что гестационный диабет ближе к диабету 1 типа, чем к сахарному диабету 2 типа. Мол. Биол. Rep. 40, 5351–5358. DOI: 10.1007 / s11033-013-2635-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Колайер, Х.А., Армстронг, Р.Н., Миллс, К.И. (2012). Микромассив для эпигенетических изменений: массивы экспрессии генов. Methods Mol. Биол. 863, 319–328. DOI: 10.1007 / 978-1-61779-612-8_20
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крофт М., Картер Л., Суэйн С. Л. и Даттон Р. У. (1994).Генерация поляризованных антиген-специфичных эффекторных популяций CD8: реципрокное действие интерлейкина (ИЛ) -4 и ИЛ-12 в стимулировании профилей цитокинов типа 2 по сравнению с типом 1. J. Exp. Med. 180, 1715–1728. DOI: 10.1084 / jem.180.5.1715
PubMed Аннотация | CrossRef Полный текст | Google Scholar
de Goffau, M. C., Luopajärvi, K., Knip, M., Ilonen, J., Ruohtula, T., Härkönen, T., et al. (2013). Состав фекальной микробиоты у детей с β-клеточным аутоиммунитетом и без него различается. Диабет 62, 1238–1244. DOI: 10.2337 / db12-0526
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Димело, С., Бургенер, А. В., Гралерт, Дж., И Хесс, К. (2017). Метаболизм Т-клеток, регулирующий активацию, пролиферацию и дифференцировку; модульный вид. Иммунология 150, 35–44. DOI: 10.1111 / imm.12655
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дуарте, Н. К., Беккер, С. А., Джамшиди, Н., Тиле, И., Мо, М.Л., Во, Т. Д. и др. (2007). Глобальная реконструкция метаболической сети человека на основе геномных и библиомических данных. Proc. Natl. Акад. Sci. США 104, 1777–1782. DOI: 10.1073 / pnas.0610772104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эбрахим, А., Алмаас, Э., Бауэр, Э., Бордбар, А., Бургард, А. П., Чанг, Р. Л. и др. (2015). Нужны ли модели в масштабе генома точные решатели или более четкие стандарты? Мол. Syst. Биол. 11: 831. DOI: 10.15252 / msb.20156157
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эдвардс, К. Дж., Фельдман, Дж. Л., Бич, Дж., Шилдс, К. М., Стовер, Дж. А., Трепиккио, В. Л. и др. (2007). Молекулярный профиль мононуклеарных клеток периферической крови пациентов с ревматоидным артритом. Мол. Med. 13, 40–58. DOI: 10.2119 / 2006-00056.Edwards
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эль-Семман, И. Э., Карлссон, Ф. Х., Шоаи, С., Нукау, И., Солиман, Т. Х., и Нильсен, Дж. (2014). Метаболические реконструкции в масштабе генома Bifidobacterium adolescentis L2-32 и Faecalibacterium prausnitzii A2-165 и их взаимодействие. BMC Syst. Биол. 8:41. DOI: 10.1186 / 1752-0509-8-41
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фалькаи, А., Соейро-Перейра, П., Кубо, К., Аранда, К., Соле, Д., и Кондино-Нето, А. (2015). Мононуклеарные клетки периферической крови детей с тяжелой астмой выделяют меньшее количество IL-12 и IL-4 после стимуляции LPS. Аллергол. Immunopathol. 43, 482–486. DOI: 10.1016 / j.aller.2014.10.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фернандес, Д. Р., Теларико, Т., Бонилья, Э., Ли, К., Банерджи, С., Миддлтон, Ф. А. и др. (2009). Активация рапамицина-мишени млекопитающих контролирует потерю TCRζ в Т-клетках волчанки через HRES-1 / Rab4-регулируемую деградацию лизосом. J. Immunol. 182, 2063–2073. DOI: 10.4049 / jimmunol.0803600
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Филен, Дж.-J., Filén, S., Moulder, R., Tuomela, S., Ahlfors, H., West, A., et al. (2009). Количественная протеомика показывает, что белки 1 и 4 семейства GIMAP по-разному регулируются во время дифференцировки Т-хелперных клеток человека. Мол. Клетка. Протеомика 8, 32–44. DOI: 10.1074 / mcp.M800139-MCP200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Förster, J., Famili, I., Fu, P., Palsson, B. Ø., And Nielsen, J. (2003). Реконструкция в масштабе генома метаболической сети Saccharomyces cerevisiae . Genome Res. 13, 244–253. DOI: 10.1101 / gr.234503
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фосс-Фрейтас, М. К., Фосс, Н. Т., Расси, Д. М., Донади, Э. А., и Фосс, М. К. (2008). Оценка продукции цитокинов мононуклеарными клетками периферической крови пациентов с диабетом 1 типа. Ann. N.Y. Acad. Sci. 1150, 290–296. DOI: 10.1196 / анналы.1447.053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гейгер Р., Rieckmann, J.C., Wolf, T., Basso, C., Feng, Y., Fuhrer, T., et al. (2016). L-аргинин модулирует метаболизм Т-клеток и увеличивает выживаемость и противоопухолевую активность. Ячейка 167, 829–842 e813. DOI: 10.1016 / j.cell.2016.09.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гионго А., Гано К. А., Крабб Д. Б., Мукерджи Н., Новело Л. Л., Казелла Г. и др. (2011). К определению аутоиммунного микробиома диабета 1 типа. ISME J. 5, 82–91.DOI: 10.1038 / ismej.2010.92
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гринберг, С. А., Пинкус, Дж. Л., Пинкус, Г. С., Бурлесон, Т., Сануду, Д., Тавил, Р. и др. (2005). Интерферон-альфа / бета-опосредованные механизмы врожденного иммунитета при дерматомиозите. Ann. Neurol. 57, 664–678. DOI: 10.1002 / ana.20464
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан, Ф., Ли, Г., Дай, С., и Хуанг, Дж. (2016). Полногеномная метаболическая модель для улучшения понимания метаболизма CD4 + Т-клеток, иммунометаболизма и применения в разработке лекарственных препаратов. Мол. Биосист. 12, 431–443. DOI: 10.1039 / C5MB00480B
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Haudek-Prinz, V.J., Klepeisz, P., Slany, A., Griss, J., Meshcheryakova, A., Paulitschke, V., et al. (2012). Сигнатуры протеома первичных мононуклеарных клеток периферической крови человека, активированных воспалением. J. Proteomics 76 Спец. № 150–162. DOI: 10.1016 / j.jprot.2012.07.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хирахара, К., Вахеди, Г., Горески, К., Янг, X. П., Накаямада, С., Канно, Ю. и др. (2011). Дифференцировка и пластичность вспомогательных Т-клеток: выводы из эпигенетики. Иммунология 134, 235–245. DOI: 10.1111 / j.1365-2567.2011.03483.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ху, Г., Тан, К., Шарма, С., Ю, Ф., Эскобар, Т. М., Мулджо, С. А., и др. (2013). Экспрессия и регуляция межгенных длинных некодирующих РНК во время развития и дифференцировки Т-клеток. Нат. Иммунол. 14, 1190–1198. DOI: 10.1038 / ni.2712
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hyötyläinen, T., Jerby, L., Petäjä, E.M., Mattila, I., Jäntti, S., Auvinen, P., et al. (2016). Исследование в масштабе генома показывает снижение метаболической адаптивности у пациентов с неалкогольной жировой болезнью печени. Нат. Commun. 7: 8994. DOI: 10.1038 / ncomms9994
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Иикура, К., Katsunuma, T., Saika, S., Saito, S., Ichinohe, S., Ida, H., et al. (2011). Мононуклеарные клетки периферической крови пациентов с бронхиальной астмой демонстрируют нарушенный врожденный иммунный ответ на риновирус in vitro . Внутр. Arch. Allergy Immunol. 155 (Приложение 1), 27–33. DOI: 10.1159 / 000327262
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дженсен П. А., Папин Дж. А. (2011). Функциональная интеграция модели метаболической сети и данных экспрессии без произвольного определения порога. Биоинформатика 27, 541–547. DOI: 10.1093 / биоинформатика / btq702
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кандури К., Трипати С., Ларджо А., Маннерстрем Х., Уллах У., Лунд Р. и др. (2015). Идентификация глобальных регуляторов спецификации клонов Т-хелперных клеток. Genome Med. 7: 122. DOI: 10.1186 / s13073-015-0237-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кью, С., Банерджи, Т., Минихейн, А.М., Финнеган Ю. Э., Уильямс К. М. и Колдер П. С. (2003). Связь между жирнокислотным составом мононуклеарных клеток периферической крови и показателями функции иммунных клеток у здоровых, свободно живущих субъектов в возрасте 25–72 лет. Am. J. Clin. Nutr. 77, 1278–1286.
PubMed Аннотация | Google Scholar
Клейвеланд, К. Р. (2015). «Мононуклеарные клетки периферической крови», in The Impact of Food Bioactives on Health , eds K. Verhoeckx, P. Cotter, I. López-Expósito, C.Клейвеланд, Т. Леа, А. Маки, Т. Рекена, Д. Святецка, Х. Уичерс (Спрингер), 161–167.
Google Scholar
Косевич, М. М., Драйден, Г. В., Чабра, А., Алард, П. (2014). Взаимосвязь между микробиотой кишечника и развитием заболевания, связанного с Т-лимфоцитами. FEBS Lett. 588, 4195–4206. DOI: 10.1016 / j.febslet.2014.03.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kostic, A. D., Gevers, D., Siljander, H., Vatanen, T., Hyötyläinen, T., Хямяляйнен А.-М. и др. (2015). Динамика микробиома кишечника младенца человека в развитии и прогрессировании к диабету 1 типа. Клеточный микроб-хозяин 17, 260–273. DOI: 10.1016 / j.chom.2015.01.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kröger, W., Mapiye, D., Entfellner, J.-B. Д., Тиффин Н. (2016). Мета-анализ общедоступных данных микрочипов позволяет идентифицировать регулирующие пути генов, нарушенные в мононуклеарных клетках периферической крови у людей с системной красной волчанкой по сравнению с теми, у кого нет. BMC Med. Геномика 9:66. DOI: 10.1186 / s12920-016-0227-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Г. Р., Ким, С. Т., Спилианакис, К. Г., Филдс, П. Э. и Флавелл, Р. А. (2006). Дифференцировка Т-хелперов: регуляция цис-элементами и эпигенетика. Иммунитет 24, 369–379. DOI: 10.1016 / j.immuni.2006.03.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леви, Х., Ван, Х., Калдунски, М., Jia, S., Kramer, J., Pavletich, S.J., et al. (2012). Транскрипционные сигнатуры как специфический для заболевания и прогнозирующий воспалительный биомаркер диабета 1 типа. Genes Immun. 13, 593–604. DOI: 10.1038 / gene.2012.41
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Li, J., Jia, H., Cai, X., Zhong, H., Feng, Q., Sunagawa, S., et al. (2014a). Интегрированный каталог эталонных генов микробиома кишечника человека. Нат. Biotechnol. 32, 834–841.DOI: 10.1038 / NBT.2942
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Li, J., Zhang, S.X., Wang, W., Cheng, K., Guo, H., Rao, C.L., et al. (2017a). Потенциальный антидепрессант и механизм устойчивости, выявленный метаболомным исследованием мононуклеарных клеток периферической крови устойчивых к стрессу крыс. Behav. Brain Res. 320, 12–20. DOI: 10.1016 / j.bbr.2016.11.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли С., Накая Х.И., Казмин, Д. А., О, Дж. З., Пулендран, Б. (2013). «Системно-биологические подходы к измерению и пониманию вакцинного иммунитета у людей», в Seminars in Immunology (Elsevier), 209–218.
Google Scholar
Li, S., Rouphael, N., Duraisingham, S., Romero-Steiner, S., Presnell, S., Davis, C., et al. (2014b). Молекулярные сигнатуры антител, полученные в результате исследования системной биологии пяти человеческих вакцин. Нат. Иммунол. 15, 195–204. DOI: 10.1038 / ni.2789
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли С., Салливан Н. Л., Руфаэль Н., Ю Т., Бентон С., Маддур М. С. и др. (2017b). Метаболические фенотипы ответа на вакцинацию у людей. Cell 169, 862–877.e17. DOI: 10.1016 / j.cell.2017.04.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю, М. Л., Чжан, X. Т., Ду, X. Y., Фанг, З., Лю, З., Сюй, Ю., и др. (2015). Тяжелое нарушение метаболизма глюкозы в мононуклеарных клетках периферической крови больных шизофренией: целевое метаболомное исследование. J. Transl. Med. 13, 226. DOI: 10.1186 / s12967-015-0540-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лойет, К. М., Оуян, В., Итон, Д. Л., и Стулс, Дж. Т. (2005). Протеомное профилирование поверхностных белков на клетках Th2 и Th3. J. Proteome Res. 4, 400–409. DOI: 10.1021 / pr049810q
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лакхирам Р. В., Чжоу Р., Верма А. Д. и Ся Б. (2012). CD4 + Т-клетки: дифференциация и функции. Clin. Dev. Иммунол. 2012: 12. DOI: 10.1155 / 2012/925135
CrossRef Полный текст | Google Scholar
Ма, Э. Х., Бантуг, Г., Грисс, Т., Кондотта, С., Джонсон, Р. М., Самборска, Б. и др. (2017). Серин является важным метаболитом для размножения эффекторных Т-клеток. Cell Metab. 25, 345–357. DOI: 10.1016 / j.cmet.2016.12.011
CrossRef Полный текст | Google Scholar
Ма, Х., Сорокин А., Мазеин А., Сельков А., Сельков Э., Демин О. и др.(2007). Реконструкция метаболической сети человека в Эдинбурге и ее функциональный анализ. Мол. Syst. Биол. 3: 135. DOI: 10.1038 / msb4100177
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Magnúsdóttir, S., Heinken, A., Kutt, L., Ravcheev, D. A., Bauer, E., Noronha, A., et al. (2016). Создание метаболических реконструкций в масштабе генома для 773 представителей кишечной микробиоты человека. Нат. Biotechnol. 35, 81–89. DOI: 10.1038 / NBT.3703
PubMed Аннотация | CrossRef Полный текст
Мак, Т.W., Grusdat, M., Duncan, G. S., Dostert, C., Nonnenmacher, Y., Cox, M., et al. (2017). Глутатион стимулирует метаболизм Т-клеток к воспалению. Иммунитет 46, 1089–1090. DOI: 10.1016 / j.immuni.2017.06.009
CrossRef Полный текст | Google Scholar
Mardinoglu, A., Agren, R., Kampf, C., Asplund, A., Nookaew, I., Jacobson, P., et al. (2013). Интеграция клинических данных с метаболической моделью адипоцита человека в масштабе генома. Мол. Syst. Биол. 9: 649. DOI: 10.1038 / msb.2013.5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мардиноглу А., Агрен Р., Кампф К., Асплунд А., Улен М. и Нильсен Дж. (2014). Моделирование метаболизма гепатоцитов в масштабе генома выявляет дефицит серина у пациентов с неалкогольной жировой болезнью печени. Нат. Commun. 5: 3083. DOI: 10.1038 / ncomms4083
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мурри М., Лейва И., Гомес-Сумакеро, Дж. М., Tinahones, F. J., Cardona, F., Soriguer, F., et al. (2013). Микробиота кишечника у детей с диабетом 1 типа отличается от таковой у здоровых детей: исследование случай-контроль. BMC Med. 11:46. DOI: 10.1186 / 1741-7015-11-46
PubMed Аннотация | CrossRef Полный текст | Google Scholar
О’Брайен, Э. Дж., Лерман, Дж. А., Чанг, Р. Л., Хайдук, Д. Р., и Палссон, Б. О. (2013). Модели метаболизма и экспрессии генов в масштабе генома расширяют и уточняют предсказание фенотипа роста. Мол. Syst. Биол. 9: 693. DOI: 10.1038 / msb.2013.52
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Острейх, К. Дж., И Вайнманн, А. С. (2012). Стабильность кодирования против гибкости: уроки, извлеченные из изучения эпигенетики дифференцировки Т-хелперных клеток. Curr. Верхний. Microbiol. Иммунол. 356, 145–164. DOI: 10.1007 / 82_2011_141
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Олафсдоттир, Т.А., Линдквист, М., Nookaew, I., Andersen, P., Maertzdorf, J., Persson, J., et al. (2016). Сравнительный системный анализ выявляет молекулярные сигнатуры клинически протестированных вакцинных адъювантов. Sci. Отчет 6: 39097. DOI: 10.1038 / srep39097
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pagani, M., Rockstroh, M., Schuster, M., Rossetti, G., Moro, M., Crosti, M., et al. (2015). Эталонный протеом высокоочищенных клеток Th2 человека обнаруживает сильное влияние на метаболизм и убиквитинирование белков при дифференцировке. Proteomics 15, 3644–3647. DOI: 10.1002 / pmic.201400139
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Патил, К. Р., Нильсен, Дж. (2005). Раскрытие транскрипционной регуляции метаболизма с помощью топологии метаболической сети. Proc. Natl. Акад. Sci. США 102, 2685–2689. DOI: 10.1073 / pnas.0406811102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Патил, К. Р., Роша, И., Фёрстер, Дж., И Нильсен, Дж.(2005). Эволюционное программирование как платформа для метаболической инженерии in silico. BMC Bioinformatics 6: 308. DOI: 10.1186 / 1471-2105-6-308
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пейн, К. К., Зун, К. К., Ван, В., Марлар, К., Кейм, Р. К., Кенари, М. Н. и др. (2013). Мононуклеарные клетки периферической крови пациентов с раком груди могут быть перепрограммированы для усиления анти-HER-2 / neu реактивности и преодоления миелоидных клеток-супрессоров. Breast Cancer Res.Относиться. 142, 45–57. DOI: 10.1007 / s10549-013-2733-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пирс, Э. Л., Поффенбергер, М. К., Чанг, С.-Х., и Джонс, Р. Г. (2013). Подпитка иммунитета: понимание метаболизма и функции лимфоцитов. Наука 342: 1242454. DOI: 10.1126 / science.1242454
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pharkya, P., and Maranas, C.D. (2006). Структура оптимизации для выявления кандидатов активации / ингибирования или исключения реакции для перепроизводства в микробных системах. Metab. Англ. 8, 1–13. DOI: 10.1016 / j.ymben.2005.08.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фаркья П., Бургард А. П. и Маранас К. Д. (2004). OptStrain: вычислительная платформа для модернизации систем производства микробов. Genome Res. 14, 2367–2376. DOI: 10.1101 / gr.2872004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Price, N. D., Reed, J. L., and Palsson, B. Ø. (2004). Модели микробных клеток в масштабе генома: оценка последствий ограничений. Нат. Rev. Microbiol. 2, 886–897. DOI: 10.1038 / nrmicro1023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Qin, J., Li, R., Raes, J., Arumugam, M., Burgdorf, K. S., Manichanh, C., et al. (2010). Каталог микробных генов кишечника человека, созданный путем метагеномного секвенирования. Природа 464: 59. DOI: 10.1038 / nature08821
CrossRef Полный текст | Google Scholar
Равикришнан А. и Раман К. (2015). Критическая оценка метаболических сетей в масштабе генома: необходимость в едином стандарте. Краткое. Биоинформатика 16, 1057–1068. DOI: 10.1093 / bib / bbv003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рош, Л. Ф., Лорка, Г. Л., Казелла, Г., Гионго, А., Наранхо, А., Пионцио, А. М. и др. (2009). Независимая от культуры идентификация кишечных бактерий коррелировала с началом диабета в модели на крысах. ISME J. 3, 536–548. DOI: 10.1038 / ismej.2009.5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Салехзаде-Язди, А., Асгари, Ю., Сабури, А., и Масуди-Нежад, А. (2014). Вычислительный анализ взаимной ассоциации метаболизма и эпигенетики у почкующихся дрожжей: подход на основе метаболической модели в масштабе генома (GSMM). PLoS ONE 9: e111686. DOI: 10.1371 / journal.pone.0111686
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саварин, Дж. П., Тоби, Т. К., Катерман, А. Д., Феллерс, Р. Т., ЛеДюк, Р. Д., Томас, П. М. и др. (2016). Сравнительная протеомика мононуклеарных клеток периферической крови от реципиентов почечного трансплантата с нормальной биопсией почек или острым отторжением. Proteomics 16, 2048–2058. DOI: 10.1002 / pmic.201600008
CrossRef Полный текст | Google Scholar
Schellenberger, J., Que, R., Fleming, R.M., Thiele, I., Orth, J.D., Feist, A.M., et al. (2011). Количественное прогнозирование клеточного метаболизма с помощью моделей на основе ограничений: COBRA Toolbox v2.0. Нат. Protoc. 6, 1290–1307. DOI: 10.1038 / nprot.2011.308
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сен, П., Флакон, Х.Дж., Радулеску О. (2016). Математическое моделирование и интеграция атомных данных для понимания динамической адаптации паразитов Apicomplexan и определения фармацевтических целей. Компр. Анальный. Parasite Biol. 7: 457. DOI: 10.1002 / 9783527694082.ch30
CrossRef Полный текст | Google Scholar
Шломи Т., Кабили М. Н., Херргард М. Дж., Палссон Б. О. и Руппин Э. (2008). Сетевое прогнозирование тканеспецифического метаболизма человека. Нат. Biotechnol. 26, 1003–1010.DOI: 10.1038 / NBT.1487
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Shoaie, S., and Nielsen, J. (2014). Выяснение взаимодействия между микробиотой кишечника человека и его хозяином посредством метаболического моделирования. Фронт. Genet. 5:86. DOI: 10.3389 / fgene.2014.00086
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Shoaie, S., Ghaffari, P., Kovatcheva-Datchary, P., Mardinoglu, A., Sen, P., Pujos-Guillot, E., et al. (2015).Количественная оценка вызванных диетой метаболических изменений микробиома кишечника человека. Cell Metab. 22, 320–331. DOI: 10.1016 / j.cmet.2015.07.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Симеони, О., Пирас, В., Томита, М., и Сельвараджу, К. (2015). Отслеживание ответов глобальной экспрессии генов при дифференцировке Т-клеток. Ген 569, 259–266. DOI: 10.1016 / j.gene.2015.05.061
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смильянович, Б., Grün, J. R., Biesen, R., Schulte-Wrede, U., Baumgrass, R., Stuhlmüller, B., et al. (2012). Многогранный баланс TNF-α и ответов интерферона I / II типа при СКВ и РА: как моноциты управляют воздействием цитокинов. J. Mol. Med. 90, 1295–1309. DOI: 10.1007 / s00109-012-0907-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Свейнстон, Н., Смоллбоун, К., Хефзи, Х., Добсон, П. Д., Брюэр, Дж., Ханшо, М. и др. (2016). Рекон 2.2: от реконструкции к модели метаболизма человека. Метаболомика 12: 109. DOI: 10.1007 / s11306-016-1051-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тейшейра В. Х., Оласо Р., Мартин-Маньетт М. Л., Ласблейс С., Жак Л., Оливейра К. Р. и др. (2009). Анализ транскриптома, описывающий новые гены иммунитета и защиты в мононуклеарных клетках периферической крови пациентов с ревматоидным артритом. PLoS ONE 4: e6803. DOI: 10.1371 / journal.pone.0006803
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тиле, И., Суэйнстон, Н., Флеминг, Р. М., Хоппе, А., Саху, С., Аурих, М. К. и др. (2013). Глобальная реконструкция метаболизма человека по инициативе сообщества. Нат. Biotechnol. 31, 419–425. DOI: 10.1038 / NBT.2488
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Туомела С., Раутио С., Альфорс Х., Олинг В., Сало В., Уллах У. и др. (2016). Сравнительный анализ транскриптомов человека и мыши при праймировании клеток Th27. Oncotarget 7, 13416–13428. DOI: 10.18632 / oncotarget.7963
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Twine, N. C., Stover, J. A., Marshall, B., Dukart, G., Hidalgo, M., Stadler, W., et al. (2003). Профили экспрессии, связанной с заболеванием, в мононуклеарных клетках периферической крови пациентов с запущенной почечно-клеточной карциномой. Cancer Res. 63, 6069–6075.
PubMed Аннотация | Google Scholar
Вяремо, Л., Шееле, К., Брохольм, К., Мардиноглу, А., Кампф, К., Асплунд, А., и другие. (2016). Реконструкция метаболической сети человеческих миоцитов, управляемая протеомами и транскриптомами, и ее использование для идентификации маркеров диабета. Cell Rep. 14: 1567. DOI: 10.1016 / j.celrep.2015.04.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, X., Цзя, С., Джеффри, Р., Алемзаде, Р., Гош, С., и Хесснер, М. Дж. (2008). Идентификация молекулярной сигнатуры сахарного диабета 1 типа человека с использованием сыворотки и функциональной геномики. J. Immunol. 180, 1929–1937. DOI: 10.4049 / jimmunol.180.3.1929
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Й., Эдди Дж. А. и Прайс Н. Д. (2012). Реконструкция метаболических моделей в масштабе генома для 126 тканей человека с использованием mCADRE. BMC Syst. Биол. 6: 153. DOI: 10.1186 / 1752-0509-6-153
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вэнь, Л., Лей, Р. Э., Волчков, П. Ю., Странджес, П. Б., Аванесян, Л., Stonebraker, A.C., et al. (2008). Врожденный иммунитет и микробиота кишечника в развитии диабета 1 типа. Природа 455, 1109–1113. DOI: 10.1038 / nature07336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Юань Д., Кох К. и Уайлдер Дж. (1994). Взаимодействие между В-лимфоцитами и NK-клетками. FASEB J. 8, 1012–1018.
PubMed Аннотация | Google Scholar
Zhang, Z.-N., Xu, J.-J., Fu, Y.-J., Liu, J., Jiang, Y.-J., Cui, H.-L., et al. (2013). Транскриптомный анализ мононуклеарных клеток периферической крови в быстро прогрессирующих ранней стадии ВИЧ-инфекции выявляет признак, тесно связанный с прогрессированием заболевания. Clin. Chem. 59, 1175–1186. DOI: 10.1373 / Clinchem.2012.197335
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Первичные мононуклеарные клетки человека и питательная среда
Эти продукты доступны в США, Канаде и некоторых странах Европы.
Система культуры мононуклеарных клеток человека
Мононуклеарные клетки (МНК) представляют собой обогащенную фракцию лимфоцитов и моноцитов цельной крови. Их выделяют из пуповинной крови и периферической крови взрослых здоровых доноров. Мононуклеарные клетки пуповинной крови содержат относительно высокий процент примитивных клеток-предшественников, в то время как мононуклеарные клетки периферической крови взрослых (hMNC-PB) содержат высокую долю зрелых иммунных клеток.
Мононуклеарные клетки производятся из свежесобранной цельной крови, которую тщательно отделяют центрифугированием в градиенте низкой плотности, эффективно удаляя гранулоциты.Чтобы избежать общего повреждения клеток, эритроциты аккуратно истощаются по запатентованному протоколу, а не с использованием традиционных методов осмотического лизиса. Полученные сверхчистые мононуклеарные клетки не слипаются при оттаивании и демонстрируют превосходную жизнеспособность и неизменную биологическую функцию. Сразу после выделения свежеприготовленные мононуклеарные клетки подвергаются криоконсервации с использованием запатентованной среды для замораживания, не содержащей сыворотки, Cryo-SFM. Каждая криопробирка содержит не менее 25 миллионов жизнеспособных клеток после размораживания.
Среда для мононуклеарных клеток — это высокопитательная среда для краткосрочного обслуживания, которая обеспечивает оптимальную жизнеспособность мононуклеарных клеток из пуповинной крови, периферической крови взрослых и других источников, таких как костный мозг.Он одобрен для поддержания мононуклеарных клеток на срок до 48 часов, прежде чем приступить к вашим экспериментам. Среда для мононуклеарных клеток состоит из флакона с базальной средой и одного флакона с SupplementMix. Комбинирование SupplementMix с базальной средой составляет полную среду.
Среда для мононуклеарных клеток рекомендуется для
- Мононуклеарные клетки человека из пуповинной крови (hMNC-CB)
- Мононуклеарные клетки человека из периферической крови (hMNC-PB)
Подробная информация о добавках среды для мононуклеарных клеток
PromoCell ® Среда для мононуклеарных клеток содержит все факторы роста и добавки, необходимые для оптимального кратковременного поддержания мононуклеарных клеток.Среда для мононуклеарных клеток не содержит антибиотиков или антимикотиков и разработана для использования в инкубаторе с атмосферой 5% CO 2 .
Подготовка среды для мононуклеарных клеток с добавками
- Разморозьте смесь Mononuclear Cell SupplementMix при 15-25 ° C.
- Соблюдайте правила асептики, смешивая растворы добавок, осторожно пипетируя их вверх и вниз.
- Перенесите все содержимое каждой добавки в базальную среду для мононуклеарных клеток.
- Закройте бутылку и осторожно взболтайте, чтобы получить однородную смесь.
Хранение и стабильность продуктов мононуклеарных клеток
- Храните базальную среду для мононуклеарных клеток при 4–8 ° C в темноте, а смесь Mononuclear Cell SupplementMix при -20 ° C сразу после доставки. Не замораживайте базальную среду для мононуклеарных клеток.
- При правильном хранении продукты стабильны до истечения срока годности, указанного на этикетке.
- После добавления Mononuclear Cell SupplementMix в базальную среду для мононуклеарных клеток срок хранения полной среды составляет 6 недель при 4-8 ° C.Не замораживайте всю среду.
- Для использования, аликвотируйте и предварительно нагрейте только объем одноядерной клеточной среды, необходимый для одноразового использования, а оставшуюся среду держите в холодильнике при 4–8 ° C.
- После доставки криоконсервированные клетки следует немедленно засеять или хранить в жидком азоте.
Контроль качества системы культуры мононуклеарных клеток
Контроль качества среды для мононуклеарных клеток
Все партии среды для мононуклеарных клеток подвергаются всестороннему контролю качества с использованием первичных мононуклеарных клеток человека из пуповинной крови и периферической крови взрослых.Каждую партию среды для мононуклеарных клеток проверяют на кратковременное поддержание неизменной функции и жизнеспособности мононуклеарных клеток. В качестве эталона используются одобренные внутренние партии мононуклеарных клеточных сред. Кроме того, все партии сред были протестированы на отсутствие микробных загрязнений (грибов, бактерий, микоплазм).
Контроль качества мононуклеарных клеток человека
Жесткие тесты контроля качества проводятся для каждой партии мононуклеарных клеток человека.
- Партии обычно характеризуются проточной цитометрией на предмет жизнеспособности и ряда клеточных характеристик, включая размер и зернистость клеток.
- Клетки проверены на отсутствие ВИЧ-1, ВИЧ-2, HBV, HCV, HTLV-1, HTLV-2 и микробных загрязнителей (грибов, бактерий и микоплазм).
- Для каждой партии мононуклеарных клеток предоставляется подробная информация относительно процентного содержания основных клеточных субпопуляций, таких как лимфоциты, моноциты и гранулоциты.
- Подробный сертификат анализа (CoA) для каждого лота доступен для скачивания.
Мононуклеарные клетки периферической крови человека (PBMC) Lonza
Обзор продукта
Lonza — ваш идеальный партнер при покупке PBMC.Наши мононуклеарные клетки периферической крови (PBMC) выделяются из периферической крови с помощью афереза и разделения в градиенте плотности. Гарантированно они содержат ≥50 миллионов жизнеспособных клеток в ампуле. ВИЧ-1, гепатит B и гепатит C выявляются не для всех доноров и / или партий клеток. Сертификат анализа предоставляется на каждую приобретенную партию ячеек.
Возможность скрининга различных доноров
Представление образца в вашем эксперименте имеет значение. Мы ведем инвентаризацию различных доноров, чтобы удовлетворить ваши требования к представлению образцов.Вы можете выбрать лот на основе демографических характеристик донора и просмотреть несколько лотов, чтобы найти те, которые лучше всего подходят для вас. Кроме того, мы можем запросить повторных доноров, если вам нужны дополнительные клетки от конкретного донора.
Богатый источник иммунных клеток
Мононуклеарные клетки периферической крови (PBMC) представляют собой смешанную популяцию одноядерных клеток. Их можно дополнительно очистить для выделения отдельных типов клеток, таких как естественные клетки-киллеры, Т-клетки и В-клетки.Кроме того, PMBC являются богатым источником моноцитов, которые могут дифференцироваться либо в макрофаги, либо в дендритные клетки посредством культивирования с различными цитокинами. Поддерживается оптимизированной системой сред LGM-3 TM Среда для роста лимфоцитов была специально разработана для поддержки и поддержания лимфоцитов и оптимизирована для культивирования без сыворотки (в зависимости от применения могут потребоваться дополнительные цитокины) Также могут быть приемлемы альтернативные среды, содержащие сыворотку .
Пожалуйста, свяжитесь с Scientific Support для получения рекомендаций по сыворотке, содержащей среды.Lonza гарантирует работоспособность клеток Clonetics TM / Poietics TM только в том случае, если используются только соответствующие среды и реагенты Clonetics TM / Poietics TM и соблюдаются рекомендуемые протоколы хранения и использования. Любые изменения, внесенные в рекомендуемые системы ячеек, включая использование альтернативных сред, реагентов или протоколов, аннулируют гарантии производительности ячеек и сред. Если вам нужна помощь в выборе подходящей среды, реагентов или протокола, обратитесь в службу поддержки Lonza Scientific.
Новый терапевтический подход с использованием мононуклеарных клеток периферической крови, предварительно кондиционированных кислородно-глюкозной депривацией
Состояние OGD превосходит как только кислородную депривацию, так и только депривацию глюкозы для секреции VEGF в PBMC
Эксперименты проводились с использованием PBMC человека, чтобы определить, какое состояние среди OGD только лишение кислорода и только депривация глюкозы превосходили секрецию VEGF. Для выделения фракций РВМС проводили центрифугирование Ficoll-Hypaque, и было продемонстрировано, что секреция VEGF в условиях OGD была значительно выше, чем в условиях только кислородного голодания или нормоксических условиях.Таким образом, секреция VEGF из человеческих PBMC в состоянии OGD может превосходить состояние кислородной недостаточности (дополнительная фигура 1). Это указывает на то, что состояние OGD может быть подходящим для переключения в защитную поляризацию в PBMC, таких как микроглия 9 .
Условия 18-часового OGD превосходили 6-часовые и 30-часовые условия OGD по секреции VEGF в PBMC
Для оценки временного эффекта OGD на секрецию VEGF с помощью PBMC мы измерили уровень VEGF на клетку у крысы. Среда, кондиционированная PBMC, после 6, 18 и 30 ч инкубации с OGD.На основании результатов твердофазного иммуноферментного анализа (ELISA) секреция VEGF была выше после 18-часовой обработки OGD-PBMC, чем через 6 часов (дополнительный рисунок 2), тогда как 30-часовая обработка OGD приводила к гибели клеток. Таким образом, 18 часов были оптимальной продолжительностью лечения для этого исследования.
Заметные изменения уровней VEGF и TGF-β, секретируемых из OGD-PBMC
Для исследования секреции факторов защитного ремоделирования из OGD-PBMC, уровни VEGF и TGF-β в кондиционированных средах обоих PBMC и изолированные моноциты / макрофаги в нормоксических условиях и в условиях OGD (18 ч) сравнивали с помощью вестерн-блоттинга.Вкратце, хотя моноциты / макрофаги были изолированы с помощью магнитной сортировки клеток (MACS) с использованием антитела против CD11b, их чистота была> 99%, как определено иммунопозитивностью Mac-1 (CD11b / 18) в проточной цитометрии (дополнительный рисунок 3). ). Хотя уровни VEGF были обнаружены в кондиционированной среде OGD-PBMC, то же самое не было достоверным для PBMC в нормоксических условиях (P = 0,029) (фиг. 1A). Кроме того, уровень TGF-β в кондиционированной среде OGD-PBMC был выше, чем в нормоксических условиях (P = 0.044). Вестерн-блоттинг для TNF-α показал полосу около 42 кДа, слабую полосу 25 кДа и полосу 18 кДа. Однако различий в уровне TNF-α в кондиционированной среде между OGD и нормоксическими условиями не обнаружено (P = 0,19, 0,19 и 0,12, соответственно) (рис. 1B). Последовательно определяли отношение TGF-β к TNF-α, поскольку оно отражает поляризацию защитных противовоспалительных и токсичных провоспалительных моноцитов / макрофагов 29 и микроглии 9 . Отношение TGF-β к TNF-α около полос 42 кДа и 25 кДа из OGD-PBMC было выше, чем у PBMC в нормоксических условиях (P = 0.044 и 0,027) (рис. 1С). Наконец, уровни VEGF, TGF-β и TNF-α в кондиционированной среде из моноцитов как в нормоксических условиях, так и в условиях OGD не были обнаружены в этих экспериментах (рис. 1A, B; вестерн-блоты большой длины также представлены в дополнительных Рисунок 4А, Б).
Рисунок 1Характеристики первично культивируемых мононуклеарных клеток периферической крови (PBMC) крыс, предварительно обработанных кислородно-глюкозной депривацией (OGD) (OGD-PBMC). Уровни секреторного фактора роста эндотелия сосудов (VEGF) (N = 4) (A) , противовоспалительного цитокинового фактора роста-β (TGF-β) и провоспалительного цитокинового фактора некроза опухоли-α (TNF- α) (N = 7 каждый) (B) из кондиционированной среды первично культивируемых PBMC крыс и изолированных моноцитов, подвергнутых либо нормоксии (норма), либо OGD.Вестерн-блоттинг для TNF-α показал полосу около 42 кДа, слабую полосу 25 кДа и полосу 18 кДа (стрелка). ( C ) Отношение TGF-β к TNF-α, которое отражает поляризацию PBMC как в нормоксических условиях, так и в условиях OGD (N = 7 для каждого). Увеличение соотношения TGF-β к TNF-α показывает поляризацию защитного противовоспалительного статуса в условиях OGD. ( D ) Репрезентативные фигуры указывают на экспрессию провоспалительного маркера (т.е. индуцибельной синтазы оксида азота, iNOS) и защитного противовоспалительного маркера (кластер дифференцировки 206, CD206) в клеточном лизате из PBMC в обоих случаях: normoxic и состояния OGD (N = 6 каждый).( E ) Отношение CD206 к iNOS, которое отражает поляризацию PBMC как в нормоксических условиях, так и в условиях OGD (N = 6 каждый). Увеличение соотношения CD206 на iNOS показывает поляризацию защитного противовоспалительного статуса в условиях OGD. ( F ) Типичные цифры показывают экспрессию рецептора γ, активируемого пролифератором пероксисом (PPARγ), в клеточном лизате из PBMC как в нормоксических условиях, так и в условиях OGD (N = 6 каждый). Трансферрин и β-актин подтвердили равную загрузку белков.Данные представляют собой относительные оптические плотности каждого образца по сравнению с полосой контроля нагрузки по непарному t-критерию. * P <0,05. ** P <0,01.
Примирование защитного противовоспалительного переключателя в OGD-PBMC
Поляризацию OGD-PBMC на маркеры клеточной поверхности исследовали с использованием антител против индуцибельной синтазы оксида азота (iNOS, т.е. провоспалительный маркер) и CD206. (т.е. защитный противовоспалительный маркер) (рис.1D). Вестерн-блоттинг показал, что уровень iNOS в лизатах клеток OGD-PBMC ниже, чем в лизатах нормоксических клеток PBMC (P = 0,01) (фиг. 1D; вестерн-блоты большой длины также представлены на дополнительном рисунке 4C). Напротив, то же самое было неверно для уровней CD206 (P = 0,94). Соотношение уровней CD206 на iNOS, которое отражает поляризацию защитных противовоспалительных и токсичных провоспалительных моноцитов / макрофагов 29 и микроглии 9 , было выше в состоянии OGD, чем в нормоксическом состоянии (P = 0.023) (рис. 1Е).
Механизм поляризации PBMC с помощью OGD
Чтобы определить механизм, с помощью которого оптимальный OGD влияет на поляризацию PBMC, мы оценили уровень рецептора-γ, активируемого пролифератором пероксисомы фактора транскрипции (PPARγ). PPARγ, ядерный рецептор, активируемый лигандом, проявляет мощные противовоспалительные свойства за счет своей позитивной регуляции, а также обеспечивает защитную дифференцировку моноцитов в макрофаги 30 . Вестерн-блоттинг показал, что уровень PPARγ был выше в лизатах клеток OGD-PBMC, чем в лизатах нормоксических клеток PBMC (P <0.001).
Оптимальное количество клеток для внутриартериального введения
Было проведено несколько экспериментов для определения оптимального количества клеток для внутриартериального введения, учитывая, что целью этого исследования было изучение внутриартериального введения клеток. В результате смертность крыс, которым вводили PBMC через общую сонную артерию, зависела от количества клеток, поскольку большое количество клеток может привести к эмболическому инсульту (дополнительный рисунок 5).Уровень смертности 20% (0,21), связанный с введением внутриартериальных PBMC (5 × 10 5 клеток), был самым низким среди протестированных концентраций PBMC. Учитывая эти результаты, мы вводили 5 × 10 5 клеток на крыс после экспериментов, чтобы избежать смерти, связанной с эмболическим инсультом.
Миграция введенных OGD-PBMC в паренхиму мозга
Чтобы подтвердить, мигрировали ли OGD-PBMC в паренхиму мозга через ГЭБ, были исследованы как OGD-PBMC, так и нормоксические PBMC, полученные из трансгенных мышей с зеленым флуоресцентным белком (GFP) 31 проводился исследователем, не имеющим отношения к терапевтической информации.Хотя OGD-GFP-PBMC наблюдались в пограничной области между ишемическим ядром и периферией через 3 дня после введения (фиг. 2A), они не были обнаружены через 21 день после введения. Однако в группе введения нормоксических GFP-PBMC сигналов не наблюдалось.
Рисунок 2Миграция администрируемых OGD-PBMC. ( A ) Управляемые OGD-PBMC от мышей GFP (зеленые, OGD-GFP-PBMC) мигрировали в пограничную область между ишемическим ядром и полутенью через 3 дня после введения в трех повторностях.Однако сигналы не наблюдались в образцах мозга от введения нормоксических PBMC от мышей GFP (нормоксические GFP-PBMC). Масштабная линейка 50 мкм. Анализы с 4 ‘, 6’-диамидино-2-фенилиндолом (DAPI; синий) проводились исследователем, не знающим терапевтической информации. ( B ) Репрезентативный вестерн-блоттинг и гистограммы, показывающие относительную интенсивность сигнала хемоаттрактантного белка-1 моноцитов (MCP-1) из кондиционированной среды первично культивируемых PBMC крыс, подвергнутых нормоксии (норма) или OGD (N = 5 каждый).Повышение уровня MCP-1 показывает, что OGD-PBMC могут мигрировать в ответ на MCP-1 в паренхиму мозга. Трансферрин подтвердил одинаковую загрузку белков. Данные представляют собой относительные оптические плотности каждого образца по сравнению с полосой контроля нагрузки по непарному t-критерию. ** P <0,01 (N = 5).
Последовательно исследовали уровень хемоаттрактантного протеина-1 моноцитов (MCP-1), который является одним из ключевых хемокинов, регулирующих миграцию и инфильтрацию в пораженные участки мозга моноцитов / макрофагов, PBMC и стволовых клеток 26,32 , 33 .Кроме того, сообщалось, что дефицит MCP-1 снижает восприимчивость к инфильтрации и миграции после церебральной ишемии 26,33 . Чтобы определить влияние предварительного условия OGD на секрецию MCP-1, сравнивали уровни MCP-1 на PBMC как в нормоксических, так и в условиях OGD в кондиционированных средах. Уровни MCP-1 в условиях OGD были в 6 раз выше, чем в нормоксических условиях (P = 0,006) (рис. 2B).
Увеличение количества SSEA-3-положительных клеток путем введения OGD-PBMC
Мы предположили, что OGD-PBMC могут увеличивать количество стволовых клеток, поскольку SSEA-3-положительные клетки были обнаружены в PBMC после церебральной ишемии 22 .Учитывая, что положительность антител против SSEA-3 была неизвестна, их положительность для стволовых клеток была подтверждена с использованием клеток плюрипотентной эмбриональной карциномы (NTERA-2 cl.D1 [NT2 / D1] (ATCC ® CRL -1973 ™). ), экспрессирует SSEA-3 34 и октамер-связывающий фактор транскрипции 3/4 (Oct3 / 4) (фиг. 3A).
Рисунок 3Увеличение числа SSEA-3-положительных клеток после OGD in vitro и наличие SSEA-3-положительных клеток после введения OGD-PBMC in vivo .( A ) Типичные цифры октамерсвязывающего фактора транскрипции 3/4 (Oct3 / 4) (красный) / стадийно-специфического эмбрионального антигена-3 (SSEA-3) (зеленый) / DAPI (синий) тройного мечения NTERA- 2 клетки, исследованные с помощью конфокальной микроскопии. Масштабные линейки, 20 мкм. ( B, C ) Экспрессия SSEA-3 с использованием OGD-PBMC человека ( B ) и крысы ( C ) методом проточной цитометрии. Ось X представляет собой прямое рассеяние, а ось Y представляет канал SSEA-3-FITC. SSEA-3-положительные клетки в OGD-PBMC были более заметны, чем клетки в нормоксических PBMC, по непарному t-критерию.** P <0,01. (каждый N = 6). ( D ) Двухточечный временной ряд экспрессии SSEA-3-положительных клеток в человеческих OGD-PBMC с помощью проточно-цитометрических анализов с помощью двухфакторного дисперсионного анализа ANOVA. (каждый N = 6). ( E ) Рекрутинг SSEA-3-положительных клеток в ложно прооперированной и ишемической коре головного мозга на 10-й день (т.е. введение через 3 дня) и 28 (т.е. введение через 21 день) после ишемии. Гистограмма представляет общее количество SSEA-3-положительных клеток. Статистический анализ проводился с помощью однофакторного дисперсионного анализа.Контрольные антитела, содержащие только вторичные антитела, подтверждают его специфичность. Масштабные линейки, 20 мкм. * Р <0,05. (N = 28).
Затем экспрессию SSEA-3 в OGD-PBMC человека и крысы оценивали с помощью проточно-цитометрических анализов с использованием антитела против SSEA-3. Процент SSEA-3-положительных клеток в группе OGD-PBMC был более заметным, чем в группе нормоксических PBMC у человека (P <0,001) (рис. 3B), а также у крыс (P = 0,07) (рис. 3С). Фактически, количество SSEA-3-положительных клеток в группе OGD-PBMC (2496 ± 1796 / лунка) было более значительным, чем в группе нормоксических PBMC (738 ± 996 / лунка) у человека (P = 0.037). Интересно, что увеличение частоты SSEA-3-позитивных клеток в OGD-PBMC в условиях 18-часового OGD было более очевидным, чем при 6-часовом состоянии OGD у человека (P <0,001) (фиг. 3D).
Наконец, исследовали, вызывает ли введение OGD-PBMC увеличение количества SSEA-3-положительных клеток в паренхиме мозга после церебральной ишемии. В частности, SSEA-3-положительные клетки подсчитывали путем иммунофлуоресцентного окрашивания ишемической коры головного мозга через 3 и 21 день после введения (т.е.через 10 и 28 дней после церебральной ишемии соответственно) с использованием антитела против SSEA-3. Хотя SSEA-3-положительные клетки не были идентифицированы в группе ложной операции, они наблюдались в ишемическом ядре (фиг. 3E, дополнительная фиг. 6). Изображения с меньшим увеличением качественно показали общее состояние ткани (дополнительный рисунок 6). Однако было трудно различить количественные различия между группами при малом увеличении. Были исследованы семь случайно выбранных неперекрывающихся полей высокой мощности (630 ×) на уровне передней спайки ложно прооперированной или ишемической коры головного мозга (дополнительный рисунок 7) 9,35,36 .Число SSEA-3-положительных клеток в группе введения OGD-PBMC было более выраженным, чем в контрольной группе с фосфатно-солевым буфером (PBS) через 3 дня после введения (P = 0,04) (фиг. 3E). Однако разницы в количестве SSEA-3-положительных клеток между тремя группами не наблюдалось через 21 день после введения. Дополнительные эксперименты с использованием антител различных производителей против SSEA-3 дали результаты, аналогичные упомянутым выше (дополнительный рисунок 8).
Экспрессия VEGF и TGF-β при введении OGD-PBMC
Чтобы подтвердить, регулирует ли введение OGD-PBMC факторы ремоделирования в паренхиме поврежденного мозга, был проведен иммуногистохимический анализ мозга трансплантированных крыс с использованием антител против обоих VEGF. и TGF-β через 21 день после введения (т.е.е., через 28 дней после ишемии головного мозга). В то время как экспрессия VEGF и TGF — β не была обнаружена в головном мозге крыс с ложной операцией, заметная экспрессия VEGF и увеличение числа TGF-β-положительных клеток наблюдались в пограничной области в ишемическом ядре через 21 день после введения (то есть через 28 дней после церебральной ишемии) (рис. 4A, B). Анализ интенсивности иммунореактивности показал, что введение 5 × 10 5 OGD-PBMC вызывало более выраженную экспрессию VEGF по сравнению с введением 5 × 10 5 нормоксических PBMC и 1 × 10 5 OGD-PBMC (оба P <0.001) (рис. 4А). Кроме того, количество TGF-β-позитивных клеток было более заметно при введении OGD-PBMC, чем количество при введении нормоксических PBMC, в то время как то же самое не было достоверным для контрольной группы PBS (обе P <0,001) (рис. . 4B). Однако различий между группами в экспрессии VEGF и количестве TGF-β-положительных клеток в ишемической полутени не наблюдалось.
Фиг.4. ВведениеOGD-PBMC способствует экспрессии факторов ремоделирования через 28 дней после церебральной ишемии.Типичные цифры и относительные интенсивности сигналов фактора роста эндотелия сосудов (VEGF) ( A ) и трансформирующего фактора роста-β (TGF-β) ( B ) из коры головного мозга трансплантированных групп через 28 дней после церебральной ишемии . VEGF ( A ) и TGF-β ( B ) (зеленый) / MAP2 (красный) / DAPI (синий) тройное мечение коры головного мозга на границе между ишемическим ядром и полутенью через 28 дней после церебральной ишемии , как исследовали с помощью конфокальной микроскопии.( A ) Значительно более высокая иммунореактивность для VEGF наблюдалась при введении группы 5 × 10 5 OGD-PBMC по сравнению с введением 1 × 10 5 OGD-PBMC и 5 × 10 5 введение нормоксических PBMC на границе ишемического ядра (N = 28). Напротив, различий в иммунореактивности для VEGF в ишемической полутени не наблюдалось. ( B ) Значительно большее количество TGF-β-положительных клеток наблюдалось при введении группы OGD-PBMC по сравнению с введением нормоксических PBMC и контрольных групп PBS на границе внутри ишемического ядра (N = 21) .Гистограммы представляют объемную интенсивность сигнала VEGF и количество TGF-β-положительных клеток в образцах головного мозга с помощью однофакторного дисперсионного анализа. Контрольные антитела, содержащие только вторичные антитела, подтверждают его специфичность. Масштабные линейки, 20 мкм. ** P < 0,01.
Стимуляция ангиогенеза путем введения OGD-PBMC
Мы предположили, что экспрессия как VEGF, так и TGF-β при введении OGD-PBMC может способствовать ангиогенезу, учитывая, что наша исследовательская группа ранее продемонстрировала, что их экспрессия в пограничной области между ишемическое ядро и полутень при введении OGD-микроглии приводит к ангиогенезу 9 .Следовательно, ангиогенные эффекты введения OGD-PBMC оценивали с помощью иммунофлуоресцентного окрашивания ишемической коры через 28 дней после церебральной ишемии с использованием антитела против маркера ангиогенеза, то есть CD31 (фиг. 5A). Конфокальные микроскопические исследования показали, что иммунореактивность CD31 на единицу объема в пограничной области между ишемическим ядром и полутенью при введении 5 × 10 5 OGD-PBMC была более заметной, чем обнаруженная в группе ложной операции и введении нормоксических PBMC и 1 × 10 5 OGD-PBMC через 28 дней после церебральной ишемии (т.е.е., через 21 день после введения) (все P <0,001).
Фиг.5. ВведениеOGD-PBMC способствует как ангиогенезу в пограничной области между ишемическим ядром и полутенью, так и разрастанию аксонов в ишемической полутени через 28 дней после церебральной ишемии. ( A ) Типичные цифры и гистограммы, представляющие иммунореактивность для кластера дифференцировки 31 (CD31) объема, выраженного в мкм 3 , в ишемическом ядре и полутени от коры головного мозга в группе ложнооперированной группы и введении группа нормоксических PBMC, 1 × 10 5 OGD-PBMC или 5 × 10 5 групп OGD-PBMC через 28 дней после церебральной ишемии.Тройное мечение CD31 (зеленый) / MAP2 (красный) / DAPI (синий) в ишемической коре головного мозга через 28 дней после церебральной ишемии по данным конфокальной микроскопии. ( B ) Типичные цифры и гистограммы, представляющие иммунореактивность для SMI31-положительных объемов, выраженную в мкм 3 , в ишемической полутени от коры головного мозга при введении нормоксических PBMC, 1 × 10 5 OGD-PBMC , или 5 × 10 5 групп OGD-PBMC. Двойное мечение SMI31 (зеленый) / DAPI (синий) в ишемической коре головного мозга через 28 дней после церебральной ишемии по данным конфокальной микроскопии (N = 28).Гистограмма представляет интенсивность сигналов CD31 и SMI31 в образцах головного мозга с помощью однофакторного дисперсионного анализа. Более того, контрольный образец антител, содержащий только вторичные антитела, подтвердил его специфичность. Масштабные линейки, 20 мкм. ** P < 0,01.
Стимуляция разрастания аксонов путем введения OGD-PBMC
Кроме того, было исследовано, может ли введение OGD-PBMC вызвать разрастание аксонов, с помощью иммунофлуоресцентного окрашивания ишемической коры через 28 дней после церебральной ишемии с использованием антител против маркера белка нейрофиламентов. я.э., СМИ31 9 . Иммунореактивность SMI31 в ишемической полутени при введении 5 × 10 5 OGD-PBMC была более выраженной, чем при введении нормоксических PBMC и 1 × 10 5 OGD-PBMC через 28 дней после церебральной ишемии (т.е. , через 21 день после введения) (P <0,001 и P <0,001) (фиг. 5B).
Терапевтические эффекты введения OGD-PBMC против фокальной церебральной ишемии
Наконец, было исследовано, улучшило ли введение OGD-PBMC функциональный результат с использованием модели временной фокальной церебральной ишемии на крысах.Неврологические исходы сравнивали между контрольной группой PBS, группой введения нормоксических PBMC и группой введения OGD-PBMC. Неврологический дефицит, измеренный по сенсомоторной шкале с угловым тестом 37 , был значительно улучшен в группе введения 5 × 10 5 OGD-PBMC по сравнению как с контролем PBS, так и с введением нормоксических PBMC 5 × 10 5 группы через 28 дней после церебральной ишемии (P = 0,020 и 0,268 соответственно) (фиг. 6A).Кроме того, были оценены пути доставки для введения клеток. Улучшения у крыс, которым вводили 5 × 10 5 OGD-PBMC через бедренную вену, не было обнаружено (дополнительная фигура 9). Кроме того, после введения не наблюдались аллергические реакции, симптомы заболевания трансплантат против хозяина, внутримозговое кровоизлияние и отек.
Рисунок 6Улучшение неврологических исходов после введения OGD-PBMC. (A) Значительно лучшее функциональное восстановление, оцененное в угловом тесте (выполненном 20 раз), наблюдалось при введении группы OGD-PBMC по сравнению с контрольной группой с инъецированным носителем (контрольная группа PBS) и группой нормоксичных PBMC при 28 дней после ишемии головного мозга; # P <0.05 по сравнению с контрольной группой PBS (N = 6 ~ 8 на группу). Наблюдалось отсутствие разницы в функциональном восстановлении между группой введения 5 × 10 5 нормоксичных PBMC и контрольной группой PBS. Кроме того, не наблюдалось функционального восстановления при введении как 1 × 10 5 OGD-моноцитов (группа OGD-моноцитов), так и 1 × 10 5 OGD-PBMC, и контроля PBS (N = 5 ~ 6). группы с помощью двустороннего дисперсионного анализа. ( B ) Значительно лучшее функциональное восстановление, оцененное в угловом тесте, наблюдалось при введении группы 18-часового OGD-PBMC по сравнению с контрольной группой PBS.Наконец, не было обнаружено улучшения при введении 6-часовой группы OGD-PBMC; # P <0,05 по сравнению с контрольной группой PBS с помощью однофакторного дисперсионного анализа (N = 5 ~ 6).
Последовательно, чтобы исследовать функциональное восстановление в зависимости от количества клеток при введении OGD-PBMC, были проанализированы неврологические исходы между группами с введением 5 × 10 5 и 1 × 10 5 OGD-PBMC. Неврологический дефицит, измеренный с помощью углового теста, был значительно улучшен в группе с введением 5 × 10 5 OGD-PBMC по сравнению с контрольными группами PBS (P = 0.028) через 28 дней после церебральной ишемии (то есть через 21 день после введения), хотя группа с введением 1 × 10 5 OGD-PBMC не показала значительных улучшений по сравнению с контрольной группой PBS (P = 0,497) (Рис. 6A).
Адекватные условия введения OGD-PBMC
Чтобы определить, улучшило ли введение OGD-PBMC или изолированных моноцитов / макрофагов, предварительно обработанных OGD, функциональный результат, оценивали терапевтические эффекты изолированных моноцитов / макрофагов, предварительно обработанных OGD.
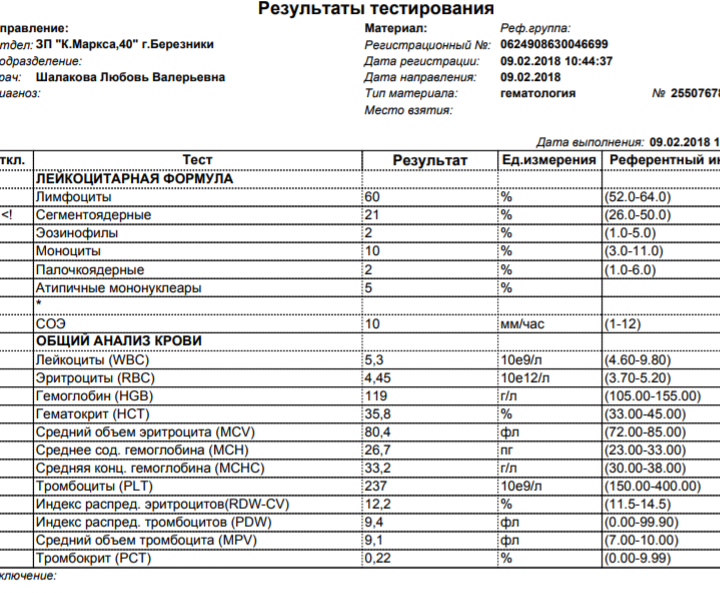 В типичных случаях инфекционного мононуклеоза, при подсчете лейкоцитарной формулы, их количество от 15 до 70% .
В типичных случаях инфекционного мононуклеоза, при подсчете лейкоцитарной формулы, их количество от 15 до 70% .