Немного о роли микрофлоры кишечника в жизни человека
Кудин А.П., к.м.н., доцент, зав. инфекционным отделением № 5 УЗ «Городская детская инфекционная больница г. Минска»
Организм человека населяет большое количество микроорганизмов (по приблизительным подсчетам — около 1000 видов), основную массу которых составляют бактерии. В значительно меньшем количестве представлены другие микроорганизмы (вирусы, археи, простейшие). В норме все они находятся в состоянии равновесия между собой и с организмом человека.
Микроорганизмы попадают к человеку из внешней среды и заселяют (с рождения и пожизненно) те области, которые непосредственно контактируют с внешней средой: кожа, дыхательные пути, мочевыводящие пути, желудочно-кишечный тракт (ЖКТ). Внутренняя среда макроорганизма, а также альвеолы, внутреннее и среднее ухо, матка, почки и мочеточники в норме стерильны. Очевидно, самые благоприятные условия для пребывания микробов в организме человека создаются в ЖКТ.
Заселение кишечника ребенка начинается примерно с середины периода внутриутробного развития (единичные микробы), но основное заселение происходит с момента рождения. При прохождении через родовые пути начинается интенсивная колонизация кожных покровов и слизистых оболочек, соприкасающихся с внешней средой. Эпидермальные стафилококки заселяют кожу α-стрептококки – носоглотку. Массивная колонизация кишечника здорового новорожденного происходит гетерогенной флорой (аэробной и анаэробной) в первые сутки. Однако с 3-5 дня основной (резидентной) флорой становятся бифидобактерии, которые вытесняют другие микроорганизмы из местного биотопа. Это связано с тем, что лактоза грудного молока активно метаболизируется в первую очередь бифидо- и лактобактериями. Кроме того, содержащийся в женском (но не коровьем) молоке N-ацетилглюкозамин стимулирует рост бифидобактерий.
При родоразрешении путем кесарева сечения состав микробов, колонизирующих организм новорожденного, отличается в сторону дефицита лактобацилл, энтеробактерий и дифтероидов.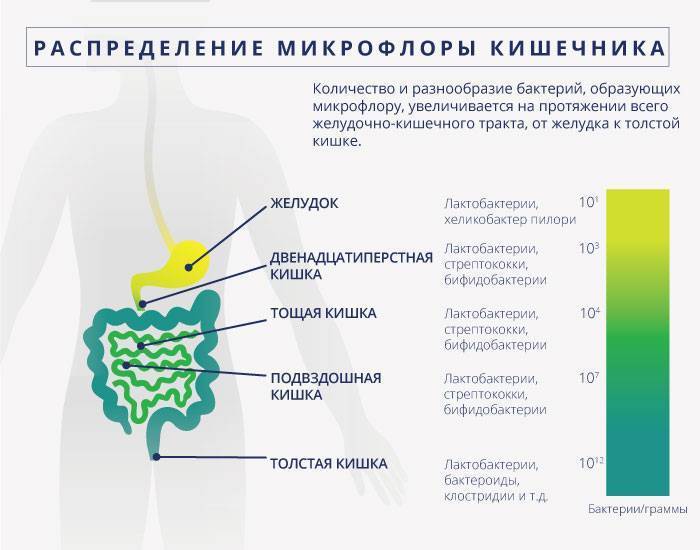
Некоторые факторы (течение беременности, способ родоразрешения, особенности выхаживания ребенка после рождения и др.) могут нарушать этапность заселения и видовой состав микрофлоры кишечника.
Состав микробного пейзажа во многом определяется характером питания. У грудных детей, находящихся на естественном вскамливании, доминируют бифидо- и лактобактерии. У грудных детей на искусственном вскармливании микрофлора кишечника более гетерогенна, и преобладание молочно-кислых микробов над другими выражено в значительно меньшей степени. У более старших детей по мере уменьшения в питании доли молочных продуктов и включения мяса и мясных продуктов увеличивается удельный вес протеолитических микробов.
Нормальная микрофлора человека представлена облигатными микроорганизмами (которые присутствуют, практически, постоянно) и транзиторными (факультативными), на долю которых приходится не более 1-2%.
В зависимости от особенностей метаболизма все микробы кишечника можно условно разделить на протеолитические (кишечная палочка и другие грамм-отрицательные энтеробактерии, бакероиды, клостридии) и сахаролитические (бифидо- и лактобактерии, энтерококки).
По отношению к кислороду бактерии делят на облигатные аэробы, растущие только в присутствии кислорода, облигатные анаэробы рост которых подавляется кислородом (бактероиды, бифидобактерии, клостридии) и факультативные анаэробы, способные к росту как в присутствии кислорода, так и без него (лактобактерии, кишечная палочка и др. грамм-отрицательные энтеробактерии, стафилококки, стрептококки, энтерококки). На долю облигатных анаэробов (бактероиды и бифидобактерии) приходится 95-99% всех микробов кишечника (причем, бактероидов больше).
По локализации в кишечнике выделяют пристеночную и полостную микрофлору. В тонкой кишке содержание пристеночной флоры на несколько порядков превышает численность полостной. В толстой кишке это соотношение меняется на противоположное.
Общее колическтво микробных клеток в организме человека по расчетам составляет около 1014, что превышает число собственных клеток человека.
Распределение нормальной микрофлоры вдоль желудочно-кишечного тракта (ЖКТ) неоднородно по качественному и количественному составу.
В ротовой полости анаэробов примерно на порядок больше, чем аэробов, т.к. первые, находясь в труднодоступных местах (десневые карманы, щели между зубами и т.д.), лучше защищены от действия лизоцима и других протективных факторов слюны. Среди бактерий здесь преобладают стрептококки (до 60% всех микробов ротовой полости). Из других частых представителей микрофлоры следует упомянуть фузобактерии, вейонеллы, бактероиды, спирохеты, актиномицеты. Здесь же обитают микоплазмы (M.salivarium), грибы рода Candida, простейшие (Entamoeba buccalis, Entamoeba dentalis, Trichomonas buccalis). Данная микробиота представляет собой первый барьер, препятствующий проникновению болезнетворных микроорганизмов, попадающих в полость рта из внешней среды, дальше в ЖКТ.
В желудке здорового человека микробов, практически, нет из-за действия желудочного сока, имеющего низкое значение рН. В небольшом количестве здесь могут существовать некоторые лактобактерии и грамотрицательные энтеробактерии. Содержание Helicobacter pylori обычно не превышает 103 бактерий в 1 мл содержимого желудка.
Верхние отделы тонкой кишки относительно мало заселены микроорганизмами. В физиологических условиях в тощей кишке содержится 10 4-5/мл микробов (в основном, лакто- и бифидобактерии), и по мере приближения к илеоцекальному клапану количество микробов в подвздошной кишке увеличивается до 107/мл (в основном за счет бактероидов, энтерококков, кишечной палочки).
Толстая кишка отличается самой высокой плотностью заселения микроорганизмами, количество которых достигает 109-1012/мл, из которых анаэробы составляют 95-99%. К ним относятся грамположительные палочки (бифидо-, лакто- и эубактерии), грамотрицательные палочки (бактероиды), грамположительные спорообразующие палочки (клостридии). Из других частых представителей нормальной микрофлоры следует назвать энтерококки, грамотрицательные факультативно-анаэробные палочки (кишечная палочка, клебсиелла, энтеробактер и др.). в меньших количествах обнаруживаются стафилококки, дрожжевые грибы, простейшие и вирусы.
Сохранению относительного постоянства нормальной микрофлоры способствуют различные факторы, к которым относятся нормальная перистальтика кишечника (прежде всего, тонкой кишки), герметичность эпителиального слоя, компоненты пищеварительных соков (соляная кислота, желчные кислоты, протеолитические ферменты и т.д.), сохранная функция илеоцекального клапана, факторы местного иммунитета (секреторные IgA, лизоцим, лимфоидные образования кишечника, состояние перманентного физиологического воспаления в стенке кишки).
Значение кишечной микробиоты для организма человека трудно переоценить. К основным функциям нормальной микрофлоры относятся:
- Защитная функция, суть которой заключается в обеспечении колонизационной резистентности, т.е. предотвращении колонизации ЖКТ патогенными микроорганизмами. Это осуществляется за счет конкуренции за питательные вещества, за места адгезии (рецепторы), за счет выработки бактериоцинов, короткоцепочечных жирных кислот, а также за счет стимуляции местных защитных факторов (в виде состояния легкого воспаления).

- Пищеварительная функция. Микрофлора обеспечивает конечный гидролиз белков, омыление жиров, сбраживание высокомолекулрных углеводов, которые не метаболизировались в тонкой кишке. Кроме того, некоторые вещества, поступающие с пищей, могут расщепляться только кишечной микрофлорой (например, целлюлоза). Под действием нормальной микрофлоры в подвздошной кишке происходит деконъюгация 90% желчный кислот с последующим обратным всасыванием и повторным участием в пищеварении. Оставшиеся в кале желчные кислоты обеспечивают нормальную гидратацию каловых масс.
- Двигательная функция. На перистальтику кишечника микрофлора может влиять по-разному. С одной стороны, за счет стимуляции синтеза окиси азота и активации L-клеток кишечника может замедлять моторику в тонкой кишке и проксимальных отделах толстой кишки. С другой стороны, короткоцепочечные жирные кислоты, синтезирующиеся микрофлорой, в дистальных отделах толстой кишки стимулируют усиление моторики.
- Способствует всасыванию воды (с помощью некоторых продуктов микробного метаболизма).

- Нормальная микрофлора способна обезвреживать многие токсические вещества как путем их химической обработки, так и за счет сорбции на своей поверхности и выведения с каловыми массами. По антитоксической функции некоторые авторы приравнивают кишечных микробов к печени.
- Участвуют в синтезе некоторых необходимых веществ: витаминов группы В (В1,В2,В6,В12), фолиевой кислоты, витамина К и др. и хотя большинство из этих синтезирующихся веществ не всасываются, они могут оказаться важными и полезными для собственно слизистой кишечника. Например, было показано, что недостаточное поступление к эпителию слизистой толстой кишки витаминов В 6, В12 и фолиевой кислоты связано с повышенным риском развития рака толстой кишки.
Стоит отметить, что геном человека содержит около 23 тыс генов, а количество генов микробов и вирусов, содержащихся только в ЖКТ, составляет более 3 млн, и, возможно, часть из них участвует в синтезе необходимых человеку веществ. В эксперименте показано, например, что у стерильных («гнотобиологических») животных отмечается недоразвитие лимфоидной и гемопоэтической ткани, отмечаются нарушения со стороны головного мозга, истончается стенка кишечника, ослабляется реактивность фагоцитов, развивается гипогаммаглобулинемия.
В эксперименте показано, например, что у стерильных («гнотобиологических») животных отмечается недоразвитие лимфоидной и гемопоэтической ткани, отмечаются нарушения со стороны головного мозга, истончается стенка кишечника, ослабляется реактивность фагоцитов, развивается гипогаммаглобулинемия.
- Иммуномодулирующая функция связана с воздействием на факторы врожденного и адаптивного иммунитета как на местном, так и на системном уровне. И это влияние, возможно, является главным во взаимодействии микрофлоры и макроорганизма. Влияние нормальной микрофлоры на систему иммунитета складывается из нескольких моментов. Во-первых, слизистая кишечника, особенно толстой кишки (вследствие наиболее массивного заселения бактериями), обильно инфильтрирована макрофагами, лимфоцитами, плазматическими клетками, т.е., фактически, находится в состоянии постоянного хронического воспаления. Это перманентное воспаление обеспечивает пребывание иммунокомпетентных клеток в состоянии субактивации и, как следствие, — более быстрый и эффективный ответ на попадание агрессивной (патогенной) флоры.

 ч. и аутоиммунных.
ч. и аутоиммунных.
Различные виды и штаммы представителей нормальной микрофлоры слизистых могут оказывать разнонаправленное влияние на активность иммунной системы. Поэтому существует потенциальная возможность целенаправленно влиять на функционирование иммунной системы человека посредством воздействия с помощью микроорганизмов на факторы врожденного и адаптивного иммунитета. Здесь будет уместно процитировать статью Андреевой И.В. и Стецюк О.У., в которой суммированы данные литературы о влиянии различных пробиотиков на организм человека (табл.).
Влияние пробиотиков на макроорганизм (И.В. Андреева и О.У. Стецюк, 2010),
|
Штамм пробиотика |
Положительное влияние на макроорганизм |
|
L.rhamnosus GG |
Усиление иммунного ответа, профилактика и лечение инфекций дыхательных путей у детей, профилактика и лечение инфекционной диареи у детей, профилактика антибиотик-ассоциированной диареи, профилактика возникновения атопического дерматита у детей, улучшение эрадикации H. |
|
L.reuteri SD2112 |
Усиление иммунного ответа, профилактика инфекций дыхательных путей у взрослых, лечение ротавирусной диареи |
|
L.casei DN-114001 |
Усиление иммунного ответа, лечение диареи |
|
L.acidophilus NCFM |
Снижение непереносимости лактозы, уменьшение выраженности синдрома избыточного бактериального роста, лечение и профилактика урогенитальных инфекций у женщин, лечение инфекций дыхательных путей у детей, лечение диареи у детей, улучшение эрадикации H.pylori |
|
L.plantarum 299V |
Нейтрализация проявлений синдрома раздраженного кишечника, применяется в восстановительном периоде после хирургических вмешательств |
|
L.casei Shirota YIT9029 |
Профилактика рецидивов поверхностного рака мочевого пузыря, усиление иммунного ответа |
|
L. |
Нейтрализация проявлений воспалительных заболеваний кишечника |
|
B.lactis BB-12 |
Профилактика инфекций дыхательных путей у детей, профилактика и лечение инфекционной диареи и желудочно-кишечных расстройств у детей, профилактика антибиотик-ассоциированной диареи |
|
B.infantis 35624 |
Нейтрализация проявлений синдрома раздраженного кишечника |
|
B.longum BB536 |
Лечение атопической экземы, улучшение эрадикации H.pylori, лечение язвенного колита |
|
B.lactis HN019 (DR10) |
Усиление иммунного ответа, особенного у пожилых |
|
B.animalis DN173-010 |
Нормализация времени прохождения пищи по кишечнику |
|
L. |
Улучшение эрадикации H.pylori, усиление иммунного ответа |
|
S.boulardii |
Профилактика антибиотик-ассоциированной диареи |
|
S.thermophilus (большинство штаммов) |
Профилактика проявлений лактазной недостаточности |
Взаимодействие макроорганизма с кишечной микрофлорой может осуществляться несколькими путями: в виде комменсализма, паразитизма, симбиоза.
По современным представлениям, провести четкую границу между комменсалами и условно-патогенной микрофлорой невозможно. В определенных случаях заболевание могут вызвать различные микробы, входящие в состав нормальной микрофлоры.
В настоящее время в печати (в том числе, и медицинской) нередко говорится о дисбактериозе, как о несуществующей проблеме. Аргументируется это разными доводами.
- Под «дисбактериозом» обычно обозначают изменения соотношений и состава нормальной микрофлоры организма, а также места их обитания.
 Однако до настоящего времени во всем мире нет понятия нормы кишечного биоценоза. И нет «золотого стандарта» диагностики дисбактериоза.
Однако до настоящего времени во всем мире нет понятия нормы кишечного биоценоза. И нет «золотого стандарта» диагностики дисбактериоза. - Наиболее часто для диагностики дисбактериоза используют посев кала. Однако результаты этого анализа непоказательны. Во-первых, анализ показывает состояние микробов, обитающих только в просвете толстой кишки, причем в ее дистальном (конечном) отделе. Состав микробиоты тонкой кишки остается неизвестным. Во-вторых, при таком исследовании выделяют 8-12 видов микробов, в то время как их количество в кишечнике более 1000 (причем не учитывается содержание даже бактериодов, которые составляют более 50% массы всех кишечных микробов). В-третьих, для достоверной диагностики требуется собрать содержимое кишечника в стерильных условиях, транспортировать материал при определенной температуре и доставить его в лабораторию в течение 2 часов. Иначе результаты будут искажены.
Существует другая методика: посев аспирата тонкокишечного содержимого или биоптата стенки тонкой кишки. В этом случае мы получаем данные о состоянии флоры в тонком кишечнике. Но такая диагностика применяется крайне редко.
В этом случае мы получаем данные о состоянии флоры в тонком кишечнике. Но такая диагностика применяется крайне редко.
Есть также косвенные методы, которые позволяют судить о состоянии микрофлоры кишечника. К ним относятся химические методы: газожидкостная хроматография и масс-спектрометрия.
Для анализа используется содержимое кишечника, в котором определяется концентрация веществ — продуктов жизнедеятельности микрофлоры, а затем делается вывод о ее качественном и количественном составе.
Используются также дыхательные тесты, когда продукты жизнедеятельности бактерий определяют в выдыхаемом воздухе. Однако эти методы можно использовать только в качестве предварительной диагностики, так как велика доля ложных результатов.
- Даже современные молекулярные методики не дают исчерпывающего результата: до 75% разновидностей микробов остаются не классифицируемыми. Содержание микробов в кале не отражает реальной ситуации в просвете тонкой и толстой кишок, а тем более в пристеночных биотопах, где состав микробов может заметно отличаться от состава просветной флоры.

- И, кроме того, диагноз «дисбактериоз кишечника» не имеет четкой клинической составляющей — иными словами, такой болезни просто не существует.
Все перечисленное верно. Однако говорить об отсутствии проблемы нарушенного, аномального, избыточного и т.д. роста кишечных микробов, очевидно, неверно. Небольшие возможности современной диагностики этого состояния не исключают существование самой проблемы. В зарубежной литературе вместо термина «дисбактериоз кишечника» для обозначения нарушений качественного и количественного состава кишечной микрофлоры применяют термин «синдром избыточного роста бактерий» в тонкой кишке (bacterial overgrowth syndrome). Под этим синдромом понимают клинически и/или лабораторно подтвержденный синдром мальдигестии/мальабсорбции, связанный с качественными или количественными изменениями микробиоты тонкой кишки.
В этой статье, говоря о проблеме влияния измененноймикробиоты на организм человека, мы будем пользоваться привычным нам термином «дисбактериоз».
При дисбактериозе происходит перераспределение флоры на протяжении кишечника: малонаселенная в норме тонкая кишка оказывается заполненной огромным количеством бактерий, а в толстой кишке меняется их видовой состав. Вместо полезных и привычных видов появляются патогенные (чаще это условно-патогенные микробы, которые при определенных условиях начинают проявлять свойства патогенных).
Причин нарушения видового состава и количества микроорганизмов в кишечнике очень много, и обычно действуют они в комплексе.
«Полезные» бактерии гибнут:
- если им нечего есть. Такое случается, когда рацион несбалансирован, беден растительной клетчаткой и кисломолочными продуктами.
- если им некомфортно. При различных заболеваниях (колит, панкреатит, холецистит, гастрит, гепатит и др.) в кишечнике меняется pH. В изменившихся условиях нарушается обмен веществ и целостность клеток кишечных микробов.
- если их место занимают агрессивные «собратья» — патогенные бактерии, микроорганизмы, гельминты, грибы.

Не секрет, что облигатнопатогенные микробы (сальмонеллы, шигеллы, иерсинии, кампилобактерии и др.) вызывают соответствующие заболевания. При дисбактериозе же часто обнаруживаются, так называемые, условно-патогенные микробы, но в большом количестве. И здесь будет уместно напомнить о таком феномене, как «чувство кворума» (quorum sensing) – способность ощущать плотность собствнной популяции микробов. Оказалось, что микроорганизмы обладают способностью к самостимуляции собственного размножения. При благоприятных условиях они начинают продуцировать специальные автоиндукторы, стимулирующие соседние и недалеко расположенные микробные клетки данного вида. При превышении определенной пороговой концентрации биологические свойства этих микробов изменяются: у них экспрессируются заторможенные до этого гены, в которых закодированы биологически активные вещества, повышающие патогенность микробов (различные токсины, ферменты и т.д.). Таким образом, вроде бы безобидные микроорганизмы приобретают свойства патогенных. И в этом случае они уже способны оказывать повреждающее действие на организм человека и вызывать заболевание. (Если немного отвлечься от микробов, то можно сказать, что этот феномен, наверное, имеет универсальное действие. Например, люди в офисе, на стройке или производстве обычно ведут себя адекватно, но собираясь большой группой, например, на стадионе могут становиться агрессивными). Следует отметить, что предпринимаются попытки использовать «чувство кворума» в лечебных целях для увеличения метаболической и антагонистической активности представителей нормальной микрофлоры с целью защиты макроорганизма от действия патогенных агентов.
И в этом случае они уже способны оказывать повреждающее действие на организм человека и вызывать заболевание. (Если немного отвлечься от микробов, то можно сказать, что этот феномен, наверное, имеет универсальное действие. Например, люди в офисе, на стройке или производстве обычно ведут себя адекватно, но собираясь большой группой, например, на стадионе могут становиться агрессивными). Следует отметить, что предпринимаются попытки использовать «чувство кворума» в лечебных целях для увеличения метаболической и антагонистической активности представителей нормальной микрофлоры с целью защиты макроорганизма от действия патогенных агентов.
Поэтому лечение дисбактериоза может потребовать применения антимикробных препаратов, включая антибиотики. Однако следует помнить, что принципиально важным является то, что нужно лечить не плохой анализ на дисбактериоз, а клинически выраженное патологическое состояние, в основе которого лежит дисбактериоз. В немногочисленных данных содержимого тонкой кишки было показано, что до 20% здоровых людей могут иметь отклонения в микробном пейзаже (при патологии этот показатель составляет до 64%).
И, конечно же, говоря о лечении дисбактериоза, нельзя не сказать о применении биопрепаратов. Все они делятся на:
- Пребиотики (лаклулоза, инулин, фруктозо- и галактозоолигосахариды и др.) — это препараты, которые подготавливают кишечник к заселению нормальной микрофлорой, создают для нее комфортные условия. К пребиотикам относятся также продукты питания, такие как: кукурузные, овсяные каши, ржаной хлеб, бобовые, соки с мякотью, отруби, молочные продукты и др.
- Пробиотики (эубиотики) — это препараты, содержащие нормальную микрофлору кишечника и способные благоприятно воздействовать на кишечную микробиоту и общее состояние огранизма. Свойствами пробиотиков также обладают кисломолочные продукты, обогащенные лакто- и бифидобактериями.
- Синбиотики— комбинированные препараты про- и пребиотиков.
Практика показывает, что хорошо работающие «в пробирке» препараты не всегда оказывают должный эффект в организме. Введенная с пробиотиками флора часто пропадает после окончания курса терапии. Дело в том, что дисбактериоз — это скорее следствие, нежели причина болезней. В больном организме «полезные» бактерии просто не приживаются, сколько их не «сажай». Дисбактериоз развивается под влиянием множества факторов. И вылечить его только лишь приемом лекарств невозможно.
Отдельно необходимо сказать о применении биопреаратов после приема антибиотиков. Многие считают, что это является обязательным. На самом деле, при отсутствии каких-либо клинических проявлений антибиотик-ассоциированной диареи в применении биопрепаратов нет необходимости. (Так же, как и при наличии изменений в анализе на дисбактериоз при отсутствии соответствующей симптоматики).
Прежде чем заниматься микрофлорой, необходимо лечение хронических заболеваний, особенно желудочно-кишечного тракта. Важно избавиться от очагов инфекции во рту, ЛОР-органах. Огромное значение имеет сбалансированный рацион питания. То есть, нужно создать самые благоприятные условия для колонизации кишечника, и только после этого рассчитывать на благоприятный эффект от лечения.
И наконец, следует сказать о еще одном заблуждении, которое довольно широко распространено. Многие считают что живые пробиотики колонизируют кишечник и, тем самым, излечивают дисбактериоз. Однако оказалось, что профилактические и лечебные эффекты пробиотиков могут быть воспроизведены с убитыми бактериями и продуктами их разрушения. Это служит подтверждением мысли о том, что основной механизм действия биопрепаратов связан с их влиянием на систему местной защиты организма ребенка (местного врожденного и адаптивного иммунитета кишечника).
Использование пробиотиков в медицине теоретически имеет большие перспективы. К настоящему времени доказана их эффективность при различных заболеваниях ЖКТ как инфекционных (ротавирусная инфекция, диарея путешественников, хеликобактерных хронических гастритах), так и – неинфекционных (некротизирующий энтероколит, неспецифический язвенный колит). Кроме того, показана терапевтическая эффективность пробиотиков при атопических заболеваниях, снижение частоты и тяжести эпизодов ОРИ у детей на фоне применения пробиотиков, и даже – усиление иммунного ответа на вакцинацию. Существуют работы, в которых показана возможная эффективность определенных пробиотиков в лечении воспалительных заболеваний кишечника (болезни Крона, неспецифического язвенного колита).
Если пофантазировать, то при определенном уровне знаний можно с помощью пробиотиков вызывать вполне определенные, необходимые данному конкретному пациенту иммунные реакции, способные помочь человеку справиться с различными по патогенезу заболеваниями (инфекционными, иммунными, неоплазменными). Но, как легко понять, это дело не близкого будущего.
И, в заключение, несколько ключевых моментов этой статьи:
- При отсутствии клинических признаков поражения ЖКТ (неустойчивый стул, боли в животе, беспокойство, плохая прибавка массы тела и т.д.) обнаруженные в анализе кала признаки дисбактериоза не требуют лечения (!),
- Проведение АБ-терапии не означает, что детям обязательно необходимо назначать биопрепараты. В подавляющем большинстве случаев достаточно правильного полноценного питания, с включением продуктов, содержащих растительную клетчатку, и, если нет противопоказаний в виде лактазной недостаточности или непереносимости белка коровьего молока, — кисломолочных продуктов.
- Развитие АБ-ассоциированной диареи обычно купируется после отмены причинно-значимого препарата. Хотя в этом случае может возникнуть потребность в медикаментозном лечении, что в каждом случае решается индивидуально. Однако роль правильного питания и в этом случае также является решающей. (Исключением является псевдомембранозный колит клостридиозной этиологии, лечение которого довольно сложное и может быть не всегда эффективным).
- У детей первых 4-6 месяцев жизни расстройство стула часто трудно поддаются лечению, но в большинстве случаев быстро исчезают после введения прикорма (в первую очередь, фруктов и овощей).
- Необходимо понимать, что проблема дисбактериоза – это проблема местной защиты. Поэтому, даже если путем героических усилий добиться нормализации состава микрофлоры кишечника (по анализу кала на дисбактериоз, что само по себе ни о чемне говорит, как уже упоминалось ранее), то при сохранении плохой местной защиты попадание в кишечник достаточно агрессивных возбудителей вновь приведет развитию дисбактериоза.
- Микробы, содержащиеся в биопрепаратах, хоть и могут участвовать в заселении кишечника, но их роль в этом процессе невелика. Основная их функции – стимуляция местного иммунитета. (Косвенным подтверждением этого тезиса является убедительно доказанный факт защитного действия L.rhamnosus GG при ротавирусном энтерите).
Роль микрофлоры желудочно–кишечного тракта и принципы коррекции нарушений ее состава | Горелов А.В., Усенко Д.В.
Со времен открытия А. Левенгуком мира бактерий умы ученых занимают вопросы взаимоотношений человека с микроорганизмами как внутри нас, так и в окружающей среде. При этом если вначале ученые воспринимали микроорганизмы только как «агрессоров», несущих болезнь, то работы великого русского ученого И.И. Мечникова послужили основой нового учения о «симбионтной микрофлоре», оказывающей огромное влияние на наш организм, и о биотерапии, как способе лечения ряда патологических состояний, укрепления здоровья, а в итоге и продления жизни.
Как известно, микрофлора представляет собой неотъемлемую часть любой биосферы. Во всех природных системах микроорганизмы существуют в виде сложных многокомпонентных сообществ – биоценозов, внутри которых формируются характерные взаимоотношения, способствующие сохранению жизнеспособности микробных популяций. Они заселяют все наружные поверхности и полости человека, образуя единую экологическую систему с многогранным разветвленным механизмом взаимовыгодных симбиотических отношений.Специфика расселения различных микробных популяций по отдельным биотопам макроорганизма коррелирует со сложившимися там условиями для обитания микроорганизмов. Наиболее густо заселенной экосистемой является толстокишечный биотоп, в нем сконцентрировано около 60% всей микрофлоры. Желудочно–кишечный тракт (ЖКТ) человека населен мириадами микробов, которые различаются в колоссальной степени по своей локализации, продолжительности жизненного цикла и своим функциям [1]. Результаты недавних исследований строения фрагмента 16S рибосомной РНК показали, что большинство штаммов кишечной микрофлоры пока еще не поддаются культивированию, но представлены в основном грамположительными бактериями с низким (около 20%) или высоким (около 50%) содержанием гуанина и цитозина (Г + Ц пар) [2]. Интересно отметить, что большинство культур пробиотиков также являются грамположительными бактериями с низким содержанием гуанина и цитозина (Lactobacillus casei DN–114001, L. Shirota, L. Plantarum 299v, L. rhamnosus GG, L.johnsoni La1) или высоким содержанием гуанина и цитозина (Bifidobacterium lactis BB12).
Нормальную микрофлору ЖКТ подразделяют на следующие составные части: индигенная или облигатная микрофлора (немногочисленная в видовом составе, но в численном соотношении она составляет основу биоценоза), факультативная или сопутствующая (концентрация клеток не превышает 5% от общей численности микроорганизмов), и транзиторная или случайная (в количественном отношении в норме не должна превышать 0,01%) [3].
Хорошо известно, что одной из ключевых функций индигенной микрофлоры ЖКТ является формирование и поддержание колонизационной резистентности. По определению Van der Vaaij (1987), «колонизационная резистентность» – это «резистентность, с которой сталкиваются потенциально патогенные микроорганизмы при попытке колонизировать места обитания на слизистой оболочке одного из трех трактов, имеющих открытое сообщение с внешним миром: дыхательного, мочеполового и пищеварительного». Помимо микрофлоры, в обеспечении колонизационной резистентности участвуют кожные покровы и слизистые, а также клеточные и гуморальные элементы иммунной системы. Однако именно с нормальной микрофлорой – первым и основным барьером – сталкиваются экзогенные микроорганизмы, во множестве поступающие с обсемененной пищей, водой, частицами капельного и пылевого аэрозоля и др. Механизмы колонизационной резистентности можно разделить на прямые и непрямые. К прямым механизмам относятся продукция бактериями ингибиторных факторов (короткоцепочечные жирные кислоты, бактериоцины, дефенсины, лантабиотики и др.), нарушающих метаболизм патогенных и условно–патогенных бактерий, конкурентная борьба за питательные субстраты, места адгезии, прямая деградация токсинов, антиэндотоксической действие, препятствие транслокации в другие участки организма [4–6]. К непрямым эффектам относятся активация иммунной системы, стимуляция системы мононуклеаров, интерфероногенная функция, ингибирование конъюгации желчных кислот и т.д. Естественно, что множественность механизмов, обеспечивающих колонизационную резистентность, предполагает и многообразие вариантов, комбинации в конкретных ситуациях. Однако одним из определяющих условий эффективной работы системы колонизационной резистентности является количественный и качественный состав микрофлоры ЖКТ, а также состояние среды ее обитания.
Иммуномодулирующая функция микрофлоры ЖКТ реализуется на различных уровнях иммунной защиты [7,8]. Один из основных эффектов – стимуляция местного иммунитета, за счет повышения уровня секреторного иммуноглобулина А. Помимо этого, микрофлора активно взаимодействует с клетками иммунной системы ЖКТ, определяя их дифференцировку, играет ключевую роль в индукции пищевой толерантности, влияя на баланс в системе Th2/Th3. Компоненты клеточной стенки кишечных бактерий способны проникать в системный кровоток, выполняя функцию иммуностимулятора.
Исключительно важную роль микрофлора ЖКТ выполняет в переваривании пищи и обмене веществ: гидролиз белков, сбраживание углеводов, участие в метаболизме желчных кислот, холестерина, ксенобиотиков и т.д. По своей метаболической активности микрофлора кишечника сопоставима с печенью.
Микроорганизмы ЖКТ способны продуцировать значительное количество медиаторов, гормоноподобных соединений, регулирующих деятельность пищеварительной и эндокринной систем. Так, летучие жирные кислоты, помимо энергетического субстрата для эпителиальных клеток кишечника, являются регуляторами его моторной функции, одновременно обладая и антибактериальной активностью. Нельзя не отметить активность микрофлоры в обеспечении организма витаминами В1, В2, В6, В12, многие из которых синтезируются в физиологически значимых количествах.
Несмотря на то, что микроэкологическая система кишечника является динамической саморегулирующейся системой, огромное число внешних и внутренних факторов способны вывести ее из равновесия, провоцируя формирование дисбиотических нарушений. При этом даже минимальные отклонения, не имеющие клинических проявлений, способны впоследствии явиться причиной различных заболеваний. Так, по данным И.Н. Ручкиной, более чем у 70% больных синдромом раздраженного кишечника причиной заболевания явились перенесенные кишечные инфекции с последующим развитием дисбактериоза [9].
Роль нарушений состава микрофлоры ЖКТ в детском возрасте определяется ее неспособностью выполнять в полном объеме физиологические функции, и прежде всего – противостоять колонизации кишечника экзогенными патогенными микроорганизмами. В результате снижения уровня бифидобактерий нарушаются процессы пищеварения: всасывания питательных веществ, синтез витаминов, утрачивается способность к активации различных ферментов и их субстратов в кишечном содержимом. Элиминация лактобактерий приводит к изменению рН кала и снижению уровня ферментативной активности. При наличии кишечных расстройств изменяется большинство биохимических показателей кала: повышается содержание общих липидов, триглицеридов, углеводов, общего белка [10]. Многими авторами описано развитие мальабсорбции углеводов в патогенезе кишечных инфекций, как фактор, отягощающий их течение [10–12].
На фоне снижения резистентности организма и угнетения иммунологических сил при нарушении питания, гиповитаминозах или интеркурентных инфекциях и пр. создаются условия для реализации патогенного действия условно–патогенных микробов.
Чаще всего в результате элиминации индигенных микроорганизмов экологические ниши заселяются представителями условно–патогенной аэробной флоры – бактериями родов Klebsiella, Enterobacter, Proteus, Staphylococcus, Clostridium (Cl. difficile), Acinetobacter, Pseudomonas и грибов рода Candida, которые высокорезистентны к антибиотикам и менее требовательны к условиям размножения. Среди всех изученных культур условно–патогенных энтеробактерий, по данным исследований О.Г. Крамаря, самым высоким уровнем устойчивости к антибиотикам отличались Proteus (89%), затем Klebsiella (51–94%), Enterobacter (56–98%), Staphylococcus (67–90%) [13].
В настоящее время определены основные принципы коррекции микроэкологических нарушений ЖКТ. Ключевым моментом является понимание того, что дисбактериоз свидетельствует не просто о дефиците бактерий облигатной или факультативной микрофлоры (бифидо–, лактобактерий, кишечной палочки), но и является индикатором различных патологических состояний, сопровождающихся нарушением микроэкологии ЖКТ. По этой причине простого назначения пробиотиков с целью «заселения» слизистой оболочки кишечника может быть недостаточно.
Первым этапом коррекции микроэкологических нарушений ЖКТ является базисный курс терапии с целью достижения клинической ремиссии основного заболевания (коррекция моторной, секреторной, пищеварительной и др. функций ЖКТ). Затем патогенетически обосновано проведение энтеросорбции и энтеропротекции, особенно в условиях роста уровня антибиотикорезистентности микробов. Это обеспечивает извлечение, фиксацию и выведение из ЖКТ бактериальных токсинов, продуктов естественного обмена, активированных ферментов, желчных кислот, медиаторов воспаления, биологически активных веществ, перекисных продуктов, условно–патогенных микроорганизмов и вирусов [14].
Следующим этапом является селективная деконтаминация, направленная на снижение обсемененности ЖКТ условно–патогенными микроорганизмами. Показаниями к ее проведению является избыточный бактериальный рост в тонкой кишке, наличие воспалительных процессов в кишечнике, выявление высоких титров условно–патогенной микрофлоры в просвете кишечного содержимого [14]. К средствам, направленным на борьбу с условно–патогенной микрофлорой, относятся антибиотики, бактериофаги, споровые препараты, кишечные антисептики. Использование первых оправдано только при тяжелом течении заболевания, сопровождающемся нарушением трофологического статуса и выраженными изменениями параклинических показателей. Более безопасно применение кишечных антисептиков. Среди них прекрасно зарекомендовали себя современные препараты нутриционного ряда, в частности, нифуроксазид, нифурател, характеризующиеся широким спектром антибактериальной активности в отношении наиболее значимых микробных агентов: стафилококка, протеев, клебсиелл, патогенных эшерихий и др.
Несмотря на скептическое отношение некоторых врачей–педиатров, применение бактериофагов в коррекции легких и среднетяжелых нарушений микрофлоры ЖКТ при правильном выборе препарата характеризуется высокой эффективностью, сочетающейся с минимальным негативным влиянием на облигатную микрофлору. Наиболее широко используются стафилококковый, колипротейный, клебсиеллезный, комбинированный пиобактериофаг (активен в отношении стафилококков, стрептококков, протеев, эшерихий, синегнойной палочки), интестибактериофаг (действует против шигелл, сальмонелл, эшерихий, протеев, стафилококков, энтеробактерий, синегнойной палочки). Безусловно, выбор того или иного бактериофага должен определяться чувствительностью к нему доминирующего условно–патогенного микроорганизма. С целью повышения санирующей эффективности фагов, целесообразно их одновременное использование с комплексными иммуноглобулиновыми препаратами КИП и кипферон. Не рационально одновременное использование бактериофагов и пробиотиков, как по причине разных значений рН кишечной среды, необходимых для их действия, так и по возможности формирования фагорезистентных штаммов транзиторной и условно–патогенной микрофлоры.
При отсутствии чувствительности патогенных микроорганизмов к бактериофагам эффективным подходом к деконтаминации кишечника у детей старше 2 лет является использование споровых препаратов.
Наиболее важным этапом является восстановление состава облигатной микрофлоры ЖКТ с использованием пробиотиков, содержащих живых микробов свойственных кишечнику человека, и пребиотиков, способствующих их росту. Термин «пробиотики» используется для описания бактерий, оказывающих положительное влияние на организм человека или животных при их употреблении внутрь в достаточном количестве. Впервые на важную роль молочнокислых бактерий в поддержании здоровья человека указал лауреат Нобелевской премии И.И. Мечников в начале прошлого века. С тех пор его имя неотрывно связано с выработкой научного подхода к выделению и последующему использованию пробиотических штаммов. Самостоятельный термин «пробиотик» впервые был использован в 1965 году Lilly and Stillwell для обозначения метаболитов, продуцируемых одними живыми микроорганизмами для стимуляции роста других [15]. В 1989 году Fuller, подчеркивая микробное происхождение пробиотиков, так определил это понятие: это живые микроорганизмы, позитивно влияющие на организм вследствие улучшения функции его нормальной микрофлоры. Согласно определению ВОЗ, принятому в 2001 году, пробиотики – это живые микроорганизмы, которые при употреблении в достаточном количестве оказывают позитивное воздействие на здоровье (FAO UN WHO 2001).
В настоящее время выбор биологических препаратов для коррекции дисбактериоза кишечника, в том числе отечественных пробиотиков, весьма велик. Все они могут быть разделены на 3 группы:
Монокомпонентные препараты, содержащие представителей только одного вида – бифидобактерии; лактобактерии; непатогенные эшерихии.
Поликомпонентные препараты, содержащие микроорганизмы нескольких видов, что обеспечивает множественные эффекты, по составу приближены к естественной микрофлоре.
Комбинированные – содержащие, кроме живых микроорганизмов, различные добавки – в виде сорбентов, витаминов, иммунопротекторов (Аципол и др.).
Многолетний опыт применения пробиотиков позволил выделить основные положительные их эффекты, включающие антагонистическое воздействие на патогенные и условно–патогенные бактерии кишечной микрофлоры, укрепление слизистого барьера, а также влияние на параметры местного иммунного ответа.
Одним из наиболее изученных механизмов действия пробиотиков является их антагонистическое влияние на факультативную микрофлору ЖКТ. Многие годы основным фактором оказывающим влияние на рост патогенной микрофлоры считались молочная и уксусная кислота, перекись водорода и СО2, являющиеся основным продуктом метаболизма гомо– и гетероферментативных лактобацилл [16]. В последующем было установлено, что антимикробная активность молочной кислоты, продуцируемой лактобациллами, зависит не столько от величины рН, сколько от совместного присутствия молочной, уксусной и пропионовой кислот [17]. Синергизм такого сочетания обеспечивает ингибицию роста сальмонелл, эшерихий, клостридий и некоторых видов дрожжей, оставляя толерантным к действию этого сочетания кислотообразующие лактобациллы [18].
Одной их важных функций пробиотических микроорганизмов является продукция бактериоцинов и бактериоциноподобных субстанций [19]. По механизму своего действия бактериоцины весьма близки к антибиотикам, имея при этом существенное от них отличие в том, что большинство из них ингибирует ограниченное число близкородственных микроорганизмов. При изучении спектра противомикробной активности бактериоцинов наблюдали угнетение роста клостридий, листерий, сальмонелл, шигелл, синегнойной палочки [20].
Следующим уровнем влияния пробиотических микроорганизмов на состояние защитных систем ЖКТ, является слизистая оболочка. Данные научных исследований, полученные в последние годы, во многом раскрывают механизмы профилактического действия пробиотиков. Как известно, патогенные бактерии могут увеличивать проницаемость слизистого барьера кишечника, способствуя тем самым проникновению бактерий и пищевых макромолекул через его стенку [21]. Было показано, что некоторые пробиотические бактерии способствуют предотвращению и восстановлению указанных повреждений слизистой оболочки, вызванных пищевыми антигенами или лекарственными веществами [22]. Кроме этого, было обнаружено, что L. acidiphilus предотвращает нарушение межклеточных связей, а целые клетки некоторых пробиотиков вместе со своими питательными средами способствуют увеличению патоген–индуцированной резистентности клеточного монослоя к трансэпителиальному переносу, а также индуцированию экспрессии гена MUC–3 [23]. При этом увеличивается пролиферация эпителиальных клеток в ворсинках слизистой кишечника гнотобионтных и конвенциональных крыс [24].
При ротавирусной инфекции некоторые пробиотики способны препятствовать адгезии ротавируса за счет изменения степени гликозилирования рецептора на эпителиальных клетках с использованием растворимого фактора (факторов), выделяемого пробиотиками [25].
В ряде исследований было продемонстрировано, что проникновение энтерогеморрагического, энтероинвазивного и энтеропатогенного штаммов E. сoli в монослой клеточных культур существенно снижалось при предварительном культивировании монослоя с определенными штаммами пробиотических лактобацилл (L. rhamnous, L. acidophilus или L. plantarum) перед инфицированием [26,27]. Пробиотические штаммы препятствуют разрыву молекул «цитоскелетных» и «тесно связывающих» белков в эпителиальных клетках, вызываемому патогеном, улучшая тем самым барьерную функцию слизистой и препятствуя нарушению секреции электролитов.
Иммунологические аспекты действия пробиотиков уже давно вышли за рамки сугубо научных исследований и находят все большее применение в клинической практике. Общеизвестно, что эпителиальные клетки кишечника находятся в непосредственном контакте с просветной микрофлорой, а также взаимодействуют с клетками иммунной системы. Бактерии в желудочно–кишечном тракте могут связываться с рецепторами распознавания, присутствующими на поверхности эпителиальных клеток, инициируя тем самым срабатывание цепочки механизмов иммунологической защиты (например, выработку про– и противовоспалительных цитокинов). Система врожденного иммунитета распознает большую группу консервативных молекулярных структур в бактериях, включая липополисахариды (LPS), липотейхоевую кислоту и неметилированные CpG фрагменты ДНК, а также способна различать «свои» и «чужие» структуры. Эти структуры распознаются рецепторами паттерн–распознавания, например, Toll–подобными рецепторами, которые активируются патогенными бактериями [28]. Пробиотические бактерии, как было установлено, активируют ключевые компоненты, ответственные за выработку провоспалительных цитокинов и хемокинов, хотя для L. rhamnosus ответ был гораздо слабее, чем для Streptococcus pyogenes [29]. В исследовании Braat H. с соавт. сравнивалось влияние грамотрицательной Klebsiella pneumoniae и L. rhamnosus на созревание незрелых антиген–представляющих дендритных клеток (ДК). При этом было отмечено, что оба микроорганизма индуцировали созревание ДК, но обусловливали разный цитокиновый профиль. K. рneumoniae преимущественно активировала экспрессию клеток T– хелперов типа Th–1, тогда как L. rhamnosus уменьшала выработку провоспалительных цитокинов (фактора некроза опухолей–альфа [TNF–а] и интерлейкинов [IL] 6 и 12) незрелыми ДК и продуцирование IL–12 и IL–18 зрелыми ДК. Присутствие пробиотического штамма стимулировало образование Т–клеток, отличных от фенотипа T–хелперов [30]. Эти результаты подтверждают идею о том, что пробиотические бактерии способны модулировать врожденный иммунный ответ как в «противовоспалительном», так и «провоспалительном» направлениях.
Однако иммуномодулирующее влияние пробиотических микроорганизмов существенно различается между разными штаммами или видами. Так, при использовании препарата VSL#3 на основе смеси восьми различных штаммов (Lactobacillus acidophilus, L. bulgaricus, L. casei, L. plantarum, Bifidobacterium longum, B. infafntis, B. breve и Streptococcus thermophilus), [31], наблюдалась активация продукции IL–10 и подавление – IL–12 за счет ДК, поступающих из человеческой крови и собственной пластинки слизистой оболочки кишечника. Провоспалительное воздействие LPS было ослаблено за счет подавления продуцирования IL–12 в присутствии пробиотика VSL#3 при одновременном поддержании высокого уровня продуцирования IL–10. Основной эффект от воздействия смеси VSL#3 обеспечивается бифидобактериями, которые активируют продуцирование IL–10. Кроме этого, большинство штаммов подавляет продуцирование IL–12 [32]. Результаты другой работы показали, что бифидобактерии способны играть главную роль в иммунологическом эффекте; ДНК B. breve и B. infantis из одной и той же комбинации пробиотиков (VSL#3) усиливает продукцию IL–10 и IL–1 [33]. С другой стороны, бифидобактерии содержат ДНК с высоким содержанием Г + Ц пар и, соответственно, большой фракцией неметилированных СрG участков, которые оказывают воздействие на иммунную систему через взаимодействие с Toll–подобным рецептором 9, запуская процесс продуцирования провоспалительных цитокинов и стимулирования ответа Th–1 [34].
Одним из наиболее перспективных биотерапевтических препаратов, обладающих, помимо пробиотической активности, выраженным иммуномодулирующим влиянием, является Аципол. Входящие в его состав штаммы ацидофильных лактобацилл – NK1, NK2, NK5 и NK12, принадлежат к виду L. acidophilus, характеризуются высокой антагонистической активностью в отношении энтеропатогенных кишечных палочек, протея, шигелл, сальмонелл, коагулазоположительных стафилококков и других. Бактерицидные свойства обусловлены наличием специфических антибиотических веществ, действие которых усиливается в присутствии молочной кислоты. С учетом современных требований по безопасности пробиотических препаратов бактерийные компоненты Аципола прошли паспортизацию при депонировании в ФГУП Гос НИИ генетики. По результатам генетического картирования с помощью полимеразной цепной реакции с применением праймеров для штаммовой идентификации молочнокислых бактерий и с помощью ДНК–маркеров, используемые при производстве Аципола штаммы ацидофильных лактобацилл признаны непатогенными для человека (СП 1.2.731–99).
Иммуномодулирующий эффект препарата Аципол обусловлен наличием в его составе полисахарида кефирного грибка и был подтвержден в ряде клинических исследований [35].
Помимо применения пробиотиков, эффективным является использование препаратов, способствующих росту собственной микрофлоры ЖКТ – пребиотиков. В клинической практике используются 2 группы препаратов–пребиотиков.
1 группа – естественные олигосахариды и синтетические дисахариды, инулин. Они не расщепляются в тонкой кишке, но ферментируются в толстой кишке представителями нормальной микрофлоры, служат субстратом для их роста и оказывают целый ряд воздействий на организм (стимуляция секреции муцина, иммунопротекторное действие, нормализация нарушений моторики кишечника). Олигосахариды содержатся в большом количестве в грудном молоке и целом ряде овощей и злаков (лук, овес, чеснок, топинамбур и др.). В педиатрии широкое применение нашел синтетический дисахарид лактулоза и появились обогащенные олигосахаридами адаптированные смеси – заменители грудного молока.
2 группа – препараты, содержащие метаболиты микроорганизмов (дисахариды, органические кислоты) и другие стимуляторы размножения нормальной микрофлоры, которые одновременно могут оказывать и противовоспалительное, и иммунопротекторное действие.
Безусловным элементом биоценозкорригирующей программы являются эффективные поддерживающие и профилактические мероприятия, включающие основные элементы функционального питания, в первую очередь – регулярное употребление пробиотических продуктов. Согласно общепринятому определению, пробиотические продукты питания – это продукты питания, содержащие пробиотические культуры и сохраняющие положительные свойства пробиотиков на протяжении всего срока годности. Сюда относятся и кисломолочные продукты, заквашенные пробиотическими микроорганизмами, и смеси с пробиотиками.
Таким образом, микрофлора ЖКТ является одним из важных факторов полноценного развития ребенка и поддержания его здоровья. Однако огромное количество факторов, в том числе ятрогенных, способны вызвать нарушения баланса «полезных» и «вредных» микроорганизмов в ЖКТ. Задача врача–педиатра – своевременно понять причину и масштабность данных нарушений, коррекция которых, требующая проявлять терпение, упорство, настойчивость, является залогом благополучного физического и интеллектуального развития ребенка.
Литература.
1. Zoetendal EG, Cheng B, Koike S, Mackie RL. Molecular microbial ecology of the gastrointestinal tract from phytogeny to function. Curr Issues Intest Microbiol 2004, 5:31 –45.
2. Harmsen HJM, Raangs GC, He T, et al: Extensive set of 16S rRNA–based probes for detection of bacteria in human feces. Appl Environ Microbiol 2002 68:2982–2990.
3. Moon N. J. Inhibition of the growth of acid tolerant yeasts by acetate, lactate and propionate and their mixture. J.Appl.Bacteriol., 1983, vol. 55.– P.455–460.
4. Silva M., Jacobus N V., Deneke С , Gorbach S. L. Antimicrobial substance from a human Lactobacillus strains. Antimicrob. Agents Chemother., 1987, vol. 31. — P. 1231–1233.
5. Axselsson L.Т., Chung T.C, Dobrogosz W, et al. Production of a broad spectrum antimicrobial substance by Lactobacillus reuten. Microbi. Ecolog. Health Dis., 1989, vol. 2. — P. 131–136.
6. Квасников Е.И., Нестеренко О.А. Молочнокислые бактерии и пути их использования.– М.: Наука, 1975. — С. 392.
7. Lammers KM, Brigidi P, Vitali B, et al. Immunomodulatory effects of probiotic bacteria DNA: IL–1 and IL–10 response in human peripheral blood mononuclear cells. FEMS Immunol Med Microbiol. 2003 Sep 22; 38(2):165–72.
8. Veckman V, Miettinen M, Matikainen S, et al. Lactobacilli and streptococci induce inflammatory chemokine production in human macrophages that stimulates Th2 cell chemotaxis. J Leukoc Biol. 2003 Sep;74(3):395–402.
9. Ручкина И.Н. Роль острых кишечных инфекций и нарушений микробиоценоза в этиологии и патогенезе синдрома раздраженного кишечника. Автореф. дисс… докт. мед. наук. – М., 2005, 42с.
10. Воронцов И.М. Диетология развития – важнейший компонент профилактической педиатрии и валеологии детства. Педиатрия 1997.– №3.– С. 57–61.
11. Никитенко В.М.. Ткаченко Е.И., Стадников АЛ. и др. Транслокация бактерий из желудочно–кишечного трактата – естественный защитный механизм. Экспериментальная и клиническая гастроэнтерология. –2004.–№1.–С.48.
12. Постникова Е. А., Пикина А.П., Кафарская Л.И., Ефимов Б.А. Изучение качественного и количественного состава микрофлоры кишечника у клинически здоровых детей в раннем возрасте . Журн. микробиол., 2004. –№1.– С. 67–69.
13. Крамарь О.Г. Микробные популяции и биоценозы при острых кишечных инфекциях, вызванных условно–патогенными микроорганизмами: Автореф. дисс… канд. мед. наук. – М., 1997, 24с.
14. Урсова Н.И. Нарушения микрофлоры и дисункции билиарного тракта у детей. М., 218с.
15. Lilly D. M., Stillwell R. H. Probiotics:Growth promoting factors produced by microorganisms. Science. 1965. V147. P. 747–748.
16. Квасников Е. И., Нестеренко О. А. Молочнокислые бактерии и пути их использования.– М.: Наука, 1975. — С. 392.
17. Baird–Parker А.С. Organic acids. — In: Microbial Ecology of Foods (Silliker J.). Academic Press, New York. 1980, P. 126–135.
18. Adams M R., Hall C. J. Growth inhibition of food–borne pathogen by lactic and acetic acids and their mixtures. Int. J. Fud. Sci. Technol . 1988, vol. 23. P.–292.
19. Silva M., Jacobus N V., Deneke С , Gorbach S. L. Antimicrobial substance from a human Lactobacillus strains . Antimicrob. Agents Chemother., 1987, vol. 31. — P. 1231–1233.
20. Axselsson L. Т., Chung T. C, Dobrogosz W., Lindgren S. Production of a broad spectrum antimicrobial substance by Lactobacillus reuten . Microbi. Ecolog. Health Dis., 1989, vol. 2. — P. 131–136.
21. Lee D.J., Drongowski R.A., Coran A.G., Harmon C.M. Evaluation of probiotic treatment in a neonatal animal model . Pediatr Surg Int.– 2000–№16.–P. 237–42
22. Rosenfeidt V., Benfeldt E., Valerius N.H., Paerregaard A. Effect of probiotics on gastrointestinal symptoms ahd intestinal permeability in children with atopis dermatitis . J.Pediatr.–2004.– Vol. 145.–P.612–16
23. Otte J.M., Podolsky D.K. Functional modulation on enterocytes by Gram–positive and Gram–negative microorganisms . Am.J.Physiol.Gastrointest.Liver Physiol.– 2004.–Vol. 286. –P.613–26.
24. Banasaz M., Norin E., Holma R., Midtvedt T. Increased enterocyte production in gnotobiotic rats mono–associated with Lactobacillus rhamnosus GG . Appl Environ Microbiol. 2002.– Vol. 68(6).–P.3031–4.
25. Freitas M, Tavan E, Cayuela C, et al. Host–pathogens cross–talk. Indigenous bacteria and probiotics also play the game. Biol Cell. 2003 Nov;95(8):503–6.
26. Michail S, Abernathy F. Lactobacillus plantarum inhibits the intestinal epithelial migration of neutrophils induced by enteropathogenic Escherichia coli. J Pediatr Gastroenterol Nutr. 2003 Mar;36(3):385–91.
27. Resta–Lenert S, Barrett KE. Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasive Escherichia coli (EIEC). Gut. 2003 Jul;52(7):988–97.
28. Cummings JH, Antoine JM, Azpiroz F, et al. PASSCLAIM—gut health and immunity. Eur J Nutr. 2004 Jun;43 Suppl 2:II118–II173.
29. Miettinen M, Lehtonen A, Julkunen I, Matikainen S. Lactobacilli and Streptococci activate NF–kappa B and STAT signaling pathways in human macrophages . J Immunol. 2000 Apr 1;164(7):3733–40.
30. Braat H, de Jong EC, van den Brande JM, et al. Dichotomy between Lactobacillus rhamnosus and Klebsiella pneumoniae on dendritic cell phenotype and function . J Mol Med. 2004 Mar;82(3):197–205. Epub 2003 Dec 13.
31. Gionchetti P, Rizzello F, Helwig U, et al. Prophylaxis of pouchitis onset with probiotic therapy: a double–blind, placebo–controlled trial . Gastroenterology. 2003 May;124(5):1202–9.
32. Hart AL, Lammers K, Brigidi P, et al. Modulation of human dendritic cell phenotype and function by probiotic bacteria . Gut. 2004 Nov;53(11):1602–9.
33. Lammers KM, Brigidi P, Vitali B, et al. Immunomodulatory effects of probiotic bacteria DNA: IL–1 and IL–10 response in human peripheral blood mononuclear cells. FEMS Immunol Med Microbiol. 2003 Sep 22;38(2):165–72.
34. Jiang W, Pisetsky DS. Enhancing immunogenicity by CpG DNA . Curr Opin Mol Ther. 2003 Apr;5(2):180–5.
35. Феклисова Л.В. Применение лактосодержащих пробиотиков: оценка многолетнего использования Аципола в педиатрической практике. Consilium medicum.Педиатрия. – 2007; 2: 123–7.
.
Микрофлора кишечника у взрослых | Энтерожермина
Их количество огромно! Только представьте: оно в 10 раз больше, чем общее число клеток в нашем организме. Общая масса микрофлоры кишечника составляет от 1 до 3 кг.Уникальность микрофлоры кишечника каждого человека позволяет рассматривать ее как своеобразные «отпечатки пальцев». При этом микрофлора кишечника здорового человека идеально адаптирована к потребностям именно его организма, и поэтому ее состав достаточно стабилен на протяжении всей жизни. Виды бактерий, которые преобладают в кишечнике, являются «хорошими», они сохраняют баланс и обеспечивают нормальную работу желудочно-кишечного тракта. При этом виды, которые вредны для организма, хотя и населяют микрофлору кишечника, не способны вызвать расстройство системы или заболевание. Однако под влиянием различных факторов (антибиотики, несбалансированное питание, инфекции и др.) баланс микрофлоры кишечника нарушается, патогенные виды бактерий разрастаются, их становится больше, а «хорошая» микрофлора кишечника угнетается. В этих случаях необходимо принять меры для восстановления нормального баланса микрофлоры кишечника, например, использовать специализированные медицинские препараты.
Из чего состоит микрофлора кишечника?
Состав микрофлоры кишечника меняется в зависимости от различных уровней пищеварительной системы. Кроме того, на нее оказывают влияние и другие факторы, такие как возраст, пол, питание, образ жизни человека и тому подобное. Итак, чтобы ответить на вопрос: «Из чего состоит микрофлора кишечника?», следует знать, что в желудочно-кишечном тракте микроорганизмы распределены по-разному: в желудке рост микроорганизмов ограничивается кислой средой (низкий уровень рН), вдоль тонкой кишки их концентрация постепенно увеличивается, а наибольшее количество бактерий располагается в толстом кишечнике.
Микроорганизмы, которые могут жить без кислорода (анаэробные), составляют 95% всей микрофлоры кишечника, тогда как бактерии, которым для жизни необходим кислород (аэробные), — всего 5%.
Рот, желудок, тонкая и толстая кишка — каждый из этих участков заселяют разные типы бактерий. Микроорганизмы в полости рта выполняют защитную функцию (стрептококки, бактероиды, лактобактерии и дрожжи). Бактерии желудочно-кишечного тракта (лактобациллы, энтерококки, бактероиды и др.) — это невероятно сложный барьер на пути инфекций.
Формирование нормального состава микрофлоры кишечника — длительный и сложный процесс. Фактически с рождения человеческий организм начинают заселять различные микроорганизмы, на протяжении нескольких лет происходит созревание сбалансированного микромира. И хотя с возрастом количество и состав микроорганизмов меняется, уникальность и баланс микрофлоры кишечника сохраняется в течение всей жизни человека.
Микробиота кишечника | Biocodex Microbiote Institut
Микроорганизмы в вашем кишечнике, в первую очередь бактерии, образуют с ним «партнерство», которое начинается с самого рождения. Для полноценного формирования микробиоты желудочно-кишечного тракта требуется около трех лет – с рождения до периода относительной стабильности, который затем продолжается до старости, когда микробиота снова претерпевает глубокие изменения.
Пищеварительная система новорожденного быстро колонизируется «простой» микробиотой, происходящей из вагинальных и фекальных бактерий его матери. Развитие полезных бактерий, таких как бифидобактерии, быстрее осуществляется при грудном вскармливании, но стабилизация микробиоты кишечника длится около трех лет. Эта стабилизация зависит от множества факторов. Например, анаэробные бактерии, которые не нуждаются в кислороде для выживания, находятся в меньшинстве у младенцев, но доминируют у взрослых. Развитие этих анаэробных бактерий происходит медленнее в случае родоразрешения путем кесарева сечения или в случае преждевременных родов, при этом микробиота у таких детей менее разнообразна, чем у младенцев, рожденных естественным путем и в срок. Разнообразие микробиоты также зависит от окружающей среды в раннем детстве: у детей, живущих в западных странах, наблюдается меньшее разнообразие, которое может быть связано с чрезмерной гигиеной. Желудочно-кишечная микробиота наращивается с годами, при этом она всегда сохраняет отпечаток профиля раннего детства. Меньшее микробиологическое разнообразие может привести в дальнейшем к развитию заболеваний.
Утрата разнообразия в пожилом возрасте
В зрелом возрасте немногие факторы могут радикально изменить доминантную микробиоту в отличие от гормональных изменений во время полового созревания, беременности и менопаузы. Но именно в старости изменения становятся более выраженными. Микробиота становится менее разнообразной из-за физиологических изменений, таких как снижение иммунитета, скудный рацион питания, прием многочисленных лекарств, включая антибиотики, и особенно образ жизни, когда люди становятся более зависимыми. Действительно, у пожилых людей, живущих в домах престарелых, микробиота беднее, чем у тех, кто живет дома и соблюдает свой обычный рацион. Это глубокое изменение равновесия микробиоты может привести к заболеваниям, таким как воспаление кишечника и повышенная восприимчивость к инфекции.
Источники
Yatsunenko T, Rey FE, Manary MJ, et al. Human gut microbiome viewed across age and geography. Nature 2012 ; 486 : 222-7.
Guaraldi F, Salvatori G. Effect of breast and formula feeding on gut microbiota shaping in newborns. Front Cell Infect Microbiol 2012 ; 2 : 94.
Campeotto F, Waligora-Dupriet AJ, Doucet-Populaire F, et al. Establishment of the intestinal microflora in neonates. Gastroenterol Clin Biol 2007 ; 31 : 533-42.
Biasucci G, Rubini M, RiboniS et al. Mode of delivery affects the bacterial community in the newborn gut. Early Hum Dev 2010 ; 86 (Suppl 1) : 13-5.
Okada H, Kuhn C, Feillet H, Bach JF. The ‘hygiene hypothesis’ for autoimmune and allergic diseases: an update. Clin Exp Immunol. 2010;160(1):1-9.
Koren O, Goodrich JK, Cullender TC, et al. Host remodeling of the gut microbiome and metabolic changes during pregnancy. Cell 2012 ; 150 : 470-80
Biagi E, Candela M, Turroni S, et al. Ageing and gut microbes : perspectives for health maintenance and longevity. Pharmacol Res 2013 ; 69 : 11-20.
Claesson MJ, Jeffery IB, Conde S, et al. Gut microbiota composition correlates with diet and health in the elderly. Nature 2012 ; 488 : 178-84.
Микрофлора кишечника: как восстановить баланс?
Важность системы микроорганизмов, населяющих желудочно-кишечный тракт, для здоровья человека сложно переоценить. Однако баланс в количественном и качественном составе микрофлоры является весьма чувствительным и его нарушение чревато развитием дисбактериоза. Факторов, способствующих этому, довольно много: практически все воспалительные заболевания слизистой оболочки кишечника инфекционной и неинфекционной природы могут вызвать дисбактериоз, состав микрофлоры кишечника может существенно меняться под влиянием новых условий обитания и питания, физических и психических нагрузок. Но особо неблагоприятное воздействие на микрофлору кишечника оказывает длительная и интенсивная антибактериальная терапия. Следует помнить и о возрастном факторе. Давно отмечено, что кишечный дисбактериоз особенно часто возникает в старческом и детском возрастах (Самсыгина Г.А., 2003). Таким образом, в жизни многих из нас так или иначе присутствуют факторы, отрицательно влияющие на состояние микрофлоры кишечника и его здоровье в целом.
Для того чтобы позаботиться о здоровье собственного кишечника и восстановить баланс микрофлоры, актуальным является использование пробиотиков и пребиотиков.
Пробиотики — это живые микроорганизмы и вещества микробного происхождения, оказывающие при естественном способе введения позитивные эффекты на физиологические, биохимические и иммунные реакции организма человека через стабилизацию и оптимизацию функции его нормальной микрофлоры, в свою очередь, пребиотики — это вещества немикробного происхождения, способные оказывать позитивный эффект на организм через селективную стимуляцию роста или усиление метаболической активности нормальной микрофлоры кишечника.
Одним из наиболее перспективных пребиотических веществ является инулин, который избирательно стимулирует рост бифидо- и лактобактерий, подавляет рост условно-патогенных микроорганизмов, а также способствует нормализации моторной функции кишечника. Его комбинация с пробиотическими культурами является весьма перспективной основой для синбиотических средств (Кривущев Б.И., 2010). Поэтому для нормализации микрофлоры кишечника и его эвакуаторной функции актуальным является включение в рацион питания взрослых и детей в возрасте старше 11 лет диетической добавки ЛЕПИКОЛ, в состав которой входит сразу 3 компонента — клетчатка, пребиотик и пробиотические организмы. В 1 дозе (5 г) ЛЕПИКОЛА содержатся пробиотические организмы Lactobacillus rhamnosus PXN 54, Bifidobacterium bifidum PXN 23, Lactobacillus acidophilus PXN 35, Lactobacillus plantarum PXN 47, Lactobacillus bulgaricus PXN 39 — суммарно 6,0·108 КУО, а также инулин и шелуха семян подорожника.
Благодаря слабительным свойствам компонентов ЛЕПИКОЛА и способности нормализовать эвакуаторную функцию кишечника, данная диетическая добавка подойдет пациентам с запором или тем, кто нуждается в смягчении каловых масс ввиду заболеваний желудочно-кишечного тракта, например, синдрома раздраженной толстой кишки с преобладанием запора, дивертикулита, геморроя и др. Поскольку не за горами долгожданное лето ЛЕПИКОЛ также будет актуальным для тех, у кого отмечают запоры в путешествиях вследствие изменения рациона питания или непривычной обстановки вокруг.
ЛЕПИКОЛ: позаботьтесь о здоровье кишечника!
Спрашивайте ЛЕПИКОЛ у оптовых поставщиков: «БАДМ», «Вента. ЛТД», «Оптима-Фарм», «Фармпланета», «ФРАМ КО». Производитель: «Probiotics International Limited» (Великобритания). Импортер: «Топ-Маркет», тел.: +38 (044) 458-96-54. Дополнительную информацию о продукте ЛЕПИКОЛ можно найти на сайте: www.lepicol.com.uarel=»nofollow»>rel=»nofollow»>
Пресс-служба «Еженедельника АПТЕКА»
Цікава інформація для Вас:
британский генетик о связи микрофлоры кишечника с COVID-19 и психическим здоровьем — РТ на русском
У пациентов с тяжёлым течением COVID-19 сильно страдает микрофлора кишечника. Такого мнения придерживается британский специалист в области эпидемиологических исследований в генетике и автор книг о здоровом питании профессор Тим Спектор. В интервью RT учёный также рассказал, что состояние микробиома имеет огромное значение для защиты от коронавируса и других серьёзных заболеваний. По словам генетика, для микрофлоры крайне вредна пища, прошедшая технологическую обработку и насыщенная солью и сахаром, а правильная диета поможет улучшить не только физическое, но и психическое состояние человека.
— Тим, вы много изучаете микробиом (микрофлору кишечника) человека. Какую роль он играет в защите от COVID-19?
— Главным образом микробиом поддерживает здоровье нашей иммунной системы, не даёт ей слишком остро реагировать на внешние факторы, при этом обеспечивая её готовность защищаться от вирусов и бактерий. Мы знаем, что у людей, которые тяжело переносили COVID-19 и оказались в больнице, микробиом кишечника находился в плачевном состоянии. Таким образом, его нарушение и эта болезнь определённо взаимосвязаны.
Нам известно, что в число многих факторов, вызывающих ухудшение состояния микробиома, входят избыточный вес, диабет, социальная неустроенность. Всё это серьёзные факторы риска. Согласно нашему исследованию, к ним относится и отсутствие сбалансированного питания. Вместе эти четыре фактора указывают на то, что состояние микробиома имеет огромное значение для защиты от коронавирусного и других серьёзных заболеваний.
— Можно ли утверждать, что определённые продукты могут снизить восприимчивость организма к COVID-19?
— На данный момент проведено исследование, охватившее два миллиона человек. Мы изучаем эпидемиологические связи, но пока не можем со стопроцентной уверенностью сказать, что какая-то конкретная пища плохо влияет на микробиом и повышает риск заражения COVID-19.
Проводились и другие изыскания. В январе опубликовано наше исследование, охватившее 1 тыс. человек. По его результатам мы смогли определить связь пятнадцати видов вредных для здоровья микробов с определёнными продуктами и чрезмерным их потреблением. Впервые в этой области удалось найти что-то общее между пищевыми продуктами, микроорганизмами в кишечнике и последствиями для здоровья. Но в отношении коронавируса такие выводы пока делать рано.
— О какой вредной еде, содержащей «плохие» микробы, идёт речь?
— Это пища, которая подвергается сильной технологической обработке. В ней содержатся химикаты, искусственные вкусовые добавки, чрезмерное количество сахара или соли. Всё то, что отсутствует в натуральных продуктах. Как правило, в такой еде мало клетчатки, может присутствовать сильно обработанное мясо. Противоположностью такой низкокачественной пище являются овощи, фрукты, оливковое масло — всё, что, как правило, полезно для живущих в кишечнике микроорганизмов.
- Специалист предостерегает от употребления в пищу продуктов, подвергнутых сильной технологической обработке и содержащих химикаты, искусственные вкусовые добавки, чрезмерное количество сахара или соли
- Gettyimages.ru
- © Bogdan Kurylo
— А что насчёт пробиотиков? Их употребление делает нас более устойчивыми к вирусу?
— Мы изучали этот вопрос на примере 2 млн людей с COVID-19 и без. Данные о пробиотиках неоднозначные. Они показывают небольшой положительный эффект у женщин, но не у мужчин. Поэтому мы подозреваем, что здесь возможна ошибка в выборке.
В целом с пробиотиками проблема в том, что микробиота кишечника у всех разная. У нас с вами могут совпадать, скажем, лишь 20% микробов. Поэтому сложно судить о том, стоит ли нам принимать одинаковые пробиотики. Это всё равно что посадить одни и те же семена в Африке и в Сибири. Условия разные, вот и расти они будут по-разному. На данный момент это напоминает лотерею: никогда не знаешь, поможет пробиотик или нет. Это зависит от того, какие пробиотики выбрать и как они будут взаимодействовать в кишечнике друг с другом.
— Известно, что микробиом кишечника ребёнка начинает формироваться во время естественных родов. Значит ли это, что после кесарева сечения дети лишаются этой крайне важной первой дозы микробов? Грозит ли это их здоровью в будущем?
— Сейчас всё больше данных указывают на то, что всё именно так. Известно, что в большинстве стран от тридцати до сорока процентов женщин рожают путём кесарева сечения. В ряде стран это уже почти стандартная процедура.
Когда мы рождаемся естественным образом, то получаем микробы от матери. При кесаревом сечении ребёнок рождается стерильным и получает микробы извне. Поэтому в первые три года жизни микрофлора у рождённых разными способами людей будет различаться. Результаты исследований показали, что у детей, рождённых посредством кесарева сечения, более высокий риск развития аллергий, большая предрасположенность к лишнему весу в зрелом возрасте.
Важно понимать, что у кесарева сечения есть минусы. Эта спасающая жизни женщинам операция не идеальна во всех отношениях. Кроме того, хочу заострить внимание на важности грудного вскармливания. Через молоко мать передаёт свои микробы ребёнку, и это ещё один способ поддержать его здоровье.
- Через молоко мать передаёт свои микробы ребёнку, а это ещё один способ поддержать его здоровье, утверждает профессор Спектор
- Gettyimages.ru
- © petrunjela
Сегодня имеющиеся у нас данные действительно предостерегают от проведения слишком большого числа кесаревых сечений, поскольку это чревато возникновением проблем с иммунитетом или нарушением обмена веществ у будущих поколений.
— Можно лечить болезни, воздействуя на наш микробиом?
— Нам известно, что есть несколько микробов, которые сопутствуют многим болезням. Но, как правило, не бывает так, чтобы конкретный микроб вызывал конкретную болезнь. Это устаревшие представления о генетике. Скорее всего, причина в том, что у каждого из нас свой уникальный микробиом. Это значит, что все наши микробы, которые, по сути, можно назвать химзаводами, производят разные химические соединения в нашей крови. Они работают сообща, а не обособленно друг от друга. Следовательно, нужно менять их целыми группами, а до этого нам ещё далеко. Эффективность трансплантации микробов одного человека другому для ряда заболеваний доказана. Но это не панацея от всех бед. На данный момент такая пересадка помогает лишь в случае очень хорошо изученных болезней, эффективность для остальных случаев исследуется.
— Существует связь между микрофлорой кишечника и душевным состоянием, стрессами?
— Определённо присутствует связь между кишечником и мозгом. Микробиом производит химические соединения, которые сказываются на нашем мозге, на нашем настроении. Скажем, они могут влиять на уровень дофамина. Согласно многим исследованиям, у людей с депрессией или тревожностью неважный кишечный микробиом. Если страдающим депрессией людям начать давать пробиотики или здоровую пищу средиземноморской кухни, то можно добиться такого же улучшения их психического состояния, как при приёме обычных антидепрессантов.
Также по теме
«Старение — расстройство организма»: американский генетик — о клеточной терапии, вечной молодости и таблетке долголетияСтарение — причина многих заболеваний, поэтому его необходимо лечить и обращать вспять. Так считает американский генетик, профессор…
— А есть связь между микробиомом и долголетием?
— Известно, что где-то с 50-летнего возраста микробиом начинает постепенно ухудшаться. После 75 этот процесс ускоряется, поэтому у пожилых людей наблюдается недостаток разных бактерий. По состоянию микробиома людей старше 75 лет можно довольно точно предсказать, сколько они ещё проживут, можно хорошо спрогнозировать, что будет с человеком в следующие пять лет. Думаю, в будущем это станет очень захватывающим направлением науки.
— Какие популярные идеи о питании правдивы?
— О пользе растительной пищи в больших количествах. Насчёт остального специалисты спорят, но большинство согласится с тем, что большая часть фруктов и овощей, если их потреблять в разумных количествах, в целом полезны для организма. Большинство также согласится с тем, что чрезмерное употребление сахаросодержащих напитков, конфет и так далее вредно для организма и для зубов. В остальном однозначности нет, ведутся масштабные споры о жирах, углеводах, мясе и так далее.
— А хорошее вино — это сахаросодержащий напиток? В умеренных количествах оно полезно?
— В этом вопросе я предвзят, поскольку люблю красное вино. Красное вино опережает любые напитки по количеству полифенольных соединений, а они выполняют в растениях защитную функцию. И наши микробы их любят. Для кишечного микробиома это что-то вроде ракетного топлива. Мы провели исследование среди нескольких тысяч человек в Великобритании и США. Оно показало, что у людей, употребляющих красное вино, микробиом здоровее, чем у тех, кто вина не пьёт. Я большой сторонник умеренного употребления красного вина, хотя не все коллеги со мной согласятся.
— Много говорится о том, что жирная и жареная пища повышает риск сердечно-сосудистых заболеваний, укорачивает жизнь. Это предрассудки?
— Думаю, о жире мы рассуждали слишком упрощённо. Всё началось с американских учёных, которые лет 30 назад объявили жир вредным. По мере изучения вопроса доказательства становились всё менее явными. Важно понимать, что жиры бывают хорошими и плохими, при этом могут содержаться в одном и том же продукте.
- Умеренное употребление красного вина и жирного мяса допустимо, считает британский специалист
- Gettyimages.ru
- © Sergey Nazarov
Взять, скажем, такой по-настоящему полезный продукт, как оливковое масло первого холодного отжима. Все согласятся, что оно полезно. На 13% это насыщенный жир. Но из-за того, что в нём есть множество полезных жиров, это здоровая пища. Да, если в чрезмерных количествах употреблять лишь искусственные трансжиры, которые содержатся в очень дешёвом печенье или жареной пище, то, вероятно, это нанесёт вред. Но вообще жиры — это не плохо.
— То есть можно сказать, что стейк из мраморной говядины с корочкой — это полезно?
— Если умеренно — то да. А если ежедневно, то уже вряд ли полезно. Многое зависит и от того, что ещё у вас на тарелке. Не могу сказать, что у тех, кто регулярно употребляет мясо в небольших количествах, есть какие-то проблемы со здоровьем, если при этом они едят много растительной пищи и их рацион разнообразен. Все новые данные указывают на то, что нельзя просто так обозначить что-то как хорошее или плохое.
Если заменить жир на рафинированные углеводы, такие как картофель или рис, то это не будет полезно. Но если заменить его на бобы, чечевицу, салаты и другие продукты средиземноморской диеты, такая замена принесёт пользу. Представление о том, что продукты с низким содержанием жира полезны, а с высоким — вредны, сильно устарело. Пищевая промышленность позаботилась, чтобы производить более дешёвые продукты с ещё меньшим содержанием жира, которые для нас, пожалуй, вреднее первоначальных. Вот почему мы должны наконец хорошо осознать значение качественного питания и сбалансированной диеты.
- Профессор Тим Спектор (Великобритания)
- © RT
— Много споров ведётся и о том, когда нужно есть, через какие временные интервалы?
— Старая концепция, согласно которой есть нужно помалу, но часто, — это ерунда. Теперь мы знаем, что для обмена веществ полезнее длительные интервалы голодания. От перекусов нужно перейти к основательным приёмам пищи, забыть американскую модель шестиразового питания и вернуться к двум основным приёмам пищи в день. Возможно, плюс завтрак.
Микробиом кишечника справляется лучше, если у него есть перерыв хотя бы в 12 часов. Простое решение — выделить такой интервал ночью. Но это можно сделать и в любое другое время, потому что здоровье микробов улучшается, когда они отдыхают, а после чистят стенки кишечника.
Также нам постоянно твердили, что самый важный приём пищи — это завтрак. Но некоторые, проснувшись, просто не хотят есть. Наши исследования показали, что у двух третей людей обмен веществ лучше утром, но у трети — вечером. Так что это вопрос персональный.
— То есть вы предлагаете два основных приёма пищи в день и один лёгкий — будь то завтрак, обед или ужин? И никаких перекусов между ними?
— Да, так говорит наука.
Полную версию смотрите на сайте RTД.
ABC-медицина
При эубиозе (то есть в норме) микрофлора кишечника представляет собой оптимальное соотношение различных бактерий – кишечной палочки, лактобацилл, энтерококков и др., всего более 500 видов. Дисбактериозом называют дисбаланс микробов, который длится продолжительное время. Это очень распространенное состояние, встречающееся примерно у 90 % взрослых и 95 % детей.
При должной коррекции, которую может назначить только врач, дисбактериоз кишечника проходит, но при отсутствии лечения обычно переходит в более тяжелую, прогрессирующую форму. Данное бактериологическое состояние принято рассматривать в качестве проявления или осложнения какого-либо заболевания, чаще всего – желудочно-кишечного тракта.
Причины развития дисбактериоза
Гибель полезных бактерий, населяющих микрофлору кишечника, может быть связана с такими факторами, как:
- изменение функций желудка, поджелудочной железы или печени, приводящее к недостатку пищеварительных ферментов и появлению непереваренных остатков пищи, которые способствуют росту болезнетворных микробов;
- пониженный тонус гладкой мускулатуры кишечника или ее спазмы, возникающие в результате психического или физического стресса, хирургического вмешательства, вегетососудистой дистонии – все это приводит к нарушению передвижения пищевых масс;
- различные заболевания желудочно-кишечного тракта, такие как холецистит, гастрит, панкреатит и пр., связанные с повышением кислотности или щелочности среды обитания бактерий, что влечет за собой изменение обмена веществ и клеточных мембран полезных микроорганизмов;
- неправильное пищевое поведение (диеты, недостаток кисломолочных продуктов и клетчатки, употребление консервантов) препятствует нормальному росту полезных микробов или провоцирует их уничтожение;
- наличие в кишечнике паразитов или болезнетворных микробов, чьи продукты жизнедеятельности убивают полезные микроорганизмы – обычно это связано с дизентерией, сальмонеллезом, вирусными заболеваниями и пр.;
- прием антибиотиков, пагубно действующих не только на вредных микробов, но и на полезных.
К факторам, повышающим риск развития дисбактериоза кишечника, относят постоянные стрессы и неблагоприятную экологию, от которых страдают жители современных мегаполисов.
Общая симптоматика
Симптомы дисбактериоза кишечника различаются по локализации дисбиотических изменений и степени их выраженности. На тяжесть клинических проявлений влияют возраст, образ жизни, состояние иммунной системы, стадия развития патологии.
1 стадия
На данном этапе дисбаланс бактерий выражен слабо: пациента могут беспокоить небольшие расстройства кишечника. Обычно такое состояние связано с кратковременным воздействием на микрофлору, например, со сменой привычной пищи, напитков. После окончания воздействия провоцирующих факторов или привыкания к новым условиям баланс микрофлоры восстанавливается.
2 стадия
Прекращается производство кишечником необходимого количества ферментов, обеспечивающих нормальное пищеварение. В результате возникает процесс брожения, который проявляется болью и вздутием живота, горечью во рту, метеоризмом, запорами или, наоборот, диареей. Это могут быть симптомы как прогрессирующего дисбактериоза, так и развития заболеваний желудочно-кишечного тракта.
3 стадия
На этой стадии при воздействии большого количества патогенной флоры на стенки кишечника развивается воспалительный процесс. Такой дисбактериоз уже требует медицинского вмешательства. К выраженным симптомам добавляются тошнота, рвота, непереваренные фрагменты пищи в стуле, сильные боли в животе. В некоторых случаях – повышение температуры тела.
4 стадия
Это состояние кишечника, при котором нормальная микрофлора практически полностью вытеснена болезнетворными микроорганизмами, что приводит к нарушению всасывания полезных веществ, развитию авитаминоза и даже анемии. Образующиеся в результате токсины попадают в кровь и провоцируют тяжелые аллергические реакции. Клинические проявления включают возникновение сыпи, экземы, крапивницы, возможно развитие астмы, бессонницы, хронической усталости. Пациент может жаловаться на проблемы с концентрацией внимания. При отсутствии своевременного лечения возникает угроза развития тяжелых кишечных инфекций.
Крайняя степень дисбактериоза – проникновение бактерий желудочно-кишечного тракта в кровь (бактериемия), в некоторых случаях – развитие сепсиса.
Диагностика дисбактериоза
Основная цель диагностики – определение вида микробов, заселяющих кишечник, и их количества. Как правило, используются следующие основные методы:
- бактериологическое исследование, на качество результатов которого влияют соблюдение сроков доставки и сохранности материала, а также условий культивирования разных видов бактерий;
- исследование метаболитов микрофлоры, которое основано на определении летучих жирных кислот, выделяемых микроорганизмами. Отличается точностью результатов, простотой и оперативностью выполнения.
При проведении диагностики и постановке диагноза учитывается также, что микрофлора кишечника индивидуальна для каждого человека. Ее состав может зависеть от возраста, потребляемой пищи и сезона. В связи с этим специалист основывается не только на результатах анализов, но и на дополнительных обследованиях, позволяющих выявить причину развития дисбактериоза.
Лечение дисбактериоза
Лечение дисбактериоза у взрослых зависит от причин и симптомов и назначается комплексно. Стандартная схема обычно включает меры, направленные на:
- устранение избыточности патогенных микроорганизмов;
- восстановление нормальной микрофлоры;
- улучшение процесса пищеварения;
- нормализацию моторики кишечника;
- стимулирование реактивности всего организма.
Помните, что назначить грамотное и эффективное лечение может только специалист. Чтобы получить квалифицированную консультацию, запишитесь на прием к врачу клиники «АВС-Медицина» по номеру +7 (495) 223-38-83 или заполните заявку на нашем сайте.
Микробиология желудочно-кишечного тракта — Медицинская микробиология
Общие понятия
Состав и распределение микрофлоры кишечника
Микрофлора кишечника представляет собой сложную экосистему, содержащую более 400 бактерий. разновидность. Количество анаэробов превышает количество факультативных анаэробов. Флора в желудок и верхний отдел кишечника, но больше в нижнем отделе кишечника. Бактерии встречаются как в просвете, так и прикрепляются к слизистой оболочке, но обычно не проникают в стенка кишечника.
Метаболическая активность
Кишечные бактерии являются важным компонентом энтерогепатической циркуляции в какие метаболиты конъюгированы в печени и выводятся с желчью: деконъюгируется в кишечнике бактериальными ферментами, затем всасывается через слизистая оболочка и вернулась в печень в портальный кровоток. Многие лекарства и эндогенные соединения подвергаются энтерогепатической циркуляции. Антибиотики, которые подавление флоры может изменить экскрецию фекалий и, следовательно, уровень в крови эти соединения.Флора также играет роль в переваривании клетчатки и синтезирует определенные витамины.
Кишечная микрофлора
Кишечная микрофлора может предотвратить инфекцию, взаимодействуя с патогенами. Флора включает небольшие популяции потенциально патогенных организмов, таких как Clostridium difficile . Антибиотики, нарушающие баланс нормальной флоры может способствовать как заражению экзогенными патогенами, так и разрастание эндогенными патогенами. Если стенка кишечника нарушена, кишечная бактерии могут проникать в брюшину и вызывать перитонит и абсцессы.
Бактериальные диареи
Диареи, опосредованные энтеротоксинами : Энтеротоксигенные бактерии, такие как Холерный вибрион и энтеротоксигенный Escherichia coli , колонизируют верхнюю часть кишечника и вызывают водянистую диарею путем вырабатывает энтеротоксин, который стимулирует клетки слизистой оболочки выделять жидкость через увеличение внутриклеточного АМФ.
Инвазивная диарея : Инвазивные бактерии, такие как Shigella и Campylobacter , проникают через слизистая кишечника.Кровянистый слизистый диарейный стул с воспалительным экссудатом произведено.
Вирусные диареи
Ротавирус и калицивирус (ранее вирус Норуолк) являются основными причинами диареи болезнь. Ротавирусная диарея поражает в основном детей раннего возраста; Калицивирус причины болезнь во всех возрастных группах
Паразитарные диареи
Некоторые простейшие (особенно Entamoeba histolytica и Giardia lamblia ), а также некоторые кишечные гельминты могут вызвать диарейное заболевание.
Клинический диагноз
Обычно энтеротоксигенные бактерии и вирусы поражают верхний отдел кишечника, вызывая водянистый понос и околопупочная боль. Инвазивные бактерии действуют в основном в толстой кишки ( Shigella и Campylobacter ) или нижняя подвздошная кишка ( Salmonella ). Стул при этих заболеваниях может содержат кровь. Колит характеризуется болезненным натуживанием во время стула (тенезмами).
Состав и распределение микрофлоры
Бактериальные обитатели желудочно-кишечного тракта человека составляют комплекс экосистема.Более 400 видов бактерий были идентифицированы в фекалиях один человек. Преобладают анаэробные бактерии. Верхний отдел желудочно-кишечного тракта ( желудок, двенадцатиперстная кишка, тощая кишка и верхняя подвздошная кишка) обычно содержат редкую микрофлору; концентрация бактерий менее 10 4 организмов / мл кишечного выделения (). Большинство из них организмы происходят из ротоглотки и проходят через кишечник с каждым приемом пищи. Колонизация верхнего отдела кишечника бактериями группы кишечной палочки является аномальным явлением и характерен для некоторых инфекционных патогенов, таких как Vibrio cholerae и энтеротоксигенный Escherichia coli .В напротив, толстый кишечник обычно содержит пышную микрофлору с общим концентрации 10 11 бактерий / г стула (). Анаэробы, такие как Bacteroides , анаэробных стрептококков и клостридий больше, чем факультативных анаэробов, таких как E coli в 1000 раз.
Рисунок 95-1
Концентрация бактериальной флоры в регионах желудочно-кишечный тракт.
Характер бактериальной флоры меняется не только по длине желудочно-кишечный тракт, а также в разрезе слизистой оболочки поверхность.Бактерии занимают просвет, покрывают эпителиальные клетки и прикрепляются к слизистая оболочка. Проникновение бактерий через поверхность слизистой оболочки является ненормальным явлением; патогены, такие как Shigella , Salmonella и Campylobacter вторгаются таким образом.
Те же механизмы, которые контролируют нормальную флору, также защищают кишечник от вторжение болезнетворными микроорганизмами. Желудочная кислота в желудке убивает большинство организмов, которые проглотил. Люди с пониженным содержанием желудочного сока или его отсутствием имеют высокую частоту: бактериальные колонии в верхних отделах тонкой кишки и более восприимчивы к бактериальная диарейная болезнь.Желчь обладает антибактериальными свойствами и поэтому может быть еще один фактор контроля флоры. Прямая пропульсивная моторика (перистальтика) является ключевым элементом подавления флоры верхнего отдела кишечника. Наконец, микрофлора, производя собственные антибактериальные вещества (например, бактериоцины и жирные кислоты), стабилизирует нормальные популяции и предотвращает имплантацию возбудители.
Метаболические активности микрофлоры
Метаболические возможности кишечных бактерий чрезвычайно разнообразны.Бактериальный ферменты могут использовать в качестве субстрата практически любое соединение в просвете кишечника, будь то принимается перорально или попадает в кишечник путем секреции через желчные пути или непосредственно через слизистую.
Энтерогепатическое кровообращение
Ферменты, вырабатываемые кишечными бактериями, играют центральную роль в энтерогепатическом кровотоке. тираж. Вещества, которые подвергаются энтерогепатической циркуляции, метаболизируются. в печени, выводится с желчью и попадает в просвет кишечника, где они реабсорбируются слизистой оболочкой кишечника и возвращаются в печень через портальное обращение.Энтерогепатическая циркуляция обычно включает: соединения, которые конъюгированы в печени с полярной группой, такой как глюкуроновая кислота, сульфат, таурин, глицин или глутатион. Конъюгация увеличивает растворимость метаболита в желчи, но конъюгированные соединения плохо всасывается слизистой оболочкой кишечника. Ферменты, вырабатываемые кишечником бактерии, такие как ß-глюкуронидаза, сульфатаза и различные гликозидазы — деконъюгируют эти соединения, высвобождая родительские соединения, которые легко всасываются через стенку кишечника.Многие эндогенные соединения подвергаются энтерогепатической циркуляции, включая билирубин, желчные кислоты, холестерин, эстрогены и метаболиты витамина D. Кроме того, многие лекарства которые выводятся печенью, включая наперстянку, диэтилстильбестрол, морфин, колхицин, рифампицин и хлорамфеникол входят в этот путь.
Антибиотики блокируют энтерогепатическое кровообращение, подавляя кишечную флора и тем самым снижая уровень деконъюгированных ферментов. Если антибиотик назначается пациенту, который также принимает препарат, вызывающий энтерогепатический кровообращение, в результате угнетение энтерогепатического кровообращения будет увеличить фекальную экскрецию препарата и тем самым снизить его уровень в плазме и период полураспада.Например, уровень эстрогена в крови и период полураспада при рождении количество противозачаточных таблеток уменьшается при приеме антибиотиков.
Микрофлора и питание
Ферменты, вырабатываемые кишечными бактериями, играют важную роль в метаболизме несколько витаминов. Микрофлора кишечника синтезирует витамин К, который является необходимый кофактор при производстве протромбина и др. свертывания крови факторы. Лечение антибиотиками, особенно у людей, соблюдающих диету низкое содержание витамина К, может привести к снижению уровня протромбина в плазме и склонности к кровоточить.Кишечные бактерии также синтезируют биотин, витамин B 12 , фолиевую кислоту. кислота и тиамин.
Кишечная флора способна сбраживать неперевариваемые углеводы (диетические волокна) до короткоцепочечных жирных кислот, таких как ацетат, пропионат и бутират. В основным источником таких ферментируемых углеводов в толстой кишке человека являются растительные клетки. полисахариды стенок, такие как пектины, целлюлоза и гемицеллюлоза. Кислоты производимые из этих волокнистых субстратов бактериями, могут быть важным источником энергии источник для хоста.
У некоторых людей наблюдается дефицит кишечной лактазы, фермента слизистой оболочки. для гидролиза дисахарида лактозы в молоке. У этих людей лактоза не переваривается и не всасывается в кишечнике. Лактоза, которая достигает толстый кишечник подвергается интенсивной бактериальной ферментации. Результат может быть вздутие живота, газы и диарея.
Микрофлора кишечника и инфекции
Защитные действия флоры
Как и в других сложных экосистемах, микрофлора кишечника относительно стабильна со временем поддерживая примерно постоянное количество и типы бактерий в каждом область кишечника.Стабильность нормальной флоры препятствует инфицированию экзогенных патогенов и предотвращает чрезмерный рост потенциально патогенных членов. Новые организмы, попадающие в систему с зараженной пищей или водой, как правило, подавляется установившейся флорой. Это подавление связано с производством представителями местной флоры противомикробных веществ, таких как бактериоцины или короткоцепочечные жирные кислоты, которые подавляют рост чужеродных микроорганизмы. Антибиотики, убивающие часть кишечной флоры, могут расстроить его баланс и может открыть дверь для инфекции или патологического разрастания.
Патогенез пищевого отравления Salmonella иллюстрирует это. явление. Нормальные люди довольно устойчивы к Salmonella , и для инициировать заражение. Если кишечная флора подавляется антибиотиками, однако человек становится гораздо более восприимчивым и может заразиться относительно небольшой посевной материал.
Заболевания, вызванные чрезмерным ростом потенциальных патогенов
Нормальная кишечная флора включает небольшие популяции организмов, вызывающих болезнь, если они зарастают.Например, разрастание Clostridium difficile вызывает тяжелое воспаление толстой кишки с диареей (псевдомембранозный колит). Введение антибиотиков запускает процесс подавляя нормальную флору.
Перитонит
Бактерии кишечной флоры являются основной причиной инфекции в брюшная полость при нарушении нормальных барьеров стенки кишечника. Стенка кишечника может быть перфорирована травмой (ножевые ранения, огнестрельные ранения, тупая травма), заболеванием (аппендицит, проникающий рак кишечника) или хирургические процедуры.Как только барьер слизистой оболочки нарушен, бактерии проникают через стенку кишечника в обычно стерильную брюшную полость и ее окружающие конструкции. Плохое кровообращение, снижение подачи кислорода и отмершие ткани в непосредственной близости от перфорации способствуют образованию абсцесса и особенно благоприятствуют росту анаэробных бактерий. Культуры брюшины абсцесс обычно выводит несколько типов бактерий из кишечника. микрофлора, особенно виды Bacteroides , Clostridium и Peptostreptococcus и E. coli .
Бактериальные диареи
Диарейные заболевания, опосредованные энтеротоксинами
Некоторые бактерии, продуцирующие энтеротоксины, вызывают диарейные заболевания (). Диарейное заболевание вызванные Vibrio cholerae и энтеротоксигенными штаммами E coli имеет три основных характеристики. Во-первых, есть потеря кишечной жидкости, связанная с действием энтеротоксина на эпителиальные клетки тонкой кишки. Во-вторых, сам организм не вторгается в поверхность слизистой оболочки; скорее, он колонизирует верхнюю часть тонкой кишки, прилипая к эпителиальные клетки и вырабатывающие энтеротоксин.Архитектура слизистой оболочки остается нетронутым без признаков разрушения клеток. Бактериемия не происходить. В-третьих, фекальные стоки водянистые и часто объемные, так что диарея может привести к клиническому обезвоживанию. Жидкость берет начало в верхней части тонкий кишечник. где энтеротоксин наиболее активен.
Таблица 95-1
Бактерии, продуцирующие токсины, связанные с диарейными заболеваниями.
Холера
Парадигма энтеротоксигенных диарейных болезней — холера (см. Гл.24), при котором объем стула может превышают 1 л / ч, с ежедневным выходом каловых масс от 15 до 20 л, если пациент находится гидратированный. Холера вызывается V cholerae , которая обычно попадает в загрязненную воду. Вибрионы, которые выживают при прохождении через желудок колонизировать поверхность тонкой кишки, размножаться и разрабатывать энтеротоксин. Токсин холеры действует через аденилатциклазу, стимулируя секрецию вода и электролиты из эпителиальных клеток попадают в просвет кишечника. В двенадцатиперстная кишка и верхняя часть тощей кишки более чувствительны к токсину, чем подвздошная кишка.Толстая кишка относительно нечувствительна к токсину и может все еще поглощать воду и электролиты в норме. Таким образом, холера — это «переполнение. диарея », при которой большие объемы жидкости производятся в верхних Кишечник подавляет резорбтивную способность нижнего отдела кишечника.
Стул холеры напоминает рисовую воду — прозрачную жидкость. покрыт слизью и изотоничен плазме. Микроскопия не выявляет воспалительные клетки в сточных водах; все, что можно увидеть, это маленькие числа сброшенных клеток слизистой оболочки.
Энтеротоксигенная кишечная палочка Диарея
Определенные штаммы кишечной палочки вызывают диарейное заболевание, вызывая энтеротоксины (см. гл. 25). Эти штаммы продуцируют два типа энтеротоксина. Один из них, называемый термолабильным токсином, — это сходен по структуре и механизму действия с холерным токсином. Другой, называемый термостабильным токсином, по-видимому, действует через гуанилатциклазу. Энтеротоксигенный Штаммы кишечной палочки являются наиболее частой причиной болезней путешественников. диарея
Другие токсины, вызывающие диарею
Многие штаммы Shigella продуцируют энтеротоксин, называемый Shiga токсин, вызывающий секрецию жидкости из тонкой кишки (см. гл.22). Токсин шига имеет деструктивное, цитотоксическое действие на эпителий тонкой кишки, вызывая грубое травма поверхности кишечника. Он не активирует аденилатциклазу. E coli 0157: H7, организм, связанный с потреблением недоваренное рубленое мясо также производит токсин, подобный шиге; это вызывает кровавый диарея и колит. Организм, вырабатывающий другой тип цитотоксина, — это Vibrio parahaemolyticus , бактерия, связанная с морепродукты. Штаммы пищевого отравления Staphylococcus aureus и Clostridium perfringens вырабатывают энтеротоксины, которые цитотоксический.Стафилококковый энтеротоксин также оказывает прямое влияние на рвотный центр в головном мозге.
Заболевания желудочно-кишечного тракта, вызванные инвазивными бактериями
В отличие от энтеротоксигенных организмов, инвазивные бактерии оказывают основное влияние на хозяине, вызывая серьезное разрушение эпителиальной архитектуры; гистологические данные включают изъязвление слизистой оболочки и воспалительную реакцию в собственная пластинка. Основными возбудителями этой группы являются: Salmonella, Shigella, Campylobacter , инвазивные E coli и Yersinia .Кишечные вирусы также вторгаются в эпителиальные клетки кишечника, но степень разрушения слизистой оболочки значительно меньше, чем вызвано инвазивными бактериальными патогенами.
Salmonella EnteritisSalmonella видов являются частой причиной пищевых отравлений. В основным местом поражения является нижняя подвздошная кишка, где сальмонеллы вызывают слизистую оболочку. изъязвление. Они быстро пробиваются через эпителиальную поверхность в lamina propria и попадают в лимфатические сосуды и кровоток.Как минимум две вирулентности факторы, связанные с кишечной инфекцией: один отвечает за слизистую оболочку вторжение, а другой вызывает секрецию жидкости и электролитов в кишечник.
Shigella DysenteryShigella Микроорганизмы вызывают бактериальную дизентерию, инвазивную диарейное заболевание нижнего отдела кишечника, при котором стул содержит воспалительный экссудат, состоящий из полиморфноядерных лейкоцитов. Бациллы вторгаются в эпителий толстой кишки и вызывают поверхностные изъязвления.Этот инвазивный процесс зависит от наличия двух факторов вирулентности. Первый опосредует начальный проникновение на поверхность слизистой оболочки за счет разрушения щеточной каймы; бактерии впоследствии поглощаются инвагинацией плазматической мембраны. Второй Фактор вирулентности позволяет организму размножаться в ткани слизистой оболочки. В результате появляются изъязвления слизистой, сопровождающиеся интенсивным воспалительным ответом собственная пластинка. Инфекция обычно ограничивается слизистой оболочкой; лимфа поражение узлов и бактериемия встречаются редко.
Производство жидкости при инвазивных диарейных заболеваниях
Механизм (ы), посредством которых жидкость, вызывающая водянистую диарею, образуется в инвазивные диарейные заболевания обсуждаются. Были задействованы три механизма предложенный. Во-первых, Shigella и, возможно, Штаммы Salmonella , по-видимому, продуцируют энтеротоксин, который стимулирует слизистую оболочку выделять воду и электролиты. Во-вторых, есть доказательства того, что инвазивные организмы стимулируют синтез простагландинов на месте воспаления и простагландины вызывают секрецию жидкости.В экспериментальные животные, секреция жидкости может быть заблокирована ингибиторами простагландинов такие как индометацин и аспирин. В-третьих, некоторые данные свидетельствуют о том, что повреждение эпителий толстой кишки вызывает диарею, предотвращая нормальную резорбцию жидкость.
Вирусные диареи
Два вируса — ротавирус (см. Гл. 63) и калицивирус (вирус Норуолк) (см. Главу 65) — были определены как основные кишечные патогены в организме человека. Ротавирусы — очень важная причина младенческого диарея, которая в неразвитых странах может привести к летальному исходу.Взрослые могут быть инфицированы и распространение вируса, но клиническое заболевание проявляется почти исключительно у детей младше 2 года. Калицивирус, напротив, может вызывать гастроэнтерит во всех возрастных группах и является причиной крупных эпидемий. Первоначальное поражение формируется в проксимальном отделе тонкой кишки. Архитектура слизистой оболочки повреждена с укорочением ворсинок и гиперплазией склепы. Воспалительный экссудат затем появляется в собственной пластинке.
Механизмы, ответственные за секрецию жидкости при вирусных диареях, не изучены. выяснил.Известно, что заражение калицивирусом может вызвать стеаторею и нарушение всасывания ксилозы и прямое повреждение ферментов щеточной каймы. Активность аденилатциклазы в эпителиальных клетках не изменяется в остром болезнь.
Паразитарные диареи
Некоторые виды простейших и гельминтов могут вызывать диарейные заболевания. Что-нибудь из этого инфекции могут быть переданы в Соединенных Штатах, хотя воздействие кишечных паразиты гораздо чаще встречаются в тропических и развивающихся странах.Некоторые из более частыми причинами паразитарной диареи являются Entamoeba histolytica , Giardia lamblia , Strongyloides stercoralis , и кишечные сосальщики.
Клиническая диагностика диарейного заболевания
Понимание патофизиологии может быть использовано для постановки предположительного диагноза в пациенты с инфекционной диареей (). Пожалуй, самый удобный подход — разделить патогены, которые вовлекают тонкую кишку из тех, которые атакуют толстую кишку.Энтеротоксигенный бактерии ( E coli, V cholerae ), вирусы и паразиты Лямблии являются примерами патогенов тонкой кишки. Эти организмы вызывают водянистый понос, который может привести к обезвоживанию. Боль в животе, хотя часто диффузная и плохо выраженная, обычно околопупочная. Микроскопический исследование стула не позволяет выявить сформированные клеточные элементы, такие как эритроциты и лейкоциты.
Таблица 95-2
Клинические признаки диарейных заболеваний.
Патогены толстой кишки (основными из которых являются Shigella и Campylobacter ) являются инвазивными организмами и вызывают клинические синдром, известный как дизентерия.Вовлечение толстой кишки настоятельно рекомендуется характерная ректальная боль, известная как тенезмы. Хотя фекальные стоки могут быть сначала водянистый, ко второму-третьему дню болезни стул скудный и часто кровянистый или слизистый. Микроскопическое исследование почти всегда выявляет обильные эритроциты и лейкоциты. Проктоскопия показывает диффузно изъязвленный, геморрагический, и рыхлая слизистая ободочной кишки.
Пищевое отравление сальмонеллой не укладывается в эту простую схему, потому что болезнь может отображать черты, характерные для заболеваний как тонкой, так и толстой кишки.Организм инвазивный для слизистой оболочки тонкой кишки, особенно нижней подвздошной кишки, и может вызвать обильную секрецию жидкости. Кроме того, сепсис и метастатический Иногда происходит распространение возбудителя на другие органы.
Ссылки
- Finegold S (ed): Столетний симпозиум по анаэробам: Памятник Андре Вейону. Clin Infect Dis 18: 5–245, 1994 . [PubMed: 8086570]
Голдин Б.Р., Лихтенштейн А.Х., Горбач С.Л.: роль кишечная флора.п. 500. В Shils ME, Young VR (eds): Modern Nutrition in Здоровье и болезнь. Леа и Фебригер, Филадельфия, 1994.
Горбач С.Л.: Инфекционная диарея и бактериальная пища. отравление. п. 1128 In Sleisenger MH, Fordtran JS (ред.): Желудочно-кишечный тракт. Болезни. WB Saunders, Philadelphia, 1993.
Simon GL, Gorbach SL: Нормальный пищеварительный тракт. микрофлора. п. 53. In Blaser MJ, Smith PD, Ravdin JI, Greenberg HB, Guerrant RL (ред.): Инфекции желудочно-кишечного тракта, Raven Press, Нью-Йорк, 1995 .
Микрофлора желудочно-кишечного тракта: обзор
Поверхность слизистой оболочки желудочно-кишечного тракта человека составляет около 200-300 м2 и заселена 1013-14 бактериями 400 различных видов и подвидов. Сэвидж определил и разделил микрофлору желудочно-кишечного тракта на два типа: автохтонная флора (местная флора) и аллохтонная флора (временная флора). Автохтонные микроорганизмы колонизируют определенные места обитания, т.е.е., физические пространства в желудочно-кишечном тракте, тогда как аллохтонные микроорганизмы не могут колонизировать определенные среды обитания, кроме как в ненормальных условиях. Большинство патогенов — это аллохтонные микроорганизмы; тем не менее, некоторые патогены могут быть автохтонными для экосистемы и обычно живут в гармонии с хозяином, за исключением случаев, когда система нарушена. Распространенность бактерий в различных частях желудочно-кишечного тракта, по-видимому, зависит от нескольких факторов, таких как pH, перистальтика, окислительно-восстановительный потенциал, бактериальная адгезия, взаимодействие бактерий, секреция муцина, доступность питательных веществ, диета и бактериальный антагонизм.Из-за низкого pH желудка и относительно быстрой перистальтики желудка и тонкой кишки, желудок и верхние две трети тонкой кишки (двенадцатиперстная кишка и тощая кишка) содержат лишь небольшое количество микроорганизмов, которое колеблется от 103 до 104 бактерии / мл содержимого желудка или кишечника, в основном кислотоустойчивые лактобациллы и стрептококки. В дистальном отделе тонкой кишки (подвздошная кишка) микрофлора начинает напоминать микрофлору толстой кишки с примерно 107-108 бактериями / мл содержимого кишечника.При снижении перистальтики, кислотности и снижении окислительно-восстановительного потенциала подвздошная кишка поддерживает более разнообразную микрофлору и более высокую бактериальную популяцию. Вероятно, из-за медленной перистальтики кишечника и очень низкого окислительно-восстановительного потенциала толстая кишка является основным местом микробной колонизации человека. В толстой кишке обитает огромное количество различных видов бактерий. Однако 99,9% микрофлоры толстой кишки — облигатные анаэробы.
Анатомия и нормальная микробиота пищеварительной системы
Цели обучения
- Описать основные анатомические особенности пищеварительной системы человека
- Опишите нормальную микробиоту различных регионов пищеварительной системы человека
- Объясните, как микроорганизмы преодолевают защитные силы пищеварительного тракта и вызывают инфекцию или интоксикацию
- Опишите общие признаки и симптомы, связанные с инфекциями пищеварительной системы
Клиническое направление: Ирен, часть 1
После утренней игры на улице четырехлетняя Ирэн забежала внутрь обедать.Откусив от жареного яйца, она оттолкнула его и заскулила: «Это слишком скользко, мамочка. Я больше не хочу «. Но ее мать, не в настроении для игр, отрывисто ответила, что, если она хочет выйти на улицу, ей лучше закончить свой обед. Ирен нехотя подчинилась, изо всех сил стараясь не заткнуть рот, когда она подавилась жидким яйцом.
Той ночью Ирэн проснулась от тошноты. Она плакала из-за родителей, а затем ее начало рвать. Ее родители пытались утешить ее, но ее продолжала рвать всю ночь, у нее начался понос и поднялась температура.К утру родители сильно забеспокоились. Они срочно доставили ее в отделение неотложной помощи.
- Что могло вызвать признаки и симптомы Ирен?
Мы вернемся к примеру Ирен на следующих страницах.
Пищеварительная система человека или желудочно-кишечный тракт (ЖКТ) начинается со рта и заканчивается анусом. Части рта включают зубы, десны, язык, преддверие рта (пространство между деснами, губами и зубами) и собственно ротовую полость (пространство за зубами и деснами).Другими частями желудочно-кишечного тракта являются глотка, пищевод, желудок, тонкий кишечник, толстый кишечник, прямая кишка и задний проход. Дополнительные органы пищеварения включают слюнные железы, печень, желчный пузырь, селезенку и поджелудочную железу.
Пищеварительная система содержит нормальную микробиоту, включая архей, бактерии, грибы, протистов и даже вирусы. Поскольку эта микробиота важна для нормального функционирования пищеварительной системы, изменения микробиоты антибиотиками или диетой могут быть вредными.Кроме того, попадание патогенов в желудочно-кишечный тракт может вызвать инфекции и заболевания. В этом разделе мы рассмотрим микробиоту здорового пищеварительного тракта, а также общие признаки и симптомы, связанные с инфекциями полости рта и желудочно-кишечного тракта.
Рис. 1. Пищеварительная система или желудочно-кишечный тракт включает все органы, связанные с перевариванием пищи.
Анатомия и нормальная микробиота полости рта
Пища попадает в пищеварительный тракт через рот, где начинается механическое пищеварение (путем жевания) и химическое пищеварение (с помощью ферментов в слюне , ).Внутри ротовой полости находятся язык , зубы и слюнные железы , включая околоушные, подъязычные и подчелюстные железы. Слюнные железы производят слюну, которая смазывает пищу и содержит пищеварительные ферменты.
Рис. 2. (a) Когда пища попадает в рот, начинается пищеварение. (б) Слюнные железы — вспомогательные органы пищеварения. (кредит: модификация работы Национального института рака)
Структура зуба начинается с видимой внешней поверхности, называемой коронкой , которая должна быть чрезвычайно твердой, чтобы выдерживать силу прикусывания и жевания.Коронка покрыта эмалью , которая является самым твердым материалом в корпусе. Под коронкой слой относительно твердого дентина простирается в корень зуба вокруг самой внутренней полости пульпы , которая включает пульповую камеру наверху зуба и канал пульпы, или корневой канал , расположенный в корень. Пульпа, заполняющая полость пульпы, богата кровеносными, лимфатическими, соединительными тканями и нервами. Корень зуба и часть коронки покрыты цементом , который взаимодействует с периодонтальной связкой, фиксируя зуб в кости челюсти.Мягкие ткани, окружающие зубы и кости, называются десной или десной . Десневое пространство или десневая щель расположена между деснами и зубами.
Рис. 3. Зуб имеет видимую коронку с внешним слоем эмали, слоем дентина и внутренней пульпой. Корень, скрытый деснами, содержит канал пульпы (корневой канал). (кредит: модификация работы Брюса Блауса)
Микробы, такие как бактерии и археи, многочисленны во рту и покрывают все поверхности ротовой полости.Однако различные структуры, такие как зубы или щеки, содержат уникальные сообщества как аэробных, так и анаэробных микробов. Некоторые факторы, по-видимому, препятствуют тому, чтобы во рту обитали определенные микробы. Например, жевание позволяет микробам лучше смешиваться со слюной, поэтому их легче проглотить или выплюнуть. Слюна также содержит ферменты, в том числе лизоцим , которые могут повреждать микробные клетки. Напомним, что лизоцим является частью первой линии защиты врожденной иммунной системы и расщепляет β- (1,4) гликозидные связи между N-ацетилглюкозамином (NAG) и N-ацетилмурамовой кислотой (NAM) в бактериальном пептидогликане (см. Раздел «Химическая защита»). ).Кроме того, в десневом пространстве вырабатываются жидкости, содержащие иммуноглобулины и фагоцитарные клетки. Несмотря на все эти химические и механические действия, во рту обитает большое микробное сообщество.
Подумай об этом
- Какие факторы делают рот непригодным для определенных микробов?
Анатомия и нормальная микробиота желудочно-кишечного тракта
Когда пища покидает ротовую полость, она проходит через глотку или заднюю часть глотки и перемещается в пищевод , который переносит пищу из зева в желудок без добавления каких-либо дополнительных пищеварительных ферментов.В желудке вырабатывается слизь, для защиты слизистой оболочки, а также пищеварительные ферменты и кислота для расщепления пищи. Затем частично переваренная пища покидает желудок через пилорический сфинктер , достигая первой части тонкой кишки, называемой двенадцатиперстной кишкой . Панкреатический сок, содержащий ферменты и ионы бикарбоната, попадает в тонкий кишечник, чтобы нейтрализовать кислый материал желудка и помочь пищеварению. Желчь, вырабатываемая печенью , но хранящаяся в желчном пузыре , также выделяется в тонкую кишку для эмульгирования жиров, чтобы они могли перемещаться в водянистой среде тонкой кишки.Пищеварение продолжается в тонком кишечнике, где всасывается большинство питательных веществ, содержащихся в пище. Простые столбчатые эпителиальные клетки, называемые энтероцитами , выстилают поверхность просвета складок тонкого кишечника, называемых ворсинками . Каждый энтероцит имеет более мелкие микроворсинки (расширения цитоплазматической мембраны) на апикальной поверхности клетки, которые увеличивают площадь поверхности, позволяя более интенсивному всасыванию питательных веществ.
Рис. 4. (a) Структура стенки тонкой кишки позволяет организму абсорбировать большую часть питательных веществ.(б) Ворсинки — это складки на поверхности тонкой кишки. Микроворсинки — это цитоплазматические продолжения отдельных клеток, которые увеличивают площадь поверхности для абсорбции. (c) На светлой микрофотографии показана форма ворсинок. (d) Электронная микрофотография показывает форму микроворсинок. (кредит b, c, d: Модификация микрофотографий, предоставленных Медицинской школой Риджентс Мичиганского университета © 2012)
Переваренная пища покидает тонкую кишку и перемещается в толстую кишку или толстую кишку , где микробиота более разнообразна.Рядом с этим соединением в толстой кишке находится небольшой мешочек под названием слепая кишка , который прикрепляется к отростку . Дальнейшее пищеварение происходит по всей толстой кишке, и вода реабсорбируется, затем отходы выводятся через прямую кишку , последний отдел толстой кишки, и выводятся из организма через анус .
Окружающая среда большей части желудочно-кишечного тракта суровая, что служит двум целям: пищеварению и иммунитету. В желудке очень кислая среда (pH 1.5–3.5) из-за желудочного сока, который расщепляет пищу и убивает множество проглоченных микробов; это помогает предотвратить заражение болезнетворными микроорганизмами. Окружающая среда в тонком кишечнике менее суровая и способна поддерживать микробные сообщества. Микроорганизмы, присутствующие в тонком кишечнике, могут включать лактобациллы , дифтериоиды и гриб Candida . С другой стороны, толстая кишка (толстая кишка) содержит разнообразную и многочисленную микробиоту, которая важна для нормального функционирования.Эти микробы включают Bacteriodetes (особенно роды Bacteroides и Prevotella ) и Firmicutes (особенно представители рода Clostridium). Метаногенные археи и некоторые грибы также присутствуют среди многих других видов бактерий. Все эти микробы помогают пищеварению и способствуют образованию фекалий, отходов, выделяемых из пищеварительного тракта, и газов, газов, образующихся в результате микробной ферментации непереваренной пищи.Они также могут производить ценные питательные вещества. Например, молочнокислые бактерии , такие как бифидобактерии , могут синтезировать витамины, такие как витамин B12, фолат и рибофлавин, которые люди не могут синтезировать сами. E. coli , обнаруженная в кишечнике, также может расщеплять пищу и помогать организму вырабатывать витамин К, который важен для свертывания крови.
В желудочно-кишечном тракте есть несколько других методов снижения риска заражения патогенами. Небольшие агрегаты подлежащей лимфоидной ткани в подвздошной кишке, называемые Пейеровыми пятнами , обнаруживают патогены в кишечнике через микроскладчатые (М) клетки, которые переносят антигены из просвета кишечника в лимфоциты на Пейеровских пятнах, чтобы вызвать иммунный ответ.Затем пятна Пейера секретируют IgA и другие патоген-специфические антитела в просвет кишечника, чтобы поддерживать безопасный уровень кишечных микробов. Бокаловидные клетки, которые представляют собой модифицированные простые столбчатые эпителиальные клетки, также выстилают GI тракт . Бокаловидные клетки секретируют гелеобразующий муцин , который является основным компонентом слизи . Создание защитного слоя слизи помогает снизить риск проникновения патогенов в более глубокие ткани.
Постоянное движение материалов по желудочно-кишечному тракту также помогает вывести из организма преходящие патогены.Фактически, кал состоит примерно на 25% из микробов, на 25% из отшелушенных эпителиальных клеток, на 25% из слизи и на 25% из переваренной или непереваренной пищи. Наконец, нормальная микробиота обеспечивает дополнительный барьер для инфекции через множество механизмов. Например, эти организмы побеждают потенциальных патогенов за пространство и питательные вещества в кишечнике. Это известно как конкурентное исключение . Члены микробиоты также могут секретировать белковые токсины, известные как , бактериоцины , которые способны связываться со специфическими рецепторами на поверхности чувствительных бактерий.
Рис. 5. Увеличенное изображение ворсинок кишечника в желудочно-кишечном тракте показывает бокаловидные клетки. Эти клетки играют важную роль в производстве защитного слоя слизи.
Подумай об этом
- Сравните и сопоставьте микробиоту тонкого и толстого кишечника.
Общие признаки и симптомы заболеваний полости рта и желудочно-кишечного тракта
Несмотря на многочисленные защитные механизмы, защищающие от инфекции, все части пищеварительного тракта могут стать очагами инфекции или интоксикации.Термин пищевое отравление иногда используется для обозначения всех инфекций и интоксикаций желудочно-кишечного тракта, но не все формы заболеваний желудочно-кишечного тракта происходят от патогенов или токсинов пищевого происхождения.
Во рту, ферментация анаэробными микробами производит кислоты, которые повреждают зубы и десны. Это может привести к кариесу, кариесу и пародонтозу , состоянию, характеризующемуся хроническим воспалением и эрозией десен . Кроме того, некоторые патогены могут вызывать инфекции слизистой оболочки, желез и других структур во рту, что приводит к воспалению, язвам, язвам и другим поражениям.Открытая рана во рту или желудочно-кишечном тракте обычно называется язвой .
Инфекции и интоксикации нижних отделов желудочно-кишечного тракта часто вызывают такие симптомы, как тошнота, рвота, диарея, боли и лихорадка. В некоторых случаях рвота и диарея могут вызвать сильное обезвоживание и другие осложнения, которые могут стать серьезными или смертельными. Для описания желудочно-кишечных симптомов используются различные клинические термины. Например, гастрит — это воспаление слизистой оболочки желудка, которое приводит к отеку, а энтерит относится к воспалению слизистой оболочки кишечника.Когда воспаление затрагивает как слизистую оболочку желудка, так и слизистую оболочку кишечника, это состояние называется гастроэнтеритом . Воспаление печени называется гепатитом . Воспаление толстой кишки, называемое колитом , обычно возникает при пищевой интоксикации. Поскольку воспаленная толстая кишка не реабсорбирует воду так эффективно, как обычно, стул становится водянистым, вызывая диарею. Повреждение эпителиальных клеток толстой кишки также может вызвать кровотечение и появление избытка слизи в водянистом стуле, состояние, называемое дизентерией .
Подумай об этом
- Перечислите возможные причины, признаки и симптомы пищевого отравления.
Ключевые концепции и резюме
- Пищеварительный тракт, состоящий из ротовой полости, глотки, пищевода, желудка, тонкой и толстой кишок, имеет нормальную микробиоту, которая важна для здоровья.
- Постоянное движение материалов через желудочно-кишечный канал, защитный слой слизи, нормальная микробиота и агрессивная химическая среда в желудке и тонком кишечнике помогают предотвратить колонизацию болезнетворными микроорганизмами.
- Инфекции или микробные токсины в полости рта могут вызывать кариес , пародонтоз и различные типы язв .
- Инфекции и отравления желудочно-кишечного тракта могут вызывать общие симптомы, такие как тошнота, рвота, диарея и лихорадка. Локализованное воспаление желудочно-кишечного тракта может привести к гастриту , энтериту , гастроэнтериту , гепатиту или колиту , а повреждение эпителиальных клеток толстой кишки может привести к дизентерии .
- Болезнь пищевого происхождения относится к инфекциям или интоксикациям, которые происходят из-за патогенов или токсинов, попавших в загрязненную пищу или воду.
Множественный выбор
Что из перечисленного НЕ помогает нормальной микробиоте кишечника предотвратить инфекцию?
- Вырабатывает кислоты, понижающие pH в желудке.
- Ускоряет процесс выведения микробов из пищеварительного тракта.
- Он потребляет пищу и занимает место, превосходя потенциальные патогены.
- Он производит большое количество кислорода, убивающего анаэробные патогены.
г. Он производит большое количество кислорода, убивающего анаэробные патогены.
Какие виды микробов обитают в кишечнике?
- Различные виды бактерий, архей и грибов, особенно Bacteroides и Firmicutes бактерии
- Узкий круг бактерий, особенно Firmicutes
- Узкий круг бактерий и грибов, особенно Bacteroides
- Только археи и грибы
а.В кишечнике обитают различные виды бактерий, архей и грибов, особенно бактерии Bacteroides и Firmicutes .
Заполните бланк
Часть желудочно-кишечного тракта с наибольшей естественной микробиотой — _________.
Покажи ответЧасть желудочно-кишечного тракта с наибольшей естественной микробиотой — толстый или толстый кишечник .
Подумай об этом
- Чем диарея, вызванная дизентерией, отличается от других типов диареи?
Микробная флора желудка и желудочно-кишечного тракта
Желудок и желудочно-кишечный тракт не стерильны и заселены микроорганизмами , которые выполняют полезные для хозяина функции, включая производство необходимых витаминов и предотвращение колонизации нежелательными микробами.
Преимущества тесной связи между микроорганизмами и хозяином также распространяются на микробы. Микроорганизмам предоставляется защищенное место для жизни и среда, богатая питательными веществами, и относительно свободная от хищников.
Это взаимовыгодное объединение присутствует всегда. При рождении у человека желудок и пищеварительный тракт обычно стерильны. Но при первом приеме пищи начинается колонизация бактериями . Например, у детей, находящихся на грудном вскармливании, большая часть кишечной флоры состоит из бактерий, известных как бифидобактерии.По мере того как грудное молоко уступает место молоку в бутылках, кишечная флора изменяется и включает кишечные бактерии, бактероиды, энтерококки, лактобациллы и клостридии.
Флора желудочно-кишечного тракта животных интенсивно изучается. Эти исследования показали, что бактерии — самые многочисленные микробы, присутствующие в желудке и желудочно-кишечном тракте. Состав бактериальных популяций варьируется от животного к животному, даже внутри одного вида. Иногда в рационе животного может преобладать одна или несколько бактерий над другими видами.Аналогичная ситуация и у людей. Другие факторы, влияющие на бактериальный состав желудка и желудочно-кишечного тракта человека, включают возраст, культурные условия и использование антибиотиков . В частности, прием антибиотиков может сильно изменить состав желудочно-кишечной флоры.
Несмотря на разнообразие бактериальной флоры, в желудочно-кишечном тракте людей и многих животных, как правило, присутствуют следующие бактерии: Escherichia coli , Clostridium perfringens , Enterococci, Lactobacilli и Bacteroides .
Пищевод считается частью желудочно-кишечного тракта. В этой области обычно присутствуют бактерии, которые были проглочены вместе с пищей. Эти бактерии обычно не выживают при прохождении через желудок с высокой кислотностью. Только бактерии, которые могут переносить сильнокислую среду, могут выжить в желудке. Одна бактерия, которая, как было доказано, присутствует в желудке многих людей, — это Helicobacter pylori . В настоящее время известно, что эта бактерия является основной причиной язвы желудка.Кроме того, появляется все больше убедительных доказательств связи бактерии с развитием рака желудка и кишечника.
У человека тонкий кишечник содержит небольшое количество бактерий, от 100 000 до 10 миллионов бактерий на миллилитр жидкости. Чтобы представить эти цифры в перспективе, лабораторная жидкая культура , в которой достигнуто максимальное количество бактерий, будет содержать от 100 миллионов до одного миллиарда бактерий на миллилитр. Бактериальная флора этого региона состоит в основном из лактобацилл и Enterococcus faecalis .В нижних отделах тонкой кишки содержится больше бактерий и более разнообразных видов, включая бактерии группы кишечной палочки, такие как Escherichia coli .
В толстом кишечнике количество бактерий может достигать 100 миллиардов на миллилитр жидкости. Преобладающими видами являются анаэробные бактерии, которые не растут в присутствии кислорода. К ним относятся анаэробные молочнокислые бактерии , Bacteroides и Bifidobacterium bifidum . Количество и состав бактерий в толстой кишке фактически соответствует фекальному материалу.
Огромное количество бактерий в толстом кишечнике создает особые разновидности флоры. Образцы стенок кишечника в разных местах выявят различия в видах присутствующих бактерий. Кроме того, взятие пробы в любой точке кишечника выявит различия в бактериальной популяции на разной глубине прикрепленного роста на стенке кишечника.
Некоторые бактерии специфически связываются с определенными клетками желудочно-кишечного тракта. Грамположительные бактерии, такие как , стрептококки, и лактобациллы, часто прикрепляются к клеткам посредством капсул, окружающих бактерии.Грамотрицательные бактерии, такие как Escherichia coli , могут прикрепляться к рецепторам эпителиальных клеток кишечника с помощью бактериального придатка, называемого фимбриями.
Важность микробной флоры желудка и желудочно-кишечного тракта была продемонстрирована путем сравнения структуры и функции пищеварительного тракта нормальных животных и животных-нотобиотов. Последние животные лишены бактерий. Измененная структура кишечного тракта у животных-нотобиотов менее эффективна с точки зрения обработки пищи и поглощения питательных веществ.Кроме того, у таких животных, как коровы, которые потребляют целлюлозу, активность кишечных микроорганизмов ферментация жизненно важна для пищеварения. Таким образом, флора желудка и кишечника очень важна для здоровья животных, в том числе человека.
См. Также Enterobacteriaceae; Пробиотики; Пищевое отравление сальмонеллой
Нормальная флора желудочно-кишечного тракта
4 марта 2018 Гаураб Карки Микробиология 0
- Желудочно-кишечные тракты состоят из желудка, тонкой кишки и толстой кишки.Различные части желудочно-кишечного тракта различаются по своим экологическим характеристикам, химическому составу и физиологическим свойствам. Поэтому виды и количество микрофлоры в разных частях различаются.
- В целом количество микроорганизмов увеличивается от желудка к тонкому кишечнику и толстому кишечнику.
Нормальная флора желудка:
- Желудок получает большое количество микроорганизмов изо рта вместе с пищей и водой, но антимикробная активность HCl убивает большинство из них.Немногочисленные микроорганизмы, которые могут переносить кислотность желудка, могут образовывать резидентную нормальную флору желудка.
- Примеры: lactobacillus , Candida albicans , Helicobacter pylori , lactobacillus , Enterococcus и т. Д.
- Количество микроорганизмов в желудке увеличивается сразу после приема пищи, но вскоре уменьшается после выделения желудочного сока.
Нормальная флора тонкого кишечника:
- Двенадцатиперстная кишка прилегает к желудку и поэтому имеет слабокислый характер.Поэтому микроорганизмы в двенадцатиперстной кишке похожи на микроорганизмы желудка. В двенадцатиперстной кишке обнаружены в основном Lactobacillus и Enterococcus .
- Из двенадцатиперстной кишки кишечник становится менее кислым, и, следовательно, увеличивается количество микроорганизмов.
- В тощей кишке обнаружены Enterococci , lactobacillus , Diphtheroid и Candida albican s.
- Микроорганизм подвздошной кишки начинает напоминать микроорганизм толстой кишки.Обнаруживаются в основном облигатные анаэробы, такие как Clostridium perfinges , Bacteroides и анаэробные E. coli.
Нормальная флора толстого кишечника:
- Толстая кишка анаэробна по своей природе. Он содержит облигатные анаэробы и факультативные анаэробы.
- C lostridium perfingens, Bifidobacterium, Bacteroides, Streptococcus fecalis, E. coli
Факторы, влияющие на количество и типы нормальной флоры желудочно-кишечного тракта:
- Диета: Типы продуктов влияют на количество и типы микрофлоры в желудочно-кишечном тракте.В вегетарианской диете количество сахролитических микроорганизмов, таких как , E . coli увеличивается, и если мясо потребляется, протеолитический организм, такой как Clostridium
- HCl и желчь: HCl в желудке и желчь в двенадцатиперстной кишке обладают противомикробными свойствами, поэтому количество микроорганизмов в желудке и двенадцатиперстной кишке ниже, чем в других желудочно-кишечных трактах.
- Антибиотики: при пероральном приеме антибиотиков количество микроорганизмов уменьшается. При длительной антибактериальной терапии снижается значительное количество микрофлоры желудочно-кишечного тракта.
- Физиологическое состояние: при диарее количество микробиоты уменьшается за счет промывания кишечника.
Роль нормальной кишечной флоры:
- Синтезировать витамин B12 и витамин K
- Производит различные ферменты, метаболизирующие углеводы, и помогает в переваривании пищи. Например. Целлюлаза, глюкозидаза, галактозидаза
- Помогает в метаболизме стероидов
- Производит такие газы, как Ch5 и CO2
- Производит другие вещества, такие как индол, скатол, масляную кислоту и т. Д.
Нормальная флора желудочно-кишечного тракта
Желудочно-кишечный тракт 6: влияние микробиоты кишечника на здоровье человека
В этой статье — последней в серии из шести статей о желудочно-кишечном тракте — описывается роль микроорганизмов в желудочно-кишечном тракте и то, как нарушение микробиоты кишечника может увеличить риск некоторых заболеваний и состояний здоровья
Аннотация
Комбинированная кишечная микробиота (сообщество микроорганизмов в желудочно-кишечном тракте) оказывает сильное и разнообразное воздействие на физиологию.Он играет роль в синтезе полезных биологически активных молекул, модулируя иммунные ответы, поведение и настроение. Дисбиоз, при котором нарушается баланс микробиоты, связан с повышенным риском определенных заболеваний, состояний и аутоиммунных реакций. В этой статье, последней в серии из шести статей о желудочно-кишечном тракте, исследуется микробиота кишечника и ее роль в организме.
Образец цитирования: Knight, J et al. (2019) Желудочно-кишечный тракт 6: влияние микробиоты кишечника на здоровье человека. Nursing Times [онлайн]; 115: 11, 46-50.
Авторы: Джон Найт — доцент кафедры биомедицины; Зубейде Байрам-Вестон — преподаватель биомедицинских наук; Ямни Нигам — профессор биомедицинских наук; все в Колледже здоровья и наук Университета Суонси.
- Эта статья прошла двойное слепое рецензирование
- Прокрутите вниз, чтобы прочитать статью или загрузить PDF-файл для печати здесь (если не удается полностью загрузить PDF-файл, попробуйте еще раз, используя другой браузер)
- Нажмите здесь , чтобы увидеть другие статьи из этой серии
Введение
Предыдущие статьи этой серии о желудочно-кишечном тракте последовательно исследовали компоненты желудочно-кишечного тракта от рта до ануса и описывали процессы механического и химического пищеварения и всасывания.В этой заключительной статье исследуется микробиота кишечника (сообщество микроорганизмов, обитающих в желудочно-кишечном тракте) и роль, которую она играет в желудочно-кишечном тракте и в общем состоянии здоровья.
Обзор микробиоты
Желудочно-кишечный тракт человека имеет массивную общую площадь 250-400 м2 (Терсби и Джадж, 2017). Это усиливает процессы пищеварения и абсорбции и действует как поверхностный субстрат для прикрепления и колонизации микробов. Также обнаружено, что большее количество микробов находится во взвешенном состоянии и размножается в плотной питательной среде желудочно-кишечного секрета и частично переваренной пищи.По оценкам, 100 триллионов микроорганизмов, включая бактерии, вирусы, грибы и простейшие, колонизируют желудочно-кишечный тракт, при этом количество микробов превышает количество человеческих клеток от трех до 10 к одному (European Commission, 2018).
Считается, что объединенный микробный геном включает более 3 миллионов генов, что значительно превышает 23 000 генов, присутствующих в геноме человека. Этот огромный микробный геном известен под общим названием кишечного микробиома и кодирует множество микробных метаболитов, которые попадают в кишечник, а затем абсорбируются и распределяются по всему телу.Комбинированную микробиоту кишечника часто называют «суперорганизмом», который, поскольку он высвобождает биологически активные молекулы, можно рассматривать как «виртуальный эндокринный орган», который оказывает мощное и разнообразное воздействие на физиологию человека (Valdes et al, 2018). При предполагаемом общем весе 2 кг микробиота кишечника имеет большую массу, чем печень, которая является самым большим внутренним органом.
В течение многих лет было понятно, что бактерии, живущие в кишечнике, такие как Escherichia coli ( E coli ), выполняют жизненно важные функции, такие как биосинтез витамина К (ключевой кофактор в каскаде свертывания крови. ), но только в последнее десятилетие постепенно становится понятным сложное взаимодействие между микроорганизмами микробиоты кишечника и тканями человека.Сегодня признано, что микробиота не только играет роль в синтезе полезных биологически активных молекул, но и непосредственно участвует в модуляции иммунных ответов, а также влияет на поведение и настроение. Особый интерес представляет наблюдение, что дисбактериоз, при котором нарушается нормальный баланс видов в микробиоте, связан с повышенным риском определенных заболеваний и медицинских состояний, включая болезнь Паркинсона, аутизм, ожирение, диабет и некоторые аутоиммунные реакции.
Виды микробов, образующие микробиоту кишечника
Основная проблема при попытке идентифицировать микробы, обитающие в желудочно-кишечном тракте человека, заключается в том, что многие из них не могут быть выращены с использованием стандартных методов микробиологического культивирования. Однако появление современного секвенирования генома позволило быстро идентифицировать микроорганизмы без необходимости культивирования. Бактериальные виды кишечника были наиболее изучены, в то время как знания о вирусных и грибковых микроорганизмах кишечной микробиоты в настоящее время скудны.Низкий уровень кислорода, присутствующий во внутренней среде желудочно-кишечного тракта, способствует росту строго анаэробных видов бактерий, количество которых значительно превышает количество факультативных анаэробов (бактерий, которые могут переключаться между аэробным и анаэробным метаболизмом в зависимости от концентрации кислорода) и аэробных видов (бактерий, которые требуют наличия кислорода) (Секиров и др., 2010).
Две основные группы бактерий доминируют в желудочно-кишечном тракте (рис. 1) с Firmicutes (например, Lactobacillus и Streptococcus видов), составляющими около 65% от общего количества, и Bacteroidetes (например, Bacteroides Кишечник ) около 30%.Остальные 5% состоят из примитивных бактериальных групп, включая протеобактерии (например, E coli ) и актинобактерии, такие как Bifidobacteria видов (Yang et al, 2009).
По оценкам, в кишечнике каждого человека обитает от 500 до 1000 видов бактерий. Популяционные исследования указывают на большие различия между людьми, причем каждый человек имеет уникальный профиль микробного вида. Предполагается, что коллективная бактериальная микробиота кишечника человека составляет до 35000 видов, при этом постоянно открываются новые виды, в том числе многие ранее неизвестные науке (Barras, 2019).
Первоначальная колонизация после рождения
Младенцы появляются из обычно стерильной среды матки с минимальной бактериальной колонизацией. Неудивительно, что те, кто родился естественным путем естественным путем, имеют раннюю микробиоту кишечника, аналогичную влагалищной, с преобладанием таких групп, как Lactobacillus. Это контрастирует с младенцами, рожденными с помощью кесарева сечения, у которых ранняя микробиота кишечника аналогична микробиоте, обнаруженной на коже матери, с такими группами, как Corynebacterium и Staphylococcus видов, присутствующих в большом количестве (Dominguez-Bello et al, 2011).Разнообразие видов бактерий обычно увеличивается с возрастом, поскольку разные виды приобретаются в результате контакта с окружающей средой, особенно в результате употребления в пищу различных продуктов и контактов с другими людьми и животными. Считается, что приобретение зрелой микробиоты, напоминающей микробиоту взрослого, достигается в первые три года жизни, при этом страна проживания также влияет на микробиотический профиль (Яцуненко и др., 2012).
Различия по кишечнику
Из-за совершенно разных условий, особенно с точки зрения pH, популяции бактерий и других микроорганизмов заметно различаются в разных областях кишечника.Неудивительно, что сильно кислые условия желудка ограничивают микробную колонизацию, и поэтому относительно небольшое количество видов бактерий могут там выжить. Заметными исключениями являются видов Lactobacillus и Helicobacter pylori , которая является ключевой бактерией, связанной с образованием язв желудка (см. Часть 2). Точно так же активные ферменты протеазы, такие как трипсин, химотрипизин и кишечные пептидазы, ограничивают рост бактерий в тонком кишечнике, в котором преобладают виды Lactobacillus и Streptococcal .
Как видно на рис. 2, толстая кишка является местом обитания самых разнообразных сообществ бактерий, при этом основная масса кишечной микробной биомассы, по оценкам, составляет 2 кг. Увеличение микробного разнообразия в толстой кишке отражает значительно сниженную активность ферментов в этой области, которая в первую очередь предназначена для реабсорбции воды и соли (см. Часть 5). PH толстой кишки также более благоприятен, от слабокислого до нейтрального (обычно pH 5,5-7,0).
Источник: Питер Лэмб
Влияние на физиологию человека
Исследования влияния микробиоты на физиологические процессы все еще находятся в зачаточном состоянии.Одной из основных проблем в этой области исследований является невозможность культивирования многих ключевых видов бактерий, обнаруженных в кишечнике. Культивирование необходимо для изучения биохимии кишечных микробов и выявления микробных метаболитов, которые могут влиять на физиологию человека. Несмотря на эту проблему, недавно была получена полезная информация о роли кишечной микробиоты в модуляции физиологических процессов человека.
Роль в пищеварении
Микробные сообщества толстой кишки в основном зависят от частично переваренной пищи, поступающей из тонкой кишки, для питания и выживания.Сама микробиота кишечника играет активную роль в переваривании углеводных, жировых и белковых компонентов пищи.
Бактерии, находящиеся в толстом кишечнике, играют особенно важную роль в переваривании пищевых волокон с образованием короткоцепочечных жирных кислот (SCFA), таких как ацетат, пропионат и бутират. Считается, что пропионат играет важную роль в качестве молекулы насыщения, способствуя выключению чувства голода, в то время как бутират способствует запрограммированной гибели клеток (апоптозу) в злокачественных эпителиальных клетках, выстилающих толстую кишку, тем самым снижая риск рака кишечника. .Переваривание и ферментация пищевых волокон микробиотой кишечника дает большое количество газов, таких как метан, углекислый газ и водород без запаха, вместе с меньшими количествами едких пахучих газов, таких как сероводород (Rowland et al, 2018).
Биосинтез витаминов
Клетки и ткани человека не могут напрямую синтезировать многие из основных витаминов, необходимых для здоровья и выживания, поэтому они должны быть получены путем сочетания приема с пищей и биосинтеза микробиотой желудочно-кишечного тракта.Здоровое, хорошо сбалансированное микробное сообщество, богатое Bifidobacteria , Lactobacilli и E coli , способно синтезировать многие водорастворимые витамины, включая ключевые витамины группы B, такие как фолиевая кислота (B9), рибофлавин (B2) биотин (B7), кобаламин (B12), никотиновая кислота (B3), пантотеновая кислота (B5) и тиамин (B1) — вместе с незаменимыми жирорастворимыми витаминами, такими как группа витамина K (Yoshii et al 2019; Leblanc et al. al, 2013).
Метаболизм и взаимодействия ксенобиотиков
Ксенобиотики — это химические вещества, обнаруженные в организме человека, но не производимые им.Эти химические вещества включают загрязнители окружающей среды, такие как пестициды и пищевые добавки, включая консерванты, искусственные ароматизаторы, подсластители и фармацевтические агенты в большинстве основных групп лекарственных средств. Большинство ксенобиотиков обычно метаболизируются в печени до предсказуемых продуктов распада, которые затем выводятся с желчью для выведения с калом или в кровь для выведения почками.
Метаболизм ксенобиотиков кишечной микробиотой в настоящее время плохо изучен, но по мере развития знаний о микробных сообществах желудочно-кишечного тракта фармакологи должны учитывать различия в метаболизме лекарств, обусловленные чрезвычайно разнообразными сообществами микробов, присутствующих у разных людей.Эта новая область фармакологических исследований известна как фармакомикробиомика (Das et al, 2016).
Недавнее обширное исследование, посвященное изучению того, как 76 распространенных видов бактерий из микробиоты кишечника человека метаболизируют 271 перорально вводимый препарат, обнаружило, что 176 из них метаболизируются по крайней мере одной из исследованных бактерий. Предполагается, что метаболизм лекарства резидентными бактериями в кишечнике может приводить к образованию метаболитов, которые могут вызывать побочные эффекты, в то время как у людей, у которых отсутствуют бактерии, способные метаболизировать лекарство, побочных эффектов не наблюдается (Zimmermann, 2019).
Ось кишечник-мозг и ось мозг-кишечник-микробиом
В части 1 этой серии статей мы кратко исследовали роль кишечной нервной системы в контроле движения пищи через кишечник путем координации процесса перистальтики. Это достигается за счет густой сети нервных волокон, известных как мышечно-кишечное сплетение, которая проникает в мышечные слои стенки кишечника. Ось кишечник-мозг относится к прямым и косвенным связям и передаче сигналов между кишечной и центральной нервной системами. Этот перекрестный разговор является двунаправленным, позволяя мозгу влиять на физиологию кишечника, а активность мозга, включая познание и настроение, может быть изменена. поражаются тканями кишечника (Carabotti et al, 2015).
С увеличением знаний о микробиоте кишечника вскоре стало очевидно, что местные микробные сообщества и их коктейли из секретируемых метаболитов могут влиять на активность как кишечной, так и центральной нервной системы. Это сложное взаимодействие между кишечной микробиотой и нервной системой называется осью мозг-кишечник-микробиом (Martin et al, 2018). Хотя в настоящее время это плохо изучено, в основном из-за разнообразия химических сигналов, производимых кишечной микробиотой, и сложности задействованных нервных путей, недавно были сделаны некоторые важные открытия.
Метаболиты кишечной микробиоты, особенно короткоцепочечные жирные кислоты, способны стимулировать высвобождение гормонов нейроэндокринными клетками кишечника; к ним относятся пептид YY (PYY), который является гормоном сытости, который снижает желание есть, и глюкагоноподобный пептид-1 (GLP-1), который, помимо стимулирования насыщения, усиливает секрецию инсулина в ответ на повышение уровня глюкозы в крови. (Фарзи и др., 2018). Это говорит о том, что дисбаланс (дисбиоз) микробиоты кишечника может способствовать перееданию и ожирению и может быть связан с плохим гомеостазом глюкозы и потенциально диабетом.
Иммунная модуляция
Бактерии, колонизирующие кишечник, напрямую влияют на способность организма бороться с болезнями и инфекциями. Хорошо известно, что младенцы, находящиеся на грудном вскармливании, обладают иммунологическим преимуществом по сравнению со своими сверстниками, находящимися на искусственном вскармливании, благодаря передаче секреторных антител от матери к ребенку, которые обеспечивают защиту от патогенов в раннем младенчестве.
До недавнего времени считалось, что грудное молоко стерильно и не содержит микроорганизмов, однако недавние исследования показали, что грудное молоко содержит множество «дружественных» пробиотических бактерий (бактерий, способствующих здоровью), включая Lactobacillus и Bifidobacterium виды, которые, как известно, улучшают как кишечник, так и общее здоровье (Ojo-Okunola et al, 2018).Бактерии, присутствующие в грудном молоке, по-видимому, дополняют полезные бактерии (в основном виды Lactobacillus ), которые первоначально приобретаются в результате естественных вагинальных родов, что приводит к здоровой начальной микробиоте кишечника. Грудное молоко также, по-видимому, предотвращает колонизацию кишечника патогенными микроорганизмами, а у детей, находящихся на грудном вскармливании, есть микробиом кишечника, который способствует созданию среды, которая обычно является противовоспалительной по всему телу, снижая риск воспалительных заболеваний, таких как астма и другие заболевания. атопический дерматит (Toscano et al, 2017).
Олигосахаридные (короткоцепочечные) сахара, присутствующие в грудном молоке, богаты фруктанами (короткие цепи фруктозы), которые стимулируют рост пробиотических бактерий, включая виды Lactobacillus и Bifidobacterium . Это гарантирует, что первоначальные пробиотические популяции грудных детей поддерживаются в большом количестве; и наоборот, сухое молоко, которое дают детям, находящимся на искусственном вскармливании, по-видимому, способствует росту потенциально патогенных видов энтрококков и энтеробактерий (Lazar et al, 2018).
По мере того, как младенцев постепенно переводят на твердую пищу, они подвергаются воздействию более разнообразных популяций бактерий и достигают зрелой кишечной микробиоты. Постепенно иммунная система становится толерантной к резидентным кишечным бактериям, которые эффективно рассматриваются как продолжение «я» (Lazar et al, 2018).
Понимание «перекрестной связи» между кишечной микробиотой и иммунной системой в настоящее время минимально. Однако здоровая популяция пробиотических видов бактерий обычно связана с хорошо настроенной иммунной системой и общей противовоспалительной средой.И наоборот, уменьшение количества пробиотических бактерий увеличивает риск колонизации потенциально патогенными видами, что нарушает тонкую настройку иммунных ответов и увеличивает риск воспалительных заболеваний и других форм иммунной дисфункции (Cianci et al, 2018).
Дисбактериоз
Разнообразие микроорганизмов, живущих как сообщество в желудочно-кишечных трактах человека, называется их энтеротипом, и это может значительно различаться у разных людей. Дисбиоз можно определить как дисбаланс в количестве или разнообразии микробиоты.Поскольку знания о микробиоте кишечника все еще находятся в зачаточном состоянии, диагностика дисбактериоза может быть трудной, но некоторые общие особенности известны.
Дисбиоз микробиоты кишечника может иметь множество причин, как было рассмотрено выше: младенцы, рожденные естественным путем и находящиеся на грудном вскармливании, приобретают первоначальную популяцию здоровых пробиотических бактерий от своих матерей и с большей вероятностью будут иметь сбалансированную микробиоту, чем роды после кесарева сечения. аналоги на искусственном вскармливании. Однако даже исходная здоровая микробиота кишечника может быстро измениться в результате факторов окружающей среды, включая неправильное питание, психосоциальный стресс и прямое воздействие патогенных организмов.Дисбиоз, вызванный терапией антибиотиками, является наиболее изученной формой дисбактериоза кишечника, когда антибиотики широкого спектра действия без разбора уничтожают как дружественные, так и патогенные кишечные бактерии и приводят к серьезным изменениям в демографии кишечной микробиоты, которые могут способствовать росту патогенов ( Блюмштейн и др., 2014).
Дисбактериоз и инфекция
Хорошо известно, что определенные группы дружественных бактерий могут часто превосходить патогенные микроорганизмы, помогая поддерживать здоровье кишечника и тканей по всему телу.Бактерии, такие как виды Lactobacillus , продуцируют кислоты (молочную кислоту) и другие противомикробные и противогрибковые молекулы (такие как перекись водорода и хитиназа), которые делают условия окружающей среды в кишечнике, ротовой полости и репродуктивном тракте неблагоприятными для других бактерий и дрожжей, таких как как Candida albicans (Allonsius et al, 2019). К сожалению, курс антибиотиков нарушает естественный баланс микробиоты кишечника, потенциально истощая популяции дружественных бактерий и позволяя потенциально патогенным бактериям, таким как C difficile , беспрепятственно расти (Mullish, 2018).
Дисбактериоз и болезнь Паркинсона
Недавние исследования показали, что несколько нейродегенеративных расстройств могут быть связаны с изменениями микробиома кишечника, причем связи с болезнью Паркинсона исследуются наиболее интенсивно (Gerhardt and Mohajeri, 2018).
Болезнь Паркинсона — это прогрессирующее нейродегенеративное заболевание, поражающее движение, при котором у человека развиваются тремор покоя, ригидность, брадикинезия (замедленность движений) и постуральная нестабильность вместе с другими немоторными симптомами.Патологическим признаком является наличие телец Леви, которые образуются, когда белок, называемый альфа-синуклеином, откладывается в нейронах (нервных клетках). По мере того, как тельца Леви накапливаются, они нарушают нервную функцию и способность вырабатывать нейротрансмиттеры, такие как дофамин, который истощается у людей с болезнью Паркинсона. Тельца Леви накапливаются в их мозгу, но были обнаружены и в других регионах, включая кишечную нервную систему (Kalia and Lang, 2015).
Хотя обычно считается, что болезнь Паркинсона начинается в нервных тканях мозга, некоторые исследователи предположили, что она возникает в кишечнике, с изменениями микробиоты кишечника, способными влиять на структуру и целостность тканей кишечника (Lionnet, 2018).Заболевание, по-видимому, связано с изменениями в составе микробиоты кишечника: исследование, изучающее колонизацию кишечника у пациентов с болезнью Паркинсона, обнаружило истощение 15 видов бактерий, в том числе: Bacteroides massiliensis , Bacteroides coprocola , Blautia glucerasea , Dorea longicatena , Bacteroides plebeius , Prevotella copri , Coprococcus eutactus и Ruminococcus callidus .Это же исследование также показало усиленную колонизацию бактериями Christensenella , Catabacter , Lactobacillus , Oscillospira , Bifidobacterium , Christensenella minuta , Catabromocillus catabromocillus 904cabromocillus 904cocillus, Catabromocillus 904cocillus. Papillibacter cinnamivorans . Исследователи предположили, что эта демография кишечных бактерий может предрасполагать людей к провоспалительной среде, в которой может происходить отложение тельцов Леви (Петров и др., 2017).
Дисбактериоз и расстройство аутистического спектра
Расстройство аутистического спектра обычно характеризуется нарушенными социальными взаимодействиями и общением, а также повторяющимися и ограничивающими моделями поведения. Хотя его этиология плохо изучена, генетические факторы и факторы окружающей среды были связаны с повышенным риском развития расстройства, включая дисбаланс питания, ошибки во время пренатального развития и дисфункцию иммунной системы (Risch, 2014).
У большого числа людей с расстройством аутистического спектра наблюдается значительная дисфункция желудочно-кишечного тракта, например, изменение привычки, частоты кишечника, диарея или запор, а также хроническая боль в животе.Состояние питания и симптомы со стороны желудочно-кишечного тракта, по-видимому, сильно коррелируют с тяжестью заболевания (Adams et al, 2011; Horvath and Perman, 2002). Диета с высоким содержанием жира и сахара во время беременности и наличие гестационного диабета, по-видимому, связаны с повышенным риском расстройства аутистического спектра, потенциально за счет изменения состава микробиоты кишечника (Fattorusso et al, 2019; Connolly, 2016). Грудное вскармливание младенцев в течение четырех месяцев связано с меньшим риском по сравнению с кормлением из бутылочки; это может отражать повышенный риск дисбактериоза, поскольку у детей, которых кормят молочными смесями, кишечник способствует росту патогенных групп бактерий (Azad, 2013).Микробиота кишечника детей с расстройствами аутистического спектра часто отличается от их нейротипичных братьев и сестер и здоровых людей из контрольной группы (De Angelis et al, 2015).
Недавнее исследование 18 участников с расстройством аутистического спектра и хроническими желудочно-кишечными проблемами показало, что передача микробиоты (через фекальную трансплантацию от здоровых доноров) значительно увеличила бактериальное разнообразие и относительную численность ключевых видов пробиотиков, включая Bifidobacteria и Prevotella , и улучшила симптомы, связанные с расстройством аутистического спектра (Kang, 2019).Автор рекомендовал провести двойное слепое плацебо-контролируемое исследование.
Использование пробиотиков
Поскольку дисбактериоз, связанный с потерей пробиотических бактерий и микробного разнообразия в кишечной микробиоте, теперь хорошо известен как вредный для здоровья, появилась целая индустрия, занимающаяся производством пробиотических бактерий в надежде увеличить количество дружественных бактерий в кишечнике. В своей простейшей форме пробиотики можно давать в форме коммерчески доступных живых йогуртов и напитков, содержащих жизнеспособные популяции пробиотических бактерий, таких как виды Lactobacillus и Bifidobacterium .Исследования, изучающие эффективность таких пробиотиков, были противоречивыми, и многие исследователи указали на тот факт, что многие из проглоченных микроорганизмов не переживут коктейль из кислоты, щелочей и ферментов в достаточном количестве, чтобы существенно повлиять на баланс микроорганизмов в организме. микробиота кишечника.
Были приняты и другие подходы, включая использование «таблеток от стула», которые включают прием внутрь небольших гранул фекального материала, заключенного в энтеросолюбильное покрытие, от донора с заранее определенной здоровой микробиотой.Теоретически они должны позволить микроорганизмам выжить в разрушительной среде желудка и тонкой кишки до того, как энтеросолюбильное покрытие растворится, высвобождая гранулы стула в толстую кишку, в надежде, что здоровые донорские бактерии начнут колонизировать более гостеприимную среду обитания. толстая кишка.
Прямая трансплантация фекалий также использовалась, когда донорский фекальный материал имплантировался реципиенту, обычно с помощью эндоскопических процедур. Хотя эффективность этих методов все еще требует полной оценки, «таблетки от стула» и фекальные трансплантаты, по-видимому, эффективны в снижении инфекции и колита, вызванных C. difficile (Wischmeyer et al, 2016; Mayor, 2017).
Заключение
Несмотря на бурный рост исследований микробиоты кишечника за последнее десятилетие, знания о роли, которую играет это разнообразное сообщество микроорганизмов, все еще ограничены, и необходимы дальнейшие исследования для более полного понимания его роли в здоровье и болезнях.
Ключевые моменты
- Сообщество микроорганизмов, живущих в желудочно-кишечном тракте, оказывает сильное и разнообразное воздействие на физиологию человека
- Кишечные бактерии оказывают непосредственное влияние на иммунную систему и способность организма бороться с болезнями и инфекциями
- Такие факторы, как антибиотикотерапия, неправильное питание, психосоциальный стресс и прямое воздействие патогенных организмов, могут влиять на микробиоту кишечника
- Дисбаланс микробиоты кишечника может увеличить риск определенных заболеваний и состояний
- Доказательства эффективности пробиотиков противоречивы, но таблетки от стула и фекальные трансплантаты, по-видимому, эффективны в уменьшении Clostridium difficile инфекции и колита
Adams JB et al (2011) Пищевой и метаболический статус детей с аутизмом vs.нейротипичные дети и связь с тяжестью аутизма. Питание и обмен веществ . 8, 34.
Allonsius CN et al (2019) Ингибирование морфогенеза Candida albicans хитиназой из Lactobacillus rhamnosus GG. Scientific Reports ; 9, номер статьи: 2900.
Azad MB et al (2013) Микробиота кишечника здоровых канадских младенцев: профили по способам родоразрешения и питанию младенцев в 4 месяца. Журнал Канадской медицинской ассоциации ; 185: 5, 385–394.
Barras C (2019) Ваш таинственный микробиом. New Scientist ; 242: 3225, 28-31.
Blumstein DT et al (2014) Дисбактериоз желудочно-кишечного тракта. Эволюция, медицина и общественное здравоохранение ; 1: 163.
Carabotti et al (2015) Ось кишечник-мозг: взаимодействие между кишечной микробиотой, центральной и кишечной нервной системами. Анналы гастроэнтерологии ; 28: 2: 203-209.
Cianci R et al (2018) Взаимодействие микробиоты и иммунной системы в отношении здоровья и болезней. Медиаторы воспаления ; Идентификатор статьи 2: Doi: 0.1155 / 2018/29.
Коннолли Н. и др. (2016) Факторы метаболического риска у матери для расстройства аутистического спектра: анализ электронных медицинских карт и связанных данных о рождении. Исследования аутизма ; 9: 829–837.
Das A et al (2016) Метаболизм ксенобиотиков и микробиомы кишечника. PLoS ONE ; 11: 10, 1-26.
De Angelis M et al (2015) Расстройства аутистического спектра и кишечная микробиота. Кишечные микробы ; 6: 3, 207–213.
Домингес-Белло М.Г. и др. (2011) Развитие микробиоты желудочно-кишечного тракта человека и выводы из высокопроизводительного секвенирования. Гастроэнтерология ; 140: 6, 1713–1719.
Европейская комиссия (2018) Микробиота кишечника человека: обзор и анализ современных научных знаний и возможное влияние на здравоохранение и благополучие.
Farzi A et al (2018) Микробиота кишечника и нейроэндокринная система. Neurotherapeutics ; 15: 1, 5–22.
Fattorusso A et al (2019) Расстройства аутистического спектра и микробиота кишечника. Питательные вещества ; 11: 3, 521.
Horvath K, Perman JA (2002) Аутичное расстройство и желудочно-кишечные заболевания. Current Opinion in Pediatrics ; 14: 15, 583–587.
Gerhardt S, Mohajeri MH (2018) Изменения бактериального состава толстой кишки при болезни Паркинсона и других нейродегенеративных заболеваниях. Питательные вещества ; 10: 6, E708.
Kalia LV, Lang AE (2015) Болезнь Паркинсона. Ланцет ; 386: 9996, 896–912.
Kang D-W et al (2019) Долгосрочная польза терапии переносом микробиоты на симптомы аутизма и микробиоту кишечника. Scientific Reports ; 9, 5821.
Лазар В. и др. (2018) Аспекты взаимодействий кишечной микробиоты и иммунной системы при инфекционных заболеваниях, иммунопатологии и раке. Frontiers in Immunology ; 9: 1830.
Leblanc JG et al (2013) Бактерии как поставщики витаминов своему хозяину: взгляд на микробиоту кишечника. Текущее мнение в области биотехнологии ; 24: 2, 160-8.
Lionnet A et al (2018) Начинается ли болезнь Паркинсона в кишечнике? Acta Neuropathologica ; 135; 1–12.
Mayor S (2017) Трансплантат фекалий, введенный в пероральной капсуле, снижает количество рецидивов Clostridium difficile, показано в исследовании. Британский медицинский журнал ; 359; j5501.
Martin CR et al (2018) Ось микробиома мозга и кишечника. Клеточная и молекулярная гастроэнтерология и гепатология ; 6: 2,133–148.
Mullish BH (2018) Инфекция Clostridium difficile и диарея, связанная с антибиотиками. Клиническая медицина ; 18: 3, 237–241.
Ojo-Okunola A et al (2018) Бактериом грудного молока человека в здоровье и болезнях. Nutrients , 10: 11, 164.
Петров В.А. и др. (2017) Анализ микробиоты кишечника у пациентов с болезнью Паркинсона. Бюллетень экспериментальной биологии и медицины ; 162: 6, 734–737.
Риш Н. и др. (2014) Семейные рецидивы расстройства аутистического спектра: оценка генетического и экологического вклада. Американский журнал психиатрии ; 171: 11, 1206–1213.
Rowland I et al (2018) Функции кишечной микробиоты: метаболизм питательных веществ и других компонентов пищи. Европейский журнал питания ; 57: 1, 1–24.
Секиров И. и др. (2010) Микробиота кишечника в здоровье и болезнях. Физиологические обзоры ; 90: 3, 859-904.
Терсби Э., судья № (2017) Введение в микробиоту кишечника человека. Биохимический журнал ; 474: 11, 1823–1836.
Toscano M et al (2017) Роль микробиоты человеческого грудного молока в иммунной системе новорожденных: мини-обзор. Frontiers in Microbiology ; 8: 2100.
Valdes AM et al (2018) Роль микробиоты кишечника в питании и здоровье. Британский медицинский журнал ; 361: K2179.
Wischmeyer PE et al (2016) Роль микробиома, пробиотиков и «терапии дисбактериоза» в критических состояниях. Current Opinion in Critical Care ; 22: 4, 347-53.
Ян X и др. (2009) Более 9 000 000 уникальных генов в кишечном бактериальном сообществе человека: оценка количества генов в организме человека. PloS ONE ; 4: 6, e6074.
Яцуненко Т. и др. (2012) Микробиом кишечника человека в разрезе возраста и географии. Nature ; 486: 7402, 222–227.
Yoshii K et al (2019) Метаболизм диетических и микробных витаминов группы B в регуляции иммунитета хозяина. Frontiers in Nutrition ; 17: 6, 48.
Циммерманн М. и др. (2019) Картирование метаболизма лекарств в микробиоме человека кишечными бактериями и их генами. Nature ; 570: 7762, 462-467.
Кишечная флора — обзор
Постнатально
Постнатально комменсальная кишечная флора, по-видимому, является сильным стимулом для созревания иммунного статуса, особенно ответа Th2.В желудочно-кишечном тракте человека насчитывается более 400 видов бактерий, которые конкурируют за рецепторы адгезии, стимулируют противомикробные препараты и лимфоидную ткань, ассоциированную с кишечником. Каллиомаки и Исолаури 30 сообщили, что использование пробиотиков (лактобациллы) для матери и ребенка было связано с 23% распространенностью экземы по сравнению с 46% в контрольной группе. Было продемонстрировано, что пробиотики способствуют выработке ИЛ-2, ИФН-гамма, TGF-бета и ингибируют выработку ИЛ-4, ИЛ-5 и ИЛ-13, а также улучшают кишечные барьеры и снижают проницаемость кишечника.
Некоторые исследования клещей домашней пыли показали, что попытки снизить воздействие до и после родов могут уменьшить последующую астму и атопию, но эти результаты противоречивы, и многие другие исследования показали, что снижение воздействия может фактически привести к повышенной сенсибилизации в более позднем возрасте. детство. Perzanowski и его коллеги 31 обнаружили, что воздействие кошачьей шерсти в раннем младенчестве может вызвать толерантность с более высокими уровнями защитного IgG4. Те, кто живет на фермах, подверженных воздействию травы, и те, кто в Африке спит на травяных матрасах, демонстрируют относительную защиту от сенсибилизации травой. 32
Посещение детских садов, большие семьи и проживание на фермах с повышенным контактом с домашними животными было связано с защитой от атопии, и утверждается, что это может быть связано со стимуляцией ответа Th2 микробами, липополисахариды или эндотоксины. 33,34 Липополисахариды могут влиять на врожденный иммунитет через TLR2, TLR4 и CD14, и могут быть генетические предрасположенности в различных полиморфизмах этих рецепторов. Этот дисбаланс активности Th2 / Th3 чрезмерно упрощает сложность функции Т-клеток, и гипотезы не объясняют одновременное повышение уровня Th2-состояний, таких как диабет.Объяснение, скорее всего, будет сложным, потому что парадигма Th2 / Th3 не так ясна с клетками Th2, способными увеличивать некоторые медиаторы Th3 и влиянием факторов, включая дозу воздействия и время.
Развитие атопического заболевания и астмы следует рассматривать в нескольких дискретных фазах: индукция, прогрессирование и обострение острых эпизодов. Во время фазы индукции основной воспалительный ответ и гиперреактивность дыхательных путей индуцируются факторами окружающей среды, влияющими на генетически предрасположенного хозяина.Будучи вызванными, факторы окружающей среды будут вызывать обострения и / или прогрессирование воспаления и реактивности дыхательных путей, что обычно приводит к клиническим симптомам. Воздействие одного и того же экологического агента на этих этапах может быть различным. Микробы и высокие уровни аллергенов могут быть защитными во время индукции, но в меньших дозах ответственны за усиленные реакции, приводящие к прогрессированию / обострениям у уже индуцированных. Последовательность контакта с микробами или аллергенами может повлиять на реакцию друг друга.
Грудное вскармливание по-разному влияет на атопию. Большинство исследований не показывают значительного снижения атопии. Wright и соавторы 35 и другие сообщили о снижении заболеваемости нижних дыхательных путей при грудном вскармливании, но последующем увеличении атопии, если мать страдает атопией.
Косвенные измерения развития дыхательных путей с помощью тестирования функции легких вскоре после рождения по-разному связаны с наличием или отсутствием астмы, тяжестью астмы или наличием преходящего свистящего дыхания. Снижение функции легких, предполагающее уменьшение размера дыхательных путей, может быть результатом изменений слизистой оболочки (эпителий, слизистые железы, подслизистая ткань), мышц, эластических свойств легких или эластичности дыхательных путей в дополнение к росту дыхательных путей.Слизистая оболочка является источником цитокинов, факторов роста, оксида азота, пептидов эпителиального происхождения и молекул адгезии, которые могут способствовать этим изменениям.
Техника быстрой грудной компрессии позволила измерить максимальный поток при функциональной остаточной емкости (FRC) в раннем младенчестве, а низкие уровни были связаны с курением матери во время беременности, заболеваниями свистящего дыхания, сохраняющейся низкой функцией легких (отслеживание) и гипер- отзывчивость в дальнейшей жизни. Большинство исследований показывают связь снижения функции легких у младенцев с преходящим хрипом у младенцев 36,37 и некоторые, 36 , но не все, с постоянным хрипом.Многие исследования также показывают, что снижение функции легких в младенчестве и раннем детстве связано с ухудшением функции легких и астмой в подростковом возрасте. 36 Устойчивая гиперреактивность бронхов в раннем возрасте также связана с аномальной функцией легких и астмой в более позднем возрасте, 38 , но измерения чувствительности дыхательных путей могут отражать различные процессы, причем повышенная реактивность в младенчестве связана со структурой дыхательных путей, а в более позднем возрасте. детство и взрослая жизнь с текущей астмой.
Хроническая неонатальная болезнь легких / бронхолегочная дисплазия выявляется все чаще по мере увеличения выживаемости детей с крайне низкой массой тела при рождении. По-видимому, это результат воздействия вентиляции под высоким давлением и высокого вдыхаемого кислорода на незрелые легкие. Сообщалось, что генетическая предрасположенность, курение матери, пренатальный прием стероидов и семейный анамнез астмы влияют на развитие и тяжесть заболевания легких. Семейный анамнез астмы, по-видимому, связан с серьезностью, а не с распространенностью. 39
Внутриутробная хориоамниотическая инфекция может причинить вред (привести к острым и хроническим неонатальным заболеваниям легких) или принести пользу (способствовать созреванию альвеол). 40,41 Его роль в развитии хронической неонатальной болезни легких и последующем росте легких неизвестна. Сообщалось, что многие цитокины и медиаторы пуповинной крови, такие как IL-6, IL-8, растворимый TNF-1, E-селектин и матриксные металлопротеиназы 42,43 , связаны с развитием хронической неонатальной болезни легких.


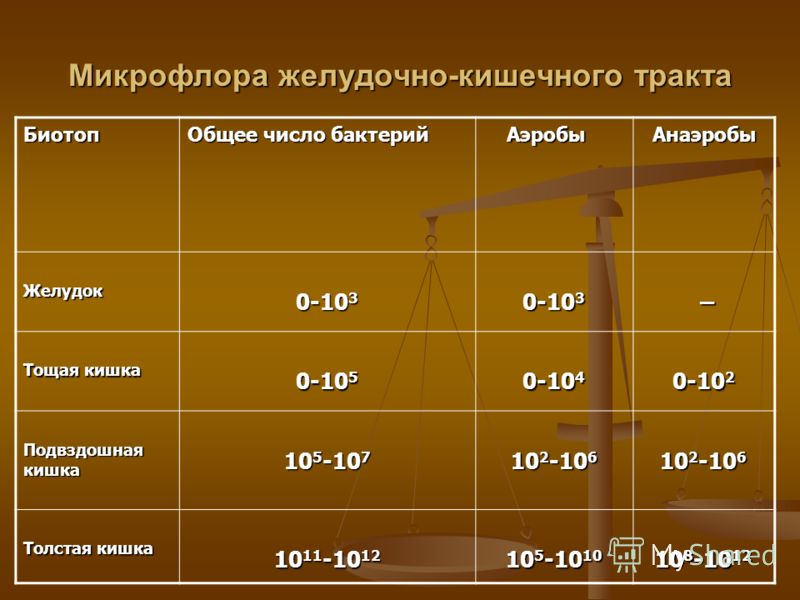 ч. и аутоиммунных.
ч. и аутоиммунных. pylori
pylori salivarius UCC118
salivarius UCC118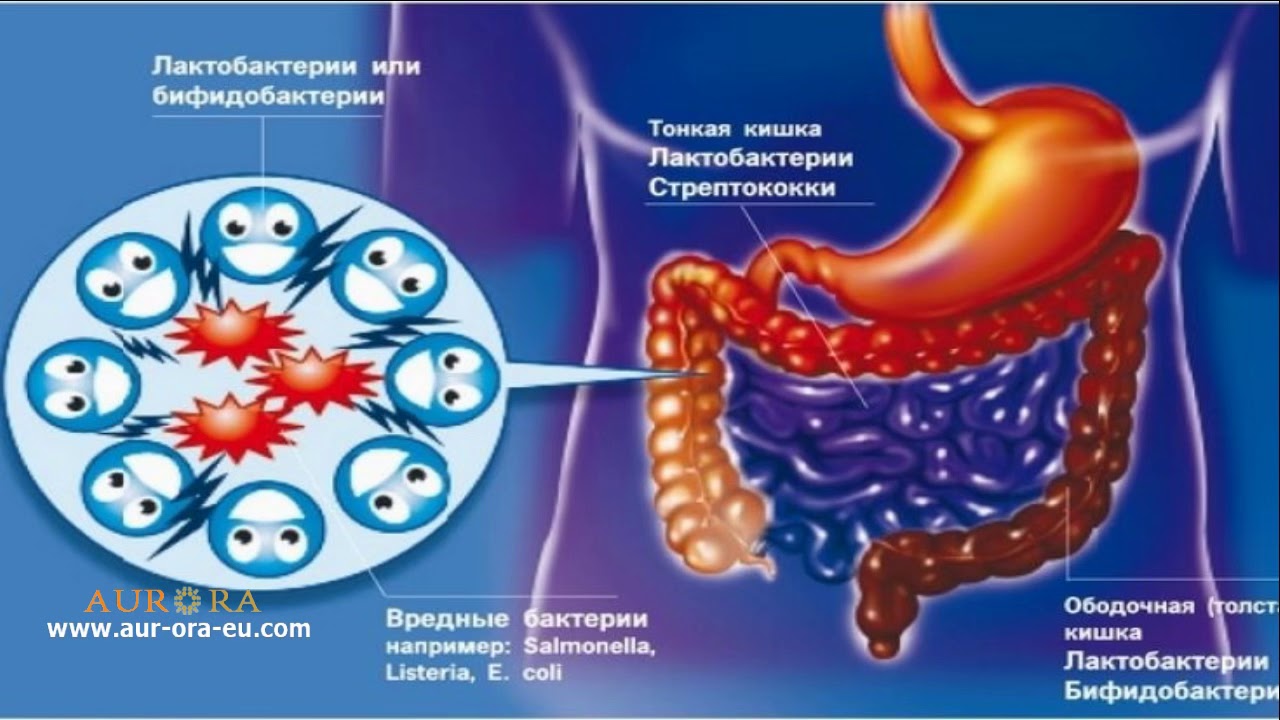 johnsonii La1 (Lj1)
johnsonii La1 (Lj1) Однако до настоящего времени во всем мире нет понятия нормы кишечного биоценоза. И нет «золотого стандарта» диагностики дисбактериоза.
Однако до настоящего времени во всем мире нет понятия нормы кишечного биоценоза. И нет «золотого стандарта» диагностики дисбактериоза.