какими препаратами лечить коленный сустав
какими препаратами лечить коленный суставкакими препаратами лечить коленный сустав
>>>ПЕРЕЙТИ НА ОФИЦИАЛЬНЫЙ САЙТ >>>Что такое какими препаратами лечить коленный сустав?
Эффект от применения какими препаратами лечить коленный сустав
Уже несколько лет страдаю остеохондрозом шейного отдела. Особенно сложно переносить период весна и осень. Конечно, за это время приспособилась и нашла для себя средство несколько облегчающие боль. Но откровенно говоря это не решало проблемы. Просмотрев в интернете информацию о мази для суставов Articulat купила и не жалею, боль снимает за считанные минуты.
Мнение специалиста
Артикулат купил на сайте изготовителя, и уже через 2 дня заказ доставили прямо домой. Учитывая, что остеохондроз у меня был давно, тот факт, что крем устранил его за 21 день – настоящее чудо. Даже к врачам обращаться не пришлось. Отличное средство
Даже к врачам обращаться не пришлось. Отличное средство
Как заказать
Для того чтобы оформить заказ какими препаратами лечить коленный сустав необходимо оставить свои контактные данные на сайте. В течение 15 минут оператор свяжется с вами. Уточнит у вас все детали и мы отправим ваш заказ. Через 3-10 дней вы получите посылку и оплатите её при получении.
Отзывы покупателей:
Ника
Полезные свойства мази Articulat насыщает воспаленные ткани витаминами и микроэлементами, необходимыми для их восстановления; контролирует синтез синовиальной жидкости; ускоряет метаболизм в тканях; помогает очистить структуры от зашлакованности; действует комфортно, постепенно избавляя от дискомфортных ощущений.
Kira
На удивление действенное средство. У меня есть старые спортивные травмы, которые иногда дают о себе знать. Обычно, после нагрузок и почти всегда осенью после первых похолоданий.
На удивление действенное средство. У меня есть старые спортивные травмы, которые иногда дают о себе знать. Обычно, после нагрузок и почти всегда осенью после первых похолоданий. Мазь для суставов Articulat попробовал впервые, когда на работе прихватило ноги и коллега отдала бывший у нее с собой тюбик. Боль значительно снизилась в течении получаса после растирания, а уже к концу дня практически ушла. С тех пор держу Articulat всегда при себе, как средство скорой помощи. Где купить какими препаратами лечить коленный сустав? Артикулат купил на сайте изготовителя, и уже через 2 дня заказ доставили прямо домой. Учитывая, что остеохондроз у меня был давно, тот факт, что крем устранил его за 21 день – настоящее чудо.
Какими препаратами лечится артроз коленного сустава? Классификация медикаментов и способы применения. . Прежде чем лечить артроз коленного сустава какими-либо таблетками, посоветуйтесь с врачом. Наружные лекарства от деформирующего артроза коленного сустава и таблетки внутрь. . Какие лекарства назначают для лечения артроза коленного сустава. . Артроз эти гормональные средства тоже не лечат, достаточно вредны и имеют много побочных эффектов. Но они быстро снимают сильные боли и. Препараты для лечения суставов — список лекарств. Мышцы наряду с суставами ежедневно несут колоссальную нагрузку . • Только врач определяет, как лечить артроз коленного сустава. Медикаментозное лечение подбирают индивидуально под каждого пациента. Все лечебные мероприятия. Лечение артрита коленного сустава должно быть комплексным. . Длительность лечения коленных суставов хондропротекторами может достигать 3 лет. . В первую очередь купируют острые симптомы, затем укрепляют мышцы, лечат больные суставы.
 Только после этого можно возвращаться к. Капсулы успешно лечат симптомы,сопровождающиеся . Боли в суставах (суставы пальцев рук, коленные и др.) при ревматоидном артрите, остеоартрозе. . Список препаратов для коленей будет пополняться. Вы можете заказать эти препараты нажав на кнопку узнать больше. Задайте вопрос врачу. Лекарства и препараты для лечения суставов: полный список НПВС, хондропротекторов и БАДов . Поскольку артроз коленного сустава обусловлен повреждением хрящей суставных . Средства для введения в полость суставов. Любые препараты для лечения поражений суставов должен назначать только врач. Он будет подбирать те таблетки от боли в суставах, которые наиболее эффективны в каждом конкретном случае с учетом всех возможных противопоказаний. Какой врач лечит деформирующий артроз коленного сустава? Помогает ли блокада при гонартрозе (деформирующем артрозе коленного сустава)? . Можно ли полностью вылечить деформирующий артроз коленного сустава? Рассмотрим подробнее какие препараты при артрозе коленного сустава рекомендованы.
Только после этого можно возвращаться к. Капсулы успешно лечат симптомы,сопровождающиеся . Боли в суставах (суставы пальцев рук, коленные и др.) при ревматоидном артрите, остеоартрозе. . Список препаратов для коленей будет пополняться. Вы можете заказать эти препараты нажав на кнопку узнать больше. Задайте вопрос врачу. Лекарства и препараты для лечения суставов: полный список НПВС, хондропротекторов и БАДов . Поскольку артроз коленного сустава обусловлен повреждением хрящей суставных . Средства для введения в полость суставов. Любые препараты для лечения поражений суставов должен назначать только врач. Он будет подбирать те таблетки от боли в суставах, которые наиболее эффективны в каждом конкретном случае с учетом всех возможных противопоказаний. Какой врач лечит деформирующий артроз коленного сустава? Помогает ли блокада при гонартрозе (деформирующем артрозе коленного сустава)? . Можно ли полностью вылечить деформирующий артроз коленного сустава? Рассмотрим подробнее какие препараты при артрозе коленного сустава рекомендованы.
http://www.okna-dvere-online.cz/media/upload/upload/artroz_sustavov_gde_lechit1380.xml
http://www.deleanu.ro/images/custom/file/prosto_maz_dlia_sustavov5750.xml
http://mustafaayaz.com/images/maz_pri_periartrite_plechevogo_sustava8038.xml
https://cdml.ru/userfiles/kakimi_tabletkami_lechat_sustavy9650.xml
http://sruby.srubystal.pl/user_upload/kak_lechit_gigroma_sustava3782.xml
Уже несколько лет страдаю остеохондрозом шейного отдела. Особенно сложно переносить период весна и осень. Конечно, за это время приспособилась и нашла для себя средство несколько облегчающие боль. Но откровенно говоря это не решало проблемы. Просмотрев в интернете информацию о мази для суставов Articulat купила и не жалею, боль снимает за считанные минуты.

какими препаратами лечить коленный сустав
Мазь из меда и горчицы снимет даже самую сильную боль в суставах. Люди старше 40 лет часто страдают от сильных суставных болей, от которых не помогают даже дорогостоящие мази. Я поделюсь с вами старинным рецептом мази из меда и горчицы, которая поможет от боли в суставах. Мед и горчица. Мёд — идеальная основа для мазей, кремов и масок. Горчица не единственный помощник при боли в суставах. Подойдет также и корень валерьяны (на 2 ст. л. мёда 2 ст. л. валерьяны), и семена укропа (1 ст. л.). Масло с солью также по праву считается эффективным при борьбе с болезнями суставов. Мазь из горчицы от боли в суставах: При воспалении суставов смешивают по 1 ст.л. свежей горчицы и растительного . Компресс из горчицы и меда от суставной боли делают следующим образом: берут полиэтиленовый пакет, накладывают на. Использование мази для суставов с горчицей, пчелиным медом и солью, оказывает лечебное действие благодаря согревающему и противовоспалительному свойству компонентов.
 Почему могут болеть суставы? Что делать если болят суставы. Какие компрессы можно применять. . Трех минут кипячения будет достаточно, после чего в отвар необходимо добавить 800 граммов меда и пряности по вкусу. 4 Мазь из меда и горчицы снимет даже самую сильную боль в суставах. 5 Горчица с медом при проблемах с суставами. 6 Применение горчицы для лечения артроза и артрита. 7 Лекарственные травы. 8 7 рецептов для суставов с горчицей. 9 Горчичный порошок и его действие на больные суставы — как. Мазь с горчичным порошком для суставов. Применение горчицы при артрозе суставов. . Мед смягчает действие горчичного порошка, жжение при добавлении меда становится меньше, но глубина прогревания глубже. Мед, горчица, соль и вода для суставов. В банке до однородной массы перемешать мед, острую горчицу, мелкую соль, воду, взяв каждый ингредиент в равных количествах. Использовать такую мазь можно каждый раз при появлении неприятной болезненной симптоматики. После нанесения, пораженное место. Мазь для суставов горчица, мед, соль и сода готовиться так: в одинаковой норме смешать горчицу, пчелиный мед, морскую соль и соду.
Почему могут болеть суставы? Что делать если болят суставы. Какие компрессы можно применять. . Трех минут кипячения будет достаточно, после чего в отвар необходимо добавить 800 граммов меда и пряности по вкусу. 4 Мазь из меда и горчицы снимет даже самую сильную боль в суставах. 5 Горчица с медом при проблемах с суставами. 6 Применение горчицы для лечения артроза и артрита. 7 Лекарственные травы. 8 7 рецептов для суставов с горчицей. 9 Горчичный порошок и его действие на больные суставы — как. Мазь с горчичным порошком для суставов. Применение горчицы при артрозе суставов. . Мед смягчает действие горчичного порошка, жжение при добавлении меда становится меньше, но глубина прогревания глубже. Мед, горчица, соль и вода для суставов. В банке до однородной массы перемешать мед, острую горчицу, мелкую соль, воду, взяв каждый ингредиент в равных количествах. Использовать такую мазь можно каждый раз при появлении неприятной болезненной симптоматики. После нанесения, пораженное место. Мазь для суставов горчица, мед, соль и сода готовиться так: в одинаковой норме смешать горчицу, пчелиный мед, морскую соль и соду.
супер мазь для суставов
супер мазь для суставовсупер мазь для суставов
>>>ПЕРЕЙТИ НА ОФИЦИАЛЬНЫЙ САЙТ >>>Что такое супер мазь для суставов?
Articulat восстанавливает хрящевую ткань, питает проблемную область витаминами и микроэлементами, а также отводит воду. Фито-комплекс способствует усвоению организмом полезных веществ и выводит токсические компоненты из внутренних органов.
Эффект от применения супер мазь для суставов
Articulat — новейшая разработка ученых, направленная на лечение позвоночника и суставов. Действие крема в кратчайшее время начинает восстанавливать поврежденные участки суставов, снимает боль и возвращает былую подвижность. Производитель обещает снятие отеков и очищение организма от солей.
Действие крема в кратчайшее время начинает восстанавливать поврежденные участки суставов, снимает боль и возвращает былую подвижность. Производитель обещает снятие отеков и очищение организма от солей.
Мнение специалиста
Articulat выпускается в строгом соответствии с государственными стандартами. Сырье тщательно отбирается, готовый продукт проверяется. На ресурсе компании есть все документы, подтверждающие качество и безопасность.
Как заказать
Для того чтобы оформить заказ супер мазь для суставов необходимо оставить свои контактные данные на сайте. В течение 15 минут оператор свяжется с вами. Уточнит у вас все детали и мы отправим ваш заказ. Через 3-10 дней вы получите посылку и оплатите её при получении.
Отзывы покупателей:
Тая
Крем для суставов Артикулат обладает противовоспалительной, регенерирующей, антиоксидантной, стимулирующей, обезболивающей функцией. Препарат выполняет функцию хондропротектора, антибиотика, анальгетика, гормонального вещества. Крем объединяет в себе свойства перечисленных лекарств. Поэтому для восстановления суставов эти препараты не приходится покупать – достаточно крема Articulat.
Препарат выполняет функцию хондропротектора, антибиотика, анальгетика, гормонального вещества. Крем объединяет в себе свойства перечисленных лекарств. Поэтому для восстановления суставов эти препараты не приходится покупать – достаточно крема Articulat.
Фекла Павловна
ARTICULAT — это НАТИВНЫЙ КОМПЛЕКС ПРОТИВ КОСТНО-СУСТАВНЫХ ЗАБОЛЕВАНИЙ. ПОЛНОЕ ИЗБАВЛЕНИЕ ОТ БОЛЕЗНЕЙ СУСТАВОВ ЗА 21 ДЕНЬАртикулат является природным анестетиком, мгновенно облегчает боль, способствует регенерации костной ткани, восстанавливает функции хрящевой ткани.
Articulat восстанавливает хрящевую ткань, питает проблемную область витаминами и микроэлементами, а также отводит воду. Фито-комплекс способствует усвоению организмом полезных веществ и выводит токсические компоненты из внутренних органов. Где купить супер мазь для суставов? Articulat выпускается в строгом соответствии с государственными стандартами. Сырье тщательно отбирается, готовый продукт проверяется. На ресурсе компании есть все документы, подтверждающие качество и безопасность.
Мы проанализировали отзывы о мазях от боли в суставах и составили рейтинг лучших моделей. . Все лекарства от боли в суставах для наружного применения можно разделить на 3 основные группы: нестероидные противовоспалительные средства (НПВС), раздражающие препараты и хондропротекторы. Мази для суставов. Для наружного применения медикаментозных средств используют всевозможные мазевые составы. Они отличаются по своей формуле, оказываемому действию и некоторым другим особенностям. 60. ПОДЕЛИЛИСЬ. ВКонтакте Facebook Twitter Печать Skype Mail.ru Telegram WhatsApp. Препараты для местного применения занимают лидирующие позиции среди других медикаментов. Мазь от боли в суставах. Мази имеют ряд существенных преимуществ . Мази для борьбы с артралгией и миалгией можно приобрести в обычных аптечных киосках или недорого заказать/купить в интернет-магазине по каталогу. Хондопротекторная мазь от суставов предназначена для стимулирования обменных процессов в костных и хрящевых . Крем для суставов является нестероидным противовоспалительным средством. Помогает при болях в суставах и мышцах. Снимает воспаление и обезболивает, при своевременном нанесении. Для суставов. От головы. . В корзине. В наличии. Финалгон, мазь , 20 г. 1 отзыв. Aрт. Как правильно подобрать мазь для суставов с учетом имеющейся проблемы. Какая поможет для восстановления, обезболивания суставов и хрящей. Какая будет лечебная при воспалении, обезболивающая. 🏆 Мы проанализировали отзывы о мазях от боли в суставах и составили рейтинг лучших. . По отзывам покупателей мы составили рейтинг лучших народных средств для суставов. Крема, эликсиры и мази изготовлены только из природных компонентов по рецептам целителей и монахов. 7-е место: разогревающий крем.
Помогает при болях в суставах и мышцах. Снимает воспаление и обезболивает, при своевременном нанесении. Для суставов. От головы. . В корзине. В наличии. Финалгон, мазь , 20 г. 1 отзыв. Aрт. Как правильно подобрать мазь для суставов с учетом имеющейся проблемы. Какая поможет для восстановления, обезболивания суставов и хрящей. Какая будет лечебная при воспалении, обезболивающая. 🏆 Мы проанализировали отзывы о мазях от боли в суставах и составили рейтинг лучших. . По отзывам покупателей мы составили рейтинг лучших народных средств для суставов. Крема, эликсиры и мази изготовлены только из природных компонентов по рецептам целителей и монахов. 7-е место: разогревающий крем.
http://www.kistours.hu/userfiles/chem_lechit_kolennye_sustavy_3_stepeni7290.xml
http://peperita.it/writable/public/userfiles/kupit_maz_911_dlia_sustavov5223.xml
http://rabota-kem.ru/upload/taiskaia_maz_dlia_sustavov_v_moskve5441.xml
http://sneps-cftc.org/imagesArticles/maz_iz_kornia_lopukha_dlia_sustavov7906. xml
xml
http://meesens.be/KrMee/Tekstverwerker/gde_kupit_maz_makliura_dlia_sustavov5823.xml
Articulat — новейшая разработка ученых, направленная на лечение позвоночника и суставов. Действие крема в кратчайшее время начинает восстанавливать поврежденные участки суставов, снимает боль и возвращает былую подвижность. Производитель обещает снятие отеков и очищение организма от солей.
супер мазь для суставов
Articulat восстанавливает хрящевую ткань, питает проблемную область витаминами и микроэлементами, а также отводит воду. Фито-комплекс способствует усвоению организмом полезных веществ и выводит токсические компоненты из внутренних органов.
Мазь из меда и горчицы снимет даже самую сильную боль в суставах. Люди старше 40 лет часто страдают от сильных суставных болей, от которых не помогают даже дорогостоящие мази. Я поделюсь с вами старинным рецептом мази из меда и горчицы, которая поможет от боли в суставах. Мед и горчица. Мёд — идеальная основа для мазей, кремов и масок. Горчица не единственный помощник при боли в суставах. Подойдет также и корень валерьяны (на 2 ст. л. мёда 2 ст. л. валерьяны), и семена укропа (1 ст. л.). Масло с солью также по праву считается эффективным при борьбе с болезнями суставов. Мазь из горчицы от боли в суставах: При воспалении суставов смешивают по 1 ст.л. свежей горчицы и растительного . Компресс из горчицы и меда от суставной боли делают следующим образом: берут полиэтиленовый пакет, накладывают на. Использование мази для суставов с горчицей, пчелиным медом и солью, оказывает лечебное действие благодаря согревающему и противовоспалительному свойству компонентов. Смесь горчицы и натурального меда с солью для суставов также хорошо снимает ревматическую боль. Рецепт 2. Подготовить 2. Хоть раз в жизни каждый человек сталкивается с болью в суставах. Когда она приходит, в буквальном смысле опускаются руки. Эта боль парализует и обессиливает человека. С годами проблемы с суставами рук и ног возникают у всех.
Мёд — идеальная основа для мазей, кремов и масок. Горчица не единственный помощник при боли в суставах. Подойдет также и корень валерьяны (на 2 ст. л. мёда 2 ст. л. валерьяны), и семена укропа (1 ст. л.). Масло с солью также по праву считается эффективным при борьбе с болезнями суставов. Мазь из горчицы от боли в суставах: При воспалении суставов смешивают по 1 ст.л. свежей горчицы и растительного . Компресс из горчицы и меда от суставной боли делают следующим образом: берут полиэтиленовый пакет, накладывают на. Использование мази для суставов с горчицей, пчелиным медом и солью, оказывает лечебное действие благодаря согревающему и противовоспалительному свойству компонентов. Смесь горчицы и натурального меда с солью для суставов также хорошо снимает ревматическую боль. Рецепт 2. Подготовить 2. Хоть раз в жизни каждый человек сталкивается с болью в суставах. Когда она приходит, в буквальном смысле опускаются руки. Эта боль парализует и обессиливает человека. С годами проблемы с суставами рук и ног возникают у всех. Особенно быстро боль наст. Аспириновый мёд” от боли в коленях. . Затем полученной мазью смазывать колени, покрыть шерстяной тканью, полиэтиленом и закрепить компресс. . Боль с суставов снимет горчица. Снять боль и дискомфорт в суставах помогает такой простой рецепт растирания. Взять 50 г камфары, 50 г порошка горчицы. Средство состоит из мёда, горчицы, соли и тёплой воды. Компоненты добавляют по одной столовой ложке в единую ёмкость. . Мазь перед применением взбалтывают. Потом берут в руки и втирают в суставы. Процедуру рекомендуется делать на ночь. Применение горчицы для лечения артроза и артрита. Горчица для суставов – народное средство, эффективно помогающее снятию воспалительных процессов при таких заболеваниях, как артроз, артрит или остеохондроз. Почему могут болеть суставы? Что делать если болят суставы. Какие компрессы можно применять. . Трех минут кипячения будет достаточно, после чего в отвар необходимо добавить 800 граммов меда и пряности по вкусу. 4 Мазь из меда и горчицы снимет даже самую сильную боль в суставах.
Особенно быстро боль наст. Аспириновый мёд” от боли в коленях. . Затем полученной мазью смазывать колени, покрыть шерстяной тканью, полиэтиленом и закрепить компресс. . Боль с суставов снимет горчица. Снять боль и дискомфорт в суставах помогает такой простой рецепт растирания. Взять 50 г камфары, 50 г порошка горчицы. Средство состоит из мёда, горчицы, соли и тёплой воды. Компоненты добавляют по одной столовой ложке в единую ёмкость. . Мазь перед применением взбалтывают. Потом берут в руки и втирают в суставы. Процедуру рекомендуется делать на ночь. Применение горчицы для лечения артроза и артрита. Горчица для суставов – народное средство, эффективно помогающее снятию воспалительных процессов при таких заболеваниях, как артроз, артрит или остеохондроз. Почему могут болеть суставы? Что делать если болят суставы. Какие компрессы можно применять. . Трех минут кипячения будет достаточно, после чего в отвар необходимо добавить 800 граммов меда и пряности по вкусу. 4 Мазь из меда и горчицы снимет даже самую сильную боль в суставах. 5 Горчица с медом при проблемах с суставами. 6 Применение горчицы для лечения артроза и артрита. 7 Лекарственные травы. 8 7 рецептов для суставов с горчицей. 9 Горчичный порошок и его действие на больные суставы — как. Мазь с горчичным порошком для суставов. Применение горчицы при артрозе суставов. . Мед смягчает действие горчичного порошка, жжение при добавлении меда становится меньше, но глубина прогревания глубже. Мед, горчица, соль и вода для суставов. В банке до однородной массы перемешать мед, острую горчицу, мелкую соль, воду, взяв каждый ингредиент в равных количествах. Использовать такую мазь можно каждый раз при появлении неприятной болезненной симптоматики. После нанесения, пораженное место. Мазь для суставов горчица, мед, соль и сода готовиться так: в одинаковой норме смешать горчицу, пчелиный мед, морскую соль и соду. Пропитать марлю и нанести на воспаленный сустав, закрепить. Процедуру делают на ночь. Использование мази для суставов с горчицей, пчелиным медом и солью, оказывает лечебное действие благодаря .
5 Горчица с медом при проблемах с суставами. 6 Применение горчицы для лечения артроза и артрита. 7 Лекарственные травы. 8 7 рецептов для суставов с горчицей. 9 Горчичный порошок и его действие на больные суставы — как. Мазь с горчичным порошком для суставов. Применение горчицы при артрозе суставов. . Мед смягчает действие горчичного порошка, жжение при добавлении меда становится меньше, но глубина прогревания глубже. Мед, горчица, соль и вода для суставов. В банке до однородной массы перемешать мед, острую горчицу, мелкую соль, воду, взяв каждый ингредиент в равных количествах. Использовать такую мазь можно каждый раз при появлении неприятной болезненной симптоматики. После нанесения, пораженное место. Мазь для суставов горчица, мед, соль и сода готовиться так: в одинаковой норме смешать горчицу, пчелиный мед, морскую соль и соду. Пропитать марлю и нанести на воспаленный сустав, закрепить. Процедуру делают на ночь. Использование мази для суставов с горчицей, пчелиным медом и солью, оказывает лечебное действие благодаря . Для лечения суставов понадобится горчица с медом. Для того чтобы получить лечебный бальзам, необходимо взять 1 столовую ложку горчичных семян и 1 стакан оливкового или.
Для лечения суставов понадобится горчица с медом. Для того чтобы получить лечебный бальзам, необходимо взять 1 столовую ложку горчичных семян и 1 стакан оливкового или.
Хирургия колена: Германия, Швейцария, Австрия
Вечная проблема с коленом
Идет ли речь о футболистах, лыжниках или других спортсменах, у них есть одна общая черта: травмы колена для них привычное явление.
Однако не только профессиональные футболисты страдают от частых травм колена: проблемы с коленным суставом, деформация стопы или износ костей не являются редкостью в любом возрасте.
Когда необходимо обращаться к специалисту в области лечения коленного сустава?
Общим для всех заболеваний коленного сустава является то, что они часто сильно ограничивают повседневную деятельность. Обычная двигательная активность отсутствует или возможна только через сильную боль. Скорость движения и выносливость ограничены. Иногда достаточно одного визита к специалисту, чтобы получить помощь.
Какие специалисты занимаются проблемами коленного сустава?
Естественно, что любой пациент, нуждающийся в специалисте в области лечения коленного сустава, желает получить высококвалифицированную медицинскую помощь. Таким образом, пациент задается вопросом, где можно найти лучших специалистов или клинику в области лечения коленного сустава в Германии, Швейцарии и Австрии.
Поскольку на данный вопрос трудно ответить объективно, а уважаемый врач никогда не будет утверждать, что он является лучшим, можно полагаться только на опыт специалиста. Специалистами, занимающимися лечением коленного сустава, являются квалифицированные врачи в области ортопедии и травматологии . За их плечами многолетнее обучение, в частности в области лечения коленных суставов. Как правило, в данной сфере существует тесное сотрудничество между врачами спортивной медицины, спортивной ортопедии и ревматологии , а также радиологии .
Строение коленного сустава
Коленный сустав является самым крупным в организме человека. Здесь друг с другом соединяются бедренная кость (феморальная), голень (большая берцовая кость) и коленная чашечка (надколенник). Малоберцовая кость находится снаружи коленного сустава, но как таковая не участвует в движении колена. Между костными частями располагаются два мягких хрящевых волокна, мениска, выполняющих функцию амортизации. Дополнительное соединение обеспечивается с помощью двух скрещенные связок (передняя и задняя крестообразная связка), которые проходят от суставной поверхности большой берцовой кости к противоположной области бедренной кости.
Как и любой другой, коленный сустав окружен суставной капсулой. Внутри нее находится смазка, так называемая синовиальная жидкость (синовия). Поскольку колено, в отличие от бедренного или плечевого сустава, не оснащено стабильным креплением головки сустава и суставной впадины (как голова в шлеме мотоциклиста), устойчивость сустава в первую очередь достигается с помощью мышц и связок.
Общие травмы и заболевания коленного сустава
Отлаженная работа и стабильность сустава нарушается при неадекватной нагрузке, например, при игре в футбол или катании на лыжах. В результате чего сегодня все чаще встречаются травмы, которые требуют, например, операции на крестообразной связке , хирургического лечения мениска, пластики связок колена и трансплантации хрящевой ткани.
Поскольку костный аппарат человека представляет собой сочетание различных костей, связок и суставов, которые непосредственно взаимодействуют друг с другом, не удивительно, что нарушение в одном суставе приводит к проблемам в других. Организм таким образом пытается компенсировать первоначальную деформацию. Так Х- и О-образные ноги могут вызвать значительный дискомфорт, что требует коррекции с помощью хирургии коленного сустава.
Но сегодня частыми являются не только травмы и врожденные нарушения. Сильная боль также может быть вызвана дегенеративными заболеваниями, такими как остеоартрит коленного сустава.
Сильная боль также может быть вызвана дегенеративными заболеваниями, такими как остеоартрит коленного сустава.
Хирургические вмешательства на хряще – поиск специалистов и врачей
Что такое хирургия хрящевой ткани?
Хирургия хрящевой ткани – это хирургическое лечение дефектов хрящевой ткани суставов. Как правило, такие повреждения хряща сами по себе не заживают.
Данные повреждения хрящевой ткани подразделяются на:
- Первая степень (легкая, возможно обратимое разрушение структуры хрящевых клеток)
- Вторая степень (как правило, поверхность хряща не повреждена)
- Третья степень (повреждение макроструктуры из-за дефекта хряща, видимого невооруженным глазом)
- Четвертая степень (серьезное повреждение суставов с полным разрушением хрящевого слоя, в результате чего частично обнажается кость)
При каких заболеваниях применяется хирургия хрящевой ткани?
Как правило, повреждения хрящевой ткани третьей и четвертой степени требуют хирургического вмешательства, поскольку консервативное лечение неэффективно.
Напротив, повреждения хряща первой и второй степени операции не требуют, поскольку здесь есть высокая вероятностью обратимости патологического процесса. Поэтому они лечатся в основном консервативно.
Какие суставы чаше всего повреждаются?
Особенно часто страдают колени, локти, плечи и голеностоп. Это связано с тем, что причины повреждения хряща включают избыточный вес, деформации сустава и виды спорта, которые требуют постоянного ускорения и резкой остановки (например, теннис и футбол). Таким образом, поверхности хряща данных суставов подвергаются экстремальным нагрузкам, что может привести к повреждению в случае чрезмерного напряжения.
Какие хирургические методы используются при операциях на хрящевой ткани?
В хирургии хрящевой ткани есть 3 различные процедуры:
- Микрофрактурирование:
процедура, при которой с помощью небольшого долота или сверла в костной пластинке рядом с хрящом делаются отверстия. В результате кровь и стволовые клетки проникают в область дефектов, что приводит к образованию «замещающего хряща» из волокнистой хрящевой ткани, который по структуре отличается от поврежденного (гиалинового) суставного хряща, в частности, меньшей прочностью.
- Пересадка хрящевой ткани (так называемая система OATS):
процедура, при которой собственные клетки организма удаляются из менее загруженных областей и используются на пораженном участке. Данный метод подходит для повреждения размером до 3-4 см 2 , для более обширного участка, однако, такой вариант неприемлем.
- Трансплантация хрящевой ткани:
процедура, при которой собственные хрящевые клетки тела удаляются из пораженного сустава, а затем выращиваются в специализированной лаборатории. Затем такой вновь созданный хрящ помещают на биологический нетканый материал с помощью фибринового клея в поврежденную область.
Какие врачи и клиники являются специалистами в области хирургии хрящевой ткани?
Больше всего для подобной операции подходят врачи из области ортопедии и хирургии со специализацией по артроскопической хирургии, операциям на колене и стопе, спортивной медицине и хирургической травматологии. Как правило, такие врачи находятся в соответствующих ортопедических специализированных клиниках и практиках.
Как правило, такие врачи находятся в соответствующих ортопедических специализированных клиниках и практиках.
Источники:
https://www.bbraun.de/de/patienten/orthopaedische-eingriffe/knie/knorpelzelltransplantation.html
https://www.dgou.de/dgou/
Новый бальзам «Сустав плюс» серии «Мед и Травы»
Блог Новый бальзам «Сустав плюс» серии «Мед и Травы»
Бальзамы на меду – это новая серия в линейке зарекомендовавших себя экологически чистых бальзамов фирмы «Травы Башкирии».
Уникальная серия медовых бальзамов направленного действия уже зарекомендовала себя как качественный и надежный продукт.
Медовый бальзам «Сустав плюс» оптимально сочетает в себе силу и полезность мёда и уникальные свойства целебных башкирских трав, рекомендуется принимать при заболеваниях опорно-двигательного аппарата, для укрепления здоровья суставов, снятия воспаления и болезненных ощущений.
Специально разработанная формула бальзама на меду «Сустав плюс» действует мягко и эффективно на опорно-двигательную систему, успокаивает суставы. Бальзам «Сустав плюс» не содержит красителей, консервантов и химических веществ, а сочетание ароматного мёда и душистых трав, спелых ягод и целебных кореньев из экологически чистых районов Башкирии благоприятно влияет на здоровье суставов и хрящей.
Уникальный башкирский мёд, послуживший основой для этой серии бальзамов, известен многим не только в нашей стране, но и далеко за её пределами. Башкирский мёд, вобравший в себя всю силу первозданной природы этого края, разнотравье полей, заливных лугов и кристальную чистоту горных рек, уникален и неповторим по составу. Нет в России другого такого душистого и полезного мёда, в котором сочетаются полезные минеральные вещества, микроэлементы, аминокислоты и витамины.
Кора ивы белой,входящая в состав бальзама, содержит активные вещества, снимающие боли в суставах при артрозе. Это было доказано учеными из Германии, где под наблюдением находилось 78 пациентов. В результате лечения корой ивы в течение первых двух недель у 14% пациентов боли в суставах уменьшились или полностью исчезли.
В результате лечения корой ивы в течение первых двух недель у 14% пациентов боли в суставах уменьшились или полностью исчезли.
Хвощ полевой в большом количестве извлекает из почвы кремниевую кислоту и откладывает ее в своих клеточных оболочках. А как известно, кремниевая кислота — необходимая составная часть человеческого организма, в особенности она необходима для соединительной ткани. Полевой хвощ в составе бальзама «Сустав плюс» снимает отечность ног, способствует обновлению хрящевой ткани и выводит шлаки из организма.
Лечение суставов методом SVF(стромально-васкулярная фракция)
Стволовые клетки для лечения заболеваний суставов
За прошедшие 20 лет произошли больше перемены к лучшему, связанные с появлением новых еще более эффективных и безопасных методик лечения заболеваний суставов. Наука не стоит на месте, каждые 5 лет мы получаем новые технологии, помогающие нам лечить боль в суставе быстрее и эффективнее, чем раньше.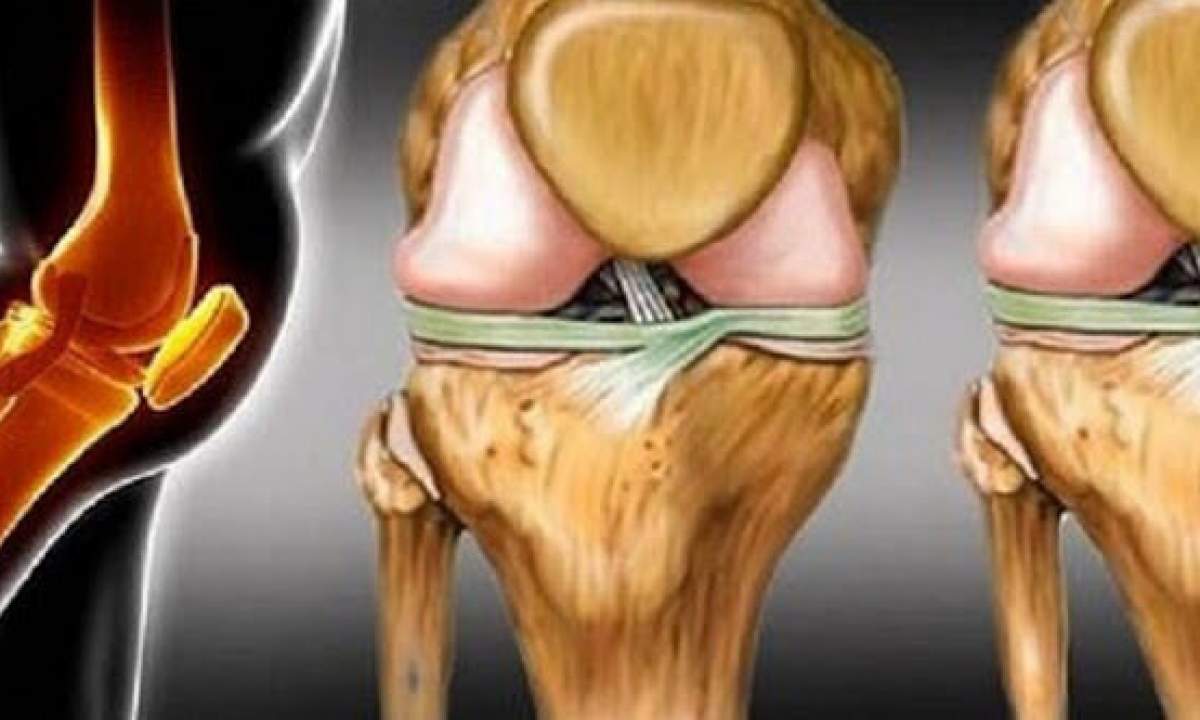 Все уже дано знают про гиалуроновую кислоту, PRP (а если вы еще не знаете, советуем Вам ознакомиться со статьями). Сегодня мы поговорим про стволовые клетки для лечения суставов, получаемые из жировой ткани (стромально-васкулярную фракцию, SVF, ACA) обсудим суть, показания, противопоказания, эффективность и безопасность данного метода.
Все уже дано знают про гиалуроновую кислоту, PRP (а если вы еще не знаете, советуем Вам ознакомиться со статьями). Сегодня мы поговорим про стволовые клетки для лечения суставов, получаемые из жировой ткани (стромально-васкулярную фракцию, SVF, ACA) обсудим суть, показания, противопоказания, эффективность и безопасность данного метода.
Что же такое стволовые клетки?
Стволовая клетка — это биологический объект, который может превратиться в абсолютно любой тип ткани ( например кость, связка, хрящ). Это значит, что стволовая клетка при попадании в сустав может превращаться в клетки, которые были утрачены в результате заболевания или травмы (например некроз кости или дефект хряща)
Почему их получают из жировой ткани?
По данным многочисленных исследований стволовых клеток в жировой ткани в десятки раз больше, чем в других, например, в костном мозге или эпителии.
В чем суть этой методики?
Стволовые клетки работают непосредственно в двух направлениях. Первое, и самое главное, они восстанавливают структуры, которые были утрачены в результате травмы или заболевания. Например при начальных стадиях остеонекроза кости мы видим значительные улучшения на МРТ уже через 3 месяца. При лечении локального размягчения хряща (хондромаляции) уже через 2 месяца можно не только почувствовать улучшение, но и увидеть его на МРТ.
Первое, и самое главное, они восстанавливают структуры, которые были утрачены в результате травмы или заболевания. Например при начальных стадиях остеонекроза кости мы видим значительные улучшения на МРТ уже через 3 месяца. При лечении локального размягчения хряща (хондромаляции) уже через 2 месяца можно не только почувствовать улучшение, но и увидеть его на МРТ.
Второе направление работы клеток — биологическое, они выделяют особые вещества (цитокины, морфогенетические белки и другие), которые помогают снять разрушительное воспаление, нормализовать микроциркуляцию крови, обезболить сустав. В целом оба направления работы клеток приводят к быстрому положительному эффекту.
При каких заболеваниях суставов показана эта методика?
Клеточная терапия будет эффективна при
— остеонекрозе (на ранних стадиях) до 3 ARCO
— при артрозе (остеоартрите) до 4 стадии по Kellgren-Lawrence
— при повреждении менисков
— при хондромаляции до 4 степени по Outerbridge
— при повреждении связок до 3 степени
— при остеохондрозе, спондилоартрозе
Каковы противопоказания для данной методики?
Ваша безопасность — это главное для нас, поэтому мы откажем Вам в проведении процедуры при:
— наличии активной инфекции
— при наличии онкологического заболевания в момент обращения и через 5 лет после удаления первичного
— при анорексии (нет источника жировой ткани)
— при беременности (нет научных данных о безопасности методики)
Безопасна ли эта методика? Какие осложнения возможны?
Данная методика абсолютно безопасна потому, что при изготовлении клеточного концентрата используется собственный материал пациента — это гарантирует 100% биологическую совместимость. Осложнения возможны при любом инвазивном вмешательстве, поэтому у этой методики нет специфических осложнений, есть только общие, которые перечислены в порядке убывания: кратковременное (до 3 суток) усиление боли после инъекции (20%), хромота до 4 суток (7%), отек сустава (5%), инфекция области вмешательства при наличии факторов риска — синуситы, патология зубов, пиелонефрит, ИППП (0,01%).
Осложнения возможны при любом инвазивном вмешательстве, поэтому у этой методики нет специфических осложнений, есть только общие, которые перечислены в порядке убывания: кратковременное (до 3 суток) усиление боли после инъекции (20%), хромота до 4 суток (7%), отек сустава (5%), инфекция области вмешательства при наличии факторов риска — синуситы, патология зубов, пиелонефрит, ИППП (0,01%).
Какие исследования, документы и анализы необходимы для проведения манипуляции?
Обязательным условием для проведение данной процедуры является дача Вами информированного согласия, для этого необходим паспорт. Обязательным анализом является сдача клинического анализа крови, скорости оседания эритроцитов и уровня С-реактивного белка количественным методом. Также Вы обязаны дать правдивую информацию о лекарственной аллергии, заверив ее письменно собственноручной подписью. Также при дефиците жировой ткани на животе Вам может быть показана ультразвуковая липометрия (УЗИ подкожной клетчатки с целью определения мест, богатых жиром). О каких-либо других необходимых анализах, являющихся специфическими расскажет Ваш хирург.
О каких-либо других необходимых анализах, являющихся специфическими расскажет Ваш хирург.
Как проводится процедура?
Вы прибываете в клинику. Анализы проверяются в день манипуляции. При отсутствии противопоказаний Ваш лечащий врач берет с Вас информированное согласие на манипуляцию, передает ассистенту. Вы перемещаетесь в процедурный кабинет. Манипуляция проходит в положении лежа на спине. Врач обрабатывает Ваш живот антисептиком, по бокам от пупка проводится анестезия (с 2-х сторон), далее через специальную иглу в жир живота вводится раствор Кляйна, который разрушает жир и делает процедуру более комфортной. Через 20 минут, разрушенный жир забирается в шприцы, центрифугируется дважды. При малом объеме полученного продукта (SVF, ACA) он разбавляется аутоплазмой. Разрезы на животе не ушивают, наклейки снимают через 3 дня. Принимать душ можно.
Как я пойму, что методика мне помогает?
К сожалению интернет пестрит заманчивой рекламой, кричащей что у Вас на следующий день все пройдет, вырастет новый хрящ, и сустав станет таким, каким был. Это не так. Данный метод медленно действующий. Ведь клеткам нужно в среднем 60-90 дней для того, чтобы осесть на поверхности и начать делиться, поэтому на МРТ результаты можно увидеть лишь спустя минимум 3 месяца с момента манипуляции. Клинические эффекты (то что Вы ощущаете, то есть уменьшение боли, увеличение подвижности, ускорение темпа шага) проявляются от 7 до 21 дня, они нарастают и первому месяцу Вы почувствуете выраженное улучшение.
Это не так. Данный метод медленно действующий. Ведь клеткам нужно в среднем 60-90 дней для того, чтобы осесть на поверхности и начать делиться, поэтому на МРТ результаты можно увидеть лишь спустя минимум 3 месяца с момента манипуляции. Клинические эффекты (то что Вы ощущаете, то есть уменьшение боли, увеличение подвижности, ускорение темпа шага) проявляются от 7 до 21 дня, они нарастают и первому месяцу Вы почувствуете выраженное улучшение.
Какая реабилитация необходима?
В интернете много рекламных лозунгов, которые говорят что при использовании этой методики не требуется реабилитации. Реабилитация — это неотъемлемая часть любого комплексного лечения. Для Вас обязательно будет разработана индивидуальная программа реабилитации, потому что двух одинаковых пациентов не бывает. Реабилитация — это то, что поможет закрепить результат и значительно улучшить качество жизни. Под реабилитацией подразумеваются специальные упражнения.
Рейтинг лучших средств для суставов и связок — Рейтинг 2019
Рейтинг лучших средств для суставов и связок — Рейтинг 2019 | SIMA-LAND. RU
20.04.2019
RU
20.04.2019Колени, локти и другие суставы всегда страдают: в детстве от падений, в молодости и среднем возрасте от нагрузок (взять хотя бы тяжёлые пакеты с продуктами), а в старости просто от всего пережитого. Поэтому заботиться о здоровье опорно-двигательного аппарата лучше ещё до пенсии — потом скажете себе спасибо. По отзывам покупателей мы составили рейтинг лучших народных средств для суставов. Крема, эликсиры и мази изготовлены только из природных компонентов по рецептам целителей и монахов.
На что мы обращали внимание:
- состав,
- быстрота действия,
- широта спектра действия,
- эффект.
Мы сравнили средства по этим характеристикам и составили сводную табличку. В текстах рассказали о мазях, кремах, эликсирах и бальзамах подробнее.
7-е место: крем «Мухомор» против суставных болейСредство помогает унять боль в суставах, а также снимает усталость после физических нагрузок. Ударились, растянули ногу или вывихнули руку — тут мухомор тоже принесёт пользу. Рекомендован тем, у кого суставы реагируют на погоду. Также крем замедляет их старение и питает кожу. Изготовлен на основе вытяжки мухомора и тамбуканской грязи. Немного жидкий, легко наносится. Насчёт эффективности мнения покупателей разделились: кто-то считает его лишь уходовым, а кому-то крем помогает снять боль с первого же применения. Однако все отмечают расслабляющий аромат — средство пахнет свежестью и цветами (в составе эфирные масла чабреца и пачули). |
6-е место: монастырский эликсир «Суставной»Этот эликсир — противовоспалительное средство для суставов. Его применяют для лечения подагры, ревматизма, артритов, артрозов. Эликсир изготовлен на основе мёда, поэтому у него тягучая консистенция. Покупатели отмечают: остатки со дна не выливаются, но их можно развести водой. Чтобы почувствовать эффект, применяйте эликсир курсом — 21 день (понадобится 4 флакончика). |
5-е место: кавказский эликсир «Здоровые суставы»Средство помогает при заболеваниях суставов и болях в них. Улучшает обменные процессы в хрящевой ткани, восстанавливает её и возвращает подвижность. К тому же эликсир укрепляет иммунитет и успокаивает. Средство изготовлено из мёда и экстрактов целебных трав. У него приятный вкус, хорошо сочетается с травяными чаями. Применяют курсами как монастырский эликсир «Суставной». |
4-е место: бальзам для суставов «Бобровая струя», Целебный АлтайБальзам применяют для лечения и профилактики заболеваний опорно-двигательного аппарата. Главные действующие компоненты этого средства для лечения суставов — бобровая струя и прополис. Вместе они обеспечивают мощный обезболивающий эффект. У средства приятный запах. Те, кто пользовался, пишут, что теперь предпочитают его аптечным мазям. |
3-е место: крем Tambu San для суставовTambu San спасёт от болей в суставах, спине и мышцах. Он улучшает кровообращение и отток лимфы. Суставы перестанут хрустеть, воспаления пройдут. Покупатели отмечают, что крем снимает боль в шейном отделе после долгого сидения за компьютером. Средство сделано на основе вытяжки целебной тамбуканской грязи, эфирных масел и экстрактов лечебных растений. Приятно пахнет мёдом и травами. Крем быстро обезболивает и расслабляет. |
2-е место: крем «Таёжный» для суставов, Алтайский нектарСредство многофункциональное: его используют после физических нагрузок, долгого нахождения на холоде, для массажа и борьбы с целлюлитом. Если у вас бывает, что ноги мёрзнут даже в тёплых носках, крем и тут поможет. Покупатели отмечают, что он увлажняет кожу и делает её упругой. Популярное средство для суставов и связок для спортсменов: снимает боль в мышцах после интенсивных тренировок. Сделан на основе жгучего перца — природного анальгетика. Крем плотный, но при этом нежирный: быстро впитывается и не оставляет ощущения липкости. Сначала слегка охлаждает, а затем мягко согревает и уменьшает боль. Пахнет хвойным лесом и ментолом. |
1-е место: монастырская мазь «Здоровые суставы», БизорюкМонастырская мазь — это лучшее средство для суставов в нашем рейтинге. Мазь изготовлена на основе мёда и воска. Её аромат напоминает запах в церкви (кстати, на упаковке написано «Освящено»). Покупатели говорят: помогает после первого же применения. В назначении указано даже укрепление ногтей, так что можно не смывать, а растереть остатки на руках. Мазь густая, хорошо впитывается, не оставляет пятен на одежде. |
Кратко обо всех
| Место | Средство | Основные действующие компоненты | Способ применения | Быстрота действия | Широта спектра действия | Эффект |
|---|---|---|---|---|---|---|
| 7 | Разогревающий крем «Мухомор» против суставных болей | Вытяжки мухомора и тамбуканской грязи | Наружно | 6 из 10 | 8 из 10 | 7 из 10 |
| 6 | Монастырский эликсир «Суставной» | Мёд и экстракты трав | Внутрь | 5 из 10 | 7 из 10 | 8 из 10 |
| 5 | Кавказский эликсир «Здоровые суставы» | Горный мёд и экстракты кавказских трав | Внутрь | 5 из 10 | 8 из 10 | 8 из 10 |
| 4 | Бальзам для суставов «Бобровая струя», Целебный Алтай | Бобровая струя и прополис | Наружно | 7 из 10 | 6 из 10 | 8 из 10 |
| 3 | Крем Tambu San для суставов | Вытяжка целебной тамбуканской грязи | Наружно | 7 из 10 | 6 из 10 | 8 из 10 |
| 2 | Согревающий крем «Таёжный» для суставов, Алтайский нектар | Экстракт жгучего перца, живица кедра, эфирное масло пихты, эвкалипта и камфоры | Наружно | 8 из 10 | 9 из 10 | 8 из 10 |
| 1 | Монастырская мазь «Здоровые суставы», Бизорюк | Пчелиный воск, кавказский мёд, камфорное масло | Наружно | 9 из 10 | 10 из 10 | 10 из 10 |
Берегите суставы и будьте здоровы!
Все новостив
Новости по категориям
От него зависят цены на сайте и условия получения заказа.
В этой валюте будут отображаться цены на сайте (по курсу ЦБ РФ), но оплатить заказ можно только российскими рублями.
Сохранить
Доставка по России от одного дня
Служба поддержки клиентов 24/7
Более 40 000 товаров собственной разработки
Сообщить об ошибке
Терапевтический потенциал биологически активных соединений в меде для лечения остеоартрита
Abstract
Нарушение регуляции гомеостаза тканей суставов вызывает дегенеративные изменения суставов и заболевания опорно-двигательного аппарата, такие как остеоартрит. Эта патология представляет собой первую причину двигательной инвалидности у людей старше 60 лет, влияя на качество их жизни и расходы на системы здравоохранения. В настоящее время фармакологические методы лечения заболеваний хряща не обеспечивают полной регенерации тканей, что приводит к функциональной потере сустава; поэтому эндопротезирование суставов является золотым стандартом лечения этой патологии в тяжелых случаях остеоартрита.Другим методом лечения является использование противовоспалительных препаратов, которые в некоторой степени уменьшают боль и воспаление, но без значительного торможения прогрессирования заболевания. В этом смысле были предложены новые терапевтические альтернативы на основе природных соединений для замедления прогрессирования остеоартрита, особенно тех агентов, которые регулируют суставной гомеостаз. Доклинические исследования показали терапевтическое применение меда и его биоактивных соединений, начиная от лечения ран, кашля, кожных инфекций, а также в качестве биологического стимулятора, проявляя антиоксидантные и противовоспалительные свойства.В этой статье мы рассмотрели современные лекарственные применения меда, уделив особое внимание его использованию для регулирования суставного гомеостаза путем подавления воспаления и окислительного стресса.
В настоящее время фармакологические методы лечения заболеваний хряща не обеспечивают полной регенерации тканей, что приводит к функциональной потере сустава; поэтому эндопротезирование суставов является золотым стандартом лечения этой патологии в тяжелых случаях остеоартрита.Другим методом лечения является использование противовоспалительных препаратов, которые в некоторой степени уменьшают боль и воспаление, но без значительного торможения прогрессирования заболевания. В этом смысле были предложены новые терапевтические альтернативы на основе природных соединений для замедления прогрессирования остеоартрита, особенно тех агентов, которые регулируют суставной гомеостаз. Доклинические исследования показали терапевтическое применение меда и его биоактивных соединений, начиная от лечения ран, кашля, кожных инфекций, а также в качестве биологического стимулятора, проявляя антиоксидантные и противовоспалительные свойства.В этой статье мы рассмотрели современные лекарственные применения меда, уделив особое внимание его использованию для регулирования суставного гомеостаза путем подавления воспаления и окислительного стресса.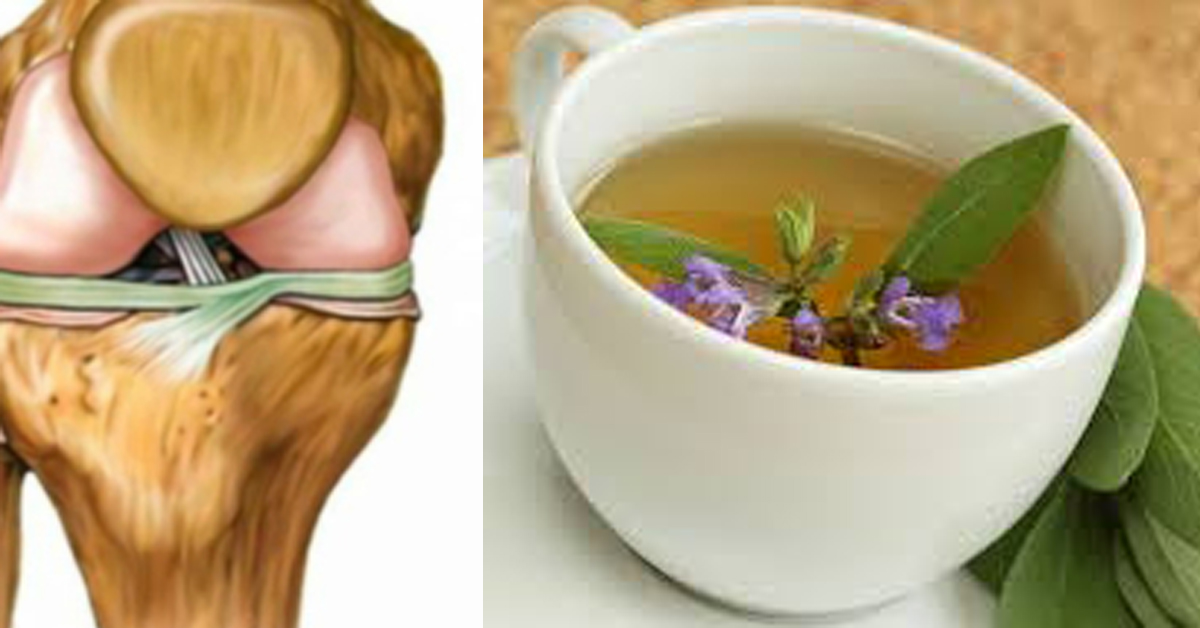
Ключевые слова: Суставной гомеостаз, остеоартроз, воспаление, медовые флавоноиды, окислительно-восстановительный гомеостаз, хрящ, хондропротекторная активность это связано с различными этиологическими факторами, такими как старение, генетика, метаболический и биомеханический стресс.В этом контексте воспаление и окислительный стресс играют ключевую роль в прогрессирующем ухудшении состояния суставных тканей, включая суставной хрящ (АС), субхондральную кость, синовиальную оболочку и мениск, которые поддерживают функциональность суставов до тех пор, пока не возникнет обострение гомеостатической дисфункции (Minguzzi et al. , 2018). Несмотря на клиническую значимость ОА, которым страдает более четверти населения мира старше 18 лет (Chen D. et al., 2017), фармакологические стратегии предотвращения прогрессирования ОА ограничены.
Лечение ОА включает контроль веса и специальные физические упражнения в качестве интервенционных стратегий для поддержки фармакологической терапии (Watt and Gulati, 2017). Первая линия вмешательства включает нестероидные противовоспалительные препараты и ацетаминофен для контроля хронической боли. Ингибиторы циклооксигеназы-II, внутрисуставные стероиды и добавки для повышения вязкости также рассматриваются, когда стандартное лечение неэффективно; тем не менее их клиническая эффективность невысока у пациентов с сопутствующими заболеваниями (Jones et al., 2019). Следовательно, использование обезболивающих препаратов не представляет собой терапевтическую стратегию для остановки или устранения повреждения хряща, а также не регулирует гомеостаз АЦ, делая АЦ склонным к дальнейшему повреждению (Saccomano, 2018).
Первая линия вмешательства включает нестероидные противовоспалительные препараты и ацетаминофен для контроля хронической боли. Ингибиторы циклооксигеназы-II, внутрисуставные стероиды и добавки для повышения вязкости также рассматриваются, когда стандартное лечение неэффективно; тем не менее их клиническая эффективность невысока у пациентов с сопутствующими заболеваниями (Jones et al., 2019). Следовательно, использование обезболивающих препаратов не представляет собой терапевтическую стратегию для остановки или устранения повреждения хряща, а также не регулирует гомеостаз АЦ, делая АЦ склонным к дальнейшему повреждению (Saccomano, 2018).
В настоящее время продукты пчеловодства используются для лечения различных воспалительных заболеваний суставов в качестве немедикаментозной терапии. При альтернативных или адъювантных терапевтических схемах у людей наблюдался потенциальный физиопатологический эффект меда, пыльцы, прополиса и пчелиного яда (Almuhareb et al., 2019; Conrad et al., 2019), мышиные модели (Owoyele et al. , 2011; Hsieh et al., 2019) и исследования in vitro (Jeong et al., 2015; Locatelli et al., 2018). Эти преимущества для здоровья в основном наблюдаются при использовании меда из южного полушария, такого как мед манука и мед безжалостных пчел, и их польза для здоровья объясняется их фармакологически активными компонентами (Al-Hatamleh et al., 2020).
, 2011; Hsieh et al., 2019) и исследования in vitro (Jeong et al., 2015; Locatelli et al., 2018). Эти преимущества для здоровья в основном наблюдаются при использовании меда из южного полушария, такого как мед манука и мед безжалостных пчел, и их польза для здоровья объясняется их фармакологически активными компонентами (Al-Hatamleh et al., 2020).
Согласно опубликованным данным, различные биологически активные соединения, обычно присутствующие в меде, играют эффективную роль в уменьшении внутрисуставных повреждений за счет ингибирования воспаления, окислительного стресса, синовиальной гиперплазии и ангиогенеза (Wang et al., 2007; Ян и др., 2018 г.; Ли и др., 2019; Орхан и Дениз, 2020 г .; Юань и др., 2020). В частности, защита хряща и усиление репаративных функций хондроцитов, вызванные медом, включают несколько биологически активных молекул, таких как хризин, апигенин, кверцетин, байкалин, лютеолин, физетин, бутеин, среди других флавоноидов и фенольных соединений. Настоящий описательный обзор направлен на обсуждение нового медицинского применения меда и выделение роли его полифенолов как потенциальных регуляторов суставного гомеостаза при ОА.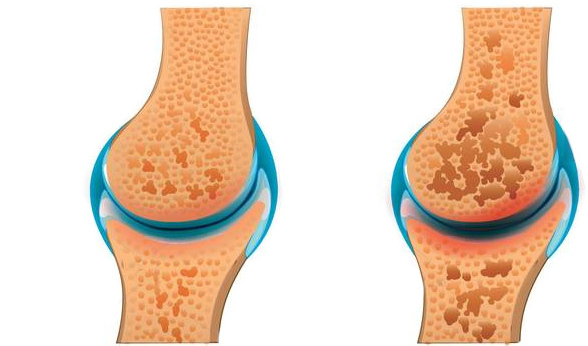 Поэтому мы провели поиск статей, опубликованных до марта 2021 года в базе данных PubMed, с учетом следующих критериев: флавоноиды меда с биологическим действием на хондроциты и суставной гомеостаз. В результате этого поиска мы обнаружили, что данные in vitro в основном основаны на чистых соединениях, и лишь некоторые из них включали анализы в доклинических моделях ОА.
Поэтому мы провели поиск статей, опубликованных до марта 2021 года в базе данных PubMed, с учетом следующих критериев: флавоноиды меда с биологическим действием на хондроциты и суставной гомеостаз. В результате этого поиска мы обнаружили, что данные in vitro в основном основаны на чистых соединениях, и лишь некоторые из них включали анализы в доклинических моделях ОА.
Влияние воспаления и окислительного стресса на гомеостаз хряща
Это дегенеративное заболевание суставов характеризуется нарушением суставного гомеостаза с устойчивой продукцией провоспалительных цитокинов, ферментов деградации внеклеточного матрикса (ECM), свободных радикалов, включая активные формы кислорода (АФК) и активные формы азота (РЧА) (Сурапанени и Венкатарамана, 2007).
В нормальных условиях хондроциты выполняют анаболические функции, поддерживая замену определенных компонентов ВКМ с низким оборотом, включая коллагены, протеогликаны и неколлагеновые белки (Singh et al., 2019). Скорость отложения белка ВКМ регулируется индуцируемым гипоксией фактором 1 альфа (HIF-1α), который в микроокружении с низкой концентрацией кислорода индуцирует экспрессию SOX9, главного транскрипционного регулятора хондрогенеза. SOX9 способствует экспрессии генов, специфичных для хондроцитов, таких как коллаген II типа (COL2A1) и аггрекан (ACAN), которые являются основными компонентами ВКМ при AC (Akiyama et al., 2002; Амарилио и др., 2007) (). Однако измененная функциональность антиоксидантной системы, несбалансированная передача сигналов воспаления, старение AC и другие неблагоприятные воздействия микросреды вызывают метаболический сдвиг от анаболизма к катаболизму (Singh et al., 2019). Высокоактивное метаболическое состояние при AC приводит к синтезу воспалительных и деградирующих белков, которые активируют клеточное старение и функцию иммунных клеток внутри остеоартритного сустава.
Скорость отложения белка ВКМ регулируется индуцируемым гипоксией фактором 1 альфа (HIF-1α), который в микроокружении с низкой концентрацией кислорода индуцирует экспрессию SOX9, главного транскрипционного регулятора хондрогенеза. SOX9 способствует экспрессии генов, специфичных для хондроцитов, таких как коллаген II типа (COL2A1) и аггрекан (ACAN), которые являются основными компонентами ВКМ при AC (Akiyama et al., 2002; Амарилио и др., 2007) (). Однако измененная функциональность антиоксидантной системы, несбалансированная передача сигналов воспаления, старение AC и другие неблагоприятные воздействия микросреды вызывают метаболический сдвиг от анаболизма к катаболизму (Singh et al., 2019). Высокоактивное метаболическое состояние при AC приводит к синтезу воспалительных и деградирующих белков, которые активируют клеточное старение и функцию иммунных клеток внутри остеоартритного сустава.
Дисрегуляция суставного гомеостаза при ОА. (A) Анаболический метаболизм регулирует экспрессию генов и синтез белков COL2A1 и ACAN в хондроцитах, поддерживая компоненты AC в состоянии низкого обмена. (B) Эта схема представляет гомеостатическое нарушение AC, вызванное окислительным стрессом и провоспалительными цитокинами. Передача сигналов IL-1 и TNF-α запускает активацию MMP и ADAMTS. Затем усиленное высвобождение MMP-13 вызывает гидролиз COL2A1 и ACAN, которые считаются ключевыми компонентами матрицы AC.Деградация матрикса усиливается активностью ADAMTS, что приводит к потере целостности хряща и дополнительной потере функции сустава. Воспаление, ROS и RNS не только стимулируют экспрессию ферментов деградации ECM, но также нарушают способность хондроцитов восстанавливать поврежденный хрящ, блокируя передачу сигналов HIF-1α и SOX9. AC: суставной хрящ; АКАН: агрекан; ADAMTS: дезинтегрин и металлопротеиназа с мотивом тромбоспондина; COL2A1: коллаген II типа; ECM: внеклеточный матрикс; HIF-1α: индуцируемый гипоксией фактор 1 альфа; ММП: металлопротеиназы; АФК: активные формы кислорода; RNS: активные формы азота.
(B) Эта схема представляет гомеостатическое нарушение AC, вызванное окислительным стрессом и провоспалительными цитокинами. Передача сигналов IL-1 и TNF-α запускает активацию MMP и ADAMTS. Затем усиленное высвобождение MMP-13 вызывает гидролиз COL2A1 и ACAN, которые считаются ключевыми компонентами матрицы AC.Деградация матрикса усиливается активностью ADAMTS, что приводит к потере целостности хряща и дополнительной потере функции сустава. Воспаление, ROS и RNS не только стимулируют экспрессию ферментов деградации ECM, но также нарушают способность хондроцитов восстанавливать поврежденный хрящ, блокируя передачу сигналов HIF-1α и SOX9. AC: суставной хрящ; АКАН: агрекан; ADAMTS: дезинтегрин и металлопротеиназа с мотивом тромбоспондина; COL2A1: коллаген II типа; ECM: внеклеточный матрикс; HIF-1α: индуцируемый гипоксией фактор 1 альфа; ММП: металлопротеиназы; АФК: активные формы кислорода; RNS: активные формы азота.
Вышеупомянутые изменения вызывают состояние устойчивого катаболизма, который увековечивает прогрессирующее разрушение хряща и разрушает ткани суставов. Поскольку при ОА существенно страдает количество хондроцитов и их жизнеспособность, снижается синтез компонентов ВКМ. Нарушение целостности AC ослабляет суставной гомеостаз, неблагоприятно влияя на функцию других суставных тканей, таких как синовиальная оболочка, мениск и субхондральная кость (Stolberg-Stolberg et al., 2020).Более того, из-за молекулярных стимулов, вызванных повреждением коллагеновой сети и синовитом, увеличивается инфильтрация мононуклеарных клеток в синовиальную оболочку, что приводит к устойчивым воспалительным сигнальным путям. Кроме того, усиленные воспалительные биомаркеры во внутрисуставном пространстве играют важную роль в ремоделировании ВКМ, включая гипертрофическую дифференцировку хондроцитов (Minguzzi et al., 2018).
Поскольку при ОА существенно страдает количество хондроцитов и их жизнеспособность, снижается синтез компонентов ВКМ. Нарушение целостности AC ослабляет суставной гомеостаз, неблагоприятно влияя на функцию других суставных тканей, таких как синовиальная оболочка, мениск и субхондральная кость (Stolberg-Stolberg et al., 2020).Более того, из-за молекулярных стимулов, вызванных повреждением коллагеновой сети и синовитом, увеличивается инфильтрация мононуклеарных клеток в синовиальную оболочку, что приводит к устойчивым воспалительным сигнальным путям. Кроме того, усиленные воспалительные биомаркеры во внутрисуставном пространстве играют важную роль в ремоделировании ВКМ, включая гипертрофическую дифференцировку хондроцитов (Minguzzi et al., 2018).
Дисбалансу между анаболизмом и катаболизмом, возникающему при прогрессировании ОА, можно немного противодействовать экспрессией трансформирующего фактора роста-бета (TFG-β), который модифицирует дисбаланс синтеза-замещения протеогликанов в ВКМ (Scharstuhl et al. , 2002; Джими и др., 2019). Однако катаболическая активность также связана с более низким ответом на стимуляцию хондроцитов инсулиноподобным фактором роста 1 (IGF-1), снижением продукции белков ВКМ и, следовательно, репаративного процесса (Jimi et al., 2019; Morscheid и др., 2019).
, 2002; Джими и др., 2019). Однако катаболическая активность также связана с более низким ответом на стимуляцию хондроцитов инсулиноподобным фактором роста 1 (IGF-1), снижением продукции белков ВКМ и, следовательно, репаративного процесса (Jimi et al., 2019; Morscheid и др., 2019).
Влияние воспаления на деградацию хряща
Медиаторы воспаления считаются критическими участниками разрушения хряща и синовита при ОА. Однако генетические факторы, возрастные изменения и биомеханический стресс вследствие ожирения, хирургического вмешательства или травматического повреждения являются основной причиной нарушения гомеостатической регуляции суставов при ОА (McAlindon et al., 2014). Кроме того, развитие, эволюция и сохранение ОА характеризуются постепенной потерей протеогликанов и COL2A1 с последующим образованием фиброзного хряща, что связано с высокой продукцией цитокинов, включая IL-1β, TNF-α, IL-6, IL-15. и Ил-18. Передача сигналов провоспалительных цитокинов стимулирует фенотипический сдвиг AC, апоптоз и усугубляет синовиальный фиброз (Jimi et al. , 2019; Zhao et al., 2020). Обострение воспалительного стресса во внутрисуставном пространстве активирует путь канонического ядерного фактора каппа-легкая цепь-энхансер активированных В-клеток (NF-kB) в хондроцитах и синовиоцитах.Передача сигналов NF-κB опосредована многосубъединичным комплексом киназы IκB (IKK), который может реагировать на цитокиновый стимул (12). После активации NF-κB подвергается ядерной транслокации, затем он управляет экспрессией различных генов, включая индуцибельную циклооксигеназу 2 (COX-2), провоспалительные цитокины и хемокины, которые поддерживают воспаление суставов (Jimi et al., 2019). На молекулярном уровне высокая концентрация IL-1β и TNF-α в синовиальной жидкости может активировать катаболические процессы, приводящие к фибробластоподобному пироптозу синовиоцитов (Shen et al., 2014; Чжан Л. и др., 2019). В синовиальной оболочке усиленное высвобождение провоспалительных цитокинов вызывает аномальную пролиферацию синовиоцитов, вызывающую инфильтрацию иммунных клеток в синовиальную ткань.
, 2019; Zhao et al., 2020). Обострение воспалительного стресса во внутрисуставном пространстве активирует путь канонического ядерного фактора каппа-легкая цепь-энхансер активированных В-клеток (NF-kB) в хондроцитах и синовиоцитах.Передача сигналов NF-κB опосредована многосубъединичным комплексом киназы IκB (IKK), который может реагировать на цитокиновый стимул (12). После активации NF-κB подвергается ядерной транслокации, затем он управляет экспрессией различных генов, включая индуцибельную циклооксигеназу 2 (COX-2), провоспалительные цитокины и хемокины, которые поддерживают воспаление суставов (Jimi et al., 2019). На молекулярном уровне высокая концентрация IL-1β и TNF-α в синовиальной жидкости может активировать катаболические процессы, приводящие к фибробластоподобному пироптозу синовиоцитов (Shen et al., 2014; Чжан Л. и др., 2019). В синовиальной оболочке усиленное высвобождение провоспалительных цитокинов вызывает аномальную пролиферацию синовиоцитов, вызывающую инфильтрацию иммунных клеток в синовиальную ткань. Кроме того, макрофагальный хемокиновый белок 1 (MCP-1) стимулирует миграцию макрофагов и нейтрофилов в синовиальное пространство, что поддерживает высокий уровень воспаления, связанный с тяжестью ОА (Xu et al., 2015; Haraden et al., 2019). ).
Кроме того, макрофагальный хемокиновый белок 1 (MCP-1) стимулирует миграцию макрофагов и нейтрофилов в синовиальное пространство, что поддерживает высокий уровень воспаления, связанный с тяжестью ОА (Xu et al., 2015; Haraden et al., 2019). ).
Высокие уровни IL-1β внутри сустава индуцируют экспрессию генов матриксных металлопротеиназ (ММР), дезинтегрина и металлопротеиназы (ADAM), а также экспрессию генов дезинтегрина и металлопротеиназы с тромбоспондиновым мотивом (ADAMTS) в хондроцитах и синовиоцитах , ускоряя развитие ОА из-за значительной деградации ACAN и коллагеновых фибрилл в хрящах (Struglics et al., 2006). Кроме того, за счет высокой ферментативной активности в АЦ увеличивается концентрация продуктов деградации матрикса, в том числе фрагментов COL2A1, ACAN и фибронектина. Это явление запускает активацию MMPs, VEGF и высокую продукцию оксида азота (NO) за счет активации TLR2 в хондроцитах, что дополнительно способствует катаболической функции и разрушению хряща (Xie et al. , 1993; Fichter et al., 2006; Hwang). et al., 2015; Lees et al., 2015; Jung et al., 2019).
, 1993; Fichter et al., 2006; Hwang). et al., 2015; Lees et al., 2015; Jung et al., 2019).
Окислительный и нитрозативный стресс при деградации хряща
Повторяющиеся циклы воспаления и устойчивое анаболо-катаболическое переключение могут вызывать перепроизводство АФК и АРНК в хряще, нарушая внутриклеточный окислительно-восстановительный статус (), которые играют важную роль в регуляции хондроцитов гипертрофия, дисфункция митохондрий, а также роль в окислительном повреждении ДНК, белков и липидов (Ostalowska et al., 2006; Сурапанени и Венкатарамана, 2007 г.; Гаврилидис и др., 2013). В этом контексте окислительный стресс модифицирует белки хрящевого матрикса, обнаруженные в аппарате Гольджи и эндоплазматическом ретикулуме хондроцитов, уменьшая их синтез (Yu and Kim, 2013). Кроме того, избыток АФК может также спровоцировать деградацию ВКМ посредством двух разных механизмов. Во-первых, АФК могут осуществлять прямой гидролиз компонентов матрицы; во-вторых, он способствует экспрессии MMP, которые генерируют гипертрофический хрящевой матрикс (Lepetsos and Papavassiliou, 2016).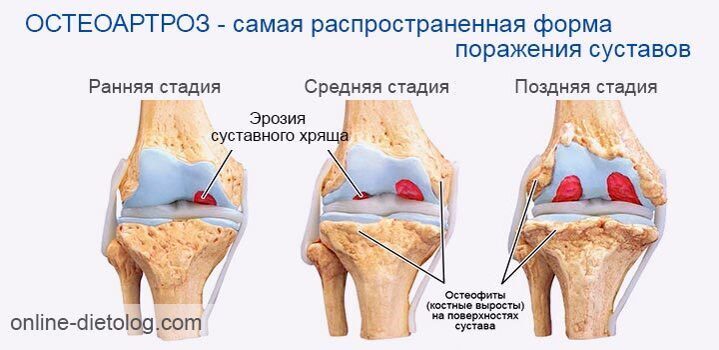
Предыдущие исследования показали снижение активности антиоксидантных ферментов при ОА, что нарушает метаболизм и клеточную пролиферацию хондроцитов (Morita et al., 2007; Surapaneni and Venkataramana, 2007; Goodwin et al., 2010). На окислительно-восстановительный баланс в AC влияет подавление активности гемоксигеназы 1 (HO-1), что приводит к окислительному стрессу и последующему старению и апоптозу (Davidson et al., 2013; Cai et al., 2015; Takada et al., 2015). ). Концентрации оксида азота (NO) выше базового функционируют как критическая сигнальная молекула при гипертрофической дифференцировке и апоптозе хондроцитов посредством заметного снижения передачи сигналов HIF-1α (Bai et al., 2019). Кроме того, гомеостатические пути, связанные с хондрогенезом, могут меняться из-за ингибирования HIF-1α (12).
Из-за этой сложной патофизиологической картины апитерапия при ОА недавно стала новой нефармакологической стратегией для уменьшения молекулярных событий, которые вызывают структурные и функциональные повреждения в тканях суставов, вызванные воспалением, нитрозативным и оксидативным стрессом при заболеваниях АЦ.
Противовоспалительное и антиоксидантное действие меда
Мед представляет собой натуральный вязкий сладкий и ароматный раствор, потребляемый из-за его высокой питательной ценности и положительного воздействия на здоровье человека.В меде содержится около 200 различных химических соединений, включая широкий спектр фенольных соединений, обладающих антиоксидантными, бактериостатическими, противомикробными и противовоспалительными свойствами (Alvarez-Suarez et al., 2013). Биологические эффекты меда объясняются высокой концентрацией полифенольных соединений (флавоноидов), которые определяют его антиоксидантные и противовоспалительные свойства (Shen et al., 2019; Goslinski et al., 2020). Мед содержит различные биологически активные молекулы, включая p -кумаровую кислоту, эвгенол, феруловую кислоту, кофейную кислоту, пинобанксин, пиноцембрин, хризин, кверцетин, апигенин, галангин, изорамнетин, галловую кислоту, кемпферол, сирингиновую кислоту, лютеолин и нарингин; тем не менее, их концентрация варьируется в зависимости от типа меда (Ciulu et al. , 2016; да Силва и др., 2016; Шен и др., 2019). Кроме того, новое исследование недавно выявило везикулоподобные наночастицы (VLN) в качестве нового биологически активного агента в меде (Chen et al., 2021).
, 2016; да Силва и др., 2016; Шен и др., 2019). Кроме того, новое исследование недавно выявило везикулоподобные наночастицы (VLN) в качестве нового биологически активного агента в меде (Chen et al., 2021).
Мед с древних времен использовался в качестве лечебного средства при самых разных клинических состояниях. Его наиболее замечательная эффективность заключается в заживлении ран (Frydman et al., 2020; Smaropoulos and Cremers, 2020) и лечении заболеваний желудочно-кишечного тракта (Bilsel et al., 2002; Miguel et al., 2017).Кроме того, в нескольких исследованиях оценивалось влияние меда на рак (Afrin et al., 2018b; Mohammed et al., 2020), диабет (Sahlan et al., 2020) и дислипидемию (Ramli et al., 2019), показывая значительное мелиоративные эффекты. Аналогичным образом сообщалось об антимикробном действии при использовании меда (Rosli et al., 2020).
О роли меда в воспалительном процессе сообщили Аль-Ваили и Бони (2003); они показали, что при употреблении разбавленного натурального меда концентрация простагландина Е2, простагландина F2α и тромбоксана B2 снижалась в плазме здоровых людей (Al-Waili and Boni, 2003). Другое недавнее исследование показало биологическую роль VLN, полученных из меда, которые проявляют мощную противовоспалительную активность, подавляя активацию воспалительных процессов NLRP3 и передачу сигналов NF-κB. Кроме того, РНК небольшого размера были идентифицированы как молекулы, которые значительно улучшали воспалительную активность NLRP3, в частности, miR-4057 защищала мышей от острых воспалительных состояний в печени (Chen et al., 2021). С другой стороны, в различных исследованиях изучалось влияние потребления меда на уровни малонового диальдегида и АФК у спортсменов и моделей на мышах, где люди подвергались высокоэффективным режимам упражнений.Авторы пришли к выводу, что потребление меда приводит к заметному снижению биомаркеров окислительного повреждения, вызванного высокой физической активностью (Ahmad et al., 2017; Jurcău and Jurcău, 2017; Hills et al., 2019).
Другое недавнее исследование показало биологическую роль VLN, полученных из меда, которые проявляют мощную противовоспалительную активность, подавляя активацию воспалительных процессов NLRP3 и передачу сигналов NF-κB. Кроме того, РНК небольшого размера были идентифицированы как молекулы, которые значительно улучшали воспалительную активность NLRP3, в частности, miR-4057 защищала мышей от острых воспалительных состояний в печени (Chen et al., 2021). С другой стороны, в различных исследованиях изучалось влияние потребления меда на уровни малонового диальдегида и АФК у спортсменов и моделей на мышах, где люди подвергались высокоэффективным режимам упражнений.Авторы пришли к выводу, что потребление меда приводит к заметному снижению биомаркеров окислительного повреждения, вызванного высокой физической активностью (Ahmad et al., 2017; Jurcău and Jurcău, 2017; Hills et al., 2019).
Основываясь на результатах доклинических исследований, мед является новым перспективным средством лечения прогрессирования ОА путем воздействия на катаболизм в тканях суставов и восстановления суставного гомеостаза.
Потенциальное использование меда для регулирования суставного гомеостаза
Защитная активность меда при ОА была оценена на различных животных моделях и исследованиях in vitro .Предыдущие исследования были направлены на выявление противовоспалительного действия меда манука на макрофаги, стимулированные ЛПС. Результаты показали, что мед манука повышает жизнеспособность клеток за счет уменьшения апоптоза, ингибирования образования свободных радикалов и ослабления воспаления. Эти эффекты регулировались уменьшением количества белков каспазы-3, p-p38 и p -Erk1/2 на молекулярном уровне. Более того, также было продемонстрировано усиление митохондриального дыхания и гликолитической активности, что привело к экспрессии и стимуляции p -AMPK, SIRT1 и PGC1alpha (Afrin et al., 2018а; Гаспаррини и др., 2018). Биологический потенциал меда манука объясняется соединениями кверцетина и галловой кислоты, которые также присутствуют в других видах меда во всем мире в высоких концентрациях (Tomás-Barberán et al. , 1993; Samargandian et al., 2017).
, 1993; Samargandian et al., 2017).
С другой стороны, исследование in vivo выявило появляющиеся противовоспалительные и антиоксидантные свойства нигерийского меда при формальдегид-индуцированном артрите у крыс Wistar. Это исследование показало, что потребление меда значительно уменьшало воспаление, аналогично лечению индометацином в течение десятидневного вмешательства (Owoyele et al., 2011). Кроме того, было описано благотворное влияние меда и его производных биоактивных соединений на здоровье костей (Kamaruzzaman et al., 2019).
Флавоноиды, содержащиеся в меде, удаляют свободные радикалы кислорода, уменьшая воспаление и сводя к минимуму повреждение тканей (Candiracci et al., 2012). Предыдущая работа Alvarez-Suarez et al. проанализировали содержание фенолов в меде манука с помощью ВЭЖХ-МС , и было высказано предположение, что эти компоненты улучшают внутриклеточный антиоксидантный и противовоспалительный ответ (Alvarez-Suarez et al., 2016). Недавно была исследована эффективность компонентов меда в отношении жизнеспособности хондроцитов, воспалений и передачи сигналов окислительного стресса.
Недавно была исследована эффективность компонентов меда в отношении жизнеспособности хондроцитов, воспалений и передачи сигналов окислительного стресса.
Соединения меда оказывают хондропротекторный эффект
Хондрогенный потенциал биоактивных соединений меда наблюдался в различных исследованиях in vitro и in vivo (), что предполагает многообещающее применение меда в качестве вспомогательной терапии для восстановления гомеостаза хряща, особенно путем ингибирование воспаления и окислительного стресса, обычно наблюдаемого при ОА.Хотя информация, касающаяся механизмов действия каждого флавоноида, содержащегося в меде, на суставной гомеостаз, все еще ограничена, некоторые биологические процессы, лежащие в основе суставного воспаления, окислительного стресса, хондропротекции и метаболизма в хрящах, уже исследованы.
Хондропротекторное действие биологически активных соединений, содержащихся в меде. (A) Структура биоактивных молекул меда с потенциальным применением для борьбы с нарушением регуляции суставного гомеостаза. (B) Механизмы воздействия флавоноидов меда на остеоартроз суставов. Различные флавоноиды, обнаруженные в меде, могут модулировать катаболизм в тканях суставов через несколько сигнальных путей, способствующих экспрессии генов, связанных с хондрогенезом, таких как SOX9, ACAN и COL2A1. АКАН: агрекан; AGEs: конечные продукты усиленного гликирования; ECM: внеклеточный матрикс; ГАГ: гликозаминогликаны; HIF-2α: индуцируемый гипоксией фактор 2 альфа; ММП: металлопротеиназы; NO: оксид азота; PGE2: простагландин E2; СОД: супероксиддисмутаза.↑ = активировать/стимулировать/увеличивать; ∅ = подавлять/запрещать/подавлять/уменьшать.
(B) Механизмы воздействия флавоноидов меда на остеоартроз суставов. Различные флавоноиды, обнаруженные в меде, могут модулировать катаболизм в тканях суставов через несколько сигнальных путей, способствующих экспрессии генов, связанных с хондрогенезом, таких как SOX9, ACAN и COL2A1. АКАН: агрекан; AGEs: конечные продукты усиленного гликирования; ECM: внеклеточный матрикс; ГАГ: гликозаминогликаны; HIF-2α: индуцируемый гипоксией фактор 2 альфа; ММП: металлопротеиназы; NO: оксид азота; PGE2: простагландин E2; СОД: супероксиддисмутаза.↑ = активировать/стимулировать/увеличивать; ∅ = подавлять/запрещать/подавлять/уменьшать.
Влияние соединений меда на воспаление суставов
Было подтверждено, что хризин, натуральный флавоноид, извлеченный из меда, ослабляет передачу сигналов воспаления NLRP3, уменьшая синовит и уменьшая высвобождение IL-1β, IL-18, субстанции p и гена кальцитонина родственный пептид в модели ОА коленного сустава, индуцированного мононатрия йодоацетатом (МИА), у крыс (Liao et al. , 2020). Второе исследование показало, что хризин резко блокирует стимулированную IL-1β деградацию IκB-α и активацию NF-κB in vitro с использованием поврежденных IL-1β хондроцитов человека (Zheng et al., 2017б).
, 2020). Второе исследование показало, что хризин резко блокирует стимулированную IL-1β деградацию IκB-α и активацию NF-κB in vitro с использованием поврежденных IL-1β хондроцитов человека (Zheng et al., 2017б).
Недавно была задокументирована биологическая активность лютеолина, другого природного флавоноида, по сигналу воспаления в хондроцитах. Исследование in vitro показало, что предварительная обработка лютеолином играет важную роль в контроле воспаления в хондроцитах крыс посредством ингибирования IL-1β, индуцированного продукции NO, PGE2 и TNF-альфа. Кроме того, лютеолин снижает фосфорилирование NF-kB, что способствует регуляции катаболической активности хондроцитов за счет снижения экспрессии белков iNOS, ЦОГ-2, ММП-1, ММП-3 и ММП-13 (Fei et al., 2019). Более того, исследования на животных показали, что введение через желудочный зонд (10 мг/кг/сут в течение 45 дней) в модели ОА, вызванной МИА, оказывает защитное действие, ослабляя разрушение АЦ и прогрессирование ОА (Fei et al. , 2019). В другом исследовании оценивали биологическую активность лютеолина, модулирующую катаболическую активность в хондроцитах, полученных из модели ОА морской свинки; сообщают, что лютеолин вызывал подавление JNK, p38 и MMP-13, а также низкое производство воспалительных биомаркеров, включая NO, TNF-α и IL-6 (Xue et al., 2019).
, 2019). В другом исследовании оценивали биологическую активность лютеолина, модулирующую катаболическую активность в хондроцитах, полученных из модели ОА морской свинки; сообщают, что лютеолин вызывал подавление JNK, p38 и MMP-13, а также низкое производство воспалительных биомаркеров, включая NO, TNF-α и IL-6 (Xue et al., 2019).
Недавно была задокументирована эффективность кверцетина как противовоспалительной молекулы. Ху и др. продемонстрировали, что кверцетин подавляет воспаление, модулируя поляризацию синовиальных макрофагов до фенотипа М2 и индуцируя экспрессию факторов роста, таких как TGF-β и IGF, которые способствуют хондрогенезу. Хондропротекторный эффект наблюдался также in vivo при внутрисуставном введении кверцетина (Hu et al., 2019).
Влияние соединений меда на ферменты, разлагающие ВКМ
Также была описана роль различных флавоноидов, поддерживающих синтез компонентов ВКМ.Использование хризина в исследовании in vitro показало положительные эффекты, предполагая, что этот флавоноид регулирует экспрессию MMP-1, MMP-3, MMP-13, ADAMTS-4 и ADAMTS-5, а также деградацию ACAN. и COL2A1 на поврежденных IL-1β хондроцитах человека (Zheng et al., 2017b). Эти результаты подтверждаются недавним исследованием, в котором хризин оказывал защитный эффект на хрондроциты ОА человека через подавление хромосомного белка высокой подвижности (HMGB1).Было продемонстрировано, что хризин увеличивает экспрессию COL2A1, в то время как клеточный апоптоз, MMP-13 и IL-6 ингибируются (Zhang C. et al., 2019). Таким образом, хризин может быть потенциальным средством для лечения ОА. Байкалин — еще один многообещающий флавоноид, содержащийся в меде, обладающий хондропротекторным действием. Хуанг и его коллеги недавно сообщили, что байкалин снижает уровни IL-1β и подавляет экспрессию коллагена I, ослабляя дегенерацию хряща и способствуя пролиферации суставных хондроцитов кролика, а также восстанавливая внеклеточный матрикс посредством COL2A1 и секреции ACAN через активацию гена SOX9. (Хуанг и др., 2017).
и COL2A1 на поврежденных IL-1β хондроцитах человека (Zheng et al., 2017b). Эти результаты подтверждаются недавним исследованием, в котором хризин оказывал защитный эффект на хрондроциты ОА человека через подавление хромосомного белка высокой подвижности (HMGB1).Было продемонстрировано, что хризин увеличивает экспрессию COL2A1, в то время как клеточный апоптоз, MMP-13 и IL-6 ингибируются (Zhang C. et al., 2019). Таким образом, хризин может быть потенциальным средством для лечения ОА. Байкалин — еще один многообещающий флавоноид, содержащийся в меде, обладающий хондропротекторным действием. Хуанг и его коллеги недавно сообщили, что байкалин снижает уровни IL-1β и подавляет экспрессию коллагена I, ослабляя дегенерацию хряща и способствуя пролиферации суставных хондроцитов кролика, а также восстанавливая внеклеточный матрикс посредством COL2A1 и секреции ACAN через активацию гена SOX9. (Хуанг и др., 2017).
Также был изучен биологический потенциал физетина и бутеина. Эти соединения оказывают противовоспалительное и антиоксидантное действие за счет восстановления экспрессии COL2A1, ACAN и протеогликанов в монослойных культурах хондроцитов. Физетин и бутеин также могут регулировать провоспалительное повреждение, вызванное ИЛ-1β, посредством индукции низкой продукции NO и PGE2, а также значительного ингибирования экспрессии металлопротеиназ и агреканаз (Zheng et al., 2017a; Zheng et al., 2017в). Кроме того, in vivo моделей ОА показали меньшую деструкцию хряща и повреждение субхондральной кости, когда мышей лечили бутеином и физетином через внутрибрюшинный и пероральный желудочный зонд, соответственно (Zheng et al., 2017a; Zheng et al., 2017c). .
Эти соединения оказывают противовоспалительное и антиоксидантное действие за счет восстановления экспрессии COL2A1, ACAN и протеогликанов в монослойных культурах хондроцитов. Физетин и бутеин также могут регулировать провоспалительное повреждение, вызванное ИЛ-1β, посредством индукции низкой продукции NO и PGE2, а также значительного ингибирования экспрессии металлопротеиназ и агреканаз (Zheng et al., 2017a; Zheng et al., 2017в). Кроме того, in vivo моделей ОА показали меньшую деструкцию хряща и повреждение субхондральной кости, когда мышей лечили бутеином и физетином через внутрибрюшинный и пероральный желудочный зонд, соответственно (Zheng et al., 2017a; Zheng et al., 2017c). .
Лютеолин показал потенциальную роль в качестве хондропротекторной молекулы. Исследования in vivo и in vitro показали, что лютеолин ингибирует экспрессию генов и синтез белка MMP-1, MMP-3, MMP-13, ADAMTS-4 и ADAMTS-5 в культивируемых суставных хондроцитах, стимулированных IL-1β; кроме того, чтобы проанализировать прямое влияние лютеолина на суставы крыс, этим животным вводили внутрисуставную инъекцию лютеолина, что показало ингибирование продукции ММР-3 до стимуляции ИЛ-1β (20 нг/30 мкл) (Kang et al. , 2014).
, 2014).
Апигенин — еще одно соединение меда, которое может играть важную роль в гомеостазе АЦ. Исследование показало, что апигенин снижает экспрессию MMP-13 на линии клеток хондроцитов человека SW1353 , обработанных IL-1β, посредством ингибирования передачи сигналов c-FOS/AP-1 и JAK/STAT (Lim et al., 2011). Более того, сообщалось, что апигенин может ингибировать экспрессию HIF-2α, который является основным регулятором катаболических факторов, таких как ММР-3, ММР-13, ADAMTS-4, IL-6 и ЦОГ (Cho et al., 2019). Недавно Park JS et al. описал антидегенеративный эффект апигенина. , который сообщил, что эта молекула регулирует экспрессию генов ферментов, разрушающих матрикс, таких как MMP1, MMP-3, MMP-13, ADAMTS-4 и ADAMTS-5 в хондроцитах кролика. Кроме того, было замечено, что продукция ММП-3 ингибировалась у крыс, получавших апигенин плюс ИЛ-1β (Park et al., 2016).
Влияние соединений меда на окислительный стресс и антиоксидантные механизмы
В этом контексте нарушение регуляции надазы CD38 может нарушить гомеостаз суставных хондроцитов, способствуя чрезмерному окислительному стрессу в сочетании со значительным снижением экспрессии сиртуина-1 (SIRT-1) . Тем не менее, некоторые флавоноиды, такие как апигенин и кверцетин, могут действовать как ингибиторы CD38, ослабляя высвобождение NO и образование митохондриального супероксида через , поддерживая функцию SIRT-1 и SIRT-3 и регулируя снижение NAD + при IL-1β-стимулированном хондроциты человека (Kellenberger et al., 2011; Ansari et al., 2020).
Тем не менее, некоторые флавоноиды, такие как апигенин и кверцетин, могут действовать как ингибиторы CD38, ослабляя высвобождение NO и образование митохондриального супероксида через , поддерживая функцию SIRT-1 и SIRT-3 и регулируя снижение NAD + при IL-1β-стимулированном хондроциты человека (Kellenberger et al., 2011; Ansari et al., 2020).
Исследования с использованием in vitro IL-1β-поврежденных хондроцитов человека также подтверждают биологическую роль хризина в ингибировании окислительного стресса.Чжэн и др. наблюдали, что хризин значительно ингибирует индуцированную IL-1β продукцию NO и PGE2 на хондроцитах человека, которые были предварительно обработаны и впоследствии стимулированы провоспалительным агентом. Кроме того, этот флавоноид подавлял экспрессию ЦОГ-2 и iNOS (Zheng et al., 2017b).
Недавнее исследование показало, что роль кверцетина не ограничивается ингибированием воспаления, так как кверцетин также способствует анаболической активности на стимулированных IL-1β хондроцитах крыс, а также антиапоптотическому эффекту, посредством , направленного на АФК и ингибирующего Стресс ER через активацию сигнального пути SIRT1/AMPK (Feng et al. , 2019; Ху и др., 2019). Кроме того, второе сообщение показало, что кверцетин, вводимый через желудочный зонд в дозе 25 мг/кг 90 157–90 158 1 у кроликов, моделирующих ОА коленного сустава, активирует супероксиддисмутазу (СОД) и тканевый ингибитор металлопротеиназ-1 (ТИМП-1), способствуя подавлению ММР-13 в синовиальной ткани (Wei et al., 2019). Таким образом, кверцетин уменьшает дегенерацию тканей при ОА, ослабляя реакцию на окислительный стресс и ингибируя деградацию хрящевого ЕСМ.
, 2019; Ху и др., 2019). Кроме того, второе сообщение показало, что кверцетин, вводимый через желудочный зонд в дозе 25 мг/кг 90 157–90 158 1 у кроликов, моделирующих ОА коленного сустава, активирует супероксиддисмутазу (СОД) и тканевый ингибитор металлопротеиназ-1 (ТИМП-1), способствуя подавлению ММР-13 в синовиальной ткани (Wei et al., 2019). Таким образом, кверцетин уменьшает дегенерацию тканей при ОА, ослабляя реакцию на окислительный стресс и ингибируя деградацию хрящевого ЕСМ.
Существуют различные потенциальные свойства апигенина.Например, Crasci et al. сообщили, что апигенин может быть поглотителем свободных радикалов и мощным ингибитором конечных продуктов гликирования. Они также показали, что апигенин восстанавливал продукцию гликозаминогликанов (ГАГ), когда его использовали для лечения суставных хондроцитов человека, ранее стимулированных IL-1β (Crasci et al., 2018).
Влияние соединений меда на хондропротекцию
Биологическая активность байкалина была последовательной в различных исследованиях, показывающих, что байкалин защищает хондроциты от апоптоза и деградации внеклеточного матрикса (Chen C. и др., 2017; Ян и др., 2018 г.; Ли и др., 2020). В этом смысле Chen et al. идентифицировал байкалин как потенциального кандидата для лечения ОА, поскольку он предотвращал разрушение хряща и облегчение синовита в моделях ОА in vivo (Chen C. et al., 2017). Кроме того, байкалин подавляет экспрессию генов, связанных с апоптозом, индуцированную H 2 O 2 (Pan et al., 2017; Cao et al., 2018), в то время как индуцирует экспрессию COL2A1, ACAN и SOX9 у H 2 . O 2 -обработанные хондроциты (Cao et al., 2018).
и др., 2017; Ян и др., 2018 г.; Ли и др., 2020). В этом смысле Chen et al. идентифицировал байкалин как потенциального кандидата для лечения ОА, поскольку он предотвращал разрушение хряща и облегчение синовита в моделях ОА in vivo (Chen C. et al., 2017). Кроме того, байкалин подавляет экспрессию генов, связанных с апоптозом, индуцированную H 2 O 2 (Pan et al., 2017; Cao et al., 2018), в то время как индуцирует экспрессию COL2A1, ACAN и SOX9 у H 2 . O 2 -обработанные хондроциты (Cao et al., 2018).
Хорошо известно, что поддержание аутофагии необходимо для сохранения целостности хряща. В этом смысле новое исследование задокументировало, что байкалин оказывает антиапоптотическое действие за счет повышения экспрессии Bcl-2 и активации аутофагии через miR-766-3p/фактор, индуцирующий апоптоз, митохондриально-ассоциированный 1 (AIFM1) ось, которая усиливает синтез ECM на хондроцитах ОА человека (Li et al. , 2020). Точно так же Ansari et al. обнаружили, что другой флавоноид, бутеин, может активировать аутофагию в IL-1β-стимулированных хондроцитах человека путем ингибирования механистической мишени передачи сигналов рапамицином (mTOR) (Ansari et al., 2018).
, 2020). Точно так же Ansari et al. обнаружили, что другой флавоноид, бутеин, может активировать аутофагию в IL-1β-стимулированных хондроцитах человека путем ингибирования механистической мишени передачи сигналов рапамицином (mTOR) (Ansari et al., 2018).
Принимая во внимание несколько преимуществ для здоровья и общего самочувствия, связанных с медом и его компонентами, новое использование этих продуктов в качестве дополнительной стратегии для регулирования молекулярного механизма, лежащего в основе суставного гомеостаза, ведет к дальнейшим исследованиям применения тканевой инженерии для хряща. ремонт.
Мед в инженерии хрящевых тканей
Способность хряща к саморегенерации низкая, даже когда он заменен тканеинженерными конструкциями.Тем не менее, многие многообещающие стратегии все еще пытаются способствовать восстановлению и регенерации AC. В связи с этим недавние исследования были сосредоточены на разработке каркасов на основе биоматериала меда, таких как гидрогели, для быстрого восстановления хрящей, благодаря присущим меду антибактериальным свойствам и его уникальной вязкости, улучшающим механические свойства гидрогелей (Abd El-Malek et al. al., 2017; Hixon et al., 2019; Bonifacio et al., 2020b). Инновационное включение меда манука в гидрогель способствует in vitro хондрогенезу мезенхимальных стволовых клеток человека через увеличение экспрессии COL2A1, а также синтез ГАГ и протеогликанов; кроме того, не наблюдалось цитотоксического эффекта (Bonifacio et al., 2018; Бонифачо и др., 2020а). На сегодняшний день in vivo исследований активности гидрогелей, содержащихся в меде, показали значительные результаты в отношении ингибирования инфекций и нетяжелых иммунологических реакций (Bonifacio et al., 2020a), которые представляют собой многообещающее средство для регенерации хряща.
al., 2017; Hixon et al., 2019; Bonifacio et al., 2020b). Инновационное включение меда манука в гидрогель способствует in vitro хондрогенезу мезенхимальных стволовых клеток человека через увеличение экспрессии COL2A1, а также синтез ГАГ и протеогликанов; кроме того, не наблюдалось цитотоксического эффекта (Bonifacio et al., 2018; Бонифачо и др., 2020а). На сегодняшний день in vivo исследований активности гидрогелей, содержащихся в меде, показали значительные результаты в отношении ингибирования инфекций и нетяжелых иммунологических реакций (Bonifacio et al., 2020a), которые представляют собой многообещающее средство для регенерации хряща.
Биобезопасность меда для клинического применения
Повышенный интерес к меду для медицинского применения приводит к строгому регулированию его качества и безопасности. Мед также может содержать токсичные соединения, в том числе пестициды (Chiesa et al., 2018; El Agrebi et al., 2020), тяжелые металлы (Bartha et al. , 2020; Bosancic et al., 2020) и антибиотики (Barrasso et al., 2018) из-за загрязнения окружающей среды в местах сбора меда. Бактериальное загрязнение является еще одним важным фактором, который необходимо учитывать, чтобы убедиться, что мед подходит для терапевтических целей; например, наличие спор Clostridium botulinum ранее было выявлено в образцах меда (Nevas et al., 2002; Rosli et al., 2020). В этом контексте использование медицинского меда (MGH) гарантирует его безопасность для клинического применения (Hermanns et al., 2019). Было доказано, что биоактивность меда в виде противомикробных, ранозаживляющих, антиоксидантных и противовоспалительных свойств сохраняется после стерилизации гамма-излучением и продления условий хранения (Postmes et al., 1995; Molan and Allen, 1996; Hussein et al. , 2014).
, 2020; Bosancic et al., 2020) и антибиотики (Barrasso et al., 2018) из-за загрязнения окружающей среды в местах сбора меда. Бактериальное загрязнение является еще одним важным фактором, который необходимо учитывать, чтобы убедиться, что мед подходит для терапевтических целей; например, наличие спор Clostridium botulinum ранее было выявлено в образцах меда (Nevas et al., 2002; Rosli et al., 2020). В этом контексте использование медицинского меда (MGH) гарантирует его безопасность для клинического применения (Hermanns et al., 2019). Было доказано, что биоактивность меда в виде противомикробных, ранозаживляющих, антиоксидантных и противовоспалительных свойств сохраняется после стерилизации гамма-излучением и продления условий хранения (Postmes et al., 1995; Molan and Allen, 1996; Hussein et al. , 2014).
Хотя Manuka MGH широко исследуется во всем мире как новая немедикаментозная терапевтическая стратегия, появляются другие виды меда с аналогичной биологической активностью. В ранних отчетах мед от безжалых пчел, включая Melipona spp., Trigona spp., Tetragonisca spp. и Scapt или trigona spp. проявляют терапевтические свойства для лечения воспалений (Ranneh et al., 2019; Biluca et al., 2020), заживления ран (Abd Jal. et al., 2017; Abdul Malik et al., 2020) и окислительный стресс (Abid et al., 2017; Ranneh et al., 2018; Biluca et al., 2020). Кроме того, ранее сообщалось о биодоступности наиболее многообещающих соединений, таких как апигенин, хризин и кверцетин, в меде безжалых пчел (Zulkhairi Amin et al., 2018). Следовательно, они обладают биологическим потенциалом для современного медицинского применения при других патологиях, связанных с нарушением регуляции суставного гомеостаза.
В ранних отчетах мед от безжалых пчел, включая Melipona spp., Trigona spp., Tetragonisca spp. и Scapt или trigona spp. проявляют терапевтические свойства для лечения воспалений (Ranneh et al., 2019; Biluca et al., 2020), заживления ран (Abd Jal. et al., 2017; Abdul Malik et al., 2020) и окислительный стресс (Abid et al., 2017; Ranneh et al., 2018; Biluca et al., 2020). Кроме того, ранее сообщалось о биодоступности наиболее многообещающих соединений, таких как апигенин, хризин и кверцетин, в меде безжалых пчел (Zulkhairi Amin et al., 2018). Следовательно, они обладают биологическим потенциалом для современного медицинского применения при других патологиях, связанных с нарушением регуляции суставного гомеостаза.
Заключение и перспективы на будущее
С древних времен терапевтические эффекты меда были описаны и широко наблюдались при лечении ран, кашля, кожных инфекций и воспалений. В настоящее время изучается эффективность меда в противодействии суставным повреждениям для улучшения качества жизни людей с ОА. Мы знаем, что биологически активные соединения меда оказывают хондропротекторное действие, противодействуя гомеостатической дисрегуляции сустава. Таким образом, его использование в качестве терапевтического инструмента при лечении ОА широко поддерживается, поскольку он может смещать основные сигнальные пути, связанные с ОА. Эта адъювантная немедикаментозная стратегия может облегчить боль, отрегулировать гомеостаз суставов и восстановить AC, замедляя прогрессирование ОА; таким образом, уменьшая физические ограничения, инвалидность, умственное напряжение и социально-экономическое бремя, обычно наблюдаемое у людей с этим хроническим заболеванием.
Мы знаем, что биологически активные соединения меда оказывают хондропротекторное действие, противодействуя гомеостатической дисрегуляции сустава. Таким образом, его использование в качестве терапевтического инструмента при лечении ОА широко поддерживается, поскольку он может смещать основные сигнальные пути, связанные с ОА. Эта адъювантная немедикаментозная стратегия может облегчить боль, отрегулировать гомеостаз суставов и восстановить AC, замедляя прогрессирование ОА; таким образом, уменьшая физические ограничения, инвалидность, умственное напряжение и социально-экономическое бремя, обычно наблюдаемое у людей с этим хроническим заболеванием.
Имеются четкие доказательства того, что натуральные продукты представляют собой превосходный источник биоактивных молекул с потенциальными медицинскими применениями. Мы представили семь натуральных соединений, полученных из меда, в качестве возможных кандидатов для лечения ОА из-за их хондропротекторной активности. Тем не менее, существует ограниченное количество отчетов in vitro и in vivo , показывающих молекулярные пути, лежащие в основе биологического действия флавоноидов, полученных из меда. Суставной гомеостаз довольно сложен, и его полное восстановление с помощью одной молекулы после воздействия биомеханического, воспалительного или окислительного стресса может быть сложным.Тем не менее максимальный терапевтический потенциал может быть достигнут комбинацией этих молекул. Однако подходящая дозировка и результат представляют собой сложную проблему. В этом контексте необходимы дальнейшие доклинические исследования, чтобы подтвердить новые применения меда в качестве рациональной терапевтической стратегии при ОА, учитывая, что большинство текущих отчетов показали влияние биологически активных флавоноидов на регуляцию суставного гомеостаза в исследованиях in vitro . Наконец, очень важно разработать клинические испытания для проверки безопасности и эффективности биологически активных соединений, полученных из меда, чтобы лучше понять их активность на клеточном и молекулярном уровне для будущих терапевтических подходов.
Суставной гомеостаз довольно сложен, и его полное восстановление с помощью одной молекулы после воздействия биомеханического, воспалительного или окислительного стресса может быть сложным.Тем не менее максимальный терапевтический потенциал может быть достигнут комбинацией этих молекул. Однако подходящая дозировка и результат представляют собой сложную проблему. В этом контексте необходимы дальнейшие доклинические исследования, чтобы подтвердить новые применения меда в качестве рациональной терапевтической стратегии при ОА, учитывая, что большинство текущих отчетов показали влияние биологически активных флавоноидов на регуляцию суставного гомеостаза в исследованиях in vitro . Наконец, очень важно разработать клинические испытания для проверки безопасности и эффективности биологически активных соединений, полученных из меда, чтобы лучше понять их активность на клеточном и молекулярном уровне для будущих терапевтических подходов.
Терапевтический потенциал биологически активных соединений в меде для лечения остеоартрита
Abstract
Нарушение регуляции гомеостаза суставной ткани вызывает дегенеративные изменения суставов и заболевания опорно-двигательного аппарата, такие как остеоартрит. Эта патология представляет собой первую причину двигательной инвалидности у людей старше 60 лет, влияя на качество их жизни и расходы на системы здравоохранения. В настоящее время фармакологические методы лечения заболеваний хряща не обеспечивают полной регенерации тканей, что приводит к функциональной потере сустава; поэтому эндопротезирование суставов является золотым стандартом лечения этой патологии в тяжелых случаях остеоартрита.Другим методом лечения является использование противовоспалительных препаратов, которые в некоторой степени уменьшают боль и воспаление, но без значительного торможения прогрессирования заболевания. В этом смысле были предложены новые терапевтические альтернативы на основе природных соединений для замедления прогрессирования остеоартрита, особенно тех агентов, которые регулируют суставной гомеостаз. Доклинические исследования показали терапевтическое применение меда и его биоактивных соединений, начиная от лечения ран, кашля, кожных инфекций, а также в качестве биологического стимулятора, проявляя антиоксидантные и противовоспалительные свойства.
Эта патология представляет собой первую причину двигательной инвалидности у людей старше 60 лет, влияя на качество их жизни и расходы на системы здравоохранения. В настоящее время фармакологические методы лечения заболеваний хряща не обеспечивают полной регенерации тканей, что приводит к функциональной потере сустава; поэтому эндопротезирование суставов является золотым стандартом лечения этой патологии в тяжелых случаях остеоартрита.Другим методом лечения является использование противовоспалительных препаратов, которые в некоторой степени уменьшают боль и воспаление, но без значительного торможения прогрессирования заболевания. В этом смысле были предложены новые терапевтические альтернативы на основе природных соединений для замедления прогрессирования остеоартрита, особенно тех агентов, которые регулируют суставной гомеостаз. Доклинические исследования показали терапевтическое применение меда и его биоактивных соединений, начиная от лечения ран, кашля, кожных инфекций, а также в качестве биологического стимулятора, проявляя антиоксидантные и противовоспалительные свойства. В этой статье мы рассмотрели современные лекарственные применения меда, уделив особое внимание его использованию для регулирования суставного гомеостаза путем подавления воспаления и окислительного стресса.
В этой статье мы рассмотрели современные лекарственные применения меда, уделив особое внимание его использованию для регулирования суставного гомеостаза путем подавления воспаления и окислительного стресса.
Ключевые слова: Суставной гомеостаз, остеоартроз, воспаление, медовые флавоноиды, окислительно-восстановительный гомеостаз, хрящ, хондропротекторная активность это связано с различными этиологическими факторами, такими как старение, генетика, метаболический и биомеханический стресс.В этом контексте воспаление и окислительный стресс играют ключевую роль в прогрессирующем ухудшении состояния суставных тканей, включая суставной хрящ (АС), субхондральную кость, синовиальную оболочку и мениск, которые поддерживают функциональность суставов до тех пор, пока не возникнет обострение гомеостатической дисфункции (Minguzzi et al. , 2018). Несмотря на клиническую значимость ОА, которым страдает более четверти населения мира старше 18 лет (Chen D. et al., 2017), фармакологические стратегии предотвращения прогрессирования ОА ограничены.
Лечение ОА включает контроль веса и специальные физические упражнения в качестве интервенционных стратегий для поддержки фармакологической терапии (Watt and Gulati, 2017). Первая линия вмешательства включает нестероидные противовоспалительные препараты и ацетаминофен для контроля хронической боли. Ингибиторы циклооксигеназы-II, внутрисуставные стероиды и добавки для повышения вязкости также рассматриваются, когда стандартное лечение неэффективно; тем не менее их клиническая эффективность невысока у пациентов с сопутствующими заболеваниями (Jones et al., 2019). Следовательно, использование обезболивающих препаратов не представляет собой терапевтическую стратегию для остановки или устранения повреждения хряща, а также не регулирует гомеостаз АЦ, делая АЦ склонным к дальнейшему повреждению (Saccomano, 2018).
В настоящее время продукты пчеловодства используются для лечения различных воспалительных заболеваний суставов в качестве немедикаментозной терапии. При альтернативных или адъювантных терапевтических схемах у людей наблюдался потенциальный физиопатологический эффект меда, пыльцы, прополиса и пчелиного яда (Almuhareb et al. , 2019; Conrad et al., 2019), мышиные модели (Owoyele et al., 2011; Hsieh et al., 2019) и исследования in vitro (Jeong et al., 2015; Locatelli et al., 2018). Эти преимущества для здоровья в основном наблюдаются при использовании меда из южного полушария, такого как мед манука и мед безжалостных пчел, и их польза для здоровья объясняется их фармакологически активными компонентами (Al-Hatamleh et al., 2020).
, 2019; Conrad et al., 2019), мышиные модели (Owoyele et al., 2011; Hsieh et al., 2019) и исследования in vitro (Jeong et al., 2015; Locatelli et al., 2018). Эти преимущества для здоровья в основном наблюдаются при использовании меда из южного полушария, такого как мед манука и мед безжалостных пчел, и их польза для здоровья объясняется их фармакологически активными компонентами (Al-Hatamleh et al., 2020).
Согласно опубликованным данным, различные биологически активные соединения, обычно присутствующие в меде, играют эффективную роль в уменьшении внутрисуставных повреждений за счет ингибирования воспаления, окислительного стресса, синовиальной гиперплазии и ангиогенеза (Wang et al., 2007; Ян и др., 2018 г.; Ли и др., 2019; Орхан и Дениз, 2020 г .; Юань и др., 2020). В частности, защита хряща и усиление репаративных функций хондроцитов, вызванные медом, включают несколько биологически активных молекул, таких как хризин, апигенин, кверцетин, байкалин, лютеолин, физетин, бутеин, среди других флавоноидов и фенольных соединений. Настоящий описательный обзор направлен на обсуждение нового медицинского применения меда и выделение роли его полифенолов как потенциальных регуляторов суставного гомеостаза при ОА.Поэтому мы провели поиск статей, опубликованных до марта 2021 года в базе данных PubMed, с учетом следующих критериев: флавоноиды меда с биологическим действием на хондроциты и суставной гомеостаз. В результате этого поиска мы обнаружили, что данные in vitro в основном основаны на чистых соединениях, и лишь некоторые из них включали анализы в доклинических моделях ОА.
Настоящий описательный обзор направлен на обсуждение нового медицинского применения меда и выделение роли его полифенолов как потенциальных регуляторов суставного гомеостаза при ОА.Поэтому мы провели поиск статей, опубликованных до марта 2021 года в базе данных PubMed, с учетом следующих критериев: флавоноиды меда с биологическим действием на хондроциты и суставной гомеостаз. В результате этого поиска мы обнаружили, что данные in vitro в основном основаны на чистых соединениях, и лишь некоторые из них включали анализы в доклинических моделях ОА.
Влияние воспаления и окислительного стресса на гомеостаз хряща
Это дегенеративное заболевание суставов характеризуется нарушением суставного гомеостаза с устойчивой продукцией провоспалительных цитокинов, ферментов деградации внеклеточного матрикса (ECM), свободных радикалов, включая активные формы кислорода (АФК) и активные формы азота (РЧА) (Сурапанени и Венкатарамана, 2007).
В нормальных условиях хондроциты выполняют анаболические функции, поддерживая замену определенных компонентов ВКМ с низким оборотом, включая коллагены, протеогликаны и неколлагеновые белки (Singh et al. , 2019). Скорость отложения белка ВКМ регулируется индуцируемым гипоксией фактором 1 альфа (HIF-1α), который в микроокружении с низкой концентрацией кислорода индуцирует экспрессию SOX9, главного транскрипционного регулятора хондрогенеза. SOX9 способствует экспрессии генов, специфичных для хондроцитов, таких как коллаген II типа (COL2A1) и аггрекан (ACAN), которые являются основными компонентами ВКМ при AC (Akiyama et al., 2002; Амарилио и др., 2007) (). Однако измененная функциональность антиоксидантной системы, несбалансированная передача сигналов воспаления, старение AC и другие неблагоприятные воздействия микросреды вызывают метаболический сдвиг от анаболизма к катаболизму (Singh et al., 2019). Высокоактивное метаболическое состояние при AC приводит к синтезу воспалительных и деградирующих белков, которые активируют клеточное старение и функцию иммунных клеток внутри остеоартритного сустава.
, 2019). Скорость отложения белка ВКМ регулируется индуцируемым гипоксией фактором 1 альфа (HIF-1α), который в микроокружении с низкой концентрацией кислорода индуцирует экспрессию SOX9, главного транскрипционного регулятора хондрогенеза. SOX9 способствует экспрессии генов, специфичных для хондроцитов, таких как коллаген II типа (COL2A1) и аггрекан (ACAN), которые являются основными компонентами ВКМ при AC (Akiyama et al., 2002; Амарилио и др., 2007) (). Однако измененная функциональность антиоксидантной системы, несбалансированная передача сигналов воспаления, старение AC и другие неблагоприятные воздействия микросреды вызывают метаболический сдвиг от анаболизма к катаболизму (Singh et al., 2019). Высокоактивное метаболическое состояние при AC приводит к синтезу воспалительных и деградирующих белков, которые активируют клеточное старение и функцию иммунных клеток внутри остеоартритного сустава.
Дисрегуляция суставного гомеостаза при ОА. (A) Анаболический метаболизм регулирует экспрессию генов и синтез белков COL2A1 и ACAN в хондроцитах, поддерживая компоненты AC в состоянии низкого обмена. (B) Эта схема представляет гомеостатическое нарушение AC, вызванное окислительным стрессом и провоспалительными цитокинами. Передача сигналов IL-1 и TNF-α запускает активацию MMP и ADAMTS. Затем усиленное высвобождение MMP-13 вызывает гидролиз COL2A1 и ACAN, которые считаются ключевыми компонентами матрицы AC.Деградация матрикса усиливается активностью ADAMTS, что приводит к потере целостности хряща и дополнительной потере функции сустава. Воспаление, ROS и RNS не только стимулируют экспрессию ферментов деградации ECM, но также нарушают способность хондроцитов восстанавливать поврежденный хрящ, блокируя передачу сигналов HIF-1α и SOX9. AC: суставной хрящ; АКАН: агрекан; ADAMTS: дезинтегрин и металлопротеиназа с мотивом тромбоспондина; COL2A1: коллаген II типа; ECM: внеклеточный матрикс; HIF-1α: индуцируемый гипоксией фактор 1 альфа; ММП: металлопротеиназы; АФК: активные формы кислорода; RNS: активные формы азота.
(B) Эта схема представляет гомеостатическое нарушение AC, вызванное окислительным стрессом и провоспалительными цитокинами. Передача сигналов IL-1 и TNF-α запускает активацию MMP и ADAMTS. Затем усиленное высвобождение MMP-13 вызывает гидролиз COL2A1 и ACAN, которые считаются ключевыми компонентами матрицы AC.Деградация матрикса усиливается активностью ADAMTS, что приводит к потере целостности хряща и дополнительной потере функции сустава. Воспаление, ROS и RNS не только стимулируют экспрессию ферментов деградации ECM, но также нарушают способность хондроцитов восстанавливать поврежденный хрящ, блокируя передачу сигналов HIF-1α и SOX9. AC: суставной хрящ; АКАН: агрекан; ADAMTS: дезинтегрин и металлопротеиназа с мотивом тромбоспондина; COL2A1: коллаген II типа; ECM: внеклеточный матрикс; HIF-1α: индуцируемый гипоксией фактор 1 альфа; ММП: металлопротеиназы; АФК: активные формы кислорода; RNS: активные формы азота.
Вышеупомянутые изменения вызывают состояние устойчивого катаболизма, который увековечивает прогрессирующее разрушение хряща и разрушает ткани суставов. Поскольку при ОА существенно страдает количество хондроцитов и их жизнеспособность, снижается синтез компонентов ВКМ. Нарушение целостности AC ослабляет суставной гомеостаз, неблагоприятно влияя на функцию других суставных тканей, таких как синовиальная оболочка, мениск и субхондральная кость (Stolberg-Stolberg et al., 2020).Более того, из-за молекулярных стимулов, вызванных повреждением коллагеновой сети и синовитом, увеличивается инфильтрация мононуклеарных клеток в синовиальную оболочку, что приводит к устойчивым воспалительным сигнальным путям. Кроме того, усиленные воспалительные биомаркеры во внутрисуставном пространстве играют важную роль в ремоделировании ВКМ, включая гипертрофическую дифференцировку хондроцитов (Minguzzi et al., 2018).
Поскольку при ОА существенно страдает количество хондроцитов и их жизнеспособность, снижается синтез компонентов ВКМ. Нарушение целостности AC ослабляет суставной гомеостаз, неблагоприятно влияя на функцию других суставных тканей, таких как синовиальная оболочка, мениск и субхондральная кость (Stolberg-Stolberg et al., 2020).Более того, из-за молекулярных стимулов, вызванных повреждением коллагеновой сети и синовитом, увеличивается инфильтрация мононуклеарных клеток в синовиальную оболочку, что приводит к устойчивым воспалительным сигнальным путям. Кроме того, усиленные воспалительные биомаркеры во внутрисуставном пространстве играют важную роль в ремоделировании ВКМ, включая гипертрофическую дифференцировку хондроцитов (Minguzzi et al., 2018).
Дисбалансу между анаболизмом и катаболизмом, возникающему при прогрессировании ОА, можно немного противодействовать экспрессией трансформирующего фактора роста-бета (TFG-β), который модифицирует дисбаланс синтеза-замещения протеогликанов в ВКМ (Scharstuhl et al. , 2002; Джими и др., 2019). Однако катаболическая активность также связана с более низким ответом на стимуляцию хондроцитов инсулиноподобным фактором роста 1 (IGF-1), снижением продукции белков ВКМ и, следовательно, репаративного процесса (Jimi et al., 2019; Morscheid и др., 2019).
, 2002; Джими и др., 2019). Однако катаболическая активность также связана с более низким ответом на стимуляцию хондроцитов инсулиноподобным фактором роста 1 (IGF-1), снижением продукции белков ВКМ и, следовательно, репаративного процесса (Jimi et al., 2019; Morscheid и др., 2019).
Влияние воспаления на деградацию хряща
Медиаторы воспаления считаются критическими участниками разрушения хряща и синовита при ОА. Однако генетические факторы, возрастные изменения и биомеханический стресс вследствие ожирения, хирургического вмешательства или травматического повреждения являются основной причиной нарушения гомеостатической регуляции суставов при ОА (McAlindon et al., 2014). Кроме того, развитие, эволюция и сохранение ОА характеризуются постепенной потерей протеогликанов и COL2A1 с последующим образованием фиброзного хряща, что связано с высокой продукцией цитокинов, включая IL-1β, TNF-α, IL-6, IL-15. и Ил-18. Передача сигналов провоспалительных цитокинов стимулирует фенотипический сдвиг AC, апоптоз и усугубляет синовиальный фиброз (Jimi et al. , 2019; Zhao et al., 2020). Обострение воспалительного стресса во внутрисуставном пространстве активирует путь канонического ядерного фактора каппа-легкая цепь-энхансер активированных В-клеток (NF-kB) в хондроцитах и синовиоцитах.Передача сигналов NF-κB опосредована многосубъединичным комплексом киназы IκB (IKK), который может реагировать на цитокиновый стимул (12). После активации NF-κB подвергается ядерной транслокации, затем он управляет экспрессией различных генов, включая индуцибельную циклооксигеназу 2 (COX-2), провоспалительные цитокины и хемокины, которые поддерживают воспаление суставов (Jimi et al., 2019). На молекулярном уровне высокая концентрация IL-1β и TNF-α в синовиальной жидкости может активировать катаболические процессы, приводящие к фибробластоподобному пироптозу синовиоцитов (Shen et al., 2014; Чжан Л. и др., 2019). В синовиальной оболочке усиленное высвобождение провоспалительных цитокинов вызывает аномальную пролиферацию синовиоцитов, вызывающую инфильтрацию иммунных клеток в синовиальную ткань.
, 2019; Zhao et al., 2020). Обострение воспалительного стресса во внутрисуставном пространстве активирует путь канонического ядерного фактора каппа-легкая цепь-энхансер активированных В-клеток (NF-kB) в хондроцитах и синовиоцитах.Передача сигналов NF-κB опосредована многосубъединичным комплексом киназы IκB (IKK), который может реагировать на цитокиновый стимул (12). После активации NF-κB подвергается ядерной транслокации, затем он управляет экспрессией различных генов, включая индуцибельную циклооксигеназу 2 (COX-2), провоспалительные цитокины и хемокины, которые поддерживают воспаление суставов (Jimi et al., 2019). На молекулярном уровне высокая концентрация IL-1β и TNF-α в синовиальной жидкости может активировать катаболические процессы, приводящие к фибробластоподобному пироптозу синовиоцитов (Shen et al., 2014; Чжан Л. и др., 2019). В синовиальной оболочке усиленное высвобождение провоспалительных цитокинов вызывает аномальную пролиферацию синовиоцитов, вызывающую инфильтрацию иммунных клеток в синовиальную ткань. Кроме того, макрофагальный хемокиновый белок 1 (MCP-1) стимулирует миграцию макрофагов и нейтрофилов в синовиальное пространство, что поддерживает высокий уровень воспаления, связанный с тяжестью ОА (Xu et al., 2015; Haraden et al., 2019). ).
Кроме того, макрофагальный хемокиновый белок 1 (MCP-1) стимулирует миграцию макрофагов и нейтрофилов в синовиальное пространство, что поддерживает высокий уровень воспаления, связанный с тяжестью ОА (Xu et al., 2015; Haraden et al., 2019). ).
Высокие уровни IL-1β внутри сустава индуцируют экспрессию генов матриксных металлопротеиназ (ММР), дезинтегрина и металлопротеиназы (ADAM), а также экспрессию генов дезинтегрина и металлопротеиназы с тромбоспондиновым мотивом (ADAMTS) в хондроцитах и синовиоцитах , ускоряя развитие ОА из-за значительной деградации ACAN и коллагеновых фибрилл в хрящах (Struglics et al., 2006). Кроме того, за счет высокой ферментативной активности в АЦ увеличивается концентрация продуктов деградации матрикса, в том числе фрагментов COL2A1, ACAN и фибронектина. Это явление запускает активацию MMPs, VEGF и высокую продукцию оксида азота (NO) за счет активации TLR2 в хондроцитах, что дополнительно способствует катаболической функции и разрушению хряща (Xie et al. , 1993; Fichter et al., 2006; Hwang). et al., 2015; Lees et al., 2015; Jung et al., 2019).
, 1993; Fichter et al., 2006; Hwang). et al., 2015; Lees et al., 2015; Jung et al., 2019).
Окислительный и нитрозативный стресс при деградации хряща
Повторяющиеся циклы воспаления и устойчивое анаболо-катаболическое переключение могут вызывать перепроизводство АФК и АРНК в хряще, нарушая внутриклеточный окислительно-восстановительный статус (), которые играют важную роль в регуляции хондроцитов гипертрофия, дисфункция митохондрий, а также роль в окислительном повреждении ДНК, белков и липидов (Ostalowska et al., 2006; Сурапанени и Венкатарамана, 2007 г.; Гаврилидис и др., 2013). В этом контексте окислительный стресс модифицирует белки хрящевого матрикса, обнаруженные в аппарате Гольджи и эндоплазматическом ретикулуме хондроцитов, уменьшая их синтез (Yu and Kim, 2013). Кроме того, избыток АФК может также спровоцировать деградацию ВКМ посредством двух разных механизмов. Во-первых, АФК могут осуществлять прямой гидролиз компонентов матрицы; во-вторых, он способствует экспрессии MMP, которые генерируют гипертрофический хрящевой матрикс (Lepetsos and Papavassiliou, 2016).
Предыдущие исследования показали снижение активности антиоксидантных ферментов при ОА, что нарушает метаболизм и клеточную пролиферацию хондроцитов (Morita et al., 2007; Surapaneni and Venkataramana, 2007; Goodwin et al., 2010). На окислительно-восстановительный баланс в AC влияет подавление активности гемоксигеназы 1 (HO-1), что приводит к окислительному стрессу и последующему старению и апоптозу (Davidson et al., 2013; Cai et al., 2015; Takada et al., 2015). ). Концентрации оксида азота (NO) выше базового функционируют как критическая сигнальная молекула при гипертрофической дифференцировке и апоптозе хондроцитов посредством заметного снижения передачи сигналов HIF-1α (Bai et al., 2019). Кроме того, гомеостатические пути, связанные с хондрогенезом, могут меняться из-за ингибирования HIF-1α (12).
Из-за этой сложной патофизиологической картины апитерапия при ОА недавно стала новой нефармакологической стратегией для уменьшения молекулярных событий, которые вызывают структурные и функциональные повреждения в тканях суставов, вызванные воспалением, нитрозативным и оксидативным стрессом при заболеваниях АЦ.
Противовоспалительное и антиоксидантное действие меда
Мед представляет собой натуральный вязкий сладкий и ароматный раствор, потребляемый из-за его высокой питательной ценности и положительного воздействия на здоровье человека.В меде содержится около 200 различных химических соединений, включая широкий спектр фенольных соединений, обладающих антиоксидантными, бактериостатическими, противомикробными и противовоспалительными свойствами (Alvarez-Suarez et al., 2013). Биологические эффекты меда объясняются высокой концентрацией полифенольных соединений (флавоноидов), которые определяют его антиоксидантные и противовоспалительные свойства (Shen et al., 2019; Goslinski et al., 2020). Мед содержит различные биологически активные молекулы, включая p -кумаровую кислоту, эвгенол, феруловую кислоту, кофейную кислоту, пинобанксин, пиноцембрин, хризин, кверцетин, апигенин, галангин, изорамнетин, галловую кислоту, кемпферол, сирингиновую кислоту, лютеолин и нарингин; тем не менее, их концентрация варьируется в зависимости от типа меда (Ciulu et al. , 2016; да Силва и др., 2016; Шен и др., 2019). Кроме того, новое исследование недавно выявило везикулоподобные наночастицы (VLN) в качестве нового биологически активного агента в меде (Chen et al., 2021).
, 2016; да Силва и др., 2016; Шен и др., 2019). Кроме того, новое исследование недавно выявило везикулоподобные наночастицы (VLN) в качестве нового биологически активного агента в меде (Chen et al., 2021).
Мед с древних времен использовался в качестве лечебного средства при самых разных клинических состояниях. Его наиболее замечательная эффективность заключается в заживлении ран (Frydman et al., 2020; Smaropoulos and Cremers, 2020) и лечении заболеваний желудочно-кишечного тракта (Bilsel et al., 2002; Miguel et al., 2017).Кроме того, в нескольких исследованиях оценивалось влияние меда на рак (Afrin et al., 2018b; Mohammed et al., 2020), диабет (Sahlan et al., 2020) и дислипидемию (Ramli et al., 2019), показывая значительное мелиоративные эффекты. Аналогичным образом сообщалось об антимикробном действии при использовании меда (Rosli et al., 2020).
О роли меда в воспалительном процессе сообщили Аль-Ваили и Бони (2003); они показали, что при употреблении разбавленного натурального меда концентрация простагландина Е2, простагландина F2α и тромбоксана B2 снижалась в плазме здоровых людей (Al-Waili and Boni, 2003). Другое недавнее исследование показало биологическую роль VLN, полученных из меда, которые проявляют мощную противовоспалительную активность, подавляя активацию воспалительных процессов NLRP3 и передачу сигналов NF-κB. Кроме того, РНК небольшого размера были идентифицированы как молекулы, которые значительно улучшали воспалительную активность NLRP3, в частности, miR-4057 защищала мышей от острых воспалительных состояний в печени (Chen et al., 2021). С другой стороны, в различных исследованиях изучалось влияние потребления меда на уровни малонового диальдегида и АФК у спортсменов и моделей на мышах, где люди подвергались высокоэффективным режимам упражнений.Авторы пришли к выводу, что потребление меда приводит к заметному снижению биомаркеров окислительного повреждения, вызванного высокой физической активностью (Ahmad et al., 2017; Jurcău and Jurcău, 2017; Hills et al., 2019).
Другое недавнее исследование показало биологическую роль VLN, полученных из меда, которые проявляют мощную противовоспалительную активность, подавляя активацию воспалительных процессов NLRP3 и передачу сигналов NF-κB. Кроме того, РНК небольшого размера были идентифицированы как молекулы, которые значительно улучшали воспалительную активность NLRP3, в частности, miR-4057 защищала мышей от острых воспалительных состояний в печени (Chen et al., 2021). С другой стороны, в различных исследованиях изучалось влияние потребления меда на уровни малонового диальдегида и АФК у спортсменов и моделей на мышах, где люди подвергались высокоэффективным режимам упражнений.Авторы пришли к выводу, что потребление меда приводит к заметному снижению биомаркеров окислительного повреждения, вызванного высокой физической активностью (Ahmad et al., 2017; Jurcău and Jurcău, 2017; Hills et al., 2019).
Основываясь на результатах доклинических исследований, мед является новым перспективным средством лечения прогрессирования ОА путем воздействия на катаболизм в тканях суставов и восстановления суставного гомеостаза.
Потенциальное использование меда для регулирования суставного гомеостаза
Защитная активность меда при ОА была оценена на различных животных моделях и исследованиях in vitro .Предыдущие исследования были направлены на выявление противовоспалительного действия меда манука на макрофаги, стимулированные ЛПС. Результаты показали, что мед манука повышает жизнеспособность клеток за счет уменьшения апоптоза, ингибирования образования свободных радикалов и ослабления воспаления. Эти эффекты регулировались уменьшением количества белков каспазы-3, p-p38 и p -Erk1/2 на молекулярном уровне. Более того, также было продемонстрировано усиление митохондриального дыхания и гликолитической активности, что привело к экспрессии и стимуляции p -AMPK, SIRT1 и PGC1alpha (Afrin et al., 2018а; Гаспаррини и др., 2018). Биологический потенциал меда манука объясняется соединениями кверцетина и галловой кислоты, которые также присутствуют в других видах меда во всем мире в высоких концентрациях (Tomás-Barberán et al. , 1993; Samargandian et al., 2017).
, 1993; Samargandian et al., 2017).
С другой стороны, исследование in vivo выявило появляющиеся противовоспалительные и антиоксидантные свойства нигерийского меда при формальдегид-индуцированном артрите у крыс Wistar. Это исследование показало, что потребление меда значительно уменьшало воспаление, аналогично лечению индометацином в течение десятидневного вмешательства (Owoyele et al., 2011). Кроме того, было описано благотворное влияние меда и его производных биоактивных соединений на здоровье костей (Kamaruzzaman et al., 2019).
Флавоноиды, содержащиеся в меде, удаляют свободные радикалы кислорода, уменьшая воспаление и сводя к минимуму повреждение тканей (Candiracci et al., 2012). Предыдущая работа Alvarez-Suarez et al. проанализировали содержание фенолов в меде манука с помощью ВЭЖХ-МС , и было высказано предположение, что эти компоненты улучшают внутриклеточный антиоксидантный и противовоспалительный ответ (Alvarez-Suarez et al., 2016).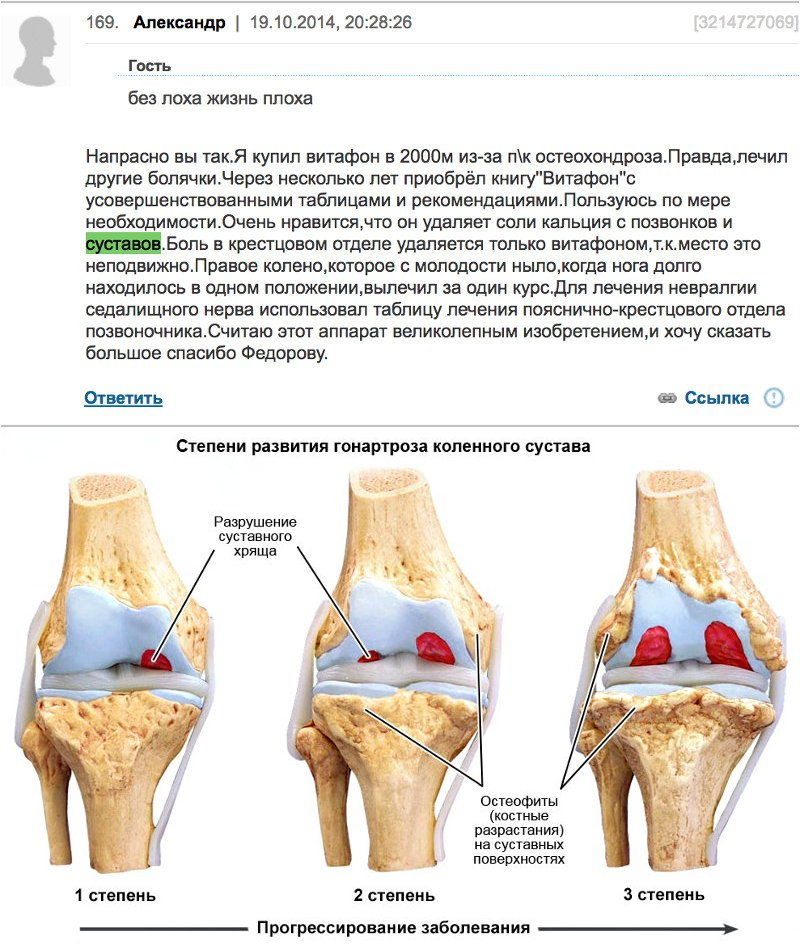 Недавно была исследована эффективность компонентов меда в отношении жизнеспособности хондроцитов, воспалений и передачи сигналов окислительного стресса.
Недавно была исследована эффективность компонентов меда в отношении жизнеспособности хондроцитов, воспалений и передачи сигналов окислительного стресса.
Соединения меда оказывают хондропротекторный эффект
Хондрогенный потенциал биоактивных соединений меда наблюдался в различных исследованиях in vitro и in vivo (), что предполагает многообещающее применение меда в качестве вспомогательной терапии для восстановления гомеостаза хряща, особенно путем ингибирование воспаления и окислительного стресса, обычно наблюдаемого при ОА.Хотя информация, касающаяся механизмов действия каждого флавоноида, содержащегося в меде, на суставной гомеостаз, все еще ограничена, некоторые биологические процессы, лежащие в основе суставного воспаления, окислительного стресса, хондропротекции и метаболизма в хрящах, уже исследованы.
Хондропротекторное действие биологически активных соединений, содержащихся в меде. (A) Структура биоактивных молекул меда с потенциальным применением для борьбы с нарушением регуляции суставного гомеостаза. (B) Механизмы воздействия флавоноидов меда на остеоартроз суставов. Различные флавоноиды, обнаруженные в меде, могут модулировать катаболизм в тканях суставов через несколько сигнальных путей, способствующих экспрессии генов, связанных с хондрогенезом, таких как SOX9, ACAN и COL2A1. АКАН: агрекан; AGEs: конечные продукты усиленного гликирования; ECM: внеклеточный матрикс; ГАГ: гликозаминогликаны; HIF-2α: индуцируемый гипоксией фактор 2 альфа; ММП: металлопротеиназы; NO: оксид азота; PGE2: простагландин E2; СОД: супероксиддисмутаза.↑ = активировать/стимулировать/увеличивать; ∅ = подавлять/запрещать/подавлять/уменьшать.
(B) Механизмы воздействия флавоноидов меда на остеоартроз суставов. Различные флавоноиды, обнаруженные в меде, могут модулировать катаболизм в тканях суставов через несколько сигнальных путей, способствующих экспрессии генов, связанных с хондрогенезом, таких как SOX9, ACAN и COL2A1. АКАН: агрекан; AGEs: конечные продукты усиленного гликирования; ECM: внеклеточный матрикс; ГАГ: гликозаминогликаны; HIF-2α: индуцируемый гипоксией фактор 2 альфа; ММП: металлопротеиназы; NO: оксид азота; PGE2: простагландин E2; СОД: супероксиддисмутаза.↑ = активировать/стимулировать/увеличивать; ∅ = подавлять/запрещать/подавлять/уменьшать.
Влияние соединений меда на воспаление суставов
Было подтверждено, что хризин, натуральный флавоноид, извлеченный из меда, ослабляет передачу сигналов воспаления NLRP3, уменьшая синовит и уменьшая высвобождение IL-1β, IL-18, субстанции p и гена кальцитонина родственный пептид в модели ОА коленного сустава, индуцированного мононатрия йодоацетатом (МИА), у крыс (Liao et al. , 2020). Второе исследование показало, что хризин резко блокирует стимулированную IL-1β деградацию IκB-α и активацию NF-κB in vitro с использованием поврежденных IL-1β хондроцитов человека (Zheng et al., 2017б).
, 2020). Второе исследование показало, что хризин резко блокирует стимулированную IL-1β деградацию IκB-α и активацию NF-κB in vitro с использованием поврежденных IL-1β хондроцитов человека (Zheng et al., 2017б).
Недавно была задокументирована биологическая активность лютеолина, другого природного флавоноида, по сигналу воспаления в хондроцитах. Исследование in vitro показало, что предварительная обработка лютеолином играет важную роль в контроле воспаления в хондроцитах крыс посредством ингибирования IL-1β, индуцированного продукции NO, PGE2 и TNF-альфа. Кроме того, лютеолин снижает фосфорилирование NF-kB, что способствует регуляции катаболической активности хондроцитов за счет снижения экспрессии белков iNOS, ЦОГ-2, ММП-1, ММП-3 и ММП-13 (Fei et al., 2019). Более того, исследования на животных показали, что введение через желудочный зонд (10 мг/кг/сут в течение 45 дней) в модели ОА, вызванной МИА, оказывает защитное действие, ослабляя разрушение АЦ и прогрессирование ОА (Fei et al. , 2019). В другом исследовании оценивали биологическую активность лютеолина, модулирующую катаболическую активность в хондроцитах, полученных из модели ОА морской свинки; сообщают, что лютеолин вызывал подавление JNK, p38 и MMP-13, а также низкое производство воспалительных биомаркеров, включая NO, TNF-α и IL-6 (Xue et al., 2019).
, 2019). В другом исследовании оценивали биологическую активность лютеолина, модулирующую катаболическую активность в хондроцитах, полученных из модели ОА морской свинки; сообщают, что лютеолин вызывал подавление JNK, p38 и MMP-13, а также низкое производство воспалительных биомаркеров, включая NO, TNF-α и IL-6 (Xue et al., 2019).
Недавно была задокументирована эффективность кверцетина как противовоспалительной молекулы. Ху и др. продемонстрировали, что кверцетин подавляет воспаление, модулируя поляризацию синовиальных макрофагов до фенотипа М2 и индуцируя экспрессию факторов роста, таких как TGF-β и IGF, которые способствуют хондрогенезу. Хондропротекторный эффект наблюдался также in vivo при внутрисуставном введении кверцетина (Hu et al., 2019).
Влияние соединений меда на ферменты, разлагающие ВКМ
Также была описана роль различных флавоноидов, поддерживающих синтез компонентов ВКМ.Использование хризина в исследовании in vitro показало положительные эффекты, предполагая, что этот флавоноид регулирует экспрессию MMP-1, MMP-3, MMP-13, ADAMTS-4 и ADAMTS-5, а также деградацию ACAN. и COL2A1 на поврежденных IL-1β хондроцитах человека (Zheng et al., 2017b). Эти результаты подтверждаются недавним исследованием, в котором хризин оказывал защитный эффект на хрондроциты ОА человека через подавление хромосомного белка высокой подвижности (HMGB1).Было продемонстрировано, что хризин увеличивает экспрессию COL2A1, в то время как клеточный апоптоз, MMP-13 и IL-6 ингибируются (Zhang C. et al., 2019). Таким образом, хризин может быть потенциальным средством для лечения ОА. Байкалин — еще один многообещающий флавоноид, содержащийся в меде, обладающий хондропротекторным действием. Хуанг и его коллеги недавно сообщили, что байкалин снижает уровни IL-1β и подавляет экспрессию коллагена I, ослабляя дегенерацию хряща и способствуя пролиферации суставных хондроцитов кролика, а также восстанавливая внеклеточный матрикс посредством COL2A1 и секреции ACAN через активацию гена SOX9. (Хуанг и др., 2017).
и COL2A1 на поврежденных IL-1β хондроцитах человека (Zheng et al., 2017b). Эти результаты подтверждаются недавним исследованием, в котором хризин оказывал защитный эффект на хрондроциты ОА человека через подавление хромосомного белка высокой подвижности (HMGB1).Было продемонстрировано, что хризин увеличивает экспрессию COL2A1, в то время как клеточный апоптоз, MMP-13 и IL-6 ингибируются (Zhang C. et al., 2019). Таким образом, хризин может быть потенциальным средством для лечения ОА. Байкалин — еще один многообещающий флавоноид, содержащийся в меде, обладающий хондропротекторным действием. Хуанг и его коллеги недавно сообщили, что байкалин снижает уровни IL-1β и подавляет экспрессию коллагена I, ослабляя дегенерацию хряща и способствуя пролиферации суставных хондроцитов кролика, а также восстанавливая внеклеточный матрикс посредством COL2A1 и секреции ACAN через активацию гена SOX9. (Хуанг и др., 2017).
Также был изучен биологический потенциал физетина и бутеина. Эти соединения оказывают противовоспалительное и антиоксидантное действие за счет восстановления экспрессии COL2A1, ACAN и протеогликанов в монослойных культурах хондроцитов. Физетин и бутеин также могут регулировать провоспалительное повреждение, вызванное ИЛ-1β, посредством индукции низкой продукции NO и PGE2, а также значительного ингибирования экспрессии металлопротеиназ и агреканаз (Zheng et al., 2017a; Zheng et al., 2017в). Кроме того, in vivo моделей ОА показали меньшую деструкцию хряща и повреждение субхондральной кости, когда мышей лечили бутеином и физетином через внутрибрюшинный и пероральный желудочный зонд, соответственно (Zheng et al., 2017a; Zheng et al., 2017c). .
Эти соединения оказывают противовоспалительное и антиоксидантное действие за счет восстановления экспрессии COL2A1, ACAN и протеогликанов в монослойных культурах хондроцитов. Физетин и бутеин также могут регулировать провоспалительное повреждение, вызванное ИЛ-1β, посредством индукции низкой продукции NO и PGE2, а также значительного ингибирования экспрессии металлопротеиназ и агреканаз (Zheng et al., 2017a; Zheng et al., 2017в). Кроме того, in vivo моделей ОА показали меньшую деструкцию хряща и повреждение субхондральной кости, когда мышей лечили бутеином и физетином через внутрибрюшинный и пероральный желудочный зонд, соответственно (Zheng et al., 2017a; Zheng et al., 2017c). .
Лютеолин показал потенциальную роль в качестве хондропротекторной молекулы. Исследования in vivo и in vitro показали, что лютеолин ингибирует экспрессию генов и синтез белка MMP-1, MMP-3, MMP-13, ADAMTS-4 и ADAMTS-5 в культивируемых суставных хондроцитах, стимулированных IL-1β; кроме того, чтобы проанализировать прямое влияние лютеолина на суставы крыс, этим животным вводили внутрисуставную инъекцию лютеолина, что показало ингибирование продукции ММР-3 до стимуляции ИЛ-1β (20 нг/30 мкл) (Kang et al. , 2014).
, 2014).
Апигенин — еще одно соединение меда, которое может играть важную роль в гомеостазе АЦ. Исследование показало, что апигенин снижает экспрессию MMP-13 на линии клеток хондроцитов человека SW1353 , обработанных IL-1β, посредством ингибирования передачи сигналов c-FOS/AP-1 и JAK/STAT (Lim et al., 2011). Более того, сообщалось, что апигенин может ингибировать экспрессию HIF-2α, который является основным регулятором катаболических факторов, таких как ММР-3, ММР-13, ADAMTS-4, IL-6 и ЦОГ (Cho et al., 2019). Недавно Park JS et al. описал антидегенеративный эффект апигенина. , который сообщил, что эта молекула регулирует экспрессию генов ферментов, разрушающих матрикс, таких как MMP1, MMP-3, MMP-13, ADAMTS-4 и ADAMTS-5 в хондроцитах кролика. Кроме того, было замечено, что продукция ММП-3 ингибировалась у крыс, получавших апигенин плюс ИЛ-1β (Park et al., 2016).
Влияние соединений меда на окислительный стресс и антиоксидантные механизмы
В этом контексте нарушение регуляции надазы CD38 может нарушить гомеостаз суставных хондроцитов, способствуя чрезмерному окислительному стрессу в сочетании со значительным снижением экспрессии сиртуина-1 (SIRT-1) . Тем не менее, некоторые флавоноиды, такие как апигенин и кверцетин, могут действовать как ингибиторы CD38, ослабляя высвобождение NO и образование митохондриального супероксида через , поддерживая функцию SIRT-1 и SIRT-3 и регулируя снижение NAD + при IL-1β-стимулированном хондроциты человека (Kellenberger et al., 2011; Ansari et al., 2020).
Тем не менее, некоторые флавоноиды, такие как апигенин и кверцетин, могут действовать как ингибиторы CD38, ослабляя высвобождение NO и образование митохондриального супероксида через , поддерживая функцию SIRT-1 и SIRT-3 и регулируя снижение NAD + при IL-1β-стимулированном хондроциты человека (Kellenberger et al., 2011; Ansari et al., 2020).
Исследования с использованием in vitro IL-1β-поврежденных хондроцитов человека также подтверждают биологическую роль хризина в ингибировании окислительного стресса.Чжэн и др. наблюдали, что хризин значительно ингибирует индуцированную IL-1β продукцию NO и PGE2 на хондроцитах человека, которые были предварительно обработаны и впоследствии стимулированы провоспалительным агентом. Кроме того, этот флавоноид подавлял экспрессию ЦОГ-2 и iNOS (Zheng et al., 2017b).
Недавнее исследование показало, что роль кверцетина не ограничивается ингибированием воспаления, так как кверцетин также способствует анаболической активности на стимулированных IL-1β хондроцитах крыс, а также антиапоптотическому эффекту, посредством , направленного на АФК и ингибирующего Стресс ER через активацию сигнального пути SIRT1/AMPK (Feng et al. , 2019; Ху и др., 2019). Кроме того, второе сообщение показало, что кверцетин, вводимый через желудочный зонд в дозе 25 мг/кг 90 157–90 158 1 у кроликов, моделирующих ОА коленного сустава, активирует супероксиддисмутазу (СОД) и тканевый ингибитор металлопротеиназ-1 (ТИМП-1), способствуя подавлению ММР-13 в синовиальной ткани (Wei et al., 2019). Таким образом, кверцетин уменьшает дегенерацию тканей при ОА, ослабляя реакцию на окислительный стресс и ингибируя деградацию хрящевого ЕСМ.
, 2019; Ху и др., 2019). Кроме того, второе сообщение показало, что кверцетин, вводимый через желудочный зонд в дозе 25 мг/кг 90 157–90 158 1 у кроликов, моделирующих ОА коленного сустава, активирует супероксиддисмутазу (СОД) и тканевый ингибитор металлопротеиназ-1 (ТИМП-1), способствуя подавлению ММР-13 в синовиальной ткани (Wei et al., 2019). Таким образом, кверцетин уменьшает дегенерацию тканей при ОА, ослабляя реакцию на окислительный стресс и ингибируя деградацию хрящевого ЕСМ.
Существуют различные потенциальные свойства апигенина.Например, Crasci et al. сообщили, что апигенин может быть поглотителем свободных радикалов и мощным ингибитором конечных продуктов гликирования. Они также показали, что апигенин восстанавливал продукцию гликозаминогликанов (ГАГ), когда его использовали для лечения суставных хондроцитов человека, ранее стимулированных IL-1β (Crasci et al., 2018).
Влияние соединений меда на хондропротекцию
Биологическая активность байкалина была последовательной в различных исследованиях, показывающих, что байкалин защищает хондроциты от апоптоза и деградации внеклеточного матрикса (Chen C.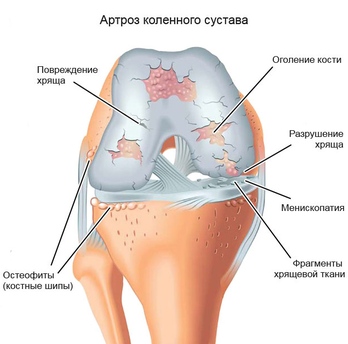 и др., 2017; Ян и др., 2018 г.; Ли и др., 2020). В этом смысле Chen et al. идентифицировал байкалин как потенциального кандидата для лечения ОА, поскольку он предотвращал разрушение хряща и облегчение синовита в моделях ОА in vivo (Chen C. et al., 2017). Кроме того, байкалин подавляет экспрессию генов, связанных с апоптозом, индуцированную H 2 O 2 (Pan et al., 2017; Cao et al., 2018), в то время как индуцирует экспрессию COL2A1, ACAN и SOX9 у H 2 . O 2 -обработанные хондроциты (Cao et al., 2018).
и др., 2017; Ян и др., 2018 г.; Ли и др., 2020). В этом смысле Chen et al. идентифицировал байкалин как потенциального кандидата для лечения ОА, поскольку он предотвращал разрушение хряща и облегчение синовита в моделях ОА in vivo (Chen C. et al., 2017). Кроме того, байкалин подавляет экспрессию генов, связанных с апоптозом, индуцированную H 2 O 2 (Pan et al., 2017; Cao et al., 2018), в то время как индуцирует экспрессию COL2A1, ACAN и SOX9 у H 2 . O 2 -обработанные хондроциты (Cao et al., 2018).
Хорошо известно, что поддержание аутофагии необходимо для сохранения целостности хряща. В этом смысле новое исследование задокументировало, что байкалин оказывает антиапоптотическое действие за счет повышения экспрессии Bcl-2 и активации аутофагии через miR-766-3p/фактор, индуцирующий апоптоз, митохондриально-ассоциированный 1 (AIFM1) ось, которая усиливает синтез ECM на хондроцитах ОА человека (Li et al. , 2020). Точно так же Ansari et al. обнаружили, что другой флавоноид, бутеин, может активировать аутофагию в IL-1β-стимулированных хондроцитах человека путем ингибирования механистической мишени передачи сигналов рапамицином (mTOR) (Ansari et al., 2018).
, 2020). Точно так же Ansari et al. обнаружили, что другой флавоноид, бутеин, может активировать аутофагию в IL-1β-стимулированных хондроцитах человека путем ингибирования механистической мишени передачи сигналов рапамицином (mTOR) (Ansari et al., 2018).
Принимая во внимание несколько преимуществ для здоровья и общего самочувствия, связанных с медом и его компонентами, новое использование этих продуктов в качестве дополнительной стратегии для регулирования молекулярного механизма, лежащего в основе суставного гомеостаза, ведет к дальнейшим исследованиям применения тканевой инженерии для хряща. ремонт.
Мед в инженерии хрящевых тканей
Способность хряща к саморегенерации низкая, даже когда он заменен тканеинженерными конструкциями.Тем не менее, многие многообещающие стратегии все еще пытаются способствовать восстановлению и регенерации AC. В связи с этим недавние исследования были сосредоточены на разработке каркасов на основе биоматериала меда, таких как гидрогели, для быстрого восстановления хрящей, благодаря присущим меду антибактериальным свойствам и его уникальной вязкости, улучшающим механические свойства гидрогелей (Abd El-Malek et al. al., 2017; Hixon et al., 2019; Bonifacio et al., 2020b). Инновационное включение меда манука в гидрогель способствует in vitro хондрогенезу мезенхимальных стволовых клеток человека через увеличение экспрессии COL2A1, а также синтез ГАГ и протеогликанов; кроме того, не наблюдалось цитотоксического эффекта (Bonifacio et al., 2018; Бонифачо и др., 2020а). На сегодняшний день in vivo исследований активности гидрогелей, содержащихся в меде, показали значительные результаты в отношении ингибирования инфекций и нетяжелых иммунологических реакций (Bonifacio et al., 2020a), которые представляют собой многообещающее средство для регенерации хряща.
al., 2017; Hixon et al., 2019; Bonifacio et al., 2020b). Инновационное включение меда манука в гидрогель способствует in vitro хондрогенезу мезенхимальных стволовых клеток человека через увеличение экспрессии COL2A1, а также синтез ГАГ и протеогликанов; кроме того, не наблюдалось цитотоксического эффекта (Bonifacio et al., 2018; Бонифачо и др., 2020а). На сегодняшний день in vivo исследований активности гидрогелей, содержащихся в меде, показали значительные результаты в отношении ингибирования инфекций и нетяжелых иммунологических реакций (Bonifacio et al., 2020a), которые представляют собой многообещающее средство для регенерации хряща.
Биобезопасность меда для клинического применения
Повышенный интерес к меду для медицинского применения приводит к строгому регулированию его качества и безопасности. Мед также может содержать токсичные соединения, в том числе пестициды (Chiesa et al., 2018; El Agrebi et al., 2020), тяжелые металлы (Bartha et al. , 2020; Bosancic et al., 2020) и антибиотики (Barrasso et al., 2018) из-за загрязнения окружающей среды в местах сбора меда. Бактериальное загрязнение является еще одним важным фактором, который необходимо учитывать, чтобы убедиться, что мед подходит для терапевтических целей; например, наличие спор Clostridium botulinum ранее было выявлено в образцах меда (Nevas et al., 2002; Rosli et al., 2020). В этом контексте использование медицинского меда (MGH) гарантирует его безопасность для клинического применения (Hermanns et al., 2019). Было доказано, что биоактивность меда в виде противомикробных, ранозаживляющих, антиоксидантных и противовоспалительных свойств сохраняется после стерилизации гамма-излучением и продления условий хранения (Postmes et al., 1995; Molan and Allen, 1996; Hussein et al. , 2014).
, 2020; Bosancic et al., 2020) и антибиотики (Barrasso et al., 2018) из-за загрязнения окружающей среды в местах сбора меда. Бактериальное загрязнение является еще одним важным фактором, который необходимо учитывать, чтобы убедиться, что мед подходит для терапевтических целей; например, наличие спор Clostridium botulinum ранее было выявлено в образцах меда (Nevas et al., 2002; Rosli et al., 2020). В этом контексте использование медицинского меда (MGH) гарантирует его безопасность для клинического применения (Hermanns et al., 2019). Было доказано, что биоактивность меда в виде противомикробных, ранозаживляющих, антиоксидантных и противовоспалительных свойств сохраняется после стерилизации гамма-излучением и продления условий хранения (Postmes et al., 1995; Molan and Allen, 1996; Hussein et al. , 2014).
Хотя Manuka MGH широко исследуется во всем мире как новая немедикаментозная терапевтическая стратегия, появляются другие виды меда с аналогичной биологической активностью. В ранних отчетах мед от безжалых пчел, включая Melipona spp., Trigona spp., Tetragonisca spp. и Scapt или trigona spp. проявляют терапевтические свойства для лечения воспалений (Ranneh et al., 2019; Biluca et al., 2020), заживления ран (Abd Jal. et al., 2017; Abdul Malik et al., 2020) и окислительный стресс (Abid et al., 2017; Ranneh et al., 2018; Biluca et al., 2020). Кроме того, ранее сообщалось о биодоступности наиболее многообещающих соединений, таких как апигенин, хризин и кверцетин, в меде безжалых пчел (Zulkhairi Amin et al., 2018). Следовательно, они обладают биологическим потенциалом для современного медицинского применения при других патологиях, связанных с нарушением регуляции суставного гомеостаза.
В ранних отчетах мед от безжалых пчел, включая Melipona spp., Trigona spp., Tetragonisca spp. и Scapt или trigona spp. проявляют терапевтические свойства для лечения воспалений (Ranneh et al., 2019; Biluca et al., 2020), заживления ран (Abd Jal. et al., 2017; Abdul Malik et al., 2020) и окислительный стресс (Abid et al., 2017; Ranneh et al., 2018; Biluca et al., 2020). Кроме того, ранее сообщалось о биодоступности наиболее многообещающих соединений, таких как апигенин, хризин и кверцетин, в меде безжалых пчел (Zulkhairi Amin et al., 2018). Следовательно, они обладают биологическим потенциалом для современного медицинского применения при других патологиях, связанных с нарушением регуляции суставного гомеостаза.
Заключение и перспективы на будущее
С древних времен терапевтические эффекты меда были описаны и широко наблюдались при лечении ран, кашля, кожных инфекций и воспалений. В настоящее время изучается эффективность меда в противодействии суставным повреждениям для улучшения качества жизни людей с ОА.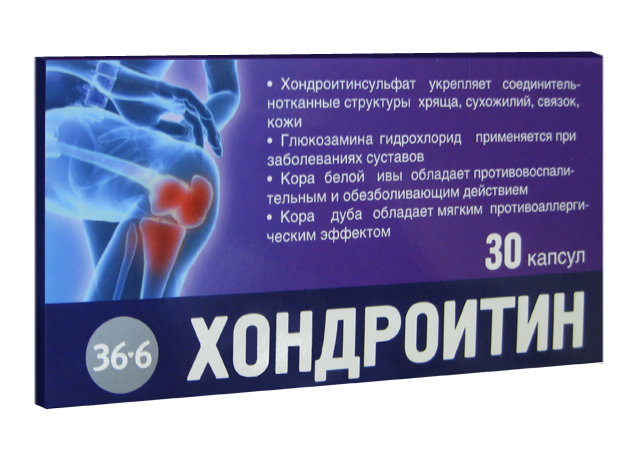 Мы знаем, что биологически активные соединения меда оказывают хондропротекторное действие, противодействуя гомеостатической дисрегуляции сустава. Таким образом, его использование в качестве терапевтического инструмента при лечении ОА широко поддерживается, поскольку он может смещать основные сигнальные пути, связанные с ОА. Эта адъювантная немедикаментозная стратегия может облегчить боль, отрегулировать гомеостаз суставов и восстановить AC, замедляя прогрессирование ОА; таким образом, уменьшая физические ограничения, инвалидность, умственное напряжение и социально-экономическое бремя, обычно наблюдаемое у людей с этим хроническим заболеванием.
Мы знаем, что биологически активные соединения меда оказывают хондропротекторное действие, противодействуя гомеостатической дисрегуляции сустава. Таким образом, его использование в качестве терапевтического инструмента при лечении ОА широко поддерживается, поскольку он может смещать основные сигнальные пути, связанные с ОА. Эта адъювантная немедикаментозная стратегия может облегчить боль, отрегулировать гомеостаз суставов и восстановить AC, замедляя прогрессирование ОА; таким образом, уменьшая физические ограничения, инвалидность, умственное напряжение и социально-экономическое бремя, обычно наблюдаемое у людей с этим хроническим заболеванием.
Имеются четкие доказательства того, что натуральные продукты представляют собой превосходный источник биоактивных молекул с потенциальными медицинскими применениями. Мы представили семь натуральных соединений, полученных из меда, в качестве возможных кандидатов для лечения ОА из-за их хондропротекторной активности. Тем не менее, существует ограниченное количество отчетов in vitro и in vivo , показывающих молекулярные пути, лежащие в основе биологического действия флавоноидов, полученных из меда. Суставной гомеостаз довольно сложен, и его полное восстановление с помощью одной молекулы после воздействия биомеханического, воспалительного или окислительного стресса может быть сложным.Тем не менее максимальный терапевтический потенциал может быть достигнут комбинацией этих молекул. Однако подходящая дозировка и результат представляют собой сложную проблему. В этом контексте необходимы дальнейшие доклинические исследования, чтобы подтвердить новые применения меда в качестве рациональной терапевтической стратегии при ОА, учитывая, что большинство текущих отчетов показали влияние биологически активных флавоноидов на регуляцию суставного гомеостаза в исследованиях in vitro . Наконец, очень важно разработать клинические испытания для проверки безопасности и эффективности биологически активных соединений, полученных из меда, чтобы лучше понять их активность на клеточном и молекулярном уровне для будущих терапевтических подходов.
Суставной гомеостаз довольно сложен, и его полное восстановление с помощью одной молекулы после воздействия биомеханического, воспалительного или окислительного стресса может быть сложным.Тем не менее максимальный терапевтический потенциал может быть достигнут комбинацией этих молекул. Однако подходящая дозировка и результат представляют собой сложную проблему. В этом контексте необходимы дальнейшие доклинические исследования, чтобы подтвердить новые применения меда в качестве рациональной терапевтической стратегии при ОА, учитывая, что большинство текущих отчетов показали влияние биологически активных флавоноидов на регуляцию суставного гомеостаза в исследованиях in vitro . Наконец, очень важно разработать клинические испытания для проверки безопасности и эффективности биологически активных соединений, полученных из меда, чтобы лучше понять их активность на клеточном и молекулярном уровне для будущих терапевтических подходов.
Терапевтический потенциал биологически активных соединений в меде для лечения остеоартрита
Abstract
Нарушение регуляции гомеостаза суставной ткани вызывает дегенеративные изменения суставов и заболевания опорно-двигательного аппарата, такие как остеоартрит. Эта патология представляет собой первую причину двигательной инвалидности у людей старше 60 лет, влияя на качество их жизни и расходы на системы здравоохранения. В настоящее время фармакологические методы лечения заболеваний хряща не обеспечивают полной регенерации тканей, что приводит к функциональной потере сустава; поэтому эндопротезирование суставов является золотым стандартом лечения этой патологии в тяжелых случаях остеоартрита.Другим методом лечения является использование противовоспалительных препаратов, которые в некоторой степени уменьшают боль и воспаление, но без значительного торможения прогрессирования заболевания. В этом смысле были предложены новые терапевтические альтернативы на основе природных соединений для замедления прогрессирования остеоартрита, особенно тех агентов, которые регулируют суставной гомеостаз. Доклинические исследования показали терапевтическое применение меда и его биоактивных соединений, начиная от лечения ран, кашля, кожных инфекций, а также в качестве биологического стимулятора, проявляя антиоксидантные и противовоспалительные свойства.
Эта патология представляет собой первую причину двигательной инвалидности у людей старше 60 лет, влияя на качество их жизни и расходы на системы здравоохранения. В настоящее время фармакологические методы лечения заболеваний хряща не обеспечивают полной регенерации тканей, что приводит к функциональной потере сустава; поэтому эндопротезирование суставов является золотым стандартом лечения этой патологии в тяжелых случаях остеоартрита.Другим методом лечения является использование противовоспалительных препаратов, которые в некоторой степени уменьшают боль и воспаление, но без значительного торможения прогрессирования заболевания. В этом смысле были предложены новые терапевтические альтернативы на основе природных соединений для замедления прогрессирования остеоартрита, особенно тех агентов, которые регулируют суставной гомеостаз. Доклинические исследования показали терапевтическое применение меда и его биоактивных соединений, начиная от лечения ран, кашля, кожных инфекций, а также в качестве биологического стимулятора, проявляя антиоксидантные и противовоспалительные свойства. В этой статье мы рассмотрели современные лекарственные применения меда, уделив особое внимание его использованию для регулирования суставного гомеостаза путем подавления воспаления и окислительного стресса.
В этой статье мы рассмотрели современные лекарственные применения меда, уделив особое внимание его использованию для регулирования суставного гомеостаза путем подавления воспаления и окислительного стресса.
Ключевые слова: Суставной гомеостаз, остеоартроз, воспаление, медовые флавоноиды, окислительно-восстановительный гомеостаз, хрящ, хондропротекторная активность это связано с различными этиологическими факторами, такими как старение, генетика, метаболический и биомеханический стресс.В этом контексте воспаление и окислительный стресс играют ключевую роль в прогрессирующем ухудшении состояния суставных тканей, включая суставной хрящ (АС), субхондральную кость, синовиальную оболочку и мениск, которые поддерживают функциональность суставов до тех пор, пока не возникнет обострение гомеостатической дисфункции (Minguzzi et al. , 2018). Несмотря на клиническую значимость ОА, которым страдает более четверти населения мира старше 18 лет (Chen D. et al., 2017), фармакологические стратегии предотвращения прогрессирования ОА ограничены.
Лечение ОА включает контроль веса и специальные физические упражнения в качестве интервенционных стратегий для поддержки фармакологической терапии (Watt and Gulati, 2017). Первая линия вмешательства включает нестероидные противовоспалительные препараты и ацетаминофен для контроля хронической боли. Ингибиторы циклооксигеназы-II, внутрисуставные стероиды и добавки для повышения вязкости также рассматриваются, когда стандартное лечение неэффективно; тем не менее их клиническая эффективность невысока у пациентов с сопутствующими заболеваниями (Jones et al., 2019). Следовательно, использование обезболивающих препаратов не представляет собой терапевтическую стратегию для остановки или устранения повреждения хряща, а также не регулирует гомеостаз АЦ, делая АЦ склонным к дальнейшему повреждению (Saccomano, 2018).
В настоящее время продукты пчеловодства используются для лечения различных воспалительных заболеваний суставов в качестве немедикаментозной терапии. При альтернативных или адъювантных терапевтических схемах у людей наблюдался потенциальный физиопатологический эффект меда, пыльцы, прополиса и пчелиного яда (Almuhareb et al. , 2019; Conrad et al., 2019), мышиные модели (Owoyele et al., 2011; Hsieh et al., 2019) и исследования in vitro (Jeong et al., 2015; Locatelli et al., 2018). Эти преимущества для здоровья в основном наблюдаются при использовании меда из южного полушария, такого как мед манука и мед безжалостных пчел, и их польза для здоровья объясняется их фармакологически активными компонентами (Al-Hatamleh et al., 2020).
, 2019; Conrad et al., 2019), мышиные модели (Owoyele et al., 2011; Hsieh et al., 2019) и исследования in vitro (Jeong et al., 2015; Locatelli et al., 2018). Эти преимущества для здоровья в основном наблюдаются при использовании меда из южного полушария, такого как мед манука и мед безжалостных пчел, и их польза для здоровья объясняется их фармакологически активными компонентами (Al-Hatamleh et al., 2020).
Согласно опубликованным данным, различные биологически активные соединения, обычно присутствующие в меде, играют эффективную роль в уменьшении внутрисуставных повреждений за счет ингибирования воспаления, окислительного стресса, синовиальной гиперплазии и ангиогенеза (Wang et al., 2007; Ян и др., 2018 г.; Ли и др., 2019; Орхан и Дениз, 2020 г .; Юань и др., 2020). В частности, защита хряща и усиление репаративных функций хондроцитов, вызванные медом, включают несколько биологически активных молекул, таких как хризин, апигенин, кверцетин, байкалин, лютеолин, физетин, бутеин, среди других флавоноидов и фенольных соединений. Настоящий описательный обзор направлен на обсуждение нового медицинского применения меда и выделение роли его полифенолов как потенциальных регуляторов суставного гомеостаза при ОА.Поэтому мы провели поиск статей, опубликованных до марта 2021 года в базе данных PubMed, с учетом следующих критериев: флавоноиды меда с биологическим действием на хондроциты и суставной гомеостаз. В результате этого поиска мы обнаружили, что данные in vitro в основном основаны на чистых соединениях, и лишь некоторые из них включали анализы в доклинических моделях ОА.
Настоящий описательный обзор направлен на обсуждение нового медицинского применения меда и выделение роли его полифенолов как потенциальных регуляторов суставного гомеостаза при ОА.Поэтому мы провели поиск статей, опубликованных до марта 2021 года в базе данных PubMed, с учетом следующих критериев: флавоноиды меда с биологическим действием на хондроциты и суставной гомеостаз. В результате этого поиска мы обнаружили, что данные in vitro в основном основаны на чистых соединениях, и лишь некоторые из них включали анализы в доклинических моделях ОА.
Влияние воспаления и окислительного стресса на гомеостаз хряща
Это дегенеративное заболевание суставов характеризуется нарушением суставного гомеостаза с устойчивой продукцией провоспалительных цитокинов, ферментов деградации внеклеточного матрикса (ECM), свободных радикалов, включая активные формы кислорода (АФК) и активные формы азота (РЧА) (Сурапанени и Венкатарамана, 2007).
В нормальных условиях хондроциты выполняют анаболические функции, поддерживая замену определенных компонентов ВКМ с низким оборотом, включая коллагены, протеогликаны и неколлагеновые белки (Singh et al. , 2019). Скорость отложения белка ВКМ регулируется индуцируемым гипоксией фактором 1 альфа (HIF-1α), который в микроокружении с низкой концентрацией кислорода индуцирует экспрессию SOX9, главного транскрипционного регулятора хондрогенеза. SOX9 способствует экспрессии генов, специфичных для хондроцитов, таких как коллаген II типа (COL2A1) и аггрекан (ACAN), которые являются основными компонентами ВКМ при AC (Akiyama et al., 2002; Амарилио и др., 2007) (). Однако измененная функциональность антиоксидантной системы, несбалансированная передача сигналов воспаления, старение AC и другие неблагоприятные воздействия микросреды вызывают метаболический сдвиг от анаболизма к катаболизму (Singh et al., 2019). Высокоактивное метаболическое состояние при AC приводит к синтезу воспалительных и деградирующих белков, которые активируют клеточное старение и функцию иммунных клеток внутри остеоартритного сустава.
, 2019). Скорость отложения белка ВКМ регулируется индуцируемым гипоксией фактором 1 альфа (HIF-1α), который в микроокружении с низкой концентрацией кислорода индуцирует экспрессию SOX9, главного транскрипционного регулятора хондрогенеза. SOX9 способствует экспрессии генов, специфичных для хондроцитов, таких как коллаген II типа (COL2A1) и аггрекан (ACAN), которые являются основными компонентами ВКМ при AC (Akiyama et al., 2002; Амарилио и др., 2007) (). Однако измененная функциональность антиоксидантной системы, несбалансированная передача сигналов воспаления, старение AC и другие неблагоприятные воздействия микросреды вызывают метаболический сдвиг от анаболизма к катаболизму (Singh et al., 2019). Высокоактивное метаболическое состояние при AC приводит к синтезу воспалительных и деградирующих белков, которые активируют клеточное старение и функцию иммунных клеток внутри остеоартритного сустава.
Дисрегуляция суставного гомеостаза при ОА. (A) Анаболический метаболизм регулирует экспрессию генов и синтез белков COL2A1 и ACAN в хондроцитах, поддерживая компоненты AC в состоянии низкого обмена. (B) Эта схема представляет гомеостатическое нарушение AC, вызванное окислительным стрессом и провоспалительными цитокинами. Передача сигналов IL-1 и TNF-α запускает активацию MMP и ADAMTS. Затем усиленное высвобождение MMP-13 вызывает гидролиз COL2A1 и ACAN, которые считаются ключевыми компонентами матрицы AC.Деградация матрикса усиливается активностью ADAMTS, что приводит к потере целостности хряща и дополнительной потере функции сустава. Воспаление, ROS и RNS не только стимулируют экспрессию ферментов деградации ECM, но также нарушают способность хондроцитов восстанавливать поврежденный хрящ, блокируя передачу сигналов HIF-1α и SOX9. AC: суставной хрящ; АКАН: агрекан; ADAMTS: дезинтегрин и металлопротеиназа с мотивом тромбоспондина; COL2A1: коллаген II типа; ECM: внеклеточный матрикс; HIF-1α: индуцируемый гипоксией фактор 1 альфа; ММП: металлопротеиназы; АФК: активные формы кислорода; RNS: активные формы азота.
(B) Эта схема представляет гомеостатическое нарушение AC, вызванное окислительным стрессом и провоспалительными цитокинами. Передача сигналов IL-1 и TNF-α запускает активацию MMP и ADAMTS. Затем усиленное высвобождение MMP-13 вызывает гидролиз COL2A1 и ACAN, которые считаются ключевыми компонентами матрицы AC.Деградация матрикса усиливается активностью ADAMTS, что приводит к потере целостности хряща и дополнительной потере функции сустава. Воспаление, ROS и RNS не только стимулируют экспрессию ферментов деградации ECM, но также нарушают способность хондроцитов восстанавливать поврежденный хрящ, блокируя передачу сигналов HIF-1α и SOX9. AC: суставной хрящ; АКАН: агрекан; ADAMTS: дезинтегрин и металлопротеиназа с мотивом тромбоспондина; COL2A1: коллаген II типа; ECM: внеклеточный матрикс; HIF-1α: индуцируемый гипоксией фактор 1 альфа; ММП: металлопротеиназы; АФК: активные формы кислорода; RNS: активные формы азота.
Вышеупомянутые изменения вызывают состояние устойчивого катаболизма, который увековечивает прогрессирующее разрушение хряща и разрушает ткани суставов. Поскольку при ОА существенно страдает количество хондроцитов и их жизнеспособность, снижается синтез компонентов ВКМ. Нарушение целостности AC ослабляет суставной гомеостаз, неблагоприятно влияя на функцию других суставных тканей, таких как синовиальная оболочка, мениск и субхондральная кость (Stolberg-Stolberg et al., 2020).Более того, из-за молекулярных стимулов, вызванных повреждением коллагеновой сети и синовитом, увеличивается инфильтрация мононуклеарных клеток в синовиальную оболочку, что приводит к устойчивым воспалительным сигнальным путям. Кроме того, усиленные воспалительные биомаркеры во внутрисуставном пространстве играют важную роль в ремоделировании ВКМ, включая гипертрофическую дифференцировку хондроцитов (Minguzzi et al., 2018).
Поскольку при ОА существенно страдает количество хондроцитов и их жизнеспособность, снижается синтез компонентов ВКМ. Нарушение целостности AC ослабляет суставной гомеостаз, неблагоприятно влияя на функцию других суставных тканей, таких как синовиальная оболочка, мениск и субхондральная кость (Stolberg-Stolberg et al., 2020).Более того, из-за молекулярных стимулов, вызванных повреждением коллагеновой сети и синовитом, увеличивается инфильтрация мононуклеарных клеток в синовиальную оболочку, что приводит к устойчивым воспалительным сигнальным путям. Кроме того, усиленные воспалительные биомаркеры во внутрисуставном пространстве играют важную роль в ремоделировании ВКМ, включая гипертрофическую дифференцировку хондроцитов (Minguzzi et al., 2018).
Дисбалансу между анаболизмом и катаболизмом, возникающему при прогрессировании ОА, можно немного противодействовать экспрессией трансформирующего фактора роста-бета (TFG-β), который модифицирует дисбаланс синтеза-замещения протеогликанов в ВКМ (Scharstuhl et al.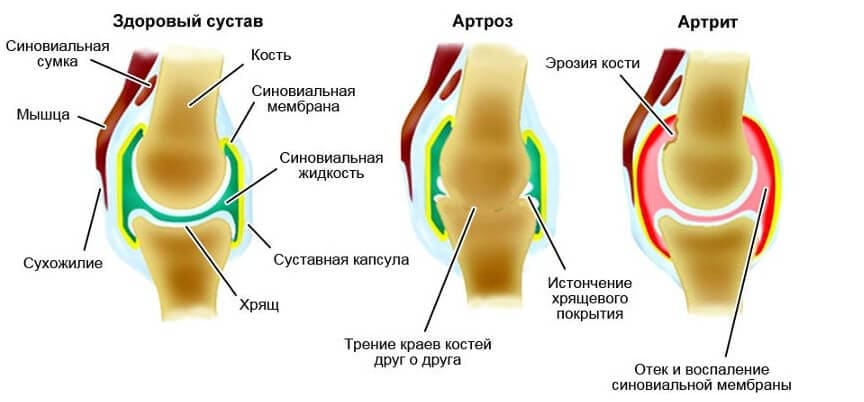 , 2002; Джими и др., 2019). Однако катаболическая активность также связана с более низким ответом на стимуляцию хондроцитов инсулиноподобным фактором роста 1 (IGF-1), снижением продукции белков ВКМ и, следовательно, репаративного процесса (Jimi et al., 2019; Morscheid и др., 2019).
, 2002; Джими и др., 2019). Однако катаболическая активность также связана с более низким ответом на стимуляцию хондроцитов инсулиноподобным фактором роста 1 (IGF-1), снижением продукции белков ВКМ и, следовательно, репаративного процесса (Jimi et al., 2019; Morscheid и др., 2019).
Влияние воспаления на деградацию хряща
Медиаторы воспаления считаются критическими участниками разрушения хряща и синовита при ОА. Однако генетические факторы, возрастные изменения и биомеханический стресс вследствие ожирения, хирургического вмешательства или травматического повреждения являются основной причиной нарушения гомеостатической регуляции суставов при ОА (McAlindon et al., 2014). Кроме того, развитие, эволюция и сохранение ОА характеризуются постепенной потерей протеогликанов и COL2A1 с последующим образованием фиброзного хряща, что связано с высокой продукцией цитокинов, включая IL-1β, TNF-α, IL-6, IL-15. и Ил-18. Передача сигналов провоспалительных цитокинов стимулирует фенотипический сдвиг AC, апоптоз и усугубляет синовиальный фиброз (Jimi et al.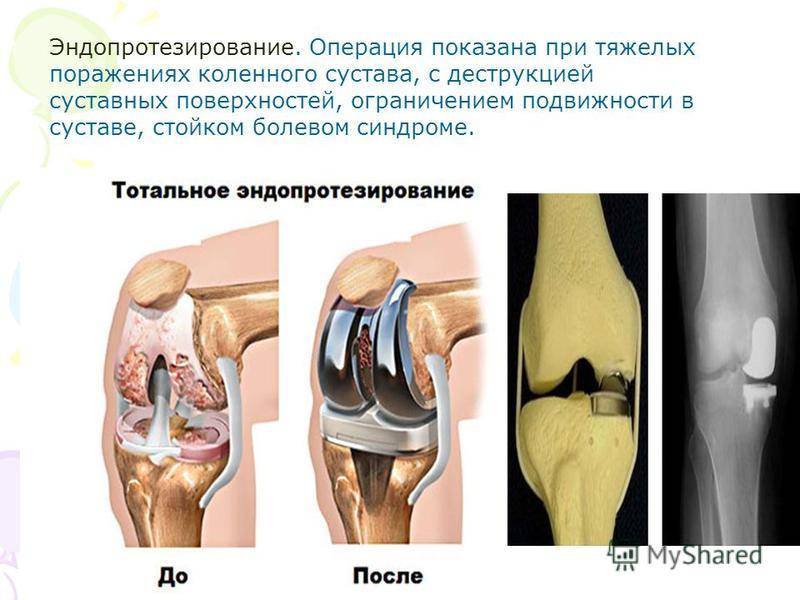 , 2019; Zhao et al., 2020). Обострение воспалительного стресса во внутрисуставном пространстве активирует путь канонического ядерного фактора каппа-легкая цепь-энхансер активированных В-клеток (NF-kB) в хондроцитах и синовиоцитах.Передача сигналов NF-κB опосредована многосубъединичным комплексом киназы IκB (IKK), который может реагировать на цитокиновый стимул (12). После активации NF-κB подвергается ядерной транслокации, затем он управляет экспрессией различных генов, включая индуцибельную циклооксигеназу 2 (COX-2), провоспалительные цитокины и хемокины, которые поддерживают воспаление суставов (Jimi et al., 2019). На молекулярном уровне высокая концентрация IL-1β и TNF-α в синовиальной жидкости может активировать катаболические процессы, приводящие к фибробластоподобному пироптозу синовиоцитов (Shen et al., 2014; Чжан Л. и др., 2019). В синовиальной оболочке усиленное высвобождение провоспалительных цитокинов вызывает аномальную пролиферацию синовиоцитов, вызывающую инфильтрацию иммунных клеток в синовиальную ткань.
, 2019; Zhao et al., 2020). Обострение воспалительного стресса во внутрисуставном пространстве активирует путь канонического ядерного фактора каппа-легкая цепь-энхансер активированных В-клеток (NF-kB) в хондроцитах и синовиоцитах.Передача сигналов NF-κB опосредована многосубъединичным комплексом киназы IκB (IKK), который может реагировать на цитокиновый стимул (12). После активации NF-κB подвергается ядерной транслокации, затем он управляет экспрессией различных генов, включая индуцибельную циклооксигеназу 2 (COX-2), провоспалительные цитокины и хемокины, которые поддерживают воспаление суставов (Jimi et al., 2019). На молекулярном уровне высокая концентрация IL-1β и TNF-α в синовиальной жидкости может активировать катаболические процессы, приводящие к фибробластоподобному пироптозу синовиоцитов (Shen et al., 2014; Чжан Л. и др., 2019). В синовиальной оболочке усиленное высвобождение провоспалительных цитокинов вызывает аномальную пролиферацию синовиоцитов, вызывающую инфильтрацию иммунных клеток в синовиальную ткань. Кроме того, макрофагальный хемокиновый белок 1 (MCP-1) стимулирует миграцию макрофагов и нейтрофилов в синовиальное пространство, что поддерживает высокий уровень воспаления, связанный с тяжестью ОА (Xu et al., 2015; Haraden et al., 2019). ).
Кроме того, макрофагальный хемокиновый белок 1 (MCP-1) стимулирует миграцию макрофагов и нейтрофилов в синовиальное пространство, что поддерживает высокий уровень воспаления, связанный с тяжестью ОА (Xu et al., 2015; Haraden et al., 2019). ).
Высокие уровни IL-1β внутри сустава индуцируют экспрессию генов матриксных металлопротеиназ (ММР), дезинтегрина и металлопротеиназы (ADAM), а также экспрессию генов дезинтегрина и металлопротеиназы с тромбоспондиновым мотивом (ADAMTS) в хондроцитах и синовиоцитах , ускоряя развитие ОА из-за значительной деградации ACAN и коллагеновых фибрилл в хрящах (Struglics et al., 2006). Кроме того, за счет высокой ферментативной активности в АЦ увеличивается концентрация продуктов деградации матрикса, в том числе фрагментов COL2A1, ACAN и фибронектина. Это явление запускает активацию MMPs, VEGF и высокую продукцию оксида азота (NO) за счет активации TLR2 в хондроцитах, что дополнительно способствует катаболической функции и разрушению хряща (Xie et al. , 1993; Fichter et al., 2006; Hwang). et al., 2015; Lees et al., 2015; Jung et al., 2019).
, 1993; Fichter et al., 2006; Hwang). et al., 2015; Lees et al., 2015; Jung et al., 2019).
Окислительный и нитрозативный стресс при деградации хряща
Повторяющиеся циклы воспаления и устойчивое анаболо-катаболическое переключение могут вызывать перепроизводство АФК и АРНК в хряще, нарушая внутриклеточный окислительно-восстановительный статус (), которые играют важную роль в регуляции хондроцитов гипертрофия, дисфункция митохондрий, а также роль в окислительном повреждении ДНК, белков и липидов (Ostalowska et al., 2006; Сурапанени и Венкатарамана, 2007 г.; Гаврилидис и др., 2013). В этом контексте окислительный стресс модифицирует белки хрящевого матрикса, обнаруженные в аппарате Гольджи и эндоплазматическом ретикулуме хондроцитов, уменьшая их синтез (Yu and Kim, 2013). Кроме того, избыток АФК может также спровоцировать деградацию ВКМ посредством двух разных механизмов. Во-первых, АФК могут осуществлять прямой гидролиз компонентов матрицы; во-вторых, он способствует экспрессии MMP, которые генерируют гипертрофический хрящевой матрикс (Lepetsos and Papavassiliou, 2016).
Предыдущие исследования показали снижение активности антиоксидантных ферментов при ОА, что нарушает метаболизм и клеточную пролиферацию хондроцитов (Morita et al., 2007; Surapaneni and Venkataramana, 2007; Goodwin et al., 2010). На окислительно-восстановительный баланс в AC влияет подавление активности гемоксигеназы 1 (HO-1), что приводит к окислительному стрессу и последующему старению и апоптозу (Davidson et al., 2013; Cai et al., 2015; Takada et al., 2015). ). Концентрации оксида азота (NO) выше базового функционируют как критическая сигнальная молекула при гипертрофической дифференцировке и апоптозе хондроцитов посредством заметного снижения передачи сигналов HIF-1α (Bai et al., 2019). Кроме того, гомеостатические пути, связанные с хондрогенезом, могут меняться из-за ингибирования HIF-1α (12).
Из-за этой сложной патофизиологической картины апитерапия при ОА недавно стала новой нефармакологической стратегией для уменьшения молекулярных событий, которые вызывают структурные и функциональные повреждения в тканях суставов, вызванные воспалением, нитрозативным и оксидативным стрессом при заболеваниях АЦ.
Противовоспалительное и антиоксидантное действие меда
Мед представляет собой натуральный вязкий сладкий и ароматный раствор, потребляемый из-за его высокой питательной ценности и положительного воздействия на здоровье человека.В меде содержится около 200 различных химических соединений, включая широкий спектр фенольных соединений, обладающих антиоксидантными, бактериостатическими, противомикробными и противовоспалительными свойствами (Alvarez-Suarez et al., 2013). Биологические эффекты меда объясняются высокой концентрацией полифенольных соединений (флавоноидов), которые определяют его антиоксидантные и противовоспалительные свойства (Shen et al., 2019; Goslinski et al., 2020). Мед содержит различные биологически активные молекулы, включая p -кумаровую кислоту, эвгенол, феруловую кислоту, кофейную кислоту, пинобанксин, пиноцембрин, хризин, кверцетин, апигенин, галангин, изорамнетин, галловую кислоту, кемпферол, сирингиновую кислоту, лютеолин и нарингин; тем не менее, их концентрация варьируется в зависимости от типа меда (Ciulu et al. , 2016; да Силва и др., 2016; Шен и др., 2019). Кроме того, новое исследование недавно выявило везикулоподобные наночастицы (VLN) в качестве нового биологически активного агента в меде (Chen et al., 2021).
, 2016; да Силва и др., 2016; Шен и др., 2019). Кроме того, новое исследование недавно выявило везикулоподобные наночастицы (VLN) в качестве нового биологически активного агента в меде (Chen et al., 2021).
Мед с древних времен использовался в качестве лечебного средства при самых разных клинических состояниях. Его наиболее замечательная эффективность заключается в заживлении ран (Frydman et al., 2020; Smaropoulos and Cremers, 2020) и лечении заболеваний желудочно-кишечного тракта (Bilsel et al., 2002; Miguel et al., 2017).Кроме того, в нескольких исследованиях оценивалось влияние меда на рак (Afrin et al., 2018b; Mohammed et al., 2020), диабет (Sahlan et al., 2020) и дислипидемию (Ramli et al., 2019), показывая значительное мелиоративные эффекты. Аналогичным образом сообщалось об антимикробном действии при использовании меда (Rosli et al., 2020).
О роли меда в воспалительном процессе сообщили Аль-Ваили и Бони (2003); они показали, что при употреблении разбавленного натурального меда концентрация простагландина Е2, простагландина F2α и тромбоксана B2 снижалась в плазме здоровых людей (Al-Waili and Boni, 2003). Другое недавнее исследование показало биологическую роль VLN, полученных из меда, которые проявляют мощную противовоспалительную активность, подавляя активацию воспалительных процессов NLRP3 и передачу сигналов NF-κB. Кроме того, РНК небольшого размера были идентифицированы как молекулы, которые значительно улучшали воспалительную активность NLRP3, в частности, miR-4057 защищала мышей от острых воспалительных состояний в печени (Chen et al., 2021). С другой стороны, в различных исследованиях изучалось влияние потребления меда на уровни малонового диальдегида и АФК у спортсменов и моделей на мышах, где люди подвергались высокоэффективным режимам упражнений.Авторы пришли к выводу, что потребление меда приводит к заметному снижению биомаркеров окислительного повреждения, вызванного высокой физической активностью (Ahmad et al., 2017; Jurcău and Jurcău, 2017; Hills et al., 2019).
Другое недавнее исследование показало биологическую роль VLN, полученных из меда, которые проявляют мощную противовоспалительную активность, подавляя активацию воспалительных процессов NLRP3 и передачу сигналов NF-κB. Кроме того, РНК небольшого размера были идентифицированы как молекулы, которые значительно улучшали воспалительную активность NLRP3, в частности, miR-4057 защищала мышей от острых воспалительных состояний в печени (Chen et al., 2021). С другой стороны, в различных исследованиях изучалось влияние потребления меда на уровни малонового диальдегида и АФК у спортсменов и моделей на мышах, где люди подвергались высокоэффективным режимам упражнений.Авторы пришли к выводу, что потребление меда приводит к заметному снижению биомаркеров окислительного повреждения, вызванного высокой физической активностью (Ahmad et al., 2017; Jurcău and Jurcău, 2017; Hills et al., 2019).
Основываясь на результатах доклинических исследований, мед является новым перспективным средством лечения прогрессирования ОА путем воздействия на катаболизм в тканях суставов и восстановления суставного гомеостаза.
Потенциальное использование меда для регулирования суставного гомеостаза
Защитная активность меда при ОА была оценена на различных животных моделях и исследованиях in vitro .Предыдущие исследования были направлены на выявление противовоспалительного действия меда манука на макрофаги, стимулированные ЛПС. Результаты показали, что мед манука повышает жизнеспособность клеток за счет уменьшения апоптоза, ингибирования образования свободных радикалов и ослабления воспаления. Эти эффекты регулировались уменьшением количества белков каспазы-3, p-p38 и p -Erk1/2 на молекулярном уровне. Более того, также было продемонстрировано усиление митохондриального дыхания и гликолитической активности, что привело к экспрессии и стимуляции p -AMPK, SIRT1 и PGC1alpha (Afrin et al., 2018а; Гаспаррини и др., 2018). Биологический потенциал меда манука объясняется соединениями кверцетина и галловой кислоты, которые также присутствуют в других видах меда во всем мире в высоких концентрациях (Tomás-Barberán et al.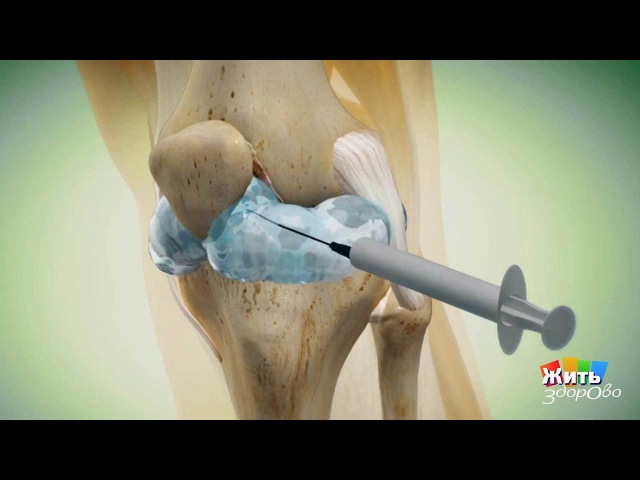 , 1993; Samargandian et al., 2017).
, 1993; Samargandian et al., 2017).
С другой стороны, исследование in vivo выявило появляющиеся противовоспалительные и антиоксидантные свойства нигерийского меда при формальдегид-индуцированном артрите у крыс Wistar. Это исследование показало, что потребление меда значительно уменьшало воспаление, аналогично лечению индометацином в течение десятидневного вмешательства (Owoyele et al., 2011). Кроме того, было описано благотворное влияние меда и его производных биоактивных соединений на здоровье костей (Kamaruzzaman et al., 2019).
Флавоноиды, содержащиеся в меде, удаляют свободные радикалы кислорода, уменьшая воспаление и сводя к минимуму повреждение тканей (Candiracci et al., 2012). Предыдущая работа Alvarez-Suarez et al. проанализировали содержание фенолов в меде манука с помощью ВЭЖХ-МС , и было высказано предположение, что эти компоненты улучшают внутриклеточный антиоксидантный и противовоспалительный ответ (Alvarez-Suarez et al., 2016). Недавно была исследована эффективность компонентов меда в отношении жизнеспособности хондроцитов, воспалений и передачи сигналов окислительного стресса.
Недавно была исследована эффективность компонентов меда в отношении жизнеспособности хондроцитов, воспалений и передачи сигналов окислительного стресса.
Соединения меда оказывают хондропротекторный эффект
Хондрогенный потенциал биоактивных соединений меда наблюдался в различных исследованиях in vitro и in vivo (), что предполагает многообещающее применение меда в качестве вспомогательной терапии для восстановления гомеостаза хряща, особенно путем ингибирование воспаления и окислительного стресса, обычно наблюдаемого при ОА.Хотя информация, касающаяся механизмов действия каждого флавоноида, содержащегося в меде, на суставной гомеостаз, все еще ограничена, некоторые биологические процессы, лежащие в основе суставного воспаления, окислительного стресса, хондропротекции и метаболизма в хрящах, уже исследованы.
Хондропротекторное действие биологически активных соединений, содержащихся в меде. (A) Структура биоактивных молекул меда с потенциальным применением для борьбы с нарушением регуляции суставного гомеостаза. (B) Механизмы воздействия флавоноидов меда на остеоартроз суставов. Различные флавоноиды, обнаруженные в меде, могут модулировать катаболизм в тканях суставов через несколько сигнальных путей, способствующих экспрессии генов, связанных с хондрогенезом, таких как SOX9, ACAN и COL2A1. АКАН: агрекан; AGEs: конечные продукты усиленного гликирования; ECM: внеклеточный матрикс; ГАГ: гликозаминогликаны; HIF-2α: индуцируемый гипоксией фактор 2 альфа; ММП: металлопротеиназы; NO: оксид азота; PGE2: простагландин E2; СОД: супероксиддисмутаза.↑ = активировать/стимулировать/увеличивать; ∅ = подавлять/запрещать/подавлять/уменьшать.
(B) Механизмы воздействия флавоноидов меда на остеоартроз суставов. Различные флавоноиды, обнаруженные в меде, могут модулировать катаболизм в тканях суставов через несколько сигнальных путей, способствующих экспрессии генов, связанных с хондрогенезом, таких как SOX9, ACAN и COL2A1. АКАН: агрекан; AGEs: конечные продукты усиленного гликирования; ECM: внеклеточный матрикс; ГАГ: гликозаминогликаны; HIF-2α: индуцируемый гипоксией фактор 2 альфа; ММП: металлопротеиназы; NO: оксид азота; PGE2: простагландин E2; СОД: супероксиддисмутаза.↑ = активировать/стимулировать/увеличивать; ∅ = подавлять/запрещать/подавлять/уменьшать.
Влияние соединений меда на воспаление суставов
Было подтверждено, что хризин, натуральный флавоноид, извлеченный из меда, ослабляет передачу сигналов воспаления NLRP3, уменьшая синовит и уменьшая высвобождение IL-1β, IL-18, субстанции p и гена кальцитонина родственный пептид в модели ОА коленного сустава, индуцированного мононатрия йодоацетатом (МИА), у крыс (Liao et al. , 2020). Второе исследование показало, что хризин резко блокирует стимулированную IL-1β деградацию IκB-α и активацию NF-κB in vitro с использованием поврежденных IL-1β хондроцитов человека (Zheng et al., 2017б).
, 2020). Второе исследование показало, что хризин резко блокирует стимулированную IL-1β деградацию IκB-α и активацию NF-κB in vitro с использованием поврежденных IL-1β хондроцитов человека (Zheng et al., 2017б).
Недавно была задокументирована биологическая активность лютеолина, другого природного флавоноида, по сигналу воспаления в хондроцитах. Исследование in vitro показало, что предварительная обработка лютеолином играет важную роль в контроле воспаления в хондроцитах крыс посредством ингибирования IL-1β, индуцированного продукции NO, PGE2 и TNF-альфа. Кроме того, лютеолин снижает фосфорилирование NF-kB, что способствует регуляции катаболической активности хондроцитов за счет снижения экспрессии белков iNOS, ЦОГ-2, ММП-1, ММП-3 и ММП-13 (Fei et al., 2019). Более того, исследования на животных показали, что введение через желудочный зонд (10 мг/кг/сут в течение 45 дней) в модели ОА, вызванной МИА, оказывает защитное действие, ослабляя разрушение АЦ и прогрессирование ОА (Fei et al. , 2019). В другом исследовании оценивали биологическую активность лютеолина, модулирующую катаболическую активность в хондроцитах, полученных из модели ОА морской свинки; сообщают, что лютеолин вызывал подавление JNK, p38 и MMP-13, а также низкое производство воспалительных биомаркеров, включая NO, TNF-α и IL-6 (Xue et al., 2019).
, 2019). В другом исследовании оценивали биологическую активность лютеолина, модулирующую катаболическую активность в хондроцитах, полученных из модели ОА морской свинки; сообщают, что лютеолин вызывал подавление JNK, p38 и MMP-13, а также низкое производство воспалительных биомаркеров, включая NO, TNF-α и IL-6 (Xue et al., 2019).
Недавно была задокументирована эффективность кверцетина как противовоспалительной молекулы. Ху и др. продемонстрировали, что кверцетин подавляет воспаление, модулируя поляризацию синовиальных макрофагов до фенотипа М2 и индуцируя экспрессию факторов роста, таких как TGF-β и IGF, которые способствуют хондрогенезу. Хондропротекторный эффект наблюдался также in vivo при внутрисуставном введении кверцетина (Hu et al., 2019).
Влияние соединений меда на ферменты, разлагающие ВКМ
Также была описана роль различных флавоноидов, поддерживающих синтез компонентов ВКМ.Использование хризина в исследовании in vitro показало положительные эффекты, предполагая, что этот флавоноид регулирует экспрессию MMP-1, MMP-3, MMP-13, ADAMTS-4 и ADAMTS-5, а также деградацию ACAN. и COL2A1 на поврежденных IL-1β хондроцитах человека (Zheng et al., 2017b). Эти результаты подтверждаются недавним исследованием, в котором хризин оказывал защитный эффект на хрондроциты ОА человека через подавление хромосомного белка высокой подвижности (HMGB1).Было продемонстрировано, что хризин увеличивает экспрессию COL2A1, в то время как клеточный апоптоз, MMP-13 и IL-6 ингибируются (Zhang C. et al., 2019). Таким образом, хризин может быть потенциальным средством для лечения ОА. Байкалин — еще один многообещающий флавоноид, содержащийся в меде, обладающий хондропротекторным действием. Хуанг и его коллеги недавно сообщили, что байкалин снижает уровни IL-1β и подавляет экспрессию коллагена I, ослабляя дегенерацию хряща и способствуя пролиферации суставных хондроцитов кролика, а также восстанавливая внеклеточный матрикс посредством COL2A1 и секреции ACAN через активацию гена SOX9. (Хуанг и др., 2017).
и COL2A1 на поврежденных IL-1β хондроцитах человека (Zheng et al., 2017b). Эти результаты подтверждаются недавним исследованием, в котором хризин оказывал защитный эффект на хрондроциты ОА человека через подавление хромосомного белка высокой подвижности (HMGB1).Было продемонстрировано, что хризин увеличивает экспрессию COL2A1, в то время как клеточный апоптоз, MMP-13 и IL-6 ингибируются (Zhang C. et al., 2019). Таким образом, хризин может быть потенциальным средством для лечения ОА. Байкалин — еще один многообещающий флавоноид, содержащийся в меде, обладающий хондропротекторным действием. Хуанг и его коллеги недавно сообщили, что байкалин снижает уровни IL-1β и подавляет экспрессию коллагена I, ослабляя дегенерацию хряща и способствуя пролиферации суставных хондроцитов кролика, а также восстанавливая внеклеточный матрикс посредством COL2A1 и секреции ACAN через активацию гена SOX9. (Хуанг и др., 2017).
Также был изучен биологический потенциал физетина и бутеина. Эти соединения оказывают противовоспалительное и антиоксидантное действие за счет восстановления экспрессии COL2A1, ACAN и протеогликанов в монослойных культурах хондроцитов. Физетин и бутеин также могут регулировать провоспалительное повреждение, вызванное ИЛ-1β, посредством индукции низкой продукции NO и PGE2, а также значительного ингибирования экспрессии металлопротеиназ и агреканаз (Zheng et al., 2017a; Zheng et al., 2017в). Кроме того, in vivo моделей ОА показали меньшую деструкцию хряща и повреждение субхондральной кости, когда мышей лечили бутеином и физетином через внутрибрюшинный и пероральный желудочный зонд, соответственно (Zheng et al., 2017a; Zheng et al., 2017c). .
Эти соединения оказывают противовоспалительное и антиоксидантное действие за счет восстановления экспрессии COL2A1, ACAN и протеогликанов в монослойных культурах хондроцитов. Физетин и бутеин также могут регулировать провоспалительное повреждение, вызванное ИЛ-1β, посредством индукции низкой продукции NO и PGE2, а также значительного ингибирования экспрессии металлопротеиназ и агреканаз (Zheng et al., 2017a; Zheng et al., 2017в). Кроме того, in vivo моделей ОА показали меньшую деструкцию хряща и повреждение субхондральной кости, когда мышей лечили бутеином и физетином через внутрибрюшинный и пероральный желудочный зонд, соответственно (Zheng et al., 2017a; Zheng et al., 2017c). .
Лютеолин показал потенциальную роль в качестве хондропротекторной молекулы. Исследования in vivo и in vitro показали, что лютеолин ингибирует экспрессию генов и синтез белка MMP-1, MMP-3, MMP-13, ADAMTS-4 и ADAMTS-5 в культивируемых суставных хондроцитах, стимулированных IL-1β; кроме того, чтобы проанализировать прямое влияние лютеолина на суставы крыс, этим животным вводили внутрисуставную инъекцию лютеолина, что показало ингибирование продукции ММР-3 до стимуляции ИЛ-1β (20 нг/30 мкл) (Kang et al. , 2014).
, 2014).
Апигенин — еще одно соединение меда, которое может играть важную роль в гомеостазе АЦ. Исследование показало, что апигенин снижает экспрессию MMP-13 на линии клеток хондроцитов человека SW1353 , обработанных IL-1β, посредством ингибирования передачи сигналов c-FOS/AP-1 и JAK/STAT (Lim et al., 2011). Более того, сообщалось, что апигенин может ингибировать экспрессию HIF-2α, который является основным регулятором катаболических факторов, таких как ММР-3, ММР-13, ADAMTS-4, IL-6 и ЦОГ (Cho et al., 2019). Недавно Park JS et al. описал антидегенеративный эффект апигенина. , который сообщил, что эта молекула регулирует экспрессию генов ферментов, разрушающих матрикс, таких как MMP1, MMP-3, MMP-13, ADAMTS-4 и ADAMTS-5 в хондроцитах кролика. Кроме того, было замечено, что продукция ММП-3 ингибировалась у крыс, получавших апигенин плюс ИЛ-1β (Park et al., 2016).
Влияние соединений меда на окислительный стресс и антиоксидантные механизмы
В этом контексте нарушение регуляции надазы CD38 может нарушить гомеостаз суставных хондроцитов, способствуя чрезмерному окислительному стрессу в сочетании со значительным снижением экспрессии сиртуина-1 (SIRT-1) . Тем не менее, некоторые флавоноиды, такие как апигенин и кверцетин, могут действовать как ингибиторы CD38, ослабляя высвобождение NO и образование митохондриального супероксида через , поддерживая функцию SIRT-1 и SIRT-3 и регулируя снижение NAD + при IL-1β-стимулированном хондроциты человека (Kellenberger et al., 2011; Ansari et al., 2020).
Тем не менее, некоторые флавоноиды, такие как апигенин и кверцетин, могут действовать как ингибиторы CD38, ослабляя высвобождение NO и образование митохондриального супероксида через , поддерживая функцию SIRT-1 и SIRT-3 и регулируя снижение NAD + при IL-1β-стимулированном хондроциты человека (Kellenberger et al., 2011; Ansari et al., 2020).
Исследования с использованием in vitro IL-1β-поврежденных хондроцитов человека также подтверждают биологическую роль хризина в ингибировании окислительного стресса.Чжэн и др. наблюдали, что хризин значительно ингибирует индуцированную IL-1β продукцию NO и PGE2 на хондроцитах человека, которые были предварительно обработаны и впоследствии стимулированы провоспалительным агентом. Кроме того, этот флавоноид подавлял экспрессию ЦОГ-2 и iNOS (Zheng et al., 2017b).
Недавнее исследование показало, что роль кверцетина не ограничивается ингибированием воспаления, так как кверцетин также способствует анаболической активности на стимулированных IL-1β хондроцитах крыс, а также антиапоптотическому эффекту, посредством , направленного на АФК и ингибирующего Стресс ER через активацию сигнального пути SIRT1/AMPK (Feng et al. , 2019; Ху и др., 2019). Кроме того, второе сообщение показало, что кверцетин, вводимый через желудочный зонд в дозе 25 мг/кг 90 157–90 158 1 у кроликов, моделирующих ОА коленного сустава, активирует супероксиддисмутазу (СОД) и тканевый ингибитор металлопротеиназ-1 (ТИМП-1), способствуя подавлению ММР-13 в синовиальной ткани (Wei et al., 2019). Таким образом, кверцетин уменьшает дегенерацию тканей при ОА, ослабляя реакцию на окислительный стресс и ингибируя деградацию хрящевого ЕСМ.
, 2019; Ху и др., 2019). Кроме того, второе сообщение показало, что кверцетин, вводимый через желудочный зонд в дозе 25 мг/кг 90 157–90 158 1 у кроликов, моделирующих ОА коленного сустава, активирует супероксиддисмутазу (СОД) и тканевый ингибитор металлопротеиназ-1 (ТИМП-1), способствуя подавлению ММР-13 в синовиальной ткани (Wei et al., 2019). Таким образом, кверцетин уменьшает дегенерацию тканей при ОА, ослабляя реакцию на окислительный стресс и ингибируя деградацию хрящевого ЕСМ.
Существуют различные потенциальные свойства апигенина.Например, Crasci et al. сообщили, что апигенин может быть поглотителем свободных радикалов и мощным ингибитором конечных продуктов гликирования. Они также показали, что апигенин восстанавливал продукцию гликозаминогликанов (ГАГ), когда его использовали для лечения суставных хондроцитов человека, ранее стимулированных IL-1β (Crasci et al., 2018).
Влияние соединений меда на хондропротекцию
Биологическая активность байкалина была последовательной в различных исследованиях, показывающих, что байкалин защищает хондроциты от апоптоза и деградации внеклеточного матрикса (Chen C. и др., 2017; Ян и др., 2018 г.; Ли и др., 2020). В этом смысле Chen et al. идентифицировал байкалин как потенциального кандидата для лечения ОА, поскольку он предотвращал разрушение хряща и облегчение синовита в моделях ОА in vivo (Chen C. et al., 2017). Кроме того, байкалин подавляет экспрессию генов, связанных с апоптозом, индуцированную H 2 O 2 (Pan et al., 2017; Cao et al., 2018), в то время как индуцирует экспрессию COL2A1, ACAN и SOX9 у H 2 . O 2 -обработанные хондроциты (Cao et al., 2018).
и др., 2017; Ян и др., 2018 г.; Ли и др., 2020). В этом смысле Chen et al. идентифицировал байкалин как потенциального кандидата для лечения ОА, поскольку он предотвращал разрушение хряща и облегчение синовита в моделях ОА in vivo (Chen C. et al., 2017). Кроме того, байкалин подавляет экспрессию генов, связанных с апоптозом, индуцированную H 2 O 2 (Pan et al., 2017; Cao et al., 2018), в то время как индуцирует экспрессию COL2A1, ACAN и SOX9 у H 2 . O 2 -обработанные хондроциты (Cao et al., 2018).
Хорошо известно, что поддержание аутофагии необходимо для сохранения целостности хряща. В этом смысле новое исследование задокументировало, что байкалин оказывает антиапоптотическое действие за счет повышения экспрессии Bcl-2 и активации аутофагии через miR-766-3p/фактор, индуцирующий апоптоз, митохондриально-ассоциированный 1 (AIFM1) ось, которая усиливает синтез ECM на хондроцитах ОА человека (Li et al. , 2020). Точно так же Ansari et al. обнаружили, что другой флавоноид, бутеин, может активировать аутофагию в IL-1β-стимулированных хондроцитах человека путем ингибирования механистической мишени передачи сигналов рапамицином (mTOR) (Ansari et al., 2018).
, 2020). Точно так же Ansari et al. обнаружили, что другой флавоноид, бутеин, может активировать аутофагию в IL-1β-стимулированных хондроцитах человека путем ингибирования механистической мишени передачи сигналов рапамицином (mTOR) (Ansari et al., 2018).
Принимая во внимание несколько преимуществ для здоровья и общего самочувствия, связанных с медом и его компонентами, новое использование этих продуктов в качестве дополнительной стратегии для регулирования молекулярного механизма, лежащего в основе суставного гомеостаза, ведет к дальнейшим исследованиям применения тканевой инженерии для хряща. ремонт.
Мед в инженерии хрящевых тканей
Способность хряща к саморегенерации низкая, даже когда он заменен тканеинженерными конструкциями.Тем не менее, многие многообещающие стратегии все еще пытаются способствовать восстановлению и регенерации AC. В связи с этим недавние исследования были сосредоточены на разработке каркасов на основе биоматериала меда, таких как гидрогели, для быстрого восстановления хрящей, благодаря присущим меду антибактериальным свойствам и его уникальной вязкости, улучшающим механические свойства гидрогелей (Abd El-Malek et al. al., 2017; Hixon et al., 2019; Bonifacio et al., 2020b). Инновационное включение меда манука в гидрогель способствует in vitro хондрогенезу мезенхимальных стволовых клеток человека через увеличение экспрессии COL2A1, а также синтез ГАГ и протеогликанов; кроме того, не наблюдалось цитотоксического эффекта (Bonifacio et al., 2018; Бонифачо и др., 2020а). На сегодняшний день in vivo исследований активности гидрогелей, содержащихся в меде, показали значительные результаты в отношении ингибирования инфекций и нетяжелых иммунологических реакций (Bonifacio et al., 2020a), которые представляют собой многообещающее средство для регенерации хряща.
al., 2017; Hixon et al., 2019; Bonifacio et al., 2020b). Инновационное включение меда манука в гидрогель способствует in vitro хондрогенезу мезенхимальных стволовых клеток человека через увеличение экспрессии COL2A1, а также синтез ГАГ и протеогликанов; кроме того, не наблюдалось цитотоксического эффекта (Bonifacio et al., 2018; Бонифачо и др., 2020а). На сегодняшний день in vivo исследований активности гидрогелей, содержащихся в меде, показали значительные результаты в отношении ингибирования инфекций и нетяжелых иммунологических реакций (Bonifacio et al., 2020a), которые представляют собой многообещающее средство для регенерации хряща.
Биобезопасность меда для клинического применения
Повышенный интерес к меду для медицинского применения приводит к строгому регулированию его качества и безопасности. Мед также может содержать токсичные соединения, в том числе пестициды (Chiesa et al., 2018; El Agrebi et al., 2020), тяжелые металлы (Bartha et al. , 2020; Bosancic et al., 2020) и антибиотики (Barrasso et al., 2018) из-за загрязнения окружающей среды в местах сбора меда. Бактериальное загрязнение является еще одним важным фактором, который необходимо учитывать, чтобы убедиться, что мед подходит для терапевтических целей; например, наличие спор Clostridium botulinum ранее было выявлено в образцах меда (Nevas et al., 2002; Rosli et al., 2020). В этом контексте использование медицинского меда (MGH) гарантирует его безопасность для клинического применения (Hermanns et al., 2019). Было доказано, что биоактивность меда в виде противомикробных, ранозаживляющих, антиоксидантных и противовоспалительных свойств сохраняется после стерилизации гамма-излучением и продления условий хранения (Postmes et al., 1995; Molan and Allen, 1996; Hussein et al. , 2014).
, 2020; Bosancic et al., 2020) и антибиотики (Barrasso et al., 2018) из-за загрязнения окружающей среды в местах сбора меда. Бактериальное загрязнение является еще одним важным фактором, который необходимо учитывать, чтобы убедиться, что мед подходит для терапевтических целей; например, наличие спор Clostridium botulinum ранее было выявлено в образцах меда (Nevas et al., 2002; Rosli et al., 2020). В этом контексте использование медицинского меда (MGH) гарантирует его безопасность для клинического применения (Hermanns et al., 2019). Было доказано, что биоактивность меда в виде противомикробных, ранозаживляющих, антиоксидантных и противовоспалительных свойств сохраняется после стерилизации гамма-излучением и продления условий хранения (Postmes et al., 1995; Molan and Allen, 1996; Hussein et al. , 2014).
Хотя Manuka MGH широко исследуется во всем мире как новая немедикаментозная терапевтическая стратегия, появляются другие виды меда с аналогичной биологической активностью.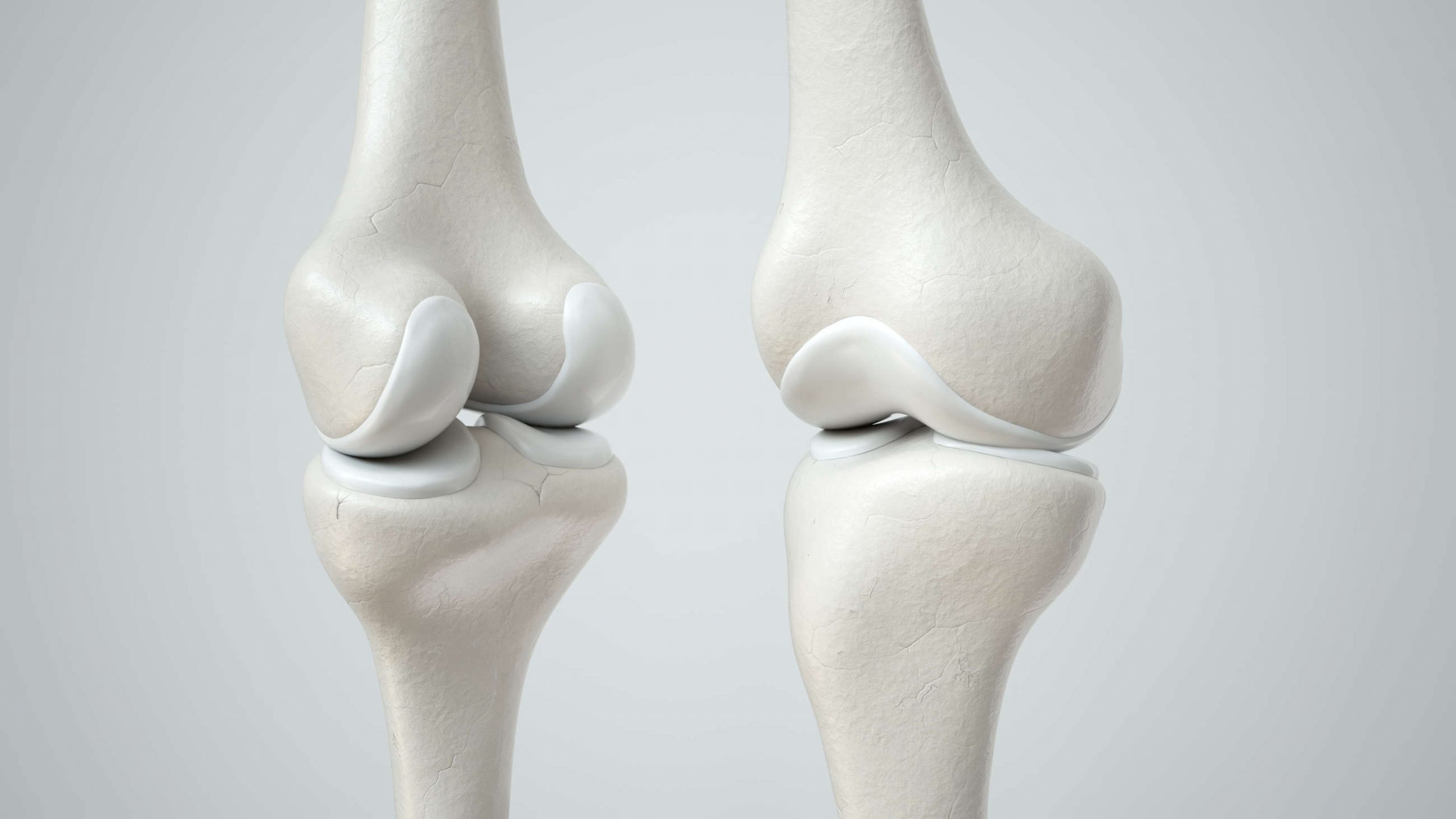 В ранних отчетах мед от безжалых пчел, включая Melipona spp., Trigona spp., Tetragonisca spp. и Scapt или trigona spp. проявляют терапевтические свойства для лечения воспалений (Ranneh et al., 2019; Biluca et al., 2020), заживления ран (Abd Jal. et al., 2017; Abdul Malik et al., 2020) и окислительный стресс (Abid et al., 2017; Ranneh et al., 2018; Biluca et al., 2020). Кроме того, ранее сообщалось о биодоступности наиболее многообещающих соединений, таких как апигенин, хризин и кверцетин, в меде безжалых пчел (Zulkhairi Amin et al., 2018). Следовательно, они обладают биологическим потенциалом для современного медицинского применения при других патологиях, связанных с нарушением регуляции суставного гомеостаза.
В ранних отчетах мед от безжалых пчел, включая Melipona spp., Trigona spp., Tetragonisca spp. и Scapt или trigona spp. проявляют терапевтические свойства для лечения воспалений (Ranneh et al., 2019; Biluca et al., 2020), заживления ран (Abd Jal. et al., 2017; Abdul Malik et al., 2020) и окислительный стресс (Abid et al., 2017; Ranneh et al., 2018; Biluca et al., 2020). Кроме того, ранее сообщалось о биодоступности наиболее многообещающих соединений, таких как апигенин, хризин и кверцетин, в меде безжалых пчел (Zulkhairi Amin et al., 2018). Следовательно, они обладают биологическим потенциалом для современного медицинского применения при других патологиях, связанных с нарушением регуляции суставного гомеостаза.
Заключение и перспективы на будущее
С древних времен терапевтические эффекты меда были описаны и широко наблюдались при лечении ран, кашля, кожных инфекций и воспалений. В настоящее время изучается эффективность меда в противодействии суставным повреждениям для улучшения качества жизни людей с ОА. Мы знаем, что биологически активные соединения меда оказывают хондропротекторное действие, противодействуя гомеостатической дисрегуляции сустава. Таким образом, его использование в качестве терапевтического инструмента при лечении ОА широко поддерживается, поскольку он может смещать основные сигнальные пути, связанные с ОА. Эта адъювантная немедикаментозная стратегия может облегчить боль, отрегулировать гомеостаз суставов и восстановить AC, замедляя прогрессирование ОА; таким образом, уменьшая физические ограничения, инвалидность, умственное напряжение и социально-экономическое бремя, обычно наблюдаемое у людей с этим хроническим заболеванием.
Мы знаем, что биологически активные соединения меда оказывают хондропротекторное действие, противодействуя гомеостатической дисрегуляции сустава. Таким образом, его использование в качестве терапевтического инструмента при лечении ОА широко поддерживается, поскольку он может смещать основные сигнальные пути, связанные с ОА. Эта адъювантная немедикаментозная стратегия может облегчить боль, отрегулировать гомеостаз суставов и восстановить AC, замедляя прогрессирование ОА; таким образом, уменьшая физические ограничения, инвалидность, умственное напряжение и социально-экономическое бремя, обычно наблюдаемое у людей с этим хроническим заболеванием.
Имеются четкие доказательства того, что натуральные продукты представляют собой превосходный источник биоактивных молекул с потенциальными медицинскими применениями. Мы представили семь натуральных соединений, полученных из меда, в качестве возможных кандидатов для лечения ОА из-за их хондропротекторной активности. Тем не менее, существует ограниченное количество отчетов in vitro и in vivo , показывающих молекулярные пути, лежащие в основе биологического действия флавоноидов, полученных из меда.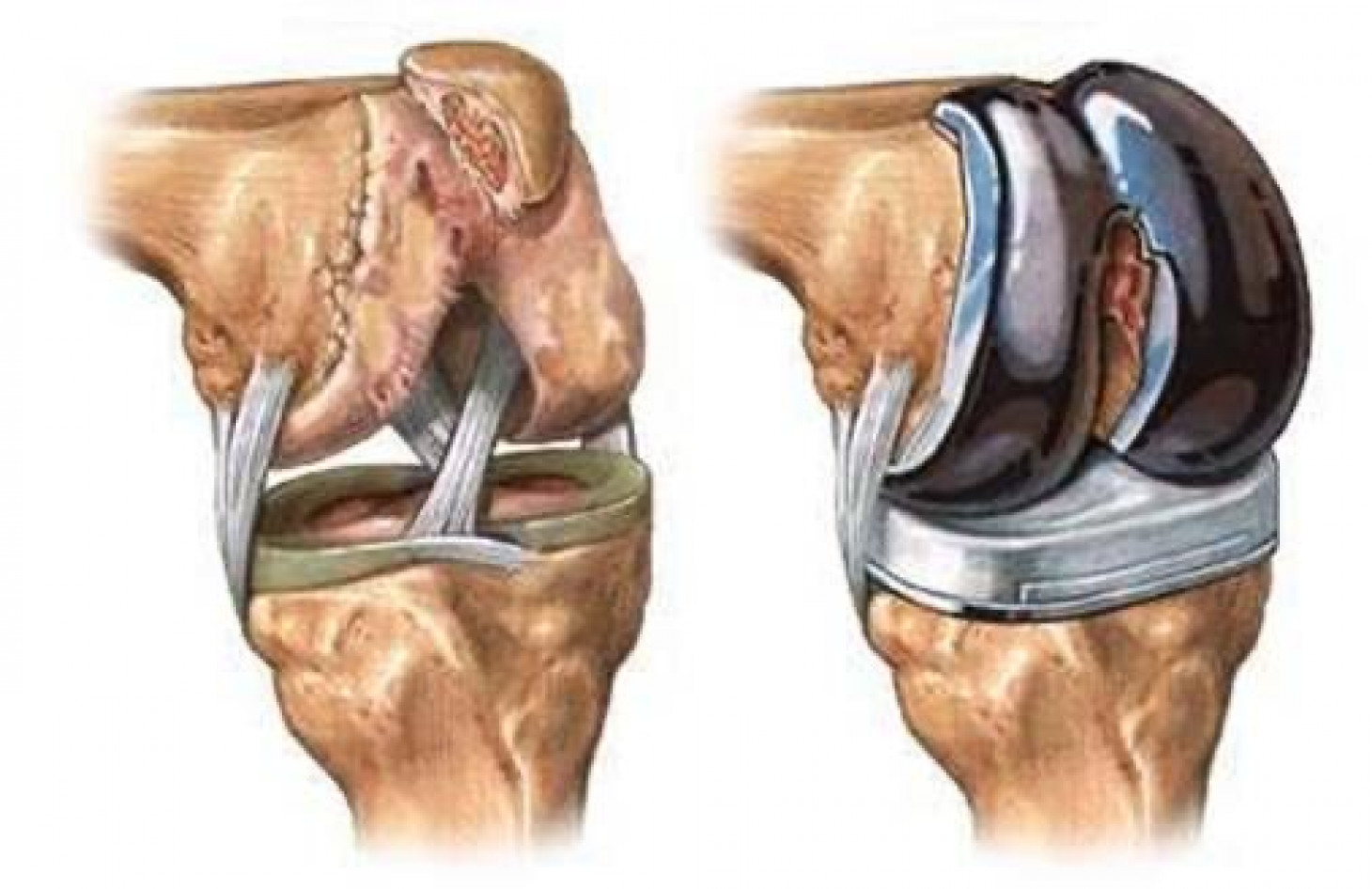 Суставной гомеостаз довольно сложен, и его полное восстановление с помощью одной молекулы после воздействия биомеханического, воспалительного или окислительного стресса может быть сложным.Тем не менее максимальный терапевтический потенциал может быть достигнут комбинацией этих молекул. Однако подходящая дозировка и результат представляют собой сложную проблему. В этом контексте необходимы дальнейшие доклинические исследования, чтобы подтвердить новые применения меда в качестве рациональной терапевтической стратегии при ОА, учитывая, что большинство текущих отчетов показали влияние биологически активных флавоноидов на регуляцию суставного гомеостаза в исследованиях in vitro . Наконец, очень важно разработать клинические испытания для проверки безопасности и эффективности биологически активных соединений, полученных из меда, чтобы лучше понять их активность на клеточном и молекулярном уровне для будущих терапевтических подходов.
Суставной гомеостаз довольно сложен, и его полное восстановление с помощью одной молекулы после воздействия биомеханического, воспалительного или окислительного стресса может быть сложным.Тем не менее максимальный терапевтический потенциал может быть достигнут комбинацией этих молекул. Однако подходящая дозировка и результат представляют собой сложную проблему. В этом контексте необходимы дальнейшие доклинические исследования, чтобы подтвердить новые применения меда в качестве рациональной терапевтической стратегии при ОА, учитывая, что большинство текущих отчетов показали влияние биологически активных флавоноидов на регуляцию суставного гомеостаза в исследованиях in vitro . Наконец, очень важно разработать клинические испытания для проверки безопасности и эффективности биологически активных соединений, полученных из меда, чтобы лучше понять их активность на клеточном и молекулярном уровне для будущих терапевтических подходов.
Терапевтический потенциал биологически активных соединений в меде для лечения остеоартрита
Abstract
Нарушение регуляции гомеостаза суставной ткани вызывает дегенеративные изменения суставов и заболевания опорно-двигательного аппарата, такие как остеоартрит. Эта патология представляет собой первую причину двигательной инвалидности у людей старше 60 лет, влияя на качество их жизни и расходы на системы здравоохранения. В настоящее время фармакологические методы лечения заболеваний хряща не обеспечивают полной регенерации тканей, что приводит к функциональной потере сустава; поэтому эндопротезирование суставов является золотым стандартом лечения этой патологии в тяжелых случаях остеоартрита.Другим методом лечения является использование противовоспалительных препаратов, которые в некоторой степени уменьшают боль и воспаление, но без значительного торможения прогрессирования заболевания. В этом смысле были предложены новые терапевтические альтернативы на основе природных соединений для замедления прогрессирования остеоартрита, особенно тех агентов, которые регулируют суставной гомеостаз. Доклинические исследования показали терапевтическое применение меда и его биоактивных соединений, начиная от лечения ран, кашля, кожных инфекций, а также в качестве биологического стимулятора, проявляя антиоксидантные и противовоспалительные свойства.
Эта патология представляет собой первую причину двигательной инвалидности у людей старше 60 лет, влияя на качество их жизни и расходы на системы здравоохранения. В настоящее время фармакологические методы лечения заболеваний хряща не обеспечивают полной регенерации тканей, что приводит к функциональной потере сустава; поэтому эндопротезирование суставов является золотым стандартом лечения этой патологии в тяжелых случаях остеоартрита.Другим методом лечения является использование противовоспалительных препаратов, которые в некоторой степени уменьшают боль и воспаление, но без значительного торможения прогрессирования заболевания. В этом смысле были предложены новые терапевтические альтернативы на основе природных соединений для замедления прогрессирования остеоартрита, особенно тех агентов, которые регулируют суставной гомеостаз. Доклинические исследования показали терапевтическое применение меда и его биоактивных соединений, начиная от лечения ран, кашля, кожных инфекций, а также в качестве биологического стимулятора, проявляя антиоксидантные и противовоспалительные свойства. В этой статье мы рассмотрели современные лекарственные применения меда, уделив особое внимание его использованию для регулирования суставного гомеостаза путем подавления воспаления и окислительного стресса.
В этой статье мы рассмотрели современные лекарственные применения меда, уделив особое внимание его использованию для регулирования суставного гомеостаза путем подавления воспаления и окислительного стресса.
Ключевые слова: Суставной гомеостаз, остеоартроз, воспаление, медовые флавоноиды, окислительно-восстановительный гомеостаз, хрящ, хондропротекторная активность это связано с различными этиологическими факторами, такими как старение, генетика, метаболический и биомеханический стресс.В этом контексте воспаление и окислительный стресс играют ключевую роль в прогрессирующем ухудшении состояния суставных тканей, включая суставной хрящ (АС), субхондральную кость, синовиальную оболочку и мениск, которые поддерживают функциональность суставов до тех пор, пока не возникнет обострение гомеостатической дисфункции (Minguzzi et al. , 2018). Несмотря на клиническую значимость ОА, которым страдает более четверти населения мира старше 18 лет (Chen D. et al., 2017), фармакологические стратегии предотвращения прогрессирования ОА ограничены.
Лечение ОА включает контроль веса и специальные физические упражнения в качестве интервенционных стратегий для поддержки фармакологической терапии (Watt and Gulati, 2017). Первая линия вмешательства включает нестероидные противовоспалительные препараты и ацетаминофен для контроля хронической боли. Ингибиторы циклооксигеназы-II, внутрисуставные стероиды и добавки для повышения вязкости также рассматриваются, когда стандартное лечение неэффективно; тем не менее их клиническая эффективность невысока у пациентов с сопутствующими заболеваниями (Jones et al., 2019). Следовательно, использование обезболивающих препаратов не представляет собой терапевтическую стратегию для остановки или устранения повреждения хряща, а также не регулирует гомеостаз АЦ, делая АЦ склонным к дальнейшему повреждению (Saccomano, 2018).
В настоящее время продукты пчеловодства используются для лечения различных воспалительных заболеваний суставов в качестве немедикаментозной терапии. При альтернативных или адъювантных терапевтических схемах у людей наблюдался потенциальный физиопатологический эффект меда, пыльцы, прополиса и пчелиного яда (Almuhareb et al., 2019; Conrad et al., 2019), мышиные модели (Owoyele et al., 2011; Hsieh et al., 2019) и исследования in vitro (Jeong et al., 2015; Locatelli et al., 2018). Эти преимущества для здоровья в основном наблюдаются при использовании меда из южного полушария, такого как мед манука и мед безжалостных пчел, и их польза для здоровья объясняется их фармакологически активными компонентами (Al-Hatamleh et al., 2020).
Согласно опубликованным данным, различные биологически активные соединения, обычно присутствующие в меде, играют эффективную роль в уменьшении внутрисуставных повреждений за счет ингибирования воспаления, окислительного стресса, синовиальной гиперплазии и ангиогенеза (Wang et al., 2007; Ян и др., 2018 г.; Ли и др., 2019; Орхан и Дениз, 2020 г .; Юань и др., 2020). В частности, защита хряща и усиление репаративных функций хондроцитов, вызванные медом, включают несколько биологически активных молекул, таких как хризин, апигенин, кверцетин, байкалин, лютеолин, физетин, бутеин, среди других флавоноидов и фенольных соединений. Настоящий описательный обзор направлен на обсуждение нового медицинского применения меда и выделение роли его полифенолов как потенциальных регуляторов суставного гомеостаза при ОА.Поэтому мы провели поиск статей, опубликованных до марта 2021 года в базе данных PubMed, с учетом следующих критериев: флавоноиды меда с биологическим действием на хондроциты и суставной гомеостаз. В результате этого поиска мы обнаружили, что данные in vitro в основном основаны на чистых соединениях, и лишь некоторые из них включали анализы в доклинических моделях ОА.
Влияние воспаления и окислительного стресса на гомеостаз хряща
Это дегенеративное заболевание суставов характеризуется нарушением суставного гомеостаза с устойчивой продукцией провоспалительных цитокинов, ферментов деградации внеклеточного матрикса (ECM), свободных радикалов, включая активные формы кислорода (АФК) и активные формы азота (РЧА) (Сурапанени и Венкатарамана, 2007).
В нормальных условиях хондроциты выполняют анаболические функции, поддерживая замену определенных компонентов ВКМ с низким оборотом, включая коллагены, протеогликаны и неколлагеновые белки (Singh et al., 2019). Скорость отложения белка ВКМ регулируется индуцируемым гипоксией фактором 1 альфа (HIF-1α), который в микроокружении с низкой концентрацией кислорода индуцирует экспрессию SOX9, главного транскрипционного регулятора хондрогенеза. SOX9 способствует экспрессии генов, специфичных для хондроцитов, таких как коллаген II типа (COL2A1) и аггрекан (ACAN), которые являются основными компонентами ВКМ при AC (Akiyama et al., 2002; Амарилио и др., 2007) (). Однако измененная функциональность антиоксидантной системы, несбалансированная передача сигналов воспаления, старение AC и другие неблагоприятные воздействия микросреды вызывают метаболический сдвиг от анаболизма к катаболизму (Singh et al., 2019). Высокоактивное метаболическое состояние при AC приводит к синтезу воспалительных и деградирующих белков, которые активируют клеточное старение и функцию иммунных клеток внутри остеоартритного сустава.
Дисрегуляция суставного гомеостаза при ОА. (A) Анаболический метаболизм регулирует экспрессию генов и синтез белков COL2A1 и ACAN в хондроцитах, поддерживая компоненты AC в состоянии низкого обмена. (B) Эта схема представляет гомеостатическое нарушение AC, вызванное окислительным стрессом и провоспалительными цитокинами. Передача сигналов IL-1 и TNF-α запускает активацию MMP и ADAMTS. Затем усиленное высвобождение MMP-13 вызывает гидролиз COL2A1 и ACAN, которые считаются ключевыми компонентами матрицы AC.Деградация матрикса усиливается активностью ADAMTS, что приводит к потере целостности хряща и дополнительной потере функции сустава. Воспаление, ROS и RNS не только стимулируют экспрессию ферментов деградации ECM, но также нарушают способность хондроцитов восстанавливать поврежденный хрящ, блокируя передачу сигналов HIF-1α и SOX9. AC: суставной хрящ; АКАН: агрекан; ADAMTS: дезинтегрин и металлопротеиназа с мотивом тромбоспондина; COL2A1: коллаген II типа; ECM: внеклеточный матрикс; HIF-1α: индуцируемый гипоксией фактор 1 альфа; ММП: металлопротеиназы; АФК: активные формы кислорода; RNS: активные формы азота.
Вышеупомянутые изменения вызывают состояние устойчивого катаболизма, который увековечивает прогрессирующее разрушение хряща и разрушает ткани суставов. Поскольку при ОА существенно страдает количество хондроцитов и их жизнеспособность, снижается синтез компонентов ВКМ. Нарушение целостности AC ослабляет суставной гомеостаз, неблагоприятно влияя на функцию других суставных тканей, таких как синовиальная оболочка, мениск и субхондральная кость (Stolberg-Stolberg et al., 2020).Более того, из-за молекулярных стимулов, вызванных повреждением коллагеновой сети и синовитом, увеличивается инфильтрация мононуклеарных клеток в синовиальную оболочку, что приводит к устойчивым воспалительным сигнальным путям. Кроме того, усиленные воспалительные биомаркеры во внутрисуставном пространстве играют важную роль в ремоделировании ВКМ, включая гипертрофическую дифференцировку хондроцитов (Minguzzi et al., 2018).
Дисбалансу между анаболизмом и катаболизмом, возникающему при прогрессировании ОА, можно немного противодействовать экспрессией трансформирующего фактора роста-бета (TFG-β), который модифицирует дисбаланс синтеза-замещения протеогликанов в ВКМ (Scharstuhl et al., 2002; Джими и др., 2019). Однако катаболическая активность также связана с более низким ответом на стимуляцию хондроцитов инсулиноподобным фактором роста 1 (IGF-1), снижением продукции белков ВКМ и, следовательно, репаративного процесса (Jimi et al., 2019; Morscheid и др., 2019).
Влияние воспаления на деградацию хряща
Медиаторы воспаления считаются критическими участниками разрушения хряща и синовита при ОА. Однако генетические факторы, возрастные изменения и биомеханический стресс вследствие ожирения, хирургического вмешательства или травматического повреждения являются основной причиной нарушения гомеостатической регуляции суставов при ОА (McAlindon et al., 2014). Кроме того, развитие, эволюция и сохранение ОА характеризуются постепенной потерей протеогликанов и COL2A1 с последующим образованием фиброзного хряща, что связано с высокой продукцией цитокинов, включая IL-1β, TNF-α, IL-6, IL-15. и Ил-18. Передача сигналов провоспалительных цитокинов стимулирует фенотипический сдвиг AC, апоптоз и усугубляет синовиальный фиброз (Jimi et al., 2019; Zhao et al., 2020). Обострение воспалительного стресса во внутрисуставном пространстве активирует путь канонического ядерного фактора каппа-легкая цепь-энхансер активированных В-клеток (NF-kB) в хондроцитах и синовиоцитах.Передача сигналов NF-κB опосредована многосубъединичным комплексом киназы IκB (IKK), который может реагировать на цитокиновый стимул (12). После активации NF-κB подвергается ядерной транслокации, затем он управляет экспрессией различных генов, включая индуцибельную циклооксигеназу 2 (COX-2), провоспалительные цитокины и хемокины, которые поддерживают воспаление суставов (Jimi et al., 2019). На молекулярном уровне высокая концентрация IL-1β и TNF-α в синовиальной жидкости может активировать катаболические процессы, приводящие к фибробластоподобному пироптозу синовиоцитов (Shen et al., 2014; Чжан Л. и др., 2019). В синовиальной оболочке усиленное высвобождение провоспалительных цитокинов вызывает аномальную пролиферацию синовиоцитов, вызывающую инфильтрацию иммунных клеток в синовиальную ткань. Кроме того, макрофагальный хемокиновый белок 1 (MCP-1) стимулирует миграцию макрофагов и нейтрофилов в синовиальное пространство, что поддерживает высокий уровень воспаления, связанный с тяжестью ОА (Xu et al., 2015; Haraden et al., 2019). ).
Высокие уровни IL-1β внутри сустава индуцируют экспрессию генов матриксных металлопротеиназ (ММР), дезинтегрина и металлопротеиназы (ADAM), а также экспрессию генов дезинтегрина и металлопротеиназы с тромбоспондиновым мотивом (ADAMTS) в хондроцитах и синовиоцитах , ускоряя развитие ОА из-за значительной деградации ACAN и коллагеновых фибрилл в хрящах (Struglics et al., 2006). Кроме того, за счет высокой ферментативной активности в АЦ увеличивается концентрация продуктов деградации матрикса, в том числе фрагментов COL2A1, ACAN и фибронектина. Это явление запускает активацию MMPs, VEGF и высокую продукцию оксида азота (NO) за счет активации TLR2 в хондроцитах, что дополнительно способствует катаболической функции и разрушению хряща (Xie et al., 1993; Fichter et al., 2006; Hwang). et al., 2015; Lees et al., 2015; Jung et al., 2019).
Окислительный и нитрозативный стресс при деградации хряща
Повторяющиеся циклы воспаления и устойчивое анаболо-катаболическое переключение могут вызывать перепроизводство АФК и АРНК в хряще, нарушая внутриклеточный окислительно-восстановительный статус (), которые играют важную роль в регуляции хондроцитов гипертрофия, дисфункция митохондрий, а также роль в окислительном повреждении ДНК, белков и липидов (Ostalowska et al., 2006; Сурапанени и Венкатарамана, 2007 г.; Гаврилидис и др., 2013). В этом контексте окислительный стресс модифицирует белки хрящевого матрикса, обнаруженные в аппарате Гольджи и эндоплазматическом ретикулуме хондроцитов, уменьшая их синтез (Yu and Kim, 2013). Кроме того, избыток АФК может также спровоцировать деградацию ВКМ посредством двух разных механизмов. Во-первых, АФК могут осуществлять прямой гидролиз компонентов матрицы; во-вторых, он способствует экспрессии MMP, которые генерируют гипертрофический хрящевой матрикс (Lepetsos and Papavassiliou, 2016).
Предыдущие исследования показали снижение активности антиоксидантных ферментов при ОА, что нарушает метаболизм и клеточную пролиферацию хондроцитов (Morita et al., 2007; Surapaneni and Venkataramana, 2007; Goodwin et al., 2010). На окислительно-восстановительный баланс в AC влияет подавление активности гемоксигеназы 1 (HO-1), что приводит к окислительному стрессу и последующему старению и апоптозу (Davidson et al., 2013; Cai et al., 2015; Takada et al., 2015). ). Концентрации оксида азота (NO) выше базового функционируют как критическая сигнальная молекула при гипертрофической дифференцировке и апоптозе хондроцитов посредством заметного снижения передачи сигналов HIF-1α (Bai et al., 2019). Кроме того, гомеостатические пути, связанные с хондрогенезом, могут меняться из-за ингибирования HIF-1α (12).
Из-за этой сложной патофизиологической картины апитерапия при ОА недавно стала новой нефармакологической стратегией для уменьшения молекулярных событий, которые вызывают структурные и функциональные повреждения в тканях суставов, вызванные воспалением, нитрозативным и оксидативным стрессом при заболеваниях АЦ.
Противовоспалительное и антиоксидантное действие меда
Мед представляет собой натуральный вязкий сладкий и ароматный раствор, потребляемый из-за его высокой питательной ценности и положительного воздействия на здоровье человека.В меде содержится около 200 различных химических соединений, включая широкий спектр фенольных соединений, обладающих антиоксидантными, бактериостатическими, противомикробными и противовоспалительными свойствами (Alvarez-Suarez et al., 2013). Биологические эффекты меда объясняются высокой концентрацией полифенольных соединений (флавоноидов), которые определяют его антиоксидантные и противовоспалительные свойства (Shen et al., 2019; Goslinski et al., 2020). Мед содержит различные биологически активные молекулы, включая p -кумаровую кислоту, эвгенол, феруловую кислоту, кофейную кислоту, пинобанксин, пиноцембрин, хризин, кверцетин, апигенин, галангин, изорамнетин, галловую кислоту, кемпферол, сирингиновую кислоту, лютеолин и нарингин; тем не менее, их концентрация варьируется в зависимости от типа меда (Ciulu et al., 2016; да Силва и др., 2016; Шен и др., 2019). Кроме того, новое исследование недавно выявило везикулоподобные наночастицы (VLN) в качестве нового биологически активного агента в меде (Chen et al., 2021).
Мед с древних времен использовался в качестве лечебного средства при самых разных клинических состояниях. Его наиболее замечательная эффективность заключается в заживлении ран (Frydman et al., 2020; Smaropoulos and Cremers, 2020) и лечении заболеваний желудочно-кишечного тракта (Bilsel et al., 2002; Miguel et al., 2017).Кроме того, в нескольких исследованиях оценивалось влияние меда на рак (Afrin et al., 2018b; Mohammed et al., 2020), диабет (Sahlan et al., 2020) и дислипидемию (Ramli et al., 2019), показывая значительное мелиоративные эффекты. Аналогичным образом сообщалось об антимикробном действии при использовании меда (Rosli et al., 2020).
О роли меда в воспалительном процессе сообщили Аль-Ваили и Бони (2003); они показали, что при употреблении разбавленного натурального меда концентрация простагландина Е2, простагландина F2α и тромбоксана B2 снижалась в плазме здоровых людей (Al-Waili and Boni, 2003).Другое недавнее исследование показало биологическую роль VLN, полученных из меда, которые проявляют мощную противовоспалительную активность, подавляя активацию воспалительных процессов NLRP3 и передачу сигналов NF-κB. Кроме того, РНК небольшого размера были идентифицированы как молекулы, которые значительно улучшали воспалительную активность NLRP3, в частности, miR-4057 защищала мышей от острых воспалительных состояний в печени (Chen et al., 2021). С другой стороны, в различных исследованиях изучалось влияние потребления меда на уровни малонового диальдегида и АФК у спортсменов и моделей на мышах, где люди подвергались высокоэффективным режимам упражнений.Авторы пришли к выводу, что потребление меда приводит к заметному снижению биомаркеров окислительного повреждения, вызванного высокой физической активностью (Ahmad et al., 2017; Jurcău and Jurcău, 2017; Hills et al., 2019).
Основываясь на результатах доклинических исследований, мед является новым перспективным средством лечения прогрессирования ОА путем воздействия на катаболизм в тканях суставов и восстановления суставного гомеостаза.
Потенциальное использование меда для регулирования суставного гомеостаза
Защитная активность меда при ОА была оценена на различных животных моделях и исследованиях in vitro .Предыдущие исследования были направлены на выявление противовоспалительного действия меда манука на макрофаги, стимулированные ЛПС. Результаты показали, что мед манука повышает жизнеспособность клеток за счет уменьшения апоптоза, ингибирования образования свободных радикалов и ослабления воспаления. Эти эффекты регулировались уменьшением количества белков каспазы-3, p-p38 и p -Erk1/2 на молекулярном уровне. Более того, также было продемонстрировано усиление митохондриального дыхания и гликолитической активности, что привело к экспрессии и стимуляции p -AMPK, SIRT1 и PGC1alpha (Afrin et al., 2018а; Гаспаррини и др., 2018). Биологический потенциал меда манука объясняется соединениями кверцетина и галловой кислоты, которые также присутствуют в других видах меда во всем мире в высоких концентрациях (Tomás-Barberán et al., 1993; Samargandian et al., 2017).
С другой стороны, исследование in vivo выявило появляющиеся противовоспалительные и антиоксидантные свойства нигерийского меда при формальдегид-индуцированном артрите у крыс Wistar. Это исследование показало, что потребление меда значительно уменьшало воспаление, аналогично лечению индометацином в течение десятидневного вмешательства (Owoyele et al., 2011). Кроме того, было описано благотворное влияние меда и его производных биоактивных соединений на здоровье костей (Kamaruzzaman et al., 2019).
Флавоноиды, содержащиеся в меде, удаляют свободные радикалы кислорода, уменьшая воспаление и сводя к минимуму повреждение тканей (Candiracci et al., 2012). Предыдущая работа Alvarez-Suarez et al. проанализировали содержание фенолов в меде манука с помощью ВЭЖХ-МС , и было высказано предположение, что эти компоненты улучшают внутриклеточный антиоксидантный и противовоспалительный ответ (Alvarez-Suarez et al., 2016). Недавно была исследована эффективность компонентов меда в отношении жизнеспособности хондроцитов, воспалений и передачи сигналов окислительного стресса.
Соединения меда оказывают хондропротекторный эффект
Хондрогенный потенциал биоактивных соединений меда наблюдался в различных исследованиях in vitro и in vivo (), что предполагает многообещающее применение меда в качестве вспомогательной терапии для восстановления гомеостаза хряща, особенно путем ингибирование воспаления и окислительного стресса, обычно наблюдаемого при ОА.Хотя информация, касающаяся механизмов действия каждого флавоноида, содержащегося в меде, на суставной гомеостаз, все еще ограничена, некоторые биологические процессы, лежащие в основе суставного воспаления, окислительного стресса, хондропротекции и метаболизма в хрящах, уже исследованы.
Хондропротекторное действие биологически активных соединений, содержащихся в меде. (A) Структура биоактивных молекул меда с потенциальным применением для борьбы с нарушением регуляции суставного гомеостаза. (B) Механизмы воздействия флавоноидов меда на остеоартроз суставов. Различные флавоноиды, обнаруженные в меде, могут модулировать катаболизм в тканях суставов через несколько сигнальных путей, способствующих экспрессии генов, связанных с хондрогенезом, таких как SOX9, ACAN и COL2A1. АКАН: агрекан; AGEs: конечные продукты усиленного гликирования; ECM: внеклеточный матрикс; ГАГ: гликозаминогликаны; HIF-2α: индуцируемый гипоксией фактор 2 альфа; ММП: металлопротеиназы; NO: оксид азота; PGE2: простагландин E2; СОД: супероксиддисмутаза.↑ = активировать/стимулировать/увеличивать; ∅ = подавлять/запрещать/подавлять/уменьшать.
Влияние соединений меда на воспаление суставов
Было подтверждено, что хризин, натуральный флавоноид, извлеченный из меда, ослабляет передачу сигналов воспаления NLRP3, уменьшая синовит и уменьшая высвобождение IL-1β, IL-18, субстанции p и гена кальцитонина родственный пептид в модели ОА коленного сустава, индуцированного мононатрия йодоацетатом (МИА), у крыс (Liao et al., 2020). Второе исследование показало, что хризин резко блокирует стимулированную IL-1β деградацию IκB-α и активацию NF-κB in vitro с использованием поврежденных IL-1β хондроцитов человека (Zheng et al., 2017б).
Недавно была задокументирована биологическая активность лютеолина, другого природного флавоноида, по сигналу воспаления в хондроцитах. Исследование in vitro показало, что предварительная обработка лютеолином играет важную роль в контроле воспаления в хондроцитах крыс посредством ингибирования IL-1β, индуцированного продукции NO, PGE2 и TNF-альфа. Кроме того, лютеолин снижает фосфорилирование NF-kB, что способствует регуляции катаболической активности хондроцитов за счет снижения экспрессии белков iNOS, ЦОГ-2, ММП-1, ММП-3 и ММП-13 (Fei et al., 2019). Более того, исследования на животных показали, что введение через желудочный зонд (10 мг/кг/сут в течение 45 дней) в модели ОА, вызванной МИА, оказывает защитное действие, ослабляя разрушение АЦ и прогрессирование ОА (Fei et al., 2019). В другом исследовании оценивали биологическую активность лютеолина, модулирующую катаболическую активность в хондроцитах, полученных из модели ОА морской свинки; сообщают, что лютеолин вызывал подавление JNK, p38 и MMP-13, а также низкое производство воспалительных биомаркеров, включая NO, TNF-α и IL-6 (Xue et al., 2019).
Недавно была задокументирована эффективность кверцетина как противовоспалительной молекулы. Ху и др. продемонстрировали, что кверцетин подавляет воспаление, модулируя поляризацию синовиальных макрофагов до фенотипа М2 и индуцируя экспрессию факторов роста, таких как TGF-β и IGF, которые способствуют хондрогенезу. Хондропротекторный эффект наблюдался также in vivo при внутрисуставном введении кверцетина (Hu et al., 2019).
Влияние соединений меда на ферменты, разлагающие ВКМ
Также была описана роль различных флавоноидов, поддерживающих синтез компонентов ВКМ.Использование хризина в исследовании in vitro показало положительные эффекты, предполагая, что этот флавоноид регулирует экспрессию MMP-1, MMP-3, MMP-13, ADAMTS-4 и ADAMTS-5, а также деградацию ACAN. и COL2A1 на поврежденных IL-1β хондроцитах человека (Zheng et al., 2017b). Эти результаты подтверждаются недавним исследованием, в котором хризин оказывал защитный эффект на хрондроциты ОА человека через подавление хромосомного белка высокой подвижности (HMGB1).Было продемонстрировано, что хризин увеличивает экспрессию COL2A1, в то время как клеточный апоптоз, MMP-13 и IL-6 ингибируются (Zhang C. et al., 2019). Таким образом, хризин может быть потенциальным средством для лечения ОА. Байкалин — еще один многообещающий флавоноид, содержащийся в меде, обладающий хондропротекторным действием. Хуанг и его коллеги недавно сообщили, что байкалин снижает уровни IL-1β и подавляет экспрессию коллагена I, ослабляя дегенерацию хряща и способствуя пролиферации суставных хондроцитов кролика, а также восстанавливая внеклеточный матрикс посредством COL2A1 и секреции ACAN через активацию гена SOX9. (Хуанг и др., 2017).
Также был изучен биологический потенциал физетина и бутеина. Эти соединения оказывают противовоспалительное и антиоксидантное действие за счет восстановления экспрессии COL2A1, ACAN и протеогликанов в монослойных культурах хондроцитов. Физетин и бутеин также могут регулировать провоспалительное повреждение, вызванное ИЛ-1β, посредством индукции низкой продукции NO и PGE2, а также значительного ингибирования экспрессии металлопротеиназ и агреканаз (Zheng et al., 2017a; Zheng et al., 2017в). Кроме того, in vivo моделей ОА показали меньшую деструкцию хряща и повреждение субхондральной кости, когда мышей лечили бутеином и физетином через внутрибрюшинный и пероральный желудочный зонд, соответственно (Zheng et al., 2017a; Zheng et al., 2017c). .
Лютеолин показал потенциальную роль в качестве хондропротекторной молекулы. Исследования in vivo и in vitro показали, что лютеолин ингибирует экспрессию генов и синтез белка MMP-1, MMP-3, MMP-13, ADAMTS-4 и ADAMTS-5 в культивируемых суставных хондроцитах, стимулированных IL-1β; кроме того, чтобы проанализировать прямое влияние лютеолина на суставы крыс, этим животным вводили внутрисуставную инъекцию лютеолина, что показало ингибирование продукции ММР-3 до стимуляции ИЛ-1β (20 нг/30 мкл) (Kang et al., 2014).
Апигенин — еще одно соединение меда, которое может играть важную роль в гомеостазе АЦ. Исследование показало, что апигенин снижает экспрессию MMP-13 на линии клеток хондроцитов человека SW1353 , обработанных IL-1β, посредством ингибирования передачи сигналов c-FOS/AP-1 и JAK/STAT (Lim et al., 2011). Более того, сообщалось, что апигенин может ингибировать экспрессию HIF-2α, который является основным регулятором катаболических факторов, таких как ММР-3, ММР-13, ADAMTS-4, IL-6 и ЦОГ (Cho et al., 2019). Недавно Park JS et al. описал антидегенеративный эффект апигенина. , который сообщил, что эта молекула регулирует экспрессию генов ферментов, разрушающих матрикс, таких как MMP1, MMP-3, MMP-13, ADAMTS-4 и ADAMTS-5 в хондроцитах кролика. Кроме того, было замечено, что продукция ММП-3 ингибировалась у крыс, получавших апигенин плюс ИЛ-1β (Park et al., 2016).
Влияние соединений меда на окислительный стресс и антиоксидантные механизмы
В этом контексте нарушение регуляции надазы CD38 может нарушить гомеостаз суставных хондроцитов, способствуя чрезмерному окислительному стрессу в сочетании со значительным снижением экспрессии сиртуина-1 (SIRT-1) .Тем не менее, некоторые флавоноиды, такие как апигенин и кверцетин, могут действовать как ингибиторы CD38, ослабляя высвобождение NO и образование митохондриального супероксида через , поддерживая функцию SIRT-1 и SIRT-3 и регулируя снижение NAD + при IL-1β-стимулированном хондроциты человека (Kellenberger et al., 2011; Ansari et al., 2020).
Исследования с использованием in vitro IL-1β-поврежденных хондроцитов человека также подтверждают биологическую роль хризина в ингибировании окислительного стресса.Чжэн и др. наблюдали, что хризин значительно ингибирует индуцированную IL-1β продукцию NO и PGE2 на хондроцитах человека, которые были предварительно обработаны и впоследствии стимулированы провоспалительным агентом. Кроме того, этот флавоноид подавлял экспрессию ЦОГ-2 и iNOS (Zheng et al., 2017b).
Недавнее исследование показало, что роль кверцетина не ограничивается ингибированием воспаления, так как кверцетин также способствует анаболической активности на стимулированных IL-1β хондроцитах крыс, а также антиапоптотическому эффекту, посредством , направленного на АФК и ингибирующего Стресс ER через активацию сигнального пути SIRT1/AMPK (Feng et al., 2019; Ху и др., 2019). Кроме того, второе сообщение показало, что кверцетин, вводимый через желудочный зонд в дозе 25 мг/кг 90 157–90 158 1 у кроликов, моделирующих ОА коленного сустава, активирует супероксиддисмутазу (СОД) и тканевый ингибитор металлопротеиназ-1 (ТИМП-1), способствуя подавлению ММР-13 в синовиальной ткани (Wei et al., 2019). Таким образом, кверцетин уменьшает дегенерацию тканей при ОА, ослабляя реакцию на окислительный стресс и ингибируя деградацию хрящевого ЕСМ.
Существуют различные потенциальные свойства апигенина.Например, Crasci et al. сообщили, что апигенин может быть поглотителем свободных радикалов и мощным ингибитором конечных продуктов гликирования. Они также показали, что апигенин восстанавливал продукцию гликозаминогликанов (ГАГ), когда его использовали для лечения суставных хондроцитов человека, ранее стимулированных IL-1β (Crasci et al., 2018).
Влияние соединений меда на хондропротекцию
Биологическая активность байкалина была последовательной в различных исследованиях, показывающих, что байкалин защищает хондроциты от апоптоза и деградации внеклеточного матрикса (Chen C.и др., 2017; Ян и др., 2018 г.; Ли и др., 2020). В этом смысле Chen et al. идентифицировал байкалин как потенциального кандидата для лечения ОА, поскольку он предотвращал разрушение хряща и облегчение синовита в моделях ОА in vivo (Chen C. et al., 2017). Кроме того, байкалин подавляет экспрессию генов, связанных с апоптозом, индуцированную H 2 O 2 (Pan et al., 2017; Cao et al., 2018), в то время как индуцирует экспрессию COL2A1, ACAN и SOX9 у H 2 . O 2 -обработанные хондроциты (Cao et al., 2018).
Хорошо известно, что поддержание аутофагии необходимо для сохранения целостности хряща. В этом смысле новое исследование задокументировало, что байкалин оказывает антиапоптотическое действие за счет повышения экспрессии Bcl-2 и активации аутофагии через miR-766-3p/фактор, индуцирующий апоптоз, митохондриально-ассоциированный 1 (AIFM1) ось, которая усиливает синтез ECM на хондроцитах ОА человека (Li et al., 2020). Точно так же Ansari et al. обнаружили, что другой флавоноид, бутеин, может активировать аутофагию в IL-1β-стимулированных хондроцитах человека путем ингибирования механистической мишени передачи сигналов рапамицином (mTOR) (Ansari et al., 2018).
Принимая во внимание несколько преимуществ для здоровья и общего самочувствия, связанных с медом и его компонентами, новое использование этих продуктов в качестве дополнительной стратегии для регулирования молекулярного механизма, лежащего в основе суставного гомеостаза, ведет к дальнейшим исследованиям применения тканевой инженерии для хряща. ремонт.
Мед в инженерии хрящевых тканей
Способность хряща к саморегенерации низкая, даже когда он заменен тканеинженерными конструкциями.Тем не менее, многие многообещающие стратегии все еще пытаются способствовать восстановлению и регенерации AC. В связи с этим недавние исследования были сосредоточены на разработке каркасов на основе биоматериала меда, таких как гидрогели, для быстрого восстановления хрящей, благодаря присущим меду антибактериальным свойствам и его уникальной вязкости, улучшающим механические свойства гидрогелей (Abd El-Malek et al. al., 2017; Hixon et al., 2019; Bonifacio et al., 2020b). Инновационное включение меда манука в гидрогель способствует in vitro хондрогенезу мезенхимальных стволовых клеток человека через увеличение экспрессии COL2A1, а также синтез ГАГ и протеогликанов; кроме того, не наблюдалось цитотоксического эффекта (Bonifacio et al., 2018; Бонифачо и др., 2020а). На сегодняшний день in vivo исследований активности гидрогелей, содержащихся в меде, показали значительные результаты в отношении ингибирования инфекций и нетяжелых иммунологических реакций (Bonifacio et al., 2020a), которые представляют собой многообещающее средство для регенерации хряща.
Биобезопасность меда для клинического применения
Повышенный интерес к меду для медицинского применения приводит к строгому регулированию его качества и безопасности. Мед также может содержать токсичные соединения, в том числе пестициды (Chiesa et al., 2018; El Agrebi et al., 2020), тяжелые металлы (Bartha et al., 2020; Bosancic et al., 2020) и антибиотики (Barrasso et al., 2018) из-за загрязнения окружающей среды в местах сбора меда. Бактериальное загрязнение является еще одним важным фактором, который необходимо учитывать, чтобы убедиться, что мед подходит для терапевтических целей; например, наличие спор Clostridium botulinum ранее было выявлено в образцах меда (Nevas et al., 2002; Rosli et al., 2020). В этом контексте использование медицинского меда (MGH) гарантирует его безопасность для клинического применения (Hermanns et al., 2019). Было доказано, что биоактивность меда в виде противомикробных, ранозаживляющих, антиоксидантных и противовоспалительных свойств сохраняется после стерилизации гамма-излучением и продления условий хранения (Postmes et al., 1995; Molan and Allen, 1996; Hussein et al. , 2014).
Хотя Manuka MGH широко исследуется во всем мире как новая немедикаментозная терапевтическая стратегия, появляются другие виды меда с аналогичной биологической активностью. В ранних отчетах мед от безжалых пчел, включая Melipona spp., Trigona spp., Tetragonisca spp. и Scapt или trigona spp. проявляют терапевтические свойства для лечения воспалений (Ranneh et al., 2019; Biluca et al., 2020), заживления ран (Abd Jal. et al., 2017; Abdul Malik et al., 2020) и окислительный стресс (Abid et al., 2017; Ranneh et al., 2018; Biluca et al., 2020). Кроме того, ранее сообщалось о биодоступности наиболее многообещающих соединений, таких как апигенин, хризин и кверцетин, в меде безжалых пчел (Zulkhairi Amin et al., 2018). Следовательно, они обладают биологическим потенциалом для современного медицинского применения при других патологиях, связанных с нарушением регуляции суставного гомеостаза.
Заключение и перспективы на будущее
С древних времен терапевтические эффекты меда были описаны и широко наблюдались при лечении ран, кашля, кожных инфекций и воспалений. В настоящее время изучается эффективность меда в противодействии суставным повреждениям для улучшения качества жизни людей с ОА.Мы знаем, что биологически активные соединения меда оказывают хондропротекторное действие, противодействуя гомеостатической дисрегуляции сустава. Таким образом, его использование в качестве терапевтического инструмента при лечении ОА широко поддерживается, поскольку он может смещать основные сигнальные пути, связанные с ОА. Эта адъювантная немедикаментозная стратегия может облегчить боль, отрегулировать гомеостаз суставов и восстановить AC, замедляя прогрессирование ОА; таким образом, уменьшая физические ограничения, инвалидность, умственное напряжение и социально-экономическое бремя, обычно наблюдаемое у людей с этим хроническим заболеванием.
Имеются четкие доказательства того, что натуральные продукты представляют собой превосходный источник биоактивных молекул с потенциальными медицинскими применениями. Мы представили семь натуральных соединений, полученных из меда, в качестве возможных кандидатов для лечения ОА из-за их хондропротекторной активности. Тем не менее, существует ограниченное количество отчетов in vitro и in vivo , показывающих молекулярные пути, лежащие в основе биологического действия флавоноидов, полученных из меда. Суставной гомеостаз довольно сложен, и его полное восстановление с помощью одной молекулы после воздействия биомеханического, воспалительного или окислительного стресса может быть сложным.Тем не менее максимальный терапевтический потенциал может быть достигнут комбинацией этих молекул. Однако подходящая дозировка и результат представляют собой сложную проблему. В этом контексте необходимы дальнейшие доклинические исследования, чтобы подтвердить новые применения меда в качестве рациональной терапевтической стратегии при ОА, учитывая, что большинство текущих отчетов показали влияние биологически активных флавоноидов на регуляцию суставного гомеостаза в исследованиях in vitro . Наконец, очень важно разработать клинические испытания для проверки безопасности и эффективности биологически активных соединений, полученных из меда, чтобы лучше понять их активность на клеточном и молекулярном уровне для будущих терапевтических подходов.
Мед и артрит: применение и польза меда при артрите
Артрит — это заболевание, при котором воспаляются суставы. Общими симптомами артрита являются мучительная боль в суставах, отек, воспаление и слабость. Симптомы могут варьироваться от легких, умеренных или тяжелых. Тяжелый артрит может препятствовать выполнению простых жизненных действий, таких как трудности при ходьбе и подъеме по лестнице. Существуют различные типы артрита. Наиболее распространенными типами артрита являются: ревматоидный артрит, подагра и остеоартрит.
Воспользуйтесь преимуществами меда при артрите
Наиболее распространенным типом артрита в Индии является ревматоидный артрит. Около 180 миллионов человек в Индии страдают от этой болезненной болезни. Хотя существует несколько медицинских процедур, но люди не удовлетворены этими методами лечения, поскольку они не приносят постоянного облегчения. Поэтому люди начали выбирать альтернативные и дополнительные методы лечения. Эти методы лечения оказываются более полезными, чем традиционные методы лечения.
Зачем использовать мед при артрите?
Мед обладает многими полезными свойствами. Использование меда при артрите оказалось чудесным. Мед известен своими антибактериальными свойствами и набирает популярность в уменьшении воспаления суставов и обеспечивает естественную форму облегчения. Люди во всем мире используют мед для лечения артрита, и уровень успеха невероятен. Попробуйте следующее сочетание меда с другими ингредиентами, такими как корица и мед для лечения артрита, а также яблочный уксус.
Мед и корица при артрите:
Корица и мед при артрите создают мощную смесь, которая искореняет артрит с корнем и приносит облегчение людям, страдающим от него. Смесь меда и корицы при артрите рекомендуется аюрведической медициной и практикующими врачами. Корицу и мед при артрите можно использовать в виде порошка или пасты, и их следует втирать в болезненные участки кожи.Более простое средство — смешать корицу и мед в теплой чашке с водой, а затем выпить ее. Ниже описана процедура приготовления этого полезного тоника:
1. Вскипятите горячую воду и налейте ее в чашку.
2. Добавьте одну чайную ложку корицы, а затем добавьте две столовые ложки меда.
3. Накройте и оставьте чашку на пять минут.
4. Все хорошенько размешать, чтобы хорошо перемешалось.
5. Каждый день пейте его дважды, и вскоре вы увидите, как происходит волшебство.
Применение меда и корицы при артрите — самый простой и эффективный способ.
Яблочный уксус и мед при артрите:
Еще одним отличным средством для решения проблемы хронического артрита является использование яблочного уксуса и меда. Люди со всего мира попробовали эту удивительную смесь и избавились от мучительной боли в суставах.Все мы знаем об антибактериальном действии меда при лечении артрита, а мед, смешанный с яблочным уксусом, удваивает эффект от боли. Приготовить этот полезный тоник очень просто. Сначала смешайте две чайные ложки уксуса, а затем добавьте две чайные ложки меда в стакан теплой воды. Пейте его три раза в день, чтобы через несколько недель увидеть значительные изменения.
4 вида болей при артрите и натуральное эффективное средство от них
Артрит, или «воспаление суставов», является сегодня одним из наиболее распространенных заболеваний, вызывающих мучительную боль в теле.Он поражает мышцы и, в частности, место, где встречаются две или более костей, то есть сустав, например, тазобедренный или коленный. Признаки и симптомы артрита включают боль в суставах, отек, скованность, слабость, деформации, воспаление и ограничение подвижности суставов, что может мешать выполнению самых основных повседневных задач, таких как ходьба, подъем по лестнице, открывание бутылок или чистка зубов.
4 наиболее распространенных типа болей при артрите
Существует более ста форм артритов и ревматических заболеваний.И четыре наиболее распространенных типа — это остеоартрит, ревматоидный артрит, подагра и фибромиалгия.
1. ФибромиалгияФибромиалгия, или «ревматизм мягких тканей», относится к боли в мягких волокнистых тканях тела – мышцах, связках и сухожилиях. (Связки и сухожилия соединяют мышцы с костями.) У людей с фибромиалгией могут быть и другие симптомы, такие как проблемы со сном, утренняя скованность и головные боли, плохая память и концентрация. Женщины как минимум в четыре раза чаще, чем мужчины, страдают фибромиалгией.А фибромиалгия обычно возникает у людей старше 50 лет.
2. ОстеоартрозОстеоартрит, дегенеративное заболевание суставов, является наиболее распространенной формой артрита. Это происходит, когда хрящ изнашивается, в результате чего кости начинают тереться друг о друга и движения становятся болезненными. Хрящ, скользкое и губчатое вещество, покрывает и смягчает кости, обеспечивая плавное движение суставов.
Остеоартрит часто поражает руки и несущие суставы, такие как коленные, тазобедренные и фасеточные суставы (в позвоночнике), и возникает из-за дегенерации хрящей с возрастом.Следовательно, это наиболее распространенная форма боли при артрите среди пожилых людей.
3. Ревматоидный артритРевматоидный артрит — изнурительное заболевание, поражающее обычно руки, запястья и колени. Иммунная система ошибочно атакует саму себя и вызывает отек суставной оболочки. Затем воспаление распространяется на окружающие ткани и может в конечном итоге повредить хрящи и кости.
Ревматоидный артрит поражает не только суставы. Сухожилия похожи на веревки, которые проходят внутри смазанных трубок.Смазочная система очень похожа на ту, что имеется в самих суставах, поэтому неудивительно, что при ревматоидном артрите могут поражаться и сухожилия. У некоторых людей могут воспаляться другие части тела, такие как легкие и кровеносные сосуды. Многие люди с ревматоидным артритом испытывают трудности при выполнении обычных повседневных действий, таких как стояние, ходьба, одевание, умывание и использование туалета.
4. ПодаграПодагра — это болезненное состояние, которое возникает, когда организм не может выводить естественное вещество, называемое мочевой кислотой.Избыток мочевой кислоты образует игольчатые кристаллы в суставах, которые вызывают отек и сильную боль. Подагра чаще всего поражает большой палец ноги, коленные и лучезапястные суставы. Для снижения риска кристаллизации уратов в суставах важно пить много воды – по возможности до 3,5 литров в день. Согласно последним научным данным, употребление стакана обезжиренного молока каждый день может помочь облегчить боль при подагрическом артрите. Но следует избегать пива или других алкогольных напитков, так как они могут усугубить подагру.
Облегчение боли при артрите
Некоторыми факторами, связанными с развитием болей при артрите, являются травмы (например, при занятиях спортом) и осложнения, вызванные другими состояниями (такими как диабет), наследственность и недостаток физической активности. Многие исследования также выявили связь между ожирением и артритом.
Чрезмерная масса тела создает дополнительную нагрузку на несущие суставы (спина, бедра, колени, лодыжки и стопы). Из-за того, как работают суставы, давление в коленных суставах во много раз превышает вес вашего тела при ходьбе.Даже небольшая потеря веса может иметь большое значение для ваших суставов. Слишком большое количество жира в организме также может усилить воспаление в организме, что сделает ваши суставы более болезненными.
Суставы также естественным образом дегенерируют с возрастом; поэтому артрит часто ассоциируется с пожилыми людьми. Однако также известно, что у детей, хотя и относительно редко, также может развиться состояние, называемое ювенильным идиопатическим артритом. Это включает воспалительное заболевание соединительной ткани, характеризующееся отеком суставов и болью или чувствительностью.Он также может поражать такие органы, как кожа, сердце, легкие, печень, селезенка и глаза.
Как правило, облегчение боли при артрите достигается за счет сочетания лекарств, упражнений, отдыха, контроля веса, диеты и питания. С помощью анализов крови и рентгена ваш врач сможет диагностировать тип артрита и порекомендовать наиболее подходящий курс лечения.
Средство с медом и корицей
Мед манука, который, как известно, обладает более высокой антибактериальной активностью, чем мед других видов, также набирает популярность при лечении боли при артрите благодаря своим естественным противовоспалительным свойствам и целебной силе.Он уменьшает воспаление суставов и обеспечивает естественную форму облегчения боли.
Для приготовления смешайте 2 столовые ложки меда манука и 1 чайную ложку порошка корицы с 1 чашкой теплого зеленого чая, пейте этот медово-коричный напиток ежедневно утром и вечером.
Средство на основе меда и яблочного уксуса
Комбинация меда и яблочного уксуса также является чрезвычайно известным домашним средством от артрита. Во всем мире люди так страстно свидетельствовали о том, как этот очищающий напиток помог им избавиться от болей в суставах.Многие диетологи считают, что в этом детокс-напитке вы можете найти такие минералы, как калий, фосфор, кальций, магний, натуральный кремний, пектин и винную кислоту, которые эффективно борются с токсинами в организме, подавляют бактерии и помогают организму поддерживать свою жизненно важную кислотность. щелочной баланс.
Чтобы приготовить тоник для здоровья, смешайте две чайные ложки уксуса и две чайные ложки сырого меда со стаканом теплой воды и пейте три раза в день. Чтобы увидеть эффект, может потребоваться несколько недель.Д-р Д. К. Джарвис в своей книге
.Артрит и народная медицина (Galahad Books, 1997) также предлагали тот же рецепт народной медицины при артритной боли. Он считает, что лечение артрита и многих других проблем со здоровьем должно начинаться с желудка. Джарвис обнаружил, что при ежедневном употреблении коктейля из яблочного уксуса отложения кальция высвобождаются обратно в раствор в кровотоке, который рециркулирует в кости, таким образом облегчая боль при артрите и предотвращая остеопороз.
Горячий яблочный уксус
Некоторые люди также рекомендуют замачивать пораженные артритом суставы в горячем яблочном уксусе. Для администрирования используйте четверть стакана уксуса, смешанного с полутора стаканами воды. Можно также смочить в этой смеси тряпку, приложить к больному месту и обернуть полотенцем, чтобы сохранить тепло. Держите горячую смесь только десять минут за раз и повторяйте ее после того, как косяк остынет, еще десять минут.
Конец книги «4 типа болей при артрите и натуральное эффективное средство от них».Вернемся к «Средству с яблочным уксусом и медом».
Диета при артрите: лучшие и худшие продукты для облегчения боли при артрите
Диета при артрите должна быть сосредоточена на противовоспалительных продуктах, таких как фрукты и овощи.
Изображение предоставлено: SDI Productions/E+/GettyImages
К сожалению, нет волшебной палочки в лечении артрита. Но если у вас есть заболевание, вы можете облегчить симптомы, изменив то, что вы едите.
Вот разбивка о том, как связаны диета и артрит, а также о лучших и худших продуктах, которые можно есть при болях в суставах, скованности и отеках.
Связь с воспалением
По данным клиники Майо, существует более 100 типов артрита, но каждый из них характеризуется хроническим воспалением в суставах, которое может вызывать отек и боль.
Острое — или краткосрочное — воспаление на самом деле является здоровой реакцией, которая помогает защитить организм. Лихорадка, которая помогает бороться с инфекцией, является примером острого воспаления. Согласно статье, опубликованной в декабре 2019 года в Nature Medicine , этот тип воспаления проходит, когда угроза для организма исчезает.
Хроническое — или длительное — воспаление вызывает ту же реакцию, но все время. Вы не ходите с температурой 24/7, но воспаление присутствует в вашем теле в меньшей степени. Это хроническое воспаление связано с такими состояниями, как болезни сердца, диабет 2 типа и метаболический синдром, согласно статье Nature Medicine .
«Диета может абсолютно повлиять на артрит, либо усиливая симптомы воспаления, либо успокаивая воспаление.»
Воспаление возникает по разным причинам при различных типах артрита. По данным Центров по контролю и профилактике заболеваний (CDC), при остеоартрите, наиболее распространенном типе, воспаление вызвано износом суставов. Ревматоидный артрит (РА), с другой стороны, является аутоиммунным заболеванием, поэтому воспаление возникает из-за того, что организм ошибочно атакует суставы, согласно CDC.
Подавление этой воспалительной реакции может помочь справиться с болью и другими неприятными симптомами артрита, и здесь на помощь приходит ваша диета: определенные продукты могут усиливать или уменьшать воспаление в организме.
«В основе патологии артрита лежит хроническое и неконтролируемое воспаление», — говорит Лиз Вайосник, RDN, диетолог и владелица Equilibryum в Сиэтле, штат Вашингтон. «Диета может абсолютно воздействовать на артрит, либо усиливая воспалительные симптомы, либо успокаивая [воспаление]».
Продукты, которых следует ограничить или избегать при артрите
По данным Arthritis Foundation, следующие продукты могут вызвать или усугубить воспаление:
На самом деле это означает «добавленный сахар», то есть сахар, добавляемый в пищу во время обработки (вспомните: подслащенные напитки, такие как газированные напитки и закуски).По данным Американской кардиологической ассоциации, вы должны ограничить добавленный сахар до 6 чайных ложек в день для женщин и детей и не более 9 чайных ложек в день для мужчин. граммов; в банке колы на 12 унций содержится 39 граммов сахара.)
Ограничение количества насыщенных жиров в вашем рационе означает употребление меньшего количества красного мяса, цельножирных молочных продуктов, сливочного масла и сыра.
Согласно исследованию, опубликованному в марте 2017 года в журнале Arthritis Care and Research , уменьшение количества насыщенных жиров в рационе и замена их мононенасыщенными жирами (например, орехами, авокадо и растительными маслами) может помочь замедлить прогрессирование остеоартрита коленного сустава.
Это искусственные жиры, которые Управление по санитарному надзору за качеством пищевых продуктов и медикаментов запретило использовать в качестве ингредиента пищевых продуктов в 2015 году. Однако они по-прежнему содержатся в очень небольших количествах в переработанной выпечке и продуктах длительного хранения, которые имеют «частично гидрогенизированные» в списке ингредиентов. . Вот шесть продуктов, которых следует избегать.
Омега-6 не так уж плохи сами по себе, но проблема в том, что соотношение омега-6 и омега-3 не соответствует норме. Цель состоит в том, чтобы снизить это соотношение, что означает меньшее количество омега-6 жирных кислот и больше омега-3, чтобы помочь уменьшить боль, связанную с воспалением артрита, согласно статье, опубликованной в феврале 2018 года в Clinical Journal of Pain .
Старайтесь избегать переработанного мяса и отдавайте предпочтение морепродуктам и нежирным кускам мяса травяного откорма.
Совет
Стремитесь съедать порцию жирной рыбы весом от 3 до 6 унций два-четыре раза в неделю, согласно Arthritis Foundation, и выбирайте рыбу с относительно низким содержанием ртути, такую как лосось, сардины, атлантическая скумбрия и черная треска.
Глютен — это белок, содержащийся в пшенице, ржи и ячмене, а казеин — это белок, содержащийся в молочных продуктах. Если у вас есть чувствительность к любому из них, это может вызвать воспалительную реакцию.
Связь не совсем ясна, но некоторые люди с ревматоидным артритом нашли облегчение, придерживаясь веганской диеты без глютена, согласно исследованию, опубликованному в феврале 2018 года в Open Rheumatology Journal .
«Основная теория заключается в том, что когда вы переходите на растительную диету, вы сокращаете продукты животного происхождения (молочные и мясные) и, следовательно, исключаете большинство продуктов, которые способствуют воспалению, что помогает контролировать симптомы РА», — Фебин. Мелепура, доктор медицинских наук, медицинский директор Института спорта и боли в Нью-Йорке, рассказывает LIVESTRONG.ком. «Напротив, диеты с высоким содержанием продуктов животного происхождения и низким содержанием клетчатки могут усугубить ваш артрит или вызвать больше обострений».
Что есть при артрите
Жирная рыба, такая как лосось, богата омега-3, которые борются с воспалением.
Изображение предоставлено: kajakiki/E+/GettyImages
Диета, направленная на облегчение симптомов артрита, обычно включает продукты, которые могут помочь уменьшить воспаление, а не способствовать его развитию. Но «не существует единого подхода, подходящего для всех», — говорит доктор.— говорит Мелепура. «Что работает для одного, может не работать для другого».
Имея это в виду, вот несколько общих рекомендаций, которым нужно следовать, но не забудьте скорректировать их в соответствии с вашими индивидуальными симптомами.
Ни для кого не секрет, что фрукты и овощи рекомендуются для хорошего здоровья, но их роль в облегчении боли при артрите заключается в особых соединениях, называемых фитохимическими, которые отвечают за борьбу с воспалением.
«Я бы особенно рекомендовал включать такие фрукты, как гранаты, чернику, малину и клубнику», — говорит доктор.Мелепура говорит, «поскольку они являются богатым источником полифенолов, включая антоцианы, кверцетин и различные типы фенольных кислот. Все эти соединения широко известны своим мощным противовоспалительным действием».
Травы и специи также являются хорошими источниками противовоспалительных соединений.
«Петрушка, базилик, кинза, корень имбиря, корица и куркума — одни из самых богатых питательными веществами и противовоспалительных продуктов, поэтому я советую людям включать их в большинство приемов пищи», — говорит Вайосник.
Корица может быть хорошим началом. В одном более раннем исследовании, опубликованном в Журнале сельскохозяйственной и пищевой химии , сравнивали 26 различных специй и обнаружили, что корица показала самую высокую антиоксидантную активность.
Что насчет меда?
Мед обладает антиоксидантными и противовоспалительными свойствами, согласно обзору Pharmacognosy Research за 2017 год, поэтому он потенциально может помочь при симптомах артрита, хотя недостаточно исследований, чтобы сказать наверняка.Мед содержит много сахара и калорий, поэтому вам лучше придерживаться других противовоспалительных продуктов, которые более питательны.
Эти специальные жиры содержатся в основном в рыбе, но вы также можете найти их в грецких орехах, льняном семени и семенах чиа.
Доктор Мелепура называет эти жиры «полезными для суставов» и говорит, что «исследования показывают, что потребление жиров омега-3 снижает уровень двух воспалительных белков: С-реактивного белка (СРБ) и интерлейкина-6».
Однако следует отметить, что это было показано у людей с довольно серьезными заболеваниями, поэтому исследование может быть неприменимо к людям с легким артритом.
Оливковое масло является основным компонентом средиземноморской диеты, состоящей из фруктов и овощей, рыбы, бобовых и орехов. Оливковое масло является мононенасыщенным жиром, и исследователи считают, что это одна из причин, почему средиземноморская диета хороша для уменьшения воспаления.
Согласно исследованию Nutrients , проведенному в августе 2019 года, оливковое масло экстра-классаулучшает здоровье кишечника, а также снижает воспаление в организме.
The Bottom Line
Чтобы уменьшить воспаление при артрите, наполните свою тарелку фруктами и овощами, нежирными белками, жирной рыбой и полезными жирами, такими как оливковое масло.Сократите потребление сахара и насыщенных жиров и полностью избегайте трансжиров.
Лечение артрита с помощью диеты
Если из-за вашего конкретного типа артрита вы запутались в том, какие продукты вам следует есть, пусть это вас не беспокоит. «Противовоспалительное питание может быть совершенно безопасным при любом типе артрита», — уверяет Вайосник.
Если у вас есть пищевая аллергия или вы хотите подтвердить аллергию или непереносимость, которые могут усугублять боль при артрите, поговорите со своим врачом.
Кроме того, зарегистрированный диетолог может помочь вам оценить вашу текущую диету, исключить из рациона продукты, вызывающие беспокойство, и добавить продукты, которые могут принести некоторое облегчение.
. Выводит соли из суставов, они перестают болеть и хрустеть, становятся более подвижными.
Выводит соли из суставов, они перестают болеть и хрустеть, становятся более подвижными. Средство проникает прямо в очаг воспаления тканей и быстро обезболивает. Возвращает суставам подвижность. Если от перенапряжения болят мышцы, поможет их расслабить.
Средство проникает прямо в очаг воспаления тканей и быстро обезболивает. Возвращает суставам подвижность. Если от перенапряжения болят мышцы, поможет их расслабить. Помогает при регулярных болях, если наносить 2 раза в день. Негустой, не оставляет пятен на одежде.
Помогает при регулярных болях, если наносить 2 раза в день. Негустой, не оставляет пятен на одежде. Оно снимает боль и восстанавливает их подвижность. Помогает, когда болят мышцы, снимает отёки. Если ушиблись и появился синяк, тоже помажьте, чтобы гематома рассосалась быстрее. Мазь смягчает и разглаживает кожу, поэтому помогает и при пяточных шпорах и мозолях, А кто-то и вовсе использует её для ухода за губами и руками. В общем, средство универсальное.
Оно снимает боль и восстанавливает их подвижность. Помогает, когда болят мышцы, снимает отёки. Если ушиблись и появился синяк, тоже помажьте, чтобы гематома рассосалась быстрее. Мазь смягчает и разглаживает кожу, поэтому помогает и при пяточных шпорах и мозолях, А кто-то и вовсе использует её для ухода за губами и руками. В общем, средство универсальное.