все вопросы… к микрофлоре кишечника?
Наш кишечник — «дом» для миллиардов микроорганизмов. Есть среди них полезные и вредные, взаимодействующие друг с другом и независимые. Их состав непостоянен, но главное — все они выполняют определенные функции и именно от них зависит наша способность противостоять вирусам и инфекциям. Иными словами, микрофлора кишечника определяет крепость иммунитета. Возникает вполне логичный вопрос о том, как заселить наши кишечники полезными бактериями и получить крепкое здоровье? Давайте разбираться.Иммунитет и кишечник: взаимосвязь очевидна!
Если бы нас спросили: «Где находится иммунитет?», мы бы без раздумий ответили, что он в кишечнике. Именно здесь сосредоточены 80% иммунных клеток, которые стоят на страже нашего здоровья. Это задумано природой не случайно. Несмотря на то, что кишечник — внутренний орган, он постоянно контактирует с внешней средой. Все, что мы даем организму в качестве еды, поступает в него. Завтрак, обед, ужин, перекус — факторы риска для нашего кишечника, ведь в любой момент с продуктами в него могут опасть вредоносные микроорганизмы. Нужен какой-то «фильтр», который создаст мощную защиту для организма.
Завтрак, обед, ужин, перекус — факторы риска для нашего кишечника, ведь в любой момент с продуктами в него могут опасть вредоносные микроорганизмы. Нужен какой-то «фильтр», который создаст мощную защиту для организма.
Этот «фильтр» формируется при нормальной микрофлоре. Когда в нашем пищеварительном тракте находятся исключительно нужные микроорганизмы в достаточном количестве, мы стойко противостоим всем внешним угрозам, прекрасно себя чувствуем, хорошо выглядим. Хорошая микрофлора кишечника способствует регуляции иммунных ответов на вторжение «агрессоров». Кроме того, здоровый ЖКТ – главное условие для правильного усвоения пищи и полезных компонентов, которые поступают в наш организм. Это очень важно, ведь недостаточно дать организму витамины и минералы. Нужно, чтобы они усвоились, а не прошли транзитом. Их всасывание происходит в кишечнике.
В свою очередь задача иммунитета – определить, кто для организма «свой», а кто «чужой». К первому он проявит толерантность, а навстречу второму пойдет в атаку. Если ЖКТ «говорит», что вещество полезно, организм принимает его. Этот механизм получил название иммунная толерантность. Это важнейшая функция иммунитета.
Если ЖКТ «говорит», что вещество полезно, организм принимает его. Этот механизм получил название иммунная толерантность. Это важнейшая функция иммунитета.
Какие бактерии живут в кишечнике
В нашем кишечнике проживает множество микроорганизмов, которые помогают вырабатывать устойчивость к возбудителям инфекций. Их общая масса у ребенка оставляет около полутора килограммов, у взрослого человека — до 4 кг. Их более 500 видов, численность — примерно 10% всех клеток организма.
Какие функции они выполняют?
-
Препятствуют размножению патогенной микрофлоры.
-
Отвечают за синтез аминокислот, витаминов группы B, C, K.
-
Продуцируют ферменты, необходимые для переваривания пищи.
-
Повышают усвояемость витамина D.
-
Способствуют укреплению иммунитета, так как стимулируют образование лимфоцитов.

-
Поддерживают выработку иммуноглобулинов.
-
Обеспечивают иммунный ответ при обнаружении чужеродных объектов.
Как нормализовать микрофлору кишечника
Хотите помочь своему кишечнику – дайте ему пробиотики и пребиотики. Что это за вещества и в чем между ними разница? Мы уже выяснили, что для иммунитета нужен здоровый кишечник. Если в организме нарушается баланс между дружественными и патогенными бактериями, растет число иммунных клеток, которые способствуют развитию воспаления. Главная опасность заключается в том, что часто этот процесс перерастает в хронический. Причем воспаления возможны не только в кишечнике, но и в других органах. Это чревато развитием различных заболеваний, ускоренными возрастными изменениями, ослаблением иммунитета.
Исправить ситуацию и устранить дисбаланс микрофлоры можно при помощи пробиотиков, пребиотиков и их сочетания.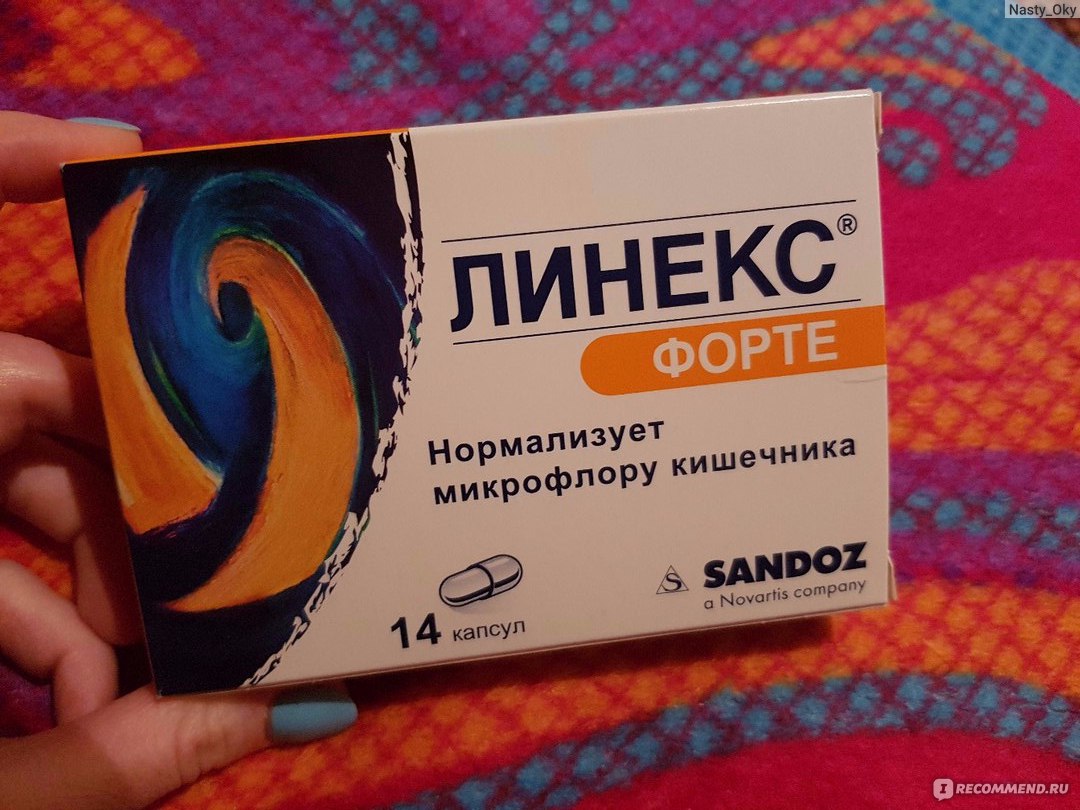
Пробиотики
Пожалуй, многие слышали о пользе пробиотиков, но далеко не все знают, что это и как именно обеспечивается их благотворное влияние на микрофлору кишечника. Пробиотики — препараты с живыми бактериями, представителями нормальной микрофлоры.
В составе препаратов есть бифидобактерии, штаммы лактобацилл, стрептококков, лактококков, энтерококков, пропионибактерий и даже кишечной палочки. У каждого компонента свои уникальные биологические свойства.
Пробиотики принимают с такими целями:
-
минимизация риска инфицирования дыхательной системы;
-
предупреждение/лечение заболеваний желудочно-кишечного тракта;
-
эрадикация бактерии Helicobacter Pylori, которая провоцирует язвенную болезнь и даже рак желудка;
-
ослабление проявлений аллергических реакций;
-
борьба с лишним весом;
-
помощь при диабете;
-
снижение риска развития сердечно-сосудистых заболеваний;
-
терапия патологии мочеполовой системы.

Это неполный список случаев, когда полезен прием пробиотиков.
Пребиотики
Пребиотики — препараты, в которых не содержатся сами бактерии, но содержатся биологически активные компоненты, которые создают благоприятную среду для жизнедеятельности полезных микроорганизмов.
Они стимулируют рост нормальной микрофлоры кишечника, способствуют укреплению иммунитета. У них есть и другие полезные свойства, которые используются при выборе конкретных препаратов, исходя из текущего состояния организма.
Например, к пребиотикам относят пищевые волокна. Пример такого полезного компонента — кукурузный декстрин. Это основной ингредиент биологически активной добавки «Турбослим Активные волокна». Препарат способствует замедленному всасыванию глюкозы, за счет чего она не скапливается в жировых депо, а направляется по назначению.
Этот комплекс разработан для:
-
поддержания нормального уровня холестерина;
-
улучшения состояния кожи;
-
стимулирования выделительной системы, чтобы организму было легче избавляться от токсинов и продуктов метаболизма.

К пребиотикам относится множество компонентов, которые известны нам своими полезными свойствами, в том числе не связанными с воздействием на состояние кишечника. Это соевые и молочные пептиды, витамины А, С, Е, антиоксиданты, глутатион, коэнзим Q10, каротиноиды, ненасыщенные жирные кислоты, лизоцим, растительные экстракты (например, экстракт морских водорослей, тыквы, риса, моркови, чеснока). Список пребиотиков можно продлевать еще достаточно долго. И это далеко не полный перечень.
Синбиотики
Это еще одна группа препаратов, полезных для иммунитета и кишечника. Они менее известны, чем пробиотики и пребиотики, хотя на самом деле, не несут в себе ничего нового. По сути, это смесь одних и вторых. Препараты такого типа выпускает компания «Эвалар». Например, биологически активная добавка «Мультифлора» — классический пример синбиотика нового поколения. В составе БАД — 7 видов бифидо- и лактобактерий, а также пребиотик инулин.
Препарат способствует:
-
укреплению иммунитета;
-
восстановлению микрофлоры кишечника – как в целях профилактики, так и для восстановления баланса после приема антибиотиков;
-
улучшению пищеварения;
-
ускоренному выведению токсинов;
-
сохранению красоты и молодости кожи.
Препарат представляет собой таблетки с двуслойной оболочкой. При поступлении в кишечник сохраняется его неизменный вид, что дает максимум пользы для здоровья. Этот продукт не требует особых температурных условий. Его можно хранить без холодильника, брать с собой в поездки, где существенно возрастает риск проблем с кишечником из-за стрессов, акклиматизации, нарушения режима питания.
У компании «Эвалар» есть еще одна хорошая добавка для организма — «Бифилар». Ее разработкой производитель занимался совместно с UAS Laboratories. Это американская компания, признанная во всем мире лидером в производстве высококачественных пробиотиков. Уникальность этого препарата заключается в комбинации фруктоолигосахаридов, бифидо- и лактобактерий. Такое сочетание дает высокую эффективность. В кишечнике «Бифилар» стимулирует рост полезных бактерий и способствует нормализации микрофлоры. Принцип действия препарата основан на использовании полезными бактериями фруктоолигосахаридов как питательной среды для жизнедеятельности.
Ее разработкой производитель занимался совместно с UAS Laboratories. Это американская компания, признанная во всем мире лидером в производстве высококачественных пробиотиков. Уникальность этого препарата заключается в комбинации фруктоолигосахаридов, бифидо- и лактобактерий. Такое сочетание дает высокую эффективность. В кишечнике «Бифилар» стимулирует рост полезных бактерий и способствует нормализации микрофлоры. Принцип действия препарата основан на использовании полезными бактериями фруктоолигосахаридов как питательной среды для жизнедеятельности.
Где купить?
А также спрашивайте в аптеках!
Правильное питание для здоровья ЖКТ
Основную поддержку нашему организму дает питание. Для здоровья кишечника стоит включить в свой рацион еду, богатую пищевыми волокнами. Клетчатка активирует моторную функцию кишечника и играет роль «фильтра», очищая ЖКТ.Другие полезные советы по питанию:
-
сбалансируйте рацион по минерально-витаминному составу;
-
откажитесь от продуктов, употребление которых скорее вредно, чем полезно — копчености, сладкая газированная вода, чипсы, картошка фри, полуфабрикаты;
-
избегайте продуктов, которые содержат искусственные красители, консерванты;
-
замените жарку тушением, варкой на пару или запеканием;
-
сведите к минимуму употребление алкогольных напитков.

Помните, что не все проблемы с кишечником можно решить самостоятельно. Не забывайте консультироваться со специалистами и решать проблемы на ранней стадии их проявления.
Защищайте себя от стрессов и негативных эмоций. Они — серьезная угроза для иммунитета и здоровья кишечника. Занимайтесь спотом и мыслите позитивно, от этого минимум на 30% зависит здоровье вашей пищеварительной системы и организма в целом.
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ.
Препараты, восстанавливающие нормальную микрофлору // Фармакология
Зацепилова Тамара Анатольевна
Доцент кафедры фармакологии фармфакультета ММА им. И.М. Сеченова
Дисбактериоз — нарушение подвижного равновесия микрофлоры, в норме заселяющей нестерильные полости и кожные покровы человека.
При дисбактериозе нормальная микрофлора не подавляет активность патогенных и гнилостных микроорганизмов; нарушаются процессы пищеварения и усвоения питательных веществ, перистальтика кишечника; ухудшается синтез витаминов; снижается иммунитет. Причины дисбактериоза разнообразны: нарушение рациона питания, длительное применение лекарственных средств (противомикробных и др.), лучевая и химиотерапия, попадание в организм токсинов из окружающей среды (свинец, кадмий, ртуть и др), стрессовые состояния, кишечные инфекции, оперативные вмешательства, заболевания ЖКТ и др. Нарушение равновесия микрофлоры возникшее в ротовой полости, кишечнике, половых и мочевыводящих органах, на коже проявляются соответствующими симптомами. Напротив, дисбактериоз приводит к заболеваниям ЖКТ, ротовой полости, урогенитального тракта, аллергическим болезням, повышает риск развития злокачественных новообразований.
Причины дисбактериоза разнообразны: нарушение рациона питания, длительное применение лекарственных средств (противомикробных и др.), лучевая и химиотерапия, попадание в организм токсинов из окружающей среды (свинец, кадмий, ртуть и др), стрессовые состояния, кишечные инфекции, оперативные вмешательства, заболевания ЖКТ и др. Нарушение равновесия микрофлоры возникшее в ротовой полости, кишечнике, половых и мочевыводящих органах, на коже проявляются соответствующими симптомами. Напротив, дисбактериоз приводит к заболеваниям ЖКТ, ротовой полости, урогенитального тракта, аллергическим болезням, повышает риск развития злокачественных новообразований.
Для восстановления нормального микробиоцеоза применяются препараты, содержащие живые культуры микроорганизмов и различные вещества, способствующие избирательной стимуляции роста полезных микроорганизмов.
Показаниями к применению препаратов, восстанавливающих нормальную микрофлору, являются заболевания и состояния, вызванные дисбактериозом или напротив приводящие к дисбактериозу: заболевания ЖКТ (диарея, запор, колит, энтероколит, синдром раздраженной кишки, гастрит, дуоденит, язвенная болезнь желудка и двенадцатиперстной кишки), респираторных органов, урогенитального тракта, аллергические заболевания, длительный прием антибактериальных средств, гормонов, НПВС, острые кишечные инфекции, пищевые отравления, синдром мальабсорбции, коррекция микробиоценоза и профилактика гнойно-септических заболеваний перед и после операций на кишечнике, печени, поджелудочной железе и др.
ПРОБИОТИКИ (ЭУБИОТИКИ)
Препараты, содержащие культуры живых микроорганизмов. Пробиотики восстанавливают нормальный микробиоценоз. Находясь в кишечнике, они размножаются, угнетают патогенные и условно-патогенные микроорганизмы и создают благоприятные условия для развития нормальной микрофлоры.
В присутствии пробиотиков происходит индукция антител (IgA), активизация фагоцитарной функции лейкоцитов. Микроорганизмы, входящие в состав пробиотиков не патогенны, не токсичны, сохраняют жизнеспособность при прохождении через все отделы ЖКТ. Состав микроорганизмов, входящих в препараты пробиотиков, разнообразен и поэтому условно их можно разделить на несколько групп.
1. Монокомпонентные препараты:
• препараты, содержащие штамм одного вида бактерий.
Колибактерин (Escherichia coli штамма М 17), Бифидумбактерин (Bifidobacterium bifidum штамм 1).
• препараты, содержащие несколько штаммов бактерий одного вида.
Ацилакт, Аципол, Лактобактерин содержат смесь активных штаммов лактобактерий.
• сорбированные препараты.
Это один из видов монокомпонентных препаратов в особой лекарственной форме.
Бифидумбактерин форте и Пробифор содержат бактерии активного штамма Bifidobacterium bifidum No 1 адсорбированные на носителе — косточковом активированном угле. Иммобилизованные на частицах угля бифидобактерии быстро заселяют слизистую оболочку толстого кишечника и обеспечивают высокую локальную колонизацию. Препараты проявляют антагонизм к широкому спектру патогенных и условно–патогенных микроорганизмов, адсорбируют и выводят из кишечника токсины.
2. Поликомпонентные препараты
Они состоят из нескольких видов бактерий.
Линекс — содержит живые лиофилизированные бактерии Bifidobacterium infantis v. liberorum, Lactobacillus acidophilus, Enterococcus faecium. Преимущество препарата Линекс состоит в том, что его можно принимать одновременно с антибиотиками и другими химиотерапевтическими средствами.
Бификол содержит микробную массу совместно выращенных живых бифидобактерий и кишечной палочки.
Бифиформ содержит Bifidobacterium longum и Enterococcus faecium.
Такое сочетание нормализует микрофлору кишечника и обеспечивает подавление значительного числа видов патогенных и условно–патогенных бактерий. Линекс и Бифиформ выпускаются в специальных капсулах, оболочка которых устойчива к действию желудочного сока. Это позволяет высвободить бактерии непосредственно в кишечнике.
3. Препараты конкурентного действия
Они содержат бактерии, вытесняющие условно-патогенную микрофлору и в дальнейшем не колонизирующие кишечник.
Бактисубтил. В его состав входят споры бактерий Bacillus cereus IP 5832.
Споры устойчивы к действию желудочного сока. Прорастание спор бактерий происходит в кишечнике. Вегетативные формы бактерий продуцируют ферменты, которые способствуют образованию кислой среды, препятствующей процессам гниения и избыточного газообразования. Прорастание спор сопровождается интенсивной продукцией антибиотических веществ. Bacillus cereus IP 5832 проявляют выраженное антагонистическое действие к бактериям рода Proteus, Escherichia coli, Staphilococcus aureus.
Bacillus cereus IP 5832 проявляют выраженное антагонистическое действие к бактериям рода Proteus, Escherichia coli, Staphilococcus aureus.
Энтерол содержит микроорганизмы Saccharomyces boulardii, которые обладают прямым антимикробным действием в отношении широкого спектра бактерий: Clostridium difficile, Candida albicans, Candida krusei, Candida pseudotropicalis, Klebsiella pneumoniae, Pseudomonas aeruginosa, Salmonella typhimurium, Yersinia enterocolitica, Escherichia coli, Shigella dysenteriae, Staphilococcus aureus и простейших: Entamoeba histolitica, Lambliae.
Бактиспорин, Споробактерин содержат суспензию сенной палочки (Bacillus subtilis), которая выделяет антибактериальную субстанцию — антибиотик белковой природы, подавляющий развитие эшерихий, стафилококков, стрептококков, протеев, клебсиелл и других микроорганизмов.
ПРЕБИОТИКИ
Различные вещества, положительно влияющие на рост и активность микроорганизмов, присутствующих в ЖКТ. Пребиотики не подвергаются гидролизу пищеварительными ферментами человека, не абсорбируются в верхних отделах тонкого кишечника. Они достигают нижних отделов кишечника и усваиваются преимущественно бифидобактериями, оставаясь малодоступными для других видов микроорганизмов.
Пребиотики не подвергаются гидролизу пищеварительными ферментами человека, не абсорбируются в верхних отделах тонкого кишечника. Они достигают нижних отделов кишечника и усваиваются преимущественно бифидобактериями, оставаясь малодоступными для других видов микроорганизмов.
Пребиотиками являются ксилит, сорбит, фруктоолигосахариды, галактоолигосахариды, лактулоза, лацитол, инулин, валин, аргинин, глутаминовая кислота, пищевые волокна. Пребиотики содержатся в молочных продуктах, кукурузных хлопьях, крупах, хлебе, луки репчатом, цикории полевом, чесноке, фасоли, горохе, артишоке, бананах, топинамбуре и др. Они служат источником энергии для микроорганизмов. Пребиотики сбраживаются бифидобактериями до уксусной, молочной и других кислот, что ведет к снижению рН внутри толстой кишки и создает неблагоприятные условия для развития других родов бактерий, например сальмонелл. Образовавшиеся кислые продукты и другие метаболиты подавляют развитие гнилостной микрофлоры. В результате этого уменьшается количество колоний патогенных бактерий и токсичных метаболитов (аммиака, скатола, индола и др). Пребиотики не токсичны, их можно применять длительно.
Пребиотики не токсичны, их можно применять длительно.
Лактулоза (Дюфалак, Нормазе, Порталак) — синтетический олигосахарид, состоящий из остатков галактозы и фруктозы. Лактулоза попадает в толстый кишечник в неизмененном виде. Микрофлора толстой кишки гидролизует лактулозу с образованием кислот (молочной, частично муравьиной и уксусной). При этом в толстой кишке повышается осмотическое давление и снижается значение рН, что приводит к удержанию ионов аммония, переходу аммака из крови в кишечник и его ионизации. На фоне лактулозы идет активное размножение вводимых извне бифидобактерий и лактобактерий, а так же стимуляция роста естественной микрофлоры кишечника.
Хилак форте содержит концентрат продуктов обмена веществ нормальной микрофлоры кишечника (Escherichia coli, Streptococcus faecalis, Lactobacillus acidophilus, Lactobacillus helveticus). Эти вещества являются источником питания кишечного эпителия, способствуют его регенерации и улучшению функции, нормализуют рН и водно–электролитный баланс, способствуют восстановлению нормальной микрофлоры, подавляют рост патогенных микроорганизмов. Препарат стимулирует иммунитет за счет увеличения синтеза IgА.
Препарат стимулирует иммунитет за счет увеличения синтеза IgА.
КОМБИНИРОВАННЫЕ ПРЕПАРАТЫ (СИНБИОТИКИ)
В состав этих препаратов входят пробиотики, пребиотики и другие вещества.
Бифилиз содержит бифидобактерии и лизоцим. Последний подавляет активность патогенных микроорганизмов, на этом фоне бифидумбактерии начинают активно заселять кишечник.
Нормофлорин-Л и Нормофлорин-Б содержит живые лакто– и бифидобактерии, культуральную среду их обитания (гидролизат козеина средней степени расщепления, пептиды, органические кислоты, витамины, ферменты), пребиотики — активаторы роста и метаболизма бактерий, не разлагающиеся в тонком кишечнике и доходящие в неизмененном виде до толстого кишечника.
Полибактерин содержит семь видов лакто– и бифидобактерий, обезжиренное молоко и концентрат топинамбура.
Восстановление микробиоценоза — длительный и сложный процесс, поэтому фармацевт должен предупредить больного о строгом соблюдении режимов дозирования этих препаратов и всех других предписаний, назначенных врачом.
Как восстановить микрофлору кишечника с помощью питания и лекарственных препаратов?
В кишечнике каждого человека обитает около 50 триллионов разнообразных микроорганизмов, без которых пищеварительный тракт не смог бы полноценно выполнять свою основную функцию – усваивать питательные вещества из продуктов. Общий вес этих маленьких «жильцов» может достигать 3 кг, все они образуют кишечную микрофлору.
У здорового человека микрофлора состоит из 1% условно-патогенных микроорганизмов, среди которых дрожжеподобные грибки, стафилококки и клостридии. Остальные 99% совершенно безвредны. К ним относят бифидо- и лактобактерии, кишечные палочки, энтерококков, аэробов. Если баланс микроорганизмов отклоняется в сторону вредных, и их численность начинает превышать положенный 1%, а популяция полезных бактерий сокращается, значит у человека развивается дисбактериоз.
Внимание! Нарушение микрофлоры кишечника возникает по многочисленным причинам.Очень важно поддерживать микрофлору кишечника. С этими задачами справляется комплекс пробиотиков Эльбифид — Essential Probiotics, который поддерживает баланс естественной микрофлоры кишечника, ответственной за качество иммунного ответа и гармонизацию работы пищеварительной системы.Основные – затяжной прием слабительных, гормональных, антибактериальных препаратов, неправильное питание, диеты и голодания, болезни эндокринной системы, снижение иммунитета, оперативные вмешательства, частые стрессы и депрессии, переутомления, вредные привычки, последствия самостоятельной чистки организма.
Cтоит также обратить ваше внимание на Бифидогенный бальзам — Сибирский прополис Агатовый, который также плодотворно влияет на естественный баланс микрофлоры кишечника, стимулируя её рост. Улучшенная формула бальзама содержит ещё больше лактулозы и сибирских целебных трав.
Лекарственная терапия
При выраженном дисбактериозе микрофлору кишечника восстанавливают медикаментозным способом. Самостоятельно принимать препараты нельзя, поскольку можно еще сильнее усугубить ситуацию. Следует обратиться к врачу, который подберет наиболее подходящий метод лечения дисбактериоза и лекарственные средства. Могут быть назначены:
Самостоятельно принимать препараты нельзя, поскольку можно еще сильнее усугубить ситуацию. Следует обратиться к врачу, который подберет наиболее подходящий метод лечения дисбактериоза и лекарственные средства. Могут быть назначены:
- антибиотики – показаны только в запущенных случаях для устранения вредной флоры;
- пребиотики – для создания благоприятных условий для жизни полезных микроорганизмов;
- пробиотики – живые микроорганизмы, аналогичные тем, которые обитают в здоровом кишечнике;
- симбиотики – для заселения кишечника полезными бактериями и создания подходящих условий для их жизнедеятельности;
- ферменты – для улучшения процесса переваривания пищи.
На какое средство падет выбор врача, зависит от симптоматики у больного. При диарее назначаются пробиотики, при задержке стула – пребиотики, при непостоянном стуле – симбиотики.
Питание
Микрофлору помогают восстановить некоторые продукты и народные средства. Соблюдение правильного питания – одно из важнейших условий для эффективного лечения дисбактериоза. Именно грамотно подобранные продукты позволяют наладить пищеварение, избавиться от проблем со стулом и снабдить организм недостающими микроорганизмами и витаминами.
Соблюдение правильного питания – одно из важнейших условий для эффективного лечения дисбактериоза. Именно грамотно подобранные продукты позволяют наладить пищеварение, избавиться от проблем со стулом и снабдить организм недостающими микроорганизмами и витаминами.
При задержке стула рекомендовано употребление чернослива, свеклы, отрубей, семян льна, овсяной каши. При диарее – цветной капусты, печеных яблок, моркови, риса, приготовленных на пару рыбных и мясных блюд. При метеоризме – легкие бульоны, картофель, омлеты. Исключить в последнем случае придется бобовые, молоко, сладости и выпечку.
Ощутить комфорт и лёгкость в желудке благодаря уникальной композиции сибирских трав вам поможет Фиточай из диких трав № 5 (Комфортное пищеварение) из серии Baikal Tea Collection. Ромашка, курильский чай, подорожник и володушка нормализуют работу пищеварительной системы и восстанавливают микрофлору кишечника.
В качестве перекуса можно использовать Питательный коктейль Ванильная лукума — Yoo Gо, богатый витаминами, аминокислотами и полезными жирами. Каждая порция — это полноценный полезный перекус, наполненный пищевыми волокнами, омега-3 ПНЖК, белком и L-карнитином. Сбалансированный состав обеспечивает организм жизненно важными нутриентами и помогает сохранить ощущение сытости долгое время.
Внимание! Для восстановления кишечной микрофлоры в домашних условиях все равно придется принимать пребиотики и пробиотики. Первые можно получить из чеснока, лука, банана, спаржи, отрубей. Вторые – из кефира и натурального йогурта. Обоими компонентами организм можно снабдить с помощью пищевых добавок.
При дисбактериозе полезно употреблять в пищу паровые овощи, запеченные фрукты, некислые соки, легкие супы, молочные и кисломолочные продукты, цельнозерновые крупы, миндаль. Можно включить в рацион нежирные сорта мяса и рыбы, зачерствелый белый хлеб, отруби, галеты. Под строгим запретом – жирные сорта мяса и рыбы, копчености, соленые, острые, маринованные, кислые продукты, жареные блюда, консервы, мороженое, мучные и кондитерские изделия, концентрированные бульоны, шоколад, перловка, соуса, крепкий чай и кофе, бобовые, грибы, алкоголь.
Нормализуем работу кишечника
Кишечник человека населяют сотни видов различных микроорганизмов, которые отвечают за защиту его слизистой, переваривание пищи и усвоение полезных веществ. Для правильной работы кишечника необходимо, чтобы в нём поддерживался баланс “хороших” и “плохих” бактерий – своих и чужеродных.
Баланс этих бактерий легко нарушить при неправильном питании, приёме антибиотиков, стрессах и некоторых диетах. При возникновении дисбаланса в кишечной флоре патогенные бактерии атакуют иммунную систему, проникая в организм и вызывая изменения.
Нарушения иммунитета могут выражаться по-разному: от акне и частых простуд до тяжелейших заболеваний, способных навредить человеку. Нормализовать работу кишечника могут помочь различные препараты, которые стоит подбирать в зависимости от ситуации.
За микрофлору кишечника отвечают бифидобактерии.
Эти микроорганизмы отвечают за такие важные функции как: синтез витаминов, пищеварение, абсорбирование желчных кислот и холестерина, предупреждение запоров и поносов, стимуляция иммунных реакций.
Одним из источников бифидобактерий является Симбиоз Альфлорекс, он поможет вам восстановить микрофлору кишечника и нормализовать пищеварение.
БАДы в помощь для восстановления микрофлоры кишечника после приёма антибиотиков.
В процессе приёма некоторых препаратов (например, антибиотиков) полезные бактерии погибают, баланс нарушается и микрофлора кишечника страдает. Это выливается в неприятные последствия в виде запоров или диареи.
Для устранения этих последствий есть несколько БАДов, которые себя хорошо зарекомендовали на рынке.
Если вы не любите глотать таблетки, для вас подойдёт Витастронг Флориоза в удобной форме саше.
Если форма выпуска для вас не принципиальна, то на ваш выбор:
- Линекс Форте, успевший зарекомендовать себя среди покупателей;
- Аципол Актив с приятным грушевым вкусом, где один флакон рассчитан на один приём.
Микрофлора кишечника у малышей.
К сожалению, малыши также могут столкнуться с дисбалансом в кишечнике. Восстановить бифидобактерии в этом случае поможет Бифиформ бэби. Также многие педиатры назначают Аципол малыш в удобной форме капель, который содержит в себе и лакто- и бифидобактерии.
С расстройством кишечника могут сталкиваться и малыши, и взрослые, поэтому в целях удобства и экономии есть возможность приобрести нужные препараты сразу в необходимых объёмах для всей семьи.
Не забывайте проверять противопоказания и консультироваться с лечащим врачом по поводу принимаемых препаратов!
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ПЕРЕД ПРИМЕНЕНИЕМ НЕОБХОДИМО ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ
Пре- и пробиотики. Зачем они нужны?
Состав кишечной микрофлоры здорового человека находится в балансе. Когда этот баланс нарушается, возникает дисбактериоз — плохих бактерий становится больше, чем хороших. Основными причинами нарушения бактериального баланса являются:
- неправильное питание,
- бесконечные диеты,
- прием некоторых лекарственных препаратов,
- хронические и инфекционные заболевания.
Все это приводит к дисбалансу флоры и началу патологических реакций брожения и гниения. Сбои в работе желудка и кишечника проявляются расстройством стула (диарея, запор), метеоризмом, отрыжкой, бурлением в животе. Подобные симптомы объясняются деятельностью патогенной микрофлоры и снижением функции «полезных» кишечных бактерий.
Про- и пребиотики – залог правильной работы желудочно-кишечного тракта и здоровья в целом.
Пробиотиками называют продукты или препараты, содержащие полезные микроорганизмы. Они помогают заселить кишечник правильными бактериями и способствуют гибели патогенных организмов. Также к пробиотикам относятся и дрожжи.
Микроорганизмы из пробиотического продукта доходят до кишечника человека и входят в состав его микрофлоры. Повышение содержания полезных бактерий сдерживают размножение патогенных микроорганизмов. Со временем восстанавливается нормальный состав флоры кишечника. Полезные бактерии-пробиотики способны обезвреживать многие вещества, начиная с ядовитых продуктов обмена веществ и заканчивая антибиотиками, тяжелыми металлами и канцерогенами. Пробиотические бактерии выделяют целый ряд веществ, укрепляющих и оздоравливающих кишечную стенку при различных воспалительных процессах.
К продуктам, которые содержат больше всего естественных пробиотиков, можно отнести:
— Кефир, йогурт, сметана, пахта, мягкий сыр, ряженка, закисшая соя, чайный гриб, квашеная капуста.
Исходя из этого, пробиотики оказывают следующие положительные эффекты на физиологические функции и общее состояние человека:
— Заселение толстого кишечника представителями нормальной микрофлоры;
— Улучшение баланса между представителями нормальной микрофлоры и патогенными (условно-патогенными) микроорганизмами;
— Бактерии нормальной микрофлоры, расщепляя компоненты пищи в толстой кишке, продуцируют витамин К, биотин, ниацин и фолиевую кислоту;
— Пробиотики способствуют расщеплению солей желчных кислот, что позволяет понизить концентрацию холестерина в крови;
— Улучшение пищеварения, а также нормализация моторной функции кишечника, устранение вздутия живота, метеоризма;
— Оптимизация времени прохождения пищевого комка по толстому кишечнику;
— Губительно воздействуют на бактерию Helicobacter pylori;
— Восстанавливают микрофлору кишечника после антибиотикотерапии.
Пребиотики – это вещества, которые способствуют восстановлению нормальной микрофлоры кишечника. Пребиотики важны для кишечника – попадая в него, они стимулируют размножение хороших бактерий, заживляют слизистые оболочки, выводят накопившиеся токсины. У пребиотиков есть одно важное и очень ценное качество – в отличие от пробиотиков, они не заселяют организм чужими (пусть и полезными) бактериями. Они из всех сил стремятся вылечить вашу собственную микрофлору и создать все условия для полноценной работы кишечника и всего организма.
Пребиотик стимулирует рост полезных микроорганизмов в прямой кишке (лактобактерий, бифидобактерий). Пребиотические препараты нормализуют пищеварительные процессы, помогают при диарее, запоре, повышенном метеоризме.
К продуктам, которые содержат больше всего естественных пребиотиков, можно отнести:
— Цикорий, чеснок, лук, спаржа, бананы, артишок, овсяная каша, рожь, какао, семена льна, яблоки.
Пребиотики оказывают следующие положительные эффекты на функционирование пищеварительного тракта и общее состояние человека:
— Способствуют увеличению количества представителей нормальной микрофлоры;
— Подавление роста и размножения патогенных микробов;
— Устраняют избыточное количество слизи со стенок и из просвета толстого кишечника;
— Ускоряют процессы заживления стенки толстой кишки;
— Поддерживают оптимальную кислотность (рН) для жизнедеятельности нормальной микрофлоры;
— Увеличивают объем каловых масс, стимулируя перистальтику кишечника и, тем самым, устраняя запоры;
— Уменьшают газообразование в кишечнике, избавляя человека от вздутия живота;
— Стимулируют синтез витаминов группы В и К;
— Оказывают умеренное антибактериальное действие на представителей патогенной микрофлоры за счет стимуляции механизмов местного иммунитета.
Екатерина Толкачева, врач-валеолог
отдела общественного здоровья
Гомельского областного ЦГЭ и ОЗ
18 распространенных лекарств, связанных с измененным микробиомом кишечника
По данным голландских исследователей, почти половина из 41 распространенного класса лекарств связана с изменениями микробиоты кишечника человека.
Значительные изменения в таксономической структуре, метаболической активности и резистоме (гены устойчивости к антибиотикам) были замечены в образцах фекалий человека после использования 18 из 41 распространенной категории лекарств, при этом четырьмя наиболее частыми виновниками были ингибиторы протонной помпы (ИПП), метформин, об антибиотиках и слабительных, сообщил Арнау Вич Вила, магистр медицинских наук из Университетского медицинского центра Гронингена на Объединенной европейской неделе гастроэнтерологии в Барселоне.
Вич Вила и его коллеги выполнили секвенирование метагеномики на 1883 свежезамороженных образцах кала из трех независимых когорт: популяционная группа, пациенты с воспалительным заболеванием кишечника и пациенты с синдромом раздраженного кишечника, смешанные со здоровыми контрольными группами.
Различия между потребителями наркотиков и лицами, не употребляющими наркотики, оценивались путем изучения эффекта от приема одного лекарства, а также с учетом использования нескольких наркотиков каждым участником. Когортные результаты были объединены в метаанализ с использованием обратной дисперсии.
«Наша работа подчеркивает важность учета роли микробиоты кишечника при разработке лечения, а также указывает на новые гипотезы, которые могут объяснить определенные побочные эффекты, связанные с использованием лекарств», — сказал Вич Вила. Эти ассоциации должны быть функционально исследованы в свете важности микробиоты кишечника для здоровья и широкого использования многих лекарств.
Изменения микробиоты кишечника, вызванные лекарственными препаратами, могут увеличить риск кишечных инфекций и ожирения, отмечает Вич Вила.
После внесения поправки на полипрагмазию, семь категорий лекарств остались достоверно связанными с изменениями в 46 кишечных таксонах и путях.
Микробиота кишечника пользователей ИПП, например, показала большее количество стрептококковых бактерий верхних отделов ЖКТ и повышенный биосинтез жирных кислот, в то время как у пользователей метформина были более высокие уровни потенциально инфекционной кишечной палочки Escherichia coli.
В других ассоциациях:
- Увеличение механизмов устойчивости к антибиотикам было связано с восемью различными категориями лекарств: антиандрогенными пероральными контрацептивами, бета-симпатомиметическими ингаляторами, слабительными, метформином, другими пероральными противодиабетическими средствами, ИПП, нестероидными противовоспалительными препаратами и triptans
- Депрессанты селективного ингибитора обратного захвата серотонина были связаны с обилием Eubacterium ramulus , обычно считающихся полезным разрушителем пищевых флавоноидов
- Пероральные стероиды были связаны с обогащением метаногенными бактериями, которые были связаны с повышенным индексом массы тела
«Мы уже знаем, что на эффективность и токсичность некоторых лекарств влияет бактериальный состав желудочно-кишечного тракта и что микробиота кишечника связана с множеством заболеваний», — сказал Вич Вила в пресс-релизе UEGW.«Поэтому очень важно понять, каковы последствия использования лекарств для микробиома кишечника».
Исследователи указали на увеличение количества сообщений об изменениях микробиоты кишечника, связанных с ожирением, диабетом, заболеваниями печени и нейродегенеративными заболеваниями, а также раком.
Гейл Креши, доктор философии, доктор медицинских наук из клиники Кливленда в Огайо, которая не принимала участия в исследовании, отметила, что хорошо известно, что лекарства могут изменять состав и разнообразие кишечных микробов, в частности тех, которые изменяют pH желудочного сока (например, ИПП), уничтожают бактерии (антибиотики) или изменяют моторику (слабительные).
«Секвенирование метагеномики в настоящее время продвигает вперед область, касающуюся функции микробиома кишечника и медицинских методов лечения», — сказала она MedPage Today. «Это было замечено с иммунотерапевтическими агентами, использующими состав и функцию микробиома в качестве средства для измерения ответа и токсичности иммунной терапии рака, а также с использованием пребиотиков, пробиотиков, постбиотиков и трансплантации фекальной микробиоты для модуляции иммунной терапии», — сказал Креши, который не принимал участия в голландских исследованиях.
Точно так же Дэвид Т.Рубин, доктор медицины из Чикагского университета, сказал, что это исследование способствует развитию понимания того, насколько изменчивой может быть кишечная микробиота. «Конечно, понятно, что диета и воспаление влияют на состав кишечной микробиоты, но оценка воздействия многих медицинских методов лечения ранее не описывалась», — сказал он MedPage Today.
«Открытие того, что большинство этих методов лечения действительно влияет на состав микробиоты кишечника прямым или косвенным образом, имеет значение для того, как эти лекарства могут влиять на другие биологические функции, включая метаболизм», — сказал Рубин, не участвовавший в исследовании.«Будет интересно глубже понять продольные изменения с течением времени, а также то, возвращается ли микробиом к своему исходному уровню или компенсируется другими способами».
Охарактеризовав исследование как ассоциативное, Джек Гилберт, доктор философии из Калифорнийского университета в Сан-Диего, сказал, что, тем не менее, оно выявило потенциально важные изменения, связанные с лекарствами. «Это предварительная информация, но она дает некоторые проверяемые гипотезы для будущей работы», — сказал он MedPage Today.
Дайана Свифт — независимый медицинский журналист из Торонто.
Раскрытие информации
Это исследование было поддержано Исследовательским советом Нидерландов и Университетом Гронингена. Авторы не сообщили о конфликте интересов. Креши, Рубин и Гилберт сообщили об отсутствии конкурирующих интересов в отношении своих комментариев.
Пожалуйста, включите JavaScript, чтобы просматривать комментарии от Disqus.Многие распространенные лекарства могут изменить ваш микробиом
Роберт ПрейдтHealthDay Reporter
СРЕДА, 23 октября 2019 г. (Новости HealthDay) — Некоторые широко используемые лекарства изменяют популяцию микробов в кишечнике, и их количество увеличивается риск устойчивости к антибиотикам, показывает новое голландское исследование.
Микробиом кишечника включает не менее 1000 видов бактерий и находится под влиянием ряда различных факторов, в том числе лекарств. Исследования показывают, что изменения микробиома кишечника связаны с ожирением, диабетом, заболеваниями печени, раком и нейродегенеративными заболеваниями.
«Мы уже знаем, что на эффективность и токсичность некоторых лекарств влияет бактериальный состав желудочно-кишечного тракта и что микробиота кишечника связана с множеством заболеваний; поэтому очень важно понять, какие последствия использование лекарств в микробиоме кишечника », — сказал ведущий исследователь Арнау Вич Вила из Университетского медицинского центра Гронингена.
В этом исследовании исследователи изучили 41 наиболее часто используемую категорию лекарств и оценили 1883 образца фекалий людей, которые принимали и не принимали лекарства, в том числе некоторые с синдромом раздраженного кишечника (СРК) и воспалительным заболеванием кишечника (ВЗК).
Восемнадцать категорий лекарств оказали серьезное воздействие на микробиом кишечника, а восемь повышали риск устойчивости к противомикробным препаратам.
Категории, оказавшие наибольшее влияние на микробиом, были:
- Ингибиторы протонной помпы (ИПП), используемые для лечения расстройства желудка, пептической язвы, эрадикации H. pylori , желудочного рефлюкса и пищевода Барретта.
- Метформин, применяемый для лечения диабета 2 типа.
- Антибиотики, применяемые для лечения бактериальных инфекций.
- Слабительные, применяемые для лечения и профилактики запоров.
Микробиомы кишечника пользователей ИПП имели более высокие уровни бактерий верхних отделов желудочно-кишечного тракта и повышенное производство жирных кислот, а у пользователей метформина были более высокие уровни потенциально вредных бактерий E. coli .
По словам исследователей, семь других категорий лекарств были связаны со значительными изменениями в популяциях бактерий в кишечнике.
Например, использование антидепрессантов СИОЗС людьми с СРК было связано с повышенным уровнем потенциально вредных видов бактерий Eubacterium ramulus .
Между тем, использование пероральных стероидов было связано с высоким уровнем метаногенных бактерий, связанных с ожирением и увеличением индекса массы тела (оценка жира в организме на основе веса и роста).
Исследование должно было быть представлено в среду на ежегодном собрании UEG (United European Gastroenterology) в Барселоне. Такое исследование считается предварительным, пока оно не будет опубликовано в рецензируемом журнале.
«Наша работа подчеркивает важность учета роли кишечной микробиоты при разработке лечения, а также указывает на новые гипотезы, которые могут объяснить определенные побочные эффекты, связанные с использованием лекарств», — сказал Вила в пресс-релизе встречи.
Общие лекарства, связанные с изменениями микробиома кишечника
23 октября, 2019
2 мин чтения
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписывайся Нам не удалось обработать ваш запрос. Пожалуйста, попробуйте позже. Если проблема не исчезнет, обратитесь по адресу [email protected].Вернуться в Healio
Группа широко используемых категорий лекарств оказывает значительное влияние на состав микробиома кишечника, что может увеличить риск инфекций, ожирения и других состояний, согласно результатам исследования, представленным на Неделе UEG.
Arnau Vich Vila, , отделение гастроэнтерологии и гепатологии Университетского медицинского центра Гронингена в Нидерландах, и его коллеги обнаружили, что 18 общих категорий лекарств были связаны с изменениями в составе или функции микробиома кишечника. . Их исследования изучали изменения в общей популяции, а также у пациентов с такими заболеваниями, как воспалительные заболевания кишечника и синдром раздраженного кишечника.
«Мы уже знаем, что на эффективность и токсичность некоторых лекарств влияет бактериальный состав желудочно-кишечного тракта и что микробиота кишечника связана с множеством заболеваний», — говорится в пресс-релизе Вич Вила. «Поэтому крайне важно понять, каковы последствия использования лекарств для микробиома кишечника».
Исследователи выполнили метагеномное секвенирование 1883 свежезамороженных образцов фекалий, взятых из трех независимых групп.Первой была популяционная когорта. Вторая группа включала пациентов с ВЗК, а третья включала пациентов с ВЗК, смешанных со здоровыми людьми из контрольной группы.
Исследователи сравнили таксономические и метаболические функции людей, употреблявших или не употреблявших наркотики. В их анализе рассматривалось влияние однократного приема лекарства и влияние комбинированного приема лекарств.
Из 41 категории лекарств, которые они включили, Вич Вила и его коллеги обнаружили, что 18 были связаны со значительными изменениями в микробиоме кишечника.Наибольшее влияние оказали ингибиторы протонной помпы, метформин, антибиотики и слабительные средства.
В микробиомах людей, которые принимали ИПП, исследователи обнаружили повышенное количество бактерий верхних отделов желудочно-кишечного тракта, а также повышенное производство жирных кислот. Среди людей, которые принимали метформин, они обнаружили более высокие уровни Escherichia coli .
Исследователи также наблюдали более высокую численность Eubacterium ramulus у пациентов с СРК, принимавших СИОЗС, и обнаружили, что использование пероральных стероидов было связано с более высоким уровнем метаногенных бактерий.
В своем анализе Вич Вила и его коллеги также определили восемь групп лекарств, которые, по-видимому, увеличивают механизмы устойчивости к антибиотикам в микробиоме.
«Наша работа подчеркивает важность учета роли микробиоты кишечника при разработке методов лечения, а также указывает на новые гипотезы, которые могут объяснить определенные побочные эффекты, связанные с использованием лекарств», — говорится в сообщении Вич Вила. — Алекс Янг
Артикул:
Vich Vila A, et al.Аннотация OP334. Представлено на: Неделе UEG. 19-23 октября 2019 г .; Барселона.
Раскрытие информации s: Авторы не сообщают о раскрытии соответствующей финансовой информации.
Перспектива
Вернуться к началуТаха Кази, Мэриленд
Это было хорошо проведенное исследование. Я думаю, что авторы пытались оценить изменения в микробиоме пациентов, которым прописывались лекарства, и тех, кто их не принимал. Авторы также попытались контролировать такие аспекты, как полипрагмазия.Фактически, исследователи сообщили о том, на что ранее намекали, что микробиом — это динамичная и разнообразная система органов, на которую в определенной степени влияют не только диета, страна происхождения, воспаление, но и назначенные лекарства.
Это исследование предполагает, что лекарства, которые мы предоставляем нашим пациентам, могут иметь эффект, в том числе на метаболизм и физиологию, который выходит за рамки их предполагаемой фармацевтической цели. Авторы предположили, что обычные лекарства, такие как оральные контрацептивы, метформин, ИПП и слабительные средства, повышают устойчивость к антибиотикам.Очевидно, нам нужно посмотреть на эти данные в долгосрочном плане, чтобы определить, как эти изменения влияют на пациентов.
Как гастроэнтеролог, мы чаще всего назначаем ИПП и слабительные средства, которые оказывают ощутимое влияние на микробиом кишечника, как это предполагалось в этом исследовании. Авторы связывают эти препараты с паттернами устойчивости к антибиотикам. Однако я не думаю, что в отсутствие продольных данных это изменит мою практику предоставления этих агентов. Тем не менее, это предостережение для врачей и пациентов.
Таха Кази, Мэриленд
Клиника Кливленда
Раскрытие информации: Qazi не раскрывает соответствующей финансовой информации.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписывайся Нам не удалось обработать ваш запрос. Пожалуйста, попробуйте позже. Если проблема не исчезнет, обратитесь по адресу [email protected].Вернуться в Healio
Ресурсный центр микробиома
Как улучшить здоровье кишечника — Forbes Health
Определенные продукты и здоровый образ жизни могут естественным образом улучшить здоровье кишечника.
1. Ешьте продукты, богатые клетчаткой и содержащие пробиотики
Волокно — это питательное вещество растительного происхождения, которое снижает риск метаболических заболеваний, стимулируя рост и разнообразие полезных бактерий в кишечнике, как показывают исследования. Сладкий картофель, шпинат, свекла, морковь и фенхель полны натуральной клетчатки, улучшающей работу кишечника. Помимо фруктов и овощей, цельнозерновые продукты также являются богатым источником клетчатки.
Ферментированные продукты, такие как йогурт, кимчи, квашеная капуста и чайный гриб, также ценятся за их способность улучшать работу кишечника благодаря наличию пробиотиков.Йогурт может помочь успокоить желудочно-кишечные заболевания, такие как диарея, воспалительные заболевания кишечника и запоры. Одно исследование показало, что у людей, которые регулярно едят йогурт, в кишечнике больше лактобактерий, полезных для кишечника бактерий, а также меньше энтеробактерий — типа бактерий, связанных с воспалением.
2. Рассмотрим дополнение
Пробиотические добавки становятся все более популярными, поскольку слухи о важности здоровья кишечника продолжают распространяться. Хотя пробиотические добавки не являются панацеей для здоровья кишечника, есть некоторые свидетельства того, что они могут улучшить микробиоту и восстановить здоровье кишечника при определенных условиях.
Ваш врач может также порекомендовать пробиотическую добавку, если вам прописали антибиотик. Данные свидетельствуют о том, что это может помочь предотвратить диарею, связанную с приемом антибиотиков.
Если вас интересуют пробиотические добавки, посоветуйтесь со своим врачом. Хотя такие добавки заведомо безопасны, особенно у здоровых людей, риск вредных эффектов выше у людей с ослабленной иммунной системой.
Купить сейчас: доступно на Amazon.
3. Часто упражнения
Движение — это лекарство для многих частей человеческого тела, включая микробиом.В исследованиях как на животных, так и на людях исследователи обнаружили, что упражнения способствуют увеличению разнообразия полезных бактерий в кишечнике.
В то время как несколько исследований подчеркивают роль, которую упражнения и диета могут играть вместе в положительном влиянии на здоровье кишечника, в обзоре 2019 года конкретно сообщается, что упражнения могут изменять состав и функциональность кишечных бактерий независимо от диеты. Исследователи обнаружили, что более длительные тренировки и высокоинтенсивные аэробные тренировки, в частности, больше всего способствовали разнообразию и функционированию кишечных бактерий с точки зрения общего самочувствия.Они также отметили, что худощавые люди с большей вероятностью получат пользу от физических упражнений для здоровья кишечника, чем люди с избыточным весом или ожирением.
4. Ограничьте употребление алкоголя
Чрезмерное употребление алкоголя также может негативно повлиять на ваш микробиом. Повторное употребление алкоголя связано с гастритом — раздражением кишечника, при котором он воспаляется. Такое воспаление может привести к изжоге, хроническому дискомфорту, язвам и бактериальным инфекциям.
Чрезмерное употребление алкоголя также связано с воспалением кишечника, которое является признаком нездорового кишечника.Исследования показывают, что этот вид воспаления влияет на микробиоту, в том числе на то, насколько хорошо она работает, и может вывести ее из равновесия.
Развивайте привычки пить лучше
Cutback Coach использует психологический подход, чтобы помочь вам пить более осознанно. Получите индивидуальный план, основанный на ваших текущих привычках и целях в отношении употребления алкоголя, а затем ежедневные текстовые сообщения помогут вам отслеживать прогресс и оставаться на цели.
5. Снижение уровня стресса
Стресс — это не просто психическое заболевание: подумайте о бабочках, которых вы чувствуете, когда возбуждены или тревожны.Эксперты по здоровью кишечника часто ссылаются на «связь между кишечником и мозгом» и называют кишечник «вторым мозгом». Хотя мы не знаем всего об их отношениях, мы знаем, что психическое здоровье и кишечник тесно связаны.
Исследования показывают, что на тревожность и депрессию влияет кишечник, и наоборот — они могут повышать риск СРК, а люди с СРК с большей вероятностью будут испытывать эти расстройства психического здоровья.
Поиск способов управлять своим психическим здоровьем и уровнем стресса может помочь уменьшить неприятные симптомы со стороны желудочно-кишечного тракта и вернуть ваше тело в равновесие.Не знаете с чего начать? Попробуйте добавить в свой день немного физической активности. Такие простые вещи, как ежедневная прогулка, могут улучшить здоровье кишечника, поскольку исследования показывают, что упражнения могут повысить качество и количество полезных для здоровья кишечных микробов.
Исследование: неантибиотические препараты влияют на кишечные бактерии, могут способствовать развитию устойчивости.
Новое исследование группы немецких ученых показывает, что антибиотики — не единственные препараты, влияющие на микробиом кишечника.
В исследовании, проведенном сегодня в Nature, исследователей из Европейской лаборатории молекулярной биологии (EMBL) сообщают, что более четверти (250 из 923) неантибиотических препаратов, включая противовирусные препараты, нейролептики, кислотоснижающие препараты, химиотерапию. лекарства и лекарства от кровяного давления — подавляли рост по крайней мере одного штамма бактерий, обычно встречающихся в кишечнике здоровых людей.Исследователи также обнаружили, что потребление некоторых неантибиотиков может способствовать устойчивости к антибиотикам.
В то время как все больше исследований изучают задокументированные эффекты антибиотиков на микробиом кишечника и их влияние на здоровье человека, это исследование является первым, в котором систематически профилируется взаимодействие между неантибиотиками и кишечными бактериями человека.
«Количество неродственных лекарств, поражающих кишечные микробы в качестве побочного ущерба, было удивительным», — сказал в пресс-релизе EMBL автор-корреспондент и старший научный сотрудник EMBL Пер Борк, доктор философии.«Этот сдвиг в составе наших кишечных бактерий способствует побочным эффектам лекарств, но также может быть частью их полезного действия».
Лекарства, нацеленные на человека, противомикробное воздействие
В рамках исследования исследователи наблюдали за ростом 40 репрезентативных изолятов кишечных бактерий человека после обработки 1079 соединениями. Отобранные штаммы, выращенные в лабораторных культурах, представляли 38 видов бактерий, обычно встречающихся в микробиоме кишечника здоровых людей, включая Escherichia coli, Bacteroides fragilis, и Clostridium difficile .
Из 1079 протестированных препаратов 156 имели известную антибактериальную активность (144 антибиотика и 12 антисептиков) и 88 были эффективны против вирусов, грибков и паразитов. Остальные были лекарствами, которые нацелены на клетки человека, а не на клетки микробов. Препараты были протестированы в концентрациях, которые, по оценкам, обнаруживаются в кишечнике человека.
Неудивительно, что результаты показали, что 78% антибактериальных средств подавляли рост по крайней мере одного вида бактерий, а некоторые были активны против нескольких видов.Несмотря на то, что антибиотики используются для уничтожения или подавления определенных патогенных бактерий у пациента, многие классы антибиотиков также нацелены на нормальную кишечную флору. Вот почему лечение антибиотиками часто вызывает проблемы с желудочно-кишечным трактом и считается основным фактором инфекции C difficile , наиболее частой причины госпитальной диареи. Нарушение микробиома кишечника антибиотиками может позволить C difficile процветать в кишечном тракте.
Но 27% протестированных лекарств, не являющихся антибиотиками, также повлияли на рост бактерий, в том числе 24% лекарств, нацеленных на человека.К ним относятся такие препараты, как омепразол, ингибитор протонной помпы, продаваемый под торговой маркой Prilosec; локсапин, который используется для лечения шизофрении; и метформин, противодиабетический препарат. Исследователи подозревают, что антимикробные эффекты некоторых из этих препаратов, например метформина, могут быть напрямую связаны с механизмом их действия. А с нейролептиками воздействие на кишечные бактерии может способствовать терапевтическому эффекту.
В то время как большинство из 203 лекарственных препаратов, нацеленных на человека, воздействовали на один или несколько штаммов бактерий, 40 воздействовали как минимум на 10 штаммов.Химиотерапевтические препараты, блокаторы кальциевых каналов (используемые для лечения высокого кровяного давления) и нейролептики подавляли больше кишечных бактерий, чем другие лекарства.
Хотя восприимчивость видов бактерий к лекарствам варьировала, исследователи сообщают, что виды, которые наиболее распространены в кишечнике здоровых людей, были более восприимчивыми, включая такие виды, как Roseburia Кишечник, Eubacterium rectale, и Bacteroides vulgaris. .
«Это говорит о том, что лекарственные препараты, нацеленные на человека, оказывают еще большее влияние на микробиом кишечника с ключевыми видами, связанными с состоянием здоровья», — пишут авторы.
Повышение устойчивости к антибиотикам
Еще одно удивительное открытие: исследователи также обнаружили, что определенные механизмы устойчивости к антибиотикам, по-видимому, работают против неантибиотиков. Отметив, что существует сильная корреляция между бактериями, устойчивыми к антибиотикам, и бактериями, устойчивыми к лекарствам, нацеленным на человека, исследователи экспериментировали со штаммом E coli , несущим ген устойчивости к антибиотикам tolC, , который продуцирует белок который выталкивает антибиотики и другие химические вещества из бактериальных клеток.Они обнаружили, что E. coli , сверхэкспрессирующая ген, были устойчивы как к антибиотикам, так и к шести из семи неантибиотиков, тогда как E coli без гена были более чувствительны к обоим.
Этот эксперимент также показал, что другие гены, которые ранее были связаны с устойчивостью к антибиотикам, способствовали устойчивости к лекарствам, нацеленным на человека. Авторы говорят, что эти результаты вызывают беспокойство, потому что они предполагают, что прием определенных кислотоснижающих лекарств или препаратов от кровяного давления может способствовать устойчивости к антибиотикам, подавляя чувствительные штаммы бактерий и позволяя устойчивым к лекарствам штаммам процветать.
Возможный потенциал роста
Поскольку была протестирована лишь небольшая часть из сотен видов бактерий в кишечнике человека, авторы говорят, что количество неантибиотических препаратов, подавляющих рост бактерий, вероятно, выше, что подчеркивает необходимость изучения роли этого эти препараты потенциально играют роль в заболеваниях, связанных с микробиомом.
«Принимая во внимание, что многие члены кишечного микробиома человека больше подвержены влиянию лекарств, можно предположить, что фармацевтические препараты, регулярно используемые в наше время, могут способствовать уменьшению разнообразия микробиомов в современных западных обществах», они записывать.
Но есть и положительный момент, добавляют они. Например, лекарственные препараты, нацеленные на человека, которые ингибируют рост бактерий, можно использовать в качестве антибиотиков; авторы отмечают, что ряд неантибиотиков специфически подавлял рост C. difficile. Также могут быть возможности для разработки индивидуализированных методов лечения, непосредственно направленных на микробиоту кишечника. И дальнейшее изучение того, как эти препараты влияют на микробиом кишечника, может привести к улучшениям, которые уменьшают побочные эффекты и повышают эффективность.
См. Также:
19 марта Природа аннотация
19 марта Пресс-релиз EMBL
Кишечный микробиотический метаболизм лекарств при воспалительном заболевании кишечника | Журнал болезни Крона и колита
Абстрактные
Предпосылки и цели
Микробиота кишечника играет важную роль в метаболизме и модуляции некоторых типов лекарств. В этом исследовании мы стремились изучить литературу, касающуюся микробного метаболизма лекарств, назначаемых при воспалительных заболеваниях кишечника [ВЗК].
Методы
Систематический поиск литературы проводился в Embase и PubMed с момента создания до октября 2019 года. Поиск проводился с использованием предварительно определенных MeSH / Emtree и текстовых терминов. Подходили все исследования метаболизма лекарств микробиотой лекарств, прописанных в практике ВЗК. Всего было обнаружено 1018 записей, и 89 статей были отобраны для полнотекстового чтения.
Результаты
На метаболизм или модуляцию кишечных бактерий влияют четыре конкретных препарата, используемых при ВЗК (месалазины, метотрексат, глюкокортикоиды и тиогуанин).Микробиота кишечника расщепляет азосвязь сульфасалазина, бальсалазида и олсалазина и высвобождает активный фрагмент 5-аминосалициловой кислоты. Он влияет на метаболизм и, возможно, на реакцию на терапию метотрексатом. В частности, тиогуанин может превращаться кишечными бактериями в фармакологически активные нуклеотиды 6-тиогуанина без необходимости метаболизма хозяина. Глюкокортикоидные соединения могут быть подвержены бактериальному разложению.
Заключение
Микробиота кишечника человека может иметь большое влияние на метаболизм лекарств и эффективность лекарств, назначаемых в практике ВЗК.Необходимо более глубокое понимание этих взаимодействий между микробиотой и лекарствами, и оно должно стать неотъемлемой частью процесса разработки новых лекарств от ВЗК.
1. Введение
Микробиом — это совокупность геномов всех микроорганизмов в окружающей среде. С другой стороны, микробиота обычно относится к конкретным микроорганизмам [например, бактерии, вирусы и грибки], которые встречаются в определенной среде, что приводит к локальным различиям в микробиоте каждого человека в зависимости от того, где в организме собирается микробиота.Микробиом кишечника человека представляет собой сложное, плотное и разнообразное микробное сообщество. По оценкам, в его состав входит более пяти миллионов уникальных генов и более 100 триллионов клеток. 1 Несмотря на это разнообразие, кишечные микробы в основном распространены в четырех типах бактерий, а именно: Actinobacteria, Bacteroidetes, Firmicutes и Proteobacteria. 2 Микробиота кишечника играет важную роль во многих аспектах здоровья человека, включая метаболические, иммунные и нейроповеденческие особенности, но также является важной мишенью для лекарств. 3
Микробиота кишечника может активировать, инактивировать или сделать лекарство токсичным. Он может влиять на метаболизм лекарств напрямую через биотрансформацию, которая представляет собой преобразование органических соединений в другие химические формы или метаболиты, и этому могут способствовать микроорганизмы. 4 Наиболее распространенными механизмами метаболизма лекарств кишечной микробиоты являются гидролитические и восстановительные реакции. Кроме того, сообщалось о многих других химических реакциях, включая ацетилирование, дезаминирование, дегидроксилирование, декарбоксилирование, деметилирование, деконъюгацию и протеолиз. 5 Помимо биотрансформирующих лекарств, микробиота кишечника может косвенно контролировать эффективность лекарств, изменяя метаболизм хозяина и производя метаболиты, которые конкурируют с рецептором лекарства. 5
Важность взаимодействия между микробиотой и лекарствами была отмечена в 1993 году, когда соридувин был представлен на японском рынке в качестве препарата для лечения инфекции, вызванной вирусом ветряной оспы и опоясывающего лишая. В течение 40 дней после введения 18 человек умерли после того, как им назначили соридувин вместе с пероральным 5-флуоурацилом, противораковым препаратом.Позже было обнаружено, что соридувин трансформировался микробиотой кишечника в ( E ) -5- (2-бромовинил) урацил, который ингибирует метаболизм 5-фторурацила, что приводит к токсическим уровням этого конкретного препарата. 6 Это лекарственное взаимодействие подчеркивает важность изучения метаболизма лекарств микробиотой кишечника.
Помимо этих возможных токсических эффектов, микробиота кишечника также может использоваться для активации или повышения эффективности лекарств, то есть преобразования пролекарств в активные лекарства.Один из примеров этого механизма продемонстрирован в терапии лактулозой. Этот препарат гидролизуется кишечными бактериями с образованием уксусной и молочной кислоты, которые снижают pH в желудочно-кишечном тракте. Из-за более низкого pH аммиак и другие амины протонируются и, как правило, выводятся с фекалиями, что приводит к слабительному эффекту лактулозы и ее использованию для лечения гипераммонии и печеночной энцефалопатии. 7,8
В последние годы были проведены обширные исследования роли микробиома в патогенезе воспалительного заболевания кишечника [ВЗК] и терапевтического потенциала кишечной микробиоты при лечении ВЗК, включая трансплантацию фекальной микробиоты. 2 Меньше внимания уделялось роли кишечной микробиоты в метаболизме и модуляции некоторых препаратов, назначаемых для лечения ВЗК. В этом обзоре мы стремимся описать роль микробного метаболизма лекарственных средств при ВЗК и, таким образом, потенциал таргетной терапии ВЗК.
2. Методы
Систематический электронный поиск литературы проводился с использованием электронных баз данных Embase и PubMed для сбора публикаций до октября 2019 г. Поиск проводился с использованием комбинации следующих слов MeSH / Emtree и текстовых терминов со звездочками [*], где это применимо: «Воспаление кишечника болезнь, болезнь Крона, язвенный колит, микробиом желудочно-кишечного тракта, микрофлора, метагеном, микробиота, бактерии, фармакокинетика, биотрансформация, активация, инактивация, метаболизм, пролекарства, конверсия, токсичность, эффективность и взаимодействие лекарственного микробиома ».Весь поиск был объединен с общими и фирменными названиями лекарств от ВЗК [Дополнительные данные 1]. Поиск не ограничивался исключительно людьми, чтобы собрать все доступные исследования по этой теме. Списки литературы идентифицированных статей были проверены, чтобы найти дополнительные релевантные исследования, пропущенные во время первоначального поиска. Любая оригинальная полная статья или тезисы конференции, написанные на голландском или английском языке, имели право, и не было никаких ограничений в отношении даты публикации.Неоригинальные статьи, отчеты о случаях, дубликаты и статьи, написанные на языке, отличном от голландского или английского, были исключены из этого обзора.
После поиска собранная литература была проверена по названию и аннотации первым и последним автором [F.C. и N.dB.] на право проведения полнотекстовой оценки. Разногласия относительно приемлемости исследования были разрешены путем консенсуса между первым и последним авторами [F.C. и N.d.B.]. Тот же процесс использовался для полнотекстового просмотра. Были включены исследования, если в них сообщалось об исходах метаболизма лекарств микробиотой, даже если этот метаболизм наблюдался у субъектов без ВЗК, но с лекарствами, регулярно прописываемыми в практике ВЗК.Когда в исследованиях сообщалось об использовании покрывающих соединений для замедленного высвобождения, таких как полисахарид, они не считались истинной системой доставки, активируемой микробиотой, и поэтому были исключены. Кроме того, исследования, в которых описывалось влияние лекарств на сам микробиом, не принимались во внимание. Также были исключены исследования, касающиеся микробного метаболизма экспериментальных препаратов против ВЗК или исследования пробиотиков.
2.1. Результатов
Стратегия поиска выявила 1018 статей, которые были проверены на соответствие критериям отбора.После удаления дубликатов было проверено 937 статей по названию и аннотации. В 89 отобранных полнотекстовых статьях описаны четыре конкретных препарата, используемых для лечения пациентов с ВЗК. Процесс отбора изображен на Рисунке 1. Консенсус в отношении правомочности был достигнут между двумя независимыми рецензентами на всех этапах отбора.
Рисунок 1.
Блок-схема выбора исследования.
Рисунок 1.
Блок-схема выбора исследования.
3.Микробный метаболизм лекарственных средств при ВЗК
3.1. Сульфасалазин
Сульфасалазин, открытый в 1940-х годах, представляет собой лекарственное средство, состоящее из противовоспалительной составляющей [салициловой кислоты], связанной с противомикробным препаратом [сульфаномидом]. 9 Сульфасалазин был получен путем связывания сульфапиридина [молекула сульфаномида] с 5-аминосалициловой кислотой [5-ASA] путем диазосочетания. Сульфасалазин первоначально был разработан для лечения воспалительных состояний, которые, как предполагалось, имели бактериальное происхождение, но позже было обнаружено, что он полезен для лечения язвенного колита [UC]. 9
Сульфасалазин имеет ограниченную абсорбцию в верхних отделах кишечника, но в толстой кишке уменьшение диазо-связи происходит с помощью ферментов диазоредуктазы, продуцируемых кишечной микробиотой в толстой кишке. После этого расщепления 5-АСК и сульфапиридин становятся доступными для системной абсорбции; первый является активным лекарством для местного применения, а второй — нет [Рисунок 2]. 8,10 5-АСК эффективен при ЯК, поскольку он вызывает противовоспалительные эффекты путем ингибирования провоспалительных медиаторов, а сульфапиридин действует в основном как неактивная молекула-носитель. 11 Фармакологические действия 5-ASA до конца не изучены, но исследования показали, что его противовоспалительное действие проявляется за счет нацеливания на рецептор-γ, активируемого пролифератором пероксисом, а также модулирования активности множественного клеточного метаболизма. 12
Рисунок 2.
Расщепление сульфасалазина бактериальной диазоредуктазой.
Рисунок 2.
Расщепление сульфасалазина бактериальной диазоредуктазой.
Это расщепление диазосвязи кишечной флорой было впервые описано у крыс Peppercorn и Goldman в 1972 году. 13 Они продемонстрировали, что обработанные антибиотиками или стерильные крысы, получавшие сульфасалазин, имели неизмененный сульфасалазин в их слепой кишке и фекалиях, в отличие от экскрементов нормальных крыс, которые не содержали неизмененного сульфасалазина. Когда стерильные крысы были инфицированы четырьмя специфическими бактериями, обычно обнаруживаемыми в желудочно-кишечном тракте, сульфасалазин метаболизировался так же, как и у нормальных крыс, и в их экскрементах не обнаруживался неизмененный сульфасалазин. Это расщепление диазосвязи было также обнаружено, когда штаммы бактерий, репрезентативные для штаммов, обнаруженных в кишечном тракте человека, культивировали в присутствии сульфасалазина. 13 Кроме того, Шредер и Кэмпбелл показали в фармакокинетическом исследовании на здоровых людях-добровольцах очень небольшое количество исходного лекарственного средства, выделяемого почками, и отсутствие экскреции с фекалиями. 14 Эти данные показывают, что кишечные бактерии необходимы для активации этого лекарства, а также частично объясняют, почему сульфасалазин оказывается более эффективным при ЯК, чем при болезни Крона [CD]. Последний может быть локализован во всем желудочно-кишечном тракте и не ограничен областью толстой кишки, что согласуется с тем, что лекарство более эффективно, когда воспаление кишечника находится в области, где более вероятно возникновение бактериального распада. 10 Различные виды бактерий участвуют в секреции диазоредуктазы в толстой кишке человека, но наибольшее количество продуцируется анаэробным родом Clostridium . 15 Множественные исследования in vitro подтвердили, что род Clostridium продуцирует наибольшее количество диазоредуктазы, но также показали, что бактерии всех основных типов бактерий способны метаболизировать сульфасалазин. 13,15,16
Кишечный метаболизм сульфасалазина может быть увеличен при совместном приеме с пробиотиками.Исследование in vitro показало, что после анаэробной инкубации содержимого толстой кишки крысы с сульфасалазином или сульфасалазином с пробиотиками [лиофилизированные культуры Lactobacillus acidophilus , Bifidobacterium lactus и Lactobacillus rhamonus 5-ASA] и более высокая концентрация в последнем был восстановлен сульфапиридин. 17 Это предполагает, что эти пробиотические виды обладают диазоредуктазной активностью. 17
Интересно, что метаболизм сульфасалазина в кишечнике может быть затруднен при совместном применении с холестирамином, секвестрантом желчных кислот, который может использоваться для лечения диареи желчных кислот у пациентов с [обширной] БК подвздошной кишки или после хирургической илеоцекальной резекции.Крысы, получавшие эту комбинацию, имели более высокую фекальную экстракцию интактного сульфасалазина по сравнению с контрольной группой, что указывает на индуцированное холестирамином ингибирование кишечного метаболизма сульфасалазина. 18 Есть много возможных объяснений этого открытия, но наиболее правдоподобным является возникновение прямого взаимодействия холестирамин-сульфасалазин, которое приводит к менее доступной диазо-связи сульфасалазина для бактериальной диазоредуктазы. 18 Результаты исследования Pieniaszek и Bates предполагают, что совместное введение холестирамина и сульфасалазина может вызвать значительное снижение абсорбции и метаболизма последнего, что приводит к снижению эффективности сульфасалазина из-за неполного бактериального метаболизма. 18 Время прохождения через желудочно-кишечный тракт также важно для полного бактериального метаболизма сульфасалазина, так как у пациентов с диареей, вызванной лекарствами, восстановление нерасщепленного сульфасалазина через 72 часа увеличилось с 0,5% до 45,4%. 19 Важность продолжительности контакта с микробиотой для метаболизма сульфасалазина была подтверждена исследованием in vitro , которое после инкубации с фекалиями человека продемонстрировало постепенное снижение содержания сульфасалазина и увеличение 5-АСК с течением времени.В отсутствие фекального материала сульфасалазин оставался стабильным во время эксперимента. 20
Хотя сульфасалазин является эффективным и недорогим средством лечения ЯК, он потерял популярность, поскольку до 30% пациентов испытывают нежелательные эффекты, такие как тошнота, кожная сыпь или анорексия, которые, по-видимому, связаны с циркулирующим сульфапиридином. . 21 Для уменьшения этих побочных эффектов в некоторых исследованиях использовались удерживающие клизмы с сульфасалазином, приводящие к значительному эндоскопическому и гистологическому улучшению по сравнению с плацебо без возникновения известных побочных эффектов, даже у пациентов, которые ранее испытывали гиперчувствительность к сульфасалазину. 22 Было продемонстрировано, что после ректального приема сульфасалазина у пациентов наблюдалось снижение уровня сульфапиридина в плазме, что позволяет предположить, что это может быть одной из причин снижения частоты нежелательных эффектов. 22,23 Хотя уровни 5-ASA в плазме не измерялись после ректального приема сульфасалазина, снижение этих уровней вряд ли снизит эффективность, поскольку механизм действия 5-ASA, по-видимому, является местным, а не системным. 24
3.2. Различные пролекарства месалазина с диазосвязью
При пероральном введении 5-АСК быстро и почти полностью всасывается в тонком кишечнике, тогда как известно, что 5-АСК действует локально в более дистальных отделах слизистой оболочки кишечника. Предпочтительно высвобождение 5-ASA из лекарственного препарата происходит в месте воспаления, то есть дистальном отделе подвздошной кишки или толстой кишки, поскольку эффективность лекарственного средства больше связана с концентрацией лекарственного средства в слизистой оболочке, чем с концентрацией в крови. 24,25
Чтобы преодолеть проблему токсичного носителя в сульфасалазине и быстрой системной абсорбции 5-ASA, были разработаны другие пролекарства месалазина с диазосвязывающими связями.
Одним из этих пролекарств является олсалазин, который состоит из двух молекул 5-ASA, связанных диазосвязью между своими аминогруппами. Комплекс плохо всасывается в верхних отделах желудочно-кишечного тракта, но в толстом кишечнике диазосвязь расщепляется анаэробными и аэробными бактериями, что приводит к высвобождению двух молекул 5-ASA на каждый моль олсалазина. 26 У пациентов с илеостомией почти весь олсалазин восстанавливается в илеостомической жидкости, а 5-АСК не обнаруживается в моче, что позволяет предположить, что это пролекарство действительно проходит через тонкий кишечник с минимальной абсорбцией и без расщепления диазо-связь. 26 Эти результаты подтверждаются многочисленными исследованиями, которые показали, что концентрация диазосвязанного 5-ASA в фекалиях почти во всех случаях составляла менее 5% от принятой дозы, что свидетельствует о почти полном диазоредукции толстой кишки. 19,27 Степень метаболизма олсалазина также зависит от времени прохождения; У пациентов с ускоренным прохождением через желудочно-кишечный тракт 72-часовое извлечение олсалазина с фекалиями увеличивалось до 50%. 19,27 Важность продолжительности контакта между олсалазином и микробиотой также была продемонстрирована в исследовании in vitro , в котором наблюдалось снижение уровня олсалазина со временем и повышение уровня 5-АСК. 20
Бальсалазид — еще одно пролекарство с диазосвязывающими связями, которое было разработано в 1983 году и одобрено в 1997 году в Европе для лечения ЯК. Бальсалазид состоит из 4-аминобензоил-бета-аланина [4-ABA], диазо-связанного с 5-ASA. Этот носитель разработан таким образом, чтобы быть менее токсичным, чем сульфапиридин, из-за минимального всасывания этой пролекарства после диазо-восстановления в толстой кишке, при сохранении плохой абсорбции пролекарства в верхних отделах желудочно-кишечного тракта. 28 Восстановление диазосвязи бактериальной диазоредуктазой приводит к высвобождению эквимолярных количеств 5-ASA и 4-ABA.После перорального приема бальсалазида наблюдается почти полное диазо-редукция толстой кишки, при этом менее 1% исходного препарата выводится через почки или с фекалиями. Примерно 25% его метаболитов всасывается системно, и приблизительно 15% этих метаболитов, всасываемых системно, состоят из 4-АБК, хотя концентрации 4-АБК в плазме ниже уровня обнаружения. 29 Как ранее было продемонстрировано на примере сульфасалазина и олсалазина, продолжительность контакта с микробиотой также важна для степени бактериального метаболизма бальсалазида. 20
В отличие от ранее описанного диазо-восстановления пролекарства 5-ASA, некоторые исследования предложили более сложный механизм. Они предполагают, что сульфасалазин обладает более быстрым азовосстановительным механизмом по сравнению с другими пролекарствами 5-АСК, поскольку меньший процент неизмененного сульфасалазина восстанавливается с фекалиями по сравнению с олсалазином и бальсалазидом. 20,27,30 Это соответствует модели фекальных микробов in vitro , которая наблюдала более высокую скорость метаболизма сульфасалазина. 20 Напротив, Райан и др. . изучили субстратную специфичность трех генов, кодирующих азоредуктазу, из Pseudomonas aeruginosa и обнаружили, в зависимости от гена, более высокую специфичность связывания для бальсалазида или олсалазина по сравнению с сульфасалазином. 31 Эти данные подчеркивают более сложный механизм диазо-восстановления пролекарства 5-ASA и предполагают, что бактериальный метаболизм пролекарств 5-ASA может зависеть не только от присутствия диазосвязи, но и от субстрата фермента. специфичность молекулы, окружающей эту химическую связь. 20
После диазо-восстановления исходного лекарственного средства 5-АСК высвобождается в толстой кишке и может ацетилироваться ферментами N -ацетилтрансферазы [NAT], среди прочего, в метаболите N -ацетил-5 -ASA [Ac-5-ASA]. 25 Остается неясным, является ли эффективная составляющая 5-ASA или Ac-5-ASA, хотя систематический обзор эффективности Ac-5-ASA пришел к выводу, что два из трех плацебо-контролируемых исследований продемонстрировали, что этот метаболит неактивен. 29 Это ацетилирование в Ac-5-ASA в основном опосредуется ферментами слизистой оболочки, поскольку инкубация биоптатов толстой кишки с 5-ASA приводит к почти полному ацетилированию через 10 мин. 32 Однако после инкубации 5-ASA в образцах фекалий через 24 часа наблюдалось более медленное и ограниченное ацетилирование, что также свидетельствует о том, что ацетилирование может быть опосредовано бактериальными процессами в фекалиях. 32 Эти данные свидетельствуют о том, что микробиота, помимо снижения количества исходного пролекарства и высвобождения активного компонента, может также в определенной степени инактивировать 5-ASA путем ацетилирования. Кроме того, воспаление толстой кишки также может влиять на эффективность терапии 5-АСК; в модели на мышах острое воспаление толстой кишки снижает способность к метаболизму 5-ASA за счет нарушения экспрессии и функции одного из ферментов NAT. 33
Хотя другие диазосвязанные пероральные пролекарства с альтернативными молекулами-носителями были созданы в попытке уменьшить побочные эффекты, в настоящее время в основном лекарства, которые сочетают пролекарство 5-ASA с pH-зависимым и / или Для лечения ЯК используются составы с зависящим от времени высвобождением. 34
3.3. Метотрексат
Метотрексат [метотрексат] был представлен в конце 1940-х годов в качестве противоопухолевой терапии для лечения острого лейкоза у детей, а затем и для лечения рака твердых органов. 35 В конце 1950-х годов низкие дозы метотрексата были разработаны в качестве противовоспалительной терапии ревматоидного артрита [РА], псориатического артрита и псориаза, а в 1987 году были опубликованы первые результаты внутримышечной терапии метотрексатом у пациентов с рефрактерной ВЗК. 36,37 В настоящее время метотрексат является хорошо известным иммуномодулятором, который может вызывать и поддерживать ремиссию у пациентов с CD и часто сочетается с биологическими препаратами. 38,39 Внутри клетки метотрексат полиглутамирован [PG] фолилполиглутаматсинтазой [FPGS] в MTX-PG.Внутриклеточный метотрексат и метотрексат-PG действуют как конкурентные ингибиторы дигидрофолической редуктазы [DHFR], что в конечном итоге приводит к снижению количества соединений, участвующих в синтезе ДНК и РНК. MTX-PG также может оказывать противовоспалительное действие за счет ингибирования 5-аминоимидазол-4-карбоксамид рибонуклеотид [AICAR] трансформилазы, которая заставляет накопленный аденозин покидать клетку и связывать рецепторы в окружающих клетках. 40
Одной из причин для исследования роли микробиоты в метаболизме метотрексата было наблюдение, что введение антибиотика неомицина до введения метотрексата увеличивает смертность мышей.Авторы пришли к выводу, что возможным объяснением этой повышенной летальности было снижение кишечной флоры, которая обычно метаболизирует метотрексат в нетоксичную форму. 41 Эти результаты были подтверждены другим исследованием на животных, в котором они сравнивали количество радиоактивности в фекалиях у нормальных мышей и мышей без микробов, которым вводили внутрибрюшинно меченый метотрексатом. Они обнаружили более высокое количество радиоактивности у стерильных мышей по сравнению с нормальными мышами, что указывает на то, что бактерии кишечного тракта, вероятно, играют заметную роль в деградации метотрексата и могут быть ответственны за изменение токсичности метотрексата, наблюдаемое во время лечения антибиотиками у мышей. . 41 Другое исследование на мышах in vitro показало, что содержимое слепой кишки мышей может расщеплять метотрексат до АРА [2,4-диаминометилптероевой кислоты], основного кишечного метаболита. Эта реакция расщепления в значительной степени предотвращается путем предварительной обработки мышей антибиотиками перед удалением слепой кишки. 42
Как упоминалось ранее, у человека внутриклеточный метотрексат превращается в метотрексат-PG, который плохо транспортируется в клетки и из них. MTX-PG может экспортироваться после удаления полиглутаматного хвоста либо глутаматкарбоксипептидазой II, либо фолатгидролазой, но это удаление снижает его эффективность как ингибитора DHFR. 40 Это удаление глутаматных структур может также выполняться карбоксипептидазой G2 [CPG2], продуцируемой штаммами Pseudomonas и другими ортологическими ферментами у видов бактерий. 43,44 Эти ферменты придают видам бактерий способность метаболизировать и инактивировать MTX in vitro , тем самым изменяя его эффективность. Помимо удаления глутамата с помощью карбоксипептидазы, по крайней мере два вида бактерий способны метаболизировать метотрексат до метотрексата-PG путем добавления глутамата к метотрексату через ферменты, подобные FPGS. 45 Маловероятно, что удаление глутамата из метотрексата с помощью бактериальной карбоксипептидазы приведет к снижению эффективности перорального метотрексата, поскольку это не повлияет на образование метотрексата после абсорбции. Однако переход с перорального на парентеральное введение метотрексата приводит к значительному увеличению [очень] длинноцепочечных MTX-PG, которые, как известно, являются более сильными ингибиторами. 46 Это предполагает, что пероральный путь может ингибировать образование более мощного MTX-PG, возможно, из-за превращения MTX бактериальной карбоксипептидазой.Однако при парентеральном введении метотрексат, как и при пероральном введении метотрексата, может вступать в контакт с кишечной микробиотой из-за секреции желчных путей, а также может быть предрасположен к бактериальному метаболизму. 47 Это взаимодействие между парентерально введенным метотрексатом и микробиотой было подтверждено на мышах, колонизированных стулом от пациента с РА, ранее не получавшего метотрексата. После внутрибрюшинной инъекции метотрексата или перорального введения метотрексата тот же эффект наблюдался в составе микробиоты, а именно: уменьшение уровня Bacteroidetes и увеличение количества двух других типов, Proteobacteria и Firmicutes. 47 Эти результаты подтверждают, что у мелких лабораторных животных, независимо от пути введения, метотрексат вступает в контакт с кишечной микробиотой и может изменять ее состав; однако, чтобы действительно выяснить влияние метаболизма бактерий на вводимый перорально и парентерально метотрексат, необходимы дополнительные исследования [на людях].
В одном исследовании изучалась роль микробиоты в определении ответа на пероральный прием метотрексата у пациентов с РА. Авторы создали прогностические модели, используя данные микробиоты, и смогли различить хороших и плохих респондентов. 48 Это говорит о том, что микробиота кишечника может вносить вклад в индивидуальные вариации фармакокинетики и клинических исходов у пациентов, получавших пероральный метотрексат.
3.4. Глюкокортикоиды
,00С 1950-х годов первое поколение глюкокортикоидов, то есть преднизолон, метилпреднизолон и гидрокортизон, эффективно использовалось для индукции ремиссии у пациентов с ВЗК. 49 Они хорошо всасываются в верхних отделах кишечника, и лишь небольшая их часть попадает в воспаленную подвздошную или толстую кишку. 50 Вследствие этой системной абсорбции длительное введение глюкокортикоидов может вызвать серьезные системные побочные эффекты, такие как отек, остеопороз, гипертония или диабет. Следовательно, пероральное или внутривенное введение глюкокортикоидов первого поколения обычно предназначено для лечения тяжелого активного заболевания, а не для длительной поддерживающей терапии. 50 Для уменьшения системных побочных эффектов были разработаны глюкокортикоиды второго поколения, например будесонид и беклометазон дипропионат [BDP], которые предназначены для высвобождения кортикостероидов в подвздошной или проксимальной части толстой кишки, и мультиматричная система будесонида [MMX], которая была сконструирована для высвобождения кортикостероидов во всей толстой кишке. 51 Это местное высвобождение в основном достигается за счет pH-зависимого покрытия и дает преимущество в виде высокой местной доставки активного соединения и снижения системных побочных эффектов из-за, среди прочего, метаболизма первого прохождения в печени. Несмотря на эти преимущества, не наблюдается повышения эффективности по сравнению с глюкокортикоидами системного действия первого поколения. 52
Из-за местного высвобождения глюкокортикоидов в толстой кишке существует прямой контакт с микробиотой толстой кишки, и исследования показали, что кишечная микробиота играет роль в метаболизме глюкокортикоидов. 53,54
Для определения in vitro бактериального метаболизма в толстой кишке различных типов глюкокортикоидов количество каждого глюкокортикоида измеряли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) в различные интервалы времени после инкубации в содержимом слепой кишки крыс . 53 Их исследование показало различную восприимчивость к метаболизму слепой кишки в зависимости от типа глюкокортикоидов. Концентрация кортизона снизилась наиболее резко и не поддалась измерению через 4 часа инкубации, в то время как концентрация флуоцинолона ацетонида не изменилась. 53 Метаболическая стабильность глюкокортикоидов, по-видимому, зависит от их химической структуры, т.е. глюкокортикоиды с одинарной связью 1,2, такие как гидрокортизон и кортизон, очень чувствительны к метаболизму слепой кишки, в то время как глюкокортикоиды с заместителями на 6 и / или Положение 9, такое как флуоцинолона ацетонид и бетаметазон, более устойчивы, in vitro . 53 Продолжительность контакта между кишечной микробиотой и различными глюкокортикоидами также влияет на метаболизм этих препаратов.При инкубации разных типов глюкокортикоидов в содержимом толстой кишки крыс через 3 часа оставалось соответственно 22%, 35%, 53% и 92% кортизона, гидрокортизона, преднизолона и дексаметазона. Эти значения снизились до 0%, 8%, 28% и 85% после 7 часов инкубации. 55 Эта переменная деградация во времени в зависимости от типа глюкокортикоидов также наблюдалась в другом исследовании in vitro . 53 Кроме того, глюкокортикоиды в жидкости толстой кишки или фекальных массах человека склонны к бактериальной деградации в толстой кишке. 54 Эта бактериальная деградация происходила в различной степени в зависимости от типа глюкокортикоида: преднизолон и BDP разлагались значительно быстрее, чем будесонид. 54 Этот метаболизм микрофлорой толстой кишки может повлиять на терапевтическую доступность в целевом участке, хотя in vivo и исследований по этому поводу отсутствуют.
Необходимы дополнительные исследования для выяснения влияния пути введения на бактериальную деградацию глюкокортикоидов, хотя энтерогепатическая циркуляция также известна как фактор метаболизма глюкокортикоидов, поэтому теоретически парентерально вводимые глюкокортикоиды могут быть подвержены бактериальному развитию. метаболизм. 56
3.5. Тиопурины
Тиогуанин [TG] и более известные традиционные тиопурины, азатиоприн [AZA] и меркаптопурин [MP] — это иммунодепрессанты, первоначально разработанные как химиотерапевтические средства для лечения острого лимфобластного лейкоза. 57 Благодаря своему иммуносупрессивному потенциалу тиопурины в конце 1950-х — начале 1960-х годов постепенно вводились для предотвращения отторжения трансплантата органов и лечения хронических идиопатических воспалительных заболеваний, таких как РА и ВЗК. 58,59 Сегодня тиопурины являются важными иммуномодулирующими агентами для поддержания ремиссии у пациентов с ВЗК, но с относительно медленным терапевтическим действием. 60 TG, AZA и MP внутриклеточно метаболизируются до тех же терапевтически эффективных конечных метаболитов, фосфорилированных нуклеотидов 6-тиогуанина [6-TGNs]. Их механизм действия частично объясняется включением 6-TGN в ДНК во время репликации. 60 Однако основной иммуносупрессивный механизм действия обусловлен конкуренцией с эндогенным GTP в связывании внутриклеточного Ras-связанного субстрата 1 ботулинического токсина C3 [RAC1], вызывая апоптоз и нарушение способности Т-лимфоцитов образовывать комплексы с антигеном. -представляющие клетки. 61
Метаболизм «обычных» тиопуринов, MP и его пролекарства AZA, сложен и требует нескольких ферментативных стадий. 62 Хотя чрезмерное превращение в 6-TGN может вызвать нежелательную лейкопению, токсичность обычных тиопуринов в основном связана с образованием потенциально гепатотоксичных метаболитов 6-метилмеркаптопурина [6-MMP]. 63 TG, с другой стороны, имеет гораздо менее сложный метаболизм. После перорального всасывания TG быстро транспортируется в клетку, где гипоксантинфосфорибозилтрансфераза [HPRT] напрямую превращает TG в фармакологически активный 6-TGN.Конкурирующая тиопурин S -метилтрансфераза [TPMT] и ксантиноксидаза [XO] дают 6-метилтиогуанин [6-MTG] и 6-тиуровую кислоту [6-TUA] соответственно; на этом пути избегают генерации 6-ММП. 62
В отличие от этих хорошо установленных путей, требующих системного преобразования, Movva et al . продемонстрировали, что микробиота кишечника может метаболизировать TG и, в гораздо меньшей степени, MP, до терапевтически эффективного 6-TGN. 64 Они культивировали Escherichia coli DH5α в среде, содержащей TG или MP, и после лизирования бактерий внутриклеточно продуцируемый 6-TGN измеряли в соответствии с методом Dervieux et al . 64 Они обнаружили, что Escherichia coli DH5α способна преобразовывать TG и в минимальной степени MP в 6-TGN, что подчеркивается трехкратным увеличением продукции 6-TGN при инкубации TG по сравнению с MP. 64
Этот бактериальный метаболизм TG в 6-TGN также наблюдался in vitro с использованием Escherichia coli , Enterococcus faecalis и Bacteroides thetaiotaomicron , которые являются репрезентативными кишечными бактериями из бактериальной филы Bactericide. и протеобактерии.После инкубации бактериальных осадков с TG были обнаружены 6-TGN, тогда как инкубация с MP привела к минимальному обнаружению 6-TGN. Это открытие метаболизма ТГ бактериями, принадлежащими к разным типам, согласуется со знаниями о том, что критический фермент, метаболизирующий ТГ, HPRT присутствует во многих формах жизни. Это говорит о том, что все кишечные бактерии способны производить это преобразование, и подразумевает, что индивидуальные вариации в составе микробиоты хозяина могут не иметь большого значения в способности локально метаболизировать ТГ, хотя это еще не исследовано.
In vivo было показано, что колит, вызванный декстрансульфатом натрия [DSS], у мышей с дефицитом HPRT улучшился после лечения пероральным TG, и что метаболиты 6-TGN были обнаружены в их фекальных суспензиях. Это предполагает локальный метаболизм TG из-за бактериального метаболизма, поскольку HPRT является ферментом-хозяином, необходимым для превращения TG в 6-TGN, а мышиный хозяин с дефицитом HPRT не может осуществить это преобразование. В соответствии с неспособностью мыши-хозяина с дефицитом HPRT преобразовывать TG в 6-TGN, не было снижения количества лейкоцитов ни в мезентериальных лимфатических узлах [MLN], ни в компартментах периферической крови. 65 Кроме того, интраректальное лечение TG у мышей Winnie быстро привело к значительному уменьшению колита в областях толстой кишки, непосредственно контактирующих с введенными TG. Этого не было у мышей, получавших интраректальный МП.
Таким образом, местная доставка TG может привести к локальному превращению в 6-TGN под действием микробной HPRT, позволяя более быстрое терапевтическое действие с возможным предотвращением нежелательных системных побочных эффектов. 65 Следуя этим открытиям, разрабатываются пероральные препараты TG с контролируемым высвобождением, и несколько пациентов получали ежедневные клизмы или суппозитории с TG с многообещающим ответом на лечение и с низкими системными уровнями 6-TGN. 66
4. Обсуждение
Микробиота кишечника человека может иметь большое влияние на метаболизм лекарств, и это взаимодействие лекарств и микробиоты может изменять токсичность и эффективность лекарств, применяемых для лечения ВЗК. Микробиота кишечника может расщеплять азосвязь сульфасалазина, бальсалазида и олсалазина и высвобождать активный фрагмент 5-ASA, он влияет на метаболизм метотрексата, он может превращать TG в фармакологически активный 6-TGN без потребности хозяина метаболизм, и глюкокортикоиды могут быть подвержены бактериальной деградации.Более того, индивидуальная реакция пациентов на лекарства от ВЗК может [частично] объясняться влиянием микробиоты хозяина на метаболизм этих лекарств. Необходимо более глубокое понимание микробиоты и взаимодействия лекарств, которое должно стать неотъемлемой частью процесса разработки новых лекарств от ВЗК.
В настоящее время для лечения ВЗК разрабатывается множество новых терапевтических соединений с системами пероральной доставки. В идеале эти пероральные препараты обладают минимальными системными побочными эффектами и являются мощными и эффективными в очаге воспаления.Этого можно добиться с помощью пероральных препаратов с фармакодинамическими эффектами в толстой кишке, но их эффективность зависит от того, доставляются ли адекватные концентрации лекарства к месту воспаления. Ранее использовались различные подходы для сайт-специфической доставки в толстую кишку с минимальным проксимальным желудочно-кишечным всасыванием лекарства, такие как использование систем с контролируемым временем высвобождения или использование pH-чувствительного покрытия. 67 Последний подход был оптимизирован в последние годы и в настоящее время используется для разработки таблеток будесонида нулевого порядка высвобождения, нацеленных на илео-толстую кишку, с многообещающими результатами in vitro и для производства перорального инфликсимаба для местного лечения ВЗК в подвздошно-ободочная область. 68,69
Кишечная микробиота также может быть использована для системы доставки лекарств, специфичной для толстой кишки, и, по-видимому, является наиболее локально-специфичным подходом из-за резкого увеличения плотности микробиоты толстой кишки и связанной с ней ферментативной активности в нижних отделах кишечника. желудочно-кишечный тракт. Существует пролекарственный подход, когда неактивное производное молекулы лекарства требует бактериальных метаболических процессов в толстой кишке для высвобождения активной части лекарства из носителя лекарства, что имеет место в случае сульфасалазина. 70 Несколько исследований также изучали возможность пролекарства глюкокортикоидов, приводящего к уменьшению побочных эффектов и увеличению терапевтических концентраций в целевом участке. 71,72 Азополимеры или полисахариды также могут использоваться в качестве материала для покрытия ядер лекарств, которые могут разрушаться микробиотой кишечника и высвобождать захваченное лекарство в толстой кишке. 73,74 Комбинированные подходы с двойной активацией также разрабатываются для преодоления ограничений единственного подхода, например, с помощью нового покрытия, которое объединяет системы, запускаемые микробиотой, и pH-зависимые системы, используемые, среди прочего, для разработки системы 1600 раз в сутки. -мг таблетированный препарат месалазина. 75,76 Новые подходы для доставки лекарств, нацеленных на толстую кишку, все еще разрабатываются, такие как система доставки лекарств с контролируемым давлением, которая использует разницу в перистальтике в кишечнике, системы на основе заряда, доставка лекарств, опосредованная лигандом / рецептором системы, системы наночастиц или осмотически контролируемые способы доставки лекарств. 77
Эта локальная доставка лекарств может использоваться для разработки более стабильных и эффективных терапевтических средств с уменьшением системных побочных эффектов, связанных с лекарствами.Однако при применении доставки лекарств, специфичных для толстой кишки, существует прямой контакт между микробиотой в кишечнике и местно высвобождаемым лекарством, что приводит к возможному взаимодействию лекарств и микробиоты. Это взаимодействие может изменить эффективность и токсичность лекарства, что, как описано ранее, имеет место в случае in vitro с бактериальной деградацией глюкокортикоидов. Хотя это еще не изучено in vivo , можно представить, что этот метаболизм микрофлорой толстой кишки может влиять на терапевтическую доступность в целевом участке с доставкой глюкокортикоидов, специфичной для толстой кишки. 53,54 Учитывая разработку новых лекарств от ВЗК, которые локально высвобождаются в толстой кишке, таких как пероральный инфликсимаб, важно, чтобы эти возможные взаимодействия между микробиотой и лекарствами были неотъемлемой частью пути разработки лекарств. При разработке лекарств также необходимо принимать во внимание межиндивидуальные и внутрииндивидуальные изменения микробного разнообразия, поскольку состав микробиома человека не статичен, и это также может влиять на эффективность и токсичность лекарства с течением времени. 78,79
Учитывая влияние микробиоты на метаболизм лекарств, существует также возможность изменения микробиоты для повышения терапевтической эффективности или снижения токсичности лекарств от ВЗК. Антибиотики являются наиболее очевидной категорией лекарств для изменения микробиоты кишечника, и после приема наблюдаются значительные изменения в составе микробиоты, но трансплантация фекальной микробиоты также является способом изменения состава. 80 Степень, в которой пробиотики влияют на микробиоту кишечника хозяина, еще не ясна, но было продемонстрировано, что совместное введение пробиотиков, нацеленных на толстую кишку, улучшает эффективность сульфасалазина на моделях колита у грызунов. 81 Однако, прежде чем размышлять о модуляции микробиоты кишечника как потенциальной мишени для повышения терапевтической эффективности, необходимо лучше понять точное взаимодействие между микробами и лекарствами и то, как изменение состава микробиоты влияет на это взаимодействие.
Микробиота кишечника человека может иметь большое влияние на метаболизм лекарств, и лучшее понимание всех этих взаимодействий между микробиотой и лекарствами от ВЗК должно быть неотъемлемой частью процесса разработки лекарств.Этот вклад микробиоты кишечника можно использовать в качестве подхода точной медицины для разработки более стабильных и эффективных терапевтических средств при одновременном снижении побочных эффектов, связанных с лекарствами. Более того, модулирование микробиоты, например путем трансплантации фекальной микробиоты, одновременное введение антибиотиков или пробиотиков также может быть потенциальной мишенью для повышения терапевтической эффективности лекарств от ВЗК.
Финансирование
Для выполнения и написания этого исследования финансирование не требовалось.
Конфликт интересов
F.C. и Х. нечего заявлять. N.d.B. выступал в качестве спикера в AbbVie и MSD, а также консультантом и главным исследователем в компаниях TEVA Pharma BV и Takeda. Он получил [неограниченный] исследовательский грант от доктора Фалька, TEVA Pharma BV, MLDS и Takeda.
Авторские взносы
F.C. провели систематический поиск литературы. F.C. и N.d.B. выполнил извлечение данных.F.C. подготовил первый вариант рукописи. N.d.B. и Х. критически переработал рукопись. Все авторы одобрили окончательную версию статьи, включая список авторов.
Благодарности
Для этого исследования не требовалось письменной помощи. Этот документ, включая соответствующие данные и цифры, ранее не публиковался и больше нигде не рассматривается.
Список литературы
1.Цинь
Дж
,Li
R
,Raes
J
и др..;Консорциум MetaHIT
.Каталог кишечных микробных генов человека, созданный методом метагеномного секвенирования
.Природа
2010
;464
:59
—65
.2.Аггелетопулу
Я
,Konstantakis
C
,Assimakopoulos
SF
,Triantos
C
.Роль кишечной микробиоты в лечении воспалительных заболеваний кишечника
.Microb Pathog
2019
;137
:103774
.3.Вальдес
AM
,Вальтер
Дж
,Сигал
E
,Спектор
TD
.Роль микробиоты кишечника в питании и здоровье
.BMJ
2018
;361
:k2179
.4.Sousa
т
,Paterson
R
,Moore
V
,Carlsson
A
,Abrahamsson
B
,Basit
AW
.Микробиота желудочно-кишечного тракта как место биотрансформации лекарственных средств
.Int J Pharm
2008
;363
:1
—25
. 5.Уилсон
ID
,Николсон
JK
.Взаимодействие микробиома кишечника с метаболизмом, эффективностью и токсичностью лекарств
.Transl Res
2017
;179
:204
—22
.6.Окуда
H
,Ogura
K
,Kato
A
,Takubo
H
,Watabe
T
.Возможный механизм смерти восемнадцати пациентов, вызванный взаимодействием соривудина, нового противовирусного препарата, с пероральными пролекарствами 5-фторурацила
.J Pharmacol Exp Ther
1998
;287
:791
—9
.7.Элкингтон
SG
,Floch
MH
,Conn
HO
.Лактулоза в лечении хронической портально-системной энцефалопатии
.N Eng J Med
1969
;281
:408
—12
.8.Перец
MA
.Взаимодействие лекарств и бактерий
.Drug Metab Drug Interact
1976
:75
—88
.9.Бахрах
WH
.Сульфасалазин: I. Историческая перспектива
.Am J Gastroenterol
1988
;83
:487
—96
. 10.Перец
MA
,Goldman
P
.Исследования распределения салицилазосульфапиридина и его метаболитов
.Гастроэнтерология
1973
;64
:240
—5
.11.Хайллар
Дж
,Бьярнасон
I
.Сульфасалазин при язвенном колите: наизусть?
Кишечник
1991
;32
:462
—3
.12.Лихтенштейн
GR
,Камм
MA
.Обзорная статья: Препараты 5-аминосалицилата для лечения язвенного колита — методы сравнения скорости высвобождения и доставки 5-аминосалицилата на слизистую оболочку толстой кишки
.Алимент Фармакол Тер
2008
;28
:663
—73
.13.Перец
MA
,Goldman
P
.Роль кишечных бактерий в метаболизме салицилазосульфапиридина
.J Pharmacol Exp Ther
1972
;181
:555
—62
. 14.Шредер
H
,Кэмпбелл
DE
.Абсорбция, метаболизм и выведение салицилазосульфапиридина у человека
.Clin Pharmacol Ther
1972
;13
:539
—51
. 15.Рафии
Ф
,Cerniglia
CE
.Восстановление азокрасителей и нитроароматических соединений бактериальными ферментами из кишечного тракта человека
.Environ Health Perspect
1995
;103
[Suppl 5
]:17
–9
.16.Азад Хан
АК
,Guthrie
G
,Johnston
HH
,Truelove
SC
,Williamson
DH
.Тканевое и бактериальное расщепление сульфасалазина
.Clin Sci (Лондон)
1983
;64
:349
—54
. 17.Ли
HJ
,Zhang
H
,Orlovich
DA
,Fawcett
JP
.Влияние лечения пробиотиками на метаболизм сульфасалазина у крыс
.Xenobiotica
2012
;42
:791
—7
.18.Pieniaszek
HJ
Младший ,Бейтс
т.р.
.Индуцированное холестирамином ингибирование метаболизма салицилазосульфапиридина (сульфасалазина) микрофлорой кишечника крыс
.J Pharmacol Exp Ther
1976
;198
:240
—5
,19.Rijk
MC
,van Hogezand
RA
,van Schaik
A
,van Tongeren
JH
.Удаление 5-аминосалициловой кислоты из лекарственных средств, доставляющих 5-аминосалициловую кислоту, во время ускоренного кишечного транзита у здоровых добровольцев
.Сканд Дж. Гастроэнтерол
1989
;24
:1179
—85
.20.Sousa
т
,Yadav
V
,Zann
V
,Borde
A
,Abrahamsson
B
,Basit
AW
.О бактериальном метаболизме азосвязанных пролекарств 5-аминосалициловой кислоты в толстой кишке
.J Pharm Sci
2014
;103
:3171
—5
. 21.Нильсен
OH
.Непереносимость сульфасалазина. Ретроспективный обзор причин прекращения лечения сульфасалазином у пациентов с хроническим воспалительным заболеванием кишечника
.Сканд Дж Гастроэнтерол
1982
;17
:389
—93
.22.Палмер
KR ,Goepel
JR
,Holdsworth
CD
.Удерживающие клизмы сульфасалазина при язвенном колите: двойное слепое исследование
.Br Med J (Clin Res Ed)
1981
;282
:1571
—3
. 23.Allgayer
H
,Kruis
W
,Eisenburg
J
,Paumgartner
G
.Сравнительная фармакокинетика сульфасалазина и сульфапиридина после ректального и перорального введения пациентам с язвенным колитом
.Eur J Clin Pharmacol
1984
;26
:275
—7
. 24.Klotz
U
.Клиническая фармакокинетика сульфасалазина, его метаболитов и других пролекарств 5-аминосалициловой кислоты
.Clin Pharmacokinet
1985
;10
:285
—302
.25.De Vos
м
,Verdievel
H
,Schoonjans
R
,Praet
M
,Bogaert
M
,Barbier
F
.Концентрации 5-ASA и Ac-5-ASA в гомогенатах илеоколонической биопсии человека после пероральных препаратов 5-ASA
.Gut
1992
;33
:1338
—42
. 26.Сандберг-Герцен
H
,Райд
M
,Ярнерот
G
.Абсорбция и выведение однократной дозы 1 г азодисала натрия у пациентов с илеостомией
.Сканд Дж. Гастроэнтерол
1983
;18
:107
—11
,27.Уодворт
AN
,Фиттон
А
.Ольсалазин. Обзор его фармакодинамических и фармакокинетических свойств и терапевтического потенциала при воспалительном заболевании кишечника
.Наркотики
1991
;41
:647
—64
.28.Зеленый
JRB
.Лечение язвенного колита бальсалазидом натрия
.Инфламмофармакология
1993
;2
:289
—95
,29.Sandborn
WJ
,Hanauer
SB
.Систематический обзор: фармакокинетические профили пероральных форм месалазина и пролекарств месалазина, используемых при лечении язвенного колита
.Алимент Фармакол Тер
2003
;17
:29
—42
.30.Чан
RP
,Поуп
DJ
,Гилберт
AP
,Sacra
PJ
,Baron
JH
,Lennard-Jones
JE
.Исследования двух новых аналогов сульфасалазина, ипсалазида и бальсалазида
.Dig Dis Sci
1983
;28
:609
—15
.31.Райан
А
,Wang
CJ
,Laurieri
N
,Westwood
I
,Sim
E
.Механизм реакции азоредуктаз предполагает конвергентную эволюцию с хинон оксидоредуктазами
.Protein Cell
2010
;1
:780
—90
.32.Allgayer
H
,Ahnfelt
NO
,Kruis
W
и др..N-ацетилирование 5-аминосалициловой кислоты в толстой кишке при воспалительном заболевании кишечника
.Гастроэнтерология
1989
;97
:38
—41
. 33.Рамирес-Алькантара
В
,Монтроуз
MH
.Острый мышиный колит снижает метаболизм 5-аминосалициловой кислоты в толстой кишке за счет регуляции N-ацетилтрансферазы-2
.Am J Physiol Gastrointest Liver Physiol
2014
;306
:G1002
—10
.34.Ye
В
,фургон Лангенберг
DR
.Препараты месалазина для лечения язвенного колита: все ли созданы равными?
World J Gastrointest Pharmacol Ther
2015
;6
:137
—44
.35.Фарбер
S
.Химиотерапия в лечении лейкемии и опухоли Вильмса
.JAMA
1966
;198
:826
—36
,36.Бенедек
ТГ
.Метотрексат: от его введения в неонкологические терапевтические средства до анти-TNF-α
.Clin Exp Rheumatol
2010
;28
:S3
—8
.37.Козарек
RA
,Patterson
DJ
,Gelfand
MD
,Botoman
VA
,Ball
TJ
,Wilske
KR
.Метотрексат вызывает клиническую и гистологическую ремиссию у пациентов с рефрактерным воспалительным заболеванием кишечника
.Ann Intern Med
1989
;110
:353
—6
.38.Фиган
BG
,Fedorak
RN
,Irvine
EJ
и др. .Сравнение метотрексата и плацебо для поддержания ремиссии при болезни Крона.Исследователи Североамериканской исследовательской группы Крона
.N Engl J Med
2000
;342
:1627
—32
.39.Фиган
BG
,Рочон
J
,Fedorak
RN
и др. .Метотрексат для лечения болезни Крона. Исследователи Североамериканской исследовательской группы Крона
.N Engl J Med
1995
;332
:292
—7
.40.Тиан
H
,Кронштейн
BN
.Понимание механизмов действия метотрексата: значение для лечения ревматоидного артрита
.Bull NYU Hosp Jt Dis
2007
;65
:168
—73
.41.Захарко
DS
,Bruckner
H
,Oliverio
VT
.Антибиотики изменяют метаболизм и выведение метотрексата
.Наука
1969
;166
:887
—8
.42.Валерино
DM
,Johns
DG
,Zaharko
DS
,Oliverio
VT
.Исследования метаболизма метотрексата кишечной флорой. I. Идентификация и изучение биологических свойств метаболита 4-амино-4-дезокси-N 10 -метилптероевой кислоты
.Biochem Pharmacol
1972
;21
:821
—31
. 43.Леви
CC
,Goldman
P
.Ферментативный гидролиз метотрексата и фолиевой кислоты
.J Biol Chem
1967
;242
:2933
—8
. 44.Уэбб
м
.Инактивация аналогов фолиевой кислоты некоторыми нетребовательными бактериями
.Biochim Biophys Acta
1955
;17
:212
—25
. 46.Dervieux
т
,Заблоцкий
Р
,Кремер
Дж
.Полиглутаматы метотрексата эритроцитов возникают в зависимости от интенсивности дозировки и пути введения во время пульсовой терапии метотрексатом при ревматоидном артрите
.Ревматология (Оксфорд)
2010
;49
:2337
—45
.47.Наяк
руб. ,Александр
M
,Стэплтон-Грей
K
и др.Нарушение микробиома кишечника человека лекарственным средством, не являющимся антибиотиком, способствует разрешению аутоиммунного заболевания
.bioRxiv
2019
:600155
. 48.Чжан
Х
,Zhang
D
,Jia
H
и др..Микробиомы полости рта и кишечника нарушены при ревматоидном артрите и частично нормализованы после лечения
.Nat Med
2015
;21
:895
—905
.49.Benchimol
EI
,Seow
CH
,Steinhart
AH
,Griffiths
AM
.Традиционные кортикостероиды для индукции ремиссии при болезни Крона
.Кокрановская база данных Syst Rev
2008
;2008
:CD006792-CD
.50.Domènech
E
.Воспалительное заболевание кишечника: современные терапевтические возможности
.Пищеварение
2006
;73
[Suppl 1
]:67
–76
.51.Трэвис
SP
,Danese
S
,Kupcinskas
L
, et al..Ежедневный прием будесонида MMX при активном язвенном колите легкой и средней степени тяжести: результаты рандомизированного исследования CORE II
.Гут
2014
;63
:433
—41
,52.Де Кассан
С
,Fiorino
G
,Danese
S
.Кортикостероиды второго поколения для лечения болезни Крона и язвенного колита: более эффективны и меньше побочных эффектов?
Dig Dis
2012
;30
:368
—75
.53.Конг
H
,Ли
Y
,Kim
H
и др. .Чувствительность глюкокортикоидов к метаболизму толстой кишки и фармакологическому вмешательству в метаболизм: влияние на терапевтическую активность специфичного для толстой кишки глюкокортикоида 21-сульфата натрия в целевом участке
.J Pharm Pharmacol
2012
;64
:128
—38
. 54.Ядав
В
,Gaisford
S
,Merchant
HA
,Basit
AW
.Бактериальный метаболизм кортикостероидов в толстой кишке
.Int J Pharm
2013
;457
:268
—74
.55.Ким
IH
,Kong
HS
,Choi
BI
, et al..Синтез и in vitro свойства дексаметазона 21-сульфата натрия как специфического для толстой кишки пролекарства дексаметазона
.Лекарство Дев Инд Фарм
2006
;32
:389
—97
. 56.Гайд
PM
,Уильямс
RH
.Поглощение и метаболизм гидрокортизона-4-C14
.J Biol Chem
1957
;227
:1063
—81
.57.Элион
ГБ
.Пуриновый путь к химиотерапии
.Science
1989
;244
:41
—7
. 58.Цвейман
В
.Иммуносупрессивные эффекты определенных классов агентов с особым упором на трансплантацию органов. Иммуносупрессия тиопуринами
.Transplant Proc
1973
;5
:1197
—201
.59.Брук
БН
,Hoffmann
DC
,Swarbrick
ET
.Азатиоприн при болезни Крона
.Ланцет
1969
;2
:612
—4
.60.де Бур
НКХ
,Peyrin-Biroulet
L
,Jharap
B
и др. .Тиопурины при воспалительных заболеваниях кишечника: новые открытия и перспективы
.J Crohns Colitis
2018
;12
:610
—20
.61.Сейнен
ML
,van Nieuw Amerongen
GP
,de Boer
NK
,van Bodegraven
AA
.Rac-атака: модуляция малой GTPase Rac при воспалительном заболевании кишечника и тиопуриновой терапии
.Мол Диаг Тер
2016
;20
:551
—7
.62.Дерикс
LJ
,Гилиссен
LP
,Hooymans
PM
,Hommes
DW
.Обзорная статья: тиопурины при воспалительном заболевании кишечника
.Алимент Фармакол Тер
2006
;24
:715
—29
.63.де Бур
NK
,van Bodegraven
AA
,Jharap
B
,de Graaf
P
,Mulder
CJ
.Drug Insight: фармакология и токсичность тиопуриновой терапии у пациентов с ВЗК
.Нат Клин Практик Гастроэнтерол Гепатол
2007
;4
:686
—94
.64.Мовва
R
,Lobb
M
,Ó Cuív
P
,Florin
THJ
,Duley
JA
,Oancea
I
.Микробный метаболизм тиопуринов: метод измерения тиогуаниновых нуклеотидов
.J Microbiol Methods
2016
;128
:102
—7
.65.Oancea
Я
,Das
ID
,De Carcer
DA
и др.Микробиота толстой кишки может способствовать быстрому уменьшению колита у мышей с помощью тиогуанина независимо от Т-лимфоцитов и метаболизма хозяина
.Гастроэнтерология
2016
;150
:S196
—S7
.66.Флорин
THJ
,Wright
JD
,Jambhrunkar
SD
,Henman
MG
,Popat
A
.Хорошо переносимый и быстродействующий тиопурин при ВЗК?
Drug Discov Today
2019
;24
:37
—41
0,67.Газзанига
А
,Iamartino
P
,Maffione
G
,Sangalli
ME
.Оральная система с отсроченным высвобождением для специфической доставки в толстую кишку
.Int J Pharm
1994
;108
:77
—83
0,68.Гареб
В
,Dijkstra
G
,Kosterink
JGW
,Frijlink
HW
.Разработка новых таблеток будесонида нулевого порядка высвобождения для лечения воспалительного заболевания кишечника и толстой кишки и сравнение с препаратами, используемыми в настоящее время в клинической практике
.Int J Pharm
2019
;554
:366
—75
0,69.Гареб
В
,Posthumus
S
,Beugeling
M
и др.На пути к пероральному лечению воспалительных заболеваний кишечника и толстой кишки таблетками инфликсимаба: разработка и проверка производственного процесса
.Фармацевтика
2019
;11
:428
.70.Филипп
АК
,Филип
B
.Системы адресной доставки лекарств в толстую кишку: обзор основных и новых подходов
.Oman Med J
2010
;25
:79
—87
.71.Ким
Я
,Kong
H
,Lee
Y
и др. .Дексаметазон 21-сульфат улучшает терапевтические свойства дексаметазона против экспериментального колита крыс, специфически доставляя стероид в толстую кишку
.Pharm Res
2009
;26
:415
—21
,72.Chourasia
МК
,Jain
SK
.Фармацевтические подходы к системам адресной доставки лекарств в толстую кишку
.J Pharm Pharm Sci
2003
;6
:33
—66
,73.Van den Mooter
G
,Самын
C
,Kinget
R
.Оценка in vivo специфической системы доставки лекарств в толстую кишку: исследование абсорбции теофиллина из капсул, покрытых азополимерами, на крысах
.Pharm Res
1995
;12
:244
–7
,74.Эшфорд
м
,Fell
J
,Attwood
D
,Sharma
H
,Woodhead
P
.Оценка пектина как носителя для доставки лекарств в толстую кишку
.J Control Release
1993
;26
:213
—20
.75.Ибекве
VC
,Khela
MK
,Evans
DF
,Basit
AW
.Новая концепция нацеливания лекарств на толстую кишку: комбинированная технология доставки лекарств, реагирующих на pH и запускаемых бактериями
.Алимент Фармакол Тер
2008
;28
:911
—6
.76.D’Haens
GR
,Sandborn
WJ
,Zou
G
и др. .Рандомизированное исследование не меньшей эффективности: 1600 мг против 400 мг таблеток месалазина для лечения язвенного колита легкой и средней степени тяжести
.Алимент Фармакол Тер
2017
;46
:292
—302
.77.Явдан
В
,Lopez
JG
,Chankhamjon
P
и др..Персонализированное картирование метаболизма лекарств микробиомом кишечника человека
.Ячейка
2020
;181
:1661
—1679.e22
.78.Скарпеллини
E
,Ianiro
G
,Attili
F
,Bassanelli
C
,De Santis
A
,Gasbarrini
A
.Микробиота кишечника человека и виром: потенциальные терапевтические последствия
.Dig Liver Dis
2015
;47
:1007
–12
,79.Войт
RM
,Forsyth
CB
,Green
SJ
и др. .Циркадная дезорганизация изменяет кишечную микробиоту
.PLoS One
2014
;9
:e97500
.80.Йернберг
С
,Löfmark
S
,Edlund
C
,Jansson
JK
.Долгосрочное воздействие антибиотиков на микробиоту кишечника человека
.Микробиология
2010
;156
:3216
—23
,81.Prudhviraj
G
,Vaidya
Y
,Singh
SK
и др. .Эффект от совместного введения пробиотиков с системами адресной доставки на основе полисахаридов в толстую кишку для оптимизации высвобождения лекарственного средства в конкретном месте
.Eur J Pharm Biopharm
2015
;97
:164
—72
.© Автор (ы) 2020. Опубликовано Oxford University Press от имени Европейской организации Крона и колита.
Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution (http://creativecommons.org/licenses/by-nc/4.0/), которая разрешает некоммерческое повторное использование, распространение, и воспроизведение на любом носителе при условии правильного цитирования оригинала.По вопросам коммерческого повторного использования обращайтесь по адресу [email protected].Микробиом | Источник питания
Перейти к:
Что такое микробиом?
Как микробиота приносит пользу организму
Роль пробиотиков
Может ли диета повлиять на микробиоту человека?
Будущие направления исследований
Что такое микробиом?
Представьте шумный город утром в будний день, тротуары заполнены людьми, спешащими на работу или на встречи.Теперь представьте это на микроскопическом уровне, и вы получите представление о том, как выглядит микробиом внутри нашего тела, состоящий из триллионов микроорганизмов (также называемых микробиотой или микробами) тысяч различных видов. [1] К ним относятся не только бактерии, но и грибы, паразиты и вирусы. У здорового человека эти «жучки» мирно сосуществуют, причем наибольшее их количество обнаруживается в тонком и толстом кишечнике, а также по всему телу. Микробиом даже называют поддерживающим органом, потому что он играет очень много ключевых ролей в обеспечении бесперебойной повседневной работы человеческого тела.
У каждого человека есть совершенно уникальная сеть микробиоты, которая изначально определяется его ДНК. Человек впервые подвергается воздействию микроорганизмов в младенчестве, во время родов через родовые пути и через грудное молоко матери. [1] То, каким именно микроорганизмам подвергается младенец, зависит исключительно от вида, обнаруженного у матери. Позже воздействие окружающей среды и диета могут изменить микробиом человека, сделав его полезным для здоровья или подвергнуть его большему риску заболевания.
Микробиом состоит из полезных и потенциально вредных микробов. Большинство из них являются симбиотическими (от которых выигрывают и человеческое тело, и микробиота), а некоторые, в меньшем количестве, являются патогенными (способствуют развитию болезни). В здоровом организме без проблем сосуществуют патогенная и симбиотическая микробиота. Но если есть нарушение этого баланса, вызванное инфекционными заболеваниями, определенными диетами или длительным использованием антибиотиков или других препаратов, уничтожающих бактерии, возникает дисбактериоз, прекращающий эти нормальные взаимодействия.В результате организм может стать более восприимчивым к болезням.
Как микробиота приносит пользу организму
Микробиота стимулирует иммунную систему, расщепляет потенциально токсичные пищевые соединения и синтезирует определенные витамины и аминокислоты [2], включая витамины группы B и витамин K. Например, ключевые ферменты, необходимые для образования витамина B12, содержатся только в бактериях, не у растений и животных. [3]
Сахара, такие как столовый сахар и лактоза (молочный сахар), быстро всасываются в верхней части тонкой кишки, но более сложные углеводы, такие как крахмалы и волокна, не так легко перевариваются и могут перемещаться ниже в толстую кишку.Там микробиота помогает расщеплять эти соединения с помощью их пищеварительных ферментов. Ферментация неперевариваемых волокон вызывает производство короткоцепочечных жирных кислот (SCFA), которые могут использоваться организмом в качестве источника питательных веществ, но также играют важную роль в функции мышц и, возможно, в профилактике хронических заболеваний, включая некоторые виды рака и расстройства кишечника. . Клинические исследования показали, что SCFA могут быть полезны при лечении язвенного колита, болезни Крона и диареи, связанной с антибиотиками.[2]
Микробиота здорового человека также обеспечивает защиту от патогенных организмов, попадающих в организм, например, через питье или употребление зараженной воды или пищи.
Крупные семейства бактерий, обнаруженных в кишечнике человека, включают Prevotella , Ruminococcus , Bacteroides и Firmicutes . [4] В толстой кишке, в среде с низким содержанием кислорода, вы найдете анаэробные бактерии Peptostreptococcus, Bifidobacterium , Lactobacillus и Clostridium .[4] Считается, что эти микробы предотвращают чрезмерный рост вредных бактерий, конкурируя за питательные вещества и места прикрепления к слизистой оболочке кишечника, которая является основным местом иммунной активности и производства антимикробных белков. [5,6]
Роль пробиотиков
Если микробиота так жизненно важна для нашего здоровья, как мы можем гарантировать, что у нас есть достаточное количество или правильные типы? Возможно, вы знакомы с пробиотиками или, возможно, уже используете их. Это либо продукты, которые естественным образом содержат микробиоту, либо таблетки-добавки, содержащие живые активные бактерии, рекламируемые для улучшения здоровья пищеварительной системы.Продажи пробиотических добавок превысили 35 миллиардов долларов в 2015 году с прогнозируемым увеличением до 65 миллиардов долларов к 2024 году. Верите ли вы в заявления о здоровье или думаете, что это еще одна афера со змеиным маслом, они составляют многомиллиардную отрасль, которая развивается в тандеме с быстро появляющиеся исследования.
Д-р Аллан Уокер, профессор питания Гарвардской школы общественного здравоохранения и Гарвардской медицинской школы, считает, что, хотя опубликованные исследования противоречат друг другу, существуют определенные ситуации, когда пробиотические добавки могут быть полезны.«Пробиотики могут быть наиболее эффективными для обоих концов возрастного спектра, потому что в этом случае ваши микробы не так устойчивы, как обычно», — объясняет Уокер. «В эти периоды вы можете более эффективно влиять на этот огромный процесс бактериальной колонизации с помощью пробиотиков». Он также отмечает ситуации стресса для организма, когда пробиотики могут быть полезны, например, уменьшение тяжести диареи после контакта с патогенами или восстановление нормальных бактерий в кишечнике после того, как пациент принимает антибиотики.Тем не менее, Уокер подчеркивает, что «это все обстоятельства, при которых происходит нарушение баланса в кишечнике. Если вы имеете дело со здоровым взрослым или более старшим ребенком, который не принимает антибиотики, я не думаю, что введение пробиотика будет столь же эффективным для общего улучшения их здоровья ».
Поскольку пробиотики относятся к категории добавок, а не продуктов питания, они не регулируются Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.Это означает, что, если компания, производящая добавки, добровольно не раскроет информацию о качестве, например, наличие USP (U.S. Pharmacopeial Convention) печать, которая обеспечивает стандарты качества и чистоты, пробиотические таблетки могут не содержать количества, указанные на этикетке, или даже не гарантировать, что бактерии живы и активны во время использования.
Может ли диета повлиять на микробиоту?
Помимо семейных генов, окружающей среды и использования лекарств, диета играет большую роль в определении того, какие виды микробиоты обитают в толстой кишке. [2] Все эти факторы создают уникальный микробиом от человека к человеку.В частности, диета с высоким содержанием клетчатки влияет на тип и количество микробиоты в кишечнике. Пищевые волокна могут быть расщеплены и ферментированы только ферментами микробиоты, живущей в толстой кишке. Короткоцепочечные жирные кислоты (SCFA) высвобождаются в результате ферментации. Это снижает рН толстой кишки, что, в свою очередь, определяет тип присутствующей микробиоты, которая выживет в этой кислой среде. Более низкий уровень pH ограничивает рост некоторых вредных бактерий, таких как Clostridium difficile . Растущие исследования SCFA исследуют их широкое влияние на здоровье, включая стимуляцию активности иммунных клеток и поддержание нормального уровня глюкозы и холестерина в крови.
Продукты, поддерживающие повышенный уровень SCFA, — это неперевариваемые углеводы и волокна, такие как инулин, резистентные крахмалы, камеди, пектины и фруктоолигосахариды. Эти волокна иногда называют пребиотиками, потому что они питают нашу полезную микробиоту. Хотя существуют добавки, содержащие пребиотические волокна, существует множество полезных для здоровья продуктов, содержащих пребиотики. Наибольшее количество содержится в сырых версиях следующих ингредиентов: чеснок, лук, лук-порей, спаржа, топинамбур, зелень одуванчика, бананы и водоросли.В целом, фрукты, овощи, бобы и цельнозерновые продукты, такие как пшеница, овес и ячмень, являются хорошими источниками пребиотических волокон.
Имейте в виду, что высокое потребление пребиотических продуктов, особенно если их вводить внезапно, может увеличить газообразование (метеоризм) и вздутие живота. Лица с чувствительностью желудочно-кишечного тракта, такой как синдром раздраженного кишечника, должны вводить эти продукты в небольших количествах, чтобы сначала оценить переносимость. При продолжении использования переносимость может улучшиться с меньшим количеством побочных эффектов.
Если человек не чувствителен к пище, важно постепенно внедрять диету с высоким содержанием клетчатки, потому что диета с низким содержанием клетчатки может не только уменьшить количество полезной микробиоты, но и увеличить рост патогенных бактерий, которые процветают в менее кислой среде. .
Продукты с пробиотиками содержат полезную живую микробиоту, которая может еще больше изменить микробиом человека. К ним относятся ферментированные продукты, такие как кефир, йогурт с живыми активными культурами, маринованные овощи, темпе, чайный гриб, кимчи, мисо и квашеная капуста.
Будущие направления исследований
Микробиом — это живая динамическая среда, в которой относительная численность видов может колебаться ежедневно, еженедельно и ежемесячно в зависимости от диеты, лекарств, физических упражнений и множества других факторов окружающей среды.Однако ученые все еще находятся на ранних этапах понимания широкой роли микробиома для здоровья и масштабов проблем, которые могут возникнуть в результате прерывания нормальных взаимодействий между микробиомом и его хозяином. [7]
Некоторые актуальные темы исследований:
- Как микробиом и их метаболиты (вещества, вырабатываемые метаболизмом) влияют на здоровье и болезни человека.
- Какие факторы влияют на структуру и баланс микробиома человека.
- Разработка пробиотиков в качестве функционального продукта питания и решение нормативных вопросов.
Конкретные области интересов:
- Факторы, влияющие на микробиом беременных женщин, младенцев и детей.
- Манипулируют микробами, чтобы противостоять болезням и лучше реагировать на лечение.
- Различия в микробиоме здоровых людей и людей с хроническими заболеваниями, такими как диабет, желудочно-кишечные заболевания, ожирение, рак и сердечно-сосудистые заболевания.
- Разработка диагностических биомаркеров из микробиома для выявления болезней до их развития.
- Изменение микробиома в результате трансплантации микробов между людьми (например, трансплантация фекалий).
Связанные Ссылки
- Ursell, L.K., et al. Определение микробиома человека. Nutr Ред. , август 2012 г .; 70 (Дополнение 1): S38 – S44.
- den Besten, Gijs., Et al. Роль короткоцепочечных жирных кислот во взаимодействии между диетой, кишечной микробиотой и энергетическим обменом хозяина .J Lipid Res. 2013 сен; 54 (9): 2325–2340.
- Morowitz, M.J., Carlisle, E., Alverdy, J.C. Вклад кишечных бактерий в питание и метаболизм у критически больных. Surg Clin North Am. августа 2011 г .; 91 (4): 771–785.
- Arumugam, M., et al. Энтеротипы микробиома кишечника человека. Природа. 12 мая 2011 г .; 473 (7346): 174-80.
- Кэнни, Г.О., Маккормик, Б.А. Бактерии в кишечнике, полезные жители или враги изнутри. Инфекция и иммунитет. августа 2008 г. 76 нет. 8, 3360-3373.
- Джандхьяла, С. Роль нормальной микробиоты кишечника. World J Gastroenterol. 7 августа 2015 г .Лекарства для улучшения микрофлоры кишечника: Препараты для восстановления микрофлоры кишечника



 Основные – затяжной прием слабительных, гормональных, антибактериальных препаратов, неправильное питание, диеты и голодания, болезни эндокринной системы, снижение иммунитета, оперативные вмешательства, частые стрессы и депрессии, переутомления, вредные привычки, последствия самостоятельной чистки организма.
Основные – затяжной прием слабительных, гормональных, антибактериальных препаратов, неправильное питание, диеты и голодания, болезни эндокринной системы, снижение иммунитета, оперативные вмешательства, частые стрессы и депрессии, переутомления, вредные привычки, последствия самостоятельной чистки организма.