Лечение неходжкинской лимфомы — Медицинский портал EUROLAB
Причины возникновения неходжкинской лимфомы
Неходжкинская лимфома — злокачественная опухоль, развивающаяся из клеток лимфоидной ткани, характеризуется локальным ростом и на начальных стадиях не сопровождается диффузным поражением костного мозга. Неходжкинские злокачественные лимфомы чрезвычайно гетерогенные по происхождению, уровню дифференцировки и функциональным признакам клеток, из которых состоит субстрат опухоли. У взрослых в основном диагностируют первичные опухоли различных групп лимфатических узлов. Экстранодальные очаги поражения наблюдаются реже.
Первичная локализация патологического процесса коррелирует с цитологическим вариантом опухоли и во многом определяет клинические проявления заболевания и прогноз. Мужчины болеют чаще, чем женщины, у взрослых заболевание преобладает в возрасте 16-30 лет, а также — после 90 лет.
Повышенный риск заболеваемости наблюдается у детей с врожденным и приобретенным иммунодефицитом. Определенное значение имеет антигенная стимуляция при многих хронических инфекционных заболеваниях, которые вызывают дисфункцию иммунорегуляторных механизмов. Есть данные о связи персистенции вируса Эпштейн- Барра с лимфомой Беркитта (которая является эндемическим заболеванием среди детей африканского континента) и с другими типами лимфом. К факторам, которые вызывают развитие этих опухолей, принадлежат:
- ионизационные излучения,
- воздействие лучевой и химиотерапии (диоксин, цитостатики),
- аутоиммунные заболевания (системная красная волчанка, синдром Шегрена).
За последние 10 лет значительно расширились представления о происхождении лимфоидных опухолей. Благодаря современным методам диагностики описаны новые виды неходжкинских злокачественных лимфом, которые ранее не входили в классификацию. Международная группа по изучению лимфом разработала рекомендации по объединению рациональных аспектов европейских и американских классификаций, которые получили название «Пересмотренная Евро-Американская классификация лимфом» — классификация, где собраны лимфомы с подобными морфологическими признаками.
По характеру роста неходжкинские злокачественные лимфомы делятся на нодулярные (фолликулярные) и диффузные. Для нодулярных лимфом характерно образование псевдофоликулярних структур, которые, в отличие от настоящих фолликулов, содержатся не только в корковом, но и в мозговом слое лимфоцитов, имеют большие размеры, нечеткие контуры. Фолликулярный рост присущ в основном В-лимфомам из центров фолликулов (они могут развиваться из трех зон: в основном из малых клеток, из малых и больших клеток, преимущественно из крупных клеток). Диффузный тип роста с тотальным разрастанием клеток, полным стиранием структуры лимфатического узла присущий всем видам неходжкинских злокачественных лимфом. Их разделяют по степени злокачественности (высокий, низкий, промежуточный), а также по течению.
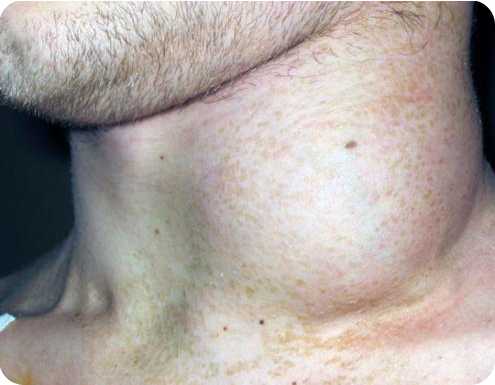
Клиническая картина различных форм неходжкинских злокачественных лимфом имеет много общих черт. Первым симптомом заболевания часто бывает увеличение лимфатических узлов, селезенки, яичек, долей щитовидной железы и пр. В некоторых случаях развитию опухоли предшествует клиника общей интоксикации Часто болезнь может развиваться под маской аутоиммунной гемолитической анемии, геморрагического васкулита, полиартрита, экземы.
Лимфатические узлы имеют плотную консистенцию, подвижны, безболезненны, образуют конгломераты, достигающие больших размеров (16-20 см в диаметре), могут сдавливать крупные сосуды средостения, вызывать застой в системе верхней полой вены. В случае сжатия трахеи может нарушаться функция дыхания. Вследствие увеличения лимфатических узлов в воротах печени и сжатия общего желчного протока возникает желтуха. Увеличение брыжеечных и забрюшинных лимфатических узлов приводит к нарушению функции кишечника, мочевых органов.
 Среди лимфобластных лимфом тип В-клеточного происхождения составляет около 20%. Чаще болеют дети, чем взрослые. Главные очаги поражения локализуются в лимфатических узлах, коже, костях. В патологический процесс рано привлекается костный мозг.
Среди лимфобластных лимфом тип В-клеточного происхождения составляет около 20%. Чаще болеют дети, чем взрослые. Главные очаги поражения локализуются в лимфатических узлах, коже, костях. В патологический процесс рано привлекается костный мозг.
Лимфоплазмоцитарная лимфома (иммуноцитома) чаще наблюдается у больных пожилого возраста. Поражаются лимфатические узлы, селезенка, костный мозг, реже возникают экстранодальные очаги поражения, а также появляются опухолевые клетки в периферической крови.
Для лимфомы мантийной зоны характерны лимфаденопатия, спленомегалия, экстранодальные поражения, особенно органов пищеварительного тракта. Течение заболевания умеренно агрессивное. В случае прогрессирования патологического процесса наблюдается инфильтрация опухолевыми клетками костного мозга.
Фолликулярная лимфома из клеток центров фолликулов (центроцитов) наблюдается среди лимфом значительно чаще, обычно у взрослых. Почти 40% больных с опухолями лимфоидной ткани страдают фолликулярной лимфомой. Очаги поражения обнаруживают в лимфатических узлах, селезенке, костном мозге, а также экстранодальные. В случае прогрессирования возможна трансформация заболевания в крупноклеточную В-неходжкинскую злокачественную лимфому.
Классический вариант лимфомы Беркитта описан у детей из Восточной Африки и Новой Гвинеи. Он характеризуется поражением костей, лимфатических узлов, почек, яичников, легких. Костный мозг привлекается в процесс редко.
Т-лимфобластные неходжкинские злокачественные лимфомы бывают чаще у подростков и молодых мужчин. Заболевание сопровождается увеличением лимфатических узлов и/или опухолью средостения (вилочковой железы), часто лейкемизацией.
У больных с грибовидным микозом (синдром Сезари) обнаруживают многочисленные поражения кожи (узлы, бляшки). Кроме того, наблюдается поражение лимфатических узлов. Т-клеточная лимфома кишечника наблюдается у взрослых, сопровождается энтеропатиями, язвами и перфорацией слизистой оболочки тонкой кишки.
Как лечить неходжкинская лимфома?
Основой для планирования лечения неходжкинских лимфом является степень злокачественности и стадия опухолевого поражения. В комплексной терапии неходжкинских злокачественных лимфом используют полихимиотерапию в комбинации с лучевой терапией и хирургическими методами.Хирургическое лечение показано только при единичных опухолях пищеварительной системы, щитовидной и молочной желез. Если возникают сомнения в эффективности проведенного радикального вмешательства, а также при лимфомах высокой степени злокачественности, хирургическое вмешательство обязательно дополняют полихимиотерапией.
Показаниями к удалению селезенки при неходжкинских злокачественных лимфомах является первичная лимфома селезенки без признаков генерализации, угроза разрыва селезенки, прогрессивная цитопения, обусловлена гиперспленизмом (при спленомегалии). Лучевую терапию как самостоятельный метод лечения при неходжкинских злокачественных лимфомах применяют редко.
Степень интенсивности лечения и выбор схемы химиотерапии зависят от морфологического варианта лимфомы, иммунофенотипа и стадии заболевания. При неходжкинских злокачественных лимфомах низкой степени злокачественности длительное время можно проводить монохимиотерапию циклофосфаном или хлорбутином (лейкераном). Преднизолон в сочетании с ними усиливает действие противоопухолевых препаратов. Такие курсы лечения повторяют каждые 5-6 месяцев. При лимфомах высокой степени злокачественности назначают курсы полихимиотерапии.
В последние годы для лечения отдельных форм неходжкинских злокачественных лимфом низкой степени злокачественности применяют а-интерфероны (лаферон, интрон А). Обычно такое лечение проводят параллельно с химиотерапией, перед или после нее. Назначение альфа-интерферона может увеличивать количество полных ремиссий в 1,5-2 раза.
Новым направлением терапии является назначение мабтеры (ритуксимаб, специфичный к антигену СD20).
С какими заболеваниями может быть связано
В случае прогрессирования патологического процесса развивается нормохромная анемия и тромбоцитопения.Поражение костного мозга может наблюдаться при любой морфологической форме неходжкинских злокачественных лимфом.
Лечение неходжкинской лимфомы в домашних условиях
Продолжительность лечения неходжкинской лимфомы может составлять 12-18 месяцев, каждые 5-6 месяцев больной должен проходить госпитализацию и повторные курсы химиотерапии. Госпитализации не удастся избежать и в операционный, послеоперационный период. в остальное время лечение может проходить в домашних условиях, медикаменты в низких дозировках принимаются в стадии ремиссии. Все предписания лечащего врача должны быть соблюдены. Самолечение недопустимо.
Средняя продолжительность жизни больных неходжкинскими злокачественные лимфомы низкой степени злокачественности составляет 7 лет, высокого — до 1 года.
Какими препаратами лечить неходжкинская лимфома?
- циклофосфан — по 200 мг в сутки или по 400 мг через сутки; курс лечения повторяют каждые 5-6 месяцев;
- хлорбутин — по 10 мг 5 раз в неделю; курс лечения повторяют каждые 5-6 месяцев;
- преднизолон — в дозе 30-40 мг в сутки; усиливает действие противоопухолевых препаратов;
- а-интерфероны (лаферон, интрон-А) — применяют параллельно с химиотерапией, перед или после нее; назначают в дозе 6 000 000 — 9 000 000 МЕ в сутки.
Лечение неходжкинской лимфомы народными методами
Лечение неходжкинской лимфомы народными средствами не обуславливает обратный эффект, а потому на него не должны возлагаться надежды. Обсудить со своим лечащим врачом можете иммуноукрепляющие отвары для приема в период ремиссии, однако таковые решающую роль в лечении не отыграют.
Лечение неходжкинской лимфомы во время беременности
Диагноз неходжкинской лимфомы на фоне беременности крайне неблагоприятен, развивается болезнь агрессивно по причине молодости самого организма. Лимфомы, связанные с беременностью, как правило, агрессивны по гистологическому типу, и без адекватного лечения, которое должно начинаться как можно раньше, отражаются на здоровье матери негативнейшим образом.
Стратегия лечения, равно как и прогноз на выздоровление и благополучное родоразрешение зависит от стадии заболевания на этапе его выявления. Во втором и третьем триместре адекватным назначением будет полихимиотерапия с содержанием мабтеры среди всего прочего. В первом триместре пациентке будет рекомендован медикаментозный аборт.
В лечении доктор непременно отталкивается от соотношения «риск-польза» как для матери, так и для плода. Отмечается, что большинство противоопухолевых препаратов имеют свойство проникать через плацентарный барьер.
К каким докторам обращаться, если у Вас неходжкинская лимфома
Течение неходжкинской лимфомывероятно и тогда, когда анализ периферической крови остается без сдвигов. Количество лейкоцитов нормальное или повышенное, особенно при некоторых формах неходжкинских злокачественных лимфом низкой степени злокачественности, например при лимфоцитарных, течение которых сопровождается лейкоцитозом. Значительных изменений в лейкоцитарной формуле не наблюдают. Показатели красной крови и количество тромбоцитов в начале заболевания, как правило, не меняются.
Диагноз неходжкинских злокачественных лимфом может быть установлен после биопсии и изучения удаленной опухоли или ее части с помощью гистологических, цитологических, в частности цитохимических и иммунофенотипических методов исследования костного мозга и трепанобиоптата. Для уточнения клинической стадии, то есть распространенности патологического процесса, обследование больного дополняют данными УЗИ, компьютерной, ядерно-магнитной томографии, сцинтиграфии печени, селезенки, костей скелета.
Отсутствие на мембранах клеток-рецепторов С034 и С024 считают неблагоприятными прогностическими факторами при злокачественных лимфобластных лимфомах. Фенотипическими признаками лимфом низкой степени злокачественности является экспрессия пан-В-клеточных антигенов.
Критерии неблагоприятного течения лимфом:
- возраст старше 60 лет;
- прогрессирование В-симптомов: лихорадка, потеря массы тела более 10% в течение 6 месяцев, ночные потения;
- экстранодальное распространение патологического процесса.
Дифференциальную диагностику проводят с заболеваниями, сопровождающимися лимфаденопатией, в частности лимфогранулематозом, лейкемиями, метастазами рака, инфекционными заболеваниями (тифы, паратиф, бруцеллез, инфекционный мононуклеоз, туберкулез лимфатических узлов, болезнь «кошачьих царапин», трихинеллез, сифилис), болезнью Крона, саркоидозом, диффузными заболеваниями соединительной ткани, системной красной волчанкой, системным васкулитом, первичным и вторичным иммунодефицитом, в том числе ВИЧ-инфекцией.
При лимфогранулематозе (болезни Ходжкина) диагноз верифицируют на основании цитологического и гистологического исследований биоптатов лимфатических узлов (клетки Березовского-Штернберга).
Динамическое наблюдение за ходом названных заболеваний в сочетании с биопсией лимфатических узлов, иммунотипированием их клеток, серологическим тестированием позволяют установить правильный диагноз.
Лечение других заболеваний на букву — н
Информация предназначена исключительно для образовательных целей. Не занимайтесь самолечением; по всем вопросам, касающимся определения заболевания и способов его лечения, обращайтесь к врачу. EUROLAB не несет ответственности за последствия, вызванные использованием размещенной на портале информации.
www.eurolab.ua
симптомы болезни, профилактика и лечение Лимфомы, причины заболевания и его диагностика на EUROLAB
Как правило, первым симптомом лимфомы является значительное увеличение размеров лимфатических узлов на шее, в подмышечных впадинах или в паху. При этом, в отличие от инфекционных заболеваний, увеличенные лимфатические узлы безболезненны, их размеры не уменьшаются со временем и при лечении антибиотиками. Иногда, вследствие давления со стороны увеличенных печени, селезенки и лимфатических узлов, возникает чувство переполнения в животе, затруднения дыхания, распирающие боли в нижней части спины, ощущение давления в лице или на шее
Другими симптомами, встречающимися при лимфоме, являются:
Виды лимфом
Термином неходжкинские лимфомы обозначают довольно большую группу лимфом, которые не являются болезнью Ходжкина (лимфогранулематозом). Решение о принадлежности лимфомы к группе неходжкинских лимфом или к болезни Ходжкина принимается после гистологического исследования образца биопсированной ткани. Если при микроскопическом исследовании находят специфические для болезни Ходжкина клетки Березовского-Штернберга-Рида, то ставят диагноз болезни Ходжкина. Если эти специфические клетки не находят, то лимфому относят к группе неходжкинских.
Неходжкинские лимфомы имеют много подвидов, которые отличаются по гистологической картине, клиническим проявлениям и подходам к их лечению. Одни виды лимфом имеют медленное и благоприятное течение, порой длительное время не требуют специального лечения. Такие лимфомы называют индолентными. Ряд других лимфом, напротив, характеризуются быстрым прогрессированием, большим количеством симптомов и требуют немедленного начала лечения. Такие лимфомы называют агрессивными. Встречаются лимфомы с промежуточными характеристиками. Чаще всего аномальный рост лимфоцитов начинается в лимфатических узлах, при этом развивается классический вариант лимфомы, сопровождающийся увеличением лимфатических узлов. Однако встречаются лимфомы, при которых лимфатические узлы не увеличиваются, т.к. заболевание первично возникает не в лимфатическом узле, а в различных органах: селезенке, желудке, кишке, легких, головном мозге. Такие лимфомы называют экстранодальными.
Долгое время во многих странах существовали различные классификации, включающие разные названия и термины для обозначения одного и того же вида неходжкинских лимфом, что создавало большие трудности, как для врачей, так и для пациентов. В 2001 международное сообщество выработало единые подходы к классификации лимфом, и была принята единая, так называемая классификация Всемирной организации здравоохранения (ВОЗ), которой сегодня пользуются в большинстве стран мира.
Мы представляем классификацию ВОЗ в полном объеме. При желании каждый может ознакомиться с ней настолько, насколько считает для себя необходимым.
Стадии лимфомы
Определение стадии лимфомы помогает понять степень распространенности заболевания. Это важная информация для принятия правильного решения в отношении программы лечения. Подходы к лечению начальных (местных) стадий и распространенных стадий лимфом обычно отличаются. При избрании программы лечения учитывают не только стадию, но и многие другие факторы: вид лимфомы, результаты дополнительных исследований (цитогенетических, иммунологических, молекулярных др.), состояние больного, его возраст, сопутствующие заболевании и т.д. Тем не менее, информация о стадии заболевания чрезвычайно важна для разработки эффективной программы лечения.
В соответствии с общепринятой международной классификацией (ее называют классификацией Анн-Арбор по названию города в США, где она была принята) выделяют 4 стадии заболевания: I-ю, II-ю, III-ю и IV-ю. К номеру стадии обычно добавляют буквы А или Б. С помощью этих букв указывают на наличие или отсутствие 3-х важных симптомов, которые могут встречаться у больных лимфомой: лихорадки, выраженной ночной потливости и снижение веса. Если используют букву А — это означает, что вышеуказанные симптомы отсутствуют, если используют букву Б — это говорит о наличии у больного вышеуказанных симптомов.
В классификации выделено четыре стадии заболевания, которые могут быть условно обозначены как местные (локальные, ограниченные) — I-я и II-я стадии и распространенные — III-я и IV-я стадии.
- I-я стадия — допускается вовлечение в лимфомный процесс одной области лимфатических узлов
- II-я стадия — допускается вовлечение в процесс двух и более областей лимфатических узлов с одной стороны диафрагмы (диафрагма — это мышечный листок, который разделяет грудную клетку и брюшную полость).
- III-я стадия — допускается поражение лимфатических узлов с обеих сторон диафрагмы.
- IV-я стадия — заболевание распространяется помимо лимфатических узлов на внутренние органы: сердце, печень, почки, кишку, костный мозг и др.
Классификация неходжкинских лимфом Всемирной организации здравоохранения
В-клеточные опухоли из предшественников В-лимфоцитов:
- В-лимфобластная лимфома / лейкоз из клеток-предшественников (В-клеточный острый лимфобластный лейкоз из клеток-предшественников).
- В-клеточные опухоли из периферических (зрелых) В-лимфоцитов:
- В-клеточный хронический лимфоцитарный лейкоз / лимфома из малых лимфоцитов (лимфоцитарная лимфома)
- В-клеточный пролимфоцитарный лейкоз
- Лимфоплазмоцитарная лимфома
- Селезеночная лимфома маргинальной зоны (+/- ворсинчатые лимфоциты)
- Волосатоклеточный лейкоз
- Плазмоклеточная миелома/плазмоцитома
- Экстранодальная В-клеточная лимфома маргинальной зоны MALT-типа
- Нодальная В-клеточная лимфома маргинальной зоны (+/- моноцитоидные В- лимфоциты)
- Фолликулярная лимфома
- Лимфома из клеток мантийной зоны
- Диффузная В-крупноклеточная лимфома
- Медиастинальная диффузная В-крупноклеточная лимфома
- Первичная экссудативная лимфома
- Лимфома / лейкоз Беркитта
Т- и NK-клеточные опухоли из предшественников Т-лимфоцитов
- Т-лимфобластная лимфома/лейкоз из клеток-предшественников (Т-клеточный острый лимфобластный лейкоз из клеток-предшественников)
Т-клеточные лимфомы из периферических (зрелых) Т-лимфоцитов:
- Т-клеточный пролимфоцитарный лейкоз
- Т-клеточный лейкоз из крупных гранулярных лимфоцитов
- Агрессивный NK-клеточный лейкоз
- Т-клеточная лимфома / лейкоз взрослых (HTLV1+)
- Экстранодальная NK/T-клеточная лимфома, назальный тип
- Т-клеточная лимфома, ассоциированная с энтеропатией
- Гепатолиенальная Т-клеточная лимфома
- Т-клеточная панникулитоподобная лимфома подкожной клетчатки
- Грибовидный микоз / синдром Сезари
- Анапластическая крупноклеточная лимфома, Т/0-клеточная, с первичным поражением кожи
- Периферическая Т-клеточная лимфома, неуточненная
- Ангиоиммунобластная Т-клеточная лимфома
- Анапластическая крупноклеточная лимфома, Т/0-клеточная, с первичным системным поражением
Приведенные формы неходжкинских лимфом также подразделяются в зависимости от особенностей их клинического течения на агрессивные и индолентные.
Чтобы поставить диагноз лимфомы необходимо пройти обследование по следующему плану:
- Врачебный осмотр
- Общий клинический и биохимический анализы крови
- Биопсия (хирургическое удаление) пораженного лимфатического узла с его последующим морфологическим и иммунологическим исследованием
Основным анализом, позволяющим подтвердить диагноз лимфомы, является микроскопическое исследование образца лимфоидной ткани, полученной при биопсии (хирургическом удалении лимфатического узла или кусочка ткани пораженного органа). Эта ткань направляется на морфологическое исследование к врачу-патоморфологу, главной задачей которого является определить: «Есть ли в изучаемой ткани опухолевые (лимфомные) клетки?» Если врач находит опухолевые (лимфомные) клетки в изучаемом гистологическом препарате, то следующий вопрос, который он должен решить: » С каким видом лимфомы мы имеем дело?»
- Лучевая диагностика
Лучевая диагностика (рентгенологическое исследование, компьютерная, магнитно-резонансная томография) позволяет выявить наличие опухолевых образований в различных частях тела, которые не доступны врачу при внешнем осмотре.
Методы лучевой диагностики применяют для определения стадии лимфомы.
- Исследование костного мозга также проводится с целью установить: «Есть ли опухолевые (лимфомные) клетки в костномозговой ткани?»
- Дополнительные методы исследования позволяют уточнить ряд особенностей лимфомы. К ним относятся иммунофенотипирование методом проточной цитометрии, цитогенетические и молекулярно-генетические исследования.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Eurolab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
www.eurolab.ua
Лимфома
Лимфома — стадии, диагностика, лечение
Лечение лимфомы
Лимфома – это группа онкологических заболеваний, которая характеризуется поражением клеток, играющих важную роль в работе иммунной системы, а также клеток, образующих лимфатическую систему организма. Лимфатическая система – это сеть ветвящихся сосудов, по которым циркулирует жидкость, называемая лимфой. Клетки лимфы – лимфоциты, выполняют важнейшую функцию в борьбе с инфекциями. Лимфатическая система имеет множество лимфоузлов. Их задача – фильтрация лимфы, которая может содержать бактерии или вирусы.
Рак возникает тогда, когда нормальные лимфоциты трансформируются в клетки, начинающие бесконтрольно расти и размножаться. Такие клетки могут собираться в одном или нескольких лимфоузлах или других тканях, образуя массы неправильно развивающихся клеток, или опухоль. В дальнейшем они вторгаются в соседние ткани и отдаленные органы, образуя метастазы. Например, если поражена центральная нервная система, то развивается лимфома мозга.
Классификация болезни производится по двум группам:
Обе категории рака имеют схожие симптомы, но с помощью анализа крови и исследования образцов ткани под микроскопом специалисты Центра Лечения Рака Крови диагностируют определенный тип лимфомы. При своевременном принятии мер для лечения лимфомы прогноз достаточно оптимистичный.
Болезнь Ходжкина возникает из-за неправильного развития В-лимфоцитов, продуцирующих специальные белки, которые крепятся к инфицированным и чужеродным клеткам для того, чтобы иммунная система могла распознать и уничтожить их.
Неходжкинская лимфома возникает при аномальном функционировании Т-клеток, которые уничтожают зараженные клетки и принимают участие в регуляции иммунитета. Существует множество подтипов рака, которые по-разному реагируют на терапию. Одним из вариантов неходжскинской лимфомы является первичная лимфома мозга, которая составляет 2% от всех онкологических поражений ЦНС.
Болезнь Ходжкина является распространенной формой опухоли среди молодежи в возрасте от 16 до 35 лет и у пожилых людей от 55 лет. Неходжкинские типы недуга развиваются в основном у пожилых людей. Изучение причин, которые приводят к подобным нарушениям генетической составляющей клеток лимфы, является одним из основных направлений исследований медицинских онкологических центров.
Ученые не знают точных причин возникновения лимфомы мозга и других типов заболевания. Большинство людей, которым поставили такой диагноз, старше 60 лет. В группу риска попадают люди, инфицированные ВИЧ/СПИД, вирусом Эпштейна-Барра и гепатита C. Иммунная система таких пациентов крайне ослаблена, а поэтому и более восприимчива к лимфоме. Воздействие высоких уровней радиационного излучения повышает риск развития неходжкинской лимфомы.
Симптомы лимфомы
Ранние симптомы лимфомы могут проявляться незначительно и имитировать менее опасные распространенные заболевания. Один из первых симптомов лимфомы – безболезненный отек шеи, подмышечных впадин или паха из-за увеличения соответствующих лимфоузлов. Растущие лимфатические узлы сдавливают близко расположенные нервные волокна или вены. Как следствие, возникает онемение, покалывание и/или боль в пораженном месте или отек конечностей.
Если увеличение узлов происходит в области желудка, то пациент ощущает раннее чувство сытости при употреблении пищи. Другие симптомы проявляются в виде лихорадки, необъяснимой потери веса, озноба, ночной потливости, болей в груди или пояснице, упадка сил, а также появления кожной сыпи и зуда.
Диагностика лимфомы
Чтобы выбрать оптимальный вариант лечения, специалисты Центра Лечения Рака Крови исследуют лимфатические узлы. Для определения типа опухоли проводится процедура биопсии, предполагающая взятие небольшого образца увеличенного лимфатического узла и изучение его под микроскопом. Биопсию проводят опытные специалисты с применением специализированной техники.
Тип лимфомы можно определить по внешнему виду раковых клеток под микроскопом и с помощью маркеров, которые распознают особые молекулы на лимфоидных клетках. Такие дополнительные анализы, как анализ крови, рентген грудной клетки или исследование клеток костного мозга помогают врачам увидеть, насколько далеко распространилась болезнь и какие органы поражены.
Стадии лимфомы
Чтобы определить, на какой стадии находится заболевание, используется комплексная диагностика. Это необходимо для выбора правильного лечения. Большинство лимфом имеют 4 стадии, каждой из которых соответствует определенный размер опухоли и дальность распространения рака.
I стадия лимфомы. Область развития опухоли ограничена одной группой лимфатических узлов и, в более редких случаях, одним близкорасположенным органом, не относящимся к лимфатической системе организма.
II стадия болезни. Рак обнаружен в двух и более группах лимфатических узлов, по одну сторону диафрагмы, также может быть поражен орган другой системы организма, расположенный рядом с пораженными узлами лимфатической системы.
III стадия. Поражение присутствует в группе лимфатических узлов по обе стороны диафрагмы, иногда с привлечением других соседних органов. На этой стадии нередко поражена селезенка.
IV стадия лимфомы. Рак распространился на кости, ткани костного мозга, легкие и другие органы, расположенные далеко от первоначального очага развития лимфомы – пораженных лимфатических узлов.
Лечение лимфомы
Если у пациента подтвержден диагноз лимфома, прогноз развития болезни может носить различный характер, и зависит от многих факторов, включая стадию болезни, возраст человека и многое другое. После изучения результатов лабораторных исследований и уточнения стадии разрабатывается индивидуальная программа лечения. Существует четыре вида лечения, которые используются самостоятельно или в сочетании друг с другом:
- химиотерапия;
- биологическая терапия;
- лучевая терапия;
- трансплантация стволовых клеток.
Болезнь Ходжкина обычно лечится с помощью лучевой терапии и химиотерапии. Лечение неходжкинской лимфомы зависит от конкретного вида рака. Химиотерапия – основной метод лечения, а лучевая и биологическая терапия добавляются при необходимости как дополнительный способ лечения.
Лечение лимфомы на разных стадиях может иметь затяжные побочные эффекты, такие, как боль в костях и суставах, онемение рук и ног, снижение способности концентрировать внимание, потливость. Такие явления могут длиться более года после достижения ремиссии. Женщины могут ощущать симптомы менопаузы. Организму требуется время для того, чтобы восстановиться после интенсивной терапии. Лечащий врач поможет пациенту преодолеть реабилитационный период.
www.rak-krovi.ru
Современное лечение лимфомы Ходжкина (лимфогранулематоза) | Демина Е.А.
Российский онкологический научный центр им. Н.Н. Блохина РАМН
К концу ХХ века 10–летняя безрецидивная выживаемость больных лимфомой Ходжкина, по данным крупных исследовательских центров, при ранних стадиях достигла 90%: EORTC (Европейская организация по исследованию и лечению рака), 1993 г. – 92%, Stanford, 1997 г. – 93%, Harvard, 1999 г. – 96%, РОНЦ, 1988 г. – 89%. При распространенных стадиях 5–летняя выживаемость при этом заболевании, по данным NCI (Национальный раковый институт, США), 1999 г. достигает 60% [1,5]. В течение двух последних десятилетий прошлого века проводились многочисленные клинические исследования – велся целенаправленный поиск наилучшей комбинации химиотерапии и оптимального сочетания лучевой и химиотерапии при лечении больных лимфомой Ходжкина (название употребляется в соответствии с классификацией лимфом, принятой ВОЗ в 2001 г.). Анализ этих исследований позволил предложить новую комбинацию факторов риска и иное разделение больных по прогностическим группам при выборе программы лечения. Появились и новая стратегия лечения, и новые терапевтические программы.
С конца 70–х годов в зарубежной литературе вместо терминов «локализованные» и «генерализованные» стадии стали использоваться термины «early» – ранние и «advanced» – распространенные (продвинутые) стадии в значении местно–распространенный/диссеминированный процесс (аналогично терминологии при солидных опухолях). Обоснованием для этих терминов стал анализ результатов радикальной лучевой терапии лимфомы Ходжкина, при котором было показано, что эффективность лечения зависит от общей массы опухоли: при поражении только одной анатомической зоны лимфатических коллекторов 10–летняя безрецидивная выживаемость достигала 80%, в то время как при поражении 4 и более зон – лишь 23% [5]. Кроме того, 10–летняя безрецидивная выживаемость больных с I–II стадиями и массивным поражением средостения оказалась такой же низкой (56%), как у больных с распространенными стадиями (62%) [5]. С онкологической точки зрения этот факт легко объясняется тем, что эффективность лечения всех опухолей, и лимфомы Ходжкина в том числе, зависит от общей массы опухоли. При IIIА стадии с небольшими числом, малыми размерами лимфатических узлов и двумя зонами поражения общая масса опухоли меньше, чем при I или II стадиях с массивным поражением средостения.
В конце 70–х годов на смену радикальной лучевой терапии при I–III А стадиях лимфомы Ходжкина приходит комбинированное химио–лучевое лечение. К этому времени по результатам радикальной лучевой терапии определены прогностические факторы для I–II стадий лимфомы Ходжкина [6,9]. Набор прогностических факторов несколько варьировал у различных исследовательских групп, но в целом к неблагоприятным прогностическим факторам для I и II стадий были отнесены следующие факторы: возраст старше 40 (или 50) лет, поражение 3 и более лимфатических областей (или 4 и более), СОЭ выше 30 мм/час при наличии симптомов интоксикации и выше 50 мм/час при их отсутствии, гистологические варианты смешанноклеточный и лимфоидное истощение, а также массивное (медиастинально–торокальный индекс (МТИ) более 0,33) поражение медиастинальных лимфатических узлов. Эти прогностические факторы разделяли только больных с I и II стадиями лимфомы Ходжкина на две группы, нуждающиеся в различном объеме лечения.
В связи с тем, что понятие «поражение 3 и более лимфатических областей» неоднозначно трактовалось разными исследователями, на V международном симпозиуме по лимфогранулематозу в сентябре 2001 года было обращено особое внимание на различие терминов «area» – область и «region» – зона. Было уточнено, что термином «зона» (region) обозначаются анатомические зоны, по которым устанавливается стадия заболевания в соответствии с классификацией, принятой в Ann–Arbor. Термин «область» (area) – более широкое понятие, область может включать в себя одну или более зон. Так, в одну область были включены шейные, над– и подключичные лимфатические узлы с одной стороны. Также в одну область объединены медиастинальные лимфатические узлы и лимфатические узлы корней легких; одной областью считаются лимфатические узлы «верхнего этажа» брюшной полости (ворота печени, ворота селезенки и корень брыжейки) и одной областью – лимфатические узлы «нижнего этажа» брюшной полости (парааортальные и мезентериальные).
Во второй половине 90–х годов EORTC и Германской группой по изучению лимфомы Ходжкина (GHDG) был проведен многофакторный анализ прогностических факторов. В исследование было включено более 14000 больных [5]. Этот анализ показал, что для всех больных лимфомой Ходжкина при использовании химиотерапии и комбинированного лечения, кроме стадии заболевания и симптомов интоксикации, прогностически значимыми являются только следующие факторы:
1. Массивное поражение средостения (МТИ >0,33).
2. Массивное поражение селезенки (наличие 5 и более очагов или увеличение органа с его диффузной инфильтрацией).
3. Экстранодальное поражение в пределах стадии, обозначаемой символом «Е».
4. Поражение трех или более областей лимфоузлов.
5. Увеличение СОЭ>30 мм/час при стадии Б и >50 мм/час при стадии А [2,3,5].
Эти факторы в совокупности со стадией заболевания и симптомами интоксикации позволили исследователям из GHDG разделить больных лимфомой Ходжкина на прогностические группы. В соответствии с объемом опухолевой массы были выделены три прогностические группы – с благоприятным, промежуточным и неблагоприятным прогнозом (табл. 1), и тем самым выбор программы лечения был поставлен в прямую зависимость от объема опухолевой массы.
Адекватные дозы лучевой терапии на каждое лучевое поле для лимфомы Ходжкина были разработаны H. Kaplan в 60–х годах. Именно он показал, что при дозе облучения в 30 Гр риск рецидива в облученном поле составляет всего 11%, а в интервале доз от 35 до 40 Гр снижается лишь до 4,4%, но 100–процентная эффективность все равно не достигается при дальнейшем повышении дозы облучения. Еще трижды, в середине 70–х годов Fletcher G.H. и Shukovsky L.G., в начале 90–х годов Brincker H. и Bentzen S.M. и в конце 90–х годов M.Loeffler с соавторами проводили анализ эффективности различных доз лучевой терапии для больных с лимфомой Ходжкина [2,3,5,6]. Все три исследования на большом клиническом материале подтвердили выводы, сделанные H. Kaplan, о достижении максимальной тумороцидной дозы в интервале между 30 и 40 Гр и нецелесообразности превышения дозы локального облучения выше 40 Гр, в том числе и на большие опухолевые массы. Brincker H. и Bentzen S.M. при анализе всех опубликованных исследований с 1960 по 1990 гг. показали, что при проведении только радикальной лучевой терапии 95% контроль за лимфомой Ходжкина достигается для лимфатических узлов размером менее 6,0 см при дозе 26,5 Гр, а для лимфатических узлов более 6,0 см при дозе 32,5 Гр [6]. Эти данные были подтверждены клиническим исследованием M.Loeffler с соавторами (1997 г.), которое показало, что при использовании 20 Гр, 30 Гр и 40 Гр на зоны исходно пораженных лимфатических узлов (на большие массивы доза облучения всегда достигала 40 Гр) в рамках комбинированной химио–лучевой терапии не выявлено различия в результатах лечения: 4–летняя выживаемость, свободная от неудач лечения, составила 86%, 80% и 90% соответственно, а общая выживаемость – 93%, 94% и 88% (р=0,5) [5].
До настоящего времени при лечении первичных больных лимфомой Ходжкина использовались две основные схемы полихимиотерапии – схема МОРР (и ее аналоги) и схема ABVD. Длительный, 30–летний спор о преимуществе одной из схем был решен в последнее десятилетие в пользу программы ABVD. В конце 80–х – начале 90–х годов три крупные исследовательские группы опубликовали результаты больших рандомизированных исследований. Эти исследования показали статистически значимое преимущество комбинированных программ, в которых использовалась полихимиотерапия по схеме ABVD, по сравнению с программами со схемой МОРР. В исследовании EORTC (1997 г.) при одинаковой 10–летней общей выживаемости (больные с I–II стадиями лимфомы Ходжкина и неблагоприятным прогнозом, 6 циклов полихимиотерапии и лучевая терапия) риск неудачи лечения к 10 годам составил 24% для больных, получавших химиотерапию МОРР, и 12% для больных, получавших химиотерапию ABVD (p<0,01). В исследовании Миланской группы (1987 г.) выявилось преимущество схемы ABVD перед схемой МОРР как по непосредственным результатам (частота полных ремиссий 92% и 82% соответственно, p<0,02), так и по отдаленным – семилетняя выживаемость до прогрессирования составила 63% и 91% (p<0,02), а общая выживаемость – 68% и 77% (p<0,003) соответственно. В исследовании CALGB (Cancer and Leukemia group B, 1992 г.) также выявилось преимущество в 7–летней общей выживаемости (77% против 68%, p<0,02) и 7–летней выживаемости, свободной от неудач лечения (81% против 63%, p<0,03) [5]. В прошедшем году GHSH также подтвердила преимущество программы ABVD перед программой МОРР. Поэтому на V международном симпозиуме по лимфоме Ходжкина в сентябре 2001 года в Кельне схема ABVD (адриамицин 25 мг/м2, блеомицин 10 мг/м2, винбластин 6 мг/м2, дакарбазин 375 мг/м2, все препараты вводятся в 1 и 15–й дни с интервалом в 2 недели) была признана приоритетной для первичных больных с лимфомой Ходжкина.
В последние десятилетия комбинированное химио–лучевое лечение прочно заняло лидирующее положение в лечении всех первичных больных лимфомой Ходжкина.
Для первичных больных лимфомой Ходжкина основной идеологией терапии стало положение: «Объем лечения соответствует объему поражения». Разделение больных на три прогностические группы облегчает выбор адекватной программы лечения.
Лечение больных с благоприятным прогнозом
Эта группа больных малочисленна и требует небольшого объема лечения. Во всех исследованиях длительная (10–летняя и более) выживаемость в этой группе достигает 96–100%. За последние два десятилетия в этой группе больных несколькими крупными рандомизированными исследованиями было доказано преимущество комбинированной терапии. В исследовании EORTC 6–летняя выживаемость, свободная от неудач лечения, составила в группе комбинированного лечения 90%, в то время как в группе, получавшей радикальную лучевую терапию, лишь 81% – p<0,019 [5]. В рандомизированном исследовании GHSH проведено сравнение комбинированной терапии, состоящей из 2 курсов по схеме ABVD и последующего облучения расширенными полями с лечением по радикальной лучевой программе. Получены аналогичные результаты: 2–летняя свободная от неудач лечения выживаемость составила 96% и 87% соответственно – p<0,05 [5]. Аналогичные результаты опубликовала Манчестерская группа (111 больных): 3–летняя выживаемость до прогрессирования в группе комбинированного химио–лучевого лечения 91% по сравнению с 73% в группе, получавшей только лучевую терапию расширенными полями. Программа Манчестерской группы интересна тем, что она очень короткая, состоит из 4 недель полихимиотерапии по схеме VAPEC–B (винкристин 1,4 мг/м2 1–й и 8–й дни, адрибластин 35 мг/м2 1–й и 15–й дни, преднизолон 50 мг внутрь с 1–го по 28 день ежедневно, этопозид 100 мг/м2 в/в с 15–го по 19 день ежедневно, блеомицин 10 мг/м2 1–й и 8–й дни). После двухнедельного интервала следует лучевая терапия на зоны исходного поражения. Вся программа выполняется за 10 недель [5]. В 1978–88 гг. в РОНЦ им. Н.Н. Блохина РАМН также проводилось рандомизированное исследование по лечению этой группы больных (85 человек). Сравнивалась комбинированная терапия (4 цикла CVPP + облучение зон исходного поражения) и радикальная лучевая терапия. Шестилетняя выживаемость, свободная от неудач лечения, составила 88% и 63% соответственно – p<0,01 при одинаковой общей выживаемости.
Лечение больных промежуточной прогностической группы
Эта группа больных лимфомой Ходжкина наиболее многочисленна, и принципиальное преимущество комбинированной терапии для этой группы больных было доказано еще к началу 90–х годов. В рандомизированном исследовании EORTC (1977–1982 гг.) 15–летняя общая выживаемость оказалась одинаковой – 69%, но риск рецидива на этот срок в группе больных, получавших радикальную лучевую терапию, составил 35% по сравнению с 16% в группе комбинированного лечения – p<0,001. Преимущество комбинированной терапии было выявлено и при сравнении ее с полихимиотерапией. Опубликованные A.Preti с соавторами результаты рандомизированного исследования (104 больных) показали преимущество комбинированной терапии как по 7–летней общей выживаемости (84% против 66% p<0,01), так и по безрецидивной выживаемости (75% против 34% – p<0,001) [5]. Такие же результаты были получены при аналогичном рандомизированном исследовании в РОНЦ. Шестилетняя общая выживаемость в группах больных с промежуточным прогнозом, получавших полихимиотерапию (6 циклов по схеме CVPP), радикальную лучевую терапию и комбинированное лечение (6 циклов CVPP + облучение лимфатических коллекторов выше диафрагмы) составила 88%, 77% и 94% соответственно (p<0,01), а безрецидивная выживаемость 46%, 60% и 87% соответственно (p<0,01). Однако в терапии этой группы до последнего времени оставался открытым вопрос об объеме лучевой терапии – надо ли облучать только зоны исходного поражения или необходимо использовать широкопольное облучение на все лимфатические коллекторы выше диафрагмы. Два крупных рандомизированных исследования показали нецелесообразность широкопольного облучения в рамках комбинированной терапии. Французская кооперированная группа (1985 г., 218 больных) не выявила различия в 6–летнем безрецидивном течении при облучении только зон исходного поражения по сравнению с методикой расширенных полей (87% против 93% – р=0,15) в рамках комбинированного химио–лучевого лечения [8]. Аналогичные данные были представлены Ruffer J–U. (GSHG) на V международном симпозиуме по лимфоме Ходжкина в сентябре 2001 года в Кельне. Рандомизировано 1068 больных, частота полных ремиссий оказалась одинаковой (97% и 98%), а 2–летняя выживаемость, свободная от неудач лечения, достигла 92% и 94%, при одинаковой общей выживаемости (97%) в обеих группах [7]. В РОНЦ до 1989 г. эта группа больных получала комбинированное лечение: 6 циклов CVPP и облучение всех лимфатических коллекторов выше диафрагмы в дозе 36 Гр, а с 1990 г. по 2000 г. объем облучения был сокращен до зон исходного поражения в той же дозе. Медиана наблюдения составила 80 мес и 43 мес соответственно, частота полных ремиссий – 93% и 98%. Шестилетняя общая выживаемость достигла 94% и 97%, а выживаемость, свободная от неудач лечения – 81% и 81% соответственно. Как видно из всех этих исследований, для больных с лимфомой Ходжкина сокращение объема лучевой терапии в рамках комбинированного химио–лучевого лечения до облучения только зон исходного поражения не снижает ни непосредственных, ни отдаленных результатов лечения.
Лечение больных неблагоприятной прогностической группы
Для лечения этой группы больных всегда использовалась полихимиотерапия. Непосредственная эффективность лечения достигала 60–80% полных ремиссий, но 5–летняя выживаемость редко превышала 60%, а выживаемость, свободная от неудач лечения, достигла лишь 40% [2,3,5]. В начале 80–х годов две группы исследователей (из Ванкувера и из Милана) предложили объединить в одной программе обе схемы полихимиотерапии первой линии (MOPP и ABVD) для повышения эффективности терапии. В 80–х – начале 90–х годов 9 крупных исследовательских групп провели многоцентровые рандомизированные исследования, пытаясь доказать преимущество 7–8–компонентной полихимиотерапии перед 4–компонентной. Только в 3 из 9 исследований было показано незначительное преимущество многокомпонентной химиотерапии перед 4–компонентной по безрецидивной выживаемости, однако остальные 6 исследований не выявили никаких различий [4,5].
В начале 90–х годов две группы исследователей – из Стэнфорда и из Германии (GHSG) – независимо друг от друга предложили новую концепцию для лечения этих больных. Проанализировав предшествовавшие программы лечения в большой группе больных (более 700 человек в группе GHSG), эти исследователи предложили иные принципы интенсификации лечения. Кроме объединения в одной схеме основных препаратов первой линии и эскалации доз, был сокращен интервал между циклами химиотерапии, чем достигалась более высокая еженедельная дозная нагрузка в течение всей программы лечения. Широкое внедрение в лечебную практику гранулоцитарных и макрофагальных колониестимулирующих факторов (граноцит, нейпоген, лейкомакс) позволило проводить всю программу лечения в оптимальном режиме без удлинения интервалов.
Стэнфордская группа предложила программу Stanford V, а GHSG – схемы ВЕАСОРР–базовый и ВЕАСОРР–эскалированный с добавлением лучевой терапии в дозе 30–36 Гр на зоны исходно больших массивов и/или остаточные опухолевые массы. Программа Stanford V состоит из 12–недельной беспрерывной полихимиотерапии и последующей лучевой терапии у больных, не достигших полной ремиссии. Лечение получили 126 больных и при 4,5–летней медиане наблюдения прогнозируемая 8–летняя общая выживаемость составила 96%, а выживаемость, свободная от неудач лечения – 89% [5]. GHSG предложила программу, состоящую из 8 циклов полихимиотерапии ВЕАСОРР базового или эскалированного уровня с последующим облучением. Эта исследовательская группа представила наиболее убедительные доказательства преимущества нового принципа лечения в рандомизированном многоцентровом исследовании. Было проведено сравнение 8 циклов ВЕАСОРР базового (циклофосфамид 650 мг/м2 в 1–й день, адрибластин 25 мг/м2 в 1–й день, вепезид 100 мг/м2 1–3–й дни, прокарбазин 100 мг/м2 1–7 дни, преднизолон 40 мг/м2 1–8 дни, блеомицин 10 мг/м2 в 8–й день и винкристин 1,4 мг/м2 в 8–й день, курс возобновляется на 21–й день) и эскалированного (по дозам адрибластина, вепезида и циклофосфамида) уровней, со стандартной полихимиотерапией СОРР/ABVD (4 двойных цикла). Облучение зон исходно больших массивов и/или остаточных опухолевых масс проводилось во всех трех сравниваемых программах. Всего в исследование было включено 689 больных. Частота полных ремиссий составила 83%, 88% и 95% в группах больных, получавших полихимиотерапию СОРР/ABVD, ВЕАСОРР–базовый и ВЕАСОРР–эскалированный. Статистически значимо больше было больных с прогрессированием заболевания в группе, получавшей СОРР/ABVD – 13% по сравнению с 9% и 2% соответственно в группах, получавших ВЕАСОРР–базовый и ВЕАСОРР–эскалированный, что и обеспечило лучшую 2–летнюю выживаемость, свободную от неудач лечения в группах, получавших ВЕАСОРР: 72%, 81%, 89% соответственно, р<0,05. Общая выживаемость также имела тенденцию к повышению в группах больных, лечившихся по программе ВЕАСОРР – 89%, 94%, 96% соответственно, однако различия статистически незначимы. Смертность в процессе лечения от осложнений терапии была одинаковой – 3%, 1% и 2%, но в группе получавших ВЕАСОРР–эскалированный было больше миелоидных лейкозов (4 больных), в то время, как в группах, получавших СОРР/ABVD и ВЕАСОРР–базовый – неходжкинских лимфом – 4 и 5 соответственно.
В РОНЦ с декабря 1998 г. проводится лечение по программе ВЕАСОРР–базовый 67 больных. К январю 2002 г. закончили лечение, после чего прослежены в течение 3 месяцев и оценены 25 больных. Общее число циклов полихимиотерапии составило 192, но в стационаре проведено лишь 40 циклов – 20% от общего числа циклов, что свидетельствует о хорошей переносимости программы. Медиана наблюдения составила 17 месяцев. Острый миелоидный лейкоз М4 развился в полной ремиссии лимфомы Ходжкина у 1 больной. Частота полных ремиссий достигла 88%, выживаемость, свободная от неудач лечения на медиану наблюдения – 75%, а общая выживаемость – 83%.
Заключение
Таким образом, прошедшее столетие показало возможность излечения большинства больных лимфомой Ходжкина, а на рубеже столетий были сформулированы новые концепции лечения этих больных. Ушли в прошлое радикальная лучевая терапия и широкопольное облучение. Лучевая терапия стала применяться для всех больных только в сочетании с химиотерапией, исключительно на зоны поражения и в дозах не выше 30–40 Гр. Четко определилась тенденция к дальнейшему снижению суммарных очаговых доз облучения.
Основным лечебным принципом стало соответствие объема терапии объему опухолевой массы. Разделение больных на прогностические группы в соответствии с объемом опухолевой массы позволило более адекватно выбирать программу лечения. Так, для благоприятной прогностической группы с минимальным объемом поражения показан минимальный объем лечения – 2–4 цикла химиотерапии + облучение только исходно пораженных лимфатических коллекторов; для промежуточной прогностической группы – 4–6 циклов полихимиотерапии + облучение только исходно пораженных зон; для неблагоприятной прогностической группы с большим объемом опухоли максимальный объем лечения – 8 циклов полихимиотерапии + облучение зон исходно больших массивов и/или зон с остаточными лимфатическими узлами.
Литература:
1. Клиническая онкогематология.// Ред. Волкова М.А. // Москва, Медицина, 2001.
2. Bailliere’s Clinical Haematology. International Practice and Research. Hodgkin’s Disease. // Guest editor V. Diehl. – 1996.
3. Cancer. Principles & Practice of Oncology. 4th Edition. // Ed. by V.T.DeVita, S. Hellman, S.A. Rosenberg // Philadelphia. – 1993. – V 2. – Р. 1819–1858.
4. Diehl V., Franklin J., Hansenclever D. et al. // Ann. of Oncol. – 1998. – V 9. (Suppl 5). – P. 68 – 71.
5. Hodgkin’s disease. // Ed. by Mauch P.V., Armitage J.O., Diehl V. et al // Philadelphia. – 1999.
6. Brincker H., Bentzen S.M.//Radiotherapy & Oncology, 30 (1994), 227–230.
7. Ruffer J–U., Sieber M., Pfistner B., et al.// Leukemia & Lymphoma –2001. – V 42 (Suppl. 2). – Abstr. P–095.– P.54
8. Zittoun R., Audebert A., Hoerni B. Et al.// J. Clin/ Oncol. – 1985. – V 3. – P. 203–214.
www.rmj.ru
Лечение лимфомы, Онкология, Лимфомы
Лечение лимфом зависит от варианта поражения лимфатической системы и степени выраженности поражения. Основным способом лечения заболевания является химиотерапия. По показаниям проводят трансплантацию костного мозга.
Варианты лечения лимфом
Выбор программы лечения зависит от вида лимфомы и состояния больного.
Индолентные лимфомы (лимфомы, имеющие медленное и благоприятное течение) в отдельных случаях могут не требовать лечения, достаточным является наблюдение врача (гематолога или онколога). Однако появление первых признаков прогрессирования заболевания (увеличения лимфатических узлов, усиления слабости, повышения температуры тела и др.) являются сигналом для начала лечения.
При местно распространенных стадиях часто используют радиотерапию — облучение пораженных опухолью лимфатических узлов. При генерализованных (распространенных) стадиях предпочтение отдают химиотерапии. Спектр возможных препаратов для лечения индолентных лимфом достаточно велик — хлорбутин, флударабин, циклофосфан, винкристин, ритуксимаб и др.
Индолентные лимфомы относятся к заболеваниям, полное излечение которых сегодня представляется маловероятным. Основной целью лечения индолентных лимфом считают увеличение продолжительности и улучшение качества жизни больного.Агрессивные лимфомы, как правило, требуют немедленного начала лечения. Одной из наиболее распространенных программ химиотерапии является программа с применением моноклонального антитела Ритуксимаб.
Высоко агрессивные лимфомы лечатся по программам химиотерапии для острых лимфобластных лейкозов или сходных с ними. Целью лечения агрессивных и высокоагрессивных лимфом является излечение. Однако, это возможно не во всех случаях.
Одной из эффективных программ лечения агрессивных и высокоагрессивных лимфом является высокодозная химиотерапия с трансплантацией кроветворных стволовых клеток.
Лечение лимфогранулематоза (лимфомы Ходжкина)
Независимо от морфологического варианта и стадии лимфогранулематоза конечная цель терапии — излечение заболевания. При первой и второй стадиях заболевания вероятность излечения очень высока, но и при далеко зашедших стадиях адекватное лечение имеет хорошие шансы на успех. Лечение на этой стадии может проводиться методами лучевой терапии в сочетании с химиотерапией.
При распространенных стадиях заболевания проводится 6-8 циклов стандартной химиотерапии. При неблагоприятном течении лимфогранулематоза эффективным методом лечения является высокодозная химиоте
Однако, это возможно не во всех случаях.Одной из эффективных программ лечения агрессивных и высокоагрессивных лимфом является высокодозная химиотерапия с трансплантацией кроветворных стволовых клеток.
Лечение лимфогранулематоза (лимфомы Ходжкина)
Независимо от морфологического варианта и стадии лимфогранулематоза конечная цель терапии — излечение заболевания. При первой и второй стадиях заболевания вероятность излечения очень высока, но и при далеко зашедших стадиях адекватное лечение имеет хорошие шансы на успех. Лечение на этой стадии может проводиться методами лучевой терапии в сочетании с химиотерапией.
При распространенных стадиях заболевания проводится 6-8 циклов стандартной химиотерапии. При неблагоприятном течении лимфогранулематоза эффективным методом лечения является высокодозная химиотерапия с аутологичной трансплантацией костного мозга.
Выбор метода лечения — это этап принятия очень важного решения, которое должно основываться на точных данных, касающихся диагноза заболевания, с учетом индивидуальных особенностей больного. Обсуждение вопросов лечения с больным и, по его желанию, с его близкими является неотъемлемым элементом утверждения общей программы лечения.
По материалам статьи «Симптомы лимфомы»
Мне нравится
Нравится
Твитнуть
+1
Одноклассники
www.medkrug.ru