Тениоз:Причины,Симптомы,Лечение | doc.ua
Причины
Тениоз вызывается вооруженным (свиным) цепнем. Тело гельминта плоское и лентовидное, а на сколексе расположено несколько присосок и хобот с длинными и короткими хитиновыми крючками (всего 22 или 23). Длина уже взрослого гельминта достигает целых 3–4 метра. Свиной цепень отличается от бычьего меньшим количеством члеников (около 800–1000), их размерами (диаметр около 6–7 мм, длина около 12–15 мм) и меньшим количеством ответвлений матки в уже зрелом членике. Активной подвижностью членики не обладают. Каждый из члеников содержит 30–50 тысяч яиц. У матки отсутствует выводное отверстие. Морфологически онкосферы бычьего и свиного цепня неотличимы.
Окончательным хозяином является человек, в чьем кишечнике паразитирует зрелая форма гельминта. Промежуточный хозяин – свинья, в организме которой зародыш освобождается из яйца, затем проникает в кишечник, после чего с кровотоком проникает в организм. Через 60 дней зародыш превращается в цистицерк – финны, которые в диаметре достигают 5–7 мм, а в паренхиматозных органах – целых 1,5 см.
Источником тениоза является человек, пораженный тениозом, в окружающую среду он выделяет со своими экскрементами онкосферы . А это приводит к заражению свиней финнозом. Причина заражения – сырое, некачественно обработанное финнозное свиное мясо, которое человек употребляет в пищу. Тениоз регистрируют в тех странах, где сильно развито свиноводство.
Симптомы
При неосложненном тениозе в основе развития лежат точно те же факторы, что и при тениаринхозе. Но когда зрелые членики забрасываются из кишечника уже в желудок, тогда возможно самозаражение онкосферами. В таком случае тениоз может осложниться развитием цистицеркоза глаз, скелетных мышц мозга.
Если у человека обнаружен тениоз, симптомы его напоминают симптомы тениаринхоза. При тениозе довольно часто регистрируют астеноневротические и диспепсические проявления: рвоту, тошноту, головные боли, нарушение аппетита, нарушение сна, боли в животе, кратковременные обморочные состояния, расстройство стула.
Диагностика
Диагностика тениоза включает непосредственные указания больного на отхождения члеников, а также небольших фрагментов гельминта при дефекации. Для отличия тениоза от тениаринхоза и подтверждения диагноза следует провести микроскопическое исследование члеников, которые выделяет больной, учитывая тот факт, что онкосферы бычьего и свиного цепней морфологически неотличимы друг от друга.
При появлении боли в области живота необходима проконсультироваться у хирурга для того, чтобы исключить осложнения. Консультация офтальмолога необходима для исключения цистицеркоза при нарушении зрения, а консультация невролога – при появлении неврологических симптомов.
Лечение
Если у человека обнаружен тениоз, лечение проводят в стационаре. Назначают «Никлозамидом»: 2 грамма принимают на ночь, тщательно разжевав и запив водой. За 15 минут до приема пищи рекомендуется выпить 1–2 г питьевой соды (натрия гидрокарбоната). Препарат достаточно эффективен, он вызывает гибель незрелых члеников и сколекса. Сегодня часто применяют «Празиквантел», который однократно назначают больным всех возрастных групп в дозе 15 мг/кг. Оба препарата хорошо переносятся, побочные реакции слабые (иногда возникают рвота, тошнота, понос, боли в животе).
За 15 минут до приема пищи рекомендуется выпить 1–2 г питьевой соды (натрия гидрокарбоната). Препарат достаточно эффективен, он вызывает гибель незрелых члеников и сколекса. Сегодня часто применяют «Празиквантел», который однократно назначают больным всех возрастных групп в дозе 15 мг/кг. Оба препарата хорошо переносятся, побочные реакции слабые (иногда возникают рвота, тошнота, понос, боли в животе).
Найти и забронировать лекарства Вы можете на нашем сайте в соответствующем разделе.
Лечение свиного цепня не нуждается в диспансерном наблюдении. Через 1–3 месяца после лечения необходимо повторное исследование экскрементов на наличие члеников гельминта. Болезнь можно предотвратить в случае ветеринарного контроля мяса, санитарного надзора за убоем и содержанием свиней, благоустройства населенных пунктов, санитарного просвещения населения.
Какую опасность несет человеку бычий цепень, как от него избавиться
Способы заражения паразитами разнообразны, но самый частый путь попадания в организм человека червей – через продукты питания.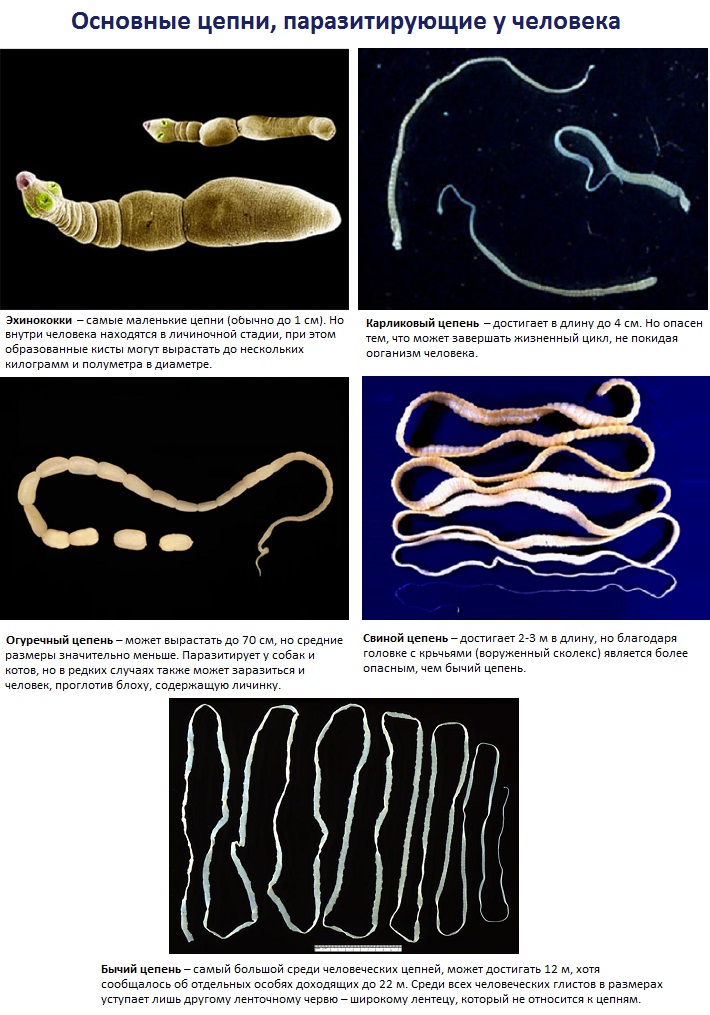 Так бычий цепень проникает внутрь человека через плохо обработанное термически мясо крупного рогатого скота. Он представляет собой ленточного червя длиной от двух до двенадцати метров, тело которого разделено на членики. При созревании части тела паразита отделяются от взрослого цепня, покидая кишечник человека.
Так бычий цепень проникает внутрь человека через плохо обработанное термически мясо крупного рогатого скота. Он представляет собой ленточного червя длиной от двух до двенадцати метров, тело которого разделено на членики. При созревании части тела паразита отделяются от взрослого цепня, покидая кишечник человека. Некоторое время членики вместе с яйцами паразита ждут, когда попадут в корову или быка, чтобы продолжать свое развитие. Ожидание может длиться несколько недель, при этом яйца сохраняют свою жизнеспособность. И только в теле крупного рогатого скота идет их превращение в личинки, а затем по крови они разносятся по мышцам животного, где скрываются внутри пузырьков. Как только человек употребит ростбиф с кровью из зараженной говядины, он становится хозяином паразита.
Симптомы заражения солитером
Местом паразитирования червя является отделы тонкого кишечника. Там он поглощает питательные вещества, необходимые человеку для нормальной жизнедеятельности. Благодаря полноценному питанию в сутки длина ленточного солитера возрастает на семь-двенадцать сантиметров. Присасываясь к стенкам слизистой кишечника, цепень вызывает воспаление этой части органа. А выросшая в несколько метров взрослая особь заполняет все пространство кишечного прохода, не давая ему нормально перерабатывать пищу.
Благодаря полноценному питанию в сутки длина ленточного солитера возрастает на семь-двенадцать сантиметров. Присасываясь к стенкам слизистой кишечника, цепень вызывает воспаление этой части органа. А выросшая в несколько метров взрослая особь заполняет все пространство кишечного прохода, не давая ему нормально перерабатывать пищу.
Если на начальных стадиях заболевания тениаринхоза симптомы почти не проявляются, то мере паразитирования червя появляются серьезные признаки инвазии:
- Воспалительному процессу, проходящему в кишечнике, сопутствуют боли в области живота. Зараженному человеку кажется, что у него началась язвенная болезнь двенадцатиперстной кишки или колики в желчном пузыре.
- Появление рвоты, тошноты, изжоги, повышенного слюноотделения связано с развивающейся диспепсией.
- Постоянные движения паразита внутри организма человека приводят к невротическим отклонениям, раздражительности, расстройствам сна.
- Пациент, зараженный бычьим цепнем, страдает либо от отсутствия аппетита, либо от обжорства.

Уточнить диагноз гельминтоза позволят исследования кала, крови. Следы бычьего цепня зафиксирует и метод рентгенографии кишечника. Токсичность для человека бычьего цепня так велика, что откладывать лечение нельзя.
Как избавиться от паразита
Терапия тениаринхоза включает в себя как медикаментозное лечение, так и народные средства:
- К основным препаратам против инвазии цепнем относится Фенасал – противогельминотное средство широкого спектра действия. Активное вещество в составе его – никлозамид – высокоэффективно борется с паразитами, парализуя их нервно-мышечный аппарат. Принимают таблетки по восемь-десять штук натощак утром или вечером, размельчив их и растворив в теплой воде. После контрольного исследования при рецидиве заболевания лечение повторяют через десять-пятнадцать дней.
- В основе Бильтрицида – вещество празиквантел, которое приводит к гибели паразита внутри человека. Для достижения положительного результата необходимо поддерживать концентрацию вещества в плазме крови пациента от четырех до шести часов.
 А для этого таблетки принимают с интервалом в четыре часа, при назначении однократного приема – вечером.
А для этого таблетки принимают с интервалом в четыре часа, при назначении однократного приема – вечером.
- Настоем горькой полыни можно удалить ленточных глистов. Готовят его так: стаканом кипятка заливают столовую ложку травы. Через тридцать минут напиток можно принимать, делая это по одной-две столовых ложки трижды в день за двадцать минут до еды. Поможет сочетание их с клизмами из чесночного настоя. Лечение должно продолжаться до пяти дней.
- За три дня можно вывести цепней, съедая ежедневно ананасы. Они содержат фермент, расщепляющий белки.
Правильное лечение от инвазии назначит только специалист, самолечение в этом случае опасно для здоровья. Оно грозит возникновением кишечной непроходимости. Если части бычьего цепня с кровью попадут в мозг, сердце, легкие, то человек может погибнуть.
Профилактика тениаринхоза
Предотвратить попадание солитера в организм человека возможно, если приобретать мясо только у проверенных производителей, готовить его по все правилам кулинарии.
Публикация подготовлена по материалам: https://parazitycheloveka.ru/
Источник: Pharmindex.ru для газеты «Аптека-Фарминдекс»
Бычий цепень: симптомы, терапия, профилактика
Бычий цепень, пожалуй, самый крупный большой паразит, какой только может поселиться в теле человека. В длину этот червь вполне может достигать шести метров или даже превышать этот рубеж. Головка его имеет круглую форму, ее диаметр может быть до двух миллиметров. Все тело паразита покрыто мелкими и частыми присосками. Зоной его роста является тонкая шейка, которая проходит через все тело, разделенное на множество члеников.
Бычий цепень, симптомы и лечение которого будут в этой статье рассмотрены, может прожить более двадцати лет. Также стоит сказать, что подхватить его не так уж и сложно.
Цикл развития бычьего цепня
Он паразитирует в тонком кишечнике. Его членики, как правило, выходят из организма вместе с испражнениями. Яйца выходят наружу точно таким же образом. Попадая в окружающую среду, членики заражают ее и делают крайне опасной. Часто личинки паразита можно обнаружить на траве пастбищ, где пасется крупный рогатый скот.
Попадая в организм животных, личинки (цистицерки или финны) могут осесть в их мышцах. У оленей Крайнего Севера их можно найти даже в мозгу.
Цистицерки могут быть до пятидесяти миллиметров, цвета они всегда белого, а внутри у них находится прозрачная жидкость. В теле скота они могут прожить до двух лет.
Заражение же человека происходит тогда, когда он съедает мясо животного-носителя заразы. Опасно только сырое или полусырое мясо, так как в хорошо проваренном или прожаренном мясе личинки не сохраняются.
Цистицерки бычьего цепня, попав в кишечник человека, крепятся к его стенкам, а три месяца спустя из них появляется взрослый половозрелый червь.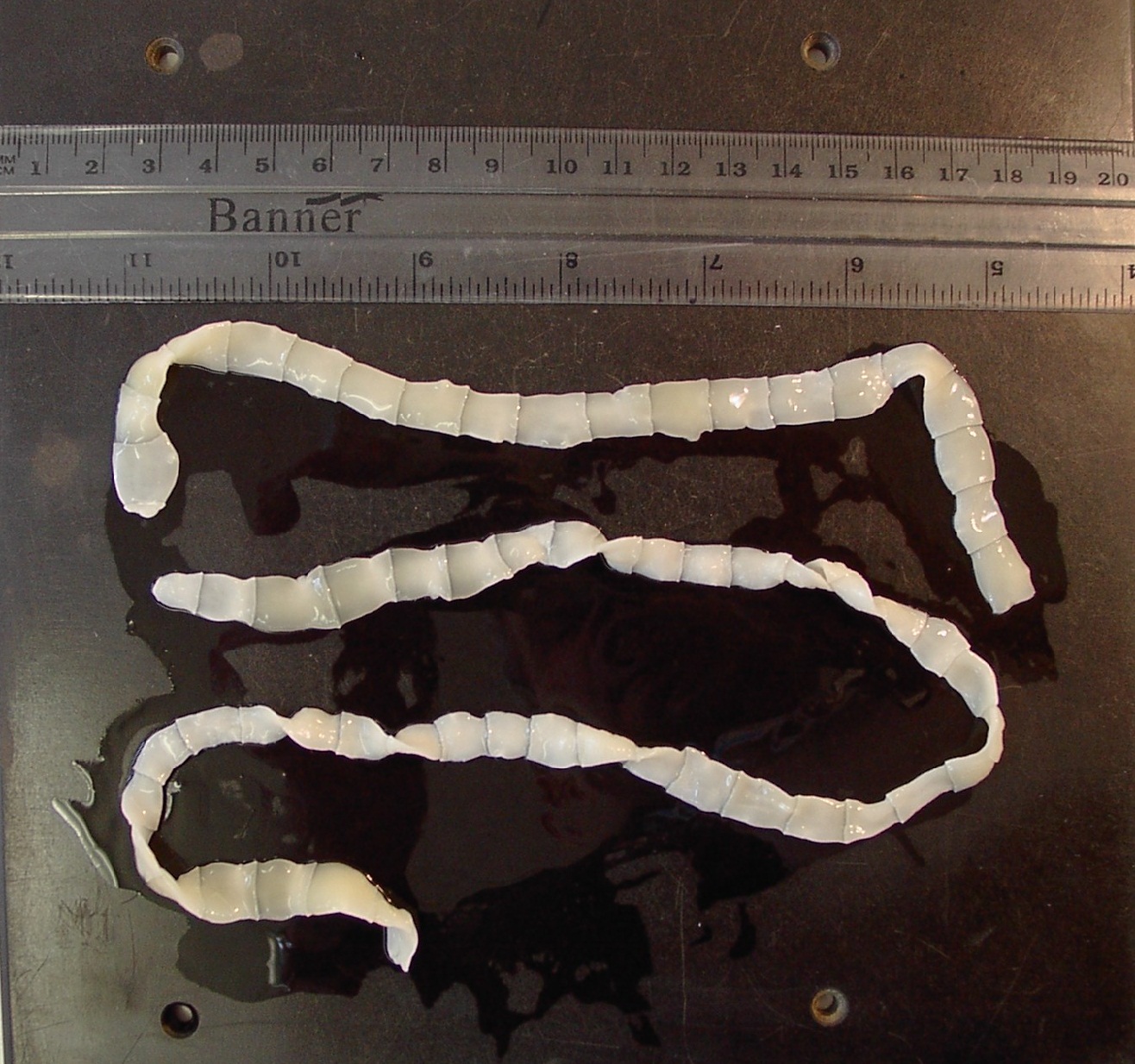 Дальнейшее развитие бычьего цепня, а также его рост происходят очень и очень быстро.
Дальнейшее развитие бычьего цепня, а также его рост происходят очень и очень быстро.
Бычий цепень: симптомы
Данный паразит может привести к появлению у человека такого заболевания как тениаринхоз.
Бычий цепень, симптомы которого мы рассматриваем, может долгое время жить внутри человека и ничем себя не выдать. Правда, вот его членики можно обнаружить в кале. Удивительно, но в некоторых случаях они вполне самостоятельно выбираются из анального отверстия.
Вообще же к симптомам можно отнести полную или частичную потерю аппетита, всевозможные кишечные расстройства, тошноту, рвоту. Общую слабость организма. Конечно же, все это может сопровождаться резкими болями в животе. Все эти симптомы появляются не сразу, а постепенно.
Бычий цепень лишает человека сил, и тот начинает постепенно чахнуть, меняется цвет лица, сквозь кожу начинают проглядывать кости. Пациенты страдают бессонницей, а также их могут мучить ночные кошмары.
Диагностируют бычьего цепня при помощи анализа кала. В некоторых случаях его путают со свиным цепнем.
В некоторых случаях его путают со свиным цепнем.
Лечение часто проводится в стационарных условиях. В первую очередь это связано с тем, что препараты, которые должны принимать пациенты, являются очень токсичными.
Какие могут быть осложнения
Отметим, что осложнения можно наблюдать только в редких случаях. Проблемы начинаются тогда, когда членики паразита попадают во влагалище, чревообразный отросток, в брюшную полость или куда-либо еще. К осложнениям можно еще отнести и обтурационную непроходимость кишечника.
Профилактика
Бычий цепень, симптомы которого мы рассматривали, в некоторых случаях с первого раза может быть удален не полностью. По этой причине люди, прошедшие лечение, должны будут еще полгода регулярно сдавать анализы.
Сегодня сельское хозяйство в нашей стране развито намного лучше, чем это было раньше. Это заключается и в том, что корм для животных проходит специальную обработку, при которой личинки всевозможных паразитов погибают.
Людям же рекомендуется есть только правильно приготовленное мясо, избегать общественных уборных и мыть руки как можно чаще и тщательнее.
Бычий цепень у людей | Мой город.Онлайн–пишем полезные новости
Бычий цепень – это паразит, который обитает в организме человека и может нанести ущерб здоровью. Если вовремя не будут приняты меры, то это может привести даже к летальному исходу. Бычий цепень у человека – это довольно крупный паразит, который может достигнуть 10 метров. Средние размеры, которые обнаруживали врачи в человеке – около 6 метров. Но ощутимые симптомы болезни проявляются в самом начале заражения, когда паразит достигает размеров до 1 метра. Относится этот паразит к ленточным червям и состоит из головы, длинного туловища с присосками.
Заражение происходит из мяса, которое недостаточным образом термически обработано. Также заражение может произойти напрямую при попадании яйца паразита, которое может находиться в почте или на траве, в организм человека. Наиболее частыми очагами распространения заболевания являются сельские местности, места содержания и выпаса скота. Скот является промежуточным местом обитания червя. Обычно червь живет в теле животного, не причиняя ему неудобств, и откладывает внутри тела яйца. Далее с фекалиями яйца частично попадают на почву, траву и водоемы, где может заразиться человек.
Наиболее частыми очагами распространения заболевания являются сельские местности, места содержания и выпаса скота. Скот является промежуточным местом обитания червя. Обычно червь живет в теле животного, не причиняя ему неудобств, и откладывает внутри тела яйца. Далее с фекалиями яйца частично попадают на почву, траву и водоемы, где может заразиться человек.
Симптомы и последствия заражения:
- червь постоянно мигрирует по кишечнику, вызывая его расстройство. Зараженный человек ощущает дискомфорт, а иногда и боли в кишечнике. Могут наблюдаться такие симптомы, как изжога, вздутие, тошнота;
- нередки возникновения болей вне кишечника при передвижении червя;
- если при возникновении первых симптомов заболевания лечение не применяется, червь может размножаться. Несколько особей способны блокировать кишечник;
- возникновение анемии. Человек ощущает слабость, у него наблюдается бледность кожных покровов. Червь питается полезными веществами, поэтому организму их не хватает;
- возможны довольно сильные интоксикации и аллергические реакции за счет скопления отходов жизнедеятельности червя;
- могут наблюдаться общие недомогания: головокружения, утомляемость, беспокойный сон, изменение вкусовых предпочтений.

От паразита в организме можно избавиться, вовремя обратившись к врачу и применяя назначенное лечение. Оно включает непосредственно прием медикаментов, диету и профилактику заражения членов семьи. При появлении симптомов необходимо обратиться к профильному доктору. Лечение дает положительные результаты, и паразит полностью изгоняется из организма.
Хотите читать новости в удобном для вас виде?
мясо может быть источником заражения паразитарными заболеваниями
Дата публикации: 29.12.2014
Среди паразитарных болезней человека, которыми можно заразиться при употреблении мяса, важное социальное значение имеет трихинеллез. Практически нет ни одной страны, благополучной по данному гельминтозу, включая Австралию, в которой до конца 80 годов не было зарегистрировано ни одного случая заболевания людей и животных. Актуальность этой проблемы в значительной степени возросла с открытием трихинелл нового бескапсульного вида – T.pseudospiralis. К трихинеллезу восприимчивы более 100 видов млекопитающих и птиц (свиньи, кабаны, волки, шакалы, лисы, кошки, белые и бурые медведи, крысы, барсуки, бобры, горностаи, ежи, моржи, дельфины). В качестве резервуаров выявлены морские звезды, моллюски, и ракообразные, питающиеся падалью. В последнее время трихинеллы находят в мышцах лошадей. Рыба трихинеллезом не болеет. Птицы болеют в кишечной форме, то есть выделяют инвазионных личинок во внешнюю среду с фекалиями и могут служить источником заражения. Не следует скармливать собакам и другим животным тушки птиц вместе с кишечником, так они смогут заразиться.
В качестве резервуаров выявлены морские звезды, моллюски, и ракообразные, питающиеся падалью. В последнее время трихинеллы находят в мышцах лошадей. Рыба трихинеллезом не болеет. Птицы болеют в кишечной форме, то есть выделяют инвазионных личинок во внешнюю среду с фекалиями и могут служить источником заражения. Не следует скармливать собакам и другим животным тушки птиц вместе с кишечником, так они смогут заразиться.
Биология развития. Трихинелла – это мелкий круглый червь. Самка имеет длину около 4 мм, самец – 1,6 мм. В процессе развития приобрели феноменальную особенность – для них одно и тоже животное является промежуточным и основным хозяином. Например, в тонкой кишке свиньи самки оплодотворяются, после этого самцы погибают, а самки внедряются в подслизистую и через 6-7 суток продуцируют в большом количестве личинок (от 1500 до 10000). Личинки внедряются в кровеносные сосуды и током крови разносятся по всему организму. В местах локализации они растут, развиваются, сворачиваются спиралеобразно, достигают инвазионной (заразной) стадии через 17 суток. Вокруг личинки через 21-28 суток формируется лимоновидная капсула. В организме различных животных трихинеллы сохраняют жизнеспособность годами (до 25 лет у человека).
Вокруг личинки через 21-28 суток формируется лимоновидная капсула. В организме различных животных трихинеллы сохраняют жизнеспособность годами (до 25 лет у человека).
Мышечные трихинеллы очень устойчивы к неблагоприятным воздействиям внешних факторов: в гниющем мясе они сохраняют свои инвазионные свойства в течение 4 месяцев, длительное время сохраняются при температуре – 10*С. При слабом солении и обычном копчении личинки не погибают. При -30*С полностью погибают все мышечные трихинелл в свиных тушах через 52-64 часа, при -50*С через 15-18 часов.
С накоплением сведений о распространении трихинеллеза среди многих животных стало очевидным, что нельзя считать основным хозяином трихинелл какой — нибудь один вид животного, но крыса является ведущим звеном в распространении трихинелл.
Трихинеллы в состоянии поражать все органы и системы. Это могут быть мышечный слой сердечной стенки, центральная нервная система, скелетные мышцы. Примерно в 2/3 случаев при трихинеллезе наблюдаются поражения печени. Симптомы трихинеллеза у человека: боль в животе, тошнота, потеря аппетита, жидкий стул – в первые дни после заражения. Через одну-две недели после заражения появляются повышение температуры тела до 39-40°, отек лица, боль в мышцах конечностей, зуд и высыпания на коже. В этот период, при массивном заражении личинками, возможен летальный исход. Смертельная доза для человека — 5 личинок на 1 кг массы тела больного. Примерно через три-четыре недели наступает выздоровление, в этот период личинки, закрепившиеся в мышцах, покрываются капсулой – организм изолирует паразита.
Симптомы трихинеллеза у человека: боль в животе, тошнота, потеря аппетита, жидкий стул – в первые дни после заражения. Через одну-две недели после заражения появляются повышение температуры тела до 39-40°, отек лица, боль в мышцах конечностей, зуд и высыпания на коже. В этот период, при массивном заражении личинками, возможен летальный исход. Смертельная доза для человека — 5 личинок на 1 кг массы тела больного. Примерно через три-четыре недели наступает выздоровление, в этот период личинки, закрепившиеся в мышцах, покрываются капсулой – организм изолирует паразита.
Лечение трихинеллеза. Специфическое лечение проводят в клинике. Наибольший эффект наблюдается в первые две недели после заражения.
Профилактика – проваривание мяса, причем небольшими кусками и не менее двух с половиной часов. Другие методы обработки (соление, замораживание) недостаточно эффективны.
Неблагополучными по трихинеллезу в нашей области являются Сальский, Зимовниковский, Целинский, Весёловский, Зерноградский районы. Город Волгодонск благополучен по трихинеллёзу. На мясных рынках в лабораториях ветеринарно-санитарной экспертизы все туши свиней и нутрий исследуются. При обнаружении в 24 срезах хотя бы одной трихинеллы (не зависимо от ее жизнеспособности), тушу и субпродукты, имеющие мышечную ткань (пищевод, прямую кишку), а также обезличенные мясные продукты направляют на техническую утилизацию.
Город Волгодонск благополучен по трихинеллёзу. На мясных рынках в лабораториях ветеринарно-санитарной экспертизы все туши свиней и нутрий исследуются. При обнаружении в 24 срезах хотя бы одной трихинеллы (не зависимо от ее жизнеспособности), тушу и субпродукты, имеющие мышечную ткань (пищевод, прямую кишку), а также обезличенные мясные продукты направляют на техническую утилизацию.
Также свинина и говядина может быть заражена финозом. Это личинки бычьего и свиного цепней. Длина взрослого бычьего цепня — до 7 метров, свиного — до 2 метров, срок жизни — до 20 лет.
Тениоз (свиной цепень, вооруженный цепень) – паразитарное заболевание человека и животных, вызываемое гельминтом свиным цепнем, характеризующееся преимущественным поражением пищеварительной системы, а именно – тонкого кишечника.
В странах бывшего СССР тениоз встречается с определенной частотой на Украине (западная ее часть), в Белоруссии. В России тревожным по тениозу остается Красноярский край.
Заражение происходит при употреблении мяса свиней (кабанов) содержащего одну из промежуточных форм цепня – финны (белесые пузырьки размером до 0,5 см).
Больной выделяет яйца паразита. Разница в том, что заразит он людей и себя не тениозом, а цистицеркозом (личиночной стадией цепня), что труднее поддается лечению.
Цикл развития свиного цепня:Взрослые половозрелые особи свиного цепня паразитируют в тонком кишечнике окончательного хозяина — человека. С испражнениями конечные членики выделяются во внешнюю среду. Во внешней среде из члеников выделяются онкосферы, которые попадают в организм свиней при поедании ими загрязненных онкосферами отбросов. При разрушении оболочки яиц в желудке или кишечнике промежуточного хозяина онкосферы могут свободно проникнуть в кровеносные сосуда и разнестись по всему организму. Большая их часть через 2-3 дня оседает в мышечной ткани. Финны или цистицерки (личинки свиного цепня), которые имеют пузырьковый вид, формируются через 60-70 дней после заражения. Основное место локализации финн – межмышечная соединительная ткань, однако они могут формироваться и в других органах и тканях (при цистицеркозе). Цистицерки представляют собой пузырьки диаметром до 10 мм с прозрачной жидкостью внутри, а также прикрепленной к внутренней стенке пузырька. Финны не стойки к высоким и низким температурам. При температуре внутри куска 80° финны надежно обезвреживаются. Выдержка при этом не менее 1 часа. Для обезвреживания туш свиней с финнами требуется длительное замораживание мяса до минус 12-15° в течение 10 суток.
Основное место локализации финн – межмышечная соединительная ткань, однако они могут формироваться и в других органах и тканях (при цистицеркозе). Цистицерки представляют собой пузырьки диаметром до 10 мм с прозрачной жидкостью внутри, а также прикрепленной к внутренней стенке пузырька. Финны не стойки к высоким и низким температурам. При температуре внутри куска 80° финны надежно обезвреживаются. Выдержка при этом не менее 1 часа. Для обезвреживания туш свиней с финнами требуется длительное замораживание мяса до минус 12-15° в течение 10 суток.
Через 2 месяца после заражения у особей цепня в тонком кишечнике появляются половозрелые членики с яйцами головки цепня. Яйца свиного цепня заразны для человека (в отличие от яиц бычьего цепня). Диагноз при заболевании этим видом гельминтоза поставить совсем не трудно: в каловых массах можно невооруженным глазом увидеть фрагменты члеников цепня. При исследовании кала под микроскопом видны и многочисленные созревшие яйца гельминта.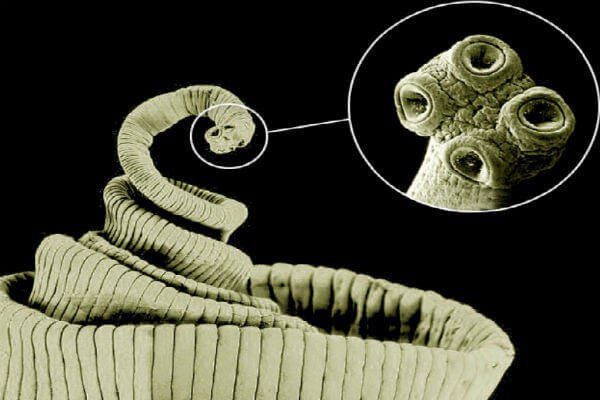 Все пациенты должны получать лечение в стационаре из-за опасности развития цистицеркоза при разрушении оболочек яиц и заносе онкосфер в общий кровоток. Иммунитет после перенесенного тениоза нестойкий, возможно повторное заражение.
Все пациенты должны получать лечение в стационаре из-за опасности развития цистицеркоза при разрушении оболочек яиц и заносе онкосфер в общий кровоток. Иммунитет после перенесенного тениоза нестойкий, возможно повторное заражение.
Тениаринхоз (бычий цепень, невооруженный цепень). В СНГ тениаринхоз распространен в республиках Закавказья, в Дагестанской республике, республиках Средней Азии, в Казахстане., северных районах Якутской и Бурятской республик, Иркутской области, Красноярском крае. Жизненный цикл бычьего цепня похож на цикл развития свиного цепня, но яйца этого паразита не способны развиваться в организме человека, поэтому финнозная стадия при заражении бычьим цепнем не встречается. Он не дает страшного осложнения в виде цистицеркоза в отличие от свиного цепня.
Зараженность мяса при тениаринхозе значительно ниже, чем при тениозе. В промежуточных хозяевах финны бычьего цепня живут недолго, поэтому заболевание гораздо быстрее поддается лечению и не дает тяжелых осложнений.
Заражение ленточными червями-паразитами обычно проявляется расстройством желудка, неустойчивым стулом, болями в животе, аллергическими реакциями, нарушениями деятельности нервной системы.
Половозрелый бычий цепень паразитирует в верхнем отделе тонкой кишки человека — окончательного хозяина. Промежуточными хозяевами бычьего цепня являются коровы, реже буйволы, зебу, яки, у которых в мышечной ткани развиваются личинки — цистицерки (финны), а также северный олень, у которого цистицерки развиваются в головном мозге.
При попадании финн в пищеварительный тракт человека, через 3 месяца образуется взрослая ленточная особь и начинается выделение члеников. Продвижение члеников провоцирует болевой синдром, проявляющийся схваткообразными болями, напоминающими боли при аппендиците. Выделение члеников происходит не только с фекалиями, но и самопроизвольно; они могут активно выползать из заднего прохода и ползать по телу больного.
Лечение тениаринхоза проводят в стационаре. Прогноз благоприятный.
Прогноз благоприятный.
Профилактикой заражения свиным и бычьим цепнями является употребление в пищу только прошедшего ветеринарный контроль мяса. При отсутствии данных о проверке, мясо необходимо подвергнуть длительной варке, так как при жарке прогрев кусков мяса может быть недостаточным.
Директор Волгодонского филиала Государственного бюджетного учреждения Ростовской области «Ростовская областная станция по борьбе с болезнями животных с противоэпизоотическим отрядом» Е.Г. Сидорчик
Количество просмотров: 1684
Симптомы и лечение бычьего цепня. Цикл развития паразита
Паразитарные заболевания являются популярным явлением среди людей. Нас окружает огромное количество видов паразитов, готовых поселиться в любом живом организме. Попадая внутрь, они препятствуют нормальному функционированию человеческих органов. Наибольшую опасность здоровью человека представляет паразитарный бычий цепень.
Огромный и опасный паразит
Бычий цепень, иначе именуемый солитер, является ленточным паразитом, поселяющимся в кишечнике человека и домашних животных. Бычий цепень у людей провоцирует опасное для здоровья состояние. Зафиксирован ряд стран распространения данного гельминта. Бытует мнение, что по принадлежности цепень относится к странам Латинской Америки, Африки, Филиппин.
Солитер в кишечнике — съемки мини видеокамерой
От других гельминтов бычий цепень отличается по следующим признакам:
- Имеет сложное строение. Тело состоит из огромного количества члеников.
- За среду обитания выбирает тонкий кишечник.
- Строение половой системы: из женских и мужских половых органов.
- Длина червя способна достигать 12 метров.
- Существовать в теле человека может до 20 лет.
Самый большой солитер имел почти 25 метров
Питается гельминт отличительным образом: путём задействования рецепторов поверхностной стороны тела он поглощает питательные вещества. Такое строение тела позволяет паразиту выживать даже в самых экстремальных условиях.
Такое строение тела позволяет паразиту выживать даже в самых экстремальных условиях.
Учитывая перечисленные особенности, реально вообразить уровень опасности, вызываемым паразитом.
Описание
Рассмотрим, как выглядит бычий цепень. По своему происхождению он относится к классу ленточных червей. Конструкция тела представлена несколькими органами:
- Сколекс, иначе именуемый в народе головкой, имеет диаметр 1,5-2 мм. Сколекс окружен присосками, которыми червь цепляется за стенку кишечника. В отличие от свиного цепня, сколекс солитера не имеет крючков.
- Шейка – орган регенерации, способный самостоятельно создавать новые членики.
- Членики – составляющие части самого тела паразита, крепящиеся друг к другу.
- Покровы – представлены слизистой тканью с ворсинками, полностью покрывающей поверхность паразита.
Строение тела бычьего цепня
Цикл развития паразита
Пути заражения паразитом многообразны. Раскрыть все опасности инфицирования паразитом способен жизненный цикл бычьего цепня.
Многочисленные сегменты в виде члеников тела солитера достигают необходимой зрелости и отсоединяются от туловища. Внутри члеников содержится большое число яиц. Выходя наружу естественным путем через анальное отверстие, паразитарные элементы проникают в окружающую среду и, быстро адаптируясь, в течение продолжительного времени продолжают самостоятельное выживание даже в экстремальных условиях.
За весь цикл развития бычьего цепня среда обитания паразита может быть сменена несколько раз.
Продолжению развития цикла способствует промежуточный хозяин паразита. Таким обладателем становится животное, крупных размеров, обычно – корова. Яйца ленточного червя вместе с кормом попадают в тело скотины. Но, промежуточный хозяин бычьего цепня — не только крс, а может быть любое животное, съевшее личинки.
Инфицированный организм животного способствует дальнейшему созреванию яиц. Заключительной стадией созревания станет вылупление личинок. Личинки проникают в кровеносные сосуды и концентрируются в мышцах. Такое скопление образует финны – своего рода куколки для личинок. Финна бычьего цепня похожа на вывернутую личинку мутного цвета. Именно она представляет опасность человеческому организму.
Такое скопление образует финны – своего рода куколки для личинок. Финна бычьего цепня похожа на вывернутую личинку мутного цвета. Именно она представляет опасность человеческому организму.
Зрелые членики солитера с яйцами
Увидеть в скелетных частях туши пузырьки-финны очень просто – она хорошо заметны при внимательном осмотре мяса специалистом.
Не рекомендуется пробовать избавлять мясо от этих паразитов (это практически невозможно), а лучше его уничтожить, не дав личинке перейти в стадию развития, встретившись с хозяином бычьего цепня.
Как это трагично не звучит, но человек – основной хозяин бычьего цепня. Заболевание носит название тениаринхоз.
Финны цепня в говяжьем мясе
Употребление в пищу зараженного мяса, без необходимой термической обработки, порождает заражение, начинает новый цикл развития и размножения бычьего цепня. Окончательный хозяин бычьего цепня подвергается вредному воздействию червя. Его присутствие вызывает негативные последствия:
- расстройства флоры желудка и тонкого кишечника;
- ощущение дисфункции всех отделов ЖКТ;
- ослабление естественной защиты иммунитета;
- кожный зуд;
- заражение токсинами;
- постоянное подташнивание и частые головные боли.

Питается солитер питательными и полезными для организма веществами, поэтому окончательным хозяином ощущается нехватка необходимых витаминов и минералов.
Как правило, зараженные люди очень худые, даже если полноценно питаются.
Способы заражения человека бычьим цепнем
Непрожаренное мясо может стать причиной заражения
Некоторые люди полагают, что инфицирование паразитом может произойти только в случае контакта с больным животным. Суждение достаточно абстрактно.
Существуют и другие способы инфицирования:
- Домашние питомцы. Ленточный червь может существовать в теле собаки и кошки. Следовательно, любимые домашние животные становятся прямым источником инфицирования.
- Приобретение мяса на рынке понижает уровень безопасности продукта для человека. Рассмотреть личинки бычьего цепня без опыта трудно и не всегда возможно.
- Любители популярных блюд из сырого мяса и рыбы подвергают свою жизнь серьезной опасности.
 Поэтому лучше употреблять такую пищу не часто и приготовив в домашних условиях. В пунктах общественного питания невозможно узнать истинное происхождение ингредиентов блюд.
Поэтому лучше употреблять такую пищу не часто и приготовив в домашних условиях. В пунктах общественного питания невозможно узнать истинное происхождение ингредиентов блюд. - Недостаточная обработка кухонного инвентаря после разделки мяса провоцирует попадание паразитов на другие продукты, соприкасаемые в дальнейшем с этими приборами.
Предположить присутствие заболевания можно самостоятельно.
Бычий цепень симптомы: понижение массы тела, потеря аппетита, усиливающиеся запоры, боль в области живота, раздражительность, нарушение сна и покоя, снижение памяти, повышение уровня утомляемости. Такие признаки могут являться симптоматикой тениаринхоза. Причем дальнейшее развитие бычьего цепня в организме усугубляет состояние здоровья.
Диагностика тениаринхоза и методы лечения
Человек способен самостоятельно предположить присутствие инородных жителей в организме, но основным и решающим вердиктом должен стать диагноз медицинского специалиста. На первичном приеме доктор выслушивает жалобы и выясняет в ходе беседы причины недугов. Врач устанавливает наличие обстоятельств, возможных допустить попадание инфекции в тело пациента, объясняет пути заражения бычьим цепнем. Затем пациент направляется на сдачу необходимых анализов кала и крови.
На первичном приеме доктор выслушивает жалобы и выясняет в ходе беседы причины недугов. Врач устанавливает наличие обстоятельств, возможных допустить попадание инфекции в тело пациента, объясняет пути заражения бычьим цепнем. Затем пациент направляется на сдачу необходимых анализов кала и крови.
Анализ крови позволит выявить уровень воспалительных процессов. Нахождение бычьего цепня в организме будет обусловлено повышенным уровнем эозинофилов, клеток лейкоцитов, а гемоглобин и эритроциты представятся в недостаточном количестве. Допустимы в диагностике тениаринхоза серологические реакции обнаружения антител к антигенам ленточного червя, а также, рентгенологическое исследование органов кишечника. На основании данных исследования специалист ставит окончательный диагноз и назначает необходимое лечение.
Лечение, начатое своевременно, обычно проходит на дому под амбулаторным контролем.
Бильтрицид — эффективное лекарство от солитера
Развитие осложнений в организме вследствие развития бычьего цепня является причиной помещения человека в стационар.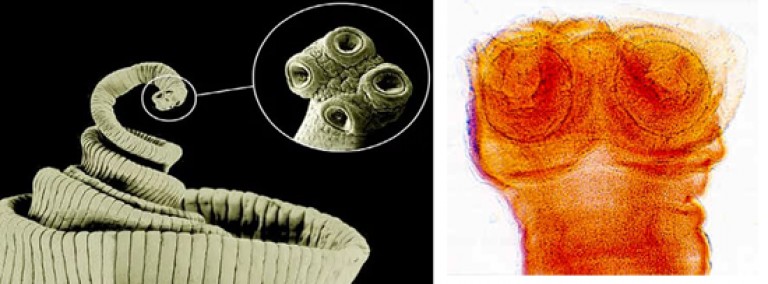
Лечение больного происходит в комплексе приема медикаментозных препаратов с народными средствами. Их действие нарушает целостность паразита, вследствие чего он не способен дальше удерживаться на стенках кишечника, и вынужден вывестись из организма человека.
Лечение сопровождается с соблюдением необходимых мер:
- Соблюдение диеты.
- Традиционное лечение – как первоочередный способ уничтожения паразита.
- Применение фитотерапии в качестве дополняющего эффекта, чтобы уничтожить бычий цепень у человека.
Экстракт папоротника народное средство против цепня
Представленная схема лечения тениаринхоза пойдет под откос в случае повторного инфицирования организма. Поэтому необходимо в дальнейшем придерживаться профилактических мер, чтобы избежать повторного появления заболевания.
Ни в коем случае не нужно исключать из рациона говядину. Следует лишь обращать пристальное внимание на его качество и способ обработки.
youtube.com/embed/Xa68aYqWCJs» frameborder=»0″ allowfullscreen=»allowfullscreen»/>
симптомы заражения, диагностика и принципы лечения медикаментами и народными средствами
Это особый вид паразитов, относящийся к биогельминтозам. Внешне бычий цепень представляет собой обычного ленточного червя. Он вызывает у людей тениаринхоз — заболевание, которое протекает в кишечнике. Часто такое заболевание носит хронический характер и начинается каждый раз, когда у человека нарушается система пищеварения.
История открытия
Первый случай заражения данным видом червя был замечен еще в 1500 г. Данный вид паразитов считается самым первым из червей, которые начали обосновываться в организме человека. Позже, в 1690 г бычий цепень мог попадать в организм людей от свиней. В 1800 года цепень стал поражать коров и быков, в потом основался в организме человека.
Морфология
Морфология бычьего цепня особенна. Данный вид плоских червей достигает в длину от 5 до 13 м, ширина его может быть 7 мм, толщина доходить до 3 мм. Были выявлены случаи, когда червь достигал в длину 21 м. Тело бычьего цепня отличается особым строением сколекса, шеи и жесткой стробилы. Взрослые черви на вид плоские, напоминают длинную ленту. У данных паразитов нет системы пищеварения, они не имеют рта, у них нет ануса, желудка и кишечника. Питаются они благодаря плоской мембране, поглощают из тела скота или человека углеводы, в большом количестве полисахариды, глюкозу. Данные вещества имеют большое значение для жизни червей.
Были выявлены случаи, когда червь достигал в длину 21 м. Тело бычьего цепня отличается особым строением сколекса, шеи и жесткой стробилы. Взрослые черви на вид плоские, напоминают длинную ленту. У данных паразитов нет системы пищеварения, они не имеют рта, у них нет ануса, желудка и кишечника. Питаются они благодаря плоской мембране, поглощают из тела скота или человека углеводы, в большом количестве полисахариды, глюкозу. Данные вещества имеют большое значение для жизни червей.
У бычьего цепня есть сколекс и проглоттид. Стробила оснащена члениками, вырабатывающими яйца. Вырастают проглоттиды в области шее, что выталкивает созревших члеников к заднему проходу, где они полностью открываются и из них выходят несколько тысяч яиц. Данный процесс является самым важным в жизнедеятельности такого паразита.
Сколекс достигает 3 мм и имеет четыре присоски, благодаря которым паразит впивается в кишечник. По форме яйца цепня либо круглые, либо овальные, сверху имеют тонкую бесцветную пленку.
Жизненный цикл
Проглоттиды, которые находятся в кишечнике животного либо человека, выходят наружу с каловыми массами. В каждом сегменте червя может находиться до 120 тысяч яиц, из которого быстро вылупливаются личинки паразитов.
Проглоттиды в течение определенного времени находятся в траве, разносятся на ближайшие расстояния, крепятся к почве. Траву поглощает домашний скот, с которой в их организм попадают яйца паразитов, некоторое время они находятся в желудке и кишечнике. Скот является промежуточным хозяином бычьего цепня.
Желудочный сок скота и ферменты кишечника способствуют быстрому разрушению оболочки яиц, после чего личинки выходят наружу. Они проникают сквозь эпителий и распространяются по всему телу скота через кровяные тельца. Готовые к новой жизни личинки поражают мышечные ткани.
Бычий цепень может попасть в организм человека при употреблении сырого и слабо обработанного мяса. Пищеварительная система человека подобно пищеварению скота способна разрушить тонкий эпителий личинок, после чего черви крепятся к стенкам кишечника человека — окончательного хозяина.
В дальнейшем развиваются взрослые черви, у которых быстро начинает расти головка, шейка, развиваются новые проглоттиды, готовые отложить яйца. За короткий срок, примерно до трех месяцев, цепень достигает 5 метров в длину. После того как червь вырос и полностью созрел, он откладывает проглоттидов с яйцами и жизненный цикл развивается вновь.
Географическое распространение
Бычий цепень встречается в любом уголке земного шара, особенно сильно страдают от него люди, проживающие в Африке, Азии, Китае, Австралии. В таких странах люди часто разводят домашний скот, ведь именно в кишечнике крупного рогатого скота он и селится. Окончательно бычий цепень селится в кишечнике человека. В России данный паразит водится в Дагестане, Бурятии, Туве, в Пермском и Красноярском крае.
Чаще всего заражение бычьим цепнем диагностируется в европейских странах, Турции и Словакии. Паразит развивается в основном у сельских жителей, а также у людей, которые употребляют мясо коровы, прошедшее недостаточную термическую обработку.:max_bytes(150000):strip_icc()/GettyImages-680806401-909f34717a734196864bed3586a18d41.jpg)
Симптомы бычьего цепня и его патогенное действие
Бычий цепень попадает в организм через употребление человеком сырого или слабо обработанного мяса коровы. Личинки паразита за 3 месяца превращаются во взрослых особей, после этого могут жить в организме до 30 лет. Чаще всего в момент обнаружения червей в кишечнике остается не более одной особи, способной откладывать яйца.
Бычий цепень в большинстве случае селится в организме взрослого человека, реже у детей. Это происходит потому, что взрослые больше употребляют мяса. Симптомы бычьего цепня характерны, взрослые могут спустя некоторое время их почувствовать.
Признаки и симптомы
Большая часть людей, в организме которых поселился бычий цепень, не чувствуют внутренний дискомфорт до тех пор, пока цепень не достигнет определенной длины. Как только паразит вырастает, человек может чаще обычного ощущать сытость, иногда его может даже тошнить и наступать рвота. Чтобы узнать, есть ли в организме бычий цепень, диагностика просто необходима, и для этого надо обратиться к врачу.
Человек может почувствовать следующие симптомы, указывающие на то, что в организме поселился данный вид паразитов:
- Происходит снижение аппетита, вплоть до отказа от пищи.
- Человек теряет вес.
- Случаются частые запоры или понос.
- Наступают головные боли, слабость.
- Возникает зуд в анальном проходе.
Чаще всего заметить червей можно в кале, после дефекаций. Паразиты способны передвигаться внутри кишечника, ползать в области бедер, тем самым вызывая щекотливые ощущения, это происходит в тот момент, когда человек двигается.
Если у человека может возникать отрыжка или изжога еще до приема пищи, это могут быть симптомы бычьего цепня. У больного в больших количествах выделяется слюна, начинает болеть живот, причем сильные боли возникают тогда, когда паразит переползает через заслонку, между тонким и толстым кишечником.
Черви могут способствовать развитию язвы двенадцатиперстной кишки или возникновению желчных колик. Непроходимость кишечника может возникать тогда, когда червь свернулся в клубок, в этом случае каловые массы не могут выйти наружу, возникает сильная, схваткообразная боль в животе. В это время человек думает о расстройствах пищеварения, начинает прием специальных препаратов, однако они оказываются бессильны.
Непроходимость кишечника может возникать тогда, когда червь свернулся в клубок, в этом случае каловые массы не могут выйти наружу, возникает сильная, схваткообразная боль в животе. В это время человек думает о расстройствах пищеварения, начинает прием специальных препаратов, однако они оказываются бессильны.
Наряду с кратковременным чувством сытости, может наступать чувство голода. Человек может принимать большое количество пищи, при этом масса тела не увеличивается. Бычий цепень может вызывать аллергию из-за яд, который выпускает гельминт.
О том, что в организме человека завелся бычий цепень, может свидетельствовать высокий уровень иммуноглобулина. Бычий цепень мене опаснее свиного паразите, который может проникать даже в нервную систему или глаза. Страшен он тем, что способен перерастать в небольшие кисты под кожей, в этом случае возникает заболевание — цистицеркоз.
Вред бычьего цепня для организма человека
Бычий цепень наносит вред организму, при этом отмечаются общие воздействия паразитов:
- Черви воздействуют на организм механическим путем, а именно с помощью присосок крепятся к стенкам кишечника, из-за высокой активности члеников способны долгое время перемещаться по кишечнику.

- Паразиты вызывают боль в момент перемещения из тонкого кишечника в толстый.
- Во время большого скопления червей в кишечнике возникает непроходимость, как следствие развивается воспаление.
- Цепень поглощает питательные вещества из организма человека, в результате он испытывает дефицит необходимых минералов.
- По причине выпрыскивания ядовитых веществ червями, возникает аллергия.
Диагностика
Диагностировать нахождение бычьего цепня в организм не так легко. Дело в том, что паразит практически не выдает себя, у человека не возникает характерных симптомов, до тех пор, пока цепень не достигнет значительных размеров.
Врач может напрямую спросить у пациента, обнаруживал ли он, что из анального отверстия выползали цистирки, те же черви, только маленьких размеров. По такому симптому можно легко определить глистные инвазии. В большинстве случае пациент может заметить червей в кале.
В случае подозрения на цепня, специалист назначает анализ на обнаружение яиц глистов. Дополнительно можно определить паразитов в кишечнике методом мазка, ректальным соскобом, с помощью отпечатка, сделанного липкой лентой.
Дополнительно можно определить паразитов в кишечнике методом мазка, ректальным соскобом, с помощью отпечатка, сделанного липкой лентой.
Данные процедуры не позволяют в точности узнать, что в тонком кишечнике находится именно бычий цепень. Диагностика для определения вида паразита должна включать изучение яйца глистов. Врач должен определить, бычий или свиной цепень обосновался в полости кишечника.
Часто, паразитов определяют после проведения рентгена кишечника. В этом случае, цепень показывается в виде белых ленточных полос.
По общему анализу крови можно увидеть только определенное количество эозинофилов, также выявить анемию.
Как лечить бычий цепень медикаментозно
Вывести бычьего цепня из организма можно с помощью специальных препаратов. Редко, когда такое лечение проходит в стационаре, в основном человек лечиться дома, однако обследуется у специалиста до полного выведения паразитов из кишечника. Не всегда человек знает, как лечить бычий цепень, для этого и необходимо посетить специалиста.
Пациент должен определенное время принимать противогельминтные лекарства, к примеру, Фенасал, дополнительно Бильтрицид. Фенасал необходимо принимать на пустой желудок утром, либо спустя два часа после ужина. Дозировка должна определяться врачом, она рассчитывается от массы тела и от степени заражения. Взрослому чаще всего назначают прием лекарства в дозировке не более 3 г, однократно. Бильтрицид также пьется за один раз.
Диетическая система питания
Перед тем, как начать лечение и на протяжении всей терапии необходимо питаться специальным образом, а именно соблюдать безшлаковую диету:
- Необходимо отказаться от слишком жирной, жареной пищи, соленых и сладких блюд.
- Следует питаться исключительно легкими супами, крупами, больше употреблять молочных продуктов, кефир.
- В качестве напитков должны быть кисель, очищенная вода, чай, компот.
- Запрещено употреблять свеклу, капусту, зелень, виноград, малину, кофе, шоколад, спиртные напитки, бобовые.

Питаться нужно не менее пяти раз в день, при этом порции должны быть маленькими. Наряду с питанием врач может назначить слабительные средства, также очистительные клизмы. Заражение бычьим цепнем происходит довольно быстро, к сожалению, лечение проводится долгое время.
После трехмесячного курса, пациент не должен замечать личинок в кале, такое состояние говорит об эффективном лечении. Если в кале обнаруживаются членики глистов, терапию продлевают, пока заражение бычьим цепнем полностью не излечится.
В большинстве случаев диета помогает вывести паразитов из организма.
Как избавиться от бычьего цепня народными методами
Бычий цепень боится некоторых трав и продуктов питания, употребление которых может вызвать скорейший выход паразитов из кишечника. Так как избавиться от бычьего цепня можно с помощью народных средств, лучше перед этим проконсультироваться с врачом и сдать анализы после лечения.
Следует употреблять сырые или жареные семена тыквы каждый день. Паразиты через некоторое время начнут искать выход из кишечника.
Паразиты через некоторое время начнут искать выход из кишечника.
Чеснок также является губительным для взрослых глистов и для их личинок. Его следует добавлять во все блюда, а также кушать в свежем виде.
Отвар бессмертника или корня валерианы способен снизить двигательную активность у червей, в результате они перестанут ползать по кишечнику, паразитам станет тяжело добывать питательные вещества, они также выйдут наружу. Отвар необходимо пить каждый день 4 раза в сутки по половине стакана до еды. Курс лечения составляет один месяц.
Профилактика
Врачи рекомендуют соблюдать некоторые правила, которые помогут избежать поражения паразитами:
- Необходимо раз в год обследоваться людям, работающим на фермах, мясокомбинате.
- Не употреблять сырое мясо коровы.
- Тщательно проваривать мясо, при этом убьются все личинки цепня.
- При характерных симптомах нужно немедленно посетить врача.
- Перед покупкой свежего мяса его следует тщательно осмотреть, чаще всего можно легко увидеть личинки червей.

Бычий цепень является паразитом опасным для организма, как животного, так и человека. Необходимо проходить тщательное лечение при обнаружении его в организме, а также соблюдать все меры профилактики для того, чтобы избежать попадания его в организм.
Автор: Оксана СвиридоваЗаражение ленточными червями — диагностика и лечение
Диагностика
Чтобы диагностировать заражение ленточным червем, ваш врач может полагаться на одно из следующего:
Анализ кала. В случае заражения кишечным цепнем врач может проверить ваш стул или отправить образцы в лабораторию для тестирования. Лаборатория использует методы микроскопической идентификации для проверки наличия яиц или сегментов ленточного червя в фекалиях.

Поскольку яйца и сегменты выделяются нерегулярно, лаборатории может потребоваться собрать от двух до трех образцов в течение определенного периода времени, чтобы обнаружить паразита.Яйца иногда находятся в анусе, поэтому ваш врач может использовать кусок прозрачной клейкой ленты, прижатый к анусу, чтобы собрать яйца для микроскопической идентификации.
- Анализ крови. При тканевых инвазивных инфекциях ваш врач может также проверить вашу кровь на наличие антител, которые ваш организм мог вырабатывать для борьбы с инфекцией ленточного червя. Наличие этих антител свидетельствует о заражении ленточными червями.
- Визуальное обследование. Определенные типы визуализации, такие как КТ или МРТ, рентген или ультразвуковое исследование кист, могут свидетельствовать об инвазивной инфекции ленточными червями.
Дополнительная информация
Показать дополнительную информациюЛечение
Некоторым больным ленточными червями лечение не требуется, так как ленточный червь выходит из организма сам по себе.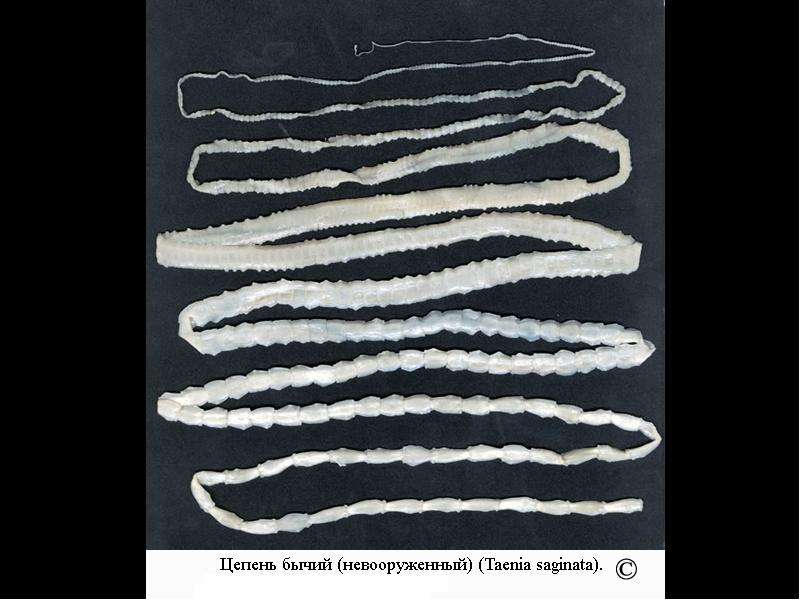 Другие не осознают, что у них это есть, потому что у них нет симптомов. Однако, если у вас диагностирована инфекция кишечного цепня, для избавления от нее, скорее всего, будут назначены лекарства.
Другие не осознают, что у них это есть, потому что у них нет симптомов. Однако, если у вас диагностирована инфекция кишечного цепня, для избавления от нее, скорее всего, будут назначены лекарства.
Средства для лечения кишечных инфекций
Наиболее распространенное лечение ленточных червей включает пероральные препараты, токсичные для взрослых ленточных червей, в том числе:
- Празиквантел (Бильтрицид)
- Альбендазол (Альбенза)
- Нитазоксанид (Алиния)
Какие лекарства пропишет ваш врач, зависит от вида вовлеченного ленточного червя и места заражения.Эти препараты нацелены на взрослых цепней, а не на их яйца, поэтому важно избегать повторного заражения. Всегда мойте руки после посещения туалета и перед едой.
Чтобы быть уверенным, что инфекция, вызванная ленточным червем, прошла, ваш врач, вероятно, через определенные промежутки времени будет проверять образцы вашего стула после того, как вы закончите принимать лекарства. Успешное лечение — это означает, что в вашем стуле отсутствуют яйца, личинки или проглоттиды ленточных червей — наиболее вероятно, если вы получите соответствующее лечение от типа ленточного червя, вызвавшего вашу инфекцию.
Успешное лечение — это означает, что в вашем стуле отсутствуют яйца, личинки или проглоттиды ленточных червей — наиболее вероятно, если вы получите соответствующее лечение от типа ленточного червя, вызвавшего вашу инфекцию.
Лечение инвазивных инфекций
Лечение инвазивных инфекций зависит от локализации и последствий инфекции.
- Противогельминтные препараты. Альбендазол (Альбенза) может уменьшить размер некоторых цист ленточного червя. Ваш врач может периодически контролировать кисты, используя визуализирующие исследования, такие как ультразвук или рентген, чтобы убедиться, что препарат эффективен.
- Противовоспалительная терапия. Умирающие цисты ленточного червя могут вызвать отек или воспаление в тканях или органах, поэтому врач может порекомендовать рецептурные кортикостероидные препараты, такие как преднизолон или дексаметазон, для уменьшения воспаления.
- Противоэпилептическая терапия.
 Если болезнь вызывает судороги, противоэпилептические препараты могут их остановить.
Если болезнь вызывает судороги, противоэпилептические препараты могут их остановить. - Установка шунта. Один из видов инвазивной инфекции может вызывать слишком много жидкости в головном мозге, что называется гидроцефалией. Ваш врач может порекомендовать установить постоянную трубку (шунт) в голову для оттока жидкости.
Хирургия. Возможность хирургического удаления кисты зависит от ее локализации и симптомов. Кисты, которые развиваются в печени, легких и глазах, обычно удаляют, так как в конечном итоге они могут угрожать функционированию органов.
Ваш врач может порекомендовать дренажную трубку в качестве альтернативы хирургическому вмешательству. Трубка позволяет проводить агрессивное ополаскивание (орошение) пораженного участка антипаразитарными растворами.
Подготовка к приему
При заражении ленточным червем вы можете сначала обратиться к своему лечащему врачу. Однако в некоторых случаях он может направить вас к врачу, специализирующемуся на инфекционных заболеваниях, или врачу, специализирующемуся на заболеваниях желудочно-кишечного тракта (гастроэнтерологу).
Однако в некоторых случаях он может направить вас к врачу, специализирующемуся на инфекционных заболеваниях, или врачу, специализирующемуся на заболеваниях желудочно-кишечного тракта (гастроэнтерологу).
Вот некоторая информация, которая поможет вам подготовиться к приему, и о том, что вы можете ожидать от своего врача.
Что вы можете сделать
- Запишите симптомы, которые вы испытываете, включая любые, которые могут показаться не связанными с причиной, по которой вы записались на прием.
- Запишите ключевую личную информацию, включая информацию о недавних поездках, особенно в другие страны. Сообщите своему врачу, если вы считаете, что подверглись воздействию пищи или воды, зараженных солитером.
- Составьте список всех лекарств, витаминов и добавок, которые вы принимаете.
- Запишите вопросы, чтобы задать своему врачу.

Время, проведенное с врачом, ограничено, поэтому подготовка списка вопросов может помочь вам максимально эффективно проводить время вместе. При заражении ленточным червем некоторые основные вопросы, которые следует задать врачу, включают:
- Какова наиболее вероятная причина моих симптомов?
- Существуют ли другие возможные причины?
- Какие анализы мне нужны, если они нужны?
- Какие методы лечения доступны и какие вы рекомендуете?
- Есть ли какие-либо диетические ограничения, которым я должен следовать?
- Есть ли брошюры или другие печатные материалы, которые я могу взять с собой домой? Какие сайты вы рекомендуете посетить?
В дополнение к вопросам, которые вы приготовили задать своему врачу, не стесняйтесь задавать вопросы во время приема.
Чего ожидать от врача
Ваш врач может попросить вас принести на прием образец кала для анализа. Ваш врач может также задать вам вопросы о вашем состоянии, например:
- Когда у вас появились симптомы?
- Насколько серьезны ваши симптомы?
- Что-нибудь улучшает ваши симптомы?
- Что-нибудь ухудшает ваши симптомы?
- Вы недавно путешествовали? В какие районы?
- Могли ли вы контактировать с пищей или напитками, зараженными солитером?
Что вы можете сделать в это время
Пока вы ожидаете визита к врачу, старайтесь избегать обезвоживания.
Тениоз | Часто задаваемые вопросы
Дома
Ресурсы
| Тениоз ( Taenia saginata , Taenia solium , Заражение ленточным червем) МКБ-9 123; МКБ-10 B68 |
Что следует знать о тениозе
Что такое тениоз?Тениоз — инфекция пищеварительного тракта, вызванная взрослыми ленточными червями.Люди могут заразиться от говядины, которая обычно является переносчиком солитера Taenia saginata, или от свиней, переносчиков Taenia solium.
Каковы симптомы тениоза? Что вызывает тениоз?
В большинстве случаев заболевание протекает бессимптомно, и во многих случаях пациенты узнают об инфекции, обнаружив проглоттиды (сегменты солитера) в стуле или подвижные роглоттиды Taenia saginata, выходящие из заднего прохода. Если они возникают, симптомы легкие и неспецифические и включают боль в животе, расстройства пищеварения, чрезмерный аппетит или потерю аппетита, слабость и потерю веса.
Как распространяется тениоз? Как люди заражаются тениозом?
Тениоз возникает в результате употребления в пищу сырой или недоваренной свинины или говядины, зараженной личиночной стадией свиного или говяжьего цепня. Личинки из зараженного мяса развиваются в кишечнике человека во взрослых ленточных червей. Проглоттиды ленточного червя созревают и заполняются яйцами. Проглоттиды отделяются, и затем яйца выходят с фекалиями. Яйца могут жить в окружающей среде месяцами или даже годами.Крупный рогатый скот и свиньи заражаются при проглатывании растительности, содержащей яйца. Яйца вылупляются, развиваются в личиночную стадию и внедряются в мышцы животного.
При заражении Taenia solium может происходить передача инфекции от человека к человеку, но результатом является скорее цистицеркоз , чем образование ленточного червя.
Что такое цистицеркоз? Чем он отличается от тениоза?
В то время как тениоз представляет собой инфекцию, вызываемую взрослыми говяжьими или свиными цепнями, цистицеркоз представляет собой инфекцию, вызываемую личиночной стадией свиного цепня, Taenia solium.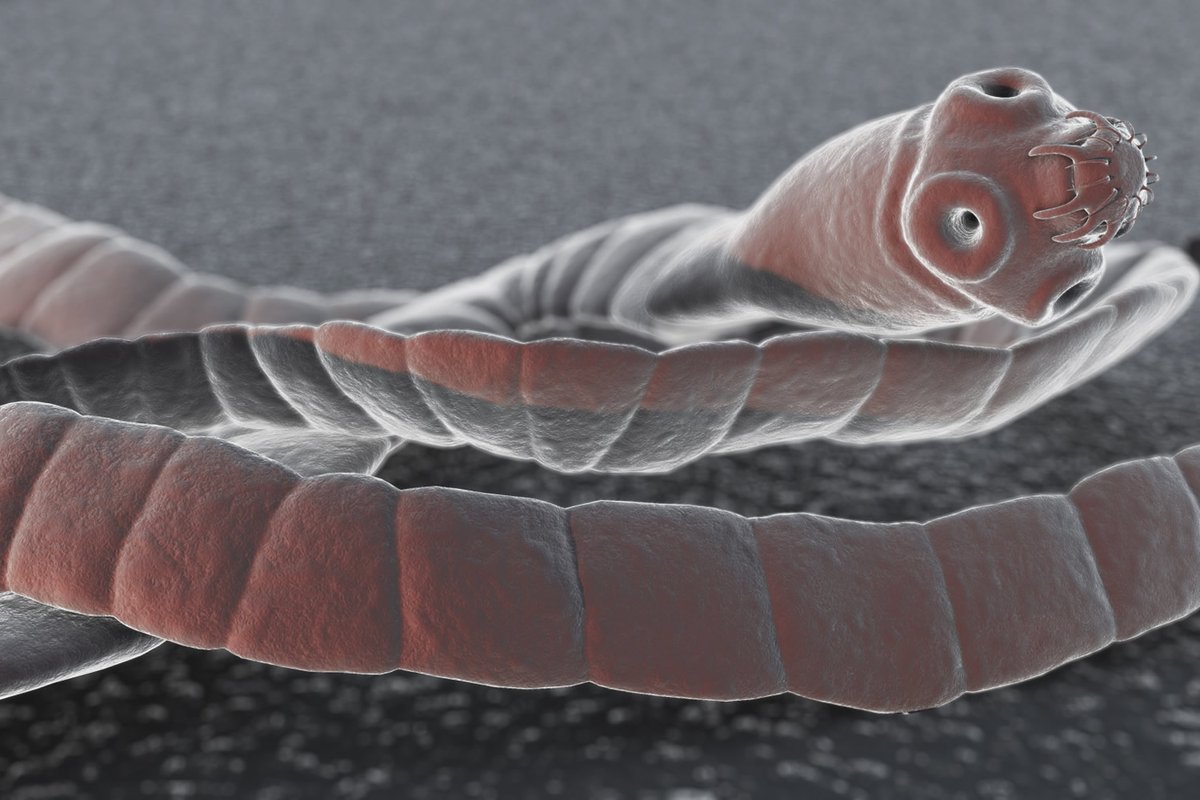 Цистицеркоз обычно возникает, когда люди случайно проглатывают яйца Taenia solium. Как только яйца вылупляются в тонкой кишке человека, личинки проникают через слизистую оболочку тонкой кишки и попадают в кровоток. Отсюда личинки могут распространяться в любой орган тела, где образуют цисты. Кисты чаще всего обнаруживаются в коже, скелетных мышцах, сердце, глазах и центральной нервной системе (ЦНС). Нейроцистицеркоз, инфекция ЦНС человека личинками Taenia solium, является основной причиной приобретенной эпилепсии в мире.
Цистицеркоз обычно возникает, когда люди случайно проглатывают яйца Taenia solium. Как только яйца вылупляются в тонкой кишке человека, личинки проникают через слизистую оболочку тонкой кишки и попадают в кровоток. Отсюда личинки могут распространяться в любой орган тела, где образуют цисты. Кисты чаще всего обнаруживаются в коже, скелетных мышцах, сердце, глазах и центральной нервной системе (ЦНС). Нейроцистицеркоз, инфекция ЦНС человека личинками Taenia solium, является основной причиной приобретенной эпилепсии в мире.
Многие случаи цистицеркоза, вероятно, возникают в результате проглатывания человеком яиц, вырабатываемых ленточным червем, живущим в его или ее собственном кишечном тракте. Люди также могут заразиться через пищу или воду, зараженные яйцами, или через яйца, присутствующие в домашнем хозяйстве или на работе.
Из-за увеличения иммиграции из Центральной Америки и поездок в районы, где обнаружен цистицеркоз, цистицеркоз растет в США, особенно в Калифорнии, Аризоне, Нью-Мексико, Техасе и Колорадо.
Национальный центр инфекционных заболеваний. DPDx Идентификация и диагностика паразитов, представляющих интерес для общественного здравоохранения Parasites & Health
Насколько распространен тениоз?
Приблизительно 50 миллионов человек во всем мире инфицированы обоими паразитами; ежегодно от цистицеркоза умирает около 50 000 человек. В США законы, регулирующие практику кормления и инспекцию домашних животных, в значительной степени устранили проблему ленточных червей.Ежегодно в США диагностируется около 1000 новых случаев цистицеркоза.
Как защититься от тениоза?
Надлежащее приготовление мяса уничтожает личинки ленточного червя и предотвращает заражение ленточным червем. Хорошая гигиена и мытье рук после посещения туалета предотвратит самозаражение человека ленточными глистами. Заражение животных предотвращается путем защиты мест кормления животных или пастбищ от загрязнения человеческими фекалиями.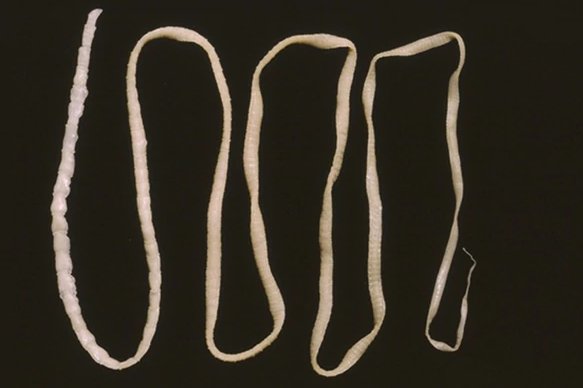
Как защитить других от тениоза?
Инфицированные люди могут подвергать других людей воздействию яиц Taeniasis solium, часто при контакте с пищевыми продуктами.Воздержитесь от контакта с едой, если вы знаете, что можете быть заражены, и возобновите эту деятельность только после того, как ваш лечащий врач проинструктировал вас об этом.
Инфицированные люди могут предотвратить заражение животных, следя за тем, чтобы не происходило заражение фекалиями корма для животных или пастбищ.
Что мне делать, если я подозреваю, что у меня тениоз?
Проконсультируйтесь со своим лечащим врачом.
Как диагностируются тениозные инфекции?
Идентификация сегментов, яиц или головок паразита в фекалиях позволяет диагностировать тениоз, но невозможно в течение первых 3 месяцев после заражения, до развития взрослых ленточных червей.Врач может попросить вас предоставить дополнительные образцы стула в течение определенного промежутка времени. Лица, у которых обнаружены яйца или проглоттиды в фекалиях, могут быть обследованы с помощью анализа крови, поскольку может произойти самозаражение и цистицеркоз.
Лица, у которых обнаружены яйца или проглоттиды в фекалиях, могут быть обследованы с помощью анализа крови, поскольку может произойти самозаражение и цистицеркоз.
Как лечить тениоз?
Ленточные черви лечат пероральными препаратами. Хирургическое вмешательство иногда необходимо для лечения случаев цистицеркоза глаз, случаев, которые не реагируют на медикаментозное лечение, или для уменьшения отека мозга.
Должен ли я беспокоиться о тениозе, когда я выезжаю за границу?
Тениоз встречается во всем мире.Taenia saginata распространена в регионах разведения крупного рогатого скота: в Африке, на Ближнем Востоке, в Центральной и Южной Америке, Европе и Азии. Taenia solium распространена в Центральной и Южной Америке (особенно в Мексике), Африке, Юго-Восточной Азии, Восточной Европе, Микронезии.
Во время поездок в развивающиеся страны или там, где зарегистрирован тениоз, избегайте употребления в пищу сырой или недоваренной свинины и другого мяса; не ешьте мясо свиней, которые могут быть заражены солитером; и мойте руки водой с мылом после посещения туалета и особенно перед тем, как прикасаться к еде.
Заражение лентецом – обзор
Клиническая картина
Заражение лентецом кишечника часто протекает бессимптомно, хотя описаны неспецифические боли в животе, спазмы и диарея. Тошнота и рвота могут быть объяснены растяжением или спазмом кишечника, вызванным движением гельминтов. Обнаружение инфекции часто происходит, когда сегмент или более длинная «лента» проглоттид ленточного червя выходит из прямой кишки во время дефекации или спонтанно появляется в нижнем белье с типичными покачивающими движениями.Перианальное или вагинальное раздражение также может быть отличительной чертой.
Чаще всего заражение ленточными червями выявляют по наличию яиц (выделенных из проглоттид) или сегментов в образцах стула, собранных для паразитологического исследования. В случае хронической инфекции D. latum ленточные черви могут конкурировать с человеком-хозяином за поглощение витамина B 12 и связаны с мегалобластной анемией, вторичной по отношению к дефициту витамина B 12 . Рыбий ленточный червь является редкой причиной этого типа анемии.
Рыбий ленточный червь является редкой причиной этого типа анемии.
Инфекция тканей Echinoccocus sp. вызывает эхинококковую болезнь и чаще всего проявляется из-за массовых эффектов медленно растущих кистозных поражений. Обычно они возникают в печени, но могут пройти десятилетия, прежде чем они достигнут симптоматического размера. Первичные кисты могут достигать 25 см и более в диаметре. Пациент часто приходит на обследование из-за массы или давления в правом верхнем квадранте живота. Разрыв кисты может привести к высвобождению антигенного материала в организм хозяина, вызывая острое аллергическое или анафилактическое проявление.Вторичная бактериальная инфекция кист печени может проявляться аналогично абсцессу печени. Предыдущее затекание кисты печени в брюшную полость может проявляться множественными вторичными кистозными разрастаниями по всей брюшной полости. Легочные эхинококковые кисты обычно протекают бессимптомно, но при их прорыве в бронхиальное дерево могут возникать кровохарканье и кашель из дочерних кист, которые могут выглядеть как кожица винограда. Описаны эхинококковые кисты в других органах (например, в коже, костях, головном мозге, глазах и внутренних органах), которые проявляются в виде кистозных масс или опухолей.
Описаны эхинококковые кисты в других органах (например, в коже, костях, головном мозге, глазах и внутренних органах), которые проявляются в виде кистозных масс или опухолей.
Альвеолярные эхинококковые инфекции обычно проявляются в виде быстро прогрессирующей солидной опухоли в печени. Из-за их агрессивных проявлений эти инфекции клинически ведут себя как злокачественные новообразования.
Инфекция тканей цистицерками T. solium Инфекция обычно протекает бессимптомно, даже если кисты находятся в головном мозге. Нейроцистицеркоз является частой причиной эпилептических припадков в Мексике, Центральной и Южной Америке, Африке, Индии, Китае, Восточной Европе и Индонезии.Редкая форма инфекции центральной нервной системы, называемая рацемозным цистицеркозом, связана с виноградоподобными кистозными разрастаниями в головном мозге, вызывающими обструктивную гидроцефалию, арахноидит и мозжечок.
Естественная резистентность к гельминтам усугубляет тяжесть туберкулеза крупного рогатого скота независимо от коинфекции гельминтами
Значение
Взаимодействия между патогенами могут оказывать существенное негативное влияние на здоровье хозяина.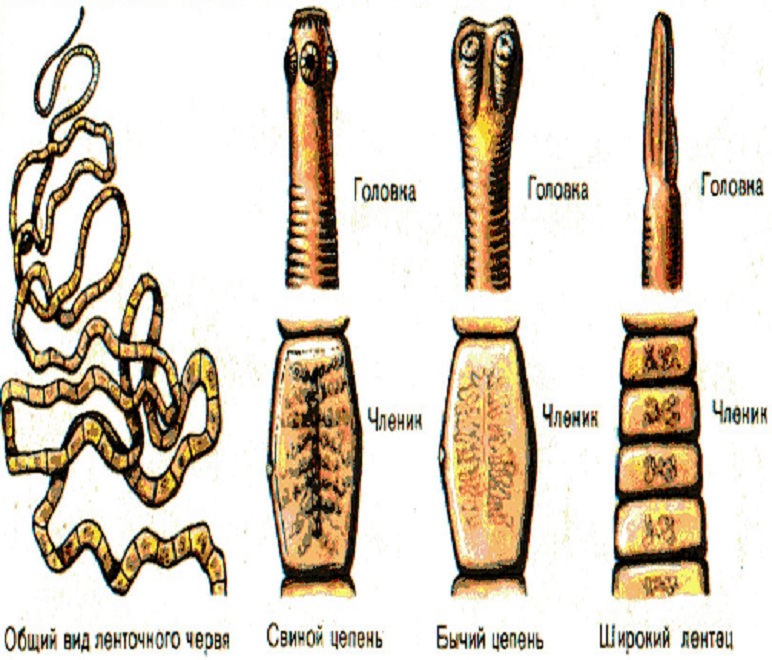 Таким образом, выявление причин этих взаимодействий является неотъемлемой частью эффективного лечения и контроля заболеваний.Взаимодействия между двумя патогенами, которые одновременно или последовательно заражают одного и того же хозяина, являются обычным явлением. Мы показываем, что взаимодействия также возникают, когда генетически обусловленная защита от одного патогена влияет на реакцию на другой, даже когда первый патоген одновременно отсутствует. Этот способ взаимодействия патогенов дает представление о закономерностях изменения тяжести заболевания в природных популяциях. Это также означает, что при некоторых условиях стратегии контроля, основанные на отборе на устойчивость к одному патогену, например, у домашнего скота, могут поставить под угрозу контроль над другим.
Таким образом, выявление причин этих взаимодействий является неотъемлемой частью эффективного лечения и контроля заболеваний.Взаимодействия между двумя патогенами, которые одновременно или последовательно заражают одного и того же хозяина, являются обычным явлением. Мы показываем, что взаимодействия также возникают, когда генетически обусловленная защита от одного патогена влияет на реакцию на другой, даже когда первый патоген одновременно отсутствует. Этот способ взаимодействия патогенов дает представление о закономерностях изменения тяжести заболевания в природных популяциях. Это также означает, что при некоторых условиях стратегии контроля, основанные на отборе на устойчивость к одному патогену, например, у домашнего скота, могут поставить под угрозу контроль над другим.
Abstract
Взаимодействия патогенов, возникающие при коинфекции, могут усугубить тяжесть заболевания, например, когда иммунный ответ, направленный против одного патогена, негативно влияет на защиту другого. Также возможно, что иммунный ответ хозяина на патоген, сформированный историческими эволюционными взаимодействиями между хозяином и патогеном, может модифицировать иммунную защиту хозяина таким образом, что это имеет последствия для других патогенов. В этом случае негативные взаимодействия между двумя возбудителями могут возникать даже при отсутствии сопутствующей инфекции.Паразитические черви и туберкулез (ТБ) участвуют в одном из наиболее географически обширных взаимодействий патогенов, и при коинфекции черви могут усугублять исходы заболевания туберкулезом. Здесь мы показываем, что у диких млекопитающих естественная устойчивость к глистам влияет на тяжесть туберкулеза крупного рогатого скота (BTB) независимо от активной инфекции червей. Мы обнаружили, что устойчивые к глистам люди с большей вероятностью умирали от ВТБ, чем неустойчивые, и их болезнь прогрессировала быстрее. Антигельминтное лечение смягчало, но не устраняло эффект резистентности, а эффекты резистентности и лечения были противоположными и аддитивными, при этом у нелеченых устойчивых индивидуумов наблюдалась самая высокая смертность.
Также возможно, что иммунный ответ хозяина на патоген, сформированный историческими эволюционными взаимодействиями между хозяином и патогеном, может модифицировать иммунную защиту хозяина таким образом, что это имеет последствия для других патогенов. В этом случае негативные взаимодействия между двумя возбудителями могут возникать даже при отсутствии сопутствующей инфекции.Паразитические черви и туберкулез (ТБ) участвуют в одном из наиболее географически обширных взаимодействий патогенов, и при коинфекции черви могут усугублять исходы заболевания туберкулезом. Здесь мы показываем, что у диких млекопитающих естественная устойчивость к глистам влияет на тяжесть туберкулеза крупного рогатого скота (BTB) независимо от активной инфекции червей. Мы обнаружили, что устойчивые к глистам люди с большей вероятностью умирали от ВТБ, чем неустойчивые, и их болезнь прогрессировала быстрее. Антигельминтное лечение смягчало, но не устраняло эффект резистентности, а эффекты резистентности и лечения были противоположными и аддитивными, при этом у нелеченых устойчивых индивидуумов наблюдалась самая высокая смертность. Кроме того, резистентность и антигельминтное лечение оказывали неперекрывающееся влияние на патологию BTB. Эффекты резистентности, проявляющиеся в легких (основной очаг инфекции BTB), в то время как эффекты лечения почти полностью проявляются в лимфатических узлах (место диссеминированного заболевания), что позволяет предположить, что резистентность и активная глистная инфекция влияют на прогрессирование BTB с помощью различных механизмов. . Наши результаты показывают, что взаимодействие между патогенами может происходить как следствие процессов, возникающих в очень разных временных масштабах.
Кроме того, резистентность и антигельминтное лечение оказывали неперекрывающееся влияние на патологию BTB. Эффекты резистентности, проявляющиеся в легких (основной очаг инфекции BTB), в то время как эффекты лечения почти полностью проявляются в лимфатических узлах (место диссеминированного заболевания), что позволяет предположить, что резистентность и активная глистная инфекция влияют на прогрессирование BTB с помощью различных механизмов. . Наши результаты показывают, что взаимодействие между патогенами может происходить как следствие процессов, возникающих в очень разных временных масштабах.
Взаимодействия между патогенами, совместно встречающимися в пределах одного хозяина, могут оказывать сильное влияние на исход инфекции, начиная от тяжести клинических проявлений заболевания у отдельных хозяев и заканчивая скоростью распространения заболевания в популяции (1⇓–3). Поскольку большинство хозяев обычно инфицируются более чем одним типом патогена одновременно (4), понимание последствий взаимодействия патогенов во время одновременной инфекции (или коинфекции) имеет важное значение для эффективного лечения и контроля заболевания. Хотя многие исследования сосредоточены на взаимодействиях патогенов, которые являются результатом реакции одного патогена на одновременное присутствие другого (5), два патогена не обязательно должны перекрываться во времени, чтобы взаимодействовать друг с другом.Например, гетерологичный иммунитет, при котором предшествующее воздействие или инфицирование одним патогеном изменяет иммунный ответ на другой, может вызывать как положительные, так и отрицательные взаимодействия между патогенами (6). Это явление показывает, как модификации иммунной системы хозяина одним патогеном, которые происходят в течение жизни хозяина (т. Е. В экологическое время), могут формировать будущие ответы на вторичные патогены. Точно так же сильное давление отбора, оказываемое патогенами на хозяев, особенно на иммунную функцию (7), может привести к модификациям иммунной системы хозяина, которые происходят в поколениях (т.э., в эволюционное время), процесс, который также должен влиять на реакцию на вторичные инфекции.
Хотя многие исследования сосредоточены на взаимодействиях патогенов, которые являются результатом реакции одного патогена на одновременное присутствие другого (5), два патогена не обязательно должны перекрываться во времени, чтобы взаимодействовать друг с другом.Например, гетерологичный иммунитет, при котором предшествующее воздействие или инфицирование одним патогеном изменяет иммунный ответ на другой, может вызывать как положительные, так и отрицательные взаимодействия между патогенами (6). Это явление показывает, как модификации иммунной системы хозяина одним патогеном, которые происходят в течение жизни хозяина (т. Е. В экологическое время), могут формировать будущие ответы на вторичные патогены. Точно так же сильное давление отбора, оказываемое патогенами на хозяев, особенно на иммунную функцию (7), может привести к модификациям иммунной системы хозяина, которые происходят в поколениях (т.э., в эволюционное время), процесс, который также должен влиять на реакцию на вторичные инфекции. В этом случае историческая реакция на уровне популяции на отбор одного патогена может вызвать наследуемые различия между людьми в современных реакциях на другой. Важно отметить, что взаимодействия между патогенами в экологическом и эволюционном масштабах могут действовать по разным причинам, поэтому различие между ними является неотъемлемой частью понимания как механистической основы, так и последствий этих взаимодействий.
В этом случае историческая реакция на уровне популяции на отбор одного патогена может вызвать наследуемые различия между людьми в современных реакциях на другой. Важно отметить, что взаимодействия между патогенами в экологическом и эволюционном масштабах могут действовать по разным причинам, поэтому различие между ними является неотъемлемой частью понимания как механистической основы, так и последствий этих взаимодействий.
Гельминты, или паразитические черви, и туберкулез (ТБ) участвуют в одном из наиболее географически обширных взаимодействий патогенов (2, 8). Оба патогена поражают примерно одну треть населения мира и широко распространены среди домашних и диких животных (9⇓–11). Вызывается бактериями комплекса Mycobacterium tuberculosis , в том числе M.tuberculosis ( Mtb ), возбудителем туберкулеза человека, и Mycobacterium bovis ( Mb ), возбудителем туберкулеза крупного рогатого скота. ответственны за 2 миллиона человеческих смертей (12) и 25% всех падежей крупного рогатого скота, связанных с болезнями (13) ежегодно. У людей около 10% людей, инфицированных Mtb , прогрессируют до активного заболевания легких, но механизмы, лежащие в основе прогрессирования до активного ТБ, плохо изучены (14). Накопленные данные свидетельствуют о том, что коинфекция глистами может быть фактором прогрессирования заболевания туберкулезом (2, 15), хотя некоторые исследования не подтверждают эту связь, подчеркивая сложную природу взаимодействия червей и туберкулеза (16). Интересно, что исследования на лабораторных животных показывают, что повышенный иммунитет (т.е. резистентность) к гельминтам может поставить под угрозу способность хозяина контролировать ТБ даже в отсутствие активного заражения гельминтами (17⇓⇓–20), подразумевая, что развившаяся защита от гельминтов может независимо воздействовать на организм. ответ на ТБ.В свете широко распространенной резистентности к гельминтам в популяциях человека и животных (21, 22) и широкого географического совпадения гельминтов и туберкулеза взаимодействие червей и туберкулеза может представлять собой показательный случай, когда различия в развившейся резистентности к одному патогену (гельминтам) способствуют различным ответы на другой (ТБ).
У людей около 10% людей, инфицированных Mtb , прогрессируют до активного заболевания легких, но механизмы, лежащие в основе прогрессирования до активного ТБ, плохо изучены (14). Накопленные данные свидетельствуют о том, что коинфекция глистами может быть фактором прогрессирования заболевания туберкулезом (2, 15), хотя некоторые исследования не подтверждают эту связь, подчеркивая сложную природу взаимодействия червей и туберкулеза (16). Интересно, что исследования на лабораторных животных показывают, что повышенный иммунитет (т.е. резистентность) к гельминтам может поставить под угрозу способность хозяина контролировать ТБ даже в отсутствие активного заражения гельминтами (17⇓⇓–20), подразумевая, что развившаяся защита от гельминтов может независимо воздействовать на организм. ответ на ТБ.В свете широко распространенной резистентности к гельминтам в популяциях человека и животных (21, 22) и широкого географического совпадения гельминтов и туберкулеза взаимодействие червей и туберкулеза может представлять собой показательный случай, когда различия в развившейся резистентности к одному патогену (гельминтам) способствуют различным ответы на другой (ТБ).
В этом исследовании мы проверили гипотезу о том, что устойчивость к червям изменяет реакцию хозяина на ТБ. Для этого мы наблюдали за желудочно-кишечными (ЖК) инфекциями (в частности, стронгилезной нематодой) и Mb в когорте диких африканских буйволов ( Syncerus caffer ), чтобы оценить влияние естественной изменчивости устойчивости к червям на заболеваемость, тяжесть, и прогрессирование туберкулеза крупного рогатого скота (BTB).В предыдущей работе мы продемонстрировали наличие экологического взаимодействия между червями и BTB у буйволов, показав, что устранение активной инфекции червей с помощью антигельминтной обработки снижает смертность, связанную с BTB (23). Таким образом, мы воспользовались тем фактом, что половина наших исследуемых животных подвергалась длительной дегельминтизации, чтобы сравнить относительные эффекты коинфекции глистами и естественной резистентности к глистам на исходы BTB. Мы обнаружили доказательства генетической основы устойчивости к глистам у буйволов и того, что буйволы с устойчивостью к глистам были более серьезно поражены BTB с точки зрения как риска смертности, так и прогрессирования заболевания. Однако механизмы, с помощью которых естественная изменчивость ответа хозяина на червей была связана с прогрессированием BTB, по-видимому, отличались от эффектов лечения антигельминтами. Наши результаты показывают, что негативное влияние червей на исходы BTB возникает как в результате одновременного заражения червями, так и в результате генетически обусловленных различий в реакции хозяина на червей. Это открытие коренным образом меняет наше понимание временных масштабов, в течение которых черви и туберкулез взаимодействуют в реальных популяциях.
Однако механизмы, с помощью которых естественная изменчивость ответа хозяина на червей была связана с прогрессированием BTB, по-видимому, отличались от эффектов лечения антигельминтами. Наши результаты показывают, что негативное влияние червей на исходы BTB возникает как в результате одновременного заражения червями, так и в результате генетически обусловленных различий в реакции хозяина на червей. Это открытие коренным образом меняет наше понимание временных масштабов, в течение которых черви и туберкулез взаимодействуют в реальных популяциях.
Results
Мы отследили 209 самок африканского буйвола старше 4 лет в Национальном парке Крюгера (KNP), Южная Африка. Сто двенадцать животных (53%) были заражены глистами при первичном отборе образцов, а количество яиц гельминтов, выделяемых с фекалиями всех особей (далее — количество фекальных яиц [ФЭК]), варьировало от 0 до 850 яиц на грамм. фекалий (среднее ± SE = 96,9 ± 10). При первом и всех последующих отборах образцов примерно половина исследуемых животных, обозначенных как экспериментальная группа, получали антигельминтный препарат для борьбы с глистными инфекциями.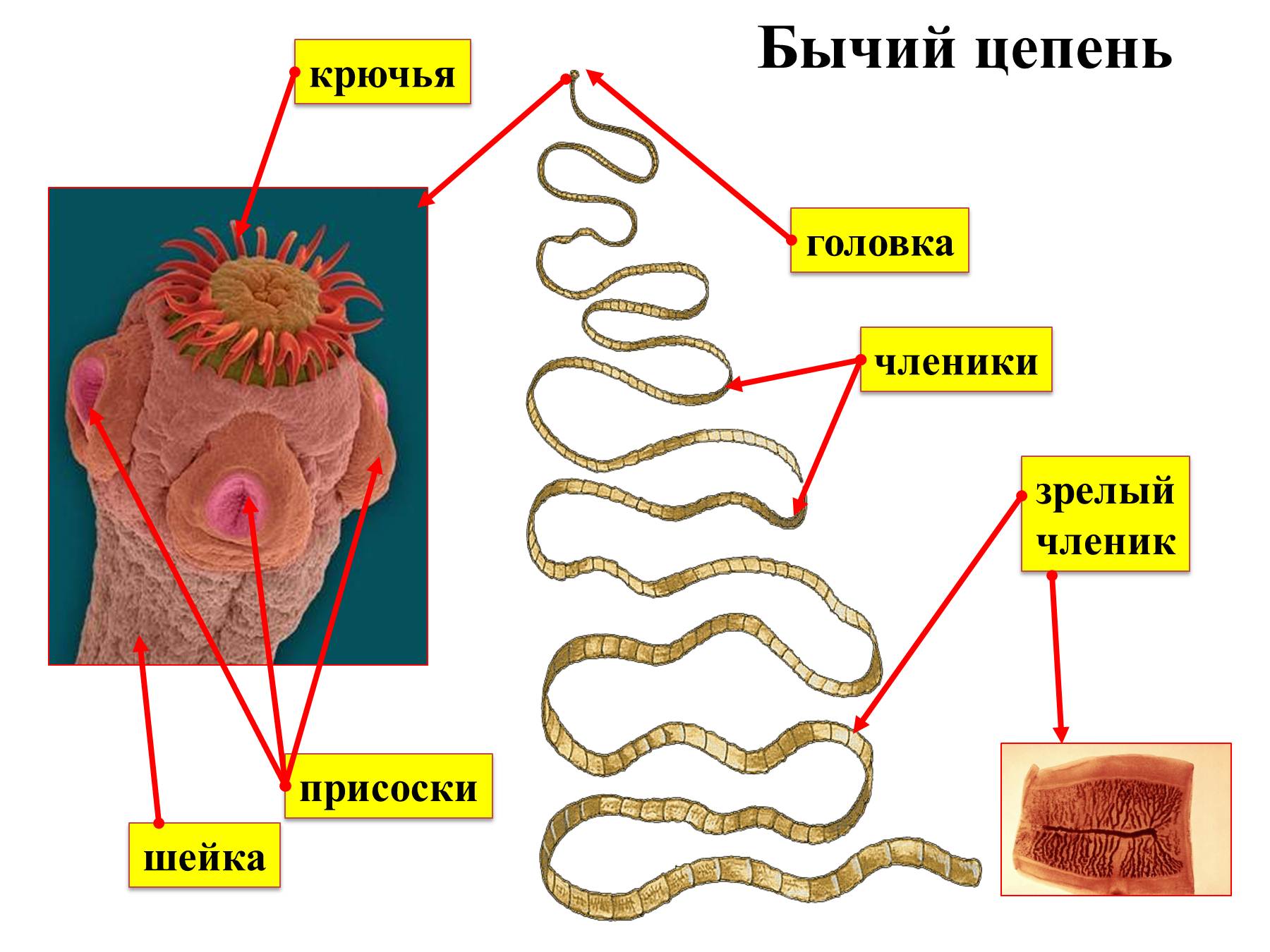 Этот режим лечения эффективно снижал выделение яиц гельминтов (23), что является надежным показателем бремени взрослых гельминтов в этой исследуемой популяции (24). Из подгруппы нелеченых животных, не получавших антигельминтное средство, FEC значительно повторялся у одного человека с течением времени ( R = 0,41, 95% ДИ: от 0,31 до 0,49; P < 0,0001; n = 103 особи, 651 наблюдение), обнаруживая высокую степень естественной внутрииндивидуальной согласованности в величине выделения яиц глистов.Поскольку FEC является широко используемым показателем устойчивости к червям в домашнем скоте (25), а низкие и высокие значения FEC использовались в качестве основы для фенотипической селекции (26), мы исследовали потенциальный источник последовательной изменчивости яйценоскости у буйволов, группируя животных в дискретные категории на основе уровней откладывания яиц при первоначальном отборе проб. Мы использовали основанный на модели подход для выявления статистически различных кластеров в данных FEC ( SI, Приложение , рис.
Этот режим лечения эффективно снижал выделение яиц гельминтов (23), что является надежным показателем бремени взрослых гельминтов в этой исследуемой популяции (24). Из подгруппы нелеченых животных, не получавших антигельминтное средство, FEC значительно повторялся у одного человека с течением времени ( R = 0,41, 95% ДИ: от 0,31 до 0,49; P < 0,0001; n = 103 особи, 651 наблюдение), обнаруживая высокую степень естественной внутрииндивидуальной согласованности в величине выделения яиц глистов.Поскольку FEC является широко используемым показателем устойчивости к червям в домашнем скоте (25), а низкие и высокие значения FEC использовались в качестве основы для фенотипической селекции (26), мы исследовали потенциальный источник последовательной изменчивости яйценоскости у буйволов, группируя животных в дискретные категории на основе уровней откладывания яиц при первоначальном отборе проб. Мы использовали основанный на модели подход для выявления статистически различных кластеров в данных FEC ( SI, Приложение , рис. S1), а затем разделили людей на две группы на основе этих кластеров: «низкий» FEC (≤50), представляющий самый большой кластер и «высокий» FEC (≥100), представляющий все остальные кластеры.Затем мы проверили, является ли этот низкий или высокий фенотип FEC предиктором вариации иммунного ответа хозяина на заражение червями, и искали доказательства генетической основы фенотипа. Управляемый моделью подход к дискретизации значений FEC позволил нам идентифицировать закономерности, которые могли быть скрыты из-за сильно рассредоточенного распределения данных FEC (рис. 1 A ), потенциальных нелинейных взаимосвязей между непрерывным FEC и нашими фокальными переменными-предикторами, или оба.
S1), а затем разделили людей на две группы на основе этих кластеров: «низкий» FEC (≤50), представляющий самый большой кластер и «высокий» FEC (≥100), представляющий все остальные кластеры.Затем мы проверили, является ли этот низкий или высокий фенотип FEC предиктором вариации иммунного ответа хозяина на заражение червями, и искали доказательства генетической основы фенотипа. Управляемый моделью подход к дискретизации значений FEC позволил нам идентифицировать закономерности, которые могли быть скрыты из-за сильно рассредоточенного распределения данных FEC (рис. 1 A ), потенциальных нелинейных взаимосвязей между непрерывным FEC и нашими фокальными переменными-предикторами, или оба.
FEC при первоначальном отлове были сильно агрегированы среди особей, а фенотип выделения яиц червя (высокий или низкий) при первом отлове взаимодействовал с антигельминтной обработкой для определения выделения на протяжении всего исследования. ( A ) В начале исследования 60% буйволов выделяли менее 100 яиц червей на грамм фекалий и относились к «низкому» фенотипу, в то время как 40% выделяли более 100 яиц на грамм фекалий. и были классифицированы как «высокий» фенотип ( Приложение SI , рис.С1). ( B ) На протяжении всего исследования лица с высоким уровнем FEC в группе, не получавшей лечения (нелеченый-высокий), выделяли значительно больше яиц глистов, чем люди с низким уровнем FEC в нелеченной группе (нелеченый-низкий) или люди с высоким FEC в группе, получавшей лечение. группа (леченная-высокая). Величина влияния фенотипа червя на выделение яиц червя (необработанный-высокий – необработанный-низкий: 0,79; Приложение SI , таблица S2) был почти эквивалентен эффекту антигельминтной обработки (необработанный-высокий – обработанный-высокий: 0 .98; Приложение SI , таблица S2). FEC были логарифмически (x + 1)-преобразованы; символы показывают средние значения, а SE и звездочки обозначают значительные отличия от LMM (*** P <0,001, ** P <0,01; NS = не значимо).
и были классифицированы как «высокий» фенотип ( Приложение SI , рис.С1). ( B ) На протяжении всего исследования лица с высоким уровнем FEC в группе, не получавшей лечения (нелеченый-высокий), выделяли значительно больше яиц глистов, чем люди с низким уровнем FEC в нелеченной группе (нелеченый-низкий) или люди с высоким FEC в группе, получавшей лечение. группа (леченная-высокая). Величина влияния фенотипа червя на выделение яиц червя (необработанный-высокий – необработанный-низкий: 0,79; Приложение SI , таблица S2) был почти эквивалентен эффекту антигельминтной обработки (необработанный-высокий – обработанный-высокий: 0 .98; Приложение SI , таблица S2). FEC были логарифмически (x + 1)-преобразованы; символы показывают средние значения, а SE и звездочки обозначают значительные отличия от LMM (*** P <0,001, ** P <0,01; NS = не значимо).
Шестьдесят процентов животных попали в категорию с низким FEC, а 40% попали в категорию с высоким FEC (рис. 1 A ), и вероятность того, что особь проявляет фенотип с низким или высоким FEC, повторялась во времени (). R приближение логит-связи = 0.355, 95% ДИ: от 0,22 до 0,44; P <0,0001), что указывает на то, что наша дискретизированная мера фенотипа FEC отражала последовательную вариацию в отбрасывании яиц, наблюдаемую в непрерывной метрике FEC. Кроме того, фенотип FEC при начальном отлове был связан с различиями в откладывании яиц червей на протяжении всего исследования, почти эквивалентными по величине эффекту антигельминтной обработки ( SI, Приложение , Таблицы S1 и S2). Принимая во внимание ряд экологических факторов, связанных с риском заражения гельминтами (возраст, стадо и время года), мы обнаружили, что среди нелеченых животных особи с высоким фенотипом выделяли значительно больше яиц гельминтов, чем особи с низким фенотипом, но лечение устраняло разницу между высокие и низкие особи (рис.1 B и SI Приложение , таблица S2). Кроме того, разница в яйцекладке между необработанными особями с высоким и необработанным низким уровнем была аналогична разнице между необработанными и обработанными особями (рис.
1 A ), и вероятность того, что особь проявляет фенотип с низким или высоким FEC, повторялась во времени (). R приближение логит-связи = 0.355, 95% ДИ: от 0,22 до 0,44; P <0,0001), что указывает на то, что наша дискретизированная мера фенотипа FEC отражала последовательную вариацию в отбрасывании яиц, наблюдаемую в непрерывной метрике FEC. Кроме того, фенотип FEC при начальном отлове был связан с различиями в откладывании яиц червей на протяжении всего исследования, почти эквивалентными по величине эффекту антигельминтной обработки ( SI, Приложение , Таблицы S1 и S2). Принимая во внимание ряд экологических факторов, связанных с риском заражения гельминтами (возраст, стадо и время года), мы обнаружили, что среди нелеченых животных особи с высоким фенотипом выделяли значительно больше яиц гельминтов, чем особи с низким фенотипом, но лечение устраняло разницу между высокие и низкие особи (рис.1 B и SI Приложение , таблица S2). Кроме того, разница в яйцекладке между необработанными особями с высоким и необработанным низким уровнем была аналогична разнице между необработанными и обработанными особями (рис. 1 B и SI Приложение , таблица S2), что указывает на то, что FEC фенотип оказывает влияние на выделение яиц глистов почти так же сильно, как и лечение антигельминтами. Важно отметить, что фенотип «высокий-низкий» отражал различия в ключевых иммунных реакциях на червей.Среди нелеченых животных у особей с низким уровнем эозинофилов, тучных клеток и иммуноглобулина А (IgA) было больше эозинофилов, тучных клеток и иммуноглобулина А (IgA), чем у особей с высоким уровнем как в сычуге (критерий суммы рангов Уилкоксона, n = 7 высоких, 7 низких, эозинофилы: Z = -2,41 , P = 0,0159, рис. 0,00006, рис. 2 C ) и тонкой кишки ( n = 6 высоких, 6 низких, эозинофилы: Z = -1.86, Р = 0,0632; тучные клетки: Z = -2,81, P = 0,0049; IgA: Z = -2,80, P = 0,0021), два первичных очага заражения гельминтами. Тот факт, что все три из этих хорошо известных маркеров антигельминтного иммунитета (27) были выше у особей с низким FEC, подтверждает наличие у этих животных более сильной реакции устойчивости к глистам.
1 B и SI Приложение , таблица S2), что указывает на то, что FEC фенотип оказывает влияние на выделение яиц глистов почти так же сильно, как и лечение антигельминтами. Важно отметить, что фенотип «высокий-низкий» отражал различия в ключевых иммунных реакциях на червей.Среди нелеченых животных у особей с низким уровнем эозинофилов, тучных клеток и иммуноглобулина А (IgA) было больше эозинофилов, тучных клеток и иммуноглобулина А (IgA), чем у особей с высоким уровнем как в сычуге (критерий суммы рангов Уилкоксона, n = 7 высоких, 7 низких, эозинофилы: Z = -2,41 , P = 0,0159, рис. 0,00006, рис. 2 C ) и тонкой кишки ( n = 6 высоких, 6 низких, эозинофилы: Z = -1.86, Р = 0,0632; тучные клетки: Z = -2,81, P = 0,0049; IgA: Z = -2,80, P = 0,0021), два первичных очага заражения гельминтами. Тот факт, что все три из этих хорошо известных маркеров антигельминтного иммунитета (27) были выше у особей с низким FEC, подтверждает наличие у этих животных более сильной реакции устойчивости к глистам.
Фенотип «высокий-низкий» FEC у буйволов отражает вариации иммунного ответа на червей в месте заражения в кишечнике и имеет генетическую основу.У лиц с низким FEC было значительно больше ( A ) эозинофилов (клеток на 2 мм 2 ), ( B ) тучных клеток (клеток на 2 мм 2 ) и ( C ) IgA (количество IgA+ лейкоцитов) в сычуге, чем у лиц с высоким ФЭК. Горизонтальные столбцы показывают медианные значения, открытые кружки представляют собой необработанные точки данных, а звездочки обозначают значительные отличия от критериев суммы рангов Уилкоксона (*** P < 0,001, * P < 0,05). Кроме того, фенотип FEC был связан с полиморфизмом в локусе BL4 рядом с геном гамма-интерферона.( D ) Аллель BL4-141 был чрезмерно представлен среди людей с низким FEC (темно-красный против светло-красного) по сравнению с людьми с высоким FEC (темно-синий против светло-голубого), а люди, несущие аллель 141, выделяли значительно меньше яиц червей (перекрестные представляет медианный и межквартильный диапазон, открытые кружки показывают полный диапазон значений FEC, а значение P получено из критерия суммы рангов Уилкоксона). ( E ) Напротив, аллель BL4-167 был чрезмерно представлен среди людей с высоким FEC (темно-синий против голубого) по сравнению с людьми с низким FEC (темно-красный против голубого).светло-красный), и люди, несущие этот аллель, имели тенденцию выделять больше яиц глистов (крест представляет собой средний и межквартильный диапазон, незакрашенные кружки показывают полный диапазон значений FEC, а значение P получено из критерия суммы рангов Уилкоксона).
( E ) Напротив, аллель BL4-167 был чрезмерно представлен среди людей с высоким FEC (темно-синий против голубого) по сравнению с людьми с низким FEC (темно-красный против голубого).светло-красный), и люди, несущие этот аллель, имели тенденцию выделять больше яиц глистов (крест представляет собой средний и межквартильный диапазон, незакрашенные кружки показывают полный диапазон значений FEC, а значение P получено из критерия суммы рангов Уилкоксона).
Фенотип FEC также был связан с аллельными вариациями вблизи гена гамма-интерферона (IFNG), области гена, которая ранее была связана с вариациями количества яиц нематод у домашних овец (28), диких сойских овец (29) и буйволов ( 30). Сосредоточение внимания на локусе BL4, расположенном 3.На 6 сМ выше IFNG (31) мы идентифицировали девять аллелей, два из которых, BL4-141 и BL4-167, были связаны с фенотипом FEC. BL4-141 встречался с частотой 29% в исследуемой популяции (51 из 177 отобранных особей), а низкорослые животные значительно чаще носили этот аллель (высокий = 12/67, низкий = 39/110, χ Пирсона ). 2 тест: χ 2 = 6,25, P = 0,0124; рис. 2 D ). Напротив, BL4-167 встречался с частотой всего 7%, и в этом случае высокие животные значительно чаще были носителями аллеля (высокий = 8/67, низкий = 4/110, критерий Пирсона χ 2 ). : х 2 = 4.54, Р = 0,033; рис. 2 E ). В подтверждение этих паттернов присутствие обоих аллелей коррелировало с непрерывным FEC при первоначальном отборе проб. Особи, несущие BL4-141, выделяли значительно меньше яиц червей (критерий суммы рангов Уилкоксона: Z = -2,49, P = 0,0129; рис. 2 D ), в то время как носители BL4-167, как правило, выделяли больше яиц ( Z = 1,94, P = 0,0518 (рис. 2 E ). В сочетании как иммунологические, так и генетические паттерны предполагают, что фенотип с высоким или низким FEC у буйволов является надежным показателем генетически обусловленных различий в естественной устойчивости к заражению червями.
2 тест: χ 2 = 6,25, P = 0,0124; рис. 2 D ). Напротив, BL4-167 встречался с частотой всего 7%, и в этом случае высокие животные значительно чаще были носителями аллеля (высокий = 8/67, низкий = 4/110, критерий Пирсона χ 2 ). : х 2 = 4.54, Р = 0,033; рис. 2 E ). В подтверждение этих паттернов присутствие обоих аллелей коррелировало с непрерывным FEC при первоначальном отборе проб. Особи, несущие BL4-141, выделяли значительно меньше яиц червей (критерий суммы рангов Уилкоксона: Z = -2,49, P = 0,0129; рис. 2 D ), в то время как носители BL4-167, как правило, выделяли больше яиц ( Z = 1,94, P = 0,0518 (рис. 2 E ). В сочетании как иммунологические, так и генетические паттерны предполагают, что фенотип с высоким или низким FEC у буйволов является надежным показателем генетически обусловленных различий в естественной устойчивости к заражению червями.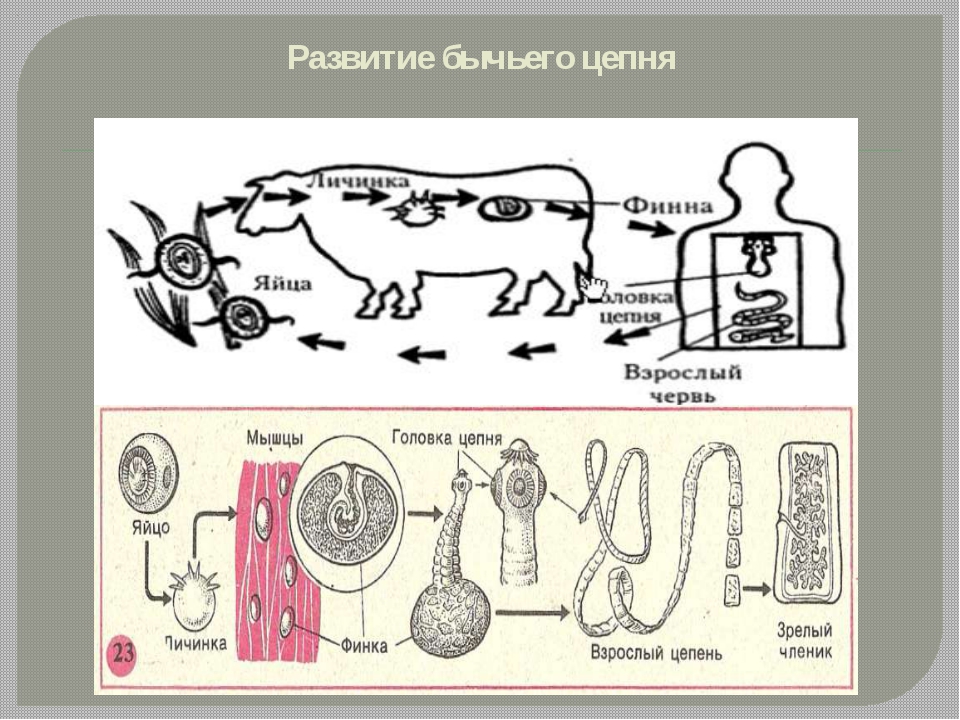
Когда мы изучили последствия фенотипа FEC (далее именуемого фенотипом «устойчивости к червям») для болезни BTB, мы обнаружили, что устойчивость не влияет на риск заражения буйволов BTB (высокий = 29/77, низкий = 37/118; опасность соотношение [HR] = 0,693, 95% ДИ: от 0,406 до 1,185, P = 0,181; Приложение SI , таблица S3), но был сильным предиктором риска смертности после инфицирования BTB. Среди лиц, инфицированных BTB, смертность была примерно в шесть раз выше у лиц с низким уровнем смертности по сравнению с лицами с высоким уровнем (высокий уровень = 2/24, низкий уровень = 10/32; HR = 5.68, 95% ДИ: от 1,08 до 29,9, P = 0,04; Рис. 3 и Приложение SI , Таблица S4). Этот эффект устойчивости к гельминтам не зависел от статуса антигельминтного лечения, но отсутствие лечения имело аддитивное влияние на риск смертности ( Приложение SI , Таблица S4). Разница в кумулятивной смертности составила 26% между нелеченными людьми с высоким и нелеченым низким уровнем смертности (рис. 3). Однако кумулятивная смертность у лиц с высоким уровнем лечения составила 0% по сравнению с 14% у лиц с низким уровнем лечения (рис.3), предполагая, что лечение ослабляло эффект фенотипа резистентности к глистам, хотя резистентность к глистам по-прежнему приводила к стоимости смертности, связанной с BTB, несмотря на значительное снижение количества гельминтов благодаря лечению. Лечение снижало смертность, связанную с BTB, как у лиц с высоким, так и с низким уровнем заболеваемости, что отражалось в снижении кумулятивной смертности на 18% и 30% у нелеченных по сравнению с получавшими лечение лиц с высоким и низким уровнем заболеваемости соответственно (рис. 3). Кроме того, аддитивный негативный эффект резистентности к гельминтозам и отсутствия лечения был наиболее очевиден в существенной разнице в совокупной смертности между людьми с высоким и низким уровнем лечения (0% по сравнению с44%; рис. 3). Важно отметить, что не было влияния фенотипа устойчивости к гельминтам на смертность среди лиц, не инфицированных BTB ( SI, Приложение , таблица S5), что указывает на взаимодействие между фенотипом устойчивости к гельминтам и BTB в качестве движущей силы модели смертности, основанной на устойчивости.
3). Однако кумулятивная смертность у лиц с высоким уровнем лечения составила 0% по сравнению с 14% у лиц с низким уровнем лечения (рис.3), предполагая, что лечение ослабляло эффект фенотипа резистентности к глистам, хотя резистентность к глистам по-прежнему приводила к стоимости смертности, связанной с BTB, несмотря на значительное снижение количества гельминтов благодаря лечению. Лечение снижало смертность, связанную с BTB, как у лиц с высоким, так и с низким уровнем заболеваемости, что отражалось в снижении кумулятивной смертности на 18% и 30% у нелеченных по сравнению с получавшими лечение лиц с высоким и низким уровнем заболеваемости соответственно (рис. 3). Кроме того, аддитивный негативный эффект резистентности к гельминтозам и отсутствия лечения был наиболее очевиден в существенной разнице в совокупной смертности между людьми с высоким и низким уровнем лечения (0% по сравнению с44%; рис. 3). Важно отметить, что не было влияния фенотипа устойчивости к гельминтам на смертность среди лиц, не инфицированных BTB ( SI, Приложение , таблица S5), что указывает на взаимодействие между фенотипом устойчивости к гельминтам и BTB в качестве движущей силы модели смертности, основанной на устойчивости. Наконец, когда мы изучили связь между постоянным FEC и смертностью, мы обнаружили закономерности, соответствующие результатам, основанным на фенотипе устойчивости к червям. Среди лиц, инфицированных BTB, у лиц с более низким FEC наблюдалась тенденция к более высокой смертности ( P = 0.07; Приложение SI , Таблица S6), тогда как эта тенденция исчезла среди лиц, не инфицированных BTB ( P = 0,42; Приложение SI , Таблица S7). Эти паттерны подтверждают, что наш дискретизированный фенотип FEC (т. е. устойчивость к червям) отражает важный лежащий в основе биологический феномен.
Наконец, когда мы изучили связь между постоянным FEC и смертностью, мы обнаружили закономерности, соответствующие результатам, основанным на фенотипе устойчивости к червям. Среди лиц, инфицированных BTB, у лиц с более низким FEC наблюдалась тенденция к более высокой смертности ( P = 0.07; Приложение SI , Таблица S6), тогда как эта тенденция исчезла среди лиц, не инфицированных BTB ( P = 0,42; Приложение SI , Таблица S7). Эти паттерны подтверждают, что наш дискретизированный фенотип FEC (т. е. устойчивость к червям) отражает важный лежащий в основе биологический феномен.
Фенотип устойчивости к гельминтозам влияет на выживаемость буйволов, зараженных ВТБ, и антигельминтная обработка снижает, но не устраняет этот эффект. Кривые выживаемости, показывающие долю устойчивых к червям (фенотип с низким уровнем FEC червей) и неустойчивых (фенотип с высоким FEC) буйволов в зависимости от состояния, получавшего и не получавшего антигельминтное лечение, выживших после инфекции BTB, в зависимости от времени в днях. Вероятность смерти от инфекции BTB была значительно выше у лиц с низким уровнем FEC по сравнению с лицами с высоким уровнем FEC, а эффекты устойчивости к глистам не зависели от лечения антигельминтами ( SI, Приложение , Таблица S4). Кумулятивные показатели смертности во всех группах показывают, что, хотя лечение снижало смертность от резистентности к гельминтам (обработанные-высокая по сравнению с необработанной-высокая и обработанная-низкая по сравнению с необработанной-низкой), резистентные животные, обработанные от гельминтов (обработанные-низкая), по-прежнему страдали от гельминтозов. смертная цена сопротивления.
Вероятность смерти от инфекции BTB была значительно выше у лиц с низким уровнем FEC по сравнению с лицами с высоким уровнем FEC, а эффекты устойчивости к глистам не зависели от лечения антигельминтами ( SI, Приложение , Таблица S4). Кумулятивные показатели смертности во всех группах показывают, что, хотя лечение снижало смертность от резистентности к гельминтам (обработанные-высокая по сравнению с необработанной-высокая и обработанная-низкая по сравнению с необработанной-низкой), резистентные животные, обработанные от гельминтов (обработанные-низкая), по-прежнему страдали от гельминтозов. смертная цена сопротивления.
Чтобы лучше понять, как фенотип устойчивости к гельминтозам и антигельминтное лечение ускоряют смертность от BTB, мы провели макроскопическое и гистопатологическое исследование легких и респираторных лимфатических узлов подгруппы лиц, инфицированных BTB, чтобы определить влияние этих признаков на прогрессирование заболевания BTB. Легкие являются первичным местом заражения BTB, а лимфатические узлы, обычное место внелегочной инфекции, отражают диссеминацию заболевания (32). В легких мы количественно оценили способность хозяина контролировать бактериальную инфекцию (количество поражений, образование многоядерных гигантских клеток [MNGC]), продолжительность и тяжесть инфекции (стадия поражения) и степень повреждения тканей в очагах (наличие минерализации). ), включая неспособность вернуться к нормальной архитектуре ткани (фиброз).После учета продолжительности инфекции BTB у субъектов с низким фенотипом, как правило, было больше поражений легких (таблица 1). Поражения в этой группе животных также со значительно большей вероятностью имели MNGC (таблица 1 и Приложение SI , рис. S2 A ) и находились на значительно более поздней стадии (таблица 1), оба из которых являются индикаторами менее эффективно контролируемая инфекция BTB. Только на один показатель заболевания в легких, наличие фиброза в очагах поражения, повлияла обработка антигельминтами, а не фенотип устойчивости к гельминтам.У леченных животных была более высокая степень фиброза в пределах поражений легких (таблица 1), что позволяет предположить, что лечение было связано с неспособностью обратить вспять повреждение тканей в легких, в то время как глистная инфекция способствовала регенерации тканей.
В легких мы количественно оценили способность хозяина контролировать бактериальную инфекцию (количество поражений, образование многоядерных гигантских клеток [MNGC]), продолжительность и тяжесть инфекции (стадия поражения) и степень повреждения тканей в очагах (наличие минерализации). ), включая неспособность вернуться к нормальной архитектуре ткани (фиброз).После учета продолжительности инфекции BTB у субъектов с низким фенотипом, как правило, было больше поражений легких (таблица 1). Поражения в этой группе животных также со значительно большей вероятностью имели MNGC (таблица 1 и Приложение SI , рис. S2 A ) и находились на значительно более поздней стадии (таблица 1), оба из которых являются индикаторами менее эффективно контролируемая инфекция BTB. Только на один показатель заболевания в легких, наличие фиброза в очагах поражения, повлияла обработка антигельминтами, а не фенотип устойчивости к гельминтам.У леченных животных была более высокая степень фиброза в пределах поражений легких (таблица 1), что позволяет предположить, что лечение было связано с неспособностью обратить вспять повреждение тканей в легких, в то время как глистная инфекция способствовала регенерации тканей.
Влияние антигельминтной терапии, фенотип резистентности к гельминтозам и продолжительность инфекции на тяжесть ВТБ, количественно определяемые макроскопическим и гистопатологическим исследованием легких и респираторных лимфатических узлов
В отличие от легких, прогрессирование ВТБ происходило исключительно в лимфатических узлах связаны со статусом антигельминтного лечения, а не с фенотипом резистентности к гельминтам (табл. 1).Чтобы оценить заболевание лимфатических узлов, мы количественно определили количество респираторных лимфатических узлов с поражениями BTB, а также оценили тяжесть поражения в заглоточном лимфатическом узле (RPLN). В RPLN мы количественно оценили распределение (оценка гранулемы), тяжесть (стадия) и степень повреждения ткани (минерализация, казеозный некроз и образование MNGC). У животных, получавших антигельминтное средство, было значительно меньше положительных лимфатических узлов (таблица 1), а поражения в RPLN были менее выраженными с точки зрения стадии заболевания, с меньшим вовлечением узлов (т. е., более низкая оценка гранулемы) и меньше MNGC (таблица 1 и Приложение SI , рис. S2 B ).
е., более низкая оценка гранулемы) и меньше MNGC (таблица 1 и Приложение SI , рис. S2 B ).
Обсуждение
Наше исследование показало, что устойчивость к глистам, как и коинфекция глистами, влияет на реакцию хозяина на инфекцию BTB. В частности, устойчивые к гельминтам хозяева с естественным низким количеством гельминтов были более серьезно поражены BTB, в то время как хозяева, получавшие антигельминтное лечение с искусственно низким количеством гельминтов, были менее серьезно поражены BTB. Мы также показали, что резистентность к гельминтозам и лечение антигельминтами оказывали разное влияние на прогрессирование заболевания BTB.Эти противоположные и различные эффекты лечения по сравнению с фенотипом устойчивости предполагают, что тяжесть ТБ независимо зависит от временной шкалы реакции хозяина на червей (т. Е. Экологическая [активная инфекция] против эволюционной [генетически обусловленная устойчивость]). Этот вывод также подтверждается нашим открытием, что устойчивые к гельминтам люди, инфицированные BTB, страдали более тяжелым прогрессированием заболевания и более высокой смертностью, даже когда их лечили от глистов. Таким образом, одновременных взаимодействий между червями и ТБ не требовалось для проявления негативных последствий ТБ, вызванных резистентностью.Скорее генетическая изменчивость в устойчивости к червям, вероятно, вызванная историческими эволюционными взаимодействиями между хозяевами и червями (33, 34), оказалась достаточной для создания вариаций в прогрессировании туберкулеза. Вопреки здравому смыслу это означает, что хозяева, которые лучше всего контролируют гельминтов и имеют самые низкие показатели коинфекции гельминтами, могут быть так же скомпрометированы в своей способности контролировать ТБ, как и хозяева с высокой зараженностью гельминтами.
Таким образом, одновременных взаимодействий между червями и ТБ не требовалось для проявления негативных последствий ТБ, вызванных резистентностью.Скорее генетическая изменчивость в устойчивости к червям, вероятно, вызванная историческими эволюционными взаимодействиями между хозяевами и червями (33, 34), оказалась достаточной для создания вариаций в прогрессировании туберкулеза. Вопреки здравому смыслу это означает, что хозяева, которые лучше всего контролируют гельминтов и имеют самые низкие показатели коинфекции гельминтами, могут быть так же скомпрометированы в своей способности контролировать ТБ, как и хозяева с высокой зараженностью гельминтами.
В животноводстве FEC широко используются в качестве показателя устойчивости к глистам (25). У овец, например, FEC являются наследственным признаком, предсказывающим изменчивость антигельминтного иммунитета (35).Мы показали, что фенотип FEC у буйволов был повторяемым, связанным с различиями в антигельминтном иммунитете и связанным с вариациями иммунного гена, который, как известно, играет роль в устойчивости к глистам. В совокупности этот набор данных поддерживает использование фенотипа FEC в качестве показателя устойчивости к червям в нашей популяции. Важно отметить, что наш прокси для устойчивости к червям хорошо предсказывал вариации смертности среди BTB-инфицированных, но не неинфицированных буйволов, предполагая, что фенотип устойчивости к червям и BTB взаимодействуют, приводя к результатам смертности.Кроме того, влияние устойчивости к гельминтам на смертность BTB не зависело от присутствия или количества гельминтов, а двойное влияние устойчивости к гельминтам и статуса лечения было аддитивным, так что люди, которые были одновременно устойчивы к глистам и активно заражены глистами, испытали наибольшую большие затраты на смертность. Аддитивный эффект подразумевает, что взаимодействие червей и туберкулеза может возникать в результате различных процессов.
В совокупности этот набор данных поддерживает использование фенотипа FEC в качестве показателя устойчивости к червям в нашей популяции. Важно отметить, что наш прокси для устойчивости к червям хорошо предсказывал вариации смертности среди BTB-инфицированных, но не неинфицированных буйволов, предполагая, что фенотип устойчивости к червям и BTB взаимодействуют, приводя к результатам смертности.Кроме того, влияние устойчивости к гельминтам на смертность BTB не зависело от присутствия или количества гельминтов, а двойное влияние устойчивости к гельминтам и статуса лечения было аддитивным, так что люди, которые были одновременно устойчивы к глистам и активно заражены глистами, испытали наибольшую большие затраты на смертность. Аддитивный эффект подразумевает, что взаимодействие червей и туберкулеза может возникать в результате различных процессов.
Неперекрывающиеся эффекты резистентности и антигельминтного лечения на патологию BTB подтверждают идею о том, что лечение и резистентность влияют на прогрессирование BTB посредством различных механизмов.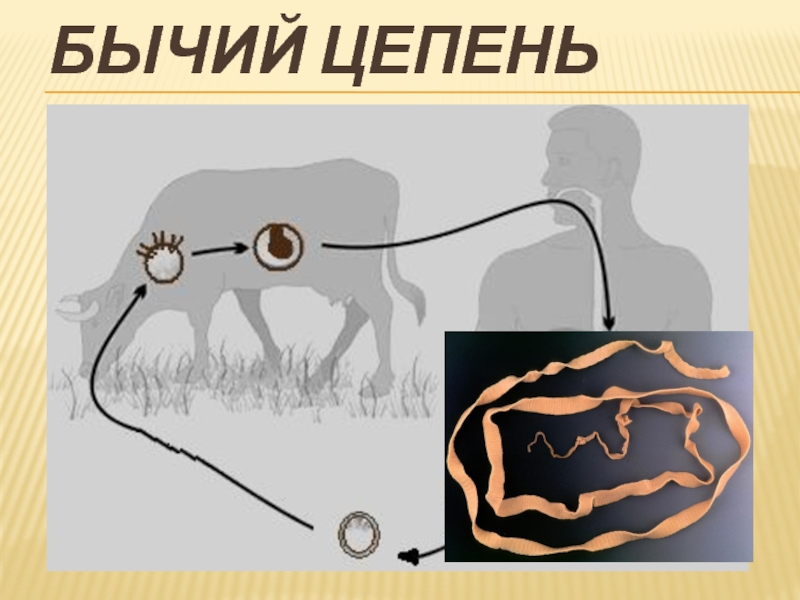 Выявлено, что эффекты гельминтозной резистентности при ВТБ-патологии проявляются преимущественно в легких, тогда как эффекты антигельминтной обработки проявляются преимущественно в лимфатических узлах. Наиболее часто упоминаемый механизм воздействия червей на туберкулез заключается в модуляции иммунного ответа хозяина. В частности, активация иммунных ответов Т-хелперных клеток 2 (Th3) червями и сопутствующее подавление антибактериальных ответов Т-хелперных клеток 1 (Th2) были идентифицированы как центральный механизм, связывающий глистную инфекцию с усилением тяжести ТБ (36⇓⇓–39). ).Совсем недавно индукция альтернативно активированных макрофагов (ААМ) в легких во время коинфекции червями была связана с нарушением контроля над туберкулезом (17, 18). Интересно, что ААМ также связаны с повышенным иммунитетом к глистам (19, 20), а генетическая изменчивость активности аргиназы-1, ключевого фермента, экспрессируемого ААМ, влияет на исход инфекции Mtb даже в отсутствие глистной инфекции (17 , 40).
Выявлено, что эффекты гельминтозной резистентности при ВТБ-патологии проявляются преимущественно в легких, тогда как эффекты антигельминтной обработки проявляются преимущественно в лимфатических узлах. Наиболее часто упоминаемый механизм воздействия червей на туберкулез заключается в модуляции иммунного ответа хозяина. В частности, активация иммунных ответов Т-хелперных клеток 2 (Th3) червями и сопутствующее подавление антибактериальных ответов Т-хелперных клеток 1 (Th2) были идентифицированы как центральный механизм, связывающий глистную инфекцию с усилением тяжести ТБ (36⇓⇓–39). ).Совсем недавно индукция альтернативно активированных макрофагов (ААМ) в легких во время коинфекции червями была связана с нарушением контроля над туберкулезом (17, 18). Интересно, что ААМ также связаны с повышенным иммунитетом к глистам (19, 20), а генетическая изменчивость активности аргиназы-1, ключевого фермента, экспрессируемого ААМ, влияет на исход инфекции Mtb даже в отсутствие глистной инфекции (17 , 40). В совокупности эти наблюдения указывают на потенциальный механистический путь (т.д., уровень активации ААМ), с помощью которого устойчивость к червям может независимо влиять на контроль над ТБ и прогрессирование заболевания.
В совокупности эти наблюдения указывают на потенциальный механистический путь (т.д., уровень активации ААМ), с помощью которого устойчивость к червям может независимо влиять на контроль над ТБ и прогрессирование заболевания.
Идея о том, что активация ААМ может объяснить связь, которую мы обнаружили между резистентностью к червям и прогрессированием заболевания BTB, косвенно подтверждается несколькими нашими гистопатологическими наблюдениями. Во-первых, образование MNGC обычно связано с хроническим воспалением в легких (41), а более тяжелое воспалительное состояние легких, которое мы описали у устойчивых к глистам инфицированных BTB животных ( SI Приложение , рис.S2 A ) отражает наблюдения, что у мышей, инфицированных Mtb , с повышенной активностью аргиназы-1 обнаруживаются более выраженные воспалительные повреждения в легких (17). Во-вторых, воспалительный эффект, опосредованный ААМ, может объяснить, почему мы наблюдали лишь слабую связь между фенотипом резистентности и числом поражений легких, поскольку первичный эффект резистентности к червям должен действовать через патологию, вызванную воспалением, а не через бактериальный контроль. Действительно, если эта гипотеза верна, отсутствие влияния фенотипа устойчивости к гельминтам на прогрессирование BTB в лимфатических узлах может быть прямым следствием менее иммунореактивной среды в лимфатическом узле (что объясняет отсутствие влияния на архитектуру ткани) и ограниченным влиянием на бактериальная репликация (объясняя слабое влияние на диссеминацию бактерий в лимфатические узлы).В-третьих, в противоположность этому, сильное влияние антигельминтной обработки на лимфатические узлы, в частности, уменьшение количества Mb- инфицированных узлов, согласуется с ослаблением индуцированного червями нарушения Th2 при лечении антигельминтной терапией и сопутствующим усилением контроля хозяина. над репликацией бактерий. Вместе эти наблюдения предполагают интригующую роль активации AAM в объяснении эффектов устойчивости к червям на BTB; однако для проверки этой гипотезы необходимы будущие исследования на механистическом уровне.В более широком смысле, понимание вклада генетической изменчивости хозяина в гетерогенность популяций иммунных клеток и того, как это создает асимметрию в исходах заболевания (например, ссылка 42), является неотъемлемой частью определения ряда вероятных механизмов, которые могут объяснить явление, которое мы описываем в этой статье.
Действительно, если эта гипотеза верна, отсутствие влияния фенотипа устойчивости к гельминтам на прогрессирование BTB в лимфатических узлах может быть прямым следствием менее иммунореактивной среды в лимфатическом узле (что объясняет отсутствие влияния на архитектуру ткани) и ограниченным влиянием на бактериальная репликация (объясняя слабое влияние на диссеминацию бактерий в лимфатические узлы).В-третьих, в противоположность этому, сильное влияние антигельминтной обработки на лимфатические узлы, в частности, уменьшение количества Mb- инфицированных узлов, согласуется с ослаблением индуцированного червями нарушения Th2 при лечении антигельминтной терапией и сопутствующим усилением контроля хозяина. над репликацией бактерий. Вместе эти наблюдения предполагают интригующую роль активации AAM в объяснении эффектов устойчивости к червям на BTB; однако для проверки этой гипотезы необходимы будущие исследования на механистическом уровне.В более широком смысле, понимание вклада генетической изменчивости хозяина в гетерогенность популяций иммунных клеток и того, как это создает асимметрию в исходах заболевания (например, ссылка 42), является неотъемлемой частью определения ряда вероятных механизмов, которые могут объяснить явление, которое мы описываем в этой статье. изучать.
изучать.
Независимо от конкретных механизмов, определяющих влияние устойчивости к гельминтам и антигельминтной терапии на прогрессирование заболевания BTB, наши результаты проливают важный свет на природу и сложность взаимодействия червей и туберкулеза в частности и взаимодействия патогенов в целом.Несмотря на неопровержимые лабораторные данные о том, что черви и различные микробы взаимодействуют способами, которые могут быть вредными для хозяев (2, 43), очень мало единого мнения о последствиях этих взаимодействий для исходов заболеваний в реальных популяциях. Наша работа на диких буйволах показывает, что взаимодействия между одной и той же парой патогенов могут возникать в результате процессов, происходящих в очень разных временных масштабах и управляемых потенциально различными лежащими в их основе механизмами. Важно отметить, что как экологические, так и эволюционные явления могут действовать в тандеме, формируя результат взаимодействия патогенов.Например, все животные в нашем исследовании ранее контактировали с глистами. Дикие буйволы подвергаются заражению глистами вскоре после отлучения от груди (средний возраст первого заражения составляет около 9 месяцев), при этом пик заражения глистами приходится на возраст от 3 до 4 лет, после чего они начинают снижаться, вероятно, в результате приобретенного иммунитета ( 44, 45). У домашнего скота воздействие червей вызывает развитие защитного иммунитета, причем уровень защиты зависит от генотипа (27). Точно так же мы предполагаем, что у буйволов воздействие червей в раннем возрасте помогло сформировать наблюдаемую нами степень фенотипической изменчивости устойчивости к червям.Более того, воздействие червей (экологическое явление) взаимодействовало с генотипом хозяина (продукт истории эволюции), что приводило к значительным различиям в том, как буйволы реагировали на инфекцию BTB. Таким образом, экологическое давление со стороны червей имело решающее значение для раскрытия полного негативного эффекта устойчивости к червям, результат, который легко скрыть в лабораторных исследованиях, когда исследуемые животные, как правило, не подвергаются естественным экологическим процессам, таким как предшествующее воздействие патогенов или другие факторы стресса окружающей среды, которые могут увеличить различия между лица (46).
Дикие буйволы подвергаются заражению глистами вскоре после отлучения от груди (средний возраст первого заражения составляет около 9 месяцев), при этом пик заражения глистами приходится на возраст от 3 до 4 лет, после чего они начинают снижаться, вероятно, в результате приобретенного иммунитета ( 44, 45). У домашнего скота воздействие червей вызывает развитие защитного иммунитета, причем уровень защиты зависит от генотипа (27). Точно так же мы предполагаем, что у буйволов воздействие червей в раннем возрасте помогло сформировать наблюдаемую нами степень фенотипической изменчивости устойчивости к червям.Более того, воздействие червей (экологическое явление) взаимодействовало с генотипом хозяина (продукт истории эволюции), что приводило к значительным различиям в том, как буйволы реагировали на инфекцию BTB. Таким образом, экологическое давление со стороны червей имело решающее значение для раскрытия полного негативного эффекта устойчивости к червям, результат, который легко скрыть в лабораторных исследованиях, когда исследуемые животные, как правило, не подвергаются естественным экологическим процессам, таким как предшествующее воздействие патогенов или другие факторы стресса окружающей среды, которые могут увеличить различия между лица (46).
Наконец, наши результаты могут иметь решающее значение для полного понимания динамики коинфекции и последствий для контроля над заболеванием. Для ТБ учет взаимодействий червей и ТБ, обусловленных процессами, действующими в эволюционной шкале времени, может помочь согласовать несоответствия в эмпирических закономерностях (например, ссылка 15), которые в настоящее время рассматриваются исключительно через призму экологического времени. Есть также разветвления для борьбы с болезнями. Например, у людей учет закономерностей генетической изменчивости устойчивости к глистам может предоставить новые цели для поиска биомаркеров прогрессирования заболевания туберкулезом, тогда как у домашнего скота селекция на устойчивость к глистам становится все более необходимой альтернативой использованию противогельминтных препаратов (25). , может быть экономически целесообразно понять, связана ли селекция на устойчивость с непредвиденными затратами на здоровье, связанными с BTB.
Материалы и методы
Протоколы на животных для этого исследования были одобрены комитетами по уходу и использованию животных Университета Джорджии и Университета штата Орегон (UGA AUP № A2010 10-190-Y3-A5; OSU AUP № 3822 и 4325). ).
).
Отлов животных.
Мы отловили самку африканского буйвола ( S. caffer ) в южной части КНП, Южная Африка, в период с июня 2008 г. по август 2012 г. транспортное средство.Животные были отловлены из двух стад в разных местах: стада Крокодилового моста (CB) и соседнего стада Нижней Саби (LS). При первоначальном отлове мы случайным образом распределили животных в группу лечения антигельминтными препаратами (болюс фенбендазола; Intervet) или группу без лечения. Особи, потерянные из-за смерти или эмиграции во время исследования, были заменены, а замены были отнесены к той же экспериментальной группе, что и исходное животное. Животных отлавливали в среднем шесть раз (диапазон: от двух до девяти раз), и при всех отловах мы собирали образцы фекалий и крови для мониторинга заражения червями и статуса заражения BTB соответственно.Мы оценили возраст каждого животного, как описано в исх. 47. В начале исследования средний возраст исследуемых животных составлял 4 года (диапазон: от 1,4 до 11 лет). В общей сложности мы наблюдали за 209 уникальными людьми, которые были BTB-отрицательными в начале исследования и для которых были доступны данные о заражении червями при первоначальном захвате.
В общей сложности мы наблюдали за 209 уникальными людьми, которые были BTB-отрицательными в начале исследования и для которых были доступны данные о заражении червями при первоначальном захвате.
Глистная инфекция, резистентность и иммунитет.
Сообщество желудочно-кишечных червей буйвола в нашем исследовании состояло как минимум из семи видов нематод: Cooperia Fuelleborni , Haemonchus placei , Haemonchus bedfordi , Parabronema ., TrichoStrongylus Sp., Африканский африканский Гигантик и Африканский сборник , преобладающих сильными нематодами C. Топливноборные , г. Placei и H. Bedfordi (24). Препарат фенбендазол высокоэффективен против стронгилезных нематод (48), и выборка летальных исходов у подмножества наших исследуемых животных показала, что лечение болюсом фенбендазола с медленным высвобождением почти устраняло взрослых гельминтов в желудочно-кишечном тракте обработанных животных на срок до 200 дней. 49).У живых животных мы отслеживали статус заражения стронгилезом, используя образцы фекалий, собранные при отлове. Фекалии собирали непосредственно из прямой кишки обездвиженных животных, хранили на льду в полевых условиях и обрабатывали в тот же день. Мы количественно определили выход яиц нематод, используя модификацию метода подсчета фекальных яиц McMaster с чувствительностью 50 яиц на грамм фекалий (50). Яйца нематод Strongyle не различимы на уровне видов, поэтому наши FEC отражают выход всех видов нематод вместе взятых.Тем не менее подсчет яиц дает точное представление об общем количестве взрослых червей в нашей популяции буйволов (24), и, как и в случае со взрослыми червями, наш режим антигельминтной обработки эффективно снижал выделение яиц червей у подопытных на протяжении всего исследования, так что только 8% образцов фекалий собранные у обработанных буйволов в течение среднего интервала повторной отлова примерно 180 дней, содержали яйца червей, по сравнению с 55% у необработанных буйволов (23).
49).У живых животных мы отслеживали статус заражения стронгилезом, используя образцы фекалий, собранные при отлове. Фекалии собирали непосредственно из прямой кишки обездвиженных животных, хранили на льду в полевых условиях и обрабатывали в тот же день. Мы количественно определили выход яиц нематод, используя модификацию метода подсчета фекальных яиц McMaster с чувствительностью 50 яиц на грамм фекалий (50). Яйца нематод Strongyle не различимы на уровне видов, поэтому наши FEC отражают выход всех видов нематод вместе взятых.Тем не менее подсчет яиц дает точное представление об общем количестве взрослых червей в нашей популяции буйволов (24), и, как и в случае со взрослыми червями, наш режим антигельминтной обработки эффективно снижал выделение яиц червей у подопытных на протяжении всего исследования, так что только 8% образцов фекалий собранные у обработанных буйволов в течение среднего интервала повторной отлова примерно 180 дней, содержали яйца червей, по сравнению с 55% у необработанных буйволов (23).
Чтобы максимизировать нашу способность различать сигналы в схемах выделения гельминтов буйвола при анализе с переменными размерами выборки, мы использовали неконтролируемый подход машинного обучения для выявления статистически различимых групп в данных FEC, что позволило нам разделить людей на две дискретные яйца червя- выпадение фенотипов.Мы использовали смешанную модель Гаусса, реализованную в пакете mclust v5 (51) в R версии 3.4.3, для идентификации кластеров в наборе данных FEC, который включал уровень выделения яиц червей каждого субъекта исследования только при начальном захвате. Параметры модели были оценены с использованием алгоритма максимизации ожидания, а оптимальная модель была выбрана с использованием байесовских информационных критериев (BIC). Модель, которая максимизирует BIC, считается оптимальной, поскольку она представляет собой модель с наивысшей интегрированной вероятностью (52).Были сопоставлены все возможные модели, включая до девяти кластеров с двумя различными структурами ковариации (E и V). Оптимальная модель имела семь кластеров (логарифм правдоподобия = -1221,863, n = 209, степени свободы = 14, BIC = -2518,518), при этом 126 из 209 человек были помещены в первый кластер, представляющий FEC от 0 до 50, и 83 особи, помещенные во все остальные кластеры, представляющие FEC от 100 до 850 ( Приложение SI , рис. S1 A — C ). На основании этих результатов мы разделили животных на две категории FEC (т.т. е., фенотипы устойчивости к глистам), «низкая» и «высокая», которые отделяют животных, которые не выделяют или очень мало яиц червя (от 0 до 50), самый низкий статистически различимый кластер FEC, от тех, которые выделяют большее количество яиц червя. (≥100). Наконец, мы подтвердили, что эти два фенотипа резистентности были связаны с различиями в иммунологической резистентности к глистам, проверяя связь между фенотипом и ключевыми иммунологическими реакциями слизистой оболочки на инфекцию глистами: количеством эозинофилов, тучных клеток и общей секрецией IgA в желудочно-кишечном тракте.
Оптимальная модель имела семь кластеров (логарифм правдоподобия = -1221,863, n = 209, степени свободы = 14, BIC = -2518,518), при этом 126 из 209 человек были помещены в первый кластер, представляющий FEC от 0 до 50, и 83 особи, помещенные во все остальные кластеры, представляющие FEC от 100 до 850 ( Приложение SI , рис. S1 A — C ). На основании этих результатов мы разделили животных на две категории FEC (т.т. е., фенотипы устойчивости к глистам), «низкая» и «высокая», которые отделяют животных, которые не выделяют или очень мало яиц червя (от 0 до 50), самый низкий статистически различимый кластер FEC, от тех, которые выделяют большее количество яиц червя. (≥100). Наконец, мы подтвердили, что эти два фенотипа резистентности были связаны с различиями в иммунологической резистентности к глистам, проверяя связь между фенотипом и ключевыми иммунологическими реакциями слизистой оболочки на инфекцию глистами: количеством эозинофилов, тучных клеток и общей секрецией IgA в желудочно-кишечном тракте. 27, 53).
27, 53).
Мы количественно оценили иммунный ответ желудочно-кишечного тракта на червей, сосредоточив внимание на сычуге и тонкой кишке (тощей кишке), двух основных местах инфекции для наших очаговых видов нематод. Ткань желудочно-кишечного тракта собирали у подгруппы исследуемых животных, убитых и вскрытых по завершении исследования. Убой проводился в рамках программы наблюдения KNP BTB и осуществлялся в соответствии со стандартной операционной процедурой KNP. Количество эозинофилов регистрировали путем исследования стандартных фиксированных формалином, залитых парафином срезов сычуга и срезов ткани проксимального отдела тощей кишки (толщиной 8 мм), окрашенных гематоксилином и эозином.Для тучных клеток реплики одних и тех же срезов ткани окрашивали красителем Гимза, а затем подсчитывали. Наличие эозинофильных гранул и полиморфного ядра позволило идентифицировать эозинофилы, а наличие метахроматических гранул облегчило идентификацию тучных клеток (53). Количество эозинофилов и тучных клеток представлено как количество клеток на 10 случайных полей зрения при высоком увеличении на собственной пластинке ворсинок, что эквивалентно количеству клеток на 2 мм 2 .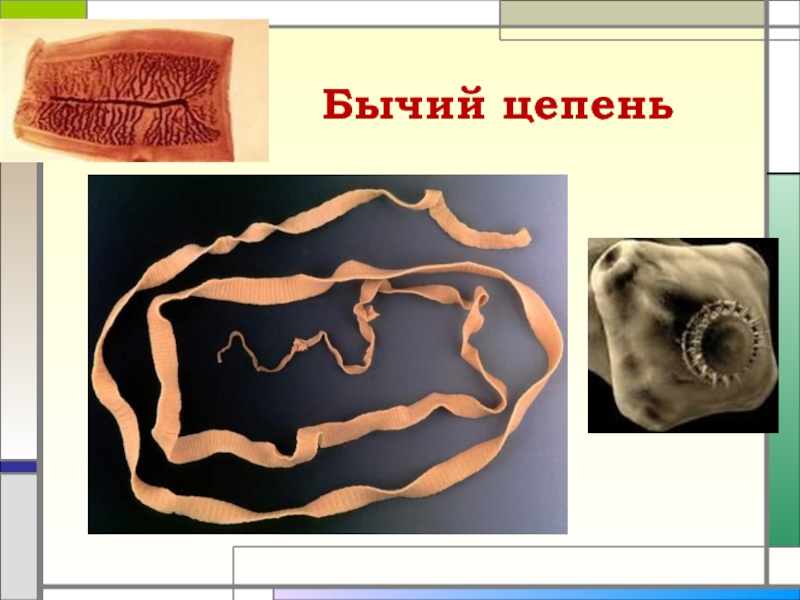
Продукцию IgA измеряли с помощью иммуногистохимии.В этом случае фиксированные формалином, залитые парафином срезы сычуга и проксимального отдела тощей кишки депарафинизировали, регидратировали и инкубировали с разбавленным (1:800) кроличьим первичным антителом против бычьего IgA в течение 1 ч (A10-108A; лаборатории). После 30-минутной инкубации с биотинилированным универсальным козьим линком (Dako) визуализацию комплексов антиген-антитело получали путем 10-минутной инкубации со стрептавидином, конъюгированной с пероксидазой хрена (Biocare), с последующей 5-минутной инкубацией с диаминобензидин-пероксидазой ( Лаборатории Вектора).Для отрицательного контроля мы применили тот же протокол к участкам сычуга и тонкой кишки, но заменили первичное антитело фосфатно-солевым буфером. В качестве положительного контроля мы использовали срезы тощей кишки и брыжеечных лимфатических узлов домашнего скота, инфицированного Haemonchus sp. и Cooperia sp. В отрицательном контроле не было обнаружено окрашивания, а в положительном контроле всегда наблюдалось заметное цитоплазматическое окрашивание энтероцитов крипт, плазматических клеток и других лейкоцитов. Продукция IgA в слизистой оболочке оценивалась по количеству IgA-позитивных лейкоцитов в 10 случайно выбранных полях микроскопа (400×) вдоль кишечных ворсинок и крипт (54). Мы сравнили иммунитет кишечника у животных с высоким и низким FEC, используя данные о нелеченых животных, которые не получали антигельминтное лечение. Для сычужного иммунитета мы использовали данные от 14 животных (семь с высоким FEC, семь с низким FEC), а для кишечного иммунитета мы использовали данные от 12 животных (шесть с высоким FEC, шесть с низким FEC). Поскольку люди могут приобретать иммунитет с возрастом, мы подтвердили, что подгруппа животных, использованных для обоих анализов, не различалась по возрасту на момент отбора проб (средний возраст иммунитета сычуга [диапазон]: высокий = 7.3 [от 5,4 до 9,8] лет, низкий = 7,4 [от 5,5 до 9,5] лет; t тест: n = 14, t = -0,12, P = 0,9; средний возраст кишечного иммунитета [диапазон]: высокий = 7,3 [от 5,4 до 9,8] лет, низкий = 7,4 [от 5,5 до 9,5] лет; t тест: n = 12, t = -0,08, P = 0,93).
Продукция IgA в слизистой оболочке оценивалась по количеству IgA-позитивных лейкоцитов в 10 случайно выбранных полях микроскопа (400×) вдоль кишечных ворсинок и крипт (54). Мы сравнили иммунитет кишечника у животных с высоким и низким FEC, используя данные о нелеченых животных, которые не получали антигельминтное лечение. Для сычужного иммунитета мы использовали данные от 14 животных (семь с высоким FEC, семь с низким FEC), а для кишечного иммунитета мы использовали данные от 12 животных (шесть с высоким FEC, шесть с низким FEC). Поскольку люди могут приобретать иммунитет с возрастом, мы подтвердили, что подгруппа животных, использованных для обоих анализов, не различалась по возрасту на момент отбора проб (средний возраст иммунитета сычуга [диапазон]: высокий = 7.3 [от 5,4 до 9,8] лет, низкий = 7,4 [от 5,5 до 9,5] лет; t тест: n = 14, t = -0,12, P = 0,9; средний возраст кишечного иммунитета [диапазон]: высокий = 7,3 [от 5,4 до 9,8] лет, низкий = 7,4 [от 5,5 до 9,5] лет; t тест: n = 12, t = -0,08, P = 0,93).
Генетика устойчивости к гельминтозам.
Чтобы проверить генетическую основу фенотипов устойчивости к червям, характерных для нашей исследуемой популяции, мы собрали образцы тканей буйвола и хранили их в силикагеле при комнатной температуре до 24 месяцев до выделения ДНК.ДНК выделяли из образцов тканей с использованием набора Qiagen Blood & Tissue Kit в соответствии с протоколом производителя. Образцы ДНК были генотипированы по микросателлитному локусу BL4, расположенному примерно на 3 сМ выше гена гамма-интерферона (31). BL4 и другие микросателлиты в этой области хромосом связаны с устойчивостью к нематодам у овец (28, 29, 55, 56). Локус BL4 также ранее был связан с устойчивостью к нематодам у африканских буйволов (30). Генотипирование проводили с помощью ПЦР и визуализации флуоресцентно меченых фрагментов ДНК на автоматическом капиллярном секвенаторе ABI3130xl (Applied Biosystems), как описано в ссылке.31. Размеры аллелей определяли с использованием лестницы ABI GS600LIZ (Applied Biosystems). Хроматограммы были проанализированы двумя независимыми специалистами с использованием GeneMapper v3.7. Тесты на наличие нулевых аллелей и отклонений от пропорций Харди-Вайнберга (HWP) показали отсутствие нулевых аллелей в BL4 и отклонений от HWP (31).
Хроматограммы были проанализированы двумя независимыми специалистами с использованием GeneMapper v3.7. Тесты на наличие нулевых аллелей и отклонений от пропорций Харди-Вайнберга (HWP) показали отсутствие нулевых аллелей в BL4 и отклонений от HWP (31).
ВТБ-инфекция и прогрессирование заболевания.
Мы тестировали буйволов на BTB при каждой отлове с помощью анализа гамма-интерферона цельной крови (IFNγ) (BOVIGAM), проводимого в соответствии с инструкциями производителя.Мы использовали бычий и птичий туберкулин в качестве стимуляторов высвобождения IFNγ in vitro в образцах крови буйволов. Тесты BTB считались отрицательными, если показания оптической плотности для образцов, стимулированных бычьим туберкулином, были ниже порогового значения 0,375, и положительными при показаниях 0,375 или выше. Тесты также считались отрицательными, если показания оптической плотности проб, стимулированных бычьим туберкулином, не превышали показания проб, стимулированных птичьим туберкулином, не менее чем на 10% из-за вероятной перекрестной реактивности при воздействии Mycobacterium avium . Этот тестовый протокол обеспечивает специфичность ~93,5% и чувствительность 85,4% (57). Для каждого буйвола мы использовали временные ряды от двух до девяти результатов тестов, чтобы классифицировать статус конверсии BTB. Для каждого животного каждый тест интерпретировали в контексте полного временного ряда результатов, чтобы повысить уверенность в нашем присвоении статуса инфекции BTB (подробности см. в ссылке 23).
Этот тестовый протокол обеспечивает специфичность ~93,5% и чувствительность 85,4% (57). Для каждого буйвола мы использовали временные ряды от двух до девяти результатов тестов, чтобы классифицировать статус конверсии BTB. Для каждого животного каждый тест интерпретировали в контексте полного временного ряда результатов, чтобы повысить уверенность в нашем присвоении статуса инфекции BTB (подробности см. в ссылке 23).
Для количественной оценки прогрессирования BTB мы провели макроскопические и гистопатологические исследования убитых животных. Сначала животных подвергали вскрытию для оценки распределения макроскопических поражений BTB в легких и респираторных лимфатических узлах (нижнечелюстных, околоушных, небных миндалин, заглоточных, каудальных медиастинальных и трахеобронхиальных).Вскрытие проводилось ветеринарами Ветеринарной службы дикой природы национальных парков Южной Африки и Государственной ветеринарной службы Южной Африки в соответствии со стандартными протоколами обнаружения BTB у буйволов (58). Во время некропсии мы серийно делали срезы бронхов и RPLN от каждого выбракованного буйвола с интервалом в 1 см для исследования туберкулезных или других поражений и сразу же помещали срезы размером 2 × 2 × 0,5 см из каждого лимфатического узла (с поражениями или без). в 10% нейтральном забуференном формалине (НБФ). Мы тщательно исследовали легкие, составили схему и измерили все поражения BTB.Мы взяли срез размером 2 × 2 × 0,5 см с края самого большого легочного поражения каждого животного в 10% NBF. У животных без поражений туберкулезом мы собрали репрезентативный срез легкого в 10% NBF. Все ткани, фиксированные формалином, обычно обрабатывали для гистопатологии и окрашивали гематоксилином и эозином. Гистологические срезы исследовал сертифицированный ветеринарный патологоанатом, который не знал об экспериментальных группах. Срезы всех тканей с туберкулезными гранулемами исследовали на примерный процент участка, пораженного гранулематозным воспалением, и процент некротического поражения.
Во время некропсии мы серийно делали срезы бронхов и RPLN от каждого выбракованного буйвола с интервалом в 1 см для исследования туберкулезных или других поражений и сразу же помещали срезы размером 2 × 2 × 0,5 см из каждого лимфатического узла (с поражениями или без). в 10% нейтральном забуференном формалине (НБФ). Мы тщательно исследовали легкие, составили схему и измерили все поражения BTB.Мы взяли срез размером 2 × 2 × 0,5 см с края самого большого легочного поражения каждого животного в 10% NBF. У животных без поражений туберкулезом мы собрали репрезентативный срез легкого в 10% NBF. Все ткани, фиксированные формалином, обычно обрабатывали для гистопатологии и окрашивали гематоксилином и эозином. Гистологические срезы исследовал сертифицированный ветеринарный патологоанатом, который не знал об экспериментальных группах. Срезы всех тканей с туберкулезными гранулемами исследовали на примерный процент участка, пораженного гранулематозным воспалением, и процент некротического поражения. Срезы легких оценивали на предмет стадии гранулемы (59), наличия или отсутствия минерализации, фиброза и многоядерных гигантских клеток. Срезы RPLN оценивали по стадии (59), степени гранулемы (1 = очаговая, 2 = многоочаговая, 3 = сливающаяся, 4 = большая часть среза), а также наличие или отсутствие минерализации, казеозного некроза и многоядерных гигантских клеток. Мы провели макроскопические и гистопатологические исследования 34 животных (18 с высоким FEC, 16 с низким FEC; 21 пролеченный, 13 нелеченый), которые дали положительный результат на BTB с помощью анализа BOVIGAM.Ни высокие, ни низкие, ни леченые и нелеченые подгруппы животных не различались по возрасту на момент исследования ( t тест: высокий-низкий, t = -0,99, P = 0,33; леченные-нелеченные, t = -1,37, P = 0,18).
Срезы легких оценивали на предмет стадии гранулемы (59), наличия или отсутствия минерализации, фиброза и многоядерных гигантских клеток. Срезы RPLN оценивали по стадии (59), степени гранулемы (1 = очаговая, 2 = многоочаговая, 3 = сливающаяся, 4 = большая часть среза), а также наличие или отсутствие минерализации, казеозного некроза и многоядерных гигантских клеток. Мы провели макроскопические и гистопатологические исследования 34 животных (18 с высоким FEC, 16 с низким FEC; 21 пролеченный, 13 нелеченый), которые дали положительный результат на BTB с помощью анализа BOVIGAM.Ни высокие, ни низкие, ни леченые и нелеченые подгруппы животных не различались по возрасту на момент исследования ( t тест: высокий-низкий, t = -0,99, P = 0,33; леченные-нелеченные, t = -1,37, P = 0,18).
Буйвол Смертность.
На всех исследуемых животных были надеты радиоошейники, поэтому мы постоянно отслеживали активность всех особей для выявления случаев естественной смертности. Для всех возможных случаев смертности мы искали ошейники, связанные с этими случаями, чтобы определить судьбу животного.Смертность была подтверждена в 50 из 67 случаев, и по возможности была установлена причина смерти (например, хищничество). Три случая смерти, которые были сочтены связанными с отловом (например, нападение льва сразу после освобождения пойманного животного), были исключены из набора данных. Для каждого события смертности в качестве даты смерти была назначена дата последней зарегистрированной активности ошейника.
Для всех возможных случаев смертности мы искали ошейники, связанные с этими случаями, чтобы определить судьбу животного.Смертность была подтверждена в 50 из 67 случаев, и по возможности была установлена причина смерти (например, хищничество). Три случая смерти, которые были сочтены связанными с отловом (например, нападение льва сразу после освобождения пойманного животного), были исключены из набора данных. Для каждого события смертности в качестве даты смерти была назначена дата последней зарегистрированной активности ошейника.
Статистические анализы: повторяемость FEC и фенотип устойчивости к глистам.
Чтобы изучить степень, в которой буйволы демонстрировали постоянство уровня выделения яиц глистов с течением времени, мы оценили повторяемость ( R ) как непрерывного FEC [log 10 (FEC) + 1], так и категориального выделения яиц глистов. фенотип (высокий FEC или низкий FEC).Мы оценили повторяемость FEC и фенотипа червя, используя методы линейной смешанной модели (LMM) (гауссова) и обобщенного LMM (бинарного), соответственно, реализованные с помощью пакета rptR (60) в R версии 3. 4.3. Доверительные интервалы оценивались с использованием 1000 параметрических бутстрапов. Для бинарной повторяемости мы представляем R как аппроксимацию логит-шкалы связи, которая обеспечивает лучшую оценку лежащей в основе склонности человека к выражению высокого или низкого FEC. Для обоих анализов повторяемости мы ограничили наши анализы подмножеством буйволов, не получавших антигельминтное лечение ( n = 103 особи, 651 наблюдение), чтобы оценить уровни естественной согласованности выделения гельминтов в отсутствие антигельминтного лечения, которое мы ожидали. нарушать закономерности откладывания яиц.
4.3. Доверительные интервалы оценивались с использованием 1000 параметрических бутстрапов. Для бинарной повторяемости мы представляем R как аппроксимацию логит-шкалы связи, которая обеспечивает лучшую оценку лежащей в основе склонности человека к выражению высокого или низкого FEC. Для обоих анализов повторяемости мы ограничили наши анализы подмножеством буйволов, не получавших антигельминтное лечение ( n = 103 особи, 651 наблюдение), чтобы оценить уровни естественной согласованности выделения гельминтов в отсутствие антигельминтного лечения, которое мы ожидали. нарушать закономерности откладывания яиц.
Влияние исходного фенотипа червя на откладывание яиц с течением времени и взаимодействие с антигельминтной обработкой.
Чтобы оценить, предсказывает ли фенотип червя (низкий или высокий) при первоначальном отлове животного выделение яиц червя в ходе исследования и как это связано с антигельминтной обработкой, мы проверили влияние фенотипа червя при отлове № 1 на ФЭК. при захватах № 2- n с использованием LMM. Идентификатор животного был включен в модель как случайный эффект, а также статус лечения (необработанные, обработанные), возраст, стадо (CB, LS, Other), сезон (ранняя сушка, поздняя сушка, ранняя влажная, поздняя влажная) и интервал отлова. (время с момента последнего захвата) были включены в качестве фиксированных эффектов.Мы учитывали лечение и взаимодействие между фенотипом червя и лечением, поскольку наша предыдущая работа показала, что лечение значительно влияет на скорость откладывания яиц (23). Возраст, стадо и сезон были включены в качестве предикторов, поскольку эти факторы, вероятно, связаны с различиями в воздействии червей и имеют известное влияние на выделение яиц червей у буйволов (23). Наконец, мы включили интервал отлова, чтобы учесть переменное повторное накопление паразитов у обработанных животных, отловленных с разной продолжительностью интервала.Перед анализом мы нормализовали распределение зависимой переменной (FEC) с помощью логарифмического преобразования.
при захватах № 2- n с использованием LMM. Идентификатор животного был включен в модель как случайный эффект, а также статус лечения (необработанные, обработанные), возраст, стадо (CB, LS, Other), сезон (ранняя сушка, поздняя сушка, ранняя влажная, поздняя влажная) и интервал отлова. (время с момента последнего захвата) были включены в качестве фиксированных эффектов.Мы учитывали лечение и взаимодействие между фенотипом червя и лечением, поскольку наша предыдущая работа показала, что лечение значительно влияет на скорость откладывания яиц (23). Возраст, стадо и сезон были включены в качестве предикторов, поскольку эти факторы, вероятно, связаны с различиями в воздействии червей и имеют известное влияние на выделение яиц червей у буйволов (23). Наконец, мы включили интервал отлова, чтобы учесть переменное повторное накопление паразитов у обработанных животных, отловленных с разной продолжительностью интервала.Перед анализом мы нормализовали распределение зависимой переменной (FEC) с помощью логарифмического преобразования. Модель запускалась с использованием R-пакетов lme4 и lmerTest. Достоверность модели оценивали путем визуального осмотра остатков, как описано в (61). Функция difflsmeans в lmerTest использовалась для проверки значительных различий между средними значениями методом наименьших квадратов. Значения P были скорректированы для множественных сравнений с использованием метода Холма, реализованного с помощью функции p.adjust в пакете stats.
Модель запускалась с использованием R-пакетов lme4 и lmerTest. Достоверность модели оценивали путем визуального осмотра остатков, как описано в (61). Функция difflsmeans в lmerTest использовалась для проверки значительных различий между средними значениями методом наименьших квадратов. Значения P были скорректированы для множественных сравнений с использованием метода Холма, реализованного с помощью функции p.adjust в пакете stats.
Связь между фенотипом резистентности к глистам и иммунитетом желудочно-кишечного тракта и генотипом BL4.
Мы проверили связь между фенотипом устойчивости к глистам (высокий FEC против низкого FEC) и иммунными реакциями желудочно-кишечного тракта с использованием критерия суммы рангов Уилкоксона. Этот анализ был сосредоточен только на буйволах, не получавших антигельминтное лечение, и мы оценили влияние высокого и низкого статуса на количество эозинофилов, тучных клеток и выработку IgA в сычуге и тонком кишечнике. Мы проверили связь между фенотипом устойчивости к червям и аллельными вариациями в локусе BL4 (наличие/отсутствие аллелей 141 и 167) с использованием тестов χ 2 . Мы также использовали критерий суммы рангов Уилкоксона, чтобы проверить, связано ли присутствие двух аллелей BL4 с различиями в FEC при начальном захвате. Для этих анализов на основе генотипа мы включили всех отобранных особей (нелеченных и обработанных антигельминтными средствами), поскольку лечение не должно было влиять на фенотип червя (который был классифицирован при первоначальном отлове до первой обработки) или генотип.
Мы также использовали критерий суммы рангов Уилкоксона, чтобы проверить, связано ли присутствие двух аллелей BL4 с различиями в FEC при начальном захвате. Для этих анализов на основе генотипа мы включили всех отобранных особей (нелеченных и обработанных антигельминтными средствами), поскольку лечение не должно было влиять на фенотип червя (который был классифицирован при первоначальном отлове до первой обработки) или генотип.
Влияние фенотипа резистентности к червям на вероятность заражения ВТБ и смертность.
Чтобы изучить влияние фенотипа устойчивости к гельминтам на вероятность инфицирования BTB с учетом статуса антигельминтного лечения, мы добавили статус устойчивости (высокий FEC по сравнению снизкий FEC) и возраст при первом включении в качестве ковариантов в многомерную модель пропорциональных рисков, которая ранее использовалась для проверки влияния антигельминтной обработки на риск инфицирования BTB (см. ссылку 23). Модель включала фенотип устойчивости к глистам, лечение, исходное стадо и возраст в качестве предикторов. Вероятность заражения ВТБ оценивали как время от первоначального отлова животного до заражения ВТБ или до последнего теста на ВТБ. Включение термина взаимодействия между статусом обработки и фенотипом устойчивости к глистам не оказало качественного влияния на результаты модели, поэтому мы не сообщаем о модели взаимодействия.Наш анализ включал 195 человек с известными историями заражения BTB, которые также были охарактеризованы по фенотипу червя при первоначальном захвате. Данные о лицах, которые не дали положительный результат на ВТБ к концу периода исследования или покинули исследование из-за смерти или эмиграции, подверглись цензуре справа. Метод Эфрона использовался для устранения совпадений во времени событий, а обоснованность предположения о пропорциональных опасностях была проверена с использованием остатков Шенфельда (фенотип червя, низкий: χ 2 = 0,048, P = 0.826, Лечение, управление: χ 2 = 0.241, p = 0,623, стадо, ls: χ 2 = 0,014, p = 0,906, Возраст: χ 2 = 1,59, p = 0.
Вероятность заражения ВТБ оценивали как время от первоначального отлова животного до заражения ВТБ или до последнего теста на ВТБ. Включение термина взаимодействия между статусом обработки и фенотипом устойчивости к глистам не оказало качественного влияния на результаты модели, поэтому мы не сообщаем о модели взаимодействия.Наш анализ включал 195 человек с известными историями заражения BTB, которые также были охарактеризованы по фенотипу червя при первоначальном захвате. Данные о лицах, которые не дали положительный результат на ВТБ к концу периода исследования или покинули исследование из-за смерти или эмиграции, подверглись цензуре справа. Метод Эфрона использовался для устранения совпадений во времени событий, а обоснованность предположения о пропорциональных опасностях была проверена с использованием остатков Шенфельда (фенотип червя, низкий: χ 2 = 0,048, P = 0.826, Лечение, управление: χ 2 = 0.241, p = 0,623, стадо, ls: χ 2 = 0,014, p = 0,906, Возраст: χ 2 = 1,59, p = 0.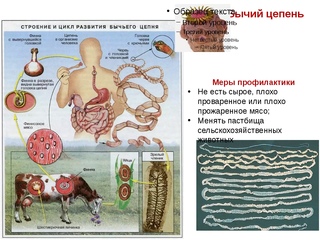 207 , глобальная модель: χ 2 = 2,566, P = 0,633). Регрессионные модели Кокса и остаточные проверки были выполнены в R с пакетом выживания. HR, CI и тесты отношения правдоподобия для модели приведены в SI, Приложение , Таблица S3. HR для переменной фенотипа устойчивости к червям (т.т. е., высокий FEC по сравнению с низким FEC) представляет собой мгновенную вероятность того, что индивидуум с низким FEC более или менее вероятен, чем индивидуум с высоким FEC, приобрести BTB.
207 , глобальная модель: χ 2 = 2,566, P = 0,633). Регрессионные модели Кокса и остаточные проверки были выполнены в R с пакетом выживания. HR, CI и тесты отношения правдоподобия для модели приведены в SI, Приложение , Таблица S3. HR для переменной фенотипа устойчивости к червям (т.т. е., высокий FEC по сравнению с низким FEC) представляет собой мгновенную вероятность того, что индивидуум с низким FEC более или менее вероятен, чем индивидуум с высоким FEC, приобрести BTB.
Мы использовали аналогичную процедуру моделирования, чтобы проверить влияние фенотипа устойчивости к червям на риск смертности для людей, инфицированных BTB. В этом случае многомерная модель включала в качестве предикторов фенотип резистентности к червям, лечение, стадо и возраст при первом отлове. Модель, включающая взаимосвязь между статусом лечения и фенотипом устойчивости к глистам, не поддается определению из-за небольшого размера выборки.Для всех BTB-позитивных с известной судьбой, которые были охарактеризованы для фенотипа червя при первоначальном захвате ( n = 56), мы использовали время от конверсии BTB либо до смерти, либо до окончания исследования в качестве переменной ответа. Цензуре подвергались животные, не погибшие к концу исследования или выведенные из исследования по другим причинам (например, эмиграция из района исследования). Четыре BTB-положительных особи, которые преобразовались во время их последней поимки, были усечены из набора данных. Проверка остатков Шенфельда подтвердила предположения о пропорциональных опасностях (фенотип червя, низкий: χ 2 = 3.344, P = 0,0675, Лечение, Управление: χ 2 = 0.113, p = 0,7363, Стадо, ls: χ 2 = 0,645, p = 0,4217, Возраст: χ 2 = 0,267 , P = 0,6052, глобальная модель: χ 2 = 6,307, P = 0,1774). HR с доверительными интервалами и тестами отношения правдоподобия представлены в SI, Приложение , Таблица S4.
Цензуре подвергались животные, не погибшие к концу исследования или выведенные из исследования по другим причинам (например, эмиграция из района исследования). Четыре BTB-положительных особи, которые преобразовались во время их последней поимки, были усечены из набора данных. Проверка остатков Шенфельда подтвердила предположения о пропорциональных опасностях (фенотип червя, низкий: χ 2 = 3.344, P = 0,0675, Лечение, Управление: χ 2 = 0.113, p = 0,7363, Стадо, ls: χ 2 = 0,645, p = 0,4217, Возраст: χ 2 = 0,267 , P = 0,6052, глобальная модель: χ 2 = 6,307, P = 0,1774). HR с доверительными интервалами и тестами отношения правдоподобия представлены в SI, Приложение , Таблица S4.
Чтобы убедиться, что влияние фенотипа устойчивости к червям на смертность буйволов, которое мы наблюдали, было ограничено BTB-положительными особями и не было характерно для BTB-отрицательных особей, мы также исследовали предикторы риска смертности у BTB-отрицательных буйволов. Было 116 BTB-отрицательных животных с известной судьбой и характеристиками фенотипа червя. Для этих людей мы использовали время от первоначального захвата до смерти или окончания исследования в качестве соответствующей переменной ответа. Животные, не погибшие к концу исследования или исключенные из исследования по другим причинам, подвергались цензуре справа. Многомерная модель пропорциональных рисков имела ту же структуру, что и модель для BTB-положительных лиц ( SI, Приложение , Таблица S5). Остаточные проверки подтвердили предположения о пропорциональных опасностях для этой модели (фенотип червя, низкий: χ 2 = 0.085, p = 0,771, Лечение, Управление: χ 2 = 0.105, p = 0,706, Стадо, ls: χ 2 = 0,702, p = 0,402, Возраст: χ 2 = 0,156 , P = 0,693, глобальная модель: χ 2 = 1,076, P = 0,898).
Было 116 BTB-отрицательных животных с известной судьбой и характеристиками фенотипа червя. Для этих людей мы использовали время от первоначального захвата до смерти или окончания исследования в качестве соответствующей переменной ответа. Животные, не погибшие к концу исследования или исключенные из исследования по другим причинам, подвергались цензуре справа. Многомерная модель пропорциональных рисков имела ту же структуру, что и модель для BTB-положительных лиц ( SI, Приложение , Таблица S5). Остаточные проверки подтвердили предположения о пропорциональных опасностях для этой модели (фенотип червя, низкий: χ 2 = 0.085, p = 0,771, Лечение, Управление: χ 2 = 0.105, p = 0,706, Стадо, ls: χ 2 = 0,702, p = 0,402, Возраст: χ 2 = 0,156 , P = 0,693, глобальная модель: χ 2 = 1,076, P = 0,898).
Наконец, чтобы оценить, повлияло ли использование нами дискретизированных категорий FEC (т. е. фенотипов устойчивости к червям) на выводы о закономерностях смертности, мы повторно провели описанный выше анализ смертности как для BTB-инфицированных, так и для неинфицированных буйволов, заменив фенотип устойчивости к червям непрерывным FEC.Все остальные предикторы остались прежними, а остаточные проверки были выполнены, как описано. Подробная информация о модели представлена в SI, Приложение , Таблицы S6 и S7.
е. фенотипов устойчивости к червям) на выводы о закономерностях смертности, мы повторно провели описанный выше анализ смертности как для BTB-инфицированных, так и для неинфицированных буйволов, заменив фенотип устойчивости к червям непрерывным FEC.Все остальные предикторы остались прежними, а остаточные проверки были выполнены, как описано. Подробная информация о модели представлена в SI, Приложение , Таблицы S6 и S7.
Влияние фенотипа резистентности к гельминтозам и лечения на прогрессирование BTB.
Мы изучили комбинированное влияние фенотипа резистентности к червям (высокий FEC по сравнению с низким FEC) и антигельминтного лечения на прогрессирование заболевания BTB, используя общие и обобщенные линейные модели (GLM). Зависимыми переменными были общие и гистологические показатели патологии легких и лимфатических узлов.Номинальные переменные были смоделированы с использованием биномиальной GLM, порядковые переменные были смоделированы с использованием порядковой регрессии (пакет R: порядковый номер), а две непрерывные переменные (количество поражений легких и количество положительных лимфатических узлов) были смоделированы с использованием отрицательных биномиальных GLM. Для всех моделей в качестве переменных-предикторов были включены фенотип устойчивости к гельминтам, лечение, продолжительность инфекции BTB и взаимодействие между фенотипом гельминта и лечением. Пошаговый подход к выбору модели на основе информационного критерия Акаике (AIC) (реализованный с помощью функции «шаг») использовался для упрощения каждой модели и определения ключевых переменных-предикторов, объясняющих вариации в прогрессировании заболевания.
Для всех моделей в качестве переменных-предикторов были включены фенотип устойчивости к гельминтам, лечение, продолжительность инфекции BTB и взаимодействие между фенотипом гельминта и лечением. Пошаговый подход к выбору модели на основе информационного критерия Акаике (AIC) (реализованный с помощью функции «шаг») использовался для упрощения каждой модели и определения ключевых переменных-предикторов, объясняющих вариации в прогрессировании заболевания.
Благодарности
Мы благодарим Южноафриканские национальные парки (SANParks) за разрешение провести это исследование в Крюгере и весь Департамент ветеринарных служб дикой природы SANParks за неоценимую помощь в отлове животных и логистике проекта. Мы благодарим Р. Спаана, Дж. Спана, К. Томпсона, Б. Бихлера, Э. Горсича, П. Снайдера, Дж. Алагаппана, С. Амиша, Л. Остина, Л. Мегоу, К. Раума, Н. Роджерса, и М. Смит за работу по отлову животных и обработке образцов. Ф. Куинн и П. Рохани предоставили ценные комментарии к черновому варианту рукописи. Это исследование было поддержано NSF (NSF DEB-1102493) и NIH (NIH 1R01GM131319) в рамках совместной программы NSF/NIH/Министерства сельского хозяйства США по экологии и развитию инфекционных заболеваний.
Это исследование было поддержано NSF (NSF DEB-1102493) и NIH (NIH 1R01GM131319) в рамках совместной программы NSF/NIH/Министерства сельского хозяйства США по экологии и развитию инфекционных заболеваний.
Сноски
Вклад авторов: В.О.Э., С.А.Б., Г.Л., А.Э.Дж. и К.С. проектное исследование; В.О.Э., С.А.Б., П.Б., М.С., Г.Л., А.Э.Дж. и К.С. проведенное исследование; Г.О.Э. проанализированные данные; и В.О.Э. написал статью с отзывами всех авторов.
Авторы заявляют об отсутствии конкурирующих интересов.
Эта статья является прямой отправкой PNAS.
Эта статья содержит вспомогательную информацию в Интернете по адресу https://www.pnas.org/lookup/suppl/doi:10.1073/pnas.2015080118/-/DCSupplemental.
Лечение и профилактика кокцидиоза крупного рогатого скота
Опубликовано в октябре 2016 г. | Идентификатор: VTMD-9129
От
Крис Ричардс, Д. Л. Степ, Элизабет Дж. Гидт
Л. Степ, Элизабет Дж. Гидт
Что такое кокцидиоз
Coccidia — простейшие паразиты, специфичные для хозяина; например, у крупного рогатого скота есть свои специфические
кокцидии ( Eimeria sp., рис. 1), у домашней птицы есть свои кокцидии и др. Ооциста выделяется с фекалиями
как пораженных животных с симптомами, так и животных-носителей, не проявляющих симптомов.Ооцисты образуют споры (созревают) во влажной теплой среде и становятся инфекционными.
Ооцисты кокцидий попадают в организм животных при употреблении зараженного корма, воды,
пастбища или лизать грязную шерсть. При попадании внутрь паразит может развиваться внутри
животное-хозяин, вызывая повреждение клеток кишечника и потенциально приводя к
у животного понос и кровь в фекалиях. Поражение слизистой оболочки кишечника также
влияет на способность животного поглощать жидкости, чтобы компенсировать потери воды в
диарея. Ооциста очень устойчива и может выживать во влажных затененных местах.
на несколько лет.
Поражение слизистой оболочки кишечника также
влияет на способность животного поглощать жидкости, чтобы компенсировать потери воды в
диарея. Ооциста очень устойчива и может выживать во влажных затененных местах.
на несколько лет.
Рис. 1. Кровавый понос у бычков при кокцидиозе.
Болезнь: Многие животные подвергаются воздействию кокцидий и заражаются ими, и у них не развивается
симптомы, но затем развивается видоспецифический иммунитет. Заболевание возникает при больших
инвазионной формы простейших (ооцисты) попадает в организм крупного рогатого скота.
стресс или иммунный ответ животных нарушен. Отлучение от груди, доставка или переезд
крупный рогатый скот может вызвать достаточный стресс, чтобы вызвать болезнь и клинические признаки. Больные животные
обычно имеют острую диарею с кровью или без нее (рис. 2), снижение аппетита и
легкая депрессия.При более тяжелых инфекциях это может прогрессировать до тяжелой депрессии,
обезвоживание, бледность слизистых оболочек, напряжение и резкая потеря веса. Немного крупного рогатого скота
при кокцидиозе могут проявляться неврологическими симптомами. Смерть может наступить, несмотря на терапию.
Болезнь обычно поражает молодых животных, содержащихся группами в антисанитарных условиях.
Могут поражаться телята в возрасте 16 дней.
Заболевание возникает при больших
инвазионной формы простейших (ооцисты) попадает в организм крупного рогатого скота.
стресс или иммунный ответ животных нарушен. Отлучение от груди, доставка или переезд
крупный рогатый скот может вызвать достаточный стресс, чтобы вызвать болезнь и клинические признаки. Больные животные
обычно имеют острую диарею с кровью или без нее (рис. 2), снижение аппетита и
легкая депрессия.При более тяжелых инфекциях это может прогрессировать до тяжелой депрессии,
обезвоживание, бледность слизистых оболочек, напряжение и резкая потеря веса. Немного крупного рогатого скота
при кокцидиозе могут проявляться неврологическими симптомами. Смерть может наступить, несмотря на терапию.
Болезнь обычно поражает молодых животных, содержащихся группами в антисанитарных условиях.
Могут поражаться телята в возрасте 16 дней.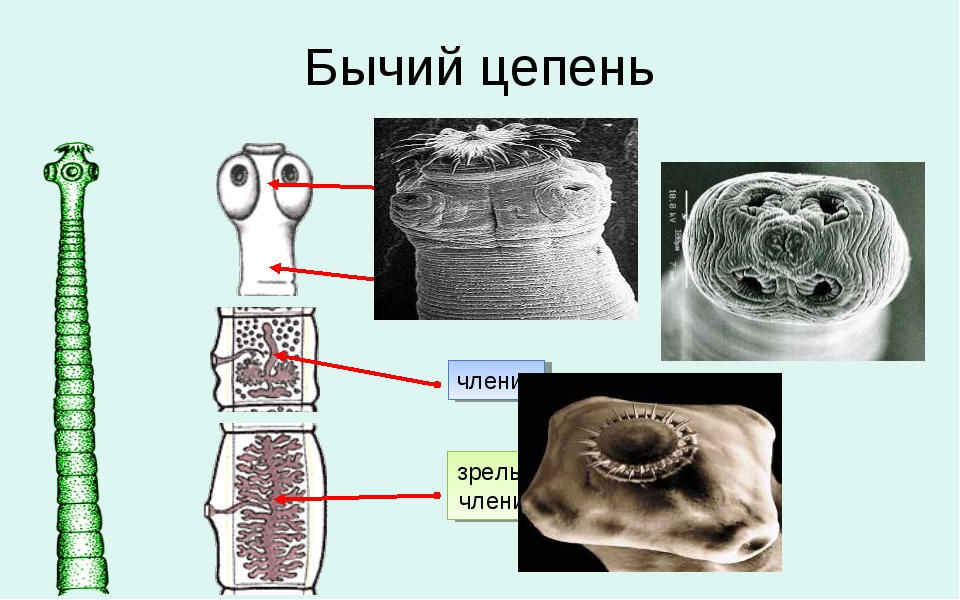 Пожилой скот менее восприимчив
заболеванию, чем молодой крупный рогатый скот, если только они не испытывают сильного стресса или
подавленная иммунная система.
Пожилой скот менее восприимчив
заболеванию, чем молодой крупный рогатый скот, если только они не испытывают сильного стресса или
подавленная иммунная система.
Рисунок 2. Ооцисты Eimeria sp. кокцидий крупного рогатого скота. Ооцисты показаны X 400.
Более хроническая форма заболевания вызывает замедление темпов роста и/или действует как
стрессор, вызывающий повышенную восприимчивость к другим инфекциям, таким как сальмонеллез
(кишечное заболевание), или респираторное заболевание крупного рогатого скота. Кокцидиоз – это прежде всего заболевание
который влияет на молодых животных, но может повлиять на старых животных, которые находятся в плохом состоянии
или имеют ослабленный иммунитет. Это обычно происходит в замкнутых условиях, но может возникать
в условиях свободного выгула, которые имеют места скопления, такие как кормление, тень и
зоны полива.
Кокцидиоз – это прежде всего заболевание
который влияет на молодых животных, но может повлиять на старых животных, которые находятся в плохом состоянии
или имеют ослабленный иммунитет. Это обычно происходит в замкнутых условиях, но может возникать
в условиях свободного выгула, которые имеют места скопления, такие как кормление, тень и
зоны полива.
Экономика : Кокцидиоз может привести к значительным экономическим потерям из-за снижения работоспособности, смерти
от прямых инфекций, а также предрасполагая крупный рогатый скот к вторичному бактериальному и вирусному
инфекции.Дополнительные экономические потери возникают из-за спроса на рабочую силу для ухода
лечение инфицированного скота и расходы на лекарства.
Передача: Кокцидиоз передается от животного к животному фекально-оральным путем. Зараженный фекалии могут загрязнять корм, воду или почву; следовательно, крупный рогатый скот может заразиться болезнь при употреблении пищи и питья из зараженных источников или облизывании себя или других животных.Телята могут заразиться при кормлении зараженным выменем. Серьезность Клиническая форма заболевания зависит от количества проглоченных ооцист. Чем больше ооцист проглочено, тем тяжелее болезнь.
Диагноз: Кокцидиоз диагностируют по клиническим признакам, исследованию кала флотацией или мазком,
и при патологоанатомическом исследовании. Клинические признаки обычно проявляются примерно через 17 дней после приема внутрь.
ооцист. К тому времени, когда появляются клинические признаки, повреждение уже далеко зашло, и
жизненный цикл кокцидий в организме животного завершается. История часто включает в себя
предшествовавшее стрессовому событию в жизни животного. Следует отметить, что кокцидии могут
обнаруживаются в фекалиях нормального здорового крупного рогатого скота, и диагноз должен исключать другие заболевания.
таких как BVDV, сальмонеллез, внутренние паразиты и токсичность.
Клинические признаки обычно проявляются примерно через 17 дней после приема внутрь.
ооцист. К тому времени, когда появляются клинические признаки, повреждение уже далеко зашло, и
жизненный цикл кокцидий в организме животного завершается. История часто включает в себя
предшествовавшее стрессовому событию в жизни животного. Следует отметить, что кокцидии могут
обнаруживаются в фекалиях нормального здорового крупного рогатого скота, и диагноз должен исключать другие заболевания.
таких как BVDV, сальмонеллез, внутренние паразиты и токсичность.
Лечение: Наиболее эффективным методом лечения уже больного животного является поддерживающая терапия (жидкости).
и антибиотики для предотвращения вторичных инфекций. В идеале владельцы должны изолировать
пострадавшее животное (животные) для предотвращения повышенного загрязнения помещений. Ампролиум в
10 мг/кг/день в течение пяти дней и сульфаниламиды обычно используются для лечения клинических
заболевание (таблица 1).Лекарства, вводимые с кормом или водой, нельзя употреблять больным.
животных, и с тяжело пораженными животными, возможно, потребуется обращаться и лечить индивидуально.
Ампролиум в
10 мг/кг/день в течение пяти дней и сульфаниламиды обычно используются для лечения клинических
заболевание (таблица 1).Лекарства, вводимые с кормом или водой, нельзя употреблять больным.
животных, и с тяжело пораженными животными, возможно, потребуется обращаться и лечить индивидуально.
При наличии одного клинического случая в группе крупного рогатого скота высока вероятность того, что другие подвергались воздействию и содержали кокцидии на промежуточных стадиях развития.Должное к лекарственной чувствительности паразита на промежуточных стадиях развития, следует проводить профилактическую терапию. Лекарства, полезные для лечения, не обязательно полезно для профилактической терапии и наоборот. Антикокцидийно-профилактическая терапия обычно для крупного рогатого скота следует использовать в соответствии с рекомендациями на этикетке, уделяя особое внимание поддерживать профилактические уровни в течение достаточно продолжительных периодов (28 дней или дольше), чтобы воздействовать жизненный цикл кокцидий.Возможно применение антикокцидиальной профилактической терапии. в рационы и добавки мясного скота.
Наиболее эффективная программа борьбы с кокцидиозом направлена на профилактическую терапию, а затем на клинические проявления. появляются признаки.
Профилактика
Профилактика направлена на предотвращение фекального загрязнения окружающей среды крупного рогатого скота, корм и вода.Профилактические мероприятия по содержащемуся в стойле скоту включают:
- Регулярно очищайте резервуары для воды, а также более регулярную очистку при вводе новых животных.
- Убирайте фекалии с кормушек перед каждым кормлением.
- Очистите и продезинфицируйте помещения между группами крупного рогатого скота. Сушка и воздействие солнечный свет способствует отмиранию ооцист
- Не перегружайте животных.
- Уменьшение накопления навоза (регулярная очистка загонов).
- Если в стойлах, обеспечьте адекватную чистую подстилку.
- Используйте кокцидиостатики в корме, воде или соли в соответствии с рекомендациями вашего ветеринара.
Профилактические меры при выпасе скота включают:
- Регулярное ограничение выпаса скота вблизи ручьев и прудов или резервуаров с чистой водой, с более регулярная уборка при вводе новых животных.
- Убирайте фекалии с кормушек перед каждым кормлением.
- При кормлении сеном с земли переместите места кормления, чтобы уменьшить накопление ооцист.
- Предотвращение чрезмерного выпаса скота. Животные, вынужденные пастись до корней растений, могут поедать большие количества паразитов.
- Устранение грязных участков в окружающей среде.Используйте хорошо дренированные пастбища.
- Используйте кокцидиостатики в корме, воде или соли в соответствии с рекомендациями вашего ветеринара.
Таблица 1. Противококцидийные лечебные и профилактические средства для крупного рогатого скота. * Следуйте всем меткам указания по времени вывода мяса.
| Лечение | Профилактика | Лечение | |
|---|---|---|---|
| АМПРОЛИУМ (КОРДИД®) (АМПРОЛ®) | Вспомогательные средства для профилактики (5 мг/кг) на 28 дней | Вспомогательные средства для лечения (10 мг/кг) на 5 дней | |
| ДЕКОКВИНАТ (DECCOX®) | 0.5 мг/кг в течение 28 дней | ||
| ЛАЗАЛОЦИД (BOVATEC®) | 1,0 мг/кг в течение 28 дней | ||
| МОНЕНСИН (РУМЕНСИН) | 1,2 мг/кг в течение 28 дней |
Выводы
- Кокцидиоз — дорогостоящая кишечная болезнь, преимущественно молодняка крупного рогатого скота, при интенсивном животноводческие условия или свободный выгул на пастбищах.
- Кокцидиоз вызывает как тяжелое заболевание с возможной смертью, так и скрытое заболевание, вызывающее стресс и делает животное более восприимчивым к вторичным заболеваниям, которые могут усугубить нанести вред здоровью животного.
- Контроль и лечение должны быть двоякими: надлежащие меры животноводства для предотвращения проглатывание инфекционных ооцист другим крупным рогатым скотом, а также применение антикокцидийных профилактическая терапия для предотвращения дальнейшего заболевания и загрязнения помещений.
- Помните, что животные, не проявляющие клинических признаков, могут заболеть кокцидиозом после учреждение антикокцидиальной профилактической терапии. Кокцидии могут быть развиты за пределами восприимчивости к профилактической терапии в их жизненном цикле. Это делает не означает прекращения превентивных мер. Целью профилактической терапии является не только предотвратить заболевание животного, но и уменьшить концентрацию паразита на территории.
Крис Ричардс, доктор философии
Специалист по расширению и исследованию мясного скота
Д.Л. Шаг, ДВМ, ACVIM
Центр ветеринарных медицинских наук
Элизабет Дж.Гидт, DVM, MBA
Директор по непрерывному образованию, развитию и взаимодействию с общественностью
Центр ветеринарных медицинских наук
Была ли эта информация полезной?
ДА НЕТКишечные черви (паразитический гастроэнтерит или ПГЕ)
Причина
Паразитарным гастроэнтеритом называют инфекцию сычуга и кишечника.Как только инфекция накапливается, крупный рогатый скот становится все хуже и хуже, что имеет серьезные экономические последствия и последствия для благосостояния.
Инфекция вызывается паразитами, в большинстве случаев сычужным червем.
Пастбищные животные могут заразиться инфекцией в начале пастбищного сезона от личинок, выживших за зиму на пастбище – это может вызвать заболевание, если пастбищная нагрузка очень велика, но обычно эти перезимовавшие личинки действуют как слабый источник инфекции, что позволяет телята заражаются и начинают выделять яйца гельминтов на пастбище во время пастбищного сезона.
Существует два основных сезона возникновения кишечных червей у крупного рогатого скота, первый из которых приходится на конец лета и осень и конец зимы и раннюю весну.
Жизненный цикл
Крупный рогатый скот выделяет яйца глистов с фекалиями. Эти яйца затем развиваются в инфекционную личиночную стадию в домашних условиях (что обычно занимает около 2 недель при оптимальных условиях). Затем коровы заражаются, когда они поедают эти личиночные стадии, которые к настоящему времени мигрировали на пастбище (несъеденные личинки в конце пастбищного сезона потенциально могут выжить на пастбище, выступая в качестве источника инфекции для пастбищных животных в следующие сезоны).
Затем в желудочно-кишечном тракте коров проходит еще несколько личиночных стадий, прежде чем червь становится половозрелым и начинает откладывать яйца.
Развитие внутри коровы обычно занимает около трех недель, чтобы достичь стадии яйцекладки. Весь цикл от яйца до производства зрелых яиц занимает около пяти недель, однако в некоторых случаях развитие внутри коровы может остановиться, и личинки могут впасть в спячку, что позволит им снова появиться на свет до шести месяцев.
Симптомы
- Диарея водянистая, зеленая
- Значительная потеря веса
- Потеря аппетита
- Большая часть пораженных животных
Лечение
При лечении животных с клиническими заболеваниями следует учитывать следующее: 1) обеспечение адекватного питания, 2) лечение всех животных в группе в качестве превентивной меры и для уменьшения дальнейшего загрязнения пастбищ, и 3) перемещение скота на «чистые» пастбища для свести к минимуму повторное заражение.
PGE можно лечить антигельминтиками/противогельминтными препаратами. Можно использовать различные типы, и то, что доступно, будет зависеть от местоположения.
Профилактика
Стратегическое использование антигельминтных средств предназначено для снижения количества гельминтов и, следовательно, загрязнения пастбищ. Сроки введения основаны на знании сезонных изменений инфекции и региональной эпидемиологии различных гельминтозов. Крайне важно быстро распознать обстоятельства, которые могут способствовать развитию паразитарного заболевания, например, погода, пастбищное поведение и потеря веса и физического состояния.
Ротация гельминтозов должна планироваться из года в год, чтобы свести к минимуму вероятность того, что паразиты станут устойчивыми к этим продуктам.
У телят обычно вырабатывается иммунитет к червям во время их первого пастбищного сезона, который может ослабевать в течение зимы, делая пасущихся во второй сезон пастбищ восприимчивыми к повторному заражению. Однако иммунитет обычно быстро восстанавливается, а симптомы обычно слабо выражены и преходящи. Пастухи третьего сезона и далее должны иметь стойкий иммунитет к глистам и не нуждаются в лечении.
Другой совет заключается в эффективном использовании пастбищ, чтобы скот не пасся на зараженных пастбищах в пик сезона. Это может быть так же просто, как перегон крупного рогатого скота на свежие пастбища без пастбища (например, силосные остатки) непосредственно перед летним увеличением численности личинок.
Сокращение рутинной борьбы с гельминтами путем мониторинга, особенно количества яиц глистов и их роста. Это сэкономит вам деньги и уменьшит риск развития резистентности на вашей ферме.
Червь в жилище на складе восприимчив к зимующим личинкам.
Заражение ленточными червями | Encyclopedia.com
Введение
История болезни, характеристики и передача
Масштаб и распространение
Лечение и профилактика
Воздействие и проблемы
БИБЛИОГРАФИЯ
Ленточные черви Жизненный цикл ленточного червя включает людей в качестве основного или промежуточного хозяина. Обе эти ситуации вызывают инфицирование человека. Люди заражаются ленточными червями либо при употреблении в пищу мяса, содержащего осушенных ленточных червей, либо при проглатывании яиц ленточных червей.В первом случае первичными хозяевами выступают люди. Во втором случае человек выступает в роли промежуточного хозяина.
Хотя инфекции ленточными червями, как правило, протекают бессимптомно, могут проявляться некоторые симптомы, включая боль в животе, тошноту, диарею, стул, содержащий слизь, и выделение сегментов ленточных червей или проглоттид. Однако при заражении человека яйцами могут возникнуть более серьезные осложнения. Образовавшиеся личинками цисты в тканях могут вызывать повреждения, в том числе поражения жизненно важных органов, например головного мозга.
Заражение ленточными червями встречается во всем мире, но более распространено в странах с низким уровнем гигиены и санитарии или в районах, где люди живут рядом со скотом. Ленточные черви передаются преимущественно через мясо, содержащее осушенных ленточных червей, или через пищу и воду, загрязненные инфицированными человеческими фекалиями. Лечение включает противопаразитарные препараты, такие как празиквантел, и обычно эффективно.
СЛОВА, КОТОРЫЕ НУЖНО ЗНАТЬ
Цестоды: Класс червей, характеризующихся плоскими сегментированными телами, широко известный как ленточные черви.
ПРОМЕЖУТОЧНЫЙ ХОЗЯИН: Организм, инфицированный паразитом, пока паразит находится в стадии развития, но не достиг половой зрелости.
ПЕРВИЧНЫЙ ХОЗЯИН: Первичный хозяин — это организм, который обеспечивает пищу и убежище для паразита, позволяя ему стать половозрелым, а вторичный хозяин — это организм, занимаемый паразитом на личиночной или бесполой стадиях его жизненного цикла.
Ленточные черви — паразитические плоские черви, принадлежащие к классу Cestoda. Жизненный цикл ленточного червя обычно включает в себя первичного хозяина и промежуточного хозяина.Жизненный цикл начинается, когда яйцо ленточного червя попадает от первичного хозяина в почву или воду. Промежуточный хозяин проглатывает яйцо, и личинки вылупляются, проникают в ткани и образуют цисты. Затем первичный хозяин проглатывает цисты, когда они поедают плоть промежуточного хозяина. Эти кисты развиваются во взрослых особей, которые размножаются половым путем в кишечнике хозяина.
В большинстве случаев люди заражаются ленточными червями после употребления в пищу недоваренного или сырого мяса животных, содержащего цисты ленточных червей. Эти черви мигрируют в кишечник, где они размножаются.Фекалии этих инфицированных людей заразны, так как содержат яйца ленточных червей. Наиболее распространенными ленточными червями, заражающими людей таким образом, являются: Taenia solium , присутствующий у свиней; Taenia saginata , присутствующая у крупного рогатого скота; видов Diphyllobothrium , которые присутствуют в пресноводных рыбах; видов Hymenolepis , которые встречаются у грызунов и насекомых; и Diphyllobothrium caninum , который присутствует у кошачьих и собачьих блох.
В некоторых случаях люди являются промежуточными хозяевами. В этих случаях люди проглатывают яйца ленточного червя. Из них вылупляются личинки, которые мигрируют в ткани тела и образуют цисты. Это происходит с Taenia solium , если люди проглатывают пищу или воду, содержащую зараженные человеческие фекалии. Это также происходит, когда люди случайно проглатывают насекомых, содержащих личинок видов Hymenolepis .
Заражение ленточными червями обычно протекает бессимптомно. Однако возможные симптомы включают боль в животе, тошноту, диарею, стул, содержащий слизь, и выделение сегментов ленточных червей или проглоттид.Серьезным риском, связанным с заражением T. solium , является риск развития цистицеркоза. Это происходит, когда яйца проглатываются, а личинки образуют цисты в тканях. Наиболее серьезная форма этой инфекции связана с образованием кист в центральной нервной системе — состояние, известное как нейроцистицеркоз. Это может вызвать неврологические проблемы и судороги. В тяжелых случаях может произойти необратимое повреждение головного мозга или смерть.
Заражение ленточными червями происходит во всем мире. Однако некоторые виды присутствуют или более распространены только в определенных регионах.В Соединенных Штатах только несколько ленточных червей обычно вызывают инфекцию. Заражение T. saginata и T. solium редко встречается в Соединенных Штатах, при этом уровень заражения T. saginata составляет менее 1%. Это связано с почти полным отсутствием этих паразитов в животноводстве. Однако заражение видами Diphyllobothrium , вызванное употреблением в пищу сырой или недоваренной рыбы, происходит чаще.
В других странах мира, T.saginata и T. solium более распространены. T. saginata является эндемиком Латинской Америки, Африки, Ближнего Востока и Центральной Азии. Он также встречается в Европе, Южной Азии, Японии и на Филиппинах. T. solium распространен в Латинской Америке, славянских странах, Африке, Юго-Восточной Азии, Индии и Китае. Он также встречается в Европе, но с меньшей распространенностью. Цистицеркоз, возникающий при заражении человека личиночной формой ленточных червей, эндемичен почти во всех странах Латинской Америки.
Инфекция, вызванная видом Diphyllobothrium , также часто встречается в Европе, Канаде, Африке, некоторых странах Азии, Южной Америке и Австралии. Однако наиболее распространенная инфекция ленточного червя у людей вызывается Hymenolepis nana . Инфекция возникает, когда люди случайно проглатывают инфицированных насекомых или проглатывают пищу или воду, зараженные инфицированными насекомыми. Кроме того, яйца передаются от человека к человеку через зараженные фекалии. Чаще всего заражаются дети, инвалиды в развитии и психически больные.Кроме того, эти паразиты обычно встречаются в регионах с плохой гигиеной и санитарией.
Инфекции, вызванные ленточными червями, обычно лечат антипаразитарными препаратами. Одним из самых распространенных и эффективных препаратов является празиквантел. Этот препарат эффективно убивает взрослых ленточных червей. Есть несколько легких побочных эффектов празиквантела, но они, как правило, недолговечны. Альбендазол является альтернативой празиквантелу с аналогичными эффектами. Другой альтернативой празикванталу является никлозамид, который используется для лечения инфекций, вызванных ленточными червями Taenia и Diphyllobothrium .Побочные эффекты этого препарата включают тошноту, боль в животе, рвоту, диарею, головокружение и кожную сыпь. В случае нейроцистицеркоза, при котором личинки ленточного червя образуют цисты в центральной нервной системе, раннее лечение этой инфекции может свести к минимуму повреждение системы и, таким образом, снизить риск неврологических осложнений.
Эти методы лечения убивают взрослых ленточных червей, а не их яйца, поэтому пациент может остаться инфицированным после лечения. Поэтому необходимо посетить врача через три месяца после лечения, чтобы проверить наличие продолжающейся инфекции и определить, необходимо ли дальнейшее лечение.
Прививок для предотвращения заражения ленточными червями не существует. Таким образом, лучший метод профилактики — избегать заражения. Для ленточных червей, обнаруженных в мясе, приготовление мяса при температуре выше 150 ° F (65,5 ° C) или его замораживание в течение 12–24 часов убивает ленточных червей. Кроме того, дегельминтизация скота снижает риск его заражения и передачи инфекции людям.
Пищевые продукты и вода могут быть заражены инфицированными фекалиями, особенно в регионах с плохой гигиеной и санитарией.Таким образом, мытье сырой пищи или тщательное ее приготовление помогает удалить паразитов. Кроме того, кипячение или фильтрация питьевой воды снижает вероятность проглатывания паразитов из воды. Надлежащая личная гигиена, такая как мытье рук с мылом и водой перед тем, как прикасаться к пище, и строгие правила санитарии, особенно когда речь идет о человеческих экскрементах, также снижают вероятность передачи паразитов среди населения.
Ленточные черви представляют собой серьезную проблему для здоровья в ряде стран.Поскольку ленточные черви обычно возникают в домашнем скоте или заражены человеческими фекалиями, регионы, в которых люди живут рядом со своим домашним скотом, и районы с низкими стандартами гигиены и санитарии имеют более высокую распространенность инфекций ленточными червями. Инфекции ленточного червя, как правило, эндемичны в развивающихся странах, где санитария плохая из-за отсутствия финансирования, а медицинское лечение часто недоступно.
Заражение ленточными червями все еще происходит в развитых странах по ряду причин. Путешествия и иммиграция стали источником заражения ленточными червями, поскольку инфицированные люди взаимодействуют с неинфицированными людьми, потенциально распространяя ленточных червей.Кроме того, поскольку заражение ленточным червем обычно протекает бессимптомно, ленточный червь может оставаться незамеченным в течение многих лет, прежде чем будет назначено лечение и ленточный червь будет удален из организма.
Поскольку ленточные черви образуют цисты в мясе животных, употребление в пищу сырого или недоваренного мяса увеличивает вероятность заражения. Это не является серьезной проблемой для таких стран, как Соединенные Штаты, в которых домашний скот почти полностью свободен от инвазий ленточными червями благодаря методам дегельминтизации. Однако в странах, где методы, связанные с животноводством, более расслаблены, существует более высокая вероятность того, что употребление мяса может вызвать инфекцию.
Хотя многие случаи заражения ленточными червями остаются незамеченными в течение многих лет из-за бессимптомного характера инфекции, наиболее тяжелая форма инфекции — цистицеркоз — может вызывать серьезные проблемы со здоровьем. Если человек проглатывает яйца ленточного червя, они вылупляются, а личинки образуют цисты в тканях тела. Это может привести к повреждению жизненно важных органов тела и, в худшем случае, к повреждению нервной системы. Это может привести к смерти или необратимому повреждению головного мозга.
См. также Эндемичность; Болезни пищевого происхождения и безопасность пищевых продуктов; Мытье рук; Паразитарные заболевания; санитария; Тениоз (тениозная инфекция).
Книги
Beers, M.H. The Merck Manual of Medical Information . Нью-Йорк: Pocket Books, 2003.
Bush, AO, et al.

 А для этого таблетки принимают с интервалом в четыре часа, при назначении однократного приема – вечером.
А для этого таблетки принимают с интервалом в четыре часа, при назначении однократного приема – вечером.


 Поэтому лучше употреблять такую пищу не часто и приготовив в домашних условиях. В пунктах общественного питания невозможно узнать истинное происхождение ингредиентов блюд.
Поэтому лучше употреблять такую пищу не часто и приготовив в домашних условиях. В пунктах общественного питания невозможно узнать истинное происхождение ингредиентов блюд.


 Если болезнь вызывает судороги, противоэпилептические препараты могут их остановить.
Если болезнь вызывает судороги, противоэпилептические препараты могут их остановить.