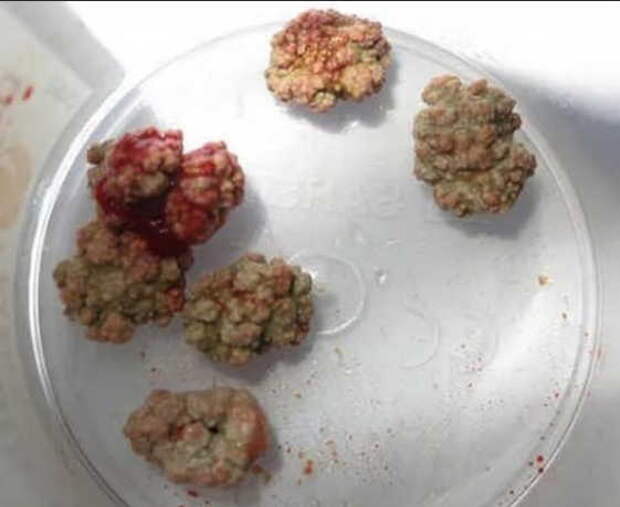
Профилактика формирования камней в почках
Болевой синдром, обусловленный наличием камней в почках, является одним из самых тяжелых и сильных, которые может испытать человек. На сегодняшнее время причины возникновения камней в почках достоверно неизвестны, однако существуют некоторые общие рекомендации по питанию, соблюдение которых поможет предупредить их формирование.
Камни в почках могут иметь различный тип. Знание типа камней — это ключ к профилактике их повторного образования. Большинство камней в почках формирует кальций в виде оксалата (80 %), или же это кристаллы мочевой кислоты (5–10 %). Образованию таких камней способствует кислотная среда, таким образом, с целью профилактики могут применяться препараты, содержащие щелочные минералы. Редко встречаются камни, сформированные фосфатом кальция, для которых характерна щелочная среда.
Возникновению камней в почках способствует способ питания, потребление прохладительных напитков, содержащих ортофосфорную кислоту, водопроводной воды, продуктов, подвергшихся технологической обработке, мясных полуфабрикатов, пастеризованных молочных продуктов, поваренной соли и сладостей.
Для снижения риска формирования камней в почках немаловажное значение имеет противовоспалительная диета. Основным ее правилом является выпивание чистой воды в количестве, равном по крайней мере половине массы тела, но в унциях. Далее необходимо насытить свой рацион овощами, богатыми питательными веществами продуктами — источниками жира и чистого белка. Источниками «здорового» жира служат плоды кокоса, авокадо, оливковое масло и рыбий жир с очищенными омега-3 насыщенными кислотами. Источниками «здорового» белка являются рыба, пойманная непромышленным путем, красное мясо скота, выращенного на подножном корме, мясо цыплят, индюков, выращенных в естественных условиях, яйца. Противовоспалительным действием обладают такие растения, как куркума, корица, имбирь, орегано, чеснок.
Главным же врагом камней, сформированных кальцием, является цитрат, который содержится в цитрусовых фруктах. Прекрасным средством против камней в почках служит свежевыжатый сок лимона, разбавленный водой (см. рецепт ниже). Цитрат также очень эффективен при комбинации его с калием и магнием, которые также присутствуют в свежевыжатом лимонном соке. Такое сочетание снижает кислотность мочи, что, в свою очередь, уменьшает вероятность формирования камней.
рецепт ниже). Цитрат также очень эффективен при комбинации его с калием и магнием, которые также присутствуют в свежевыжатом лимонном соке. Такое сочетание снижает кислотность мочи, что, в свою очередь, уменьшает вероятность формирования камней.
Для людей с камнями в почках в анамнезе очень важно придерживаться диеты с низким содержанием оксалатов и натрия. К продуктам с высоким содержанием оксалатов относятся пиво, шоколад, орехи, шпинат, мангольд, клубника, определенные виды чая, свекла, пророщенная пшеница. При метаболизме витамина С выделяется оксалат, поэтому принято считать, что витамин С повышает риск формирования камней, что было подтверждено в некоторых исследованиях. Однако в исследованиях с убедительной базой было показано, что принимать витамин С необходимо, поскольку его наличие ассоциируется с высоким уровнем витамина В6 (например, в лимоне), который естественным способом связывает оксалаты. При нормальных уровнях кальция он связывается с оксалатами в кишечнике до того, как оксалаты фильтруются в почках.
Появление камней мочевой кислоты в большинстве случает обусловлено рационом питания, а именно потреблением продуктов, богатых белком и, возможно, фруктозой. Мочевая кислота является продуктом метаболизма белка, алкоголя и фруктозы. У некоторых лиц отмечаются проблемы с выведением этой кислоты, что способствует отложению кристаллов уратов, характерных для подагры, и мелких частиц в почках. Таким людям следует избегать потребления алкоголя, продуктов, богатых пуринами, таких как красное мясо, субпродукты, бобовые. Кроме того, им следует исключить из рациона продукты с высоким содержанием фруктозы, а именно кукурузный сироп, мед, нектар агавы и многие фрукты.
Рецепт противовоспалительного лимонада: 1 чашка свежевыжатого лимонного сока (4–6 лимонов), 4–6 чашек очищенной воды (по вкусу), 1 ч. л. молотой куркумы, 1 ч.л. корицы, 1/2 ч.л. молотого/свежего имбиря.
л. молотой куркумы, 1 ч.л. корицы, 1/2 ч.л. молотого/свежего имбиря.
http://www.naturalnews.com/031618_kidney_stones_prevention.html
Камни в почках: роль кишечной микробиоты
Группа итальянских ученых сравнила состав кишечной микробиоты у 52 пациентов, имевших хотя бы два симптома камней в почках, которые более чем на 80 % состояли из кристаллов оксалата кальция (группа C+), и у контрольной группы из 48 здоровых субъектов. Камни этого типа встречаются в 70 % случаев почечной колики, которая обычно не имеет установленной причины. Питание (чрезмерное потребление кальция и оксалатов) является единственным известным фактором развития идиопатического литиаза, чаще рецидивирующего. Роль кишечной микробиоты ранее рассматривалась в исследовании о способности кишечной бактерии (Oxalobacter formigenes) расщеплять оксалат, тем самым снижая его всасывание и выведение с мочой.
Роды бактерий, отвечающие за развитие гипероксалурии
Новые исследования подтверждают эту гипотезу: образцы группы C+ отличаются снижением разнообразия и, с таксономической точки зрения, значимым сокращением численности трех родов: Faecalibacterium, Enterobacter, Dorea. При этом содержание Oxalobacter formigenes в каждом образце было чрезвычайно низким у обеих групп. Далее ученые изучили возможные различия в оксалат-расщепляющей активности бактерий. Они взяли в каждой группе по пять образцов и проанализировали их с помощью особого метода секвенирования генов, отвечающих за расщепление оксалатов. В образцах группы C+ снижение доли этих генов обратно коррелировало с гипероксалурией через 24 часа и выведением с калом. Этот генетический метод также позволил впервые обнаружить бактерии и археи, гены которых участвуют в расщеплении оксалатов (в том числе Escherichia coli) и в большем количестве определяются в контрольной группе здоровых субъектов.
При этом содержание Oxalobacter formigenes в каждом образце было чрезвычайно низким у обеих групп. Далее ученые изучили возможные различия в оксалат-расщепляющей активности бактерий. Они взяли в каждой группе по пять образцов и проанализировали их с помощью особого метода секвенирования генов, отвечающих за расщепление оксалатов. В образцах группы C+ снижение доли этих генов обратно коррелировало с гипероксалурией через 24 часа и выведением с калом. Этот генетический метод также позволил впервые обнаружить бактерии и археи, гены которых участвуют в расщеплении оксалатов (в том числе Escherichia coli) и в большем количестве определяются в контрольной группе здоровых субъектов.
Перспективы модуляции микробиоты
Ранее ученым не удавалось доказать эффективность пре- и пробиотиков на основе Oxalobacter formigenes для профилактики рецидивов почечнокаменной болезни. По их данным, это связано с участием других видов в поддержании баланса оксалата кальция. Именно поэтому эти работы открывают новые направления в изучении связи «кишечник-печень» и патофизиологии почечнокаменной болезни.
Мочекаменная болезнь — причины, симптомы и лечение МКБ
Общая информация о болезни
Мочекаменная болезнь (МКБ) – вторая по частоте после воспалительных заболеваний мочеполовой системы причина обращений к врачу-урологу [1]. Заболевание известно с древнейших времен, еще Гиппократ и Авиценна не только подробно описывали его симптомы, но и предлагали методы извлечения камней из мочевыводящих путей хирургическим путем. Из исторических источников известно, что МКБ страдали Наполеон, Петр I и другие великие люди своего времени.
Заболеваемость МКБ выше среди мужчин, чем среди женщин (соотношение около 3:1), и наиболее часто проявляется в возрасте 40–50 лет.
Суть патологии заключается в образовании в почках, мочевом пузыре и других органах мочевыводящей системы конкрементов – твердых отложений различных солей.
Многие люди не подозревают о наличии у них патологии до тех пор, пока камень не начнет движение по мочеиспускательному каналу. В этот момент пациент начинает испытывать острую мучительную боль, и состояние требует немедленной врачебной помощи.
Причины
В научной медицинской среде вопрос о причинах мочекаменной болезни до сих пор остается дискуссионным. Кристаллизация солей происходит из-за нарушения биохимических процессов в организме, но для того, чтобы соли не вымывались, а откладывались, необходим еще ряд негативных факторов.
В основе развития МКБ лежат нарушения обменных процессов, связанные как с алиментарными факторами, так и с заболеваниями эндокринной системы, наследственной предрасположенностью, а также с климато-географическими условиями.
Застою солей способствуют патологические процессы в почках – пороки их развития, опущение, гидронефроз, а также хирургические операции на органах мочеполовой системы. Также установлена связь между образованием камней и гиперфункцией паращитовидной железы.
Также установлена связь между образованием камней и гиперфункцией паращитовидной железы.
Классификация камней
Классификация конкрементов проводится по нескольким основаниям, подробное определение их свойств способствует выработке оптимальной тактики лечения МКБ.
Самая общая классификация различает камни по месту их нахождения:
- в мочевом пузыре,
- в мочеточнике,
- в почках.
По химическому составу они бывают уратные, оксалатные, фосфатные, белковые и другие. Камни также делятся на одиночные и множественные, мелкие и крупные, заполняющие почечные лоханки полностью или частично.
Симптомы мочекаменной болезни
Проявления МКБ зависят от размера камней, их локализации, формы, химического состава и ряда других факторов.
Микроскопические камни, которые называются песком, выходят вместе с мочой по мочеточнику, вызывая только легкое жжение и дискомфорт из-за воспаления стенки уретры. Камни более крупных размеров образуются в почках, при прохождении через мочеточник они могут закупорить его в самом узком месте. Такое состояние называется почечной коликой и проявляется характерными симптомами:
Камни более крупных размеров образуются в почках, при прохождении через мочеточник они могут закупорить его в самом узком месте. Такое состояние называется почечной коликой и проявляется характерными симптомами:
- приступами острой сильной боли, которая может возникнуть внезапно при тряске в транспорте или после приема алкоголя;
- повышением температуры тела;
- болью, отдающей в область паха, поясницу, в надлобковую зону.
Маленькие камни могут откладываться в начальном отделе мочевыводящих путей, который называется почечной чашечкой. Они выводятся с мочой при большом количестве выпитой жидкости. Их активное движение по мочеточнику может сопровождаться приступами боли при движении, иррадиирущей в поясницу и пах.
Вся выработанная почками моча попадает в почечную лоханку – самую объемную часть мочевыводящих путей. Здесь скапливаются средние и крупные камни, которые при движении могут закупорить мочеточник и вызвать острый приступ почечной колики.
Симптомы МКБ при локализации камней в мочеточнике зависят от размера конкрементов и той части канала, по которому они проходят. Интенсивность боли во многом определяется гладкостью поверхности камня: чем больше на нем острых выступов, тем более выражен болевой синдром.
Камни в мочевом пузыре проявляются периодической болью внизу живота, отдающими в промежность. Для этой локализации камней характерно внезапное прекращение мочеиспускания, которое может возобновиться при перемене положения тела.
Диагностика
Для правильной постановки диагноза важную роль играет сбор подробного анамнеза. На первичном приеме врач-уролог должен получить точные данные о характере боли, проблемах при мочеиспускании, изменении цвета мочи. МКБ легко диагностируется, если больной говорит о том, что после приступа колики в моче появилась кровь и вышли камни. В других случаях необходимо полное урологическое обследование, которое включает:
- УЗИ – основной метод исследования при подозрении на МКБ, который позволяет определить локализацию камней, их размер, плотность и структуру.
 Также этот метод направлен на оценку общего состояния мочевыделительной системы и позволяет проследить динамику развития ситуации.
Также этот метод направлен на оценку общего состояния мочевыделительной системы и позволяет проследить динамику развития ситуации.
- Урография – рентгенологический метод с введением контрастного вещества, позволяющий получить изображение камней и определить их количество и положение. Сейчас на смену урографии пришел более точный метод диагностики – компьютерная томография.
Возможные осложнения
МКБ нередко имеет тяжелые осложнения и может вести к инвалидизации. Пациенты с МКБ должны находиться под постоянным диспансерным наблюдением и лечиться не менее 5 лет после полного удаления камня. Коррекция метаболических нарушений должна осуществляться урологами с подключением к лечебному процессу консультантов: эндокринологов, диетологов, гастроэнтерологов. Важно не только удаление камня из мочевого тракта, но и предотвращение рецидивов камнеобразования, назначение соответствующей терапии, направленной на коррекцию метаболических нарушений.
Лечение мочекаменной болезни
Мочекаменная болезнь хорошо изучена, и современная медицина предлагает много способов ее лечения. Они делятся на две большие группы: консервативные (с помощью лекарственных препаратов) и путем хирургического вмешательства, когда камни удаляются при операции. Выбор метода зависит от размера и локализации камней, общего состояния мочевыделительной системы, возраста пациента, наличия у него хронических заболеваний и некоторых других факторов.
Наименее инвазивные технологии удаления конкрементов, широко внедренные в отечественную практику, позволили сделать один этап лечения МКБ относительно безопасным и рутинным.
- При уратных камнях осуществляется консервативная терапия — пероральный хемолиз (растворение конкрементов с помощью приема специальных препаратов) под контролем pH мочи с помощью тест-полосок через равные промежутки времени в течение дня. Доза ощелачивающего препарата корректируется врачом в каждом конкретном случае с учетом уровня pH мочи пациента.

- Предотвратить формирование камней из мочевой кислоты можно употреблением большого количества жидкости (более 2 литров в сутки).
- Нормализации содержания мочевой кислоты можно достичь строгим соблюдением диеты. Увеличение растительных продуктов и уменьшение мясных, содержащих много пуринов, позволит предотвратить рецидив камнеобразования*.
- Фитолизин® Паста — препарат, содержащий сгущенный экстракт 9 растительных компонентов, а также 4 эфирных масла, который представлен в виде готовой пасты для приготовления суспензии для приема внутрь. Оказывает мочегонное, противовоспалительное, спазмолитическое действие, способствует вымыванию песка и мелких конкрементов из мочевых путей, уменьшает кристаллизацию минеральных компонентов мочи. Взрослым назначают внутрь по 1 чайной ложке пасты, растворенной в 1/2 стакана теплой сладкой воды, 3-4 раза в день после еды. Длительность терапии определяется специалистом [3].
В лечении МКБ широко применяется метод литотрипсии – дробление камней различными аппаратами для облегчения их вывода из мочевыводящих путей [2].
При отсутствии эффекта от консервативной терапии показано хирургическое вмешательство, методику проведения которого определяет лечащий врач.
МКБ – серьезная патология мочевыводящей системы, серьезно снижающая качество жизни пациента. Болезнь имеет склонность к рецидивам, поэтому после проведенного лечения необходимо оставаться в постоянном контакте с лечащим врачом.
- Аполихин О.И., Сивков А.В., Москалева Н.Г., Солнцева Т.В., Комарова В.А. Анализ уронефрологической заболеваемости и смертности в Российской Федерации за десятилетний период (2002-2012 гг.) по данным официальной статистики//Экспериментальная и клиническая урология, 2014 № 2, с. 4-12
- Ходырева Л.А., Зайцев А.В., Берников А.Н. и др. Острый и рецидивирующий цистит. Что нам известно? РМЖ. 2020;11:69-74.
- Инструкция по применению препарата Фитолизин® Паста для приготовления суспензии для приема внутрь
Как предотвратить камни в почках?
Если вы хотите узнать, как предотвратить камни в почках, необходимо понимать, что вызвало их образование в прошлом. Как только вам станет известно, какая именно разновидность камней вас беспокоила, вы сможете эффективно скорректировать образ жизни и питания. В этом материале мы рассмотрим, как избежать или хотя бы снизить риск повторного образования камней.
Как только вам станет известно, какая именно разновидность камней вас беспокоила, вы сможете эффективно скорректировать образ жизни и питания. В этом материале мы рассмотрим, как избежать или хотя бы снизить риск повторного образования камней.
Медикаменты и дополнительные хирургические меры
Само собой, профилактика камней в почках должна в первую очередь основываться на изменении образа жизни. Однако существуют и терапевтические меры, которые нельзя игнорировать. В зависимости от разновидности камней, с которыми вы сталкивались ранее, вам возможно потребуется прием препаратов. Если их назначат, они могут приниматься неделями, месяцами и даже дольше.
Например, если вас беспокоили струвитные камни, в данном случае могут назначить антибиотик, который принимается до 6 или более недель. При другой разновидности камней могут назначить цитрат калия в таблетках. Его принимают на протяжении нескольких месяцев.
Ниже представлена таблица с препаратами, которые могут назначить при разных разновидностях камней:
Вид камней | Препараты |
Кальциевые (оксалатные) |
|
Уратные |
|
Струвитные |
|
Цистиновые |
|
Удаление паращитовидной железы
Иногда кальциевые камни образуются у людей с гиперпаратиреозом. Это состояние, при котором в крови очень сильно повышается уровень кальция. В данном случае может потребоваться операция по удалению паращитовидной железы. После ее удаления риск образования кальциевых камней существенно снижается.
Питание при камнях в почках
Самое главное – пить много жидкости. Жидкость разбавляет мочу и снижает концентрацию минералов, из которых могут формироваться камни.
Если у человека почечная недостаточность, ему нужно быть очень осторожным с количеством употребляемой жидкости. Лучшее, что он может сделать – узнать о необходимом режиме питья у лечащего врача.
Что пить при камнях в почках?
Лучший вариант – обычная вода без газа, которую рекомендуют пить в количестве 6-8 стаканов в день. Хотя и другая жидкость может быть полезной, особенно – напитки из цитрусовых. Некоторые исследования показывают, что благодаря содержанию в своем составе цитрата, натуральные лимонады и апельсиновые соки помогают в профилактике камней в почках.
Если у человека были цистиновые камни, в его случае необходимо пить еще больше. Но перед этим необходимо получить одобрение от врача. При почечной недостаточности, недержании мочи и частых мочеиспусканиях большие объемы жидкости могут быть противопоказаны.
Влияет ли вид камней на диету при камнях в почках?
Влияет. Рацион при разных видах камней хоть и не существенно, но отличается.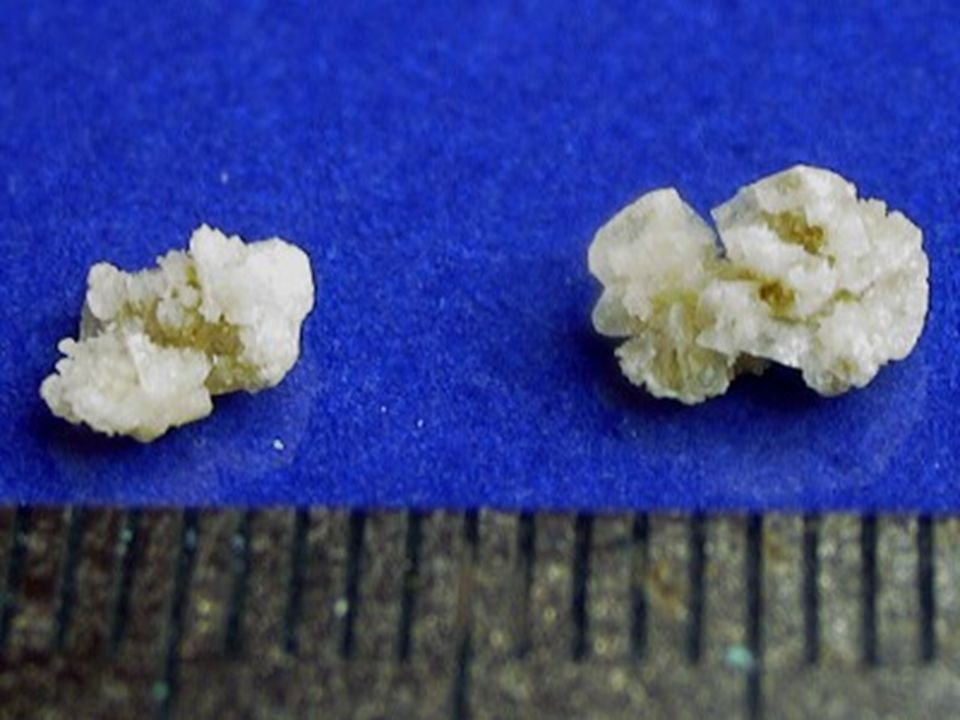 В любом случае необходимо строго следить за количеством употребляемых оксалатов, соли, белка животного происхождения и кальция.
В любом случае необходимо строго следить за количеством употребляемых оксалатов, соли, белка животного происхождения и кальция.
Питание при оксалатных (кальциевых) камнях в почках
Первое, что необходимо сделать – разобраться, где содержится большое количество оксалатов. Этих продуктов необходимо избегать или сильно ограничить их употребление:
- Орехи,
- Арахис,
- Ревень,
- Шпинат,
- Свекла,
- Шоколад,
- Пшеничные отруби.
Поменьше соли
Риск повторного образования камней существенно увеличивается, если человек употребляет много натрия. Этот минерал входит в состав соли, которая в больших количествах содержится в фаст-фуде, консервах и других упакованных продуктах. Также много соли находится в приправах и мясных блюдах. Позже мы рассмотрим, как снизить употребление соли.
Ограничьте употребление белка животного происхождения
Питание при камнях в почкахне должно включать много белка животного происхождения. Он может увеличить риск образования оксалатных, фосфатных и уратных камней. Рекомендуется ограничить употребление:
Он может увеличить риск образования оксалатных, фосфатных и уратных камней. Рекомендуется ограничить употребление:
- Говядины, курицы, свинины, особенно – органов,
- Яиц,
- Рыбы и моллюсков,
- Молока, сыра и других молочных продуктов.
Важно понимать, что каждому человеку необходим белок, поэтому полностью отказываться от этого нутриента нельзя. Мясо, морепродукты и молочные продукты можно заменить на растительные источники белка – бобовые. Фасоль, зеленый горошек, чечевица – все это замечательные источники белка с низким содержанием оксалатов.
Для составления индивидуального рациона с допустимым количеством белка обращайтесь к доктору-диетологу.
Получайте достаточно кальция
В правильных количествах кальций способен блокировать вещества в пищеварительном тракте, которые провоцируют образование камней. Хотя на первый взгляд может показаться, что в питании при оксалатных камнях в почках нет места кальцию. Лучше всего этот минерал получать из растительных продуктов с низким содержанием оксалатов.
Питание при фосфатных камнях
Снизьте употребление соли и замените белок животного происхождения на растительный. Специалисты из Национального института здоровья рекомендуют заменить мясные, море- и молочные продукты на следующие:
- Бобовые, включая фасоль, сушеный горох, чечевицу и арахис,
- Соевые продукты: соевое молоко и тофу,
- Орехи: миндаль, кешью, грецкие орехи и фисташки,
- Семечки подсолнечника.
Также рекомендуется следить за употреблением кальция, отдавая предпочтение растительным источникам этого минерала.
Диета при уратных камнях в почках
В данном случае необходимо придерживаться рекомендаций для профилактики фосфатных камней. Особое внимание отводится красному мясу, мясным субпродуктам (органам) и моллюскам. В них содержится большая концентрация природного химического соединения – пуринов. Потребление пуринов приводит к повышенной выработке мочевой кислоты, а также нагружает почки, которые выводят мочевину. Выведение большого количества мочевины приводит к падению pH мочи, из-за чего она становится более кислой. Это создает благоприятные условия для образования уратных камней.
Выведение большого количества мочевины приводит к падению pH мочи, из-за чего она становится более кислой. Это создает благоприятные условия для образования уратных камней.
Также людям, которые уже пострадали от уратных камней, необходимо следить за своим весом. Лишние килограммы или ожирение значительно увеличивают риск их повторного образования.
Диета при цистиновых камнях в почках
Для предотвращения их повторного образования важнее всего пить много жидкости – в основном воды без газа.
Что нельзя есть при камнях в почках?
В целом специалисты рекомендуют по минимуму употреблять:
- Свеклу, шоколад, батат, шпинат, ревень, чай и большинство орехов – все эти продукты богаты на оксалаты,
- Колу – в ней содержится много фосфатов.
Также специалисты из Национального фонда почек рекомендуют одновременно употреблять продукты, в которых содержатся оксалаты и кальций. При этом создаются лучшие условия для связывания оксалатов с кальцием в желудке и кишечнике. За счет этого меньше шансов, что в почках образуются оксалатные камни.
За счет этого меньше шансов, что в почках образуются оксалатные камни.
Как снизить потребление соли?
В день рекомендуется употреблять менее 2,3 грамма соли. Такое количество соли содержится в одной чайной ложечке. Для того чтобы снизить употребление натрия, рекомендуется:
- Не покупать приготовленную еду, а готовить самостоятельно. Особенно нужно избегать фаст-фуда и консервированных продуктов.
- Читать этикетки и выбирать продукты с пометками «Без соли» или «Низкое количество соли/натрия».
- Избегать продуктов со скрытой солью. Она обозначается как бикарбонат натрия (химическое название пищевой соды), динатрийфосфат, глутамат натрия, альгинат натрия,нитрат натрия.
Профилактика камней в почках не гарантирует, что они вас больше не побеспокоят. Однако с помощью полученных рекомендаций вы хотя бы снизите риск их повторного образования. Будьте здоровы, а при первых же симптомах – обращайтесь к врачу.
Источники:
- Kidney Stones, The National Institute of Diabetes and Digestive and Kidney Diseases,
- 5 steps for preventing kidney stones, Harvard University,
- 6 Easy Ways to Prevent Kidney Stones, National Kidney Foundation.

Бактерии кишечника защищают от камней в почках
Бактерии Oxalobacter formigenes (O. formigenes), входящие в состав естественной микрофлоры кишечника, уменьшают риск рецидивов мочекаменной болезни на 70%. К такому выводу пришли ученые из Бостонского университета в результате клинического исследования с участием пятисот человек, сообщает Journal of the American Society of Nephrology.
По статистике, основную массу почечных камней составляют оксалаты, состоящие из солей щавелевой кислоты и кальция. Риск образования таких камней особенно велик при выявлении оксалатов в моче. В тоже время, открытые сравнительно недавно бактерии O. formigenes обладают способностью утилизировать оксалаты в желудочно-кишечном тракте человека, регулируя уровень этих солей в плазме и моче.
Ученые под руководством Дэвида Кауфмана (David Kaufman) определяли содержание O. formigenes в кале у 247 взрослых пациентов, страдающих рецидивирующей мочекаменной болезнью, и 259 здоровых участников (контрольная группа). Также у участников по анализам мочи оценивалась 24-часовая экскреция оксалатов. В результате исследования бактерии O. formigenes были выявлены у 17% пациентов с мочекаменной болезнью и 38% людей из контрольной группы.
«Мы наблюдали устойчивую обратную взаимосвязь между колонизацией кишечника O. formigenes и рецидивами оксалатных камней в почках», — сообщил Кауфман. Он уточнил, что при наличии бактерий риск рецидивов мочекаменной болезни уменьшался на 70%.
По статистике, в США мочекаменная болезнь развивается у 5-15% жителей, а риск рецидива в течение пяти лет составляет от 30 до 50%. По мнению исследователей, применение бактерий O. formigenes в качестве пробиотиков поможет предотвратить образование новых камней в почках. В настоящее время эта методика проходит ранние стадии клинических испытаний, отметил Кауфман.
Ссылка на публикацию: MedPortal
Доктор73 — Новости — Предупредить мочекаменную болезнь намного проще, чем лечить!
Предупредить мочекаменную болезнь намного проще, чем лечить!
Мочекаменная болезнь (МКБ) – заболевание, связанное с нарушением обмена веществ в организме, которое приводит к отложению солей, появлению песка и образованию камней в почках и мочевыводящих путях. Камни могут быть мизерными или очень большими в диаметре. Если вовремя не обратиться к врачу за помощью, может возникнуть пиелонефрит, который иногда приводит к гнойному воспалению почки. К сожалению, заболевание регистрируется не только среди пациентов старших возрастных групп, оно может встречаться у ребенка, при этом причина его возникновения не всегда остается понятной. Это заболевание носит обменный характер, то есть его возникновению предшествуют разные биохимические сбои в работе организма. Такое состояние в своем развитии требует наличия сразу нескольких причин и предрасполагающих факторов, которые в совокупности могут стать толчком для начала патологического процесса. Поэтому профилактика мочекаменной болезни играет немаловажную роль в обеспечении удовлетворительного состояния людей. «Различают три вида камней в почках: фосфаты, оксалаты и мочекислые камни (ураты). Чтобы определить, есть ли в ваших почках камни — нужно пройти УЗИ, урографию и сдать необходимые анализы. Если появляются болезненные симптомы, они все равно приведут вас к врачу, а он в свою очередь определит, какой способ диагностики подходит для данного случая. Запущенное заболевание, когда камни в почках увеличиваются до больших размеров, грозит тем, что может развиться почечная недостаточность, означающая потерю функции почки», — отметил заведующий урологическим отделением Центральной медсанчасти, врач-уролог, кандидат медицинских наук Дмитрий Соловьёв. Так, в 2017 году с данной патологией в урологическом отделении было пролечено 463 пациента, а в 2018 году — 403. В зависимости от размера камня выбирается медикаментозный или хирургический метод лечения. Каждому четвертому пациенту было применено оперативное лечение, что говорит о серьёзности данного заболевания. Как же предупредить мочекаменную болезнь? Особое внимание в профилактике развития уролитиаза (мочекаменной болезни) уделяется соблюдению правильного пищевого и питьевого режимов. — Во-первых, необходимо строгое соблюдение диеты. Выбор диеты зависит от состава камней. И здесь важно проявить силу воли и здравый смысл. А именно: при уратах ограничивают потребление мяса и субпродуктов, яиц, рыбы, копченостей; при оксалатах – фасоль, щавель, чай, кофе, шоколад. При фосфорно-карбонатных конкрементах следует максимально ограничить продукты, богатые кальцием, например, молоко или сыр. Существуют и общие рекомендации по питанию для пациентов с камнями в почках. Например, стоит ограничить спиртосодержащие напитки, стараться не переедать, ограничить поваренную соль до 3 г в сутки, не злоупотреблять аскорбиновой кислотой. Необходимо исключать консервы и газированные напитки. При крупных камнях нельзя злоупотреблять мочегонными препаратами и продуктами способными нарушить отток мочи. — Во-вторых, важен питьевой режим. Обязательно употребление достаточного количества жидкости, до 3 литров в сутки. Нехватка жидкости ускоряет образование камней в почках, мочеточниках и мочевом пузыре. Эту цифру стоит обсудить с врачом, так как при некоторых сопутствующих заболеваниях требуется более резкое ограничение жидкости. Всем остальным в качестве профилактики мочекаменной болезни рекомендуется пить по 1,5-2 литра воды в сутки. — В-третьих, нужно тепло одеваться, дабы предотвратить переохлаждение, ведь это может навредить здоровью почек и поспособствовать появлению камней в них. — В-четвёртых, обязательно исключите алкоголь. Спиртные напитки негативно отражаются на обменных процессах в организме, сбой которых может привести к образованию камней в почках. «Опасность патологии почек и мочевого пузыря состоит в отсутствии видимых признаков на ранних стадиях заболевания. Иногда даже при среднетяжёлой степени болезней органов мочевыделительной системы пациент не испытывает негативных ощущений, пока камни находятся на месте. Регулярное посещение врача позволит во время выявить и предотвратить проблему камнеобразования или рецидива мочекаменной болезни. Особенно это касается тех, кто уже сталкивался с камнями в почках. Будьте внимательны к своему здоровью и помните, что всегда профилактика – лучшее лечение», — подчеркнула главный врач Центральной клинической медсанчасти Елена Ледяева.
Мочекаменная болезнь у котов: симптомы и лечение
Мочекаменная болезнь у котов: симптомы и лечениеБ
- Балашиха
- Быково
Ж
- Железнодорожный
- Жуковский
К
- Королёв
- Красково
- Красногорск
- Курск
Л
- Лобня
- Лыткарино
- Люберцы
М
- Москва
- Московский
- Мытищи
Р
- Раменское
- Реутов
- Ростов-на-Дону
С
- Санкт-Петербург
Еда, диета и питание для лечения камней в почках
Могу ли я предотвратить образование камней в почках, изменив то, что я ем и пью?
Употребление достаточного количества жидкости, в основном воды, — это самое важное, что вы можете сделать для предотвращения образования камней в почках. Если у вас нет почечной недостаточности, многие специалисты в области здравоохранения рекомендуют выпивать от шести до восьми стаканов по 8 унций в день. Посоветуйтесь с врачом о том, сколько жидкости вам следует пить.
Исследования показали, что диетические подходы к борьбе с гипертонией (DASH) могут снизить риск образования камней в почках.Узнайте больше о диете DASH. 2
Исследования показали, что лишний вес увеличивает риск образования камней в почках. Диетолог поможет вам спланировать приемы пищи, чтобы помочь вам сбросить вес.
Влияет ли тип камня в почках на выбор пищи, которую я должен сделать?
Да. Если у вас уже были камни в почках, спросите своего лечащего врача, какой тип камней у вас был. В зависимости от типа камня в почках вы можете предотвратить образование камней в почках, изменив количество натрия, животного белка, кальция или оксалата в еде, которую вы едите.
При этих типах камней в почках может потребоваться изменить то, что вы едите и пьете:
Диетолог, специализирующийся на профилактике камней в почках, может помочь вам спланировать питание, чтобы предотвратить образование камней в почках. Найдите диетолога, который сможет вам помочь.
Камни оксалата кальция
Восстановить оксалат
Если у вас были камни из оксалата кальция, вы можете отказаться от этих продуктов, чтобы снизить количество оксалата в моче:
- орехи и ореховые изделия
- арахис — бобовые, а не орехи, с высоким содержанием оксалата
- ревень
- шпинат
- отруби пшеничные
Поговорите с врачом о других пищевых источниках оксалатов и о том, сколько оксалатов должно быть в том, что вы едите.
Уменьшить натрий
Ваш шанс развития камней в почках увеличивается, если вы едите больше натрия. Натрий входит в состав соли. Натрий содержится во многих консервированных, упакованных и фаст-фудах. Он также входит во многие приправы, приправы и мясо.
Проконсультируйтесь с врачом о том, сколько натрия должно быть в вашей еде. См. Советы по снижению потребления натрия.
Ограничение животного белка
Употребление в пищу животных белков может увеличить ваши шансы на развитие камней в почках.
Медицинский работник может посоветовать вам ограничить употребление животного белка, в том числе
- говядина, курица и свинина, особенно субпродукты
- яиц
- рыба и моллюски
- молоко, сыр и прочие молочные продукты
Хотя вам может потребоваться ограничить количество животного белка, которое вы потребляете каждый день, вам все же необходимо убедиться, что вы получаете достаточно белка. Подумайте о том, чтобы заменить часть мяса и животного белка, которые вы обычно едите, фасолью, сушеным горошком и чечевицей — растительными продуктами с высоким содержанием белка и низким содержанием оксалатов.
Поговорите со специалистом в области здравоохранения о том, сколько общего белка вам следует съесть и сколько должно поступать из продуктов животного или растительного происхождения.
Получать достаточно кальция из продуктов
Хотя звучит так, будто кальций является причиной кальциевых камней, это не так. В нужных количествах кальций может блокировать другие вещества в пищеварительном тракте, которые могут вызывать камни. Поговорите с врачом о том, сколько кальция вам следует съесть, чтобы предотвратить образование камней из оксалата кальция и укрепить кости.Лучше всего получать кальций из растительных продуктов с низким содержанием оксалатов, таких как обогащенные кальцием соки, хлопья, хлеб, некоторые виды овощей и некоторые виды бобов. Спросите диетолога или другого медицинского работника, какие продукты являются для вас лучшим источником кальция.
Камни фосфата кальция
Уменьшить натрий
Ваш шанс развития камней в почках увеличивается, если вы едите больше натрия. Натрий входит в состав соли. Натрий содержится во многих консервированных, упакованных и фаст-фудах.Он также входит во многие приправы, приправы и мясо.
Проконсультируйтесь с врачом о том, сколько натрия должно быть в вашей еде. См. Советы по снижению потребления натрия.
Ограничение животного белка
Употребление в пищу животных белков может увеличить ваши шансы на развитие камней в почках.
Медицинский работник может посоветовать вам ограничить употребление животного белка, в том числе
- говядина, курица и свинина, особенно субпродукты
- яиц
- рыба и моллюски
- молоко, сыр и прочие молочные продукты
Хотя вам может потребоваться ограничить количество животного белка, которое вы потребляете каждый день, вам все же необходимо убедиться, что вы получаете достаточно белка.Подумайте о замене части мяса и животного белка, которые вы обычно едите, некоторыми из этих растительных продуктов с высоким содержанием белка:
- бобовые, такие как фасоль, сушеный горох, чечевица и арахис
- соевые продукты, такие как соевое молоко, соевое ореховое масло и тофу
- орехи и ореховые продукты, такие как миндаль и миндальное масло, кешью и масло кешью, грецкие орехи и фисташки
- семечки
Поговорите со специалистом в области здравоохранения о том, сколько общего белка вам следует съесть и сколько должно поступать из продуктов животного или растительного происхождения.
Получать достаточно кальция из продуктов
Хотя звучит так, будто кальций является причиной кальциевых камней, это не так. В нужных количествах кальций может блокировать другие вещества в пищеварительном тракте, которые могут привести к образованию камней. Поговорите с врачом о том, сколько кальция вам следует съесть, чтобы предотвратить накопление кальций-фосфатных камней и поддержать прочность костей. Лучше всего получать кальций из продуктов растительного происхождения, таких как обогащенные кальцием соки, хлопья, хлеб, некоторые виды овощей и некоторые виды бобов.Спросите диетолога или другого медицинского работника, какие продукты являются для вас лучшим источником кальция.
Камни мочевой кислоты
Ограничение животного белка
Употребление в пищу животных белков может увеличить ваши шансы на развитие камней в почках.
Медицинский работник может посоветовать вам ограничить употребление животного белка, в том числе
- говядина, курица и свинина, особенно субпродукты
- яиц
- рыба и моллюски
- молоко, сыр и прочие молочные продукты
Хотя вам может потребоваться ограничить количество животного белка, которое вы потребляете каждый день, вам все же необходимо убедиться, что вы получаете достаточно белка.Подумайте о замене части мяса и животного белка, которые вы обычно едите, некоторыми из этих растительных продуктов с высоким содержанием белка:
- бобовые, такие как фасоль, сушеный горох, чечевица и арахис
- соевые продукты, такие как соевое молоко, соевое ореховое масло и тофу
- орехи и ореховые продукты, такие как миндаль и миндальное масло, кешью и масло кешью, грецкие орехи и фисташки
- семечки
Поговорите со специалистом в области здравоохранения о том, сколько общего белка вам следует съесть и сколько должно поступать из продуктов животного или растительного происхождения.
Похудание при избыточном весе особенно важно для людей, у которых были камни из мочевой кислоты.
Цистиновые камни
Употребление достаточного количества жидкости, в основном воды, является наиболее важным изменением образа жизни, которое вы можете сделать для предотвращения образования цистиновых камней. Посоветуйтесь с врачом о том, сколько жидкости вам следует пить.
Советы по снижению потребления натрия
Большинство американцев потребляют слишком много натрия. Взрослые должны стремиться потреблять менее 2300 мг в день. 3 Одна чайная ложка поваренной соли содержит 2325 миллиграммов (мг) натрия. Если у вас были камни из оксалата кальция или фосфата кальция, вы должны следовать этому руководству, даже если вы принимаете лекарства для предотвращения образования камней в почках.
Вот несколько советов, которые помогут вам снизить потребление натрия:
- Проверьте процентную суточную норму натрия (% DV) на этикетке «Пищевая ценность», которую можно найти на многих пищевых продуктах. Низкое содержание натрия составляет 5% или меньше, а высокое содержание натрия — 20% или более.
- Запишите, сколько натрия вы потребляете каждый день.
- Когда едите вне дома, спросите о содержании натрия в пище.
- Готовим с нуля. Избегайте полуфабрикатов и фаст-фуда, консервированных супов и овощей, а также мясных обедов.
- Ищите продукты с этикетками: без натрия, без соли, с очень низким содержанием натрия, с низким содержанием натрия, с пониженным или меньшим содержанием натрия, с низким содержанием натрия, без добавления соли, несоленый и слабосоленый.
Проверьте этикетки на наличие ингредиентов и скрытого натрия, например
- бикарбонат натрия, химическое название пищевой соды
- разрыхлитель, содержащий бикарбонат натрия и другие химические вещества
- динатрийфосфат
- глутамат натрия, или MSG
- альгинат натрия
- натрия нитрат или нитрит
Список литературы
[2] Тейлор Э. Н., Фунг Т. Т., Курхан Г. С..Диета в стиле DASH снижает риск образования камней в почках. Журнал Американского общества нефрологов. 2009; 20 (10): 2253–2259.
[3] Министерство здравоохранения и социальных служб США и Министерство сельского хозяйства США. Диетические рекомендации для американцев. Восьмое издание. 2015-2020 гг. health.gov/dietaryguidelines/2015/guidelines. Опубликовано в декабре 2015 г. Проверено 18 апреля 2017 г.
Диетический оксалат и образование камней в почках
Am J Physiol Renal Physiol.1 марта 2019 г .; 316 (3): F409 – F413.
Отделение урологии, Университет Алабамы в Бирмингеме, Бирмингеме, Алабама
Автор, ответственный за перепечатку, адрес для перепечатки и другой корреспонденции: Р.П. Холмс, Департамент урологии, UAB Kaul 816B 720 20th Street, South Birmingham, AL 35294 (электронная почта: ude.bau@semlohr).Поступило 31.07.2018 г .; Пересмотрено 14 декабря 2018 г .; Принято 17 декабря 2018 г.
Авторские права © Американское физиологическое общество, 2019 г.Abstract
Пищевые оксалаты растительного происхождения и могут входить в состав овощей, орехов, фруктов и злаков. У нормальных людей примерно половина оксалатов в моче поступает с пищей, а половина — за счет эндогенного синтеза. Количество оксалата, выделяемого с мочой, играет важную роль в образовании камней из оксалата кальция. Крупные эпидемиологические когортные исследования показали, что экскреция оксалатов с мочой является непрерывной переменной, если ее индексировать с учетом риска образования камней. Таким образом, люди с экскрецией оксалатов> 25 мг / день могут получить пользу от снижения выделения оксалатов с мочой.24-часовой анализ мочи может пропустить периоды кратковременных скачков экскреции оксалатов с мочой, которые могут способствовать росту камней и являются ограничением этого анализа. В этом обзоре мы описываем влияние диетических оксалатов и их вклад в рост камней. Чтобы ограничить рост оксалатных камней, мы рекомендуем пациентам поддерживать соответствующую гидратацию, избегать продуктов, богатых оксалатами, и потреблять достаточное количество кальция.
Ключевые слова: оксалат кальция, кристаллурия, камни в почках, оксалат
ВВЕДЕНИЕ
Количество оксалата, выделяемого с мочой, является критическим фактором роста камней из оксалата кальция (CaOx) (24, 48).Оксалат с мочой получают из двух основных источников: диета и эндогенный синтез. Вклад оксалатов с пищей в образование камней трудно точно оценить по причинам, включающим 1 ) необходимость контролировать потребление оксалатов, кальция и других питательных веществ для точного определения факторов, влияющих на выведение оксалатов, 2 ) трудность оценки потребления оксалатов, 3 ) необъяснимая изменчивость абсорбции и секреции оксалатов, 4 ) изменчивость содержания оксалатов в продуктах питания из-за условий окружающей среды / роста, 5 ) взаимодействия оксалатов с пищевым кальцием, 6 ) влияние микробов, разлагающих оксалаты, и 7 ) отсутствие клинических исследований, показывающих, что уменьшение потребления оксалатов снижает частоту рецидивов камней.В этом обзоре мы обсуждаем абсорбцию, разложение и выведение оксалатов с пищей и их потенциальное влияние на рост камней в почках. Кроме того, рассматриваются будущие направления исследований вклада оксалатов с пищей в развитие каменной болезни.
ДИЕТИЧЕСКИЙ ОКСАЛАТ И КАМЕННЫЙ РИСК
Два общих инструмента, которые использовались в последние несколько десятилетий для понимания роли диетического оксалата в риске образования камней, — это опросники частоты приема пищи и 24-часовой сбор мочи. Оба этих инструмента предлагают ценную информацию о потреблении оксалатов пациентом и риске каменной болезни, соответственно.Однако они не полностью оценивают значительный риск, который может быть связан со спорадическим приемом большого количества оксалатов с пищей. Анкеты по частоте приема пищи использовались для изучения предполагаемого камнеобразования в трех отдельных долгосрочных когортах. Эти исследования показали незначительный риск, связанный с потреблением оксалатов с пищей и каменной болезнью [относительный риск 1,21 (мужчины) и 1,22 (пожилые женщины)] (51). Несмотря на нечастое потребление, вареный и сырой шпинат был указан в качестве основного источника диетических оксалатов в этих группах.Потребление нормальной порции шпината (50–100 г) приведет к нагрузке ~ 500–1000 мг оксалатов с пищей и значительно увеличит выведение оксалатов с мочой (21, 23). В этих исследованиях влияние оксалатов с пищей на риск образования камней могло быть минимальным из-за 1 ) неспособности участников точно вспомнить, как часто они употребляли продукты, содержащие большое количество оксалата, в течение 1 месяца, 2 ) вариабельности в количестве пищи, богатой оксалатами, потребляемой участником, и 3 ) вариабельность всасывания проглоченного оксалата.В других исследованиях эти же исследователи показали большее влияние диетического кальция, чем диетического оксалата, на риск образования камней в почках (отрицательная корреляция) (3, 9, 52). Было высказано предположение, что этот ответ связан с уменьшением количества кристаллического оксалата в кишечнике, при этом низкое потребление кальция приводит к большему всасыванию оксалата и повышенной экскреции с мочой.
Круглосуточная экскреция оксалата с мочой использовалась для оценки риска развития почечного камня. Курхан и Тейлор сообщили о трех-четырехкратном увеличении относительного риска образования камня в их когорте медицинских работников по сравнению с группами с самым низким или самым высоким выделением оксалатов (8).Таким образом, относительный риск каменной болезни был намного выше при исследовании суточного анализа оксалата мочи, чем при использовании опросника частоты приема пищи. У мужчин с экскрецией оксалатов в пределах нормы даже небольшое увеличение экскреции оксалатов с мочой (5 мг / день) удваивает риск образования камней в почках, демонстрируя, что экскреция оксалатов является непрерывной переменной. Важно отметить, что Курхан и Тейлор также признали, что «24-часовой сбор мочи дает картину выведения оксалатов за день, но не дает информации о низких и высоких периодах.«Концепция вызванного диетой временного всплеска экскреции оксалатов была ранее сообщена Erickson et al. (11) у лиц, получающих кальциевую нагрузку с пищей. Впоследствии мы показали аналогичные всплески экскреции оксалатов после оксалатных нагрузок (20, 34). Таким образом, вполне возможно, что воздействие выброса оксалата после приема пищи, богатой оксалатами, не может быть обнаружено с помощью 24-часового сбора мочи. Такой всплеск может быть связан с временным увеличением перенасыщения мочи CaOx.Prochaska et al. недавно показали, что умеренные изменения относительного перенасыщения мочи СаОх связаны с большими изменениями риска образования камней (46). Таким образом, оказывается, что экскреция оксалатов> 25 мг / день является повышенным фактором риска образования камней и что> 40 мг / день следует рассматривать как индикатор первичной или вторичной гипероксалурии. Необходимы дополнительные исследования для дальнейшего изучения этого вопроса.
ДИЕТИЧЕСКИЙ ОКСАЛАТ И ЕГО КИШЕЧНОЕ ПОГЛОЩЕНИЕ
Оксалат абсорбируется пара- и трансклеточными механизмами, и их относительный вклад может различаться в разных сегментах кишечника (14).Считается, что транспортеры SLC26 играют важную роль в трансклеточном транспорте, при этом SLC26A3 регулирует кишечную абсорбцию (14). Результаты исследования 30 лиц без образования камней, которые прошли тест на абсорбцию в трех повторностях, показали, что ~ 5-10% нагрузки растворимого оксалата (нагрузка 50 мг [ 13 C 2 ] оксалата натрия) впитывается. Однако абсорбция может составлять от 1 до 20% с большой индивидуальной и внутрииндивидуальной вариабельностью (56). Сообщается, что количество оксалата, абсорбируемого в таком тесте, выше у людей, образующих камни, чем у людей, не образующих камни (19).Однако остается неопределенность, поскольку неизвестно, насколько хорошо абсорбция оксалата натрия при этой нагрузке повторяет абсорбцию оксалата пищевого происхождения. Кроме того, влияние абсорбции кальция, перистальтики желудочно-кишечного тракта, колонизации компонентами фекального микробиома, включая Oxalobacter formigenes и другими потенциальными модификаторами, четко не определено.
На всасывание оксалата с пищей в кишечнике в значительной степени влияет растворимость (биодоступность) проглоченного оксалата.Люди потребляют в среднем 15–25 ммоль кальция в день по сравнению с 1–3 ммоль оксалата, что позволяет предположить, что в кишечнике большая часть оксалата представляет собой нерастворимый кристаллический CaOx. Кристаллический оксалат удаляется с потоком фекалий; таким образом, пул оксалата, который может абсорбироваться, находится в растворимой форме. Эффект растворимости оксалата в пище был проиллюстрирован Tang et al., Которые сравнили экскрецию оксалата с мочой после приема двух веществ с одинаковым содержанием оксалата, корицы и куркумы, но с разной степенью растворимости оксалата (50).Расчетная абсорбция оксалата куркумой, обогащенной растворимым оксалатом, составила 8,2% по сравнению с 2,6% корицей, в основном состоящей из кристаллического оксалата. В показано изменение экскреции оксалатов у 12 человек, которые перешли с самостоятельно выбранной диеты ( день 0 ) на диету, не содержащую оксалатов (21). Примечательно, что для выведения оксалата из кишечника требуется несколько дней. Это было подтверждено оксалатным анализом стула двух человек, у которых оксалат был обнаружен на день 4 , но не на день 6 (22).
Уменьшение экскреции оксалатов с мочой у 12 здоровых субъектов, потребляющих диету без оксалатов. Показаны относительные количества оксалата в моче, полученного в результате всасывания в кишечнике и эндогенного синтеза. Ценности — это средние значения (СО). [Данные были рассчитаны по Holmes et al. (21).]
ДЕГРАДАЦИЯ ОКСАЛАТОВ ЖИВОТНЫМИ БАКТЕРИЯМИ
Исследования разложения оксалатов в кишечнике микроорганизмами были сосредоточены на O. formigenes , который использует оксалат в качестве основного источника энергии и углерода.Сообщалось, что колонизация этим организмом снижает риск повторного образования камней CaOx на 70% (29). Мы обнаружили, что колонизация этим организмом приводила к снижению экскреции оксалатов с мочой только тогда, когда субъекты принимали диету с низким содержанием кальция (400 мг) и умеренно высоким содержанием оксалата (250 мг) (28). Как упоминалось ранее, диета с низким содержанием кальция является фактором риска камнеобразования (9), и, таким образом, колонизация может быть защитной в этих условиях. Исследования на крысах показали, что O.formigenes стимулирует секрецию оксалатов из плазмы в кишечник (2, 17), что может снизить выведение оксалатов с мочой и снизить риск образования камней. Хотя первоначальные исследования были сосредоточены на этом организме, важно признать, что микробиом фекалий содержит ряд других организмов, которые могут поддерживать выживание O. formigenes , метаболизировать оксалаты, а также влиять на транспорт в кишечнике. Таким образом, больше исследований, посвященных коллективному влиянию микробиома на разложение и транспорт оксалатов, а также тому, как он поддерживает разложение оксалатов O.formigenes (40, 42).
ВЫДЕЛЕНИЕ ДИЕТИЧЕСКИХ ОКСАЛАТОВ И МОЧЕВЫХ ОКСАЛАТОВ
Несмотря на свои ограничения, суточный сбор мочи — лучший доступный инструмент для оценки вклада оксалатов с пищей в экскрецию оксалатов с мочой. В идеале потребление оксалатов и кальция с пищей должно оптимально контролироваться, но для пациентов это практически непрактично. Также было бы предпочтительно контролировать другие диетические компоненты, включая гидроксипролин и витамин С, которые могут влиять на эндогенное производство оксалата.Несколько исследований показывают, что увеличение содержания кальция в рационе снижает экскрецию оксалатов с мочой у людей, соблюдающих контролируемую диету (37, 39, 55). Мы показали, что снижение содержания кальция в рационе с 1000 до 400 мг / день на оксалатной диете 250 мг / день увеличивает среднюю экскрецию оксалата на 20,3% у колонизированных людей и на 50,3% у неколонизированных () (28). Это открытие подчеркивает влияние диетического кальция, а также статуса колонизации на экскрецию оксалатов с мочой. дополнительно иллюстрирует взаимосвязь между оксалатами с пищей и экскрецией оксалатов с мочой и показывает, что в широком диапазоне потребления оксалатов с пищей, от 50 до 750 мг / день, на каждые 100 мг оксалата, потребляемого при диете с кальцием 1000 мг / день, содержание оксалатов с мочой увеличивается. Автор: 2.7 мг. При диете, содержащей <50 мг оксалата в день, доля абсорбированного оксалата увеличивается более резко (21). Это может быть результатом того, что большая часть пищевого оксалата растворима при низких концентрациях или сегментарных различиях в абсорбции в тонком кишечнике, где может преобладать параклеточное поглощение (31).
Экскреция оксалатов с мочой у здоровых субъектов, соблюдающих диету с контролем оксалатов и кальция: группы из 39 человек (19 мужчин, 20 женщин, 22–43 года) из 4 ранее опубликованных контролируемых диетой исследований в нашей лаборатории (28, 32, 33, 35).Пунктирная линия представляет собой линию, наиболее подходящую для диеты с 1000 мг кальция (■) и от 50 до 750 мг оксалата с пищей. Экскреция оксалатов с мочой увеличивается на 2,7 мг на каждые 100 мг оксалатов с пищей. При приеме 250 мг оксалата точки данных демонстрируют экскрецию оксалата с мочой при 400 мг кальция у Oxalobacter formigenes- колонизированных (○) и -неколонизированных (∆) индивидуумов. □, Выведение оксалатов с мочой у лиц, соблюдающих диету без оксалатов (21). Ценности — это средние значения (СО).
ОБРАЩЕНИЕ С ДИЕТИЧЕСКИМ ОКСАЛАТОМ И ПОЧЕЧНЫМ ОКСАЛАТОМ
Поглощенный диетический оксалат доставляется в почки, где он фильтруется и либо секретируется, либо реабсорбируется.Относительный вклад этих процессов в экскрецию оксалатов с мочой точно не определен. Bergsland и соавторы измерили фракционную экскрецию оксалатов у здоровых людей и людей, образующих камни CaOx, на тщательно контролируемой диете с относительно низким содержанием оксалатов, 92 мг / день (4). Доля экскреции оксалата была> 1 у некоторых камнеобразователей, но не у контрольной группы. Это указывает на то, что в этих условиях происходит некоторая секреция оксалатов даже при низком потреблении оксалатов.Ранее мы сообщали о наличии выраженных секреторных потоков оксалата у здоровых субъектов и лиц, образующих камни в почках с CaOx, получавших относительно высокие нагрузки растворимых оксалатов (20, 34). О секреции оксалатов также сообщалось у пациентов с первичной гипероксалурией I типа, и кристаллы CaOx были идентифицированы в проксимальных канальцах почек этой группы (58). Очевидно, что необходимы дальнейшие исследования для оценки влияния оксалатов с пищей (в малых и больших количествах) на обработку оксалатов в почках, особенно на реакцию на более высокие уровни потребления оксалатов с пищей.
РЕКОМЕНДАЦИИ ПО ПИТАНИЮ ОКСАЛАТОВ И ПИЩЕВЫХ ПРОДУКТОВ
Усилия по предотвращению образования камней CaOx должны быть направлены на ограничение перенасыщения мочи CaOx, который, как известно, влияет на риск образования камней (46). Пациенты должны знать, что чрезмерное потребление оксалатов и низкое потребление кальция за один прием пищи может временно увеличить абсорбцию оксалатов и повлиять на перенасыщение мочи CaOx. Практическая стратегия — это ограниченное потребление продуктов с высоким содержанием оксалатов, как показано на рисунке, и поддержание нормального потребления кальция с пищей.Пациенты с кишечной гипероксалурией могут быть предрасположены к развитию оксалатной нефропатии с высоким уровнем потребления оксалатов. Оксалатная нефропатия также может возникать у людей с нормальной функцией желудочно-кишечного тракта, когда они потребляют продукты с высоким содержанием оксалата, особенно в его растворимой форме (1, 7, 10, 16, 49). Это отложение оксалатов, по-видимому, усугубляется с началом хронической болезни почек. Речь идет о арахисе, ревене, карамболе и «сочных» овощах.Другой подход для пациентов — это соблюдение диетических подходов к остановке гипертонии (DASH), которая, как было показано, эффективна в снижении перенасыщения CaOx (44).
Таблица 1.
Упрощенные диетические инструкции по ограничению экскреции оксалатов с мочой
| Избегать | Ограничение | Прием пищи | ||
|---|---|---|---|---|
| Шпинат | Картофель (<100327 с пищей) –400 мг) | |||
| Мангольд | Шоколад | |||
| Ревень | Орехи | |||
| Звездчатые фрукты | Свекла | 9032 Отруби ферментных препаратов, которые теоретически снижают содержание оксалатов в кишечнике, также были исследованы для снижения экскреции оксалатов с мочой.Hoppe и его коллеги показали, что O. formigenes хорошо переносится, но не приводит к значительному снижению экскреции оксалатов с мочой у пациентов с первичной гипероксалурией (25). Кроме того, O. formigenes не снижал уровень оксалатов в моче в рандомизированном исследовании фазы II / III (26). Одним из возможных подходов к снижению содержания оксалатов в моче является использование ALLN-177, новой пероральной ферментной терапии, которая, как было показано, снижает экскрецию оксалатов с мочой за счет разложения оксалатов в кишечнике у людей (36).БУДУЩИЕ НАПРАВЛЕНИЯПоскольку потребление оксалатов с пищей может играть роль в росте камней в почках, необходимы более эффективные методы измерения потребления оксалатов. Одним из подходов, требующих оценки, является использование методов на основе изображений (смартфон) для отслеживания потребления пищи и оценки потребления оксалатов и кальция (6). Этот подход может оказаться более точным, чем вопросники о частоте приема пищи и письменные диетические записи. Если этот подход будет подтвержден, возможно, что приложения также могут быть разработаны для улучшения соблюдения диеты. Еще одним важным фактором в этом процессе является роль кристаллов CaOx в камнеобразовании. Эван и его коллеги изящно продемонстрировали роль бляшки Рэндалла в идиопатическом образовании камней CaOx (12, 13). Они не обнаружили кристаллов CaOx в нефроне своей когорты. Однако испытуемые находились в уникальном состоянии: натощак, гидратировали и находились под общей анестезией. Необходимо выяснить, могут ли скачки доставки оксалата в почки при приеме пищи, богатой оксалатами, привести к образованию кристаллов CaOx.Используя анализатор наночастиц, исследователи обнаружили нанокристаллы CaOx в моче человека (15, 18). Такие кристаллы (<1 мкм и не обнаруживаемые обычными методами) могут попадать в мочевое пространство, прикрепляться к бляшке Рэндалла и приводить к росту камней CaOx. Кроме того, кристаллы могут стимулировать иммунные ответы (5, 27, 30, 38, 43, 47, 53). Хотя это не было показано в гистологии пациентов, экспериментальные модели показали, что кристаллы CaOx стимулируют продукцию хемоаттрактантного белка-1 моноцитов в эпителиальных клетках почек (41, 54).Вероятно, это может происходить при попытке удалить кристаллы через систему моноцитов / макрофагов. Ранее мы определили, что небольшая группа людей, образующих камни из CaOx, подавляет клеточную энергетику моноцитов (57). Мы также показали, что оксалат вызывает аналогичные ответы в моноцитах здоровых субъектов (45). Таким образом, понимание роли диетического оксалата в формировании иммунных ответов может иметь большое значение и требует дальнейших исследований с использованием моделей на животных или исследований диетического питания на людях. ВЫВОДЫДиетический оксалат может иметь важное влияние на риск образования камней CaOx в почках. Степень воздействия трудно определить количественно, поскольку текущие оценки не фокусируются на кратковременном повышении экскреции оксалатов, которое происходит при потреблении оксалатов с пищей. Для более точной количественной оценки таких реакций необходим инструмент оценки питания в режиме реального времени. Сниженное потребление продуктов с высоким содержанием оксалатов и нормальное потребление кальция с пищей может быть практическим методом уменьшения перенасыщения CaOx и, таким образом, может ограничить риск образования камней у людей, образующих камни в почках. ГРАНТЫЭто исследование финансировалось Национальным институтом диабета, болезней органов пищеварения и почек, гранты DK-106284 (T. Mitchell), DK-87967 (J. Knight), DK-115833 (KD Wood), DK-62284 ( DG Assimos), а также DK-50466 и DK-54468 (Р.П. Холмс). РАСКРЫТИЕ ИНФОРМАЦИИАвторы не заявляют о конфликте интересов, финансовом или ином. ВЗНОС АВТОРОВT.M., J.K., and R.P.H. подготовленные фигурки; T.M., D.G.A. и R.P.H. составленная рукопись; Т.M., P.K., T.R., K.D.W., J.K., D.G.A. и R.P.H. отредактированная и исправленная рукопись; T.M., P.K., T.R., K.D.W., J.K., D.G.A. и R.P.H. утверждена окончательная версия рукописи. ССЫЛКИ1. Альберсмайер М., Хильге Р., Шреттле А., Вайс М., Ситтер Т., Вильхауэр В. Острое повреждение почек после приема ревеня: вторичная оксалатная нефропатия у пациента с сахарным диабетом 1 типа. BMC Nephrol 13: 141, 2012. DOI: 10.1186 / 1471-2369-13-141. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 2. Арванс Д., Юнг Ю.К., Антонопулос Д., Коваль Дж., Гранджа I, Башир М., Каррар Е., Рой-Чоудхури Дж., Муш М., Асплин Дж., Чанг Е., Хасан Х. Oxalobacter formigenes — биоактивные факторы, полученные из , стимулируют транспорт оксалатов эпителиальными клетками кишечника. J Am Soc Nephrol 28: 876–887, 2017. DOI: 10.1681 / ASN.2016020132. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 3. Барр Р.Г., Вентовски С.К., Курхан Г.К., Сомерс С.К., Штампфер М.Дж., Шварц Дж., Шпайзер Ф.Е., Камарго Калифорния мл. Проспективное исследование использования парацетамола и впервые выявленной астмы у женщин. Am J Respir Crit Care Med 169: 836–841, 2004. DOI: 10.1164 / rccm.200304-596OC.[PubMed] [CrossRef] [Google Scholar] 4. Бергсланд К.Дж., Зисман А.Л., Асплин Дж.Р., Вустер Э.М., Коу, Флорида. Доказательства чистой секреции оксалата почечными канальцами у пациентов с кальциевыми камнями в почках. Am J Physiol Renal Physiol 300: F311 – F318, 2011. DOI: 10.1152 / ajprenal.00411.2010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 5. Бунла С., Хунапатхед С., Боворнпадунгкитти С., Пунпиром К, Тунгсанга К., Сампатанукул П., Тосуховонг П. Экспрессия матричной РНК моноцитов, хемоаттрактантного белка-1 и интерлейкина-6 в почках, содержащих камни.BJU Int 101: 1170–1177, 2008. DOI: 10.1111 / j.1464-410X.2008.07461.x. [PubMed] [CrossRef] [Google Scholar] 6. Boushey CJ, Spoden M, Zhu FM, Delp EJ, Kerr DA. Новые мобильные методы оценки питания: обзор методов оценки питания с использованием изображений и изображений. Proc Nutr Soc 76: 283–294, 2017. DOI: 10.1017 / S0029665116002913. [PubMed] [CrossRef] [Google Scholar] 7. Chen CL, Fang HC, Chou KJ, Wang JS, Chung HM. Острая оксалатная нефропатия после употребления карамболы. Am J Kidney Dis 37: 418–422, 2001.DOI: 10.1053 / ajkd.2001.21333. [PubMed] [CrossRef] [Google Scholar] 8. Курхан ГК, Тейлор ЭН. 24-часовое выведение мочевой кислоты и риск образования камней в почках. Почка Int 73: 489–496, 2008. DOI: 10.1038 / sj.ki.5002708. [PubMed] [CrossRef] [Google Scholar] 9. Curhan GC, Willett WC, Rimm EB, Stampfer MJ. Проспективное исследование диетического кальция и других питательных веществ и риска появления симптоматических камней в почках. N Engl J Med 328: 833–838, 1993. DOI: 10.1056 / NEJM199303253281203. [PubMed] [CrossRef] [Google Scholar] 10. Эллис Д., Либ Дж.Гипероксалурия и мочеполовые расстройства у детей, употребляющих миндальные молочные продукты. J Педиатр 167: 1155–1158, 2015. DOI: 10.1016 / j.jpeds.2015.08.029. [PubMed] [CrossRef] [Google Scholar] 11. Эриксон С.Б., Купер К., Бродус А.Е., Смит Л.Х., Вернесс П.Г., Биндер Г.Дж., Доббинс Дж.В. Поглощение оксалатов и перенасыщение мочи после приема пищи в экспериментальной модели абсорбтивной гиперкальциурии на людях. Clin Sci (Лондон) 67: 131–138, 1984. DOI: 10.1042 / cs0670131. [PubMed] [CrossRef] [Google Scholar] 12. Эван А., Лингеман Дж., Коу, Флорида, Вустер Э.Бляшка Рэндалла: патогенез и роль в оксалатно-кальциевом нефролитиазе. Почка Int 69: 1313–1318, 2006. DOI: 10.1038 / sj.ki.5000238. [PubMed] [CrossRef] [Google Scholar] 13. Эван А.П., Лингеман Дж. Э., Коу Флорида, Паркс Дж. Х., Бледсо С. Б., Шао Й., Соммер А. Дж., Патерсон Р.Ф., Куо Р.Л., Гринпас М. Бляшка Рэндалла больных нефролитиазом начинается в базальных мембранах тонких петель Генле. J Clin Invest 111: 607–616, 2003. DOI: 10.1172 / JCI17038. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14. Фрил РВ, Уиттамор Дж. М., Хэтч М.Трансцеллюлярная абсорбция оксалата и Cl — в кишечнике мышей опосредуется анионообменником DRA Slc26a3, а делеция DRA снижает содержание оксалата в моче. Am J Physiol Gastrointest Liver Physiol 305: G520 – G527, 2013. DOI: 10.1152 / ajpgi.00167.2013. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Гао Дж., Сюэ Дж.Ф., Сюй М., Гуй Би С, Ван Ф. Х, Оуян Дж.М. Сравнение физико-химических свойств нано- и микрокристаллов в моче пациентов с камнями оксалата кальция и контрольной группы.J Nanomater 2014: 7, 2014. DOI: 10.1155 / 2014/7. [CrossRef] [Google Scholar] 16. Получение JE, Gregoire JR, Phul A, Kasten MJ. Оксалатная нефропатия, вызванная «выжиманием сока»: отчет о болезни и обзор. Am J Med 126: 768–772, 2013. DOI: 10.1016 / j.amjmed.2013.03.019. [PubMed] [CrossRef] [Google Scholar] 17. Хэтч М, Корнелиус Дж, Эллисон М, Сидху Х, Пек А, Фрил РВ. Oxalobacter sp. снижает выведение оксалатов с мочой, способствуя секреции оксалатов в кишечнике. Почка Int 69: 691–698, 2006. DOI: 10.1038 / sj.ki.5000162. [PubMed] [CrossRef] [Google Scholar] 18. Он JY, Deng SP, Ouyang JM. Морфология, гранулометрический состав, агрегация и кристаллическая фаза нанокристаллитов в моче здоровых людей и пациентов с литогенными заболеваниями. IEEE Trans Nanobioscience 9: 156–163, 2010. DOI: 10.1109 / TNB.2010.2045510. [PubMed] [CrossRef] [Google Scholar] 19. Hesse A, Schneeberger W, Engfeld S, Von Unruh GE, Sauerbruch T. Кишечная гиперабсорбция оксалата у пациентов, образующих камни из оксалата кальция: применение нового теста с оксалатом [ 13 C 2 ].J Am Soc Nephrol 10, Suppl 14: S329 – S333, 1999. [PubMed] [Google Scholar] 20. Холмс Р.П., Амброзиус В.Т., Ассимос Д.Г. Диетические оксалатные нагрузки и обращение с оксалатами почек. Дж Урол 174: 943–947, 2005. DOI: 10.1097 / 01.ju.0000169476.85935.e2. [PubMed] [CrossRef] [Google Scholar] 21. Холмс Р.П., Гудман ХО, Ассимос Д.Г. Вклад диетических оксалатов в экскрецию оксалатов с мочой. Почка Int 59: 270–276, 2001. DOI: 10.1046 / j.1523-1755.2001.00488.x. [PubMed] [CrossRef] [Google Scholar] 22. Холмс Р.П., Гудман ХО, Ассимос Д.Г.Диетический оксалат и его всасывание в кишечнике. Сканирующий Microsc 9: 1109–1118, 1995. [PubMed] [Google Scholar] 23. Холмс Р.П., Кеннеди М. Оценка содержания оксалатов в продуктах питания и суточного потребления оксалатов. Почка Int 57: 1662–1667, 2000. DOI: 10.1046 / j.1523-1755.2000.00010.x. [PubMed] [CrossRef] [Google Scholar] 24. Холмс Р.П., Рыцарь Дж., Ассимос Д.Г. Снижение экскреции оксалатов с мочой для уменьшения оксалатно-каменной болезни. Мочекаменная болезнь 44: 27–32, 2016. DOI: 10.1007 / s00240-015-0839-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 25.Хоппе Б., Грутофф Дж. В., Хултон С.А., Кочат П., Ниоде П., Кемпер М.Дж., Дешен Дж., Анвин Р., Миллинер Д. Эффективность и безопасность Oxalobacter formigenes для снижения содержания оксалата в моче при первичной гипероксалурии. Трансплантация нефрола Dial 26: 3609–3615, 2011. DOI: 10.1093 / ndt / gfr107. [PubMed] [CrossRef] [Google Scholar] 26. Хоппе Б., Ниадет П., Саломон Р., Харамбат Дж., Хултон С.А., Ван’т Хофф В., Мухала С.Х., Дешен Дж., Линднер Е., Сьегрен А., Кочат П. Рандомизированное исследование фазы I / II для оценки эффективности и безопасности перорального введения Oxalobacter formigenes для лечения первичной гипероксалурии.Педиатр Нефрол 32: 781–790, 2017. DOI: 10.1007 / s00467-016-3553-8. [PubMed] [CrossRef] [Google Scholar] 27. Хуанг М.Ю., Чатурведи Л.С., Коул С., Коул Гонконг. Оксалат стимулирует выработку IL-6 в клетках HK-2, линии эпителиальных клеток проксимальных канальцев почек человека. Почка Int 68: 497–503, 2005. DOI: 10.1111 / j.1523-1755.2005.00427.x. [PubMed] [CrossRef] [Google Scholar] 28. Цзян Дж., Рыцарь Дж., Истер Л.Х., Нейберг Р., Холмс Р.П., Ассимос Д.Г. Влияние диетического кальция и оксалатов и колонизации Oxalobacter formigenes на экскрецию оксалатов с мочой.Дж Урол 186: 135–139, 2011. DOI: 10.1016 / j.juro.2011.03.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 29. Кауфман Д.В., Келли Дж.П., Курхан Г.К., Андерсон Т.Э., Дретлер С.П., Премингер Г.М., Cave DR. Oxalobacter formigenes может снизить риск образования камней в почках из оксалата кальция. J Am Soc Nephrol 19: 1197–1203, 2008. DOI: 10.1681 / ASN.2007101058. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 30. Хан SR. Роль почечных эпителиальных клеток в инициации образования камней из оксалата кальция.Нефрон, Опыт Нефрол 98: e55 – e60, 2004. DOI: 10.1159 / 000080257. [PubMed] [CrossRef] [Google Scholar] 31. Knauf F, Ko N, Jiang Z, Robertson WG, Van Itallie CM, Anderson JM, Aronson PS. Чистый транспорт оксалата в кишечнике отражает пассивную абсорбцию и секрецию, опосредованную SLC26A6. J Am Soc Nephrol 22: 2247–2255, 2011. DOI: 10.1681 / ASN.2011040433. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 33. Рыцарь Дж., Истер Л.Х., Нейберг Р., Ассимос Д.Г., Холмс Р.П. Повышенное потребление белка при контролируемой оксалатной диете не увеличивает экскрецию оксалатов с мочой.Урол Рес 37: 63–68, 2009. DOI: 10.1007 / s00240-009-0170-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 34. Рыцарь Дж., Холмс Р.П., Ассимос Д.Г. Воздействие оксалатной нагрузки на кишечник и почки у здоровых людей и у пациентов с камнеобразованием. Урол Рес 35: 111–117, 2007. DOI: 10.1007 / s00240-007-0090-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 35. Рыцарь Дж., Цзян Дж., Ассимос Д.Г., Холмс Р.П. Проглатывание гидроксипролина и экскреция оксалатов и гликолатов с мочой. Почка Int 70: 1929–1934, 2006.DOI: 10.1038 / sj.ki.5001906. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 36. Langman CB, Grujic D, Pease RM, Easter L, Nezzer J, Margolin A, Brettman L. Двойное слепое плацебо-контролируемое рандомизированное перекрестное исследование фазы 1 с ALLN-177, ферментом, расщепляющим оксалаты, вводимым перорально. Am J Nephrol 44: 150–158, 2016. DOI: 10.1159 / 000448766. [PubMed] [CrossRef] [Google Scholar] 37. Либман М., Коста Г. Влияние кальция и магния на экскрецию оксалатов с мочой после оксалатных нагрузок. Дж Урол 163: 1565–1569, 2000.DOI: 10.1016 / S0022-5347 (05) 67680-X. [PubMed] [CrossRef] [Google Scholar] 38. Лиске Дж. К., Тобак Ф. Г.. Взаимодействие кристаллов мочи с эпителиальными клетками почек в патогенезе нефролитиаза. Семин Нефрол 16: 458–473, 1996. [PubMed] [Google Scholar] 39. Лиске Дж. К., Тремейн В. Дж., Де Симон С., О’Коннор Х. М., Ли Х, Бергстраль Е. Дж., Гольдфарб Д. С.. Диета, но не пероральные пробиотики, эффективно снижает экскрецию оксалатов с мочой и перенасыщение оксалатом кальция. Почка Int 78: 1178–1185, 2010. DOI: 10.1038 / ки.2010.310. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 40. Лю М., Ко Х., Курц З. Д., Батталья Т., ПеБенито А., Ли Х., Наззал Л., Блазер МД. Oxalobacter formigenes -ассоциированные особенности хозяина и структуры микробного сообщества исследованы с помощью American Gut Project. Микробиом 5: 108, 2017. DOI: 10.1186 / s40168-017-0316-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 41. Лю З., Ван Т., Ян Дж., Ван С., Ян В., Лю Дж, Е З. Кристаллы моногидрата оксалата кальция стимулируют хемоаттрактантный белок-1 моноцитов и трансформирующий фактор роста β1 в эпителиальных клетках почек человека.Мол Мед Реп 5: 1241–1244, 2012. DOI: 10.3892 / mmr.2012.813. [PubMed] [CrossRef] [Google Scholar] 42. Миллер А.В., Оуксон К.Ф., Дейл С., Уважаемый доктор медицинских наук. Влияние пищевого оксалата на микробиоту кишечника травоядных млекопитающих Neotoma albigula . Appl Environ Microbiol 82: 2669–2675, 2016. DOI: 10.1128 / AEM.00216-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 43. Мулай С.Р., Кулькарни О.П., Рупанагуди К.В., Миглиорини А., Дарисипуди М.Н., Вилайсане А., Муруве Д., Ши Й., Манро Ф., Лиапис Х., Андерс Х.Дж.Кристаллы оксалата кальция вызывают воспаление почек за счет секреции IL-1β, опосредованной NLRP3. J Clin Invest 123: 236–246, 2013. DOI: 10.1172 / JCI63679. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 44. Нури Н., Хонаркар Э., Гольдфарб Д.С., Калантар-Заде К., Тахери М., Шахссалим Н., Парвин М., Басири А. Профиль литогенного риска мочи у рецидивирующих камнеобразователей с гипероксалурией: рандомизированное контролируемое исследование, сравнивающее диеты в стиле DASH (диетические подходы для остановки гипертонии) и диеты с низким содержанием оксалатов. Am J Kidney Dis 63: 456–463, 2014.DOI: 10.1053 / j.ajkd.2013.11.022. [PubMed] [CrossRef] [Google Scholar] 45. Патель М., Ярлагадда В., Адедойин О., Сайни В., Ассимос Д. Г., Холмс Р. П., Митчелл Т. Оксалат вызывает дисфункцию митохондрий и нарушает окислительно-восстановительный гомеостаз в клеточной линии, полученной из моноцитов человека. Редокс Биол 15: 207–215, 2018. doi: 10.1016 / j.redox.2017.12.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 46. Прочаска М., Тейлор Э., Ферраро П.М., Курхан Г. Относительное перенасыщение суточной мочи и вероятность образования камней в почках.Дж Урол 199: 1262–1266, 2018. DOI: 10.1016 / j.juro.2017.10.046. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 47. Ри Э, Сантьяго Л., Парк Э, Лад П., Беллман Г. Уровень IL-6 в моче повышен у пациентов с мочекаменной болезнью. Дж Урол 160: 2284–2288, 1998. DOI: 10.1016 / S0022-5347 (01) 62311-5. [PubMed] [CrossRef] [Google Scholar] 48. Робертсон WG. Возможная роль колебаний состава почечной канальцевой жидкости через нефрон в инициировании пробок Рэндалла и кристаллурии оксалата кальция в компьютерной модели почечной функции.Мочекаменная болезнь 43, Дополнение 1: 93–107, 2015. DOI: 10.1007 / s00240-014-0737-1. [PubMed] [CrossRef] [Google Scholar] 49. Сасаки М., Мураками М., Мацуо К., Мацуо Ю., Танака С., Оно Т., Мори Н. Оксалатная нефропатия с гранулематозным поражением из-за чрезмерного употребления арахиса. Clin Exp Nephrol 12: 305–308, 2008. DOI: 10.1007 / s10157-008-0046-5. [PubMed] [CrossRef] [Google Scholar] 50. Тан М., Ларсон-Мейер Д.Е., Либман М. Влияние корицы и куркумы на экскрецию оксалатов с мочой, липидов плазмы и глюкозы в плазме у здоровых людей.Am J Clin Nutr 87: 1262–1267, 2008. DOI: 10.1093 / ajcn / 87.5.1262. [PubMed] [CrossRef] [Google Scholar] 51. Тейлор Э. Н., Курхан Г. С.. Прием оксалатов и риск нефролитиаза. J Am Soc Nephrol 18: 2198–2204, 2007. DOI: 10.1681 / ASN.2007020219. [PubMed] [CrossRef] [Google Scholar] 52. Тейлор Э. Н., Штампфер М. Дж., Курхан Г. К.. Факторы питания и риск возникновения камней в почках у мужчин: новые данные после 14 лет наблюдения. J Am Soc Nephrol 15: 3225–3232, 2004. DOI: 10.1097 / 01.ASN.0000146012.44570.20.[PubMed] [CrossRef] [Google Scholar] 53. Умекава Т, Чегини Н, Хан SR. Ионы оксалата и кристаллы оксалата кальция стимулируют экспрессию МСР-1 эпителиальными клетками почек. Почка Int 61: 105–112, 2002. DOI: 10.1046 / j.1523-1755.2002.00106.x. [PubMed] [CrossRef] [Google Scholar] 54. Умекава Т., Цудзи Х., Уэмура Х., Хан С.Р. Супероксид НАДФН-оксидазы в качестве второго мессенджера для экспрессии остеопонтина и моноцитарного хемоаттрактантного белка-1 в почечных эпителиальных клетках, подвергшихся воздействию кристаллов оксалата кальция.BJU Int 104: 115–120, 2009. DOI: 10.1111 / j.1464-410X.2009.08374.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 55. фон Unruh GE, Voss S, Sauerbruch T, Hesse A. Зависимость абсорбции оксалатов от суточного потребления кальция. J Am Soc Nephrol 15: 1567–1573, 2004. DOI: 10.1097 / 01.ASN.0000127864.26968.7F. [PubMed] [CrossRef] [Google Scholar] 56. фон Unruh GE, Voss S, Sauerbruch T, Hesse A. Референсный диапазон абсорбции оксалата в желудочно-кишечном тракте, измеренный с помощью стандартизированного теста [ 13 C 2 ] абсорбции оксалата.Дж Урол 169: 687–690, 2003. DOI: 10.1016 / S0022-5347 (05) 63993-6. [PubMed] [CrossRef] [Google Scholar] 57. Уильямс Дж., Холмс Р.П., Ассимос Д.Г., Митчелл Т. Функция митохондрий моноцитов при образовании камней из оксалата кальция. Урология 93: 224.e1–224.e6, 2016. doi: 10.1016 / j.urology.2016.03.004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 58. Worcester EM, Evan AP, Coe FL, Lingeman JE, Krambeck A, Sommers A, Phillips CL, Milliner D. Проверка гипотезы о том, что секреция оксалатов вызывает кристаллизацию проксимальных канальцев при первичной гипероксалурии I.Am J Physiol Renal Physiol 305: F1574 – F1584, 2013. DOI: 10.1152 / ajprenal.00382.2013. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]Гексаметафосфат как потенциальное средство для лечения и предотвращения образования камней в почкахЗаболеваемость камнями в почках растет во всем мире, и рецидивы являются обычным явлением (50% в течение 5 лет). Цитрат, текущий золотой стандарт терапии, который обычно назначается в виде солей калия или натрия, используется потому, что он повышает pH мочи и хелатирует кальций, основной компонент до 94% камней.В этом исследовании было обнаружено, что гексаметафосфат (HMP), мощный хелатор кальция, в 12 раз более эффективен при растворении оксалата кальция, основного компонента почечных камней, чем цитрат. Также было обнаружено, что ГМФ эффективен против других распространенных компонентов камней в почках, а именно фосфата кальция и струвита (фосфат магния-аммония). Интересно, что HMP был способен повышать дзета-потенциал частиц оксалата кальция с -15,4 до -34,6 мВ, что может предотвратить рост камней за счет агрегации, самого быстрого механизма роста, и, таким образом, предотвратить окклюзию.Примечательно, что было показано, что HMP в 16 раз эффективнее цитрата при растворении камней в почках человека в смоделированных физиологических условиях. Таким образом, можно сделать вывод, что ГМФ является многообещающим потенциальным средством лечения кальциевых и струвитных камней в почках. Эта статья в открытом доступе Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте снова?Камень оксалата кальция — обзорОсложненная инфекция мочевыводящих путейКак упоминалось ранее, осложненная инфекция классифицируется как инфекция, которая плохо поддается лечению, или как инфекция, связанная с факторами хозяина, которые увеличивают риск неудачи терапии. 8 Важно распознавать пациентов с осложненными ИМП, поскольку это имеет значение для обследования и лечения. Какие факторы приводят к классификации осложненных ИМП? Эти факторы можно классифицировать как структурные или функциональные аномалии, состояния, которые ставят под угрозу реакцию хозяина, и состояния, способствующие инфицированию вирулентными бактериями (таблица 86-5). Патогенные организмы, культивируемые при осложненных ИМП, отличаются от тех, которые наблюдаются при неосложненных ИМП (Таблица 86-6). Если пациент достаточно хорошо себя чувствует, чтобы лечиться в амбулаторных условиях, то в качестве терапии первой линии следует выбрать фторхинолон. Однако, если у пациента тяжелая инфекция, требующая госпитализации, следует назначить противомикробные препараты широкого спектра действия. 7 Обычно для лечения требуется от 14 до 21 дня антимикробной терапии. 40 Индивидуальные сценарии сложных инфекций обсуждаются в следующих параграфах. НепроходимостьСлучай: Женщина 32 лет с нефролитиазом в анамнезе, с болью в правом боку и лихорадкой. Камни из оксалата кальция могут вызвать обструкцию мочеточника и вторичную колонизацию. Помимо камней, обструкция мочевыводящих путей также может быть вызвана опухолью, сгустком или папиллярным некрозом. Бактерии, расщепляющие мочевину, вызывающие образование струвитных камнейСлучай: 25-летняя женщина с рецидивом ИМП недавно прошла курс противомикробных препаратов после перенесенной ИМП, вызванной P. mirabilis . Посев мочи после терапии получают и выращивают тот же организм.В настоящее время у нее нет симптомов. P. mirabilis вызывает ощелачивание мочи, что приводит к осаждению солей кальция, магния, аммония и фосфата и последующему образованию струвитных камней. Эти камни стали известны как камни оленьего рога, потому что они, как правило, представляют собой большие камни, принимающие форму собирающей системы почек. Бактерии сохраняются в этих струвитных камнях, и бактериурия имеет тенденцию повторяться почти сразу после прекращения противомикробной терапии.Струвитные камни часто содержат минимальное количество кальция и могут быть не видны на рентгенограммах. 7 Врожденные аномалии мочевыводящих путейСлучай: У 18-летней женщины с известной историей обструкции лоханочно-мочеточникового перехода в анамнезе имеются рецидивирующие ИМП. У пациентов с аномалиями мочевыводящих путей и ИМП рецидивирующая бактериурия с одним и тем же организмом обычно возникает до тех пор, пока аномальная структура не будет исправлена хирургическим путем.Такие аномалии включают дупликацию мочеточника с эктопическим мочеточником, перикаликулярные дивертикулы, урахальные кисты, односторонние медуллярные губчатые почки и врожденные обструкции с нефункционирующими почками. 7 БеременностьСлучай: 29-летняя беременная женщина в третьем триместре беременности жалуется на лихорадку, боль в левом боку, тошноту и рвоту. Хотя было показано, что частота бактериурии у беременных женщин аналогична таковой у небеременных женщин, частота острого пиелонефрита значительно выше у беременных женщин по сравнению с небеременными. 47 Возможно, это связано с многочисленными анатомическими и физиологическими изменениями, которые происходят в мочевыводящих путях во время беременности (вставка 86-4). Неудивительно, что пиелонефрит чаще всего наблюдается в третьем триместре, когда застой и гидронефроз наиболее очевидны. 7 До появления противомикробной терапии у беременных с пиелонефритом был повышенный уровень недоношенности и перинатальной смертности. Сегодня в литературе продолжаются дискуссии о том, приводит ли гестационный пиелонефрит к преждевременным родам и последующей перинатальной смертности.В любом случае пациенты с пиелонефритом при беременности должны быть госпитализированы и пролечены парентеральными средствами. 7 Противомикробные препараты, которые можно использовать во время беременности, включают пенициллины, цефалоспорины и нитрофурантоин. Последний, однако, не следует использовать при пиелонефрите, поскольку он не обеспечивает адекватного проникновения в ткани. Следует избегать агентов, которые могут нанести вред развивающемуся плоду. Фторхинолоны могут нарушать развитие хряща, а TMP-SMX связан с тератогенным действием антифолатов в первом триместре и с неонатальной гипербилирубинемией в третьем триместре. 48 После лечения женщинам следует либо назначить профилактику, либо внимательно наблюдать на протяжении оставшейся части беременности, поскольку существует повышенный риск повторных эпизодов пиелонефрита. 49 Сахарный диабетСлучай: В больницу с острым пиелонефритом поступила 45-летняя женщина с плохо контролируемым диабетом. Несмотря на парентеральную антимикробную терапию в течение 3 дней, у нее по-прежнему наблюдаются резкие скачки температуры. Показано, что заболеваемость ИМП у женщин с диабетом значительно выше, чем у женщин без диабета. 50 Лечение может быть более трудным при наличии гломерулопатии, поскольку концентрация противомикробных препаратов в моче может быть ниже оптимальной. 7 Диабет также связан с определенными патологиями, такими как внутрипочечный и периренальный абсцесс, эмфизематозный пиелонефрит и цистит, ксантогранулематозный пиелонефрит и папиллярный некроз. 8 Дальнейшее обсуждение этих сущностей выходит за рамки данной главы. Травмы спинного мозгаСлучай: У 27-летней женщины с травмой грудного отдела спинного мозга в анамнезе наблюдается лихорадка и зловонная моча. Она управляет своим мочевым пузырем с помощью чистой периодической катетеризации. Метод лечения мочевого пузыря играет большую роль при ИМП у этих пациентов. Пациенты с постоянными уретральными или надлобковыми катетерами имеют высокий уровень инфицирования. 51 Чистая периодическая катетеризация была введена в 1972 году и произвела революцию в лечении мочевого пузыря у пациентов с травмой спинного мозга.Было показано, что он снижает факторы риска ИМП за счет снижения внутрипузырного давления и количества камней. 52 Тем не менее, ИМП — обычная проблема у пациентов с травмой спинного мозга, и ее часто трудно диагностировать. Из-за потери чувствительности у пациентов нет типичных симптомов, таких как частые позывы, срочность позывов или дизурия. Кроме того, анализ мочи у этих пациентов часто демонстрирует бактериурию и пиурию независимо от наличия инфекции. Поэтому диагноз часто ставят клинически, основываясь на симптомах дискомфорта в боку, спине или животе; утечка между катетеризациями; высокая температура; повышенная спастичность; и / или мутная моча с неприятным запахом. 7 Посев мочи должен быть получен до начала терапии, поскольку высока вероятность бактериальной резистентности. 7 Пациентам с травмой спинного мозга и рецидивирующей ИМП следует пройти визуализацию мочевыводящих путей, уродинамическое тестирование и пересмотреть свою программу лечения мочевого пузыря. 53 Произошла ошибка при настройке пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Настройка вашего браузера для приема файлов cookieСуществует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Почему этому сайту требуются файлы cookie?Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня. Что сохраняется в файле cookie?Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется. Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать. Разнообразие протеиновых профилей отдельных почечных камней оксалата кальцияAbstractКамни в почках из оксалата кальция содержат небольшое количество белков, некоторые из которых участвуют в прогрессировании или предотвращении образования камней в почках.Чтобы получить представление о патофизиологии мочекаменной болезни, мы охарактеризовали белковые компоненты оксалатных камней в почках с помощью протеомных подходов. Как сообщалось, белки, извлеченные из почечных камней, показали весьма гетерогенные модели миграции при гель-электрофорезе. Вероятно, это происходило главным образом из-за протеолитической деградации и сшивания белок-белок белка Тамма-Хорсфалла и протромбина. Белковые профили почечных камней из оксалата кальция были получены путем расщепления протеазой в растворе с последующей масс-спектрометрией nanoLC-MALDI-тандем, в результате которой было идентифицировано в общей сложности 92 белка в камнях от 9 пациентов с мочекаменной болезнью.Дальнейший анализ показал, что виды белков и их относительные количества сильно различались в зависимости от отдельных камней. Хотя белки, такие как протромбин, остеопонтин, кальгранулин A и кальгранулин B, были обнаружены в большинстве протестированных камней, в некоторых образцах было высокое содержание протромбина и остеопонтина, а в других — калгранулины. Кроме того, камни, богатые кальгранулином, содержали различные обогащенные нейтрофилами белки, такие как миелопероксидаза и лактотрансферрин. Эти протеомные профили отдельных камней в почках предполагают, что множественные системы, состоящие из разных групп белков, включая белки, полученные из лейкоцитов, по-разному участвуют в патогенезе отдельных камней в почках в зависимости от ситуации. Образец цитирования: Окумура Н., Цуджихата М., Момохара С., Йошиока И., Суто К., Нономура Н. и др. (2013) Разнообразие белковых профилей отдельных почечных камней оксалата кальция. PLoS ONE 8 (7): e68624. https://doi.org/10.1371/journal.pone.0068624 Редактор: Дульсе Елена Казарини, Федеральный университет Сан-Паулу (UNIFESP), Escola Paulista de Medicina, Бразилия Поступила: 6 февраля 2013 г. ; Принята к печати: 30 мая 2013 г .; Опубликован: 9 июля 2013 г. Авторские права: © 2013 Okumura et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Финансирование: Работа выполнена при финансовой поддержке Министерства образования, культуры, спорта, науки и технологий Японии. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.Дополнительного внешнего финансирования для этого исследования не получено. Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов. ВведениеМочекаменная болезнь — распространенное заболевание почек, заболеваемость которым в течение жизни составляет более 10% мужчин и 5% женщин во многих странах с небольшими региональными различиями. Хотя сейчас доступны ударно-волновая литотрипсия и эндоскопия для неинвазивного удаления камней из почек, частота рецидивов мочекаменной болезни очень высока, особенно после лечения ударной волной [1].Чтобы уменьшить возникновение и рецидивы почечнокаменной болезни, важно знать патофизиологию образования камней в почках, но все еще оставалось нерешенным, как образуются камни в почках и как можно предотвратить образование камней. Камни в почках более чем у 60% пациентов с мочекаменной болезнью содержат оксалат кальция (CaOx) в качестве основного компонента. Они образуются в результате сложных процессов, включая зарождение кристаллов, рост кристаллов, агрегацию кристаллов и взаимодействие кристалл-ячейка [1].Образование кристаллов CaOx может быть инициировано при перенасыщении CaOx, но у здоровых людей камни в почках не развиваются, даже если CaOx в моче часто перенасыщен [2]. Кроме того, небольшие кристаллы CaOx в моче обнаруживаются не только у камнеобразователей, но и у тех, кто не болел мочекаменной болезнью. Это указывает на то, что существуют физиологические системы, предотвращающие образование камней CaOx в почках. Камни в почкахCaOx обычно содержат различные белки на низком уровне [3].Белки, идентифицированные до сих пор в почечных камнях CaOx, включают белок Тамма-Хорсфалла (THP или уромодулин) [4], остеопонтин [5], протромбин [6], кальгранулин A (S100A8) [7], калгранулин B (S100A9) [7], сывороточный альбумин [8], дефенсин [8], белок Z [9] и несколько лейкоцит-специфических белков, включая катепсин G, лейкоцитарную эластазу, азуроцидин, эозинофильный катионный белок, лизоцим [10] и миелопероксидазу [11]. Недавно был проведен всесторонний анализ камней в почках с использованием протеомных методов, и в камнях почек CaOx было обнаружено больше видов белка [12] — [14]. Следует отметить, что некоторые из этих белков обладают ингибирующей или стимулирующей активностью в отношении камнеобразования, указывая на то, что они могут играть ключевую роль в патофизиологии мочекаменной болезни [15], [16]. Фрагмент 1 протромбина, который представляет собой N-концевую область протромбина, содержащую остатки γ-карбоксиглутамата (Gla), является одним из наиболее мощных ингибиторов образования камней в почках CaOx [17], [18]. Кальгранулин A и B [7], которые представляют собой кальцийсвязывающие белки семейства S100 с мотивами EF-hand, и остеопонтин [19], [20], который присутствует на апикальной поверхности мочевыводящих путей, также ингибируют инициацию и рост CaOx. кристаллы.С другой стороны, сообщалось, что THP способствует или ингибирует образование камней в почках в зависимости от условий [21]. В последнее время у THP-нулевых мышей наблюдается высокая частота образования камней в почках из оксалата кальция и фосфата кальция, что указывает на то, что THP также ингибирует камнеобразование в нормальных почках [22], [23]. Хотя камни в почках CaOx содержат множество белков, обычные биохимические методы не подходят для анализа из-за низкого содержания белков и низкой растворимости CaOx.Кроме того, белки экстракта камней обычно демонстрируют сильно диффузные картины миграции при электрофорезе в SDS-полиакриламидном геле (SDS-PAGE), что затрудняет анализ белков камней. В последние несколько лет протеомные подходы с использованием наножидкостной хроматографии (nanoLC) и тандемной масс-спектрометрии (MS / MS) были применены для изучения камней в почках [12] — [14]. В настоящем исследовании мы идентифицировали белковые компоненты в солюбилизированных камнях CaOx с помощью нано-ЖХ / MALDI-MS / MS и проанализировали различия в белковых компонентах в отдельных камнях CaOx.Результаты предоставят информацию о механизмах образования кристаллов CaOx и биологических системах, которые предотвращают рост мочевых камней CaOx. Материалы и методыЗаявление об этикеИсследовательский проект, представленный в этом документе, был одобрен институциональным наблюдательным советом Высшей школы медицины Университета Осаки. Письменное информированное согласие всех испытуемых было получено в соответствии с процедурой, утвержденной советом. Приготовление экстрактов камнейКамни в почках человека были получены от 9 больных мочекаменной болезнью, а минеральные компоненты были определены методом ИК-спектроскопии.Камни в почках, содержащие моногидрат или дигидрат CaOx в качестве основного компонента, были использованы для следующего исследования. Камни в почках с CaOx весом 10-20 мг каждый трижды промывали дистиллированной водой с помощью вихревой мешалки и измельчали до мелкого порошка с помощью ультразвукового дезинтегратора (Branson sonifier 250, Branson, Danbury, США) в 50 объемах солюбилизирующего раствора, состоящего из 10 мМ трис-HCl, pH 7,4, 1 мМ дитиотреитол (DTT) и 1 мМ фенилметилсульфонилфторид. К аликвоте суспензии объемом 3 мл добавляют 30 мл 10 мМ трис-HCl, pH 8.0, содержащий 50 мМ этилендиаминтетраацетат (EDTA), 7 M мочевину, 2 M тиомочевину и 10 мМ DTT, и инкубировали в течение 3 часов при комнатной температуре при постоянном встряхивании. Суспензию диализовали против 2 литров 10 мМ трис-HCl, pH 7,4, содержащего 1 мМ DTT, в течение ночи при 4 ° C, затем концентрировали ультрафильтрацией до примерно 50 мкл (Amicon Ultra-15, Millipore, Billerica, USA). Концентрацию белка определяли по методу Брэдфорда [24], используя бычий сывороточный альбумин в качестве стандарта. Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и расщепление трипсином в гелеЭкстракт косточки, содержащий 0.2 мкг белка разделяли с помощью SDS-PAGE по методу Laemmli [25] и окрашивали серебром [26] или Sypro Ruby (Invitrogen) [27], как указано в легенде к рисунку. Для расщепления трипсином в геле полосу для образца разрезали на 14 частей и кусочки геля подвергали расщеплению в геле с 1 пмоль трипсина (Promega, Мэдисон, США), как описано ранее [28]. Полученную смесь пептидов наносили на колонку с гидрофобным картриджем объемом 0,1 мл (Intersep RP1, GL Science, Токио, Япония), промывая 0.1% трифторуксусной кислоты (TFA) и элюируется 50% ацетонитрилом / 0,1% TFA. Элюат концентрировали с помощью вакуумного концентратора и растворяли в 25 мкл 5% ацетонитрила / 0,1% TFA. Ферментное расщепление экстрактов косточек в раствореДля анализа методом дробовика каждый экстракт почечных камней (10 мкг белка в 10 мкл 50 мМ хлорида натрия, 25 мМ Трис-HCl, pH 7,4) инкубировали с 0,5 единицами N-гликаназы (Roche, Базель, Швейцария) в течение ночи при 37 ° C. ° C. К этому образцу добавляют 50 мкл денатурирующего раствора, состоящего из 10 мМ трис-HCl, pH 7.Добавляли 4,7 М мочевины, 2 М тиомочевины и 10 мМ DTT и инкубировали в течение 30 мин при комнатной температуре. Затем остатки цистеина алкилировали добавлением к раствору 1 М акриламида до конечной концентрации 50 мМ и инкубировали в течение 30 минут при комнатной температуре. Раствор диализовали против 10 мМ трис-HCl, содержащего 1 мМ DTT, в течение ночи при 4 ° C и концентрировали ультрафильтрацией с использованием Microcon 30 (Millipore). Образец инкубировали с 1 пмоль трипсина (Promega) или химотрипсина (Roche) в течение ночи при 37 ° C.Реакционную смесь обессоливали с использованием 0,1 мл колонки с гидрофобным картриджем (Intersep RP1), как описано выше. Идентификация белков с помощью нано-LC / MALDI-MS / MS и статистического анализаКонцентрированную смесь пептидов разделяли на колонке C 18 (0,075 × 150 мм) с использованием системы нано-ЖХ (Ultimate, Dionex, Саннивейл, США). Более подробно, 10 мкл образца наносили на колонку, промывали 97% растворителем A (0,1% TFA) / 3% растворителем B (ацетонитрил / 0,1% TFA) и элюировали 80-минутным градиентом 3–80%. растворитель B с расходом 300 нл / мин.Каждую 1-минутную фракцию собирали непосредственно на 192-луночном планшете-мишени MALDI с использованием Probot Microfraction Collector (Dionex) и анализировали с помощью масс-спектрометра MALDI-MS / MS (4700 Proteomics Analyzer, Applied Biosystems, Foster City, USA) с α-циано -4-гидроксикоричная кислота в качестве матрицы. Из полученных спектров МС / МС с помощью программного обеспечения Peak to Mascot (ABI) был создан список пиков со следующими параметрами; минимальный S / N: 12, минимальная площадь: 1000 и максимальный пик / предшественник: 100. Поиск в базе данных выполнялся с использованием MASCOT 1.0 (Matrix Science, Лондон, Великобритания) со следующими параметрами; база данных: swissprot (выпуск 54.5), таксономия: человек (содержит 17742 последовательности), толерантность к пептидам: 0,1 Да, заряд пептида: 1+, толерантность к МС / МС: 0,2 Да, фиксированные модификации: пропионамид (C), фермент: нет, вариабельный модификации: окисление (M), формилкинуренин (W) и дезамидирование (N), без ограничения массы белка. Белок-кандидат оценивался как пораженный белок, если оценка белка превышала 50 и по крайней мере один пептид соответствовал количеству ионов MS / MS более 30.Анализ главных компонентов проводился с использованием функции «prcomp» пакета «stat» программного обеспечения «R» (R Foundation проекта GNU). Иммуноблоттингэкстрактов почечных камней, содержащих 0,1 мкг белка каждый, разделяли с помощью SDS-PAGE с использованием 10% полиакриламидного геля с катодным буфером, состоящим из 82 мМ Трис, 100 мМ трицина и 0,1% SDS, и анодным буфером, состоящим из 100 мМ Трис-HCl, pH 8,8. Для иммуноблоттинга белки переносили на поливинилиденфторидную мембрану и инкубировали в T-TBS (10 мМ Tris-HCl, pH 7.4, 150 мМ NaCl и 0,1% твин 20), содержащего 1% бычий сывороточный альбумин, в течение ночи при комнатной температуре. Затем мембрану инкубировали с первичным антителом, разведенным в T-TBS. В качестве первичных используемых антител были овечий антипротромбиновый фрагмент 1 (разведение 150000, Cedarlane, Онтарио, Канада, CL20111AP), мышиный антикальгранулин A (разведение 1-200, Santa Cruz Biotechnology, Санта-Крус, США, sc-48352) , козьи антитела против кальгранулина B (разведение 1∶100, Santa Cruz Biotechnology, sc-8114) и кроличьи антитела против THP (1∶200, Santa Cruz Biotechnology, sc-20631).После промывания T-TBS мембрану инкубировали с меченными пероксидазой хрена антителами против овечьих IgG, против козьих IgG или против кроличьих IgG. Мембрану промывали T-TBS, инкубировали с хемилюминесцентными реагентами (Western lightning ™, Perkin Elmer Life Sciences, Уолтем, США) и детектировали иммунореактивные полосы с помощью анализатора изображений с охлаждаемым детектором CCD (LAS-1000, Fujifilm, Токио, США). Япония). Изображения сохраняли в 16-битном формате Tiff, а интенсивность полос количественно определяли с помощью программного обеспечения Image J (Национальный институт здравоохранения, Мэриленд, США). РезультатыПолучение экстрактов почечных камней и паттерны их миграции в паспорте безопасности (SDS-PAGE)Камни почек из оксалата кальция были собраны у девяти больных мочекаменной болезнью. Инфракрасный спектроскопический анализ показал, что основным минеральным компонентом образцов 1 и 2 был моногидрат оксалата кальция, а в образцах 3–9 — дигидрат оксалата кальция (таблица). Каждый почечный камень измельчали с помощью ультразвукового разрушителя клеток и солюбилизировали в буфере Tris-HCl, содержащем EDTA, мочевину, тиомочевину и DTT.Для солюбилизации CaOx необходима ЭДТА, тогда как мочевина и тиомочевина были добавлены для увеличения растворимости белков с низкой растворимостью. Несколько нерастворимых материалов были видны после обработки ЭДТА, но они исчезли после обработки протеазой (данные не показаны). Выход белка находился в диапазоне от 0,5 до 3 мкг белка / мг камня в почках, за исключением Образца 4, который содержал менее 0,1 мкг белка / мг камня в почках (Таблица 1). Первоначальную характеристику белковых экстрактов из почечных камней CaOx проводили с помощью SDS-PAGE (рис.1). Все экстракты показали сильно рассеянную картину окрашивания, как сообщили другие группы [8], [9]. Лишь несколько широких полос белка были обнаружены при 30 кДа в образце 1 и 10–14 кДа в образце 6, 8 и 5, но различия в структуре белков между образцами не были четкими. Рисунок 1. Анализ белков, экстрагированных из камней в почках с СаОх, методом SDS-PAGE. Камни в почках CaOx, полученные от 8 человек, солюбилизировали, диализовали, концентрировали, а затем экстракты, содержащие 0.2 мкг каждого белка подвергали SDS-PAGE. Белки визуализировали окрашиванием серебром. Образец 4, выход которого составлял <0,1 мкг / мг камня, также показал аналогичную картину диффузного белка (данные не показаны). Электрофорез и окрашивание проводили трижды, и все они дали аналогичные результаты. https://doi.org/10.1371/journal.pone.0068624.g001 Для характеристики структуры диффузного белка один из образцов (образец 3) был разделен с помощью SDS-PAGE и разделен на 14 частей в соответствии с электрофоретической подвижностью. (Инжир.2А). Мы выбрали образец 3, потому что он показал типичную электрофоретическую картину (рис. 1) и имел умеренную концентрацию белка (таблица 1). Белковый состав каждого кусочка геля анализировали с помощью расщепления трипсином в геле с последующим автономным анализом МС / МС наножидкостной хроматографией / MALDI. Список белков каждого кусочка геля показан в таблице 2, где представлены оценки Mascot вместе с количеством попаданий пептидов. Из 14 кусочков геля было идентифицировано в общей сложности 22 белка, и большинство из них было обнаружено в определенных областях геля.Однако пептидные фрагменты, полученные из протромбина и THP, были обнаружены почти на всей площади геля, что указывает на то, что по крайней мере эти два белка были сильно гетерогенными с точки зрения электрофоретической подвижности. Рис. 2. Характеристика выделенных из геля белков из почечного камня CaOx с помощью анализа MALDI-MS / MS с помощью наноЖХ. (A) Один из экстрактов почечных камней, Образец 3, был отделен с помощью SDS-PAGE, окрашен Sypro Ruby и разрезан на 14 частей, как указано. Каждый кусочек геля подвергали расщеплению трипсином в геле , и полученные пептиды анализировали с помощью nanoLC / MALDI MS / MS с последующим поиском в базе данных на MASCOT.Результаты представлены в таблице 2. (B) Доменная структура THP человека (SwissProt: UROM_HUMAN). (C) По результатам, показанным в таблице 2, пептиды, соответствующие THP, были картированы на аминокислотной последовательности THP человека. https://doi.org/10.1371/journal.pone.0068624.g002 Чтобы дополнительно охарактеризовать модели диффузной миграции, фрагменты, полученные из THP, обнаруженные в каждом кусочке геля, были картированы на его аминокислотной последовательности (рис. 2B, C) . Фрагменты, соответствующие C-концевому домену zona pellucida-like (ZP), были обнаружены почти на всей площади геля, в то время как от средней до N-концевой части выявлялись только в кусочках геля 4–7.Эти результаты показывают, что THP в почечных камнях CaOx присутствует в виде гетерогенных форм в результате протеолитической деградации и сшивания. Профилирование белков экстрактов почечных камней с CaOxПоскольку электрофоретическая подвижность некоторых белков почечных камней была очень гетерогенной, белковые профили отдельных камней в почках CaOx были получены путем протеазного расщепления экстрактов протеина в растворе с последующим анализом nanoLC / MALDI-MS / MS (рис. 3). Для дальнейшего увеличения количества попаданий пептида и покрытия пептидом, расщепления химотрипсина в дополнение к расщеплениям трипсина были приготовлены и проанализированы независимо. Рисунок 3. Процедура определения профиля белка CaOx почечных камней. Для анализа белкового состава отдельных камней CaOx экстракты из почечных камней CaOx подвергали расщеплению протеазой в растворе и анализировали с использованием нано-ЖХ и MALDI-MS / MS, как показано на этой схеме. https://doi.org/10.1371/journal.pone.0068624.g003 В этом анализе в 9 образцах было идентифицировано 92 различных белка. Полные результаты этого анализа были показаны в Таблице S1, где были представлены названия белков, количество попаданий пептидов и покрытия белков, поскольку ожидалось, что количество совпадений пептидов и покрытия последовательностей будут отражать относительное количество белка [29].Примечательно, что список белков включал по крайней мере 22 кальций-связывающих белка, которые имеют различные кальций-связывающие домены (Таблица S2). Как показано на Фиг.3, расщепленные трипсином и химотрипсином сначала были проанализированы с помощью LC-MS / MS и списки пиков, полученные отдельно. Когда каждый список пиков подвергался поиску в базе данных, данные из расщепления трипсина приводили к большему количеству попаданий белка, чем из перевариваемых химотрипсином (таблица S3). Однако объединение списков пиков перевариваемых трипсином и химотрипсином приводило к увеличению попаданий белка (таблица S3), увеличению количества белков и увеличению соответствия пептидов (данные не показаны).Поэтому в этом анализе использовались объединенные списки пиков. Белки, обнаруженные в почечных камнях CaOx, можно разделить на три группы в зависимости от их возможного происхождения (рис. 4). Из 92 белков 51 присутствует во внутриклеточных областях или внеклеточном матриксе клеток почек. К ним относятся THP, который экспрессируется в толстой восходящей конечности Генле (TALH), и остеопонтин, который находится в TALH и некоторых других областях почек, таких как тонкая петля Генле и собирательный проток.Они также включают витронектин, фибронектин и несколько протеогликанов, которые являются компонентами внеклеточного матрикса или базальной мембраны. Все образцы также содержали клеточные белки, которых много в цитоскелете (актин, миозин, тубулин и т. Д.), Цитозоле (белки теплового шока, метаболические ферменты и т. Д.) И ядре (нуклеолин и т. Д.) В большинстве типов клеток. Рис. 4. Классификация белковых компонентов, обнаруженных в камнях в почках с CaOx. Экстракты из 9 отдельных образцов камня CaOx были исследованы отдельно с помощью дробового анализа, как показано на рис.3, а результаты подробно представлены в таблице S1. Как показано на этом рисунке, всего в этом анализе было идентифицировано 92 белка. Эти белки можно разделить на три основные группы в зависимости от их возможного происхождения, т.е. е. белки почек, белки крови и белки, связанные с лейкоцитами. Белки в каждой группе были дополнительно разделены на подгруппы. https://doi.org/10.1371/journal.pone.0068624.g004 Вторая группа состоит из белков, преимущественно присутствующих в крови.К ним относятся (1) основные белки плазмы (например, сывороточный альбумин, иммуноглобулин G) (2) белки системы свертывания (например, протромбин, белок Z), (3) белки системы комплемента (например, маннан-связывающая лектин-серинпротеаза, комплемент C9 ), и (4) белки острой фазы ответа (например, амилоид β A4 белок и сывороточный амилоидный Р-компонент). Хотя эти белки, скорее всего, происходят из крови, некоторые белки этой категории, такие как протромбин, также экспрессируются в почках [30], поэтому мы не можем исключить возможность того, что некоторые из них происходят из клеток почек. Третья группа состоит из белков, высоко экспрессируемых лейкоцитами, таких как макрофаги и нейтрофилы. К ним, в частности, относятся различные белки, обогащенные азурофильными гранулами нейтрофилов [31], такие как нейтрофильный дефенсин 3, α-HS-гликопротеин (фетуин A), лактотрансферрин, азуроцидин, миелопероксидаза и катепсин G. Также были обнаружены два специфичных для эозинофилов белка. в нескольких образцах. Кальгранулин A и кальгранулин B присутствовали в большинстве образцов, особенно в образцах 2, 5, 6 и 8.Известно, что эти калгранулины экспрессируются в моноцитах на высоком уровне и, таким образом, были отнесены к третьей группе на этом рисунке. Однако некоторые другие типы почечных клеток, такие как эпителиальные клетки, также могут продуцировать калгранулины в почках [7]. Различия в белковом составе отдельных камней в почках с CaOxЭтот анализ также показал, что белковые составы отдельных камней в почках отличаются друг от друга (Таблица S1). Чтобы прояснить различия в составе белков, были рассчитаны процентные соотношения количества попаданий пептида основных компонентов почечного камня (рис.5А). В образце 1 почти 80% всех попаданий пептидов были получены из остеопонтина и протромбина. С другой стороны, в образцах 4, 3 и 9 пептиды из этих двух белков составляли 30–50%, а в образцах 6, 2 и 5 — менее 10%. В свою очередь, калгранулины, сывороточный альбумин и некоторые из них. нейтрофил-специфические белки преобладали в образцах 6, 2 и 5. Рисунок 5. Сравнение относительных количеств пептидов, обнаруженных в отдельных камнях в почках с СаОх. (A) После анализа нано-ЖХ / MALDI-MS / MS количество попаданий пептидов было представлено в виде гистограммы с общим количеством попаданий пептидов в каждом образце геля, равным 100%.(B) Количество попаданий пептида было подвергнуто анализу главных компонентов, и первый (слева) и второй (справа) собственные векторы были показаны в порядке убывания. (C) Оценка главного компонента 1 каждого образца была представлена в виде гистограммы. https://doi.org/10.1371/journal.pone.0068624.g005 Для дальнейшего анализа различий белковых компонентов отдельных камней в почках количество попаданий пептидов было подвергнуто анализу главных компонентов (рис.5Б, В). В компоненте 1 белки, включая сывороточный альбумин, кальгранулин A, кальгранулин B, миелопероксидазу и лактотрансферрин, дали положительные оценки, тогда как остеопонтин, протромбин и витамин K-зависимый белок Z дали отрицательные оценки. С другой стороны, Компонент 2 во многом зависит от содержания THP. Что касается компонента 1, образцы 2, 5 и 6 показали положительные оценки, а образцы 1, 3, 4, 7, 8 и 9 показали противоположные оценки (рис. 5C). Эти результаты показывают, что отдельные камни в почках содержат несколько разных групп белков, и что соотношение каждой группы варьируется от образца к образцу.Кроме того, было высказано предположение, что остеопонтин, протромбин и белок Z составляют одну группу, тогда как сывороточный альбумин, кальгранулин A, кальгранулин B, миелопероксидаза и лактотрансферрин составляют другую группу. Для дальнейшего подтверждения различий в белковых профилях отдельных почечных камней протромбин, кальгранулин A, кальгранулин B и THP исследовали вестерн-блоттингом (рис. 6). Чтобы подтвердить специфичность используемых антител, концентрированный образец мочи здорового человека наносили на последнюю полосу каждого геля, поскольку известно, что эти белки присутствуют в моче [32] — [34].Это также позволяет нам сравнивать молекулярные формы антигенов в камнях в почках и в моче. Рисунок 6. Вестерн-блот-анализ основных белков СаОх почечных камней. Экстракты СаОх почечных камней, содержащие 0,1 мкг белков, разделяли с помощью SDS-PAGE и наносили на мембрану из PVDF. Чтобы подтвердить реактивность антител и указать размер белков в моче, концентрированный образец мочи нормального субъекта (1 мкг белка) наносили на последнюю полосу каждого геля.Затем мембрану зондировали анти-протромбиновым фрагментом 1, анти-кальгранулином A, анти-кальгранулином B или антителами против THP. Стрелки указывают положения протромбинового фрагмента 1 (вверху слева), полноразмерного THP (вверху справа), полноразмерного кальгранулина A (внизу слева) и полноразмерного кальгранулина B (внизу справа). Вестерн-блоттинг повторяли два раза и давали аналогичные результаты. Когда Образцы 1, 3, 9 и 7 (Группа 1) сравнивали с Образцами 8, 6, 2 и 5 (Группа 2), p-значение U-критерия Манна-Уитни было равно 0.028 для протромбина, кальгранулина A и кальгранулина B, а для THP — 0,8857. https://doi.org/10.1371/journal.pone.0068624.g006 Протромбин, предшественник тромбина, состоит из фрагмента 1, фрагмента 2 и домена протеазы тромбина. Используя антитело против протромбинового фрагмента 1, белковые полосы, соответствующие фрагменту 1, который мигрировал чуть выше 31 кДа, были обнаружены в нескольких экстрактах почечных камней, а также в моче [32]. Количество протромбина было самым высоким в образце 1, затем в образце 3, в то время как его было трудно обнаружить в образцах 8, 6, 2 и 5.Этот рисунок также показывает, что экстракты почечных камней, но не моча, имеют низкоподвижные формы протромбина с кажущейся молекулярной массой 45-200 кДа, что указывает на наличие поперечно-сшитых форм в почечных камнях. Кальгранулин A и кальгранулин B представляют собой небольшие белки с теоретической молекулярной массой 11 к и 13 к, соответственно. Вестерн-блоттинг подтвердил, что кальгранулин А присутствует в нормальной моче и мигрировал в положение, близкое к его теоретической массе (рис. 6). С другой стороны, в этом анализе кальгранулин B не был обнаружен в нормальной моче.Сообщалось, что содержание кальгранулина B в моче у мужчин намного ниже, чем у женщин [33]. Поскольку мы использовали нормальную мочу мужского пола, отсутствие полосы кальгранулина B могло быть связано с гендерными различиями. В экстрактах почечных камней кальгранулин A и кальгранулин B проявлялись в виде полос 8 и 12 кДа, соответственно, со слабыми сигналами мазка в области высокомолекулярного веса. В отличие от протромбина, их иммунореактивные полосы были самыми высокими в образце 5, за которым следовали образцы 2, 6 и 8.Эта обратная взаимосвязь между уровнями протеина протромбина и калгранулинов согласуется с результатами, показанными на рис. 5. GPI-заякоренный мембранный гликопротеин, THP, является основным компонентом мочи с кажущейся молекулярной массой 60–90 кДа, как показано на рис. 2. В экстрактах почечных камней, однако, он мигрировал в виде полосы мазка> 30 кДа. , указывает на то, что он разлагается и перекрестно сшивается в почечных камнях. Это согласуется с результатом на фиг. 2. Интенсивность THP-иммунореактивности была самой высокой в образце 6, за которым следовали 9, 3, 5 и 7, и не была связана с количеством протромбина и калгранулинов.Это также согласуется с результатами, показанными на рис. 5. Когда образцы 1, 3, 9 и 7 (группа 1) сравнивали с образцами 8, 6, 2 и 5 (группа 2) с помощью U-критерия Манна-Уитни, протромбин был значительно выше в группе 1 (p <0,05), в то время как кальгранулин A и кальгранулин B были выше в группе 2 (p <0,05). Напротив, THP не отличался статистически между двумя группами, поскольку значение p составляло 0,88. ОбсуждениеВ настоящем исследовании белковые экстракты CaOx почечных камней были охарактеризованы с помощью анализа nanoLC-MALDI.Во-первых, мы провели первоначальную характеристику экстрактов почечных камней с помощью SDS-PAGE и подтвердили, что белки в почечных камнях очень гетерогенны по электрофоретической подвижности (рис. 1, 2). Распространение белков, по-видимому, частично связано с гетерогенностью основных компонентов камня, THP и протромбина (рис. 2B). В случае THP, C-концевой домен ZP был обнаружен в более высокой и более низкой области, чем исходное положение миграции, как обнаружено с помощью спектрометрии nanoLC-MALDI MS / MS. Это указывает на то, что некоторые белки в почечных камнях CaOx, такие как THP, подвержены протеолитической деградации и сшиванию белок-белок. Поскольку белки в камнях почек CaOx плохо разделялись с помощью SDS-PAGE, профили белков отдельных камней в почках были исследованы методом дробовика, и в общей сложности 92 белка были идентифицированы в камнях CaOx у 9 пациентов. Список белков содержал типичные компоненты почечных камней, такие как протромбин, THP, кальгранулин A, кальгранулин B и миелопероксидаза [13]. Кроме того, было замечено, что белковые составы отдельных образцов отличаются друг от друга, как обсуждается ниже.Опубликованные на данный момент статьи иногда показывают некоторые несоответствия, например, миелопероксидаза была обнаружена в нескольких исследованиях, а в других не обнаружена. Настоящие результаты показывают, что эти расхождения, вероятно, связаны с разнообразием белкового состава отдельных образцов. Белки, идентифицированные в образцах, были разделены на три группы. Одна из групп содержит те, которые, вероятно, происходят из почечных клеток, таких как эпителиальные клетки почечных канальцев и интерстициальные клетки.Остеопонтин и THP являются основными белками, экспрессируемыми на апикальной поверхности почечных канальцев, в то время как витронектин, фибронектин и протеогликаны являются компонентами внеклеточного матрикса. Фибронектин индуцируется CaOx [34] и предотвращает агрегацию камней CaOx в почках [34], повреждение клеток, вызванное CaOx [35], и эндоцитоз [36]. Эти результаты согласуются с идеей о том, что определенные молекулы клеточной поверхности могут предотвращать рост кристаллов и повреждение клеток. Образцы также содержали белки крови, включая сывороточный альбумин, гамма-иммуноглобулин, и различные белки свертывания крови, такие как протромбин, белок Z, белок C, белок S, фибриногены, плазминоген и фактор свертывания крови X.Хотя они, скорее всего, происходят из крови, некоторые из этих белков, такие как протромбин, также экспрессируются в почках [30]. Сообщалось, что протромбин, белок Z, белок S и остеопонтин присутствовали в камнях из СаОх, но не в камнях из мочевой кислоты, что указывает на их важную роль в образовании камней из СаОх [14]. В соответствии с этим, протромбин и остеопонтин были обнаружены во всех камнях CaOx, протестированных в настоящем исследовании. Все исследованные камни в почках с CaOx также содержали различные количества кальгранулина A и кальгранулина B (рис.5, таблица S1). Эти белки сильно экспрессируются в макрофагах и нейтрофилах и секретируются клетками. Кроме того, некоторые камни, богатые кальгранулином А, также содержат нейтрофилы дефенсин 3, кальгранулин С, фетуин А, лактотрансферрин, азуроцидин и миелопероксидазу, которые в основном экспрессируются в нейтрофилах [37]. Присутствие этих белков, происходящих из лейкоцитов, в почечных камнях СаОх согласуется с несколькими другими сообщениями [11], [13]. Это указывает на то, что лейкоциты присутствуют рядом с камнями в почках с CaOx в определенных ситуациях. Различия в белковых профилях отдельных камней были дополнительно проанализированы несколькими способами. Анализ главных компонентов показал, что главный компонент 1 был осью, созданной в основном протромбином, остеопонтином и протеином Z по сравнению с миелопероксидазой, кальгранулином A и кальгранулином B (рис. 5B, C). Фактически, протромбин показал обратную связь с кальгранулином А и В, что было подтверждено вестерн-блоттингом (рис. 6). Эти различия могут отражать наличие или отсутствие клеток, продуцирующих кальгранулин и миелопероксидазу, рядом с камнями.Макрофаги или нейтрофилы обычно не наблюдаются вблизи места образования камней, но у крыс, нагруженных этиленгликолем, сообщалось об инфильтрации нескольких лимфоцитов [30]. Кроме того, ранние кристаллы CaOx, продуцируемые загрузкой этиленгликоля, окружены эпителиальными клетками и взаимодействуют с лимфоцитами, что указывает на наличие активных механизмов клиренса, которые удаляют отложения CaOx этими клетками [38]. Таким образом, настоящее исследование предполагает, что несколько различных систем клиренса, включая лимфоциты, могут действовать на камни СаОх в зависимости от ситуации у пациента с мочекаменной болезнью. Дополнительная информацияТаблица S3.Сравнение эффективности расщепления трипсином и химотрипсином для идентификации белка дробовика. Списки пиков МС / МС, полученные при расщеплении трипсина и химотрипсина, сначала отдельно подвергали анализу поиска в базе данных с использованием MASCOT. После этого два списка пиков были объединены и произведен поиск аналогичным образом. Количество попаданий белка, автоматически обнаруженных MASCOT (p <0,05), представлено в таблице. https://doi.org/10.1371/journal.pone.0068624.s003 (XLSX) Вклад авторовЭксперимент задумал и спроектировал: MT NN AO TT. Проведены эксперименты: NO CM IY. Проанализированы данные: НЕТ КС ТТ. Написал газету: НЕТ. Ссылки
Обращение с оксалатом в организме и происхождение оксалата в камнях из оксалата кальция — FullText — Urologia Internationalis 2020, Vol. 104, № 3-4АннотацияМочекаменная болезнь — одно из самых распространенных урологических заболеваний в промышленно развитых странах. Более 80% почечных камней состоят из оксалата кальция, и небольшие изменения концентрации оксалата в моче влияют на риск образования камней.Выяснение источника оксалата и механизма его транспорта имеет решающее значение для понимания этиологии мочекаменной болезни. Источники оксалата могут быть как эндогенными, так и экзогенными. Что касается транспорта оксалатов, были проведены тесты для подтверждения функции связанного с растворенным веществом носителя 4 (SLC4) и SLC26. Молекулярный механизм мочекаменной болезни, вызываемой SLC4 и SLC26, до сих пор неясен. Растущее число исследований молекулярной физиологии SLC4 и SLC26, вместе с экспериментами на генетических мышах с нокаутом, предполагают, что SLC4 и SLC26 могут быть элементом, способствующим мочекаменной болезни.Этот обзор суммирует недавние исследования источников оксалата и характеристики оксалатных транспортных ионообменников SLC4 и SLC26, с акцентом на различные физиологические дефекты в моделях нокаутных мышей, включая образование камней в почках. Кроме того, обменники SLC4 и SLC26 позволяют по-новому взглянуть на мочекаменную болезнь и могут быть новой терапевтической мишенью для модификации экскреции оксалатов с мочой. © 2019 S. Karger AG, Базель ВведениеМочекаменная болезнь — это частое урологическое заболевание, заболеваемость которым возрастает [1-3].В Азии от 1 до 19,1% населения страдает мочекаменной болезнью [4]. Риск рецидива в течение жизни составляет 50%, с расчетным временем рецидива до 1 года в 10% случаев, до 5 лет в 35–50% и до 10 лет как минимум в 50% случаев [5]. В связи с изменением образа жизни и экономическим развитием заболеваемость мочекаменной болезнью в последние несколько десятилетий неуклонно возрастала. Оксалат кальция (CaOx) является наиболее распространенным типом камней, удаляемых у пациентов [6, 7]. Более 70% пациентов с почечнокаменной болезнью страдают мочекаменной болезнью, вызванной камнями СаОх; из них дигидрат CaOx является наиболее распространенным кристаллом в моче здорового человека, а моногидрат CaOx — наиболее распространенным кристаллом в почечных камнях [7, 8].Перенасыщение мочи CaOx является основным фактором образования камней CaOx [2]. Таким образом, гипероксалурия признана одним из независимых факторов риска камнеобразования. Оксалат получают из пищевых источников (например, растений и продуктов растительного происхождения), он может синтезироваться организмом и выводится с мочой [9, 10]. Этиология гипероксалурии имеет разные аспекты у разных людей. Считается, что частое употребление продуктов, содержащих оксалаты и предшественники оксалатов, способствует развитию гипероксалурии у некоторых людей.Низкая или неоптимальная колонизация оксалат-деградирующими бактериями в желудочно-кишечном тракте [11], заболевание короткого или мальабсорбтивного кишечника [12] и бариатрическая хирургия ожирения [13] также считаются факторами, способствующими этому. В последнее время исследования были сосредоточены на транспорте оксалатов, который представляет собой трансклеточный процесс, который зависит от анионообменников. Таким образом, интерес к исследованиям SLC4 и SLC26 постепенно возрастал. SLC, который принадлежит к многофункциональной системе анионита, активно участвует в гомеостазе оксалатов [14].Белок полосы 3 эритроцитов человека (AE1 или SLC4A1), участвующий в транспорте оксалатов в красных кровяных тельцах, подробно не изучался, но в некоторых работах описывается обработка красных кровяных телец с различными концентрациями H 2 DIDS (4,4 ‘ -диизотиоцианатостильбен-2,2’-дисульфонат) ингибирует Cl — -Cl — и оксалат-оксалатный обмен в той же степени, что позволяет предположить, что SLC4A1 является основным путем транспорта оксалата [15]. Мутации и нокаут SLC4A1 вызывают ацидоз дистальных почечных канальцев (dRTA) и сфероцитарную гемолитическую анемию [16].SCL26A6 представляет собой анионообменник, экспрессирующийся на апикальной мембране многих тканей, включая почки и кишечник [17-20]. Среди своих транспортных активностей SLC26A6 служит основным путем секреции оксалатов [21]. Мыши, лишенные SLC26A6, имеют дефект кишечной секреции оксалатов, приводящий к усиленному чистому всасыванию оксалата [22]. SLC26A1, A2, A3 и A7 также могут участвовать в обмене оксалатов [23]. Кроме того, члены семейств генов SLC4 и SLC26 кодируют Na + -независимые обмены Cl — / HCO 3 — , которые экспрессируются во многих тканях, включая почки и желудочно-кишечный тракт.Секреция и реабсорбция кислотно-основных эквивалентов и Cl — , обменники Cl — / HCO 3 — регулируют внутриклеточный pH и уровни Cl — , а также объем клеток [17]. Далее, текущие знания о механизмах оксалатных обменников SLC4 и SLC26 будут обсуждены в связи с различными этиологическими типами мочекаменной болезни. Источники оксалатаОксалат с мочой получают как из экзогенных, так и из эндогенных источников, которые, в зависимости от рациона, могут в равной степени способствовать выведению оксалатов с мочой [2].Появились новые данные о том, что оксалаты с пищей могут составлять до 50–80% оксалатов, выделяемых с мочой [2, 24]. Экзогенные источники оксалатов — овощи, фрукты и чай. Продукты с высоким содержанием оксалатов: шпинат, ревень, чай, шпинат и соевые бобы. Эндогенные источники оксалата в основном синтезируются эритроцитами и печенью. Эндогенные источники оксалата включают аскорбиновую кислоту, белок (через метаболизм аминокислот тирозина, триптофана, фенилаланина и гидроксипролина) и непосредственные предшественники оксалата, такие как L-глицерат. гликолят и глиоксилат [25].Процесс синтеза оксалатов в эритроцитах неизвестен, а вклад катаболизма аскорбата в содержание оксалатов в моче является спорным [26-31]. Печень является основным источником эндогенного оксалата, а глиоксилат — основным непосредственным предшественником оксалата [32, 33]. Концентрация глиоксилата в основном регулируется многими путями. Глиоксилат может метаболизироваться в оксалат гликолатоксидазой или лактатдегидрогеназой, а глиоксилат является важным промежуточным продуктом в нескольких реакциях.Избыток глиоксилата усиливает метаболизм глиоксилата в оксалат, что приводит к гипероксалурии. Глиоксилат и аланин могут быть преобразованы в глицин и пируват, соответственно, посредством трансаминирования аланин / глиоксилат аминотрансферазой (AGT). AGT — это специфический для печени фермент, локализованный в пероксисомах, полная активность которого зависит от кофактора пиридоксина (витамин B 6 ) [34]. Глицин метаболизируется в невод, а серин превращается в ОН-пируват, который метаболизируется гликоальдегидом с помощью глиоксилатредуктазы / ОН-пируватредуктазы (GRHPR).В конечном итоге гликоальдегид может метаболизироваться до глиоксилата в несколько этапов. Другой источник метаболизма глиоксилата — расщепление гидроксипролина [35] через 4-гидрокси-2-оксоглутарат альдолазу (HOGA1). Этиология первичной гипероксалурииГипероксалурию обычно делят на следующие 2 категории: первичная гипероксалурия (PH) и вторичная гипероксалурия. В зависимости от рациона суточная экскреция оксалатов с мочой у здоровых людей составляет от 10 до 40 мг в сутки (0.1–0,45 ммоль за 24 ч) [36]. Концентрации более 40–45 мг в сутки (0,45–0,5 ммоль в сутки) считаются показателями клинической гипероксалурии [34]. ЛГ — это редкая врожденная ошибка метаболизма глиоксилата, которая приводит к высокому производству оксалата в основном печенью [37, 38], и ЛГ делится на следующие 3 класса: PH I, PH II, PHII. ЛГ I, составляющая большинство всех случаев (70–80%) [38], является пероксисомальным заболеванием и является наиболее тяжелым типом. Это вызвано мутациями в AGT [39], пероксисомном ферменте, расположенном в печени; это заболевание с генетическим дефектом и наследуется по аутосомно-рецессивному типу.Мутация или отсутствие AGT, приводящие к серьезному снижению ферментативной активности AGT в пероксисоме, вызывают усиление агрегации глиоксилата, который метаболизируется в оксалат с помощью гликолатоксидазы или лактатдегидрогеназы, что приводит к гипероксалурии. ЛГ II, составляющая около 10% случаев ЛГ, вызвана дефицитом цитозольного фермента печени GRHPR [40, 41]. Дефицит или мутация активности GRHPR у пациентов с Ph3 приводит к увеличению концентрации оксалата и L-глицерата в моче.Симптомы гипероксалурии, вызванной ЛГ II, менее выражены, чем симптомы, вызванные ЛГ I. Тяжелая гипероксалурия является клиническим признаком этих 2 типов ЛГ, с зарегистрированными значениями в диапазоне от 88 до 352 мг в 24 часа (1–4 ммоль в 24 часа). ) для PH I и 88 и 176 мг в 24 ч (1-2 ммоль в 24 ч) для PH II [42]. PH III, составляющая 10% случаев PH, вызвана дефицитом HOGA1, митохондриального фермента, который расщепляет 4-гидрокси-2-оксоглутарат на пируват и глиоксилат и является последней стадией пути деградации гидроксипролина [43].Потеря активности фермента HOGA1, ведущая к широкому диапазону повышения оксалатов в моче, является характеристикой PH III, которая становится более частой, чем Ph3, как причина PH. Все типы ЛГ, вызывающие нарушения оксалатного обмена в раннем детстве и подростковом возрасте, оказывают большое влияние на перенасыщение СаОх, что приводит к формированию нефрокальциноза / нефролитиаза. Возраст выявления ЛГ варьирует от рождения до шестого десятилетия жизни, в среднем 5,5 лет [44]. Кроме того, ЛГ может серьезно повредить функцию почек и затруднить диагностику ЛГ из-за отсутствия значимых симптомов и эффективных методов обследования.У некоторых пациентов с терминальной стадией почечной недостаточности CaOx, депонированный во многих органах со снижением функции почек и повышенным уровнем оксалатов в крови, вызывает системный оксалоз, включая метаболическое заболевание костей, анемию и кожные язвы. Этиология вторичной гипероксалурииВторичная гипероксалурия включает множество аспектов, включая: (1) диету с высоким содержанием оксалатов (2) кишечную гипероксалурию, (3) оксалат-разлагающие микроорганизмы (4) и ионообменники SLC4 и SLC26. Вторичная гипероксалурия — главный фактор риска мочекаменной болезни, которая может быть вызвана либо увеличением абсорбции оксалатов в кишечнике, либо потреблением диеты с высоким содержанием оксалатов [45].В течение многих лет считалось, что пищевой источник оксалатов вносит только 10–15% суточной экскреции оксалатов. Однако сообщалось, что диетические оксалаты могут составлять до 50–80% оксалатов, выделяемых с мочой [2, 24]. Ежедневное потребление оксалатов с пищей находится в диапазоне 0,05–0,2 г, но может превышать 1 г, если употребляются продукты, богатые оксалатами [46–48]. Некоторые продукты, включая клубнику, листовой шпинат, ревень, свеклу, орехи, пшеничные отруби, шоколад, чай, щавель, кунжут, карамболу, миндаль и кофе, имеют значительно высокие концентрации оксалатов [47, 49].Исследования показали, что достаточное количество кальция [50], особенно когда оно распределяется с пищей, защищает от риска образования камней CaOx у пациентов с камнеобразованием [51, 52], по-видимому, из-за взаимодействия и экскреции кальция с оксалатом. в желудочно-кишечном тракте. Предполагается, что прием магния снижает всасывание оксалатов и выведение с мочой почти так же эффективно, как кальций, путем связывания оксалатов в кишечнике [53]. Кроме того, гипомагнезиурия является известным фактором риска образования кальциевых камней, поскольку магний связывается с оксалатом и снижает насыщение мочи CaOx [54].Белок играет важную роль в процессе камнеобразования [55]. Некоторые аминокислоты, такие как L-гидроксипролин, являются предшественниками оксалата, который увеличивает концентрацию оксалата в моче и относительное перенасыщение CaOx и, по-видимому, увеличивает экскрецию оксалата почками [56]. Оксалат является эндогенным побочным продуктом метаболизма аминокислот, а также всасывается в желудке, тонкой кишке и толстой кишке [57]. Кишечная гипероксалурия — это форма вторичной гипероксалурии, вызванная заболеванием или резекцией желудочно-кишечного тракта, приводящим к синдромам мальабсорбции.Резекция тонкой кишки или воспалительное заболевание кишечника могут нарушить энтерогепатическую циркуляцию солей желчных кислот, что приводит к потере желчных кислот и мальабсорбции жиров, что приводит к влиянию стеатореи на движение оксалатов. Энтеральная гипероксалурия может иметь следующие 2 основных механизма: (1) изменение проницаемости оксалатов слизистой оболочки (как соли дигидроксил желчных кислот, так и жирные кислоты увеличивают проницаемость слизистой оболочки кишечника для оксалатов; перфузия слизистой оболочки толстой кишки крыс с помощью 5 мМ дезоксихолата натрия заметно увеличивает проницаемость толстой кишки). проницаемость для оксалата) [58] и (2) повышенная концентрация ионного оксалата в просвете (при мальабсорбции со стеатореей пищевой кальций связывается свободными жирными кислотами в просвете кишечника, поэтому с оксалатом связывается меньше кальция; комплексообразование жирных кислот с кальцием в просвете увеличивает количество растворимого оксалата, доступного для абсорбции, поскольку нерастворимые комплексы CaOx больше не образуются) [13].Следовательно, растворимый оксалат присутствует в относительно высоких концентрациях в толстой кишке и может пассивно диффундировать в кровь, где он фильтруется и выводится почками [61]. У ряда пациентов с резекцией тонкой кишки или воспалительным заболеванием кишечника высокая частота образования камней из СаОх. У пациентов с бариатрическими хирургическими вмешательствами это уже давно связано с более высокой частотой впервые возникшего нефролитиаза, при этом средний интервал от операции до диагностики нефролитиаза составляет от 1,5 до 3,6 лет [59–61].Риск нефролитиаза варьируется в зависимости от процедуры, он является самым высоким для процедур, связанных с нарушением всасывания (22–28,7%) [59, 62], что может привести к кишечной гипероксалурии. Связь между резекцией тонкой кишки и повышенной экскрецией оксалатов с мочой была впервые обнаружена в 1970 году [63]; впоследствии были зарегистрированы многочисленные случаи, и многие пациенты, перенесшие обходной желудочный анастомоз по Руссен-Y по поводу морбидного ожирения, имеют риск гипероксалурии, нефролитиаза и оксалатной нефропатии [64]. Кишечная гипероксалурия может вызвать CaOx-каменную болезнь, и, как и при ЛГ, экскреция оксалатов с мочой может быть достаточно высокой, чтобы вызвать повреждение почек и, в конечном итоге, терминальную стадию почечной недостаточности [65]. В течение нескольких десятилетий было признано, что кишечные микроорганизмы могут разлагать оксалат и снижать концентрацию оксалата в крови и моче. Существует множество бактерий, включая Enterococcus faecalis [66], Bifidobacterium infantis [67] и Oxalobacter formigenes [68]. Наиболее известным микроорганизмом, разлагающим оксалаты, является O. formigenes , грамотрицательная анаэробная бактерия, выделенная из фекалий человека и других животных, способная снижать всасывание оксалатов в кишечнике. O. formigenes потенциально метаболизирует оксалат с образованием формиата и CO 2 посредством фермента формил-КоА трансферазы и фермента оксалил-КоА декарбоксилазы. Многие случаи и данные подтвердили, что O. formigenes играют важную роль в разложении оксалатов в кишечном тракте. В исследовании, отсутствие O. formigenses у камнеобразователей связано с повышением содержания оксалата в моче [69], а у камнеобразователей обычно более низкий уровень колонизации O.formigenses на больше, чем у некаменеющих [70-72]. Кроме того, бариатрическая хирургия, заболевания кишечника и пациенты с муковисцидозом могут ингибировать реколонизацию O. formigenses в просвете кишечника, что приводит к увеличению абсорбции свободного оксалата и концентрации оксалата в крови и моче. Транспортеры SLC4Семейство генов SLC4 включает 3 основные клады [73], включая Na + -независимый электронейтральный Cl — / HCO 3 — обменников (SLC4A1 / AE1, SLC4A2 и SLC4A2 / AE4 / AE3), Na + -независимые переносчики HCO 3 — транспортеры (электрогенные SLC4A4 / NBCel и SLC4A5 / NBCe2), электронейтральные Na + / HCO 3 / SLCA4 / SLCA4 NBCn2) и Na + -2HCO 3 — обменник (SLC4A8 / NDCBE) и SLC4A11 / BTR1.Все полипептиды SLC4 имеют общий структурный образец из 3 доменов. За N-концевым цитоплазматическим доменом из 400–700 аминокислот следует C-концевой политопный трансмембранный домен из ∼500 аминокислот и C-концевой цитоплазматический домен из ∼30–100 аминокислот [17]. Кроме того, анионообменники SLC4 участвуют в транспорте анионов, например, плазмалемма Cl — / HCO 3 — обменники, которые регулируют внутриклеточный pH и Cl — и объем клеток и способствуют трансэпителиальной секреции и реабсорбции кислотно-основных эквиваленты и Cl — .Кроме того, сообщалось об обменниках SLC4, участвующих в транспорте оксалатов. SLC4A1, член обменников SLC4, был изучен в отношении транспорта оксалатов. Мы сосредоточимся на структуре и функциях SLC4A1. Ген SLC4A1 / AE1 человека, кодирующий анионообменник 1 (AE1 / band3), расположен на хромосоме 17q21-q22, занимает примерно 20 т.п.н. и состоит из 20 экзонов, разделенных 19 интронами [74]. SLC4A1 человека кодирует как эритроидную (eAE1 / band3), так и почечную (kAE1) изоформы белка AE1 с использованием различных промоторов и альтернативного сплайсинга.МРНК полосы 3 транскрибируется со всех экзонов его вышестоящим промотором, тогда как мРНК kAE1 транскрибируется промотором в интроне 3. Таким образом, в мРНК kAE1 отсутствуют последовательности экзонов 1–3 eAE1 и последовательности короче, чем eAE1, которые у человека инициируются при Met66. Белок полосы 3 человека или eAE1, состоящий из гликопротеина из 911 аминокислот, включает 2 различных структурных и функциональных домена, то есть N-концевой цитоплазматический домен 40 кДа и интегральный мембранный домен C-концевого участка 50 кДа. N-концевой цитозольный домен из остатков 1–360 взаимодействует с гемоглобином [75], гликолитическими ферментами [76] и белками цитоскелета, включая анкирин [77], белок 4.1 [78] и белок 4.2 [79], тогда как N-концевой цитоплазматический домен kAE1 (который на 65 аминокислот короче, чем у eAE1) не связывается с анкирином или гликолитическими ферментами и его взаимодействующими белками в a-интеркалированном ячейка еще предстоит идентифицировать. Тетрамеры eAE1 связываются с белками анкирина и цитоскелета. что имеет решающее значение для поддержания формы двояковогнутого диска эритроцитов. С-конец 50 кДа в тергальном мембранном домене с 12-13 трансмембранными остатками простирается от остатка 361 до остатка 882 и опосредует обмен Cl — / HCO 3 — [80], в то время как область опосредованного оксалатом пока неизвестно.И eAE1, и kAE1 имеют короткий кислый цитоплазматический C-концевой хвост (остатки 883–911), содержащий сайты связывания для карбоангидразы (CA) II [81]. Идентичные C-концевые хвосты AE1 и kAE1 могут связываться с CAII через кислотный мотив (-LDADD-). Бикарбонат (HCO 3 —) от разложения угольной кислоты (H 2 CO 3 ), образующийся при гидратации углекислого газа (CO 2 ) под действием CA II, переносится через клеточную мембрану в обмен на хлорид (Cl — ) по AE1 [74].EAE1 эритроцитов, экспрессируемый в плазматической мембране эритроцитов, опосредует электронейтральный обмен 1: 1 многих анионов, в то время как Cl – и HCO 3 – являются его основными физиологическими субстратами [82]. Было также подтверждено, что eAE1 опосредует обмен оксалата на Cl —. Кузен и Мотаис [93] показали, что различные обратимо действующие ингибиторы оказывают параллельное действие на Cl — -Cl — и оксалат-оксалатный обмен, предполагая, что транспорт оксалата эритроцитов опосредуется полосой 3, но характеристики транспорта оксалат через мембрану эритроцитов до сих пор неизвестен.Дженнингс и Адам [16] использовали низкую концентрацию H 2 DIDS (4,4’-диизотиоцианатостильбен-2,2’-дисульфонат) с эритроцитами для изучения кинетики обмена оксалата и Cl —. Результаты показали, что eAE1 эритроцитов опосредует котранспорт H + / оксалат в электронейтральном обмене на Cl —, а очевидное сродство к Cl — в 2–3 раза выше, чем у оксалата. Кроме того, оксалат при низком внеклеточном pH переносится полосой 3 почти так же быстро, как Cl — при нейтральном pH.Чтобы изучить функциональные различия белка полосы 3 эритроцитов у пациентов с камнеобразованием и здоровых пациентов, Oehlschläger et al. [84] обнаружили, что концентрация транспортного белка полосы 3 эритроцитов у пациентов с камнеобразованием примерно в 2 раза выше, чем у здоровых пациентов, но потоки оксалата в плазме, клеточного оксалата и оксалата эритроцитов не отличаются у пациентов с камнеобразованием у мужчин по сравнению с нормальными. пациенты. Более того, в нормальных условиях (pH 7,55) отток оксалата у пациентов с камнеобразованием примерно в 2 раза выше, чем у здоровых пациентов in vivo.SLC4A1 может влиять на клеточные уровни оксалатов и клиренс оксалатов мочи посредством обмена Cl — / HCO 3 — и уровней pH. Полипептид SLC4A1 широко экспрессируется в эритроцитах и в секретирующих кислоту интеркалированных клетках почечного собирательного канала. В эритроцитах eAE1 стабилизирует липидный бислой и его связь с анкирином и белками цитоскелета, чтобы поддерживать форму двояковогнутого диска эритроцитов. В почках интеркалированные клетки типа A реабсорбируют HCO 3 — через апикальную экскрецию H + с мочой.Мутации или нокаут гена SLC4A1 человека подразделяются на эритроидный и почечный фенотип и связаны с рядом заболеваний человека. Одна групповая мутация eAE1 кодирует почти полностью бессимптомный полиморфизм, кодирующий антигены группы крови, распознаваемые антисывороткой пациента в интактных эритроцитах [85]. Самая большая группа мутаций или нокаут eAE1 может привести к наследственному сфероцитозу, распространенной аутосомно-доминантной наследственной сфероцитарной анемии с уменьшением осмотической хрупкости и площади поверхности.Наследственный сфероцитоз, вовлеченный во многие полипептиды, такие как E40K, G130R и L707P, может происходить из-за бессмысленных мутаций гена, сдвига рамки считывания и миссенс-мутаций SLC4A1. Многие мутантные аллели гена генерируют нестабильную мРНК, и образующиеся эритроциты экспрессируют пониженные уровни полипептида eAE1 дикого типа, часто в условиях дозовой компенсации аллелем дикого типа. Обычно эти пациенты имеют нормальный фенотип почечного закисления, но гомозиготная мутация SLC4A1 V488M может вызывать тяжелый наследственный сфероцитоз и dRTA [86].Клинические фенотипы широко варьируются: от бессимптомных пациентов до пациентов с тяжелой гемолитической анемией, требующей переливания крови [87]. Кроме того, овалоцитоз в Юго-Восточной Азии — это морфологическая аномалия эритроцитов, вызванная мутационной делецией 27 п.н. в экзоне 11 SLC4A1, ведущей к делеции 9-аминокислот в рамке считывания с участием Ala400-Ala408 eAE1 на стыке между N-концом домен и первый трансмембранный промежуток [88]. Делеция Ala400-Ala408 из eAE1 нарушает встраивание мутантного белка в мембрану [89].Мутантный белок неактивен для функции транспорта анионов и снижает способность к образованию эритроцитов за счет образования олигомеров. Гомозиготная мутация является полностью летальной in utero при отсутствии экстраординарного медицинского вмешательства [90], в то время как гетерозиготная мутация проявляет неактивность в отношении транспорта анионов и жесткости мембран. Гетерозиготная мутация овалоцитоза SLC4A1 Юго-Восточной Азии не вызывает dRTA [91]. Однако мутации или нокаут kAE1 могут вызывать dRTA. dRTA — это заболевание, связанное с нарушением закисления мочи, которое вызвано недостаточной экскрецией чистой кислоты с мочой интеркалированными клетками почек типа А.Интеркалированные клетки типа A опосредуют реабсорбцию бикарбоната в кровь в обмен на хлорид, а протоны переносятся в мочу апикальным V-типом H + . Пациенты с dRTA нарушают секрецию кислоты и показывают повышенный pH мочи даже после введения кислоты. Эти пациенты с dRTA более подвержены мочекаменной болезни, чем здоровые люди. При заболевании почек dRTA бывает доминантной и рецессивной [92]. Доминантные мутанты kAE1, такие как R589Q, могут образовывать гетеродимеры с AE1 дикого типа и сохранять белок широкого типа в эндоплазматическом ретикулуме [93].Гомозиготные мутанты kAE1, такие как s773p [94], вызывающие рецессивный почечный канальцевый ацидоз, нарушают перенос белков на поверхность клетки. Составные гетерозиготные рецессивные мутанты, такие как G701D и A858D kAE1, могут образовывать гетеродимеры, которые преимущественно удерживаются в эндоплазматическом ретикулуме [95], в то время как гетеродимеры с белком дикого типа могут перемещаться к плазматической мембране в трансфицированных почках эмбриона человека. Недавно разработанный метод плавления с высоким разрешением является эффективным и воспроизводимым для обнаружения мутаций и полиморфизмов SLC4A1 [96], что упрощает диагностику dRTA, вызванного SLC4A1. Транспортеры SLC26Изоформы SLC26 составляют консервативное семейство анионных транспортеров с 10 отдельными членами [97], включая SLC26A1, SLC26A2, SLC26A3, SLC26A4, SLC26A5, SLC26A6, SLC26A7, SLC26A8 и SLC26A9. SLC26A10 является псевдогеном и поэтому не участвует. Полипептиды SLC26 характеризуются N-концевыми цитоплазматическими доменами, 10–14 гидрофобными трансмембранными промежутками и C-концевыми цитоплазматическими STAS доменами и, по-видимому, являются гомоолигомерными [24]. Семейство генов SLC26, за исключением SLC26A5 / prestin, кодирует многофункциональный анион обменники и каналы, по которым транспортируются количества субстратов, включая Cl — , HCO 3 — , оксалат, сульфат и формиат.Некоторые члены семейства SLC26 могут конкретно функционировать как Cl — / HCO 3 —, включая SLC26A3, SLC26A4, SLC26A6, SLC26A7, SLC26A9 и SLC26A9. Члены семейства SLC26, включая SLC26A1, SLC26A2, SLC26A3, SLC26A6 и SLC26A7, могут участвовать в транспорте оксалатов. SLC26A1 / Sat1, первый член семейства SLC26, был клонирован из печени крысы [98] и локализован на базолатеральной плазматической мембране гепатоцитов и клетках проксимальных канальцев почек (сегменты S1, S2 и S3). соответственно [99, 100].Ген SLC26A1 / Sat1 человека картирован на хромосоме 4p 16.3 [101]. SLC26A1 / Sat1 представляет собой анионообменник для сульфата и бикарбоната, который способен опосредовать транспорт оксалата, а сродство к оксалату ниже, чем к противоанионам. Некоторые исследования на крысах и мышах показали, что гендерные различия в экспрессии SLC26A1 / Sat1 с преобладанием мужской экспрессии могут объяснять заболеваемость оксалатным мочекаменным заболеванием у мужчин и женщин. Исследование SLC26A1 / Sat1 на крысах показало, что самцы крыс по сравнению с самками крыс демонстрируют более высокие уровни оксалата в плазме, более высокую почечную экспрессию SLC26A1 / Sat1 и более высокую экскрецию оксалата с мочой [102].У крыс, получавших этиленгликоль, самки крыс демонстрировали бодрствующую оксалемию и отсутствие оксалурии по сравнению с самцами крыс, у которых наблюдалась гипероксалиемия, гипероксалурия и оксалатный мочекаменная болезнь за счет повышения экспрессии белков печеночного и почечного транспортера оксалата SCL26A1 / Sat1 [103]. У людей заболеваемость мочекаменной болезнью в 2–3 раза выше у пациентов мужского пола среднего возраста (возраст 30–59 лет), но одинакова для обоих полов у молодых и пожилых пациентов [104]. Эти исследования показали, что половые гормоны могут способствовать развитию оксалатного нефролитиаза у людей и крыс в зависимости от пола.Исследования на SLC26A1 / Sat1-нулевых мышах продемонстрировали, что Sat1 играет важную роль в гомеостазе как сульфата, так и оксалата [105]. Slc26A1 / Sat1-нулевые мыши имеют гипероксалиемию: уровень оксалата в плазме выше у Sat1-нулевых мышей, чем у мышей Sat1 дикого типа, а у Sat1-нулевых мышей наблюдается гипероксалиемия, гипероксалурия и кальциевый мочекаменный болезнь. Потеря SLC26A1 / Sat1 приводит не только к образованию мочевых камней и вызванной лекарствами гепатотоксичности, но также к гипосульфатемии, гиперсульфатурии и усилению гепатотоксичности у SLC26A1 / Sat1-нулевых мышей [106].Недавние исследования показали, что мутации SLC26A1 могут вызывать рецессивную менделевскую форму нефролитиаза [107]. SLC26A2 / переносчик сульфата диастрофической дисплазии (DTDST) был впервые идентифицирован путем позиционного клонирования как ген, лежащий в основе аутосомно-рецессивной диастрофической дисплазии [108]. У человека SLC26A2 / DTDST содержит 3 экзона и кодирует белок из 739 аминокислот. SLC26A2 / DTDST представляет собой DTDST и располагается на апикальной мембране тонкой кишки крысы, проксимальных канальцах крысы, толстой кишке человека и заметно в хондроцитах.SLC26A2 / DSDST может опосредовать SO 4 2–, Cl –, HCO 3 – и транспорт оксалатов [109]. Обмен SO 4 2– на SLC26A2 / DSDST имеет решающее значение для развития и функции хряща [110], а функция SLC26A2 / DSDST в хондроцитах не может быть компенсирована каким-либо другим SLC26 SO 4 2– транспортеров, таких как вездесущие SCL26A1 и SLC26A6 или SLC26A3 [111, 118]. Мутации в SLC26A2 / DSDST связаны с диастрофической дисплазией [112].Особенности заболевания обычно объясняются отсутствием транспорта SO 4 2–, который необходим для сульфатирования белков внеклеточного матрикса, а нокдаун и сверхэкспрессия SLC26A2 / DSDST выявили важную роль SLC26A2 / DSDST в хондроцитах. дифференциация и созревание [113]. Некоторые результаты показали, что свойства транспорта оксалата очень похожи на свойства транспорта SO 4 2–, но скорость транспорта оксалата примерно на 50% ниже, чем скорость транспорта SO 4 2– [114].Кроме того, SLC26A2 вряд ли играет важную роль в метаболизме оксалатов в толстой кишке или почках [114]; ни у мышей, ни у пациентов с хондродисплазией SLC26A2 не было отмечено ни гипероксалурии, ни литиаза. SLC26A3 / DRA (подавленный в аденоме) был впервые идентифицирован как кандидатный ген-супрессор опухоли [115]. SLC26A3 / DRA экспрессируется на апикальной мембране энтероцитов человека и опосредует транспорт оксалатов Cl — , HCO 3 — , OH — .Недавние исследования показали, что делеция SLC26A3 / DRA у мышей с нокаутом приводит к значительному снижению экскреции оксалатов с мочой и концентраций оксалатов в сыворотке [116], предполагая, что SLC26A3 / DRA играет решающую роль в транспорте оксалатов в энтероцитах, уменьшая слизистую оболочку. транспорт оксалатов к серозе в подвздошной и толстой кишке. Заболевания человека связаны с мутациями SLC26A3 / DRA, такими как врожденная диарея с потерей хлоридов, которая характеризуется водянистым стулом с избытком хлоридов и метаболическим алкалозом [117].Мыши, лишенные SLC26A3 / DRA, демонстрируют пониженную транспортную способность Cl — / HCO 3 — в эпителии толстой кишки, что приводит к кислой диарее с содержанием хлоридов, уменьшению объема и задержке роста [118]. SLC26A6 / PAT1 был впервые клонирован гомологично от человека [19], охватывая 21 кодирующий экзон и около 10 т.п.н. геномной ДНК. Экспрессия гена SLC26A6 / PAT1 человека на хромосоме 3p21 человека [18] широко распространена со значительным количеством транскриптов в нескольких эпителиальных и неэпителиальных тканях [119], включая кишечник, проксимальные канальцы почек и сердце.SLC26A6 / PAT1 — это многофункциональный режим анионного обмена с участием Cl — , HCO 3 — , сульфата, гидроксила и оксалата. Опосредованный SLC26A6 мыши обмен Cl — / формиат является электронейтральным [120], тогда как Cl — / оксалат является электронным [121]. SLC26A6 / PAT1 экспрессируется на апикальной мембране во многих тканях желудочно-кишечного тракта, включая поджелудочную железу и тонкий кишечник [19]. SLC26A6 / PAT1 экспрессируется на высоких уровнях в тонкой кишке (на эквивалентных уровнях в двенадцатиперстной и тощей кишках и на более низких уровнях в подвздошной кишке) с гораздо более низкими уровнями экспрессии в толстой кишке [21].Недавно было обнаружено, что мыши с нокаутом SLC26A6 имеют пониженную (50-75%) кишечную секрецию оксалата и повышенное чистое количество оксалата, абсорбируемого в желудочно-кишечном тракте, а не чистую секрецию оксалата проксимальными канальцами, повышая содержание оксалата в плазме и вызывая гипероксалурия. Более того, у мышей с нокаутом SLC26A6 в моче присутствуют оксалатно-кальциевые камни, тогда как у мышей дикого типа двулучепреломляющие отложения в почках отсутствуют. Это исследование подтверждает тот факт, что SLC26A6 / PAT1 является основным транспортером, секретирующим оксалат, и может быть новой мишенью для лечения камней CaOx в желудочно-кишечном тракте.SLC26A6 / PAT1 человека имеет более низкое сродство к внеклеточному Cl –, а обмен Cl – -оксалата, по-видимому, является электронейтральным, что позволяет предположить, что секреция оксалата в кишечнике человека менее эффективна по сравнению с мышами, не содержащими SLC26A6 [121]. SLC26A7 клонировали на основании гомологии с другими изоформами SLC26 [122]. У человека SLC26A7 отображается на хромосоме 8 и кодирует белок из 656 аминокислот. Сообщалось, что SLC26A7 проявляет Cl —, HCO 3 и активность обмена оксалата.SLC26A7 локализован на базолатеральной мембране париетальных клеток желудка и базолатеральной мембране интеркалированных клеток типа А собирательного канала почек [123]. Механизм оксалатного транспорта SLC26A7 неизвестен, но транспорт может участвовать в отложении кристаллов CaOx в просветах мозговых собирательных каналов у гипероксалурических крыс [124]. Кроме того, одно исследование показало, что транспорт оксалата через эпителиальную мембрану сосочков может быть вовлечен в отложение кристаллов CaOx на бляшках Рэндалла [125].SLC26A7-нулевые мыши отличались dRTA и гипохлоргидрией желудка [126] из-за пониженной базолатеральной анионообменной активности Cl — -HCO 3 — . ЗаключениеТранспорт оксалатов в организме человека, включая кишечник, эритроциты и почки) затруднен. Существует множество факторов, которые могут изменить нормальный способ транспорта оксалатов, способствуя повышению концентрации оксалатов в крови и моче и увеличивая частоту образования камней CaOx.Однако важно знать, что транспортеры анионного обмена SLC26 и SLC4 играют незаменимую роль в поддержании оксалатного гомеостаза. В будущем транспортеры анионного обмена SLC26 и SLC4 могут стать новыми мишенями для лечения камней CaOx. Наше следующее исследование будет посвящено взаимосвязи камней CaOx и переносчиков анионного обмена. БлагодарностьСпасибо профессору YuChen Liu за редактирование языка. Заявление о раскрытии информацииАвторы заявляют об отсутствии конфликта интересов. Источники финансированияНет. Вклад авторовИ Хуанг, Цзэ Пай Чи и Ру Хуанг являются первыми авторами. Юн Хай Чжан является автором-корреспондентом. И Хуанг подготовил этот документ. Цзэ Пай Чи и Ру Хуанг внесли свой вклад в переработку этого документа на предмет важного содержания. Юн Хай Чжан отредактировал и одобрил окончательную версию этого документа. Все авторы прочитали и одобрили окончательную версию этой статьи. Список литературы
Автор КонтактыYong Hai Zhang Отделение урологии Больница Шаньтоу при Университете Сунь Ятсена Район Цзинь Пин Да Хуа ул.№ 114, Шаньтоу, Гуандун 515000 (Китай) Электронная почта [email protected] Подробности статьи / публикацииПредварительный просмотр первой страницы Получено: 15 августа 2019 г. Количество страниц для печати: 10 ISSN: 0042-1138 (печатный) Для дополнительной информации: https: // www.karger.com/UIN Авторские права / Дозировка препарата / Заявление об ограничении ответственности Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. . Камни в почках оксалаты: Мочекаменная болезнь — причины, симптомы, диагностика и лечение |
 Также этот метод направлен на оценку общего состояния мочевыделительной системы и позволяет проследить динамику развития ситуации.
Также этот метод направлен на оценку общего состояния мочевыделительной системы и позволяет проследить динамику развития ситуации.