Lactoflorene Холестерол | Холестерин под контролем
Lactoflorene Холестерол | Холестерин под контролемФАКТОРЫ РИСКА РАЗВИТИЯ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ
неправильное питание
чрезмерное употребление алкоголя
курение
физическая инертность
избыточный вес и ожирение
повышенный холестерин
возраст
гипертония
А ТЫ ЗНАЕШЬ СВОЙ УРОВЕНЬ ХОЛЕСТЕРИНА?
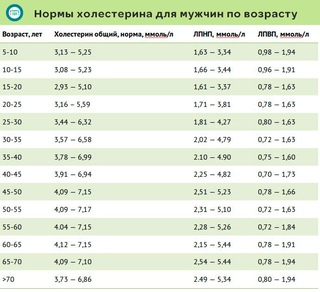
НОРМА ОБЩЕГО ХОЛЕСТЕРИНА ММОЛЬ/Л
| возраст | женщины | мужчины | ||
| минимум | максимум | минимум | максимум | |
| 30-40 лет | 3,37 | 6,27 | 3,57 | 6,99 |
| 40-50 лет | 3,81 | 6,86 | 3,91 | 7,15 |
| 50-60 лет | 4,2 | 7,77 | 4,09 | 7,15 |
| 60-70 лет | 4,45 | 7,85 | 4,12 | 7,1 |
| 71 год и старше | 4,48 | 7,25 | 3,73 | 6,86 |
для кого?
ДЛЯ ТЕХ, КТО НАХОДИТСЯ В ГРУППЕ РИСКА В СВЯЗИ С НЕЗДОРОВЫМ
ОБРАЗОМ ЖИЗНИ, ВОЗРАСТОМ И ИЗБЫТОЧНЫМ ВЕСОМ.
выгодные цены Авгуса
ИННОВАЦИОННАЯ ФОРМУЛА
действие
Lactoflorene® ХОЛЕСТЕРОЛ помогает улучшить липидный профиль, хорошо переносится пациентами с умеренной гиперхолестеринемией
- ПОМОГАЕТ СНИЗИТЬ ЛПНП — ХОЛЕСТЕРИН -26%
- ПОМОГАЕТ СНИЗИТЬ УРОВЕНЬ
АПОЛИПОПРОТЕИНА B -20% - ПОМОГАЕТ СНИЗИТЬ ОБЩИЙ ХОЛЕСТЕРИН -17%
 Efficacy and safety of a nutraceutical with probiotic and red yeast rice extract in patients with moderate hypercholesterolemia: A randomized, double-blind, placebo-controlled study. Atherosclerosis August 2017 Volume 263, Page e109 (Макки Ч. Эффективность и безопасность БАДа с пробиотиками и экстрактом красного фермент. риса у пациентов с умеренной гиперхолестеринемией)
Efficacy and safety of a nutraceutical with probiotic and red yeast rice extract in patients with moderate hypercholesterolemia: A randomized, double-blind, placebo-controlled study. Atherosclerosis August 2017 Volume 263, Page e109 (Макки Ч. Эффективность и безопасность БАДа с пробиотиками и экстрактом красного фермент. риса у пациентов с умеренной гиперхолестеринемией)ИННОВАЦИОННАЯ УПАКОВКА
Пробиотики очень чувствительны к влаге и взаимодействию с другими веществами.
Система DUOCAM®- позволяет содержащимся внутри компонентам не взаимодействовать друг с другом до использования продукта
- обеспечивает оптимальное сохранение свойств пробиотиков
СПОСОБ ПРИМЕНЕНИЯ
ОТКРЫТЬ
пакетик DUOCAM®РАСТВОРИТЬ
содержимое в небольшом количестве воды комнатной температурыВЫПИТЬ
полученный раствор- ПРОСТО
- удобно
- вкусно
faq
Что такое холестерин?
Холестерин – жироподобное вещество, содержащееся в клеточных мембранах всех животных организмов. В организме человека выполняет ряд важных функций. Вещество входит в состав клеточных оболочек, защищая каждую частицу нашего организма от влияния извне. Именно поэтому с возрастом концентрация холестерина в организме увеличивается — клетки становятся более уязвимыми, и им нужна дополнительная защита. Холестерин играет важную роль в процессе выработки витамина D, стероидных гормонов, эстрогенов, тестостерона, а также участвует в процессах нервной и иммунной системы. Большую часть холестерина (80%) производит печень, кишечник и почки, а остальные 20% поступают в организм вместе с едой.
В организме человека выполняет ряд важных функций. Вещество входит в состав клеточных оболочек, защищая каждую частицу нашего организма от влияния извне. Именно поэтому с возрастом концентрация холестерина в организме увеличивается — клетки становятся более уязвимыми, и им нужна дополнительная защита. Холестерин играет важную роль в процессе выработки витамина D, стероидных гормонов, эстрогенов, тестостерона, а также участвует в процессах нервной и иммунной системы. Большую часть холестерина (80%) производит печень, кишечник и почки, а остальные 20% поступают в организм вместе с едой.
Какой уровень холестерина считается высоким?
Содержание общего холестерина ниже 5 ммоль/л считается оптимальным («желательным»).
Уровень общего холестерина 5,1-5,9 ммоль/л расценивается как умеренно повышенный.
Уровень общего холестерина выше 6 ммоль/л расценивается как высокий.
Что такое липопротеины высокой и низкой плотности?
Липопротеины высокой плотности (ЛПВП), «хороший холестерин», замедляют рост бляшек и ведут к торможению процессов атеросклероза, их высокий уровень не вредит здоровью, а только способствует его укреплению.«Плохой холестерин» – липопротеины низкой плотности (ЛПНП) в высокой концентрации приводят к оседанию холестерина на стенках сосудов, в результате значительно повышается риск развития сердечно-сосудистых заболеваний.
Что такое гиперхолестеринемия?
Патологическое состояние, связанное со стойким повышением уровня холестерина в крови. Гиперхолестеринемия не считается заболеванием, а является только фактором, способствующим возникновению атеросклероза.
Что такое дислипидемия?
Дислипидемия – нарушение липидного обмена, характеризующееся повышенным содержанием в крови холестерина, триглицеридов и атерогенных липопротеинов и/или снижение содержания антиатерогенных липопротеинов высокой плотности. Нарушения липидного обмена (в первую очередь, повышенное содержание в крови холестерина, триглицеридов и атерогенных липопротеинов) являются важнейшим фактором риска атеросклероза.
Нарушения липидного обмена (в первую очередь, повышенное содержание в крови холестерина, триглицеридов и атерогенных липопротеинов) являются важнейшим фактором риска атеросклероза.
Что такое атеросклероз?
Атеросклероз – хроническое заболевание, характеризующиеся возникновением в стенках артерий очагов липидной инфильтрации (бляшек). Атеросклероз является основным фактором развития сердечно-сосудистых заболеваний.С атеросклерозом связаны такие заболевания, как:
- инфаркт миокарда
- ишемическая болезнь сердца
- инсульт
- атеросклероз артерий нижних конечностей
- нарушение кровообращения органов брюшной полости
Какие штаммы бифидобактерий входит в Lactoflorene®Холестерол?
Бифидобактерии Bifidobacterium longum BB536® в количестве 1×109КОЕ. *
*Имеют статус GRAS (Generally Regarded as Safe), это означает международное признание безопасности бифидобактерий Bifidobacterium lactis HN019TM в том числе для детей с первых дней жизни, а также отсутствие ограничений в использовании в пищевой и фармацевтической промышленностях.
*KOE – колониеобразующая единица (показатель количества жизнеспособных микроорганизмов).
ДРУГИЕ ПРОДУКТЫ LACTOFLORENE®
источники
1. Efficacy and safety of a nutraceutical with probiotic and red yeast rice extract in patients with moderate hypercholesterolemia: A randomized, double-blind, placebo-controlled study Chiara Macchi, Margherita Botta, Raffaella Bosisio, Chiara Pavanello,
Chiara Maria Toldo, Giuliana Mombelli, Laura Calabresi, Massimiliano Ruscica, Paolo Magni Abstract ID 78448. 2. Сравнительная эффективность статинов в профилактике и лечении ишемической болезни сердца С.В. Шалаев, З.М. Сафиуллина, Л.В.
Кремнева, О.В. Абатурова. 3. Хохлов А.А., Сычев Д.А. Оценка частоты потенциально значимых межлекарственных взаимодействий у пациентов, принимающих статины. Клиническая фармакология и терапия. 2015. Т. 24. № 5. С. 38-42. 4. Zambon Alberto.
Холестерин, не связанный с липопротеинами высокой плотности, и сердечно-сосудистые заболевания у пациентов с сахарным диабетом и дислипидемией. Сахарный диабет. 2020. Т. 23. № 1. С. 65-71. 5. Перепонов Ю.П. Возможности применения коэнзима
q10 (кудесан) в комплексной терапии ишемической болезни сердца (обзор литературы). РМЖ. 2011. Т. 19. № 4. С. 244-247. 6. Инструкция по применению БАД Lactoflorene® Холестерол.
2. Сравнительная эффективность статинов в профилактике и лечении ишемической болезни сердца С.В. Шалаев, З.М. Сафиуллина, Л.В.
Кремнева, О.В. Абатурова. 3. Хохлов А.А., Сычев Д.А. Оценка частоты потенциально значимых межлекарственных взаимодействий у пациентов, принимающих статины. Клиническая фармакология и терапия. 2015. Т. 24. № 5. С. 38-42. 4. Zambon Alberto.
Холестерин, не связанный с липопротеинами высокой плотности, и сердечно-сосудистые заболевания у пациентов с сахарным диабетом и дислипидемией. Сахарный диабет. 2020. Т. 23. № 1. С. 65-71. 5. Перепонов Ю.П. Возможности применения коэнзима
q10 (кудесан) в комплексной терапии ишемической болезни сердца (обзор литературы). РМЖ. 2011. Т. 19. № 4. С. 244-247. 6. Инструкция по применению БАД Lactoflorene® Холестерол.
Доктор Агапкин объяснил, как понизить давление с помощью диеты
В эфире передачи «О самом главном» на телеканале «Россия 1» доктор Сергей Агапкин рассказал о диете, разработанной специально для гипертоников. Ее соблюдение помогает снизить давление в среднем на 10 мм ртутного столба, а в отдельных случаях и на 20, и на 30. При этом в с списке необходимых продуктов нет никаких экзотических или недоступных позиций.
Ее соблюдение помогает снизить давление в среднем на 10 мм ртутного столба, а в отдельных случаях и на 20, и на 30. При этом в с списке необходимых продуктов нет никаких экзотических или недоступных позиций.
Так, предпочтение нужно отдавать жирным сортам морской рыбы. Это палтус, сайра, скумбрия, килька. Она содержит Омега-3, которая положительно влияет на состояние сосудов. В свой рацион необходимо включать фасоль — это источник пищевых волокон, который является средством снижения уровня холестерина и источником растительного белка.
Не стоит забывать про кисломолочные продукты. Недавние исследования показали, что именно они влияют на состав кишечной микрофлоры, а она, в свою очередь, – на артериальное давление. Овощи и фрукты — это источник сосудоукрепляющих витаминов C и P. Также большая часть овощей является источником калия, который выводит воду из организма и снижает давление.
Также гипертоникам рекомендуется употреблять в пищу горький шоколад (лучше тот, что не содержит сахара) и пить чай. Это позволит снизить вязкость крови, что положительно сказывается на уровне давления.
Это позволит снизить вязкость крови, что положительно сказывается на уровне давления.
Врач-диетолог Михаил Гинзбург также добавил к этому перечню грубые крупы: гречневую, перловую, полбу и киноа. Также он порекомендовал включить в своем меню хлеб, содержащий злаки. При этом содержание соли в блюдах нужно сократить.
Специалисты отметили, что далеко не в каждом случае страдающие гипертонией могут обойтись лишь диетой. Поэтому развитие болезни нужно контролировать и регулярно проходить обследования.
«Примечательно, что первые 10-15 лет повышенное давление никто не замечает, потому что человек чувствует себя нормально. Иногда он измеряет давление, видит повышенные цифры, но чувствует себя при этом хорошо, а потом говорит, что это его рабочее давление. Так делать нельзя! Не зря говорят, что гипертония — это тихий убийца!» – заявил Агапкин.
Еще больше интересных новостей – в нашем Instagram и Telegram-канале @smotrim_ru
Преимущества масел в спрее Healthy Style
Друзья, давайте сегодня поговорим о преимуществах использования подсолнечного масла в такой упаковке, как спрей.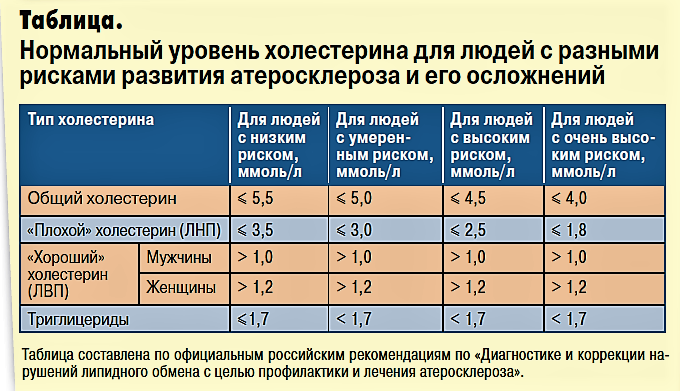
Такое понятное и привычное подсолнечное масло… Что, казалось бы, ничем уже не удивить😎 А между тем стоит приглядеться! К классным, ароматным и очень вкусным маслам Healthy Style💛
Профессиональные повара и кондитеры давно уже используют масла-спреи во время приготовления своих блюд. А вот в быту такие бутылочки можно встретить не так часто. А зря! Ведь у такого вида упаковки, как в нашей линейке подсолнечных масел Healthy Style, имеется масса преимуществ!
✔️ Вакуумная система хранения BOV. Масло в такой упаковке хранится значительно дольше, так как не подвергается воздействию прямых солнечных лучей, воздуха и других внешних факторов. За счёт этого оно не окисляется и остается свежим очень длительное время.
✔️ Стерильность. В масло не попадают вредные компоненты, так как оно постоянно находится в закрытом виде. Также бутылка не становится жирной (как это обычно происходит с растительными маслами).
✔️ Удобство использования. Масло-спрей легко и удобно распылять над любыми блюдами или поверхностями, при этом площадь его распыления не очень большая, что не позволит маслу запачкать всё вокруг тарелки, сковороды или кастрюли.
✔️ Экономия. При таком использовании расход масла снижается в несколько раз. При использовании обычной бутылки выливается достаточно много продукта, а он не всегда требуется в таких количествах, соответственно при использовании масла-спрея экономится не только сам продукт, но и средства на его покупку.
✔️ Простота и скорость. Для того чтоб воспользоваться маслом нет необходимости откручивать крышку у бутылки, переворачивать её и трусить. А если масла осталось не очень много, то не ждать пока оно стечёт. Масло-спрей применяется очень легко и быстро – всего одно нажатие!
✔️ Эстетика. Дизайнерский баллон станет украшением вашей кухни или прекрасным полезным подарком друзьям.
5 причин полюбить подсолнечное масло Healthy Style🌻
Уникальность масел Healthy Style заключается не только в функциональной упаковке, но и в удивительных свойствах. Чтобы сохранить пользу и энергию семян подсолнечника, мы используем бережные технологии производства и сырье только проверенных поставщиков.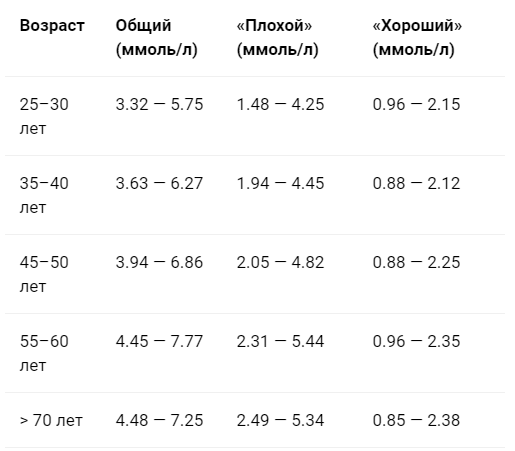 Поэтому масла Healthy Style:
Поэтому масла Healthy Style:
✔️Помогают поддерживать баланс жирных кислот в организме, поскольку содержат пальмитиновую, стеариновую, олеиновую и линолевую кислоты.
✔️Содержат витамин Е – прекрасный антиоксидант, способствующий профилактике старения, укреплению иммунитета и поддержке сердца.
✔️Богаты лецитином, который регулирует содержание холестерина в организме.
✔️Дают энергетический заряд. Масло в спрее сложно «переесть», то есть излишние калории вам не грозят. А вот прилив энергии на долгий период времени – то, что нужно для активной жизни
✔️Идеально сочетаются с различными блюдами 😋. Вам стоит только выбрать:
Прованские травы – для салатов.
Пахучий карри – для мясных блюд и овощей на мангале.
Цитрусовый микс – для рыбы и морепродуктов.
Классическое подсолнечное масло – для жарки и выпечки.
Лайфхаки от Олком: как хранить подсолнечное масло
Любое растительное масло, в том числе и подсолнечное – очень нежный продукт..gif) «Живым» оно является до соприкосновения с воздухом и солнечным светом, после чего в нем начинается необратимый процесс окисления. Через месяц после открытия бутылки масло начинает горчить и его уже не желательно употреблять в пищу.
«Живым» оно является до соприкосновения с воздухом и солнечным светом, после чего в нем начинается необратимый процесс окисления. Через месяц после открытия бутылки масло начинает горчить и его уже не желательно употреблять в пищу.
Итак, как же сохранить масло свежим как можно дольше? Все масла любят темные, сухие и прохладные, но не холодные❗ места. Переохлаждение не будет способствовать сохранению содержащихся в масле полезных веществ😔
Оптимальное решение для хранения масел – закрытый шкаф, желательно нижний (ведь чем он ниже, тем прохладнее) и не слишком близкий к плите. Хранить рядом с маслом специи и пряности не рекомендуется, так как оно имеет свойство впитывать запахи.
К сожалению, столешница (самое удобное место для хранения масла) является самым неблагоприятным из-за близости к плите, перепадов температур, дневного и искусственного света. Но ведь это так удобно всегда иметь бутылочку под рукой, что же делать? Народные рецепты предлагают для более длительного хранения добавлять в масло соль, лавровый лист и даже фасоль🤦♀️!
Мы же предлагаем не экспериментировать, и доверить свежесть масла бренду Olkom👌!
Уникальная вакуумная упаковка масел Healthy Style исключает контакт с воздухом и солнечными лучами на всех этапах его использования, а значит, не дает ему окисляться и сохраняет все полезные свойства👍
Герметичный диспенсер-распылитель не дает воздуху и бактериям попадать в масло. Соответственно, оно не портится.
Соответственно, оно не портится.
Для его хранения не нужно искать специальное место – масло Healthy Style не пропадет даже при +50°! Так что если вы захотите взять его на пикник, дачу или в любую дальнюю поездку – смело берите! Olkom не подведет😉
Купить масла в спрее Healthy Style можно в нашем интернет-магазине shop.olkom.ua 🌻
Долой вредные привычки!
Курение и здоровые сосуды несовместимы. Никотин спазмирует сосуды, поэтомуартериальное давление повышается. Кроме этого, сосудистые стенки повреждаются, на них откладываются бляшки, которые и являются основной причиной сердчено-сосудистых заболеваний. Страдает мозг курильщика, нарушается память, возможно возникновение паралича. Поэтому для профилактики образования тромбов и разрушения стенок сосудов от курения необходимо отказаться.
Еще одной губительной привычкой является неумеренный прием алкоголя. Этанол действует быстро: под его воздействием эритроциты теряют отрицательный заряд и начинают слипаться друг с другом, ухудшая проходимость сосудов, усиливая свертываемость крови и увеличивая риск образования крайне опасных тромбов. Кислородное голодание испытывают не только органы и ткани, но еще и миокард; сердце начинает биться быстрее, истощая свои ресурсы. Помимо этого этанол вмешивается в жировой обмен, резко повышая уровень холестерина в крови, а он способствует образованию бляшек на стенках сосудов.
Кислородное голодание испытывают не только органы и ткани, но еще и миокард; сердце начинает биться быстрее, истощая свои ресурсы. Помимо этого этанол вмешивается в жировой обмен, резко повышая уровень холестерина в крови, а он способствует образованию бляшек на стенках сосудов.
Любители горячительных напитков должны знать, что систематическое употребление алкоголя, неважно какого – пива, вина или шампанского, провоцирует замену мышечных слоев миокарда на жировые. Нарушается прием электрических импульсов, падает способность миокарда сокращаться, и это грозит появлением аритмий, ишемии миокарда и другим тяжелейшим последствиям. Вывод один – максимально сократите употребление алкоголя, а если на банкете его не избежать, то просто вместе с ним съедайте как можно больше свежих зеленых овощей.
К вредным привычкам можно отнести и долгое вечернее просиживание перед телевизором или компьютером. Человек, лишающий себя сна, изнашивает свое сердце, ведь и ему требуются периоды отдыха. Для того, чтобы сердце не испытывало перегрузок, рекомендуется спать не менее 8 часов в день, причем это время можно распределять в течение дня.
Для того, чтобы сердце не испытывало перегрузок, рекомендуется спать не менее 8 часов в день, причем это время можно распределять в течение дня.
О пользе регулярного обследования
Заболевания сердца и сосудов могут протекать незаметно, без каких-либо внешних проявлений. Поэтому следует примерно раз в год обследовать свои сосуды и сердце с помощью основных доступных методов.
- ЭКГ (электрокардиография). Этот способ основан на фиксации сердечного ритма с помощью специальных электродов. Позволяет выявить нарушения в работе миокарда, внутрисердечную проходимость и т.д.;
- Эргометрия. Суть методики состоит в исследовании работы сердечно-сосудистой системы в динамике;
- УЗДГ (ультразвуковая допплерография). Используется, в основном, для профилактики болезней сосудов головного мозга. Врач оценивает кровоток в крупных сосудах шеи и головы;
- МРТ (магнитно-резонансная томография). С помощью МРТ специалисты определяют проходимость сосудов, наличие в нем тромбов, его анатомию и диаметр.
 Ее достоинства очевидны: оперативность, точность и безвредность для пациента.
Ее достоинства очевидны: оперативность, точность и безвредность для пациента. - МРА (магнитно-резонансная ангиография). Этот метод является наиболее современным и эффективным, особенно при диагностике состояния сосудов головного мозга, поскольку позволяет получить трехмерное изображение сосудистой сетки исследуемого участка. Если исследуются сосуды тела, то в артерию или вену вводится специальное красящее вещество, благодаря которому снимки получаются четкими и понятными.
Базовое представление о состоянии сердечно-сосудистой системы можно получить при помощи простого измерения пульса. Врач может не только оценить количество ударов в минуту, но и ритмичность сердечных сокращений. Фонендоскоп хорошо передает шумы и тоны в сердце, которые дают информацию о возможных дефектах в работе клапанов сердца.
Какой конкретной метод подойдет именно вам должен определить кардиолог. Чем больше факторов риска, тем более глубоким должно быть исследование.
Как понизить холестерин и очистить сосуды при помощи простых продуктов — Болезни и лечение — Здоровье
youtube.com/embed/Rj5xmGkzgW8″ frameborder=»0″ allowfullscreen=»»/>
Холестерин – натуральный жирный спирт, что через кровоток попадает во все системы органов. Это вещество вовсе не является врагом человека, поддержание холестерина на необходимом уровне важно для хорошего самочувствия. Правда, речь скорее о «хорошем» холестерине – липопротеидах высокой плотности. Они способствуют синтезу витамина D и ряда гормонов, а также выработке веществ, что расщепляют другие жиры.Но есть липопротеиды с малой плотностью, так называемый «плохой» холестерин. Из-за него в сосудах образовываются бляшки и тромбы. Плотные липопротеиды обычно выводят «плохие», но из-за несбалансированного рациона этот процесс может нарушиться. На сегодняшний день проблема с повышенным холестерином очень распространена, но многие люди обнаруживают у себя ее лишь тогда, когда уровень неплотных липопротеидов становится критическим.
Чем он опасен?
Для каждой возрастной группы есть определенные нормы «хорошего» и «плохого» холестерина. В любом возрасте будет нелишним следить за показателями. Если анализы показали отклонения от нормы, значит ты – в зоне риска. Откладываясь на стенках сосудов, холестерин становится причиной атеросклероза, инфаркта, инсульта, ишемической болезни сердца и других подобных проблем.
В любом возрасте будет нелишним следить за показателями. Если анализы показали отклонения от нормы, значит ты – в зоне риска. Откладываясь на стенках сосудов, холестерин становится причиной атеросклероза, инфаркта, инсульта, ишемической болезни сердца и других подобных проблем.Для их предотвращения, конечно, стоит проконсультироваться с врачом, который назначит необходимую терапию. Помимо этого, при повышенном холестерине следует соблюдать определенную диету.
Запрещенные продукты
В первую очередь необходимо исключить из рациона некоторые продукты, богатые жирами и повышающие уровень холестерина. Среди них:наваристые бульоны – вопреки стереотипам «первое» – далеко не основа здорового питания: наваристый бульон содержит немало жира;
жирные молочные продукты – лучше не употреблять ничего с жирностью более 5%, особенно сливочное масло;
сладкое – кондитерские изделия – просто кладезь опасных трансжиров;
майонез – опять же, сплошной жир, лучше завести привычку заправлять еду оливковым маслом;
фастфуд – подобная еда – пустые калории без малейшей пользы;
жирное мясо – отказываться от мяса необязательно, просто стоит выбирать диетические сорта;
сладкая газировка – не просто пустые, но и опасные калории – за счет большого количества сахара;
крепкие кофе и чай – они не так опасны, как прочие продукты, но могут негативно влиять на работу сосудов, поэтому стоит быть осторожным.
Пища с содержанием жиров животного происхождения при высоком количестве «плохих» липопротеидов противопоказана. Сахар – тоже угроза для «хорошего» холестерина. Повышенный сахар нарушает баланс и наносит удар по сосудам, увеличивая риск образования холестериновых бляшек. А растущий от сладкой пищи инсулин может стать причиной развития атеросклероза.
Но полностью исключать сладкое диетологи не рекомендуют. Организм все равно требует такой пищи и, если его ограничивать, велик риск однажды сорваться и переесть. Более здоровой альтернативой сахару является мед, но если твоя задача – похудеть, он может не подойти. Фруктоза способствует набору веса. К его увеличению скорее приведет злоупотребление фруктозой, чем умеренное потребление сахарозы.
Самый лучший вариант – натуральные сахарозаменители. Но не все они одинаково безопасны, так как сладкий вкус блюда способен заставить организм усиленно выделять инсулин. Диетологи рекомендуют стевию и сукралозу как единственные безвредные подсластители при повышенном холестерине. Однако злоупотреблять ими в любом случае не стоит, а сладкие блюда лучше всегда оставлять на десерт, чтобы уровень сахара в крови рос постепенно.
Однако злоупотреблять ими в любом случае не стоит, а сладкие блюда лучше всегда оставлять на десерт, чтобы уровень сахара в крови рос постепенно.
Что же есть?
Главное правило при нарушении уровня холестерина: сбалансированный рацион. В нем много сезонных овощей и фруктов, бобовых, круп, отрубей – всего того, что диетологи постоянно рекомендуют всем. Нужно есть достаточно белка, витаминов, клетчатки, ненасыщенных жирных кислот. Блюда должны быть разнообразными, чтобы организм получал все необходимые витамины и микроэлементы.Чрезмерная обработка продуктам не нужна, пусть это будет обжаривание на гриле без добавления масла, запекание в духовке, приготовление на пару, отваривание. При таких способах в еде остается максимум полезных веществ. А простые блюда можно разнообразить при помощи натуральных специй и трав. Вместо закруток с сахаром или солью плоды лучше замораживать. Благодаря таким заготовкам в любое время года у тебя будут свежие ягоды, фрукты и овощи.
Подобное питание не только понизит опасный холестерин, но и будет отличной профилактикой для тех, у кого таких проблем нет. Бонусами станут укрепление иммунитета, улучшение состояния волос, ногтей и кожи, а также идеальная работа кишечника.
Самые полезные продукты
МорковьЭтот овощ признан наиболее эффективным для уменьшения числа опасных липопротеидов. Пара штук в день в течение месяца – и уровень «плохого» холестерина уменьшится на 15%. Также морковь хорошо влияет на кожу, зубы и органы зрения. Полезно есть как сырую, так и запеченную.
Помидоры
Томаты прекрасно очищают сосуды и приводят уровень холестерина в норму. Калий в их составе самым лучшим образом сказывается на работе сердца. Эксперты утверждают: всего 2 стакана томатного сока в день уберегут от образования холестериновых бляшек.
Сладкий перец
В перце множество витаминов, что укрепят сосуды, выведут бляшки и не дадут артериальному давлению превысить норму.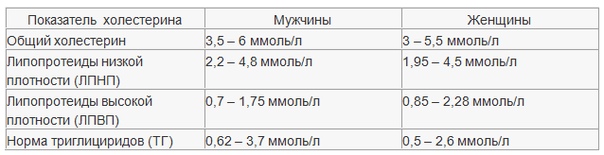
Баклажаны
В них много магния, что необходим для правильной работы сердечно-сосудистой системы. Также, употребляя баклажаны, легко поддерживать в норме водно-солевой обмен. А значит – никаких отложений холестерина и отеков.
Чеснок
Благодаря аллицину в составе чеснок продуктивно очищает сосуды, нормализует давление, хорошо влияет на работу мозга и способствует увеличению мышечной массы при силовых тренировках. А еще это одна из лучших натуральных приправ для любых блюд.
Имбирь
Насыщенный гинеролом корень имбиря – идеальное дополнение и к напиткам, и к выпечке, и к экзотическим блюдам. Помимо пикантного вкуса он принесет пользу: ускорит обмен веществ, снизит вес и приведет уровень холестерина в норму.
Цитрусовые
Пользу витамина С для кожи и иммунитета нельзя отрицать, но это не единственная причина, почему стоит есть лимоны и апельсины. В цитрусовых содержится пектин, что способствует выведению холестерина из организма.
Киви
Регулярное употребление экзотического фрукта с витамином Е укрепит иммунную систему, улучшит усвоение железа и понизит холестерин.
Клюква
В этой ягоде больше витамина С, чем в любом цитрусе. Она незаменима как для борьбы с вирусами, так и повышенным холестерином, ведь способна очищать сосуды и укреплять сердечную мышцу.
Фасоль
Сытная бобовая культура богата белком, поэтому должна стать основой здорового рациона. Если каждый день на протяжении 3 недель есть фасоль, «плохой» холестерин «падает» на 10%.
Горох
За счет витаминов группы В эта бобовая культура может на 20% уменьшить число холестерина. Для этого придется съесть немало отварного гороха: 1,5 стакана ежедневно в течение месяца. Но даже меньшее количество окажет на организм положительное влияние.
Соя
В ней также есть белок, но главное достоинство сои – нейтральный вкус, что делает ее отличной основой для любых блюд, от десертов до веганского мяса. Именно соя даст тебе максимальное число продуктовых сочетаний, что помогут противостоять образованию бляшек.
Именно соя даст тебе максимальное число продуктовых сочетаний, что помогут противостоять образованию бляшек.
Орехи
Богатые ненасыщенными жирными кислотами фундук, миндаль или арахис хорошо скажутся на сосудах и сердце. Благодаря горсти орехов в день можно снизить холестерин до 7%. Еще они полезны для мозга, ведь предотвращают развитие старческого слабоумия.
Овсянка
Овсяная каша на завтрак или домашнее печенье из овсяной муки также помогут избежать повышенного холестерина. Главное – брать настоящий овес. Хлопья быстрого приготовления не подойдут.
Семена льна
Это действительно недооцененный полезный продукт, что не только понижает холестерин, но и налаживает работу желудка, сердца и успокаивает давление. Льняными семечками можно приправлять любые блюда – от выпечки до салатов.
Рыба жирных сортов
Жирные сорта рыбы, например, лосось или семга, эффективно борются с холестериновыми бляшками. Все благодаря ненасыщенным жирным кислотам, которые очень полезны для всего организма.
Зеленый чай
Простой и доступный способ противостоять холестериновым бляшкам – регулярно пить хороший зеленый чай. Бодрящий напиток также снимет отеки и уничтожит опасные свободные радикалы.
Вода
Банально, но для здоровья необходимо пить достаточно простой воды (примерно 0,33 л на 10 кг твоего веса). Без нее не обходится ни один обменный процесс в организме, поэтому забывать про воду попросту вредно.
Как еще понизить холестерин
Помимо правильного питания важна физическая активность. Ты ведь знаешь, что спорт продлевает жизнь и улучшает самочувствие. Однако для понижения уровня неплотных липопротеидов подойдут не всякие тренировки. Силовые нагрузки вроде бодибилдинга тут не помогут, а вот аэробные – совсем другое дело.
Например, велосипед – это не только полезно для здоровья, но в теплое время года может стать прекрасной альтернативой машине или общественному транспорту. Проехавшись до работы на велосипеде, ты сэкономишь, оздоровишься и получишь заряд хорошего настроения. Также здорово работает плавание: холестерин снижается, позвоночник укрепляется, все мышцы тренируются.
Также здорово работает плавание: холестерин снижается, позвоночник укрепляется, все мышцы тренируются.
Если ты любишь играть с друзьями в футбол, баскетбол или другие командные игры, считай, что идеальный спорт для борьбы с холестерином найден. Ну и, конечно, всегда можно прогуляться пешком. Обычная или скандинавская ходьба продолжительностью всего 45 минут в день станет отличной нагрузкой на все мышцы.
Старайся тренироваться регулярно, однако не увлекайся и не забывай о предосторожности. Если раньше ты никогда не занимался спортом, проконсультируйся со специалистом, подходит ли выбранный вид тренировок твоему организму. Повышай нагрузку постепенно и прекращай занятие, если замечаешь ухудшение самочувствия.
Также существуют народные рецепты против холестериновых отложений, например, травяные сборы. Мы бы не советовали особо полагаться на них. Во-первых, в отличие от медикаментов, они не всегда проходят тщательную проверку и сертификацию. Во-вторых, как мы отметили выше, лучшие натуральные средства – полезные продукты.
Если ты не слишком доверяешь лекарствам, можешь иногда пить травяной чай, но обязательно сообщи об этом лечащему врачу и внимательно отслеживай реакцию своего организма.
Если эти рекомендации оказались полезными для тебя, обязательно делись статьей в социальных сетях. И расскажи нам о своих любимых продуктах для укрепления здоровья!
Чем вреден чай: 6 неожиданных выводов учёных
В пользе чая мало кто сомневается: миллиарды азиатов, употребляющих это горячее питьё в течение тысячелетий, не могут ошибаться. Чай превосходно утоляет жажду и бодрит, снижает уровень холестерина и нормализует работу сердечно-сосудистой системы, замедляет старение и даже делает умнее.
Однако обилие плюсов вовсе не исключает минусов.
1. Горячий чай может вызвать кровотечение
Британский отоларинголог и пластический хирург Генри Шарп (Henry Sharpe) полагает , что привычка пить чай обжигающе горячим может плохо сказаться на сосудах носоглотки. Пар из чашки заставляет их расширяться и нередко провоцирует носовые кровотечения.
Кроме того, существует версия , что горячий чай может увеличить риск развития рака пищевода. К счастью, с ней согласны не все.
В любом случае оптимальной температурой напитка считаются 50–60 °С. Чтобы достичь идеала, чашке со свежезаваренным питьём достаточно постоять 5–7 минут при комнатной температуре.
2. Слишком крепкий чай разрушает зубы и кости
The New England Journal of Medicine опубликовал истории нескольких пациентов, пострадавших от привычки пить слишком крепкий напиток. Так, примечателен случай 47-летней женщины , на протяжении 17 лет ежедневно угощавшейся чаем, заваренным из 100–150 пакетиков. За относительно короткий срок она потеряла практически все зубы и приобрела излишнюю хрупкость костей. Это симптомы скелетного флюороза . Его вызывает накопление в костях фтора, поступающего в том числе из крепкого чая.
Понятно, что столько крепкого чая не каждый в себя вольёт, однако помнить о мере всё-таки стоит. Диетологи рекомендуют употреблять не более 4–5 чашек в день.
3. Чай может содержать тяжёлые металлы
В 2013 году канадский Journal of Toxicology опубликовал результаты исследования большого количества образцов пакетированного чая из разных регионов планеты.
Токсикологи обнаружили в образцах тяжёлые металлы, в частности свинец, алюминий, мышьяк и кадмий. Предполагается, что металлы попадают в чайные листья из-за загрязнённости почвы: нередко плантации располагаются, например, рядом с неэкологичными угольными электростанциями.
Концентрация металлов в напитке зависит от времени заваривания. Если пакетик находится в воде 15–17 минут, уровень токсичных веществ поднимается до небезопасного (например, в некоторых образцах концентрация алюминия составила до 11 449 мкг/л при допустимом дневном максимуме в 7 000 мкг/л).
Учёные сделали вывод: чем дольше заваривается чай, тем больше всякой гадости вымывается из листьев в воду. Поэтому не стоит настаивать напиток дольше 3 минут.
Ещё один вариант — отдавать предпочтение белому чаю. Его листья срывают совсем молодыми, а значит, они не успевают накопить в себе критическую дозу тяжёлых металлов.
4. Иногда чай вреден для печени
Травяные чаи нередко накапливают в себе пирролизидиновые алкалоиды — токсины, вырабатываемые некоторыми видами цветущих растений. Например, безобидной на первый взгляд мать-и-мачехой.
Эти токсины негативно влияют на организм в целом, но основной их мишенью является печень . В 2015 году американский журнал Food Chemistry опубликовал результаты исследования 44 образцов травяных чаёв, предназначенных для младенцев, беременных и кормящих женщин. Учёные обнаружили пирролизидиновые алкалоиды в 86% образцов.
В принципе, доза токсинов, которую реально получить из чая (при умеренном его употреблении, естественно), для взрослого человека практически безопасна. С грудными детьми, а также беременными и кормящими женщинами ситуация иная. Из-за низкого веса тела младенец и тем более ещё не рождённый малыш более уязвимы для токсинов, которые попадают к ним от матери.
5. Употребление чая после еды может привести к нехватке железа
Исследования, проведённые в Калифорнийском университете в 2011 году, доказали : чай «связывает» поступившее с пищей железо, значительно ухудшая его поглощение организмом. Если регулярно пить чай после еды, можно допиться до железистого дефицита, что чревато неприятными последствиями: от ухудшения состояния кожи, волос, вялости до железодефицитной анемии, разбираться с которой придётся вместе с врачом.
Поэтому медики рекомендуют не запивать любимым напитком завтрак, обед или ужин. До чаепития должно пройти хотя бы 20 минут.
6. Чай провоцирует бессонницу
Виноваты в этом кофеин и ароматические вещества, за которые мы, собственно, чай и любим. Бодрящий эффект напитка имеет физиологическую основу: пульс учащается, кровоток ускоряется, надпочечники выделяют больше адреналина , центральная нервная система и головной мозг приходят в возбуждение… Утром или в разгар трудового дня чай — просто находка!
А вот вечером чайное перевозбуждение может перебить вам весь сон. Если уж очень хочется чайку на ночь, лучше ограничиться травяными напитками, содержание кофеина в которых снижено по сравнению с чёрным и особенно зелёным чаем.
Читайте также 🧐
Участники программы студенческого туризма посетили Северный Кавказ — Поиск
Северо-Кавказский федеральный университет принял гостей по программе развития студенческого туризма – ими стали трое студентов из Москвы, Калуги и
Владивостока.
Программа студенческого туризма, подготовленная Министерством науки и высшего образования РФ по поручению Президента Российской Федерации, нацелена в
первую очередь на развитие внутреннего туризма в России, а также создание возможностей доступного безопасного отдыха для студентов. Участие в программе
принимают высшие образовательные учреждения, расположенные в наиболее туристически привлекательных регионах страны. Северо-Кавказский федеральный
университет вошел в двадцатку вузов России, готовых принять в своих общежитиях путешествующих по стране студентов, и уже успел встретить гостей из Москвы, Калуги и Владивостока, а также организовал экскурсию по главным достопримечательностям не только Ставрополья, но и всего округа.
Туристы остановились в административном центре СКФО – городе Пятигорске. Среди множества памятников большой интерес у студентов вызвала самая известная
достопримечательность города – скульптура «Орел». Величественная фигура орла, сражающегося со змеей, стала не только символом Пятигорска, но и всего района
Кавказских Минеральных Вод. Также студенты посетили еще одну курортную достопримечательность – Китайскую беседку. Благодаря удачному расположению из нее
открывается великолепный вид на горы, окружающие город: Эльбрус, Машук, Бештау.
“Безусловно, для меня Пятигорск ассоциируется с жизнью и творчеством М.Ю. Лермонтова. Было очень приятно увидеть сохраненные памятные места и любимые уголки поэта. Мы прошлись по самым известным лермонтовским местам курорта: Лермонтовской галерее, парку «Цветник» и, конечно же, месту дуэли поэта”, – поделилась студентка Калужского государственного университета им. К. Э. Циолковского Ольга Федотова.
Особое впечатление на гостей произвел поход по горам Карачаево-Черкесской Республики, который был организован Межрегиональным туристическим центром СКФО. Участники похода посетили одно из самых живописных мест Нижнего Архыза – Софийские водопады, которые считаются одними из самых высоких на Кавказе, прогулялись к красивым высокогорным озёрам, расположенным на высоте около 2500 метров. Отдельного внимания гостей был удостоен Тебердинский заповедник, созданный для сохранения уникальных природных комплексов.
“Потрясающий вид гор, свежий воздух и солнечная погода оставили невероятные впечатления. Организаторы постарались за короткий срок показать нам красоты Северного Кавказа, а мы ловили любую возможность насладиться прекрасными пейзажами”, – рассказала студентка Дальневосточного федерального университета Айыына Иванова.
Участниками похода стали не только студенты, посетившие СКФУ по программе студенческого туризма, но и обучающиеся из Карачаево-Черкесского государственного университета и Северо-Кавказской государственной академии. Напомним, программа по развитию студенческого туризма реализуется с 15 июля по 25 августа 2021 года. В пилотную программу вошли 20 российских университетов от Москвы до Дальнего Востока.
Управление по информации и связям общественностью СКФУ
Уровень холестерина влияет на поверхностный заряд липидных мембран в физиологическом растворе.
van Meer, G., Voelker, D. & Feigenson, G. Мембранные липиды: где они находятся и как ведут себя. Молекулярная клетка. Биол. 9. С. 112–124 (2008).
CAS Google ученый
Róg, T., Pasenkiewicz-Gierula, M., Vattulainen, I. & Karttunen, M. Biochim. Биофиз. Acta. 1788. С. 97–121 (2009).
Артикул Google ученый
Марш, Д.И Смит, И. Конформация головной группы и ассоциация липид-холестерин в фосфатидилхолиновых везикулах: исследование ядерного эффекта оверхаузера 31P (1H). Биохим. Биофиз. Acta 298, 133–144 (1973).
CAS Статья Google ученый
Джейкобс Р. и Олдфилд Е. Взаимодействие холестерина с липидным матриксом мембран. Метод твердотельного ЯМР. Биохимия. 18, 3280–3285 (1979).
CAS Статья Google ученый
Йигл, П.L. Метил-β-циклодекстрины и липосомы как водорастворимые носители для включения холестерина в мембраны и его оценка с помощью анализа микроферментной флуоресценции и красителей, чувствительных к текучести мембран. Биохимия . Биофиз. Acta. 822, 267–287 (1985).
CAS Google ученый
Coderch, L. et al. Влияние холестерина на текучесть липосом посредством связи EPR с чрескожным всасыванием. J. Control Release.68, 85–95 (2000).
CAS Статья Google ученый
Васир, Дж. К. и Лабхасетвар, В. Биоразлагаемые наночастицы для цитозольной доставки терапевтических средств. Adv. Препарат, средство, медикамент. Поставка Ред. 59, 718–728 (2007).
CAS Статья Google ученый
Семпл, С. К., Чонн, А. и Каллис, П. Р. Влияние холестерина на ассоциацию белков плазмы с липосомами.Биохимия. 35, 2521–2525 (1996).
CAS Статья Google ученый
Баренхольц, Ю. Дж. Системы адресной доставки лекарств, опосредованные новым пептидом в терапии рака груди и контролируемом высвобождении с помощью визуализации. PLOS один. 160, 117–134 (2012).
CAS Google ученый
Максфилд, Ф. Р. и Табас, И. Роль холестерина и липидной организации в заболевании.Природа. 438, 612–621 (2005).
ADS CAS Статья Google ученый
Зидовска, А., Эванс, Х. М., Ахмад, А., Эверт, К. К. и Сафинья, С. Р. Роль холестерина и структурно родственных молекул в усилении трансфекции с помощью комплексов катионная липосома-ДНК. J. Phys. Chem. Б., 113, 5208–5216 (2009).
CAS Статья Google ученый
Гатфилд, Дж.И Питерс, Дж. Существенная роль холестерина в проникновении микобактерий в макрофаги. Наука. 288. С. 1647–1650 (2000).
ADS CAS Статья Google ученый
Lingwood, D. et al. Холестерин модулирует конформацию гликолипидов и активность рецепторов. Nature Chem. Биол. 7. С. 260–262 (2011).
CAS Статья Google ученый
Орловский, А.и другие. Сильное предпочтение дофамина и L-допы по отношению к головной группе липидов: важность липидного состава и влияние на метаболизм нейромедиаторов. Neurochem. 122, 681–690 (2012).
Артикул Google ученый
Берковиц М. Л., Бостик Д. Л. и Пандит С. Водные растворы рядом с поверхностями фосфолипидных мембран: выводы из моделирования. Chem. Ред. 106, 1527–1539 (2006).
CAS Статья Google ученый
Степневский, М., Бункер, А., Пасенкевич-Гиерула, М., Карттунен, М. и Рог, Т. Влияние фазового состояния липидного бислоя на поверхность раздела водной мембраны. J. Phys. Chem. Б. 114, 11784–11792 (2010).
CAS Статья Google ученый
Магаркар, А., Каракас, Э., Степневски, М., Рог, Т. и Бункер, А. Моделирование молекулярной динамики ПЭГилированного бислоя, взаимодействующего с ионами соли: модель поверхности липосом в кровотоке. Дж.Phys. Chem. Б. 116, 4212–4219 (2012).
CAS Статья Google ученый
Фербер, У. М., Каггва, Г. и Джарвис, С. П. Прямая визуализация солевых эффектов на липидный бислой с субмолекулярным разрешением евро . Биофиз. J. 2011. Т. 40. С. 329–338.
CAS Google ученый
Бёкманн, Р. А., Хак, А., Хаймбург и Грубмюллер, Т. Влияние хлорида натрия на липидный бислой.Биофиз. J., 85 (2003), 1647–1655.
Артикул Google ученый
Мартинес-Сеара, Х., Рог, Т., Карттунен, М., Ваттулайнен, И. и Риегада, Р. Холестерин индуцирует определенный пространственный и ориентационный порядок в холестериновых / фосфолипидных мембранах. PLoS ONE, 5, e11162 (2010).
ADS Статья Google ученый
Пандит, С., Бостик, Д. и Берковиц, Л.М. Комплексообразование липидов фосфотидилхолина с холестерином. Биофизический журнал. 86, 1345–1356 (2004).
ADS CAS Статья Google ученый
Хуанг, Дж. Й. и Фейгенсон, Г. В. Микроскопическая модель взаимодействия максимальной растворимости холестерина в липидных бислоях. Биофизический журнал. 76, 2142–2157 (1999).
ADS CAS Статья Google ученый
Миеттинен, М.С., Гуртовенко, А. А., Ваттулайнен, И., Карттунен, М. Ионная динамика в двухслойных катионных липидных системах в солевых растворах. J. Phys. Chem. Б. 113, 9226–9234 (2009).
CAS Статья Google ученый
Макино К. и др. Температура и ионная сила индуцировали конформационные изменения в области головной липидной группы липосом, как предполагают данные дзета-потенциала. Биофизическая химия. 41, 175–183 (1991).
CAS Статья Google ученый
Scherphof, G.Л. и Кампс, Дж. А. А. М. Опсонизация липосом. Liposome Res. 15, 109–139 (2005).
Артикул Google ученый
Klasczyk, K. & Knecht, V. Проверка сродства ионно-липидной ассоциации на основе моделирования в сравнении с экспериментом. J. Phys. Chem. А. 115, 10587–10595 (2011).
CAS Статья Google ученый
Юркевич, П., Цвиклик, Л., Войтишкова, А., Юнгвирт, П. и Хоф, М. Структура, динамика и гидратация бислоев POPC / POPS, взвешенных в растворах NaCl, KCl и CsCl. Биохим. Биофиз. Acta. 1818. С. 609–616 (2012).
CAS Статья Google ученый
Pronk, S. et al. GROMACS 4.5: высокопроизводительный и высокопараллельный набор инструментов молекулярного моделирования с открытым исходным кодом. Биоинформатика. 29, 845–854 (2013).
CAS Статья Google ученый
Titantah, J.Т. и Карттунен, М. Длительные корреляции и гидрофобно-модифицированная динамика водородных связей при гидрофобной гидратации. Варенье. Chem. Soc. 134, 9362–9368 (2012).
CAS Статья Google ученый
Парринелло М. и Рахман А. Полиморфные переходы в монокристаллах: новый метод молекулярной динамики. J. Appl. Phys. 52, 7182–7190 (1981).
ADS CAS Статья Google ученый
Нозе, С.J. Единая формулировка методов молекулярной динамики при постоянной температуре. Chem. Phys. 81, 511–519 (1984).
ADS Google ученый
Гувер У. Г. Каноническая динамика: равновесные распределения в фазовом пространстве. Phys. Rev. A. 31, 1695–1697 (1985).
ADS CAS Статья Google ученый
Йоргенсен, W. L. & Tirado-Rives, J. Потенциальные функции OPLS для белков.Минимизация энергии кристаллов циклических пептидов и крамбина. Варенье. Chem. Soc. 110, 1657–1666 (1988).
CAS Статья Google ученый
Йоргенсен, В. Л., Чандрасекхар, Дж., Мадура, Дж. Д., Импей, Р. и Кляйн, М. Л. Сравнение простых потенциальных функций для моделирования жидкой воды. J. Chem. Phys. 79, 926–935 (1983).
ADS CAS Статья Google ученый
Гесс, Б., Беккер, Х., Берендсен, Х. Дж. К. и Фраайе, Дж. Г. Э. М. Решатель линейных ограничений для молекулярного моделирования. J. Comput. Chem. 18, 1463–1472 (1997).
CAS Статья Google ученый
Essmann, U. et al. Метод Эвальда с использованием сетки гладких частиц. J. Chem. Phys. 103, 8577–8593 (1995).
ADS CAS Статья Google ученый
Гесс, Б. Определение сдвиговой вязкости модельных жидкостей на основе моделирования молекулярной динамики.J. Chem. Phys. 116, 209–217 (2002).
ADS CAS Статья Google ученый
Олсон, Ф., Хант, К. А., Сока, Ф. К., Вейл, У. Дж. И Папахаджопулос, Д. Получение липосом определенного распределения по размерам путем экструзии через поликарбонатные мембраны. Биохим. Биофиз. Acta. 557, 9–23 (1997).
Артикул Google ученый
Липиды
Липиды — это семейство соединений, разнообразие которых также стало возможным благодаря построению сложных молекул из множества единиц более простых молекул, и мы снова видим характерные кольца и цепи.
Полярные и неполярные молекулы
Вы, вероятно, слышали выражение «масло и вода не смешиваются», и вы заметили, как заправка для салатов, состоящая из уксуса (который является водным, т.е. в основном вода) и масла, разделяется, когда его оставляют стоять. Эта несовместимость связана с тем, что молекулы воды полярны, а масло неполярно. Вода — полярная молекула, потому что отрицательно заряженные электроны, вращающиеся вокруг ядер атомов, распределены неравномерно. Атом кислорода имеет гораздо большую массу, чем два атома водорода, и поэтому электроны проводят больше времени рядом с атомом кислорода.В результате конец молекулы воды, где расположен кислород, имеет относительно отрицательный заряд, тогда как конец с атомами водорода относительно положительно заряжен. Положительные концы молекулы воды притягиваются к отрицательным концам соседних молекул воды, как показано на рисунке ниже, и это позволяет молекулам воды объединяться. Вы также могли видеть капли воды на лобовом стекле автомобиля в результате этого явления.
Источник: http://www.personal.psu.edu/staff/m/b/mbt102/bisci4online/chemistry/chemistry3.htm
Липиды, т. Е. Жирные молекулы, с другой стороны, неполярны, что означает, что распределение заряда равномерно, и молекулы не имеют положительных и отрицательно заряженных концов. Неполярные молекулы плохо растворяются в полярных такие растворы, как вода; на самом деле полярные и неполярные молекулы имеют тенденцию отталкиваться друг от друга точно так же, как масло и вода не смешиваются и отделяются друг от друга, даже если их сильно встряхнуть в попытке смешать их.Это различие между полярными и неполярными молекулами имеет важные последствия для живых существ, которые состоят как из полярных, так и из неполярных молекул. Следующие разделы продемонстрируют важность этого.
жирные кислоты
Жирные кислоты представляют собой цепочечные молекулы, которые являются важными компонентами нескольких типов липидов. На рисунках ниже показаны две разные молекулы жирных кислот. Каждый из них имеет характерную карбоксильную группу (-COOH), присоединенную к углеродной цепи с атомами водорода, присоединенными к углеродной цепи.Следует отметить две вещи. Во-первых, углеводородная цепь очень неполярна и поэтому плохо растворяется в воде. Однако углеводородные цепи легко связываются друг с другом. Во-вторых, обратите внимание, что из ненасыщенной жирной кислоты удалены два атома водорода, и это позволяет образовывать двойную связь, то есть более прочную связь между двумя атомами углерода. Также обратите внимание, что двойная связь имеет тенденцию вызывать изгиб или перегиб жирной кислоты. На рисунке справа показаны две другие распространенные жирные кислоты: стеариновая кислота, которая представляет собой прямую 18-углеродную цепь без двойных связей, и олеиновая кислота, которая представляет собой 18-углеродную цепь с одинарной двойной связью, которая вызывает изгиб углерода. цепь.
Триглицериды
Молекула жира — это тип липида, который состоит из трех молекул жирных кислот, связанных с трехуглеродным глицериновым остовом, как показано справа. Три жирные кислоты могут отличаться друг от друга. Поскольку углеводородные цепи очень неполярны, жиры не растворяются в воде; вместо этого молекулы жира имеют тенденцию сливаться друг с другом. Поскольку молекула жира состоит из 3 жирных кислот, связанных с молекулой глицерина, их также называют тригилцеридами.
Фосфолипиды
Фосфолипиды составляют еще один важный класс липидов. Они похожи на тригилцериды тем, что имеют глицериновую основу, но есть только две жирные кислоты, связанные с глицерином. Третий углерод глицеринового остова присоединен к фосфатной группе (атом фосфора, связанный с четырьмя атомами кислорода), а фосфатная группа присоединена к основной молекуле холина, серина или этаноламина.Часть фосфолипида с фосфатом и основанием на самом деле очень полярна и имеет тенденцию отворачиваться от двух жирных кислот. Это придает молекулам фосфолипидов форму шпильки. Головка шпильки очень полярна и поэтому любит ассоциироваться с водой (она гидрофильна), в то время как две цепи жирных кислот («хвосты») очень неполярны и, как правило, избегают воды (гидрофобны) и связываются с другими углеводородные цепи.
Фосфолипиды можно описать как amphipathic («amphi» означает «оба»), потому что они имеют двойную природу (частично полярную и частично неполярную).Эта характеристика вызывает самоассоциацию фосфолипидов в большие макромолекулярные комплексы в водной (водной) среде.
Холестерин
Холестерин также является важным компонентом мембран животных (мембраны растений имеют похожий, но отличный от других «стерин» в мембранах). Это липид, потому что он почти полностью состоит из углерода и водорода, но он отличается от жирных кислот, жиров и фосфолипидов тем, что расположен в виде ряда колец. Кольца состоят из 5 или 6 атомов углерода, связанных вместе.Атомы углерода на вершинах гексагонального и пентагонального колец имеют присоединенные к ним атомы водорода. Кольцеобразные структуры довольно жесткие, но есть еще углеводородный хвост, который несколько гибкий. Вся конструкция чем-то напоминает навороченный коршун с хвостом.
Холестерин очень неполярен, за исключением гидроксильной группы, присоединенной к первому кольцу. Следовательно, в мембране животной клетки полярная гидроксильная группа прикрепляется к водной среде (внеклеточной или внутриклеточной воде), а остальная часть молекулы холестерина, которая неполярна, находится среди неполярных жирных кислотных хвостов. фосфолипиды.На изображении ниже изображен участок клеточной мембраны с водой снаружи и внутри. Полярные головные группы фосфолипидов представлены красным, а их неполярные жирнокислотные хвосты показаны зигзагообразными линиями, отходящими от полярной головной группы. Как мы видим более подробно, клеточные мембраны состоят из бислоя фосфолипидов с другими молекулами, вставленными в бислой. На этой иллюстрации показаны пять молекул холестерина (черные структуры с четырьмя соединенными кольцами), вставленные в липидный бислой.Большая часть молекулы холестерина неполярна и, следовательно, связана с неполярными жирнокислотными хвостами фосфолипидов. Однако гидроксильная группа (-ОН) холестерина несет отрицательный заряд и поэтому ассоциируется с полярным окружением воды либо внутри клетки, либо снаружи.
вернуться наверх | предыдущая страница | следующая страница
Эффект повышения заряда холестерина на катионных липосомах
Основные моменты
-
Изучено влияние катионных молекулярных структур на дзета-потенциал липосом.
-
Смешивание холестерина усиливает положительный дзета-потенциал катионных липосом.
-
Катионные липосомы можно приготовить с меньшим содержанием катионных поверхностно-активных веществ.
-
Хол-индуцированный фазовый переход в липосомной мембране ответственен за это.
-
Предложена новая стратегия конструирования катионных липосом с низкой цитотоксичностью.
Abstract
Катионные липосомы, которые использовались в качестве носителей для доставки лекарств или генов, могут быть получены путем смешивания катионных поверхностно-активных веществ в фосфолипидных липосомах.Цитотоксичность катионных молекул — одна из проблем катионных наноносителей. Поэтому мы стремились создать высоко положительно заряженные катионные липосомы с низким содержанием катионного поверхностно-активного вещества, которые обладают как более высокой способностью к клеточному захвату, так и более низкой цитотоксичностью. Мы исследовали поведение дзета-потенциала в системах вода / лецитин соевых бобов / катионное поверхностно-активное вещество / холестерин по изменению состава, а также молекулярной структуры катионного поверхностно-активного вещества. Смешивание хлоридов моноалкила (C 12 , C 16 и C 18 ) и диалкил (C 12 и C 18 ) четвертичного аммония увеличивало дзета-потенциал липосом с отрицательных до положительных значений (более чем +50 мВ).Смешивание холестерина с катионными липосомами дополнительно увеличивало максимальный дзета-потенциал, а также вызывало большой сдвиг отрицательно-положительной точки перехода по отношению к смешиваемой фракции катионного поверхностно-активного вещества. Это означает, что для получения высоко положительно заряженных липосом требуется гораздо меньше катионных поверхностно-активных веществ. Значительное влияние холестерина на дзета-потенциал липосом было объяснено на основании неоднородности распределения липидов, вызванной повышенной текучестью жидкоупорядоченных фазовых мембран и большим критическим параметром упаковки отрицательно заряженного липида.
Ключевые слова
Катионная липосома
Носитель лекарственного средства
Зета-потенциал
Эффект холестерина
Жидкая упорядоченная фаза
Рекомендуемые статьиЦитирующие статьи (0)
Полный текст© 2016 Elsevier B.V. Все права защищены.
Рекомендуемые статьи
Ссылки на статьи
Холестерин | химическое соединение | Britannica
Холестерин , восковое вещество, которое присутствует в плазме крови и во всех тканях животных.Химически холестерин представляет собой органическое соединение, принадлежащее к семейству стероидов; его молекулярная формула: C 27 H 46 O. В чистом виде это белое кристаллическое вещество без запаха и вкуса. Холестерин необходим для жизни; это основной компонент мембраны, окружающей каждую клетку, и исходный материал или промежуточное соединение, из которого организм синтезирует желчные кислоты, стероидные гормоны и витамин D. Холестерин циркулирует в кровотоке и синтезируется печенью и несколько других органов.Люди также потребляют значительное количество холестерина в процессе нормальной диеты. Компенсаторная система регулирует количество холестерина, синтезируемого печенью, при этом повышенное потребление холестерина с пищей приводит к снижению синтеза соединения в печени.
Высокий уровень холестерина в крови — чрезвычайно важная причина атеросклероза. При этом заболевании отложения холестерина и других жирных веществ, циркулирующих в крови, накапливаются во внутренних стенках кровеносных сосудов.Эти жировые отложения накапливаются, утолщаются и кальцифицируются, в конечном итоге превращая стенки сосудов в рубцовую ткань. Отложения сужают каналы кровеносных сосудов и, таким образом, могут ограничивать кровоток, вызывая сердечные приступы и инсульты. Высокий уровень холестерина в крови (более 240 мг холестерина на 100 см3 плазмы крови) ускоряет накопление отложений холестерина в стенках сосудов; Таким образом, люди с высоким уровнем холестерина в конечном итоге становятся более восприимчивыми к ишемической болезни сердца.
Подробнее по этой теме
липид: холестерин и его производные
Холестерин может быть наиболее изученной небольшой молекулой биологического происхождения. Мало того, что его сложный биосинтетический …
Изучите соотношение холестерина ЛПВП и холестерина ЛПНП, чтобы определить, подвержен ли человек риску сердечного приступа или инсульта.
Есть два основных белковых комплекса, переносящих холестерин через кровоток: липопротеины высокой плотности (ЛПВП) и липопротеины низкой плотности ( ЛПНП).Холестерин, связанный с ЛПНП, в первую очередь накапливается в атеросклеротических отложениях в кровеносных сосудах; по этой причине ЛПНП часто называют «плохой» формой холестерина. С другой стороны, ЛПВП могут фактически служить для замедления или уменьшения накопления атеросклероза, и, следовательно, ЛПВП часто называют «хорошей» формой холестерина.
Британская энциклопедия, Inc. Посмотрите все видео к этой статьеХолестерин не растворяется в крови; он должен быть присоединен к определенным белковым комплексам, называемым липопротеинами, для того, чтобы транспортироваться через кровоток.Липопротеины низкой плотности (ЛПНП) транспортируют холестерин от места его синтеза в печени к различным тканям и клеткам организма, где он отделяется от липопротеина и используется клеткой. Липопротеины высокой плотности (ЛПВП) могут транспортировать избыточный или неиспользованный холестерин из тканей обратно в печень, где он расщепляется на желчные кислоты и затем выводится из организма. Холестерин, связанный с ЛПНП, в первую очередь накапливается в атеросклеротических отложениях в кровеносных сосудах. ЛПВП, с другой стороны, могут фактически служить для замедления или уменьшения накопления атеросклероза.
Основным средством предотвращения высокого уровня холестерина в крови является снижение потребления холестерина с пищей. Поскольку холестерин присутствует в животных жирах (т. Е. Насыщенных или полиненасыщенных жирах), но не в жирах, полученных из растительных источников (т. Е. Ненасыщенных или полиненасыщенных жирах), это можно сделать путем: (1) снижения общего потребления жиров, (2) ) частичная или полная замена потребления насыщенных жиров потреблением ненасыщенных жиров, и (3) сокращение потребления продуктов, содержащих холестерин.Таким образом, следует избегать продуктов с высоким содержанием насыщенных жиров, таких как сало, сливочное масло, сыр, цельное молоко, красное мясо, конфеты и выпечка, содержащие шортенинг, равно как и такие продукты, содержащие холестерин, как яичные желтки, креветки, мозг и другие органы животных. Ненасыщенные жиры, такие как рыбий жир и кукурузное, арахисовое, сафлоровое и соевое масла, могут быть заменены животными жирами. Недавно было обнаружено, что рыбий жир, содержащийся в лососе, тунце, скумбрии и некоторых других морских рыбах, повышает уровень ЛПВП и, таким образом, снижает или замедляет атеросклеротические процессы.В настоящее время обширные исследования подтвердили причинную связь между богатой холестерином диетой, высоким уровнем холестерина в крови и ишемической болезнью сердца, но власти расходятся во мнениях относительно общей ценности длительного снижения холестерина для «нормального» человека. См. Также липопротеин .
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас(PDF) Уровень холестерина влияет на поверхностный заряд липидных мембран в физиологическом растворе
Очевидно, что плазма крови сложнее, чем наша простая картина
, состоящая из воды, ионов и опсонинов, и как наши экспериментальные, так и расчетные модели — это очень упрощенные модели, которые охватывают только один аспект этой сложной системы.Несмотря на это, мы предлагаем
, чтобы наши результаты предоставили новое представление о влиянии
холестерина на липидную мембрану с растворенными солями в его растворителе,
, и это, в свою очередь, дает представление о роли холестерина в
липидных мембран как биологически, так и фармацевтически.
Методы
При моделировании молекулярной динамики мы приготовили десять фосфолипидных бислоев для
всего 288 липидных молекул с различными пропорциями насыщенного 1,2-дистеароил-sn-
глицеро-3-фосфохолина (DSPC) или мононенасыщенного 1-пальмитоил-2-олеоил-sn-
глицеро-3-фосфохолин (POPC) и холестерин в пропорциях: 650, 551, 451,
351, 251 и 151.Точный состав смоделированных систем приведен в Таблице
S1. Все моделирование проводилось с использованием программного обеспечения GROMACS 4.5.5
28
. Продолжительность моделирования
составляла 200 нс, при этом начальные 100 нс рассматривались как период уравновешивания
на основании анализа площади поверхности на липид и количества ионов, связывающихся с границей раздела мембран
, как показано в дополнительных рисунок S3 и S5 соответственно. В добавлении
мы измерили динамику ионного обмена между связанными и
несвязанными состояниями, показанными на дополнительном рисунке S8.Они показывают увеличение динамики обмена
с увеличением уровня холестерина и более быструю динамику для
POPC, чем DSPC. Наибольшее время связывания для чистой системы DSPC соответствует
результатам нашей предыдущей работы
16
. Во всех случаях данные соответствовали мультиэкспоненциальной
29
, и наша интерпретация этой мультиэкспоненциальной аппроксимации содержится в дополнительном материале
.
Последние 100 нс траектории использовались для всего анализа.Моделирование динамики молекул
проводилось при постоянном давлении (1 бар), контролируемом
через баростат Parrinello2Rahman
30
с использованием схемы полуизотропного давления.
Температура (310 К) контролировалась термостатом Носа
´-Гувера
31,32
. Температуры растворенного вещества и растворителя контролировали независимо. Для параметризации
всех молекул и ионов мы использовали силовое поле всего атома OPLS
33
(OPLS-AA) как
, описанное в наших предыдущих публикациях
13–15
.Для воды мы использовали модель воды TIP3
34
.
Периодические граничные условия с обычным условием минимального изображения использовались
во всех трех направлениях. Чтобы сохранить длину ковалентных связей, был использован алгоритм линейного решателя ограничений
(LINCS)
35
, а во всех симуляциях
использовался временной шаг 2 фс. Взаимодействия Леннарда-Джонса были отсечены на длине волны 1,0 нм, а для электростатических взаимодействий
мы использовали метод Эвальда с сеткой частиц
36
.Все погрешности
баров были рассчитаны блочным методом
37
.
Для измерения f– потенциала липосом были приготовлены липосомы DSPC и POPC
. И DSPC, и POPC были приобретены у LipoidHGmbH, Германия,
, холестерин(чистота 99%) и хлорид натрия (чистота 99%) были получены от Sigma-
Aldrich. Остальные реагенты и растворители были аналитической чистоты. Вода, полученная из системы
MilliPore с проводимостью 18 МВ · см
21
, была использована для приготовления липосом
с использованием гидратации тонкой пленки с последующей экструзией
38
методом до
достижения однородного размер липосом.Среда для гидратации содержала 140 мМ NaCl.
Липосомные суспензии хранили при 4uC и анализировали на размер частиц и потенциал f–
.
1. Ван Меер, Г., Фелькер, Д. и Фейгенсон, Г. Мембранные липиды: где они находятся и
как они себя ведут. Молекулярная клетка. Биол. 9. С. 112–124 (2008).
2. Ro
´g, T., Pasenkiewicz-Gierula, M., Vattulainen, I. & Karttunen, M. Biochim.
Biophys. Acta. 1788. С. 97–121 (2009).
3.Марш, Д. и Смит, И. Конформация головной группы и ассоциация липид-холестерин
в везикулах фосфатидилхолина: исследование ядерного эффекта оверхаузера 31P (1H).
Биохим. Биофиз. Acta 298, 133–144 (1973).
4. Джейкобс Р. и Олдфилд Е. Взаимодействие холестерина с липидом мембраны
матрикс. Метод твердотельного ЯМР. Биохимия. 18, 3280–3285 (1979).
5. Йигл, П. Л. Метил-b-циклодекстрины и липосомы как водорастворимые носители
для включения холестерина в мембраны и его оценка с помощью микроферментного флуоресцентного анализа
и красителей, чувствительных к текучести мембран.
Биохим. Биофиз. Acta. 822, 267–287 (1985).
6. Coderch, L. et al. Влияние холестерина на текучесть липосом по взаимосвязи EPR-
с чрескожной абсорбцией. J. Control Release. 68, 85–95 (2000).
7. Васир, Дж. К. и Лабхасетвар, В. Биоразлагаемые наночастицы для цитозольной доставки
терапевтических средств. Adv. Препарат, средство, медикамент. Поставка Ред. 59, 718–728 (2007).
8. Семпл С., Чонн А. и Куллис П. Р. Влияние холестерина на ассоциацию белков плазмы
с липосомами.Биохимия. 35, 2521–2525 (1996).
9. Баренхольц, Ю. Дж. Системы адресной доставки лекарств, опосредованные новым пептидом, в терапии рака молочной железы
и контролируемом высвобождении с помощью визуализации. PLOS один. 160, 117–134
(2012).
10. Максфилд, Ф. Р. и Табас, И. Роль холестерина и липидной организации в заболевании.
Природа. 438, 612–621 (2005).
11. Зидовска, А., Эванс, Х. М., Ахмад, А., Эверт, К. К. и Сафинья, С. Р. Роль
холестерина и структурно родственных молекул в усилении трансфекции
катионных комплексов липосома-ДНК.J. Phys. Chem. Б., 113, 5208–5216 (2009).
12. Гатфилд Дж. И Питерс Дж. Существенная роль холестерина в проникновении микобактерий в макрофаги
. Наука. 288. С. 1647–1650 (2000).
13. Lingwood, D. et al. Холестерин модулирует конформацию гликолипида и активность рецептора
. Nature Chem. Биол. 7. С. 260–262 (2011).
14. Орловски А. и др. Сильное предпочтение дофамина и L-допа по отношению к группе липидов
: важность липидного состава и влияние на метаболизм нейротрансмиттеров
.Neurochem. 122, 681–690 (2012).
15. Берковиц М. Л., Бостик Д. Л. и Пандит С. Водные растворы рядом с поверхностями фосфолипидных мембран
: выводы из моделирования. Chem. Ред. 106,
1527–1539 (2006).
16. Степневски, М., Бункер, А., Пасенкевич-Гиерула, М., Карттунен, М. и Рог, Т.
Влияние фазового состояния липидного бислоя на поверхность раздела водной мембраны. J. Phys.
Chem. Б. 114, 11784–11792 (2010).
17.Магаркар, А., Каракас, Э., Степневски, М., Ро
´g, Т. и Бункер, А. Молекулярное моделирование
динамики ПЭГилированного бислоя, взаимодействующего с ионами соли: модель
поверхности липосом в кровоток. J. Phys. Chem. Б. 116, 4212–4219 (2012).
18. Фербер, У. М., Каггва, Г. и Джарвис, С. П. Прямая визуализация солевых эффектов на липид
бислой, упорядочивающий субмолекулярное разрешение Eur. Биофиз. J. 2011. Т. 40. С. 329–338.
19. Bockmann, R.A., Hac, A., Heimburg & Grubmu
ller, T. Влияние хлорида натрия
на липидный бислой. Биофиз. J., 85 (2003), 1647–1655.
20. Martinez-Seara, H., Ro
´g, T., Karttunen, M., Vattulainen, I. & Riegada, R.
Холестерин индуцирует определенный пространственный и ориентационный порядок в холестериновых /
фосфолипидных мембранах . PLoS ONE, 5, e11162 (2010).
21. Пандит, С., Бостад, Д. и Берковиц, Л. М. Комплексообразование фосфотидилхолина
липидов с холестерином.Биофизический журнал. 86, 1345–1356 (2004).
22. Хуанг, Дж. Й. и Фейгенсон, Г. В. Микроскопическая модель взаимодействия максимальной растворимости холестерина
в липидных бислоях. Биофизический журнал. 76, 2142–2157
(1999).
23. Миеттинен, М. С., Гуртовенко, А. А., Ваттулайнен, И., Карттунен, М. Ионная динамика
в двухслойных катионных липидных системах в солевых растворах. J. Phys. Chem. Б. 113,
9226–9234 (2009).
24. Макино, К.и другие. Температура и ионная сила индуцировали конформационные изменения
в области головной липидной группы липосом, как предполагают данные дзета-потенциала
. Биофизическая химия. 41, 175–183 (1991).
25. Шерфоф Г. Л. и Кампс Дж. А. А. М. Опсонизация липосом. Liposome Res. 15,
109–139 (2005).
26. Клашик, К. и Кнехт, В. Проверка сродства ион-липидной ассоциации на основе моделирования
в сравнении с экспериментом. Дж.Phys. Chem. А. 115, 10587–10595 (2011).
27. Юркевич, П., Цвиклик, Л., Войты
´s
kova
´, А., Юнгвирт, П. и Хоф, М. Структура,
динамика и гидратация POPC / POPS бислои суспендированы в растворах NaCl, KCl и
CsCl. Биохим. Биофиз. Acta. 1818. С. 609–616 (2012).
28. Pronk, S. et al. GROMACS 4.5: высокопроизводительный и высокопараллельный набор инструментов молекулярного моделирования
с открытым исходным кодом. Биоинформатика.29, 845–854 (2013).
29. Титантах, Дж. Т. и Карттунен, М. Длительные корреляции и гидрофобно-модифицированная динамика
водородных связей при гидрофобной гидратации. Варенье. Chem. Soc. 134,
9362–9368 (2012).
30. Парринелло М. и Рахман А. Полиморфные переходы в монокристаллах: новый метод молекулярной динамики
. J. Appl. Phys. 52, 7182–7190 (1981).
31. Нос
´, S.J. Единая формулировка методов молекулярной динамики при постоянной температуре
.Chem. Phys. 81, 511–519 (1984).
32. Гувер У. Г. Каноническая динамика: равновесные распределения в фазовом пространстве. Phys.
Ред. A. 31, 1695–1697 (1985).
33. Йоргенсен, В. Л. и Тирадо-Ривес, Дж. Возможные функции OPLS для белков.
Минимизация энергии для кристаллов циклических пептидов и крамбина. Варенье. Chem.
Soc. 110, 1657–1666 (1988).
34. Йоргенсен, В. Л., Чандрасекхар, Дж., Мадура, Дж. Д., Импей, Р. и Кляйн, М. Л.
Сравнение простых потенциальных функций для моделирования жидкой воды. J. Chem.
Phys. 79, 926–935 (1983).
35. Гесс, Б., Беккер, Х., Берендсен, Х. Дж. К. и Фраайе, Дж. Г. Э. М. Решатель линейных ограничений
для молекулярного моделирования. J. Comput. Chem. 18, 1463–1472 (1997).
36. Essmann, U. et al. Метод Эвальда с использованием сетки гладких частиц. J. Chem. Phys. 103,
8577–8593 (1995).
37. Гесс, Б. Определение сдвиговой вязкости модельных жидкостей из молекулярных
динамических симуляций.J. Chem. Phys. 116, 209–217 (2002).
38. Olson, F., Hunt, C.A., Szoka, F. C., Vail, W. J. & Papahadjopoulos, D. Получение
липосом определенного распределения по размерам путем экструзии через поликарбонатные
мембраны. Биохим. Биофиз. Acta. 557, 9–23 (1997).
Благодарности
Авторы хотели бы поблагодарить Центр научных вычислений (CSC), Финляндия, за предоставление
вычислительных ресурсов. Авторы благодарят профессора Арто Уртти за совет.Эту работу профинансировали Академия
Финляндии и Финский культурный фонд.
Вклад авторов
A.M. и Т. построил расчетные модели систем и выполнил моделирование
В.Д. и M.E. провели эксперименты и проанализировали данные P.K. и T.V. разработали
экспериментов, A.M., T.R. и А. написал рукопись.
Дополнительная информация
Дополнительная информация прилагается к этому документу по адресу http: // www.nature.com/
Scientificreports
www.nature.com/scientificreports
НАУЧНЫЕ ОТЧЕТЫ | 4: 5005 | DOI: 10.1038 / srep05005 4
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Холестерин обеспечивает неактивную защиту мембранных липидов от химического повреждения на границе раздела воздух-вода.
Значение
Составляя 30 мол.% Липидов в клеточных мембранах, холестерин играет жизненно важную биофизическую роль в однослойных и двухслойных мембранах.Он увеличивает плотность липидной упаковки и поддерживает высокую текучесть мембран. Большинство исследований холестерина в мембранах сосредоточено на его влиянии на структуру и физические свойства мембран, с минимальным вниманием к возможным биохимическим последствиям, которые могут сопровождать эти изменения. В этом исследовании масс-спектрометрия с капельной ионизацией, индуцированной полем, используется для прямого измерения химического разложения монослойных фосфолипидов, вызванного сильнодействующими реагентами ОН и HCl на границе раздела воздух-вода.При добавлении к липидному слою холестерин выполняет неактивную химиопротекторную функцию, ингибируя существенное разложение как 1,2-дипальмитоил-sn-глицеро-3-фосфохолина, так и 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфора. (1′-rac-глицерин), возникающий в отсутствие холестерина.
Abstract
Роль холестерина в двухслойных и монослойных липидных мембранах представляет большой интерес. На биофизическом фронте холестерин значительно увеличивает порядок упаковки липидов, снижает проницаемость мембран и поддерживает текучесть мембран, образуя липидные рафты с жидкой упорядоченной фазой.Однако прямые наблюдения за каким-либо влиянием на химию мембран, связанных с этими индуцированными холестерином физическими свойствами, отсутствовали. Здесь мы сообщаем, что добавление 30 мол.% Холестерина к 1,2-дипальмитоил-sn-глицеро-3-фосфохолину (DPPC) или 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфо- (1′-rac -глицерин) (POPG) на границе раздела воздух-вода значительно снижает химические процессы окисления и расщепления сложноэфирной связи, инициируемые сильнодействующими химическими веществами, такими как радикалы ОН и пары HCl, соответственно.Эти результаты проливают свет на незаменимую химиозащитную функцию холестерина в липидных мембранах. Еще одно важное открытие заключается в том, что при окислении ненасыщенных липидов ОН образуется промежуточный продукт Криджи, который является важным радикалом, участвующим во многих атмосферных процессах.
Холестерин (хол) обычно составляет до 30 мол.% Липидов в плазматических мембранах эукариот (1). Это большое количество холестерина модулирует множество биофизических свойств липидных мембран. Как для двухслойных, так и для однослойных мембран, экспериментальные и теоретические усилия предоставили доказательства того, что холестерин обладает уникальной способностью увеличивать порядок упаковки липидов (1-4), снижать проницаемость (5, 6) и поддерживать текучесть и скорость диффузии. (1, 2, 4) одновременно.Исследования латеральной фазы комплексов холестерин / фосфолипид показывают, что образование жидкоупорядоченной фазы ( l o ) отвечает за кажущееся противоречивым сосуществование плотной упаковки и высокой текучести как в монослойных, так и в двухслойных мембранах (4, 7). Небольшие, динамичные, плотно связанные холестерин-липидные сборки, известные как липидные рафты в фазе , , , , , , считаются микроскопическим механизмом уникальных функций холестерина в бислоях и монослоях (8-10).На сегодняшний день незаменимая роль холестерина в липидных мембранах в основном обсуждается в контексте физических свойств, и исследования, направленные на биохимические функции холестерина в мембранах, немногочисленны. Играет ли холестерин химическую роль, которая в конечном итоге может повлиять на здоровье? Ответить на этот вопрос пытались лишь несколько исследований. Было высказано предположение, что холестерин может действовать как жертвенный антиоксидант, поскольку окисленный холестерин (оксистерин) часто обнаруживается в крови (11).Также было высказано предположение, что холестерин может снизить повреждение фосфолипидных слоев, вызванное окислением, инициированным ионизирующим излучением, на основании косвенных методов, таких как измерение времени жизни флуоресценции других добавок (12, 13). Продукты окисления в этих исследованиях не идентифицированы.
Учитывая, что исследования биохимической, а не биофизической роли холестерина давно назрели, мы сообщаем о прямом наблюдении за функцией холестерина в снижении химического повреждения насыщенного липида 1,2-дипальмитоил-sn-глицеро-3- фосфохолин (DPPC) и монослои ненасыщенного липида 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфо- (1′-rac-глицерин) (POPG), возникающие в результате воздействия окислителей и сильных кислот на границе раздела воздух-вода .Роль холестерина в реструктуризации мембран, обеспечивающая химиозащитную функцию, суммирована на рис. 1. Межфазные монослои фосфолипидов вездесущи по своей природе, присутствуют в виде покрытия природных вод (14), составляющих половину двухслойных клеточных мембран, и 80 мол.% открытой поверхности легочных альвеол, которая находится в непосредственном контакте с воздухом, в котором DPPC занимает до 50 мол.% всех легочных фосфолипидов (15). Следовательно, липидные монослои часто являются границей, на которой происходят деструктивные химические процессы.Химические реакции в текущем исследовании инициируются исключительно мощными гидроксильными радикалами (ОН) и парами соляной кислоты (HCl), двумя типичными химическими веществами, которые способны химически атаковать фосфолипиды потенциально опасным для здоровья человека образом. ОН — это окислитель, который существует как в атмосфере, так и in vivo (16⇓ – 18). Его время жизни в этих двух средах составляет ∼1 с (16) и 1 нс (18) соответственно. После вдыхания или образования in vivo он может быстро атаковать практически все молекулярные виды.Присутствующая как в атмосфере, так и in vivo, HCl выбрана в качестве типичной сильной кислоты, которая может разрушать фосфолипиды мембран посредством реакций гидролиза, катализируемых кислотой (19).
Рис. 1.Рисунок, иллюстрирующий уникальную способность холестерина увеличивать порядок упаковки липидов и снижать проницаемость и последующую реакцию разлагающих химических веществ в липидных слоях на границе раздела воздух-вода.
Подробные экспериментальные методы представлены в Материалы и методы .Вкратце, монослои чистого DPPC, чистого POPG, 70 мол.% DPPC / 30 мол.% Холода или 70 мол.% POPG / 30 мол.% Холода образуют на границе раздела окружающий воздух-вода каплю воды диаметром 2 мм, которая подвешена на поверхности. конец капилляра из нержавеющей стали (рис. 2). Это молярное соотношение выбрано для воспроизведения типичного количества холестерина, присутствующего в клеточных мембранах. Радикалы ОН (1 × 10 9 молекул · см -3 ) генерируются источником диэлектрического барьерного разряда (20), а пары HCl образуются в результате испарения из чашки Петри 36.Под каплей помещают 5% раствор HCl. Давление паров HCl составляет 114 мм рт. Ст. (21), что соответствует 3 × 10 18 молекул · см -3 . Это число значительно превышает географически сильно варьирующуюся концентрацию HCl в окружающей среде, которая, по измерениям, составляет около 1 ppb (2,5 × 10 10 молекул · см −3 ) в южной Калифорнии (22). После воздействия ОН или HCl в течение определенного периода времени состав монослоев определяется с помощью методологии масс-спектрометрии с индуцированной полем капельной ионизацией, чувствительной к границе раздела фаз (FIDI-MS) (рис.2), разработанные в нашей лаборатории (23, 24). Цвиттерионный DPPC детектируется как натриевый или протонированный катион, POPG детектируется как анион (без противоиона Na + ), а холестерин протонируется и отбирается как дегидратированный катион.
Рис. 2.Схема установки и работы FIDI-MS.
Результаты
Рис. 3 A представляет временное разрешение окисления чистого монослоя DPPC для 0-, 30-, 60- и 90-секундного воздействия радикалов ОН, соответственно.Пик m / z 757 представляет собой натриевый исходный катион DPPC, а пики с более высоким значением m / z являются продуктами окисления. Эти продукты инициируются отрывом атомов водорода от пальмитоильных хвостов DPPC радикалами ОН с последующими стадиями, частично опосредованными окружающими молекулами O 2 и NO, с образованием карбонильных и гидроксильных функциональных групп ( см. Ниже ). За 90 с ~ 90% DPPC окисляется с добавлением одного или нескольких атомов кислорода. Отсутствие продуктов с низкой массой указывает на то, что очень незначительное разрушение связей C – C происходит в результате ОН-опосредованного окисления.Среднее количество атомов кислорода на молекулу DPPC как функция времени окисления показано на фиг. 3 C в виде черных квадратов. Наблюдаемое линейное поведение предполагает, что процесс окисления гетерогенной поверхности лучше всего описывается кинетикой Ленгмюра-Хиншелвуда (20, 25). Если бы OH немедленно реагировал при контакте со связями C – H (кинетика Элея – Ридила), то данные на рис. 3 C , вероятно, имели бы искривление вверх из-за введения более слабых и более реактивных связей C – H, таких как как связи α-C – H, прилегающие к карбонильной группе, на границе раздела воздух-вода.Вместо этого мы утверждаем, что ОН с большой вероятностью размещается на поверхности, диффундирует через углеводородный слой и в конечном итоге вступает в реакцию путем отвода водорода. Степень окисления, следовательно, определяется постоянным потоком ОН на поверхности, и с течением времени не происходит ускорения или замедления скорости включения кислорода. Это изображено на рисунке в левой части рис. 1.
Рис. 3.Результаты ОН-окисления DPPC и холестеринсодержащих монослоев на границе раздела воздух-вода.( A ) Спектры FIDI-MS в катионном режиме с временным разрешением, включая реагент и продукты из чистого монослоя DPPC. За 90 с ~ 90% образующегося липидного слоя окисляется добавлением одного или нескольких атомов кислорода, в основном в виде нескольких карбонильных и гидроксильных групп. ( B ) Спектр FIDI-MS в катионном режиме, включая реагент и продукты из монослоя 70 мол.% DPPC / 30 мол.% Холода после 180 с времени окисления. Нет никаких доказательств того, что холестерин окисляется и степень окисления липидов значительно снижена по сравнению с таковой в A .( C ) Среднее количество включенных атомов кислорода на молекулу DPPC как функция времени из монослоев чистого DPPC (черные квадраты) и 70 мол.% DPPC / 30 мол.% Хол (красные кружки).
На фиг. 3 B представлены продукты из монослоя смеси 70 мол.% DPPC / 30 мол.% Холода после 180 с воздействия ОН при плотности, идентичной плотности, использованной на фиг. 3 A . Удивительно, но при наличии холестерина DPPC практически невосприимчив к окислению радикалами ОН даже после гораздо более длительного времени воздействия, чем в отсутствие холестерина, 180 с (рис.3 С , красные кружки). Таким образом, очевидно, что холестерин подавляет окисление. Из этого наблюдения возникает очевидный вопрос. Играет ли холестерин жертвенную роль и окисляется ли предпочтительнее ДПФХ, аналогично антиоксидантной роли, которую играет витамин С (26), или является ли реструктурированная плотно упакованная фаза смеси холестерол / ДПФХ, блокирующая доступ О к липиду? Рис. 3 B показывает, что холестерин находится в протонированной дегидратированной форме ( m / z 369), как и ожидалось при обнаружении с помощью МС (27), и никаких продуктов окисления не наблюдается, даже если холестерин с высоким содержанием связей C – H присутствует. Ожидается, что он будет уязвим для атаки OH.В свете этого можно сделать вывод, что холестерин не является жертвенным, а вместо этого реструктурирует липидный слой таким образом, что значительно снижает поглощение радикалов ОН, тем самым ингибируя окисление как самого себя, так и DPPC. Это иллюстрируется правой частью рис. 1, на котором показано влияние холестерина на структуру и упаковку липидов.
Согласно фиг. 3 C , ОН требуется около 25 секунд, чтобы окислить DPPC примерно одним атомом кислорода на молекулу липида.Поскольку концентрация ОН, использованная в нашем исследовании, на три порядка выше, чем концентрация в окружающей среде, потребуется 7 часов, чтобы вызвать такую же степень окисления окружающими радикалами ОН. Когда присутствует 30 мол.% Холестерина, по приблизительной оценке с использованием данных на рис. 3 C , такая же степень окислительного повреждения легочного DPPC при вдыхании окружающего ОН будет увеличена до более чем 600 часов!
Рис. 4 A показывает ОН-окисление POPG в течение 0, 30, 60 и 90 с. Пик m / z 747 является родительским анионом POPG.В отличие от химии окисления насыщенных пальмитоильных групп DPPC, продукты окисления POPG появляются при более низких m / z в результате введения ненасыщенной олеильной группы. В химии окисления POPG преобладает высокореакционная двойная связь олеоильной цепи. Продукт m / z 637 является результатом расщепления двойной связи на альдегидную группу, а частицы m / z 671 являются результатом окисления двойной связи в продукт гидроксигидропероксида (HHP) через промежуточное соединение Криджи ( CI) ( см. Ниже ).Примечательно, что ХИ является важным атмосферным радикалом, возникающим в результате реакции озона с олефинами (28), и основным источником радикалов ОН в тропосфере (29). Наши результаты свидетельствуют о том, что окисление ненасыщенных углеводородов ОН может, в свою очередь, приводить к образованию ХИ. Рис. 4 D представляет процент превращения в продукты в зависимости от времени окисления (черные квадраты). Наблюдаемое линейное поведение указывает на то, что реакция протекает быстро и ограничивается потоком ОН на границе раздела воздух-вода, что опять же согласуется с кинетикой Ленгмюра-Хиншелвуда (20, 25).И снова холестерин оказывает заметное подавление окисления, и только небольшая часть смеси 70% POPG / 30% холода окисляется после 180-секундной выдержки (рис. 4 B и D , красные кружки). Как и в случае DPPC, холестерин не убивается (фиг. 4 C ). Из этих результатов можно сделать вывод, что присутствие 30 мол.% Холестерина значительно снижает проницаемость ОН в монослои, содержащие как насыщенные, так и ненасыщенные фосфолипиды на границе раздела воздух-вода.
Рис. 4.Результаты ОН-окисления ПОПГ и холестеринсодержащих монослоев на границе раздела воздух – вода. ( A ) Спектры FIDI-MS в анионном режиме с временным разрешением, включая реагент и продукты из чистого монослоя POPG. ( B ) Спектр FIDI-MS в анионном режиме, включающий реагент и продукты из монослоя 70 мол.% POPG / 30 мол.% Холода после 180 с времени окисления. Степень окисления липидов значительно снижена по сравнению с таковой в A . ( C ) Спектр FIDI-MS в катионном режиме, показывающий хол из монослоя 70 мол.% DPPC / 30 мол.% Холода после 180 с времени окисления.Нет никаких доказательств того, что холестерин окисляется. ( D ) Процент продуктов в зависимости от времени из монослоев чистого POPG (черные квадраты) и 70 мол.% POPG / 30 мол.% Хол (красные кружки).
Представляет интерес сравнить различное поведение насыщенных и ненасыщенных липидов, наблюдаемое на рис. 3 и 4 соответственно. Среднее количество кислорода, включенного в поверхностные молекулы DPPC, линейно увеличивается со временем. Это не происходит в значительной степени с POPG, что указывает на то, что ОН, диффундирующий через липидный слой, гораздо быстрее реагирует с оставшимися ненасыщенными олеильными группами, чем с уже окисленными липидами.Это согласуется с данными газофазных исследований реакций радикалов ОН с углеводородами, в которых обнаружено, что олефины в 10–100 раз активнее, чем их насыщенные аналоги (30).
На фиг. 5 A и C показана зависимость от времени катализируемого кислотой гидролиза сложноэфирных связей чистой однослойной пленки DPPC, возникающей в результате воздействия паров HCl. Продукты, связанные с потерей одного из хвостов пальмитиновой кислоты ( m / z 497), постепенно увеличиваются по интенсивности с увеличением времени воздействия, что является прямым доказательством кислотно-катализируемого гидролиза.Добавление 30 мол.% Холестерина к липидному слою смягчает процесс гидролиза (рис. 5 B ). После 180 секунд воздействия гидролизуется только 9% DPPC (рис. 5 C , красные кружки). В случае POPG (рис. 6 A ) наблюдаются два возможных продукта гидролиза: потеря олеиновой кислоты ( m / z 483) и потеря пальмитиновой кислоты ( m / z 509). примерно в равных количествах. Еще раз, добавление холестерина значительно снижает гидролиз POPG, вызванный парами HCl (рис.6 B и C ). Как и в случае радикалов ОН, можно сделать вывод, что проницаемость HCl значительно снижается в комбинированном межфазном слое хол / липид. Это пример непосредственно наблюдаемой химии кислотно-катализируемого сложноэфирного расщепления мембранных липидов на границе раздела воздух-вода, демонстрирующий эффективность методологии FIDI для исследования сложной межфазной химии.
Рис. 5.Результаты разложения паров HCl DPPC и холестеринсодержащих монослоев на границе раздела воздух-вода.( A ) Спектры FIDI-MS в катионном режиме с временным разрешением, включая реагент и продукты из чистого монослоя DPPC. ( B ) Спектр FIDI-MS в катионном режиме, включающий реагент и продукты из монослоя 70 мол.% DPPC / 30 мол.% Холина после 180 с времени воздействия. Степень деградации липидов значительно снижена по сравнению с таковой в A . ( C ) Процент продуктов в зависимости от времени из монослоев чистого DPPC (черные квадраты) и 70 мол.% DPPC / 30 мол.% Хол (красные кружки).
Рис. 6.Результаты разложения POPG парами HCl и холестеринсодержащих монослоев на границе раздела воздух-вода. ( A ) Спектры FIDI-MS в анионном режиме с временным разрешением, включая реагент и продукты из чистого монослоя POPG. ( B ) Спектр FIDI-MS в анионном режиме, включая реагент и продукты из монослоя 70 мол.% POPG / 30 мол.% Холода после 180 с времени воздействия. Степень деградации липидов значительно снижена по сравнению с таковой в A .( C ) Процент продуктов в зависимости от времени из монослоев чистого POPG (черные квадраты) и 70 мол.% POPG / 30 мол.% Хол (красные кружки).
Обсуждение
На рис. 7 представлены предложенные механизмы ОН-окисления POPG и DPPC. Окисление ОН DPPC происходит в двух гидрофобных насыщенных алкильных цепях, которые присутствуют на границе раздела воздух-вода. Поскольку два пальмитоильных хвоста богаты реакционноспособными связями C – H, все они являются потенциальными центрами реакции. На рис.7 A DPPC упрощен как R 1 CH 2 R 2 .Реакция начинается со стадии (1), отрыва атома Н радикалом ОН, в результате чего образуется алкильный радикал. После этого алкильный радикал, образованный на стадии (1), может присоединить молекулу O 2 с образованием пероксирадикала на стадии (2), поскольку концентрация окружающего O 2 на много порядков выше, чем концентрация ОН. Шаг (3) — это хорошо известный механистический шаг, в котором участвует NO (31, 32). Концентрация NO в окружающей среде в районе Лос-Анджелеса обычно составляет ∼1 × 10 11 молекул · см −3 (33), что значительно выше, чем концентрация ОН (∼1 × 10 9 молекул · см −3 ) в текущем исследовании.NO будет отрывать атом кислорода от пероксигруппы с образованием алкоксирадикала и NO 2 . С этим алкоксильным радикалом могут протекать две разные реакции. Он может либо реагировать с молекулой O 2 с образованием карбонильной группы [стадия (4)] и уходящей группы HO 2 , либо отрывать атом H от окружающего HO 2 с образованием гидроксильной группы [стадия (5 )]. Окружающая концентрация HO 2 обычно составляет ∼2 × 10 9 молекул · см -3 (34). И стадия (4), и стадия (5) являются хорошо задокументированными путями в реакциях ОН с насыщенными углеводородами (30, 35).Образование карбонильной группы добавляет 14 Да к молекулярной массе, а образование гидроксильной группы добавляет 16 Да. Первоначальное введение гидроксильных и карбонильных групп в насыщенные углеводороды создает участки, в которых ослабленные связи C – H с большей вероятностью будут реагировать в дальнейшем с OH путем отвода водорода, а затем с O 2 , NO и HO 2 в соответствии с рис. 7 A , что приводит к большему количеству комбинаций карбонильных (+14 Да) и гидроксильных групп (+16 Да) по отношению к исходному иону DPPC, что составляет m / z 771 (DPPC + карбонил), 773 (DPPC + гидроксил), 785 (DPPC + 2 карбонил), 787 (DPPC + карбонил + гидроксил), 789 (DPPC + 2 гидроксил), 801 (DPPC + 2 карбонил + гидроксил), 803 (DPPC + карбонил + 2 гидроксил), 815 (DPPC + 3 карбонил + гидроксил) и 817 (DPPC + 2 карбонил + 2 гидроксил) пики продуктов на рис.3 А . Продолжающаяся последовательность реакций в конечном итоге приводит к сильно окисленным продуктам, таким как те, которые наблюдаются на рис. 3 A после окисления в течение 90 с, за это время ∼90% подвергшейся воздействию поверхности DPPC окисляется с добавлением одного или нескольких кислорода. -содержащие функциональные группы. Аналогичные закономерности окисления насыщенных углеводородов радикалами ОН наблюдаются для 18-углеродной цепи стеариновой кислоты на границе раздела воздух – вода (20).
Рис. 7.Предлагаемые механизмы окисления ОН ( A ) DPPC и ( B ) POPG.
Рис. 7 B изображает механизмы реакции, предложенные для ОН-окисления POPG. В отличие от DPPC, в этом случае предпочтительны продукты расщепления связи. Стадия (1) представляет собой гетерогенный захват радикала ОН из газовой фазы двойной связью либо у ω — 9, либо у ω — 10 углерода, в результате чего образуются два разных β-гидроксиалкильных радикала (35). Разумно предположить, что ОН присоединяется к атомам углерода ω — 9 и ω — 10 с одинаковой вероятностью, поскольку оба они находятся около середины монослоя, имея аналогичную доступность для радикалов ОН в газовой фазе.После добавления ОН стадия (2) включает поглощение молекулы O 2 с образованием двух разных β-гидроксипероксирадикалов, один из которых может подвергаться β-расщеплению до α-гидроксиалкильного радикала [стадия (3)], а второй может далее реагировать с O 2 с образованием уходящей группы HO 2 и молекулы альдегида [ m / z 637, стадия (4)]. Альдегид реагирует с H 2 O с образованием полуацетального продукта [ m / z 655, стадия (5)]. Второй β-гидроксипероксирадикал, образованный на стадии (2), также может подвергаться термической диссоциации на CI и гидроксиалкильный радикал [стадия (6)].Этот продукт CI, записанный в его предпочтительной цвиттерионной форме, может реагировать с поглотителем CI, H 2 O, с образованием продукта HHP m / z 671 [стадия (7)]. Этот продукт HHP является символическим свидетельством пути реакции ХИ (36) и в конечном итоге становится продуктом в изобилии. Для дальнейшего подтверждения пути ХИ были также использованы два других поглотителя ХИ (37), метанол и этанол, путем образования капель, содержащих растворы вода / метанол или вода / этанол (1/1). Поскольку метанол и этанол можно рассматривать как группу ОН в воде, замещенную метокси или этокси, ожидается, что продуктами будут метоксигидропероксид (MHP, m / z 685) и этоксигидропероксид (EHP, m / z 699). , На 14 и 28 Да соответственно больше, чем у продукта HHP.Соответственно, продукты наблюдаются с соответствующими каплями смешанного растворителя (рис. 8). Поскольку вода присутствует в каплях всех трех систем вместе с окружающей атмосферной водой и потоком гелия, засеянным водяным паром из источника DBD, HHP наблюдается во всех трех экспериментах. На фиг. 8 также есть несколько других пиков полуацеталевых продуктов, возникающих в результате реакции между альдегидом ( m / z 637) и водой, метанолом или этанолом. Рис. 7 B изображает предложенный механизм реакции, включая стадии с участием метанола и этанола.Альдегид, образующийся на стадии (4), может реагировать с H 2 O, MeOH или EtOH с образованием соответствующих полуацетальных продуктов [стадия (5)]. ХИ, образующийся на этапе (6), реагирует с H 2 O, MeOH или EtOH с образованием продуктов HHP, MHP или EHP на этапе (7).
Рис. 8.Масс-спектры продуктов окисления ОН аниона POPG в каплях, содержащих воду, 1/1 растворы вода / метанол и 1/1 вода / этанол. Ожидаемые продукты, HHP, MHP и EHP, наблюдаются по реакциям между ХИ и водой, метанолом и этанолом, соответственно.
Для изучения энергетики, связанной с образованием КИ, расчеты поверхности потенциальной энергии с использованием C 2 H 4 в качестве модельной системы представлены на рис. 9. Все структуры оптимизированы на ωB97X-D / 6 –311 ++ G (3df, 3pd) (38) уровень теории с нулевой энергией, скорректированный с помощью пакета Gaussian09 (39). Функционал ωB97X-D был выбран из-за его хороших характеристик при описании взаимодействий на больших расстояниях, таких как водородная связь. Добавление OH и O 2 к C 2 H 4 понижает энергию от 0 до -1.27 и −2,63 эВ соответственно. Опосредованный O 2 , β-гидроксипероксирадикал может диссоциировать на радикал HO 2 , молекулу формальдегида и CI, энергия которого на 0,55 эВ ниже, чем у реагентов. Реакция между CI и H 2 O с образованием HHP дополнительно снижает энергию до -2,35 эВ. Следовательно, путь CI в целом термодинамически предпочтителен для модельной системы C 2 H 4 , что дает больше уверенности в предложенном механизме на рис. 7 B .Структура CI повторно оптимизирована на уровне теории связанных кластеров с использованием синглетных, дублетных и пертурбативных триплетных возбуждений [CCSD (t)] (40) с тем же базисным набором, а заряд атома рассчитывается с помощью методов анализа естественной населенности. (41). Расчеты свойств CI, включая длины связей, углы, атомные заряды и его дальнейшую реакцию с водой, полностью воспроизводят опубликованные результаты (42). Одной из проблем, связанных с расчетным путем реакции, является стадия разрыва связи, которая формирует CI, что включает увеличение энергии на 2.11 эВ. Это кажется довольно высоким барьером, который необходимо преодолеть, поскольку выигрыш в энергии от первых двух шагов будет быстро рассеиваться в среде конденсированной фазы. Мы предполагаем, что могут быть другие молекулы, такие как вода, которые могут опосредовать реакцию и значительно снизить этот энергетический барьер. Такое явление наблюдалось между ХИ (из газовой фазы) и водой на границе воздух – вода, где скорость реакции, приводящей к ГПЧ, увеличивается на 2–3 порядка за счет участия других молекул воды (43).
Рис. 9.Относительные энергии (электрон-вольт) образования и истощения ХИ с использованием этилена в качестве модельной системы. Также представлены расчетные свойства CI, включая длины связей (ангстремы), валентный угол ∠OOC (градусы) и заряд атомов, полученные из анализа естественной заселенности ( e ).
Особый интерес представляет то, что продукты окисления ОН POPG сильно отличаются от продуктов окисления ОН олеиновой кислоты (20), где двойная связь окисляется добавлением карбонильных групп вместо расщепления, даже если реакционноспособный олеил функциональные группы одинаковы в обоих случаях.Это различие может быть связано с ограничениями, налагаемыми гораздо более высокой плотностью упаковки POPG по сравнению с плотностью упаковки олеиновой кислоты на границе раздела воздух-вода (44, 45). Продукты окисления OH DPPC и POPG в этом исследовании также отличаются от продуктов окисления OH DPPC и 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолина (POPC), изученных на поверхности частиц NaCl микрометрового размера. и характеризуется инфракрасной спектроскопией диффузного отражения и MALDI-TOF-MS (46). POPC и POPG имеют одинаковые хвосты жирных кислот.Это различие снова может быть результатом разницы в упаковке липидов на границе воздух-вода и воздух-NaCl.
Для реакций, инициированных HCl, моделирование молекулярной динамики показывает, что связи сложных эфиров жирных кислот погружены в водную часть границы раздела воздух-вода (47). Мы предполагаем, что HCl диссоциирует для снижения межфазного pH и осуществления кислотно-катализируемого гидролиза сложноэфирных связей. Обратите внимание, что два сайта сложноэфирной связи не являются химически эквивалентными, и связь олеилового эфира немного более погружена на границе раздела.Это могло бы привести к более эффективной сольватации переходного состояния для гидролиза и способствовать немного более высокому содержанию соответствующего продукта, наблюдаемого на фиг. 6 A и B .
На основании представленных выше результатов и механизмов, а также наблюдения, что холестерин сам по себе не окисляется ни в одном из этих экспериментов, можно сделать вывод, что холестерин защищает липиды мембран от химического повреждения на границе раздела воздух-вода за счет увеличения плотности упаковки. липидов и снижение проницаемости липидного слоя для сильнодействующих разрушающих химических веществ, таких как OH и HCl.
Заключение
В заключение, насыщенные и ненасыщенные мембранные липиды DPPC и POPG сами по себе на границе раздела воздух-вода могут сильно повреждаться радикалами OH и HCl. Окисление насыщенных липидов ОН приводит к добавлению к алкильным цепям множества кислородсодержащих функциональных групп, таких как гидроксил или карбонил. Напротив, ОН-окисление ненасыщенных липидов предпочитает расщепление двойной связи цепи жирной кислоты. Примечательно, что наши результаты свидетельствуют о том, что ОН-окисление липидов, включающих ненасыщенные жирные кислоты, может генерировать CI, важный вид, образующийся при озонолизе олефинов в атмосфере (28).Механизмы этих реакций были предложены на рис. 7. Повреждение мембранных липидов HCl на границе раздела воздух-вода объясняется реакциями гидролиза, катализируемыми кислотой, что приводит к потере цепей жирных кислот. Добавление 30 мол.% Холестерина к межфазным фосфолипидам реструктурирует липидные слои таким образом, что значительно снижает их проницаемость для ОН и HCl в липидных слоях на границе раздела воздух-вода, существенно предотвращая химическое повреждение, инициированное этими частицами (рис.1). Сам холестерин не является жертвой этих реакций. Природа наделила холестеринсодержащие мембраны физическими свойствами, которые обеспечивают защиту от разложения сильными химическими агентами.
Материалы и методы
DPPC и POPG были приобретены у Avanti Polar Lipids и использовались без дополнительной очистки. Холестерин (≥99%) был приобретен у Sigma-Aldrich и использовался без дополнительной очистки. Все растворители (вода и метанол) предназначены для ВЭЖХ и приобретены у EMD Chemicals Inc.Растворы 2 мМ DPPC, POPG и холестерина сначала получают путем растворения химических веществ в метаноле, а затем разбавляют водой для получения растворов 100 мкМ чистого DPPC, 100 мкМ чистого POPG, смеси 70 мкМ DPPC / 30 мкМ холестерина и Смесь 70 мкМ POPG / 30 мкМ холестерина для экспериментального использования.
На рис. 2 представлена схема установки FIDI-MS. Вкратце, висящая капля с наружным диаметром ∼2 мм. (∼4 мкл в объеме) подвешивается на конце капилляра из нержавеющей стали между двумя параллельными пластинчатыми электродами, разделенными шестью.3 мм. Капли образуются из жидкости, подаваемой через капилляр с помощью моторизованного шприцевого насоса. Параллельные пластины установлены на трансляционном столике, чтобы обеспечить возможность совмещения отверстия в электрически заземленной пластине с входом атмосферного давления масс-спектрометра LTQ-XL (Thermo-Fisher). Капилляр устанавливается на отдельном трансляционном столике, чтобы поместить каплю точно посередине между двумя пластинами и совместить с входным отверстием LTQ-XL. Масс-спектрометрический отбор проб висящей капли осуществляется путем подачи импульсного высокого напряжения (обычно 3-5 кВ, длительность 100 мс, полярность может меняться в зависимости от отбираемых ионов) к задней параллельной пластине и капилляру при половина величины, приложенной к задней пластине, чтобы поддерживать однородность поля между передней и задней пластинами.Когда прикладывается достаточно высокое напряжение, генерируется биполярный выброс сильно заряженных дочерних капель диаметром менее 1 мкм с противоположных концов подвешенной капли. Заряженные капли определенной полярности попадают в передаточный капилляр масс-спектрометра, что приводит к обнаружению ионов газовой фазы. В этом исследовании мы прикладываем положительное напряжение к задней пластине для обнаружения протонированного дегидратированного холестерина, натриевого или протонированного DPPC и связанных катионов, а также отрицательное напряжение для обнаружения десодифицированного POPG и связанных анионов.Когда каждая капля первоначально сформирована, мы даем молекулам 60 с для диффузии к границе раздела воздух-вода перед тем, как подвергнуть каплю воздействию гидроксильных радикалов или паров HCl в течение переменного времени реакции. После реакции мы запускаем высокое напряжение для отбора проб как реагентов, так и продуктов. Выборка происходит в миллисекундном масштабе времени. Каждый эксперимент начинается со свежей капли.
Гидроксильные радикалы генерируются с использованием источника диэлектрического барьерного разряда (DBDS), состоящего из боросиликатной трубки (1/4 дюйма o.d., 3/16 дюйма i.d.), который действует как диэлектрический материал. Внутренний электрод из вольфрамовой нити герметизирован внутри трубки, а проводящее серебряное эпоксидное покрытие (McMaster-Carr) действует как внешний электрод. Стеклянный барботер подает водонасыщенный гелий через DBDS с потоком 1000 мл / мин, контролируемым цифровым контроллером массового расхода типа πMFC (модель PFC-50; MKS Instruments). Источник высокого напряжения переменного тока (Trek PM04015) смещал внутренний электрод во время экспериментов при 12 кВ (от пика до пика) и 1000 Гц, в то время как внешний электрод оставался заземленным.Между источником питания и вольфрамовой нитью накала есть резистор сопротивлением 1 МОм, используемый в качестве ограничителя тока. Внутри трубки образуется низкотемпературная плазма (диэлектрический барьерный разряд), производящая гидроксильные радикалы в потоке газа. По сравнению с концентрацией тропосферного радикала ОН, которая, согласно измерениям, составляла 1–3 × 10 6 молекул · см −3 (16), DBDS может генерировать ∼1 · 10 9 молекул · см −3 OH радикалов (20) в зависимости от времени, необходимого для окисления монослоя поверхностно-активного вещества в среднем одним кислородом на молекулу поверхностно-активного вещества.Высокая интенсивность радикалов ОН значительно ускоряет процесс окисления по сравнению с условиями окружающей среды.
Реакции, инициированные парами HCl, осуществляются путем помещения чашки Петри со свежим 36,5% -ным раствором HCl под каплю. Чашка достаточно большая, чтобы охватить всю площадь установки FIDI, так что каждая капля может подвергаться воздействию устойчивой и однородной среды паров HCl.
Благодарности
Эта работа была поддержана Институтом Бекмана в Калифорнийском технологическом институте и грантом NSF CHE-1508825.
 Ее достоинства очевидны: оперативность, точность и безвредность для пациента.
Ее достоинства очевидны: оперативность, точность и безвредность для пациента.