Метастазы в лимфоузлах | Прогноз, лечение
Метастазы в лимфоузлах при раке свидетельствуют о развитии злокачественного процесса до III или IV стадии. В процессе роста первичной опухоли от нее отделяются патологические клетки и попадают в лимфоток и кровеносные сосуды. В зависимости от того, лимфа или кровь стала путем распространения, это называется лимфогенным или гематогенным метастазированием. Сначала поражаются регионарные лимфоузлы — расположенные вблизи от опухоли. Позже раковые клетки могут мигрировать в отдаленные органы и, оставаясь там, провоцировать появление вторичных очагов.
Госпитализация онкологических больных. Ежедневно. Круглосуточно
Нам доверяют 9500 пациентов ежегодно.
До сих пор однозначно не выявлено, что служит спусковым крючком для агрессивного роста новообразования и его распространения на другие органы, но после появления метастазов в лимфоузлах прогноз по выживаемости заметно снижается.
На скорость роста метастатических опухолей влияют такие факторы, как разновидность, размеры, расположение первичного новообразования, возраст и состояние иммунитета больного, анамнез.
Поскольку первичные злокачественные опухоли на ранних стадиях не дают выраженной симптоматики, во многих случаях сначала диагностируется именно метастатическое поражение лимфатической системы, а уже потом определяется основной диагноз. По степени тяжести выделяют 3 стадии:
- легкая — 1–3 узла;
- средняя — 4–9;
- тяжелая — 10 и более.
Симптомы болезни:
- снижение иммунитета, частые простуды и т. д.;
- повышенная утомляемость, слабость;
- температура выше нормальной, на которую не влияют жаропонижающие средства;
- мигрени и невротические расстройства;
- увеличение лимфатических узлов в размерах, их болезненность.
Иванов Антон Александрович
Медицинский директор, врач онколог-хирург, к.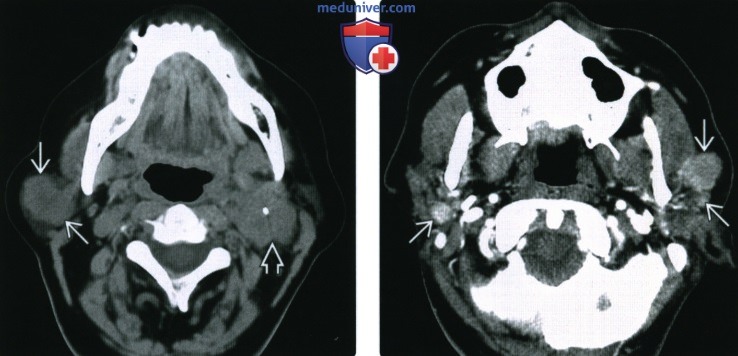 м.н
м.н
Связь лимфотока и локализации вторичных новообразований
На метастазирование влияет ход тока лимфы. Например, метастазы в лимфоузлах от опухолей легких и молочной железы — это в основном зона над ключицей, от крестца, ног и наружных половых органов — в паховой области. При опухолях языка, глотки, гортани, щитовидной железы обычно развиваются метастазы в лимфоузлах шеи. Однако на IV стадии это правило не работает, поскольку раковые клетки уже распространились по всему организму — новые раковые образования могут разрастаться в любом органе.
Учитывая интенсивность лимфотока в различных органах, метастазы в лимфоузлах чаще всего приводят к поражениям печени, легких, надпочечников. Подобные локализации свидетельствуют о терминальной стадии рака, в том время как регионарные лимфатические узлы могут поражаться и на третьей, когда шансы на восстановление выше.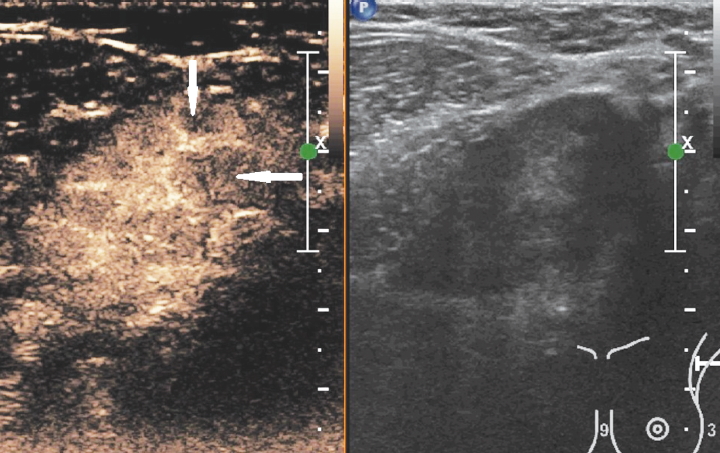
Метастазы в лимфоузлах — лечение и прогнозы
Для диагностики используют МРТ, КТ, биопсию и гистологические исследования лимфы. Делать это необходимо при первых же подозрениях на диагноз, чтобы при необходимости начать лечение как можно раньше.
Отправьте документы на почту [email protected]. Возможность проведения лечения рассмотрит главный врач клиники Антон Александрович Иванов, онколог-хирург, кмн
Одновременно с хирургическим удалением первичной опухоли обычно удаляют пораженные узлы. При этом делается все необходимое, чтобы раковые клетки не мигрировали в кровь. Как правило, используется и химиотерапия — препараты эффективно уничтожают агрессивные клетки или препятствуют их дальнейшему делению. Радиотерапия применяется реже, но позволяет уничтожить фрагменты опухолей, локализация которых хорошо определяется.
В каждом случае используемые методы определяются индивидуально. Клиника НАКФФ обладает всеми ресурсами, чтобы по возможности быстро и эффективно провести диагностические и лечебные мероприятия, организовать реабилитацию после лечения или оказать паллиативную помощь.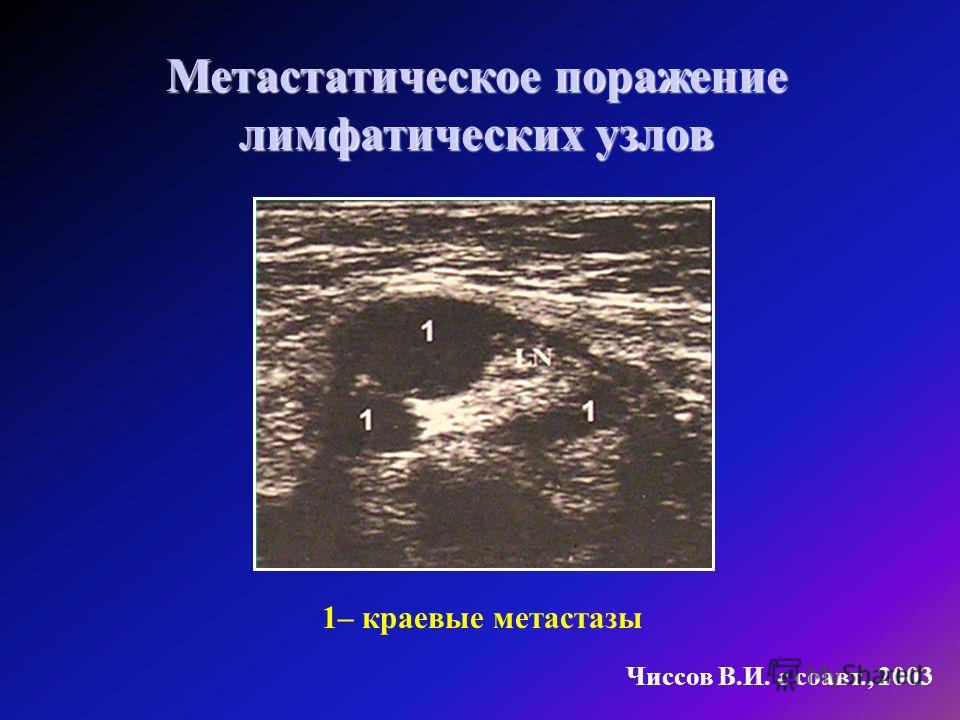 Запишитесь на первичную консультацию по телефону +7 (495) 259-44-44.
Запишитесь на первичную консультацию по телефону +7 (495) 259-44-44.
Метастазы в лимфоузлы брюшной полости, забрюшинного пространства и малого таза
Лимфоузлы брюшной полости и забрюшинного пространства и малого таза — лечение распространенного рака
В случае, если опухоль не была обнаружена на ранней стадии, она начинает свое распространение в другие части организма. Одной их наиболее частых «мишеней» метастазирования становятся лимфоузлы. При этом большинство злокачественных опухолей органов брюшной полости дают метастазы в близлежащие отделы лимфатической системы.
А это значит, что с высокой долей вероятности пациенту, одновременно с лечением первичной опухоли предстоит лечение метастазов в лимфоузлы брюшной полости, забрюшинного пространства и малого таза. В современных условиях тактика лечения предусматривает одновременное лечение первичной опухоли и метастазов в лимфоузлы КиберНожом (радиохирургия), либо хирургическое удаление пораженных лимфоузлов (если проводилось хирургическое лечение первичной опухоли), а также лучевую терапию пораженных лимфоузлов, либо тех, на которые с высокой долей вероятности мог распространиться опухолевый процесс.
Сочетанное лечение метастазов в лимфоузлы
Традиционно, локальное распространение клеток первичной опухоли в в близко расположенные лимфоузлы встречается довольно часто. В случае, если выбор методом радикального лечения была избрана хирургия, пациенту рекомендовано удаление близлежащих лимфоузлов. Если лимфоузлы поражены отдаленными метастазами (лимфогенное метастазирование), их хирургическое лечение (второе хирургическое вмешательство) может быть затруднено ввиду тяжести состояния пациента либо большого объема требуемого вмешательства.
В случае наличия множественных метастазов пациенту показана химиотерапия, а для лечения единичных метастазов в мировой практике широко применяется высокоточная лучевая терапия IMRT. Также, лучевая терапия комбинируется с хирургическим лечением первичной опухоли, после которого большинство мировых протоколов предусматривают облучение ложа удаленной опухоли и лимфоузлов.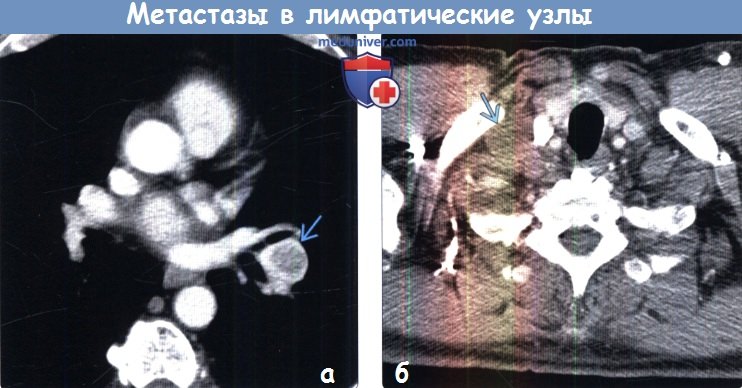
Метастазы в лимфоузлы брюшной полости и забрюшинного пространства, план лучевой терапии IMRT на современном линейном ускорителе
Лечение метастазов в лимфатическую систему на КиберНоже
Радиохирургическая система КиберНож — самый эффективный метод борьбы с метастазами рака
Во многих случаях для того, чтобы провести лечение метастазов в лимфоузлы не обязательно применять хирургическое вмешательство, которое связано с необходимостью проведения наркоза, повреждением здоровых тканей во время доступа к метастазу, а также восстановительным периодом на время заживления. Такой бескровной альтернативой традиционной хирургией является стереотаксическая радиохирургия, реализуемая на системе КиберНож.
Однозначной рекомендации том, что любой метастаз в лимфоузел подлежит лечению на КиберНоже, не существует. В ряде случаев лечение метастазов в лимфоузлы брюшной полости, забрюшинного пространства и малого таза большей эффективности можно добиться радикальным лечением на высокоточном линейном ускорителе (IMRT).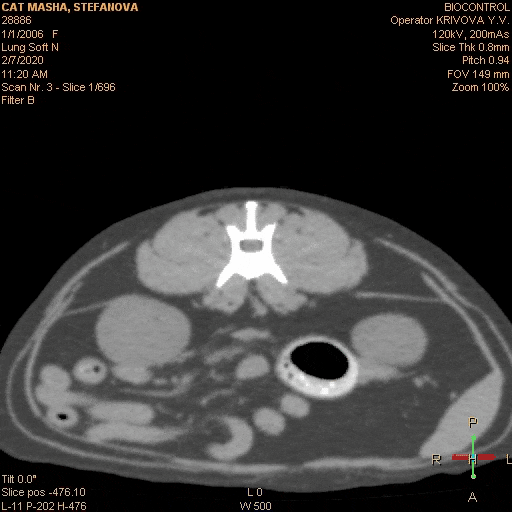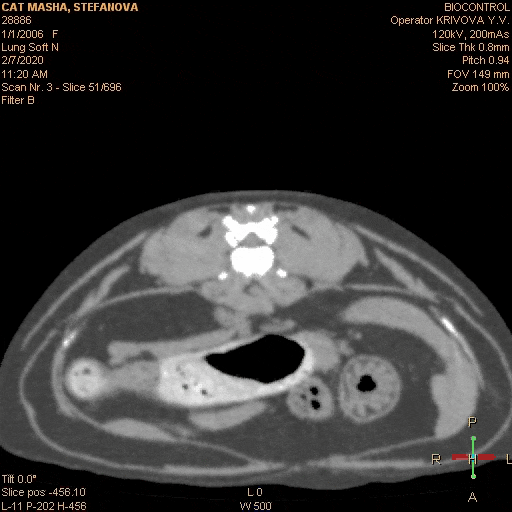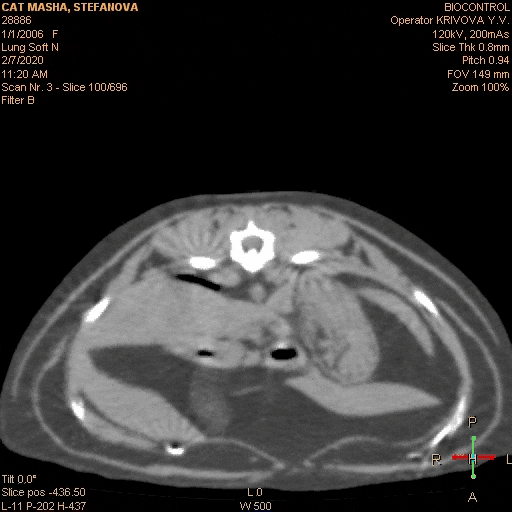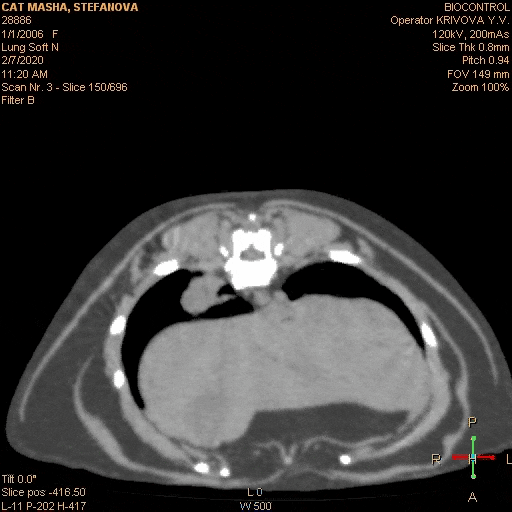 Поэтому, как и любое другие лечение, радиохирургия на КиберНоже для метастазов в лимфоузлы назначается после проведения междисциплинарного консилиума, на котором врачи различных специализаций рассматривают все аспекты конкретного случая с тем, чтобы определить максимально эффективную схему лечения.
Поэтому, как и любое другие лечение, радиохирургия на КиберНоже для метастазов в лимфоузлы назначается после проведения междисциплинарного консилиума, на котором врачи различных специализаций рассматривают все аспекты конкретного случая с тем, чтобы определить максимально эффективную схему лечения.Если пациенту показана радиохирургия на КиберНоже, проводится предварительное планирование, во время которого на основание данных КТ- и МРТ-диагностики будет создана объемная модель взаимного расположения пораженного лимфатического узла, окружающих его здоровых тканей, а также будет учтены расположенные вблизи структуры организма, в которые недопустима подача ионизирующего излучения.
Во время каждого из сеансов лечения (фракций) КиберНож на основании плана лечения подаст множество одиночных пучков ионизирующего излучения, на пересечении которых будет сформирована зона высокой дозы, отвечающая форме и объему метастаза в лимфатический узел. Кроме того, лечение метастазов на КиберНоже может включаться в состав фракции (сеанса) по лечению первичной опухоли или других метастазов.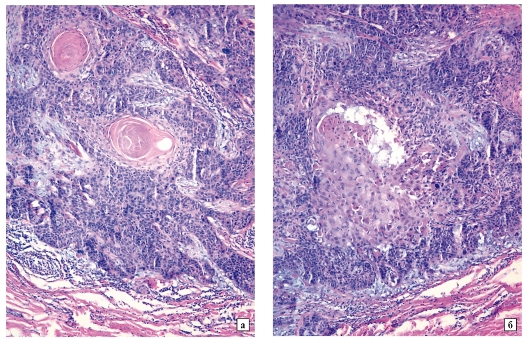
Как правило, стоимость лечения на КиберНоже ниже, чем при хирургическом вмешательстве, т.к. нет необходимости в наркозе и восстановительном периоде.
Диагностика
Компьютерная томография (КТ) не всегда позволяет дифференцировать метастазы и неизмененную ткань лимфатических узлов. Магнитно-резонансная томография (МРТ) имеет небольшое преимущество перед КТ, потому что МРТ позволяет с большей точностью определять стадию опухолевого процесса органов малого таза.
Что такое метастазы и откуда они берутся?
У значительного числа больных при росте опухоли, которая не получила достаточного или своевременного лечения, в близлежащих и удаленных органах появляются метастазы — вторичные опухолевые узлы. Лечение метастазов проходит легче, когда они имеют небольшие объемы, но микрометастазы и циркулирующие опухолевые клетки, часто не обнаруживаются доступными способами диагностики.
Метастазы могут возникать в виде единичных узлов (единичные метастазы), но могут быть и множественными.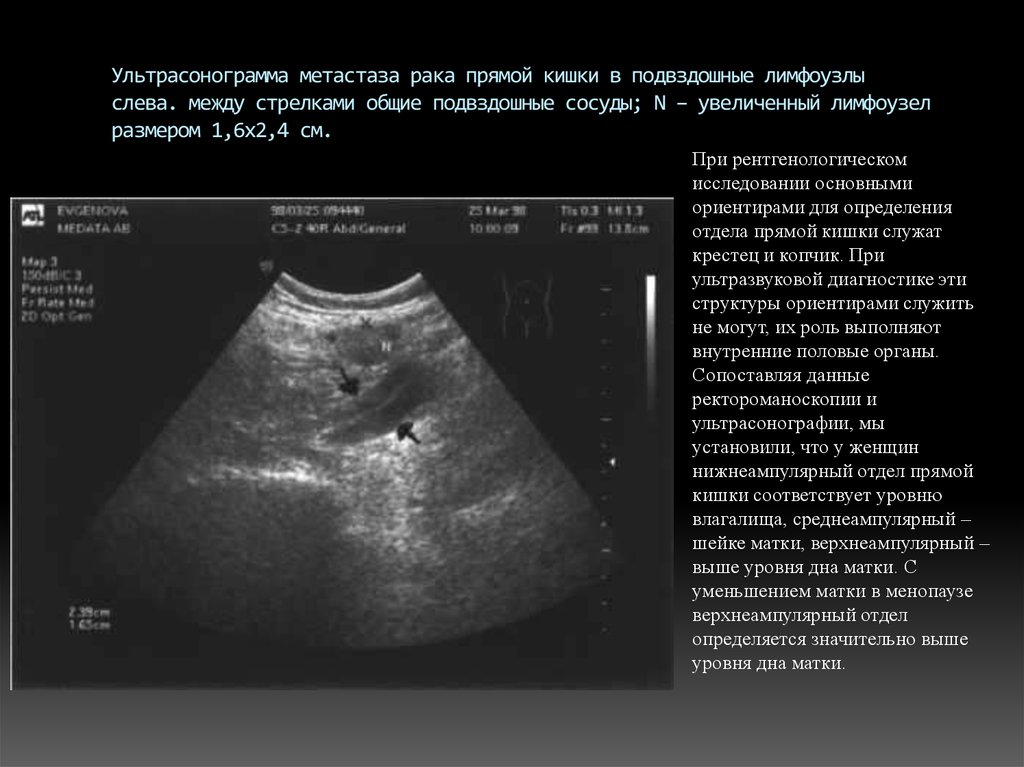 Это зависит от особенностей самой опухоли и стадии ее развития.
Это зависит от особенностей самой опухоли и стадии ее развития.
Различают следующие пути метастазирования раковых опухолей: лимфогенный, гематогенный и смешанный.
- гематогенные — когда раковые клетки, проникая в кровеносный сосуд, с током крови проходят в иные органы (легкие, печень, кости скелета и т.д.). Данным путем появляются метастазы от раковых опухолей лимфатической и кроветворной ткани, саркомы, гипернефромы, хорионэпителиомы.
Лимфатические узлы брюшной полости подразделяются на пристеночные и внутренностные:
- пристеночные (париетальные) узлы концентрируются в поясничной области.
 Среди них выделяют левые поясничные лимфатические узлы, к которым относятся латеральные аортальные, предаортальные и постаортальные узлы, промежуточные поясничные узлы, располагающиеся между воротной и нижней полой венами; и правые поясничные узлы, включающие в себя латеральные кавальные, предкавальные и посткавальные лимфатические узлы.
Среди них выделяют левые поясничные лимфатические узлы, к которым относятся латеральные аортальные, предаортальные и постаортальные узлы, промежуточные поясничные узлы, располагающиеся между воротной и нижней полой венами; и правые поясничные узлы, включающие в себя латеральные кавальные, предкавальные и посткавальные лимфатические узлы. - внутренностные (висцеральные) узлы располагаются в несколько рядов. Часть их располагается на пути лимфы от органов по ходу крупных внутренностных сосудов и их ветвей, остальные собираются в области ворот паренхиматозных органов и около полых органов.
Лимфа от желудка поступает в левые желудочные узлы, располагающиеся в области малой кривизны желудка; левые и правые желудочно-сальниковые узлы, залегающие в области большой кривизны желудка; печеночные узлы, следующие вдоль печеночных сосудов; панкреатические и селезеночные узлы, находящиеся в воротах селезенки; пилорические узлы, направляющиеся по ходу желудочно-двенадцатиперстно-кишечной артерии; и в кардиальные узлы, образующие лимфатическое кольцо кардии.
При раковых опухолях в брюшной полости (желудка) и полости малого таза (яичника) возникает диссеминация процесса по брюшине в форме мелких «пылевых» метастазов с развитием геморрагического выпота — асцита.
Метастатический рак яичника может возникать из любого органа, пораженного раком, но чаще всего наблюдается при раке желудка, откуда опухолевые клетки заносятся либо током крови, либо ретроградно по лимфатическим путям (опухоль Крукенберга). Метастатический рак яичника обладает быстрым ростом и более злокачественным течением. Чаще поражаются оба яичника. Опухоль рано переходит на брюшину малого таза, образуя множественные бугристые опухолевые узлы.
При метастазировании раков яичника в различные органы на первом месте стоят метастазы в брюшину, на втором месте – в забрюшинные лимфатические узлы, затем – большой сальник, подвздошные лимфатические узлы, печень, малый сальник, второй яичник, плевру и диафрагму, лимфатические узлы брыжейки, брыжейку топкой кишки, параметральную клетчатку, паховые лимфатические узлы, легкие, селезенку, матку, шейные лимфатические узлы, почки, надпочечники, пупок.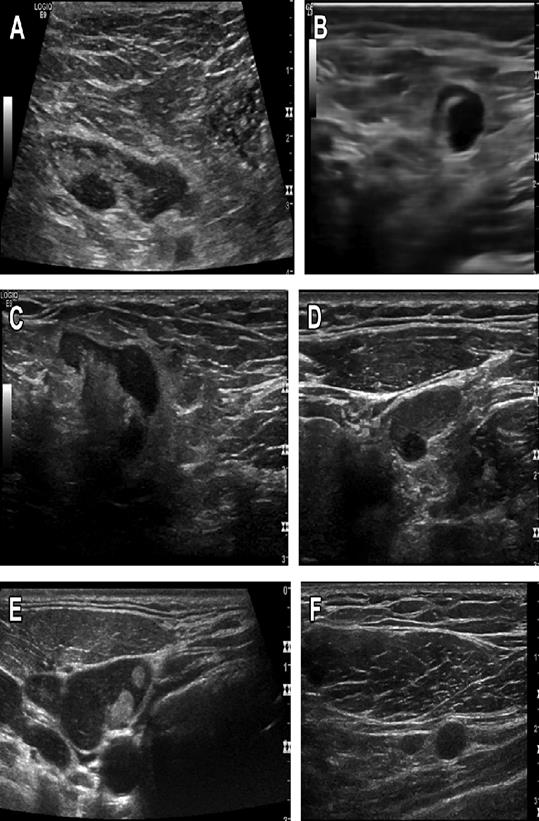
Метастазы – Лечение и диагностика в Киеве – Симптомы
Раковые клетки метастазируют гематогенным путем — через кровь
Метастазы (от греческого metástasis, перемещение) – это распространение опухолевых клеток из места возникновения (первичной опухоли) в другие отделы и органы организма пациента. Основных путей распространения метастазов два: по сосудам лимфатической системы (лимфогенное метастазирование) и по сосудам кровеносной системы (гематогенное метастазирование).
Метастазы — ни что иное, как раковые клетки, оторвавшиеся от первичной опухоли и начавшее свое “путешествие” по сосудам. Обычно опухоли дают метастазы на поздних стадиях, поэтому чрезвычайно важно определить, является ли выявленная опухоль первичной, либо следует внимательно изучить организм в поисках источника метастазирования.
Лечение метастазов
Метастазы рака, как и само заболевание, требуют лечения. Для этого применяются следующие методы:
Для этого применяются следующие методы:
Метод лечения метастазов, исходя из особенностей каждого заболевания, определяется консилиумом специалистов.
Среди методов терапии метастазов особого внимания заслуживает КиберНож. Это метод бескровной дистанционной радиохирургии признан “золотым стандартом” лечения и применяется в большинстве случаем распространенности онкологического процесса:
«Лечение метастазов рака на КиберНоже является неинвазивным, нетоксичным и безопасным воздействием на организм, которое дает возможность организму пациента восстановиться и набраться сил перед следующим этапом лечения опухолевого процесса», — Ирина Дионисьева, врач-радиолог высшей категории, более 25 лет в медицине.
КиберНож не предусматривает хирургического вмешательства, как при традиционном оперативном лечении метастазов. Радиохирургическая система осуществляет доставку высоких доз ионизирующего излучения точно в объем опухолевых клеток, позволяя за один-два сеанса удалить не только единичные но и множественные новообразования.
Механизмы злокачественного роста
Развитие рака начинается в тот момент, когда воспроизводится клетка с поврежденными генами. Впоследствии раковые клетки осуществляют неконтролируемое деление (ненормальный митоз), что приводит к быстрому увеличению скопления клеток, которое может быть обнаружено при обследовании пациента во время профилактического онкоскрининга. Совокупность раковых клеток в месте начала опухолевого процесса и является первичной опухолью. Дальнейший рост опухоли может приводить к ее прорастанию в окружающие ткани и органы. Такие прорастания принято называть локальными метастазами.
При продолжении опухолевого процесса наблюдается отрыв отдельных клеток с дальнейшим их распространением по кровотоку и лимфотоку, ввиду чего, при определенных условиях (сниженном общем или местном иммунитете), происходит развитие метастатических опухолей. У пациентов с хорошей сопротивляемостью организма занос опухолевых клеток в другие органы не приводит к развитию метастатического поражения.
Идентифицировать недифференцированные клетки при подозрении на наличие опухоли помогают методы биохимических и цитогенетических исследований.
Передвижение метастазов
Попадают опухолевые клетки в сосуды лимфатической и/или кровеносной систем после того, как целостность сосудов в их месте соприкосновения с опухолью нарушается.
Механизмы метастазирования опухолей
Если опухолевой клетке, циркулирующей в крови или лимфе, удается прикрепиться к стенке сосуда либо к органу, через который проходит сосуд, она проникает за пределы своего “транспортного коридора” и продолжает неконтролируемое размножение.
Таким образом формируется еще одна опухоль (вторичная, или метастатическая), которая может быть выявлена в процессе клинической диагностики. При детальном рассмотрении, тип клеток этой новой опухоли (метастаза) совпадает с типом клеток первичной опухоли. Таким образом, клетки метастаза по структуре и метаболизму, в большинстве случаев, соответствуют клеткам первичной опухоли. В некоторых случаях это помогает сделать лечение рака более эффективным — выявление неспецифичного для данной локализации типа опухоли служит сигналом для дальнейшего поиска первичного опухолевого очага.
В некоторых случаях это помогает сделать лечение рака более эффективным — выявление неспецифичного для данной локализации типа опухоли служит сигналом для дальнейшего поиска первичного опухолевого очага.
К примеру, рак молочной железы чаще всего метастазирует в легкие. Поэтому при обнаружении в легких опухоли, состоящей из аномальных клеток молочной железы, онколог обязан предпринять действия по обнаружению первичной опухоли.
Метастазирование — основной (но не единственный) признак злокачественности опухоли. Однако способность метастазировать у различных видов рака — различна. Например, из двух опухолей кожи меланома — крайне агрессивно метастазирует, а случаи метастазирования базалиомы (базальноклеточный рак кожи) — чрезвычайно редки.
Рецидивы и метастазы злокачественной опухоли — тяжелое осложнение, более опасное для жизни больного, чем первичная опухоль. Раннее выявление этих осложнений и специализированное лечение являются основным направлением борьбы за продолжительность жизни онкологических больных.
Особенности рецидивирования и метастазирования опухолей
Разнообразные клинические наблюдения и результаты статистических исследований доказали, что на частоту и особенности возникновения рецидивов и метастазирования, которые определяют прогноз болезни, влияют следующие факторы:
- Стадия опухоли на момент начала специализированного лечения
Теоретически, у пациентов, получивших радикальное лечение (хирургия или радиохирургия) на ПЕРВОЙ стадии заболевания, опухолевые клетки не проникли за пределы опухоли в сосуды лимфатической или кровеносной системы. А значит, нет причин ожидать метастазов или рецидива опухоли.
Метастазы в кожу, первичная опухоль — аденокарцинома желудка
Однако точной информации о том, не проникли ли единичные клетки в кровоток/лимфоток, в полном ли объеме была иссечена опухоль, в полный ли объем опухолевого поражения была осуществлена доставка радиохирургической дозы ионизирующего излучения от КиберНожа или Гамма Ножа, — нет.
Поэтому пациенты, получившие лечение на первой стадии рака подлежат обязательным осмотрам.
- Локализация опухоли
Современные методы лечения позволяют достичь эффективности лечения, например, (кроме меланомы), в 70-80 %. Этот же показатель у пациентов на первой стадии немеланомных раков кожи достигает 100%. При этом расположение (локализация) первичной опухоли оказывает влияние на только на частоту метастазирования, но и на те “цели”, в которые она “отправляет” метастазы.
Примеры метастазирования:
рак анального отдела прямой кишки — в паховые лимфатические узлы;
опухоли средне- и верхнеампулярных отделов кишечника — вверх по брыжейке и в лимфоузлы тазовой клетчатки;
рак простаты — в костную систему (таз, крестец, позвоночник).
Из-за особенностей анатомического строения каждого из органов даже размещение опухоли в определенной части является фактором влияния на прогноз распространения. К примеру, при развитии опухоли молочной железы во внутреннем квадранте прогноз может быть хуже, чем при локализации в наружном квадранте и т. д.
К примеру, при развитии опухоли молочной железы во внутреннем квадранте прогноз может быть хуже, чем при локализации в наружном квадранте и т. д.
- Форма опухолевого роста и гистологического строения опухоли
Поверхностные формы рака кожи растут медленно, многие годы не метастазируя. Опухоли инфильтративного типа растут быстро и рано дают метастазы. Неблагоприятные результаты лечения больных раком легкого отмечены при низкодифференцированных формах рака. Чрезвычайно активно метастазирует меланома. Экзофитные опухоли желудочно-кишечного тракта (полипообразный, грибовидный) менее злокачественны, чем инфильтративные формы рака этого же органа.
- Характер и объем радикального лечения
Прямое влияние на вероятность и характер метастазирования оказывает то, каким образом пациент получил лечение первичной опухоли. Современная онкология многократно доказала, что наибольшего эффекта (в том числе снизить частоту рецидивов и метастазирования) удается добиться при проведении сочетанного лечения, при котором используется комбинация методов: хирургии, радиохирургии (КиберНож, Гамма Нож), химиотерапии, таргетного лечения и др.
- Возраст пациентов
Рост опухоли и метастазирование у более молодых людей, в сравнении с более пожилыми пациентами, протекает аналогично другим биологическим процессам — быстрее и интенсивнее.
Пути метастазирования
Основных путей метастазирования (путей распространения опухолевых клеток от первичной опухоли в другие части организма) — два.
Типичные пути метастазирования опухолей
Лимфогенный путь — перенос клеток опухоли, проросшей сквозь стенку лимфатического сосуда, с током лимфы в регионарные (близлежащие) лимфоузлы или отдаленные лимфоузлы.
Наиболее часто метастазируют лимфогенным путем такие опухоли как:
Гематогенный путь метастазирования — перенос опухолевых клеток от первичной опухоли с кровотоком. Мишенью таких метастазов становятся легкие, печень и кости. Наиболее часто гематогенным путем метастазируют следующие виды опухолей:
- злокачественные опухоли лимфатической и кроветворной ткани,
- саркома,
- гипернефрома,
- хорионэпителиома.

При этом наиболее часто регистрируемые опухоли (рак легких и бронхов, рак молочной железы, рак щитовидной железы, рак яичников) с одинаковой интенсивностью распространяют метастазы как гематогенным, так и лимфогенным путем.
Также одним из проявлений метастазирования опухолей брюшной полости (рак желудка) и полости малого таза (рак яичника) является диссеминация процесса по брюшине в виде мелких «пылевых» метастазов с развитием асцита — геморрагического выпота.
Рак брюшины — наличие раковых клеток, рассеянных метастазами по брюшине. На фото можно увидеть тонкую кишку, покрытую блестящей брюшиной с несколькими небольшими розовыми имплантациями раковых клеток (обозначены синей стрелкой)
Наиболее предсказуемым является лимфогенное метастазирование, которое является и наиболее изученным, регионарные метастазы в лимфоузлы являются одним из основных объектов диагностики в каждом из случаев. Это позволяет выявлять метастазы в лимфоузлы раньше, а лечить — эффективнее.
Это позволяет выявлять метастазы в лимфоузлы раньше, а лечить — эффективнее.
Лимфогенные метастазы
Основной “мишенью” метастазирования является область шеи, вернее, лимфоузлы шеи, через которые проходит лимфоток как от верхней части организма (голова, органы грудной полости, верхние конечности), так и от структур и органов нижней половины тела человека (органов брюшной полости, туловища, нижних конечностей).
Типичные пути метастазирования
Ввиду особенностей топографии лимфатической системы, наиболее частыми “маршрутами” лимфогенного метастазирования являются следующие:
- рак нижней губы, передних отделов языка и полости рта, верхней челюсти метастазирует, прежде всего, в подбородочные и подчелюстные лимфатические узлы;
- опухоли задних отделов языка, дна полости рта, глотки, гортани, щитовидной железы — в лимфатические узлы по ходу сосудисто-нервного пучка шеи;
- рак легких и рак молочной железы метастазирует в надключичную область, в лимфоузлы, расположенные снаружи от грудинно-ключично-сосцевидной мышцы.

Грибовидный метастаз рака легких в кожу плеча
- рак органов брюшной полости метастазирует в надключичную область, в лимфатические узлы, расположенные внутрь от грудино-ключично-сосцевидной мышцы, между и позади ее ножек
- метастазы рака желудка распространяются настолько показательно, что метастазы в каждую из мишеней имеют свою классификацию в зависимости от “мишени”: метастазы в лимфоузлы левую надключичную область (метастазы Вирхова, вирховские узлы), в лимфоузлы тазовой области (метастазы Шницлера, шницлеровские узлы), лимфоузлы подмышечной области (метастазы Айриша), метастаз в яичники (метастаз Крукенберга), в пупок (метастаз сестры Марии Джозеф)
Рак правого яичника (1) с метастазами в брюшной полости: метастазы в кишечнике (2), метастазы диафрагмы (3) и сальника (4)
Второе место по частоте сосредоточения лимфоузлов, в которые направляются метастазы, — подмышечная область. Их исследование требуется при наличии у пациента рака молочной железы, рака кожи туловища и верхних конечностей (в том числе, меланомы).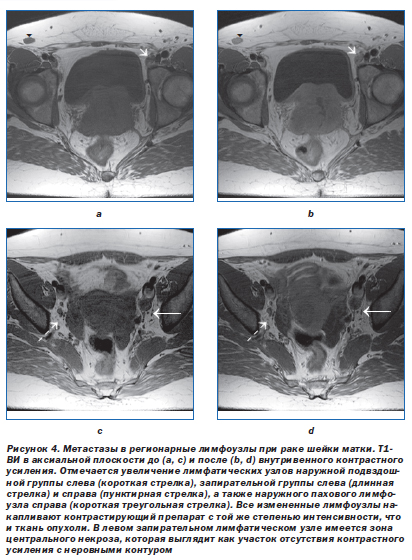
Метастазы в лимфоузлы паховой области дают злокачественные опухоли наружных половых органов, нижних конечностей, крестцово-ягодичной области.
Гематогенные метастазы
В отличие от лимфогенных, гематогенные метастазы чаще бывают множественными и располагаются на значительном удалении от первичной опухоли. Наиболее частые источники гематогенных метастазов в легких — злокачественные опухоли яичника, рак молочной железы, рак почек, остеосаркомы и саркомы мягких тканей. В печень часто метастазируют рак желудка и поджелудочной железы, рак прямой кишки, рак легкого, рак почек.
Признаки (симптомы) метастазов:
Для метастазов в различные “мишени” существуют характерные признаки, по которым врач или сам пациент могут определить наличие процесса метастазирования:
- лимфоузлы: лимфаденопатия;
- легкие : кашель, кровохарканье и одышка;
- печень: гепатомегалия (увеличение печени), тошнота и желтуха;
- кости: боль в костях, переломы пострадавших костей;
- головной мозг: неврологические симптомы, такие симптомы как головные боли, припадки и головокружение возникают позже.

И наоборот, метастазами в отдельные “органы-мишени” характеризуются группы локализаций, в которых с высокой вероятностью развивается первичная опухоль:
- сдавливание гортанного нерва (хриплая речь, шепот, изменение голоса) может свидетельствовать о первичной опухоли пищевода, щитовидной железы, легкого;
- боли в позвоночнике, костях таза и трубчатых костях — могут быть признаками метастазов рака молочной железы, щитовидной железы, простаты, рака легкого.
Рецидив опухоли
При наблюдении пациентов, получивших лечение по поводу злокачественного новообразования, следует обращать внимание не только на развитие возможных метастазов, но и на рецидив заболевания — возобновление роста из клеток опухоли, оставшихся после хирургического лечения или после лучевого лечения. Рецидив может начаться из одиночной опухолевой клетки. Как правило, рецидивы возникают после проведения радикального лечения, при котором применялись устаревшие технологии лучевого лечения (например, лучевая терапия без визуализации расположения опухолей и зон различных подводимых доз), хирургического вмешательства, выполненного в сокращенном объеме из-за особенностей расположения опухоли либо состояния пациента. Однако случаи, когда рецидив опухоли происходит из нескольких первичных очагов, расположенных в разных отделах одного органа (первичная множественность) — также встречаются.
Однако случаи, когда рецидив опухоли происходит из нескольких первичных очагов, расположенных в разных отделах одного органа (первичная множественность) — также встречаются.
Одной из задач наблюдения после проведенного лечения и является выявление вероятного рецидива. Именно поэтому пациентам категорически не рекомендуется игнорировать назначенные визиты в медицинский центр. Методы определения вероятного рецидива аналогичны тем, что используются при постановке первичного диагноза.
Однако задача по своевременному выявлению рецидивов опухоли должна решаться не только лечащим врачом. Как правило, первым замечает ранее перенесенные симптомы сам пациент. К сожалению, психологический аспект, заключающийся в непринятии пациентов вероятности повторения заболевания и связанного с этим лечения, приводит к несвоевременному обращению к онкологу.
Важную роль в ранней диагностике возможного рецидива опухолевого заболевания имеет внимание членов семьи, друзей и родственников пациента, получившего радикальное лечение. Такие симптомы, как слабость, увеличение лимфоузлов, местная болезненность, психические нарушения, депрессия и т.д. являются сигналом к внеплановому визиту к онкологу и проведению соответствующего обследования. Тем более, что многие опухоли и их метастазы имеют ряд характерных симптомов, например, отечность верхних конечностей у пациентки после лечения рака груди может быть связан не только с рубцеванием тканей подмышечной области после проведенной операции, но и симптомов роста метастазов в подмышечных лимфоузлах, лимфостаз в нижних конечностях у пациентки после радикального лечения рака шейки матки также может свидетельствовать о рецидиве заболевания или наличии метастазов.
Такие симптомы, как слабость, увеличение лимфоузлов, местная болезненность, психические нарушения, депрессия и т.д. являются сигналом к внеплановому визиту к онкологу и проведению соответствующего обследования. Тем более, что многие опухоли и их метастазы имеют ряд характерных симптомов, например, отечность верхних конечностей у пациентки после лечения рака груди может быть связан не только с рубцеванием тканей подмышечной области после проведенной операции, но и симптомов роста метастазов в подмышечных лимфоузлах, лимфостаз в нижних конечностях у пациентки после радикального лечения рака шейки матки также может свидетельствовать о рецидиве заболевания или наличии метастазов.
Реабилитация пациентов после лечения метастазов и рецидивов
Реабилитация пациента после лечения злокачественных опухолей — важная составляющая комплексной онкологической помощи. Правильная разработка и реализация плана по физиологической и психологической реабилитации — эта задача должна решаться одновременно с окончанием этапа лечения и началом наблюдения на предмет выявления возможных рецидивов или метастазов.
«Метастазы в лимфоузлах» – Яндекс.Кью
Метастазы — это вторичные опухолевые образования, которые возникают в результате рассеивания злокачественных клеток из первичных очагов. Они могут распространяться по всему организму, поражая практически любой орган. Однако в подавляющем большинстве случаев первые метастазы обнаруживаются в лимфоузлах.
Причины метастазирования в лимфоузлы
Механизмы возникновения метастазов до конца не ясны. Известно, что в данном процессе играет роль активация у злокачественных клеток способности к миграции и структурная перестройка кровеносных и лимфатических сосудов, питающих и окружающих опухоль — в них отсутствует базальная мембрана и перициты. Некоторые капилляры даже образованы непосредственно опухолевыми клетками. Таким образом, злокачественные клетки попадают в лимфатические сосуды и по ним достигают ближайших лимфатических узлов.
Способность рака к метастазированию определяется несколькими факторами:
- Степенью злокачественности рака.
 Чем менее дифференцированы клетки опухоли, тем она агрессивнее и тем раньше начинает метастазировать.
Чем менее дифференцированы клетки опухоли, тем она агрессивнее и тем раньше начинает метастазировать. - Гистологическим типом опухоли. Чаще всего лимфогенным путем метастазируют карциномы — злокачественные новообразования, происходящие из эпителиальной ткани.
- Возрастом пациента. У молодых людей метастазы при одних и тех же опухолях в среднем появляются раньше, чем у людей пожилого возраста. Это связывают с особенностями кровообращения и активностью иммунной системы.
Ускорить процесс метастазирования могут тепловые процедуры и физиопроцедуры на область локализации новообразования, а также несоблюдение правил абластики при удалении опухоли. Последний момент очень важен при хирургическом лечении рака, поэтому онкологические операции должны выполняться в специализированных стационарах, в которых есть определенные условия для проведения подобных вмешательств и квалифицированный персонал.
Пути распространения
Сначала поражаются регионарные лимфоузлы, т. е. те, которые расположены ближе всего к первичному опухолевому очагу. На какое-то время они сдерживают дальнейшее распространение, но злокачественные клетки прорываются через этот барьер и распространяются на отдаленные группы лимфоузлов. Там они также на какое-то время блокируются, но затем идут дальше, распространяясь до другим группам лимфатических узлов, внутренним органам и даже костям и костному мозгу.
е. те, которые расположены ближе всего к первичному опухолевому очагу. На какое-то время они сдерживают дальнейшее распространение, но злокачественные клетки прорываются через этот барьер и распространяются на отдаленные группы лимфоузлов. Там они также на какое-то время блокируются, но затем идут дальше, распространяясь до другим группам лимфатических узлов, внутренним органам и даже костям и костному мозгу.
На какие виды рака указывает наличие метастазов в лимфоузлах
Как мы уже говорили, в лимфоузлы чаще всего метастазируют опухоли эпителиального происхождения, т. е. карцинома. Саркомы (злокачественные опухоли из соединительной ткани) чаще метастазируют гематогенным путем, т. е. с током крови. Однако и лимфогенный путь также имеет место быть.
Также лимфоузлы поражаются при лейкозах (раке крови) и лимфомах (рак лимфатической системы). В последнем случае количество групп пораженных лимфоузлов играет решающее значение для определения стадии заболевания.
Для определения вида опухоли потребуется гистологическое исследование измененных узлов. Только после этого можно говорить об определенном диагнозе. Но бывают случаи, когда имеются метастазы, в том числе и множественные, но первичный очаг выявить не удается даже с использованием самых современных методов исследования. В этом случае диагноз так и звучит — метастатическое поражение из невыясненного первичного источника.
Как проявляются метастазы в лимфоузлах
Главным клиническим симптомом метастатического поражения лимфоузлов является их увеличение. Это неспецифическое проявление, которое может развиваться при воспалительных заболеваниях, некоторых инфекциях, лимфоаденопатиях, аутоиммунных патологиях и др. Если лимфоузлы располагаются поверхностно, их можно пропальпировать. При раке они, как правило, имеют мягкую консистенцию и безболезненны на ощупь.
Если происходит увеличение глубоко расположенных лимфоузлов, они могут сдавливать внутренние органы, нарушать их работу и вызывать боль. Симптоматика в этом случае будет зависеть от локализации пораженных лимфоузлов. Узлы ворот печени могут сдавливать воротную вену, приводя к развитию портальной гипертензии. Поражение лимфоузлов брыжейки может вызвать нарушение работы кишечника, внутригрудных — одышку и нарушение работы сердца.
Симптоматика в этом случае будет зависеть от локализации пораженных лимфоузлов. Узлы ворот печени могут сдавливать воротную вену, приводя к развитию портальной гипертензии. Поражение лимфоузлов брыжейки может вызвать нарушение работы кишечника, внутригрудных — одышку и нарушение работы сердца.
Диагностика метастатического поражения лимфоузлов
При обнаружении злокачественных опухолей обязательно проводится исследование регионарных и отдаленных лимфатических узлов. С этой целью применяются инструментальные и лабораторные методы:
- Ультразвуковое исследование.
- Компьютерная томография.
- Магнитно-резонансная томография.
- Контрастная лимфоангиография.
- Эндоскопические методы исследования — с помощью специальной оптической техники производится осмотр внутренних полостей и органов.
Одним из самых перспективных методов обнаружения метастазов является ПЭТ-КТ. В основе метода лежит внутривенное введение короткоживущих изотопов, которые сильнее всего накапливаются в зонах активного метаболизма, коими являются злокачественные новообразования. Таким способом можно диагностировать даже микрометастазы размером всего несколько миллиметров, которые невозможно детектировать другими методами исследования.
Таким способом можно диагностировать даже микрометастазы размером всего несколько миллиметров, которые невозможно детектировать другими методами исследования.
После обнаружения подозрительных лимфоузлов, их пунктируют или проводят биопсию. Полученный материал отправляют в лабораторию на гистологическое или цитологическое исследование. Только после лабораторного подтверждения можно достоверно говорить о наличии метастазов.
Как лечат метастазы в лимфоузлах
Тактика лечения метастазов выбирается индивидуально, с учетом следующих аспектов:
- Органная принадлежность новообразования и ее гистологический вариант.
- Молекулярно-генетические особенности рака.
- Чувствительность к тому или иному методу лечения.
- Количество метастазов, их локализация и размеры.
- Общее состояние больного.
В качестве лечения могут применяться как стандартные противоопухолевые методы, так и самые современные разработки:
- Химиотерапия.

- Радиотерапия.
- Хирургические лечение.
- Таргетная терапия.
- Иммунотерапия.
- Гормонотерапия.
Хирургическое удаление лимфатических узлов называется лимфаденэктомией. Такие операции могут проводиться превентивно, при первичном удалении опухоли с высоким риском распространения по лимфатической системе, например, при раке яичников. В других случаях лимфоузлы удаляются после подтверждения их метастатического поражения. Например, проводят биопсию сторожевого лимфоузла, и если результат положительный, проводят лимфаденэктомию.
Другим методом борьбы с метастазами является химиотерапия. Она оказывает системное влияние на организм и повсеместно уничтожает раковые клетки, даже в случае микрометастазов, которые невозможно диагностировать имеющимися на сегодняшний день методами исследования. Химиотерапия может быть назначена как самостоятельное лечение, так и в дополнение хирургическим операциям или лучевой терапии.
Следует отметить, что опухоль представляет собой гетерогенную группу клеток с мутациями различного типа. Химиопрепараты уничтожают их основную массу, но какая-то часть из них выживает и приобретает устойчивость к терапии первой линии. Из-за этого развивается рецидив или прогрессирование заболевания. В таком случае переходят к терапии второй и последующих линий, которые помимо цитостатиков могут содержать таргетные препараты (моноклональные антитела) и др. Они более прицельно действуют на молекулярные механизмы онкогенеза и если не приводят к выздоровлению, то на какое-то время сдерживают прогрессирование опухоли.
Химиопрепараты уничтожают их основную массу, но какая-то часть из них выживает и приобретает устойчивость к терапии первой линии. Из-за этого развивается рецидив или прогрессирование заболевания. В таком случае переходят к терапии второй и последующих линий, которые помимо цитостатиков могут содержать таргетные препараты (моноклональные антитела) и др. Они более прицельно действуют на молекулярные механизмы онкогенеза и если не приводят к выздоровлению, то на какое-то время сдерживают прогрессирование опухоли.
Некоторые злокачественные новообразования чувствительны к действию гормонов, которые в свою очередь стимулируют их рост и размножение. Если подавить этот механизм, опухоль не сможет активно развиваться, что на некоторое время сдержит ее рост. К таким новообразованиями относятся многие виды рака молочной железы. Проведение антигормональной терапии хоть и не излечивает больных, но продляет им жизнь на годы, а в некоторых случаях даже на десятки лет.
Лучевая терапия назначается для удаления метастазов радиочувствительных опухолей. В некоторых случаях она может заменять хирургические операции без ухудшения качества лечения и соответственно прогноза заболевания.
В некоторых случаях она может заменять хирургические операции без ухудшения качества лечения и соответственно прогноза заболевания.
Профилактика
Для рака с высоким риском лимфогенного метастазирования обязательно проводятся профилактические мероприятия. В одних случаях требуется превентивное удаление лимфоузлов, даже если нет данных за их поражение. В других — проводят их облучение. Также в большом количестве случаев назначается химиотерапия, которая призвана в максимальном объеме уничтожить распространившиеся по организму раковые клетки.
Если говорить о профилактике возникновения метастазов в лимфоузлах, то стоит отметить, что практически любая злокачественная опухоль рано или поздно метастазирует. Однако этому процессу способствуют такие процедуры, как массаж, прогревания и т.д. Таким образом, обнаружив у себя в организме новообразование, необходимо незамедлительно обратиться за специальной помощью, а не заниматься самолечением, которое может лишь усугубить ситуацию и ухудшить прогноз.
Запись на консультацию круглосуточно +7 (495) 255-53-51
Материал предоставлен www.euroonco.ru«Я чувствую себя бессмертной»: каково это — победить рак груди
Ежегодно, по данным ВОЗ, от рака груди во всем мире умирает около полумиллиона женщин. Чтобы обнаружить заболевание на ранней стадии, женщинам после 40 лет рекомендуют ежегодно делать маммографию. Елизавета Ангелевич рассказала «Афише Daily», как победила рак.
У моей мамы был рак молочной железы четыре года назад. Она сама обнаружила у себя опухоль — уплотнение в груди. Пошла к маммологу в Москве, и когда опасения подтвердились, сразу поехала в Германию. Я тогда жила в Англии, и она ничего не сказала мне о болезни, чтобы я не волновалась. Просто сообщила, что переезжает. Для нашей семьи в этом нет ничего особенного: мама жила в разных странах, много путешествовала по работе и для удовольствия. Но потом мама переписала на меня все наше имущество. Вот тут я запереживала. «Мама, что случилось?» — «Я заболела и плохо себя чувствую, мне тяжело сейчас следить за вещами, банковскими делами и работой, поэтому я на тебя все переписываю — сама разбирайся».
Но потом мама переписала на меня все наше имущество. Вот тут я запереживала. «Мама, что случилось?» — «Я заболела и плохо себя чувствую, мне тяжело сейчас следить за вещами, банковскими делами и работой, поэтому я на тебя все переписываю — сама разбирайся».
Поскольку эта болезнь у всех протекает по-разному, то понятие стадий врачи не применяют. Но можно сориентироваться: есть начальная стадия, когда опухоль до одного сантиметра, потом, когда больше, но еще без лимфоузлов. Потом вторая А — когда один лимфоузел задействован, вторая Б — это два или три лифмоузла. На третьей поражены все лимфоузлы вокруг. На четвертой появляются метастазы. У моей мамы было предметастазное состояние. У нее вся грудь была поражена.
Химиотерапия на нее так хорошо подействовала, что опухоль рассосалась. После первой операции ей удалили только маленький кусочек, где была опухоль. Молочную железу не трогали. Но потом на всякий случай решили сделать вторую операцию, и, чтобы рак не вернулся, удалили грудь и поставили импланты.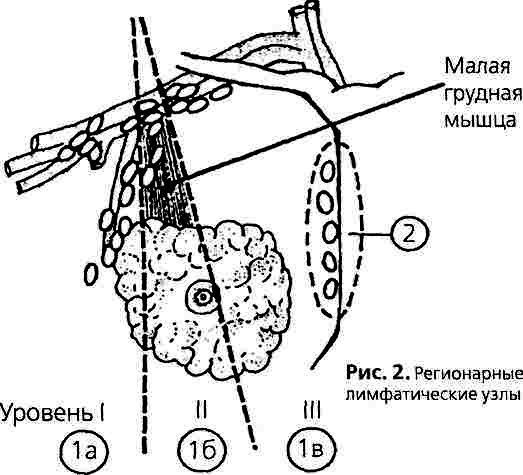 Мне кажется, что они сейчас такого хорошего качества, что и сам человек разницы не чувствует.
Мне кажется, что они сейчас такого хорошего качества, что и сам человек разницы не чувствует.
Моя мама выздоровела. До болезни она контролировала все: не дай бог выпить лишний бокал вина, не дай бог проспать тренировку в 7 утра. Она никогда себе не позволяла отступать от режима, съесть лишнего. Сейчас она совсем другая — намного раслабленнее и веселее, ей хочется везде ездить и все смотреть.
Диагноз
Мама начала гонять меня на регулярные обследования, и раз в полгода я делала УЗИ. Тогда мне это не нравилось, но теперь я думаю, что обследование надо проходить каждому человеку.
В прошлом году на одном из осмотров у меня нашли опухоль. Маленькую, где-то один сантиметр. Сделали биопсию — это когда шприцем протыкают грудь и берут пункцию из опухоли. В заключении, которое написала лаборатория, опухолевые клетки были, но при этом непонятно, какого типа. Мама подумала, что российская лаборатория ошиблась. Мы поехали в Германию. Сделали маммографию. Врач сказал, что в моем возрасте (тогда мне было 25 лет) невозможно, чтобы у меня был рак, а вот доброкачественные опухоли — норма. Мы расслабились и забыли об этом на два месяца.
Мы расслабились и забыли об этом на два месяца.
Когда говорят, что у вас рак, то первое чувство: внутри все опускается, мир рухнул. Но потом ничего. Я в этот же вечер сходила на свидание, чтобы отвлечься
В это время я планировала путешествие по миру — год копила деньги, нашла волонтерскую организацию, где должна была преподавать английский. За пять дней до вылета, когда я уже собрала чемодан, мама попросила приехать еще раз в Германию на обследование — для ее спокойствия. Опухоль уже разрослась, рак пошел в лимфоузлы. Врач сказал, что все выглядит очень плохо, — нужно лечиться.
Когда говорят, что у вас рак, то первое чувство: внутри все опускается, мир рухнул. Но потом ничего. Я в этот же вечер сходила на свидание, чтобы отвлечься. Прекрасно провела время. Потом, когда у меня уже выпали волосы, я сказала этому мальчику: «Прости, я не могу с тобой видеться, потому что у меня уже выпали волосы. Давай увидимся, когда отрастут». И мы с ним переписываемся раз в месяц, он спрашивает, в силе ли наше свидание.
Давай увидимся, когда отрастут». И мы с ним переписываемся раз в месяц, он спрашивает, в силе ли наше свидание.
Как лечат рак
Лечащий врач рассказал мне про наш план. Во всем мире есть только одна химия, которая применяется ко всем больным раком груди. Сперва раз в три недели так называемая EC — это тяжелая химия, ее нужно пройти четыре раза. Потом раз в неделю на протяжении трех месяцев — таксол. Это уже полегче. Потом делают операцию, закрепляют эффект радиацией. Но все зависит от результатов. Если химия не работает, то курс прерывается и тебе делают операцию, могут удалить грудь.
Первое, что мне нужно было сделать до начала терапии, — заморозить яйцеклетки, потому что после лечения был риск остаться бесплодной. Две недели я делала себе гормональные уколы в живот. Это не больно, но странно и страшно. Мои яйцеклетки — по ощущениям — росли: у меня живот раздулся, было неудобно ходить. Потом 15-минутная операция — и готово. После нее за один день я сдала все возможные анализы. Мне вводили контрастную жидкость и сканировали все тело, чтобы увидеть все раковые клетки и есть ли метастазы. Опухоль пометили металлическими скобами, чтобы затем следить, как она уменьшается, и чтобы, если она от химии рассосется, знать, какую часть ткани удалять на операции.
Мне вводили контрастную жидкость и сканировали все тело, чтобы увидеть все раковые клетки и есть ли метастазы. Опухоль пометили металлическими скобами, чтобы затем следить, как она уменьшается, и чтобы, если она от химии рассосется, знать, какую часть ткани удалять на операции.
Химия — это капельница, но ее вводят не в вену на руке, а через порт — пластиковую коробку в районе ключицы — в вену, которая идет к сердцу. Во время каждой процедуры кожу протыкают специальной иглой, в которую уже вставляют капельницу. Поэтому следующим этапом мне установили порт. Это тоже операция, под местным наркозом. Тебя отгораживают ширмочкой, чтобы ты не смотрел и не боялся, но разговаривать с врачом можно. Он тебе рассказывает: «Вот я тебя разрезаю, вот ищу вену к сердцу. О, нашел! Вставляю трубку». А тебе правда очень хочется говорить, потому что под наркозом кажется, что все классно, проблем не существует, — великолепно просто.
На следующий день ты уже приходишь на первую химию. Таким образом от диагноза до лечения проходит около трех недель, но в клинике стараются сделать все максимально быстро. У нас даже было так, что для выставления счета мне не хватало одной бумажки, но это не повлияло на начало лечения: принесите, когда хотите, заплатите, когда можете. Немцы вообще не требуют бумаг и доказательств — всегда идут навстречу. К примеру, я получала вид на жительство. Объяснила сотруднику, что мне нужно лечение. Он воспринял это по-товарищески: «Ой, ты бедная, давай я сбегаю соберу все бумаги, поскольку ты не говоришь по-немецки я сам тебе все оформлю, я за тебя позвоню во все учреждения и все сделаю». И так было во всем.
У нас даже было так, что для выставления счета мне не хватало одной бумажки, но это не повлияло на начало лечения: принесите, когда хотите, заплатите, когда можете. Немцы вообще не требуют бумаг и доказательств — всегда идут навстречу. К примеру, я получала вид на жительство. Объяснила сотруднику, что мне нужно лечение. Он воспринял это по-товарищески: «Ой, ты бедная, давай я сбегаю соберу все бумаги, поскольку ты не говоришь по-немецки я сам тебе все оформлю, я за тебя позвоню во все учреждения и все сделаю». И так было во всем.
Германию мы выбрали еще и потому, что, как ни странно, с израильским паспортом здесь дешевле, чем в Израиле. Все лечение стоило в пределах 5 тысяч евро, я себе на поездку и то больше отложила. Деньги у нас были. Уложиться можно было бы тысяч в 20 евро — достаточно машину продать.
Подробности по теме
«Я вообще перестал бояться»: как московский татуировщик борется с лимфомой
«Я вообще перестал бояться»: как московский татуировщик борется с лимфомойХимиотерапия
За сутки до химии нельзя есть. Считается, что так меньше будет тошнить. Хотя теоретически единственное, чего нельзя во время лечения, — грейпфрутовый сок (я не знаю почему), все остальное — по самочувствию. Хочешь кури, хочешь пей — все что хочешь. Просто ничего особенно и не хочется.
Зона, куда все приходят на химиотерапию, похожа на спа: большие кресла, свечи и аромолампы. Пациентки собираются примерно в одно и то же время, все в хорошем настроении, потому что каждая химия — это минус один пункт в плане лечения, это ближе к выздоровлению.
Девчонки, в основном, правда, всем по 50–60 лет, обсуждают, у кого какие симптомы и кто как себя чувствует. Если сидеть не хочется, то можно гулять с капельницей по всей больнице. Да, немножко подташнивает и голова мутная, но ничего сверхъестественного или ужасного.
Чтобы у меня не выпадали волосы, я решила во время химиотерапии делать «охлаждающую шапку». Это новая технология, ей всего два года. Шапка большая и подсоединена ко всяким датчикам, так что с ней уже не погуляешь. Ее надеваешь за полчаса до химии и снимаешь через два часа после ее окончания, то есть где-то семь часов ты сидишь в ней. Это самое ужасное. В ней адски холодно, прям так холодно, что это хуже любой боли, вообще чего-либо: нельзя побегать или попрыгать, чтобы согреться. Ты сидишь и замерзаешь. Я сделала две процедуры, и у меня все равно выпали волосы. Моей подруге шапка, правда, помогла, но и она больше шести раз не выдержала.
Через два часа после EC, когда уже пришел домой, тебе становится нереально плохо. Ужасная тошнота, но тебя не рвет, сильно болят голова и мышцы, обезболивание не действует. Заснуть не можешь. Но через несколько дней все проходит.
Через неделю начинается как бы менопауза. Организм считает, что он умирает, и отбрасывает все ненужные функции — репродуктивную в первую очередь. Случаются приливы: когда тебе сперва нереально жарко, потом нереально холодно. Это достает.
После EC начался курс таксола. Его капают раз в неделю. Я пришла в клинику, приготовившись, что вот сейчас, как обычно, после процедуры мне станет плохо. Но не стало. Тошноты никакой, напротив, хочется есть и спать. После первого таксола я проспала сутки, но потом привыкла и спала как нормальный человек.
Меня все время тянуло на хлеб и сладкое. Голод жуткий, но есть можно сразу на химии — и все так и делают. В итоге за EC я потеряла 10 кг, а на таксоле их набрала.
Нормальная жизнь
Моя мама считает, что человек обязан радоваться всему и делать то, что нужно делать. Мы с мамой друзья, но при этом мне не нужна ее поддержка. Мне вообще не нужна поддержка — я и сама нормально справляюсь. Я всегда рада видеть своих друзей, очень их люблю — ко мне почти каждые выходные кто-то приезжал. Но мне не нужно, чтобы кто-то рядом со мной сидел, смотрел в глаза и за руку держал. Мне нужно, чтобы меня развлекли, ну в бар сводили, например.
Я много занимаюсь спортом, и химиотерапия никак на тренировки не повлияла
Когда лечишься, ты не думаешь постоянно: «О боже! У меня рак!» Нет, ты живешь своей обычной жизнью, просто время от времени приходишь на процедуры. Это входит в привычку.
Лечиться я начала в октябре, а с ноября пошла на курсы немецкого — так что четыре часа в день я учу язык. Дневник тоже веду на немецком, чтобы практиковаться.
Я много занимаюсь спортом, и химиотерапия никак на тренировки не повлияла. Сейчас я увлекаюсь кроссфитом. Тренеры все знают, что я делаю химию, но если бы я не сказала — никто бы и не заметил. С мышцами ничего не происходит, можешь быстрее уставать, если целый день по городу гуляешь, но ты не немощный, тебе не хочется лежать целый день. Просто мне обычно хотелось спать не в 11, а в 9 вечера.
До химии я не думала, что волосы — это важно. Подумаешь, заново отрастут. Когда они выпали, я даже обрадовалась — хоть в охлаждающей шапке мучиться не буду, с прической возиться не надо: надел шапку или платок — и хорошо. Но через какое-то время стало тяжело.
Например, когда мужчины перестали смотреть на меня как на женщину. Я привыкла, например, что прихожу в кафе, а там официант молодой. Я ему говорю: «А принесите мне это». А он мне: «Да, я принесу вам это побыстрее и еще дам конфетку к кофе». Я не специально, я так общаюсь. А теперь заигрываешь, а обратной реакции никакой. Обидно.
Я все время ходила в шапке и чувствовала, что люди смотрят и думают: «Почему ты в шапке?» Парик я купила только месяц назад, потрясающая вещь. Раньше о нем не подумала только потому, что мама сказала, что он жаркий и не удобный.
Тяжелее, чем волосы, отсутствие бровей и ресниц. Брови я все время крашу. Без них или если вообще смыть макияж, я становлюсь похожа на… как-будто у меня рак.
За время лечения я путешествовала только два раза. На рождество ездила к другу в Ганновер. Это далось с трудом, для путешествий ты все-таки очень уставший. На Новый год я хотела поехать в Мюнхен. Но мне сказали, чтобы я дома сидела, потому что уровень лейкоцитов — иммунных клеток — был очень низким и высок риск подхватить любую болезнь. Я позвонила другу: «Вот как мне плохо. Я одна на Новый год, все поедут в Мюнхен, а я нет». Он приехал на следующий день, но первое, что сказал: «Я так болен, пойду в аптеку, куплю ингалятор». Естественно, я заразилась.
Болеть раком очень странно. Вообще-то, ты знаешь, как ты болеешь, ты болел сто раз за свою жизнь — ты знаешь, что насморк проходит за пару дней. А тут проходит неделя, а насморк как в первый день.
Еще меняются вкус еды и запахи. Некоторые продукты перестаешь любить. Мне кажется, мозг просто какие-то странные фокусы вытворяет: на химии попила как-то фруктовый чай, после этого не переношу клубнику. То же было с имбирем или мамиными любимыми духами, которыми я тоже раньше душилась.
Выздоровление
Операцию мне делала та же врач, что и маме. За день до нее я сдала все анализы, меня снова просвечивали после введения контрастной жидкости и еще вставили проволоку в лимфоузел, чтобы во время операции найти путь к опухоли. Проволока торчала из-под мышки — это было неудобно.
Когда меня вывезли на каталке в коридор, каждая медсестра из тех, что сидят на химиотерапии (их всего 10–15 человек), подошла, обняла и пожелала удачи. В больнице в Германии вообще все постоянно обнимаются.
После операции ко мне пришла вся спортивная группа, с которой я занималась, чтобы поддержать. А аптекарь, у которого я покупала обезболивающее, вместе с заказом прислал цветы. Одноклассники из Москвы записали видео с песнями и танцами.
После операции я должна приходить на УЗИ раз в месяц. Сейчас у меня курс радиации — ее делают каждый день по пять минут на протяжении шести недель. Она закрепляет эффект химии. У радиации нет никаких побочных эффектов, но сильно устаешь.
После того как все закончится, мне нужно будет в течение пяти-десяти лет пить противораковое лекарство, чтобы рак не вернулся. Я буду участвовать в эксперименте по тестированию нового препарата, и есть 50%-ная вероятность, что мне будут давать плацебо.
Я снова здорова и теперь чувствую себя бессмертной. Хочу преподавать английский и работать в детском саду.
Удаление лимфоузлов подмышечной области — хирургическое лечение в Днепре в стационарном отделении Garvis
Лимфатические узлы – так называемые скопления лимфатических тканей, которые разбросаны по всему телу, главной функцией которых является фильтр лимфы и накапливание элементов иммунной системы, предназначенных для борьбы с возбудителями болезней.
В лимфатических узлах, к сожалению, могут фиксироваться как микробы, так и клетки рака. Для оценки стадии раковой опухоли очень важно изучение лимфатических узлов на наличие данных клеток.
Причины удаления лимфоузлов при раке молочной железы
При раке груди, хирурги-онкологи пристальное внимание уделяют следующим типам лимфатических узлов:
- шейные узлы, надключичные и подключичные узлы;
- лимфоузлы подмышечной области.
Подмышечные лимфатические узлы характеризуются сбором лимфы от некоторой части грудной области, от молочных желез, верхних конечностей и плеча, а также от некоторых отделов брюшной полости.
Если говорить о злокачественных опухолях молочных желез, то лимфоузлы увеличиваются лишь в том случае, когда клетки рака отталкиваются от первоначального места возникновения и попадают в узел. Защитные силы организма с помощью лимфоузлов пытаются остановить процесс выхода раковых клеток дальше по телу.
Увеличение подмышечных лимфоузлов – признак, говорящий о том, что опухолевый процесс распространяется.
Раковая опухоль молочных желез, метастазируя, первым делом распространяется по лимфатическим сосудам. Иммунная система распознает их как чужеродные, и, всеми силами, пытается с ними бороться. Если злокачественных элементов сосредотачивается большое количество, иммунитет оказывается подавлен, и тогда раковые клетки приступают к активному размножению. Так появляется метастаз, который необходимо удалить, чтобы остановить распространение злокачественной опухоли.
В ситуациях инвазивного рака груди достаточно часто проводится удаление некоторых подмышечных лимфоузлов прямо во время мастэктомии.
Операция по удалению подмышечного лимфоузла
Хирургическое вмешательство, в процессе которого происходит удаление лимфоузла под мышкой называется – лимфаденэктомия.
В наше время существуют несколько методов удаления лимфоузла под мышкой при раке:
- Подмышечная лимфаденэктомия. В процессе данной операции хирург иссекает некоторое количество ткани, в которой находятся лимфаузлы. Чтобы оценить состояние лимфатических узлов, в большинстве случаев, достаточно удаления порядка десятка узлов. Все пораженные лимфатические узлы подлежат удалению. В зависимости от анатомических особенностей пациента, количество узлов в подмышечной области у всех разное: у кого-то их будет 7, а у кото-то 27. При традиционной операции по удалению лимфоузла под мышкой иссекаются лимфоузлы первого (ниже нижнего края грудной мышцы) и второго (под малой грудной мышцей) уровня. Лимфаденэктомия проводится в процессе мастэктомии или же через отдельный хирургический разрез после удаления опухоли.
- Удаление сигнальных лимфоузлов при раке молочной железы. Сигнальные лимфоузлы – узлы, которые первыми реагируют на вхождение в них клеток рака. Хирург находит более близкие к опухоли лимфатические узлы и удаляет их. Данная операция, на сегодняшний день, является достойной альтернативой традиционной подмышечной лимфаденэктомии. Чтобы не удалять более десятка узлов, удаляется один или несколько лимфоузлов, которые, вероятно, могут быть поражены раковыми клетками. Далее они отправляются на гистологическое исследование.
Противопоказания к удалению подмышечных лимфоузлов при раке
Существуют некоторые противопоказания к удалению лимфоузлов под мышкой:
- Не удается полностью удалить опухоль. Это те ситуации, когда рак диагностирован уже на поздних стадиях и опухоль успела поразить другие ткани и органы.
- Общее тяжелое состояние человека: патологии сердца и сосудов, почечно-печеночная недостаточность, нарушение кровообращения головного мозга.
Перечисленные причины могут быть преградой не только к удалению лимфоузлов, но и к операции на груди в целом.
Многолетний стаж и опыт работы специалистов клиники “Гарвис” гарантирует высокое качество проведения операций по удалению подмышечных лимфоузлов. Использование самых современных методов хирургического вмешательства позволяет оказать высококвалифицированную хирургическую помощь пациентам.
Записывайтесь на консультацию по телефонам: (056)7941020; (095) 2831020, (067) 3531020 или с помощью формы записи на нашем сайте
Типичные ошибки при лечении онкологических заболеваний в ветеринарной онкологии
В последние годы мы наблюдаем активное развитие ветеринарной медицины мелких домашних животных. Растет профессиональный уровень ветеринарных врачей. Появляются новые возможности для обмена опытом с зарубежными специалистами. Идет формирование узкоспециализированных профессиональных врачебных сообществ. В некоторых областях ветеринария в плотную приближается к стандартам диагностики и лечения гуманной медицины. Однако, движение вперед не возможно без критического анализа собственного не удачного врачебного опыта и сложных случаев у коллег. Каждый не равнодушный врач тяжело переживает любой случай не удачного лечения пациентов и всеми силами старается не повторять выявленных ошибок. Поэтому мы решили в этой статье систематизировать и описать типичные врачебные ошибки при лечении онкологических заболеваний молочных желез, лимфатической системы, мягких тканей и кожи, которые в совокупности составляют более 80 % от всех случаев обращений с онкологическими заболеваниями собак и кошек в ветеринарные клиники. Надеемся, что наш негативный опыт позволит избежать клинических неудач всем ветеринарным специалистам, которые занимаются лечением онкологических заболеваний у мелких домашних животных.
Злокачественные опухоли молочных желез у собак и кошек являются одной из наиболее частых причин обращения к ветеринарному онкологу. Мне бы хотелось выделить две основные ошибки в лечебном подходе к новообразованиям этой локализации. Во-первых, это бездействие врача, связанное с недостатком квалификации. Очень часто встречается ошибочное мнение, что «»маленькую»» опухоль лучше не трогать, пока она не растет. Между тем следует напомнить, что злокачественная опухоль имеет возможность метастазировать с началом формирования ангиогенеза в опухоли, то есть при диаметре опухоли 0,5 мм! С этого момента раковые клетки уже могут попадать в кровяное русло. При этом следует помнить, что опухоли молочных желез склонны к малигнизации и с течением времени их злокачественный потенциал только усиливается. У кошек малигнизация опухолей молочных желез происходит особенно быстро. Скорость метастазирования злокачественной опухоли молочной железы не всегда коррелирует со скоростью роста первичного очага. Мы наблюдали наличие метастазов в легкие при опухоли молочной железы у кошки диаметром 1,5 — 1,8 см. (Т 2 М1) и у собак при размерах опухоли 3-5 см (Т 2 ), мы наблюдали отдаленные метастазы несколько раз. Поэтому рекомендацию наблюдение — при опухоли молочной железы (без цитологической диагностики и при отсутствии противопоказаний к хирургической операции) мы считаем профессиональной ошибкой, которая может перевести излечимое заболевание в неизлечимое. Однако у пациентов с большим коэффициентом наркозного риска, после проведения предварительной цитологической диагностики, при доброкачественном течении процесса, наблюдение может быть оправдано.
Вторая группа ошибок при лечении опухоли молочной железы связана с проведением не радикальной хирургической операции. При злокачественных опухолях молочных желез у собак радикальными следует считать регионарную или унилатеральную мастэктомию. Если врач не проводил предварительного цитологического исследования, то любую опухоль молочной железы следует считать потенциально злокачественной. У кошек мы рекомендуем проводить только унилатеральную мастэктомию. Это связано с особенностями лимфооттока от молочной железы у кошек и с более агрессивным ростом и развитием у них рака молочных желез . У собак регионарную мастэктомию возможно проводить двумя способами в зависимости от локализации опухоли. При локализации новообразования в паховых пакетах молочных желез удаляют обе паховые и грудную молочную железу единым блоком (3, 4 и 5 молочные железы) вместе с регионарным лимфатическим узлом . При локализации опухоли в 1 или 2 грудной молочной железы, удаляют первые 3 молочные железы единым блоком. При поражении опухолью центральной молочной железы (3 -ей молочной железы) радикальной будет считаться только унилатеральная мастэктомия — это связано с особенностью лимфооттока от молочных желез. Отток лимфы от 1-2 пары грудных молочных желез осуществляется в подмышечные лимфоузлы, от 4-5 паховых молочных желез в паховые лимфатические узлы, а лимфоотток от 3 пары осуществляется как в грудные, так и в паховые лимфоузлы. Если при пальпации врач обнаруживает даже незначительное уплотнение в тканях молочных желез со стороны поражения опухолью, то такие железы считаются пораженными и нуждаются в удалении единым блоком вместе с молочными железами на которых опухоль определяется явно (принцип блочности в онкологической хирургии). Кроме того, у кошек мы регулярно встречаем рецидивы в области 1-2 пары грудных молочных желез и поражение подмышечного лимфоузла после нерадикальных операций, проведенных в других лечебных учреждениях. Это показывает небрежное отношение некоторых хирургов к технике удаления ткани молочной железы. У кошек грудные молочные железы не имеют явно выраженного апоневроза в области глубокой грудной мышцы, поэтому она должна быть удалена единым блоком вместе с лимфоузлами. Не радикальная операция в этой области ведет к рецидиву, а рецидивная опухоль всегда является более злокачественной и активно метастазирующей, чем первичная.
Однако, существуют и случаи, когда хирургическое удаление опухоли является лечебной ошибкой. Во первых, при наличии метастатического поражения внутренних органов, поскольку тогда операция не повлияет на продолжительность жизни животного, более того, есть данные, что удаление первичной опухоли может ускорять развитие метастазов. Во -вторых, хирургическое удаление воспалительно — инфильтративной формы рака молочной железы без предварительного применения лучевой или (и) химиотерапии заканчивается бурным рецидивом в течении 2-4 недель.
Использование послеоперационной (адьювантной) химиотерапии должно быть четко регламентировано. Если врач не назначает химиотерапию при раке молочной железы у собак или кошек, это не может считаться лечебной ошибкой, так как для использования химиотерапевтических препаратов необходимы специальные знания. Однако если доктор назначил химиотерапию неправильно — не в тех дозах, без соответствующего контроля за пациентом, это является серьезным врачебным промахом. Такие назначения приведут к ухудшению общего состояния пациента, а в некоторых случаях могут привести и к смерти. В настоящее время показаниями для проведения адьювантной химиотерапии при раке молочной железы у собак является: размер опухоли более 5 см и гистологически подтвержденное, поражение регионарного лимфоузла. У кошек : опухоль более 3 см, поражение регионарного лимфоузла, гистологически подтвержденная низкодифференцированная аденокарцинома молочной железы. В качестве протокола адьювантной химиотерапии рака молочной железы у собак рекомендованы: Доксорубицин — 25 мг/ м2, Циклофосфан — 250 мг/ м2, 1 раз в 3 недели — 3- 5 курсов. У кошек доксорубицин в монорежиме 1 мг/кг, 1 раз в 3 недели — 3-5 курсов. При этом у собак и кошек мы рекомендуем еженедельный контроль клинической крови и перед введением, биохимический анализ крови и эхокардиография.
Хочется отметить так же целесообразность стерилизации при наличии опухоли молочной железы. Уже давно доказано, что злокачественные опухоли молочных желез у собак и кошек неэстрогенозависимые. Поэтому стерилизация животного не замедляет рост новообразования и не профилактирует возникновения новых опухолей, если животное имеет сформировавшийся гормональный фон. Профилактическим противоопухолевым эффектом обладает только стерилизация до первой течки и, в некоторой степени, до второй течки у сук.
За последние пять лет мы регистрируем рост числа пациентов, которым ставится диагноз -злокачественная лимфома (лимфосаркома). Так же выросло количество пациентов, которым проводилось неэффективное лечение до обращения к специалистам. Следует особо отметить, что при лимфоме время, прошедшее от начала появления клинических признаков до начала специфического лечения, имеет жизненно важное значение и напрямую влияет на продолжительность жизни пациента и исход заболевания. Самая часто встречающаяся ошибка при лимфоме, это отсутствие онкологической настороженности у врача общей практики. По нашей статистике у 85 % пациентов, которым в последствии был поставлен диагноз злокачественная лимфома, в анамнезе был назначен курс антибиотиков на 2-4 недели до проведения морфологической диагностики. В 42% случаев курс лечения составлял 1-3 месяца без явных клинических улучшений. За это время болезнь из 1-2 стадии развивалась в 3-4. При этом общее состояние животного ухудшалось, а увеличение лимфоузлов списывалось на прогрессирование инфекционного заболевания ( лептоспироз, бруцеллез, пневмония,кампилобактериоз и т,д.).
Вот типичный клинический пример: собака- породы лабрадор, кобель, возраст 5 лет, некастрированный, привит. Хозяева заметили, что в течение приблизительно 2 недель стал более вялый, аппетит снизился, хуже переносит нагрузки. Вызвали врача на дом. Диагноз — «»слабое сердце»», переутомление, назначены рибоксин и гамавит. Через неделю хозяева самостоятельно обнаружили увеличенные нижнечелюстные лимфоузлы и обратились в ветеринарную клинику. Врач проверил клиническую кровь и взял анализ на лептоспироз — по анализам — лейкоцитоз, незначительная анемия и титр к Lept.C. 1: 100 . Были назначены витамины и антибиотики сроком на 2 недели. После начала лечения собаки стало клинически лучше, лимфатические узлы не уменьшились . Через 2 недели титр антител показал 1:50 и антибиотики были отменены. Собаке стало резко хуже на 3-й день. Врач опять назначил другой антибиотик и ронколейкин, но собаке лучше не становилось. Анемия прогрессировала, увеличились другие поверхностные лимфоузлы. Были назначены капельницы, проведено ультразвуковое исследование брюшной полости, на котором обнаружили множественные образования в брюшной полости и спленомегалию, после чего было рекомендовано усыпление, так как у собаки опасное инфекционное заболевание и «»рак 4-ой стадии»». После этого хозяева обратились в нашу клинику, где был поставлен диагноз злокачественная лимфома на основании биопсии из лимфоузла. С момента появления клинических признаков прошло более 2 -х. месяцев. Собака была истощена, сильно анемичная, с гепатоспленомегалией и свободной жидкостью в брюшной полости, самостоятельно не ела около недели. После постановки диагноза было начато специфическое лечение и все клинические симптомы исчезли в течении 2 -х. недель. После этого собака на химиотерапии прожила 1 год и 3 месяца. Если бы диагноз был поставлен сразу, возможно, продолжительность жизни была бы дольше, так как состояние в котором животное поступило в клинику не позволило нам назначить более агрессивный протокол химиотерапии. Отсутствие онкологической настороженности и непроведенная вовремя морфологическая диагностика увеличенных лимфоузлов стали грубой диагностической ошибкой. Ещё одной грубой врачебной ошибкой является назначение при злокачественной лимфоме длительного гормонального лечения без химиотерапии . Такое лечение дает быстрое клиническое улучшение в состоянии больного животного, однако это улучшение длится не долго- примерно 4-6 недель. В последствии болезнь быстро рецидивирует и перестает реагировать не только на терапию стероидами, но и на любые химиотерапевтические препараты. Это связано с развитием у опухолевых клеток множественной лекарственной резистентности, которая стимулируется длительным курсом стероидов. Поэтому монотерапия стероидами противопоказана пациентам с диагнозом лимфосаркома.
Неправильным следует признать лечебный подход, при котором врач начинает лечение хаотично, пробуя различные химиотерапевтические препараты. При этом он обычно начинает с небольших доз и наиболее простых препаратов, как правило, с винкристина. Лечебный эффект в начале лечения присутствует, но если рассматривать долгосрочные перспективы, то они будут неблагоприятны. Вот типичный клинический пример: Собака породы немецкая овчарка, 4 года, кобель, не кастрирован. Хозяева заметили увеличенные нижнечелюстные лимфоузлы и обратились к врачу, который назначил курс антибиотиков, продолжительностью в 2 недели. При этом общее состояние животного было хорошим. Лимфоузлы уменьшились незначительно и хозяева были направлены на консультацию к ветеринарному онкологу. Врач провел гистологическую диагностику, после чего был поставлен диагноз злокачественная лимфома. Собаке был назначен химиотерапевтический протокол АСОР. После начала лечения клиническая картина нормализовалась. Собака хорошо переносила инъекции винкристина и циклофосфана, однако после доксорубицина у животного 3 дня была анорексия, рвота и диспепсия. Хозяева обратились в другую ветеринарную клинику, где им рекомендовали использовать только винкристин с интервалом 1 раз в 14 дней. В течении двух месяцев собака чувствовала себя хорошо, признаков болезни не наблюдалось. Затем увеличились лимфоузлы, которые уменьшались после инъекции винкристина, но через 5-7 дней снова следовало их увеличение. Собака стала более вялая, ухудшился аппетит. Винкристин стали вводить 1 раз в 7 дней, однако это не приносило улучшения состояния животного. В течении месяца лимфоузлы перестали реагировать на введение винкристина, собака отказалась от приема пищи, анемия прогрессировала. Было решено использовать доксорубицин. После первой инъекции лимфоузлы уменьшились до нормального размера, однако через 10-14 дней они снова начали увеличиваться. Общее состояние собаки начало ухудшаться. Было решено усилить схему химиотерапии циклофосфаном, но это не дало клинического эффекта. В результате эффективным средством оказалась только L — аспаргиназа, которая давала клиническое улучшение на 5-7 дней, а доксорубицин потерял эффективность после 3-ей инъекции (вводили 1 раз в 3 недели). В итоге собака погибла на 5-ом месяце лечения, из которых она хорошо себя чувствовала только 2-3 месяца. Если бы врач и владельцы точно следовали протоколу химиотерапии без рецидивный период был бы гораздо дольше. По статистике на протоколе ACOP +L без рецидивный период в среднем составляет 11 месяцев. Как показывает наш опыт, очень неблагоприятное влияние на безрецидивный период оказывают перерывы в лечении. Особенно часто мы сталкиваемся с этой проблемой в начале лета, когда владельцы вывозят своих питомцев на дачу. Если владельцы физически не могут привозить животное в клинику, мы рекомендуем не прекращать лечение, а менять протокол на сочетание таблеток ломустина 60 мг/ м2, 1 раз в 3 недели и лейкерана — 4 мг/ м2, 1 раз в 48 часов. Вместо лейкерана можно использовать эндоксан в дозе 50 мг/ м2, 1 раз в 48 часов. Кроме этого, можно использовать доксорубицин в дозе 30 мг/ м2 (1мг/кг при массе тела менее 10 кг) или митоксантрон в дозе 5,5 мг/ м2, 1 раз в 3 недели в сочетании с эндоксаном или лейкераном, если хозяева могут привозить животное в клинику с такой периодичностью. Когда хозяева вновь смогут регулярно посещать врача, можно вернуться к тому протоколу химиотерапии, на котором пациент был до момента смены лечения. Хозяевам необходимо подробно объяснить, что при отказе от лечения на длительное время в организме больного животного начинают активно размножаться наиболее агрессивные и устойчивые к лечению опухолевые клетки. Это приводит к развитию лекарственной резистентности и к значительному укорочению без рецидивного периода. При использовании химиотерапии некоторые врачи не уделяют должного внимания контролю за состоянием пациента. Следует помнить, что химиотерапевтические средства — это в первую очередь ядовитые вещества. Они убивают наиболее быстро делящиеся клетки такие, как клетки опухоли и клетки самого организма, (в первую очередь клетки костного мозга и клетки желудочно- кишечного тракта). Клетки организма должны успевать восстанавливаться после сеанса химиотерапии, иначе лечение может убить пациента. Перед очередным введением цитостатика, необходимо обязательно провести клинический анализ крови, а если есть подозрения на нарушение работы внутренних органов или наличие хронических заболеваний, то провести биохимический анализ крови. Если уровень лейкоцитов у пациента менее 2,9 тыс./мл или тромбоцитов менее 50 тыс./мл, то от введения следует отказаться до нормализации показателей клинической крови. Отсутствие контроля гематологических показателей при проведении химиотерапии следует признать грубой врачебной ошибкой. Для борьбы с миелосупрессией можно использовать стимуляторы лейкопоэза, например, нейпоген (филгростим) — 0,5 млн. ед./кг 1 раз в день подкожно 1-2 дня или беталейкин 10-15 мг/кг 1 раз в день, подкожно 3-5 дней. При использовании доксорубицина следует помнить о его кардиотоксичности и контролировать функцию сократимости левого желудочка. Для этого мы рекомендуем проводить пациенту эхокардиографию перед каждым введением доксорубицина и в течении 3 мес. после окончания курса. Так же не следует превышать кумулятивную дозу кардиотоксичности 180 мг/ м2. У собак предрасположенных к дилятационной кардиомиопатии лечение доксорубицином нужно проводить с особой осторожностью. У доберманов вместо доксорубицина можно использовать эпирубицин, который менее кардиотоксичен.
Говоря о врачебных ошибках при использовании химиотерапии нельзя не упомянуть банальное введение химиотерапевтического препарата мимо вены. Это может привести к развитию глубокой некротической язвы и даже к потере конечности. Если такая экстравазация произошла — следует немедленно прекратить введение препарата, сделать циркулярную блокаду с кортикостероидами, приложить к месту инъекции холод, в последствии лечить, как трофическую язву.
При планировании лечения лимфомы у таких пород как колли, шелти, бобтейл, австралийская овчарка, их метисы, и некоторые другие, следует помнить о наличии у них MDR — мутации гена гликопротеина P, который отвечает за выведение из клеток организма некоторых химиотерапевтических агентов. Для этих пород очень высокой токсичностью обладают : винкристин, винбластин, доксорубицин, таксаны. Введение этих препаратов таким пациентам может закончиться скоропостижной смертью с клиническими признаками острой интоксикации (рвота, понос, судороги и др.) Сейчас в нашей стране доступны генетические тесты на наличие этой мутации, поэтому нельзя применять эти препараты без предварительного генетического анализа. Если же это сделать невозможно, то для пород группы риска следует подобрать протокол химиотерапии, не содержащий опасных лекарств.
Рассматривая типичные врачебные ошибки при лечении опухолей мягких тканей, в первую очередь необходимо рассмотреть причины ранних рецидивов после проведения хирургического удаления опухоли. На наш взгляд это связано с пренебрежением предоперационной морфологической диагностикой удаляемого новообразования. Для проведения радикальной операции врачу необходимо точно знать какую именно опухоль он собирается удалять. Наибольший процент местных рецидивов приходится на нерадикальное удаление сарком мягких тканей. Проблема эффективного лечения сарком мягких тканей связана с несколькими факторами. Во первых, это разнообразие морфологических форм опухолей и трудность первичной цитологической диагностики вида опухоли. Во-вторых, необходимость неукоснительно соблюдать все принципы онкологической хирургии при удаление саркомы из организма животного. В- третьих, специфичность чувствительности разных морфологических форм опухолей к лучевой и химиотерапии. Основой успешного лечения в онкологии является его правильное и заблаговременное планирование. В случае с саркомами мягких тканей это особенно актуально. Чтобы определить оптимальное лечение необходимо знать стадию процесса:
При 4 стадии процесса хирургическое удаление опухоли оправдано только, в том случае если это значительно улучшит качество жизни пациента, например, уберёт болевой синдром. Перед планированием операции мы всегда тщательно проводим диагностику наличия отдалённых метастазов в организме больного животного. Для этого необходимо провести рентгенодиагностику грудной клетки и УЗИ брюшной полости. Метастатическая способность сарком зависит от гистотипа опухоли :
В целом следует отметить преобладание гематогенного пути метастазирования над лимфогенным. Перед началом планирования лечения необходимо оценить факторы, влияющие на агрессивность онкологического процесса. Для сарком мягких тканей нужно обращать внимание на следующие факторы:
Размер опухоли: опухоли у собак более 5 см имеют в 3 раза большую вероятность метастазирования
Местоположение опухоли: средняя продолжительность жизни у собак при инвазии кожи была почти в 3 раза больше, чем у собак с инвазией мышечной ткани. Также саркомы на конечностях имеют более агрессивный рост, чем саркомы в области головы.
Подвижность относительно окружающих тканей является благоприятным фактором прогноза.
После проведения морфологического исследования у врача появляется ценная прогностическая информация:
Степень дифференцировки клеток опухоли : чем ниже дифференцировка, тем более вероятно отдалённое метастазирование и быстрый местный инвазивный рост опухоли
Чем больше в опухоли очагов некроза, тем хуже её чувствительность к лучевой и химиотерапии.
Количество митозов в опухоли говорит о степени её злокачественности, наиболее злокачественные опухоли имеют более 20 митозов в поле зрения
Основной метод лечения сарком — хирургический. При этом очень важно удалить всю опухолевую ткань, то есть провести радикальную операцию. Для этого нужно соблюдать следующие принципы:
Абластичность — полное удаление опухолевых клеток из организма и недопущение попадания в рану во время операции. Самое главное при абластичном удаление саркомы мягких тканей — это правильно определить границы резекции опухоли в здоровых тканях. При росте саркома сдавливает окружающие ткани, при этом образуется так называемая псевдокапсула -участок уплотнённых тканей вокруг опухоли. Эта псевдокапсула не является барьером для прохождения опухолевых клеток, поэтому при удалении опухоли граница резекции должна проходить не ближе 3 см от границ псевдокапсулы. Для поствакцинальной саркомы кошек минимальное расстояние до края опухоли является 5 см. Недопустимо повреждать капсулу при удалении опухоли. Место взятия биопсии обязательно должно попасть в удаляемый участок тканей. Часто при планировании операции по удалению саркомы приходится планировать и реконструктивную часть для закрытия образовавшегося после удаления опухоли дефекта. Следует помнить, что после завершения онкологической части операции необходимо сменить перчатки и инструменты, чтобы избежать обсеменения опухолевыми клетками операционной раны. Если на опухоли имеются язвы или другие повреждения кожного покрова, необходимо их закрыть стерильными салфетками, чтобы перчатки и инструменты не касались опухолевой ткани. Во время операции опухоль не следует брать в руки, сжимать, надавливать на неё, так как всё это стимулирует выброс опухолевых клеток в кровоток организма.
Принцип футлярности: саркомы мягких тканей распространяются по межфасциальным пространствам, поэтому при операции необходимо удалять все анатомические структуры и ткани, входящие с опухолью в общий фасциальный футляр, то есть все мышцы и покрывающие их фасции.
Для кошек одной из самых агрессивных сарком мягких тканей является поствакцинальная фибросаркома. Её название связано с гипотезой о том, что причиной возникновения данной опухоли является адъювант, входящий в состав многих вакцин. Вызывая хроническое воспаление с пролиферацией в зоне инъекции он становится пусковым механизмом развития саркомы. Так же есть данные о вирусной природе заболевания и о генетической предрасположенности определённых линий кошек к развитию данного новообразования. Эта опухоль обладает агрессивным инвазивным ростом и имеет минимальное время удвоения — 9 дней. Для сравнения самая агрессивная опухоль молочной железы имеет скорость удвоения опухолевой массы — 30 дней. Метастазирует поствакцинальная саркома нечасто, менее чем в 20% случаев и как правило, в запущенных случаях или после нерадикальной операции и последующего рецидива. Поэтому, для излечения животного, необходимо как можно раньше диагностировать болезнь и провести радикальную операцию. Любой ветеринарный врач должен развивать в себе онкологическую настороженность и проводить цитологическое исследование уплотнений у кошек в месте проведения вакцинации или введения инъекционных препаратов. Настораживающими признаками развития фибросаркомы являются:
Припухлость, которая сохраняется более 3 -х. месяцев после вакцинации
Уплотнение более 2 см в диаметре
Уплотнение, увеличивающееся в размерах спустя 4 недели после вакцинации.
Для абластического удаления данной опухоли необходимо провести широкое иссечение новообразования. Хирургические границы должны составлять не менее 3 см от края опухоли, однако и этого может оказаться недостаточно. Среди некоторых ветеринарных онкологов в настоящее время существует мнение, что безопасным следует считать расстояние в 5 см от видимой границы опухоли. Эффективность лучевой и химиотерапии в дополнение к хирургическому лечению поствакцинальной фибросаркомы кошек в настоящее время изучается. По нашему мнению адьювантная химиотерапия оправдана при наличии положительного края резекции. Существуют исследования, которые показывают увеличение продолжительности жизни кошек при использовании адьювантной химиотерапии доксорубицином в монорежиме, однако эти данные требуют дополнительного изучения.
В качестве профилактики и для улучшения возможной резектабельности опухоли можно предложить следующие меры:
Не вводить вакцину в область между лопатками Вакцину от бешенства вводить под кожу правой голени. Вакцину от FeLV вводить под кожу левой голени. Остальные вакцины вводить в правое плечо.При лечении эпидермальных новообразований основные проблемы возникают при недооценивании врачом злокачественного потенциала опухоли. Чаще всего это происходит при небольших по диаметру новообразованиях кожи. Если речь идет о доброкачественных опухолях, то хирургическое удаление с соблюдением принципов абластики является достаточным для излечения животного. Хирургическая граница при доброкачественных опухолях может составлять не более 0,5 см здоровой ткани от края новообразования. При злокачественных опухолях хирургическая граница зависит от гистологического типа новообразования кожи. Если врач предварительно не проводит морфологической диагностики новообразования, то его оперативное вмешательство может быть нерадикальным. Вот типичный клинический пример: Собака породы французский бульдог, сука, возраст 3 года, не стерилизована. Хозяева заметили небольшое новообразование кожи диаметром 1 см на передней лапе. Собака периодически его вылизывала. В ветеринарной клинике, куда обратились хозяева, доктор поставил диагноз — папиллома, визуально, без морфологической диагностики. Удалил опухоль под местной анестезией. Гистологическая диагностика удаленного материала не проводилась. Через 5 — 7 дней на месте операции образовался отек диаметром 2- 3 см, периодически выделялась сукровица, процесс заживления шел медленно. Через 14 дней сняли швы, однако сращение по первичному натяжению не наступило. Через 30 дней на месте операции образовалась изъязвленная поверхность диаметром 2-3 см, которая очень беспокоила собаку. После этого хозяева обратились в нашу клинику. После цитологического исследования был поставлен диагноз мастоцитома кожи. Была проведена повторная операция по иссечению новообразования, и послеоперационный курс лучевой терапии суммарной общей дозой 45 Грей и адьювантная химиотерапия ломустином в дозе 70 мг/ м2, 1 раз в 3 недели — 5 курсов. Рецидива опухоли не возникло ( время наблюдения более 3-х лет). Это относительно удачный пример лечения рецидивной мастоцитомы. По нашей статистике мы за 4 года зарегистрировали 12 случаев летального исхода пациентов с рецидивом этой опухоли. Часто, кроме местного рецидива мы обнаруживаем метастазы в регионарных лимфатических узлах, реже в печени и в селезенке. Мастоцитома нуждается в радикальном удалении. Граница хирургического удаления должна проходить не ближе 2- 3 см от видимых границ опухоли. При этом, чем больше диаметр новообразования, тем дальше, по возможности, должна проходить линия резекции. Мастоцитомы чувствительны к лучевой терапии, поэтому, если есть возможность, необходимо проводить комбинированное лечение. Неоадьювантная лучевая терапия позволяет уменьшить размеры удаляемого новообразования и перевести неоперабельные опухоли в операбельные. Химиотерапия не очень эффективна при лечении животных с диагнозом мастоцитома. При наличии нескольких новообразований, а также при рецидивах и метастазах опухоли в регионарные лимфоузлы, мы используем сочетание преднизолона в дозе 40 мг/ м2 и винбластина в дозе 2- 2,5 мг/ м2, или ломустин в дозе 60-90 мг/ м2 . Эффективность не превышает 30%, чаще всего мы наблюдаем частичный регресс опухоли. Последнее время появились новые химиотерапевтические препараты для лечения мастоцитом у собак. Это ингибиторы тирозинкиназы, MASIVET и PALLADIA. В России они не зарегистрированы, поэтому опыт их применения у нас небольшой. Мы назначаем MASIVET в дозе 12,5 мг/ кг 1 раз в день — 6 недель, далее дозу можно уменьшить до 9 мг/кг. Их эффективность требует дальнейшего изучения. У кошек мастоцитомы бывают гораздо реже чем у собак, но чаще всего они множественные и метастазируют в печень и селезенку. При плоскоклеточном раке и меланоме кожи достаточным будет отступить 2 см от видимых границ опухоли.
В заключении хотелось бы сформулировать несколько правил, которые помогут врачу избежать ошибок при лечении онкологических пациентов.
1) Всегда проводить морфологическую диагностику опухоли, если такой возможности нет, лечить её как злокачественную. 2) Перед тем, как предпринимать лечебные мероприятия необходимо обследовать животное на наличие отдалённых метастазов. 3) Если существует несколько вариантов лечения злокачественного новообразования, предпочтение желательно отдавать наиболее надежному и радикальному из возможных и приемлемых для владельцев. Рецидивные опухоли всегда более злокачественные, чем первичные и имеют худший прогноз. 4) При обнаружении злокачественной опухоли, лечение следует начинать как можно быстрее, поскольку метастазирование может происходить в любой момент времени. 5) Цитологический диагноз в онкологии не является окончательным, при решении о назначении длительного лечения ( химиотерапии, лучевой терапии) или эутоназии животного необходимо руководствоваться результатами гистологии.Рецидив гистиоцитарной саркомы мягких тканей, через 1 месяц после не радикальной операции.
Рецидив рабдомиосаркомы через 1,5- 2 месяца после не радикальной операции.
Постиньекционная фибросаркома кошек.
Рецидив мастоцитомы через 2 месяца после не радикальной операции.
Лимфоотток от молочных желез у собаки.
Рецидив низкодифференцированной аденокарциномы молочной железы с внутрикожными метастазами.
лимфатических узлов и рака
Что такое лимфатическая система?
Лимфатическая (или лимфатическая) система — это часть иммунной системы вашего организма. Он включает сеть лимфатических сосудов и лимфатических узлов. Лимфатические сосуды во многом похожи на вены, которые собирают и переносят кровь по телу. Но вместо крови эти сосуды несут прозрачную водянистую жидкость, называемую лимфой. Лимфатическая жидкость также содержит лейкоциты, которые помогают бороться с инфекциями.
Лимфатическая жидкость могла бы накапливаться и вызывать опухоль, если бы ее каким-либо образом не слить. Лимфатические сосуды забирают лимфатическую жидкость вокруг клеток, чтобы направить ее в грудную клетку. Там лимфатическая жидкость собирается в большой сосуд, который стекает в кровеносный сосуд рядом с сердцем.
Лимфатические узлы и их функция
Лимфатические сосуды отправляют лимфатическую жидкость через узлы по всему телу. Лимфатические узлы — это небольшие структуры, которые работают как фильтры для посторонних веществ, таких как раковые клетки и инфекции.Они содержат иммунные клетки, которые могут помочь бороться с инфекцией, атакуя и уничтожая микробы, которые переносятся через лимфатическую жидкость. Лимфатические узлы расположены во многих частях тела, включая шею, подмышку, грудь, живот (живот) и пах. Они содержат иммунные клетки, которые могут помочь бороться с инфекцией, атакуя и уничтожая микробы, которые переносятся через лимфатическую жидкость.
По всему телу есть сотни лимфатических узлов. Каждый лимфатический узел фильтрует жидкость и вещества, улавливаемые ведущими к нему сосудами.Лимфатная жидкость из пальцев, например, движется к груди, присоединяясь к жидкости из руки. Эта жидкость может фильтроваться через лимфатические узлы в локте или под мышкой. Жидкость из головы, волосистой части головы и лица течет вниз через лимфатические узлы на шее. Некоторые лимфатические узлы находятся глубоко внутри тела, например, между легкими или вокруг кишечника, чтобы фильтровать жидкость в этих областях.
Увеличение лимфатических узлов
При возникновении проблемы, например инфекции, травмы или рака, лимфатические узлы в этой области могут набухать или увеличиваться, поскольку они отфильтровывают «плохие» клетки.Увеличение лимфатических узлов (лимфаденопатия) говорит о том, что что-то не так, но другие симптомы помогают определить проблему. Например, боль в ухе, лихорадка и увеличенные лимфатические узлы возле уха могут указывать на то, что у вас может быть ушная инфекция или простуда.
Некоторые области, где обычно увеличиваются лимфатические узлы, находятся в области шеи, паха и подмышек. В большинстве случаев набухает только одна область узлов. Когда увеличивается более одной области лимфатических узлов, это называется генерализованной лимфаденопатией .Некоторые инфекции (например, стрептококковая ангина и ветряная оспа), некоторые лекарства, заболевания иммунной системы и такие виды рака, как лимфома и лейкемия, могут вызывать такой отек. Ваш лечащий врач запросит дополнительную информацию, чтобы выяснить причину отека. Набухание лимфатических узлов часто вызвано не раком, а чем-то другим.
Рак лимфатических узлов
Рак может появиться в лимфатических узлах двумя способами: он может либо начаться там, либо распространиться откуда-то еще.
Рак, который начинается в лимфатических узлах, называется лимфомой . Подробнее о лимфоме при лимфоме Ходжкина и неходжкинской лимфоме.
Чаще рак начинается где-то еще, а затем распространяется на лимфатические узлы. Этому и посвящен этот раздел.
Как рак распространяется на лимфатические узлы?
Рак может распространяться от того места, где он возник (первичный очаг), на другие части тела.
Когда раковые клетки отделяются от опухоли, они могут перемещаться в другие области через кровоток или лимфатическую систему.Если они проходят через лимфатическую систему, раковые клетки могут попасть в лимфатические узлы. Большинство уцелевших раковых клеток умирают или погибают, прежде чем смогут начать расти где-нибудь еще. Но один или два могут поселиться на новом месте, начать расти и образовывать новые опухоли. Это распространение рака на новую часть тела называется метастазом .
Чтобы раковые клетки распространились на новые части тела, они должны претерпеть несколько изменений. Они должны иметь возможность отделиться от исходной опухоли и прикрепиться к внешней стенке лимфы или кровеносного сосуда.Затем они должны пройти через стенку сосуда, чтобы течь с кровью или лимфой к новому органу или лимфатическому узлу.
Когда рак действительно распространяется на лимфатические узлы, он обычно распространяется на узлы рядом с самой опухолью. Это узлы, которые выполняют большую часть работы по фильтрации или уничтожению раковых клеток.
Как обнаруживается рак лимфатических узлов?
Нормальные лимфатические узлы крошечные, и их трудно найти, но при инфекции, воспалении или раке узлы могут увеличиваться.Те, что находятся у поверхности тела, часто становятся достаточно большими, чтобы их можно было почувствовать пальцами, а некоторые даже можно увидеть. Но если в лимфатическом узле всего несколько раковых клеток, он может выглядеть и чувствовать себя нормально. Лимфатические узлы глубоко в теле не прощупываются или не видны. Поэтому врачи могут использовать сканирование или другие визуализационные тесты, чтобы искать увеличенные узлы в глубине тела. Часто предполагается, что увеличенные лимфатические узлы рядом с раком содержат рак.
Единственный способ узнать, есть ли рак в лимфатическом узле, — это сделать биопсию.Врачи могут удалить лимфатические узлы или взять образцы одного или нескольких узлов с помощью игл. Удаленная ткань исследуется под микроскопом патологом (врачом, который диагностирует болезнь с помощью образцов ткани), чтобы выяснить, есть ли в ней раковые клетки. Патологоанатом составляет отчет, в котором подробно описывается обнаруженное. Если в узле обнаружен рак, в отчете описывается, как он выглядит и сколько было замечено.
Когда хирург выполняет операцию по удалению первичного рака, он может также удалить один или несколько близлежащих (региональных) лимфатических узлов.Удаление одного лимфатического узла считается биопсией, но когда удаляются многие лимфатические узлы, это называется диссекцией лимфатических узлов . Когда рак распространился на лимфатические узлы, существует более высокий риск того, что рак может вернуться после операции. Эта информация помогает врачу решить, может ли после операции потребоваться дополнительное лечение, такое как химиотерапия, иммунотерапия, таргетная терапия или лучевая терапия.
Что означает рак лимфатического узла?
Если рак обнаружен в одном или нескольких лимфатических узлах, это может означать, что необходимы дополнительные тесты, чтобы узнать, насколько далеко распространился рак.Эта информация используется для определения стадии вашего рака и наилучших вариантов лечения.
Для получения дополнительной информации о стадировании см. Стадия рака или найдите свой тип рака для получения более подробной информации.
Эффекты удаления лимфатических узлов
При удалении лимфатических узлов он может покинуть пораженный участок без возможности оттока лимфатической жидкости. Многие лимфатические сосуды теперь заходят в тупик на месте, где раньше находился узел, и жидкость может возвращаться обратно. Это называется лимфедема , , которая может стать проблемой на всю жизнь.Чем больше удалено лимфатических узлов, тем больше вероятность, что это произойдет. Чтобы узнать больше о том, на что обращать внимание, как снизить риск и как справиться с этим побочным эффектом, см. Лимфедема.
Удаление лимфатических узлов во время онкологической хирургии маловероятно, чтобы ослабить иммунную систему человека, поскольку иммунная система большая и сложная и расположена по всему телу.
Новая концепция профилактики и лечения метастатических лимфатических узлов с помощью химиотерапии, проводимой через лимфатическую сеть.
Эксперименты проводились в соответствии с утвержденными руководящими принципами и были одобрены Комитетом по уходу и использованию животных Университета Тохоку.
Мышей
MXh20 / Mo- lpr / lpr (MXh20 / Mo / lpr) мышей (16–18 недель) разводили в определенных условиях, свободных от патогенов, в Институте исследований животных Университета Тохоку. Мыши MXh20 / Mo / lpr уникальны; их самые периферические LNs вырастают до 10 мм в размере в возрасте 2,5–3 месяцев и, в частности, у мышей не развиваются тяжелые аутоиммунные заболевания 9 .
Клеточная культура
Использовали злокачественные фиброзные гистиоцитомоподобные клетки KM-Luc / GFP, стабильно экспрессирующие слияние генов люциферазы и усиленного зеленого флуоресцентного белка 22 .Клетки культивировали в среде Игла, модифицированной Дульбекко (DMEM; Sigma-Aldrich, Сент-Луис, Миссури, США), с добавлением 10% инактивированной нагреванием фетальной бычьей сыворотки и 1% L-глутамин-пенициллин-стрептомицин (Sigma-Aldrich). Клетки инкубировали (37 ° C, 5% CO 2 /95% воздуха) до достижения 80% слияния. Отсутствие контаминации Mycoplasma было подтверждено в день инокуляции (набор для обнаружения MycoAlert Mycoplasma ; Lonza Rockland, Allendale, NJ, USA).
Индукция метастазов в PALN путем инъекции опухолевых клеток в SiLN
Метастазы в PALN вызывали инъекцией 3.3 × 10 5 клеток, суспендированных в смеси 20 мкл фосфатно-солевого буфера (PBS) и 40 мкл 400 мг / мл Matrigel (Collaborative Biomedical Products, Бедфорд, Канада) в одностороннем SiLN ( n = 25) . Контрольным животным вводили 60 мкл носителя (20 мкл PBS плюс 40 мкл Matrigel) без клеток ( n = 14). Инокуляцию проводили с помощью иглы 24-го калибра под контролем системы высокочастотной ультразвуковой визуализации (VEVO770; VisualSonics, Торонто, Канада) с датчиком 25 МГц (RMV-710B; осевое разрешение 70 мкм; фокусное расстояние 15 мм; VisualSonics).Каждую мышь анестезировали 2% изофлураном в кислороде, и день инокуляции был определен как день 0.
Обнаружение роста опухоли и метастазирования с помощью
in vivo биолюминесцентная визуализацияМетастазы в PALN оценивали с помощью in vivo система визуализации биолюминесценции (IVIS; Xenogen, Аламеда, Калифорния, США) в дни 0, 3 и 6 для клеток KM-Luc / GFP. Фоновая активность люциферазы в контроле составляла ~ 4 · 10 4 фотонов / сек. Мыши, у которых люциферазная активность в PALN была выше, чем фоновая люциферазная активность, считались метастатическими мышами.Каждую мышь анестезировали 2,0% изофлураном в кислороде и внутрибрюшинно вводили люциферин 150 мг / кг (Promega, Мэдисон, Висконсин, США). Через 10 минут биолюминесценцию люциферазы измеряли в течение 30 секунд с помощью IVIS. Мыши с метастазами были разделены на две группы: группа на 6-й день, состоящая из мышей, обследованных через 6 дней после инокуляции опухолевых клеток ( n, = 17), и группа на 12-й день, состоящая из мышей, обследованных через 12 дней после инокуляции опухолевых клеток ( n. = 4).
Скорость доставки в PALN после инъекции флуоресцентного раствора в SiLN
40 мкл 62.Раствор ICG 5 мкг / мл (Daiichi Sankyo, Tokyo, Japan) вводили со скоростью 50 мкл / мин с помощью шприцевого насоса в односторонний SiLN мышей на 6-й день ( n = 7) и контрольную ( n = 4) группы 22 . Интенсивность флуоресценции PALN оценивали с использованием системы визуализации биолюминесценции in vivo и (IVIS; Xenogen). Эту процедуру проводили через 5 минут, 30 минут, 1 час, 2 часа, 6 часов и 24 часа после введения раствора ICG.
Ex vivo оценка скорости доставки в PALN после инъекции флуоресцентного раствора в SiLN40 мкл 62.Раствор ICG 5 мкг / мл вводили со скоростью 50 мкл / мин с помощью шприцевого насоса в односторонний SiLN мышей на 6-й день ( n = 4), 12-й день ( n = 4) и контрольные ( n = 4) группы. PALN препарировали и гомогенизировали, и интенсивность флуоресценции тканевой суспензии оценивали с использованием системы визуализации биолюминесценции in vivo (IVIS; Xenogen).
Поток индийских чернил из SiLN в PALN во время развития метастазов
100 мкл черных чернил India было введено с помощью шприцевого насоса со скоростью 50 мкл / мин в односторонний SiLN мышей на 6-й день. ( n = 6) и контрольная ( n = 6) группы.
Визуализация лимфатических путей от SiLN и AALN к PALN
Под анестезией на коже живота был сделан дугообразный разрез от подвздошной к соответствующей подмышечной области. Зеленые и желтые красители (Pentel, Токио, Япония) вводили в SiLN и AALN соответственно ( n = 3). Оба красителя растворяли в PBS (краситель: PBS = 2: 1). Два красителя вводили независимо друг от друга с использованием отдельных шприцев, игл-бабочек 27G и шприцевых насосов. Зеленый краситель вводили в центр SiLN, а желтый краситель — в центр AALN.Сначала зеленый краситель перемещался из SiLN в направлении PALN со скоростью 50 мкл / мин с помощью шприцевого насоса. Через 2 мин после начала инъекции зеленого красителя желтый краситель перемещался из AALN в PALN со скоростью 50 мкл / мин с использованием другого шприцевого насоса. Оба введения были прекращены через 3 мин после начала первой инъекции. Общий объем введенного зеленого красителя составлял 150 мкл, а желтого красителя — 50 мкл. Впоследствии мышь умерщвляли, собирали PALN, помещали в соединение с оптимальной температурой резки (OCT), замораживали и хранили при -80 ° C.
Доставка индийских чернил из AALN в метастатическую опухоль в PALN
На 6 день после инокуляции опухолевых клеток в SiLN индийские чернила вводили в AALN на 60 секунд со скоростью 50 мкл / мин с помощью шприца. насос ( n = 4). Затем мышь умерщвляли, собирали PALN, помещали в соединение OCT, замораживали и хранили при -80 ° C.
Гистологический анализ
Образцы, залитые парафином, разрезали на серийные срезы 2 мкм. Замороженные образцы разрезали на срезы размером 10 мкм с помощью криостата.Все срезы окрашивали H&E.
Статистический анализ
Все измерения представлены как среднее ± стандартное отклонение. Различия между группами определяли с помощью однофакторного дисперсионного анализа (рис. 1С) с последующим U-критерием Манна-Уитни (рис. 2В, D). Значение P <0,05 считалось статистически значимым. Статистический анализ проводился с использованием Excel 2010 (Microsoft) с программным обеспечением Statcel2.
Увеличение лимфатических узлов — Диагностика и лечение
Диагностика
Для диагностики того, что может быть причиной увеличения лимфатических узлов, вашему врачу может потребоваться:
- Ваша история болезни. Ваш врач захочет узнать, когда и как развились ваши увеличенные лимфатические узлы, а также есть ли у вас какие-либо другие признаки или симптомы.
- Медицинский осмотр. Ваш врач также захочет проверить лимфатические узлы у поверхности кожи на предмет размера, нежности, тепла и текстуры. Местоположение ваших опухших лимфатических узлов и другие признаки и симптомы могут указывать на основную причину.
- Анализы крови. Некоторые анализы крови могут помочь подтвердить или исключить любые подозреваемые основные заболевания.Конкретные тесты будут зависеть от предполагаемой причины, но, скорее всего, будут включать полный анализ крови (CBC). Этот тест помогает оценить ваше общее состояние здоровья и выявить ряд заболеваний, включая инфекции и лейкемию.
- Визуальные исследования. Рентген грудной клетки или компьютерная томография (КТ) пораженного участка могут помочь определить потенциальные источники инфекции или обнаружить опухоли.
- Биопсия лимфатического узла. Ваш врач может назначить вам биопсию для подтверждения диагноза.Он или она возьмет образец из лимфатического узла или даже целого лимфатического узла для микроскопического исследования.
Дополнительная информация
Показать дополнительную информациюЛечение
Увеличение лимфатических узлов, вызванное вирусом, обычно нормализуется после того, как вирусная инфекция проходит. Антибиотики бесполезны для лечения вирусных инфекций. Лечение опухших лимфатических узлов, вызванных другими причинами, зависит от причины:
- Инфекция. Наиболее распространенным средством лечения опухших лимфатических узлов, вызванных бактериальной инфекцией, являются антибиотики. Если ваши увеличенные лимфатические узлы вызваны ВИЧ-инфекцией, вы получите специальное лечение для этого состояния.
- Иммунное расстройство. Если ваши увеличенные лимфатические узлы являются результатом определенных состояний, таких как волчанка или ревматоидный артрит, лечение направлено на основное заболевание.
- Рак. Опухшие узлы, вызванные раком, требуют лечения от рака.В зависимости от типа рака лечение может включать хирургическое вмешательство, лучевую терапию или химиотерапию.
Образ жизни и домашние средства
Если ваши увеличенные лимфатические узлы чувствительны или болезненны, вы можете получить некоторое облегчение, выполнив следующие действия:
- Приложите теплый компресс. Приложите теплый влажный компресс, например тряпку для мытья посуды, смоченную в горячей воде и выжатую, на пораженный участок.
- Примите безрецептурное обезболивающее. К ним относятся аспирин, ибупрофен (Адвил, Мотрин и др.), Напроксен (Алив) или ацетаминофен (Тайленол и др.). Соблюдайте осторожность, давая аспирин детям или подросткам. Хотя аспирин одобрен для использования у детей старше 2 лет, детям и подросткам, выздоравливающим после ветрянки или гриппоподобных симптомов, нельзя принимать аспирин. Если у вас есть проблемы, поговорите со своим врачом.
- Достаточно отдыхайте. Вам часто нужен отдых, чтобы помочь вылечиться от основного заболевания.
Подготовка к приему
Если у вас увеличились лимфатические узлы, вы, скорее всего, сначала обратитесь к семейному врачу. Когда вы звоните, чтобы записаться на прием, вас могут попросить немедленно обратиться за медицинской помощью, если вы испытываете серьезные симптомы, такие как затрудненное дыхание или глотание.
Вот некоторая информация, которая поможет вам подготовиться к встрече.
Что вы можете сделать
- Помните о любых ограничениях, связанных с предварительной записью. Во время записи на прием спросите, нужно ли вам что-нибудь сделать заранее.
- Перечислите любые симптомы, которые вы испытываете, и как долго. Помимо других симптомов, ваш врач захочет узнать, были ли у вас симптомы гриппа, такие как лихорадка или боль в горле, и может спросить, заметили ли вы изменения в своем весе. Включите в свой список все симптомы, от легких до тяжелых, которые вы заметили с тех пор, как ваши лимфатические узлы начали увеличиваться.
- Составьте список всех недавних контактов с возможными источниками инфекции. Это могут быть поездки за границу, походы в районы, где обитают клещи, употребление в пищу недоваренного мяса, почесывание кошкой или участие в рискованном сексуальном поведении или сексе с новым партнером.
- Составьте список вашей ключевой медицинской информации, , включая другие заболевания, от которых вы лечитесь, и названия лекарств, которые вы принимаете. Включите все рецептурные и безрецептурные препараты, которые вы принимаете, а также все витамины и добавки.
- Список вопросов, которые нужно задать своему врачу.
При увеличении лимфатических узлов врачу следует задать следующие основные вопросы:
- Что вызывает мои симптомы?
- Какие еще возможные причины моих симптомов?
- Какие тесты мне нужны?
- Какое лечение вы рекомендуете?
- Как быстро я почувствую себя лучше?
- Я заразен? Как я могу снизить риск заражения других?
- Как я могу предотвратить это в будущем?
- У меня другие проблемы со здоровьем.Нужно ли мне менять методы лечения, которые я использую?
- Есть ли альтернатива лекарству, которое вы мне прописываете?
- Есть ли у вас какие-нибудь брошюры или другие печатные материалы, которые я могу взять с собой? Какие сайты вы рекомендуете?
Чего ожидать от врача
Ваш врач, скорее всего, задаст вам ряд вопросов, например:
- Каковы ваши симптомы?
- Когда у вас впервые появились симптомы?
- Увеличились ли ваши пораженные лимфатические узлы со временем?
- Болезненность пораженных лимфатических узлов?
- Были ли у вас жар или ночная потливость?
- Вы похудели без всяких попыток?
- У вас болит горло или затруднено глотание?
- Испытывали ли вы затруднения с дыханием?
- Изменились ли ваши привычки к кишечнику?
- Какие лекарства вы принимаете в настоящее время?
- Вы недавно были в другой стране или в районах, населенных клещами? Заболел ли кто-нибудь, кто путешествовал с вами?
- Были ли вы недавно знакомы с новыми животными? Вас укусили или поцарапали?
- Были ли у вас недавно половые контакты с новым партнером?
- Практикуете ли вы безопасный секс? Делали ли вы это с тех пор, как стали вести половую жизнь?
- Вы курите? На сколько долго?
Что вы можете сделать тем временем
Пока вы ждете приема, если ваши опухшие узлы вызывают боль, попробуйте облегчить дискомфорт, используя теплые компрессы и болеутоляющее средство OTC , такое как ибупрофен (Advil, Motrin IB, другие) или ацетаминофен (Тайленол, другие).
09 октября 2019 г.
Показать ссылки- Fletcher RH. Оценка периферической лимфаденопатии у взрослых. https://www.uptodate.com/contents/search. По состоянию на 3 сентября 2019 г., .
- Jameson JL, et al., Eds. Увеличение лимфатических узлов и селезенки. В: Принципы внутренней медицины Харрисона. 20-е изд. Компании Макгроу-Хилл; 2018. https://accessmedicine.mhmedical.com. По состоянию на 3 сентября 2019 г., .
- Лимфаденопатия.Руководство Merck Professional Version. https://www.merckmanuals.com/professional/cardiovascular-disorders/lymphatic-disorders/lymphadenopathy#. По состоянию на 3 сентября 2019 г., .
- Papadakis MA, et al., Eds. Лимфангит и лимфаденит. В: Текущая медицинская диагностика и лечение, 2019. 58-е изд. McGraw-Hill Education; 2019. https://accessmedicine.mhmedical.com. По состоянию на 3 сентября 2019 г., .
- Американское онкологическое общество. Лимфатические узлы и рак. https://www.cancer.org/cancer/cancer-basics/lymph-nodes-and-cancer.html. По состоянию на 3 сентября 2019 г., .
Связанные
Связанные процедуры
Показать другие связанные процедурыПродукты и услуги
Показать больше продуктов и услуг Mayo ClinicРост и иммунное уклонение от метастазов лимфатических узлов
Front Oncol.2018; 8: 36.
Деннис Джонс
1 Лаборатории Эдвина Л. Стила по биологии опухолей, Отделение радиационной онкологии, Онкологический центр MGH, Массачусетская больница общего профиля, Бостон, Массачусетс, США
2 Гарвардская медицинская школа, Бостон, Массачусетс, США
Этель Р. Перейра
1 Лаборатории Эдвина Л. Стила по биологии опухолей, Отделение радиационной онкологии, Онкологический центр MGH, Массачусетская больница общего профиля, Бостон, Массачусетс, США
2 Гарвардская медицинская школа, Бостон, Массачусетс, США
Тимоти П.Падера
1 Лаборатории биологии опухолей Эдвина Л. Стила, Отделение радиационной онкологии, Онкологический центр MGH, Массачусетская больница общего профиля, Бостон, Массачусетс, США
2 Гарвардская медицинская школа, Бостон, Массачусетс, США
1 Лаборатории Эдвина Л. Стила по биологии опухолей, Отделение радиационной онкологии, Онкологический центр MGH, Массачусетская больница общего профиля, Бостон, Массачусетс, США
2 Гарвардская медицинская школа, Бостон, Массачусетс, США
Под редакцией Автор: Триантафиллос Стилианопулос, Кипрский университет, Кипр
Рецензент: Марк Эйчен, Онкологический центр Питера МакКаллума, Австралия; Нэнси Х.Раддл, Йельский университет, США
Специальная секция: эта статья была отправлена в раздел «Молекулярная и клеточная онкология» журнала «Границы в онкологии»
Поступила в редакцию 18 ноября 2017 г .; Принято 1 февраля 2018 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (CC BY). Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора (авторов) и правообладателя и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой.Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья цитируется в других статьях в PMC.Abstract
Онкологические больные с метастазами в лимфатические узлы (ЛУ) имеют худший прогноз, чем пациенты без лимфатических узлов. Однако, почему метастазы в LN коррелируют с уменьшением выживаемости пациентов, недостаточно изучено. Недавние открытия дают представление о механизмах, лежащих в основе роста опухоли в LNs. Опухолевые клетки и их секретируемые молекулы взаимодействуют с стромальными, миелоидными и лимфоидными клетками первичных опухолей и лимфатической системы, снижая противоопухолевый иммунитет и способствуя росту опухоли.Понимание механизмов выживания рака и роста LN является ключом к разработке эффективной терапии для ликвидации метастазов LN. Кроме того, выявление последствий метастазов в ЛУ для системной опухолевой нагрузки будет способствовать принятию решений о лечении. В этом обзоре мы обсуждаем современные знания о посеве, росте и дальнейшем распространении метастазов LN.
Ключевые слова: лимфатические узлы, лимфатический узел, опухоль, метастазы, иммунитет
Введение
Метастазы являются основной причиной смерти от рака (1) и представляют сложную клиническую проблему.Лимфатические узлы (ЛУ) являются частыми местами метастазирования, и узловая болезнь предсказывает повышенную смертность при многих типах рака. Между тем, LN имеют решающее значение для инициирования противоопухолевого иммунного ответа. Таким образом, раковые клетки, которые метастазировали в LN, должны избегать иммунного обнаружения, чтобы избежать разрушения. Процесс лимфатического метастазирования регулируется на нескольких этапах и несколькими разными молекулами (рисунки и, соответственно), начиная с оркестровки лимфангиогенеза и подготовки микроокружения LN, благоприятного для роста опухоли (преметастатическая ниша).Затем раковые клетки проникают в ассоциированные с опухолью лимфатические сосуды в первичном участке на пути к дренирующим опухоль LN (TDLN), где они выживают и растут. В метастатическом узле иммунологическое разрушение раковых клеток зависит от степени иммуногенности раковых клеток и степени узловой иммуносупрессии. Подобно первичным опухолям, раковые клетки в LN формируют свое взаимодействие с иммунной системой хозяина, контролируя инфильтрацию и реактивность иммунных клеток. Локальное микроокружение ЛУ также определяет рост и реакцию метастазов ЛУ на терапевтическое вмешательство.Например, лишь небольшая часть системно доставленных лекарств накапливается в LN (2). Определение эффективной терапии метастазов в LN приобретает новую актуальность, поскольку раковые клетки в LN также могут распространяться в другие места метастазирования лимфатическим или гематогенным путем. В этом обзоре мы суммируем недавний прогресс в понимании лимфатических метастазов и метастатического разрастания. Мы также обсуждаем последствия лимфатических метастазов и терапевтических усилий по нацеливанию на поражения LN в экспериментальных моделях мышей и людей.
Прогрессирование лимфатических метастазов от первичной опухоли к лимфодренажным лимфатическим узлам (TDLN). Первичные опухоли индуцируют лимфангиогенез, способствуя лимфатическим метастазам и высвобождению иммуномодулирующих молекул, включая экзосомы, что приводит к иммуносупрессии TDLN. Лимфатические эндотелиальные клетки (LEC) лимфатических узлов (LN) захватывают опухолевый антиген и толеризуют Т-клетки посредством запрограммированной экспрессии лиганда смерти 1 . Связанные с опухолью лимфатические сосуды и третичные лимфоидные органы участвуют в подавлении иммунитета и активации иммунной системы.Венулы с высоким содержанием эндотелия, обнаруженные в первичных опухолях, могут способствовать инфильтрации наивных Т-клеток, которые могут далее дифференцироваться в эффекторные Т-клетки. Связанные с опухолью лимфатические сосуды привлекают как раковые, так и иммунные клетки, высвобождая хемоаттрактанты (см. Рисунок). Раковые клетки, Т-клетки и дендритные клетки проникают в лимфатические капилляры и мигрируют через собирающие лимфатические сосуды в ЛУ. Раковые клетки в лимфатических сосудах могут прикрепляться к лимфатическому эндотелию на пути к LN. Активные механизмы, такие как передача сигналов CCL1 / CCR8, контролируют проникновение раковых клеток в LN.Поликлональные раковые клетки пролиферируют с образованием метастатического поражения, которое проникает глубже в паренхиму ЛУ, где оно может расти и заменять ткань ЛУ в отсутствие роста новых кровеносных сосудов. Иммунный ответ на растущее метастатическое поражение ограничен; некоторые иммунные клетки исключены из поражений LN, в то время как другие иммунные клетки присутствуют, но не могут уничтожить раковые клетки (не показаны). Некоторые раковые клетки могут выходить через эфферентные лимфатические сосуды и вторичные дренирующие лимфатические узлы. Недавние данные свидетельствуют о том, что LEC сфингозин-1-фосфат (S1P) помогает формировать противоопухолевый иммунный ответ.
Лимфатические сосуды, связанные с опухолью, способствуют метастазированию и прогрессированию рака. (i) Связанные с опухолью макрофаги и раковые клетки секретируют VEGF-C и VEGF-D, которые связываются с VEGFR-2/3 в лимфатических капиллярах, опосредуя лимфангиогенез. VEGF-C усиливает продукцию CCL21 лимфатическими эндотелиальными клетками (LEC). CCL21 привлекает раковые клетки, Т-клетки и дендритные клетки (DC), которые экспрессируют CCR7, рецептор CCL21. Также было показано, что VEGF-C повышает экспрессию CXCR4 на LEC. Ось CXCL12 – CXCR4 может стимулировать лимфангиогенез, способствуя миграции раковых клеток.Альтернативно, LEC способствуют миграции CXCR4-положительных раковых клеток путем секреции CXCL12. Опухолевый антиген доставляется в лимфатические узлы, дренирующие опухоль, где он представляется Т-клеткам посредством DC и LEC. (ii) Связывание LEC-лиганда 1 запрограммированной смерти (PD-L1) с Т-клеточным рецептором PD-1 индуцирует толерантность Т-клеток CD8 к опухолевым антигенам.
Лимфатические эндотелиальные клетки (LEC) и опухолевый иммунитет
Медиаторы иммуносупрессии
Недавние исследования показывают, что лимфатические сосуды не только служат воротами для распространения опухоли, но и способствуют росту опухоли за счет подавления иммунитета (3).Чтобы вызвать противоопухолевый Т-клеточный ответ, мигрирующие дендритные клетки (ДК) из первичных опухолей перекрестно праймируют наивные Т-клетки в TDLN (4). Лиганд адгезии Mac-1 на ДК может связываться с молекулой адгезии, молекулой межклеточной адгезии-1 (ICAM-1), которая активируется на эндотелиальных клетках собирающих лимфатические сосуды в ответ на воспаление (5), включая воспаление, вызванное микроокружением опухоли. . Это взаимодействие Mac-1 / ICAM-1 ингибирует созревание ДК (5) и может притуплять способность ДК в воспаленном микроокружении опухоли примировать противоопухолевые Т-клетки.LEC дополнительно ингибируют противоопухолевые Т-клеточные ответы, индуцируя толерантность к опухолевым антигенам. LEC могут собирать опухолевые и другие периферические антигены и перекрестно презентировать их Т-клеткам CD8, но LEC не имеют костимулирующих молекул, необходимых для полной активации Т-клеток CD8 (6). Лиганд запрограммированной смерти 1 (PD-L1), лиганд для рецептора PD-1, ингибирующего Т-клетки, экспрессируется на лимфатических сосудах, ассоциированных с опухолью (7), и LEC LN (8). Взаимодействие PD-L1 на LEC с PD-1 Т-лимфоцитов индуцирует толерантность Т-лимфоцитов CD8 к опухолевым антигенам (7, 8).Учитывая нехватку противоопухолевых Т-клеток и функциональных лимфатических сосудов в некоторых опухолях (9, 10), степень взаимодействия Т-лимфоцитов CD8 с лимфатическими сосудами, ассоциированными с опухолью, и их степень подавления противоопухолевого иммунитета остается неясной. Недавние исследования показывают, что присутствие LEC внутри опухолей делает опухоли более чувствительными к терапии анти-PD-1, предполагая, что лимфатические сосуды могут оказывать мощное ингибирующее действие на функцию Т-клеток (11).
В нормальной физиологии LEC продуцируют сфингозин-1-фосфат (S1P), который секретируется в лимфу и контролирует выход лимфоцитов из LN (12).Нейтрализация системного S1P терапевтическим антителом подавляет метастазирование в легкие (13). Совсем недавно с помощью полногеномного функционального скрининга был идентифицирован гомолог 2 S1P транспортера старой девы ( Spns2 ) в качестве регулятора метастатической колонизации у животных с экспериментальными метастазами в легкие (14). Spns2 экспрессируется на LEC и является критическим для высвобождения LEC S1P (15). Глобальная и лимфатическая делеция Spns2 уменьшала легочные метастазы после внутривенной инъекции опухолевых клеток, с меньшим количеством общих Т-клеток, присутствующих в легких по сравнению с мышами WT (14).Однако более высокая пропорция эффекторных Т-клеток памяти к регуляторным Т-клеткам (Treg) была обнаружена в легких животных с дефицитом Spns2 (14). В сочетании с усиленной активацией Т-клеток KLRG1 + , CD69 + CXCR3 + , эти данные свидетельствуют об адаптивном иммунном ответе против метастазов в легких (14). Кроме того, популяция естественных киллеров (NK) в легких животных с дефицитом Spns2 увеличивалась и ограничивала рост метастазов в легких даже после истощения Т-лимфоцитов CD8 (16).Напротив, передача сигналов S1P может способствовать противоопухолевым Т-клеточным ответам. LEC-продуцируемый S1P, по-видимому, функционирует не только как регулятор циркуляции лимфоцитов, но также поддерживает выживание наивных CD4 T-клеток, поддерживая их митохондриальное содержание посредством механизма, зависимого от рецептора S1P 1 (16). Нацеливание передачи сигналов S1P на уменьшение метастатической нагрузки требует лучшего понимания его временной и пространственной роли в формировании противоопухолевых Т-клеточных ответов.
Хемокин CCL21 производится LEC и мобилизует DC в LN (17).Хотя CCL21 также может создавать иммуносупрессивное микроокружение опухоли (18), недавно было показано, что лимфатические сосуды, связанные с опухолью, также способствуют привлечению наивных Т-клеток в опухоли меланомы за счет продукции CCL21 (11). Присутствие Т-клеток обеспечивает местное иммунное праймирование и способность проявлять мощную противоопухолевую активность в ответ на вакцинацию или блокаду иммунных контрольных точек (11). Таким образом, хотя LEC и CCL21 сами по себе помогают подавлять противоопухолевые иммунные ответы, их способность привлекать Т-клетки сенсибилизирует лимфангиогенные опухоли к иммунотерапии.Больные раком с повышенным уровнем VEGF-C (что свидетельствует об увеличении лимфангиогенеза и лимфатических метастазах) обычно имеют плохой прогноз. Основываясь на недавних данных, VEGF-C [который активирует CCL21 (19)] теперь может использоваться в качестве биомаркера у этих пациентов для прогнозирования их ответа на иммунотерапию. Способность Т-клеток с эффекторной функцией покидать первичные опухоли и перемещаться в TDLN через афферентные лимфатические сосуды также предполагает, что лимфатические сосуды, связанные с опухолью, могут способствовать замедлению роста опухоли (20).
Приведенные выше примеры иллюстрируют потенциал для зависящего от контекста преимущества ингибирования, изменения или использования внутренних свойств LEC для максимизации эффективных противоопухолевых иммунных ответов.
Лимфангиогенез
Лимфангиогенез является отличительной чертой многих солидных опухолей. Расширение лимфатической сети в первую очередь опосредуется VEGF-C и его рецепторами VEGFR-2/3 (21). VEGF-D также связывает VEGFR-2/3 и сильно индуцирует лимфангиогенез (22, 23). Экспрессия как VEGF-C, так и VEGF-D коррелирует с увеличением метастазов в LN (24).Кроме того, мыши с дефицитом Vegf-d проявляли меньше лимфатических метастазов по сравнению с мышами дикого типа с опухолью (25). Многие доклинические исследования показали предотвращение лимфатических метастазов путем блокирования VEGF-C или VEGF-D-опосредованного лимфангиогенеза (26–28). Клинически этот момент вмешательства является сложным, поскольку лимфангиогенез является ранним событием в естественной истории прогрессирования рака, и у многих пациентов уже будут метастазы в LN при первичном обращении. Однако могут существовать дополнительные возможности для нацеливания на лимфангиогенез.Например, лимфангиогенез был идентифицирован как механизм устойчивости опухоли к химиотерапии паклитакселом у мышей (29). В ответ на паклитаксел на моделях мышей инфильтрирующие опухоль макрофаги секретируют катепсин, который активирует гепараназу. Активная гепараназа с помощью неизвестных механизмов увеличивает как транскрипцию VEGF-C, так и инвазивность опухоли (30). В другом исследовании мышей-репортеров VEGFR-3 использовали для визуализации лимфангиогенеза в удаленных ЛУ, печени, легких и селезенке у мышей с опухолями. После резекции опухоли уровни VEGFR-3 снизились, но вновь появились перед рецидивом опухоли, что указывает на определенное окно возможностей для ингибирования лимфангиогенеза в дистальных отделах преметастазов (31).
Хотя существует множество мишеней для ингибирования лимфангиогенеза (32), многие исследования показывают, что передача сигналов VEGF-C / -D-VEGFR-2/3 прямо или косвенно способствует лимфангиогенезу в ответ на широкий спектр стимулов (22). , 24, 25). Удивительно, но несколько клинических испытаний, нацеленных на лимфатический эндотелий при раке, продолжаются, хотя несколько небольших молекул, которые неизбирательно нацелены на VEGFR-3-опосредованный лимфангиогенез, одобрены при показаниях к раку (33). Недавно было завершено исследование фазы I, в котором оценивалось влияние LY3022856 (IMC-3C5), моноклонального антитела, нацеленного на человеческий VEGFR-3, на колоректальный рак (CRC) (34).В то время как LY3022856 хорошо переносился в данной дозе, у пациентов с CRC отмечалось минимальное противоопухолевое действие. Влияние LY3022856 на лимфангиогенез опухоли и лимфатические метастазы не оценивалось. Как упоминалось ранее, ингибирование лимфангиогенеза путем нацеливания на VEGF-C / D или VEGFR-3 также осложняется неопределенностью влияния лимфатических сосудов на противоопухолевые ответы Т-клеток (11).
Независимо от роста лимфатических сосудов и лимфангиогенеза, VEGF-C может способствовать метастазированию рака за счет разрушения комплекса сосудистого эндотелия кадгерин / β-катенин в межклеточных соединениях LEC (35).Авторы пришли к выводу, что повышенная проницаемость лимфатических сосудов кишечника, вызванная VEGF-C, может увеличивать трансмиграцию и метастазирование CRC. Таким образом, то, как терапия, направленная на передачу сигналов VEGF-C / D, будет влиять на прогрессирование рака, будет зависеть от конкретного контекста заболевания, а также от других терапий, используемых вместе.
Создание преметастатической ниши в TDLN
Внеклеточные везикулы (EV)
Помимо доставки клеток лимфатические сосуды доставляют первичные растворимые и связанные с везикулами факторы, полученные из опухоли, для кондиционирования TDLN до прибытия раковых клеток.Было показано, что экзосомы, разновидность ЭВ, модулируют иммунный и стромальный ответ в TDLN (36, 37). Клетки меланомы, введенные в подушечку стопы и захваченные местными лимфатическими сосудами, имели сходный характер распределения с экзосомами, происходящими от преметастатической меланомы, ранее введенными в подушечку стопы, что позволяет предположить, что экзосомы влияют на рекрутирование раковых клеток в ЛУ (38). Механически экзосомы активировали гены-хозяева, которые способствовали удержанию, привлечению и прогрессированию метастазов LN (38).Неясно, какие компоненты экзосомального груза (например, мРНК, миРНК или белки) были необходимы для изменений в экспрессии узловых генов. Также было показано, что экзосомы меланомы усиливают метастазирование, «обучая» и мобилизуя полученные из костного мозга клетки в места метастазирования (36), включая LN, где они способствуют инвазии раковых клеток. ЭВ, происходящие от меланомы, были идентифицированы в афферентных лимфатических сосудах пациентов (39). Совместное культивирование ЭВ из клеток меланомы человека с ДК привело к ингибированию созревания ДК (39).В преметастатических ЛУ макрофаги субкапсулярного синуса (SCS) CD169 + захватывают внеклеточные везикулы опухолевого происхождения (TeV) (40) и защищают LN хозяина от TeV-опосредованной иммуносупрессии. Высвобождение ТэВ требовалось для ускорения прогрессирования опухоли после того, как исследователи истощили макрофаги хозяина. Однако неясно, как TeV могут избежать захвата макрофагами SCS, чтобы доставить свою полезную нагрузку в нормальных условиях. В отличие от проопухолевых эффектов EV, мигрирующие DC приобретают секретируемые опухолью пузырьки, высвобождаемые циркулирующими опухолевыми клетками в легких (41).Отсюда нагруженные везикулами DCs мигрируют в LN средостения, чтобы взаимодействовать с противоопухолевыми Т-клетками и потенциально активировать их для ограничения роста метастазов. Взятые вместе, эти данные предполагают, что TeV обладают иммунорегулирующими функциями, а также помогают инициировать и поддерживать рост метастазов LN.
Лимфатические сосуды в преметастатических ЛУ
Известно, что лимфангиогенез происходит в преметастатических ЛУ (42, 43). Узловой лимфангиогенез, как было показано, не зависит от опухолевого антигена и зависит от В-клеток (42, 44) за счет продукции VEGF-A и VEGF-C (43–46).Недавно мидкин, гепарин-связывающий фактор, продуцируемый опухолевыми клетками, был идентифицирован как критический фактор для mTOR-зависимого лимфангиогенеза в преметастатических участках, включая кожу, LN, селезенку и легкие (31). Кроме того, мидкин опосредовал адгезию опухолевых клеток к LEC и способствовал колонизации опухолью отдаленных органов.
Неясно, как лимфангиогенез LN приводит к метастазированию. Одна из гипотез состоит в том, что лимфангиогенез LN может приводить к более эффективной доставке раковых клеток к LN и отдаленным органам (47).Этому может способствовать усиление лимфотока, которое сопровождает усиление лимфангиогенеза LN (42). Повышенный лимфодренаж от первичных опухолей также был связан с увеличением LN (48) и ремоделированием узлов, что может изменить распределение антигена и растворимых факторов. Повышенный лимфодренаж также совпал с отложением коллагена и гиалуроновой кислоты в преметастатических TDLN опухолей B16F10. Родительские клетки меланомы B16 не могут увеличивать ремоделирование матрикса TDLN и неэффективны при метастазировании, что позволяет предположить, что в дополнение к лимфангиогенезу увеличение матрикса TDLN может быть предпосылкой для образования метастазов LN (48, 49).
Фибробластные ретикулярные клетки
LN содержит массив стромальных клеток, включая фибробластные ретикулярные клетки (FRC). Многое известно об опухолевых эффектах фибробластов, связанных с раком, но лишь несколько сообщений охарактеризовали реакцию FRC на раковые клетки. Транскрипционное профилирование FRC от животных, не несущих опухоли, выявило обильную экспрессию хемокинов, критических для рекрутирования лимфоцитов, включая CCL19, CCL21, CXCL12 и CXCL13 (50).FRC также продуцируют несколько форм коллагена (50), что указывает на их роль в формировании системы кондуита, доставляющей небольшие антигены глубоко в LN для презентации антигена (51). FRC экспрессируют гены, необходимые для презентации MHC класса 1/2 (50), и могут представлять периферические антигены Т-клеткам (52). Подобно LEC, FRC вносят вклад в периферическую толерантность, облегчая делеционную толерантность (52, 53) и подавляя пролиферацию эффекторных Т-клеток (54, 55). Недавний транскрипционный анализ показал, что FRC в преметастатических LN «перепрограммированы», чтобы способствовать росту опухоли (56).В спонтанных и ортотопических моделях меланомы FRC TDLN пролиферировали, но продуцировали меньше IL-7 и CCL21 , которые имеют решающее значение для выживания Т-клеток и руководства, соответственно. Уменьшение количества IL-7 и CCL21 привело к нарушению архитектуры TDLN с потерей четкого разграничения между B- и T-клеточными зонами. В отдельном исследовании потеря FRC CCL21 в TDLN была связана с дезорганизованными зонами Т-клеток и В-клеток в преметастатических ЛУ (57).Нарушение архитектуры LN из-за измененных сигнальных молекул FRC предполагает изменение иммунных ответов на опухоли. Поскольку LN являются первичными сайтами для адаптивных иммунных ответов, неупорядоченная архитектура LN может не вызывать системной защиты от последующих клонов гетерогенных раковых клеток, которые прибывают в TDLN (56). В метастатических ЛУ выработка коллагена была увеличена по сравнению с ЛУ без опухолей (58). Хотя неясно, являются ли рекрутированные фибробласты, FRC или раковые клетки источником дополнительного коллагена, исследователи предполагают, что повышенная плотность коллагеновых волокон может позволить раковым клеткам прилипать и мигрировать в метастатических LN.Неизвестно, как опухолевые клетки влияют на статус транскрипции FRC.
Миграция опухолевых клеток в LN
Раковые клетки проникают в лимфатические сосуды и перемещаются вместе с лимфой, вызывая метастазы в LN (59). Раковые клетки могут активно мигрировать в лимфатические капилляры в ответ на молекулярные сигналы (19, 60) или пассивно проникать в лимфатические капилляры (19, 60). Метастазирование в LN, вероятно, зависит от комбинации внутренних свойств раковых клеток и сигналов в микросреде опухоли.И VEGF-C, и лимфатический поток активируют CCL21 в лимфатическом эндотелии (19, 61), привлекая опухолевые клетки CCR7 + (62). В модели трижды отрицательного рака молочной железы CCL21 было достаточно для рекрутирования врожденных лимфоидных клеток (ILC) RORγt + в первичную опухоль и стимулирования метастазирования в LN (63). Более того, CXCL13 необходим для кластеризации ILC и индукции эпителиально-мезенхимального перехода, вероятно, управляя инвазией раковых клеток. У пациентов с раком молочной железы наличие ИЛК было значительно связано с лимфатической инвазией в первичной опухоли.
Несколько исследований показали, что другой хемокин, CXCL12, способствует лимфатическому метастазированию опухолевых клеток CXCR4 + (64–66). Экспрессия CXCL12 обнаруживается на лимфатических сосудах в первичных опухолях и направляет клетки меланомы CXCR4 + к лимфатическим сосудам. Миграция и инвазия клеток папиллярной карциномы щитовидной железы CXCR4 + зависят от CXCL12, который продуцируется стареющими раковыми клетками на границе инвазии (67). Эти стареющие клетки проникали в лимфатические сосуды и сохранялись в метастатических очагах, предполагая, что они могут способствовать лимфатическим метастазам.CXCR4 также экспрессируется на поверхности LEC (68) и имеет решающее значение для лимфангиогенеза посредством стимуляции CXCL12, независимо от пути VEGFR-3 (68). Таким образом, нацеливание на CXCR4 / CXCL12 может обеспечить двойное преимущество ингибирования миграции раковых клеток и лимфангиогенеза для сдерживания лимфатических метастазов.
Считается, что после попадания раковых клеток в лимфатические сосуды поток лимфы позволяет раковым клеткам проходить через собирающую сеть лимфатических сосудов, пока они не достигнут TDLN (59).На основе 3D-моделирования было предсказано, что меньшие клетки рака груди могут иметь преимущество в выживаемости по сравнению с более крупными клетками рака груди в лимфатической циркуляции из-за более низкого напряжения сдвига стенки, с которым они сталкиваются (69). Несколько исследований показали, что воспаление вызывает расширение и подавляет сократительную способность лимфатических сосудов (70, 71). Необходимо проделать дополнительную работу, чтобы определить, усиливает ли индуцированное опухолью собирательное расширение лимфатических узлов (10, 22, 59) или уменьшение сокращения (72) распространение опухолевых клеток за счет снижения напряжения сдвига на раковые клетки.Известно, что опухолевые клетки могут задерживаться в лимфатических сосудах во время «транзита» к LN (73). Нарушение целостности барьера лимфатических сосудов может позволить задержанным раковым клеткам выйти из лимфатических сосудов и образовать метастазы (74, 75). Для лечения транзитных метастазов необходима дополнительная характеристика механизма прикрепления опухолевых клеток к лимфатическому эндотелию и их роста в лимфатических сосудах.
Недавно было продемонстрировано, что хемокин CCL1 и его рецептор CCR8 важны для проникновения клеток меланомы в TDLN.CCL1 продуцируется LEC SCS и опосредует проникновение клеток меланомы CCR8 + в LN (60). Опухолевые клетки в SCS могут также обходить паренхиму LN и дренировать через кортикальные и мозговые синусы, чтобы выйти из LN через эфферентных лимфатических сосудов (76). Фермент липоксигеназа 15 (ALOX15) метаболизирует арахидоновую кислоту до 12 (S) -гидроксиэйкозатетраеновой кислоты [12 (S) -HETE] и 15 (S) -гидроксиэйкозатетраеновой кислоты [15 (S) -HETE]. 12 (S) -HETE, полученный из раковых клеток, образует разрывы в стенках лимфатических сосудов, позволяя метастазам LN проникать в узловые лимфатические сосуды (77).Судьба этих раковых клеток неясна, хотя сообщалось, что лимфангиогенез TDLN участвует в дальнейшем лимфатическом распространении рака груди человека (78), а наличие инвазии лимфатических сосудов метастазами LN связано с худшей выживаемостью (79). Возможно, что раковые клетки циркулируют в дополнительных узлах через лимфатические сосуды и в конечном итоге попадают в системный кровоток через грудной проток.
Иммунное уклонение в TDLN
Макрофаги
Макрофаги SCS лимфатических узлов являются первой линией защиты от опухолевых клеток, проникающих в LN.Макрофаги SCS захватывают микробы, комплексы антиген-антитело и мертвые раковые клетки для доставки этих антигенов к ближайшим иммунным клеткам (80, 81). В преметастатических LN экспериментальный антиген (флуоресцентный белок, сверхэкспрессируемый в опухолевых клетках) из первичной опухоли захватывается макрофагами SCS и распределяется по фолликулярным DC, что приводит к продукции антител против антигена (82). Макрофаги SCS также могут напрямую перекрестно презентовать опухолевые антигены Т-клеткам CD8 (81). Макрофаги синуса в региональных ЛУ пациентов с CRC вступали в прямой контакт с Т-лимфоцитами CD8, и высокая плотность макрофагов синуса связана с увеличением общей выживаемости (83).С другой стороны, макрофаги, связанные с опухолью, часто связаны с плохим прогнозом и способствуют росту опухоли (84). Стратегии истощения ТАМ включают нацеливание на рецептор колониестимулирующего фактора 1 (CSF1-R) (85), который контролирует хемотаксис макрофагов. Интересно, что увеличение количества метастазов в LN было обнаружено после лечения антителом против CSF1-R (86). Это увеличение метастатической нагрузки было связано с потерей макрофагов SCS из-за терапии анти-CSF1-R (86). Стратегии истощения опухолевых макрофагов (M2) должны исследовать влияние на макрофаги SCS, чтобы избежать непреднамеренного роста метастазов LN.
Нейтрофилы
Нейтрофилы, такие как макрофаги, неоднородны и, как сообщается, обладают проопухолевым или противоопухолевым фенотипом в первичных опухолях (87). Высокие уровни нейтрофилов, ассоциированных с опухолью, связаны с метастазами в ЛУ и плохим прогнозом (88). Гранулоцитарный колониестимулирующий фактор был необходим для расширения и поляризации нейтрофилов до иммуносупрессивного фенотипа у мышей с опухолями молочной железы (89). Иммуносупрессивные нейтрофилы, экспансия которых также была вызвана IL-17, были способны подавлять цитотоксические Т-клетки и способствовать образованию метастазов LN.Нейтрофилы также могут секретировать провоспалительные лейкотриены и инициировать метастазы LN через лейкотриеновые рецепторы (LTR) на раковых клетках (90). Экспрессия LTR была обнаружена в когорте первичных опухолей и опухолей LN от пациентов с раком молочной железы. Необходимы дополнительные исследования, чтобы охарактеризовать фенотип нейтрофилов, обнаруженных в метастазах LN, и их роль в прогрессировании метастазов.
Т-клетки
TDLN часто не в состоянии обеспечить эффективный противоопухолевый иммунитет и вместо этого способствует толерантности пациента к опухолевым антигенам (91).Механизмы, индуцирующие системную толерантность, включают перекрестную презентацию опухолевого антигена толерогенными антигенпрезентирующими клетками, апоптоз антигенпрезентирующих клеток (92) и подавление противоопухолевых Т-клеток расширенным пулом Treg. Экспериментально подкожная инъекция меланомы B16 привела к толеризованным CD8 T-клеткам и летальному метастатическому росту (93). Однако клетки B16, имплантированные непосредственно в LN — без первичной опухоли — были отвергнуты, что подтверждает предыдущие данные (94), которые показали, что первичная опухоль оказывает толерогенный эффект на TDLN (94).Однако начальные метастатические отложения в лимфоидных органах важны для индукции противоопухолевых CD8 Т-клеток и отторжения опухоли (94). В частности, было показано, что опухолевые клетки, введенные в LN с использованием различных моделей рака, сохраняются и распространяются в отдаленные органы (95). Эти различия можно объяснить такими факторами, как иммуногенность и способность различных раковых клеток к презентации антигена. Повышенное количество метастазов в LN было обнаружено у онкологических больных с подавлением опухолью MHC I (96).
NK-клетки
Естественные клетки-киллеры — это цитотоксические лимфоциты врожденной иммунной системы, которые часто участвуют в опухолях, включая простату (97), меланому, почки, печень и грудь (98). NK-клетки способны распознавать и устранять клетки с аберрантным лигандом или измененной / отсутствующей экспрессией MHC (99, 100). Однако инфильтрация NK-клеток в первичные опухоли ограничена; NK-клетки, попадающие в опухоли, часто обнаруживаются в строме первичной опухоли и не имеют прямого контакта с раковыми клетками (98).Аналогичным образом, NK-клетки в метастатических LNs были смежными с поражениями метастатической меланомы (101). Более того, NK-клетки, выделенные из метастатических LN человека, показали значительно сниженную цитотоксичность (101, 102). NK-клетки, выделенные из метастатических поражений LN и стимулированные IL-2 или IL-15, показали более эффективный лизис раковых клеток (101), что свидетельствует о том, что микроокружение LN опухоли подавляет функцию NK-клеток. Таким образом, несмотря на их присутствие в TDLN, иммунодепрессивные NK-клетки могут не обладать способностью уничтожать раковые клетки.
B-клетки
Количество B-клеток в дометастатических TDLN значительно увеличивается (42). ЭВ из опухолевых клеток увеличивали иммуносупрессивные В-клетки в преметастатических ЛУ (40). Истощение SCS-макрофагов у животных с опухолями позволило взаимодействовать TeV с В-клетками и привело к увеличению продукции антител. Хотя специфичность антител к опухолевому антигену неизвестна, передача этих антител мышам-реципиентам дикого типа коррелировала с усилением роста опухоли по сравнению с переносом антител от животных, несущих опухоль, без разрушения макрофагов SCS.Регуляторные B-клетки (Breg) были недавно идентифицированы в крови мышей и людей, а также во вторичных лимфоидных органах (103). Breg могут секретировать иммуносупрессивные цитокины, такие как TGF-β и IL-10 (104), чтобы ослабить эффекторную активность противоопухолевых Т-клеток. Однако данные противоречат друг другу относительно того, поддерживают или подавляют рост опухоли Breg (105). Фенотипические маркеры, идентифицирующие Breg, также остаются неясными.
Вместе эти данные предполагают, что несколько типов иммунных клеток в преметастатических и метастатических LN обладают субоптимальной активностью в отношении уничтожения раковых клеток.Идентификация молекулярных мишеней для обратного подавления иммунитета нескольких типов клеток будет иметь терапевтическое преимущество при лечении метастатического рака.
Ectopic ln Immunity
Высокие эндотелиальные венулы (HEV) и их гомеостатически связанные хемокины имеют решающее значение для проникновения наивных лимфоцитов в LN (106). Внематочные HEV при первичном раке груди человека и опухолях меланомы допускают интравазацию лимфоцитов и предсказывают благоприятный прогноз (106, 107). LTα 3 –TNFR передача сигналов, а не LTβR, была критической для генерации HEV-подобной сосудистой сети, экспрессирующей адресин периферических узлов (PNAd) в моделях рака легких и меланомы (108), изученных Peske et al.Сосудистая сеть PNAd + имела решающее значение для инфильтрации наивных Т-клеток в опухоли. Рост HEV-содержащих опухолей задерживался, хотя лечение антагонистом S1P FTY720 сохраняло опухолеспецифические Т-клетки во вторичных лимфоидных органах (108). Эти данные предполагают, что наивные Т-клетки могут дифференцироваться в эффекторные Т-клетки в первичных опухолях.
Третичные лимфоидные органы (TLO) представляют собой совокупность иммунных клеток, имитирующих структуру и функцию LN. Они образуются при нескольких заболеваниях, связанных с хроническим воспалением, включая рак (109).TLO включают лимфоциты, лимфатические сосуды и HEV (110). TLO в опухолях связаны с улучшенными результатами для пациентов и функционируют как участки иммунного прайминга для генерации противоопухолевых лимфоцитов. В моделях рака поджелудочной железы и молочной железы на животных ассоциированные с опухолью кровеносные сосуды вырабатывали маркеры HEV и формировали TLO-подобные структуры в ответ на комбинацию антиангиогенной (DC101) и иммунной контрольной терапии (PD-L1) терапии (111). Образование HEV, зависящих от передачи сигналов LTβR, привело к усилению инфильтрации и активации противоопухолевых Т-клеток, а также к лучшим противоопухолевым ответам (111).Напротив, было показано, что присутствие TLO и эктопических HEV способствует росту опухоли в других экспериментальных условиях. Финкин и др. обнаружили, что богатая цитокинами среда TLO печени способствует росту клеток-предшественников гепатоцеллюлярной карциномы на модели гепатоцеллюлярной карциномы (112). Из исследований с использованием мышиной модели рака легких Joshi et al. Обнаружили, что TLO в легких, несущих опухоль, являются местом презентации антигена (113). Однако большое количество Treg внутри TLO предположительно подавляло противоопухолевые ответы Т-клеток.Использование ингибиторов иммунных контрольных точек, таких как антитело против CTLA-4 ипилимумаб, может привести к истощению Treg (114) и может усилить противоопухолевую функцию эффекторных лимфоцитов в опухолях и TLO с высоким соотношением Treg: эффекторные Т-клетки. . В отдельном исследовании истощение Tregs приводило к внутриопухолевому образованию HEV и большему количеству активированных CD4 и CD8 T-клеток в индуцированных канцерогенами фибросаркомах, что приводило к снижению опухолевой нагрузки (115, 116). TNF-продуцирующие Т-клетки, которые передают сигналы через TNFR, имеют решающее значение для внутриопухолевого неогенеза HEV (116).
Учитывая контекстно-зависимое преимущество TLO, неясно, является ли индукция TLO жизнеспособной терапевтической стратегией для ограничения прогрессирования опухоли. Образование TLO может сопровождаться стратегией предотвращения образования Treg для создания эффективного противоопухолевого ответа. Более того, сигнальные механизмы, вызывающие образование TLO, по-видимому, зависят от различных цитокинов и рецепторов семейства лимфотоксинов / TNF, а также от местного микроокружения, что требует дальнейших исследований для построения нашего понимания.
Рост раковых клеток в LN
LN Vasculature
В первичных опухолях гипоксия связана с экспрессией VEGF, что, в свою очередь, приводит к прорастанию формирующихся кровеносных сосудов. Было показано, что первичная гипоксия опухоли увеличивает частоту метастазов в LN (117) за счет активации субъединицы интегрина α 5 , которая необходима для трехмерной миграции клеток in vitro (117). Мы и другие обнаружили гипоксические опухолевые клетки в ЛУ (118, 119). Неясно, сохраняют ли эти гипоксические раковые клетки в синусе LN этот статус, исходя из своего состояния в первичной опухоли, или же опухолевые клетки становятся гипоксическими по прибытии и пролиферации в бессосудистом синусе LN.
Ангиогенные и неангиогенно-зависимые метастазы были обнаружены в LNs и других метастатических тканях, таких как легкие и печень (120–123). Присутствие гипоксических раковых клеток коррелирует с пролиферацией эндотелиальных клеток в некоторых метастазах LN, паттерн, который можно предсказать по характеристикам первичной опухоли (124). Мы обнаружили повышенный VEGF и ангиогенез в первичных опухолях, но не обнаружили того же в метастатических LN, несмотря на присутствие гипоксических раковых клеток (118).В соответствии с выводами об отсутствии ангиогенеза в метастазах ЛУ из нашей лаборатории, другие исследования показали, что сосудистая плотность метастатических ЛУ ниже, чем у неметастатических узлов (121, 125, 126).
Хотя избыточная экспрессия VEGF ведет к расширению сети лимфатических сосудов LN (43–45, 127), ограниченное количество исследований предполагает, что VEGF или другие факторы роста влияют на количество кровеносных сосудов в LN. Сообщалось, что сверхэкспрессия VEGF увеличивает количество HEV (45).Напротив, другие сообщения демонстрируют, что VEGF только увеличивает диаметр кровеносных сосудов LN, возможно, за счет пролиферации эндотелиальных клеток существующих сосудов (43, 127). Недостаток доказательств, касающихся VEGF и индуцированного воспалением прорастающего ангиогенеза по сравнению с лимфангиогенезом, поднимает вопросы о механистическом контроле сосудистой сети LN. Во время прогрессирования метастазов в ЛУ существующая сосудистая сеть ЛУ может быть достаточной для поддержки роста опухоли. Было высказано предположение, что ангиогенез является избыточным для роста опухоли в LN из-за богатой нативной васкуляризации LN; плотность сосудов ЛУ сравнима с плотностью первичной опухоли (125).Также было высказано предположение, что ремоделированные HEV в TDLN могут лелеять установленные метастатические поражения в LNs (128). Хотя исследования VEGF в других метастатических органах требуют изучения, невосприимчивость метастазов LN к антиангиогенной терапии (59, 118) добавляет еще одно объяснение плохих результатов терапии анти-VEGF в адъювантных условиях.
Недавние исследования изучали механизмы устойчивости к антиангиогенезной терапии при метастатическом заболевании. Ингибитор тирозинкиназы сунитиниб, мишенью которого являются рецепторы VEGF, стимулировал транскрипцию и стабилизацию мРНК VEGF-C в модели ксенотрансплантата почечно-клеточной карциномы (129).В результате увеличился лимфангиогенез и лимфатические метастазы. Недавнее исследование показало, что сосудистая кооптация при метастазах рака груди в печень является еще одним механизмом устойчивости к терапии против VEGF (123). При «замещающей» модели роста метастазы в печени замещали гепатоциты и были физически связаны с синусоидальными кровеносными сосудами печени. Подавление актиновых белков 2/3 (ARP 2/3), которые опосредуют подвижность клеток рака молочной железы, эффективно ингибирует сосудистую кооперацию этих метастазов в печени.Остается определить, активен ли этот механизм сосудистой кооптации при метастазах в ЛУ. Поскольку в метастазах в печень наблюдались множественные способы роста, метастатический рост и васкуляризация могут зависеть от множества факторов, включая тип опухоли. Необходимы дальнейшие исследования, чтобы адаптировать методы лечения, направленные на рост метастазов, в том числе метастазов в LN.
Клиническое ведение и лечение метастазов в лимфатические узлы
Метастазы в лимфатические узлы являются важным прогностическим показателем для пациентов с солидными опухолями, включая меланому, рак груди и желудка.Однако роль метастазов в ЛУ в прогрессировании рака обсуждалась в клинике на протяжении десятилетий (130). Рекомендации и стратегии лечения пациентов с узловой болезнью развиваются по мере проведения клинических испытаний, направленных на улучшение способности сдерживать и лечить метастазы. До недавнего времени диссекция подмышечных лимфатических узлов (ALND) была стандартом лечения пациентов с раком груди с поражением сторожевого узла. Однако недавние клинические испытания, призванные определить пользу ALND, изменили способ лечения пациентов с раком груди.Клиническое испытание Международной группы по изучению рака груди 23-01 (IBCSG 23-01) было проведено для определения пользы ALND у пациентов с ограниченным поражением сторожевых узлов (1-2 микрометастатических узла) и опухолями менее 5 см (131). . Пятилетнее наблюдение не показало улучшения выживаемости без признаков заболевания у пациентов, перенесших БАНД, по сравнению с пациентами, которые этого не сделали. Эти результаты согласуются с исследованием ACOSOG Z0011 с участием пациентов с ограниченным поражением сторожевых узлов, перенесших операцию по сохранению груди, в котором эти пациенты были случайным образом распределены для получения либо ALND, либо без дальнейшей подмышечной хирургии (132, 133).Оба исследования предполагают, что БАНД у пациентов с ранней стадией рака молочной железы с ограниченным поражением лимфоузлов не дает преимущества в отношении выживаемости по сравнению с пациентами, не подвергавшимися БАПД. Эти испытания привели к сокращению числа пациентов с раком молочной железы, перенесших ALND, что также снизило заболеваемость, связанную с ALND. Однако все эти пациенты получали традиционную системную адъювантную терапию и лучевую терапию, которая потенциально устранила любую остаточную болезнь в ЛУ (132). Таким образом, лучевая и системная терапия может быть достаточной для контроля лимфоузлов, что делает ALND ненужной для пациентов с раком груди с ограниченным поражением LN.
Чтобы проверить эту гипотезу, недавние клинические испытания оценили пользу подмышечной лучевой терапии (АРТ) у пациентов с раком груди на ранней стадии в качестве альтернативной стратегии лечения АЛНД. Хотя ALND обеспечивает превосходный региональный контроль над заболеванием, пациенты испытывают изнуряющие побочные эффекты, такие как лимфедема. В рандомизированном исследовании III фазы после картирования подмышечной впадины: лучевая терапия или хирургия (AMAROS) сравнивали пациентов с раком молочной железы T1-2 с положительным сигнальным узлом, которые получали АРТ или ALND в качестве адъювантного лечения после системной терапии (134).Результаты этого исследования показали, что АРТ обеспечивает превосходный местный контроль заболевания, а результаты сопоставимы с АЛНД. Кроме того, у пациентов, получающих АРТ, было меньше осложнений по сравнению с пациентами, получавшими АЛНД.
Для пациентов с меланомой, Многоцентровое испытание селективной лимфаденэктомии-I (MSLT-I) предоставило доказательства того, что пациенты, перенесшие дозорную биопсию ЛУ (СЛУ), имеют повышенную выживаемость (135). В этом исследовании пациенты были рандомизированы для (i) широкого иссечения меланомы с помощью процедуры SLN с последующим полным расслоением лимфатических узлов у пациентов с положительным SLN или (ii) широкого иссечения и узлового наблюдения с лимфаденэктомией во время рецидива LN. .Однако важность полного рассечения ЛУ оставалась спорной, поскольку основное различие между методами лечения пациентов с заболеванием ЛУ заключалось в сроках проведения лимфаденэктомии, а у пациентов, у которых ранее удаленное заболевание (пациенты с СЛУ), были лучшие результаты. Совсем недавно были опубликованы результаты рандомизированного многоцентрового клинического исследования фазы 3 MSLT-II, проведенного на 1934 пациентах с меланомой (136). В исследовании MSLT-II оценивалась важность полного рассечения LN путем рандомизации пациентов с метастазами в сторожевые узлы либо для немедленного полного рассечения LN, либо для наблюдения узлов с помощью ультразвукового исследования.Результаты этого исследования показали, что немедленное полное расслоение ЛУ у пациентов с метастазами в сторожевые узлы не было связано с увеличением 3-летней выживаемости, специфичной для меланомы. Тем не менее, пациенты, перенесшие полное расслоение LN, имели более высокий уровень контроля местного заболевания по сравнению с группой наблюдения через 3 года (92 + 1,0 против 77 + 1,5%) и немного более высокий уровень выживаемости без заболевания по сравнению с группой наблюдения. через 3 года (68 + 1,7 и 63 + 1,7% соответственно). Результаты испытаний MSLT-I и MSLT-II показывают, что удаление положительных SLN улучшает результаты, но дальнейшее удаление LN не улучшает 3-летнюю общую выживаемость.Однако полное рассечение лимфатических узлов у положительных пациентов с СЛУ действительно уменьшило рецидив заболевания. Таким образом, ставится под сомнение важность рецидивов заболевания в прогрессировании рака и конечном выживании пациентов. Очень важно выяснить, есть ли разница в 5- и 10-летней общей выживаемости в исследовании MSLT-II, поскольку эти данные могут быть в состоянии объяснить системное прогрессирование рецидива заболевания. Риск системного прогрессирования от рецидива заболевания должен быть сопоставлен с очень четким снижением скорости лимфедемы у пациентов, которым не проводилось полное расслоение ЛУ.
Взятые вместе, результаты этих клинических испытаний произвели революцию в подходах клиницистов к лечению рака. В современной клинической практике принята теория, согласно которой менее обширное расслоение ЛУ у пациентов с ранней стадией заболевания снижает риск осложнений без изменения общей выживаемости. В этих случаях системная адъювантная терапия и лучевая терапия могут помочь справиться с любым остаточным заболеванием. Лечение местного заболевания в ЛУ, которое еще не распространилось в другие места, с помощью системной терапии и облучения может снизить уровень долгосрочной смертности пациентов (137), потенциально смягчая последствия менее обширных операций, которые оставляют в некоторых ЛУ метастатические раковые клетки. пациенты.Однако фундаментальные вопросы биологии метастазов LN все еще остаются без ответа, в том числе: какова судьба раковых клеток после их метастазирования в LN? Распространяются ли метастазы LN за пределы узла и способствуют ли прогрессированию заболевания? Ответы на эти вопросы в ходе непрерывных исследований позволят нам лучше понять наиболее эффективную стратегию управления прогрессированием солидных опухолей.
Хотя нет прямых экспериментальных доказательств того, что раковые клетки могут покидать LN, несколько генетических исследований предоставляют доказательства того, что узловая болезнь может колонизировать отдаленные органы.В недавнем исследовании использовалось филогенетическое отслеживание для анализа эволюции опухолевых клеток у пациентов с CRC. Анализ этого исследования показал, что 35% отдаленных метастазов в печень имеют метастазы LN в качестве ближайшего филогенетического соседа (138). Более раннее исследование охарактеризовало соматическую эволюцию мутаций в раковых клетках из первичных и метастатических опухолей путем секвенирования генома на генетически модифицированной мышиной модели мелкоклеточной карциномы легкого (SCLC) (139). Этот анализ показал, что несколько связанных субклонов первичной опухоли могут засеять LN, а затем один клон может распространяться дальше от узла к печени.Из экспериментов на модели SCLC авторы не смогли сделать вывод, предшествовали ли метастазы LN системному распространению и изменяло ли микросреда LN генетический и эпигенетический состав раковых клеток до отдаленного распространения.
Даже при лучевой и системной терапии у некоторых пациентов все еще наблюдаются рецидивы ЛУ. Системные методы лечения, которые сводят к минимуму токсичность и одновременно воздействуют на заболевание в LN, представляют собой многообещающий подход. Лишь небольшая часть системно доставляемого химиотерапевтического препарата накапливается в LNs (2).Мы обнаружили, что повышенная проницаемость сосудов ЛУ не увеличивает проникновение химиотерапии в паренхиму ЛУ (140). Многие современные стратегии сосредоточены на оптимизации лимфатической доставки и удерживающих свойств терапевтических средств, которые воздействуют на лимфатические сосуды, связанные с опухолью (141). Направленная доставка иммуномодулирующих агентов или цитотоксических препаратов, специфичных для раковых клеток, в TDLN может улучшить стратегии вакцинации против рака (142) и искоренить болезнь в LN соответственно (141).
Заключение
Растущий интерес и способность изучать биологию LEC позволили глубже понять роль лимфатических сосудов в метастазировании опухоли и прогрессировании рака.Хотя известно, что лимфатические сосуды, ассоциированные с опухолью, являются путём метастазирования, теперь понятно, что опухолевые клетки также используют эти сосуды для установления иммунологической толерантности в TDLN. Хотя противоопухолевые иммунные ответы могут возникать локально в первичных опухолях, TDLN служат критическими сайтами для противоопухолевых иммунных ответов. Остается неизвестным, как системный адаптивный иммунный ответ на рак формируется иммуносупрессивными LN. Остается еще несколько важных областей исследования, включая понимание влияния микросреды LN на поведение раковых клеток и определение вклада метастазов LN в метастазирование отдаленных органов, что в настоящее время остается спорным.Терапия, направленная на метастазы LN, также должна учитывать усиление презентации антигена опухолеспецифическим Т-клеткам. Более того, методы лечения, активирующие опухолеспецифические Т-клетки, следует рассматривать параллельно со стратегиями нарушения толерантности и другими механизмами иммуносупрессии. Продолжая исследования LN, мы получим более глубокое понимание механизмов уклонения иммунной системы от раковых клеток. Более глубокое понимание молекулярных сигналов, которые способствуют метастазированию опухоли в TDLN и за их пределами, также может обеспечить терапевтические цели для контроля дальнейшего распространения лимфатических метастазов.Благодаря этому продолжающемуся прогрессу выживаемость пациентов от метастатического рака будет продолжать улучшаться.
Вклад авторов
DJ, EP и TP участвовали в написании рукописи.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа была поддержана NIH DP2OD008780 (TP), R01CA214913 (TP), R01HL128168 (TP), NCI Federal Share / MGH Proton Beam Income на C06 {«type»: «entrez-nucleotide», «attrs «: {» text «:» CA059267 «,» term_id «:» 24389510 «,» term_text «:» CA059267 «}} CA059267 (TP) и Исполнительный комитет Массачусетской больницы общего профиля по исследованиям ISF (TP) и Фонд для Награда за докторскую степень в области медицинских открытий (EP) и награда за программу повышения квалификации после докторской диссертации Берроуза Веллкома (DJ).Авторы выражают благодарность доктору Лэнсу Манн и Соне Перейра за их помощь с графической иллюстрацией.
Ссылки
1. Чаффер К.Л., Вайнберг Р.А. Взгляд на метастазирование раковых клеток. Наука (2011) 331: 1559–64.10.1126 / science.1203543 [PubMed] [CrossRef] [Google Scholar] 2. Чен Дж, Ван Л., Яо Кью, Лин Р, Ли К., Ван Х. Концентрация препарата в подмышечных лимфатических узлах после лимфатической химиотерапии у пациентов с раком груди. Рак молочной железы Res (2004) 6: R474–7.10.1186 / bcr819 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 3. Lund AW, Wagner M, Fankhauser M, Steinskog ES, Broggi MA, Spranger S, et al. Лимфатические сосуды регулируют иммунную микросреду при меланоме человека и мыши. J Clin Invest (2016) 126: 3389–402.10.1172 / JCI79434 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 4. Шпрангер С., Бао Р., Гаевски Т.Ф. Внутренняя передача сигналов бета-катенина меланоме предотвращает противоопухолевый иммунитет. Nature (2015) 523: 231–5.10.1038 / nature14404 [PubMed] [CrossRef] [Google Scholar] 5.Подграбинска С., Камалу О., Майер Л., Шимаока М., Снок Н., Рэндольф Г. Дж. И др. Воспаленный лимфатический эндотелий подавляет созревание и функционирование дендритных клеток посредством Mac-1 / ICAM-1-зависимого механизма. J Immunol (2009) 183: 1767–79.10.4049 / jimmunol.0802167 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Hirosue S, Vokali E, Raghavan VR, Rincon-Restrepo M, Lund AW, Corthesy-Henrioud P, et al. Устойчивое удаление антигена, перекрестная презентация и праймирование CD8 + Т-лимфоцитов: новая роль лимфатических эндотелиальных клеток.J Immunol (2014) 192: 5002–11.10.4049 / jimmunol.1302492 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 7. Dieterich LC, Ikenberg K, Cetintas T, Kapaklikaya K, Hutmacher C., Detmar M. Связанные с опухолью лимфатические сосуды активируют PDL1, подавляя активацию Т-клеток. Front Immunol (2017) 8: 66.10.3389 / fimmu.2017.00066 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Tewalt EF, Cohen JN, Rouhani SJ, Guidi CJ, Qiao H, Fahl SP и др. Лимфатические эндотелиальные клетки вызывают толерантность через PD-L1 и отсутствие костимуляции, что приводит к высокому уровню экспрессии PD-1 на Т-клетках CD8.Blood (2012) 120: 4772–82.10.1182 / blood-2012-04-427013 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 9. Чен Д.С., Меллман И. Элементы противоракового иммунитета и установочная точка противоракового иммунитета. Nature (2017) 541: 321–30.10.1038 / nature21349 [PubMed] [CrossRef] [Google Scholar] 10. Падера Т.П., Кадамби А., ди Томазо Э., Каррейра С.М., Браун Э.Б., Буше И. и др. Лимфатические метастазы при отсутствии функциональных внутриопухолевых лимфатических сосудов. Science (2002) 296: 1883–6.10.1126 / science.1071420 [PubMed] [CrossRef] [Google Scholar] 11.Fankhauser M, Broggi MAS, Potin L, Bordry N, Jeanbart L, Lund AW, et al. Опухолевый лимфангиогенез способствует инфильтрации Т-лимфоцитов и усиливает иммунотерапию меланомы. Sci Transl Med (2017) 9.10.1126 / scitranslmed.aal4712 [PubMed] [CrossRef] [Google Scholar] 12. Pham TH, Baluk P, Xu Y, Grigorova I., Bankovich AJ, Pappu R, et al. Активность сфингозинкиназы лимфатических эндотелиальных клеток необходима для выхода лимфоцитов и формирования лимфатического паттерна. J Exp Med (2010) 207: 17–27.10.1084 / jem.20091619 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 13.Поннусами С., Сельвам С.П., Мехротра С., Кавамори Т., Снайдер А.Дж., Обейд Л.М. и др. Связь между организмом-хозяином и раковыми клетками преобразуется системной передачей сигналов сфингозинкиназа 1 / сфингозин-1-фосфат для регулирования метастазирования опухоли. EMBO Mol Med (2012) 4: 761–75.10.1002 / emmm.201200244 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14. ван дер Вейден Л., Арендс М.Дж., Кэмпбелл А.Д., Лысый Т., Уордл-Джонс Х., Григгс Н. и др. Полногеномный скрининг in vivo позволяет выявить новые регуляторы метастатической колонизации хозяина.Nature (2017) 541: 233–6.10.1038 / nature20792 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Fukuhara S, Simmons S, Kawamura S, Inoue A, Orba Y, Tokudome T и др. Транспортер сфингозин-1-фосфата Spns2, экспрессируемый на эндотелиальных клетках, регулирует перенос лимфоцитов у мышей. J Clin Invest (2012) 122: 1416–26.10.1172 / JCI60746 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Мендоза А., Фанг В., Чен С., Серасингхе М., Верма А., Мюллер Дж. И др. Лимфатический эндотелиальный S1P способствует митохондриальной функции и выживанию в наивных Т-клетках.Nature (2017) 546: 158–61.10.1038 / nature22352 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 17. Рэндольф Г.Дж., Анджели В., Шварц Массачусетс. Доставка дендритных клеток в лимфатические узлы через лимфатические сосуды. Nat Rev Immunol (2005) 5: 617–28.10.1038 / nri1670 [PubMed] [CrossRef] [Google Scholar] 18. Шилдс Дж. Д., Куртис И. К., Томей А. А., Робертс Дж. М., Шварц М. А.. Индукция лимфоидной стромы и ускользание от иммунитета опухолями, экспрессирующими хемокин CCL21. Science (2010) 328: 749–52.10.1126 / science.1185837 [PubMed] [CrossRef] [Google Scholar] 19.Issa A, Le TX, Shoushtari AN, Shields JD, Swartz MA. Фактор роста эндотелия сосудов-С и хемокиновый рецептор 7 С-С в перекрестном взаимодействии опухолевых клеток и лимфатических клеток способствуют инвазивному фенотипу. Cancer Res (2009) 69: 349–57.10.1158 / 0008-5472.CAN-08-1875 [PubMed] [CrossRef] [Google Scholar] 20. Торселлан Т., Хэмптон Х.Р., Бейли Дж., Томура М., Бринк Р., Чтанова Т. Фотомечение in vivo инфильтрирующих опухоль клеток показывает строго регулируемый выход субпопуляций Т-клеток из опухолей. Proc Natl Acad Sci U S A (2017) 114: 5677–82.10.1073 / pnas.1618446114 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 21. Карпанен Т., Эгеблад М., Карккайнен М.Дж., Кубо Х., Ила-Херттуала С., Яаттела М. и др. Фактор роста эндотелия сосудов С способствует лимфангиогенезу опухоли и внутрилимфатическому росту опухоли. Cancer Res (2001) 61: 1786–90. [PubMed] [Google Scholar] 22. Карнезис Т., Шаян Р., Цезарь К., Руфейл С., Харрис Н.С., Ардипраджа К. и др. VEGF-D способствует метастазированию опухоли, регулируя простагландины, вырабатываемые собирающимся лимфатическим эндотелием.Cancer Cell (2012) 21: 181–95.10.1016 / j.ccr.2011.12.026 [PubMed] [CrossRef] [Google Scholar] 24. Таммела Т., Алитало К. Лимфангиогенез: молекулярные механизмы и перспективы на будущее. Cell (2010) 140: 460–76.10.1016 / j.cell.2010.01.045 [PubMed] [CrossRef] [Google Scholar] 25. Кох М., Деттори Д., Ван Нуффелен А., Суффро Дж., Маркончини Л., Уоллайс Дж. И др. Дефицит VEGF-D у мышей не влияет на эмбриональный или постнатальный лимфангиогенез, но снижает лимфатические метастазы. J Pathol (2009) 219: 356–64.10.1002 / path.2605 [PubMed] [CrossRef] [Google Scholar] 27. Stacker SA, Caesar C, Baldwin ME, Thornton GE, Williams RA, Prevo R и др. VEGF-D способствует метастатическому распространению опухолевых клеток через лимфатические сосуды. Nat Med (2001) 7: 186–91.10.1038 / 84635 [PubMed] [CrossRef] [Google Scholar] 28. He Y, Kozaki K, Karpanen T., Koshikawa K, Yla-Herttuala S, Takahashi T. и др. Подавление лимфангиогенеза опухоли и метастазирования в лимфатические узлы путем блокирования передачи сигналов рецептора 3 фактора роста эндотелия сосудов. J Natl Cancer Inst (2002) 94: 819–25.10.1093 / jnci / 94.11.819 [PubMed] [CrossRef] [Google Scholar] 29. Алишекевиц Д., Гингис-Велицки С., Кайдар-Персон О, Гаттер-Капон Л., Шерер С.Д., Равив З. и др. Макрофаги-индуцированный лимфангиогенез и метастазирование после химиотерапии паклитакселом регулируются VEGFR3. Cell Rep (2016) 17: 1344–56.10.1016 / j.celrep.2016.09.083 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 30. Коэн-Каплан В., Народицкий И., Зецер А., Илан Н., Влодавский И., Доуек И. Гепараназа индуцирует VEGF C и способствует лимфангиогенезу опухоли.Int J Cancer (2008) 123: 2566–73.10.1002 / ijc.23898 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 31. Olmeda D, Cerezo-Wallis D, Riveiro-Falkenbach E, Pennacchi PC, Contreras-Alcalde M, Ibarz N, et al. Визуализация всего тела лимфоваскулярных ниш выявляет дометастатические роли мидкина. Nature (2017) 546: 676–80.10.1038 / nature22977 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 32. Джонс Д., Мин В. Обзор лимфатических сосудов и их новой роли в сердечно-сосудистых заболеваниях.J Cardiovasc Dis Res (2011) 2: 141–52.10.4103 / 0975-3583.85260 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 33. Дитрих Л.С., Детмар М. Лимфангиогенез опухоли и разработка новых лекарств. Adv Drug Deliv Rev (2016) 99: 148–60.10.1016 / j.addr.2015.12.011 [PubMed] [CrossRef] [Google Scholar] 34. Саиф М.В., Кност Дж. А., Чиореан Э. Г., Камбхампати С. Р., Ю. Д., Питовски Б. и др. Исследование фазы 1 моноклонального антитела против рецептора 3 фактора роста эндотелия сосудов LY3022856 / IMC-3C5 у пациентов с распространенными и рефрактерными солидными опухолями и распространенным колоректальным раком.Cancer Chemother Pharmacol (2016) 78: 815–24.10.1007 / s00280-016-3134-3 [PubMed] [CrossRef] [Google Scholar] 35. Таккони С., Корреале С., Ганделли А., Спинелли А., Дежана Е., Д’Алессио С. и др. Фактор роста эндотелия сосудов С разрушает эндотелиальный лимфатический барьер, способствуя инвазии колоректального рака. Гастроэнтерология (2015) 148: 1438–51.e8.10.1053 / j.gastro.2015.03.005 [PubMed] [CrossRef] [Google Scholar] 36. Peinado H, Aleckovic M, Lavotshkin S, Matei I, Costa-Silva B, Moreno-Bueno G, et al. Экзосомы меланомы приучают клетки-предшественники костного мозга к прометастатическому фенотипу посредством MET.Nat Med (2012) 18: 883–91.10.1038 / nm.2753 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 38. Худ JL, Сан-РС, Уиклайн С.А. Экзосомы, высвобождаемые клетками меланомы, подготавливают сторожевые лимфатические узлы для метастазирования опухоли. Cancer Res (2011) 71: 3792–801.10.1158 / 0008-5472.CAN-10-4455 [PubMed] [CrossRef] [Google Scholar] 39. Maus RLG, Jakub JW, Nevala WK, Christensen TA, Noble-Orcutt K, Sachs Z, et al. Внеклеточные везикулы, происходящие из меланомы человека, регулируют созревание дендритных клеток. Фронт Иммунол (2017) 8: 358.10.3389 / fimmu.2017.00358 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 40. Пуччи Ф., Гарри С., Лай С. П., Ньютон А., Пфиршке С., Энгблом С. и др. Макрофаги SCS подавляют меланому, ограничивая взаимодействия пузырьков опухоли с B-клетками. Science (2016) 352: 242–6.10.1126 / science.aaf1328 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 41. Headley MB, Bins A, Nip A, Roberts EW, Looney MR, Gerard A и др. Визуализация немедленных иммунных ответов на пионерские метастатические клетки в легких.Nature (2016) 531: 513–7.10.1038 / nature16985 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 42. Harrell MI, Iritani BM, Ruddell A. Опухоль-индуцированный лимфангиогенез сторожевых лимфатических узлов и увеличение лимфотока предшествуют метастазам меланомы. Am J Pathol (2007) 170: 774–86.10.2353 / ajpath.2007.060761 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 43. Hirakawa S, Kodama S, Kunstfeld R, Kajiya K, Brown LF, Detmar M. VEGF-A индуцирует опухоль и лимфангиогенез сторожевых лимфатических узлов и способствует лимфатическим метастазам.J Exp Med (2005) 201: 1089–99.10.1084 / jem.20041896 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 44. Анджели В., Жинхо Ф., Ллодра Дж., Кеменер Л., Френетт П.С., Скобе М. и др. Управляемый В-клетками лимфангиогенез в воспаленных лимфатических узлах усиливает мобилизацию дендритных клеток. Иммунитет (2006) 24: 203–15.10.1016 / j.immuni.2006.01.003 [PubMed] [CrossRef] [Google Scholar] 45. Шреста Б., Хасигучи Т., Ито Т., Миура Н., Такенучи К., Ояма Ю. и др. Фактор роста эндотелия сосудов А, полученный из В-клеток, способствует лимфангиогенезу и высокому расширению эндотелиальных венул в лимфатических узлах.J Immunol (2010) 184: 4819–26.10.4049 / jimmunol.03 [PubMed] [CrossRef] [Google Scholar] 46. Хиракава С., Браун Л.Ф., Кодама С., Паавонен К., Алитало К., Детмар М. VEGF-C-индуцированный лимфангиогенез в сторожевых лимфатических узлах способствует метастазированию опухоли в отдаленные участки. Blood (2007) 109: 1010–7.10.1182 / blood-2006-05-021758 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 47. Алитало А., Детмар М. Взаимодействие опухолевых клеток и лимфатических сосудов при прогрессировании рака. Онкоген (2012) 31: 4499–508.10.1038 / onc.2011.602 [PubMed] [CrossRef] [Google Scholar] 48. Ронер Н.А., Макклейн Дж., Туэлл С.Л., Уорнер А., Смит Б., Юн Й и др. Биофизическое ремоделирование лимфатических узлов связано с лимфодренажем меланомы. FASEB J (2015) 29: 4512–22.10.1096 / fj.15-274761 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 49. Lund AW, Duraes FV, Hirosue S, Raghavan VR, Nembrini C, Thomas SN и др. VEGF-C способствует иммунной толерантности в меланоме B16 и перекрестной презентации опухолевого антигена лимфатическими узлами лимфатических узлов. Cell Rep (2012) 1: 191–9.10.1016 / j.celrep.2012.01.005 [PubMed] [CrossRef] [Google Scholar] 50. Малхотра Д., Флетчер А.Л., Астарита Дж., Лукач-Корнек В., Таялия П., Гонсалес С.Ф. и др. Транскрипционное профилирование стромы воспаленных и покоящихся лимфатических узлов определяет иммунологические признаки. Nat Immunol (2012) 13: 499–510.10.1038 / ni.2262 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Розендаал Р., Мемпель Т.Р., Питчер Л.А., Гонсалес С.Ф., Вершор А., Мебиус Р.Э. и др. Трубопроводы опосредуют транспорт низкомолекулярного антигена к фолликулам лимфатических узлов.Immunity (2009) 30: 264–76.10.1016 / j.immuni.2008.12.014 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 52. Флетчер А.Л., Лукач-Корнек В., Рейносо Э.Д., Пиннер С.Е., Бельмар-Пеллетье А., Карри М.С. и др. Фибробластные ретикулярные клетки лимфатических узлов непосредственно представляют антиген периферической ткани в стационарных и воспалительных условиях. J Exp Med (2010) 207: 689–97.10.1084 / jem.20092642 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 53. Коэн JN, Guidi CJ, Tewalt EF, Qiao H, Rouhani SJ, Ruddell A и др.Резидентные в лимфатическом узле лимфатические эндотелиальные клетки опосредуют периферическую толерантность через Aire-независимую прямую презентацию антигена. J Exp Med (2010) 207: 681–8.10.1084 / jem.20092465 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 54. Лукач-Корнек В., Малхотра Д., Флетчер А.Л., Актон С.Е., Элпек К.Г., Тайалия П. и др. Регулируемое высвобождение оксида азота негематопоэтической стромой контролирует увеличение пула активированных Т-клеток в лимфатических узлах. Nat Immunol (2011) 12: 1096–104.10.1038 / ni.2112 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 55.Siegert S, Huang HY, Yang CY, Scarpellino L, Carrie L, Essex S и др. Фибробластные ретикулярные клетки из лимфатических узлов ослабляют рост Т-клеток, производя оксид азота. PLoS One (2011) 6: e27618.10.1371 / journal.pone.0027618 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Ридель А., Шортхаус Д., Хаас Л., Холл Б. А., Шилдс Дж. Вызванное опухолью перепрограммирование стромы приводит к трансформации лимфатических узлов. Nat Immunol (2016) 17: 1118–27.10.1038 / ni.3492 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 57.Суджа С.М., Анри С., Мелло М., Часон Л., Мас А., Вехбе М. и др. Нарушение лимфатического узла и стромы селезенки у мышей с индуцированными воспалительными меланомами связано с нарушением набора Т и дендритных клеток. PLoS One (2011) 6: e22639.10.1371 / journal.pone.0022639 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 58. Ризван А., Булте С., Калайчелван А., Ченг М., Кришнамачари Б., Бхуджвалла З.М. и др. Метастатические клетки рака молочной железы в лимфатические узлы увеличивают узловую плотность коллагена. Научный журнал (2015) 5: 10002.10.1038 / srep10002 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Хошида Т., Исака Н., Хагендорн Дж., Ди Томазо Э., Чен Ю.Л., Питовски Б. и др. Этапы визуализации лимфатических метастазов показывают, что фактор роста эндотелия сосудов С увеличивает метастазирование за счет увеличения доставки раковых клеток в лимфатические узлы: терапевтическое значение. Cancer Res (2006) 66: 8065–75.10.1158 / 0008-5472.CAN-06-1392 [PubMed] [CrossRef] [Google Scholar] 60. Das S, Sarrou E, Podgrabinska S, Cassella M, Mungamuri SK, Feirt N и др.Вход опухолевых клеток в лимфатический узел контролируется хемокином CCL1, экспрессируемым лимфатическими синусами лимфатических узлов. J Exp Med (2013) 210: 1509–28.10.1084 / jem.20111627 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 61. Митева Д.О., Рутковски Дж. М., Диксон Дж. Б., Киларски В., Шилдс Дж. Д., Шварц М. А.. Трансмуральный поток модулирует клеточные и жидкостные транспортные функции лимфатического эндотелия. Circ Res (2010) 106: 920–31.10.1161 / CIRCRESAHA.109.207274 [PubMed] [CrossRef] [Google Scholar] 62. Шилдс Д.Д., Флери М.Э., Йонг С., Томей А.А., Рэндольф Г.Дж., Шварц М.А.Аутологичный хемотаксис как механизм возвращения опухолевых клеток в лимфатические сосуды через интерстициальный поток и аутокринную передачу сигналов CCR7. Cancer Cell (2007) 11: 526–38.10.1016 / j.ccr.2007.04.020 [PubMed] [CrossRef] [Google Scholar] 63. Иршад С., Флорес-Борха Ф., Лоулер К., Монипенни Дж., Эванс Р., Мале В. и др. RORgammat + врожденные лимфоидные клетки способствуют метастазированию рака груди в лимфатические узлы. Cancer Res (2017) 77: 1083–96.10.1158 / 0008-5472.CAN-16-0598 [PubMed] [CrossRef] [Google Scholar] 64. Muller A, Homey B, Soto H, Ge N, Catron D, Buchanan ME и др.Участие хемокиновых рецепторов в метастазировании рака груди. Nature (2001) 410: 50–6.10.1038 / 35065016 [PubMed] [CrossRef] [Google Scholar] 65. Учида Д., Оноуэ Т., Томизука Ю., Бегум Н.М., Мива Ю., Йошида Н. и др. Участие системы фактора-1 / CXCR4 аутокринных стромальных клеток в отдаленных метастазах плоскоклеточной карциномы ротовой полости человека. Mol Cancer Res (2007) 5: 685–94.10.1158 / 1541-7786.MCR-06-0368 [PubMed] [CrossRef] [Google Scholar] 66. Хиракава С., Детмар М., Керьяшки Д., Нагамацу С., Мацуо К., Танемура А. и др.Узловой лимфангиогенез и метастазирование: роль индуцированной опухолью активации лимфатических сосудов при экстрамаммарной болезни Педжета. Am J Pathol (2009) 175: 2235–48.10.2353 / ajpath.2009.0
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67. Kim YH, Choi YW, Lee J, Soh EY, Kim JH, Park TJ. Стареющие опухолевые клетки возглавляют коллективную инвазию рака щитовидной железы. Nat Commun (2017) 8: 15208.10.1038 / ncomms15208 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 68. Zhuo W, Jia L, Song N, Lu XA, Ding Y, Wang X и др.Хемокиновый путь CXCL12-CXCR4: новая ось регулирует лимфангиогенез. Clin Cancer Res (2012) 18: 5387–98.10.1158 / 1078-0432.CCR-12-0708 [PubMed] [CrossRef] [Google Scholar] 69. Морли С.Т., Ньюпорт Д.Т., Уолш М.Т. К предсказанию распределения напряжения сдвига, вызванного потоком, испытываемого клетками рака груди в лимфатических сосудах. Модель биомеха, механобиол (2017) 16: 2051–62.10.1007 / s10237-017-0937-z [PubMed] [CrossRef] [Google Scholar] 70. Liao S, Cheng G, Conner DA, Huang Y, Kucherlapati RS, Munn LL, et al.Нарушение лимфатического сокращения, связанное с иммуносупрессией. Proc Natl Acad Sci U S A (2011) 108: 18784–9.10.1073 / pnas.1116152108 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 72. Пру С.Т., Лучани П., Кристиансен А., Караман С., Блюм К.С., Риндеркнехт М. и др.
Использование конъюгированного с ПЭГ яркого красителя в ближнем инфракрасном диапазоне для функциональной визуализации изменения маршрута лимфатического дренажа опухоли после метастазирования в сторожевые лимфатические узлы. Биоматериалы (2013) 34: 5128–37.10.1016 / j.biomaterials.2013.03.034 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 73.Таммела Т., Сааристо А., Холопайнен Т., Ила-Херттуала С., Андерссон Л.С., Виролайнен С. и др.
Фотодинамическая абляция лимфатических сосудов и внутрилимфатических раковых клеток предотвращает метастазирование. Sci Transl Med (2011) 3: 69ra11.10.1126 / scitranslmed.3001699 [PubMed] [CrossRef] [Google Scholar] 74. Kwon S, Agollah GD, Wu G, Chan W., Sevick-Muraca EM. Прямая визуализация изменений лимфатической функции и дренажных путей при метастазах в лимфатические узлы меланомы B16F10 с использованием флуоресцентной визуализации в ближнем инфракрасном диапазоне. Биомед Опт Экспресс (2013) 4: 967–77.10.1364 / BOE.4.000967 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 75. Thelmo MC, Morita ET, Treseler PA, Nguyen LH, Allen RE, Jr, Sagebiel RW и др.
Микрометастазы в транзитные лимфатические узлы от злокачественной меланомы конечностей и туловища. Энн Сург Онкол (2001) 8: 444–8.10.1007 / s10434-001-0444-3 [PubMed] [CrossRef] [Google Scholar] 76. Джафарнеджад М., Вудрафф М.С., Завиея Д.К., Кэрролл М.С., Мур Дж.Э., младший. Моделирование лимфотока и обмена жидкости с кровеносными сосудами в лимфатических узлах. Lymphat Res Biol (2015) 13: 234–47.10.1089 / lrb.2015.0028 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 77. Kerjaschki D, Bago-Horvath Z, Rudas M, Sexl V, Schneckenleithner C, Wolbank S и др.
Липоксигеназа опосредует инвазию интраметастатических лимфатических сосудов и способствует развитию метастазов в лимфатических узлах ксенотрансплантатов карциномы молочной железы человека у мышей. J Clin Invest (2011) 121: 2000–12.10.1172 / JCI44751 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78. Van den Eynden GG, Vandenberghe MK, van Dam PJ, Colpaert CG, van Dam P, Dirix LY, et al.Повышенный лимфангиогенез дозорных лимфатических узлов связан с поражением не сигнальных подмышечных лимфатических узлов у пациентов с раком молочной железы с положительным сигнальным узлом. Clin Cancer Res (2007) 13: 5391–7.10.1158 / 1078-0432.CCR-07-1230 [PubMed] [CrossRef] [Google Scholar] 79. Шифер А.И., Шоппманн С.Ф., Бирнер П. Лимфоваскулярная инвазия опухолевых клеток при метастазах в лимфатические узлы оказывает негативное влияние на выживаемость при раке пищевода. Хирургия (2016) 160: 331–40.10.1016 / j.surg.2016.02.034 [PubMed] [CrossRef] [Google Scholar] 80.Junt T, Moseman EA, Iannacone M, Massberg S, Lang PA, Boes M и др.
Макрофаги субкапсульного синуса в лимфатических узлах очищают лимфатические вирусы и представляют их противовирусным В-клеткам. Nature (2007) 450: 110–4.10.1038 / nature06287 [PubMed] [CrossRef] [Google Scholar] 81. Асано К., Набеяма А., Мияке Ю., Цю Ч., Курита А., Томура М. и др.
CD169-положительные макрофаги доминируют над противоопухолевым иммунитетом за счет перекрестного представления антигенов, связанных с мертвыми клетками. Иммунитет (2011) 34: 85–95.10.1016 / j.immuni.2010.12.011 [PubMed] [CrossRef] [Google Scholar] 82.Моалли Ф., Проул С. Т., Швенденер Р., Детмар М., Шлапбах С., Штайн СП. Прижизненная визуализация и визуализация всего органа выявляют захват антигена, происходящего от меланомы, субкапсулярными макрофагами лимфатических узлов, что приводит к широко распространенному отложению на фолликулярных дендритных клетках. Front Immunol (2015) 6: 114.10.3389 / fimmu.2015.00114 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 83. Ohnishi K, Komohara Y, Saito Y, Miyamoto Y, Watanabe M, Baba H и др.
CD169-положительные макрофаги в регионарных лимфатических узлах связаны с благоприятным прогнозом у пациентов с колоректальной карциномой.Cancer Sci (2013) 104: 1237–44.10.1111 / cas.12212 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 85. Ries CH, Cannarile MA, Hoves S, Benz J, Wartha K, Runza V и др.
Нацеливание на ассоциированные с опухолью макрофаги с помощью антитела против CSF-1R раскрывает стратегию лечения рака. Cancer Cell (2014) 25: 846–59.10.1016 / j.ccr.2014.05.016 [PubMed] [CrossRef] [Google Scholar] 86. Холлмен М., Караман С., Швагер С., Лисибах А., Кристиансен А. Дж., Максимов М. и др.
G-CSF регулирует фенотип макрофагов и связан с плохой общей выживаемостью при тройном отрицательном раке груди у человека.Онкоиммунология (2016) 5: e1115177.10.1080 / 2162402X.2015.1115177 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 87. Фридлендер З.Г., Сун Дж., Ким С., Капур В., Ченг Дж., Линг Л. и др.
Поляризация опухолево-ассоциированного нейтрофильного фенотипа с помощью TGF-бета: «N1» по сравнению с «N2» TAN. Cancer Cell (2009) 16: 183–94.10.1016 / j.ccr.2009.06.017 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 88. Ван Дж, Цзя И, Ван Н, Чжан Х, Тан Б., Чжан Г и др.
Клиническое значение инфильтрирующих опухоль нейтрофилов и соотношения нейтрофилов к CD8 + лимфоцитам у пациентов с резектабельной плоскоклеточной карциномой пищевода.J Transl Med (2014) 12: 7.10.1186 / 1479-5876-12-7 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 89. Коффелт С.Б., Керстен К., Дорнебал К.В., Вайден Дж., Фрайланд К., Хау С.С. и др.
Гаммадельта-Т-клетки и нейтрофилы, продуцирующие IL-17, участвуют в сговоре, способствуя метастазированию рака груди. Nature (2015) 522: 345–8.10.1038 / nature14282 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 91. Манн Д.Х., Меллор А.Л. Лимфатический узел, отводящий опухоль, как иммунопривилегированный участок. Immunol Rev (2006) 213: 146–58.10.1111 / j.1600-065X.2006.00444.x [PubMed] [CrossRef] [Google Scholar] 92. Ито М., Минамия Й., Кавай Х., Сайто С., Сайто Х., Накагава Т. и др.
TGFbeta-1, полученный из опухоли, индуцирует апоптоз дендритных клеток в сторожевом лимфатическом узле. J. Immunol (2006) 176: 5637–43.10.4049 / jimmunol.176.9.5637 [PubMed] [CrossRef] [Google Scholar] 93. Preynat-Seauve O, Contassot E, Schuler P, Piguet V, French LE, Huard B. Экстралимфатические опухоли подготавливают дренирующие лимфатические узлы к инвазии через процесс перекрестной толерантности Т-клеток. Cancer Res (2007) 67: 5009–16.10.1158 / 0008-5472.CAN-06-4494 [PubMed] [CrossRef] [Google Scholar] 94. Ochsenbein AF, Klenerman P, Karrer U, Ludewig B, Pericin M, Hengartner H, et al.
Иммунный надзор за солидной опухолью не удается из-за иммунологического незнания. Proc Natl Acad Sci U S A (1999) 96: 2233–8.10.1073 / pnas.96.5.2233 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 95. Чо Дж.К., Хён Ш., Чхве Н., Ким М.Дж., Падера Т.П., Чой Дж.Й. и др.
Значение метастазов в лимфатические узлы в распространении рака головы и шеи.Перевод Oncol (2015) 8: 119–25.10.1016 / j.tranon.2015.03.001 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 96. Пантель К., Шлимок Г., Куттер Д., Шаллер Г., Генц Т., Вибеке Б. и др.
Частое подавление экспрессии основного антигена класса I гистосовместимости на отдельных микрометастатических клетках карциномы. Cancer Res (1991) 51: 4712–5. [PubMed] [Google Scholar] 97. Pasero C, Gravis G, Granjeaud S, Guerin M, Thomassin-Piana J, Rocchi P и др.
Высокоэффективные NK-клетки связаны с хорошим прогнозом у пациентов с метастатическим раком простаты.Oncotarget (2015) 6: 14360–73.10.18632 / oncotarget.3965 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 99. Маркус А., Гоуэн Б.Г., Томпсон Т.В., Яннелло А., Ардолино М., Дэн В. и др.
Распознавание опухолей системой врожденного иммунитета и естественными клетками-киллерами. Adv Immunol (2014) 122: 91–128.10.1016 / B978-0-12-800267-4.00003-1 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 100. Юнггрен Х.Г., Карре К. В поисках «пропавшего я»: молекулы MHC и распознавание NK-клеток. Immunol Today (1990) 11: 237–44.10.1016 / 0167-5699 (90) -S [PubMed] [CrossRef] [Google Scholar] 101. Messaoudene M, Fregni G, Fourmentraux-Neves E, Chanal J, Maubec E, Mazouz-Dorval S, et al.
Зрелые цитотоксические естественные клетки-киллеры CD56 (яркие) / CD16 (+) могут проникать в лимфатические узлы, прилегающие к метастатической меланоме. Cancer Res (2014) 74: 81–92.10.1158 / 0008-5472.CAN-13-1303 [PubMed] [CrossRef] [Google Scholar] 102. Кесслер Д. Д., Микель Р. А., Лихтенштейн А. Подавленная активность естественных клеток-киллеров в шейных лимфатических узлах, содержащих очаговую метастатическую плоскоклеточную карциному.Хирургия головы и шеи Arch Otolaryngol (1988) 114: 313–8.10.1001 / archotol.1988.01860150095022 [PubMed] [CrossRef] [Google Scholar] 103. Россер ЕС, Маури С. Регуляторные В-клетки: происхождение, фенотип и функция. Иммунитет (2015) 42: 607–12.10.1016 / j.immuni.2015.04.005 [PubMed] [CrossRef] [Google Scholar] 104. Schwartz M, Zhang Y, Rosenblatt JD. В-клеточная регуляция противоопухолевого ответа и роль в канцерогенезе. J Immunother Cancer (2016) 4: 40.10.1186 / s40425-016-0145-x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 106.Мартине Л., Ле Геллек С., Филлерон Т., Ламант Л., Мейер Н., Роша П. и др.
Венулы высокого эндотелия (HEV) в очагах меланомы человека: главные ворота для лимфоцитов, инфильтрирующих опухоль. Онкоиммунология (2012) 1: 829–39.10.4161 / onci.20492 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 107. Мартине Л., Филлерон Т., Ле Геллек С., Рошэ П., Гарридо И., Жирар Дж. П.
Венулы высокого эндотелия кровеносных сосудов для инфильтрирующих опухоль лимфоцитов связаны с дендритными клетками, продуцирующими лимфотоксин бета, при раке груди человека.J Immunol (2013) 191: 2001–8.10.4049 / jimmunol.1300872 [PubMed] [CrossRef] [Google Scholar] 108. Песке Д.Д., Томпсон Э.Д., Гемта Л., Бейлис Р.А., Фу YX, Энгельхард В.Х. Индуцированная эффекторными лимфоцитами сосудистая сеть, подобная лимфатическим узлам, позволяет наивным Т-клеткам проникать в опухоли и повышает противоопухолевый иммунитет. Nat Commun (2015) 6: 7114.10.1038 / ncomms8114 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 109. Дрейтон Д.Л., Ляо С., Маунзер Р.Х., Раддл Н.Х. Развитие лимфоидных органов: от онтогенеза к новообразованию. Nat Immunol (2006) 7: 344–53.10.1038 / ni1330 [PubMed] [CrossRef] [Google Scholar] 110. Раддл NH. Венулы и лимфатические сосуды высокого эндотелия в третичных лимфоидных органах: характеристики, функции и регуляция. Front Immunol (2016) 7: 491.10.3389 / fimmu.2016.00491 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 111. Аллен Э., Жабуй А., Ривера Л. Б., Лодевийкс I, Миссиан Р., Стери В. и др.
Комбинированная антиангиогенная и анти-PD-L1 терапия стимулирует опухолевый иммунитет за счет образования HEV. Sci Transl Med (2017) 9.10.1126 / scitranslmed.aak9679 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 112. Финкин С., Юань Д., Стейн И., Танигучи К., Вебер А., Унгер К. и др.
Эктопические лимфоидные структуры функционируют как микроники для клеток-предшественников опухоли при гепатоцеллюлярной карциноме. Nat Immunol (2015) 16: 1235–44.10.1038 / ni.3290 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 113. Джоши Н.С., Акама-Гаррен Э.Х., Лу Й., Ли Д.Й., Чанг Г.П., Ли А. и др.
Регуляторные Т-клетки в ассоциированных с опухолью третичных лимфоидных структурах подавляют противоопухолевые Т-клеточные ответы.Immunity (2015) 43: 579–90.10.1016 / j.immuni.2015.08.006 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 114. Лю Ц., Воркман Си-Джей, Виньяли Д.А. Ориентация на регуляторные Т-клетки в опухолях. FEBS J (2016) 283: 2731–48.10.1111 / febs.13656 [PubMed] [CrossRef] [Google Scholar] 115. Хиндли Дж. П., Джонс Э., Смарт К., Бриджман Х., Лаудер С. Н., Ондондо Б. и др.
Транспортировка Т-клеток, облегчаемая венулами с высоким содержанием эндотелия, необходима для контроля опухоли после истощения регуляторных Т-клеток. Cancer Res (2012) 72: 5473–82.10.1158 / 0008-5472.CAN-12-1912 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 116. Колбек Э.Дж., Джонс Э., Хиндли Дж.П., Смарт К., Шульц Р., Браун М. и др.
Истощение Treg лицензирует управляемый Т-клетками неогенез HEV и способствует разрушению опухоли. Cancer Immunol Res (2017) 5: 1005–15.10.1158 / 2326-6066.CIR-17-0131 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 117. Кэрнс Р.А., Хилл Р.П. Острая гипоксия усиливает спонтанное метастазирование в лимфатические узлы на ортотопической модели рака шейки матки человека на мышах.Cancer Res (2004) 64: 2054–61.10.1158 / 0008-5472.CAN-03-3196 [PubMed] [CrossRef] [Google Scholar] 118. Jeong HS, Jones D, Liao S, Wattson DA, Cui CH, Duda DG и др.
Исследование отсутствия ангиогенеза при образовании метастазов в лимфатических узлах. J Natl Cancer Inst (2015) 10710.1093 / jnci / djv155 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 119. Чжэн X, Ван X, Мао Х, Ву В., Лю Б., Цзян X. Гипоксически-специфичное сверхчувствительное обнаружение опухолей и раковых клеток in vivo. Нац Коммун (2015) 6: 5834.10.1038 / ncomms6834 [PubMed] [CrossRef] [Google Scholar] 120. Гуиди А.Дж., Берри Д.А., Бродуотер Дж., Перлофф М., Нортон Л., Баркос М.П. и др.
Связь ангиогенеза метастазов в лимфатических узлах с исходом рака молочной железы. J Natl Cancer Inst (2000) 92: 486–92.10.1093 / jnci / 92.6.486 [PubMed] [CrossRef] [Google Scholar] 121. Pezzella F. Доказательства нового неангиогенного пути метастазирования рака груди. Рабочая группа по прогрессированию рака молочной железы. Lancet (2000) 355: 1787–8.10.1016 / S0140-6736 (00) 02268-6 [PubMed] [CrossRef] [Google Scholar] 122.Стесселс Ф., Ван ден Эйнден Дж., Ван дер Аувера И., Сальгадо Р., Ван ден Хевел Э., Харрис А. Л. и др.
Метастазы аденокарциномы молочной железы в печень, в отличие от метастазов колоректального рака в печень, демонстрируют неангиогенный характер роста, который сохраняет строму и лишен гипоксии. Br J Cancer (2004) 90: 1429–36.10.1038 / sj.bjc.6601727 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 123. Frentzas S, Simoneau E, Bridgeman VL, Vermeulen PB, Foo S, Kostaras E, et al.
Коопция сосуда опосредует резистентность к антиангиогенной терапии при метастазах в печень.Nat Med (2016) 22: 1294–302.10.1038 / nm.4197 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 124. Van den Eynden GG, Van der Auwera I, Van Laere SJ, Colpaert CG, Turley H, Harris AL, et al.
Ангиогенез и гипоксия в метастазах лимфатических узлов предсказывается ангиогенезом и гипоксией в первичной опухоли у пациентов с раком груди. Br J Cancer (2005) 93: 1128–36.10.1038 / sj.bjc.6602828 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 125. Нареш К.Н., Неруркар А.Ю., Борхес А.М. Ангиогенез является избыточным для роста опухоли в метастазах лимфатических узлов.Гистопатология (2001) 38: 466–70.10.1046 / j.1365-2559.2001.01061.x [PubMed] [CrossRef] [Google Scholar] 126. Arapandoni-Dadioti P, Giatromanolaki A, Trihia H, Harris AL, Koukourakis MI. Ангиогенез при протоковой карциноме молочной железы. Сравнение плотности микрососудов между первичной опухолью и метастазами в лимфатических узлах. Cancer Lett (1999) 137: 145–50.10.1016 / S0304-3835 (98) 00343-7 [PubMed] [CrossRef] [Google Scholar] 127. Halin C, Tobler NE, Vigl B, Brown LF, Detmar M. VEGF-A, продуцируемый хронически воспаленной тканью, индуцирует лимфангиогенез в дренирующих лимфатических узлах.Blood (2007) 110: 3158–67.10.1182 / blood-2007-01-066811 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 128. Qian CN, Berghuis B, Tsarfaty G, Bruch M, Kort EJ, Ditlev J, et al.
Подготовка «почвы»: первичная опухоль вызывает реорганизацию сосудистой сети в сторожевом лимфатическом узле до прибытия метастатических раковых клеток. Cancer Res (2006) 66: 10365–76.10.1158 / 0008-5472.CAN-06-2977 [PubMed] [CrossRef] [Google Scholar] 129. Дюфи М., Джулиано С., Амброзетти Д., Кларен А., Ндиай П. Д., Мастри М. и др.Сунитиниб стимулирует экспрессию VEGFC опухолевыми клетками и способствует лимфангиогенезу в светлоклеточных почечно-клеточных карциномах. Cancer Res (2017) 77: 1212–26.10.1158 / 0008-5472.CAN-16-3088 [PubMed] [CrossRef] [Google Scholar] 130. Натансон С.Д., Шах Р., Россо К. Метастазы в сторожевые лимфатические узлы при раке: причины, обнаружение и их роль в прогрессировании заболевания. Semin Cell Dev Biol (2015) 38: 106–16.10.1016 / j.semcdb.2014.10.002 [PubMed] [CrossRef] [Google Scholar] 131. Галимберти В., Коул Б.Ф., Зуррида С., Виале Г., Луини А., Веронези П. и др.Подмышечная диссекция в сравнении с отсутствием подмышечной диссекции у пациентов с микрометастазами сторожевых узлов (IBCSG 23-01): рандомизированное контролируемое исследование фазы 3. Lancet Oncol (2013) 14: 297–305.10.1016 / S1470-2045 (13) 70035-4 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 132. Джагси Р., Чадха М., Мони Дж., Баллман К., Лори Ф., Бухгольц Т.А. и др.
Дизайн радиационного поля в испытании ACOSOG Z0011 (альянс). J Clin Oncol (2014) 32: 3600–6.10.1200 / JCO.2014.56.5838 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 133.Джулиано А.Е., Хант К.К., Баллман К.В., Бейтч П.Д., Уитворт П.В., Блюменкранц П.В. и др.
Подмышечная диссекция по сравнению с отсутствием подмышечной диссекции у женщин с инвазивным раком груди и метастазами в сторожевые узлы: рандомизированное клиническое испытание. JAMA (2011) 305: 569–75.10.1001 / jama.2011.90 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 134. Донкер М., ван Тиенховен Г., Стравер М.Э., Мейнен П., ван де Велде С.Дж., Мансель Р.Э. и др.
Лучевая терапия или хирургия подмышечной впадины после положительного результата на сигнальном узле при раке молочной железы (EORTC 10981-22023 AMAROS): рандомизированное многоцентровое открытое исследование не меньшей эффективности, фаза 3.Lancet Oncol (2014) 15: 1303–10.10.1016 / S1470-2045 (14) 70460-7 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 135. Morton DL, Thompson JF, Cochran AJ, Mozzillo N, Nieweg OE, Roses DF и др.
Заключительный отчет об испытании биопсии сторожевого узла по сравнению с наблюдением узлов при меланоме. N Engl J Med (2014) 370: 599–609.10.1056 / NEJMoa1310460 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 136. Фариес МБ, Томпсон Дж. Ф., Кокран А. Дж., Андтбака Р. Х., Моззилло Н., Загер Дж. С. и др.
Завершение вскрытия или наблюдение за метастазами в сторожевые узлы при меланоме.N Engl J Med (2017) 376: 2211–22.10.1056 / NEJMoa1613210 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 137. Punglia RS, Morrow M, Winer EP, Harris JR.
Местная терапия и выживаемость при раке груди. N Engl J Med (2007) 356: 2399–405.10.1056 / NEJMra065241 [PubMed] [CrossRef] [Google Scholar] 138. Naxerova K, Reiter JG, Brachtel E, Lennerz JK, van de Wetering M, Rowan A, et al.
Происхождение лимфатических и отдаленных метастазов при колоректальном раке человека. Science (2017) 357: 55–60.10.1126 / science.aai8515 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 139.McFadden DG, Papagiannakopoulos T, Taylor-Weiner A, Stewart C, Carter SL, Cibulskis K, et al.
Генетическое и клональное рассечение прогрессирования мелкоклеточной карциномы легких мышей путем секвенирования генома. Cell (2014) 156: 1298–311.10.1016 / j.cell.2014.02.031 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 140. Meijer EFJ, Blatter C, Chen IX, Bouta E, Jones D, Pereira ER, et al.
Эффективная проницаемость сосудов лимфатических узлов и эффективность химиотерапии. Микроциркуляция (2017) 2410.1111 / micc.12381 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 141.Треваскис Н.Л., Каминскас Л.М., Портер С.Дж. Из канализации к спасителю — воздействуя на лимфатическую систему, чтобы стимулировать воздействие и активность наркотиков. Nat Rev Drug Discov (2015) 14: 781–803.10.1038 / nrd4608 [PubMed] [CrossRef] [Google Scholar] 142. Майзель К., Сассо М.С., Потин Л., Шварц М.А. Использование лимфатических сосудов для иммуномодуляции: обоснование, возможности и проблемы. Adv Drug Deliv Rev (2017) 114: 43–59.10.1016 / j.addr.2017.07.005 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Управление метастазами в лимфатические узлы с использованием существующих методов не обеспечивает селективности в лимфатические узлы и может вызвать токсичность, отличную от целевой Разработка нового метода лечения требует надлежащих доклинических исследований. модель для точной оценки терапевтической эффективности Узловые метастазы послужили источником отдаленных метастазов, а своевременное лечение предотвратило прогрессирование системного заболевания Местное введение ПЭГилированных мицелл вызвало высокоспецифичное накопление в региональных лимфатических узлах Местная химиотерапия эффективно управляет метастазами лимфатических узлов tasis и обеспечил значительный выигрыш в выживаемости Управление метастазами в лимфатические узлы (LNM) с помощью традиционных методов, таких как лучевая терапия и системная химиотерапия, демонстрирует ограниченную селективность LNM и, следовательно, может вызывать нежелательные явления, не соответствующие цели.В то время как разработка систем доставки лекарств, специфичных для LNM, имеет огромный потенциал для обеспечения более безопасного метода лечения и улучшения лечения рака, точная оценка терапевтической эффективности и последствий была сложной задачей из-за отсутствия подходящей доклинической модели. Здесь мы создали экспериментальную модель LNM у мышей путем прямого посева раковых клеток в лимфатический узел (LN), в котором развились спонтанные LNM-переносимые отдаленные метастазы (DM) в отсутствие первичной опухоли. В этой модели раннее, но не позднее, лечение LNM до того, как они станут системно диссеминированными, может дать значительный выигрыш в выживаемости, что позволяет предположить, что время для лечения LNM имеет решающее значение.Систематическая сравнительная оценка различных локальных систем доставки лекарств показала, что мицеллярная композиция может обеспечить высоко LNM-специфичную доставку химиотерапевтического агента, которая превосходит системную химиотерапию, эффективна при очень низких дозах и безопасна. Это исследование предполагает не только то, что экспериментальная модель LNM предоставляет полезную доклиническую модель для изучения управления LNM и его терапевтических последствий, но также и то, что мицеллы являются многообещающей системой доставки лекарств для управления LNM посредством местного введения. Метастаз в лимфатических узлах Местная доставка лекарств Местная химиотерапия Мицеллы Временное окно терапевтического действия Рекомендуемые статьиЦитирующие статьи (0) © 2020 Elsevier B.V. Все права защищены. Метастазы возникают, когда рак распространяется в другую часть тела от того места, где он возник.Метастазы не следует путать с «местнораспространенным раком». Это рак, который распространился на близлежащие ткани или лимфатические узлы. Но по телу он не распространился. Узнайте больше об основах метастазирования. Название метастатического рака может сбить вас с толку. Врачи называют метастаз исходного рака. Например, рак груди, который распространяется на кости, не является раком кости. Это называется метастатическим раком груди. В прошлом многие люди недолго жили с метастатическим раком. Даже при современных более эффективных методах лечения выздоровление не всегда возможно. Но врачи часто могут лечить рак, даже если не могут его вылечить. Хорошее качество жизни возможно в течение месяцев или даже лет. Лечение зависит от типа рака, доступных вариантов лечения и ваших пожеланий. Это также зависит от вашего возраста, общего состояния здоровья, лечения, которое вы получали ранее, и других факторов.Лечение метастатического рака включает хирургическое вмешательство, химиотерапию, гормональную терапию, иммунотерапию и лучевую терапию. Для многих людей, больных раком, цель лечения — попытаться вылечить рак. Это означает избавиться от рака и больше никогда не возвращаться. При метастатическом раке излечение рака может быть нереальной целью. Однако это все еще может быть надеждой или мечтой. Разумно спросить своего врача, является ли вылечить рак целью. Если вылечить рак не является целью лечения, цель состоит в том, чтобы помочь человеку жить как можно лучше как можно дольше.Если говорить более конкретно, эту цель можно разбить на 4 части: Чтобы иметь как можно меньше побочных эффектов от рака Чтобы иметь как можно меньше побочных эффектов от лечения рака Для лучшего качества жизни больного раком Чтобы больной раком прожил с раком как можно дольше Каждый человек оценивает эти предметы по-своему.Важно сообщить вашей медицинской бригаде, что для вас важно. Лечение метастатического рака поможет вам прожить дольше и почувствовать себя лучше. Но лечение — это всегда ваше решение. Узнайте больше о принятии решений о лечении рака. Эти рекомендации включают информацию о лечении многих типов метастатического рака. Когда врачи могут лечить метастатический рак, ваша ситуация может быть похожа на состояние человека с хроническим или длительным заболеванием.Примерами хронических заболеваний являются диабет 1 типа, застойная сердечная недостаточность и рассеянный склероз. Врачи могут лечить эти состояния, но не лечить их. Жить с метастатическим раком сложно. Задачи у всех разные, но они могут включать: Обидно, что рак вернулся. Вы можете чувствовать безнадежность, злость, грусть или ощущение того, что никто не понимает, что вы переживаете, даже семья. Беспокоиться о том, что лечение не поможет и рак только усугубится. Проведение анализов, приемы к врачу и решения. Разговор с семьей и друзьями о раке. Вам нужна помощь в повседневной деятельности, если вы чувствуете себя истощенным или у вас есть побочные эффекты от лечения. Обретение эмоциональной и духовной поддержки. Как справиться с затратами на дополнительное лечение.Даже если у вас есть страховка, она может не покрывать все. Чтобы понять вашу ситуацию, вы можете получить второе мнение. Многие люди считают, что это помогает получить мнение другого онколога, и многие врачи его поддерживают. Ваш врач может помочь вам справиться с симптомами рака и побочными эффектами лечения. Например, если вы испытываете боль, ваше лечение может включать операцию по удалению опухоли в болезненной области.Ваш врач может также прописать обезболивающие или лекарства от тошноты. Преодоление эмоций и проблем, связанных с образом жизни, — важная часть жизни с метастатическим раком. Способы преодоления включают: Узнаем о метастазе. Возможно, вы захотите узнать все возможное или просто основную информацию. Обсуждение вашей ситуации с другим медицинским работником, например, психологом, психиатром, консультантом или социальным работником онкологии. Управление стрессом. От планирования до медитации и йоги — существует множество способов снизить уровень стресса. В поисках смысла. Вам может помочь разговор с больничным капелланом, консультантом или вашим религиозным лидером. Говорить о страхах и беспокойствах важно, даже если лечение работает хорошо. Расскажите своему лечащему врачу об эмоциональных симптомах. Люди могут годами жить с метастатическим раком.Ваш врач может помочь вам добиться наилучшего возможного качества жизни в это время. В больницах и медицинских центрах есть много ресурсов для вас и вашей семьи. Вашим близким тоже может понадобиться помощь. Наличие члена семьи или друга с метастатическим раком — непростая задача, особенно для людей, которые помогают заботиться о вас. Они могут попробовать способы, описанные выше. Или ваша медицинская бригада может посоветовать другие советы. Например, существуют личные и онлайн-группы поддержки для членов семей больных раком. Как справиться с неопределенностью Лечение рецидива рака В поисках друга поддержки Американское онкологическое общество: понимание рецидивов Национальный институт рака: лечение рака как хронического состояния При метастазировании раковые клетки отрываются от того места, где они впервые образовались (первичный рак), перемещаются по кровеносной или лимфатической системе и образуют новые опухоли (метастатические опухоли) в других частях тела.Метастатическая опухоль — это тот же тип рака, что и первичная опухоль. Рак, который распространяется от места своего возникновения в отдаленную часть тела, называется метастатическим раком. Многие виды рака также называют раком стадии IV (4). Процесс, посредством которого раковые клетки распространяются на другие части тела, называется метастазированием. При наблюдении под микроскопом и других исследованиях метастатические раковые клетки имеют черты, сходные с характеристиками первичного рака, а не клетки в том месте, где обнаружен метастатический рак.Таким образом врачи могут определить, что это рак, распространившийся из другой части тела. Метастатический рак имеет то же название, что и первичный рак. Например, рак груди, который распространяется на легкие, называется метастатическим раком груди, а не раком легких. Его лечат как рак груди IV стадии, а не как рак легких. Иногда, когда у людей диагностируют метастатический рак, врачи не могут сказать, с чего это началось. Этот тип рака называется раком неизвестного первичного происхождения или CUP.См. Дополнительную информацию на странице «Карцинома неизвестного первичного звена». Метастазы: как распространяется рак Во время метастазирования раковые клетки распространяются из того места в теле, где они впервые образовались, в другие части тела. Раковые клетки распространяются по телу в несколько этапов. Эти шаги включают: В большинстве случаев раковые клетки умирают в какой-то момент в этом процессе.Но пока условия благоприятны для раковых клеток на каждом этапе, некоторые из них могут образовывать новые опухоли в других частях тела. Метастатические раковые клетки также могут оставаться неактивными в отдаленном месте в течение многих лет, прежде чем они начнут снова расти, если вообще начнут расти. Рак может распространяться практически на любую часть тела, хотя разные типы рака с большей вероятностью распространятся на определенные области, чем на другие. Наиболее частыми участками распространения рака являются кости, печень и легкие.В следующем списке показаны наиболее распространенные места метастазов, не включая лимфатические узлы, для некоторых распространенных видов рака: Метастатический рак не всегда вызывает симптомы.Когда симптомы действительно возникают, то, каковы они и как часто они возникают, будет зависеть от размера и местоположения метастатических опухолей. Некоторые общие признаки метастатического рака включают: Существуют методы лечения большинства типов метастатического рака.Часто цель лечения метастатического рака состоит в том, чтобы контролировать его, останавливая или замедляя его рост. Некоторые люди могут жить годами с метастатическим раком, который хорошо контролируется. Другие методы лечения могут улучшить качество жизни за счет облегчения симптомов. Этот вид помощи называется паллиативной. Его можно вводить на любом этапе лечения рака. Лечение, которое вы можете пройти, зависит от вашего типа первичного рака, места его распространения, лечения, которое вы получали в прошлом, и вашего общего состояния здоровья.Чтобы узнать о вариантах лечения, в том числе о клинических испытаниях, найдите свой тип рака в Обзоре информации о раке PDQ® для лечения взрослых и детей. Если вам сказали, что ваш рак больше не поддается контролю, вы и ваши близкие, возможно, захотите обсудить уход за пациентами в конце жизни. Независимо от того, решите ли вы продолжить лечение, чтобы уменьшить рак или контролировать его рост, вы всегда можете получить паллиативную помощь, чтобы контролировать симптомы рака и побочные эффекты лечения.Информация о том, как справиться с ситуацией и планировать уход за пациентами в конце жизни, доступна в разделе продвинутого рака на этом сайте. Исследователи изучают новые способы убить или остановить рост первичных и метастатических раковых клеток. Эти способы включают: Посетите страницу исследования метастатического рака на этом сайте, чтобы быть в курсе текущих исследований, финансируемых NCI. Управление метастазами в лимфатические узлы с помощью местной химиотерапии может предотвратить отдаленные метастазы и улучшить выживаемость у мышей
Основные моменты
Abstract
Ключевые слова
Рекомендуемые статьи
Ссылки на статьи
Как справиться с метастатическим раком | Cancer.Net
Название метастатического рака
Что значит иметь метастатический рак?
Как лечится метастатический рак?
Цели лечения
Жизнь с хроническим раком
Проблемы жизни с раком
Решение проблем метастатического рака
Работа с эмоциями и изменение образа жизни
Признайте свои чувства и заботы
Поддержка ваших опекунов
Связанные ресурсы
Дополнительная информация
Метастатический рак: когда рак распространяется
Что такое метастатический рак?
Как распространяется рак
Там, где распространяется рак
Тип рака Основные места метастазирования Мочевой пузырь Кость, печень, легкое Грудь Кость, мозг, печень, легкое Двоеточие Печень, легкое, брюшина Почка Надпочечник, кость, мозг, печень, легкое Легкое Надпочечник, кость, мозг, печень, другое легкое Меланома Кость, мозг, печень, легкое, кожа, мышца Яичник Печень, легкое, брюшина Поджелудочная железа Печень, легкое, брюшина Простата Надпочечник, кость, печень, легкое Ректальный Печень, легкое, брюшина Желудок Печень, легкое, брюшина Щитовидная железа Кость, печень, легкое Матка Кость, печень, легкое, брюшина, влагалище Симптомы метастатического рака
Лечение метастатического рака
Когда метастатический рак больше не поддается контролю
Текущие исследования

 Среди них выделяют левые поясничные лимфатические узлы, к которым относятся латеральные аортальные, предаортальные и постаортальные узлы, промежуточные поясничные узлы, располагающиеся между воротной и нижней полой венами; и правые поясничные узлы, включающие в себя латеральные кавальные, предкавальные и посткавальные лимфатические узлы.
Среди них выделяют левые поясничные лимфатические узлы, к которым относятся латеральные аортальные, предаортальные и постаортальные узлы, промежуточные поясничные узлы, располагающиеся между воротной и нижней полой венами; и правые поясничные узлы, включающие в себя латеральные кавальные, предкавальные и посткавальные лимфатические узлы.
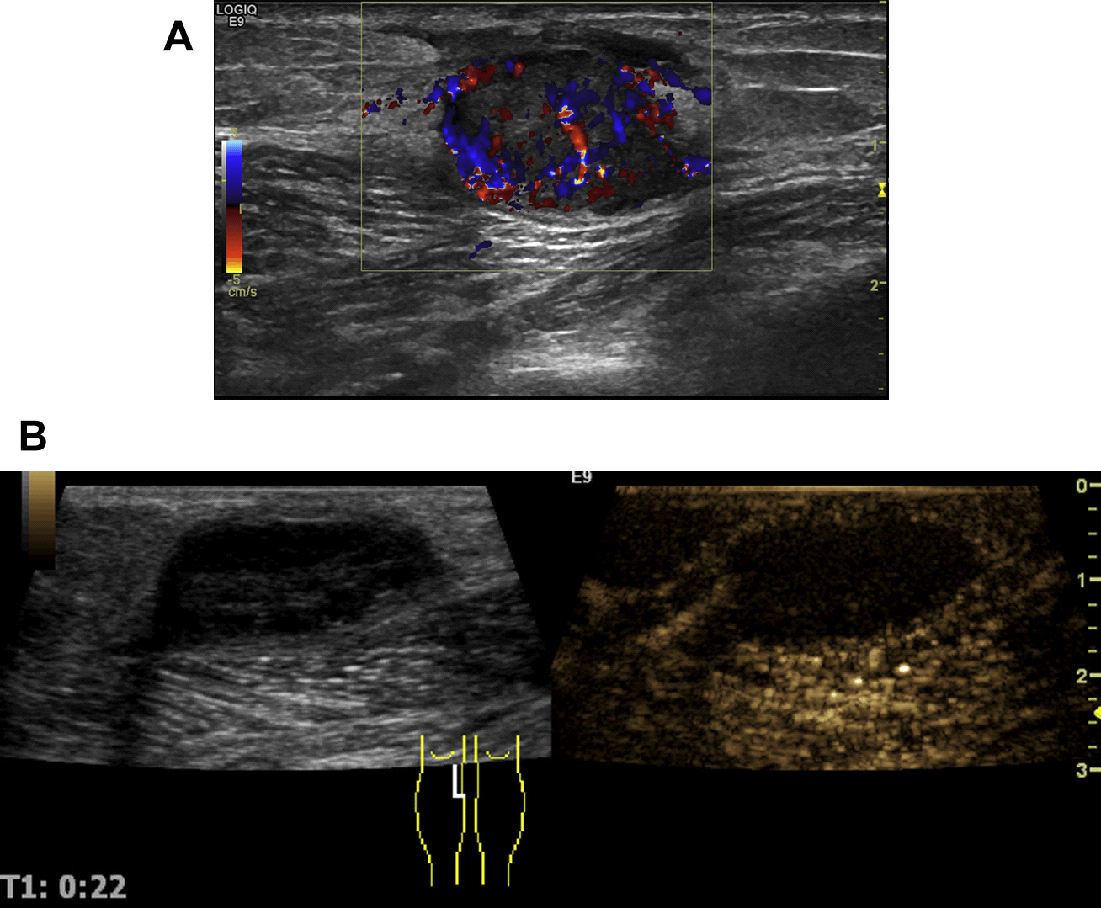
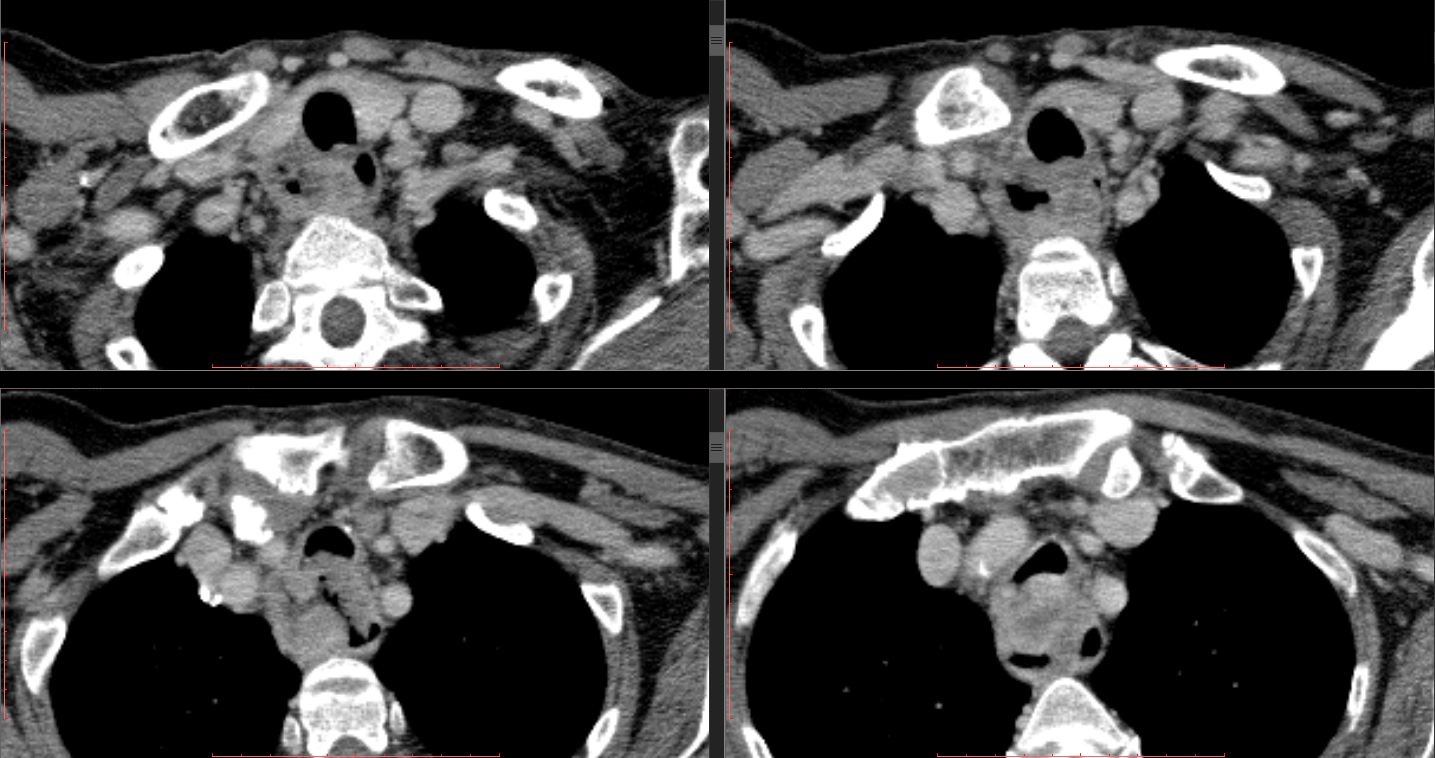
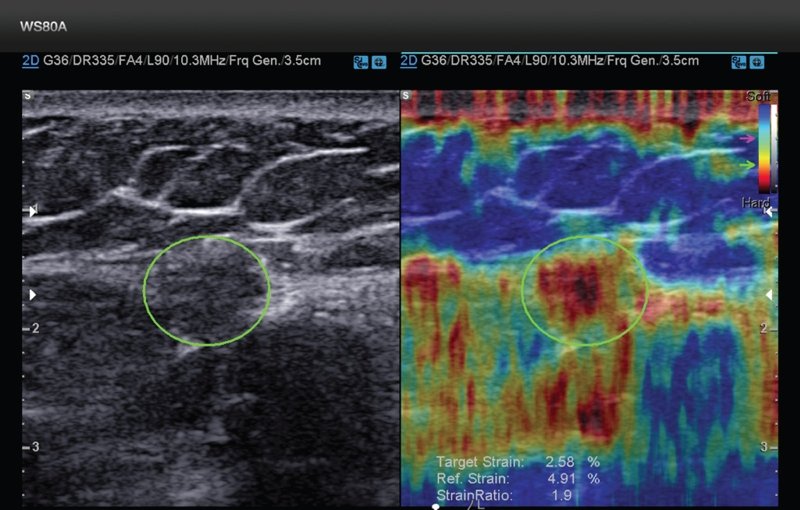 Чем менее дифференцированы клетки опухоли, тем она агрессивнее и тем раньше начинает метастазировать.
Чем менее дифференцированы клетки опухоли, тем она агрессивнее и тем раньше начинает метастазировать.