Рецидивирующие стрептококковые ангины — Доказательная медицина для всех
Стрептококковые ангины не являются редкостью в практике педиатров и терапевтов. Фарингиты, вызванные бета-гемолитическим стрептококком группы А (БГСА) не только доставляют выраженный дискомфорт во время самой болезни, но и чреваты ревматическими осложнениями после нее.Вопросы лечения обострения стрептококковых ангин обычно не вызывают крупных разногласий между врачами. Однако когда речь заходит о тактике ведения пациентов с рецидивирующими БГСА-тонзиллитами (БГСА-фарингитами), или бактерионосительством БГСА в зеве — врачи, нередко, дают диаметрально противоположные рекомендации.
Рецидивы острого БГСА-тонзиллита, подтвержденные лабораторными методами, могут объясняться несколькими причинами:
- Хроническое носительство БГСА, обостряющееся во время вирусного фарингита .
- Несоблюдение рекомендованного режима антибактериальной терапии .
- Реинфекция БГСА от носителей (например, внутри семьи) или острых больных (например, в детском коллективе).
- Неэффективность лечения (особенно если штамм первого случая и рецидива — одинаков), но этот вариант встречается редко.
При выявлении случаев рецидива острого фарингита (тонзиллита), БГСА-этиология которого подтверждена посевом или стрептатестом, следует повторить курс антибактериального лечения. Лечение следует повторять антибиотиком, более устойчивым к воздействию бета-лактамаз, нежели антибиотик, применявшийся для терапии первого эпизода фарингита. Если приверженность пациента терапии подвергается обоснованным сомнениям — для лечения рецидива врач может использовать внутримышечное введение бензатина пенициллина G.
Если при лечении первого эпизода полный курс пенициллина был проведен абсолютно корректно, то рецидив следует лечить антибиотиками первого поколения цефалоспоринов (например, цефалексином). Если для лечения первого эпизода использовалось первое поколение цефалоспоринов (и курс лечения был выполнен безупречно), следует использовать второе или третье поколение цефалоспоринов (например, цефуроксим, цефиксим, цефтриаксон). Альтернативными препаратами при рецидире БГСА-фарингита, являются амоксициллин-клавуланат или клиндамицин.
Контрольный мазок из зева на БГСА после успешного лечения рецидива — не требуется, за исключением некоторых особых случаев.
При наличии многочисленных рецидивов БГСА-фарингитов, бывает очень сложно отличить истинные реинфекции БГСА от вирусных фарингитов на фоне носительства БГСА. Вполне вероятно, что большинство из этих пациентов являются носителями, и обострения вызваны нестрептококковыми инфекциями. В таких ситуациях показано лечение клиндамицином или амоксициллин-клавуланатом, поскольку эти препараты продемонстрировали в исследованиях наилучшие показатели санации при хроническом носительстве.В тех случаях, когда пациент испытывает шесть и более БГСА-фарингитов в течение одного года, или три-четыре БГСА-фарингита в течение двух лет подряд, следует рассмотреть вопрос о профилактической тонзиллэктомии. Ее польза при рецидивах БГСА была доказана в нескольких рандомизированных исследованиях, в том числе на 187 детях с рецидивирующим БГСА-фарингитом, из которых 95 детей перенесли тонзилэктомию. Заболеваемость фарингитом в течение первых двух лет наблюдения была значительно ниже в группе детей, перенесших тонзилэктомию.
Профилактика
Обычно БГСА может находиться в ротоглотке пациентов длительное время, вне всякой связи с ангинами и нарушениями иммунитета. В умеренном климате, в зимне-весенний период, носителями БГСА являются до 20% детей, без симптомов фарингита. Носительство стрептококка может продолжаться в течение многих месяцев.
У носителей будут положительные мазки из зева на БГСА, и положительный стрептатест — и во время обычных ОРВИ, в том числе вирусных фарингитов, имитируя стрептококковую ангину. В таких условиях различить вирусный фарингит от стрептококкового бывает почти невозможно. Можно ориентироваться на некоторые косвенные признаки, такие как возраст пациента, время года, эпидемиологию местности и характеристики развития болезни. Кроме того, носители стрептококка в ротоглотке обычно имеют низкие титры АСЛ-О, а высокие титры АСЛ-О могут косвенно свидетельствовать о том, что фарингит вызван именно стрептококком. Носительство стрептококка крайне редко приводит к ревматической лихорадке или гнойным стрептококковым осложнениям. Кроме того, излечение от хронического носительства БГСА — гораздо труднее, чем излечение от острой БГСА-инфекции. Поэтому носители БГСА, за редким исключением, не требуют антибактериальной терапии.Непрерывные курсы антибиотиков подходят только для профилактики рецидивов ревматизма у пациентов, которые уже пережили один эпизод ревматической атаки
Вакцинация. На данный момент нет вакцин против БГСА, хотя разработка таких вакцин ведется.
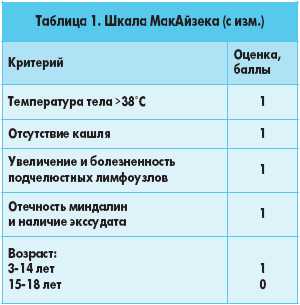
В диагностике и выборе тактики также может помочь шкала МакАйзека,
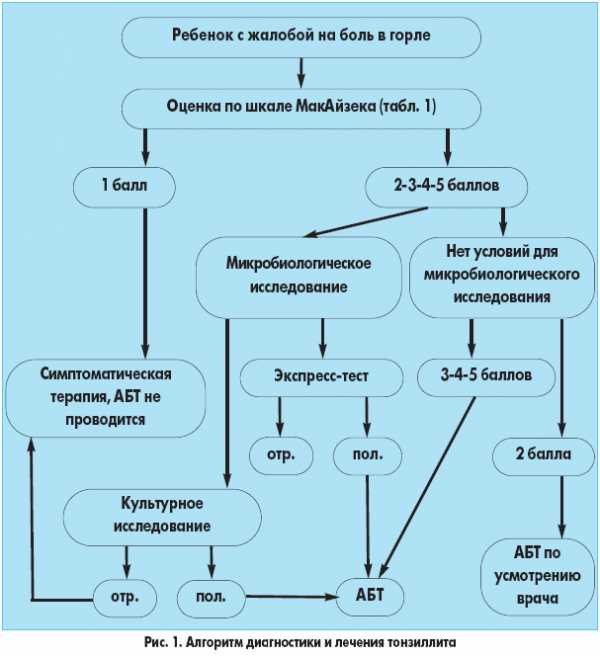
а также этот алгоритм.
medspecial.ru
Виды стрептококков в горле — гемолитический и зеленящий, пиогенный и негемолитический и др. 2019
Стрептококк, пожалуй, одна из самых известных бактерий. Многие наслышаны об опасности этого микроорганизма, его способности вызывать серьезные болезни и давать тяжелые осложнения на почки, сердце и суставы. Именно поэтому диагноз «гемолитический стрептококк в горле» звучит устрашающе. Действительно ли стрептококк так опасен? Чем отличается гемолитический стрептококк от негемолитического? Что такое «зеленящий стрептококк? Если вы хотите узнать ответы на эти вопросы, данная статья для вас.
Содержание статьи
Стрептококк — род бактерий, объединяющий множество видов, которыми различаются патогенностью для человека, устойчивостью к лекарствам, биохимическими и генетическими особенностями. При этом все они — паразиты, которые могут существовать в горле, носовой полости, нижних дыхательных путях и желудочно-кишечном тракте. Поговорим подробнее о видах стрептококков и их опасности.
Стрептококк — особенности микроорганизма
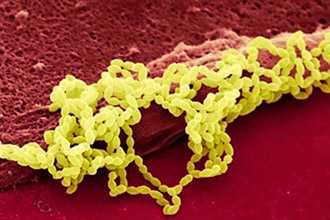 Стрептококки, как и другие бактерии-кокки, имеют шаровидную форму клеток. Размножаются они путем простого деления надвое.
Стрептококки, как и другие бактерии-кокки, имеют шаровидную форму клеток. Размножаются они путем простого деления надвое.
Стрептококк — бактерия, постоянно циркулирующая в человеческих популяциях. Этот микроорганизм достаточно долго может сохраняться в воздухе, каплях жидкости, но лучше всего он себя чувствует внутри человеческого тела. Оптимальная температура для его размножения находится в диапазоне 35-37°С, что соответствует показателям термометрии здорового (а также слегка заболевшего) человека.
При температуре выше 38°С жизнедеятельность стрептококка угнетается, однако он может выживать при повышении температуры вплоть до 60°С.
Стрептококк может долгое время храниться в засохшем гное и вязкой мокроте, покрывающей слизистую дыхательных путей. Благодаря этому стрептококк может быть причиной хронических инфекций.
Распространение инфекции происходит при контакте здорового человека с больным — при разговоре, поцелуях и т.п. Такой путь передачи называют воздушно-капельным. Установлено, что бактерия также может передаваться алиметарным (пищевым) и контактно-бытовым путем (при пользовании общей посудой, полотенцами и т.д.).
Стрептококковая инфекция может вызывать такие болезни горла, как:
- банальная ангина;
- хронический тонзиллит;
- скарлатина;
- острый или хронический фарингит.
Классификация стрептококков. Какими они бывают?
Общепринятая классификация стрептококков основана на особенностях роста данных бактерий в культуре (т.е. в лабораторных условиях). Стрептококк выращивают на особой питательной среде — кровяном агаре. Помимо прочих компонентов, кровяной агар содержит эритроциты — красные клетки крови.
В зависимости от того, разрушает ли стрептококк эритроциты, выделяют следующие его группы:
- Альфа-гемолитические стрептококки. Представители данной группы разрушают клетки крови, вызывая окисление гемоглобина. При окислении гемоглобин становится зеленым, поэтому альфа-гемолитический стрептококк нередко называют «зеленящим». Наиболее распространенным представителем зеленящих стрептококков является Streptococcus viridans. Он представлен в большом количестве на коже, слизистых оболочках рта, дыхательных путей, половых органов. Данный микроорганизм является представителем нормальной микрофлоры. Для здорового человека Streptococcus viridans неопасен, но при снижении иммунитета он может вызвать воспаление.
Альфа-гемолитические стрептококки зачастую вызывают бактериальные осложнения простуды и гриппа. В частности, они могут спровоцировать бактериальное осложнение вирусного тонзиллита или фарингита.
В редких случаях альфа-гемолитический стрептококк дает осложнения на сердце.
Именно представители БГСА способны вызвать острый и хронический тонзиллит, фарингит, скарлатину.
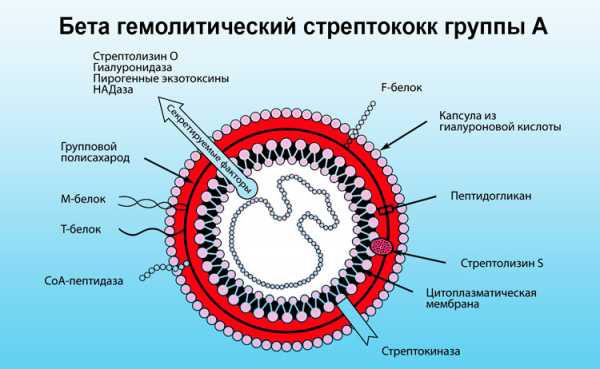
- Бета-гемолитические стрептококки. При выращивании на кровяном агаре вызывают гемолиз (т.е. разрушение эритроцитов). Именно бета-гемолитические стрептококки наиболее опасны для человека. Бета-гемолитические виды стрептококков в горле вызывают острое воспаление, которое сопровождается бурным иммунным ответом. В рамках данной группы выделяют 20 серогрупп (обозначаются буквами латинского алфавита, от А до О), в зависимости от биохимических особенностей бактерий. Наибольшее медицинское значение имеют серогруппы А и В:
- Бета-гемолитический стрептококк группы А (в медицине часто используется аббревиатура БГСА)– возбудитель большинства стрептококковых болезней.
- Бета-гемолитический стрептококк группы В (БГСВ) — может быть обнаружен на коже и слизистых здоровых людей. При снижении иммунитета данный микроорганизм может спровоцировать развитие воспаления легких, почек, кишечника, мозга. Особенно опасен БГСВ для беременных женщин.
- Гамма-гемолитические стрептококки. Не вызывают разрушение эритроцитов при выращивании в культуре. Представители данной группы обитают в ротовой полости, кишечнике. В норме не способны нанести вред организму.
Чтобы точно определить, какой именно стрептококк вызвал болезнь горла, необходимо сдать анализ мазка из зева. Врач-лаборант, выращивая бактерии на кровяном агаре, определит, присутствуют ли в горле стрептококки, и к каким группам они относятся. Если требуется более точное определение (до вида) рекомендуется сдать ПЦР-анализ мокроты, основанный на определении ДНК микроорганизма.
Стрептококковые болезни горла
Распространенными заболеваниями горла, которые вызваны стрептококковой инфекцией, являются ангина, фарингит и скарлатина.
Интересно, что стрептококковая инфекция, в первую очередь БГСА, зачастую поражает небные гланды и глотку одновременно, вызывая тонзиллофарингит.
Тонзиллофарингит — высоко контагиозное заболевание. Первые его симптомы проявляются через 24-48 часов после контакта с носителем инфекции. Особенно высока вероятность передачи инфекции от человека, страдающего острым тонзиллитом.
Начало болезни острое, внезапное. Температура тела резко поднимается до 38-39°С (у детей могут быть и более высокие показатели). Больной страдает от головной боли, тошноты, выраженной слабости. У детей часто наблюдается рвота, нарушение пищеварения, боль в животе. Причина этого — интоксикация. Лимфатические узлы на шее увеличиваются, их ощупывание вызывает боль.
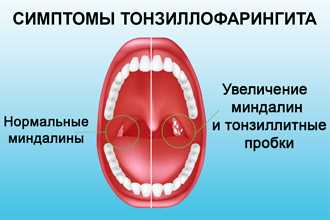
Один из наиболее ярких симптомов тонзиллофарингита — боль в горле. Она беспокоит больного практически постоянно, усиливается при глотании, разговоре, кашле и т.п.
При осмотре горла заметно сильное увеличение миндалин, покраснение зева (миндалин, мягкого неба, глотки). Поверхность слизистой оболочки бугристая, отекшая. На миндалинах обычно присутствует гнойный налет. При попытке его снять он легко сдвигается, не вызывая кровотечения (отличие от дифтерии). Отличием от скарлатины является отсутствие каких-либо высыпаний на коже и слизистой оболочке ротовой полости.
Симптомы достигают пика на 2 день болезни, далее постепенно идут на спад (при должном лечении). Болезнь проходит в течение 5-10 дней. Лимфатические узлы могут восстанавливаться немного дольше (до 14 дней).
Стрептококковый тонзиллофарингит склонен к переходу в хроническую форму. В таком случае наблюдается периодическое обострение ангины и фарингита.
В чем опасность стрептококковых инфекций?
Главное, что необходимо знать о стрептококковой инфекции — она способна вызывать развития тяжелых осложнений. В первую очередь это касается БГСА — наиболее распространенного и опасного возбудителя.
Стрептококковые заболевания горла, такие как ангина и фарингит, можно вылечить за неделю. Если же запустить болезнь, начинают развиваться осложнения — ревматоидный артрит, гломерулонефрит и др.
Такие осложнения приходиться лечить годами. Именно поэтому вопрос о правильном лечении стафилококковых инфекций требует особого внимания.
Терапия стрептококковых инфекций, в том числе тонзиллофарингита, в обязательном порядке включает прием антибактериальных препаратов системного действия (антибиотиков в виде таблеток или инъекций). При отказе от антибиотикотерапии существенно возрастает вероятность развития осложнений, что доказано многочисленными медицинскими исследованиями. Конечно, осложнения развиваются не у всех, но рисковать не стоит. Когда на одной чаше весов — незначительные побочные эффекты антибиотиков, а на другой — тяжелые последствия отказа от них, выбор очевиден.
Перечислим осложнения, которые может вызвать БГСА:
- острая ревматическая лихорадка;
- ревматическая болезнь сердца, поражающая клапаны и стенку сердца;
- постстрептококковый гломерулонефрит, проявляющийся в воспалении почечных клубочков;
- ревматоидный артрит (воспаление суставов).
Такие осложнения обычно развиваются через 2-3 недели после выздоровления. Все вышеуказанные заболевания существенно снижают качество жизни и тяжело поддаются лечению.
Как и почему развиваются постстрептококковые осложнения? Первый механизм — воздействие токсинов, выделяемых бактерией. Особый вред стрептококковые токсины наносят сердцу. Второй механизм более сложный. Дело в том, что белки клеточной стенки стрептококка по своей структуре напоминают некоторые белки тела человека, входящие в состав сердечной мышцы, клапанов сердца, почечных лоханок, суставных поверхностей. Если стрептококк задерживается в организме слишком долго (например, при хроническом тонзиллите, затяжном фарингите), иммунная система начинает активно уничтожать все, что напоминает по строению клетку стрептококка. В результате вырабатываемые антитела разрушают не только вредоносную бактерию, но и собственные клетки организма.
Таким образом, стрептококковая инфекция способна запускать в организме аутоииммунные реакции.
Лечение стрептококковой инфекции горла
Основа лечения стрептококковых инфекций, вызванных БГСА — антибиотики. Своевременный прием антибиотиков не только приводит к быстрому исчезновению симптомов болезни, но и предупреждает развитие осложнений, в том числе ревматических.
БГСА обладает высокой чувствительностью к пенициллинам, цефалоспоринам и макролидам. Препаратами первого выбора являются пенициллины. Препараты Феноксиметил-пенициллин и Амоксициллин принимают трижды в день, по 500 мг (т.е. 1,5 г в сутки). Уточните дозировку у лечащего врача. Она может варьировать в зависимости от возраста больного и тяжести инфекции. При непереносимости пенициллина врач может назначить макролиды — эритромицин, азитромицин, кларитромицин. Схемы лечения данными препаратами назначаются индивидуально.
Препараты гентамицин, тетрациклин и канамицин малоэффективны по отношению к бета-гемолитическому стрептококку группы А. Назначать их при ангине нецелесообразно.
Стандартный курс лечения стрептококковой инфекции — 10 дней. Исключение — азитромицин (курс лечения данным препаратом составляет 5 дней). При этом улучшение наблюдается уже на 2 сутки лечения. В этот момент важно не прекращать лечение. Для полного уничтожения очага инфекции необходимо полностью пройти курс.
Через 2 недели после выздоровления рекомендуется сдать бактериологические анализы, подтверждающие отсутствие стрептококковой инфекции в организме.
Автор: Оксана Циклаури
Источники: medscape.com, health.harvard.edu, medicalnewstoday.com.
liergroup.ru
А-СТРЕПТОКОККОВЫЙ ТОНЗИЛЛИТ: клиническое значение, вопросы антибактериальной терапии | #01-02/02
Что подразумевают под острым тонзиллитом?
Почему при БГСА-тонзиллите необходима антибактериальная терапия?
Какие антибактериальные средства выбрать?
Острый тонзиллит (ангина)1 — заболевание, которое характеризуется острым воспалением одного или нескольких лимфоидных образований глоточного кольца (чаще небных миндалин) и принадлежит к числу широко распространенных инфекций верхних дыхательных путей.
Наиболее значимым бактериальным возбудителем острого тонзиллита является β-гемолитический стрептококк группы А (Streptococcus pyogenes, БГСА). Реже острый тонзиллит вызывают вирусы, стрептококки групп C и G, Arcanobacterium haemolyticum, Neisseria gonorrhoeae, Corynebacterium diphtheria (дифтерия), анаэробы и спирохеты (ангина Симановского — Плаута — Венсана), крайне редко — микоплазмы и хламидии.
БГСА передается воздушно-капельным путем. Источниками инфекции являются больные и реже бессимптомные носители. Вероятность заражения увеличивается при высокой степени обсемененности и тесном контакте с больным. Вспышки острого БГСА-тонзиллита чаще всего встречаются в организованных коллективах (в детских дошкольных учреждениях, школах, воинских частях и т. д.). Поражаются преимущественно дети в возрасте 5-15 лет, а также лица молодого трудоспособного возраста. Наибольшая заболеваемость отмечается в зимне-весенний период.
Высокая частота заболевания, контагиозность инфекции, большие трудопотери, влекущие за собой экономический ущерб, возможность развития серьезных осложнений — все это свидетельствует о том, что проблема БГСА-тонзиллита по-прежнему стоит достаточно остро как в научном, так и в практическом аспекте.
Клиническая картина. Инкубационный период при остром БГСА- тонзиллите составляет от нескольких часов до 2-4 дней. Для этого заболевания характерны острое начало с повышением температуры до 37,5–39°С, познабливание или озноб, головная боль, общее недомогание, боль в горле, усиливающаяся при глотании; нередки артралгии и миалгии. У детей могут быть тошнота, рвота, боли в животе. Развернутая клиническая картина наблюдается, как правило, на вторые сутки с момента начала заболевания, когда общие симптомы достигают максимальной выраженности. При осмотре выявляется покраснение небных дужек, язычка, задней стенки глотки. Миндалины гиперемированы, отечны, часто с гнойным налетом желтовато-белого цвета. Налет рыхлый, пористый, легко удаляется шпателем с поверхности миндалин без кровоточащего дефекта. У всех больных отмечаются уплотнение, увеличение и болезненность при пальпации шейных лимфатических узлов на уровне угла нижней челюсти (регионарный лимфаденит). В анализах крови — повышенный лейкоцитоз (9-12 109/л), сдвиг лейкоцитарной формулы влево, ускорение СОЭ (иногда до 40-50 мм/ч), появление С-реактивного белка. Длительность периода разгара (без лечения) составляет примерно 5-7 дней. В дальнейшем при отсутствии осложнений основные клинические проявления болезни (лихорадка, симптомы интоксикации, воспалительные изменения в миндалинах) быстро исчезают, нормализуется картина периферической крови. Симптомы регионарного лимфаденита могут сохраняться до 10-12 дней.
Диагноз БГСА-тонзиллита подтверждается микробиологическим исследованием мазка с поверхности миндалин и/или задней стенки глотки. При соблюдении правил техники забора образца чувствительность метода достигает 90 %, а специфичность — 95-99 %. Популярные за рубежом методы экспресс-диагностики А-стрептококкового антигена в мазках из зева дают возможность получить ответ через 15-20 мин. В то же время следует подчеркнуть, что культуральный метод не позволяет дифференцировать активную инфекцию от БГСА-носительства, а современные экспресс-тесты, несмотря на их высокую специфичность (95-100%), характеризуются сравнительно низкой чувствительностью (60-80%), то есть отрицательный результат быстрой диагностики не исключает стрептококковой этиологии заболевания.
Дифференциальная диагностика острого БГСА-тонзиллита, основанная только на клинических признаках, нередко представляет собой достаточно трудную задачу даже для опытных врачей. Однако необходимо отметить, что наличие респираторных симптомов (кашля, ринита, охриплости голоса и др.), а также сопутствующие конъюнктивит, стоматит или диарея указывают на вирусную этиологию острого тонзиллита. В отличие от скарлатины для острого БГСА-тонзиллита не характерны какие-либо виды высыпаний на коже и слизистых. При локализованной дифтерии ротоглотки налет с миндалин снимается с трудом, не растирается на предметном стекле, не растворяется в воде, а медленно оседает на дно сосуда; после удаления налета отмечается кровоточивость подлежащих тканей. Ангинозная форма инфекционного мононуклеоза, как правило, начинается с распространенного поражения лимфатических узлов (шейных, затылочных, подмышечных, абдоминальных, паховых), симптоматика тонзиллита развивается на 3-5-й день болезни, при исследовании периферической крови выявляется лейкоцитоз с преобладанием мононуклеаров (до 60-80%). Ангина Симановского — Плаута — Венсана характеризуется слабо выраженными признаками общей интоксикации и явлениями одностороннего язвенно-некротического тонзиллита, при этом возможно распространение некротического процесса на мягкое и твердое небо, десны, заднюю стенку глотки и гортань.
Поскольку БГСА-тонзиллит по своей сути — самокупирующееся заболевание и может заканчиваться полным выздоровлением (даже при отсутствии лечения) без каких-либо осложнений, у некоторых врачей по-прежнему существуют сомнения в отношении тщательности курации таких больных. Совершенно необоснованно отдается предпочтение местному лечению (полосканиям, ингаляциям и др.) в ущерб системной антибиотикотерапии. Подобный подход ни в коей мере не оправдывает себя и может привести к весьма печальным для больного последствиям.
Многочисленные литературные данные свидетельствуют о том, что в конце XX столетия произошли существенные изменения в эпидемиологии БГСА-инфекций верхних дыхательных путей и, что особенно важно, их осложнений, обусловленные «возрождением» высоковирулентных А-стрептококковых штаммов. Так, в середине 1980-х годов в США, стране с наиболее благополучными медико-статистическими показателями, разразилась вспышка острой ревматической лихорадки (ОРЛ), сначала среди солдат-новобранцев на военной базе в Сан-Диего (Калифорния), а чуть позже — среди детей в континентальных штатах (Юте, Огайо, Пенсильвании). Причем в большинстве случаев заболевали дети из семей, годовой достаток в которых превышал средний по стране (то есть имеющих отдельное жилище, полноценное питание, возможность своевременного получения квалифицированной медицинской помощи). Примечательно, что диагноз ОРЛ в большинстве случаев был поставлен с опозданием. Среди наиболее вероятных причин данной вспышки далеко не последнюю роль сыграл и так называемый врачебный фактор. Как справедливо отметил G.H. Stollerman (1997), молодые врачи никогда не видели больных с ОРЛ, не предполагали возможности циркуляции стрептококка в школьных коллективах, не знали об определяющем профилактическом значении пенициллина и часто вообще понятия не имели о том, что при тонзиллитах нужно применять антибиотики. Наряду с этим оказалось, что в половине случаев ОРЛ являлась следствием БГСА-тонзиллита, протекавшего со стертым клиническим симптомокомплексом (удовлетворительное общее состояние, температура тела нормальная или субфебрильная, небольшое чувство першения в глотке, исчезающее через 1-2 дня), когда большинство больных не обращались за медицинской помощью, а проводили лечение самостоятельно без применения соответствующих антибиотиков.
Результаты исследований глоточных культур, выполненных в пораженных ОРЛ-популяциях в конце 1980-х годов, позволяют вести речь о существовании «ревматогенных» БГСА-штаммов, обладающих рядом определенных свойств. Среди них особое значение имеет наличие в молекулах М-протеина эпитопов, перекрестно реагирующих с различными тканями макроорганизма-хозяина: миозином, синовией, мозгом, сарколеммальной мембраной. Указанные данные подкрепляют концепцию молекулярной мимикрии как основного патогенетического механизма реализации стрептококковой инфекции в ОРЛ за счет того, что образующиеся в ответ на антигены стрептококка антитела реагируют с аутоантигенами хозяина. С другой стороны, М-протеин обладает свойствами суперантигена, индуцирующего эффект аутоиммунитета. Приобретенный аутоиммунный ответ может быть в свою очередь усилен последующим инфицированием ревматогенными штаммами, содержащими перекрестно-реактивные эпитопы.
В конце 1980-х — начале 1990-х годов из США и ряда стран Западной Европы стали поступать сообщения о чрезвычайно тяжелой инвазивной БГСА-инфекции, протекающей с гипотензией, коагулопатией и полиорганной функциональной недостаточностью. Для обозначения этого состояния был предложен термин «синдром стрептококкового токсического шока» (streptococcal toxic shock-like syndrome), по аналогии со стафилококковым токсическим шоком. И хотя основными «входными воротами» для этой угрожающей жизни БГСА-инфекции служили кожа и мягкие ткани, в 10-20 % случаев заболевание ассоциировалось с первичным очагом, локализующимся в лимфоидных структурах носоглотки. При анализе инвазивных БГСА-инфекций, проводившемся в США в 1985-1992 годах, было установлено, что кривые заболеваемости ОРЛ и синдромом токсического шока стрептококкового генеза оказались очень схожими как по времени, так и по амплитуде.
На сегодняшний день истинные причины упомянутого «возрождения» высоковирулентной БГСА-инфекции по-прежнему полностью не раскрыты. В связи с этим роль точного диагноза и обязательной антибиотикотерапии БГСА-тонзиллита (в том числе его малосимптомных форм) как в контроле за распространением этих инфекций, так и в профилактике осложнений еще более возросла.
Лечение. Несмотря на то что БГСА по-прежнему сохраняет практически полную чувствительность к β-лактамным антибиотикам, в последние годы отмечаются определенные проблемы в терапии тонзиллитов, вызванных этим микроорганизмом. По данным разных авторов, частота неудач пенициллинотерапии БГСА-тонзиллитов составляет 25-30%, а в некоторых случаях — даже 38%. Одной из возможных причин этого может быть гидролиз пенициллина специфическими ферментами — β-лактамазами, которые продуцируются микроорганизмами — копатогенами (золотистым стафилококком, гемофильной палочкой и др.), присутствующими в глубоких тканях миндалин, особенно при наличии хронических воспалительных процессов в последних.
Как видно из табл. 1, препараты пенициллинового ряда остаются средствами выбора только при лечении острого БГСА-тонзиллита. На сегодняшний день оптимальным препаратом из группы оральных пенициллинов представляется амоксициллин, который по противострептококковой активности аналогичен ампициллину и феноксиметилпенициллину, но существенно превосходит их по своим фармакокинетическим характеристикам, отличаясь большей биодоступностью (95, 40 и 50 % соответственно) и меньшей степенью связывания с сывороточными белками (17, 22 и 80 %). При сомнительной комплаентности (исполнительности) больного, а также в определенных клинико-эпидемиологических ситуациях показано назначение однократной инъекции бензатин-пенициллина.
Феноксиметилпенициллин целесообразно назначать только детям младшего возраста, учитывая наличие лекарственной формы в виде суспензии, а также несколько большую комплаентность, обеспечиваемую благодаря контролю со стороны родителей, чего нельзя сказать о подростках.
Наряду с пенициллинами несомненного внимания заслуживает представитель оральных цефалоспоринов I поколения цефадроксил, высокая эффективность которого в терапии БГСА-тонзиллитов, а также хорошая переносимость подтверждены в ходе многочисленных клинических исследований.
При непереносимости β-лактамных антибиотиков целесообразно назначать макролиды (спирамицин, азитромицин, рокситромицин, кларитромицин, мидекамицин). Наряду с высокой противострептококковой активностью преимуществами этих препаратов являются способность создавать высокую тканевую концентрацию в очаге инфекции, более короткий (в частности, для азитромицина) курс лечения, хорошая переносимость. Применение эритромицина — первого представителя антибиотиков данного класса — в настоящее время существенно сократилось, особенно в терапевтической практике, поскольку он чаще других макролидов вызывает нежелательные эффекты со стороны желудочно-кишечного тракта, обусловленные стимулирующим действием эритромицина на моторику желудка и кишечника.
Следует отметить, что в последние годы из Японии и ряда стран Европы все чаще поступают сообщения о нарастании резистентности БГСА к эритромицину и другим макролидам. На примере Финляндии было показано, что формирование резистентности — процесс управляемый. Широкая разъяснительная кампания среди врачей в этой стране привела к двукратному снижению потребления макролидов и, как следствие, к двукратному уменьшению частоты БГСА-штаммов, устойчивых к упомянутым антибиотикам. В то же время в России резистентность БГСА к макролидам составляет 13-17% (Страчунский Л. С. и др., 1997). И этот факт, несомненно, заслуживает самого серьезного внимания.
Антибиотики-линкозамины (линкомицин, клиндамицин) назначают при БГСА-тонзиллите только при непереносимости как b-лактамов, так и макролидов. Широко применять эти препараты при данной нозологической форме не рекомендуется. Известно, что при частом применении оральных пенициллинов чувствительность к ним со стороны зеленящих стрептококков, локализующихся в ротовой полости, существенно снижается. Поэтому у данной категории пациентов, среди которых немало больных с ревматическими пороками сердца, линкозамины рассматриваются как препараты первого ряда для профилактики инфекционного эндокардита при выполнении различных стоматологических манипуляций.
При наличии хронического рецидивирующего БГСА-тонзиллита вероятность колонизации очага инфекции микроорганизмами, продуцирующими b-лактамазы, достаточно высока. В этом случае целесообразно проведение курса лечения ингибитор-защищенными пенициллинами (амоксициллин/клавуланат) или оральными цефалоспоринами II поколения (цефуроксим — аксетил), а при непереносимости b-лактамных антибиотиков — линкозаминами (табл. 2). Указанные антибиотики рассматриваются также как препараты второго ряда для случаев, когда пенициллинотерапия острого БГСА-тонзиллита оказывается безуспешной (что чаще встречается при использовании феноксиметилпенициллина). Универсальной же схемы, обеспечивающей 100%-ную элиминацию БГСА из носоглотки, в мировой клинической практике не сууществует.
Необходимо отметить, что применение тетрациклинов, сульфаниламидов, ко-тримоксазола и хлорамфеникола при БГСА-инфекции глотки в настоящее время не оправдано по причине высокой частоты резистентности и, следовательно, низких показателей эффективности терапии.
Таким образом, в современных условиях вопросы своевременной и качественной диагностики и рациональной антибиотикотерапии БГСА-тонзиллита сохраняют свою актуальность. Появившиеся в последние годы новые антибактериальные средства существенно расширили возможности антимикробной терапии БГСА-тонзиллита, но полностью данную проблему не решили. В связи с этим многие исследователи возлагают большие надежды на создание вакцины, содержащей эпитопы М-протеинов ревматогенных БГСА- штаммов, не вступающих в перекрестную реакцию с тканевыми антигенами человеческого организма. Такая вакцина, в частности в рамках первичной профилактики ОРЛ, очень необходима в первую очередь лицам с генетическими маркерами, указывающими на предрасположенность к заболеванию.
Назначение антибиотиков при катаральной ангине и неосложненных формах хронического тонзиллита не всегда оправданно, тем более без четкого представления о возбудителе.
На этих стадиях заболевания, еще не отягощенных суперинфекцией, альтернативным лечением может стать гомеопатия. Это регулирующая терапия, воздействующая на процессы саморегуляции с помощью лекарств, подобранных индивидуально с учетом реакции больного. С позиций классической гомеопатии ангина и хронический тонзиллит являются не локальными заболеваниями, а частным проявлениями конституционной слабости и наследственной предрасположенности.
На таких положениях основывается подбор компонентов гомеопатического препарата «Тонзилотрен» компании «Немецкий гомеопатический союз», клинические исследования которого в России показали высокую эффективность и безопасность.
1 В зарубежной литературе широко используются взаимозаменяемые термины «тонзиллофарингит» и «фарингит».
назад
www.lvrach.ru
Стрептококк (стрептококковая инфекция): симптомы, лечение
Стрептококковая инфекция — ряд патологий бактериальной этиологии, имеющих разнообразные проявления. Возбудителем заболеваний является стрептококк, который можно обнаружить в окружающей среде — почве, растениях и на теле человека.
Гемолитические стрептококки становятся причиной инфекции, вызывающей разнообразные патологии — скарлатину, рожу, тонзиллит, абсцессы, фурункулы, отит, остеомиелит, эндокардит, ревматизм, гломерулонефрит, пневмонию, сепсис. Эти заболевания имеют тесную взаимосвязь благодаря общему этиологическому фактору, сходным клиническим и морфологическим изменениям, эпидемиологическим закономерностям, патогенетическим звеньям.
Группы стрептококков
По типу гемолиза эритроцитов — красных кровяных телец стрептококки делятся на:
- Зеленящие или альфа-гемолитические – Streptococcus viridans, Streptococcus pneumoniae;
- Бета-гемолитические – Streptococcus pyogenes;
- Негемолитические – Streptococcus anhaemolyticus.
Медицински значимыми являются стрептококки с бета-гемолизом:
- Streptococcus pyogenes — стрептококк группы А, который является возбудителем инфекционной ангины у детей, а также ревматизма и гломерулонефрита.

- Streptococcus pneumoniae — пневмококки – возбудители пневмонии или синусита.
- Streptococcus faecalis и Streptococcus faecies — энтерококки, являющиеся причиной эндокардита и гнойного воспаления брюшины.
- Streptococcus agalactiae — стрептококк группы В, вызывающий заболевания мочеполовой системы или послеродовое воспаление эндометрия.
Негемолитические или зеленящие стрептококки — сапрофитные микроорганизмы, довольно редко вызывающие заболевания у человека.
Отдельно выделяют термофильный стрептококк, который относится к группе молочно-кислых бактерий и используется в пищевой промышленности для приготовления молочно-кислых продуктов. Поскольку этот микроб сбраживает лактозу и другие сахара, его применяют для лечения лиц с лактазной недостаточностью. Термофильный стрептококк обладает бактерицидным действием в отношении некоторых патогенных микроорганизмов, а также используется для профилактики срыгиваний у новорожденных.
Этиология
Возбудитель стрептококковой инфекции — бета-гемолитический стрептококк, способный разрушать эритроциты крови. Стрептококки представляют собой шаровидные бактерии – грамположительные кокки, располагающиеся в мазке в виде цепочек или попарно.
Факторы патогенности микроба:
- Стрептолизин — яд, разрушающий клетки крови и сердца,
- Скарлатинозный эритрогенин — токсин, расширяющий капилляры и способствующий образованию скарлатинозной сыпи,
- Лейкоцидин — фермент, разрушающий лейкоциты и вызывающий дисфункцию иммунной системы,
- Некротоксин,
- Летальный токсин,
- Ферменты, обеспечивающие проникновение и распространение бактерий в тканях – гиалуронидаза, стрептокиназа, амилаза, протеиназа.
Стрептококки устойчивы к нагреванию, замораживанию, высыханию и высокочувствительны к воздействию химических дезинфектантов и антибиотиков – пенициллина, эритромицина, олеандомицина, стрептомицина. Они могут длительное время сохраняться в пыли и на окружающих предметах, но при этом постепенно утрачивают свои патогенные свойства. Энтерококки являются самыми стойкими из всех микробов данной группы.
Стрептококки — факультативные анаэробы. Эти бактерии являются неподвижными и не образуют спор. Растут они только на селективных средах, приготовленных с добавлением сыворотки или крови. В сахарном бульоне образуют придонно-пристеночный рост, а на плотных средах – мелкие, плоские, полупрозрачные колонии. Патогенные бактерии образуют зону прозрачного или зеленого гемолиза. Практически все стрептококки являются биохимически активными: они ферментируют углеводы с образованием кислоты.
Эпидемиология
Источник инфекции — больной человек или бессимптомный бактерионоситель.
 Пути заражения стрептококком:
Пути заражения стрептококком:
- Контактный,
- Воздушно-капельный,
- Пищевой,
- Половой,
- Инфицирование органов мочеполовой системы при несоблюдении правил личной гигиены.
Наиболее опасными для окружающих являются больные со стрептококковым поражением горла. Во время кашля, чихания, разговора микробы попадают во внешнюю среду, высыхают и циркулируют в воздухе вместе с пылью.
При стрептококковом воспалении кожи рук бактерии часто попадают в продукты питания, размножаются и выделяют токсины. Это приводит к развитию пищевой токсикоинфекции.
Стрептококк в носу вызывает ринит с характерной симптоматикой и упорным течением.
Стафилококковая инфекция часто развивается на фоне тяжелых хронических заболеваний:
- Эндокринной патологии,
- Хламидийной и микоплазменной инфекции,
- Дисфункции кишечника.
Стрептококковая инфекция характеризуется всеобщей восприимчивостью и сезонностью. Патогенный стрептококк поражает обычно детей и молодых людей в холодное время – осенью и зимой.
Патогенез
Стрептококк проникает в организм человека и в месте внедрения образует воспалительный очаг. С помощью ферментов и факторов патогенности микроб попадает в кровь и лимфу, разносится к внутренним органам и вызывает развитие в них патологии. Воспаление сердца, костей или легких всегда сопровождается регионарным лимфаденитом.
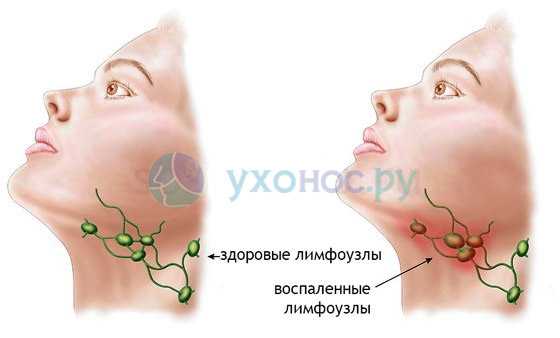
Лимфаденит
Стрептококковые токсины вызывают интоксикационный, диспепсический и аллергический синдромы, которые проявляются лихорадкой, рвотой и тошнотой, головной болью, спутанностью сознания. Клеточная оболочка бактерий воспринимается собственной иммунной системой как аллерген, что приводит к повреждению почечной ткани, сердца, суставов и развитию аутоиммунного воспаления — гломерулонефрита, ревматоидного артрита и эндокардита.
Симптоматика
Возбудителем стрептококковой инфекции является бета-гемолитический стрептококк группы А, который вызывает локализованные формы поражения ЛОР-органов – фарингит, ангину, скарлатину, аденоидит, отит, синусит.
Стрептококк у взрослых
Стрептококковая инфекция горла протекает у взрослых в виде тонзиллита или фарингита.
Фарингит – острое воспалительное заболевание слизистой глотки вирусной или бактериальной этиологии. Стрептококковый фарингит характеризуется острым началом, короткой инкубацией, интенсивной болью в горле.
Фарингит
Заболевание начинается с общего недомогания, субфебрильной температуры, познабливания. Боль в горле бывает настолько сильной, что больные теряют аппетит. Возможно появление признаков диспепсии — рвоты, тошноты, боли в эпигастрии. Воспаление глотки стрептококковой этиологии обычно сопровождается покашливанием и охриплостью голоса.
При фарингоскопии обнаруживается гиперемированная и отечная слизистая глотки с гипертрофией миндалин и лимфоузлов, которые покрываются налетом. На слизистой оболочке ротоглотки появляются ярко-красные фолликулы, по форме напоминающие бублик. Затем возникает ринорея с мацерацией кожи под носом.
Стрептококковый фарингит длится недолго и проходит самопроизвольно. Он редко возникает у детей младше 3 лет. Обычно заболевание поражает пожилых и молодых людей, организм которых ослаблен длительно текущими недугами.
Осложнениями фарингита являются:
- Гнойный средний отит,
- Паратонзиллярный абсцесс,
- Синусит,
- Лимфаденит;
- Отдаленные очаги гнойного воспаления — артрит, остеомиелит.
Стрептококк в горле также вызывает острый тонзиллит, который при отсутствии своевременного и адекватного лечения часто становится причиной аутоиммунных заболеваний — миокардита и гломерулонефрита.
Факторы, способствующие развитию стрептококковой ангины:
- Ослабление местной иммунной защиты,
- Снижение общей резистентности организма,
- Переохлаждение,
- Негативное воздействие факторов внешней среды.
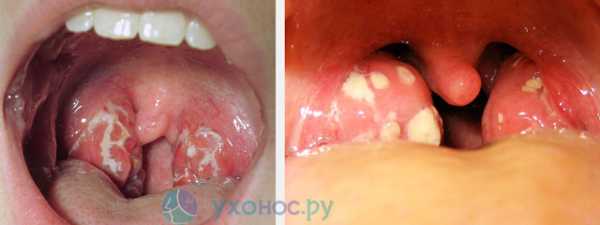
Ангина
Стрептококк попадает на слизистую миндалин, размножается, продуцирует факторы патогенности, что приводит к развитию местного воспаления. Микробы и их токсины проникают в лимфоузлы и кровь, вызывая острый лимфаденит, общую интоксикацию, поражение центральной нервной системы с появлением беспокойства, судорожного синдрома, менингеальных симптомов.
Клиника ангины:
- Интоксикационный синдром — жар, недомогание, ломота в теле, артралгия, миалгия, головная боль;
- Регионарный лимфаденит;
- Постоянная боль в горле;
- У детей диспепсия;
- Отек и гиперемия зева, гипертрофия миндалин, появление на них гнойного, рыхлого, пористого налета, легко снимающегося шпателем,
- В крови – лейкоцитоз, ускорение СОЭ, появление С-реактивного белка.
Осложнения стрептококковой ангины делятся на гнойные — отиты, синуситы и негнойные — гломерулонефрит, ревматизм, токсический шок.
Стрептококк у детей
Гемолитический стрептококк группы А у детей обычно вызывает воспаление органов дыхания, кожных покровов и органа слуха.
Болезни стрептококковой этиологии у детей условно подразделяют на 2 большие группы – первичные и вторичные.
- Первичная патология возникает при
 воспалении мест внедрения микроба — тонзиллит, фарингит, отит, импетиго.
воспалении мест внедрения микроба — тонзиллит, фарингит, отит, импетиго. - Вторичные болезни — аутоиммунные патологии различных органов и целых систем. К ним относятся ревматизм, васкулит, гломерулонефрит.
- Более редкие формы — воспаление мышечных фасций, эндокардит, сепсис.
Скарлатина— детская инфекционно-воспалительная патология, проявляющаяся лихорадкой, точечной сыпью и ангиной. Симптоматика заболевания обусловлена не самим стрептококком, а воздействием его эритрогенного токсина, выделяющегося в кровь.
Скарлатина — высококонтагиозное заболевание. Заражение происходит в основном в детских садах или школах воздушно-капельным путем от больных ангиной детей или бактерионосителей. Болеют скарлатиной обычно дети в возрасте 2-10 лет. Патология проявляется симптомами трех основных синдромов — токсического, аллергического и септического.
Формы скарлатины:
- Легкая — слабовыраженная интоксикация, длительность заболевания 5 дней;
- Среднетяжелая — более выраженные катаральные и интоксикационные симптомы, длительность лихорадки — 7 дней;
- Тяжелая форма встречается в 2 видах — токсическая и септическая. Первая характеризуется резко выраженной интоксикацией, судорогами, появлением менингиальных знаков, интенсивным воспалением горла и кожи; вторая — развитием некротической ангины, выраженным лимфаденитом, септическим воспалением миндалин, мягкого неба и глотки.
Скарлатина имеет острое начало и длится в среднем 10 дней.
Симптомы заболевания:
- Интоксикация – жар, озноб, слабость, боль при глотании, разбитость, тахикардия, учащенный пульс. Больной ребенок становится вялым и сонливым, лицо его одутловато, глаза блестят.
- Дети жалуются на жжение в глотке и испытывают трудности при проглатывании.
- Воспаленные и опухшие железы, расположенные под нижней челюстью, вызывают боль и не дают открыть рот.
- Фарингоскопия позволяет обнаружить признаки классической ангины.
- На следующий день у больного на гиперемированной коже появляется мелкоточечная розеолезная или папуллезная сыпь, которая сначала покрывает верхнюю часть туловища, а спустя пару дней — конечности. Она напоминает красную гусиную кожу.
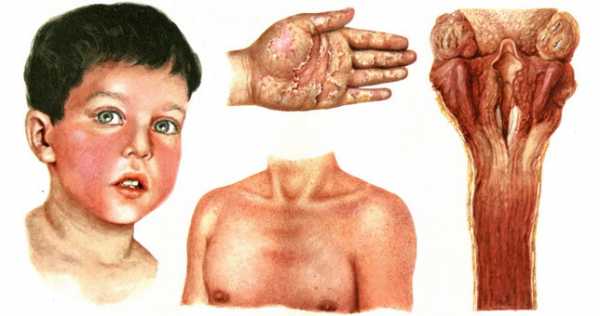
Проявления скарлатины
- Сыпь на ярко-красной коже щек сливается, и они становятся алыми.
- Носогубный треугольник у больных бледный, губы вишневые.
- Язык при скарлатине обложен, сосочки выступают над его поверхностью. Спустя 3 дня язык самоочищается, начиная с кончика, становится ярко-красным с четкими сосочками и напоминает ягоду малины.
- Симптом Пастиа — патогномоничный признак болезни, характеризующийся скоплением зудящей сыпи в естественных складках.
- Выраженная интоксикация сопровождается поражением центральной нервной системы и помутнением сознания.
К 3 дню заболевания сыпь достигает своего максимума и постепенно исчезает, температура понижается, кожа становится сухой и шершавой с выраженным белым дермографизмом. Кожа на ладонях и подошвах шелушится, начиная от ногтей, и сходит целыми пластами .
Повторное инфицирование человека, переболевшего скарлатиной, приводит к развитию ангины.
Скарлатина — заболевание, которое заканчивается благополучно при правильном и своевременном лечении антибиотиками.
Если лечение не проводилось или было неадекватным, заболевание осложняется рядом патологий — гнойным воспалением ушей, лимфоузлов, а также ревматоидной лихорадкой, миокардитом и гломерулонефритом.
Патогенные стрептококки часто поражают новорожденных. Заражение происходит интранатальным путем. У детей развивается пневмония, бактериемия, менингит. В 50% случаев клинические признаки появляются в первые сутки с момента рождения. Заболевания стрептококковой этиологии протекают крайне тяжело и часто заканчиваются летальным исходом. У новорожденных стрептококковая инфекция проявляется жаром, подкожными гематомами, кровяными выделениями изо рта, гепатоспленомегалией, остановкой дыхания.
Стрептококк у беременных
Норма условно-патогенных стрептококков в анализах отделяемого из влагалища беременной женщины – менее 104 КОЕ/мл.
Большое значение в развитии патологии беременности имеют:
- Streptococcus pyogenes — возбудитель послеродового сепсиса,
- Streptococcus agalactiae – причина инфицирования недоношенных новорожденных детей и матерей.
Streptococcus pyogenes проявляется у беременных тонзиллитом, пиодермией, эндометритом, вульвовагинитом, циститом, гломерулонефритом, послеродовым сепсисом. Возможно интранатальное заражение плода и развитие неонатального сепсиса.
Streptococcus agalactiae вызывает у беременных воспаление мочевыводящих путей, эндоментрит, а у плода — сепсис, менингит, пневмонию, неврологические расстройства.
Стрептококк при беременности передается контактным путем, что требует неукоснительного соблюдения правил асептики в родах.
Диагностика
Трудности лабораторной диагностики заболеваний, вызванных стрептококками, обусловлены сложностью этиологической структуры, биохимическими свойствами возбудителей, скоротечностью патологического процесса, недостаточным освещением современных методов диагностики в инструктивно-методической документации.
Основным диагностическим методом стрептококковой инфекции является микробиологический анализ отделяемого зева, носа, очага поражения на коже, мокроты, крови и мочи.
- Стерильным ватным тампоном берут мазок из зева, засевают исследуемый материал на кровяной агар, инкубируют сутки при 37°С и учитывают результаты. Выросшие на агаре колонии микроскопируют. Колонии с гемолизом пересевают на сахарный или кровяной бульон. Стрептококки дают в бульоне характерный придонно-пристеночный рост. Дальнейшее исследование направлено на определение серогруппы путем постановки реакции преципитации и идентификации возбудителя до вида.

- Бактериологическое исследование крови проводят при подозрении на сепсис. 5 мл крови засевают во флаконы с сахарным бульоном и тиогликолевой средой для определения стерильности. Посевы инкубируют 8 суток с двукратным высевом на кровяной агар на 4 и 8 день. В норме кровь у человека стерильна. При появлении роста на кровяном агаре проводят дальнейшую идентификацию выделенного микроба.
- Серодиагностика направлена на определение в крови антител к стрептококку.
- Экспресс-диагностика стрептококковой инфекции — реакция латекс–агглютинации и ИФА.
Проводят дифференциальную диагностику стрептококковой и стафилококковой инфекции.
Стрептококки и стафилококки вызывают одни и те же заболевания — тонзиллит, отит, фарингит, ринит, которые отличаются выраженностью клинических симптомов и тяжестью течения.
Стрептококковая ангина развивается раньше стафилококковой, протекает тяжелее и имеет серьезные последствия. Золотистый стафилококк часто становится причиной вторичного инфицирования, плохо поддается лечению и характеризуется более острыми симптомами.
Лечение
Больным скарлатиной и стрептококковой ангиной показан постельный режим, обильное питье и щадящая диета. Рекомендуют употреблять протертую, жидкую или полужидкую пищу с ограничением белка. Запрещено термическое раздражение воспаленной слизистой горла с полным исключением из рациона горячих и холодных блюд. Переходить к обычному питаю можно только после стихания острых симптомов заболевания.
Лечение стрептококковой инфекции должно быть этиологически и симптоматически обоснованным.
Этиотропная терапия
Больным проводят адекватную антибактериальную терапию. Выбор препарата определяется результатами анализа мазка из зева. После выделения возбудителя и определения его чувствительности к антибиотикам специалисты назначают лечение.
- Антибиотики пенициллинового ряда – «Ампициллин», «Бензилпенициллин»,
- «Эритромицин»,
- Современные полусинтетические пенициллины – «Амоксиклав», «Амоксициллин»,
- Макролиды – «Азитромицин», «Кларитромицин»,
- Цефалоспорины – «Цефаклор», «Цефалексин»,
- Сульфаниламиды – «Ко-тримоксазол».
Для восстановления микрофлоры кишечника используют пре- и пробиотики:
- «Линекс»,
- «Аципол»,
- «Бифиформ».
Симптоматическое лечение
- Больным детям назначают антигистаминные препараты – «Супрастин», «Диазолин», «Зодак».
- Иммуномодуляторы общего и местного действия – «Иммунал», «Имунорикс», «Имудон», «Лизобакт».
- В тяжелых случаях больным назначают стрептококковый бактериофаг. Это иммунобиологический препарат, способный лизировать стрептококки. Его применяют для лечения и профилактики различных форм стрептококковой инфекции — воспаления органов дыхания, слухового аппарата, кожных покровов, внутренних органов. Перед началом лечения необходимо определить чувствительность выделенного микроба к бактериофагу. Способ его применения зависит от локализации очага инфекции. Кроме стрептококкового бактериофага используют также комбинированный пиобактериофаг.

- Дезинтоксикационная терапия включает обильное питье — 3 литра жидкости: морсы, травяные чаи, соки, вода.
- С целью укрепления сосудистой стенки и выведения токсинов из организма показан прием витамина С.
- Полоскания горла антисептиками — фурацилином, диоксидином, отваром ромашки, шалфея, календулы, настойкой прополиса.
- Пастилки и спреи для горла – «Стрепсилс», «Мирамистин», «Гексорал».
- В домашних условиях детям, больным скарлатиной, дают теплый липовый чай, ставят на горло согревающий компресс, прикладывают холодные примочки на воспаленные глаза и голову, при боли в ушах ставят водочный компресс. Детям постарше специалисты рекомендуют полоскать больное горло теплым настоем шалфея или ромашки.
Лечение стрептококка — непростая задача, не смотря на то, что многие микробы не опасны для человека. При снижении иммунитета стрептококки становятся причиной тяжелых заболеваний.
Профилактика
Профилактические мероприятия при стрептококковой инфекции:
- Соблюдение правил личной гигиены и регулярная уборка помещения,
- Закаливание,
- Занятия спортом,
- Полноценное, сбалансированное питание,
- Борьба с вредными привычками,
- Своевременная обработка повреждений кожи антисептиками,
- Изоляция больных на время лечения,
- Текущая дезинфекция в помещении, где находился больной,
- Профилактика внутрибольничной инфекции.
Видео: стрептококк, “Доктор Комаровский”
Мнения, советы и обсуждение:
uhonos.ru
Ревматическая лихорадка — Библиотека — Доктор Комаровский
Авторы: Рыльцов А. Ю.
Ревматическая лихорадка (устаревшее название ревматизм) – это аутоиммунная воспалительная реакция обусловленная бета-гемолитическим стрептококком группы А (БГСА). В основе воспалительного процесса лежит феномен молекулярной мимикрии – антигены стрептококка близки по своей структуре к антигенам некоторых тканей человека. Антитела к этим антигенам атакуют ткани человека, что ведет к аутоиммунному поражению преимущественно клапанного аппарата сердца.
Ревматическая лихорадка (РЛ) развивается как осложнение стрептококковой ангины обусловленной БГСА или субклинической БГСА-инфекции преимущественно у детей 5-15 лет. РЛ крайне редко возникает у детей моложе 3-х лет и лиц старше 23-х лет. Частота РЛ в развитых странах радикально снизилась на протяжении 20-го века и в настоящее время остается весьма низкой — единичные случаи на 100 000 детей, тогда как в ряде развивающихся стран частота РЛ достигает 300-400 случаев на 100 000 детей. До конца 19-го века примерно 3% стрептококковых ангин заканчивались развитием ревматической лихорадки. Причиной снижения распространенности РЛ в развитых странах принято считать широкое применение антибиотиков при лечении стрептококовой ангины, высокие гигиенические стандарты, отсутствие скученности населения и антигенные эволюционные изменения самого стрептококка. РЛ можно в известной степени назвать социальным заболеванием. Однако, экономический кризис, разразившийся в начале 90-х на постсоветском пространстве и обнаживший проблему многих социальных болезней (туберкулез, сифилис, СПИД ) к росту РЛ не привел. Причиной тому, видимо, является то, что кризис на постсоветском пространстве не привел у увеличению скученности населения и несильно снизил гигиенические стандарты бывших советских людей. Также вероятную играет роль снижение распространенности ревматогенных штаммов БГСА в нашей популяции.
Ключевое средство профилактики РЛ в правильной диагностике и своевременном лечении стрептококковой ангины.
Начнем с определения. Ангиной принято называют всякое острое воспаление миндалин. Однако, такое широкое определение позволит диагностировать ангину при каждом ОРВИ и у каждого пациента отметившего першение в горле.
Важно выделить бактериальную ангину, требующую специального лечения, а именно вызванную БГСА.
Типичные клинические и эпидемиологические черты ангины обусловленной БГСА:
- Внезапное начало заболевания.
- Боли в горле.
- Лихорадка.
- Головные боли.
- Тошнота, рвота, боли в животе (чаще у детей).
- Воспалительный процесс в глотке и миндалинах.
- Болезненные, увеличенные переднешейные лимфоузлы.
- Возраст 5-15 лет.
- Проявление в зимний или ранний весенний период.
- Контакт в больным Аниной в анамнезе.
Симптомы указывающие на вирусную этиологию Анины:
- Конъюнктивит.
- Насморк.
- Кашель.
- Понос (у детей).
- Высыпания типичные для вирусных инфекций.
|
Клинические критерии позволяющие оценить вероятность связи острого тонзиллита с БГСА — шкала Сентора . |
|
|
Клинический критерий |
Количество баллов |
|
Лихорадка (температура тела более 38,0 С) |
1 |
|
Отсутствие кашля |
1 |
|
Увеличенные, болезненные переднешейные (углочелюстные) лимофузлы) |
1 |
|
Отечность миндалин и наличие на них экссудата |
1 |
|
Интерпретация: |
|
|
Количество баллов |
Вероятность связи острого тонзиллита с БГСА в процентах |
|
0 |
2,5% |
|
1 |
6–6,9% |
|
2 |
14,1–16,6% |
|
3 |
30,1–34,1% |
|
4 |
55,7 % |
|
Клинические критерии позволяющие оценить вероятность связи острого тонзиллита с БГСА — шкала МакАйзека. |
||
|
Клинический критерий |
Количество баллов |
|
|
Лихорадка (температура тела более 38,0 С) |
1 |
|
|
Отсутствие кашля |
1 |
|
|
Увеличенные, болезненные переднешейные (углочелюстные) лимофузлы) |
1 |
|
|
Отечность миндалин и наличие на них экссудата |
1 |
|
|
Возраст: |
3-15 лет |
1 |
|
15-45лет |
0 |
|
|
Старше 45 лет |
-1 |
|
|
Интерпретация: |
||
|
Количество баллов |
Вероятность связи острого тонзиллита с БГСА в процентах |
|
|
0 |
1-2,5% |
|
|
1 |
5-10% |
|
|
2 |
11-17% |
|
|
3 |
28-35% |
|
|
4 |
51-53% |
|
Как видно из представленных сведений клинический диагноз стрептококковой ангины достоверным быть не может.
Основания для назначения антибиотиков при стрептококковой ангине:
- Радикальное снижение риска развития РЛ. Применение антибиотика при стрептококковой ангине снижает риск на РЛ более чем на 80%.
- Уменьшение симптомов и ускорение выздоровления.
- Профилактика местных осложнений (паратонзиллярный абсцесс).
- Прекращение выделения возбудителя и эпидемиологического процесса. При назначении антибиотика выделение стрептококка больным прекращается в течение суток.
Варианты подхода к лечению ангины:
- Диагностика стрептококковой ангины по клиническим критериям и немедленное назначение антибиотика на 10 дней. Эта опция актуальна при недоступности диагностических тестов на БГСА.
- Выполнение экспресс-теста на БГСА и лечение по результату.
- Взятие мазка на посев, ожидание результата с назначением антибиотика при выявлении стрептококка. Исследования показывают, что назначение лечения в течение 9 дней от начала БГСА-инфекции ставит надежный заслон перед РЛ. Однако, есть риск оставления без лечения других бактериальных ангин.
- Взятие мазка на посев, с безотлагательным назначением антибиотика. В случае выявления БГСА в посеве лечение продолжается до 10 дней, при получении отрицательного результата посева антибиотик отменяется. Эта тактика допустима, но оставляет недолеченными другие бактериальные ангины.
Тактика должна определяться в каждом случае индивидуально с учетом региональных эпидемиологических, фармакоэкономических особенностей и доступности диагностических тестов.
Экспресс-тест на стрептококк не везде доступен для практического применения, чувствительность и специфичность его балансируют на уровне 95%. Оставшиеся 5% составляют нишу для необоснованного применения или неприменения антибиотика с риском осложнений. Надо учитывать, что 10% здоровых людей являются здоровыми носителями БГСА. Небактериальный тонзиллит на фоне здорового носительства БГСА по результату теста на стрептококк будет истолкован как стрептококковая ангина, что приведет к необоснованному лечению, ибо здоровое носительство БГСА в большинстве случаев лечению не подлежит. А если и подлежит по эпидпоказаниям, то тактика лечения носительства иная, предпочтение отдается цефалоспоринам и клиндамицину.
Никто не отменял ангины вызванные другими не БГСА бактериями – стрептококками других групп, стафилококками, микоплазмами, хламидиями. Назначение антибиотиков только при подтвержденной БГСА-ангине приведет к оставлению без лечения других бактериальных ангин.
Основным препятствием для эмпирического назначения антибиотика при ангине считается проблема роста резистентности бактерий к антибиотикам на фоне их неоправданного назначения. При эмпирическом лечении ангины антибиотиком есть риск необоснованного назначения для ряда случаев, но риск этот составит каплю в море необоснованных назначений антибиотиков по поводу ОРВИ и острого бронхита.
В условиях недоступности специфических тестов на БГСА представляется оправданной тактика эмпирического лечения ангины антибиотиком. Ключевой критерий бактериального воспаления в миндалинах — гнойный экссудат. Подобный экссудат бывает и при сугубо вирусном инфекционном мононуклеозе, исключаемом по данным общего анализа крови серологических тестов.
Препараты выбора при лечении стрептококковой ангины:
- Амоксициллин детям 20 мг/кг 2 раза в день 10 дней. Взрослым по 500 мг 2-3 раза в день 10 дней
- Бензатин пенициллин G пациентам с весом до 27 кг внутримышечно однократно 600,000 ЕД, пациентам с весом более 27 кг внутримышечно однократно 1 200 000 ЕД. Эта опция наиболее актуальна пи высоком риске развития ревматической лихорадки и для пациентов с сомнительной комплаентностью.
Альтернативные опции для пациентов с аллергией на пенициллиновый:
- Цефалексин 20 мг/кг 2 раза в день 10 дней. Взрослым по 500 мг 2 раза в день 10 дней
- Цефалоспорины рекомендуются тем пациентам, которые не имеют в анамнезе реакции гиперчувствительности к пенициллину немеленого типа.
- Цефадроксил 30 мг/кг1 раз в день 10 дней. . Взрослым по 1000 мг 1 раз в день 10 дней.
- Азитромицин 12 мг/кг 1 раз в день 5 дней. . Взрослым по 500 мг 1 раз в день 5 дней.
- Клиндамицин 7 мг/кг 3 раза в день 10 дней. Взрослым по 300 мг 3 раз в день 5 дней.
Ревматическая лихорадка развивается как осложнение нелеченной БГСА-ангины, бессимптомной БГСА-инфекции и крайне редко как осложнение леченной БГСА-ангины.
В диагностике сохраняют свою актуальность критерии Джонса:
I «Большие» критерии:
- Кардит.
- Полиартрит.
- Хорея.
- Ревматические узелки.
- Кольцевидная эритема
II. «Малые» критерии:
- Лихорадка.
- Артралгии
- Ускорение СОЭ в общем анализе крови или повышение уровня С-реактивного белка в сыворотке крови.
- Удлинение интервала PQ на ЭКГ.
Два больших и один малый критерий или два малых с одним большим составляют диагностический признак РА при наличии признаков предшествующей БГСА-инфекции. К последним относятся:
- Выявление БГСА в посеве или положительный результат экспресс теста на БГСА.
- Повышенный титр антител к стрептококку в сыворотке крови (АСЛО –антистрептолизин О)
Лечение РЛ включает назначение антибактериальной терапии по поводу БГСА-инфекции, симптоматическое применение НПВС и антиконвульсантов при наличии хореи, после чего планируется длительная вторичная профилактика рецидива РА путем ежемесячного внутримышечного ведения ретардной формы пенициллина (например, бензатин пенициллин G).
Читайте также в Библиотеке сайта «Сердечно-сосудистые осложнения бактериальных инфекций ЛОР-органов: профилактика и лечение».
Консультации Александра Рыльцова в КлубКоме
опубликовано 17/02/2014 12:27
обновлено 26/11/2016
— Разное, Разное
lib.komarovskiy.net
Еще раз о термине «Вирусно-бактериальная инфекция» Текст научной статьи по специальности «Медицина и здравоохранение»
А.С. ПОЛЯКОВА, к.м.н., В.К. ТАТОЧЕНКО, д.м.н., профессор, Научный центр здоровья детей, Москва
ЕЩЕ РАЗ О ТЕРМИНЕ
«ВИРУСНО-БАКТЕРИАЛЬНАЯ ИНФЕКЦИЯ»
Большинство педиатров согласится, что наиболее частыми жалобами пациентов и их родителей являются лихорадка, насморк и/или боль в горле. Ежегодно врачи осматривают около 40% детей до 6 мес. и свыше 60% детей в возрасте от 6 мес. до 5 лет только по поводу лихорадки, которая в большинстве случаев является проявлением самоограничивающейся острой респираторной вирусной инфекции (ОРВИ) [1]. Тем не менее в этой ситуации перед врачом возникает задача не пропустить серьезное бактериальное заболевание, с одной стороны, и не назначить лишних исследований и препаратов — с другой.
Ключевые слова:
ОРВИ, боль в горле вирусно-бактериальная инфекция лечение, гексэтидин, Гексорал
На практике все оказывается не так просто: например, многие родители требуют усиления лечения антибиотиком, тем более что у детей, особенно младшего возраста, острые респираторные заболевания (ОРЗ) могут иметь затяжное течение. Кроме того, формулировка диагноза «вирусно-бактериальная инфекция», видимо, сама по себе дает повод врачу назначить антибиотик. Термин «вирусно-бактериальная инфекция» принят к употреблению только в России, им можно обозначить инфекцию респираторного тракта, вызванную одновременно и вирусом, и микробом, хотя совпадение длительности инкубационного, продромального периода и времени развития клинических проявлений крайне маловероятно. Можно обозначить им и последовательное присоединение бактериальной инфекции к вирусной, что бывает достаточно часто, но в этих случаях правильнее назвать последнюю, обозначив форму бактериального заболевания (например, «грипп, осложненный острым средним отитом»). Это тем более важно, что нет строгих доказательств эффективности антибиотиков в предотвращении бактериальных осложнений ОРВИ [2].
Поэтому использование термина «вирусно-бактери-альная инфекция» стимулирует получившее широкое распространение неоправданное применение антибиотиков при ОРВИ и острых тонзиллитах (ОТ) [3].
Кроме того, такая формулировка диагноза у детей с ОРЗ (особенно затянувшимся) в амбулаторной практике нередко служит поводом для микробиологического исследования материала из носа и горла «на флору», а положительные результаты посева (чаще высев стафилококков, гемофильной палочки или пневмококков) как бы доказывает правомерность назначения антибиотиков.
Носительство патогенной флоры в носоглотке достаточно часто наблюдается у детей, а при наличии определенных условий может быть фактором риска развития острого среднего отита (ОСО), риносинусита, пневмонии. Такими условиями могут быть эндогенные причины (анатомические особенности, нарушение пневматизации
полости среднего уха вследствие увеличения аденоидов и т. д.) или экзогенные (снижение мукоцилиарного клиренса и/или иммунного ответа, например при гриппе и других инфекциях). Пневмококки и гемофильная палочка остаются главными возбудителями этих заболеваний, но борьба с их носительством предусматривает вакцинацию (против S. pneumoniae и H. influenzae типа b), а не антибактериальную терапию [4-6]. Носительство S. aureus в полости носа может наблюдаться почти у четверти здоровых лиц и не рассматривается как фактор риска каких-либо осложнений у людей с сохранным иммунитетом [7].
Так как выделение флоры из носа у детей с ОРЗ в подавляющем большинстве случаев не позволяет судить о точном диагнозе и этиологии заболевания, целесообразность такого исследования весьма сомнительна, и оно не рекомендуется авторитетными документами [5].
Наличие флоры в полости рта и горле также не считается диагностически значимым, за исключением острых тонзиллитов, при которых высев S. pyogenes является показанием для назначения антибактериальной терапии.
В полости рта может быть выявлено более 700 сероти-пов бактерий, из которых свыше 50% не культивированы. При обследовании взрослых здоровых лиц в ротоглотке флора оказывается намного богаче, чем в полости носа. В одном из исследований у 5 здоровых людей был выявлен 141 вид бактерий, из которых более 60% не культивированы [9]. При этом наличие в горле или полости рта кишечной флоры, нередко наблюдаемое у детей, находящихся на стационарном лечении (особенно получающих антибиотики), указывает на нарушение биоценоза и может способствовать развитию внутрибольничной инфекции.
Если при респираторной инфекции мы сталкиваемся с частым излишним назначением культурального исследования из носа и горла, то при остром тонзиллите, случае, когда результат этого исследования реально необходим для верификации диагноза и назначения этиотропной терапии, ситуация прямо противоположная.
Известно, что ОТ в большинстве случаев вызваны вирусами и не требуют лечения антибиотиком [10]. Основной бактериальный возбудитель S. pyogenes — ß-гемолитический стрептококк группы А (БГСА) — обусловливает до 15-30% случаев ОТ у детей. Только БГСА-тонзиллиты требуют антибактериального лечения ввиду возможности развития как гнойных осложнений, так и острой ревматической лихорад-
ки, гломерулонефрита, PANDAS-синдрома и др. Этиологическая диагностика ОТ важна как для эрадикации стрептококка, так и отказа от ненужных антибиотиков при вирусных формах заболевания [11]. Это тем более важно, т. к. вирусные и бактериальные формы ОТ имеют схожую клиническую симптоматику и фарингоскопическую картину (налеты на небных миндалинах встречаются в 80-90% случаев), и различить их удается иногда лишь по наличию катаральных явлений, конъюнктивита при вирусных тонзиллитах [12, 13]. Более того, уровень маркеров бактериального воспаления (лейкоцитоз, С-реактивный белок, прокальцитонин) также не позволяет отличить БГСА-тонзиллиты от вирусных [11].
Несмотря на важность бактериологического исследования для исключения или подтверждения БГСА-инфекции, на практике оно выполняется редко. По европейским данным, культуральное исследование при ОТ назначается 54% больных, а выполняется лишь 4,2% [14]. По результатам многоцентрового исследования ФАЭТОН, в России частота назначения системных антибиотиков при ОТ у взрослых составила 93-100%, тогда как бактериологическое исследование было проведено лишь у 2% пациентов. Создание экспресс-тестов на БГСА существенно облегчило этиологическую диагностику, однако пока, к сожалению, в России этот метод широко не применяется.
Целью данного исследования явилось изучение диагностической ценности бактериологического исследования материала из верхних дыхательных путей, в т. ч. с определением чувствительности флоры к антибиотикам при различных ОРЗ, а также оценка эффективности местной терапии вирусных тонзиллитов у детей.
Материалы и методы. В Научном центре здоровья детей проводится мониторинг распространенности пневмококковой инфекции, в рамках которого у госпитализированных детей, в т. ч. в отделении диагностики и восстановительного лечения, проводилось бактериологическое исследование мазков из носо- и ротоглотки с их типиро-ванием и определением чувствительности к антибиотикам. В рамках этой работы мы провели исследование частоты носительства патогенной и условно-патогенной флоры в полости носа и в горле у детей с вирусными инфекциями (ОРВИ — только назофарингит, бронхиолит/ обструктивный бронхит, круп) и бактериальными (острый средний отит, пневмония), в т. ч. поступавших с диагнозом «вирусно-бактериальная инфекция» и продолжавших лихорадить на фоне антибактериальной терапии. Все больные размещались в индивидуальные боксы, что исключало перекрестную инфекцию. Оценка устойчивости пневмококков оценивалась по системе EUCAST
В контрольную группу были отнесены пациенты с инфекцией иной локализации (инфекция мочевых путей, гастроэнтерит), а также дети, находившиеся в отделении на плановом обследовании. Внимание уделялось получению антибактериальной терапии в течение последних 2 мес. до госпитализации, поскольку это могло повлиять на состав флоры.
Всего было обследовано 292 ребенка в возрасте от 19 дней до 17 лет. В основную группу вошли 144 больных с ОРЗ, в контрольную — 121 пациент.
РЕЗУЛЬТАТЫ
Частота носительства пневмотропной флоры в полости носа существенно различалась в зависимости от формы патологии (табл. 1). Носителями были практически все больные с ОСО, вне зависимости от того, лечился ребенок антибиотиками или нет. При этом более половины высевов составляли пневмококки и гемофильная палочка. При другом бактериальном заболевании — пневмонии, пневмотропная флора выделялась значительно реже — всего в 1/3 случаев, причем мы ни разу не высеяли пневмококк, хотя у большинства детей именно пневмококковая этиология пневмонии была наиболее вероятна.
При вирусных инфекциях нижних дыхательных путей -бронхиолите и обструктивном бронхите, а также крупе пневмотропы высевались в 55-60% случаев, причем, как и при ОСО, пневмококки и гемофилюс составляли около половины; влияния предшествующей терапии мы также не выявили. При вирусных назофарингитах (ОРВИ) структура высева была такой же, но его частота — в 2 раза ниже.
В целом частота носительства у детей с ОРЗ (43%) не отличалась существенно от таковой в контрольной группе (51%), однако там более половины штаммов составлял S. aureus, тогда как при ОРЗ — всего 23%. Вместе с этим пневмококки и гемофилюс составляли 27 и 56% соответственно.
Исследование лекарственной чувствительности выделенных пневмококков дало неожиданные результаты. Все 28 тестированных штаммов были чувствительны к амокси-циллину, но из них к пенициллину, 14- и 15-членным макролидам и клиндамицину были чувствительны только 12, тогда как 7 — резистентны. Таким образом, всего из 28 штаммов сниженную чувствительность к пенициллину имели 12 (43%), к макролидам и клиндамицину — 11 (39%) штаммов. Резистентными к пенициллину были 2 штамма пневмококков из 4, выделенных у детей из контрольной группы. Устойчивыми к ко-тримоксазолу оказалось 25% штаммов.
Все тестированные штаммы гемофильной палочки были чувствительными к амоксициллину.
Частота носительства кишечной флоры в ротоглотке оценивалась в тех же группах пациентов; высевались Klebsiella pneumoniae и E. coli, а также неферментирующие глюкозу микроорганизмы (Acinetobacter, Pseudomonas aeruginosa) (табл. 2). У детей с респираторной инфекцией, не получавших антибиотики, носительство этой флоры составило 28%, у получавших — 16%, в контрольной группе — 15%.
Частота назначения бактериологического исследования при ОТ у детей. Из 98 госпитализированных в 2013 г. в нашу клинику детей с ОТ лишь двоим по месту жительства было назначено исследование на дифтерию; посев или экспресс-тест на БГСА не были назначены ни разу. В клинике БГСА-этиология ОТ была подтверждена у 9 больных (9%), однако системные антибиотики по месту жительства были назначены половине пациентов с ОТ (в половине случаев — амино-пенициллины, в — цефалоспорины, в 17% — макролиды; 2 и более препаратов были назначены каждому 7-му ребенку).
Очевидно, что педиатру поликлиники при отсутствии экспресс-тестов на выявление БГСА (пока не вошедших в
стандарты оказания медицинской помощи в России) было проще назначить антибиотик, чем вызвать сестру для взятия мазка и наблюдать за больным до получения ответа лаборатории. Кроме того, как среди родителей, так и врачей существует некий стереотип боязни налетов на небных миндалинах. Из госпитализированных детей в 37% случаев поводом для назначения антибиотика с последующей госпитализацией послужили именно налеты на миндалинах при нормальном самочувствии ребенка.
В соответствии с международными рекомендациями [15, 16], мы назначаем системные антибиотики только детям с положительным результатом культурального исследования или экспресс-теста на БГСА: аминопени-циллины курсом на 10 дней, цефуроксим аксетил — на 5 дней. Однако, когда пациент уже получил антибиотик до госпитализации, бактериологическое исследование в любом случае покажет отрицательный результат, так что судить об этиологии приходится на основании эффекта антибиотика, а если он был назначен на 4-5-е сутки болезни — по уровню антистрептолизина-О.
Установление диагноза БГСА-тонзиллита существенно упрощает лечение больного — мы крайне редко видим неэффективность антибиотика. Эти пациенты редко жалуются на сильную боль в горле, тогда как у детей с вирусными тонзиллитами она выражена, как и значительная заложенность носа. Помимо жаропонижающих и туалета носа (с эффективной аспирацией слизи), у таких детей весьма желательно использование местных антисептических и смягчающих препаратов. Применение антисептиков может быть оправдано и при других ОРЗ с учетом значительной обсемененности полости рта несвойственной ей флорой.
Использование антисептических препаратов. Наличие болевого синдрома при ОТ и вирусных фарингитах ставит вопрос о применении местного лечения. Из-за возможности повреждения слизистой оболочки втирание, например
спиртового раствора Люголя, не рекомендуется, тем более что он обладает местнораздражающим действием. У маленьких детей, которые не умеют полоскать горло и не смогут рассасывать таблетки, предпочтительна форма топических препаратов в виде спрея (из-за опасности ларинго-спазма немногие спреи, в их числе гексэтидин, разрешены с 3-летнего возраста). Гексэтидин — действующее вещество препарата Гексорал®, имеет высокий профиль безопасности и может применяться 2 раза в день, что значительно повышает комплаентность [17]. Доказана его эффективность в инактивации рино- и РС-вируса, вирусов гриппа А (H5N1, H7N9, h2N1), вируса простого герпеса 1-го типа [18, 19]. Гексэтидин бактерициден в отношении S. pyogenes как с низким (4 мг/л), так и высоким значением МПК (16 мг/л) [20]. Кроме того, этот препарат разрушает биопленки и препятствует их образованию, что потенцирует эффективность как системного антибиотика, так и непосредственную антисептическую активность гексэтидина [21]. У детей с ОТ результатами ранее проведенных исследований было показано статистически значимое ускорение в купировании симптомов тонзиллофарингита при лечении гексэтидином и его хорошая переносимость [22, 23].
Мы применяем Гексорал® уже в течение нескольких лет и ни разу не регистрировали развитие нежелательных побочных эффектов. Его эффективность мы изучили на группе в 79 детей с ОТ (8 — со стрептококковой этиологией, 13 — с инфекционным мононуклеозом, 38 — с респираторно-вирусными ОТ и у 20 детей с гриппом (15 детей имели грипп А и 5 детей — В)). Все дети предъявляли жалобы на боль в горле. Из 79 детей с подобными жалобами местную терапию гексэтидином получали 68 детей (11 детей были младше 3 лет). Помимо гексэтидина, 8 детям со стрептококковым тонзиллитом были назначены антибиотики, пациентам с гриппом вводили осельтами-вир. Остальные дети с ОТ получали только симптоматиче-
Таблица 1. Флора полости носа. Не получали АБ
Дети с ОРЗ 144 Контрольная
Пневмония Круп Бронхиолит ОРВИ ОСО Всего с ОРЗ группа
19 11 22 70 22 144 121
Str. pneumoniae — 1 7 4 7 19 9
H. influenzae 3 1 3 5 6 18 8
M. catarrhalis 1 3 2 5 3 14 13
St. aureus 3 1 1 5 5 15 32
Всего 7 6 13 19 21 66 62
% 37 55 59 27 95 39 51
Таблица 2. Флора ротоглотки
Дети с ОРЗ 171 Контрольная
Пневмония Круп Бронхиолит ОРВИ ОСО Тонзиллит Всего группа
19 11 22 70 22 27 171 121
Klebsiella 2 1 1 3 1 1 9 4
E. coli — 1 — 4 — — 5 6
Неферментирующие — 4 2 10 4 2 22 8
Всего 2 6 3 17 5 3 36 18
% 10 52 14 24 23 11 21 15
Рисунок 2. 2-й день лечения I Рисунок 3. 3-й день лечения I Рисунок 4. 4-й день лечения
скую терапию (туалет носа, жаропонижающие препараты, системные глюкокортикостероиды у 4 детей с инфекционным мононуклеозом).
Гексорал® у всех детей, независимо от этиологии тонзиллита, ускорял улучшение фарингоскопической картины уже через сутки; 57% детей отметили субъективное облегчение болевого синдрома после первого орошения гексэтидином, к концу вторых суток лечения у всех детей купировались неприятные ощущения в горле.
Из 68 детей, лечившихся гексэтидином, у 31 до начала лечения из горла высевалась кишечная флора; у 18 из них проводилось повторное культуральное исследование, которое выявило рост только нормальной флоры полости рта.
Опрос по оценке вкусовых качеств Гексорала в виде спрея показал, что из 68 респондентов (41 ребенок старше 5 лет и 27 взрослых (родители пациентов)) 78% оценили препарат как приятный на вкус, 12,5% — как терпимый и в 9% случаев препарат не понравился на вкус. 24% взрослых имели его в домашней аптечке.
Клинический случай.
Лиза М, 12 лет. Поступила на 3-й день фебрильной лихорадки с жалобами на боль в горле, затруднение носового дыхания.
При поступлении: гиперемия конъюнктив, резкое затруднение носового дыхания за счет увеличения аденоидов, скудное слизисто-гнойное отделяемое в общих носовых ходах, яркая гиперемия задней стенки глотки, небных миндалин, миндалины II степени с плотными белыми налетами, симметричный отек передних небных дужек, боль в горле при глотании (рис. 1). Переднешейные лимфатические узлы увеличены до 3-3,5 см, подвижные, безболезненные, эластической консистенции. Печень +3 см из-под края реберной дуги, селезенка +1,5 см. В общем анализе крови: лейкоциты 17х109/л, нейтрофилы 8,2х109/л. Был заподозрен инфекционный мононуклеоз, подтвержденный высоким (>160 Ед/мл) титром Ig M к вирусу Эпштейна — Барр. Экспресс-тест на стрептококк отрицательный. Посев мазка из горла выявил рост Staphylococcus aureus и Acinetobacter junii. К назальным деконгестантам и жаропонижающим при высокой лихорадке был добавлен местно Гексорал® в виде
спрея дважды в день. Через сутки отмечено уменьшение отека передних небных дужек и размеров миндалин, облегчение глотания (рис. 2). Боль в горле полностью купировалась в начале 2-х суток лечения с прогрессивным улучшением фарингоскопической картины (рис. 3, 4), лихорадка купировалась самостоятельно в начале 6-х суток болезни. В этот же день был выполнен повторный посев мазка из горла, выявивший рост нормальной флоры полости рта.
Таким образом, у ребенка с типичным течением инфекционного мононуклеоза основные жалобы сводились к боли в горле, которая с успехом купировалась на фоне лечения гексэтидином. Фарингоскопическая картина улучшилась раньше, чем купировалась лихорадка.
ОБСУЖДЕНИЕ
Проведенный нами анализ частоты носительства пнев-мотропной флоры в полости носа еще раз показал отсутствие корреляции ее наличия и бактериальной этиологии процесса, что делает нерациональным культуральное исследование материала из носа и глотки у большинства детей с лихорадкой, учитывая одинаковую частоту высева патогенной флоры у детей с ОРЗ и у детей из контрольной группы. Использовать положительные результаты посева для оправдания термина «вирусно-бактериальная инфекция», как и антибактериального лечения (фактически «лечения анализов») абсолютно неправомерно.
Факт усиленного размножения пневмококков и гемо-фильной палочки (но не стафилококков) в дыхательных путях при ОРВИ и гриппе известен в литературе. Вероятно, одним из способствующих факторов является большое количество слизи в респираторном тракте, затрудняющей эвакуацию микроорганизмов и служащей для них питательной средой [24]. В случае бронхиолитов, при которых присоединение бактериальной инфекции наблюдается очень редко [25-27], несомненна защитная роль сужения просвета бронхов, препятствующего проникновению пневмококков в легкое. Обилие флоры в носоглотке при ОСО, очевидно, играет роль в развитии микробного воспаления.
Существенно более важным является высокий уровень резистентности пневмококков у носителей. До последнего времени считалось, что в целом уровень устойчивости
пневмококков в России невелик (11% к пенициллину и менее 10% к макролидам), хотя в детских коллективах он был намного выше [28]. Однако в последние годы ситуация изменилась, устойчивость пневмококков к пенициллину и макролидам резко возросла [29, 30], о чем говорят и наши данные. При этом назначение антибактериальной терапии до заболевания практически не влияло на частоту выделения из носа пневмотропной флоры.
Эти данные показывают, что нам следует пересмотреть критерии определения групп риска с возможной устойчивостью пневмококков, которых мы придерживались ранее (дети, посещающие ДДУ, получающие антибиотики до заболевания и т. д.). Видимо, сейчас нужно считать возбудителя устойчивым к пенициллинам, макролидам и ко-три-моксазолу у всех детей с пневмококковыми заболеваниями и, соответственно, повысить рекомендуемые начальные дозы амоксициллина и амоксициллин/клавуланата до 80-100 мг/кг/сут, как это практикуется в странах с высоким распространением резистентных штаммов пневмококка [31, 32]. Кроме того, необходимо отказаться от назначения макролидов при респираторных инфекциях, за исключением случаев, вызванных атипичными возбудителями.
Наши данные показали практически полное отсутствие амбулаторных назначений бактериологических исследований для выявления БГСА при ОТ, что приводит к избыточному назначению антибиотиков при этой патологии (9 из 10 больных). С учетом высокой заболеваемости тонзиллитом (8,8% детского населения в год) нетрудно представить себе астрономическую цифру ненужных курсов антибиотиков в масштабах страны [33].Использование экспресс-теста на участке позволяет избавить до 90% больных ОТ детей от лечения антибиотиками и сэкономить значительные средства [33].
Отказ от антибактериальной терапии вирусных тонзиллитов не снимает задачу оптимизации их лечения, в частности применения местных смягчающих и антисептических средств. Эти средства также полезны и при стрептококковых формах, а также у детей с ОРВИ, сопровождающимися кишечным синдромом, имеющих значительную обсемененность полости рта кишечной и неферментирующей глюкозу флорой. Наш опыт применения препарата гексэтидина у детей старше 3-х лет
показал эффективность и обоснованность такого подхода. ф
ЛИТЕРАТУРА
1. Hay AD. The prevalence of symptoms and consultations in pre-school children in the Avon Longitudinal Study of Parents and Children (ALSPAC): A prospective cohort study. Family Practice, 2005, 22(4): 367-374.
2. Союз педиатров России, Международный Фонд охраны здоровья матери и ребенка. Научно-практическая программа «Острые респираторные заболевания у детей. Лечение и профилактика». М., 2002 г.
3. Canli H, Saatci E, Bozdemir N, Akpinar E, Kiroglu M. The antibiotic prescribing behaviour of physicians for acute tonsillopharyngitis in primary care. Ethiop Med J, 2006, 44(2): 139-43.
4. Casey JR, Pichichero ME. Changes in frequency and pathogens causing acute otitis media in 19952003. Pediatr Infect Dis J, 2004, 23(9): 824-828.
5. Fokkens WJ, Lund VJ, Mullol J. et al., European Position Paper on Nasal Polyps 2012. Rhinology, 2012, 50(23): 1-298.
6. Таточенко В.К. Антибиотико- и химиотерапия инфекций у детей, М. ИПК Континент-Пресс, 2008: 256.
7. Choi CS(1), Yin CS, Bakar AA, Sakewi Z, Naing NN, Jamal F, Othman N. Nasal carriage of Staphylococcus aureus among healthy adults. J Microbiol Immunol Infect, 2006, 39(6): 458-64.
8. Lemon KP, Klepac-Ceraj V, Schiffer HK, Brodie EL, Lynch SV, Kolter R. Comparative analyses of the bacterial microbiota of the human nostril and oropharynx. Mbio, 2010, 22;1(3). Pii: e00129-10. doi: 10.1128/mBio.00129-10.
9. AasJA, Paster BJ, Stokes LN, Olsen I, Dewhirst FE. Defining the normal bacterial flora of the oral cavity. J Clin Microbiol, 2005, 43(11): 5721-32.
10. Свистушкин В.М. Эмпирическая антибактериальная терапия при острых воспалительных заболеваниях верхних отделов дыхательных путей. Русский медицинский журнал, 2005, 13(4): 216-219.
11. Brook I, Dohar JE. Management of group A beta-haemolytic streptococcal pharyngotonsil-litis in children. J Fam Pract, 2006, 55(12): 1-11.
12. Cheng CC, Huang LM, Kao CL, Lee PI, Chen JM, Lu CY, Lee CY, Chang SY, Chang LY. Molecular and clinical characteristics of adenoviral infections in Taiwanese children in 2004-2005. Eur J Pediatr, 2008, 167(6): 633-40.
13. Таточенко В.К., Бакрадзе МД., Дарманян А.С. Острые тонзиллиты в детском возрасте: диагностика и лечение. Фарматека, 2009, 14: 65-69.
14. Vranjes Z, Katic V, Vinter-Repalust N, Jurkovic L, et al. Acute infections of the upper respiratory tract-factors that contribute to diagnosis and antibiotic prescription decisions. Acta Med Croatia, 2007, 61(1): 83-90.
15. Stanford T Shulman, 1 Alan L. Bisno, and Management of Group A Streptococcal Pharyngitis: 2012 Update by the Infectious Diseases Society of America Clinical Infectious Diseases Advance Access, 2012 — Р 1-17.
16. Chiappini E, Principi N, Mansi N et all. Management of acute pharyngitis in children: summary of the Italian National Institute of Health guidelines. Clin Ther, 2012, 34(6): 1442-1458.
17. Ernst CP, Canbek K, Dillenburger A, Willershausen B. Clinical study on the effectiveness and side effects of hexetidine and chlorhexidine mouthrinses versus a negative control. Quintessence Int. 2005 Sep. Vol. 36 (8). Р. 641-652.
18. Сайдискис Р ДЖ. Заключительный отчет исследования ополаскивателя для полости рта. Кафедра Изучения биологии полости рта и черепно-лицевой области. Стоматологический факультет университета Мэриленд, Балтимор, Мэриленд, 1997. — 22 стр.
19. Отчет о научно-исследовательской работе. Изучение противовирусной активности гексэ-тидина in vitro в отношении ряда вирусов, вызывающих острые респираторные инфекции. ФГБУ «НИИ вирусологии им. Д.И. Ивановского». М., 2014: 1-35.
20. Эйдельштейн И.А., Козлов Р.С., Чагарян А.Н. Чувствительность клинических штаммов Streptococcus pyogenes к антисептическому препарату гексэтидину и антимикробным препаратам для системного применения. Клин микробиол антимикроб химиотер, 2014, 16(3): 212-218.
21. Поляков Д.П. Принципы антибактериальной терапии стрептококкового тонзиллофаринги-та. Вопросы современной педиатрии, 2014, 13(2): 83-88.
22. Геппе Н.А., Дронов И.А. Роль местных антимикробных средств в терапии тонзиллофарин-гита у детей. Доктор.ру. 2012, 9(77): 11-15.
23. Gorman SP, McGovern JG, Woolfson AD, Adair CG, Jones David S. The concomitant development of poly(vinyl chloride)-related biofilm and antimicrobial resistance in relation to ventilator-associated pneumonia. Biomaterials, 2001, 22: 2741-2747.
24. Катосова Л.К. Клинико-биологическая оценка пневмотропной флоры при острых и хронических бронхолегочных болезнях у детей. Автореф. Дисс. Докт. М., 1990, 47 с.
25. Ralston S, Hill V, Waters A. Occult serious bacterial infection in infants younger than 60 to 90 days with bronchiolitis: A systematic review. Arch PediatrAdolescMed., 2011, 165(10): 951-956.
26. American Academy of Pediatrics. Diagnosis and Management of Bronchiolitis. Pediatrics, 2006, 118 (4): 1774 -1793.
27. Карраро С., Занконато С., Баральди Е. Бронхиолит. От эмпиризма до научных доказательств. Лечащий врач, 2011, 6: 24-28.
28. Козлов Р.С., Сивая О.В., Кречикова О.И. с соавт. Динамика резистентности Streptococcus pneumoniae к антибиотикам в России за период 1999-2009 гг. (Результаты многоцентрового проспективного исследования ПеГАС). Клин. микробиол. антимикроб.химиотер, 2010, 12(4): 1-13.
29. Сидоренко С.В., Грудинина С.А., Филимонова О.Ю. Резистентность к макролидам и линкозамидам среди Streptococcus pneumoniae и Streptococcus pyogenes в Российской Федерации. Клиническая фармакология и терапия, 2008, 17(2): 1-4.
30. Mayanskiy N, Alyabieva O, Ponomarenko A, Lazareva L, Katosova A, Ivanenko T, Kulichenko L, Namazova-Baranova A. Baranov. Serotypes and antibiotic resistance of noninvasive Streptococcus pneumoniae circulating in pediatric hospitals in Moscow, Russia. International Journal of Infectious Diseases,
2014, 20: 58-62.
31. World Health Organization. Porcket book of hospital care for children. Guidelines for management of common childhood illnesses. 2nd edn. Geneva: WHO. 2013. p 438.
32. Bradley JS, Byington CL, Shah SS, Alverson B, Carter ER, Harrison C, Kaplan SL, Mace SE, McCracken GH Jr, Moore MR, St Peter SD, Stockwell JA, Swanson JT. Executive summary: the management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America. Clin Infect Dis., 2011 53(7): 617-30.
33. Черкасова Е.Н. Оптимизация диагностики и лечения острого тонзиллита у детей в амбулаторных условиях. Дисс. канд. мед. наук.
2015, 104 с.
cyberleninka.ru
Стрептококк бета гемолитический инфекция группы А: симптомы и лечение
Бактерии стрептококки имеют шаровидную форму, соединяются в цепочки и чувствительны к воздействию окружающей среды. Стрептококки могут длительное время находиться в организме человека, не вызывая никаких тревожных симптомов и заболеваний.
Активизировать рост бактерий могут различные факторы, способствующие снижению иммунитета. Медицина выделяет несколько типов стрептококков, и самым опасным является бета гемолитический стрептококк, выполняющий полный гемолиз эритроцитов.
Содержание статьи
Классификация стрептококков
Streptococcus подразделяют на несколько типов из учета их гемолитических характеристик. Одними из самых изучаемых являются альфа- и бета-гемолитические, которые несут наибольшую опасность для человеческого организма.
Стрептококк
Альфа-гемолитические стрептококки
Альфа-гемолитические еще называют «зеленящими», так как при бактериологическом исследовании, окрашиваются в зеленый цвет. Данный тип маловирулентный, и обитает в минимальном количестве в здоровой микрофлоре полости рта. При снижении иммунитета может стать причиной развития кариеса. К типу альфа относятся такие бактерии:
- Streptococcus pneumoniae – становится причиной менингита, синусита, отита и пневмонии.
- Streptococcus thermophilus–полезная бактерия используемая для приготовления различных кисломолочных продуктов.
Альфа-гемолитические стрептококки не вызывают разрушения эритроцитов. Определяется наличие бактерий методом исследования мазка с зева, воспалений на коже, посева мочи и крови, УЗИ.
Бета-гемолитические стрептококки
Бета-гемолитические стрептококки – это целая группа, которая объединяет патогенные бактерии, способные полностью разрушать эритроциты. Самым опасным является бета гемолитический стрептококк группы а, который вызывает различные серьезные заболевания. К бета типу относятся такие бактерии:
- Streptococcus pyogenes – серогруппа А, которая вызывает такие заболевания, как тонзиллит, скарлатина, ангина, фарингит. В редких случаях может развиться пневмония, фасцит, ревматизм.
- Streptococcus agalactiae – серогруппа B может встречаться у 20% людей в составе здоровой микрофлоры ЖКТ и урогенитальном тракте. Зачастую бактерия вызывает серьезные заболевания у новорожденных и рожениц.
При снижении иммунитета, бета бактерии начинают выделять стрептолизин, лейкоцидин, эритрогенин и нейротоксин. Эти вещества разрушают кровяные клетки, отравляют организм, подавляют иммунитет и поглощают здоровые клетки.
Способы инфицирования бета-гемолитическим стрептококком

Инфекция передается при незащищенном половом акте
Инфекция бета гемолитическим стрептококком предается различными методами. Одним из наиболее распространенных является заражение извне, когда инфицирование происходит от больного носителя:
- Воздушно-капельный путь передачи предполагает распространение инфекции через разговор, кашель или чихание. Бактерии распространяются по воздуху и заглатываются здоровым человеком.
- Бытовой путь – это заражение через грязные руки и личные вещи, где может находиться засохшая слюна больного. Бактерии стрептококки устойчивы к холодным температурам и повышенной влажности.
- Половой путь предполагает передачу инфекций при незащищенном половом акте.
- Алиментарный путь – это заражение продуктами питания не прошедших тепловую обработку: бутерброды, молочные продукты, торты и пирожные.
- От матери к ребенку бактерия предается внутриутробно или при рождении.
Существует и другой путь заражения гемолитическим стрептококком – это аутоинфицирование. Стрептококки часто располагаются на теле человека, не вызывая никаких патологий, так как их рост сдерживается местным иммунитетом. Если же иммунная система начинает работать хуже, бактерии проникают в кровь, и разносятся по внутренним органам. Заражение аутоинфицированным методом возможно в таких случаях:
- Стоматологическое лечение.
- Выдавливание прыщей и фурункулов.
- Удаление аденоидов и миндалин.
- Бронхит, тонзиллит, синусит.
Располагающийся бета гемолитический стрептококк в зеве начинает активно делиться, образовывать цепочки и выделять токсичные яды.
Симптомы стрептококковой инфекции
Клиническая картина стрептококковой инфекции обширна, и зависит от поражения органа, возраста пациента и наличия сопутствующих заболеваний.
Зачастую, инкубационный период составляет 3-7 дней, после которого проявляются характерные симптомы, сопровождающие все стрептококковые инфекции.
Лихорадка возникает с первых дней инфицирования
Лихорадка возникает с первых дней инфицирования. Это защитная реакция организма на активность патогенов, и самый тревожный звоночек при котором необходимо обязательно обратиться к врачу. У пациентов с сильным иммунитетом температура повышается незначительно, в пределах 37-37.8, у малышей и пожилых людей лихорадка сопровождается гипертермией.
Интоксикация организма происходит в результате выделения бактериями токсичных ядов. Проявляется симптом тошнотой, слабостью, головной болью, сонливостью, снижением работоспособности, болью в мышцах и суставах.
Местное воспаление происходит по причине локализации большой колонии бактерий в определенном месте. На участке возникает припухлость, нагноение, отечность и зуд.
Артериальное давление при стрептококковой инфекции всегда снижено, что указывает на нестабильную работу сердца.
Аллергические реакции сопровождают стрептококковые инфекции в 50% случаев. Сыпь на коже локализуется в различных местах и имеет форму эритематозных пятен. Причиной такого симптома является разрушение поверхностных капилляров и повреждение клеток эпителия.
Воспалительные процессы горла происходят по причине развития стрептококков на слизистой глотки и миндалин. Симптомами служит болезненность при глотании, покрасненье и отечность, образование гнойного налета.
Некроз тканей происходит при тяжелых стадиях инфекции. При наличии бета гемолитического стрептококка группы а, симптомы сопровождаются воспалительным очагом под кожей, отечностью, болезненностью при пальпации.
Симптомы у детей
У детей клиническая картина имеет ярко-выраженные симптомы, так как болезнь развивается стремительно. Изначально малыша беспокоит озноб и недомогание, затем проявляются и другие симптомы. Признаки инфекции у детей до 6 месяцев:
- Ребенок отказывается от еды.
- Насморк с обильными зеленоватыми или желтыми выделениями.
- Плаксивость, раздражительность, беспокойный сон.
- Тошнота и рвота.

Увеличение лимфоузлов у детей один из признаков патологии
У детей дошкольного и школьного возраста наблюдается сонливость, потеря аппетита, увеличение лимфоузлов.
К основным симптомам можно отнести такие:
- Жалобы на боль и першение в горле.
- Головная боль и головокружения.
- Навязчивое покашливание.
- Высокая температура.
Бета гемолитический стрептококк у детей особенно опасен, так как способен вызывать такие заболевания, как ларингит, скарлатина, ревматоидный артрит, эндокардит, отит, ангина, васкулит.
Лечение гемолитического стрептококка
Терапия стрептококковой инфекции проводится при помощи антибактериальных препаратов, которые позволяют быстро устранить количество бактерий, снизить риск осложнений и предупредить поражение других внутренних органов.
Группа пенициллины:
- Бензилпенициллин – инъекции вводятся внутримышечно.
- Пенициллин V – курс лечения зависит от тяжести заболевания и возраста пациента.
- Флемоксин Солютаб – принимается по 1 г утром и вечером.
- Амоксиклав – детям назначается в виде суспензии, взрослым инъекции или таблетки.
Группа цефалоспорины:
- Цефтазидим – внутримышечные инъекции 2 раза в сутки.
- Цефуроксим-аксетин – назначается внутривенно или внутримышечно.
Данные группы препаратов наиболее эффективны в отношении гемолитических стрептококков. Однако прежде чем назначить определенный тип антибиотика, необходимо провести лабораторную антибиотикограмму, которая определит чувствительность бактерии к тому или иному типу препарата.
Длительность лечения составляет 7-10 дней, зависит от тяжести заболевания. В комплексе с антибиотиками назначаются и другие препараты, снимающие характерные симптомы:
- Растворы для полоскания и промывания горла.
- Антисептические рассасывающие таблетки и леденцы.
- Жаропонижающие препараты.
- Сосудосуживающие капли в нос.

Амоксиклав
При диагностике бета гемолитического стрептококка группы а, лечение должно проводиться только под присмотром специалиста. Так как необходимо проводить контроль восстановления микрофлоры кишечника, следить за укреплением иммунитета и снижением интоксикации.
Для повышения эффективности лечения к медикаментозной терапии добавляются рецепты народной медицины. Снизить воспалительный процесс и повысить иммунитет помогут чаи с шиповником, клюквой и листьями малины. Для полоскания горла полезно применять отвары череды, дуба и коры ивы.
В процессе лечения пациентам рекомендуется соблюдать постельный режим, избегать физических нагрузок и соблюдать водный баланс для выведения токсинов из организма.
При поражении горла стоит пересмотреть меню и исключить горячую, холодную и твердую пищу, которая будет травмировать воспаленную слизистую.
Бета стрептококк группы «а» при отсутствии лечения, способен вызвать такие осложнения, как абсцессы печени и почек, пневмонию, менингит, сепсис и токсический шок. Такие последствия зачастую возникают на 7-27 день, после начала инфекции и требуют госпитализации.
Для того чтобы избежать развития стрептококковой инфекции необходимо укреплять защитные силы организма, избегать контакта с инфицированными, и своевременно лечить возможные очаги инфекции: кариес, фурункулы, воспаление аденоидов и миндалин.
Вконтакте
Google+
Одноклассники
101parazit.com

 воспалении мест внедрения микроба — тонзиллит, фарингит, отит, импетиго.
воспалении мест внедрения микроба — тонзиллит, фарингит, отит, импетиго.