ИНТРОГРЕССИЯ ХРОМАТИНА РЖИ В ГЕНОМ МЯГКОЙ ПШЕНИЦЫ: ЦИТОГЕНЕТИЧЕСКИЕ АСПЕКТЫ | Силкова
1. Голубовская И.Н. Цитогенетика отдаленных гибридов пшеницы и перспективы их использования в селекции // Цитогенетика пшеницы и ее гибридов / Под ред. П.М. Жуковского, В.В. Хвостовой. М.: Наука, 1971. С. 243–286.
2. Дубовец Н.И., Дымкова Г.В., Соловей Л.А. и др. Реконструкция кариотипа гексаплоидных тритикале путем межгеномных замещений хромосом // Генетика. 1995. Т. 31. № 10. С. 1394–1399.
3. Дубовец Н.И., Сычева Е.А., Соловей Л.А. и др. Рекомбинантный геном злаков – закономерности формирования и роль в эволюции полиплоидных видов // Генетика. 2008. Т. 44. № 1. С. 54–61.
4. Карпеченко Г.Д. Избранные труды. М.: Наука, 1971. C. 303.
Карпеченко Г.Д. Избранные труды. М.: Наука, 1971. C. 303.
5. Левитский Г.А. К истории плодовитых промежуточных константных пшенично-ржаных гибридов // Цитогенетика растений / Ред. Н.П. Дубинин. М.: Наука, 1978а. С. 251–253.
6. Левитский Г.А. Цитология пшенично-ржаных амфидиплоидов // Цитогенетика растений / Ред. Н.П. Дубинин. М.: Наука, 1978б. С. 224–250.
7. Леонова И.Н., Добровольская О.Б., Каминская Л.Н. и др. Молекулярный анализ линий тритикале, содержащих различные системы VRN-генов, с помощью молекулярных маркеров и гибридизации in situ // Генетика. 2005. Т. 41. № 9. С. 1014–1020.
8. Логинова Д.Б., Силкова О.Г. Митотическое поведение центромер в мейозе как механизм восстановления фертильности у пшенично-ржаных амфигаплоидов // Генетика.
9. Мюнтцинг А. Генетические исследования. М.: Изд-во иностр. лит-ры, 1963. 488 с.
10. Першина Л.А. Хромосомная инженерия растений – направление биотехнологии // Вавилов. журн. генет. и селекции. 2014. Т. 18. № 1. С. 139–146.
11. Писарев В.Е. Селекция зерновых культур. М.: Колос, 1964. 317 с.
12. Силкова О.Г., Добровольская О.Б., Дубовец Н.И. и др. Создание пшенично-ржаных замещенных линий с идентификацией хромосомного состава кариотипов методами С-бэндинга, GISH и SSR-маркеров // Генетика. 2006. Т. 42. № 6. С. 793–802.
13. Силкова О.Г., Добровольская О.Б, Дубовец Н. И. и др. Получение пшенично-ржаных замещенных линий на основе озимых сортов ржи с идентификацией кариотипов методами С-бэндинга, GISH и SSR-маркеров // Генетика. 2007. Т. 43. № 8. С. 1149–1152.
И. и др. Получение пшенично-ржаных замещенных линий на основе озимых сортов ржи с идентификацией кариотипов методами С-бэндинга, GISH и SSR-маркеров // Генетика. 2007. Т. 43. № 8. С. 1149–1152.
14. Силкова О.Г., Кабаненко Ю.Н., Логинова Д.Б. Влияние пшенично-ржаного замещения на элиминацию хромосом: анализ поведения унивалентов в мейозе пшеницы с димоносомией и тетрамоносомией // Генетика. 2014. Т. 50. № 3. C. 282–290.
15. Силкова О.Г., Щапова А.И., Кравцова Л.А. Механизмы мейотической реституции и их генетическая регуляция у пшенично-ржаных полигаплоидов // Генетика. 2003. Т. 38. № 11. С. 1514–1523.
16. Силкова О.Г., Щапова А.И., Шумный В.К. Мейотическая реституция у амфигаплоидов в трибе Triticeae // Генетика. 2011. Т. 47. № 4. С. 437–448.
17. Трубачеева Н.В., Россеева Л.П., Белан И.А. и др. Особенности сортов яровой мягкой пшеницы Западной Сибири, несущих пшенично-ржаную транслокацию 1RS.1BL // Генетика. 2011. Т. 47. № 1. С. 18–24.
Трубачеева Н.В., Россеева Л.П., Белан И.А. и др. Особенности сортов яровой мягкой пшеницы Западной Сибири, несущих пшенично-ржаную транслокацию 1RS.1BL // Генетика. 2011. Т. 47. № 1. С. 18–24.
18. Хвостова В.В., Голубовская И.Н., Шкутина Ф.М. Цитогенетика аллополиплоидов в подтрибе Triticinae на примере Triticale и 56-хромосомных ППГ (неполных амфидиплоидов) // Полиплоидия и селекция / Под ред. Н.В. Турбина. Минск, 1972. С. 95–105.
20. Щапова А.И., Кравцова Л.А. Цитогенетика пшенично-ржаных гибридов. Новосибирск: Наука. Сиб. отд-ние, 1990. 164 с.
21. Щапова А.И., Потапова Т.А., Кравцова Л.А. Генетическая обусловленность нерасхождения хромосом в мейозе пшенично-ржаных полигаплоидов // Генетика. 1987. Т. 23. № 3. С. 473–481.
Щапова А.И., Потапова Т.А., Кравцова Л.А. Генетическая обусловленность нерасхождения хромосом в мейозе пшенично-ржаных полигаплоидов // Генетика. 1987. Т. 23. № 3. С. 473–481.
22. Aase H.C. Cytology of Triticum, Secale, and Aegilops hybrids with reference to phylogeny // Res. Stud. State Coll. Wash. 1930. V. 2. P. 5–60.
23. Alkhimova A.G., Heslop-Harrison J.S., Shchapova A.I., Vershinin A.V. Rye chromosome variability in wheat-rye addition and substitution lines // Chromosome Res. 1999. V. 7. P. 205–212.24. Aragón-Alcaide L., Reader S., Miller T., Moore G. Centromeric behaviour in wheat with high and low homeologous chromosomal pairing // Chromosoma. 1997. V. 106. P. 327–333.
25. Badaeva E.D., Badaev N.S., Bolsheva N.L., Zelenin A.V. Chromosome alterations in the karyotype of triticale in comparison with the parental forms 1. Heterochromatic regions of R genome chromosomes // Theor. Appl. Genet. 1986. V. 72. P. 518–523.
Badaeva E.D., Badaev N.S., Bolsheva N.L., Zelenin A.V. Chromosome alterations in the karyotype of triticale in comparison with the parental forms 1. Heterochromatic regions of R genome chromosomes // Theor. Appl. Genet. 1986. V. 72. P. 518–523.
26. Bai X., Peirson B.N., Dong F. et al. Isolation and characterization of SYN1, a RAD21-like gene essential for meiosis in Arabidopsis // Plant Cell. 1999. V. 11. P. 417–430.
27. Benavente E., Fernandez-Calvin B., Orellana J. Relationship between the levels of wheat-rye metaphase I chromosomal pairing and recombination revealed by GISH // Chromosoma. 1996. V. 105. P. 92–96.
28. Bento M., Gustafson P., Viegas W., Silva M. Genome merger: from sequence rearrangements in triticale to their elimination in wheat-rye addition lines // Theor. Appl. Genet. 2010. V. 121. Р. 489–497.
Appl. Genet. 2010. V. 121. Р. 489–497.
29. Bolsheva N.L., Badaeva E.D., Badaev N.S., Zelenin A.V. Chromosome alterations in the karyotype of triticale in comparison with the parental forms 2. Heterochromatin of the wheat chromosomes // Theor. Appl. Genet. 1986. V. 73. P. 66–71.
30. Cai X., Xu S.S., Zhu X. Mechanism of haploidy-dependent meiotic cell division of polyploid wheat // Chromosoma. 2010. V. 119. P. 275–285.
31. Feldman M., Levy A.A. Allopolyploidy – a shaping force in the evolution of wheat genomes // Cytogenet. Genome Res. 2005. V. 109. P. 250–258.
32. Fu S., Yang M., Fei Y. et al. Alterations and abnormal mitosis of wheat chromosomes induced by wheat-rye monosomic addition lines // PLoS ONE. 2013. V. 8. No. 7. e70483. doi:10.1371/journal.pone.0070483
2013. V. 8. No. 7. e70483. doi:10.1371/journal.pone.0070483
34. Islam A.K.M.R., Shepherd K.W. Meiotic restitution in wheatbarley hybrids // Chromosoma. 1980. V. 79. P. 363–372.
35. Landjeva S., Korzun V., Tsanev V. et al. Distribution of wheat-rye translocation 1RS.1BL among bread wheat varieties of Bulgaria // Plant Breed. 2006. V. 125. P. 102–104.
36. Lukaszewski A.J. Frequency of 1RS.1AL and 1RS.1BL translocations in United States wheats // Crop Sci. 1990.
37. Ma X.F., Gustafson J.P. Genome evolution of allopolyploids: a process of cytological and genetic diploidisation // Cytogenet. Genome. Res. 2005. V. 109. P. 236–249.
38. Ma X.F., Gustafson J.P. Timing and rate of genome variation in triticale following allopolyploidization // Genome. 2006. V. 49. P. 950–958.
39. Ma X.F., Gustafson J.P. Allopolyploidization-accommodated genomic sequence changes in triticale // Ann. Bot. 2008. V. 101. P. 825–832.
40. Ma X.F., Fang P., Gustafson J.P. Polyploidization-induced genome variation in triticale // Genome. 2004. V. 47. P. 839–848.
 Maan S.S., Sasakuma T. Fertility of amphihaploids in Triticinae // J. Hered. 1977. V. 57. P. 76–83.
Maan S.S., Sasakuma T. Fertility of amphihaploids in Triticinae // J. Hered. 1977. V. 57. P. 76–83.42. Mater Y., Baenziger S., Gill K. et al. Linkage mapping of powdery mildew and greenbug resistance genes on recombinant 1RS from ‘Amigo’ and ‘Kavkaz’ wheat-rye translocations of chromosome 1RS.1AL // Genome. 2004. V. 47. P. 292–298.
43. Matsuoka Y., Nasuda S. Durum wheat as candidate for the unknown female progenitor of bread wheat: an empirical study with a highly fertile F1 hybrid with Aegilops tauschii Coss. // Theor. Appl. Genet. 2004. V. 109. P. 1710–1717.
44. Matsuoka Y., Nasuda S., Ashida Y. et al. Genetic basis for spontaneous hybrid genome doubling during allopolyploid speciation of common wheat shown by natural variation analyses of the paternal species // PLoS ONE. 2013. 8(8): e68310. doi:10.1371/journal.pone.0068310
2013. 8(8): e68310. doi:10.1371/journal.pone.0068310
45. Mergoum M., Singh P.K., Pena R.J. et al. Triticale: A «New» Crop with Old Challenges // Cereals. 2009. DOI:10.1007/978-0-387-72297-9 / Ed. M.J. Carena. Springer Science + Business Media, LLC.
46. Miller T.E., Reader S.M., Purdie K.A., King I.P. Determination of the frequency of wheat-rye chromosome pairing in wheat × rye hybrids with and without chromosome 5B // Theor. Appl. Genet. 1994. V. 89. P. 255–258.
47. Nasuda S., Friebe B., Gill B.S. Gametocidal genes induce chromosome breakage in the interphase prior to the first mitotic cell division of the male gametophyte in wheat // Genetics. 1998. V. 149. P. 1115–1124.
48. Olesczuk S., Lukaszewski A.J. The origin of unusual chromosome constitutions among newly formed allopolyploids // AJB. 2014. V. 101. P. 318–326.
Olesczuk S., Lukaszewski A.J. The origin of unusual chromosome constitutions among newly formed allopolyploids // AJB. 2014. V. 101. P. 318–326.
49. Rimpau W. Kreuzungsprodukte landwirtschaftlicher Kulturpflanzen // Landwirtsh Jahrb. 1891. V. 20. No. 4. P. 335–371.
50. Ren T.H., Yang Z.J., Yan B.J. et al. Development and characterization of a new 1BL.1RS translocation line with resistance to stripe rust and powdery mildew of wheat // Euphytica. 2009. V. 169. P. 207–213.
51. Sears E.R. Genetic control of chromosome pairing in common wheat // Annu. Rev. Genet. 1976. V. 10. P. 31–51.
52. Sears E.R. Homoeologous chromosomes in Triticum aestivum (abstr.) // Genetics. 1952. V. 37. P. 624.
P. 624.
53. Sears E.R. The aneuploids of common wheat // Res. Bull. Mis. Agric. Exptl. Stat. 1954. V. 572. P. 1– 8.
54. Shchapova A.I., Potapova T.A., Kravtsova L.A., Numerova O.M. Karyotype stabilization in intergeneric hybrids of the subtriebe Triticinae // Theor. Appl. Genet. 1984. V. 68. P. 289–296.
55. Shlegel R. Current list of wheats with rye and alien introgression. 2010. V05-08, 1–14. http://www.desicca. de/Wheatrye introgression.
56. Silkova O.G., Adonina I.G., Krivosheina E.A. et al. Chromosome pairing in meiosis of partially fertile wheat/rye (ABDR) hybrids // Plant Reprod. 2013. V. 26. P. 33–41.
57. Silkova O.G., Shchapova A.I., Shumny V.K. Patterns of meiosis in ABDR amphihaploids depend on the specifi c type of univalent chromosome division // Euphytica. 2011. V. 178. P. 415–426.
Silkova O.G., Shchapova A.I., Shumny V.K. Patterns of meiosis in ABDR amphihaploids depend on the specifi c type of univalent chromosome division // Euphytica. 2011. V. 178. P. 415–426.
58. Tsuchida M., Fukushima T., Nasuda S. et al. Dissection of rye chromosome 1R in common wheat // Genes Genet. Syst. 2008. V. 83. P. 43–53.
59. Villareal R.L., Banuelos O., Mujeeb-Kazi A., Rajaram S. Agronomic performance of chromosome 1B and T1BL.1RS near-isolines in the spring bread wheat Seri M82 // Euphytica. 1998. V. 103. P. 195–202.
60. Voylokov A.V., Tikhenko N.D. Triticale as a model for study of genomic interaction and genome evolution in allopolyploids plants // Proc. of the 5th Intern. Triticale Symp. Poland. 2002. V. 1. P. 63–70.
61. Wagenaar E.B. Meiotic restitution and the origin of polyploidy. I. Infl uence of genotype on polyploid seedset in a Triticum crassum × Triticum turgidum hybrid // Can. J. Genet. Cytol. 1968. V. 10. P. 836–843.
Wagenaar E.B. Meiotic restitution and the origin of polyploidy. I. Infl uence of genotype on polyploid seedset in a Triticum crassum × Triticum turgidum hybrid // Can. J. Genet. Cytol. 1968. V. 10. P. 836–843.
62. Weimarck A. Elimination of wheat and rye chromosomes in a strain of octoploid triticale as revealed by Giemsa banding technique // Hereditas. 1974. V. 77. P. 281–286.
63. Xu S.J., Joppa L.R. Mechanisms and inheritance of first division restitution in hybrids of wheat, rye, and Aegilops squarrosa // Genome. 1995. V. 38. P. 607–615.
64. Xu S.J., Joppa L.R. First division restitution in hybrids of Langdon durum disomic substitution linnes with rye and Aegilops squarrosa // Plant Breed. 2000. V. 119. P. 233–241.
65. Yediay F.E., Baloch F.S., Kilian B., Ozkan H. Testing of rye-specifi c markers located on 1RS chromosome and distribution of 1AL.RS and 1BL.RS translocations in Turkish wheat (Triticum aestivum L., T. durum Desf.) varieties and landraces // Genet. Resour. Crop. Evol. 2010. V. 57. P. 119–129.
Yediay F.E., Baloch F.S., Kilian B., Ozkan H. Testing of rye-specifi c markers located on 1RS chromosome and distribution of 1AL.RS and 1BL.RS translocations in Turkish wheat (Triticum aestivum L., T. durum Desf.) varieties and landraces // Genet. Resour. Crop. Evol. 2010. V. 57. P. 119–129.
66. Zhang L., Chen Q., Yuan Z. et al. Production of aneuhaploid and euhaploid sporocytes by meiotic restitution in fertile hybrids between durum wheat Langdon chromosome substitution lines and Aegilops tauschii // J. Genet. Genom. 2008. V. 35. P. 617–623.
67. Zhang L., Yen Y., Zheng Y., Liu D. Meiotic restriction in emmer wheat is controlled by one or more nuclear genes that continue to function in derived line // Sex. Plant Reprod. 2007. V. 20. P. 159–166.
68. Zhou J. , Zhang H., Yang Z. et al. Characterization of a new T2DS.2DL-?R translocation triticale ZH-1 with multiple resistances to diseases // Genet. Resour. Crop. Evol. 2012. V. 59. P. 1161–116.
, Zhang H., Yang Z. et al. Characterization of a new T2DS.2DL-?R translocation triticale ZH-1 with multiple resistances to diseases // Genet. Resour. Crop. Evol. 2012. V. 59. P. 1161–116.
Получение дигаплоидов ржи с использованием культуры пыльников in vitro Текст научной статьи по специальности «Агробиотехнологии»
Получение дигаплоидов ржи с использованием культуры пыльников in vitro
I Резюме. В статье изложены основные результаты изучения возможности применения технологии культуры пыльников in vitro для получения удвоенных гаплоидов озимой ржи. Установлены наиболее приемлемые питательные среды для образования каллусов. Дигаплоидные формы выделены только при использовании пыльников тетраплоидного сорта ржи Белая Вежа. Эти формы исследованы по озерненности колоса и массе 1 тысячи зерен. Ключевые слова: биотехнология, генетика, селекция, рожь, культура пыльников.
®Эрома Урбан,
заместитель генерального
Научно-практического хозяйственных наук
Станислав Гордей,
заведующий лабораторией озимой пшеницы Научно-практического центра НАН Беларуси по земледелию, кандидат биологических наук
На современном этапе развития генетики и селекции эффект гетерозиса — один из основных способов повышения урожайности сельскохозяйственных культур. К настоящему времени для большинства из них созданы гетеро-зисные гибриды Б1, которые широко используются в мировом сельхозпро-изводстве [1]. Среди зерновых культур по применению эффекта гетерозиса озимая рожь занимает лидирующее положение. Исследования
по данной проблеме ведутся с конца 60-х гг.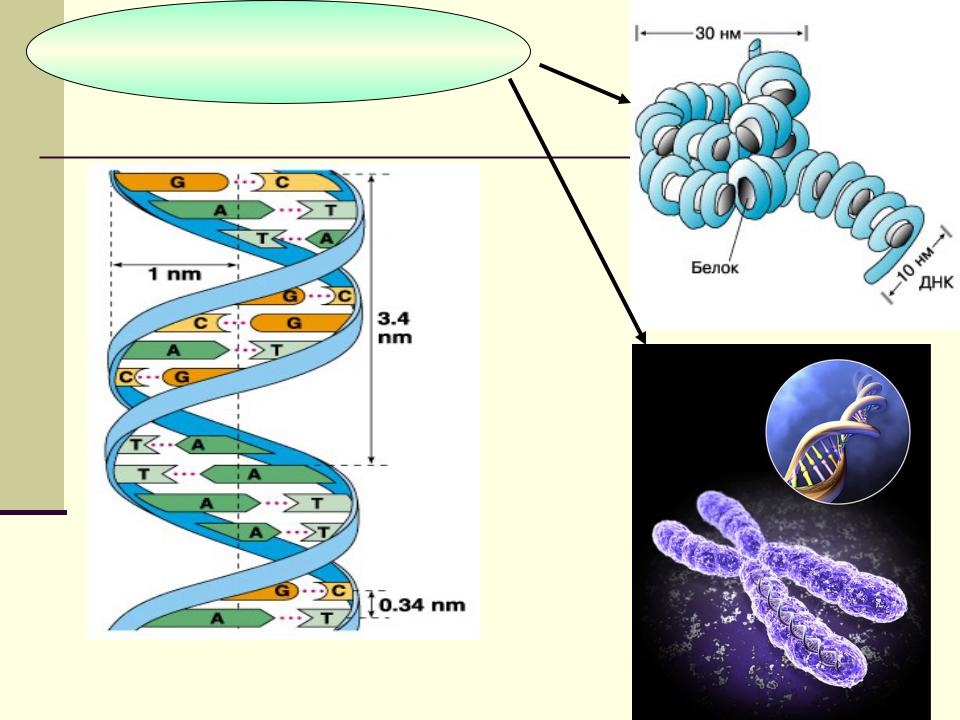 прошлого века. Гибридные сорта ржи зарегистрированы в странах Западной и Восточной Европы, в том числе и в Беларуси.
прошлого века. Гибридные сорта ржи зарегистрированы в странах Западной и Восточной Европы, в том числе и в Беларуси.
Успех селекции гибридных сортов определяется в первую очередь наличием обширного генофонда родительских компонентов с высокой комбинационной способностью [2]. Для ржи — это создание коллекций самофертильных линий со слабым проявлением инбредной депрессии в поколениях. Получение ин-цухт-линий традиционным способом заключается во введении генов самофертильности (Sf, Z) в популяцию (сорт, образец) ржи с дальнейшими последовательными принудительными самоопылениями отдельных растений и отбором самофертильных форм [3]. Этот процесс занимает 4-6 лет, при этом достичь константности линий и 100%-ной гомозиготности невозможно.
Создание удвоенных гаплоидов растений (DH-линий, double haploid) — наиболее эффективный способ получения константных гомозиготных генотипов. В настоящее время для выделения дигапло-
идов используется культура пыльников in vitro. Данная технология позволяет существенно сократить сроки извлечения гомозиготных форм. Эта методика успешно отработана на пшенице, тритикале, ячмене, рапсе [4]. У ржи получение регенерантов из пыльников затруднено из-за биологии самой культуры, в частности по причине самонесовместимости и последующей инбредной депрессии. Рожь как никакое другое растение трудно поддается регенерации на искусственной питательной среде при использовании как эмбриокультуры, так и культуры пыльников.
Данная технология позволяет существенно сократить сроки извлечения гомозиготных форм. Эта методика успешно отработана на пшенице, тритикале, ячмене, рапсе [4]. У ржи получение регенерантов из пыльников затруднено из-за биологии самой культуры, в частности по причине самонесовместимости и последующей инбредной депрессии. Рожь как никакое другое растение трудно поддается регенерации на искусственной питательной среде при использовании как эмбриокультуры, так и культуры пыльников.
Технология культуры пыльников in vitro для ржи — новое и актуальное направление научных исследований в нашей республике. Для этой культуры необходимо определение оптимальной стадии развития микроспор для посадки пыльников на искусственные среды, методов предобработки колосьев, состава питательных сред, условий искусственного климата для индукции каллусообразования, прямого эмбриогенеза и регенерации, методов удвоения числа хромосом, процесса
БИОТЕХНОЛОГИИ
Подготовка донорных растений. Предобработка в растворе Кнопа с добавлением этрела в концентрации 4 мг/л и бензимидазола в концентрации 5 мг/л. Выдерживание при t = 4 °С в течение 2-3 суток
Предобработка в растворе Кнопа с добавлением этрела в концентрации 4 мг/л и бензимидазола в концентрации 5 мг/л. Выдерживание при t = 4 °С в течение 2-3 суток
Стерилизация посадочного материала (5%-ный хлорамин), посадка на питательные среды с разным набором гормонов: Мурасиге — Скуга, N6 и Potato (по 30 пыльников на 1 пробирку)
Инкубация посадочного материала в термостате в течение 4-5 недель до появления новообразований при t = 25-28 °С
Посадка каллусов на безгормональную питательную среду Мурасиге -Скуга для регенерации гаплоидов
Полиплоидизация гаплоидов (0,2%-ный колхицин в 4%-ном диметилсульфоксиде) с использованием вакуум-инфильтрации
I этап
II этап
III этап
IV этап
V этап
VI этап
Посадка и культивирование регенерантов в почве. Получение семенного потомства
Получение семенного потомства
Таблица 1. Технология получения в культуре пыльников in vitro андрогенных растений ржи
Питательная среда
Генотип ржи Мурасиге — Скуга N Potato Всего
Сахароза Мальтоза
Голубка 840 1100 1470 1290 1850 3780 1140 8060 4700 6980 9900 4590 26170
Гибрид F1 2040 1320 1080 2220 3000
Всего 5040 5330 1050 7740
Таблица2. Количество пыльников ржи, посаженных на питательные среды
Питательная среда
Генотип ржи Мурасиге — Скуга Potato Всего
Сахароза Мальтоза N6
Голубка 13 — 5 3 28 3 21 126 47 10 204
Гибрид F1 94 19 18 4 7
Всего 132 18 3 19 1 35 |
Таблица3. Выход каллусов озимой ржи на питательных средах
Выход каллусов озимой ржи на питательных средах
пересадки регенерантов в искусственную почву и грунт, а также адаптация ex vitro. В настоящее время ни один из этих этапов не отработан, подобные изыскания в Беларуси в прошедшие два десятилетия не проводились. В связи с этим освоение технологии культуры пыльников in vitro и создание удвоенных гаплоидов ржи весьма актуальны.
Исходным материалом для настоящих исследований послужили: диплоидный сорт Голубка, тетра-плоидный сорт Белая Вежа, гетеро-зисный гибрид F1 и инцухт-линия из коллекции Научно-практического центра НАН Беларуси
по земледелию. При использовании тетраплоида предполагалось исключить полиплоидизацию колхицином и, соответственно, предотвратить гибель ослабленных ре-генерантов. На основании литературных данных и опыта работы по андрогенезу in vitro с другими культурами апробация технологии получения регенерантов in vitro из пыльников ржи велась по этапам (табл. 1).
1).
Выращивание донорных растений указанных сортов, гибрида и инцухт-линии ржи проводилось в условиях фитотронно-теплично-го комплекса при контролируемом
температурном и световом режимах, при разных сроках высадки отдельных экземпляров после яровизации для расширения периода созревания. Во избежание переопыления использовали групповые пергаментные изоляторы для каждого образца.
Для проведения исследований по всем образцам ржи с применением различных питательных сред было высажено 26 170 пыльников (табл. 2). Среди них образовалось 204 каллуса, что составляет 0,9% от общего количества пыльников (табл. 3).
Наибольшей способностью к формированию новообразований характеризуется тетраплоидный сорт ржи Белая Вежа: у его пыльников сформировано больше всего каллусов (126 шт.). Важную роль в образовании растительной ткани играет питательная среда. Наибольшее количество каллусов появилось у пыльников при использовании среды Мурасиге — Скуга с добавлением сахарозы. На этой же среде с мальтозой у популяцион-ных сортов Голубка, Белая Вежа и инцухт-линии каллусы вообще не сформировались. В наименьшей степени генотипическая специфичность по образованию каллусов проявилась при применении искусственной среды М6 (см. табл. 3). Следовательно, среди испытанных четырех типов сред наиболее приемлемой является среда Мурасиге — Скуга с добавлением сахарозы. Относительно высокая способность каллусообразования у тетраплоидного сорта ржи Белая Вежа, возможно, связана с диплоидным набором числа хромосом в генеративных тканях, что, скорее всего, повлияло на ряд физиологических процессов,воздействующих на прорастание пыльников.
Наибольшее количество каллусов появилось у пыльников при использовании среды Мурасиге — Скуга с добавлением сахарозы. На этой же среде с мальтозой у популяцион-ных сортов Голубка, Белая Вежа и инцухт-линии каллусы вообще не сформировались. В наименьшей степени генотипическая специфичность по образованию каллусов проявилась при применении искусственной среды М6 (см. табл. 3). Следовательно, среди испытанных четырех типов сред наиболее приемлемой является среда Мурасиге — Скуга с добавлением сахарозы. Относительно высокая способность каллусообразования у тетраплоидного сорта ржи Белая Вежа, возможно, связана с диплоидным набором числа хромосом в генеративных тканях, что, скорее всего, повлияло на ряд физиологических процессов,воздействующих на прорастание пыльников.
78 НАУКА И ИННОВАЦИИ | №5 (183) | Май 2018 |
http://innosfera.by
Образованные каллусы были пересажены на безгормональную питательную среду Мурасиге — Скуга для регенерации гаплоидов. Из 204 каллусов новообразования регенерировались у 123, включая ризоге-нез, альбиносные и зеленые растения (табл. 4, рис. 1).
Из 204 каллусов новообразования регенерировались у 123, включая ризоге-нез, альбиносные и зеленые растения (табл. 4, рис. 1).
Как показывают результаты исследования, новообразования из каллусов формировались в 58,3% случаев в среднем для всех использованных форм ржи. У 73 каллусов развивались только корни (ризо-генез) разных размеров, после чего наступало их отмирание, так как не было развития верхних органов.
На 46 каллусах от тетраплоид-ного сорта ржи Белая Вежа и диплоидного гибрида Б1 шло формирование как корневой системы, так и листьев (рис. 1Б). Два растения на каллусах сорта Белая Вежа оказались альбиносами. Такой эффект часто наблюдается при использовании культуры пыльников и других культур, таких как ячмень, тритикале, а также при отдаленной гибридизации. Это связано с генетическими и физиологическими нарушениями в процессе онтогенеза, которые приводят к отсутствию в растениях хлоропластов. Во всех случаях растения погибают, поскольку не происходит фотосинтеза. В результате из 204 высаженных каллусов на искусственной питательной среде сформировалось 44 зеленых растения (21,6% от общего числа) на генетической основе сорта Белая Вежа и гибрида Б1.
Во всех случаях растения погибают, поскольку не происходит фотосинтеза. В результате из 204 высаженных каллусов на искусственной питательной среде сформировалось 44 зеленых растения (21,6% от общего числа) на генетической основе сорта Белая Вежа и гибрида Б1.
Зеленые гаплоидные регенеран-ты из гибрида Б1 были подвергнуты полиплоидизации колхицином методом вакуум-инфильтрации. После колхицинирования все образцы погибли на начальных стадиях онтогенеза. Литературные данные
Рис. 1.
Формирование каллусов из пыльников (А), регенерация зеленых растений (Б)
Генотип ржи Высажено каллусов, шт. Результат регенерации, шт.
Ризогенез Альбиносы Зеленые растения Нет развития
Голубка 21 9 — — 12
Белая Вежа 126 45 2 28 51
Гибрид F1 47 18 — 16 13
Инцухт-линия 10 1 — — 9
Всего 204 73 2 44 85
Таблица 4. Выход новообразований в культуре пыльников ржи in vitro
Выход новообразований в культуре пыльников ржи in vitro
подтверждают высокий уровень гибели растений ржи при обработке этим препаратом, обладающим сильным мутагенным эффектом: он действует не только на блокирование веретена деления в мей-озе, но и на ряд других хромосомных (генных) перестроек, приводящих в большинстве случаев к летальному исходу. Как показала практика экспериментальной полиплоидии, при обработке раствором колхицина 1,5-2-дневных проростков диплоидных образцов ржи 9095% их гибнет. Поскольку в наших исследованиях регенеранты, полученные из пыльников на искусственных питательных средах, были крайне ослаблены в своем развитии,
реакция на колхицин привела к гибели в 100% случаев.
Растения-регенеранты, полученные с использованием тетраплоид-ного сорта Белая Вежа, не подвергались полиплоидизации, так как предполагалось, что тетраплоид-ный набор хромосом позволит исключить данную операцию и получить диплоидные образцы. После формирования корневой системы и первичных листьев регенеранты от пыльников этого сорта были пересажены из пробирок изначально на искусственную почву, а затем в сосуды с грунтом (рис. 2).
После формирования корневой системы и первичных листьев регенеранты от пыльников этого сорта были пересажены из пробирок изначально на искусственную почву, а затем в сосуды с грунтом (рис. 2).
Из 28 зеленых растений на различных стадиях онтогенеза погибло 15 из-за различных нарушений
Рис. 2.
Выращивание растений -регенерантов ржи на искусственной почве(А) и в сосудах с грунтом (Б)
БИОТЕХНОЛОГИИ
№ расте- Число цветков Число зерен Озерненность, Масса
ния в колосе, шт. в колосе, шт. % 1000 зерен, г
1 58 5 8,6 11,2
2 56 12 21,4 17,5
3 58 25 43,1 19,7
4 60 19 31,7 23,0
5 54 4 7,4 14,9
6 58 16 27,6 14,4
7 52 9 17,3 12,6
Среднее 56,6 12,9 22,4 16,2
Таблица 5. Характеристика растений — регенерантов ржи по озерненности колоса и массе 1 тысячи зерен
Характеристика растений — регенерантов ржи по озерненности колоса и массе 1 тысячи зерен
Рис. 3. Колос дигаплоида ржи
в хромосомном составе (анеупло-идные генотипы), в основном после стадии яровизации до цветения. Из 13 оставшихся генотипов семена удалось получить на 7 растениях, остальные были полностью стерильны, что также связано в первую очередь с несбалансированностью хромосомного состава. Все 7 растений, давшие семенное потомство, характеризовались слабым уровнем озерненности колоса и низкой массой тысячи зерен (табл. 5, рис. 3).
Причина низкой озерненности колоса — нарушения в процессах микро-, макро- и гаметогенеза. По данным [5, 6], этот показатель у ржи на 44% обусловлен сбоями в макро-гаметогенезе и на 50% — изменениями в ходе эмбрио- и эндосперма-генеза. Все это приводит к образованию анеуплоидных растений с несбалансированным числом хромосом. Хотя упомянутые исследования проводились на ржи, не связанной с технологией культуры пыльников in vitro, аналогичные нарушения, несомненно, имеют место и в настоящем случае. Можно также заключить, что перевод на другой уровень плоидности вызывает дезинтеграцию системы организма, которая оказывается фактором, разрушающим сложившуюся на те-траплоидном уровне устойчивость онтогенеза в процессах регуляции
Хотя упомянутые исследования проводились на ржи, не связанной с технологией культуры пыльников in vitro, аналогичные нарушения, несомненно, имеют место и в настоящем случае. Можно также заключить, что перевод на другой уровень плоидности вызывает дезинтеграцию системы организма, которая оказывается фактором, разрушающим сложившуюся на те-траплоидном уровне устойчивость онтогенеза в процессах регуляции
физиологических и морфологических функций клетки (цитогенети-ческий гомеостаз). Это распространяется и на перевод ржи с диплоидного уровня плоидности на тетра-плоидный [7, 8].
Есть основания полагать, что стабилизация созданных генотипов ржи произойдет в ближайшие несколько поколений. Не исключена также элиминация ряда форм вследствие указанных нами нарушений.
Результаты настоящих исследований показали возможность использования технологии андроге-неза для ржи. Тем не менее получить удвоенные гаплоиды на генетической основе диплоидных образцов не удалось. В первую очередь это обусловлено биологией данной зерновой культуры. Крайне слабая ее отзывчивость на культуру in vitro каких бы то ни было генотипов требует скрупулезной разработки каждой стадии процесса культуры пыльников. Вместе с тем, несмотря на низкий процент выхода фертильных удвоенных гаплоидов (5,6 % от числа посаженных каллусов), удалось получить растения-регенеранты (дигаплои-ды) из пыльников тетраплоидного сорта ржи Белая Вежа, а также семенное потомство. При использовании тетраплоидных популяций ржи также необходимо дальнейшее
Тем не менее получить удвоенные гаплоиды на генетической основе диплоидных образцов не удалось. В первую очередь это обусловлено биологией данной зерновой культуры. Крайне слабая ее отзывчивость на культуру in vitro каких бы то ни было генотипов требует скрупулезной разработки каждой стадии процесса культуры пыльников. Вместе с тем, несмотря на низкий процент выхода фертильных удвоенных гаплоидов (5,6 % от числа посаженных каллусов), удалось получить растения-регенеранты (дигаплои-ды) из пыльников тетраплоидного сорта ржи Белая Вежа, а также семенное потомство. При использовании тетраплоидных популяций ржи также необходимо дальнейшее
изучение способов и методов повышения эффективности технологии культуры пыльников.
Заслуживает внимания идея предварительной по-липлоидизации диплоидных форм ржи до внедрения рассмотренной в статье технологии in vitro, поскольку, как видно из результатов наших исследований, ослабленные регенеранты полностью погибают при применении колхицина. Для создания гомозиготных инцухт-линий как родительских компонентов гибридных сортов также требуется предварительная интродукция генов самофертильности в популяции либо использование существующих ге-терозисных гибридов ржи, где уже присутствуют эти гены. Без генов самофертильности невозможно размножение инцухт-линий в поколениях, так как при принудительном самоопылении зерновки не завязываются из-за самонесовместимости. СП
Для создания гомозиготных инцухт-линий как родительских компонентов гибридных сортов также требуется предварительная интродукция генов самофертильности в популяции либо использование существующих ге-терозисных гибридов ржи, где уже присутствуют эти гены. Без генов самофертильности невозможно размножение инцухт-линий в поколениях, так как при принудительном самоопылении зерновки не завязываются из-за самонесовместимости. СП
ЛИТЕРАТУРА
1. Geiger H.H. Hybrid rye and Heterosis / H.H. Geiger, Т. Miedaner // Genetics and Exploitation of Heterosis in Crops.- Madison, Wisconsin, USA, 1999. Р. 439-450.
2. Geiger H.H. Cytoplasmic male sterility in rye (Secale cereale L.) / H.H. Geiger, F.W. Schnell // Crop. Sci. 1970. Vol. 10. P. 56-60.
3. Гордей С.И.Селекционно-генетические аспекты использования эффекта гетерозиса у озимой ржи (Secale cereale L. ) // Весц На-цыянальнай акадэми навук Беларуси Сер. бiял. навук. 2002, №1. С. 103-108.
) // Весц На-цыянальнай акадэми навук Беларуси Сер. бiял. навук. 2002, №1. С. 103-108.
4. Гурецкая В.С. Методические рекомендации по культуре изолированных пыльников ячменя (Hordeum vulgare L.).- Жодино, 2013.
5. Тороп А.А. Направления, методы и результаты селекции озимой ржи в условиях Центрально-Черноземной зоны РСФСР:дис. в виде науч. докл. … д-ра с.-х. наук.- Немчиновка, 1993.
6. Тороп А.А.Наследуемость озерненности тетраплоидной ржи / А.А. Тороп, В.В. Корякин // Генетика. 1990, №5. С. 886-893.
7. Фадеева Т.С. Генетические механизмы, определяющие особенности полиплоидов и эволюционное значение полиплоидов / Т.С.Фадеева, Н.М. Иркаева// Теоретические и практические проблемы полиплоидии.- М., 1974. С. 104-114.
8. Урбан Э. П. Озимая рожь в Беларуси (селекция, семеноводство, технология возделывания): монография.- Минск, 2009.
П. Озимая рожь в Беларуси (селекция, семеноводство, технология возделывания): монография.- Минск, 2009.
http://innosfera.by/2018/05/in_vitro
80 НАУКА И ИННОВАЦИИ | №5 (183) | Май 2018 |
http:// in nos fera. by
Особенности загрузки белков ASY1 и ZYP1 в структуру мейотических хромосом ржи дикого типа и мейотических мутантов sy1 и sy19
158
линии Л-458 отсутствовали, что обнаружило локализацию восьми хромосом специфичных
маркеров – BNL1064, BNL2884, BNL3650, CIR203, Gh032, Gh039, Gh082 и TMB1538 на
хромосомно-замещенных гибридах F1 Мо13х Pima 3-79 и Мо67х Pima 3-79. Так как ранее
эти маркеры были локализованы на хромосоме 6 A-субгенома хлопчатника, можно
считать, что две моносомные линии — Мо13 и Мо67 Цитогенетической коллекции НУУз
имеют нехватку по хромосоме 6. Еще одна моносомная линия Мо27 была
Еще одна моносомная линия Мо27 была
идентифицирована, поскольку с помощью молекулярного анализа один маркер BNL1531
был локализован на этой моносоме. Поскольку ранее он был приписан к хромосоме 7 A-
субгенома хлопчатника, можно считать, что эта моносомная лини – Мо27
Цитогенетической коллекции НУУз имеет нехватку по хромосоме 7.
Таким образом, использование SSR-маркеров позволило идентифицировать
нехватки хромосом у 23 моносомных линий хлопчатника, что значительно облегчило
процесс идентификации хромосом.
ОСОБЕННОСТИ ЗАГРУЗКИ БЕЛКОВ ASY1 И ZYP1 В СТРУКТУРУ
МЕЙОТИЧЕСКИХ ХРОМОСОМ РЖИ ДИКОГО ТИПА И МЕЙОТИЧЕСКИХ
МУТАНТОВ sy1 И sy19
Симановский С.А.1, Иорданская И.В.2, Коломиец О.Л. 1, Богданов Ю.Ф. 1
1Институт общей генетики им. Н.И. Вавилова Российской академии наук, Москва.
2Московский НИИСХ “Немчиновка”, Московская область
Синаптонемный комплекс (СК) – уникальная и универсальная белковая структура,
которая формируется между гомологичными хромосомами в профазе I мейоза (и только в
ней) у абсолютного большинства высших эукариот. Функция СК заключается в
Функция СК заключается в
обеспечении обратимого синаписиса гомологичных хромосом и создании структурной и
молекулярной основы для протекания процессов мейотической рекомбинации. СК состоит
из двух латеральных элементов (ЛЭ), к которым прикрепляются петли хроматина
спаривающихся гомологичных хромосом, и центрального элемента (ЦЭ), который
объединяют латеральные элементы. У животных и некоторых видов растений белки ЦЭ
встраиваются в состав СК в процессе синапсиса гомологов. Для Arabidobsis thaliana
известны два специфичных белка СК – ASY1 (ассоциирован с ЛЭ) и ZYP1 (белок
поперечных филаментов ЦЭ). Е.И. Михайловой и соавтороами (2006, 2010) было
установлено, что у ржи Secale cereale L. дикого типа и мейотических мутантов sy10
загрузка ортологов белков AtASY1 и AtZYP1 в структуру осевых элементов (ОЭ) хромосом
начинается одновременно уже на стадии лептотены: разобщенные линейные тракты обоих
белков выявляются в структуре формирующихся ЛЭ еще до начала синапсиса
гомологичных хромосом. По мере продвижения синапсиса, на стадии зиготены и после его
По мере продвижения синапсиса, на стадии зиготены и после его
Создание секалотритикум — экспериментальный ароморфоз и эффективный путь расширения генофонда амфидиплоидов пшеницы с рожью
Создание секалотритикум — экспериментальный ароморфоз и эффективный путь расширения генофонда амфидиплоидов пшеницы с рожью
Белько Н.Б., к.б.н., Гордей И.А., д.б.н., Хохлова С.А., к.б.н., Щетько И.С., Быченко А.П.
Институт генетики и цитологии НАН Беларуси, г. Минск, Беларусь
Селекционно-генетический анализ созданного генофонда тритикале показал, что у тритикале недостаточно реализован генетический потенциал адаптивности ржи. Тритикале, как правило, уступают озимой ржи по морозо- и зимостойкости, устойчивости к грибным болезням и более требовательны к плодородию почв. Урожайность тритикале варьирует в зависимости от зоны и года возделывания, что обусловлено недостаточной экологической пластичностью и слабой устойчивостью растений к биотическим и абиотическим факторам. Причиной недостаточной экологической пластичности используемых в сельскохозяйственном производстве пшенично-ржаных амфидиплоидов является ингибирование в гибридном ядре генетических систем ржи, определяющих высокую адаптивность растений, вследствие взаимодействия их с количественно преобладающими геномами и цитоплазмой пшеницы.
Причиной недостаточной экологической пластичности используемых в сельскохозяйственном производстве пшенично-ржаных амфидиплоидов является ингибирование в гибридном ядре генетических систем ржи, определяющих высокую адаптивность растений, вследствие взаимодействия их с количественно преобладающими геномами и цитоплазмой пшеницы.
Дальнейший прогресс в селекции этой культуры может быть связан с решением проблемы усиления экспрессии ржаного генома в полигеноме амфидиплоидов ржи с пшеницей, расширением и обогащением генофонда исходного материала на основе вовлечения видового потенциала пшеницы и ржи путём синтеза амфидиплоидов различного геномного состава и ядерно-цитоплазматической структуры с последующей интрогрессивной и рекомбинационной селекцией. В этой связи особый интерес представляет создание рекомбинантных форм тритикале с цитоплазмой ржи [1,2] и их хромосомно-замещенных линий. Синтез таких форм будет способствовать оптимизации цитоплазматического фона для экспрессии геномов исходных видов в полигеноме гибридов и расширению генетического разнообразия исходного материала вследствие эффектов замещений хромосом и новых ядерно-цитоплазматических взаимодействий.
В данной работе представлены результаты цитогенетического анализа гибридов F1 (тетраплоидная рожь, 4х=28 х гексаплоидное тритикале, 6х=42), идентификации кариотипов методом дифференциального окрашивания хромосом созданных секалотритикум и их замещенных форм в связи с морфотипом и продуктивностью растений.
В качестве исходного материала использованы районированные и перспективные сорта тетраплоидной озимой ржи (RRRR, 4x=28), формы гексаплоидного тритикале (AABBRR, 6x=42) и сорта мягкой озимой пшеницы (AABBDD, 6x=42). Создание секалотритикум осуществлялось по разработанному нами методу, основанному на использовании в скрещиваниях с рожью гексаплоидных тритикале в качестве источника геномов пшеницы [2-4]. Хромосомно-замещенные линии секалотритикум получали путём интрогрессивной гибридизации секалотритикум с мягкой пшеницей. Исследование микроспорогенеза у гибридов проводили на окрашенных ацетокармином давленых препаратах. Хромосомно-замещенные линии секалотритикум идентифицировали с помощью метода дифференциального окрашивания хромосом.
Установлено, что определяющим этапом формирования генома секалотритикум являются ржано-тритикальные пентаплоиды F1 (RRABR, 5х=35). Мейоз у них характеризуется рядом специфических особенностей вследствие специфики геномного состава – один диплоидный (RR) и три гаплоидных (ABR) генома — и взаимодействия генетических систем контроля микроспорогенеза ржи и пшеницы. Основные из них: 1) высокий уровень гомеологичной конъюгации хромосом (до 15 бивалентов на клетку вместо 7), связанный с ингибированием Ph-системы пшеницы бивалентной конъюгации гомологов в условиях ржаной цитоплазмы и трёх геномов ржи и уменьшением дозы Ph-гена; 2) эквационное деление части унивалентов (до 7) в А1 вследствие перехода от однополярной ориентации хромосом к диполярной или нарушения связи одной из хроматид с полюсом под действием тройной дозы P/Edu генов; 3) неравномерное распределение генетического материала по клеткам, образование диад и тетрад (от 72,2 до 90,9%) с микроядрами.
Специфические особенности мейотического деления, вызванные межгеномными и ядерно-цитоплазматическими взаимодействиями, координируют мейоз унивалентных хромосом, делая его в целом более регулярным, чем у истинных гаплоидов, и приводят к внутри- и межгеномным рекомбинациям, неравномерному расхождению и интенсивной элиминации генетического материала. Это обусловливает формирование у ржано-тритикальных гибридов F1 относительно высокого процента жизнеспособных гамет и зерновок (фертильность пыльцы от 5,1 до 13,0%, фертильность колоса при свободном опылении — в среднем 4,9 зерна на колос) с различным числом и геномным составом хромосом. В результате в F1BC1 и последующих поколениях обеспечивается получение ржано-пшеничных амфиплоидов в достаточном объёме с широким спектром изменчивости (табл. 1).
Таблица 1 Распределение ржано-тритикальных амфиплоидов F1BC1 по числу хромосом
|
Число хромосом |
35 |
36 |
37 |
38 |
39 |
40 |
41 |
42 |
43 |
47 |
Растений |
|
Частота,% |
14,2 |
4,2 |
17,4 |
22,7 |
12,0 |
14,7 |
2,5 |
11,7 |
0,1 |
0,4 |
674 |
У гибридов F1BC1 число хромосом варьировало в пределах 33-47. Большая часть растений содержала 35, 37, 38, 39, 40 и 42 хромосомы. Большинство 42-хромосомных растений имели несбалансированный кариотип по наборам хромосом пшеницы и ржи, характеризовались низкой фертильностью. Сбалансированные по наборам хромосом, цитологически стабильные и фертильные гексаплоиды составляли около 1%.
Большая часть растений содержала 35, 37, 38, 39, 40 и 42 хромосомы. Большинство 42-хромосомных растений имели несбалансированный кариотип по наборам хромосом пшеницы и ржи, характеризовались низкой фертильностью. Сбалансированные по наборам хромосом, цитологически стабильные и фертильные гексаплоиды составляли около 1%.
На основе 42-хромосомных растений, выщепившихся в F2BC1 и F1BC2 в скрещиваниях 8 сортов тетраплоидной озимой ржи (Радзіма, Новосибирская, Верасень, Пуховчанка, Ясельда, Ислочь, Калинка, Fernando) и 10 форм гексаплоидных тритикале с использованием разработанного в лаборатории метода создан генофонд ржано-пшеничных амфидиплоидов с цитоплазмой ржи, включающий более 200 семей F1-F4 секалотритикум. Установлено, что степень проявления морфологических, хозяйственно-ценных признаков и свойств у ранних поколений созданных секалотритикум варьировала в зависимости от комбинации скрещивания, а также от семьи и конкретного растения в пределах одного и того же гибрида. Например, у линии секалотритикум 109-4, полученной на основе сорта ржи Новосибирская и тритикале Л 246, масса 1000 зерен составила 43,1, а у линии этой же комбинации 110-2 – 47,0 г, т.е оказалась выше на 9,3%. В то же время для линии 110-2 характерны в среднем более низкие озерненность и масса зерна с растения. Линя 109-1 созревала на неделю позже линий 109-4 и 110-2. Сравнение коэффициентов вариации одноименных признаков позволило установить большую степень изменчивости элементов структуры урожая у созданных секалотритикум по сравнению с тритикале. При этом максимальные варианты у секалотритикум имели более высокие значения признаков, чем максимальные варианты у тритикале. Выявленные между линиями и растениями одного и того же гибрида различия в степени проявления признаков и свойств свидетельствуют о наличии генотипической изменчивости у ранних поколений созданных ржано-пшеничных амфидиплоидов, которая обусловлена рядом факторов.
Например, у линии секалотритикум 109-4, полученной на основе сорта ржи Новосибирская и тритикале Л 246, масса 1000 зерен составила 43,1, а у линии этой же комбинации 110-2 – 47,0 г, т.е оказалась выше на 9,3%. В то же время для линии 110-2 характерны в среднем более низкие озерненность и масса зерна с растения. Линя 109-1 созревала на неделю позже линий 109-4 и 110-2. Сравнение коэффициентов вариации одноименных признаков позволило установить большую степень изменчивости элементов структуры урожая у созданных секалотритикум по сравнению с тритикале. При этом максимальные варианты у секалотритикум имели более высокие значения признаков, чем максимальные варианты у тритикале. Выявленные между линиями и растениями одного и того же гибрида различия в степени проявления признаков и свойств свидетельствуют о наличии генотипической изменчивости у ранних поколений созданных ржано-пшеничных амфидиплоидов, которая обусловлена рядом факторов. Из основных факторов, кроме сложного геномного состава ржано-тритикальных амфиплоидов F1 (RRABR, 5x=35) и F1BC1 и специфичности протекания у них мейоза, следует выделить модификации хромосом, возникающие у гибридов отдаленных скрещиваний и разнообразие аллелей геномов A, B и R исходных сортов тритикале и ржи, используемых при получении секалотритикум. В результатье этих процессов у ржано-тритикальных амфиплоидов F1, F1BC1, F2BC1 и F1BC2 в процессе мейоза образуется большое разнообразие гамет, объединение которых при оплодотворении приводит к разнообразию зигот, гетерогенности последующих поколений и сложному характеру расщепления. Высокая гетерогенность ранних поколений секалотритикум и широкий спектр изменчивости признаков продуктивности являются базой для создания генетического разнообразия исходного материала секалотритикум, отбора генотипов с комплексом элементов продуктивности и создания высокоурожайных и экологически пластичных линий.
Из основных факторов, кроме сложного геномного состава ржано-тритикальных амфиплоидов F1 (RRABR, 5x=35) и F1BC1 и специфичности протекания у них мейоза, следует выделить модификации хромосом, возникающие у гибридов отдаленных скрещиваний и разнообразие аллелей геномов A, B и R исходных сортов тритикале и ржи, используемых при получении секалотритикум. В результатье этих процессов у ржано-тритикальных амфиплоидов F1, F1BC1, F2BC1 и F1BC2 в процессе мейоза образуется большое разнообразие гамет, объединение которых при оплодотворении приводит к разнообразию зигот, гетерогенности последующих поколений и сложному характеру расщепления. Высокая гетерогенность ранних поколений секалотритикум и широкий спектр изменчивости признаков продуктивности являются базой для создания генетического разнообразия исходного материала секалотритикум, отбора генотипов с комплексом элементов продуктивности и создания высокоурожайных и экологически пластичных линий.
Выделено 24 цитологически стабильных форм секалотритикум. С использованием метода дифференциального окрашивания хромосом проведен анализ кариотипов некоторых ржано-пшеничных амфидиплоидов (табл. 2). Установлено, что исследованные секалотритикум являются геномно-сбалансированными гексаплоидными формами. Их кариотипы представлены полными наборами хромосом A, B геномов пшеницы и R генома ржи. Выявлены характерные особенности в рисунках дифференциального окрашивания хромосом ржи, затрагивающие как терминальные, так и интеркалярные C-блоки, которые сформировались вследствие межгеномных и ядерно-цитоплазматических взаимодействий и специфичности R-геномов, привнесённых в полигеном секалотритикум исходными тритикале и рожью. Некоторые секалотритикум характеризовались более высокой урожайностью по сравнению со стандартом – сортом тритикале Михась, которая обеспечивалась более высокой жизнеспособностью растений и высокими средними значениями элементов структуры урожая (рис).
С целью расширения генетического разнообразия и улучшения хлебопекарных качеств секалотритикум проводили реконструкцию их генома. Предполагалось, что интрогрессия в кариотип секалотритикум хромосом D-генома пшеницы позволит сохранить признаки, присущие ржаному геному: адаптивность, зимостойкость, устойчивость к болезням, и одновременно улучшить хлебопекарные свойства за счёт качества клейковины и белкового состава зерна.
Предполагалось, что интрогрессия в кариотип секалотритикум хромосом D-генома пшеницы позволит сохранить признаки, присущие ржаному геному: адаптивность, зимостойкость, устойчивость к болезням, и одновременно улучшить хлебопекарные свойства за счёт качества клейковины и белкового состава зерна.
Таблица 2 Хромосомный состав кариотипов и морфо-биологические особенности секалотритикум и хромосомно-замещенных линий
|
Линия |
Происхождение |
Хромосом, в том числе по геномам |
Идентификация замещенных хромосом |
Морфотип линии |
Биологические особенности |
Продуктив-ность, г/м2 |
||||||||
|
общее |
пшеницы |
ржи |
||||||||||||
|
A |
B |
D |
R |
|||||||||||
|
Секалотритикум |
||||||||||||||
|
109-1 |
Новосибирская х Л. |
42 |
14 |
14 |
— |
14 |
|
Высота 115см. Колос длинный и рыхлый |
Позднеспелая, устойчивая к мучнистой росе и септориозу |
646,4 |
||||
|
203-3 |
Калинка х Самсун |
42 |
14 |
14 |
— |
14 |
|
Высота 118 см. Колос плотный |
Среднеспелая, озерненность колоса высокая |
590,0 |
||||
|
Хромосомно-замещенные линии |
||||||||||||||
|
220 |
(Верасень х Л374) х Л160 х Л160 |
42 |
14 |
14 |
14 |
— |
Полное замещение ржаного генома – D/R |
Характеризуется низкой зимостойкостью |
Аллопшеница. |
268,8 |
||||
|
227 |
(Новосибирская х Л246) х Гармония х Гармония |
42 |
14 |
14 |
12 |
2 |
Пара хромосом 2R, остальные замещены на хромосомы D-генома |
Пшеничного морфотипа, фертильность до 90%. Линия среднеспелая |
Линия устойчивая к септориозу |
401,6 |
||||
|
129 |
(Папараць х AD-60) х Луцковлянка х Луцковлянка |
42 |
14 |
14 |
2 |
12 |
Замещение 1D/1R |
Морфотип секало- тритикум, средне-спелая, высокофер-тильная (95%) |
Линия устойчивая к грибным заболеваниям |
462,9 |
||||
|
217 |
(Новосибир-ская х Л246) х Копылянка х Копылянка |
42 |
14 |
14 |
|
14 |
Присутствуют 14 хромосом ржаного генома, имеются транслокации |
Морфотип секало-тритикум. |
Линия устойчивая к септориозу |
707,7 |
||||
|
Тритикале Михась |
42 |
14 |
14 |
|
14 |
|
|
|
472,9 |
|||||
В результате интрогрессивной гибридизации секалотритикум с мягкой озимой пшеницей получена серия хромосомно-замещённых форм ржано-пшеничных амфидиплоидов на цитоплазме ржи с различным сочетанием хромосом R- и D-геномов и степенью проявления хозяйственно-ценных признаков и свойств (табл. 2). Установлено, что количество замещенных хромосом в кариотипе линий варьировало от 1 до 7 пар ржаного генома на хромосомы D генома пшеницы. Кариотипический состав интрогрессивных линий определял морфотип растений: замещения 1 и 2 пар хромосом ржаного генома обуславливает формирование растений с морфотипом исходных секалотритикум, а замещение 5-7 пар ржаных хромосом – с морфотипом пшеницы. Выделены интрогрессивные линии секалотритикум с различным сочетанием хромосом
2). Установлено, что количество замещенных хромосом в кариотипе линий варьировало от 1 до 7 пар ржаного генома на хромосомы D генома пшеницы. Кариотипический состав интрогрессивных линий определял морфотип растений: замещения 1 и 2 пар хромосом ржаного генома обуславливает формирование растений с морфотипом исходных секалотритикум, а замещение 5-7 пар ржаных хромосом – с морфотипом пшеницы. Выделены интрогрессивные линии секалотритикум с различным сочетанием хромосом
R- и D- геномов (линия 129 – замещена 1R хромосома, морфотип секалотритикум; линия 227 – замещена 2R хромосома, морфотип секалотритикум; линия 220 – полное замещение ржаного генома на хромосомы D-генома пшеницы, морфотип пшеницы). Практическое значение имеют линии с замещением не более двух пар ржаных хромосом на хромосомы D-генома пшеницы. Замещения двух пар хромосом ржи не снижает продуктивность, адаптивность и устойчивость растений к болезням.
Проведенные исследования подтверждают целесообразность создания ржано-пшеничных амфидиплоидов с цитоплазмой ржи (секалотритикум) в связи с повышением адаптивности, расширением и обогащением генофонда амфидиплоидов пшеницы с рожью и высокую эффективность разработанного метода их синтеза. Полученные результаты важны для выяснения роли и эффектов взаимодействия генетических систем контроля процесса микроспорогенеза и отдельных хромосом исходных видов у отдаленных гибридов. Созданный генофонд секалотритикум и хромосомно-замещенные линии представляют интерес для практической селекции и генетических исследований.
Полученные результаты важны для выяснения роли и эффектов взаимодействия генетических систем контроля процесса микроспорогенеза и отдельных хромосом исходных видов у отдаленных гибридов. Созданный генофонд секалотритикум и хромосомно-замещенные линии представляют интерес для практической селекции и генетических исследований.
Литература
1. Гончаров С.В., Туровский А.И. Использование тетраплоидной ржи для получения рекомбинантных форм тритикале // Новое в селекции и семеноводстве сельскохозяйственных культур. — 1987. — С. 152-155
2. Гордей Г.М., Гордей И.А., Новикова Л.В., Клименко Е.П. Способ получения секалотритикум. А. С. №1734602 А1. — 1992.
3. Гордей И.А., Гордей Г.М., Новикова Л.В. Генетические основы создания тритикале (хТритикале): Создание ржано-пшеничных амфидиплоидов (секалотритикум) // Генетика. – 1996. — Т.32. С. 783-787.
4. I.A.Gordei, N.B.Belko, S.A. Khokhlova Cytogenetic analysis of genome formation in rye-wheat amphploids // 11th International Congress on Genes, Gene Families and Isozymes, june 30-july 4, 2001, Stocholm, Sweden. — P.58.
— P.58.
Как выглядит, растёт и применяется рожь (описание зерновой культуры)
Рожь относится к мятликовой группе растений. Является второй по важности сельскохозяйственной культурой после пшеницы, используется в пищевой промышленности и при изготовлении кормов для животных. Несмотря на пользу злака, ржаные посевные в России ежегодно сокращаются. Связано это с тем, что по скороспелости и урожайности она уступает пшенице. Выращивать ее не столь выгодно с экономической точки зрения.
Ботаническая характеристика ржи
Селекционные сорта ржи относятся к одно- и двулетним растениям, а многолетняя рожь — это дикие виды злака. Дикая рожь часто прорастает как сорное растение на пшеничных посевных, среди посадок овса или сортовой ржи. Однолетний злак вырастает до 175 см в длину. Все сорта делятся на озимые и яровые, а более урожайными являются озимые.
Биологические особенности ржи:
- Опыляется перекрестным способом при помощи ветра или насекомых;
- Достаточная кислотность почвы для прорастания и урожайности — 5,3-6,5 pH;
- Молодые побеги со сформировавшимся узлом кущения способны выдержать морозы до -21`С;
- Лучшие растения-предшественники для ржи — люпин, клевер, ранние сорта картофеля, гречиха.

- Культуру не высеивают после сахарной свеклы, кормовых корнеплодов, промежуточных культур и позднего картофеля.
Происхождение и распространение
Современные сорта произошли из сорно-полевого вида, родиной которого является Юго-Западная Азия. В археологических раскопках семена злака находят вместе с ячменем и пшеницей. Однако рожь — более молодая культура. Самые ранние находки датируются 2 000 лет до н.э. В этот период ее активно выращивали по берегам Оки, Днепра, Днестра, а также в горных регионах Кавказа.
Популярность культуры обуславливается неприхотливостью, зимостойкостью и хорошим урожаем. Эти качества сыграли важную роль в переселении злака в северные страны и регионы: там, где пшенице не хватало солнца и тепла рожь давала хороший урожай.
На территории Восточной Европы, в Заонежье и Кижах рожь появилась около 900 лет до н.э, а первые упоминания в письменных источниках относятся к 1 в.н.э. Распространение ржи потеснило другую важную злаковую культуру — ячмень. Люди предпочли возделывать более зимостойкий злак, который можно было пересеять даже холодной осенью. Еще одно преимущество — ржаной хлеб получался вкуснее и сытнее, чем из ячменя или овса.
Люди предпочли возделывать более зимостойкий злак, который можно было пересеять даже холодной осенью. Еще одно преимущество — ржаной хлеб получался вкуснее и сытнее, чем из ячменя или овса.
Особенности развития культуры
При прорастании семена поглощают до 65% воды от своего веса, а для развития корней им необходима температура не ниже +3`С. Побеги озимых сортов появляются на 6-7 день после посева, яровых — на 8-9 день. Из-за наличия в первом листе антоциана всходы имеют фиолетовый оттенок.
В фазе кущения образуются боковые побеги. Продолжительность кущения — от 33 до 37 дней для яровых сортов, а для озимых — 30 дней осенью и около 20 дней весной после пробуждения. Количество урожая зависит от числа стеблей с колосьями, которые образуются в стадии колошения. Еще одна характеристика этого периода — увеличение размера листьев и укрепление стебля.
Во время цветения происходит набухание лодикул и расхождение цветковых чешуек. Ветер переносит пыльцу с одного рыльца на другой для опыления и образования завязи зерновки. Минимальная температура для процесса цветения +12,5 `С. Созревание и наливание зерен зависит от ветра и температуры, влажности воздуха.
Минимальная температура для процесса цветения +12,5 `С. Созревание и наливание зерен зависит от ветра и температуры, влажности воздуха.
Молочное зерно имеет зеленый цвет и желтеет по мере достижения восковой спелости.
Описание злаковой культуры
Рожь — это вид травы с прямым и полым внутри стеблем. На верхней его части и на листовых пластинах расположены тонкие волоски, которые спасают растение от пересыхания во время жары, от резких похолоданий и перемерзания. Они же дают растению возможность прорастать на легких песчаных почвах. Свисающий колос венчает верхушку стебля. Его длина зависит от сорта и может доходить до 17 см. На колосе расположены линейные шиловидные чешуйки, под которыми скрыты овальные или продолговатые зерновки. Цвет зерновки и структура поверхности различается в зависимости от сорта злака.
Относится дикая рожь к диплоидной форме растений, имеющих пару хромосом. В ходе селекции удалось получить сорта с удвоенным хромосомным набором, что позволило увеличить размер зерна, его количество и качество. В результате работ созданы виды, стойкие к полеганию, с массой 1000 зерен до 55 г.
В результате работ созданы виды, стойкие к полеганию, с массой 1000 зерен до 55 г.
Молодые всходы очень похожи на пшеничные, различить их можно по корневой системе. У ржи побеги имеют корешки, состоящие из 4 частей, у пшеницы — из 3.
Стебель и корневая система
Средняя длина стебля — около 90 см, но при благоприятных условиях рожь может вырасти до 175-180 см. Корневая система мочковатой формы достигает двухметровой глубины. Это объясняет способность растения произрастать на легких песчаных, закисленных и малопородных почвах. Длинные корни способны доставать необходимые микроэлементы и воду с большой глубины.
Узел кущения залегает на глубине 17-20 мм при нормальной заделке семян. Если же семена залегают ниже, то рожь формирует два узла: верхний расположен ближе к поверхности земли, нижний — на 1,5-2 см ниже. Верхний узел является основным.
Во время подземного ветвления стебля растение образует наземные побеги. Их количество зависит от условий, может достигать 50 и более.
Листья ржи
Листья растения плоские, широколинейные, сизо-зеленого или серо-зеленого цвета. Длина листа зависит от сорта и может достигать 30 см, ширина — до 3 см. Основание листа венчает язычок и гладкие ушки, плотно прилегающие к стеблю. Листовая пластинка у большинства сортов покрыта защитными волосками, предохраняющими растение от пересыхания или замерзания.
Соцветия и колосья ржи
Соцветие — сложный колос, длиной от 6 до 17 см и шириной от 0,5 до 1,5 см. Стержень его имеет четырехгранную форму, обрамлен одиночными плоскими колосками. Каждый из них имеет по паре развитых цветков и один неразвитый. Чешуйки цветка линейно-шиловидной формы с 1 выраженной жилкой. Они меньшего размера и заостренного вида, с маленькой остью. Внешние цветковые чешуйки достигают в длину 15 мм, отличаются ланцетной формой и длинной остью. Верхние чешуйки короче, с 5-ю жилками и с тонкими изогнутыми ресничками по краям.
Внутренние чешуйки же имеют по паре килей, без ости, а реснички расположены только в верхней части. У цветков ржи по 3 тычинки, пыльники удлиненные, выступающие из колосков.
У цветков ржи по 3 тычинки, пыльники удлиненные, выступающие из колосков.
Зерна ржи
Злаки быстро всходят и наращивают зерновую массу. Кущение после посадки начинается через 21-25 дней, а фаза колошения наступает еще через 45 дней. Цветение наступает через 10-12 дней после начала колошения, и продолжается 2 недели. Фаза молочной спелости длится 10-12 дней, а на созревание зерна уходит до двух месяцев.
Зерновка ржи имеет продолговатую форму, сжатую с боков, с выраженной бороздкой. Размер, форма и даже цвет зерна зависит от сорта культуры. Средняя длина — от 5 до 11 мм, ширина — от 1,2 до 3,4 мм, толщина — 1,3-3 мм. Для диплоидных сортов масса 1000 зерен — до 35 г, дл тетраплоидных — до 55 г. Цвет может быть белым, сероватым, темно-коричневым, желтым, желто-коричневым или серо-зеленым.
Хозяйственное значение ржи
В России культивируется около 50 сортов ржи, большинство из них — озимые. Яровую рожь высаживают в Якутии, Забайкалье, Центральной Сибири. Озимые сорта не выдерживают снежных и морозных зим этих регионов, однако дает больший урожай.
Центральные регионы России практикуют высеивание ржи в качестве сидерата. Она хорошо очищает поле от сорняков, вредителей и снижает уровень заболевания почвы. Рожь насыщает землю калием и разрыхляет, делая грунт удобным для сохранения воды и кислорода.
По количеству протеина рожь уступает пшенице, а из-за большого содержания клейковины (до 26%) ржаной хлеб получается более плотным, и быстро черствеет.
Зародыши злака используются в качестве сырья для приготовления лекарственных препаратов, в пищевой и косметической промышленности. Из солода делают виски и спирт.
Молодые побеги являются высококалорийным и богатым витаминами кормом для домашнего скота. Для улучшения качества сенажа и силоса вместе с рожью высеивают вику или люцерну. Такой сенаж или сухое измельченное сено содержит:
- До 16% протеина;
- До 35% безазотистых экстрактивных веществ;
- До 33% клетчатки;
- До 6% жира.
Доля ржи в зерновом корме не должна превышать 50%. Обилие клетчатки и протеина может спровоцировать развитие ожирения у домашних животных и птиц.
Обилие клетчатки и протеина может спровоцировать развитие ожирения у домашних животных и птиц.
Почему рожь полезна для организма
Рожь богата витаминами и минералами. В ее составе много:
- Витаминов группы B, которые участвуют в обменных процессах, предупреждают старение и поддерживают иммунитет;
- Витаминов А и РР, сохраняющих структурную целостность клеток;
- Фолиевой кислоты, которая обладает общеукрепляющим действием и благоприятно влияет на работу сердца и сосудов;
- Лизина и треонина, отвечающих за регенерацию тканей.
- Богат злак и витамином Е, холином, бетаином, бета-каротином и лютеином.
Польза пророщенных зерен
Пророщенное зерно полезнее сухого, так как содержит больше марганца, цинка, селена и железа. Регулярное употребление свежих ростков позволяет компенсировать недостаток витаминов и минералов в организме, особенно в весенний период. Проращенное зерно можно добавлять в каши, салаты, супы, есть на завтрак с йогуртом или кефиром. Польза пророщенной ржи — нормализация работы органов пищеварения, улучшение состояния микрофлоры кишечника, очищение от шлаков и избыточного холестерина.
Польза пророщенной ржи — нормализация работы органов пищеварения, улучшение состояния микрофлоры кишечника, очищение от шлаков и избыточного холестерина.
Проращенное зерно рекомендовано при заболеваниях:
- Желудочно-кишечного тракта;
- Селезенки;
- Головного мозга;
- Эндокринной системы;
- Печени;
- Аллергии.
Изделия из ржаной муки можно употреблять во время беременности и кормления грудью, людям с высокой степенью ожирения и больным сахарным диабетом. Включение в ежедневный рацион проращенных зерен благотворно влияет на зрение, состояние кожи, волос, ногтей и зубов. Противопоказание — гастрит с высокой кислотностью и непереносимость глютена.
Химический состав зерна
Состав ржаного зерна зависит от условий выращивания злака и его сорта. Основной углевод — крахмал, в сухом веществе на его долю приходится до 65%. Он и другие углеводы в процессе гидролиза образуют фруктозу.
Содержание гуммивещества — от 2,5 до 5,5%, левулезана меньше — до 3%. Слизь представлена пентозаной, которая легко растворяется в воде и при гидратации увеличивается в объеме в 9 раз. Уровень сахара находится в диапахоне от 4,3 до 6,8%, клетчатки — 2,3-3,4%, белка — 8-19,4%. Белок представлен альбумином, глиадином, глобулином и глютелином. В ржаной муке белковые вещества быстро набухают, образуя вязкое и липкое тесто.
Слизь представлена пентозаной, которая легко растворяется в воде и при гидратации увеличивается в объеме в 9 раз. Уровень сахара находится в диапахоне от 4,3 до 6,8%, клетчатки — 2,3-3,4%, белка — 8-19,4%. Белок представлен альбумином, глиадином, глобулином и глютелином. В ржаной муке белковые вещества быстро набухают, образуя вязкое и липкое тесто.
Количество жира в 100 г сухого вещества — до 2%. Больше половины из них — ненасыщенные кислоты: линолевая, олеиновая, линоленовая, стеориновая, пальмитиновая, миристиновая. Присутствуют также и неомыляемые вещества — кампестерол, холестерол. Содержатся жиры в зародыше и алейроновом слое. Показатель зольности злака — от 1,5 до 2,8%.
Проблемы и перспективы выращивания в России
В конце прошлого столетия в России собирали до 20 млн.т. ржи в год, но за прошедшие 20-25 лет количество урожая снизилось почти в 10 раз. В 2017 г. было собрано всего 2,5 млн.т. зерна. На долю ржаного хлеба приходится чуть более 10% от общего объема производимого хлеба.
Связано это с распространением пшеницы как основной пищевой культуры. Выведение новых урожайных и устойчивых к холодам сортов привлекло большее внимание фермеров. Возрастающая производительность и скороспелость пшеницы не позволили другим злаковым конкурировать на посевных полях. Отсутствие государственного регулирования структуры зерновых и экономической заинтересованности землевладельцев в ее выращивании также привели к сокращению посевов этой культуры.
Рост интереса к продуктам и спирту изо ржи наблюдается только в последние несколько лет, когда здоровое питание становится все более популярным. Польза ржаных продуктов доказана российскими и зарубежными медиками. Но несмотря на это эксперты не предвидят увеличение посевных площадей: для удовлетворения нужд внутреннего рынка продукт выгоднее закупать, чем высаживать. Кормовую рожь высеивают вместе с викой, люцерной, клевером и другими бобово-злаковыми культурами.
Увеличение производства возможно только при расширении сферы использования злака. Ржаная крупа — лучший природный антиоксидант, который обладает противовоспалительными и противоаллергенными свойствами. Незаменим злак и как сидерат на полях, и как страховая культура в условиях нестабильного климата.
Ржаная крупа — лучший природный антиоксидант, который обладает противовоспалительными и противоаллергенными свойствами. Незаменим злак и как сидерат на полях, и как страховая культура в условиях нестабильного климата.
Меры по популяризации зерна должны проводиться на государственном уровне, как это делается в странах Европы.
Интересные факты о злаковой культуре
В некоторых регионах России, где традиции достаточно сильны, сохранился обычай: для новобрачных готовят кашу из молодого ржаного зерна. Это символ богатства, изобилия и счастья. Во второй половине 19-го века Люксембург вышел на первое место в мире по раку кишечника. Проблема нашла очень простое и неожиданное решение: в рацион стали добавлять отруби и ржаной хлеб. Показатель заболеваний быстро сократился, а через несколько десятилетий приблизился к нулю.
Рожь и ржаная мука обладают массой целебных свойств. Если приложить ржаную лепешку к нарыву или абсцессу — он быстрее проходит. Воспаление спадает, уменьшаются болевые ощущения, ускоряется регенерация в тканях.
На Руси пучком колосьев отгоняли от новорожденного злых духов, а на дно кровати младенца клали несколько ржаных зерен от сглаза и порчи.
Солома используется и сегодня в качестве кровельного материала для жилых домов и сараев, а также для изготовления саманных кирпичей.
Человек использует цельное зерно для варки каш, а мука идет на выпечку диетических видов хлеба, приготовление кваса, блинов, пирогов и пряников. Из зерен готовят настои и отвары, смягчающие кашель. Ржаные отруби понижают высокое давление и помогают в лечении анемии.
Лидерами по выращиванию злака является Германия и Польша. На долю этих двух стран приходится около 50% от мирового урожая. Зерна используют в фармацевтической отрасли для получения естественных аминокислот и витаминов, гормонов и антител. Из ржаной муки производится почти 70% хлеба и выпечки, готовых завтраков, а из солода делают спирт, благородные крепкие напитки и пиво.
Применение злака — многогранно, а неприхотливость позволяет выращивать рожь даже в районах с рискованным земледелием. Она может стать хорошей кормовой культурой для животноводства северных регионов и решить продовольственную проблему на местном уровне, однако нуждается в правильной популяризации и продвижении на государственном уровне.
Она может стать хорошей кормовой культурой для животноводства северных регионов и решить продовольственную проблему на местном уровне, однако нуждается в правильной популяризации и продвижении на государственном уровне.
Анализ на аллерген ige рожь (f5) – сдать по цене 515 руб. в Москве
* Стоимость лабораторных исследований без учёта стоимости забора биоматериала.
** Срочное исполнение действительно только для московского региона.
Краткое описание
Стоимость забора биоматериалаНастоящим уведомляем Вас о том, что с 01 марта 2016 года Лаборатория «Литех» изменяет порядок и стоимость забора биоматериала. Прейскурант
*Цены у Партнеров могут отличаться.
|
Аллергия на рожь по распространенности уступает только повышенной чувствительности к пшенице (среди злаков). При заболевании возникают следующие симптомы:
- головные боли,
- отеки,
- заложенность носа,
- приступы удушья.
Возможна реакция на рожь не только в составе продуктов, но и на пыльцу (поллиноз). Симптомы проявляются чиханием, покраснением глаз. При подозрении на аллергию нужно исключить продукты, содержащие рожь в любом виде, в пору цветения растения — ограничить выход больного на воздух, в помещении чаще проводить влажную уборку.
Точно установить причину появления недомогания позволит анализ крови на специфические антитела — иммуноглобулины класса IgE. Исследование заключается в обнаружении в сыворотке f5 — антител, которые вырабатывает иммунитет при попадании ржи в организм.
Аллергия на рожь: преимущества анализа крови
Из-за аллергии на рожь возможна реакция немедленного типа — анафилаксия. анализы крови исключают контакт аллергена и пациента в любом виде (в отличие от кожных проб). Антитела обнаруживают в сыворотке. К преимуществам этого способа диагностики относят возможность широкого использования во всех случаях, когда проведение иных проб нецелесообразно:
- возраст до 5 лет,
- низкая чувствительность кожи,
- течение аллергии без периодов ремиссии,
- невозможность отмены антигистаминных средств,
- острый период заболевания с поражением кожи.
Исследования сыворотки проводят для уточнения ложноположительных или ложноотрицательных результатов. Высокая специфичность и объективность гарантируют получение точных данных.
Высокая специфичность и объективность гарантируют получение точных данных.
Хромосомный набор — Справочник химика 21
Установлено, что первоначальный эффект действия аценафтена на растительные клетки не отличается от известного эффекта, вызываемого такими веществами, как диэтиловый эфир, хлораль-гидрат и др. Но в дальнейшем тело растительной клетки, подвергшейся действию аценафтена, разбивается перегородками на части и в каждой такой части обычно оказывается по одному ядру. Таким образом, вместо многоядерных гигантских клеток типа опухолевых, как при действии других веществ, под действием аценафтена возникают гораздо более жизнеспособные одноядерные клетки, различающиеся между собой по составу ядер. При помощи аценафтена оказывается возможным легко и разнообразно изменять хромосомные наборы растений и клеточное деление. Получающиеся под действием аценафтена полиплоиды обладают увеличенным ростом и продуктивностью, а также измененными физиологическими свойствами. [c.14]
[c.14]
Биолог. Очень просто. При оплодотворении в ядре яйцеклетки объединяются хромосомные наборы матери и отца. Митохондрии же яйце- [c.107] Хромосомные наборы мужской (Л) и женской (5) особей сливаются в один (В), [c.25]
Одним из факторов, способствующих такому росту, является то, что у яйцеклеток многих животных завершение мейоза откладывается почти до самого конца созревания, так что эти яйцеклетки содержат удвоенный ди-плоидныи набор хромосом в течение большей части периода их роста. Таким образом, они содержат больше ДНК для транскрипции, чем имеет средняя соматическая клетка в фазе G, клеточного цикла. Кроме того, сохраняя и отцовскую, и материнскую копии каждого гена, яйцеклетки избегают того риска, который создают рецессивные летальные мутации в одном из двух родительских хромосомных наборов если бы яйцеклетке приходилось проводить долгое время в гаплоидном состоянии лишь с одной копией каждого гена, риск был бы очень велик, так как у большинства организмов имеются рецессивные летали. [c.31]
[c.31]
Стабильность содержания ДНК в ядре можно использовать в двух направлениях. Во-первых, она позволяет нам вычислить количество клеток в участке ткани, если известно общее содержание ДНК [69]. Во-вторых, по отношению к ДНК можно выражать содержание в ткани остальных соединении (стр. 109). Тем самым можно избежать некоторых ошибок, присущих обычному расчету на сырой или сухой вес [69, 70]. В целом количество ДНК в ядре клетки полностью коррелирует с хромосомным набором, что было очень четко продемонстрировано на клетках асцитной опухоли [80]. [c.309]
На фиг. 3, Б изображен момент слияния ядер, а на фиг. 3,В — возникшее в результате этого слияния новое ядро. Оно имеет 4 хромосомы, т. е. сумму хромосомных наборов [c.24]
У цветковых растений эффект транслокаций изучен хорощо. У них гибель пыльцевых зерен с несбалансированным хромосомным набором обусловлена их наследственной конституцией. [c.170]
Это касается и женских половых клеток зародышевые мешки с несбалансированным хромосомным набором не способны функционировать. Лишь в исключительных случаях, при [c.171]
Лишь в исключительных случаях, при [c.171]
Как правило, каждый вид характеризуется определенным числом хромосом. Изменчивость числа хромосом в пределах вида встречается редко. При сравнении числа хромосом у различных видов, относящихся к одному роду, выявляются три возможности 1) все виды имеют одинаковое число хромосом 2) виды имеют разное число хромосом и связь между разными хромосомными наборами установить трудно 3) числа хромосом у разных видов, относящихся к одному роду, кратны одному определенному числу. Последний тип встречается довольно часто, особенно среди цветковых растений он имеет важное значение, и поэтому мы его рассмотрим более подробно. [c.311]
Л—Г. Относительный размер клеток у растений мха с нормальным набором хромосом (Л) и типов с хромосомным набором, увеличенным в 2, 3 и 4 раза (Б —Г). Д. Нормальные растения. Е. Крупные растения с удвоенным набором хромосом.
 [c.318]
[c.318]И — также 14 хромосом, но другого типа, то наборы хромосом этих видов можно обозначить соответственно АА и ВВ, причем каждая буква обозначает набор из семи хромосом. Если между этими двумя видами будут получены гибриды, то оии будут иметь хромосомный набор А В. [c.333]
У двудомных растений, так же как и у животных, в ряде случаев обнаружены специфические половые хромосомы. Впервые половые хромосомы у растений были обнаружены Алленом в 1917 г. при исследовании печеночного мха Sphaero- arpus. Выше было указано (стр. 35), что растения мхов всегда гаплоидны, тогда как спорофит — т. е. спорангий и его ножка — диплоидны. У вида, изученного Алленом, было обнаружено, что мужское растение имеет 7 обычных хромосом и одну маленькую точечную Y-хромосому, тогда как хромосомный набор женских растений состоит из тех же семи обычных хромосом и одной очень длинной Х-хромосомы (фиг. 52). При оплодотворении эти два хромосомных набора соединяются, и таким образом спорофит имеет набор 14А + X -Ь Y. Во время мейоза образуется 7 пар аутосом и одна пара X = У. Следовательно, половина спор получит набор 7А + X, а другая по- [c.135]
Во время мейоза образуется 7 пар аутосом и одна пара X = У. Следовательно, половина спор получит набор 7А + X, а другая по- [c.135]
Вид АА образует пыльцевые зерна и яйцеклетки с хромосомным набором А. Однако у гибридов АВ мейоз часто бывает настолько сильно нарушен, что гаметы с редуцированным набором хромосом образоваться не могут. Мы уже раньше видели, что это объясняется отсутствием гомологии между оказавшимися вместе хромосомами разных видов, что обусловливает нарушение конъюгации хромосом и приводит к образованию нежизнеспособных гамет с несбалансированным хромосомным набором. [c.334]
Хотя полиплоидные виды пшениц, вероятно, возникли в результате межвидовых скрещиваний и суммирования хромосомных наборов видов, участвовавших в гибридизации, другие исследования показали, что геномы (наборы хромосом) А, В и С не так резко отличаются друг от друга, как следовало бы ожидать. В сущности, между генами, имеющимися в разных геномах, наблюдается значительное сходство. Хотя эти геномы и обозначают разными буквами, однако имеются данные, что в известной степени они гомологичны, т. е. соответствуют друг другу. [c.339]
В работе, написанной в 1928 г., американский исследователь Рандольф сообщил о так называемых В-хромосомах у кукурузы. Так были обозначены особые мелкие хромосомы, обнаруженные у некоторых растений кукурузы в добавление к обычному хромосомному набору. Все нормальные растения кукурузы имеют 20 так называемых А-хромосом. Нарушение структуры или числа этих хромосом оказывает такое же сильное влияние, как и соответствующие нарушения у дрозофилы или дурмана. Между тем В-хромосомы имеются лишь у некоторых растений кукурузы, и частота их различна в разных [c.353]
Выше уже указывалось, что эти хромосомы имеют много общего и, следовательно, они представляют собой явление довольно однородное. Название их — В-хромосомы — практически удобно, но не очень удачно. Лучше называть их добавочными хромосомами, поскольку они представляют собой более или менее случайное добавление к нормальному хромосомному набору. [c.357]
В процессе функционирования X. претерпевают структур-но-морфологич. преобразования, в основе к-рых лежит процесс спирализации — деспирализации структурных единиц X. (хромонем). На одной из стадий деления клеток — в метафазе — спирализоваиные (плотноупакованные, ковденсирован-ные) X. хорошо различимы в оптич. микроскопе. В клетках тела двуполых животных и растений каждая X. представлена двумя гомологичными X., происходящими одна от материнского, а другая от отцовского организма. Каждый вид обладает характерным и постоянным набором X. в клетке число X. в хромосомном наборе варьирует от двух до неск. сотен для разных видов. [c.322]
Целые наборы хромосом от разных видов могут соединяться вместе и в результате возникают аллополиплоидные формы (от греч alios — другой) Можно соединять и неполные хромосомные наборы Так, при скрещивании 42-хромосомной пшеницы с пше-нично-ржаным амфидиплоидом, содержащим 56 хромосом, возникает гибрид с 49 хромосомами, у которого 42 хромосомы принадлежат пшенице и 7 хромосом принадлежит ржи [c.184]
Цикл полового размножения включает чередование гаплоидных поколений клеток, каждая из которых имеет одиночный набор хромосом, с диплоидными поколениями, где клетки обладают двойным хромосомным набором. Смешивание геномов происходит благодаря слиянию двух гаплоидных клеток, из которых образуется одна диплоидная. В свою очередь новые гаплоидные клетки образуются из диплоидных в результате деления особого типа, называемого мейозом, при котором гены двойного набора заново перераспределяются между одиночными наборами (рис. 14-2). Генетичестя рекомбинация хромосом в процессе мейоза приводит к тому, что каждая клетка нового гаплоидного поколения получает новое сочетание генов, происходящих частично от одной родительской клетки предыдущего гаплоидного поколения и частично от другой. Таким образом, благодаря циклам, включающим гаплоидную фазу, слияние клеток, диплоидную фазу и меноз, распадаются старые комбинации генов и создаются новые. [c.7]
У всех высших растений и животных в процессе полового размножения происходит смена ядерных фаз. При оплодотворении половые клетки (гаметы) и их ядра сливаются, образуя зиготу. Отцовское и материнское ядра вносят при оплодотворении одинаковое число хромосом (п) таким образом, ядро зиготы содержит двойной хромосомный набор (2п). Иными словами, гаметы-гаплоидные клетки (т.е. клетки с одним набором хромосом), а соматические клетки-диплоидные (с двумя наборами). Поэтому при образовании гамет следующего поколения число хромосом в клетке (2и) должно уменьшиться вдвое (2и/2 = и). Совокупность процессов, приводящих к уменьшению числа хромосом, называют мейозом или редукционным делением (рис. 2.3). Мейоз — важнейший процесс у организмов, размножающихся половым путем он приводит к двум результатам 1) к перекомбинированию отцовских и материнских наследственных факторов (генов) и 2) к уменьшению числа хромосом. Мейоз начинается с конъюгации хромосом-каждая хромосома соединяется с соответствующей (гомологичной) хромосомой, происходящей от дфугого родителя. Во время конъюгации путем разрыва и перекрестного воссоединения (кроссинговера) может происходить обмен фрагментами одинаковой длины между гомологичными хромосомами. Затем следует двукратное разделение спаренных расщепившихся хромосом, и в результате образуются четыре клетки, каждая из которых имеет гаплоидное ядро. Таким образом, в процессе мейоза не только происходит перетасовка хромосом материнского и отцовского происхождения, но может произойти и обмен сегментами между гомологичными хромосомами. Оба процесса приводят к новым сочетаниям генов (к их рекомбинации). [c.24]
Нижняя диаграмма Б) сделана по результатам анализа 50 ядер, выделенных из печени четко видно, что эти ядра распадаются на две основные группы. Меньшая группа ядер характеризуется таким же количеством ДНК, что и ядра почки во второй, менее компактной группе среднее количество ДНК вдвое больше, чем в ядрах первой группы и в ядрах почек. В этом пике сосредоточены тетраилоидные ядра (ядра с двойным хромосомным набором), тогда как в первый пик попадают диплоидные ядра (с нормальным хромосомным набором), такие, которые обнаружены в большинстве других соматических тканей. Поскольку известно, что у грызунов в клетках печени обнаруживается полиплоидия, т. е. наличие ядер с кратным диплоидному набором хромосом, не удивительно, что при микроспектрофотометрическом анализе выявилось два класса ядер. Присутствие тетранлоидных ядер в печени крыс объясняет также, почему при химических анализах содержание ДНК в ядрах печени крыс оказывается гораздо выше [72, 77], чем в других тканях. [c.308]
Даже в случаях крайней аллотетраплоидии эти хромосомные наборы отличаются друг от друга не полностью. Правда, разные хромосомные наборы обозначают разными буквами, например Л и В, но так как родительские виды АА и ВВ способны скрещиваться между собой, то мы должны допустить, что эти виды имеют много общих генов. Как правило, число этих общих генов гораздо больше, чем число разных ге нов. Поэтому даже крайне выраженный аллополиплоид представляет собой частичный автополиплоид. Можно сказать, что абсолютной может быть только автополиплоидность, тогда как аллополиплоидность означает лишь определенную степень [c.380]
За последние десять лет было обнаружено, что некоторые. микроорганизмы представляют собой чрезвычайно удобные объекты для генетических исследований. Среди них в первую очередь следует упомянуть нейроспору, принадлежащую к аскомицетам. Культуру этого гриба можно легко выращивать в пробирках в лаборатории и размножать вегетативно но этот гриб имеет также и половую фазу развития, что дает возможность получать гибриды разных биотипов. Недавно удалось проанализировать хромосомный набор нейроспоры. [c.230]
В изображенном хромосомном наборе имеются 5 квад-ривалентов Б, Г, Ж, 3, И) и А бивалента (А, В, Д, Е). [c.319]
Винге предположил, что у таких межвидовых гибридов хромосомный набор иногда удваивается на ранней стадии. Это могло бы произойти, если бы удвоение хромосом в отличие от обычного не сопровождалось делением клетки. При этом возникли бы клетки с 28 хромосомами вместо 14, что могло бы дать начало целым растениям с удвоенным набором хромосом, т. е. в нашем примере — с хромосомным набором [c.333]
Так, например, скрещивая пшенип.у и рожь, можно получить так называемые пщенично-ржаные гибриды (фиг. 162 и 163), содержащие полные хромосомные наборы ржи и пшеницы. Эти пшенично-ржаные формы сочетают в себе свойства обоих родительских видов. Выше уже говорилось, что обычная пшеница имеет 42 хромосомы и состав ААВВСС, тогда как клетки ржи содержат лишь 14 хромосом, которые не имеют гомологов ни в одном хромосомном наборе пшеницы. Таким [c.335]
Приведенные примеры убедительно показывают, что не только количественные изменения хромосомного набора при образовании автотетраплоидов, но, быть может, в еще большей степени скрещивание разных видов и суммирование разных наборов хромосом играли важную роль в возникновении полиплоидных рядов диких растений, а также, безусловно, в происхождении многих культурных растений. [c.342]
При описании автотриплоидов и автотетраплоидов мы упоминали о явлении, называемом анеуплоидией, т. е. о наличии хромосомных наборов, в которых число хромосом меньше полиплоидного числа или находится где-то между числом хромосом у разных членов полиплоидного ряда. Как уже было отмечено, гаметы, а также особи, у которых число хромосом не является строго полиплоидным, т. е. ие кратно основному числу, имеют пониженную жизнеспособность. Дальнейшие данные такого рода были получены при изучении гаплоидов, у которых жизнеспособны лишь нередуцированные гаметы. Только они содержат полный набор хромосом и поэтому способны функционировать, тогда как все другие гаметы, у которых отсутствует одна или несколько хромосом, обречены на гибель. [c.345]
Наследственная изменчивость в природе не ограничивается исключительно рекомбинационной изменчивостью, но усложняется изменениями в структуре и числе хромосом. Что касается числа хромосом, то особый интерес представляют полиплоидные формы. В гл. XXV мы показали, как путем скрещивания и удвоения хромосом могут возникнуть новые полиплоидные виды. Многие из полиплоидных культурных растений оказались аллополиплоидами. Дикорастущие растения также часто представляют собой результат сложения хромосомных наборов, полученных от родителей, у которых число хромосом было меньще. С точки зрения видообразования представляют интерес и чисто количественные автополиплоид-ные изменения в пределах вида. Как правило, автотетраплоиды очень близки к исходному диплоидному виду, отличаясь главным образом более крупными размерами, более крупными цветками и семенами, более толстыми листьями и т. п. Эти различия обусловлены увеличением размеров клеток у автополиплоидов. Однако одновременно изменяются и признаки физиологического характера, такие, как осмотическое давление клеточного сока, скорость клеточного деления, зимостойкость, раннеспелость. [c.379]
Отсюда недалеко до таких тетраплоидов, которые возникли при скрещивании между таксономически более или менее хорошо разделенными подгруппами одного и того же вида (линиями, разновидностями, подвидами, экотипами, как бы мы их ни называли). Такие тетраплоиды не являются ни типичными автополиплоидами, ни аллополиплоидами, а занимают промежуточное положение между этими формами. Типичные аллотетраплоиды получают свои хромосомные наборы от ясно обособленных видов, которые заметно различаются по генотипу, а также в отношении структурной дифференцировки. Вследствие этого конъюгация хромосом у первичных диплоидных гибридов происходит неправильно (см. стр. 337). [c.380]
При более высоких степенях полиплоидности, чем тетраплоидность, возможен иной тип комбинации между авто- и аллополиплоидией. Наиболее просто этот тип можно выразить формулой ААААВВ. Эта формула показывает, что в таком случае из 6 хромосомных наборов 4 совершенно одинаковы, а остальные 2 отклоняются. [c.381]
Хромосомный состав линий пшеницы-ржи и влияние хромосом ржи на устойчивость к болезням и агрономические признаки
Friebe, B., Jiang, J., Raupp, WJ, et al., Характеристика транслокаций пшеницы в чужеродные устойчивость к болезням и вредителям: современное состояние, Euphytica , 1996, т. 91. С. 59–87.
Артикул Google Scholar
Ji, J., Zhang, A., Wang, Z., et al., A пшеница — Thinopyrum ponticum — линия тригенерической зародышевой плазмы ржи с устойчивостью к мучнистой росе и полосатой ржавчине, Euphytica , 2012, т.188. С. 199–207.
CAS Статья Google Scholar
Ци, Л., Фрибе, Б., Чжан, П., и Гилл, Б.С., Гомеологическая рекомбинация, хромосомная инженерия и улучшение сельскохозяйственных культур, Chromosome Res. , 2007, т. 15. С. 3–19.
CAS PubMed Статья Google Scholar
Сирс, E.R., Хромосомная инженерия в пшенице, Stadler Symposia , Университет Миссури, 1972, т.4. С. 23–28.
Google Scholar
Friebe, B., Raupp, WJ, и Gill, BS, Чужеродные гены в улучшении пшеницы, в пшенице в глобальной окружающей среде , Bedö, Z. and Lóng, L., Eds., Budapest, 2001, т. 9. С. 709–720.
Артикул Google Scholar
Шлегель Р., Текущий список пшеницы с рожью и чужеродной интрогрессией, 2011. V05-08. 1–14. http: // www.desicca.de/Wheat-ryeintrogression
Google Scholar
Leach, R.C. и Дандас, И.С., Однонуклеотидный полиморфный маркер, обеспечивающий быстрый и ранний скрининг гомеолокуса β-амилазы-R1: гена, связанного с эффективностью меди на 5RL, Theor. Прил. Genet. , 2006, т. 113. С. 301–307.
CAS PubMed Статья Google Scholar
Макинтош, Р.А., Ямазаки, Ю., Дубковски, Дж., И др., Каталог генных символов пшеницы, 2013. http: / пшеница / komugi / genes
Google Scholar
Plaschke, J., Börner, A., Xie, D.X., et al., RFLP-картирование генов, влияющих на высоту и рост растений ржи, Theor. Прил. Genet. , 1993, т. 85. С. 1049–1054.
CAS PubMed Статья Google Scholar
Снейп, Дж. У., Сарма, Р., Куорри, С. А. и др., Картирование генов времени цветения и морозостойкости злаков с использованием точных генетических запасов, Euphytica , 2001, т. 120. С. 309–315.
CAS Статья Google Scholar
Рабинович С.В. Значение пшенично-ржаных транслокаций для селекции современного сорта Triticum aestivum L., Euphytica , 1998, т. 100. С. 323–340.
Артикул Google Scholar
Трубачева Н.В., Россеева Л.П., Белан И.А. и др. Характеристика сортов мягкой пшеницы Западной Сибири, несущих транслокацию пшеница-рожь 1RS.1BL, Генетика. J. Genet. , 2011, т. 47, нет. 1. С. 13–18.
CAS Статья Google Scholar
Белан И.А., Россеева Л.П., Россеев В.М. и др. Исследование адаптивных и агрономических признаков у линий мягкой пшеницы Омская 37, несущих транслокации 1RS.1BL и 7DL-7Ai, Вавилов Ж. Генет. Sel. , 2012, т. 16, нет. 1. С. 178–186.
Google Scholar
Сингх Н.К., Шеперд К.В., Макинтош Р.А. Картирование сцепления генов устойчивости к листовой, паровой и полосатой ржавчине и ω-секалинам на коротком плече хромосомы 1R ржи, Theor. Прил. Genet. , 1990, т. 80. С. 609–616.
CAS PubMed Статья Google Scholar
Моннево П., Рейнольдс М., Захариева М. и Муджиб-Кази А., Влияние транслокации хромосомы T1BL.1RS на урожай зерна мягкой пшеницы и физиологические свойства в теплой среде, Cereal Res. Commun. , 2003, т. 31. С. 371–378.
Google Scholar
Ким У., Джонсон Дж. У., Баензигер П.С. и др., Агрономический эффект транслокации пшеницы и ржи, несущей хроматин ржи (1R) из разных источников, Crop Sci., 2004, т. 44. С. 1254–1258.
Артикул Google Scholar
Crossa, J., Burgueño, J., Dreisigacker, S., et al., Ассоциативный анализ исторической зародышевой плазмы мягкой пшеницы с использованием аддитивной генетической ковариации родственников и структуры населения, Genetics , 2007, vol. 177. С. 1889–1913.
CAS PubMed Central PubMed Статья Google Scholar
Hoffmann, B., Изменение засухоустойчивости озимой пшеницы, вызванное транслокацией хромосомного сегмента 1R ржи, Cereal Res. Commun. , 2008, т. 36. С. 269–278.
Артикул Google Scholar
Фенн Д., Луков О.М., Бушук В. и Депау Р.М. Качество помола и выпечки транслокационной пшеницы 1BL.1RS: 1. Влияние генотипа и окружающей среды, Cereal Chem. , 1994, т. 71. С. 189–195.
Google Scholar
Мартин П., Гомес М. и Каррильо Дж. М., Взаимодействие между аллельными вариациями в локусе Glu-D1 и транслокацией 1BL.1RS на качество муки в мягкой пшенице, Crop Sci. , 2001, т. 41. С. 1080–1084.
Артикул Google Scholar
Козуб Н.А., Созинов И.А., Созинов А.А. Сопряжение транслокации 1BL / 1RS с качественными и количественными признаками у мягкой пшеницы T.aestivum , Цитол. Genet. , 2001, т. 35, нет. 5. С. 74–80.
CAS PubMed Google Scholar
Лелли Т., Эдер К. и Граусгрубер Х. Влияние транслокации хромосом пшеницы и ржи 1BL.1RS на генотип посредством взаимодействия с окружающей средой, Cereal Sci. , 2004, т. 39. С. 313–320.
CAS Статья Google Scholar
Саал, Б. и Врик, Г., Разработка простых маркеров повторов последовательности у ржи ( Secale cereale L.), Genome , 1999, т. 42. С. 964–972.
CAS PubMed Статья Google Scholar
Мольнар-Ланг, М., Чех, А., Сакач, Э. и Мольнар, И., Разработка генотипа пшеницы, сочетающего аллели рецессивной скрещиваемости kr2kr1kr2kr2 и транслокацию 1BL.1RS, для быстрое обогащение 1RS новой аллельной вариацией, Theor.Прил. Genet. , 2010, т. 120. С. 1535–1545.
PubMed Статья Google Scholar
Ефремова Т.Т., Майстренко О.И., Арбузова В.С. и др. Влияние замещения чужеродной хромосомы 5R (5A) на время появления колосов и зимостойкость у замещающих линий пшеницы-ржи, Euphytica , 2006, т. 151. С. 145–153.
CAS Статья Google Scholar
Сибикеев С.Н. Чужеродные гены в селекции яровой пшеницы на устойчивость к листовой ржавчине, Автореф. Дис. Докт. , Саратов, 2002.
Google Scholar
Мукаи Ю. и Гилл Б.С., Обнаружение хроматина ячменя, добавленного к пшенице путем геномной гибридизации in situ, Геном , 1991, т. 34. С. 448–452.
Артикул Google Scholar
Эдвардс, К., Джонстон, К., и Томпсон, К., Простой и быстрый метод подготовки геномной ДНК растений для ПЦР-анализа, Nucleic Acids Res. , 1991, т. 19, стр. 1349.
CAS PubMed Central PubMed Статья Google Scholar
Mago, R., Spielmeyer, W., Lawrence, GJ, et al., Идентификация и картирование молекулярных маркеров, связанных с генами устойчивости к ржавчине, расположенными на хромосоме 1RS ржи, с использованием линий транслокации пшеница-рожь, Theor .Прил. Genet. , 2002, т. 104. С. 1317–1324.
CAS PubMed Статья Google Scholar
Рокицкий П.Ф., Введение в статистическую генетику , Минск: Вышешая школа, 1974.
Google Scholar
Сеть, E.B. и Джексон, Х.С., Физиологическая специализация листовой ржавчины пшеницы Puccinia triticina Erikss., Фитопатология , 1926, т. 16. С. 89–120.
Google Scholar
Петерсон Р.Ф., Кэмпбелл А.Б., Ханна А.Е. Диаграммная шкала для оценки интенсивности ржавчины на листьях и стеблях злаков, Can. J. Res. , 1948, т. 26. С. 496–500.
Артикул Google Scholar
Щапова А.И., Силкова О.Г., Кравцова Л.А., Роль генов эквационального деления унивалентов в межгеномном замещении хромосом, Генетика. J. Genet. , 1998, т. 34, нет. 4. С. 486–491.
Google Scholar
Friebe, B., Zhang, P., Linc, G., and Gill, BS, Робертсоновские транслокации в пшенице возникают в результате центрического неправильного деления унивалентов в анафазе I и воссоединения сломанных центромер во время интеркинеза мейоза II, Cytogenet. Genome Res., 2005, т. 109. С. 293–297.
CAS PubMed Статья Google Scholar
Дэвис П.А., Паллотта М.А. и Дрисколл К.Дж., Центрическое слияние негомологичных хромосом ржи в пшенице, Can. J. Genet. Цитол. , 1985, т. 27. С. 627–632.
Google Scholar
Лукашевский А.Дж., Поведение центромер у унивалентных и центрических неправильных делений у пшеницы, Cytogenet.Genome Res. , 2010, т. 129. С. 97–109.
CAS PubMed Статья Google Scholar
Силкова О.Г., Перемыслова Е.Е., Щапова А.И., Шумный В.К. Генетическая регуляция деления центромер в одновалентных хромосомах ржи и пшеницы в димоносомике во время мейотической анафазы I // Генетика. J. Genet. , 2008, т. 44, нет. 1. С. 85–93.
CAS Статья Google Scholar
Ефремова Т.Т., Лайкова Л.И., Арбузова В.С., Попова О.М. Генетическое разнообразие анеуплоидных и замещенных линий и их использование в исследованиях мягкой пшеницы // Инф. Вестн. Вавиловского О-ва Генет. Sel. , 2008, т. 12, вып. 4. С. 662–671.
Google Scholar
Щербань А.Б., Емцева М.В., Ефремова Т.Т. Молекулярно-генетическая характеристика генов яровизации Vrn-A1, Vrn-B1 и Vrn-D1 в зародышевой плазме яровой пшеницы из России и сопредельных регионов. Cereal Res.Commun. , 2012, т. 40. С. 425–435.
Артикул Google Scholar
Galiba, G., Quarrie, SA, Sutka, J., et al., RFLP-картирование генов яровизации ( Vrn1 ) и морозостойкости ( Fr1 ) на хромосоме 5A пшеницы, Теор. Прил. Genet. , 1995, т. 90. С. 1174–1179.
CAS PubMed Статья Google Scholar
Сутка Дж., Гены морозостойкости пшеницы, Euphytica , 2001, т. 119. С. 167–172.
CAS Статья Google Scholar
Тот Б., Галиба Г., Фехер Э. и др., Картирование генов, влияющих на время цветения и морозостойкость на хромосоме 5B пшеницы, Theor. Прил. Genet. , 2003, т. 107. С. 509–514.
PubMed Статья Google Scholar
Шлегель Р. и Корзун В. О происхождении хромосомных транслокаций 1RS.1BL пшеница-рожь из Германии, Порода растений. , 1997, т. 116. С. 537–540.
Артикул Google Scholar
Zeller, E.J. и Хсам, С.Л., Расширение генетической изменчивости культурной пшеницы за счет использования хроматина ржи, в Proc. 6-й Int. Пшеница Генет. Symp. , Сакамото, С., Эд., Киото, 1983, стр. 161–173.
Google Scholar
Крупнов В.А., Воронина С.А., Крупнова О.В. Влияние транслокаций 7DL.7AG и 1BL.1RS на урожай зерна и качество мягкой пшеницы в Поволжье // Инф. Вестн. Вавиловского О-ва Генет. Sel. , 2009, т. 13, вып. 4. С. 751–758.
Google Scholar
Бернетт, К.Дж., Лоренц, К.Дж., Карвер, Б.Ф., Влияние транслокации 1B / 1R в пшенице на состав и свойства зерна и муки, Euphytica , 1995, т.86. С. 159–166.
Google Scholar
Карвер Б.Ф. и Рейберн А.Л., Сравнение родственных запасов пшеницы, обладающих хромосомами 1B или T1BL.1RS: качество зерна и муки, Crop Sci. , 1995, т. 35. С. 1316–1321.
Артикул Google Scholar
Gobaa, S., Brabant, C., Kleijer, G., и Stamp, P., Эффект транслокации 1BL.1RS и вариации Glu-B3 на пятнадцати тестах качества в двойном гаплоидная популяция пшеницы ( Triticum aestivum L.), Cereal Sci. , 2008, т. 48. С. 598–603.
CAS Статья Google Scholar
Нишио, З., Таката, К., Ито, М. и др., Наследование показателей качества хлеба в малых масштабах в мягкой пшенице: влияние высокомолекулярных субъединиц глютенина и 1BL. 1RS транслокация, Crop Sci. , 2007, т. 47. С. 1451–1458.
CAS Статья Google Scholar
Ефремова Т.Т., Арбузова В.С. Роль хромосом 5-й группы в регуляции твердости зерна и содержания белка в замещающих линиях сорта мягкой пшеницы Саратовская 29, Генетика. J. Genet. , 2011, т. 47, нет. 5. С. 546–554.
CAS Статья Google Scholar
Law, CN, Young, CF, Brown, JWS, et al., Исследование контроля белка зерна в пшенице с использованием линий замещения цельных хромосом, в Seed Protein Improvement by Nuclear Techniques , Vienna: International Atomic Энергетическое агентство, 1978, стр.483–502.
Google Scholar
Состав последовательности и содержание генов короткого плеча ржи (Secale cereale) хромосомы 1
Абстрактные
Фон
Целью исследования является выяснение состава последовательности короткого плеча хромосомы 1 ржи ( Secale cereale ) с особым акцентом на его генное содержание, поскольку эта часть генома ржи является неотъемлемой частью нескольких сотен хлебных изделий. сорта пшеницы по всему миру.
Методология / основные выводы
Многократная амплификация смещения ДНК 1RS, полученная из отсортированных по потоку хромосом 1RS с использованием дителосомной линии добавления пшеницы и ржи 1RS, и последующее секвенирование этой ДНК с помощью Roche 454FLX дало информацию о последовательности 195 313 589 п.н. Это количество информации о последовательности привело к 0,43-кратному охвату последовательности хромосомного плеча 1RS, что позволило идентифицировать гены с расчетной вероятностью 95%. Подробный анализ показал, что более 5% последовательности 1RS состояло из генного пространства, идентифицируя по крайней мере 3 121 генный локус, представляющий 1882 различных генных функции.Повторяющиеся элементы составляли около 72% последовательности 1RS, причем Gypsy / Sabrina (13,3%) была наиболее распространенной. На предмет возможного развития маркеров было идентифицировано более четырех тысяч сайтов повторов простой последовательности (SSR), в основном расположенных в считываемых последовательностях генов. Существование вставок хлоропластов в 1RS было подтверждено путем идентификации считываний химерных последовательностей хлоропластов и генома. Анализ синтения 1RS к полным геномам Oryza sativa и Brachypodium distachyon показал, что около половины генов 1RS соответствуют дистальному концу короткого плеча хромосомы 5 риса и проксимальной области длинного плеча Brachypodium distachyon хромосома 2.Сравнение содержания генов в плече хромосомы ячменя 1RS и 1HS выявило высокую степень консервативности генов, связанных с хромосомой 5 риса.
Выводы
Настоящее исследование выявило содержание генов и потенциальные функции генов на этом плече хромосомы и продемонстрировало многочисленные элементы последовательности, такие как SSR и связанные с генами последовательности, которые могут быть использованы для будущих исследований, а также в селекции пшеницы и ржи.
Образец цитирования: Fluch S, Kopecky D, Burg K, Šimková H, Taudien S, Petzold A, et al.(2012) Состав последовательности и содержание гена короткого плеча ржи ( Secale cereale ) Хромосома 1. PLoS ONE 7 (2): e30784. https://doi.org/10.1371/journal.pone.0030784
Редактор: Николас Саламин, Лозаннский университет, Швейцария
Поступила: 14 июня 2011 г .; Одобрена: 26 декабря 2011 г .; Опубликовано: 6 февраля 2012 г.
Авторские права: © 2012 Fluch et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Это исследование было поддержано Австрийским научным фондом (P18414-B2 и P19944-B17) и Министерством образования, молодежи и спорта Чешской Республики и Европейским фондом регионального развития (Оперативная программа исследований и разработок для Нововведения № ED0007 / 01/01). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
С начала прошлого века было предпринято несколько попыток интегрировать полезные генетические вариации родственных видов в культивируемую гексаплоидную пшеницу посредством межвидовой гибридизации. В 1930-е гг. В Германии произошло скрещивание сорта мягкой пшеницы ( Triticum aestivum L.) и сорта cv. «Петкус» ржи ( Secale cereale L.) сопровождался спонтанной гомеологической заменой, при которой хромосома 1B пшеницы заменялась хромосомой 1R ржи.Хромосома ржи полностью компенсировала недостающую хромосому 1B. Однако его присутствие оставалось незамеченным до начала 1970-х годов [1]. Позже было обнаружено, что хромосома 1R может в значительной степени компенсировать также отсутствие хромосом 1A и 1D, принадлежащих к одной и той же гомеологической группе.
Последующее скрещивание гексаплоидных линий пшеницы, несущих замену 1B / 1R, с линиями без хромосомы замещения привело к появлению транслокационной хромосомы 1BL.1RS, в которой короткое плечо 1R (1RS) было перемещено в длинное плечо пшеницы. хромосома 1B (1BL), заменяющая короткое плечо 1BS пшеницы.Позже были разработаны транслокации с участием хромосомных плеч 1AL и 1DL [2], [3]. Было обнаружено, что все эти транслокации придают устойчивость к нескольким болезням, вызываемым патогенами пшеницы, включая мучнистую росу, листовую ржавчину, стеблевую ржавчину, желтую ржавчину и насекомых, а также русскую пшеничную тлю, зеленый жук и пшеничный клещ. вектор вируса мозаики полос пшеницы [2], [4] — [9]. Важно отметить, что на определенном фоне пшеницы было обнаружено, что плечо хромосомы 1RS улучшает адаптацию к условиям низкой влажности и увеличивает урожай пшеницы [10], [11].Недавно было высказано предположение, что увеличение урожайности может быть связано с увеличением биомассы корней [12]. Соответствующий регион QTL был локализован в дистальной части 1RS [13], [14].
Благодаря этим ценным характеристикам, линии пшеницы, несущие 1RS, были интегрированы в программу селекции пшеницы СИММИТ (Centro Internacional de Mejoramiento de Maíz y Trigo; Международный центр улучшения кукурузы и пшеницы). Благодаря этой программе хромосома 1RS была распространена по всему миру. Позже были обнаружены сотни сортов пшеницы с 1BL.Транслокация 1RS [15], [16]. В США были выведены сорта пшеницы с транслокацией 1AL.1RS, несущие 1RS от сорта ржи Insave. Однако распространение этой транслокации оставалось ограниченным в США [7]. Сорта пшеницы с хромосомой 1DL.1RS так и не получили практического значения.
Рожь — близкий родственник пшеницы. Его 1C-значение было оценено в 8,095 пг ДНК [17] или 7917 млн пар нуклеотидов [18]. На основании измерения длины хромосом Schlegel et al. [19], молекулярный размер короткого плеча 1R оценивается в 442 Мбп.Подобно другим видам трав, геном ржи содержит большое количество некодирующей повторяющейся ДНК, которая, как сообщается, составляет 84–92% генома [20], [21]. Короткое плечо 1R несет сателлит, разделенный вторичной перетяжкой, которая также известна как область, организующая ядрышко (NOR), и содержит гены, кодирующие 45S рРНК. Число генов 45S рДНК оценивается примерно в 2000, что составляет около 3% ДНК 1RS [22]. Спутник также несет локус 5S-рДНК с примерно 5000 копиями гена 5S рДНК, составляющих 0.4% ДНК 1RS [22]. Генетическое и физическое картирование 1RS показало, что большинство ранее идентифицированных генов кластеризуется внутри сателлита 1RS [23] — [31]. В этом регионе были локализованы гены секалина [32], а также ряд генов, обеспечивающих устойчивость к листовой и полосатой ржавчине [8] российской пшеничной тли [9], зеленому клопу и пшеничному клещу [7]. Несколько молекулярных маркеров, разработанных для 1RS, также расположены в дистальной области [27], [31], которая отмечена близкой синтенией к короткому плечу гомеологической группы 1 пшеницы [33].
Колинеарность геномов растений была установлена путем разработки генетических маркеров и картирования сцепления. Колинеарность геномов детально охарактеризована для видов трав [34], [35]. Подробные карты колинеарности трав завершились сравнением последовательностей ДНК [36]. Наличие почти полных геномных последовательностей злаков с малым геномом, таких как рис, сорго и Brachypodium distachyon , облегчает анализ колинеарности крупногеномных злаков с использованием этих малых геномов в качестве матриц.Недавно Hackauf et al. [37] оценили колинеарность ржи и риса, используя 334 генетически картированных маркера ржи на основе EST. Они идентифицировали соответствующие области генома риса по in silico корреляции генов ржи и риса. В соответствии с предыдущими наблюдениями [38] и на основании последовательностей генов Hackauf et al. [37] установили статистически значимую колинеарность хромосомы 5 риса и хромосомы 1 ржи.
Недавний прогресс в разделении больших геномов злаков на более мелкие части путем сортировки отдельных хромосом и хромосомных плеч в потоке, а также возможность получения достаточных количеств ДНК всего из 10 000 хромосом путем множественной амплификации смещения (MDA) значительно облегчили анализ колинеарности в злаки с большим геномом [39] — [43].Сортировка хромосом ржи методом проточной цитометрии была разработана Kubaláková et al. [44] и Šimková et al. [45]; авторы использовали проточную цитометрию для сортировки хромосомного плеча 1RS для создания 1RS-специфической библиотеки ВАС. Наличие 1RS-специфической библиотеки ВАС позволило провести первый анализ состава последовательностей генома ржи и, в частности, 1RS, путем секвенирования ВАС-концов [21]. Одновременно Кофлер и соавт. [46] разработали набор маркеров SSR на основе ДНК 1RS с сортировкой по потоку. Несмотря на эти усилия, данные о последовательностях генома ржи (9240 последовательностей, составляющих 5557 уникальных генов) и сведения о его колинеарности с другими злаками все еще очень ограничены.Таким образом, разработка маркеров, связанных с интересующими признаками, и позиционное клонирование генов также ограничены. Снижение сложности полных геномов за счет выделения отдельных хромосом и их секвенирования с помощью технологии секвенирования следующего поколения является привлекательным средством получения больших объемов данных о последовательностях из определенных областей генома для идентификации последовательностей генов и других локусов, которые могут служить маркерами, и для установления колинеарность с другими видами, как это было продемонстрировано для ячменя [41], [42] и пшеницы [43].
Настоящее исследование посвящено анализу состава последовательности хромосомного плеча 1RS. Пиросеквенирование ДНК Shotgun 454, полученной из отсортированного по потоку 1RS, привело к 0,43-кратному охвату последовательности плеча хромосомы. Этот новый подход также позволил детально описать пространство генов, а также повторяющуюся часть этого важного плеча хромосомы, включая области SSR, которые могут быть использованы в качестве первых генетических маркеров. Был проведен сравнительный анализ содержания генов 1RS с генами риса, Brachypodium distachyon и короткого плеча хромосомы 1H ячменя, что послужило основой для анализа изменений в структуре генома, сопровождающих эволюцию культурных трав.
Результаты
Набор данных и его качество
Телоцентрическая хромосома 1RS нестабильна и наследуется от аддитивных линий пшеницы и ржи. Следовательно, требовался цитологический контроль семян, используемых для размножения, чтобы гарантировать присутствие достаточного количества 1RS в образцах для проточной цитометрии. Это привело к хорошему разрешению плеча 1RS на гистограммах интенсивности хромосомной флуоресценции (проточные кариотипы), высоким выходам при сортировке хромосом и низкому загрязнению отсортированных фракций другими хромосомами.Поточный кариотип состоял из четырех пиков, представляющих различные хромосомы пшеницы, и хорошо разрешенного пика хромосомы 1RS (рис. 1). Телосомы можно было легко отсортировать, и отсортированные 1RS были идентифицированы с помощью FISH с зондами, представляющими субтеломерный гетерохроматин (pSc200) и теломерные повторы (Рисунок 1). Чистота проб в отсортированной фракции варьировала от 89 до 93%. Для дальнейшей обработки использовали самый чистый образец. Этот образец содержал 93% 1RS и 7% различных хромосом пшеницы и их фрагментов.После очистки ДНК было получено 14 нг хромосомной ДНК из 30 000 отсортированных по потоку телосом 1RS, которые впоследствии были использованы для множественной амплификации смещения (MDA), по существу, как описано Simková et al. [40]. Выход амплифицированной ДНК 1RS составил 5,1 мкг.
Рисунок 1. Гистограмма относительной интенсивности флуоресценции («проточный кариотип»), полученная после проточного цитометрического анализа DAPI-окрашенной хромосомной суспензии добавочной линии телосомы пшеницы-ржи 1RS.
Кариотип содержит четыре пика, представляющих хромосомы пшеницы (обозначенные I, II, III и 3B), и пик телоцентрической хромосомы 1RS.Пик хромосомы 1RS четко различим, а хромосомы легко сортировать. Вставка: изображения распределенной по потоку хромосомы 1RS после FISH с зондами для теломерных последовательностей (красный) и pSc200 (зеленый) субтеломерных последовательностей ДНК. Хромосомы контрастировали с DAPI (синий).
https://doi.org/10.1371/journal.pone.0030784.g001
Последовательность читается.
Roche 454 FLX секвенирование ДНК 1RS дало 942 768 считываний последовательности. В этом наборе данных 42167 последовательностей читают (4.5%) были идентифицированы как «идентичные последовательности», то есть были обнаружены как минимум дважды в наборе данных и рассматривались как предполагаемые артефакты, скорее всего, вызванные эмульсионной ПЦР [47]. Оставив одну последовательность считанной в наборе данных, дополнительные копии были удалены вместе с прочтениями короче 50 п.н. Остальные 895199 считываний последовательности из набора данных составили информацию о последовательности 195 313 589 п.н. со средней длиной последовательности 219 п.о. и были использованы для дальнейшего анализа (таблица S1). Предполагаемый размер хромосомы 1RS, который составляет около 5.6% от общего генома ржи [19], составляет около 442 Мбп. Следовательно, доступная информация о последовательности составляет примерно 43,2% последовательности плеча хромосомы 1RS, не считая возможных перекрытий.
Состав последовательности 1RS
Более 5% всех считываний последовательностей связаны с пространством генов 1RS.
Для идентификации предполагаемых считываний связанных с геном последовательностей использовали восемь баз данных последовательностей (таблица S2). Отдельные базы данных были использованы для идентификации 5S и 45S рДНК, а также генов секалина.Используя пошаговую процедуру, описанную в разделе «Материалы и методы», мы идентифицировали 5,45% всех прочтений, представляющих генное пространство (48 841 чтение). Из этих 2,05% (18 325 считываний) представлены два рибосомных локуса (1,78% и 0,26% для локусов 45S и 5S рДНК соответственно) и 0,05% локусы секалина (400 считываний) (Таблица S1).
Рибосомные локусы 1RS.
Локусы 45S и 5S рДНК находятся в непосредственной близости от дистальной части плеча хромосомы, как показано гибридизацией in situ , и, как сообщается, присутствуют примерно в 2000 и 5000 копиях [22], содержащих примерно 18 Мбит / с. (3,9%) и 2.3 Мбит / с (0,5%) генома 1RS соответственно. Это предполагает 7,8-кратную разницу в пространственных требованиях двух локусов, что также отражено в наших результатах: мы идентифицировали 15 962 чтения последовательности (1,78%) для 45S рДНК и 2361 чтение последовательности (0,26%) для локуса 5S рДНК. , что дает разницу в 6,75 раза (Таблица S1).
Локус Secalin Sec-1.
Для ржи зарегистрировано три локуса секалина. Локусы Sec-1 и Sec-3 расположены на коротком и длинном плечах хромосомы 1R соответственно.Локус Sec-1 на 1RS содержит гены γ-секалина 40 кДа и ω-секалина (~ 45 кДа), тогда как Sec-3 на 1RL содержит локус HMW-секалина (~ 100 кДа). Локус Sec-2 , обнаруженный на коротком плече хромосомы 2R, кодирует γ-секалин массой 75 кДа. Было обнаружено, что все 400 считываний последовательности (0,05%) связаны с генами секалина. Большинство — 316 идентифицированных ридов — представляли гены ω-секалина, которые, как сообщалось, присутствовали примерно в 15 копиях в 1RS [48], в то время как 45 из них были связаны с γ-секалином.Кроме того, 39 считываний последовательностей нельзя было отнести к генам γ-секалина или ω-секалина из-за высокого уровня гомологии последовательностей двух секалинов в определенных областях (Таблица S1).
Аннотация считываний последовательностей выявляет по крайней мере 3,121 генный локус и по крайней мере 1882 различных генных функции на 1RS.
За исключением генов рибосом и секалина 3,36% всех считываний последовательностей (30 118 считываний) идентифицировали генное пространство 1RS. Основываясь на гомологии с геномом риса, эти считывания последовательности соответствуют 3,121 различным моделям генов риса (таблица 1).Дополнительные 3638 предполагаемых генных локусов, которые не имели гомологии с набором генных моделей RGA (Rice Genome Annotation), были идентифицированы на основе записей в NCBI UniGene ( Hordeum , Oryza и Triticum ), RAP -DB, Rye UniGene, Wheat ABDS и NT Cereal) соответственно, которые не имели гомологии с набором генных моделей RGA (Rice Genome Annotation). К расчетному количеству в 3638 человек следует относиться с осторожностью. Даже при работе с унифицированными наборами, содержащими только одну запись / ген в данном наборе, последовательности, представляющие один и тот же ген, могут существовать между наборами уникальных данных.Следовательно, эти результаты предполагают присутствие по крайней мере 3,121, но до 6,759 локусов гена на 1RS, включая также два локуса секалина, без учета рибосомных генов (таблица 1 и детали в таблице S3).
Определение количества функций генов в 1RS было основано на доступном наборе данных по рису в базе данных RGA. Этот набор был дополнен функциональными аннотациями, найденными в базах данных Triticum , Hordeum UniGene и NT Cereal. Используя эти два подхода, мы идентифицировали 1882 функции генов, включая γ и ω секалины.Из них 1608 были основаны на наборе данных RGA для риса, в то время как 272 функции были восстановлены с помощью баз данных Triticum UniGene, Hordeum UniGene и NT Cereal (Таблица 1). Кроме того, можно выдвинуть гипотезу максимум о 3852 дополнительных функциях генов на основании существующих, но функционально не аннотированных последовательностей EST (экспрессируемых генов) или in silico идентифицированных предполагаемых участков генов (гипотетических генов). Функциональная аннотация гена выявила 43 локусов устойчивости к заболеванию , относимых к 12 функциональным категориям, а также 29 локусов 10 функциональных категорий, относящихся к устойчивости к мучнистой росе (таблица S3).
Гены, присутствующие в 1RS, поражаются с вероятностью 95%.
Уравнения, данные Лендером и Уотерманом [49], и концепции биномиального распределения в элементарной теории вероятностей были использованы для обеспечения приближения к вероятности попадания в ген в рамках настоящего анализа. При размере 442 × 10 6 п.н. генома 1RS ржи, 895199 считываний последовательности со средней длиной 219 п.н. (L) и необходимым перекрытием (T) 50 п.н., вероятность пропуска смежной области 1514 bp (сообщается средняя предполагаемая кодирующая область гена; http: // ris.plantbiology.msu.edu) составляет примерно 4,5%, тогда как использование элементарной теории вероятности дает 5,0% соответственно. Другими словами, вероятность попадания в любую область хромосомы размером 1,51 т.п.н. при чтении хотя бы одной последовательности составляет 95%, и с этой вероятностью почти все гены представлены в нашем наборе данных, предполагая равномерное распределение считываний последовательности по геному 1RS. Для получения оценки распределения считываний последовательностей вдоль 1RS два гена, рибосомный локус 45S и ген ω-секалин, были проанализированы с помощью программного комплекса MOSAIK, который обеспечивает график покрытия с точностью до базы, анализируя представление каждой базы ссылочная последовательность в последовательности читается.Локально собранная единица рибосомного гена 45S, специфичная для ржи (JF489233), и запись последовательности AF000227, представляющая повторяющуюся единицу гена ω-секалина, были выбраны в качестве контрольных последовательностей. Эти гены повторяются несколько раз в геноме 1RS, поэтому для анализа было доступно достаточное количество считываний последовательностей (Таблица S1.). Обе эталонные последовательности охватывают около 9 т.п.н., обеспечивая достаточную матрицу для анализа покрытия. В каждом шаблоне были самокомплементарные повторяющиеся области, как выявлено анализом точечной диаграммы, что дает более высокую множественность в этих областях (дополнительный рисунок S1.). Локус ω-секалина дополнительно содержал повторяющуюся область, соответствующую входу TREP 255 (ретротранспозон, LTR, неизвестно), что давало повышенный охват этой области. Из общей длины гена ω-секалина 98,4% были представлены считыванием последовательностей, за исключением области длиной 152 п.н. Среднее покрытие было примерно 9-кратным (стандартное отклонение +/- 4) на пару оснований без учета повторяющихся участков, что по величине хорошо совпадает с опубликованным числом копий 15 для этого гена [48]. С другой стороны, полная длина рибосомного гена 45S была представлена считыванием последовательности, дающим примерно 360 × (+/- 71) среднее покрытие, без учета межгенной спейсерной области.Предполагаемое количество копий этого локуса у ржи было около 2000 [22], но Gustafson et al. [50] сообщили о сокращении области NOR для 1RS, присутствующей в пшенице.
Примерно три четверти генома 1RS имеют повторяющуюся природу.
Идентификация повторяющихся элементов при чтении последовательности 1RS была выполнена, как описано в разделе «Материалы и методы», в несколько последовательных шагов в конвейере анализа. Подход включал идентификацию известных типов повторов, таких как микросателлитные области и повторы транспозонного типа, но также были идентифицированы элементы повторов de novo.
Простые повторения последовательности 1RS.
Повторы нетранспозонного типа, такие как SSR, были идентифицированы в 18,5% всех считываний последовательностей (165 629 считываний), что составило 204 286 последовательностей SSR, которые присутствовали либо как одиночные, либо как сложные SSR в различных комбинациях. Однако только 2048 из этих считываний (0,23%) содержали SSR, охватывающие более 50% общей длины считанной последовательности. Они были идентифицированы как чтения SSR и далее не анализировались, в то время как остальные были помечены как чтения, содержащие SSR.(AG) n был наиболее распространенным динуклеотидным повтором (4,8%), за ним следовало (AT) n (3,5%). (AAG) n был наиболее распространенным (0,7%) среди тринуклеотидных повторов и (AAAT) n среди тетрануклеотидов (0,2%) (таблица S4_All SSR). Частота, особенно в случае три- и тетра-нуклеотидных повторов, может быть занижена, поскольку неопределенность при гомополимерной идентификации секвенирования 454 может нарушить обнаружение истинных SSR-областей путем прерывания регулярной повторяющейся последовательности.
SSR, содержащие элементы в качестве генетических маркеров.
Две категории считываний, содержащих SSR, были проанализированы для идентификации генетических маркеров. Считывания SSR (2048 считываний) и считывания последовательностей идентифицированы как связанные с генами, но также содержащие SSR. Около четверти считывания, связанного с генами, соответствовали этой последней категории (7 162 прочтения). Для установления ампликонов ПЦР для SSR было идентифицировано положение SSR в считанной последовательности. Принимая во внимание среднюю длину праймера для ПЦР 18–22 п.н., мы вычислили правильные положения SSR для минимальной длины фланкирования 30 п.о. и 40 п.н.SSR, содержащие чтения, удовлетворяющие этим требованиям, были помечены как предполагаемые кандидаты в генетические маркеры (Таблица S4).
Что касается считываний SSR, было идентифицировано 321 или 455 (15,7% и 22,2%) считываний в зависимости от разрешенной длины фланкирующей последовательности 30 или 40 пар оснований (таблица S4_ SSR). Это контрастировало с считыванием последовательности, связанной с геном, где более половины считываний содержали SSR в пригодном для использования положении (SSR, относящиеся к таблице S4_Gene). Предварительный анализ 103 прочтений SSR выявил 26 полос, специфичных только для 1RS.
Шесть классов транспозонов доминируют в ландшафте повторов 1RS.
Обнаружение повторяющихся элементов известного типа было основано на базе данных повторений TREP с использованием его категоризации также для тех элементов, которые идентифицированы с использованием других баз данных. Таким образом, 68,5% всех операций чтения были помечены как совпадающие хотя бы с одной из записей (Таблица 2). Повторяющиеся элементы 1RS совпадают с 341 из 1717 записей, присутствующих в полной базе данных TREP-повторов, включая 122 класса I, 183 класса II и 36 неклассифицированных типов (таблица S5).Однако 4 записи из 35 записей о происхождении ржи в базе данных TREP не показали гомологии ни с одним из считываний последовательностей, специфичных для 1RS. Идентифицированные считывания включали часто используемые специфичные для ржи зонды, представляющие перемежающийся повторяющийся элемент pSC119.1 (0,6%) и pSC119.2 (0,05%), преимущественно зонд для маркирования теломер. Также «Revolver», недавно описанный [51] в геноме ржи транспозон, равномерно распределенный, представлял 0,3% прочтений последовательности, в то время как Bilby (ретротранспозон / LTR / Copia), семейство центромерных повторов, специфичных для генома ржи [52], было представлено на 0.2% от всех чтений (Таблица S5). Что касается транспозонных элементов, наиболее распространенными ретротранспозонами были суперсемейства Gypsy и Copia, составляющие около 42,7% и 7,3% считываний последовательности, соответственно, за которыми следовало суперсемейство транспозонов ДНК CACTA (6,3% всех считываний) (Таблица 2).
Половина считываний последовательностей, идентифицированных как повторяющиеся элементы, была получена из 29 семейств транспозонов, из которых 25 представляли ретротранспозоны класса I (Gypsy 21 и Copia 4), а 4 семейства — типы транспозонов ДНК класса II (все CACTA).Самым многочисленным семейством в 1RS было ретроэлементное семейство класса I Gypsy / Sabrina, которое составляло 13,3% считываний последовательности и примерно в 2,5 раза превосходило второе по численности семейство, а именно Gypsy / WHAM (4,9%). Следующими обильными ретроэлементами были Wilma, Sabine и Cereba (все суперсемейство Gypsy), составляющие 3,3, 2,8 и 2,5% считываний последовательности, соответственно. Суперсемейство CACTA Хорхе было наиболее частым элементом транспозона ДНК класса II; что составляет 2,7% считываний последовательности (Таблица S5).
Считывания последовательности, частично удовлетворяющие критериям фильтрации (хорошее выравнивание, но низкий охват или плохое выравнивание, но хорошее покрытие), но не помеченные в противном случае, также рассматривались как предполагаемые повторяющиеся элементы, представляющие 6.7% от всех прочтений (Таблица 2).
Новые повторяющиеся элементы.
RepeatScout — программный пакет de novo для поиска повторов [53], который использовался для идентификации предполагаемых повторяющихся элементов. Эта система идентифицировала 9842 предполагаемых повторяющихся элемента последовательности после устранения низкой сложности и тандемных повторов. Повторное совмещение полученных предполагаемых повторяющихся мотивов с считыванием последовательностей с использованием программного обеспечения RepeatMasker дало 685 повторяющихся последовательностей, достигших по меньшей мере 10 считываний последовательностей. Они были приняты как «повторы романа».Наконец, для исключения множественных представлений среди новых повторов был использован BASTClust, уменьшив количество идентифицированных новых повторов до 638, представленных 31 001 считыванием последовательности. Новые повторы имели среднюю длину 245 пар оснований (от 51 до 461 п.н.) и были представлены от 10 до 317 считываний последовательностей.
Считывание химерной последовательности указывает на предполагаемые вставки хлоропластов в 1RS.
Анализ ядерных геномов растений выявил вставки генов, происходящих из органелл, в ядерный геном [54], [55].Для оценки присутствия органелл-специфичных последовательностей, указывающих на предполагаемые вставки в 1RS, набор данных был сначала проверен с параметрами высокой строгости (90% совпадение и 90% идентичность) по отношению к доступным хлоропластным и митохондриальным последовательностям пшеницы, идентифицировав 0,2% всех читает (1803 просмотров). Внутри хитовых последовательностей 421 представляли последовательности хлоропластов (Cp) и 1355 митохондриальных (Mt) последовательностей, в то время как 27 не могли быть отнесены исключительно к какому-либо из геномов (Таблица S1). Во-вторых, был проведен скрининг с одинаково высоким значением идентичности (90%), но с уменьшенным перекрытием (40%), чтобы идентифицировать предполагаемые химерные фрагменты, представляющие соединения органеллар / ядер, несущие как органелларные, так и предполагаемые последовательности ДНК, специфичные для 1RS.Этот последний скрининг не выявил митохондрий, но обнаружил 24 считывания последовательности, представляющих 15 областей хлоропласта химерного типа. Шесть из 15 регионов представляли соединения хлоропласт / транспозон. Один представлял собой соединение, обозначенное как хромосомную ДНК Triticum aestivum, в то время как 8 из них были соединениями хлоропласта с участками последовательности, не имеющими гомологии. Контролируя достоверность этих областей соединения с помощью ПЦР, 9 из 15 повторно амплифицированы из смеси геномной ДНК ржи различных видов (3, 1 и 5 положительных реакций ПЦР в соединениях хлоропласт / транспозон, хлоропласт / хромосома и хлоропласт / но- гомологии соответственно).Наличие химерных фрагментов указывает на наличие вставок генома хлоропластов в 1RS, в то время как аналогичные митохондриальные фрагменты не могут быть проверены. Считывание специфичных для органелл последовательностей покрывает 54% хлоропластов и 49% митохондриальных геномов, что дает несколько более высокие значения, чем среднее значение, полученное для всего набора данных (43%). Однако нельзя полностью исключить присутствие загрязняющей органелларной ДНК, особенно в случае митохондрий.
Разные некодирующие области генома.
Для восстановления всех возможных совпадений считываний последовательностей с доступной информацией о последовательностях растений считывания последовательностей были протестированы с базами данных, представляющими различную информацию о последовательностях некодирующих геномных областей, таких как Brachypodium distachyon , и базами данных риса, представляющими 1 кб выше и ниже по течению. области генов или межгенные области. Всего было идентифицировано 79 271 считывание последовательности, что составляет почти 8,9% всех считываний функционально неидентифицированных областей.Большинство из них (8,47%) попали в 374 записи BAC NCBI (37 из Hordeum , 337 из Triticum ), в то время как остальные были охарактеризованы базами данных Brachypodium и риса, представляющими 1 т.п. гены и записи NCBI, не относящиеся к BAC (SCAR, микросателлит, RAPD, маркер STS) (Таблица S1)
Связь 1RS с геномами других трав
Synteny к
Oryza sativa и Brachypodium distachyon обнаруживают неравномерное распределение локусов.Для визуализации синтении (идентичности содержания гена) генома 1RS с геномами риса и Brachypodium distachyon, модельные геномы были разрезаны in silico на 10 5 бункеров п.н., что дало 3729 и 2713 бинов соответственно. В среднем эти бункеры содержали 10,9 и 9,4 генных моделей на бункер для Oryza sativa и Brachypodium distachyon , соответственно (Таблица 3). Впоследствии считывания последовательности ржи, ранее идентифицированные как предполагаемые гены в рисе, и геномов Brachypodium distachyon были отнесены к этим ячейкам на основе общей аннотации риса для локусов, относящихся к локусам LOC_Os риса (база данных аннотаций генома риса).Таким образом, 3076 генных моделей риса и 1363 гена Brachypodium distachyon были распознаны в двух модельных геномах как гомолог считывания последовательности 1RS ржи. Гены-гомологи 1RS были рассредоточены по геномам, включая 1863 (49,96%) и 931 (34,3%) интервал в геномах Oryza sativa и Brachypodium distachyon соответственно (рис. 2). Идентификация бункеров, содержащих высокую долю гомологичных локусов 1RS (Highly Homolog Bin, HHB), позволила нам идентифицировать области генома риса, преимущественно представленные в 1RS.Бункеры с высокой степенью гомологичности, возможно, представляют собой группу генов, которые были унаследованы как блоки в процессе эволюции. Мы идентифицировали 109 HHB в Oryza sativa и 100 HHB в Brachypodium distachyon , содержащих 436 и 306 совпадений генной модели, соответственно (Таблица 3). Как в Oryza sativa , так и в Brachypodium distachyon , почти каждая вторая модель гена попадала в «корзины с высокой степенью гомологии»: 43,56% и 44,41% генов соответственно.
Рисунок 2. Синтения считывания последовательности 1RS с моделями генов, не связанных с ТЕ, для Oryza sativa и Brachypodium distachyon .
Частота совпадений генов в сгенерированных in silico бункерах геномов Oryza sativa и Brachypodium distachyon была выражена как кратное стандартному отклонению (SD). A : Oryza sativa хромосомы 1–12. B : Brachypodium distachyon хромосом 1–5. CEN : Centromere. Цветовое кодирование: 0 Контейнер без гомологии 1RS. 1 Бункеры с незначительной гомологией 1RS 2 Бункеры со значительной гомологией 1RS на уровне 95% (1.98 SD) 3 Бункеры со значительной гомологией 1RS на уровне 99% (Highly Homolog Bin, 2,58 SD).
https://doi.org/10.1371/journal.pone.0030784.g002
Бункеры, показывающие гомологию считыванию последовательностей, были распределены по всем хромосомам обоих модельных геномов (рис. 2), в то время как HHB показали кластеризацию в обоих геномах. У риса около 42% HHB сосредоточено в дистальной области короткого плеча хромосомы 5, в то время как у Brachypodium distachyon более половины (54%) HHB сосредоточены в проксимальной области длинного плеча хромосомы 2 ( Таблица 4).В этих HHB существует 546 моделей гена риса и 502 Brachypodium distachyon , в то время как только 262 (48%) и 232 (46,2%) были затронуты считыванием последовательности, связанной с 1RS.
Анализ синтении от 1RS до 1HS идентифицирует консервативные блоки генов.
Редкая доступность картированных маркеров на основе последовательностей 1RS по сравнению с 1HS не позволила провести анализ прямой коллинеарности (порядка генов) двух хромосом. Однако содержание гена 1RS коррелировало с содержанием гена 1HS на основе риса в качестве эталонного генома.Недавно был опубликован анализ коллинеарности хромосомы 1H ячменя и риса и геномов Sorghum [41], в которых описывается 4 125 рисовых локусов, гомологов генам, идентифицированным на 1H. Более одной трети этих генов (1 409) были расположены на хромосомах 5 и 10 риса. В последней публикации это число было пересмотрено до 1845 [42]. Используя этот набор данных, мы идентифицировали 322 и 218 локусов гомологов на коротком плече хромосомы 1H, гомологов генам, идентифицированным на хромосомах 5 и 10 риса, соответственно.Кроме того, мы идентифицировали 465 локусов гомологов 1RS риса на хромосоме 5 и 156 на хромосоме 10 (Таблица S6.). Гомологичные наборы генов риса, соответствующие 1RS или 1HS, сравнивали, анализируя небольшие приращения генома риса с использованием описанных выше виртуальных бункеров из 10 5 п.о., что позволило идентифицировать наборы генов с высоким сходством. Индекс сходства бункера рассчитывали путем сравнения количества генов, демонстрирующих гомологию как с 1HS, так и с 1RS (общие гены), со всеми генами, демонстрирующими гомологию 1HS и / или 1RS в этом конкретном бункере (см. M&M).Что касается набора генов, связанных с хромосомой 5, было идентифицировано 242 общих гена (44,4%) из 545 гомологичных локусов. Они были распределены по 57 ячейкам (среднее сходство 0,77). Что касается хромосомы 10, только 24 (6,9%) общих гена, расположенных в 19 ячейках (среднее сходство 0,18), были идентифицированы из 350 гомологов (Таблица 5). Что касается распределения генов-гомологов по хромосомам риса, то общие гомологи, специфичные для хромосомы 5, кумулировались в ящиках на дистальной части короткого плеча. Бункеры, содержащие общие гены, относящиеся к хромосоме 10, сгруппированы в середине длинного плеча (рис.3). Заметная разница, как в доле общих генов, так и в уровнях сходства, предполагает, что блоки генов, родственные хромосоме 5, эволюционно более консервативны по сравнению с элементами, родственными хромосоме 10, которые группируются в перицентрической области 1HS. Кроме того, существует заметная разница между геномами 1HS и 1RS в отношении распределения этих генов, которые не являются общими в двух плечах хромосом. Гомологи риса, специфичные исключительно для 1RS, распределены по всей длине 5 и 10 хромосом риса.На хромосоме 5 были зарегистрированы только случайные представления исключительно 1HS-специфических гомологов риса. На 10-й хромосоме 1HS-специфические гомологи риса были ограничены областью общих генов (рис. 3).
Рис. 3. Сравнение содержания генов 1RS и 1HS на основе Chr.5 и Chr.10 модельного генома риса.
Созданные in silico 10 5 виртуальных бункеров по п.н. хромосом 5 и 10 риса использовали в качестве платформ для сравнения содержания генов гомологов 1RS и 1HS с рисом.Сходство 1RS и 1HS в отношении конкретного контейнера для риса оценивали путем оценки доли общих локусов по всем локусам гомолога в конкретном контейнере, как описано в разделе «Материалы и методы». Цветная полоса показывает уровень сходства от 0 (синий) до 1 (полное сходство; красный), что означает, что все хит-локусы проявляют гомологию как с 1RS, так и с 1HS. Общий : распределение бункеров, содержащих гены, гомологи как 1RS, так и 1HS. Гомолог 1RS : бункеры, содержащие гены, гомологи 1RS, Гомолог 1HS : распределение бункеров, содержащих гены, гомологи 1HS.В двух последних случаях красным цветом обозначены бины с генами, представляющими исключительно гомологи 1RS или 1HS.
https://doi.org/10.1371/journal.pone.0030784.g003
Обсуждение
Высокопроизводительное секвенирование 454 оказалось мощным средством получения более глубокого понимания состава последовательностей огромных геномов растений за счет предоставления огромного количества информации о последовательностях по разумной цене [56], [57]. Недавний прогресс в разделении геномов растений на мелкие части путем сортировки хромосом с использованием проточной цитометрии в сочетании с технологией высокопроизводительного секвенирования ДНК [39], [41] — [43] предоставил новые и мощные средства анализа сложных геномов растений размером с гигабазу.На сегодняшний день этот подход был использован для секвенирования хромосомы 1H ячменя [41] и хромосомы 7DS пшеницы [43]. Используя аналогичный подход, описанный Mayer et al. [41], в настоящем исследовании мы сосредоточились на коротком плече хромосомы 1R ржи, которая несет ряд известных сельскохозяйственных генов и была включена в большое количество сортов пшеницы как транслокация 1BL.1RS. Наши результаты обеспечивают первое крупномасштабное понимание структуры последовательностей и состава генома ржи и, в частности, 1RS.Более того, мы показали, что охват считывания последовательностей следующего поколения всего лишь 0,43 × может дать ценную информацию об интересующем геноме, позволяя идентифицировать гены, присутствующие в геноме, с предполагаемой вероятностью до 95%.
В этой работе мы использовали технологию Roche 454 FLX для секвенирования ДНК, полученной из потоковой сортировки хромосомы 1RS. Чтобы обеспечить достаточное количество ДНК для секвенирования, ДНК отсортированных хромосом была амплифицирована с помощью множественной амплификации смещения. Несмотря на то, что MDA имеет самую низкую систематическую ошибку амплификации среди методов амплификации всего генома [58], он имеет свои ограничения при количественном анализе неравномерной амплификацией определенных повторяющихся элементов [59].Следовательно, количественная интерпретация настоящих результатов, особенно в отношении повторяющихся элементов, должна выполняться с осторожностью. Однако сравнительный анализ основных классов повторов с 454 прочтениями последовательностей (любезно предоставленных доктором А. Хубеном), представляющих весь геном ржи (∼0,04 × охват) без MDA, дал лишь незначительные различия, которые могут быть объяснены либо существующими разница между полным геномом и 1RS или разница в охвате (данные не показаны).
В отсутствие эталонного генома самой большой проблемой при анализе 454 фрагментов является сопоставление считываний последовательностей с записями различных и в значительной степени гетерологичных баз данных с помощью BLAST.Даже с большими базами данных последовательностей, когда длина входной последовательности очень мала (то есть 100 п.о. и ниже), значение e имеет тенденцию быть очень высоким (e -2 и выше) даже при идеальном выравнивании. Причина этого в том, что более короткое выравнивание с большей вероятностью будет случайным, чем более длинное. В частности, для последовательностей 454 это может привести к отсутствию значительных совпадений при использовании значения e для оценки совпадений, поскольку даже высокое перекрытие (до 100%) или высокая идентичность (между 90 и 100%) не будут адекватно отражены в электронная стоимость.По этой причине были введены критерии, основанные на перекрытии (не менее 55%), а также на идентичности (не менее 80%) и длине выравнивания не менее 60 п.н. или 20 а.о. соответственно. Однако при использовании этих критериев хорошее выравнивание более длинных считываний последовательностей (самые длинные 454 фрагмента имели до 350 п.н.) было бы случайно пропущено из-за параметра строгой идентичности (минимум) 80%. Таким образом, подход e-value с использованием предела e -20 с пониженным идентификатором (70%) был введен в качестве вторичного набора параметров.Согласно нашему опыту, различные алгоритмы BLAST (BLASTn, BLASTp, BLASTx, tBLASTx) более чувствительны к различиям в реализации, чем фильтрация на основе идентичности / перекрытия, которая применялась в качестве основного набора параметров. Поэтому было справедливо предположение, что результаты BLAST будут в высшей степени сопоставимыми.
В ходе этой работы была получена информация о последовательности почти 200 миллионов п.о., что дает примерно 0,43-кратное покрытие плеча хромосомы 1RS. Несмотря на относительно низкий охват, вероятность поражения гена оценивалась в 95%.Достаточно равномерный охват генов 45S рДНК и ω-секалина подтверждает эту оценку и предполагает, что теоретически были идентифицированы почти все локусы гена, присутствующие в 1RS. Однако идентификация генов в наборе данных может быть затруднена из-за эволюционного расстояния запрашиваемых последовательностей и используемых баз данных гетерологичных последовательностей, что приводит к более низкому восстановлению генов. Чтобы решить эту проблему хотя бы частично, мы использовали несколько баз данных последовательностей близкородственных видов. Один из подходов к оценке предполагаемого количества генных локусов в 1RS состоит в суммировании количества неперекрывающихся генных локусов, обнаруженных в разных базах данных, с учетом генного пространства.С помощью этой процедуры мы оценили количество локусов гена в 1RS в диапазоне от 3,121 до 6,759, включая гены секалина. Однако, учитывая контаминацию отсортированной фракции 1RS различными хромосомами пшеницы, мы также можем прогнозировать завышение количества генов примерно на 10%. Кроме того, к аннотациям, возникающим из баз данных UniGene, следует относиться с осторожностью, поскольку эти базы данных содержат записи EST. Таким образом, более одной записи Unigene могут представлять один и тот же локус гена. Записи также могут быть связаны с мобильными элементами, а дубликаты генов могут существовать в наборах данных для различных видов.Все эти факторы могут дополнительно снизить предполагаемое максимальное количество генных локусов на 1RS.
При условии, что 1RS составляет около 5,6% генома ржи и содержит не менее 3,121 генного локуса, можно предположить, что на каждый гаплоидный геном ржи приходится 56 000 генных локусов без учета локусов рДНК. Это хорошо согласуется с размером почти 51000 идентифицированных генных моделей в Oryza sativa (http://rice.plantbiology.msu.edu/), от 38000 до 48000 генов ячменя [41], [42] и 55000 до 111 000 локусов генов на диплоидный геном пшеницы [60].С другой стороны, мы идентифицировали по крайней мере 1882 различных генных функции, связанных с 1RS, что, безусловно, является недооценкой истинного числа функций гена, потому что 3852 экспрессированных и гипотетических гена были идентифицированы без функциональной аннотации. Среди идентифицированных функций генов несколько локусов, участвующих в устойчивости к мучнистой росе, были обнаружены в 1RS, которые могут быть ответственны за передачу этой устойчивости сортам пшеницы. В нашем наборе данных все одиннадцать генов, признанных Bartos et al.[21] в 1RS с использованием информации о конечной последовательности BAC.
Анализ состава последовательностей 1RS дал возможность сосредоточиться на представлении органеллярных элементов генома. У эукариот ДНК обменивалась и продолжает обмениваться между происходящими из эндосимбиоза митохондриальными и хлоропластными геномами и ядром, таким образом, служа важной движущей силой для эволюции генов и геномов [61] — [63]. Переносы ДНК от органелл к ядру во время ранней эволюции органелл вызывали массовое перемещение генов органелл в ядро, в результате чего функциональные образования все еще активно транскрибировались.Напротив, почти все недавние ядерные переносы митохондриальной или пластидной ДНК касаются некодирующих последовательностей. Сообщалось, что в геноме риса инсерции органелл могут происходить в горячих точках, где можно найти целые блоки вставок органеллярной ДНК [64]. Настоящее исследование выявило наличие вставок хлоропластов в 1RS путем идентификации считывания химерных последовательностей хлоропластов и предполагаемых геномных элементов. Несмотря на большее количество идентифицированных считываний специфических митохондриальных последовательностей, химерные фрагменты с митохондриальными последовательностями не были обнаружены, что свидетельствует о возможном митохондриальном загрязнении отсортированных хромосом.
Наши результаты показывают, что 74,46% последовательности плеча хромосомы 1RS содержат известные повторяющиеся элементы, включая рибосомные локусы, но не включают предполагаемые семейства генов. Эти данные хорошо согласуются с данными Bartoš et al. [21], основанный на анализе концевых последовательностей ВАС (BES) клонов, представляющих 1RS (75,6% известных повторов). Однако были различия в подклассах, например. Gypsy 49% против 43%, Copia 14% против 7,3% и CACTA 4,4% против 6,3% при сравнении BES и настоящего набора данных. Эту разницу можно объяснить примерно 100-кратной разницей в охвате: 0.45% против 43% покрытия генома 1RS для BES и настоящего набора данных соответственно. Кроме того, Бартош и др. [21] обнаружили 8,8% неизвестных повторяющихся элементов, в то время как в нашем случае мы идентифицировали около 4% новых повторяющихся элементов с помощью поиска RepeatScout, что дало 84,2% и 74,5% повторяющихся элементов, соответственно. Однако данные, основанные на информации о последовательности 1RS, заметно ниже уровня 92%, опубликованного ранее Flavell et al. [20]. В последней работе часть повторяющихся последовательностей всего генома ржи была определена с помощью анализа C o t, который идентифицирует все повторяющиеся элементы в геноме, в то время как BES и наша стратегия идентифицировали повторяющиеся элементы только с использованием методов in silico.Отклонение данных, полученных in silico, от данных, ранее опубликованных Flavell et al. [20] может быть связано с различием в методологии, анализ C o t более чувствителен к идентификации повторяющихся элементов последовательности в геноме.
Полученная информация о последовательности также может быть использована для создания генетических маркеров для этого плеча хромосомы. Таким образом, мы идентифицировали около 5000 предполагаемых маркерных сайтов на основе областей SSR, которые либо охватывают более половины считываемой последовательности, либо присутствуют в считанной последовательности, представляющей пространство генов 1RS.Предварительные эксперименты показали, что около четверти идентифицированных областей могут служить маркерами, специфичными для 1RS, на основе ПЦР у транслокационной пшеницы 1BL.1RS. Возможно, эти ампликоны применимы и к диплоидной ржи. В дополнение к сайтам маркеров на основе SSR вся информация о последовательностях, относящаяся к генам в 1RS, может быть использована для создания, например, маркеров типа SNP или InDel путем повторного секвенирования.
Колинеарность геномов растений была обнаружена после появления сравнительного картирования, что привело к созданию сравнительной геномики.Наиболее полный набор данных в царстве растений доступен для семейства Poaceae , включая основные зерновые культуры: кукурузу, пшеницу, ячмень, рожь, сорго и просо, а также рис и Brachypodium distachyon . Последние два вида представляют собой полностью секвенированные небольшие геномы [65], [66]. В нашем исследовании аннотированные чтения последовательности 454 не были генетически картированы на плече хромосомы ржи. Однако большое количество предполагаемых локусов генов позволило провести подробный корреляционный анализ генома 1RS с полными геномами риса и Brachypodium distachyon .Анализ показал, что гены, присутствующие в 1RS, разбросаны по всей длине двух модельных геномов, но не равномерно. В соответствии с предыдущими наблюдениями коллинеарности 5-й хромосомы риса и 1-й хромосомы ржи [37], [38], в нашем случае высокогомологичные бункеры, представляющие синтенические области, сгруппированные в дистальной области короткого плеча 5-й хромосомы риса и в проксимальном направлении. область длинной руки chr2 Brachypodium distachyon . Это согласуется с высокой коллинеарностью между рисом и Brachypodium distachyon в этих двух регионах.Кроме того, в настоящем исследовании мы показываем первый анализ синтении в Triticeae между рожью и ячменем, основанный на данных, полученных с помощью технологии секвенирования следующего поколения. Сравнение содержания генов в коротких плечах хромосомы 1 было выполнено с помощью информации о последовательностях, доступной для генома риса, используемого в качестве платформы, поскольку полная информация о последовательностях сравниваемых геномов недоступна. Использование виртуальных бункеров, созданных на модельном геноме, позволило выявить участки генома, которые наследуются блоками в процессе эволюции этих видов.Анализ синтении коротких плеч хромосомы 1 двух видов показал, что более компактные области генома риса были представлены в 1HS, в то время как области гомологов 1RS были более разбросаны в проанализированных хромосомах риса. Наибольшее сходство содержания гена 1RS / 1HS было локализовано в дистальной части 5-й хромосомы риса, что предполагает высокий уровень консервативности в этой области. Гораздо меньшее сходство наблюдалось в отношении генов, родственных хромосоме 10, которые представляют перицентрическую область 1HS.Наблюдаемое различие между двумя хромосомными плечами может быть связано либо с приблизительным положением центромеры в 1H, либо с более низкой консервативностью этой области во время эволюции. Однако мы должны отметить, что различный подход к идентификации гомологии в 1RS и 1HS также может вносить свой вклад в наблюдаемые различия.
Заключение
Из-за присутствия во многих сортах пшеницы, выращиваемых во всем мире, плечо хромосомы ржи 1RS считается важным элементом зародышевой плазмы пшеницы.Настоящее исследование выявило содержание генов и потенциальные функции генов на этом плече хромосомы и продемонстрировало многочисленные элементы последовательностей, такие как SSR и связанные с генами последовательности, которые можно использовать для будущих исследований, а также для селекции пшеницы и ржи. Недавно были установлены контиги 1RS с отпечатками пальцев BAC (Burg K, неопубликовано) и помещены в базу данных физических карт, размещенную в Калифорнийском университете в Дэвисе (http://probes.pw.usda.gov:8080/rye1RS/). Tsuchida et al. [67] разработали линии делеции (рассечения) 1RS, которые были успешно использованы для физического картирования 150 1RS-специфичных SSR-маркеров 26, происходящих из настоящего исследования, в 15 бункеров (Lelley T, личное сообщение).В настоящем исследовании мы сопоставили содержание гена 1RS с плечом хромосомы 1HS Hordeum , которое является генетически хорошо изученным компонентом геномов Triticeae. Все эти результаты и ресурсы будут способствовать дальнейшему описанию молекулярной структуры 1RS. Поскольку все хромосомы ржи могут быть очищены с помощью проточной цитометрической сортировки, либо непосредственно из ржи (хромосома 1R), либо из линий добавления хромосом пшеницы и ржи — хромосом 2R – 7R [44], можно использовать стратегию, изложенную и проверенную в настоящем исследовании. для секвенирования и подробного анализа всего генома ржи поэтапно для каждой хромосомы.
Материалы и методы
Сортировка хромосом и множественное смещение амплификации (MDA)
Семена дителосомной аддитивной линии пшеницы-ржи 1RS, полученные от ржи ( Secale cereale L.) cv. «Императорский» на фоне пшеницы ( Triticum aestivum L.) сорт. «Китайская весна» [68] была предоставлена доктором Б. Фрибе (Университет штата Канзас, Манхэттен, США). Поскольку эта добавочная линия 1RS является цитологически нестабильной, семена, отобранные для размножения, проверяли на наличие 1RS путем цитологического исследования в кончиках корней.Выращивали только те семена, которые имели 44 хромосомы, включая два телоцентрика 1RS. Растения из таких семян дают около 60% дителоцентрических и 40% монотелоцентрических потомков, в то время как монотелоцентрические растения с 43 хромосомами (42 + 1 телецентрический 1RS) будут давать только около 30% монотелоцентрических и не дителоцентрических потомков, что делает их непригодными для сортировки. Семена прорастали до оптимальной длины корня 2–3 см. Синхронизацию клеточного цикла и накопление метафаз в кончиках корней и приготовление жидких суспензий хромосом проводили согласно Kubaláková et al.[44]. Хромосомы в суспензии окрашивали 2 мкг / мл DAPI (4 ‘, 6-диамидино-2-фенилиндол) и анализировали с помощью проточного цитометра FACSVantage SE (Becton Dickinson, Сан-Хосе, США) со скоростью около 800–1200 хромосом / сек. Телосомы 1RS сортировали со скоростью 10 / сек порциями по 30 000 в 50 мкл деионизированной воды в пробирке для ПЦР. Чистоту отсортированных фракций проверяли с помощью флуоресценции in situ гибридизации с хромосомами, отсортированными на предметном стекле микроскопа, с использованием зондов для субтеломерного гетерохроматина (pSc200) и теломерных повторов [40].Изотермическую амплификацию хромосомной ДНК проводили согласно Šimková et al. [40]: хромосомы, отсортированные по потоку, обрабатывали протеиназой K, очищали с использованием колонки Microcon YM-100 (Millipore Corporate, Billerica, USA), и очищенную хромосомную ДНК амплифицировали с использованием набора для амплификации ДНК Illustra GenomiPhi V2 (GE Healthcare, Chalfont St. Giles, United Kingdom) в соответствии с инструкциями производителя в 20 мкл реакции в течение 1,5 часов. Образцы были лиофилизированы и отправлены для секвенирования 454.
Roche 454 FLX, курс
Пять микрограммов ДНК, амплифицированных из отсортированного в потоке 1RS, использовали для подготовки библиотеки секвенирования 454 с использованием набора для подготовки библиотеки ДНК GS FLX в соответствии с инструкциями производителя (Roche Diagnostics, Бранфорд, США). Одноцепочечные библиотеки секвенирования 454 были количественно определены с помощью количественного анализа ПЦР [69] и обработаны с использованием стандартного набора I emPCR GSFLX и стандартного набора для секвенирования LR70 (Roche Diagnostics, Бранфорд, США) в соответствии с инструкциями производителя.Секвенирование выполняли на четырех дорожках 16-полосной прокладки на пикотитровом планшете FLX 70 × 75 («титрование») и на двух полных пикотитровых планшетах 70 × 75, в результате было получено 942 768 считываний со средней длиной считывания 219 п.н., что дало ∼ 205 Мб необработанных данных последовательности. Данные двух полных циклов вместе с циклом титрования были объединены для обработки всего набора данных за один цикл.
Анализ последовательностей.
Считывание низкокачественных последовательностей было удалено интегрированной программой Roche 454 NEWBLER (v1.1.03.24) программное обеспечение. Был создан биоинформатический конвейер для анализа оставшихся считываний последовательностей. Для этого были интегрированы различные программные инструменты и скрипты Perl. Ядром документации по результатам была база данных Microsoft SQL Server, которая использовалась для сбора всех результатов анализа и хранения данных анализа для последующих запросов результатов.
Конвейер использовал пошаговую процедуру для классификации считываний последовательностей, начиная с исключения фрагментов короче 50 бит / с. Остальные считывания последовательностей были сканированы на идеальные и почти идеальные повторяющиеся последовательности с использованием PHRAP [70] для удаления технических артефактов.Считывание двух последовательностей считалось идеальным дубликатом, если они имели одинаковую длину, и при выравнивании двух последовательностей не было обнаружено несоответствия по одному основанию. Считывания последовательностей считались почти идеальными дубликатами, если они демонстрировали (1) разницу в длине менее 5 п.н., (2) максимум три несоответствия и (3) максимум 2 п.н. смещения при выравнивании. Считывания последовательности, удовлетворяющие одному из двух критериев сопоставления, рассматривались как технические дубликаты и удалялись, в результате чего в наборе данных оставался только один представитель считывания последовательности.После удаления технически несоответствующих считываний качество оставшейся последовательности считываний было проверено путем анализа «значений качества, совместимых с PHRED» [71], полученных из блок-схем. Эти проверки показали, что 99,1% считываний последовательностей имели баллы выше 20 и 0,86% между 15 и 20. Всего лишь 169 считываний последовательностей имели баллы 10–15 и только 5 были ниже 10.
После удаления низкокачественных последовательностей оставшиеся считывания последовательностей считались репрезентативным набором данных для 1RS, который впоследствии анализировался на наличие повторов, органелл или элементов генного пространства в геноме, как описано ниже.После каждого шага вновь классифицированные чтения последовательности помечались соответствующей классификацией и удалялись из набора данных, то есть исключались из следующих шагов анализа.
Идентификатор SSR
Репрезентативный набор данных был подвергнут двухэтапному анализу SSR с использованием программного обеспечения SciRoKo [72]. Сначала были идентифицированы мононуклеотиды длиной более 8 п.н. и динуклеотиды с> 4 повторениями мотива. Во-вторых, были идентифицированы тринуклеотиды с> 4 повторами и тетра-, пента- и гексануклеотиды с> 3-мя повторами мотива.Только фрагменты с SSR-областями, охватывающими более 50% длины фрагмента, были исключены из дальнейшего анализа; остальные последовательности были помечены как SSR-содержащие элементы и сохранены в наборе данных для последующего анализа.
Обнаружение повторяющихся элементов и рДНК
повторяющихся элементов и рДНК были идентифицированы с использованием программного обеспечения RepeatMasker [73] со стандартными настройками параметров, за исключением того, что проверки на наличие бактерий были отключены. Три набора данных использовались в качестве справочных баз данных для обнаружения повторяющихся элементов: а) TREP, б) TIGR Oryza повторов и в) самосборная коллекция элементов Secale Revolver.Для обнаружения рДНК были отобраны три набора данных: а) все элементы рДНК MIPS-REcat, б) все элементы рДНК повторов TIGR Oryza и в) самокомпилированная коллекция элементов рДНК Musa и Secale ( Таблица S2). Автоматическая классификация выравниваний между считанными последовательностями ржи и эталонными последовательностями была основана на следующих критериях: выравнивание считалось неприемлемым, если а) perc_div (процентное расхождение) было выше 30% или b) perc_div составляло от 20 до 30% и либо perc_ins (процентное соотношение) вставок) или perc_del (процент удалений) были выше 5%.Кроме того, выравнивания с перекрытием менее 20 п.н. были признаны ненадежными. Все остальные расстановки были приняты как качественные. Все считывания последовательностей, охватываемые более чем 60% качественными совпадениями, были классифицированы как повторяющиеся элементы или рДНК и исключены из последующего анализа. Все считывания последовательностей, удовлетворяющие критериям качества, но имеющие покрытие менее 60% или плохое выравнивание, были помечены как предполагаемые элементы в соответствующей категории и сохранены в наборе данных. В конце конвейера анализа считанные теги последовательности без назначенной функции были отнесены к предполагаемой категории повторов.Впоследствии неклассифицированные считывания последовательностей были дополнительно проанализированы с помощью BLAST относительно всех последовательностей Secale , Triticum и Hordeum из базы данных NCBI NT Cereal (Таблица S2), которая содержит значительные количества информации о последовательностях, связанных с транспозонами. Считывания последовательности, производящие значительный удар (подробности о применяемых параметрах приведены ниже) против элементов транспозона или рДНК, были идентифицированы и также исключены из последующего анализа.
Экспрессированные последовательности, относящиеся к транспозонам, были идентифицированы с использованием базы данных Rice Protein при поиске в исходной строке FASTA записи «транспозон».
Все повторяющиеся элементы, идентифицированные последними базами данных, были включены в систему номенклатуры базы данных TREP.
Органелларные элементы
считываний последовательностей, связанных с органеллами, идентифицировали путем сравнения BLAST с доступными последовательностями хлоропластов и митохондрий T. aestivum (таблица S2). WU-BLAST использовали для сравнения последовательностей, используя 90% в качестве порогового значения как для перекрытия, так и для идентичности. Считывания последовательности, вызывающие совпадение с одной из двух эталонных последовательностей, были классифицированы как органеллярные элементы и впоследствии удалены из набора данных.Второй раунд поиска был проведен по пониженному значению перекрытия (40%), чтобы идентифицировать предполагаемые считывания химерной последовательности, несущие органеллар, а также связанные с 1RS геномные элементы.
Единая (аннотация) онтология на основе риса
Чтобы получить общую аннотацию для всех считываний последовательностей, согласованных между видами, все контрольные последовательности доступны в базе данных пептидов Brachypodium distachyon , Secale cereale UniGene, Triticum aestivum UniGene, Oryza sativa UniGene40 и записи базы данных были аннотированы относительно базы данных пептидов Oryza (т.е. Аннотация генома риса, RGA) с использованием BLASTp или BLASTx с параметрами, описанными ниже. Дополнительные источники аннотаций использовались для локусов, которые не могли быть аннотированы на основе наборов данных RGA. Некоторые записи в базах данных Triticum UniGene и Hordeum UniGene уже имели аннотации NCBI, которые были приняты в качестве дополнительных источников аннотаций для чтения последовательности ржи. Впоследствии оставшиеся неотмеченные записи были подвергнуты поиску методом BLAST по записям RAP-DB (Rice Annotation Project-Database), в результате чего были получены дополнительные аннотированные записи в базе данных.Используя этот подход, примерно 10% локусов UniGene могут быть аннотированы через RGA, 2% через NCBI и 1% через RAP-DB.
Обнаружение считывания последовательностей, представляющих генное пространство
Все еще не классифицированные считывания последовательности набора данных были подвергнуты серии анализа WU-BLAST 2.0. Одиннадцать наборов данных были использованы для идентификации считываний последовательностей, представляющих пространство генов 1RS (таблица S2). Для получения информации о пространстве генов 1RS мы сначала идентифицировали хорошо известные локусы генов секалинов (ω-секалин и γ-секалин).Затем восемь эталонных наборов данных были использованы для идентификации считываний последовательностей, представляющих предполагаемые экспрессированные части генома ( пептидов Oryza sativa, , пептидов Brachypodium distachyon, , NCBI: Oryza sativa, UniGene, Secale cereale UniGritene, Hordeum vulgare UniGene, NT Зерновые и бин-картированные локусы коротких плеч хромосом пшеницы 1A, 1B и 1D). Дополнительные два набора данных были использованы для выяснения предполагаемых нетранскрибируемых областей генного пространства 1RS ( Oryza UTR, Oryza Intron).Только набор данных Secale UniGene был видоспецифичным и поэтому был согласован с доступными считываниями последовательностей с помощью BLASTn. Сравнение считываний последовательностей с другими видами было выполнено в основном на уровне белка с использованием BLASTx в базах данных Oryza sativa и Brachypodium distachyon Peptide. Чтобы оптимизировать восстановление аннотаций чтения последовательностей, как tBLASTx, так и BLASTn использовались для идентификации последовательностей, специфичных для генного пространства, в базах данных Oryza , Triticum , Hordeum UniGene и NT Cereal, где как субъектная, так и запрашиваемая последовательности находились на уровне нуклеотидов. .Перекрытие между двумя методами оказалось достаточно высоким. Вопреки нашим ожиданиям, с помощью tBLASTx было идентифицировано только 10% дополнительных высококачественных совпадений (данные не показаны).
Для автоматического анализа результатов BLAST было важно использовать один и тот же набор параметров для всех сравнений последовательностей. Выравнивание двух последовательностей считалось значимым, когда i) либо они имели перекрытие не менее 55%, идентичность не менее 80% и длину выравнивания не менее 60 п.н. или 20 аминокислотных остатков соответственно, либо, альтернативно, ii) они имели e-значение e −20 и идентичность не менее 70%.Первый критерий использовался для первичной фильтрации набора данных, за которым следовал критерий 2 с последующим объединением совпадений. Первое попадание, удовлетворяющее этим критериям, использовалось в качестве аннотации для данного чтения последовательности, показывая единственную аннотацию для каждого чтения.
Анализ синтении 1RS ржи на геномы Oryza sativa и Brachypodium distachyon
Для визуализации синтении последовательности 1RS с геномами риса и Brachypodium distachyon, модельные геномы были разрезаны in silico на 10 бункеров 5 п.н.Впоследствии считывания последовательностей, ранее идентифицированные как предполагаемые гены в соответствующем геноме, были размещены в сгенерированных ячейках. Для каждого бина была идентифицирована необработанная оценка (X = количество локусов, пораженных по крайней мере одним считыванием последовательности, деленное на общее количество локусов в бункере). Для сравнения интервалов стандартная оценка (Z) для каждого интервала определялась по следующей формуле: (X = исходная оценка, μ = среднее значение, σ = стандартное отклонение). Чтобы идентифицировать бункеры и области модельных геномов, которые чрезмерно представлены в 1RS, бункеров с высокой гомологией (HHB) со стандартными оценками более 2.Было выбрано 58 × стандартное отклонение (σ) (предел 99%), и было проанализировано их распределение в модельных геномах.
Сравнительный анализ содержания генов 1HS и 1RS
Для сравнения содержания генов 1RS и 1HS была рассчитана фракция содержания общего гомологичного гена (сходство) 10 5 виртуальных бункеров п.н. по следующей формуле: C 1RS & 1HS : количество рисовых локусов, демонстрирующих гомологию. как для чтения последовательностей, специфичных для 1RS, так и для 1HS (общие локусы).H 1RS : число считываний локусов риса, гомолога специфичных для 1RS. H 1HS : число считываний локусов риса, гомолога специфичных для 1HS.
При вычислении доли гомолога, но не общих локусов, относящихся к 1RS или 1HS, использовалась аналогичная формула, за исключением того, что числитель был изменен на H 1RS -C 1RS и 1HS для 1RS или H 1HS — C 1RS & 1HS за 1HS.
Преобразование идентификации локусов RAP-DB, опубликованное в Mayer et al.[42] в соответствующие локусы RGA было выполнено с использованием таблицы преобразования RGA-MSU (http://rapdb.dna.affrc.go.jp/download/index.html). Предполагаемое положение центромеры в 1H было идентифицировано в соответствии с набором карт UCR04162008 из The Hordeum Toolbox (http://wheat.pw.usda.gov/tht/maps.php). На основании этого было идентифицировано 300 локусов RGA гомологов хромосомы 5 и 168 хромосомы 10, представляющих геном 1HS (Таблица S6).
Оценка вероятности попадания в отдельные гены в 1RS
Для оценки вероятности попадания в один ген были применены уравнения Лендера и Уотермана [49] и элементарная теория вероятностей.Используя формулы Лендера и Уотермана, вероятность того, что ген средней длины (L g в п.н.) не охвачен никакими считываниями последовательности, содержащимися в текущем наборе данных, была рассчитана на основе следующего предположения: вероятность для «океана» (промежуток между двумя обнаруженными последовательностями) длины kL задается как e -c (k + θ) , где L — длина средней считанной последовательности, k — коэффициент размера (L g / L), c = (N * L) / G — избыточность покрытия и θ = T / L.(N = количество считываний последовательности, L = средняя длина считываемой последовательности в п.о., G = длина исследуемого генома в п.о. и T = желаемая длина для обнаружения перекрытия в п.о.). Используя элементарную теорию вероятностей и применяя концепции биномиального распределения, вероятность того, что данная часть генома не будет затронута, дается как (1-L / G) N , что приблизительно эквивалентно e -c для больших №
График покрытия локусов ω-секалина и 45S рДНК
МОСАИК — http: // биоинформатика.bc.edu/marthlab/Mosaik — ассемблер, ориентированный на ссылки, был использован для сопоставления всех считываний последовательностей с эталонными последовательностями ржи 45S (JF489233) и ω-секалина (AF000227) с использованием размера хэша 10 и коэффициента ошибок 20 % в выравнивании. MosaikCoverage использовался для создания графического представления смещения представления на базовом точном графике покрытия. Допускались множественные выравнивания, так что считывание последовательности, попадающее в различные области в пределах эталона, многократно отображалось в распределении покрытия.Повторяющиеся части эталонных последовательностей визуализировали с помощью программного обеспечения для создания точечных графиков Gepard [74].
Прочие некодирующие элементы
После идентификации считываний последовательностей, связанных с органелларами, повторами и пространством гена, оставшиеся считывания, помеченные ранее как предполагаемые повторы и впоследствии не идентифицированные иным образом, были перемещены в категорию «Предполагаемый повтор». Остальные считывания последовательности были протестированы на предмет того, связаны ли они с каким-либо типом геномных элементов, присутствующих в Brachypodium distachyon на 1 k вверх и 1 k вниз, а также в базах данных Oryza 1 k вверх и Oryza intergenic или NT Cereal с использованием BLASTn.
Идентификация новых повторяющихся элементов
Новые повторяющиеся элементы были идентифицированы в два этапа с помощью программного пакета RepeatScout, анализирующего считывания последовательности, не помеченные на предыдущих этапах. На начальном этапе с использованием стандартных настроек программное обеспечение сгенерировало предполагаемые новые последовательности повторяющихся элементов с последующим удалением элементов низкой сложности и тандемных повторяющихся элементов. Полученные предполагаемые новые повторяющиеся элементы были проверены путем повторного совмещения их с считыванием последовательностей с помощью RepeatMasker, установленного как минимум на 50% перекрытия и 85% сходства.Предполагаемые повторяющиеся элементы, пораженные более чем 10 прочтениями последовательности, были идентифицированы как новые повторяющиеся элементы. Анализ BLASTClust (60% перекрытия и 90% идентичности) использовали для исключения предполагаемых новых повторов, представляющих одну и ту же повторяющуюся последовательность.
Все считывания последовательности Roche 454FLX, полученные в этом исследовании, были отправлены в архив коротких считываний NCBI GenBank под регистрационным номером SRA012605.
База данных (форматы MSExcel2007, MySQL 5.1 Dump, Unix Text и Windows Text), содержащая теги для чтения последовательности, доступна для загрузки на веб-сайте: http: // www.picme.at/index.php/downloads.
Благодарности
Мы благодарим доктора Павлу Суханкову, доктора Ярмилу Чихаликову, Роману Новакову, до н. Э. и г-же Зденьке Дубской за отличную помощь в сортировке хромосом и амплификации хромосомной ДНК. Авторы благодарны доктору Андреасу Хубену (Институт генетики растений и исследований сельскохозяйственных культур им. Лейбница (IPK), Гатерслебен (Германия)) за предоставленные титановые считывания последовательности Roche 454 полного генома ржи.
Вклад авторов
Задумал и спроектировал эксперименты: SF KB ST JD TL.Проведены эксперименты: ГС АП МК МБ СК. Проанализированы данные: СФ ДК СК КБ МП. Предоставленные реагенты / материалы / инструменты анализа: TL. Написал статью: КБ ДК СФ.
Список литературы
- 1. Zeller FJ (1973) 1B / 1R хромосомные замены и транслокации пшеницы и ржи. В: Sears S ER, Sears LMS, редакторы. С. 209–221. Proc 4 th Int Wheat Genet Symp, Колумбия.
- 2. Shepherd KW (1973) Гомеология пшеницы и чужеродных хромосом, контролирующих фенотипы белков эндосперма.В: Sears ER, Sears LMS, редакторы. С. 745–760. Proc 4 th Int Wheat Genet Symp, Колумбия.
- 3. Zeller FJ, Fuch E (1983) Cytologie und Krankheitsresistenz einer 1A / 1R und mehrerer 1B / 1R Weizen-Roggen Translokationssorten. Zeitschrift für Pflanzenzüchtung 90: 285–296.
- 4. Zeller FJ, Hsam SLK (1984) Расширение генетической изменчивости культурной пшеницы за счет использования хроматина ржи. В: Сакамото С., редактор. С. 161–173. Proc 6 th Int Wheat Genet Symp, Kyoto.
- 5. Макинтош Р.А. (1988) Каталог символов генов пшеницы. В: Миллер Т.Э., Кебнер Р.М.Д., ред. С. 1225–1320. Proc 7 th Int Wheat Genet Symp, Cambridge.
- 6. Коннер Р.Л., Томас Дж. Б., Уилан ЭДП (1991) Сравнение устойчивости к клещам для борьбы с мозаикой из полос пшеницы. Crop Sci 31: 315–318.
- 7. Graybosch RA (2001) Непростые союзы: качественные эффекты переноса хроматина ржи на пшеницу. J Cereal Sci 33: 3–16.
- 8.Маго Р., Спилмейер В., Лоуренс Дж. Дж., Лагуда Е. С., Эллис Дж. Г. и др. (2002) Идентификация и картирование молекулярных маркеров, связанных с генами устойчивости к ржавчине, расположенными на хромосоме 1RS ржи, с использованием линий транслокации пшеница-рожь. Theor Appl Genet 104: 1317–1324.
- 9. Андерсон Г.Р., Папа Д., Пенг Дж., Тахир М., Лапитан NLV (2003) Генетическое картирование Dn7, гена ржи, придающего устойчивость к российской пшеничной тле в пшенице. Theor Appl Genet 107: 1297–1303.
- 10.Villareal RL, Banuelos O, Mujeeb-Kazi A, Rajaram S (1998) Агрономические характеристики хромосом 1B и T1BL.1RS, близкие к изолиниям в яровой мягкой пшенице Seri M82. Euphytica 103: 195–202.
- 11. Карвер Б.Ф., Рейберн А.Л. (1995) Сравнение родственных запасов пшеницы, обладающих хромосомами 1B или T1BL.1RS: качество зерна и муки. Crop Sci 35: 1316–1321.
- 12. Echdaie B, Whitkus RW, Waines JG (2003) Корневая биомасса, эффективность использования воды и эффективность пшенично-ржаных транслокаций хромосом 1 и 2 у яровой мягкой пшеницы «Pavon».Crop Sci 43: 710–717.
- 13. Шарма С., Бхат П.Р., Эдаи Б., Клоуз Т.Дж., Лукашевский А.Дж. и др. (2009) Интегрированная генетическая карта и генетический анализ области, связанной с корневыми признаками на коротком плече хромосомы 1 ржи у мягкой пшеницы. Theor Appl Genet 119: 783–793.
- 14. Sharma S, Xu S, Ehdaie B, Hoops A, Close TJ, et al. (2011) Анализ эффектов QTL для корневых признаков с использованием популяции, специфичной для картирования хромосомных плеч мягкой пшеницы. Theor Appl Genet 122: 759–769.
- 15. Рабинович С.В. (1998) Значение пшенично-ржаных транслокаций для селекции современных сортов Triticum aestivum L. Euphytica 100: 323–340.
- 16. Lelley T, Eder C, Grausgruber H (2004) Влияние транслокации хромосомы пшеницы-ржи 1BL.1RS на генотип за счет взаимодействия с окружающей средой. J Cereal Sci 39: 313–320.
- 17. Doležel J, Greilhuber J, Lucretti S, Meister A, Lysak MA, et al. (1998) Оценка размера генома растений методом проточной цитометрии: межлабораторное сравнение.Ann Bot 82: Дополнение. A17–26.
- 18. Doležel J, Bartoš J, Voglmayr H, Greilhuber J (2003) Содержание ядерной ДНК и размер генома форели и человека. Цитометрия 51: 127–128.
- 19. Schlegel R, Melz G, Nestrowicz R (1987) Универсальный эталонный кариотип ржи, Secale cereale L. Theor Appl Genet 74: 820–826.
- 20. Flavell RB, Bennett MD, Smith JB, Smith DB (1974) Размер генома и доля повторяющейся ДНК нуклеотидной последовательности в растениях.Biochem Genet 12: 257–269.
- 21. Бартош Дж., Поукс Э., Кофлер Р., Гавранкова М., Копецки Д. и др. (2008) Первое исследование состава генома ржи (Secale cereale) посредством секвенирования BAC-конца короткого плеча хромосомы 1R. BMC Plant Biology 8: 95.
- 22. Баум М., Аппельс Р. (1991) Цитогенетическая и молекулярная архитектура хромосомы 1R — одного из наиболее широко используемых источников чужеродного хроматина в сортах пшеницы. Хромосома 101: 1–10.
- 23.Сингх Н.К., Шеперд К.В., Макинтош Р.А. (1990) Картирование сцепления генов устойчивости к листовой, стеблевой и полосатой ржавчине и ω-секалинам на коротком плече хромосомы 1R ржи. Theor Appl Genet 80: 609–616.
- 24. Алонсо-Бланко C, Goicoechea PG, Roca A, Alvarez E, Giraldez R (1994) Генетическое картирование цитологических и изоферментных маркеров на хромосомах 1R, 3R, 4R и 6R ржи. Theor Appl Genet 88: 208–214.
- 25. Wanous MK, Gustafson JP (1995) Генетическая карта хромосомы 1R ржи, объединяющая RFLP и цитогенетические локусы.Theor Appl Genet 91: 720–726.
- 26. Бёрнер А., Корзун В. (1998) Консенсусная карта сцепления ржи (Secale cereale L.), включающая 374 RFLP, 24 изофермента и 15 локусов генов. Theor Appl Genet 97: 1279–1288.
- 27. Ma XF, Wanous MK, Houchins K, Rodriguez Milla MA, Goicoechea PG, et al. (2001) Картирование молекулярных связей у ржи ( Secale cereale L.). Theor Appl Genet 102: 517–523.
- 28. Корзун В., Малышев С., Войлоков А.В., Бёрнер А. (2001) Генетическая карта ржи ( Secale cereale L.) объединение ПДРФ, изоферментов, белков, микросателлитных и генных локусов. Theor Appl Genet 102: 709–717.
- 29. Masojc P, Myskow B, Milczarski P (2001) Расширение генетической карты ржи на основе RFLP с использованием случайной амплифицированной полиморфной ДНК (RAPD) и изоферментных маркеров. Theor Appl Genet 102: 1273–1279.
- 30. Nagy ED, Eder Ch, Molnár-Láng M, Lelley T (2003) Генетическое картирование последовательностей-специфичных маркеров на основе ПЦР на коротком плече транслокации пшеница-рожь 1BL.1RS.Euphytica 132: 243–250.
- 31. Nagy ED, Lelley T (2003) Генетическое и физическое картирование специфичных для последовательности амплифицированных полиморфных (SSAP) маркеров на плече хромосомы 1RS ржи на фоне пшеницы. Theor Appl Genet 107: 1271–1277.
- 32. Ван М.Л., Аткинсон М.Д., Чиной К.Н., Девос К.М., Харкорт Р.Л. и др. (1991) Theor Appl Genet 82: 174–178.
- 33. Sandhu D, Gill KS (2002) Геносодержащие области геномов пшеницы и других трав.Физиоло растений 128: 803–811.
- 34. Девос К.М., Гейл М.Д. (2000) Отношения генома: модель травы в текущем исследовании. Растительная клетка 12: 637–646.
- 35. Тан Х, Бауэрс Дж. Ф., Ван Х, Мин Р., Алам М. и др. (2008) Синтения и коллинеарность в геномах растений. Наука 320: 486–488.
- 36. Патерсон А.Х., Бауэрс Дж. Э., Бруггманн Р., Дубчак И., Гримвуд Дж. И др. (2009) Геном Sorghum bicolor и разнообразие трав.Природа 15: 551–556.
- 37. Hackauf B, Rudd S, van der Voort JR, Miedaner T, Wehling P (2009) Сравнительное картирование последовательностей ДНК в ржи ( Secale cereale L.) по отношению к геному риса. Theor Appl Genet 118: 371–384.
- 38. Гейл, М.Д., Девос, К.М., Мур, Г. (1995) Рис как ключевой геном в новую эру сравнительной генетики трав. Генетика риса III. В кн .: Хуш Г.С., редактор. С. 77–84. Материалы третьего Международного симпозиума по генетике риса.
- 39. Doležel J, Kubaláková M, Paux E, Bartoš J, Feuillet C (2007) Геномика на основе хромосом в зерновых культурах. Chromosome Res 15: 51–66.
- 40. Шимкова Х., Шафарж Я., Суханкова П., Коваржова П., Бартош Я. и др. (2008) Новый ресурс по геномике Triticeae: библиотека ВАС, специфичная для короткого плеча хромосомы 1R (1RS) ржи ( Secale cereale L.). BMC Genomics 9: 237.
- 41. Майер KFX, Таудиен С., Мартис М., Шимкова Х., Суханкова П. и др.(2009) Содержание генов и виртуальный порядок генов хромосомы ячменя 1H. Физиология растений 151: 496–505.
- 42. Mayer KFX, Martis M, Hedley PE, Šimková H, Hui H и др. (2011) Раскрытие генома ячменя с помощью хромосомной и сравнительной геномики. Растительная клетка. DOI 10.1105 / tpc.110.082537.
- 43. Беркман П.Дж., Скаршевски А., Лоренц М.Т., Лай К., Дюран С. и др. (2011) Секвенирование и сборка низкокопийных и генных регионов изолированного плеча 7DS хромосомы Triticum aestivum.Завод Биотех Дж.
- 44. Кубалакова М., Валарик М., Бартош Дж., Варани Дж., ЧиИхаликова Дж. И др. (2003) Анализ и сортировка хромосом ржи ( Secale cereale L.) с использованием проточной цитометрии. Геном 46: 893–905.
- 45. Шимкова Х., Свенссон Дж. Т., Кондамин П., Грибова Е., Суханкова П. и др. (2008b) Связывание амплифицированной ДНК из отсортированных по потоку хромосом с картированием SNP высокой плотности ячменя. BMC Genomics 9: 294.
- 46. Кофлер Р., Бартош Дж., Ли Дж., Стифт Дж., Суханкова П. и др.(2008) Разработка микросателлитных маркеров, специфичных для короткого плеча ржи ( Secale cereale L.) хромосомы 1. Theor Appl Genet 117: 915–926.
- 47. Грин RE, Краузе Дж., Птак С.Е., Бриггс А.В., Ронан М.Т. и др. (2006) Анализ одного миллиона пар оснований ДНК неандертальцев. Природа 444: 330–336. (Дополнительная информация).
- 48. Хуанг CY, Ayliffe MA, Timmis JN (2003) Прямое измерение скорости переноса ДНК хлоропластов в ядро.Природа 422: 72–76.
- 49. Noutsos C, Kleine T, Armbruster U, DalCorso G, Leister D (2007) Ядерные вставки органеллярной ДНК могут создавать новые участки функциональных последовательностей экзонов. Тенденции Genet 23: 597–601.
- 50. Tomita M, Shinohara K, Morimoto M (2008) Revolver — это новый класс транспозоноподобных генов, составляющих геном Triticeae. ДНК Res 15: 49–62.
- 51. Francki GM (2001) Идентификация Bilby, дивергированного центромерного семейства ретротранспозонов Ty1-copia из зерновой ржи ( Secale cereale L.). Геном 44: 266–274.
- 52. Lander ES, Waterman MS (1988) Геномное картирование путем снятия отпечатков пальцев случайных клонов: математический анализ. Геномика 2: 231–239.
- 53. Clarke BC, Mukai Y, Appels R (1996) Локус Sec-1 на коротком плече хромосомы 1R ржи (Secale cereale). Хромосома 105: 269–275.
- 54. Густафсон Дж. П., Дера А. Р., Петрович С. (1988) Экспрессия модифицированных генов рибосомной РНК ржи в пшенице. Proc Nat Acad Sci 85: 3943–3945.
- 55. Прайс А.Л., Джонс NC, Певзнер PA (2005) Идентификация de novo семейств повторов в больших геномах, Bioinformatics 21: i351 – i358.
- 56. Wicker T, Schlagenhauf E, Graner A, Close TJ, Keller B, et al. (2006) 454 секвенирование подверглось проверке с использованием сложного генома ячменя. BMC Genomics 7: 275.
- 57. Wicker T, Taudien S, Houben A, Keller B, Graner A и др. (2009) Снимок всего генома из 454 последовательностей раскрывает состав генома ячменя и предоставляет доказательства параллельной эволюции размера генома у пшеницы и ячменя.Завод J 59: 712–722.
- 58. Хосоно С., Фаруки А.Ф., Дин Ф.Б., Ду И, Сан Зи и др. (2003) Беспристрастная амплификация всего генома непосредственно из клинических образцов. Genome Res 13: 954–964.
- 59. Дин Ф. Б., Хосоно С., Фанг Л., Ву Х, Фаруки А. Ф. и др. (2002) Комплексная амплификация генома человека с использованием множественной амплификации смещения. Proc Nat Acad Sci 99: 5261–5266.
- 60. Девос К.М., Коста де Оливейра А., Сюй Х, Эстилл Дж. К., Эстеп М. и др.Апплс Р., Иствуд Р., Лагуда Е., Лэнгридж П., Маккей М., Макинтайр Л., Шарп П., редакторы. (2008) Структура и организация генома пшеницы — количество генов в геноме гексаплоидной пшеницы. Материалы 11-го Международного симпозиума по генетике пшеницы, Sydney University Press, Сидней. Доступно: http://ses.library.usyd.edu.au/bitstream/2123/3389/1/O25.pdf. По состоянию на 4 января 2012 г.
- 61. Adams KL, Daley DO, Qiu YL, Whelan J, Palmer JD (2000) Повторные, недавние и разнообразные переносы митохондриального гена в ядро цветковых растений.Nature 408: 354–357.
- 62. Бок Р., Тиммис Дж. Н. (2008) Реконструкция эволюции: перенос генов от пластид к ядру. BioEssays 30: 556–566.
- 63. Шеппард А.Е., Тиммис Дж. Н. (2009) Нестабильность пластидной ДНК в ядерном геноме. PLoS Genetics 5: e1000323.
- 64. Guo X, Ruan S, Hu W, Cai D, Fan L (2008) Вставки ДНК хлоропластов в ядерный геном риса: вовлеченные гены, сайты и возраст вставки. Funct Integr Genomics 8: 101–108.
- 65. Международный проект по секвенированию генома риса (2005) Последовательность генома риса на основе карты. Природа 436: 793–800.
- 66. Международная инициатива по брахиподиуму (2010) Секвенирование и анализ генома модельной травы Brachypodium distachyon . Природа 463: 763–768.
- 67. Цучида М., Фукусима Т., Насуда С., Масуди-Неджад А., Исикава Г. и др. (2008) Диссекция ржи 1R в мягкой пшенице. Гены Genet Syst 83: 43–53.
- 68. Дрисколл CJ, Sears ER (1971) Индивидуальное добавление хромосом ржи Imperial к пшенице. Рефераты по агрономии 6 1971.
- 69. Мейер М., Бриггс А.В., Маричич Т., Хёбер Б., Хёффнер Б. и др. (2008) От микрограмм к пикограммам: количественная ПЦР снижает материальные требования к высокопроизводительному секвенированию. Нуклеиновые кислоты Res 36: e5.
- 70. de la Bastide M, McCombie WR (2007) Сборка последовательностей геномной ДНК с помощью PHRAP. В Current Protocols in Bioinformatics, Chapter 11: Unit11.4.
- 71. Ewing B, Hillier L, Wendl M, Green P (1998) Базовый вызов трассировок автоматического секвенсора с использованием phred. I. Оценка точности. Genome Res 8: 175–185.
- 72. Кофлер Р., Шлёттерер С., Лелли Т. (2007) SciRoKo: новый инструмент для поиска и исследования микросателлитов всего генома. Биоинформатика 23: 1683–1685.
- 73. Smit AFA, Hubley R, Green P RepeatMasker Open-3.0 . 1996–2010 годы Доступно: http: //www.repeatmasker.орг. По состоянию на 4 января 2012 г.
- 74. Krumsiek J, Arnold R, Rattei T (2007) Gepard: быстрый и чувствительный инструмент для создания точечных диаграмм в масштабе генома. Биоинформатика 23: 1026–1028.
(PDF) Получение линий замещения пшеница-рожь и определение хромосомного состава кариотипов с использованием маркеров C-бэндинга, GISH и SSR
РОССИЙСКИЙ ГЕНЕТИЧЕСКИЙ ЖУРНАЛ Vol. 42 № 6 2006
ПРОИЗВОДСТВО ЛИНИЙ ЗАМЕЩЕНИЯ ПШЕНИЦЫ И РЖИ 653
Triticeae, Proc.2-й Int. Triticeae Symp., Логан, Юта,
1994, стр. 17.
11. Браун, С.М., Шевц-Макфадден, А.К., и Кресович, С.,
Разработка и применение локусов простых последовательностей
(SSR) для анализа генома растений, методы анализа генома растений
, Jauhar, PP, Ed., New York:
CRC, 1996, стр. 147–162.
12. Рёдер, М.С., Корзун, В., Вендехаке, К. и др., Эллитная карта пшеницы A Microsat-
, Генетика, 1998, т.149, pp. 2007–
2023.
13. Песцова, Э., Ганал, М.В., и Рёдер, М.С., Изоляция
и картирование микросателлитных маркеров, специфичных для генома
D хлебной пшеницы, Genome, 2000 , т. 43,
с. 689–697.
14. Стивенсон П., Брайан Г., Кирби Дж. И др., Пятьдесят новых
микросателлитных локусов для генетической карты пшеницы, Theor.
Заявл. Genet., 1998, т. 97. С. 946–947.
15. Эуджайл И., Сорреллс М.Э., Баум М.и др., Выделение
EST-производных микросателлитных маркеров для фенотипирования
геномов A и B пшеницы, Theor. Прил. Genet.,
2002, т. 104. С. 399–407.
16. Гупта П.К., Балян Х.С., Эдвардс К.Дж. и др., Genetic
Картирование 66 новых локусов микросателлитов (SSR) в хлебе
Wheat, Theor. Прил. Genet., 2002, т. 105, pp. 413–
422.
17. Корзун В., Малышев С., Войлоков А., Бёрнер А.,
Генетическая карта ржи (Secale cereale L.) Объединение
RFLP, изофермента, белка, микросателлитного и генного локусов,
Theor. Прил. Genet., 2001, т. 102. С. 709–717.
18. Хлесткина Е.К., Мьинт Тан М.Х., Песцова Е.Г.,
и др., Картирование 99 новых образованных микросателлитов локусов
во ржи (Secale cereale L.), включая 39 экспрессированных
тегов секвенирования, Теор. Прил. Genet., 2004, т. 109,
с. 725–732.
19. Ma, X.F., Wanous, M.K., Houchins, K., et al., Molecular
Картирование сцепления во ржи (Secale cereale L.) Теор.
Заявл. Genet., 2001, т. 102. С. 517–523.
20. Саал Б. и Врик Г., Разработка простых маркеров повторения последовательности
во ржи (Secale cereale L.)
Геном, 1999, том. 42. С. 964–972.
21. Вильярреал, Р.Л., Бануэлос, О., Муджиб-Кази, А., и
Раджарам, С., Агрономические характеристики хромосомы
1B и T1BL.1RS, близкие изолинии в яровом хлебе
Пшеница Сери M82, Euphytica, 1998, т. 103. С. 195–
202.
22. Риберио-Карвальо, К., Гедес-Пинто, Х., Хеслоп-Харри-
сын, Дж. С. и Шварцахер, Т., Интрогрессия ржи
Хроматин на хромосоме 2D в португальской пшенице
Ландрас «Барбела», Геном, 2001, т. 44, pp. 1122–
1128.
23. Бадаев Н.С., Бадаева Е.Д., Максимов Н.Г., Зеле-
нин А.В. Цитогенетическое исследование гибридов, полученных скрещиванием гексаплоидного тритикала с Common
Пшеница, Теор.Прил. Genet., 1985, т. 70. С. 536–541.
24. Плашке Дж., Ганал М.В. и Рёдер М.С. Выявление генетического разнообразия
в близкородственной хлебной пшенице с использованием микросателлитных маркеров
, Theor. Прил. Genet., 1995, т. 91,
с. 1001–1007.
25. Шуберт, И., Ши, Ф., Фукс, Дж., И Эндо, Т.Р., An Ef
cient Скрининг на терминальные делеции и транслокации
хромосом ячменя, добавленных к обычным
пшеницы Завод Дж., 1998, т. 14. С. 489–495.
26. Райли Р., Чепмен В., Производство и фенотипы линий присоединения хромосом пшеницы и ржи к ржи и пшенице,
Наследственность, 1958, вып. 12. С. 301–315.
27. Лукашевский А.Дж., Хроматиды и тип хромосом
Циклы разрыв – слияние – мостик в пшенице (Triticum
aestivum L.) Генетика, 1995, вып. 140. С. 1069–1085.
28. Friebe, B., Kynast, R.G., and Gill, B.S., Gametocidal
Фактор-индуцированные структурные перестройки в мосомах ржи Chro-
, добавленные к пшенице обыкновенной, Chromosome Res.,
2000, т. 8. С. 501–511.
29. Масуди-Неджад А., Насуда С., Макинтош Р.А. и
Эндо Т.Р., Перенос хромосомных сегментов ржи в пшеницу
с помощью гаметоцидной системы, Chromosome Res.,
2002, т. . 10. С. 349–357.
Динамика структуры центромерного гистона CENh4 в ржано-пшеничных амфидиплоидах (Secalotriticum)
Центромеры осуществляют интегральный контроль процесса деления клеток и правильного распределения хромосом в дочерних клетках.Правильное течение этого процесса часто нарушается при удаленной гибридизации, которая является стрессовым фактором. Комбинация родительских геномов разных видов в гибридной клетке приводит к «геномному шоку», за которым следует потеря генов, изменение экспрессии генов, делеции, инверсии и транслокации участков хромосом. Созданные аллополиплоидные гибриды ржи и пшеницы, которые вместе получили название secalotriticum, представляют собой новую интересную модель для изучения влияния удаленной гибридизации на центромеру и ее компоненты.Основным признаком активной центромеры является наличие специфической модификации гистона h4 в центромерных нуклеосомах, которая у растений обозначается как CENh4. В данной работе представлены результаты цитогенетического анализа кариотипов гибридов secalotriticum и сравнение структуры N-концевого домена CENh4 родительской и гибридной форм. Показано, что кариотипы созданных форм secalotriticum представляют собой стабильные сбалансированные гексаплоиды, полностью или частично не содержащие минихромосомы с удаленными плечами.Высокий уровень гомологии между рожью и пшеницей позволяет экспрессировать обе родительские формы гена CENh4 в гибридных геномах сортов secalotriticum. Структура CENh4 у гибридов в каждой комбинации скрещивания имеет некоторые особенности. Процент полиморфизмов в нескольких положениях аминокислот намного выше у одного из гибридов secalotriticum, STr VD, чем у родительских форм, тогда как другой гибрид, STr VM, наследует высокий уровень аминокислотных замен в положении 25 от материнской родитель.
1. Введение
Многие виды трибы Triticeae являются природными аллополиплоидами и привлекательными объектами для получения синтетических гибридов, которые являются перспективным материалом для практической селекции. Наиболее распространенными и изученными примерами таких гибридов являются аллополиплоидный тритикале. Синтетический аллогексаплоидный тритикале имеет структуру генома, аналогичную гексаплоидной мягкой пшенице, за исключением того, что у него есть рожь в качестве одного из его предков вместо донора генома D Aegilops tauschii .Тритикале — важная модель для изучения быстрых изменений, которые происходят после полиплоидизации, включая ремоделирование генома и изменения в экспрессии генов [1]. Однако селекция и генетический анализ генофонда тритикале показали, что генетический потенциал адаптивности ржи реализован недостаточно. На молекулярном уровне было обнаружено, что 9% генов у октоплоидного тритикале и до 30% генов у гексаплоидного тритикале становятся молчащими [2], что может быть одной из причин неполной реализации генетического потенциала гибридов.
Синтез амфидиплоидов ржи и пшеницы, опылителем которых является пшеница ( Triticum L.), а материнская форма — рожь ( Secale L.), может предложить лучшие условия для повышения экспрессии генов ржи и создания ценных для селекции гибридов [3]. Подобные скрещивания обычно трудно достичь из-за несовместимости, поэтому ржано-пшеничные амфиплоиды еще не изучены. Преодоление этого барьера обычно связано с серьезными перестройками геномов родительских форм, что является наиболее ярким проявлением «геномного шока», возникающего при объединении геномов родителей в гибридную клетку [4] и сопровождающегося различными хромосомными аномалиями. , в том числе влияющие на структуру центромеры.Ранее было определено, что использование промежуточного вида тритикале в качестве источника геномов пшеницы при скрещивании с рожью оказалось эффективным для преодоления барьера однонаправленной прогамной несовместимости родительских видов [3]. В результате эти амфидиплоидные гибриды ржи и пшеницы были созданы путем скрещивания тетраплоидной ржи (RRRR, 2n = 4x = 28) с гексаплоидным тритикале (RRAABB, 2n = 6x = 42) и получили название secalotriticum (× Secalotriticum, син. × Secalotriticum = Secale L. × Triticum L., RRAABB, 2n = 6x = 42). Наличие материнской цитоплазмы ржи у гибридов было доказано путем анализа рестрикционных фрагментов видоспецифической митохондриальной ДНК 18S / 5S-повторяющихся последовательностей и ndhH -области хлоропластной ДНК, которые показали паттерн, характерный для хлоропластной ДНК и митохондриальной ДНК ржи [3 ]. Созданные гибриды secalotriticum характеризуются более широким диапазоном изменчивости по морфологическим и хозяйственно-ценным признакам по сравнению с исходными формами тритикале [3].Seсalotritiсum создает более благоприятные условия для повышения экспрессии генетических систем ржи и проявления ее ценных адаптивных свойств.
Процесс формирования гибридного генома и его последующая стабилизация напрямую связаны с нормализацией мейоза и правильной сегрегацией хромосом. Несовместимость центромер разных видов, по-видимому, является основной причиной элиминации хромосомы одного из родительских геномов у гибридов [5, 6]. Ключевая роль в правильной сегрегации хромосом во время мейоза и митоза лежит на центромерах, их идентичность определяется присутствием центромер-специфичного варианта гистона h4, известного у растений как центромер-специфический вариант гистона h4 CENh4 [7, 8].Это связано с тем, что на молекулярном уровне наиболее специализированной и универсальной характеристикой активной центромеры является присутствие CENh4 вместо канонического гистона h4 в нуклеосомах центромерного хроматина. Как было показано на некоторых видах млекопитающих и Drosophila , в случае потери центромерного гистона по какой-то причине не происходит образования кинетохор и правильной сегрегации хромосом во время деления клеток [9]. В отличие от канонического гистона Н3, который имеет консервативную структуру, CENh4 обычно обнаруживает значительную изменчивость у разных видов [5, 10, 11].Различные домены этой молекулы расходятся по-разному. Расширенный N-концевой хвостовой (NTT) домен и петля 1 гистонового складчатого домена (HFD) предположительно взаимодействуют с центромерной ДНК [12] и демонстрируют признаки положительного отбора у некоторых видов животных и растений [13], в то время как часть HFD, лежащий вне петли 1, обычно консервативен [14, 15].
Из-за особой роли CENh4 в формировании и функции центромер, мы исследуем эффекты удаленной гибридизации с использованием необычной комбинации родительских форм на структуру этого белка и выполняем цитогенетический анализ кариотипов.
2. Материалы и методы
Две комбинации секалотритикум (× Secalotriticum Rozenst., RRAABB, 2n = 6x = 42) Верасень × Михась (STr VМ) и Верасень × Дубрава (STr VD) были получены гибридизацией тетраплоидный сорт ржи Верасень (RRRR, 2n = 4x = 28) с гексаплоидными сортами тритикале Михась и Дубрава (AABBRR, 2n = 6x = 42). Тритикале выступил промежуточным видом, источником геномов пшеницы и ингибитором S-РНКаз ржи, что позволило преодолеть прогамную несовместимость ржи с пшеницей.Стабилизации кариотипов способствовало однократное обратное скрещивание гибридов рожь-тритикале пентаплоидных F1 (S / RRABR, 5x = 35) на тритикале с последующим самоопылением в течение 15 поколений и постоянным отбором на цитологическую стабильность и фенотипическую однородность.
Кариотипирование secalotriticum, идентификация исходных видовых хромосом проводилась с помощью раздавленных препаратов апикальной меристемы корня и дифференциального окрашивания по методу Гимза (C-banding) [16].
Молекулярный анализ проведен на растениях родительских форм и гибридов, выращенных в теплице.Суммарную РНК выделяли из листьев 10-12-дневных проростков 4-5 растений родительских форм. РНК гибридных форм выделяли от каждого растения отдельно. Выделение РНК проводили с использованием реагента TRI (MRC, Ink., США) [17]. Чтобы избежать загрязнения геномной ДНК, тотальную РНК обрабатывали ДНКазой RQ-RNase_Free (Promega, Мэдисон, США). Для синтеза кДНК использовали набор RevertAidTM H Minus First Strand cDNA Synthesis Kit (Thermo Scientific, США). Полученную кДНК использовали в качестве матрицы в серии реакций ПЦР с праймерами, синтезированными специально для амплификации N-концевого хвоста CENh4 (NTT).Последовательности праймеров представляют собой 5′-ATGGCCCGCACCAAGC (F) и 5′-GAAACTCGACCGACTTCTG (R). Размер продукта 268 п.н. Продукты ПЦР клонировали в плазмиду pTZ57R / T (набор для клонирования InsTAclone PCR, Thermo Scientific, США) и анализировали секвенированием по Сэнгеру с использованием набора BigDye Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems, США). Продукты реакции разделяли на приборе 3500 Genetic Analyzer (Applied Biosystems, США). Последовательности отдельных клонов, полученные для каждого образца, анализировали с помощью программного обеспечения UniPro Ugene (http: // ugene.net) и пакет программ FASTA [18]. Поиск идентичности нуклеотидных последовательностей проводился с использованием алгоритма BLAST в базе данных NCBI (http://blast.ncbi.nlm.nih.gov/Blast.cgi). Выравнивание аминокислот выполняли онлайн с использованием Clustal Omega (http://www.ebi.ac.uk/Tools/msa/clustalo) и использовали для последующего анализа и визуализации (http://www.jalview.org). Графические изображения были подготовлены с помощью программы Jalview (http://www.jalview.org/).
3. Результаты и обсуждение
Кариотипы секалотрита STr VM (Verasen ‘× Mikhas’) и STr VD (Verasen ‘× Dubrava) (S / RRAABB, 2n = 6x = 42) были проанализированы с помощью дифференциального окрашивания (C-banding ) [16].Этот метод выявляет характер локализации гетерохроматических областей, который является специфическим для каждой хромосомы ржи и пшеницы, что позволяет идентифицировать каждую хромосому в гибридном кариотипе. Рисунки 1 (a) и 1 (b) показывают, что кариотипы гибридов STr VM и STr VD представляют собой стабильные сбалансированные гексаплоиды, не содержащие минихромосомы с удаленными плечами, полностью или частично. Гибриды и исходные формы ржи и пшеницы имеют идентичный образец С-образных полос.
Одним из проявлений геномного шока, возникающего в результате объединения двух родительских геномов в гибридной клетке в случае удаленной гибридизации, являются различные хромосомные аберрации.Делеции и транслокации отдельных хромосомных участков и хромосомных плеч являются одними из наиболее распространенных изменений и были обнаружены при цитогенетическом анализе как линий замены и добавления пшеница-рожь [19, 20], так и тритикале и потомков от скрещиваний тритикале × пшеница [19, 20] 21, 22]. При этом зарегистрированы нарушения в хромосомах обеих родительских форм. Стабилизации кариотипов secalotriticum способствовало однократное обратное скрещивание гибридов рожь-тритикале пентаплоидных F1 (S / RRABR, 5x = 35) на тритикале с последующим самоопылением в течение 15 поколений и постоянным отбором на цитологическую стабильность и фенотипическую однородность.Диплоидный геном RR-ржи у гибридов рожь-тритикале F1 является фактором стабилизации мейоза и обеспечивает функциональность гамет с различным хромосомным составом. Формирование генома secalotriticum происходит в F1BC1 на основе частично нередуцированных 21-хромосомных гамет пентаплоидов F1 со сбалансированными наборами хромосом гаплогеномов исходного вида (7 (R), 7 (A), 7 (B)). Разделение по уравнению (разделение на хроматиды) асинаптических унивалентов в анафазе I (AI) является основным источником хромосомных аномалий во время второго деления мейоза (MII): отдельные хроматиды не включаются в метафазную пластинку в MII; в анафазе II они часто отстают в делении от других хромосом, расслаиваются случайным образом, подвергаются фрагментации и образуют микроядра в тетрадах микроспор, что приводит к уничтожению генетического материала и анеуплоидии и геномной нестабильности [3, 23, 24].Стабильность генома secalotriticum и его генетическое разнообразие определяется типом цитоплазмы и некоторыми факторами, по-видимому, связанными со структурным и функциональным состоянием центромер в его геноме. Анализируя мейоз у гибридов, мы наблюдали образование (псевдо) унивалентов в основном в результате десинапсиса [23, 24]. Десинапсис здесь означает раннее разложение бивалентов на униваленты десинаптического происхождения (псевдоуниваленты), которые происходят в поздней профазе (прометафаза I) мейоза.В отличие от асинаптических унивалентов, характерных для тритикале, псевдоуниваленты сохраняют свою униполярную ориентацию центромер в редукционном (I) делении мейоза. Эквациональное (II) деление мейоза характеризовалось регулярной полярной сегрегацией и низким уровнем элиминации хромосом [23, 24].
Созданные формы secalotriticum подверглись быстрой стабилизации в мейозе при селекции на продуктивность. Стабилизация произошла за счет сужения спектра и быстрого снижения частоты хромосомных аномалий во втором делении мейоза (на 15-50%) в F1-F3, в том числе уровня элиминации хромосом (с 30% до 6%). тетрады с микроядрами).У F3-5 и последующих поколений secalotriticum нормализация первого деления мейоза была более выраженной: средний уровень аномалий в метафазе ИМ снизился с 57,3% в F3 до 16,9% в F5, а также с 25-30% до 8. -10% в анафазах AI-AII и достигала менее 5% на стадии тетрад [3, 23, 24]. Тот факт, что упомянутые выше хромосомные изменения имеют тенденцию происходить быстро и наиболее интенсивно в первых поколениях, вплоть до пятого включительно и особенно в F1 до удвоения хромосом, вероятно, является общей тенденцией удаленной гибридизации злаков [3, 21 , 23, 24].Таким образом, непрерывные циклы скрещиваний в продукции secalotriticum сыграли значительную роль в стабилизации гибридного кариотипа и замещении возможных потерянных частей родительских геномов в первых поколениях после гибридизации.
Различия в структуре CENh4 между родителями позволяют оценить уровень экспрессии родительских форм белка в новом геномном окружении, возникающем в гибридной клетке при удаленной гибридизации. Первая работа по изучению возможной связи различий в структуре CENh4 у родительских форм с процессами сегрегации хромосом родительских геномов при делении гибридных клеток была проведена на гибридах, полученных от скрещивания культурного ячменя H.vulgare и его ближайший дикий родственник H. bulbosum [5]. Молекулы CENh4 не были включены в центромеры хромосом H. bulbosum , которые при этом были инактивированы и элиминированы из гибридных эмбрионов. Возможно, отсутствие CENh4 в центромерах хромосом H. bulbosum вызвано заметными различиями в структуре этого белка между видами ячменя, особенно в структуре N-концевого хвоста (NTT) [5]. В отличие от видов ячменя, последовательности ДНК α и β форм CENh4 различных видов ржи и пшеницы имеют очень высокую идентичность (95-99%) [25], что значительно затрудняет поиск межвидовых различий и, соответственно, выявление характера их наследования в гибридных геномах.
Консенсусные аминокислотные последовательности, полученные из секвенированных клонов кДНК, полученных из α CENh4 NTT родительских форм Verasen ’и Mikhas’, отличаются только одной несинонимичной заменой аминокислотного серина на пролин в положении 25 (фиг. 2). Он был обнаружен в 73,3% проанализированных клонов сорта Верасен ‘(рис. 3 (а)), но только в 7,7% клонов отцовского сорта Михась. Сорт secalotriticum Verasen ’× Mikhas’ унаследовал высокое содержание пролина от материнской формы Verasen ’(67.4%, рисунок 3 (а)). Однако другой гибрид не поддерживает эту тенденцию: Verasen ’× Dubrava имеет такой же низкий процент замен (2,6%), как и донорский сорт тритикале Dubrava (6,7%). С другой стороны, Dubrava обычно имеет больший полиморфизм, чем донор Verasen ‘в нескольких нуклеотидных положениях, что приводит к следующим аминокислотным заменам: аланин на валин, аланин на глицин, глутаминовую кислоту на глутамин и лизин на аспарагин (Рисунки 2 и 3 (б)). Интересно, что хотя процент замен не превышает 50% (от общего числа секвенированных клонов), это значение намного выше у сорта secalotriticum Verasen ‘× Dubrava, чем у Dubrava, что-то вроде случая гетерозиса (рис. )).Таким образом, полученные результаты указывают на то, что оба родительских генома участвуют в продукции белка CENh4 у гибридов secalotriticum. В то же время сравнение нуклеотидных и аминокислотных последовательностей наиболее вариабельного N-концевого хвоста молекулы CENh4 у родительских форм и гибридов не выявляет определенной тенденции наследования.
Опубликованные данные о регуляции экспрессии различных генов и других классов последовательностей ДНК в гибридных геномах, полученные путем скрещивания разных видов или контрастных популяций одного вида, указывают на сложный и гетерогенный образец наследования.Феномен доминирования ядрышка, характерный для экспрессии генов рибосомной РНК у тритикале, как пример геномного доминирования, заключается в репрессии генов рРНК ржи посредством метилирования цитозина [26]. Однако этот тип наследования, а именно геномное доминирование одного из родителей, не характерен для большинства других примеров. Результаты изучения экспрессии генов у гибридов между разными экотипами Arabidopsis противоречивы. В одном случае было идентифицировано общее материнское доминирование [27], в то время как в другом было обнаружено, что материнский и отцовский геномы транскрипционно эквивалентны [28].Также было продемонстрировано, что различные гибридные комбинации демонстрируют значительные вариации в активации родительских аллелей [29]. У некоторых гибридов между экотипами Arabidopsis документально подтвержден гетерозис по биомассе и урожаю семян [30]. У этих гибридов 95% активных генов демонстрируют промежуточный уровень экспрессии. Среди большинства других генов, не экспрессируемых аддитивно, сдвиг экспрессии происходил в сторону материнского родителя [30]. При изучении транскрипции и эпигенетической адаптации хромосом кукурузы в добавленных линиях овса-кукурузы, содержащих полный геном овса и отдельные хромосомы кукурузы, большинство генов кукурузы показали транскрипцию, специфичную для кукурузы, но репрессия активности генов была более распространенной тенденцией, чем активация [31].
Уровень экспрессии родительских генов у аллополиплоидных гибридов, полученных при скрещивании видов пшеницы и ржи, представляет для нас значительный интерес. Нам не известны такие исследования, проведенные на secalotriticum; однако обширный анализ экспрессии гена ржи с использованием кДНК, выделенной из различных тканей гибридных растений, был проведен на аллогексаплоидном тритикале, полученном от скрещивания T. turgidum × S. cereale [1]. Выявлены классы отсутствующих или молчащих генов ржи.Сравнение диплоидной ржи и гексаплоидного тритикале выявило 112 контигов кДНК ржи (~ 0,5% от общего количества), которые не были определены анализом экспрессии ни в одной из тканей тритикале, хотя их экспрессия была относительно высокой в тканях ржи. Средняя идентичность последовательностей ДНК между генами ржи, не обнаруженными в тритикале, и их наиболее сходными контигами в геномах A и B у T. aestivum составила только 81%. Эта степень идентичности была значительно ниже, чем в среднем в мире 91% идентичности между набором из 200 случайно выбранных генов ржи и их наилучшими совпадениями в геномах A и B T.aestivum . Таким образом, гены ржи с низким сходством со своими гомеологами в геномах Triticum имеют более высокую вероятность репрессии или отсутствия из-за делеций в геномах аллополиплоидов. Этот вывод хорошо согласуется с нашими результатами. Высокая идентичность последовательностей CENh4 ржи и пшеницы (99%) обеспечивает высокий уровень экспрессии обеих родительских форм в гибридных геномах secalotriticum.
Доступность данных
Данные, использованные для подтверждения выводов этого исследования, можно получить у соответствующего автора по запросу.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Работа поддержана Российским фондом фундаментальных исследований (проект 18-54-00013), Российской программой фундаментальных научных исследований (проект 0310-2018-0010) и Белорусским республиканским фондом фундаментальных исследований (проект Б18Р-170).
Вариация номера хромосомы
Эуплоидия и видообразование растений
Одной из целей селекции растений было создание аллополиплоидов, обладающих новыми чертами, которые не встречается у других видов.На сегодняшний день разработан один полезный аллополиплоид — тритикале. Этот амфидиплоид был получен в результате опыления пшеницы (Triticum, 2n = 42) рожью (Secale, 2n = 14). Целью этого эксперимента было объединить грубый фенотип ржи с высоким Урожайность пшеницы. Окончательный хромосомный состав составил 2n = 56 хромосом.Теперь было продемонстрировано, что аллополиплоидия была основным генетическим событием в процессе развития растений. видообразование. Анализ геномов растений позволил понять, как эти эволюционные события произошла и скорость, с которой может происходить эволюция.Три рода растений, которые будут обсуждаются Brassica , пшеница и Spartina .
Brassica Спецификация Три вида Brassica образуют триаду, от которой произошли три других вида в тех же родах. полученный. B. oleracea (брокколи и цветная капуста) имеет гаплоидное число хромосом n = 9 и гаплоидное число для B. campesteris (репа) n = 10. Еще Brassica видов, B.napus имеет гаплоидное число n = 19. Этот вид, по-видимому, произошел в результате гибридизации B. oleracea с B. campesteris с последующим удвоением хромосом для получения новых разновидность. (Этот вид в настоящее время является основным источником исследований из-за качества его масла.) На рисунке ниже показано, как амфидиплоидия породила два других родственных вида Brassica .Вставьте сюда фигуру Brassica
Вид пшеницы
Пшеница сыграла важную роль в развитии мировой цивилизации.В одомашнивание пшеницы было важным событием в мировой цивилизации, потому что это позволило людям переход от кочевых охотничьих сборов к постоянным жителям определенных мест. Следующие это предлагаемая в настоящее время разработка современной мягкой пшеницы.
Triticum urartu (AA) X Aegilops speltoides (BB)
|
|
|
\ _ /
Triticum turgidum (AABB) X Triticum tauschii (DD)
|
|
|
\ _ /
Triticum aestivum (AABBDD)
Археологические данные показали, что Triticum turgidum (AABB) выращивали в обеих Месопатамии.
(Долина рек Тигр и Евфрат) и в долине реки Нил 10 000 лет назад.Потому что дикий T. tauschii встречается только в горных районах юга России, западного Ирана и северных регионов.
Ираг считается, что гибридизация, дающая T. aestivum , произошла именно в этом регионе. Оно имеет
было высказано предположение, что это произошло совсем недавно, 8000 лет назад, что совпадает с
развитие коллективных поселений человеком. Пшеница, разработанная вышеупомянутыми
Схема гибридизации каждый культивируется сегодня.В культуре т.turgidum называется твердой пшеницей. Северная Дакота, по сути, единственный штат в США, где выращивают твердую пшеницу. Эта пшеница обработано и использовано для макаронных изделий. Хлеб, печенье и мучные кондитерские изделия — это возделываемые сорта т. aestivum . Северная Дакота также является ведущим производителем этой пшеницы, а Северная Дакота часто производитель №1 по всем видам пшеницы.
Спартиния Вид Последний пример аллополиплоидов — недавнее развитие нового вида солончаков.В семена американской солончаковой травы начала девятнадцатого века ( Spartina alterniflora ) были случайно перевезли на южное побережье Англии и северное побережье Франции. В трава начала расти в том же месте, что и европейская солончаковая трава ( S. maritima ). выросли. Вскоре появился новый вид солончаков — трава Таунсенда ( S. townsendii ). Модель роста этого вида была более энергичной, и вскоре он вытеснил два других вида. аборигенные виды.Эти характеристики были признаны, и вскоре он был введен в Голландию для стабилизировать дамбы, а затем и в другие места по той же причине.Хромосомный анализ показал, что трава Таунсенда была амфидиплоидом, потому что ее хромосомный номер, 2n = 122, может происходить из американской (2n = 62) и европейской (2n = 60) хромосомы числа. По-видимому, на пляжах произошла гибридизация с последующим хромосомным удвоение, чтобы произвести текущий вид. Важно учитывать, насколько быстро видообразование может происходить из аллополиплоида.Ясно, что таунсендские травы появились и стали создана в течение 100 лет из-за своего стремительного роста.
Было подсчитано, что около 50% всех покрытосеменных (цветковых растений) полиплоидны. В Ниже приведены некоторые примеры обычных культурных растений, которые являются автополиплоидами.
| Дикие виды | Культурные виды |
|---|---|
| Дикий картофель (2n = 24) | Культурный картофель (2n = 48) |
| Дикий хлопок (2n = 26) | Культурный хлопок (2n = 52) |
| Георгин (2n = 32) | Георгин садовый (2н = 64) |
| Дикий табак (2n = 24) | Культурный табак (2n = 48) |
Для некоторых видов растений наблюдается ряд последовательных уровней плоидности.Чтобы описать эти вида необходимо ввести последний символ X. X — базовое число хромосом для определенный ряд видов. Для розы 2n = 14, а базовое число хромосом (X) равно 7. Итак для диплоидной розы 2n = 2X = 14. Однако для серии тетраплоидные виды роз составляют 2n = 4X = 28. хромосом, пентаплоидные розы — 2n = 5X = 35 хромосом, а гексаплоидные розы — 2n = 6X = 42 хромосомы. Виды папоротников имеют одно из самых больших чисел хромосом, и это результат полиплоидия.Папоротник гадюки (Ophiglossum) имеет базовое число 120 хромосом. В диплоидный вид — 2n = 2X = 240 хромосом. Один родственный вид имеет 2n = 10X = 1200 хромосомы. Это демонстрирует высокий предел числа хромосом, обнаруженных в эукариотические виды.
Авторские права © 1997. Филипп МакКлин
Frontiers | B-хромосомы — вопрос хромосомного привода
Введение
Когда скорость передачи хромосом выше 0.5, не подчиняясь закону Мендели о равной сегрегации, результирующее преимущество передачи коллективно называется « влечение ». Хотя B-хромосомы (Bs), возможно, демонстрируют наиболее распространенную форму влечения, известную для генетических элементов (Jones, 1991), мало знаний существует о клеточном и молекулярном механизме, стоящем за их движением. B не являются необходимыми для роста и нормального развития организмов, но они присутствуют во всех типах эукариот и, как считается, обозначают особый тип эгоистичной ДНК (Kimura and Kayano, 1961; Jones and Rees, 1982; Jones, 1991; Берт и Триверс, 2006).B могут различаться по структуре и свойствам хроматина видоспецифичным образом. Как правило, предполагается, что B происходят из стандартных хромосом (также называемых хромосомами A), либо от того же самого, либо от родственного вида (см. Обзор в Camacho et al., 2000; Jones and Houben, 2003; Houben et al., 2014). ; Валенте и др., 2016). Помимо B-хромосом, различные другие генетические элементы способствуют их собственной передаче за счет других компонентов генома. Наиболее изученными примерами драйва, которые соответствуют аутосомным искажателям, являются гаплотип t у мыши, убийца спор у грибов и Distorter сегрегации ( SD ) у Drosophila (Lyttle, 1991).О естественном мейотическом влечении, связанном с половыми хромосомами и влияющем на соотношение полов, сообщалось в основном у Rodentia и Diptera (обзор Helleu et al., 2015).
Привод В-хромосом происходит в пре-мейотических, мейотических или пост-мейотических делениях видоспецифическим образом. Помимо драйва, неменделирующее наследование Bs также может быть вызвано митотической и мейотической нестабильностью. Максимальное количество B, переносимое хозяином, варьируется между видами (например, кукуруза, чеснок и рожь могут нести до 34, 20, 6 B, соответственно) и зависит от баланса между накоплением B-хромосом на основе драйва и B-хромосомой. отрицательные эффекты, особенно на фертильность и жизнеспособность [эффекты, вызванные витаминами B, перечислены в Bougourd and Jones (1997)].Однако не все виды, несущие B, обладают приводным механизмом. У этих видов, вероятно, должно действовать противодействие выгодным свойствам, чтобы поддерживать полиморфизм B [примеры перечислены в Jones (1991)]. В то время как предыдущие обзоры на Bs уже давали исчерпывающие обзоры эволюции и общего значения влечения B-хромосомы (Jones, 1991; Burt and Trivers, 2006), этот обзор будет сосредоточен на потенциальном механизме, лежащем в основе влечения, приводящем к большему, чем ожидалось, количеству. Bs в следующем поколении.
Механизм В-хромосомы у ржи и других видов
Постмейотический драйв В-хромосомы ржи ( Secale cereale L.) является одним из наиболее проанализированных механизмов среди B-хромосом. Хасегава (1934) первым отметил необычное поведение В-хромосом во время первого митоза пыльцевого зерна ржи. Он описал поведение B следующим образом: «… две расщепленные половины (сестринские хроматиды) дополнительных хромосом в большинстве случаев включаются в генеративное ядро в поздней анафазе.Его наблюдения были резюмированы в изумительных ручных рисунках, показанных на рисунке 1. Он заметил, что во время анафазы первого митоза пыльцы две В-хроматиды не расщепляются, и в большинстве случаев обе В-хроматиды становятся частью генеративного ядра. Основываясь на этом наблюдении, он пришел к выводу, что «… из-за нерегулярного распределения дополнительной (B) хромосомы, растения, имеющие 14, 15 и 16 хромосом в диплоиде, можно ожидать в потомстве 8-хромосомной ржи» (примечание, в настоящее время термин «В-хромосома» еще не существовал, и растение ржи, имеющее 2Bs, было названо «8-хромосомная рожь», в то время как нормальная рожь имеет семь пар хромосом).Частота отсутствия расхождения при первом митозе пыльцы зависит от генотипа (Puertas et al., 1998, 2000). При втором митозе пыльцы сестринские хроматиды В делятся нормально, как стандартные хромосомы. У ржи привод был обнаружен у растений с количеством B до шести (Kishikawa, 1965). При скрещиваниях 0B × 2B или 2B × 0B в потомстве получают растения с количеством до 4B. Однако растения с нечетным числом B наблюдались редко (Müntzing, 1945). Предполагалось, что подобный драйв имеет место и у женских гаметофитов.В самом деле, Håkanson (1948) наблюдал анафазные клетки с отстающими Bs также в эмбриональном мешке во время первого постмейотического деления. Подобный драйв Bs во время первого митоза пыльцы был обнаружен у видов Triticeae . Aegilops mutica и A. speltoides. (Mendelson, Zohary, 1972; Ohta, 1996). Примечательно, что неразрывная связь B также работает, когда избыточная хромосома ржи вводится в качестве дополнительной хромосомы в S. vavilovii (Puertas et al., 1985), гексаплоидную пшеницу (Lindström, 1965; Müntzing, 1970; Niwa et al. ., 1997; Endo et al., 2008) или гипопентаплоид Triticale (Kishikawa, Suzuki, 1982). Следовательно, В-хромосома сама регулирует процесс нерасхождения (Matthews and Jones, 1983; Romera et al., 1991).
РИСУНОК 1. Ручной рисунок Хасегавы (1934), впервые изображающий процесс возбуждения В-хромосомы при первом митозе пыльцы у ржи (А) метафаза, (В) отстающая В-хромосома из-за отсутствия расхождения. . (C) Разъединенные сестринские хроматиды B-хромосомы, идущие к разным полюсам, (D) хромосомный драйв, будущее генеративное ядро получает обе сестринские хроматиды B, в отличие от вегетативного ядра, содержащего только 7 стандартных хромосом A. .Было получено разрешение на использование материалов, защищенных авторским правом, от Японского общества Менделя.
Анализ вариантов В-хромосомы позволил идентифицировать участок, контролирующий процесс недифференцировки на конце длинного плеча хромосомы. Рожь B, лишенная так называемой области контроля неразъединения (NCR) (например, изокороткое плечо Bs), подвергается нормальному разъединению в первой анафазе пыльцы [(Müntzing, 1945, 1948; Håkanson, 1959; Endo et al., 2008). , Фигура 2]. NCR может действовать в trans , потому что отсутствие дизъюнкции работает для стандартной и дефектной B-хромосомы, если стандартная B или NCR-содержащая область длинного B-плеча присутствует в одной и той же клетке (e.g., перемещенный в хромосому A), обрабатывающий дефицитный B (Lima-de-Faria, 1962; Endo et al., 2008). В гетерохроматическом NCR находится несколько B-специфических сателлитных ДНК (Sandery et al., 1990; Blunden et al., 1993; Carchilan et al., 2007; Klemme et al., 2013). NCR также метят эухроматин-специфической посттрансляционной гистоновой меткой h4K4me3 (Carchilan et al., 2007). Наблюдение за тем, что некоторые NCR-специфические сателлиты продуцируют длинную некодирующую РНК преимущественно в пыльниках (Carchilan et al., 2007) может указывать на возможное участие NCR-производной некодирующей РНК в поддержании слипчивости в ключевых регионах B-сестринских хроматид, предотвращая правильную сегрегацию. Вероятно, нарушение митотической сегрегации отражает нарушение правильного разрешения перицентромерного гетерохроматина В-хромосомы во время первого митоза пыльцы ржи.
РИСУНОК 2. Структура и привод В-хромосом ржи. trans -действующая область контроля дизъюнкции (NCR) обогащена B-специфическими сателлитными ДНК, экспрессирующими некодирующую РНК.Во время первого митоза пыльцы Bs не разъединяются, и обе хроматиды предпочтительно включаются в генеративное ядро. Напротив, из-за отсутствия NCR-дефицитных Bs сегрегируют во время первого митоза пыльцы, как стандартные хромосомы A.
Хотя никакого сходства между последовательностями, расположенными на NCR- и B (пери) центромере, не описано, интересно, что на уровне белка существует некоторое сходство между частью NCR-расположенного сателлитного повтора E3900 (который кодирует частичный gag ). ретротранспозона LTR Ty3 / gypsy-типа) и консервативные центромерные повторы osrch4 и CentC риса и кукурузы соответственно (Langdon et al., 2000). С другой стороны, сходство последовательностей между некодирующей РНК и целевой областью не требуется. Например, участки некодирующей РНК Xist (X-inactive specific transcript), которые необходимы для локализации на инактивированной половой X-хромосоме, не имеют заметного сходства на уровне последовательностей (Wutz et al., 2002). Следовательно, возможно, что некодирующие РНК, кодируемые В-хромосомой, блокируют доступ к необходимым факторам в определенных геномных локусах, таких как перицентромера В; в качестве альтернативы некодирующие РНК, происходящие из B, могут действовать как «направляющие молекулы» для управления белковыми комплексами (Banaei-Moghaddam et al., 2012).
В качестве альтернативы или в дополнение недавняя идентификация неожиданно большого количества B-кодируемых транскриптов у ряда видов, например, у ржи (Martis et al., 2012; Banaei-Moghaddam et al., 2013; Ma et al., 2016), рыб (Silva et al., 2014; Valente et al., 2014; Ramos et al., 2016), Drosophila (Bauerly et al., 2014) и цервид (Makunin et al., 2016). основание для гипотез об участии генов, кодирующих белок, или псевдогенов, в контроле отсутствия дизъюнкции.Напр., B-специфический ген, контролирующий не дизъюнкцию, может существовать по аналогии с механизмом привода половых хромосом у Drosophila . У Drosophila simulans быстро эволюционирующий ген Х-сцепленного гетерохроматинового белка 1, HP1D2 , выполняет важную функцию в системе мейотического влечения парижского типа соотношения полов (Helleu et al., 2016).
Состав (пери) центромеры различается между хромосомами А и В
Сравнение центромер А и В ржи выявило различия в составе (пери) центромерных повторов (Banaei-Moghaddam et al., 2012). Центромера B имеет те же известные повторы, что и центромера As. Но кроме того, перицентромера B расширена B-специфическим повтором ScCl11 и митохондриальной ДНК. Обе последовательности не взаимодействуют с CENh4-содержащими нуклеосомами (Banaei-Moghaddam et al., 2012). Можно представить себе, что центромера B произошла от стандартной центромеры и дополнительных повторов, накопленных в центромере новообразованной B-хромосомы. Сравнимый отчетливый состав наблюдался также для центромеры В-хромосомы кукурузы.Повторы CentC и специфические для центромеры ретротранспозоны кукурузы B разрушаются видоспецифичными B-центромерными последовательностями (Jin et al., 2005).
Накопление B-специфических повторов в перицентромере, вероятно, участвует в организации перицентрического гетерохроматина, который, как мы знаем, играет роль в сегрегации хромосом (Yamagishi et al., 2008). Гетерохроматин необходим для правильного сцепления сестринских хроматид, например, в Schizosaccharomyces pombe , повторы рядом с кинетохорой необходимы для правильного сцепления сестринских хроматид (Bernard et al., 2001).
Клеточные события во время В-хромосомы у ржи и других видов
У ряда видов растений веретено микротрубочек асимметрично во время митоза первого пыльцевого зерна. Асимметрия этого деления играет критическую роль в последующем формировании неравных дочерних клеток, генеративной и вегетативной (Twell, 2010). Из-за асимметричного деления и образования двух ядер, имеющих разную степень конденсации хроматина, у ржи центромеры A-хромосомы сгруппированы в конденсированном генеративном ядре, тогда как в менее конденсированном вегетативном ядре центромеры разбросаны по большей площади (Banaei- Moghaddam et al., 2012). Примечательно, что в генеративном ядре центромеры A и стандартные хромосомы B не смешиваются. Напротив, Bs, лишенные NCR-области, группируются вместе с A-хромосомами. Т.о., отчетливое межфазное положение стандартных Bs в генеративном ядре вероятно связано с их отставанием от разделенных хроматид A во время анафазы первого митоза пыльцы (Banaei-Moghaddam et al., 2012).
Принимая во внимание асимметричную геометрию веретена при первом митозе пыльцы, вероятно, как предположил Джонс (1991), включение Bs в генеративное ядро вызвано тем фактом, что экваториальная пластина находится ближе к генеративному полюсу и Отстающие B пассивно включаются в генеративное ядро.Альтернативно, из-за более высокой тянущей силы на B центромере по направлению к генеративному полюсу Bs могут преимущественно накапливаться в генеративном ядре (Banaei-Moghaddam et al., 2012). Асимметричные веретена, вероятно, также являются ключевым компонентом мейотического привода B-хромосом у кузнечиков Myrmeleotettix maculatus (Hewitt, 1976) и премейотического привода Bs у Asteraceae Crepis capillaris (Rutishauser, 1966). Таким образом, асимметрия веретена микротрубочек, по-видимому, является компонентом механизмов накопления B.
В кукурузе для движения Bs требуется фактор, расположенный на длинном плече B, который может действовать на в транс. Приводной механизм кукурузы B включает нерасхождение во втором митозе пыльцевого зерна, помещая две копии B в один из двух сперматозоидов. Сперматозоиды, несущие Bs, предпочтительно оплодотворяют яйцеклетку (Роман, 1947; Карлсон, 1978; Лэмб и др., 2006). Характеристика эпигенетически подавленной центромеры B кукурузы продемонстрировала, что отсутствие дизъюнкции не зависит от функциональной центромеры (Han et al., 2007). У кукурузы нерасхождение Bs также имеет место в клетках эндосперма и тапетума (Alfenito and Birchler, 1990; Chiavarino et al., 2000). В клетках тапетума Bs опосредуют нестабильность A хромосом (Gonzalez-Sanchez et al., 2004). Спорофитное нерасхождение B происходит в основном, если эта сверхкомплектная хромосома присутствует с большим числом копий, это означает, что недизъюнкция подавляется, если количество Bs низкое (Masonbrink and Birchler, 2010). Один фактор, кодируемый стандартной хромосомой А кукурузы, по-видимому, влияет на процесс накопления B (Gonzalez-Sanchez et al., 2003). Ядра сперматозоидов, несущие делеционные производные транслокационной хромосомы B-9 (включающие части стандартной хромосомы A 9 и B), в которых отсутствует центральный гетерохроматин и, возможно, некоторый эухроматин B, больше не обладают способностью к преимущественному оплодотворению яйцеклетки. (Карлсон, 2007). Таким образом, хотя В-хромосомы ржи и кукурузы возникли независимо (Martis et al., 2012), сходные механизмы возбуждения у обоих злаков развивались параллельно.
Перспективы на будущее
Учитывая, что Bs не существовали бы без драйва, пора расшифровать этот процесс на молекулярном уровне.С развитием новых аналитических инструментов становится возможным лучшее понимание этого интригующего механизма. Достаточная информация о последовательности генома доступна для некоторых видов, несущих В-хромосому, или может быть получена для поиска генов-кандидатов некодирующих транскриптов, участвующих в процессе влечения. Сравнительный анализ транскриптов генотипов с разной степенью недисъюнкции B может быть использован для идентификации транскриптов, не связанных с дизъюнкцией. Методы редактирования генома станут инструментами для анализа функции последовательностей, участвующих в неразъединении.Новые методы визуализации хроматина (например, CRISPR-FISH) позволяют маркировать определенные области генома в живых клетках, что полезно для расшифровки пространственно-временного распределения Bs; и даже засвидетельствовать процесс хромосомного движения в живых клетках. Сочетание инновационных технологий расширит наши возможности по раскрытию тайны В-хромосомы.
Авторские взносы
Автор подтверждает, что является единственным соавтором данной работы, и одобрил ее к публикации.
Финансирование
Эта работа была поддержана DFG Германии (HO 1779 / 10-1 / 14-1).
Заявление о конфликте интересов
Автор заявляет, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Я благодарю своих коллег и рецензентов за их полезные предложения, содержательные комментарии и обсуждения этого обзора.
Список литературы
Альфенито, М.и Бирчлер Дж. (1990). Исследования стабильности B-хромосомы во время развития. Майдика 35, 359–366.
Google Scholar
Банаеи-Могхаддам, А. М., Мейер, К., Карими-Аштияни, Р., и Хубен, А. (2013). Формирование и экспрессия псевдогенов на В-хромосоме ржи. Растительная клетка 25, 2536–2544. DOI: 10.1105 / tpc.113.111856
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Банаеи-Могхаддам, А. М., Шуберт, В., Кумке, К., Weiβ, O., Klemme, S., Nagaki, K., et al. (2012). Нерасхождение в пользу хромосомы: механизм привода В-хромосомы ржи во время митоза пыльцы. Растительная клетка 24, 4124–4134. DOI: 10.1105 / tpc.112.105270
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бауэрли Э., Хьюз С. Э., Виетти Д. Р., Миллер Д. Э., МакДауэлл В. и Хоули Р. С. (2014). Обнаружение лишних В-хромосом у Drosophila melanogaster . Генетика 196, 1007–1016.DOI: 10.1534 / genetics.113.160556
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бернар П., Мор, Дж. Ф., Партридж, Дж. Ф., Женье, С., Джаверзат, Дж. П., и Олшир, Р. К. (2001). Необходимость гетерохроматина для сцепления центромер. Наука 294, 2539–2542. DOI: 10.1126 / science.1064027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бланден, Р., Уилкс, Т. Дж., Форстер, Дж. У., Хименес, М. М., Сандери, М.J., Karp, A., et al. (1993). Идентификация семейства E3900, 2-го семейства повторяющихся последовательностей, специфичных для хромосомы B ржи. Геном 36, 706–711. DOI: 10.1139 / g93-095
CrossRef Полный текст | Google Scholar
Берт А. и Триверс Р. (2006). Гены в конфликте: биология эгоистичных генетических элементов . Кембридж, Массачусетс: The Belknap Press of Harvard University Press, 602. DOI: 10.4159 / 9780674029118
CrossRef Полный текст | Google Scholar
Карчилан, М., Дельгадо, М., Рибейро, Т., Коста-Нунес, П., Каперта, А., Мораис-Сесилио, Л. и др. (2007). Транскрипционно активный гетерохроматин в В-хромосомах ржи. Растительная клетка 19, 1738–1749. DOI: 10.1105 / tpc.106.046946
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кьяварино, А. М., Розато, М., Мансанеро, С., Хименес, Г., Гонсалес-Санчес, М., и Пуэртас, М. Дж. (2000). На нерасхождение и нестабильность хромосом в тапетальных клетках влияют В-хромосомы кукурузы. Генетика 155, 889–897.
PubMed Аннотация | Google Scholar
Эндо, Т. Р., Насуда, С., Джонс, Н., Доу, К., Акахори, А., Вакимото, М., и др. (2008). Рассечение В-хромосом ржи и свойства нерасхождения рассеченных сегментов на фоне мягкой пшеницы. Genes Genet. Syst. 83, 23–30. DOI: 10.1266 / ggs.83.23
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гонсалес-Санчес, М., Гонсалес-Гонсалес, Э., Молина, Ф., Кьяварино, А. М., Розато, М., и Пуэртас, М. Дж. (2003). Один ген определяет накопление В-хромосомы кукурузы путем предпочтительного оплодотворения; другой ген (ы) определяет их мейотическую потерю. Наследственность 90, 122–129. DOI: 10.1038 / sj.hdy.6800185
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гонсалес-Санчес, М., Розато, М., Кьяварино, М., и Пуэртас, М. Дж. (2004). Хромосомная нестабильность и запрограммированная гибель клеток тапетальных клеток кукурузы с В-хромосомами и влияние на жизнеспособность пыльцы. Генетика 166, 999–1009. DOI: 10.1534 / genetics.166.2.999
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Håkanson, A. (1948). Поведение добавочных хромосом ржи в зародышевом мешке. Hereditas 34, 35–59. DOI: 10.1111 / j.1601-5223.1948.tb02826.x
CrossRef Полный текст | Google Scholar
Håkanson, A. (1959). Поведение различных мелкодоступных хромосом ржи при митозе пыльцы. Hereditas 45, 623–631.DOI: 10.1111 / j.1601-5223.1959.tb03071.x
CrossRef Полный текст | Google Scholar
Хан, Ф., Лэмб, Дж. К., Ю, В., Гао, З., и Бирчлер, Дж. А. (2007). Функция центромеры и нерасхождение являются независимыми компонентами механизма накопления В-хромосомы кукурузы. Растительная клетка 19, 524–533. DOI: 10.1105 / tpc.106.049577
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хеллеу, К., Жерар, П. Р., Дубрюй, Р., Огеро, Д., Прюдом, Б., Loppin, B., et al. (2016). Быстрая эволюция гетерохроматинового белка Y-хромосомы лежит в основе мейотического драйва половых хромосом. Proc. Natl. Акад. Sci. США 113, 4110–4115. DOI: 10.1073 / pnas.1519332113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Houben, A., Banaei-Moghaddam, A.M., Klemme, S., and Timmis, J. N. (2014). Эволюция и биология дополнительных B-хромосом. Ячейка. Мол. Life Sci. 71, 467–478. DOI: 10.1007 / s00018-013-1437-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джин, В., Лэмб, Дж. К., Вега, Дж. М., Доу, Р. К., Бирчлер, Дж. А. и Цзян, Дж. (2005). Молекулярное и функциональное рассечение центромеры В-хромосомы кукурузы. Растительная клетка 17, 1412–1423. DOI: 10.1105 / tpc.104.030643
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонс, Р. Н., и Рис, Х. (1982). B Хромосомы , 1-е изд. Нью-Йорк, штат Нью-Йорк: Academic Press.
Google Scholar
Кимура, М., и Каяно, Х. (1961). Поддержание лишних хромосом в диких популяциях Lillium callosum путем преимущественной сегрегации. Генетика 46, 1699–1712.
Google Scholar
Кишикава, Х. (1965). Цитогенетические исследования В-хромосом ржи, Secale cereale L в Японии. Agric. Бык. Saga Univ. 21, 1–81.
Google Scholar
Кишикава Х. и Судзуки А. (1982). Цитологическое исследование гипопентаплоидного тритикале с четырьмя В-хромосомами ржи. Jpn. J. Genet. 57, 17–24. DOI: 10.1266 / jjg.57.17
CrossRef Полный текст | Google Scholar
Клемме, С., Banaei-Moghaddam, A.M., Macas, J., Wicker, T., Novák, P., and Houben, A. (2013). Последовательности с высоким числом копий показывают отчетливую эволюцию В-хромосомы ржи. New Phytol. 199, 550–558. DOI: 10.1111 / nph.12289
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lamb, J. C., Han, F., Auger, D. L., and Birchler, J. A. (2006). Фактор транс-действия, необходимый для нерасхождения B-хромосомы, расположен дистальнее точки разрыва TB-4Lb на B-хромосоме. Maize Genet.Coop. News Lett. 80, 51–54.
Google Scholar
Лэнгдон, Т., Сиго, К., Джонс, Р. Н., Угэм, Х., Томас, Х., Форстер, Дж. У. и др. (2000). Эволюция de novo сателлитной ДНК на В-хромосоме ржи. Генетика 154, 869–884.
PubMed Аннотация | Google Scholar
Лима-де-Фариа, А. (1962). Генетическое взаимодействие у ржи выражено по хромосомному фенотипу. Генетика 47, 1455–1462.
Google Scholar
Линдстрем, Дж.(1965). Перенос на пшеницу дополнительных хромосом ржи. Hereditas 54, 149–155. DOI: 10.1111 / j.1601-5223.1965.tb02012.x
CrossRef Полный текст | Google Scholar
Ма, В., Габриэль, Т.С., Мартис, М.М., Гурсинский, Т., Шуберт, В., Врана, Дж. И др. (2016). Хромосомы ржи B кодируют функциональный белок, подобный Argonaute, с активностью слайсера in vitro, аналогичной его паралогу A-хромосомы. New Phytol. 213, 916–928. DOI: 10.1111 / Nph.14110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Макунин, А.И., Кичигин, И. Г., Ларкин, Д. М., О’Брайен, П. К., Фергюсон-Смит, М. А., Янг, Ф. и др. (2016). Контрастное происхождение В-хромосом у двух цервид (сибирская косуля и серый олень) выявлено с помощью хромосомно-специфичного секвенирования ДНК. BMC Genomics 17: 618. DOI: 10.1186 / s12864-016-2933-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартис, М. М., Клемме, С., Банаи-Могхаддам, А. М., Блаттнер, Ф. Р., Макас, Дж., Шмутцер, Т. и др. (2012).Эгоистичная сверхкомплектная хромосома обнаруживает свое происхождение как мозаику генома хозяина и последовательностей органелл. Proc. Natl. Акад. Sci. США 109, 13343–13346. DOI: 10.1073 / pnas.1204237109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мейсонбринк, Р. Э., и Берчлер, Дж. А. (2010). Спорофитное нерасхождение В-хромосомы кукурузы при большом количестве копий. J. Genet. Геномика 37, 79–84. DOI: 10.1016 / S1673-8527 (09) 60027-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мэтьюз Р.Б. и Джонс Р. Н. (1983). Динамика полиморфизма В-хромосомы у ржи II. Оценки параметров. Наследственность 50, 119–137. DOI: 10.1038 / HDY.1983.14
CrossRef Полный текст | Google Scholar
Мендельсон Д. и Зохари Д. (1972). Поведение и передача дополнительных хромосом у Aegilops speltoides . Наследственность 29, 329–339. DOI: 10.1038 / HDY.1972.97
CrossRef Полный текст | Google Scholar
Мюнцинг, А.(1945). Цитологические исследования экстрафрагментных хромосом ржи. II. Передача и умножение стандартных фрагментов и изо-фрагментов. Hereditas 31, 457–477. DOI: 10.1111 / j.1601-5223.1945.tb02763.x
CrossRef Полный текст | Google Scholar
Müntzing, A. (1948). Цитологические исследования экстрафрагментных хромосом ржи. V. Новый тип фрагмента, возникший в результате делеции. Hereditas 34, 435–442. DOI: 10.1111 / j.1601-5223.1948.tb02853.x
CrossRef Полный текст | Google Scholar
Мюнцинг, А.(1970). Хромосомная изменчивость в штамме Lindström пшеницы, несущей дополнительные хромосомы ржи. Hereditas 66, 279–286. DOI: 10.1111 / j.1601-5223.1970.tb02351.x
CrossRef Полный текст | Google Scholar
Нива К., Хориучи Г. и Хираи Ю. (1997). Производство и характеристика мягкой пшеницы с В-хромосомами ржи из Кореи. Hereditas 126, 139–146. DOI: 10.1111 / j.1601-5223.1997.00139.x
CrossRef Полный текст | Google Scholar
Охта, с.(1996). Механизмы накопления В-хромосом у Aegilops mutica Boiss. Genes Genet. Syst. 71, 23–29. DOI: 10.1266 / ggs.71.23
CrossRef Полный текст | Google Scholar
Пуэртас, М., Хименес, Г., Мансанеро, С., Кьяварино, А. М., Розато, М., Наранхо, К. А., и др. (2000). Генетический контроль передачи В-хромосомы у кукурузы и ржи. Хромосомы сегодня 13, 79–92. DOI: 10.1007 / 978-3-0348-8484-6_7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пуэртас, М.Дж., Хименес, Г., Мансанеро, С., Чиаварино, А. М., Розато, М., Наранхо, К. А. и др. (1998). Генетический контроль передачи В-хромосомы у кукурузы и ржи. Cytogenet. Cell Genet. 81, 103–103.
PubMed Аннотация | Google Scholar
Пуэртас, М. Дж., Ромера, Ф., и Делапена, А. (1985). Сравнение эффектов В-хромосомы на Secale cereale и Secale vavilovii . Наследственность 55, 229–234. DOI: 10.1038 / HDY.1985.95
CrossRef Полный текст | Google Scholar
Рамос, Э., Cardoso, A. L., Brown, J., Marques, D. F., Fantinatti, B.E., Cabral-de-Mello, D. C., et al. (2016). Повторяющийся элемент ДНК BncDNA, обогащенный B-хромосомой рыбы-цихлиды Astatotilapia latifasciata, транскрибирует потенциально некодирующую РНК. Chromosoma (в печати). DOI: 10.1007 / s00412-016-0601-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роман, Х. (1947). Митотическое нерасхождение в случае обменов с участием хромосомы B-типа кукурузы. Генетика 32, 391–409.
PubMed Аннотация | Google Scholar
Ромера Ф., Хименес М. М. и Пуэртас М. Дж. (1991). Факторы, контролирующие динамику полиморфизма В-хромосомы корейской ржи. Наследственность 67, 189–195. DOI: 10.1038 / HDY.1991.79
CrossRef Полный текст | Google Scholar
Рутисхаузер А. и Ротлисбергер Э. (1966). Механизм повышения B-хромосом в Crepis capilaris. Хромосомы сегодня 1, 28–30.
Google Scholar
Сандери М. Дж., Форстер Дж. У., Бланден Р. и Джонс Р. Н. (1990). Идентификация семейства повторяющихся последовательностей на В-хромосоме ржи. Геном 33, 908–913. DOI: 10.1139 / g90-137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Силва, Д. М., Пансонато-Алвес, Дж. К., Уцуномия, Р., Арая-Хайме, К., Руис-Руано, Ф. Дж., Даниэль, С. Н. и др. (2014). Определение происхождения B-хромосомы с помощью картирования FISH, окраски хромосом и анализа последовательности ДНК у Astyanax paranae (Teleostei, Characiformes). PLoS ONE 9: e94896. DOI: 10.1371 / journal.pone.0094896
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валенте, Г. Т., Конте, М. А., Фантинатти, Б. Э., Кабраль-де-Мелло, Д. К., Карвалью, Р. Ф., Викари, М. Р. и др. (2014). Происхождение и эволюция В-хромосом у рыб цихлид Astatotilapia latifasciata на основе комплексного геномного анализа. Мол. Биол. Evol. 31, 2061–2072. DOI: 10.1093 / molbev / msu148
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валенте, Г.T., Nakajima, R.T., Fantinatti, B.E., Marques, D.F., Almeida, R.O., Simões, R.P. и др. (2016). В-хромосомы: от цитогенетики до системной биологии. Хромосома [Epub перед печатью].
Google Scholar
Wutz, A., Rasmussen, T. P., and Jaenisch, R. (2002). Хромосомное молчание и локализация опосредуются разными доменами Xist РНК. Nat. Genet. 30, 167–174. DOI: 10,1038 / ng820
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ямагиши, Ю., Сакуно, Т., Шимура, М., и Ватанабэ, Ю. (2008). Гетерохроматин связывается с центромерной защитой путем привлечения шугошина. Природа 455, 251–255. DOI: 10.1038 / nature07217
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Последовательный состав и содержание гена короткого плеча хромосомы ржи (Secale cereale) 1
Флух, С., Копецки, Д., Бург, К., Шимкова, Х., Таудьен, С., Петцольд, А., Кубалакова, М., Платцер, М., Берени, М., Крайнер, С., Долежел, Я., Лелли, Т.PLoS ONE 7 (2) : e30784, 2012
Ключевые слова:
Аннотация: Задний план:
Цель исследования — выяснить последовательность составов короткого плеча хромосомы 1 ржи.
(Secale cereale) с особым вниманием к его генному составу, потому что эта часть генома ржи является неотъемлемой частью
несколько сотен сортов мягкой пшеницы по всему миру. Методология / основные выводы:
Множественная амплификация смещения ДНК 1RS, полученная из отсортированных по потоку 1RS
хромосомы, используя дителосомную линию добавления 1RS пшеница-рожь, и последующее секвенирование этой ДНК методом Roche 454FLX.
дали информацию о последовательности 195 313 589 п.н.Это количество информации о последовательности привело к охвату последовательности 0,436.
плеча хромосомы 1RS, что позволяет идентифицировать гены с расчетной вероятностью 95%. Детальный анализ
выявили, что более 5% последовательности 1RS состоит из генного пространства, идентифицируя по крайней мере 3,121 генный локус, представляющий
1882 различных генных функции. Повторяющиеся элементы составили около 72% последовательности 1RS, Gypsy / Sabrina (13,3%)
будучи самым многочисленным. Более четырех тысяч сайтов повторов простых последовательностей (SSR), в основном расположенных в связанных с генами
Считывания последовательности были идентифицированы для возможного развития маркера.Существование вставок хлоропластов в 1RS было доказано.
проверяется путем идентификации считываний химерной хлоропласт-геномной последовательности. Анализ синтения 1RS к полному геному Oryza
sativa и Brachypodium distachyon выявили, что около половины генов 1RS соответствуют дистальному концу короткого
плечо хромосомы 5 риса и проксимальная область длинного плеча хромосомы 2 Brachypodium distachyon.
Сравнение содержания генов в плечах хромосом ячменя 1RS и 1HS выявило высокую консервативность генов, связанных с
хромосома 5 риса.Выводы:
Настоящее исследование выявило содержание генов и потенциальные функции генов на этом плече хромосомы и
продемонстрировали многочисленные элементы последовательности, такие как SSR и связанные с генами последовательности, которые могут быть использованы для будущих исследований.
а также в селекции пшеницы и ржи.
DOI:
Полный текст: связаться с авторами IEB
Авторы IEB: Ярослав Долежел, Хана Шимкова
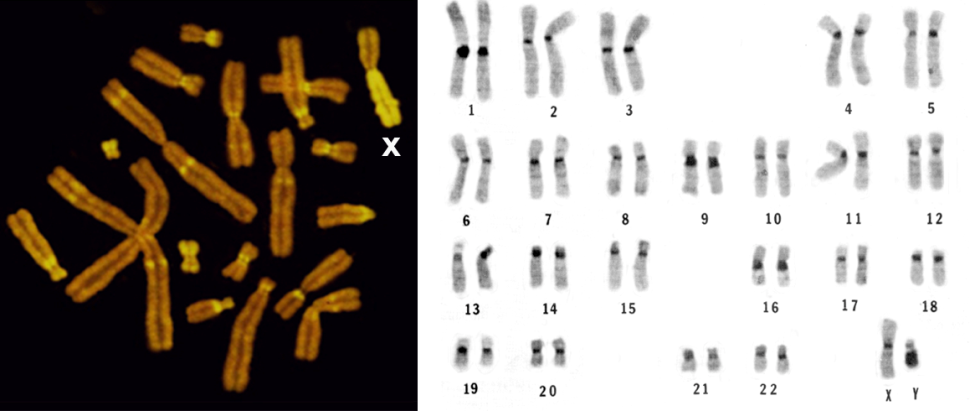 246
246
 Поражается мучнистой росой и септориозом
Поражается мучнистой росой и септориозом Растения выровненные, фертильные
Растения выровненные, фертильные
