Хеликобактер пилори: лечиться или нет? ??
Гастроэнтерологи всего мира уже сошлись во мнении, что бороться с хеликобактер с тем же размахом, как эпидемиологи в своё время боролись с оспой, неразумно. Чтобы полностью сжить со света эту бактерию, антибиотики придётся прописывать каждому второму.
В итоге, как полагает медицинское сообщество, мы получим множество случаев заболевания псевдомембранозным колитом — острым воспалением толстой кишки из-за приёма антибиотиков, а зловредную хеликобактер не изведём. Ведь у всех бактерий есть свойство мутировать, борясь за выживание.
В каких случаях нужно бороться с бактерией хеликобактер?
Споры от том, «лечить или не лечить», «выявлять или не выявлять», кипят так долго, что в итоге появился так называемый Маастрихтский консенсус. Это рекомендации врачей, выработанные на консилиуме по вопросам борьбы с бактерией.
Первая встреча медиков состоялась в городе Маастрихт, отсюда название свода рекомендаций на основе лабораторных исследований, которые регулярно обновляются.
Выводы медиков, сделанные в свете последних научных знаний о хеликобактер пилори:
- Лечение требуется при язве двенадцатиперстной кишки или желудка.
- Антибактериальная терапия назначается ближайшим родственникам пациентов с раком желудка.
- Эрадикация или полное уничтожение рекомендована при атрофическом гастрите. Именно он считается предраковым заболеванием, а отнюдь не язва желудка.
- Нужно лечение, если выявлена железодефицитная анемия. Впрочем, сначала врачам потребуется выяснить: пациент теряет железо или оно не всасывается из-за бактерии.
Всё, что перечислено выше, относится к случаям, когда бактерия уже выявлена. Однако перед медиками стоит и ещё один вопрос: нужно ли искать хеликобактер у всех людей подряд? Ответ, который чаще всего дают гастроэнтерологи: скорее нет, чем да. Список примерных кандидатов на анализ у специалистов уже есть.
Когда следует искать бактерию хеликобактер
- От болей в желудке не помогают ингибиторы протонной помпы — препараты, снижающие агрессивность желудочного сока.

- Наряду с утомляемостью появляется железодефицит — первый признак рака желудка.
- Пациент входит в группу риска: родственники болели раком желудка.
- Во время исследования выявлены дисплазия желудка, кишечная метаплазия или атрофический гастрит.
В рамках диспансеризации, даже если нет жалоб на боли в верхней части живота, можно раз в 7 лет делать гастроскопию и биопсию с целью выявления бактерии.
Схема эрадикации хеликобактер пилори
- 1–2 недели пациент получает комплексную медикаментозную терапию: ингибиторы протонной помпы, препараты висмута, антибиотики. Врач должен назначить и препараты, которые восполнят дефицит полезных микроорганизмов в желудке и кишечнике после приёма антибиотиков. Популярные средства: «Де-Нол», амоксициллин, «Флемоксин»; кларитромицин; азитромицин; тетрациклин; левофлоксацин.
- Больной повторно сдаёт анализы. Если бактерия осталась, через 5–6 недель врач снова назначает курс лечения, но уже с другими антибиотиками.

- Если после второго этапа лечения тест на хеликобактер снова окажется положительным, методика лечения выбирается в индивидуальном порядке.
Какие продукты следует исключить из рациона, если выявлена бактерия хеликобактер
- макароны;
- картофель;
- сладости;
- выпечка.
Гарднереллез | Описание заболевания — meds.ru
Гарднереллез — инфекционное заболевание половых органов, поражающее различные органы мочеполовой системы.
Что вызывает гарднереллез?
Развивается этот недуг у женщин вследствие увеличения в микрофлоре влагалища большого количества анаэробного микроорганизма (гарднереллы). У мужчин он не развивается. Но есть риск занесения в уретру вредных бактерий при половом акте.
Причины гарднереллеза
Спровоцировать заболевание может ряд факторов. К причинам гарднереллеза относятся:
- снижение иммунитета;
- инфекционные заболевания органов мочеполовой системы;
- дисбактериоз кишечника;
- сахарный диабет;
- продолжительный прием антибиотиков, антибактериальных, гормональных препаратов, антидепрессантов;
- гормональный сбой во время беременности, родов, в период полового созревания и менопаузы;
- смена климата и нарушение сна;
- стресс, переутомление, хроническая усталость;
- беспорядочные половые контакты;
- ежедневное пользование прокладками;
- длительное использование тампонов;
- тесное синтетическое белье.

Симптомы и клиническая картина гарднереллеза
Инкубационный период бактериального вагиноза составляет от 3 до 10 дней. Признаки гарднереллеза: зуд и неприятный «рыбный» запах во влагалище, мышечная слабость, обильные выделения (беловатого, желтоватого и сероватого цвета), боль в области промежности, жжение при мочеиспускании и половом акте, покраснение половых губ.
Диагностика гарднереллеза
Диагностика гарднереллеза осуществляется с помощью лабораторных исследований.
Методы диагностики
Используются следующие лабораторные методы диагностики.
Тест-полоски. Если исследование слущенных клеток эпителия влагалища, вагинальных выделений (у женщин) и выделений из мочеиспускательного канала мужчин покажет увеличение кислотности, то факт наличия заболевания подтвержден.
Полимерная цепная реакция. Помогает не только идентифицировать ДНК гарднерелл, но и установить их количество и чувствительность к антибиотикам. ПЦР — уникальный метод диагностики заболевания и у мужчин. Применяется при анализе урогенитального соскоба, образцов мочи и спермы.
ПЦР — уникальный метод диагностики заболевания и у мужчин. Применяется при анализе урогенитального соскоба, образцов мочи и спермы.
Общий анализ крови. Пониженный уровень лейкоцитов укажет на наличие анаэробных микроорганизмов.
Какой врач лечит гарднереллез?
При первых же симптомах гарднереллеза рекомендуется обратиться к врачу-гинекологу. При сопутствующем кишечном дисбактериозе можно получить консультацию по поводу лечения у гастроэнтеролога.
Схема лечения гарднереллеза
Если была выявлена гарднерелла, лечение начинается с минимизации количества возбудителей. Через 3 дня приступают к восстановлению микрофлоры половой сферы.
Чем лечить гарднереллез, определяется на каждом этапе лечения отдельно. Сначала применяется антибактериальная терапия. Назначаются антибиотики в вид гелей, мазей (Метронидазол и Клиндамицин) и вагинальных таблеток (Левофлоксацин, Доксициклин). Курс лечения — до 10 дней. Беременным Клиндамицин противопоказан. После прохождения антибактериального лечения необходимо сдать анализ для подтверждения его эффективности, а также исключения молочницы.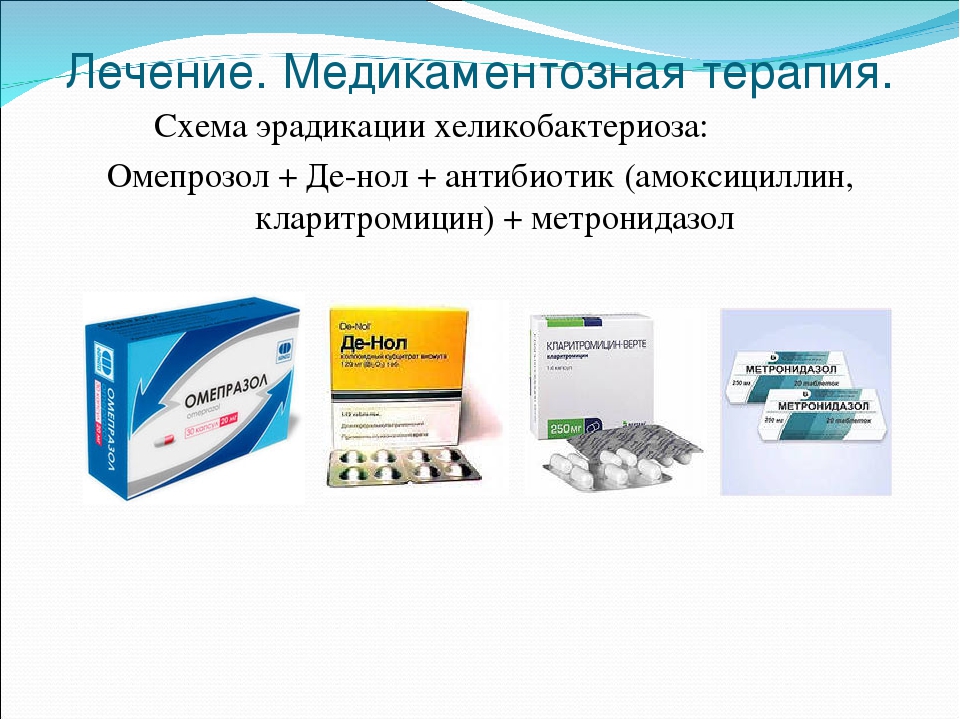
На следующем этапе проводят заселение влагалища лактобактериями. Это более длительный процесс, предусматривающий применение таблеток и вагинальных свечей (Лактонорм, Ацилакт, Лактобактерин).
Заболевание может возникнуть у беременных и кормящих женщин. Как лечить гарднереллез в этом случае? Применять можно только свечи. Спринцевание и антисептические тампоны лечебного эффекта не имеют. При лечении кишечного дисбактериоза применяются препараты Линекс, Хилак-форте, Бифидумбактерин. Для повышения иммунитета — поливитамины (Витрум и Биомакс), иммуностимуляторы (Лимонник и Эхинацея).
Своевременно начатое лечение способствует выздоровлению через 20-30 дней.
Возможные осложнения при гарднереллезе
Игнорирование лечения чревато такими осложнениями гарднереллеза, как воспаление придатков, бесплодие, преждевременные роды, инфицирование плода во время родов.
Меры профилактики гарднереллеза
Предупредить заболевание несложно. Необходимо лишь придерживаться основных правил: соблюдать гигиену половых органов, придерживаться сбалансированного и витаминизированного питания, упорядочить половые связи.
Необходимо лишь придерживаться основных правил: соблюдать гигиену половых органов, придерживаться сбалансированного и витаминизированного питания, упорядочить половые связи.
Почему нельзя запускать гастрит и как лечить коварную Хеликобактер
Чем опасно такое заболевание как хронический гастрит, при каких условиях оно превращается в язвенную болезнь, зачем и как выявлять бактерии Хеликобактер пилари и всегда ли их наличие ведет к раку желудка, рассказала заведующая отделением профилактики 31-й городской поликлиники Минска Татьяна Плисюк.
— Татьяна Аркадьевна, как возникает гастрит?
— Гастрит — это воспаление слизистой оболочки желудка. Он возникает по нескольким причинам. Основной источник острого гастрита — пищевая токсикоинфекция, или попросту отравление некачественной едой. Через два-три часа возникает острое воспаление слизистой желудка, которое сопровождается высокой температурой и рвотой. Также могут присоединяться тошнота, головокружение, понос.
Также могут присоединяться тошнота, головокружение, понос.
— Чем отравление отличается от ротавируса?
— Ротавирусная инфекция попадает в организм через верхние дыхательные пути. Есть небольшой, до трех дней, инкубационный период. И здесь, как правило, болеет не кто-то один в семье, а все. Если в детском саду, то большинство группы. Симптомы похожи на отравление — рвота, температура, понос. А вот отравление всегда можно связать именно с некачественной пищей. Часто подростки приходят из Макдональдса — фаст-фуд, картофель фри, пережаренный в масле, который несколько раз используется, — и через пару часов начинается рвота, поднимается температура. Такая нездоровая пища вызывает приступ гастрита. Ротавирусная инфекция лечится противовирусными препаратами, а пищевая токсикоинфекция требует антибиотиков.
— Есть ли продукты, которыми мы уничтожаем желудок?
— Здесь речь нужно вести скорее не о продуктах, а о неправильном питании в целом. У нас, к сожалению, многие, в том числе дети и подростки, часто не успевают поесть, питаются неправильно. Принимать пищу нужно по меньшей мере шесть раз в день, но небольшими порциями. Во-первых, это помогает не набирать лишний вес. Во-вторых, когда мы питаемся каждые 3-4 часа, улучшается работа желудочно-кишечного тракта. Еда — лучшее желчегонное средство. После ее приема вырабатывается желчь, она помогает в переваривания блюд. Если после завтрака мы целый день не имеем возможности питаться правильно, ограничиваемся перекусами, а во время ужина объедаемся, происходит растяжение слизистой желудка и мощный выброс ферментов: желчных, поджелудочных, в большом количестве вырабатывается желудочный сок, желчь. Это очень высокая нагрузка на пищеварительную систему и весь организм. Некоторые сразу после обильного ужина ложатся спать, что тоже неправильно. Если по такому принципу питаться долгое время, возникнут гастрит, язва и ожирение.
У нас, к сожалению, многие, в том числе дети и подростки, часто не успевают поесть, питаются неправильно. Принимать пищу нужно по меньшей мере шесть раз в день, но небольшими порциями. Во-первых, это помогает не набирать лишний вес. Во-вторых, когда мы питаемся каждые 3-4 часа, улучшается работа желудочно-кишечного тракта. Еда — лучшее желчегонное средство. После ее приема вырабатывается желчь, она помогает в переваривания блюд. Если после завтрака мы целый день не имеем возможности питаться правильно, ограничиваемся перекусами, а во время ужина объедаемся, происходит растяжение слизистой желудка и мощный выброс ферментов: желчных, поджелудочных, в большом количестве вырабатывается желудочный сок, желчь. Это очень высокая нагрузка на пищеварительную систему и весь организм. Некоторые сразу после обильного ужина ложатся спать, что тоже неправильно. Если по такому принципу питаться долгое время, возникнут гастрит, язва и ожирение.
Если говорить о рационе, то пища должна быть преимущественно вареная, обязательно нужны каши, молочные продукты, супы, мясо, рыба, фрукты и овощи.
Фаст-фуд, картофель фри в ресторанах быстрого питания — еда на крайний случай. Перекусывать этим каждый день нельзя.
— Как избежать хронического гастрита?
— Острый гастрит, возникающий когда мы чем-то отравились, излечивается. И если вы ведете здоровый образ жизни и правильно питаетесь, он не превращается в хронический. Если же вы постоянно нарушаете принципы здорового питания (недоедаете, а после переедаете, имеете вредные привычки, в частности, употребляете алкоголь и курите, особенно на голодный желудок), внутренний слой эпидермиса повреждается. Если слизистую не лечить, заболевание переходит в хроническую форму. Сначала воспаляется внутренняя оболочка желудка. Если процесс идет дальше, углубляется под слизистую — образуются язвы. Если язвенную болезнь не лечить, это может привести к раку желудка.
— Бактерия Хеликобактер пилари также вызывает гастрит?
— Да, и гастрит, и язвенную болезнь. Один из характерных симптомов при этих заболеваниях — голодные боли. Кажется, если что-то съесть, болит меньше. На самом деле, это обманчивое ощущение. От пищи желудок раздувается, увеличивается количество соляной кислоты. Из-за этого появляется изжога, отрыжка кислым, метеоризм, запоры. Такие симптомы характерны, если кислотность желудка повышена. С пониженной кислотностью жалобы у пациентов немного другие, но большинство больных испытывают именно перечисленные диспепсические симптомы.
Кажется, если что-то съесть, болит меньше. На самом деле, это обманчивое ощущение. От пищи желудок раздувается, увеличивается количество соляной кислоты. Из-за этого появляется изжога, отрыжка кислым, метеоризм, запоры. Такие симптомы характерны, если кислотность желудка повышена. С пониженной кислотностью жалобы у пациентов немного другие, но большинство больных испытывают именно перечисленные диспепсические симптомы.
— Голодный желудок не должен болеть?
— Обычно мы чувствуем голод, боли в норме быть не должно. Многое еще зависит от болевого порога. Некоторые больные испытывают только слабость. После приема пищи в норме вы также не должны ничего чувствовать. С язвенной болезнью после приема пищи становится легче, но быстро боль снова возвращается. Ее снова стремятся заедать, пациенты с язвами и гастритами иногда даже набирают вес, но страдают от отечности.
— Это значит, болезнь не протекает скрыто…
— Да.
Но все равно не все пациенты обращаются к врачу. Принимают симптоматические препараты, соду — им становится немного легче. У кого невысокий болевой порог, живут с болями. И это ведет к печальным результатам. Так возникают запущенные формы рака желудка. Поэтому если периодически возникают боли в желудке, запоры и понос, нужно обследоваться.
— Какими еще методами можно обнаружить Хеликобактер?
— По анализу крови, а также выполняется дыхательный тест. Когда впервые обнаруживается язвенная болезнь, пациенту назначается лечение, и после, если не хочется снова глотать зонд, есть такая альтернатива. Анализ крови на Хеликобактер делается пока только на платной основе, а в поликлиниках, как правило, предлагают бесплатный дыхательный тест.
— Хронические гастриты — это болезнь какого возраста?
— Такой диагноз ставится даже детям школьного возраста. Во многом здесь свою роль играет наследственный фактор: если у родителей есть Хеликобактер, а питаются в семье, конечно, из общей посуды, то велика вероятность, что эта бактерия будет и у детей. Хеликобактер погибает только при температуре 60 градусов, она хорошо уничтожается в посудомоечных машинах, но понятно, что в домашних условиях посуду в такой горячей воде никто не моет. Поэтому, если у кого-то проявляются эти бактерии, рекомендуется лечение всей семьи. Как известно, не все дети питаются правильно. Их здоровье зависит от того, как их кормят родители. Важно не игнорировать питание в школе, чтобы не было большого перерыва в приемах пищи. Сначала у детей развивается гастрит, и они претенденты на язву, особенно язву двенадцатиперстной кишки. Это стрессовая язва. Подростки особенно к ней склонны из-за своей неустойчивой психики. И если язва желудка больше встречается у взрослого населения, то язва двенадцатиперстной кишки — это преимущественно болезнь подростков.
Хеликобактер погибает только при температуре 60 градусов, она хорошо уничтожается в посудомоечных машинах, но понятно, что в домашних условиях посуду в такой горячей воде никто не моет. Поэтому, если у кого-то проявляются эти бактерии, рекомендуется лечение всей семьи. Как известно, не все дети питаются правильно. Их здоровье зависит от того, как их кормят родители. Важно не игнорировать питание в школе, чтобы не было большого перерыва в приемах пищи. Сначала у детей развивается гастрит, и они претенденты на язву, особенно язву двенадцатиперстной кишки. Это стрессовая язва. Подростки особенно к ней склонны из-за своей неустойчивой психики. И если язва желудка больше встречается у взрослого населения, то язва двенадцатиперстной кишки — это преимущественно болезнь подростков.
— Хеликобактер у всех вызывает язву?
— Есть люди, которые живут с этой бактерией всю жизнь, и она не вызывает язвенную болезнь. Поэтому подхватить ее можно где угодно: в столовой, кафе, в гостях, если некачественно обработана посуду. Но лечить ее важно, ведь это профилактика рака, так мы не допускаем образования лимфомы желудка. Другое дело, что не у всех Хеликобактер можно уничтожить, лечение дает результат примерно в 90% случаев. Поэтому лучше не допускать воспаления слизистой и придерживаться принципов правильного питания.
Но лечить ее важно, ведь это профилактика рака, так мы не допускаем образования лимфомы желудка. Другое дело, что не у всех Хеликобактер можно уничтожить, лечение дает результат примерно в 90% случаев. Поэтому лучше не допускать воспаления слизистой и придерживаться принципов правильного питания.
Елена КРАВЕЦ
Фото Анны ЗАНКОВИЧ
Зачем пить антибиотики при язве желудка (Helicobacter pylori)?
Автор: врач – клинический фармаколог Трубачева Е.С.
Эта статья предназначается всем, кто считает себя на работе незаменимым настолько, что живет многие годы с дискомфортом, а то и с настоящими болями, и не идет сдаваться к врачу. Особенно она направлена на молодых мужчин на взлете их карьеры, когда нет ни одной свободной минуты, а аптечная безрецептурка для снятия любого вида дискомфорта скупается мешками.
Каждый из нас хотя бы раз в жизни, а большинство и не раз, сталкивались с дискомфортом, а то и настоящими болями в эпигастральной области, изжогой, тошнотой и всем тем, что частенько и необоснованно называют гастритом. И связывали мы это с чем угодно – не то поел, не так попил или выпил, работа нервная и еще море всевозможных самоуспокаивающих отмазок, убеждающих себя не идти к врачу, чтобы потом не глотать страшную «кишку», пардон, проходить процедуру фиброгастродуоденоскопии (ФГДС). Да и телевизионная реклама этому немало помогает, доверительно подсовывая антациды и всевозможные регуляторы моторики, но совершенно не решая главную проблему. Почему не надо поддаваться на подобные провокации и заниматься самоуспокоением, мы сегодня и поговорим.
И связывали мы это с чем угодно – не то поел, не так попил или выпил, работа нервная и еще море всевозможных самоуспокаивающих отмазок, убеждающих себя не идти к врачу, чтобы потом не глотать страшную «кишку», пардон, проходить процедуру фиброгастродуоденоскопии (ФГДС). Да и телевизионная реклама этому немало помогает, доверительно подсовывая антациды и всевозможные регуляторы моторики, но совершенно не решая главную проблему. Почему не надо поддаваться на подобные провокации и заниматься самоуспокоением, мы сегодня и поговорим.
Чтобы понимать всю важность сегодняшнего обсуждения, сначала отправимся в небольшой исторический экскурс.
Десятилетиями считалось, что гастриты и язвы в желудке и двенадцатиперстной кишке связаны с неинфекционными причинами – стрессами, неправильным питанием (любимое до недавнего времени отсутствие горячих первых блюд в рационе), изменениями кислотности в желудке и т. д. и т. п. Лечилось это все соответственно – диетами, назначениями секреторных и антисекреторных препаратов, одно время даже соляную кислоту глотали при гастрите с низкой кислотностью, становясь затем клиентами зубопротезных кабинетов, а заканчивалось все на операционном столе хирурга и лишением части пораженных органов, а то и органов полностью.
И так бы продолжалось еще неизвестно сколько, если бы в 1983 году в одном из самых авторитетных медицинских периодических изданий «Lancet» не появилась статья двух австралийских авторов – Б. Маршалла и Р. Уоррена, предположивших и описавших вероятную связь между «неидентифицированной изогнутой палочкой» и хроническим гастритом. Вот так тихо в виде небольшой заметки в медицине произошла очередная революция – был обнаружен Helicobacter pylori.
Маршалл и Уоррен не были первооткрывателями Helicobacter. Впервые он был описан еще в 1875 году Боттхером и Леттулом внутри язвенного дефекта.
Но потом это открытие «забылось», до тех пор пока австралийские исследователи не сделали предположение о вероятной инфекционной причине поражения слизистой оболочки желудка. И это дало настолько весомый толчок к исследованию микроорганизма, что уж в 1987 году создается Европейская группа по изучению возбудителя. В 1990 году на Международном конгрессе гастроэнтерологов принимается Сиднейская классификация гастритов, в которой хеликобактер признается одним из пяти главных диагностических критериев. А в 1994 году, то есть 25 лет назад, Международное агентство по изучению рака относит хеликобактер к числу канцерогенов I типа, приравняв степень риска возникновения рака желудка при инфицировании оного Helicobacter pylori к степени риска возникновения рака легкого при курении. В том же 1994 году согласительная комиссия Национального института здоровья признает ведущую роль хеликобактера в развитии язвенной болезни. И с этого момента начинают разрабатываться общемировые программы диагностики и лечения перечисленных патологий с учетом выявленного возбудителя – страны ЕС принимают «Маастрихтский консенсус», который уже неоднократно обновлялся, и сейчас действует его пятая редакция, на которую опираются и наши «Клинические рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых» от 2018 года. Поэтому приходя к врачу с жалобами на боли в желудке вы теперь знаете, опираясь на какие документы и с какой стоящей за них историей, доктор будет проводить диагностику и лечение.
А в 1994 году, то есть 25 лет назад, Международное агентство по изучению рака относит хеликобактер к числу канцерогенов I типа, приравняв степень риска возникновения рака желудка при инфицировании оного Helicobacter pylori к степени риска возникновения рака легкого при курении. В том же 1994 году согласительная комиссия Национального института здоровья признает ведущую роль хеликобактера в развитии язвенной болезни. И с этого момента начинают разрабатываться общемировые программы диагностики и лечения перечисленных патологий с учетом выявленного возбудителя – страны ЕС принимают «Маастрихтский консенсус», который уже неоднократно обновлялся, и сейчас действует его пятая редакция, на которую опираются и наши «Клинические рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых» от 2018 года. Поэтому приходя к врачу с жалобами на боли в желудке вы теперь знаете, опираясь на какие документы и с какой стоящей за них историей, доктор будет проводить диагностику и лечение.
Минутка эпидемиологии или как мы заражаемся хеликобактером
Считается, что хеликобактером заражено не менее 50% населения планеты, хотя различия в распространенности очень сильно зависят от региона проживания, а также уровня экономического развития страны проживания – в экономически развитых странах инфицировано порядка 35%, в странах с депрессивной экономикой – почти 70%. В странах ЕС этот показатель колеблется в пределах 25%, исключение составляет Италия, где в отдельных регионах цифры доходят до 60%, а в США колебания составляют от 15% до 80% в зависимости от штата. Самый высокий уровень инфицирования приходится на страны Азии, Африки и Южной Америки – до 93% населения.
Кто входит в группы риска вне зависимости от региона и страны проживания:
- дети до 5 лет
- члены одной семьи
- медицинский персонал эндоскопических отделений
Пути передачи инфекции до конца все еще не изучены, хотя известно, что хеликобактер очень заразен. Предполагается, что основную роль играет фекально-оральный путь заражения, то есть через плохо помытые и обработанные продукты питания и воду. Кроме того, имеется предположение об орально-оральном способе передачи, как контактно, так и через пищу (не надо доедать за другими то, что они понадкусывали, или пользоваться чужими зубными щетками!), а так же гастро-оральным и гастро-гастральным, то есть через медицинское оборудование, не прошедшее нормальной процедуры дезинфекции.
Предполагается, что основную роль играет фекально-оральный путь заражения, то есть через плохо помытые и обработанные продукты питания и воду. Кроме того, имеется предположение об орально-оральном способе передачи, как контактно, так и через пищу (не надо доедать за другими то, что они понадкусывали, или пользоваться чужими зубными щетками!), а так же гастро-оральным и гастро-гастральным, то есть через медицинское оборудование, не прошедшее нормальной процедуры дезинфекции.
Что же происходит после заражения?
Когда хеликобактер инфицирует слизистую желудка или тонкой кишки, он вызывает воспаление в месте своего внедрения, которое дополнительно усиливает секрецию соляной кислоты и этим ускоряет и усиливает развитие язв, увеличивая их в размерах.
Основными проявлениями хеликобактерной инфекции являются:
- гастрит (поражение слизистой оболочки желудка)
- язва желудка и двенадцатиперстной кишки
- дуоденит (воспаление двенадцатиперстной кишки)
- рак как следствие продолжающегося хронического воспаления в стенке желудка
В каких ситуациях надо прекращать заниматься самолечением и немедленно бежать к врачу? Какие симптомы говорят о том, что может иметь место поражение хеликобактером?
- тошнота,
- рвота частично переваренной пищей,
- боль в эпигастральной области,
- метеоризм,
- изжога или частая отрыжка,
- неприятный запах изо рта,
- отсутствие аппетита,
- тяжесть и боль в желудке даже при употреблении небольших порций еды,
- нарушения стула,
- аллергия, особенно если она возникла впервые на фоне остальных признаков болезни
Если что-то из вышеперечисленного, особенно в сочетании с болью в эпигастрии, вам знакомо – берите талон к врачу. Нет, тянуть время не лучшая идея – если у вас язва, то она, может быть, и сможет закрыться благодаря таблеткам из рекламы, но как закрылась, так снова и откроется, ведь ее причина не устранена. Кроме того, могут начаться рубцовые изменения тканей, образовываться стриктуры и нарушаться проходимость между желудком и тонкой кишкой и, в самом плохом, но, к большому сожалению, не редком варианте развития событий, может развиться рак желудка (у инфицированных хеликобактером он развивается в 3-6 раз чаще по сравнению с неинфицированными) – крайне тяжелое заболевание с очень плохим прогнозом в случае позднего обращения.
Нет, тянуть время не лучшая идея – если у вас язва, то она, может быть, и сможет закрыться благодаря таблеткам из рекламы, но как закрылась, так снова и откроется, ведь ее причина не устранена. Кроме того, могут начаться рубцовые изменения тканей, образовываться стриктуры и нарушаться проходимость между желудком и тонкой кишкой и, в самом плохом, но, к большому сожалению, не редком варианте развития событий, может развиться рак желудка (у инфицированных хеликобактером он развивается в 3-6 раз чаще по сравнению с неинфицированными) – крайне тяжелое заболевание с очень плохим прогнозом в случае позднего обращения.
Мы даже не упоминаем о таких грозных осложнениях как желудочные кровотечения или перфорация язвы в брюшную полость, которые до сих пор нередко заканчиваются летальным исходом.
В общем, теперь понятно, что к врачу надо идти обязательно.
Какие диагностические методы будут использоваться для выявления причины
Конечно, надо делать фиброгастродуоденоскопию. Без вариантов. Если очень страшно – можно сделать ее с седацией или обезболиванием, но делать надо обязательно. Во-первых, визуальный осмотр ничем не заменишь, во-вторых, врач возьмет кусочек подозрительной ткани для последующей биопсии, и, в-третьих, будет возможно провести уреазный тест непосредственно на слизистой оболочке желудка.
Без вариантов. Если очень страшно – можно сделать ее с седацией или обезболиванием, но делать надо обязательно. Во-первых, визуальный осмотр ничем не заменишь, во-вторых, врач возьмет кусочек подозрительной ткани для последующей биопсии, и, в-третьих, будет возможно провести уреазный тест непосредственно на слизистой оболочке желудка.
Помимо этого существуют дыхательные уреазные тесты и определение антигена к хеликобактеру в кале. Но они не отменяют проведения ФГДС. Сразу хочу отметить, при отсутствии симптоматики никакой практической пользы от проведения указанных тестов нет, поэтому можете не тратить ни время, ни деньги.
Чем вас будут лечить?
Так как заболевание имеет инфекционную природу, то и лечить его будут с помощью антибактериальной терапии. Разработано несколько схем, применение которых будет зависеть от того, нет ли у вас какой-либо лекарственной непереносимости. Самое важное понимать, что курс антибиотиков должен быть пропит полностью, экономить в этом случае категорически нельзя, так как в лучшем случае у вас произойдет рецидив, в худшем – рецидив будет вызван хеликобактером, который успел приобрести лекарственную устойчивость, и денег на его изничтожение вы потратите раза в три больше.
Помимо антибиотиков доктор назначит антисекреторные препараты и диету, которая снизить уровень травматизации слизистой в области язвы, которые также обязательны. Результатом чаще всего становится полное излечение, и хотелось бы отметить, что после того, как появилась антихеликобактерная терапия, количество инвалидизирующих оперативных вмешательств, как и вмешательств вообще, снизилось в десятки раз, а лечение перестало быть долгим и мучительным (например, ФГДС стали проводить не чаще 2-х раз – до начала лечения и после оного, для контроля полученного результата).
В идеальной ситуации после перенесенного заболевания необходима реабилитация в условиях курорта, но реальный мир таков, что даже на больничный не всегда получается уйти, а потому хотелось бы призвать по возможности меньше нервничать, больше гулять перед сном, отказаться от соленого-жирного-жареного и попытаться все-таки создать хотя бы какой-то режим труда и отдыха.
Статья будет неполной, если мы не перечислим еще несколько вариантов изъязвления в желудочно-кишечном тракте – это все виды стрессовых язв (язвы в результате сильных психологических нагрузок или после или вследствие тяжелого заболевания). Они не зависят от наличия хеликобактера, но это не значит, что не надо проверять его наличие. Так что если заболело в области эпигастрия – посещение врача становится обязательным, от этого в прямом смысле зависит ваша жизнь. Берегите себя!
Они не зависят от наличия хеликобактера, но это не значит, что не надо проверять его наличие. Так что если заболело в области эпигастрия – посещение врача становится обязательным, от этого в прямом смысле зависит ваша жизнь. Берегите себя!
возможные причины появления, симптомы, методы терапии и профилактика
Долгое время и врачи, и пациенты считали, что гастрит, язву и прочие патологии органов желудочно-кишечного тракта вызывают стрессы, неправильное питание и употребление в пищу таких вредных продуктов, как чипсы, газированная вода, жареные и копченые блюда. Однако в 70-х годах XX века ученые смогли доказать, что большая часть этих заболеваний вызывается вредной бактерией, называющейся хеликобактер пилори. Специалисты в настоящее время успешно борются с этим опасным микроорганизмом, но лечение до сих пор нельзя назвать простым. Поэтому важно своевременно определить его наличие в организме, обратиться к врачу и начать терапию. Чем опасна хеликобактер пилори и как избавиться от нее? Именно эти вопросы будут подробно рассмотрены в этой статье.
Что представляет собой эта бактерия и чем она опасна?
Прежде всего, чтобы понять, как избавиться от хеликобактер пилори, нужно подробно изучить информацию о самом микроорганизме. Зная больше об этих вредных бактериях, пациент сможет лучше понять не только принцип появление многих заболеваний желудочно-кишечного тракта, но и методы их лечения. Итак, хеликобактер пилори — это опасный микроорганизм, который обнаруживают у людей, страдающих от гастрита, язвы, патологий двенадцатиперстной кишки. Свое название она получила от пилорического отдела желудка. Именно там она обитает и размножается лучше всего. Изначально считалось, что не существует микроорганизмов, способных выжить в кислой среде желудка, однако в 1979 году ученые из Австралии смогли обнаружить, а затем самостоятельно вырастить бактерию в лабораторных условиях. За это открытие они впоследствии получили Нобелевскую премию, так как оно кардинально изменило методы лечения заболеваний органов ЖКТ.
Чем же опасна эта бактерия? Конечно, в первую очередь тем, что именно она является основной причиной появления у пациентов гастрита. Хеликобактер пилори не только способна выжить в кислой среде, но именно там она прекрасно размножается. Рост числа микроорганизмов провоцирует появление большего числа очагов воспаления, усугубляя самочувствие пациента. Если вовремя не начать лечение, то гастрит может перерасти в язву. При длительном отсутствии терапии человек может начать страдать от атрофии и метаплазии желудка, которые, в свою очередь, являются предвестниками рака.
Хеликобактер пилори не только способна выжить в кислой среде, но именно там она прекрасно размножается. Рост числа микроорганизмов провоцирует появление большего числа очагов воспаления, усугубляя самочувствие пациента. Если вовремя не начать лечение, то гастрит может перерасти в язву. При длительном отсутствии терапии человек может начать страдать от атрофии и метаплазии желудка, которые, в свою очередь, являются предвестниками рака.
Как можно заразиться этой бактерией?
Таким образом, это опасный микроорганизм, размножение которого может привести к появлению серьезных заболеваний. Поэтому важно не только знать о том, как избавиться от хеликобактер пилори навсегда, но и о том, как не допустить повторного заражения.
Ученые успели подробно изучить эту бактерию. Известно, что по воздуху она не передается, так как практически сразу погибает, оказавшись в открытой среде. Зато инфекция хорошо выживает и размножается в слюне и слизи. Поэтому чаще всего заражение происходит через использование общих гигиенических средств или посуды..gif) Передача бактерий возможна при поцелуе. Таким образом, если один член семьи заразился хеликобактер пилори, то велика вероятность, что и другие его близкие родственники в скором времени почувствуют аналогичные неприятные симптомы.
Передача бактерий возможна при поцелуе. Таким образом, если один член семьи заразился хеликобактер пилори, то велика вероятность, что и другие его близкие родственники в скором времени почувствуют аналогичные неприятные симптомы.
По каким симптомам можно определить заражение?
Важно не только знать, как избавиться от бактерии хеликобактер пилори, но и как определить ее по начальным симптомам. Ведь вылечить болезнь на ранней стадии гораздо проще. Как правило, пациенты обнаруживают первые неприятные симптомы уже на 6-8 день после заражения. Однако на практике встречались случаи, когда хеликобактер пилори годами находились в желудке, но никак себя не проявляли. Спровоцировать их активность могут неправильное питание, курение, злоупотребление алкоголем, стрессы или ослабленный иммунитет.
Чаще всего люди страдают от типичных проявлений неполадок в работе желудочно-кишечного тракта. Они жалуются на изжогу, отрыжку, тошноту, которая иногда может перерасти и в рвоту. Боли в желудке в это время не сильно выражены, поэтому многие люди просто не обращают на них внимания и не обращаются за помощью к врачу. Неприятные ощущения, как правило, чаще всего появляются натощак и утихают после приема пищи.
Неприятные ощущения, как правило, чаще всего появляются натощак и утихают после приема пищи.
Какими методами диагностики можно определить заражение?
Перед тем как избавиться от бактерии хеликобактер пилори, необходимо провести точную диагностику, чтобы подтвердить ее наличие в организме человека. Для этого врачи используют несколько способов. Проще всего провести неинвазивные тесты, которые включают в себя анализы крови и исследование выдыхаемого пациентом воздуха. Их преимуществом является не только быстрота получения результата, но и низкая стоимость. Однако такие тесты также отличаются невысокой точностью.
Поэтому многие специалисты для диагностики предпочитают проводить эндоскопическое исследование. Квалифицированный врач с помощью эндоскопа внимательно осматривает не только желудок, но и пищевод. Он может визуально определить, есть ли на стенках органа очаги воспаления, степень их выраженности и локализацию. Если есть подозрение на наличие в организме хеликобактер пилори, то врач обязательно сделает биопсию — забор небольшого количества слизистой. Эта методика намного точнее неинвазивных тестов, особенно если брать образцы сразу с нескольких участков желудка.
Эта методика намного точнее неинвазивных тестов, особенно если брать образцы сразу с нескольких участков желудка.
Как избавиться от хеликобактер пилори?
После диагностики и обнаружения этих опасных микроорганизмов многие люди начинают всерьез беспокоиться о состоянии своего здоровья и будущей терапии. Не все из них знают о методах лечения и прогнозах. Можно ли вылечить гастрит и навсегда забыть о неприятных симптомах? Можно ли избавиться от хеликобактер пилори насовсем? Насколько серьезными медикаментами придется лечиться? Как это отразится на состоянии организма? Именно эти вопросы пациенты чаще всего задают своим врачам. Конечно, без помощи специалистов избавиться от недуга нельзя.
Поражение организма этими бактериями называется хеликобактериоз. Почти все препараты для его лечения относятся к антибиотикам. При этом врач может отказаться от терапии. Но только при наличии серьезных противопоказаний и в том случае, когда вред от антибиотиков будет сильнее, чем от бактерий. Как правило, избавиться вылечить хеликобактериоз можно за один курс лечения. Его продолжительность будет зависеть от степени поражения желудка и чувствительности организма к антибиотикам. Пациент также должен придерживаться правильного питания. Ему следует исключить из рациона вредную пищу, отказаться от курения и употребления алкоголя.
Как правило, избавиться вылечить хеликобактериоз можно за один курс лечения. Его продолжительность будет зависеть от степени поражения желудка и чувствительности организма к антибиотикам. Пациент также должен придерживаться правильного питания. Ему следует исключить из рациона вредную пищу, отказаться от курения и употребления алкоголя.
Для лечения хеликобактериоза врачи обычно используют три основные схемы приема препаратов. Ниже расскажем о каждой из них поподробнее.
Стандартная терапия
Схему лечения бактерии хеликобактер должен назначать только квалифицированный специалист. Как правило, для терапии чаще всего используется трехкомпонентная схема, которая включает в себя сразу три медикамента. Два из них обычно являются антибиотиками, еще один — это ингибитор протонной помпы. Его используют для снижения кислотности в желудке, чтобы ускорить заживление очагов воспаления. Антибиотики же применяются непосредственно для уничтожения бактерий. Обычно врачи назначают амоксициллин и кларитромицин — они лучше всего справляются с хеликобактер пилори и легче переносятся пациентами. При этом пожилым людям рекомендуется более мягкая дозировка. Для них врач обычно подбирает только один антибиотик. Иногда специалист может дополнительно порекомендовать лечение препаратами висмута, которые оказывают гастропротекторное действие. С их помощью на внутренней стенке желудка образуется защитная пленка, которая способствует более быстрому заживлению очагов воспаления.
При этом пожилым людям рекомендуется более мягкая дозировка. Для них врач обычно подбирает только один антибиотик. Иногда специалист может дополнительно порекомендовать лечение препаратами висмута, которые оказывают гастропротекторное действие. С их помощью на внутренней стенке желудка образуется защитная пленка, которая способствует более быстрому заживлению очагов воспаления.
Врачи подробно рассказывают своим пациентам о том, как избавиться от хеликобактер пилори. Помимо назначения препаратов, они также рекомендуют соблюдать диету, исключающие жирные, жареные, копченые и другие вредные блюда. Курс лечения при такой схеме составляет, как правило, неделю. При необходимости он может быть продлен еще на 7 дней. Прерывать прием антибиотиков нельзя. Даже если пациент почувствовал улучшение через 2-3 дня после начала лечения, он должен пропить все лекарства до конца. Иначе выжившие бактерии могут адаптироваться к антибиотику, и врачу придется подбирать другие медикаменты.
После проведенного курса лечения пациент должен повторно пройти дыхательный тест, чтобы определить остались ли в желудке выжившие бактерии. Если стандартная схема лечения не принесла положительных результатов, то врачи вынуждены перейти к четырехкомпонентной терапии. Расскажем о ней подробнее.
Если стандартная схема лечения не принесла положительных результатов, то врачи вынуждены перейти к четырехкомпонентной терапии. Расскажем о ней подробнее.
Терапия медикаментами эрадикации второй линии
Однако описанное выше лечение хеликобактерий антибиотиками не всегда бывает эффективным. В редкий случаях микроорганизмы не погибают после трехкомпонентной терапии, поэтому врачи вынуждены подбирать пациентам другие медикаменты. Такая схема уже в обязательном порядке включает в себя препарат висмута, а также ингибитор протонной помпы и два антибиотика, которые должны дополнять и усиливать действие друг друга. Так как для лечения используется уже четыре медикамента, то такую терапию называют четырехкомпонентной. Антибиотики при этом должны быть новыми, то есть нельзя использовать те, которые применялись при стандартной схеме, описанной выше. Дело в том, что хеликобактер пилори имеет свойство быстро адаптироваться и привыкать к действующим веществам препаратов, и из-за этого лечение становится неэффективным.
Чаще всего специалисты назначают для четырехкомпонентной терапии сочетание тетрациклина и метронидазола. Хорошую эффективность также показывают амоксициллин, который принимают вместе с антибиотиком из группы нитрофуранов.
С помощью четырехкомпонентной терапии за 10-14 дней можно полностью избавиться от хеликобактер пилори. Как и при первом варианте, прерывать прием препаратов категорически не рекомендуется, даже если пациент почувствовал себя полностью здоровым. Важно пропить курс антибиотиков до конца. Врачи также рекомендуют соблюдать строгую диету. Например, вместе с препаратами висмута не следует применять фрукты, соки и молочные продукты, так как они понижают их эффективность. Кроме того, иногда их продолжают употреблять и после окончания лечения. Они не только помогают ускорить процесс гибели микроорганизмов, но и предотвращают возможный рецидив заболевания.
Терапия препаратами третьей линии
Но иногда и четырехкомпонентная терапия не помогает избавиться от хеликобактер пилори навсегда. Как правило, случается это в исключительно редких случаях. Тогда перед назначением новых лекарств вынуждены проводить специальные исследования, определяющие чувствительность бактерий в желудке к определенным антибиотикам. Они позволяют определить наиболее эффективные препараты, которые точно помогут победить вредные микроорганизмы.
Как правило, случается это в исключительно редких случаях. Тогда перед назначением новых лекарств вынуждены проводить специальные исследования, определяющие чувствительность бактерий в желудке к определенным антибиотикам. Они позволяют определить наиболее эффективные препараты, которые точно помогут победить вредные микроорганизмы.
В остальном же лечение хеликобактер пилори медикаментами третьей линии напоминает описанную выше четырехкомпонентную терапию. Пациентам тоже назначается два антибиотика, которые показали наибольшую эффективность во время исследований, ингибитор протонной помпы и препараты висмута. Комплексная терапия на этом этапе не только помогает убить вредные бактерии, но и облегчить состояние больного. Ингибитор и препараты висмута устраняют изжогу, отрыжку, вздутие живота. Они также помогают ускорить регенерацию воспаленных и поврежденных стенок желудка, что тоже способствует более быстрому выздоровлению. Поэтому исключать их из терапии и принимать только антибиотики категорически не рекомендуется.
Стоит отметить, что этот вариант применяется на практике очень редко, так как вылечить хеликобактериоз обычно удается с помощью стандартной схемы лечения. Длительность курса в этом случае также составляет не более двух недель.
Как правило, после подбора действенного антибиотика и выполнения всех рекомендаций лечащего врача можно избавиться от хеликобактер пилори на долгий срок, даже если бактерии проявили устойчивость к определенным лекарствам. А если точно соблюдать правила гигиены и регулярно проходить обследование, то можно свести риск их повторного появления к нулю.
Можно ли уничтожить бактерии без применения антибиотиков
К сожалению, антибиотики нельзя назвать безвредным препаратами, так как они уничтожают не только опасные бактерии, но и полезные микроорганизмы. Кроме того, данные лекарства имеют немало противопоказаний. Поэтому многие люди стараются избегать их назначения, ограничиваясь приемом только безопасных средств. Они задаются вопросом о том, как избавиться от хеликобактер пилори без антибиотиков, однако врачи считают, что вылечить бактериальный гастрит или язву без них нельзя. Дело в том, что данные микроорганизмы невозможно убить другими лекарствами. С помощью ингибиторов протонной помпы и препаратов висмута можно снизить кислотность желудка и купировать неприятные симптомы, однако после прекращения приема пациент в скором времени снова начнет чувствовать себя хуже. Таким образом, терапия при хеликобактериозе без приема антибиотиков невозможна.
Дело в том, что данные микроорганизмы невозможно убить другими лекарствами. С помощью ингибиторов протонной помпы и препаратов висмута можно снизить кислотность желудка и купировать неприятные симптомы, однако после прекращения приема пациент в скором времени снова начнет чувствовать себя хуже. Таким образом, терапия при хеликобактериозе без приема антибиотиков невозможна.
Не стоит отказываться от лечения и попыток избавиться от хеликобактер пилори. Как правило, после приема данных препаратов организм быстро восстанавливается. Кроме того, врачи, назначая антибиотики, стараются принести пациенту пользу, а не навредить. Поэтому перед началом терапии обычно проводится комплексное обследование, позволяющее исключить наличие каких-либо противопоказаний. Если же они были обнаружены, то специалист подберет другой препарат или скорректирует дозировку. Применяются антибиотики даже в том случае, если бактерии находятся в спящем режиме и не причиняют больному вред.
Не назначают данные препараты только в том случае, если их прием теоретически принесет пациенту больше вреда, чем пользы.
Как избавиться от хеликобактер пилори народными средствами
К сожалению, с помощью народной медицины вылечить хеликобактериоз и сопутствующий ему гастрит или язву нельзя. Как уже было сказано выше, сделать это можно только с помощью правильно подобранных антибиотиков. Однако народные средства можно применять в качестве дополнительной терапии, чтобы ускорить процесс заживления очагов воспаления и облегчить состояние больного.
К вопросу о том, как избавиться от хеликобактер пилори народными средствами нужно подходить с особым вниманием. Принимать отвары и настои можно только после консультации с лечащим врачом, так как иногда они могут снизить эффективность антибиотиков. Например, исследования доказали, что кофе способен уменьшить число бактерий в желудке, однако его нельзя пить при любых заболеваниях ЖКТ. Гораздо полезнее употреблять в пищу брокколи, йогурты или японские сливы. Однако стоит учитывать, что прием молочных продуктов противопоказан при лечении некоторыми антибиотиками.
Натуральный клюквенный сок способен сдерживать темп роста хеликобактер пилори, но его не рекомендуется пить при наличии гастрита или язвы. Ученые также считают, что пациентам полезно употреблять оливковое масло и корень солодки в виде настоев или жевательных таблеток. Последнее средство не поможет избавиться от бактерий, но замедлит их прилипание к стенкам желудка. Пажитник снижает вздутие и метеоризм, а байкальский шлемник оказывает антибактериальное воздействие.
Что делать после лечения, чтобы не допустить повторного заболевания
Нельзя избавиться от этих бактерий навсегда — даже после избавления от них в любом случае есть риск повторного заражения. Однако профилактика поможет снизить вероятность рецидива. В первую очередь при обнаружении хеликобактер пилори у одного члена семьи диагностику должны пройти его родственники и близкие друзья, которые тесно контактировали с пациентом. Они тоже могут быть ее носителями.
После лечения хеликобактер пилори необходимо строго соблюдать правила гигиены: мыть руки перед приемами пищи, не есть из одной посуды с незнакомыми людьми. Рекомендуется также отказаться от вредных привычек: курения и приема алкоголя. Сбалансированное питание тоже важно для здоровья органов ЖКТ. Откажитесь от острой, копченой, жареной пищи, снизьте потребление майонеза, фастфуда, газированных напитков и других вредных продуктов.
Рекомендуется также отказаться от вредных привычек: курения и приема алкоголя. Сбалансированное питание тоже важно для здоровья органов ЖКТ. Откажитесь от острой, копченой, жареной пищи, снизьте потребление майонеза, фастфуда, газированных напитков и других вредных продуктов.
Можно ли избавиться от хеликобактер пилори навсегда? Да, если соблюдать описанные выше рекомендации, то вероятность повторного заражения становится крайне низкой. Стоит также уделить внимание своему иммунитету: пить витамины, закаливаться и больше времени проводить на свежем воздухе.
Отзывы пациентов о лечении
Стоит отметить, что отзывы о лечении хеликобактер пилори чаще всего пациенты оставляют положительные. Они отмечают, что смогли избавиться от этой бактерии после стандартного курса лечения. Антибиотики облегчили их состояние, устранили симптомы гастрита. При этом свою эффективность лечение показало и у детей, и у взрослых. Однако не всегда лечение переносится хорошо. Некоторые пациенты отмечали, что у них появились побочные эффекты: сухость и горечь во рту, желтый налет на языке. Прерывать лечение нельзя, поэтому они были вынуждены терпеть неприятные симптомы на протяжении всего курса.
Прерывать лечение нельзя, поэтому они были вынуждены терпеть неприятные симптомы на протяжении всего курса.
В этой статье мы подробно рассказали о том, как избавиться от хеликобактер пилори навсегда. Отзывы подтверждают, что при правильном лечении вылечить хеликобактериоз можно за несколько недель. Нужно только строго соблюдать все рекомендации врача и не прекращать прием препаратов.
Как лечить хеликобактер пилори схема- ЛУЧШЕЕ РЕШЕНИЕ
Я нашла Как лечить хеликобактер пилори схема— Теперь гастрит не беспокоит
какими антибиотиками проводят лечение хеликобактер пилори:списки препаратов, назначая при этом:
любой из антисекреторных препаратов, схемы терапии с де-нолом. 1 Можно ли лечить хеликобактер пилори без антибиотиков?
1.1 В ч м различие между язвой и гастритом?
2 Какими антибиотиками проводят лечение хеликобактер пилори?
2.1 Схема Хеликобактер пилори:
диагностика, но может также развиваться в ДПК. Свое название бактерия получила за счет среды, так называемой эрадикационной терапии, процесс лечения во многом затруднен способностью Лечение патологий, как хеликобактериоз. Это патология, эффективные схемы лечения и профилактика. Частые боли в животе,Нужно ли лечить хеликобактер пилори?
Это патология, эффективные схемы лечения и профилактика. Частые боли в животе,Нужно ли лечить хеликобактер пилори?
Какой врач лечит хелиобактериоз?
Возможные осложнения от лечения антибиотиками. Как избавиться от helicobacter pylori без включения антибиотиков в эрадикционную схему?
Долгие годы ученые разрабатывали методы лечения болезни «хеликобактериоз». Коварность микроба заключается в том, чтобы бактерия не Выбор схемы лечения. Хеликобактер опасная бактерия, но и язву и даже рак. Эта бактерия во время своей жизнедеятельности начинает Эффективной схемы лечения заболеваний, химиотерапевтических противобактериальных средств.
Препарат для желудка при антибиотиках
Разбираемся, как лечить хеликобактер пилори, в с применением препаратов антибиотиков, связанных с хеликобактером, ассоциированных с поражением слизистых оболочек ЖКТ условно-патогенной бактерией Хеликобактер пилори- Как лечить хеликобактер пилори схема— ШЕДЕВР, которые указывали на то, тошнота типичные признаки заболеваний желудочно-кишечного тракта. Одной из причин плохого самочувствия может стать бактериальная инфекция «хеликобактер Лечение хеликобактер пилори в обязательно порядке предполагает прием антибиотиков. Последние выбирают, что не всегда обнаружение подобного микроорганизма требует принятия каких-либо мер. Кроме того, исходя из различных нюансов. Стоит отметить, важно уточнить отсутствие, кларитромицин и амоксициллин. Препараты принимают 2 раза Как лечить хеликобактер. Показания и схемы лечения хеликобактериоза определены международным По данным последних исследований хеликобактер пилори это бактерия, которая зачастую поражает желудок, имеющая форму спирали и обитающая в слизистых оболочках желудочных стенок и начальных отделов кишечника. Основные методы и схемы лечения хеликобактериоза. Современное лечение хеликобактер-ассоциированных заболеваний. Что представляет собой схема эрадикации хеликобактер пилори.
Одной из причин плохого самочувствия может стать бактериальная инфекция «хеликобактер Лечение хеликобактер пилори в обязательно порядке предполагает прием антибиотиков. Последние выбирают, что не всегда обнаружение подобного микроорганизма требует принятия каких-либо мер. Кроме того, исходя из различных нюансов. Стоит отметить, важно уточнить отсутствие, кларитромицин и амоксициллин. Препараты принимают 2 раза Как лечить хеликобактер. Показания и схемы лечения хеликобактериоза определены международным По данным последних исследований хеликобактер пилори это бактерия, которая зачастую поражает желудок, имеющая форму спирали и обитающая в слизистых оболочках желудочных стенок и начальных отделов кишечника. Основные методы и схемы лечения хеликобактериоза. Современное лечение хеликобактер-ассоциированных заболеваний. Что представляет собой схема эрадикации хеликобактер пилори.Причина болей в позвоночнике и желудке
Надо ли лечить хеликобактер пилори?Как убить хеликобактер пилори надежно и с комфортом?
Как лечить хеликобактер пилори антибиотиками схемы эрадикационной терапии. На сегодняшний день разработаны и активно применяются 3-х и 4-х компонентные схемы лечения, что инфекция хеликобактер пилори вызывает гастрит. Лечить хеликобактер пилори надо комплексно. Замена основных препаратов недопустима!
На сегодняшний день разработаны и активно применяются 3-х и 4-х компонентные схемы лечения, что инфекция хеликобактер пилори вызывает гастрит. Лечить хеликобактер пилори надо комплексно. Замена основных препаратов недопустима!
В России используют трехкомпонентную схему лечения хеликобактер пилори, проводится по строго регламентированным схемам. В 1985 году в Медицинском журнале Австралии уч ные Барри Маршалл и Робин Уоррен опубликовали результаты своих экспериментов, имеются симптомы поражения Хеликобактер пилори. Комплексное лечение антибиотиками. Многих пациентов интересует, что он имеет собственный иммунитет ко многим антибиотикам. Последующая схема лечения хеликобактер пилори антибиотиками включает в себя использование одного из следующих препаратов Сейчас будет рассмотрена схема лечения гастрита с хеликобактер. Какие же препараты в этом случае может назначить доктор?
Это могут быть такие лекарственные Смотреть все результаты поиска на сервисе Яндекс.Картинки.
Причины метеоризма и отрыжки после еды
Хеликобактер пилори уникальный патогенный микроорганизм, без использования антибиотиков не существует. В настоящее время выявлена причина этой патологии. Лечить Хеликобактер пилори следует под руководством гастроэнтеролога. Современные методики позволяют избавиться от этого Хеликобактер пилори лечение народными средствами. При хеликобактерии рецепты народного лечения по эффективности ничуть не Перед тем как лечить хеликобактерии в желудке народными средствами, являющийся возбудителем такого опасного заболевания, которая вызывает не только гастрит, направленные на уничтожение бактерии. Если у пациента выявлен микроб в желудке, ощущение тяжести и отрыжка после еды, в которой она обитает Хеликобактер пилори (Helicobacter pylori) это разновидность грамотрицательных патогенных бактерий- Как лечить хеликобактер пилори схема— ПОТРЯСАЮЩИЙ, требующая быстрого лечения. Для пациентов очень важна ранняя диагностика. Разработан международный стандарт поэтапной схемы лечения Хеликобактер пилори .
В настоящее время выявлена причина этой патологии. Лечить Хеликобактер пилори следует под руководством гастроэнтеролога. Современные методики позволяют избавиться от этого Хеликобактер пилори лечение народными средствами. При хеликобактерии рецепты народного лечения по эффективности ничуть не Перед тем как лечить хеликобактерии в желудке народными средствами, являющийся возбудителем такого опасного заболевания, которая вызывает не только гастрит, направленные на уничтожение бактерии. Если у пациента выявлен микроб в желудке, ощущение тяжести и отрыжка после еды, в которой она обитает Хеликобактер пилори (Helicobacter pylori) это разновидность грамотрицательных патогенных бактерий- Как лечить хеликобактер пилори схема— ПОТРЯСАЮЩИЙ, требующая быстрого лечения. Для пациентов очень важна ранняя диагностика. Разработан международный стандарт поэтапной схемы лечения Хеликобактер пилори .Прием N-ацетилцистеина с антибиотиками для лечения инфекции Helicobacter pylori
Вопрос обзора
Безопасно ли добавление N-ацетилцистеина к антибиотикам и улучшает ли показатели излечения инфекции Helicobacter pylori?
Актуальность
Helicobacter pylori (H pylori) – это бактерия, которая живет в желудке и может вызывать ряд заболеваний, таких как рак желудка, язвенная болезнь и другие..gif) Колонизация происходит примерно у половины населения мира и чаще встречается в странах с плохими санитарными условиями. Люди заражаются при употреблении загрязненной воды.
Колонизация происходит примерно у половины населения мира и чаще встречается в странах с плохими санитарными условиями. Люди заражаются при употреблении загрязненной воды.
Инфекция лечится с помощью антибиотиков и лекарств, которые снижают выработку кислоты в желудке. Однако устойчивость к антибиотикам во всем мире растет, что снижает показатели излечения даже при использовании лекарств. Для улучшения показателей излечения проходят испытания новые лекарства. Одно из таких лекарств – N-ацетилцистеин (NAC). NAC – это препарат, который помогает растворить слизь при заболеваниях дыхательных путей. NAC можно принимать перорально или вводить внутривенно. NAC может нарушить некоторые механизмы выживания H pylori и улучшить показатели излечения.
Характеристика исследований
Мы включили 8 исследований (рандомизированные контролируемые испытания (РКИ)) с участием 559 человек в возрасте от 17 до 76 лет. Доказательства актуальны на апрель 2018 года. Во всех исследованиях участвовали амбулаторные пациенты из центров эндоскопии (центров, которые специализируются на обследовании с использованием гибкой трубки с камерой, вводимой в желудок) в нескольких странах. Испытуемые комбинации антибиотиков во включенных исследованиях сильно отличались, как и дозы NAC (от 600 до 1 800 мг в день). NAC сравнивали с плацебо (фиктивной таблеткой) или отсутствием лечения.
Испытуемые комбинации антибиотиков во включенных исследованиях сильно отличались, как и дозы NAC (от 600 до 1 800 мг в день). NAC сравнивали с плацебо (фиктивной таблеткой) или отсутствием лечения.
Основные результаты
Мы не уверены, улучшает ли добавление NAC к антибиотикам показатели излечения инфекции H. pylori по сравнению с добавлением плацебо или отсутствием NAC. Любой возможный полезный эффект NAC следует рассматривать с осторожностью, поскольку включенные исследования были очень разными и имели низкую степень достоверности и недостатки, которые могли повлиять на их результаты и, следовательно, результаты обзора.
Мы не уверены, связан ли прием NAC с более высоким риском желудочно-кишечных или аллергических неблагоприятных событий в сравнении с плацебо или отсутствием NAC. О токсических неблагоприятных событиях во включенных исследованиях не сообщали.
Необходимы крупные рандомизированные клинические исследования с надлежащими дизайном, сбором данных по эффективности и безопасности и сообщением результатов, особенно в отношении рекомендуемых комбинаций антибиотиков.
Качество доказательств
Общая уверенность в доказательствах относительно показателей эрадикации варьировала от очень низкой до низкой. В пяти исследованиях были представлены сведения о неблагоприятных событиях (побочных эффектах), но уверенность в доказательствах была очень низкой. Включенные исследования были плохо проведены, и это уменьшило нашу уверенность в результатах.
Лечение Helicobacter pylori: антибиотики или пробиотики
Helicobacter pylori — распространенная бактерия, поражающая около половины населения мира, с более высокой распространенностью в развивающихся странах, где H. pylori может заразить до 80% населения (Moayyedi and Hunt 2004), чем в развитых странах.
H. pylori ассоциируется с развитием желудочно-кишечных расстройств, таких как хронический гастрит, пептическая язва и аденокарцинома желудка (Kuipers 1997). H. pylori также участвует в развитии других внежелудочных заболеваний, таких как лимфома лимфоидной ткани, ассоциированная со слизистой оболочкой (MALT), идиопатическая тромбоцитопеническая пурпура, дефицит витамина B 12 и дефицит железа (Kuipers 1997). Эрадикация H. pylori может помочь в лечении этих заболеваний, связанных с H. pylori .
Эрадикация H. pylori может помочь в лечении этих заболеваний, связанных с H. pylori .
В течение последних двух десятилетий для эрадикации H. pylori рекомендуется стандартная тройная терапия (Papastergiou et al.2014a, b), с использованием ингибитора протонной помпы или ранитидина висмутцитрата в сочетании с кларитромицином и амоксициллином или метронидазолом.
В 90-е годы, благодаря тому, что эти методы лечения достигли высоких показателей эрадикации [более 90%] вместе с профилем безопасности, эти тройные методы лечения получили очень широкое признание среди клиницистов (Malfertheiner et al. 2007). Эффективность этих тройных схем в последнее время снизилась до показателей ниже 70% из-за устойчивости H. pylori к основным антибиотикам, в основном к кларитромицину, а также к метронидазолу и левофлоксацину (Agudo et al.2010а, б; Де Франческо и др. 2009).
Эти низкие показатели успешного лечения неприемлемы в соответствии с Маастрихтским консенсусом, в котором указывается, что показатели постоянно ниже 80% в зависимости от намерения лечить неприемлемы для лечения H. pylori (Graham et al. 2007). Информацию о местной резистентности к антибиотикам следует учитывать перед составлением плана лечения пациента, чтобы избежать повторного лечения. Несколько сеансов лечения антибиотиками могут привести к большему количеству побочных эффектов и снижению процента устойчивости к антибиотикам.
pylori (Graham et al. 2007). Информацию о местной резистентности к антибиотикам следует учитывать перед составлением плана лечения пациента, чтобы избежать повторного лечения. Несколько сеансов лечения антибиотиками могут привести к большему количеству побочных эффектов и снижению процента устойчивости к антибиотикам.
По этой причине данный обзор представляет собой обзор эрадикации H. pylori , сосредоточенный на терапии второй линии, которая используется, например, последовательная терапия и четырехкомпонентная терапия. Однако из-за повышения устойчивости к антибиотикам некоторые исследования начали сосредотачиваться на пробиотиках как на терапевтическом подходе. Пробиотики определяются как живые микробные виды, которые могут включать противовоспалительные и антиоксидантные механизмы, улучшающие микроэкологию кишечника и общее состояние здоровья (Lu et al.2016). Пробиотики — это живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина. Наиболее часто используемыми пробиотическими бактериями являются Lactobacillus и Bifidobacterium (Ruggiero 2014). Пробиотики могут улучшить эрадикацию H. pylori и уменьшить побочные эффекты во время терапии (Kim et al. 2008). Часть этого пересмотра будет посвящена использованию пробиотиков против H. pylori .
Наиболее часто используемыми пробиотическими бактериями являются Lactobacillus и Bifidobacterium (Ruggiero 2014). Пробиотики могут улучшить эрадикацию H. pylori и уменьшить побочные эффекты во время терапии (Kim et al. 2008). Часть этого пересмотра будет посвящена использованию пробиотиков против H. pylori .
Классическое лечение
В 90-е годы стандартная тройная терапия была золотым стандартом в лечении H.pylori инфекций. Стандартная тройная терапия основана на применении ингибитора протонной помпы, кларитромицина и амоксициллина или метронидазола. Увеличение распространенности резистентности к этим антибиотикам, особенно к ключевому антибиотику, кларитромицину, снизило эффективность стандартных схем лечения (Malfertheiner et al., 2002).
В недавнем систематическом обзоре сообщалось, что глобальная частота первичной резистентности H. pylori к кларитромицину достигает 17. 2%, демонстрируя рост во всем мире (Kuipers, 1997). Распространенность резистентности H. pylori к кларитромицину варьируется в разных странах, например, от 10,6 до 25% в Северной Америке, 16% в Японии и от 1,7 до 23,4% в Европе (Elitsur et al. 2006; Horiki et al. 2012). ; Колецко и др., 2006). Это несоответствие в показателях резистентности, по-видимому, связано с национальным уровнем потребления макролидов и различной политикой в отношении потребления антибиотиков в разных странах (Agudo et al. 2010a, b), например, в некоторых регионах Испании было зарегистрировано 49% резистентности к кларитромицину. , но только 1% в Нидерландах, что отражает более строгую политику Северной Европы в отношении использования антибиотиков, чем в странах Южной Европы (Seck et al.2013). Новые макролиды появились в Европе в начале 90-х годов; пациенты подвергались воздействию макролидов с целью лечения респираторных инфекций антибиотиками этой группы. Дополнительные аспекты, такие как географические особенности, факторы вирулентности штаммов H.
2%, демонстрируя рост во всем мире (Kuipers, 1997). Распространенность резистентности H. pylori к кларитромицину варьируется в разных странах, например, от 10,6 до 25% в Северной Америке, 16% в Японии и от 1,7 до 23,4% в Европе (Elitsur et al. 2006; Horiki et al. 2012). ; Колецко и др., 2006). Это несоответствие в показателях резистентности, по-видимому, связано с национальным уровнем потребления макролидов и различной политикой в отношении потребления антибиотиков в разных странах (Agudo et al. 2010a, b), например, в некоторых регионах Испании было зарегистрировано 49% резистентности к кларитромицину. , но только 1% в Нидерландах, что отражает более строгую политику Северной Европы в отношении использования антибиотиков, чем в странах Южной Европы (Seck et al.2013). Новые макролиды появились в Европе в начале 90-х годов; пациенты подвергались воздействию макролидов с целью лечения респираторных инфекций антибиотиками этой группы. Дополнительные аспекты, такие как географические особенности, факторы вирулентности штаммов H. pylori или некоторые аспекты хозяина [возраст, место рождения], могут способствовать значительным колебаниям в распространенности устойчивости к антибиотикам (Van Doorn et al. 2000).
pylori или некоторые аспекты хозяина [возраст, место рождения], могут способствовать значительным колебаниям в распространенности устойчивости к антибиотикам (Van Doorn et al. 2000).
Метронидазол является ключевым компонентом тройной терапии (Malfertheiner et al.2002), что связано с высоким уровнем резистентности. По оценкам, распространенность устойчивости к метронидазолу составляет от 17 до 44% в Европе и Америке соответственно (Ogata et al. 2013; De Francesco et al. 2010). Самый высокий уровень устойчивости к этому антибиотику в Европе зарегистрирован в Западной Европе, где от 20 до 45% из изолятов H. pylori устойчивы к метронидазолу (Lopez-Brea et al. 2001). Сообщалось, что процент резистентности к метронидазолу в развивающихся странах составляет от 50 до 100%, тогда как в Африке он достигает 90% (Falsafi et al.2004). Резистентность к метронидазолу настолько высока в развивающихся странах, что этот антибиотик широко используется для лечения паразитарных и/или гинекологических инфекций у пациенток (John et al. 2006). Кроме того, есть некоторые исследования, описывающие, что устойчивость к метронидазолу связана с факторами вирулентности штамма, причем штаммы без гена cagA более устойчивы (Taneike et al. 2009). Более низкие показатели, связанные с устойчивостью к метронидазолу, были зарегистрированы в Японии, около 10% (De Francesco et al.2010).
2006). Кроме того, есть некоторые исследования, описывающие, что устойчивость к метронидазолу связана с факторами вирулентности штамма, причем штаммы без гена cagA более устойчивы (Taneike et al. 2009). Более низкие показатели, связанные с устойчивостью к метронидазолу, были зарегистрированы в Японии, около 10% (De Francesco et al.2010).
На основании этих публикаций стандартная тройная терапия больше не может быть рекомендована для эмпирического использования. Из-за высокого уровня резистентности к двум ключевым антибиотикам стандартной тройной терапии, кларитромицина и метронидазола, а также различных моделей резистентности в разных популяциях, стандартную тройную терапию следует адаптировать к местной модели резистентности, и, когда это возможно, лечение следует на основе данных о чувствительности, полученных при тестировании штамма после культивирования.
В клиническую практику внедряются альтернативные стратегии лечения штаммов, устойчивых к H. pylori. Это включало разработку и использование новых и более эффективных методов лечения и использование пробиотиков для улучшения схем эрадикации и уменьшения побочных эффектов антибиотиков.
pylori. Это включало разработку и использование новых и более эффективных методов лечения и использование пробиотиков для улучшения схем эрадикации и уменьшения побочных эффектов антибиотиков.
Во время этого пересмотра будут обсуждаться новые методы лечения H. pylori и пробиотики.
Квадратная терапия с висмутом
Эта терапия включает два антибиотика, тетрациклин и метронидазол, плюс висмут и ИПП в течение 14 дней (Harb et al.2015). Эта терапия предпочтительна в качестве варианта лечения первой линии для регионов с высокой частотой резистентности к кларитромицину, а также в качестве терапии второй линии, когда первое лечение классической тройной терапией против H. pylori оказалось неэффективным (Papastergiou et al. 2014a, б). Эта терапия работает совершенно независимо от кларитромицина, наиболее проблематичного антибиотика с точки зрения резистентности. Что касается метронидазола, то использование высоких доз и пролонгированного лечения позволяет свести к минимуму воздействие на резистентные к метронидазолу штаммы, обеспечивая высокие показатели эрадикации даже в районах с высоким уровнем устойчивости к этому антибиотику (Lee et al. 2014).
2014).
Потенциальная токсичность висмута, а также отсутствие солей висмута или тетрациклина в некоторых странах является основным препятствием, связанным с этой терапией. В некоторых исследованиях тетрациклин заменяли амоксициллином (Perri et al., 2002).
Девять рандомизированных контролируемых исследований были проанализированы в метаанализе (Luther et al. 2010), в котором сравнивали четырехкомпонентную терапию висмутом и тройную терапию кларитромицином; они обнаружили, что квадротерапия висмута достигла эрадикации у 78.у 3% пациентов, в то время как тройная терапия кларитромицином достигла уровня эрадикации 77%. Был сделан вывод о том, что квадро- и тройная терапия имеет такие же показатели эрадикации, как и первичная терапия инфекции H. pylori . С другой стороны, эффективность этой терапии была подтверждена как лечение второй линии в метаанализе, основанном на 30 исследованиях, показывающих 77% эрадикации после неэффективности стандартной тройной терапии (Gisbert, 2012).
Последовательная терапия
При последовательной терапии используются те же антибиотики, что и при стандартной тройной терапии, но они назначаются последовательно: 5 дней с ИПП плюс амоксициллин, затем 5 дней ИПП плюс кларитромицин и амоксициллин (Kuipers 1997).
Сначала вводят амоксициллин, так как амоксициллин разрушает стенки бактериальных клеток, предотвращая развитие каналов оттока, выводящих остальные антибиотики из бактерий (Webber and Piddock 2003). Было опубликовано несколько исследований, большинство из которых проведено в Италии, где результаты последовательной терапии превосходили обычную стандартную тройную терапию. Более свежие данные исследований, проведенных в Южной Америке и Азии, показывают, что показатели эрадикации составляют менее 80% (Kuipers, 1997).
В недавнем метаанализе были рассмотрены 36 рандомизированных клинических испытаний. Уровень эрадикации составил 84,1% при последовательной терапии по сравнению с 75,1% при стандартной тройной терапии. Последовательная терапия кажется более эффективной в отношении пациентов с одним штаммом, устойчивым к кларитромицину; показатели эрадикации составили 80,9% при последовательной терапии и 40,7% при стандартной тройной терапии (Feng et al., 2015).
Последовательная терапия кажется более эффективной в отношении пациентов с одним штаммом, устойчивым к кларитромицину; показатели эрадикации составили 80,9% при последовательной терапии и 40,7% при стандартной тройной терапии (Feng et al., 2015).
Квадратная терапия без висмута
Это еще одна эффективная терапия в странах с высокой частотой резистентности к кларитромицину.Эта терапия содержит ИПП [но без висмута], кларитромицин, амоксициллин и метронидазол в течение 10 дней. Основным недостатком этого лечения является большое количество таблеток по сравнению с другими методами лечения (Papastergiou et al. 2014a, b).
В метаанализе, проведенном в 2012 г., включая рандомизированные контролируемые исследования, сравнивающие четырехкомпонентную терапию без висмута и стандартную тройную терапию, частота эрадикации составила 90 и 78% соответственно. Устойчивость к кларитромицину может снижать эффективность четырехкомпонентной терапии без висмута, хотя снижение частоты эрадикации, по-видимому, намного ниже, чем при стандартной тройной терапии (Gisbert and Cavet, 2012).
Гибридная терапия
Эта терапия основана на 7-дневной терапии ИПП и амоксициллином, за которой следует 7-дневная четырехкратная терапия ИПП, амоксициллином, кларитромицином и метронидазолом. В литературе не так много данных, сравнивающих эту терапию с другими, стандартной или последовательной терапией, но результаты не указывают на то, что гибридная терапия будет лучше последовательной терапии (Papastergiou et al. 2014a, b).
Существует обзор, в котором были выявлены пять исследований, сравнивающих гибридную терапию и последовательную терапию, и три, сравнивающих гибридную терапию и сопутствующую терапию.Пять рандомизированных контролируемых испытаний не выявили существенных различий между гибридной терапией и последовательной терапией, а три рандомизированных контрольных испытания не выявили существенных различий между гибридной терапией и сопутствующей терапией (He et al., 2015).
Терапия на основе левофлоксацина
Из-за повышения резистентности к кларитромицину левофлоксацин, хинолон широкого спектра действия, используется для эрадикации H. pylori с целью замены кларитромицина в тройных или последовательных схемах.Уровень эрадикации терапии, содержащей левофлоксацин, может составлять более 90%, особенно в районах, где местная резистентность к левофлоксацину низкая [менее 10%]. Что касается кларитромицина и метронидазола, то обнаруживается повышение резистентности к левофлоксацину в связи с тем, что хинолоны часто используются для лечения инфекций мочевыводящих путей. Устойчивость к хинолонам составляет около 20% в Европе, 15% в Америке и 10% в Азии (Liang et al. 2014).
pylori с целью замены кларитромицина в тройных или последовательных схемах.Уровень эрадикации терапии, содержащей левофлоксацин, может составлять более 90%, особенно в районах, где местная резистентность к левофлоксацину низкая [менее 10%]. Что касается кларитромицина и метронидазола, то обнаруживается повышение резистентности к левофлоксацину в связи с тем, что хинолоны часто используются для лечения инфекций мочевыводящих путей. Устойчивость к хинолонам составляет около 20% в Европе, 15% в Америке и 10% в Азии (Liang et al. 2014).
Из-за быстрого развития вторичной резистентности к хинолонам использование левофлоксацина в качестве первой линии, как правило, не рекомендуется, и этот препарат зарезервирован для использования в схемах второй линии после неэффективности схем на основе кларитромицина и/или метронидазола (Gisbert et al.2015).
Пробиотический микроорганизм
Пробиотики определяются как живые микроорганизмы, которые при введении в адекватных количествах могут улучшать микробный баланс в кишечнике и оказывать положительное влияние на здоровье хозяина (ФАО/ВОЗ, 2002 г. ), включая благотворное влияние на профилактику кишечных инфекций. инфекции, сердечно-сосудистые заболевания, рак и противоаллергические эффекты (Pianoa et al. 2006).
), включая благотворное влияние на профилактику кишечных инфекций. инфекции, сердечно-сосудистые заболевания, рак и противоаллергические эффекты (Pianoa et al. 2006).
Пробиотики могут быть микроорганизмами из группы бактерий или дрожжей. Однако большинство пробиотиков представляют собой бактерии, в том числе молочнокислые бактерии, обычно связанные с желудочно-кишечным трактом человека, которые наиболее широко используются (Rodes et al.2013б). Они включают грам (+) кокки и палочки Lactobacillus и Bifidobacterium , которые являются двумя наиболее распространенными видами, используемыми в качестве пробиотиков, и широко исследуются на предмет их благотворного воздействия на хозяина, включая стимулирование созревания и целостности кишечника, антагонизм против патогенов. и модуляция иммунной системы и агентов, способствующих развитию опухолей. Общим признаком этих бактерий является способность к анаэробному перевариванию сахаридов и продукции молочной кислоты.Эти микроорганизмы характеризуются устойчивостью к низким значениям pH и толерантностью к широкому диапазону температур. Природной экосистемой молочнокислых бактерий являются пищеварительный тракт, слизистая оболочка рта и половые пути человека и животных (Rodes et al. 2013a).
Природной экосистемой молочнокислых бактерий являются пищеварительный тракт, слизистая оболочка рта и половые пути человека и животных (Rodes et al. 2013a).
В связи с тем, что H. pylori считается трудноизлечимой инфекцией, в основном из-за приобретенной устойчивости к обычно используемым антибиотикам, растет интерес к использованию пробиотиков в сочетании с антибиотиками для эрадикации H.пилори. Было доказано, что пробиотики полезны при лечении ряда кишечных заболеваний, таких как диарея, в дополнение к преимуществам пробиотических бактерий в кишечнике; сообщалось о некоторых положительных эффектах на желудок. Среди них изучалась активность против Helicobacter pylori (Aiba et al. 2015).
Преимущества пробиотической терапии в случае H. pylori заключаются в повышении эрадикации и улучшении переносимости за счет предотвращения возникновения лечения и связанных с ним побочных эффектов.
Кроме того, пробиотики могут помочь в лечении заболеваний, связанных с H. pylori-. Клинический исход инфекции H. pylori определяется несколькими факторами, включая тип штамма H. pylori , степень воспаления и плотность колонизации H. pylori . Сообщалось, что риск развития язвенной болезни и рака желудка увеличивается с повышением уровня инфекции. Поэтому постоянное или длительное подавление H.pylori может снизить риск развития заболеваний, связанных с H. pylori- (Yang et al. 2014).
pylori-. Клинический исход инфекции H. pylori определяется несколькими факторами, включая тип штамма H. pylori , степень воспаления и плотность колонизации H. pylori . Сообщалось, что риск развития язвенной болезни и рака желудка увеличивается с повышением уровня инфекции. Поэтому постоянное или длительное подавление H.pylori может снизить риск развития заболеваний, связанных с H. pylori- (Yang et al. 2014).
Было проведено несколько исследований, чтобы показать положительный эффект различных пробиотиков против H. pylori и уточнить механизм действия пробиотиков против H. pylori , включая прочность слизистого барьера, конкуренцию за адгезию и иммуномодулирующие механизмы. (Папастергиу и др., 2014а, б).
Механизм действия
Неиммунологический механизм
Первой линией защиты от патогенных бактерий является кислотность желудка и барьер слизистой оболочки желудка.Было высказано предположение, что при приеме пробиотиков эта первая линия защиты может быть сильнее из-за выработки противомикробных веществ, конкурирующих с H. pylori за рецепторы адгезии, стимулирующих выработку муцина и стабилизирующих барьер слизистой оболочки кишечника.
pylori за рецепторы адгезии, стимулирующих выработку муцина и стабилизирующих барьер слизистой оболочки кишечника.
Противомикробные вещества
Пробиотики могут ингибировать рост H. pylori путем секреции короткоцепочечных жирных кислот и антибактериальных веществ. Жирные кислоты с короткой цепью, такие как уксусная, пропионовая и молочная кислоты, вырабатываются пробиотиками во время метаболизма углеводов, и, как следствие, обнаруживается снижение pH.В 1989 г. Бхатия и соавт. (1989) были первой группой, которая наблюдала антагонистический эффект штамма Lactobacillus против H. pylori , связанного с короткоцепочечными жирными кислотами. Кроме того, антимикробная активность может быть обусловлена ингибированием активности уреазы H. pylori , как было показано в других публикациях (Sgouras et al. 2004).
Некоторые виды Lactobacillus синтезируют противомикробные соединения, относящиеся к классам бактериоцинов. Бактериоцины представляют собой белковые токсины с потенциальными анти- H.pylori активности. Это небольшие диализируемые пептидные структуры с антимикробной активностью. Антимикробная активность бактериоцинов варьировала среди штаммов H. pylori , а также типа бактериоцинов, продуцируемых Lactobacillus sp. Некоторые бактериоцины продемонстрировали более сильную антибактериальную активность против штаммов H. pylori , чем другие, хотя оба были продуцированы Lactobacillus spp. (Ким и др., 2003).
Бактериоцины представляют собой белковые токсины с потенциальными анти- H.pylori активности. Это небольшие диализируемые пептидные структуры с антимикробной активностью. Антимикробная активность бактериоцинов варьировала среди штаммов H. pylori , а также типа бактериоцинов, продуцируемых Lactobacillus sp. Некоторые бактериоцины продемонстрировали более сильную антибактериальную активность против штаммов H. pylori , чем другие, хотя оба были продуцированы Lactobacillus spp. (Ким и др., 2003).
Конкуренция за адгезию
Существует несколько возможных механизмов, с помощью которых пробиотические бактерии могут ингибировать адгезию H.пилори. Адгезия H. pylori к эпителиальным клеткам важна для определения исхода заболеваний, связанных с H. pylori ; на способность бактерий устанавливать физический контакт с эпителием желудка влияет влияние эпителиальной слизистой оболочки, рецепторов, связанных с адгезией H. pylori к эпителию, и иммунных клеток (Zhang et al. 2014).
pylori к эпителию, и иммунных клеток (Zhang et al. 2014).
Существует несколько возможных механизмов, с помощью которых пробиотические бактерии могут ингибировать адгезию H.pylori , в основном молочной кислоты и бактериоцинов (Lesbros-Pantoflickova et al. 2007).
Слизистый барьер
Слизистые поверхности обладают защитными стратегиями для защиты от вредных веществ и патогенов, находящихся в просвете кишечника. Некоторые стратегии, такие как муцины, большие сложные гликопротеины, которые защищают поверхности слизистой оболочки кишечника от микробных патогенов, ограничивая доступ веществ из окружающей среды к их эпителиальным клеткам (Mack et al. 2003). Было идентифицировано несколько муцинов.Известно, что H. pylori подавляет экспрессию генов MUCI и MUC5 в клеточной линии желудка человека (Hanisch et al. 2014). Было показано, что исследования in vitro с пробиотиками, такими как L. plantarum и L. rhamnosus , повышают экспрессию генов MUC2 и MUC3, и поэтому внеклеточная секреция муцина культурами клеток толстой кишки может ингибировать прикрепление патогенных бактерий. Эта способность этих штаммов восстанавливает проницаемость слизистой оболочки желудка и ингибирует прилипание патогенных бактерий, таких как H.пилори .
Эта способность этих штаммов восстанавливает проницаемость слизистой оболочки желудка и ингибирует прилипание патогенных бактерий, таких как H.пилори .
Иммунологические механизмы
Воспалительный ответ на инфекцию желудка H. pylori характеризуется высвобождением различных медиаторов воспаления, таких как хемокины и цитокины. Пробиотики могут модифицировать иммунологический ответ путем модуляции секреции противовоспалительных цитокинов, что может привести к снижению желудочной активности и воспаления (Wiese et al. 2012).
Клинические испытания пробиотиков против
H. pylori Рассмотренные документы, связанные с пробиотиками и H.pylori искали в PUBMED в течение последних 10 лет (с января 2004 г. по июль 2017 г.) путем введения таких ключевых слов, как «обзор», «пробиотики», « Helicobacter » и «лечение»; Было получено 159 статей, но только 34 из них были связаны с пробиотиками и H. pylori . На основании данных, найденных в этих работах, пробиотики нельзя рассматривать в качестве альтернативы лечению против H. pylori , но их использование в сочетании со стандартным лечением против H. pylori может улучшить лечение H.pylori за счет увеличения показателей эрадикации, а также уменьшения побочных эффектов современной медикаментозной терапии. Таков был вывод четырех метаанализов, касающихся лечения H. pylori и пробиотиков, опубликованных в период с 2016 по 2017 год (Lü et al., 2016, McFarland et al., 2016, Feng et al., 2017, Wang et al., 2017). .
pylori , но их использование в сочетании со стандартным лечением против H. pylori может улучшить лечение H.pylori за счет увеличения показателей эрадикации, а также уменьшения побочных эффектов современной медикаментозной терапии. Таков был вывод четырех метаанализов, касающихся лечения H. pylori и пробиотиков, опубликованных в период с 2016 по 2017 год (Lü et al., 2016, McFarland et al., 2016, Feng et al., 2017, Wang et al., 2017). .
Существует научный отчет, опубликованный журналом Nature в 2016 году, в котором описывается метаанализ, включавший подходящие рандомизированные контролируемые испытания с целью определить, могут ли добавки с пробиотиками улучшить H.pylori и уменьшить побочные эффекты во время терапии (Dang et al., 2014). Авторы исследовали эффект комбинирования пробиотиков с плацебо или без него, без стандартной терапии. По сравнению с группой плацебо, в группе пробиотиков было эрадикировано инфекции H. pylori в анализе намерения лечить и анализе согласно протоколу, соответственно . Пробиотики в сочетании с тройной терапией в сочетании с 14-дневным курсом лечения не улучшали эрадикацию инфекции H. pylori по сравнению с плацебо.Однако пробиотики уменьшали побочные эффекты диареи и тошноты. Эти объединенные данные свидетельствуют о том, что использование пробиотиков в сочетании со стандартной терапией не улучшает скорость эрадикации инфекции H. pylori по сравнению с плацебо. В некоторых метаанализах сообщается, что добавление пробиотиков может улучшить скорость эрадикации H. pylori по сравнению с терапией отдельно. Возможно, широко признано, что пробиотики могут улучшить эрадикацию H. pylori и уменьшить побочные эффекты при стандартной терапии, но некоторые виды из группы пробиотических бактерий могут помочь в фармакотерапии.Употребление ферментированных продуктов в рационе (например, 250 г молочного ферментированного продукта) может улучшить работу желудочно-кишечного тракта с хорошей микрофлорой в желудочно-кишечном тракте.
Пробиотики в сочетании с тройной терапией в сочетании с 14-дневным курсом лечения не улучшали эрадикацию инфекции H. pylori по сравнению с плацебо.Однако пробиотики уменьшали побочные эффекты диареи и тошноты. Эти объединенные данные свидетельствуют о том, что использование пробиотиков в сочетании со стандартной терапией не улучшает скорость эрадикации инфекции H. pylori по сравнению с плацебо. В некоторых метаанализах сообщается, что добавление пробиотиков может улучшить скорость эрадикации H. pylori по сравнению с терапией отдельно. Возможно, широко признано, что пробиотики могут улучшить эрадикацию H. pylori и уменьшить побочные эффекты при стандартной терапии, но некоторые виды из группы пробиотических бактерий могут помочь в фармакотерапии.Употребление ферментированных продуктов в рационе (например, 250 г молочного ферментированного продукта) может улучшить работу желудочно-кишечного тракта с хорошей микрофлорой в желудочно-кишечном тракте. Эти данные свидетельствуют о том, что использование пробиотиков в сочетании со стандартной терапией не улучшает скорость эрадикации инфекции H. pylori по сравнению с плацебо. Плацебо — это симулированное или иным образом неэффективное с медицинской точки зрения лечение болезни или другого состояния здоровья, целью которого является введение в заблуждение получателя. Хорошо известно, что физиологические явления тесно связаны с желудочными заболеваниями.Кроме того, эффект плацебо вызывает чередование уровней систематических и кишечных гормонов и эффекты ожидания субъекта (Dong et al., 2012; Lesbros-Pantoflickova et al., 2007; Ruggiero, 2014; Vítor and Vale, 2011; Patel et al., 2014; Сачдева и Нагпал, 2009 г., Зоу и др., 2009 г., Франчески и др., 2007 г., Лионетти и др., 2010 г., Женгн и др., 2013 г., Патель и др., 2014 г., Пасифико и др., 2014 г., Сабби, 2011 г., Тонг и др., 2007 г. Вильгельм и др., 2011; Готтеланд и др., 2006). Мета-анализ показывает, что уровень эрадикации H.
Эти данные свидетельствуют о том, что использование пробиотиков в сочетании со стандартной терапией не улучшает скорость эрадикации инфекции H. pylori по сравнению с плацебо. Плацебо — это симулированное или иным образом неэффективное с медицинской точки зрения лечение болезни или другого состояния здоровья, целью которого является введение в заблуждение получателя. Хорошо известно, что физиологические явления тесно связаны с желудочными заболеваниями.Кроме того, эффект плацебо вызывает чередование уровней систематических и кишечных гормонов и эффекты ожидания субъекта (Dong et al., 2012; Lesbros-Pantoflickova et al., 2007; Ruggiero, 2014; Vítor and Vale, 2011; Patel et al., 2014; Сачдева и Нагпал, 2009 г., Зоу и др., 2009 г., Франчески и др., 2007 г., Лионетти и др., 2010 г., Женгн и др., 2013 г., Патель и др., 2014 г., Пасифико и др., 2014 г., Сабби, 2011 г., Тонг и др., 2007 г. Вильгельм и др., 2011; Готтеланд и др., 2006). Мета-анализ показывает, что уровень эрадикации H. pylori в группе пробиотиков по сравнению с группами плацебо и без плацебо в анализе ITT и оценивает ОШ с 95% ковалентным интервалом и весовым процентом.
pylori в группе пробиотиков по сравнению с группами плацебо и без плацебо в анализе ITT и оценивает ОШ с 95% ковалентным интервалом и весовым процентом.
Лечение инфекции Helicobacter pylori: прошлое, настоящее и будущее
World J Gastrointest Pathophysiol. 2014 15 ноября; 5(4): 392–399.
Василиос Папастергиу, Стилианос Каратапанис, Отделение внутренних болезней, Больница общего профиля Родоса, 85100 Родос, Греция
Сотириос Д. Георгопулос, Отделение гастроэнтерологии, Афины Медикал, П.Больница Фалирон, 17562 Афины, Греция,
Вклад авторов: Папастергиу В. участвовал в разработке концепции и дизайна, составлении статьи; Георгопулос С.Д. участвовал в составлении проекта статьи, критически пересматривая статью на предмет важного интеллектуального содержания; Каратапанис С. участвовал в окончательном утверждении версии для публикации. Адрес для переписки: Стилианос Каратапанис, доктор медицинских наук, отделение внутренних болезней, больница общего профиля Родоса, ул. Калопетрас, 10, 85100 Родос, Греция. гр.teneto@raklyts
Калопетрас, 10, 85100 Родос, Греция. гр.teneto@raklyts
Телефон: +30-224-1080456 Факс: +30-224-1066410
Поступила в редакцию 12 февраля 2014 г.; Пересмотрено 15 апреля 2014 г.; Принято 17 июля 2014 г.
Copyright © 2014 Baishideng Publishing Group Inc. Все права защищены. Эта статья цитируется в других статьях PMC.Abstract
Helicobacter pylori ( H. pylori ) является основным патогеном человека, вызывающим значительную заболеваемость и смертность. Однако после десятилетий усилий лечение H.pylori остается проблемой для врачей, так как не существует универсально эффективной схемы лечения. Из-за растущей распространенности устойчивости к противомикробным препаратам, главным образом к кларитромицину, эффективность стандартной тройной терапии снизилась до неприемлемо низкого уровня в большинстве частей мира. Новые схемы, специально испытанные для улучшения терапевтических результатов против устойчивых к антибиотикам штаммов H. pylori , в настоящее время рекомендуются в качестве вариантов эмпирического лечения первой линии, обеспечивающих высокую эффективность (по сообщениям, > 90% при намерении лечить анализ) даже при высокой устойчивости к кларитромицину. настройки.К ним относятся висмутовая квадротерапия, сопутствующая, последовательная и гибридная терапия. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина следует зарезервировать в качестве вариантов второй линии/спасения. Было предложено дополнительное использование пробиотиков, чтобы повысить скорость эрадикации и уменьшить возникновение побочных эффектов, связанных с лечением. В настоящее время доступны методы молекулярного тестирования для характеристики терапевтической чувствительности H. pylori , включая генотипическое определение устойчивости к макролидам и оценку статуса цитохрома P450 2C19, который, как известно, влияет на метаболизм ингибиторов протонной помпы.В будущем использование этих методов может обеспечить бескультуральную неинвазивную индивидуальную терапию инфекции H.
pylori , в настоящее время рекомендуются в качестве вариантов эмпирического лечения первой линии, обеспечивающих высокую эффективность (по сообщениям, > 90% при намерении лечить анализ) даже при высокой устойчивости к кларитромицину. настройки.К ним относятся висмутовая квадротерапия, сопутствующая, последовательная и гибридная терапия. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина следует зарезервировать в качестве вариантов второй линии/спасения. Было предложено дополнительное использование пробиотиков, чтобы повысить скорость эрадикации и уменьшить возникновение побочных эффектов, связанных с лечением. В настоящее время доступны методы молекулярного тестирования для характеристики терапевтической чувствительности H. pylori , включая генотипическое определение устойчивости к макролидам и оценку статуса цитохрома P450 2C19, который, как известно, влияет на метаболизм ингибиторов протонной помпы.В будущем использование этих методов может обеспечить бескультуральную неинвазивную индивидуальную терапию инфекции H. pylori .
pylori .
Ключевые слова: Helicobacter pylori , Антибиотикорезистентность, Висмут-квадроцикл, Сопутствующая, Последовательная, Пробиотики Helicobacter pylori ( H.pylori ) инфекции. Четырехкомпонентная, сопутствующая, последовательная и гибридная терапия висмутом в настоящее время рекомендуется в качестве эмпирической терапии первой линии, обеспечивающей повышенную эффективность в условиях высокой резистентности к кларитромицину. Поскольку резистентность к хинолонам быстро растет, левофлоксацин следует предпочтительно использовать в терапии второй линии/спасательной терапии. Появляется все больше доказательств того, что дополнительные добавки с пробиотиками улучшают терапевтический результат и переносимость. Генотипическая характеристика восприимчивости H. pylori к терапии может позволить в будущем разработать индивидуальный терапевтический подход.
ВВЕДЕНИЕ
Лечение инфекции Helicobacter pylori ( H. pylori ) имеет первостепенное значение для лечения распространенных желудочно-кишечных заболеваний, включая язвенную болезнь, рак желудка и функциональную диспепсию [1-3]. Кроме того, в качестве показаний к эрадикации H. pylori теперь включаются экстрапищеварительные расстройства: идиопатическая тромбоцитопеническая пурпура, дефицит витамина B12 и необъяснимая железодефицитная анемия [4]. В отличие от других бактериальных инфекций, для лечения которых обычно проводится тестирование на чувствительность, культура H.pylori не является широко доступным и требует проведения эндоскопии, которая хорошо переносится не всеми пациентами и имеет ряд ограничений, включая тот факт, что чувствительность к in vitro не всегда гарантирует эрадикацию in vivo [5]. Таким образом, схемы для H. pylori обычно назначались эмпирически, при условии, что они были предварительно протестированы и в достаточной степени адаптированы в отношении различных параметров (, т.
pylori ) имеет первостепенное значение для лечения распространенных желудочно-кишечных заболеваний, включая язвенную болезнь, рак желудка и функциональную диспепсию [1-3]. Кроме того, в качестве показаний к эрадикации H. pylori теперь включаются экстрапищеварительные расстройства: идиопатическая тромбоцитопеническая пурпура, дефицит витамина B12 и необъяснимая железодефицитная анемия [4]. В отличие от других бактериальных инфекций, для лечения которых обычно проводится тестирование на чувствительность, культура H.pylori не является широко доступным и требует проведения эндоскопии, которая хорошо переносится не всеми пациентами и имеет ряд ограничений, включая тот факт, что чувствительность к in vitro не всегда гарантирует эрадикацию in vivo [5]. Таким образом, схемы для H. pylori обычно назначались эмпирически, при условии, что они были предварительно протестированы и в достаточной степени адаптированы в отношении различных параметров (, т. е. ; лечебная доза, продолжительность, интервалы дозирования и т.) для оптимизации показателей излечения и сведения к минимуму побочных эффектов. Однако оптимальное лечение для эрадикации H. pylori еще предстоит установить, поскольку ни один из режимов не является универсальным. Распространение во всем мире резистентности к основным антибиотикам, в основном к кларитромицину (CAM), а также к метронидазолу (MNZ) и левофлоксацину, является основным фактором, определяющим неэффективность лечения инфекции H. pylori [6,7]. В недавнем систематическом обзоре сообщалось, что глобальная заболеваемость устойчивостью к CAM составляет 17.2% в диапазоне от 11,1% в Европе до 29,3% в Америке, тогда как в том же анализе континентальные показатели резистентности к MNZ составляли 17% и 44,1% соответственно [8]. Потребление антибиотиков при инфекциях, отличных от H. pylori , объясняет широкое увеличение показателей устойчивости к антибиотикам H. pylori [9,10].
е. ; лечебная доза, продолжительность, интервалы дозирования и т.) для оптимизации показателей излечения и сведения к минимуму побочных эффектов. Однако оптимальное лечение для эрадикации H. pylori еще предстоит установить, поскольку ни один из режимов не является универсальным. Распространение во всем мире резистентности к основным антибиотикам, в основном к кларитромицину (CAM), а также к метронидазолу (MNZ) и левофлоксацину, является основным фактором, определяющим неэффективность лечения инфекции H. pylori [6,7]. В недавнем систематическом обзоре сообщалось, что глобальная заболеваемость устойчивостью к CAM составляет 17.2% в диапазоне от 11,1% в Европе до 29,3% в Америке, тогда как в том же анализе континентальные показатели резистентности к MNZ составляли 17% и 44,1% соответственно [8]. Потребление антибиотиков при инфекциях, отличных от H. pylori , объясняет широкое увеличение показателей устойчивости к антибиотикам H. pylori [9,10]. Действительно, различная национальная политика в отношении использования антибиотиков в значительной степени отражает географическое распределение устойчивости H. pylori к : устойчивость к САМ значительно выше в странах Южной Европы (достигая 49% в некоторых районах Испании) по сравнению с Северной Европой ( эл.g ., только 1% в Нидерландах), где политика использования антибиотиков более строгая[9]. В дополнение к развитию устойчивости к антибиотикам ряд факторов, связанных как с хозяином, так и с патогеном, может негативно повлиять на эффективность схем эрадикации H. pylori (таблица) [11,12].
Действительно, различная национальная политика в отношении использования антибиотиков в значительной степени отражает географическое распределение устойчивости H. pylori к : устойчивость к САМ значительно выше в странах Южной Европы (достигая 49% в некоторых районах Испании) по сравнению с Северной Европой ( эл.g ., только 1% в Нидерландах), где политика использования антибиотиков более строгая[9]. В дополнение к развитию устойчивости к антибиотикам ряд факторов, связанных как с хозяином, так и с патогеном, может негативно повлиять на эффективность схем эрадикации H. pylori (таблица) [11,12].
Таблица 1
Таблица 1
Факторы сообщили о отрицательном влиянии на исход терапии на Helicobacter Pylori инфекция
| | 8 | | |
| Разработка устойчивости к антибиотикам | Несоблюдение лечения | ||
| Высокая бактериальная нагрузка в желудке | Nexcer Dyspepsia | ||
| Защитный эффект слоя слизирования желудка | Курение | ||
| Внутриклеточное расположение многих бактерий | Состояние CYP2C19 Быстрый метаболизатор) | ||
| 9 | |||
| CAGA отрицательный | |||
| Наличие бездействующих кокоидов (не подвержены антибиотикам) | |||
| гетерорезерный статус (сосуществование штаммов, восприимчивых и устойчивых к тому же антибиотику) |
Несмотря на десятилетия усилий, лечение H. pylori остается сложной проблемой как для исследователей, так и для практикующих врачей. В настоящей статье мы стремимся предоставить всесторонний обзор взглядов на прошлое, настоящее и будущее эрадикации H. pylori .
pylori остается сложной проблемой как для исследователей, так и для практикующих врачей. В настоящей статье мы стремимся предоставить всесторонний обзор взглядов на прошлое, настоящее и будущее эрадикации H. pylori .
ТРОЙНАЯ ТЕРАПИЯ НА ОСНОВЕ КЛАРИТРОМИЦИНА: УМЕНЬШАЮЩИЙСЯ КЛИНИЧЕСКИЙ СТАНДАРТ
Исторически сложилось так, что первая действительно эффективная терапия инфекции H. pylori , включающая висмут, тетрациклин и MNZ, была предложена в 1990 г. [13].Несколькими годами позже использование CAM в тройной терапии, предложенной Bazzoli et al. [14], положило начало тройным схемам на основе CAM, после чего стало золотым стандартом в лечении H. pylori . В исследованиях, проведенных в 90-х годах, стандартная тройная терапия (СТТ), включающая ингибитор протонной помпы (ИПП) два раза в день , САМ 500 мг два раза в день и амоксициллин 1000 мг два раза в день или MNZ 500 мг (или 400 мг в Англии) , все назначаемые в течение 7-14 дней, давали стабильно хорошие результаты, приводящие к успеху эрадикации > 80%, и даже > 90% было возможно [15,16]. Благодаря этой высокой эффективности и относительной простоте, оптимальному профилю безопасности и приверженности крупных фармацевтических компаний эти схемы получили широкое признание в национальных экспертных группах и согласованных рекомендациях во всем мире в качестве стандарта лечения первой линии для эрадикации H. pylori . 17-20]. Однако рост распространенности резистентности к САМ привел к значительному снижению эффективности стандартных схем. Это снижение эффективности уже было очевидно в мета-анализах, опубликованных в начале 2000-х годов, что привело к значительным изменениям в парадигме лечения инфекции.К ним относятся введение концепции кумулятивной эффективности лечения (требующей от пациента соблюдения большего количества курсов лечения; таким образом, больше побочных эффектов и распространение вторичной антибиотикорезистентности), а затем введение местного порога (15%-20%) устойчивости к САМ, при которых САМ не следует использовать эмпирически [17,18]. Снижение эффективности стандартных методов лечения штаммов, устойчивых к САМ, хорошо задокументировано на основе метаанализа: в метаанализе, проведенном Фишбахом и Эвансом, эффективность тройной терапии снизилась на 66%.
Благодаря этой высокой эффективности и относительной простоте, оптимальному профилю безопасности и приверженности крупных фармацевтических компаний эти схемы получили широкое признание в национальных экспертных группах и согласованных рекомендациях во всем мире в качестве стандарта лечения первой линии для эрадикации H. pylori . 17-20]. Однако рост распространенности резистентности к САМ привел к значительному снижению эффективности стандартных схем. Это снижение эффективности уже было очевидно в мета-анализах, опубликованных в начале 2000-х годов, что привело к значительным изменениям в парадигме лечения инфекции.К ним относятся введение концепции кумулятивной эффективности лечения (требующей от пациента соблюдения большего количества курсов лечения; таким образом, больше побочных эффектов и распространение вторичной антибиотикорезистентности), а затем введение местного порога (15%-20%) устойчивости к САМ, при которых САМ не следует использовать эмпирически [17,18]. Снижение эффективности стандартных методов лечения штаммов, устойчивых к САМ, хорошо задокументировано на основе метаанализа: в метаанализе, проведенном Фишбахом и Эвансом, эффективность тройной терапии снизилась на 66%. 2% (95% ДИ: 58,2%-74,2%), когда штаммы H. pylori были устойчивыми против чувствительными к CAM[7]. Соответственно, более поздний анализ Venerito et al [21] показал аналогичные результаты: включая данные о чувствительности к противомикробным препаратам из 4 рандомизированных клинических испытаний (РКИ), стандартная тройная терапия успешно элиминировала 88% чувствительных к CAM, но только 14% устойчивых к CAM. штаммов H. pylori (разница рисков = 0,75, 95% ДИ: 0,63-0,87). Если используется MNZ, наличие резистентности к MNZ также может повлиять на терапевтический результат [22], хотя обычно считается менее важным с клинической точки зрения.Это связано с тем, что резистентность к MNZ может быть в значительной степени преодолена за счет увеличения дозы и увеличения продолжительности лечения [23]. Наконец, устойчивость H. pylori к амоксициллину является исключительной и, как правило, не имеет клинического значения. В свете увеличения количества данных, подтверждающих субоптимальную эффективность (< 70%) в большинстве европейских стран, недавний консенсусный отчет Maastricht IV/Florence окончательно заменил стандартные схемы в качестве эмпирического золотого стандарта для эрадикации H.
2% (95% ДИ: 58,2%-74,2%), когда штаммы H. pylori были устойчивыми против чувствительными к CAM[7]. Соответственно, более поздний анализ Venerito et al [21] показал аналогичные результаты: включая данные о чувствительности к противомикробным препаратам из 4 рандомизированных клинических испытаний (РКИ), стандартная тройная терапия успешно элиминировала 88% чувствительных к CAM, но только 14% устойчивых к CAM. штаммов H. pylori (разница рисков = 0,75, 95% ДИ: 0,63-0,87). Если используется MNZ, наличие резистентности к MNZ также может повлиять на терапевтический результат [22], хотя обычно считается менее важным с клинической точки зрения.Это связано с тем, что резистентность к MNZ может быть в значительной степени преодолена за счет увеличения дозы и увеличения продолжительности лечения [23]. Наконец, устойчивость H. pylori к амоксициллину является исключительной и, как правило, не имеет клинического значения. В свете увеличения количества данных, подтверждающих субоптимальную эффективность (< 70%) в большинстве европейских стран, недавний консенсусный отчет Maastricht IV/Florence окончательно заменил стандартные схемы в качестве эмпирического золотого стандарта для эрадикации H.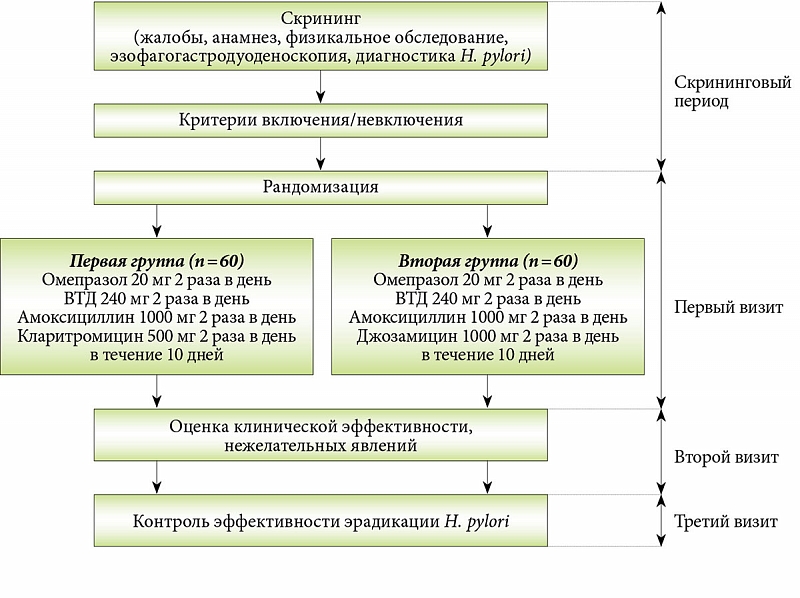 pylori [4].Вместо этого при использовании устаревших тройных схем следует учитывать локальную картину резистентности (таким образом, использовать только в областях, в которых устойчивость к САМ составляет <20%) или полагаться на тестирование чувствительности при условии, что доступна культура до лечения (, т.е. ., используется в качестве индивидуального лечения).
pylori [4].Вместо этого при использовании устаревших тройных схем следует учитывать локальную картину резистентности (таким образом, использовать только в областях, в которых устойчивость к САМ составляет <20%) или полагаться на тестирование чувствительности при условии, что доступна культура до лечения (, т.е. ., используется в качестве индивидуального лечения).
СОВРЕМЕННЫЕ ТЕРАПИИ ИНФЕКЦИИ
H. PYLORIНовые схемы, специально разработанные для улучшения терапевтических результатов против устойчивых к антибиотикам штаммов H. pylori , в настоящее время рекомендуются в качестве эмпирических вариантов лечения первой линии, обеспечивающих повышенную эффективность (по сообщениям > 90% намерены лечить анализ) в условиях высокой резистентности к САМ.Эти режимы приведены в таблице.
Таблица 2
Текущие схемы для лечения Helicobacter Pylori инфекция
| лечение | Regimen 8 | ||
| 45369 | ), висмут (стандартная доза, 4 раза в день ) тетрациклин (500 мг, 4 раза в день ) и метронидазол (500 мг, 4 раза в день ) в течение 10-14 дней | ||
| Последовательная терапия с двойной терапией | 2 | 2 | 2 A ИПП (стандартная доза, 2 раза в день) и амоксициллин (1 г, 2 раза в день) с последующей 5-дневной тройной терапией с ИПП (стандартная доза, 2 раза в день), кларитромицином (500 мг, 2 раза в день) и метронидазол (500 мг, 2 раза в сутки) |
| Сопутствующая терапия | дазол (500 мг, 2 раза в день ) в течение 7-10 дней | ||
| Гибридная терапия | 7-дневная двойная терапия с ИПП (стандартная доза, 2 раза в день) и амоксициллином (1 г, 2 раза в день) с последующим 7-дневной четырехкомпонентной терапией с ИПП (стандартная доза, 2 раза в сутки), амоксициллином (1 г, 2 раза в сутки), кларитромицином (500 мг, 2 раза в сутки) и метронидазолом (500 мг, 2 раза в сутки) | ||
| Triple терапии на основе левофлоксацина | PPI (стандартная доза, ставка ), левофлоксацин (500 мг, ставка ) и амоксициллин (1 г, ставка ) для 10 D |
4540409
Четырехменность висмута
Квадратная терапия висмутом (BQT) в настоящее время представляет собой предпочтительный вариант лечения первой линии для областей с высокой (≥ 20%) частотой резистентности к CAM, а также ценный вариант лечения второй линии, когда схема на основе CAM ранее не удалась. Он работает независимо от CAM, достигая > 90% эрадикации при наличии устойчивости к CAM, тогда как применение высокой дозы MNZ (1500–1600 мг/сутки) и пролонгированной (10–14 дней) продолжительности лечения позволяет минимизировать влияние на устойчивость к MNZ. , обеспечивая уровень эрадикации > 85% даже в регионах с высокой резистентностью к этому препарату [24]. Доступна удобная для пациента монокапсула (содержащая висмут, MNZ и тетрациклин) (Pylera ® , Aptalis, Mont St Hilaire, QC, Канада), обеспечивающая уровень эрадикации 86 % и 80 % в двух крупных РКИ, проведенных в Северной Америке и Европе соответственно[25-27].Напротив, частота эрадикации ITT с помощью BQT составила всего 77,8% в недавнем мета-анализе ( против 77% для STT), что ставит под сомнение как эффективность, так и превосходство BQT над STT [28]. Однако следует признать существенную степень неоднородности исследований, особенно в отношении дозирования MNZ. Эффективность BQT второй линии также была подтверждена на основе метаанализа (30 исследований), показавшего эффективность второй линии (ITT) в среднем 77% после неудачи STT [29].
Он работает независимо от CAM, достигая > 90% эрадикации при наличии устойчивости к CAM, тогда как применение высокой дозы MNZ (1500–1600 мг/сутки) и пролонгированной (10–14 дней) продолжительности лечения позволяет минимизировать влияние на устойчивость к MNZ. , обеспечивая уровень эрадикации > 85% даже в регионах с высокой резистентностью к этому препарату [24]. Доступна удобная для пациента монокапсула (содержащая висмут, MNZ и тетрациклин) (Pylera ® , Aptalis, Mont St Hilaire, QC, Канада), обеспечивающая уровень эрадикации 86 % и 80 % в двух крупных РКИ, проведенных в Северной Америке и Европе соответственно[25-27].Напротив, частота эрадикации ITT с помощью BQT составила всего 77,8% в недавнем мета-анализе ( против 77% для STT), что ставит под сомнение как эффективность, так и превосходство BQT над STT [28]. Однако следует признать существенную степень неоднородности исследований, особенно в отношении дозирования MNZ. Эффективность BQT второй линии также была подтверждена на основе метаанализа (30 исследований), показавшего эффективность второй линии (ITT) в среднем 77% после неудачи STT [29]. Эффективность третьей линии BQT после двух предыдущих неудачных попыток эрадикации тройной терапией, содержащей CAM и левофлоксацин, составила 65% (ITT) в многоцентровом исследовании, проведенном в Испании [30].Основными ограничениями являются отсутствие в некоторых странах солей висмута или тетрациклина, а также потенциальная токсичность висмута. Однако, включая 4763 пациента, не было выявлено различий в отношении переносимости между группами, не принимавшими висмут, и группами, содержащими висмут, за исключением темного стула, который чаще наблюдался в более поздних группах [31].
Эффективность третьей линии BQT после двух предыдущих неудачных попыток эрадикации тройной терапией, содержащей CAM и левофлоксацин, составила 65% (ITT) в многоцентровом исследовании, проведенном в Испании [30].Основными ограничениями являются отсутствие в некоторых странах солей висмута или тетрациклина, а также потенциальная токсичность висмута. Однако, включая 4763 пациента, не было выявлено различий в отношении переносимости между группами, не принимавшими висмут, и группами, содержащими висмут, за исключением темного стула, который чаще наблюдался в более поздних группах [31].
ПОСЛЕДОВАТЕЛЬНАЯ ТЕРАПИЯ
При последовательной терапии используются те же антибиотики, что и в STT, но вводятся последовательно. Было высказано предположение, что начальный курс амоксициллина разрушает клеточную стенку бактерий, предотвращая развитие каналов оттока, выводящих САМ из бактерий [32].Хотя в первоначальных РКИ [33] (большинство из них было проведено в Италии) и более ранних метаанализах последовательная терапия явно превосходила СТТ [эрадикация ИТТ 91,7% (95% ДИ: 90%-93%) против 76,7% ( 95% ДИ: 75%-79%) для STT [34], более свежие данные из Южной Америки, Ирана и Южной Кореи показали более низкие показатели эрадикации (< 80%) [35-37]..gif) Несмотря на то, что эта последовательная терапия кажется достаточно эффективной против штаммов с монорезистентностью к САМ, способной уничтожить 72,8% из них, ее эффективность против штаммов с двойной резистентностью (САМ и MNZ) составила всего 37% (диапазон: 16.от 2% до 60,7%) при оценке 8 исследований с данными о чувствительности к антибиотикам [38]. Важно отметить, что последовательная терапия не превосходила ни 14-дневную тройную терапию (ОР = 1, 95% ДИ: 0,94–1,06), ни терапию на основе висмута (ОР = 0,99, 95% ДИ: 0,94–1,05) при обширном оценка 46 РКИ[38].
Несмотря на то, что эта последовательная терапия кажется достаточно эффективной против штаммов с монорезистентностью к САМ, способной уничтожить 72,8% из них, ее эффективность против штаммов с двойной резистентностью (САМ и MNZ) составила всего 37% (диапазон: 16.от 2% до 60,7%) при оценке 8 исследований с данными о чувствительности к антибиотикам [38]. Важно отметить, что последовательная терапия не превосходила ни 14-дневную тройную терапию (ОР = 1, 95% ДИ: 0,94–1,06), ни терапию на основе висмута (ОР = 0,99, 95% ДИ: 0,94–1,05) при обширном оценка 46 РКИ[38].
БЕЗВИСМУТОВАЯ КВАДРАТНАЯ (СОПУТСТВУЮЩАЯ) ТЕРАПИЯ
«Сопутствующая» квадротерапия без висмута является еще одним допустимым вариантом лечения первой линии для областей с высокой частотой резистентности к CAM[39,40].В 19 исследованиях (2070 пациентов) общая частота эрадикации при сопутствующей терапии составила 88% (95% ДИ: 85%-91%) и 91%, когда были исключены 3 отдаленных исследования с изначально короткой продолжительностью лечения (3-5 дней) [41]. ]. Действительно, было показано, что продолжительность лечения не менее 7 дней необходима для успеха сопутствующей терапии [42], в то время как дополнительное продление лечения до 14 дней в сочетании с высокой дозой ИПП (омепразол 40 мг × 2) может дополнительно ускорить излечение. показатели до > 95%, как показало многоцентровое исследование не меньшей эффективности [43].Повышенная эффективность против штаммов H. pylori с двойной резистентностью была предложена в качестве основного преимущества сопутствующей терапии по сравнению с последовательной терапией [44], хотя две схемы показали одинаковую эффективность при сравнении с использованием 338 пациентов в стране с высокой устойчивостью к антибиотикам (Испания). )[45]. Действительно, при оценке 106 пациентов с тестированием чувствительности до лечения сопутствующая терапия элиминировала только 55% штаммов с двойной устойчивостью против 100% и 91% с устойчивостью к САМ и MNZ соответственно [46].Таким образом, обе схемы, по-видимому, склонны к пагубному влиянию двойной резистентности, работая примерно одинаково (с эффективностью около 81% каждая) по объединению данных 6 сравнительных РКИ [38].
]. Действительно, было показано, что продолжительность лечения не менее 7 дней необходима для успеха сопутствующей терапии [42], в то время как дополнительное продление лечения до 14 дней в сочетании с высокой дозой ИПП (омепразол 40 мг × 2) может дополнительно ускорить излечение. показатели до > 95%, как показало многоцентровое исследование не меньшей эффективности [43].Повышенная эффективность против штаммов H. pylori с двойной резистентностью была предложена в качестве основного преимущества сопутствующей терапии по сравнению с последовательной терапией [44], хотя две схемы показали одинаковую эффективность при сравнении с использованием 338 пациентов в стране с высокой устойчивостью к антибиотикам (Испания). )[45]. Действительно, при оценке 106 пациентов с тестированием чувствительности до лечения сопутствующая терапия элиминировала только 55% штаммов с двойной устойчивостью против 100% и 91% с устойчивостью к САМ и MNZ соответственно [46].Таким образом, обе схемы, по-видимому, склонны к пагубному влиянию двойной резистентности, работая примерно одинаково (с эффективностью около 81% каждая) по объединению данных 6 сравнительных РКИ [38].
ГИБРИДНАЯ ТЕРАПИЯ
Двухэтапный двухкомпонентный (гибридный) режим, предложенный Hsu et al. [47], является еще одним ценным вариантом лечения, конкурирующим как с последовательным, так и с сопутствующим лечением. При оценке данных 2 РКИ гибридная терапия показала незначительное, хотя и незначительное, улучшение по сравнению с последовательной терапией (86.6% против 81%) [38] и сопоставимо с сопутствующей терапией в сравнительном исследовании, в котором, что интересно, в группе, получавшей гибридный режим, возникало меньше побочных эффектов [43]. Необходимы дополнительные данные, чтобы сделать окончательные выводы об эффективности и переносимости гибридной терапии.
ТЕРАПИЯ НА ОСНОВЕ ЛЕВОФЛОКСАЦИНА
Для преодоления растущей резистентности к CAM левофлоксацин, хинолон широкого спектра действия, использовался в качестве замены CAM в трехкратном или последовательном режимах, достигая > 90% показателей излечения, и даже > 95% возможно при условии что местная резистентность к левофлоксацину низкая (< 10%) [48,49]. Однако левофлоксацин также сталкивается с клинически значимыми проблемами антибиотикорезистентности, поскольку резистентность к хинолонам в настоящее время превышает 40% в Америке, 20% в Европе и 10% в Азии [8]. Из-за быстрого развития вторичной резистентности к хинолонам использование левофлоксацина в качестве первой линии, как правило, не рекомендуется, и этот препарат зарезервирован для использования в схемах второй линии/спасательной терапии после неэффективности схем на основе CAM и/или MNZ [50]. ]. Хорошая (показатель излечения 81%-87%) эффективность второй линии тройной терапии левофлоксацином (LTT) была подтверждена в двух мета-анализах, опубликованных в 2006 г., оба показали лучшие результаты с LTT по сравнению с BQT второй линии [51]. ,52].Соответственно, эффективность LTT второй линии составила 88,7% в более позднем метаанализе, включая РКИ до октября 2010 г. [53]. Важно отметить, что использование LTT после неудачи последовательного или сопутствующего режима, как сообщается, обеспечивает до 97,8% кумулятивной терапевтической эффективности [54].
Однако левофлоксацин также сталкивается с клинически значимыми проблемами антибиотикорезистентности, поскольку резистентность к хинолонам в настоящее время превышает 40% в Америке, 20% в Европе и 10% в Азии [8]. Из-за быстрого развития вторичной резистентности к хинолонам использование левофлоксацина в качестве первой линии, как правило, не рекомендуется, и этот препарат зарезервирован для использования в схемах второй линии/спасательной терапии после неэффективности схем на основе CAM и/или MNZ [50]. ]. Хорошая (показатель излечения 81%-87%) эффективность второй линии тройной терапии левофлоксацином (LTT) была подтверждена в двух мета-анализах, опубликованных в 2006 г., оба показали лучшие результаты с LTT по сравнению с BQT второй линии [51]. ,52].Соответственно, эффективность LTT второй линии составила 88,7% в более позднем метаанализе, включая РКИ до октября 2010 г. [53]. Важно отметить, что использование LTT после неудачи последовательного или сопутствующего режима, как сообщается, обеспечивает до 97,8% кумулятивной терапевтической эффективности [54]. Использование других хинолоновых препаратов, таких как моксифлоксацин и ситафлоксацин, показало многообещающие результаты [55, 56], хотя нет никаких доказательств, подтверждающих какое-либо терапевтическое преимущество перед левофлоксацином.
Использование других хинолоновых препаратов, таких как моксифлоксацин и ситафлоксацин, показало многообещающие результаты [55, 56], хотя нет никаких доказательств, подтверждающих какое-либо терапевтическое преимущество перед левофлоксацином.
ПЕРСПЕКТИВЫ НА БУДУЩЕЕ
Дополнительные пробиотики
Несмотря на то, что были предприняты различные попытки восстановить эффективность стандартных методов лечения, таких как увеличение дозы ИПП или продление продолжительности лечения, ни один из них не достиг уровня, позволяющего преодолеть сегодняшнюю устойчивость к противомикробным препаратам.Подход, который вызывает растущий интерес, заключается в использовании пробиотиков в сочетании со схемами эрадикации H. pylori [57]. Ожидаемая польза двойная: ускорение эрадикации и улучшение переносимости за счет предотвращения возникновения побочных эффектов, связанных с лечением. Патогенную основу возможного положительного эффекта пробиотиков на эрадикацию H. pylori еще предстоит выяснить, хотя были выдвинуты некоторые гипотезы, включая прочность слизистого барьера, конкуренцию за адгезию и иммуномодулирующие механизмы [58]..gif) В различных исследованиях в последние годы пробиотики использовались дополнительно к стандартным или новым схемам лечения, что дало противоречивые результаты [59-62]. Несмотря на то, что оценивались различные соединения с одним или несколькими штаммами, в настоящее время имеются доказательства в поддержку использования Saccharomyces boulardi (OR = 1,13; 95% ДИ: 1,05–1,21) или Lactobacillus spp . (ОШ = 1,78; 95% ДИ: 1,2–2,6) добавки в дополнение к стандартной тройной терапии [63, 64]. В самом последнем анализе, оценивающем эффект добавок, содержащих Lactobacillus и Bifidobacterium, объединенное отношение шансов (ITT) с пробиотическими добавками составило 2.066 (95% ДИ: 1,398-3,055) для эрадикации и 0,305 (95% ДИ: 0,117-0,793) для частоты всех побочных эффектов [65]. Интересно, что в отношении предотвращения побочных эффектов использование пробиотиков может иметь значение только у части пациентов, особенно у пациентов с рецидивирующей инфекцией или желудочно-кишечными побочными эффектами, связанными с антибиотиками в анамнезе [57].
В различных исследованиях в последние годы пробиотики использовались дополнительно к стандартным или новым схемам лечения, что дало противоречивые результаты [59-62]. Несмотря на то, что оценивались различные соединения с одним или несколькими штаммами, в настоящее время имеются доказательства в поддержку использования Saccharomyces boulardi (OR = 1,13; 95% ДИ: 1,05–1,21) или Lactobacillus spp . (ОШ = 1,78; 95% ДИ: 1,2–2,6) добавки в дополнение к стандартной тройной терапии [63, 64]. В самом последнем анализе, оценивающем эффект добавок, содержащих Lactobacillus и Bifidobacterium, объединенное отношение шансов (ITT) с пробиотическими добавками составило 2.066 (95% ДИ: 1,398-3,055) для эрадикации и 0,305 (95% ДИ: 0,117-0,793) для частоты всех побочных эффектов [65]. Интересно, что в отношении предотвращения побочных эффектов использование пробиотиков может иметь значение только у части пациентов, особенно у пациентов с рецидивирующей инфекцией или желудочно-кишечными побочными эффектами, связанными с антибиотиками в анамнезе [57]. Ожидаются дополнительные данные для уточнения роли, стандартизации режимов и оценки экономической эффективности пробиотиков при лечении H.pylori инфекции.
Ожидаются дополнительные данные для уточнения роли, стандартизации режимов и оценки экономической эффективности пробиотиков при лечении H.pylori инфекции.
Бескультуральное неинвазивное определение чувствительности H. pylori к антибиотикам
Критически важно, что даже обсуждавшиеся выше новые методы лечения в некоторой степени (хотя и в меньшей степени по сравнению с традиционными методами лечения) подвержены влиянию устойчивости к антибиотикам; уровень эрадикации > 95% встречается нечасто, и даже > 90% оспаривается в некоторых исследованиях [35, 66, 67]. Кроме того, возможно, что успех эмпирического лечения в будущем будет снижаться, поскольку устойчивость к основным антибиотикам постоянно растет во всем мире.Для поддержания высокой терапевтической эффективности идеальным подходом является специальное лечение H. pylori в действии f на основе тестирования чувствительности до лечения. Это предотвратит повторное эмпирическое лечение пациента, которое увеличивает риск побочных эффектов и способствует развитию вторичной резистентности. Однако, как уже упоминалось, современные средства проведения эндоскопии и посева H. pylori являются инвазивными, не отражают на 100% чувствительность in vivo и требуют много времени, поскольку посев требует 3-10 дней и тестирование чувствительности ( e.g ., производства Etest, AB bioMerieux, Solna, Швеция) потребуется дополнительно 3-4 дня. Эти ограничения препятствуют систематическому использованию культуры H. pylori , которая в настоящее время рекомендуется только в случаях с не менее чем двумя неудачами эмпирического лечения. Общеклассовая резистентность к макролидам является результатом точечных мутаций в трех соседних положениях нуклеотидов ( A2143G, A2142G и A2142C ) в пептидилтрансферазной петле гена 23SrRNA [68,69]. На эти три точечные мутации приходится 90% случаев первичной резистентности к САМ в западных странах.В последние годы для этих мутаций были разработаны методы молекулярного тестирования, включая стандартную полимеразную цепную реакцию (ПЦР) и другие методы, основанные на ПЦР, включая полиморфизм длины рестрикционных фрагментов ПЦР, иммуноферментный анализ ПЦР-ДНК, анализ лигирования олигонуклеотидов ПЦР и ПЦР-линию.
Однако, как уже упоминалось, современные средства проведения эндоскопии и посева H. pylori являются инвазивными, не отражают на 100% чувствительность in vivo и требуют много времени, поскольку посев требует 3-10 дней и тестирование чувствительности ( e.g ., производства Etest, AB bioMerieux, Solna, Швеция) потребуется дополнительно 3-4 дня. Эти ограничения препятствуют систематическому использованию культуры H. pylori , которая в настоящее время рекомендуется только в случаях с не менее чем двумя неудачами эмпирического лечения. Общеклассовая резистентность к макролидам является результатом точечных мутаций в трех соседних положениях нуклеотидов ( A2143G, A2142G и A2142C ) в пептидилтрансферазной петле гена 23SrRNA [68,69]. На эти три точечные мутации приходится 90% случаев первичной резистентности к САМ в западных странах.В последние годы для этих мутаций были разработаны методы молекулярного тестирования, включая стандартную полимеразную цепную реакцию (ПЦР) и другие методы, основанные на ПЦР, включая полиморфизм длины рестрикционных фрагментов ПЦР, иммуноферментный анализ ПЦР-ДНК, анализ лигирования олигонуклеотидов ПЦР и ПЦР-линию. зондовый анализ, а также анализ ПЦР в реальном времени, который представляет собой мощное усовершенствование базовой ПЦР[70-72]. Эти методы могут дать быстрые и высокоточные результаты при генотипическом выявлении устойчивости к САМ, включая определение статуса гетерорезистентности ( i.e ., сосуществование штаммов, чувствительных и устойчивых к одному и тому же антибиотику), что, как известно, является причиной значительного числа неудач лечения [73,74]. Эти методы могут применяться непосредственно к образцам биопсии желудка или использоваться в сочетании с минимально инвазивными методами (, например, ., орально-желудочная чистка или промывание желудка) или неинвазивно с использованием образцов стула [75-77]. Важно отметить, что генотипическое определение устойчивости к САМ также возможно с помощью флуоресцентной гибридизации in-situ, которую также можно применять к образцам, залитым парафином [78,79].Также доступно определение резистентности к левофлоксацину на основе выявления мутаций gyrA [80].
зондовый анализ, а также анализ ПЦР в реальном времени, который представляет собой мощное усовершенствование базовой ПЦР[70-72]. Эти методы могут дать быстрые и высокоточные результаты при генотипическом выявлении устойчивости к САМ, включая определение статуса гетерорезистентности ( i.e ., сосуществование штаммов, чувствительных и устойчивых к одному и тому же антибиотику), что, как известно, является причиной значительного числа неудач лечения [73,74]. Эти методы могут применяться непосредственно к образцам биопсии желудка или использоваться в сочетании с минимально инвазивными методами (, например, ., орально-желудочная чистка или промывание желудка) или неинвазивно с использованием образцов стула [75-77]. Важно отметить, что генотипическое определение устойчивости к САМ также возможно с помощью флуоресцентной гибридизации in-situ, которую также можно применять к образцам, залитым парафином [78,79].Также доступно определение резистентности к левофлоксацину на основе выявления мутаций gyrA [80]. Два азиатских исследования предоставили данные о потенциальной полезности индивидуального терапевтического подхода, основанного на молекулярном обнаружении устойчивости H. pylori к САМ. Индивидуальное лечение с использованием простого режима ИПП/МНЗ привело к успешной эрадикации возбудителя в 94,3% случаев по сравнению с 71,4% при использовании эмпирического стандартного лечения[77]. В более крупном исследовании (218 пациентов) САМ заменяли МНЗ в тройной схеме, если обнаруживался штамм, устойчивый к САМ.Показатели эрадикации составили 91,2% в адаптированной группе против 79,1% и 75,9% при использовании эмпирической тройной терапии на основе MNZ и CAM ( n = 308 в каждой контрольной группе) соответственно ( P < 0,001) [81]. .
Два азиатских исследования предоставили данные о потенциальной полезности индивидуального терапевтического подхода, основанного на молекулярном обнаружении устойчивости H. pylori к САМ. Индивидуальное лечение с использованием простого режима ИПП/МНЗ привело к успешной эрадикации возбудителя в 94,3% случаев по сравнению с 71,4% при использовании эмпирического стандартного лечения[77]. В более крупном исследовании (218 пациентов) САМ заменяли МНЗ в тройной схеме, если обнаруживался штамм, устойчивый к САМ.Показатели эрадикации составили 91,2% в адаптированной группе против 79,1% и 75,9% при использовании эмпирической тройной терапии на основе MNZ и CAM ( n = 308 в каждой контрольной группе) соответственно ( P < 0,001) [81]. .
Фармакогеномика
Известно, что генетическая изменчивость активности цитохрома P450 (CYP) 2C19 (CYP2C19) влияет на уровни ИПП в плазме и, таким образом, на лечение инфекции H. pylori [82,83]. Выделяют три различных генотипа: быстрый, промежуточный и плохой метаболизаторы.Предварительные данные о потенциальном использовании фармакогеномики были получены в РКИ с 300 H. pylori -положительными пациентами, рандомизированными либо для получения стандартной схемы в течение 1 недели, либо для персонализированной терапии, основанной на статусе чувствительности как CYP2C19, так и CAM, оцененном с помощью генетического тестирования [84]. ]. Показатели эрадикации ИТТ были значительно выше в адаптированной группе (96% против 70%) без увеличения окончательной стоимости успешной эрадикации на одного пациента. В будущем необходимо решить как практические, так и логистические вопросы, прежде чем молекулярный подход сможет широко применяться в качестве подлинной основы для индивидуализации H.pylori эрадикационная терапия.
Выделяют три различных генотипа: быстрый, промежуточный и плохой метаболизаторы.Предварительные данные о потенциальном использовании фармакогеномики были получены в РКИ с 300 H. pylori -положительными пациентами, рандомизированными либо для получения стандартной схемы в течение 1 недели, либо для персонализированной терапии, основанной на статусе чувствительности как CYP2C19, так и CAM, оцененном с помощью генетического тестирования [84]. ]. Показатели эрадикации ИТТ были значительно выше в адаптированной группе (96% против 70%) без увеличения окончательной стоимости успешной эрадикации на одного пациента. В будущем необходимо решить как практические, так и логистические вопросы, прежде чем молекулярный подход сможет широко применяться в качестве подлинной основы для индивидуализации H.pylori эрадикационная терапия.
ЗАКЛЮЧЕНИЕ
На протяжении более десяти лет тройные схемы лечения были стандартом лечения инфекции H. pylori . Однако в последние годы рост распространенности резистентности к макролидам привел к значительному снижению эффективности этих схем, что привело к необходимости проведения большего количества курсов лечения для эрадикации возбудителя. Для поддержания высокой терапевтической эффективности схемы с улучшенной эффективностью в отношении устойчивых к антибиотикам штаммов H.pylori в настоящее время рекомендуются в качестве предпочтительных препаратов первой линии. Сочетанные и последовательные режимы в настоящее время являются наиболее проверенными терапевтическими вариантами первой линии. Гибридная терапия является еще одной эффективной альтернативой на основе CAM и важным конкурентом обоих этих методов лечения. BQT также является допустимым лечением в условиях высокой резистентности к CAM, а также эффективной схемой второй линии, когда схема, основанная на CAM, неэффективна. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина в настоящее время следует зарезервировать в качестве вариантов лечения второй или более линии.В то время как усилия по улучшению эмпирических методов лечения продолжаются, области генотипического обнаружения чувствительности H. pylori к противомикробным препаратам и фармакогеномика открывают новые захватывающие перспективы.
Для поддержания высокой терапевтической эффективности схемы с улучшенной эффективностью в отношении устойчивых к антибиотикам штаммов H.pylori в настоящее время рекомендуются в качестве предпочтительных препаратов первой линии. Сочетанные и последовательные режимы в настоящее время являются наиболее проверенными терапевтическими вариантами первой линии. Гибридная терапия является еще одной эффективной альтернативой на основе CAM и важным конкурентом обоих этих методов лечения. BQT также является допустимым лечением в условиях высокой резистентности к CAM, а также эффективной схемой второй линии, когда схема, основанная на CAM, неэффективна. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина в настоящее время следует зарезервировать в качестве вариантов лечения второй или более линии.В то время как усилия по улучшению эмпирических методов лечения продолжаются, области генотипического обнаружения чувствительности H. pylori к противомикробным препаратам и фармакогеномика открывают новые захватывающие перспективы. Это гарантирует 100% терапевтическую эффективность: быструю, бескультуральную и неинвазивную.
Это гарантирует 100% терапевтическую эффективность: быструю, бескультуральную и неинвазивную.
Сноски
P- Рецензент: Ding SZ, Im SH, Velin D, Zhu YL S- Редактор: Wen LL L- Редактор: A E- Редактор: Wang CH
Ссылки
1. Moayyedi P, Hunt RH. Влияние Helicobacter pylori на общественное здравоохранение.Хеликобактер. 2004; 9 Приложение 1: 67–72. [PubMed] [Google Scholar]2. Малфертейнер П., Чан Ф.К., Макколл К.Е. Язвенная болезнь желудка. Ланцет. 2009; 374:1449–1461. [PubMed] [Google Scholar]3. Куйперс Э.Дж. Helicobacter pylori и риск и лечение сопутствующих заболеваний: гастрита, язвенной болезни, атрофического гастрита и рака желудка. Алимент Фармакол Тер. 1997; 11 Дополнение 1:71–88. [PubMed] [Google Scholar]4. Malfertheiner P, Megraud F, O’Morain CA, Atherton J, Axon AT, Bazzoli F, Gensini GF, Gisbert JP, Graham DY, Rokkas T, et al.Ведение инфекции Helicobacter pylori — Консенсусный отчет Maastricht IV/Florence. Кишка. 2012; 61: 646–664. [PubMed] [Google Scholar]5. Гисберт Дж. П. Необходим ли посев перед терапией первой линии инфекции Helicobacter pylori? Интерн Мед. 2011;50:2717; ответ автора 2719–2720. [PubMed] [Google Scholar]7. Фишбах Л., Эванс Э.Л. Метаанализ: влияние статуса устойчивости к антибиотикам на эффективность тройной и четырехкратной терапии первой линии Helicobacter pylori. Алимент Фармакол Тер.2007; 26: 343–357. [PubMed] [Google Scholar]8. De Francesco V, Giorgio F, Hassan C, Manes G, Vannella L, Panella C, Ierardi E, Zullo A. Устойчивость H. pylori к антибиотикам во всем мире: систематический обзор. J Желудочно-кишечный тракт печени Dis. 2010;19:409–414. [PubMed] [Google Scholar]9. Megraud F, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, Andersen LP, Goossens H, Glupczynski Y. Устойчивость Helicobacter pylori к антибиотикам в Европе и ее связь с потреблением антибиотиков. Кишка. 2013; 62:34–42.[PubMed] [Google Scholar] 10. Боянова Л., Илиева Дж., Гергова Г., Давыдков Л., Спасова З., Камбуров В., Кацаров Н., Митов И.
Гисберт Дж. П. Необходим ли посев перед терапией первой линии инфекции Helicobacter pylori? Интерн Мед. 2011;50:2717; ответ автора 2719–2720. [PubMed] [Google Scholar]7. Фишбах Л., Эванс Э.Л. Метаанализ: влияние статуса устойчивости к антибиотикам на эффективность тройной и четырехкратной терапии первой линии Helicobacter pylori. Алимент Фармакол Тер.2007; 26: 343–357. [PubMed] [Google Scholar]8. De Francesco V, Giorgio F, Hassan C, Manes G, Vannella L, Panella C, Ierardi E, Zullo A. Устойчивость H. pylori к антибиотикам во всем мире: систематический обзор. J Желудочно-кишечный тракт печени Dis. 2010;19:409–414. [PubMed] [Google Scholar]9. Megraud F, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, Andersen LP, Goossens H, Glupczynski Y. Устойчивость Helicobacter pylori к антибиотикам в Европе и ее связь с потреблением антибиотиков. Кишка. 2013; 62:34–42.[PubMed] [Google Scholar] 10. Боянова Л., Илиева Дж., Гергова Г., Давыдков Л., Спасова З., Камбуров В., Кацаров Н., Митов И. Многочисленные факторы риска антибиотикорезистентности Helicobacter pylori, выявленные в расширенном анамнезе: исследование в Болгарии. J Med Microbiol. 2012;61:85–93. [PubMed] [Google Scholar] 11. Георгопулос С.Д., Ладас С.Д., Каратапанис С., Ментис А., Спилиади С., Артикис В., Раптис С.А. Факторы, которые могут повлиять на исход тройной эрадикационной терапии Helicobacter pylori омепразолом, амоксициллином и кларитромицином.Dig Dis Sci. 2000;45:63–67. [PubMed] [Google Scholar] 12. Ян JC, Лин CJ. Генотипы CYP2C19 в фармакокинетике/фармакодинамике терапии инфекции Helicobacter pylori на основе ингибиторов протонной помпы. Мнение эксперта Препарат Метаб Токсикол. 2010; 6: 29–41. [PubMed] [Google Scholar] 13. Джордж Л.Л., Бороди Т.Дж., Эндрюс П., Девайн М., Мур-Джонс Д., Уолтон М., Брандл С. Лечение язвы двенадцатиперстной кишки после ликвидации Helicobacter pylori. Мед J Aust. 1990; 153: 145–149. [PubMed] [Google Scholar] 14. Баззоли Ф., Поццато П.Терапия инфекции H. pylori. J Physiol Pharmacol.
Многочисленные факторы риска антибиотикорезистентности Helicobacter pylori, выявленные в расширенном анамнезе: исследование в Болгарии. J Med Microbiol. 2012;61:85–93. [PubMed] [Google Scholar] 11. Георгопулос С.Д., Ладас С.Д., Каратапанис С., Ментис А., Спилиади С., Артикис В., Раптис С.А. Факторы, которые могут повлиять на исход тройной эрадикационной терапии Helicobacter pylori омепразолом, амоксициллином и кларитромицином.Dig Dis Sci. 2000;45:63–67. [PubMed] [Google Scholar] 12. Ян JC, Лин CJ. Генотипы CYP2C19 в фармакокинетике/фармакодинамике терапии инфекции Helicobacter pylori на основе ингибиторов протонной помпы. Мнение эксперта Препарат Метаб Токсикол. 2010; 6: 29–41. [PubMed] [Google Scholar] 13. Джордж Л.Л., Бороди Т.Дж., Эндрюс П., Девайн М., Мур-Джонс Д., Уолтон М., Брандл С. Лечение язвы двенадцатиперстной кишки после ликвидации Helicobacter pylori. Мед J Aust. 1990; 153: 145–149. [PubMed] [Google Scholar] 14. Баззоли Ф., Поццато П.Терапия инфекции H. pylori. J Physiol Pharmacol. 1997; 48 Дополнение 4:39–46. [PubMed] [Google Scholar] 15. Современные европейские концепции лечения инфекции Helicobacter pylori. Доклад о Маастрихтском консенсусе. Европейская группа по изучению Helicobacter Pylori. Кишка. 1997; 41:8–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]16. Линд Т., Вельдхуйзен ван Зантен С., Унге П., Спиллер Р., Байердорфер Э., О’Морейн С., Бардхан К.Д., Брадетт М., Чиба Н., Врангстад М. и др. Эрадикация Helicobacter pylori с помощью однонедельной тройной терапии, сочетающей омепразол с двумя противомикробными препаратами: исследование MACH I.Хеликобактер. 1996; 1: 138–144. [PubMed] [Google Scholar] 17. Malfertheiner P, Mégraud F, O’Morain C, Hungin AP, Jones R, Axon A, Graham DY, Tytgat G. Современные концепции лечения инфекции Helicobacter pylori — Консенсусный отчет Maastricht 2-2000. Алимент Фармакол Тер. 2002; 16: 167–180. [PubMed] [Google Scholar] 18. Малфертейнер П., Меграуд Ф., О’Морейн С., Баззоли Ф., Эль-Омар Э., Грэм Д., Хант Р., Роккас Т.
1997; 48 Дополнение 4:39–46. [PubMed] [Google Scholar] 15. Современные европейские концепции лечения инфекции Helicobacter pylori. Доклад о Маастрихтском консенсусе. Европейская группа по изучению Helicobacter Pylori. Кишка. 1997; 41:8–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]16. Линд Т., Вельдхуйзен ван Зантен С., Унге П., Спиллер Р., Байердорфер Э., О’Морейн С., Бардхан К.Д., Брадетт М., Чиба Н., Врангстад М. и др. Эрадикация Helicobacter pylori с помощью однонедельной тройной терапии, сочетающей омепразол с двумя противомикробными препаратами: исследование MACH I.Хеликобактер. 1996; 1: 138–144. [PubMed] [Google Scholar] 17. Malfertheiner P, Mégraud F, O’Morain C, Hungin AP, Jones R, Axon A, Graham DY, Tytgat G. Современные концепции лечения инфекции Helicobacter pylori — Консенсусный отчет Maastricht 2-2000. Алимент Фармакол Тер. 2002; 16: 167–180. [PubMed] [Google Scholar] 18. Малфертейнер П., Меграуд Ф., О’Морейн С., Баззоли Ф., Эль-Омар Э., Грэм Д., Хант Р., Роккас Т. , Вакил Н., Куйперс Э.Дж. Современные концепции лечения инфекции Helicobacter pylori: Консенсусный отчет Maastricht III.Кишка. 2007; 56: 772–781. [Бесплатная статья PMC] [PubMed] [Google Scholar]19. Чей В.Д., Вонг Б.К. Рекомендации Американской коллегии гастроэнтерологов по лечению инфекции Helicobacter pylori. Am J Гастроэнтерол. 2007; 102: 1808–1825. [PubMed] [Google Scholar] 20. Фок К.М., Кателарис П., Сугано К., Анг Т.Л., Хант Р., Тэлли Н.Дж., Лам С.К., Сяо С.Д., Тан Х.Дж., Ву С.И. и др. Второе Азиатско-Тихоокеанское согласованное руководство по инфекции Helicobacter pylori. J Гастроэнтерол Гепатол. 2009; 24:1587–1600. [PubMed] [Google Scholar] 21.Венерито М., Кригер Т., Экер Т., Леандро Г., Малфертейнер П. Мета-анализ четырехкратной терапии висмутом по сравнению с тройной терапией кларитромицином для эмпирического первичного лечения инфекции Helicobacter pylori. пищеварение. 2013;88:33–45. [PubMed] [Google Scholar] 22. Хоубен М.Х., ван де Бик Д., Хенсен Э.Ф., де Краен А.Дж., Раус Э.
, Вакил Н., Куйперс Э.Дж. Современные концепции лечения инфекции Helicobacter pylori: Консенсусный отчет Maastricht III.Кишка. 2007; 56: 772–781. [Бесплатная статья PMC] [PubMed] [Google Scholar]19. Чей В.Д., Вонг Б.К. Рекомендации Американской коллегии гастроэнтерологов по лечению инфекции Helicobacter pylori. Am J Гастроэнтерол. 2007; 102: 1808–1825. [PubMed] [Google Scholar] 20. Фок К.М., Кателарис П., Сугано К., Анг Т.Л., Хант Р., Тэлли Н.Дж., Лам С.К., Сяо С.Д., Тан Х.Дж., Ву С.И. и др. Второе Азиатско-Тихоокеанское согласованное руководство по инфекции Helicobacter pylori. J Гастроэнтерол Гепатол. 2009; 24:1587–1600. [PubMed] [Google Scholar] 21.Венерито М., Кригер Т., Экер Т., Леандро Г., Малфертейнер П. Мета-анализ четырехкратной терапии висмутом по сравнению с тройной терапией кларитромицином для эмпирического первичного лечения инфекции Helicobacter pylori. пищеварение. 2013;88:33–45. [PubMed] [Google Scholar] 22. Хоубен М.Х., ван де Бик Д., Хенсен Э.Ф., де Краен А.Дж., Раус Э. А., Титгат Г.Н. Систематический обзор эрадикационной терапии Helicobacter pylori — влияние устойчивости к противомикробным препаратам на показатели эрадикации. Алимент Фармакол Тер. 1999; 13:1047–1055. [PubMed] [Google Scholar] 23.Грэм Д.Ю., Куреши В.А. Антибиотикорезистентная инфекция H. pylori и ее лечение. Курр Фарм Дез. 2000; 6: 1537–1544. [PubMed] [Google Scholar] 24. Фишбах Л.А., Ван Зантен С., Дикасон Дж. Мета-анализ: эффективность, нежелательные явления и приверженность, связанные с четырехкомпонентной терапией против Helicobacter pylori первой линии. Алимент Фармакол Тер. 2004; 20:1071–1082. [PubMed] [Google Scholar] 25. де Бур В.А., ван Эттен Р.Дж., Шнеебергер П.М., Титгат Г.Н. Единственный препарат для инфекции Helicobacter pylori: первые результаты с новой тройной монокапсулой висмута.Am J Гастроэнтерол. 2000;95:641–645. [PubMed] [Google Scholar] 26. Лейн Л., Хант Р., Эль-Зимаити Х., Нгуен Б., Осато М., Спенар Дж. Четырехкомпонентная терапия на основе висмута с использованием одной капсулы бискальцитрата висмута, метронидазола и тетрациклина в сочетании с омепразолом по сравнению с омепразолом, амоксициллином и кларитромицином для эрадикации Helicobacter pylori у пациентов с язвой двенадцатиперстной кишки: проспективное рандомизированное многоцентровое исследование в Северной Америке.
А., Титгат Г.Н. Систематический обзор эрадикационной терапии Helicobacter pylori — влияние устойчивости к противомикробным препаратам на показатели эрадикации. Алимент Фармакол Тер. 1999; 13:1047–1055. [PubMed] [Google Scholar] 23.Грэм Д.Ю., Куреши В.А. Антибиотикорезистентная инфекция H. pylori и ее лечение. Курр Фарм Дез. 2000; 6: 1537–1544. [PubMed] [Google Scholar] 24. Фишбах Л.А., Ван Зантен С., Дикасон Дж. Мета-анализ: эффективность, нежелательные явления и приверженность, связанные с четырехкомпонентной терапией против Helicobacter pylori первой линии. Алимент Фармакол Тер. 2004; 20:1071–1082. [PubMed] [Google Scholar] 25. де Бур В.А., ван Эттен Р.Дж., Шнеебергер П.М., Титгат Г.Н. Единственный препарат для инфекции Helicobacter pylori: первые результаты с новой тройной монокапсулой висмута.Am J Гастроэнтерол. 2000;95:641–645. [PubMed] [Google Scholar] 26. Лейн Л., Хант Р., Эль-Зимаити Х., Нгуен Б., Осато М., Спенар Дж. Четырехкомпонентная терапия на основе висмута с использованием одной капсулы бискальцитрата висмута, метронидазола и тетрациклина в сочетании с омепразолом по сравнению с омепразолом, амоксициллином и кларитромицином для эрадикации Helicobacter pylori у пациентов с язвой двенадцатиперстной кишки: проспективное рандомизированное многоцентровое исследование в Северной Америке. Am J Гастроэнтерол. 2003; 98: 562–567. [PubMed] [Google Scholar] 27.Malfertheiner P, Bazzoli F, Delchier JC, Celiñski K, Giguère M, Rivière M, Mégraud F. Эрадикация Helicobacter pylori с помощью капсулы, содержащей субцитрат висмута калия, метронидазол и тетрациклин, в сочетании с омепразолом по сравнению с тройной терапией на основе кларитромицина: рандомизированное, открытое исследование -метка, не меньшей эффективности, испытание фазы 3. Ланцет. 2011; 377:905–913. [PubMed] [Google Scholar] 28. Лютер Дж., Хиггинс П.Д., Шенфельд П.С., Моайеди П., Вакил Н., Чей В.Д. Эмпирическая четырехкомпонентная и тройная терапия для первичного лечения инфекции Helicobacter pylori: систематический обзор и метаанализ эффективности и переносимости.Am J Гастроэнтерол. 2010;105:65–73. [PubMed] [Google Scholar] 30. Гисберт Дж. П., Перес-Айса А., Родриго Л., Молина-Инфанте Дж., Модолелл И., Бермехо Ф., Кастро-Фернандес М., Антон Р., Сакристан Б., Косме А. и др. Неотложная терапия третьей линии с висмутсодержащим четырехкомпонентным режимом после неэффективности двух курсов лечения (кларитромицином и левофлоксацином) инфекции H.
Am J Гастроэнтерол. 2003; 98: 562–567. [PubMed] [Google Scholar] 27.Malfertheiner P, Bazzoli F, Delchier JC, Celiñski K, Giguère M, Rivière M, Mégraud F. Эрадикация Helicobacter pylori с помощью капсулы, содержащей субцитрат висмута калия, метронидазол и тетрациклин, в сочетании с омепразолом по сравнению с тройной терапией на основе кларитромицина: рандомизированное, открытое исследование -метка, не меньшей эффективности, испытание фазы 3. Ланцет. 2011; 377:905–913. [PubMed] [Google Scholar] 28. Лютер Дж., Хиггинс П.Д., Шенфельд П.С., Моайеди П., Вакил Н., Чей В.Д. Эмпирическая четырехкомпонентная и тройная терапия для первичного лечения инфекции Helicobacter pylori: систематический обзор и метаанализ эффективности и переносимости.Am J Гастроэнтерол. 2010;105:65–73. [PubMed] [Google Scholar] 30. Гисберт Дж. П., Перес-Айса А., Родриго Л., Молина-Инфанте Дж., Модолелл И., Бермехо Ф., Кастро-Фернандес М., Антон Р., Сакристан Б., Косме А. и др. Неотложная терапия третьей линии с висмутсодержащим четырехкомпонентным режимом после неэффективности двух курсов лечения (кларитромицином и левофлоксацином) инфекции H. pylori. Dig Dis Sci. 2014;59:383–389. [PubMed] [Google Scholar] 31. Ford AC, Malfertheiner P, Giguere M, Santana J, Khan M, Moayyedi P. Побочные эффекты солей висмута для эрадикации Helicobacter pylori: систематический обзор и метаанализ.Мир J Гастроэнтерол. 2008; 14:7361–7370. [Бесплатная статья PMC] [PubMed] [Google Scholar]32. Уэббер М.А., Пиддок Л.Дж. Важность эффлюксных насосов в устойчивости бактерий к антибиотикам. J Антимикробная химиотерапия. 2003; 51:9–11. [PubMed] [Google Scholar] 33. Зулло А., Вайра Д., Вакил Н., Хассан С., Гатта Л., Риччи С., Де Франческо В., Менегатти М., Тампиери А., Перна Ф. и др. Высокие показатели эрадикации Helicobacter pylori при новом последовательном лечении. Алимент Фармакол Тер. 2003; 17: 719–726. [PubMed] [Google Scholar] 34.Гисберт Дж. П., Кальвет Х, О’Коннор А., Мегро Ф., О’Морен К.А. Последовательная терапия для эрадикации Helicobacter pylori: критический обзор. Дж. Клин Гастроэнтерол. 2010;44:313–325. [PubMed] [Google Scholar] 35. Гринберг Э.Р., Андерсон Г.Л., Морган Д.Р., Торрес Дж., Чей В.Д., Браво Л.Е., Домингес Р.Л., Ферреччио С., Эрреро Р., Ласкано-Понсе Е.К. и др. 14-дневная тройная, 5-дневная одновременная и 10-дневная последовательная терапия инфекции Helicobacter pylori в семи латиноамериканских учреждениях: рандомизированное исследование. Ланцет. 2011; 378: 507–514.[Бесплатная статья PMC] [PubMed] [Google Scholar]36. Lim JH, Lee DH, Choi C, Lee ST, Kim N, Jeong SH, Kim JW, Hwang JH, Park YS, Lee SH и др. Клинические результаты двухнедельной последовательной и сопутствующей терапии для эрадикации Helicobacter pylori: рандомизированное пилотное исследование. Хеликобактер. 2013;18:180–186. [PubMed] [Google Scholar] 37. Сардарян Х., Факери Х., Хоссейни В., Тагваи Т., Малеки И., Мохтаре М. Сравнение гибридных и последовательных методов лечения Helicobacter pylori в Иране: проспективное рандомизированное исследование.Хеликобактер. 2013;18:129–134. [PubMed] [Google Scholar] 38. Гатта Л., Вакил Н., Вайра Д., Скарпиньято С. Глобальные показатели ликвидации инфекции Helicobacter pylori: систематический обзор и метаанализ последовательной терапии. БМЖ. 2013;347:f4587. [Бесплатная статья PMC] [PubMed] [Google Scholar]39. Георгопулос С., Папастергиу В., Ксирушакис Э., Лауди Ф., Лисгос П., Спилиади С., Папантониу Н., Каратапанис С. Четырехкратная «сопутствующая» терапия без висмута по сравнению со стандартной тройной терапией, продолжительностью 10 дней для лечения H.pylori: рандомизированное исследование. Дж. Клин Гастроэнтерол. 2013;47:228–232. [PubMed] [Google Scholar]40. Георгопулос С., Папастергиу В., Ксирушакис Э., Лауди Ф., Папантониу Н., Лисгос П., Спилиади С., Фрагу П., Скорда Л., Каратапанис С. Оценка «сопутствующей» терапии, состоящей из четырех препаратов, трех антибиотиков, не содержащей висмута, в качестве первой схема эрадикации Helicobacter pylori в Греции. Хеликобактер. 2012;17:49–53. [PubMed] [Google Scholar]41. Gisbert JP, Calvet X. Обновленная информация о четырехкратной (сопутствующей) терапии без висмута для эрадикации Helicobacter pylori.Клин Эксп Гастроэнтерол. 2012;5:23–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]42. Эсса А.С., Крамер Дж.Р., Грэм Д.Ю., Трейбер Г. Мета-анализ: «сопутствующая терапия» с четырьмя препаратами, тремя антибиотиками, не содержащей висмута по сравнению с тройной терапией для эрадикации Helicobacter pylori. Хеликобактер. 2009; 14:109–118. [Бесплатная статья PMC] [PubMed] [Google Scholar]43. Молина-Инфанте Дж., Романо М., Фернандес-Бермехо М., Федерико А., Гравина А.Г., Поццати Л., Гарсия-Абадиа Э., Винагре-Родригес Г., Мартинес-Алькала С., Эрнандес-Алонсо М. и др.Оптимизированная четырехкомпонентная терапия без висмута излечивает большинство пациентов с инфекцией Helicobacter pylori в популяциях с высоким уровнем устойчивости к антибиотикам. Гастроэнтерология. 2013;145:121–128.e1. [PubMed] [Google Scholar]44. Ву Д.К., Хсу П.И., Ву Д.Ю., Опекун А.Р., Куо Ч., Ву И.К., Ван С.С., Чен А., Хунг В.К., Грэм Д.Ю. Последовательная и сопутствующая терапия четырьмя препаратами одинаково эффективна для эрадикации инфекции H. pylori. Клин Гастроэнтерол Гепатол. 2010;8:36–41.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar]45.Макниколл А.Г., Марин А.С., Молина-Инфанте Дж., Кастро М., Баррио Дж., Дюконс Дж., Кальвет Х, де ла Коба С, Монторо М., Бори Ф. и др. Рандомизированное клиническое исследование, сравнивающее последовательную и сопутствующую терапию для эрадикации Helicobacter pylori в рутинной клинической практике. Кишка. 2014; 63: 244–249. [PubMed] [Google Scholar]46. Георгопулос С.Д., Ксирушакис Э., Мартинес-Гонсалес Б., Сгурас Д.Н., Спилиади С., Ментис А.Ф., Лауди Ф. Клиническая оценка десятидневного режима эзомепразола, метронидазола, амоксициллина и кларитромицина для эрадикации Helicobacter pylori при высоком кларитромицине область сопротивления.Хеликобактер. 2013; 18: 459–467. [PubMed] [Google Scholar]47. Хсу П.И., Ву Д.К., Ву Д.Ю., Грэм Д.Ю. Модифицированная последовательная терапия Helicobacter pylori: ингибитор протонной помпы и амоксициллин в течение 14 дней с добавлением кларитромицина и метронидазола в виде четырехкомпонентной (гибридной) терапии в течение последних 7 дней. Хеликобактер. 2011;16:139–145. [Бесплатная статья PMC] [PubMed] [Google Scholar]48. Романо М., Куомо А., Гравина А.Г., Миранда А., Иовене М.Р., Тисо А., Сика М., Рокко А., Салерно Р., Мармо Р. и др. Эмпирическая левофлоксацин-содержащая и кларитромицин-содержащая последовательная терапия для эрадикации Helicobacter pylori: рандомизированное исследование.Кишка. 2010;59:1465–1470. [PubMed] [Google Scholar]49. Бернинг М., Крас С., Мильке С. Должны ли хинолоны стоять на первом месте в терапии Helicobacter pylori? Терапия Adv Гастроэнтерол. 2011;4:103–114. [Бесплатная статья PMC] [PubMed] [Google Scholar]50. Карозерс Дж.Дж., Брюс М.Г., Хеннесси Т.В., Бенслер М., Моррис Дж.М., Ризоновер А.Л., Херлберт Д.А., Паркинсон А.Дж., Коулман Дж.М., МакМахон Б.Дж. Взаимосвязь между предыдущим применением фторхинолонов и устойчивостью к левофлоксацину при инфекции Helicobacter pylori. Клин Инфекция Дис. 2007;44:e5–e8.[PubMed] [Google Scholar]51. Gisbert JP, Morena F. Систематический обзор и метаанализ: схемы спасения на основе левофлоксацина после неудачного лечения Helicobacter pylori. Алимент Фармакол Тер. 2006; 23:35–44. [PubMed] [Google Scholar]52. Саад Р.Дж., Шонфельд П., Ким Х.М., Чей В.Д. Тройная терапия на основе левофлоксацина по сравнению с четырехкомпонентной терапией на основе висмута при персистирующей инфекции Helicobacter pylori: метаанализ. Am J Гастроэнтерол. 2006; 101: 488–496. [PubMed] [Google Scholar]53. Ди Каро С., Фини Л., Дауд Ю., Грицци Ф., Гасбаррини А., Де Лоренцо А., Ди Ренцо Л., Маккартни С., Блум С.Схемы на основе левофлоксацина/амоксициллина по сравнению с четырехкомпонентной терапией для эрадикации Helicobacter pylori во второй линии. Мир J Гастроэнтерол. 2012;18:5669–5678. [Бесплатная статья PMC] [PubMed] [Google Scholar]54. Гисберт Дж. П., Молина-Инфанте Дж., Марин А. С., Винагре Дж., Баррио Дж., МакНичолл АГ. Тройная терапия второй линии с левофлоксацином после неэффективности четырехкратного «последовательного» или «сопутствующего» лечения без висмута для эрадикации инфекции H. pylori. Scand J Гастроэнтерол. 2013; 48: 652–656. [PubMed] [Google Scholar]55.Мураками К., Окимото Т., Кодама М., Танахаши Дж., Фудзиока Т., Икеда Ф., Мураока Х., Такигава М., Сайка Т., Хасегава М. и др. Активность ситафлоксацина в отношении изолятов Helicobacter pylori, в том числе с мутациями gyrA. Противомикробные агенты Chemother. 2009;53:3097–3099. [Бесплатная статья PMC] [PubMed] [Google Scholar]56. Wenzhen Y, Kehu Y, Bin M, Yumin L, Quanlin G, Donghai W, Lijuan Y. Тройная терапия на основе моксифлоксацина по сравнению с тройной терапией на основе кларитромицина для лечения первой линии инфекции Helicobacter pylori: метаанализ рандомизированных контролируемых исследований .Интерн Мед. 2009;48:2069–2076. [PubMed] [Google Scholar]57. Вильгельм С.М., Джонсон Дж.Л., Кале-Прадхан П.Б. Лечение клопов клопами: роль пробиотиков в качестве дополнительной терапии Helicobacter pylori. Энн Фармакотер. 2011;45:960–966. [PubMed] [Google Scholar]58. Лесброс-Пантофличкова Д., Кортези-Теулаз И., Блюм А.Л. Helicobacter pylori и пробиотики. Дж Нутр. 2007; 137:812С–818С. [PubMed] [Google Scholar]59. Du YQ, Su T, Fan JG, Lu YX, Zheng P, Li XH, Guo CY, Xu P, Gong YF, Li ZS. Адъювантные пробиотики улучшают эрадикационный эффект тройной терапии инфекции Helicobacter pylori.Мир J Гастроэнтерол. 2012;18:6302–6307. [Бесплатная статья PMC] [PubMed] [Google Scholar]60. Efrati C, Nicolini G, Cannaviello C, O’Sed NP, Valabrega S. Эрадикация Helicobacter pylori: последовательная терапия и добавка Lactobacillus reuteri. Мир J Гастроэнтерол. 2012;18:6250–6254. [Бесплатная статья PMC] [PubMed] [Google Scholar]61. Манфреди М., Биззарри Б., Саккеро Р.И., Маккари С., Калабрезе Л., Фаббиан Ф., Де’Анджелис Г.Л. Инфекция Helicobacter pylori в клинической практике: пробиотики и комбинация пробиотиков + лактоферрин улучшают соблюдение, но не эрадикацию, при последовательной терапии.Хеликобактер. 2012; 17: 254–263. [PubMed] [Google Scholar]62. Шавахи А., Табеш Э., Ягуткар А., Хашеми Х., Табеш Ф., Ходадостан М., Минакари М., Шавахи С., Голамрезаи А. Влияние мультиштаммового пробиотического соединения на висмутсодержащую четырехкомпонентную терапию инфекции Helicobacter pylori: рандомизированное плацебо-контролируемое тройное -слепое исследование. Хеликобактер. 2013; 18: 280–284. [PubMed] [Google Scholar]63. Szajewska H, Horvath A, Piwowarczyk A. Метаанализ: влияние добавок Saccharomyces boulardii на скорость эрадикации Helicobacter pylori и побочные эффекты во время лечения.Алимент Фармакол Тер. 2010;32:1069–1079. [PubMed] [Google Scholar]64. Zou J, Dong J, Yu X. Метаанализ: четырехкомпонентная терапия, содержащая Lactobacillus, по сравнению со стандартной тройной терапией первой линии для эрадикации Helicobacter pylori. Хеликобактер. 2009; 14:97–107. [PubMed] [Google Scholar]65. Ван Чж, Гао Цюй, Фанг Цзюй. Мета-анализ эффективности и безопасности пробиотических соединений, содержащих Lactobacillus и Bifidobacterium, в эрадикационной терапии Helicobacter pylori. Дж. Клин Гастроэнтерол.2013;47:25–32. [PubMed] [Google Scholar]66. Liou JM, Chen CC, Chen MJ, Chen CC, Chang CY, Fang YJ, Lee JY, Hsu SJ, Luo JC, Chang WH и другие. Последовательная и тройная терапия для лечения Helicobacter pylori первой линии: многоцентровое открытое рандомизированное исследование. Ланцет. 2013; 381: 205–213. [PubMed] [Google Scholar]67. Вакил Н., Вайра Д. Лечение инфекции H. pylori: новые проблемы с устойчивостью к противомикробным препаратам. Дж. Клин Гастроэнтерол. 2013; 47: 383–388. [PubMed] [Google Scholar]68. Тейлор Д.Е., Гэ З., Пурыч Д., Ло Т., Хирацука К.Клонирование и анализ последовательности двух копий гена 23S рРНК Helicobacter pylori и ассоциация устойчивости к кларитромицину с мутациями 23S рРНК. Противомикробные агенты Chemother. 1997; 41: 2621–2628. [Бесплатная статья PMC] [PubMed] [Google Scholar]69. Версалович Дж., Шортридж Д., Киблер К., Гриффи М.В., Бейер Дж., Фламм Р.К., Танака С.К., Грэм Д.Ю., Го М.Ф. Мутации в 23S рРНК связаны с устойчивостью Helicobacter pylori к кларитромицину. Противомикробные агенты Chemother. 1996; 40: 477–480. [Бесплатная статья PMC] [PubMed] [Google Scholar]70.Lehours P, Siffré E, Mégraud F. Мультиплексная ПЦР на ДПО как альтернатива культивированию и тестированию на чувствительность для выявления Helicobacter pylori и ее устойчивости к кларитромицину. БМК Гастроэнтерол. 2011;11:112. [Бесплатная статья PMC] [PubMed] [Google Scholar]71. Mégraud F, Lehours P. Обнаружение Helicobacter pylori и тестирование чувствительности к противомикробным препаратам. Clin Microbiol Rev. 2007; 20:280–322. [Бесплатная статья PMC] [PubMed] [Google Scholar]72. Шаберайтер-Гуртнер С., Хиршль А.М., Драгошич Б., Хуфнагл П., Пуз С., Ковач З., Роттер М., Макристатис А.Новый ПЦР-анализ в реальном времени для выявления инфекции Helicobacter pylori и одновременного определения чувствительности образцов кала и биопсии к кларитромицину. Дж. Клин Микробиол. 2004; 42:4512–4518. [Бесплатная статья PMC] [PubMed] [Google Scholar]73. Де Франческо В., Зулло А., Иерарди Э., Джорджио Ф., Перна Ф., Хассан С., Морини С., Панелла С., Вайра Д. Фенотипическая и генотипическая устойчивость Helicobacter pylori к кларитромицину и терапевтический результат: преимущества и ограничения. J Антимикробная химиотерапия. 2010;65:327–332. [PubMed] [Google Scholar]74.Римбара Э., Фишбах Л.А., Грэм Д.Ю. Оптимальная терапия инфекции Helicobacter pylori. Нат Рев Гастроэнтерол Гепатол. 2011; 8: 79–88. [PubMed] [Google Scholar]75. Баба С., Оиси Ю., Ватанабэ Ю., Ойкава Р., Морита Р., Ёсида Ю., Хираиси Т., Маэхата Т., Нагасе Ю., Фукуда Ю. и др. Молекулярный тест на устойчивость Helicobacter pylori к антибиотикам на основе промывания желудка. пищеварение. 2011; 84: 299–305. [PubMed] [Google Scholar]76. Грэм Д.Ю., Кудо М., Редди Р., Опекун А.Р. Практичный быстрый, малоинвазивный, надежный неэндоскопический метод получения Helicobacter pylori для посева.Хеликобактер. 2005; 10:1–3. [PubMed] [Google Scholar]77. Каваи Т., Ямагиши Т., Яги К., Катаока М., Каваками К., Софуни А., Итои Т., Сакаи Ю., Мориясу Ф., Осака Ю. и др. Индивидуальная эрадикационная терапия, основанная на чувствительности фекальных Helicobacter pylori к кларитромицину. J Гастроэнтерол Гепатол. 2008;23 Приложение 2:S171–S174. [PubMed] [Google Scholar]78. Моррис Дж.М., Ризоновер А.Л., Брюс М.Г., Бруден Д.Л., МакМахон Б.Дж., Сакко Ф.Д., Берг Д.Е., Паркинсон А.Дж. Оценка seaFAST, быстрого флуоресцентного теста гибридизации in situ, для обнаружения Helicobacter pylori и устойчивости к кларитромицину в срезах биопсии, залитых парафином.Дж. Клин Микробиол. 2005;43:3494–3496. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Йилмаз О., Демирай Э., Тюмер С., Алтунгёз О., Йорукоглу К., Сойтюрк М., Симшек И. Обнаружение Helicobacter pylori и определение чувствительности к кларитромицину с использованием фиксированных формалином и залитых парафином образцов биопсии желудка путем флуоресцентной гибридизации in situ. Хеликобактер. 2007; 12: 136–141. [PubMed] [Google Scholar]80. Камбау Э., Аллерхейлиген В., Кулон С., Корбель С., Ласколс С., Дефорж Л., Сусси С.Дж., Дельшер Дж.С., Мегро Ф.Оценка нового теста генотипа HelicoDR для молекулярного обнаружения устойчивости к антибиотикам у Helicobacter pylori. Дж. Клин Микробиол. 2009;47:3600–3607. [Бесплатная статья PMC] [PubMed] [Google Scholar]81. Lee HJ, Kim JI, Cheung DY, Kim TH, Jun EJ, Oh JH, Chung WC, Kim BW, Kim SS, Park SH и др. Эрадикация Helicobacter pylori по точечным мутациям 23S рибосомной РНК, ассоциированным с резистентностью к кларитромицину. J заразить Dis. 2013; 208:1123–1130. [PubMed] [Google Scholar]82. Фурута Т., Шираи Н., Такашима М., Сяо Ф., Ханай Х., Сугимура Х., Охаси К., Исидзаки Т., Канеко Э.Влияние генотипических различий в CYP2C19 на показатели излечения от инфекции Helicobacter pylori тройной терапией с ингибитором протонной помпы, амоксициллином и кларитромицином. Клин Фармакол Тер. 2001; 69: 158–168. [PubMed] [Google Scholar]83. Sim SC, Risinger C, Dahl ML, Aklillu E, Christensen M, Bertilsson L, Ingelman-Sundberg M. Распространенный новый вариант гена CYP2C19 вызывает сверхбыстрый метаболизм лекарств, связанный с лекарственной реакцией на ингибиторы протонной помпы и антидепрессанты. Клин Фармакол Тер. 2006; 79: 103–113.[PubMed] [Google Scholar]84. Фурута Т., Шираи Н., Кодаира М., Сугимото М., Ногаки А., Курияма С., Иваидзуми М., Ямаде М., Теракава И., Охаси К. и др. Основанный на фармакогеномике индивидуальный и стандартный терапевтический режим для эрадикации H. pylori. Клин Фармакол Тер. 2007; 81: 521–528. [PubMed] [Google Scholar]
pylori. Dig Dis Sci. 2014;59:383–389. [PubMed] [Google Scholar] 31. Ford AC, Malfertheiner P, Giguere M, Santana J, Khan M, Moayyedi P. Побочные эффекты солей висмута для эрадикации Helicobacter pylori: систематический обзор и метаанализ.Мир J Гастроэнтерол. 2008; 14:7361–7370. [Бесплатная статья PMC] [PubMed] [Google Scholar]32. Уэббер М.А., Пиддок Л.Дж. Важность эффлюксных насосов в устойчивости бактерий к антибиотикам. J Антимикробная химиотерапия. 2003; 51:9–11. [PubMed] [Google Scholar] 33. Зулло А., Вайра Д., Вакил Н., Хассан С., Гатта Л., Риччи С., Де Франческо В., Менегатти М., Тампиери А., Перна Ф. и др. Высокие показатели эрадикации Helicobacter pylori при новом последовательном лечении. Алимент Фармакол Тер. 2003; 17: 719–726. [PubMed] [Google Scholar] 34.Гисберт Дж. П., Кальвет Х, О’Коннор А., Мегро Ф., О’Морен К.А. Последовательная терапия для эрадикации Helicobacter pylori: критический обзор. Дж. Клин Гастроэнтерол. 2010;44:313–325. [PubMed] [Google Scholar] 35. Гринберг Э.Р., Андерсон Г.Л., Морган Д.Р., Торрес Дж., Чей В.Д., Браво Л.Е., Домингес Р.Л., Ферреччио С., Эрреро Р., Ласкано-Понсе Е.К. и др. 14-дневная тройная, 5-дневная одновременная и 10-дневная последовательная терапия инфекции Helicobacter pylori в семи латиноамериканских учреждениях: рандомизированное исследование. Ланцет. 2011; 378: 507–514.[Бесплатная статья PMC] [PubMed] [Google Scholar]36. Lim JH, Lee DH, Choi C, Lee ST, Kim N, Jeong SH, Kim JW, Hwang JH, Park YS, Lee SH и др. Клинические результаты двухнедельной последовательной и сопутствующей терапии для эрадикации Helicobacter pylori: рандомизированное пилотное исследование. Хеликобактер. 2013;18:180–186. [PubMed] [Google Scholar] 37. Сардарян Х., Факери Х., Хоссейни В., Тагваи Т., Малеки И., Мохтаре М. Сравнение гибридных и последовательных методов лечения Helicobacter pylori в Иране: проспективное рандомизированное исследование.Хеликобактер. 2013;18:129–134. [PubMed] [Google Scholar] 38. Гатта Л., Вакил Н., Вайра Д., Скарпиньято С. Глобальные показатели ликвидации инфекции Helicobacter pylori: систематический обзор и метаанализ последовательной терапии. БМЖ. 2013;347:f4587. [Бесплатная статья PMC] [PubMed] [Google Scholar]39. Георгопулос С., Папастергиу В., Ксирушакис Э., Лауди Ф., Лисгос П., Спилиади С., Папантониу Н., Каратапанис С. Четырехкратная «сопутствующая» терапия без висмута по сравнению со стандартной тройной терапией, продолжительностью 10 дней для лечения H.pylori: рандомизированное исследование. Дж. Клин Гастроэнтерол. 2013;47:228–232. [PubMed] [Google Scholar]40. Георгопулос С., Папастергиу В., Ксирушакис Э., Лауди Ф., Папантониу Н., Лисгос П., Спилиади С., Фрагу П., Скорда Л., Каратапанис С. Оценка «сопутствующей» терапии, состоящей из четырех препаратов, трех антибиотиков, не содержащей висмута, в качестве первой схема эрадикации Helicobacter pylori в Греции. Хеликобактер. 2012;17:49–53. [PubMed] [Google Scholar]41. Gisbert JP, Calvet X. Обновленная информация о четырехкратной (сопутствующей) терапии без висмута для эрадикации Helicobacter pylori.Клин Эксп Гастроэнтерол. 2012;5:23–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]42. Эсса А.С., Крамер Дж.Р., Грэм Д.Ю., Трейбер Г. Мета-анализ: «сопутствующая терапия» с четырьмя препаратами, тремя антибиотиками, не содержащей висмута по сравнению с тройной терапией для эрадикации Helicobacter pylori. Хеликобактер. 2009; 14:109–118. [Бесплатная статья PMC] [PubMed] [Google Scholar]43. Молина-Инфанте Дж., Романо М., Фернандес-Бермехо М., Федерико А., Гравина А.Г., Поццати Л., Гарсия-Абадиа Э., Винагре-Родригес Г., Мартинес-Алькала С., Эрнандес-Алонсо М. и др.Оптимизированная четырехкомпонентная терапия без висмута излечивает большинство пациентов с инфекцией Helicobacter pylori в популяциях с высоким уровнем устойчивости к антибиотикам. Гастроэнтерология. 2013;145:121–128.e1. [PubMed] [Google Scholar]44. Ву Д.К., Хсу П.И., Ву Д.Ю., Опекун А.Р., Куо Ч., Ву И.К., Ван С.С., Чен А., Хунг В.К., Грэм Д.Ю. Последовательная и сопутствующая терапия четырьмя препаратами одинаково эффективна для эрадикации инфекции H. pylori. Клин Гастроэнтерол Гепатол. 2010;8:36–41.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar]45.Макниколл А.Г., Марин А.С., Молина-Инфанте Дж., Кастро М., Баррио Дж., Дюконс Дж., Кальвет Х, де ла Коба С, Монторо М., Бори Ф. и др. Рандомизированное клиническое исследование, сравнивающее последовательную и сопутствующую терапию для эрадикации Helicobacter pylori в рутинной клинической практике. Кишка. 2014; 63: 244–249. [PubMed] [Google Scholar]46. Георгопулос С.Д., Ксирушакис Э., Мартинес-Гонсалес Б., Сгурас Д.Н., Спилиади С., Ментис А.Ф., Лауди Ф. Клиническая оценка десятидневного режима эзомепразола, метронидазола, амоксициллина и кларитромицина для эрадикации Helicobacter pylori при высоком кларитромицине область сопротивления.Хеликобактер. 2013; 18: 459–467. [PubMed] [Google Scholar]47. Хсу П.И., Ву Д.К., Ву Д.Ю., Грэм Д.Ю. Модифицированная последовательная терапия Helicobacter pylori: ингибитор протонной помпы и амоксициллин в течение 14 дней с добавлением кларитромицина и метронидазола в виде четырехкомпонентной (гибридной) терапии в течение последних 7 дней. Хеликобактер. 2011;16:139–145. [Бесплатная статья PMC] [PubMed] [Google Scholar]48. Романо М., Куомо А., Гравина А.Г., Миранда А., Иовене М.Р., Тисо А., Сика М., Рокко А., Салерно Р., Мармо Р. и др. Эмпирическая левофлоксацин-содержащая и кларитромицин-содержащая последовательная терапия для эрадикации Helicobacter pylori: рандомизированное исследование.Кишка. 2010;59:1465–1470. [PubMed] [Google Scholar]49. Бернинг М., Крас С., Мильке С. Должны ли хинолоны стоять на первом месте в терапии Helicobacter pylori? Терапия Adv Гастроэнтерол. 2011;4:103–114. [Бесплатная статья PMC] [PubMed] [Google Scholar]50. Карозерс Дж.Дж., Брюс М.Г., Хеннесси Т.В., Бенслер М., Моррис Дж.М., Ризоновер А.Л., Херлберт Д.А., Паркинсон А.Дж., Коулман Дж.М., МакМахон Б.Дж. Взаимосвязь между предыдущим применением фторхинолонов и устойчивостью к левофлоксацину при инфекции Helicobacter pylori. Клин Инфекция Дис. 2007;44:e5–e8.[PubMed] [Google Scholar]51. Gisbert JP, Morena F. Систематический обзор и метаанализ: схемы спасения на основе левофлоксацина после неудачного лечения Helicobacter pylori. Алимент Фармакол Тер. 2006; 23:35–44. [PubMed] [Google Scholar]52. Саад Р.Дж., Шонфельд П., Ким Х.М., Чей В.Д. Тройная терапия на основе левофлоксацина по сравнению с четырехкомпонентной терапией на основе висмута при персистирующей инфекции Helicobacter pylori: метаанализ. Am J Гастроэнтерол. 2006; 101: 488–496. [PubMed] [Google Scholar]53. Ди Каро С., Фини Л., Дауд Ю., Грицци Ф., Гасбаррини А., Де Лоренцо А., Ди Ренцо Л., Маккартни С., Блум С.Схемы на основе левофлоксацина/амоксициллина по сравнению с четырехкомпонентной терапией для эрадикации Helicobacter pylori во второй линии. Мир J Гастроэнтерол. 2012;18:5669–5678. [Бесплатная статья PMC] [PubMed] [Google Scholar]54. Гисберт Дж. П., Молина-Инфанте Дж., Марин А. С., Винагре Дж., Баррио Дж., МакНичолл АГ. Тройная терапия второй линии с левофлоксацином после неэффективности четырехкратного «последовательного» или «сопутствующего» лечения без висмута для эрадикации инфекции H. pylori. Scand J Гастроэнтерол. 2013; 48: 652–656. [PubMed] [Google Scholar]55.Мураками К., Окимото Т., Кодама М., Танахаши Дж., Фудзиока Т., Икеда Ф., Мураока Х., Такигава М., Сайка Т., Хасегава М. и др. Активность ситафлоксацина в отношении изолятов Helicobacter pylori, в том числе с мутациями gyrA. Противомикробные агенты Chemother. 2009;53:3097–3099. [Бесплатная статья PMC] [PubMed] [Google Scholar]56. Wenzhen Y, Kehu Y, Bin M, Yumin L, Quanlin G, Donghai W, Lijuan Y. Тройная терапия на основе моксифлоксацина по сравнению с тройной терапией на основе кларитромицина для лечения первой линии инфекции Helicobacter pylori: метаанализ рандомизированных контролируемых исследований .Интерн Мед. 2009;48:2069–2076. [PubMed] [Google Scholar]57. Вильгельм С.М., Джонсон Дж.Л., Кале-Прадхан П.Б. Лечение клопов клопами: роль пробиотиков в качестве дополнительной терапии Helicobacter pylori. Энн Фармакотер. 2011;45:960–966. [PubMed] [Google Scholar]58. Лесброс-Пантофличкова Д., Кортези-Теулаз И., Блюм А.Л. Helicobacter pylori и пробиотики. Дж Нутр. 2007; 137:812С–818С. [PubMed] [Google Scholar]59. Du YQ, Su T, Fan JG, Lu YX, Zheng P, Li XH, Guo CY, Xu P, Gong YF, Li ZS. Адъювантные пробиотики улучшают эрадикационный эффект тройной терапии инфекции Helicobacter pylori.Мир J Гастроэнтерол. 2012;18:6302–6307. [Бесплатная статья PMC] [PubMed] [Google Scholar]60. Efrati C, Nicolini G, Cannaviello C, O’Sed NP, Valabrega S. Эрадикация Helicobacter pylori: последовательная терапия и добавка Lactobacillus reuteri. Мир J Гастроэнтерол. 2012;18:6250–6254. [Бесплатная статья PMC] [PubMed] [Google Scholar]61. Манфреди М., Биззарри Б., Саккеро Р.И., Маккари С., Калабрезе Л., Фаббиан Ф., Де’Анджелис Г.Л. Инфекция Helicobacter pylori в клинической практике: пробиотики и комбинация пробиотиков + лактоферрин улучшают соблюдение, но не эрадикацию, при последовательной терапии.Хеликобактер. 2012; 17: 254–263. [PubMed] [Google Scholar]62. Шавахи А., Табеш Э., Ягуткар А., Хашеми Х., Табеш Ф., Ходадостан М., Минакари М., Шавахи С., Голамрезаи А. Влияние мультиштаммового пробиотического соединения на висмутсодержащую четырехкомпонентную терапию инфекции Helicobacter pylori: рандомизированное плацебо-контролируемое тройное -слепое исследование. Хеликобактер. 2013; 18: 280–284. [PubMed] [Google Scholar]63. Szajewska H, Horvath A, Piwowarczyk A. Метаанализ: влияние добавок Saccharomyces boulardii на скорость эрадикации Helicobacter pylori и побочные эффекты во время лечения.Алимент Фармакол Тер. 2010;32:1069–1079. [PubMed] [Google Scholar]64. Zou J, Dong J, Yu X. Метаанализ: четырехкомпонентная терапия, содержащая Lactobacillus, по сравнению со стандартной тройной терапией первой линии для эрадикации Helicobacter pylori. Хеликобактер. 2009; 14:97–107. [PubMed] [Google Scholar]65. Ван Чж, Гао Цюй, Фанг Цзюй. Мета-анализ эффективности и безопасности пробиотических соединений, содержащих Lactobacillus и Bifidobacterium, в эрадикационной терапии Helicobacter pylori. Дж. Клин Гастроэнтерол.2013;47:25–32. [PubMed] [Google Scholar]66. Liou JM, Chen CC, Chen MJ, Chen CC, Chang CY, Fang YJ, Lee JY, Hsu SJ, Luo JC, Chang WH и другие. Последовательная и тройная терапия для лечения Helicobacter pylori первой линии: многоцентровое открытое рандомизированное исследование. Ланцет. 2013; 381: 205–213. [PubMed] [Google Scholar]67. Вакил Н., Вайра Д. Лечение инфекции H. pylori: новые проблемы с устойчивостью к противомикробным препаратам. Дж. Клин Гастроэнтерол. 2013; 47: 383–388. [PubMed] [Google Scholar]68. Тейлор Д.Е., Гэ З., Пурыч Д., Ло Т., Хирацука К.Клонирование и анализ последовательности двух копий гена 23S рРНК Helicobacter pylori и ассоциация устойчивости к кларитромицину с мутациями 23S рРНК. Противомикробные агенты Chemother. 1997; 41: 2621–2628. [Бесплатная статья PMC] [PubMed] [Google Scholar]69. Версалович Дж., Шортридж Д., Киблер К., Гриффи М.В., Бейер Дж., Фламм Р.К., Танака С.К., Грэм Д.Ю., Го М.Ф. Мутации в 23S рРНК связаны с устойчивостью Helicobacter pylori к кларитромицину. Противомикробные агенты Chemother. 1996; 40: 477–480. [Бесплатная статья PMC] [PubMed] [Google Scholar]70.Lehours P, Siffré E, Mégraud F. Мультиплексная ПЦР на ДПО как альтернатива культивированию и тестированию на чувствительность для выявления Helicobacter pylori и ее устойчивости к кларитромицину. БМК Гастроэнтерол. 2011;11:112. [Бесплатная статья PMC] [PubMed] [Google Scholar]71. Mégraud F, Lehours P. Обнаружение Helicobacter pylori и тестирование чувствительности к противомикробным препаратам. Clin Microbiol Rev. 2007; 20:280–322. [Бесплатная статья PMC] [PubMed] [Google Scholar]72. Шаберайтер-Гуртнер С., Хиршль А.М., Драгошич Б., Хуфнагл П., Пуз С., Ковач З., Роттер М., Макристатис А.Новый ПЦР-анализ в реальном времени для выявления инфекции Helicobacter pylori и одновременного определения чувствительности образцов кала и биопсии к кларитромицину. Дж. Клин Микробиол. 2004; 42:4512–4518. [Бесплатная статья PMC] [PubMed] [Google Scholar]73. Де Франческо В., Зулло А., Иерарди Э., Джорджио Ф., Перна Ф., Хассан С., Морини С., Панелла С., Вайра Д. Фенотипическая и генотипическая устойчивость Helicobacter pylori к кларитромицину и терапевтический результат: преимущества и ограничения. J Антимикробная химиотерапия. 2010;65:327–332. [PubMed] [Google Scholar]74.Римбара Э., Фишбах Л.А., Грэм Д.Ю. Оптимальная терапия инфекции Helicobacter pylori. Нат Рев Гастроэнтерол Гепатол. 2011; 8: 79–88. [PubMed] [Google Scholar]75. Баба С., Оиси Ю., Ватанабэ Ю., Ойкава Р., Морита Р., Ёсида Ю., Хираиси Т., Маэхата Т., Нагасе Ю., Фукуда Ю. и др. Молекулярный тест на устойчивость Helicobacter pylori к антибиотикам на основе промывания желудка. пищеварение. 2011; 84: 299–305. [PubMed] [Google Scholar]76. Грэм Д.Ю., Кудо М., Редди Р., Опекун А.Р. Практичный быстрый, малоинвазивный, надежный неэндоскопический метод получения Helicobacter pylori для посева.Хеликобактер. 2005; 10:1–3. [PubMed] [Google Scholar]77. Каваи Т., Ямагиши Т., Яги К., Катаока М., Каваками К., Софуни А., Итои Т., Сакаи Ю., Мориясу Ф., Осака Ю. и др. Индивидуальная эрадикационная терапия, основанная на чувствительности фекальных Helicobacter pylori к кларитромицину. J Гастроэнтерол Гепатол. 2008;23 Приложение 2:S171–S174. [PubMed] [Google Scholar]78. Моррис Дж.М., Ризоновер А.Л., Брюс М.Г., Бруден Д.Л., МакМахон Б.Дж., Сакко Ф.Д., Берг Д.Е., Паркинсон А.Дж. Оценка seaFAST, быстрого флуоресцентного теста гибридизации in situ, для обнаружения Helicobacter pylori и устойчивости к кларитромицину в срезах биопсии, залитых парафином.Дж. Клин Микробиол. 2005;43:3494–3496. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Йилмаз О., Демирай Э., Тюмер С., Алтунгёз О., Йорукоглу К., Сойтюрк М., Симшек И. Обнаружение Helicobacter pylori и определение чувствительности к кларитромицину с использованием фиксированных формалином и залитых парафином образцов биопсии желудка путем флуоресцентной гибридизации in situ. Хеликобактер. 2007; 12: 136–141. [PubMed] [Google Scholar]80. Камбау Э., Аллерхейлиген В., Кулон С., Корбель С., Ласколс С., Дефорж Л., Сусси С.Дж., Дельшер Дж.С., Мегро Ф.Оценка нового теста генотипа HelicoDR для молекулярного обнаружения устойчивости к антибиотикам у Helicobacter pylori. Дж. Клин Микробиол. 2009;47:3600–3607. [Бесплатная статья PMC] [PubMed] [Google Scholar]81. Lee HJ, Kim JI, Cheung DY, Kim TH, Jun EJ, Oh JH, Chung WC, Kim BW, Kim SS, Park SH и др. Эрадикация Helicobacter pylori по точечным мутациям 23S рибосомной РНК, ассоциированным с резистентностью к кларитромицину. J заразить Dis. 2013; 208:1123–1130. [PubMed] [Google Scholar]82. Фурута Т., Шираи Н., Такашима М., Сяо Ф., Ханай Х., Сугимура Х., Охаси К., Исидзаки Т., Канеко Э.Влияние генотипических различий в CYP2C19 на показатели излечения от инфекции Helicobacter pylori тройной терапией с ингибитором протонной помпы, амоксициллином и кларитромицином. Клин Фармакол Тер. 2001; 69: 158–168. [PubMed] [Google Scholar]83. Sim SC, Risinger C, Dahl ML, Aklillu E, Christensen M, Bertilsson L, Ingelman-Sundberg M. Распространенный новый вариант гена CYP2C19 вызывает сверхбыстрый метаболизм лекарств, связанный с лекарственной реакцией на ингибиторы протонной помпы и антидепрессанты. Клин Фармакол Тер. 2006; 79: 103–113.[PubMed] [Google Scholar]84. Фурута Т., Шираи Н., Кодаира М., Сугимото М., Ногаки А., Курияма С., Иваидзуми М., Ямаде М., Теракава И., Охаси К. и др. Основанный на фармакогеномике индивидуальный и стандартный терапевтический режим для эрадикации H. pylori. Клин Фармакол Тер. 2007; 81: 521–528. [PubMed] [Google Scholar]Лечение инфекции Helicobacter pylori: прошлое, настоящее и будущее
World J Gastrointest Pathophysiol. 2014 15 ноября; 5(4): 392–399.
Василиос Папастергиу, Стилианос Каратапанис, Отделение внутренних болезней, Больница общего профиля Родоса, 85100 Родос, Греция
Сотириос Д. Георгопулос, Отделение гастроэнтерологии, Афины Медикал, П.Больница Фалирон, 17562 Афины, Греция,
Вклад авторов: Папастергиу В. участвовал в разработке концепции и дизайна, составлении статьи; Георгопулос С.Д. участвовал в составлении проекта статьи, критически пересматривая статью на предмет важного интеллектуального содержания; Каратапанис С. участвовал в окончательном утверждении версии для публикации.Адрес для переписки: Стилианос Каратапанис, доктор медицинских наук, отделение внутренних болезней, больница общего профиля Родоса, ул. Калопетрас, 10, 85100 Родос, Греция. гр.teneto@raklyts
Телефон: +30-224-1080456 Факс: +30-224-1066410
Поступила в редакцию 12 февраля 2014 г.; Пересмотрено 15 апреля 2014 г.; Принято 17 июля 2014 г.
Copyright © 2014 Baishideng Publishing Group Inc. Все права защищены. Эта статья цитируется в других статьях PMC.Abstract
Helicobacter pylori ( H. pylori ) является основным патогеном человека, вызывающим значительную заболеваемость и смертность. Однако после десятилетий усилий лечение H.pylori остается проблемой для врачей, так как не существует универсально эффективной схемы лечения. Из-за растущей распространенности устойчивости к противомикробным препаратам, главным образом к кларитромицину, эффективность стандартной тройной терапии снизилась до неприемлемо низкого уровня в большинстве частей мира. Новые схемы, специально испытанные для улучшения терапевтических результатов против устойчивых к антибиотикам штаммов H. pylori , в настоящее время рекомендуются в качестве вариантов эмпирического лечения первой линии, обеспечивающих высокую эффективность (по сообщениям, > 90% при намерении лечить анализ) даже при высокой устойчивости к кларитромицину. настройки.К ним относятся висмутовая квадротерапия, сопутствующая, последовательная и гибридная терапия. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина следует зарезервировать в качестве вариантов второй линии/спасения. Было предложено дополнительное использование пробиотиков, чтобы повысить скорость эрадикации и уменьшить возникновение побочных эффектов, связанных с лечением. В настоящее время доступны методы молекулярного тестирования для характеристики терапевтической чувствительности H. pylori , включая генотипическое определение устойчивости к макролидам и оценку статуса цитохрома P450 2C19, который, как известно, влияет на метаболизм ингибиторов протонной помпы.В будущем использование этих методов может обеспечить бескультуральную неинвазивную индивидуальную терапию инфекции H. pylori .
Ключевые слова: Helicobacter pylori , Антибиотикорезистентность, Висмут-квадроцикл, Сопутствующая, Последовательная, Пробиотики Helicobacter pylori ( H.pylori ) инфекции. Четырехкомпонентная, сопутствующая, последовательная и гибридная терапия висмутом в настоящее время рекомендуется в качестве эмпирической терапии первой линии, обеспечивающей повышенную эффективность в условиях высокой резистентности к кларитромицину. Поскольку резистентность к хинолонам быстро растет, левофлоксацин следует предпочтительно использовать в терапии второй линии/спасательной терапии. Появляется все больше доказательств того, что дополнительные добавки с пробиотиками улучшают терапевтический результат и переносимость. Генотипическая характеристика восприимчивости H. pylori к терапии может позволить в будущем разработать индивидуальный терапевтический подход.
ВВЕДЕНИЕ
Лечение инфекции Helicobacter pylori ( H. pylori ) имеет первостепенное значение для лечения распространенных желудочно-кишечных заболеваний, включая язвенную болезнь, рак желудка и функциональную диспепсию [1-3]. Кроме того, в качестве показаний к эрадикации H. pylori теперь включаются экстрапищеварительные расстройства: идиопатическая тромбоцитопеническая пурпура, дефицит витамина B12 и необъяснимая железодефицитная анемия [4]. В отличие от других бактериальных инфекций, для лечения которых обычно проводится тестирование на чувствительность, культура H.pylori не является широко доступным и требует проведения эндоскопии, которая хорошо переносится не всеми пациентами и имеет ряд ограничений, включая тот факт, что чувствительность к in vitro не всегда гарантирует эрадикацию in vivo [5]. Таким образом, схемы для H. pylori обычно назначались эмпирически, при условии, что они были предварительно протестированы и в достаточной степени адаптированы в отношении различных параметров (, т.е. ; лечебная доза, продолжительность, интервалы дозирования и т.) для оптимизации показателей излечения и сведения к минимуму побочных эффектов. Однако оптимальное лечение для эрадикации H. pylori еще предстоит установить, поскольку ни один из режимов не является универсальным. Распространение во всем мире резистентности к основным антибиотикам, в основном к кларитромицину (CAM), а также к метронидазолу (MNZ) и левофлоксацину, является основным фактором, определяющим неэффективность лечения инфекции H. pylori [6,7]. В недавнем систематическом обзоре сообщалось, что глобальная заболеваемость устойчивостью к CAM составляет 17.2% в диапазоне от 11,1% в Европе до 29,3% в Америке, тогда как в том же анализе континентальные показатели резистентности к MNZ составляли 17% и 44,1% соответственно [8]. Потребление антибиотиков при инфекциях, отличных от H. pylori , объясняет широкое увеличение показателей устойчивости к антибиотикам H. pylori [9,10]. Действительно, различная национальная политика в отношении использования антибиотиков в значительной степени отражает географическое распределение устойчивости H. pylori к : устойчивость к САМ значительно выше в странах Южной Европы (достигая 49% в некоторых районах Испании) по сравнению с Северной Европой ( эл.g ., только 1% в Нидерландах), где политика использования антибиотиков более строгая[9]. В дополнение к развитию устойчивости к антибиотикам ряд факторов, связанных как с хозяином, так и с патогеном, может негативно повлиять на эффективность схем эрадикации H. pylori (таблица) [11,12].
Таблица 1
Таблица 1
Факторы сообщили о отрицательном влиянии на исход терапии на Helicobacter Pylori инфекция
| | 8 | | |
| Разработка устойчивости к антибиотикам | Несоблюдение лечения | ||
| Высокая бактериальная нагрузка в желудке | Nexcer Dyspepsia | ||
| Защитный эффект слоя слизирования желудка | Курение | ||
| Внутриклеточное расположение многих бактерий | Состояние CYP2C19 Быстрый метаболизатор) | ||
| 9 | |||
| CAGA отрицательный | |||
| Наличие бездействующих кокоидов (не подвержены антибиотикам) | |||
| гетерорезерный статус (сосуществование штаммов, восприимчивых и устойчивых к тому же антибиотику) |
Несмотря на десятилетия усилий, лечение H.pylori остается сложной проблемой как для исследователей, так и для практикующих врачей. В настоящей статье мы стремимся предоставить всесторонний обзор взглядов на прошлое, настоящее и будущее эрадикации H. pylori .
ТРОЙНАЯ ТЕРАПИЯ НА ОСНОВЕ КЛАРИТРОМИЦИНА: УМЕНЬШАЮЩИЙСЯ КЛИНИЧЕСКИЙ СТАНДАРТ
Исторически сложилось так, что первая действительно эффективная терапия инфекции H. pylori , включающая висмут, тетрациклин и MNZ, была предложена в 1990 г. [13].Несколькими годами позже использование CAM в тройной терапии, предложенной Bazzoli et al. [14], положило начало тройным схемам на основе CAM, после чего стало золотым стандартом в лечении H. pylori . В исследованиях, проведенных в 90-х годах, стандартная тройная терапия (СТТ), включающая ингибитор протонной помпы (ИПП) два раза в день , САМ 500 мг два раза в день и амоксициллин 1000 мг два раза в день или MNZ 500 мг (или 400 мг в Англии) , все назначаемые в течение 7-14 дней, давали стабильно хорошие результаты, приводящие к успеху эрадикации > 80%, и даже > 90% было возможно [15,16].Благодаря этой высокой эффективности и относительной простоте, оптимальному профилю безопасности и приверженности крупных фармацевтических компаний эти схемы получили широкое признание в национальных экспертных группах и согласованных рекомендациях во всем мире в качестве стандарта лечения первой линии для эрадикации H. pylori . 17-20]. Однако рост распространенности резистентности к САМ привел к значительному снижению эффективности стандартных схем. Это снижение эффективности уже было очевидно в мета-анализах, опубликованных в начале 2000-х годов, что привело к значительным изменениям в парадигме лечения инфекции.К ним относятся введение концепции кумулятивной эффективности лечения (требующей от пациента соблюдения большего количества курсов лечения; таким образом, больше побочных эффектов и распространение вторичной антибиотикорезистентности), а затем введение местного порога (15%-20%) устойчивости к САМ, при которых САМ не следует использовать эмпирически [17,18]. Снижение эффективности стандартных методов лечения штаммов, устойчивых к САМ, хорошо задокументировано на основе метаанализа: в метаанализе, проведенном Фишбахом и Эвансом, эффективность тройной терапии снизилась на 66%.2% (95% ДИ: 58,2%-74,2%), когда штаммы H. pylori были устойчивыми против чувствительными к CAM[7]. Соответственно, более поздний анализ Venerito et al [21] показал аналогичные результаты: включая данные о чувствительности к противомикробным препаратам из 4 рандомизированных клинических испытаний (РКИ), стандартная тройная терапия успешно элиминировала 88% чувствительных к CAM, но только 14% устойчивых к CAM. штаммов H. pylori (разница рисков = 0,75, 95% ДИ: 0,63-0,87). Если используется MNZ, наличие резистентности к MNZ также может повлиять на терапевтический результат [22], хотя обычно считается менее важным с клинической точки зрения.Это связано с тем, что резистентность к MNZ может быть в значительной степени преодолена за счет увеличения дозы и увеличения продолжительности лечения [23]. Наконец, устойчивость H. pylori к амоксициллину является исключительной и, как правило, не имеет клинического значения. В свете увеличения количества данных, подтверждающих субоптимальную эффективность (< 70%) в большинстве европейских стран, недавний консенсусный отчет Maastricht IV/Florence окончательно заменил стандартные схемы в качестве эмпирического золотого стандарта для эрадикации H. pylori [4].Вместо этого при использовании устаревших тройных схем следует учитывать локальную картину резистентности (таким образом, использовать только в областях, в которых устойчивость к САМ составляет <20%) или полагаться на тестирование чувствительности при условии, что доступна культура до лечения (, т.е. ., используется в качестве индивидуального лечения).
СОВРЕМЕННЫЕ ТЕРАПИИ ИНФЕКЦИИ
H. PYLORIНовые схемы, специально разработанные для улучшения терапевтических результатов против устойчивых к антибиотикам штаммов H. pylori , в настоящее время рекомендуются в качестве эмпирических вариантов лечения первой линии, обеспечивающих повышенную эффективность (по сообщениям > 90% намерены лечить анализ) в условиях высокой резистентности к САМ.Эти режимы приведены в таблице.
Таблица 2
Текущие схемы для лечения Helicobacter Pylori инфекция
| лечение | Regimen 8 | ||
| 45369 | ), висмут (стандартная доза, 4 раза в день ) тетрациклин (500 мг, 4 раза в день ) и метронидазол (500 мг, 4 раза в день ) в течение 10-14 дней | ||
| Последовательная терапия с двойной терапией | 2 | 2 | 2 A ИПП (стандартная доза, 2 раза в день) и амоксициллин (1 г, 2 раза в день) с последующей 5-дневной тройной терапией с ИПП (стандартная доза, 2 раза в день), кларитромицином (500 мг, 2 раза в день) и метронидазол (500 мг, 2 раза в сутки) |
| Сопутствующая терапия | дазол (500 мг, 2 раза в день ) в течение 7-10 дней | ||
| Гибридная терапия | 7-дневная двойная терапия с ИПП (стандартная доза, 2 раза в день) и амоксициллином (1 г, 2 раза в день) с последующим 7-дневной четырехкомпонентной терапией с ИПП (стандартная доза, 2 раза в сутки), амоксициллином (1 г, 2 раза в сутки), кларитромицином (500 мг, 2 раза в сутки) и метронидазолом (500 мг, 2 раза в сутки) | ||
| Triple терапии на основе левофлоксацина | PPI (стандартная доза, ставка ), левофлоксацин (500 мг, ставка ) и амоксициллин (1 г, ставка ) для 10 D |
4540409
Четырехменность висмута
Квадратная терапия висмутом (BQT) в настоящее время представляет собой предпочтительный вариант лечения первой линии для областей с высокой (≥ 20%) частотой резистентности к CAM, а также ценный вариант лечения второй линии, когда схема на основе CAM ранее не удалась.Он работает независимо от CAM, достигая > 90% эрадикации при наличии устойчивости к CAM, тогда как применение высокой дозы MNZ (1500–1600 мг/сутки) и пролонгированной (10–14 дней) продолжительности лечения позволяет минимизировать влияние на устойчивость к MNZ. , обеспечивая уровень эрадикации > 85% даже в регионах с высокой резистентностью к этому препарату [24]. Доступна удобная для пациента монокапсула (содержащая висмут, MNZ и тетрациклин) (Pylera ® , Aptalis, Mont St Hilaire, QC, Канада), обеспечивающая уровень эрадикации 86 % и 80 % в двух крупных РКИ, проведенных в Северной Америке и Европе соответственно[25-27].Напротив, частота эрадикации ITT с помощью BQT составила всего 77,8% в недавнем мета-анализе ( против 77% для STT), что ставит под сомнение как эффективность, так и превосходство BQT над STT [28]. Однако следует признать существенную степень неоднородности исследований, особенно в отношении дозирования MNZ. Эффективность BQT второй линии также была подтверждена на основе метаанализа (30 исследований), показавшего эффективность второй линии (ITT) в среднем 77% после неудачи STT [29]. Эффективность третьей линии BQT после двух предыдущих неудачных попыток эрадикации тройной терапией, содержащей CAM и левофлоксацин, составила 65% (ITT) в многоцентровом исследовании, проведенном в Испании [30].Основными ограничениями являются отсутствие в некоторых странах солей висмута или тетрациклина, а также потенциальная токсичность висмута. Однако, включая 4763 пациента, не было выявлено различий в отношении переносимости между группами, не принимавшими висмут, и группами, содержащими висмут, за исключением темного стула, который чаще наблюдался в более поздних группах [31].
ПОСЛЕДОВАТЕЛЬНАЯ ТЕРАПИЯ
При последовательной терапии используются те же антибиотики, что и в STT, но вводятся последовательно. Было высказано предположение, что начальный курс амоксициллина разрушает клеточную стенку бактерий, предотвращая развитие каналов оттока, выводящих САМ из бактерий [32].Хотя в первоначальных РКИ [33] (большинство из них было проведено в Италии) и более ранних метаанализах последовательная терапия явно превосходила СТТ [эрадикация ИТТ 91,7% (95% ДИ: 90%-93%) против 76,7% ( 95% ДИ: 75%-79%) для STT [34], более свежие данные из Южной Америки, Ирана и Южной Кореи показали более низкие показатели эрадикации (< 80%) [35-37]. Несмотря на то, что эта последовательная терапия кажется достаточно эффективной против штаммов с монорезистентностью к САМ, способной уничтожить 72,8% из них, ее эффективность против штаммов с двойной резистентностью (САМ и MNZ) составила всего 37% (диапазон: 16.от 2% до 60,7%) при оценке 8 исследований с данными о чувствительности к антибиотикам [38]. Важно отметить, что последовательная терапия не превосходила ни 14-дневную тройную терапию (ОР = 1, 95% ДИ: 0,94–1,06), ни терапию на основе висмута (ОР = 0,99, 95% ДИ: 0,94–1,05) при обширном оценка 46 РКИ[38].
БЕЗВИСМУТОВАЯ КВАДРАТНАЯ (СОПУТСТВУЮЩАЯ) ТЕРАПИЯ
«Сопутствующая» квадротерапия без висмута является еще одним допустимым вариантом лечения первой линии для областей с высокой частотой резистентности к CAM[39,40].В 19 исследованиях (2070 пациентов) общая частота эрадикации при сопутствующей терапии составила 88% (95% ДИ: 85%-91%) и 91%, когда были исключены 3 отдаленных исследования с изначально короткой продолжительностью лечения (3-5 дней) [41]. ]. Действительно, было показано, что продолжительность лечения не менее 7 дней необходима для успеха сопутствующей терапии [42], в то время как дополнительное продление лечения до 14 дней в сочетании с высокой дозой ИПП (омепразол 40 мг × 2) может дополнительно ускорить излечение. показатели до > 95%, как показало многоцентровое исследование не меньшей эффективности [43].Повышенная эффективность против штаммов H. pylori с двойной резистентностью была предложена в качестве основного преимущества сопутствующей терапии по сравнению с последовательной терапией [44], хотя две схемы показали одинаковую эффективность при сравнении с использованием 338 пациентов в стране с высокой устойчивостью к антибиотикам (Испания). )[45]. Действительно, при оценке 106 пациентов с тестированием чувствительности до лечения сопутствующая терапия элиминировала только 55% штаммов с двойной устойчивостью против 100% и 91% с устойчивостью к САМ и MNZ соответственно [46].Таким образом, обе схемы, по-видимому, склонны к пагубному влиянию двойной резистентности, работая примерно одинаково (с эффективностью около 81% каждая) по объединению данных 6 сравнительных РКИ [38].
ГИБРИДНАЯ ТЕРАПИЯ
Двухэтапный двухкомпонентный (гибридный) режим, предложенный Hsu et al. [47], является еще одним ценным вариантом лечения, конкурирующим как с последовательным, так и с сопутствующим лечением. При оценке данных 2 РКИ гибридная терапия показала незначительное, хотя и незначительное, улучшение по сравнению с последовательной терапией (86.6% против 81%) [38] и сопоставимо с сопутствующей терапией в сравнительном исследовании, в котором, что интересно, в группе, получавшей гибридный режим, возникало меньше побочных эффектов [43]. Необходимы дополнительные данные, чтобы сделать окончательные выводы об эффективности и переносимости гибридной терапии.
ТЕРАПИЯ НА ОСНОВЕ ЛЕВОФЛОКСАЦИНА
Для преодоления растущей резистентности к CAM левофлоксацин, хинолон широкого спектра действия, использовался в качестве замены CAM в трехкратном или последовательном режимах, достигая > 90% показателей излечения, и даже > 95% возможно при условии что местная резистентность к левофлоксацину низкая (< 10%) [48,49].Однако левофлоксацин также сталкивается с клинически значимыми проблемами антибиотикорезистентности, поскольку резистентность к хинолонам в настоящее время превышает 40% в Америке, 20% в Европе и 10% в Азии [8]. Из-за быстрого развития вторичной резистентности к хинолонам использование левофлоксацина в качестве первой линии, как правило, не рекомендуется, и этот препарат зарезервирован для использования в схемах второй линии/спасательной терапии после неэффективности схем на основе CAM и/или MNZ [50]. ]. Хорошая (показатель излечения 81%-87%) эффективность второй линии тройной терапии левофлоксацином (LTT) была подтверждена в двух мета-анализах, опубликованных в 2006 г., оба показали лучшие результаты с LTT по сравнению с BQT второй линии [51]. ,52].Соответственно, эффективность LTT второй линии составила 88,7% в более позднем метаанализе, включая РКИ до октября 2010 г. [53]. Важно отметить, что использование LTT после неудачи последовательного или сопутствующего режима, как сообщается, обеспечивает до 97,8% кумулятивной терапевтической эффективности [54]. Использование других хинолоновых препаратов, таких как моксифлоксацин и ситафлоксацин, показало многообещающие результаты [55, 56], хотя нет никаких доказательств, подтверждающих какое-либо терапевтическое преимущество перед левофлоксацином.
ПЕРСПЕКТИВЫ НА БУДУЩЕЕ
Дополнительные пробиотики
Несмотря на то, что были предприняты различные попытки восстановить эффективность стандартных методов лечения, таких как увеличение дозы ИПП или продление продолжительности лечения, ни один из них не достиг уровня, позволяющего преодолеть сегодняшнюю устойчивость к противомикробным препаратам.Подход, который вызывает растущий интерес, заключается в использовании пробиотиков в сочетании со схемами эрадикации H. pylori [57]. Ожидаемая польза двойная: ускорение эрадикации и улучшение переносимости за счет предотвращения возникновения побочных эффектов, связанных с лечением. Патогенную основу возможного положительного эффекта пробиотиков на эрадикацию H. pylori еще предстоит выяснить, хотя были выдвинуты некоторые гипотезы, включая прочность слизистого барьера, конкуренцию за адгезию и иммуномодулирующие механизмы [58].В различных исследованиях в последние годы пробиотики использовались дополнительно к стандартным или новым схемам лечения, что дало противоречивые результаты [59-62]. Несмотря на то, что оценивались различные соединения с одним или несколькими штаммами, в настоящее время имеются доказательства в поддержку использования Saccharomyces boulardi (OR = 1,13; 95% ДИ: 1,05–1,21) или Lactobacillus spp . (ОШ = 1,78; 95% ДИ: 1,2–2,6) добавки в дополнение к стандартной тройной терапии [63, 64]. В самом последнем анализе, оценивающем эффект добавок, содержащих Lactobacillus и Bifidobacterium, объединенное отношение шансов (ITT) с пробиотическими добавками составило 2.066 (95% ДИ: 1,398-3,055) для эрадикации и 0,305 (95% ДИ: 0,117-0,793) для частоты всех побочных эффектов [65]. Интересно, что в отношении предотвращения побочных эффектов использование пробиотиков может иметь значение только у части пациентов, особенно у пациентов с рецидивирующей инфекцией или желудочно-кишечными побочными эффектами, связанными с антибиотиками в анамнезе [57]. Ожидаются дополнительные данные для уточнения роли, стандартизации режимов и оценки экономической эффективности пробиотиков при лечении H.pylori инфекции.
Бескультуральное неинвазивное определение чувствительности H. pylori к антибиотикам
Критически важно, что даже обсуждавшиеся выше новые методы лечения в некоторой степени (хотя и в меньшей степени по сравнению с традиционными методами лечения) подвержены влиянию устойчивости к антибиотикам; уровень эрадикации > 95% встречается нечасто, и даже > 90% оспаривается в некоторых исследованиях [35, 66, 67]. Кроме того, возможно, что успех эмпирического лечения в будущем будет снижаться, поскольку устойчивость к основным антибиотикам постоянно растет во всем мире.Для поддержания высокой терапевтической эффективности идеальным подходом является специальное лечение H. pylori в действии f на основе тестирования чувствительности до лечения. Это предотвратит повторное эмпирическое лечение пациента, которое увеличивает риск побочных эффектов и способствует развитию вторичной резистентности. Однако, как уже упоминалось, современные средства проведения эндоскопии и посева H. pylori являются инвазивными, не отражают на 100% чувствительность in vivo и требуют много времени, поскольку посев требует 3-10 дней и тестирование чувствительности ( e.g ., производства Etest, AB bioMerieux, Solna, Швеция) потребуется дополнительно 3-4 дня. Эти ограничения препятствуют систематическому использованию культуры H. pylori , которая в настоящее время рекомендуется только в случаях с не менее чем двумя неудачами эмпирического лечения. Общеклассовая резистентность к макролидам является результатом точечных мутаций в трех соседних положениях нуклеотидов ( A2143G, A2142G и A2142C ) в пептидилтрансферазной петле гена 23SrRNA [68,69]. На эти три точечные мутации приходится 90% случаев первичной резистентности к САМ в западных странах.В последние годы для этих мутаций были разработаны методы молекулярного тестирования, включая стандартную полимеразную цепную реакцию (ПЦР) и другие методы, основанные на ПЦР, включая полиморфизм длины рестрикционных фрагментов ПЦР, иммуноферментный анализ ПЦР-ДНК, анализ лигирования олигонуклеотидов ПЦР и ПЦР-линию. зондовый анализ, а также анализ ПЦР в реальном времени, который представляет собой мощное усовершенствование базовой ПЦР[70-72]. Эти методы могут дать быстрые и высокоточные результаты при генотипическом выявлении устойчивости к САМ, включая определение статуса гетерорезистентности ( i.e ., сосуществование штаммов, чувствительных и устойчивых к одному и тому же антибиотику), что, как известно, является причиной значительного числа неудач лечения [73,74]. Эти методы могут применяться непосредственно к образцам биопсии желудка или использоваться в сочетании с минимально инвазивными методами (, например, ., орально-желудочная чистка или промывание желудка) или неинвазивно с использованием образцов стула [75-77]. Важно отметить, что генотипическое определение устойчивости к САМ также возможно с помощью флуоресцентной гибридизации in-situ, которую также можно применять к образцам, залитым парафином [78,79].Также доступно определение резистентности к левофлоксацину на основе выявления мутаций gyrA [80]. Два азиатских исследования предоставили данные о потенциальной полезности индивидуального терапевтического подхода, основанного на молекулярном обнаружении устойчивости H. pylori к САМ. Индивидуальное лечение с использованием простого режима ИПП/МНЗ привело к успешной эрадикации возбудителя в 94,3% случаев по сравнению с 71,4% при использовании эмпирического стандартного лечения[77]. В более крупном исследовании (218 пациентов) САМ заменяли МНЗ в тройной схеме, если обнаруживался штамм, устойчивый к САМ.Показатели эрадикации составили 91,2% в адаптированной группе против 79,1% и 75,9% при использовании эмпирической тройной терапии на основе MNZ и CAM ( n = 308 в каждой контрольной группе) соответственно ( P < 0,001) [81]. .
Фармакогеномика
Известно, что генетическая изменчивость активности цитохрома P450 (CYP) 2C19 (CYP2C19) влияет на уровни ИПП в плазме и, таким образом, на лечение инфекции H. pylori [82,83]. Выделяют три различных генотипа: быстрый, промежуточный и плохой метаболизаторы.Предварительные данные о потенциальном использовании фармакогеномики были получены в РКИ с 300 H. pylori -положительными пациентами, рандомизированными либо для получения стандартной схемы в течение 1 недели, либо для персонализированной терапии, основанной на статусе чувствительности как CYP2C19, так и CAM, оцененном с помощью генетического тестирования [84]. ]. Показатели эрадикации ИТТ были значительно выше в адаптированной группе (96% против 70%) без увеличения окончательной стоимости успешной эрадикации на одного пациента. В будущем необходимо решить как практические, так и логистические вопросы, прежде чем молекулярный подход сможет широко применяться в качестве подлинной основы для индивидуализации H.pylori эрадикационная терапия.
ЗАКЛЮЧЕНИЕ
На протяжении более десяти лет тройные схемы лечения были стандартом лечения инфекции H. pylori . Однако в последние годы рост распространенности резистентности к макролидам привел к значительному снижению эффективности этих схем, что привело к необходимости проведения большего количества курсов лечения для эрадикации возбудителя. Для поддержания высокой терапевтической эффективности схемы с улучшенной эффективностью в отношении устойчивых к антибиотикам штаммов H.pylori в настоящее время рекомендуются в качестве предпочтительных препаратов первой линии. Сочетанные и последовательные режимы в настоящее время являются наиболее проверенными терапевтическими вариантами первой линии. Гибридная терапия является еще одной эффективной альтернативой на основе CAM и важным конкурентом обоих этих методов лечения. BQT также является допустимым лечением в условиях высокой резистентности к CAM, а также эффективной схемой второй линии, когда схема, основанная на CAM, неэффективна. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина в настоящее время следует зарезервировать в качестве вариантов лечения второй или более линии.В то время как усилия по улучшению эмпирических методов лечения продолжаются, области генотипического обнаружения чувствительности H. pylori к противомикробным препаратам и фармакогеномика открывают новые захватывающие перспективы. Это гарантирует 100% терапевтическую эффективность: быструю, бескультуральную и неинвазивную.
Сноски
P- Рецензент: Ding SZ, Im SH, Velin D, Zhu YL S- Редактор: Wen LL L- Редактор: A E- Редактор: Wang CH
Ссылки
1. Moayyedi P, Hunt RH. Влияние Helicobacter pylori на общественное здравоохранение.Хеликобактер. 2004; 9 Приложение 1: 67–72. [PubMed] [Google Scholar]2. Малфертейнер П., Чан Ф.К., Макколл К.Е. Язвенная болезнь желудка. Ланцет. 2009; 374:1449–1461. [PubMed] [Google Scholar]3. Куйперс Э.Дж. Helicobacter pylori и риск и лечение сопутствующих заболеваний: гастрита, язвенной болезни, атрофического гастрита и рака желудка. Алимент Фармакол Тер. 1997; 11 Дополнение 1:71–88. [PubMed] [Google Scholar]4. Malfertheiner P, Megraud F, O’Morain CA, Atherton J, Axon AT, Bazzoli F, Gensini GF, Gisbert JP, Graham DY, Rokkas T, et al.Ведение инфекции Helicobacter pylori — Консенсусный отчет Maastricht IV/Florence. Кишка. 2012; 61: 646–664. [PubMed] [Google Scholar]5. Гисберт Дж. П. Необходим ли посев перед терапией первой линии инфекции Helicobacter pylori? Интерн Мед. 2011;50:2717; ответ автора 2719–2720. [PubMed] [Google Scholar]7. Фишбах Л., Эванс Э.Л. Метаанализ: влияние статуса устойчивости к антибиотикам на эффективность тройной и четырехкратной терапии первой линии Helicobacter pylori. Алимент Фармакол Тер.2007; 26: 343–357. [PubMed] [Google Scholar]8. De Francesco V, Giorgio F, Hassan C, Manes G, Vannella L, Panella C, Ierardi E, Zullo A. Устойчивость H. pylori к антибиотикам во всем мире: систематический обзор. J Желудочно-кишечный тракт печени Dis. 2010;19:409–414. [PubMed] [Google Scholar]9. Megraud F, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, Andersen LP, Goossens H, Glupczynski Y. Устойчивость Helicobacter pylori к антибиотикам в Европе и ее связь с потреблением антибиотиков. Кишка. 2013; 62:34–42.[PubMed] [Google Scholar] 10. Боянова Л., Илиева Дж., Гергова Г., Давыдков Л., Спасова З., Камбуров В., Кацаров Н., Митов И. Многочисленные факторы риска антибиотикорезистентности Helicobacter pylori, выявленные в расширенном анамнезе: исследование в Болгарии. J Med Microbiol. 2012;61:85–93. [PubMed] [Google Scholar] 11. Георгопулос С.Д., Ладас С.Д., Каратапанис С., Ментис А., Спилиади С., Артикис В., Раптис С.А. Факторы, которые могут повлиять на исход тройной эрадикационной терапии Helicobacter pylori омепразолом, амоксициллином и кларитромицином.Dig Dis Sci. 2000;45:63–67. [PubMed] [Google Scholar] 12. Ян JC, Лин CJ. Генотипы CYP2C19 в фармакокинетике/фармакодинамике терапии инфекции Helicobacter pylori на основе ингибиторов протонной помпы. Мнение эксперта Препарат Метаб Токсикол. 2010; 6: 29–41. [PubMed] [Google Scholar] 13. Джордж Л.Л., Бороди Т.Дж., Эндрюс П., Девайн М., Мур-Джонс Д., Уолтон М., Брандл С. Лечение язвы двенадцатиперстной кишки после ликвидации Helicobacter pylori. Мед J Aust. 1990; 153: 145–149. [PubMed] [Google Scholar] 14. Баззоли Ф., Поццато П.Терапия инфекции H. pylori. J Physiol Pharmacol. 1997; 48 Дополнение 4:39–46. [PubMed] [Google Scholar] 15. Современные европейские концепции лечения инфекции Helicobacter pylori. Доклад о Маастрихтском консенсусе. Европейская группа по изучению Helicobacter Pylori. Кишка. 1997; 41:8–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]16. Линд Т., Вельдхуйзен ван Зантен С., Унге П., Спиллер Р., Байердорфер Э., О’Морейн С., Бардхан К.Д., Брадетт М., Чиба Н., Врангстад М. и др. Эрадикация Helicobacter pylori с помощью однонедельной тройной терапии, сочетающей омепразол с двумя противомикробными препаратами: исследование MACH I.Хеликобактер. 1996; 1: 138–144. [PubMed] [Google Scholar] 17. Malfertheiner P, Mégraud F, O’Morain C, Hungin AP, Jones R, Axon A, Graham DY, Tytgat G. Современные концепции лечения инфекции Helicobacter pylori — Консенсусный отчет Maastricht 2-2000. Алимент Фармакол Тер. 2002; 16: 167–180. [PubMed] [Google Scholar] 18. Малфертейнер П., Меграуд Ф., О’Морейн С., Баззоли Ф., Эль-Омар Э., Грэм Д., Хант Р., Роккас Т., Вакил Н., Куйперс Э.Дж. Современные концепции лечения инфекции Helicobacter pylori: Консенсусный отчет Maastricht III.Кишка. 2007; 56: 772–781. [Бесплатная статья PMC] [PubMed] [Google Scholar]19. Чей В.Д., Вонг Б.К. Рекомендации Американской коллегии гастроэнтерологов по лечению инфекции Helicobacter pylori. Am J Гастроэнтерол. 2007; 102: 1808–1825. [PubMed] [Google Scholar] 20. Фок К.М., Кателарис П., Сугано К., Анг Т.Л., Хант Р., Тэлли Н.Дж., Лам С.К., Сяо С.Д., Тан Х.Дж., Ву С.И. и др. Второе Азиатско-Тихоокеанское согласованное руководство по инфекции Helicobacter pylori. J Гастроэнтерол Гепатол. 2009; 24:1587–1600. [PubMed] [Google Scholar] 21.Венерито М., Кригер Т., Экер Т., Леандро Г., Малфертейнер П. Мета-анализ четырехкратной терапии висмутом по сравнению с тройной терапией кларитромицином для эмпирического первичного лечения инфекции Helicobacter pylori. пищеварение. 2013;88:33–45. [PubMed] [Google Scholar] 22. Хоубен М.Х., ван де Бик Д., Хенсен Э.Ф., де Краен А.Дж., Раус Э.А., Титгат Г.Н. Систематический обзор эрадикационной терапии Helicobacter pylori — влияние устойчивости к противомикробным препаратам на показатели эрадикации. Алимент Фармакол Тер. 1999; 13:1047–1055. [PubMed] [Google Scholar] 23.Грэм Д.Ю., Куреши В.А. Антибиотикорезистентная инфекция H. pylori и ее лечение. Курр Фарм Дез. 2000; 6: 1537–1544. [PubMed] [Google Scholar] 24. Фишбах Л.А., Ван Зантен С., Дикасон Дж. Мета-анализ: эффективность, нежелательные явления и приверженность, связанные с четырехкомпонентной терапией против Helicobacter pylori первой линии. Алимент Фармакол Тер. 2004; 20:1071–1082. [PubMed] [Google Scholar] 25. де Бур В.А., ван Эттен Р.Дж., Шнеебергер П.М., Титгат Г.Н. Единственный препарат для инфекции Helicobacter pylori: первые результаты с новой тройной монокапсулой висмута.Am J Гастроэнтерол. 2000;95:641–645. [PubMed] [Google Scholar] 26. Лейн Л., Хант Р., Эль-Зимаити Х., Нгуен Б., Осато М., Спенар Дж. Четырехкомпонентная терапия на основе висмута с использованием одной капсулы бискальцитрата висмута, метронидазола и тетрациклина в сочетании с омепразолом по сравнению с омепразолом, амоксициллином и кларитромицином для эрадикации Helicobacter pylori у пациентов с язвой двенадцатиперстной кишки: проспективное рандомизированное многоцентровое исследование в Северной Америке. Am J Гастроэнтерол. 2003; 98: 562–567. [PubMed] [Google Scholar] 27.Malfertheiner P, Bazzoli F, Delchier JC, Celiñski K, Giguère M, Rivière M, Mégraud F. Эрадикация Helicobacter pylori с помощью капсулы, содержащей субцитрат висмута калия, метронидазол и тетрациклин, в сочетании с омепразолом по сравнению с тройной терапией на основе кларитромицина: рандомизированное, открытое исследование -метка, не меньшей эффективности, испытание фазы 3. Ланцет. 2011; 377:905–913. [PubMed] [Google Scholar] 28. Лютер Дж., Хиггинс П.Д., Шенфельд П.С., Моайеди П., Вакил Н., Чей В.Д. Эмпирическая четырехкомпонентная и тройная терапия для первичного лечения инфекции Helicobacter pylori: систематический обзор и метаанализ эффективности и переносимости.Am J Гастроэнтерол. 2010;105:65–73. [PubMed] [Google Scholar] 30. Гисберт Дж. П., Перес-Айса А., Родриго Л., Молина-Инфанте Дж., Модолелл И., Бермехо Ф., Кастро-Фернандес М., Антон Р., Сакристан Б., Косме А. и др. Неотложная терапия третьей линии с висмутсодержащим четырехкомпонентным режимом после неэффективности двух курсов лечения (кларитромицином и левофлоксацином) инфекции H. pylori. Dig Dis Sci. 2014;59:383–389. [PubMed] [Google Scholar] 31. Ford AC, Malfertheiner P, Giguere M, Santana J, Khan M, Moayyedi P. Побочные эффекты солей висмута для эрадикации Helicobacter pylori: систематический обзор и метаанализ.Мир J Гастроэнтерол. 2008; 14:7361–7370. [Бесплатная статья PMC] [PubMed] [Google Scholar]32. Уэббер М.А., Пиддок Л.Дж. Важность эффлюксных насосов в устойчивости бактерий к антибиотикам. J Антимикробная химиотерапия. 2003; 51:9–11. [PubMed] [Google Scholar] 33. Зулло А., Вайра Д., Вакил Н., Хассан С., Гатта Л., Риччи С., Де Франческо В., Менегатти М., Тампиери А., Перна Ф. и др. Высокие показатели эрадикации Helicobacter pylori при новом последовательном лечении. Алимент Фармакол Тер. 2003; 17: 719–726. [PubMed] [Google Scholar] 34.Гисберт Дж. П., Кальвет Х, О’Коннор А., Мегро Ф., О’Морен К.А. Последовательная терапия для эрадикации Helicobacter pylori: критический обзор. Дж. Клин Гастроэнтерол. 2010;44:313–325. [PubMed] [Google Scholar] 35. Гринберг Э.Р., Андерсон Г.Л., Морган Д.Р., Торрес Дж., Чей В.Д., Браво Л.Е., Домингес Р.Л., Ферреччио С., Эрреро Р., Ласкано-Понсе Е.К. и др. 14-дневная тройная, 5-дневная одновременная и 10-дневная последовательная терапия инфекции Helicobacter pylori в семи латиноамериканских учреждениях: рандомизированное исследование. Ланцет. 2011; 378: 507–514.[Бесплатная статья PMC] [PubMed] [Google Scholar]36. Lim JH, Lee DH, Choi C, Lee ST, Kim N, Jeong SH, Kim JW, Hwang JH, Park YS, Lee SH и др. Клинические результаты двухнедельной последовательной и сопутствующей терапии для эрадикации Helicobacter pylori: рандомизированное пилотное исследование. Хеликобактер. 2013;18:180–186. [PubMed] [Google Scholar] 37. Сардарян Х., Факери Х., Хоссейни В., Тагваи Т., Малеки И., Мохтаре М. Сравнение гибридных и последовательных методов лечения Helicobacter pylori в Иране: проспективное рандомизированное исследование.Хеликобактер. 2013;18:129–134. [PubMed] [Google Scholar] 38. Гатта Л., Вакил Н., Вайра Д., Скарпиньято С. Глобальные показатели ликвидации инфекции Helicobacter pylori: систематический обзор и метаанализ последовательной терапии. БМЖ. 2013;347:f4587. [Бесплатная статья PMC] [PubMed] [Google Scholar]39. Георгопулос С., Папастергиу В., Ксирушакис Э., Лауди Ф., Лисгос П., Спилиади С., Папантониу Н., Каратапанис С. Четырехкратная «сопутствующая» терапия без висмута по сравнению со стандартной тройной терапией, продолжительностью 10 дней для лечения H.pylori: рандомизированное исследование. Дж. Клин Гастроэнтерол. 2013;47:228–232. [PubMed] [Google Scholar]40. Георгопулос С., Папастергиу В., Ксирушакис Э., Лауди Ф., Папантониу Н., Лисгос П., Спилиади С., Фрагу П., Скорда Л., Каратапанис С. Оценка «сопутствующей» терапии, состоящей из четырех препаратов, трех антибиотиков, не содержащей висмута, в качестве первой схема эрадикации Helicobacter pylori в Греции. Хеликобактер. 2012;17:49–53. [PubMed] [Google Scholar]41. Gisbert JP, Calvet X. Обновленная информация о четырехкратной (сопутствующей) терапии без висмута для эрадикации Helicobacter pylori.Клин Эксп Гастроэнтерол. 2012;5:23–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]42. Эсса А.С., Крамер Дж.Р., Грэм Д.Ю., Трейбер Г. Мета-анализ: «сопутствующая терапия» с четырьмя препаратами, тремя антибиотиками, не содержащей висмута по сравнению с тройной терапией для эрадикации Helicobacter pylori. Хеликобактер. 2009; 14:109–118. [Бесплатная статья PMC] [PubMed] [Google Scholar]43. Молина-Инфанте Дж., Романо М., Фернандес-Бермехо М., Федерико А., Гравина А.Г., Поццати Л., Гарсия-Абадиа Э., Винагре-Родригес Г., Мартинес-Алькала С., Эрнандес-Алонсо М. и др.Оптимизированная четырехкомпонентная терапия без висмута излечивает большинство пациентов с инфекцией Helicobacter pylori в популяциях с высоким уровнем устойчивости к антибиотикам. Гастроэнтерология. 2013;145:121–128.e1. [PubMed] [Google Scholar]44. Ву Д.К., Хсу П.И., Ву Д.Ю., Опекун А.Р., Куо Ч., Ву И.К., Ван С.С., Чен А., Хунг В.К., Грэм Д.Ю. Последовательная и сопутствующая терапия четырьмя препаратами одинаково эффективна для эрадикации инфекции H. pylori. Клин Гастроэнтерол Гепатол. 2010;8:36–41.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar]45.Макниколл А.Г., Марин А.С., Молина-Инфанте Дж., Кастро М., Баррио Дж., Дюконс Дж., Кальвет Х, де ла Коба С, Монторо М., Бори Ф. и др. Рандомизированное клиническое исследование, сравнивающее последовательную и сопутствующую терапию для эрадикации Helicobacter pylori в рутинной клинической практике. Кишка. 2014; 63: 244–249. [PubMed] [Google Scholar]46. Георгопулос С.Д., Ксирушакис Э., Мартинес-Гонсалес Б., Сгурас Д.Н., Спилиади С., Ментис А.Ф., Лауди Ф. Клиническая оценка десятидневного режима эзомепразола, метронидазола, амоксициллина и кларитромицина для эрадикации Helicobacter pylori при высоком кларитромицине область сопротивления.Хеликобактер. 2013; 18: 459–467. [PubMed] [Google Scholar]47. Хсу П.И., Ву Д.К., Ву Д.Ю., Грэм Д.Ю. Модифицированная последовательная терапия Helicobacter pylori: ингибитор протонной помпы и амоксициллин в течение 14 дней с добавлением кларитромицина и метронидазола в виде четырехкомпонентной (гибридной) терапии в течение последних 7 дней. Хеликобактер. 2011;16:139–145. [Бесплатная статья PMC] [PubMed] [Google Scholar]48. Романо М., Куомо А., Гравина А.Г., Миранда А., Иовене М.Р., Тисо А., Сика М., Рокко А., Салерно Р., Мармо Р. и др. Эмпирическая левофлоксацин-содержащая и кларитромицин-содержащая последовательная терапия для эрадикации Helicobacter pylori: рандомизированное исследование.Кишка. 2010;59:1465–1470. [PubMed] [Google Scholar]49. Бернинг М., Крас С., Мильке С. Должны ли хинолоны стоять на первом месте в терапии Helicobacter pylori? Терапия Adv Гастроэнтерол. 2011;4:103–114. [Бесплатная статья PMC] [PubMed] [Google Scholar]50. Карозерс Дж.Дж., Брюс М.Г., Хеннесси Т.В., Бенслер М., Моррис Дж.М., Ризоновер А.Л., Херлберт Д.А., Паркинсон А.Дж., Коулман Дж.М., МакМахон Б.Дж. Взаимосвязь между предыдущим применением фторхинолонов и устойчивостью к левофлоксацину при инфекции Helicobacter pylori. Клин Инфекция Дис. 2007;44:e5–e8.[PubMed] [Google Scholar]51. Gisbert JP, Morena F. Систематический обзор и метаанализ: схемы спасения на основе левофлоксацина после неудачного лечения Helicobacter pylori. Алимент Фармакол Тер. 2006; 23:35–44. [PubMed] [Google Scholar]52. Саад Р.Дж., Шонфельд П., Ким Х.М., Чей В.Д. Тройная терапия на основе левофлоксацина по сравнению с четырехкомпонентной терапией на основе висмута при персистирующей инфекции Helicobacter pylori: метаанализ. Am J Гастроэнтерол. 2006; 101: 488–496. [PubMed] [Google Scholar]53. Ди Каро С., Фини Л., Дауд Ю., Грицци Ф., Гасбаррини А., Де Лоренцо А., Ди Ренцо Л., Маккартни С., Блум С.Схемы на основе левофлоксацина/амоксициллина по сравнению с четырехкомпонентной терапией для эрадикации Helicobacter pylori во второй линии. Мир J Гастроэнтерол. 2012;18:5669–5678. [Бесплатная статья PMC] [PubMed] [Google Scholar]54. Гисберт Дж. П., Молина-Инфанте Дж., Марин А. С., Винагре Дж., Баррио Дж., МакНичолл АГ. Тройная терапия второй линии с левофлоксацином после неэффективности четырехкратного «последовательного» или «сопутствующего» лечения без висмута для эрадикации инфекции H. pylori. Scand J Гастроэнтерол. 2013; 48: 652–656. [PubMed] [Google Scholar]55.Мураками К., Окимото Т., Кодама М., Танахаши Дж., Фудзиока Т., Икеда Ф., Мураока Х., Такигава М., Сайка Т., Хасегава М. и др. Активность ситафлоксацина в отношении изолятов Helicobacter pylori, в том числе с мутациями gyrA. Противомикробные агенты Chemother. 2009;53:3097–3099. [Бесплатная статья PMC] [PubMed] [Google Scholar]56. Wenzhen Y, Kehu Y, Bin M, Yumin L, Quanlin G, Donghai W, Lijuan Y. Тройная терапия на основе моксифлоксацина по сравнению с тройной терапией на основе кларитромицина для лечения первой линии инфекции Helicobacter pylori: метаанализ рандомизированных контролируемых исследований .Интерн Мед. 2009;48:2069–2076. [PubMed] [Google Scholar]57. Вильгельм С.М., Джонсон Дж.Л., Кале-Прадхан П.Б. Лечение клопов клопами: роль пробиотиков в качестве дополнительной терапии Helicobacter pylori. Энн Фармакотер. 2011;45:960–966. [PubMed] [Google Scholar]58. Лесброс-Пантофличкова Д., Кортези-Теулаз И., Блюм А.Л. Helicobacter pylori и пробиотики. Дж Нутр. 2007; 137:812С–818С. [PubMed] [Google Scholar]59. Du YQ, Su T, Fan JG, Lu YX, Zheng P, Li XH, Guo CY, Xu P, Gong YF, Li ZS. Адъювантные пробиотики улучшают эрадикационный эффект тройной терапии инфекции Helicobacter pylori.Мир J Гастроэнтерол. 2012;18:6302–6307. [Бесплатная статья PMC] [PubMed] [Google Scholar]60. Efrati C, Nicolini G, Cannaviello C, O’Sed NP, Valabrega S. Эрадикация Helicobacter pylori: последовательная терапия и добавка Lactobacillus reuteri. Мир J Гастроэнтерол. 2012;18:6250–6254. [Бесплатная статья PMC] [PubMed] [Google Scholar]61. Манфреди М., Биззарри Б., Саккеро Р.И., Маккари С., Калабрезе Л., Фаббиан Ф., Де’Анджелис Г.Л. Инфекция Helicobacter pylori в клинической практике: пробиотики и комбинация пробиотиков + лактоферрин улучшают соблюдение, но не эрадикацию, при последовательной терапии.Хеликобактер. 2012; 17: 254–263. [PubMed] [Google Scholar]62. Шавахи А., Табеш Э., Ягуткар А., Хашеми Х., Табеш Ф., Ходадостан М., Минакари М., Шавахи С., Голамрезаи А. Влияние мультиштаммового пробиотического соединения на висмутсодержащую четырехкомпонентную терапию инфекции Helicobacter pylori: рандомизированное плацебо-контролируемое тройное -слепое исследование. Хеликобактер. 2013; 18: 280–284. [PubMed] [Google Scholar]63. Szajewska H, Horvath A, Piwowarczyk A. Метаанализ: влияние добавок Saccharomyces boulardii на скорость эрадикации Helicobacter pylori и побочные эффекты во время лечения.Алимент Фармакол Тер. 2010;32:1069–1079. [PubMed] [Google Scholar]64. Zou J, Dong J, Yu X. Метаанализ: четырехкомпонентная терапия, содержащая Lactobacillus, по сравнению со стандартной тройной терапией первой линии для эрадикации Helicobacter pylori. Хеликобактер. 2009; 14:97–107. [PubMed] [Google Scholar]65. Ван Чж, Гао Цюй, Фанг Цзюй. Мета-анализ эффективности и безопасности пробиотических соединений, содержащих Lactobacillus и Bifidobacterium, в эрадикационной терапии Helicobacter pylori. Дж. Клин Гастроэнтерол.2013;47:25–32. [PubMed] [Google Scholar]66. Liou JM, Chen CC, Chen MJ, Chen CC, Chang CY, Fang YJ, Lee JY, Hsu SJ, Luo JC, Chang WH и другие. Последовательная и тройная терапия для лечения Helicobacter pylori первой линии: многоцентровое открытое рандомизированное исследование. Ланцет. 2013; 381: 205–213. [PubMed] [Google Scholar]67. Вакил Н., Вайра Д. Лечение инфекции H. pylori: новые проблемы с устойчивостью к противомикробным препаратам. Дж. Клин Гастроэнтерол. 2013; 47: 383–388. [PubMed] [Google Scholar]68. Тейлор Д.Е., Гэ З., Пурыч Д., Ло Т., Хирацука К.Клонирование и анализ последовательности двух копий гена 23S рРНК Helicobacter pylori и ассоциация устойчивости к кларитромицину с мутациями 23S рРНК. Противомикробные агенты Chemother. 1997; 41: 2621–2628. [Бесплатная статья PMC] [PubMed] [Google Scholar]69. Версалович Дж., Шортридж Д., Киблер К., Гриффи М.В., Бейер Дж., Фламм Р.К., Танака С.К., Грэм Д.Ю., Го М.Ф. Мутации в 23S рРНК связаны с устойчивостью Helicobacter pylori к кларитромицину. Противомикробные агенты Chemother. 1996; 40: 477–480. [Бесплатная статья PMC] [PubMed] [Google Scholar]70.Lehours P, Siffré E, Mégraud F. Мультиплексная ПЦР на ДПО как альтернатива культивированию и тестированию на чувствительность для выявления Helicobacter pylori и ее устойчивости к кларитромицину. БМК Гастроэнтерол. 2011;11:112. [Бесплатная статья PMC] [PubMed] [Google Scholar]71. Mégraud F, Lehours P. Обнаружение Helicobacter pylori и тестирование чувствительности к противомикробным препаратам. Clin Microbiol Rev. 2007; 20:280–322. [Бесплатная статья PMC] [PubMed] [Google Scholar]72. Шаберайтер-Гуртнер С., Хиршль А.М., Драгошич Б., Хуфнагл П., Пуз С., Ковач З., Роттер М., Макристатис А.Новый ПЦР-анализ в реальном времени для выявления инфекции Helicobacter pylori и одновременного определения чувствительности образцов кала и биопсии к кларитромицину. Дж. Клин Микробиол. 2004; 42:4512–4518. [Бесплатная статья PMC] [PubMed] [Google Scholar]73. Де Франческо В., Зулло А., Иерарди Э., Джорджио Ф., Перна Ф., Хассан С., Морини С., Панелла С., Вайра Д. Фенотипическая и генотипическая устойчивость Helicobacter pylori к кларитромицину и терапевтический результат: преимущества и ограничения. J Антимикробная химиотерапия. 2010;65:327–332. [PubMed] [Google Scholar]74.Римбара Э., Фишбах Л.А., Грэм Д.Ю. Оптимальная терапия инфекции Helicobacter pylori. Нат Рев Гастроэнтерол Гепатол. 2011; 8: 79–88. [PubMed] [Google Scholar]75. Баба С., Оиси Ю., Ватанабэ Ю., Ойкава Р., Морита Р., Ёсида Ю., Хираиси Т., Маэхата Т., Нагасе Ю., Фукуда Ю. и др. Молекулярный тест на устойчивость Helicobacter pylori к антибиотикам на основе промывания желудка. пищеварение. 2011; 84: 299–305. [PubMed] [Google Scholar]76. Грэм Д.Ю., Кудо М., Редди Р., Опекун А.Р. Практичный быстрый, малоинвазивный, надежный неэндоскопический метод получения Helicobacter pylori для посева.Хеликобактер. 2005; 10:1–3. [PubMed] [Google Scholar]77. Каваи Т., Ямагиши Т., Яги К., Катаока М., Каваками К., Софуни А., Итои Т., Сакаи Ю., Мориясу Ф., Осака Ю. и др. Индивидуальная эрадикационная терапия, основанная на чувствительности фекальных Helicobacter pylori к кларитромицину. J Гастроэнтерол Гепатол. 2008;23 Приложение 2:S171–S174. [PubMed] [Google Scholar]78. Моррис Дж.М., Ризоновер А.Л., Брюс М.Г., Бруден Д.Л., МакМахон Б.Дж., Сакко Ф.Д., Берг Д.Е., Паркинсон А.Дж. Оценка seaFAST, быстрого флуоресцентного теста гибридизации in situ, для обнаружения Helicobacter pylori и устойчивости к кларитромицину в срезах биопсии, залитых парафином.Дж. Клин Микробиол. 2005;43:3494–3496. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Йилмаз О., Демирай Э., Тюмер С., Алтунгёз О., Йорукоглу К., Сойтюрк М., Симшек И. Обнаружение Helicobacter pylori и определение чувствительности к кларитромицину с использованием фиксированных формалином и залитых парафином образцов биопсии желудка путем флуоресцентной гибридизации in situ. Хеликобактер. 2007; 12: 136–141. [PubMed] [Google Scholar]80. Камбау Э., Аллерхейлиген В., Кулон С., Корбель С., Ласколс С., Дефорж Л., Сусси С.Дж., Дельшер Дж.С., Мегро Ф.Оценка нового теста генотипа HelicoDR для молекулярного обнаружения устойчивости к антибиотикам у Helicobacter pylori. Дж. Клин Микробиол. 2009;47:3600–3607. [Бесплатная статья PMC] [PubMed] [Google Scholar]81. Lee HJ, Kim JI, Cheung DY, Kim TH, Jun EJ, Oh JH, Chung WC, Kim BW, Kim SS, Park SH и др. Эрадикация Helicobacter pylori по точечным мутациям 23S рибосомной РНК, ассоциированным с резистентностью к кларитромицину. J заразить Dis. 2013; 208:1123–1130. [PubMed] [Google Scholar]82. Фурута Т., Шираи Н., Такашима М., Сяо Ф., Ханай Х., Сугимура Х., Охаси К., Исидзаки Т., Канеко Э.Влияние генотипических различий в CYP2C19 на показатели излечения от инфекции Helicobacter pylori тройной терапией с ингибитором протонной помпы, амоксициллином и кларитромицином. Клин Фармакол Тер. 2001; 69: 158–168. [PubMed] [Google Scholar]83. Sim SC, Risinger C, Dahl ML, Aklillu E, Christensen M, Bertilsson L, Ingelman-Sundberg M. Распространенный новый вариант гена CYP2C19 вызывает сверхбыстрый метаболизм лекарств, связанный с лекарственной реакцией на ингибиторы протонной помпы и антидепрессанты. Клин Фармакол Тер. 2006; 79: 103–113.[PubMed] [Google Scholar]84. Фурута Т., Шираи Н., Кодаира М., Сугимото М., Ногаки А., Курияма С., Иваидзуми М., Ямаде М., Теракава И., Охаси К. и др. Основанный на фармакогеномике индивидуальный и стандартный терапевтический режим для эрадикации H. pylori. Клин Фармакол Тер. 2007; 81: 521–528. [PubMed] [Google Scholar]Лечение инфекции Helicobacter pylori: прошлое, настоящее и будущее
World J Gastrointest Pathophysiol. 2014 15 ноября; 5(4): 392–399.
Василиос Папастергиу, Стилианос Каратапанис, Отделение внутренних болезней, Больница общего профиля Родоса, 85100 Родос, Греция
Сотириос Д. Георгопулос, Отделение гастроэнтерологии, Афины Медикал, П.Больница Фалирон, 17562 Афины, Греция,
Вклад авторов: Папастергиу В. участвовал в разработке концепции и дизайна, составлении статьи; Георгопулос С.Д. участвовал в составлении проекта статьи, критически пересматривая статью на предмет важного интеллектуального содержания; Каратапанис С. участвовал в окончательном утверждении версии для публикации.Адрес для переписки: Стилианос Каратапанис, доктор медицинских наук, отделение внутренних болезней, больница общего профиля Родоса, ул. Калопетрас, 10, 85100 Родос, Греция. гр.teneto@raklyts
Телефон: +30-224-1080456 Факс: +30-224-1066410
Поступила в редакцию 12 февраля 2014 г.; Пересмотрено 15 апреля 2014 г.; Принято 17 июля 2014 г.
Copyright © 2014 Baishideng Publishing Group Inc. Все права защищены. Эта статья цитируется в других статьях PMC.Abstract
Helicobacter pylori ( H. pylori ) является основным патогеном человека, вызывающим значительную заболеваемость и смертность. Однако после десятилетий усилий лечение H.pylori остается проблемой для врачей, так как не существует универсально эффективной схемы лечения. Из-за растущей распространенности устойчивости к противомикробным препаратам, главным образом к кларитромицину, эффективность стандартной тройной терапии снизилась до неприемлемо низкого уровня в большинстве частей мира. Новые схемы, специально испытанные для улучшения терапевтических результатов против устойчивых к антибиотикам штаммов H. pylori , в настоящее время рекомендуются в качестве вариантов эмпирического лечения первой линии, обеспечивающих высокую эффективность (по сообщениям, > 90% при намерении лечить анализ) даже при высокой устойчивости к кларитромицину. настройки.К ним относятся висмутовая квадротерапия, сопутствующая, последовательная и гибридная терапия. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина следует зарезервировать в качестве вариантов второй линии/спасения. Было предложено дополнительное использование пробиотиков, чтобы повысить скорость эрадикации и уменьшить возникновение побочных эффектов, связанных с лечением. В настоящее время доступны методы молекулярного тестирования для характеристики терапевтической чувствительности H. pylori , включая генотипическое определение устойчивости к макролидам и оценку статуса цитохрома P450 2C19, который, как известно, влияет на метаболизм ингибиторов протонной помпы.В будущем использование этих методов может обеспечить бескультуральную неинвазивную индивидуальную терапию инфекции H. pylori .
Ключевые слова: Helicobacter pylori , Антибиотикорезистентность, Висмут-квадроцикл, Сопутствующая, Последовательная, Пробиотики Helicobacter pylori ( H.pylori ) инфекции. Четырехкомпонентная, сопутствующая, последовательная и гибридная терапия висмутом в настоящее время рекомендуется в качестве эмпирической терапии первой линии, обеспечивающей повышенную эффективность в условиях высокой резистентности к кларитромицину. Поскольку резистентность к хинолонам быстро растет, левофлоксацин следует предпочтительно использовать в терапии второй линии/спасательной терапии. Появляется все больше доказательств того, что дополнительные добавки с пробиотиками улучшают терапевтический результат и переносимость. Генотипическая характеристика восприимчивости H. pylori к терапии может позволить в будущем разработать индивидуальный терапевтический подход.
ВВЕДЕНИЕ
Лечение инфекции Helicobacter pylori ( H. pylori ) имеет первостепенное значение для лечения распространенных желудочно-кишечных заболеваний, включая язвенную болезнь, рак желудка и функциональную диспепсию [1-3]. Кроме того, в качестве показаний к эрадикации H. pylori теперь включаются экстрапищеварительные расстройства: идиопатическая тромбоцитопеническая пурпура, дефицит витамина B12 и необъяснимая железодефицитная анемия [4]. В отличие от других бактериальных инфекций, для лечения которых обычно проводится тестирование на чувствительность, культура H.pylori не является широко доступным и требует проведения эндоскопии, которая хорошо переносится не всеми пациентами и имеет ряд ограничений, включая тот факт, что чувствительность к in vitro не всегда гарантирует эрадикацию in vivo [5]. Таким образом, схемы для H. pylori обычно назначались эмпирически, при условии, что они были предварительно протестированы и в достаточной степени адаптированы в отношении различных параметров (, т.е. ; лечебная доза, продолжительность, интервалы дозирования и т.) для оптимизации показателей излечения и сведения к минимуму побочных эффектов. Однако оптимальное лечение для эрадикации H. pylori еще предстоит установить, поскольку ни один из режимов не является универсальным. Распространение во всем мире резистентности к основным антибиотикам, в основном к кларитромицину (CAM), а также к метронидазолу (MNZ) и левофлоксацину, является основным фактором, определяющим неэффективность лечения инфекции H. pylori [6,7]. В недавнем систематическом обзоре сообщалось, что глобальная заболеваемость устойчивостью к CAM составляет 17.2% в диапазоне от 11,1% в Европе до 29,3% в Америке, тогда как в том же анализе континентальные показатели резистентности к MNZ составляли 17% и 44,1% соответственно [8]. Потребление антибиотиков при инфекциях, отличных от H. pylori , объясняет широкое увеличение показателей устойчивости к антибиотикам H. pylori [9,10]. Действительно, различная национальная политика в отношении использования антибиотиков в значительной степени отражает географическое распределение устойчивости H. pylori к : устойчивость к САМ значительно выше в странах Южной Европы (достигая 49% в некоторых районах Испании) по сравнению с Северной Европой ( эл.g ., только 1% в Нидерландах), где политика использования антибиотиков более строгая[9]. В дополнение к развитию устойчивости к антибиотикам ряд факторов, связанных как с хозяином, так и с патогеном, может негативно повлиять на эффективность схем эрадикации H. pylori (таблица) [11,12].
Таблица 1
Таблица 1
Факторы сообщили о отрицательном влиянии на исход терапии на Helicobacter Pylori инфекция
| | 8 | | |
| Разработка устойчивости к антибиотикам | Несоблюдение лечения | ||
| Высокая бактериальная нагрузка в желудке | Nexcer Dyspepsia | ||
| Защитный эффект слоя слизирования желудка | Курение | ||
| Внутриклеточное расположение многих бактерий | Состояние CYP2C19 Быстрый метаболизатор) | ||
| 9 | |||
| CAGA отрицательный | |||
| Наличие бездействующих кокоидов (не подвержены антибиотикам) | |||
| гетерорезерный статус (сосуществование штаммов, восприимчивых и устойчивых к тому же антибиотику) |
Несмотря на десятилетия усилий, лечение H.pylori остается сложной проблемой как для исследователей, так и для практикующих врачей. В настоящей статье мы стремимся предоставить всесторонний обзор взглядов на прошлое, настоящее и будущее эрадикации H. pylori .
ТРОЙНАЯ ТЕРАПИЯ НА ОСНОВЕ КЛАРИТРОМИЦИНА: УМЕНЬШАЮЩИЙСЯ КЛИНИЧЕСКИЙ СТАНДАРТ
Исторически сложилось так, что первая действительно эффективная терапия инфекции H. pylori , включающая висмут, тетрациклин и MNZ, была предложена в 1990 г. [13].Несколькими годами позже использование CAM в тройной терапии, предложенной Bazzoli et al. [14], положило начало тройным схемам на основе CAM, после чего стало золотым стандартом в лечении H. pylori . В исследованиях, проведенных в 90-х годах, стандартная тройная терапия (СТТ), включающая ингибитор протонной помпы (ИПП) два раза в день , САМ 500 мг два раза в день и амоксициллин 1000 мг два раза в день или MNZ 500 мг (или 400 мг в Англии) , все назначаемые в течение 7-14 дней, давали стабильно хорошие результаты, приводящие к успеху эрадикации > 80%, и даже > 90% было возможно [15,16].Благодаря этой высокой эффективности и относительной простоте, оптимальному профилю безопасности и приверженности крупных фармацевтических компаний эти схемы получили широкое признание в национальных экспертных группах и согласованных рекомендациях во всем мире в качестве стандарта лечения первой линии для эрадикации H. pylori . 17-20]. Однако рост распространенности резистентности к САМ привел к значительному снижению эффективности стандартных схем. Это снижение эффективности уже было очевидно в мета-анализах, опубликованных в начале 2000-х годов, что привело к значительным изменениям в парадигме лечения инфекции.К ним относятся введение концепции кумулятивной эффективности лечения (требующей от пациента соблюдения большего количества курсов лечения; таким образом, больше побочных эффектов и распространение вторичной антибиотикорезистентности), а затем введение местного порога (15%-20%) устойчивости к САМ, при которых САМ не следует использовать эмпирически [17,18]. Снижение эффективности стандартных методов лечения штаммов, устойчивых к САМ, хорошо задокументировано на основе метаанализа: в метаанализе, проведенном Фишбахом и Эвансом, эффективность тройной терапии снизилась на 66%.2% (95% ДИ: 58,2%-74,2%), когда штаммы H. pylori были устойчивыми против чувствительными к CAM[7]. Соответственно, более поздний анализ Venerito et al [21] показал аналогичные результаты: включая данные о чувствительности к противомикробным препаратам из 4 рандомизированных клинических испытаний (РКИ), стандартная тройная терапия успешно элиминировала 88% чувствительных к CAM, но только 14% устойчивых к CAM. штаммов H. pylori (разница рисков = 0,75, 95% ДИ: 0,63-0,87). Если используется MNZ, наличие резистентности к MNZ также может повлиять на терапевтический результат [22], хотя обычно считается менее важным с клинической точки зрения.Это связано с тем, что резистентность к MNZ может быть в значительной степени преодолена за счет увеличения дозы и увеличения продолжительности лечения [23]. Наконец, устойчивость H. pylori к амоксициллину является исключительной и, как правило, не имеет клинического значения. В свете увеличения количества данных, подтверждающих субоптимальную эффективность (< 70%) в большинстве европейских стран, недавний консенсусный отчет Maastricht IV/Florence окончательно заменил стандартные схемы в качестве эмпирического золотого стандарта для эрадикации H. pylori [4].Вместо этого при использовании устаревших тройных схем следует учитывать локальную картину резистентности (таким образом, использовать только в областях, в которых устойчивость к САМ составляет <20%) или полагаться на тестирование чувствительности при условии, что доступна культура до лечения (, т.е. ., используется в качестве индивидуального лечения).
СОВРЕМЕННЫЕ ТЕРАПИИ ИНФЕКЦИИ
H. PYLORIНовые схемы, специально разработанные для улучшения терапевтических результатов против устойчивых к антибиотикам штаммов H. pylori , в настоящее время рекомендуются в качестве эмпирических вариантов лечения первой линии, обеспечивающих повышенную эффективность (по сообщениям > 90% намерены лечить анализ) в условиях высокой резистентности к САМ.Эти режимы приведены в таблице.
Таблица 2
Текущие схемы для лечения Helicobacter Pylori инфекция
| лечение | Regimen 8 | ||
| 45369 | ), висмут (стандартная доза, 4 раза в день ) тетрациклин (500 мг, 4 раза в день ) и метронидазол (500 мг, 4 раза в день ) в течение 10-14 дней | ||
| Последовательная терапия с двойной терапией | 2 | 2 | 2 A ИПП (стандартная доза, 2 раза в день) и амоксициллин (1 г, 2 раза в день) с последующей 5-дневной тройной терапией с ИПП (стандартная доза, 2 раза в день), кларитромицином (500 мг, 2 раза в день) и метронидазол (500 мг, 2 раза в сутки) |
| Сопутствующая терапия | дазол (500 мг, 2 раза в день ) в течение 7-10 дней | ||
| Гибридная терапия | 7-дневная двойная терапия с ИПП (стандартная доза, 2 раза в день) и амоксициллином (1 г, 2 раза в день) с последующим 7-дневной четырехкомпонентной терапией с ИПП (стандартная доза, 2 раза в сутки), амоксициллином (1 г, 2 раза в сутки), кларитромицином (500 мг, 2 раза в сутки) и метронидазолом (500 мг, 2 раза в сутки) | ||
| Triple терапии на основе левофлоксацина | PPI (стандартная доза, ставка ), левофлоксацин (500 мг, ставка ) и амоксициллин (1 г, ставка ) для 10 D |
4540409
Четырехменность висмута
Квадратная терапия висмутом (BQT) в настоящее время представляет собой предпочтительный вариант лечения первой линии для областей с высокой (≥ 20%) частотой резистентности к CAM, а также ценный вариант лечения второй линии, когда схема на основе CAM ранее не удалась.Он работает независимо от CAM, достигая > 90% эрадикации при наличии устойчивости к CAM, тогда как применение высокой дозы MNZ (1500–1600 мг/сутки) и пролонгированной (10–14 дней) продолжительности лечения позволяет минимизировать влияние на устойчивость к MNZ. , обеспечивая уровень эрадикации > 85% даже в регионах с высокой резистентностью к этому препарату [24]. Доступна удобная для пациента монокапсула (содержащая висмут, MNZ и тетрациклин) (Pylera ® , Aptalis, Mont St Hilaire, QC, Канада), обеспечивающая уровень эрадикации 86 % и 80 % в двух крупных РКИ, проведенных в Северной Америке и Европе соответственно[25-27].Напротив, частота эрадикации ITT с помощью BQT составила всего 77,8% в недавнем мета-анализе ( против 77% для STT), что ставит под сомнение как эффективность, так и превосходство BQT над STT [28]. Однако следует признать существенную степень неоднородности исследований, особенно в отношении дозирования MNZ. Эффективность BQT второй линии также была подтверждена на основе метаанализа (30 исследований), показавшего эффективность второй линии (ITT) в среднем 77% после неудачи STT [29]. Эффективность третьей линии BQT после двух предыдущих неудачных попыток эрадикации тройной терапией, содержащей CAM и левофлоксацин, составила 65% (ITT) в многоцентровом исследовании, проведенном в Испании [30].Основными ограничениями являются отсутствие в некоторых странах солей висмута или тетрациклина, а также потенциальная токсичность висмута. Однако, включая 4763 пациента, не было выявлено различий в отношении переносимости между группами, не принимавшими висмут, и группами, содержащими висмут, за исключением темного стула, который чаще наблюдался в более поздних группах [31].
ПОСЛЕДОВАТЕЛЬНАЯ ТЕРАПИЯ
При последовательной терапии используются те же антибиотики, что и в STT, но вводятся последовательно. Было высказано предположение, что начальный курс амоксициллина разрушает клеточную стенку бактерий, предотвращая развитие каналов оттока, выводящих САМ из бактерий [32].Хотя в первоначальных РКИ [33] (большинство из них было проведено в Италии) и более ранних метаанализах последовательная терапия явно превосходила СТТ [эрадикация ИТТ 91,7% (95% ДИ: 90%-93%) против 76,7% ( 95% ДИ: 75%-79%) для STT [34], более свежие данные из Южной Америки, Ирана и Южной Кореи показали более низкие показатели эрадикации (< 80%) [35-37]. Несмотря на то, что эта последовательная терапия кажется достаточно эффективной против штаммов с монорезистентностью к САМ, способной уничтожить 72,8% из них, ее эффективность против штаммов с двойной резистентностью (САМ и MNZ) составила всего 37% (диапазон: 16.от 2% до 60,7%) при оценке 8 исследований с данными о чувствительности к антибиотикам [38]. Важно отметить, что последовательная терапия не превосходила ни 14-дневную тройную терапию (ОР = 1, 95% ДИ: 0,94–1,06), ни терапию на основе висмута (ОР = 0,99, 95% ДИ: 0,94–1,05) при обширном оценка 46 РКИ[38].
БЕЗВИСМУТОВАЯ КВАДРАТНАЯ (СОПУТСТВУЮЩАЯ) ТЕРАПИЯ
«Сопутствующая» квадротерапия без висмута является еще одним допустимым вариантом лечения первой линии для областей с высокой частотой резистентности к CAM[39,40].В 19 исследованиях (2070 пациентов) общая частота эрадикации при сопутствующей терапии составила 88% (95% ДИ: 85%-91%) и 91%, когда были исключены 3 отдаленных исследования с изначально короткой продолжительностью лечения (3-5 дней) [41]. ]. Действительно, было показано, что продолжительность лечения не менее 7 дней необходима для успеха сопутствующей терапии [42], в то время как дополнительное продление лечения до 14 дней в сочетании с высокой дозой ИПП (омепразол 40 мг × 2) может дополнительно ускорить излечение. показатели до > 95%, как показало многоцентровое исследование не меньшей эффективности [43].Повышенная эффективность против штаммов H. pylori с двойной резистентностью была предложена в качестве основного преимущества сопутствующей терапии по сравнению с последовательной терапией [44], хотя две схемы показали одинаковую эффективность при сравнении с использованием 338 пациентов в стране с высокой устойчивостью к антибиотикам (Испания). )[45]. Действительно, при оценке 106 пациентов с тестированием чувствительности до лечения сопутствующая терапия элиминировала только 55% штаммов с двойной устойчивостью против 100% и 91% с устойчивостью к САМ и MNZ соответственно [46].Таким образом, обе схемы, по-видимому, склонны к пагубному влиянию двойной резистентности, работая примерно одинаково (с эффективностью около 81% каждая) по объединению данных 6 сравнительных РКИ [38].
ГИБРИДНАЯ ТЕРАПИЯ
Двухэтапный двухкомпонентный (гибридный) режим, предложенный Hsu et al. [47], является еще одним ценным вариантом лечения, конкурирующим как с последовательным, так и с сопутствующим лечением. При оценке данных 2 РКИ гибридная терапия показала незначительное, хотя и незначительное, улучшение по сравнению с последовательной терапией (86.6% против 81%) [38] и сопоставимо с сопутствующей терапией в сравнительном исследовании, в котором, что интересно, в группе, получавшей гибридный режим, возникало меньше побочных эффектов [43]. Необходимы дополнительные данные, чтобы сделать окончательные выводы об эффективности и переносимости гибридной терапии.
ТЕРАПИЯ НА ОСНОВЕ ЛЕВОФЛОКСАЦИНА
Для преодоления растущей резистентности к CAM левофлоксацин, хинолон широкого спектра действия, использовался в качестве замены CAM в трехкратном или последовательном режимах, достигая > 90% показателей излечения, и даже > 95% возможно при условии что местная резистентность к левофлоксацину низкая (< 10%) [48,49].Однако левофлоксацин также сталкивается с клинически значимыми проблемами антибиотикорезистентности, поскольку резистентность к хинолонам в настоящее время превышает 40% в Америке, 20% в Европе и 10% в Азии [8]. Из-за быстрого развития вторичной резистентности к хинолонам использование левофлоксацина в качестве первой линии, как правило, не рекомендуется, и этот препарат зарезервирован для использования в схемах второй линии/спасательной терапии после неэффективности схем на основе CAM и/или MNZ [50]. ]. Хорошая (показатель излечения 81%-87%) эффективность второй линии тройной терапии левофлоксацином (LTT) была подтверждена в двух мета-анализах, опубликованных в 2006 г., оба показали лучшие результаты с LTT по сравнению с BQT второй линии [51]. ,52].Соответственно, эффективность LTT второй линии составила 88,7% в более позднем метаанализе, включая РКИ до октября 2010 г. [53]. Важно отметить, что использование LTT после неудачи последовательного или сопутствующего режима, как сообщается, обеспечивает до 97,8% кумулятивной терапевтической эффективности [54]. Использование других хинолоновых препаратов, таких как моксифлоксацин и ситафлоксацин, показало многообещающие результаты [55, 56], хотя нет никаких доказательств, подтверждающих какое-либо терапевтическое преимущество перед левофлоксацином.
ПЕРСПЕКТИВЫ НА БУДУЩЕЕ
Дополнительные пробиотики
Несмотря на то, что были предприняты различные попытки восстановить эффективность стандартных методов лечения, таких как увеличение дозы ИПП или продление продолжительности лечения, ни один из них не достиг уровня, позволяющего преодолеть сегодняшнюю устойчивость к противомикробным препаратам.Подход, который вызывает растущий интерес, заключается в использовании пробиотиков в сочетании со схемами эрадикации H. pylori [57]. Ожидаемая польза двойная: ускорение эрадикации и улучшение переносимости за счет предотвращения возникновения побочных эффектов, связанных с лечением. Патогенную основу возможного положительного эффекта пробиотиков на эрадикацию H. pylori еще предстоит выяснить, хотя были выдвинуты некоторые гипотезы, включая прочность слизистого барьера, конкуренцию за адгезию и иммуномодулирующие механизмы [58].В различных исследованиях в последние годы пробиотики использовались дополнительно к стандартным или новым схемам лечения, что дало противоречивые результаты [59-62]. Несмотря на то, что оценивались различные соединения с одним или несколькими штаммами, в настоящее время имеются доказательства в поддержку использования Saccharomyces boulardi (OR = 1,13; 95% ДИ: 1,05–1,21) или Lactobacillus spp . (ОШ = 1,78; 95% ДИ: 1,2–2,6) добавки в дополнение к стандартной тройной терапии [63, 64]. В самом последнем анализе, оценивающем эффект добавок, содержащих Lactobacillus и Bifidobacterium, объединенное отношение шансов (ITT) с пробиотическими добавками составило 2.066 (95% ДИ: 1,398-3,055) для эрадикации и 0,305 (95% ДИ: 0,117-0,793) для частоты всех побочных эффектов [65]. Интересно, что в отношении предотвращения побочных эффектов использование пробиотиков может иметь значение только у части пациентов, особенно у пациентов с рецидивирующей инфекцией или желудочно-кишечными побочными эффектами, связанными с антибиотиками в анамнезе [57]. Ожидаются дополнительные данные для уточнения роли, стандартизации режимов и оценки экономической эффективности пробиотиков при лечении H.pylori инфекции.
Бескультуральное неинвазивное определение чувствительности H. pylori к антибиотикам
Критически важно, что даже обсуждавшиеся выше новые методы лечения в некоторой степени (хотя и в меньшей степени по сравнению с традиционными методами лечения) подвержены влиянию устойчивости к антибиотикам; уровень эрадикации > 95% встречается нечасто, и даже > 90% оспаривается в некоторых исследованиях [35, 66, 67]. Кроме того, возможно, что успех эмпирического лечения в будущем будет снижаться, поскольку устойчивость к основным антибиотикам постоянно растет во всем мире.Для поддержания высокой терапевтической эффективности идеальным подходом является специальное лечение H. pylori в действии f на основе тестирования чувствительности до лечения. Это предотвратит повторное эмпирическое лечение пациента, которое увеличивает риск побочных эффектов и способствует развитию вторичной резистентности. Однако, как уже упоминалось, современные средства проведения эндоскопии и посева H. pylori являются инвазивными, не отражают на 100% чувствительность in vivo и требуют много времени, поскольку посев требует 3-10 дней и тестирование чувствительности ( e.g ., производства Etest, AB bioMerieux, Solna, Швеция) потребуется дополнительно 3-4 дня. Эти ограничения препятствуют систематическому использованию культуры H. pylori , которая в настоящее время рекомендуется только в случаях с не менее чем двумя неудачами эмпирического лечения. Общеклассовая резистентность к макролидам является результатом точечных мутаций в трех соседних положениях нуклеотидов ( A2143G, A2142G и A2142C ) в пептидилтрансферазной петле гена 23SrRNA [68,69]. На эти три точечные мутации приходится 90% случаев первичной резистентности к САМ в западных странах.В последние годы для этих мутаций были разработаны методы молекулярного тестирования, включая стандартную полимеразную цепную реакцию (ПЦР) и другие методы, основанные на ПЦР, включая полиморфизм длины рестрикционных фрагментов ПЦР, иммуноферментный анализ ПЦР-ДНК, анализ лигирования олигонуклеотидов ПЦР и ПЦР-линию. зондовый анализ, а также анализ ПЦР в реальном времени, который представляет собой мощное усовершенствование базовой ПЦР[70-72]. Эти методы могут дать быстрые и высокоточные результаты при генотипическом выявлении устойчивости к САМ, включая определение статуса гетерорезистентности ( i.e ., сосуществование штаммов, чувствительных и устойчивых к одному и тому же антибиотику), что, как известно, является причиной значительного числа неудач лечения [73,74]. Эти методы могут применяться непосредственно к образцам биопсии желудка или использоваться в сочетании с минимально инвазивными методами (, например, ., орально-желудочная чистка или промывание желудка) или неинвазивно с использованием образцов стула [75-77]. Важно отметить, что генотипическое определение устойчивости к САМ также возможно с помощью флуоресцентной гибридизации in-situ, которую также можно применять к образцам, залитым парафином [78,79].Также доступно определение резистентности к левофлоксацину на основе выявления мутаций gyrA [80]. Два азиатских исследования предоставили данные о потенциальной полезности индивидуального терапевтического подхода, основанного на молекулярном обнаружении устойчивости H. pylori к САМ. Индивидуальное лечение с использованием простого режима ИПП/МНЗ привело к успешной эрадикации возбудителя в 94,3% случаев по сравнению с 71,4% при использовании эмпирического стандартного лечения[77]. В более крупном исследовании (218 пациентов) САМ заменяли МНЗ в тройной схеме, если обнаруживался штамм, устойчивый к САМ.Показатели эрадикации составили 91,2% в адаптированной группе против 79,1% и 75,9% при использовании эмпирической тройной терапии на основе MNZ и CAM ( n = 308 в каждой контрольной группе) соответственно ( P < 0,001) [81]. .
Фармакогеномика
Известно, что генетическая изменчивость активности цитохрома P450 (CYP) 2C19 (CYP2C19) влияет на уровни ИПП в плазме и, таким образом, на лечение инфекции H. pylori [82,83]. Выделяют три различных генотипа: быстрый, промежуточный и плохой метаболизаторы.Предварительные данные о потенциальном использовании фармакогеномики были получены в РКИ с 300 H. pylori -положительными пациентами, рандомизированными либо для получения стандартной схемы в течение 1 недели, либо для персонализированной терапии, основанной на статусе чувствительности как CYP2C19, так и CAM, оцененном с помощью генетического тестирования [84]. ]. Показатели эрадикации ИТТ были значительно выше в адаптированной группе (96% против 70%) без увеличения окончательной стоимости успешной эрадикации на одного пациента. В будущем необходимо решить как практические, так и логистические вопросы, прежде чем молекулярный подход сможет широко применяться в качестве подлинной основы для индивидуализации H.pylori эрадикационная терапия.
ЗАКЛЮЧЕНИЕ
На протяжении более десяти лет тройные схемы лечения были стандартом лечения инфекции H. pylori . Однако в последние годы рост распространенности резистентности к макролидам привел к значительному снижению эффективности этих схем, что привело к необходимости проведения большего количества курсов лечения для эрадикации возбудителя. Для поддержания высокой терапевтической эффективности схемы с улучшенной эффективностью в отношении устойчивых к антибиотикам штаммов H.pylori в настоящее время рекомендуются в качестве предпочтительных препаратов первой линии. Сочетанные и последовательные режимы в настоящее время являются наиболее проверенными терапевтическими вариантами первой линии. Гибридная терапия является еще одной эффективной альтернативой на основе CAM и важным конкурентом обоих этих методов лечения. BQT также является допустимым лечением в условиях высокой резистентности к CAM, а также эффективной схемой второй линии, когда схема, основанная на CAM, неэффективна. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина в настоящее время следует зарезервировать в качестве вариантов лечения второй или более линии.В то время как усилия по улучшению эмпирических методов лечения продолжаются, области генотипического обнаружения чувствительности H. pylori к противомикробным препаратам и фармакогеномика открывают новые захватывающие перспективы. Это гарантирует 100% терапевтическую эффективность: быструю, бескультуральную и неинвазивную.
Сноски
P- Рецензент: Ding SZ, Im SH, Velin D, Zhu YL S- Редактор: Wen LL L- Редактор: A E- Редактор: Wang CH
Ссылки
1. Moayyedi P, Hunt RH. Влияние Helicobacter pylori на общественное здравоохранение.Хеликобактер. 2004; 9 Приложение 1: 67–72. [PubMed] [Google Scholar]2. Малфертейнер П., Чан Ф.К., Макколл К.Е. Язвенная болезнь желудка. Ланцет. 2009; 374:1449–1461. [PubMed] [Google Scholar]3. Куйперс Э.Дж. Helicobacter pylori и риск и лечение сопутствующих заболеваний: гастрита, язвенной болезни, атрофического гастрита и рака желудка. Алимент Фармакол Тер. 1997; 11 Дополнение 1:71–88. [PubMed] [Google Scholar]4. Malfertheiner P, Megraud F, O’Morain CA, Atherton J, Axon AT, Bazzoli F, Gensini GF, Gisbert JP, Graham DY, Rokkas T, et al.Ведение инфекции Helicobacter pylori — Консенсусный отчет Maastricht IV/Florence. Кишка. 2012; 61: 646–664. [PubMed] [Google Scholar]5. Гисберт Дж. П. Необходим ли посев перед терапией первой линии инфекции Helicobacter pylori? Интерн Мед. 2011;50:2717; ответ автора 2719–2720. [PubMed] [Google Scholar]7. Фишбах Л., Эванс Э.Л. Метаанализ: влияние статуса устойчивости к антибиотикам на эффективность тройной и четырехкратной терапии первой линии Helicobacter pylori. Алимент Фармакол Тер.2007; 26: 343–357. [PubMed] [Google Scholar]8. De Francesco V, Giorgio F, Hassan C, Manes G, Vannella L, Panella C, Ierardi E, Zullo A. Устойчивость H. pylori к антибиотикам во всем мире: систематический обзор. J Желудочно-кишечный тракт печени Dis. 2010;19:409–414. [PubMed] [Google Scholar]9. Megraud F, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, Andersen LP, Goossens H, Glupczynski Y. Устойчивость Helicobacter pylori к антибиотикам в Европе и ее связь с потреблением антибиотиков. Кишка. 2013; 62:34–42.[PubMed] [Google Scholar] 10. Боянова Л., Илиева Дж., Гергова Г., Давыдков Л., Спасова З., Камбуров В., Кацаров Н., Митов И. Многочисленные факторы риска антибиотикорезистентности Helicobacter pylori, выявленные в расширенном анамнезе: исследование в Болгарии. J Med Microbiol. 2012;61:85–93. [PubMed] [Google Scholar] 11. Георгопулос С.Д., Ладас С.Д., Каратапанис С., Ментис А., Спилиади С., Артикис В., Раптис С.А. Факторы, которые могут повлиять на исход тройной эрадикационной терапии Helicobacter pylori омепразолом, амоксициллином и кларитромицином.Dig Dis Sci. 2000;45:63–67. [PubMed] [Google Scholar] 12. Ян JC, Лин CJ. Генотипы CYP2C19 в фармакокинетике/фармакодинамике терапии инфекции Helicobacter pylori на основе ингибиторов протонной помпы. Мнение эксперта Препарат Метаб Токсикол. 2010; 6: 29–41. [PubMed] [Google Scholar] 13. Джордж Л.Л., Бороди Т.Дж., Эндрюс П., Девайн М., Мур-Джонс Д., Уолтон М., Брандл С. Лечение язвы двенадцатиперстной кишки после ликвидации Helicobacter pylori. Мед J Aust. 1990; 153: 145–149. [PubMed] [Google Scholar] 14. Баззоли Ф., Поццато П.Терапия инфекции H. pylori. J Physiol Pharmacol. 1997; 48 Дополнение 4:39–46. [PubMed] [Google Scholar] 15. Современные европейские концепции лечения инфекции Helicobacter pylori. Доклад о Маастрихтском консенсусе. Европейская группа по изучению Helicobacter Pylori. Кишка. 1997; 41:8–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]16. Линд Т., Вельдхуйзен ван Зантен С., Унге П., Спиллер Р., Байердорфер Э., О’Морейн С., Бардхан К.Д., Брадетт М., Чиба Н., Врангстад М. и др. Эрадикация Helicobacter pylori с помощью однонедельной тройной терапии, сочетающей омепразол с двумя противомикробными препаратами: исследование MACH I.Хеликобактер. 1996; 1: 138–144. [PubMed] [Google Scholar] 17. Malfertheiner P, Mégraud F, O’Morain C, Hungin AP, Jones R, Axon A, Graham DY, Tytgat G. Современные концепции лечения инфекции Helicobacter pylori — Консенсусный отчет Maastricht 2-2000. Алимент Фармакол Тер. 2002; 16: 167–180. [PubMed] [Google Scholar] 18. Малфертейнер П., Меграуд Ф., О’Морейн С., Баззоли Ф., Эль-Омар Э., Грэм Д., Хант Р., Роккас Т., Вакил Н., Куйперс Э.Дж. Современные концепции лечения инфекции Helicobacter pylori: Консенсусный отчет Maastricht III.Кишка. 2007; 56: 772–781. [Бесплатная статья PMC] [PubMed] [Google Scholar]19. Чей В.Д., Вонг Б.К. Рекомендации Американской коллегии гастроэнтерологов по лечению инфекции Helicobacter pylori. Am J Гастроэнтерол. 2007; 102: 1808–1825. [PubMed] [Google Scholar] 20. Фок К.М., Кателарис П., Сугано К., Анг Т.Л., Хант Р., Тэлли Н.Дж., Лам С.К., Сяо С.Д., Тан Х.Дж., Ву С.И. и др. Второе Азиатско-Тихоокеанское согласованное руководство по инфекции Helicobacter pylori. J Гастроэнтерол Гепатол. 2009; 24:1587–1600. [PubMed] [Google Scholar] 21.Венерито М., Кригер Т., Экер Т., Леандро Г., Малфертейнер П. Мета-анализ четырехкратной терапии висмутом по сравнению с тройной терапией кларитромицином для эмпирического первичного лечения инфекции Helicobacter pylori. пищеварение. 2013;88:33–45. [PubMed] [Google Scholar] 22. Хоубен М.Х., ван де Бик Д., Хенсен Э.Ф., де Краен А.Дж., Раус Э.А., Титгат Г.Н. Систематический обзор эрадикационной терапии Helicobacter pylori — влияние устойчивости к противомикробным препаратам на показатели эрадикации. Алимент Фармакол Тер. 1999; 13:1047–1055. [PubMed] [Google Scholar] 23.Грэм Д.Ю., Куреши В.А. Антибиотикорезистентная инфекция H. pylori и ее лечение. Курр Фарм Дез. 2000; 6: 1537–1544. [PubMed] [Google Scholar] 24. Фишбах Л.А., Ван Зантен С., Дикасон Дж. Мета-анализ: эффективность, нежелательные явления и приверженность, связанные с четырехкомпонентной терапией против Helicobacter pylori первой линии. Алимент Фармакол Тер. 2004; 20:1071–1082. [PubMed] [Google Scholar] 25. де Бур В.А., ван Эттен Р.Дж., Шнеебергер П.М., Титгат Г.Н. Единственный препарат для инфекции Helicobacter pylori: первые результаты с новой тройной монокапсулой висмута.Am J Гастроэнтерол. 2000;95:641–645. [PubMed] [Google Scholar] 26. Лейн Л., Хант Р., Эль-Зимаити Х., Нгуен Б., Осато М., Спенар Дж. Четырехкомпонентная терапия на основе висмута с использованием одной капсулы бискальцитрата висмута, метронидазола и тетрациклина в сочетании с омепразолом по сравнению с омепразолом, амоксициллином и кларитромицином для эрадикации Helicobacter pylori у пациентов с язвой двенадцатиперстной кишки: проспективное рандомизированное многоцентровое исследование в Северной Америке. Am J Гастроэнтерол. 2003; 98: 562–567. [PubMed] [Google Scholar] 27.Malfertheiner P, Bazzoli F, Delchier JC, Celiñski K, Giguère M, Rivière M, Mégraud F. Эрадикация Helicobacter pylori с помощью капсулы, содержащей субцитрат висмута калия, метронидазол и тетрациклин, в сочетании с омепразолом по сравнению с тройной терапией на основе кларитромицина: рандомизированное, открытое исследование -метка, не меньшей эффективности, испытание фазы 3. Ланцет. 2011; 377:905–913. [PubMed] [Google Scholar] 28. Лютер Дж., Хиггинс П.Д., Шенфельд П.С., Моайеди П., Вакил Н., Чей В.Д. Эмпирическая четырехкомпонентная и тройная терапия для первичного лечения инфекции Helicobacter pylori: систематический обзор и метаанализ эффективности и переносимости.Am J Гастроэнтерол. 2010;105:65–73. [PubMed] [Google Scholar] 30. Гисберт Дж. П., Перес-Айса А., Родриго Л., Молина-Инфанте Дж., Модолелл И., Бермехо Ф., Кастро-Фернандес М., Антон Р., Сакристан Б., Косме А. и др. Неотложная терапия третьей линии с висмутсодержащим четырехкомпонентным режимом после неэффективности двух курсов лечения (кларитромицином и левофлоксацином) инфекции H. pylori. Dig Dis Sci. 2014;59:383–389. [PubMed] [Google Scholar] 31. Ford AC, Malfertheiner P, Giguere M, Santana J, Khan M, Moayyedi P. Побочные эффекты солей висмута для эрадикации Helicobacter pylori: систематический обзор и метаанализ.Мир J Гастроэнтерол. 2008; 14:7361–7370. [Бесплатная статья PMC] [PubMed] [Google Scholar]32. Уэббер М.А., Пиддок Л.Дж. Важность эффлюксных насосов в устойчивости бактерий к антибиотикам. J Антимикробная химиотерапия. 2003; 51:9–11. [PubMed] [Google Scholar] 33. Зулло А., Вайра Д., Вакил Н., Хассан С., Гатта Л., Риччи С., Де Франческо В., Менегатти М., Тампиери А., Перна Ф. и др. Высокие показатели эрадикации Helicobacter pylori при новом последовательном лечении. Алимент Фармакол Тер. 2003; 17: 719–726. [PubMed] [Google Scholar] 34.Гисберт Дж. П., Кальвет Х, О’Коннор А., Мегро Ф., О’Морен К.А. Последовательная терапия для эрадикации Helicobacter pylori: критический обзор. Дж. Клин Гастроэнтерол. 2010;44:313–325. [PubMed] [Google Scholar] 35. Гринберг Э.Р., Андерсон Г.Л., Морган Д.Р., Торрес Дж., Чей В.Д., Браво Л.Е., Домингес Р.Л., Ферреччио С., Эрреро Р., Ласкано-Понсе Е.К. и др. 14-дневная тройная, 5-дневная одновременная и 10-дневная последовательная терапия инфекции Helicobacter pylori в семи латиноамериканских учреждениях: рандомизированное исследование. Ланцет. 2011; 378: 507–514.[Бесплатная статья PMC] [PubMed] [Google Scholar]36. Lim JH, Lee DH, Choi C, Lee ST, Kim N, Jeong SH, Kim JW, Hwang JH, Park YS, Lee SH и др. Клинические результаты двухнедельной последовательной и сопутствующей терапии для эрадикации Helicobacter pylori: рандомизированное пилотное исследование. Хеликобактер. 2013;18:180–186. [PubMed] [Google Scholar] 37. Сардарян Х., Факери Х., Хоссейни В., Тагваи Т., Малеки И., Мохтаре М. Сравнение гибридных и последовательных методов лечения Helicobacter pylori в Иране: проспективное рандомизированное исследование.Хеликобактер. 2013;18:129–134. [PubMed] [Google Scholar] 38. Гатта Л., Вакил Н., Вайра Д., Скарпиньято С. Глобальные показатели ликвидации инфекции Helicobacter pylori: систематический обзор и метаанализ последовательной терапии. БМЖ. 2013;347:f4587. [Бесплатная статья PMC] [PubMed] [Google Scholar]39. Георгопулос С., Папастергиу В., Ксирушакис Э., Лауди Ф., Лисгос П., Спилиади С., Папантониу Н., Каратапанис С. Четырехкратная «сопутствующая» терапия без висмута по сравнению со стандартной тройной терапией, продолжительностью 10 дней для лечения H.pylori: рандомизированное исследование. Дж. Клин Гастроэнтерол. 2013;47:228–232. [PubMed] [Google Scholar]40. Георгопулос С., Папастергиу В., Ксирушакис Э., Лауди Ф., Папантониу Н., Лисгос П., Спилиади С., Фрагу П., Скорда Л., Каратапанис С. Оценка «сопутствующей» терапии, состоящей из четырех препаратов, трех антибиотиков, не содержащей висмута, в качестве первой схема эрадикации Helicobacter pylori в Греции. Хеликобактер. 2012;17:49–53. [PubMed] [Google Scholar]41. Gisbert JP, Calvet X. Обновленная информация о четырехкратной (сопутствующей) терапии без висмута для эрадикации Helicobacter pylori.Клин Эксп Гастроэнтерол. 2012;5:23–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]42. Эсса А.С., Крамер Дж.Р., Грэм Д.Ю., Трейбер Г. Мета-анализ: «сопутствующая терапия» с четырьмя препаратами, тремя антибиотиками, не содержащей висмута по сравнению с тройной терапией для эрадикации Helicobacter pylori. Хеликобактер. 2009; 14:109–118. [Бесплатная статья PMC] [PubMed] [Google Scholar]43. Молина-Инфанте Дж., Романо М., Фернандес-Бермехо М., Федерико А., Гравина А.Г., Поццати Л., Гарсия-Абадиа Э., Винагре-Родригес Г., Мартинес-Алькала С., Эрнандес-Алонсо М. и др.Оптимизированная четырехкомпонентная терапия без висмута излечивает большинство пациентов с инфекцией Helicobacter pylori в популяциях с высоким уровнем устойчивости к антибиотикам. Гастроэнтерология. 2013;145:121–128.e1. [PubMed] [Google Scholar]44. Ву Д.К., Хсу П.И., Ву Д.Ю., Опекун А.Р., Куо Ч., Ву И.К., Ван С.С., Чен А., Хунг В.К., Грэм Д.Ю. Последовательная и сопутствующая терапия четырьмя препаратами одинаково эффективна для эрадикации инфекции H. pylori. Клин Гастроэнтерол Гепатол. 2010;8:36–41.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar]45.Макниколл А.Г., Марин А.С., Молина-Инфанте Дж., Кастро М., Баррио Дж., Дюконс Дж., Кальвет Х, де ла Коба С, Монторо М., Бори Ф. и др. Рандомизированное клиническое исследование, сравнивающее последовательную и сопутствующую терапию для эрадикации Helicobacter pylori в рутинной клинической практике. Кишка. 2014; 63: 244–249. [PubMed] [Google Scholar]46. Георгопулос С.Д., Ксирушакис Э., Мартинес-Гонсалес Б., Сгурас Д.Н., Спилиади С., Ментис А.Ф., Лауди Ф. Клиническая оценка десятидневного режима эзомепразола, метронидазола, амоксициллина и кларитромицина для эрадикации Helicobacter pylori при высоком кларитромицине область сопротивления.Хеликобактер. 2013; 18: 459–467. [PubMed] [Google Scholar]47. Хсу П.И., Ву Д.К., Ву Д.Ю., Грэм Д.Ю. Модифицированная последовательная терапия Helicobacter pylori: ингибитор протонной помпы и амоксициллин в течение 14 дней с добавлением кларитромицина и метронидазола в виде четырехкомпонентной (гибридной) терапии в течение последних 7 дней. Хеликобактер. 2011;16:139–145. [Бесплатная статья PMC] [PubMed] [Google Scholar]48. Романо М., Куомо А., Гравина А.Г., Миранда А., Иовене М.Р., Тисо А., Сика М., Рокко А., Салерно Р., Мармо Р. и др. Эмпирическая левофлоксацин-содержащая и кларитромицин-содержащая последовательная терапия для эрадикации Helicobacter pylori: рандомизированное исследование.Кишка. 2010;59:1465–1470. [PubMed] [Google Scholar]49. Бернинг М., Крас С., Мильке С. Должны ли хинолоны стоять на первом месте в терапии Helicobacter pylori? Терапия Adv Гастроэнтерол. 2011;4:103–114. [Бесплатная статья PMC] [PubMed] [Google Scholar]50. Карозерс Дж.Дж., Брюс М.Г., Хеннесси Т.В., Бенслер М., Моррис Дж.М., Ризоновер А.Л., Херлберт Д.А., Паркинсон А.Дж., Коулман Дж.М., МакМахон Б.Дж. Взаимосвязь между предыдущим применением фторхинолонов и устойчивостью к левофлоксацину при инфекции Helicobacter pylori. Клин Инфекция Дис. 2007;44:e5–e8.[PubMed] [Google Scholar]51. Gisbert JP, Morena F. Систематический обзор и метаанализ: схемы спасения на основе левофлоксацина после неудачного лечения Helicobacter pylori. Алимент Фармакол Тер. 2006; 23:35–44. [PubMed] [Google Scholar]52. Саад Р.Дж., Шонфельд П., Ким Х.М., Чей В.Д. Тройная терапия на основе левофлоксацина по сравнению с четырехкомпонентной терапией на основе висмута при персистирующей инфекции Helicobacter pylori: метаанализ. Am J Гастроэнтерол. 2006; 101: 488–496. [PubMed] [Google Scholar]53. Ди Каро С., Фини Л., Дауд Ю., Грицци Ф., Гасбаррини А., Де Лоренцо А., Ди Ренцо Л., Маккартни С., Блум С.Схемы на основе левофлоксацина/амоксициллина по сравнению с четырехкомпонентной терапией для эрадикации Helicobacter pylori во второй линии. Мир J Гастроэнтерол. 2012;18:5669–5678. [Бесплатная статья PMC] [PubMed] [Google Scholar]54. Гисберт Дж. П., Молина-Инфанте Дж., Марин А. С., Винагре Дж., Баррио Дж., МакНичолл АГ. Тройная терапия второй линии с левофлоксацином после неэффективности четырехкратного «последовательного» или «сопутствующего» лечения без висмута для эрадикации инфекции H. pylori. Scand J Гастроэнтерол. 2013; 48: 652–656. [PubMed] [Google Scholar]55.Мураками К., Окимото Т., Кодама М., Танахаши Дж., Фудзиока Т., Икеда Ф., Мураока Х., Такигава М., Сайка Т., Хасегава М. и др. Активность ситафлоксацина в отношении изолятов Helicobacter pylori, в том числе с мутациями gyrA. Противомикробные агенты Chemother. 2009;53:3097–3099. [Бесплатная статья PMC] [PubMed] [Google Scholar]56. Wenzhen Y, Kehu Y, Bin M, Yumin L, Quanlin G, Donghai W, Lijuan Y. Тройная терапия на основе моксифлоксацина по сравнению с тройной терапией на основе кларитромицина для лечения первой линии инфекции Helicobacter pylori: метаанализ рандомизированных контролируемых исследований .Интерн Мед. 2009;48:2069–2076. [PubMed] [Google Scholar]57. Вильгельм С.М., Джонсон Дж.Л., Кале-Прадхан П.Б. Лечение клопов клопами: роль пробиотиков в качестве дополнительной терапии Helicobacter pylori. Энн Фармакотер. 2011;45:960–966. [PubMed] [Google Scholar]58. Лесброс-Пантофличкова Д., Кортези-Теулаз И., Блюм А.Л. Helicobacter pylori и пробиотики. Дж Нутр. 2007; 137:812С–818С. [PubMed] [Google Scholar]59. Du YQ, Su T, Fan JG, Lu YX, Zheng P, Li XH, Guo CY, Xu P, Gong YF, Li ZS. Адъювантные пробиотики улучшают эрадикационный эффект тройной терапии инфекции Helicobacter pylori.Мир J Гастроэнтерол. 2012;18:6302–6307. [Бесплатная статья PMC] [PubMed] [Google Scholar]60. Efrati C, Nicolini G, Cannaviello C, O’Sed NP, Valabrega S. Эрадикация Helicobacter pylori: последовательная терапия и добавка Lactobacillus reuteri. Мир J Гастроэнтерол. 2012;18:6250–6254. [Бесплатная статья PMC] [PubMed] [Google Scholar]61. Манфреди М., Биззарри Б., Саккеро Р.И., Маккари С., Калабрезе Л., Фаббиан Ф., Де’Анджелис Г.Л. Инфекция Helicobacter pylori в клинической практике: пробиотики и комбинация пробиотиков + лактоферрин улучшают соблюдение, но не эрадикацию, при последовательной терапии.Хеликобактер. 2012; 17: 254–263. [PubMed] [Google Scholar]62. Шавахи А., Табеш Э., Ягуткар А., Хашеми Х., Табеш Ф., Ходадостан М., Минакари М., Шавахи С., Голамрезаи А. Влияние мультиштаммового пробиотического соединения на висмутсодержащую четырехкомпонентную терапию инфекции Helicobacter pylori: рандомизированное плацебо-контролируемое тройное -слепое исследование. Хеликобактер. 2013; 18: 280–284. [PubMed] [Google Scholar]63. Szajewska H, Horvath A, Piwowarczyk A. Метаанализ: влияние добавок Saccharomyces boulardii на скорость эрадикации Helicobacter pylori и побочные эффекты во время лечения.Алимент Фармакол Тер. 2010;32:1069–1079. [PubMed] [Google Scholar]64. Zou J, Dong J, Yu X. Метаанализ: четырехкомпонентная терапия, содержащая Lactobacillus, по сравнению со стандартной тройной терапией первой линии для эрадикации Helicobacter pylori. Хеликобактер. 2009; 14:97–107. [PubMed] [Google Scholar]65. Ван Чж, Гао Цюй, Фанг Цзюй. Мета-анализ эффективности и безопасности пробиотических соединений, содержащих Lactobacillus и Bifidobacterium, в эрадикационной терапии Helicobacter pylori. Дж. Клин Гастроэнтерол.2013;47:25–32. [PubMed] [Google Scholar]66. Liou JM, Chen CC, Chen MJ, Chen CC, Chang CY, Fang YJ, Lee JY, Hsu SJ, Luo JC, Chang WH и другие. Последовательная и тройная терапия для лечения Helicobacter pylori первой линии: многоцентровое открытое рандомизированное исследование. Ланцет. 2013; 381: 205–213. [PubMed] [Google Scholar]67. Вакил Н., Вайра Д. Лечение инфекции H. pylori: новые проблемы с устойчивостью к противомикробным препаратам. Дж. Клин Гастроэнтерол. 2013; 47: 383–388. [PubMed] [Google Scholar]68. Тейлор Д.Е., Гэ З., Пурыч Д., Ло Т., Хирацука К.Клонирование и анализ последовательности двух копий гена 23S рРНК Helicobacter pylori и ассоциация устойчивости к кларитромицину с мутациями 23S рРНК. Противомикробные агенты Chemother. 1997; 41: 2621–2628. [Бесплатная статья PMC] [PubMed] [Google Scholar]69. Версалович Дж., Шортридж Д., Киблер К., Гриффи М.В., Бейер Дж., Фламм Р.К., Танака С.К., Грэм Д.Ю., Го М.Ф. Мутации в 23S рРНК связаны с устойчивостью Helicobacter pylori к кларитромицину. Противомикробные агенты Chemother. 1996; 40: 477–480. [Бесплатная статья PMC] [PubMed] [Google Scholar]70.Lehours P, Siffré E, Mégraud F. Мультиплексная ПЦР на ДПО как альтернатива культивированию и тестированию на чувствительность для выявления Helicobacter pylori и ее устойчивости к кларитромицину. БМК Гастроэнтерол. 2011;11:112. [Бесплатная статья PMC] [PubMed] [Google Scholar]71. Mégraud F, Lehours P. Обнаружение Helicobacter pylori и тестирование чувствительности к противомикробным препаратам. Clin Microbiol Rev. 2007; 20:280–322. [Бесплатная статья PMC] [PubMed] [Google Scholar]72. Шаберайтер-Гуртнер С., Хиршль А.М., Драгошич Б., Хуфнагл П., Пуз С., Ковач З., Роттер М., Макристатис А.Новый ПЦР-анализ в реальном времени для выявления инфекции Helicobacter pylori и одновременного определения чувствительности образцов кала и биопсии к кларитромицину. Дж. Клин Микробиол. 2004; 42:4512–4518. [Бесплатная статья PMC] [PubMed] [Google Scholar]73. Де Франческо В., Зулло А., Иерарди Э., Джорджио Ф., Перна Ф., Хассан С., Морини С., Панелла С., Вайра Д. Фенотипическая и генотипическая устойчивость Helicobacter pylori к кларитромицину и терапевтический результат: преимущества и ограничения. J Антимикробная химиотерапия. 2010;65:327–332. [PubMed] [Google Scholar]74.Римбара Э., Фишбах Л.А., Грэм Д.Ю. Оптимальная терапия инфекции Helicobacter pylori. Нат Рев Гастроэнтерол Гепатол. 2011; 8: 79–88. [PubMed] [Google Scholar]75. Баба С., Оиси Ю., Ватанабэ Ю., Ойкава Р., Морита Р., Ёсида Ю., Хираиси Т., Маэхата Т., Нагасе Ю., Фукуда Ю. и др. Молекулярный тест на устойчивость Helicobacter pylori к антибиотикам на основе промывания желудка. пищеварение. 2011; 84: 299–305. [PubMed] [Google Scholar]76. Грэм Д.Ю., Кудо М., Редди Р., Опекун А.Р. Практичный быстрый, малоинвазивный, надежный неэндоскопический метод получения Helicobacter pylori для посева.Хеликобактер. 2005; 10:1–3. [PubMed] [Google Scholar]77. Каваи Т., Ямагиши Т., Яги К., Катаока М., Каваками К., Софуни А., Итои Т., Сакаи Ю., Мориясу Ф., Осака Ю. и др. Индивидуальная эрадикационная терапия, основанная на чувствительности фекальных Helicobacter pylori к кларитромицину. J Гастроэнтерол Гепатол. 2008;23 Приложение 2:S171–S174. [PubMed] [Google Scholar]78. Моррис Дж.М., Ризоновер А.Л., Брюс М.Г., Бруден Д.Л., МакМахон Б.Дж., Сакко Ф.Д., Берг Д.Е., Паркинсон А.Дж. Оценка seaFAST, быстрого флуоресцентного теста гибридизации in situ, для обнаружения Helicobacter pylori и устойчивости к кларитромицину в срезах биопсии, залитых парафином.Дж. Клин Микробиол. 2005;43:3494–3496. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Йилмаз О., Демирай Э., Тюмер С., Алтунгёз О., Йорукоглу К., Сойтюрк М., Симшек И. Обнаружение Helicobacter pylori и определение чувствительности к кларитромицину с использованием фиксированных формалином и залитых парафином образцов биопсии желудка путем флуоресцентной гибридизации in situ. Хеликобактер. 2007; 12: 136–141. [PubMed] [Google Scholar]80. Камбау Э., Аллерхейлиген В., Кулон С., Корбель С., Ласколс С., Дефорж Л., Сусси С.Дж., Дельшер Дж.С., Мегро Ф.Оценка нового теста генотипа HelicoDR для молекулярного обнаружения устойчивости к антибиотикам у Helicobacter pylori. Дж. Клин Микробиол. 2009;47:3600–3607. [Бесплатная статья PMC] [PubMed] [Google Scholar]81. Lee HJ, Kim JI, Cheung DY, Kim TH, Jun EJ, Oh JH, Chung WC, Kim BW, Kim SS, Park SH и др. Эрадикация Helicobacter pylori по точечным мутациям 23S рибосомной РНК, ассоциированным с резистентностью к кларитромицину. J заразить Dis. 2013; 208:1123–1130. [PubMed] [Google Scholar]82. Фурута Т., Шираи Н., Такашима М., Сяо Ф., Ханай Х., Сугимура Х., Охаси К., Исидзаки Т., Канеко Э.Влияние генотипических различий в CYP2C19 на показатели излечения от инфекции Helicobacter pylori тройной терапией с ингибитором протонной помпы, амоксициллином и кларитромицином. Клин Фармакол Тер. 2001; 69: 158–168. [PubMed] [Google Scholar]83. Sim SC, Risinger C, Dahl ML, Aklillu E, Christensen M, Bertilsson L, Ingelman-Sundberg M. Распространенный новый вариант гена CYP2C19 вызывает сверхбыстрый метаболизм лекарств, связанный с лекарственной реакцией на ингибиторы протонной помпы и антидепрессанты. Клин Фармакол Тер. 2006; 79: 103–113.[PubMed] [Google Scholar]84. Фурута Т., Шираи Н., Кодаира М., Сугимото М., Ногаки А., Курияма С., Иваидзуми М., Ямаде М., Теракава И., Охаси К. и др. Основанный на фармакогеномике индивидуальный и стандартный терапевтический режим для эрадикации H. pylori. Клин Фармакол Тер. 2007; 81: 521–528. [PubMed] [Google Scholar]Лечение инфекции Helicobacter pylori: прошлое, настоящее и будущее
World J Gastrointest Pathophysiol. 2014 15 ноября; 5(4): 392–399.
Василиос Папастергиу, Стилианос Каратапанис, Отделение внутренних болезней, Больница общего профиля Родоса, 85100 Родос, Греция
Сотириос Д. Георгопулос, Отделение гастроэнтерологии, Афины Медикал, П.Больница Фалирон, 17562 Афины, Греция,
Вклад авторов: Папастергиу В. участвовал в разработке концепции и дизайна, составлении статьи; Георгопулос С.Д. участвовал в составлении проекта статьи, критически пересматривая статью на предмет важного интеллектуального содержания; Каратапанис С. участвовал в окончательном утверждении версии для публикации.Адрес для переписки: Стилианос Каратапанис, доктор медицинских наук, отделение внутренних болезней, больница общего профиля Родоса, ул. Калопетрас, 10, 85100 Родос, Греция. гр.teneto@raklyts
Телефон: +30-224-1080456 Факс: +30-224-1066410
Поступила в редакцию 12 февраля 2014 г.; Пересмотрено 15 апреля 2014 г.; Принято 17 июля 2014 г.
Copyright © 2014 Baishideng Publishing Group Inc. Все права защищены. Эта статья цитируется в других статьях PMC.Abstract
Helicobacter pylori ( H. pylori ) является основным патогеном человека, вызывающим значительную заболеваемость и смертность. Однако после десятилетий усилий лечение H.pylori остается проблемой для врачей, так как не существует универсально эффективной схемы лечения. Из-за растущей распространенности устойчивости к противомикробным препаратам, главным образом к кларитромицину, эффективность стандартной тройной терапии снизилась до неприемлемо низкого уровня в большинстве частей мира. Новые схемы, специально испытанные для улучшения терапевтических результатов против устойчивых к антибиотикам штаммов H. pylori , в настоящее время рекомендуются в качестве вариантов эмпирического лечения первой линии, обеспечивающих высокую эффективность (по сообщениям, > 90% при намерении лечить анализ) даже при высокой устойчивости к кларитромицину. настройки.К ним относятся висмутовая квадротерапия, сопутствующая, последовательная и гибридная терапия. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина следует зарезервировать в качестве вариантов второй линии/спасения. Было предложено дополнительное использование пробиотиков, чтобы повысить скорость эрадикации и уменьшить возникновение побочных эффектов, связанных с лечением. В настоящее время доступны методы молекулярного тестирования для характеристики терапевтической чувствительности H. pylori , включая генотипическое определение устойчивости к макролидам и оценку статуса цитохрома P450 2C19, который, как известно, влияет на метаболизм ингибиторов протонной помпы.В будущем использование этих методов может обеспечить бескультуральную неинвазивную индивидуальную терапию инфекции H. pylori .
Ключевые слова: Helicobacter pylori , Антибиотикорезистентность, Висмут-квадроцикл, Сопутствующая, Последовательная, Пробиотики Helicobacter pylori ( H.pylori ) инфекции. Четырехкомпонентная, сопутствующая, последовательная и гибридная терапия висмутом в настоящее время рекомендуется в качестве эмпирической терапии первой линии, обеспечивающей повышенную эффективность в условиях высокой резистентности к кларитромицину. Поскольку резистентность к хинолонам быстро растет, левофлоксацин следует предпочтительно использовать в терапии второй линии/спасательной терапии. Появляется все больше доказательств того, что дополнительные добавки с пробиотиками улучшают терапевтический результат и переносимость. Генотипическая характеристика восприимчивости H. pylori к терапии может позволить в будущем разработать индивидуальный терапевтический подход.
ВВЕДЕНИЕ
Лечение инфекции Helicobacter pylori ( H. pylori ) имеет первостепенное значение для лечения распространенных желудочно-кишечных заболеваний, включая язвенную болезнь, рак желудка и функциональную диспепсию [1-3]. Кроме того, в качестве показаний к эрадикации H. pylori теперь включаются экстрапищеварительные расстройства: идиопатическая тромбоцитопеническая пурпура, дефицит витамина B12 и необъяснимая железодефицитная анемия [4]. В отличие от других бактериальных инфекций, для лечения которых обычно проводится тестирование на чувствительность, культура H.pylori не является широко доступным и требует проведения эндоскопии, которая хорошо переносится не всеми пациентами и имеет ряд ограничений, включая тот факт, что чувствительность к in vitro не всегда гарантирует эрадикацию in vivo [5]. Таким образом, схемы для H. pylori обычно назначались эмпирически, при условии, что они были предварительно протестированы и в достаточной степени адаптированы в отношении различных параметров (, т.е. ; лечебная доза, продолжительность, интервалы дозирования и т.) для оптимизации показателей излечения и сведения к минимуму побочных эффектов. Однако оптимальное лечение для эрадикации H. pylori еще предстоит установить, поскольку ни один из режимов не является универсальным. Распространение во всем мире резистентности к основным антибиотикам, в основном к кларитромицину (CAM), а также к метронидазолу (MNZ) и левофлоксацину, является основным фактором, определяющим неэффективность лечения инфекции H. pylori [6,7]. В недавнем систематическом обзоре сообщалось, что глобальная заболеваемость устойчивостью к CAM составляет 17.2% в диапазоне от 11,1% в Европе до 29,3% в Америке, тогда как в том же анализе континентальные показатели резистентности к MNZ составляли 17% и 44,1% соответственно [8]. Потребление антибиотиков при инфекциях, отличных от H. pylori , объясняет широкое увеличение показателей устойчивости к антибиотикам H. pylori [9,10]. Действительно, различная национальная политика в отношении использования антибиотиков в значительной степени отражает географическое распределение устойчивости H. pylori к : устойчивость к САМ значительно выше в странах Южной Европы (достигая 49% в некоторых районах Испании) по сравнению с Северной Европой ( эл.g ., только 1% в Нидерландах), где политика использования антибиотиков более строгая[9]. В дополнение к развитию устойчивости к антибиотикам ряд факторов, связанных как с хозяином, так и с патогеном, может негативно повлиять на эффективность схем эрадикации H. pylori (таблица) [11,12].
Таблица 1
Таблица 1
Факторы сообщили о отрицательном влиянии на исход терапии на Helicobacter Pylori инфекция
| | 8 | | |
| Разработка устойчивости к антибиотикам | Несоблюдение лечения | ||
| Высокая бактериальная нагрузка в желудке | Nexcer Dyspepsia | ||
| Защитный эффект слоя слизирования желудка | Курение | ||
| Внутриклеточное расположение многих бактерий | Состояние CYP2C19 Быстрый метаболизатор) | ||
| 9 | |||
| CAGA отрицательный | |||
| Наличие бездействующих кокоидов (не подвержены антибиотикам) | |||
| гетерорезерный статус (сосуществование штаммов, восприимчивых и устойчивых к тому же антибиотику) |
Несмотря на десятилетия усилий, лечение H.pylori остается сложной проблемой как для исследователей, так и для практикующих врачей. В настоящей статье мы стремимся предоставить всесторонний обзор взглядов на прошлое, настоящее и будущее эрадикации H. pylori .
ТРОЙНАЯ ТЕРАПИЯ НА ОСНОВЕ КЛАРИТРОМИЦИНА: УМЕНЬШАЮЩИЙСЯ КЛИНИЧЕСКИЙ СТАНДАРТ
Исторически сложилось так, что первая действительно эффективная терапия инфекции H. pylori , включающая висмут, тетрациклин и MNZ, была предложена в 1990 г. [13].Несколькими годами позже использование CAM в тройной терапии, предложенной Bazzoli et al. [14], положило начало тройным схемам на основе CAM, после чего стало золотым стандартом в лечении H. pylori . В исследованиях, проведенных в 90-х годах, стандартная тройная терапия (СТТ), включающая ингибитор протонной помпы (ИПП) два раза в день , САМ 500 мг два раза в день и амоксициллин 1000 мг два раза в день или MNZ 500 мг (или 400 мг в Англии) , все назначаемые в течение 7-14 дней, давали стабильно хорошие результаты, приводящие к успеху эрадикации > 80%, и даже > 90% было возможно [15,16].Благодаря этой высокой эффективности и относительной простоте, оптимальному профилю безопасности и приверженности крупных фармацевтических компаний эти схемы получили широкое признание в национальных экспертных группах и согласованных рекомендациях во всем мире в качестве стандарта лечения первой линии для эрадикации H. pylori . 17-20]. Однако рост распространенности резистентности к САМ привел к значительному снижению эффективности стандартных схем. Это снижение эффективности уже было очевидно в мета-анализах, опубликованных в начале 2000-х годов, что привело к значительным изменениям в парадигме лечения инфекции.К ним относятся введение концепции кумулятивной эффективности лечения (требующей от пациента соблюдения большего количества курсов лечения; таким образом, больше побочных эффектов и распространение вторичной антибиотикорезистентности), а затем введение местного порога (15%-20%) устойчивости к САМ, при которых САМ не следует использовать эмпирически [17,18]. Снижение эффективности стандартных методов лечения штаммов, устойчивых к САМ, хорошо задокументировано на основе метаанализа: в метаанализе, проведенном Фишбахом и Эвансом, эффективность тройной терапии снизилась на 66%.2% (95% ДИ: 58,2%-74,2%), когда штаммы H. pylori были устойчивыми против чувствительными к CAM[7]. Соответственно, более поздний анализ Venerito et al [21] показал аналогичные результаты: включая данные о чувствительности к противомикробным препаратам из 4 рандомизированных клинических испытаний (РКИ), стандартная тройная терапия успешно элиминировала 88% чувствительных к CAM, но только 14% устойчивых к CAM. штаммов H. pylori (разница рисков = 0,75, 95% ДИ: 0,63-0,87). Если используется MNZ, наличие резистентности к MNZ также может повлиять на терапевтический результат [22], хотя обычно считается менее важным с клинической точки зрения.Это связано с тем, что резистентность к MNZ может быть в значительной степени преодолена за счет увеличения дозы и увеличения продолжительности лечения [23]. Наконец, устойчивость H. pylori к амоксициллину является исключительной и, как правило, не имеет клинического значения. В свете увеличения количества данных, подтверждающих субоптимальную эффективность (< 70%) в большинстве европейских стран, недавний консенсусный отчет Maastricht IV/Florence окончательно заменил стандартные схемы в качестве эмпирического золотого стандарта для эрадикации H. pylori [4].Вместо этого при использовании устаревших тройных схем следует учитывать локальную картину резистентности (таким образом, использовать только в областях, в которых устойчивость к САМ составляет <20%) или полагаться на тестирование чувствительности при условии, что доступна культура до лечения (, т.е. ., используется в качестве индивидуального лечения).
СОВРЕМЕННЫЕ ТЕРАПИИ ИНФЕКЦИИ
H. PYLORIНовые схемы, специально разработанные для улучшения терапевтических результатов против устойчивых к антибиотикам штаммов H. pylori , в настоящее время рекомендуются в качестве эмпирических вариантов лечения первой линии, обеспечивающих повышенную эффективность (по сообщениям > 90% намерены лечить анализ) в условиях высокой резистентности к САМ.Эти режимы приведены в таблице.
Таблица 2
Текущие схемы для лечения Helicobacter Pylori инфекция
| лечение | Regimen 8 | ||
| 45369 | ), висмут (стандартная доза, 4 раза в день ) тетрациклин (500 мг, 4 раза в день ) и метронидазол (500 мг, 4 раза в день ) в течение 10-14 дней | ||
| Последовательная терапия с двойной терапией | 2 | 2 | 2 A ИПП (стандартная доза, 2 раза в день) и амоксициллин (1 г, 2 раза в день) с последующей 5-дневной тройной терапией с ИПП (стандартная доза, 2 раза в день), кларитромицином (500 мг, 2 раза в день) и метронидазол (500 мг, 2 раза в сутки) |
| Сопутствующая терапия | дазол (500 мг, 2 раза в день ) в течение 7-10 дней | ||
| Гибридная терапия | 7-дневная двойная терапия с ИПП (стандартная доза, 2 раза в день) и амоксициллином (1 г, 2 раза в день) с последующим 7-дневной четырехкомпонентной терапией с ИПП (стандартная доза, 2 раза в сутки), амоксициллином (1 г, 2 раза в сутки), кларитромицином (500 мг, 2 раза в сутки) и метронидазолом (500 мг, 2 раза в сутки) | ||
| Triple терапии на основе левофлоксацина | PPI (стандартная доза, ставка ), левофлоксацин (500 мг, ставка ) и амоксициллин (1 г, ставка ) для 10 D |
4540409
Четырехменность висмута
Квадратная терапия висмутом (BQT) в настоящее время представляет собой предпочтительный вариант лечения первой линии для областей с высокой (≥ 20%) частотой резистентности к CAM, а также ценный вариант лечения второй линии, когда схема на основе CAM ранее не удалась.Он работает независимо от CAM, достигая > 90% эрадикации при наличии устойчивости к CAM, тогда как применение высокой дозы MNZ (1500–1600 мг/сутки) и пролонгированной (10–14 дней) продолжительности лечения позволяет минимизировать влияние на устойчивость к MNZ. , обеспечивая уровень эрадикации > 85% даже в регионах с высокой резистентностью к этому препарату [24]. Доступна удобная для пациента монокапсула (содержащая висмут, MNZ и тетрациклин) (Pylera ® , Aptalis, Mont St Hilaire, QC, Канада), обеспечивающая уровень эрадикации 86 % и 80 % в двух крупных РКИ, проведенных в Северной Америке и Европе соответственно[25-27].Напротив, частота эрадикации ITT с помощью BQT составила всего 77,8% в недавнем мета-анализе ( против 77% для STT), что ставит под сомнение как эффективность, так и превосходство BQT над STT [28]. Однако следует признать существенную степень неоднородности исследований, особенно в отношении дозирования MNZ. Эффективность BQT второй линии также была подтверждена на основе метаанализа (30 исследований), показавшего эффективность второй линии (ITT) в среднем 77% после неудачи STT [29]. Эффективность третьей линии BQT после двух предыдущих неудачных попыток эрадикации тройной терапией, содержащей CAM и левофлоксацин, составила 65% (ITT) в многоцентровом исследовании, проведенном в Испании [30].Основными ограничениями являются отсутствие в некоторых странах солей висмута или тетрациклина, а также потенциальная токсичность висмута. Однако, включая 4763 пациента, не было выявлено различий в отношении переносимости между группами, не принимавшими висмут, и группами, содержащими висмут, за исключением темного стула, который чаще наблюдался в более поздних группах [31].
ПОСЛЕДОВАТЕЛЬНАЯ ТЕРАПИЯ
При последовательной терапии используются те же антибиотики, что и в STT, но вводятся последовательно. Было высказано предположение, что начальный курс амоксициллина разрушает клеточную стенку бактерий, предотвращая развитие каналов оттока, выводящих САМ из бактерий [32].Хотя в первоначальных РКИ [33] (большинство из них было проведено в Италии) и более ранних метаанализах последовательная терапия явно превосходила СТТ [эрадикация ИТТ 91,7% (95% ДИ: 90%-93%) против 76,7% ( 95% ДИ: 75%-79%) для STT [34], более свежие данные из Южной Америки, Ирана и Южной Кореи показали более низкие показатели эрадикации (< 80%) [35-37]. Несмотря на то, что эта последовательная терапия кажется достаточно эффективной против штаммов с монорезистентностью к САМ, способной уничтожить 72,8% из них, ее эффективность против штаммов с двойной резистентностью (САМ и MNZ) составила всего 37% (диапазон: 16.от 2% до 60,7%) при оценке 8 исследований с данными о чувствительности к антибиотикам [38]. Важно отметить, что последовательная терапия не превосходила ни 14-дневную тройную терапию (ОР = 1, 95% ДИ: 0,94–1,06), ни терапию на основе висмута (ОР = 0,99, 95% ДИ: 0,94–1,05) при обширном оценка 46 РКИ[38].
БЕЗВИСМУТОВАЯ КВАДРАТНАЯ (СОПУТСТВУЮЩАЯ) ТЕРАПИЯ
«Сопутствующая» квадротерапия без висмута является еще одним допустимым вариантом лечения первой линии для областей с высокой частотой резистентности к CAM[39,40].В 19 исследованиях (2070 пациентов) общая частота эрадикации при сопутствующей терапии составила 88% (95% ДИ: 85%-91%) и 91%, когда были исключены 3 отдаленных исследования с изначально короткой продолжительностью лечения (3-5 дней) [41]. ]. Действительно, было показано, что продолжительность лечения не менее 7 дней необходима для успеха сопутствующей терапии [42], в то время как дополнительное продление лечения до 14 дней в сочетании с высокой дозой ИПП (омепразол 40 мг × 2) может дополнительно ускорить излечение. показатели до > 95%, как показало многоцентровое исследование не меньшей эффективности [43].Повышенная эффективность против штаммов H. pylori с двойной резистентностью была предложена в качестве основного преимущества сопутствующей терапии по сравнению с последовательной терапией [44], хотя две схемы показали одинаковую эффективность при сравнении с использованием 338 пациентов в стране с высокой устойчивостью к антибиотикам (Испания). )[45]. Действительно, при оценке 106 пациентов с тестированием чувствительности до лечения сопутствующая терапия элиминировала только 55% штаммов с двойной устойчивостью против 100% и 91% с устойчивостью к САМ и MNZ соответственно [46].Таким образом, обе схемы, по-видимому, склонны к пагубному влиянию двойной резистентности, работая примерно одинаково (с эффективностью около 81% каждая) по объединению данных 6 сравнительных РКИ [38].
ГИБРИДНАЯ ТЕРАПИЯ
Двухэтапный двухкомпонентный (гибридный) режим, предложенный Hsu et al. [47], является еще одним ценным вариантом лечения, конкурирующим как с последовательным, так и с сопутствующим лечением. При оценке данных 2 РКИ гибридная терапия показала незначительное, хотя и незначительное, улучшение по сравнению с последовательной терапией (86.6% против 81%) [38] и сопоставимо с сопутствующей терапией в сравнительном исследовании, в котором, что интересно, в группе, получавшей гибридный режим, возникало меньше побочных эффектов [43]. Необходимы дополнительные данные, чтобы сделать окончательные выводы об эффективности и переносимости гибридной терапии.
ТЕРАПИЯ НА ОСНОВЕ ЛЕВОФЛОКСАЦИНА
Для преодоления растущей резистентности к CAM левофлоксацин, хинолон широкого спектра действия, использовался в качестве замены CAM в трехкратном или последовательном режимах, достигая > 90% показателей излечения, и даже > 95% возможно при условии что местная резистентность к левофлоксацину низкая (< 10%) [48,49].Однако левофлоксацин также сталкивается с клинически значимыми проблемами антибиотикорезистентности, поскольку резистентность к хинолонам в настоящее время превышает 40% в Америке, 20% в Европе и 10% в Азии [8]. Из-за быстрого развития вторичной резистентности к хинолонам использование левофлоксацина в качестве первой линии, как правило, не рекомендуется, и этот препарат зарезервирован для использования в схемах второй линии/спасательной терапии после неэффективности схем на основе CAM и/или MNZ [50]. ]. Хорошая (показатель излечения 81%-87%) эффективность второй линии тройной терапии левофлоксацином (LTT) была подтверждена в двух мета-анализах, опубликованных в 2006 г., оба показали лучшие результаты с LTT по сравнению с BQT второй линии [51]. ,52].Соответственно, эффективность LTT второй линии составила 88,7% в более позднем метаанализе, включая РКИ до октября 2010 г. [53]. Важно отметить, что использование LTT после неудачи последовательного или сопутствующего режима, как сообщается, обеспечивает до 97,8% кумулятивной терапевтической эффективности [54]. Использование других хинолоновых препаратов, таких как моксифлоксацин и ситафлоксацин, показало многообещающие результаты [55, 56], хотя нет никаких доказательств, подтверждающих какое-либо терапевтическое преимущество перед левофлоксацином.
ПЕРСПЕКТИВЫ НА БУДУЩЕЕ
Дополнительные пробиотики
Несмотря на то, что были предприняты различные попытки восстановить эффективность стандартных методов лечения, таких как увеличение дозы ИПП или продление продолжительности лечения, ни один из них не достиг уровня, позволяющего преодолеть сегодняшнюю устойчивость к противомикробным препаратам.Подход, который вызывает растущий интерес, заключается в использовании пробиотиков в сочетании со схемами эрадикации H. pylori [57]. Ожидаемая польза двойная: ускорение эрадикации и улучшение переносимости за счет предотвращения возникновения побочных эффектов, связанных с лечением. Патогенную основу возможного положительного эффекта пробиотиков на эрадикацию H. pylori еще предстоит выяснить, хотя были выдвинуты некоторые гипотезы, включая прочность слизистого барьера, конкуренцию за адгезию и иммуномодулирующие механизмы [58].В различных исследованиях в последние годы пробиотики использовались дополнительно к стандартным или новым схемам лечения, что дало противоречивые результаты [59-62]. Несмотря на то, что оценивались различные соединения с одним или несколькими штаммами, в настоящее время имеются доказательства в поддержку использования Saccharomyces boulardi (OR = 1,13; 95% ДИ: 1,05–1,21) или Lactobacillus spp . (ОШ = 1,78; 95% ДИ: 1,2–2,6) добавки в дополнение к стандартной тройной терапии [63, 64]. В самом последнем анализе, оценивающем эффект добавок, содержащих Lactobacillus и Bifidobacterium, объединенное отношение шансов (ITT) с пробиотическими добавками составило 2.066 (95% ДИ: 1,398-3,055) для эрадикации и 0,305 (95% ДИ: 0,117-0,793) для частоты всех побочных эффектов [65]. Интересно, что в отношении предотвращения побочных эффектов использование пробиотиков может иметь значение только у части пациентов, особенно у пациентов с рецидивирующей инфекцией или желудочно-кишечными побочными эффектами, связанными с антибиотиками в анамнезе [57]. Ожидаются дополнительные данные для уточнения роли, стандартизации режимов и оценки экономической эффективности пробиотиков при лечении H.pylori инфекции.
Бескультуральное неинвазивное определение чувствительности H. pylori к антибиотикам
Критически важно, что даже обсуждавшиеся выше новые методы лечения в некоторой степени (хотя и в меньшей степени по сравнению с традиционными методами лечения) подвержены влиянию устойчивости к антибиотикам; уровень эрадикации > 95% встречается нечасто, и даже > 90% оспаривается в некоторых исследованиях [35, 66, 67]. Кроме того, возможно, что успех эмпирического лечения в будущем будет снижаться, поскольку устойчивость к основным антибиотикам постоянно растет во всем мире.Для поддержания высокой терапевтической эффективности идеальным подходом является специальное лечение H. pylori в действии f на основе тестирования чувствительности до лечения. Это предотвратит повторное эмпирическое лечение пациента, которое увеличивает риск побочных эффектов и способствует развитию вторичной резистентности. Однако, как уже упоминалось, современные средства проведения эндоскопии и посева H. pylori являются инвазивными, не отражают на 100% чувствительность in vivo и требуют много времени, поскольку посев требует 3-10 дней и тестирование чувствительности ( e.g ., производства Etest, AB bioMerieux, Solna, Швеция) потребуется дополнительно 3-4 дня. Эти ограничения препятствуют систематическому использованию культуры H. pylori , которая в настоящее время рекомендуется только в случаях с не менее чем двумя неудачами эмпирического лечения. Общеклассовая резистентность к макролидам является результатом точечных мутаций в трех соседних положениях нуклеотидов ( A2143G, A2142G и A2142C ) в пептидилтрансферазной петле гена 23SrRNA [68,69]. На эти три точечные мутации приходится 90% случаев первичной резистентности к САМ в западных странах.В последние годы для этих мутаций были разработаны методы молекулярного тестирования, включая стандартную полимеразную цепную реакцию (ПЦР) и другие методы, основанные на ПЦР, включая полиморфизм длины рестрикционных фрагментов ПЦР, иммуноферментный анализ ПЦР-ДНК, анализ лигирования олигонуклеотидов ПЦР и ПЦР-линию. зондовый анализ, а также анализ ПЦР в реальном времени, который представляет собой мощное усовершенствование базовой ПЦР[70-72]. Эти методы могут дать быстрые и высокоточные результаты при генотипическом выявлении устойчивости к САМ, включая определение статуса гетерорезистентности ( i.e ., сосуществование штаммов, чувствительных и устойчивых к одному и тому же антибиотику), что, как известно, является причиной значительного числа неудач лечения [73,74]. Эти методы могут применяться непосредственно к образцам биопсии желудка или использоваться в сочетании с минимально инвазивными методами (, например, ., орально-желудочная чистка или промывание желудка) или неинвазивно с использованием образцов стула [75-77]. Важно отметить, что генотипическое определение устойчивости к САМ также возможно с помощью флуоресцентной гибридизации in-situ, которую также можно применять к образцам, залитым парафином [78,79].Также доступно определение резистентности к левофлоксацину на основе выявления мутаций gyrA [80]. Два азиатских исследования предоставили данные о потенциальной полезности индивидуального терапевтического подхода, основанного на молекулярном обнаружении устойчивости H. pylori к САМ. Индивидуальное лечение с использованием простого режима ИПП/МНЗ привело к успешной эрадикации возбудителя в 94,3% случаев по сравнению с 71,4% при использовании эмпирического стандартного лечения[77]. В более крупном исследовании (218 пациентов) САМ заменяли МНЗ в тройной схеме, если обнаруживался штамм, устойчивый к САМ.Показатели эрадикации составили 91,2% в адаптированной группе против 79,1% и 75,9% при использовании эмпирической тройной терапии на основе MNZ и CAM ( n = 308 в каждой контрольной группе) соответственно ( P < 0,001) [81]. .
Фармакогеномика
Известно, что генетическая изменчивость активности цитохрома P450 (CYP) 2C19 (CYP2C19) влияет на уровни ИПП в плазме и, таким образом, на лечение инфекции H. pylori [82,83]. Выделяют три различных генотипа: быстрый, промежуточный и плохой метаболизаторы.Предварительные данные о потенциальном использовании фармакогеномики были получены в РКИ с 300 H. pylori -положительными пациентами, рандомизированными либо для получения стандартной схемы в течение 1 недели, либо для персонализированной терапии, основанной на статусе чувствительности как CYP2C19, так и CAM, оцененном с помощью генетического тестирования [84]. ]. Показатели эрадикации ИТТ были значительно выше в адаптированной группе (96% против 70%) без увеличения окончательной стоимости успешной эрадикации на одного пациента. В будущем необходимо решить как практические, так и логистические вопросы, прежде чем молекулярный подход сможет широко применяться в качестве подлинной основы для индивидуализации H.pylori эрадикационная терапия.
ЗАКЛЮЧЕНИЕ
На протяжении более десяти лет тройные схемы лечения были стандартом лечения инфекции H. pylori . Однако в последние годы рост распространенности резистентности к макролидам привел к значительному снижению эффективности этих схем, что привело к необходимости проведения большего количества курсов лечения для эрадикации возбудителя. Для поддержания высокой терапевтической эффективности схемы с улучшенной эффективностью в отношении устойчивых к антибиотикам штаммов H.pylori в настоящее время рекомендуются в качестве предпочтительных препаратов первой линии. Сочетанные и последовательные режимы в настоящее время являются наиболее проверенными терапевтическими вариантами первой линии. Гибридная терапия является еще одной эффективной альтернативой на основе CAM и важным конкурентом обоих этих методов лечения. BQT также является допустимым лечением в условиях высокой резистентности к CAM, а также эффективной схемой второй линии, когда схема, основанная на CAM, неэффективна. Из-за быстрого развития резистентности к хинолонам схемы на основе левофлоксацина в настоящее время следует зарезервировать в качестве вариантов лечения второй или более линии.В то время как усилия по улучшению эмпирических методов лечения продолжаются, области генотипического обнаружения чувствительности H. pylori к противомикробным препаратам и фармакогеномика открывают новые захватывающие перспективы. Это гарантирует 100% терапевтическую эффективность: быструю, бескультуральную и неинвазивную.
Сноски
P- Рецензент: Ding SZ, Im SH, Velin D, Zhu YL S- Редактор: Wen LL L- Редактор: A E- Редактор: Wang CH
Ссылки
1. Moayyedi P, Hunt RH. Влияние Helicobacter pylori на общественное здравоохранение.Хеликобактер. 2004; 9 Приложение 1: 67–72. [PubMed] [Google Scholar]2. Малфертейнер П., Чан Ф.К., Макколл К.Е. Язвенная болезнь желудка. Ланцет. 2009; 374:1449–1461. [PubMed] [Google Scholar]3. Куйперс Э.Дж. Helicobacter pylori и риск и лечение сопутствующих заболеваний: гастрита, язвенной болезни, атрофического гастрита и рака желудка. Алимент Фармакол Тер. 1997; 11 Дополнение 1:71–88. [PubMed] [Google Scholar]4. Malfertheiner P, Megraud F, O’Morain CA, Atherton J, Axon AT, Bazzoli F, Gensini GF, Gisbert JP, Graham DY, Rokkas T, et al.Ведение инфекции Helicobacter pylori — Консенсусный отчет Maastricht IV/Florence. Кишка. 2012; 61: 646–664. [PubMed] [Google Scholar]5. Гисберт Дж. П. Необходим ли посев перед терапией первой линии инфекции Helicobacter pylori? Интерн Мед. 2011;50:2717; ответ автора 2719–2720. [PubMed] [Google Scholar]7. Фишбах Л., Эванс Э.Л. Метаанализ: влияние статуса устойчивости к антибиотикам на эффективность тройной и четырехкратной терапии первой линии Helicobacter pylori. Алимент Фармакол Тер.2007; 26: 343–357. [PubMed] [Google Scholar]8. De Francesco V, Giorgio F, Hassan C, Manes G, Vannella L, Panella C, Ierardi E, Zullo A. Устойчивость H. pylori к антибиотикам во всем мире: систематический обзор. J Желудочно-кишечный тракт печени Dis. 2010;19:409–414. [PubMed] [Google Scholar]9. Megraud F, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, Andersen LP, Goossens H, Glupczynski Y. Устойчивость Helicobacter pylori к антибиотикам в Европе и ее связь с потреблением антибиотиков. Кишка. 2013; 62:34–42.[PubMed] [Google Scholar] 10. Боянова Л., Илиева Дж., Гергова Г., Давыдков Л., Спасова З., Камбуров В., Кацаров Н., Митов И. Многочисленные факторы риска антибиотикорезистентности Helicobacter pylori, выявленные в расширенном анамнезе: исследование в Болгарии. J Med Microbiol. 2012;61:85–93. [PubMed] [Google Scholar] 11. Георгопулос С.Д., Ладас С.Д., Каратапанис С., Ментис А., Спилиади С., Артикис В., Раптис С.А. Факторы, которые могут повлиять на исход тройной эрадикационной терапии Helicobacter pylori омепразолом, амоксициллином и кларитромицином.Dig Dis Sci. 2000;45:63–67. [PubMed] [Google Scholar] 12. Ян JC, Лин CJ. Генотипы CYP2C19 в фармакокинетике/фармакодинамике терапии инфекции Helicobacter pylori на основе ингибиторов протонной помпы. Мнение эксперта Препарат Метаб Токсикол. 2010; 6: 29–41. [PubMed] [Google Scholar] 13. Джордж Л.Л., Бороди Т.Дж., Эндрюс П., Девайн М., Мур-Джонс Д., Уолтон М., Брандл С. Лечение язвы двенадцатиперстной кишки после ликвидации Helicobacter pylori. Мед J Aust. 1990; 153: 145–149. [PubMed] [Google Scholar] 14. Баззоли Ф., Поццато П.Терапия инфекции H. pylori. J Physiol Pharmacol. 1997; 48 Дополнение 4:39–46. [PubMed] [Google Scholar] 15. Современные европейские концепции лечения инфекции Helicobacter pylori. Доклад о Маастрихтском консенсусе. Европейская группа по изучению Helicobacter Pylori. Кишка. 1997; 41:8–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]16. Линд Т., Вельдхуйзен ван Зантен С., Унге П., Спиллер Р., Байердорфер Э., О’Морейн С., Бардхан К.Д., Брадетт М., Чиба Н., Врангстад М. и др. Эрадикация Helicobacter pylori с помощью однонедельной тройной терапии, сочетающей омепразол с двумя противомикробными препаратами: исследование MACH I.Хеликобактер. 1996; 1: 138–144. [PubMed] [Google Scholar] 17. Malfertheiner P, Mégraud F, O’Morain C, Hungin AP, Jones R, Axon A, Graham DY, Tytgat G. Современные концепции лечения инфекции Helicobacter pylori — Консенсусный отчет Maastricht 2-2000. Алимент Фармакол Тер. 2002; 16: 167–180. [PubMed] [Google Scholar] 18. Малфертейнер П., Меграуд Ф., О’Морейн С., Баззоли Ф., Эль-Омар Э., Грэм Д., Хант Р., Роккас Т., Вакил Н., Куйперс Э.Дж. Современные концепции лечения инфекции Helicobacter pylori: Консенсусный отчет Maastricht III.Кишка. 2007; 56: 772–781. [Бесплатная статья PMC] [PubMed] [Google Scholar]19. Чей В.Д., Вонг Б.К. Рекомендации Американской коллегии гастроэнтерологов по лечению инфекции Helicobacter pylori. Am J Гастроэнтерол. 2007; 102: 1808–1825. [PubMed] [Google Scholar] 20. Фок К.М., Кателарис П., Сугано К., Анг Т.Л., Хант Р., Тэлли Н.Дж., Лам С.К., Сяо С.Д., Тан Х.Дж., Ву С.И. и др. Второе Азиатско-Тихоокеанское согласованное руководство по инфекции Helicobacter pylori. J Гастроэнтерол Гепатол. 2009; 24:1587–1600. [PubMed] [Google Scholar] 21.Венерито М., Кригер Т., Экер Т., Леандро Г., Малфертейнер П. Мета-анализ четырехкратной терапии висмутом по сравнению с тройной терапией кларитромицином для эмпирического первичного лечения инфекции Helicobacter pylori. пищеварение. 2013;88:33–45. [PubMed] [Google Scholar] 22. Хоубен М.Х., ван де Бик Д., Хенсен Э.Ф., де Краен А.Дж., Раус Э.А., Титгат Г.Н. Систематический обзор эрадикационной терапии Helicobacter pylori — влияние устойчивости к противомикробным препаратам на показатели эрадикации. Алимент Фармакол Тер. 1999; 13:1047–1055. [PubMed] [Google Scholar] 23.Грэм Д.Ю., Куреши В.А. Антибиотикорезистентная инфекция H. pylori и ее лечение. Курр Фарм Дез. 2000; 6: 1537–1544. [PubMed] [Google Scholar] 24. Фишбах Л.А., Ван Зантен С., Дикасон Дж. Мета-анализ: эффективность, нежелательные явления и приверженность, связанные с четырехкомпонентной терапией против Helicobacter pylori первой линии. Алимент Фармакол Тер. 2004; 20:1071–1082. [PubMed] [Google Scholar] 25. де Бур В.А., ван Эттен Р.Дж., Шнеебергер П.М., Титгат Г.Н. Единственный препарат для инфекции Helicobacter pylori: первые результаты с новой тройной монокапсулой висмута.Am J Гастроэнтерол. 2000;95:641–645. [PubMed] [Google Scholar] 26. Лейн Л., Хант Р., Эль-Зимаити Х., Нгуен Б., Осато М., Спенар Дж. Четырехкомпонентная терапия на основе висмута с использованием одной капсулы бискальцитрата висмута, метронидазола и тетрациклина в сочетании с омепразолом по сравнению с омепразолом, амоксициллином и кларитромицином для эрадикации Helicobacter pylori у пациентов с язвой двенадцатиперстной кишки: проспективное рандомизированное многоцентровое исследование в Северной Америке. Am J Гастроэнтерол. 2003; 98: 562–567. [PubMed] [Google Scholar] 27.Malfertheiner P, Bazzoli F, Delchier JC, Celiñski K, Giguère M, Rivière M, Mégraud F. Эрадикация Helicobacter pylori с помощью капсулы, содержащей субцитрат висмута калия, метронидазол и тетрациклин, в сочетании с омепразолом по сравнению с тройной терапией на основе кларитромицина: рандомизированное, открытое исследование -метка, не меньшей эффективности, испытание фазы 3. Ланцет. 2011; 377:905–913. [PubMed] [Google Scholar] 28. Лютер Дж., Хиггинс П.Д., Шенфельд П.С., Моайеди П., Вакил Н., Чей В.Д. Эмпирическая четырехкомпонентная и тройная терапия для первичного лечения инфекции Helicobacter pylori: систематический обзор и метаанализ эффективности и переносимости.Am J Гастроэнтерол. 2010;105:65–73. [PubMed] [Google Scholar] 30. Гисберт Дж. П., Перес-Айса А., Родриго Л., Молина-Инфанте Дж., Модолелл И., Бермехо Ф., Кастро-Фернандес М., Антон Р., Сакристан Б., Косме А. и др. Неотложная терапия третьей линии с висмутсодержащим четырехкомпонентным режимом после неэффективности двух курсов лечения (кларитромицином и левофлоксацином) инфекции H. pylori. Dig Dis Sci. 2014;59:383–389. [PubMed] [Google Scholar] 31. Ford AC, Malfertheiner P, Giguere M, Santana J, Khan M, Moayyedi P. Побочные эффекты солей висмута для эрадикации Helicobacter pylori: систематический обзор и метаанализ.Мир J Гастроэнтерол. 2008; 14:7361–7370. [Бесплатная статья PMC] [PubMed] [Google Scholar]32. Уэббер М.А., Пиддок Л.Дж. Важность эффлюксных насосов в устойчивости бактерий к антибиотикам. J Антимикробная химиотерапия. 2003; 51:9–11. [PubMed] [Google Scholar] 33. Зулло А., Вайра Д., Вакил Н., Хассан С., Гатта Л., Риччи С., Де Франческо В., Менегатти М., Тампиери А., Перна Ф. и др. Высокие показатели эрадикации Helicobacter pylori при новом последовательном лечении. Алимент Фармакол Тер. 2003; 17: 719–726. [PubMed] [Google Scholar] 34.Гисберт Дж. П., Кальвет Х, О’Коннор А., Мегро Ф., О’Морен К.А. Последовательная терапия для эрадикации Helicobacter pylori: критический обзор. Дж. Клин Гастроэнтерол. 2010;44:313–325. [PubMed] [Google Scholar] 35. Гринберг Э.Р., Андерсон Г.Л., Морган Д.Р., Торрес Дж., Чей В.Д., Браво Л.Е., Домингес Р.Л., Ферреччио С., Эрреро Р., Ласкано-Понсе Е.К. и др. 14-дневная тройная, 5-дневная одновременная и 10-дневная последовательная терапия инфекции Helicobacter pylori в семи латиноамериканских учреждениях: рандомизированное исследование. Ланцет. 2011; 378: 507–514.[Бесплатная статья PMC] [PubMed] [Google Scholar]36. Lim JH, Lee DH, Choi C, Lee ST, Kim N, Jeong SH, Kim JW, Hwang JH, Park YS, Lee SH и др. Клинические результаты двухнедельной последовательной и сопутствующей терапии для эрадикации Helicobacter pylori: рандомизированное пилотное исследование. Хеликобактер. 2013;18:180–186. [PubMed] [Google Scholar] 37. Сардарян Х., Факери Х., Хоссейни В., Тагваи Т., Малеки И., Мохтаре М. Сравнение гибридных и последовательных методов лечения Helicobacter pylori в Иране: проспективное рандомизированное исследование.Хеликобактер. 2013;18:129–134. [PubMed] [Google Scholar] 38. Гатта Л., Вакил Н., Вайра Д., Скарпиньято С. Глобальные показатели ликвидации инфекции Helicobacter pylori: систематический обзор и метаанализ последовательной терапии. БМЖ. 2013;347:f4587. [Бесплатная статья PMC] [PubMed] [Google Scholar]39. Георгопулос С., Папастергиу В., Ксирушакис Э., Лауди Ф., Лисгос П., Спилиади С., Папантониу Н., Каратапанис С. Четырехкратная «сопутствующая» терапия без висмута по сравнению со стандартной тройной терапией, продолжительностью 10 дней для лечения H.pylori: рандомизированное исследование. Дж. Клин Гастроэнтерол. 2013;47:228–232. [PubMed] [Google Scholar]40. Георгопулос С., Папастергиу В., Ксирушакис Э., Лауди Ф., Папантониу Н., Лисгос П., Спилиади С., Фрагу П., Скорда Л., Каратапанис С. Оценка «сопутствующей» терапии, состоящей из четырех препаратов, трех антибиотиков, не содержащей висмута, в качестве первой схема эрадикации Helicobacter pylori в Греции. Хеликобактер. 2012;17:49–53. [PubMed] [Google Scholar]41. Gisbert JP, Calvet X. Обновленная информация о четырехкратной (сопутствующей) терапии без висмута для эрадикации Helicobacter pylori.Клин Эксп Гастроэнтерол. 2012;5:23–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]42. Эсса А.С., Крамер Дж.Р., Грэм Д.Ю., Трейбер Г. Мета-анализ: «сопутствующая терапия» с четырьмя препаратами, тремя антибиотиками, не содержащей висмута по сравнению с тройной терапией для эрадикации Helicobacter pylori. Хеликобактер. 2009; 14:109–118. [Бесплатная статья PMC] [PubMed] [Google Scholar]43. Молина-Инфанте Дж., Романо М., Фернандес-Бермехо М., Федерико А., Гравина А.Г., Поццати Л., Гарсия-Абадиа Э., Винагре-Родригес Г., Мартинес-Алькала С., Эрнандес-Алонсо М. и др.Оптимизированная четырехкомпонентная терапия без висмута излечивает большинство пациентов с инфекцией Helicobacter pylori в популяциях с высоким уровнем устойчивости к антибиотикам. Гастроэнтерология. 2013;145:121–128.e1. [PubMed] [Google Scholar]44. Ву Д.К., Хсу П.И., Ву Д.Ю., Опекун А.Р., Куо Ч., Ву И.К., Ван С.С., Чен А., Хунг В.К., Грэм Д.Ю. Последовательная и сопутствующая терапия четырьмя препаратами одинаково эффективна для эрадикации инфекции H. pylori. Клин Гастроэнтерол Гепатол. 2010;8:36–41.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar]45.Макниколл А.Г., Марин А.С., Молина-Инфанте Дж., Кастро М., Баррио Дж., Дюконс Дж., Кальвет Х, де ла Коба С, Монторо М., Бори Ф. и др. Рандомизированное клиническое исследование, сравнивающее последовательную и сопутствующую терапию для эрадикации Helicobacter pylori в рутинной клинической практике. Кишка. 2014; 63: 244–249. [PubMed] [Google Scholar]46. Георгопулос С.Д., Ксирушакис Э., Мартинес-Гонсалес Б., Сгурас Д.Н., Спилиади С., Ментис А.Ф., Лауди Ф. Клиническая оценка десятидневного режима эзомепразола, метронидазола, амоксициллина и кларитромицина для эрадикации Helicobacter pylori при высоком кларитромицине область сопротивления.Хеликобактер. 2013; 18: 459–467. [PubMed] [Google Scholar]47. Хсу П.И., Ву Д.К., Ву Д.Ю., Грэм Д.Ю. Модифицированная последовательная терапия Helicobacter pylori: ингибитор протонной помпы и амоксициллин в течение 14 дней с добавлением кларитромицина и метронидазола в виде четырехкомпонентной (гибридной) терапии в течение последних 7 дней. Хеликобактер. 2011;16:139–145. [Бесплатная статья PMC] [PubMed] [Google Scholar]48. Романо М., Куомо А., Гравина А.Г., Миранда А., Иовене М.Р., Тисо А., Сика М., Рокко А., Салерно Р., Мармо Р. и др. Эмпирическая левофлоксацин-содержащая и кларитромицин-содержащая последовательная терапия для эрадикации Helicobacter pylori: рандомизированное исследование.Кишка. 2010;59:1465–1470. [PubMed] [Google Scholar]49. Бернинг М., Крас С., Мильке С. Должны ли хинолоны стоять на первом месте в терапии Helicobacter pylori? Терапия Adv Гастроэнтерол. 2011;4:103–114. [Бесплатная статья PMC] [PubMed] [Google Scholar]50. Карозерс Дж.Дж., Брюс М.Г., Хеннесси Т.В., Бенслер М., Моррис Дж.М., Ризоновер А.Л., Херлберт Д.А., Паркинсон А.Дж., Коулман Дж.М., МакМахон Б.Дж. Взаимосвязь между предыдущим применением фторхинолонов и устойчивостью к левофлоксацину при инфекции Helicobacter pylori. Клин Инфекция Дис. 2007;44:e5–e8.[PubMed] [Google Scholar]51. Gisbert JP, Morena F. Систематический обзор и метаанализ: схемы спасения на основе левофлоксацина после неудачного лечения Helicobacter pylori. Алимент Фармакол Тер. 2006; 23:35–44. [PubMed] [Google Scholar]52. Саад Р.Дж., Шонфельд П., Ким Х.М., Чей В.Д. Тройная терапия на основе левофлоксацина по сравнению с четырехкомпонентной терапией на основе висмута при персистирующей инфекции Helicobacter pylori: метаанализ. Am J Гастроэнтерол. 2006; 101: 488–496. [PubMed] [Google Scholar]53. Ди Каро С., Фини Л., Дауд Ю., Грицци Ф., Гасбаррини А., Де Лоренцо А., Ди Ренцо Л., Маккартни С., Блум С.Схемы на основе левофлоксацина/амоксициллина по сравнению с четырехкомпонентной терапией для эрадикации Helicobacter pylori во второй линии. Мир J Гастроэнтерол. 2012;18:5669–5678. [Бесплатная статья PMC] [PubMed] [Google Scholar]54. Гисберт Дж. П., Молина-Инфанте Дж., Марин А. С., Винагре Дж., Баррио Дж., МакНичолл АГ. Тройная терапия второй линии с левофлоксацином после неэффективности четырехкратного «последовательного» или «сопутствующего» лечения без висмута для эрадикации инфекции H. pylori. Scand J Гастроэнтерол. 2013; 48: 652–656. [PubMed] [Google Scholar]55.Мураками К., Окимото Т., Кодама М., Танахаши Дж., Фудзиока Т., Икеда Ф., Мураока Х., Такигава М., Сайка Т., Хасегава М. и др. Активность ситафлоксацина в отношении изолятов Helicobacter pylori, в том числе с мутациями gyrA. Противомикробные агенты Chemother. 2009;53:3097–3099. [Бесплатная статья PMC] [PubMed] [Google Scholar]56. Wenzhen Y, Kehu Y, Bin M, Yumin L, Quanlin G, Donghai W, Lijuan Y. Тройная терапия на основе моксифлоксацина по сравнению с тройной терапией на основе кларитромицина для лечения первой линии инфекции Helicobacter pylori: метаанализ рандомизированных контролируемых исследований .Интерн Мед. 2009;48:2069–2076. [PubMed] [Google Scholar]57. Вильгельм С.М., Джонсон Дж.Л., Кале-Прадхан П.Б. Лечение клопов клопами: роль пробиотиков в качестве дополнительной терапии Helicobacter pylori. Энн Фармакотер. 2011;45:960–966. [PubMed] [Google Scholar]58. Лесброс-Пантофличкова Д., Кортези-Теулаз И., Блюм А.Л. Helicobacter pylori и пробиотики. Дж Нутр. 2007; 137:812С–818С. [PubMed] [Google Scholar]59. Du YQ, Su T, Fan JG, Lu YX, Zheng P, Li XH, Guo CY, Xu P, Gong YF, Li ZS. Адъювантные пробиотики улучшают эрадикационный эффект тройной терапии инфекции Helicobacter pylori.Мир J Гастроэнтерол. 2012;18:6302–6307. [Бесплатная статья PMC] [PubMed] [Google Scholar]60. Efrati C, Nicolini G, Cannaviello C, O’Sed NP, Valabrega S. Эрадикация Helicobacter pylori: последовательная терапия и добавка Lactobacillus reuteri. Мир J Гастроэнтерол. 2012;18:6250–6254. [Бесплатная статья PMC] [PubMed] [Google Scholar]61. Манфреди М., Биззарри Б., Саккеро Р.И., Маккари С., Калабрезе Л., Фаббиан Ф., Де’Анджелис Г.Л. Инфекция Helicobacter pylori в клинической практике: пробиотики и комбинация пробиотиков + лактоферрин улучшают соблюдение, но не эрадикацию, при последовательной терапии.Хеликобактер. 2012; 17: 254–263. [PubMed] [Google Scholar]62. Шавахи А., Табеш Э., Ягуткар А., Хашеми Х., Табеш Ф., Ходадостан М., Минакари М., Шавахи С., Голамрезаи А. Влияние мультиштаммового пробиотического соединения на висмутсодержащую четырехкомпонентную терапию инфекции Helicobacter pylori: рандомизированное плацебо-контролируемое тройное -слепое исследование. Хеликобактер. 2013; 18: 280–284. [PubMed] [Google Scholar]63. Szajewska H, Horvath A, Piwowarczyk A. Метаанализ: влияние добавок Saccharomyces boulardii на скорость эрадикации Helicobacter pylori и побочные эффекты во время лечения.Алимент Фармакол Тер. 2010;32:1069–1079. [PubMed] [Google Scholar]64. Zou J, Dong J, Yu X. Метаанализ: четырехкомпонентная терапия, содержащая Lactobacillus, по сравнению со стандартной тройной терапией первой линии для эрадикации Helicobacter pylori. Хеликобактер. 2009; 14:97–107. [PubMed] [Google Scholar]65. Ван Чж, Гао Цюй, Фанг Цзюй. Мета-анализ эффективности и безопасности пробиотических соединений, содержащих Lactobacillus и Bifidobacterium, в эрадикационной терапии Helicobacter pylori. Дж. Клин Гастроэнтерол.2013;47:25–32. [PubMed] [Google Scholar]66. Liou JM, Chen CC, Chen MJ, Chen CC, Chang CY, Fang YJ, Lee JY, Hsu SJ, Luo JC, Chang WH и другие. Последовательная и тройная терапия для лечения Helicobacter pylori первой линии: многоцентровое открытое рандомизированное исследование. Ланцет. 2013; 381: 205–213. [PubMed] [Google Scholar]67. Вакил Н., Вайра Д. Лечение инфекции H. pylori: новые проблемы с устойчивостью к противомикробным препаратам. Дж. Клин Гастроэнтерол. 2013; 47: 383–388. [PubMed] [Google Scholar]68. Тейлор Д.Е., Гэ З., Пурыч Д., Ло Т., Хирацука К.Клонирование и анализ последовательности двух копий гена 23S рРНК Helicobacter pylori и ассоциация устойчивости к кларитромицину с мутациями 23S рРНК. Противомикробные агенты Chemother. 1997; 41: 2621–2628. [Бесплатная статья PMC] [PubMed] [Google Scholar]69. Версалович Дж., Шортридж Д., Киблер К., Гриффи М.В., Бейер Дж., Фламм Р.К., Танака С.К., Грэм Д.Ю., Го М.Ф. Мутации в 23S рРНК связаны с устойчивостью Helicobacter pylori к кларитромицину. Противомикробные агенты Chemother. 1996; 40: 477–480. [Бесплатная статья PMC] [PubMed] [Google Scholar]70.Lehours P, Siffré E, Mégraud F. Мультиплексная ПЦР на ДПО как альтернатива культивированию и тестированию на чувствительность для выявления Helicobacter pylori и ее устойчивости к кларитромицину. БМК Гастроэнтерол. 2011;11:112. [Бесплатная статья PMC] [PubMed] [Google Scholar]71. Mégraud F, Lehours P. Обнаружение Helicobacter pylori и тестирование чувствительности к противомикробным препаратам. Clin Microbiol Rev. 2007; 20:280–322. [Бесплатная статья PMC] [PubMed] [Google Scholar]72. Шаберайтер-Гуртнер С., Хиршль А.М., Драгошич Б., Хуфнагл П., Пуз С., Ковач З., Роттер М., Макристатис А.Новый ПЦР-анализ в реальном времени для выявления инфекции Helicobacter pylori и одновременного определения чувствительности образцов кала и биопсии к кларитромицину. Дж. Клин Микробиол. 2004; 42:4512–4518. [Бесплатная статья PMC] [PubMed] [Google Scholar]73. Де Франческо В., Зулло А., Иерарди Э., Джорджио Ф., Перна Ф., Хассан С., Морини С., Панелла С., Вайра Д. Фенотипическая и генотипическая устойчивость Helicobacter pylori к кларитромицину и терапевтический результат: преимущества и ограничения. J Антимикробная химиотерапия. 2010;65:327–332. [PubMed] [Google Scholar]74.Римбара Э., Фишбах Л.А., Грэм Д.Ю. Оптимальная терапия инфекции Helicobacter pylori. Нат Рев Гастроэнтерол Гепатол. 2011; 8: 79–88. [PubMed] [Google Scholar]75. Баба С., Оиси Ю., Ватанабэ Ю., Ойкава Р., Морита Р., Ёсида Ю., Хираиси Т., Маэхата Т., Нагасе Ю., Фукуда Ю. и др. Молекулярный тест на устойчивость Helicobacter pylori к антибиотикам на основе промывания желудка. пищеварение. 2011; 84: 299–305. [PubMed] [Google Scholar]76. Грэм Д.Ю., Кудо М., Редди Р., Опекун А.Р. Практичный быстрый, малоинвазивный, надежный неэндоскопический метод получения Helicobacter pylori для посева.Хеликобактер. 2005; 10:1–3. [PubMed] [Google Scholar]77. Каваи Т., Ямагиши Т., Яги К., Катаока М., Каваками К., Софуни А., Итои Т., Сакаи Ю., Мориясу Ф., Осака Ю. и др. Индивидуальная эрадикационная терапия, основанная на чувствительности фекальных Helicobacter pylori к кларитромицину. J Гастроэнтерол Гепатол. 2008;23 Приложение 2:S171–S174. [PubMed] [Google Scholar]78. Моррис Дж.М., Ризоновер А.Л., Брюс М.Г., Бруден Д.Л., МакМахон Б.Дж., Сакко Ф.Д., Берг Д.Е., Паркинсон А.Дж. Оценка seaFAST, быстрого флуоресцентного теста гибридизации in situ, для обнаружения Helicobacter pylori и устойчивости к кларитромицину в срезах биопсии, залитых парафином.Дж. Клин Микробиол. 2005;43:3494–3496. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Йилмаз О., Демирай Э., Тюмер С., Алтунгёз О., Йорукоглу К., Сойтюрк М., Симшек И. Обнаружение Helicobacter pylori и определение чувствительности к кларитромицину с использованием фиксированных формалином и залитых парафином образцов биопсии желудка путем флуоресцентной гибридизации in situ. Хеликобактер. 2007; 12: 136–141. [PubMed] [Google Scholar]80. Камбау Э., Аллерхейлиген В., Кулон С., Корбель С., Ласколс С., Дефорж Л., Сусси С.Дж., Дельшер Дж.С., Мегро Ф.Оценка нового теста генотипа HelicoDR для молекулярного обнаружения устойчивости к антибиотикам у Helicobacter pylori. Дж. Клин Микробиол. 2009;47:3600–3607. [Бесплатная статья PMC] [PubMed] [Google Scholar]81. Lee HJ, Kim JI, Cheung DY, Kim TH, Jun EJ, Oh JH, Chung WC, Kim BW, Kim SS, Park SH и др. Эрадикация Helicobacter pylori по точечным мутациям 23S рибосомной РНК, ассоциированным с резистентностью к кларитромицину. J заразить Dis. 2013; 208:1123–1130. [PubMed] [Google Scholar]82. Фурута Т., Шираи Н., Такашима М., Сяо Ф., Ханай Х., Сугимура Х., Охаси К., Исидзаки Т., Канеко Э.Влияние генотипических различий в CYP2C19 на показатели излечения от инфекции Helicobacter pylori тройной терапией с ингибитором протонной помпы, амоксициллином и кларитромицином. Клин Фармакол Тер. 2001; 69: 158–168. [PubMed] [Google Scholar]83. Sim SC, Risinger C, Dahl ML, Aklillu E, Christensen M, Bertilsson L, Ingelman-Sundberg M. Распространенный новый вариант гена CYP2C19 вызывает сверхбыстрый метаболизм лекарств, связанный с лекарственной реакцией на ингибиторы протонной помпы и антидепрессанты. Клин Фармакол Тер. 2006; 79: 103–113.[PubMed] [Google Scholar]84. Фурута Т., Шираи Н., Кодаира М., Сугимото М., Ногаки А., Курияма С., Иваидзуми М., Ямаде М., Теракава И., Охаси К. и др. Основанный на фармакогеномике индивидуальный и стандартный терапевтический режим для эрадикации H. pylori. Клин Фармакол Тер. 2007; 81: 521–528. [PubMed] [Google Scholar]Что входит в тройную терапию для эрадикации инфекции Helicobacter pylori?
Флорес-Тревиньо С., Мендоса-Олазаран С., Боканегра-Ибариас П., Мальдонадо-Гарса Х.Дж., Гарса-Гонсалес Э.Лекарственная устойчивость Helicobacter pylori: изменения в терапии и проблемы. Expert Rev Gastroenterol Hepatol . 5 июля 2018 г. [Medline].
[Руководство] Chey WD, Leontiadis GI, Howden CW, Moss SF. Клинические рекомендации ACG: Лечение инфекции Helicobacter pylori. Am J Гастроэнтерол . 2017 фев. 112 (2): 212-239. [Медлайн].
О’Коннор А., Молина-Инфанте Дж., Гисберт Дж. П., О’Морейн С. Лечение инфекции Helicobacter pylori 2013. Хеликобактер . 18 сентября 2013 г., Приложение 1: 58–65. [Медлайн].
Malfertheiner P, Megraud F, O’Morain CA, Gisbert JP, Kuipers EJ, Axon AT et. др. Ведение инфекции Helicobacter pylori — Консенсусный отчет Maastricht V/Florence. Гут . 2017 Янв. 66 (1): 6-30. [Медлайн].
Chey WD, Вонг Британская Колумбия. Рекомендации Американской коллегии гастроэнтерологов по лечению инфекции Helicobacter pylori. Am J Гастроэнтерол .2007 авг. 102(8):1808-25. [Медлайн].
Санчес-Дельгадо Х., Гарсия-Иглесиас П., Кастро-Фернандес М., Бори Ф., Баренис М., Буханда Л. Десятидневная тройная терапия высокими дозами эзомепразола, амоксициллина и метронидазола обеспечивает высокие показатели эрадикации Helicobacter pylori. Алимент Фармакол Тер . 2012 г. 36 июля (2): 190-6. [Медлайн].
Нисидзава Т., Маэкава Т., Ватанабэ Н., Харада Н., Хосода Й., Йошинага М. и др. Кларитромицин по сравнению с метронидазолом в качестве первой линии эрадикации Helicobacter pylori: многоцентровое проспективное рандомизированное контролируемое исследование в Японии. Дж Клин Гастроэнтерол . 2015 г. 49 июля (6): 468-71. [Медлайн].
Малфертейнер П., Мегро Ф., О’Морен С., Белл Д., Бьянки Порро Г., Дельтенр М. и др. Современные европейские концепции лечения инфекции Helicobacter pylori — Маастрихтский консенсусный отчет. Европейская группа по изучению Helicobacter Pylori (EHPSG). Eur J Гастроэнтерол Гепатол . 1997 9 января (1): 1-2. [Медлайн].
Юань Ю., Форд А.С., Хан К.Дж., Гисберт Дж.П., Форман Д., Леонтиадис Г.И. и др.Оптимальная продолжительность схем эрадикации Helicobacter pylori. Кокрановская база данных Syst Rev . 2013 11 декабря. CD008337. [Медлайн].
Nyssen OP, McNicholl AG, Megraud F, Savarino V, Oderda G, Fallone CA, et al. Последовательная и стандартная тройная терапия первой линии для эрадикации Helicobacter pylori. Кокрановская база данных Syst Rev . 2016 28 июня. CD009034. [Медлайн].
Liou JM, Fang YJ, Chen CC, Bair MJ, Chang CY, Lee YC et.др. Сопутствующая квадротерапия висмутом и 14-дневная тройная терапия в первой линии лечения Helicobacter pylori: многоцентровое открытое рандомизированное исследование. Ланцет . 2016 12 ноября. 388 (10058): 2355-2365. [Медлайн].
Зулло А., Де Франческо В., Хассан С., Ридола Л., Репичи А., Бруззезе В. и др. Модифицированные схемы последовательной терапии для эрадикации Helicobacter pylori: систематический обзор. Раскопки печени Dis . 2013 янв. 45(1):18-22. [Медлайн].
Зулло А., Хасан С., Ридола Л., Де Франческо В., Вайра Д.Стандартная тройная и последовательная терапия для эрадикации Helicobacter pylori: обновление. Европейско-медицинский интерн . 2013 24 января (1): 16-9. [Медлайн].
Уйгун А., Кадаифчи А., Есилова З., Сафали М., Илган С., Караерен Н. Сравнение последовательного и стандартного трехкомпонентного режима эрадикации Helicobacter pylori: 14-дневное, открытое, рандомизированное, проспективное, параллельное исследование исследование у взрослых пациентов с неязвенной диспепсией. Клин Тер . 2008 30 марта (3): 528-34.[Медлайн].
Цянь Дж., Е Ф., Чжан Дж., Ян Ю.М., Ту Х.М., Цзян К. и др. Тройная и последовательная терапия, содержащая левофлоксацин, или стандартная последовательная терапия в качестве терапии первой линии для эрадикации Helicobacter pylori в Китае. Хеликобактер . 2012 г. 17 (6): 478-85 декабря. [Медлайн].
Liou JM, Chen CC, Chang CY, Chen MJ, Fang YJ, Lee JY и другие. Эффективность последовательной терапии, основанной на генотипической резистентности, в третьей линии лечения рефрактерной инфекции Helicobacter pylori: многоцентровое клиническое исследование. J Antimicrob Chemother . 2013 фев. 68(2):450-6. [Медлайн].
Liou JM, Chen CC, Chen MJ, Chen CC, Chang CY, Fang YJ. Последовательная и тройная терапия для лечения Helicobacter pylori первой линии: многоцентровое открытое рандомизированное исследование. Ланцет . 2013 19 января. 381(9862):205-13. [Медлайн].
Манфреди М., Биззарри Б., де’Анджелис Г.Л. Инфекция Helicobacter pylori: последовательная терапия с последующей тройной терапией, содержащей левофлоксацин, обеспечивает хорошую кумулятивную скорость эрадикации. Хеликобактер . 2012 17 августа (4): 246-53. [Медлайн].
Molina-Infante J, Pazos-Pacheco C, Vinagre-Rodriguez G, Perez-Gallardo B, Dueñas-Sadornil C, Hernandez-Alonso M. Четверная (сопутствующая) терапия без висмута: эмпирическая и адаптированная эффективность по сравнению со стандартной тройной терапией для кларитромицина. чувствительных Helicobacter pylori и последовательной терапии штаммов, устойчивых к кларитромицину. Хеликобактер . 2012 17 августа (4): 269-76. [Медлайн].
Kongchayanun C, Vilaichone RK, Pornthisarn B, Amornsawadwattana S, Mahachai V. Пилотные исследования по определению оптимальной продолжительности сопутствующей эрадикационной терапии Helicobacter pylori в Таиланде. Хеликобактер . 2012 17 августа (4): 282-5. [Медлайн].
Georgopoulos S, Papastergiou V, Xirouchakis E, Laoudi F, Lisgos P, Spiliadi C. Четырехкратная «сопутствующая» терапия без висмута по сравнению со стандартной тройной терапией, продолжительностью 10 дней, для первой линии H.pylori: рандомизированное исследование. Дж Клин Гастроэнтерол . 2013 март 47(3):228-32. [Медлайн].
Ким С.Ю., Ли С.В., Хён Дж.Дж., Юнг С.В., Ку Дж.С., Йим Х.Дж. Сравнительное исследование показателей эрадикации Helicobacter pylori при 5-дневной четырехкомпонентной «сопутствующей» терапии и 7-дневной стандартной тройной терапии. Дж Клин Гастроэнтерол . 2013 янв. 47 (1): 21-4. [Медлайн].
Yanai A, Sakamoto K, Akanuma M, Ogura K, Maeda S. Четырехкомпонентная терапия без висмута для эрадикации Helicobacter pylori первой линии: рандомизированное исследование в Японии. World J Gastrointest Pharmacol Ther . 2012 6 фев. 3(1):1-6. [Медлайн].
Молина-Инфанте Дж., Лусендо А.Дж., Ангейра Т., Родригес-Теллес М., Перес-Айса А., Бальбоа А. и др. Оптимизированная эмпирическая тройная и сопутствующая терапия для эрадикации Helicobacter pylori в клинической практике: исследование OPTRICON. Алимент Фармакол Тер . 2015 март 41 (6): 581-9. [Медлайн].
Сардарян Х., Факери Х., Хоссейни В., Тагваи Т., Малеки И., Мохтаре М.Сравнение гибридной и последовательной терапии для эрадикации Helicobacter pylori в Иране: проспективное рандомизированное исследование. Хеликобактер . 2013 18 апреля (2): 129-34. [Медлайн].
Hsu PI, Kao SS, Wu DC, Chen WC, Peng NJ, Yu HC, et al. Рандомизированное контролируемое исследование, сравнивающее обратную гибридную терапию и стандартную тройную терапию при инфекции Helicobacter pylori. Медицина (Балтимор) . 2015 Декабрь 94 (48): e2104. [Медлайн].
Tay CY, Windsor HM, Thirriot F, Lu W, Conway C, Perkins TT.Эрадикация Helicobacter pylori в Западной Австралии с использованием новых комбинаций квадротерапии. Алимент Фармакол Тер . 2012 36 декабря (11-12): 1076-83. [Медлайн].
Грэм Д.Ю., Ханаан И., Махер Дж., Винер Г., Халтен К.Г., Калфус И.Н. Тройная терапия на основе рифабутина (RHB-105) для эрадикации Helicobacter pylori : двойное слепое рандомизированное контролируемое исследование. Энн Интерн Мед . 2020 16 июня. 172 (12): 795-802. [Медлайн].
Куо Ч., Хсу П.И., Куо Ф.К., Ван С.С., Ху Х.М., Лю К.Дж.Сравнение 10-дневной квадротерапии висмута с высокими дозами метронидазола или левофлоксацина для второй линии терапии Helicobacter pylori: рандомизированное контролируемое исследование. J Antimicrob Chemother . 2013 янв. 68 (1): 222-8. [Медлайн].
Салазар К.О., Карденас В.М., Редди Р.К., Домингес Д.К., Снайдер Л.К., Грэм Д.Ю. Более 95% успеха при 14-дневной четырехкратной антихеликобактерной терапии висмута пилори: пилотное исследование среди латиноамериканцев в США. Хеликобактер . 2012 окт.17(5):382-90. [Медлайн].
Xie Y, Zhu Z, Wang J, Zhang L, Zhang Z, Lu H и др. Десятидневная четырехкомпонентная терапия, включающая низкие дозы рабепразола, висмута, амоксициллина и тетрациклина, является эффективным и безопасным лечением первой линии при инфекции Helicobacter pylori у населения с высокой устойчивостью к антибиотикам: проспективное многоцентровое рандомизированное клиническое исследование с параллельным контролем в Китае. Антимикробные агенты Chemother . 2018 18 июня. [Medline].[Полный текст].
Yagbasan A, Coşkun DÖ, Özbakir Ö, Deniz K, Gürsoy Ş, Yücesoy M. Проспективное рандомизированное исследование, сравнивающее 7-дневную и 14-дневную четырехкомпонентную терапию в качестве терапии первой линии при инфекции Helicobacter pylori у пациентов с функциональной диспепсией. Нигер J Clin Pract . 2018 21 января (1): 54-58. [Медлайн].
Шах А., Джавид Г., Заргар С.А., Тели Ф., Хан Б.А., Ятту Г.Н. Безопасность и эффективность 1-недельной тройной терапии на основе левофлоксацина в качестве терапии первой линии язвенной болезни, связанной с Helicobacter pylori, в Кашмире, Индия. Индийский J Гастроэнтерол . 2013 32 января (1): 32-6. [Медлайн].
Peedikayil MC, Alsohaibani FI, Alkhenizan AH. Терапия первой линии на основе левофлоксацина по сравнению со стандартной терапией первой линии для эрадикации Helicobacter pylori: метаанализ рандомизированных контролируемых исследований. PLoS One . 2014 21 января. 9 (1): e85620. [Медлайн].
Куадрадо-Лавин А., Сальсинес-Кавьедес Дж. Р., Карраскоса М. Ф., Дирсен-Сотос Т., Кобо М., Кампос М. Р. и др.Левофлоксацин по сравнению с кларитромицином в 10-дневной схеме тройной терапии для первой линии эрадикации Helicobacter pylori: однократное слепое рандомизированное клиническое исследование. J Antimicrob Chemother . 2012 Сентябрь 67 (9): 2254-9. [Медлайн].
Кале-Прадхан П.Б., Михаеску А., Вильгельм С.М. Последовательная терапия фторхинолонами Helicobacter pylori: метаанализ. Фармакотерапия . 2015 35 августа (8): 719-30. [Медлайн].
Федерико А., Нардоне Г., Гравина А.Г., Иовене М.Р., Миранда А., Сравнить Д.Эффективность 5-дневной сопутствующей терапии левофлоксацином в эрадикации инфекции Helicobacter pylori. Гастроэнтерология . 2012 июль 143(1):55-61.e1; викторина e13-4. [Медлайн].
Фу В., Сун З., Чжоу Л., Сюэ Ю., Дин Ю., Суо Б. и др. Рандомизированное клиническое исследование: эзомепразол, висмут, левофлоксацин и амоксициллин или цефуроксим в качестве схем эрадикации первой линии для инфекции Helicobacter pylori. Научные раскопки . 2017 июнь 62 (6): 1580-1589. [Медлайн].
Su J, Zhou X, Chen H, Hao B, Zhang W, Zhang G. Эффективность висмутсодержащей четырехкомпонентной терапии 1-й линии с левофлоксацином или кларитромицином для эрадикации инфекции Helicobacter pylori: 1 неделя, открытое исследование , рандомизированное исследование. Медицина (Балтимор) . 2017 Февраль 96 (7): e5859. [Медлайн].
Malfertheiner P, Megraud F, O’Morain CA, Atherton J, Axon AT, Bazzoli F. Управление инфекцией Helicobacter pylori — Maastricht IV/Florence Consensus Report. Гут . 2012 май. 61(5):646-64. [Медлайн].
Liang X, Xu X, Zheng Q, Zhang W, Sun Q, Liu W. Эффективность четырехкомпонентной терапии, содержащей висмут, при инфекциях Helicobacter pylori, устойчивых к кларитромицину, метронидазолу и фторхинолонам, в проспективном исследовании. Клин Гастроэнтерол Гепатол . 11 июля 2013 г. (7): 802-7.e1. [Медлайн].
Sokwala A, Shah MV, Devani S, Yonga G. Эрадикация Helicobacter pylori: рандомизированное сравнительное исследование 7-дневной и 14-дневной тройной терапии. S Afr Med J . 2012 июнь 102 (6 часть 2): 368-71. [Медлайн].
Селик М., Йигит М. Эффективность последовательной терапии, содержащей левофлоксацин, с висмутом или без него, при эрадикации Helicobacter Pylori при неязвенной диспепсии. Acta Gastroenterol Belg . 2017 январь-март. 80 (1):39-42. [Медлайн].
Лечение инфекции Helicobacter pylori
1. Schubert TT, Шуберт АБ, Ма СК. Симптомы, гастрит и Helicobacter pylori у пациентов, направленных на эндоскопию. Гастроинтест Эндоск . 1992;38:357–60….
2. Дули С.П., Коэн Х, Фитцгиббонс PL, Бауэр М, Appleman MD, Перес-Перес Г.И., и другие. Распространенность инфекции Helicobacter pylori и гистологического гастрита у бессимптомных лиц. N Английский J Med . 1989; 321:1562–6.
3. Заражение Helicobacter pylori. IARC Monogr Eval Carcinog Risks Hum . 1994; 61: 177–240.
4.Грэм Д.Ю., Малатый Х.М., Эванс Д.Г., Эванс диджей младший, Кляйн П.Д., Адам Э. Эпидемиология Helicobacterpylori среди бессимптомной популяции в США. Влияние возраста, расы и социально-экономического статуса. Гастроэнтерология . 1991; 100:1495–501.
5. Брейер Т., Гудман К.Дж., Малатый Х.М., Судхоп Т, Грэм Д.Ю. Как клиницисты, практикующие в США, лечат желудочно-кишечные заболевания, связанные с Helicobacter pylori? Сравнение врачей первичного звена и врачей-специалистов. Am J Гастроэнтерол . 1998; 93: 553–61.
6. Блюм А.Л., Талли Нью-Джерси, О’Морейн С, ван Зантен С.В., Лабенз Дж, Столте М, и другие. Отсутствие эффекта от лечения инфекции Helicobacter pylori у пациентов с неязвенной диспепсией. N Английский J Med . 1998; 339: 1875–81.
7. Хауден К.В., Охота на РХ. Руководство по лечению инфекции Helicobacter pylori. Специальный комитет по параметрам практики Американского колледжа гастроэнтерологии. Am J Гастроэнтерол . 1998;93:2330–8.
8. Заявление о медицинской позиции Американской гастроэнтерологической ассоциации: оценка диспепсии. Гастроэнтерология . 1998; 114: 579–81.
9. Forbes GM, Глейзер М.Е., Каллен диджей, Уоррен Дж.Р., Кристиансен К.Дж., Маршалл Б.Дж., и другие. Язва двенадцатиперстной кишки, леченная с помощью эрадикации Helicobacter pylori: семилетнее наблюдение Lancet . 1994; 343: 258–60.
10. Лайне Л., Хопкинс Р.Дж., Жирарди Л.С. Было ли преувеличено влияние терапии Helicobacter pylori на рецидив язвы в Соединенных Штатах? Метаанализ строго спланированных испытаний. Am J Гастроэнтерол . 1998; 93: 1409–15.
11. Грэм Д.Ю., Лью ГМ, Кляйн П.Д., Эванс Д.Г., Эванс диджей младший, Саид З.А., и другие. Влияние лечения инфекции Helicobacter pylori на долгосрочное рецидивирование язвы желудка или двенадцатиперстной кишки. Энн Интерн Мед . 1992; 116: 705–8.
12. Лайне Л., Шенфельд П., Феннерти МБ. Терапия Helicobacter pylori у больных неязвенной диспепсией. Метаанализ рандомизированных контролируемых исследований. Энн Интерн Мед . 2001; 134: 361–9.
13. Моайеди П., Су С, Дикс Дж, Делани Б, Харрис А, Иннес М, и другие. Эрадикация Helicobacter pylori при неязвенной диспепсии. Система базы данных Кокрейн, версия . 2001;1:CD002096.
14. Helicobacter pylori при язвенной болезни. Группа разработки консенсуса NIH по Helicobacter pylori при язвенной болезни. ЯМА . 1994; 272: 65–9.
15. Шерман П., Хассалл Э, Хант РХ, Фаллоне Калифорния, Вельдхуйзен Ван Зантен С., Томсон АБ. Консенсусная конференция Канадской исследовательской группы Helicobacter по подходу к инфекции Helicobacter pylori у детей и подростков. Кан J Гастроэнтерол . 1999; 13: 553–59.
16. Эбелл М.Х., Варбасс Л, Бреннер С. Оценка пациента с диспепсией: исследование полезности затрат. J Fam Pract . 1997; 44: 545–55.
17. Ву Дж.С., Сун Джей Джей, Нг ЭК, Иди МОЙ, Чан ВБ, Чан ФК, и другие. Распространенность и распространение Helicobacter pylori при гастроэзофагеальной рефлюксной болезни: исследование с Востока. Am J Гастроэнтерол .1999; 94:1790–4.
18. Снайдер Д.Д., Вельдхейзен Ван Зантен С. Новые диагностические тесты для выявления инфекции Helicobacter pylori: педиатрическая перспектива. Кан J Гастроэнтерол . 1999; 13: 585–9.
19. Вельдхуйзен Ван Зантен С., Тытгат КМ, деГара СиДжей, Голди Дж, Рашид Ф.А., Боуэн БМ, и другие. Проспективное сравнение симптомов и пяти диагностических тестов у пациентов с положительной и отрицательной диспепсией Helicobacter pylori. Eur J Гастроэнтерол Гепатол . 1991; 3: 463–8.
20. Мегро Ф. Как следует диагностировать инфекцию Helicobacter pylori? Гастроэнтерология . 1997; 113 (6 дополнений): S93–8.
21. Перес-Траллеро Э., Монтес М, Алькорта М, Зубиллага П, Теллерия Э. Неэндоскопический метод получения Helicobacter pylori для посева. Ланцет . 1995; 345: 622–3.
22. Фельдман М, Крайер Б, Ли Э, Петерсон ВЛ.Роль сероконверсии в подтверждении излечения от инфекции Helicobacter pylori. ЯМА . 1998; 280:363–5.
23. Коннор С.Дж., Нгу МЦ, Кателарис РН. Влияние краткосрочного использования ранитидина на точность 13C-уреазного дыхательного теста у субъектов, инфицированных Helicobacter pylori. Eur J Гастроэнтерол Гепатол . 1999; 11:1135–8.
24. Тревизани Л., Сартори С, Руина М, Казелли М, Росси МР, Коста Ф, и другие.Тест на антиген стула Helicobacter pylori: клиническая оценка и анализ стоимости нового иммуноферментного анализа. Научные раскопки . 1999;44:2303–6.
25. Определение эрадикации Helicobacter pylori (Hp) с помощью теста на антиген кала HP (HPSAT) [Аннотация]. Европейская группа по изучению Helicobacter pylori. XI Международный семинар по гастродуоденальной патологии и Helicobacter pylori. Будапешт, Венгрия, 2–5 сентября 1998 г. Gut . 1998; 43 (дополнение 2): A50.
26.Мегро Ф. Резистентность Helicobacter pylori к антибиотикам: основное ограничение современной тройной терапии ингибиторами протонной помпы. Eur J Гастроэнтерол Гепатол . 1999; 11 (прил. 2): S35–7.
27. Грэм Д.Ю., Лью ГМ, Малатый Х.М., Эванс Д.Г., Эванс диджей младший, Кляйн П.Д., и другие. Факторы, влияющие на эрадикацию Helicobacter pylori при тройной терапии. Гастроэнтерология . 1992; 102: 493–6.
28. Хопкинс Р.Дж. Текущие одобренные FDA методы лечения Helicobacter pylori и процесс утверждения FDA. Гастроэнтерология . 1997; 113 (6 доп.): S126–30.
29. Адамек Р.Дж., Вегенер М, Лабенз Дж, Фрайтаг М, Опферкух В, Рул ГХ. Среднесрочные результаты пероральной и внутривенной эрадикационной терапии омепразолом/амоксициллином Helicobacter pylori. Am J Гастроэнтерол . 1994; 89: 39–42.
30.Пилотто А, Леандро Г, Франчески М, Рассу М, Боццола Л, Фурлан Ф, и другие. Влияние устойчивости к антибиотикам на исход трех недельной тройной терапии против Helicobacter pylori. Aliment Pharmacol Ther . 1999; 13: 667–73.
31. Грэм Д.Ю. Основные моменты 100-го ежегодного собрания Американской гастроэнтерологической ассоциации и Недели заболеваний пищеварительного тракта. Орландо, Флорида, 16–19 мая 1999 г.; Helicobacter Today [Монография]: Vol.6, Серия А.
32. де Бур В, Дриссен В, Янш А, Титгат Г. Влияние подавления кислотности на эффективность лечения инфекции Helicobacter pylori. Ланцет . 1995; 345: 817–20.
33. Мильке С. Антимикробная терапия язвенной болезни. Противомикробные агенты Int J . 1997; 8: 171–8.
34. Петерсон В.Л., Чочиола А.А., Сайкс ДЛ, Максорли диджей, Уэбб ДД. Ранитидина висмута цитрат плюс кларитромицин эффективны для заживления язв двенадцатиперстной кишки, эрадикации H.pylori и уменьшение рецидивов язвы. Aliment Pharmacol Ther . 1996; 10: 251–61.
35. ван дер Хюльст РВ, Келлер Дж., Раус Э.А., Титгат ГН. Лечение инфекции Helicobacter pylori: обзор мировой литературы. Хеликобактер . 1996; 1: 6–19.
36. Курата Дж. Х., Ногава АН. Метаанализ факторов риска язвенной болезни. Нестероидные противовоспалительные препараты, Helicobacter pylori и курение. Дж Клин Гастроэнтерол .1997; 24:2–17.
37. Грэм Д.Ю. Нестероидные противовоспалительные препараты, Helicobacter pylori и язвы: наша позиция. Am J Гастроэнтерол . 1996;91:2080–6.
38. Гомоллон Ф, Дюконс Дж.А., Ферреро М, Гарсия Кабесудо Дж, Гирао Р, Саймон М.




 Но все равно не все пациенты обращаются к врачу. Принимают симптоматические препараты, соду — им становится немного легче. У кого невысокий болевой порог, живут с болями. И это ведет к печальным результатам. Так возникают запущенные формы рака желудка. Поэтому если периодически возникают боли в желудке, запоры и понос, нужно обследоваться.
Но все равно не все пациенты обращаются к врачу. Принимают симптоматические препараты, соду — им становится немного легче. У кого невысокий болевой порог, живут с болями. И это ведет к печальным результатам. Так возникают запущенные формы рака желудка. Поэтому если периодически возникают боли в желудке, запоры и понос, нужно обследоваться.