диагностика и лечение заболеваний, которые она вызывает, в клинике МЕДСИ в Санкт-Петербурге
Оглавление
Бактерия Helicobacter pylori относится к грамотрицательным спиралевидным микроорганизмам и обычно «поселяется» в антральной части желудка. Продукты ее жизнедеятельности способны вызывать развитие эрозивно-язвенных, воспалительных или атрофических процессов в слизистой оболочке желудка или двенадцатиперстной кишки и провоцируют такие заболевания, как язвенная болезнь, гастрит, дуоденит и рак.
По оценкам различных авторов, во всем мире инфицированность этим микроорганизмом достигает более 60 % (15-25 % в странах Европы и Северной Америки и более 90% в странах третьего мира). В России инфицированность взрослого населения колеблется от 65% (Санкт-Петербург) до 92% Москва, Красноярск). Считают, что Helicobacter pylori распространился из Восточной Африки около 58000 лет назад. В настоящее время в 27 регионах мира выявлено 370 штаммов Helicobacter pylori.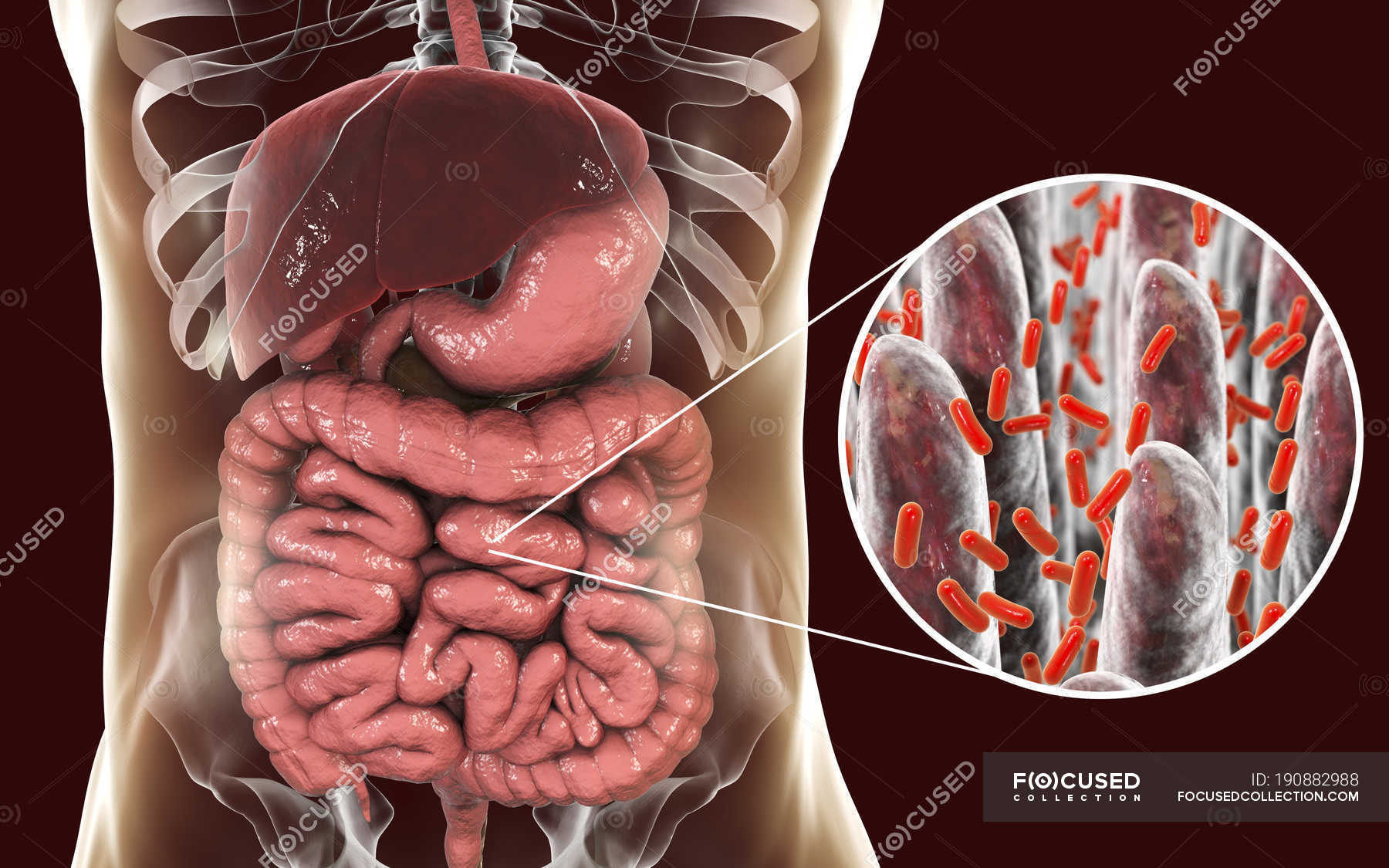
История
Первые сведения об данном микроорганизме даны немецкими учеными в 1875 г. (бактерия не росла на известных в то время искусственных питательных средах, и это случайное открытие было забыто). Потом имеются упоминания в работах 1886 года профессора Валерия Яворского из Ягеллонского университета (назвал обнаруженную им бактерию Vibrio rugula и был первым, кто предположил возможную этиологическую роль этого микроорганизма в патогенезе заболеваний желудка), в 1974 г. в работах профессора И. А. Морозова (обнаружил спиралевидные бактерии в материале больных после ваготомии во внутриклеточных канальцах клеток желудка, а также у больных язвой, которым не делали ваготомию). Бактерия была вновь открыта в 1979 году австралийским патологом Робином Уорреном, который затем провёл дальнейшие исследования её вместе с Барри Маршаллом. Уоррену и Маршаллу удалось выделить, изолировать и культвировать этот микроорганизм из проб слизистой оболочки желудка человека.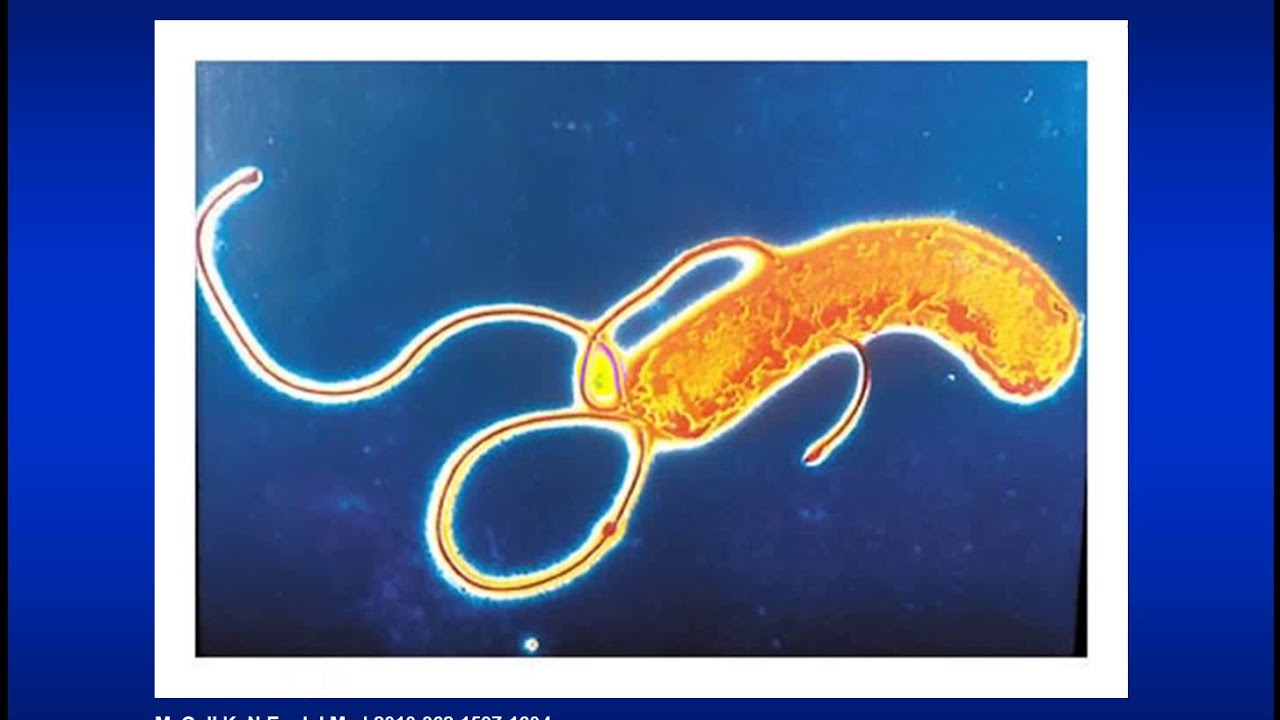
Протекание болезни
После попадания в желудок H. pylori, двигаясь при помощи жгутиков, преодолевает защитный слой слизи и колонизирует слизистую оболочку желудка. Закрепившись на поверхности слизистой, бактерия начинает вырабатывать уреазу, благодаря чему в слизистой оболочке и слое защитной слизи поблизости от растущей колонии растёт концентрация аммиака и повышается pH. По механизму отрицательной обратной связи это вызывает повышение секреции гастрина клетками слизистой желудка и компенсаторное повышение секреции соляной кислоты и пепсина, с одновременным снижением секреции бикарбонатов.
Эндотоксин VacA, вырабатываемый бактерией, вызывают вакуолизацию и гибель клеток эпителия желудка.![]() Продукты гена СagA вызывают дегенерацию клеток эпителия желудка, вызывая изменения их фенотипа клеток. Привлечённые воспалением лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой. Таким образом запускается механизм воспалительных и эрозивно-язвенных изменений в слизистой оболочке желудка и двенадцатиперстной кишки и программируемой клеточной гибели клеток эпителия желудка с запуском каскада изменений слизистой желудка (каскад Cоrrea) – нормальная слизистая – атрофия слизистой желудка – метаплазия – дисплазия – рак. Эксперты Всемирной Организации Здравоохранения признали микроорганизм Helicobacter pylori абсолютно доказанным канцерогеном 1 класса. В России ежегодно регистрируется более 37000 новых случаев рака желудка. Эта патология заняла четвертое место среди опухолевых заболеваний и второе место по структуре смертности от онкологической патологии.
Продукты гена СagA вызывают дегенерацию клеток эпителия желудка, вызывая изменения их фенотипа клеток. Привлечённые воспалением лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой. Таким образом запускается механизм воспалительных и эрозивно-язвенных изменений в слизистой оболочке желудка и двенадцатиперстной кишки и программируемой клеточной гибели клеток эпителия желудка с запуском каскада изменений слизистой желудка (каскад Cоrrea) – нормальная слизистая – атрофия слизистой желудка – метаплазия – дисплазия – рак. Эксперты Всемирной Организации Здравоохранения признали микроорганизм Helicobacter pylori абсолютно доказанным канцерогеном 1 класса. В России ежегодно регистрируется более 37000 новых случаев рака желудка. Эта патология заняла четвертое место среди опухолевых заболеваний и второе место по структуре смертности от онкологической патологии.
Диагностика и лечение
По Киотскому консенсусу, консенсусу Маастрихт V, рекомендаций Российской гастроэнтерологической ассоциации рассмотрены вопросы диагностики и оптимизации эрадикационной терапии Нр. Стратегия «тестируй на Helicobacter pylori и лечи» признана наиболее эффективной мерой профилактики некардиального рака желудка, лечения язвенной болезни и гастрита. Существующие неинвазивные (дыхательный уреазный тест, 13С – уреазный дыхательный тест, определение антигенов НР в кале, ПЦР НР в кале) и нвазивные (серологический метод исследования антител НР в крови, быстрый уреазный тест (проводится при ФГДС в биоптате слизистой желудка), бактериологическое исследование на НР, микроскопическое исследование биоптата слизистой желудка на НР) тесты диагностики позволяют с разной точностью диагностировать инфицированность Helicobacter pylori. Согласно международным согласительным рекомендациям по диагностике и лечению болезней, ассоциированных с хеликобактером золотым стандартом определения хеликобактериоза, является сочетание уреазного дыхательного теста с определением хеликобактерного антигена в кале при помощи иммуноферментного анализа. Эрадикация H. pylori устраняет воспалительный ответ слизистой желудка, приводит к обратному развитию атрофии желудка, если нет кишечной метаплазии, останавливает прогрессирование повреждения слизистой желудка до предраковых изменений и в рак.
Стратегия «тестируй на Helicobacter pylori и лечи» признана наиболее эффективной мерой профилактики некардиального рака желудка, лечения язвенной болезни и гастрита. Существующие неинвазивные (дыхательный уреазный тест, 13С – уреазный дыхательный тест, определение антигенов НР в кале, ПЦР НР в кале) и нвазивные (серологический метод исследования антител НР в крови, быстрый уреазный тест (проводится при ФГДС в биоптате слизистой желудка), бактериологическое исследование на НР, микроскопическое исследование биоптата слизистой желудка на НР) тесты диагностики позволяют с разной точностью диагностировать инфицированность Helicobacter pylori. Согласно международным согласительным рекомендациям по диагностике и лечению болезней, ассоциированных с хеликобактером золотым стандартом определения хеликобактериоза, является сочетание уреазного дыхательного теста с определением хеликобактерного антигена в кале при помощи иммуноферментного анализа. Эрадикация H. pylori устраняет воспалительный ответ слизистой желудка, приводит к обратному развитию атрофии желудка, если нет кишечной метаплазии, останавливает прогрессирование повреждения слизистой желудка до предраковых изменений и в рак.
Ученые раскрыли секретное оружие Helicobacter pylori
Исследователи Школы фармации Ноттингемского Университета Ноттингема и компании АстраЗенека определили молекулярный механизм прикрепления белка оболочки хеликобактерии к мукополисахаридам желудочной слизи. Исследование опубликовано 14 августа 2015 года в Science Advances. Источник: Abercade.
Болезнетворная бактерия Helicobacter Pylori, открытая в 1982 г., выживает в желудке человека, несмотря на высокую кислотную среду. Считается, что эта бактерия живет в организме каждого второго человека, хотя обычно у большинства инфицированных людей она не вызывает проблем со здоровьем. Однако, инфекция H. pylori считается одной из самых распространенных бактериальных инфекций человека в мире и ведущей причиной развития диспепсии, язвенной болезни и рака желудка.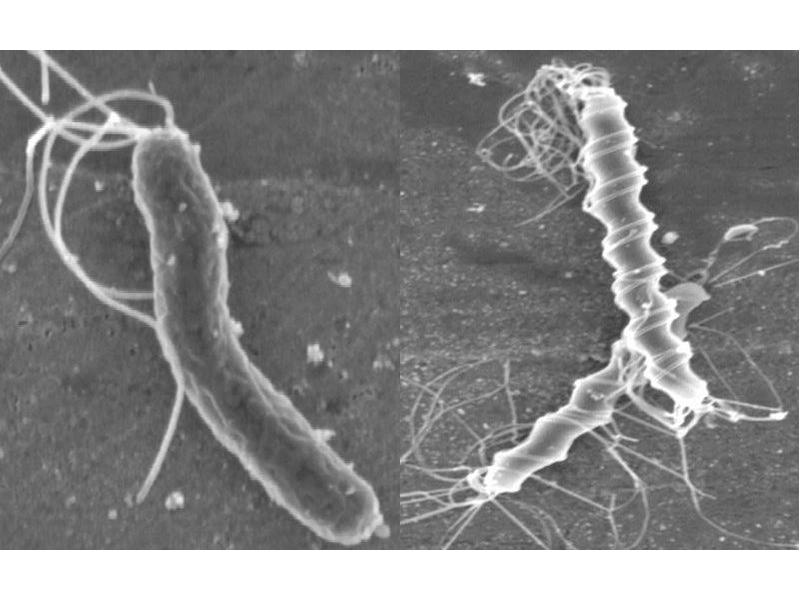
Кислотная среда желудка человека не оказывает антисептического действия на H. pylori благодаря уникальным эволюционным приспособлениям, приобретенным бактерией: она научилась скрываться в кислотоустойчивом толстом слое слизи, покрывающем стенки желудка. Оказавшись в слое слизи, бактерия с помощью особых адгезионных белков прикрепляется к углеводным молекулам, которые в норме находятся на стенках желудка. Это соединение настолько сильное, что бактерия может противостоять попыткам организма «изгнать» ее, что позволяет патогену безнаказанно колонизировать слизистую оболочку желудка.
Исследователи из Школы Фармакологии при Университете Ноттингема (School of Pharmacy at The University of Nottingham, Великобритания) и компании AstraZeneca обнаружили молекулярный механизм, на котором основана работа наиболее изученного адгезионного белка H.pylori, позволяющего бактерии прикрепляться к сахарам в желудке человека. Результаты исследования были опубликованы в журнале Science Advances. Об этом пишут Коммерческие биотехнологии.
Об этом пишут Коммерческие биотехнологии.
До этого момента выявление молекулярных взаимодействий, которые позволяют H. pylori выживать в таких суровых условиях, казалось невозможным.
По мнению исследователя Наима Хейджа (Naim Hage), который работал над этим проектом в рамках своей докторской диссертации, несмотря на то, что еще рано делать окончательные выводы, полученные данные являются хорошей новостью для пациентов.
Используя чрезвычайно мощные рентгеновские лучи, ученые смогли на атомном уровне изучить взаимодействие между адгезионным белком H. Pylori BabA и сахарами Lewisb слизистой оболочки желудка. Результаты исследования показали, что на самой вершине белка BabA находится специфическая бороздка, позволяющая белку надежно прикрепиться к сахару Lewisb с использованием сети водородных связей.
Исследовательская группа также продемонстрировала, что эти связи очень чувствительны к малейшим изменениям окружающей среды. Например, если нарушаются некоторые из водородных связей, то взаимодействия больше не происходит, и молекулы белка и сахара не соединяются между собой.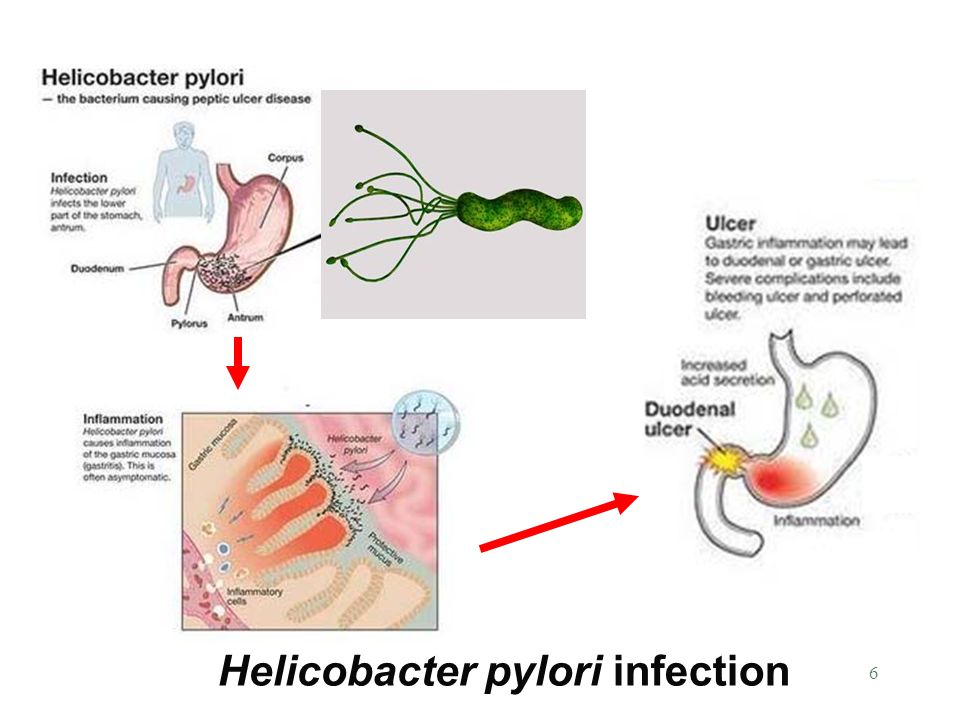
Полученные данные послужат основой для будущих исследований специалистами из Университета Ноттингема и компании AstraZeneca в области «анти-адгезионных стратегий». Предполагается, что эта стратегия будет основана на применении ингибиторов соединения BabA:Lewisb, которые будут «очищать» желудок от H. pylori путем отсоединения бактерии от его стенок. Подобные новые стратегии терапии инфекции H. pylori необходимы населению, поскольку бактерия приобретает устойчивость к действию традиционных методов антибиотикотерапии по всему миру.
«Поскольку белок BabA является уникальным для H. pylori, мы можем таргетно на него воздействовать и, возможно, полностью уничтожить эту бактерию, не затрагивая другие бактерии, относящиеся к нормальной флоре человека. В случае успеха эта терапевтическая стратегия будет чрезвычайно эффективной для лечения инфекции H.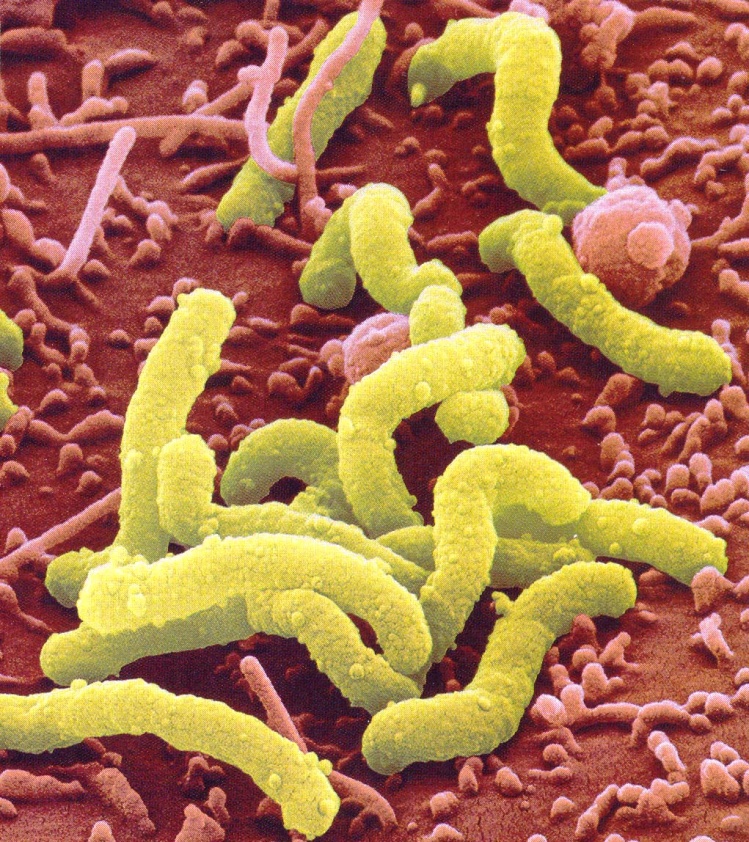
«Несмотря на то, что это исследование отвечает на давно возникшие вопросы о том, как H. pylori колонизирует желудок, оно представляет собой лишь первый шаг в направлении разработки новых методов терапии. В ближайшие несколько лет исследования, проводимые в лаборатории, будут иметь решающее значение для определения того, является ли подход, противодействующий адгезии белка BabA, жизнеспособным и может ли он превратиться в клиническую разработку. Аналогичный подход уже позволил получить многообещающие результаты при лечении инфекций мочевыводящих путей на доклинических моделях. Заглядывая вперед, мы рады продолжить тесное сотрудничество с компанией AstraZeneca, которая внесла большой вклад в это исследование», – говорит ответственный исследователь проекта, доктор Франко Фальконе (Franco Falcone).
Источник: Abercade
Анализы на Антитела к Helicobacter pylori, IgG, цены в лаборатории KDL
Хеликобактер пилори (Helicobacter pylori) — микроорганизм, инфицирование которым ассоциировано с появлением эрозий в желудке, развитием хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки. Передаётся хеликобактер пищевым путём, через грязные руки и зараженные предметы обихода. При длительном нахождении Helicobacter pylori в организме возможно развитие атрофического гастрита, который является предраковым состоянием, поэтому своевременная диагностика и лечение, направленное на устранение хеликобактера, имеют важное значение.
Передаётся хеликобактер пищевым путём, через грязные руки и зараженные предметы обихода. При длительном нахождении Helicobacter pylori в организме возможно развитие атрофического гастрита, который является предраковым состоянием, поэтому своевременная диагностика и лечение, направленное на устранение хеликобактера, имеют важное значение.
Антитела к хеликобактеру (Helicobacter pylori) IgG – белки иммунной защиты, которые вырабатываются через 3-4 недели после контакта с инфекцией, вслед за иммуноглобулинами М (IgM) и А (IgA) и сохраняются длительное время после выздоровления. Являются маркерами инфицирования организма. Исследование будет информативно для первичной диагностики инфекции хеликобактером. Для оценки эффективности проведенной терапии целесообразно использовать методы диагностики, направленные на поиск возбудителя в выдыхаемом воздухе: дыхательный уреазный тест или исследование антигена хеликобактера в кале.
В каких случаях обычно назначают исследование на определение уровня антител к хеликобактеру (Helicobacter pylori), IgG?
- При язвенной болезни желудка и двенадцатиперстной кишки – в качестве скринингового первичного обследования
- При симптомах хронического гастрита
- При обследовании родственников пациентов с выявленной инфекцией Helicobacter pylori
Что означают результаты теста?
Референсные значения:
- <0,9 МЕ/мл — антитела не обнаружены
- 0,9-1,1 МЕ/мл — анализ рекомендуется повторить через 1 неделю
- >1,1 МЕ/мл — антитела обнаружены
Результат <0,9 — антитела не обнаружены
- отсутствие инфицирования Helicobacter pylori
- возможно, исследование сделано в ранний период инфекции, когда ещё не успели выработаться IgG.

Результат – >1,1 — антитела обнаружены
- свидетельствует о наличии антител к хеликобактеру, что может быть при текущей инфекции либо еще какое-то время после проведенного лечения
Результат 0,9 – 1,1 — сомнительный результат.
- рекомендуется повторное исследование через 1- 2 недели, в случае инфицирования в повторном исследовании антитела будут обнаружены (т.е. уровень антител повысится).
Сроки выполнения теста.
1-2 дня
Как подготовиться к анализу?
Кровь можно сдать утром натощак или в течение дня через 3 часа после необильного приёма пищи.
Хеликобактер Пилори (Helicobacter pylori) в медицинском центре «Академия здоровья»
Стоимость услуги225р
Хеликобактер пилори – спиральные грам-отрицательные бактерии, которые были обнаружены на слизистой оболочке желудка более полувека назад, но они не вызывали особого интереса до начала 1980-х гг. , когда был разработан метод культивирования организмов из биопсийного материала слизистой оболочки.
В 1983 г. австралийский врач Барри Маршалл обнаружил, что H. pylori почти всегда присутствует в желудке пациентов, страдающих хроническим гастритом или язвой. Бактерии, сами по себе, язвы желудка или двенадцатиперстной кишки не вызывают, однако, провоцируют воспалительные процессы в желудке и ослабляют естественную защиту слизистой от воздействия кислотной среды желудка; при этом H. pylori стимулирует гиперсекрецию соляной кислоты, воздействуя на механизмы ее регуляции.
Если проводимая терапия приводит к снижению кислотности желудка, то язва может затянуться, но после прекращения лечения существует вероятность ее повторного возникновения. Длительные наблюдения показали, что у больных, не получавших лечение против H. pylori, язва рецидивирует через 2 года в 100 %, а у пролеченных пациентов возникает повторно (обычно вследствие реинфекции H. pylori) только в 5-10 %. Источником заражения H.
, когда был разработан метод культивирования организмов из биопсийного материала слизистой оболочки.
В 1983 г. австралийский врач Барри Маршалл обнаружил, что H. pylori почти всегда присутствует в желудке пациентов, страдающих хроническим гастритом или язвой. Бактерии, сами по себе, язвы желудка или двенадцатиперстной кишки не вызывают, однако, провоцируют воспалительные процессы в желудке и ослабляют естественную защиту слизистой от воздействия кислотной среды желудка; при этом H. pylori стимулирует гиперсекрецию соляной кислоты, воздействуя на механизмы ее регуляции.
Если проводимая терапия приводит к снижению кислотности желудка, то язва может затянуться, но после прекращения лечения существует вероятность ее повторного возникновения. Длительные наблюдения показали, что у больных, не получавших лечение против H. pylori, язва рецидивирует через 2 года в 100 %, а у пролеченных пациентов возникает повторно (обычно вследствие реинфекции H. pylori) только в 5-10 %. Источником заражения H.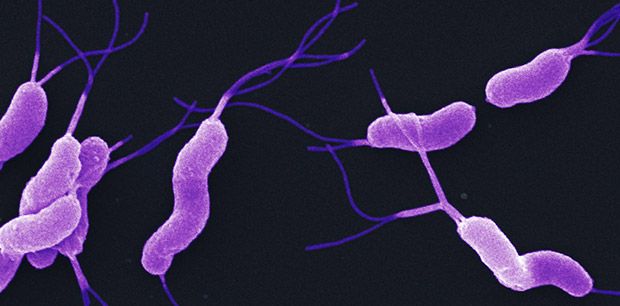 pylori является инфицированный человек, кошки, свиньи, крупный рогатый скот и обезьяны (макака-резус). Чаще заражение происходит через загрязнённую фекалиями воду и пищу (овощи, при поливе которых использовалась загрязненная вода).
Объектом передачи инфекционного начала могут быть загрязнённые руки, слюна, капли слюны или мокроты при кашле. Исследования, проведенные медиками из США, показали, что H.pylori можно считать семейной инфекцией, и, если в семье выявлен носитель H.pylori, то вероятность остальных членов семьи оказаться инфицированными составляет 95%. Обнаружение хеликобактера методом ПЦР позволяет значительно быстрее установить диагноз, проводить контроль лечения. Материалом для исследования могут служить желудочные аспираты, кал, слюна.
pylori является инфицированный человек, кошки, свиньи, крупный рогатый скот и обезьяны (макака-резус). Чаще заражение происходит через загрязнённую фекалиями воду и пищу (овощи, при поливе которых использовалась загрязненная вода).
Объектом передачи инфекционного начала могут быть загрязнённые руки, слюна, капли слюны или мокроты при кашле. Исследования, проведенные медиками из США, показали, что H.pylori можно считать семейной инфекцией, и, если в семье выявлен носитель H.pylori, то вероятность остальных членов семьи оказаться инфицированными составляет 95%. Обнаружение хеликобактера методом ПЦР позволяет значительно быстрее установить диагноз, проводить контроль лечения. Материалом для исследования могут служить желудочные аспираты, кал, слюна.
НЕ БОЛЕЙТЕ ИЛИ ТА САМАЯ Helicobacter pylori!
Еще до недавнего времени принято было считать, что причиной хронического гастрита и язвенной болезни является стресс и неправильное питание. Когда же была открыта бактерия Helicobacter pylori (Hp), стала ясна истинная причина этих заболеваний.
Когда же была открыта бактерия Helicobacter pylori (Hp), стала ясна истинная причина этих заболеваний.
Эту бактерию находят более чем у 95% больных с язвой 12-перстной кишки и у 80% больных с язвой желудка.
Инфекция Хеликобактер пилори является наиболее распространенной хронической бактериальной инфекцией у человека. Ей поражено более 60% населения индустриальных стран и еще больший процент населения развивающихся стран.
Чаще всего заражение происходит в детском возрасте и с возрастом частота инфицирования растет. Перенаселенные квартиры в городах индустриальных стран, плохие санитарно-гигиенические условия в развивающихся странах и низкий социально-экономический статус — все эти факторы имеют отношение к высокой частоте инфицирования Hp.
Инфекция может распространяться через источники водоснабжения, так как микроорганизм сохраняет жизнеспособность в воде в течение нескольких дней, удалось культивировать бактерии и из кала, слюны, налета на зубах инфицированных людей.
Повышается частота инфицирования и в семьях, где есть больные язвенной болезнью. Аналогичная ситуация наблюдается у людей, работающих в одном учреждении.
Развитие заболевания начинается с попадания Hp в желудок через рот. В желудке бактерия внедряется в защитный слой слизи и прикрепляется к клеткам эпителия, выстилающим стенки желудка. Клетки эти несут специфические рецепторы, по которым HP узнает их с помощью специального белка, поэтому сейчас ведутся работы по созданию вакцины, действие которой будет направлено против этого белка.
Выявлена интересная закономерность: лица с I группой крови больше подвержены риску развития язвы желудка или 12-перстной кишки, поскольку у них больше клеточных рецепторов на поверхности эпителия, а следовательно и большая возможность связаться с Hp.
Все штаммы Hp продуцируют большое количество ферментов и, в частности, уреазу, которая катализирует продукцию токсичного аммиака, оказывающего отрицательное воздействие на эпителиальные клетки. Другие бактериальные ферменты способны разрушать защитный слой слизи.
Другие бактериальные ферменты способны разрушать защитный слой слизи.
Сама по себе инфекция Hp стимулирует как системную, так и местную иммунную реакцию. В места инфицирования слизистой устремляются лейкоциты. Инфильтрируя ее, они вызывают характерную воспалительную реакцию, проявляющуюся в виде отека, гиперемии, нарушения питания воспаленного участка, что предваряет дегенеративное изменение эпителия слизистой. На поверхности слизистой образуется эрозия, а затем и язвы.
Воспалительный процесс вызывает не только повреждение слизистой, но и несет ответственность за повышение кислотности желудочного сока.
В настоящее время имеются факты, позволяющие предполагать участие Hp в процессе раковых трансформаций в желудке. Эта инфекция является причиной развития хронического гастрита, а неспособность иммунного барьера человека сдержать инфекцию означает, что через несколько лет или десятилетий гастрит станет атрофическим.
Результаты детальных исследований свидетельствуют, что атрофический гастрит является предраковой формой состояния человека. При наличии Hp в 4 раза повышается риск развития рака желудка.
При наличии Hp в 4 раза повышается риск развития рака желудка.
Существует несколько методов диагностики Hp. В медсанчасти № 9 в лаборатории по диагностике СПИД используют тест по выявлению антител к Hp в крови. Так как инфекция является хронической, то положительный тест указывает
на наличие текущей инфекции.
Профилактическое лечение, направленное против Helicobacter pylori, должно быть комплексным и может проводиться только под наблюдением врача. Правильно подобранные лечебные процедуры позволяют избавиться от Hp, ускорить заживление язвы и значительно уменьшить частоту обострений язвенной болезни — до 5% и менее в год, тогда как при
традиционном лечении они составляют 87%.
Для диагностики Helicobacter pylori вы можете обратиться в лабораторию по диагностике СПИД при МСЧ-9.
Телефон для справок 212-88-95.
Заведующая лабораторией ИФА Кузнецова Татьяна Юрьевна
Экспресс-тест для диагностики инфекции Helicobacter pylori — Пермский клинический центр
Хеликобактер пилори (Helicobacter Pilori) – спиралевидная кислотоустойчивая бактерия, обитающая в желудке и двенадцатиперстной кишке человека.
По данным медицинской статистики, хеликобактером заражены около 60 % всего населения Земли, хеликобактериоз является наиболее распространенным инфекционным заболеванием людей после герпеса. Заражение бактерией хеликобактер происходит через загрязенную воду или пищу, а также после контакта с инфицированным человеком через слюну или мокроту, выделяемую при кашле, чихании, поцелуе, пользовании общими предметами быта.
Инфицирование Helicobacter Pilori происходит настолько легко, что считается семейным заболеванием – при заражении одного члена семьи, в 95 % случаев оказываются инфицированными все остальные, причем, долгое время зараженный человек может не догадываться о заболевании и не испытывать никаких болезненных симптомов.
Под воздействием стрессов, простудных инфекций, травм, интоксикаций, гормональных сбоев, дремлющая в организме и долгое время не дающая о себе знать бактерия «просыпается» и начинает свое болезнетворное воздействие. Helicobacter Pilori является ведущим фактором в развитии:
1. Хронического гастрита, атрофического гастрита, гастродуоденита;
2. Язвенной болезни желудка и двенадцатиперстной кишки;
3. MALT-лимфомы желудка;
4. Аденокарциномы желудка (разновидность рака желудка).
Также большую роль Helicobacter Pilori оказывает на течение таких заболеваний как: гастоэзофагеальная рефлюксная болезнь (ГЭРБ), железодефицитная анемия, гастропатия на фоне применения нестероидных противовоспалительных препаратов.
Для своевременного лечения хеликобактерной инфекции необходима точная диагностика. В нашем лечебном учреждении вы можете провести тест на наличие инфекции Helicobacter pylori.
Для диагностики Helicobacter pylori мы используем экспресс-тест, разработанный финской компанией Biohit, основанный на определении активности фермента уреазы в биоптате. Биоптат (кусочек слизистой оболочки желудка) сразу подвергается исследованию. Результат теста можно узнать через 30 минут.
Чтобы вышеописанный тест был максимально достоверным , пациент перед проведением теста не должен принимать антибиотики, препараты висмута (де-нол) в течение 3-х недель, Н2-гистаминоблокаторы и ингибиторы протонной помпы – в течение 2-х недель.
Helicobacter pylori: вред для желудка или польза для пищевода? | Политика и общество: анализ событий в Европе, России, мире | DW
Одна из бактерий, привлекающих к себе в последние годы особое внимание исследователей, носит название Helicobacter pylori. Она обитает в слизистой оболочке желудка и двенадцатиперстной кишки человека, что само по себе необычно: желудок изнутри омывается примерно двумя литрами желудочного сока в сутки. Желудочный сок состоит из соляной кислоты в довольно высокой концентрации и пищеварительных ферментов, так что он способен расщепить самые прочные соединения, будь то бактерии, вирусы или бифштекс. Поэтому долгое время считалось, что желудок лишён флоры, практически стерилен, и лишь неожиданное открытие Helicobacter pylori 20 лет назад заставило учёных кардинально пересмотреть эту точку зрения.
Оказалось, что слизистая оболочка, выстилающая изнутри желудок и предохраняющая его от разрушительного воздействия желудочного сока, является надёжным укрытием и для бактерии. А вскоре выяснилось, что чуть ли не все нарушения пищеварения, гастриты и дуодениты, почти 100 процентов язв двенадцатиперстной кишки, 80 процентов язв желудка и даже многие случаи рака желудка могут быть смело отнесены на счёт Helicobacter pylori. Иммунная система реагирует на вторжение бактерий в организм, но лейкоциты и макрофаги, призванные уничтожить незваных гостей, оказываются неспособными проникнуть сквозь защитный слой слизи и гибнут, нанося при этом изрядный вред клеткам слизистой оболочки, что и приводит к воспалениям, язвам и прочим неприятностям.
К счастью, бактерия Helicobacter pylori весьма чувствительна к широкому спектру антибиотиков, которые и являются сегодня главным оружием против этого микроба. В то же время многие медицинские центры активно вели разработку вакцины против Helicobacter pylori, и после ряда неудач достигли в последнее время значительных успехов. Некоторые исследователи полагают, что массовые прививки уже вскоре смогут полностью избавить человечество от этой напасти.
Однако Мартин Блейзер (Martin J. Blaser), профессор микробиологии Высшей медицинской школы при Нью-Йоркском университете, высказывает в связи с подобными планами серьёзные опасения. Он считает, что Helicobacter pylori выполняют в организме и положительную функцию:
— У нас уже имеются предварительные данные, которые всё более определённо свидетельствуют о том, что Helicobacter защищают пищевод.
В частности, люди, не имеющие бактерий в желудке, чаще страдают эзофагитом, то есть воспалением пищевода, или желудочно-пищеводным рефлюксом, то есть нарушением тех механизмов, которые обычно препятствуют забрасыванию содержимого желудка обратно в пищевод. Да и рак пищевода встречается у таких пациентов чаще, – говорит профессор Блейзер:
— Меня это серьёзно беспокоит: если мы сегодня начнём проводить массовую вакцинацию против Helicobacter pylori для того, чтобы снизить заболеваемость раком желудка, то весьма вероятно, что через двадцать или сорок лет мы получим эпидемию рака пищевода.
Однако это, конечно, не означает, что пациентов, страдающих, скажем, язвой двенадцатиперстной кишки, не нужно избавить от Helicobacter pylori. Мартин Блейзер решительно возражает лишь против поголовной вакцинации населения:
— Если от такой прививки и будет толк, то лишь в том случае, если нам удастся выяснить, какой круг лиц действительно подвержен повышенному риску заболеть раком желудка. Мы полагаем, что различные сугубо индивидуальные факторы, присущие хозяину, могут удвоить, утроить или даже учетверить этот риск.
Первые генетические факторы риска учёными уже обнаружены. Судя по всему, наибольшей опасности подвержены жители восточноазиатских стран. Мартин Блейзер говорит:
— Возможно, эти факторы риска суммируются. Но не просто, а так, что два плюс два даёт девять или даже пятнадцать.
Что и говорить, необычная математика. Однако не исключено, что вскоре медики научатся определять индивидуальную степень риска для каждого носителя бактерии. Правда, тут не обойтись без информации об особенностях питания пациентов, а также о самих бактериях. Профессор Блейзер поясняет:
— Самые последние исследования, в том числе и проведённые в нашей лаборатории, показали, что степень риска заболевания сильно зависит от того, каким штаммом бактерий данный пациент инфицирован. Существует множество штаммов, специфических для определённых регионов. Исследуя тот или иной штамм, врач может с высокой долей уверенности сказать, откуда прибыл больной, у которого взята данная проба.
И лишь сведя воедино данные о бактериях и данные о пациенте, врач сможет решить, что в данном конкретном случае весомее – вред для желудка или польза для пищевода.
Дыхательный тест на мочевину и результаты для H. Pylori
Дыхательный тест на мочевину используется для обнаружения Helicobacter pylori (H. pylori), типа бактерий, которые могут инфицировать желудок и являются основной причиной язв как желудка, так и желудка. двенадцатиперстная кишка (первая часть тонкой кишки).
H. pylori вырабатывает фермент, называемый уреазой, который расщепляет мочевину на аммиак и диоксид углерода. Во время теста проглатывается таблетка, содержащая мочевину, и измеряется количество выдыхаемого углекислого газа.Это указывает на присутствие H. pylori в желудке.
Как подготовиться к дыхательному тесту на мочевину?
Чтобы подготовиться к дыхательному тесту на мочевину, следуйте этим инструкциям:
- Сообщите своему врачу, если вы беременны, имеете заболевание легких или сердца или любое другое заболевание, или если у вас аллергия на какие-либо лекарства.
- Не принимайте антибиотики как минимум за 4 недели до исследования.
- Не принимайте ингибиторы протонной помпы (Aciphex, Nexium, Prevacid, Prilosec, Protonix) или Pepto-Bismol в течение как минимум 2 недель до теста.
- Принимайте только те лекарства, которые одобрены вашим врачом в день процедуры. Принимайте их только в течение четырех часов после процедуры, запивая небольшим глотком воды. Не прекращайте прием каких-либо лекарств, не посоветовавшись предварительно со своим основным врачом или лечащим врачом.
- Ничего не ешьте и не пейте (включая воду) за четыре часа до процедуры.
Что происходит во время теста дыхания мочевиной?
Во время дыхательного теста на мочевину:
- Медицинский работник объяснит процедуру, которая длится от 40 до 60 минут, и ответит на любые ваши вопросы.
- Будут взяты пробы дыхания.
Что происходит после дыхательного теста с мочевиной?
После дыхательного теста с мочевиной:
- Образцы вашего дыхания отправляются в лабораторию, где они исследуются.
- Вы можете вернуться к своей обычной деятельности.
- Вы можете вернуться к своей обычной диете, если вам не назначены другие тесты, требующие диетических ограничений.
Когда я узнаю результаты дыхательного теста на мочевину?
Результаты дыхательного теста на мочевину обычно доступны через два дня после его завершения.
Хеликобактер пилори | Johns Hopkins Medicine
Что такое H. pylori (Helicobacter pylori)?
H. pylori (Heliobacter pylori, произносится как Hel-ee-koh-BAK-ter Pie-LORE-ee) — это тип бактерий, поражающих ваш желудок.
Он может повредить ткани желудка и первую часть тонкой кишки (двенадцатиперстную кишку). Это может вызвать покраснение и болезненность (воспаление). В некоторых случаях он также может вызывать болезненные язвы, называемые пептическими язвами, в верхних отделах пищеварительного тракта.
H. pylori является обычным явлением. У многих это есть. У большинства людей не появляются язвы и не проявляются какие-либо симптомы. Но это основная причина язв.
H. pylori атакует слизистую оболочку желудка. Бактерии вырабатывают фермент, называемый уреазой. Этот фермент снижает кислотность желудочного сока (нейтрализует их). Это ослабляет слизистую оболочку желудка.
Клетки желудка имеют больший риск быть поврежденными кислотой и пепсином, сильными пищеварительными жидкостями. Это может привести к появлению язв в желудке или двенадцатиперстной кишке.
Бактерии H. pylori также могут прилипать к клеткам желудка. Ваш желудок не может хорошо себя защитить. Эта область краснеет и опухает (воспаляется).
H. pylori также может заставить желудок вырабатывать больше кислоты. Эксперты в области здравоохранения не совсем понимают, как это сделать.
Что вызывает инфекцию H. pylori?
Эксперты в области здравоохранения не знают наверняка, как распространяется инфекция H. pylori. Они считают, что микробы могут передаваться от человека к человеку через рот, например, при поцелуях.
Также может передаваться через рвоту или стул.Это может произойти, если вы:
Кто подвержен риску заражения H. pylori?
Вы можете подвергаться большему риску заражения H. pylori из-за:
Ваш возраст. Более половины людей в США с бактериями старше 50 лет.
Ваша раса или национальность. Почти у половины всех афроамериканцев есть бактерии. Для людей, которые приезжают в США из развивающихся стран, по крайней мере 50% латиноамериканцев и 50% людей из Восточной Европы имеют H.пилори.
Большинство людей впервые заражаются бактериями в детстве, но и взрослые тоже могут заразиться.
Каковы симптомы H. pylori?
У большинства людей бактерии сохраняются годами, не зная об этом, потому что у них нет никаких симптомов. Эксперты не знают почему.
У вас может быть покраснение и опухоль (воспаление) слизистой оболочки желудка. Это называется гастритом.
Вы можете получить язвы или язвы желудка или первой части тонкой кишки (двенадцатиперстной кишки).Симптомы язвы могут включать боль в животе или животе, которые могут:
Будь тупой болью, которая не проходит
Происходит через 2–3 часа после еды
Приходи и уходи на несколько дней или недель
Происходит посреди ночи, когда ваш желудок пуст
Уходите, когда вы едите или принимаете лекарства, снижающие уровень кислоты в желудке (антациды)
Другие симптомы язвы могут включать:
Симптомы язвы могут быть похожи на другие проблемы со здоровьем.Всегда обращайтесь к своему врачу, чтобы убедиться.
Как диагностируется H. pylori?
Ваш лечащий врач изучит ваше прошлое здоровье и проведет медицинский осмотр. Он или она может также использовать другие тесты, в том числе:
Анализы крови. Они проверяют клетки (антитела), борющиеся с инфекциями, которые означают, что у вас есть бактерии.
Культура стула. Это ищет любые патологические бактерии в пищеварительном тракте, которые могут вызвать диарею и другие проблемы.Небольшой образец стула собирается и отправляется в лабораторию. Через 2 или 3 дня тест покажет, есть ли у вас какие-либо патологические бактерии.
Дыхательные пробы . Они могут проверить, есть ли углерод после того, как вы проглотите таблетку мочевины, в которой есть молекулы углерода. Если углерод обнаружен, это означает, что H. pylori произвела фермент уреазу . Этот фермент снижает кислотность желудочного сока (нейтрализует их). Он ослабляет слизистую оболочку желудка.
Верхняя эндоскопия, также называемая EGD (эзофагогастродуоденоскопия). Этот тест исследует слизистую оболочку пищевода (пищевода), желудка и двенадцатиперстной кишки (первая часть тонкой кишки). Для этого используется тонкая трубка с подсветкой или эндоскоп. На одном конце трубки есть камера. Трубка вводится в рот и в горло. Затем он попадает в пищевод, желудок и двенадцатиперстную кишку. Ваш лечащий врач может увидеть эти органы изнутри. При необходимости берется небольшой образец ткани (биопсия). Образец ткани может показать, есть ли у вас фермент уреаза. Он также может проверить наличие бактерий.
Как лечится H. pylori?
Ваш лечащий врач составит для вас план обслуживания на основе:
Ваш возраст, общее состояние здоровья и прошлое состояние здоровья
Насколько серьезно ваше дело
Насколько хорошо вы справляетесь с определенными лекарствами, методами лечения или терапии
Если ожидается ухудшение вашего состояния
Что бы вы хотели сделать
Ваш лечащий врач может попросить вас принять лекарство, убивающее бактерии (антибиотики).
Другие лекарства могут включать:
х3-блокаторов. Они используются для уменьшения количества кислоты в желудке, блокируя гормон гистамин. Гистамин помогает вырабатывать кислоту.
Ингибиторы протонной помпы. Они помогают предотвратить образование кислоты в желудке. Они делают это, останавливая работу кислотного насоса желудка.
Протекторы слизистой оболочки желудка .Эти лекарства защищают слизистую оболочку желудка от кислоты и помогают убивать бактерии.
Helicobacter Pylori у детей
H. pylori — очень частая причина язвенной болезни и гастрита у взрослых, но может возникать и возникает и у детей.
Позвоните своему педиатру, если у вашего ребенка есть симптомы, указывающие на гастрит. Если у вашего ребенка была диагностирована язва или гастрит, вызванный H. pylori, немедленно обратитесь к врачу, если возникнут следующие симптомы, поскольку они могут быть симптомами желудочно-кишечного кровотечения или перфорации язвы:
Каковы осложнения H.пилори?
Если вы инфицированы бактериями, у вас может появиться болезненная рана, называемая язвенной болезнью. Эти язвы образуются в верхних отделах пищеварительного тракта.
Очень тяжелая язва может истощить слизистую оболочку желудка. Это также может вызвать такие проблемы, как:
Кровотечение при износе кровеносного сосуда
Отверстие или перфорация в стенке желудка
Закупорка, когда язва находится в месте, препятствующем выходу пищи из желудка
H.pylori также может привести к раку желудка.
Что я могу сделать, чтобы предотвратить заражение H. pylori?
Эксперты в области здравоохранения не знают наверняка, как бактерии передаются от человека к человеку. Но хорошие привычки в отношении здоровья (гигиена) могут помочь вам обезопасить себя. Эти привычки включают:
Мытье рук водой с мылом. Это очень важно делать после посещения туалета и перед едой.
Убедитесь, что вся пища, которую вы едите, была очищена и приготовлена безопасно
Убедитесь, что ваша питьевая вода безопасна и чиста
Жизнь с H.пилори
Как только вы точно узнаете, что у вас H. pylori, обратитесь к своему врачу. Он или она проведут несколько тестов, чтобы убедиться, что бактерии удалены.
Когда мне следует позвонить своему врачу?
Позвоните своему врачу, если ваши симптомы ухудшатся или у вас появятся новые симптомы. Немедленно позвоните, если у вас есть такие симптомы, как кровавая рвота, кровь в стуле или черный, дегтеобразный стул.
Ключевые моменты
H.pylori — это тип бактерий, поражающих ваш желудок.
Он атакует ваш желудок и первую часть тонкой кишки (двенадцатиперстную кишку). Это может вызвать покраснение и отек (воспаление).
У многих людей с этой бактерией не будет никаких симптомов.
Может вызвать открытые язвы, называемые пептическими язвами, в верхних отделах пищеварительного тракта.
Может вызвать рак желудка.
Он может передаваться или передаваться от человека к человеку через рот, например, при поцелуях. Он также может передаваться при прямом контакте со рвотой или калом.
Хорошие привычки в отношении здоровья (гигиена) могут защитить вас.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от посещения врача:
Перед визитом запишите вопросы, на которые хотите получить ответы.
Возьмите с собой кого-нибудь, кто поможет вам задать вопросы и запомнить, что вам говорит поставщик.
Во время посещения запишите названия новых лекарств, методов лечения или тестов, а также все новые инструкции, которые дает вам поставщик.
Если вам назначена повторная встреча, запишите дату, время и цель этого визита.
Узнайте, как вы можете связаться с вашим поставщиком медицинских услуг, если у вас возникнут вопросы.
Helicobacter pylori и рак — Национальный институт рака
Atherton JC. Патогенез гастродуоденальных заболеваний, вызванных Helicobacter pylori. Ежегодный обзор патологии 2006 г .; 1: 63–96.
[Аннотация PubMed]Kusters JG, van Vliet AH, Kuipers EJ. Патогенез инфекции Helicobacter pylori. Обзоры клинической микробиологии 2006; 19 (3): 449–490.
[Аннотация PubMed]Ферлей Дж., Шин Х.Р., Брей Ф. и др. Оценки мирового бремени рака в 2008 г .: GLOBOCAN 2008. International Journal of Cancer 2010; 127 (12): 2893–2917.
[Аннотация PubMed]Андерсон В.Ф., Камарго М.С., Фраумени Дж. Ф. и др. Возрастные тенденции заболеваемости некардиальным раком желудка у взрослых в США. JAMA 2010; 303 (17): 1723–1728.
[Аннотация PubMed]де Мартель С., Форман Д., Пламмер М. Рак желудка: эпидемиология и факторы риска. Гастроэнтерологические клиники Северной Америки 2013; 42 (2): 219-240.
[Аннотация PubMed]Forman D, Burley VJ. Рак желудка: глобальная картина заболевания и обзор факторов риска окружающей среды. Лучшие практики и исследования в клинической гастроэнтерологии 2006; 20 (4): 633–649.
[Аннотация PubMed]Бреннер Х., Ротенбахер Д., Арндт В. Эпидемиология рака желудка. Методы молекулярной биологии 2009; 472: 467–477.
[Аннотация PubMed]Совместная группа по хеликобактерам и раку. Рак желудка и Helicobacter pylori : комбинированный анализ 12 исследований случай-контроль, проведенных в рамках проспективных когорт. Gut 2001; 49 (3): 347–353.
[Аннотация PubMed]Парсоннет Дж., Фридман Г.Д., Вандерштин Д.П. и др. Инфекция Helicobacter pylori и риск рака желудка. Медицинский журнал Новой Англии 1991; 325 (16): 1127–1131.
[Аннотация PubMed]Huang JQ, Sridhar S, Chen Y, Hunt RH. Метаанализ взаимосвязи между серопозитивностью Helicobacter pylori и. Гастроэнтерология 1998; 114 (6): 1169–1179.
[Аннотация PubMed]Eslick GD, Lim LL, Byles JE, Xia HH, Talley NJ. Связь инфекции Helicobacter pylori с карциномой желудка: метаанализ. Американский журнал гастроэнтерологии 1999; 94 (9): 2373–2379.
[Аннотация PubMed]Уэмура Н., Окамото С., Ямамото С. и др. Инфекция Helicobacter pylori и развитие рака желудка. Медицинский журнал Новой Англии 2001; 345 (11): 784–789.
[Аннотация PubMed]Исследование профилактики рака легких с использованием альфа-токоферола и бета-каротина: дизайн, методы, характеристики участников и соблюдение требований. Исследовательская группа по профилактике рака ATBC. Annals of Epidemiology 1994; 4 (1): 1–10.
[Аннотация PubMed]Камангар Ф., Доуси С.М., Блазер М.Дж. и др. Противодействие рискам кардии желудка и некардиальных аденокарцином желудка, связанных с серопозитивностью Helicobacter pylori. Журнал Национального института рака 2006; 98 (20): 1445–1452.
[Аннотация PubMed]Hansen S, Melby KK, Aase S, Jellum E, Vollset SE. Helicobacter pylori Инфекция и риск рака кардии и некардиального рака желудка. Вложенное исследование случай-контроль. Скандинавский гастроэнтерологический журнал 1999; 34 (4): 353–360.
[Аннотация PubMed]Йе В., Хельд М., Лагергрен Дж. И др. Helicobacter pylori Инфекция и атрофия желудка: риск аденокарциномы и плоскоклеточного рака пищевода и аденокарциномы кардии желудка. Журнал Национального института рака 2004; 96 (5): 388–396.
[Аннотация PubMed]Kamangar F, Qiao YL, Blaser MJ, et al. Helicobacter pylori и рак пищевода и желудка в проспективном исследовании в Китае. Британский журнал рака 2007; 96 (1): 172–176.
[Аннотация PubMed]Доуси С.М., Марк С.Д., Тейлор ПР, Лимбург П.Дж. Рак желудка и H. pylori. Gut 2002; 51 (3): 457-458.
[Аннотация PubMed]Ислами Ф., Камангар Ф. Helicobacter pylori и риск рака пищевода: метаанализ. Исследования по профилактике рака 2008; 1 (5): 329–338.
[Аннотация PubMed]Tu S, Bhagat G, Cui G, et al.Сверхэкспрессия интерлейкина-1бета вызывает воспаление и рак желудка и мобилизует у мышей миелоидные супрессорные клетки. Cancer Cell 2008; 14 (5): 408–419.
[Аннотация PubMed]Вен С., Мосс SF. Helicobacter pylori Факторы вирулентности в канцерогенезе желудка. Письма о раке 2009; 282 (1): 1–8.
[Аннотация PubMed]Bagnoli F, Buti L, Tompkins L, Covacci A, Amieva MR. Helicobacter pylori CagA вызывает переход от поляризованного фенотипа к инвазивному в клетках MDCK. Proceedings of the National Academy of Science USA 2005; 102 (45): 16339–16344.
[Аннотация PubMed]Хуанг Дж.К., Чжэн Г.Ф., Суманак К., Ирвин Э.Дж., Хант Р.Х. Метаанализ взаимосвязи между серопозитивностью cagA и раком желудка. Гастроэнтерология 2003; 125 (6): 1636–1644.
[Аннотация PubMed]Chow WH, Blaser MJ, Blot WJ, et al.Обратная связь между штаммами cagA + инфекции Helicobacter pylori и риском аденокарциномы кардии пищевода и желудка. Cancer Research 1998; 58 (4): 588–590.
[Аннотация PubMed]Андре А.Р., Феррейра М.В., Мота Р.М. и др. Аденокарцинома желудка и Helicobacter pylori : корреляция с мутацией p53 и иммуноэкспрессией p27. Эпидемиология рака 2010; 34 (5): 618–625.
[Аннотация PubMed]Wei J, Nagy TA, Vilgelm A, et al. Регулирование опухолевого супрессора p53 с помощью Helicobacter pylori в эпителиальных клетках желудка. Гастроэнтерология 2010; 139 (4): 1333–1343.
[Аннотация PubMed]Цанг Й.Х., Лэмб А., Ромеро-Галло Дж. И др. Helicobacter pylori CagA нацелена на супрессор опухоли желудка RUNX3 для протеасом-опосредованной деградации. Онкоген 2010; 29 (41): 5643–5650.
[Аннотация PubMed]Wu XC, Andrews P, Chen VW, Groves FD. Заболеваемость экстранодальными неходжкинскими лимфомами среди белых, чернокожих и выходцев из Азии / островов Тихого океана в Соединенных Штатах: различия в анатомической локализации и гистологии. Эпидемиология рака 2009; 33 (5): 337–346.
[Аннотация PubMed]Парсоннет Дж., Хансен С., Родригес Л. и др. Helicobacter pylori Инфекция и лимфома желудка. Медицинский журнал Новой Англии 1994; 330 (18): 1267–1271.
[Аннотация PubMed]Sagaert X, Van Cutsem E, De Hertogh G, Geboes K, Tousseyn T. Желудочная лимфома MALT: модель развития опухоли, вызванной хроническим воспалением. Nature Reviews Гастроэнтерология и гепатология 2010; 7 (6): 336–346.
[Аннотация PubMed]Stolzenberg-Solomon RZ, Blaser MJ, et al. Helicobacter pylori серопозитивность как фактор риска рака поджелудочной железы. Журнал Национального института рака 2001; 93 (12): 937–941.
[Аннотация PubMed]de Martel C, Llosa AE, Friedman GD, et al. Helicobacter pylori Инфекция и развитие рака поджелудочной железы. Эпидемиология, биомаркеры и профилактика рака 2008; 17 (5): 1188–1194.
[Аннотация PubMed]Лимбург П.Дж., Штольценберг-Соломон Р.З., Колберт Л.Х. и др. Helicobacter pylori серопозитивность и риск колоректального рака: проспективное исследование курящих мужчин. Эпидемиология рака, биомаркеры и профилактика 2002; 11 (10 Pt 1): 1095-1099.
[Аннотация PubMed]Кошиол Дж., Флорес Р., Лам Т.К. и др. Серопозитивность Helicobacter pylori и риск рака легких. PLoS One 2012; 7 (2): e32106.
[Аннотация PubMed]Ma JL, Zhang L, Brown LM и др.Пятнадцатилетние эффекты Helicobacter pylori, чеснока и витаминной терапии на заболеваемость и смертность от рака желудка. Журнал Национального института рака 2012; 104 (6): 488-492.
[Аннотация PubMed]Камангар Ф., Шейхаттари П., Мохебташ М. Helicobacter pylori и его влияние на здоровье человека и болезни. Архивы иранской медицины 2011; 14 (3): 192-199.
[Аннотация PubMed]Helicobacter Pylori — StatPearls — Книжная полка NCBI
Непрерывное образование
H.pylori — грамотрицательная микроаэрофильная бактерия, способная инфицировать людей. Он часто обнаруживается в желудке больных и вызывает воспаление и изъязвление. Пациенты, являющиеся носителями бактерий, бессимптомны, с болью в животе, тошнотой, рвотой и диспепсией, развивающимися только после начала гастрита и язвенной болезни. В этом упражнении описывается оценка и лечение H. pylori и объясняется роль межпрофессиональной группы в ведении пациентов с этими условиями.
Цели:
Определите патофизиологию инфекции Helicobacter pylori.
Обобщите использование дыхательного теста на мочевину при оценке инфекции Helicobacter pylori.
Опишите тройную терапию, используемую для искоренения инфекции Helicobacter pylori.
Подчеркните важность сотрудничества и общения между членами межпрофессиональной команды для улучшения оказания помощи пациентам, затронутым инфекциями Helicobacter pylori.
Введение
Helicobacter pylori (H. pylori) — это грамотрицательная спиралевидная бактерия, поражающая до 50% населения во всем мире, с более высокой распространенностью в развивающихся странах. [1] [2] [3] H. pylori является наиболее важной причиной хронического или атрофического гастрита, язвенной болезни, лимфомы желудка и карциномы желудка [4]; однако эти осложнения реже наблюдаются у детей и подростков по сравнению со взрослыми.[5] Инфекция H. pylori обычно передается в раннем детстве и сохраняется без лечения. [6] Клинические испытания фазы 3 на детях в Китае документально подтвердили эффективность и безопасность пероральной рекомбинантной вакцины против H. pylori, будущего варианта снижения заболеваемости инфекцией H. pylori. [7]
Этиология
Передача H. pylori может происходить фекально-оральным, желудочно-оральным, орально-оральным путем или половым путем. [8] Основным фактором риска более высокой распространенности инфекции является более низкий социально-экономический статус.[1]
Эпидемиология
Распространенность H. pylori варьируется во всем мире, при этом в Соединенных Штатах распространенность среди детей младше 10 лет составляет 5%. [1] Среди латиноамериканцев и афроамериканцев распространенность выше, чем у белых американцев [9].
Патофизиология
Есть четыре важных компонента, которые приводят к формированию таких клинических заболеваний, как гастрит и язва при инфекции H. pylori. Во-первых, уреазная активность H. pylori играет важную роль в противодействии кислой среде желудка.Во-вторых, опосредованная жгутиками подвижность помогает бактериям H. pylori двигаться к эпителиальным клеткам желудка хозяина. За этим следуют бактериальные адгезины, взаимодействующие с рецепторами клетки-хозяина, что приводит к успешной колонизации и стойкой инфекции. Наконец, существует множество эффекторных белков / токсинов, которые включают связанный с цитотоксином ген A (Cag A) и вакуолизирующий цитотоксин A (VacA), выделяемый H. pylori, что приводит к повреждению тканей хозяина. При гастрите, вызванном H. pylori, наблюдается как острое, так и хроническое воспаление, поскольку стимулируются эозинофилы, нейтрофилы, тучные клетки и дендритные клетки.[9] Слой эпителия желудка также секретирует хемокины, чтобы инициировать врожденный иммунитет и активировать нейтрофилы, которые в дальнейшем повреждают ткани хозяина, что приводит к образованию гастрита и язвы. [10]
Гистопатология
Микроскопическое воспаление желудка всегда наблюдается при инфекции H. pylori. [5] Окрашивание гематоксилином и эозином (H&E) для визуализации бактерий имеет чувствительность и специфичность до 90%. Было показано, что специальные красители, такие как модифицированное окрашивание Гимза, окрашивание серебром Вартина-Старри, окрашивание Гента и иммуногистохимическое (ИГХ) окрашивание, улучшают специфичность до 100%.[11] Окрашивания H&E обычно достаточно для визуализации H. pylori, в то время как окраска по Гимзе более эффективна по сравнению с другими красителями, поскольку она проста и последовательна. При наличии воспаления при гистологическом исследовании и отсутствии бактерий при окрашивании H&E или Giemsa более полезными могут быть специализированные окрашивания IHC. [12]
История и физика
У большинства детей инфекция H. pylori протекает бессимптомно. [5] Симптомы, если таковые имеются, обычно связаны с гастритом или язвенной болезнью, такими как боль в животе, тошнота, рвота или диспепсия.Детей с этими желудочно-кишечными симптомами следует обследовать, чтобы определить основную этиологию симптомов. [1] Существуют различные внекишечные проявления, связанные с инфекцией H. pylori, такие как железодефицитная анемия и хроническая иммунная тромбоцитопения (cITP). Таким образом, в руководствах рекомендуется рассмотреть возможность неинвазивного тестирования на H. pylori у детей с CITP или с рефрактерной железодефицитной анемией без установленной причины. Дети также могут страдать анемией, поскольку документально подтверждено, что инфицированные H.pylori имеют более низкие запасы железа. По-видимому, существует слабая связь с другими внекишечными проявлениями, такими как средний отит, симптомы верхних дыхательных путей, заболевания пародонта, синдром внезапной детской смерти (СВДС) или низкий рост; поэтому в таких случаях тестирование на H. pylori не рекомендуется [13].
Оценка
Инфекция H. pylori диагностируется как инвазивными, так и неинвазивными методами. Неинвазивные тесты включают обнаружение антигенов H. pylori в стуле, обнаружение антител против H.pylori в образцах сыворотки, мочи и полости рта, а также дыхательный тест на мочевину (UBT). Тест на антиген в стуле и UBT обладают высокой чувствительностью и специфичностью, аналогичной инвазивным методам [14]. Серологические тесты, выявляющие наличие антител (IgG используется в клинической лабораторной практике) к H. pylori, имеют низкую чувствительность и ненадежны для использования в клинических условиях. [13] Для инвазивных тестов требуется ткань желудка для обнаружения микроорганизма, и они включают посев, экспресс-тесты на уреазу (RUT), гистопатологию, полимеразную цепную реакцию и флуоресцентную гибридизацию in situ (FISH).Посев — единственный метод со 100% специфичностью, и положительного посева достаточно для диагностики инфекции H. pylori, но он имеет более низкую чувствительность. По этой причине для определения статуса H. pylori необходимы согласованные результаты как минимум двух тестов. Рекомендуется, чтобы первоначальный диагноз инфекции H. pylori основывался на положительном гистопатологическом исследовании и положительном RUT или на положительном посеве биопсии желудка. Текущие рекомендации по диагностике инфекции H. pylori у детей — это эндоскопия верхних отделов желудочно-кишечного тракта с биопсией желудка (антрального отдела и тела) для гистологии, посева и RUT.Для определения эрадикации H. pylori надежными неинвазивными тестами являются выявление антигена H. pylori в стуле с помощью ИФА. [15] Перед тестированием пациента на эрадикацию H. pylori рекомендуется подождать не менее 2 недель после прекращения приема ингибиторов протонной помпы (ИПП) и 4 недели после прекращения приема антибиотиков. [5]
Лечение / управление
Для достижения более высокой степени искоренения инфекции H. pylori Европейское общество педиатрической гастроэнтерологии, гепатологии и питания (ESPGHAN) и Североамериканское общество детской гастроэнтерологии, гепатологии и питания (NASPGHAN) обновили руководство по лечению для детей и подростков.Если штамм чувствителен к CLA и метронидазолу (MET). Если этот режим не дает результатов, CLA можно заменить на MET (20 мг / кг / день) без дальнейшего тестирования чувствительности к антибиотикам. Другой вариант лечения — последовательная терапия в течение 10 дней (ИПП с АМО в течение 5 дней, затем ИПП с МЕТ и CLA в течение 5 дней) у педиатрических пациентов, инфицированных полностью чувствительными штаммами.Последовательная терапия не должна проводиться, если штамм устойчив к MET или CLA; тем не менее, этот режим лечения подвергает ребенка воздействию трех разных антибиотиков. Дозы лекарств следует рассчитывать на основе веса ребенка, и рекомендуется более высокая доза ИПП на кг массы тела, чтобы подавить кислотность у детей младшего возраста по сравнению с подростками и взрослыми. ИПП рекомендуется принимать не менее чем за 15 минут до еды. В случае устойчивости как к CLA, так и к MET или когда чувствительность к противомикробным препаратам неизвестна, четырехкратная терапия висмутом, состоящая из солей висмута (8 мг / кг / день), PPI, AMO (для детей младше 8 лет) или тетрациклина (для детей) старше 8 лет) и действует НДПИ.Несмотря на ограниченные данные, в данном случае рекомендуется использовать другую схему — комбинацию тройной терапии высокими дозами АМО с МЕТ. [5] [15] Развитие устойчивости к антибиотикам — серьезная проблема, которая варьируется от региона к региону. Использование антибиотиков из группы макролидов для лечения инфекций дыхательных путей привело к появлению устойчивости к CLA H. pylori [16]. При неэффективности лечения экстренную терапию следует подбирать индивидуально в зависимости от чувствительности к антибиотикам. По сравнению с азиатами, европейцы быстрее метаболизируют ИПП из-за генетического полиморфизма CYP2C19.Следовательно, следует использовать ИПП, такие как эзомепразол и рабепразол, которые менее подвержены деградации быстрыми метаболизаторами с полиморфизмом CYP2C19, когда они доступны. Кроме того, по имеющимся данным, пробиотики не показали улучшения показателей эрадикации или уменьшения побочных эффектов [5].
Медицинская онкология
H. pylori, канцероген группы 1 может привести к аденокарциноме желудка через последовательность патологий, начиная с гастрита => атрофии => кишечной метаплазии => дисплазии => карциномы.У пациентов с лимфомой из лимфоидной ткани, связанной со слизистой оболочкой (MALT), H. pylori выявляется более чем в 75% случаев [9]. Тест на H. pylori рекомендуется детям, у которых есть родственники первой степени родства с раком желудка [15].
Улучшение результатов группы здравоохранения
Клинические испытания фазы 3 у детей в Китае документально подтвердили эффективность и безопасность пероральной рекомбинантной вакцины против H. pylori. Это можно рассматривать как будущий вариант снижения заболеваемости хеликобактерной инфекцией, особенно в развивающихся странах.Вакцина обеспечивала защиту от инфекции H. pylori до 3 лет; однако в вакцинированной когорте требуется более длительное наблюдение, а также исследование для определения сроков введения бустерных доз для долгосрочной защиты от инфекции H. pylori. [7]
Рисунок
Helicobacter pylori. Изображение любезно предоставлено S Bhimji MD
Ссылки
- 1.
- Ceylan A, Kirimi E, Tuncer O, Türkdoan K, Ariyuca S, Ceylan N. Распространенность Helicobacter pylori у детей и членов их семей в одном районе Турции.J Health Popul Nutr. 2007 декабрь; 25 (4): 422-7. [Бесплатная статья PMC: PMC2754017] [PubMed: 18402185]
- 2.
- Hooi JKY, Lai WY, Ng WK, Suen MMY, Underwood FE, Tanyingoh D, Malfertheiner P, Graham D.Y, Вонг VWS, Wu JCY, Chan FK , Sung JJY, Kaplan GG, Ng SC. Глобальная распространенность инфекции Helicobacter pylori: систематический обзор и метаанализ. Гастроэнтерология. 2017 Август; 153 (2): 420-429. [PubMed: 28456631]
- 3.
- Грэм Д. Ю., Адам Э., Редди Г. Т., Агарвал Дж. П., Агарвал Р., Эванс Д. Д., Малати Н. М., Эванс Д. Г..Сероэпидемиология инфекции Helicobacter pylori в Индии. Сравнение развивающихся и развитых стран. Dig Dis Sci. 1991 август; 36 (8): 1084-8. [PubMed: 1864201]
- 4.
- Iannone A, Giorgio F, Russo F, Riezzo G, Girardi B, Pricci M, Palmer SC, Barone M, Principi M, Strippoli GF, Di Leo A, Ierardi E. Новые фекальные тест на неинвазивное обнаружение Helicobacter pylori : исследование диагностической точности. Мир Дж. Гастроэнтерол. 2018 21 июля; 24 (27): 3021-3029. [Бесплатная статья PMC: PMC6054951] [PubMed: 30038469]
- 5.
- Джонс Н.Л., Колецко С., Гудман К., Бонтемс П., Кадранель С., Кассвалл Т., Цинн С., Голд Б.Д., Гварнер Дж., Элитсур Y, Хоман М., Калач Н., Кори М., Мадрасо А., Меграуд Ф, Пападопулу А., Роуленд М., ЭСПГАН, НАСПГАН. Совместное руководство ESPGHAN / NASPGHAN по лечению Helicobacter pylori у детей и подростков (обновление 2016 г.). J Pediatr Gastroenterol Nutr. 2017 июн; 64 (6): 991-1003. [PubMed: 28541262]
- 6.
- Джонс Н.Л., Шерман П.М. Инфекция Helicobacter pylori у детей.Curr Opin Pediatr. 1998 Февраль; 10 (1): 19-23. [PubMed: 9529633]
- 7.
- Цзэн М., Мао XH, Ли Дж. Х., Тонг В. Д., Ван Б., Чжан Ю. Дж., Го Г, Чжао З. Дж., Ли Л., Ву Д. Л., Лу Д. С., Тан З. М., Лян Х. Wu C, Li DH, Luo P, Zeng H, Zhang WJ, Zhang JY, Guo BT, Zhu FC, Zou QM. Эффективность, безопасность и иммуногенность пероральной рекомбинантной вакцины против Helicobacter pylori у детей в Китае: рандомизированное, двойное слепое, плацебо-контролируемое исследование фазы 3. Ланцет. 2015 10 октября; 386 (10002): 1457-64. [PubMed: 26142048]
- 8.
- Замани М., Вахеди А., Магдури З., Шокри-Ширвани Дж. Роль продуктов питания в передаче Helicobacter pylori в окружающей среде. Caspian J Intern Med. Лето 2017; 8 (3): 146-152. [Бесплатная статья PMC: PMC5596183] [PubMed: 28932364]
- 9.
- Diaconu S, Predescu A, Moldoveanu A, Pop CS, Fierbințeanu-Braticevici C. Инфекция Helicobacter pylori: старые и новые. J Med Life. 2017 апрель-июнь; 10 (2): 112-117. [Бесплатная статья PMC: PMC5467250] [PubMed: 28616085]
- 10.
- Kao CY, Sheu BS, Wu JJ.Инфекция Helicobacter pylori: обзор факторов вирулентности бактерий и патогенеза. Биомед Дж. 2016 Февраль; 39 (1): 14-23. [Бесплатная статья PMC: PMC6138426] [PubMed: 27105595]
- 11.
- Ли Дж.Й., Ким Н. Диагностика Helicobacter pylori с помощью инвазивного теста: гистология. Ann Transl Med. 2015 Янв; 3 (1): 10. [Бесплатная статья PMC: PMC4293485] [PubMed: 25705642]
- 12.
- Ashton-Key M, Diss TC, Isaacson PG. Обнаружение Helicobacter pylori в образцах биопсии и резекции желудка.J Clin Pathol. 1996 Февраль; 49 (2): 107-11. [Бесплатная статья PMC: PMC500340] [PubMed: 8655673]
- 13.
- Раджиндраджит С., Деванараяна Н.М., де Сильва Х.Дж. Инфекция Helicobacter pylori у детей. Саудовская Дж. Гастроэнтерол. 2009 Апрель; 15 (2): 86-94. [Бесплатная статья PMC: PMC2702974] [PubMed: 19568571]
- 14.
- Fischbach W., Malfertheiner P. Инфекция Helicobacter Pylori. Dtsch Arztebl Int. 2018 22 июня; 115 (25): 429-436. [Бесплатная статья PMC: PMC6056709] [PubMed: 29999489]
- 15.
- Koletzko S, Jones NL, Goodman KJ, Gold B, Rowland M, Cadranel S, Chong S, Colletti RB, Casswall T, Elitsur Y, Guarner J, Kalach N, Madrazo A, Megraud F, Oderda G., H pylori Рабочие группы ESPGHAN и NASPGHAN. Основанные на фактах рекомендации ESPGHAN и NASPGHAN по инфекции Helicobacter pylori у детей. J Pediatr Gastroenterol Nutr. 2011 Август; 53 (2): 230-43. [PubMed: 21558964]
- 16.
- Устойчивость к антибиотикам Mégraud F. H. pylori: распространенность, важность и успехи в тестировании.Кишечник. 2004 сентябрь; 53 (9): 1374-84. [Бесплатная статья PMC: PMC1774187] [PubMed: 15306603]
Frontiers | Адгезия и инвазия эпителиальных клеток слизистой оболочки желудка с помощью Helicobacter pylori
Введение
Helicobacter pylori — это грамотрицательные жгутиковые микроаэрофильные бактерии, которые селективно колонизируют слизистую оболочку желудка. H. pylori — один из наиболее распространенных инфекционных агентов в мире, и, по оценкам, около 50% населения мира инфицировано (Marshall and Warren, 1983, 1984).Хотя подробный путь передачи H. pylori остается неопределенным, орально-оральный или фекально-оральный путь в детстве считается наиболее вероятным методом передачи от человека к человеку (Goh et al., 2011). После создания H. pylori не имеет значительных бактериальных конкурентов (Peek and Blaser, 2002). Распространенность инфекции H. pylori широко варьируется в зависимости от географического региона, возраста, расы и социально-экономического статуса (СЭС), а в развивающихся странах уровень инфицирования выше, чем в развитых странах (Brown, 2000).Действительно, распространенность демонстрирует колебания от страны к стране: значения от 15,4% в Австралии до значений до 90% в развивающихся странах, таких как Иран (Moujaber et al., 2008; Hosseini et al., 2012; Siao и Сомсук, 2014). H. pylori уникален тем, что бактерия может сохраняться в течение десятилетий в суровых условиях желудка, повреждая слизистую оболочку желудка и изменяя характер высвобождения гормона желудка, тем самым влияя на физиологию желудка (Wang et al., 2014). Медленное развитие рака, известное как каскад Корреа (Correa, 1992), включает в себя ряд промежуточных стадий (предраковые поражения) до возникновения злокачественного новообразования как такового .Эти предраковые поражения возникают в следующем порядке: гастрит, атрофия, кишечная метаплазия (IM) и, в конечном итоге, дисплазия. H. pylori представляет собой наиболее значительный фактор риска злокачественных опухолей желудка (Wang et al., 2014). Рак желудка (РЖ) — коварное заболевание, симптомы которого часто проявляются на запущенной стадии, когда немногие оставшиеся терапевтические варианты имеют низкую эффективность (Boreiri et al., 2013). Примерно у 10% инфицированных людей развиваются тяжелые поражения желудка, например, при язвенной болезни; Прогресс до GC на 1-3% с низкой 5-летней выживаемостью (Cirak et al., 2007), и у 0–1% развивается лимфома, связанная со слизистой оболочкой лимфоидной ткани (MALT) (Noto and Peek, 2012; Parreira et al., 2013; Wang et al., 2014). По сравнению с неинфицированными людьми, люди, инфицированные H. pylori , по оценкам, имеют в 2-8 раз повышенный риск развития GC (Huang et al., 1998; Eslick et al., 1999; Helicobacter and Cancer Collaborative Group, 2001). ; Kamangar et al., 2006; Wang et al., 2007), а Международное агентство по изучению рака (IARC) классифицировало H.pylori как канцероген класса I (Рабочая группа МАИР по оценке канцерогенных рисков для человека, 1994). Однако неспособность иммунной системы избавиться от инфекции H. pylori описана недостаточно. Более того, механизмы, контролирующие индукцию и поддержание хронического воспаления, вызванного H. pylori , изучены лишь частично.
В прошлом H. pylori считалась неинвазивной бактерией, которая обычно прикреплялась только к эпителиальным клеткам слизистой оболочки желудка или выживала в просвете желудка.Напротив, недавние исследования показали, что H. pylori является инвазивным и теперь рассматривается как особый внутриклеточный патоген (Petersen and Krogfelt, 2003; Dubois and Borén, 2007). H. pylori микроколонии образуются на поверхности клеточной мембраны, и эта область затем становится микросредой для размножения бактерий (Tan et al., 2009). H. pylori может проникать в клетки и реплицироваться, чтобы воспроизводить и завершать полный биологический цикл путем деления клеток (Chu et al., 2010). Тем не менее, механизм инвазии остается неясным, и на сегодняшний день исследования в основном сосредоточены на рецептор-опосредованном эндоцитозе и тирозинкиназозависимом процессе (Evans et al., 1992; Birkness et al., 1996; Su et al., 1999; Kwok et al., 2002). Фагосома образуется после того, как H. pylori вторгается в эпителиальные клетки желудка; Затем бактерия покидает клетки, чтобы колонизировать снова, пока условия являются подходящими, и повторно заражает клетки. Эти данные свидетельствуют о том, что инвазия может играть важную роль в индукции заболевания, ускользании от иммунитета и хронической инфекции (Kwok et al., 2002; Дюбуа и Борен, 2007; Jang et al., 2013). В этом процессе «клеточной интернализации» бактерия специфически связывается с рецептором клетки-хозяина и проникает в цитоплазму через фагоцитарные вакуоли, образованные в результате инвагинации клеточной мембраны. Таким образом, чтобы получить представление о патогенном механизме H. pylori , в этой статье будут рассмотрены соответствующие исследования и описаны доказательства адгезии и инвазии эпителиальных клеток слизистой оболочки желудка этой бактерией.
Адгезия клетки-хозяина
H.пилориВ слое желудочной слизи бактерии можно найти относительно близко к просвету желудка или глубоко внутри желудочных желез, и эти микробы могут свободно плавать (Hazell et al., 1986; Schreiber et al., 2004; Celli et al. , 2009) или прикрепляются к эпителиальным клеткам желудка (Hessey et al., 1990). Чтобы добиться успешного приживления, что является наиболее важным этапом в инфекции H. pylori , бактериальные клетки должны выжить в различных неблагоприятных условиях, таких как воздействие пепсина и чрезвычайно низкий pH.Приживление происходит в первую очередь, когда молекулы адгезии или другие молекулы на поверхности H. pylori связываются с муцинами, позволяя бактериальным клеткам колонизировать эпителий слизистой оболочки желудка. Это событие запускает экспрессию нескольких бактериальных генов, в том числе тех, которые кодируют факторы вирулентности и защищают патоген от механизмов очистки, таких как поток жидкости, перистальтическое движение или отслаивание слизистого слоя (Kim et al., 2004). Этот процесс включает как минимум два этапа: (1) H.pylori быстро перемещается через слой слизи на поверхность слизистой оболочки желудка, которая имеет относительно нейтральный pH, под эгидой буферного механизма pH; и (2) H. pylori прочно прикрепляется к эпителиальным клеткам слизистой оболочки желудка через белок наружной мембраны (OMP).
Муцины
Муцины, представляющие собой высокомолекулярные, сильно гликозилированные гликопротеины, секретируемые эпителиальными клетками, играют ключевую роль в процессе адгезии. Муцины расположены на поверхности полости желудка и являются основными компонентами эпителиального слизистого слоя слизистой оболочки желудка.В этом месте муцины образуют барьер в системе защиты слизистой оболочки, который защищает эпителиальные клетки желудка от химических, ферментативных, микробных и механических повреждений. Муцин-1 (MUC-1), Муцин-5AC (MUC-5AC) и Муцин-6 (MUC-6) экспрессируются в слизистой оболочке желудка здоровых взрослых людей, а гены, кодирующие эти муцины, расположены на разных хромосомах. Основные структуры, образованные муцинами, представляют собой белковые каркасы на основе корового пептида, типичная структура которого представляет собой переменное количество тандемных повторов (VNTR), богатых серином, треонином и пролином, которые являются потенциальными сайтами гликозилирования.Одно исследование на сегодняшний день продемонстрировало, что MUC-5AC и MUC-6 разделены в геле слизистой желудка, в результате чего получается многослойный линейный массив (Ho et al., 2004). Первый в основном находится на поверхности и дне слизистого геля, а второй присутствует среди различных слоев. Это естественное расслоение муцинов увеличивает вязкость геля эпителиальной слизи слизистой оболочки желудка и обеспечивает независимую систему для полной защиты эпителиальных клеток слизистой оболочки желудка. Следовательно, H. pylori должен проходить через муцины, чтобы успешно прикрепиться к клеткам-хозяевам.
Мочевины и подвижность
Как уреаза, так и опосредованная жгутиками, управляемая хемосенсорами подвижность важны и имеют отношение к процессу колонизации (Eaton et al., 1991, 1996; Nakamura et al., 1998; Rolig et al., 2012). H. pylori секретирует большое количество уреазы, а связанный с поверхностью фермент катализирует гидролиз мочевины с образованием аммиака и бикарбоната, которые затем выделяются в цитозоль и периплазму, образуя нейтральную среду вокруг бактериальных клеток (Weeks et al. ., 2000). Этот процесс снижает вязкость и модуль упругости слоя слизи, который превращается из геля в вязкий раствор с увеличением pH, тем самым облегчая прохождение бактерий через слизь. Аммиак защищает метаболическую активность H. pylori , которая остается на уровне 50–60% от его нормального уровня активности в очень кислой среде с pH 2,5 (Celli et al., 2009; Follmer, 2010). Микроскопические исследования подвижности H. pylori в слизистой оболочке желудка при кислых и нейтральных значениях pH в отсутствие мочевины показали, что бактерии свободно плавают при высоком pH, но сильно ограничены при низком pH (Celli et al., 2009). С точки зрения гидродинамики форма клетки H. pylori также может влиять на скорость ее плавания. Предыдущие исследования показали, что H. pylori обладает многочисленными длинными жгутиками, которые позволяют клетке плавать через липкий вязкоупругий слизистый гель подобно тому, как винт проходит через пробку (Berg and Turner, 1979; Karim et al. , 1998). Скорость плавания также уменьшается с увеличением вязкости раствора полимера (Worku et al., 1999). Результаты Martínez et al.(2016) согласуются с приведенными выше наблюдениями. Исходя из этого, эти авторы проводят углубленный количественный анализ естественной изменчивости спиральных клеток и морфологии жгутика у H. pylori , показывая, что форма клеток и количество жгутиков независимо друг от друга влияют на скорость плавания в вязкой среде с количеством жгутиков. способствуя в большей степени. Кроме того, что касается других комменсальных микробов, которые колонизируют хозяина в течение длительных периодов времени, H. pylori должен улавливать и интегрировать многие сигналы, исходящие от желудочного эпителия, которые привлекают микробы к поверхности клетки для колонизации и сохранения.Эта способность двигаться в ответ на химические сигналы, т. Е. Хемотаксис, определяется основными белками сигнального комплекса CheW, CheA и CheY (Beier et al., 1997; Foynes et al., 2000; Pittman et al., 2001) . H. pylori также имеет три мембраносвязанных хеморецептора, TlpA, TlpB и TlpC, и один цитоплазматический хеморецептор, TlpD (Lertsethtakarn et al., 2011). Rolig et al. (2012) обнаружили, что разные области желудка содержат уникальные хемотаксические сигналы. Например, в корпусе H.pylori использует хемотаксис для начальной локализации, но не для последующего роста. Напротив, в антральном отделе и переходной зоне тело-антральное пространство хемотаксис не способствует начальной колонизации, но способствует последующей пролиферации. Основным хеморецептором, который позволяет H. pylori процветать в антральном отделе, является TlpD, а другие хеморецепторы играют второстепенные роли. Таким образом, хемотаксис может быть необходим для определения местоположения антрального отдела или для поддержания колонизации в этом месте. Действительно, хемотаксис H.pylori в направлении мочевины, присутствующей на поверхности эпителиальных клеток, также может иметь решающее значение для выживания в желудке (Nakamura et al., 1998). Недавно было продемонстрировано, что H. pylori плывет к поврежденному эпителию, что позволяет предположить, что бактериальные клетки привлекаются к молекулам, производным от хозяина (Aihara et al., 2014). Основным бактериальным хеморецептором, ответственным за это хемоаттрактор, является TlpB, а мочевина была идентифицирована как метаболит хозяина, который привлекает H. pylori (Huang et al., 2015). Кроме того, Хуанг и др. (2015) выявили функцию уреазы H. pylori , способствующую чувствительному обнаружению мочевины при концентрациях всего 50 наномолярных. Таким образом, H. pylori разработал чувствительную систему хемодетекции и разрушения мочевины, включающую высокоаффинное взаимодействие хеморецептор-лиганд, которое функционирует в наномолярных концентрациях, локально создаваемых уреазой, что позволяет бактериям динамически и локально изменять среду хозяина для определения местоположения эпителий.В целом, мы полагаем, что способность H. pylori проходить сквозь слизистый гель может быть достигнута двумя способами: жгутики и хемотаксис вносят определенный вклад, но также важны изменения реологических свойств окружающей среды.
Адгезины
Адгезины, которые прикрепляются к поверхности бактерии, играют жизненно важную роль, поскольку они могут распознавать структуры гликанов, экспрессируемых в слизистой оболочке желудка, а H. pylori должен плавать через гель слизи (Ilver et al., 1998; Махдави и др., 2002). Используя адгезины, H. pylori может идентифицировать пептидогликаны на поверхности эпителиальных клеток желудка, молекулы, которые в основном находятся на муцинах в геле слизистой желудка. Кроме того, любая клетка H. pylori , которая не прикрепляется к эпителиальной клетке, должна быть быстро удалена с поверхности эпителиальной клетки и геля слизи. В настоящее время принято считать, что OMP являются основными адгезинами H. pylori . Среди этих адгезинов антигенсвязывающая адгезия группы крови (BabA) может идентифицировать дифукозилированный антиген ABO / Lewis b (LeB), присутствующий на эритроцитах и эпителиальных клетках слизистой оболочки желудочно-кишечного тракта.В нормальной ткани желудка LeB-связывающие штаммы всегда связываются с MUC-5AC- и LeB-позитивными эпителиальными клетками (Van de Bovenkamp et al., 2003). Более того, взаимодействие BabA-Leb важно не только для прикрепления H. pylori к поверхности желудка, но и для закрепления системы бактериальной секреции на поверхности клетки-хозяина для эффективной инъекции бактериальных факторов в цитозоль клетки-хозяина, что является причина клинических исходов. Другими словами, как только BabA связывается с LeB, запускается передача сигналов клетки-хозяина, зависимая от системы секреции типа IV (TFSS), для индукции транскрипции генов, которые усиливают воспаление, развитие кишечной метаплазии и связанную с ней предраковую трансформацию (Ishijima et al., 2011). Другой адгезин представляет собой адгезию, связывающую сиаловую кислоту (SabA), которая может связываться с антигенами Lewis X (sLex) и Lewis a (sLea). Антигены Льюиса часто встречаются в инфицированной и воспаленной слизистой оболочке желудка (Lindén et al., 2008). Экспрессия SabA может быстро реагировать на меняющиеся условия в желудке или в различных областях желудка, что позволяет H. pylori адаптироваться к различным микросредам или иммунным ответам хозяина, обеспечивая долгосрочную колонизацию и инфекцию (Goodwin et al., 2008) .Соответственно, SabA-опосредованная приверженность положительно коррелирует с концентрацией sLex in vitro (Lindén et al., 2004). Во время стойкой инфекции и хронического воспаления H. pylori вызывает изменение в паттернах гликозилирования в слизистой оболочке желудка, включая активацию ассоциированных с воспалением антигенов sLex, а H. pylori , вероятно, прилипнет к слизистой оболочке желудка с помощью SabA. Кроме того, SabA, взаимодействуя с антигеном sLex, может усиливать H.pylori у пациентов со слабой экспрессией Leb или без нее (Yamaoka, 2008). Производство SabA действительно связано с тяжелой кишечной метаплазией, атрофией желудка и развитием рака желудка (Yamaoka et al., 2006). Однако де Клерк и соавт. (2016) также обнаружили, что определенные штаммы Lactobacillus могут ингибировать экспрессию SabA на уровне транскрипции, высвобождая эффекторную молекулу в среду, дополнительно влияя на связывающую способность H. pylori и тем самым снижая ее адгезию.В частности, Lactobacillus , хорошо известный представитель нормальной микробиоты желудочно-кишечного тракта человека, всегда изучалась в отношении H. pylori , но в основном как возможная добавка для лечения антибиотиками (Patel et al., 2014 ), а вмешательство в колонизацию H. pylori может вносить вклад в молекулярный механизм этой ассоциации (de Klerk et al., 2016). AlpA и AlpB как OMP также играют роль в прикреплении к клеткам и тканям хозяина (Odenbreit et al., 1999, 2002а). Локус alpAB, который повсеместно присутствует в штаммах H. pylori , экспрессируется во время инфекций (Rokbi et al., 2001; Odenbreit et al., 2009), а мутанты alpAB нарушают сцепление с срезами ткани желудка человека (Odenbreit и др., 1999). Одно исследование показало, что ламинин является рецептором хозяина как для AlpA, так и для AlpB, а H. pylori , дефицитный по этим факторам, вызывает более тяжелое воспаление, чем изогенный штамм дикого типа у песчанок (Senkovich et al., 2011). Причина может заключаться в том, что локус alpAB влияет на передачу сигналов в клетках-хозяевах и продукцию цитокинов (Odenbreit et al., 2002a, b; Loke et al., 2007; Lu et al., 2007). H. pylori Белок CagL представляет собой специализированный адгезин, нацеленный на поверхность пилуса, где он связывается с рецептором интегрина альфа5бета1 на эпителиальных клетках желудка и активирует его через мотив аргинин-глицин-аспартат. Это взаимодействие может опосредовать рецептор-зависимую доставку CagA в эпителиальные клетки желудка и может способствовать определенным внутриклеточным сигнальным событиям.(Kwok et al., 2007; Barden et al., 2013). Текущие данные свидетельствуют о том, что MUC-1 фактически ингибирует H. pylori колонизацию in vitro и in vivo (McGuckin et al., 2007; Lindén et al., 2009). Lindén et al. (2009) показали, что MUC1 может ингибировать связывание H. pylori с эпителиальными клетками, процесс, который происходит как через BabA, так и через SabA. Когда патоген не может связываться с MUC1, муцин стерически подавляет адгезию к другим потенциальным лигандам клеточной поверхности.Однако, когда патоген действительно связывается с MUC1, внеклеточный домен муцина высвобождается с поверхности эпителия и действует как высвобождаемая приманка для предотвращения длительного прилипания. H. pylori также может модулировать паттерны гликозилирования клетки-хозяина для усиления адгезии. Высокопатогенный штамм был способен изменять экспрессию β3GlcNAcT5 (β3GnT5), трансферазы GlcNAc, необходимой для биосинтеза антигенов Льюиса, увеличивая экспрессию sLex и адгезию H. pylori в клеточных линиях карциномы желудка человека (Marcos et al., 2008). Более того, хотя уреаза и алкилгидропероксидредуктаза (AhpC), расположенные на поверхности H. pylori , не являются OMP, эти ферменты по-прежнему обладают хорошим сродством к муцинам желудка, поскольку они являются компонентами мембраны (Nilsson et al., 2000). . Loke et al. (2007) подтвердили, что и полисахариды, и муцин могут связываться с AhpC и UreA, поэтому полисахариды могут действовать как потенциальный антиадгезивный агент против H. pylori колонизации муцина желудка, конкурируя за участки связывания муцина.Этот результат косвенно указывает на вероятную роль этих двух белков H. pylori в колонизации. Другие адгезины, такие как HopZ и OipA, также участвуют в процессе адгезии, хотя конкретные лиганды требуют дальнейшего уточнения.
Прилипает к стыкам
В слизистой оболочке желудка базальная мембрана отделена от просвета желудка только одним клеточным слоем, и H. pylori может свободно плавать в слое слизи в тесном контакте с эпителиальными клетками, предпочтительно на апикальной стороне межклеточного пространства. контакты (Hazell et al., 1986; Некки и др., 2007; Tan et al., 2009). Любое повреждение слоя эпителиальных клеток обнажит белки внеклеточного матрикса, а нарушение плотных контактов H. pylori также позволит бактериальным клеткам получить доступ к базальной мембране (Necchi et al., 2007). H. pylori , нацеливание на адгезивные соединения может быть полезным для колонизации и сохранения на эпителиальной поверхности хозяина, а также может вызывать аномальную активацию рецепторов и стимуляцию сигнальных путей, участвующих в воспалении, пролиферации, миграции и инвазии, что будет иметь пагубные последствия. последствия и привести к развитию болезни (Costa et al., 2013).
Клеточная инвазия
H. pyloriНаблюдение
In vivo и In VitroАдгезия является важным этапом интернализации H. pylori , и инвазия была подтверждена в различных образцах (Таблица 1). Некоторые исследования in vivo демонстрируют, что H. pylori могут поражать поражения слизистой оболочки желудка на разных стадиях. Например, инвазия наблюдалась у пациентов с гастритом, язвами, предраковыми поражениями и раком желудка, и бактерии были способны проникать в эпителиальные клетки желудка и двенадцатиперстной кишки, париетальные клетки и иммунные клетки и даже собственную пластинку оболочки (Noach et al., 1994; эль-Шура, 1995 год; Пападогианнакис и др., 2000; Семино-Мора и др., 2003; Дюбуа и Борен, 2007; Некки и др., 2007; Озбек и др., 2010). Животные, такие как мыши, также восприимчивы к инвазии H. pylori (Oh et al., 2005), а in vitro исследования показали, что H. pylori могут проникать в клетки. Хотя H. pylori является распространенной патогенной бактерией пищеварительной системы человека, инвазия не ограничивается клеточными линиями, которые тесно связаны с эпителиальными клетками желудка, такими как AGS, MKN45 и SGC-7901.Действительно, инвазия была подтверждена, среди прочего, в клеточных линиях Huh7, HEp-2 и HeLa (Björkholm et al., 2000; Amieva et al., 2002; Kwok et al., 2002; Terebiznik et al., 2006; Zhang et al., 2007; Ito K. et al., 2008).
Таблица 1. Обзор соответствующих исследований по инвазии H. pylori (с 2001 по 2016 г.) .
Инвазивная способность также зависит от типа клетки-хозяина и штамма H. pylori со скоростью примерно 0.01–0,1% инокулированных бактерий (Rautelin et al., 1995; Burridge, Chrzanowska-Wodnicka, 1996; Amieva et al., 2002; Dubois, Borén, 2007; Ito K. et al., 2008; Chu et al., 2010). Zhang et al. (2007) указали, что штамм 88-3887 может проникать в клетки лучше, чем штаммы SS1 и X47, и каждый штамм имел самую высокую инвазивную способность в клетках SCG-7901. Поскольку H. pylori обычно не обладает способностью свободно проникать в клетки, большинство бактериальных клеток интернализуется в цитоплазму посредством эндоцитоза (Ozbek et al., 2010). Исследование Стэнфордского университета (Amieva et al., 2002) показало, что из-за врожденного иммунного ответа клетки могут образовывать фагоцитарные везикулы, которые окружают H. pylori после проникновения в клетку, даже если везикулы были незрелыми. Инкапсулированные клетки H. pylori не проглатывались и не переваривались; вместо этого везикула действовала как защитный барьер, позволяя микробам уклоняться от иммунного ответа.
Эти исследователи также использовали дифференциальное иммунное флуоресцентное окрашивание и живую видеомикроскопию для дальнейшего изучения физиологической активности интернализованного H.pylori и обнаружили, что интернализация происходит в течение 45 минут после прикрепления бактерий к поверхности клетки. Затем бактериальные клетки попадали в вакуоли и оставались жизнеспособными в течение не менее 48 часов. Однако репликация интернализованных клеток H. pylori в исследовании не наблюдалась, возможно, из-за короткого времени мониторинга и из-за того, что внутриклеточная среда не подходила для бактериальной репликации (Amieva et al., 2002). Тем не менее, последнее исследование показало, что H. pylori может пролиферировать в клетках: две линии клеток (AGS и MKN45) были оценены в экспериментах по защите от гентамицина, и было обнаружено, что H.pylori может пролиферировать после попадания в клетки, при этом максимальное количество бактериальных клеток наблюдается через 6–12 часов (van der Wouden et al., 1999; Rokkas et al., 2009; Chu et al., 2010). Zhang et al. (2015) также наблюдали этот феномен в своем исследовании, когда H. pylori прикреплялись к клеточной мембране и объединялись с клеточными микроворсинками через 2,5 часа заражения. После инвазии двухслойные мембранные везикулы окружали клетки H. pylori (4 ч). Через 6 часов после заражения инвазия достигла пика, и в цитоплазме было обнаружено множество бактерий.Бактериальная адгезия, инвазия, деление и лизис наблюдались через 12 часов, а большая часть внутриклеточных бактериальных клеток лизировалась через 24 часа. Другое исследование подтвердило, что аутофагосомы образуются для разложения проглоченного H. pylori через лизосомный механизм уничтожения через 24 ч после инвазии (Chu et al., 2010). H. pylori обладает сложными механизмами. Например, бактерия ищет убежища внутри клеток-хозяев, когда внешняя среда меняется и становится непригодной для выживания; как только внешние условия становятся пригодными для выживания, неградио H.pylori высвобождается из клеток-хозяев во внешнюю среду в подходящее время. Эксперименты in vitro показали, что после удаления гентамицина жизнеспособные H. pylori повторно заселяют внеклеточную среду параллельно с уменьшением количества внутривакуолярных бактерий (Amieva et al., 2002). Независимо от того, как H. pylori выходит из внутриклеточного пространства, остается неясным. Возможно, что жизнеспособные бактерии высвобождаются по мере гибели инфицированных клеток.Вакуоли, содержащие живые H. pylori , напоминают мультивезикулярные тельца, которые в некоторых типах клеток способны к экзоцитозу и, таким образом, высвобождать свое содержимое во внеклеточную среду (Amieva et al., 2002). Вкратце, количество бактерий в клетке поддерживается посредством динамического процесса, включающего инвазию, пролиферацию, апоптоз и высвобождение (рис. 1).
Рисунок 1. Обычно H. pylori прикрепляется к эпителиальным клеткам слизистой оболочки желудка через белок внешней мембраны и вводит CagA в клетки-хозяева через секреторную систему типа IV, что приводит к изменениям в передаче сигналов цитокинов и контролю клеточного цикла .Когда внешняя среда меняется и становится неблагоприятной, H. pylori вторгается в эпителиальные клетки и размножается в двухслойных мембранных пузырьках в поисках убежища. После интернализации формируются аутофагосомы, разрушающие некоторые из проглоченных бактерий. Как только внешняя среда становится благоприятной, неградиентный H. pylori высвобождается из клеток-хозяев во внешнюю среду для повторного заселения.
В некоторой степени эти данные дают четкое объяснение повторного заражения H.pylori : бактериальные клетки могут избежать иммунного ответа эпителиальных клеток после инвазии, и количество и патогенность бактерий не уменьшаются во время этого процесса. Такой процесс может быть стратегией для H. pylori , чтобы избежать иммунного надзора и остаться в живых in vivo (Amieva et al., 2002; Dubois and Borén, 2007), и он способствует осложнению искоренения. Чтобы определить, играет ли интернализация H. pylori роль в неэффективности лечения, в одном исследовании (Wang et al., 2016), проведенный в нашей лаборатории, применил анализ инвазии для оценки уровней инвазии H. pylori клеток GES-1. Результаты показали, что уровни интернализации неудачных штаммов были выше, чем у успешных штаммов. Однако нет единого мнения относительно того, связан ли уровень интернализации с устойчивостью к антибиотикам, при этом некоторые исследования считают, что устойчивые штаммы связаны со значительно более высокой активностью интернализации, чем восприимчивые штаммы (Lai et al., 2006), но Wang et al. (2016) не сообщают об этом. Независимо от корреляции, если терапия не дает результатов, больше внимания следует уделять активности интернализации H. pylo ri.
Механизмы вторжения
Увеличивается объем исследований механизма инвазии инвазивных бактерий, и инвазия может происходить путем прямого взаимодействия с поверхностными рецепторами клетки-хозяина или путем прямой транслокации бактериальных белков в цитозоль клетки-хозяина, что способствует перестройке архитектуры плазматической мембраны и вызывает поглощение патогенов. .Первый — это механизм «молнии», и Yersinia и Listeria вторгаются в клетки таким образом. Последний является «спусковым механизмом», который используют такие бактерии, как Escherichia coli и Shigella, Salmonella (Pizarro-Cerdá and Cossart, 2006). Механизм инвазии H. pylori на сегодняшний день остается неясным. Kwok et al. (2002) обнаружили, что инвазия H. pylori в клетки AGS включает тесный контакт с микроворсинками на клеточной мембране и активацию сигналов фосфорилирования тирозина.Su et al. (1999) сообщили, что H. pylori проникает в культивируемые клетки AGS через рецептор интегрина бета 1 тирозинкиназозависимым образом. Другие исследователи сообщают, что H. pylori проникает в клетки посредством рецепторно-опосредованного эндоцитоза, который требует перестройки цитоскелета (Evans et al., 1992; Birkness et al., 1996). Учитывая тесную взаимосвязь между интегрином бета-1, цитоскелетом и патогенностью интернализованного H. pylori , Ito K. et al. (2008) использовали антитело к интегрину бета-1 для блокирования связывания H.pylori к соответствующему рецептору на клеточной мембране и использовал цитохалазин D для блокирования внутриклеточной полимеризации актина. Эти эксперименты были выполнены для дальнейшего наблюдения за изменениями инвазивной способности H. pylori , и результаты показали, что количество интернализованных бактерий существенно уменьшилось после применения этих факторов. Более того, действие цитохалазина D было более эффективным, чем действие антитела к интегрину бета 1, хотя ни одно из них не могло полностью блокировать инвазию, что позволяет предположить, что другие неидентифицированные и неподтвержденные пути опосредуют активность H.pylori . Кроме того, неясна роль факторов вирулентности бактерий в этом процессе. Как упоминалось выше, H. pylori после инвазии окружены двухслойными мембранными везикулами. Амиева и др. (2002) обнаружили, что вакуоли имеют ту же морфологию, что и мультивезикулярные тельца поздних эндосом, индуцированные вакуолизацией цитотоксина А (VacA). Роль VacA в индукции вакуолизации известна, также сообщалось о влиянии VacA на инвазивность H. pylori . Некоторые предыдущие исследования (Amieva et al., 2002; Теребизник и др., 2006; Чжан и др., 2007; Chu et al., 2010) показали, что VacA не влияет на способность H. pylori к клеточной инвазии. Хотя бактериальные клетки были обнаружены в вакуолях, образованных в результате VacA-зависимого процесса, исследователи предположили, что VacA влияет только на выживание и размножение интернализованных H. pylori . Однако исследование in vitro выявило повышенную интернализацию в штамме, продуцирующем вакуолизирующий цитотоксин, по сравнению с изогенным мутантом с нокаутом VacA (Björkholm et al., 2000). Петерсен и др. (2001) также обнаружили, что вакуолизирующий цитотоксин H. pylori может улучшить его внутриклеточное выживание в клетках AGS. Что еще более примечательно, VacA может нарушать аутофагию во время хронической инфекции, тем самым приводя к неспособности очистить бактерии, чтобы способствовать внутриклеточному выживанию (Raju et al., 2012). Это отличается от нашего предыдущего понимания того, что аутофагия может быть индуцирована как врожденный защитный механизм для защиты от инфекции H. pylori (Orvedahl and Levine, 2009).Это явление в основном связано с длительностью выдержки. Во время начальной инфекции бактериальная нагрузка и уровни VacA могут быть низкими, а аутофагия клетки-хозяина играет важную роль в очищении от бактерий; Во время хронической инфекции длительное воздействие VacA приводит к образованию незрелых аутофагосом (Raju et al., 2012). Ито К. и соавт. (2008) также использовали два типа H. pylori , различающиеся по вирулентности, для сравнения инвазивной способности и обнаружили лучшую вирулентность и инвазивность у штамма, несущего изогены cag патогенности (PAI), Vac A, OipA и BabA.Основываясь на этих доказательствах, факторы вирулентности также играют роль в клеточной инвазии, хотя роль каждого фактора в интернализации остается неясной и требует уточнения в экспериментах с изогенными мутантами. И наоборот, исследование в Китае показало противоположный результат: инвазивная способность была связана со средней областью VacA, а не с цитотоксин-ассоциированным геном A (Cag A), Cag A-EPIYA или Cag E (Zhang et al., 2015) . Следовательно, роль факторов вирулентности бактерий требует дополнительных исследований. Кроме того, поскольку ферменты Nudix обычно участвуют в бактериальной инвазии эукариотических клеток (Maki and Sekiguchi, 1992), некоторые авторы предполагают, что H.pylori invasin может играть роль в проникновении бактерии в эпителиальные клетки, потому что гидролаза Nudix NudA может разрушать токсические вещества, индуцированные во время инвазии (Lundin et al., 2003). Первоначально Lundin et al. (2003) не обнаружили поддающихся количественной оценке различий в частоте инвазии для мутанта H. pylori NudA J99 по сравнению с WT при использовании анализа защиты от гентамицина. Лю и др. (2012) подтвердили предыдущий отчет, используя FISH и ультраструктурный подход для внесения изменений в «классический» анализ защиты от гентамицина и продемонстрировав значительно больше внутриклеточных и меньшее количество мембраносвязанных H.pylori в клетках AGS, инфицированных WT, чем в клетках, инфицированных мутантом, несущим аллель ΔnudA. Эти наблюдения показали, что NudA играет биологически значимую роль в проникновении H. pylori в клетки-хозяева, и подчеркнули, что чувствительности «классического» анализа может быть недостаточно, чтобы продемонстрировать различия в способности к инвазии. Такое отсутствие чувствительности может быть связано с тем, что полное уничтожение внеклеточных бактерий достигается редко (Amieva et al., 2002).
Еще одна проблема — инвазивность H.pylori . Как упоминалось выше, связывание бактерии с клеточной мембраной необходимо до интернализации, и неясно, существует ли какая-либо связь между паттерном прилипания и инвазивностью. Васкес-Хименес и др. (2016) обнаружили, что штаммы H. pylori , проявляющие локальную адгезию, будут более реактивными по отношению к эпителиальным клеткам желудка по сравнению со штаммами, демонстрирующими диффузную адгезию; это привело бы к большему ущербу и большему количеству провоспалительных сигналов, но не имеет значительной связи с инвазивностью.Однако другой отчет показал конкретное соотношение инвазивных и прикрепленных H. pylori (Demirel et al., 2013). Zhang et al. (2015) не обнаружили существенных различий между различными штаммами в отношении соотношения инвазии и адгезии, открытие, которое показывает, что количество прикрепившихся бактерий, а не бактериальный штамм, определяет окончательное количество инвазивных бактерий. Адгезия является единственным основным фактором, определяющим инвазию клеток H. pylori , и многие исследователи провели различные эксперименты с инвазией для дальнейшего изучения этого процесса.В исследовании in vitro Kwok et al. (2002) обнаружили, что уровень проникновения H. pylori в эпителиальные клетки находится в том же диапазоне, что и у других известных инвазивных патогенов, таких как Salmonella enterica, Escherichia coli, Yersinia enterocolitica и Neisseria gonorrhoeae . Они также наблюдали большее поглощение H. pylori клетками AGS, чем клетками HeLa или HEp-2, что указывает на то, что поглощение в основном зависит от типа клетки-хозяина.
Связь с патогенезом
Патогенность бактерий, колонизирующих слизистую оболочку человека, зависит от их способности проникать в эпителиальные клетки и выживать в них.Однако вопрос о том, влияет ли интернализация H. pylori на патогенность, остается спорным. Исследование in vivo показало положительную корреляцию между инвазивной способностью H. pylori и тяжестью заболевания, а средняя частота инвазии штаммов H. pylori , обнаруженных при раке желудка и язвах, была выше, чем частота обнаруженных штаммов. при гастрите (Zhang et al., 2015). Более того, многие исследования подтвердили, что интернализованный H. pylori является патогенным и способен экспрессировать белки вирулентности Cag A и Vac A (Semino-Mora et al., 2003; Дюбуа и Борен, 2007; Некки и др., 2007; Ито Т. и др., 2008; Чу и др., 2010). Интернализованный H. pylori может также активировать ядерный фактор, усиливающий каппа-легкую цепь активированных В-клеток (NF-κB) сигнального пути, и индуцировать секрецию интерлейкина-8 (ИЛ-8), что позволяет предположить, что инвазия этой бактерии может быть важной стратегией в развитии заболеваний, ассоциированных с H. pylori (Zhang et al., 2015). Кроме того, in vivo и in vitro исследования показывают связь между интернализованными H.pylori и повреждение клеток, а также дезинтеграция клеток (el-Shoura, 1995; Wilkinson et al., 1998). Ито Т. и соавт. (2008) даже обнаружили, что вызванное H. pylori повреждение эпителия желудка позволяет бактериальным клеткам проникать в собственную пластинку и перемещаться в лимфатические узлы желудка, что может хронически стимулировать иммунную систему. Кроме того, бактериальные клетки, живые или нет, захваченные макрофагами, могут способствовать индукции и развитию хронического гастрита, индуцированного H. pylori .
Выводы
H. pylori — основные патогенные бактерии, вызывающие хронический активный гастрит, пептические язвы, лимфому лимфоидной ткани, ассоциированную со слизистой оболочкой желудка, и рак желудка. Эта бактерия ищет убежища внутри клеток, когда внешняя среда не подходит, и она также может завершить полный биологический цикл, включая пролиферацию и апоптоз, в эпителиальных клетках желудка. Кроме того, как только внешние условия станут подходящими, H.pylori покидают клетку-хозяина и могут высвободиться, чтобы инфицировать другие клетки и вызвать повторную инфекцию. Вышеупомянутые данные свидетельствуют о том, что инвазия играет важную роль в индукции заболевания, ускользании от иммунной системы и хронической инфекции. Более того, эти результаты открывают новое направление для исследования патогенного механизма желудочных заболеваний, ассоциированных с H. pylori . Последние согласованные рекомендации по лечению инфекции H. pylori включают в себя четырехкратную терапию без висмута и традиционную четырехкратную терапию висмутом в качестве стратегий первой линии (Fallone et al., 2016). На сегодняшний день исследования причин неэффективности эрадикации сосредоточены на устойчивости к антибиотикам. Однако интернализация H. pylori обеспечивает новый фокус исследования. Антибиотики в рекомендуемых схемах включают как антибиотики, проникающие через клеточную мембрану, такие как кларитромицин или метронидазол, так и антибиотики, не проникающие через клеточную мембрану, такие как амоксициллин. Увеличение концентрации и времени лечения антибиотиками, проникающими через клеточную мембрану, которые эффективно проникают в эпителиальные клетки и уничтожают внутриклеточные H.pylori может помочь в достижении полного искоренения.
Авторские взносы
YH, QW, DC, WX и NL внесли равный вклад в этот обзор.
Раскрытие информации
Язык был улучшен компанией AJE.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Работа поддержана Национальным фондом естественных наук Китая (No.81060038 и 81270479) и гранты от Talent 555 Project провинции Цзянси.
Список литературы
Айхара, Э., Клоссон, К., Маттис, А. Л., Шумахер, М. А., Энгевик, А. К., Заврос, Ю. и др. (2014). Подвижность и хемотаксис опосредуют преимущественную колонизацию участков повреждения желудка с помощью Helicobacter pylori . PLoS Pathog. 10: e1004275. DOI: 10.1371 / journal.ppat.1004275
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Амиева, М.Р., Салама, Н. Р., Томпкинс, Л. С., и Фалькоу, С. (2002). Helicobacter pylori проникает и выживает в мультивезикулярных вакуолях эпителиальных клеток. Cell. Microbiol. 4, 677–690. DOI: 10.1046 / j.1462-5822.2002.00222.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Barden, S., Lange, S., Tegtmeyer, N., Conradi, J., Sewald, N., Backert, S., et al. (2013). Спиральный мотив RGD, способствующий адгезии клеток: кристаллические структуры белка пиля CagL системы секреции Helicobacter pylori типа IV. Строение 21, 1931–1941. DOI: 10.1016 / j.str.2013.08.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Байер Д., Спон Г., Раппуоли Р. и Скарлато В. (1997). Идентификация и характеристика оперона Helicobacter pylori , который участвует в подвижности и адаптации к стрессу. J. Bacteriol. 179, 4676–4683.
PubMed Аннотация | Google Scholar
Биркнесс, К. А., Голд, Б. Д., Уайт, Э.Х., Бартлетт, Дж. Х. и Куинн, Ф. Д. (1996). In vitro модели для изучения прикрепления и инвазии Helicobacter pylori . Ann. N.Y. Acad. Sci. 797, 293–295. DOI: 10.1111 / j.1749-6632.1996.tb52983.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бьоркхольм Б., Жуховицкий В., Лёфман К., Хюльтен К., Энрот Х., Блок М. и др. (2000). Проникновение Helicobacter pylori в эпителиальные клетки желудка человека: потенциальный фактор вирулентности, устойчивости и неудач лечения. Helicobacter 5, 148–154. DOI: 10.1046 / j.1523-5378.2000.00023.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Борейри М., Самади Ф., Этемади А., Бабаи М., Ахмади Э., Шарифи А. Х. и др. (2013). Смертность от рака желудка в зоне высокой заболеваемости: долгосрочное наблюдение за Helicobacter pylori предраковых поражений в общей популяции. Arch. Иран. Med. 16, 343–347.
PubMed Аннотация | Google Scholar
Челли, Дж.П., Тернер, Б. С., Афдал, Н. Х., Китс, С., Гиран, И., Келли, К. П. и др. (2009). Helicobacter pylori перемещается через слизь за счет снижения вязкоупругости муцина. Proc. Natl. Акад. Sci. США 106, 14321–14326. DOI: 10.1073 / pnas.08106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чу, Ю. Т., Ван, Ю. Х., Ву, Дж. Дж., И Лей, Х. Ю. (2010). Инвазия и размножение Helicobacter pylori в эпителиальных клетках желудка и последствия для устойчивости к антибиотикам. Заражение. Иммун. 78, 4157–4165. DOI: 10.1128 / IAI.00524-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корреа, П. (1992). Канцерогенез желудка у человека: многоэтапный и многофакторный процесс — первая награда Американского онкологического общества по эпидемиологии и профилактике рака. Cancer Res. 52, 6735–6740.
PubMed Аннотация | Google Scholar
Коста А. М., Лейте М., Серука Р. и Фигейредо К. (2013). Адгезивные соединения как мишени для микроорганизмов: фокус на Helicobacter pylori . FEBS Lett. 587, 259–265. DOI: 10.1016 / j.febslet.2012.12.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
de Klerk, N., Maudsdotter, L., Gebreegziabher, H., Saroj, S.D., Eriksson, B., Eriksson, O.S, et al. (2016). Лактобациллы снижают прикрепление Helicobacter pylori к эпителиальным клеткам желудка хозяина путем ингибирования экспрессии генов адгезии. Заражение. Иммун. 84, 1526–1535. DOI: 10.1128 / IAI.00163-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Демирель, Б.Б., Аккас, Б. Е., Вурал, Г. У. (2013). Клинические факторы, связанные с инфекцией Helicobacter pylori — есть ли связь с историей рака желудка у членов семьи первой степени родства? Азиатский. Pac. J. Cancer Prev. 14, 1797–1802. DOI: 10.7314 / APJCP.2013.14.3.1797
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дюбуа А. и Борен Т. (2007). Helicobacter pylori является инвазивным и может быть факультативным внутриклеточным организмом. Cell. Microbiol. 9, 1108–1116. DOI: 10.1111 / j.1462-5822.2007.00921.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Итон, К. А., Брукс, К. Л., Морган, Д. Р. и Краковка, С. (1991). Существенная роль уреазы в патогенезе гастрита, вызванного Helicobacter pylori у гнотобиотических поросят. Заражение. Иммун. 59, 2470–2475.
PubMed Аннотация | Google Scholar
Итон, К. А., Суэрбаум, С., Йозенханс, К., и Краковка, С. (1996). Колонизация гнотобиотических поросят с помощью Helicobacter pylori , дефицитных по двум генам флагеллина. Заражение. Иммун. 64, 2445–2448.
PubMed Аннотация | Google Scholar
эль-Шура, С. М. (1995). Helicobacter pylori : I. Ультраструктурные последовательности адгезии, прикрепления и проникновения в слизистую оболочку желудка. Ultrastruct. Патол. 19, 323–333. DOI: 10.3109 / 01950
37
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эслик, Г.Д., Лим, Л. Л., Байлс, Дж. Э., Ся, Х. Х. и Талли, Н. Дж. (1999). Ассоциация инфекции Helicobacter pylori с карциномой желудка: метаанализ. Am. J. Gastroenterol. 94, 2373–2379. DOI: 10.1111 / j.1572-0241.1999.01360.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эванс, Д. Г., Эванс, Д. Дж., И Грэм, Д. Ю. (1992). Адгезия и интернализация Helicobacter pylori клетками HEp-2. Гастроэнтерология 102, 1557–1567.DOI: 10.1016 / 0016-5085 (92)
-F
PubMed Аннотация | CrossRef Полный текст
Фаллон, К. А., Чиба, Н., ван Зантен, С. В., Фишбах, Л., Гисберт, Дж. П., Хант, Р. Х. и др. (2016). Торонтский консенсус по лечению инфекции Helicobacter pylori у взрослых. Гастроэнтерология 151, 51–69.e14. DOI: 10.1053 / j.gastro.2016.04.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фойнс, С., Доррелл, Н., Уорд, С.J., Stabler, R.A., McColm, A.A., Rycroft, A.N., et al. (2000). Helicobacter pylori обладает двумя регуляторами ответа CheY и датчиком гистидинкиназы CheA, которые необходимы для хемотаксиса и колонизации слизистой оболочки желудка. Заражение. Иммун. 68, 2016–2023 гг. DOI: 10.1128 / IAI.68.4.2016-2023.2000
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Го, К. Л., Чан, В. К., Шиота, С., Ямаока, Ю. (2011). Эпидемиология инфекции Helicobacter pylori и последствия для общественного здравоохранения. Helicobacter 16 (Приложение 1), 1–9. DOI: 10.1111 / j.1523-5378.2011.00874.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гудвин, А. С., Вайнбергер, Д. М., Форд, К. Б., Нельсон, Д. К., Снайдер, Д. Д., Холл, Д. Д. и др. (2008). Экспрессия адгезина SabA Helicobacter pylori контролируется посредством изменения фазы и системы передачи сигнала ArsRS. Микробиология 154, 2231–2240. DOI: 10.1099 / mic.0.2007 / 016055-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hazell, S.Л., Ли А., Брэди Л. и Хеннесси В. (1986). Campylobacter pyloridis и гастрит: связь с межклеточными пространствами и адаптация к слизистой среде как важные факторы колонизации эпителия желудка. J. Infect. Дис. 153, 658–663. DOI: 10.1093 / infdis / 153.4.658
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Совместная группа по борьбе с раком Helicobacter (2001 г.). Рак желудка и Helicobacter pylori : комбинированный анализ 12 исследований случай-контроль, проведенных в рамках проспективных когорт. Gut. 49, 347–353. DOI: 10.1136 / gut.49.3.347
PubMed Аннотация | CrossRef Полный текст
Hessey, S.J., Spencer, J., Wyatt, J.I., Sobala, G., Rathbone, B.J., Axon, A.T., et al. (1990). Бактериальная адгезия и активность заболевания при хроническом гастрите, ассоциированном с Helicobacter. Кишечник 31, 134–138. DOI: 10.1136 / gut.31.2.134
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хо, С. Б., Такамура, К., Ануэй, Р., Шекель, Л. Л., Торибара, Н. У., и Ота, Х. (2004). Прилегающий слой слизистой желудка состоит из чередующихся слоев муциновых белков MUC5AC и MUC6. Dig. Дис. Sci. 49, 1598–1606. DOI: 10.1023 / B: DDAS.0000043371.12671.98
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хоссейни, Э., Пурсина, Ф., де Виле, Т. В., Сафаеи, Х. Г., и Адиби, П. (2012). Helicobacter pylori в Иране: систематический обзор ассоциации генотипов и гастродуоденальных заболеваний. J. Res. Med. Sci. 17, 280–292.
PubMed Аннотация | Google Scholar
Хуанг, Дж. К., Шридхар, С., Чен, Ю., и Хант, Р. Х. (1998). Метаанализ взаимосвязи между серопозитивностью Helicobacter pylori и раком желудка. Гастроэнтерология 114, 1169–1179.
PubMed Аннотация | Google Scholar
Хуанг, Дж. Й., Суини, Э. Г., Сигал, М., Чжан, Х. К., Ремингтон, С. Дж., Кантрелл, М. А., и др. (2015). Хемодетекция и разрушение мочевины хозяина позволяет Helicobacter pylori определять местонахождение эпителия. Клеточный микроб-хозяин 18, 147–156. DOI: 10.1016 / j.chom.2015.07.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рабочая группа МАИР по оценке канцерогенных рисков для человека (1994). Шистосомы, печеночные двуустки и Helicobacter pylori . Monogr. Eval. Канцерогенный. Риски Hum. 61, 1–241.
PubMed Аннотация
Ильвер Д., Арнквист А., Огрен Дж., Фрик И. М., Керсулит Д., Инчечик Е. Т. и др. (1998). Helicobacter pylori адгезин, связывающий фукозилированные антигены группы крови, выявленные с помощью повторной маркировки. Наука 279, 373–377. DOI: 10.1126 / science.279.5349.373
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Исидзима, Н., Судзуки, М., Ашида, Х., Итикава, Ю., Канеги, Ю., Сайто, И., и др. (2011). BabA-опосредованная приверженность является потенциалом активности системы секреции Helicobacter pylori типа IV. J. Biol. Chem. 286, 25256–25264.DOI: 10.1074 / jbc.M111.233601
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ито К., Ямаока Ю., Ота Х., Эль-Зимайти Х. и Грэм Д. Ю. (2008). Адгезия, интернализация и персистентность Helicobacter pylori в гепатоцитах. Dig. Дис. Sci. 53, 2541–2549. DOI: 10.1007 / s10620-007-0164-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ито, Т., Кобаяси, Д., Учида, К., Такемура, Т., Нагаока, С., Кобаяши И. и др. (2008). Helicobacter pylori проникает в слизистую оболочку желудка и перемещается в лимфатические узлы желудка. Lab. Инвестировать. 88, 664–681. DOI: 10.1038 / labinvest.2008.33
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янг, С. Х., Чо, С., Ли, Э. С., Ким, Дж. М., и Ким, Х. (2013). Фенилтиофенилпропенон RK-I-123 снижает уровни активных форм кислорода и подавляет активацию NF-κB, AP-1 и экспрессию IL-8 в клетках AGS желудочного эпителия, инфицированных Helicobacter pylori , инфицированных Helicobacter pylori. Inflamm. Res. 62, 689–696. DOI: 10.1007 / s00011-013-0621-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камангар, Ф., Доуси, С. М., Блазер, М. Дж., Перес-Перес, Г. И., Пиетинен, П., Ньюшаффер, К. Дж. И др. (2006). Противодействие рискам кардии желудка и некардиальных аденокарцином желудка, связанных с серопозитивностью Helicobacter pylori . J. Natl. Cancer Inst. 98, 1445–1452. DOI: 10.1093 / jnci / djj393
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карим, К.Н., Логан, Р. П., Пуэлс, Дж., Карнхольц, А., и Ворку, М. Л. (1998). Измерение подвижности Helicobacter pylori, Campylobacter jejuni и Escherichia coli путем компьютерного отслеживания в реальном времени с использованием Hobson BacTracker. J. Clin. Патол. 51, 623–628. DOI: 10.1136 / jcp.51.8.623
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, Н., Маркус, Э. А., Вен, Ю., Уикс, Д. Л., Скотт, Д. Р., Юнг, Х. С. и др. (2004). Гены Helicobacter pylori регулируются путем прикрепления к клеткам AGS. Заражение. Иммун. 72, 2358–2368. DOI: 10.1128 / IAI.72.4.2358-2368.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Квок, Т., Бакерт, С., Шварц, Х., Бергер, Дж., И Мейер, Т. Ф. (2002). Специфическое проникновение Helicobacter pylori в культивируемые эпителиальные клетки желудка посредством механизма, подобного застежке-молнии. Заражение. Иммун. 70, 2108–2120. DOI: 10.1128 / IAI.70.4.2108-2120.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Квок, Т., Zabler, D., Urman, S., Rohde, M., Hartig, R., Wessler, S., et al. (2007). Helicobacter использует интегрин для секреции типа IV и активации киназ. Природа. 449, 862–866. DOI: 10.1038 / nature06187
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лай, К. Х., Куо, К. Х., Чен, П. Ю., Пун, С. К., Чанг, С. С. и Ван, В. К. (2006). Связь устойчивости к антибиотикам и более высокой активности интернализации у устойчивых изолятов Helicobacter pylori . J. Antimicrob. Chemother. 57, 466–471. DOI: 10.1093 / jac / dki479
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lertsethtakarn, P., Ottemann, K. M., and Hendrixson, D. R. (2011). Подвижность и хемотаксис у Campylobacter и Helicobacter. Annu. Rev. Microbiol. 65, 389–410. DOI: 10.1146 / annurev-micro-0
-102908
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линден, С., Борен, Т., Дюбуа, А., и Карлштедт, И.(2004). Муцины желудка макаки резус: олигомерная структура, гликоформы и связывание Helicobacter pylori . Biochem. J. 379, 765–775. DOI: 10.1042 / BJ20031557
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линден, С. К., Шенг, Ю. Х., Эвери, А. Л., Майлз, К. М., Скуг, Э. К., Флорин, Т. Х. и др. (2009). MUC1 ограничивает инфекцию Helicobacter pylori как стерическими препятствиями, так и действуя как высвобождаемая приманка. PLOS Pathog. 5: e1000617. DOI: 10.1371 / journal.ppat.1000617
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линден, С., Махдави, Дж., Семино-Мора, К., Олсен, К., Карлштедт, И., Борен, Т. и др. (2008). Роль секреторного статуса ABO в врожденном иммунитете слизистых оболочек и инфекции H. pylori. PLOS Pathog. 4: e2. DOI: 10.1371 / journal.ppat.0040002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Локе, М. Ф., Луи, С. Ю., Нг, Б. Л., Гонг, М., и Хо, Б. (2007). Антиадгезивное свойство экстракта полисахарида микроводорослей в отношении связывания Helicobacter pylori с муцином желудка. FEMS Immunol. Med. Microbiol. 50, 231–238. DOI: 10.1111 / j.1574-695X.2007.00248.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лозневски А., Харистой X., Раско Д. А., Хатьер Р., Пленат Ф., Тейлор Д. Э. и др. (2003). Влияние экспрессии антигена Льюиса с помощью Helicobacter pylori на бактериальную интернализацию эпителиальными клетками желудка. Infect Immun. 71, 2902–2906. DOI: 10.1128 / IAI.71.5.2902-2906.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лу, Х., Ву, Дж. Й., Бесвик, Э. Дж., Оно, Т., Оденбрайт, С., Хаас, Р. и др. (2007). Функциональные и внутриклеточные различия в передаче сигналов, связанные с адгезином Helicobacter pylori AlpAB из западных и восточноазиатских штаммов. J. Biol. Chem. 282, 6242–6254. DOI: 10.1074 / jbc.M611178200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лундин, А., Нильссон, К., Герхард, М., Андерссон, Д. И., Краббе, М., и Энгстранд, Л. (2003). Белок NudA в возбудителе желудка Helicobacter pylori представляет собой повсеместную и конститутивно экспрессируемую динуклеозидполифосфатгидролазу. J. Biol. Chem. 278, 12574–12578. DOI: 10.1074 / jbc.M212542200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Махдави Дж., Сонден Б., Хуртиг М., Олфат Ф. О., Форсберг Л., Рош Н. и др. (2002). Helicobacter pylori Адгезин SabA при хронической инфекции и хроническом воспалении. Наука 297, 573–578. DOI: 10.1126 / science.1069076
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маркос Н. Т., Магальяйнш А., Феррейра Б., Оливейра М. Дж., Карвалью А. С., Мендес Н. и др. (2008). Helicobacter pylori индуцирует бета3GnT5 в линиях клеток желудка человека, модулируя экспрессию лиганда SabA sialyl-Lewis x. J. Clin. Инвестировать. 118, 2325–2336. DOI: 10.1172 / JCI34324
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маршалл, Б.Дж. И Уоррен Дж. Р. (1983). Неопознанные изогнутые бациллы на эпителии желудка при активном хроническом гастрите. Ланцет 1: 1273.
PubMed Аннотация
Маршалл Б. Дж. И Уоррен Дж. Р. (1984). Неопознанные изогнутые бациллы в желудке больных гастритом и язвенной болезнью. Ланцет 1, 1311–1315. DOI: 10.1016 / S0140-6736 (84) -6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартинес, Л. Э., Хардкасл, Х.М., Ван, Дж., Пинкус, З., Цанг, Дж., Гувер, Т. Р. и др. (2016). Штаммы Helicobacter pylori различаются по форме клеток и количеству жгутиков для поддержания устойчивой подвижности в вязкой среде. Мол. Microbiol. 99, 88–110. DOI: 10.1111 / mmi.13218
PubMed Аннотация | CrossRef Полный текст | Google Scholar
McGuckin, M.A., Every, A.L., Skene, C.D., Linden, S.K., Chionh, Y.T., Swierczak, A., et al. (2007). Муцин Muc1 ограничивает колонизацию Helicobacter pylori слизистой оболочки желудка мышей и ассоциированный гастрит. Гастроэнтерология 133, 1210–1218. DOI: 10.1053 / j.gastro.2007.07.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Муджабер Т., Макинтайр К. Р., Бэкхаус Дж., Гиддинг Х., Куинн Х. и Гилберт Г. Л. (2008). Сероэпидемиология инфекции Helicobacter pylori в Австралии. Внутр. J. Infect. Дис. 12, 500–504. DOI: 10.1016 / j.ijid.2008.01.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Накамура, Х., Йошияма, Х., Такеучи, Х., Мизоте, Т., Окита, К., и Накадзава, Т. (1998). Уреаза играет важную роль в хемотаксической подвижности Helicobacter pylori в вязкой среде. Заражение. Иммун. 66, 4832–4837.
PubMed Аннотация | Google Scholar
Некки В., Кандуссо М. Э., Тава Ф., Луинетти О., Вентура У., Фиокка Р. и др. (2007). Внутриклеточная, межклеточная и стромальная инвазия слизистой оболочки желудка, пренеопластические поражения и рак Helicobacter pylori . Гастроэнтерология 132, 1009–1023. DOI: 10.1053 / j.gastro.2007.01.049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нильссон И., Утт М., Нильссон Х. О., Юнг А. и Вадстрём Т. (2000). Двумерный электрофоретический и иммуноблот-анализ белков клеточной поверхности спиралевидной и кокковидной форм Helicobacter pylori . Электрофор. 21, 2670–2677. DOI: 10.1002 / 1522-2683 (20000701) 21:13 <2670 :: AID-ELPS2670> 3.0.CO; 2-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ноах, Л. А., Рольф, Т. М., и Титгат, Г. Н. (1994). Электронно-микроскопическое исследование ассоциации между Helicobacter pylori и слизистой оболочкой желудка и двенадцатиперстной кишки. J. Clin. Патол. 47, 699–704. DOI: 10.1136 / jcp.47.8.699
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оденбрайт, С., Фаллер, Г., и Хаас, Р. (2002a). Роль белков alpAB и липополисахарида в адгезии Helicobacter pylori к ткани желудка человека. Внутр. J. Med. Microbiol. 292, 247–256. DOI: 10.1078 / 1438-4221-00204
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оденбрайт, С., Каверманн, Х., Пюльс, Дж. И Хаас, Р. (2002b). Фосфорилирование тирозина CagA и индукция интерлейкина-8 с помощью Helicobacter pylori не зависят от белков внешней мембраны alpAB, HopZ и группы bab. Внутр. J. Med. Microbiol. 292, 257–266. DOI: 10.1078 / 1438-4221-00205
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оденбрайт, С., Swoboda, K., Barwig, I., Ruhl, S., Borén, T., Koletzko, S., et al. (2009). Профиль экспрессии белка внешней мембраны в клинических изолятах Helicobacter pylori . Заражение. Иммун. 77, 3782–3790. DOI: 10.1128 / IAI.00364-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оденбрайт, С., Тилль, М., Хофрейтер, Д., Фаллер, Г., и Хаас, Р. (1999). Генетическая и функциональная характеристика локуса гена alpAB, необходимого для адгезии Helicobacter pylori к ткани желудка человека. Мол. Microbiol. 31, 1537–1548. DOI: 10.1046 / j.1365-2958.1999.01300.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
О, Дж. Д., Карам, С. М., и Гордон, Дж. И. (2005). Внутриклеточный Helicobacter pylori в предшественниках эпителия желудка. Proc. Natl. Акад. Sci. США 102, 5186–5191. DOI: 10.1073 / pnas.0407657102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Озбек А., Озбек Э., Дурсун Х., Калкан, Ю., Демирчи, Т. (2010). Может ли Helicobacter pylori проникать в слизистую оболочку желудка человека? Исследование in vivo с использованием электронной микроскопии, иммуногистохимических методов и полимеразной цепной реакции в реальном времени. J. Clin. Гастроэнтерол. 44, 416–422. DOI: 10.1097 / MCG.0b013e3181c21c69
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пападогианнакис, Н., Виллен, Р., Карлен, Б., Шёстедт, С., Вадстрём, Т., и Гад, А. (2000). Способы прикрепления Helicobacter pylori к поверхностному эпителию желудка при гастродуоденальной болезни: возможная последовательность событий, ведущих к интернализации. APMIS 108, 439–447. DOI: 10.1034 / j.1600-0463.2000.d01-80.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паррейра П., Магальяйнш А., Рейс К. А., Борен Т., Лекбанд Д. и Мартинс М. К. (2013). Биоинженерные поверхности способствуют специфическому связыванию желудочного патогена Helicobacter pylori , опосредованному белком и гликаном. Acta Biomater. 9, 8885–8893. DOI: 10.1016 / j.actbio.2013.06.042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Патель, А., Шах, Н., и Праджапати, Дж. Б. (2014). Клиническое применение пробиотиков в лечении инфекции Helicobacter pylori — краткий обзор. J. Microbiol. Иммунол. Заразить. 47, 429–437. DOI: 10.1016 / j.jmii.2013.03.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Петерсен, А. М., Крогфельт, К. А. (2003). Helicobacter pylori : вторгающийся микроорганизм? Обзор. FEMS Immunol. Med. Microbiol. 36, 117–126.DOI: 10.1016 / S0928-8244 (03) 00020-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Петерсен, А. М., Соренсен, К., Блом, Дж., И Крогфельт, К. А. (2001). Снижение внутриклеточной выживаемости мутантов Helicobacter pylori vacA по сравнению с их дикими типами указывает на роль VacA в патогенезе. FEMS Immunol. Med. Microbiol. 30, 103–108. DOI: 10.1111 / j.1574-695X.2001.tb01556.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Питтман, М.С., Гудвин М. и Келли Д. Дж. (2001). Хемотаксис в желудочном патогене человека Helicobacter pylori : разные роли CheW и трех паралогов CheV и доказательства фосфорилирования CheV2. Микробиология 147, 2493–2504. DOI: 10.1099 / 00221287-147-9-2493
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Раджу Д., Хасси С., Анг М., Теребизник М. Р., Сибони М., Галиндо-Мата Э. и др. (2012). Вакуолизация цитотоксина и вариантов Atg16L1, которые нарушают аутофагию, способствуют инфицированию человека Helicobacter pylori . Гастроэнтерология 142, 1160–1171. DOI: 10.1053 / j.gastro.2012.01.043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Раутелин, Х., Кильстрём, Э., Юрстранд, М., и Даниэльссон, Д. (1995). Адгезия и инвазия клеток HeLa Helicobacter pylori . Zentralbl. Бактериол. 282, 50–53. DOI: 10.1016 / S0934-8840 (11) 80796-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рокби, Б., Сегуин, Д., Гай, Б., Мазарин, В., Видор, Э., Мион, Ф. и др. (2001). Оценка экспрессии гена Helicobacter pylori в слизистой оболочке желудка мыши и человека с помощью ПЦР с обратной транскриптазой в реальном времени. Заражение. Иммун. 69, 4759–4766. DOI: 10.1128 / IAI.69.8.4759-4766.2001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роккас Т., Секопулос П., Роботис И., Маргантинис Г. и Пистиолас Д. (2009). Кумулятивная степени эрадикации H. pylori в клинической практике за счет применения схем первого и второго ряда, предложенных Маастрихтским консенсусом III, и эмпирической схемы третьего ряда. Am. J. Gastroenterol. 104, 21–25. DOI: 10.1038 / ajg.2008.87
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ролиг, А.С., Шанкс, Дж., Картер, Дж. Э. и Оттеманн, К. М. (2012). Helicobacter pylori требует, чтобы хемотаксис, управляемый TlpD, пролиферировал в антральном отделе. Заражение. Иммун. 80, 3713–3720. DOI: 10.1128 / IAI.00407-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шрайбер, С., Конрад, М., Groll, C., Scheid, P., Hanauer, G., Werling, H.O., et al. (2004). Пространственная ориентация Helicobacter pylori в слизи желудка. Proc. Natl. Акад. Sci. США 101, 5024–5029. DOI: 10.1073 / pnas.0308386101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Семино-Мора, К., Дои, С. К., Марти, А., Симко, В., Карлштедт, И., и Дюбуа, А. (2003). Внутриклеточная и интерстициальная экспрессия генов вирулентности Helicobacter pylori при предраковой кишечной метаплазии желудка и аденокарциноме. J. Infect. Дис. 187, 1165–1177. DOI: 10.1086 / 368133
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сенькович, О.А., Инь, Дж., Экшян, В., Конант, К., Трайлор, Дж., Адегбойега, П. и др. (2011). Helicobacter pylori AlpA и AlpB связывают ламинин хозяина и влияют на воспаление желудка у песчанок. Заражение. Иммун. 79, 3106–3116. DOI: 10.1128 / IAI.01275-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сиао, Д., и Сомсук, М. (2014). Helicobacter pylori : научно-обоснованный обзор с акцентом на иммигрантское население. J. Gen. Intern. Med. 29, 520–528. DOI: 10.1007 / s11606-013-2630-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Су, Б., Йоханссон, С., Феллман, М., Патарройо, М., Гранстрём, М., и Нормарк, С. (1999). Прилипание, опосредованное сигнальной трансдукцией, и проникновение Helicobacter pylori в культивируемые клетки. Гастроэнтерология 117, 595–604.DOI: 10.1016 / S0016-5085 (99) 70452-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тан, С., Томпкинс, Л. С., Амиева, М. Р. (2009). Helicobacter pylori узурпирует клеточную полярность, чтобы превратить клеточную поверхность в репликативную нишу. PLOS Pathog. 5: e1000407. DOI: 10.1371 / journal.ppat.1000407
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Теребизник, М. Р., Васкес, К. Л., Торбицки, К., Бэнкс, Д., Ван, Т., Hong, W., et al. (2006). Helicobacter pylori Токсин VacA способствует внутриклеточному выживанию бактерий в эпителиальных клетках желудка. Заражение. Иммун. 74, 6599–6614. DOI: 10.1128 / IAI.01085-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван де Бовенкамп, Дж. Х., Махдави, Дж., Кортеланд-Ван Мале, А. М., Бюллер, Х. А., Эйнерханд, А. В., Борен, Т. и др. (2003). Гликопротеин MUC5AC является первичным рецептором для Helicobacter pylori в желудке человека. Helicobacter 8, 521–532. DOI: 10.1046 / j.1523-5378.2003.00173.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
van der Wouden, E.J., Thijs, J.C., van Zwet, A.A., Sluiter, W.J., и Kleibeuker, J.H. (1999). Влияние устойчивости к нитроимидазолу in vitro на эффективность схем лечения Helicobacter pylori , содержащих нитроимидазол: метаанализ. Am. J. Gastroenterol. 94, 1751–1759. DOI: 10.1111 / j.1572-0241.1999.01202.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Васкес-Хименес, Ф. Э., Торрес, Дж., Флорес-Луна, Л., Сересо, С. Г., и Каморлинга-Понсе, М. (2016). Паттерны прикрепления клинических изолятов Helicobacter pylori к эпителиальным клеткам и их связь с заболеванием и факторами вирулентности. Helicobacter 21, 60–68. DOI: 10.1111 / hel.12230
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, К., Юань Ю. и Хант Р. Х. (2007). Связь между инфекцией Helicobacter pylori и ранним раком желудка: метаанализ. Am J Gastroenterol. 102, 1789–1798. DOI: 10.1111 / j.1572-0241.2007.01335.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Ф., Мэн В., Ван Б. и Цяо Л. (2014). Helicobacter pylori -индуцированное воспаление желудка и рак желудка. Cancer Lett. 345, 196–202. DOI: 10.1016 / j.canlet.2013.08.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, Ю. Х., Львов, З. Ф., Чжун, Ю., Лю, Д. С., Чен, С. П., и Се, Ю. (2016). Интернализация Helicobacter pylori играет роль в неэффективности эрадикации H. pylori . Helicobacter. [Epub перед печатью]. DOI: 10.1111 / hel.12324
PubMed Аннотация | CrossRef Полный текст | Google Scholar
недель, Д. Л., Эскандари, С., Скотт, Д.Р. и Сакс Г. (2000). H + -зависимый канал мочевины: связь между уреазой Helicobacter pylori и колонизацией желудка. Наука 287, 482–485. DOI: 10.1126 / science.287.5452.482
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уилкинсон, С. М., Уль, Дж. Р., Клайн, Б. К. и Кокерилл, Ф. Р. (1998). Оценка частоты инвазии культивируемых клеток HEp-2 клиническими изолятами Helicobacter pylori с использованием анализа акридинового апельсина. J. Clin. Патол. 51, 127–133. DOI: 10.1136 / jcp.51.2.127
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Worku, M. L., Sidebotham, R. L., Baron, J. H., Misiewicz, J. J., Logan, R. P., Keshavarz, T., et al. (1999). Подвижность Helicobacter pylori в вязкой среде. Eur. J. Gastroenterol. Гепатол. 11, 1143–1150. DOI: 10.1097 / 00042737-1990-00012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ямаока, Ю.(2008). Все больше доказательств роли Helicobacter pylori SabA в патогенезе гастродуоденальной болезни. J. Infect. Dev. Ctries. 2, 174–181. DOI: 10.3855 / jidc.259
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ямаока Ю., Оджо О., Фудзимото С., Оденбрайт С., Хаас Р., Гутьеррес О. и др. (2006). Helicobacter pylori белки внешней мембраны и гастродуоденальная болезнь. Кишечник 55, 775–781. DOI: 10.1136 / гут.2005.083014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, М. Дж., Мэн, Ф. Л., Цзи, X. Y., Хэ, Л. Х. и Чжан, Дж. З. (2007). Прилипание и инвазия адаптированного к мыши H pylori в различные линии эпителиальных клеток. World J. Gastroenterol. 13, 845–850. DOI: 10.3748 / wjg.v13.i6.845
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, X., Zhang, J., Lin, Y., Xu, K., Li, N., Chen, H., et al.(2015). Анализ связи между инвазивной способностью Helicobacter pylori и гастродуоденальными заболеваниями. J. Med. Microbiol. 64, 498–506. DOI: 10.1099 / jmm.0.000049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Helicobacter pylori — Глава 4-2020 Желтая книга | Здоровье путешественников
Брэдли Коннор
ИНФЕКЦИОННЫЙ АГЕНТ
Helicobacter pylori — небольшая изогнутая микроаэрофильная грамотрицательная палочковидная бактерия.
ТРАНСМИССИЯ
Считается, что главным образом фекально-оральный или, возможно, орально-оральный.
ЭПИДЕМИОЛОГИЯ
Около двух третей населения мира инфицировано, но это чаще встречается в развивающихся странах. Краткосрочные путешественники, по-видимому, не подвергаются значительному риску заражения H. pylori во время путешествий, но эмигранты и путешественники, прибывающие на длительный срок, могут подвергаться более высокому риску.
КЛИНИЧЕСКАЯ ПРЕЗЕНТАЦИЯ
Обычно протекает бессимптомно, но H.pylori является основной причиной язвенной болезни и гастрита во всем мире, которые часто проявляются грызущей или жгучей болью в эпигастрии. Реже симптомы включают тошноту, рвоту или потерю аппетита. У инфицированных людей риск развития рака желудка и лимфомы слизистых оболочек лимфоидного типа (MALT) повышается в 2-6 раз по сравнению с их неинфицированными аналогами.
ДИАГНОСТИКА
Анализ фекального антигена, дыхательный тест на мочевину, экспресс-тест на уреазу или гистологический анализ биоптата.Положительный результат серологии указывает на наличие инфекции в настоящем или прошлом.
ЛЕЧЕНИЕ
Бессимптомные инфекции не нуждаются в лечении. Пациентов с активной язвой двенадцатиперстной кишки или желудка следует лечить, если они инфицированы. Лечение следует определять в индивидуальном порядке. Стандартное лечение — четырехкратная терапия висмутом (ИПП или блокатор H 2 + висмут + метронидазол + тетрациклин). Тройная терапия кларитромицином (ингибитор протонной помпы [ИПП] + кларитромицин + амоксициллин или метронидазол) может использоваться в регионах, где H.pylori , как известно, устойчивость к кларитромицину составляет <15% и у пациентов, ранее не подвергавшихся воздействию макролидов. См. Http://gi.org/guideline/treatment-of-helicobacter-pylori-infection.
ПРОФИЛАКТИКА
Нет особых рекомендаций.
БИБЛИОГРАФИЯ
- Chey WD, Leontiadis GI, Howden CW, Moss SF. Клинические рекомендации ACG: лечение инфекции Helicobacter pylori . Am J Gastroenterol. 2017; 112: 212–38.
- Lindkvist P, Wadstrom T, Giesecke J. Helicobacter pylori инфекция и зарубежные поездки. J Infect Dis. 1995 Октябрь; 172 (4): 1135–6.
- Potasman, I, Yitzhak A. Helicobacter pylori serostatus у туристов, путешествующих в тропические страны. Am J Trop Med Hyg. 1998. 58 (3): 305–8.
Инфекция Helicobacter Pylori: основы практики, история вопроса, патофизиология
[Рекомендации] Sugano K, Tack J, Kuipers EJ и др. Для преподавателей Киотской конференции глобального консенсуса.Киотский глобальный консенсусный отчет по гастриту Helicobacter pylori. Кишечник . 2015 Сентябрь 64 (9): 1353-67. [Медлайн].
Младенова И., Дураццо М. Передача Helicobacter pylori. Минерва Гастроэнтерол Диетол . 2018 сентябрь 64 (3): 251-4. [Медлайн].
Хорики Н., Омата Ф., Уэмура М. и др. Ежегодное изменение первичной устойчивости к кларитромицину среди изолятов Helicobacter pylori с 1996 по 2008 год в Японии. Хеликобактер .2009 14 октября (5): 86-90. [Медлайн].
Fallone CA. Эпидемиология устойчивости Helicobacter pylori к антибиотикам в Канаде. Банка J Гастроэнтерол . 2000 14 ноября (10): 879-82. [Медлайн].
Hage N, Renshaw JG, Winkler GS, Gellert P, Stolnik S, Falcone FH. Улучшенная экспрессия и очистка адгезина BabA Helicobacter pylori за счет включения гекса-лизиновой метки. Протеин Expr Purif . 2015 фев. 106: 25-30.[Медлайн]. [Полный текст].
Tomb JF, White O, Kerlavage AR, et al. Полная последовательность генома возбудителя желудочного сока Helicobacter pylori. Природа . 1997, 7 августа. 388 (6642): 539-47. [Медлайн].
Lowenthal AC, Hill M, Sycuro LK, et al. Функциональный анализ белков переключателей жгутиков Helicobacter pylori. Дж Бактериол . 2009 декабрь 191 (23): 7147-56. [Медлайн]. [Полный текст].
Гианнакис М., Чен С.Л., Карам С.М. и др.Эволюция Helicobacter pylori при прогрессировании от хронического атрофического гастрита до рака желудка и ее влияние на стволовые клетки желудка. Proc Natl Acad Sci U S A . 2008 Март 105 (11): 4358-63. [Медлайн].
Lehours P. Фактический диагноз инфекции Helicobacter pylori. Минерва Гастроэнтерол Диетол . 2018 Сентябрь 64 (3): 267-79. [Медлайн].
Pullen LC. Объясняет ли эрадикация H.pylori рост ожирения? Медицинские новости Medscape от WebMD.9 июня 2014 г. Доступно по адресу http://www.medscape.com/viewarticle/826406. Доступ: 19 июня 2014 г.
Кредитор Н., Талли, штат Нью-Джерси, Энк П. и др. Обзорная статья: связь между Helicobacter pylori и ожирением — экологическое исследование. Алимент Фармакол Тер . 2014 июл. 40 (1): 24-31. [Медлайн].
[Директива] Shah SC, Iyer PG, Moss SF. Обновление клинической практики AGA по ведению рефрактерной инфекции Helicobacter pylori: обзор экспертов. Гастроэнтерология . 2021 Апрель 160 (5): 1831-41. [Медлайн]. [Полный текст].
Koletzko L, Macke L, Schulz C, Malfertheiner P. Эрадикация Helicobacter pylori при диспепсии: новые доказательства симптоматической пользы. Лучший Практик Рес Клин Гастроэнтерол . 2019 июн — август 40–1: 101637. [Медлайн].
Лютер Дж., Дэйв М., Хиггинс П.П., Као Дж. Связь между инфекцией Helicobacter pylori и воспалительным заболеванием кишечника: метаанализ и систематический обзор литературы. Воспаление кишечника . 2010 июн.16 (6): 1077-84. [Медлайн].
Джексон Л., Бриттон Дж., Льюис С.А. и др. Популяционное эпидемиологическое исследование инфекции Helicobacter pylori и ее связи с системным воспалением. Хеликобактер . 2009 октября, 14 (5): 108-13. [Медлайн].
[Рекомендации] Tarasconi A, Coccolini F, Biffl WL, et al. Перфорированная и кровоточащая язвенная болезнь: рекомендации WSES. Мир J Emerg Surg .2020. 15: 3. [Медлайн]. [Полный текст].
Hsu PI, Wu DC, Chen WC, et al. Рандомизированное контролируемое исследование, сравнивающее 7-дневную тройную, 10-дневную последовательную и 7-дневную сопутствующую терапию инфекции Helicobacter pylori. Противомикробные агенты Chemother . 2014 Октябрь 58 (10): 5936-42. [Медлайн].
Pellicano R, Zagari RM, Zhang S, Saracco GM, Moss SF. Фармакологические соображения и пошаговое предложение по лечению инфекции Helicobacter pylori в 2018 году. Минерва Гастроэнтерол Диетол . 2018 Сентябрь 64 (3): 310-21. [Медлайн].
Papastergiou V, Georgopoulos SD, Karatapanis S. Лечение инфекции Helicobacter pylori: решение проблемы устойчивости к противомикробным препаратам. Мир J Гастроэнтерол . 2014 7 августа. 20 (29): 9898-911. [Медлайн].
Gisbert JP, Castro-Fernandez M, Perez-Aisa A, et al. Спасательная терапия четвертой линии с рифабутином у пациентов с тремя неудачными попытками эрадикации Helicobacter pylori. Алимент Фармакол Тер . 2012 апр. 35 (8): 941-7. [Медлайн]. [Полный текст].
Liu X, Wang H, Lv Z, et al. Спасательная терапия с ингибитором протонной помпы плюс амоксициллин и рифабутин для инфекции Helicobacter pylori: систематический обзор и метаанализ. Гастроэнтерол Рес Прак . 2015. 2015: 415648. [Медлайн]. [Полный текст].
FDA требует удаления с рынка всех продуктов ранитидина (Zantac). Пресс-релиз FDA .1 апреля 2020 г. Доступно на https://www.fda.gov/news-events/press-announcements/fda-requests-removal-all-ranitidine-products-zantac-market.
Отзыв на: Пероральный прием ранитидина увеличивает выведение N-нитрозодиметиламина с мочой. Канцерогенез . 2021 16 июля. 42 (7): 1008. [Медлайн].
Флориан Дж., Матта М.К., ДеПальма Р. и др. Влияние перорального ранитидина на выведение с мочой N-нитрозодиметиламина (NDMA): рандомизированное клиническое исследование. ЯМА . 2021 20 июля. 326 (3): 240-9. [Медлайн].
Дуглас Д. Использование ранитидина не приводит к увеличению выведения канцерогена NDMA с мочой. Новости Medscape от WebMD. 8 июля 2021 г. Доступно по адресу https://www.medscape.com/viewarticle/954328. Дата обращения: 20 июля 2021 г.
Сафаров Т, Киран Б, Багирова М, Аллахвердиев А.М., Абамор Э.С. Обзор основанных на нанотехнологиях подходов к лечению Helicobacter Pylori. Expert Rev Anti Infect Ther .2019 17 октября (10): 829-40. [Медлайн].
Ниаз Т., Ихсан А., Аббаси Р., Шаббир С., Нур Т., Имран М. Основанные на хитозане-альбумине нано-антимикробные вещества оболочки и короны для уничтожения резистентных желудочных патогенов. Инт Дж Биол Макромол . 1 октября 2019 г. 138: 1006-18. [Медлайн].
Zhi X, Liu Y, Lin L и др. Устные pH-чувствительные нанозонды GNS @ ab для таргетной терапии Helicobacter pylori без нарушения микробиома кишечника. Наномедицина .20 августа 2019: 10 [Медлайн].
de Avila BE, Angsantikul P, Li J, et al. Активная доставка лекарств с помощью микромотора для лечения желудочной инфекции in vivo. Нац Коммуна . 2017 16 августа. 8 (1): 272. [Медлайн]. [Полный текст].
Гринберг Э. Р., Андерсон Г. Л., Морган Д. Р. и др. 14-дневная тройная, 5-дневная сопутствующая и 10-дневная последовательная терапия инфекции Helicobacter pylori в семи странах Латинской Америки: рандомизированное исследование. Ланцет .2011 6 августа. 378 (9790): 507-14. [Медлайн].
Liou JM, Lin JT, Chang CY, et al. Тройная терапия на основе левофлоксацина и кларитромицина в качестве терапии первого и второго ряда при инфекции Helicobacter pylori: рандомизированное сравнительное исследование с перекрестным дизайном. Кишечник . 2010 май. 59 (5): 572-8. [Медлайн].
Apostolopoulos P, Koumoutsos I, Ekmektzoglou K, et al. Сопутствующая терапия по сравнению с последовательной терапией для лечения инфекции Helicobacter pylori: греческое рандомизированное проспективное исследование. Сканд Дж Гастроэнтерол . 2016 Февраль 51 (2): 145-51. [Медлайн].
Юн Х., Ким Н., Ли Б.Х. и др. Тройная терапия, содержащая моксифлоксацин, в качестве лечения второй линии при инфекции Helicobacter pylori: влияние продолжительности лечения и устойчивости к антибиотикам на скорость эрадикации. Хеликобактер . 2009 октября, 14 (5): 77-85. [Медлайн].
Malfertheiner P, Bazzoli F, Delchier JC, et al. Эрадикация Helicobacter pylori с помощью капсулы, содержащей субцитрат висмута калия, метронидазол и тетрациклин, с омепразолом по сравнению с тройной терапией на основе кларитромицина: рандомизированное открытое исследование не меньшей эффективности, фаза 3. Ланцет . 2011 12 марта. 377 (9769): 905-13. [Медлайн].
Ли С.Б., Ян Дж.В., Ким С.С. Связь между MALT-лимфомой конъюнктивы и Helicobacter pylori. Br J Офтальмол . 2008 апр. 92 (4): 534-6. [Медлайн].
Aanpreung P. Предполагаемые параметры эрадикационной терапии у детей с гастритом Helicobacter pylori. J Med Assoc Thai . 2005 г., ноябрь 88, приложение 8: S21-6. [Медлайн].
Adachi K, Hashimoto T, Komazawa Y, et al.Инфекция Helicobacter pylori влияет на симптоматический ответ на антисекреторную терапию у пациентов с ГЭРБ — перекрестное сравнительное исследование с фамотидином и низкими дозами лансопразола. Dig Liver Dis . 2005 июл. 37 (7): 485-90. [Медлайн].
Александр Г.А., Броули О.В. Связь инфекции Helicobacter pylori с раком желудка. Мил Мед . 2000, январь, 165 (1): 21-7. [Медлайн].
Ceponis PJ, Jones NL. Модуляция путей передачи сигнала клетки-хозяина инфекцией Helicobacter pylori. Банка J Гастроэнтерол . 2005 июля 19 (7): 415-20. [Медлайн].
Cheng TY, Lin JT, Chen LT и др. Ассоциация полиморфизмов регуляторных генов Т-клеток с предрасположенностью к лимфоме лимфоидной ткани, ассоциированной со слизистой оболочкой желудка. Дж Клин Онкол . 20 июля 2006 г. 24 (21): 3483-9. [Медлайн].
Craanen ME, Blok P, Dekker W, et al. Helicobacter pylori и ранний рак желудка. Кишечник . 1994 окт. 35 (10): 1372-4. [Медлайн].
Давыдов Л, Ченг Ж. Связь инфекции и ишемической болезни сердца: обновленная информация. Заключение эксперта по исследованию наркотиков . 2000 ноября, 9 (11): 2505-17. [Медлайн].
Демирель А., Онсел С., Кайдере М., Доган А., Устен Х., Онгорен А. Инфекция Helicobacter pylori в образцах после гастрэктомии. Интернет J of Gastro . 1999. 1 (1): [Полный текст].
Dunn BE, Cohen H, Blaser MJ. Helicobacter pylori. Clin Microbiol Ред. . 1997.10.10 (4): 720-41. [Медлайн].
Eaton KA, Benson LH, Haeger J, et al. Роль экспрессии фактора транскрипции T-bet клетками CD4 + при гастрите, вызванном Helicobacter pylori у мышей. Заражение иммунной . 2006 Август 74 (8): 4673-84. [Медлайн].
El-Omar EM, Carrington M, Chow WH, et al. Полиморфизм интерлейкина-1, связанный с повышенным риском рака желудка. Природа . 2000 23 марта.404 (6776): 398-402. [Медлайн].
Эрджан I, Чакир Б.О., Узел Т.С. и др. Роль желудочной инфекции Helicobacter pylori в ларингофарингеальной рефлюксной болезни. Отоларингол Хирургия головы и шеи . 2006 июль 135 (1): 52-5. [Медлайн].
Fiorini G, Vakil N, Zullo A, et al. Селекционная терапия на основе культур для пациентов, которые не ответили на предыдущее лечение инфекции Helicobacter pylori. Клин Гастроэнтерол Гепатол . 2013 май.11 (5): 507-10. [Медлайн].
Fischbach W. Первичная лимфома желудка MALT: соображения патогенеза, диагностики и лечения. Банка J Гастроэнтерол . 2000 14 ноября Дополнение D: 44D-50D. [Медлайн].
Fock KM, Katelaris P, Sugano K, et al. Второе Азиатско-Тихоокеанское согласованное руководство по инфекции Helicobacter pylori. Дж Гастроэнтерол Гепатол . 2009 24 октября (10): 1587-600. [Медлайн].
Гарсия-Альтес А., Рота Р., Баренис М. и др.Экономическая эффективность стратегии «оценка и масштаб» для лечения диспепсии. Eur J Gastroenterol Hepatol . 2005 июл.17 (7): 709-19. [Медлайн].
Gatopoulou A, Mimidis K, Giatromanolaki A, et al. Влияние инфекции Helicobacter pylori на гистологические изменения при неэрозивной рефлюксной болезни. Мир J Гастроэнтерол . 2004 15 апреля. 10 (8): 1180-2. [Медлайн].
Graham DY. Терапия Helicobacter pylori: текущее состояние и проблемы. Гастроэнтерология . 2000, февраль 118 (2 приложение 1): S2-8. [Медлайн].
Graham DY, Lew GM, Lechago J. Количество G-клеток и D-клеток антрального отдела при инфекции Helicobacter pylori: эффект эрадикации H. pylori. Гастроэнтерология . 1993 июнь 104 (6): 1655-60. [Медлайн].
Graham DY, Lew GM, Malaty HM, et al. Факторы, влияющие на эрадикацию Helicobacter pylori при тройной терапии. Гастроэнтерология . 1992 фев.102 (2): 493-6. [Медлайн].
Graham DY, Malaty HM, Evans DG, et al. Эпидемиология Helicobacter pylori у бессимптомной популяции в США. Влияние возраста, расы и социально-экономического статуса. Гастроэнтерология . 1991 июн.100 (6): 1495-501. [Медлайн].
[Директива] Howden CW, Hunt RH. Руководство по лечению инфекции Helicobacter pylori. Специальный комитет по параметрам практики Американского колледжа гастроэнтерологии. Ам Дж. Гастроэнтерол . 1998 декабрь 93 (12): 2330-8. [Медлайн].
Jia CL, Jiang GS, Li CH, Li CR. Влияние контроля зубного налета на инфекцию Helicobacter pylori в слизистой оболочке желудка. Дж Периодонтол . 2009 Октябрь 80 (10): 1606-9. [Медлайн].
Kusters JG, van Vliet AH, Kuipers EJ. Патогенез инфекции Helicobacter pylori. Clin Microbiol Ред. . 2006 июл.19 (3): 449-90. [Медлайн].
Лейнонен М., Сайкку П.Инфекции и атеросклероз. Сканд Кардиоваск J . 2000. 34 (1): 12-20. [Медлайн].
Lopes AI, Victorino RM, Palha AM, et al. Субпопуляции лимфоцитов слизистой оболочки и экспрессия антигена HLA-DR при педиатрическом гастрите, ассоциированном с Helicobacter pylori. Клин Экспер Иммунол . 2006 июл.145 (1): 13-20. [Медлайн].
Мюллер А., Сайи А., Хитцлер И. Защитные и патогенные функции Т-клеток неотделимы во время взаимодействия Helicobacter-хозяин. Дисков Мед . 2009 8 августа (41): 68-73. [Медлайн].
Накадзима С., Кришнан Б., Ота Н. и др. Участие тучных клеток в гастрите с инфекцией Helicobacter pylori или без нее. Гастроэнтерология . 1997 сентябрь 113 (3): 746-54. [Медлайн].
Padol S, Yuan Y, Thabane M, et al. Влияние полиморфизма CYP2C19 на скорость эрадикации H. pylori при терапии двойным и тройным ИПП первой линии: метаанализ. Ам Дж. Гастроэнтерол .2006 июль 101 (7): 1467-75. [Медлайн].
Peach HG, Barnett NE. Детерминанты базального уровня гастрина в плазме в общей популяции. Дж Гастроэнтерол Гепатол . 2000 15 ноября (11): 1267-71. [Медлайн].
Pratt JS, Sachen KL, Wood HD, et al. Модуляция иммунных ответов хозяина цитотоксическим токсином Helicobacter hepaticus. Заражение иммунной . 2006 г., август 74 (8): 4496-504. [Медлайн].
Reyrat JM, Rappuoli R, Telford JL.Обзор структуры цитотоксина Helicobacter. Int J Med Microbiol . 2000 Октябрь 290 (4-5): 375-9. [Медлайн].
Rodrigues MN, Queiroz DM, Bezerra Filho JG, et al. Распространенность инфекции Helicobacter pylori у детей из городских поселений на северо-востоке Бразилии и факторы риска инфицирования. Eur J Gastroenterol Hepatol . 2004 Февраль 16 (2): 201-5. [Медлайн].
Santacroce L, Bufo P, Latorre V и др. [Роль тучных клеток в физиопатологии поражений желудка, вызванных Helicobacter pylori]. Чир Итал . 2000 сен-окт. 52 (5): 527-31. [Медлайн].
Smoot DT, Mobley HL, Chippendale GR и др. Активность уреазы Helicobacter pylori токсична для эпителиальных клеток желудка человека. Заражение иммунной . 1990 июн. 58 (6): 1992-4. [Медлайн].
Stahler FN, Odenbreit S, Haas R, et al. Новый насос для оттока металла Helicobacter pylori CznABC необходим для обеспечения устойчивости к кадмию, цинку и никелю, модуляции уреазы и колонизации желудка. Заражение иммунной . 2006 июль 74 (7): 3845-52. [Медлайн].
Цай С.Дж., Перри С., Санчес Л. и др. Инфекция Helicobacter pylori у разных поколений латиноамериканцев в районе залива Сан-Франциско. Am J Epidemiol . 2005 15 августа. 162 (4): 351-7. [Медлайн].
Tytgat GN. Обзорная статья: Helicobacter pylori: где мы и куда идем ?. Алимент Фармакол Тер . 2000, 14 октября, Дополнение 3: 55-8. [Медлайн].
Уоррен Дж. Р., Маршалл Б. Неопознанные изогнутые бациллы на эпителии желудка при активном хроническом гастрите. Ланцет . 4 июня 1983 г., 1 (8336): 1273-5. [Медлайн].
Вайра Д., Гатта Л., Риччи С. и др. Язвенная болезнь и Helicobacter pylori: обновленная информация о тестировании и лечении. Постградская медицина . 2005 июн. 117 (6): 17-22, 46. [Medline].
Wang X, Wattiez R, Paggliacia C, et al. Топология мембраны цитотоксина VacA из H.пилори. FEBS Lett . 2000, 15 сентября. 481 (2): 96-100. [Медлайн].
Вт TL. Курение, Helicobacter pylori и пародонтит. BMJ . 24 июня 2006 г.. 332 (7556): 1513. [Медлайн].
Уотерспун AC. Критический обзор влияния эрадикации Helicobacter pylori на MALT-лимфому желудка. Curr Gastroenterol Rep . 2000 Декабрь 2 (6): 494-8. [Медлайн].
Chao CY, Wang CH, Che YJ, Kao CY, Wu JJ, Lee GB.Интегрированная микрофлюидная система для диагностики устойчивости Helicobacter pylori к антибиотикам на основе хинолонов. Биосенс Биоэлектрон . 2016 15 апреля. 78: 281-9. [Медлайн].
Lee YC, Chiang TH, Liou JM, Chen HH, Wu MS, Graham DY. Массовая ликвидация Helicobacter pylori для предотвращения рака желудка: теоретические и практические соображения. Печень кишечника . 2016 23 января 10 (1): 12-26. [Медлайн].
Kono Y, Okada H, Takenaka R, et al.Усиливает ли Helicobacter pylori повреждение слизистой оболочки желудка у пользователей нестероидных противовоспалительных препаратов? Многоцентровое ретроспективное исследование случай-контроль. Печень кишечника . 2016 23 января 10 (1): 69-75. [Медлайн].
Исаева Г.С., Фагуни С.
