7 гормонов, управляющих нашими эмоциями
Вещества, которые продуцируются железами внутренней секреции, выполняют в организме роль химических координаторов, обеспечивающих оптимальный режим работы органов и настраивающих тончайший механизм их взаимодействия. От минимальных колебаний уровня гормонов в крови зависит не только физическое состояние человека, но и его чувства и эмоции.
 Источник: depositphotos.com
Источник: depositphotos.comСеротонин и оптимистическое отношение к жизни
Серотонин выполняет важнейшую функцию: он обеспечивает передачу импульсов между нервными клетками. Недостаточная выработка этого гормона приводит к развитию депрессии, снижению умственной и физической активности, памяти, затруднениям с усвоением новой информации. Дефицит серотонина плохо отражается на состоянии пищеварительной, сердечно-сосудистой и иммунной систем, повышает болевую чувствительность, вызывает нарушения сна. Вредна и избыточная концентрация гормона в крови: она угнетающе действует на работу органов репродуктивной системы.
Для продуцирования серотонина организму необходима одна из незаменимых аминокислот – триптофан. Этим веществом богаты овощи семейства бобовых, творог, твердые сыры, гречневая крупа и грибы-вешенки. Кроме того, в процессе выработки серотонина участвует магний, содержащийся в морепродуктах, морской капусте, орехах, сухофруктах и отрубях. В случае падения уровня гормона ситуацию можно исправить, употребляя в пищу продукты, насыщенные витаминами группы B (бананы, финики, дыня, субпродукты).
Важно, что в организме становится больше серотонина под действием солнечного света. Недаром в осенне-зимний период, при недостатке инсоляции, многие жалуются на плохое настроение, вялость и падение трудоспособности. Нормализации уровня серотонина можно добиться и с помощью разумно дозированных физических нагрузок. Для этой цели прекрасно подходят пешие прогулки, необременительные занятия спортом и игры на свежем воздухе.
Установлено, что существует не только прямая зависимость настроения от уровня серотонина, но и обратная связь: у людей с активной жизненной позицией и оптимистическим взглядом на мир практически всегда высока концентрация этого гормона в организме. А значит, повышения выработки серотонина можно добиться методами, способствующими созданию позитивного мышления (психологическими тренингами, релаксационными практиками и т. д.).
Дофамин – гормон удовольствия
Подобно серотонину, дофамин является нейромедиатором. Он создает ощущение удовольствия. Действие особенно заметно при сексуальных контактах, приеме любимой пищи и т. д. Отличительное свойство дофамина – увеличение его выработки не только в момент приятного события, но и в процессе его приближения (так называемый эффект предчувствия). Этим определяется и негативное воздействие гормона: человек может получать приятные ощущения не столько от поступков (ситуаций), сколько от предвкушения их результата. Таков один из путей развития алкогольной зависимости: «привычный» пьяница употребляет спиртное, потому что помнит чувство удовлетворения, которое возлияния вызывали у него раньше. На понятии «дофаминового обмана» базируется одна из современных теорий возникновения шизофрении: считается, что больной концентрируется на своих мечтах, обеспечивающих ему душевный комфорт, и добровольно отказывается от активного существования в реальном мире.
Адреналин и норадреналин: помощь при стрессах
Природа предусмотрела два типа реакции на опасную ситуацию: нападение и бегство. За успех первого варианта отвечает гормон норадреналин. Он способствует мобилизации всех сил организма: мозг начинает работать активнее, кровоток ускоряется, повышаются артериальное давление и тонус мышц. На эмоциональном уровне это проявляется чувством отваги, а порой и яростью. Адреналин же предназначен для того, чтобы помочь вовремя и достаточно быстро уйти от опасности. Это далеко не всегда означает бегство. Выброс адреналина в кровь организм использует для того, чтобы без потерь разрешить ситуацию, связанную со страхом (например, во время конфликта, экзамена, дорожно-транспортного происшествия).
Оба гормона вырабатываются корой надпочечников. Избыточная концентрация этих веществ в крови опасна: высокий уровень норадреналина ведет к истощению организма, а лишний адреналин может вызвать появление неконтролируемых страхов и фобий.
Впрочем, выработка адреналина и норадреналина вовсе не всегда обусловлена отрицательными эмоциями. Эти вещества выделяются и в ситуациях, связанных с сильными приятными переживаниями, – при успешных сделках, крупных покупках, публичных выступлениях и т. д.
Эндорфины и состояние эйфории
Эндорфины обычно действуют параллельно с серотонином и дофамином. Они обладают сильным обезболивающим и успокаивающим эффектом. Однако главное свойство эндорфинов в том, что они вызывают ощущение чистой, возвышенной радости. Состояние эйфории может возникать после сильного стресса, но часто связано и с психологическим воздействием музыки, кинофильма, спектакля или книги. Мощные положительные эмоции, которые вызваны выбросом эндорфинов, могут быть спровоцированы природными явлениями или близостью любимых людей.
Высокая концентрация эндорфинов в организме – явление кратковременное, именно поэтому многие определяют ощущение счастья как нечто мимолетное.
Фенилэтиламин и влюбленность
Любовь с первого взгляда действительно существует. Внезапно возникающее чувство симпатии, сексуального влечения и эмоционального подъема у человека вызывает гормон фенилэтиламин, относящийся к группе нейротрансмиттеров. Выброс в кровь этого вещества, как правило, происходит наряду с воздействием на организм серотонина и дофамина. Именно этим объясняются курортные романы: кратковременные случайные влюбленности часто возникают на фоне праздничного настроения, характерного для людей, проводящих отпуск в непривычно комфортной обстановке.
 Источник: depositphotos.com
Источник: depositphotos.comОкситоцин и доверие
В организме женщины гормон окситоцин служит регулятором сократительной деятельности матки и усилителем процесса лактации при контакте с младенцем. Но продуцирование этого вещества связано не только с беременностью, родами и грудным вскармливанием.
Окситоцин выделяется у всех людей. В эмоциональном плане он обеспечивает формирование доверия к другому человеку, особенно при наличии тактильного контакта. Например, повышение уровня окситоцина наблюдается при объятиях, рукопожатиях, прикосновениях к рукам в процессе доверительной беседы. Гормон действует особенно эффективно, если контактирующие давно знакомы или являются родственниками.
Высокий уровень окситоцина позволяет сопереживать чужим неприятностям и даже физической боли, снимает тревожность и способствует развитию коммуникативных навыков. На этом эффекте основан метод лечения окситоцином людей, страдающих аутизмом.
Тестостерон и радость победы
Тестостерон называется мужским гормоном, хотя вырабатывается и у женщин. В организме он отвечает за формирование либидо, за эректильную функцию, развитие вторичных мужских половых признаков. В эмоциональной сфере тестостерон создает эффект успешного разрешения конкурентных ситуаций: чем выше его концентрация в организме, тем больше человек способен добиваться своей цели и побеждать соперников.
Существует и обратная связь: победа в соревновательном процессе сама по себе повышает уровень тестостерона. С этим связан определенный негативный эффект. Привыкание к избыточному содержанию гормона может при прекращении соперничества привести к тяжелой депрессии. Риск особенно высок для спортсменов, оставивших активные занятия, или для людей, сделавших успешную карьеру, после их выхода на пенсию.
Нормальная работа эндокринной системы не только обеспечивает хорошее самочувствие. Она необходима нам и для того, чтобы реализоваться в профессиональном плане, не испытывать проблем с общением, радоваться жизни, любить и быть любимыми – ведь это не менее важно, чем отсутствие проблем со здоровьем.
Видео с YouTube по теме статьи:
www.neboleem.net
Как влияют на нас гормоны

Вот это адреналин!

Надофаминились…

Гормоны и нейромедиаторы — биологические активные вещества органической природы. Поступая в кровь, они широкой волной влияют на обмен веществ и другие физиологические функции, вызывая быструю и долгую смену функционального состояния организма. На языке, более нам знакомом, они вызывают у нас страх и ярость, депрессию и счастье, влечение и привязанность.
В этой статье мы не будем различать, идет здесь речь о гормонах или нейромедиаторах, поскольку разница между ними только в том, где они вырабатываются: гормоны вырабатываются в железах внутренней секреции, а нейромедиаторы — в нервных клетках. Специалистам это важно, а нам-то что?
Основные гормоны человека
Адреналин — гормон страха и тревоги. Сердце уходит в пятки, человек бледнеет, реакция «бей и беги». Выделяется в ситуации опасности, стрессах и тревогах. Возрастает бдительность, внутренняя мобилизация, ощущение тревоги. Сильно бьется сердце, расширяются зрачки («от страха глаза велики»), происходит сужение сосудов брюшной полости, кожи и слизистых; в меньшей степени сужает сосуды скелетной мускулатуры, но расширяет сосуды головного мозга. Повышает свертываемость крови (на случай ран), готовит организм к долгому стрессу и повышенным физическим нагрузкам за счет мышц. Расслабляет кишечник (обкакался от страха), трясутся руки и челюсти.
Норадреналин — гормон ненависти, ярости, злобы и вседозволенности. Предшественник адреналина, вырабатывается в тех же ситуациях, главное действие — бьется сердце и сужение сосудов, но все яростнее и короче, и лицо краснеет. Короткая вспышка злобы (норадреналин), потом страх (адреналин). Зрачки не расширяются, сосуды головного мозга — так же.
Животные по запаху определяют, выделяется адреналин или норадреналин. Если адреналин, они распознают слабака и преследуют его. Если норадреналин, распознают лидера и готовы подчиниться.
Великий полководец Юлий Цезарь составлял лучшие воинские отряды только из тех солдат, которые при виде опасности краснели, а не бледнели.
Радость бывает разной. Есть радость спокойная и светлая, дарящая нам прозрачное счастье, а есть радость буйная, безудержная, переполненная удовольствиями и эйфорией. Так вот, эти две разные радости делают два разных гормона. Безудержная радость и эйфория — это гормон дофамин. Радость светлая и спокойная — это гормон серотонин.
Дофамин — гормон безудержной радости, удовольствия и эйфории. Дофамин толкает нас на подвиги, безумства, открытия и свершения, высокий уровень этого гормона превращает нас в донкихотов и оптимистов. Напротив, если мы испытываем недостаток дофамина в организме, мы становимся унылыми ипохондриками.
Любое занятие или состояние, от которого мы получаем (а еще точнее — предвкушаем) искреннюю радость и восторг, провоцирует мощный выброс гормона дофамина в кровь. Нам это нравится, и через некоторое время наш мозг «просит повторить». Именно так в нашей жизни появляются хобби, привычки, любимые места, обожаемая еда… Кроме того, дофамин вбрасывается в организм в стрессовых ситуациях, чтобы мы не умерли от страха, шока или боли: дофамин смягчает боль и помогает человеку адаптироваться к нечеловеческим условиям. Наконец, гормон дофамин принимает участие в таких важных процессах, как запоминание, мышление, регуляции циклов сна и бодрствования. Нехватка по каким-либо причинам гормона дофамина приводит к депрессии, ожирению, хронической усталости и резко снижает сексуальное влечение. Самый простой способ вырабатывать дофамин — заниматься сексом или слушать музыку, пробивающую тебя до дрожи. В целом — заниматься тем, само предвкушение чего вызывает у вас удовольствие.
Серотонин — это уверенность в себе, прилив сил и бодрости. Если в мозге нехватка серотонина, симптомы этого — плохое настроение, повышенная тревожность, упадок сил, рассеянность, отсутствие интереса к противоположному полу, депрессия, в том числе в самых серьезных формах. Нехватка серотонина отвечает и за те случаи, когда мы не можем выкинуть предмет обожания из своей головы, или, как вариант, не можем избавиться от навязчивых или пугающих мыслей. Если у человека повысить уровень серотонина, у него исчезает депрессия, он перестает циклиться на неприятных переживаниях, и на место проблем быстро приходят хорошее настроение, радость жизни, прилив сил и бодрости, активность, влечение к противоположному полу. Подробнее о серотонине смотри здесь… См.→
Тестостерон — гормон мужественности и полового влечения. Тестостерон запускает мужские формы полового поведения: наиболее явные отличия М от Ж, такие как агрессивность, склонность к риску, доминантность, энергичность, самоуверенность, нетерпеливость, желание соревноваться, определяются прежде всего уровнем тестостерона в крови. Мужчины становятся «петухами», легко вспыхивая гневом и проявляя драчливость. Увеличение уровня тестостерона улучшает сообразительность и «взбивает» эмпатию.
Эстроген — гормон женственности. Влияние на характер: страхи, жалость, сопереживание, привязанность к младенцам, плакса. Эстроген развивает в Ж влечение к доминирующему самцу, сильному и опытному, признанному в обществе, и дает ряд других преимуществ: улучшает координацию и точность движений (Ж лучше М справляется с задачами, требующими быстрых искусных движений), усиливает языковые способности. Если в период внутриутробного развития мальчик подвергнется воздействию ненормально высокого уровня эстрогена, он окажется в мужском теле, но с женским мозгом и вырастет миролюбивым, чувствительным, женственным.
Можно ли самостоятельно менять свой уровнь тестостерона? Да. Если мужчина практикует единоборства, силовые и экстремальные виды спорта, чаще разрешает себе гнев, его организм усиливает генерацию тестостерона. Если девушка чаще играет блондинку и разрешает себе страхи, ее организм усиливает выработку эстрогена.
Окситоцин — гормон доверия и нежной привязанности. Повышение уровня окситоцина в крови вызывает у человека чувство удовлетворения, снижение страхов и тревог, чувство доверия и спокойствия рядом с партнером: человеком, которого воспринимали как душевно близкого себе человека. На физиологическом уровне окситоцин запускает механизм привязанности: именно окситоцин делает мать или отца привязанными к своему ребенку, привязывает женщину к своему сексуальному партнеру, а мужчине создает романтический настрой и сексуальную привязанность и готовность быть верным. В частности, окситоцин заставляет женатых/влюбленных мужчин держаться подальше от посторонних привлекательных женщин. По уровню окситоцина в крови можно достаточно уверенно говорить о склонности человека к верности и готовности привязываться в близких отношениях. Любопытно, что окситоцин хорошо лечит аутизм: и дети, и взрослые люди, страдающие аутизмом, после лечения окситоцином стали не только более эмоциональны сами, но и лучше понимать и узнавать эмоции других людей. Люди с высоким уровнем окситоцина живут более здоровой и долгой жизнью, поскольку окситоцин улучшает состояние нервной и сердечной системы плюс стимулирует выработку эндорфинов — гормонов счастья.
Аналог окситоцина — вазопрессин, дает примерно тот же эффект.
Фенилэтиламин — гормон влюбленности: если он при виде привлекательного объекта в нас «взыграл», в нас загорается живая симпатия и любовное влечение. Фенилэтиламин присутствует в шоколаде, сладостях и диетических напитках, однако скармливание этих продуктов мало чему поможет: для создания состояния влюбленности необходим фенилэтиламин другой, эндогенный, то есть выделяемый самим мозгом. Любовные напитки существуют в сказании о Тристане и Изольде или в драме Шекспира «Сон в летнюю ночь», в действительности же наша химическая система ревниво охраняет свое исключительное право контроля наших эмоций.
Эндорфины рождаются в победном бою и помогают забыть про боль. Морфин — основа героина, а эндорфин — сокращенное название для эндогенного морфина, то есть наркотика, который вырабатывается у нас самим организмом. В больших дозах эндорфин, как и другие опиаты, повышает настроение и запускает эйфорию, однако «гормоном счастья и радости» называть его неверно: эйфорию вызывает дофамин, а эндорфины только способствуют активности дофамина. Главное действие эндорфина в другом: он мобилизует наши резервы и позволяет забыть про боль.
Условия выработки эндорфина: здоровый организм, серьезные физическим нагрузки, немного шоколада и ощущение радости. Для бойца — это победная схватка на поле сражения. О том, что раны победителей заживают быстрее, чем раны побежденных, было известно еще в Древнем Риме. Для спорстмена — это «второе дыхание», которое открывается на долгой дистанции («эйфория бегуна») или в спортивном состязании, когда силы кажутся на исходе, но победа близка. Радостный и долгий секс — также источник эндорфинов, при этом у мужчин он в большей степени запускается энергичной физической активностью, а у женщин — ощущением радости. Если женщины будут в сексе активнее, а мужчины увлеченно радостнее, тем крепче будет их здоровье и богаче переживания.
Если рассматривать действие гормонов и нейромедиаторов в процессе деятельности, то немного упрощенно это выглядит так.
- Восприятие и анализ информации регулируется норадреналином. Чем выше норадреналин, тем выше скорость приема и переработки информации.
- Эмоциональная реакция на полученную информацию зависит от серотонина. Чем выше серотонин, тем реакции более взвешенная, адекватная, сбалансированная.
- Генерация вариантов действий определяется дофамином: чем выше его уровень, тем легче и быстрее человек придумывает разнообразные варианты решения — впрочем, не особенно проверяя их критикой.
- Проверка критикой и отсеивание неадекватных вариантов — это работа серотонина.
- А вот чтобы в конце концов принять решение и начать действовать, нужен норадреналин.
Главное, что важно знать про гормоны: большинство из них запускается той же физической активностью, которую они же производят. Прочитайте статью еще раз:
Чтобы мужчине повысить свою мужественность, ему нужно начать вести себя мужественно: тестостерон запускает здоровую агрессивность, но и запускается единобоствами, силовыми и экстремальными видами спорта. Если девушка чаще играет блондинку и разрешает себе страхи, ее организм усиливает выработку эстрогена, запускающими страхи и тревоги.
Окситоцин укрепляет доверие и близкую привязанность, но одновременно и запускается тем же самым: начинайте доверять любимым, говорите им теплые слова, и вы повысите в себе уровень окситоцина.
Эндорфин помогает преодолевать боль и дает силы на почти невозможное. Что нужно, чтобы запустить этот процесс? Ваша готовность к физическим нагрузкам, привычка преодолевать себя…
Если вы хотите чаще получать состояние восторга и эйфории, идите туда, где практикуется это поведение. Начнете в компании таких же, как вы, кричать от восторга — забурливший в вашей крови дофамин приведет вас в восторг. Поведение восторга запускает переживание восторга.
Человек в депрессии выбирает серые тона, но серотонин, улучшающий настроение, запускается в первую очередь ярким солнечным светом. Человек в дурном настроении сутулится и предпочитает запираться в одиночестве. Но как раз хорошая осанка и прогулки способствуют выработке серотонина, который запускает вам ощущения радости и счастья. Итого: вылезайте из берлог, распрямляйте спину, включайте яркий свет, то есть ведите себя так, как ведет себя радостный человек, и ваш организм начнет вырабатывать серотонин, гормон радости и счастья.
ХОТИТЕ ИЗМЕНИТЬ СВОЕ СОСТОЯНИЕ — НАЧНИТЕ МЕНЯТЬ СВОЕ ПОВЕДЕНИЕ!

www.psychologos.ru
Гормон боли как модулятор функциональной активности клеток иммунной системы и опухолей Текст научной статьи по специальности «Медицина и здравоохранение»
Оригинальные статьи
© 2004, СПб РО РААКИ
ГОРМОН БОЛИ КАК МОДУЛЯТОР ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ КЛЕТОК ИММУННОЙ СИСТЕМЫ И ОПУХОЛЕЙ
Гариб В.Ф.
Ташкентский Институт Усовершенствования Врачей, Узбекистан Институт Иммунологии Университета Виттен/Хердеке, Виттен, Германия
Резюме. Болевой синдром ведет к развитию стресс-ответа, представляющего совокупность эндокринных и метаболических процессов и выделению стресс-гормонов, в том числе гормона боли (субстанции Р). В связи с тесным взаимодействием нейро-эндокринной и иммунной систем с канцеронегезом, целью настоящего исследования явилось изучение прямого влияния гормона боли на функциональную активность натуральных киллеров и клеток опухоли. Субстанция Р, внесенная в систему трехмерного коллагенового матрикса, способствует снижению локомоторной активности натуральных киллеров с 15,7± 1,9% до 8,6±2,0%. Отмечено усиление цитотоксической активности натуральных и лимфокин-активированных киллеров под воздействием субстанции Р в 6 из 8 экспериментов. Увеличение миграционной активности клеток аденокарциномы молочной железы линии MDA-MB-468 под влиянием субстанции Р связано со специфическим воздействием на нейрокинин-1 рецепторы, презентируемые опухолевыми клетками. Данный процесс активации ингибируется антагонистом нейрокинин-1 рецептора — L-733,060. Клетки карциномы простаты РСЗ миграционно-ареактивны по отношению к субстанции Р.
Ключевые слова: гормон боли, субстанция Р, натуральные киллеры, рак молочной железы, рак простаты.
Garib V.F.
PAIN HORMONE EFFECTS ON THE FUNCTIONAL ACTIVITY OF IMMUNE AND TUMOR CELLS Abstract. The pain syndrome cause to the development of stress-respond and release of stress-hormones, in particularly, “pain hormone” or substance P. While strong interaction of the neuro-endocrine and immune system with cancerogenesis had been found previously, the investigation of substance P direct influence on immune and tumor cells is missing. In the present study we have analyzed the function of the pain hormone on the activity of natural killer cells, as well as breast- and prostate adenocarcinoma cells. Substance P, is added in 3-dimentional-collagen matrix, reduces the migration activity of natural killer cells from 15, 7±1,9% to 8,6±2,0%. The stimulatory effect of natural killer cells cytotoxicity had been noted. Substance P predominantly binds to the neurikinin-1 receptor, is presented on MDA-MB-468 cells and increases human breast adenocarcinoma cells migratory activity. Specific NK-1 receptor antagonist L-733,060 completely inhibits the substance P mediated increase of cell migration. There is no change in regulation of PC3 prostate carcinoma cells spontaneous migration in presence of substance P. (Med.Immunol., 2004, vol.6, № 6, pp 529-536)
Введение Рии’ так и в головном мозге, где он локализуется в
Наличие любого онкологического заболевания областях, координирующих реакции на стресс (на-
вызывает достаточно высокое психоэмоциональное пРимеР’в locus coeruleus и amygdala). Субстанция Р
напряжение у пациента, что на фоне неадекватной активно мечена в обмен норадреналина и серото-
анестезии оказывает выраженное влияние на выде- нина’ и предполагается, что это серьезным образом
ление стресс-гормонов, в том числе гормона боли [2]. влияет на патофизиологию депрессии и тревоги.
Гормон боли (субстанция Р) представляет собой Было установлено, что болевой синдром ведет к раз-
нейропептид, активно работающий как на перифе- витию стресс-ответа, представляющего совокупность
_____________________________________________ эндокринных и метаболических процессов, небла-
Адрес для переписки: гоприятным образом влияющих на организм паци-
Гариб В.Ф. 700007, Узбекистан, Ташкент, ента в целом и на развитие онкозаболевания.
Институт Усовершенствования врачей, Большинство онкологических больных погибают
Паркентская, 51. Тел./факс: 998-712-68-24-57. в результате диссеминирования неопластического
E-mail: [email protected] процесса. Развитие метастазов представляет собой
многокомпонентный процесс, в течение которого клетки опухолевого клона приобретают способность к активной миграции за пределы первичной опухоли. В свою очередь для осуществления иммунологического надзора, клетки иммунной системы также должны обладать способностью к активной миграции. При развитии онкологического процесса основными эффекторными клетками выступают две субпопуляции лимфоцитов — натуральные киллеры и цитотоксические Т-лимфоциты.
Активная миграция клеток может быть стимулирована непосредственно экстрацеллюлярным матриксом [4]. В то же время триггерами клеточного передвижения могут явиться растворимые цитокины и нейротрансмиттеры [8], воздействующие на специфические рецепторы клеток. Так, ранее было продемонстрировано, что индукция миграции клеток рака молочной железы с фенотипом EGFR/c-erbB-2 основана на изменении кинетики фосфолипазы C-g в результате сигнала активации данного рецептора [6]. Активация натуральных киллеров и их конверсия в лим-фокин-активированные киллеры происходит при участии интерлейкина-2 (IL-2) [16]. Данный процесс обеспечивается благодаря экспрессии полного рецептора к IL-2 на поверхности натуральных киллеров без первичной антигенной стимуляции.
Клеточный уровень воздействия гормона боли подразумевает связывание субстанции Р с клеточными нейрокинин-1 рецепторами. На молекулярном уровне было показано, что субстанция Р вовлечена в процессы активации факторов транскрипции и связывающего протеина CREB, являющихся регуляторами миграционной активности клеток [13].
Таким образом, к настоящему времени созданы теоретические предпосылки к определению прямого влияния гормона боли на процессы канцерогенеза с позиций его воздействия на клетки иммунной системы и опухоли.
Материал и методы
Клеточная культура. Клеточная культура человеческой карциномы простаты PC-3 (DSMZ, Германия) культивировалась в средах НАМ и RPMI в соотношении 1:1, содержащих 10% бычью сыворотку. MDA-MB-468 (аденокарцинома молочной железы) была получена из американской коллекции клеточных культур (АТСС, Rockville, MD). Клетки культивировали в среде Leibovitz’s 15, обогащенной 10% инактивированной бычьей сывороткой, 100 ед/ мл пенициллином и 100 мкг/мл стрептомицином. Обе клеточные линии содержались в условиях инкубатора с постоянной температурой 37°С. Пассаж клеток производился каждую неделю после трипси-низации монослоя клеток, выросших в пластиковых плашках (Falcon).
Культура клеток К-562 использовалась в качестве клеток-мишеней при выполнении исследований для определения цитотоксической активности натуральных и лимфокинактивированных киллеров. Клеточная культура была получена от больной с хронической эритроцитарной лейкемией в стадии терминального бластного криза. Клетки культивировали в инкубаторе в среде RPMI-1640, обогащенной 10% не-инактивированной бычьей сывороткой. Особенностью клеток является их неспособность оседать на дне плашки, в связи с чем, пассаж осуществляли без предварительной трипсинизации.
Выделение натуральных киллеров. В экспериментах использовали натуральные киллеры здоровых доноров. На первом этапе популяцию лимфоцитов из гепаринизированной периферической крови изолировали посредством градиент-опосредован-ного центрифугирования, используя Ficoll-Hypaque (ICN, Meckenheim, Germany). Негативная селекция натуральных киллеров осуществлялась при помощи набора Magnetic Cell Separation Kit (Dynal, Hamburg, Germany). Мононуклеарные клетки периферической крови инкубировали с моноклональными антителами (CD3, CD14, CD36, CDwl23, HLA class II DR/ DP) в течение 10 минут при температуре 4°С. Затем клетки, связавшиеся с данными антителами и прореагировавшие с намагниченными бусами (Dynal), были притянуты к стенкам магнитной камеры и в дальнейшем удалены из системы. Все этапы производили с использованием стерильного физиологического раствора, содержащего 0,1% сывороточный бычий альбумин. Контроль за чистотой выделенной популяции натуральных киллеров осуществляли при помощи проточной цитофлуориметрии (Becton Dickinson, Heidelberg, Germany). Клетки метили флуоресцеин изотиоцианат- (РГГС)-коньюгирован-ными анти-С056 и фикоэритрин- (РЕ)-коньюгиро-ванными анти-CD 16 моноклональными антителами (Becton Dickinson, Heidelberg, Germany).
Выделенная популяция натуральных киллеров состояла более, чем на 88% из CD16 С056-позитив-ных клеток и содержала менее 5% клеток с фенотипом CD3+, что соответствовало рекомендациям производителя набора для негативной изоляции натуральных киллеров.
После выделения натуральные киллеры в течение ночи были инкубированы в среде RPMI-1640 (Life Technologies, Karlsruhe, Germany), обогащенной 10% термически инактивированной сывороткой телят (PAA Laboratories, Linz, Austria) при 37°С.
В целях конверсии в лимфокин-активированные киллеры, часть выделенных натуральных киллеров инкубировали со средой RPMI, содержащей ЮОнг/ мл IL-2.
Проточная цитофлуориметрия (FACS). Наряду с контролем за чистотой выделения популяции натуральных киллеров, проточная цитофлуоримет-
рия использовалась для определения степени конверсии натуральных киллеров в лимфокин-активи-рованные киллеры путем измерения экспрессии рецептора активации CD69.
Экспрессия нейрокининовых рецепторов клетками аденокарциномы молочной железы и простаты также определялась при помощи проточной цитоф-луометрии [1]. Десять тысяч клеток каждой линии были инкубированы с первичными (козьими) антителами к NK-1 рецепторам в течение 10 минут при комнатной температуре. После чего клетки были отмыты и подвержены вторичной 10-минутной инкубации с FITC-меченными анти-козьими антителами. Неспецифическая реакция связывания контролировалась при помощи изотип-контроля (неспецифические козьи антитела).
Метод изучения клеточной миграции. Культивируемые PC-З и MDA-MB-468 клетки были удалены из пластиковых плашек при помощи 0,25% раствора трипсина (Sigma, Deisenhofen, Germany).
Исследование клеточной подвижности проводилось в 3-х мерном коллагеновом матриксе при использовании 10-часовой видеомикроскопии и последующего компьютерного анализа.
Приготовление коллагенового матрикса. В суспензию опухолевых клеток (60х103) был внесен раствор коллагена I типа (Collagen Corporation, Fremont, СА), MEM (Sigma, Deisenhofen, Germany) (pH 7.4) до конечного объема 135 мкл с последующим добавлением субстанции Р и (или) антагониста L-733,060. Конечная концентрация субстанции Р
составила 1 мкМ, предварительно оцененная как минимальная дозовая, но максимальная по эффективности концентрация [7]. АнтагонистЫК-1 рецептора Ь-733,060 был использован в эквивалентной субстанции Р молярности. Полученная суспензия переносилась в стеклянную камеру для последующей полимеризации при 37°С и наличии 5% С02 в атмосфере инкубатора на 30 минут.
Видеомикроскопия. Запись клеточной миграции производилась в течение последующих 10 часов с замедленной съемкой, в 1920 раз отличающейся от реальной скорости движения клеток. Одновременно, в эксперименте были задействованы 4 аналогичные видеосистемы, дополнительно оснащенные блоком поддержания оптимальной температуры в камерах в пределах 37+3° С.
В дальнейшем, 30 рандомизированно отобранных клеток, находящихся в поле зрения оператора, были подвергнуты компьютерному анализу миграции с шагом в 20 минут.
Для оценки миграционной активности использовались такие параметры, как количество мигрирующих клеток популяции; скорость движения, исключающая периоды остановки; общая дистанция передвижения в течение исследуемого времени.
Каждый экспериментальный блок включал в себя 3 независимых эксперимента, т.е. влияние субстанции исследовалось на 120 опухолевых клетках. Разница миграционной активности оценивалась по отношению к контролю — движению спонтанно мигрирующих клеток.
100
ПЗ
ш
о
Cl
S
со
S
с,
контроль
1
После инкубации с субстанцией Р 3 4 5 6 7
Рис.1. Сравнительная оценка цитотоксической активности натуральных киллеров (ЫК) и лимфокин-активированных киллеров (1_АК) в контроле и после их инкубации с субстанцией Р (эксперименты 1 -8). Примечание: Цитотоксическая активность оценивалась в процентном соотношении от химически индуцированного лизиса клеток-мишеней К-562.
Миграция натуральных киллеров изучалась в аналогичной системе с использованием 200х103 клеток в 50 мкл среды RPMI и 100 мкл раствора коллагена I типа.
Цитотоксический тест. Литическую активность натуральных киллеров и лимфокин-активиро-ванных киллеров изучали с использованием нерадиоактивного цитотоксического теста (Promega, Мап-heim, Germany). В качестве клеток-мишеней была использована культура клеток человеческой миело-идной лейкемии линии К-562 (DSMZ, Braunschweig, Germany). При отработке метода использовали различные варианты соотношений эффектор:мишень. Наиболее оптимальным соотношением для изучения влияния субстанции Р на литическую активность было избрано 10:1. Цитотоксический тест был выполнен в соответствии с инструкциями производителя.
Характеристика препаратов. В исследованиях использован нейротрансмиттер — субстанция Р (Calbiochem, Bad Soden, Germany), представляющая собой синтетический пептид H-Arg-Pro-Lys-Pro-Gln-Gln-Phe-Phe-Gly-Leu-Met-OH с молекулярной
формулой С Н N О S и молярной массой 1348,6. 7, 63 97г17 14 -г*
Учитывая, что субстанция Р оказывает свое воздействие посредством активации нейрокининовых рецепторов 1 типа, в исследованиях был использован также антагонист данных рецепторов L-733,060 (Sigma, Deisenhofen, Germany). Конечная концентрация субстанции Р и L-733,060 в системе составила 1 мкМ.
Статистический анализ. В зависимости от избранного метода исследования для проведения экспериментов и параметров, статистический анализ выполнялся по нескольким программам. Помощь в проведении статистического анализа была оказана Dr.mat. Klaus Reichard из Института Математики Университета Виттен/Хердеке, Германия.
Различия в проценте мигрирующих клеток популяции под влиянием препаратов оценивали по отно-
шению к контрольной группе — спонтанно передвигающихся клеток. В связи с тем, что временное изменение процента мигрирующих клеток (миграция -отсутствие миграции) является биноминальным распределением, из среднего значения всех экспериментов одной серии с тремя различными концентрациями препарата и контроля в каждую временную точку вычитали актуальное значение соответственного времени. Используя данный фактор коррекции, среднее значение и размах во все время исследования калькулировали и вносили в z-test (Gauss-test) для статистической обработки при миграционной характеристике «процент мигрирующих клеток».
При изучении экспрессии антигенов статистический анализ выполняли при помощи программы, инсталлированной в Macintosh версии 2.03 f.
Результаты исследований
Влияние гормона боли на функциональную активность натуральных киллеров. Цитотоксичес-кая активность натуральных киллеров, использованных по отношению к клеткам-мишеням в соотношении 10:1, составила 35±17,1% от индуцированного лизиса К-562 клеток. Данный показатель увеличивался после конверсии клеток в лимфокин-ак-тивированные клетки под влиянием IL-2 до 50 ± ± 15,2% лизированных К-562 клеток (рис.1). Высокие данные разброса показателя свидетельствуют
о широкой вариабельности среди здоровых доноров. Тем не менее, для изучения влияния субстанции Р на цитотоксическую активность натуральных киллеров также использовались параметры средних величин. Данные восьми независимых экспериментов представлены на рисунке. Внесение в систему субстанции Р в конечной концентрации 1мкМ способствовало стимуляции данного эффекта в 6 из 8 экспериментов. Данная тенденция сохранялась при изучении цитотоксической активности лимфокин-активированных киллеров.
время (минуты)
Рис.2. Миграционная активность натуральных киллеров в системе трехмерного коллагенового матрикса. Примечания: контроль (А) и при наличии в данной системе субстанции Р (Б).
В отличие от донор-зависимых различий показателя цитотоксичности, миграционная активность натуральных киллеров, изолированных от доноров, отмечена как гомогенная. Среднее количество вовлеченных в спонтанную миграцию натуральных киллеров составило 15,7+1,9% от общего числа клеток данной популяции, внесенных в систему трехмерного коллагенового матрикса. При наличии в системе субстанции Р отмечено угнетение локомоторной активности натуральных киллеров, что выразилось в уменьшении числа мигрирующих клеток до 8,6±2,0% (рис. 2).
Влияние гормона боли на миграцию клеток аденокарциномы молочной железы и простаты.
При появлении болевой стимуляции субстанция Р (SP) способствует активации нейрокинин-1 рецепторов (NK-1). Анализ экспрессии NK-1 рецепторов показал, что данный тип рецепторов презентирован клетками аденокарциномы молочной железы. Так, средняя FITC-флуоресценция десяти тысяч опухолевых клеток линии MDA в контроле составила 7,78. Опытная группа аналогичных клеток, инкубированных со специфическими антителами к нейрокинин-
1 рецептору, в среднем показывала флуоресценцию 21,45 (рис. ЗА).
Проведение FACS анализа не выявило экспрессии NK-1 рецептора на поверхности клеток карциномы простаты. Так, флуоресценция клеток линии РСЗ при наличии антител к NK-1 рецептору прак-
тически не отличалась от изотопического контроля (рис. ЗБ).
Сравнительное изучение процента мигрирующих клеток линии аденокарциномы молочной железы МОА-МВ-468 (МБА) в зависимости от наличия 1 мкМ субстанции Р в системе показало статистически достоверное увеличение числа мигрирующих клеток под влиянием данного пептида (рис. 4А).
Спонтанное передвижение клеток карциномы простаты РС-3 в стандартных условиях эксперимента присуще 20% клеток популяции. Внесение в систему 1 мкМ субстанции Р не оказывает воздействие на динамику данного параметра на протяжении 10 часов непрерывного наблюдения. (рис.4Б).
На основе представленных сопоставлений 5Р-индуцированной динамики миграционного процесса ЫК-1 позитивных и 1ЧК-1 негативных клеточных линий, возникли предпосылки к раскрытию одного из механизмов воздействия субстанции Р на процессы клеточного движения.
Теоретически, препарат, блокирующий N1*^-1 рецептор, может быть способен предотвратить БР- индуцированную клеточную миграцию. В связи с этим, в рамках миграционного эксперимента был использован специфический антагонист ЫК-1 рецепторов Ь-733,060.
Внесение Ь-733,060 в коллагеновый матрикс полностью блокирует влияние субстанции Р на процент мигрирующих МОА клеток, сохраняя их на уровне
MDA-MB-468
СФИ изо 7.78 СФИ NK-1 27.45
ю( 102 103
FITC-Fluoreseence
10′
РСЗ
101 102 103 FITC-Fluorescence
10*
Рис.З. Анализ экспрессии ЫК-1 рецепторов на поверхности клеток аденокарциномы молочной железы МОА-МВ-468 (А) и карциномы простаты РСЗ (Б). Примечания: ПТС-флуоресценция связавшихся специфических антител (серая линия) сопоставлена с неспецифическим контролем (черная линия). СФИ = средняя флуоресцентная интенсивность специфического и неспецифического (изо) связывания.
MDA-M В-468
Ф 80 —
5
ф 60
s
3
2 40
>>
о.
5 0 Н-1-1-1-1-1-1-1-1-1-1-1
01 23456789 10
время (часы)
■*— Control —A—SP —Ф—L-733,060 SP+L733.060
Ф
s
3
2
>.
а
s
а
100 90 80 70 60 50 -40 -30 20 -10 -0
Control
01 23456789 10
время (часы)
Рис.4. Динамика миграции клеток аденокарциномы молочной железы М0А-МВ-468 под воздействием субстанции Р и антагониста нейрокинин-1 рецептора 1-733,060. Примечания: (А), ареактивность миграционных характеристик клеток аденокарциномы простаты РСЗ к гормону боли (Б). В качестве контроля использованы клетки линий аденокарциномы молочной железы и простаты без внесения изучаемых субстанций в коллагеновый матрикс.
контрольных показателей (рис.4А). Необходимо подчеркнуть, что данный препарат L-733,060 при его использовании в виде монотерапии не оказывает воздействия на спонтанную миграцию клеток РСЗ и MDA.
Обсуждение
Вовлечение психологических факторов в возникновение и развитие опухолевого процесса обсуждается на протяжении десятилетий, что нашло свое отражение в обзорной работе Heffner с соавт. [10]. В поддержку психоневроонкологической концепции канцерогенеза выступает также исследование по идентификации нейротрансмиттеров, индуцирующих миграцию клеток рака молочной железы [5]. Как
известно, способность клеток к миграции является необходимым компонентом в развитии метастазов.
Результаты данного исследования убедительно показывают, что гормон боли способствует вовлечению в процесс миграции большего числа клеток аденокарциномы молочной железы линии МОА-МВ-468. Воздействие при этом осуществляется посредством связывания субстанции Р с нейрокинин-1 рецепторами, презентируемыми на поверхности клеток данной линии. Интересно отметить, что клетки карциномы простаты РСЗ, не несущие данный тип рецепторов, миграционно-ареактивны по отношению к субстанции Р.
В связи с тем, что гормон боли участвует в формировании симптомокомплекса тревоги, препараты — ингибиторы функции субстанции Р, находящиеся
в стадии разработки и клинических испытаний, будут в дальнейшем использоваться в лечении депрессии и ассоциированным с ней состоянием тревоги [15]. Одной из таких субстанций является Ь-733,060.
Как показали результаты исследования, антагонист ЫК-1 рецепторов, антидепрессант Ь-733,060, способен ингибировать миграцию клеток аденокарциномы молочной железы, инициированную гормоном боли.
Однако, клеточная локомоция присуща не только клеткам опухоли. Функциональная состоятельность лейкоцитов также предполагает их активную миграцию для осуществления иммунологического надзора [9]. По сравнению с контрольными показателями миграционной активности натуральных киллеров, наличие в системе субстанции Р приводит к 2х-кратному уменьшению числа мигрирующих клеток данной популяции.
Данные литературы, освещающие влияние субстанции Р на миграционную активность лейкоцитов противоречивы. В то время как Вопаппп с соавторами не удалось обнаружить нарушения клеточной миграции в ответ на гормон боли, другие авторы отмечают стимулирующее влияние субстанции на миграцию нейтрофилов [11]. Субстанция Р способствовала снижению адгезивной способности Т-лимфоцитов на фибронектине [14], что также может влиять на их миграционные характеристики.
Необходимо подчеркнуть, что некоторые популяции клеток иммунной системы обладают способностью к продукции целого спектра нейротрансмиттеров, в том числе, субстанции Р. К таким продуцентам относятся Т-лимфоциты, моноциты и дендритные клетки [12]. В то же время, иммуносупрессия находится в прямой взаимосвязи с болевым синдромом. Так, интенсивность боли ассоциирована со степенью снижения функциональной активности клеток иммунной системы у пациентов [5].
Субстанция Р способствовала стимуляции ци-тотоксической активности натуральных киллеров и, как было описано выше, снижению их миграционной активности. Эта находка очень интересна с позиций самого процесса по осуществлению натуральными киллерами эффекторных функций. Натуральные киллеры не могут осуществлять обе функции одновременно: они либо мигрируют к клетке-мишени, либо разрушают ее. В таком случае, должен быть молекулярный механизм для переключения этих функций под воздействием субстанций передачи сигнала. В такой роли может выступать гормон боли.
Таким образом, гормон боли способен оказывать влияние на функциональную активность клеток иммунной системы (натуральные киллеры) и опухоли (аденокарцинома молочной железы), что может отражать процессы патогенеза у больных злока-
чественными новообразованиями, особенно при неадекватной анестезии. При этом антидепрессанты как антагонисты нейрокининового рецептора-1, вероятно, могут быть использованы для профилактики развития метастатического процесса.
Благодарность
Автор выражает признательность профессору К.З.Ценкеру за предоставление возможности выполнения данной работы на базе Института Иммунологии Университета Виттен/Хердеке (Германия). Спонсором проекта является немецкая ассоциация анестезиологов и реаниматологов (Deutsche Gesselschaft fuer Anaesthesiologie und Intensiv-medizin).
Список литературы
1. Гариб В.Ф., Сабиров Д.М., Ценкер К.С. Влияние ремифентанила на миграцию клеток аденокарциномы молочной железы в эксперименте // Теоре-тич. и клин. мед. — 2003. -1. — С. 6-11.
2. Жданов О.Н., Пасько В.Г. Анестезиологическое обеспечение хирургического лечения новообразований // Тезисы IV сессии МНОАР. — 2003. -С. 56.
3. Bonamin L.V., Malucelli В.Е. Substance P. does not modify mononuclear cell migration into Ehrlich tumor mass // Braz.J Med. Biol. Res. -1996. — Vol. 29. -P. 359-362.
4. Caplan A.I. The extracellular matrix is instructive // Bioassays. -1986. — Vol. 5. — P. 129-132.
5. Cabot P.J. Immune-derived opioids and peripheral antinociception // Clin Exp Pharmacol Physiol. -2001. — Vol. 28. — P. 230-232.
6. Dittmar Т., Husemann A., Schewe Y. Induction of cancer cell migration by epidermal growth factor is initiated by specific phosphorylation of tyrosine 1248 of c-erbB-2 receptor via EGFR // FASEB J. -2002. -Vol. 16. — P.1823-191825.
7. Drell T.L. 4th, Joseph J„ Lang K., Niggemann B., Zaenker K.S., Entschladen F. Effects of neurotransmitters on the chemokinesis and chemotaxis of MDA-MB-468 human breast carcinoma cells // Breast Cancer Res Treat. -2003. — Vol.80. — P.63-70.
8. Entschladen F., Zaenker K.S. Locomotion of tumor cells: a molecular comparison to migrating pre- and postmitotic leukocytes //]. Cancer Res. Clin. Oncol. -2000.-Vol. 126.-P. 671-681.
9. Entschladen F., Lang K., Drell T.L., Joseph J., Zaenker K.S. Neurotransmitters are regulators for the migration of tumor cells and leukocytes // Cancer Immunol Immunother. -2002. -Vol. 51. -P.467-82.
10. Heffner K.L., Loving T.J., Robles T.F., Kiecolt-Glaser J.K.. Examining psychosocial factors related to
cancer incidence and progression: In search of the silver lining // Brain Behav Immun. -2003. — Vol.17. — P. 109-111.
11. Kahler C.M., Pischel A.B., Haller T„ Meierhofer C., Djanani A., Kaufmann G., Wiedermann C.J. Signal transduction pathways in directed migration of human monocytes induced by human growth hormone in vitro // Int Immunopharmacol. -2001. -Vol. 1. -P.1351-1361.
12. Lambrecht B.N. Immunologists getting nervous: neuropeptides, dendritic cells and T cell activation // Respir Res. -2001. -Vol. 2. -P. 133-8.
13. Lang K., Drell T.L., Niggemann B., Zanker K.S., Entschladen F. Neurotransmitters regulate the migra-
tion and cytotoxicity in natural killer cells // Immunol Lett. -2003-Vol. 90.-P. 165-72.
14. Levite М., Cahalon L., Hershkoviz R., Steinman L., Lider O. Neuropeptides, via specific receptors, regulate T cell adhesion to fibronectin //J Immunol. -1998. -Vol. 160.-P. 993-1000.
15. Mantyh P.W. Neurobiology of substance P and theNKl receptor //J Clin Psychiatry. -2002. -Vol.63. -Suppl 11. -P. 6-10.
16. Yu Т.К., Caudell E.G., Smid C., Grimm E.A. IL-
2 activation ofNK cells: involvement of MKK1/2/ERK but not p38 kinase pathway // J Immunol. -2000. -Vol.164. -P.6244-6251.
поступила в редакцию 20.03.2004 отправлена на доработку 30.03.2004 принята к печати 05.04.2004
cyberleninka.ru
Боль. Половые гормоны.
Влияние половых гормонов на различия в восприятии боли: оценка в клинической практике. Уровень половых гормонов и боль.
Р.Р. Ильясов1 , С.Ю. Калинченко2 , А.Б. Данилов11 Кафедра нервных болезней ФППОВ Первого МГМУ им. И.М. Сеченова 2 Кафедра эндокринологии факультета повышения квалификации медицинских работников РУДН
Существует множество доказательств, свидетель ствующих о влиянии половых гормонов на различия в восприятии боли, однако в клинической практике это не оценивается. Гормоны могут модулировать обработку ноцицептивного сигнала на многих уровнях нейрональной сети, в том числе на периферическом. Один и тот же раздражитель под воздействием половых гормонов может приводить к разным эффектам в зависимости от уровня воздействия этих гормонов.
Досих пор полностью не ясно, абсолютная концентрация или изменение концентрации гормонов является фактором, определяющим про- или антиноцицептивную активность. Однако безусловным фактом является развитие проноцицептивных эффектов в результате дефицита секреции половых гормонов (в женском или мужском организме), так как неоднократно отмечено, что низкий уровень половых гормонов соответствуют большему уровню боли.
Данные закономерности все еще остаются сложными для описания, так как боль является динамическим феноменом, зависящим от влияния различных возбуждающих и ингибиторных механизмов контроля. Интересна для изучения возможность половых гормонов (тестостерона и прогестерона), помимо основных эффектов, обеспечивать антиноцицептивный эффект. Для полноценного понимания роли половых гормонов в восприятии боли необходима оценка трех важных составляющих — уровней тестостерона, прогестерона и эстрогенов.
УРОВЕНЬ ПОЛОВЫХ ГОРМОНОВ И БОЛЬ
Несомненно, имеется большой объем доказательств, демонстрирующих различное восприятие боли и ответ на некоторые классы анальгетиков у мужчин и женщин [1]. Лабораторные и клинические эксперименты пока зывают, что у женщин более низкий болевой порог, чем у мужчин, в ответ на одинаковые виды раздражителей, такие как тепло, холод, давление и электрическая стимуляция.
Исследования на взрослых самцах мышей демонстрируют, что умеренная и высокая доза тестостерона может приводить к повышению болевого порога уже через час после его приема [2]. В то же время последние наблюдения показывают, что метаболиты тестостерона (дигидротестостерон и андростендиол глюкуронид) могут стать потенциальными агентами для лечения диабетической нейропатической боли [3].
Показано, что девочки и женщины в первые дни послеоперационного периода чаще жалуются на боль, чем мальчики и мужчины [Puntillo, Weiss, 1994]. В другом исследовании выявлено, что новорожденные девочки проявляют более выраженную мимическую реакцию в ответ на болевое раздражение, чем мальчики [Guin sburg et al., 2000]. Отмечено, что при проведении стоматологических процедур женщины испытывают более интенсивные болевые ощущения, чем мужчины [Morin et al., 2000].
В эксперименте выявлено, что при предъявлении одинаковых по интенсивности болевых раздражителей у женщин объективный показатель боли (расширение зрачка) более выражен [Ellermeyer, Westphal, 1995]. Опытным путем показано, что после 16 эпизодов воздействия болевого агента на пальцы рук у 50 добровольцев обоих полов женщины в сравнении с мужчинами отмечали более высокую интенсивность боли как непосредственно в момент воздействия, так и после его окончания [Esseri et al., 2007]. Одно из исследований [5] обращает особое внимание на болевую форму стенокардии, которая оказалась более выраженной у мужчин среднего и пожилого возраста на фоне снижения уровня тестостерона.
Отечественное исследование больных с вертеброгенной поясничнокрестцовой радикулопатией (мужчин и женщин) показало, что женщины хуже переносят боль, что находит отражение не только в данных болевых шкал, но и в изменении уровней нейромедиаторов, значения которых исходно превышают аналогичные в мужской группе и свидетельствуют о более напряженной работе антиноцицептивных систем, что подтверждается устойчивой отрицательной корреляционной связью (p < 0,05) между уровнем боли и количеством медиатора [4].
Имеются сообщения о том, что эстрогены могут как увеличивать, так и уменьшать болевую чувствительность, что в свою очередь может происходить из за активации разных эстрогеновых рецепторов [Cou lombe et al., 2011]. Продемонстрировано, что эстроген может усиливать заживление ран и также может вызывать аналгезию, поскольку некоторые болевые состояния усиливаются после менопаузы, когда уровень эстрогена снижается (например, суставные и вагинальные боли) [Ashcroft et al., 1997]. Однако это связано и с тем, что в постменопаузе происходит снижение уровня тестостерона.
В исследованиях на животных отмечено быстрое увеличение энкефалинов в спинном мозге после болюсной инъекции эстрадиола [Amandusson et al., 1999], что свидетельствует о наличии связи между управлением ноцицепцией и половыми гормонами. Полученные данные свидетельствуют о наличии антиноцицептивных эффектов у тестостерона, что следует учитывать в клинической практике при лечении боли. Скорее всего, антиноцицептивные эффекты тестостерона влияют на распространенность хронических нераковых болей (ХНБ).
Проведенные исследования также позволяют утверждать, что половые различия при ХНБ могут быть связаны с колебанием уровня гормонов яичников в течение всего менструального цикла [13, 14]. Многие заболевания, сопровождаемые ХНБ, чаще возникают у женщин [5–7].
ХНБ — это совокупность клинических состояний, характеризующихся болью, которая сохраняется, несмотря на устранение каких-либо стимулов и видимое заживление тканей, или болью, которая возникает при отсутствии каких-либо обнаруживаемых повреждений и не связана с раком [8–12].
Состояния, сопровождаемые ХНБ, включают скелетномышечную боль (СМБ) (например, при фибромиалгии, ревматоидном артрите), мигренозную го ловную боль, боль при дисфункции височнонижнечелюстного сустава (ДВНЧС) и хроническую тазовую боль (например, при синдроме раздраженного кишечника, эндометриозе и интерстициальном цистите).
СКЕЛЕТНОМЫШЕЧНАЯ БОЛЬ
Фибромиалгия
Фибромиалгия — это одно из многих заболеваний, сопровождаемых ХНБ, которое, как правило, преимущественно возникает у женщин и чаще в период репродуктивного возраста. Характеризуется локальной болезненностью и скованностью мышц, распространяющимися по всему телу, а также повышенной мышечной утомляемостью, которая часто усиливается на фоне проведения физических упражнений. Мышечные боли в данном случае изменчивы по интенсивности и связаны с генерализованными проявлениями повышенной чувствительности к боли.
Фибромиалгия обычно сопровождается другими болевыми синдромами, например дисфункцией височнонижнечелюстного сустава (ДВНЧС), хронической болью в шее и спине, головными болями при мигрени [15]. Исследования показывают, что женщины, страдающие фибромиалгией в менопаузе (когда уровень тестостерона снижается), имеют больше показателей боли, чем в пременопаузе [16, 17]. У женщин с регулярным менструальным циклом боль, связанная с фибромиалгией, чаще отмечается в предменструальном периоде (периоде сниженного прогестерона), чем в постменструальном, и нередко сопровождается масталгией. Это отличает их от женщин, использующих оральные контрацептивы или перенесших аборт, не имеющих различия в тяжести боли [18].
Ревматоидный артрит
Ревматоидный артрит (РА) — это хроническое системное аутоиммунное заболевание, которое приводит к выраженному воспалению суставов и боли. РА имеет распространенность около 0,5–1 % у взрослых, однако в 2–4 раза чаще от этого расстройства страдают женщины, чем мужчины [15]. При РА, как правило, поражаются суставы пальцев, запястья, и в конечном итоге в них происходят необратимые изменения.
Считают, что боль при РА возникает в результате увеличения давления на суставы и в конечном итоге приводит к выраженным отекам в области суставов. Однако существуют данные о роли гормонов яичников в патогенезе и степени выраженности боли при РА.
Исследования показывают, что выраженность боли при РА меняется в зависимости от фазы менструального цикла, хотя нет консенсуса, какая фаза менструального цикла связана с большим количеством болевых симптомов [19, 20]. У женщин пик заболеваемости РА приходится на четвертое десятилетие, что предполагает снижение уровня женских половых гормонов, которое способствует его развитию, а именно снижение уровня эстрогенов, что способствует снижению выработки синовиальной жидкости в суставах.
У мужчин РА отмечается чаще на фоне дефицита веса, что соответствует дефициту тестостерона. Последние исследования подтверждают, что гормональные изменения предшествуют началу РА и влияют на фенотип болезни. Опубликованы данные, свидетельствующие, что более низкие уровни тестостерона являются предикторами серонегативного РА [19–21].
Хроническая боль в спине и конечностях
Изучение изменения выраженности скелетно-мышечной боли в различных областях (например, в шее, плече, спине, суставах) в зависимости от гормонального статуса установило, что интенсивность боли у женщин больше в менструальную фазу по сравнению с серединой менструального цикла и овуляторной фазой, что предполагает большую болевую чувствительность при низких уровнях эстрогенов [22].
Согласно большинству исследований скелетно-мышечной боли, можно сделать вывод, что выраженность боли у женщин варьирует в течение всего менструального цикла и усиливается на фоне снижения уровня эстрогена, а также уровней прогестерона и тестостерона в крови [16–20, 22–24].
Мужчины также часто предъявляют жалобы на диффузную скелетномышечную боль. Существуют данные, демонстрирующие низкий уровень тестостерона у таких пациентов. Однако на данный момент нет опубликованных проспективных исследований, оценивающих более четко потенциальную связь между мужчинами с диффузной мышечно-скелетной болью и концентрацией тестостерона, а также описывающих потенциально эффективную терапию тестостероном у таких пациентов [25]. МИГРЕНЬ Диагноз мигренозной головной боли актуален в те чение всего репродуктивного возраста женщины. Возникновение болевого приступа наиболее вероятно на фоне колебания уровня гормонов яичников [26, 27].
Известно, что некоторые мигренозные головные боли синхронны с различными фазами менструального цикла. Выделяют несколько вариан тов мигрени, в том числе в зависимости от времени появления приступов головной боли — в перимен струальный период или в другие фазы цикла [28–30]. При их изучении показано, что приступы мигрени бо лее распространены за 2 дня перед и 2 дня после менструации и что эти приступы, связанные с менструацией, протекают тяжелее, чем приступы, возникающие в другие фазы цикла [26, 31]. Это так называемая менструальная мигрень, которая связана со значительно большим периодом нетрудоспособности и менее чувствительна к негормональной терапии (b-блокаторами, антагонистами кальция, антидепрессантами, противоэпилептическими препара тами и т. д.) по сравнению с другими приступами, возникающими вне периода менструации [28, 29].
Взятые вместе, исследования различных типов мигрени поддерживают идею о том, что гормоны яичников опосредованно регулируют характеристики мигренозной головной боли, особенно в случае мигрени без ауры, которая более распространена среди женщин с нормальным циклом, и что симптомы, как правило, меняются с изменением уровня эстрогенов. Утверждение, что головные боли связаны с колебанием уровня гормонов, а не с их абсолютными уровнями, подтверждается иссле дованиями, в которых принимают участие беременные женщины или принимающие оральные контрацептивы, т.е. женщины с постоянным уровнем эстрогена в крови.
В работах, в которых уровни эстрогена не меняются, частота и интенсивность головных болей незначительна [32], что представляет убедительные доказательства того, что гормоны яичников, их уровни и колебания этих уровней влияют на возникновение приступов мигрени. Также существует исследование, демонстрирующее, что большая распространенность мигрени среди женщин основана не только на биологических факторах, но и на гендерной характеристике, а именно на феминности.
Феминность в большей степени доминирует в женской популяции (поэтому у женщин более низкие болевые пороги и чаще приступы мигрени). Однако в меньшей степени и реже, но все же феминность доминирует и у некоторых мужчин (у них тоже ниже болевые пороги, чаще болевые синдромы).
Дифференцированный подход к пациенту с учетом не только пола, но и гендера позволяет добиться более адекватного контроля над болью [33].
ДИСФУНКЦИЯ ВИСОЧНОНИЖНЕЧЕЛЮСТНОГО СУСТАВА (ДВНЧС)
Синдром ДВНЧС включает группу симптомов, главный из которых — боль в мышцах челюсти и/или височном суставе при пальпации и во время функционирования (например, во время жевания, открывания рта, в разговоре). В дополнение к боли в мышцах челюсти и боли в суставах, многие пациенты с ДВНЧС также страдают болями в мышцах шеи и головной болью (особенно хронической головной болью напряжения).
Многие эпидемиологические исследования выявили, что распространенность ДВНЧС выше среди женщин и наиболее высока в течение их репродуктивного возраста [6]. Пик заболеваемости приходится на период с третьего по четвертое десятилетие жизни, а затем снижается до уровня, сравнимого с мужчинами. Это показывает, что увеличение возникновения данного расстройства у женщин может быть связано с уровнем женских половых гормонов. В частности, считается, что нарушения менструального цикла, связанные с колебаниями уровней половых гормонов (как эстрогенов, так и прогестерона), которые начинаются в период полового созревания, соответствуют увеличению интенсивности боли в мышцах челюсти у женщин с ДВНЧС.
Изучение связи ДВНЧС и гормонов яичников у женщин с регулярным циклом показало изменение выраженности показателей боли в течение всего дня, с максимальными уровнями боли во время менструаций. Сравнение с женщинами, принимающими оральные контрацептивы (ОК), во всех исследованиях были более противоречивы, что, вероятно, связано с разными комбинациями эстрогенов и гестагенов в ОК.
В одном исследовании найдена большая вариабельность в тяжести боли среди женщин с естественным циклом в сравнении с принимающими ОК, что может быть связано с минимизацией эффектов гормональных колебаний на пороги боли [34]. Другое исследование показало более частое возникновение боли во время менструации как у женщин с регулярным циклом, так и у принимающих ОК, что может быть связано с эффектами низких уровней эстрогенов [6]. В исследовании, которое использовало измерение порога боли от давления (ПБД) для определения изменений в экспериментально индуцированной болевой чувствительности, ПБД был наибольшим во время фолликулярной и лютеиновой фаз и наиболее низким в перименструальный период [35], что позволяет сделать следующий вывод: боль является самой сильной, когда уровни эстрогена наиболее низкие.
Исследование оценки влияния заместительной гормональной терапии (ЗГТ) в климактерическом периоде у женщин на боль при ДВНЧС показало, что получавшие ЗГТ испытывали более выраженную боль при ДВНЧС, чем не получавшие ЗГТ. Таким образом, можно утверждать о присутствии различий между эндогенными и экзогенными гормональными воздействиями на состояния, сопровождаемые ХНБ [36]. Взятые вместе, эти исследования демонстрируют следующую модель боли при ДВНЧС, сходную с другими состояниями, сопровождаемыми ХНБ: чувствительность к боли меняется в течение всего менструального цикла, с наиболее низкими порогами и наибольшей чувствительностью при низких уровнях
ХРОНИЧЕСКАЯ ТАЗОВАЯ БОЛЬ
Хроническая тазовая боль, как и другие заболевания, сопровождаемые ХНБ, более распространена среди женщин старшего репродуктивного возраста и в постменопаузе [37]. Однако корреляция фаз менструального цикла и хронической тазовой боли остается спорной, отчасти в связи с разными вариантами ее определения. Некоторые дают определение «непериодические боли продолжительностью не менее шести месяцев, локализованные в области таза, передней брюшной стенки, на уровне или ниже пупка, поясницы и ягодиц» [38, 39], в другом варианте это «непрерывная или интермиттирующая боль в нижней части живота продолжительностью по крайней мере 6 месяцев и не связанная только с менструальным периодом или половым актом» [40, 41].
Необходимо отметить, что существует заметное сходство заболеваний, которые могут привести к хронической тазовой боли (например, эндометриоз, интерстициальный цистит и СРК), это создает трудности в точном выявлении причинного фактора [42].
Синдром раздраженного кишечника
Существуют данные о большой распространенности синдрома раздраженного кишечника (СРК) среди женщин. Среди мужчин после 50 лет СРК распространен так же часто, как среди женщин. СРК — это распространенная негинекологическая причина хронической тазовой боли, которая может составлять до 60% всех обращений [43, 44].
СРК характеризуется изменениями в ритме дефекации и повышенной висцеральной чувствительностью [45]. У женщин с СРК отмечается более частый и жидкий стул, а также спастические боли в животе и вздутие живота при приближении менструации, что свидетельствует о возможной связи между симптомами СРК и менструальным циклом [46, 47].
В клинических исследованиях, изучающих разницу в симптомах расстройств ЖКТ у женщин с СРК, сообщается о большей боли в животе и вздутии живота во время менструации по сравнению со всеми другими фазами менструального цикла [46, 47].
В других исследованиях, сравнивающих разницу выраженности симптоматики между болезнью Крона, язвенным колитом и СРК во время всего менструального цикла, обнаружено, что пациенты испытывают более сильную боль в животе во время предменструальной фазы по сравнению с контролем [48, 49]. Также существуют исследования, где не найдено каких-либо различий в боли при СРК в течение всего менструального цикла.
Таким образом, как и в случае с другими исследованиями заболеваний, сопровождаемыми ХНБ, несмотря на противоречивые результаты, указывается роль гормонов яичников в модуляции абдоминальной симптоматики, которая в основном более выражена в перименструальный период, т.е. период сниженного уровня эстрогена. В некоторых исследованиях связи СРК и половых гормонов обсуждалась возможность защитного действия мужских половых гормонов. Показана обратно пропорциональная связь выраженности симптоматики СРК у мужчин с уровнем свободного тестостерона в сыворотке крови, что указывает на потенциальное защитное действие мужских половых гормонов [50].
Необходимо отметить, что состояния, сопровождаемые ХНБ, редко встречаются в виде отдельных состояний [51–54]. Возможно, более уместно думать о хронической боли как о совокупности состояний. Dao и коллеги [55] обнаружили, что 70% больных с фибромиалгией отмечали орофациальную боль. Исходя из этого, Klineberg и соавт. [56] предположили, что фибромиалгия (генерализованная) и орофациальная (локализованная) боль могут быть разновидностью одной проблемы.
Хроническая тазовая боль, как сообщалось, также может дополняться другими заболеваниями, сопровождаемыми ХНБ [42]. Во многих исследованиях отмечено, что такое дублирование заболеваний, сопровождаемых болью, затрудняет адекватное лечение хронических болевых состояний [57–59]. Для некоторых типов заболеваний, сопровождаемых ХНБ, возникновение одного вида боли может способствовать уменьшению болевых ощущений другого заболевания, что возможно благодаря нисходящему тормозному контролю боли [60].
Нечувствительные к уровню овариальных гормонов заболевания могут скрывать или занижать действительный уровень боли восприимчивых к овариальным гормонам заболеваний [61]. Таким образом, непринятие во внимание сопутствующих заболеваний является важным упущением.
ОЖИРЕНИЕ
Ожирение всегда усугубляет боль как у мужчин, так и у женщин, поскольку влияет и на секрецию поло вых гормонов, и на секрецию цитокинов, медиато ров воспаления, играющих важную роль в развитии боли и гипералгезии. В пожилом возрасте организм менее способен тормозить секрецию цитокинов и характеризуется наличием провоспалительного статуса. Имеются данные о наличии связи между снижением уровня тестостерона и наличием провоспалительного статуса у мужчин, так как андрогены подавляют экспрессию и освобождение цитокинов и хемокинов. Такая взаимосвязь подтверждена выводами исследований, что антиандрогенная терапия приводит к увеличению уровня провоспалительных факторов и уменьшению противовоспалительных цитокинов [62].
Различные концентрации половых гормонов у мужчин и женщин считают важными факторами, способствующими половым различиям в липопротеиновом профиле [63]. Эпидемиологические данные позволяют предположить, что уровни тестостерона обратно пропорциональны уровням общего холесте рина, ЛПНП и триглицеридов, так же как и то, что уровень тестостерона у мужчины имеет сложную и противоречивую связь с уровнем ЛПВП и уровнем риска сердечно-сосудистых заболеваний.
Есть данные, что высокий уровень андрогенов в группе здоровых взрослых мужчин имеет подавляющий эффект на ЛПВП [64]. С другой стороны, несколько исследований, проведенных на больных с патологией сонной артерии, показали корреляцию высоких уровней тестостерона с высокой концентраци ей ЛПВП. В частности, было установлено, что два гена, а именно печеночная липаза (HL) и скавенджеррецептор B1 (SRB1), вовлеченные в катаболизм ЛПВП, активируются тестостероном.
SRB1 является посредником селективного поглощения липидов ЛПВП в гепатоцитах и стероидогенных клетках, в том числе клетках Сертоли и Лейдига, так же как и оттока холестерина из периферических клеток. Тестостерон активирует SRB1 в гепатоцитах человека и макрофагах и, таким образом, стимулирует селективное поглощение и отток холестерина. Печеночная липаза гидролизует фосфолипиды на поверхности ЛПВП, способствуя избирательному поглощению липидов ЛПВП скавенджеррецептором B1.
Активность печеночной липазы увеличивается после введения экзогенного тестостерона. Увеличение активности SRB1 и HL соответствует эффекту тестостерона снижать уровень общего холестерина. Ожирение, особенно висцеральные излишки жира, связано с инсулинорезистентностью, гипергликемией, атерогенной дислипидемией и гипертензией, а также протромботическим и провоспалительным статусом.
Ожирение на фоне гиперинсулинемии сопровождается подавлением синтеза ГСПГ и вместе с ним — снижением уровня циркулирующего в крови общего тестостерона. Кроме того, инсулин и лептин имеют подавляющий эффект на тестикулярный стероидогенез. Клетки висцерального жира секретируют большое количество цитокинов, которые нарушают тестикулярный стероидогенез. Отсюда есть основания полагать, что ожирение является существенным фактором в снижении уровня циркулирующего тестостерона. Кроме того, в белой жировой ткани, найденной в больших количествах у тучных мужчин, отмечается повышенная активность ароматазы и выделение гормонов жировой ткани — адипоцитов.
Таким образом, ожирение является дополнительным немаловажным фактором, способствующим нарушению баланса половых гормонов в организме мужчины, и способствует увеличению частоты возникновения различных болевых синдромов на фоне усиления провоспалительного статуса.
Андрогенная терапия, в том числе терапия тестостероном, должна приводить к уменьшению уровня провоспалительных факторов и увеличению противовоспалительных цитокинов [62], что следует учитывать в клинической практике при лечении боли. Также необходимы дальнейшие исследования влияния ожирения на уровень провоспалительных факторов у женщин.
ВЫВОДЫ
Множество исследований демонстрируют влияние гормонального фона на восприятие боли у мужчин и женщин. При этом неоднократно отмечено более выраженное восприятие боли именно среди женщин. Распространенность заболеваний, сопровождаемых ХНБ, также выше в женской популяции. Клинической моделью влияния уровня половых гормонов в крови на уровень боли у женщин является менструальный цикл. Большинство хронических болевых синдромов (скелетномышечная боль, мигрень, боль при дисфункции височнонижнечелюстного сустава и хроническая тазовая боль) имеют сходную модель боли: чувствительность к боли меняется в течение всего менструального цикла, с наиболее низкими порогами и наибольшей чувствительностью при низких уровнях эстрогена.
Важно отметить, что не только абсолютные уровни гормонов яичников, но и колебания этих уровней, а также тестостерона влияют на выраженность болевых синдромов. ЗГТ, в том числе терапия отдельными или комбинированными препара тами эстрогена и прогестагена, может эффективно использоваться в терапии хронических болевых синдромов у женщин. Но в то же время клинической моделью влияния уровня половых гормонов в крови на уровень боли у мужчин является мужской гипогонадизм, т.е. состояние андрогенодефицита.
Имеются данные о наличии связи между снижением уровня тестостерона и наличием провоспалительного статуса у мужчин, так как андрогены подавляют экспрессию и высвобождение цитокинов и хемокинов. Таким образом, нарушение баланса половых гормонов в организме мужчины способствует возникновению проноцицептивных эффектов. Есть основания полагать, что ожирение является существенным фактором в снижении уровня циркулирующего тестостерона, т.е. является вероятным фактором возникновения хронического болевого синдрома.
Андрогенная терапия, в том числе терапия тестостероном, должна приводить к уменьшению уровня провоспалительных факторов и увеличению антиноцицептивной активности, что следует учитывать в клинической практике при лечении боли. Таким образом, абсолютно необходимо проведение гормонального обследования, включающего определение тестостерона, прогестерона и эстрадиола (мультистероидного анализа методом массспектрометрии). Коррекция уровня половых гормонов может быть эффективна в комплексном лечении хронических болевых синдромов. Несмотря на наличие ряда литературных источников, указывающих на антиноцицептивные эффекты половых гормонов, это требует дальнейшего изучения.
Список литературы.
medprosvita.com.ua
Влияние половых гормонов на различия в восприятии боли | Данилов А.Б., Ильясов Р.Р.
В статье обсуждаются вопросы влияния половых гормонов на различия в восприятии боли
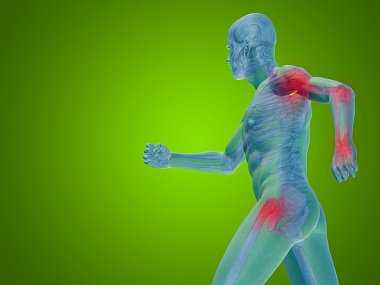 Для цитирования. Данилов А.Б., Ильясов Р.Р. Влияние половых гормонов на различия в восприятии боли // РМЖ. Болевой синдром. 2015. С. 3–6.
Для цитирования. Данилов А.Б., Ильясов Р.Р. Влияние половых гормонов на различия в восприятии боли // РМЖ. Болевой синдром. 2015. С. 3–6.Введение
На данный момент все чаще изучаются половые различия в восприятии боли. Получены данные, безусловно, позволяющие утверждать способность половых гормонов менять степень восприятия боли у мужчин и женщин, однако в клинической практике это практически не применяется. Известно, что половые гормоны могут воздействовать на обработку ноцицептивного сигнала на многих уровнях нервной системы человека: как на центральном, так и на периферическом. Абсолютная концентрация половых гормонов, а также колебание их уровня в крови обусловливают возможность возникновения противоположных эффектов: проноцицептивных или антиноцицептивных. Несомненным фактом является возникновение проноцицептивных эффектов в результате дефицита секреции половых гормонов (в женском или мужском организме), т. к. неоднократно отмечено, что низкий уровень половых гормонов соответствуют более высокому уровню боли. Данные закономерности все еще остаются сложными для описания, т. к. боль является динамическим феноменом, зависящим от влияния различных возбуждающих и ингибиторных механизмов контроля. Интересна для изучения возможность половых гормонов (тестостерона и прогестерона) помимо основных эффектов обеспечивать антиноцицептивный эффект. Для полноценного понимания роли половых гормонов в восприятии боли необходима оценка 3 важных составляющих – уровней тестостерона, прогестерона и эстрогенов.
Уровень половых гормонов и боль
Имеется большой объем доказательств, демонстрирующих различные восприятие боли и ответ на некоторые классы анальгетиков у мужчин и женщин [1]. Лабораторные и клинические эксперименты показывают, что у женщин по сравнению с мужчинами более низкий болевой порог в ответ на одинаковые виды раздражителей, такие как тепло, холод, давление и электрическая стимуляция. Показано, что девочки и женщины в первые дни послеоперационного периода чаще жалуются на боль, чем мальчики и мужчины. Новорожденные девочки проявляют более выраженную мимическую реакцию в ответ на болевое раздражение, чем мальчики. Отмечено, что женщины испытывают более интенсивные болевые ощущения при проведении стоматологических процедур, чем мужчины. В эксперименте выявлено, что при предъявлении одинаковых по интенсивности болевых раздражителей у женщин объективный показатель боли (расширение зрачка) более выражен. Опытным путем показано, что после 16 эпизодов воздействия болевого агента на пальцы рук у 50 добровольцев обоих полов женщины в сравнении с мужчинами отмечали более высокую интенсивность боли как непосредственно в момент воздействия, так и после его окончания. Особого внимания заслуживает исследование болевой формы стенокардии, которое демонстрирует, что выраженность сопутствующего болевого синдрома оказалась более выраженной у мужчин среднего и пожилого возраста на фоне снижения уровня тестостерона в крови. В современной научной литературе обсуждается наличие антиноцицептивных эффектов у тестостерона, что следует учитывать в клинической практике при лечении боли.
Относительно влияния уровня эстрогенов на восприятие боли имеются сообщения как о возможном увеличении, так и об уменьшении болевой чувствительности, что может быть из-за активации разных эстрогеновых рецепторов. Некоторые болевые состояния у женщин усиливаются после менопаузы, когда уровень эстрогена снижается (например, суставные и вагинальные боли), что также предполагает антиноцицептивный эффект достаточных уровней эстрогена.
Следует отметить высокую распространенность хронических нераковых болей (ХНБ). ХНБ – это совокупность клинических состояний, характеризующихся болью, которая сохраняется, несмотря на устранение каких-либо стимулов и видимое заживление тканей, или болью, которая возникает при отсутствии каких-либо обнаруживаемых повреждений, болью, не связанной с раком. Многие заболевания, сопровождаемые ХНБ, чаще возникают у женщин [2]. Проведенные исследования позволяют утверждать, что половые различия при ХНБ могут быть связаны с колебанием уровня гормонов яичников в течение всего менструального цикла (МЦ) у женщин [3]. Состояния, сопровождаемые ХНБ, включают в себя: скелетно-мышечную боль (СМБ) (например, при фибромиалгии, ревматоидном артрите (РА)), мигренозную головную боль, боль при дисфункции височно-нижнечелюстного сустава (ДВНЧС) и хроническую тазовую боль (ХТБ) (например, при синдроме раздраженного кишечника (СРК), эндометриозе и интерстициальном цистите).
Скелетно-мышечная боль
Фибромиалгия
Фибромиалгия – это одно из многих заболеваний, сопровождаемых ХНБ, которое, как правило, преимущественно возникает у женщин и чаще в период репродуктивного возраста. Характеризуется локальной болезненностью и скованностью в мышцах, которые распространяются по всему телу, а также повышенной мышечной утомляемостью, которая часто усиливается на фоне проведения упражнений. Мышечные боли в данном случае изменчивы по интенсивности и связаны с генерализованными проявлениями повышенной чувствительности к боли. Фибромиалгия обычно сопровождается другими болевыми синдромами, например, ДВНЧС, хронической болью в шее и спине, головными болями при мигрени [4]. Исследования показывают, что женщины, страдающие фибромиалгией в менопаузе (когда уровень тестостерона снижается), имеют больше показателей боли, чем в пременопаузе. У женщин с регулярным МЦ боль, связанная с фибромиалгией, чаще отмечается в предменструальном периоде (период сниженного уровня прогестерона), чем в постменструальном и нередко сопровождается масталгией. Это отличает их от женщин, использующих оральные контрацептивы (ОК) или перенесших аборт, не имеющих различия в тяжести боли.
Ревматоидный артрит
РА – это хроническое системное аутоиммунное заболевание, которое приводит к выраженному воспалению суставов и боли. Распространенность РА составляет у взрослых 0,5–1%, женщины страдают от этого расстройства в 2–4 раза чаще, чем мужчины. При РА, как правило, поражаются суставы пальцев, запястья, и в конечном итоге в них происходят необратимые изменения. Считают, что боль при РА возникает в результате увеличения давления на суставы, приводит к выраженным отекам в области суставов. Однако существуют данные о роли гормонов яичников в патогенезе и степени выраженности боли при РА. Исследования показывают, что выраженность боли при РА меняется в зависимости от фазы МЦ, хотя нет консенсуса относительно того, какая фаза МЦ связана с большим количеством болевых симптомов. У женщин пик заболеваемости РА приходится на 4-е десятилетие, что предполагает снижение уровня женских половых гормонов, которое способствует его развитию: снижение уровня эстрогенов приводит к уменьшению выработки синовиальной жидкости в суставах. У мужчин РА отмечается чаще на фоне дефицита веса, что соответствует дефициту тестостерона. Последние исследования подтверждают, что гормональные изменения предшествуют началу РА и влияют на фенотип болезни. Опубликованы данные, свидетельствующие, что снижение уровня тестостерона является предиктором серонегативного РА [5].
Хроническая боль в спине и конечностях
Изучение изменения выраженности СМБ в различных областях (например, в шее, плече, спине, суставах) в зависимости от гормонального статуса установило, что интенсивность боли у женщин больше в менструальную фазу, чем в середине МЦ и овуляторную фазу, что предполагает большую болевую чувствительность при низких уровнях эстрогенов. Согласно большинству исследований СМБ, можно сделать вывод, что выраженность боли у женщин варьирует в течение всего МЦ и усиливается на фоне снижения уровня эстрогена, а также прогестерона и тестостерона в крови [6].
Мужчины также часто предъявляют жалобы на диффузную СМБ. Существуют данные, демонстрирующие низкий уровень тестостерона у таких пациентов. Однако на данный момент нет публикаций о проспективных исследованиях, оценивающих более четко потенциальную связь у мужчин диффузной СМБ и концентрации тестостерона, а также описывающих потенциально эффективную терапию тестостероном у таких пациентов.
Мигрень
Диагноз мигренозной головной боли актуален в течение всего репродуктивного периода у женщины. Возникновение болевого приступа наиболее вероятно на фоне колебания уровня гормонов яичников [7]. Известно, что некоторые мигренозные головные боли синхронны с различными фазами МЦ. Выделяют несколько вариантов мигрени, в т. ч. в зависимости от времени появления приступов головной боли (в перименструальный период или в другие фазы МЦ). При их изучении показано, что приступы мигрени более распространены за 2 дня перед менструацией и в 2 дня после нее, и что приступы, связанные с менструацией, протекают тяжелее, чем возникающие в другие фазы цикла. Это так называемая менструальная мигрень, которая связана со значительно большим периодом нетрудоспособности и менее чувствительна к негормональной терапии (β-блокаторами, антагонистами кальция, антидепрессантами, противоэпилептическими препаратами и т. д.) по сравнению с приступами, возникающими вне периода менструации [7].
Исследования различных типов мигрени поддерживают идею о том, что гормоны яичников опосредованно регулируют характеристики мигренозной головной боли, особенно в случае мигрени без ауры, которая более распространена среди женщин с нормальным циклом, и что симптомы, как правило, меняются с изменением уровня эстрогенов. Утверждение, что головные боли связаны с колебанием уровня гормонов, а не с их абсолютными уровнями, подтверждается исследованиями, в которых принимают участие беременные женщины или принимающие ОК, т. е. женщины с постоянным уровнем эстрогена в крови. Если уровни эстрогена не меняются, то частота и интенсивность головных болей незначительна, что представляет убедительные доказательства того, что гормоны яичников, их уровни и колебания этих уровней влияют на возникновение приступов мигрени.
Дисфункция
височно-нижнечелюстного сустава
Синдром ДВНЧС включает группу симптомов, главный из которых – боль в мышцах челюсти и/или височном суставе при пальпации и во время функционирования (например, жевания, открывания рта, разговора). Многие пациенты с ДВНЧС также страдают болями в мышцах шеи и головной болью (особенно хронической головной болью напряжения). Многие эпидемиологические исследования выявили, что распространенность ДВНЧС выше среди женщин и наиболее высока у пациенток репродуктивного возраста [8]. Пик заболеваемости приходится на 3–4-е десятилетия жизни, а затем снижается до уровня, сравнимого с таковым у мужчин. Это показывает, что увеличение распространенности данного расстройства у женщин может быть связано с уровнем женских половых гормонов. В частности, считается, что нарушения МЦ, связанные с колебаниями уровней половых гормонов (как эстрогенов, так и прогестерона), которые начинаются в период полового созревания, соответствуют увеличению интенсивности боли в мышцах челюсти у женщин с ДВНЧС.
Изучение связи ДВНЧС и гормонов яичников у женщин с регулярным циклом показало изменение выраженности показателей боли в течение всего дня, максимальный уровень боли отмечался во время месячных. Данные исследований, в которых проводилось сравнение с женщинами, принимающими ОК, были противоречивыми, что, вероятно, связано с разными комбинациями эстрогенов и гестагенов в ОК. В одном исследовании отмечена большая вариабельность тяжести боли у женщин с естественным циклом в сравнении с принимающими ОК, что может быть связано с минимизацией эффектов гормональных колебаний на пороге боли. Другое исследование показало более частое возникновение боли во время менструации как у женщин с регулярным циклом, так и у принимающих ОК, что может быть обусловлено эффектами низких уровней эстрогенов. В исследовании, в котором измеряли порог боли от давления (ПБД) для определения изменений экспериментально индуцированной болевой чувствительности, ПБД был наиболее высоким во время фолликулярной и лютеиновой фаз и наиболее низким – в перименструальный период [8], что позволяет сделать следующий вывод: боль является наибольшей, когда уровни эстрогена наиболее низкие. Исследование оценки влияния заместительной гормональной терапии (ЗГТ) в климактерическом периоде у женщин на боль при ДВНЧС показало, что получавшие ЗГТ испытывали более выраженную боль при ДВНЧС, чем не получавшие ЗГТ. Таким образом, можно утверждать, что существуют различия между эндогенными и экзогенными гормональными воздействиями на состояния, сопровождаемые ХНБ [8]. Взятые вместе, эти исследования демонстрируют следующую модель боли при ДВНЧС, сходную с другими состояниями, сопровождаемыми ХНБ: чувствительность к боли меняется в течение всего МЦ, с наиболее низкими порогами и наибольшей чувствительностью при низких уровнях эстрогена.
Хроническая тазовая боль
ХТБ, как и другие заболевания, сопровождаемые ХНБ, более распространена среди женщин старшего репродуктивного возраста и в постменопаузе [9]. Однако корреляция фаз МЦ и ХТБ остается спорной, отчасти в связи с разными вариантами ее определения. Согласно одному определению, это «непериодические боли продолжительностью не менее 6 мес., локализованные в области таза, передней брюшной стенки, на уровне или ниже пупка, поясницы и ягодиц» [9], согласно другому, это «непрерывная или интермиттирующая боль в нижней части живота, продолжительностью по крайней мере 6 мес. и не связанная только с менструальным периодом или половым актом». Необходимо отметить, что существует заметное сходство заболеваний, которые могут привести к ХТБ (например, эндометриоз, интерстициальный цистит, СРК), это создает трудности в точном выявлении причинного фактора.
Синдром раздраженного кишечника
Существуют данные о большой распространенности СРК среди женщин. Среди мужчин после 50 лет СРК распространен так же часто, как среди женщин. СРК – это часто встречающаяся негинекологическая причина ХТБ (до 60% всех обращений) [9]. СРК характеризуется изменениями в ритме дефекации и повышенной висцеральной чувствительностью [9]. У женщин с СРК отмечаются более частый и жидкий стул, а также спастические боли в животе и вздутие живота при приближении менструации, что свидетельствует о возможной связи между симптомами СРК и МЦ [9]. В клинических исследованиях, изучавших разницу в симптомах расстройств ЖКТ у женщин с СРК, сообщается о большей боли в животе и вздутии живота во время менструации, чем в другие фазы МЦ. В других исследованиях, сравнивавших разницу выраженности симптоматики при болезни Крона, язвенном колите и СРК во время МЦ, обнаружено, что у пациентов наблюдалась более интенсивная боль в животе во время предменструальной фазы по сравнению с контролем. Также существуют исследования, в которые не отмечаются какие-либо различия в уровне боли при СРК в течение всего МЦ.
Таким образом, как и в случае с другими исследованиями заболеваний, сопровождаемых ХНБ, несмотря на противоречивые результаты, указывается на роль гормонов яичников в модуляции абдоминальной симптоматики при СРК, которая в основном более выражена в перименструальный период, т. е. в период сниженного уровня эстрогена.
В некоторых исследованиях, изучавших связь СРК и половых гормонов, обсуждалась возможность защитного действия мужских половых гормонов. Показана обратно пропорциональная связь выраженности симптоматики СРК у мужчин с уровнем свободного тестостерона в сыворотке крови, что указывает на потенциальное защитное действие мужских половых гормонов.
Необходимо отметить, что состояния, сопровождаемые ХНБ, редко встречаются отдельно. Возможно, более уместно говорить о хронической боли как о совокупности состояний. У 70% больных с фибромиалгией возможна сопутствующая орофациальная боль. Исходя из этого, предполагается, что фибромиалгия (генерализованная) и орофациальная (локализованная) боль могут быть разновидностью одной проблемы. ХТБ, как сообщалось, также может дополняться другими заболеваниями, сопровождаемыми ХНБ. Во многих исследованиях отмечено, что такое дублирование заболеваний, сопровождаемых болью, затрудняет адекватное лечение хронических болевых состояний. У пациентов с некоторыми типами заболеваний, сопровождаемых ХНБ, возникновение одного вида боли может способствовать уменьшению болевых ощущений, связанных с другим заболеванием, что возможно благодаря исходящему тормозному контролю боли. При не чувствительных к уровню овариальных гормонов заболеваниях действительный уровень боли (при восприимчивых к овариальным гормонам заболеваниях) может либо не определяться, либо занижаться. Таким образом, в клинической практике при лечении боли следует принимать во внимание сопутствующие заболевания.
Ожирение
Ожирение усугубляет боль как у мужчин, так и у женщин, поскольку влияет на секрецию и половых гормонов, и цитокинов, медиаторов воспаления, играющих важную роль в развитии боли и гипералгезии. В пожилом возрасте организм менее способен тормозить секрецию цитокинов, отмечается наличие провоспалительного статуса. Имеются данные о наличии связи между снижением уровня тестостерона и усилением провоспалительного статуса у мужчин, т. к. андрогены подавляют экспрессию и освобождение цитокинов и хемокинов [10].
Различные концентрации половых гормонов у мужчин и женщин считают важными факторами, способствующими половым различиям в липопротеиновом профиле [10]. Эпидемиологические данные позволяют предположить, что уровни тестостерона обратно пропорциональны уровням общего холестерина, липопротеинов низкой плотности и триглицеридов, так же как и то, что уровень тестостерона у мужчины имеет сложную и противоречивую связь с уровнем липопротеинов высокой плотности и уровнем риска сердечно-сосудистых заболеваний [10]. Ожирение, особенно висцеральные излишки жира, связано с инсулинорезистентностью, гипергликемией, атерогенной дислипидемией и гипертензией, а также протромботическим и провоспалительным статусом. Клетки висцерального жира секретируют большое количество цитокинов, которые нарушают тестикулярный стероидогенез. Есть основания полагать, что ожирение является существенным фактором снижения уровня циркулирующего тестостерона. Кроме того, в белой жировой ткани, найденной в больших количествах у тучных мужчин, отмечаются повышенная активность ароматазы и выделение гормонов жировой ткани – адипокинов. Таким образом, ожирение является дополнительным немаловажным фактором, способствующим нарушению баланса половых гормонов в организме мужчины, и приводит к увеличению частоты возникновения различных болевых синдромов на фоне усиления провоспалительного статуса. Андрогенная терапия, в т. ч. терапия тестостероном, должна приводить к снижению уровня провоспалительных факторов и повышению уровня противовоспалительных цитокинов [10], что следует учитывать в клинической практике при лечении боли. Также необходимы дальнейшие исследования влияния ожирения на уровень провоспалительных факторов у женщин.
Выводы
Большинство исследований описывают взаимосвязь между уровнем половых гормонов в крови и восприятием боли у мужчин и женщин. Отмечено более выраженное восприятие боли у женщин. Частота развития патологий, сопровождаемых ХНБ, также выше в женской популяции. Клинической моделью влияния уровня половых гормонов в крови на уровень боли у женщин является МЦ. Подавляющее большинство хронических болевых синдромов (мигрень, боль при ДВНЧС, СМБ и ХТБ) имеют одинаковую модель боли: чувствительность к боли меняется в течение всего МЦ, с наиболее низкими порогами и наибольшей чувствительностью при низких уровнях эстрогена. Необходимо помнить, что не только абсолютные уровни гормонов яичников, но и их колебания, а также уровень тестостерона в крови у женщин влияют на выраженность болевых синдромов. ЗГТ, в т. ч. терапия отдельными или комбинированными препаратами эстрогена и прогестагена, может эффективно использоваться в терапии хронических болевых синдромов у женщин.
Клинической моделью влияния уровня половых гормонов в крови на выраженность боли у мужчин является состояние андрогенодефицита. На данный момент известно о наличии влияния сниженного уровня тестостерона на уровень провоспалительного статуса у мужчин, т. к. андрогены подавляют экспрессию и высвобождение цитокинов и хемокинов. Можно сделать вывод, что нарушение баланса половых гормонов в организме мужчины способствует возникновению проноцицептивных эффектов. Имеются данные о том, что ожирение является важным фактором снижения уровня циркулирующего тестостерона и, таким образом, способствует возникновению хронического болевого синдрома. ЗГТ андрогенами, в т. ч. терапия тестостероном, очевидно, приводит к снижению уровня провоспалительных факторов и увеличению антиноцицептивной активности, что следует принимать во внимание при лечении болевого синдрома у мужчин.
Следовательно, в клинической практике врача-невролога важно уделять больше внимания выявлению гипогонадизма среди пациентов женского и мужского пола, для чего необходимо проведение гормонального обследования, включающего определение уровней тестостерона, прогестерона и эстрадиола (мультистероидный анализ методом масс-спектрометрии). Несомненно, использование результатов данного обследования способствует ранней коррекции уровня половых гормонов, что повышает эффективность терапии болевого синдрома, сокращает длительность проводимой терапии и снижает вероятность хронизации боли как у мужчин, так и у женщин.
www.rmj.ru
Гормоны и боль
Авторы: И.Ю. Романенко

В последние годы исследователи уделяют немало внимания вопросу половых различий в восприятии боли. На сегодняшний день имеются данные, позволяющие утверждать о способности половых гормонов изменять степень восприятия боли у мужчин и женщин. Например, известно, что половые гормоны могут воздействовать на обработку ноцицептивного сигнала как на центральном, так и на периферическом уровнях нервной системы человека. С колебанием уровня гормонов яичников в течение менструального цикла связывают более высокую распространенность хронических болевых синдромов (фибромиалгия, мигренозная боль, хроническая тазовая боль и др.) у женщин. Кроме того, в процессе генерации боли в ее передаче и модуляции принимают участие ряд других гормонов, включая адренокортикотропный гормон (АКТГ), гормоны щитовидной железы (ЩЖ), мелатонин, кальцитонин, соматомедин, вазопрессин. Они могут быть использованы в качестве терапевтических агентов в борьбе с болью. О влиянии гормонов на восприятие боли рассказала в рамках научно-практической конференции «Школа по изучению боли» кандидат медицинских наук Ирина Юрьевна Романенко.
– Cогласно определению Международной ассоциации по изучению боли (IASP) боль – это неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением или описываемое в терминах такого повреждения. Восприятие и передачу болевого сигнала осуществляет ноцицептивная система. В нормальных условиях ей противодействует антиноцицептивная система, ограничивающая поток болевой импульсации и снижающая восприятие боли.
Традиционно считается, что именно сила воздействия стимула ассоциируется со степенью восприятия боли, однако это не совсем так. Данные литературы указывают на существование значимых индивидуальных различий в восприятии и терпимости боли.
В настоящее время известно, что восприимчивость и терпимость к боли определяются полом, гормональными факторами, расовой/этнической принадлежностью, наследственностью, влиянием факторов окружающей среды.
Например, известно, что у афро- и латиноамериканцев чаще, чем у людей с белой кожей, встречаются состояния и заболевания, сопровождающиеся длительным болевым синдромом. Кроме того, для них характерна более высокая восприимчивость к боли (J.C. Ballantyne, 2009).
Гендерспецифические особенности боли
В ходе исследований R.B. Fillingim (2003) были идентифицированы ранее неизвестные полозависимые генетические ассоциации, такие как ген рецептора меланокортина-1 (МС1R), который обусловливает развитие аналгетического ответа в ответ на введение агониста каппа-опиоидных рецепторов только у мышей-самок в отличие от самцов.
Несмотря на то что опиоидные рецепторы локализованы в одной и той же области головного мозга как у мужчин, так и у женщин, именно для лиц мужского пола характерна более высокая степень устойчивости к боли.
Морфин по-разному действует на головной и спинной мозг у мужчин и женщин. Эксперименты на животных показали, что для облегчения боли самкам по сравнению с самцами требуется в два раза большая доза морфина (при одинаковом воздействии болевого агента).
Центр восприятия боли у лиц женского пола характеризуется более высокой активностью. В связи с этим интенсивность боли как в момент воздействия болевого раздражителя, так и по окончании его воздействия у женщин выше, чем у мужчин. Интересно, что во время подготовки к воздействию болевого агента в эксперименте у женщин в большей степени активировались области мозга, отвечающие за подготовку и планирование действий, направленных на избежание боли. У мужчин, в свою очередь, преобладал страх (D.V. Esseri et al., 2007).
При воздействии болевого агента у мужчин в большей степени активируется правая часть миндалевидного тела, которая соотносится с участками мозга, с внешней средой, у женщин – преимущественно левая часть миндалевидного тела, связанная с областями мозга, ассоциированными с регуляцией внутренних функций.
На восприимчивость женщин к боли влияют гормональные колебания в течение менструального цикла, а также психологические факторы, обусловленные воздействием генетических, социальных и гормональных особенностей.
Генерация боли, ее передача и модуляция непосредственно связаны с эндокринной системой, включая продукцию проопиомеланокортина, адренокортикотропного гормона, эндорфинов, гормонов ЩЖ, пролактина, мелатонина и др. Гормоны могут быть использованы в качестве важных биомаркеров хронических болевых синдромов, планируется их использование в качестве терапевтической составляющей болевых синдромов.
Гормоны ЩЖ регулируют восприятие боли путем модулирования функции гамма-аминомасляной кислоты (ГАМК), которая играет важную роль в ноцицептивной обработке сигналов в центральной нервной системе (ЦНС). На сегодняшний день доказана связь между дисфункцией ЩЖ и хронической болью (головная боль, артралгия, фибромиалгия, миопатия). Любой болевой синдром при гипофункции ЩЖ будет иметь более выраженную окраску. У многих пациентов с гипотиреозом встречается сочетание нескольких болевых синдромов.
Половые гормоны (эстрогены, тестостерон, прогестерон)
Хорошо известно, что у женщин с регулярным менструальным циклом интенсивность боли выше в перименструальную фазу (с наиболее низкими порогами и наибольшей чувствительностью) по сравнению со срединой менструального цикла и овуляторной фазой. Это связано со снижением уровня эстрогенов накануне и во время менструации. Нарушение баланса половых гормонов способствует возникновению проноцицептивных эффектов.
Эстроген- и андрогенрецепторы были обнаружены в периферической и ЦНС. В связи с этим стероидные гормоны способны модулировать процессы нейротрансмиссии на различных уровнях нервной организации. Они обеспечивают аналгезирующее действие прежде всего за счет модуляции серотонинергической и опиоидергической активности нейронов в ЦНС. Прогестерон модулирует ГАМК-ергические системы, оказывая антиноцицептивное и нейропротекторное действие. Было показано, что андрогенная терапия приводит к уменьшению уровня провоспалительных факторов и увеличению антиноцицептивной активности. Некоторые исследователи предлагают использовать тестостерон в качестве адъювантной терапии хронических болевых синдромов, а также в комбинации с опиоидной аналгезией, что позволяет снижать суммарные дозы опиатов.
Повышение уровней эстрогенов и прогестерона во время беременности регулирует естественную способность подавлять боль. Именно с этими гормонами связана индуцированная беременностью аналгезия. Показано, что хронические болевые синдромы, имевшие место до беременности, во время беременности самостоятельно проходят либо характеризуются более легким течением. В частности, индуцированная беременностью аналгезия оказывает благоприятное воздействие на течение мигрени, артрита.
Пролактин является гормоном, принимающим участие в реализации стрессовых реакций. Он имеет рецепторную представленность практически во всех органах и системах человеческого организма. На сегодняшний день участие пролактина в болевой перцепции продолжает изучаться, однако его четкой связи с серотонинергической и дофаминергической системами не обнаружено. В то же время имеются данные о том, что аномальные концентрации пролактина наблюдаются при кластерных головных болях, мигрени, аутоиммунных заболеваниях. Изучается влияние пролактина в комбинации с релаксином на развитие болезненных состояний во время беременности.
Окситоцин известен как «гормон любви» и связан с положительными эмоциями. Кроме того, он имеет выраженный антиноцицептивный эффект за счет модуляции серотонинергической, дофаминергической и опиоидергической активности нейронов в ЦНС. Во время родов окситоцин повышает болевой порог и помогает женщине легче переносить боль, а после них – полностью забыть о болевых ощущениях.
Хорионический гонадотропин человека оказывает выраженный антиноцицептивный эффект, обеспечивая как краткосрочное, так и долгосрочное уменьшение боли. Согласно данным некоторых клиницистов для купирования боли во время беременности требуются меньшие дозы опиоидов. Этот эффект связывают прежде всего с хорионическим гонадотропином. Показано, что после однократной инъекции хорионического гонадотропина человека многие пациенты сообщают об облегчении боли в течение нескольких часов, а системное его применение в качестве противоболевого агента способно обеспечить снижение выраженности боли в продолжение нескольких недель. Хорионический гонадотропин практически полностью лишен побочных эффектов и является достойным терапевтическим предложением для купирования боли. Этот гормон вместе с тестостероном даже представлен в некоторых рекомендациях в качестве адъювантного средства для лечения хронических болевых синдромов, особенно у онкологических пациентов.
Мелатонин широко представлен в ЦНС и различных тканях. Данный гормон оказывает мощный и продолжительный антиноцицептивный эффект, снижает центральную сенситизацию к боли. Его обезболивающее действие связано с опиоидной (стимулирует высвобождение β-эндорфина), ГАМК-ергической системами и активацией кальциевых каналов. Мелатонин имеет высокий профиль безопасности. В настоящее время изучается возможность его применения в качестве аналгетика наряду с нестероидными противовоспалительными препаратами и опиоидами.
Кальцитонин оказывает свое первичное аналгезирующее действие за счет модуляции серотонинергической активности нейронов в ЦНС, увеличивает высвобождение β-эндорфина. Кроме того, он ингибирует синтез некоторых болевых факторов (простагландины и цитокины), что обеспечивает периферический механизм обезболивающего действия. Ранее кальцитонин широко применяли в качестве аналгетика при остеопорозе, фантомных болях в конечностях, диабетической нейропатии, мигрени, комплексном регионарном болевом синдроме, однако сейчас его используют более осторожно. Рассматривается возможность совместного использования мелатонина с нестероидными противовоспалительными препаратами и опиоидами.
Инсулин и инсулиноподобный фактор роста необходимы для обеспечения жизненно важных нейрональных функций. Было показано, что острая боль, боль при мигрени, периферической диабетической нейропатии, патологии опорно-двигательного аппарата способствуют развитию инсулинорезистентности. Поддержание нормального метаболизма глюкозы может обеспечить облегчение острой боли и уменьшить вероятность ее хронизации.
Соматотропин. Имеются данные об использовании этого гормона в качестве адъювантной терапии у пациентов с миалгией с пролонгированным действием.
Концентрация многих гормонов существенно изменяется при наличии интенсивной и длительной болевой стимуляции. Поэтому сывороточные уровни гипофизарных, надпочечниковых и половых гормонов (кортизол, АКТГ, дегидроэпиандростерон, прогестерон, тестостерон, эстрогены, гормоны ЩЖ) считаются наиболее объективными биомаркерами контроля боли.
Большинство хронических болевых синдромов (скелетно-мышечная боль, мигрень, боль при дисфункции височно-нижнечелюстного сустава и хроническая тазовая боль) имеют сходную модель гормональных нарушений (дисфункция гипоталамо-гипофизарно-надпочечниковой оси (C.C. Palmeira, 2011). Дисфункция дофаминергической нейротрансмиссии может способствовать проявлению клинической симптоматики фибромиалгии, которая в большей степени характерна для женщин.
Одним из факторов, усугубляющих боль и способствующих хронизации болевого синдрома, является ожирение. Связь между болью и ожирением реализуется за счет влияния последнего на секрецию половых гормонов. Хорошо известно, что ожирение приводит к существенному снижению уровня циркулирующего тестостерона, способствует повышенному образованию цитокинов и медиаторов воспаления, играющих важную роль в развитии гипералгезии.
В клинической практике важно уделять больше внимания выявлению гипогонадизма среди пациентов обоих полов, включая лабораторное определение уровней тестостерона, прогестерона и эстрадиола. Доказано, что ранняя коррекция уровня половых гормонов повышает эффективность терапии болевого синдрома и сокращает длительность лечения (J.K. Anderson et al., 2010).
Таким образом, дифференцированный подход к пациенту с учетом пола, гормональных факторов, наследственности, влияния окружающей среды несомненно позволит достичь более адекватного контроля над болью.
Подготовил Вячеслав Килимчук
СТАТТІ ЗА ТЕМОЮ Ендокринологія
health-ua.com
Гормоны — Medside.ru
Читайте нас и будьте здоровы! Пользовательское соглашение о портале обратная связь- Врачи
- Болезни
- Кишечные инфекции (5)
- Инфекционные и паразитарные болезни (27)
- Инфекции, передающиеся половым путем (6)
- Вирусные инфекции ЦНС (3)
- Вирусные поражения кожи (12)
- Микозы (10)
- Протозойные болезни (1)
- Гельминтозы (5)
- Злокачественные новообразования (9)
- Доброкачественные новообразования (7)
- Болезни крови и кроветворных органов (9)
- Болезни щитовидной железы (6)
- Болезни эндокринной системы (13)
- Недостаточности питания (1)
- Нарушения обмена веществ (1)
- Психические расстройства (31)
- Воспалительные болезни ЦНС (3)
- Болезни нервной системы (19)
- Двигательные нарушения (5)
- Болезни глаза (19)
- Болезни уха (4)
- Болезни системы кровообращения (10)
- Болезни сердца (11)
- Цереброваскулярные болезни (2)
- Болезни артерий, артериол и капилляров (9)
- Болезни вен, сосудов и лимф. узлов (8)
- Болезни органов дыхания (34)
- Болезни полости рта и челюстей (15)
- Болезни органов пищеварения (29)
- Болезни печени (2)
- Болезни желчного пузыря (8)
- Болезни кожи (32)
- Болезни костно-мышечной системы (49)
- Болезни мочеполовой системы (13)
- Болезни мужских половых органов (8)
- Болезни молочной железы (3)
- Болезни женских половых органов (27)
- Беременность и роды (5)
- Болезни плода и новорожденного (3)
- Симптомы
- Амнезия (потеря памяти)
- Анальный зуд
- Апатия
- Афазия
- Афония
- Ацетон в моче
- Бели (выделения из влагалища)
- Белый налет на языке
- Боль в глазах
- Боль в колене
- Боль в левом подреберье
- Боль в области копчика
- Боль при половом акте
- Вздутие живота
- Волдыри
- Воспаленные гланды
- Выделения из молочных желез
- Выделения с запахом рыбы
- Вялость
- Галлюцинации
- Гнойники на коже (Пустула)
- Головокружение
- Горечь во рту
- Депигментация кожи
- Дизартрия
- Диспепсия (Несварение)
- Дисплазия
- Дисфагия (Нарушение глотания)
- Дисфония
- Дисфория
- Жажда
- Жар
- Желтая кожа
- Желтые выделения у женщин
- …
- ПОЛНЫЙ СПИСОК СИМПТОМОВ>
- Лекарства
- Антибиотики (211)
- Антисептики (123)
- Биологически активные добавки (210)
- Витамины (192)
- Гинекологические (183)
- Гормональные (155)
- Дерматологические (258)
- Диабетические (46)
- Для глаз (124)
- Для крови (77)
- Для нервной системы (385)
- Для печени (69)
- Для повышения потенции (24)
- Для полости рта (68)
- Для похудения (40)
- Для суставов (161)
- Для ушей (15)
- Другие (306)
- Желудочно-кишечные (314)
- Кардиологические (149)
- Контрацептивы (48)
- Мочегонные (32)
- Обезболивающие (280)
- От аллергии (102)
- От кашля (137)
- От насморка (91)
- Повышение иммунитета (123)
- Противовирусные (113)
- Противогрибковые (126)
- Противомикробные (145)
- Противоопухолевые (65)
- Противопаразитарные (49)
- Противопростудные (90)
- Сердечно-сосудистые (351)
- Урологические (89)
- ДЕЙСТВУЮЩИЕ ВЕЩЕСТВА
- Справочник
- Аллергология (4)
- Анализы и диагностика (6)
- Беременность (25)
- Витамины (15)
- Вредные привычки (4)
- Геронтология (Старение) (4)
- Дерматология (3)
- Дети (15)
- Другие статьи (22)
- Женское здоровье (4)
- Инфекция (1)
- Контрацепция (11)
- Косметология (23)
- Народная медицина (17)
- Обзоры заболеваний (27)
- Обзоры лекарств (34)
- Ортопедия и травматология (4)
- Питание (103)
- Пластическая хирургия (8)
- Процедуры и операции (23)
- Психология (10)
medside.ru