Антикоагулянты: описание фармакологической группы
Описание
Антикоагулянты в основном тормозят появление нитей фибрина; они препятствуют тромбообразованию, способствуют прекращению роста уже возникших тромбов, усиливают воздействие на тромбы эндогенных фибринолитических ферментов.
Выделяют 2 группы антикоагулянтов: а) прямые — быстрого действия, эффективные in vitro и in vivo; б) непрямые (антагонисты витамина К) — длительного действия (в т.ч. варфарин, фениндион, аценокумарол), действуют только in vivo и после латентного периода.
Антикоагулянты прямого действия, в свою очередь, делят на антикоагулянты для парентерального введения (в т.ч. гепарин натрия, далтепарин натрия, надропарин кальция, эноксапарин натрия, фондапаринукс натрия) и пероральные (апиксабан, дабигатрана этексилат, ривароксабан).
Антикоагуляционный эффект гепарина связан с прямым действием на систему свертывания крови за счет образования комплексов со многими факторами гемокоагуляции и проявляется в торможении I, II и III фаз свертывания.
Антикоагулянты непрямого действия — производные оксикумарина, индандиона, конкурентно ингибируют редуктазу витамина К, чем тормозят активирование последнего в организме и прекращают синтез К-витаминзависимых плазменных факторов гемостаза — II, VII, IX, X.
- Прямой ингибитор тромбина
- Антикоагулянтное средство прямого действия
- Антикоагулянт прямого действия — селективный ингибитор фактора свертывания крови Ха (FXa)
- Антикоагулянт прямой
- Антикоагулянт прямого действия
- Прямые ингибиторы фактора Ха
- Антикоагулянтное средство прямого действия для местного применения + прочие препараты
- Антикоагулянтное средство прямого действия для местного применения
- Прямой ингибитор фактора Ха
- Тромбина ингибитор прямой
- Антикоагулянтное средство непрямого действия
- Антитромботическое средство
| Антикоагулянты Входит в группу: 01.12 — Антиангинальные средства Описания препаратов с недействующими рег.
Описания препаратов с недействующими рег. уд. или не поставляемые на рынок РФ
Другие подгруппы из группы КФУ: Антиангинальные средства | ||||
Страница не найдена |
Страница не найдена | 404. Страница не найдена
Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
21222324252627
28
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Мар
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Антикоагулянты непрямого действия // Фармакология
Преферанская Нина Германовна
Доцент кафедры фармакологии образовательного департамента Института фармации и трансляционной медицины Мультидисциплинарного центра клинических и медицинских исследований Международной школы «Медицина будущего» Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
И.М. Сеченова (Сеченовский университет), к.фарм.н.
К антикоагулянтам непрямого действия относятся синтетические вещества, производные 4–оксикумарина: Аценокумарол (Синкумар), Варфарин (Варфарекс) и производное индандиона Фениндион (Фенилин).
Данные препараты, в отличие от гепарина, не оказывают влияния на факторы свертывания непосредственно в крови и не воздействуют на сам кровяной сгусток. В лабораторных условиях при смешивании антикоагулянтов непрямого действия с кровью не происходит свертывания крови. Антикоагулянты непрямого действия оказывают влияние на свертывающую систему через ряд биохимических реакций, в результате которых развивается состояние, аналогичное гиповитаминозу К.
Препараты являются стереоструктурными аналогами жирорастворимого витамина К и поэтому их еще называют антагонистами витамина К. При пероральном применении препаратов снижается активность плазменных факторов свертывания крови, тромбин образуется медленнее, а значит медленнее формируется тромб. Они эффективны лишь при непосредственном их введении в организм, т.к. ингибируют в печени синтез белков плазмы крови, зависимых от витамина К – фактора II (протромбина), фактора VII (проконвертина), IX (фактора Кристмаса) и Х (фактора Стюарта).
Они эффективны лишь при непосредственном их введении в организм, т.к. ингибируют в печени синтез белков плазмы крови, зависимых от витамина К – фактора II (протромбина), фактора VII (проконвертина), IX (фактора Кристмаса) и Х (фактора Стюарта).
Все эти факторы прокоагулянтного пути содержат остатки γ–карбоксиглутаминовой кислоты и образуются в эндоплазматическом ретикулуме гепатоцитов. Витамин К необходим для образования функционально полноценных факторов, т.к. выполняет роль кофермента в реакции γ–глутамил–карбоксилирования нескольких остатков глутаминовой кислоты. Ко–ферментную активность проявляет восстановленная форма витамина К–дигидрохинон. В процессе реакции карбоксилирования витамин К–дигидрохинон окисляется с образованием неактивного витамин К–2,3 эпоксида. Антикоагулянты непрямого действия препятствуют восстановлению витамин К–2,3 эпоксида в активный витамин К–дигидрохинон. Остатки γ-карбоксиглутаминовой кислоты в активированных факторах (IIа, VIIа, IXа, Ха) обеспечивают их взаимодействие непосредственно с ионами кальция и с отрицательно заряженными фосфолипидами клеточных мембран.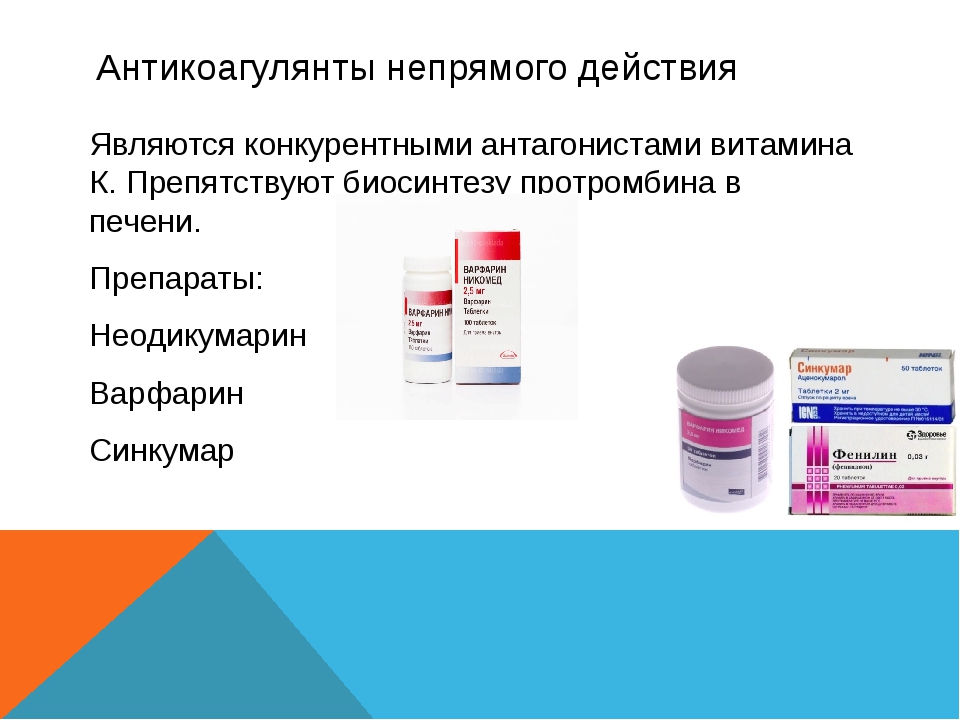
В отсутствие ионов Ca2+ кровь не свертывается. В печени непрямые антикоагулянты ингибируют тиолзависимые ферменты витамин К — НАД • Н–зависимые эпоксидредуктазуи хинонредуктазу, блокируют восстановительный этап, в результате чего образуются частично карбоксилированные функционально неактивные белки, которые попадают в кровь. Возникает торможение свертывания крови и предупреждается тромбообразование.
При применении антикоагулянтов непрямого действия в крови снижается концентрация факторов свертывания не сразу, а постепенно, одновременно понижается скорость коагуляции. Начало их действия характеризуется латентным периодом, поэтому быстрота возникновения эффекта, сила действия, степень кумуляции (накопления в организме) и продолжительность эффекта у данных препаратов варьирует. Начало действия Варфарина наступает через > 12 ч, пик эффекта — на 3–й день и продолжительность действия — от 36 до 120 ч.
У Аценокумарола антикоагулянтный эффект развивается через 24–48 ч после приема препарата, и этот эффект сохраняется 3 суток. Начало действие Фининдиона — через 8–10 ч, пик действия — 24–48 ч и продолжительность — 4 дня. Препараты обладают наиболее стабильным эффектом. Такое медленное развитие эффекта объясняется тем, что при введении они накапливаются в организме и в крови еще какое–то время циркулируют полноценные факторы свертывания.
Начало действие Фининдиона — через 8–10 ч, пик действия — 24–48 ч и продолжительность — 4 дня. Препараты обладают наиболее стабильным эффектом. Такое медленное развитие эффекта объясняется тем, что при введении они накапливаются в организме и в крови еще какое–то время циркулируют полноценные факторы свертывания.
ДОЗИРОВАНИЕ
Препараты антикоагулянтов непрямого действия обладают способностью к кумуляции как материальной, так и функциональной, что требует правильного дозирования и точного поддержания развившегося эффекта. Лечение проводят под обязательным контролем уровня протромбина в плазме крови. Методом контроля является определение протромбинового времени — показателя, величина которого зависит от содержания в крови протромбина и факторов IX и X. В период лечения необходимо осторожно достигать удлинения протромбинового времени в 2–3 раза и удерживать его в течение всего курса терапии. При применении антикоагулянтов непрямого действия от 1 до 6 лет снижается риск смертности от инфаркта миокарда и частоты развития повторного нефатального инфаркта на 20%, а при лечении варфарином снижается суммарная частота риска повторных инфарктов, инсульта и общей смертности на 50%.
Антикоагулянты непрямого действия применяют для длительной профилактики и лечения тромбозов и тромбоэмболий (тромбозов глубоких вен, тромбоэмболии легочной артерии, тромбоэмболических осложнений при мерцательной аритмии предсердий, инфаркте миокарда, протезировании клапанов сердца) в хирургической практике для предупреждения тромбообразования в послеоперационном периоде.
Антикоагулянты непрямого действия применяются исключительно внутрь (перорально), внутримышечно, внутривенно или подкожно их использовать нельзя. Выпускаются в таблетках: Аценокумарол (Синкумар) 2 мг и 4 мг; Варфарин (Варфарекс) 2,5 мг, 3 мг и 5 мг; Фениндион (Фенилин) 30 мг. Препараты хорошо и почти полностью всасываются (90%), биодоступность достигает 93–98%, подвергаются биотрансформации в печени и выводятся с мочой. Во время терапии данными препаратами необходимо строго соблюдать диету, исключив из рациона продукты, богатые витамином К: листовые овощи, цветную капусту, шпинат, томаты, кукурузное масло, говяжью печень, яйца и др.
Обратить внимание! Перечисленные препараты противопоказаны при серьезных заболеваниях печени и почек, при тяжелой артериальной гипертензии. Прекращать терапию антикоагулянтами непрямого действия следует не сразу, а постепенно — медленно, уменьшая дозу и увеличивая время между приемами препарата (до 1 раза в день или даже через день). Резкая отмена лекарственного средства может повлечь за собой внезапное компенсаторное повышение в крови уровня протромбина, что может вызвать тромбоз.
Наиболее частыми осложнениями при применении препаратов — антикоагулянтов непрямого действия являются кровотечения. Для остановки кровотечений, вызванных антикоагулянтами непрямого действия, следует вводить водорастворимый препарат витамина K1 (Викасол) или концентрат протромбинового комплекса (содержит II, VII, IX, X фактор). К другим побочным эффектам антикоагулянтов непрямого действия относятся аллергические реакции, диарея, дисфункция печени, некроз кожи.
Препараты антикоагулянтов непрямого действия проникают через плаценту и могут оказывать тератогенное действие, поэтому они противопоказаны при беременности и далее во время кормления грудью.
Фениндион, помимо перечисленных побочных эффектов, может вызвать угнетение кроветворения. На фоне лечения препаратом возможно окрашивание кожи и изменение цвета мочи. В случае появления этих симптомов следует заменить другим препаратом. Возможна повышенная чувствительность организма больного к Аценокумаролу. В случае появления аллергических реакций его необходимо отменить.
Не следует назначать одновременно с антикоагулянтами многие лекарственные средства. При одновременном применении Варфарина с ацетилсалициловой кислотой (Кардиоаспирин, ТромбоАСС) или другими антиагрегантами усиливается риск возникновения кровотечений, поскольку они способствуют повышению концентрации свободного антикоагулянта в крови. Антикоагулянтный эффект усиливают при одновременном применении препарата с НПВС, симвастатином, амиодароном, хинидином, метронидазолом, цефалоспоринами, салицилатами, сульфасалазином. Ослабляют эффект холестирамин (ухудшение адсорбции), витамин К, слабительные препараты, парацетамол в большой дозе, гризеофульвин и индукторы печеночных ферментов (барбитураты, рифампицин). Антагонистическое действие в отношении антикоагулянтного эффекта возникает у больных, хронически злоупотребляющих алкоголем и никотином.
Антагонистическое действие в отношении антикоагулянтного эффекта возникает у больных, хронически злоупотребляющих алкоголем и никотином.
Важно! Антикоагулянты прямого и непрямого действия — это очень серьезные препараты, которые при непрофессиональном приеме могут вызвать серьезнейшие и даже опасные для жизни осложнения.
Данная информация про все антикоагулянтные препараты предоставлена специалистам — провизорам и фармацевтам — лишь с целью ознакомления и категорически запрещает их рекомендовать покупателям! Определить, необходимы ли они пациенту, а также подобрать эффективную и безопасную дозировку этих препаратов может только врач–кардиолог!
Преферанская Н.Г.
Новые пероральные антикоагулянты (НОАК) для лечения эмболии легочной артерии
Актуальность
Венозная тромбоэмболия — это состояние, при котором в глубоких венах формируются сгустки крови (тромбоз глубоких вен — ТГВ) (чаще всего в ногах) и могут перемещаться, блокируя артерии легких (эмболия легочной артерии). Эмболия легочной артерии опасна для жизни и возникает примерно у 3-4 людей на 10 000 человек. Вероятность возникновения эмболии легочной артерии может увеличиваться в связи с факторами риска, включая ранее возникающие тромбы, продолжительные периоды неподвижности (например, путешествия на самолете или постельный режим), рак, воздействие эстрогенов (беременность, оральные контрацептивы или гормонозаместительная терапия), заболевания крови (тромбофилия) и травмы. Эмболия легочной артерии диагностируется с помощью определения факторов риска, а также сканирования легких для проверки наличия тромба. Если эмболия легочной артерии подтверждена, пациентов лечат с помощью антикоагулянтов. Это предотвращает образование новых тромбов. До недавнего времени назначались гепарин, фондапаринукс и антагонисты витамина К. Однако эти препараты могут вызывать побочные эффекты и имеют ограничения. Недавно были разработаны два класса прямых пероральных антикоагулянтов (НОАК): прямые ингибиторы тромбина (DTI) и ингибиторы фактора Ха.
Эмболия легочной артерии опасна для жизни и возникает примерно у 3-4 людей на 10 000 человек. Вероятность возникновения эмболии легочной артерии может увеличиваться в связи с факторами риска, включая ранее возникающие тромбы, продолжительные периоды неподвижности (например, путешествия на самолете или постельный режим), рак, воздействие эстрогенов (беременность, оральные контрацептивы или гормонозаместительная терапия), заболевания крови (тромбофилия) и травмы. Эмболия легочной артерии диагностируется с помощью определения факторов риска, а также сканирования легких для проверки наличия тромба. Если эмболия легочной артерии подтверждена, пациентов лечат с помощью антикоагулянтов. Это предотвращает образование новых тромбов. До недавнего времени назначались гепарин, фондапаринукс и антагонисты витамина К. Однако эти препараты могут вызывать побочные эффекты и имеют ограничения. Недавно были разработаны два класса прямых пероральных антикоагулянтов (НОАК): прямые ингибиторы тромбина (DTI) и ингибиторы фактора Ха. Есть определенные причины, по которым пероральные прямые ингибиторы тромбина и ингибиторы фактора Ха являются предпочтительным выбором. Они могут приниматься внутрь, имеют предсказуемый эффект, не требуют частого контроля или повторного дозирования, у них есть лишь несколько известных лекарственных взаимодействий. Данный обзор оценивает эффективность и безопасность этих новых препаратов в сравнении с традиционным лечением.
Есть определенные причины, по которым пероральные прямые ингибиторы тромбина и ингибиторы фактора Ха являются предпочтительным выбором. Они могут приниматься внутрь, имеют предсказуемый эффект, не требуют частого контроля или повторного дозирования, у них есть лишь несколько известных лекарственных взаимодействий. Данный обзор оценивает эффективность и безопасность этих новых препаратов в сравнении с традиционным лечением.
Основные результаты
В ходе поиска соответствующих исследований вплоть до января 2015 года мы нашли 5 исследований с 7897 участниками. Исследования сравнивали пероральные прямые ингибиторы тромбина и ингибиторы фактора Ха с традиционным лечением. Мы рассмотрели, предотвращает ли трехмесячное лечение новые тромбы и эмболию легочной артерии. Основными исходами были смертность и нежелательные явления, такие как кровотечение. В данном обзоре отсутствуют доказательства различия между прямыми ингибиторами тромбина и стандартным лечением в предотвращении рецидивирования тромбов в легких и ногах.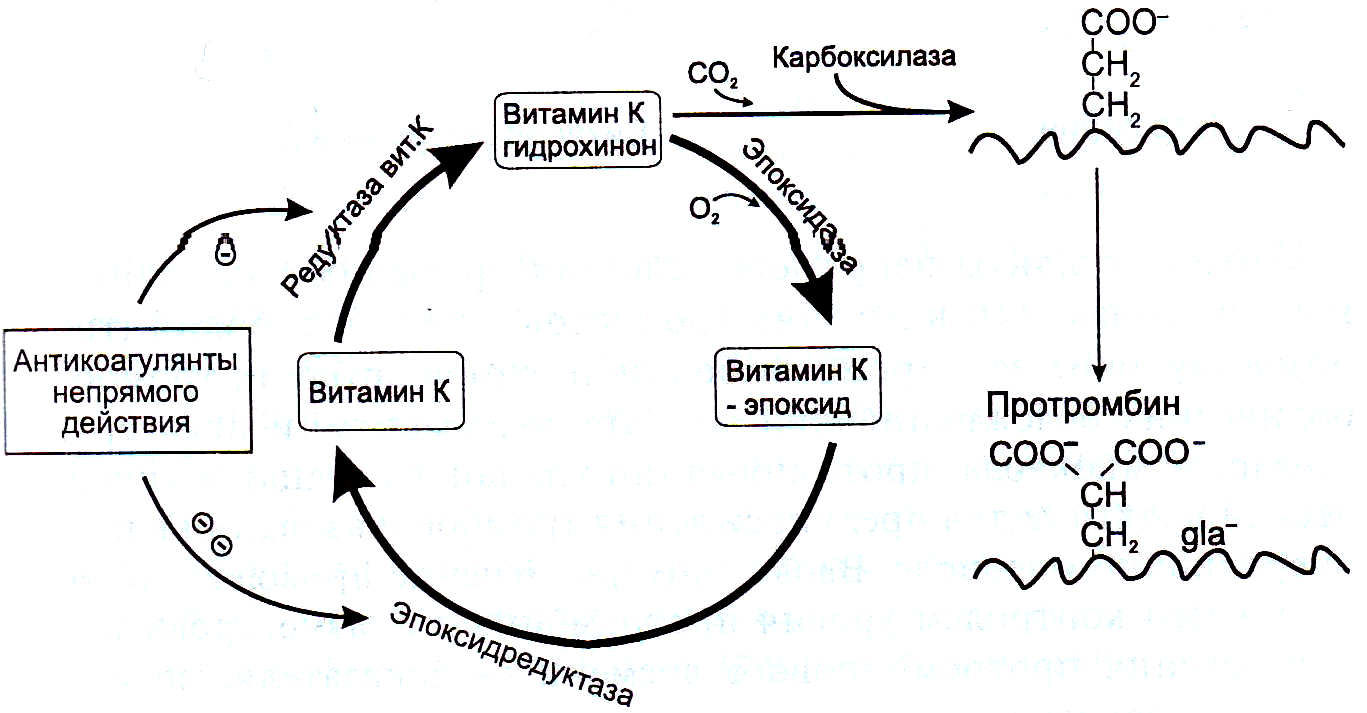 Что касается пероральных ингибиторов фактора Ха и предотвращения рецидивирования тромбов в легких, исследования были слишком разными для того, чтобы сделать какой-либо значимый вывод. Более того, не было найдено доказательств различий в отношении рецидивирующей венозной тромбоэмболии, ТГВ, смертности или кровотечения. Ни в одном из исследований не оценивалось связанное со здоровьем качество жизни.
Что касается пероральных ингибиторов фактора Ха и предотвращения рецидивирования тромбов в легких, исследования были слишком разными для того, чтобы сделать какой-либо значимый вывод. Более того, не было найдено доказательств различий в отношении рецидивирующей венозной тромбоэмболии, ТГВ, смертности или кровотечения. Ни в одном из исследований не оценивалось связанное со здоровьем качество жизни.
Качество доказательств
В отношении таких исходов, как рецидивирующая эмболия легочной артерии и смертность от любых причин, при сравнении пероральных ингибиторов фактора Xa и стандартной антикоагулянтной терапии мы понизили качество доказательств с высокого до умеренного в связи с различиями в результатах исследований и небольшим числом исследований, включенных в обзор. Качество доказательств в отношении всех других исходов было высоким.
Страница статьи : Российский медицинский журнал
Pradaxa Prescribing Information. Ridgefield, CT 06877 USA: Boehringer Ingelheim Pharmaceuticals Inc. ; 2018. Available at: https://docs.boehringer-ingelheim.com/Prescribing%20Information/PIs/Pradaxa/Pradaxa.pdf. (Accessed December 13, 2018)
; 2018. Available at: https://docs.boehringer-ingelheim.com/Prescribing%20Information/PIs/Pradaxa/Pradaxa.pdf. (Accessed December 13, 2018)
Российские клинические рекомендации по диагностике, лечению и профилактике тромбоэмболических осложнений (ВТЭО). Москва, Россия: ООО «Издательство Медиа Сфера»; 2015. Доступно на: http://webmed.irkutsk.ru/doc/pdf/pe2015.pdf (Дата обращения 29 Декабря, 2018)
Villines T.С., Schnee J., Fraeman K., Siu K., Reynolds M.W., Collins J. et al. Comparison of the safety and effectiveness of dabigatran and warfarin in non-valvular atrial fibrillation patients in a large healthcare system. Thromb Haemost. 2015; 114(12): 1290-98. doi:10.1160/Th25-06-0453
Stacy Z, Richter S. Practical Considerations for the Use of Direct Oral Anticoagulants in Patients With Atrial Fibrillation. Clinical and Applied Thrombosis/Hemostasis. 2016; 23(1): 5-19. doi:10.1177/1076029616634886
Ingrasciotta Y. Pharmacokinetics of new oral anticoagulants: implications for use in routine care. Expert Opin Drug Metab Toxicol. 2018; 14(10): 1057-69. doi:10.1080/17425255.2018.1530213
Pharmacokinetics of new oral anticoagulants: implications for use in routine care. Expert Opin Drug Metab Toxicol. 2018; 14(10): 1057-69. doi:10.1080/17425255.2018.1530213
Xarelto Prescribing Information. Titusville, NJ 08560 USA: Janssen Pharmaceuticals Inc.; 2018. Available at: http://www.janssenlabels.com/package-insert/product-monograph/prescribing-information/XARELTO-pi.pdf. (Accessed January 4, 2019).
Coleman C.I., Turpie A.G.G., Bunz T.J., Eriksson D., Sood N.A., Baker W.L. Effectiveness and safety of rivaroxaban vs. warfarin in non-valvular atrial fibrillation patients with a non-sex-related CHA2DS2-VASc score of 1. European Heart Journal — Cardiovascular Pharmacotherapy. 2018; 5(2): 64-9. doi:10.1093/ehjcvp/pvy025
Eliquis Prescribing Information. Plainsboro, NJ 08536 USA: Bristol-Myers Squibb Company; 2014. https://www.fda.gov/downloads/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/UCM333723. pdf. (Accessed January 5, 2019).
pdf. (Accessed January 5, 2019).
Rose M. Pharmacological profile of non-vitamin K antagonist oral anticoagulants. Afr J Pharm Pharmacol. 2017; 11(9): 125-36. doi:10.5897/ajpp2017.4744
Mavrakanas T., Samer C., Nessim S., Frisch G., Lipman M. Apixaban Pharmacokinetics at Steady State in Hemodialysis Patients. Journal of the American Society of Nephrology. 2017; 28(7): 2241-8. doi:10.1681/asn.2016090980
Barr D., Epps Q. Direct oral anticoagulants: a review of common medication errors. J Thromb Thrombolysis. 2018; 47(1): 146-154. doi:10.1007/s11239-018-1752-9
Tran E., Duckett A., Fisher S., Bohm N. Appropriateness of direct oral anticoagulant dosing for venous thromboembolism treatment. J Thromb Thrombolysis. 2017; 43(4): 505-13. doi:10.1007/s11239-017-1487-z
Savaysa (Edoxaban) Now Available In U.S. Pharmacies. Tokyo, Japan: Daiichi Sankyo Inc. ; 2015. https://www.daiichisankyo.com/media_investors/media_relations/press_releases/detail/006247/20150209_559_E2.pdf. (Accessed January 13, 2019).
; 2015. https://www.daiichisankyo.com/media_investors/media_relations/press_releases/detail/006247/20150209_559_E2.pdf. (Accessed January 13, 2019).
Proietti M., Lip G. Edoxaban in venous thromboembolism and stroke prevention: an appraisal. Vasc Health Risk Manag. 2016;12:45-51. doi:10.2147/vhrm.s81569
Bevyxxa Prescribing Information. San Francisco, CA 94080 USA: Portola Pharmaceuticals; 2017. https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/208383s000lbl.pdf. (Accessed January 23, 2019).
Thoenes M., Minguet J., Bramlage K., Bramlage P., Ferrero C. Betrixaban — the next direct factor Xa inhibitor?. Expert Rev Hematol. 2016; 9(12): 1111-7. doi:10.1080/17474086.2016.1256194
Viprey M., Jeannin R., Piriou V., Chevalier P., Michel C., Aulagner G. et al. Prevalence of drug-related problems associated with direct oral anticoagulants in hospitalized patients: a multicenter, cross-sectional study. J Clin Pharm Ther. 2016; 42(1): 58-63. doi:10.1111/jcpt.12473
J Clin Pharm Ther. 2016; 42(1): 58-63. doi:10.1111/jcpt.12473
Whitworth M.M., Haase K.K., Fike D.S., Bharadwaj R.M., Young R.B., MacLaughlin E.J. Utilization and prescribing patterns of direct oral anticoagulants. Int J Gen Med. 2017; 2017(10): 87-94. doi:10.2147/ijgm.s129235
Larock A., Mullier F., Sennesael A., Douxfils J., Devalet B., Chatelain C. et al. Appropriateness of Prescribing Dabigatran Etexilate and Rivaroxaban in Patients With Nonvalvular Atrial Fibrillation. Annals of Pharmacotherapy. 2014; 48(10): 1258-68. doi:10.1177/1060028014540868
Basaran O., Basaran N.F., Cekic E.G., Altun I., Dogan V., Mert G.O. et al. PRescriptiOn PattERns of Oral Anticoagulants in Nonvalvular Atrial Fibrillation (PROPER study). Clinical and Applied Thrombosis/Hemostasis. 2015; 23(4): 384-391. doi:10.1177/1076029615614395
Гайсенок О.В., Леонов А.С. Применение пероральных антикоагулянтов у пациентов с фибрилляцией предсердий: данные когортного исследования. Рациональная Фармакотерапия в Кардиологии. 2016; 12(4): 376-9. https://doi.org/10.20996/1819-6446-2016-12-4-376-379
Рациональная Фармакотерапия в Кардиологии. 2016; 12(4): 376-9. https://doi.org/10.20996/1819-6446-2016-12-4-376-379
Steinberg B.A., Shrader P., Thomas L., Ansell J., Fonarow G.C., Gersh B.J. et al. Off-Label Dosing of Non-Vitamin K Antagonist Oral Anticoagulants and Adverse Outcomes. J Am Coll Cardiol. 2016; 68(24): 2597-2604. doi:10.1016/j.jacc.2016.09.966
Conway S.E., Hwang A.Y., Ponte C.D., Gums J.G. Laboratory and Clinical Monitoring of Direct Acting Oral Anticoagulants: What Clinicians Need to Know. Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy. 2017; 37(2): 236-48. doi:10.1002/phar.1884
Ciurus T., Sobczak S., Cichocka-Radwan A., Lelonek M. CARDIAC SURGERY New oral anticoagulants — a practical guide. Polish Journal of Cardio-Thoracic Surgery. 2015; 12(2): 111-8. doi:10.5114/kitp.2015.52851
Zehnder J. Clinical use of coagulation tests. Wolters Kluwer; 2019. https://www.uptodate.com/contents/clinical-use-of-coagulation-tests. (Accessed February 19, 2019).
https://www.uptodate.com/contents/clinical-use-of-coagulation-tests. (Accessed February 19, 2019).
Siegal D., Konkle B. What is the effect of rivaroxaban on routine coagulation tests?. Hematology. 2014; 2014(1): 334-336. doi:10.1182/asheducation-2014.1.334
Praxbind Prescribing Information. Ridgefield, CT 06877 USA: Boehringer Ingelheim Pharmaceuticals Inc.; 2018. Available at: https://docs.boehringer-ingelheim.com/Prescribing%20Information/PIs/Praxbind/Praxbind.pdf. (Accessed February 23, 2019).
Sié P. Spotlight on idarucizumab and its potential for the reversal of anticoagulant effects of dabigatran. Drug Des Devel Ther. 2016; 2016(10): 1683-9. doi:10.2147/dddt.s94167
Pollack C., Reilly P., Bernstein R., Dubiel R., Eikelboom J., Glund S. et al. Design and rationale for RE-VERSE AD: A phase 3 study of idarucizumab, a specific reversal agent for dabigatran. Thromb Haemost. 2015; 114(07): 198-205. doi:10.1160/th25-03-0192
2015; 114(07): 198-205. doi:10.1160/th25-03-0192
Reilly P., van Ryn J., Grottke O., Glund S., Stangier J. Idarucizumab, a Specific Reversal Agent for Dabigatran: Mode of Action, Pharmacokinetics and Pharmacodynamics, and Safety and Efficacy in Phase 1 Subjects. Am J Med. 2016; 129(11): 64-72. doi:10.1016/j.amjmed.2016.06.007
Pollack C., Reilly P., van Ryn J., Eikelboom J., Glund S., Bernstein R. et al. Idarucizumab for Dabigatran Reversal g — Full Cohort Analysis. New England Journal of Medicine. 2017; 377(5): 431-41. doi:10.1056/nejmoa1707278
Pollack C., Reilly P., van Ryn J., Eikelboom J., Glund S., Bernstein R. et al. Idarucizumab for Dabigatran Reversal — Supplementary Appendix. New England Journal of Medicine. 2015; 373(6): 511-20. doi:10.1056/nejmoa1502000
Tummala R., Kavtaradze A., Gupta A., Ghosh R. Specific antidotes against direct oral anticoagulants: A comprehensive review of clinical trials data. Int J Cardiol. 2016; 214: 292-8. doi:10.1016/j.ijcard.2016.03.056
Int J Cardiol. 2016; 214: 292-8. doi:10.1016/j.ijcard.2016.03.056
Connolly S., Milling T., Eikelboom J., Gibson M., Curnutte J., Gold A. et al. Andexanet Alfa for Acute Major Bleeding Associated with Factor Xa Inhibitors. New England Journal of Medicine. 2016; 375(12): 1131-41. doi:10.1056/nejmoa1607887
Crowther M. Antidotes for Novel Oral Anticoagulants. Arterioscler Thromb Vasc Biol. 2015; 35(8): 1736-45. doi:10.1161/atvbaha.114.303402
Chai-Adisaksopha C. Hemodialysis for the treatment of dabigatran-associated bleeding: a case report and systematic review. Journal of Thrombosis and Haemostasis. 2015; 13(10): 1790-8. doi:10.1111/jth.13117
Hu T., Vaidya V., Asirvatham S. Reversing anticoagulant effects of novel oral anticoagulants: role of ciraparantag, andexanet alfa, and idarucizumab. Vasc Health Risk Manag. 2016; 2016(12): 35-44. doi:10.2147/vhrm.s89130
Xarelto. Procedural Steps Taken And Scientific Information After The Authorisation. London, E14 5EU UK: European Medicines Agency; 2018. https://www.ema.europa.eu/en/documents/procedural-steps-after/xarelto-epar-procedural-steps-taken-scientific-information-after-authorisation_en.pdf. (Accessed February 15, 2019).
Procedural Steps Taken And Scientific Information After The Authorisation. London, E14 5EU UK: European Medicines Agency; 2018. https://www.ema.europa.eu/en/documents/procedural-steps-after/xarelto-epar-procedural-steps-taken-scientific-information-after-authorisation_en.pdf. (Accessed February 15, 2019).
Grottke O., van Ryn J., Spronk H., Rossaint R. Prothrombin complex concentrates and a specific antidote to dabigatran are effective ex-vivo in reversing the effects of dabigatran in an anticoagulation/liver trauma experimental model. Critical Care. 2014; 18(1): R27. doi:10.1186/cc13717
Perzborn E., Heitmeier S., Laux V., Buchmüller A. Reversal of rivaroxaban-induced anticoagulation with prothrombin complex concentrate, activated prothrombin complex concentrate and recombinant activated factor VII in vitro. Thromb Res. 2014; 133(4): 671-81. doi:10.1016/j.thromres.2014.01.017
Schultz N., Tran H., Bjørnsen S. , Henriksson C., Sandset P., Holme P. The reversal effect of prothrombin complex concentrate (PCC), activated PCC and recombinant activated factor VII against anticoagulation of Xa inhibitor. Thromb J. 2017; 15(6). doi:10.1186/s12959-017-0129-1
, Henriksson C., Sandset P., Holme P. The reversal effect of prothrombin complex concentrate (PCC), activated PCC and recombinant activated factor VII against anticoagulation of Xa inhibitor. Thromb J. 2017; 15(6). doi:10.1186/s12959-017-0129-1
Levy J., Levi M. New Oral Anticoagulant-Induced Bleeding. Clin Lab Med. 2014; 34(3): 575-86. doi:10.1016/j.cll.2014.06.004
Вопрос выбора орального антикоагулянта при фибрилляции предсердий
В активном арсенале есть Дабигатран, Ривароксабан, Апиксабан. Причем Дабигатран есть в дозе 110 и 150 мг, Ривароксбан в дозе 20 и 15 мг, Апиксабан в дозе 5 и 2,5 мг.Когда проводились исследования по каждому препарату, их сравнивали с Варфарином. Выяснилось, что каждый из новых оральных антикоагулянтов лучше Варфарина. Были эффективны не хуже Варфарина в эффективности, в снижении риска инсульта или системной эмболии. Все исследуемые препараты снижали количество внутричерепных кровоизлияний. Снижение общей смертности было показано только у Апиксабана.
 Снижение, так называемых «больших кровотечений» показал Дабигатран в дозе 110 мг и Апиксабан. Снижение и «больших» и «малых кровотечений» показал Дабигатран в обеих дозировках и Апиксабан. Увеличение ЖКТ кровотечений был у Дабигатрана в дозе 150 мг и Ривароксабана.
Снижение, так называемых «больших кровотечений» показал Дабигатран в дозе 110 мг и Апиксабан. Снижение и «больших» и «малых кровотечений» показал Дабигатран в обеих дозировках и Апиксабан. Увеличение ЖКТ кровотечений был у Дабигатрана в дозе 150 мг и Ривароксабана. Кроме того, при проведении исследования оценивалась приверженность пациента к приему препарата. Прекращение приема было и у Дабигатрана, и у Ривароксабана. У Апиксабана прекращения приема не было.
Сравнение с аспирином было только у Апиксабана, который показал, что является более эффективным, чем аспирин без увеличения риска ЖКТ кровотечений.
Клинико-фармакологическая характеристика новых оральных антикоагулянтов
Дабигатран является прямым ингибитором тромбина, Апиксабан и Ривароксабаном — прямые ингибиторы Х фактора, т.е. последние являются препаратами одной группы, у них одинаковый механизм. Максимальную концентрацию они все достигают через 3 часа. Период полужизни у Дабигатрана чуть больше – 12- 17 часов, у Апиксабана и Ривароксабана чуть меньше – 9-14 часов. Выводятся по разному: дабигатран – 80% почками, Апиксабан – 25% почками и 75% фекалиями, Ривароксабан 30% почками и 70% фекалиями. Поэтому Апиксабан и Ривароксабан возможно использовать при снижении скорости клубочковой фильтрации.
Выводятся по разному: дабигатран – 80% почками, Апиксабан – 25% почками и 75% фекалиями, Ривароксабан 30% почками и 70% фекалиями. Поэтому Апиксабан и Ривароксабан возможно использовать при снижении скорости клубочковой фильтрации.
Дозы: Дабигатран — 150 мг х 2 р/сут, 110 мг х 2 р/сут.
Апиксабан — 5 мг х 2 р/сут.
Ривароксабан — 20 мг х 1 р/сут. (после еды)
Эти дозы прописаны для нормальной функции почек, если функция почек снижается, то Апиксабан можно использовать в половинной дозе 2 раза и Ривароксабан 15 мг однократно.
Показание для снижения дозы:
Дабигатран — ESC – 110 мг х 2 р/сут:
• возраст ≥ 80 лет
• риск кровотечения ≥ 3 баллов по шкале HAS-BLED
• клиренс креатинина 30-49 мл/мин
США – 75 мг х 2 р/сут.
Апиксабан — 2,5 мг х 2 р/сут:
• риск кровотечения ≥ 3 баллов по шкале HAS-BLED
• клиренс креатинина 15-30 мл/мин
Ривароксабан — 15 мг х 1 р/сут:
• риск кровотечения ≥ 3 баллов по шкале HAS-BLED
• клиренс креатинина 15-49 мл/мин
В ретроспективном когортном исследовании ARISTOPHANES Эликвис© продемонстрировал более высокую эффективность и безопасность по сравнению с Ксарелто© и Прадакса© . Включено около 500 000 пациентов с НФП.
Включено около 500 000 пациентов с НФП.
Популяция пациентов:
466 991 пациента с неклапанной фибрилляцией предсердий, сгруппированных в когорты, исходно уравненные по степени риска, включая демографию, сопутствующие заболевания, сумму баллов по шкалам CHA2DS2-VASc и HAS-BLED, сравнили сначала с ВАРФАРИНОМ:
ПОАК – варфарин
• Апиксабан – варфарин
n = 100 977
• Дабигатран – варфарин
n = 36 990
• Ривароксабан – варфарин
n = 125 068
А потом взяли эти группы и сравнили между собой:
ПОАК – ПОАК
• Апиксабан – дабигатран
n = 37 314
• Апиксабан – ривароксабан
n = 107 236
• Дабигатран – ривароксабан
n = 37 693
Антикоагулянты | Образовательный проект по фармакологии
Антикоагулянты используются для предотвращения образования или роста фибриновых/эритроцитарных тромбов в венозном кровотоке. Они не подходят для лечения артериальных тромбов, которые в основном состоят из агрегатов тромбоцитов.
Антикоагулянты можно вводить парентерально или перорально.
Парентеральные антикоагулянты:Гепарин (нефракционированный или «стандартный» гепарин) действует быстро, но также имеет короткую продолжительность действия.Эта характеристика позволяет использовать инфузию гепарина у пациентов с высоким риском кровотечения, поскольку антикоагулянтный эффект быстро заканчивается после прекращения инфузии.
Низкомолекулярные гепарины столь же эффективны, как и нефракционированный гепарин, но имеют меньший риск вызвать гепарин-индуцированную тромбоцитопению. Они также более удобны в использовании из-за большей продолжительности действия, чем нефракционированный гепарин, и поэтому являются предпочтительным вариантом для профилактики венозной тромбоэмболии, например, при лечении тромбоза глубоких вен (ТГВ), тромбоэмболии легочной артерии (ТЭЛА), инфаркт миокарда (ИМ), нестабильное заболевание коронарных артерий и для предотвращения свертывания крови при процедурах экстракорпорального кровообращения. Примеры препаратов: далтепарин натрия, эноксапарин натрия и тинзапарин натрия
Примеры препаратов: далтепарин натрия, эноксапарин натрия и тинзапарин натрия
Гепариноиды , такие как данапароид натрия, представляют собой смеси производных гепарина, называемых гликозаминогликанами, таких как гепаран, дерматан и хондроитинсульфаты. Используется для снижения риска развития ТГВ у хирургических больных.
Аргатробан представляет собой пероральный антикоагулянт, который действует как ингибитор тромбина . Он показан для профилактики или лечения тромбоза у пациентов с гепарин-индуцированной тромбоцитопенией (ГИТ) или с риском ее возникновения.
Гирудины, такие как десирудин , лепирудин и бивалирудин , являются производными слюнного антикоагулянта, обнаруженного в пиявках. Эти соединения являются прямыми ингибиторами тромбина . Бивалирудин показан при нестабильной стенокардии или ИМ без подъема сегмента ST у пациентов, которым планируется экстренное или раннее вмешательство, а также в качестве антикоагулянта у пациентов, перенесших чрескожное коронарное вмешательство.
Эпопростенол (простациклин PGI 2 ) можно использовать для предотвращения агрегации тромбоцитов во время почечного диализа, если гепарины не подходят или противопоказаны.Эпопростенол имеет очень короткий период полувыведения, поэтому его необходимо вводить путем непрерывной внутривенной инфузии. Также может использоваться в сочетании с пероральными антикоагулянтами для лечения первичной легочной гипертензии, устойчивой к другим видам лечения, под наблюдением специалиста.
Фондапаринукс ингибирует активированный фактор свертывания крови X и показан для предотвращения образования венозных тромбов у различных групп пациентов из группы риска
Пероральные антикоагулянты: Кумарины ( варфарин и аценокумарол ) и фениндион противодействуют действию витамина К, но медленно достигают полного антикоагулянтного эффекта (48-72 часа). Из этой группы препаратов препаратом выбора является варфарин. Варфарин используется для профилактики венозной тромбоэмболии у пациентов из группы риска. Килинг Д и др. (2011, PMID: 21671894) содержат рекомендации по использованию антикоагулянтов варфарином.
Из этой группы препаратов препаратом выбора является варфарин. Варфарин используется для профилактики венозной тромбоэмболии у пациентов из группы риска. Килинг Д и др. (2011, PMID: 21671894) содержат рекомендации по использованию антикоагулянтов варфарином.
Дабигатран, ривароксабан и апиксабан являются пероральными антикоагулянтами, которые являются альтернативой варфарину. Ривароксабан и апиксабан ингибируют активацию тромбоцитов и образование фибринового сгустка посредством прямого, селективного и обратимого ингибирования фактора Ха. Этексилат дабигатрана представляет собой пролекарство, которое in vivo превращается в активный дабигатран . Дабигатран является специфическим обратимым прямым ингибитором тромбина. Регулярные лабораторные испытания не требуются ни для одного из этих препаратов. Кроме того, эти пероральные антикоагулянты реже взаимодействуют с лекарствами и пищевыми продуктами. Это представляет преимущества использования этих препаратов по сравнению с варфарином.
Обзор фармакологии, дозирования и осложнений
Abstract
Антикоагулянты остаются основной стратегией профилактики и лечения тромбоза.Нефракционированный гепарин, низкомолекулярный гепарин, фондапаринукс и варфарин были изучены и широко применялись с прямыми ингибиторами тромбина, обычно предназначенными для пациентов с осложнениями или пациентов, нуждающихся в вмешательстве. Новые пероральные антикоагулянты появились в результате клинических исследований и, как ожидается, заменят старые препараты благодаря простоте применения и более благоприятным фармакодинамическим профилям. Кровотечение является основным нежелательным явлением при применении всех антикоагулянтов. С их повсеместным использованием для клиницистов становится важным иметь четкое представление о фармакологии антикоагулянтов, их дозировании и токсичности.
Ключевые слова: Тромбоз, Коагуляция, Антикоагулянты, Нефракционированный гепарин, Низкомолекулярные гепарины, Прямые ингибиторы тромбина, Варфарин, Дабигатран, Ривароксабан, Апиксабан
Введение
Антикоагулянты являются основным средством профилактики и лечения тромбоза. Хотя обычно используются антикоагулянты, их использование часто связано с побочными эффектами лекарств и увеличением частоты повторных госпитализаций. Около половины пациентов старшего возраста, поступающих в отделение неотложной помощи с побочным эффектом варфарина, нуждались в госпитализации [1].Несмотря на то, что новые антикоагулянты рекламируются как заменители препаратов варфарина и гепарина, ривароксабан был связан с серьезными тромботическими событиями, в то время как дабигатран был связан с серьезными кровотечениями [2, 3]. Поскольку использование антикоагулянтов увеличивает риск обращения в отделение неотложной помощи в 35 раз [4], клиницисты должны быть знакомы с антикоагулянтами, их фармакологическими свойствами, фармакодинамикой, дозированием, мониторингом и токсичностью.
Хотя обычно используются антикоагулянты, их использование часто связано с побочными эффектами лекарств и увеличением частоты повторных госпитализаций. Около половины пациентов старшего возраста, поступающих в отделение неотложной помощи с побочным эффектом варфарина, нуждались в госпитализации [1].Несмотря на то, что новые антикоагулянты рекламируются как заменители препаратов варфарина и гепарина, ривароксабан был связан с серьезными тромботическими событиями, в то время как дабигатран был связан с серьезными кровотечениями [2, 3]. Поскольку использование антикоагулянтов увеличивает риск обращения в отделение неотложной помощи в 35 раз [4], клиницисты должны быть знакомы с антикоагулянтами, их фармакологическими свойствами, фармакодинамикой, дозированием, мониторингом и токсичностью.
Патофизиология
Каскад свертывания крови запускается высвобождением тканевого фактора при травме ткани или повреждении сосуда (рис.) [5]. Тканевой фактор образует комплекс с фактором VIIa в присутствии кальция и расщепляет факторы свертывания X и IX до их активированных форм (факторы Ха и IXa). Затем протромбиназный комплекс собирается на фосфолипидной мембране и расщепляет протромбин (фактор II) до фактора IIa (тромбин). Тромбин является одним из наиболее мощных активаторов первичного (тромбоцитарно-опосредованного) и вторичного (опосредованного фактором свертывания крови) гемостаза. Тромбин может также потенцировать образование сгустка за счет полимеризации фибрина, активации рецепторов тромбоцитов, активации эндотелия и активации факторов V, VIII, XI и XIII.Антикоагулянты могут ингибировать тромбообразование, изменяя различные пути в каскаде свертывания крови или воздействуя непосредственно на тромбин, ослабляя образование тромбина. Непрямые ингибиторы, однако, нацелены и связываются с природными кофакторами плазмы, такими как антитромбин (АТ), катализируя их взаимодействие с ферментами свертывания крови [5].
Затем протромбиназный комплекс собирается на фосфолипидной мембране и расщепляет протромбин (фактор II) до фактора IIa (тромбин). Тромбин является одним из наиболее мощных активаторов первичного (тромбоцитарно-опосредованного) и вторичного (опосредованного фактором свертывания крови) гемостаза. Тромбин может также потенцировать образование сгустка за счет полимеризации фибрина, активации рецепторов тромбоцитов, активации эндотелия и активации факторов V, VIII, XI и XIII.Антикоагулянты могут ингибировать тромбообразование, изменяя различные пути в каскаде свертывания крови или воздействуя непосредственно на тромбин, ослабляя образование тромбина. Непрямые ингибиторы, однако, нацелены и связываются с природными кофакторами плазмы, такими как антитромбин (АТ), катализируя их взаимодействие с ферментами свертывания крови [5].
Каскад свертывания состоит из внутреннего (контактная активация) и внешнего (тканевого фактора) пути. Каждый путь запускает серию реакций, в которых активируются неактивные циркулирующие ферменты и их кофакторы. Эти активированные факторы затем катализируют следующие реакции в каскаде. Тромбин играет ключевую роль, запуская превращение растворимого фибриногена в нерастворимые мономеры фибрина, которые служат основой для образования тромба. Тромбин также активирует факторы VIII, V и XIII. Фактор XIII образует ковалентные связи, которые связывают нити фибрина, обеспечивая структурную целостность. Антикоагулянты либо за счет взаимодействия с антитромбином (АТ), либо путем прямого ингибирования тромбина прерывают эти ферментативные реакции при остром тромбозе в связи с их быстрым началом антитромботической активности.Поскольку ингибирование факторов свертывания крови гепаринами зависит от присутствия AT, они считаются антикоагулянтами непрямого действия (таблица) [6••, 7, 8]. Гепарины не обладают фибринолитической активностью и не растворяют существующие тромбы. Гепарины содержат активную пентасахаридную последовательность, которая связывается с AT. Как только гепарин связывается и активирует AT, он может легко диссоциировать и связываться с дополнительными AT, обеспечивая постоянный антикоагулянтный эффект.
Эти активированные факторы затем катализируют следующие реакции в каскаде. Тромбин играет ключевую роль, запуская превращение растворимого фибриногена в нерастворимые мономеры фибрина, которые служат основой для образования тромба. Тромбин также активирует факторы VIII, V и XIII. Фактор XIII образует ковалентные связи, которые связывают нити фибрина, обеспечивая структурную целостность. Антикоагулянты либо за счет взаимодействия с антитромбином (АТ), либо путем прямого ингибирования тромбина прерывают эти ферментативные реакции при остром тромбозе в связи с их быстрым началом антитромботической активности.Поскольку ингибирование факторов свертывания крови гепаринами зависит от присутствия AT, они считаются антикоагулянтами непрямого действия (таблица) [6••, 7, 8]. Гепарины не обладают фибринолитической активностью и не растворяют существующие тромбы. Гепарины содержат активную пентасахаридную последовательность, которая связывается с AT. Как только гепарин связывается и активирует AT, он может легко диссоциировать и связываться с дополнительными AT, обеспечивая постоянный антикоагулянтный эффект. Это связывание вызывает конформационные изменения, ускоряющие связывание АТ и инактивацию факторов свертывания крови XIIa, IXa, XIa, Xa и тромбина.Активная пентасахаридная последовательность, ответственная за катализ АТ, находится на одной трети и одной пятой цепей НФГ и НМГ соответственно. Фондапаринукс является синтетическим аналогом встречающегося в природе пентасахарида, содержащегося в гепаринах [6••, 7, 8]. Фондапаринукс избирательно и необратимо связывается с АТ. Это приводит к нейтрализации фактора Ха, что в конечном итоге ингибирует образование тромбина и развитие тромба.
Это связывание вызывает конформационные изменения, ускоряющие связывание АТ и инактивацию факторов свертывания крови XIIa, IXa, XIa, Xa и тромбина.Активная пентасахаридная последовательность, ответственная за катализ АТ, находится на одной трети и одной пятой цепей НФГ и НМГ соответственно. Фондапаринукс является синтетическим аналогом встречающегося в природе пентасахарида, содержащегося в гепаринах [6••, 7, 8]. Фондапаринукс избирательно и необратимо связывается с АТ. Это приводит к нейтрализации фактора Ха, что в конечном итоге ингибирует образование тромбина и развитие тромба.
Таблица 1
Сравнение фармакологических особенностей гепарина и его производных
| Характеристики | HEPARIN | LMWH | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Источник | Биологический | Биологический | Synthetic | |||||||
| Молекулярная вес (DA) | 15 000 | 5000 | 5000 | 5000 | 9013 | Target | XA: IIA | XA> IIA | XA | |
| биодоступность (%) | 30 | 90 | ||||||||
| Half-life (h) | 1 | 4 | 4 | 17 | 17 | |||||
| № | Да | Да | 9014Да | |||||||
| Reversal Protamine | Complete | Partial | None | |||||||
| Частота ГИТ (%) | <5. 0 0 | <1,0 | Истории болезни |
Нефракционированный гепарин
Фармакодинамика и мониторинг
Внутривенные (в/в) инфузии или подкожные инъекции являются доступными путями введения НФГ, и в/в предпочтительнее [4]. ]. При подкожном введении для терапевтического антикоагулянта дозы должны быть достаточно большими (> 30 000 ЕД/день), чтобы преодолеть низкую биодоступность НФГ. НФГ легко связывается с белками плазмы, что способствует его вариабельной антикоагулянтной реакции после парентерального введения.Несмотря на эти ограничения, при внутривенном введении быстро достигаются терапевтические концентрации в плазме, которые можно эффективно контролировать и регулировать в зависимости от скорости инфузии [7].
Выведение НФГ из системного кровотока зависит от дозы и происходит посредством двух независимых механизмов [6••, 8]. Начальная фаза представляет собой быстрое и насыщаемое связывание с эндотелиальными клетками, макрофагами и локальными белками, где происходит деполимеризация НФГ. Вторая фаза представляет собой более медленный, ненасыщаемый почечный клиренс.В терапевтических дозах НФГ выводится в основном за счет деполимеризации, при этом цепи с более высокой молекулярной массой выводятся быстрее, чем аналоги с более низкой массой. Поскольку клиренс становится зависимым от почек, увеличение или увеличение дозы НФГ приводит к непропорциональному увеличению как интенсивности, так и продолжительности антикоагулянтного эффекта.
Вторая фаза представляет собой более медленный, ненасыщаемый почечный клиренс.В терапевтических дозах НФГ выводится в основном за счет деполимеризации, при этом цепи с более высокой молекулярной массой выводятся быстрее, чем аналоги с более низкой массой. Поскольку клиренс становится зависимым от почек, увеличение или увеличение дозы НФГ приводит к непропорциональному увеличению как интенсивности, так и продолжительности антикоагулянтного эффекта.
Антикоагулянтный ответ на введение НФГ отслеживают с помощью активированного частичного тромбопластинового времени (аЧТВ). АЧТВ следует измерять каждые 6 ч при внутривенном введении и соответствующим образом корректировать дозы до тех пор, пока у пациента не будут достигнуты устойчивые терапевтические уровни.После достижения устойчивого состояния частота мониторинга может быть увеличена [8, 10].
Для преодоления переменных факторов, вызывающих НФГ, для лечения тромбоэмболических заболеваний рекомендуются номограммы дозирования на основе массы тела. Дозировочные номограммы были связаны со значительно более высокими начальными дозами НФГ, более коротким временем до терапевтического активированного АЧТВ и отсутствием увеличения частоты кровотечений. Номограммы дозирования НФГ будут различаться от больницы к больнице из-за различий в тромбопластиновых агентах и межлабораторной стандартизации измерений АЧТВ [10].
Дозировочные номограммы были связаны со значительно более высокими начальными дозами НФГ, более коротким временем до терапевтического активированного АЧТВ и отсутствием увеличения частоты кровотечений. Номограммы дозирования НФГ будут различаться от больницы к больнице из-за различий в тромбопластиновых агентах и межлабораторной стандартизации измерений АЧТВ [10].
Клинические показания
Клинические показания для НФГ включают лечение острого коронарного синдрома (ОКС), лечение или профилактику венозной тромбоэмболии (ВТЭ), мостовую терапию мерцательной аритмии (ФП) и кардиоверсию (таблица) [6••, 11 –13]. Использование НФГ уменьшилось при наличии НМГ и фондапаринукса и их превосходных фармакокинетических профилях [6••, 7]. НФГ с коротким периодом полувыведения и способностью к реверсии остается лучшим вариантом для пациентов, которым требуются более высокие дозы НФГ, у пациентов с сопутствующим риском кровотечения или у пациентов в критическом состоянии с органной дисфункцией. Пациенты с колеблющейся функцией почек или с клиренсом креатинина менее 30 мл/мин не являются кандидатами на НМГ или фондапаринукс из-за риска кумуляции и повышенного риска кровотечения [14]. При использовании для тромбопрофилактики у медицинских пациентов прием НФГ три раза в день обеспечивает лучшую эффективность в предотвращении событий ВТЭ по сравнению с приемом два раза в день, но вызывает больше эпизодов больших кровотечений [15].
Пациенты с колеблющейся функцией почек или с клиренсом креатинина менее 30 мл/мин не являются кандидатами на НМГ или фондапаринукс из-за риска кумуляции и повышенного риска кровотечения [14]. При использовании для тромбопрофилактики у медицинских пациентов прием НФГ три раза в день обеспечивает лучшую эффективность в предотвращении событий ВТЭ по сравнению с приемом два раза в день, но вызывает больше эпизодов больших кровотечений [15].
Таблица 2
| Наркотики | Показания | Дозировка, время, продолжительность | Мониторинг | Меры предосторожности |
|---|---|---|---|---|
| Разветвленный гепарин | Лечение VTE | 80 U / кг Болюс инфузия кг/ч, скорректированная для поддержания АЧТВ 2–2. 5-кратный контроль или по локальной гепариновой номограмме 5-кратный контроль или по локальной гепариновой номограмме | аЧТВ: не менее чем через 6 часов после начала, затем не реже одного раза в день тестирование (не требуется при отсутствии тромбоцитопении, тромбоза, индуцированных гепарином поражений кожи или других признаков, указывающих на возможный диагноз ГИТ Признаки и симптомы кровотечения | Аллергические реакции или реакции гиперчувствительности Врожденные или приобретенные нарушения свертываемости крови Постоянный эпидуральный катетер Желудочно-кишечные язвы и продолжающийся дренаж тонкой кишки или желудка через трубку Заболевания печени с нарушением гемостаза Наследственный дефицит АТ III и одновременное применение АТ кг Недоношенные дети с массой тела менее 1 кг Риск отсроченного начала ГИТ и ГИТТ |
| Лечение ОКС | В/в болюс: 60 ЕД/кг (максимум 4000 ЕД) 12 ЕД/кг/ч (максимум 1000 ЕД) ± фибринолиз, с поправкой на поддержание АЧТВ 1 . 5–2-кратный контроль или местная гепариновая номограмма 5–2-кратный контроль или местная гепариновая номограмма | |||
| Мостовая терапия ФП, кардиоверсия | В/в инфузия: 60–80 ЕД/кг болюс Целевое АЧТВ, 60 с, диапазон 50–70 с | 4 | Профилактика VTE в медицинской или хирургической популяции | 5000 U SC каждые 8-12 ч |
| Профилактика VTE во время беременности (с предыдущим VTE) | 7500-15 000 U SC каждые 12 ч |
Осложнения и отмена эффекта
Основные осложнения терапии НФГ включают кровотечение (обильное кровотечение, 0–7 %; фатальное кровотечение, 0–3 %) и гепарин-индуцированную тромбоцитопению (ГИТ, 1–5 %).Пациенты, получающие НФГ в течение периода более 1 месяца, также подвержены повышенному риску остеопороза и развития переломов позвонков (примерно 2 % заболеваемости) [16].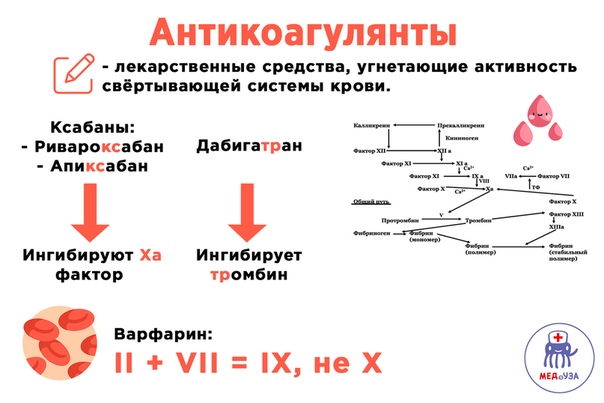 Геморрагические эпизоды связаны с интенсивностью антикоагулянтной терапии, способом введения (непрерывные инфузии связаны с более низкой частотой) и одновременным применением ингибиторов гликопротеина (gp) IIB/IIIA, аспирина или фибринолитической терапии [16–18]. Взаимосвязь между сверхтерапевтическими уровнями НФГ (повышенное АЧТВ, уровни гепарина или анти-Ха) и массивными кровотечениями не установлена и не сравнивалась проспективно в клинических исследованиях.Большие кровотечения могут возникать в пределах терапевтических уровней антикоагулянтов. Факторы риска, специфичные для пациента, являются наиболее важным фактором при определении риска кровотечения, в том числе: возраст, пол, почечная недостаточность, низкая масса тела и чрезмерное употребление алкоголя [16–18].
Геморрагические эпизоды связаны с интенсивностью антикоагулянтной терапии, способом введения (непрерывные инфузии связаны с более низкой частотой) и одновременным применением ингибиторов гликопротеина (gp) IIB/IIIA, аспирина или фибринолитической терапии [16–18]. Взаимосвязь между сверхтерапевтическими уровнями НФГ (повышенное АЧТВ, уровни гепарина или анти-Ха) и массивными кровотечениями не установлена и не сравнивалась проспективно в клинических исследованиях.Большие кровотечения могут возникать в пределах терапевтических уровней антикоагулянтов. Факторы риска, специфичные для пациента, являются наиболее важным фактором при определении риска кровотечения, в том числе: возраст, пол, почечная недостаточность, низкая масса тела и чрезмерное употребление алкоголя [16–18].
Антикоагулянтная терапия до и после хирургического вмешательства определяется индивидуально для каждого пациента в зависимости от риска и пользы. Он основан на процедуре и факторах риска кровотечения и тромбоза у пациента. Для пациентов, которым требуется периоперационная антикоагулянтная терапия при плановых процедурах или хирургическом вмешательстве, прекращения внутривенного введения терапевтических доз НФГ за 4 часа до процедуры и измерения АЧТВ обычно достаточно, поскольку нормальный гемостаз восстанавливается в этот период времени в большинстве случаев.Если АЧТВ остается повышенным, рекомендуется измерять его ежечасно до тех пор, пока АЧТВ не вернется к исходному уровню [19–21]. Терапевтическую терапию НФГ можно возобновить через 12 ч после серьезной операции, но ее следует отложить на более длительный срок из-за признаков продолжающегося кровотечения. У пациентов, получающих низкие дозы НФГ подкожно, нет противопоказаний к нейроаксиальным методам, так как риск развития гематомы позвоночника минимален. У пациентов, которым предстоит интраоперационная антикоагулянтная терапия НФГ, инфузию НФГ следует начинать не менее чем через 1 ч после введения иглы.Постоянные катетеры следует удалять через 2–4 часа после прекращения инфузии НФГ и только после оценки состояния коагуляции пациента [22].
Для пациентов, которым требуется периоперационная антикоагулянтная терапия при плановых процедурах или хирургическом вмешательстве, прекращения внутривенного введения терапевтических доз НФГ за 4 часа до процедуры и измерения АЧТВ обычно достаточно, поскольку нормальный гемостаз восстанавливается в этот период времени в большинстве случаев.Если АЧТВ остается повышенным, рекомендуется измерять его ежечасно до тех пор, пока АЧТВ не вернется к исходному уровню [19–21]. Терапевтическую терапию НФГ можно возобновить через 12 ч после серьезной операции, но ее следует отложить на более длительный срок из-за признаков продолжающегося кровотечения. У пациентов, получающих низкие дозы НФГ подкожно, нет противопоказаний к нейроаксиальным методам, так как риск развития гематомы позвоночника минимален. У пациентов, которым предстоит интраоперационная антикоагулянтная терапия НФГ, инфузию НФГ следует начинать не менее чем через 1 ч после введения иглы.Постоянные катетеры следует удалять через 2–4 часа после прекращения инфузии НФГ и только после оценки состояния коагуляции пациента [22].
Поскольку НФГ имеет короткий период полувыведения, в большинстве эпизодов кровотечения реверсия не требуется. Лечение клинически тяжелого кровотечения, связанного с НФГ, включает антигепариновую терапию (протамина сульфат), трансфузионную терапию и поддерживающую терапию. Дозировка протамина зависит от времени приема последней дозы НФГ. Для немедленной реверсии (<30 минут с момента последней дозы НФГ) 1 мг протамина вводят на каждые 100 ЕД НФГ, и последующее АЧТВ позволяет оценить реверсивную реакцию.Когда НФГ вводят в виде непрерывной внутривенной инфузии, в расчеты для определения дозы протамина следует включать только НФГ, введенный в течение предшествующих 2–2,5 часов. Если доза НФГ неизвестна, протамин 50 мг можно вводить медленно в течение 10 минут с последующими последовательными измерениями АЧТВ. Обычны тяжелые побочные реакции на протамин, такие как гипотензия и брадикардия. Тяжесть реакции можно уменьшить за счет замедления введения более чем на 1–3 мин (максимальная скорость введения составляет 5 мг/мин).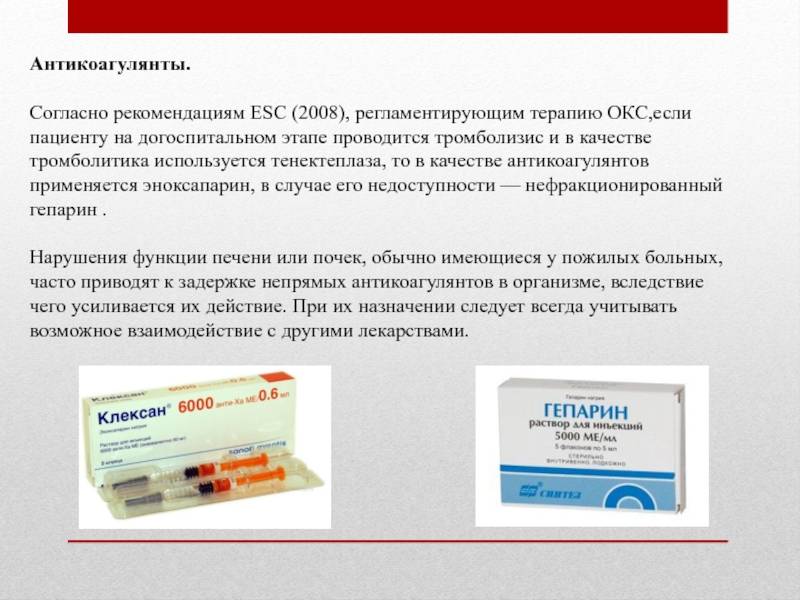 Аллергические реакции на протамин чаще встречаются у пациентов, ранее подвергавшихся воздействию препарата для нейтрализации НФГ, или получавших протаминсодержащий инсулин (нейтральный протамин-инсулин Хагедорна), перенесших вазэктомию или имеющих повышенную чувствительность к рыбе.Пациентов с риском развития антипротаминовых антител можно предварительно лечить кортикостероидами и антигистаминными препаратами [23–24].
Аллергические реакции на протамин чаще встречаются у пациентов, ранее подвергавшихся воздействию препарата для нейтрализации НФГ, или получавших протаминсодержащий инсулин (нейтральный протамин-инсулин Хагедорна), перенесших вазэктомию или имеющих повышенную чувствительность к рыбе.Пациентов с риском развития антипротаминовых антител можно предварительно лечить кортикостероидами и антигистаминными препаратами [23–24].
Низкомолекулярные гепарины
Фармакодинамика и мониторинг
НМГ обладают повышенной биодоступностью после подкожной инъекции, почечным клиренсом, который не зависит от дозы, и более длительным периодом полувыведения (17–21 ч) по сравнению с НФГ. НМГ вводят в фиксированных дозах для тромбопрофилактики или в дозах с поправкой на общую массу тела для терапевтической антикоагуляции (таблица) [5, 25].
Таблица 3
| Наркотики | Индикации | Дозировка | Дозирование, время, продолжительность | Мониторинг | Меры предосторожности |
|---|---|---|---|---|---|
| Enoxaparin (Lovenox ™) | Лечение VTE [2] | 1 мг /кг подкожно каждые 12 ч ИЛИ 1,5 мг/кг подкожно каждые 24 ч | Уровень анти-Ха у пациентов со значительной почечной недостаточностью, у пациентов с кровотечением или отклонением параметров свертывания крови, у беременных, у пациентов с ожирением или у пациентов с низким весом и дети Общий анализ крови Креатинин сыворотки Анализ на антитела к ГИТ (не требуется при отсутствии тромбоцитопении, тромбоза, индуцированных гепарином поражений кожи или других признаков, указывающих на потенциальный диагноз ГИТ Признаки и симптомы кровотечения | Постоянный эпидуральный катетер Недавняя операция на позвоночнике или офтальмология желудочно-кишечные, внутричерепные и др. ) )Врожденные или приобретенные расстройства кровотечения Бактериальный эндокардит История гепарин-индуцированного тромбоцитопении заболевания печени почечная обесценение (CRCL <30 мл / мин), рассмотрение UFH сопутствующее использование антитромботических препаратов Диабетическая ретинопатия Неконтролируемая артериальная гипертензия | |
| CrCl <30 мл/мин: 1 мг/кг подкожно каждые 24 ч | |||||
| Лечение ОКС [7] /кг с тенектеплазой с последующим введением 1 мг/кг п/к каждые 12 ч Нестабильная стенокардия/ИМ без зубца Q: 1 мг/кг п/к каждые 12 ч | Профилактика/переходная терапия ФП/кардиоверсии [3] | 1 мг/кг подкожно каждые 12 ч ИЛИ 1.5 мг/кг подкожно каждые 24 ч | |||
| CrCl <30 мл/мин: 1 мг/кг подкожно каждые 24 ч | |||||
CRCL <30 мл / мин. : 1 мг / кг SC Daily : 1 мг / кг SC Daily | |||||
| Профилактика VTE в травме пациентов | 30 мг SC каждые 12 ч или 40 мг SC каждые 24 ч | ||||
| DaltePeprin (Fragmin ™) | Лечение VTE | <56 кг: 10 000 IU SC Daily 57-68 кг: 12 500 МУ SC Daily 83-98 кг: 18 000 IU SC Daily > 99 кг: 18 000 МЕ подкожно ежедневно | |||
| Лечение ОКС | 120 МЕ/кг подкожно каждые 12 ч (МАКС. 10 000 МЕ/доза) | ||||
| ] | Начальная доза: 2500 МЕ подкожно однократно Поддерживающая доза: 2500–5000 МЕ подкожно каждые 24 h [8] | ||||
| Профилактика VTE в медицинской или хирургической популяции | 5000 IU SC каждые 24 ч | ||||
| Tenzaparin (Innheep ™) | Лечение DVT | 175 Международных единиц Анти-XA /кг подкожно в день |
При их предсказуемой реакции на дозу (пиковая анти-Ха-активность возникает через 3–5 ч после инъекции) лабораторный мониторинг обычно не требуется. Мониторинг анти-Ха является вариантом в популяциях пациентов с высоким риском (почечная недостаточность, ожирение, беременность, несоблюдение режима лечения), где может потребоваться коррекция дозы для адаптации терапии. В этих случаях уровни анти-Ха в плазме определяются через 4 часа после введения, а последующая дозировка корректируется до пиковых целевых уровней 0,5–1,1 МЕ/мл [26, 27]. Тесты анти-Ха следует контролировать и интерпретировать в зависимости от производителя конкретного используемого НМГ.
Мониторинг анти-Ха является вариантом в популяциях пациентов с высоким риском (почечная недостаточность, ожирение, беременность, несоблюдение режима лечения), где может потребоваться коррекция дозы для адаптации терапии. В этих случаях уровни анти-Ха в плазме определяются через 4 часа после введения, а последующая дозировка корректируется до пиковых целевых уровней 0,5–1,1 МЕ/мл [26, 27]. Тесты анти-Ха следует контролировать и интерпретировать в зависимости от производителя конкретного используемого НМГ.
Клинические показания
Для соматических заболеваний и послеоперационных пациентов, нуждающихся в парентеральной профилактике ВТЭ, НМГ стали подходящей заменой НФГ [28, 29].НМГ требуют меньше инъекций и вызывают меньше побочных эффектов. У госпитализированных пациентов, получающих тромбопрофилактику, НМГ ассоциировался с более низким риском тромбоза глубоких вен (ТГВ), меньшим количеством гематом в месте инъекции и отсутствием различий в частоте кровотечений по сравнению с НФГ [30]. НМГ в значительной степени заменили внутривенный НФГ у пациентов с острой ВТЭ, которые могут продолжать терапию без наблюдения в амбулаторных условиях [31]. При ОКС у пациентов с инфарктом миокарда с подъемом сегмента ST, получавших фибринолиз и НМГ, наблюдалась более низкая частота летального исхода или нефатального повторного инфаркта миокарда, но более высокая частота массивных кровотечений, чем у пациентов, получавших фибринолиз и НФГ [32].Аналогичным образом, при нестабильной стенокардии/инфаркте миокарда без подъема сегмента ST терапия НМГ снижала частоту смерти, инфаркта миокарда или срочной реваскуляризации по сравнению с НФГ [33].
НМГ в значительной степени заменили внутривенный НФГ у пациентов с острой ВТЭ, которые могут продолжать терапию без наблюдения в амбулаторных условиях [31]. При ОКС у пациентов с инфарктом миокарда с подъемом сегмента ST, получавших фибринолиз и НМГ, наблюдалась более низкая частота летального исхода или нефатального повторного инфаркта миокарда, но более высокая частота массивных кровотечений, чем у пациентов, получавших фибринолиз и НФГ [32].Аналогичным образом, при нестабильной стенокардии/инфаркте миокарда без подъема сегмента ST терапия НМГ снижала частоту смерти, инфаркта миокарда или срочной реваскуляризации по сравнению с НФГ [33].
Осложнения и обратимость эффекта
Кровотечение является основным осложнением НМГ, при этом некоторые данные подтверждают снижение частоты кровотечений по сравнению с НФГ. Сообщается о частоте фатальных кровотечений у 0–0,8 % и больших кровотечений у 0–3 % пациентов [16]. В хирургических условиях оценка периоперационного риска тромбоэмболии, оценка риска кровотечения и предпочтения врача будут играть роль в определении того, следует ли продолжить профилактическое дозирование НМГ. Для пациентов, получающих терапевтические дозы НМГ, следует рассмотреть вопрос о прекращении лечения за 12–24 часа до процедуры или дольше у пациентов с почечной дисфункцией. Терапевтические дозы НМГ не следует возобновлять в течение 24 ч после обширной процедуры или после нейроаксиальной анестезии [19, 32].
Для пациентов, получающих терапевтические дозы НМГ, следует рассмотреть вопрос о прекращении лечения за 12–24 часа до процедуры или дольше у пациентов с почечной дисфункцией. Терапевтические дозы НМГ не следует возобновлять в течение 24 ч после обширной процедуры или после нейроаксиальной анестезии [19, 32].
При передозировке или угрожающем жизни кровотечении протамин вводят в/в. Протамин не полностью обращает НМГ, но может нейтрализовать эффект АТ. Поскольку более длинные цепи гепарина связываются с протамином, протамин полностью меняет активность НМГ против фактора IIa, но только 60 % активности против фактора Ха.Если требуется немедленная реверсия в течение 8 часов после введения НМГ, доза протамина 1 мг нейтрализует 100 ЕД анти-Ха или 1 мг НМГ. Если кровотечение продолжается, можно ввести вторую дозу протамина 0,5 мг на 100 ЕД анти-Ха. Меньшие дозы протамина требуются, если интервал введения НМГ превышает 8 часов [34, 35].
ГИТ и ГИТ с тромбозом (ГИТТ) являются иммуноопосредованными заболеваниями, возникающими в результате образования антител против комплекса гепарин-тромбоцитарный фактор IV.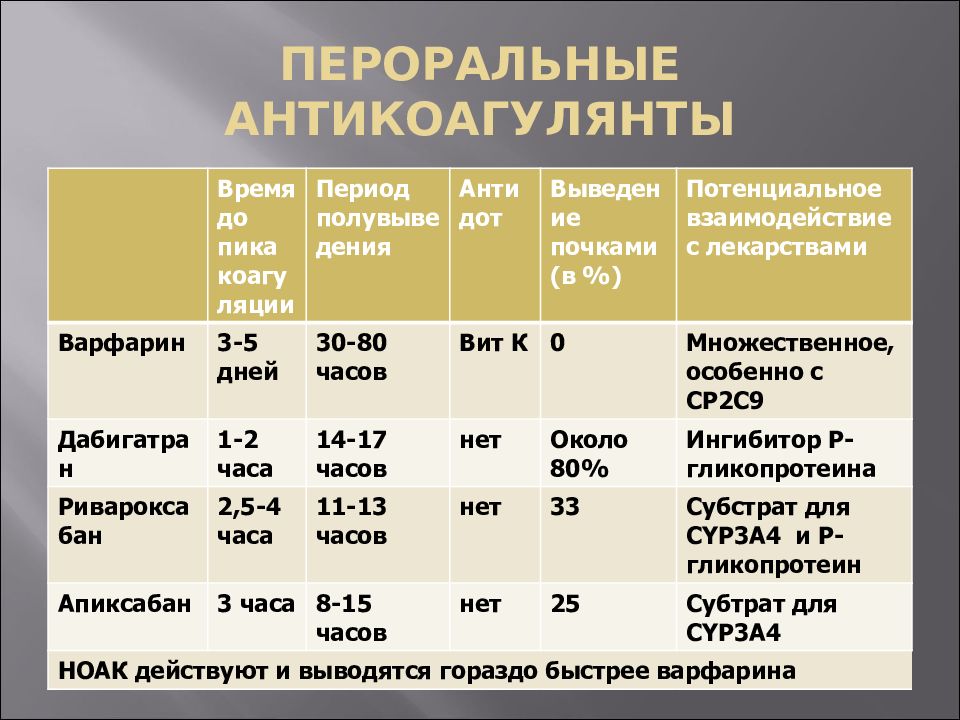 Частота ГИТТ у пациентов в критическом состоянии колеблется от 1 до 5 % и связана с развитием тромбоцитопении и опасного для жизни тромбоза примерно у 30–50 % ГИТ-положительных пациентов [36]. Этот иммунно-опосредованный ответ обычно возникает у пациентов, подвергавшихся воздействию НФГ или НМГ в течение 5–7 дней или раньше, если пациент ранее подвергался воздействию. Снижение количества тромбоцитов на 50 %, происходящее через 4–10 дней после начала терапии НФГ или НМГ, или образование нового тромба на фоне антикоагулянтной терапии может свидетельствовать о ГИТ.Количество тромбоцитов следует измерять до начала приема НФГ или НМГ и контролировать через день в течение первых 4–10 дней терапии. Частота ГИТ при НМГ примерно на одну десятую ниже, чем при НФГ [37]. При наличии аллергии на ГИТ или при выявлении положительных антител к ГИТ НМГ нельзя использовать из-за перекрестной реактивности между гликозаминогликанами. Прямые ингибиторы тромбина (ПИТ) являются препаратами выбора для пациентов с ГИТ или ГИТТ [38, 39].
Частота ГИТТ у пациентов в критическом состоянии колеблется от 1 до 5 % и связана с развитием тромбоцитопении и опасного для жизни тромбоза примерно у 30–50 % ГИТ-положительных пациентов [36]. Этот иммунно-опосредованный ответ обычно возникает у пациентов, подвергавшихся воздействию НФГ или НМГ в течение 5–7 дней или раньше, если пациент ранее подвергался воздействию. Снижение количества тромбоцитов на 50 %, происходящее через 4–10 дней после начала терапии НФГ или НМГ, или образование нового тромба на фоне антикоагулянтной терапии может свидетельствовать о ГИТ.Количество тромбоцитов следует измерять до начала приема НФГ или НМГ и контролировать через день в течение первых 4–10 дней терапии. Частота ГИТ при НМГ примерно на одну десятую ниже, чем при НФГ [37]. При наличии аллергии на ГИТ или при выявлении положительных антител к ГИТ НМГ нельзя использовать из-за перекрестной реактивности между гликозаминогликанами. Прямые ингибиторы тромбина (ПИТ) являются препаратами выбора для пациентов с ГИТ или ГИТТ [38, 39].
Остеопороз, как сообщается, возникает реже у пациентов, получающих НМГ, по сравнению с НФГ, и обычно связан с длительной терапией [6••].
Фондапаринукс
Фармакодинамика и мониторинг
После подкожного введения фондапаринукс быстро и полностью всасывается, его период полувыведения составляет 17–21 час у пациентов с нормальной функцией почек [6••]. Фондапаринукс выводится преимущественно с мочой в неизмененном виде, клиренс снижается у пациентов с почечной недостаточностью. Подобно НМГ, с предсказуемой фармакокинетикой, мониторинг уровня анти-Ха не рекомендуется во время введения фондапаринукса.
Клинические показания
Было доказано, что Фондапаринукс не менее безопасен и эффективен для лечения ТГВ и тромбоэмболии легочной артерии (ТЭЛА), чем НМГ и НФГ соответственно [40, 41] (таблица ).Фондапаринукс широко изучался для профилактики тромбообразования у соматически больных и хирургических больных [42, 43]. В трех исследованиях фондапаринукс продемонстрировал превосходную эффективность в снижении ВТЭ у пациентов, перенесших эндопротезирование коленного сустава, эндопротезирование тазобедренного сустава и операцию по поводу перелома шейки бедра [44–46]. В комбинированном анализе общая частота больших кровотечений была статистически выше при применении фондапаринукса (2,7%) по сравнению с НМГ (1,7%) [47]. Однако частота клинически значимого кровотечения, определяемого как кровотечение, приводящее к смерти, повторной операции или происходящее в критическом органе, не различалась между агентами.Различия в результатах эффективности и безопасности могут быть связаны с дозировкой, а также со временем периоперационного введения препарата. Введение фондапаринукса менее чем через 6 часов после операции было связано с увеличением частоты больших кровотечений [48]. Пациентам с риском кровотечения может быть рекомендовано проведение терапии в течение как минимум 6 ч после процедуры. Фондапаринукс может быть потенциальным вариантом тромбопрофилактики при аллергии на ГИТ, но убедительных данных нет [49].Хотя фондапаринукс изучался при ОКС, он не получил одобрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA).
В комбинированном анализе общая частота больших кровотечений была статистически выше при применении фондапаринукса (2,7%) по сравнению с НМГ (1,7%) [47]. Однако частота клинически значимого кровотечения, определяемого как кровотечение, приводящее к смерти, повторной операции или происходящее в критическом органе, не различалась между агентами.Различия в результатах эффективности и безопасности могут быть связаны с дозировкой, а также со временем периоперационного введения препарата. Введение фондапаринукса менее чем через 6 часов после операции было связано с увеличением частоты больших кровотечений [48]. Пациентам с риском кровотечения может быть рекомендовано проведение терапии в течение как минимум 6 ч после процедуры. Фондапаринукс может быть потенциальным вариантом тромбопрофилактики при аллергии на ГИТ, но убедительных данных нет [49].Хотя фондапаринукс изучался при ОКС, он не получил одобрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA).
Таблица 4
Клиническое использование FondapariNux
| Препарат | Показания | Дозирование, время, продолжительность | Мониторинг | Меры предосторожности |
|---|---|---|---|---|
| FondapariNux (Arixtra ™) | Лечение VTE [ 2, 10] Курс лечения 5–9 дней; продолжать лечение до достижения терапевтического эффекта пероральных антикоагулянтов | <50 кг: 5 мг подкожно ежедневно 50–100 кг: 7.5 мг подкожно ежедневно >100 мг кг: 10 мг подкожно ежедневно [2, 10] | ОАК Креатинин сыворотки Признаки и симптомы кровотечения Анти-Ха, у пациентов со значительным нарушением функции почек с кровотечением или аномальными параметрами коагуляции, беременные пациенты, пациенты с ожирением или с низким весом и дети Функция печени | Постоянный эпидуральный катетер Недавняя операция на позвоночнике или в офтальмологической хирургии История недавнего большого кровотечения (желудочно-кишечного, внутричерепного и т. Врожденные или приобретенные нарушения свертываемости крови |
Почечная недостаточность CrCl 50–80 мл/мин — снижение общего клиренса на 25 %; рассмотреть возможность эмпирического снижения дозы CrCl 30–50 мл/мин — снижение общего клиренса на 40 %; Рассмотрим эмпирическое сокращение дозировки CRCL менее 30 мл / мин-противопоказаний | ||||
| лечение стеблевых и NStemi A | A2,5 мг SC Daily | |||
| Профилактика VTE в основной хирургии и острые медицинские средства | 2.5 мг подкожно ежедневно |
Осложнения и изменение эффекта
Фондапаринукс противопоказан пациентам с тяжелой почечной недостаточностью (расчетный клиренс креатинина менее 30 мл/мин). Фондапаринукс не следует использовать для профилактики ВТЭ у пациентов с массой тела менее 50 кг. Реверсия фондапаринукса дополнительно осложняется его длительным периодом полувыведения [50]. Хотя специфического антидота для кровотечений, связанных с фондапаринуксом, не существует, введение рекомбинантного активированного фактора VII (rFVIIa) может нормализовать время свертывания крови и образование тромбина [51].
Фондапаринукс не следует использовать для профилактики ВТЭ у пациентов с массой тела менее 50 кг. Реверсия фондапаринукса дополнительно осложняется его длительным периодом полувыведения [50]. Хотя специфического антидота для кровотечений, связанных с фондапаринуксом, не существует, введение рекомбинантного активированного фактора VII (rFVIIa) может нормализовать время свертывания крови и образование тромбина [51].
Прямые ингибиторы тромбина (DTI)
DTI оказывают антитромботическое действие за счет прямого, селективного и обратимого связывания с активным центром тромбина. Это приводит к ингибированию катализируемых или индуцированных тромбином реакций, включая образование фибрина, активацию факторов свертывания крови V, VIII, XIII, протеина С и агрегацию тромбоцитов. Аналоги гирудина, десирудин и бивалирудин, а также аргатробан являются тремя одобренными в настоящее время DTI [52].
Фармакология, фармакодинамика и мониторинг
Бивалирудин и десирудин являются синтетическими аналогами r-гирудина, которые проявляют антикоагулянтную активность за счет обратимого связывания в ферментативном каталитическом центре и анион-связывающем центре тромбина. Аргатробан, полученный из аминокислоты аргинина, представляет собой небольшой синтетический ингибитор тромбина, который обратимо нековалентно связывается с активным центром тромбина [52].
Аргатробан, полученный из аминокислоты аргинина, представляет собой небольшой синтетический ингибитор тромбина, который обратимо нековалентно связывается с активным центром тромбина [52].
DTI различаются по своим фармакокинетическим параметрам (таблица) [52]. Бивалирудин имеет самый короткий период полувыведения, что делает его особенно полезным средством в процедурном или перипроцедурном периоде. Выбор DTI часто зависит от специфических характеристик пациента, таких как возраст, нарушение функции сердца, гемодинамическая нестабильность и дисфункция печени или почек [52, 53].Пациентам в критическом состоянии обычно требуется более низкая скорость инфузии, чем рекомендовано производителем, из-за наличия сопутствующих заболеваний и дисфункции органов. DTI контролируются с помощью АЧТВ с целью в 1,5–3 раза выше контроля или исходного уровня (аргатробан), в 1,5–2,5 раза выше контроля (бивалирудин) (таблица). Дезирудин не требует рутинного контроля коагуляции. Уровень АЧТВ следует измерять каждые 6 ч, пока у пациента не будут достигнуты устойчивые терапевтические уровни, после чего частоту мониторинга можно увеличить. Из-за несоответствий в измерениях АЧТВ было показано, что разбавленное тромбиновое время плазмы является альтернативой мониторингу уровней DTI, особенно у пациентов с ингибиторами волчанки или низкими уровнями витамин К-зависимых факторов [54].
Из-за несоответствий в измерениях АЧТВ было показано, что разбавленное тромбиновое время плазмы является альтернативой мониторингу уровней DTI, особенно у пациентов с ингибиторами волчанки или низкими уровнями витамин К-зависимых факторов [54].
Таблица 5
Таблица 5
Фармакокинетические и фармакодинамические свойства DTI
 12.13 входит в группу клинико-фармакологических указателей (КФУ) 01.12
12.13 входит в группу клинико-фармакологических указателей (КФУ) 01.12 уд. или не поставляемые на рынок РФ
уд. или не поставляемые на рынок РФ 10000 анти-Ха МЕ/1 мл: амп. 2, 5 или 10 шт., шприцы 2 или 10 шт.
10000 анти-Ха МЕ/1 мл: амп. 2, 5 или 10 шт., шприцы 2 или 10 шт. 4000 анти-Ха МЕ/0.4 мл: амп. 2, 5 или 10 шт., шприцы 2 или 10 шт.
4000 анти-Ха МЕ/0.4 мл: амп. 2, 5 или 10 шт., шприцы 2 или 10 шт. 8000 анти-Ха МЕ/0.8 мл: амп. 2, 5 или 10 шт., шприцы 2 или 10 шт.
8000 анти-Ха МЕ/0.8 мл: амп. 2, 5 или 10 шт., шприцы 2 или 10 шт. 4000 анти-Ха МЕ/0.4 мл: шприцы 6 шт.
4000 анти-Ха МЕ/0.4 мл: шприцы 6 шт. 2000 анти-Ха МЕ/0.2 мл: шприцы 2 или 10 шт. с защитной системой иглы или без нее
2000 анти-Ха МЕ/0.2 мл: шприцы 2 или 10 шт. с защитной системой иглы или без нее 2 тыс. анти-Ха МЕ/0.2 мл: шприцы 2 или 10 шт. или амп. 2 или 5 шт.
2 тыс. анти-Ха МЕ/0.2 мл: шприцы 2 или 10 шт. или амп. 2 или 5 шт. 10 000 анти-Xa МЕ/1 мл: шприцы 2 шт.
10 000 анти-Xa МЕ/1 мл: шприцы 2 шт. 10 000 анти-Ха МЕ/мл: шприцы 1, 2, 5 или 10 шт.; амп. 1, 2, 5 или 10 шт.
10 000 анти-Ха МЕ/мл: шприцы 1, 2, 5 или 10 шт.; амп. 1, 2, 5 или 10 шт. 3000 анти-Ха МЕ/0.3 мл: шприцы 1, 2, 5 или 10 шт.; амп. 1, 2, 5 или 10 шт.
3000 анти-Ха МЕ/0.3 мл: шприцы 1, 2, 5 или 10 шт.; амп. 1, 2, 5 или 10 шт. 5000 анти-Ха МЕ/0.5 мл: шприцы 1, 2, 5 или 10 шт.; амп. 1, 2, 5 или 10 шт.
5000 анти-Ха МЕ/0.5 мл: шприцы 1, 2, 5 или 10 шт.; амп. 1, 2, 5 или 10 шт. 7000 анти-Ха МЕ/0.7 мл: шприцы 1, 2, 5 или 10 шт.; амп. 1, 2, 5 или 10 шт.
7000 анти-Ха МЕ/0.7 мл: шприцы 1, 2, 5 или 10 шт.; амп. 1, 2, 5 или 10 шт. анти-Xa МЕ/мл: шприцы 2 или 10 шт.
анти-Xa МЕ/мл: шприцы 2 или 10 шт.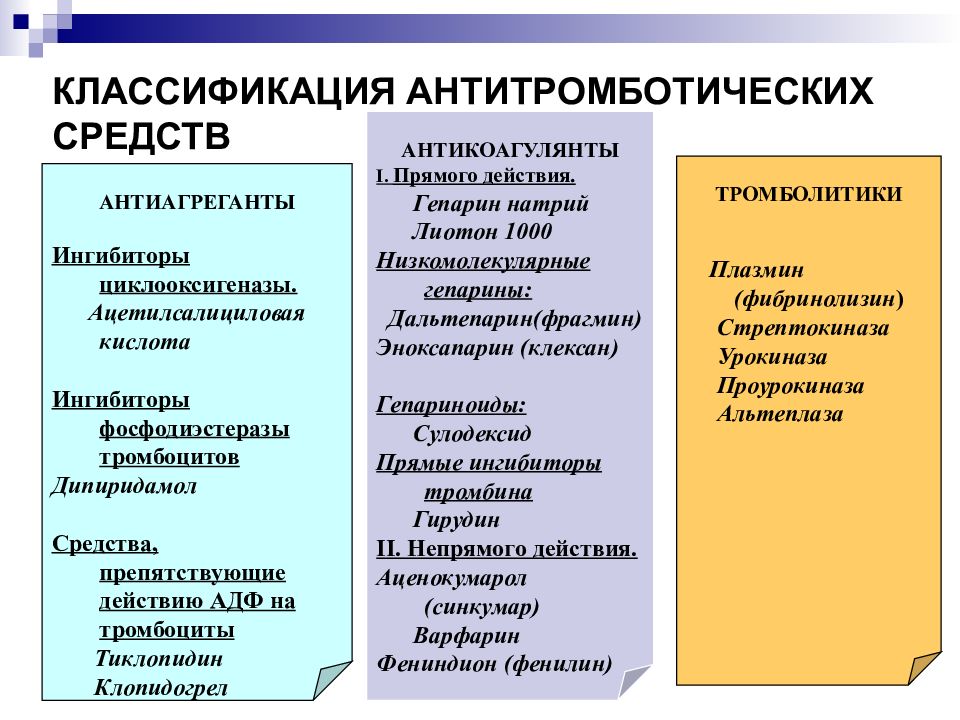 анти-Xa МЕ/0.4 мл: шприцы 2 или 10 шт.
анти-Xa МЕ/0.4 мл: шприцы 2 или 10 шт. анти-Xa МЕ/0.8 мл: шприцы 2 или 10 шт.
анти-Xa МЕ/0.8 мл: шприцы 2 или 10 шт. 2 мл: шприцы 2, 6 или 10 шт.
2 мл: шприцы 2, 6 или 10 шт. 6 мл: шприцы 2, 6 или 10 шт.
6 мл: шприцы 2, 6 или 10 шт. 2 мл: амп. 2, 5, 6,10,15 или 20 шт.
2 мл: амп. 2, 5, 6,10,15 или 20 шт. 8 мл: амп. 2, 5, 6,10,15 или 20 шт.
8 мл: амп. 2, 5, 6,10,15 или 20 шт. 09.20
09.20
 2.5 мг: 50 или 100 шт.
2.5 мг: 50 или 100 шт. 2.5 мг: 5, 10, 14, 15, 20, 25, 28, 30, 40, 42, 50, 56, 60, 70, 75, 80, 100, 125, 140, 200 или 250 шт.
2.5 мг: 5, 10, 14, 15, 20, 25, 28, 30, 40, 42, 50, 56, 60, 70, 75, 80, 100, 125, 140, 200 или 250 шт. 01.09
Дата перерегистрации: 30.05.19
01.09
Дата перерегистрации: 30.05.19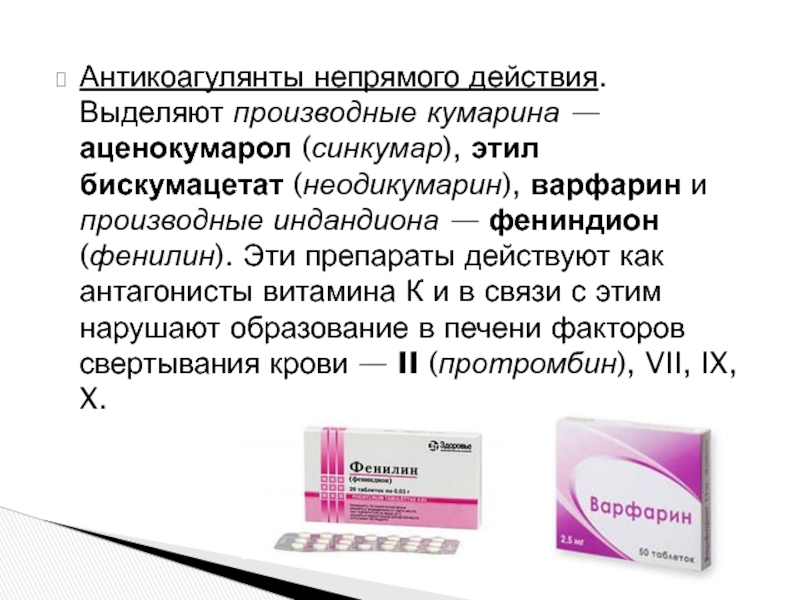 5 мл: шприц 5 шт.
5 мл: шприц 5 шт. 72 мл: шприц 5 шт.
72 мл: шприц 5 шт. 2 мл: шприц 10 шт.
2 мл: шприц 10 шт. 3 мл 2 или 10 шт.
3 мл 2 или 10 шт. 9 мл 2 или 10 шт.
9 мл 2 или 10 шт. 2 мл, 0.3 мл, 0.4 мл, 0.5 мл, 0.6 мл, 0.7 мл, 0.8 мл или 1 мл амп. 2, 5, 10, 15 или 20 шт.
2 мл, 0.3 мл, 0.4 мл, 0.5 мл, 0.6 мл, 0.7 мл, 0.8 мл или 1 мл амп. 2, 5, 10, 15 или 20 шт.
 , покр. пленочной оболочкой, 15 мг: 10, 14, 20, 28, 30, 50, 56, 98 или 100 шт.
, покр. пленочной оболочкой, 15 мг: 10, 14, 20, 28, 30, 50, 56, 98 или 100 шт.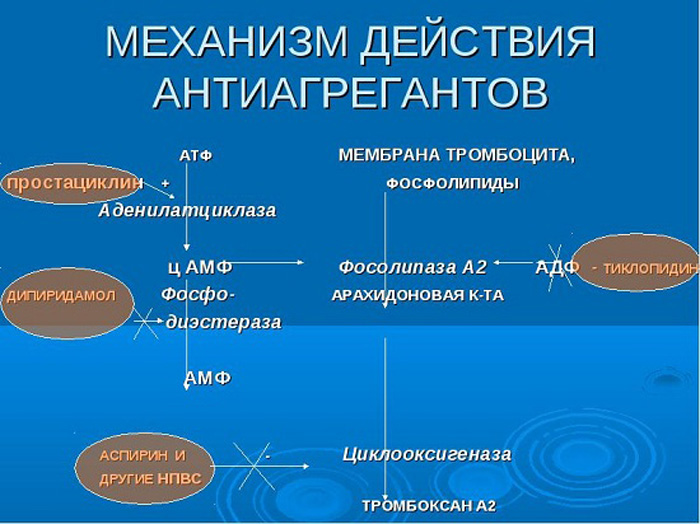 , покр. пленочной оболочкой, 15 мг: 10, 14, 20, 21, 28, 30, 35, 40, 42, 49, 50, 56, 60, 63, 70, 80, 84, 90, 98, 100, 112, 120 или 126 шт.
, покр. пленочной оболочкой, 15 мг: 10, 14, 20, 21, 28, 30, 35, 40, 42, 49, 50, 56, 60, 63, 70, 80, 84, 90, 98, 100, 112, 120 или 126 шт. .)
.)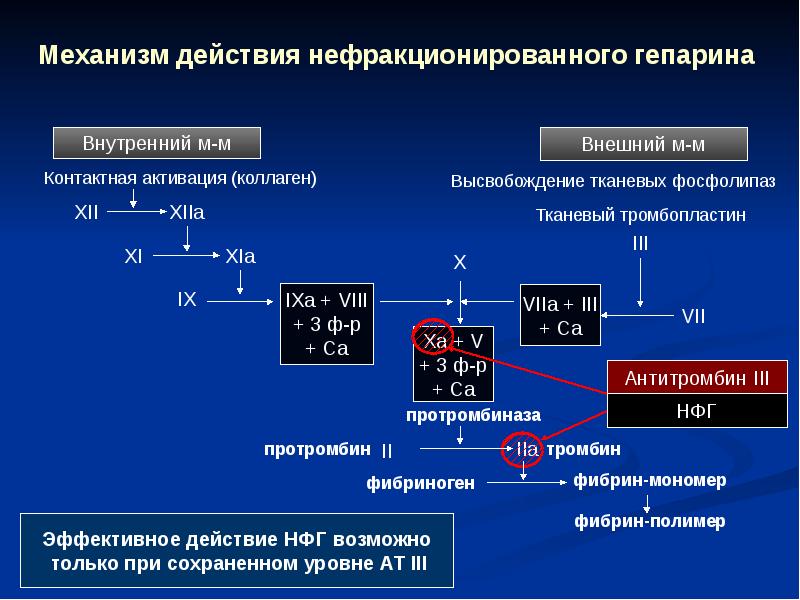
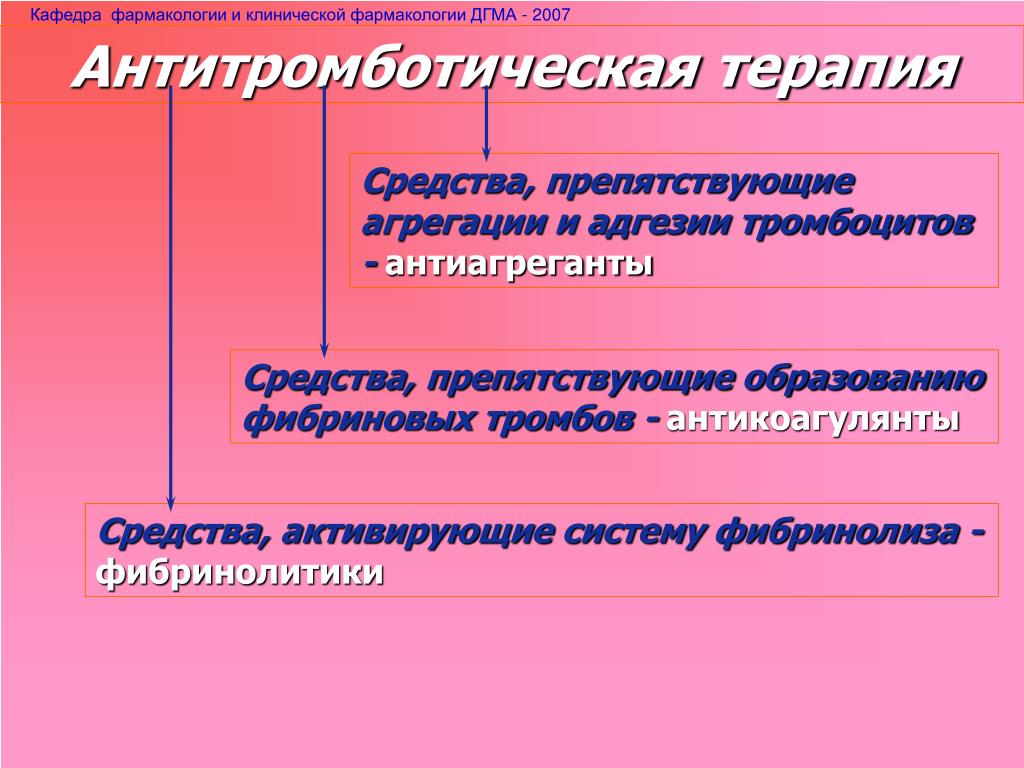 п.Врожденные или приобретенные нарушения свертываемости крови кг/ч следует учитывать; уменьшение болюсной дозы не требуется
п.Врожденные или приобретенные нарушения свертываемости крови кг/ч следует учитывать; уменьшение болюсной дозы не требуется Повторите МНО через 4–6 часов, если МНО ниже желаемого диапазона, возобновите инфузию аргатробана
Повторите МНО через 4–6 часов, если МНО ниже желаемого диапазона, возобновите инфузию аргатробана .
.
 Большие начальные дозы подавляют протеины С и S, вызывая реакцию гиперкоагуляции, что связано с избыточной антикоагулянтной терапией и более высокой частотой кровотечений.
Большие начальные дозы подавляют протеины С и S, вызывая реакцию гиперкоагуляции, что связано с избыточной антикоагулянтной терапией и более высокой частотой кровотечений.