Т-хелперы, цитокины и молекулярные шрамы
Мы продолжаем наш спецпроект по псориазу. Составить общее представление об этом распространенном заболевании позволяет первая статья цикла. А в этот раз мы расскажем о молекулярных механизмах, из-за которых возникают псориатические высыпания, о тонких взаимодействиях между клетками кожи и иммунными клетками, приводящих к развитию болезни, о молекулах, с помощью которых клетки передают друг другу сигналы об опасности, и о молекулярных шрамах, которые заметны в клетках кожи даже тогда, когда, казалось бы, все симптомы заболевания исчезли.

Cпецпроект посвящен генетическому кожному заболеванию, от которого страдает около 1% россиян. В статьях спецпроекта мы стараемся подробно, достоверно и интересно осветить это заболевание со всех возможных сторон. В этом нам помогают наши рецензенты: специалист по псориазу, кандидат биологических наук Алёна Золотаренко и врач-дерматовенеролог, кандидат медицинских наук Михаил Бетехтин.
Введение
Согласно современным представлениям, псориаз — многофакторная болезнь, которая развивается у людей с генетической предрасположенностью под воздействием внешней среды. До сих пор патогенез псориаза полностью не изучен, но за последние десятилетия ученые далеко продвинулись в его исследовании: нашли объяснения ранее наблюдаемым клиническим феноменам, установили механизмы взаимодействия клеток иммунной системы и клеток кожи, выявили взаимосвязь патогенеза псориаза и других заболеваний. Эта статья посвящена патогенезу псориаза; генетический и эпигенетический аспекты заболевания будут описаны отдельно.
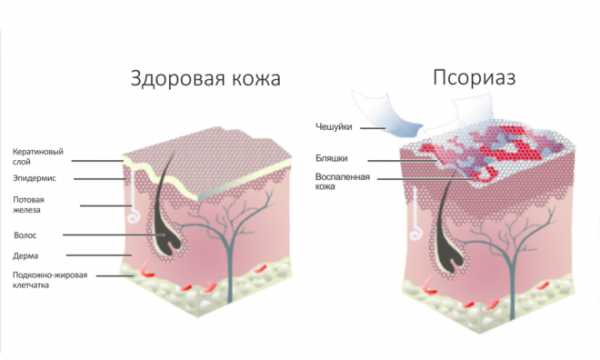
Как уже говорилось во вводной статье [1], при псориазе у больных на коже возникают приподнятые покрасневшие участки — бляшки. Их появление связано с двумя процессами: воспалением в коже
и гиперплазией (разрастанием) эпителия. Судя по всему, причина этому — разрегулировка взаимодействия иммунной системы с клетками кожи [2]. Поэтому для того чтобы понять патогенез псориаза, вначале необходимо немного узнать об особенностях строения кожи и принципах работы иммунной системы.Кожа, в которой я живу
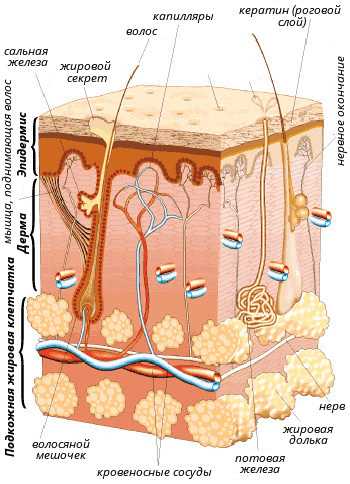
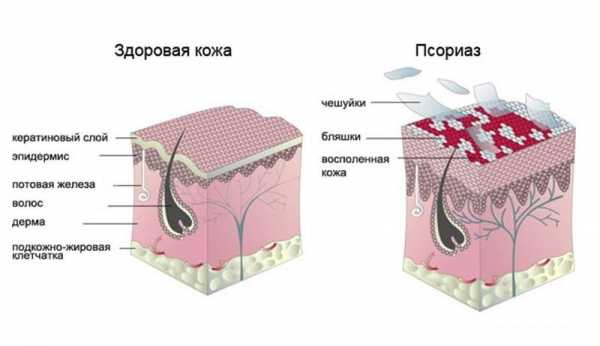
Рисунок 1. Строение кожи.
Кожа — самый крупный орган человека. С учетом подкожной жировой клетчатки она составляет до 17% от массы тела.
Кожа состоит из трех основных частей (рис. 1).
- Эпидермис — это именно та поверхностная часть кожи, доступная нашему взору, которая шелушится после солнечного ожога или образует мозоли после механического воздействия. Благодаря эпидермису формируется защитный барьер организма от патогенных бактерий, грибов, вирусов, температуры, ультрафиолетового излучения, потери воды и механических повреждений. Эпидермис образован несколькими типами клеток, но самый распространенный тип (до 90% от общего количества) —
Также в эпидермисе находятся клетки меланоциты, синтезирующие пигмент меланин, ответственный за защиту кожи от УФ-лучей, и иммунные клетки (прежде всего дендритные), первыми встречающие инфекционные и неинфекционные агенты, внедрившиеся в кожу. - Дерма — более глубокая часть кожи, отделенная от эпидермиса тонкой пластинкой базальной мембраны, образованная кровеносными сосудами и структурными белками (прежде всего коллагеном и эластином). Дерма состоит из двух слоев: сосочкового, богатого питающими сосудами, и сетчатого, богатого белками, отвечающими за прочность и эластичность кожи. Главные и самые многочисленные клетки этой части кожи — фибробласты, выделяющие коллаген и эластин. Также в дерме присутствуют единичные меланоциты и некоторые иммунные клетки, прежде всего макрофаги.
- Гиподерма — подкожная жировая клетчатка, образованная клетками
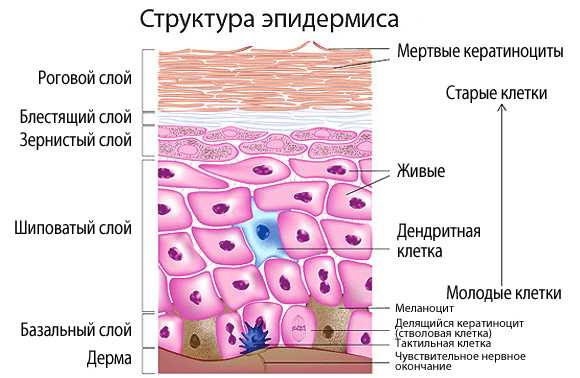
Рисунок 2. Пять слоев эпидермиса.
Также в коже находятся сальные и потовые железы, открывающие свои протоки на ее поверхности, волосяные фолликулы, нервные волокна и нервные окончания.
На защите организма
Иммунная система — это система органов и клеток, которые защищают организм от патогенов: вирусов, бактерий, простейших, гельминтов и так далее. Ежедневно организм сталкивается с миллионами микробов, многие из которых являются патогенами, но благодаря иммунным реакциям болезни развиваются редко. Иммунная система потому так хорошо дерется с врагами, что очень точно умеет их определять: она может распознавать характерные кусочки молекул напавших на нее патогенов, в основном, веществ, которыми они покрыты. Такие кусочки называются антигенами.
Для того чтобы общаться друг с другом, иммунные клетки выделяют особые информационные молекулы — цитокины. Цитокины могут быть как возбуждающими («на нас напали, свистать всех наверх!»), так и тормозящими («ложная тревога, возвращаемся к мирной жизни!»). В принципе, цитокины могут выделяться всеми клетками организма, но иммунные клетки общаются на языке цитокинов особенно активно. Ниже в таблице перечислены основные группы цитокинов и их функции.
| Название | Функция | Некоторые представители* | |||||
|---|---|---|---|---|---|---|---|
| Интерфероны | Группа молекул, выделяемых клетками в ответ на вторжение вируса; обладают сходными свойствами и противовирусным действием | Интерфероны альфа (IFN-α), бета (IFN-β), гамма (IFN-γ) | |||||
| Хемокины | Небольшие белки, продуцируемые в клетках и тканях при появлении патогена; стимулируют миграцию, адгезию и активацию клеток | CXC, CC, CX3C, XC | |||||
| Факторы некроза опухоли | Белки, синтезируемые главным образом моноцитами и макрофагами; вызывают некроз опухолевых клеток и усиливают иммунный ответ | Факторы некроза опухоли альфа (ФНО-α), бета (ФНО-β, он же — лимфотоксин-α) | |||||
| Интерлейкины | Растворимые пептиды, синтезируемые в основном Т-лимфоцитами; изолированно стимулируют группы клеток к делению или дифференцировке. Обладают про- и противовоспалительными эффектами в зависимости от интерлейкина и от клетки | IL-6, IL-17, IL-23 | |||||
| Гемопоэтины | Группа молекул со сходными свойствами; стимулируют размножение и дифференцировку клеток крови | Колониестимулирующие факторы (CSF) | |||||
| Трансформирующие факторы роста | Белки, контролирующие пролиферацию, клеточную дифференцировку и другие функции в большинстве клеток, включая иммунные | Трансформирующий фактор роста альфа (TGF-α), бета (TGF-β) | |||||
| * Некоторые цитокины обладают множественным действием и могут относиться сразу к нескольким группам (например, IL-8 — это хемокин CXCL8, а IL-2–4 влияют на гемопоэз) | |||||||
Выделяют два вида иммунитета: врожденный и приобретенный.
- Врожденный иммунитет — сумма всех эволюционно древних иммунных клеток (среди них макрофаги, дендритные клетки, гранулоциты крови и др.) и молекул (противомикробные пептиды, лизоцим, особая группа белков под названием «система комплемента» и др.). Клетки врожденного иммунитета умеют неспецифически (по антигенам, общим для разных групп чужеродных агентов) распознавать патогены и, привлекая другие иммунные клетки и молекулы, немедленно уничтожать их. В патогенезе псориаза особенно большое значение имеют два типа клеток врожденного иммунитета:
Хотя врожденный иммунитет незаменим для быстрой реакции на врага, но его работе не хватает специфичности: в том случае, если в организме очень сильно размножится, например, какая-нибудь одна бактерия, то врожденный иммунитет в борьбе с нею проиграет — она победит числом. С другой стороны, если организм будет одинаково активно реагировать на чуму и на обычную «простуду», это тоже ни к чему хорошему не приведет. Поэтому следующим этапом эволюции иммунной системы стало появление приобретенного (адаптивного) иммунитета. - Клетки приобретенного иммунитета распознают куда более специфичные антигены. Если клетки врожденного иммунитета в состоянии понять: «наш враг — какая-то бактерия», — то клетки приобретенного подмечают: «на нас напала бактерия, на поверхности которой есть такой-то и такой-то антиген», — что, согласитесь, куда полезнее для победы над врагом. Кроме того, у приобретенного иммунитета есть так называемая иммунологическая память, «черный список», где фиксируются антигены всех когда-либо покушавшихся на целостность организма патогенов (кстати: на феномене иммунологической памяти основано действие прививок).
Боевая единица приобретенного иммунитета — особые иммунные клетки, лимфоциты. Их два вида: В- и Т-лимфоциты.
B-лимфоциты — это, можно сказать, артиллеристы иммунитета. Один из подтипов В-лимфоцитов — плазматические клетки, которые умеют вырабатывать специальные белки против антигенов — антитела. Антитела налипают на антигены, облепляют патогены со всех сторон и делают их более уязвимыми — прежде всего, привлекая к ним клетки врожденного иммунитета, макрофаги, которые узнают антитела и благополучно съедают такие патогены.
Что до Т-лимфоцитов- Т-киллеры убивают те клетки, которые были помечены организмом как «неправильные» — например, зараженные вирусами или опухолевые;
- Т-хелперы раздают указания другим иммунным клеткам о том, как нужно работать. Есть разные группы (популяции) Т-хелперов: так, Т-хелперы 1 типа (Th2) подстегивают Т-киллеров. Т-хелперы 2 типа (Th3) вызывают к бою В-лимфоциты; в случае псориаза большое значение имеют Th2, а также еще один подвид Т-хелперов — Th27.
- Т-супрессоры нужны, чтобы успокоить не в меру разбушевавшихся коллег. Они регулируют баланс между активацией и торможением иммунного ответа. Т-супрессоры либо непосредственно взаимодействуют с другими клетками, либо с помощью цитокинов посылают им сигнал торможения и таким образом замедляют или останавливают иммунный ответ. Важность Т-супрессоров демонстрирует тот факт, что развитие хронических инфекций и опухолей связано с их повышенной активностью, а аутоиммунных болезней (когда родной иммунитет восстает против здоровых клеток) — со сниженной.
Связующее звено между врожденным и приобретенным иммунитетами — особые клетки врожденного иммунитета, дендритные. Они встречают патоген, захватывают его, «разбирают» на антигены и мигрируют вместе с ними в ближайший лимфатический узел, где передают информацию о них другим иммунным клеткам. Запускается иммунный ответ, Т-хелперы вызывают к бою Т-киллеры и В-лимфоциты, из наивных Т-клеток созревают популяции Th2, Th3 и Th27, и иммунная реакция разворачивается на полную катушку. И, как уже говорилось, в патогенезе псориаза дендритные клетки играют одну из главных ролей.
Начало: что запускает псориаз
При наличии у человека генетической предрасположенности достаточно небольшого толчка, чтобы запустить развитие псориаза. Сейчас хорошо изучено несколько триггеров, приводящих к проявлению этого заболевания. Их мы и рассмотрим в этом разделе.
Стрептококк и мимикрия
Как уже говорилось во вводной статье «Псориаз: на войне с собственной кожей» [1], псориаз часто возникает после того, как человек переболел стрептококковой инфекцией, например, ангиной. И связано это, видимо, с тем, что стрептококки продуцируют М-протеин — белок, похожий по структуре на белки нормальных кератиноцитов [3]. Иммунные клетки, «разбуженные» стрептококком и «натасканные» на антигены М-протеина, после победы над инфекцией продолжают сторожить границы организма и искать эти антигены. Их они и находят на поверхности кератиноцитов, принимают многочисленные безвредные кератиноциты за опасного стрептококка, бьют в набат (ведь, по их данным, на организм напала многочисленная армия опаснейших возбудителей), запускают в коже иммунный ответ и вызывают псориатические высыпания. Такое явление — когда антиген на поверхности микроорганизма очень похож на поверхностный белок нормальных клеток макроорганизма — называется молекулярной мимикрией. Иммунная система, введенная мимикрией в заблуждение, дает осечку, принимает сотрудников за оккупантов и запускает иммунный ответ там, где он вовсе не нужен.
Дисбиоз и искажение иммунного ответа
Люди живут в гармонии с более чем десятью тысячами видов микроорганизмов и вирусов [4]. Иногда эти создания приносят организму прямую пользу (например, кишечная микробиота допереваривает то, что не смог переварить желудочно-кишечный тракт). Но выгода от микробов этим не ограничивается. Они постоянно держат иммунную систему в тонусе, выступают как бы тренажерами, на которых иммунные клетки учатся распознавать антигены. И микробиота поверхности кожи здесь играет одну из основных ролей [5].
Иногда благополучие нормальной поверхностной микрофлоры кожи нарушается активным размножением «непривычных», хотя и не всегда вредных, микроорганизмов — развивается дисбиоз. Дисбиоз на одном участке кожи влечет за собой изменения в нормальной микробиоте на других участках кожи и слизистых. В результате иммунная система, лишенная привычных «тренажеров», начинает работать со сбоями. Нарушается иммунное распознавание, что, видимо, и приводит к развитию некоторых заболеваний, в частности псориаза и воспалительных болезней кишечника. Подтверждением этой гипотезы служит, например, тот факт, что у больных псориазом в кожной микробиоте повышено количество определенных микроорганизмов — фирмикутов и актинобактерий [6]. Видимо, разбалансировка состава микробиоты, пусть и безвредной, «будит» дендритные клетки, а те запускают снежный ком реакций, приводящих к появлению псориатической сыпи. Правда, в этой истории трудно понять, где здесь причина, а где следствие. Возможно, что именно развитие псориаза «перекашивает» состав микробиоты.
Травма, сигналы опасности и воспаление
Многовековые клинические наблюдения показывают, что часто псориаз развивается и обостряется в ответ на травму — царапину, рану, пирсинг и так далее. Это явление называется феноменом Кебнера. Для него есть объяснение на молекулярном уровне. Погибшие из-за травмы клетки выделяют в окружающую среду особые молекулы, так называемые сигналы опасности. Эти молекулы связываются с рецепторами на поверхности клеток врожденного иммунитета и активируют запуск сигнальных каскадов воспаления, которые приводят к тому, что иммунные клетки начинают выделять много провоспалительных цитокинов, активирующих всё новые клетки — как иммунные, так и кератиноциты. Так запускается воспаление. Вообще, воспаление — совершенно нормальный процесс, который необходим организму — например, чтобы в ранках не развивались бактерии, чтобы кожа поскорее восстанавливалась. Но при наличии генетической предрасположенности воспаление развивается неконтролируемо, кератиноциты делятся слишком активно, их накапливается всё больше (а иммунные клетки продолжают подстегивать их делиться еще и еще) — что и приводит к формированию псориатической бляшки. И специфический антиген здесь не обязателен: любое нарушение целостности кожи вызывает «сигнал опасности», который у людей, генетически склонных к такому неконтролируемому воспалению, может привести к развитию или обострению псориаза.
Боль и дендритные клетки
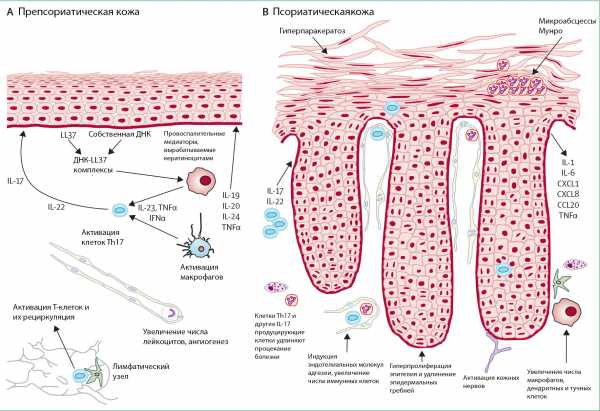
Возможно, есть и еще один механизм, вносящий вклад в патофизиологию псориаза: стимуляция бляшки нервными волокнами. Дело в том, что большое количество дендритных клеток находится в тесном контакте с кожными ноцицепторами — сенсорными нейронами, стимуляция которых вызывает ощущение боли, или иначе — нейронами, «чувствующими» механические и иные повреждения. Исследование на мышах показало, что рецепторы (ионные каналы) TRPV1 и Nav1.8 на этих нейронах могут активировать кожные дендритные клетки в экспериментально полученных высыпаниях. Дендритные клетки в ответ начинают выделять IL-23 — важный провоспалительный цитокин, который стимулирует дифференцировку самых «роковых» для псориаза лимфоцитов — Т-хелперов 17 — и таким образом усиливает псориатические высыпания (рис. 3) [7]. Иными словами, даже боль может усугублять течение псориаза.
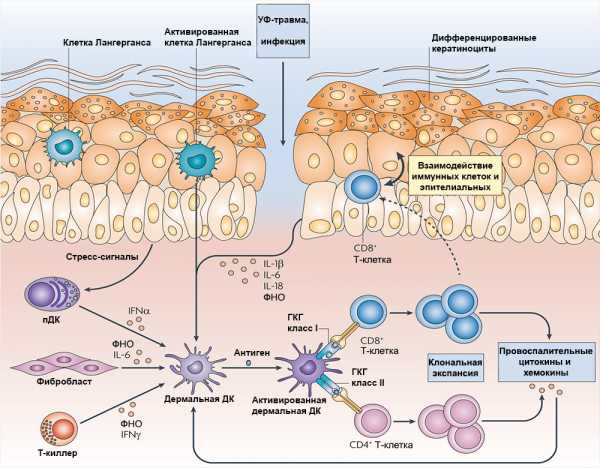
Рисунок 3. Схема работы клеток иммунной системы при псориазе. ДК — дендритные клетки; пДК — плазмацитоидные ДК; ГКГ — главный комплекс гистосовместимости; ФНО — фактор некроза опухоли; IL — интерлейкин; IFN — интерферон. Чтобы увидеть рисунок в полном размере, нажмите на него.
Что происходит с кожей при псориазе
Все вышеописанные события приводят к одному эффекту — гиперактивации иммунной системы, которая начинается, как правило, с дендритных клеток. Эти клетки выделяют различные цитокины, прежде всего, ФНО и IL-23, которые служат сигналом настолько серьезной опасности, что сильно перестраивают метаболизм других клеток и заставляют их выбрасывать всё новые и новые цитокины — идет буквально девятый вал провоспалительных молекул, и запускается воспаление. В результате нарушается нормальная жизнедеятельность практически всех типов клеток кожи. Самые многочисленные клетки кожи — кератиноциты — испытывают колоссальное давление на свои рецепторы и отвечают на воздействие гиперпролиферацией (ускоренным размножением) и продукцией новых цитокинов, а также секрецией антимикробных пептидов. В свою очередь, выделяемые кератиноцитами молекулы привлекают еще больше нейтрофилов и лимфоцитов. Так формируется положительная обратная связь: клетки иммунной системы действуют цитокинами на клетки эпидермиса, а те, в ответ на это действие, дополнительно активируют клетки иммунной системы [8]. Т-супрессоры при таком объеме работы чувствуют себя бухгалтерами, которым нужно было сдать квартальный отчет еще вчера и не могут разрулить сложившуюся патологическую ситуацию.
Гиперпролиферация кератиноцитов приводит к разрастанию эпителиальной ткани в некоторых участках — формируются псориатические бляшки. Из-за того, что размножение кератиноцитов в бляшке ускорено (их клеточный цикл сокращается с 23 до 3–5 дней), они не могут нормально дифференцироваться. Клетки, в норме теряющие свои ядра еще в зернистом слое, при псориазе сохраняют ядра даже при приближении к поверхности эпидермиса. Это явление называется паракератоз и служит диагностическим признаком псориаза. К нему присоединяются нарушения синтеза липидов, в норме скрепляющих клетки рогового слоя эпидермиса. Последнее клинически проявляется шелушением псориатических высыпаний.
Кроме воспаления и разрастания эпидермиса, есть и третий ключевой элемент патогенеза псориаза — ангионеогенез (образование новых сосудов). Воспалительная среда изменяет проницаемость сосудов и вырабатывает факторы, стимулирующие рост новых сосудов. Разрастаются новые сосуды; при этом клетки их эндотелия (внутренней оболочки) под влиянием воспалительного окружения выделяют особые цитокины — молекулы адгезии, которые привлекают в псориатическую кожу всё новые и новые лейкоциты. В то же время микроокружение растущих сосудов влияет на находящиеся в очаге воспаления T-хелперы и киллеры таким образом, что они дополнительно усиливают разрастание эпидермиса [9].
Помимо собственно эпителиальных клеток, при псориазе происходят изменения сальных желез, однако изучены они мало. При высыпаниях на волосистой части головы обычно наблюдается глубокая атрофия сальных желез с уменьшением их числа и размера, а более чем в половине случаев происходит их полная атрофия. В очагах высыпаний вперемешку встречаются как нормальные, так и атрофированные сальные железы. В остро воспаленной коже скальпа атрофия сальных желез сопровождается уменьшением диаметра волоса. В целом, хотя начальные исследования демонстрировали гистологические изменения в сальных железах, изменений в выделяемых ими липидах не выявлено. Но исследования «псориатического» профиля липидов сальных желез немногочисленны, потому необходимо и далее изучать его отличия от нормального, а также оценить перспективы модифицирования работы сальных желез как одной из терапевтических составляющих при псориазе [10].
Особенности работы иммунной системы при псориазе
Вскользь мы уже касались особенностей работы иммунной системы при псориазе, а теперь рассмотрим их подробнее.
Начнем с кератиноцитов. Хотя это не иммунные клетки, а клетки кожи, но они находятся в тесном взаимодействии с иммунитетом и при любой опасности просят иммунные клетки о помощи. Увы, в случае псориаза кератиноциты можно сравнить с гранатой, с которой чуть что срывается чека. Как уже говорилось, при гибели кератиноцитов высвобождаются «сигналы опасности» — антимикробные пептиды (в том числе LL37, S100, β-дефензины). В норме, как понятно из названия, эти пептиды направлены на борьбу с патогенами. Однако при псориазе их выделяется так много, что они привлекают избыточное внимание иммунных клеток. Антимикробные пептиды активируют иммунный ответ, повышая синтез и высвобождение различными иммунными и неиммунными клетками цитокинов IL-6, IL-10, IL-8 (CXCL8) и CXCL10, что в свою очередь привлекает в патологический очаг клетки врожденного иммунитета — нейтрофилы и макрофаги. Кстати, обилие антимикробных пептидов и иммунных клеток в очаге воспаления объясняет интересную особенность псориаза: несмотря на нарушенную структуру кожи, которая в области бляшки скорее похожа на полузажившую рану, вторичные инфекции у больных псориазом встречаются очень редко.
Кроме провоспалительных цитокинов и антимикробных пептидов кератиноциты содержат особые белковые комплексы, запускающие воспаление, — инфламмосомы (отметим в скобках, что инфламмосомы есть также у нейтрофилов и макрофагов). Один из главных белков инфламмосом — каспаза-1 — в случае опасности расщепляет вялые безынициативные предшественники цитокинов pro-IL-1 и pro-IL-8 до активных форм. Дальше начинается цепная реакция: IL-1 и IL-8 влияют на окружающие кератиноциты и инициируют продукцию одного из главных провоспалительных цитокинов — ФНО, — воспалительные реакции нарастают как снежный ком и в результате приводят к образованию и высвобождению сильных провоспалительных цитокинов IL-18 и IL-1β.
Итак, в кожу привлечено слишком много нейтрофилов — клеток врожденного иммунитета, осуществляющих защиту организма от бактериальных и грибковых инфекций. Эти клетки можно сравнить с камикадзе: они фагоцитируют (то есть поглощают) самую разную добычу — от молекул до целых клеток патогенов, — но при преобладании сил противника дают последний залп провоспалительными цитокинами и разрушаются, «выплевывая» наружу бактерицидные молекулы. Кроме того, нейтрофилы умудряются устроить для патогенов ловушку из собственного содержимого: при саморазрушении нейтрофил помимо иммуногенных молекул выбрасывает наружу свою ДНК, в которой, как в паутине, запутываются бактерии и другие чужаки. Увы, такая ловушка оказывается обоюдоострым мечом: при псориазе и некоторых других заболеваниях она вызывает аутоиммунное воспаление.
В норме нейтрофилы циркулируют в кровеносных сосудах дермы и гиподермы и отправляются в эпидермис только если прослышат (словив на рецепторы повышенное количество цитокинов) о проходящем там воспалении. А при псориазе они, наоборот, встречаются преимущественно в эпидермисе, потому что их «позвали» цитокины CXCL1, CXCL2, IL-8 и IL-18.
Нейтрофилы играют важную роль на ранней стадии развития псориаза: они привлекают в формирующуюся бляшку и активируют Т-лимфоциты, а также стимулируют пролиферацию и дифференцировку кератиноцитов.
Роль макрофагов при псориазе как следует не изучена. Имеющиеся наблюдения свидетельствуют об их участии в воспалении и корреляции их количества в очагах болезни с интенсивностью воспаления. Но вопрос об их активной роли остается открытым.
Также важную роль при псориазе играют дендритные клетки. Они, как уже говорилось в разделе об иммунной системе, передают сигнал о напавших на организм патогенах клеткам приобретенного иммунитета — Т-хелперам. Дендритные клетки бывают двух основных видов — миелоидные и плазмоцитоидные. Миелоидные занимаются прежде всего презентацией антигена Т-хелперам: ловят патоген, выделяют его антигены и, повстречавшись с наивным Т-хелпером, эти антигены ему показывают. Плазмоцитоидные же в основном действуют «химическим оружием»: управляют дифференцировкой Т-хелперов с помощью цитокинов.
В патогенезе псориаза основную роль играет кожная субпопуляция дендритных клеток — клетки Лангерганса. Эти клетки бродят в поисках патогенов по всем слоям эпидермиса, кроме рогового; также они встречаются в дерме, слизистой оболочке рта, крайней плоти и влагалища.
При псориазе клетки Лангерганса в силу тех или иных причин избыточно активируют своих «подаванов» — Т-хелперы. Важную роль в начальных стадиях псориаза играют выделяемые клетками Лангерганса цитокины: интегрин альфа-X (CD11c) миелоидных клеток и интерферон I типа плазмоцитоидных.
Возможно, вы уже заметили, что почти все вышеописанные пути в патогенезе псориаза ведут к одному типу клеток — Т-хелперам. Действительно, Т-хелперы — главные иммунные клетки, связанные с псориазом, они и опосредуют основное течение болезни. Их привлекают в кожу цитокины и дендритных клеток, и кератиноцитов, и нейтрофилов. При псориазе бόльшую часть Т-лимфоцитов в коже составляют Т-хелперы I типа (Th2), которые посредством интерферона-γ снижают активность Т-хелперов II типа и повышают активность Т-киллеров. Последние начинают атаковать кератиноциты, которые, разрушаясь, снова выделяют иммуногенные молекулы для привлечения Т-лимфоцитов. Таким образом круг замыкается, и процесс начинает поддерживать сам себя. В результате пациент с высыпаниями на коже, занимающими 20% поверхности тела, имеет около 8 млрд Т-лимфоцитов в циркулирующей крови, в то время как в псориатических бляшках их число достигает 20 млрд (в норме же это количество приходится на всю кожу целиком) [11].
В последние годы обнаружено, что существенную роль в развитии псориаза играет еще одна субпопуляция Т-хелперов — Т-хелперы 17 (Th27). Они производят множество провоспалительных цитокинов, таких как IL-17F, IL-17 (за активное выделение IL-17 лимфоциты Th27 и получили свое название) и IL-22, приводящих среди прочего к пролиферации кератиноцитов — главной характеристике псориаза [12], [13]. Последний «прорыв» в лечении псориаза — препарат секукинумаб (Cosentyx) — представляет собой как раз антитела к выделяемому Th27 цитокину IL-17A.
Наконец, есть еще один тип иммунных клеток, которые участвуют в развитии псориаза. Это миелоидные супрессорные клетки — разнородная группа иммунных клеток, берущих свое начало из костного мозга. Они умеют ингибировать Т-лимфоциты, дендритные клетки и макрофаги [14]. Такое их свойство могло бы сыграть неоценимую роль в лечении псориаза, однако пока исследования функций этих клеток при данном заболевании немногочисленны. Некоторые работы показали повышение количества моноцитарных миелоидных супрессорных клеток в очагах воспаления и в крови. Однако при этом они характеризовались низкой функциональной активностью [15]. Возможно, в перспективе получится разработать способы повышения активности миелоидных супрессорных клеток, то есть использовать для лечения заболевания не внешние ингибиторы иммунитета, а уже существующие в организме регуляторы.
Тонкий шрам на любимой коже
Несмотря на то, что с каждым днем мы всё больше узнаем о вкладе иммунной системы в развитие псориаза, полностью вылечить это заболевание пока не получается. Даже самые успешные методы лечения позволяют добиться лишь периодов ремиссии — но рано или поздно бляшки снова появляются на коже. Поиски причины такого положения дел привели исследователей к внимательному изучению кератиноцитов в том участке кожи, где раньше была бляшка. Выяснилось, что, несмотря на характерное для ремиссии визуальное улучшение, исчезновение характерных гистологических симптомов псориаза и «лишних» иммунных клеток из кожи, экспрессия некоторых генов в кератиноцитах остается измененной. Такое изменение было названо молекулярным шрамом, и, возможно, именно в нём кроется причина того, что болезнь возвращается снова и снова. Вот некоторые гены, активность которых так и не приходит в норму: ген MMP9, кодирующий фермент, который разрушает разные типы коллагена и желатин в коже, помогая клеткам кожи быть более подвижными; ген WNT5A, кодирующий важный регуляторный белок, который следит за правильным развитием кожи и волосяных фолликулов, а также может регулировать цвет кожи, влияя на меланоциты; гены различных цитокинов (CCL2, CXCR4, CCL18, LTB) и еще несколько сотен генов [16]. Может быть, изучение этих генов расскажет нам что-то новое о роли кератиноцитов в развитии и возвращении псориаза.
Заключение
За последние пару лет наше понимание патогенеза псориаза было значительно расширено за счет новых данных о генетике и иммунологии этого заболевания и коморбидностях. Патогенез псориаза заключается в избыточной активации клеток врожденной и приобретенной систем иммунитета. Вышедший из-под контроля воспалительный процесс характеризуется обильной продукцией различных цитокинов (ФНО-α, интерферона-γ, IL-12, IL-17 и IL-23, VEGF) и миграцией активированных Т-лимфоцитов в кожу. Свой вклад в патогенез псориаза вносят вредные и безвредные микроорганизмы, а также травмы. Клинические проявления псориаза, перечисленные во вводной статье, объясняются всеми описанными здесь механизмами. И знание этих механизмов дает нам надежду на разработку эффективных и безопасных способов контроля псориаза, а возможно, и полного излечения от этой болезни.
- Псориаз: на войне с собственной кожей;
- Michael P. Schön, W.-Henning Boehncke. (2005). Psoriasis. N Engl J Med. 352, 1899-1912;
- Helgi Valdimarsson, Ragna H. Thorleifsdottir, Sigrun L. Sigurdardottir, Johann E. Gudjonsson, Andrew Johnston. (2009). Psoriasis – as an autoimmune disease caused by molecular mimicry. Trends in Immunology. 30, 494-501;
- M. J. Cox, W. O. C. M. Cookson, M. F. Moffatt. (2013). Sequencing the human microbiome in health and disease. Human Molecular Genetics. 22, R88-R94;
- Shruti Naik, Nicolas Bouladoux, Jonathan L. Linehan, Seong-Ji Han, Oliver J. Harrison, et. al.. (2015). Commensal–dendritic-cell interaction specifies a unique protective skin immune signature. Nature. 520, 104-108;
- Akemi Takemoto, Otomi Cho, Yuka Morohoshi, Takashi Sugita, Masahiko Muto. (2015). Molecular characterization of the skin fungal microbiome in patients with psoriasis. J Dermatol. 42, 166-170;
- Lorena Riol-Blanco, Jose Ordovas-Montanes, Mario Perro, Elena Naval, Aude Thiriot, et. al.. (2014). Nociceptive sensory neurons drive interleukin-23-mediated psoriasiform skin inflammation. Nature. 510, 157-161;
- Amanda S. Büchau, Richard L. Gallo. (2007). Innate immunity and antimicrobial defense systems in psoriasis. Clinics in Dermatology. 25, 616-624;
- Christian Rosenberger, Caius Solovan, Alina D. Rosenberger, Li Jinping, Regina Treudler, et. al.. (2007). Upregulation of Hypoxia-Inducible Factors in Normal and Psoriatic Skin. Journal of Investigative Dermatology. 127, 2445-2452;
- Vivian Y. Shi, Michael Leo, Lauren Hassoun, Dev S. Chahal, Howard I. Maibach, Raja K. Sivamani. (2015). Role of sebaceous glands in inflammatory dermatoses. Journal of the American Academy of Dermatology. 73, 856-863;
- J G Krueger. (2005). Psoriasis pathophysiology: current concepts of pathogenesis. Annals of the Rheumatic Diseases. 64, ii30-ii36;
- Lawrence Steinman. (2007). A brief history of Th27, the first major revision in the Th2/Th3 hypothesis of T cell–mediated tissue damage. Nat Med. 13, 139-145;
- Michelle A. Lowes, Toyoko Kikuchi, Judilyn Fuentes-Duculan, Irma Cardinale, Lisa C. Zaba, et. al.. (2008). Psoriasis Vulgaris Lesions Contain Discrete Populations of Th2 and Th27 T Cells. Journal of Investigative Dermatology. 128, 1207-1211;
- Prashant Trikha, William E. Carson. (2014). Signaling pathways involved in MDSC regulation. Biochimica et Biophysica Acta (BBA) — Reviews on Cancer. 1846, 55-65;
- David C. Soler, Andrew B. Young, Lori Fiessinger, Fabrizio Galimberti, Sara Debanne, et. al.. (2016). Increased, but Functionally Impaired, CD14 + HLA-DR –/low Myeloid-Derived Suppressor Cells in Psoriasis: A Mechanism of Dysregulated T Cells. Journal of Investigative Dermatology. 136, 798-808;
- Mayte Suárez-Fariñas, Judilyn Fuentes-Duculan, Michelle A. Lowes, James G. Krueger. (2011). Resolved Psoriasis Lesions Retain Expression of a Subset of Disease-Related Genes. Journal of Investigative Dermatology. 131, 391-400;
- Nestle F.O., Di Meglio P., Qin J.Z., Nickoloff B.J. (2009). Skin immune sentinels in health and disease. Nat. Rev. Immunol. 9, 679–691.
biomolecula.ru
Псориаз генетика: этиология, патогенез, генетическое заболевание
Заболевание, известное с давних пор и приносящее массу неудобств даже в условиях доступности самых лучших приемов терапии – генерализованный псориаз. Кожные патологии данного типа не находят подтверждения ни в аспекте подтверждения этиологии, ни в качестве основной гипотезы для того, чтобы проводить адекватную терапию.

Генерализованный псориаз причиняет массу неудобств
Несколько слов о заболевании
Книга книг – Библия тоже упоминает о кожных высыпаниях, которые доставляют неудобства и делают человека очень зависимым от того, как смотрят на него окружающие. Откуда появляется псориаз и почему именно у тех или иных людей. Стоит весьма тщательно поговорить о причинах заболевания, а так как причины достаточно многочисленны, необходимо рассмотреть все. Наиболее загадочное дерматологическое заболевание, которое пытались разгадать еще величайшие врачеватели древности. Его описывали практически все – отец медицины Гиппократ, и великий врачеватель Азии – Абу ибн Сина, и знаменитый инфекционист средневековья Парацельс, доктор Боткин, Павлов, Мечников. Все они, так или иначе, пытались найти источники этой весьма загадочной болезни, которая была истинным бичом общества. Этиология псориаза могла быть самой разной. В некоторые времена псориаз относили к болезням, присущим только простонародью. В иные периоды патологию подобного типа считали особым заболеванием лиц, присущих царственным фамилиям. Заболевание носило название «звезда дьявола», как символ отметины злых сил или «жемчужина» как признак принадлежности к высшим слоям общества.
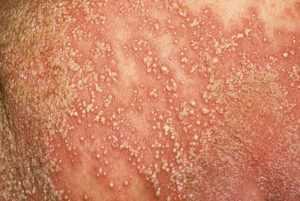
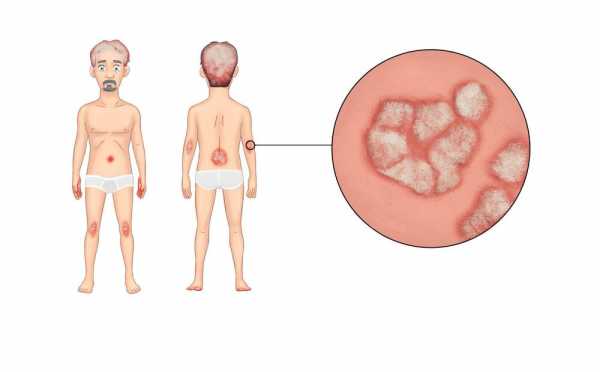
На коже появляется масса пятен — чешуек впоследствии они образуют масштабные наросты
И это совершенно оправдано клинической картиной, когда на коже появляется масса пятен — чешуек впоследствии они образуют масштабные наросты. Особенность чешуек состоит в том, что они белого цвета, локализуются повсеместно, особенно часто это волосистая часть головы. Высыпания начинают проявляться в среднем возрасте – около тридцати лет. Именно благодаря мало эстетичному виду, возникают исключительно серьезные проблемы социального характера, вплоть до полной изоляции человека. Особенно это касается осложнений психологического состояния больного в связи с появлением высыпания на коже лица. Сильный зуд и жжение, растрескивания кожи под чешуйками приводит к тому, что впоследствии появляются мацерации впоследствии превращающиеся в раны. Особенность псориаза состоит еще и в том, что псориазом затрагивается как кожа, так и область позвоночника, суставов, сухожилий, сфера иммунной и эндокринной системы. На много уровней опаснее являются псориатические поражения почек, печени, щитовидной железы. Необходимо также сделать акцент на том, что первичные признаки патологии представляются невротической соматикой, проявляющейся в хронической слабости, постоянной усталости, депрессии и невротическом состоянии. Именно эти признаки могут быть сигнальными в области появления псориаза, как, впрочем, и многих других кожных патологий.
О причинах и симптомах
Причины и возможные основания появления этого достаточно серьезного, опасного и загадочного заболевания в наши дни остаются изученными крайне мало. Этиология и патогенез псориаза и в наше время недостаточно определены. Не сегодня существует несколько групп возможных причин появления этой серьезной патологии:
Причины появления этого серьезного заболевания в наши дни остаются изученными крайне мало
- В первую очередь медицинская практика рассматривает версию генетических отклонений в виде особой предрасположенности к кожным заболеваниям подобного типа. Наиболее вероятная причина в данном контексте – это отягощенная наследственность, генетическое заболевание и склонность к появлению кожных и иных нарушений и патологии невыясненного характера.
- Очень важно подробно изучить возможность появления псориаза на фоне психологических, нервно – эмоциональных и нервно – соматических расстройств, где также имеет особое значение псориаз и его генетика. Благодаря многолетним исследованиям кожных патологий достаточно точно установлено, что именно значительные нервные потрясения, пребывание в состоянии длительного стресса, нервный срыв дают основание для усугубления патологической статистики – от 40 до 50% обращений.
- Немаловажной причиной появления или усугубления псориаза являются перенесенные острые или хронические инфекционные заболевания. Очень часто прослеживается связь между заболеванием гриппом, скарлатиной, а также туберкулез, сифилис, ВИЧ. Большое значение в отношении появления псориаза имеют герпес и грибковые патологии из серии Candida.
- Нарушенный иммунитет и генез аутоиммунного типа является на сегодня наиболее широко распространенной причиной появления характерных бляшек. Механизм до конца еще не изучен, но в основном состоит в том, что отклонения в защитных функциях приводит к избирательному поражению клеток, когда в процессе сбоев клетки иммунитета начинают активно атаковать здоровые клетки. В этом случае происходит разрушение верхнего слоя кожи – эпидермиса, а процессы деления клеток ускоряются в несколько раз.
- Как один из факторов появления этого заболевания являются поражения кожи механического типа. Обычно это частые травмы, потертости, укусы насекомых и домашних животных, а также, возможно, что этому способствует кода со слабым эпидермисом и подкожно-жировым слоем.
- Замечено, что достижения современной химии также во многом ответственны за появление и рост уровня заболеваний кожи. В частности, постоянное использование антибактериальной косметики и средств гигиены, частое соприкосновение с растворами химических реагентов, спиртами, кислотами и щелочами.
- Несанкционированное применение антибиотиков, кортикостероидных препаратов, в частности, это касается индометацина, ибупрофена, бутадиона, витаминов групп С, В, бета-блокаторов, цитостатиков, возможно влияние вакцинации, фитопрепаратов, биодобавок, является провоцирующим фактором появления псориаза у 6, 3% пациентов.
- Неправильное питание, курение и употребление алкогольных напитков, пристрастие к острым и пряным блюдам, шоколаду, кофе и крепкому чаю. Нездоровый образ жизни приводит к нарушениям со стороны органов пищеварения, следовательно, и в дальнейшем к различным патологиям.

Нездоровый образ жизни приводит к различным патологиям
- Очень часто спонтанная перемена климата, где человек постоянно проживал, особенно это касается переезда в более холодные области, что также наследственный фактор.
- Генный псориаз педиатрической сферы, когда этиология появляется на фоне возрастных изменений детского организма. Чаще всего это проявляется как следствие тяжело текущей беременности, осложненных родов, отсутствия грудного вскармливания. У ребенка подобное заболевание также может протекать совместно с диатезом, именно это приводит к тому, что очень часто диагностика затруднена и выбрано не совсем подходящая терапия.
Генетика и перспективы
Как уже было сказано выше, основная причинно-следственная связь между возникновением, течением, дальнейшим сценарием развития патологии зависит от того, насколько точно установлен повод, благодаря которому появляется эта патология. Обращаясь к специалисту – терапевту, дерматологу или педиатру следует точно вспомнить о том, кто из близких и родных мог болеть псориазом, так как осложненная генетика может повлиять на появление патологии у того или иного человека.
Осложненная генетика может повлиять на появление патологии у того или иного человека
Проведенные многолетние исследования псориаза и его этиологии доказали правоту одной из версий относительно появления патологии. Он передается в большинстве случаев наследственным путем и только в определенной последовательности – через поколение. Именно в этом случае перед тем как попасть на прием к доктору, стоит вспомнить, не было ли у бабушек или дедушек пациента подобного заболевания. Далеко не всегда им был поставлен диагноз, но любые кожные высыпания могут быть подтверждением возможности псориаза.
И если вы начинаете понимать, что ваши нервы далеки от идеального состояния, а стрессы все чаще настигают при самых разных ситуациях, следует поберечь себя и ограничить подобные случаи. В подавляющем большинстве зарегистрированных жалоб, как ни странно, провоцирующий фактор – значительный стресс, неврологическое заболевание, или психоэмоциональная травма. Изначальным фактором псориаза и его патогенеза является так называемый пробанд, то есть начальный индивидуум, который обычно болеет псориазом. Последующие поколения также обычно страдают той или иной степенью патологии. Проводимые впоследствии изучения патологического состояния дают возможность определить достаточно большой ряд молекулярных изменений, являющихся наследственными.
 Тамара Глоба: Запомните!
Деньги всегда приходят в избытке, если в доме хранить небольшой…
Читать далее…
http://www.mycpagetti3.com/rcjx
Умоляю, не удаляйте папилломы!
Умоляю, не удаляйте папилломы! Чтобы они исчезли, добавьте в стакан воды 3 капли…
Читать далее…
http://cpagetti2.com/q8pV/sub1/sub2/sub3/sub4/sub5
Тамара Глоба: Запомните!
Деньги всегда приходят в избытке, если в доме хранить небольшой…
Читать далее…
http://www.mycpagetti3.com/rcjx
Умоляю, не удаляйте папилломы!
Умоляю, не удаляйте папилломы! Чтобы они исчезли, добавьте в стакан воды 3 капли…
Читать далее…
http://cpagetti2.com/q8pV/sub1/sub2/sub3/sub4/sub5Симптоматика и особенности проявления, наружный вид отталкивает социум от больного, недостатки становятся настоящим бичом для человека. Страх и тревога, беспокойство и излишняя мнительность приводит к дополнительному стрессу, что, в свою очередь, усиливает проявления заболевания. Так, начинается прогресс и без того беспокоящего заболевания.
kozhazdorova.ru
Необычные биологические агенты могут поставить крест на псориазе
Алла К., 52 года, Н.Новгород
Что такое биологическая терапия?
Этот вид лечения основан на использовании фармакологических средств, которые по своему происхождению, составу, химической структуре и действию чрезвычайно близки к тем натуральным соединениям, которые в норме продуцирует человеческий организм.
Эффекты биологической терапии в первую очередь основаны на воздействии ее на иммунную систему. С помощью таких препаратов либо подавляются ее патологические реакции, либо усиливаются ее нормальные защитные функции. Таким образом, в перечень лекарств, которые можно отнести к биологической фармакотерапии входят самые разные группы веществ:
- интерфероны;
- интерлейкины;
- иммуносупрессоры;
- иммуностимуляторы;
- моноклональные антитела;
- вакцинирующие препараты;
- генотерапевтические соединения;
- колониестимулирующие факторы и т.д.
Какова роль биологической терапии в лечении псориаза?
На данный момент основной причиной развития этого заболевания считаются нарушения работы иммунной системы. А значит, вещества, способные влиять на ее функции, при правильном выборе дозировки могут и подавлять развитие симптомов псориаза.
Аутоиммунный механизм возникновения псориаза означает, что в этом случае иммунная система атакует клетки собственного организма, в частности, клетки кожного покрова. На более высоких стадиях развития заболевания патологический процесс распространяется и на другие органы и ткани, например, может развиваться поражение суставов – псориатический артрит.
Какие препараты используются в биологической терапии псориаза?
Так как псориаз – аутоиммунное заболевание, это означает, что причина его развития заключается в патологической активности иммунной системы, разрушающей собственные клетки. Таким образом, главной частью биологической терапии становятся препараты, способные оказывать на иммунитет подавляющее воздействие. Кроме того, ведущим звеном в симптоматике аутоиммунных заболеваний всегда являются воспалительные реакции. Псориаз при этом не исключение. Поэтому, подавив воспаление, вызванное агрессией иммунной системы, в большинстве случаев удается избавиться и от проявлений этой патологии. Не менее важной является и последующая регуляция роста и развития кожных клеток.
Ацитретин
Это дерматотропное соединение, которое нормализует процессы размножения, дифференциации и ороговения клеток кожных покровов.
Метотрексат
Мощное цитотоксическое средство, способное эффективно подавлять бесконтрольное деление клеток. Чаще применяется при псориатическом артрите на высоких стадиях развития патологии из-за довольно большого риска появления нежелательных побочных эффектов.
Энбрель
Этот препарат относится к группе селективных иммунодепрессантов. Он с высокой избирательностью связывает на химическом уровне фактор некроза опухоли – вещество, имеющее важнейшее значение для запуска и стимуляции воспаления в клетке.
Хумира
Иммунодепрессантное средство, представляющее собой моноклональное антитело и являющееся полным аналогом иммуноглобулина-G1 человека. Нормализует работу фактора некроза опухоли, не позволяя ему активировать избыточные воспалительные процессы на клеточном уровне.
Ремикэйд
Относится к группе иммунодепрессантов. Также блокирует фактора некроза опухоли, тем самым, приводя к подавлению воспалительных реакций.
Стелара
Вещество-иммунодепрессант, которое представляет собой моноклональное антитело человека — иммуноглобулин G. Стелара воздействует на интерлейкин, блокируя его биоактивность. Это приводит к остановке каскада биохимических реакций, которые запускают воспаление при псориатических поражениях кожного покрова.
Косентикс
Этот препарат относится к фармакологической группе иммуносупрессоров. Он с высокой избирательностью связывается с клеточными рецепторами интерлейкина-17A. Данное соединение играет важную роль в активации воспалительных процессов. Благодаря тому, что рецепторы на поверхности клеток уже заняты молекулами препарата, интерлейкин-17А не может к ним присоединиться. А значит, блокируется сама возможность начала и прогрессирования воспаления при псориазе.
Заполните, пожалуйста, форму, и наши координаторы свяжутся с Вами.
Будем здоровы
Два экспериментальных средства — иксекизумаб и бродалумаб могут избавить от псориаза, разными способами воздействуя на воспалительный протеин интерлейкин-17 (IL-17). Средства уже прошли успешное тестирование в течение 12 недель на пациентах, страдающих псориазом.
Дерматолог Ким Папп отметил, что псориаз является одним из самых распространенных кожных заболеваний. Однако люди, которые страдают от него, скрывают свое заболевание, меняя при этом жизнь и портя психическое здоровье.
Протеин интерлейкин-17 уже давно вяжется с псориазом. Бродалумаб является моноклональным антителом, которое привязывается к рецептору IL-17. Иксекизумаб оказывает прямое воздействие на IL-17 и нейтрализует его. В процессе тестирования первого агента, в котором участвовали 198 пациентов добровольцев, получавшие наибольшую дозировку, продемонстрировали снижение тяжести симптомов на 75-90%. А у 62% кожные поражения исчезли полностью.
В ходе тестирования иксекизумаба на 142 пациентах было установлено, что большая дозировка дает наилучшие результаты. Кожа многих пациентов стала чистой. При этом не сообщается о наличие серьезных побочных эффектов. Упоминается только воспаление слизистых оболочек горла, носа, инфекции верхних дыхательных путей и местная реакция в зоне инъекции.
Зеленые кофейные зерна быстро избавляют от лишних килограммов
Ежедневное употребление в пищу зеленых кофейных зерен способствует стабильному снижению веса. Данная теория проверена на 16 добровольцах, в возрасте от 22 до 46 лет, которые страдали от избытка веса. В среднем за время эксперимента каждый из них смог сбросить порядка 8 килограмм. Таким образом, вес тела убавился где-то на 10,5% и на 16% – объем жира.
Китайские исследователи узнали, почему перцы «чилли» так полезны для сердца
Острые блюда очень полезные для сердечников. Исследователи из Китайского университета Гонконга, утверждают, что соединения, которые дают остроту перцу «чилли», могут снизить показатели холестерина и кровяное давление.
Мутация в гене XRCC2 повышает вероятность рака груди
Мельбурнскими учеными под руководством Мелиссы Созей найден генетический маркер рака груди, с помощью которого можно будет выявлять женщин, которые предрасположены к этому заболеванию. Этого ученые достигли после 20 летнего исследования данных тысяч семей.
Штаты бьют рекорды по числу детей-аутистов
В США один ребенок из 88 страдает от аутизма – об этом свидетельствуют результаты исследований Центра по контролю за заболеваниями. Эксперты сообщают, что показатели аутизма по не известным причинам возросли на 23% в течение последних двух лет.
Самые лучшие растения для дома
Для здоровья человека атмосфера дома является важным фактором. Ведь именно от того, насколько комфортная обстановка дома, зависит психологическое состояние обитателей дома.
Растения эффективно лечат прыщи
Ученые из британского Leeds Metropolitan University ведут работы по изучению эффективности различных растений для лечения прыщей. Проведенные исследования показали, что эффективность натуральных средств куда больше выше, чем эффект от различных кремов, гелей и лосьонов, помимо этого растительные средства не вызывают раздражения и не оставляют пятна на одежде.
Содержание
Дерматология в России
- Сайт зарегистрирован как СМИ, электронное периодическое издание на русском и английском языке, ISSN 2077-3544
- Основатель и главный редактор проекта — проф. А.Ю. Сергеев
- Посещаемость сайта свыше 1500 человек в сутки (статистика). Среди более 15000 наших врачей-подписчиков 223 доктора и 1229 кандидатов медицинских наук, заведующие кафедрами, директора институтов и научных центров, руководители здравоохранения. Издание распространяется бесплатно, для использования профессиональных и интерактивных материалов необходима регистрация
- Дерматология в России выходит и обновляется практически ежедневно. Сайт предоставляет возможности коммуникации для практикующих врачей, ученых, преподавателей, представителей общественных организаций и фармацевтической индустрии
Новые препараты и селективное лечение псориаза
Новые препараты и селективное лечение псориаза
В последние десятилетия, понимание патофизиологии псориаза изменилось. В настоящее время псориаз рассматривается как системная воспалительная болезнь с очевидной ролью иммунной системы. Это отражается в постепенном переходе от неселективных методов, таких как кортикостероиды, метотрексат, и ацитретин, к селективным методам лечения, таким как циклоспорин и высокоселективные биологические методы лечения. Внедрение ингибиторов фактора некроза опухоли (ФНО-α) в практику осуществило прорыв в терапии псориаза и изменило наше представление о патофизиологии псориаза. Достижения ингибиторов ФНО-α также отражаются в объемах их ежегодных продаж. В 2013 году наиболее отпускаемыми по рецепту лекарствами в мире были адалимумаб, этанерцепт и инфликсимаб, годовой объем продаж которых составил 10 млрд. долларов. Т.к. эти препараты также используются для лечения других воспалительных состояний, например ревматоидного артрита и болезни Крона, то общее количество больных псориазом, использовавших TNF-α ингибиторы не известно.
Еще один способ лечения псориаза нацелен на Т-клетки либо путем ингибирования связывания функции лимфоцитов — антиген-3 (LFA-3) CD2 (например, алефацепт) или с помощью блокировки цепи LFA-1 CD11a и ингибирования клеточной адгезии (например эфализумаб). Тем не менее, в Европе, алефацепт утвержден не был и эфализумаб был снят из-за серьезных побочных эффектов. Единственным крупным антипсориазным препаратом с определенной физиологической мишенью является устекинумаб (моноклональные антитела к интерлейкину-12/23). Успех устекинумаба доказал важность ИЛ-23 / T хелперов 17 (Th27) при псориазе. Несколько новых биопрепаратов, направленных на эти мишени, вероятно, достигнут клиники в ближайшие годы. В 2013г. годовой объем продаж устекинумаба достиг 1,5 миллиарда долларов США.
Биопрепараты не только дороги, но и требуют повторных инъекций и некоторые пациенты испытывают потерю терапевтического эффекта (тахифилаксия). Таким образом сегодня возникла необходимость создания пероральных, доступных по цене, низкомолекулярных ингибиторов. Несколько небольших молекул для лечения псориаза находятся в фазе испытаний. Первыми из этих препаратов, которые потенциально будут утверждены, являются ингибитор Янус-киназы (JAK) тофацитиниб (tofacitinib) и ингибитор фосфодиэстеразы апремиласт (apremilast). Среди других исследуемых малых молекул аденозин агонисты рецепторов A3 и новые противовоспалительные агенты.
IL-12 и IL-23 являются гетеродимерными плейотропными цитокинами, каждый из которых состоит из 2 субъединиц, которые названы accordingto. Субъединицы р40 с молекулярным весом 40 кДа являются общими для обоих цитокинов, в то время как второй субъединицей у IL-12 является белок р35 с весом 35 кДа, а у ИЛ-23- белок р19 с весом 19кДа. Поэтому IL-23 имеет биологическую активность, подобную ИЛ-12, и вместе с тем отличающуюся от Ил-12. IL-12 продуцируется макрофагами и В-клетками и как было показано, оказывает несколько эффектов на Т-клетки и природные клетки-киллеры (NK), в то время как IL-23 является существенным для дифференциации лимфоцитов Th27. Th27-лимфоциты участвуют в развитии псориаза с помощью производства провоспалительных цитокинов IL-17A, IL-17F, и ИЛ-22. К настоящему времени опубликованы результаты испытаний только 2 ингибиторов IL-12 и IL-23 — устекинумаба и бриакинумаба. Устекинумаб одобрен в Канаде, Европе и США для лечения умеренного до тяжелого бляшечного псориаза. В клиническом испытании III фазы бриакинумаба 82% больных на 24 неделе достигли индекса PASI75 по сравнению с 40% пациентов, получавших метотрексат. Тем не менее, озабоченность по поводу возможных неблагоприятных сердечно-сосудистых эффектов у бриукинумаба привела к прекращению его использования в США и Европе в 2011 году.
В настоящее время клинические испытания проходят несколько ингибиторов с уникальной ориентацией на p19 субъединицу IL-23. На основе расширения знаний патофизиологии псориаза эта интересная мишень выглядит многообещающе, но пока никаких результатов этих исследований в рецензируемых журналах опубликовано не было. Тем не менее, результаты исследования моноклонального антитела — IgG1 к p19, тилдракизумаба (tildrakizumab) (MK-3222), были представлены на 71-й ежегодной конференции Американской академии Дерматологии (AAD) в марте 2013 г. II фаза исследования с участием 355 пациентов с псориазом показала, что после 16 недель лечения 74% достигли PASI75 по сравнению с 4,4% в группе плацебо. Результаты исследования II фазы, в котором оценивался гузелкумаб (guselkumab) (CNTO1959), другое человеческое моноклональное антитело к p19, были представлены на 72-ом ежегодном собрании в марте 2014 года (Денвер, США). Пациенты от умеренного до тяжелого псориаза (п = 293) были рандомизированы для получения плацебо, гузелкумаба или адалимумаба. На 16 неделе значение PASI75 было достигнуто у 81% пациентов группы, получавшей 50 мг гузелкумаба, по сравнению с 71% пациентов, получавших адалимумаб и 4,8% получавших плацебо. Побочные эффекты были зарегистрированы у 66% пациентов, получавших гузелкумаб и у 72% больных, получавших адалимумаб.
Семейство IL-17 включает IL-17A, IL-17B, IL-17C, ИЛ-17D, IL-17E (также называемый ИЛ-25) и IL-17F. IL-17A ключевой провоспалительный цитокин в патогенезе псориаза. IL-17 способны активировать кератиноциты, что приводит к гиперпролиферации и в дальнейшем к производству антимикробных пептидов, цитокинов и хемокинов, которые, в свою очередь, вербуют и активируют другие иммунные клетки, ведущие к усилению воспаления при псориазе.
Несколько ингибиторов Ил-17 проходят испытания для применения при псориазе. Секукинумаб (Secukinumab) является человеческим моноклональным антителом IgG1, которое избирательно связывает и нейтрализует IL-17A. II фаза исследований показала, что через 12 недель лечения подкожными инъекциями секукинумаба при умеренном-тяжелом псориазе индекса PASI75 достигли 82% больных при 9% с плацебо. Доля достигших PASI90 через 12 недель была 52% по сравнению с 5% в группе плацебо. В целом секукинумаб переносился хорошо, но в 2 случаях развилась нейтропения. На 22-м конгрессе Европейской Ассоциация дерматологии и венерологии (EADV) в октябре 2013г. (Стамбул, Турция) были представлены результаты III фазы сравнительного секукинумаба и этанерцепта с использованием 2 режимов дозирования для определения эффективности при псориазе. Более половины (54%) пациентов, получивших лечение секукинумабом достигли PASI90 на 12 неделе по сравнению с 21% у пролеченных этанерцептом. PASI100 на 12 неделе был замечен у 24% пациентов из группы секукинумаба против 4% в группе этанерцепта. Эффективность секукинумаба была устойчивой в течении всего одногодичного наблюдения. Ответ PASI90 через 52 недели сохранялся у 65% пациентов.
Иксекизумаб (Ixekizumab) — это гуманизированное моноклональное антитело IgG4, которое также нейтрализует IL-17A. Через 12 недель лечения подкожными инъекциями иксекизумаба индекс PASI75 или PASI90 был у 82% и 71%, соответственно. Побочные эффекты наблюдались у 63% пациентов, как правило, не представлявшие серьезной опасности. Во II фазе исследования бродалумаба на 12 неделе PASI75 и PASI90 были достигнуты у 82% и 75% больных, соответственно. Наиболее типичными побочными эффектами были назофарингит (8%), инфекция верхних дыхательных путей (8%), и эритема в месте инъекции (6%). Исходя из результатов опубликованных исследований, ингибиторы Ил-17, показали быстрое положительное воздействие на пациентов с умеренным до тяжелого псориаза. На 12-й неделе лечения ответ PASI75 был достигнут, по крайней мере у 82% пациентов во всех испытаниях.
Новый препарат, представляющий собой анти-ФНО антитела называется цертолизумаб. Это полиэтиленгликоль-конъюгированный ингибитор ФНО, который в отличие от других анти-ФНО моноклональных антител (например, инфликсимаба и адалимумаба) отсутствует кристализующийся фрагмент (FC) и, следовательно, не он вызывает антитело-зависимую цитотоксичность, активацию комплемента, или апоптоз в Т-клетках или макрофагах. Снижение риска таких воспалительных явлений потенциально может сделать повторное лечение безопаснее.
Аналогично инфликсимабу и адалимумабу, цертолизумаб связывается с растворимым и мембранно-связанным ФНО-α, тем самым блокируя важные события, связанные с воспалением при псориазе. В США FDA и в Европе Европейское агентство по лекарственным средствам (EMA) одобрили цертолизумаб для лечения анкилозирую
zdorovye-ptz.ru
Псориаз генетика, как передается по наследству генетически
Псориаз – это тяжелое дерматологическое заболевание, при котором у человека на кожных покровах возникают высыпания и шелушения. Это не очень распространенная болезнь. Согласно медицинским данным на сегодняшний день псориазом страдает около 2% населения. Именно поэтому тема данной болезни не очень распространена и далеко не каждый знает, передается ли псориаз по наследству, его симптомы, причины появления, а также ответы на другие интересующие вопросы.
Псориаз генетике не всегда обязан своим появлением — чтобы он проявился, необходим также сбой в работе иммунной системы. Как правило, при таких нарушениях кожа перестает избавляться от ороговевших слоев кожных покровов в правильном порядке. Именно поэтому на коже начинает расти слой клеток, который образовывает характерные для болезни бляшки. В зависимости от тяжести заболевания этих пятен может быть как мало, так и очень много. В особо тяжелых случаях болезнь может поражать практически всю поверхность кожных покров.
Гены как один из факторов болезни
Ученые во всем мире десятилетиями проводят различные исследования с целью узнать, какие именно гены должны передаваться, чтобы спровоцировать данный сбой в иммунной системе. И в последнее время им все-таки удалось приблизиться к истине.
Медики давно заметили, что приблизительно 1/3 часть пациентов больных псориазом имели близких или дальних родственников, которые также страдали этой патологией. Причем те пациенты, которые имели родственников, страдающих псориазом, сами чаще заболевали в возрасте до 30-35 лет. Именно потому ученые и заподозрили, что является псориаз генетическим заболеванием.
Современные медики пришли к выводу, что всего около 10% населения планеты имеет наследственность, предрасполагающую к развитию заболевания.
Тем не менее, патология возникает только у 1-3% из них. Это говорит о том, что помимо генов существует еще множество причин развития патологии.
Поэтому кроме семейного анамнеза врачей обычно интересуют еще и другие негативные факторы, которые присутствуют в жизни пациента. Знать их нужно обязательно, так как их устранение может привести к сильному улучшению самочувствия, а иногда даже и полному выздоровлению.

Среди факторов, которые могут вызвать поражение кожи у людей, склонных к псориазу, можно отметить стрессы, инфекционные процессы в организме и травмы кожных покровов, злоупотребление алкоголем, а также курение.
При этом важно отметить, что врачи нередко сталкиваются с ситуациями, когда не склонные генетически пациенты страдают псориазом и наоборот. Это значит, что псориаз наследственная патология не всегда и при желании заболевание можно предотвратить.
Результаты новых исследований
Недавно ученым удалось выявить у некоторых людей семь генных вариаций, отвечающих за склонность к болезни. При этом три из них напрямую связаны с развитием патологии. Эти же гены отвечают за работу иммунной системы и функционирование кожных покровов.
Помимо этого выявлен также обособленный генетический компонент. Это помогло значительно приблизиться к ответу, почему не у всех генетически предрасположенных людей к псориазу имеется данная патология в анамнезе и узнать, как передается псориаз.
В будущем это поможет устранить те процессы, которые приводят к патологии или даже, возможно, изменить саму работу генов. Именно поэтому исследования в этой области будут продолжаться и дальше.
Несмотря на то, что псориаз – это хроническое, длительно текущее заболевание, процесс его протекания должен максимально контролироваться. На данный момент имеется несколько способов облегчить состояние больного. Это применение лекарственных препаратов наружного и системного действия. Нередко для этого используются также иммунодепрессивные лекарства и антигистаминные средства.

Причем иммунодепрессанты сегодня все чаще изготавливаются на основе трав и различных биологических веществ. Их преимущество заключатся в том, что они выборочно действуют только на некоторые клетки иммунитета, но не влияют при этом на работу организма в целом.
Для быстрого облегчения состояния при запущенной болезни врачи могут порекомендовать физиотерапию и посещение лечебных курортов. К сожалению, даже комплексный и максимально правильный подход к лечению псориаза не поможет вылечить заболевание полностью (даже если оно находится на начальной стадии).
При правильном подходе медики могут добиться длительной ремиссии патологии. В некоторых случаях она длится даже всю жизнь, но при возникновении неблагоприятных факторов риск рецидива псориаза всегда значительно увеличивается.
Длительное и зачастую дорогостоящее лечение болезни нередко выматывает пациентов. Именно поэтому на новые данные о псориазе сегодня так много надежд, ведь медики уже на пути к тому чтобы узнать какую именно роль играют гены в развитии псориаза.
Вероятность унаследования патологии
Как показывает практика, если мать ребенка страдает псориазом, вероятность передачи генов, которые предрасполагают к заболеванию, составляет 15-20%, а если отец – 17-25% (болезнь по наследству от отца переходит несколько чаще).
Если данная патологию присутствует сразу у обоих родителей, риск того что предрасположенность может передаться повышается до 50-75%.
Если псориазом болели родные сестры отца или матери ребенка риск развития патологии у него повышается до 5-7%.
При этом иногда случается так, что и у абсолютно здоровых родителей происходит мутация определенных генов, которые впоследствии унаследует ребенок. К счастью, такое случается крайне редко.
Даже если мужчина и женщина страдают псориазом – это не значит, что они должны отказываться от счастья стать родителями. Да, псориаз передается по наследству, однако при ведении правильного образа жизни человек может так ни разу и не столкнуться с симптомами неприятного недуга. Ребенок больных псориазом родителей появится на свет с абсолютно здоровой кожей, а вот будет у него в дальнейшем эта патология или нет, зависит от родителей, а потом и него самого.
Пожалуйста оставьте комментарий:
Похожие статьи
papillomy.com
Псориаз — Генетическая теория развития псориаза
Все больше исследований устанавливают тесную взаимосвязь между мутациями некоторых генов и псориазом. Генетическая теория развития псориаза основана исследовании мутаций гена CARD14, которые запускают воспалительные реакции, которые типичны для псориаза.
Псориаз – это дерматологическое заболевание, характеризующееся образованием припухших пятен (папул), которые могут объединяться в большие чешуйчатые бляшки. С этой болезнью стараются бороться с незапамятных времен, однако и в наши дни псориаз остается неизлечимым заболеванием. В первую очередь это связано с тем, что до сих пор точная причина псориаза остается неизвестной. Существует множество различных теорий, косвенно доказывающих роль тех или иных факторов в развитии псориаза, и одна из них – генетическая теория развития псориаза. Наследственная предрасположенность к псориазу, возможно, является главенствующим фактором в реализации данного заболевания.
Читайте также: ПСОРИАЗ ТАЙНЫЙ И ЯВНЫЙ. 7 МЕСТ НА ТЕЛЕ, ГДЕ ОН МОЖЕТ ПОЯВИТЬСЯ
Наследственность как фактор развития псориаза
Бурный расцвет генетики и молекулярной биологии во второй половине прошлого столетия внес существенные изменения в представления о патогенезе множества заболеваний. От генетического профиля во многом зависят все анатомо-функциональные особенности организма. Что касается конкретно псориаза, то было установлено, что началу первых клинических изменений предшествуют стойкие нарушения обменных процессов в коже и крови больного. При семейном псориазе подобные изменения обнаруживаются и у клинически здоровых родственников больного. В частности, это изменения в метаболизме белков, (главным образом – ферментов), жиров и электролитов, которые формируют предрасположенность к заболеванию, и могут передаваться по наследству. При этом псориаз проявляется при воздействии внешних и внутренних факторов. Поэтому рассматривать псориаз в качестве только наследственного заболевания нельзя. В настоящее время псориаз считается мультифакторным заболеванием с полигенным наследованием, то есть данная болезнь (как и сахарный диабет, рак, шизофрения, артериальная гипертензия) наследуется довольно сложно, и механизмы такого наследования во многом остаются непонятными.
Читайте также: РОЛЬ МИКРОФЛОРЫ ТОНКОГО КИШЕЧНИКА В ПАТОГЕНЕЗЕ ПСОРИАЗА
Риск наследования псориаза в цифрах
Многочисленными медицинскими наблюдениями были определены риски наследования псориаза.
Вероятность наследования псориаза
- Если оба родителя здоровы – 4,5%.
- При наличии одного больного родителя – 14,5-17%.
- У 60% больных псориазом имеются прямые родственники с псориазом.
Некоторые исследователи не исключают влияние вирусных инфекций в реализации псориаза. Вирус проникает в клетки, где приводит к мутациям в геноме. Трансформированные (генетически измененные) клетки приобретают новые свойства, делая организм предрасположенным к появлению псориатической симптоматики.
Гены, связанные с заболеванием
Псориаз наследуется по аутосомно-доминантному типу с неполной пенетрантностью. В настоящее время уже картировано несколько хромосомных локусов, определяющих предрасположенность к данному заболеванию. Наиболее значимым из них считается локус PSORS 1, расположенный между генами MICA и CDSN. В этом регионе располагаются гены системы HLA (Human Leukocytes Antigens) – группа генов тканевой совместимости человека. Ассоциация антигена HLA-Cw6 с псориазом уже является доказанной. Также установлена связь между антигенами HLA-B13, HLA-B17 и HLA-B27.
Псориаз и мутация гена CARD14
В 2012 году в журнале The American Journal of Human Genetics была опубликована статья, в которой авторы описали первый идентифицированный ген, отвечающий за развитие псориаза. Ученые медицинской школы Сент-Луиса Вашингтонского Университета выяснили, что редкая мутация гена CARD14, которая вызывается внешними факторами, может стать причиной развития бляшечной формы псориаза. В ходе дальнейших исследований также было выяснено, что мутации гена CARD14 могут быть связаны с пустулярной формой заболевания, а также с дегенеративным артритом, протекающим на фоне псориаза.
По мнению ученых, в ряде случаев одной лишь мутации гена CARD14 уже достаточно для проявления псориаза. Исследователи обнаружили более 15 различных мутаций CARD14, которые были обнаружены у всех 6000 исследуемых больных с псориазом. В то время как у 4000 человек из контрольной группы (здоровые участники) таких мутаций не было.
Исследователи обнаружили, что мутации гена CARD14 приводят к увеличению активности белкового фактора NF-kappaB в клетках кожи – кератиноцитах. В свою очередь этот протеин увеличивает синтез ряда сигнальных молекул клетки, запускающих воспалительные реакции, которые типичны для псориаза.
Обнаружение прямой связи между псориазом и геном CARD14 открывает ученым и медикам новые надежды и возможности для поиска надежных средств от этой болезни.
ЧИТАЙТЕ ТАКЖЕ:
www.likar.info
Генетики из Уфы разобрались в причинах псориаза — Наука
Специалисты из Института биохимии и генетики Уфимского научного центра РАН обнаружили, что иммунные клетки больных псориазом реагируют на белок кератин из их собственной кожи, что в итоге и вызывает зудящие воспаления на ней. Более того, ученым также удалось найти определенный вариант гена, который ответственен за возникновение данной аутоиммунной реакции. Результаты исследования опубликованы в журнале Scientific Reports.
Псориаз — хроническое неинфекционное заболевание, поражающее кожу человека. На руках, спине и волосистой части головы больных появляются красные сухие пятна, которые сливаются между собой, образуя псориазные бляшки. Псориаз не относится к смертельно опасным болезням, однако его тяжелые формы могут заметно ухудшать качество жизни пациентов, мешая работать, заниматься спортом и вступать в интимные отношения. Кроме того, в некоторых случаях на фоне псориаза может развиваться псориатический артрит — более серьезное заболевание, которое поражает суставы. В настоящее время между учеными наиболее популярна версия об аутоиммунной природе псориаза.
Большой шаг в изучении и лечении псориаза сделали медики из Уфы. В ряде предыдущих исследований предполагалось, что фрагменты белка кератина (К17), вырабатываемого в волосяных фолликулах на коже пациента, могут провоцировать аутоиммунные реакции и таким образом вызывать воспаления, однако механизм этого процесса не был до конца ясен. Башкирские генетики выделили матричную РНК, содержащую полную аминокислотную последовательность белка кератина, из волосяных фолликул пациентов. На ее основе ученые синтезировали данный белок и проверили, как на него реагируют иммунные клетки — Т-лимфоциты страдающих псориазом людей.
Т-лимфоциты играют основную роль в приобретенном иммунитете организма. Они находят и уничтожают клетки, несущие чужеродные антигены. В некоторых случаях какой-то из этих механизмов оказывается нарушен, и лимфоциты начинают «охотиться» на собственные клетки и белки организма. В таком случае говорят об аутоиммунных заболеваниях.
Всего в исследовании башкирских врачей приняли участие 29 пациентов с разными формами псориаза, а еще 15 человек, не страдающих кожными заболеваниями, состояли в контрольной группе. Ученые взяли образцы крови каждого испытуемого, содержащие главным образом различные мононуклеарные лимфоциты. Во всех образцах с помощью метода цитометрии исследователи измерили количество Т-лимфоцитов. После чего они обработали образцы раствором, содержащим ранее синтезированные белки-кератины. Спустя пять дней после экспериментального воздействия все замеры были вновь повторены.
Выяснилось, что у большинства больных псориазом кератин вызывает заметное увеличение пролиферации (интенсивного размножения) Т-лимфоцитов. Иными словами, лимфоциты по какой-то причине «считали» этот белок вредным и начинали активно делиться, чтобы «одолеть противника». У контрольной группы таких реакций обнаружено не было. Таким образом, кератин, вероятно, действует как антиген внутреннего происхождения для больных псориазом. Именно поэтому болезнь и поражает в основном богатые этим белком кожные покровы.
Возможной причиной такого необычного поведения Т-лимфоцитов может быть наличие аллелей (определенных вариантов гена) в локусе HLA-C шестой хромосомы. Расположенные там гены участвуют в кодировании белков главного комплекса гистосовместимости, играющего центральную роль в иммунной системе и развитии иммунитета. Башкирским ученым удалось установить, что у больных псориазом, продемонстрировавших максимальную реакцию пролиферации Т-лимфоцитов на кератин, присутствует аллель HLA-Cw*06:02. Вполне вероятно, что именно его активация в геноме пациентов и приводит к возникновению этого кожного заболевания. Полученные уфимскими медиками данные дают надежду на возможную разработку генной терапии от псориаза в будущих исследованиях.
chrdk.ru
Эпигенетика
Эпигенетическая регуляция крайне важна для работы и контроля функции гена. В то же время она и очень чувствительна к внешним воздействиям. С развитием аутоиммунных заболеваний связывают такие нарушения эпигенетики, как метилирование ДНК, меняющее работу гена путем «навешивания» химической группы; модификацию гистонов — белков, поддерживающих компактную упаковку ДНК; некодирующую экспрессию РНК.Влияние образа жизни на эпигенетику подтверждают не только исследование из Стэнфордского университета. В 2014 году ученые систематически проанализировали 329 исследований разных стран по отношениям между между ожирением, адипокинами (гормонами жировой ткани) и болезнями, связанными с иммунитетом. Оказалось, что адипокины участвуют в патогенезе таких заболеваний, как ревматоидный артрит, рассеянный склероз, сахарный диабет первого типа, псориаз, воспалительное заболевание кишечника, псориатический артрит и тиреоидит Хашимото. «У нас был длинный список причин аутоиммунных расстройств: инфекции, курение, пестициды, недостаток витаминов и прочее. Но за последние пять лет появился новый фактор, который невозможно игнорировать, — ожирение«, помимо этого, результатом ожирения оказался дефицит витамина D.
Тема№7 полемики: «Экспрессия…. Регуляция….Перспективы и ральность»
http://medportal.ru/mednovosti/news/2015/08/16/680crispr/
Совершит ли система редактирования днк революцию в медицине?
Около десяти лет назад ученые поняли, что у бактерий есть система защиты, распознающая и разрушающая ДНК нападающих вирусов. Они назвали ее CRISPR – clustered, regularly interspaced, short palindromic repeats (короткие палиндромные повторы, регулярно расположенные группами) – из-за механизма работы.
В этой технологии задействованы РНК-вектор, состоящий из нескольких элементов, и фермент – нуклеаза. Первый распознает нужный участок на ДНК, а второй вырезает его. Таким образом, у исследователей есть инструмент для прицельного разрушения одного гена. Ученые уже исследуют применение CRISPR/Cas9 в лабораториях. Введение в клиническую практику будет зависеть от того, насколько успешно удастся применить эту систему в организме человека. Кроме того, с ее помощью удается и узнать много нового о функциях отдельных генов: отключив ген, можно понять, как он влиял на работу клетки. Биотехнологическая компания из Кембриджа, штат Массачусетс, Editas Medicine, разрабатывает методы лечения рака крови и амавроза Лебера, наследственного глазного заболевания, с использованием этой методики. Программа щедро финансируется. Для лечения рака крови предполагается получить иммунные клетки из организма пациента, настроить их на борьбу с раком, используя модификацию через CRISPR, а затем ввести обратно больному. В случае глазной болезни, систему CRISPR хотят ввести в сетчатку для удаления гена, ответственного за развитие амавроза Лебера. Несмотря на прекрасные перспективы, использование системы CRISPR может столкнуться с несколькими проблемами. Во-первых, пока не ясно, можно ли ее применить к любой клетке человеческого организма. Теоретически этому ничто не мешает, и можно использовать наночастицы и безопасные вирусы в качестве векторов в труднодоступные места, например, в мозг. Во-вторых, неизвестно, как эти «ножницы» повлияют на остальной геном, если вдруг система сработает не таргетно.
Источник:
Could the DNA-editing CRISPR revolutionize medicine?
A popular new gene therapy technology could help treat cataracts, liver disease, muscular dystrophy and other conditions. But the technology, dubbed the «Genesis Engine» by some, has not been tested in people yet, so no one knows whether it would be a safe and effective treatment option.
Тема №8 полемики: «Экспрессия…. Регуляция….Перспективы и ральность»
studfiles.net