|
31.Физиология ұғымы,бөлімдеріФизиология (грекше physis – табиғат, logos — ілім) тірі организм мен оның жеке жүйелері, ағзалары, тіндері және жасушаларының әрекеттерін, тірліктерін зерттейтін биологиялық ғылым. Физиология организм жүйелері мен ағзаларының бір-біріне әсерін, өзара байланысын және сыртқы ортамен қарым- қатынасын тексереді. Сонымен қатар ол әрекеттерді жас кезеңдеріне байланысты онтогенез және эволюциялық даму барысында бақылайды. Физиология жедел дамып келе жатқан ғылым. Ол дербес ғылым ретінде, анатомия мен гистологиядан бөлінгеннен бастап, организмнің тіршілік әрекеті туралы физика, химия ғылымдарының әдістерін қолданып, көптеген нақтылы деректер жинаған. Қазіргі кезде физиологиядан жеке ғылым ретінде биохимия, биофизика, нейрофизиология, эндокринология, радиобиология бөлініп шықты. Физиология – тірліктану ғылымы. Физиология өзінің ғылыми бағытына қарай жалпы, жеке және қолданбалы болып жіктеледі.   Қолданбалы физиология – адамның әлеуметтік жағдайлары мен мақсатты іс-әрекетіне байланысты заңдылықтарды анықтайды. Оның қатарына бірнеше физиология саласы жатады. Қолданбалы физиология – адамның әлеуметтік жағдайлары мен мақсатты іс-әрекетіне байланысты заңдылықтарды анықтайды. Оның қатарына бірнеше физиология саласы жатады.
32. Физиологияның негізгі физиологиялық ұғымдары мен принциптері Физиология басқа мақсаттарына, зерттейтін нысандары мен әдістеріне байланысты қалыпты, патологиялық және клиникалық болып бөлінеді.Қалыпты физиология – дені сау адам ағзаның қалыпты жағдайы, салауатты тұрмыс салтын, әртүрлі әсерлерге бейімделу әрекетін тексеріп, оларды жақсарту амалдарын анықтайды. Қалыпты физиологияның басты мұраты – адамның денсаулығын сақтау. Мұны қазіргі кезде денсаулық туралы ғылым валеология (vale – сау болу, logos — ілім) зерттейді. Денсаулық дегеніміз – адам ағзасының барынша ұзақ өмір сүру барысында биологиялық және психикалық әрекеттері мен тиімді жұмыскерлігінің, әлеуметтік белсенділігінің, сондай-ақ ерекшеліктеріне сәйкес дені сау ұрпақ жалғастыру қабілетінің сақталуы мен дамуы.  Физиологияның жас ерекшеліктері туралы саласы педагогика, психология, валеология және дене тәрбиесі ғылымдары үшін өте қажет.Физиологияның мақсаттары. Физиологияның жас ерекшеліктері туралы саласы педагогика, психология, валеология және дене тәрбиесі ғылымдары үшін өте қажет.Физиологияның мақсаттары.
1. Ағзаның және оның әрбір құрылымының қызметін ұғыну арқылы болашақ мамандардың әрекеттік және клиникалық ойлау қабілеттерін жетілдіру. 2. Физиологиялық зерттеу әдістерін үйрету арқылы әрекеттік диагностика дағдыларын қалыптастыру. 3. Физиология ғылымының қағидаларымен таныстыру арқылы адам денсаулығын тиімді ұйымдастыруды үйрету. 4. Әрбір адамға денсаулық деңгейін анықтау мен бағалау және нығайту тәсілдерін үйрету. 33.Қоздырғыш ұлпалардың жалпы сипаттамасы және қасиеттері.Қозу- Ұлпаның тітіркендіргіш әсеріне арнайы және бейарнамалы реакциямен жауап беретін физиологиялық процесс. Қозғыш ұлпа дегеніміз қозуға қабілетті ұлпаларды атайды. Қозғыш ұлпалардың 3 түрі бар:1. Жүйкелік — жүйкелік серпіністерді тасымалдау қызметін атқарады.2. Бұлшықеттік– тітіркендіргіш ұлпаның жиырылуы мен босаңсуы. 34. Қанның функциясы, физико-химиялық қасиетіҚанға физикалық және химиялық қасиеттер тән. Қанның физикалық қасиеті оның тұтқырлығы. Ол қан түйіршіктері мен плазмадағы, ірі молекулалы заттардың деңгейіне байланысты. Қан тұтқырлығы қанның қойылуына не/се сұйылуына қарай өзгеріп отырады. Қанның бұл қасиеті қан түйіршіктерінің, плазма белоктарының әсіресе глобулиндердің мөлшеріне байланысты. Қанның маңызды қасиеттерінің бірі- осмостық қысымы. Жартылай өткізгіш мембрана арқылы ертіндіні өткізетін күш осмостық қысым деп аталады. Осмостық қысым еріген электролиттер мен молекулалар санына, олардың арасындағы айырмашылыққа байланысты. Достарыңызбен бөлісу: |
дистрофия — hokage8th.simplesite.com
1. Дистрофия, анықтамасы, этиологиясы, жіктелуі, морфологиялық механизмі. -Дистрофия — жасушалар мен тіндерде зат алмасуының бүзылуьша байланы¬сты дамитын патологиялық үрдістерді түсінеміз. -Дистрофияның даму механизмдерінің негізінде, зат алмасу үрдісін қамтамасыз етуші жасушалық жөне жасушааралық қарым-қатынастардың бүзылуы жатады. Дистрофияның дамуына төмендегі өзгерістер себеп болады 1. Инфильтрация. Қан арқылы келген заттардың жасушаға не¬месе жасушааралық тінге мөлшерден тыс сіңіп қалуы. Мысалы, атеросклероз ауруында қанда холестерин мөлшері өте көбейіп кетіп, ол қан тамырларының ішкі қабатына (интимада) сіңіп қалады, семіздік кезінде майлар бауьірда, жүректе жиналады. Декомпозиция (ыдырау). Бүл қалыпты жагдайда бір-бірімен берік байланысқан, бірақ та патология жагдайында ыдырап жеке-жеке көрініп қалатын заттарға төн. Мысалы, май-белок қоспала-ры ыдырағанда келткада жеке-жеке май жөне белок заттары жина-лып қалады. Бүл көбінесе жасуша ультрақүрылымдарының ыды-рап жойылуына байланысты үрдіс. 3. Трансформация. Бүл бір заттың орнына екінші заттың түзілуі. Мысалы, май және көмірсу түзуші затгардан белоктың пайда бо-луы немесе көмірсулардан майдың түзілуі. 4. Денатурация — белоктардың әр түрлі жағдайларға байланы¬сты үйып немесе бірігіп ірі тамшылар (коагуляттар) түзуі.
-Дистрофияның даму механизмдерінің негізінде, зат алмасу үрдісін қамтамасыз етуші жасушалық жөне жасушааралық қарым-қатынастардың бүзылуы жатады. Дистрофияның дамуына төмендегі өзгерістер себеп болады 1. Инфильтрация. Қан арқылы келген заттардың жасушаға не¬месе жасушааралық тінге мөлшерден тыс сіңіп қалуы. Мысалы, атеросклероз ауруында қанда холестерин мөлшері өте көбейіп кетіп, ол қан тамырларының ішкі қабатына (интимада) сіңіп қалады, семіздік кезінде майлар бауьірда, жүректе жиналады. Декомпозиция (ыдырау). Бүл қалыпты жагдайда бір-бірімен берік байланысқан, бірақ та патология жагдайында ыдырап жеке-жеке көрініп қалатын заттарға төн. Мысалы, май-белок қоспала-ры ыдырағанда келткада жеке-жеке май жөне белок заттары жина-лып қалады. Бүл көбінесе жасуша ультрақүрылымдарының ыды-рап жойылуына байланысты үрдіс. 3. Трансформация. Бүл бір заттың орнына екінші заттың түзілуі. Мысалы, май және көмірсу түзуші затгардан белоктың пайда бо-луы немесе көмірсулардан майдың түзілуі. 4. Денатурация — белоктардың әр түрлі жағдайларға байланы¬сты үйып немесе бірігіп ірі тамшылар (коагуляттар) түзуі.
2. Белоктықпаренхималықдистрофия, морфологиялық сипаттамасы. Жасуша ішіндегі белоктар әдетте майлармен қоспа түрінде (липопротеинді кешен) кездеседі. Тек ферменттер ғана таза хими-ялық зат түрінде болады. Жасушада белок алмасуының бүзылуымен қатар су-электро¬лит алмасуы да өзгеріп, цитоплазмада су мөлшері өте көбейеді. Белоктық паренхималық дистрофияларға: гиалин-тамшылы дист¬рофия, гидропиялық (сулы) дистрофиялар және түлеу жатады.
3. Майлы паренхималықдистрофия, морфологиялық сипаттамасы. -Майлы паренхималық дистрофия деп жасуша цитоплазмасьщда майдың көбейіп кетуін, кейде майдың қалыпты жағдайда кездеспейтін жерлерде пайда болуын немесе химиялық қүрамы басқаша майлардың (мысалы, Гоше, Ниман-Пик липоидоздарын-да) жиналып қалуын түсінеміз. Жасушада негізінен үшглицерид-тер, холестерин эфирлері және фосфолипидтер жиналады. Жасу¬шада майдың пайда болуы: жасушадағы май-белок кешендерінің ьщырап, майдың көрініп қалуына (фанероз, декомпозиция), қанда май мөлшерінің көбейіп кетуіне (инфильтрация) және майдың көмірсулар мен белоктар есебінен шамадан тыс түзілуіне (транс¬формация) байланысты. Майлы дистрофия көбінесе жүректе, ба-уырда, бүйректе кездеседі. Май жиналу үрдісі жасушаның жойы-луына (деструкция) соқтырады. Бауырдың майлы циррозының дамуының негізінде осы механизмдер жатыр. Жасушаларда майды анықтау үшін арнайы гистохимиялық өдістер қолданылады. Май судан III жене шарлах бояуымен сарғ-ыш-қызыл түске, осмий қышқылы мен судан IV бояуымен кара түске боялады. Морф.сип. Бауыр жасушаларында өуелі майда тамшылар пайда болады (майда тамшылы семіру), кейінірек олар бір-біріне қосылып ірі тамшылар түзеді (ірі тамшылы семіру). Бауыр май дистрофиясы нәтижесінде үлкейіп, божырап, қамырдай жүмсарып қалады, түсі қоңыр-сарғыш немесе сары. Журектің майлы дистрофиясы электрондық миіфоскопта зер-ттегенде май тамшьшары цитоплазманы бүтіндей жайлап алады, митохондрилер ьщырап, кардиомиоциттердің көлденең жолақта-ры жойьшады. Буйректер майлы дистрофияга байланысты үлкейіп, божырап қалады. Бүйректің қыртысты қабаты қалындап, көмескіленіп, ара-сында сары түсті үсақ бедерлер пайда болады. Мюфоскоппен қара-ганда май бүйрек өзектерінің эпителийінде және ағза стромасын-да жиналып қалғанын көреміз. Май тамшыларының өзекше эпителиінде пайда болуы гломерулярлық сүзгі өтюзгіштігінің ар-тып кетуіне, несеп қүрамындагы майдың реабсорбциясына байла¬нысты.
Жасушаларда майды анықтау үшін арнайы гистохимиялық өдістер қолданылады. Май судан III жене шарлах бояуымен сарғ-ыш-қызыл түске, осмий қышқылы мен судан IV бояуымен кара түске боялады. Морф.сип. Бауыр жасушаларында өуелі майда тамшылар пайда болады (майда тамшылы семіру), кейінірек олар бір-біріне қосылып ірі тамшылар түзеді (ірі тамшылы семіру). Бауыр май дистрофиясы нәтижесінде үлкейіп, божырап, қамырдай жүмсарып қалады, түсі қоңыр-сарғыш немесе сары. Журектің майлы дистрофиясы электрондық миіфоскопта зер-ттегенде май тамшьшары цитоплазманы бүтіндей жайлап алады, митохондрилер ьщырап, кардиомиоциттердің көлденең жолақта-ры жойьшады. Буйректер майлы дистрофияга байланысты үлкейіп, божырап қалады. Бүйректің қыртысты қабаты қалындап, көмескіленіп, ара-сында сары түсті үсақ бедерлер пайда болады. Мюфоскоппен қара-ганда май бүйрек өзектерінің эпителийінде және ағза стромасын-да жиналып қалғанын көреміз. Май тамшыларының өзекше эпителиінде пайда болуы гломерулярлық сүзгі өтюзгіштігінің ар-тып кетуіне, несеп қүрамындагы майдың реабсорбциясына байла¬нысты.
4. Көмірсулы паренхималықдистрофия, морфологиялық сипаттамасы. Көмірсулар гистохимиялық қүрамы бойынша: 1) полисаха-ридтерге, 2) глюкозамингликандарға жөне 3) гликопротеидтерге бөлінеді. Күнделікті өмірде полисахаридтерге жатушы гликогеннің жөне гликопротеидтер алмасуының бүзылуы көбірек кездеседі. Гликоген алмасуының бүзылуы. Гликоген жасушаларда мөлдір тамшы түрінде көрініп, оны арнайы гистохимиялық реакциялар-мен (Беста карминімен) анықтауға болады. Ішкен тамақпен орга-низмге түскен гликоген ферменттік гидролиз нәтижесінде глюко-заға айналады, ал бауыр мен қаңқа бүлшықеттерінде осы глюкоза¬дан гликоген түзіліп «қор» түрінде жиналады. Организмге қажет болғанда осы қордагы гликоген глюкозага айналып, зат алмасу үрдісіне қатысады. Сол үшін бүл гликогенді турақсыз гликоген дейді. Ал, нерв жасушаларының, жүректің өткізгіш жүйесінің, қан тамырларының, дөнекер тіннің, шеміршектің қүрамындағы гли¬коген өзгермейді, сондықтан оны түрақты гликоген дейді. Гликопротеидтер алмасуының бүзылуы. Гликопротеидтерге му¬цин мен мукоидтар кіреді, оларды шырьшпы жөне шырышқа үқсас заттар деп атайды. Көптеген патологиялық жагдайларда тіндер мен жасушаларда шырыш істеп шыгару үрдісі бүзылады. Асқазан шы¬рышты қабатындагы бездердің тітіркенуі нөтижесінде секреция үрдісі күшейіп асқазанның ішкі қабатын шырышты зат жауып жатады (гиперсекреция). Егер шырышты заттар тиісті мөлшерден кем пайда болса, олар ылғалдап түрған шырьппты қабықтар қүрғап қалады (гипосекреция). Мысалы, Шегрен синдромында көздің шырьппты қабығы қүргап, содан соң ол жер қабынады (керато-конъюнктивит).
Гликопротеидтер алмасуының бүзылуы. Гликопротеидтерге му¬цин мен мукоидтар кіреді, оларды шырьшпы жөне шырышқа үқсас заттар деп атайды. Көптеген патологиялық жагдайларда тіндер мен жасушаларда шырыш істеп шыгару үрдісі бүзылады. Асқазан шы¬рышты қабатындагы бездердің тітіркенуі нөтижесінде секреция үрдісі күшейіп асқазанның ішкі қабатын шырышты зат жауып жатады (гиперсекреция). Егер шырышты заттар тиісті мөлшерден кем пайда болса, олар ылғалдап түрған шырьппты қабықтар қүрғап қалады (гипосекреция). Мысалы, Шегрен синдромында көздің шырьппты қабығы қүргап, содан соң ол жер қабынады (керато-конъюнктивит).
5. Стромалық-қантамырлық дистрофия, морфологиялық сипаттамасы, жіктелуі. Стромалық-қантамырлық дистрофиялар дәнекер тінде зат ал-масуының бүзылуымен, осыган байланысты агзалар стромасы мен қан тамырлары қабыргасының альтерациясымен сипатталады. Зат алмасуының бүзылу түрлеріне қарап: белоктық, майлы және көмірсулық стромалық-қантамырлық дистрофияларды ажыратады. Белоктық стромалық-қан тамырлық дистрофияларга: муко-идтық ісіну, фибриноидты ісіну, гиалиноз жөне амилоидоз кіреді
Белоктық стромалық-қан тамырлық дистрофияларга: муко-идтық ісіну, фибриноидты ісіну, гиалиноз жөне амилоидоз кіреді
6. Мукоидтық және фибриноидтық ісіну, асқынуы, морфологиялық сипаттамасы. Мукоидтық ісіну — Бұл үрдісіің негізіңце дөнекер тін қүрылысының үстірт бүзылуы жатады. Коллаген талшықтары ісініп, түтеленіп, бір-бірінен алшақтайды, дәнекер тін қүрамынан хондроидтық күкірт жөне гиалурон қышқылдары, глюкозамингликандар бөлініп шы-ғады. Осыған байланысты қан тамырлары қабырғаларының өткізгіштііі күшейіп, плазма белоктары, оның ішінде глобулиндер айналадағы тіндерге жиналады. Нәтижесінде бүл тіндер (жасушаа-ралық заттар) өздерінің белгілі бір бояулармен боялу қасиеттерін өзгертеді (метахромазия). Әдетте толуидин көгі, қалыпты тіндерді көк түске бояса, мукоидтық ісіну ошақтарында тін көкйші-қызыл түске боялады, осылайша бүл үрдісті микроскоппен анықтауға болады. Мукоидтық ісіну ревматизм тобына кіреіін ауруларда көбірек кездеседі. Бүл үрдіс дәнекер тіннің толық қайта қалпына келуімен аяқталады немесе ол фибриноидтық ісінуге өтеді.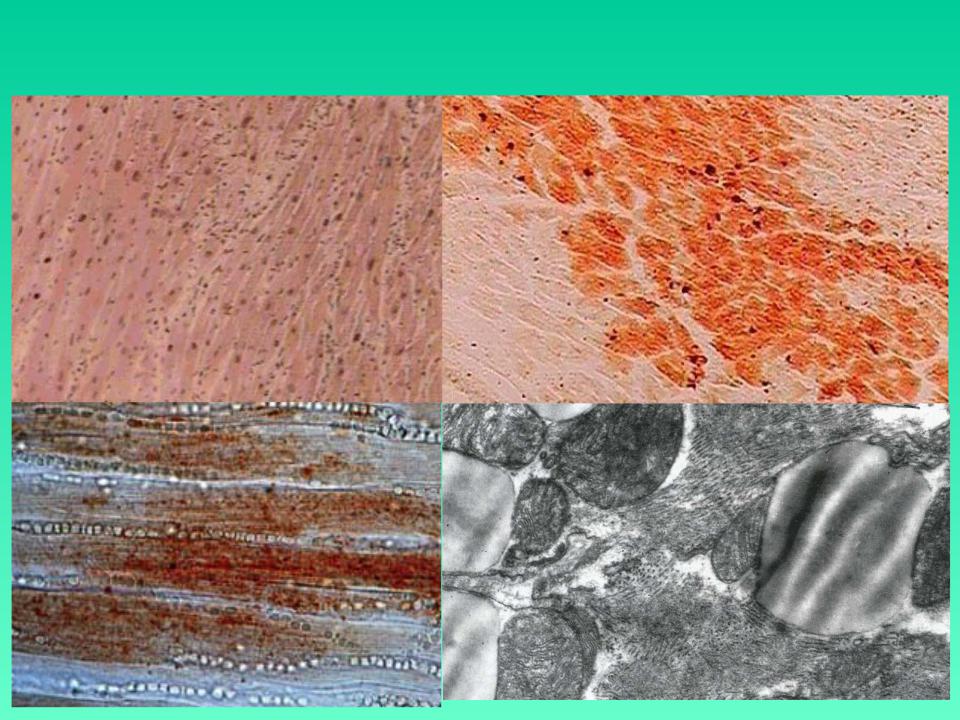 Фибриноидтық ісіну — Фибриноидтық ісіну дәнекер тіннің терең және қайтымсыз бүзылуымен, яғни деструкциясымен, қан тамы-ры мен ііндер өткізгіштігінің өте артып кеткендігімен жөне фиб-ринге үқсае заттың (фибриноид) пайда болуымен сипатталады. Дөнекер тін талшықтары ісініп, бір-біріне қосылып, біртекті бо-лып қалады және қышқыл бояуларды өзіне жақсы сіңдіреді, Пик-рофуксин бояуымен сары түске боялады (қалыпты дөнекер тін қызыл түске боялуы керек). Фибриноидтың қүрамы дәнекер ііннің зақымдану механизміне байланысты, бірақ та оның барлық түрінде де фибрин болады. Кейбір ауруларда (ревматизмдік аурулар және т.б.) фибрино¬ид қүрамында иммундық кешендер кездеседі. Ал, жүйелі қызыл жегі ауруында фибриноид өз қүрамында ядро қалдықтарының болуымен ерек-шеленеді. Фибриноидтық ісіну нәтижесінде тін бүтіндей өледі, кейінірек склерозға немесе гиалинозға айналады
Фибриноидтық ісіну — Фибриноидтық ісіну дәнекер тіннің терең және қайтымсыз бүзылуымен, яғни деструкциясымен, қан тамы-ры мен ііндер өткізгіштігінің өте артып кеткендігімен жөне фиб-ринге үқсае заттың (фибриноид) пайда болуымен сипатталады. Дөнекер тін талшықтары ісініп, бір-біріне қосылып, біртекті бо-лып қалады және қышқыл бояуларды өзіне жақсы сіңдіреді, Пик-рофуксин бояуымен сары түске боялады (қалыпты дөнекер тін қызыл түске боялуы керек). Фибриноидтың қүрамы дәнекер ііннің зақымдану механизміне байланысты, бірақ та оның барлық түрінде де фибрин болады. Кейбір ауруларда (ревматизмдік аурулар және т.б.) фибрино¬ид қүрамында иммундық кешендер кездеседі. Ал, жүйелі қызыл жегі ауруында фибриноид өз қүрамында ядро қалдықтарының болуымен ерек-шеленеді. Фибриноидтық ісіну нәтижесінде тін бүтіндей өледі, кейінірек склерозға немесе гиалинозға айналады
7. Гиалиноз: анықтамасы, этиологиясы, морфогенезі, морфологиялық сипаттамасы. Гиалиноз тіндерде біртекті, күңгірт, гиалин шеміршегіне үқсас, қатты заттардың пайда болуымен сипатталады. Гиалиноз дөнекер тінде, ағзалар строма-сында жөне қан тамырлары қабырғаларында көрінеді. Гиалиноз қан тамырларының өткізгіппігі өте артып кеткенде, олардың қабы-рғасындағы талшықтық қүрылымдар, өзгергенде, фибриноидтық ісінуден соң склероз және некроз нәтижесінде пайда болады. Қан тамыры қабырғасындағы эластикалық, аргирофилді талшықтар-дың ыдырау өнімдері сол жердегі шөгіп қалған плазма белоктары-мен біріііп, жаңа фибриллярлық белок — гиалин — түзеді. Гиалиннің химияльщ қүрамына байланысты 1) жай гиалин, 2) липогиалин, 3) күрделі гиалин түрлерін ажыратады. Жай гиалин негізінен қан плазмасынан қүралган, оның пайда болуы, қан тамырлары кемерінің өткізгіштігінің молаюымен бай¬ланысты (12-сурет). Липогиалин қантгы диабет ауруында кездеседі, оның қүрамы негізінен липопротеидтерден түрады. Организм қантты диабетке байланысты бүзылған зат алмасу үрдісін осылайша реттеуге, ягни қандағы артық липопротеидтерді қан тамырлары арқылы шыға-руғы өрекет жасайды. Күрделі гиалиннің туындауы қан тамырларына иммундық кешендердің шөгіп қалуына байланысты.
Гиалиноз дөнекер тінде, ағзалар строма-сында жөне қан тамырлары қабырғаларында көрінеді. Гиалиноз қан тамырларының өткізгіппігі өте артып кеткенде, олардың қабы-рғасындағы талшықтық қүрылымдар, өзгергенде, фибриноидтық ісінуден соң склероз және некроз нәтижесінде пайда болады. Қан тамыры қабырғасындағы эластикалық, аргирофилді талшықтар-дың ыдырау өнімдері сол жердегі шөгіп қалған плазма белоктары-мен біріііп, жаңа фибриллярлық белок — гиалин — түзеді. Гиалиннің химияльщ қүрамына байланысты 1) жай гиалин, 2) липогиалин, 3) күрделі гиалин түрлерін ажыратады. Жай гиалин негізінен қан плазмасынан қүралган, оның пайда болуы, қан тамырлары кемерінің өткізгіштігінің молаюымен бай¬ланысты (12-сурет). Липогиалин қантгы диабет ауруында кездеседі, оның қүрамы негізінен липопротеидтерден түрады. Организм қантты диабетке байланысты бүзылған зат алмасу үрдісін осылайша реттеуге, ягни қандағы артық липопротеидтерді қан тамырлары арқылы шыға-руғы өрекет жасайды. Күрделі гиалиннің туындауы қан тамырларына иммундық кешендердің шөгіп қалуына байланысты. Гиалинозға қан тамыр-ларындағы фибриноидтьщ өзгерістер және иммундық қабынулар себеп болады. Бүл гиалиннің қүрамында фибрин жөне деструк-цияға үшыраған қан тамырларының элементтері көрінеді Дөнекер тін гиалинозы фибриноидтық ісіну, плазморрагия, фибринодтық некроз, склероз нәтижесі. Фибриноидіық өзгерістерге байланысты өзгерген дәнекер тін талпплқтары бір-біріне қосылып біртекті қатты зат — гиалинге айналады. Фибриноидтық некроз иммундық кешендер әсеріңде дамиды. Сол үшін дәнекер тін гиа¬линозы ревматизмдік ауруларда, иммундық-кешенді сырқаттарда жиі кездеседі. Гиалиноздың жергілікті және жалпы түрлері бар, Жергілікті гиалиноз келлоидты тыртықтарда, сірлі қуыстардың фиброзында, тромбтарда, ісіктердің стромасында (13-сурет) кездеседі. Жалпы гиалиноз гипертония ауруында, ревматизмдік ауруларда көптеген ағзалардьщ қан тамырларьшда және стромасында көрінеді. Гиалиноз талақ қабына жергілікті жиналып қалганда, ол қалың-дап, қатайып, жылтыр сүр түсті «әйнекейлі көкбауыр» деген ерек-ше корініске ие болады (14-сурет).
Гиалинозға қан тамыр-ларындағы фибриноидтьщ өзгерістер және иммундық қабынулар себеп болады. Бүл гиалиннің қүрамында фибрин жөне деструк-цияға үшыраған қан тамырларының элементтері көрінеді Дөнекер тін гиалинозы фибриноидтық ісіну, плазморрагия, фибринодтық некроз, склероз нәтижесі. Фибриноидіық өзгерістерге байланысты өзгерген дәнекер тін талпплқтары бір-біріне қосылып біртекті қатты зат — гиалинге айналады. Фибриноидтық некроз иммундық кешендер әсеріңде дамиды. Сол үшін дәнекер тін гиа¬линозы ревматизмдік ауруларда, иммундық-кешенді сырқаттарда жиі кездеседі. Гиалиноздың жергілікті және жалпы түрлері бар, Жергілікті гиалиноз келлоидты тыртықтарда, сірлі қуыстардың фиброзында, тромбтарда, ісіктердің стромасында (13-сурет) кездеседі. Жалпы гиалиноз гипертония ауруында, ревматизмдік ауруларда көптеген ағзалардьщ қан тамырларьшда және стромасында көрінеді. Гиалиноз талақ қабына жергілікті жиналып қалганда, ол қалың-дап, қатайып, жылтыр сүр түсті «әйнекейлі көкбауыр» деген ерек-ше корініске ие болады (14-сурет). Гипертония ауруы кезіндегі бүйрек ыіумақтарының гиалино¬зы бүйректің біріншілік бүрісіп қалуының және оның жетіспеушілігінің бірден-бір себебі. Гиалиноз көбінесе қайтымсыз өзгерістерге жатады. Тек тыр-тықтанган жерлерде, келлоид ошақтарында гана, ол ішінара жой-ылуы мүмкін.
Гипертония ауруы кезіндегі бүйрек ыіумақтарының гиалино¬зы бүйректің біріншілік бүрісіп қалуының және оның жетіспеушілігінің бірден-бір себебі. Гиалиноз көбінесе қайтымсыз өзгерістерге жатады. Тек тыр-тықтанган жерлерде, келлоид ошақтарында гана, ол ішінара жой-ылуы мүмкін.
8. Амилоидоз: этиологиясы, патогенезі, морфогенезі, жіктелуі, клинико-морфологиялық көрінуі, диагностикалау әдісі. 1) Амилоидоз деп зат алмасуының өте ауыр түрде бүзылуы нәтижесінде ағзалардың аралық тінінде қүрамы өте күрделі, қалып-ты жағдайда кездеспейтін, аномалды белоктық заттың түзілуін айтады. Этиология AL — амилоидоз өз-озінен туындайтын (біріншілік) амилоидоз және әртүрлі ісіктерге байланысты пайда болатын амилоидоз үшін тән. ҒАР — амилоидоз жеке отбасы мүшелерінде үшырайтын амилоидоз. ASCI — амилои¬доз кәрілік амилоидозына, оның ішінде жүрек-қан тамырлар жүйесінің амилоидозына жатады. Жіктелуі: -Түзуші белоктардың амилоид талшықтарының, био(гисто)хи-миялық қасиеттері; -Амилоидоздың даму себептеріне қарап; — Амилоидозды тінде жайғасуына қарап: периретикулярлық және периколлагендік түрлерге бөледі; Амилоидоздың даму себептеріне қарап: — біріншілік (идиопатиялық), — түрмыста артгырылган (екіншілік), — түқым қауалау жолымен (генетикалық) дамитын, — кәрілік түрлерін ажыратады. Біріншілік амилоидоз. Жүрек-қан тамыр жүйесін, бүлшықет-терді, нервтерді зақымдауына байланысты «мезодермалық амило¬идоз» деп аталады. Аурудың себебі белгісіз. Екіншілік амилоидоз түрмыста кең тараган. Амилоидоздың ту-ындауы туберкулез, созылмалы остеомиелит, бронхоэктазия ауруы сияқты тіндердің созылмалы іріңдеуімен, соның нәтижесінде ыды-рау өнімдерінің пайда болуымен және иммундық бүзылыстары-мен сипатталатын сырқаттар үшін тән. Бірақ, осындай өзгерістер ревматизмдік ауруларда да, жаралы колитте де, аутоиммундық ауру¬ларда да кездеседі.
Біріншілік амилоидоз. Жүрек-қан тамыр жүйесін, бүлшықет-терді, нервтерді зақымдауына байланысты «мезодермалық амило¬идоз» деп аталады. Аурудың себебі белгісіз. Екіншілік амилоидоз түрмыста кең тараган. Амилоидоздың ту-ындауы туберкулез, созылмалы остеомиелит, бронхоэктазия ауруы сияқты тіндердің созылмалы іріңдеуімен, соның нәтижесінде ыды-рау өнімдерінің пайда болуымен және иммундық бүзылыстары-мен сипатталатын сырқаттар үшін тән. Бірақ, осындай өзгерістер ревматизмдік ауруларда да, жаралы колитте де, аутоиммундық ауру¬ларда да кездеседі.
Амилоидоздың морфогенезі өте күрделі болып ол бірнеше саты-ны қамтиды: 1) амилоидқа алып келуші белоктардың түзілуі; 2) олардан амилоид белоктарының пайда болуы; 3) макрофаг-амилоидобласт жасушаларында осы амилоид бе-локтарынан амилоид талшықтарының түзілуі; 4) амилоид талшықтарьшың бір-біріне жабысып амилоидтың негізгі қаңқасын қүруы; 5) амилоид фибрилдерінің қан плазмасыньщ белоктары мен гликопротеидтері және тіндегі глюкозамингликандармен қосылып амилоид қүрауы. Амилоид жасушадан тыс, ретикуляр немесе коллаген талшық-тарын бойлап, шөгіп қалады. Талшықты белоктар (фибрилдер) амилоидтың негізін қүраушы затгар болып есептеледі . Электрондық микроскоппен қара-ғанда амилоид белогы — «таза» талшықтардан және таяқшаға үқсас қүрылымдардан (Р-компонент) түзілген. Амилоид фибрилдерінің диаметрі 7,5 нм, үзындығы 800 нм-ға дейін. Әр 4 нм-нан кейін көлденең жолақтары болады. Осыған байланысты олар «қайтала-ма таяқшалар» деп аталады. Таяқшалардың диаметрі 10 нм, үзын-дығы 250 нм-ге дейін. Поляризациялаушы микроскопта осы белоктар анизотропия және дихроизм қасиеттеріне ие
Амилоид жасушадан тыс, ретикуляр немесе коллаген талшық-тарын бойлап, шөгіп қалады. Талшықты белоктар (фибрилдер) амилоидтың негізін қүраушы затгар болып есептеледі . Электрондық микроскоппен қара-ғанда амилоид белогы — «таза» талшықтардан және таяқшаға үқсас қүрылымдардан (Р-компонент) түзілген. Амилоид фибрилдерінің диаметрі 7,5 нм, үзындығы 800 нм-ға дейін. Әр 4 нм-нан кейін көлденең жолақтары болады. Осыған байланысты олар «қайтала-ма таяқшалар» деп аталады. Таяқшалардың диаметрі 10 нм, үзын-дығы 250 нм-ге дейін. Поляризациялаушы микроскопта осы белоктар анизотропия және дихроизм қасиеттеріне ие
Микроскоппен қараганда аралық тінде біртекті, гиалинге үқсас зат көрінеді, бірақ амилоид гиалиннен өзінің көптеген мор-фологиялық, гистохимиялық және иммунологиялық қасиеттерімен ерекшеленеді. Амилоид пен гиалинді бір-бірінен ажырату үшін арнайы гистохимиялық реакциялар пайдаланады: 2) Йодтың Люголь ерітіндісімен амилоид қоңыр-қызыл түске, басқа тіндер және гиалин сары түске боялады; 3) Генциан- немесе метилвиолетпен бояғанда амилоид солгын қызыл түсте, басқа тіндер көкшіл түсте көрінеді; 4) Йодгрюн бояуымен амилоид қызыл түске, ал қалған тіндер жасыл түске боялады; Конгорот бояуы басқа тіндерді қызғылт түске, ал амилоид-ты қоңыр-қызыл түске бояйды
9. Аралас дистрофиялар- анықтамасы, жіктелуі. Аралас дистрофия деп зат алмасу үрдісінің жасуша ішінде және жасушааралық тіңде бірдей бүзылуын айтады. Аралас дистрофияға: хромопротеидтер, нуклеопротеидтер, липопротеидтер және мине-ралдар алмасуының бүзылуы кіреді. Тегіне байланысты 3 топқа бөлінеді: гемоглобиногенді, гемоглобиннен түзілетін әртүрлі заттар; протеиногенді немесе тирогиногенді, тирозин белогының алмасу бұзылыстарыныан түзілген заттар липидогенді немесе липопигменттер, май алмасуынан пайда болған заттар. Пигменттің мөлшеріне байланысты: мөлшері көбеюі мүмкін азаюы мүмкін толық жойылуы мүмкін Үрдістің таралуына байланысты: -жалпы -жергілікті Этиологиялық фактор — тұқым қуалайды — жүре пайда болған -біріншілік, өз алдына пайда болған аурулардың морфологиялық субстраты болып табылады — екіншілік, әртүрлі сырқаттардан және патологиялық жағдайлардан, кейін дамиды
Аралас дистрофиялар- анықтамасы, жіктелуі. Аралас дистрофия деп зат алмасу үрдісінің жасуша ішінде және жасушааралық тіңде бірдей бүзылуын айтады. Аралас дистрофияға: хромопротеидтер, нуклеопротеидтер, липопротеидтер және мине-ралдар алмасуының бүзылуы кіреді. Тегіне байланысты 3 топқа бөлінеді: гемоглобиногенді, гемоглобиннен түзілетін әртүрлі заттар; протеиногенді немесе тирогиногенді, тирозин белогының алмасу бұзылыстарыныан түзілген заттар липидогенді немесе липопигменттер, май алмасуынан пайда болған заттар. Пигменттің мөлшеріне байланысты: мөлшері көбеюі мүмкін азаюы мүмкін толық жойылуы мүмкін Үрдістің таралуына байланысты: -жалпы -жергілікті Этиологиялық фактор — тұқым қуалайды — жүре пайда болған -біріншілік, өз алдына пайда болған аурулардың морфологиялық субстраты болып табылады — екіншілік, әртүрлі сырқаттардан және патологиялық жағдайлардан, кейін дамиды
Балалардағы дистрофия — себептері, симптомдары, диагнозы және емі
Дистрофия – бұл баланың созылмалы нашарлауы және тіндік трофизм, онда даму бұзылысы орын алады. Клиникалық көрініс nатология түріне байланысты. Ең жиі кездесетін белгілер: адинамия, аnатия, серпімділік пен тері тургорын төмендетеді, тері астындағы тіннің жұқаруы, бұлшықеттің бұлшықет тонусының төмендеуі және психофизикалық дамудың жоғарылауы. Диагноз баланы тікелей зерттеу кезінде патологиялық өзгерістерді анықтауға және зертханалық зерттеулерде бұзушылықтарды анықтауға негізделген. Емдеу принциптері – жақсы тамақтану және, мүмкіндігінше, этиологиялық факторларды алып тастау.
Клиникалық көрініс nатология түріне байланысты. Ең жиі кездесетін белгілер: адинамия, аnатия, серпімділік пен тері тургорын төмендетеді, тері астындағы тіннің жұқаруы, бұлшықеттің бұлшықет тонусының төмендеуі және психофизикалық дамудың жоғарылауы. Диагноз баланы тікелей зерттеу кезінде патологиялық өзгерістерді анықтауға және зертханалық зерттеулерде бұзушылықтарды анықтауға негізделген. Емдеу принциптері – жақсы тамақтану және, мүмкіндігінше, этиологиялық факторларды алып тастау.
Балалардағы дистрофия
Дистрофия – бұл педиатриядағы созылмалы патологиялық жағдай, ол бала нашар тамақтанумен сипатталады, метаболизм ақауларымен және дамудың кешігуімен көрінеді. Бұл ұжымдық ұғым, соның ішінде бірнеше нозологиялар: гипотрофия, ипостат және паратофия. Аурулардың бұл тобы 3 жасқа толмаған балаларға тән, алайда ол егде жастағы уақытта дами алады. Дистрофия — бұл әлеуметтік негізделген патология, себебі оның сыртқы көрінісі баланың тамақтануының ұтымдылығына және оған қамқорлықтың пайдалылығына байланысты.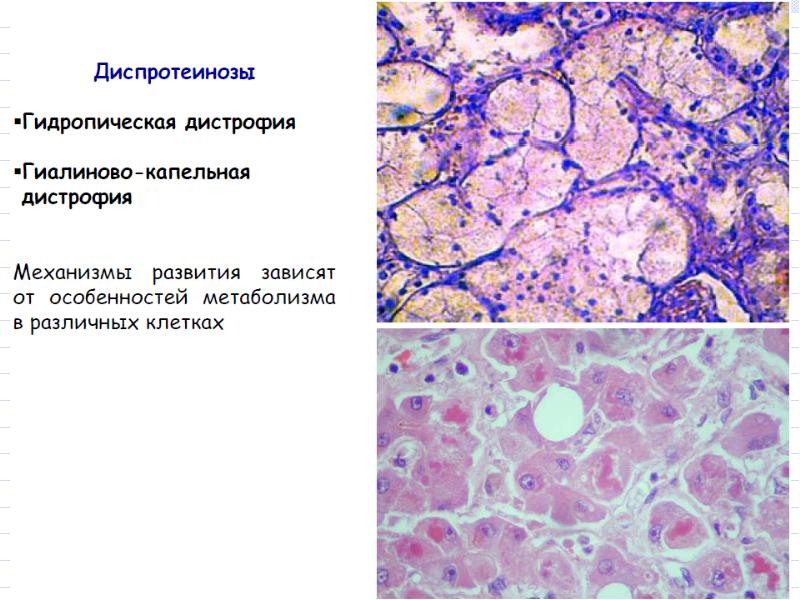 Еуропа мен ТМД елдеріндегі таралу – 2% барлық балалардан. Африкада ең жоғары көрсеткіш тіркелген – 10-27%. 37 жастан асқан жүкті балаларда дистрофия 2-2 деңгейде дамиды,5 есе жиі, толық емес мерзімге қарағанда.
Еуропа мен ТМД елдеріндегі таралу – 2% барлық балалардан. Африкада ең жоғары көрсеткіш тіркелген – 10-27%. 37 жастан асқан жүкті балаларда дистрофия 2-2 деңгейде дамиды,5 есе жиі, толық емес мерзімге қарағанда.
Балалардың дистрофиясының себептері
Балалардағы дистрофияны патологиялық өзгерістер арқылы бастауға болады, анасы сияқты, сондықтан баладан. Пренатальдық және босанғаннан кейінгі себептерді анықтауға болады. Біріншісі — жүктіліктің патологиясы (гестозы, Плацентаның патологиялық байланысы), жұқпалы аурулар (ЖРВИ), нашар тамақтану, эмоциялық жүктеме, ішімдік ішу, темекі және есірткі құралдары, аналық жас (18 жастан 40 жасқа дейін). Босанғаннан кейінгі себептердің көпшілігі баладан пайда болады. Олардың ішінде асқазан-ішек жеткіліксіздігі («жарылған тамшылары», «ерін еріні», пилорлық стеноз, мегаколон, Хиршспрунг ауруы), мальабсорбция синдромы (мистикалық фиброзбен ауырады, целиак ауруы), Асқорыту жүйесі аурулары (қатерлі ісіктер, асқазан мен ішектің полипозы, гастрит, панкреатит, холецистит және т. б). Босанғаннан кейінгі кезеңде трофизмнің бұзылуы емшек сүтімен емізу кезінде емшек сүтінің жетіспеушілігінен туындауы мүмкін, баланың тамақтануындағы ақаулықтар және ақылсыз есептеу.
б). Босанғаннан кейінгі кезеңде трофизмнің бұзылуы емшек сүтімен емізу кезінде емшек сүтінің жетіспеушілігінен туындауы мүмкін, баланың тамақтануындағы ақаулықтар және ақылсыз есептеу.
Патогенетикалық пренатальді дистрофия патогенетикалық аурулармен және жатырдың гипоксиясы. Бұл шарт, бұрылыңыз, орталық жүйке жүйесіндегі бұзылуларға әкеледі, бұл дистрофияны тудырады. Пенназальды нысандар асқазан бұзылысы мен ми қыртысының қозу қабілетіндегі бұзылыстарына байланысты дамиды.
Балалардағы дистрофияның жіктелуі
Дистрофия 3 негізгі клиникалық нұсқаны қамтиды:
- Гипотрофия. Биіктігі бойынша салмағы аз. 3 ауырлық дәрежесі бар: Мен тұрмын. – дене салмағының 10-нан 20-ға дейін жетуі%; IМен тұрмын. – 20-дан 30-ға дейін%; III ст. – 30% және тағы басқалар.
- Гипостатура. Белгілі бір жас санаты бойынша нормадан массасы мен биіктігінің біркелкі болмауы.
- Паратофия. Өздерінің жасына арналған артық салмақпен ерекшеленеді. Бұл жағдайда баланың өсуі жас мөлшеріне сәйкес болуы мүмкін.

Даму кезеңіне байланысты дистрофияның келесі түрлері бөлінеді:
- Туа біткен (пренаталдық). Бұл жағдайда бала туған сәттен бастап трофиканы бұзады, ұрықтың даму ақаулары мен жүктіліктің патологиясы туындаған.
- Сатып алынды (босанғаннан кейінгі). Бала дистрофиясыз туады. Ауытқулар дамыған аурулар аясында орын алады, тамақтану немесе күтім.
- Біріктірілген. Патологиялық факторлардың әсерінен қалыптасқан, туғаннан кейін.
Даму механизмін ескере отырып, олар жіктеледі:
- Бастапқы. Бұл жағдайда дистрофия тәуелсіз ауру ретінде пайда болады.
- Қосымша. Олар басқа патологиялардың қиындығы: метаболикалық бұзылулар, асқазан-ішек жолдарының функциясының болмауы, ішек дисбиозы.
Балалардағы дистрофия белгілері
Балалардағы дистрофия клиникасы аурудың түріне байланысты. Бірінші белгілер туған кезде де анықталуы мүмкін (пренаталдық нысандар), және туылғаннан кейін бірнеше рет (босанғаннан кейінгі) – бірнеше күннен бастап айларға немесе жылдарға дейін.
Неғұрлым жеткіліксіз тамақтану дәрежесіне байланысты клиникалық көріністің өз ерекшеліктері бар. Жұмсақ түрінде (I ст.) Нормадан ауытқулар тек мақсатты зерттеу арқылы анықталады. Баланың жалпы жағдайы ауыр емес. Мүмкін патологиялық өзгерістер – тері тургорын азайту, Ішкі абдоминаль қабырғасында тері астындағы май тінінің қабатының жұқаруы. Орташа пішін (II ст.) баланың апатиясымен сипатталады, летарги, тәбетінің төмендеуі, қалыпты зияткерлік мүгедектік. Серпімділік пен тері тургорының төмендеуі, оның құрғақтығы, дене температурасының төмендеуі және бұлшық ет тозаңы. Майлы тканьдердің қалыпты мөлшері тек бетінде қалады, басқа аудандарда ол айтарлықтай жіңішке. Жүректің жиілігі мен тыныс алу жиілігін арттыру, мылжың жүрек тондары, кафедраның бұзылуы. Жиі кездесетін аурулар бар (пневмония, синусит, пиелонефрит және т. п.).
Ауыр формасы (III ст.) ұйқышылдықпен бірге жүреді, тітіркенуді күшейтеді, теріс құбылыстар, психофизикалық дамуда артта қалады, бұрын сатып алынған дағдыларды жоғалту. Дененің барлық бөліктерінде тері астындағы майлы тіннің толық болмауы арқылы анықталады, бозғылт тері, «артық емес» тері бүктемелері, «қисынды» тұлға. Сондай-ақ, гипертоноздың аясында бұлшықетпен атрофия анықталды, тургор толық жоғалту, экзиккоз, шырышты қабықтарды және кебулерді кептіру. Дене температурасы төмендейді және қоршаған ортаға әсер етеді. Ауыр тыныс және жүрек-қан тамырларының жеткіліксіздігі орын алады, асқазан-ішек қызметінің бұзылысы. ІІ немесе ІІІ кезеңдегі клиникалық гипотрофия гипостатураға тән., алайда кез-келген патологиялық өзгерістің конституциялық тұрақсыздығы (антропометриялық ауытқулардан басқа) орын алмайды.
Дененің барлық бөліктерінде тері астындағы майлы тіннің толық болмауы арқылы анықталады, бозғылт тері, «артық емес» тері бүктемелері, «қисынды» тұлға. Сондай-ақ, гипертоноздың аясында бұлшықетпен атрофия анықталды, тургор толық жоғалту, экзиккоз, шырышты қабықтарды және кебулерді кептіру. Дене температурасы төмендейді және қоршаған ортаға әсер етеді. Ауыр тыныс және жүрек-қан тамырларының жеткіліксіздігі орын алады, асқазан-ішек қызметінің бұзылысы. ІІ немесе ІІІ кезеңдегі клиникалық гипотрофия гипостатураға тән., алайда кез-келген патологиялық өзгерістің конституциялық тұрақсыздығы (антропометриялық ауытқулардан басқа) орын алмайды.
Paratrophy көбінесе бала нашар тамақтануымен дамиды. Орташа әлсіздік байқалды және бұлшықет тонусын төмендетті. Мүмкін, мазасыздану. Егде жастағы балалар тыныс жетіспеушілігінің пайда болуына шағымдана алады, шаршау мен бас ауруларының артуы. Аппетит жиі қысқарды, қалыпты емес. Бозғылт тері, жиі паста. Тері астындағы майлы қабат тым көп дамыған (әсіресе жамбас және іштің қабырғасында), алайда, тері тургорі мен икемділігі төмендейді. Антропометриялық көрсеткіштер жас мөлшеріне сәйкес болуы немесе одан асып кетуі мүмкін. Жиі диспропорциондық физика бар.
Антропометриялық көрсеткіштер жас мөлшеріне сәйкес болуы немесе одан асып кетуі мүмкін. Жиі диспропорциондық физика бар.
Балалардағы дистрофия диагностикасы
Балалардағы дистрофия диагностикасы анамнестикалық деректер жинағына кіреді, физикалық тексеру, зертхана және, айғақтар бойынша – аспаптық зерттеу әдістері. Анамнез педиатрға дистрофияның дамуына ықпал ететін факторларды белгілеуге мүмкіндік береді (кейде – дәл этиологиясы), қабыну және инфекциялық патологиялардың жиі эпизодтары, сондай-ақ баланың жалпы жағдайындағы өзгерістер. Физикалық тексеру — бұл түстерді бағалау, тургор және терінің икемділігі, дененің түрлі бөліктеріндегі тері астындағы майдың ауырлығы, бұлшықет тону, дене температурасы, жүрек-тамыр және тыныс алу жүйелерінің жұмысы. Міндетті антропометрия жүргізіледі және алынған сандар жас нормасымен салыстырылады.
Жалпы алғанда, дистрофияның ауырлығына байланысты биохимиялық қан анализі альбумин-глобулиннің бұзылуын анықтайды, гипохромдық анемия, гипопротеинемия, ас қорыту ферменттерінің белсенділігін төмендету (ALT, AST, LDH, сілтілі фосфатаза, амилаз, липаза), метаболикалық ацидоз, полихиповитаминоз. Ауыр жағдайларда, кетонның органдарының концентрациясы артады, хлор, фосфат және плазмадағы несепнәр, қан ұюы (ESR қысқарту, гемоглобин мен эритроциттердің концентрациясы 1 мл-де артты). Ішкі мүшелердің патологиясын растау немесе алып тастау үшін іш ультрадыбысты қолдануға болады, ОГК радиографиясы, EGD және т. п. Балалардағы дистрофияның дифференциалды диагностикасы нанизм мен конституциялық қысқа мерзімде жүзеге асырылады.
Ауыр жағдайларда, кетонның органдарының концентрациясы артады, хлор, фосфат және плазмадағы несепнәр, қан ұюы (ESR қысқарту, гемоглобин мен эритроциттердің концентрациясы 1 мл-де артты). Ішкі мүшелердің патологиясын растау немесе алып тастау үшін іш ультрадыбысты қолдануға болады, ОГК радиографиясы, EGD және т. п. Балалардағы дистрофияның дифференциалды диагностикасы нанизм мен конституциялық қысқа мерзімде жүзеге асырылады.
Балалардағы дистрофияны емдеу
Дистрофияны емдеу амбулаториялық негізде педиатрдың қадағалауымен жүзеге асырылады, қоспағанда, жеткіліксіз тамақтанудың ауыр формалары. Негізгі ұстанымдар – тамақтану мен бала күтімін қалыпқа келтіру және этиологиялық факторларды жою. Қажет болса, тағайындалған дәрілік заттар. Диета терапиясы азық-түлік тасымалын анықтауды және оның жас мөлшеріне қарай біртіндеп ұлғайтылуын қамтиды. Келесі қағидалар сақталады: аз мөлшерде азық-түлік, «жасару» қабылдаған тағам (пайдаланылған өнімдер, бұл кішкентай балалар ішеді), ақуыз мөлшерін толық есептеу, жекелеген жастағы майлар мен көмірсулар, асқазан-ішек жолдарының және баланың жағдайын тұрақты бақылау.
Науқастың ауыр жағдайында дәрілік терапия қолданылады (соның ішінде – диетаны қалыпқа келтірудің жеткіліксіз әсері). Ереже бойынша, ферменттер мен дәрумендер ас қорыту процестерін қалыпқа келтіру үшін тағайындалады. Интер-вирусты ауруларды дамыту кезінде тиісті емдеу жүргізіледі, соның ішінде бактерияға қарсы терапия.
Балалардағы дистрофияларды болжау және алдын алу
Балалардағы дистрофияның болжамы этиологиялық факторға әсер ету мүмкіндігіне байланысты, бірлескен патологиялардың болуы немесе болмауы. Алғашқы аллергиялық немесе қайталама пішіндердің толық уақытында емделуімен прогноз қолайлы болып табылады.
Дистрофияның нақты алдын-алу мүмкіндігі жоқ. Неспецификалық антенатальды және босанғаннан кейін бөлінеді. Антенатальды медициналық генетикалық консультация және жүктілікті жоспарлау кіреді, Гемация кезінде ананың патологиясын толық емдеу, жаман әдеттерден бас тарту, рационды қалыпқа келтіру және жүкті әйелдерге арналған күнделікті өмір. Дистрофияның постнатальді алдын-алуды жасқа сай толық емшек емізу немесе теңдестірілген тамақтану қажет, тиісті балаларды күту, антропометриялық көрсеткіштердің өзгеру динамикасын бақылау.
Жалпы, дистрофия дегеніміз не? — Доклад
Эссе
Жалпы, дистрофия дегеніміз не? Иә, ұлпалар мен торшаларда зат алмасу бұзылуының нәтижесінде туындайтын патологиялық үдеріс екенін білеміз. Былай қарап отырсаң жай ғана зат алмасу, екі ғана процесстен тұрады, бірақ… қанша ауруларға әкеп соғады. Себебі, дистрофияның бірнеше түрі бар оның өзі жіктеледі, олардан туындайтын қаншама патология бар. Дистрофияны зат алмасу түріне, мүшенің паренхимасы мен стромасының зақымдану дәрежесіне жіктеледі. Соның ішінде аралас протеиндік дистро -фия, иа аты айтып тұрғандай белок алмасуы бұзылуының мүшенің парен -химасында да, стромасында да жүруі. Өте қызықты тақырыптардың бірі, өзіме қатты ұнаған дистрофияның түрі. Басқа дистрофиялар сияқты бұлда жіктеледі: хромопротеидтер, нуклеопротеидтер, липопротеидтер деп қарастырамыз. Иә, бұны естігенде есімізге бірден пигмент келеді емес пе?! Пигмент десе, мектеп қабырғаларынан белгілі, өзімізге таныс меланинді ең бірінші есімізге түсіреміз. Иә – иә, бұл жерде де меланин жайлы айтатын боламын.
Иә – иә, бұл жерде де меланин жайлы айтатын боламын.
Пигменттену – тірі ағза мүшелері мен ұлпаларында қандай да бір бояғыш заттың шөгуі. Олай болса біздер пигментті эндогенді және экзогенді деп қарастырайық. Эндогенді пигментті – деп ағзада синтезделетін әр түрлі химиялық табиғи заттарды айтамыз. Патологиялық жағдайы – эндогенді пигменттер ағзада мөлшерден тыс түзілуімен немесе жеткіліксіз болуымен сипатталады.
Эндогенді пигменттер жүре пайда болады және тұқым қуалайды. Эндо -генді пигменттерді хромопротеидтер деп атаймыз. Яғни, бұл күрделі боял- ған белок, солардың бұзылуы. Атап айтсақ, организмдегі тыныс алу процесін іс жүзіне асыратын эритроциттер құрамындағы гемоглобин, шаш- та, теріде, сондай-ақ көздің тор қабығында болатын меланин пигмент -терін жатқызсақ болады. Енді, бұл хропротеидтердің өзі гемоглобиндік, протеиногендік, липидогендік деп бөліп, жекелей қарастырсақ болады. Менің тақырыбым негізі протеин текті пигмент алмасуының бұзылыстары, бірақ сіздерде кішкенеде болсын басқада пигмент бұзылыстары туралы түсінік қалыптастыру мақсатында шағын ғана тоқтала кетсем.
Гемоглобин не екенін білеміз , иә, күнделікті тыныстаған оттегімізді алып, қаншама торшаларға тасымалдауда. Эритроцит құрамындағы негізгі зат – гемоглобин 2 бөліктен гем және глобин. Гема пигменттік зат немесе темір деп қарастырамыз, глобин ол белок. Эритроциттердің физиоло -гиялық ыдырауы нәтижесінде гемоглобин бөлініп одан гемосидерин, ферритин, билирубин пигменттеріне айналады. Біз бұрын соңды естимеген пигмент атаулары, иә ?! Тек арасынан билирубинді білеміз, о бұның өзі жақсы. Бұл аталған пигменттер қалыпты жағдайда болады, яғни физио — логиялық , ал патологиялық түрінда қарастырып өтейік. Осы пигменттер көбейсе, жаңа пигменттер түзіледі. Олардың қатарына: порфирин, гематин, гематоидин пигменттерін жатқызамыз. Ендеше физиологиялық жағдай- дады пигменттерді қарастырып өтейік.
Ферритин – аты айтып тұрғандай темір қоры. Бұл темір мен ерекше нәруыз апоферритин қосындысынан тұратын пигмент. Ол ішек пен ұйқы безінде қорек құрамындағы темірден, көкбауырда, сүйек кемігінде эритро- циттер ыдыраған кезде пайда болады да гемосидерин мен цитохромның түзілуіне қатысады. Осы ферритин қанда көбейіп кетсе, ферритинемия пайда болуып, ол қан тамырларын кеңейтіп, қан қысымының төмендеп кетуіне әкеліп, қайтымсыз шок пайда болуы мүмкін.
Осы ферритин қанда көбейіп кетсе, ферритинемия пайда болуып, ол қан тамырларын кеңейтіп, қан қысымының төмендеп кетуіне әкеліп, қайтымсыз шок пайда болуы мүмкін.
Гемосидерин – бұл ферритиннің полимері болып табылады. Гемосидерин түзуші жасушаларды – сидеробластар деп атайды екенбіз. Қалыпты жағдай- да көкбауырда, бауырда, жілік кемігінде, лимфа бездерінен кездестіруге болады екен. Ал, патологиялық жағдайда өте көп мөлшерде ағзада түзіліп, жинақталып қалады екен, мұны біздер гемосидероз деп атай- мыз. Біздер қай кезде пигмент алмасуы бұзылды дейміз? Пигмент қалыпты жағдайдан көбейіп кетсе, қалыпты жағдайдан төмендеп кетсе және пигмент жоқ жерде пайда болса деп қарастырамыз. Гемосидероздың жергілікті және жалпы түрлері бар .
Миотонический синдром — лечение, симптомы, причины, диагностика
Миотония это не заболевание, а симптом группы мышечных нарушений, для которых характерно нарушение способности мышцы к релаксации после сокращения. У большинства людей миотоническая атака имеет временный характер и проявляется выраженной скованностью, которая возникает после выполнения определенного вида движений. Невозможность сжатых мышц расслабиться и трудности при вставании из сидячего положения являются наиболее частыми проявлениями миотонической атаки.
Невозможность сжатых мышц расслабиться и трудности при вставании из сидячего положения являются наиболее частыми проявлениями миотонической атаки.
Длительность миотонической атаки может быть продолжительностью от секунд до минут и по интенсивности колебаться от небольшого дискомфорта до выраженного нарушения двигательных возможностей. Как правило, миотоническая атака возникает после интенсивной физической нагрузки или после длительного периода отдыха, но иногда возникает как реакция на низкие температуры или даже резкий звук.
При миотонии идет вовлечение только скелетной мускулатуры, выполняющей произвольные движения. Таким образом, миотоническая атака может возникнуть только при выполнении осознанных движений, но не поражает мышцу сердца или мышечные структуры пищеварительного тракта. В зависимости от типа и серьезности миотония может возникнуть в ногах, лице, руках, в плечах, стопе, в мышцах век глаз и даже способности говорить четко.
Как правило, миотонические синдромы являются генетически детерминированными и могут быть у любого человека. Миотонические нарушения могут быть как у женщин, так и мужчин и в любом возрасте могут быть симптомы миотонических атак. В зависимости от выраженности миотонических симптомов первые признаки этих нарушений могут появиться в подростковом возрасте или у взрослых. Наследование миотонических синдромов происходит двумя путями аутосомально-доминантным генетическим паттерном или аутосомально-рецессивным генетическим паттерном.
Миотонические нарушения могут быть как у женщин, так и мужчин и в любом возрасте могут быть симптомы миотонических атак. В зависимости от выраженности миотонических симптомов первые признаки этих нарушений могут появиться в подростковом возрасте или у взрослых. Наследование миотонических синдромов происходит двумя путями аутосомально-доминантным генетическим паттерном или аутосомально-рецессивным генетическим паттерном.
Аутосомально доминантное наследование
Нарушения, связанные с аутосомально-доминантным наследованием обычно проявляется в каждом поколении без исключений. Аутосомальный означает то, что генетическая ошибка может располагаться на любой хромосоме, в каждой клетке организма, за исключением половых хромосом. Доминантный означает, что достаточно одного родителя носителя дефектного гена для передачи заболевания по наследству. И так как нарушения могут передаваться любым родителем, то любой ребенок от родителя с генетическим дефектом имеет 50% шанс наследовать это нарушение. Выраженность нарушения и возраст дебюта могут варьировать в зависимости от конкретного индивидуума.
Выраженность нарушения и возраст дебюта могут варьировать в зависимости от конкретного индивидуума.
Аутосомально-рецессивное наследование
При аутосомально-рецессивном наследовании заболевание появляется в одном поколении и обычно без наличия семейного анамнеза этого состояния. Оба родителя могут быть носителями этого гена. Носитель дефектного гена может не отмечать какой-либо симптоматики. Рецессивность означает то, что для проявления этого гена и заболевания необходимо, чтобы у обоих родителей был дефектный ген. Дети обоего пола могут наследовать дефектный ген по этому типу наследования. При каждой беременности у 25 % детей есть вероятность наследования дефектного гена от обоих родителей. Если ребенок наследует дефектный ген от одного родителя, то он будет носителем дефектного гена, но, скорее всего, проявляться это симптомами не будет. В 50% случаев ребенок будет носителем гена. В то же время вероятность того, что ребенок не наследует дефектный ген и не будет носителем и не будет иметь клиническую манифестацию, составляет 25%.
Виды миотоний
Миотония конгенита
Миотония конгенита наиболее часто встречающаяся непрогрессирующая форма миотонического синдрома и вызвана мутацией гена, отвечающего за натриевые ионные каналы мышц. Эта форма миотонии не оказывает влияние на продолжительность жизни и имеет незначительное влияние на структуру тела или рост опорно-двигательного аппарата. Существует две формы миотонии конгенита в зависимости от типа наследования.
Частой и довольно тяжелым типом миотонии конгенита является генерализованная миотония Бейкера, и наследование этого заболевания происходит по аутосомально-рецессивному типу. Дебют этой формы миотонии бывает в детстве или раннем подростковом возрасте, но иногда при тяжелом течение дебют может быть и в раннем детском возрасте. Симптоматика может нарастать прогрессивно, в течение нескольких лет после постановки диагноза или постепенно нарастать до достижения пациентом двадцатилетнего возраста.
Аутосомально — доминантная форма наследования называют болезнью Томсена. Заболевание названо в честь датского врача Асмуса Юлиуса Томсена у которого было это заболевание и который проследил наличие этого заболевания в своей семье. Симптомы миотонии Томсена, как правило, значительно мягче, чем при миотонии Бейкера и хотя дебют заболевания бывает раньше, и первые признаки становятся заметными в раннем детстве и иногда при рождении. В редких случаях симптомы могут быть незначительными, в течение многих лет после постановки диагноза.
Заболевание названо в честь датского врача Асмуса Юлиуса Томсена у которого было это заболевание и который проследил наличие этого заболевания в своей семье. Симптомы миотонии Томсена, как правило, значительно мягче, чем при миотонии Бейкера и хотя дебют заболевания бывает раньше, и первые признаки становятся заметными в раннем детстве и иногда при рождении. В редких случаях симптомы могут быть незначительными, в течение многих лет после постановки диагноза.
Основным симптомом обеих заболеваний является генерализованная миотония, вызванная произвольными движениями. Как правило, такая симптоматика провоцируется значительной физической нагрузкой или наоборот длительным периодом отдыха и мышечной релаксации. Миотония более выражена в ногах, что вызывает затруднения при ходьбе и иногда даже падения. Также миотонией бывают охвачены мышцы плечевого пояса и головы, что может вызвать затруднения при хватании предметов, жевании или мигании. В редких случаях при миотонии Бейкера может быть обездвиживающая слабость, появляющаяся после миотонической атаки.
После миотонической атаки при обоих типах миотонии снять скованность можно с помощью повторных движений в скованных мышцах. Как правило, скованность увеличивается после нескольких первых сокращений заинтересованных мышц, а затем после пяти сокращений миотоническая скованность исчезает, что позволяет восстановить нормальную работу мышц на определенный промежуток времени. Это эффект называется эффектом разминки (разогрева) и позволяет людям с миотонией заниматься тяжелыми физическими нагрузками и силовыми видами спорта.
И хотя миотония конгенита не оказывает значительного влияния формирование опорно-двигательного аппарата, в то же время миотония влияет на размер определенных мышц. Обе миотонии Бейкера и Томсена могут вызывать необычное увеличение размеров скелетных мышц, особенно в области ног ягодиц, но также и в области рук плеч и мышц спины. Такое увеличение может считаться мышечной гипертрофией и иногда такие пациенты выглядят как настоящие атлеты. При миотонии Бейкера гипертрофия мышц более выражена, чем при миотонии Томсена.
Парамиотония конгенита
Эта миотония является редкой патологией, связанной нарушением натриевых каналов и передающаяся по аутосомно-доминантному типу. Этот тип миотонии не сокращает продолжительность жизни, и интенсивность миотонии сохраняется стабильной в течение жизни. Дебют заболевания возникает в период между рождением и ранним детским возрастом. Характерным симптомом парамиотонии конгенита является генерализованная миотоническая скованность, которая в большей степени поражает руки и лицо, а также области шеи и руки. Так же, как и при других непрогрессирующих миотониях, парамиотония конгенита провоцируется интенсивными произвольными нагрузками, а в некоторых случаях провоцируются низкой температурой. Во многих случаях, миотонические атаки индуцированные холодом и связанную с ними мышечную скованность можно снять теплом.
Атаки миотонической скованности часто сопровождаются обездвиживающей слабостью в заинтересованных зонах. Слабость может быть более длительной, чем эпизод миотонической скованности, ослабляя мышцы на период от нескольких минут до нескольких часов. Но слабость не характерна для парамиотонии конгенита. Кроме того, в отличие от других непрогрессирующих форм миотонии, для парамиотонии не характерно наличие эффекта разминки, при котором происходит снижение скованности после нескольких сокращений мышц. Наоборот, миотоническая скованность обычно увеличивается после продолжающейся активности мышц, что еще больше снижает двигательную активность. Этот феномен обычно называют парадоксальной миотонией.
Но слабость не характерна для парамиотонии конгенита. Кроме того, в отличие от других непрогрессирующих форм миотонии, для парамиотонии не характерно наличие эффекта разминки, при котором происходит снижение скованности после нескольких сокращений мышц. Наоборот, миотоническая скованность обычно увеличивается после продолжающейся активности мышц, что еще больше снижает двигательную активность. Этот феномен обычно называют парадоксальной миотонией.
Синдром Шварц Джемпела
Синдром Шварц — Джемпела является наиболее тяжелой формой непрогрессирующей миотонии. Это очень редкий тип миотонии передается по аутосомально-рецессивному типу. Дебют заболевания возникает или сразу после рождения или через небольшое время после рождения. Характер и интенсивность симптоматики могут иметь индивидуальные особенности. Одним из главных симптомов является миотоническая скованность, наиболее выраженная в лице и бедрах. При этой миотонии имеется тенденция к падениям нарушениям речи и лицевым изменениям. Как и при миотонии конгенита дополнительные сокращения мышц вызывают эффект разминки и снижают скованность. Но эффект разминки имеет незначительную степень, а некоторых случаях отсутствует. Для синдрома Шварца-Джемпела характерны различные скелетные деформации. Эти деформации к проблема роста организма и, как правило, это проявляется уменьшением роста, а также аномалиям лица, что придает лицу маскообразную форму. Другие симптомы включают гипертрофированные бедра, атрофированные плечевой пояс и длительные мышечные подергивания, а иногда и нарушения интеллектуальной сферы.
Как и при миотонии конгенита дополнительные сокращения мышц вызывают эффект разминки и снижают скованность. Но эффект разминки имеет незначительную степень, а некоторых случаях отсутствует. Для синдрома Шварца-Джемпела характерны различные скелетные деформации. Эти деформации к проблема роста организма и, как правило, это проявляется уменьшением роста, а также аномалиям лица, что придает лицу маскообразную форму. Другие симптомы включают гипертрофированные бедра, атрофированные плечевой пояс и длительные мышечные подергивания, а иногда и нарушения интеллектуальной сферы.
Причина синдрома Шварца-Джемпела не известна. Не исключается, что этот вид миотонии является разновидностью мышечных нарушений, а также возможно иметь связь с нарушениями в нервной системе или является сочетанием нарушениям в мышцах и нервах.
Диагностика
Даже на основании физикального обследования врач может провести определенные диагностические тесты, такие как миотоническая реакция на нагрузку, воздействие холодом или другие стимуляции. Но очень важно диффенцировать эти миотонии с прогрессирующими заболеваниями, такими как миотонические дистрофии. И для дифференциального диагноза необходимы специальные методы исследования. Эти исследования включают проведение ЭМГ, который позволяет определить электрическую активность мышечных ткани; лабораторные исследования (анализы крови и анализ ДНК) биопсию мышц, которая бывает иногда необходима для окончательного диагноза мышечного заболевания.
Но очень важно диффенцировать эти миотонии с прогрессирующими заболеваниями, такими как миотонические дистрофии. И для дифференциального диагноза необходимы специальные методы исследования. Эти исследования включают проведение ЭМГ, который позволяет определить электрическую активность мышечных ткани; лабораторные исследования (анализы крови и анализ ДНК) биопсию мышц, которая бывает иногда необходима для окончательного диагноза мышечного заболевания.
Лечение
В настоящее время не существует методов лечения, позволяющих избавиться полностью от какого либо миотонического синдрома. Лечение носит симптоматический характер. Если миотонические атаки становятся интенсивными, возникает необходимость применения медикаментов, позволяющих снизить симптоматику. Наиболее известным препаратом является мексилитен, а также такие препараты как гуанин, прокаинамид, тегретол, фенитоин. Но все эти препараты имеют массу побочных эффектов и поэтому их длительное употребление не желательно. Наиболее оптимально, когда пациент знает провоцирующие миотонические атаки факторы и старается по возможности избегать провоцирующих ситуаций, а после атак дает возможность мышцам восстановиться с помощью отдыха.
Наиболее оптимально, когда пациент знает провоцирующие миотонические атаки факторы и старается по возможности избегать провоцирующих ситуаций, а после атак дает возможность мышцам восстановиться с помощью отдыха.
Тіндердегі патологиялық процестер | iKaz.info
Тіндердегі патологиялық процестер гипобиотикалық және гипербиотикалық болып жіктеледі. Гипобиотикалық процестер деп жасуша мен тіндердің жеткіліксіз өсіп-көбеюін айтады. Бұған жататындар: атрофия, дистрофия, некроз және гангрена.
Атрофия деп жасушаның жеткіліксіз қоректенуі немесе зат алмасуының бұзылуы салдарынан оның көлемінің кішіреюін айтамыз. Пайда болуына қарай атрофия физиологиялық және патологиялық болып жіктеледі.
Физиологиялық атрофия — организмнің қалыпты тіршілік ету байқалатын процесс, мысалы, жануардың буаздығынан кейінгі жатырдың қалпына келуі, жемсау безіндегі кері даму.
Патологиялық атрофия – әр түрлі ауру тудыратын факторлар әсерiнен пайда болады, мысалы, ағзаның функциясы төмендегенде, ағза немесе тін қысылғанда, нерв зақымданғанда, эндокринді жүйенің функциясы бұзылғанда.
Дистрофия (грекше: Duse — бұзылу, trohhe — қоректену) —зат алмасудың бұзылуы салдарынан жасуша мен тіндер құрылымының, сонымен қатар олардың физикалық, химиялық қасиеттерінің және қызметінің өзгеруі. Дистрофиялар бірнеше түрге ақуыздық, май, көмірсулық, минералдық, т.б.
Дистрофия кезінде жасуша цитоплазмасында, ядросында және жасуша аралық затта саны мен сапасы жағынан өзгерген зат алмасу өнімдері жиналып, құрылымдық өзгерістер тудырады.
Кахексия (грекше кachexia — жүдеу) күрт әлсіздікпен, ағза мен жүйелердің қызметінің бұзылуымен және организм тіршілігінің төмендеуімен сипатталады. Кахексия ұзаққа созылған ауру кезінде, әcipece созылмалы індеттерде, инвазияларда, улануда байқалады (туберкулез, маңқа, паратуберкулез, iciктep, пироплазмоз).
Некроз (грекше necros — шipy, өліеттену) жасушалардың, тіндердің, ағзаның тұтастай немесе жартылай өліеттенуі. Тіндер некрозы механикалық, физикалық химиялық жолдармен және індетті агенттердің ықпалынан пайда болады. Некроздың eкi түрi бар: құрғақ және ылғалды. Құрғақ некрозға туберкулезге, маңқаға тән сүзбе тәрізді некроз, анемиялық инфаркт, т.б. жатады.
Тіндер некрозы механикалық, физикалық химиялық жолдармен және індетті агенттердің ықпалынан пайда болады. Некроздың eкi түрi бар: құрғақ және ылғалды. Құрғақ некрозға туберкулезге, маңқаға тән сүзбе тәрізді некроз, анемиялық инфаркт, т.б. жатады.
Ылғалды некрозға сұйығы мол ағзалар мен тіндер ұшырайды (мысалы, ми).
Гангрена. Тіндердің және ағзалардың некрозға үшырап, қан пигментінің өзгеруінен некроздалған ошақ көгерген немесе қарайған түске енеді. Көптеген жағдайда гангрена себебі тамырлардың зақымдалуы болып саналады. Сыртқы ортамен тікелей қатынасы бар ағзалар ұшырайтын некроздың бір түрi болып келеді. Гангрена құрғақ және ылғалды болады. Құрғақ гангренаға тepi жиі шалдығады. Себебі: кейбір індетті аурулар, үсу, күю, т.б. Ылғалды гангренаға өкпе, ішек, жатыр шалдығады.
Гипербиотикалық процестер. Жасушалардың, тіндердің және ағзалардың шектен тыс өсіп-көбеюін гипербиотикалық процестер деп атайды. Бұл процестерге жататындар: гипертрофия, гиперплазия, регенерация, iciктep.
Гипертрофия — құрамындағы жекеленген жасушалардың көлемінің ұлғаюынан немесе ағзалардың көлемінің ұлғаюы. Жасуша саны қалыпты.
Гиперплазия – жасуша санының көбеюінен тіндердің немесе ағзалардың көлемінің ұлғаюы. Гипертрофия мен гиперплазияның сырқат организмде ішкі орта тұрақғылығын сақтауда мәнi зор.
Гипертрофия нағыз және жалған, физиологиялық және патологиялық болып жіктелінеді.
Нағыз гипертрофия паренхиматозды жасушалардың кобеюінен тіннің немесе ағзаның ұлғаюы және қызметінің артуы (мысалы, жүрек гипертрофиясы, буаздық жатырдың гипертрофиясы, т.б.)
Жалған гипертрофия дәнекер немесе май тін арқылы ағзаның ұлғаюы. Мұндай мүшенің қызметі кемиді.
Физиологиялық гипертрофия организмнің қалыпты тіршілік кезеңінде байқалады. Бұл жағдайда ағзаның ұлғаюы және қызметінің күшеюі байқалады (мысалы, буаздық кезіндегі жатырдың, жүрек және қаңқа бұлшық етінің гипертрофиясы).
Патологиялық гипертрофия ағзаға қолайсыз жағдай әсерiнен шамадан тыс күш түскен кезде байқалады. Tiн немесе ағза құрылымының және қызметінің өзгеруіне әкеледі. Мысалы, жүрек ақаулары кезіндегі жүрек гипертрофиясы, бір бүйректі алып тастағанда екіншісінің оның жұмысын қосымша атқару салдарынан гипертрофияға үшырауы.
Tiн немесе ағза құрылымының және қызметінің өзгеруіне әкеледі. Мысалы, жүрек ақаулары кезіндегі жүрек гипертрофиясы, бір бүйректі алып тастағанда екіншісінің оның жұмысын қосымша атқару салдарынан гипертрофияға үшырауы.
Регенерация — бүлінген немесе жойылған тіндердің, ағзалардың қайтадан қалпына келуі. Регенерация тipi атаулыға тән құбылыс. Жануарлар сатысы неғұрлым төмен болса, регенерация процесі соғұрлым жоғары болады (мысалы, шаян үзіліп қалған аяғын бұрынғы қалпына келтіре алады). Жоғары сатыдағы жануарлар тіндерінің жекелеген түрінің регенерациясы емес. Жиі зақымдалатын тіндер тез қалпына келеді. (Мысалы, эпидермис, кілегейлі қабықтар, дәнекер тін).
Регенерация eкi түрлі болады: физиологиялық және патологиялық.
Физиологиялық регенерация дегеніміз— тіршілік кезінде қалыпты организмде болатын процесс (мысалы, қан жасушаларының, терінің, ішек-қарын, тыныс алу жүйелерінің эпителийінің алмасып тұруы).
Патологиялық регенерация дегеніміз — ерекше тітіркендіргіштің ықпалынан зақымдалған тіндер мен ағзалардың қалпына келу процесі.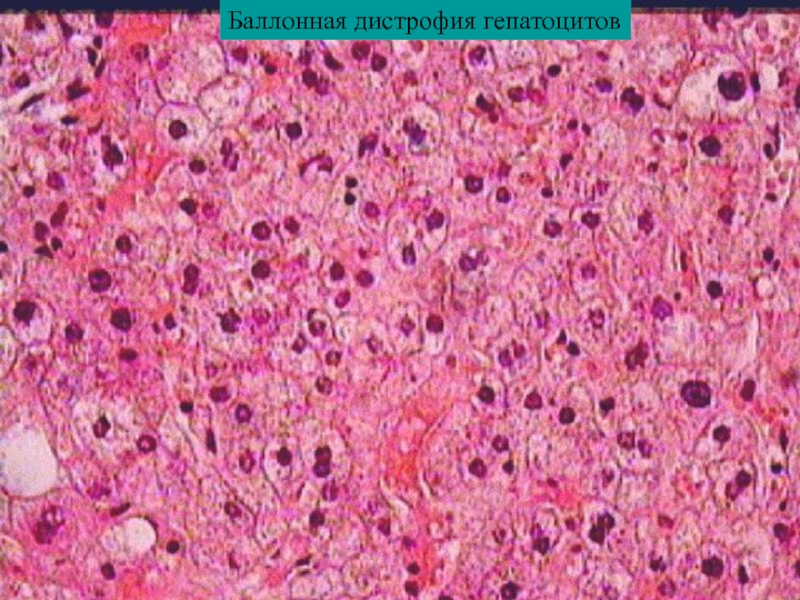
Жараның жазылуы. Жара деп механикалық әсерлерден терінің немесе ағзалардың бүтіндігінің бұзылуын айтады.
Жараның жазылуында регенерация процесінің маңызы зор. Зақымдалған тері, сүйек, тамырлар, дәнекер тін қайтадан қалпына ерекше жақсы келеді. Ішкі ағзалардың жазылуы дәнекер тін арқылы өтеді, тыртықпен аяқталады. Жүйке жүйесінің тіндерінің закымдалғаннан кейін қайтадан калпына келуі өте әлсіз болады.
Жараның жазылуы бірінші және екінші жетілу арқылы өтеді. Жараның жазылу процесі организм икемділігіне, қоректенуіне, жасына, жануар түріне және басқа да факторларға байланысты.
Вконтакте
Мой мир
Дистрофик — бұл кім? Дистрофия
Көптеген естіген кезде адам деп атайды, «дистрофик». Бұл сөзді жиі қолданады қатысты өте худым адамдарға. Бірақ шын мәнінде, бұл ғана емес, шуточное деген сөз, ал қауіпті ауру. Дистрофик « бұл ауру емес, қарапайым худоба.
Бұл дистрофия
Дистрофией деп атайды патологиялық процесс, жетекші жинақтау немесе жоғалуына алып келген сол заттар, оларға тән қалыпты күйде.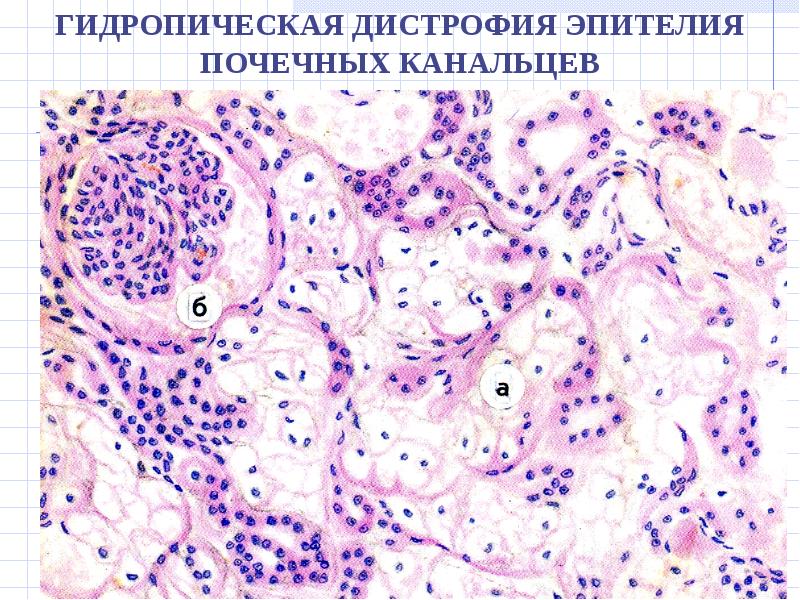 Мысал ретінде бола алады жиналуы өкпенің көмір. Кезінде дистрофиясы повреждаются жасушалары, сондай-ақ межклеточное вещество. Бұл жүреді функцияларының бұзылуы науқастың органның.
Мысал ретінде бола алады жиналуы өкпенің көмір. Кезінде дистрофиясы повреждаются жасушалары, сондай-ақ межклеточное вещество. Бұл жүреді функцияларының бұзылуы науқастың органның.
организмде бар механизмдер кешені, сақталуына және метаболизмі жасушалық құрылымын. Ол деп аталады трофика. Дистрофик « бұл адам, бұл трофика зардап шегеді.
Ең жиі дистрофиясы бейім балалар жасына дейін үш жыл. Ол әкеледі кешіктіру ғана емес, физикалық даму, бірақ және психомоторлық, сондай-ақ зияткерлік. Бұл ретте жұмысы бұзылады иммундық жүйенің және зат алмасу.
ауру Түрлері
Сонымен, дистрофик « бұл кім? Адам ауыратын бұзылған организмде. Бар бірнеше түрлері дистрофиясы. Оны бөледі, минералды, белковую, углеводную және май түріне байланысты бұзылу процестерін алмасу.
туралы айтатын болсақ, оқшаулау, онда дистрофия мүмкін внеклеточной, жасушалық, сондай-ақ аралас.
шығу тегі Бойынша ауру болуы мүмкін туа біткен және сатып алынған. Туа біткен дистрофиясы пайда болады генетикалық себептер де, бұзылған зат алмасу жүреді тұқым қуалау сипаты.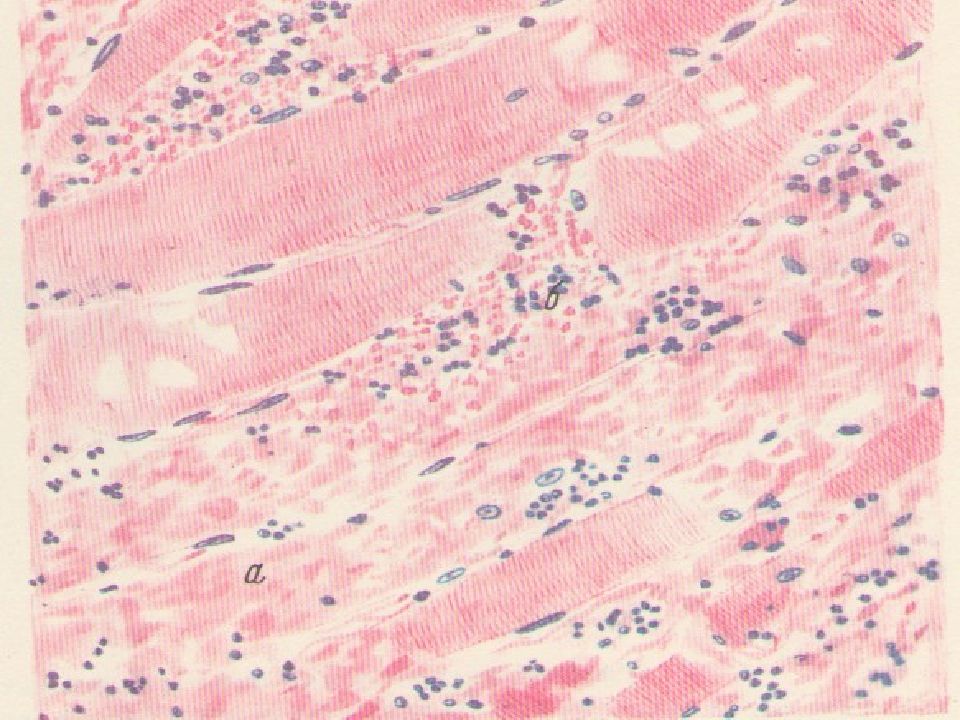 Қандай фермент, ол үрдісіне қатысады, зат алмасудың болмауы мүмкін, организмде ал бұл әкеледі метаболизмінің өнімдері расщепляются толық және тіндерінде жиналады.
Қандай фермент, ол үрдісіне қатысады, зат алмасудың болмауы мүмкін, организмде ал бұл әкеледі метаболизмінің өнімдері расщепляются толық және тіндерінде жиналады.
Көп:
Кальций Д3 Никомед Пікірлер мен ұсыныстар тұтынушылардың
Экология қазіргі заманғы өмір бізді үнемі қолдап, өз ағзасы. Жетіспеушілігі кезінде дәрумендерді, минералдарды және басқа да заттарды қажеттілігі оларды толықтыру.соның бірі-кальций. Деп айтуға болады, ол алады жетекші позиция құрамында адам ағзасыны…
Қалай тез протрезветь үй жағдайында?
Кейде солай жүреді», — деп атап затянувшихся мерекелер адамға қажет тез оралу трезвому жағдай талап ететін саналы әрекеттер, мысалы, бұл азамат. Қалай тез протрезветь және құтылу күйік исінен оқыңыз, осы мақалада. Үміттенеміз, ол сіз үшін пайдалы! Н…
Қант диабеті, пайда болу себептері
Бұл эндокриндік ауру кеңінен таралған әлемде. Халқының шамамен 10% дамыған елдер зардап шегеді оларға. Саны ауыратын үнемі өсуде. Медицина ие препараттармен, олар продляют өмір, ауру және оны неғұрлым мағыналы. Алайда, қант диабеті, пайда болу себепт…
Алайда, қант диабеті, пайда болу себепт…
Поражаться мүмкін әр түрлі маталар, бірақ барлық жағдайларда … зақымданады ОЖЖ. Дистрофик « бұл адам ауыратын ауыр ауру, өйткені жетіспеушілігі кейбір ферменттер, өлімге әкелуі мүмкін.
Тағы дистрофию ортақ үш түрге: паратрофия, гипостатура және гипотрофия.
Паратрофией бұзу болып табылады зат алмасу және тамақтану, ол тәсіл-артық дене салмағы бар.
Гипостатурой болып табылады бірдей жетіспеушілігі өсуі мен салмағы сәйкес жас нормасы.
Гипотрофия « бұл ең көп таралған нысаны дистрофиясы. Көрінеді ол кішкентай дене салмағы өсуіне қатысты.
ауру
Дистрофиясы негізделген үлкен саны бар әр түрлі себептері. Басқа туа біткен бұзушылықтарды генетикалық деңгейде байланысты бұзылған зат алмасу, ауру болуы мүмкін-стресс, инфекциялық аурулар, дұрыс тамақтанбау. Арасында басқа да себептерінің айта кету керек әлсіз иммунитет, аурулар хромосомалардың, қолайсыз сыртқы факторлар және жүргізу дұрыс емес өмір салтын.
Бар деген қате пікір, бұл дистрофик « бұл бала дүниеге келген тиісті мерзімінен бұрын. Бірақ бұл олай емес, өйткені ауру дамуы мүмкін кейін ұзақ уақыт жетіспеушілігінен немесе, керісінше, переедания өнімдерін қамтылған көмірсулар.
туа біткен дистрофией мүмкін шегеді, бала туғыз, тым жас немесе өте қарт анасы.
Симптомдары
Дистрофиясы танытады, өзіне қарай нысаны мен ауырлығы. Арасында жалпы белгілерін атап өтеді қозғау, нашарлауы тәбет және ұйқы, тез шаршағыштық және әлсіздік, салмақ жоғалту және жеткізілуінің кешіктірілгені өсу.
Егер дамып, гипотрофия, дене салмағы төмендейді 30 пайыз орын бозару, төмендейді серпімділігі тіндердің және бұлшық ет тонусы.
Науқастарда жүргізіледі иммунитеттің бұзылуы, бауыр ұлғаюы мүмкін, ал дәрет бұзылады.
Кезінде күшті гипотрофия басталады ағзаның арықтау, тері жоғалады, көз алма западают жүреді бұзу жүрек ырғағының және тыныс алу, дене температурасы төмендейді және қан қысымы.
Кезінде паратрофии адамның кейінге қалдырылады артық май клетчаткасында. Науқастар бледны және бейім аллергиям. Бұл ретте, ішектің жұмысы бұзылады. В складках тері бастайды құрылуы опрелости.
Науқастар бледны және бейім аллергиям. Бұл ретте, ішектің жұмысы бұзылады. В складках тері бастайды құрылуы опрелости.
Кезінде гипостатуре белгілері ұқсас гипотрофией. Бұл ең тұрақты формасы дистрофиясы және оны емдеуге өте қиын.
Қалай емдеуге дистрофию
Емдеу аурудың болуы тиіс кешенді. Егер дистрофиясы екіншілік сипатта болса, онда дәрігерлер емдейді ауру, ол тудырды. Басқа жағдайда қолданады диетотерапию, сондай-ақ алдын алу жұмыстарын жүргізеді қайталама инфекция.
Егер балада гипотрофияның 1-ші дәрежесі, онда емдеу жүзеге асырады. Кезде неғұрлым жоғары дәрежедегі, баланың орналастырады стационарға.
— мен ауыратын Науқастарға қандай тағамға ана сүті, сондай-ақ қышқыл сүт қоспалары. Тамақтану тиіс кезекпен « дейін 10 рет. Бұл ретте дәрігер жүргізеді өзгеруі туралы жазбаны дене салмағының. Қосымша тағайындалады ферменттер, дәрумендер және биологиялық белсенді қоспалар.
Сонымен, дистрофик – кім бұл? Бұл шындап науқас адам қажет мүмкіндігінше тезірек бастау емдеуге, өйткені салдарлары қайғылы жағдайға әкелуі мүмкін.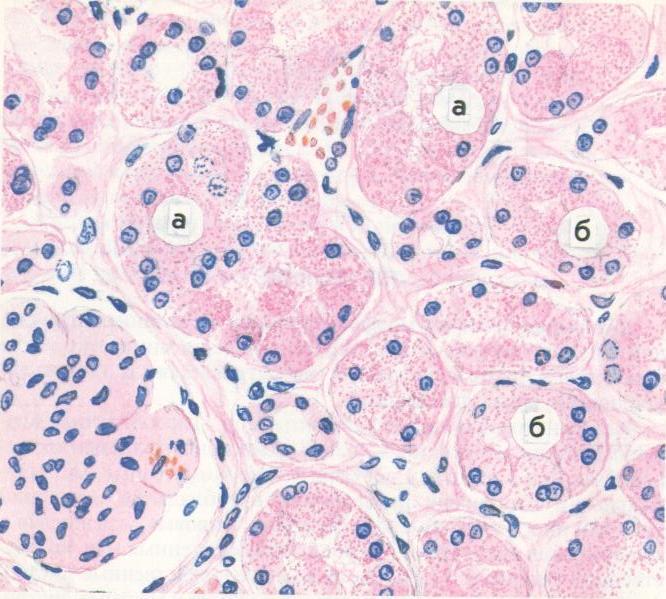
Мышечная дистрофия: основы практики, патофизиология, этиология
Конте Г., Джоха Л. Скрофола мышечной системы. Annali Clinici dell’Ospedale degli Incurabili di Napoli . 1836. 2:66-79.
Мерион Э. О зернистой и жировой дистрофии произвольных мышц. Медико-хирургический транс . 1852. 35:73-4.
Дюшенн GBA. Recherches sur la paralysie musculaire pseudo-hypertrophique ou paralysie myo-sclerosique. Arch General Med . 1868. 11:5-25.
Янагисава А., Буше С., Кихано-Рой С., Вийомье-Барро С., Кларк Н., Одент С. и др. Внутригенные делеции POMT2 и аномалии сплайсинга, вызывающие врожденную мышечную дистрофию с умственной отсталостью. Евр Дж Мед Жене . 2009 июль-август. 52 (4): 201-6. [Медлайн].
Уэйт А., Тинсли К.Л., Лок М., Блейк Д.Дж. Нейробиология гликопротеинового комплекса, связанного с дистрофином. Энн Мед . 2009. 41 (5): 344-59. [Медлайн].
Бэнкс ГБ, Чемберлен Дж. С., Фрёнер СК. Укороченные дистрофины могут влиять на структуру нервно-мышечных синапсов. Mol Cell Neurosci . 2009 40 апреля (4): 433-41. [Медлайн].
Бушби К. Генетика и мышечные дистрофии. Dev Med Детский нейрол . 2000 ноябрь 42 (11): 780-4. [Медлайн].
Гонсалес-Эррера Л., Гамас-Трухильо П.А., Гарсия-Эскаланте М.Г., Кастильо-Сапата И., Пинто-Эскаланте Д. [Выявление делеций в гене дистрофина и выявление носителей в семьях с мышечной дистрофией Дюшенна/Беккера]. Rev Нейрол . 2009 16-31 января. 48 (2): 66-70. [Медлайн].
Rev Нейрол . 2009 16-31 января. 48 (2): 66-70. [Медлайн].
Дики Р.П., Зитер Ф.А., Смит Р.А. Мышечная дистрофия Эмери-Дрейфуса. J Педиатр . 1984 Апрель 104 (4): 555-9. [Медлайн].
Миллер Р.Г., Лайзер Р.Б., Меллентин М.А., Голаби М., Франкоз Р.А., Молл Дж.С. Мышечная дистрофия Эмери-Дрейфуса с аутосомно-доминантным типом передачи. Неврология . 1985 35 августа (8): 1230-3. [Медлайн].
Добровски Ю.М., Зайчук Ю.Т., ЛаПиана Ф.Г., Хенсли С.Д. мл. Окулофарингеальная мышечная дистрофия: клинические и гистопатологические корреляции. Отоларингол Head Neck Surg .1986 сен. 95 (2): 131-42. [Медлайн].
Дубовиц В. Мышечные заболевания у детей . 2-е изд. Филадельфия: В. Б. Сондерс; 1995. 34-132.
Эмери А.Э. Популяционные частоты наследственных нервно-мышечных заболеваний — всемирный обзор. Нервно-мышечное расстройство . 1991. 1 (1): 19-29. [Медлайн].
Шапиро Ф., Шпехт Л. Диагностика и ортопедическое лечение наследственных мышечных заболеваний детского возраста. J Bone Joint Surg Am . 1993 март 75 (3): 439-54. [Медлайн].
Пратт М.Ф., Мейерс П.К. Окулофарингеальная мышечная дистрофия: недавние ультраструктурные доказательства митохондриальных аномалий. Ларингоскоп . 1986 Апрель 96 (4): 368-73. [Медлайн].
Проссер Э.Дж., Мерфи Э.Г., Томпсон М.В. Интеллект и ген мышечной дистрофии Дюшенна. Арч Ди Чайлд . 1969 апр. 44 (234): 221-30. [Медлайн].
Лейбовиц Д., Дубовиц В. Интеллект и поведение при мышечной дистрофии Дюшенна. Dev Med Детский нейрол .1981 23 октября (5): 577-90. [Медлайн].
Пане М., Ломбардо М.Е., Альфьери П., Д’Амико А., Бьянко Ф., Васко Г. и др. Синдром дефицита внимания с гиперактивностью и когнитивная функция при мышечной дистрофии Дюшенна: корреляция фенотипа и генотипа. J Педиатр . 2012 окт. 161 (4): 705-9.e1. [Медлайн].
Томпсон Г. Х., Беренсон Ф.Р. Другие нервно-мышечные расстройства. Вайнштейн С.Л., Флинн Дж.М., ред. Детская ортопедия Ловелла и Винтера .7-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2014. 587-628.
Х., Беренсон Ф.Р. Другие нервно-мышечные расстройства. Вайнштейн С.Л., Флинн Дж.М., ред. Детская ортопедия Ловелла и Винтера .7-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2014. 587-628.
Sussman MD. Преимущество ранней стабилизации позвоночника и спондилодеза у пациентов с мышечной дистрофией Дюшенна. J Pediatr Orthop . 1984 Сентябрь 4 (5): 532-7. [Медлайн].
Вейманн Р.Л., Гибсон Д.А., Мозли С.Ф., Джонс Д.К. Хирургическая стабилизация позвоночника при мышечной дистрофии Дюшенна. Позвоночник (Фила Па, 1976) . 1983 8 октября (7): 776-80. [Медлайн].
Almenrader N, Patel D. Хирургия спондилодеза у детей с неидиопатическим сколиозом: нужна ли рутинная послеоперационная вентиляция легких? Бр Дж Анаст . 2006 г., декабрь 97 (6): 851-7. [Медлайн].
Бирнкрант Диджей. Новые проблемы в лечении пациентов с длительным выживанием после нервно-мышечных заболеваний у детей: взгляд пульмонолога. Детский пульмонол . 2006 Декабрь 41 (12): 1113-7. [Полный текст].
Миллер Р.Г., Чалмерс А.С., Дао Х., Филлер-Кац А., Холман Д., Бост Ф. Влияние сращения позвоночника на дыхательную функцию при мышечной дистрофии Дюшенна. Неврология . 1991 янв. 41 (1):38-40. [Медлайн].
Миллер Ф., Мозли С.Ф., Кореска Дж., Левисон Х.Легочная функция и сколиоз при дистрофии Дюшенна. J Pediatr Orthop . 1988 март-апрель. 8 (2): 133-7. [Медлайн].
1988 март-апрель. 8 (2): 133-7. [Медлайн].
Thrush PT, Allen HD, Viollet L, Mendell JR. Повторное исследование электрокардиограммы у мальчиков с мышечной дистрофией Дюшенна и корреляция ее с дилатационной кардиомиопатией. Ам Дж Кардиол . 2009 15 января. 103 (2): 262-5. [Медлайн].
Чемберлен Дж.С., Гиббс Р.А., Раньер Дж.Е., Нгуен П.Н., Каски КТ. Делеционный скрининг локуса мышечной дистрофии Дюшенна с помощью мультиплексной амплификации ДНК. Рез. нуклеиновых кислот . 1988 9 декабря. 16 (23): 11141-56. [Медлайн]. [Полный текст].
Миядзаки Д., Ёсида К., Фукусима К., Накамура А., Судзуки К., Сато Т. и др. Характеристика контрольных точек делеции у пациентов с дистрофинопатией, несущих делецию экзонов 45-55 гена мышечной дистрофии Дюшенна (МДД). J Hum Genet . 2009 54 февраля (2): 127-30. [Медлайн].
[Медлайн].
Драхман Д.Б., Тойка К.В., Майер Э. Преднизолон при мышечной дистрофии Дюшенна. Ланцет . 1974, 14 декабря. 2 (7894): 1409-12. [Медлайн].
Mendell JR, Moxley RT, Griggs RC, Brooke MH, Fenichel GM, Miller JP, et al. Рандомизированное двойное слепое шестимесячное исследование преднизолона при мышечной дистрофии Дюшенна. N Английский J Med . 1989 15 июня. 320 (24): 1592-7. [Медлайн].
McAdam LC, Mayo AL, Alman BA, Biggar WD. Канадский опыт длительного лечения дефлазакортом при мышечной дистрофии Дюшенна. Акта Миол . 2012 май. 31 (1):16-20. [Медлайн].
Лебель Д.Е., Корстон Дж.А., МакАдам Л.С., Биггар В.Д., Алман Б.А. Лечение глюкокортикоидами для профилактики сколиоза у детей с мышечной дистрофией Дюшенна: долгосрочное наблюдение. J Bone Joint Surg Am . 2013 19 июня. 95 (12): 1057-61. [Медлайн].
J Bone Joint Surg Am . 2013 19 июня. 95 (12): 1057-61. [Медлайн].
Чирак С., Аречавала-Гомеза В., Гульери М., Фэн Л., Торелли С., Энтони К. и др. Пропуск экзонов и восстановление дистрофина у пациентов с мышечной дистрофией Дюшенна после лечения системным фосфородиамидатным морфолиноолигомером: открытое исследование фазы 2 с повышением дозы. Ланцет . 2011 13 августа. 378 (9791): 595-605. [Медлайн].
Vyondys 53 (голодирсен) [вкладыш]. Кембридж, Массачусетс: Sarepta Therapeutics. Декабрь 2019 г. Доступно на [Полный текст].
Viltepso (viltolarsen) [вкладыш]. Парамус, Нью-Джерси: NS Pharma, Inc., август 2020 г. Доступно на [Полный текст].
Исследование SRP-4045 и SRP-4053 у пациентов с МДД (ESSENCE). Клинические испытания.gov. Доступно на https: // www.Clinictrials.gov/ct2/show/NCT02500381. 18 марта 2021 г .; Доступ: 24 июня 2021 г.
Доступно на https: // www.Clinictrials.gov/ct2/show/NCT02500381. 18 марта 2021 г .; Доступ: 24 июня 2021 г.
Кейси А., Константин-Теодосиу Д., Хауэлл С., Халтман Э., Гринхаф П.Л. Прием креатина благоприятно влияет на производительность и мышечный метаболизм во время максимальных упражнений у людей. Am J Physiol . 1996 г., июль 271 (1 часть 1): E31-7. [Медлайн].
Тарнопольский М.А., Макленнан Д.П. Добавка моногидрата креатина повышает эффективность упражнений высокой интенсивности у мужчин и женщин. Int J Sport Nutr Exerc Metab . 2000 г. 10 декабря (4): 452-63. [Медлайн].
Тарнопольский М.А., Рой Б.Д., Макдональд Дж.Р. Рандомизированное контролируемое исследование моногидрата креатина у пациентов с митохондриальными цитопатиями. Мышечный нерв . 1997 20 декабря (12): 1502-9. [Медлайн].
[Медлайн].
Чанг Ю.Л., Александрсон Х., Пипитоне Н., Моррисон С., Дастмальчи М., Стол-Халленгрен С. и др. Добавки креатина у пациентов с идиопатической воспалительной миопатией, которые клинически слабы после обычного фармакологического лечения: шестимесячное двойное слепое рандомизированное плацебо-контролируемое исследование. Ревматоидный артрит . 2007 15 мая. 57 (4): 694-702. [Медлайн].
Клопшток Т., Квернер В., Шмидт Ф., Гекелер Ф., Уолтер М., Хартард М. и др. Плацебо-контролируемое перекрестное исследование креатина при митохондриальных заболеваниях. Неврология . 2000 12 декабря. 55 (11): 1748-51. [Медлайн].
Louis M, Lebacq J, Poortmans JR, Belpaire-Dethiou MC, Devogelaer JP, Van Hecke P, et al. Благотворное влияние добавок креатина у пациентов с дистрофией. Мышечный нерв . 2003 май. 27 (5): 604-10. [Медлайн].
2003 май. 27 (5): 604-10. [Медлайн].
Клей Р.А., Тарнопольский М.А., Воргерд М. Креатин для лечения мышечных заболеваний. Кокрановская база данных Syst Rev . 2011 16 февраля. 2: CD004760. [Медлайн].
Хамед С.А. Оценка препарата: PTC-124 — потенциальное средство для лечения муковисцидоза и мышечной дистрофии Дюшенна. IDrugs . 2006 9 ноября (11): 783-9. [Медлайн].
DMD-ataluren (Translarna) для лечения генетических заболеваний.ПТЦ Терапия. Доступно на http://www.ptcbio.com/en/pipeline/ataluren-translarna/ataluren-faq/. 2020; Доступ: 1 июля 2021 г.
Раго Т., Винсент Н., Чафи П., Винье Э., Гильгенкранц Х., Кутон Д. и др. Эффективный аденовирус-опосредованный перенос гена минидистрофина человека в скелетные мышцы мышей mdx. Природа . 1993, 18 февраля. 361 (6413): 647-50. [Медлайн].
1993, 18 февраля. 361 (6413): 647-50. [Медлайн].
Ван З., Аллен Дж. М., Ридделл С. Р., Грегоревич П., Сторб Р., Тапскотт С. Дж. и др.Иммунитет к переносу генов, опосредованному аденоассоциированным вирусом, в случайно выведенной собачьей модели мышечной дистрофии Дюшенна. Хум Джин Тер . 2007 18 января (1): 18-26. [Медлайн].
Howell JM, Lochmüller H, O’Hara A, Fletcher S, Kakulas BA, Massie B, et al. Экспрессия дистрофина высокого уровня после аденовирус-опосредованного переноса минигена дистрофина в скелетные мышцы собак с дистрофией: пролонгация экспрессии при иммуносупрессии. Хум Джин Тер .1998 20 марта. 9 (5): 629-34. [Медлайн].
Griggs RC, Karparti G, ред. Терапия переноса миобластов (достижения экспериментальной медицины и биологии) . Дордрехт, Нидерланды: Kluwer Academic Publishers; 1990.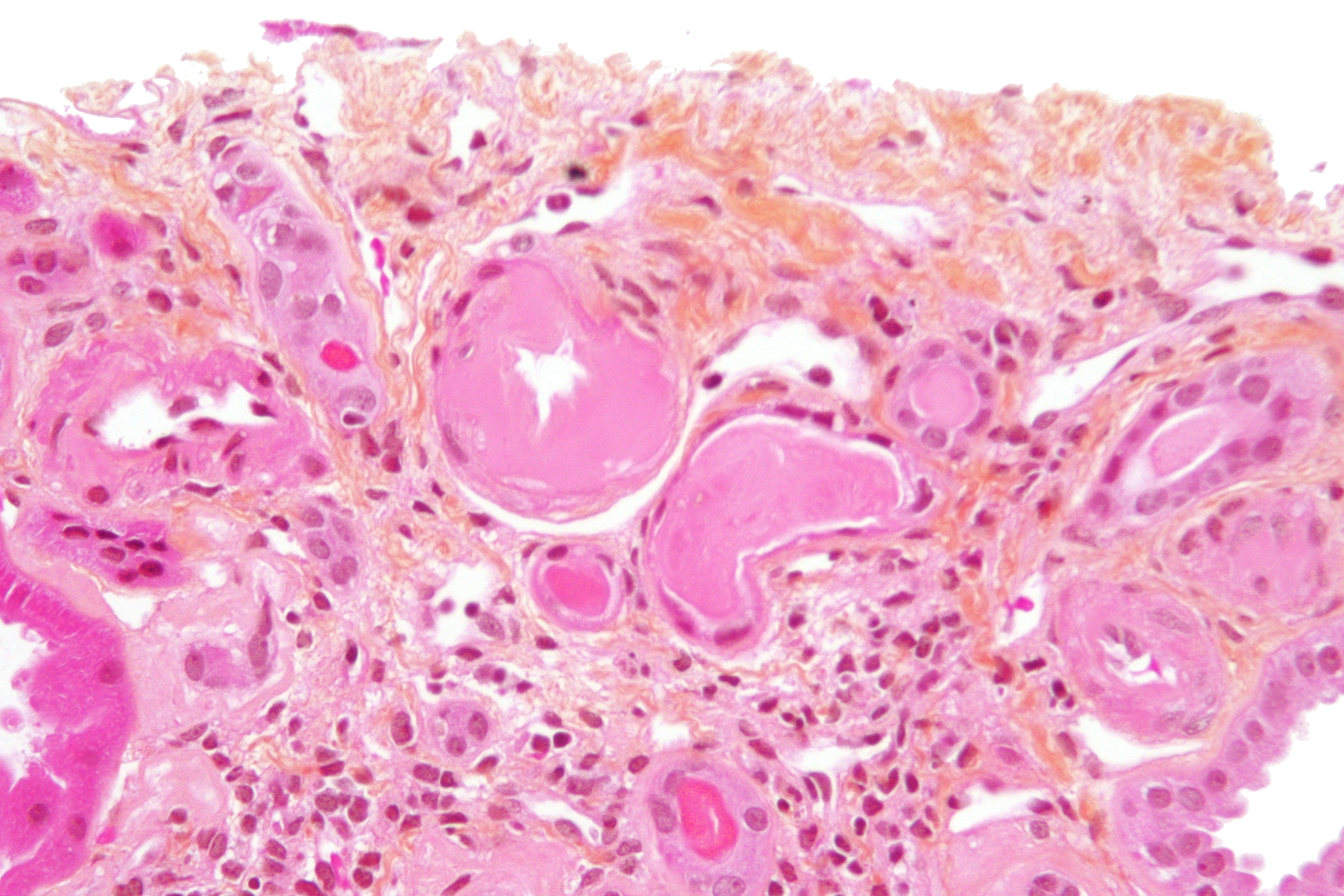
Рандо Т.А. Невирусная генная терапия мышечной дистрофии Дюшенна: прогресс и проблемы. Биохим Биофиз Акта . 2007, февраль 1772 г. (2): 263–71. [Медлайн].
Уэллс Диджей. Терапевтическое восстановление экспрессии дистрофина при мышечной дистрофии Дюшенна. J Muscle Res Cell Motil . 2006. 27 (5-7):387-98. [Медлайн].
Судья Л.М., Чемберлен Дж.С. Генная терапия мышечной дистрофии Дюшенна: AAV лидирует. Акта Миол . 2005 24 декабря (3): 184-93. [Медлайн].
Brooke MH, Fenichel GM, Griggs RC, Mendell JR, Moxley R, Florence J, et al. Мышечная дистрофия Дюшенна: закономерности клинического прогрессирования и эффекты поддерживающей терапии. Неврология . 1989 апр.39 (4): 475-81. [Медлайн].
Дреннан Дж. Нервно-мышечные расстройства. Лоуэлл В.В., Моррисси Р.Т., Винтер Р.Б., ред. Детская ортопедия Ловелла и Винтера . 3-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс; 1990.381.
Юнт CC. Роль напрягателя бедренной кости при некоторых деформациях нижних конечностей. J Хирургическая хирургия костей . 1926. 8:171-93.
Сук К.С., Ли Б.Х., Ли Х.М., Мун С.Х., Чой Ю.К., Шин Д.Е. и др. Функциональные исходы при миодистрофическом сколиозе Дюшенна: сравнение различий между хирургическим и нехирургическим лечением. J Bone Joint Surg Am . 2014 5 марта. 96 (5): 409-15. [Медлайн].
2014 5 марта. 96 (5): 409-15. [Медлайн].
Брукс Дж. Т., Спонсор ПД.Что нового в лечении нервно-мышечного сколиоза. J Pediatr Orthop . 2016 Сентябрь 36 (6): 627-33. [Медлайн].
Джайн А., Хассанзаде Х., Страйк С.А., Менга Э.Н., Спонсор PD, Кебайш К.М. Тазовая фиксация во взрослой и детской хирургии позвоночника: историческая перспектива, показания и методы: выбор выставки AAOS. J Bone Joint Surg Am . 2015 16 сент. 97 (18): 1521-8. [Медлайн].
Гейн В.Дж., Лим Дж., Стефенсон В., Галаско К.С.Прогрессирование сколиоза после спондилодеза при мышечной дистрофии Дюшенна. J Bone Joint Surg Br . 2004 май. 86 (4): 550-5. [Медлайн].
Сенгупта Д.К., Мехдиан С.Х., МакКоннелл Дж.Р., Эйзенштейн С.М., Уэбб Дж.К. Тазовая или поясничная фиксация для хирургического лечения сколиоза при мышечной дистрофии Дюшенна. Позвоночник (Фила Па, 1976) . 2002 15 сентября. 27 (18): 2072-9. [Медлайн].
Позвоночник (Фила Па, 1976) . 2002 15 сентября. 27 (18): 2072-9. [Медлайн].
Мубарак С.Дж., Морин В.Д., Лич Дж. Спондилодез при мышечной дистрофии Дюшенна — фиксация и сращение с крестцово-тазами?. J Pediatr Orthop . 1993 ноябрь-декабрь. 13 (6): 752-7. [Медлайн].
Тиан С., Вонг Б., Хорнунг Л. и др. G.P.171: Возрастная распространенность остеопороза и частота плохих показателей здоровья костей при мышечной дистрофии Дюшенна. Нервно-мышечное расстройство . 2014 24 октября (9-10):857.
Сингх А., Шеффер Э.К., Рейли К.В. Переломы позвонков у пациентов с мышечной дистрофией Дюшенна, получавших дефлазакорт. J Pediatr Orthop .2018 38 июля (6): 320-324. [Медлайн].
Бакнер Д.Л., Боуден С.А., Махан Д.Д. Оптимизация здоровья костей при мышечной дистрофии Дюшенна. Int J Endocrinol . 2015. 2015:928385. [Медлайн]. [Полный текст].
Int J Endocrinol . 2015. 2015:928385. [Медлайн]. [Полный текст].
[Рекомендации] Noritz GH, Murphy NA, Группа экспертов по нейромоторному скринингу. Моторные задержки: раннее выявление и оценка. Педиатрия . 2013 июнь 131 (6):e2016-27. [Медлайн]. [Полный текст].
Мышечная дистрофия: средства диагностики.Центры по контролю и профилактике заболеваний. Доступно на http://www.cdc.gov/ncbddd/musculardystrophy/diagnostic-tool.html. 7 октября 2020 г .; Доступ: 1 июля 2021 г.
Ранняя диагностика имеет значение. ChildMuscleWeakness.org. Доступно на http://www.childmuscleweakness.org/index.php. 2021; Доступ: 1 июля 2021 г.
[Руководство] Бушби К., Финкель Р., Бирнкрант Д.Дж., Кейс Л.Е., Клеменс П.Р., Крайп Л. и др. Диагностика и лечение мышечной дистрофии Дюшенна, часть 1: диагностика, фармакологическое и психосоциальное лечение. Ланцет Нейрол . 2010 9 января (1): 77-93. [Медлайн]. [Полный текст].
Ланцет Нейрол . 2010 9 января (1): 77-93. [Медлайн]. [Полный текст].
[Руководство] Бушби К., Финкель Р., Бирнкрант Д.Дж., Кейс Л.Е., Клеменс П.Р., Крайп Л. и др. Диагностика и лечение мышечной дистрофии Дюшенна, часть 2: осуществление междисциплинарной помощи. Ланцет Нейрол . 2010 9 февраля (2): 177-89. [Медлайн]. [Полный текст].
[Руководство] Бирнкрант Д.Дж., Панич Х.Б., Бендитт Дж.О., Бойтано Л.Дж., Картер Э.Р., Цвик В.А. и др.Консенсусное заявление Американского колледжа торакальных врачей о респираторном и связанном с ним лечении пациентов с мышечной дистрофией Дюшенна, подвергающихся анестезии или седации. Сундук . 2007 г., декабрь 132 (6): 1977–86. [Медлайн]. [Полный текст].
[Рекомендации] Tawil R, Kissel JT, Heatwole C, et al. Краткое изложение рекомендаций, основанных на фактических данных: Оценка, диагностика и лечение плечелопаточно-лицевой мышечной дистрофии: отчет Подкомитета по разработке, распространению и внедрению рекомендаций Американской академии неврологии и Группы по обзору практических вопросов Американской ассоциации нейромышечной и электродиагностической медицины. Неврология . 2015 28 июля. 85 (4): 357-64. [Медлайн]. [Полный текст].
Неврология . 2015 28 июля. 85 (4): 357-64. [Медлайн]. [Полный текст].
[Руководство] Wang CH, Bonnemann CG, Rutkowski A и др., Комитет по международным стандартам медицинской помощи при врожденной мышечной дистрофии. Согласованное заявление о стандарте лечения врожденных мышечных дистрофий. J Детский Нейрол . 2010 25 декабря (12): 1559-81. [Медлайн]. [Полный текст].
[Руководство] Канг П.Б., Моррисон Л., Яннакконе С.Т. и др., Подкомитет по разработке рекомендаций Американской академии неврологии и Группа по обзору практических вопросов Американской ассоциации нейромышечной и электродиагностической медицины.Краткое изложение рекомендаций, основанных на фактических данных: оценка, диагностика и лечение врожденной мышечной дистрофии: отчет Подкомитета по разработке рекомендаций Американской академии неврологии и Группы по обзору практических вопросов Американской ассоциации нейромышечной и электродиагностической медицины. Неврология . 2015 31 марта. 84 (13): 1369-78. [Медлайн]. [Полный текст].
Неврология . 2015 31 марта. 84 (13): 1369-78. [Медлайн]. [Полный текст].
[Руководство] Нараянасвами П., Вайс М., Селсен Д. и др., Подкомитет по разработке рекомендаций Американской академии неврологии, Группа по анализу практических вопросов Американской ассоциации нейромышечной и электродиагностической медицины.Краткое изложение рекомендаций, основанных на фактических данных: диагностика и лечение дистрофий пояса и дистальных отделов конечностей: отчет подкомитета по разработке рекомендаций Американской академии неврологии и экспертной группы по вопросам практики Американской ассоциации нейромышечной и электродиагностической медицины. Неврология . 2014 14 окт. 83 (16): 1453-63. [Медлайн]. [Полный текст].
Мышечная дистрофия (для родителей) — Nemours KidsHealth
Что такое мышечная дистрофия?
Мышечная дистрофия — это заболевание, которое со временем ослабляет мышцы. Существуют различные виды мышечных дистрофий. Каждый тип начинается в разном возрасте и может вызывать легкую или сильную мышечную слабость.
Существуют различные виды мышечных дистрофий. Каждый тип начинается в разном возрасте и может вызывать легкую или сильную мышечную слабость.
Двумя наиболее распространенными типами мышечной дистрофии (DISS-truh-fee) являются мышечная дистрофия Дюшенна и мышечная дистрофия Беккера.
Каковы признаки и симптомы мышечной дистрофии?
Дети с мышечной дистрофией Дюшенна или Беккера могут:
- трудно подниматься по лестнице
- быть неуклюжим
- путешествовать и много падать
- походка на носках
- болит нога
- имеют слабые мышцы рук, ног или лица
- имеют крупные телята
Симптомы мышечной дистрофии Дюшенна (роса-SHEN) и Беккера прогрессируют.Это означает, что со временем они ухудшаются. У детей с мышечной дистрофией также может развиться сколиоз (искривление позвоночника), проблемы с сердцем, проблемы с дыханием и проблемы с ходьбой.
Что вызывает мышечную дистрофию?
Мышечная дистрофия является генетическим заболеванием. Генетические условия передаются от родителя (или родителей) ребенку. При мышечной дистрофии изменение гена не позволяет организму вырабатывать белки, необходимые для построения и поддержания здоровых мышц.
Генетические условия передаются от родителя (или родителей) ребенку. При мышечной дистрофии изменение гена не позволяет организму вырабатывать белки, необходимые для построения и поддержания здоровых мышц.
Консультант-генетик может помочь родителям понять, как мышечная дистрофия может передаваться в семьях.
Как диагностируется мышечная дистрофия?
Врачи диагностируют мышечную дистрофию по:
- вопросы о симптомах
- сдавать экзамен
- узнать, есть ли у других членов семьи мышечная дистрофия
- проведение анализов крови, включая генетическое тестирование
- взятие мышечной биопсии (просмотр небольшого кусочка мышцы под микроскопом)
- сделать ЭМГ (тест, который проверяет, как нервы и мышцы работают вместе)
- сделать ЭКГ или эхокардиограмму для проверки работы сердца
Как лечится мышечная дистрофия?
Мышечная дистрофия неизлечима.Но лечение может помочь людям оставаться максимально активными и независимыми. Клинические испытания продолжаются, и разрабатываются новые лекарства для лечения и, возможно, лечения мышечной дистрофии.
Клинические испытания продолжаются, и разрабатываются новые лекарства для лечения и, возможно, лечения мышечной дистрофии.
Лечение мышечной дистрофии зависит от возраста ребенка, вида мышечной дистрофии и ее тяжести. Лечение может включать:
Чем могут помочь родители?
Если у вашего ребенка мышечная дистрофия, команда врачей-специалистов будет работать с вами и вашей семьей, чтобы помочь вашему ребенку получить наилучший уход.В группу по уходу могут входить: невролог, ортопед, пульмонолог, физиотерапевт, эрготерапевт, практикующая медсестра, кардиолог, дипломированный диетолог и социальный работник.
Чтобы помочь вашему ребенку:
- Посещайте все медицинские учреждения.
- Убедитесь, что ваш ребенок принимает все лекарства и выполняет все инструкции, данные лечащим персоналом.
Вы можете узнать больше о мышечной дистрофии через свою группу по уходу и онлайн по телефону:
Паттерн-дистрофия — Macular Society
Паттерн-дистрофия — это общий термин для группы заболеваний сетчатки. Все они вызывают накопление отходов, называемых липофусцином, которые вызывают повреждение тканей глаза.
Все они вызывают накопление отходов, называемых липофусцином, которые вызывают повреждение тканей глаза.
Различные формы дистрофии вызывают различные повреждения, которые могут выглядеть как яичные желтки, бабочки или рыболовные сети с узлами. У людей обычно проявляются симптомы в обоих глазах, и каждый из них может иметь различный характер повреждения.
Как наследуется?
Паттерновые дистрофии вызываются мутациями (или ошибками) в одном из нескольких генов, но все они наследуются по аутосомно-доминантному типу.Это означает, что у человека с паттерн-дистрофией есть 50-процентный шанс передать ее своему ребенку, будь то мальчик или девочка. Ген не всегда «выражается» одинаково, поэтому у человека со значительной потерей зрения может родиться ребенок с легким нарушением зрения.
Симптомы
Симптомы паттерн-дистрофии аналогичны возрастной дегенерации желтого пятна (AMD), но, как правило, менее выражены. Несмотря на некоторую нечеткость зрения и потерю мелких деталей, люди обычно могут водить машину и читать газету. Часто отложения липофусцина обнаруживаются во время обычной проверки зрения до того, как пациент заметит какую-либо потерю зрения.
Часто отложения липофусцина обнаруживаются во время обычной проверки зрения до того, как пациент заметит какую-либо потерю зрения.
Хотя симптомы действительно ухудшаются, обычно это происходит очень медленно, в течение 20–30 лет. Примерно у 15% людей в тканях глаза появляются новые протекающие кровеносные сосуды (например, влажная AMD). Аналогичная пропорция обнаруживает, что участки светочувствительных клеток в их сетчатке начинают отмирать из-за географической атрофии (также симптом сухой AMD). Обычно это происходит у людей старше 60 лет.
Методы лечения
В настоящее время не существует методов лечения паттерн-дистрофии. Людей, у которых развиваются симптомы влажной формы ВМД, можно лечить с помощью инъекций анти-VEGF, чтобы замедлить рост новых кровеносных сосудов.
Исследования
Наше понимание генетических изменений, вызывающих паттерн дистрофию, улучшается с каждым годом. Будущие методы лечения ВМД и других дистрофий могут оказаться эффективными и при паттерн-дистрофии.
Для получения информации о жизни с наследственной макулярной дистрофией позвоните в Консультативно-информационную службу по телефону 0300 3030 111 или напишите по электронной почте help@macularsociety.орг
Что такое ювенильная макулярная дистрофия?
Ювенильная макулярная дистрофия (иногда называемая ювенильной дегенерацией желтого пятна) — это группа наследственных заболеваний глаз, поражающих детей и молодых людей. Ювенильная макулярная дистрофия отличается от возрастной макулодистрофии (ВМД). ВМД возникает как часть естественного процесса старения организма, но ювенильная макулярная дистрофия является наследственным заболеванием.
Макула – это небольшой участок сетчатки — светочувствительной ткани, выстилающей заднюю часть глаза.Макула обеспечивает центральное зрение и позволяет четко видеть мелкие детали. Макула составляет лишь небольшую часть сетчатки, однако она гораздо более чувствительна к деталям, чем остальная часть сетчатки (так называемая периферическая сетчатка). Макула — это то, что позволяет вам вдевать нить в иголку, читать мелкий шрифт и читать уличные знаки. Периферическая сетчатка обеспечивает боковое (или периферийное) зрение. Если кто-то стоит сбоку от вас, ваша периферическая сетчатка поможет вам это узнать. Он делает это, позволяя вам видеть их общую форму.
Макула — это то, что позволяет вам вдевать нить в иголку, читать мелкий шрифт и читать уличные знаки. Периферическая сетчатка обеспечивает боковое (или периферийное) зрение. Если кто-то стоит сбоку от вас, ваша периферическая сетчатка поможет вам это узнать. Он делает это, позволяя вам видеть их общую форму.
Наиболее распространенной формой ювенильной макулярной дистрофии является болезнь Штаргардта. Другие типы ювенильной макулодистрофии включают:
- Болезнь Беста (также называемая вителлиформной дистрофией сетчатки Беста)
- ювенильный ретиношизис
Все эти заболевания встречаются редко и вызывают потерю центрального зрения.
Каковы симптомы ювенильной макулодистрофии?
Все формы ювенильной макулярной дистрофии имеют сходные характеристики.Все они вызывают проблемы с центральным зрением. Ваше центральное зрение может быть размытым, искаженным или иметь темные области. Боковое зрение обычно не нарушается, но на более поздних стадиях может нарушаться цветовосприятие. Первые симптомы появляются в детстве или подростковом возрасте. Эти симптомы не всегда одинаково влияют на каждый глаз.
Первые симптомы появляются в детстве или подростковом возрасте. Эти симптомы не всегда одинаково влияют на каждый глаз.
Некоторые люди с ювенильной макулярной дистрофией сохраняют нормальное зрение во взрослом возрасте. У других болезнь прогрессирует быстрее. Люди с болезнью Беста часто имеют почти нормальное зрение в течение многих десятилетий.Многие люди могут даже не подозревать, что они у них есть. Напротив, болезнь Штаргардта часто приводит к зрению 20/200. Это определение правовой слепоты.
Ювенильный ретиношизис также приводит к потере зрения от 20/60 до 20/120. Около половины людей с этим заболеванием теряют боковое зрение. К 60 годам и старше потеря зрения может достигать 20/200.
У детей с ювенильным ретиношизисом также могут проявляться признаки:
Кто подвержен риску ювенильной макулодистрофии?
Ювенильная макулярная дистрофия — наследственное генетическое заболевание.Это означает, что болезнь переходит от родителей к ребенку. Разные типы болезни имеют разный характер наследования.
Например, болезнь Штаргардта обычно является рецессивной. Это означает, что ребенок должен унаследовать его от обоих родителей, чтобы болезнь развилась. Родители чаще всего являются «носителями» болезни. Это означает, что у них нет болезни, но они могут незаметно передать болезнь своим детям.
Болезнь Беста является доминантным геном. Это означает, что ребенок должен унаследовать ген только от одного родителя, чтобы заболеть.Когда у больного есть дети от здорового партнера, вероятность того, что ребенок заболеет, составляет 50% (5 из 10).
Юношеский ретиношизис — заболевание, сцепленное с Х-хромосомой, которым преимущественно страдают мужчины. Генетическая мутация, вызывающая заболевание, находится в Х-хромосоме. Самцы наследуют эту хромосому от своих матерей. (Отцы вносят Y-хромосому.)
Лучшая болезнь (Лучшая вителлиформная макулярная дистрофия) — RNIB
Лучшая болезнь — это генетическое заболевание, с которым вы рождаетесь, хотя оно обычно не начинает влиять на ваше зрение до более позднего возраста.
Бест Болезнь поражает макулу, которая является частью сетчатки в задней части глаза, которую вы используете при чтении, письме или просмотре телевизора. В настоящее время лечения болезни Беста не существует, хотя исследования в области генной терапии продолжаются, что может привести к лечению в будущем.
На этой странице содержится краткая информация о болезни Беста. Чтобы прочитать нашу полную информацию, загрузите наш информационный бюллетень:
Загрузите наш информационный бюллетень о лучших заболеваниях в Word
Быстрые ссылки
— Что такое лучшая болезнь?
– Что вызывает болезнь Беста?
– Как болезни Беста влияют на глаза?
– Есть ли лечение болезни Беста?
– Забота о вашем зрении
– Преодоление болезни
Что такое лучшая болезнь?
Болезнь Беста — это заболевание глаз, которое поражает крошечную часть сетчатки в задней части глаза, называемую макулой.Болезнь Беста вызывает проблемы с центральным зрением, но не приводит к полной потере зрения и не вызывает болезненных ощущений. Болезнь Беста влияет на зрение, которое вы используете, когда смотрите прямо на что-то, например, когда читаете, смотрите фотографии или смотрите телевизор. Болезнь Беста может сделать это центральное зрение искаженным или размытым, а со временем может вызвать пустое пятно в центре вашего зрения. Болезнь Беста обычно не влияет на ваше периферическое (боковое) зрение.
Болезнь Беста влияет на зрение, которое вы используете, когда смотрите прямо на что-то, например, когда читаете, смотрите фотографии или смотрите телевизор. Болезнь Беста может сделать это центральное зрение искаженным или размытым, а со временем может вызвать пустое пятно в центре вашего зрения. Болезнь Беста обычно не влияет на ваше периферическое (боковое) зрение.
Болезнь Беста является разновидностью макулодистрофии и также называется «вителлиформной макулодистрофией Беста».Макулярная дистрофия — это наследственное заболевание глаз, которое означает, что оно вызвано сбоем в гене.
Бест Заболевание может поражать как мужчин, так и женщин. Обычно это происходит в обоих глазах, но может не влиять на зрение в одинаковой степени в каждом глазу. Иногда поражает только один глаз. Болезнь Беста может начать вызывать изменения в макуле в возрасте от трех до 15 лет, хотя обычно она не влияет на зрение до более позднего возраста. Потеря зрения, вызванная болезнью Беста, может развиваться в течение многих лет, и некоторые люди с болезнью Беста могут продолжать читать в свои сорок, пятьдесят и даже больше.
Наверх
Что вызывает болезнь Беста?
Лучшая болезнь — это генетическое заболевание. Это означает, что это вызвано «неисправным» геном, который может быть унаследован от родителя или возникать как новая ошибка в гене.
Болезнь Беста может быть вызвана дефектом в гене, известном как BEST1 (также известном как VMD2).
Исследователи выявили сотни различных нарушений в одном гене, которые могут привести к нескольким дистрофиям желтого пятна, известным под общим названием бестрофинопатии.К ним относятся:
- лучшие вителлиформерные макулярные дистрофии (наилучшее заболевание)
- Vish-Neediform Vitelliform Cheetelopy Cheetelophy
- Автосомно-рецессивная бестрофинопатия
- AutoSomal Domentator VitreoRetinochoroidopathy
- RETINITE PIGMENTOSA (RP)
Как унаследованы гены?
Все гены идут парами. Вы наследуете по одной копии гена от каждого из ваших родителей, чтобы образовать пару. Ваши гены дают клеткам вашего тела инструкции, необходимые для того, чтобы они хорошо работали и оставались здоровыми.Когда ген неисправен, гены не дают правильных инструкций клеткам, и тогда клетки не развиваются и не работают должным образом.
Ваши гены дают клеткам вашего тела инструкции, необходимые для того, чтобы они хорошо работали и оставались здоровыми.Когда ген неисправен, гены не дают правильных инструкций клеткам, и тогда клетки не развиваются и не работают должным образом.
Существует несколько путей передачи дефектного гена от родителей. Эти «способы» также известны как модели наследования.
Аутосомно-доминантное наследование
Болезнь Беста наследуется по доминантному типу.
Доминантное наследование означает, что болезнь наследуется только от одного из ваших родителей. Когда «дефектный» ген находится в паре с нормальным геном от другого родителя, он является доминантным и «включает» признак или состояние.Он «доминирует» над другим «нормальным» геном, унаследованным от другого родителя.
Это означает, что если у человека есть одна дефектная копия и одна здоровая копия гена, он сам будет страдать болезнью Беста и будет иметь 50-процентный шанс передать дефектный ген каждому своему ребенку. Если ребенок не унаследует дефектный ген болезни Беста, он не сможет передать его своим детям.
Если ребенок не унаследует дефектный ген болезни Беста, он не сможет передать его своим детям.
Аутосомно-рецессивное наследование
Совсем недавно исследователи обнаружили, что некоторые дефекты в гене BEST1 могут наследоваться по рецессивному типу.Это означает, что вам нужно унаследовать две копии неисправного гена (по одной от каждого из ваших родителей), чтобы заболеть этим заболеванием. Это более редкий тип макулярной дистрофии, известный как аутосомно-рецессивная бестрофинопатия.
Вителлиформная макулярная дистрофия, начинающаяся у взрослых
В большинстве случаев вителлиформная макулярная дистрофия, начинающаяся у взрослых, причина неизвестна. Однако в некоторых случаях дефекты могут быть обнаружены либо в BEST1, либо в других идентифицированных генах, включая PRPh3, IMPG1 или IMPG2.Многие люди с вителлиформной макулодистрофией, начинающейся во взрослом возрасте, не имеют дефекта ни в одном из этих генов, и причина остается неизвестной.
Характер наследования вителлиформной макулярной дистрофии у взрослых еще не ясен.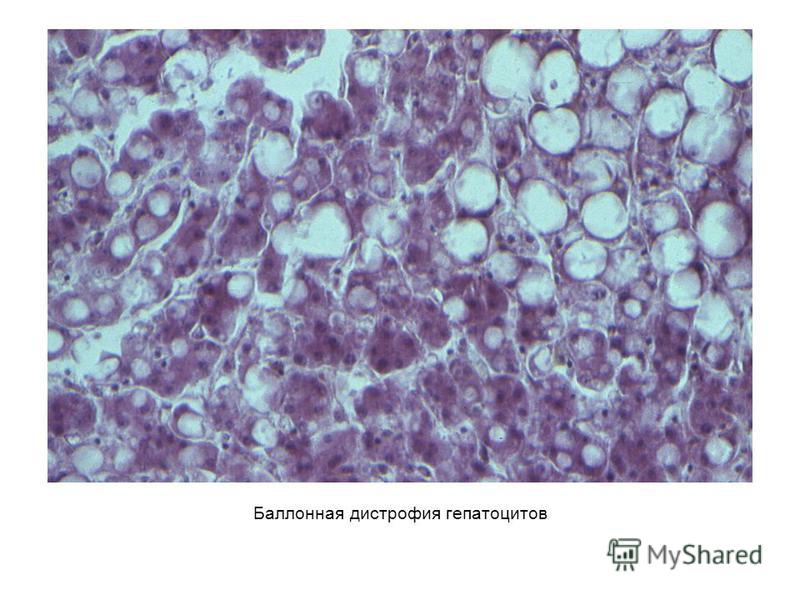 Не у всех, у кого есть это заболевание, есть семейный анамнез, и не у всех, кто наследует дефектный ген, развиваются симптомы. Если у кого-то и появляются симптомы, они обычно начинаются в возрасте от 30 до 50 лет с нечеткости или искажения центрального зрения. Состояние прогрессирует очень медленно, и многие люди могут сохранять хорошее зрение в более позднем возрасте.
Не у всех, у кого есть это заболевание, есть семейный анамнез, и не у всех, кто наследует дефектный ген, развиваются симптомы. Если у кого-то и появляются симптомы, они обычно начинаются в возрасте от 30 до 50 лет с нечеткости или искажения центрального зрения. Состояние прогрессирует очень медленно, и многие люди могут сохранять хорошее зрение в более позднем возрасте.
Генетическое тестирование и консультирование
Если в вашей семье есть болезнь Беста, вам может быть полезно поговорить с консультантом по генетическим вопросам, генетиком-консультантом или офтальмологом (врачом больницы), специализирующимся в области генетики.
Генетическое тестирование может помочь подтвердить ген, ответственный за болезнь Беста, и способ его наследования. Генетическое консультирование может помочь вам понять, как болезнь Беста передавалась в вашей семье, и каковы шансы ее передачи будущим детям.
Генетическое консультирование — это бесплатная услуга NHS. Вы можете попросить своего врача общей практики или офтальмолога направить вас в местную генетическую службу.
Вернуться к началу
Как болезнь Беста влияет на глаза?
Ранние признаки болезни Беста обычно развиваются в возрасте от 3 до 15 лет. На этих ранних стадиях болезнь Беста не всегда сильно влияет на зрение, поэтому ребенок может не заметить проблемы со зрением. Иногда его выявляют при осмотре глаз, когда оптометрист может увидеть изменения в макуле до того, как ухудшится зрение.
Иногда кто-то может заметить изменение в своем зрении, и проверка зрения подтверждает, что у него есть изменения в макуле, которые могут указывать на болезнь Беста. Несмотря на то, что у кого-то могут быть изменения в макуле из-за болезни Беста в раннем возрасте, у него могут возникнуть проблемы со зрением гораздо позже, часто в возрасте старше 40 лет.
Пять стадий болезни Беста
Существует пять стадий Лучшее заболевание, которое может увидеть окулист или офтальмолог, когда они смотрят на макулу.Ни одна из этих стадий не вызывает боли в глазах.
Этап 1: На этом этапе макула выглядит здоровой, изменений не видно. Могут быть тонкие изменения в слое под макулой, но обычно это не влияет на зрение.
Могут быть тонкие изменения в слое под макулой, но обычно это не влияет на зрение.
Стадия 2: Эта стадия называется вителлиформной стадией . На этом этапе в области макулы появляется волдырь, похожий на яичный желток. Хотя оптометрист или офтальмолог часто могут видеть эти изменения, в это время они не влияют на зрение или вызывают очень незначительные изменения зрения.Обычно эта стадия возникает в возрасте от трех до 15 лет. На этой стадии часть желтого вещества, из-за которого образуются волдыри, похожие на яичный желток, может прорвать слой под сетчаткой. Это приводит к образованию кисты под сетчаткой. Опять же, может быть небольшое изменение уровня зрения. Эта стадия обычно наблюдается в подростковом возрасте.
Стадия 4: Эта стадия называется вителлируптивной стадией .На этой стадии поражение начинает разрушаться и может привести к повреждению некоторых клеток в слоях сетчатки. В этот момент вы можете начать ощущать изменения в своем видении. Вы можете начать замечать, что прямые линии выглядят волнистыми или у вас возникают проблемы с чтением мелкого шрифта.
Вы можете начать замечать, что прямые линии выглядят волнистыми или у вас возникают проблемы с чтением мелкого шрифта.
Стадия 5: Это последняя стадия болезни Беста. Она называется атрофической стадией . Желтый материал, вызвавший поражения, начинает отходить и исчезать. Однако он оставляет рубцы и поврежденные клетки на сетчатке.На этом этапе ваше зрение страдает более серьезно, и вам может быть трудно читать.
Это классические стадии болезни Беста, однако у некоторых людей развивается другая стадия, называемая хориоидальной неоваскуляризацией (ХНВ). Эта стадия развивается во время атрофической стадии, когда глаз пытается исправить повреждение желтого пятна, создавая новые кровеносные сосуды. К сожалению, эти новые кровеносные сосуды очень негерметичны, из-за чего они кровоточат, что в конечном итоге может привести к образованию рубцовой ткани и дальнейшему ухудшению зрения.Однако в большинстве случаев CNV не возникает.
Вы можете долгое время болеть болезнью Беста без проблем со зрением. Ваше зрение обычно не страдает до стадии 4 или 5, которая может не развиться до тех пор, пока вам не исполнится 40 лет, хотя это может произойти и раньше, в конце двадцатых или начале тридцатых годов. Невозможно точно знать, когда и в какой степени это повлияет на ваше зрение, поскольку оно может варьироваться от человека к человеку.
Ваше зрение обычно не страдает до стадии 4 или 5, которая может не развиться до тех пор, пока вам не исполнится 40 лет, хотя это может произойти и раньше, в конце двадцатых или начале тридцатых годов. Невозможно точно знать, когда и в какой степени это повлияет на ваше зрение, поскольку оно может варьироваться от человека к человеку.
Вернуться к началу
Существует ли лечение болезни Беста?
К сожалению, на данный момент лечения болезни Беста не существует.Несмотря на то, что в идентификации генов, ответственных за болезнь Беста, было достигнуто много успехов, это еще не привело к лечению.
У небольшой части людей с болезнью Беста могут развиваться новые кровеносные сосуды на макуле или под ней, что в медицине называется хориоидальной неоваскуляризацией (ХНВ).
Риск развития CNV, возможно, увеличивается при травме головы. Поэтому имеет смысл принять дополнительные меры предосторожности в ситуациях, когда вы можете получить удар по голове, например, избегать контактных видов спорта или носить велосипедный шлем при езде на велосипеде.
Новые кровеносные сосуды можно лечить лазером и, возможно, инъекцией препарата против VEGF. Хотя лечение новых кровеносных сосудов может не привести к значительному улучшению зрения, оно часто помогает предотвратить дальнейшее повреждение желтого пятна и зрения.
Препараты против фактора роста эндотелия сосудов (анти-VEGF) — это категория препаратов, которые останавливают или уменьшают рост новых кровеносных сосудов. Это может замедлить их утечку и замедлить потерю зрения. Анти-VEGF еще не доступны автоматически в NHS для людей с CNV, связанной с вителлиформной макулодистрофией, но ваш офтальмолог лучше всего может решить, какое лечение необходимо в вашем случае.
Генная терапия в настоящее время изучается как возможное средство лечения различных типов наследственных макулодистрофий. Генная терапия направлена на замену неисправного гена новым геном, который работает должным образом. Нормальные гены вводятся в сетчатку с помощью безвредного вируса для переноса генетического материала. Есть надежда, что пораженные клетки сетчатки затем начнут работать должным образом, а повреждение либо остановится, либо обратится вспять. Многие из этих исследований находятся на ранних стадиях, и может пройти много лет, прежде чем они станут признанным методом лечения, хотя такого рода исследования являются положительным шагом вперед.
Есть надежда, что пораженные клетки сетчатки затем начнут работать должным образом, а повреждение либо остановится, либо обратится вспять. Многие из этих исследований находятся на ранних стадиях, и может пройти много лет, прежде чем они станут признанным методом лечения, хотя такого рода исследования являются положительным шагом вперед.
На данный момент нет конкретных исследований, показывающих, что диета может помочь замедлить прогрессирование болезни Беста. Тем не менее, хорошая диета, богатая свежими фруктами и овощами, может помочь здоровью глаз в целом. Известно, что курение ускоряет развитие других форм болезни желтого пятна, поэтому было бы разумно бросить курить, так как это, возможно, также может помочь замедлить прогрессирование болезни Беста.
Вернуться к началу
Забота о вашем зрении
Несмотря на то, что в настоящее время не существует лечения болезни Беста, очень важно, чтобы вы получали долгосрочное последующее наблюдение для наблюдения за своим состоянием и его прогрессированием. Также очень важно регулярно проходить осмотры в больнице или у окулиста, чтобы гарантировать, что любое развитие CNV может быть обнаружено как можно раньше, чтобы при необходимости можно было начать лечение.
Также очень важно регулярно проходить осмотры в больнице или у окулиста, чтобы гарантировать, что любое развитие CNV может быть обнаружено как можно раньше, чтобы при необходимости можно было начать лечение.
Если у вас диагностирована болезнь Беста и вы заметили внезапное изменение зрения в любом из ваших глаз, вам следует обратиться к окулисту или немедленно сообщить об этом в глазную клинику. Это связано с тем, что у некоторых людей может развиться CNV, и в этом случае может быть возможно лечение для сохранения зрения.
Если у вас есть незначительные изменения в зрении, вам следует записаться на осмотр к офтальмологу.Они обучены выявлять любые проблемы со зрением и при необходимости могут направить вас к офтальмологу в больнице.
У людей с болезнью Беста гораздо выше вероятность развития дальнозоркости. Дальнозоркость означает, что глазам трудно сфокусироваться вблизи. Дальнозоркость легко корректируется очками.
Хотя очки или контактные линзы не могут исправить проблемы со зрением, вызванные болезнью Беста, ваш окулист может улучшить вашу дальнозоркость или близорукость с помощью очков, чтобы помочь вам улучшить зрение. Ваш оптометрист может проверить рецепт на очки во время осмотра офтальмолога, чтобы убедиться, что ваши очки, если это необходимо, подходят вам.
Ваш оптометрист может проверить рецепт на очки во время осмотра офтальмолога, чтобы убедиться, что ваши очки, если это необходимо, подходят вам.
Важно помнить, что многие молодые люди с болезнью Беста могут иметь хорошее зрение в течение длительного времени и могут нуждаться в помощи только тогда и в том случае, если их болезнь Беста прогрессирует до более поздних стадий.
Вернуться к началу
Что делать
Диагноз заболевания глаз может быть очень неприятным.Вы можете обнаружить, что беспокоитесь о будущем и о том, как вы справитесь с изменением своего видения. Мы здесь, чтобы поддержать вас на каждом этапе и ответить на любые вопросы, которые могут у вас возникнуть — просто свяжитесь с нашей консультационной службой по потере зрения.
Macular Society имеет местные группы, которые встречаются по всей стране, а также предлагают консультационные услуги по телефону. Иногда полезно поговорить о своих чувствах или поделиться ими с людьми, у которых может быть подобный опыт.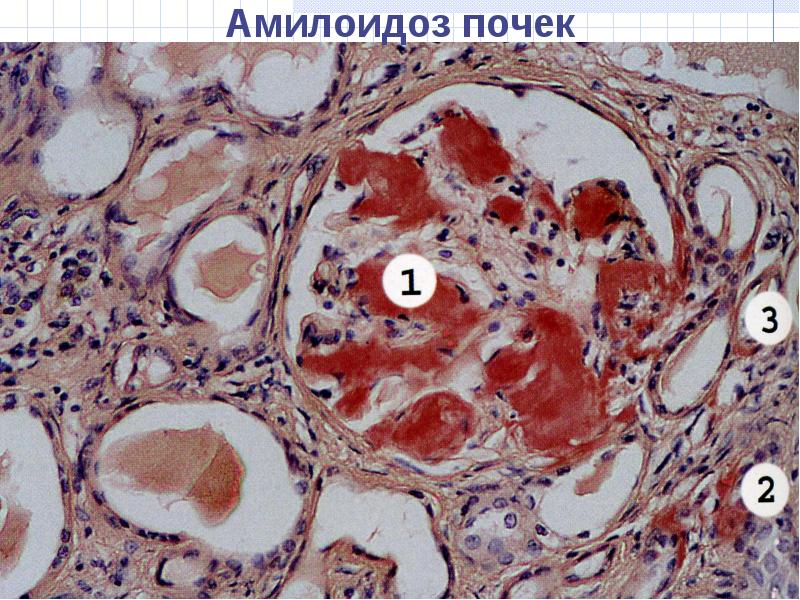
Помогите лучше видеть
Лучший Болезнь может вызвать проблемы с центральным зрением.Тем не менее, у большинства людей с болезнью Беста есть некоторое зрение, которое они могут использовать каждый день, и использование вашего зрения не усугубит болезнь.
Есть много вещей, которые вы можете сделать, чтобы максимально использовать свое видение. Это может означать увеличение объектов, использование более яркого освещения или использование цвета, чтобы объекты было лучше видно. Попросите своего офтальмолога, офтальмолога или терапевта направить вас в местную службу для людей с плохим зрением, которая может предоставить вам лупы для помощи при чтении, советы по освещению и советы о том, как максимально использовать ваше периферийное зрение для выполнения повседневных задач, чтобы помочь улучшить зрение. большая часть твоего зрения.
Местные социальные службы также должны быть в состоянии предложить вам информацию о том, как оставаться в безопасности дома и безопасно выходить из дома. Они также должны быть в состоянии предложить вам практическое обучение мобильности, чтобы придать вам больше уверенности, когда вы находитесь вне дома.
Они также должны быть в состоянии предложить вам практическое обучение мобильности, чтобы придать вам больше уверенности, когда вы находитесь вне дома.
Наша Консультация по потере зрения также может дать вам практические рекомендации о том, как жить с потерей зрения, а в нашем Интернет-магазине есть продукты, которые облегчат повседневные задачи.
Другие источники помощи
1. Beat the Best — базирующаяся в США некоммерческая онлайн-группа поддержки для людей с Best на Facebook.
2. Хотя в Великобритании нет специальной группы для людей и семей, пострадавших от болезни Беста, Macular Society является национальной благотворительной организацией для всех, кто страдает потерей центрального зрения.
3. Genetic Alliance UK — это национальная благотворительная организация, работающая над улучшением жизни пациентов и их семей, страдающих от всех типов генетических заболеваний.
Вернуться к началу
Вас также может заинтересовать.
 ..
..Мышечная дистрофия Дюшенна у детей
Не то, что вы ищете?Что такое мышечная дистрофия Дюшенна у детей?
Мышечная дистрофия Дюшенна [doo-SHEN] (МДД) — это редкое генетическое заболевание, которое ослабляет мышцы вашего ребенка.Это самая распространенная мышечная дистрофия, разновидность наследственного болезнь мышц. МДД вызывает слабость и потерю мышечной массы, которые распространяются по всему телу вашего ребенка. тело.
МДД появляется у мальчиков раннего возраста, обычно
в возрасте от 2 до 5 лет. Это вызывает потерю мышечной массы, которая со временем ухудшается. Большинство мальчиков с
DMD нуждаются в инвалидной коляске к тому времени, когда они становятся подростками. МДД повреждает мышцы, необходимые для
движение. МДД также может ослабить сердечную мышцу и вызвать увеличение сердца (расширение
кардиомиопатия). МДД не лечится, но некоторые люди с МДД могут дожить до 40 лет.
50-е гг.
МДД не лечится, но некоторые люди с МДД могут дожить до 40 лет.
50-е гг.
Что вызывает мышечную дистрофию Дюшенна у ребенка?
МДД вызывается изменениями (мутациями) в гене, который помогает вырабатывать дистрофин. Дистрофин является важным белком в мышечных клетках. Помогает сохранить мышечные волокна стабильными и защищает их.
Мышцы состоят из пучков длинных мышечных волокон (мышечных клеток).Эти волокна тянут вместе (сокращение), когда нервные сигналы от мозга поступают в определенное место (соединение), где нерв активирует мышцу. Дистрофин входит в состав сложного комплекса белки, которые обычно защищают мышечные волокна вашего ребенка, когда они сокращаются и расслабляться.
При МДД генные изменения вызывают
организм ребенка вырабатывает очень мало или вообще не производит дистрофина. Без достаточного количества дистрофина
мышечные клетки становятся негерметичными и умирают.Это приводит к ослаблению мышц. Если ген может
все еще делают немного дистрофина, состояние имеет более легкие симптомы. Это называется Беккер.
мышечная дистрофия. У людей с МДД вообще нет дистрофина.
Без достаточного количества дистрофина
мышечные клетки становятся негерметичными и умирают.Это приводит к ослаблению мышц. Если ген может
все еще делают немного дистрофина, состояние имеет более легкие симптомы. Это называется Беккер.
мышечная дистрофия. У людей с МДД вообще нет дистрофина.
МДД обычно поражает мальчиков, потому что ген дистрофина находится на X хромосома . Хромосомы — это части ваших клеток, которые содержат ваш гены. Мальчики имеют только одну Х-хромосому. У девочек две Х-хромосомы, по одной от каждой родитель.Мальчики получают одну Х-хромосому от матери и одну Y-хромосому от матери. отец. Заболевание редко поражает девочек.
Потому что у мальчика только одна копия
ген дистрофина, мутация МДД означает, что у него не будет достаточного количества дистрофина, чтобы
чтобы его мышцы работали хорошо. По этой причине МДД называют Х-сцепленным заболеванием. Когда девочка наследует мутацию МДД на одной из своих Х-хромосом, она обычно получает достаточно
дистрофина из здорового гена на другой Х-хромосоме.Но у некоторых девушек нет
вполне достаточно дистрофина. Это вызывает легкие или умеренные симптомы МДД и заболевание
сердечной мышцы (кардиомиопатия).
Когда девочка наследует мутацию МДД на одной из своих Х-хромосом, она обычно получает достаточно
дистрофина из здорового гена на другой Х-хромосоме.Но у некоторых девушек нет
вполне достаточно дистрофина. Это вызывает легкие или умеренные симптомы МДД и заболевание
сердечной мышцы (кардиомиопатия).
Женщины с мутацией МДД являются носителями МДД. У них шанс пройти 1 к 2 ген на каждого ребенка. Если мальчик получает мутацию, он заболевает. Девушка, которая получает мутацию, будет носителем. Мутация также может иногда происходить без передается от родителей.Это называется мутацией de novo.
Каковы симптомы мышечной дистрофии Дюшенна у ребенок?
Мышечная слабость начинается у детей раннего возраста. Это влияет на бедра и бедра до распространяется на руки и остальные части тела. Первые признаки и симптомы МДД у дошкольники могут включать:
- Проблемы с бегом, прыжками и подъемом по лестнице
- Использование рук для вставания из положения сидя или на корточках.
 Это движение называется Gower’s
подписать.
Это движение называется Gower’s
подписать. - Увеличенные телята
- Переваливание
- Боль в ногах
- Проблемы с обучением
По мере ухудшения состояния МДД может привести к:
- Сломанные кости при падении
- Большая потребность в инвалидной коляске
- Искривление позвоночника (сколиоз)
- Тугоподвижность суставов, которые не могут двигаться (контрактуры)
- Усталость (усталость) и слабость
- Одышка или другие проблемы с дыханием
- Нерегулярное сердцебиение или другие проблемы с сердцем
Как диагностируется мышечная дистрофия Дюшенна у ребенка?
Лечащий врач вашего ребенка
соберет полную историю болезни и спросит о текущих симптомах и прошлом здоровье
условия. Он или она спросит о связанных условиях в семье. Он или она обычно
проводит медицинский осмотр и лабораторные анализы. Вашему ребенку могут потребоваться тесты, которые включают:
Он или она спросит о связанных условиях в семье. Он или она обычно
проводит медицинский осмотр и лабораторные анализы. Вашему ребенку могут потребоваться тесты, которые включают:
- Анализы крови на мышечные ферменты, такие как креатинкиназа
- Анализы крови ДНК на изменения дистрофина
- Анализ крови на дистрофин, анализ крови на наличие дистрофина
- Электромиография для измерения электрической активности мышц
- МРТ или УЗИ, чтобы посмотреть на мышцы
- Биопсия мышц для изучения мышечных клеток или подтверждения диагноза
Ваш ребенок может сначала увидеть свою
основного поставщика медицинских услуг, а затем пройти диагностику у невролога.У некоторых неврологов
специальная подготовка для лечения нервных и мышечных заболеваний, таких как МДД. Ваш ребенок также может
нуждаются в помощи других поставщиков, таких как кардиологи, пульмонологи и физиотерапевты. терапевты.
терапевты.
Как лечится мышечная дистрофия Дюшенна у ребенка?
МДД неизлечима, но многие поддерживающие методы лечения могут помочь справиться с этим заболеванием. Немного возможные методы лечения детей с МДД включают:
- Стероидные препараты.Это может помочь замедлить потерю мышц.
- Лекарства для сердца. Они могут помочь в лечении кардиомиопатии.
- Кардиостимуляторы или другие сердечные устройства. Это может помочь сохранить сердцебиение регулярным.
- Дыхательные аппараты. Это может помочь вашему ребенок получает достаточно воздуха. Многие люди с МДД спят с маской дыхательного аппарата в ночь. Вашему ребенку также может понадобиться устройство для трахеостомии.
- Упражнения на диапазон движений.Эти могут
помочь вашему ребенку оставаться гибким и ограничить контрактуры суставов.
 Легкие упражнения
как водные упражнения могут быть безопасными. Медицинская бригада вашего ребенка может помочь разработать безопасный
программа упражнений для вашего ребенка.
Легкие упражнения
как водные упражнения могут быть безопасными. Медицинская бригада вашего ребенка может помочь разработать безопасный
программа упражнений для вашего ребенка. - Хирургия может облегчить контрактуры или выпрямить искривленный позвоночник. Но дети с МДД есть дополнительные риски при анестезии.
Достижения в области ухода увеличили продолжительность жизни людей с МДД.Исследователи работает над созданием новых лекарств.
Какие возможны осложнения мышечной дистрофии Дюшенна в ребенке?
В дополнение к мышечной слабости во всем теле, МДД может вызвать серьезные проблемы для сердце и легкие. Вашему ребенку могут понадобиться эти тесты:
- Дыхательные тесты
- Эхокардиограммы, чтобы увидеть, насколько хорошо работает сердце вашего ребенка
- Электрокардиограммы для проверки сердечного ритма
- Исследования глотания для выявления проблем, влияющих на прием пищи
- Рентген для выявления сколиоза
- Сканирование костей для наблюдения за здоровьем костей
Можно ли предотвратить мышечную дистрофию Дюшенна у ребенка?
Поскольку МДД является генетическим заболеванием, вы мало что можете сделать для его предотвращения. Но если DMD работает в
членов вашей семьи, вы можете поговорить с консультантом-генетиком и сдать анализы.
до рождения детей. Если у вас или вашего партнера есть изменение DMD, вы можете решить
проверьте свои оплодотворенные яйцеклетки и имплантируйте только те из них, у которых нет МДД. Если вы или ваш
партнер недавно забеременела, вы также можете проверить жидкость вне плода
чтобы увидеть, есть ли у плода МДД.
Но если DMD работает в
членов вашей семьи, вы можете поговорить с консультантом-генетиком и сдать анализы.
до рождения детей. Если у вас или вашего партнера есть изменение DMD, вы можете решить
проверьте свои оплодотворенные яйцеклетки и имплантируйте только те из них, у которых нет МДД. Если вы или ваш
партнер недавно забеременела, вы также можете проверить жидкость вне плода
чтобы увидеть, есть ли у плода МДД.
Как я могу помочь моему ребенку выжить с мышечной болезнью Дюшенна? дистрофия?
Сотрудничайте со службой здравоохранения вашего ребенка
поставщика медицинских услуг и его или ее медицинской бригады.Вашему ребенку могут понадобиться медицинские работники, которые
может помочь при нервно-мышечных, ортопедических, респираторных и сердечных проблемах МДД.
Ваша семья может получить помощь от службы социальной и психиатрической поддержки.
Физиотерапевты и эрготерапевты могут помочь вашему ребенку сохранить его или ее независимость и подвижность по мере ухудшения состояния.
Пока ваш ребенок еще может ходить, некоторые полезные методы лечения включают:
- Диапазон движений голеностопного, тазобедренного и коленного суставов для сохранения подвижности
- Ортезы на голень и кисти для предотвращения контрактур
- Легкая ручная инвалидная коляска для дальних поездок
Если ваш ребенок постоянно пользуется инвалидной коляской, вам также может помочь следующее:
- Объем движений в плечевом, локтевом, лучезапястном суставах и суставах пальцев, в дополнение к суставам ног
- Инвалидная коляска с электроприводом
- Механический подъемник
- Кровати со специальным приводом
Вы и члены вашей семьи можете получить дополнительную информацию о состоянии вашего ребенка
в Ассоциации мышечной дистрофии.
Основные положения о мышечной дистрофии Дюшенна у детей
- МДД — это генетическое заболевание мальчиков раннего возраста, вызывающее мышечную слабость во всем тело.
- МДД вызывается дефектом гена, отвечающего за выработку дистрофина. это белок который играет ключевую роль в защите мышечных волокон.
- Симптомы включают мышечную слабость. Вы можете заметить, что у вашего ребенка проблемы бег, прыжки или подъем по лестнице.
- Медицинская бригада может помочь вашему ребенку справиться с различными аспектами МДД.
Следующие шаги
Советы, которые помогут вам получить максимальную отдачу от посещения врача вашего ребенка:
- Знайте причину визита и то, что вы хотите, чтобы произошло.
- Перед посещением запишите вопросы, на которые вы хотите получить ответы.

- При посещении запишите название нового диагноза и любые новые лекарства, лечения или анализов.Также запишите все новые инструкции, которые дает вам ваш врач. Твой ребенок.
- Знайте, почему назначено новое лекарство или лечение и как оно поможет вашему ребенку. Также знайте, какие бывают побочные эффекты.
- Спросите, можно ли лечить состояние вашего ребенка другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если ваш ребенок не примет лекарство или не пройдет тест или процедура.
- Если вашему ребенку назначен повторный прием, запишите дату, время и цель. за этот визит.
- Знайте, как вы можете связаться с врачом вашего ребенка в нерабочее время. Это важно
если ваш ребенок заболел и у вас есть вопросы или вам нужен совет.

Дисфункция колбочек у пациентов с поздней дистрофией колбочек и возрастной дегенерацией желтого пятна | Заболевания желтого пятна | JAMA Офтальмология
Цели Определить клинические и функциональные находки у пациентов с поздней колбочковой дистрофией (LOCD) (после 50 лет), что встречается редко; и сравнить их с таковыми у пациентов с возрастной дегенерацией желтого пятна (ВМД).
Методы Одиннадцать пациентов с LOCD прошли офтальмологическое и электроретинографическое обследование. Электроретинограммы полного поля записывали в соответствии со стандартом Международного общества клинической электрофизиологии зрения. Результаты сравнивали с результатами группы из 20 пациентов с ВМД и группы из 23 возрастных контрольных субъектов.
Результаты Не было различий между пациентами с LOCD и AMD в отношении тяжести потери остроты зрения, дефицита цветового зрения и дефектов центрального поля зрения. Изменения заднего полюса присутствовали у всех пациентов с LOCD и AMD. В отличие от группы AMD, у всех пациентов с LOCD не было друз, а у 6 из 11 пациентов с LOCD наблюдалась бледность височного диска зрительного нерва. Электроретинограмма выявила основные функциональные различия с выраженным снижением колбочек-опосредованных ответов и умеренным снижением палочково-опосредованных ответов у пациентов с LOCD. Неожиданно оказалось, что у пациентов с ВМД амплитуда мерцания с частотой 30 Гц была снижена по сравнению со здоровыми людьми из контрольной группы.
Изменения заднего полюса присутствовали у всех пациентов с LOCD и AMD. В отличие от группы AMD, у всех пациентов с LOCD не было друз, а у 6 из 11 пациентов с LOCD наблюдалась бледность височного диска зрительного нерва. Электроретинограмма выявила основные функциональные различия с выраженным снижением колбочек-опосредованных ответов и умеренным снижением палочково-опосредованных ответов у пациентов с LOCD. Неожиданно оказалось, что у пациентов с ВМД амплитуда мерцания с частотой 30 Гц была снижена по сравнению со здоровыми людьми из контрольной группы.
Выводы Колбочковая дистрофия с поздним началом и ВМД имеют несколько общих черт.У пожилых пациентов с прогрессирующей потерей зрения и без друз следует рассматривать LOCD. Результаты электроретинографии у небольшой группы пациентов с ВМД указывают на генерализованную дисфункцию колбочек.
ПРОГРЕССИРУЮЩИЕ колбочковые дистрофии представляют собой гетерогенную группу наследственных дистрофий сетчатки, характеризующихся прежде всего нарушением функции колбочек сетчатки. Характерными симптомами являются светобоязнь, прогрессирующая потеря зрения, дефекты цветового зрения вплоть до монохроматизма, относительные или абсолютные центральные скотомы. 1 -5 Офтальмоскопические данные варьируются от нормальных до неспецифических нарушений пигментации сетчатки и до макулопатии в виде «бычьего глаза». 1 ,3 Клинические признаки колбочковой дистрофии могут развиваться прогрессивно в течение всех десятилетий жизни. 4 У большинства пациентов первые симптомы возникают между первым и третьим десятилетием жизни. Более позднее начало, в четвертой или даже после шестой декады, встречается редко. 1 ,5 ,6 Таким образом, диагноз колбочковой дистрофии у пожилых пациентов часто не ставится.Кроме того, возрастные морфологические изменения, такие как нарушения пигментации и друзы, могут маскировать правильный диагноз. У пожилых пациентов наблюдается повышенная частота других возрастных заболеваний, таких как возрастная макулярная дегенерация (ВМД), проявляющаяся сходными признаками.
Характерными симптомами являются светобоязнь, прогрессирующая потеря зрения, дефекты цветового зрения вплоть до монохроматизма, относительные или абсолютные центральные скотомы. 1 -5 Офтальмоскопические данные варьируются от нормальных до неспецифических нарушений пигментации сетчатки и до макулопатии в виде «бычьего глаза». 1 ,3 Клинические признаки колбочковой дистрофии могут развиваться прогрессивно в течение всех десятилетий жизни. 4 У большинства пациентов первые симптомы возникают между первым и третьим десятилетием жизни. Более позднее начало, в четвертой или даже после шестой декады, встречается редко. 1 ,5 ,6 Таким образом, диагноз колбочковой дистрофии у пожилых пациентов часто не ставится.Кроме того, возрастные морфологические изменения, такие как нарушения пигментации и друзы, могут маскировать правильный диагноз. У пожилых пациентов наблюдается повышенная частота других возрастных заболеваний, таких как возрастная макулярная дегенерация (ВМД), проявляющаяся сходными признаками. Паранеопластическая ретинопатия 7 и интоксикация наперстянкой 8 должны рассматриваться как другие возможные дифференциальные диагнозы.
Паранеопластическая ретинопатия 7 и интоксикация наперстянкой 8 должны рассматриваться как другие возможные дифференциальные диагнозы.
В этом исследовании изучаются клинические и электрофизиологические особенности у пациентов с началом колбочковой дистрофии после 50 лет (позднее начало колбочковой дистрофии [LOCD]).Наиболее частым заболеванием желтого пятна у пожилых пациентов является AMD, и некоторые пациенты с LOCD были направлены с диагнозом AMD. Поэтому группу LOCD сравнивали с группой пациентов с AMD.
Для этого исследования из 160 пациентов с колбочковой дистрофией были отобраны 11 пациентов с первыми признаками колбочковой дистрофии в возрасте старше 50 лет. 5 Пациенты, которым не удалось точно определить начало симптомов, не были включены в это исследование.Их средний возраст ± стандартное отклонение на момент исследования составлял 65 ± 10 (диапазон 52–80) лет. Семь пациентов были женщинами и 4 мужчинами.
Пациентов с LOCD сравнивали с группой пациентов с AMD и здоровой контрольной группой; минимальный возраст для всех групп составлял 50 лет. Пациенты с генерализованными заболеваниями, которые могли поражать глаза (сахарный диабет или метастатический рак), были исключены из группы ВМД или из контрольной группы. Группа ВМД состояла из 20 пациентов (9 женщин и 11 мужчин), а их средний возраст ± стандартное отклонение составил 70 ± 9 (диапазон 54–89) лет.У всех пациентов с ВМД были друзы. У некоторых пациентов была небольшая (<1 диаметра диска) хориоидальная неоваскуляризация (CNV) без значительного количества субретинальной жидкости или кровоизлияний, но у большинства были нарушения пигментного эпителия или атрофическая дегенерация сетчатки.
В контрольную группу вошли только лица без известных глазных заболеваний или лица, которым не проводилась офтальмологическая хирургия на исследуемом глазу; их средний возраст ± стандартное отклонение составил 62 ± 7 (диапазон 51–73) лет. Требовалась острота зрения 20/20, а аномалии рефракции были ограничены до ±2 диоптрий (D).Кроме того, следующие результаты должны были быть нормальными: биомикроскопия переднего и заднего сегментов, поле зрения Гольдмана, глазное давление и цветовое зрение.
Требовалась острота зрения 20/20, а аномалии рефракции были ограничены до ±2 диоптрий (D).Кроме того, следующие результаты должны были быть нормальными: биомикроскопия переднего и заднего сегментов, поле зрения Гольдмана, глазное давление и цветовое зрение.
Обследования в этом исследовании проводились после получения информированного согласия в соответствии с Хельсинкской декларацией. Всем пациентам и всем контрольным пациентам было проведено подробное офтальмологическое обследование, включающее определение остроты зрения и рефракции, измерение внутриглазного давления, исследование переднего отрезка глаза с помощью щелевой лампы и стереоскопическое исследование сетчатки.Цветовое зрение оценивали с помощью теста Лантони денасыщенной панели D15 (Luneau Ophtalmologie, Шартр, Франция). Поле зрения определяли кинетическим периметром Гольдмана.
Полнопольные электроретинограммы (ЭРГ) были записаны для всех пациентов и контрольной группы в соответствии со стандартом Международного общества клинической электрофизиологии зрения, 9 , как подробно сообщалось ранее. 10 Для записи ЭРГ использовалось коммерческое записывающее устройство (Nicolet Spirit; Nicolet, Мэдисон, Висконсин) в сочетании со стимулятором полного поля (Nicolet Ganzfeld; Nicolet).Регистрацию проводили без усреднения, с использованием электрода для контактных линз Jet и максимально расширенных зрачков (расширенных с помощью 2,5% фенилэфрина гидрохлорида и 0,5% тропикамида). Длительность стимула составляла 0,1 миллисекунды. После 30-минутной темновой адаптации для записи в темноте использовали 4 стимула с возрастающей интенсивностью (максимальная интенсивность света, 10 кандел [кд]·с/м 2 ). Светоадаптированные записи были выполнены через 10 минут световой адаптации в присутствии белого фонового света (30 кд/м 2 ) с белыми стимулами максимальной интенсивности света.Для всех стимулов с одиночной вспышкой были измерены амплитуды и неявные времена волн a и b, а также амплитуда и неявное время отклика на мерцание 30 Гц. Статистические данные были проанализированы с помощью суммы рангов Уилкоксона/непараметрического критерия Крускала-Уоллиса, и данные считались значимыми при P <0,05.
10 Для записи ЭРГ использовалось коммерческое записывающее устройство (Nicolet Spirit; Nicolet, Мэдисон, Висконсин) в сочетании со стимулятором полного поля (Nicolet Ganzfeld; Nicolet).Регистрацию проводили без усреднения, с использованием электрода для контактных линз Jet и максимально расширенных зрачков (расширенных с помощью 2,5% фенилэфрина гидрохлорида и 0,5% тропикамида). Длительность стимула составляла 0,1 миллисекунды. После 30-минутной темновой адаптации для записи в темноте использовали 4 стимула с возрастающей интенсивностью (максимальная интенсивность света, 10 кандел [кд]·с/м 2 ). Светоадаптированные записи были выполнены через 10 минут световой адаптации в присутствии белого фонового света (30 кд/м 2 ) с белыми стимулами максимальной интенсивности света.Для всех стимулов с одиночной вспышкой были измерены амплитуды и неявные времена волн a и b, а также амплитуда и неявное время отклика на мерцание 30 Гц. Статистические данные были проанализированы с помощью суммы рангов Уилкоксона/непараметрического критерия Крускала-Уоллиса, и данные считались значимыми при P <0,05.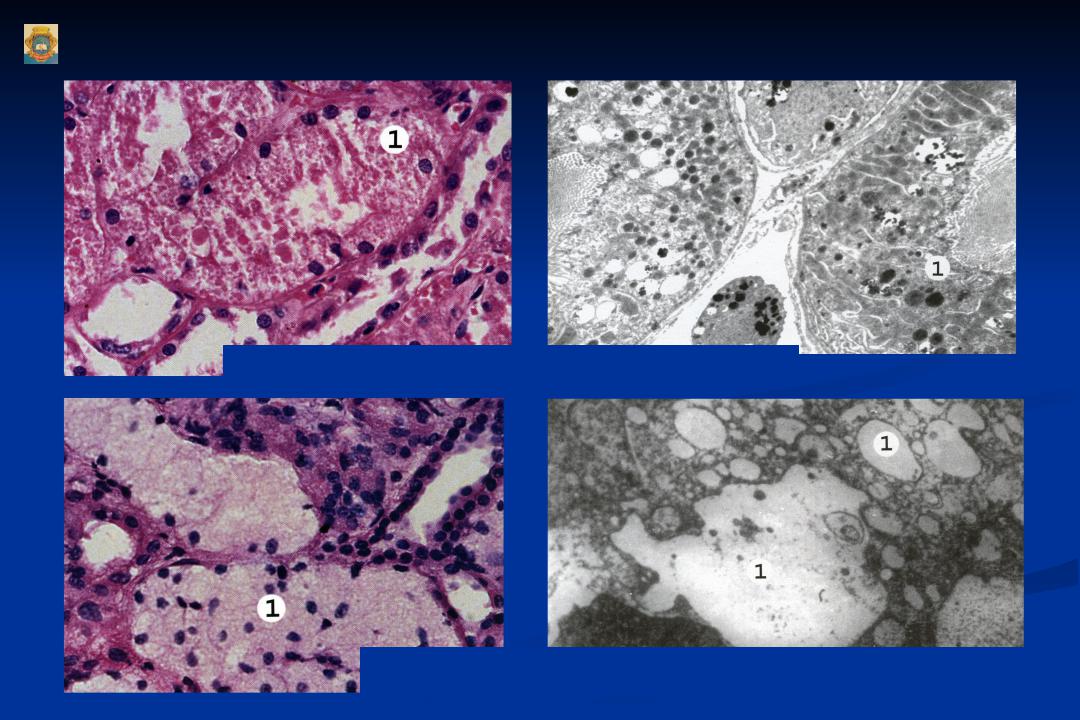
Пациенты в группе LOCD были исследованы в среднем возрасте ± SD 65 ± 10 (диапазон 52–80) лет, но начало симптомов было отмечено в среднем возрасте ± SD 56 ± 6 (диапазон 50–80 лет). 66) лет больными.В начале заболевания трудности с чтением и потеря зрения были наиболее важными начальными признаками. Хотя почти все пациенты описывали дефекты цветового зрения, лишь немногие находили их неприятными и сообщали о них без вопросов. Три пациента с LOCD спонтанно жаловались на светобоязнь.
Первое исследование группы ВМД проводилось при среднем возрасте пациентов ± SD 70 ± 9 (диапазон 54–89) лет, а начальные симптомы возникали при среднем возрасте ± SD 67 ± 11 (диапазон 50–73) лет. годы. Начальными признаками в начале были метаморфопсии и потеря зрения; ни один пациент с ВМД не жаловался спонтанно на светобоязнь или дефекты цветовосприятия.
Передний сегмент был нормальным для возраста у всех пациентов с LOCD и AMD. Изменения заднего полюса присутствовали у большинства пациентов с LOCD и у всех пациентов группы AMD. Офтальмоскопические данные были симметричны для обоих глаз, за исключением CNV у пациентов с AMD. У шести пациентов в группе LOCD был бледный диск зрительного нерва по сравнению с отсутствием пациентов в группе AMD. В группе LOCD у одного пациента была макулопатия «бычий глаз», а у других пациентов были обнаружены изменения от нормального внешнего вида глазного дна до незначительных фовеальных изменений (отчетливые участки атрофии пигментного эпителия и хориокапилляров заднего полюса).Друзы встречались у всех пациентов группы ВМД. Атрофия пигментного эпителия присутствовала у 12 пациентов с ВМД, а CNV присутствовала у остальных 8 пациентов с ВМД. Периферия сетчатки была нормальной у всех пациентов с AMD и большинства пациентов с LOCD. У одного пациента с LOCD в средней периферии можно было наблюдать умеренные костные спикулы.
Офтальмоскопические данные были симметричны для обоих глаз, за исключением CNV у пациентов с AMD. У шести пациентов в группе LOCD был бледный диск зрительного нерва по сравнению с отсутствием пациентов в группе AMD. В группе LOCD у одного пациента была макулопатия «бычий глаз», а у других пациентов были обнаружены изменения от нормального внешнего вида глазного дна до незначительных фовеальных изменений (отчетливые участки атрофии пигментного эпителия и хориокапилляров заднего полюса).Друзы встречались у всех пациентов группы ВМД. Атрофия пигментного эпителия присутствовала у 12 пациентов с ВМД, а CNV присутствовала у остальных 8 пациентов с ВМД. Периферия сетчатки была нормальной у всех пациентов с AMD и большинства пациентов с LOCD. У одного пациента с LOCD в средней периферии можно было наблюдать умеренные костные спикулы.
Острота зрения в группах LOCD и AMD была снижена в среднем до 20/63 на глазу с более низкой остротой зрения при первом исследовании (рис. 1).Все пациенты обеих групп отмечали прогрессирующее снижение остроты зрения.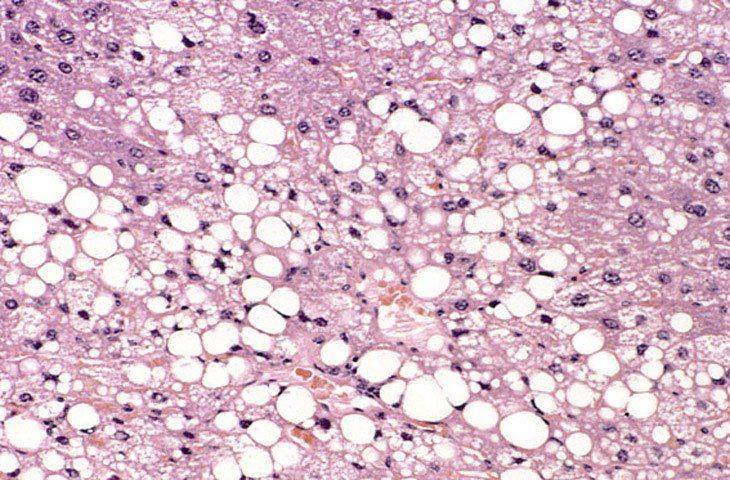 История прогрессирующей потери зрения характеризовалась переменным течением, особенно в группе LOCD. В то время как некоторые пациенты сообщали о заметном снижении остроты зрения в течение нескольких месяцев, у других прогрессирование было намного медленнее. У большинства пациентов с ВМД наблюдалось постепенное снижение зрения от нескольких месяцев до нескольких лет. Пациенты с LOCD имели среднюю коррекцию рефракции ± SD 0,25 ± 3,30 (диапазон от -5,0 до 6,0) дптр. У 6 пациентов был астигматизм.У одного пациента была артифакия обоих глаз. Среднее ± стандартное отклонение рефракционной коррекции в группе ВМД составило 0,68 ± 2,60 (диапазон от -6,5 до 5,0) дптр. Двенадцать пациентов страдали дальнозоркостью, 4 — миопией и 4 — эмметропией. Астигматизм имел место у 14 пациентов.
История прогрессирующей потери зрения характеризовалась переменным течением, особенно в группе LOCD. В то время как некоторые пациенты сообщали о заметном снижении остроты зрения в течение нескольких месяцев, у других прогрессирование было намного медленнее. У большинства пациентов с ВМД наблюдалось постепенное снижение зрения от нескольких месяцев до нескольких лет. Пациенты с LOCD имели среднюю коррекцию рефракции ± SD 0,25 ± 3,30 (диапазон от -5,0 до 6,0) дптр. У 6 пациентов был астигматизм.У одного пациента была артифакия обоих глаз. Среднее ± стандартное отклонение рефракционной коррекции в группе ВМД составило 0,68 ± 2,60 (диапазон от -6,5 до 5,0) дптр. Двенадцать пациентов страдали дальнозоркостью, 4 — миопией и 4 — эмметропией. Астигматизм имел место у 14 пациентов.
Ни у одного из пациентов с LOCD не было нормального цветового зрения. Корреляции между остротой зрения и дефектами цветового зрения не выявлено. Только у одного пациента с ВМД было нормальное цветовое зрение. В группе ВМД дефекты цветового зрения были более серьезными с повышенным снижением остроты зрения.Результаты тестирования поля зрения у пациентов с LOCD включали нормальные данные, умеренное концентрическое сужение наружных изоптр, парацентральные скотомы и центральные скотомы. Пациенты с центральной скотомой имели заметно худшую остроту зрения по сравнению с пациентами с другими ограничениями поля зрения. С другой стороны, центральная скотома не могла быть обнаружена у всех пациентов с LOCD с резко сниженной остротой зрения. В группе ВМД сужения наружных изоптр не обнаружено; однако почти у всех пациентов выявлялась центральная или парацентральная скотома.Все пациенты с ВМД с центральной скотомой имели сильно сниженную остроту зрения.
В группе ВМД дефекты цветового зрения были более серьезными с повышенным снижением остроты зрения.Результаты тестирования поля зрения у пациентов с LOCD включали нормальные данные, умеренное концентрическое сужение наружных изоптр, парацентральные скотомы и центральные скотомы. Пациенты с центральной скотомой имели заметно худшую остроту зрения по сравнению с пациентами с другими ограничениями поля зрения. С другой стороны, центральная скотома не могла быть обнаружена у всех пациентов с LOCD с резко сниженной остротой зрения. В группе ВМД сужения наружных изоптр не обнаружено; однако почти у всех пациентов выявлялась центральная или парацентральная скотома.Все пациенты с ВМД с центральной скотомой имели сильно сниженную остроту зрения.
Что касается других тестов, то при оценке полнопольной ЭРГ внутриглазные различия у каждого пациента оставались в пределах нормы. Поэтому для каждого пациента в дальнейшие оценки включался только глаз с более низкими амплитудами. На рисунке 2 показаны типичные записи ЭРГ для всех групп; В таблице 1 представлен обзор всех результатов ERG. У двух пациентов с LOCD не было измеримых потенциалов при любых настройках стимула, тогда как у всех пациентов с AMD были измеримые потенциалы при всех условиях записи.
У двух пациентов с LOCD не было измеримых потенциалов при любых настройках стимула, тогда как у всех пациентов с AMD были измеримые потенциалы при всех условиях записи.
После адаптации к темноте у пациентов с LOCD значительно уменьшились амплитуды а- и b-волн палочковидного ответа и смешанного колбочково-палочкового ответа. Неявное время b-волны для смешанного ответа колбочек-палочек при максимальной интенсивности стимула было единственной переменной, которая находилась в пределах нормального диапазона в группе LOCD. У пациентов с ВМД были нормальные амплитуда зубца b и имплицитное время. Амплитуда а-волны, однако, была снижена для реакции палочек и смешанной реакции колбочек-палочек, что может свидетельствовать о легкой дисфункции фоторецепторов.
После адаптации к свету амплитуды a- и b-волн в реакции конуса на одиночную вспышку были значительно снижены у пациентов с LOCD, а имплицитное время b-волны было заметно увеличено. Напротив, у пациентов с ВМД имплицитное время зубца b находилось в пределах нормы. Амплитуда зубца b была несколько ниже по сравнению с контрольной группой, но разница не была достоверной. Только амплитуды а-волны были значительно снижены у пациентов с ВМД.
Амплитуда зубца b была несколько ниже по сравнению с контрольной группой, но разница не была достоверной. Только амплитуды а-волны были значительно снижены у пациентов с ВМД.
Реакция на мерцание 30 Гц была значительно снижена у пациентов с LOCD.Неявное время мерцания 30 Гц было значительно увеличено, хотя это время было немного меньше по сравнению с ответом на одиночную вспышку. Неожиданно у пациентов с ВМД произошло значительное снижение мерцания с частотой 30 Гц по сравнению с контрольной группой; это была самая большая разница между всеми переменными, сравнивающими пациентов с ВМД с контрольной группой. В отличие от пациентов с LOCD, не было существенной разницы в неявном времени отклика мерцания 30 Гц между контрольной группой и пациентами с AMD.
Из большой группы пациентов с колбочковой и колбочково-стержневой дистрофиями были отобраны 11 человек, у которых впервые стало известно о прогрессирующей потере бинокулярной остроты зрения после 50 лет. Фотофобия была дополнительным субъективным симптомом у нескольких из этих 11 пациентов. При офтальмоскопическом исследовании выявляли либо нормальное глазное дно, либо изменения различной степени выраженности. Функциональная оценка выявила снижение остроты зрения, дефицит цветового зрения и дефекты поля зрения.Реакции колбочек ЭРГ полного поля после адаптации к свету, особенно реакции мерцания 30 Гц, были более уменьшены и задержаны по сравнению с реакциями, адаптированными к темноте. Эти результаты ЭРГ указывают на преобладающую дисфункцию пути колбочек и менее выраженную дисфункцию пути палочек. Таким образом, морфологические и функциональные характеристики и вариабельность клинического течения у этих 11 пациентов сопоставимы с данными, полученными в большей группе пациентов с прогрессирующей дисфункцией колбочек, и с характеристиками, описанными для дистрофии колбочек в литературе. 1 ,5 Мы выбрали LOCD для описания этой подгруппы, потому что только возраст отделял эту группу от более молодых пациентов с колбочковой дистрофией.
Фотофобия была дополнительным субъективным симптомом у нескольких из этих 11 пациентов. При офтальмоскопическом исследовании выявляли либо нормальное глазное дно, либо изменения различной степени выраженности. Функциональная оценка выявила снижение остроты зрения, дефицит цветового зрения и дефекты поля зрения.Реакции колбочек ЭРГ полного поля после адаптации к свету, особенно реакции мерцания 30 Гц, были более уменьшены и задержаны по сравнению с реакциями, адаптированными к темноте. Эти результаты ЭРГ указывают на преобладающую дисфункцию пути колбочек и менее выраженную дисфункцию пути палочек. Таким образом, морфологические и функциональные характеристики и вариабельность клинического течения у этих 11 пациентов сопоставимы с данными, полученными в большей группе пациентов с прогрессирующей дисфункцией колбочек, и с характеристиками, описанными для дистрофии колбочек в литературе. 1 ,5 Мы выбрали LOCD для описания этой подгруппы, потому что только возраст отделял эту группу от более молодых пациентов с колбочковой дистрофией.
Имеется лишь несколько сообщений о пациентах с LOCD. Rowe et al 6 описали 6 случаев, а Krill et al 1 описали 4 случая этого расстройства. В настоящем исследовании семейный анамнез предполагал наследственное заболевание только у одного пациента с LOCD. Rowe и соавт. описали 1 из 6 пациентов с LOCD с возможным семейным наследованием.Было показано, что у более молодых пациентов дистрофия колбочек представляет собой гетерогенную группу заболеваний с аутосомно-доминантным, аутосомно-рецессивным или Х-сцепленным наследованием. 1 ,2,4 ,5,11 -13 Сообщалось, что мутации в различных генах связаны с прогрессирующей дистрофией колбочек, и были обнаружены дополнительные генные локусы. 14 Следует ожидать, что LOCD также обобщает гетерогенную группу генетических дефектов. Молекулярно-генетические и семейные исследования будут необходимы для расширения нашего понимания патофизиологических особенностей; однако их трудно проводить при заболеваниях с поздним началом и редко возникающих.
У пациентов с LOCD и при колбочковой дистрофии в других возрастных группах внешний вид глазного дна при офтальмоскопии сам по себе не может установить диагноз. 5 ,15 У большинства пациентов были неспецифические дефекты пигментного эпителия, у одного была макулопатия типа «бычий глаз», у одного — периферические костные спикулы. Два пациента имели нормальные морфологические данные глазного дна. Rowe et al. 6 описали 2 пациентов с LOCD с нормальным задним полюсом; у остальных пациентов выявлены легкие изменения пигментного эпителия.Вариабельность морфологических изменений сравнима с находками у более молодых пациентов с колбочковой дистрофией. 1 ,4 ,5 Друзы не наблюдались ни у одного пациента с LOCD.
У пожилых людей важно исключить возможный дифференциальный диагноз, который может встречаться так же часто, как LOCD. Приобретенные колбочковые дистрофии встречаются редко и могут возникать в связи с приемом препаратов 8 или как паранеопластические ретинопатии. 7 Поэтому обязательна тщательная дифференциальная диагностика, поскольку дисфункция сетчатки может быть ранним признаком рака, а отмена препарата может уменьшить симптомы и остановить прогрессирование.В настоящем исследовании история болезни была отрицательной в отношении потенциально ретинотоксических препаратов, рака и вторичных причин дисфункции сетчатки (инфекция или травма). Невозможно исключить влияние невыявленной сосудистой дисфункции на функцию сетчатки; однако у пациентов с LOCD не было обнаружено сосудистых аномалий, и пациенты не сообщали о тяжелых генерализованных сосудистых заболеваниях.
7 Поэтому обязательна тщательная дифференциальная диагностика, поскольку дисфункция сетчатки может быть ранним признаком рака, а отмена препарата может уменьшить симптомы и остановить прогрессирование.В настоящем исследовании история болезни была отрицательной в отношении потенциально ретинотоксических препаратов, рака и вторичных причин дисфункции сетчатки (инфекция или травма). Невозможно исключить влияние невыявленной сосудистой дисфункции на функцию сетчатки; однако у пациентов с LOCD не было обнаружено сосудистых аномалий, и пациенты не сообщали о тяжелых генерализованных сосудистых заболеваниях.
Однако наиболее частыми дифференциальными диагнозами в этой возрастной группе являются возрастная макулопатия и ВМД.Пациенты с AMD были включены в это исследование, потому что у них есть несколько общих симптомов с пациентами с LOCD. У пациентов с AMD, отобранных для этого исследования, были друзы, географическая атрофия пигментного эпителия или небольшие CNV с ограниченным окружающим экссудатом. Пациенты с тяжелыми дискообразными рубцами, субретинальными кровоизлияниями, выраженным экссудативным заболеванием или прогрессирующей географической атрофией не были включены; из-за их клинических признаков маловероятно, что они будут неправильно диагностированы пациентами с LOCD, а вторичные изменения сетчатки будут влиять на тестирование функции сетчатки.
Пациенты с тяжелыми дискообразными рубцами, субретинальными кровоизлияниями, выраженным экссудативным заболеванием или прогрессирующей географической атрофией не были включены; из-за их клинических признаков маловероятно, что они будут неправильно диагностированы пациентами с LOCD, а вторичные изменения сетчатки будут влиять на тестирование функции сетчатки.
У пациентов с LOCD и AMD первым признаком заболевания была потеря остроты зрения, отмеченная либо как проблема с чтением, либо во время вождения. Возраст начала был ниже у пациентов с LOCD, но в обеих группах наблюдалась большая вариабельность. Потеря зрения прогрессировала при обоих заболеваниях, и острота зрения снижалась в одинаковой степени. Никаких различий не было обнаружено в отношении ошибки рефракции. Практически у всех пациентов обеих групп имелись неспецифические нарушения цветового зрения. Дефекты центрального поля зрения были обнаружены в обеих группах; однако, как и ожидалось, дефекты периферического поля не были обнаружены в группе AMD. Офтальмоскопическое исследование дало первое указание на то, что существует четкое различие между пациентами с LOCD и AMD. Хотя нарушения пигментации наблюдались у большинства пациентов в обеих группах, друзы встречались только у пациентов с ВМД. Это не может быть исключительным диагностическим критерием, поскольку нельзя исключить, что у некоторых пожилых пациентов с LOCD могут также развиться друзы из-за возрастных изменений пигментного эпителия. Бледность диска зрительного нерва не редкость у пациентов с колбочковой дистрофией и наблюдалась у 6 из 11 пациентов с LOCD, но не у всех пациентов с AMD.
Офтальмоскопическое исследование дало первое указание на то, что существует четкое различие между пациентами с LOCD и AMD. Хотя нарушения пигментации наблюдались у большинства пациентов в обеих группах, друзы встречались только у пациентов с ВМД. Это не может быть исключительным диагностическим критерием, поскольку нельзя исключить, что у некоторых пожилых пациентов с LOCD могут также развиться друзы из-за возрастных изменений пигментного эпителия. Бледность диска зрительного нерва не редкость у пациентов с колбочковой дистрофией и наблюдалась у 6 из 11 пациентов с LOCD, но не у всех пациентов с AMD.
Основные функциональные различия между пациентами с LOCD и AMD были продемонстрированы при полнопольной ЭРГ. У пациентов с LOCD имплицитное время b-волны при максимальной интенсивности стимула после адаптации к темноте было единственной переменной в пределах возрастного нормального диапазона. Для всех других переменных ЭРГ амплитуды были заметно снижены, а имплицитные времена были задержаны. В группе ВМД все амплитуды были ниже нормы; однако разница была значимой только для амплитуды а-волны и отклика мерцания на частоте 30 Гц.Не было значительной задержки одиночной вспышки b-волны или мерцания с частотой 30 Гц.
В группе ВМД все амплитуды были ниже нормы; однако разница была значимой только для амплитуды а-волны и отклика мерцания на частоте 30 Гц.Не было значительной задержки одиночной вспышки b-волны или мерцания с частотой 30 Гц.
Результаты ЭРГ с полным полем зрения у пациентов с LOCD определяют их как имеющие форму дистрофии колбочек. Хотя реальное начало болезни остается неизвестным и термин позднее начало , следовательно, зависит от его определения, пациенты в этой серии и пациенты, описанные Rowe et al. 6 и Krill et al. возможный дифференциальный диагноз у пожилых пациентов с прогрессирующей зрительной дисфункцией.Пациентам старше 50 лет с прогрессирующей потерей зрения, с дефицитом цветового зрения и без друз особенно следует проводить детальное ЭРГ-обследование. Несмотря на отсутствие конкретных вариантов лечения, отсутствие LOCD может иметь последствия для пациента в отношении консультирования по поводу прогрессирования, оптимальных средств для слабовидящих и привязанности к другим членам семьи. Однако для нашего понимания патофизиологических процессов, лежащих в основе потери зрения у пожилых пациентов, важно точно определить расстройства, которые могут иметь сходство с ВМД.
Однако для нашего понимания патофизиологических процессов, лежащих в основе потери зрения у пожилых пациентов, важно точно определить расстройства, которые могут иметь сходство с ВМД.
Неожиданным открытием в настоящем исследовании были изменения полнопольной ЭРГ у пациентов с ВМД. Макулярная область небольшая и содержит около 5% колбочек сетчатки. Таким образом, макулярные расстройства обычно сопровождаются нормальными данными ЭРГ полного поля. Фактически, сложность выявления патологических особенностей макулы с помощью полнопольной ЭРГ была основной причиной разработки усовершенствованных методов ЭРГ, таких как паттерн и мультифокальная ЭРГ. Заметное снижение амплитуды 30-герцовых мерцаний у пациентов с ВМД указывает на поражение большей площади сетчатки, чем макулы.Кроме того, разница во времени ответа на мерцание 30 Гц у пациентов с ВМД и LOCD может быть основана на различных патологических особенностях сетчатки.
Предыдущие сообщения об ЭРГ у пациентов с ВМД дали противоречивые результаты. У пациентов с ВМД в некоторых исследованиях не было обнаружено различий в ответах ЭРГ по сравнению со здоровыми людьми из контрольной группы, 16 , в то время как в других наблюдались уменьшенные амплитуды ответов, опосредованных колбочками и палочками, но нормальная реакция мерцания. 17 У пациентов с возрастной макулопатией Falsini et al. 18 сообщили о снижении чувствительности к мерцанию при фокальной регистрации ЭРГ. Аномальная функция фовеальных колбочек была продемонстрирована в парных глазах пациентов с односторонними ХНВ при ВМД. 19 В последнем исследовании неявные времена были задержаны, но снижение амплитуды было небольшим. Эти результаты подтверждаются мультифокальной оценкой ЭРГ ранней стадии ВМД, которая выявила задержку имплицитного времени и снижение амплитуды. 20 По сравнению с частотой ВМД, в это исследование было включено лишь несколько пациентов с ВМД. Таким образом, следует соблюдать осторожность при обобщении результатов ЭРГ в этом исследовании на всех пациентов с ВМД.
У пациентов с ВМД в некоторых исследованиях не было обнаружено различий в ответах ЭРГ по сравнению со здоровыми людьми из контрольной группы, 16 , в то время как в других наблюдались уменьшенные амплитуды ответов, опосредованных колбочками и палочками, но нормальная реакция мерцания. 17 У пациентов с возрастной макулопатией Falsini et al. 18 сообщили о снижении чувствительности к мерцанию при фокальной регистрации ЭРГ. Аномальная функция фовеальных колбочек была продемонстрирована в парных глазах пациентов с односторонними ХНВ при ВМД. 19 В последнем исследовании неявные времена были задержаны, но снижение амплитуды было небольшим. Эти результаты подтверждаются мультифокальной оценкой ЭРГ ранней стадии ВМД, которая выявила задержку имплицитного времени и снижение амплитуды. 20 По сравнению с частотой ВМД, в это исследование было включено лишь несколько пациентов с ВМД. Таким образом, следует соблюдать осторожность при обобщении результатов ЭРГ в этом исследовании на всех пациентов с ВМД. Однако для этих пациентов не использовался какой-либо конкретный критерий отбора: ряд последовательных пациентов с ВМД, которые соответствовали критериям включения, были приглашены для участия в этом исследовании. Противоречивые результаты в литературе и результаты настоящего исследования требуют дальнейшего анализа полнопольной ЭРГ у пациентов с ВМД.
Однако для этих пациентов не использовался какой-либо конкретный критерий отбора: ряд последовательных пациентов с ВМД, которые соответствовали критериям включения, были приглашены для участия в этом исследовании. Противоречивые результаты в литературе и результаты настоящего исследования требуют дальнейшего анализа полнопольной ЭРГ у пациентов с ВМД.
Автор, ответственный за переписку: Ульрих Кельнер, доктор медицинских наук, кафедра офтальмологии, Universitäts-Klinikum Benjamin Franklin, Freie Universität Berlin, Hindenburgdamm 30, 12200 Berlin, Germany (e-mail: [email protected]).
Подано в печать 31 декабря 2002 г.; окончательная редакция получена 20 мая 2003 г.; принято 9 июня 2003 г.
2.Франсуа Джде Рук AVerriest Где Лаэй Джей Джей Кэмби E Прогрессирующая генерализованная дисфункция колбочек. Офтальмология. 1974;169255-284PubMedGoogle ScholarCrossref 3. Kellner
UKleine-Hartlage
ПФорстер
Конусные дистрофии MH: клинические и электрофизиологические данные. Ger J Офтальмол. 1992;1105-109PubMedGoogle Scholar4.Weleber
Рейснер
Дегенерация колбочек («бычий глаз» дистрофии) и дефекты цветового зрения. В: Ньюсом
DAed. Дистрофии и дегенерации сетчатки. Нью-Йорк, NY Raven Press, 1988; 233– 256Google Scholar5.
Kellner
UKleine-Hartlage
ПФорстер
Конусные дистрофии MH: клинические и электрофизиологические данные. Ger J Офтальмол. 1992;1105-109PubMedGoogle Scholar4.Weleber
Рейснер
Дегенерация колбочек («бычий глаз» дистрофии) и дефекты цветового зрения. В: Ньюсом
DAed. Дистрофии и дегенерации сетчатки. Нью-Йорк, NY Raven Press, 1988; 233– 256Google Scholar5.Келлнер U Die Progressen Zapfendystrophien. Штутгарт, Германия Enke1996;Bücherei des Augenarztes Series135
6.Rowe SEТроб JDSивинг PA Идиопатическая дисфункция фоторецепторов вызывает необъяснимую потерю остроты зрения в более позднем взрослом возрасте. Офтальмология. 1990;971632-1637PubMedGoogle ScholarCrossref 7.Cogan Д.Г.Кувабара ТКарри Дж. Катта J Paraneoplastische Retinopathie unter dem klinischen Bild einer Zapfendystrophie mit Achrometopsie. Клин Monatsbl Augenheilkd. 1990;197156-158PubMedGoogle ScholarCrossref 8.Madreperla
С.А.Джонсон
МАКатанани
K Электрофизиологические и электроретинографические данные о дисфункции фоторецепторов как токсическом эффекте дигоксина. Арка Офтальмол. 1994;112807-812PubMedGoogle ScholarCrossref 10.Kellner
Украус
Хейманн
Хелбиг
Х.Борнфельд
НФерстер
MF Электрофизиологическая оценка потери зрения при дистрофии блеска клеток Мюллера. Br J Офтальмол. 1998;82650- 654PubMedGoogle ScholarCrossref 11.Szlyk
JPFishman
ГААлександр
КРПичи
Н.Дерлацкий
DJ Клинические подтипы колбочково-стержневой дистрофии. Арка Офтальмол. 1993;111781- 788PubMedGoogle ScholarCrossref 12.Ripps
Hблагородный
KGGreenstein
VCSiegel
IMCarr
RE Прогрессирующая колбочковая дистрофия. Trans Am Ophthalmol Soc. 1987;8582- 100PubMedGoogle Scholar13.Jacobson
Д.М.Томпсон
Х.С.Бартли
JA X-сцепленная прогрессирующая колбочковая дистрофия: клинические характеристики пораженных мужчин и женщин-носителей. Офтальмология. 1989;96885-895PubMedGoogle ScholarCrossref 15.
Клин Monatsbl Augenheilkd. 1990;197156-158PubMedGoogle ScholarCrossref 8.Madreperla
С.А.Джонсон
МАКатанани
K Электрофизиологические и электроретинографические данные о дисфункции фоторецепторов как токсическом эффекте дигоксина. Арка Офтальмол. 1994;112807-812PubMedGoogle ScholarCrossref 10.Kellner
Украус
Хейманн
Хелбиг
Х.Борнфельд
НФерстер
MF Электрофизиологическая оценка потери зрения при дистрофии блеска клеток Мюллера. Br J Офтальмол. 1998;82650- 654PubMedGoogle ScholarCrossref 11.Szlyk
JPFishman
ГААлександр
КРПичи
Н.Дерлацкий
DJ Клинические подтипы колбочково-стержневой дистрофии. Арка Офтальмол. 1993;111781- 788PubMedGoogle ScholarCrossref 12.Ripps
Hблагородный
KGGreenstein
VCSiegel
IMCarr
RE Прогрессирующая колбочковая дистрофия. Trans Am Ophthalmol Soc. 1987;8582- 100PubMedGoogle Scholar13.Jacobson
Д.М.Томпсон
Х.С.Бартли
JA X-сцепленная прогрессирующая колбочковая дистрофия: клинические характеристики пораженных мужчин и женщин-носителей. Офтальмология. 1989;96885-895PubMedGoogle ScholarCrossref 15.Kellner ULadewig Генрих C Наследственные дистрофии сетчатки [книга на компакт-диске]. Штутгарт, Германия Тиме2000;
16.Солнечность JSMassof Р.В.Джонсон М.А.Финкельштейн DFine SL Периферическая функция сетчатки при возрастной дегенерации желтого пятна. Арка Офтальмол. 1985;103811-816PubMedGoogle ScholarCrossref 17.Walter Виддер РАЛюк Конигсфельд ПБраннер R Электрофизиологические аномалии при возрастной дегенерации желтого пятна. Graefes Arch Clin Exp Ophthalmol. 1999;237962-968PubMedGoogle ScholarCrossref 18.Falsini BSerrao СФадда А и другие. Фокальные электроретинограммы и внешний вид глазного дна при неэкссудативной возрастной макулодистрофии: количественная связь между морфологией и функцией сетчатки. Graefes Arch Clin Exp Ophthalmol. 1999;237193- 200PubMedGoogle ScholarCrossref 19.Sandberg М.А.Миллер SGaudio AR ЭРГ фовеального конуса в парных глазах пациентов с односторонней неоваскулярной возрастной дегенерацией желтого пятна. Invest Ophthalmol Vis Sci. 1993;343477- 3480PubMedGoogle Scholar20.Li JTso МОЛам TT Уменьшенная амплитуда и задержка латентного периода фовеального ответа мультифокальной электроретинограммы при дегенерации желтого пятна, связанной с ранним возрастом. Br J Офтальмол. 2001;85287- 290PubMedGoogle ScholarCrossref .
 3. Бездік– сөл бөлу қызмет атқарады.Қозғыш ұлпалардың қасиеттері: Қозғыштық– осы үш ұлпаның қозуға қабілеті.Өткізгіштік– ұлпаның серпіністерді тасымалдауы. Мысалы: Жүйке.Жиырылғыштық– ұлпаның тітіркендіргіш әсерінен жиырылуы және босаңсуы.Тітіркендіргіштік– тітіркендіргіш әсеріне ұлпаның жауап беру қасиеті.Лабильділік немесе қызметтік қимыл– ұлпаның қызметтік тұрақсыздығы.Қозғыш ұлпалардың тітіркендіру заңдары. Табалдырық – қозуды тудыра алатын тітіркендіргіштің ең төменгі күші. Егер тітіркендіргіш күші қозу табалдырығынан төмен болса, табалдырықасты деп, ал табалдырықтан асса ол табалдырықтан жоғары күш деп атайды.Тітіркендіргіш қозуды тудыру үшін:1. Жеткілікті түрде күшті (күшке байланысты заң).2. Жеткілікті түрде ұзақ (уақытқа байланысты заң).3. Жеткілікті түрде жылдам (айырмашылыққа байланысты заң) болуы тиіс.Бұл қозғыш ұлпаның үш тітіркендіру заңы болып табылады.
3. Бездік– сөл бөлу қызмет атқарады.Қозғыш ұлпалардың қасиеттері: Қозғыштық– осы үш ұлпаның қозуға қабілеті.Өткізгіштік– ұлпаның серпіністерді тасымалдауы. Мысалы: Жүйке.Жиырылғыштық– ұлпаның тітіркендіргіш әсерінен жиырылуы және босаңсуы.Тітіркендіргіштік– тітіркендіргіш әсеріне ұлпаның жауап беру қасиеті.Лабильділік немесе қызметтік қимыл– ұлпаның қызметтік тұрақсыздығы.Қозғыш ұлпалардың тітіркендіру заңдары. Табалдырық – қозуды тудыра алатын тітіркендіргіштің ең төменгі күші. Егер тітіркендіргіш күші қозу табалдырығынан төмен болса, табалдырықасты деп, ал табалдырықтан асса ол табалдырықтан жоғары күш деп атайды.Тітіркендіргіш қозуды тудыру үшін:1. Жеткілікті түрде күшті (күшке байланысты заң).2. Жеткілікті түрде ұзақ (уақытқа байланысты заң).3. Жеткілікті түрде жылдам (айырмашылыққа байланысты заң) болуы тиіс.Бұл қозғыш ұлпаның үш тітіркендіру заңы болып табылады.
 Қан қызыл түсті,оның құрамы өте күрделі. Қанның түсі эритроцит ішіндегі гемоглобиннің газдармен,басқа да химиялық заттармен реакцияға түсіп, қосындылар құруына байланысты. Артерия қанының ашық қызыл түсі қанда оксигемоглобиннің /гемоглобинмен оттегі қосындысы/ болуына байланысты. Вена қанының күнгірт түсі карбогемоглобиннің /гемоглобинмен көмірқышқылды газдың қосындысы
Қан қызыл түсті,оның құрамы өте күрделі. Қанның түсі эритроцит ішіндегі гемоглобиннің газдармен,басқа да химиялық заттармен реакцияға түсіп, қосындылар құруына байланысты. Артерия қанының ашық қызыл түсі қанда оксигемоглобиннің /гемоглобинмен оттегі қосындысы/ болуына байланысты. Вена қанының күнгірт түсі карбогемоглобиннің /гемоглобинмен көмірқышқылды газдың қосындысы Еріген заттардың иондар саны неғұрлым көп болса, оның осмостық қысымы соғұрлым жоғары болады. Қанның осмостық қысымы оның қату температурасы арқылы анықталады. Қанның белок молекулалары тудыратын осмостық қысымы колоидтық-осмостық қысым деп аталады. Қанның осмос қысымына тең тұз ертіндісі изотониялық ертінді деп аталады. Тұзы аз болса гипотониялық ерітінді ал керісінше жоғары болса гипертониялық ерітінді дейді. Осмостық, онкотикалық қысымдар, тіршілік процестердің барысына тікелей әсер етеді. Жасушалар қалыпты қызмет атқару үшін осмостық қысым тұрақты болуға тиіс. Оның тұрақтылығын күрделі механизмдер қамтамасыз етеді. Солардың бірі қан және тін иондарымен судың ара-қатынасы.
Еріген заттардың иондар саны неғұрлым көп болса, оның осмостық қысымы соғұрлым жоғары болады. Қанның осмостық қысымы оның қату температурасы арқылы анықталады. Қанның белок молекулалары тудыратын осмостық қысымы колоидтық-осмостық қысым деп аталады. Қанның осмос қысымына тең тұз ертіндісі изотониялық ертінді деп аталады. Тұзы аз болса гипотониялық ерітінді ал керісінше жоғары болса гипертониялық ерітінді дейді. Осмостық, онкотикалық қысымдар, тіршілік процестердің барысына тікелей әсер етеді. Жасушалар қалыпты қызмет атқару үшін осмостық қысым тұрақты болуға тиіс. Оның тұрақтылығын күрделі механизмдер қамтамасыз етеді. Солардың бірі қан және тін иондарымен судың ара-қатынасы.
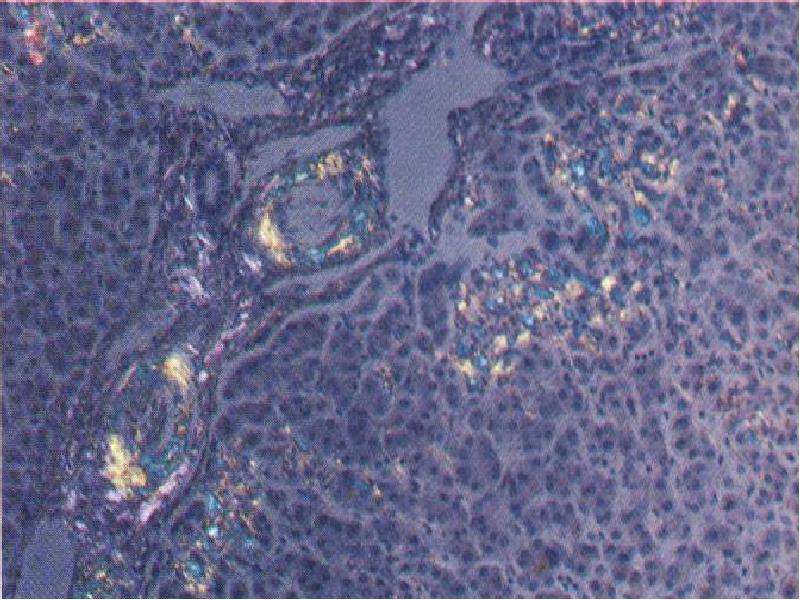
 Это движение называется Gower’s
подписать.
Это движение называется Gower’s
подписать. Легкие упражнения
как водные упражнения могут быть безопасными. Медицинская бригада вашего ребенка может помочь разработать безопасный
программа упражнений для вашего ребенка.
Легкие упражнения
как водные упражнения могут быть безопасными. Медицинская бригада вашего ребенка может помочь разработать безопасный
программа упражнений для вашего ребенка.
