описание, особенности и лечение инфекции
В мире существуют разные заболевания. Но ни одно среди них не вызывало такого ужаса и страха, как чума. Эта болезнь с древних времен не знала пощады. Она унесла миллионы жизней, невзирая на пол, возраст и благосостояние людей. Сегодня болезнь уже не приносит огромного количества смертей и горя. Благодаря чудесам современной медицины чуму удалось превратить в менее опасное заболевание. Однако полностью искоренить недуг не удалось. Чумная палочка (Yersinia pestis), вызывающая болезнь, продолжает существовать в этом мире и поражать людей.
Предок возбудителя
Несколько лет назад специалисты-микробиологи начали проводить исследования с целью изучения эволюции болезнетворных микроорганизмов. Изучалась и палочка чумы. Среди существующих микроорганизмов нашлась генетически похожая на нее бактерия – Yersinia pseudotuberculosis. Это возбудитель псевдотуберкулеза.
Проведенные исследования позволили ученым сделать один вывод. Когда на планете начала зарождаться жизнь, палочки чумы еще не было. Примерно 15–20 тысяч лет назад существовал возбудитель псевдотуберкулеза. Он был потребителем мертвой органики, размножался в экскрементах животных, вокруг захороненных в земле трупов. Некоторые факторы спровоцировали в дальнейшем его эволюцию. Часть возбудителей псевдотуберкулеза трансформировалась в чумную палочку.
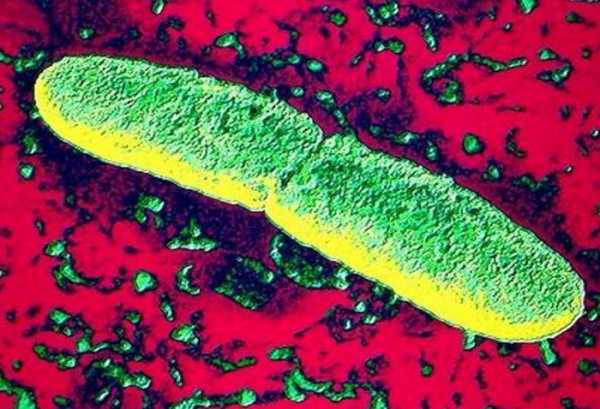
Как произошла эволюция
В тех местах, где возникли первичные очаги чумы, возбудитель псевдотуберкулеза обитал в норах сурков (тарбаганов). Его эволюции, то есть появлению палочки чумы, поспособствовали определенные факторы:
- Наличие на животных блох. Когда сурки впадали в спячку, насекомые скапливались на их мордах. Это было самым благоприятным местом для их обитания. Зимой в норе всегда стояла отрицательная температура. Только рот и нос зверьков были источником теплого воздуха.
- Наличие на слизистой оболочке ротовой полости сурков кровоточащих ранок. Живущие на мордах блохи кусали зверьков в течение всей зимы. В местах прокусов возникали кровотечения. Они не останавливались, потому что животные спали, и температура их тела была низкой. У активных сурков кровотечения быстро бы прекращались.
- Наличие Yersinia pseudotuberculosis на лапках зверьков. Тарбаганы перед спячкой зарывали входы в норы собственным пометом. Из-за этого на их лапках скапливались возбудители псевдотуберкулеза.
Когда зверьки впадали в спячку, они закрывали свои морды лапками. В ранки, образовывающиеся из-за укусов блох, попадали возбудители псевдотуберкулеза. В кровеносной системе активных животных эта бактерия не смогла бы выжить. Ее бы мгновенно убили макрофаги. А вот в спящих сурках для Yersinia pseudotuberculosis не было никаких угроз. Кровь была охлаждена до благоприятных температур, а иммунитет был «отключен». Конечно, подъемы температуры возникали, но редкие и короткие. Они создавали идеальные условия для естественного отбора форм возбудителя. Все эти процессы в итоге привели к зарождению палочки чумы.

Эпидемии болезни в прошлом
Современные ученые не могут сказать, всегда ли чума преследовала людей. По сохранившимся сведениям, известно лишь о трех крупных эпидемиях. Первая из них – так называемая Юстинианова чума – началась примерно в 540-х годах в Египте. За несколько десятков лет чумная палочка опустошила почти все государства Средиземноморья.
Вторая эпидемия, названная «черной смертью», была зафиксирована в середине XIV века. Палочка чумы распространилась из природного очага в пустыне Гоби из-за резкого изменения климата. Возбудитель проник в дальнейшем в Азию, Европу, Северную Африку. Затронутым болезнью оказался и остров Гренландия. Вторая эпидемия очень сильно сказалась на численности населения. Палочка чумы унесла примерно 60 млн жизней.
Третья эпидемия чумы началась в конце XIX века. Вспышку заболевания зафиксировали в Китае. За 6 месяцев в этой стране погибло 174 тысячи человек. Следующая вспышка произошла в Индии. В период с 1896 года по 1918 год от возбудителя опасного заболевания погибло 12,5 млн людей.

Чума и современность
В настоящее время ученые, анализируя последствия эпидемий и изучая важные исторические источники, называют чуму «царицей болезней». При этом она уже не вызывает такого страха и ужаса, ведь больше в мире не фиксировалось крупных вспышек, уносящих миллионы жизней.
По проявлениям чумы в современном периоде ведется статистика. Всемирная организация здравоохранения отмечает, что в период с 2010 года по 2015 год чумой заболело 3248 человек. Летальный исход был в 584 случаях. Это значит, что у 82% людей наступило выздоровление.
Причины ослабления «хватки» возбудителя
Чумная палочка стала менее опасной по нескольким причинам. Во-первых, люди стали соблюдать правила гигиены, чистоту. Для примера можно сравнить современный период со Средневековьем. Несколько веков назад в Западной Европе люди выбрасывали все пищевые отходы и фекалии прямо на улицы. Из-за загрязненности окружающей среды горожане страдали от различных заболеваний, умирали от чумы.
Во-вторых, современные люди живут вдалеке от природных очагов заболевания. С зараженными грызунами и блохами чаще всего сталкиваются только охотники, туристы.
В-третьих, на сегодняшний день медицине известны эффективные способы лечения и профилактики опасного заболевания. Специалистами созданы вакцины, определены препараты, которые способны убить палочку чумы.

А теперь о возбудителе
Если говорить о строении чумной палочки, то Yersinia pestis представляет собой грамотрицательную мелкую бактерию. Она отличается выраженным полиморфизмом. Подтверждают это встречающиеся формы – зернистые, нитевидные, колбовидные, продолговатые и др.
Yersinia pestis является зоонозной бактерией, относящейся к семейству Enterobacteriaceae. Этому микроорганизму родовое название Yersinia было дано в честь французского бактериолога Александра Йерсена. Именно этот специалист в 1894 году во время исследования биологических материалов людей, умерших от опасной болезни, смог выявить возбудителя.
Микроорганизм, способный вызывать эпидемии с высоким уровнем летальности, после обнаружения всегда интересовал микробиологов. Специалисты с момента открытия Yersinia pestis изучали строение бактерии (чумной палочки), ее особенности. Результатом одних исследований, проведенных отечественными учеными, стало составление в 1985 году классификации возбудителя, выделенного на территории СССР и Монголии.
| Подвиды чумной палочки | Район циркуляции |
| Pestis (основной) | Природные очаги Азии, Америки и Африки |
| Altaica (алтайский) | Горный Алтай |
| Caucasica (кавказский) | Закавказское нагорье, Горный Дагестан |
| Hissarica (гиссарский) | Гиссарский хребет |
| Ulegeica (улэгейский) | Северо-восточная Монголия, пустыня Гоби |
Способы проникновения палочки
Возбудитель чумы обитает в организме мелких млекопитающих. В кровеносной системе палочка размножается. Блоха во время укусов зараженных животных становится переносчиком инфекции. В организме насекомого бактерия оседает в зобу, начинает интенсивно размножаться. Из-за увеличения количества палочек зоб закупоривается. Блоха начинает испытывать сильный голод. Для его утоления она скачет с одного хозяина на другого, разнося при этом инфекцию между животными.
В организм человека палочка попадает несколькими способами:
- при укусе инфицированной блохи;
- во время незащищенного контакта с зараженными материалами и инфицированными биологическими жидкостями;
- при вдыхании инфицированных мелких частиц или мелкодисперсных капель (воздушно-капельным путем).

Формы заболевания и симптомы
В зависимости от способов проникновения чумной палочки в организм выделяют 3 формы болезни. Первая из них – бубонная. При такой чуме возбудитель попадает в лимфатическую систему человека после укуса блохи. Из-за болезни лимфатические узлы воспаляются, становятся так называемыми бубонами. На поздних стадиях чумы они превращаются в гнойные раны.
Вторая форма заболевания – септическая. При ней возбудитель попадает прямо в кровеносную систему. Бубоны не образуются. Септическая форма возникает при двух способах проникновения чумной палочки в организм человека – после укуса зараженной блохи, а также после контакта с инфицированными материалами (попадание возбудителя через повреждения кожи).
Третья форма – легочная. Она передается от зараженных больных воздушно-капельным путем. Легочная форма чумы считается самой опасной. Без лечения итогом прогрессирования заболевания в большинстве случаев является летальный исход.
Лечение чумы
В течение долгого времени человечество не знало о способах проникновения чумной палочки, не догадывалось, чем можно остановить смертельно опасное заболевание. Лекари придумывали разные причудливые способы, которые не приводили к излечению. К примеру, в Средние века целители готовили непонятные зелья из растений, измельченных змей, советовали людям быстро и надолго бежать из зараженной местности.
Сегодня чума лечится антибиотиками из группы аминогликозидов (стрептомицином, амикацином, гентамицином), тетрациклинами, рифампицином, левомицетином. Летальные исходы наступают в тех случаях, когда заболевание протекает в молниеносной форме, и специалистам не удается своевременно выявить болезнетворную бактерию.
Чумная палочка, несмотря на достижения современной медицины, по-прежнему относится к коварным возбудителям. Очаги заболевания в природе занимают порядка 7 % суши. Они располагаются на пустынных и степных равнинах, в высокогорной местности. Людям, побывавшим в природных очагах чумы, стоит обращать внимание на свое здоровье. При попадании возбудителя в организм инкубационный период длится от нескольких часов до 9 дней. Затем возникают первые симптомы – внезапно повышается температура тела до 39 градусов и выше, возникают судороги, озноб, сильная головная и мышечная боль, затрудняется дыхание. При таких симптомах требуется незамедлительное обращение к врачу.
fb.ru
Черная смерть. История о том, как безобидная бактерия стала беспощадной убийцей
Статья на конкурс «био/мол/текст»: На первый взгляд она — микроскопическая и безобидная бактерия, а на деле — беспощадная убийца, унесшая жизни почти трети европейского населения в 14 веке. Yersinia pestis, известная в народе под именем чумная палочка, является возбудителем опаснейшего заболевания — чумы. С древних времен вокруг Y. pestis возникали научные споры, которые продолжаются до сих пор. Самые яркие из них, а также факты из жизни одного из самых загадочных микроорганизмов освещены в этой статье.
Обратите внимание!
Эта работа заняла первое место в номинации «Лучшее новостное сообщение» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Незнакомка в маске
Y. pestis долго скрывалась от человеческого глаза в силу множества обстоятельств. Сначала помехой был размер: до изобретения братьями Янсенами в 1590 году микроскопа* и дальнейшего его использования Гуком и Левенгуком (которому, кстати, и обязаны «выходом в свет» бактерии и простейшие) никто даже не задумывался о том, что кроме видимых глазу живых объектов существуют еще и крошечные организмы. Но даже с появлением оптики чумная палочка продолжала сохранять статус инкогнито, сбрасывая свою вину на бактерии родов Bacterium, Bacillus и Pasteurella. Тем временем Y. pestis свободно гуляла по миру и уносила человеческих жизней больше, чем война.
За всю историю известны три пандемии чумы. Первой из них была «Юстинианова чума» (названа в честь византийского правителя Юстиниана I), охватившая территорию всего цивилизованного мира того времени. Историки датируют ее 541-580 годами н.э., хотя вспышки неведомой болезни преследовали человечество еще на протяжении двух веков. По утверждению известного исследователя переносчиков инфекций, медицинского энтомолога Милана Даниэля, на пике заболеваемости в Константинополе (ныне — Стамбул, Турция) ежедневно погибало до десяти тысяч человек. На основе современных исследований ученые сделали вывод, что половина европейцев умерла задолго до того, как чума покинула поредевшее и измученное население.
Вторая пандемия, наиболее известная как «Черная смерть», начала свое наступление на Европу в 1346 году. Занесенная из Восточного Китая по Великому шелковому пути в Крым, инфекция быстро прокладывала себе дорогу на север, и в течение четырех лет сумела унести жизни более 25 миллионов человек, что на тот момент составляло третью часть всего европейского населения. Болезнь не сдавалась на протяжении четырех веков — то затаивалась, то вспыхивала (в основном в крупных городах), кочуя из страны в страну. В 1665-1666 годах каждый пятый житель Лондона погиб от бубонной чумы [3]; но, несмотря на плачевную ситуацию, медицина оставалась бессильной.
Лики чумы
В настоящее время основные формы чумы — бубонная, легочная и септическая. Изредка встречаются и другие разновидности: кожная, кишечная, фарингеальная и менингеальная. Бубонная чума обычно развивается после укуса блохи — переносчика Y. pestis или после работы с тушами зараженных животных и характеризуется воспалением лимфатических узлов с образованием их болезненных конгломератов — «бубонов», «шишек» разного размера. Если вовремя не заняться лечением, инфекция может генерализоваться: развиваются сепсис (вторичная септическая чума) или пневмония (вторичная легочная чума). В последнем случае мокрота служит инфицирующей субстанцией для других людей, у которых впоследствии развивается уже первичная легочная чума. Именно из-за способности передаваться от человека к человеку (воздушно-капельным путем) легочная форма болезни вызывает наибольшие опасения. Септическая и легочная формы иногда протекают молниеносно, и без неотложной антибиотикотерапии смерти не избежать.
Возможно, преобладание какой-либо из форм чумы (преимущественное поражение того или иного органа) во время разных эпидемий связано не только с механизмами передачи бактерий, но и со свойствами конкретного штамма-возбудителя.
Решающей стала третья пандемия, разгоревшаяся в Китае в 1855 году. На разгадку самой страшной тайны были брошены все научные силы, изрядно к тому времени поокрепшие. И наконец в 1894 году исследования французского бактериолога Александра Йерсéна (Alexandre Yersin) и японского врача Сибасабуро Китасато (Shibasaburō Kitasato), проводимые независимо друг от друга в Гонконге, принесли долгожданные результаты. Исследуя человеческий патологический материал и трупы грызунов, Китасато и Йерсен выделили и описали коккобациллы, предположительно вызывающие чуму. И если результаты Йерсена нареканий не вызвали, то японскому бактериологу изрядно подпортили репутацию (и вызвали бесконечные споры относительно приоритета в открытии чумной палочки) противоречия в описании возбудителя, судя по всему, объясняемые загрязнением образцов оппортунистами-пневмококками [4].
Жертва мутации
Довольно давно известно, что предком чумной палочки является Yersinia pseudotuberculosis — энтеропатоген, возбудитель псевдотуберкулеза. Предположительно, Y. pestis отделилась от предкового вида около двадцати тысяч лет назад. Причиной эволюции стало резкое изменение климата в позднем плейстоцене (четвертичный период кайнозойской эры): холод сменялся жарой, вызывая перестройку экосистем; как правило, такие «скачки» погоды стимулируют эволюцию видов [5]. Однако до последнего времени не были известны генетические изменения, критичные для трансформации патогена, вызывающего инфекционное заболевание кишечника, в опасный микроорганизм, способный поражать легкие и провоцировать молниеносный сепсис.
Эволюционная ветвь Y. pestis была изучена учеными из Северо-Западного университета США. В ходе исследования Виндем Латем (Wyndham Lathem) и Даниель Зимблер (Daniel Zimbler) установили, что приобретение единственного гена превратило ранние формы Y. pestis, уже несколько отличавшиеся генетически и фенотипически от Y. pseudotuberculosis, в успешного легочного патогена. Чтобы выявить механизм «переселения» чумной палочки из кишечника в легкие, авторы проводили эксперименты над древними штаммами бактерий и анализировали их поведение в организме мышей. В ходе сравнения штаммов — возбудителей легочной чумы с относительно безобидными предками было выявлено лишь одно, но очень существенное, различие: критичным стало приобретение гена поверхностного белка Pla (см. врезку) в составе плазмиды pPCP1. Для проверки гипотезы этот ген внедрили в ДНК эволюционно более ранних штаммов — и результаты подтвердили причастность протеазы Pla к эффективному поражению дыхательных путей.
Однако этого приобретения Y. pestis было недостаточно для того, чтобы научиться вызывать опаснейшую системную инфекцию (септическую форму чумы). Оказалось, что для подобного усовершенствования потребовалась всего одна (!) аминокислотная замена в белке Pla — I259T. Эта замена оптимизировала протеолитическую активность белка и существенно повысила инвазивный потенциал бактерий при развитии бубонной чумы. Таким образом, ученые полагают, что первым делом бактерия приобрела свойства легочного патогена, провокатора вспышек легочной чумы, а позже в результате дополнительной мутации появились еще более опасные штаммы, вызывающие пандемии легочно-септической и бубонно-септической чумы [6].
Тем не менее среди всех минусов Y. pestis ученые находят и плюсы ее контакта с людьми. В 2014 году в журнале PLoS ONE
была опубликована статья Шэрон де Витте из Университета Южной Каролины, в которой говорилось, что люди, пережившие пандемию чумы, стали обладателями более крепкого здоровья. Ученые исследовали останки людей, живших до, во время и после чумы, обращая особое внимание на причины смерти и состояние их костей. Результаты показали, что пережившие эпидемию, а также их потомки, доживали в среднем до 75 лет и обладали завидным иммунитетом.Немного о Pla
Рисунок 1. Механизм предотвращения апоптоза протеазой Pla Y. pestis. Слева — нормальная Fas-сигнализация при инактивации Pla, справа — подавление апоптоза «рабочей» протеазой. FasL — трансмембранный белок, локализованный на поверхности лимфоцитов; Fas — рецептор FasL; Pla — протеаза, встроенная во внешнюю мембрану бактериальной клетки. Рисунок из [7].
Почему же протеаза Pla относится к факторам вирулентности, то есть
Недавно была установлена связь развития первичной легочной инфекции с механизмом, связанным с инактивацией апоптотической сигнальной молекулы под названием Fas-лиганд (FasL). Роль FasL в клетке определяется его способностью запускать процесс апоптоза. У этого белка, пронизывающего мембрану активированных цитотоксических Т-лимфоцитов и эпителиальных клеток дыхательных путей, есть внеклеточный домен, который связывается с рецептором FasR на поверхности других клеток (преимущественно лимфоцитов, а также гепатоцитов, раковых и некоторых других), что посредством активации протеаз caspase-8 и caspase-3/7 запускает апоптоз. Так поддерживается гомеостаз иммуноцитов, предотвращаются аутоиммунные процессы и уничтожаются клетки, экспрессирующие чужеродные антигены.
Протеаза Pla катализирует расщепление в нескольких местах «рабочего» домена FasL и тем самым инактивирует этот белок — причем как мембранную, так и растворимую его формы. Таким образом Pla предотвращает апоптоз и связанные с ним воспалительные реакции, необходимые для полноценного иммунного ответа, что способствует выживанию патогена в организме хозяина (рис. 1) [7].
Проводимые на мышах эксперименты показали следующее: бактерии с нормальной протеазой Pla способствовали снижению количества FasL, что приводило к быстрой колонизации легких, в то время как йерсинии с инактивированной Pla размножались медленнее. Описанный механизм подавления иммунного ответа, по мнению ученых, может использоваться и другими патогенами, в особенности вызывающими инфекции дыхательный путей. А это, в свою очередь, открывает новые перспективы в борьбе с такими заболеваниями: можно подумать, например, над разработкой ингибиторов Pla или введением дополнительных молекул FasL [7].
«Такси до дома»
Основным переносчиком Y. pestis от грызунов к человеку является блоха (рис. 2), причем для насекомого это вынужденная «доставка пассажира», цена которой — жизнь «перевозчика».

Рисунок 2. Блоха цепляется за шерсть крысы. Фотография сделана с помощью электронного микроскопа, применено окрашивание. Рисунок с сайта science.nationalgeographic.com.
Блохи — прожорливые кровососы. Питание особи может длиться от одной минуты до нескольких часов; некоторые виды умудряются заполнить свои желудки до отказа — так, что даже не успевают переварить свой кровавый обед. Возможно, именно этот факт сыграл для насекомых злую шутку, но пришелся как нельзя более кстати Y. pestis.
Чумная палочка попадает в организм блохи во время ее питания и накапливается в зобу, где начинает интенсивно размножаться. При этом бактерии образуют своего рода биопленку — многослойное скопление клеток, погруженных в экзополисахаридный матрикс. Это явление даже получило название «чумной блок». Таким образом, при последующем питании блохи кровь не попадает в желудок — насекомое чувствует голод и чаще «выходит на охоту». Зараженные блохи живут недолго (оно и понятно — без еды далеко не убежишь), но за это время успевают заразить около 15 животных, в том числе и человека.
Происходит это следующим образом. Поскольку кровь не проходит дальше биопленки, она накапливается в пищеводе и зобу. Когда блоха кусает жертву, новой порции пищи просто некуда деваться, и часть предыдущей трапезы насекомого вместе с порцией бактерий Y. pestis попадает в ранку. Малютке нужен всего один час, чтобы «обойти» организм несчастного и вместе с кровотоком проникнуть в селезенку, печень и легкие. Инкубационный период (время от проникновения возбудителя в организм до первых клинических проявлений) длится от нескольких часов до 12 дней [8]. Схема передачи возбудителя* изображена на рисунке 3.
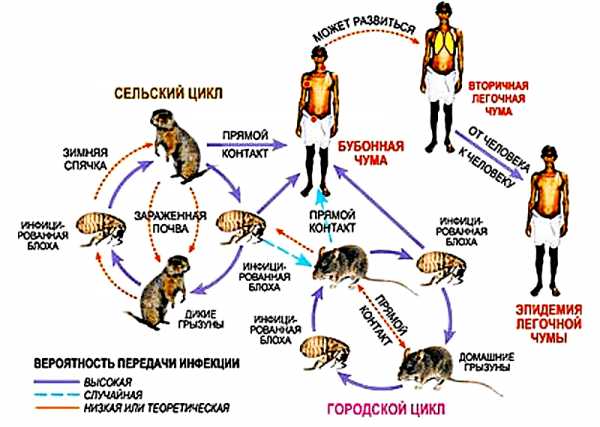
Рисунок 3. Схема передачи возбудителя чумы от грызунов человеку. Рисунок с сайта www.nkj.ru.
«Верю, не верю»
Вокруг Y. pestis бродит множество слухов и мифов. Так, например, бактерию считали виновницей «Афинской чумы» — эпидемии, охватившей Древние Афины на втором году Пелопонесской войны. Наплыв беженцев в греческий город стал причиной перенаселения и скученности людей, что, несомненно, способствовало антисанитарии: следить за гигиеной было некогда, поскольку основные силы были направлены на достижение военного превосходства над врагами. В этих условиях зародилась эпидемия «чумы», воспринятая греками как божественная кара за родовое проклятие Алкмеонидов. Тем не менее современные исследования доказывают непричастность Y. pestis к эпидемии в Древней Греции. С помощью молекулярно-генетического анализа было установлено, что на зубах*, найденных в захоронениях жертв афинской эпидемии, нет ДНК чумной палочки, зато присутствует ДНК бактерии Salmonella typhi — возбудителя брюшного тифа [10].
Дальнейшие споры возникают вокруг «помощников» в распространении Y. pestis. Заболевание переносится блохами, а блохи — грызунами. Считалось, что европейские крысы (рис. 4), когда-то заразившись чумой, служили резервуаром инфекции на протяжении нескольких веков, однако сейчас этот факт оспаривается норвежскими учеными. Нильс Христиан Стенсет (Nils Christian Stenseth) из Университета Осло поясняет, что вспышки чумы должны быть связаны с погодными колебаниями: особенно теплые и влажные весенне-летние периоды характеризуются бурным развитием растений и изобилием пищи, количество грызунов в такие годы значительно возрастает, а значит, и чума распространяется быстрее. Изучение древних записей об изменении климата в Европе и Азии во время пандемий привело к заключению, что в Европе начало эпидемий действительно соответствовало благоприятным природным условиям, но только… в Азии и со стабильной отсрочкой примерно в 15 лет. Это позволило сделать вывод о том, то чумная палочка вовсе не таилась в европейских крысах на протяжении многих веков, а завозилась торговцами из Азии снова и снова. Правда, данная гипотеза еще требует строгих научных подтверждений — Стенсет планирует провести генетический анализ останков жертв европейских вспышек чумы и сопоставить геномы возбудителей [12].

Рисунок 4. Крысы (Rattus norvegicus) являются переносчиками блох, а следовательно, и чумной палочки. Рисунок из [12].
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- По ту сторону дифракционного барьера: Нобелевская премия по химии 2014;
- Plague. The Black Death. Сайт National Geographic;
- Bibel D.J. and Chen T.H. (1976). Diagnosis of plaque: an analysis of the Yersin-Kitasato controversy. Bacteriol. Rev. 40 (3), 633–651;
- Сунцов В.В. и Сунцова Н.И. Чума. Происхождение и эволюция эпизоотической системы (экологические, географические и социальные аспекты). М.: КМК, 2006. — 247 с.;
- Zimbler D.L., Schroeder J.A., Eddy J.L., Lathem W.W. (2015). Early emergence of Yersinia pestis as a severe respiratory pathogen. Nature. 6, 7487;
- Caulfield A.J., Walker M.E., Gielda L.M., Lathem W.W. (2014). The Pla protease of Yersinia pestis degrades fas ligand to manipulate host cell death and inflammation. Cell Host Microbe. 15 (4), 424–434;
- Fleas. Сайт Illinois Department of Public Health;
- Зильбер Л.А. (1966). Операция «РУДА». Наука и жизнь. 12;
- Это чума;
- Мамонты, кости и лекарственная устойчивость: новые технологии позволяют изучать эволюцию возбудителей инфекционных заболеваний;
- Чердак: «Европейские крысы оказались невиновны в средневековых эпидемиях чумы»..
biomolecula.ru
85. Возбудитель чумы. Таксономия и характеристика. Микробиологическая диагностика. Специфическая профилактика и лечение.
Таксономия: Y.pestis вызывает чуму; отдел Gracilicutes, семейство Enterobacteriaceae, род Yersinia. Возбудитель – Yersinia pestis.
Морфологические свойства: грамотрицательные палочки, овоидной формы, окрашиваются биполярно. Подвижны, имеют капсулу, спор не образуют.
Культуральные свойства.
Факультативные анаэробы. Температурный оптимум +25С. Хорошо культивируются на простых питательных средах. Ферментируют большинство углеводов без образования газа. Психофилы — способны менять свой метаболизм в зависимости от температуры и размножаться при низких температурах. Вирулентные штаммы образуют шероховатые (R) колонии, переходные (RS) и сероватые слизистые гладкие авирулентные(S) формы.
Два типа колоний — молодые и зрелые. Молодые с неровными краями. Зрелые колонии крупные, с бурым зернистым центром и неровными краями. На скошенном агаре черед двое суток при +28 С образуют серовато — белый налет, врастающий в среду, на бульоне — нежную поверхностную пленку и хлопковидный осадок.
Биохимические свойства: фенментативная активнсть высокая: ферментация до кислоты ксилозу, синтез плазмокоагулазы, фибринолизина, гемолизина, лецитиназу, сероводород. Рамнозу, мочевину не ферментирует.
Антигенная структура.
Группа белково — полисахаридных и липополисахаридных антигенов: термостабильный соматический О-антиген и термолабильный капсульный V,W антигены. С W-антигеном связывают вирулентность бактерий. Продуцирует факторы патогенности: фибринолизин, плазмокоагулазу, эндотоксин, экзотоксин, капсулу, V,W антигены.
Резистентность: чувствителен к антибиотикам (особенно стрептомицин), нестоек к окружающей среде при высокой температуре.
Патогенные свойства.
Обладает патогенным потенциалом, подавляет функции фагоцитарной системы, подавляет окислительный взрыв в фагоцитах и беспрепятственно в них размножается. Факторы патогенности контролируются плазмидами трех классов. В патогенезе выделяют три основных стадии — лимфогенного заноса, бактеремии, генерализованной септицемии. Имеют адгезины и инвазины, низкомолекулярные протеины (ингибируют бактерицидные факторы), энтеротоксин. Часть факторов контролируется плазмидами вирулентности.
Клинические особенности: Инкубационный период – несколько часов до 8 сут. Различают локальные – кожно-бубонная, бубонная; внешне-диссеминированные – первично-легочная, вторично-легочная и кишечная; генерализованная – первично-септическая, вторично-септическая формы чумы. Региональная лимфоаденопатия, энтероколиты, реактивные артриты, спондилит, лихорадка.
Эпидемиология: Чума — классический природноочаговый зооноз диких животных. Основные носители в природе — сурки, суслики, в городских условиях — крысы. В передаче возбудителя — блохи животных, способные заражать человека.
Иммунитет: клеточно-гуморальный, ограничен по длительности и напряженности.
Микробиологическая диагностика:
Бактериоскопическое исследование. Из исследуемого материала готовят мазки, окрашивают по Граму и водным раствором метиленового синего. Бактерии чумы представляют собой грамотрицательные палочки овоидной формы Бактериологическое исследование. Исследуемый материал засевают на чашки с питательным агаром. Посевы инкубируют при 25С. Первичное изучение посевов производят через 10ч. К этому сроку появляются колонии, которые образованы вирулентными R-формами. Мало- и авирулентные бактерии формируют S-формы колоний. Идентификацию чистой культуры проводят по морфологии бактериальных клеток, характеру роста, антигенным и биохимическим свойствам, чувствительности к специфическому фагу и биопробе.
На бульоне бактерии образуют пленку; ферментируют многие сахара до кислоты, индола не образуют, желатин не разжижают. Содержат групповой термостабильный соматический антиген и специфический термолабильный капсульный антиген.
Биопроба. Проводится для выделения чистой культуры из материала, загрязненного посторонней микрофлорой. Наиболее чувствительными лабораторными животными являются морские свинки, которым материал вводят подкожно. Внутрибрюшинно материал вводят в том случае, если он не загрязнен другими бактериями. После гибели животных отмечают патологические изменения органов и проводят бактериологическое исследование
Экспресс-методы лабораторной диагностики:
1.Иммунофлюоресцентный метод позволяет обнаружить присутствие возбудителя как в патологическом материале, так и в объектах окружающей среды (вода, воздух), а также в пищевых продуктах и эктопаразитах. С этой целью используют люминесцентную видоспецифическую противочумную сыворотку, люминесцентные противокапсульную и противосоматическую сыворотку.
2.РПГА — для обнаружения антигенов бактерий в материале с помощью стандартной противочумной сыворотки, антитела которой нагружены на эритроциты.
Лечение: антибиотики –стрептомицин, препараты тетрациклинового ряда.
Профилактика: специфическая профилактика — живая ослабленная чумная вакцина EV. Имеется сухая таблетированная вакцина для перорального применения. Для оценки иммунитета к чуме (естественного постинфекционного и вакцинального) может применяться внутрикожная аллергическая проба с пестином.
Чумной бактериофаг – при идентификации Y.pestis.
Чумная сухая вакцина – высушенная живая культура Y.pestis вакцинного штамма EV, используется для профилактики чумы.
studfiles.net
Чума: возбудитель, симптомы, лечение, профилактика
  Чума — это тяжелое инфекционное заболевание, относящееся к карантинным заболеваниям.
  Возбудитель чумы был открыт в 1894 году независимо французским ученым А. Йерсеном и японским ученым С. Китасато.
  Возбудитель — бактерия чумная палочка (лат. Yersinia pestis), не образующая спор, имеющая капсулу, вырабатывающая токсины как при жизни, так и после разрушения. Устойчива при низких температурах, в норах грызунов может сохраняться несколько месяцев, в блохах и клещах — более года. Кипячение и дезинфицирующие средства легко убивают ее.
  Ворота инфекции — поврежденная кожа (при укусе блохи, как правило, Xenopsylla cheopis), слизистые оболочки дыхательных путей, пищеварительного тракта, конъюнктивы.
  Микробиологи считают, что возбудитель чумы появился примерно 1500–2000 лет назад в результате мутации псевдотуберкулеза.
  Заражение человека происходит несколькими путями:
- при укусах инфицированных блох, заразившихся от крыс
- при контакте со шкурой больных крыс
- пищевым путем при загрязнении продуктов питания
- воздушно-капельным путем при контакте с больными легочной формой чумы
  Блохи являются специфическим переносчиком возбудителя чумы. Это связано с особенностями устройства пищеварительной системы блох: перед самым желудком пищевод блохи образует утолщение — зоб.
 
При укусе заражённого животного (крысы) бактерия чумы оседает в зобу блохи и начинает интенсивно размножаться, полностью закупоривая его (т. н. «чумной блок»). Кровь не может попасть в желудок, поэтому блоха отрыгивает кровь вместе с возбудителем обратно в ранку.
  А так как такую блоху постоянно мучает чувство голода, она переходит с хозяина на хозяина в надежде получить свою порцию крови и успевает заразить большое количество людей, прежде чем погибнет (такие блохи живут не более десяти дней, но опыты на грызунах показали, что одна блоха может заразить до 11 хозяев).
Симптомы
  Инкубационный период длится от 3 до 6 дней. Заболевание начинается с резкого повышения температуры до 39–40 °С и развития симптомов интоксикации: головной боли, тошноты, рвоты (может быть с кровью), мышечных болей.
  Дальнейшие события могут развиваться по нескольким сценариям:
- Первично септическая форма развивается при ослабленном иммунитете и характеризуется нарастанием симптомов интоксикации и гибелью больного от инфекционно-токсического шока.
- Наиболее часто встречается кожно-бубонная форма, при которой на коже появляется язва, напоминающая сибиреязвенную, а подмышечные, шейные, околоушные или паховые лимфоузлы превращаются в гнойники, называемые бубонами.
- Легочная форма — наиболее тяжелая и чаще всего приводящая к смерти. Нарастание сердцебиения, одышки, появление болей в груди, кашля, мокроты, которая постепенно становится кровавой. Смерть наступает из-за отека легких.
Лечение
  Возбудитель чумы чувствителен к широко распространенным антибиотикам, прием которых нужно начинать как можно раньше. По показаниям проводят дезинтоксикационную терапию, лечение сердечной и дыхательной недостаточности, общеукрепляющую терапию.
  Лечение чумы является комплексным и включает применение этиотропных, патогенетических и симптоматических средств. Для лечения чумы наиболее эффективны антибиотики стрептомицинового ряда: стрептомицин, дигидрострептомицин, пасомицин. При этом, наиболее широко применяется стрептомицин.
 
При бубонной форме чумы больному вводят внутримышечно стрептомицин 3—4 раза в сутки (суточная доза по 3 г), тетрациклиновые антибиотики (вибромицин, морфоциклин) в/в по 4 г/сут. При интоксикации в/в вводят солевые растворы, гемодез.
  Прогноз В условиях современной терапии смертность при бубонной форме не превышает 5—10 %, но и при других формах процент выздоровлений достаточно высок, если лечение начато рано. В ряде случаев возможна быстротечная септическая форма заболевания, слабо поддающаяся прижизненной диагностике и лечению («молниеносная форма чумы»).
Осложнения
  Любая из форм чумы может перейти в септическую или легочную. Могут развиться менингит, отек мозга, отек легких или массивные кровотечения, которые служат причиной смерти.
Профилактика
  Больной с подозрением на чуму немедленно госпитализируется в специализированное инфекционное отделение. Контактные подвергаются карантину на 6 дней. Им проводится профилактическая терапия антибиотиками.
  Общепринято считать, что первая из 3 великих пандемий чумы (моровой язвы) началась в 15-й год правления римского императора Юстиниана I (она так и называлась «Чума Юстиниана»). Она властвовала примерно 100 лет — с 531 до 650 года.
  Вторая эпидемия, с чем также согласно большинство ученых, известна под названием «черной смерти». Она началась в 1348 году и длилась свыше 300 лет, то есть до 1666 года и Великого лондонского пожара. Однако некоторые историки считают, что стадия пандемии длилась только 4 года. Третья пандемия началась в Китае в 1892 году и, согласно оценке некоторых историков, закончилась 15 лет спустя. По мнению других, она продолжалась до 1959 года. А некоторые считают, что она и сегодня еще не истреблена: бациллы чумы и ее носители проявляют все возрастающую сопротивляемость к антибиотикам и пестицидам.
doclvs.ru
Остались вопросы?
Нужен совет врача?
Врачи всех специальностей ответят на беспокоящие Вас вопросы! бесплатно!
Внимание! информация на сайте не является медицинским диагнозом, или руководством к действию и предназначена только для ознакомления.
doclvs.ru
Чума возбудитель бактерия — Инфекционные заболевания
Возбудитель зооантропонозной чумы (Yersinia pestis) вызывает острую инфекционную болезнь, характеризующуюся тяжелой интоксикацией, поражением лимфатической системы, тенденцией к септицемии. Чума – природно-очаговая болезнь, возбудитель которой в естественных условиях сохраняется благодаря циркуляции среди грызунов. Заражению здоровых животных способствуют переносчики, в первую очередь блохи. Из сельскохозяйственных животных к чуме наиболее восприимчивы верблюды: заражаются в периоды интенсивной эпизоотии чумы грызунов и представляют собой опасный источник заражения людей.
Бактерию чумы открыли и выделили в чистой культуре в 1894 г. Китазато и Иерсен во время эпидемии чумы в Гонконге. В честь Иерсена бактерия получила родовое название «иерсиния».
Морфология. Yersinia pestis – полиморфная грамотрицательная палочка 1-2 мкм в длину и 0,3-0,5 мкм в ширину. Спор не образует, жгутиков не имеет. При выращивании на влажных и кислых питательных средах при 37 0С вокруг палочек образуется мукоидная оболочка в виде капсулы. В препаратах из органов и крови ее находят очень редко.
Бактерия чумы окрашивается биполярно всеми анилиновыми красителями, лучше всего синькой Леффлера и по Романовскому–Гимзе. Микробы в форме палочек обнаруживают в мазках из органов и крови животных, погибших от острой формы чумы, при хроническом течении процесса бактерии шарообразной формы, плохо окрашиваются. В мазках на 1-2 суточных бульонных культурах возбудитель окрашивается биполярно и располагается в виде коротких и длинных цепочек, а в культурах на пластинке агара в чашке Петри – в виде мелких коротких палочек с плохо выраженной биполярностью; в препаратах из культур с влажного скошенного в пробирках МПА и особенно из конденсационной жидкости биполярная окраска четкая.
Культивирование. Факультативный анаэроб. Хорошо растет на обычных питательных средах при 28-30 0С и рН 7-7,2. Темп роста замедленный, поэтому в питательные среды добавляют различные стимуляторы (кровь, сульфат натрия и др.). На пластинках агара растет в
0851365.net
Возбудитель чумы — оружие массового поражения
Возбудитель чумы — оружие массового поражения

Возбудителем чумы является чумная палочка – бактерия, вызывающая тяжелое инфекционное заболевание, сопровождающееся воспалением лимфоузлов и лихорадкой. Зачастую в ходе болезни развивается сепсис, при котором поражаются все органы, а в ряде случаев поражается легочная ткань. При этом чума переходит в легочную форму. Возникает чумная пневмония, которая сопровождается цианозом, кашлем с пенистой кровянистой мокротой. Человек, заболевший чумной пневмонией, становится источником заражения – при этом происходит заражение первичной легочной чумой.
Переносчики заболевания в природе – суслики, сурки, песчанки, мыши и крысы, зайцеобразные, кошки. Из домашних животных – верблюды. Передается возбудитель чумы от животного к животному, а от них – человеку через блох. Инкубационный период инфекции – 2-6 дней.
Чума – крайне заразная болезнь, требующая немедленного принятия карантинных мер при малейшем подозрении на ее возникновение. При этом изолируют не только заболевшего, но и всех, контактировавших с ним на протяжении инкубационного периода. При соблюдении современных карантинных и терапевтических мер смертность от чумы составляет не выше 5-10%. В условиях современной медицинской профилактики заражения лечащего персонала, контактирующего с больным, не происходит.
Возбудитель чумы как оружие
Попытки использовать заражение чумой в военных целях предпринимались с древних времен. Первые серьезные попытки разработать биологическое оружие на основе возбудителя чумы начались во время Первой Мировой войны. Невзирая на Конвенцию 1925 г., запретившую разработку биологического оружия, попытки продолжались и долгое время после окончания Второй Мировой.
Возбудители болезни способны проникнуть в организм при вдыхании зараженного воздуха, употреблении зараженной воды и продуктов, через открытые раны и ожоговые поверхности, через слизистые, через укусы зараженных насекомых.
Самые распространенные способы применения биологического оружия:
- Артиллерийские мины и снаряды;
- Авиационные бомбы;
- Сброс с самолетов контейнеров, мешков, пакетов и коробок;
- Рассеивание с самолетов зараженных насекомых;
- Распыление аэрозолей с самолетов;
- Методы диверсии.
Применяется и такой способ, как оставление при отводе войск зараженных предметов обихода – еды, одежды и пр., а так же зараженных людей, которые становятся переносчиками инфекции.
Особенности распространения
При поражении возбудителями инфекции выявить болезнь удается не сразу – в течение инкубационного периода болезнь не дает видимых проявлений, не влияет на боеспособность, и беспрепятственно передается от заболевших к здоровым. Обнаружить возбудителей заболевания и определить их вид достаточно сложно – для этого требуются специальные лабораторные исследования. Это отнимает время, и затрудняет своевременное проведение противоэпидемиологических мероприятий.
Биологическое оружие не только наносит потери противнику в живой силе, но и оказывает мощное психологическое давление – поскольку страх заражения оказывает деморализующее действие на людей.
Актуальность применения биологического оружия
Высокая эффективность обусловлена малостью необходимой для инфицирования дозы агента. При этом с одного носителя возможно заражение огромных площадей. Для обеспечения защиты войск и населения от заражения, а так же ликвидации последствий заражения, требуется огромный объем сложных мер. Биологическое оружие способно поражать крупные цели, как то:
- Группировки войск;
- Военные базы – морские и наземные;
- Крупные административные и промышленные центры;
- Сельскохозяйственные районы.
Последствия применения биологического оружия снижают военно-экономический потенциал противника, ослабляет тыл, что ухудшает снабжение войск, дезорганизует государственные системы управления.
Сложности в применении биологического оружия
Изначально биологическое оружие считалось «оружием бедных» — поскольку, казалось бы, для его разработки и применения нужно не столь много ресурсов. Однако еще в 30х годах прошлого столетия германский профессор Конрих сформулировал основные сложности в его использовании.
- В лабораторных условиях сохранить вирулентность инфекционного возбудителя в течение долгого времени невозможно.
- Вирулентность микроорганизма – недостаточное условие для того, чтобы вызвать эпидемию.
- При рассеивании микробов большая их часть погибнет из-за несоответствующих условий.
Возбудитель чумы, растущий на питательных средах, быстро теряет способность заражать людей. И, хотя японцам во время Второй Мировой удалось вывести микроорганизмы, вирулентность которых превышала вирулентность природных штаммов в 60 раз – этого, как выяснилось, недостаточно. Мало получить вирулентный штамм – необходимо сохранить его вирулентность до попадания в организм жертвы.
Возбудитель чумы теряет способность заражать при многократном посеве в культиваторах, масштабировании производства, хранении и лиофильном высушивании.
Уже после Второй Мировой в Штатах было сделано открытие – частицы аэрозоля способны инфицировать человека лишь при попадании в альвеолы. Для этого их размер не должен превышать 5 микрон. Получение столь мелкодисперсного аэрозоля оказалось сопряжено с определенными трудностями. Повышение дисперсности распыления с самолетов зачастую приводит к гибели микроорганизмов. К тому же полученный мелкодисперсный аэрозоль ведет себя непредсказуемо при распылении – его распространение и сохранение необходимых свойств сложно предсказать и невозможно контролировать. Вдобавок феномен «открытого воздуха» — большое количество примесей – способствует преждевременной потере вирулентности и жизнеспособности микроорганизмов.
Распыление сухих порошков немногим лучше аэрозолей. Во-первых, измельчение сухого лиофилизата бактерий до необходимого размера сопряжено с рядом сложностей. Во-вторых, сохранить тонкодисперсный порошок еще сложнее, чем получить – он быстро слеживается при хранении.
Сброс с самолетов, зараженных насекомых тоже не дает высокой гарантии поражения цели: насекомых может попросту отнести потоком воздуха от целевого участка, либо они погибнут до того, как заразят противника.
Резюмируя вышесказанное – в задачи разработки биологического оружия на основе возбудителя чумы входит:
- Получение и сохранение высокой вирулентности штаммов, способных преодолевать действие современных вакцин и антибиотиков;
- Сохранение жизнеспособности микроорганизмов до их попадания в организм жертвы;
- Получение препаратов необходимой степени дисперсности и их сохранение с применением разрыхляющих и стабилизирующих веществ;
- Разработка точных и надежных средств доставки возбудителей болезни, учитывающих, в том числе и направление ветра.
Все вышеперечисленное делает использование биологического оружия сложным и крайне затратным, но при этом эффективным средством ведения войны.
total-rating.ru
Биологические свойства возбудителя чумы
Возбудитель чумы относится к семейству Enterobacteriaceae , роду Yersinia, виду pestis. В качестве внутривидовой классификации самой признанной за рубежом считается классификация Р. Девинья, которая, учитывая принципы формирования разновидностей в исторические эпохи и некоторые биохимические свойства штаммов, делит вид на 3 биовара: antiqua (древний), mediаevalis (средневековый) и orientalis (восточный) (табл.21).
Таблица 21
Внутривидовая классификация Yersinia pestis (R. Devignat)
| Номенклатура и краткая характеристика разновидностей поR. Devignat | Отличительные признаки | ||
| Ферментация глицерина | Нитрификация | Денитрификация | |
| Y. pestisvar. orientalis (восточная разновидность, причина пандемии 1894 г.) | − | ± | + |
| Y. pestisvar. antiqua (древняя разновидность, причина пандемии «юстинианова чума») | + | ± | + |
| Y. pestisvar.mediaevalis (средневековая разновидность, причина пандемии «черная смерть») | + | − | − |
В нашей стране принята единая систематическая схема подвидовых категорий, наименование которых отражает конкретные географические территории. В основу схемы положены результаты изучения штаммов, выделенных на данных территориях, методами геносистематики и нумерической таксономии. Она учитывает степень фенотипического сходства, а так же различия по содержанию ГЦ-пар в ДНК и др. Согласно этой схеме вид Y. pestis делится на 5 подвидов: Y.pestisssp. pestis (основной), Y. pestisssp. caucasica (кавказский), Y. Pestis ssp.altaica (алтайский), Y. Pestis ssp. hissarica (гиссарский) и Y. Pestis ssp. ulegeica (улэгейский) (табл.22).
Таблица 22
Таксономические признаки, характеризующие различные подвиды Y. Pestis
| Подвиды Yersinia pestis subsp. | Ферментация | денитрификация | Продукция пестицина I | Чувствительность к пестицину I | Фибринолитическая активность | Коагулазная активность | Зависимость от источников питания | Вирулентность для морских свинок | Район циркуляции (природные очаги чумы) | Носителивозбудителячумы | ||||||
| рамноза | мелибиоза | арабиноза З а | глицерин | лейцин | метионин | аргинин | тиамин | |||||||||
| pestis | − | − | + | ± | ± | + | − | + | + | ± | + | − | − | + | Азия, Африка, Америка | Marmota, Citellus, Meriones, Rattus |
| altaica | + | + | − | + | − | + | + | + | + | + | − | + | − | − | Горный Алтай | Ochotona pricei |
| caucasica | + | + | + | + | + | − | + | − | − | ± | + | + | + | − | Закавказское нагорье, Горный Дагестан | Microtus arvalis |
| hissarica | + | + | − | + | − | + | ± | + | + | + | + | − | − | − | Гиссарский хребет | Microtus carruthersi |
| ulegeica | + | + | + | + | − | + | +/- | + | + | − | − | − | − | − | Северо-Восточная Монголия, пустыня Гоби | Ochotona pricei |
Примечание: «+» -наличие признака; «-» -отсутствие признака; «±» — наличие признака не у всех штаммов; «+/-» -чувствительны к пестицину штаммов основного и алтайского подвидов и нечувствительны к пестицину штаммов собственного подвида.
Y. pestis-полиморфная овоидная грамотрицательная палочка, длиной 1-2 мкм, толщиной 0,3-0,7 мкм, с закругленными концами и утолщенной серединой.
В мазках с плотной питательной среды палочки могут быть удлиненными, нитевидными; описаны также фильтрующиеся формы. При затяжном заболевании в мазках из бубона и органов больного возбудитель чумы может принимать форму шаров различной величины и теней. В мазках-отпечатках из тканей и органов, а также в мазках из бульонных культур окрашивается биполярно (более интенсивно на концах клетки). Биполярность ярче выявляется при окраске метиленовой синькой Леффлера.
Возбудитель чумы не имеет жгутиков и спор. Капсулу образует в организме теплокровных животных и людей, кровяном и сывороточном агаре при температуре 37 °С.
Чумной микроб – облигатный паразит с факультативным анаэробным типом дыхания, относится к природным ауксотрофам. Помимо источника энергии нуждается в дополнительных факторах роста – аминокислотах и витаминах. Для роста при 28 °С необходимы фенилаланин, валин, метионин, изолейцин и глицин или треонин; при 37 °С — биотин, тиамин, глютаминовая кислота и пантотенат. Штаммы из разных очагов чумы, как правило, имеют неодинаковые потребности в факторах роста, что находит отражение в схеме внутривидовой таксономии чумного микроба.
Для культивирования возбудителя требуются питательные среды с глубоким расщеплением белка. Лучшими по качеству являются среды, приготовленные из ферментативных гидролизатов кровяных сгустков (не требуют добавления стимуляторов и рост наблюдается при посеве 10-100 микробных клеток) и казеина, перевара Хоттингера, кислотного гидролизата рыбокостной муки.
Самые распространенные среды для изучения чумного микроба: бульон и агар Хоттингера, Мартена, казеиново-дрожжевой агар (питательный агар для выращивания чумного микроба, сухой), дезоксихолатно-цитратный агар.
Оптимальные условия выращивания: температура 28-30 °С и pH 7,0-7,2, но возбудитель способен расти на питательных средах в температурном диапазоне от 2 до 45 °С и показателях pH среды от 5,8 до 8,0.
Чумной микроб на плотных питательных средах имеет характерную морфологию роста. При посеве бактериологической петлей через 24-48 часов инкубации представляет собой бурый «тяж» в начале штриха и отдельные шероховатые колонии в конце. Морфология колоний под микроскопом является одним из основных диагностических признаков возбудителя чумы. Через 12 ч инкубации появляются микроколонии в виде нежных прозрачных образований чаще треугольной или прямоугольной формы, напоминающих битое стекло (рис.23).
Рис.23. «битое стекло» (12-24 ч)
Через 18-24ч микроколонии сливаются в плоские прозрачные образования с фестончатыми краями — «кружевные платочки» (рис.24).
Рис.24. «кружевные платочки» (18-24 ч)
В дальнейшем (24-48ч) «кружевные платочки» превращаются в зрелые колонии. Типичные зрелые колонии имеют бурый зернистый центр с постепенно уплощающейся прозрачной периферической зоной с фестончатыми краями.
На скошенном агаре возбудитель чумы растет в виде сочного, серовато-белого налета, хорошо фиксированного на среде. На жидкой питательной среде (МПБ, бульон Хоттингера и др.) образует хлопьевидный или порошковидный, легко распадающийся при встряхивании осадок, в совершенно прозрачном бульоне и нежную пленку на поверхности.
Бактерии чумы растут в R-форме, которая является вирулентной. Однако они относительно легко могут диссоциировать под влиянием ряда факторов (например, под действием фага) и через О-форму переходить в S-авирулентную форму.
Возбудитель чумы имеет признаки, характерные для представителей семейства Enterobacteriaceae. Он оксидазо-отрицателен и каталазо-положителен; проявляет выраженную ферментативную активность по отношению к различным моно-, ди-, трисахаридам и спиртам; расщепляет на 1-3 сутки глюкозу, маннозу, маннит, мальтозу, эскулин, до кислоты без газа; не ферментирует лактозу, сахарозу, сорбит, инозит, дульцит, мочевину. Отношение к глицерину, салицину, арабинозе, рамнозе и мелибиозе — вариабельное. Не образует индол, сероводород, ацетилметилкарбинол. Дает положительную реакцию с метиловым красным. Протеолитические свойства выражены слабо: не разжижает желатин и не свертывает молоко (табл. 23).
Таблица 23
Основные ферментативные свойства возбудителей чумы
| Тест | ||||||||||
| Глюкоза | Глицерин | Мочевина | Рамноза | Сахароза | Маннит | Мальтоза | Арабиноза | H2S | Реакция Фогес-Проскауэра | Желатина |
| + | ± | - | ± | - | + | + | ± | - | - | - |
Примечание: «+» — расщепление; «-»-отсутствие расщепления;
«±» — возможны варианты расщепления.
Важным свойством чумного микроба является его способность к денитрификации, т.е. восстановлению нитратов в нитриты. Эта окислительно-восстановительная реакция служит стойкой генетической меткой, используемой во всех схемах внутривидовой классификации штаммов чумного микроба.
Чумной микроб (кроме штаммов, выделенных от полевок на Закавказском нагорье), в отличие от псевдотуберкулезного микроба, синтезирует ферменты патогенности — фибринолизин и плазмокоагулазу. Фибринолизин обладает способностью локально растворять сгустки фибрина и фибриногена крови в очагах воспаления. Плазмокоагулаза обусловливает свертываемость плазмы крови кролика, морской свинки и человека. Фибринолизин-коагулазная система обеспечивает возбудителю чумы высокую инвазивную способность и генерализацию чумной инфекции.
Большинство штаммов чумного микроба продуцируют в окружающую среду антибиотикоподобное вещество (бактериоцин), который получил название пестицин 1(Р1). Он представляет собой видоспецифический термолабильный мономерный белок. Р1 участвует в гидролизе муреинлипопротеина клеточной стенки чувствительных к нему клеток, превращая их в нежизнеспособные сферопласты. Он подавляет рост штаммов Y. Pseudotuberсulosis I серовара (по Талю) и некоторых штаммов Y. pestis, циркулирующих в природных очагах чумы Закавказского нагорья, Горного Алтая, на Гиссарском хребте, в Таджикистане, и т.д., что связано с наличием в их составе 3,6-ди-деоксид-В-рибогексозы, которая выполняет роль рецептора для Р1. Способность к продукции пестицина 1, фибринолизина и плазмокоагулазы является видовым признаком штаммов Y. pestis и играет важную роль в таксономии и дифференциальной диагностике чумы. Исключение составляют штаммы кавказского подвида, которые выделяются от полевок в Закавказском нагорье и Горном Дагестане. Они не только не продуцируют Р1, но и проявляют к нему чувствительность. Пестицин-фибринолизин-плазмокоагулаза кодируются одной низкомолекулярной плазмидой — pPst. Эти признаки сцеплены друг с другом и потеря одного из них сопровождается потерей двух других.
В настоящее время методами иммунохимического анализа в чумном микробе обнаружено до 90 иммунохимически активных компонентов, среди которых многие являются общими с Y. pseudotuberсulosis, E. coli, Schigella и эритроцитами человека О-группы. И только некоторые из них, как капсульный антиген (фракция I, FI), являются специфическими для возбудителя чумы.
FI-основой компонент, связанный с капсулой, представляет собой чистый белок. Наиболее интенсивно синтез FI происходит при 37 °С выращивания in vitro и организме животных (in vivo). При более низких температурах культивирования капсульный антиген у микроорганизма не обнаруживается. В организме членистоногих (блох) FI не выявляется. Фракция I является основным иммуногеном и обладает строгой специфичностью, хотя в природе описаны штаммы, не синтезирующие этот белок.
Геном возбудителя чумы состоит из хромосомы размером 4,65 т.п.н. и трех плазмид-пестиногенности (pPst), кальцийзависимости (рСаd), фракции I и «мышиного токсина» (pFra), имеющих молекулярные массы соответственно 6, 47 и 61-65 мегадальтон.
pPst кодирует продукцию пестицина I, устойчивость к нему, синтез фибринолизина и плазмокоагулазы. Наличие этой плазмиды повышает вирулентность возбудителя чумы в опытах при подкожном заражении морских свинок и белых мышей.
рСаd определяет характер роста клеток при 37 °С в зависимости от наличия в среде ионов кальция, а также отвечает за синтез антигенов V, W и других поверхностных белков.
pFra ответственна за продукцию фракции I и синтез «мышиного» токсина.
Возбудитель чумы относится к группе полипатогенных бактерий с высокой инвазивностью, но с относительно невысокой токсичностью. К ферментам патогенности относятся гиалуронидаза, фибринолизин, коагулаза, нейраминидаза, каталаза и др. Характерными признаками вирулентных штаммов возбудителя чумы являются: наличие капсулы, V- W- и рН6-антигенов, способность синтезировать пурины, образование пигментированных колоний на среде с гемином, пестициногенность, неспособность расти на средах при 37 °С в отсутствии ионов кальция.
Дифференциальная диагностика культуры чумного микроба от большинства видов патогенных бактерий и банальной микрофлоры, как правило, особого труда не составляет. Если культуру чумного микроба невозможно дифференцировать от палочки Фридлендера, кишечной палочки, сальмонелл и других представителей кишечной группы бактерий при микроскопии мазков, так как они практически ничем не отличаются, то по морфологии колоний на агаре и характеру роста на жидких питательных средах это сделать, возможно. Исключением является возбудитель псевдотуберкулеза в R- и OR- формах, который по морфологии микроба в мазках, а так же культуральным свойствам часто просто невозможно отличить от возбудителя чумы. В таблице 24 представлена дифференциальная диагностика.
Таблица 24
Дифференциация возбудителей чумы и псевдотуберкулеза
| Признаки | Возбудитель чумы* | Возбудитель псевдотуберкулеза |
| Подвижность в полужидком агаре при 20-22 °С | Неподвижен | Подвижен |
| Лизабельность чумным фагом Покровской | Лизируется | Не лизируется (+**) |
| Лизабельность фагом Лариной Л-413С | Лизируется | Не лизируется |
| Лизабельность псевдотуберкулезным фагом | Лизируется | Лизируется |
| Ферментация мочевины | − (+***) | + |
| Способность синтезировать специфический капсульный антиген F1 | + (−****) | _ |
| Наличие пестицин-фибринолизин-плазмокоагулирующей активности | + | _ |
| Полимеразная цепная реакция (ПЦР) с тест-системой для детекции плазмид pFra и pPst | + | _ |
Примечание:*- типичныевирулентные штаммы.
** — 17-25% штаммов Y. Pseudotuberculosis лизируются чумным фагом Покровской.
*** — свежевыделенные штаммы чумного микроба могут ферментировать мочевину.
**** — способность синтезировать капсульный антиген (F1) отсутствует у штаммов возбудителя чумы, выделяемых во Вьетнаме (в том числе и от людей), а также – от грызунов в некоторых Среднеазиатских природных очагах чумы.
ПРАКТИЧЕСКИЕ ЗАНЯТИЯ
Занятие 1.
Биологические свойства Y. pestis и Y. pseudotuberculosis
· Изучение характера роста культуры на скошенном агаре.
· Изучение морфологии микробов в мазках, приготовленных из агаровой культуры, и в мазках-отпечатках органов грызунов, павших от чумы. Окрашивание мазков по Граму и синькой Леффлера. Постановка пробы с 3 % КОН.
· Посев каждой культуры на 3 чашки питательного агара (ПА), 2 чашки агара с генцианвиолетом, в пробирки с 0,3 % питательным агаром, средами Гисса с глюкозой, лактозой, сахарозой, глицерином, рамнозой, арабинозой, маннитом, мальтозой, со средой Кристенсена, цветной дифференциальной средой (ЦДС), в питательный бульон (ПБ), ПБ с KN03, в пробирки со скошенным питательным агаром.
· Определение пестициногенной активности (приложение).
· Посев культуры возбудителя чумы и возбудителя псевдотуберкулеза на чашку 1,5 % питательного агара с генцианвиолетом бляшками диаметром 0,5-1,0.
Примечания:
— посев на ПА поместить при 28 °С, 37 °С и при комнатной температуре;
— посевы на агаре с генцианвиолетом — при 28 °С и при комнатной температуре;
— посев на 0,3% ПА — в шкаф при комнатной температуре;
Занятие 2.
Биологические свойства Y. pestis и Y. pseudotuberculosis
· Изучение морфологию формирующихся колоний на ПА, ПА с генцианвиолетом.
· Изучение морфологии роста культур в бульоне.
· Приготовление мазков из агаровой и бульонной культур, окрашивание по Граму и синькой Леффлера.
· Определение подвижности на 0,3 % ПА.
· Изучение ферментации углеводов и спиртов на средах Гисса, уреазной активности на среде Кристенсена и ЦДС (приложение).
· Изучение фаголизабельности.
· Постановка пробы на чувствительность к бактериофагам Л-413С, Покровской, псевдотуберкулезному методом «стерильного пятна».
· Постановка пробы на чувствительность к бактериофагам Л-413С, Покровской, псевдотуберкулезному двухслойным методом (приложение).
· Постановка пробы на чувствительность к бактериофагу Покровской методом дифференциального рабочего титра (приложение).
· Постановка пробы на чувствительность к бактериофагу Л-413С ускоренным методом.
· Посев культуры в пробирки со скошенным питательным агаром.
Занятие 3.
Биологические свойства Y. pestis и Y. pseudotuberculosis
- Изучение морфологии 2-х суточного роста возбудителей чумы и псевдотуберкулеза на ПА, ПА с генцианвиолетом.
- Изучение морфологии роста культур в бульоне через 48 ч.
- Регистрация ферментации углеводов и спиртов на средах Гисса.
- Определение фибринолитической и коагулазной активности (приложение).
- Посев культуры возбудителя чумы на пластинчатый и скошенный ПА с кровью.
- Посев культуры на скошенный ПА.
- Изучение фаголизабельности.
- Учет пробы с фагами.
- Определение пестициногенной активности (приложение).
Примечание: инкубирование посевов с кровью на ПА при 37 °С.
Занятие 4.
Биологические свойства Y. pestis и Y. pseudotuberculosis
- Учет пробы на фибринолизин и коагулазу.
- Постановка пробы на нитриты с реактивом Грисса.
- Определение пестициногенной активности.
- Регистрация зоны задержки роста индикаторного штамма возбудителем чумы.
- Изучение вирулентности чумного микроба на специальных питательных средах.
Рост на среде Джексона-Берроуза
На поверхность среды с гемином или ДАС нанести 0,1 мл взвеси односуточной агаровой культуры, содержащей 5х103 м.к./мл, и распределить шпателем по поверхности агара. Посевы инкубировать 4-5 сут. при 28 °С. Вирулентные бактерии чумы вырастают в виде бурых колоний на среде с гемином, темно-красных или темно-синих на ДАС (Psb)+. Бактерии, утратившие вирулентность, образуют бесцветные колонии (Psb)—.
Рост на среде Хигучи-Смита и питательной среде для определения потребности чумного микроба в ионах кальция сухой (ВМ)
Для исследования на среде Хигучи-Смита и ВМ из односуточной агаровой культуры готовят взвеси, содержащие 103 или 2х103м.к./мл. Из каждого разведения по 0,1 мл высевают на чашки со средой. Посевы инкубируют при 37 °С. Через 48 ч отмечают колонии I порядка (бактерии, независимые от ионов кальция, авирулентные). Через 24 ч дополнительной инкубации при той же температуре регистрируют колонии II порядка, состоящие из авирулентных иммуногенных клеток. Затем посевы помещают при 28 °С и подсчитывают вновь появившиеся колонии, состоящие из вирулентных клеток. В качестве контроля 100 или 200 м.к. высевают на агаровые пластины с 1 % дефибринированной крови барана или кролика при использовании среды Хигучи-Смита или питательный агар для выращивания чумного микроба-при работе со средой ВМ.
- Посев суточной культуры возбудителя чумы на среду ВМ с контролем и Джексона-Берроуза или ДАС для выявления вирулентных и авирулентных клеток.
- Изучение антигенной структуры возбудителя чумы. Определение фракции I чумного микроба.
- Определение 2 сывороточных единиц (СЕ) противочумной сыворотки.
- Приготовление микробной взвеси 109 м.к./мл на 2 % растворе формалина из культуры возбудителя чумы, выращенной на ПА с кровью при 37 °С.
- Контрольный высев через 1 ч из обработанной формалином взвеси на чашку ПА.
Примечание: инкубация посевов на среде ВМ и контроля — при 37 °С, на среде Джексона-Берроуза — при 28°С.
Занятие 5.
Биологические свойства Y. pestis и Y. pseudotuberculosis
- Изучение антигенной структуры. Определение F1 чумного микроба.
- Люминесцентно-серологический метод.
- Серологические реакции с применением эритроцитарных диагностикумов (РПГА, РНАт).
Занятие 6.
Биологические свойства Y. pestis
- Изучение вирулентности возбудителя чумы на специальных средах.
- Регистрация всех колоний (I — II порядка), выросших на среде ВМ при 37 °С в течение 42-48 ч, сравнение с ростом на контрольной чашке. Инкубация посевов при 28 °С.
· Выявление ДНК (pFra и pPst) Y.pestis методом полимеразной цепной реакции.
· Подготовка пробы — микробной взвеси 104 м.к./мл.
· Постановка ПЦР:
ГенПест тест-система предназначена для выявления ДНК возбудителя чумы в исследуемом материале методом ПЦР.
Для детекции Y. pestis подобрана система, состоящая из двух пар праймеров, выбранных на основе двух собственных плазмид чумного микроба pFra и pPst. Первая пара праймеров, соответствующих нуклеотидной последовательности гена pla (плазмида pPst), обеспечивает амплификацию фрагмента 478 п.н., вторая пара праймеров F21-F22, комплементарных участку гена caf (плазмида pFra), амплифицирует фрагмент — 295 п.н.
В состав тест — системы входят следующие компоненты: деионизованная вода,10 х буфер, дНТФ, plaY 1 – праймер, plaY 2 – праймер, F 21 — праймер, F 22 – праймер, фермент Taq — полимераза, контрольная ДНК, масло вазелиновое.
Набор хранится при температуре -20°С. Срок хранения не более 6 месяцев.
Объектом для исследования может быть клинический материал, объекты внешней среды, органы животных, а также клеточные взвеси при идентификации выделенных культур. При работе с клиническим материалом и загрязненными объектами внешней среды необходим предварительный этап подготовки проб (выделение ДНК). Подготовку проб осуществляют с помощью поставляемого отдельно набора и прилагаемой к нему инструкции.
При работе с микробными взвесями (109 м.к./мл) возможна их обработка мертиолатом натрия (0,01 %) с последующим прогреванием при 56 °С в течение 30 мин для обеззараживания. Разведения чистых культур из 109 м.к./мл до 104~ 106 м.к./мл следует готовить на бидистиллированной воде, поскольку хлорид натрия, входящий в состав физиологического раствора, является ингибитором ПЦР.
Для проведения ПЦР готовят необходимое количество 0,6 мл микропробирок, соответствующее числу исследуемых проб, а также еще три пробирки — для приготовления реакционной смеси, положительного и отрицательного контролей. Затем извлекают тест-систему из морозильной камеры, размораживают содержимое пробирок (для этого лучше использовать ледяную баню). После транспортировки или длительного хранения пробирки центрифугируют на микроцентрифуге 20 сек (для осаждения капель со стенок) и тщательно перемешивают на вортексе. После этого готовят реакционную смесь в специально предназначенной для этого микропробирке из расчета на одну пробу: деионизованной воды — 5,8 мкл, 10х буфера – 2,5 мкл, дНТФ — 2,5 мкл праймеров — по 1 мкл каждого и фермента Taq — полимеразы — 0,2 мкл. Фермент в реакционную смесь вносят в последнюю очередь и оставляют его вместе с наконечником в микропробирке. Затем в этот наконечник вставляют дозатор, настроенный на 15 мкл, тщательно перемешивают реакционную смесь не только круговыми движениями наконечника, но и поступательными движениями поршня дозатора (пипетированием). По окончании перемешивания добавляют по 15 мкл реакционной смеси в каждую микропробирку, включая контроли, после чего раскапывают минеральное масло. Минеральное масло вносят по одной капле из 1 мл наконечника микродозатора для предотвращения испарения реакционной смеси при термоциклировании. После этого в пробирку, обозначенную как отрицательный контроль, вносят 10 мкл деионизованной воды, а в пробирку, обозначенную как положительный контроль, — 10 мкл контрольной ДНК (контрольную ДНК необходимо вносить специально предназначенным для этого микродозатором!). Пробы в объеме 10 мкл вносят (также предназначенным для этого микродозатором) под минеральное масло. По мере заполнения пробирки закрывают, нумеруют, помещают в амплификатор и проводят термоциклирование по следующей матричной программе:
94°————3 мин х 1 цикл
94°————40 сек !
58°————40 сек ! 35 циклов
72°————40 сек !
72°————3 мин х 1 цикл
10°————хранение
Учет результатов. Продукты, полученные в ПЦР, анализируют методом электрофореза в 1,5–2 % агарозе с добавлением бромистого этидия. Агарозу готовят на 1х ТАЕ буфере, который готовят из 50-кратного, путем разведения в 50 раз (состав 1 литра 50- кратного ТАЕ буфера: 242 г триса, ледяная уксусная кислота — 57 мл, 0,5 М раствор ЭДТА — 100 мл, бромистый этидий — 0,5 мкг/мл, рН 8,0). Доведенную до кипения и охлажденную до 50 °С агарозу заливают в специальную ванночку, устанавливают гребенку и оставляют застывать при комнатной температуре. После полимеризации осторожно извлекают гребенку и переносят гель в камеру для проведения электрофореза. Затем к амплификату добавляют 4-5 мкл смеси, состоящей из 0,25 % бромфенолового синего и 25 % фиколла-400, приготовленной на дистиллированной воде, перемешивают при помощи того же наконечника и вносят в карманы геля. По окончании камеру подключают к источнику тока и задают напряжение 10-15 в/см. Электрофоретическое разделение продолжают в течение 25-35 мин до прохождения лидирующего красителя около 2/3 длины трека (рекомендуемая длина трека — 4 см), после чего извлекают гель из камеры и помещают на стекло трансиллюминатора с УФ излучением 310 нм.
Внимание! С гелем агарозы следует работать в перчатках, поскольку бромистый этидий является мутагеном.
Оценка результатов ПЦР:
1. Положительный контроль — выявляются две специфичных полосы размером 478 п.н. и 295 п.н.
2. Отрицательный контроль: полосы на уровне положительного контроля должны отсутствовать, наличие полос свидетельствует о контаминации тест-системы.
3. Анализируемые пробы: наличие одной или двух полос строго на уровне положительного контроля указывает на присутствие ДНК данного возбудителя.
4. Наличие полос, располагающихся выше или ниже контрольных, является неспецифичным ответом и во внимание не принимается.
5. Полученные результаты можно документировать с помощью видеосистемы или фотографированием геля с использованием оранжевого или интерференциального (594 им) светофильтра.
Чувствительность метода – не менее 1000 геномов Y. pestis в 1 мл.
Занятие 7.
Биологические свойства Y. pestis и Y. pseudotuberculosis
- Изучение многосуточного роста возбудителей чумы и псевдотуберкулеза на плотных и жидких питательных средах.
- Приготовка и просмотр окрашенных по Граму мазков с агаровой и бульонной культур.
- Регистрация ферментации углеводов и спиртов на средах Гисса.
- Изучение потребности штаммов чумного микроба в аминокислотах.
- Изучение вирулентности возбудителя чумы на специальных средах.
- Подсчет вновь появившихся колоний (III порядка) на среде ВМ, сравнение с ростом на контрольной чашке.
- Обеззараживание посевов.
- Окончательный учет РПГА и РНАт.
Занятие 8.
Биологические свойства Y. pestis
- Подсчет количества вирулентных и авирулентных клеток на среде Джексона-Берроуза или ДАС.
- Обеззараживание посевов.
Занятие 9.
Биологические свойства Y. pestis
infopedia.su