Радиоактивный газ радон ‒ доступными словами
Что такое радон?
Как газ радон попадает в помещения?
Помещения, попадающие в группу риска.
Как обнаружить газ радон?
Многие люди даже не догадываются – сколько опасностей может таить в себе, вдыхаемый ими воздух. В его составе могут присутствовать самые разные элементы – одни полностью безвредны для человеческого организма, другие – возбудители самых серьезных и опасных заболеваний. Например, многие знают об опасности, которая таит в себе радиация, но не все догадываются, что повышенную долю можно легко получить и в повседневной жизни. Некоторые люди ошибочно принимают симптомы от воздействия повышенного уровня радиоактивности за признаки других болезней. Общее ухудшение самочувствия, головокружение, ломота в теле – человек привык их связывать совершенно с другими первопричинами. Но это очень опасно, так как радиация может привести к очень серьезным последствиям, а человек тратит время на борьбу с надуманными болезнями. Ошибкой многих людей является то, что они не верят в возможность получения
Многие люди считают, что они достаточно защищены, так как проживают достаточно далеко от рабочих атомных электростанций, не посещают с экскурсиями военные корабли, работающие за счет ядерного топлива, а о Чернобыле слышали только по фильмам, книгам, новостям и играм. К сожалению, это не так! Радиация присутствует вокруг нас повсеместно – важно находится там, где ее количество находится в допустимых нормах.
Итак, что может скрывать обычный воздух, окружающий нас? Не знаете? Мы упростим вам задачу, дав наводящий вопрос, и сразу ответ на него:
— Радиоактивный газ 5 букв?
— Радон.
Первые предпосылки к обнаружению этого элемента сделали в конце девятнадцатого века легендарные Пьер и Мари Кюри. Впоследствии, их исследованиями заинтересовались другие известные ученные, которые смогли выделить радон в чистом виде в 1908-ом году, а также описать некоторые из его характеристик. За свою историю официального существования этот газ поменял множество названий, и только в 1923 оду стал известен как радон – 86-й элемент в периодической таблице Менделеева.
Радон. Именно этот элемент может незаметно окружать человека в его доме, квартире, офисе. Постепенно приводить к ухудшению состояния здоровья людей, вызывать очень серьезные заболевания. Но избежать опасности очень трудно – одна из опасностей, которую таит в себе газ радон, заключается в том, что его невозможно определить по цвету или запаху. Радон ничем не выделяется из окружающего воздуха, поэтому может незаметно облучать человека в течение очень длительного времени.
Но как этот газ может появиться в обычных помещениях, где живут и работают люди?
Где и главное чем его можно обнаружить радон?
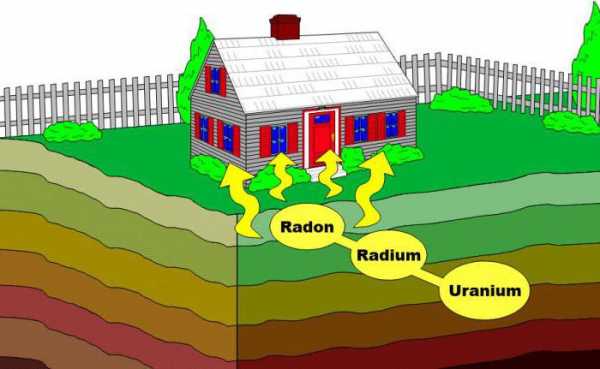
Вполне логичные вопросы. Одним из источников радона является слои почвы, которые расположены под зданиями. Существует множеств веществ, которые выделяют этот газ. Например, обычный гранит. То есть, материал, который активно используется при строительных работах (например, в качестве добавки в асфальт, бетон) или находится в больших количествах непосредственно в Земле. На поверхность газ могут вынести грунтовые воды, особенно во время обильных дождей, не стоит забывать и об глубоководных скважинах, откуда многие люди черпают бесценную жидкость. Еще одним источником этого радиоактивного газа является пища – в сельском хозяйстве используется радон для активации кормов.
Главная неприятность заключается в том, что человек может поселиться в экологически чистом месте, но это не даст ему полной гарантии защиты от пагубного воздействия радона. Газ может проникнуть в его обитель с едой, водопроводной водой, в качестве испарений после дождя, от окружающих элементов отделки здания и материалов, из которого оно было возведено. Не будет же человек каждый раз, заказывая или покупая что-то интересоваться об уровне радиации в месте производства приобретаемой продукции?
Итог – газ радон может концентрироваться в опасных количествах в помещениях, где живут и работают люди. Поэтому важно знать ответ и на второй, поставленный выше вопрос.
Радон значительно тяжелее воздуха. То есть, при попадании в воздушную среду его основной объем концентрируется в нижних слоях воздуха. Поэтому потенциально-опасными местами считаются квартиры многоэтажных домов на первых этажах, частные домовладения, подвалы и полуподвалы. Эффективным способом избавления от этой угрозы является постоянное проветривание помещений и обнаружение источника поступления радона. В первом случае можно избежать опасной концентрации радона, который мог появиться в строении случайным образом. Во втором – уничтожить источник его постоянного возникновения. Естественно, что большинство людей не сильно задумываются о некоторых характеристиках использованных строительных материалов, а в холодное время года не всегда проветривают помещения. Многие подвалы вообще не имеют естественной или принудительной вентиляционной системы, поэтому и становятся источником концентрации опасного количества этого радиоактивного газа.
Учитывая все выше написанное, важно знать – как можно обнаружить радон в бытовых условиях, чтобы вовремя начать борьбу с его пагубным воздействием на человеческий организм. К счастью, существует оборудование, которое можно сегодня легко приобрести в специализированных магазинах, и способное решить поставленную задачу. Современные датчики радона (монитор радона) – компактные и удобные в использовании приборы, которые стоят недорого, по крайней мере – значительно дешевле стоимость дальнейшего излечения от целого списка опасных заболеваний, который включает в себя лейкемию и появление раковых опухолей.
Одной из неприятных особенностей радона является то, что воздух в помещении остается радиоактивным в течение недели, даже если вынести из него источник, выделяющий этот газ. Следовательно, избавиться от этой опасности можно только:
- Выполнить обследование помещений на наличие в воздухе опасного уровня концентрации газа радона;
- Сменить воздух, благодаря принудительной вентиляции;
- Убрать источник распространения радиации.
Только такой вариант последовательных действий гарантирует нужный результат и безопасность здоровья человека. Поэтому не стоит просто бежать отламывать куски гранита, выбрасывать их, и успокаиваться на этом.
Наша компания занимается производством современных и высокоэффективных датчиков — индикаторов газа радон, которые помогут выявить скрытую опасность в жилых и рабочих помещениях, где человек проводит значительную часть своего времени. Это очень эффективный и доступный способ, поэтому
Весь модельный ряд приборов, разработанный нашей компанией, – это итоговый результат труда ученых и опытных разработчиков, команда которых смогла создать простые в использовании, но очень эффективные приборы. Каждая выбранная модель — максимально подготовленная для использования в течение длительного времени в бытовых условиях, поэтому единоразовое вложение денег позволит защитить вас и ваших близких от широчайшего списка различных заболеваний и побочных эффектов, связанных с присутствием в помещениях радиоактивного газа Радон.
www.quarta-rad.ru
Чем опасен радон для здоровья человека
Решение вопроса с радоном на государственном уровне
Миф или реальность?
Чем опасен радон?
Немного о пользе радона
Всемирная организация здравоохранения и радон
Владение информацией – путь к безопасности
Радиоактивный газ радон известен человечеству немногим более ста лет. Впервые этим элементом заинтересовались в начале 20-го века в своих работах Пьер и Мари Кюри. Впоследствии уже другие ученые занимались этим вопросом, в том числе и его воздействием на человеческий организм. Последствия оказались настолько серьезны, что правительства многих стран, и нашей в том числе, приняли ряд законов, регулирующих вопрос с допустимым количеством этого газа в жилых и общественных помещениях.
Правительство Российской Федерации также уделило проблеме с газом радоном свое внимание. Благодаря этому, в 1995-ом году вступил в силу Федеральный закон, который предназначен для контроля концентрации этого элемента в помещениях, а также мерах безопасности в подобных случаях.
Согласно этому закону, концентрация газа радона в жилых помещениях не должна превышать 200 Бк на один кубический метр. Если замеры превышают допустимую норму, то необходимо выполнить противорадоновые мероприятия, призванные снизить количество радона до нормальных значений.
Важным моментом этого постановления является указание, которое должно выполняться при невозможности снизить концентрацию радиоактивного газ ниже, чем 400 Бк на один кубический метр помещения. Если все используемые меры защиты не помогли справиться с проблемой, то местные власти обязаны переселить жильцов опасного дома, а самому зданию поменять профиль использования или демонтировать полностью.
Радон. Миф или реальность?
Многие люди привыкли серьезно воспринимать опасность только в том случае, если она уже начала непосредственное влияние на человека. В противном случае относятся к ней с иронией и недоверием.
Несколько лет назад одна из отечественных компаний решила провести эксперимент – проверить выборочно некоторые квартиры на территории Владивостока. Результаты были шокирующие – в некоторых помещениях концентрация радона превышала норму в несколько десятков раз! Статистика же говорит о том, что в как минимум одной квартире из трех, расположенных на первом этаже многоэтажного дома количество этого газа опасно для здоровья человека! Такая удручающая статистика связана, прежде всего, с очень плохой вентиляцией в помещениях, особенно если говорить о давно эксплуатируемых домах, где этот важнейший элемент жизнеобеспечения людей может находиться в очень плачевном состоянии.
Еще одна проблема современных квартир – ванные комнаты или туалеты. Вспомните планировку подобных помещений. Практически всегда в них отсутствуют окна, выходящие наружу, поэтому вентиляция возможна только через общие вытяжки, проходящие через весь дом. Если они засорены, то радон стремительно начинает скапливаться в таких помещениях.
Конечно, здравомыслящего человека должен интересовать этот вопрос, особенно если учесть серьезное отношение к нему на высшем государственном уровне. И опасность действительно очень серьезная. Например, ученые выяснили, что именно газ радон является наиболее распространенной причиной возникновения рака легких, после, естественно, курения табачных изделий. А теперь представьте себе эффект, который даст повышенная концентрация этого газа в доме, где проживает курильщик? Возможность получения очень неприятного диагноза возрастает в десятки раз!
Но радиоактивные элементы поражает не только легкие человека. Ученые выяснили, что газ радон негативно влияет на иммунные, половые и кроветворные клетки. К чему это может привести? Первый вариант к потере естественно защищенности человеческого организма, что, естественно, провоцирует развитие самых разнообразных заболеваний. Второй вариант очень опасен тем, что пораженные клетки могут стать основой новой жизни – при зачатии ребенка, которые может родиться уже не полноценным. Третий вариант – лейкемия, тоже не самое приятное заболевание, излечиться от которого требует сил, времени и наличия хорошей суммы денег.
Кстати, исследователи, проводившие многолетние тесты, связанные с этим газом, выяснили, три четверти всего годового облучения, которые получает каждый человек, проживающий на нашей планете, связаны именно с радоном.
Немного о пользе радона
Удивительно, но этот очень опасный для человеческого здоровья радиоактивный газ нашел свое применение в современной медицине. Его используют в так называемых радоновых ваннах, которые позволяют излечивать достаточно внушительный перечень заболеваний.
Важно понимать, что категорически не рекомендуется использовать подобный элемент в процедурах самолечения или пользоваться услугами подозрительных лечебных заведений. Газ радон – очень опасен, поэтому работать с ним в качестве лечебного препарата могут только очень опытные специалисты, естественно, при наличии всего необходимого диагностического оборудования.
Всемирная организация здравоохранения и радон
Уровень вредного воздействия радона на человеческий организм настолько высок, что этой проблемой заинтересовались и во Всемирной организации здравоохранения. Согласно их отчету, от трех до четырнадцати процентов всех заболеваний раком легких в мире связанны с воздействием на человека именно этого радиоактивного газа. При показателях концентрации радона на уровне 100 Бк на один кубический метр в помещении, количество заболевших этим заболеванием увеличивается до 16-ти процентов.
В итоге ВОЗ приняла резолюцию, которая призвала все страны мира создать собственные национальные программы для борьбы с этой опасностью. В частности в нее входят такие пункты:
- Рекомендации к совершенствованию строительных кодексов, учитывая проблему радона.
- Снижение общепринятых допустимых норм до 100 Бк на один кубический метр (в некоторых государствах эта норма завышена в два, а то и в четыре раза!).
Под патронатом этой организации был создан специальный проект, который объединил в себе 30 стран, а также огромное число независимых организаций. Его цель – мониторинг заболеваний, связанных непосредственно с газом радон, а также реализация проектов, позволяющих существенно уменьшить его воздействие на человеческий организм.
Владение информацией – путь к безопасности
Это тот принцип, который следует применять в борьбе с влияние радона на человека. И наиболее эффективный способ получения подобной информации – применение специальных приборов, которые позволяют обнаружить и зафиксировать количество радиоактивного газа в жилых и рабочих помещениях.
Это легко можно сделать благодаря разработкам нашей компании, воплощенных в доступное, удобное и высокоэффективное оборудование, а именно индикатор радона. Он, прежде всего, предназначен для обнаружения и наблюдения за уровнем радиоактивного газа радона в бытовых условиях.
www.quarta-rad.ru
Радон — это… Что такое Радон?
| Внешний вид простого вещества | |
|---|---|
Бесцветный, слегка флюоресцирующий радиоактивный газ | |
| Свойства атома | |
| Имя, символ, номер | Радо́н / Radon (Rn), 86 |
| Атомная масса (молярная масса) | 222,0176 а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p6 |
| Радиус атома | 214 пм |
| Химические свойства | |
| Ковалентный радиус | 140—150 пм |
| Степени окисления | 0 |
| Энергия ионизации (первый электрон) | 1036,5(10,74) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | (газ, при 0 °C) 9,81 кг/м3 |
| Температура плавления | 202 (-71,15 °C) |
| Температура кипения | 211,4 (-61,75 °C) |
| Теплота плавления | 2,7 кДж/моль |
| Теплота испарения | 18,1 кДж/моль |
| Молярная теплоёмкость | 20,79[1] Дж/(K·моль) |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая |
| Прочие характеристики | |
| Теплопроводность | (300 K) (газ, при 0 °C) 0,0036 Вт/(м·К) |
| 86 | Радон |
| 4f145d106s26p6 | |
Радо́н — элемент главной подгруппы восьмой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 86. Обозначается символом Rn (Radon). Простое вещество радон (CAS-номер: 10043-92-2) при нормальных условиях — бесцветный инертный газ; радиоактивен, может представлять опасность для здоровья и жизни. При комнатной температуре является одним из самых тяжелых газов. Наиболее стабильный изотоп (222Rn) имеет период полураспада 3,8 суток.
История открытия и происхождение названия
Английский учёный Э. Резерфорд в 1899 году отметил, что препараты тория испускают, кроме α-частиц, и некое неизвестное ранее вещество, так что воздух вокруг препаратов тория постепенно становится радиоактивным. Это вещество он предложил назвать эмана́цией (от латинского emanatio — истечение) тория и дать ему символ Em. Последующие наблюдения показали, что и препараты радия также испускают некую эманацию, которая обладает радиоактивными свойствами и ведет себя как инертный газ.
Первоначально эманацию тория называли торо́ном, а эманацию радия — радо́ном. Было доказано, что все эманации на самом деле представляют собой радионуклиды нового элемента — инертного газа, которому отвечает атомный номер 86. Впервые его выделили в чистом виде Рамзай и Грей в 1908 году, они же предложили назвать газ нитон (от лат. nitens, светящийся). В 1923 году газ получил окончательное название радон и символ Em был сменён на Rn.
В публичной лекции 1936 г. Резерфорд кратко изложил итоги их работ:
Я помогал ему [профессору по электротехнике Оуэнсу в университете МакГилл в г. Монреале в Канаде с декабря 1898 г. по 26 мая 1899 г.] в проведении экспериментов, и мы обнаружили некоторые очень странные явления. Оказалось, что радиоактивное воздействие окиси тория может проходить сквозь дюжину листков бумаги, положенных поверх этой окиси, но задерживается тончайшей пластинкой слюды, как будто излучается что-то, способное диффундировать сквозь поры бумаги. Тот факт, что прибор был очень чувствителен к движению воздуха, поддерживал эту диффузионную гипотезу. Затем мы провели эксперименты, в которых воздух проходил над окисью тория, а потом попадал в ионизационную камеру. Эти опыты показали, что активность может переноситься воздухом. Однако, когда поток воздуха прекращался, активность в ионизационной камере не сразу исчезала, а уменьшалась постепенно по экспоненциальному закону. Я назвал это газообразное вещество, которое может диффундировать сквозь бумагу, переноситься воздухом и в течение некоторого времени сохранять свою активность, исчезающую по характерному закону, «эманацией тория». Я установил, что эта эманация обладает чрезвычайно своеобразным свойством делать радиоактивными тела, над которыми она проходит. Казалось, что это свойство, скорее всего, обусловлено осаждением некой материальной субстанции, а не какой-либо активностью, возникшей в самих телах под действием излучения, так как тогда количество осажденного вещества должно увеличиваться при приложении электрического поля. В те времена многие получали неповторяющиеся и странные результаты, помещая предметы вблизи радиоактивных веществ. По-видимому, все это могло объясняться наличием таких же эманаций, как обнаруженная нами у тория. Прежде чем считать такое объяснение правильным, необходимо было выяснить истинную природу эманации. Это было очень трудно, так как доступное количество ее всегда было очень мало.
Заслуга открытия радона, как химического элемента, часто приписывается также немецкому химику Фредерику Эрнсту Дорну (en:Friedrich Ernst Dorn, 1848—1916). Вопросы приоритета в открытии радона рассматриваются в работе Джеймса и Вирджинии Маршалл[2], где показано, что первооткрывателем радона как химического элемента следует считать Резерфорда. В 1900 г. Дорн открыл изотоп радона-222 с периодом полураспада 3,823 дня и опубликовал статью об этом, сославшись на более раннюю работу Резерфорда. Резерфорд, сперва с Оуэнсом, а затем один в 1899 г. работал с другим изотопом Rn-220 (тороном), период полураспада которого около 54,5 секунд. Резерфорд не знал о работах немца, так как тот опубликовал свою работу в немецком журнале с небольшим тиражом. Резерфорд не знал немецкого. Дорн совершенно не интересовался радиоактивностью. И только в 1902 г. Резерфорд и Содди экспериментально доказали, что эманация — это изотоп радона. Они сумели её охладить и превратить в жидкость с помощью новой физической установки в университете МакГилл и опубликовали статьи.
Нахождение в природе
Входит в состав радиоактивных рядов 238U, 235U и 232Th. Ядра радона постоянно возникают в природе при радиоактивном распаде материнских ядер. Равновесное содержание в земной коре 7·10−16% по массе. Ввиду химической инертности радон относительно легко покидает кристаллическую решётку «родительского» минерала и попадает в подземные воды, природные газы и воздух. Поскольку наиболее долгоживущим из четырёх природных изотопов радона является 222Rn, именно его содержание в этих средах максимально.
Концентрация радона в воздухе зависит, в первую очередь, от геологической обстановки (так, граниты, в которых много урана, являются активными источниками радона, в то же время над поверхностью морей радона мало), а также от погоды (во время дождя микротрещины, по которым радон поступает из почвы, заполняются водой; снежный покров также препятствует доступу радона в воздух). Перед землетрясениями наблюдалось повышение концентрации радона в воздухе, вероятно, благодаря более активному обмену воздуха в грунте ввиду роста микросейсмической активности.
Получение
Для получения радона через водный раствор любой соли радия продувают воздух, который уносит с собой образующийся при радиоактивном распаде радия радон. Далее воздух тщательно фильтруют для отделения микрокапель раствора, содержащего соль радия, которые могут быть захвачены током воздуха. Для получения собственно радона из смеси газов удаляют химически активные вещества (кислород, водород, водяные пары и т. д.), остаток конденсируют жидким азотом, затем из конденсата отгоняют азот и инертные газы (аргон, неон и т.д).
Физические свойства
Радон — радиоактивный одноатомный газ без цвета и запаха. Растворимость в воде 460 мл/л; в органических растворителях, в жировой ткани человека растворимость радона в десятки раз выше, чем в воде. Газ хорошо просачивается сквозь полимерные плёнки. Легко адсорбируется активированным углем и силикагелем.
Собственная радиоактивность радона вызывает его флюоресценцию. Газообразный и жидкий радон флюоресцирует голубым светом, у твёрдого радона при охлаждении до азотных температур цвет флюоресценции становится сперва жёлтым, затем красно-оранжевым.
Цвет свечения в газовом разряде у радона — синий, так как в видимой части спектра радона особо выделяются 8 линий, отвечающих длинам волн от 3982 до 5085 Å и лежащих главным образом в синей части спектра[3], однако из-за отсутствия стабильных изотопов применение его в газосветных приборах невозможно.
Химические свойства
«Благородный газ». Однако радон является наиболее активным благородным газом в химическом отношении, так как его валентные электроны находятся на максимальном удалении от ядра. Радон образует клатраты, которые, хотя и имеют постоянный состав, химических связей с участием атомов радона в них нет. С фтором радон при высоких температурах образует соединения состава RnFn, где n = 4, 6, 2. Так, дифторид радона RnF2 является белым нелетучим кристаллическим веществом. Фториды радона могут быть получены также под действием фторирующих агентов (например, фторидов галогенов). При гидролизе тетрафторида RnF4 и гексафторида RnF6 образуется оксид радона RnO3. Получены также соединения с катионом RnF+.
Применение
Радон используют в медицине для приготовления радоновых ванн. Радон используется в сельском хозяйстве для активации кормов домашних животных[1], в металлургии в качестве индикатора при определении скорости газовых потоков в доменных печах, газопроводах. В геологии измерение содержания радона в воздухе и воде применяется для поиска месторождений урана и тория, в гидрологии — для исследования взаимодействия грунтовых и речных вод. Динамика концентрации радона в подземных водах может применяться для прогноза землетрясений[4].
История вопроса
Открытие радиоактивности и радона совпало с повышением интереса к биологическим эффектам радиации. Было установлено, что вода многих источников минеральных вод богата эманацией радия (так именовался радон в то время). Вслед за этим открытием последовала волна моды «на радиацию». В частности, в рекламе того времени радиоактивность минеральных вод выдавалась за главный показатель их полезности и эффективности.
Естественный радиационный фон помещений зданий
Основные составляющие радиационного фона помещений в значительной степени зависят от деятельности человека. Это вызвано, прежде всего, такими факторами, как выбор строительных материалов, конструктивных решений зданий и применяемых в них систем вентиляции[5]. Измерения не всегда подтверждают сложившийся вывод о том, что в подвальных помещениях и на нижних этажах зданий радон скапливается в больших концентрациях, чем на верхних.
Биологическое воздействие
Попадая в организм человека, радон способствует процессам, приводящим к раку лёгких. Распад ядер радона и его дочерних изотопов в легочной ткани вызывает микроожог, поскольку вся энергия альфа-частиц поглощается практически в точке распада. Особенно опасно (повышает риск заболевания) сочетание воздействия радона и курения. Считается, что радон — второй по частоте (после курения) фактор, вызывающий рак лёгких преимущественно бронхогенного (центрального) типа. Рак лёгких, вызванный радоновым облучением, является шестой по частоте причиной смерти от рака[6].
Радионуклиды радона обусловливают более половины всей дозы радиации, которую в среднем получает организм человека от природных и техногенных радионуклидов окружающей среды.
В настоящее время во многих странах проводят экологический мониторинг концентрации радона в зданиях, так как в районах геологических разломов его концентрации в помещениях зданий могут носить ураганный характер и существенно превышать средние значения по остальным регионам.
Предельно допустимое поступление радона-222 через органы дыхания равно 146 МБк/год[1].
Изотопы
Радон не имеет стабильных изотопов. Наиболее устойчив 222Rn (T1/2=3,8235 дня), входящий в природное радиоактивное семейство урана-238 (семейство урана-радия) и являющийся непосредственным продуктом распада радия-226. Иногда название «радон» относят именно к этому изотопу. В семейство тория-232 входит 220Rn (T1/2=55,6 с), иногда его называют торон (Tn). В семейство урана-235 (урана-актиния) входит 219Rn (T1/2=3,96 с), его называют актинон (An). В одну из побочных ветвей (коэффициент ветвления 2·10−7) семейства урана-радия входит также очень короткоживущий (T1/2=35 мс) радон-218. Все отмеченные изотопы радона испытывают альфа-распад. Этими четырьмя нуклидами исчерпывается список природных изотопов радона. Известны ещё 30 искусственных изотопов Rn с массовым числом от 195 до 228. Некоторые нейтронодефицитные изотопы радона имеют также возбуждённые метастабильные состояния; таких состояний известно 13. Преобладающие моды распада у лёгких изотопов Rn — альфа-распад, позитронный распад и электронный захват. Начиная с массового числа A=212 альфа-распад становится доминирующим. Тяжёлые изотопы радона (начиная с A=223) распадаются преимущественно посредством бета-минус-распада.
Примечания
- ↑ 1 2 3 Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1995. — Т. 4. — С. 174. — 639 с. — 20 000 экз. — ISBN 5—85270—039—8
- ↑ James L. Marshall and Virginia R. Marshall (2003). «ERNEST RUTHERFORD, THE «TRUE DISCOVERER» OF RADON». Bulletin for the History of Chemistry 28 (2): 76-83.
- ↑ Библиотека НЕФТЬ-ГАЗ
- ↑ Уткин В. И., Юрков А. К. Динамика выделения радона из массива горных пород как краткосрочный предвестник землетрясения // Докл. РАН. 1998. Т.358. № 5. С.675-680.
- ↑ Назиров, Р. А. Снижение естественной радиоактивности цементных бетонов / Р. А. Назиров, Е. В. Пересыпкин, И. В. Тарасов, В. И. Верещагин // Научно-теоретический журнал Известия вузов «Строительство» — Новосибирск: НГАСУ, 2007. С. 45-49.
- ↑ S. Darby, D. Hill, R. Doll (2001). «Radon: A likely carcinogen at all exposures». Annals of Oncology 12 (10): 27. DOI:10.1023/A:1012518223463.
Ссылки
dic.academic.ru
Что такое радон? Элемент 18-й группы периодической системы химических элементов Д. И. Менделеева
В свете стремительного развития науки и техники специалисты выражают озабоченность отсутствием пропаганды радиационной гигиены среди населения. Эксперты прогнозируют, что в ближайшее десятилетие «радиологическое невежество» может стать причиной реальной угрозы безопасности общества и планеты.
Невидимый убийца
В XVΙ веке европейских медиков ставила в тупик аномально высокая смертность от легочных заболеваний среди работников рудников, добывающих железо, полиметаллы и серебро. Загадочный недуг, получивший название «горной болезни», поражал шахтеров в пятьдесят раз чаще, чем среднего обывателя. Только в начале XX века, после открытия радона, именно его признали причиной стимулирования развития рака легких горняков Германии и Чехии.
Что такое радон? Только ли отрицательное влияние оказывает он на организм человека? Чтобы ответить на эти вопросы, следует вспомнить историю открытия и изучения этого таинственного элемента.

Эманация — значит «истечение»
Первооткрывателем радона принято считать английского физика Э. Резерфорда. Именно он в 1899 году заметил, что препараты на основе тория кроме тяжелых α-частиц излучают бесцветный газ, приводящий к повышению уровня радиоактивности окружающей среды. Исследователь назвал предполагаемое вещество эманацией тория (от emanation (лат.) — истечение) и присвоил ему буквенное обозначение Em. Похожие эманации присущи также препаратам радия. В первом случае испускающийся газ получил название торон, во втором — радон.
В дальнейшем удалось доказать, что газы являются радионуклидами нового элемента. Выделить его в чистом виде впервые удалось шотландскому химику, Нобелевскому лауреату (1904 г.) Уильяму Рамзаю (совместно с Витлоу Греем) в 1908 году. Спустя пять лет за элементом окончательно закрепилось название радон и символьное обозначение Rn.

Что такое радон?
В периодической системе химических элементов Д. И. Менделеева радон находится в 18-й группе. Имеет атомный номер z=86.
Все существующие изотопы радона (более 35, с массовыми числами от 195 до 230) радиоактивны и представляют определенную опасность для человека. В природе встречаются четыре разновидности атомов элемента. Все они входят в состав естественных радиоактивных рядов актиноурана, тория и урана — радия. Некоторые изотопы имеют собственные названия и их, по исторически сложившейся традиции, называют эманациями:
- актиния — актинон 219Rn;
- тория — торон 220Rn;
- радия — радон 222Rn.
Последний отличается наибольшей стабильностью. Период полураспада радона 222Rn — 91,2 часа (3,82 суток). Время устойчивого состояния остальных изотопов исчисляется секундами и миллисекундами. При распаде с излучением α-частиц происходит образование изотопов полония. Кстати, именно при исследовании радона ученые впервые столкнулись с многочисленными разновидностями атомов одного и того же элемента, которые впоследствии и назвали изотопами (от греческого «равный», «одинаковый»).
Физические и химические свойства
В нормальных условиях радон — газ без цвета и запаха, присутствие которого можно определить только специальными приборами. Плотность — 9,81 г/л. Является самым тяжелым (воздух легче в 7,5 раз), самым редким и самым дорогим из всех известных на нашей планете газов.
Хорошо растворим в воде (460 мл/л), но в органических соединениях растворимость радона на порядок выше. Обладает эффектом флюоресценции, вызванным высокой собственной радиоактивностью. Для газообразного и жидкого состояния (при температуре ниже -62˚С) характерно голубое свечение, для кристаллического (ниже -71˚С) — желтое или оранжево-красное.
Химическая характеристика радона обусловлена его принадлежностью к группе инертных («благородных») газов. Ему свойственны химические реакции с кислородом, фтором и некоторыми другими галогенами.
С другой стороны, неустойчивое ядро элемента является источником частиц высоких энергий, влияющих на многие вещества. Воздействие радона приводит к окрашиванию стекла и фарфора, разлагает воду на кислород, водород и озон, разрушает парафин и вазелин и т. д.

Получение радона
Для выделения изотопов радона достаточно пропустить над веществом, содержащим радий в том или ином виде, струю воздуха. Концентрация газа в струе будет зависеть от многих физических факторов (влажности, температуры), от кристаллической структуры вещества, его состава, пористости, однородности и может колебаться от малых долей до 100%. Обычно используют растворы бромистого или хлористого радия в соляной кислоте. Твердые пористые вещества применяют гораздо реже, хотя радон при этом выделяется более чистым.
Полученную газовую смесь очищают от паров воды, кислорода и водорода, пропуская ее через раскаленную медную сетку. Остаток (1/25000 от первоначального объема) конденсируют жидким воздухом и из конденсата удаляют примеси азота, гелия и инертных газов.
Для заметки: во всем мире за год производится всего лишь несколько десятков кубических сантиметров химического элемента радона.
Распространение в природе
Ядра радия, продуктом деления которых является радон, в свою очередь образуются при распаде урана. Таким образом, основной источник радона — грунты и минералы, содержащие уран и торий. Наиболее высока концентрация этих элементов в магматических, осадочных, метаморфических породах, темноцветных сланцах. Газ радон вследствие своей инертности легко покидает кристаллические решетки минералов и по пустотам и трещинам в земной коре легко распространяется на большие расстояния, выделяясь в атмосферу.
Кроме того, грунтовые межпластовые воды, омывая такие породы, легко насыщаются радоном. Радоновая вода и ее определенные свойства использовались человеком задолго до открытия самого элемента.

Друг или враг?
Несмотря на тысячи научных и научно-популярных статей, написанных об этом радиоактивном газе, однозначно ответить на вопрос: «Что такое радон и каково его значение для человечества?» представляется затруднительным. Перед современными исследователями стоят, как минимум, две проблемы. Первая заключается в том, что в сфере воздействия излучения радона на живую материю он является одновременно вредным и полезным элементом. Вторая — в отсутствии достоверных средств регистрации и мониторинга. Существующие на сегодняшний день детекторы радона в атмосфере, даже самые современные и чувствительные, при повторении измерений могут выдавать результаты, различающиеся в несколько раз.
Осторожно, радон!
Основную дозу радиации (более 70%) в процессе жизнедеятельности человек получает благодаря природным радионуклидам, среди которых лидирующие позиции принадлежат бесцветному газу радону. В зависимости от географического расположения жилого строения, его «вклад» может составлять от 30 до 60%. Постоянное количество нестабильных изотопов опасного элемента в атмосфере поддерживается непрерывным поступлением из земных пород. Радон имеет неприятное свойство накапливаться внутри жилых и общественных помещений, где его концентрация может увеличиваться в десятки и сотни раз. Для здоровья человека опасность представляет не столько сам радиоактивный газ, сколько химически активные изотопы полония 214Po и 218Po, образующиеся в результате его распада. Они прочно удерживаются в организме, губительно воздействуя внутренним α-излучением на живую ткань.
Кроме астматических приступов удушья и депрессивного состояния, головокружения и мигрени, это чревато развитием рака легких. В группу риска входят работники урановых шахт и горно-обогатительных комбинатов, вулканологи, радонотерапевты, население неблагоприятных районов с высоким содержанием радоновых производных в земной коре и артезианских водах, радоновых курортов. Для выявления таких территорий составляют карты радоноопасности, применяя геологические и радиационно-гигиенические методы.
Для заметки: считается, что именно облучение радоном спровоцировало гибель от рака легких в 1916 году шотландского исследователя этого элемента Уильяма Рамзая.
Способы защиты
В последнее десятилетие, по примеру западных соседей, необходимые противорадоновые мероприятия стали распространяться и в странах бывшего СНГ. Появились нормативные документы (СанПин 2.6.1., СП 2.6.1.) с четкими требованиями по обеспечению радиационной безопасности населения.
К основным мерам по защите от почвенных газов и природных источников излучения относятся:
- Обустройство на земляном подполье деревянных полов монолитной бетонной плиты с щебеночным основанием и надежной гидроизоляцией.
- Обеспечение усиленной вентиляции цокольного и подвального пространства, проветривание жилых зданий.
- Вода, поступающая в кухни и ванные комнаты, должна подвергаться специальной фильтрации, а сами помещения оборудуются принудительными вытяжными устройствами.

Радиомедицина
Что такое радон, наши предки не знали, но еще славные всадники Чингисхана врачевали свои раны водами источников Белокурихи (Алтай), насыщенными этим газом. Дело в том, что в микродозах радон оказывает положительное влияние на жизненно важные органы человека и центральную нервную систему. Воздействие радоновых вод ускоряет обменные процессы, благодаря чему поврежденные ткани восстанавливаются гораздо быстрее, нормализуется работа сердца и системы кровообращения, укрепляются стенки сосудов.
Курорты горных районов Кавказа (Ессентуки, Пятигорск, Кисловодск), Австрии (Гаштейн), Чехии (Яхимов, Карловы Вары), Германии (Баден-Баден), Японии (Мисаса) издавна пользуются заслуженной славой и популярностью. Современная медицина кроме радоновых ванн предлагает лечение в форме орошения, ингаляции под строгим контролем соответствующего специалиста.

На службе человечества
Область применения газа радона не ограничивается одной лишь медициной. Способность изотопов элемента к адсорбции активно используется в материаловедении для измерения степени неоднородности металлических поверхностей и декорирования. В производстве стали и стекла радон служит для контроля протекания технологических процессов. С его помощью проводят проверку противогазов и средств химзащиты на герметичность.
В геофизике и геологии многие методы поиска и обнаружения залежей полезных ископаемых и радиоактивных руд основаны на применении радоновой съемки. По концентрации изотопов радона в почве можно судить о газопроницаемости и плотности горных образований. Мониторинг радоновой обстановки выглядит перспективным в плане прогнозирования предстоящих землетрясений.
Остается надеяться, что с негативными воздействиями радона человечество все-таки справиться и радиоактивный элемент будет приносить населению планеты только пользу.
fb.ru
Радон — Википедия. Что такое Радон
| Внешний вид простого вещества | |
|---|---|
Бесцветный, слегка флюоресцирующий радиоактивный газ | |
| Свойства атома | |
| Название, символ, номер | Радо́н / Radon (Rn), 86 |
| Атомная масса (молярная масса) | 222,0176 (наиболее стабильный изотоп) а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p6 |
| Радиус атома | 214 пм |
| Химические свойства | |
| Ковалентный радиус | 140—150 пм |
| Степени окисления | +2, +4, +6, +8[1] |
| Энергия ионизации (первый электрон) | 1036,5 (10,74) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | (газ, при 0 °C) 9,81 кг/м3 (жидк., при −62 °C) 4,4 г/см³ |
| Температура плавления | 202 K (−71,15 °C) |
| Температура кипения | 211,4 K (−61,75 °C) |
| Уд. теплота плавления | 2,7 кДж/моль |
| Уд. теплота испарения | 18,1 кДж/моль |
| Молярная теплоёмкость | 20,79[1] Дж/(K·моль) |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Прочие характеристики | |
| Теплопроводность | (300 K) (газ, при 0 °C) 0,0036 Вт/(м·К) |
| Номер CAS | 10043-92-2 |
| 86 | Радон |
| 4f145d106s26p6 | |
Радо́н — элемент 18-й группы периодической системы химических элементов Д. И. Менделеева (по старой классификации — главной подгруппы 8-й группы), 6-го периода, с атомным номером 86. Обозначается символом Rn (лат. Radon). Простое вещество радон при нормальных условиях — бесцветный инертный газ; радиоактивен, стабильных изотопов не имеет, может представлять опасность для здоровья и жизни. При комнатной температуре является одним из самых тяжёлых газов. Наиболее стабильный изотоп (222Rn) имеет период полураспада 3,8 суток.
История открытия и происхождение названия
В 1899 году Пьер и Мария Кюри обнаружили, что газ, находившийся в контакте с радием, остаётся радиоактивным в течение месяца[2]. Эрнест Резерфорд и Роберт Оуэнс позже в том же году отметили[3], что радиоактивность препаратов тория колеблется со временем. Позже Резерфорд объяснил это тем, что торий испускает, кроме α-частиц, и некое неизвестное ранее вещество, так что воздух вокруг препаратов тория постепенно становится радиоактивным[4]. Это вещество он предложил назвать эмана́цией (от лат. emanatio «истечение») тория и дать ему символ Em. Последующие наблюдения Резерфорда в 1901 году показали, что и препараты радия также испускают некую эманацию, которая обладает радиоактивными свойствами и ведёт себя как инертный газ[5], однако он в этой работе отметил приоритет супругов Кюри в открытии эманации. В 1903 году французский химик Андре-Луи Дебьерн обнаружил короткоживущую эманацию актиния[6].
Первоначально эманацию тория называли торо́ном, эманацию радия — радо́ном, актиния — актино́ном. Было доказано, что все эманации на самом деле представляют собой радионуклиды нового элемента — инертного газа, которому отвечает атомный номер 86. Впервые его выделили в чистом виде и измерили его плотность Уильям Рамзай и Роберт Уитлоу-Грей в 1908 году[7], они же предложили назвать газ нитон (от лат. nitens, светящийся). В 1923 году газ получил окончательное название радон, и символ Em был сменён на Rn.
В публичной лекции 1936 года Резерфорд кратко изложил итоги их работ:
Я помогал ему [профессору по электротехнике Оуэнсу в университете МакГилл в г. Монреале в Канаде с декабря 1898 года по 26 мая 1899 года] в проведении экспериментов, и мы обнаружили некоторые очень странные явления. Оказалось, что радиоактивное воздействие окиси тория может проходить сквозь дюжину листков бумаги, положенных поверх этой окиси, но задерживается тончайшей пластинкой слюды, как будто излучается что-то, способное диффундировать сквозь поры бумаги. Тот факт, что прибор был очень чувствителен к движению воздуха, поддерживал эту диффузионную гипотезу. Затем мы провели эксперименты, в которых воздух проходил над окисью тория, а потом попадал в ионизационную камеру. Эти опыты показали, что активность может переноситься воздухом. Однако, когда поток воздуха прекращался, активность в ионизационной камере не сразу исчезала, а уменьшалась постепенно по экспоненциальному закону. Я назвал это газообразное вещество, которое может диффундировать сквозь бумагу, переноситься воздухом и в течение некоторого времени сохранять свою активность, исчезающую по характерному закону, «эманацией тория».
Я установил, что эта эманация обладает чрезвычайно своеобразным свойством делать радиоактивными тела, над которыми она проходит. Казалось, что это свойство, скорее всего, обусловлено осаждением некой материальной субстанции, а не какой-либо активностью, возникшей в самих телах под действием излучения, так как тогда количество осаждённого вещества должно увеличиваться при приложении электрического поля. В те времена многие получали неповторяющиеся и странные результаты, помещая предметы вблизи радиоактивных веществ. По-видимому, всё это могло объясняться наличием таких же эманаций, как обнаруженная нами у тория.
Прежде чем считать такое объяснение правильным, необходимо было выяснить истинную природу эманации. Это было очень трудно, так как доступное количество её всегда было очень мало.
Заслуга открытия радона как химического элемента часто приписывается также немецкому химику Фридриху Дорну. Вопросы приоритета в открытии радона рассматриваются в работе Джеймса и Вирджинии Маршалл[8], где показано, что первооткрывателем радона как химического элемента следует считать Резерфорда.
В 1900 году Дорн открыл изотоп радона 222Rn с периодом полураспада 3,823 дня и опубликовал статью[9][10] об этом, сославшись на более раннюю работу Резерфорда. Резерфорд, сперва с Оуэнсом, а затем один в 1899 году работал с другим изотопом 220Rn (тороном), период полураспада которого около 55,6 секунды. Резерфорд не знал о работах немца, так как тот опубликовал свою работу в немецком журнале с небольшим тиражом. Резерфорд не знал немецкого. Дорн совершенно не интересовался радиоактивностью. И только в 1902 году Резерфорд и Содди экспериментально доказали, что эманация — это изотоп радона. Они сумели её охладить и превратить в жидкость с помощью новой физической установки в университете МакГилл и опубликовали статьи.
Нахождение в природе
Входит в состав радиоактивных рядов 238U, 235U и 232Th. Ядра радона постоянно возникают в природе при радиоактивном распаде материнских ядер. Равновесное содержание в земной коре 7·10–16% по массе. Ввиду химической инертности радон относительно легко покидает кристаллическую решётку «родительского» минерала и попадает в подземные воды, природные газы и воздух. Поскольку наиболее долгоживущим из четырёх природных изотопов радона (218, 219, 220, 222) является 222Rn, именно его содержание в этих средах максимально.
Концентрация радона в воздухе зависит, в первую очередь, от геологической обстановки (так, граниты, в которых много урана, являются активными источниками радона, в то же время над поверхностью морей радона мало), а также от погоды (во время дождя микротрещины, по которым радон поступает из почвы, заполняются водой; снежный покров также препятствует доступу радона в воздух).
Перед землетрясениями наблюдается повышение концентрации радона в воздухе, благодаря сейсмической активности[11]. Выход радона из земли в это время называется эксхаляция[12]
Получение
Для получения радона через водный раствор любой соли радия-226 продувают воздух, который уносит с собой радон-222, образующийся при радиоактивном распаде радия-226. Далее воздух тщательно фильтруют для отделения микрокапель раствора, содержащего соль радия, которые могут быть захвачены током воздуха. Для получения собственно радона из смеси газов удаляют химически активные вещества (кислород, водород, водяные пары и т. д.), остаток конденсируют жидким азотом, затем из конденсата отгоняют азот и инертные газы (аргон, неон и т. д.).
В одном грамме радия-226 возникает за сутки около 1 мм3 радона-222.
Физические свойства
Эмиссионный спектр радона, сфотографированный Э. Резерфордом в 1908 году. Числа на краях спектра представляют собой длины волн. Средний спектр принадлежит радону, внешние спектры — гелию (добавлены для калибровки длин волн)Радон — радиоактивный одноатомный тяжёлый газ без цвета и запаха. Растворимость в воде при комнатной температуре составляет 460 мл/л, что выше, чем растворимость более лёгких инертных газов. В органических растворителях и в жировой ткани человека растворимость радона в десятки раз выше, чем в воде. Газ хорошо просачивается сквозь полимерные плёнки. Легко адсорбируется активированным углём и силикагелем.
Собственная радиоактивность радона вызывает его флюоресценцию. Газообразный и жидкий радон флюоресцирует голубым светом, у твёрдого радона при охлаждении до азотных температур цвет флюоресценции становится сперва жёлтым, затем — красно-оранжевым.
Цвет свечения в газовом разряде у радона — синий, так как в видимой части спектра радона особо выделяются 8 линий, отвечающих длинам волн от 3982 до 5085 Å и лежащих главным образом в синей части спектра[13], однако из-за отсутствия стабильных изотопов применение его в газосветных приборах невозможно.
Плотность радона при нормальных условиях составляет 9,73 кг/м3, что примерно в 7,6 раз больше плотности воздуха.
Химические свойства
 схема электронных оболочек радона
схема электронных оболочек радонаВ химическом отношении радон является наиболее активным из благородных газов, так как его электроны внешних электронных оболочек имеют относительную низкую энергию ионизации.
Радон образует химические соединения с фтором. Так, дифторид радона RnF2 является белым нелетучим кристаллическим веществом.
Фториды радона могут быть получены также под действием сильных фторирующих агентов (например, фторидов галогенов: ClF3, BrF5, IF7[14]).
Получены также соединения с катионом RnF+: RnF[SbF6], RnF[Sb2F11][14].
Кроме фтора, радон может образовывать бинарные соединения с кислородом; в частности, был получен триоксид радона[15], однако получение других оксидов радона не подтверждено.
Кроме того, радон может входить в состав различных клатратов, которые, хотя и имеют постоянный стехиометрический состав, не образуют химических связей с участием атомов радона.
Применение
Радон используют в медицине для приготовления радоновых ванн (при этом их эффективность научно не доказана[источник не указан 491 день]). Радон используется в сельском хозяйстве для активации кормов домашних животных[1], в металлургии в качестве индикатора при определении скорости газовых потоков в доменных печах, газопроводах. В геологии измерение содержания радона в воздухе и воде применяется для поиска месторождений урана и тория, а также активных тектонических разломов, на наличие которых может указывать повышенное содержание радона в приземном и подпочвенном воздухе; в гидрогеологии — для исследования взаимодействия грунтовых и речных вод.
Динамика концентрации радона в подземных водах может применяться для прогноза землетрясений[16].
История
Открытие радиоактивности и радона совпало с повышением интереса к биологическим эффектам радиации. Было установлено, что вода многих источников минеральных вод богата эманацией радия (так именовался радон в то время). Вслед за этим открытием последовала волна моды «на радиацию». В частности, в рекламе того времени радиоактивность минеральных вод выдавалась за главный показатель их полезности и эффективности.
Радиационный фон помещений
Радиационный фон помещений зданий (РФП) — излучение земного и космического происхождения постоянно воздействующее на человека при его нахождении в пространстве внутри здания. РФП формируется, как естественный и технологически измененный радиационный фон; обычно причиной возникновения радиационного фона в зданиях является активность трех основных естественных долгоживущих радионуклидов: радий-226, торий-232 и калий-40, а также техногенного цезия-137 в строительных материалах и активность в воздухе короткоживущих изотопов (Т1/2<10 сут) радия и крайне редко тория. Основные составляющие радиационного фона помещений в значительной степени зависят от деятельности человека. Это вызвано, прежде всего, такими факторами, как выбор площадки для строительства, радиационных характеристик строительных материалов, конструктивных решений зданий и применяемых в них систем вентиляции[17][18]. Измерения не всегда подтверждают сложившийся вывод о том, что в подвальных помещениях и на нижних этажах зданий радон скапливается в больших концентрациях, чем на верхних. Безопасной средней по площади здания плотность потока радона на поверхности грунта считается менее 80 мБк/м2с для жилых зданий и 40 мБк/м2с для малоэтажных коттеджей[19].
Биологическое воздействие
Радон радиотоксичен и канцерогенен. Попадая в организм человека, он способствует процессам, приводящим к раку лёгкого. Распад ядер радона и его дочерних изотопов в лёгочной ткани вызывает микроожог, поскольку вся энергия альфа-частиц поглощается практически в точке распада. Особенно опасно (повышает риск заболевания) сочетание воздействия радона и курения. По данным департамента здравоохранения США радон — второй по частоте (после курения) фактор, вызывающий рак лёгких преимущественно бронхогенного (центрального) типа. Рак лёгких, вызванный радоновым облучением, является шестой по частоте причиной смерти от рака[20].
Радон и его дочерние продукты обусловливают более половины всей эффективной дозы облучения, которую в среднем получает организм человека от природных и техногенных радионуклидов окружающей среды.
В настоящее время во многих странах проведен мониторинг концентрации радона в зданиях как первый этап оптимизации защиты населения[21].
МКРЗ установила референтный уровень объемной активности радона в жилище на уровне 300 Бк/куб.м.[22]
Тестирование и снижение уровня радона
| Этот раздел описывает ситуацию применительно лишь к одному региону, возможно, нарушая при этом правило о взвешенности изложения. Вы можете помочь Википедии, добавив информацию для других стран и регионов. |
 Цифровой измеритель уровня радона
Цифровой измеритель уровня радонаСуществуют достаточно простые тесты, позволяющие измерить уровень радона. В некоторых странах такие тесты методически проводятся в местах, где систематически наблюдаются угрозы. Устройства для измерения уровня радона имеются в продаже. Цифровые устройства для измерения радона позволяют проводить текущие измерения, производящие ежедневные, еженедельные, краткосрочные и долгосрочные отчеты с помощью цифрового дисплея. Устройства для краткосрочного первоначального тестирования уровня радона недороги, и в некоторых случаях бесплатны. Существуют строгие правила проведения краткосрочных тестов, и их соблюдение крайне важно. Комплект для измерения уровня радона включает в себя коллектор, который необходимо повесить на нижнем этаже жилого дома на период от 2х до 7 дней. Далее пользователю необходимо отправить коллектор в лабораторию для анализа. Также доступны приборы для долгосрочного (на срок до одного года) измерения уровня радона. Есть возможность измерения количества выделяемого из земли радона до начала строительства [23]. Концентрация радона может меняться ежедневно, поэтому необходимы долгосрочные измерения средней концентрации радона в помещениях, где человек проводит значительную часть времени [24].
Концентрация радона подвержена естественным колебаниям из-за таких факторов, как смена погодных условий, поэтому первоначальный тест может дать неточный результат относительно средней концентрации радона. Уровень радона в воздухе максимален в наиболее холодной части дня, когда перепады давления наиболее велики[25]. Поэтому при обнаружении высокой концентрации радона (более 4 pCi/L) оправдано проведение повторных измерений перед осуществлением более дорогостоящих мероприятий по борьбе с выделением газа. Показания в промежутке от 4 до 10 pCi/L являются показанием к проведению долгосрочного теста. Показания выше 10 pCi/L требуют только дополнительного краткосрочного теста, дабы избежать чрезмерного промедления в борьбе с выделением газа. Покупателям недвижимости рекомендуется отложить или отказаться от покупки, если продавец не смог снизить уровень радона до 4 pCi/L или менее[23].
Поскольку период полураспада радона составляет всего 3,8 дней, удаление или изоляция источника значительно снижает угрозу в течение нескольких недель. Также можно снизить концентрацию радона с помощью изменения вентилирования сооружения. Концентрация радона, как правило, снижается при вентиляции помещения[26]. В хорошо проветриваемых помещениях концентрация радона имеет тенденцию выравниваться до уровня улицы (обычно 10 Бк/м3, в пределах от 1 до 100 Бк/м3)[23].
Есть четыре основных способа снизить концентрацию радона в домах[23][27]:
- Разгерметизация (всасывание почвы) за счет увеличения вентилирования между этажами
- Улучшение вентиляции помещения и предотвращение проникновения радона из подвальных помещений в жилые помещения
- Установка системы для удаления радона из подвальных помещений
- Установка систем вентиляции с положительным давлением
Согласно EPA[23], для уменьшения концентрации радона в первую очередь используются система труб дефлектора и вентилятор, высасывающие радон из-под дома наружу. Концентрация радона в помещении, как правило, может быть уменьшена с помощью разгерметизации и перенаправления загрязненного радоном воздуха в открытое пространство, вдалеке от окон и строительных отверстий. EPA рекомендует использовать методы, препятствующие проникновения радона в помещение. Всасывание почвы, например, предотвращает появление радона в доме, потому что радон из-под дома выпускается наружу через трубы, где он разбавляется[28]. EPA не рекомендует использовать герметизацию без других мер, поскольку использование такого метода не приводит к значительным и последовательным снижениям уровня радона[28].
Система вентиляции с положительным давлением может быть объединена с теплообменником для восстановления энергии в процессе воздухообмена с воздухом извне, поскольку исключительно выведение воздуха наружу может быть недостаточным решением, так как это может привести к всасыванию воздуха в жилище. В дома, построенные над погребами, можно установить листы пластика, покрывающие пустое пространство — это будет барьером для радона [23]. Вентиляционная труба и вентилятор используются для выведения радона из-под пласта пластика на открытый воздух. Этот способ выведения радона называется «подмембранное всасывание», и при правильном применении оно является самым эффективным способом выведения радона в домах с погребным помещением[24].
Изотопы
Радон не имеет стабильных изотопов. Наиболее устойчив 222Rn (T1/2=3,8235 суток), входящий в природное радиоактивное семейство урана-238 (семейство урана-радия) и являющийся непосредственным продуктом распада радия-226. Иногда название «радон» относят именно к этому изотопу. В семейство тория-232 входит 220Rn (T1/2=55,6 с), иногда его называют торон (Tn). В семейство урана-235 (урана-актиния) входит 219Rn (T1/2=3,96 с), его называют актинон (An). В одну из побочных ветвей (коэффициент ветвления 2·10−7) семейства урана-радия входит также очень короткоживущий (T1/2=35 мс) радон-218. Все отмеченные изотопы радона испытывают альфа-распад. Этими четырьмя нуклидами исчерпывается список природных изотопов радона. Известны ещё 30 искусственных изотопов Rn с массовым числом от 195 до 228. Некоторые нейтронодефицитные изотопы радона имеют также возбуждённые метастабильные состояния; таких состояний известно 13. Преобладающие моды распада у лёгких изотопов Rn — альфа-распад, позитронный распад и электронный захват. Начиная с массового числа A=212 альфа-распад становится доминирующим. Тяжёлые изотопы радона (начиная с A=223) распадаются преимущественно посредством бета-минус-распада.
Примечания
- ↑ 1 2 3 Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
- ↑ P.Curie, Mme. Marie Curie (1899). «Sur la radioactivite provoquee par les rayons de Becquerel». Comptes rendus hebdomadaires des séances de l’Académie des sciences 129: 714–716.
- ↑ E. Rutherford, R. B. Owens (1899). «Thorium and uranium radiation». Trans. R. Soc. Can. 2: 9–12.
- ↑ Rutherford, E. (1900). «A radioactive substance emitted from thorium compounds». Phil. Mag. 40: 1–4.
- ↑ E. Rutherford, H.T. Brooks (1901). «The new gas from radium». Trans. R. Soc. Can. 7: 21–25.
- ↑ Debierne, André-Louis (1903). «Sur la radioactivite induite provoquee par les sels d’actinium». Comptes rendus hebdomadaires des seances de l’Academie des sciences 136.
- ↑ W.Ramsay, R. W. Gray (1910). «La densité de l’emanation du radium». Comptes rendus hebdomadaires des seances de l’Academie des sciences 151: 126–128.
- ↑ James L. Marshall and Virginia R. Marshall (2003). «ERNEST RUTHERFORD, THE «TRUE DISCOVERER» OF RADON». Bulletin for the History of Chemistry 28 (2): 76-83.
- ↑ Dorn, Friedrich Ernst (1900). «Ueber die von radioaktiven Substanzen ausgesandte Emanation». Abhandlungen der Naturforschenden Gesellschaft zu Halle 22.
- ↑ Dorn, F. E. (1900). «Die von radioactiven Substanzen ausgesandte Emanation». Abhandlungen der Naturforschenden Gesellschaft zu Halle 23: 1–15.
- ↑ Уткин В. И., Юрков А. К. Радон как «детерминированный» индикатор природных и техногенных геодинамических процессов // Доклады РАН. 2009. Т. 426. № 6. С. 816—820.
- ↑ Уткин В. И., Юрков А. К. Отражение сейсмических событий в поле эксхаляции радона // Геофизика. 1997. № 6. С. 50-56.
- ↑ Михайленко Я. И. Курс общей и неорганической химии. — 1966. — С. 635. — 664 с.
- ↑ 1 2 Леонтьев А. В., Фомичева О. А., Проскурнина М. В., Зефиров Н. С. (1982). «Современное состояние химии радона». Успехи химии 51 (1): 23-39.
- ↑ A. G. Sykes. Recent Advances in Noble-Gas Chemistry // Advances in Inorganic Chemistry. — Academic Press, 1998. — Vol. 46. — P. 91–93. — ISBN 978-0120236466.
- ↑ Уткин В. И., Юрков А. К. Динамика выделения радона из массива горных пород как краткосрочный предвестник землетрясения // Докл. РАН. 1998. Т. 358. № 5. С. 675-680.
- ↑ Крисюк, Э.М. Радиационный фон помещений. — М.: Энергоатомиздат, 1989. — 120 с. — ISBN 5-283-02992-1.
- ↑ Р. А. Назиров, Е.В. Пересыпкин, И.В. Тарасов, В.И. Верещагин. Снижение естественной радиоактивности цементных бетонов // Известия высших учебных заведений. Строительство : науч. — теоретич. журн./ М-во высш. и сред. специального образования РФ, Ассоц. строит. вузов СНГ, Новосиб. гос. архитектурно — строит. ун-т. : журнал. — 2007. — Январь (№ 1). — С. 45—49. — ISSN 0536-1052.
- ↑ Таблица № 2 ТСН РБ-2003 МО
- ↑ S. Darby, D. Hill, R. Doll (2001). «Radon: A likely carcinogen at all exposures». Annals of Oncology 12 (10): 27. DOI:10.1023/A:1012518223463.
- ↑ WHO Handbook on Indoor Radon: A Public Health Perspective. — Geneva: World Health Organization, 2009-01-01. — (WHO Guidelines Approved by the Guidelines Review Committee). — ISBN 9789241547673.
- ↑ M. Tirmarche, J. D. Harrison, D. Laurier, F. Paquet, E. Blanchardon. ICRP Publication 115. Lung cancer risk from radon and progeny and statement on radon // Annals of the ICRP. — 2010-02-01. — Т. 40, вып. 1. — С. 1–64. — ISSN 1872-969X. — DOI:10.1016/j.icrp.2011.08.011.
- ↑ 1 2 3 4 5 6 United States Environmental Protection Agency. «A Citizen’s Guide to Radon».
- ↑ 1 2 Baes, Fred. Environmental and Background Radiation — Radon.
- ↑ Thad. Godish, (2001) . «Indoor Environment Quality». Boca Raton, FL. CRC Press LLC.
- ↑ Agency for Toxic Substances and Disease Registry, U.S. Public Health Service, In collaboration with U.S. Environmental Protection Agency. Toxicological profile for radon.
- ↑ World Health Organization. Radon and cancer, fact sheet 291.
- ↑ 1 2 Consumer’s Guide to Radon Reduction: How to fix your home.
Ссылки
wiki.sc
Радиоактивный газ 5 букв — РАДОН, как влияет на человека?
Ответы на эти и другие вопросы приведены в интервью заведующего лабораторией радиационно-экологического мониторинга жилых, общественных и промышленных комплексов МосНПО “РАДОН” Виктора Рогалиса, напечатанном в экологический журнал «Барьер безопасности» №6 2001, выдержки из которого мы приводим.
«До недавнего времени мало кто задумывался, что от радона страдают и обычные люди, никакого отношения к урану и атомной промышленности не имеющие. В нашей стране серьезно изучать воздействие радона на население стали около 10 лет назад, на Западе — уже лет 25. В НАТО даже создан специальный комитет по этой проблеме, а в Соединенных Штатах едва ли не в каждом доме есть датчики уровня радона. В России, прибор для наблюдения за уровнем радона называется — датчик — монитор радона.
Итак, что же такое радон?
Это — инертный тяжелый газ (в 7,5 раз тяжелее воздуха), который высвобождается из почвы повсеместно или выделяется из некоторых строительных материалов (например, гранита, пемзы, кирпича из красной глины). Радон не имеет ни запаха, ни цвета, а значит его не обнаружишь без специальных приборов — радиометров. Этот газ и продукты его распада излучают весьма опасные aльфа — частицы, которые разрушают живые клетки. Прилипая к микроскопическим пылинкам, aльфа — частицы создают радиоактивную аэрозоль. Ее-то мы и вдыхаем — именно так происходит облучение клеток дыхательных органов. Значительные дозы могут спровоцировать рак легких или лейкемию.
Как уберечься от радона?
Не может же человек не дышать или все время носить респиратор. И ведь все-таки радон в ответе за самый весомый вклад в дозу облучения. И как быть, если дом строится или уже построен на радоноопасном участке?
Это не значит, что там нельзя жить. Просто, такие дома должны быть хорошо изолированы от проникновения радона. При сооружении фундамента обязательно выполняется противорадоновая защита — между плитами прокладывается, например, битум. А за содержанием радона в таких помещениях необходим постоянный контроль.
Наиболее опасен радон для детей, в силу более низкой сопротивляемости детского организма. В некоторых классах и детсадовских группах концентрация (ЭРОА) радона достигает 60-80 Бк/м3, это на мой взгляд нельзя считать нормальным, хотя согласно Нормам радиационной безопасности (НРБ), содержание радона в воздухе жилых помещений не должно превышать 200 Беккерелей на метр кубический, и названные значения вполне укладываются в этот норматив.
Дело в том, что, мы, как правило, 80% своего времени проводим в помещении. Вот и получается, что эта норма (200 Бк/м3) в пересчете на дозовую нагрузку “выльется” в значение, превышающее 8 мЗ/год. А в “Основных санитарных правилах обеспечения радиационной безопасности (1999 г.)” такой уровень облучения классифицируется как высокий. Более того, в Великобритании, где действует все тот же гигиенический норматив — 200 Бк/м3, пришли к выводу, что такое содержание радона в жилых помещениях на 34% повышает риск лейкозов у детей. Поэтому для детских садов и школ мы уже и при 60 Бк/м3 обязательно рекомендуем выполнить тщательную изоляцию в подвальных помещениях и, повторюсь еще раз, почаще проветривать комнаты.»
www.quarta-rad.ru
Чем опасен газ радон? | Мир вокруг нас
Радиоактивные элементы естественного происхождения присутствуют повсюду в окружающей человека среде. В больших объемах образуются искусственные радионуклиды, главным образом в качестве побочного продукта на предприятиях оборонной промышленности и атомной энергетики. Попадая в окружающую среду, они оказывают воздействия на живые организмы, в чем и заключается их опасность. И наиболее опасен в этом плане радиоактивный газ радон.
Впервые открыл это вещество английский физик Э. Резерфорд в 1900 г., назвавший его эманацией (производное от латинского слова «истечение»). А современное имя «радон» дал ему английский физик Дорн в 1900 г, сопоставив его с первоначальным радием. Но радон образуется при распаде не только радия, но также урана, тория, актиния и других радиоактивных элементов.
1. Радон в природе.
Это благородный газ без цвета и запаха, ядовит, да еще и радиоактивен. Он легко растворяется в воде, а еще лучше в жировых тканях живых организмов. Так как радон довольно тяжел (в 7,5 раз тяжелее воздуха), он «обитает» в толщах земных пород, и, конечно, выделяется понемногу в атмосферу. Но не сам по себе, а в смеси с увлекающими его потоками других, более легких газов — водорода, углекислого газа, метана, азота и других. Все они порождаются глубинными процессами. Интересен тот факт, что радон, являясь инертным газом, не образует аэрозолей, т. е. не присоединяется к пылинкам, тяжёлым ионам и т. д. Из-за химической инертности и большого периода полураспада он может мигрировать по трещинам, порам почвы и пород на большие расстояния, причём довольно длительно (около 10 дней). Радон также содержится в некоторых минеральных водах, которые так и называются радоновыми.
2. Влияние на живые организмы.
Лишь недавно ученые выяснили, что наибольший вклад в радиоактивное облучение человека вносит именно радон. Он ответствен за ¾ годовой дозы облучения, получаемой людьми от земных источников радиации и примерно за половину этой дозы от всех природных источников. Установлено, что основная часть облучения происходит от дочерних продуктов распада радона — изотопов свинца, висмута и полония.
Продукты распада радона попадают в легкие человека вместе с воздухом и задерживаются в них. Распадаясь, выделяют альфа-частицы, поражающие клетки эпителия. Распад ядер радона в легочной ткани вызывает микроожоги, а повышенная концентрация газа в воздухе может привести к раку. Также альфа-частицы вызывают повреждения в хромосомах клеток костного мозга человека, что увеличивает вероятность развития лейкозов.
К сожалению, наиболее уязвимы для радона самые важные клетки — половые, кроветворные и иммунные. Частицы ионизирующей радиации повреждают наследственный код и, притаившись, никак себя не проявляют, до тех пор, пока «больной» клетке не настанет время делиться или создавать новый организм — ребенка. Тогда речь может идти о мутации клеток, приводящей к сбоям в жизнедеятельности человека.
3. Радон в доме.
В дом радон может попасть разными путями: Из недр Земли; из стен и фундамента зданий, т.к. строительные материалы (цемент, щебень, кирпич, шлакоблоки) в разной степени, в зависимости от качества, содержат дозу радиоактивных элементов; вместе с водопроводной водой и природным газом. Так как этот газ тяжелее воздуха, он оседает и концентрируется в нижних этажах и подвалах.
Самый значимый путь накопления радона в помещениях связан с выделением радона из почвы, на которой стоит здание. Большую опасность представляет поступление радона с водяными парами при пользовании душем, ванной, парной. Он содержится и в природном газе, и поэтому на кухне необходимо устанавливать вытяжку, чтобы предотвратить накапливание и распространение радона.
В 1995 году в нашей стране принят федеральный закон «О радиационной безопасности населения» и действуют специальные нормы радиационной безопасности. По нему следует, что при проектировании здания среднегодовая активность изотопов радона в воздухе не должна превышать 100 бк/куб.м (беккерелей на метр кубический). В жилых квартирах не более 200 бк/куб.м, иначе встает вопрос о проведении защитных мероприятий, а если значение достигает 400 бк — здание должно быть снесено или перепрофилировано.
Сейчас многие люди приобретают личные дозиметры, чтобы измерить общий фон радиации в квартире. Но для измерения уровня радона он бесполезен, тут необходимо вызывать специалистов с радиометром радона. Если вы хотите самостоятельно обезопасить свое жилище от вредного газа, вам следует заделать щели в стенах и полах, поклеить обои, загерметизировать подвальные помещения и просто чаще проветривать комнаты в вашем доме, замечу, что концентрация радона в непроветриваемом помещении в 8 раз больше.
4. Польза радона.
Но в природе нет ничего лишнего и помимо важных исследований в области химии и физики, радон используется во многих сферах человеческой жизни. Его используют в медицине для приготовления «радоновых ванн», в сельском хозяйстве для активации кормов домашних животных, в металлургии в качестве индикатора для определения скорости газовых потоков в доменных печах и газопроводах. Геологи с его помощью находят залежи радиоактивных элементов. Сейсмологи, анализируя выход радона из почв, могут спрогнозировать сильные землетрясения и извержения вулканов. Поэтому при успешных и своевременных мерах защиты даже такую «химеру» можно заставить служить человечеству.
shkolazhizni.ru