Фотодинамическая терапия рака
Рассмотрен новый метод диагностики и лечения злокачественных опухолей — фотодинамическая терапия рака. Изложены основные принципы метода, механизмы разрушения опухолей, дана оценка сенсибилизаторов первого и второго поколений. Указаны перспективные направления развития нового метода.
Фотодинамическая терапия рака — НОВЫЙ ЭФФЕКТИВНЫЙ МЕТОД ДИАГНОСТИКИИ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
А. Ф. МИРОНОВ
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова
ВВЕДЕНИЕ
Сегодня каждый пятый человек в мире умирает от рака. Онкологические заболевания чрезвычайно разнообразны и затрагивают глубинные механизмы жизнедеятельности клетки. Борьба с раком затруднена, поскольку заболевание связано с перерождением собственных клеток, механизм которого пока далек от окончательного понимания. Раковые клетки отличаются от нормальных двумя важными особенностями. Во-первых, они теряют способность останавливаться в своем размножении при достижении соседних родственных им клеток. Во-вторых, в своем безудержном делении они заполняют не только те места, что предназначены для их нормальной жизнедеятельности, но и другие пространства, им обычно не принадлежащие. Сегодня считается доказанным, что развитие раковой опухоли начинается из одной мутированной клетки. К моменту обнаружения опухоль обычно содержит 109 — 1010 переродившихся клеток. В то же время значительное число клеток, иногда более половины, по-прежнему остаются нормальными. Поэтому при удалении опухоли желательно использовать методы, позволяющие селективно устранять лишь переродившиеся клетки. К сожалению, существующие подходы, включая операции с высокоэнергетическими лазерами, различные радиоизотопные методы, химиотерапия, не обладают подобной селективностью.
Поиск эффективных и щадящих методов лечения ведется по разным направлениям и одним из них, несомненно, является фотодинамическая терапия рака. Еще в начале двадцатого столетия было обнаружено, что раковая клетка обладает одним чрезвычайно интересным свойством — она может селективно накапливать и некоторое время удерживать окрашенные вещества, как находящиеся в организме (эндогенные порфирины), так и вводимые в него извне (экзогенные порфирины). Возникла идея воздействовать на этот участок светом с длиной волны, возбуждающей лишь данные соединения, причем общая энергия света должна быть невысокой, чтобы не происходило поражения находящихся рядом здоровых клеток. Эта идея была реализована в 1978 году американским профессором Т. Догерти, который сообщил об успешном лечении первых 25 пациентов. В дальнейшем метод фотодинамической терапии рака (ФДТ) получил развитие в Англии, Франции, ФРГ, Италии, Японии, Китае, ряде других стран, а с 1992 года и в нашей стране.
В настоящем обзоре рассмотрена сущность метода ФДТ, механизмы деструкции раковой клетки, сенсибилизаторы, используемые в клинике, новые препараты, проходящие предклинические испытания, перспективные сенсибилизаторы и общие перспективы развития метода.
СУЩНОСТЬ МЕТОДА ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ РАКА
В отличие от большинства способов, используемых в онкологии, при ФДТ необходимо сочетание химиотерапевтических и физических методов воздействия. Отдельно взятые сенсибилизатор и низкоэнергетическое лазерное облучение практически не оказывают должного влияния.
На практике метод включает четыре этапа (рис. 1). На первом этапе пациенту вводят, обычно внутривенно, раствор сенсибилизатора. Второй этап продолжительностью от нескольких часов до трех суток необходим для накопления сенсибилизатора в опухоли. При этом в зависимости от химической природы вещества и типа опухоли устанавливается определенное соотношение концентрации сенсибилизатора в опухоли и окружающей нормальной ткани. Для используемых сегодня препаратов это отношение колеблется от 3 до 10. На этом этапе по флуоресценции сенсибилизатора судят о размерах опухоли и ее расположении. На третьем этапе пораженный участок облучают светом определенной длины волны в течение 15 — 20 минут. В качестве источника света обычно используется лазер и система световодов, которая позволяет доставлять свет во внутренние органы. В участках опухоли, содержащих сенсибилизатор, развиваются высокотоксичные фотохимические превращения, которые приводят к гибели раковых клеток. При этом соседние нормальные клетки сохраняются. Четвертый этап продолжительностью от 2 до 4 недель приводит к разрушению злокачественной опухоли и к частичному или полному восстановлению пораженных участков.
МЕХАНИЗМЫ ДЕСТРУКЦИИ РАКОВОЙ КЛЕТКИ
Транспорт сенсибилизатора к клетке осуществляется за счет различных компонентов крови, среди которых большое значение имеют комплексы белков с липидами, так называемые липопротеиды низкой плотности. Методами флуоресцентной микроскопии было показано, что сенсибилизаторы первоначально адсорбируются на внешней мембране клетки, в течение нескольких часов проходят через мембрану внутрь клетки и затем адсорбируются на внутренних мембранах органелл, таких, например, как митохондрии.
В результате освещения в клетке начинаются фотохимические процессы, в основе которых лежат два механизма. Реакции первого типа включают процессы, в которых образующаяся активная форма сенсибилизатора непосредственно взаимодействует с молекулой субстрата. Общий механизм по типу I представлен уравнениями (а) — (г):
C + hn *C
*C + RH JCH + RJ
JCH +O2 C +
RJ + O2
На первом этапе (а) молекула сенсибилизатора С под действием света переходит в возбужденную форму *C. Последняя реагирует с субстратом клетки, давая два радикала (б). Гидрированная форма сенсибилизатора (стадия в) окисляется кислородом воздуха в исходную структуру. Радикал субстрата RJ может окислять либо другие субстраты, либо присоединять кислород, образуя перекисные радикалы (г).
При втором механизме (тип II) возбужденная молекула сенсибилизатора взаимодействует с кислородом, давая активную синглетную форму кислорода 1О2 . Последняя обладает значительно большей подвижностью по сравнению с формой *C (тип I) и более активно окисляет внутренние элементы клетки. Механизм по типу II обычно преобладает при ФДТ.
Молекула сенсибилизатора С (рис. 2) при облучении переходит из основного состояния S0 в синглетное состояние S1 и затем в результате потери части энергии — в долгоживущее триплетное состояние Т1 . На стадиях синглетного и частично триплетного состояний сенсибилизатор может участвовать в фотохимических реакциях типа I. При достаточном времени жизни триплетного состояния и энергии, превышающей 94 кДж, возможно образование синглетного кислорода 1О2 , согласно переходу 5. В этом случае некроз клетки протекает, в основном, по типу II. На рис. 3 показаны реакции окисления некоторых биологически активных соединений синглетным кислородом. Это могут быть ненасыщенные липиды (реакции 1 и 2 ), из которых построены биологические мембраны, аминокислоты в составе белков (3, 4 ) и другие молекулы.
СЕНСИБИЛИЗАТОРЫ ПЕРВОГО ПОКОЛЕНИЯ НА ОСНОВЕ ПОРФИРИНОВ
Развитие и становление фотодинамической терапии рака тесно связано с разработкой первых сенсибилизаторов на основе порфиринов. В связи с этим целесообразно хотя бы кратко остановиться на этом классе природных соединений. Порфирины и их гидрированные аналоги — хлорины и бактериохлорины — играют важную роль в природе. Они входят в состав таких известных белков, как гемоглобин, миоглобин, ферментов каталазы, пероксидазы и многочисленной группы цитохромов. Эти гемопротеиды участвуют в транспорте кислорода и обеспечении животных организмов энергией. Фотосинтез и родственные ему процессы выполняются второй обширной группой порфиринов — хлорофиллами и бактериохлорофиллами. Первая группа порфиринов выступает в форме железных комплексов, а хлорины и бактериохлорины содержат магний.
В основе всех порфириновых соединений лежит сопряженное макроциклическое кольцо (1 ), состоящее из четырех пиррольных остатков, соединенных между собой метиновыми мостиками. Хлорины имеют два добавочных атома водорода (вместо двойной связи) в положениях 17 и 18, а бактериохлорины — 4 атома водорода в положениях 7, 8, 17 и 18. Более полные сведения о распространении порфиринов в природе и их свойствах можно получить в специальных изданиях, приведенных в конце статьи.
Большое количество порфиринов было исследовано в качестве сенсибилизаторов для ФДТ. Наиболее перспективным среди них оказался гематопорфирин IX, и именно на его основе Липсон с сотрудниками в 1961 году получил так называемое «производное гематопорфирина», которое Т. Догерти применил при лечении своих первых пациентов. И сегодня в медицинской практике наиболее широко используются препараты на основе гематопорфирина. Это Фотофрин в США и Канаде, Фотосан в ФРГ, HpD в Китае и Фотогем в России. Многочисленными работами, включая ряд наших исследований, показано, что образующийся по методике Липсона продукт состоит из мономерных порфиринов, димеров и высокомолекулярных олигомеров. Причем именно последние обладают наибольшей активностью при ФДТ. Порфириновые макроциклы в олигомерах соединены тремя типами связи — сложноэфирной (А ), простой эфирной (Б ) и углерод-углеродной связью (В ).
Одна из возможных структур олигомерного гематопорфирина.
Предполагается, что олигомеры при попадании в клетку подвергаются расщеплению по связи А и В, высвобождая мономерные порфирины. Этим можно объяснить повышение флуоресценции опухоли при ФДТ, несмотря на то, что первоначально накапливающиеся там олигомеры имеют слабое свечение. Таким образом, можно говорить о том, что олигомеры выполняют роль переносчиков мономерных порфиринов в клетку.
В настоящее время в ряде стран заканчивается клиническая проверка препаратов на основе гематопорфирина. При этом только в США курс лечения за период с 1978 по 1993 гг. прошли свыше 5000 больных. В результате получено разрешение на использование препарата Фотофрин 2 при различных типах рака. В нашей стране во второй половине 80-х годов под руководством автора этой статьи был разработан первый отечественный сенсибилизатор Фотогем, который в период с 1992 по 1995 год прошел клиническую проверку и с 1996 года разрешен для медицинского применения.
СЕНСИБИЛИЗАТОРЫ ВТОРОГО ПОКОЛЕНИЯ
Наряду с ныне используемыми препаратами активно исследуются новые соединения, получившие название сенсибилизаторов второго поколения. Основные требования к этим пигментам можно сформулировать следующим образом: 1) они должны иметь высокую селективность к раковым клеткам и слабо задерживаться в нормальных тканях; 2) обладать низкой токсичностью и легко выводиться из организма; 3) слабо накапливаться в коже; 4) быть устойчивыми при хранении и введении в организм; 5) обладать хорошей люминесценцией для надежной диагностики опухоли; 6) иметь высокий квантовый выход триплетного состояния с энергией не меньше 94 кДж/моль; 7) иметь интенсивный максимум поглощения в области 660 — 900 нм.
Если бы удалось найти соединение, обладающее всеми этими свойствами, то можно было бы говорить об идеальном сенсибилизаторе для ФДТ. Многочисленные полученные соединения лишь приближаются к этому стандарту. Первые четыре требования являются достаточно очевидными и не требуют пояснений. Пункт 5 нельзя рассматривать в отрыве от следующего пункта 6 — флуоресценция сенсибилизатора, необходимая для диагностики опухоли, и генерация синглетного кислорода (терапия) взаимосвязаны между собой и необходим разумный компромисс между этими требованиями. Для эффективной генерации синглетного кислорода сенсибилизатор должен иметь высокий квантовый выход триплетного состояния, достаточно продолжительное время жизни (10- 4 — 10- 2 с) и энергию триплетного состояния не ниже 94 кДж/моль для возможности передачи энергии молекуле кислорода. Квантовый выход синглетного кислорода является ключевым параметром при подборе сенсибилизатора. Большое значение имеет также наличие интенсивного максимума в красной и ближней инфракрасной части спектра. Это связано с тем, что видимый свет плохо проникает через кожу и ткани. Обширные и глубокорасположенные опухоли не могут быть освещены, и возможности ФДТ снижаются. На рис. 4 показано прохождение света различных длин волн через кожу и клетчатку с указанием распределения энергии.
Производные хлорофилла а
и бактериохлорофилла а
Упомянутые выше природные пигменты интенсивно изучают с целью создания сенсибилизаторов второго поколения. Они имеют приемлемые спектральные характеристики — 660 — 740 нм и 770 — 820 нм и достаточно высокие квантовые выходы синглетного кислорода. Немалое значение имеет также и то, что для этих соединений существует широкая сырьевая база: ежегодный биосинтез хлорофилла на нашей планете составляет около одного миллиарда тонн. Биотехнология позволяет выращивать биомассу, содержащую лишь один из изомеров — хлорофилл а и бактериохлорофилл а. К настоящему времени опубликованы в печати и запатентованы сотни возможных сенсибилизаторов. Мы укажем здесь в качестве примеров лишь некоторые из них.
Природный хлорофилл а (2) недостаточно устойчив для использования в ФДТ. Большей стабильностью обладает феофорбид а (3), который получают удалением иона магния и сложноэфирной группы (фитола). Феофорбид имеет интенсивный максимум поглощения в области 660 нм и хорошо генерирует синглетный кислород. Его недостатком, однако, является слабая растворимость в воде. Поэтому предложены многочисленные производные феофорбида с двумя, тремя и более карбоксильными группами. Следующим важным производным хлорофилла является хлорин е6 (4). Три кислотных остатка обеспечивают этому сенсибилизатору хорошую растворимость в воде. Среди производных хлорина особенно удачными оказались моно- и диамиды с природной аспарагиновой кислотой, получившие название МАСЕ (5) и DАСЕ (6). Они более успешно накапливаются в опухоли и легко выводятся из организма. Широкие исследования в области хлорина е6 в течение ряда лет проводились в Белоруссии под руководством профессора Г.П. Гуриновича. Результатом работ явилось создание препарата на основе хлорина е6 , который проходит сейчас клинические испытания.
Интересным сенсибилизатором на основе хлорофилла оказался пурпурин 18 (7а, R = -CH=Ch3). Выполненные в нашей лаборатории, а также в США группой профессора К. Смита исследования показали исключительную перспективность этого соединения для получения новых сенсибилизаторов. Так, химическая модификация винильной группы позволила получить производные с такими электроотрицательными группами, как ацетильная (7б) и формильная (7в), у последней основной максимум поглощения смещается до 740 нм! Если вспомнить, что сам хлорофилл и его производные имеют эту полосу около 660 нм, то подобный сдвиг в красную часть спектра следует признать весьма значительным.
С целью улучшения гидрофильных свойств пурпуринов были получены спиртовые производные (7г, д). Еще большей растворимости можно добиться, раскрыв ангидридный цикл в пурпурине действием оснований. К сожалению, хлорины (8а — д) уже не обладают теми спектральными характеристиками, которые имеют их предшественники. В этой связи представляет интерес способность хлоринов (8) в кислой среде снова переходить в пурпурины. Поскольку опухоль имеет повышенную кислотность, то можно ожидать, что хлорины, попадая в эти ткани, будут превращаться в циклические формы, выгодные для облучения.
Бактериохлорофилл а — основной фотосинтетический пигмент пурпурных бактерий — отличается от хлорофилла а дополнительным гидрированием двойной связи в положениях 7 и 8. Это приводит к смещению основной полосы поглощения в ближнюю ИК-область примерно на 100 нм. По аналогии с хлорофиллом а получены производные бактериохлорофилла и среди них сравнительно недавно в нашей лаборатории — бактериопурпурин с интенсивной полосой поглощения в районе 820 нм. Производные бактериохлорофилла по своим спектральным и фотофизическим характеристикам являются перспективными соединениями для ФДТ, но исследования в этой области по-настоящему разворачиваются только в последние годы.
Синтетические хлорины и бактериохлорины
Наряду с природными хлорофиллами существует большое число синтетических ди- и тетрагидропорфиринов, для которых уже успешно проведены биологические и клинические испытания.
В Англии профессор Р. Боннетт предложил в качестве сенсибилизаторов тетрагидроксифенилхлорин (9) и соответствующий бактериохлорин (10). Эти соединения имеют интенсивные максимумы в области 650 и 735, прекрасно генерируют синглетный кислород и обладают низкой фототоксичностью. Хлорин (9) под торговым названием Темопорфин успешно проверяется в клинике. Два дигидропорфирина — бензопорфирин (11) и этиопурпурин (12) — хорошо показали себя в серии предклинических и клинических испытаний. Однако эти сенсибилизаторы плохо растворяются в воде, что требует приготовления их липосомальных форм для введения в организм.
Тетраазапорфирины
Тетраазапорфирины представляют собой порфирины с четырьмя атомами азота вместо мезо-углеродных мостиков. Наиболее изученными соединениями этого ряда являются фталоцианины и нафталоцианины.
Фталоцианины (13, М = 2Н) имеют четыре бензольных кольца, сопряженных с макроциклом. Для них характерно наличие высокоинтенсивного пика в области 670 нм. Известно большое количество фталоцианинов с различными заместителями R и ионами металла в макроцикле. Комплексы с цинком, алюминием и кремнием проявляют повышенную биологическую активность. Особенно хорошие результаты получены для цинкового комплекса фталоцианина с четырьмя гидроксильными группами (13, М = Zn, R = OH) и холестерином в качестве аксиального лиганда к центральному иону металла.
Серьезная трудность при работе с фталоцианинами связана с их высокой гидрофобностью и необходимостью в связи с этим использовать липосомы. Для повышения растворимости в воде получают сульфированные металлокомплексы фталоцианинов (13, R = SO3H, М = Аl). К сожалению, при этом может образовываться смесь соединений, различающихся как количеством, так и положением сульфогрупп в макроцикле. Степень сульфирования сильно влияет на биологическую активность. Показано, что для алюминиевого комплекса фталоцианина активность возрастает в ряду: AlФцS4 AlФцS3 AlФцS2, где S2 — S4 обозначают количество сульфогрупп в макрокольце.
Нафталоцианины (14) имеют максимум поглощения в области хорошей проницаемости света через ткани при 750 — 780 нм, продолжительное время жизни триплетного состояния и эффективно генерируют синглетный кислород. К сложностям работы с этими соединениями относится их высокая гидрофобность и, как следствие, плохая растворимость в воде. Одним из достоинств нафталоцианинов является возможность использования при работе с ними сравнительно недорогих и компактных диодных лазеров. В заключение следует отметить, что в 1994 году начаты клинические испытания препарата Фотосенс — алюминий-сульфофталоцианина, разработанного коллективом авторов во главе с членом-корреспондентом Российской Академии наук Г.Н. Ворожцовым. Это первое использование фталоцианинов при ФДТ рака.
Аналоги порфиринов
В поисках новых сенсибилизаторов предложены аналоги порфиринов, имеющие иной тип сопряжения между пиррольными кольцами. В качестве примера можно указать на «расширенный порфирин» (15), у которого мезо-мостики заменены на сопряженную цепочку из трех углеродных атомов. Результатом этого является смещение основного максимума поглощения до 783 нм. Однако квантовый выход синглетного кислорода в этом случае оказался низким. Дальнейшее расширение порфиринового макроцикла до пяти углеродных атомов с тремя двойными связями смещает максимум поглощения до 997 нм, но при этом соединение вообще теряет способность к генерации синглетного кислорода.
Более близкими к порфиринам являются порфицены (16). По спектральным характеристикам они находятся между сенсибилизаторами первого и второго поколения: основной максимум поглощения лежит в области 630 — 660 нм и его интенсивность в 15 раз превосходит интенсивность аналогичной полосы в порфиринах. Для порфиценов характерно хорошее накопление в опухоли и низкая фототоксичность кожи.
НОВЫЕ НАПРАВЛЕНИЯ В ФДТ
Создание новых сенсибилизаторов и соответствующих им лазеров — не единственный путь повышения эффективности ФДТ. В последние годы серьезные усилия прилагаются для развития направленной фотодинамической терапии рака (НФДТ). Как следует из названия, метод основан на точной доставке сенсибилизатора в заданную цель. Для этого используются моноклональные антитела, липопротеиды, белки и другие носители. При этом многократно понижается количество используемого сенсибилизатора. Несмотря на очевидные достоинства НФДТ, трудности, которые возникают на пути конкретной реализации метода, пока не позволили приступить к проверке метода в клинической практике.
Другим принципиально новым подходом в ФДТ является предложенный канадским ученым Д. Кеннеди метод, основанный на таком регулировании биосинтеза порфиринов, при котором избыточно образующиеся в организме эндогенные порфирины сами направляются в опухоль. Естественно, что при этом отпадает необходимость введения в организм внешних сенсибилизаторов. Как же это происходит? Рассмотрим основные этапы биосинтеза порфиринов в организме.
На первом этапе под действием определенных ферментов, включая АЛК-синтетазу, образуется d-аминолевулиновая кислота (d-АЛК) — предшественница всех порфиринов, образующихся в дальнейшем в ходе биосинтеза. d-АЛК через ряд стадий превращается в протопорфирин IX и его комплекс с железом — протогем. Последний осуществляет контроль за образованием d-АЛК по механизму обратной связи. Чем больше его синтезируется в клетке, тем сильнее ингибируется фермент АЛК-синтетаза и, соответственно, меньше образуется d-АЛК. При добавлении d-АЛК «со стороны» контроль биосинтеза нарушается и образующиеся в значительном количестве порфирины начинают накапливаться в опухоли.
Метод Кеннеди предполагает местное нанесение d-АЛК в форме крема. Для освещения в этом случае используется обычная проекционная лампа. Полное излечение наблюдается в четырех случаях из пяти, что является очень высоким показателем. В настоящее время АЛК-ФДТ активно используется в ряде лабораторий для лечения кожных злокачественных заболеваний. В перспективе предполагается применение метода и для других типов опухолей при пероральном введении препарата.
ЗАКЛЮЧЕНИЕ
Методу фотодинамической терапии рака чуть больше 15 лет. За это время выполнен огромный объем клинических исследований. Успешно прошли курс лечения тысячи людей. Препарат Фотофрин разрешен для лечения рака легких, желудка, пищевода, матки, мочевого пузыря. В нашей стране завершены клинические испытания препарата Фотогем и на стадии проверки находится сенсибилизатор Фотосенс. Растет число новых сенсибилизаторов, которые либо уже испытываются, либо в скором времени такие испытания будут начаты. Ниже перечислены эти сенсибилизаторы, зарубежные фирмы, на которых осваивается их производство, и уровень их испытаний:
Приведенный перечень свидетельствует о серьезном интересе, который проявляет деловой мир к развитию фотодинамической терапии рака.
ЛИТЕРАТУРА
1. Порфирины: структура, свойства, синтез / Под ред. Н.С. Ениколопяна. М.: Наука, 1985. 333 с.
2. Миронов А.Ф. Фотосенсибилизаторы на основе порфиринов и родственных соединений // Итоги науки и техники. Совр. пробл. лаз. физ. М.: ВИНИТИ, 1990. Т. 3. 224 с.
3. Красновский А.А. Синглетный молекулярный кислород и первичные механизмы фотодинамического действия оптического излучения. // Там же.
4. Черняева Е.Б. и др. Механизмы взаимодействия фотосенсибилизаторов с клетками. // Там же.
5. Химическая энциклопедия. Порфирины. М., 1995. Т. 4. С. 144 — 149.
6. Химическая энциклопедия. Хлорофиллы. М., 1995. Т. 5.
* * *
Андрей Федорович Миронов, профессор, зав. кафедрой химии и технологии тонких органических соединений, декан Факультета биотехнологии и органического синтеза Московской государственной академии тонкой химической технологии им. М.В. Ломоносова, академик Российской Инженерной академии. Научные интересы связаны с химией природных и синтетических порфиринов и хлоринов, их металлокомплексов. Под его руководством разработан первый отечественный сенсибилизатор Фотогем для фотодинамической терапии рака, создаются препараты второго поколения на основе природных хлорофиллов. Автор свыше 250 научных публикаций, обзоров, двух монографий.
(с) http://www.pereplet.ru/obrazovanie/stsoros/147.html
kubanlaser.ru
лечение фдт шейки матки в гинекологии
Фотодинамическая терапия (ФДТ) — это один из нехирургических способов лечения рака и предраковых состояний. Во всем мире ФДТ активно используется с конца 70-х годов прошлого века, в России — уже в течение 10 лет.
В основе фотодинамической терапии лежит использование специальных веществ-фотосенсибилизаторов, избирательно накапливающихся в патологических клетках и повышающих их чувствительность к свету. Под действием световых волн определенной длины эти вещества вызывают фотохимическую реакцию и в результате приводят к образованию активных форм кислорода, который уничтожает злокачественные клетки. Затем погибшие клетки поглощаются «санитарами» организма — фагоцитами.
Кроме того, в процессе фотодинамической терапии повреждаются кровеносные сосуды, идущие к опухоли, что нарушает доставку питательных веществ и кислорода, и также способствует ее гибели.
Применение фотодинамической терапии
Фотодинамическая терапия показана в лечении разных форм рака и предраковых состояний, а также при заболеваниях кожи, глаз, ревматоидном артрите. Она хорошо переносится пациентами в любом возрасте и может использоваться как самостоятельный способ лечения. ФДТ применяют при сопутствующих тяжелых заболеваниях у пациента, при неэффективности традиционных способов или необходимости паллиативного лечения.
К преимуществам фотодинамического лечения относится то, что после него не остается шрамов и рубцов. Кроме того, фотодинамическую терапию можно применять при труднодоступной локализации рака, когда операцию провести затруднительно — например, на губе, на языке, на ушной раковине и др.
- Препараты-фотосенсибилизаторы вводят в вену или местно в области опухоли (способом аппликации). В течение 1–2 суток они накапливаются в раковых клетках, повышая их чувствительность к свету.
- Затем целевую область в течение нескольких минут облучают лазером.
- Гибель опухоли продолжается 2–3 месяца, здоровые окружающие ткани при этом не повреждаются.
- Как правило, одной такой процедуры бывает достаточно, но при необходимости можно проводить и повторные сеансы.
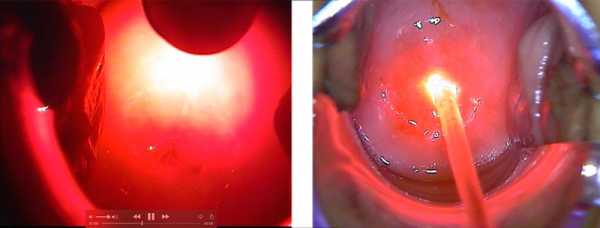
Фотодинамическая терапия при поражении шейки матки
Ограничением, которое процедура накладывает на образ жизни пациента, является необходимость избегать солнечных лучей в течение определенного времени.
Противопоказания к ФДТ
Фотодинамическая терапия противопоказана при заболеваниях печени, почек и сердца в стадии декомпенсации, во время беременности и лактации, а также людям с повышенной чувствительностью к фотосенсибилизаторам.
Запись на консультацию круглосуточно
www.euroonco.ru
|
Кандидат физико-математических наук Е. Лозовская
Фотодинамическая терапия — новый, но уже отлично зарекомендовавший себя способ лечения некоторых видов рака — активно развивается во многих странах мира с конца семидесятых годов прошлого века. В феврале нынешнего года исполнилось десять лет, как началось клиническое применение этого метода в России. На вопросы редакции отвечает руководитель отделения лазерной онкологии и фотодинамической терапии Государственного научного центра лазерной медицины Минздрава РФ доктор медицинских наук, профессор Е. Ф. Странадко. Беседу ведет специальный корреспондент журнала «Наука и жизнь» кандидат физико-математических наук Е. ЛОЗОВСКАЯ.
— Евгений Филиппович, расскажите, пожалуйста, на чем основан метод фотодинамической терапии? Судя по названию, лечение связано со светом?
-Этот метод основан на том, что опухолевые клетки разрушаются под действием активных форм кислорода, которые образуются в фотохимической реакции. Поэтому свет и в самом деле необходимый компонент фотодинамической терапии. Только свет определенных длин волн, а именно красный способен проникать в живые ткани. Чтобы повысить чувствительность тканей к красному свету, нужен фотосенсибилизатор — второй компонент фотохимической реакции. Причем такой сенсибилизатор, который способен избирательно накапливаться в опухолевых клетках. Третий необходимый компонент, без которого лечебный эффект невозможен, — это кислород, всегда присутствующий в живых организмах. Фотосенсибилизатор переносит энергию света на кислород, благодаря чему последний переходит в так называемое синглетное состояние. Синглетный кислород химически очень активен: он окисляет белки и другие биомолекулы и тем самым разрушает внутренние структуры опухолевой клетки. Клетка становится нежизнеспособной, и ее «съедают» фагоциты — «санитары» организма.
Стоит сказать, что кроме прямого уничтожения раковых клеток есть еще один важный эффект: фотодинамическая терапия вызывает повреждение кровеносных сосудов внутри опухоли, которые питают ее и доставляют кислород. А без питательных веществ опухоль, образно говоря, начинает погибать от голода. Таким образом, атака идет с двух сторон - разрушение клетки изнутри и «голодная блокада» снаружи.
— Как давно существует этот метод?
— Первый сеанс фотодинамической терапии был проведен почти сто лет назад, в 1903 году в Германии профессором Мюнхенского университета Г. Таппайнером и его коллегами. Тогда же был введен и термин «фотодинамическое действие». А началось все с того, что в 1897 году студент этого же университета Оскар Рааб обнаружил, что микроорганизмы, помещенные в раствор красителя акридинового оранжевого, гибнут на солнечном свету. Потом оказалось, что фототоксическим действием обладают и некоторые другие вещества, в частности эозин, ярко-розовый флуоресцирующий краситель. Первых пациентов с базальноклеточным раком кожи лица лечили так: пораженные места просто смазывали раствором эозина и затем облучали светом дуговой лампы.
Несмотря на успех этих опытов, метод развивался крайне медленно. В основном фотосенсибилиза торы пытались применять для диагностики рака, что, конечно, тоже было очень важно. Но по-настоящему интерес к фотодинамической терапии вспыхнул только в конце семидесятых годов, когда американский ученый Т. Догерти опубликовал впечатляющие результаты клинического применения этого метода. Догерти облучал пациентов светом лазера на красителях и использовал в качестве фотосенсибилизатора препарат на основе гематопорфирина, позднее получивший название «фотофрин».
— Когда началось развитие фотодинамической терапии в России?
— С конца восьмидесятых годов. Главным инициатором этого выступил член-корреспондент Российской академии медицинских наук, профессор О. К. Скобелкин. Зарубежный фотофрин был очень дорог, требовались доступные отечественные сенсибилизаторы. Российским аналогом фотофрина стал фотогем, созданный под руководством профессора А. Ф. Миронова в Московской академии тонкой химической технологии имени М. В. Ломоносова. Десять лет назад, в феврале 1992 года, этот препарат был впервые применен для лечения рака. Сейчас фотогем разрешен Министерством здравоохранения РФ для широкого клинического использования. Позднее появились и другие отечественные препараты — фотосенс, аласенс. Постоянно идет поиск новых соединений, и основные критерии отбора — это высокая степень избирательности по отношению к злокачественным тканям, поглощение в красной области спектра и быстрое выведение из организма.
— А почему фотосенсибилизатор накапливается именно в опухолевых клетках? С чем это связано?
— В фотодинамической терапии применяют в основном фотосенсибилизаторы из группы порфиринов. Еще в двадцатые годы было показано, что гематопорфирин, который, кстати, сам по себе присутствует в живом организме, имеет повышенное сродство к раковым клеткам. Почему это происходит, до сих пор до конца неясно, но есть данные, что порфирины связываются с сывороточными белками, в том числе с липопротеинами низкой плотности. А опухолевые клетки содержат большое количество особых рецепторов, к которым прикрепляются липопротеины. Поэтому фотосенсибилизаторы в комплексе с липопротеинами скапливаются на цитоплазматических мембранах клетки и мембранах внутриклеточных органелл: митохондрий, лизосом, ядра.
— Какие виды рака лучше всего поддаются фотодинамической терапии?
— Конечно, чаще всего мы применяем этот метод для лечения рака кожи и слизистых оболочек. Фотодинамическая терапия просто незаменима в тех случаях, когда опухоль расположена в «неудобных» местах: на губе, в полости рта, на веке, на ушных раковинах. Хирургическая операция в таких случаях ведет к серьезным косметическим дефектам и функциональным ограничениям. Представь те, к примеру, каково преподавателю или экскурсоводу согласиться на удаление языка. Это же настоящая трагедия! А методом фотодинамической терапии удается убрать такую опухоль без хирургического вмешательства.
По мере развития метода и накопления опыта мы начали применять фотодинамическую терапию и для лечения рака внутренних органов. Чтобы подвести свет к опухоли, используют эндоскоп — прибор, который очень широко применяется в современной медицине. Он позволяет нам добраться до опухолей, расположенных в желудке, пищеводе, трахее и крупных бронхах. Благодаря эндоскопической технике можно применять фотодинамическую терапию в гинекологии и при раке мочевого пузыря. Есть технические приемы, которые позволяют подвести свет к нужному месту пункционно, то есть через прокол. Этот способ используют при раке молочной железы. В последние годы стали отрабатывать технологию для поджелудочной железы, большого дуоденального сосочка, общего желчного протока и даже для внутрипеченочных протоков. Это те случаи, где хирургическая операция трудновыполнима, даже если опухоль небольшая.
— В качестве источника света всегда используют лазер?
— Обычно — да. Но в принципе можно применять любой источник, дающий свет той длины волны, которая возбуждает сенсибилизатор. Например, проекционные лампы, светодиоды. Лазер же нужен только потому, что лазерный пучок очень узкий и его можно ввести в тонкий моноволоконный кварцевый световод, чтобы потом этот световод через эндоскоп подвести к опухоли и произвести прицельное облучение поврежденного места. Для опухолей, расположенных снаружи, на поверхности тела, лазер необязателен, хотя и в этом случае узкий направленный пучок света очень удобен.
— Как подбирают дозы света и фотосенсибилизатора, как врачи находят тот нужный уровень воздействия, чтобы опухоль погибла?
— Есть определенные правила проведения клинических испытаний. Все препараты проходят предварительную экспериментальную проверку на культуре клеток и на животных. На первой стадии клинических испытаний проверяют, есть ли у препарата лечебный эффект и не вредит ли он здоровью, а на второй стадии подбираются дозы. И затем мы даем рекомендации по применению препарата с учетом размеров, формы и локализации опухоли.
В фотодинамической терапии используют низкоэнергетические лазеры и подбирают дозу облучения так, чтобы не был превышен порог чувствительности к термическому воздействию — он составляет примерно 400 милливатт на квадратный сантиметр. Если порог будет перейден, пациент почувствует боль и жжение. Нам удается этого избежать. Метод тем и хорош, что не требует анестезии, ни местной, ни общей. Он позволяет лечить тех пациентов, которым наркоз противопо казан или опасен.
— А что собой представляет сама лечебная процедура?
— Пациенту вводят раствор фотосенсибилизатора, обычно внутривенно. Чтобы сенсибилизатор накопился в опухоли, требуется некоторое время — от нескольких часов до двух-трех дней. Затем опухоль облучают светом, обычно в течение нескольких минут. Далее начинается процесс рассасывания опухоли — он продолжается 2-3 недели. Большинству больных достаточно одного сеанса, хотя в запущенных случаях через некоторое время лечение приходится повторять.
— Каковы основные преимущества фотодинамической терапии перед традиционными методами лечения рака?
— Прежде всего, локальность воздействия. Она обеспечивается тем, что, во-первых, сенсибилизатор накапливается избирательно, в опухоли. Во-вторых, мы направляем свет только на пораженный участок. Этим фотодинамическая терапия выгодно отличается от традиционных методов лечения рака.
Другой плюс — косметический. После фотодинамической терапии на коже остается лишь нежный рубец практически того же цвета, что и окружающие ткани, иногда с легкой пигментацией. Это исключительно важно для пациентов с опухолями на открытых участках тела.
— Неужели при фотодинамической терапии нет никаких побочных эффектов?
— Единственный и вполне естественный недостаток фотодинамической терапии — то, что после лечения пациенту приходится избегать яркого света, иногда довольно долго — до нескольких недель. Это связано с тем, что, хотя фотосенсибилизатор скапливается в основном в опухоли, все-таки какое-то его количество оседает в других тканях. В результате на некоторое время кожа становится излишне чувствительной к свету, поэтому пациенту лучше избегать солнечных лучей, иначе появятся отеки, краснота, а затем пигментация, напоминающая загар. Но и данный побочный эффект фотодинамической терапии скоро будет сведен к минимуму: сейчас уже синтезированы фотосенсибилизаторы, которые выводятся из организма за два-три дня.
— При химиотерапии раковые клетки со временем приобретают устойчивость к препаратам, подавляющим их рост. Не происходит ли что-то подобное при фотодинамической терапии?
— Очень интересный и важный вопрос. Если подходить с позиций логики, то устойчивости опухолей к фотодинамической терапии возникать не должно, потому что разрушающим фактором является кислород — только в более активном, чем обычно, состоянии. А кислород нужен всем живым клеткам — и нормальным и раковым. Поэтому клетка не может выработать устойчивость к кислороду — тем самым она обречет себя на вымирание.
Есть и еще один аргумент: при фотодинамической терапии нет мутагенного действия, то есть она не вызывает генетических изменений в клетках. А механизм появления опухолевых штаммов, устойчивых к химическим препаратам, связан именно с мутациями.
В клинической практике, по нашему опыту, до десяти повторных сеансов с одним и тем же фотосенсибилизатором не вызывали привыкания. Однако за рубежом в последние годы иногда появляются краткие сообщения о том, что в экспериментальных условиях отдельные виды раковых клеток проявляют определенную устойчивость к некоторым фотосенсибилизаторам. С чем это связано — пока не ясно, но наука не стоит на месте, и уже разрабатываются методики, которые позволят справиться и с этой проблемой, если она возникнет при лечении больных.
— Вы упоминали, что фотосенсибилизаторы используются не только для лечения, но и для диагностики. Расскажите об этом, пожалуйста.
— Да, благодаря способности многих фотосенсибилизаторов флуоресцировать опухоль можно как бы выделить на фоне здоровой ткани. Сейчас проходит клинические испытания российский препарат аласенс на основе производных d-аминолевулиновой кислоты, он очень удобен для флуоресцентной диагностики. Поскольку в злокачественных клетках сенсибилизатора гораздо больше, чем в окружающей ткани, то при освещении ультрафиолетом или видимым синим светом у опухоли появляется яркое красное свечение. Можно разглядеть и те очаги, которые при обычном освещении не видны. А раннее выявление рака — это, как правило, стопроцентное излечение.
— Каковы дальнейшие перспективы развития этого метода? Применяют ли его при других, не раковых заболеваниях?
— Да, безусловно. В течение последнего десятилетия, после того как фотодинамическая терапия завоевала прочные позиции в онкологии, ее начали активно применять и при других болезнях. Я не буду перечислять их все — список займет целую страницу, скажу лишь о наиболее интересных результатах.
Один из примеров — использование метода в офтальмологии, при возрастной дегенерации желтого пятна, которая нередко возникает у людей старше 50 лет. Начавшись, этот процесс прогрессирует, снижая остроту зрения. В области желтого пятна, где расположены зрительные анализаторы, развивается сеть мелких кровеносных сосудов. В результате нормальные здоровые ткани замещаются более плотными, фиброзными, не пропускающими света. На начальных этапах, которые тянутся годами, удается остановить процесс. Уже сотни людей пролечены этим методом за рубежом. К сожалению, у нас в стране офтальмологи пока не взяли его на вооружение. Зато мы совместно с МНТЦ «Микрохирургия глаза» использовали фотодинамическую терапию для профилактики помутнения пересаженной роговицы. Пересадка роговицы — это основной способ устранения ожогового бельма на глазу. Такая травма, как правило, результат несчастного случая, и страдают молодые люди. Но после пересадки в роговице может развиться патологическая капиллярная сеть, и тогда наступает рецидив слепоты. Вовремя проведенный сеанс фотодинамической терапии помогает избежать осложнений.
Другой пример — лечение атеросклероза. Атеросклеротические бляшки, как и опухолевые клетки, способны накапливать некоторые фотосенсибилизаторы. Поэтому фотодинамическую терапию начали применять для устранения бляшек в крупных артериальных сосудах, куда можно ввести световод. Эта процедура гораздо проще и дешевле, чем операция аортокоронарного шунтирования и другие аналогичные операции, а эффект тот же.
Недавно мы начали интенсивно использовать фотодинамическую терапию для лечения длительно незаживающих гнойных ран и трофических язв. Местное применение фотосенсибилизатора и облучения светом приводит к быстрому заживлению ран. Разумеется, сначала были проведены эксперименты на культурах патогенных микробов, часто встречающихся в гнойных ранах. Под действием света количество микроорганизмов, предварительно инкубированных в растворе сенсибилизатора, уменьшалось в сотни и тысячи раз. И что, быть может, самое главное — при фотодинамическом воздействии погибают и те штаммы бактерий, у которых выработалась устойчивость к антибиотикам.
Есть и другие перспективы — например, лечение ревматоидных артритов, поскольку патологические ткани, образующиеся в суставах при артрите, тоже способны накапливать сенсибилизатор.
С появлением новых эффективных фотосенсибилизаторов возможности применения метода станут еще шире. Кстати, американские ученые считают, что по значению для человечества изобретение фотодинамической терапии можно сравнить с открытием антибиотиков. Подробности для любознательных
ФОТОСЕНСИБИЛИЗАТОРЫ В ПРИРОДЕ И МЕДИЦИНЕ
Фотосенсибилизаторы — это вещества, которые способны «усиливать» действие света, а точнее, передавать его энергию другим веществам и тем самым запускать цепочку самых разных физических и химических процессов.
Чтобы органическое вещество было фотосенсибилизатором, его молекула непременно должна иметь в своем составе хромофорную группу атомов, которая способна поглощать свет в видимой или ближней ультрафиолетовой области спектра. Именно хромофоры (это слово происходит от греческого chroma — цвет) обеспечивают яркость красок в природе. Поглотив квант света, молекула получает дополнительную энергию и переходит в возбужденное состояние. При этом изменяется конфигурация ее электронного облака. Говоря упрощенно, один из двух электронов, находящихся на верхней заполненной молекулярной орбитали, перескакивает на более высокий уровень энергии. В зависимости от того, как взаимно ориентированы спины этих двух электронов, состояния называют синглетными или триплетными. Поглотив квант, молекула переходит из основного состояния в синглетное возбужденное. В таком состоянии она живет совсем не долго — не более нескольких микросекунд, то есть миллионные, а чаще всего лишь миллиардные доли секунды.
Что происходит дальше? Есть несколько путей. Молекула может излучить свет с другой длиной волны (это явление называют флуоресценцией), может рассеять энергию в тепло или же, например, просто развалиться на части. Но есть еще одна возможность, и именно она обычно реализуется в фотосенсибилизаторах — переход в триплетное состояние. Такой переход называется интеркомбинационной конверсией, при этом электрон меняет направление спина. Триплетные состояния — долгоживущие, разумеется по меркам микромира. Типичное время их жизни — это сотые и тысячные доли секунды, хотя в особых условиях, например в замороженном растворе, молекула может находиться в триплетном состоянии несколько секунд или даже десятков секунд. Для перехода из триплетного состояния в основное тоже есть несколько путей: тепловое рассеяние энергии, испускание света (фосфоресценция). Однако сотых долей секунды все же вполне достаточно, чтобы значительная часть возбужденных триплетных молекул успела передать свою энергию другим молекулам или вступить в химическую реакцию.
Наибольший интерес представляют те реакции, которые приводят к образованию свободных радикалов и активных форм кислорода. К примеру, возбужденный сенсибилизатор может оторвать атом водорода от молекулы белка. Белковая молекула превращается в радикал, и начинается цепочка окислительных реакций. Сам фотосенсибилизатор умудряется «выйти сухим из воды»: он позволяет кислороду оторвать уже не нужный ему водород и возвращается в исходное состояние, готовый поглотить очередную порцию света. Что касается кислорода, то он в результате превращается в очень активный анион-радикал, так называемый супероксид.
Если триплетная молекула сенсибилизатора напрямую сталкивается с молекулой кислорода, то кислород отбирает у сенсибилизатора энергию и сам переходит в возбужденное состояние. Кислород в синглетном возбужденном состоянии, как и супероксид, чрезвычайно активен: обе эти маленькие юркие частицы очень подвижны и способны окислить буквально все, что попадается у них на пути.
Фотосенсибилизаторы встречаются в природе довольно часто, они содержатся в организме человека и животных (например, порфирины - компоненты гемоглобина и других белков), входят в состав растений. Люди давно догадались, что растения, повышающие чувствительность к свету, можно использовать в медицине. Еще в ХIII веке арабские врачи применяли препараты из амми большой (семейство зонтичных) для лечения депигментации кожи (лейкодермии). Уже позднее выяснилось, что в состав амми входят фурокумарины — именно они и обеспечивают фотосенсибилизирующий эффект. Сейчас препараты на основе фурокумаринов в сочетании с облучением длинноволновым ультрафиолетом (320-390 нанометров) применяют для лечения псориаза, витилиго, микозов.
Но фурокумарины пригодны для применения только на поверхности кожи. Большая часть ультрафио лета поглощается в эпидермисе, то есть на глубине в одну десятую миллиметра. Слой кожи толщиной в два миллиметра почти полностью задерживает видимый свет в диапазоне 400-600 нанометров, и только красный свет с длинами волн 630-750 нанометров и инфракрасное излучение способны проникать в подкожные ткани. Кстати, в этом легко убедиться с помощью елочной гирлянды с миниатюрными разноцветными лампочками: прикройте кончиками пальцев синюю или зеленую лампочку и вы ничего не увидите, а вот свет от красной лампочки пройдет сквозь кожу и внутренние ткани, хотя и сильно ослабленный.
Поэтому для фотодинамической терапии раковых опухолей, активно развивающейся в последние десятилетия, используют сенсибилизаторы на основе порфиринов — они как раз поглощают красный свет. Кроме того, некоторые порфирины обладают замечательной способностью накапливаться именно в опухолевых клетках, что позволяет предотвратить или уменьшить повреждение здоровых клеток в процессе разрушения опухоли.
Окислительные процессы, которые «запускает» фотосенсибилизатор, для здоровых тканей вредны и опасны. К сожалению, среди широко распространенных лекарств много таких, которые обладают побочным фотосенсибилизирующим действием. Это фенотиазины, тетрациклины, сульфаниламиды, тиазиды, нестероидные противовоспалительные препараты, антибиотики на основе налидиксовой кислоты (фторхинолоны), пироксикам и некоторые другие. Поэтому тем, кто принимает эти препараты, не стоит проводить много времени на солнце — это может закончиться фотодерматитом или конъюнктивитом, а также увеличивает риск развития катаракты и рака кожи. Фотосенсибилизирующий эффект оказывают некоторые витамины, например рибофлавин (B2) и пиридоксин (B6).
Причиной повышенной чувствительности к свету могут стать и растения, причем совсем не экзотические, а самые обычные, например зверобой, в котором содержится сильный фотосенсибилизатор гиперицин. Из-за этого вещества иногда страдает домашний скот: если коровы случайно съедают много зверобоя, то после длительного пребывания на солнце на коже животных появляются краснота, волдыри, отеки. Известны случаи, когда фотодерматит возникал из-за контакта с соком зеленых частей петрушки, пастернака, сельдерея, которые содержат фурокумарины. |
libanomaly.ru
Фотодинамическая терапия при онкологических заболеваниях | Страницы сайта
В последнее время одним из новых методов комплексного лечения онкологических заболеваний, и востановления является метод ФДТ. При его использовании применяют «ФОТОСТИМ». Он предотвращает метастазирование и способствует быстрому восстановлению организма.
Онкология является отраслью медицины, которая занимается исследованиями раковых опухолей. Специалист в данной отрасли называется онкологом. Этот термин происходит от греческого onkos (?????), а это означает сгусток, массу, или опухоль и имеет суффикс — тупой, что означает «изучение».
Онколог часто координирует междисциплинарную помощь больным раком, которая может включать в себя физиотерапию, консультации, исследование клинической генетики, но это еще не все. Онкологу часто приходится взаимодействовать с патологоанатомами, чтобы узнать о точном биологическом характере опухоли, которые в настоящее время рассматриваются.
Онкология включает:
» Диагностику рака
» Терапию (например, хирургическое вмешательство, химиотерапию, лучевую терапию и другие методы)
» Паллиативную помощь больным злокачественными опухолями
» Этические вопросы, касающиеся ухода за больными раком
» Скрининг-усилия :
» Изучение населения или родственников пациентов (к которым в видам рака, подвержены по наследству, например такие, как рак молочной железы).
1. Диагностика
2. Терапия
3. Паллиативная помощь
4. Этические вопросы
5. Прогресс научных исследований в области онкологии
6. Дополнительные и альтернативные терапии
7. Специальности
Наиболее важным диагностическим инструментом остается медицинская история: характер жалоб и какие-либо конкретные симптомы (утомляемость, потеря веса, необъяснимая анемия, лихорадка неизвестного происхождения, paraneoplastic явлений и других знаков). Часто медицинское обследование позволяет выявить местонахождение опухоли.
К диагностическим методам относятся:
» Биопсия, либо incisional или excisional;
» Эндоскопия, либо верхниго или нижнего желудочно-кишечного тракта, бронхоскопия, или nasendoscopy;
» Х-лучей, сканирование КТ, МРТ сканирования, ультразвука и других радиационных технологий;
» Сцинтиграфия, одноместные фотоны выбросовКомпьютерная томография, Позитронно-эмиссионная томография и другие методы ядерной медицины;
» Анализ крови, в том числе опухолевые маркеры, которые могут увеличить подозрения некоторых видов опухолей или даже pathognomonic какого-либо конкретного заболевания.
Помимо диагностики в этих формах (в частности, изображений путем сканирования КТ) зачастую используется для определения функциональности, то есть можно ли хирургическим путем полностью удалить опухоль.
Как правило, биопсия считается необходимой для точного диагноза. Когда ее не возможно сделать, то проводят «эмпирическую терапию» (без точного диагноза) может быть предоставлена на основе имеющихся доказательств (например, истории, рентгена и сканирования.)
Она полностью зависит от характера определенной опухоли, какого рода терапевтическое вмешательство будет необходимо. Некоторые опухоли требуют немедленной химиотерапии и приема лекарств (такие, как все или БОД), в то время как другие больные будут проходить регулярный медицинский осмотр и сдавать анализы крови.
Часто хирурги пытаются удалить опухоль целиком. Это бывает возможным лишь тогда, когда существует определенная степень уверенности в том, что опухоль может быть в действительности быть удалена. Когда есть уверенность в том, что части опухоли останутся. Лечебная хирургии зачастую невозможна, например, когда есть метастазы распространились в другие места, или когда опухоль вторглась в органы, которые не могут эксплуатироваться, не рискуя при жизни пациента. Иногда операция может улучшить выживание, даже если новообразование ткани было удалено не полностью, процедура называется «debulking» (т.е. снижение общего объема опухолевой ткани). Хирургия используется также для паллиативного лечения некоторых видов рака, например, для облегчения желчной обструкции, или для облегчения проблем, связанных с опухолями головного мозга. Риск операции необходимо сопоставлять с выгодами.
используются в качестве первой линии терапии в радикальных случаях — злокачественные. Они используются также для вспомогательной терапии, то есть когда макроскопические опухоли уже были полностью удалены хирургическим путем, но имеются достаточные статистические риски, что они будут повторяться. Химиотерапия и лучевая терапии обычно используются для palliation, где это заболевание является точно неизлечимым: в такой ситуации цель состоит в том, чтобы облегчить боли и продлить жизнь.
Гормоны манипуляций хорошо изучены, в частности в лечении рака груди и рака простаты.
Существует в настоящее время быстрый рост в использовании лечения моноклональных антител, в первую очередь для лимфомы (Rituximab), а также рак молочной железы (Trastuzumab).
Вакцины и другие терапии по повышению иммунитета являются предметом интенсивных исследований.
Применение ультразвука в форме HIFU твердых опухолей находится в стадии исследования.
Значительная часть работы онколога заключается во взаимодействии онкологических больных, которые были успешно вылечены. Для некоторых видов рака, на ранней стадии выявления рецидивов, с оперативным лечением, могут привести к успешным результатам и продлить жизнь. Это зависит от характера рака. Некоторые онкологические центры работают по программам, одобренным Американской коллегией хирургов и должны придерживаться стандартов, установленных этой организацией. Один из этих стандартов требует ежегодного follow-up, каждого пациента включают в реестр раковой программы на всю оставшуюся жизнь пациента. Это своего рода долгосрочный follow-up помогает проанализировать длительность жизни и повторение болезни через большое количество времени после первого успешного лечения.
Примерно 50% всех случаев заболевания раком в западном мире можно вылечить радикальными методами лечения. Для педиатрических пациентов, эта цифра гораздо выше. Большое число онкологических больных умирает от этой болезни, а значительная часть пациентов, с неизлечимым раком, умирает по другим причинам. Это может быть связано с текущими проблемами, не проконтролированными симптомами, связанными с прогрессированием рака, а также при лечении этого заболевания. Эти проблемы могут включать в себя боль, тошноту, отсутствие аппетита, усталость, неподвижность, а также депрессии. Не все вопросы носят строго физический характер, могут быть затронуты личные достоинства. Моральные и духовные вопросы также имеют большое значение.
Хотя многие из этих проблем входят в сферу онкологии, паллиативный уход, созревший в отдельных, тесно связанных специальностях по решению проблем, связанных с запущенной стадией заболевания. Паллиативная помощь является неотъемлемой частью междисциплинарного ухода команды за больным раком. Паллиативная помощь может быть не меньше эффективной, когда медсестры и врачи онкологического центра имеют возможность посещать пациентов на дому.
Есть целый ряд повторяющихся этических вопросов и дилемм в онкологической практике. К ним относятся:
» Какую информацию предоставить пациенту о степени болезни (продвижение) прогноз.
» Участие в клинических испытаниях, особенно лицам с неизлечимой болезнью.
» Методы активного лечения.
» «Не возродить» заказов и другой конец жизни.
Эти вопросы тесно связаны с личностями пациентов, религией, культурой, личной и семейной жизнью. Ответы редко бывают однозначными. Пациенты обладают высокой степенью чувствительности и со стороны команды онкологии требуются определенный подход для правильного решения этих проблем.
В последнее время одним из новых методов комплексного лечения онкологических заболеваний, и востановления является метод ФДТ. При его использовании применяют «ФОТОСТИМ».
Существует огромное количество исследований, проводимых на всех границах онкологии, начиная от рака клеточной биологии до лечения химиотерапией и оптимального паллиативного ухода и боли. Онкология это делает постоянно в быстро меняющейся сфере.
Лечебные судебные процессы часто связаны с пациентами из разных больниц в конкретном регионе. В Великобритании, пациенты часто участвуют в крупных исследованиях, координируемых организация по исследованию рака Великобритании (CRUK) [1], Медицинский исследовательский совет (MRC) [2], Европейская организация по исследованию и лечению рака (EORTC) [3] или Национальная онкологическая научная сеть (NCRN) [4].
Дополнительные и альтернативные терапии
Основная статья: Альтернативная медицина
Многие больные раком используют дополнительную помощь и дополняют основное лечение альтернативными методами лечения. Большинство дополняют терапию, не имея твердой научной или доказательной базы. Некоторые пациенты, несомненно, находят, что дополняющая терапия эффективна.
Хотя большинство больных дополняют терапию, и вероятно она является безвредной и может быть дорогостоящей. Они могут быть также позитивно вредными, если пациент отказывается от обычного лечения вообще, отдавая предпочтение альтернативной медицине. Некоторые альтернативные методы, несомненно, являются опасными.
Есть несколько подвидов в рамках специальности онкологии. Кроме того, онкологи нередко развивают интерес в опыте управления конкретными видами рака.
Онкология может быть подразделена на основании видов лечения:
» Радиационная онкология — лечение в первую очередь с радиацией, и этот процесс называется радиотерапией.
« Хирургическая онкология — врачи, которые специализируются на удалениях опухолей.
» Медицинская онкология — лечение в первую очередь наркотиками, например, химиотерапия.
» Гинекологическая онкология — основное внимание уделяется раковым заболеваниям женской репродуктивной системы.
» Детская онкология — включается в себя диагностику и лечение рака у детей
В Соединенном Королевстве и ряде других стран, онкологи могут быть либо клиническими или медицинскими. Основное различие заключается в том, что клинические онкологи используют лучевую терапию, в то время как медицинские онкологи этого не делают. (Эта разница не применяется в Северной Америке, здесь клинические и медицинские онкологи взаимозаменяемые.)
В ветеринарной медицине, ветеринарной онкологи является югу от специальности, что касается диагностики рака и лечения животных.
Термины:
Скрининг — это методический подход, который используется с целью выявления определенного заболевания (группы заболеваний) или факторов, способствующих развитию данного заболевания (фактора риска:
Paraneoplastic-синдром — является симптомом заболевания, который является следствием наличия рака в организме, но это не связано с местным присутствием раковых клеток. Эти симптомы являются гуморальными факторами (на гормоны и цитокины) экскременты опухолевых клеток или иммунного ответа против опухоли. Paraneoplastic-синдромы характерны среди среднего возраста для пожилых больных, и они наиболее часто присутствуют у больных раком легких, молочной железы, яичников или лимфатической системы (лимфомы). Иногда симптомы синдрома paraneoplastic могут появиться еще до диагностики злокачественных опухолей.
bewell.ru
Фотодинамическая терапия рака: преимущества, суть, фото
Фотодинамическая терапия представляет собой инновационную методику лечения и диагностики злокачественных новообразований, которая включает применение фотосенсибилизирующих веществ и лазерного облучения пораженных раком тканей.
Показания к проведению фотодинамического лечения
- Раковые поражения кожных покровов (базальноклеточная и плоскоклеточная форма) и меланома.
- Злокачественные новообразования, нечувствительные к традиционным противораковым методикам.
- Рецидивные и метастатические опухоли.
- Раковые очаги, которые расположены в труднодоступных местах для хирургического вмешательства.
- Отказ пациента от оперативного иссечения новообразования.
Противопоказания
- Хронические деструктивные и воспалительные заболевания почечной, сердечно-сосудистой или респираторной системы в стадии декомпенсации.
- Для пациентов женского пола: беременность и период лактации.
- Реакции гиперчувствительности к компонентам фотодинамический препаратов.
Суть фотодинамического метода лечения рака
Фотодинамика проводится с помощью сочетания химиотерапевтического и физического воздействия на очаг злокачественного роста. В качестве цитостатического средства при этой методике применяется сенсибилизатор, а физиотерапевтический эффект обеспечивает низкоэнергетическое излучение лазера.
Фотодинамическая терапия в онкологии включает осуществление следующих последовательных этапов:
- Внутривенное введение сенсибилизирующего раствора.
- Накопление химиотерапевтического средства в патологически измененных тканях. В зависимости от вида препарата и локализации опухоли, данный этап может длиться от нескольких часов до 3 суток. По степени концентрации сенсибилизатора врачи судят о размере и расположении опухоли. Именно на этом этапе врачи-онкологи диагностируют онкологию.
- Облучение мутированных тканей лазерными лучами. В случае глубокого расположения опухоли источник излучения доставляется к пораженному органу через систему светодиодных трубок. Под воздействием лазера в опухолевых тканях, содержащих фотосенсибилизатор, происходит токсическая реакция. При этом близлежащие здоровые клетки не поддаются разрушению.
- Распад раковой опухоли и восстановление мутированных тканей. Длительность этого этапа в среднем составляет около одного месяца.
Механизм клеточной деструкции во время фотодинамики
Фотодинамическая терапия рака базируется на фотохимических реакциях внутри пораженной клетки. Липопротеиды пониженной плотности, которые соединяются с сенсибилизатором в крови, переносят это вещество к атипичным клеткам. Первоначально химиотерапевтический препарат присоединяется к внешней клеточной мембране. Через несколько часов лекарственное средство проникает во внутриклеточное пространство. В конечном итоге данное вещество концентрируется во всех органеллах, а особенно в клеточных митохондриях, которые обеспечивают питание клетки.
Под действием лазерного излучения в раковой опухоли запускается механизм разрушения, в ходе которого образуются свободные радикалы. Токсические вещества являются пусковым механизмом клеточного некроза.
Важно знать: Таргетная терапия – инновация в лечении рака
Препараты, которые используют в фотодинамике
Для проведения фотодинамического лечения врачи-онкологи используют следующие препараты:
- Сенсибилизаторы первого поколения, в состав которых входят порфирины.
- Второе поколение фотосенсибилизаторов.
Основные требования к таким препаратам включают:
- Обладать повышенным концентрированием в раковом новообразовании и при этом не задерживаться в здоровых тканях.
- Препарат должен иметь низкую токсичность и после фотодинамической терапии легко выводится с организма.
- Не накапливаться в кожных покровах.
- Подобные средства должны быть устойчивыми к хранению и введению в кровеносную систему.
- Люминесцентные качества сенсибилизатора способствует проведению предварительной диагностики онкологии.
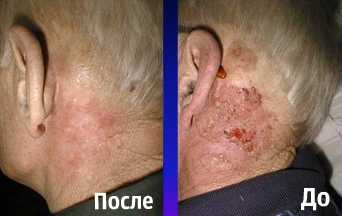
Фотодинамическая терапия местнораспространенного рака кожи – фото До и После лечения:
Преимущества
- Методика обладает локальным воздействием на человеческий организм.
- Процедура не требует общего наркоза, что минимизирует побочное действие обезболивающих средств.
- Отсутствие разрезов и послеоперационных швов.
- Возможность проведения амбулаторного лечения.
Инновационные методики проведения фотодинамики
В современной онкологической науке исследования проводятся в направлении повышения качества фотодинамических препаратов и способов усовершенствования техники лазерного облучения. Точное подведение лекарственного средства осуществляется с помощью моноклональных антител, что также способствует уменьшению дозировки сенсибилизатора.
Еще один принципиально новый подход к фотодинамике предложил канадский онколог и ученый Д. Кеннеди. Согласно его технологии, внешнее регулирование биосинтеза порфиринов стимулирует эндогенное образование сенсибилизаторов. Также такие процессы способствуют концентрации препарата в области злокачественного новообразования.
Читайте также: Гамма-терапия: суть, показания, последствия
Заключение
Фотодинамическая терапия, отзывы о которой на сегодняшний разнообразны, является инновационной противораковой процедурой. Данной методике на сегодняшний день около 15 лет. За это время ученые провели многочисленные клинические наблюдения. С точки зрения эффективности, фотодинамическая терапия рака и опухолей остается перспективной методикой. Современные исследования мировых фармацевтических компаний уделяют большое внимание разработке новых поколений сенсибилизаторов.
Такая терапия должна проводиться только на сертифицированном оборудовании под контролем квалифицированного врача-онколога. Особенные рекомендации для пациентов, прошедших курс фотодинамики сводятся к соблюдению солнцезащитного режима в течение одной недели.
orake.info
МЕЛАНОМА — Фотодинамическая терапия
Онкологическая клиника в Москве ¦ ЛЕЧЕНИЕ МЕЛАНОМЫ В ЕВРОПЕЙСКОЙ КЛИНИКЕ ¦ Фотодинамическая терапия
В настоящее время доктора-онкологи в своей практике успешно используют передовую органосберегающую методику, получившую название «фотодинамическая терапия» (сокр.: ФДТ) при различных клинических вариантах меланомы, в т.ч.:
- при первичных меланомах;
- при рецидивах меланомы после ранее проведенного лечения другими методами;
- при множественных внутрикожных метастазах меланомы. ФТД основана на уникальнейшей способности некоторых веществ (так наз. фотосенсибилизаторов) селективно уничтожать опухолево-перерожденные клетки под действием света.
Содержащее фотосенсибилизатор, лекарственное средство по типуфотодитазина, глюкаминовой соли хлорина Е6, гелиофора вводится больному внутривенно.
В течение определенного промежутка времени препарат накапливается в тканях опухоли, т.е. происходит, по сути, процесс фотосенсибилизации, который несравненно более выражен в злокачественных клетках, чем в здоровых.
При рассмотрении в этот момент в ультрафиолете пораженногоонкопроцессомучастка кожных покрововлибо слизистой оболочки, выстилающей полый орган, абсолютно по всей площади разрастания меланомы заметно слабое розовое свечение, или флюоресценция.
Благодаря флюоресцентной маркировке удается точно обозначить внешние границы опухолевого образования на плоскости и подготовится непосредственно к этапу лечения, в ходе которого патологический очаг подвергают воздействию красного лазера с длиной волны, четко соответствующей максимуму поглощения препарата-фотосенсибилизатора (для фотодитазина и прочих хлоринов – 660-670 нм).
Плотность лазерного излучения специалисты подбирают таким образом, чтобы живые тканиорганизма не нагревались выше 38˚С (100 мвт/см2). Длительность облучения определяетсяплощадью очага: если опухоль размером с десятикопеечную монету, фотоэкспозиция длится около 10-15 минут, если с ладонь – обычно несколько часов.
В это время фотоны света передают энергию молекулам поглощенного опухолью фотосенсибилизатора, а они, в свою очередь, выступая в роли своеобразных посредников, передаютсвои свободные электроны кислороду, в результате чего последний начинает вступать в определенные химические реакции с прочими веществами внутри клеток, в межклеточном веществе, а также в плазме крови.
Целый каскад последовательных химических реакций оказывает крайне губительное влияние на опухоль, а здоровые ткани, что очень важно, при этомне страдают, что является неоспоримым преимуществом ФДТ.
В дальнейшем погибшие при ФДТопухолевые клетки активно поглощаются лимфоцитами и макрофагами, т.е. клетками иммунной системы, для которой это служит мощнейшим стимулом.
Ученые отметили, что при прямом повреждающем воздействии на первичную меланомную опухоль наблюдается феномен, суть которого заключается в непрямом фотодинамическом лизисемикрометастазов меланомы, рассеянных по организму. Другими словами, ФДТ способна влиять на отдаленные вторичные опухолевые очаги, которые не подвергаются прямому фотодинамическому воздействию. У
ченые установили, что особенно хорошо выражена фотоиндукция иммунитета при ФДТ первичной меланомы: при использовании данного метода лечения у этой категории больных не наблюдаются рецидивы меланомы на месте, где возникла первоначальная опухоль, тогда как после оперативного удаления новообразования, не смотря порой даже на внушительные объемы резецируемых тканей у каждого десятого пациента онкопроцесс развивается вновь в зоне постоперационного рубца.
В ряде ситуаций, когда хирургическая операция и радиотерапия могут привести к инвалидности и/или сильно обезобразить человека, ФДТ становится единственно возможным методом лечения меланомы кожи (например, при меланоме кожи в районе века, медиального угла глаза, носогубных складок и т.д.).
+7(925)191-50-55 — европейские протоколы лечения в Москве
ЗАПРОС в КЛИНИКУ
www.rusmedserv.com