Ученые считают, что желудочные бактерии могут провоцировать болезнь Паркинсона
Живущий в желудке почти у половины землян Helicobacter pylori так модифицирует холестерин, что тот вызывает дегенерацию допамин-продуцирующих клеток в мозгу — и это, увы, приводит к развитию болезни Паркинсона.Желудочно-кишечная бактерия Helicobacter pylori, при всех её положительных качествах, является довольно опасным симбионтом: считается, что именно она является одной из основных причин язвенной болезни. Причём, если верить микробиологам из Центра исследований здоровья при Университете Луизианы (США), опасность этой бактерии даже преуменьшается, и серьёзно. Как показали эксперименты американцев, хеликобактер может провоцировать болезнь Паркинсона.
Паркинсонизм — тяжёлое нейродегенеративное заболевание, связанное с разрушением особых клеток в мозгу, производящих нейромедиатор допамин, что прежде всего проявляется в неконтролируемых движениях больного, дрожании и т. д. Ежегодно только в США диагностируется около 60 тыс.
И вот на съезде Американского микробиологического общества 22 мая прозвучало сообщение о том, что хеликобактер провоцирует болезнь Паркинсона у мышей. У животных среднего возраста неконтролируемые движения стали обнаруживаться через несколько месяцев после заражения их бактерией; при этом у них снижалось число допамин-продуцирующих клеток в долях мозга, ответственных за моторику, что дополнительно указывало на развитие паркинсонизма. (На молодых мышей инфицированность H. pylori не влияла.)
Оказалось, что бактерия даже не обязательно должна быть живой, чтобы вызвать болезнь Паркинсона: те же симптомы появлялись у животных, которых кормили мёртвыми хеликобактерами. Это заставило исследователей повнимательней присмотреться к биохимии H.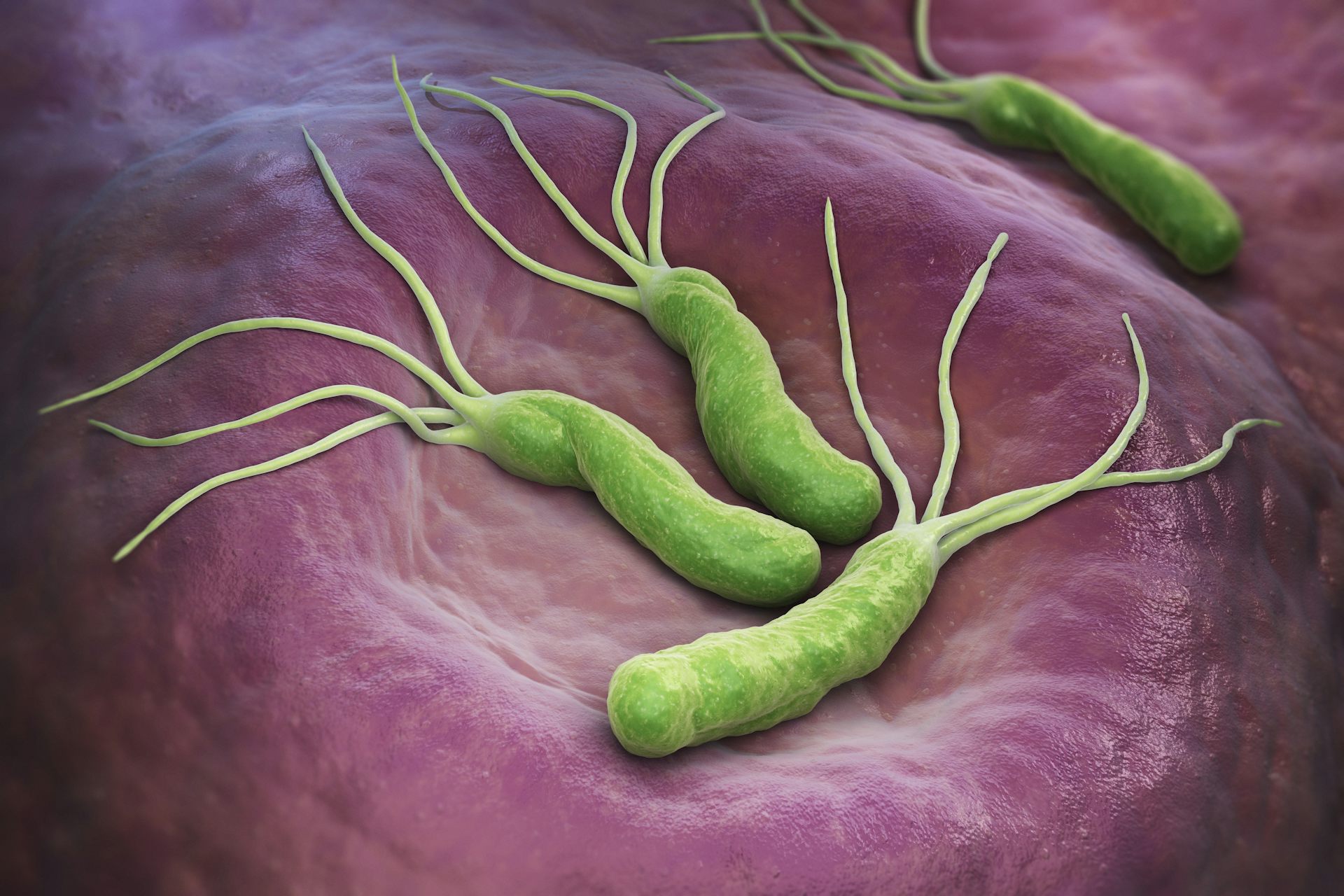
H. pylori живёт в желудке примерно у половины населения Земли. Но даже если колоссальными усилиями попытаться изгнать его из всех носителей, не очень понятно, как быть с отрицательными эффектами, которые неизбежно проявятся в отсутствие этой бактерии в человеческом организме. Хотя хеликобактер провоцирует язвенную болезнь и даже рак желудка, одновременно он защищает нас от некоторых аллергий, астмы, рака пищевода и отдельных расстройств, связанных с кислотным балансом.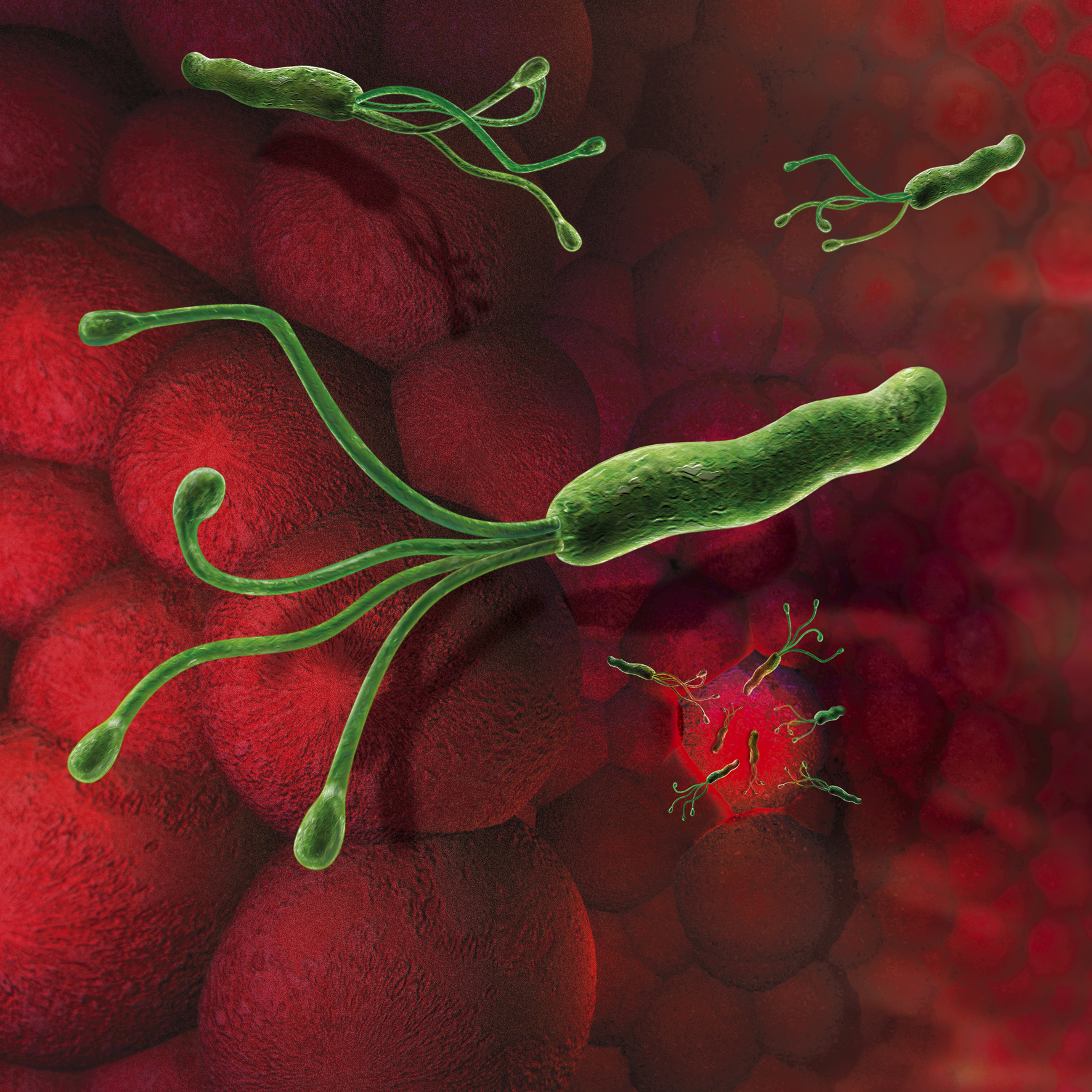
Подготовлено по материалам ScienceNews.
Источник: Компьюлента
Фитнес-блог. Загадочный микробиом, или Что чуют кишки
- Катерина Архарова
- Русская служба Би-би-си, Лондон
Автор фото, Getty
Подпись к фото,Для некоторых людей съесть помидор — все равно что мороженое, показало исследование
К тому же, если все-таки удается вывести разговор на более конкретный уровень, то за «ничего» чаще всего скрывается целая бакалейная лавка: тут и полпачки корнфлекса (он же невесомый!), и «несладкие» конфеты со сниженным содержанием сахара, и прочие фантазмы.
Так что я давно отказалась верить подобным откровениям, но тут ученые (и на этот раз не британские, а израильские) доказали, что каждый организм по-своему реагирует на одну и ту же пищу, даже здоровую.
Участникам исследования (в основном людям с лишним весом) в течение недели давали одну и ту же еду и замеряли у них уровень глюкозы в крови. Выяснилось, что кому-то не вредило даже сливочное масло, а у одной женщины из 800 уровень сахара взлетал от помидоров, как от конфет.
Проводившие эксперимент ученые говорят, что эта разница в метаболизме во многом объясняется разным составом микрофлоры в нашем желудке или микробиомом, и рекомендуют полностью пересмотреть подход к похуданию и диетам, потому что одной на всех просто нет.
Упоминание этого загадочного микробиома стало появляться все чаще (поскольку его с помощью новейших технологий стало легче просчитывать), хотя ученые и признают, что знают о нем все меньше. Взять хотя бы этого недавнего «нобелевского лауреата» – бактерию хеликобактер пилори. За нее десять лет назад двое ученых получили Нобелевскую премию по медицине; они открыли, что именно ее присутствие вызывает гастрит и язву двенадцатиперстной кишки.
Мнение другого специалиста
Автор фото, Thinkstock
Подпись к фото,Десять лет назад выяснилось, что гастрит и язву вызывает бактерия хеликобактер пилори
Вскоре после этого открытия всех, у кого были какие-то проблемы с желудком, стали проверять на наличие «хелика» в организме. Проверили и меня. Хелика обнаружили, но Нобелевскую премию мне за это не дали. Мой семейный доктор, откинувшись на спинку кресла и прокручивая в руках перьевую ручку, сказал следующее: «Мы, конечно, можем пропить курс антибиотиков, как они рекомендуют, но боюсь, как бы не оказать медвежью услугу. Выкосим массу здоровых микробов, да и хелик сам по себе далеко не однозначен – у половины населения он есть».
«Здоровых микробов»? «Хелик – не однозначен»? Да он бредит, подумала я, уходя расстроенная из его кабинета без рецепта, но крыть мне было нечем, потому что пока шло обследование, желудок мой совершенно перестал болеть. Хелик понял, что его обнаружили и стал паинькой. Я же ринулась получать «second opinion», то есть мнение другого специалиста – интернета.
Я же ринулась получать «second opinion», то есть мнение другого специалиста – интернета.
Вообще, как мы жили столько тысячелетий без обнаружения хеликобактера, я примерно себе представляю, а вот как без интернета – просто подумать страшно. Только впечатал искомое слово и тут же – полная тебе картина, у кого, сколько и какого, извините, цвета.
Нет, я серьезно, это сразу как-то приобщает, помогает осознать, что ты не одна такая, ужасно несчастная, попалась в лапы зловредной бактерии с одной стороны и помешанного на вреде антибиотиков доктора с другой. Понимаешь, что есть еще масса других людей, и английских, и русских (потому что проверка second opinion проводится обычно на двух языках), которые пропили курс, а от бактерии не избавились: она весело помахала лаборанту хвостиком при повторном анализе.
Короче говоря, я решила повременить с бомбардировкой антибиотиками и, вроде бы, не зря: этим летом на научном фестивале в Челтнэме профессор-гастроэнтеролог из Оксфордского университета Фиона Поури прочла лекцию о том, что некоторые благотворные бактерии, составляющие микробиом западного человека, находятся на грани исчезновения и их чуть ли не пора заносить в Красную книгу, как амурского тигра.
В пример она привела как раз хеликобактер пилори, которую теперь вытравляют из кишечника антибиотиками. «А между тем, у нее есть ряд позитивных свойств: она регулирует такую функцию желудка, которая контролирует выработку кислоты, поэтому когда у вас нет хеликобактера, то может быть выраженный кислотный рефлюкс (когда желудочная кислота выбрасывается в пищевод, что дает сильную изжогу и т.д. – К.А.) , что в свою очередь может привести к синдрому Барретта и раку пищевода», — сказала профессор.
Я эту цитату здесь привожу не чтобы пугать тех, у кого нет хелика, боже упаси, а просто, чтобы показать, что не все так однозначно.
Диета из биг-маков
Но не только антибиотики виной тому, что микрофлора населения многих развитых стран ухудшается. Эксперты говорят, что главным образом это происходит за счет плохого рациона.
Это экспериментальным путем доказал другой британский профессор, Тим Спектор, чью книжку «Миф о диетах»(The Diet Myth) я уже как-то цитировала. Он уговорил своего сына, студента-генетика Тома, ради науки 10 дней просидеть на диете из фаст-фуда, чтобы понять, что произойдет с его кишечной микрофлорой. Том ел биг-маки, картофельные чипсы, куриные «наггетсы» и пил колу.
Он уговорил своего сына, студента-генетика Тома, ради науки 10 дней просидеть на диете из фаст-фуда, чтобы понять, что произойдет с его кишечной микрофлорой. Том ел биг-маки, картофельные чипсы, куриные «наггетсы» и пил колу.
До начала эксперимента в его кишечнике мирно проживали 3500 бактерий, преимущественно грамположительные фирмикуты (например, бифидобактерии к ним относятся). Однако за несколько первых дней эксперимента Том потерял 1300 бактерий, набрал почти два кг, и соотношение бактерий в его кишечнике изменилось: там стали брать верх грамотрицательные бактероиды, которые в случае снижения иммунитета и прочих неблагоприятных факторов могут вызывать в организме всякую гадость.
Кстати, схожий опыт (но, к счастью, без бактериологического анализа) проходил у меня на кухне, когда к моему сыну приходили его школьные друзья: английские мальчики ели исключительно чипсы и эти жуткие рыбные палочки или куриные «наггетсы» – мне приходилось, чтобы казаться «нормальной мамой», предлагать им иногда эту ерунду. Мы до сих пор вспоминаем одного мальчишку, который, придя к нам в гости после уроков и окинув накрытый обеденный стол, загибая пальцы занудным голосом стал перечислять: «Я не ем помидоры, я не ем огурцы, я не ем хлеб, я не ем мясо, я не ем рыбу…» Все же, кто происходил из иностранных семей, гораздо охотнее ели обычную домашнюю еду, включая даже овощной салат.
Мы до сих пор вспоминаем одного мальчишку, который, придя к нам в гости после уроков и окинув накрытый обеденный стол, загибая пальцы занудным голосом стал перечислять: «Я не ем помидоры, я не ем огурцы, я не ем хлеб, я не ем мясо, я не ем рыбу…» Все же, кто происходил из иностранных семей, гораздо охотнее ели обычную домашнюю еду, включая даже овощной салат.
Но вернусь к более научному эксперименту профессора Спектора, который подтвердил еще одну свою догадку о том, что две трети взрослого населения Британии обладают лишним весом или ожирением не просто потому, что слишком много едят, а потому, что в их кишках в результате неразумного питания просто вымерли полезные микробы, так как именно они, помимо переваривания пищи, еще и контролируют то, как мы усваиваем калории и сколько.
Четыре ингредиента
Автор фото, Thinkstock
Подпись к фото,Пища людей на Западе недостаточно разнообразна
«Большинство людей сегодня потребляют менее 20 различных типов пищи, львиная доля которой, если не вся, рафинирована. Большая часть продуктов, подвергшихся предварительной обработке, производятся, как это ни ужасно, всего лишь из четырех ингредиентов: кукурузы, сои, пшеницы или мяса», — сокрушается Тим Спектор.
Большая часть продуктов, подвергшихся предварительной обработке, производятся, как это ни ужасно, всего лишь из четырех ингредиентов: кукурузы, сои, пшеницы или мяса», — сокрушается Тим Спектор.
Обнаружилось также, что поскольку степень полноты зависит от собственной микробиоты, то если худому человеку сделать трансплантацию фекальных масс полного человека, то худой с большой вероятностью прибавит в весе.
Схожими исследованиями занимается в Штатах профессор Роб Найт, автор книги Follow Your Gut (здесь в названии сокрыта игра слов, поэтому самый близкий перевод будет что-то вроде «Чувствуй кишками») . Его вплотную заинтересовал этот вопрос после того, как он и его жена получили острую кишечную инфекцию после поездки в Перу. Уже после выздоровления профессор «просто так» потерял больше 35 килограммов собственного веса, превратившись из очень полного в мужчину с нормальным весом. Он стал подозревать, что это произошло именно из-за смены его кишечной флоры.
Поразительно, но факт: очень похожая вещь произошла однажды и со мной. Когда мне было 11 лет, я целый год провела в одной экзотической стране и заболела там какой-то местной желудочной лихорадкой. Никто из врачей не знал, что это такое; сначала думали, что холера, потом аппендицит, температура росла, мнения множились. Увидев, что к консилиуму врачей присоединились экваториальные тараканища, меня из больницы под свою ответственность забрала мама (не врач), когда почувствовала у себя ранние признаки того же самого и поняла, что это всего лишь вирус. Мы с ней успешно переболели этой непонятной лихорадкой, которая, возможно, была ничем иным как сражением советских кишечных бактерий с иноземными, кто знает.
Когда мне было 11 лет, я целый год провела в одной экзотической стране и заболела там какой-то местной желудочной лихорадкой. Никто из врачей не знал, что это такое; сначала думали, что холера, потом аппендицит, температура росла, мнения множились. Увидев, что к консилиуму врачей присоединились экваториальные тараканища, меня из больницы под свою ответственность забрала мама (не врач), когда почувствовала у себя ранние признаки того же самого и поняла, что это всего лишь вирус. Мы с ней успешно переболели этой непонятной лихорадкой, которая, возможно, была ничем иным как сражением советских кишечных бактерий с иноземными, кто знает.
Главное, что после этого я очень значительно похудела и уже не вернулась к своему «пышечному» состоянию, хотя рацион мой не изменился, а, вернувшись в Москву, я продолжала баловаться калорийными булочками с изюмом за 10 копеек и прочими гастрономическими радостями. А ведь в моей семье есть склонность к полноте и, возможно, не «задружись» я тогда с иноземным микробиомом, то мне было бы гораздо труднее все последующие годы поддерживать нормальный вес, даже несмотря на мои упражнения и фитнес.
Ожирение заразно?
Но я снова вернусь к профессорским изысканиям. Итак, Роб Найт обнаружил, что микробиом варьируется не только от человека к человеку, но и от страны к стране – вероятно, из-за особенностей национальной кухни. Он также установил, что пересадка бактерий из кишечника человека с ожирением в кишки худенькой мышки приводили к тому, что мышь начинала полнеть как на дрожжах.
Ученые, кстати сказать, в последнее время стали и вовсе склоняться к такой крамольной мысли, что ожирение может быть частично заразно: опыты Тима Спектора доказали, что если худеньких мышек пересадить в клетки к полненьким, то первые тоже начинали полнеть!
Но самое главное, что следует из исследований этих двух светил гастроэнтерологии, так это то, что здоровая (то есть не ведущая к лишнему весу) диета – это не исключение каких-то продуктов, как раз наоборот — это разнообразное питание, которое приведет к большему набору бактерий у нас в кишках.
Вообще, вся эта «фекальная тема» не такая уж безумная: некоторые ученые предрекают, что, вполне возможно, скоро на Запад придется завозить «бурое золото», добытое у жителей Африки и Латинской Америки, поскольку у них более разнообразный микробиом из-за того, что они едят натуральную и разнообразную еду. Представляю будущие газетные заголовки: «Объем импорта фекальных масс достиг небывалых размеров» или что-то в этом роде.
Вообще, дух захватывает от мысли, что наши желудочно-кишечные палочки в ответе не только за состояние нашего тела, но и за состояние нашего духа: уже доказано, что они контролируют уровень серотонина, от которого зависит хорошее настроение. У англичан даже есть выражение «бабочки в животе» (butterflies in the stomach) — это когда видишь человека, в которого влюблен, и чувствуешь, как откуда-то из-под солнечного сплетения по всему телу полетело, мелко-мелко перебирая крылышками, твое чувство. Правда, что это за «бабочки» такие, пока не выяснено, так что работы еще много.
Может, еще немного расшифровки этих кишечных дебрей и ученые придут к выводу, что на самом деле это именно там завариваются все эти бесконечные войны, а вовсе не в политических умах. И откроют, наконец, миролюбивую колонию «бабочек», которую можно будет паковать в виде сухой капсюли и рассылать политикам всего мира для заглатывания целиком еще на стадии избирательной кампании – в профилактических целях.
Желудочные бактерии опьянили китайца без алкоголя. И вызвали болезнь печени — Наука
В желудке 27-летнего китайца ученые обнаружили бактерию, которая умеет синтезировать алкоголь. Она может нарушить работу печени даже у непьющих людей. Описание исследования вышло на страницах научного журнала Cell Metabolism, кратко об этом сообщает издание Gizmodo.
Бактерию нашли у пациента, который в течение 10 лет страдал от приступов необъяснимого отравления. Часто анализы показывали, что у него в крови высокий уровень алкоголя, хотя больной в то время не пил вовсе. Иногда такой эффект проявлялся после того, как китаец выпивал обычную колу.
Иногда такой эффект проявлялся после того, как китаец выпивал обычную колу.
Сначала врачи диагностировали у больного синдром самоопьянения. Он проявляется из-за деятельности дрожжей, которые перерабатывают попадающие в организм сахара в алкоголь. Однако лечение, направленное против таких дрожжей, пациенту не помогло. Далее медики выявили у него неалкогольную жировую болезнь печени (НАЖБП). В ходе этой болезни в печени пациентов образуется большое количество жира, и ее работа нарушается.
Специалисты предположили, что причиной состояния китайца могут быть не дрожжи, а бактерии. Проанализировав бактериальную микрофлору желудка пациента, ученые выделили несколько культур бактерии Klebsiella pneumoniae, которая могла отвечать за производство алкоголя.
Чтобы проверить свою гипотезу, исследователи поместили образцы этих бактерий в желудок лабораторных мышей. В результате у животных тоже развилась неалкогольная жировая болезнь печени. Вдобавок к этому авторы работы изучили бактериальное содержание желудков китайских пациентов, страдающих от НАЖБП, и у более чем 60% из них нашлась Klebsiella pneumoniae. Следовательно, отвечает руководитель работы Юань Цзинь, довольно высока вероятность того, что именно эта бактерия является возбудителем неалкогольной жировой болезни печени.
Следовательно, отвечает руководитель работы Юань Цзинь, довольно высока вероятность того, что именно эта бактерия является возбудителем неалкогольной жировой болезни печени.
Ученые планируют продолжить свою работу в этом направлении: в частности, они хотят понять, почему эта бактерия поселяется в желудке у одних людей и не приживается у других.
Долгожители отличаются кишечными микробами | Наука и жизнь
Желудочная микрофлора столетних людей защищает их от потенциально опасных бактерий.
Сотрудники Университета Кэйо пишут в Nature, что у тех, кому повезло преодолеть столетний рубеж, кишечная микрофлора заметно отличается от микрофлоры тех, кто помоложе. В исследовании участвовали 160 человек, средний возраст которых составлял 107 лет. (долгожители не всегда настоящие, лишние годы у них появляются порой из-за неразберихи в бумагах или же ввиду откровенного обмана; но, надо надеяться, что в данном случае авторы работы все эти подводные камни учли. ) Кишечных бактерий столетних людей сравнивали с бактериями тех, кому было от 85 до 89 лет, а также с бактериями тех, кому было от 21 до 55 лет.
) Кишечных бактерий столетних людей сравнивали с бактериями тех, кому было от 85 до 89 лет, а также с бактериями тех, кому было от 21 до 55 лет.
Некоторые группы микробов у долгожителей были в большем изобилии, чем у людей из двух других возрастных групп; а некоторых микробов, наоборот, было заметно меньше. Все бактерии выделяют какие-то вещества, образующиеся в ходе бактериального обмена веществ; соответственно, у микрофлоры долгожителей метаболическая картина должна была как-то отличаться. Исследователи обратили внимание, что среди бактериальных веществ, которые выделяла микрофлора столетних людей, было особенно много так называемых вторичных желчных кислот. Мы знаем, что желчные кислоты синтезируются в печени, накапливаются в желчном пузыре и из него поступают в кишечник, где помогают всасываться различным жирам и жирорастворимым витаминам.
Но когда желчные кислоты поступают в кишечник, их здесь химически модифицируют местные бактерии – так получаются вторичные желчные кислоты.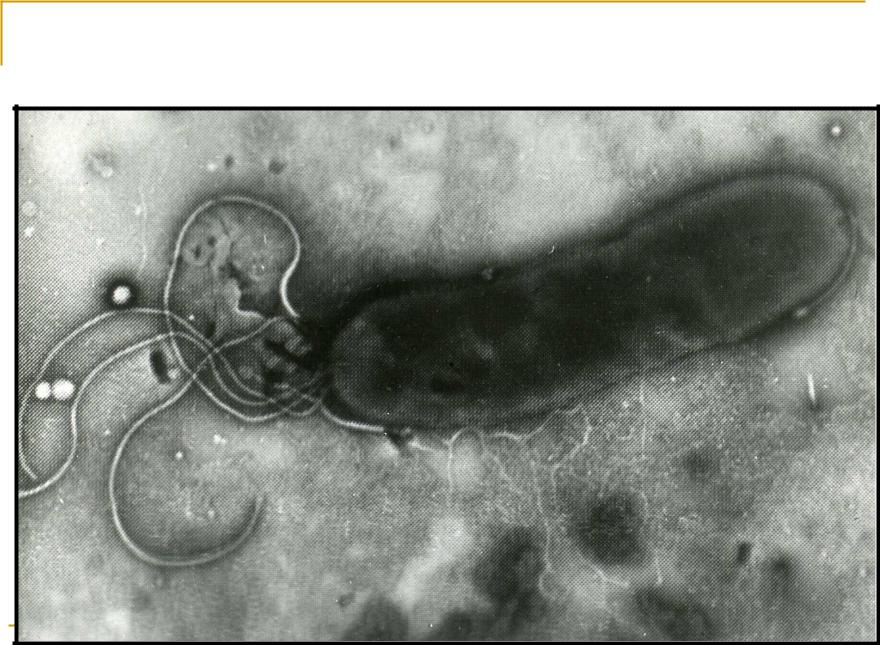 У тех, кто перешёл столетний рубеж, особенно много было вторичной желчной кислоты под названием изоаллолитохолевая кислота, которая образуется благодаря бактериям из рода Odoribacteraceae. Вторичные желчные кислоты выполняют отчасти те же задачи, что и первичные. Но не только: у изоаллолитохолевой кислоты, например, обнаружились антимикробные свойства. Она подавляла рост потенциально патогенных бактерий, таких, как Clostridium difficile, которая вызывает диарею и воспаление кишечника. Также эта кислота действовала против некоторых бактерий, ставших устойчивых к антибиотику ванкомицину.
У тех, кто перешёл столетний рубеж, особенно много было вторичной желчной кислоты под названием изоаллолитохолевая кислота, которая образуется благодаря бактериям из рода Odoribacteraceae. Вторичные желчные кислоты выполняют отчасти те же задачи, что и первичные. Но не только: у изоаллолитохолевой кислоты, например, обнаружились антимикробные свойства. Она подавляла рост потенциально патогенных бактерий, таких, как Clostridium difficile, которая вызывает диарею и воспаление кишечника. Также эта кислота действовала против некоторых бактерий, ставших устойчивых к антибиотику ванкомицину.
Можно предположить, что долгожители потому стали долгожителями, что их микрофлора поддерживает кишечник здоровым, защищая его от нежелательных микробов. От состояния желудочно-кишечного тракта у нас зависит очень много – именно от него во многом зависит долгая здоровая жизнь. Но вряд ли стоит весь секрет долгожительства относит только на счёт правильной микрофлоры. Кроме того, сами авторы работы указывают, что они не знают, почему у долгожителей оказался такой состав кишечных бактерий – то ли благодаря какой-то диете, то ли благодаря особенностям иммунитета.
Кроме того, сами авторы работы указывают, что они не знают, почему у долгожителей оказался такой состав кишечных бактерий – то ли благодаря какой-то диете, то ли благодаря особенностям иммунитета.
Наконец, пока что мы увидели только то, что микрофлора у долгожителей отличается от микрофлоры людей помоложе, и о причинно-следственных связях тут стоит говорить с большой осторожностью. Но в любом случае новые данные помогут понять, как бороться с опасными бактериями в кишечнике, даже если человеку не исполнилось ещё ста лет.
По материалам LiveScience
Культивируемая бактериальная микробиота желудка больных Helicobacter pylori с положительным и отрицательным результатом заболевания желудка
Желудок человека является единственной известной естественной средой обитания Helicobacter pylori ( Hp ), основного бактериального патогена, вызывающего различные гастродуоденальные заболевания. Несмотря на это, влияние Hp на разнообразие и состав микробиоты желудка мало изучено.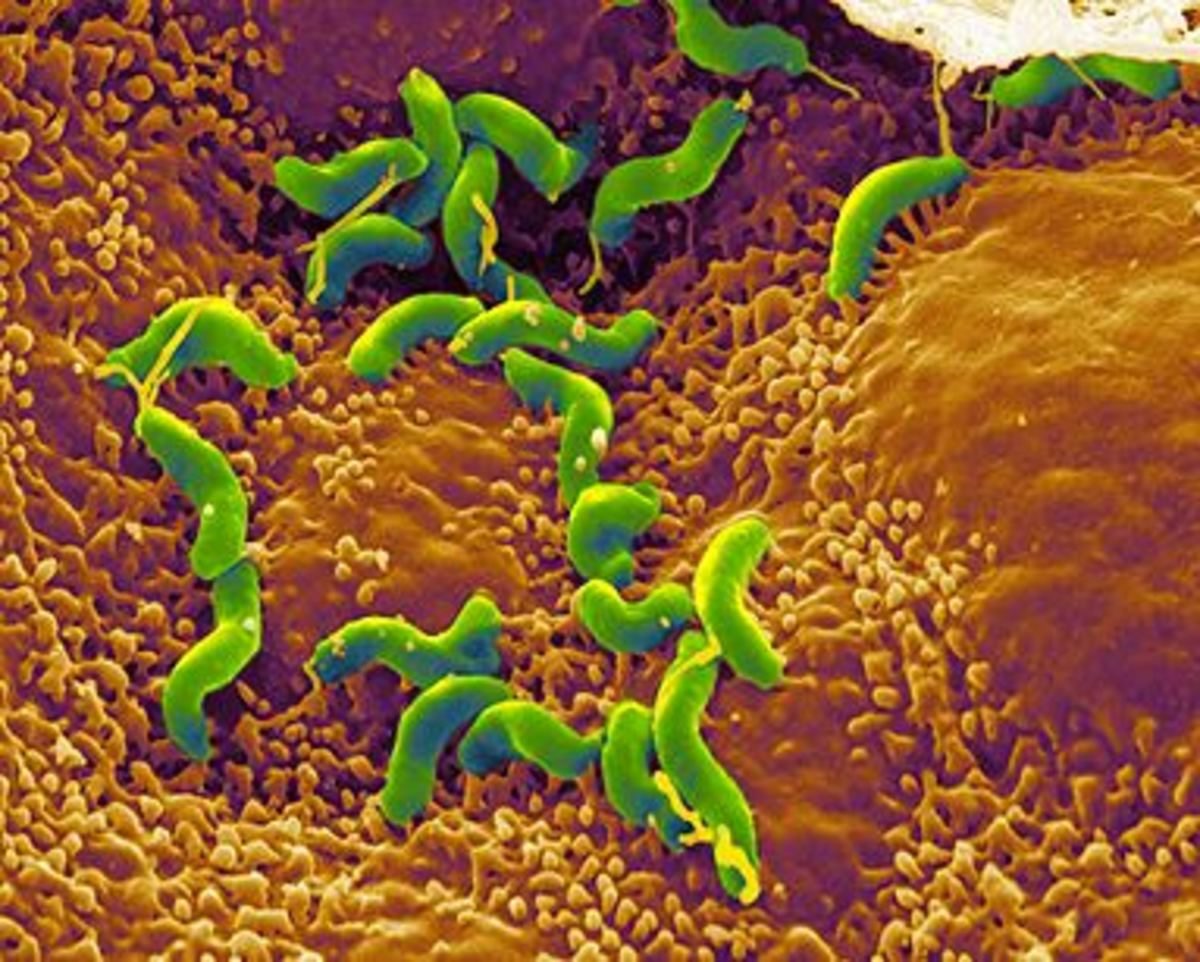 В этом исследовании мы проанализировали культивируемую микробиоту желудка 215 малазийских пациентов, в том числе 131 Hp положительных и 84 Hp отрицательных лиц, которые страдали различными желудочными заболеваниями.Не- бактерии Hp , выделенные из образцов биопсии, были идентифицированы с помощью масс-спектрометрии с лазерной десорбцией и ионизацией на основе матрицы, основанной на биотипировании, и секвенировании 16SrRNA . Присутствие Hp существенно не изменило разнообразие микробиоты желудка. Однако была обнаружена корреляция между выделением стрептококков и язвенной болезнью. Кроме того, в качестве первого сообщения, Burkholderia pseudomallei также были выделены из желудочных проб местного населения.Это исследование показало, что могут быть географические различия в разнообразии желудочного микробиома человека. Географически связанное разнообразие микробиома желудка и возможные взаимодействия между Hp и другими видами бактерий из микробиоты желудка в патогенезе предлагаются для дальнейших исследований.
В этом исследовании мы проанализировали культивируемую микробиоту желудка 215 малазийских пациентов, в том числе 131 Hp положительных и 84 Hp отрицательных лиц, которые страдали различными желудочными заболеваниями.Не- бактерии Hp , выделенные из образцов биопсии, были идентифицированы с помощью масс-спектрометрии с лазерной десорбцией и ионизацией на основе матрицы, основанной на биотипировании, и секвенировании 16SrRNA . Присутствие Hp существенно не изменило разнообразие микробиоты желудка. Однако была обнаружена корреляция между выделением стрептококков и язвенной болезнью. Кроме того, в качестве первого сообщения, Burkholderia pseudomallei также были выделены из желудочных проб местного населения.Это исследование показало, что могут быть географические различия в разнообразии желудочного микробиома человека. Географически связанное разнообразие микробиома желудка и возможные взаимодействия между Hp и другими видами бактерий из микробиоты желудка в патогенезе предлагаются для дальнейших исследований.
1. Введение
Роскошная микробная флора, которая важна для здоровья и благополучия хозяина, обитает в желудочно-кишечном тракте человека. Микробиота кишечника участвует в нескольких функциях, включая сбор и накопление энергии из рациона [1], развитие и регуляцию связанной с кишечником иммунной системы слизистой оболочки [2], регуляцию центральной нервной системы [3], детоксикацию ксенобиотиков и канцерогенов и защита от колонизации патогенами [4].Микробиота кишечника приобретается рано после рождения и формируется под влиянием нескольких факторов, включая диету [5], генетический фон и окружающую среду [6]. Его состав и сложность могут быть изменены физиологическими изменениями, такими как старение [5] и беременность [7]. Колебания микробиоты кишечника также могут быть результатом лечения антибиотиками, метаболических, иммунологических или инфекционных заболеваний [6]. В частности, хронические инфекционные и неинфекционные заболевания могут вызывать длительные изменения микробиоты кишечника, которые сильно влияют на гомеостаз кишечника и могут способствовать развитию других заболеваний [4].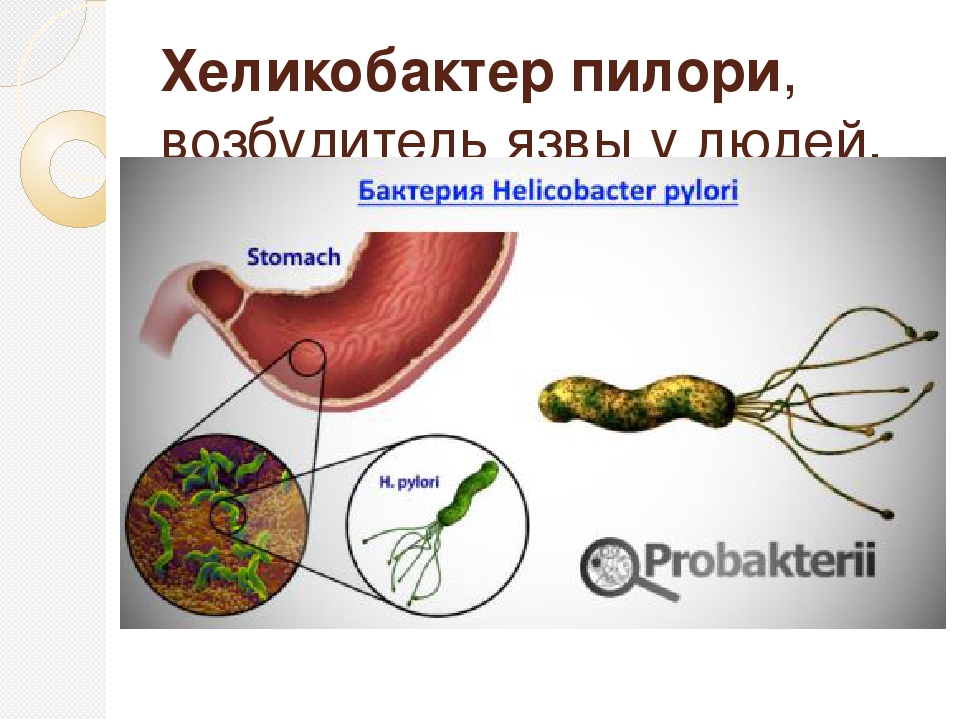 Анализ микробиоты кишечника и ее вариаций становится медицинским подходом, который будет использоваться для профилактики или лечения заболеваний.
Анализ микробиоты кишечника и ее вариаций становится медицинским подходом, который будет использоваться для профилактики или лечения заболеваний.
Helicobacter pylori ( Hp ) является основным патогеном, который ассоциируется с человеком более 60 000 лет [8]. Подсчитано, что более половины населения мира инфицировано Hp [9]. Однако инфекция Hp в большинстве случаев остается бессимптомной. У небольшой части людей инфекция приводит к различным заболеваниям, включая пептические язвы, хронический атрофический гастрит, рак желудка и лимфому кишечника [10, 11].Интересно, что Hp , как полагают, также обеспечивает своему хозяину защиту от определенных заболеваний, включая аллергии, воспалительные заболевания [12] и туберкулез [13]. Патогенез Hp и его взаимодействие с иммунной системой слизистой оболочки кишечника широко изучались [14]. Исследования пациентов-людей и исследования на животных моделях, включая мышей, песчанок и обезьян, позволили получить значительный объем знаний об острой фазе инфекции Hp , установлении колонизации, активации иммунной системы слизистой оболочки кишечника и ускользании от иммунного ответа. стратегии, которые приводят к хронической колонизации [14].Желудок человека является единственной известной естественной средой обитания для Hp , и после установления эта бактерия обычно становится преобладающим видом желудочной микробиоты [15]. Однако мало что известно об модификации желудочной микробиоты в результате хронической инфекции Hp и взаимодействиях этой бактерии с другими членами желудочной экосистемы. Изучение микробиоты желудка было отложено из-за того, что до открытия Hp считалось, что человеческий желудок представляет собой враждебную среду, которая не может поддерживать колонизацию микроорганизмами.В небольшом количестве исследований проанализирован состав микробиоты желудка человека у здоровых людей и у пациентов, страдающих различными заболеваниями. В этих исследованиях использовались высокопроизводительные молекулярные подходы, включая метагеномику [15–18], полиморфизм длин терминальных рестрикционных фрагментов (T-RFLP) [19] и микрочипы [20], которые являются мощными методами, позволяющими захватывать последовательности ДНК из большинства бактерии, присутствующие в желудке, включая как культивируемые, так и некультивируемые виды.
стратегии, которые приводят к хронической колонизации [14].Желудок человека является единственной известной естественной средой обитания для Hp , и после установления эта бактерия обычно становится преобладающим видом желудочной микробиоты [15]. Однако мало что известно об модификации желудочной микробиоты в результате хронической инфекции Hp и взаимодействиях этой бактерии с другими членами желудочной экосистемы. Изучение микробиоты желудка было отложено из-за того, что до открытия Hp считалось, что человеческий желудок представляет собой враждебную среду, которая не может поддерживать колонизацию микроорганизмами.В небольшом количестве исследований проанализирован состав микробиоты желудка человека у здоровых людей и у пациентов, страдающих различными заболеваниями. В этих исследованиях использовались высокопроизводительные молекулярные подходы, включая метагеномику [15–18], полиморфизм длин терминальных рестрикционных фрагментов (T-RFLP) [19] и микрочипы [20], которые являются мощными методами, позволяющими захватывать последовательности ДНК из большинства бактерии, присутствующие в желудке, включая как культивируемые, так и некультивируемые виды. Однако одним важным ограничением в этих исследованиях является небольшое количество образцов человека (4–23 человека), что затрудняет получение статистически значимых выводов.Что касается Hp , то еще меньше исследований анализировали влияние этой бактерии на состав желудочной микробиоты. Недавно Ху и соавт. использовали подход, основанный на культивировании, для выделения видов, отличных от Hp , из биопсий желудка 103 пациентов, инфицированных Hp , и идентифицировали большинство бактерий на уровне видов с помощью биотипирования на основе масс-спектрометрии MALDI-TOF [21]. Ограничение этого подхода состоит в том, что он пропускает некультивируемые бактерии, которые преобладают в желудке [22].Однако точность масс-спектрометрического биотипирования при идентификации бактерий позволяет проводить быстрый анализ большого количества образцов.
Однако одним важным ограничением в этих исследованиях является небольшое количество образцов человека (4–23 человека), что затрудняет получение статистически значимых выводов.Что касается Hp , то еще меньше исследований анализировали влияние этой бактерии на состав желудочной микробиоты. Недавно Ху и соавт. использовали подход, основанный на культивировании, для выделения видов, отличных от Hp , из биопсий желудка 103 пациентов, инфицированных Hp , и идентифицировали большинство бактерий на уровне видов с помощью биотипирования на основе масс-спектрометрии MALDI-TOF [21]. Ограничение этого подхода состоит в том, что он пропускает некультивируемые бактерии, которые преобладают в желудке [22].Однако точность масс-спектрометрического биотипирования при идентификации бактерий позволяет проводить быстрый анализ большого количества образцов.
В этом исследовании мы хотели получить более полное представление о влиянии колонизации Hp на состав и разнообразие микробиоты желудка человека. Мы использовали технологию масс-спектрометрического биотипирования для идентификации бактерий, которые были культивированы из биоптатов желудка 215 пациентов, включая 131 Hp -положительных и 84 Hp -отрицательных субъектов.Пациенты страдали различными желудочными заболеваниями и принадлежали к разным этническим группам, проживающим в Малайзии. Помимо влияния инфекции Hp , подход, использованный в этом исследовании, может дать представление о вкладе других факторов, таких как этническая принадлежность и заболевание, в состав и разнообразие микробиоты желудка.
Мы использовали технологию масс-спектрометрического биотипирования для идентификации бактерий, которые были культивированы из биоптатов желудка 215 пациентов, включая 131 Hp -положительных и 84 Hp -отрицательных субъектов.Пациенты страдали различными желудочными заболеваниями и принадлежали к разным этническим группам, проживающим в Малайзии. Помимо влияния инфекции Hp , подход, использованный в этом исследовании, может дать представление о вкладе других факторов, таких как этническая принадлежность и заболевание, в состав и разнообразие микробиоты желудка.
2. Материалы и методы
2.1. Исследуемая популяция
Образцы биопсии желудка были получены в период с 2011 по 2013 год у пациентов, направленных на эндоскопическое обследование в Медицинский центр Университета Малайя (UMMC, Куала-Лумпур, Малайзия).Образцы биопсии брали из антрального отдела и тела желудка у каждого пациента. Это исследование было одобрено Комитетом по медицинской этике УГМК, и перед включением в исследование было получено письменное согласие пациентов.
2.2. Бактериальный рост и идентификация
Свежие биоптаты желудка гомогенизировали и одновременно инокулировали на чашки с неселективным и селективным шоколадным агаром (с добавлением 5% лошадиной крови, а в случае селективных сред антибиотики, включая триметоприм (5 мк г/мл), ванкомицин (10 мк г/мл), налидиксовая кислота (20 мк г/мл) и амфотерицин В (5 мк г/мл)).Все антибиотики были произведены Sigma-Aldrich Corporation (Сент-Луис, Миссури, США). Чашки с агаром инкубировали одновременно при 37°С во влажных условиях с 10% диоксидом углерода и в условиях окружающего воздуха. Все хорошо изолированные колонии отбирали и культивировали для дальнейших исследований. Колонии Hp образовались по крайней мере через три дня роста на селективных чашках в наших условиях культивирования и были подтверждены положительными тестами на уреазу, каталазу и оксидазу. Кроме того, было проведено окрашивание по Граму и микроскопический анализ для подтверждения наличия грамотрицательных спиральных палочковидных бактерий. Бактериальные виды, отличные от Hp (далее называемые другими бактериями), были идентифицированы с использованием комбинации морфологии колоний, масс-спектрометрии и секвенирования 16SrRNA .
Бактериальные виды, отличные от Hp (далее называемые другими бактериями), были идентифицированы с использованием комбинации морфологии колоний, масс-спектрометрии и секвенирования 16SrRNA .
2.3. Морфология колоний
Другие колонии были отобраны и классифицированы в соответствии с морфологическими признаками, включая размер, текстуру, пигментацию, гемолиз, форму, внешний вид, края и высоту. Отбирали не менее одной колонии из каждого морфотипа, присутствующего на каждой чашке. Колонии повторно высевали штрихами на неселективные чашки и после достаточного роста хранили при -80°C в бульоне с сердечно-мозговым экстрактом (BHI) (Sigma-Aldrich, США) с добавлением 0.4% (вес/объем) дрожжевого экстракта и 20% (объем/объем) глицерина.
2.4. Масс-спектрометрия
Экстракцию этанолом/муравьиной кислотой и масс-спектрометрию проводили в соответствии с рекомендациями Bruker Daltonics GmbH (Брем, Германия). Вкратце, от 1 до 2 хорошо изолированных колоний (или несколько колоний в случае небольшого размера колонии) сходного морфотипа суспендировали в 300 мкл л сверхчистой (тип 1) воды (EMD Millipore Corporation, Billerica, MA, США), к которому добавили 900 мкл л чистого этанола. Образцы центрифугировали (13 000×g, 2 мин). Супернатанты декантировали, а осадки сушили на воздухе. После сушки добавляли 50 мкл л 70% муравьиной кислоты (Fluka Analytical, чистота для ВЭЖХ) и 50 мкл л ацетонитрила (Friedemann Schmidt Chemical, чистота для ВЭЖХ), и образцы снова центрифугировали. Затем 1 мкл л супернатанта наносили на полированную стальную мишень MSP 96 BC microScout Target (Bruker Daltonics GmbH) и давали полностью высохнуть на воздухе перед нанесением 1 мкл л свежего α -циано- Матричный раствор 4-гидроксикоричной кислоты (HCCA, Bruker Daltonics GmbH).Перед анализом образцы высушивали на масс-спектрометрической системе Microflex LRF MALDI-TOF, оснащенной азотным лазером с частотой 60 Гц и источником ионов microScout (Bruker Daltonics GmbH). Настройки параметров были следующими: задержка 12719 pts; источник ионов 20 кВ; источник ионов 18,34 кВ; напряжение линзы 9 кВ; диапазон масс 2–20 кДа. Спектры получены в положительном линейном режиме после 240 импульсов.
Образцы центрифугировали (13 000×g, 2 мин). Супернатанты декантировали, а осадки сушили на воздухе. После сушки добавляли 50 мкл л 70% муравьиной кислоты (Fluka Analytical, чистота для ВЭЖХ) и 50 мкл л ацетонитрила (Friedemann Schmidt Chemical, чистота для ВЭЖХ), и образцы снова центрифугировали. Затем 1 мкл л супернатанта наносили на полированную стальную мишень MSP 96 BC microScout Target (Bruker Daltonics GmbH) и давали полностью высохнуть на воздухе перед нанесением 1 мкл л свежего α -циано- Матричный раствор 4-гидроксикоричной кислоты (HCCA, Bruker Daltonics GmbH).Перед анализом образцы высушивали на масс-спектрометрической системе Microflex LRF MALDI-TOF, оснащенной азотным лазером с частотой 60 Гц и источником ионов microScout (Bruker Daltonics GmbH). Настройки параметров были следующими: задержка 12719 pts; источник ионов 20 кВ; источник ионов 18,34 кВ; напряжение линзы 9 кВ; диапазон масс 2–20 кДа. Спектры получены в положительном линейном режиме после 240 импульсов. Необработанные спектры MALDI-TOF анализировали с помощью MALDI Biotyper 3.1 (Bruker Daltonics) с настройками по умолчанию. Порогом пикового восприятия было отношение сигнал/шум, равное 3.Пики с разницей отношения массы к заряду () >250 ppm считались идентичными. Сгенерированные списки пиков были сопоставлены с справочной библиотекой Biotyper с использованием встроенного алгоритма сопоставления с образцом. Критерии оценки идентификации, используемые в зависимости от производителя, были следующими: оценка ≥2,000 указывала на идентификацию на уровне вида, оценка от 1,700 до 1,999 указывала на идентификацию на уровне рода, а оценка <1,700 указывала на ненадежную идентификацию. Дендрограммы были созданы с использованием меры корреляционного расстояния и настроек алгоритма среднего сцепления программного обеспечения Biotyper для изучения разнообразия и родства изолятов внутри вида на основе снятия белковых отпечатков пальцев [23].
Необработанные спектры MALDI-TOF анализировали с помощью MALDI Biotyper 3.1 (Bruker Daltonics) с настройками по умолчанию. Порогом пикового восприятия было отношение сигнал/шум, равное 3.Пики с разницей отношения массы к заряду () >250 ppm считались идентичными. Сгенерированные списки пиков были сопоставлены с справочной библиотекой Biotyper с использованием встроенного алгоритма сопоставления с образцом. Критерии оценки идентификации, используемые в зависимости от производителя, были следующими: оценка ≥2,000 указывала на идентификацию на уровне вида, оценка от 1,700 до 1,999 указывала на идентификацию на уровне рода, а оценка <1,700 указывала на ненадежную идентификацию. Дендрограммы были созданы с использованием меры корреляционного расстояния и настроек алгоритма среднего сцепления программного обеспечения Biotyper для изучения разнообразия и родства изолятов внутри вида на основе снятия белковых отпечатков пальцев [23].
2.5.
16SrRNA Секвенирование гена Образцы бактерий, которые не удалось разделить с помощью Biotyper до уровня вида, были проанализированы с помощью секвенирования гена 16SrRNA . Геномную ДНК готовили с использованием набора RTP Bacteria DNA Mini Kit (STRATEC Biomedical AG, Berlin-Buch, Germany) в соответствии с рекомендациями производителя. Гипервариабельные области V3 и V6 гена 16SрРНК амплифицировали методом ПЦР с использованием универсальных праймеров V3f (5′-CCAGACTCCTACGGGAGGCAG-3′)/V3r (5′-CGTATTACCGCGGCTGCTG-3′) и V6f (5′-TCGATGCAACGCGAAGAA)/ V6r (5′-ACATTTCACAACACGAGCTGACGA) соответственно [24].Соответствующие продукты ПЦР размером 203 и 124 п.н. очищали с использованием геля Wizard SV и системы очистки ПЦР (Promega Corporation, Мэдисон, Висконсин, США), а последовательности определяли с использованием секвенатора ДНК ABI PRISM (Perkin Elmer Inc., Уолтем, Массачусетс). , США). Нуклеотидные последовательности анализировали с использованием программного обеспечения BLAST Национального центра биотехнологической информации (http://www.ncbi.nlm.nih.gov).
Геномную ДНК готовили с использованием набора RTP Bacteria DNA Mini Kit (STRATEC Biomedical AG, Berlin-Buch, Germany) в соответствии с рекомендациями производителя. Гипервариабельные области V3 и V6 гена 16SрРНК амплифицировали методом ПЦР с использованием универсальных праймеров V3f (5′-CCAGACTCCTACGGGAGGCAG-3′)/V3r (5′-CGTATTACCGCGGCTGCTG-3′) и V6f (5′-TCGATGCAACGCGAAGAA)/ V6r (5′-ACATTTCACAACACGAGCTGACGA) соответственно [24].Соответствующие продукты ПЦР размером 203 и 124 п.н. очищали с использованием геля Wizard SV и системы очистки ПЦР (Promega Corporation, Мэдисон, Висконсин, США), а последовательности определяли с использованием секвенатора ДНК ABI PRISM (Perkin Elmer Inc., Уолтем, Массачусетс). , США). Нуклеотидные последовательности анализировали с использованием программного обеспечения BLAST Национального центра биотехнологической информации (http://www.ncbi.nlm.nih.gov).
2.6. Статистический анализ
Статистический анализ был выполнен с использованием программного обеспечения IBM SPSS 22. 0.Разнообразие не- Hp культивируемой микробиоты (количество выделенных видов) в различных группах ( Hp -положительных против Hp -отрицательных, этнических групп, болезней и т. д.) анализировали с использованием независимых t — тест или однофакторный дисперсионный анализ. Распространенность Hp и не- Hp бактерий в различных группах анализировали с использованием точного критерия хи-квадрат Фишера. Значение ≤ 0,05 считалось статистически значимым.
0.Разнообразие не- Hp культивируемой микробиоты (количество выделенных видов) в различных группах ( Hp -положительных против Hp -отрицательных, этнических групп, болезней и т. д.) анализировали с использованием независимых t — тест или однофакторный дисперсионный анализ. Распространенность Hp и не- Hp бактерий в различных группах анализировали с использованием точного критерия хи-квадрат Фишера. Значение ≤ 0,05 считалось статистически значимым.
3.Результаты
3.1. Демографические и клинические данные пациентов
Мы проанализировали образцы биопсии желудка от 215 пациентов, обратившихся на эндоскопию в Медицинский центр Университета Малайи. Пациенты состояли из 102 (47,4%) и 113 (52,6%) мужчин и женщин, соответственно, со средним возрастом 59 лет (диапазон от 14 до 85 лет). Этническое распределение пациентов соответствовало 18 малайцам (8,4%), 91 китайцу (42,3%) и 92 индийцам (43,8%), трем основным этническим группам Малайзии. Остальные 14 пациентов (6,5%) принадлежали к малочисленным этническим группам, проживающим в стране. У 185 человек (87,6%) была диагностирована неязвенная диспепсия (НЯД), у 22 (10,2%) — язвенная болезнь (ЯБ), у 8 (3,7%) — рак желудка (РЖ) (табл. 1).
Остальные 14 пациентов (6,5%) принадлежали к малочисленным этническим группам, проживающим в стране. У 185 человек (87,6%) была диагностирована неязвенная диспепсия (НЯД), у 22 (10,2%) — язвенная болезнь (ЯБ), у 8 (3,7%) — рак желудка (РЖ) (табл. 1).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hp , Helicobacter pylori ; , количество биопсий; %, процент в соответствующей группе; Non- Hp , среднее число видов non- Hp , выделенных в соответствующей группе. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Распространенность и распространение
Helicobacter pylori в антральном отделе и теле желудка Hp был успешно культивирован из образцов 131 (60,9%) человека, включая 60,5% НЯД (112/185), 77,3% ЯБН (17/ 22) и 25% (2/8) больных РЖ (табл. 1). Биопсии, из которых Hp не удалось культивировать, подвергались дальнейшему микроскопическому исследованию после окрашивания гематоксилин-эозином независимым консультантом-гистопатологом. Образцы, из которых Hp не удалось культивировать и которые не показали бактерии при микроскопии, в этом исследовании считались Hp -отрицательными. Распространенность Hp не зависела от возраста, пола или этнической принадлежности пациентов. Напротив, между тремя группами заболеваний были отмечены значительные различия (таблица 1). Наличие Hp было сопоставимо у пациентов с НЯД (77,3% положительных образцов) и ЯБДК (60,5% положительных образцов), в то время как распространенность в обеих группах была значительно выше, чем у пациентов с РЖ (25% положительных образцов).Этот результат согласуется с известным прогрессивным исчезновением Hp из тканей желудка во время канцерогенеза [25]. Hp может колонизировать различные отделы желудка, в основном антральный отдел и тело желудка. Мы хотели знать, как Hp распределялись между этими двумя желудочными областями. Большинство (61,8%) из Hp -положительных пациентов содержали бактерии как в антральном отделе, так и в теле, в то время как 26% и 11,5% были колонизированы только в антральном отделе или теле, соответственно.
Образцы, из которых Hp не удалось культивировать и которые не показали бактерии при микроскопии, в этом исследовании считались Hp -отрицательными. Распространенность Hp не зависела от возраста, пола или этнической принадлежности пациентов. Напротив, между тремя группами заболеваний были отмечены значительные различия (таблица 1). Наличие Hp было сопоставимо у пациентов с НЯД (77,3% положительных образцов) и ЯБДК (60,5% положительных образцов), в то время как распространенность в обеих группах была значительно выше, чем у пациентов с РЖ (25% положительных образцов).Этот результат согласуется с известным прогрессивным исчезновением Hp из тканей желудка во время канцерогенеза [25]. Hp может колонизировать различные отделы желудка, в основном антральный отдел и тело желудка. Мы хотели знать, как Hp распределялись между этими двумя желудочными областями. Большинство (61,8%) из Hp -положительных пациентов содержали бактерии как в антральном отделе, так и в теле, в то время как 26% и 11,5% были колонизированы только в антральном отделе или теле, соответственно. Эти цифры составляют в общей сложности 87,8% и 73,3% положительных субъектов, колонизированных в антральном отделе и теле соответственно. Распределение Hp в антральном отделе и организме не зависело от возраста, пола, этнической принадлежности и заболевания пациентов.
Эти цифры составляют в общей сложности 87,8% и 73,3% положительных субъектов, колонизированных в антральном отделе и теле соответственно. Распределение Hp в антральном отделе и организме не зависело от возраста, пола, этнической принадлежности и заболевания пациентов.
3.3. Идентификация видов не-
Helicobacter pylori Bacteria Чтобы проанализировать влияние колонизации Hp на состав и разнообразие желудочной микробиоты, мы выделили 552 колонии из биоптатов желудка и попытались провести идентификацию видов с помощью масс-спектрометрии MALDI-TOF. биотипирование.Большинство этих колоний были успешно идентифицированы на видовом уровне (табл. 2). Однако 43 колонии (от 37 пациентов), принадлежащие к роду Streptococcus , не удалось различить между видами S. pneumonia , S. mitis и S. oralis . Секвенирование гипервариабельных областей V3 и V6 гена 16SrRNA показало, что 43 колонии Streptococcus соответствуют колониям S. mitis . Кроме того, мы проанализировали последовательности генов 16SrRNA 18 колоний (от 15 пациентов), первоначально идентифицированных как Burkholderia fongorum путем биотипирования.Справочная библиотека Brucker, используемая в этом исследовании для идентификации колоний, содержала ограниченные данные о бактериях Burkholderia , которые не могли различить виды этого рода [26]. Результаты подтвердили, что колонии действительно соответствовали B. pseudomallei . Тридцать колоний (от 23 пациентов) были отнесены путем биотипирования либо к видам E. coli , либо к видам Shigella . Для однозначной идентификации этих бактерий мы выращивали клетки на агаре Мак-Конки.В этой среде бактерии, ферментирующие лактозу (например, E. coli ), образуют красные колонии, а бактерии, не ферментирующие лактозу ( Shigella ), образуют белые колонии. Результаты показали, что 30 колоний соответствовали E. coli . В целом, комбинируя биотипирование, секвенирование гена 16SrRNA и выращивание на среде MacConkey, мы смогли идентифицировать на видовом уровне все другие микробные колонии, выделенные из биопсий.
mitis . Кроме того, мы проанализировали последовательности генов 16SrRNA 18 колоний (от 15 пациентов), первоначально идентифицированных как Burkholderia fongorum путем биотипирования.Справочная библиотека Brucker, используемая в этом исследовании для идентификации колоний, содержала ограниченные данные о бактериях Burkholderia , которые не могли различить виды этого рода [26]. Результаты подтвердили, что колонии действительно соответствовали B. pseudomallei . Тридцать колоний (от 23 пациентов) были отнесены путем биотипирования либо к видам E. coli , либо к видам Shigella . Для однозначной идентификации этих бактерий мы выращивали клетки на агаре Мак-Конки.В этой среде бактерии, ферментирующие лактозу (например, E. coli ), образуют красные колонии, а бактерии, не ферментирующие лактозу ( Shigella ), образуют белые колонии. Результаты показали, что 30 колоний соответствовали E. coli . В целом, комбинируя биотипирование, секвенирование гена 16SrRNA и выращивание на среде MacConkey, мы смогли идентифицировать на видовом уровне все другие микробные колонии, выделенные из биопсий.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Идентифицировано секвенированием 16SrRNA ; лактозоферментирующий микроорганизм на агаре Мак-Конки. значение ≤ 0,05 считается статистически значимым. , количество положительных биопсий; %, процент в зависимости от статуса Hp . значение ≤ 0,05 считается статистически значимым. , количество положительных биопсий; %, процент в зависимости от статуса Hp . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.4. Преобладающие не-
Helicobacter pylori Бактерии, выделенные из желудка пациентов с желудочными заболеваниями Всего было идентифицировано 64 других микробных вида, представляющих 3 бактериальных типа (таблица 2). Преобладали Firmicutes (270 колоний из 208 биопсий) и Proteobacteria (220 колоний из 160 биопсий), тогда как Actinobacteria (53 колонии из 43 биопсий) встречались реже.Кроме того, 9 колоний из 8 биоптатов соответствовали 90 003 видам Candida 90 004 (тип грибов Ascomycota). На уровне рода Streptococci были наиболее распространены (126 положительных результатов биопсии, 58,6%), за ними следуют Neisseria (44 положительных результата биопсии), Klebsiella (41 положительный результат биопсии) и Lactobacilli (41 положительный результат биопсии), каждый из которых был выделен из ~20% образцов. Escherichia coli (23 положительных результата биопсии) и Rothia mucilaginosa (20 положительных результатов биопсии) присутствовали примерно у 10% пациентов.Преобладающие виды (таблица 2) включали несколько комменсалов ротовой полости и верхних дыхательных путей человека ( Streptococcus parasanguinis , S. mitis , S. salivarius , Neisseria flavescens , R.muginosa 3,
Escherichia coli (23 положительных результата биопсии) и Rothia mucilaginosa (20 положительных результатов биопсии) присутствовали примерно у 10% пациентов.Преобладающие виды (таблица 2) включали несколько комменсалов ротовой полости и верхних дыхательных путей человека ( Streptococcus parasanguinis , S. mitis , S. salivarius , Neisseria flavescens , R.muginosa 3,4 и
4).
) и представители кишечной микрофлоры ( Lactobacillus fermentum и E. coli ). Интересно, что также было выделено несколько человеческих патогенов или условно-патогенных микроорганизмов. К ним относятся Klebsiella pneumonia , Streptococcus anginosus , Burkholderia pseudomallei , Bacillus cereus и Acinetobacter baumannii .
3.5.
Helicobacter pylori Колонизация не оказала существенного влияния на разнообразие микробиоты желудка До 12 бактерий, не относящихся к Hp , можно было выделить из отдельных биоптатов (таблица 3). Клетки, отличные от Hp , не удалось выделить у 27,4% (59) пациентов, в то время как 1 и 2 бактерии, отличные от Hp , были культивированы из 23,3% и 21,9% образцов соответственно. Эти цифры аналогичны данным, полученным в предыдущем исследовании, в котором анализировались желудочные бактерии одновременно с инфекцией Hp с использованием подхода, аналогичного тому, который был использован в этом исследовании [21].Среднее количество не- видов Hp у отдельных индивидуумов составляло 1,93 и существенно не отличалось между Hp -положительными и Hp -отрицательными пациентами (таблица 1). Это наблюдение согласуется с предыдущими выводами, предполагающими, что, хотя колонизация Hp может изменить микрофлору желудка, она существенно не влияет на ее разнообразие [15]. Точно так же количество не- клеток Hp , выделенных из биопсий, существенно не различалось в зависимости от возраста, заболевания, пола или расы пациентов (таблица 1).
Клетки, отличные от Hp , не удалось выделить у 27,4% (59) пациентов, в то время как 1 и 2 бактерии, отличные от Hp , были культивированы из 23,3% и 21,9% образцов соответственно. Эти цифры аналогичны данным, полученным в предыдущем исследовании, в котором анализировались желудочные бактерии одновременно с инфекцией Hp с использованием подхода, аналогичного тому, который был использован в этом исследовании [21].Среднее количество не- видов Hp у отдельных индивидуумов составляло 1,93 и существенно не отличалось между Hp -положительными и Hp -отрицательными пациентами (таблица 1). Это наблюдение согласуется с предыдущими выводами, предполагающими, что, хотя колонизация Hp может изменить микрофлору желудка, она существенно не влияет на ее разнообразие [15]. Точно так же количество не- клеток Hp , выделенных из биопсий, существенно не различалось в зависимости от возраста, заболевания, пола или расы пациентов (таблица 1).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

3.6. Болезнь и этническая принадлежность оказывают большее влияние, чем
Helicobacter pylori , на состав желудочной микробиоты Чтобы проанализировать влияние Hp на состав желудочной микробиоты у пациентов с заболеваниями желудка, мы сравнили наличие отдельных не- Hp видов бактерий у Hp -положительных и Hp -отрицательных субъектов. Примечательно, что Bacillus cereus был единственным видом, который достоверно ассоциировался с присутствием Hp (таблица 4) у всех пациентов, у которых была выделена эта бактерия (), также колонизированных Hp.B. cereus образует группу разносторонних бактерий, способных адаптироваться к различным экологическим нишам [27]. Связанный с человеком B. cereus в основном вызывает пищевое отравление; однако мы не знаем, какова была бы, если таковая имеется, ее связь с инфекцией Hp . Анализ наличия не- Hp бактерий в группах заболевания показал, что 50% и 25% больных РЖ содержали Klebsiella pneumoniae и Acinetobacter baumannii соответственно (табл. 5 и 7).Эта распространенность была значительно выше, чем в группах НЯД и ЯБД (таблицы 5 и 7), хотя к этим результатам следует относиться с осторожностью из-за небольшого количества РЖ по сравнению с пациентами с НЯБ и ЯБ. Тем не менее, они заслуживают внимания, учитывая изменение разнообразия и состава микробиоты у больных раком желудка человека [19, 28]. Интересно, что анализ хи-квадрат показал, что Klebsiella pneumoniae и Acinetobacter baumannii также по-разному присутствовали в четырех этнических группах (таблицы 6 и 8).Обе бактерии были значительно менее распространены у китайцев (), чем у индийцев (табл. 6 и 8). Эти две этнические группы составляли большую часть нашего населения и были схожи по размеру, что делало статистический анализ надежным. Ни один из других видов бактерий, выделенных в этом исследовании, не показал существенной разницы в распространенности среди четырех этнических групп. В целом, эти результаты показывают, что, хотя Hp может влиять на присутствие или отсутствие видов бактерий, другие факторы оказывают большее влияние на состав микробиоты желудка человека.
5 и 7).Эта распространенность была значительно выше, чем в группах НЯД и ЯБД (таблицы 5 и 7), хотя к этим результатам следует относиться с осторожностью из-за небольшого количества РЖ по сравнению с пациентами с НЯБ и ЯБ. Тем не менее, они заслуживают внимания, учитывая изменение разнообразия и состава микробиоты у больных раком желудка человека [19, 28]. Интересно, что анализ хи-квадрат показал, что Klebsiella pneumoniae и Acinetobacter baumannii также по-разному присутствовали в четырех этнических группах (таблицы 6 и 8).Обе бактерии были значительно менее распространены у китайцев (), чем у индийцев (табл. 6 и 8). Эти две этнические группы составляли большую часть нашего населения и были схожи по размеру, что делало статистический анализ надежным. Ни один из других видов бактерий, выделенных в этом исследовании, не показал существенной разницы в распространенности среди четырех этнических групп. В целом, эти результаты показывают, что, хотя Hp может влиять на присутствие или отсутствие видов бактерий, другие факторы оказывают большее влияние на состав микробиоты желудка человека. Интересно, что вида Streptococcus были выделены значительно чаще у пациентов с ЯБД, чем у пациентов с ЯБД (значение) (Таблица 9). Дендрограммы S. mitis и S. parasanguinis , основанные на фингерпринтинге белков, были проиллюстрированы на рисунках 1 (а) и 1 (б) соответственно, чтобы продемонстрировать разнообразие этих микроорганизмов, выделенных из желудка человека.
Интересно, что вида Streptococcus были выделены значительно чаще у пациентов с ЯБД, чем у пациентов с ЯБД (значение) (Таблица 9). Дендрограммы S. mitis и S. parasanguinis , основанные на фингерпринтинге белков, были проиллюстрированы на рисунках 1 (а) и 1 (б) соответственно, чтобы продемонстрировать разнообразие этих микроорганизмов, выделенных из желудка человека.
| ||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
Kp , Klebsiella pneumonia 9; поз. , положительный; отрицательный, отрицательный; , количество биопсий; %, процент в соответствующей группе; НЯД, неязвенная диспепсия; ЯБ, язвенная болезнь; РЖ, рак желудка. , положительный; отрицательный, отрицательный; , количество биопсий; %, процент в соответствующей группе; НЯД, неязвенная диспепсия; ЯБ, язвенная болезнь; РЖ, рак желудка. | ||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ab, Acinetobacter baumannii ; поз., положительный; отрицательный, отрицательный; , количество биопсий; %, процент в соответствующей группе; НЯД, неязвенная диспепсия; ЯБ, язвенная болезнь; РЖ, рак желудка. | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
 , положительный; отрицательный, отрицательный; , количество биопсий; %, процент в соответствующей группе.
, положительный; отрицательный, отрицательный; , количество биопсий; %, процент в соответствующей группе.
| ||||||||||||||||||||||||
| , количество биопсий; %, проценты в соответствующих группах.значение ≤ 0,05 считается статистически значимым. | ||||||||||||||||||||||||
4.
 Обсуждение
Обсуждение В этом исследовании мы выделили и идентифицировали виды бактерий из биоптатов желудка 131 Hp — положительных и 84 Hp — отрицательных жителей Малайзии, страдающих желудочными заболеваниями и принадлежащих к разным этническим группам. . Выявлено 552 колонии бактерий, принадлежащих к 61 виду, 27 родам и 3 типам. Преобладающим типом были Proteobacteria (220 колоний), за которыми следовали Firmicutes (270 колоний), в то время как актинобактерии встречались редко (53 колонии).На видовом уровне преобладали Streptococci (121 положительный результат биопсии), за ними следуют Neisseria (44 положительных результата биопсии), Klebsiella (42 положительных результата биопсии) и Lactobacilli (42 положительных результата биопсии) (таблица 2). Результаты этого исследования согласуются с предыдущими исследованиями, в которых сообщалось, что Proteobacteria, Firmicutes, Actinobacteria и Bacteroidetes были преобладающими типами в микробиоте желудка человека [15–17, 19–21]. Мы не выделяли Bacteroidetes, так как не использовали анаэробные условия роста.Мы смогли идентифицировать до 12 различных видов бактерий в отдельных образцах. Среднее количество бактерий, отличных от Hp , на одного пациента составляло 1,93, что объясняется подходом, использованным в этом исследовании, который был направлен на получение качественного, а не количественного представления о составе микробиоты желудка. Сравнение данных Hp -положительных и Hp -негативных образцов свидетельствует о том, что Hp не оказывает существенного влияния ни на разнообразие, ни на состав желудочной микробиоты человека.Следует отметить, что в отличие от предыдущих исследований мы не использовали ПЦР-амплификацию генетических материалов при обнаружении Hp . Наша попытка состояла в том, чтобы в первую очередь определить, влияет ли Hp непосредственно на разнообразие или состав желудочной микробиоты. Поэтому мы рассудили, что такой эффект потребует наличия клеток Hp в значительном количестве.
Мы не выделяли Bacteroidetes, так как не использовали анаэробные условия роста.Мы смогли идентифицировать до 12 различных видов бактерий в отдельных образцах. Среднее количество бактерий, отличных от Hp , на одного пациента составляло 1,93, что объясняется подходом, использованным в этом исследовании, который был направлен на получение качественного, а не количественного представления о составе микробиоты желудка. Сравнение данных Hp -положительных и Hp -негативных образцов свидетельствует о том, что Hp не оказывает существенного влияния ни на разнообразие, ни на состав желудочной микробиоты человека.Следует отметить, что в отличие от предыдущих исследований мы не использовали ПЦР-амплификацию генетических материалов при обнаружении Hp . Наша попытка состояла в том, чтобы в первую очередь определить, влияет ли Hp непосредственно на разнообразие или состав желудочной микробиоты. Поэтому мы рассудили, что такой эффект потребует наличия клеток Hp в значительном количестве. Хотя эта точка зрения является гипотезой, а не доказанным фактом, мы считаем ее весьма вероятной.Во время острой инфекции клеток Hp , попадающие в просвет желудка, быстро уплывают из этой агрессивной среды в сторону эпителия [29, 30]. Спиральная форма бактерии позволяет ей эффективно проникать в рыхлый наружный и плотный внутренний слои слизи [31, 32]. Показано, что большинство из клеток Hp находятся во внутреннем слизистом слое, прочно прикрепленном к эпителиальным клеткам [33, 34]. Этот сайт является естественной нишей Hp , где бактерии эффективно размножаются, как показано во многих исследованиях, установивших, что Hp является преобладающим видом в тканях желудка человека [15, 16, 35].Поэтому мы считали отрицательными те пробы, в которых эта бактерия не могла быть ни культивирована, ни обнаружена после тщательного микроскопического исследования. Влияние Hp на состав и разнообразие микробиоты желудка плохо изучено. В соответствии с нашими результатами, Bik et al.
Хотя эта точка зрения является гипотезой, а не доказанным фактом, мы считаем ее весьма вероятной.Во время острой инфекции клеток Hp , попадающие в просвет желудка, быстро уплывают из этой агрессивной среды в сторону эпителия [29, 30]. Спиральная форма бактерии позволяет ей эффективно проникать в рыхлый наружный и плотный внутренний слои слизи [31, 32]. Показано, что большинство из клеток Hp находятся во внутреннем слизистом слое, прочно прикрепленном к эпителиальным клеткам [33, 34]. Этот сайт является естественной нишей Hp , где бактерии эффективно размножаются, как показано во многих исследованиях, установивших, что Hp является преобладающим видом в тканях желудка человека [15, 16, 35].Поэтому мы считали отрицательными те пробы, в которых эта бактерия не могла быть ни культивирована, ни обнаружена после тщательного микроскопического исследования. Влияние Hp на состав и разнообразие микробиоты желудка плохо изучено. В соответствии с нашими результатами, Bik et al. которые использовали метагеномный подход, не обнаружили влияния Hp на разнообразие желудочной микробиоты [15]. Точно так же Мальдонадо-Контрерас и соавт. не сообщили об изменении числа присутствующих не- Hp , но обнаружили, что присутствие Hp приводило к различиям в относительной численности нескольких типов [20].Эти наблюдения следует рассматривать с осторожностью, учитывая, что упомянутые исследования включали небольшое количество людей.
которые использовали метагеномный подход, не обнаружили влияния Hp на разнообразие желудочной микробиоты [15]. Точно так же Мальдонадо-Контрерас и соавт. не сообщили об изменении числа присутствующих не- Hp , но обнаружили, что присутствие Hp приводило к различиям в относительной численности нескольких типов [20].Эти наблюдения следует рассматривать с осторожностью, учитывая, что упомянутые исследования включали небольшое количество людей.
Интересно, что виды Burkholderia (15 случаев), Bacillus (14 случаев) и видов Acinetobacter (10 случаев) были выделены из желудка субъектов из Малайзии, но не в аналогичных исследованиях на субъектах из США, Китая, Венесуэлы. , Бангладеш и Руанде [15, 20, 21]. Мелиоидоз, вызываемый B. pseudomallei , является преимущественно болезнью тропического климата, особенно в Юго-Восточной Азии и северной Австралии, где он широко распространен.Бактерия находится в загрязненной воде и почве. Таким образом, могут быть различия в микробиоме желудка между популяциями из разных географических регионов. Гудиер и др. продемонстрировали на мышах, что B. pseudomallei преимущественно сохраняется в желудке после перорального введения и служит резервуаром для распространения инфекции во внекишечные участки [36]. Насколько нам известно, это исследование является первым отчетом об выделении B. pseudomallei из желудка бессимптомных людей.Значение присутствия B. pseudomallei в желудке человека заслуживает дальнейшего изучения.
Гудиер и др. продемонстрировали на мышах, что B. pseudomallei преимущественно сохраняется в желудке после перорального введения и служит резервуаром для распространения инфекции во внекишечные участки [36]. Насколько нам известно, это исследование является первым отчетом об выделении B. pseudomallei из желудка бессимптомных людей.Значение присутствия B. pseudomallei в желудке человека заслуживает дальнейшего изучения.
Стрептококки часто скапливаются в ротовой полости. Высокий уровень выделения (в среднем 56,5%) в этом исследовании предполагает, что эти бактерии могут колонизировать желудок, а не быть просто временными бактериями. Несмотря на относительно небольшое число больных язвенной болезнью, включенных в данное исследование, была продемонстрирована значимая корреляция между выделением стрептококков и язвенной болезнью.Молекулярное взаимодействие между стрептококками и Hp может играть роль в развитии язвенной болезни и заслуживает дальнейшего изучения.
Методы метагеномики и микрочипов исследуют разнообразие и относительный количественный анализ как культивируемых, так и некультивируемых бактерий. Напротив, подход, принятый Hu et al. и в нашем исследовании учитывались только бактерии, культивируемые в определенных лабораторных условиях. Тем не менее, этот подход был принят, поскольку он позволяет проводить дальнейшее исследование in vitro на изолятах, отличных от Hp , для изучения роли коинфекций, вызванных Hp и не- Hp .
Инфекция Hp обычно становится хронической, вызывает сильный иммунный ответ, влияет на выработку важных желудочных гормонов, включая грелин, который действует в центральной нервной системе, и изменяет рН желудка [25]. Каждый из этих эффектов потенциально может влиять на микробиоту желудка. Вполне вероятно, что при эволюции инфекции Hp в хроническую форму происходит несколько рекомпозиций желудочной микробиоты. Например, изменения pH желудка могут привести к колонизации бактериями со слизистой оболочки полости рта, верхних дыхательных путей или кишечника, которые не могут сохраняться в здоровой среде желудка. В то же время в разные периоды могут существовать виды, которые постепенно исчезают, поскольку изменения делают желудочную среду неблагоприятной для их сохранения. Примером этого служат Hp , которые постепенно исчезают в тканях желудка в процессе канцерогенеза [25]. В целом изменения, происходящие в желудочной среде во время инфекции Hp , сложны и включают несколько факторов, одним из которых является присутствие Hp . Каждый фактор будет иметь незначительное влияние, и их комбинация будет определять не только состав желудочной микробиоты, но и развитие различных заболеваний.В соответствии с этой идеей, Maldonado-Contreras et al. сообщили, что на статус Hp приходится 28% общей дисперсии микробиоты желудка у 12 проанализированных ими людей [20]. Исследования крупномасштабных человеческих популяций с использованием методов пропускной способности необходимы для лучшего понимания влияния различных факторов, влияющих на формирование микробиоты желудка. Такие исследования могут быть подтверждены подходами, подобными тому, который был использован в этом исследовании, с конечной целью выявления видов бактерий, которые можно было бы использовать в качестве микробных маркеров, информирующих о развитии различных Hp- связанных желудочных заболеваний.
В то же время в разные периоды могут существовать виды, которые постепенно исчезают, поскольку изменения делают желудочную среду неблагоприятной для их сохранения. Примером этого служат Hp , которые постепенно исчезают в тканях желудка в процессе канцерогенеза [25]. В целом изменения, происходящие в желудочной среде во время инфекции Hp , сложны и включают несколько факторов, одним из которых является присутствие Hp . Каждый фактор будет иметь незначительное влияние, и их комбинация будет определять не только состав желудочной микробиоты, но и развитие различных заболеваний.В соответствии с этой идеей, Maldonado-Contreras et al. сообщили, что на статус Hp приходится 28% общей дисперсии микробиоты желудка у 12 проанализированных ими людей [20]. Исследования крупномасштабных человеческих популяций с использованием методов пропускной способности необходимы для лучшего понимания влияния различных факторов, влияющих на формирование микробиоты желудка. Такие исследования могут быть подтверждены подходами, подобными тому, который был использован в этом исследовании, с конечной целью выявления видов бактерий, которые можно было бы использовать в качестве микробных маркеров, информирующих о развитии различных Hp- связанных желудочных заболеваний.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарности
Авторы хотели бы поблагодарить сотрудников отделения эндоскопии Медицинского центра Университета Малайи (UMMC) за всю помощь, оказанную в процессе сбора образцов для этого исследования. Это исследование было поддержано Университетом Малайи-Министерства образования (UM-MoE) High Impact Research (HIR) Grant UM.C/625/1/HIR/MoE/CHAN/02 (счет №.H-50001-A000013).
Нобелевская премия за открытие H. pylori
Нобелевская ассамблея Каролинского института в Стокгольме, Швеция, присудила Нобелевскую премию по физиологии и медицине 2005 года доктору Барри Дж. Маршаллу, 54 года, и доктору Дж. Робину Уоррену, 68 лет, за их открытие Helicobacter pylori (H. pylori) бактерия и ее роль в развитии гастрита и язвенной болезни. Вплоть до их прорыва в 1982 году долгое время считалось, что острая пища или стресс вызывают язвенную болезнь.
Согласно информации, опубликованной Нобелевским фондом, д-р Робин Уоррен, патологоанатом из Перта, Австралия, наблюдал небольшие изогнутые бактерии, колонизирующие нижнюю часть желудка примерно у 50% пациентов, которым проводили биопсию желудка. Он заметил, что признаки воспаления всегда присутствовали в слизистой оболочке желудка рядом с тем местом, где он видел бактерии.
Барри Маршалл, коллега, заинтересовался выводами Уоррена, и вместе они инициировали исследование биопсий 100 пациентов.Маршаллу удалось культивировать ранее неизвестный вид бактерий, позже названный Helicobacter pylori , из нескольких таких биопсий. Они обнаружили, что микроорганизм присутствует почти у всех пациентов с воспалением желудка, язвой двенадцатиперстной кишки или язвой желудка. Основываясь на этих результатах, они предположили, что эти недавно идентифицированные бактерии вызывают эти заболевания.
До этого времени настолько укоренилось убеждение, что образ жизни вызывает язву, что даже с их доказательствами этим двум исследователям было трудно убедить мир в том, что H. pylori при язвенной болезни. На самом деле, сам Альфред Нобель сказал в конце 19 века: «Беспокоенность — худший яд для желудка». Чтобы предоставить еще более убедительные доказательства, в 1985 году Маршалл преднамеренно заразил себя этой бактерией и обнаружил у себя болезнь желудка.
pylori при язвенной болезни. На самом деле, сам Альфред Нобель сказал в конце 19 века: «Беспокоенность — худший яд для желудка». Чтобы предоставить еще более убедительные доказательства, в 1985 году Маршалл преднамеренно заразил себя этой бактерией и обнаружил у себя болезнь желудка.
Сегодня многими исследователями во всем мире твердо доказано, что H. pylori вызывает более 90% язв двенадцатиперстной кишки и до 80% язв желудка. Оставшиеся язвы обычно являются результатом регулярного приема обезболивающих препаратов, называемых нестероидными противовоспалительными препаратами (НПВП), которые включают аспирин и ибупрофен.Многие люди принимают НПВП для уменьшения боли и воспаления. Однако частое или длительное использование НПВП, особенно среди пожилых людей, может увеличить риск развития язвенной болезни.
Уровень инфицирования H. pylori среди взрослых в развивающихся странах значительно превышает 80%, а в промышленно развитых странах он составляет от 20 до 50%. Инфекция H. pylori связана с повышенным риском развития рака желудка, одного из наиболее распространенных заболеваний во всем мире.
Инфекция H. pylori связана с повышенным риском развития рака желудка, одного из наиболее распространенных заболеваний во всем мире.
Пептическая язва — это рана или разрыв слизистой оболочки пищеварительного тракта, в котором присутствуют желудочные соки (кислота и пепсин).Большинство язв возникают в первой части тонкой кишки (язвы двенадцатиперстной кишки), но они также могут образовываться в желудке (язвы желудка). Около 10% канадцев в какой-то момент своей жизни заболевают язвой.
Когда бактерии H. pylori прикрепляются к защитной слизистой оболочке желудка и двенадцатиперстной кишки, они ослабляют ее, позволяя кислоте проникать к чувствительной оболочке под ней. И кислота, и бактерии раздражают слизистую оболочку и вызывают образование раны или язвы. В настоящее время неясно, как эти бактерии распространяются от человека к человеку.Также неизвестно, почему лишь у небольшого процента людей, инфицированных H. pylori , — всего 10–15% — развиваются пептические язвы.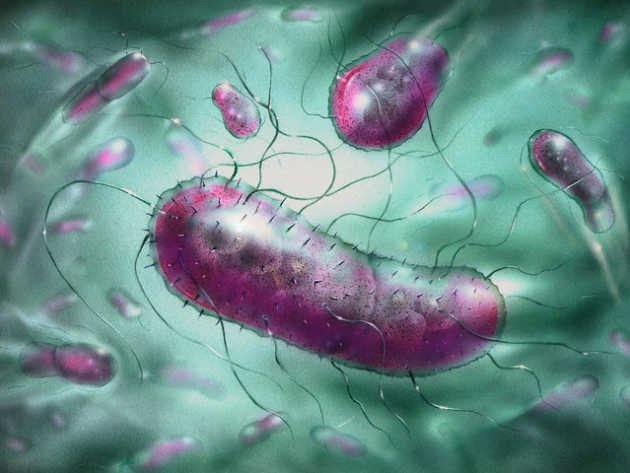 Тот факт, что в вашем желудке присутствует H. pylori , не означает, что у вас разовьется язва, хотя большинство людей с язвой инфицированы H. pylori .
Тот факт, что в вашем желудке присутствует H. pylori , не означает, что у вас разовьется язва, хотя большинство людей с язвой инфицированы H. pylori .
Язвы болезненны и, если их не лечить, могут привести к серьезным осложнениям, включая перфорацию желудка и кровотечение.
Существует несколько тестов, позволяющих определить наличие у человека вируса H.pylori : можно взять кровь и проверить наличие антител к бактериям; специальный дыхательный тест может обнаружить бактериальную выработку фермента в желудке; или биоптаты из желудка могут быть исследованы на наличие бактерий.
Врачам важно определить причину язвы до назначения лечения. Если НПВП вызвали язву, врач может порекомендовать пациенту прекратить прием препарата, возможно, предложить другое обезболивающее или добавить другие лекарства вместе с НПВП для защиты желудка и двенадцатиперстной кишки.
Если причиной язвы является инфекция H. pylori , врач назначит план лечения, чтобы убить инфекцию и уменьшить количество желудочной кислоты. Обычно это комбинация одного или нескольких антибиотиков для уничтожения бактерий и ингибитора протонной помпы (ИПП) для блокировки желудочной кислоты. При соблюдении предписаний это лечение, обычно называемое тройной терапией, может навсегда вылечить 80-90% пептических язв. Для оставшихся 10-20% резистентных случаев может потребоваться четырехкратная терапия с добавлением других антибактериальных препаратов.
Обычно это комбинация одного или нескольких антибиотиков для уничтожения бактерий и ингибитора протонной помпы (ИПП) для блокировки желудочной кислоты. При соблюдении предписаний это лечение, обычно называемое тройной терапией, может навсегда вылечить 80-90% пептических язв. Для оставшихся 10-20% резистентных случаев может потребоваться четырехкратная терапия с добавлением других антибактериальных препаратов.
Целесообразно лечить H. pylori консервативно у пациентов без документированной язвенной болезни из-за риска того, что неизбирательное использование антибиотиков для эрадикации H. pylori у всех, включая здоровых носителей, может привести к серьезным проблемам с бактериальной резистентностью к эти важные препараты.
Натуральный продукт — клюквенный сок — обещает предотвратить прикрепление бактерий к стенке желудка. Бактерии H. pylori присутствуют только у людей и адаптировались к среде желудка.Сама бактерия чрезвычайно изменчива, и штаммы заметно различаются по многим параметрам, таким как прикрепление к слизистой оболочке желудка и способность провоцировать воспаление. Даже у одного инфицированного человека не все бактерий H. pylori идентичны, и в ходе хронической инфекции эти бактерии адаптируются к изменяющимся условиям в желудке. Генетические вариации среди людей могут влиять на их восприимчивость к H. pylori .
Даже у одного инфицированного человека не все бактерий H. pylori идентичны, и в ходе хронической инфекции эти бактерии адаптируются к изменяющимся условиям в желудке. Генетические вариации среди людей могут влиять на их восприимчивость к H. pylori .
Многие заболевания человека, такие как болезнь Крона, язвенный колит, ревматоидный артрит и атеросклероз, связаны с хроническим воспалением.Открытие того, что одно из наиболее распространенных заболеваний человечества — язвенная болезнь — имеет микробную природу, стимулировало поиск микробов как возможных причин других хронических воспалительных состояний.
Несмотря на отсутствие определенных ответов, последние данные ясно указывают на то, что дисфункция в распознавании микробных продуктов иммунной системой человека может привести к развитию заболевания. Открытие Helicobacter pylori привело к лучшему пониманию связи между хронической инфекцией, воспалением и раком.Определенно достоин Нобелевской премии!
Впервые опубликовано в информационном бюллетене
Inside Tract ®, выпуск 152 – ноябрь/декабрь 2005 г.
Изображение: K_E_N | bigstockphoto.com
Helicobacter pylori-индуцированная матриксная металлопептидаза-10 способствует колонизации желудка бактериями и развитию гастритаХотя персистирующая колонизация
H. pylori и развитие гастрита, ассоциированного с H. pylori , в слизистой оболочке желудка остаются плохо изученными, считается, что взаимодействие между желудочным эпителием и иммунным ответом, индуцированным H. pylori , является ключевой способствующий фактор. Эпителиальные клетки желудка являются не только первой линией защиты хозяина, но также могут продуцировать факторы, привлекающие иммунные клетки для усиления воспалительной реакции.Среди многих молекул, продуцируемых эпителиальными клетками желудка в ответ на инфекцию, есть матриксные металлопротеиназы (ММР). Сообщалось, что у мышей ММР-10 играет роль в регуляции биологических процессов в реакциях хозяина эпителия дыхательных путей на Pseudomonas aeruginosa ( 2 ). Напротив, другие исследователи обнаружили, что уровни MMP-10 увеличивались по мере прогрессирования заболевания в мышиных моделях инфекции Borrelia burgdorferi ( 3 ) и были связаны с тяжестью сепсиса у людей ( 4 ). ММП-10 представляет собой недавно обнаруженную ММП во время инфекции H. pylori ( 5 ), но на сегодняшний день практически ничего не известно о ее регуляции, функции и клинической значимости во время инфекции H. pylori у людей или мышей.
ММП-10 представляет собой недавно обнаруженную ММП во время инфекции H. pylori ( 5 ), но на сегодняшний день практически ничего не известно о ее регуляции, функции и клинической значимости во время инфекции H. pylori у людей или мышей. В текущем исследовании мы продемонстрировали, что ММП-10 играет роль в проколонизации и провоспалении при инфекции H. pylori . Повышенный уровень ММП-10 обнаруживается в слизистой оболочке желудка пациентов и мышей, инфицированных H. pylori , и синергически индуцируется в эпителиальных клетках желудка H.pylori и интерлейкина-22 (IL-22) через путь киназы, регулируемой внеклеточным сигналом (ERK). Мы также демонстрируем, что MMP-10 способствует выработке CXCL16, который, в свою очередь, рекрутирует CD8 + Т-клетки, которые способствуют воспалению, и ингибирует Reg3a, эпителиальный кадгерин (E-кадгерин) и zonula occludens-1 (ZO-1). приводя к нарушению защитных сил хозяина и увеличению колонизации H.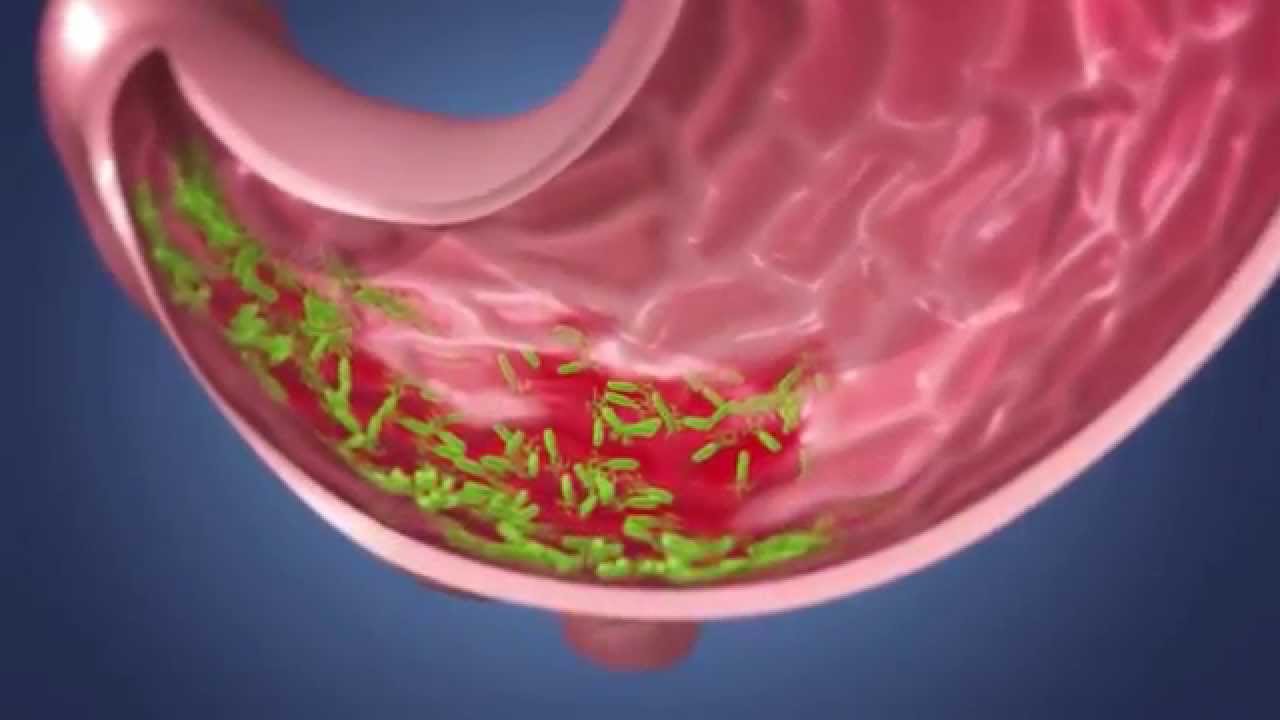 pylori . В совокупности эти данные подчеркивают патологическую роль MMP-10 в H. pylori — персистирующей инфекции и клиническом гастрите.
pylori . В совокупности эти данные подчеркивают патологическую роль MMP-10 в H. pylori — персистирующей инфекции и клиническом гастрите.
ОБСУЖДЕНИЕ
MMP-10 играет разные роли в зависимости от характера инфекции. Например, при инфекции P. aeruginosa ( 2 ) ММР-10 обеспечивает защиту хозяина. Напротив, при инфекции B. burgdorferi ( 3 ) ММР-10 может способствовать прогрессированию патологии. Наши данные согласуются с последним исследованием, поскольку они показывают, что во время инфекции H. pylori MMP-10 способствует бактериальной колонизации и способствует развитию гастрита.Поскольку все больше данных указывает на то, что ММР, такие как ММР-1 ( 12 ) и ММР-7 ( 13 ), сильно экспрессируются при инфицировании H. pylori , мы теперь добавили ММР-10 в этот список. Что остается неясным, так это то, почему ММР-10 защищает от одних инфекций, но патогенен от других. С этой целью наши данные о том, что H. pylori , связанный с фактором вирулентности cagA , был необходим для индукции максимальной экспрессии ММП-10, позволяют предположить, что внутренние факторы, кодируемые самой инфекцией, вероятно, играют важную роль во влиянии на роль ММП-10. .В этом исследовании мы не только выявили ранее непризнанную роль ММР-10 во время инфекции H. pylori , но также обнаружили, что экспрессия ММР-10 легко индуцировалась при инфицировании H. pylori ex vivo в первичных эпителиальных клетках желудка и клеточных мембранах. линии. Этот ответ согласуется с предыдущими наблюдениями за экспрессией MMP-10 в воспаленных тканях и/или клетках, таких как эпителиальные клетки трахеи при инфекции P. aeruginosa ( 2 ) и эпителиальные клетки толстой кишки при воспалительных заболеваниях кишечника ( 14 ) .Известно, что экспрессии ММП-10 способствуют воспалительные цитокины/медиаторы, такие как трансформирующий фактор роста-β1 ( 15 , 16 ) и С-реактивный белок ( 14 ) в различных эпителиальных/эндотелиальных клетках. В нашем случае мы идентифицировали новый цитокин, регулирующий MMP-10, IL-22, во время инфекции H. pylori : он оказывает синергетическое действие на индукцию MMP-10, активируя путь ERK ( 5 ).
.В этом исследовании мы не только выявили ранее непризнанную роль ММР-10 во время инфекции H. pylori , но также обнаружили, что экспрессия ММР-10 легко индуцировалась при инфицировании H. pylori ex vivo в первичных эпителиальных клетках желудка и клеточных мембранах. линии. Этот ответ согласуется с предыдущими наблюдениями за экспрессией MMP-10 в воспаленных тканях и/или клетках, таких как эпителиальные клетки трахеи при инфекции P. aeruginosa ( 2 ) и эпителиальные клетки толстой кишки при воспалительных заболеваниях кишечника ( 14 ) .Известно, что экспрессии ММП-10 способствуют воспалительные цитокины/медиаторы, такие как трансформирующий фактор роста-β1 ( 15 , 16 ) и С-реактивный белок ( 14 ) в различных эпителиальных/эндотелиальных клетках. В нашем случае мы идентифицировали новый цитокин, регулирующий MMP-10, IL-22, во время инфекции H. pylori : он оказывает синергетическое действие на индукцию MMP-10, активируя путь ERK ( 5 ).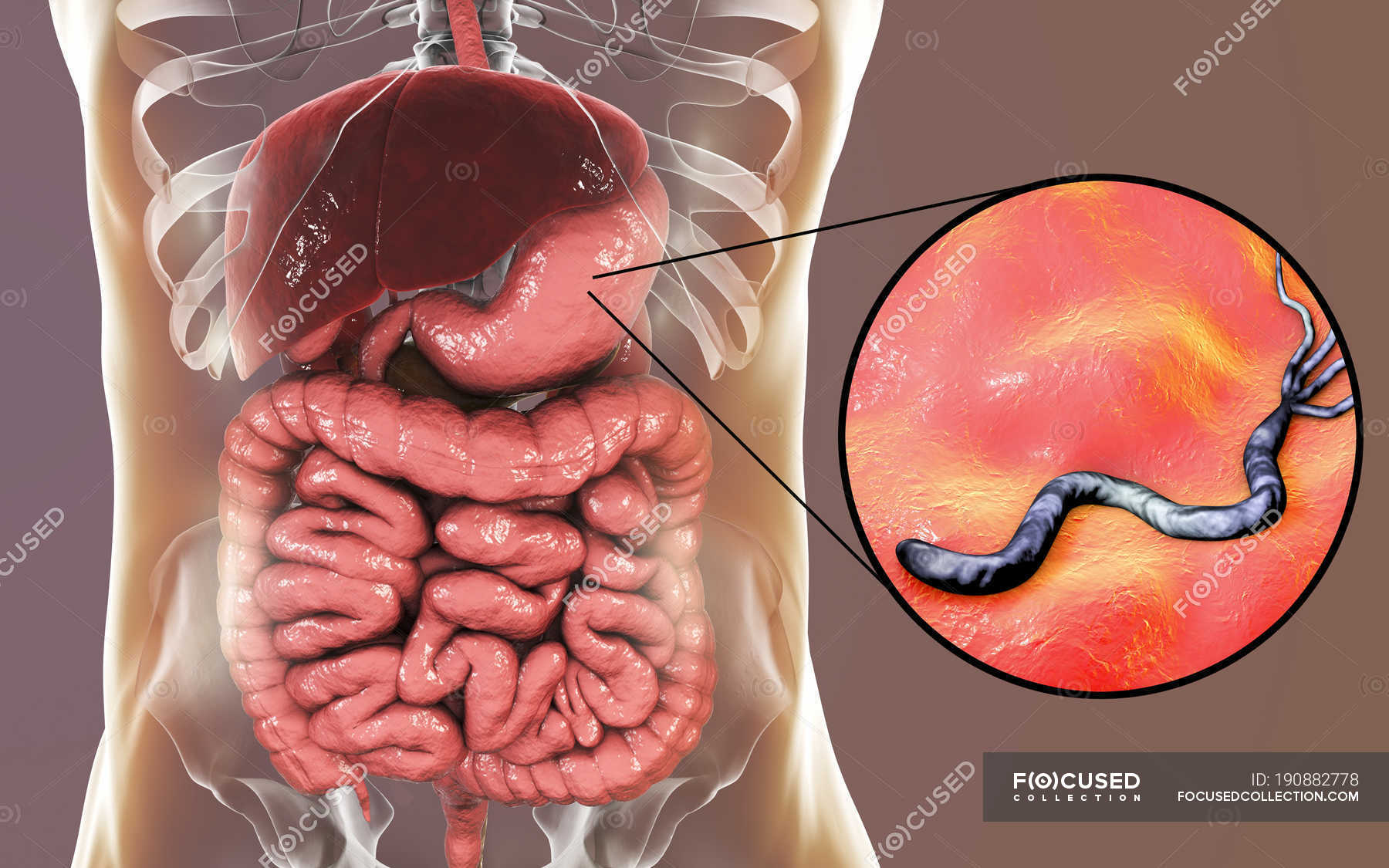 Эти результаты, вместе с нашими предыдущими наблюдениями за провоспалительными эффектами IL-22 в H.pylori – ассоциированный гастрит ( 8 ), указывают на комбинированную активность IL-22 и H. pylori как на важные детерминанты индукции ММР-10 в слизистой оболочке желудка. Сообщается, что IL-22 был ключевой детерминантой индуцированной слизистой вакциной защиты от H. pylori , поскольку снижение колонизации H. pylori было показано у вакцинированных IL-22 -/- мышей ( 17 ), что отличается от наших результатов. Можно предположить, что в г.pylori – вакцинированных мышей или у мышей с первичной инфекцией H. pylori , IL-22 может выполнять различные функции: стимулируя экспрессию антимикробных пептидов, таких как Reg3β ( 17 ). IL-22 защищает хозяина у мышей, индуцированных вакциной, во время инфекции H. pylori ; однако IL-22 играет роль проколонизатора, вероятно, путем ингибирования клеточного ответа T H 1 ( 8 ) у мышей с первичной инфекцией H.
Эти результаты, вместе с нашими предыдущими наблюдениями за провоспалительными эффектами IL-22 в H.pylori – ассоциированный гастрит ( 8 ), указывают на комбинированную активность IL-22 и H. pylori как на важные детерминанты индукции ММР-10 в слизистой оболочке желудка. Сообщается, что IL-22 был ключевой детерминантой индуцированной слизистой вакциной защиты от H. pylori , поскольку снижение колонизации H. pylori было показано у вакцинированных IL-22 -/- мышей ( 17 ), что отличается от наших результатов. Можно предположить, что в г.pylori – вакцинированных мышей или у мышей с первичной инфекцией H. pylori , IL-22 может выполнять различные функции: стимулируя экспрессию антимикробных пептидов, таких как Reg3β ( 17 ). IL-22 защищает хозяина у мышей, индуцированных вакциной, во время инфекции H. pylori ; однако IL-22 играет роль проколонизатора, вероятно, путем ингибирования клеточного ответа T H 1 ( 8 ) у мышей с первичной инфекцией H. pylori . Также сообщается, что IL-22 стимулировал Reg3a в эпителиальных клетках кишечника человека в зависимости от STAT3 (преобразователь сигнала и активатор транскрипции 3) in vitro ( 18 ), что отличается от наших результатов увеличения Reg3a в IL- 22 -/- мыши in vivo.Что касается более высокого уровня Reg3a у мышей IL-22 -/- MMP-10 -/- по сравнению с таковым у мышей IL-22 -/- (фиг. 6A), а также регуляции MMP-10 с помощью IL -22 (рис. 3), можно предположить, что ослабленное ингибирование Reg3a с помощью MMP-10 у мышей IL-22 -/- могло способствовать увеличению Reg3a у мышей IL-22 -/- , принимая во внимание, что эксперименты in vivo часто бывают более сложными. Таким образом, лежащие в основе регуляторные механизмы между IL-22 и Reg3a в воспалительной среде H.pylori -индуцированный гастрит требует дальнейшего изучения. Многочисленные данные подтверждают мнение о том, что ММП-10 опосредует многие изменения в окружающей среде, которые приводят к защите тканей ( 19 ) или повреждению тканей ( 20 ): ММП-10 из костномозгового происхождения.
pylori . Также сообщается, что IL-22 стимулировал Reg3a в эпителиальных клетках кишечника человека в зависимости от STAT3 (преобразователь сигнала и активатор транскрипции 3) in vitro ( 18 ), что отличается от наших результатов увеличения Reg3a в IL- 22 -/- мыши in vivo.Что касается более высокого уровня Reg3a у мышей IL-22 -/- MMP-10 -/- по сравнению с таковым у мышей IL-22 -/- (фиг. 6A), а также регуляции MMP-10 с помощью IL -22 (рис. 3), можно предположить, что ослабленное ингибирование Reg3a с помощью MMP-10 у мышей IL-22 -/- могло способствовать увеличению Reg3a у мышей IL-22 -/- , принимая во внимание, что эксперименты in vivo часто бывают более сложными. Таким образом, лежащие в основе регуляторные механизмы между IL-22 и Reg3a в воспалительной среде H.pylori -индуцированный гастрит требует дальнейшего изучения. Многочисленные данные подтверждают мнение о том, что ММП-10 опосредует многие изменения в окружающей среде, которые приводят к защите тканей ( 19 ) или повреждению тканей ( 20 ): ММП-10 из костномозгового происхождения. клетки (макрофаги) играли защитную роль в модели колита, вызванного декстрансульфатом натрия ( 21 ), однако ММР-10 из клеток, не происходящих из BM (фибробластов), способствовали разрушению тканей при артрите ( 22 ). Последнее может иметь место и для H.pylori – инфицированная среда желудка, где подтвержден источник ММП-10 из клеток, не происходящих из БМ (эпителиальные клетки желудка), и высокая экспрессия ММП-10 в клинических образцах в связи с развитием заболевания. Учитывая очевидную взаимосвязь между уровнями ММР-10 и тяжестью воспаления желудка, даже язвы желудка, у пациентов, инфицированных H. pylori , наблюдаемых в этом исследовании, следует рассмотреть возможность использования ММР-10 в качестве ранее неизвестного диагностического биомаркера для . ЧАС.pylori , заболевания, связанные с инфекцией. Было высказано предположение, что патологическая природа ММП связана с различными механизмами. Например, MMP-9 или MMP-10 регулируют хемотаксис, связанный с CXCL12 или CCL5, для развития системной красной волчанки ( 23 ) или гепатоканцерогенеза ( 21 ) соответственно.
клетки (макрофаги) играли защитную роль в модели колита, вызванного декстрансульфатом натрия ( 21 ), однако ММР-10 из клеток, не происходящих из BM (фибробластов), способствовали разрушению тканей при артрите ( 22 ). Последнее может иметь место и для H.pylori – инфицированная среда желудка, где подтвержден источник ММП-10 из клеток, не происходящих из БМ (эпителиальные клетки желудка), и высокая экспрессия ММП-10 в клинических образцах в связи с развитием заболевания. Учитывая очевидную взаимосвязь между уровнями ММР-10 и тяжестью воспаления желудка, даже язвы желудка, у пациентов, инфицированных H. pylori , наблюдаемых в этом исследовании, следует рассмотреть возможность использования ММР-10 в качестве ранее неизвестного диагностического биомаркера для . ЧАС.pylori , заболевания, связанные с инфекцией. Было высказано предположение, что патологическая природа ММП связана с различными механизмами. Например, MMP-9 или MMP-10 регулируют хемотаксис, связанный с CXCL12 или CCL5, для развития системной красной волчанки ( 23 ) или гепатоканцерогенеза ( 21 ) соответственно. В то же время было обнаружено, что MMP-9 регулирует дифференцировку бокаловидных клеток в толстой кишке, что способствует изменению защиты слизистой оболочки, что приводит к воспалению (, 24, ). Наши результаты согласуются с этими исследованиями и демонстрируют, что H.pylori и IL-22 синергически индуцируют ММР-10 в эпителиальных клетках желудка, что приводит к усилению бактериальной колонизации из-за вероятного нарушения защиты хозяина (снижение антибактериального белка Reg3a), повреждения слизистой оболочки желудка (снижение белков плотных контактов E-кадгерина и ZO-1). ), а также усиление воспаления, характеризующееся притоком Т-клеток CD8 + по оси MMP-10–CXCL16. Путем скрининга мы обнаружили, что Т-клетки CD8 + оказались единственными иммунными клетками нижестоящими по отношению к ММР-10.Считалось, что Т-клетки CD8 + играют минимальную роль во время хронической инфекции H. pylori ( 25 ). В этом исследовании мы продемонстрировали повышенные уровни CD8 + Т-клеток (включая процентное содержание и общее количество клеток) в слизистой оболочке желудка мышей и людей, инфицированных H.
В то же время было обнаружено, что MMP-9 регулирует дифференцировку бокаловидных клеток в толстой кишке, что способствует изменению защиты слизистой оболочки, что приводит к воспалению (, 24, ). Наши результаты согласуются с этими исследованиями и демонстрируют, что H.pylori и IL-22 синергически индуцируют ММР-10 в эпителиальных клетках желудка, что приводит к усилению бактериальной колонизации из-за вероятного нарушения защиты хозяина (снижение антибактериального белка Reg3a), повреждения слизистой оболочки желудка (снижение белков плотных контактов E-кадгерина и ZO-1). ), а также усиление воспаления, характеризующееся притоком Т-клеток CD8 + по оси MMP-10–CXCL16. Путем скрининга мы обнаружили, что Т-клетки CD8 + оказались единственными иммунными клетками нижестоящими по отношению к ММР-10.Считалось, что Т-клетки CD8 + играют минимальную роль во время хронической инфекции H. pylori ( 25 ). В этом исследовании мы продемонстрировали повышенные уровни CD8 + Т-клеток (включая процентное содержание и общее количество клеток) в слизистой оболочке желудка мышей и людей, инфицированных H.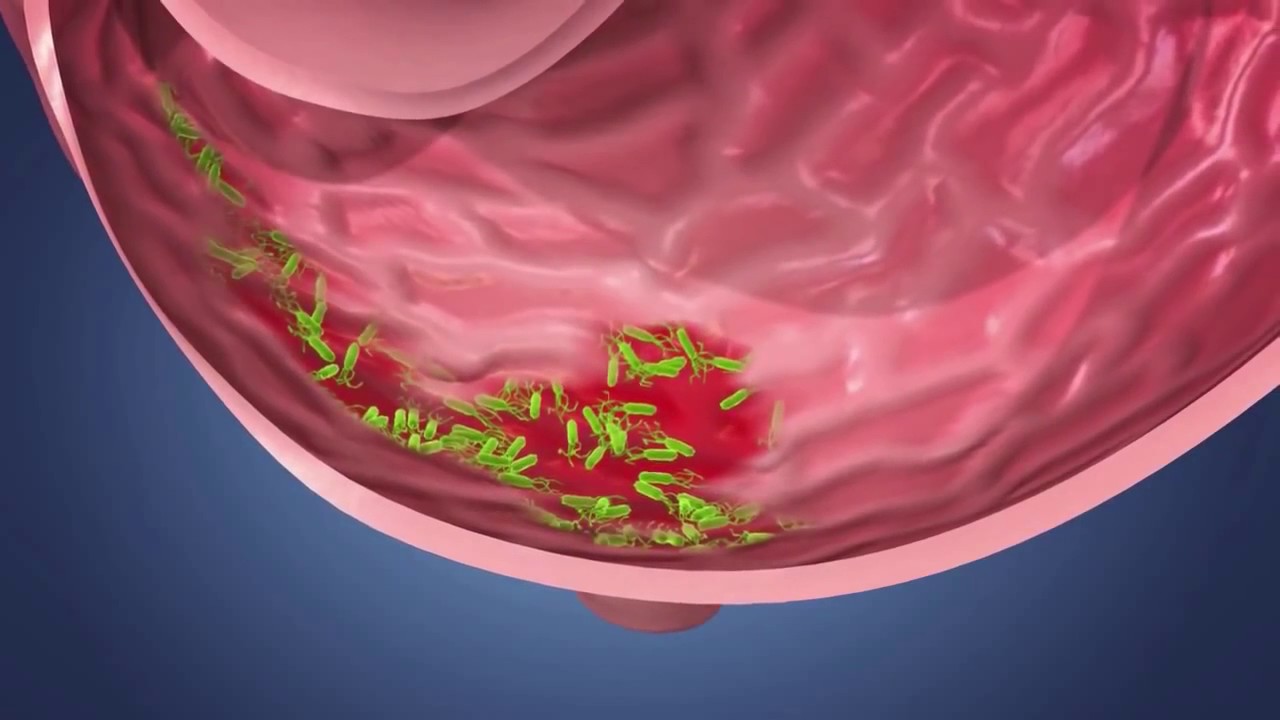 pylori , что указывает на то, что эти клетки действительно могут играть важную провоспалительную роль. роль во время хронической инфекции H. pylori , что дополнительно подтверждается уменьшением воспаления в H.pylori – инфицированные CD8 -/- мыши. Также сообщалось, что дисфункция кишечного эпителия, опосредованная ММП-2, была связана со значительным снижением уровня белка плотных контактов клаудина-5 ( 26 ), что напоминает наши данные о регуляции ZO-1 с помощью ММП-10 в желудочном эпителии. . В частности, наши данные in vitro и in vivo вместе представляют собой многоступенчатую модель хронического гастрита, сопровождающегося персистирующей инфекцией H. pylori , включающей взаимодействие между H.pylori , IL-22, эпителиальные клетки желудка, MMP-10 и CD8 + Т-клетки в слизистой оболочке желудка (рис. 6F). Хотя эрадикационная терапия для H. pylori пероральными антибиотиками в последние годы прогрессировала ( 27 , 28 ), следует отметить, что хронический гастрит и колонизация H.
pylori , что указывает на то, что эти клетки действительно могут играть важную провоспалительную роль. роль во время хронической инфекции H. pylori , что дополнительно подтверждается уменьшением воспаления в H.pylori – инфицированные CD8 -/- мыши. Также сообщалось, что дисфункция кишечного эпителия, опосредованная ММП-2, была связана со значительным снижением уровня белка плотных контактов клаудина-5 ( 26 ), что напоминает наши данные о регуляции ZO-1 с помощью ММП-10 в желудочном эпителии. . В частности, наши данные in vitro и in vivo вместе представляют собой многоступенчатую модель хронического гастрита, сопровождающегося персистирующей инфекцией H. pylori , включающей взаимодействие между H.pylori , IL-22, эпителиальные клетки желудка, MMP-10 и CD8 + Т-клетки в слизистой оболочке желудка (рис. 6F). Хотя эрадикационная терапия для H. pylori пероральными антибиотиками в последние годы прогрессировала ( 27 , 28 ), следует отметить, что хронический гастрит и колонизация H.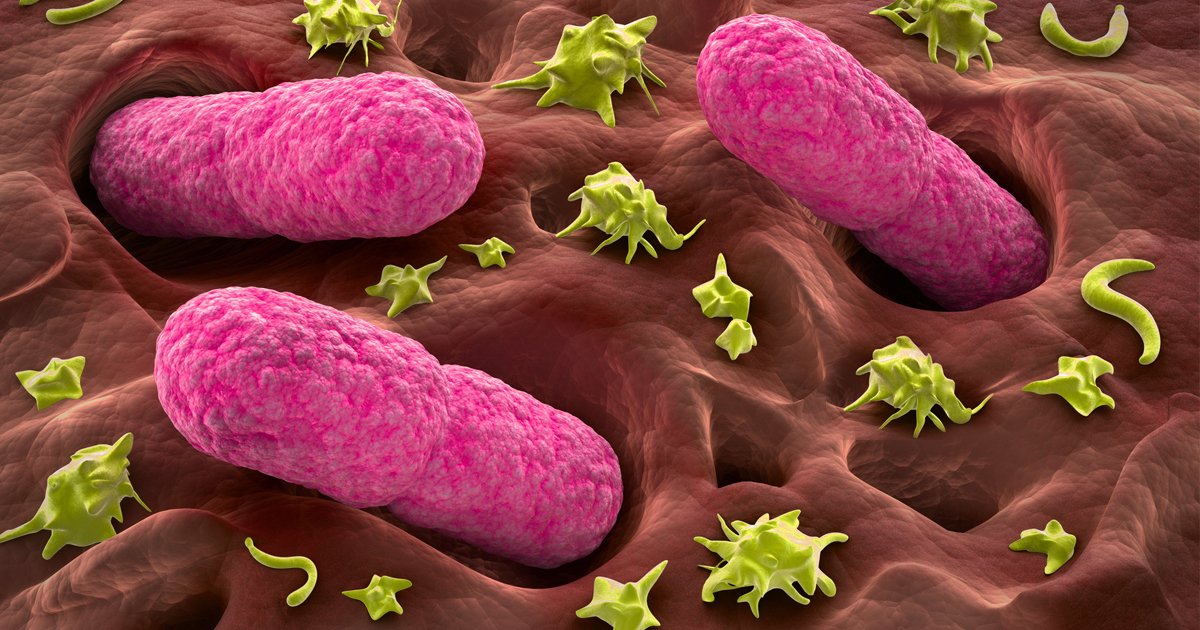 pylori обычно сохраняются из-за повышенной устойчивости к противомикробным препаратам. Таким образом, в этих случаях лечение, направленное на устранение основного воспалительного процесса, может иметь клиническое значение.В связи с этим наши результаты предполагают возможную терапевтическую мишень, MMP-10. В то же время будет интересно проверить, действуют ли связанные с MMP-10 провоспалительные клеточные сети и молекулярные пути, описанные здесь для H. pylori -ассоциированного гастрита, при других хронических инфекциях, где эрадикация более сложна. Если это правда, то нацеливание на эти молекулярные пути также может принести клиническую пользу.
pylori обычно сохраняются из-за повышенной устойчивости к противомикробным препаратам. Таким образом, в этих случаях лечение, направленное на устранение основного воспалительного процесса, может иметь клиническое значение.В связи с этим наши результаты предполагают возможную терапевтическую мишень, MMP-10. В то же время будет интересно проверить, действуют ли связанные с MMP-10 провоспалительные клеточные сети и молекулярные пути, описанные здесь для H. pylori -ассоциированного гастрита, при других хронических инфекциях, где эрадикация более сложна. Если это правда, то нацеливание на эти молекулярные пути также может принести клиническую пользу.МАТЕРИАЛЫ И МЕТОДЫ
Пациенты и образцы
Образцы биопсии желудка и кровь были взяты из 96 H.pylori – инфицированных и 42 неинфицированных больных, которым в госпитале СиньЦяо была выполнена верхняя эзофагогастродуоденоскопия по поводу диспепсических явлений (таблица S1). Инфекцию H. pylori определяли с помощью [ 14 C] уреазного дыхательного теста и быстрого уреазного теста образцов биопсии, взятых из антрального отдела желудка, и впоследствии конформировали с помощью полимеразной цепной реакции (ПЦР) в реальном времени для 16 S рибосомной ДНК ( рДНК) и серологический тест на специфические антитела против H. pylori ( 8 ).Для выделения первичных эпителиальных клеток желудка человека свежие неопухолевые ткани желудка (на расстоянии не менее 5 см от места опухоли) были получены от пациентов с раком желудка, перенесших хирургическую резекцию, и были определены как H. pylori -негативные лица, как описанное выше, в Юго-Западной больнице. Ни один из этих пациентов не получал химиотерапию или лучевую терапию до отбора проб. Лица с атрофическим гастритом, гипохлоргидрией, лечением антибиотиками, аутоиммунными заболеваниями, инфекционными заболеваниями и множественным раком были исключены.Исследование было одобрено комитетом по этике госпиталя Синьцяо и Юго-Западного госпиталя Третьего военно-медицинского университета. Письменное информированное согласие было получено от каждого человека.
pylori ( 8 ).Для выделения первичных эпителиальных клеток желудка человека свежие неопухолевые ткани желудка (на расстоянии не менее 5 см от места опухоли) были получены от пациентов с раком желудка, перенесших хирургическую резекцию, и были определены как H. pylori -негативные лица, как описанное выше, в Юго-Западной больнице. Ни один из этих пациентов не получал химиотерапию или лучевую терапию до отбора проб. Лица с атрофическим гастритом, гипохлоргидрией, лечением антибиотиками, аутоиммунными заболеваниями, инфекционными заболеваниями и множественным раком были исключены.Исследование было одобрено комитетом по этике госпиталя Синьцяо и Юго-Западного госпиталя Третьего военно-медицинского университета. Письменное информированное согласие было получено от каждого человека.Антитела и другие реагенты
Мыши Все разведение и эксперименты проводились с одобрения и одобрения Комитета по этике и экспериментам на животных Третьего военно-медицинского университета (таблица S2). По соглашениям о передаче материала мыши C57BL/6 MMP-10 -/- были получены от W.C. Parks (Вашингтонский университет, США) и C57BL/6 IL-22 -/- мыши были получены от W. Ouyang (Genentech). IL-22 -/- Мыши MMP-10 -/- и их однопометные контрольные мыши (WT) были получены путем скрещивания с мышами IL-22 -/- и MMP-10 -/- . Мыши C57BL/6 IL-17A -/- и мыши C57BL/6 IFN-γ -/- были предоставлены R.A. Flavell (Йельский университет, США). Мыши C57BL/6Rag1 -/- и C57BL/6CD8 -/- были получены из лаборатории Джексона (Бар-Харбор, США).Все мыши, использованные в экспериментах, были самками, за исключением мышей-самцов для химерных экспериментов, и не имели вирусных антител к патогенным мышиным вирусам, отрицательных к патогенным бактериям, включая Helicobacter spp. и паразитов, а также содержались в условиях, свободных от патогенов, в барьерном учреждении и обеспечивались стерильной пищей и водой ( 8 ).
По соглашениям о передаче материала мыши C57BL/6 MMP-10 -/- были получены от W.C. Parks (Вашингтонский университет, США) и C57BL/6 IL-22 -/- мыши были получены от W. Ouyang (Genentech). IL-22 -/- Мыши MMP-10 -/- и их однопометные контрольные мыши (WT) были получены путем скрещивания с мышами IL-22 -/- и MMP-10 -/- . Мыши C57BL/6 IL-17A -/- и мыши C57BL/6 IFN-γ -/- были предоставлены R.A. Flavell (Йельский университет, США). Мыши C57BL/6Rag1 -/- и C57BL/6CD8 -/- были получены из лаборатории Джексона (Бар-Харбор, США).Все мыши, использованные в экспериментах, были самками, за исключением мышей-самцов для химерных экспериментов, и не имели вирусных антител к патогенным мышиным вирусам, отрицательных к патогенным бактериям, включая Helicobacter spp. и паразитов, а также содержались в условиях, свободных от патогенов, в барьерном учреждении и обеспечивались стерильной пищей и водой ( 8 ).
Бактериальная культура и заражение мышей бактериями
H. pylori NCTC 11637 ( cagA положительный) (WT H.pylori ) и cagA -нокаутный мутант H. pylori NCTC 11637 (Δ cagA ) выращивали в чашках для инфузии мозг-сердце, содержащих 10% крови кролика, при 37°C в микроаэрофильных условиях. Для заражения мышей бактерии размножали в бульоне бруцелл с 5% эмбриональной бычьей сывороткой (FBS) при осторожном встряхивании при 37°C в микроаэробных условиях. После культивирования в течение 1 дня собирали живые бактерии и доводили до 10 9 колониеобразующих единиц (КОЕ)/мл. Мышей не кормили в течение ночи и дважды с интервалом в 1 день орогастрально инокулировали 3 × 10 92 631 8 92 632 КОЕ бактерий.Инфекционный статус H. pylori и гастрит, вызванный H. pylori , в экспериментах на мышах были подтверждены с помощью ПЦР в реальном времени H. pylori 16 S рДНК, анализов биопсии уреазы, окрашивания Уортина-Старри и иммуногистохимического окрашивания для H.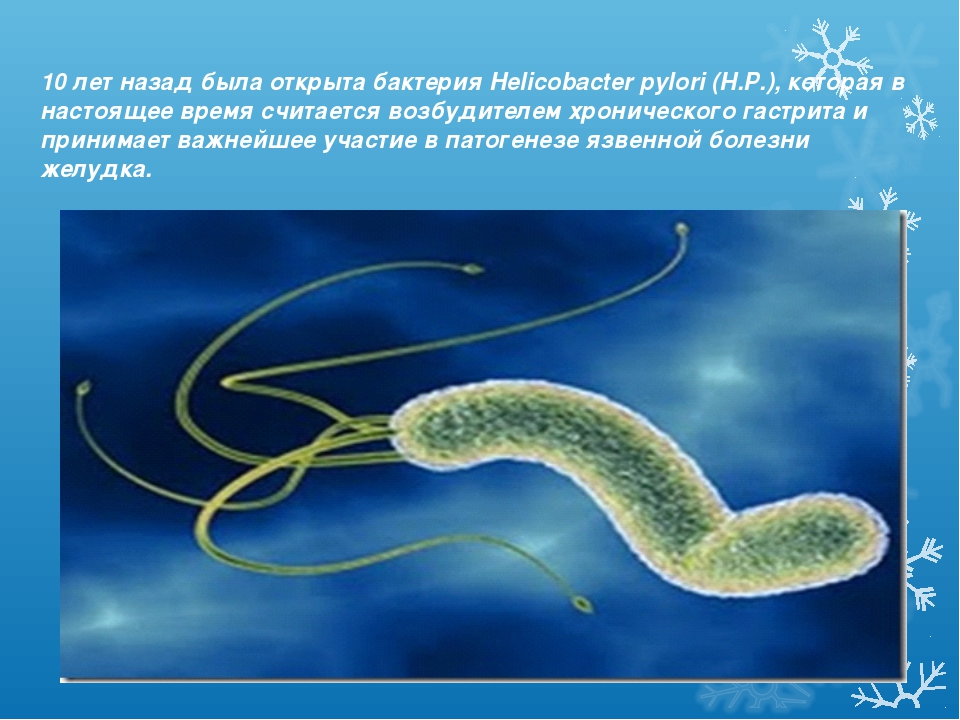 pylori и оценка воспаления с помощью окрашивания гематоксилином и эозином (H&E) ( 8 ).
pylori и оценка воспаления с помощью окрашивания гематоксилином и эозином (H&E) ( 8 ).Поколение мышей BM
Были созданы следующие химерные мыши BM: самцы IL-22 −/− BM→самки MMP-10 −/− мыши и самцы MMP-10 −/− BM→самки IL -22 -/- мыши; или самцы WT BM→самки IL-22 –/– MMP-10 –/– мыши, самцы IL-22 –/– BM→самки IL-22 –/– MMP-10 –/ − мыши, самцы MMP-10 −/− BM→самки IL-22 −/− MMP-10 −/− мыши и самцы IL-22 −/− MMP-10 −/ − BM→самка IL-22 −/− MMP-10 −/− мыши; или самцы BM WT → самки мышей WT, самцы BM WT → самки мышей MMP-10 -/- , самцы MMP-10 -/- BM → самки мышей WT и самцы MMP-10 -/- BM → самки MMP-10 -/- мыши.Клетки костного мозга собирали из бедренной и большеберцовой кости мышей-доноров путем аспирации и промывания и суспендировали в фосфатно-солевом буфере (PBS) в концентрации 5 × 10 7 /мл. BM у мышей-реципиентов удаляли летальным облучением (8 Грэй). Затем животным под наркозом внутривенно вводили 1,5×10 7 клеток КМ от мышей-доноров в объеме 300 мкл стерильного PBS. После этого трансплантированному BM давали возможность регенерировать в течение 8 недель перед последующими экспериментальными процедурами.Чтобы проверить успешное приживление и восстановление костного мозга у мышей-хозяев, геномную ДНК выделяли из тканей хвоста каждой мыши-химеры через 8 недель после трансплантации костного мозга. Количественную ПЦР проводили для обнаружения гена Sry , присутствующего в Y-хромосоме (праймеры показаны в таблице S3), и гена β2-микроглобулина мыши в качестве внутреннего контроля. Химерные скорости были рассчитаны в предположении, что отношение гена Sry к гену β2-микроглобулина составляет 100% у самцов мышей. Мы подтвердили, что химерные показатели постоянно превышали 90%.После подтверждения восстановления BM мышей инфицировали бактериями, как описано выше.
BM у мышей-реципиентов удаляли летальным облучением (8 Грэй). Затем животным под наркозом внутривенно вводили 1,5×10 7 клеток КМ от мышей-доноров в объеме 300 мкл стерильного PBS. После этого трансплантированному BM давали возможность регенерировать в течение 8 недель перед последующими экспериментальными процедурами.Чтобы проверить успешное приживление и восстановление костного мозга у мышей-хозяев, геномную ДНК выделяли из тканей хвоста каждой мыши-химеры через 8 недель после трансплантации костного мозга. Количественную ПЦР проводили для обнаружения гена Sry , присутствующего в Y-хромосоме (праймеры показаны в таблице S3), и гена β2-микроглобулина мыши в качестве внутреннего контроля. Химерные скорости были рассчитаны в предположении, что отношение гена Sry к гену β2-микроглобулина составляет 100% у самцов мышей. Мы подтвердили, что химерные показатели постоянно превышали 90%.После подтверждения восстановления BM мышей инфицировали бактериями, как описано выше.
Введение Abs/CXCL16/Reg3a
Через день после инфицирования WT H. pylori , как описано выше, мышам WT внутрибрюшинно вводили 25 мкг рекомбинантного мышиного CXCL16 или Reg3a, или антимышиного CXCL16, или изотипического контроля Ab (100 мкг) и повторяли каждую неделю до эвтаназии мышей; ММР-10 -/- мышам внутрибрюшинно вводили антитела против мышиного Reg3a или изотипического контроля (100 мкг) и повторяли каждую неделю до тех пор, пока мыши не были подвергнуты эвтаназии.
pylori , как описано выше, мышам WT внутрибрюшинно вводили 25 мкг рекомбинантного мышиного CXCL16 или Reg3a, или антимышиного CXCL16, или изотипического контроля Ab (100 мкг) и повторяли каждую неделю до эвтаназии мышей; ММР-10 -/- мышам внутрибрюшинно вводили антитела против мышиного Reg3a или изотипического контроля (100 мкг) и повторяли каждую неделю до тех пор, пока мыши не были подвергнуты эвтаназии.
Оценка колонизации бактериями
Мышей подвергали эвтаназии в указанные сроки. Желудок разрезали по большой кривизне, и половину ткани разрезали на четыре части для выделения РНК, выделения ДНК, выделения белка и фиксации ткани для иммуногистохимического или иммунофлуоресцентного окрашивания. ДНК из образцов биопсии экстрагировали с помощью набора QIAamp DNA Mini Kit. Как описано ранее ( 29 ), колонизацию H. pylori количественно определяли путем измерения H.pylori – специфичная 16 S рДНК с использованием специфического праймера и зонда (таблица S3) методом TaqMan. Количество мышиной ДНК β2-микроглобулина в том же образце использовали для нормализации данных. Согласно предыдущему исследованию ( 30 ), плотность H. pylori была показана как количество бактериальных геномов на нанограмм геномной ДНК хозяина ( 7 ). Другая половина желудка использовалась для выделения одиночных клеток, как описано ниже. Выделенные отдельные клетки собирали и анализировали с помощью окрашивания методом проточной цитометрии.
Количество мышиной ДНК β2-микроглобулина в том же образце использовали для нормализации данных. Согласно предыдущему исследованию ( 30 ), плотность H. pylori была показана как количество бактериальных геномов на нанограмм геномной ДНК хозяина ( 7 ). Другая половина желудка использовалась для выделения одиночных клеток, как описано ниже. Выделенные отдельные клетки собирали и анализировали с помощью окрашивания методом проточной цитометрии.Оценка воспаления
Мышей подвергали эвтаназии в указанные сроки. Большую кривизну желудка разрезали для проведения окрашивания гематоксилин-эозином. Интенсивность воспаления оценивали независимо два патологоанатома по ранее установленным критериям ( 8 , 31 ).Выделение одиночных клеток из тканей
Свежие ткани трижды промывали раствором Хенкса, содержащим 1% FBS, разрезали на мелкие кусочки, собирали в RPMI 1640, содержащем коллагеназу IV (1 мг/мл) и дезоксирибонуклеазу I (10 мг/мл) , а затем механически диссоциируют с помощью мягкого диссоциатора MACS (Miltenyi Biotec). Диссоциированные клетки далее инкубировали от 0,5 до 1 часа при 37°С при непрерывном вращении. Затем клеточные суспензии фильтровали через 70-мкм клеточный фильтр (BD Labware).
Диссоциированные клетки далее инкубировали от 0,5 до 1 часа при 37°С при непрерывном вращении. Затем клеточные суспензии фильтровали через 70-мкм клеточный фильтр (BD Labware).
Культура клеток/тканей и стимуляция
Первичные эпителиальные клетки желудка очищали из суспензий одиночных клеток ткани желудка от неинфицированных доноров или мышей с помощью системы очистки на колонке MACS с использованием магнитных шариков против человеческого или мышиного CD326 (Miltenyi Biotec). Отсортированные первичные эпителиальные клетки желудка использовали только тогда, когда их жизнеспособность была определена >90%, а их чистота >95%.Для линий эпителиальных клеток желудка человека (клетки AGS, клетки GES-1, клетки BGC-823, клетки HGC-27 и клетки SGC-7901) 3 × 10 92 631 5 92 632 клеток на лунку в 12-луночном планшете для культивирования клеток ( для ПЦР в реальном времени) или 1 × 10 6 клеток на лунку в 6-луночном планшете для культивирования клеток [для вестерн-блоттинга и твердофазного иммуноферментного анализа (ELISA)] голодали в DMEM (среда Игла, модифицированная Дульбекко)/F -12 с добавлением пенициллина (100 ЕД/мл) и стрептомицина (100 мкг/мл) в течение 6 часов во влажной среде, содержащей 5% СО 2 при 37°С. Затем клетки инкубировали в среде DMEM/F-12, не содержащей антибиотиков, с добавлением вместо нее 10% FBS. Линии клеток использовали при определении их жизнеспособности >90%. Линии эпителиальных клеток желудка человека, первичные эпителиальные клетки желудка или первичные ткани слизистой оболочки желудка от неинфицированных доноров стимулировали WT H. pylori или Δ cagA при множественности инфекции (MOI) 100 в течение 24 часов. Клетки AGS, первичные эпителиальные клетки желудка или первичные ткани слизистой оболочки желудка также стимулировали WT H.pylori (MOI = 100) и/или IL-22 (100 нг/мл) в присутствии или в отсутствие нейтрализующих антител к IL-22 (20 мкг/мл) и/или IL-22R1 (20 мкг/мл) для 24 часа. Клетки AGS также стимулировали WT H. pylori при различных MOI (24 часа) или в указанные моменты времени (MOI = 100), стимулировали WT H. pylori (MOI = 100) и/или IL-22. (100, 200 и 400 нг/мл), IFN-γ или IL-17A (100 нг/мл) в течение 24 часов, или стимулированные Δ cagA (MOI = 100) и/или IL-22 (100 нг/мл) в течение 24 часов.
Затем клетки инкубировали в среде DMEM/F-12, не содержащей антибиотиков, с добавлением вместо нее 10% FBS. Линии клеток использовали при определении их жизнеспособности >90%. Линии эпителиальных клеток желудка человека, первичные эпителиальные клетки желудка или первичные ткани слизистой оболочки желудка от неинфицированных доноров стимулировали WT H. pylori или Δ cagA при множественности инфекции (MOI) 100 в течение 24 часов. Клетки AGS, первичные эпителиальные клетки желудка или первичные ткани слизистой оболочки желудка также стимулировали WT H.pylori (MOI = 100) и/или IL-22 (100 нг/мл) в присутствии или в отсутствие нейтрализующих антител к IL-22 (20 мкг/мл) и/или IL-22R1 (20 мкг/мл) для 24 часа. Клетки AGS также стимулировали WT H. pylori при различных MOI (24 часа) или в указанные моменты времени (MOI = 100), стимулировали WT H. pylori (MOI = 100) и/или IL-22. (100, 200 и 400 нг/мл), IFN-γ или IL-17A (100 нг/мл) в течение 24 часов, или стимулированные Δ cagA (MOI = 100) и/или IL-22 (100 нг/мл) в течение 24 часов. Для экспериментов по ингибированию сигнального пути клетки AGS предварительно обрабатывали 5 мкл (20 мкМ) ингибитора киназы гликогенсинтазы-3β, BAY 11-7082 (ингибитор ядерного фактора κB), SP600125 (ингибитор N-концевой киназы c-Jun), SB203580 (ингибитор митоген-активируемой протеинкиназы p38), U0126 [ингибитор MEK-1 (MAPK-киназы-1) и MEK-2] или U0126 (5, 10, 15, 20 и 25 мкМ) в течение 2 часов. Для экспериментов по ингибированию ММР-10 клетки AGS предварительно обрабатывали миРНК ММР-10, миРНК NC (40 нМ) или только Lipo3000 (Mock) в течение 24 часов.После совместного культивирования клетки собирали для микрочипа, ПЦР в реальном времени и вестерн-блоттинга, а супернатанты культуры собирали для ELISA.
Для экспериментов по ингибированию сигнального пути клетки AGS предварительно обрабатывали 5 мкл (20 мкМ) ингибитора киназы гликогенсинтазы-3β, BAY 11-7082 (ингибитор ядерного фактора κB), SP600125 (ингибитор N-концевой киназы c-Jun), SB203580 (ингибитор митоген-активируемой протеинкиназы p38), U0126 [ингибитор MEK-1 (MAPK-киназы-1) и MEK-2] или U0126 (5, 10, 15, 20 и 25 мкМ) в течение 2 часов. Для экспериментов по ингибированию ММР-10 клетки AGS предварительно обрабатывали миРНК ММР-10, миРНК NC (40 нМ) или только Lipo3000 (Mock) в течение 24 часов.После совместного культивирования клетки собирали для микрочипа, ПЦР в реальном времени и вестерн-блоттинга, а супернатанты культуры собирали для ELISA.
Для трансвеллальных анализов плотность клеток AGS доводили до 3 × 10 5 клеток/мл, и всего 600 мкл клеточной суспензии в бессывороточной среде DMEM/F-12 добавляли в нижнюю камеру на 6 часов. . Затем клетки инкубировали в 600 мкл среды DMEM/F-12, не содержащей антибиотиков, с добавлением 10% FBS. В одной группе WT H. pylori (в 100 мкл среды DMEM/F-12, не содержащей антибиотиков, при MOI 100) помещали в нижние камеры трансвеллов (0.поры 4 мкм). В другой группе тот же WT H.pylori помещали в верхние камеры, а в нижние камеры добавляли равное количество среды без WT H.pylori . После инкубации в течение 24 часов при 37°С супернатанты культур собирали для ELISA.
В одной группе WT H. pylori (в 100 мкл среды DMEM/F-12, не содержащей антибиотиков, при MOI 100) помещали в нижние камеры трансвеллов (0.поры 4 мкм). В другой группе тот же WT H.pylori помещали в верхние камеры, а в нижние камеры добавляли равное количество среды без WT H.pylori . После инкубации в течение 24 часов при 37°С супернатанты культур собирали для ELISA.
Бактерицидный анализ in vitro
Двести микролитров 10 5 КОЕ/мл Суспензию WT H. pylori инкубировали с человеческим Reg3a (30 мкг/мл) в течение 24 часов. В качестве контроля использовали PBS.Бактерии серийно разбавляли и высевали на чашки для инфузии мозг-сердце, содержащие 10% кроличьей крови, и инкубировали в течение 3-5 дней при 37°C в микроаэрофильных условиях перед подсчетом. КОЕ подсчитывали при 37°С в течение 3-5 дней после посева.
Анализ казеиновой зимографии
Клетки AGS стимулировали WT H. pylori или Δ cagA при MOI 100 в течение 24 часов. Супернатанты культуры собирали и центрифугировали для казеиновой зимографии в соответствии с инструкциями производителя.Вкратце, равные объемы супернатанта клеточной культуры и буфера для загрузки геля смешивали в невосстанавливающих условиях без нагревания; затем смешанные образцы наносили на гели (сополимеризованные с казеиновым субстратом) и разделяли электрофорезом. После электрофореза гели переносили в буфер для ренатурации на 1 час при комнатной температуре. Затем гели помещали в буфер для расщепления на 4 часа при 37°C при легком перемешивании. Поскольку ММР-10 вызывает деградацию субстрата, можно анализировать его профермент и активную форму.При окрашивании гелей переваренные участки выглядят как четкие полосы на синем фоне.
Супернатанты культуры собирали и центрифугировали для казеиновой зимографии в соответствии с инструкциями производителя.Вкратце, равные объемы супернатанта клеточной культуры и буфера для загрузки геля смешивали в невосстанавливающих условиях без нагревания; затем смешанные образцы наносили на гели (сополимеризованные с казеиновым субстратом) и разделяли электрофорезом. После электрофореза гели переносили в буфер для ренатурации на 1 час при комнатной температуре. Затем гели помещали в буфер для расщепления на 4 часа при 37°C при легком перемешивании. Поскольку ММР-10 вызывает деградацию субстрата, можно анализировать его профермент и активную форму.При окрашивании гелей переваренные участки выглядят как четкие полосы на синем фоне.
Анализ хемотаксиса
CD8 + Т-клетки из крови H. pylori – инфицированных доноров или WT H. pylori – инфицированных мышей (9 недель pi) были отсортированы с использованием флуоресцентно-активированного клеточного сортера (FACS) (FACSAria II, BD Biosciences).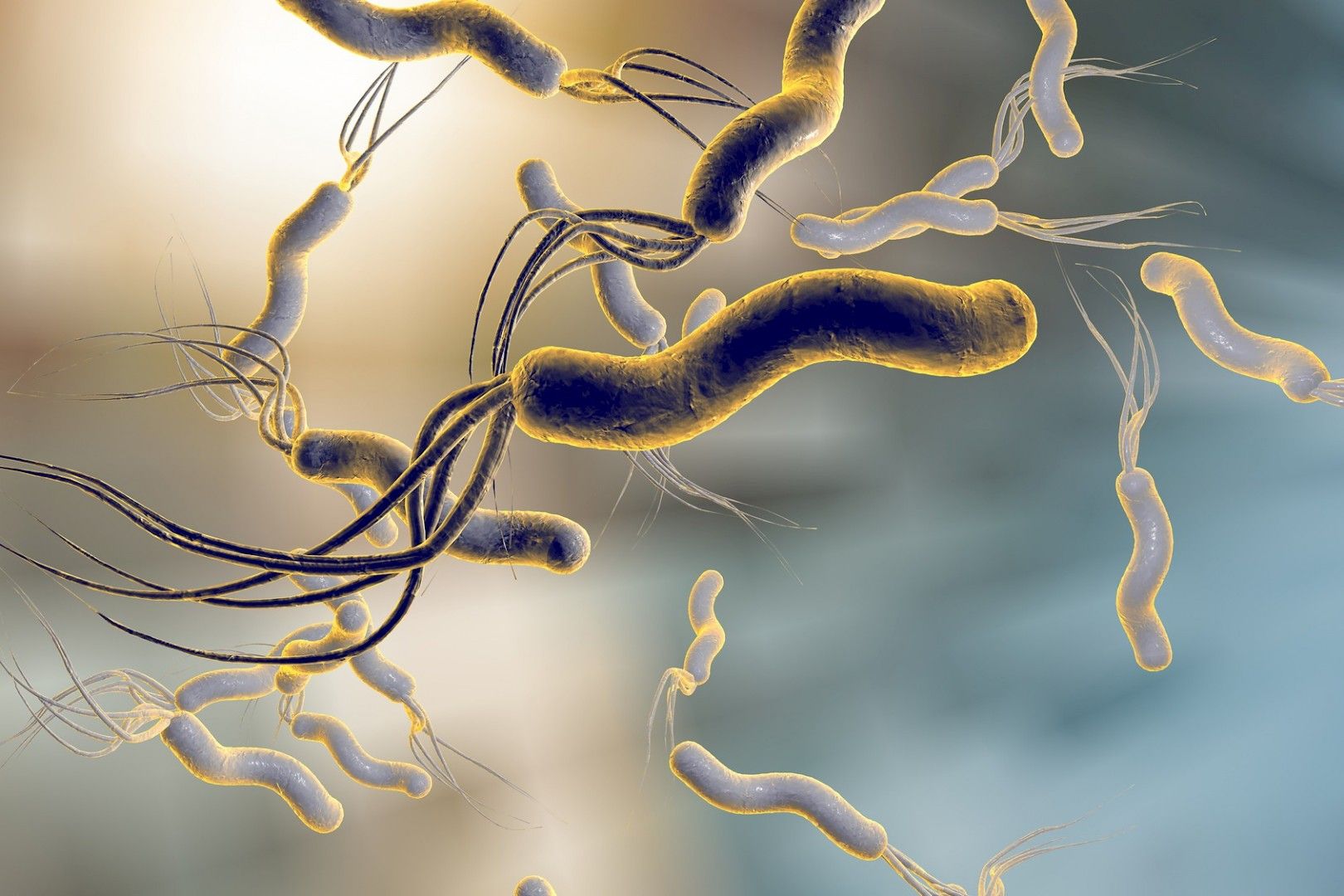 Клетки AGS предварительно обрабатывали миРНК MMP-10, миРНК NC (оба в концентрации 40 нМ) или только Lipo3000 (Mock) в течение 24 часов, а затем стимулировали WT H.pylori или Δ cagA (MOI = 100) в течение 24 часов. Супернатанты культуры собирали и использовали в качестве источника хемоаттрактантов в анализе хемотаксиса Т-клеток CD8 + . В другой серии экспериментов первичные эпителиальные клетки желудка мыши очищали из суспензий одиночных клеток ткани желудка неинфицированных мышей с помощью системы очистки колонки MACS с использованием магнитных шариков против мышиного CD326 (Miltenyi Biotec), а затем стимулировали WT H. pylori . или Δ cagA (MOI = 100) в течение 24 часов.Супернатанты культуры собирали, как указано выше. Эти культуральные супернатанты затем использовали в качестве хемоаттрактантов в анализе хемотаксиса Т-клеток CD8 + на мышах.
Клетки AGS предварительно обрабатывали миРНК MMP-10, миРНК NC (оба в концентрации 40 нМ) или только Lipo3000 (Mock) в течение 24 часов, а затем стимулировали WT H.pylori или Δ cagA (MOI = 100) в течение 24 часов. Супернатанты культуры собирали и использовали в качестве источника хемоаттрактантов в анализе хемотаксиса Т-клеток CD8 + . В другой серии экспериментов первичные эпителиальные клетки желудка мыши очищали из суспензий одиночных клеток ткани желудка неинфицированных мышей с помощью системы очистки колонки MACS с использованием магнитных шариков против мышиного CD326 (Miltenyi Biotec), а затем стимулировали WT H. pylori . или Δ cagA (MOI = 100) в течение 24 часов.Супернатанты культуры собирали, как указано выше. Эти культуральные супернатанты затем использовали в качестве хемоаттрактантов в анализе хемотаксиса Т-клеток CD8 + на мышах.
В анализе хемотаксиса отсортированные Т-клетки CD8 + (2 × 10 5 ) переносили в верхние камеры трансвеллов (поры 5 мкм).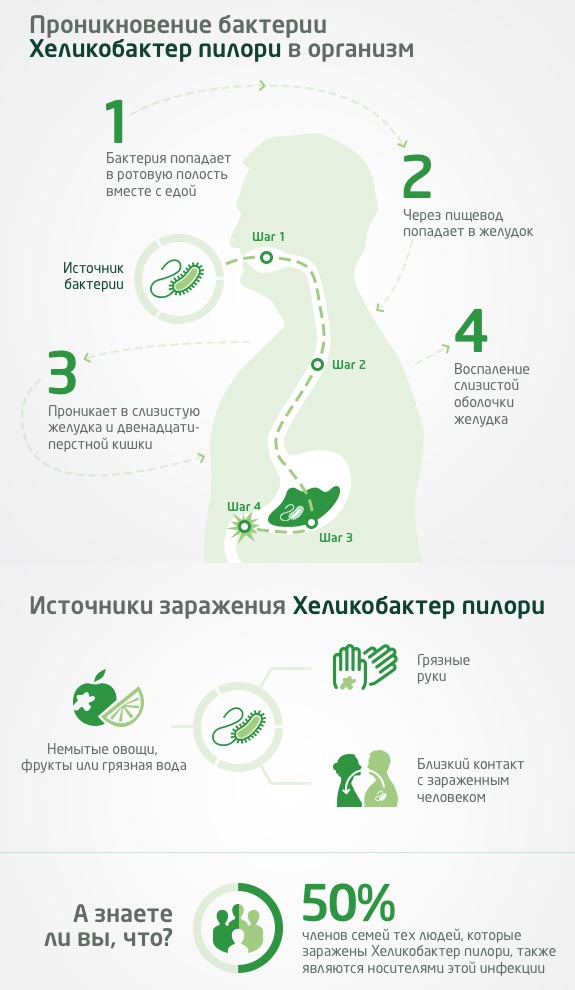 CXCL16 (100 нг/мл) и культуральные супернатанты из различных культур помещали в нижние камеры. После 6-часового культивирования миграцию количественно определяли путем подсчета клеток в нижней камере и клеток, прилипших к нижней части мембраны.В некоторых случаях перед анализом хемотаксиса в культуральные супернатанты добавляли блокирующие антитела к CXCL16 (20 мкг/мл) или соответствующий контрольный иммуноглобулин G2a (IgG2a; 20 мкг/мл).
CXCL16 (100 нг/мл) и культуральные супернатанты из различных культур помещали в нижние камеры. После 6-часового культивирования миграцию количественно определяли путем подсчета клеток в нижней камере и клеток, прилипших к нижней части мембраны.В некоторых случаях перед анализом хемотаксиса в культуральные супернатанты добавляли блокирующие антитела к CXCL16 (20 мкг/мл) или соответствующий контрольный иммуноглобулин G2a (IgG2a; 20 мкг/мл).
Иммуногистохимия
Образцы, фиксированные параформальдегидом и залитые парафином, разрезали на срезы толщиной 5 мкм. Для иммуногистохимического окрашивания срезы инкубировали с кроличьим античеловеческим или мышиным MMP-10, мышиным античеловеческим CD8 или кроличьим античеловеческим Reg3a, а затем конъюгированным с пероксидазой хрена (HRP) антикроличьим IgG и, позднее, его субстратный диаминобензидин или набор для обнаружения полимерного двойного окрашивания (Mo/HRP + Rb/AP).В завершение все срезы докрашивали гематоксилином и исследовали под микроскопом (Nikon Eclipse 80i, Nikon).
Иммунофлуоресценция
Фиксированные параформальдегидом криостатные срезы ткани отмывали в PBS, блокировали в течение 30 мин 20% козьей сывороткой в PBS, окрашивали на ММП-10 и Н + /К + АТФаза, ММП-10 и пепсиноген II, или MMP-10 и H. pylori . Предметные стекла исследовали с помощью конфокального флуоресцентного микроскопа (LSM 510 META, Zeiss).
ПЦР в реальном времени
ДНК из биоптатов экстрагировали с помощью набора QIAamp DNA Mini Kit, а РНК из биоптатов и культивированных клеток экстрагировали с помощью реагента TRIzol.Образцы РНК подвергали обратной транскрипции в комплементарную ДНК с помощью набора реагентов PrimeScript RT. ПЦР в реальном времени проводили на iQ5 (Bio-Rad) с мастер-миксом для ПЦР в реальном времени в соответствии со спецификациями производителя. Экспрессию мРНК 16 генов S рДНК, cagA , MMP-10, IL-22, хемокина, β-дефензина и Reg3 измеряли с использованием метода TaqMan и/или SYBR green с соответствующими праймерами (таблица S3). . Для мышей уровень мРНК β2-микроглобулина мыши служил нормализатором, а его уровень в желудке неинфицированных мышей или мышей WT служил калибратором.Для человека уровень мРНК β-актина человека служил нормализатором, а его уровень в нестимулированных клетках или желудке неинфицированных доноров служил калибратором. Относительную экспрессию гена выражали как кратное изменение соответствующей мРНК, рассчитанное методом ΔΔ C t .
. Для мышей уровень мРНК β2-микроглобулина мыши служил нормализатором, а его уровень в желудке неинфицированных мышей или мышей WT служил калибратором.Для человека уровень мРНК β-актина человека служил нормализатором, а его уровень в нестимулированных клетках или желудке неинфицированных доноров служил калибратором. Относительную экспрессию гена выражали как кратное изменение соответствующей мРНК, рассчитанное методом ΔΔ C t .
Проточная цитометрия
Маркеры клеточной поверхности окрашивали специфическими или изотипическими контрольными антителами и анализировали с помощью многоцветной проточной цитометрии на FACSCanto II (BD Biosciences). Данные анализировали с помощью программного обеспечения FlowJo (Tree Star) или FACSDiva (BD Biosciences).
Иммуноферментный анализ
Изолированные ткани желудка человека и мыши гомогенизировали в 1 мл стерильного реагента для экстракции белка и центрифугировали. Супернатанты тканей собирали для ELISA.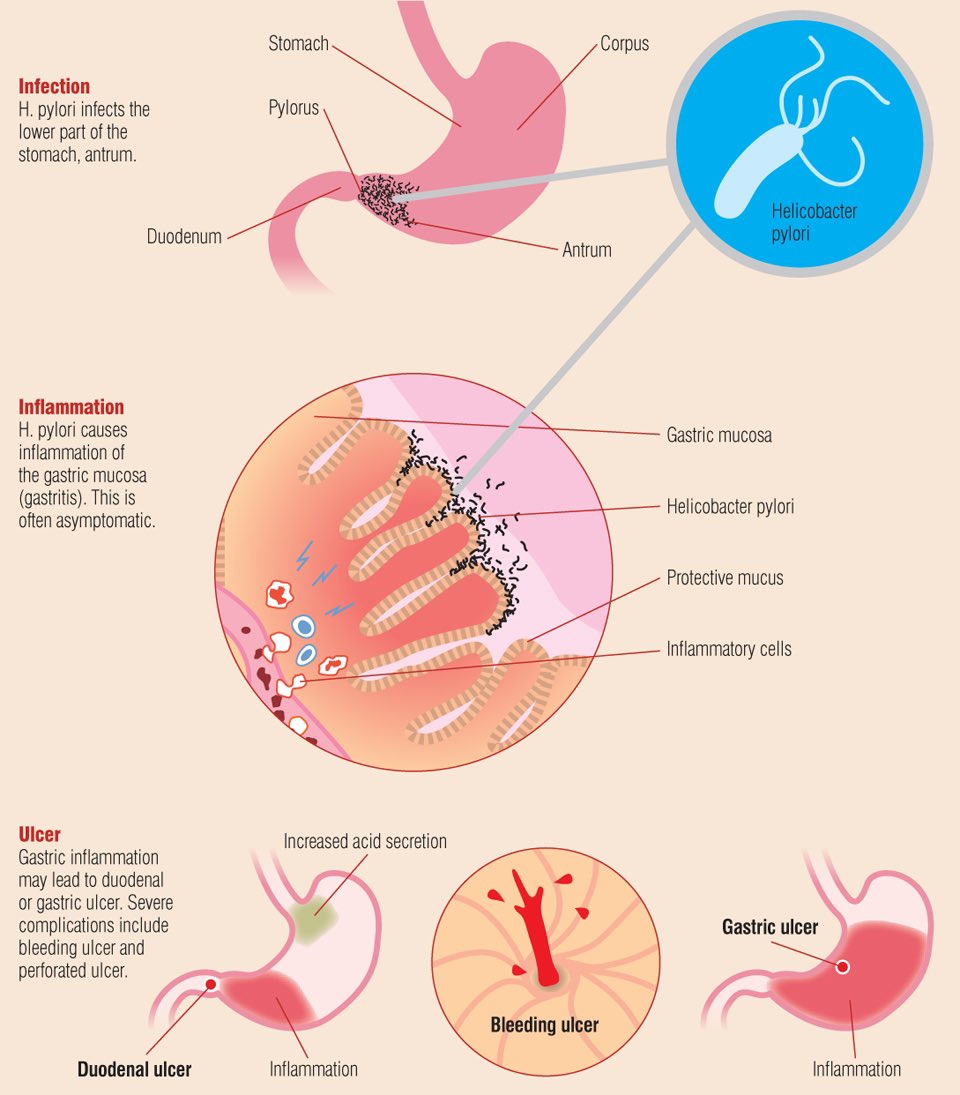 Концентрации CXCL16 и Reg3a в супернатантах тканей и концентрации MMP-10 и CXCL16 в супернатантах культур эпителиальных клеток желудка или культурах тканей определяли с использованием наборов ELISA в соответствии с инструкциями производителя.
Концентрации CXCL16 и Reg3a в супернатантах тканей и концентрации MMP-10 и CXCL16 в супернатантах культур эпителиальных клеток желудка или культурах тканей определяли с использованием наборов ELISA в соответствии с инструкциями производителя.
Вестерн-блот-анализ
Вестерн-блоттинг выполняли на 10–15% поливинилидендифторидных (ПВДФ) мембранах, содержащих 10–15% SDS-электрофорез в геле-полиакриламидном геле, с эквивалентными количествами белков клеточного или тканевого лизата для каждого образца.Для блокировки ПВДФ-мембран использовали пятипроцентное обезжиренное молоко. Мышиные MMP-10, E-кадгерин и ZO-1 были обнаружены с помощью кроличьих антител против MMP-10, мышиных антител против E-кадгерина и кроличьих антител против ZO-1; MMP-10, ERK1/2 и p-ERK1/2 человека были обнаружены с помощью кроличьего антитела против MMP-10, кроличьего антитела против ERK1/2 и кроличьего антитела против p-ERK1/2 соответственно. Затем следовала инкубация с HRP-конъюгированными вторичными антителами. Связанные белки визуализировали с использованием набора SuperSignal West Dura Extended Duration Substrate.
Связанные белки визуализировали с использованием набора SuperSignal West Dura Extended Duration Substrate.
Матрица MMP
Белковые профили MMP первичной слизистой оболочки желудка человека инфицированных H. pylori и неинфицированных доноров анализировали с помощью набора Proteome Profiler Human Protease Array Kit (ARY021B, R&D Systems) в соответствии с инструкциями производителя. Вкратце, эквивалентное количество (около 0,3 мм 3 ) первичной слизистой оболочки желудка человека от H. pylori инфицированных пациентов и парных неинфицированных доноров гомогенизировали в 0,2 мл стерильного реагента для экстракции белка и центрифугировали.Количественную оценку концентрации белка в образце проводили с помощью анализа общего белка на основе бицинхониновой кислоты. Сначала каждую мембрану инкубировали в блокирующем буфере матрицы в течение 1 часа на качающейся платформе. Затем к каждому приготовленному образцу добавляли по 15 мкл восстановленного коктейля антител, обнаруживающих протеазу, при комнатной температуре на 1 час. Затем из лунок удаляли блокирующий буфер, а приготовленные смеси образец/АТ добавляли к соответствующей мембране и инкубировали в течение ночи при 4°С. Затем каждую мембрану трижды промывали промывочным буфером, затем инкубировали со стрептавидином-HRP в течение 30 мин при комнатной температуре, а затем проявляли 1 мл приготовленной смеси химических реагентов в течение 1 мин.
Затем из лунок удаляли блокирующий буфер, а приготовленные смеси образец/АТ добавляли к соответствующей мембране и инкубировали в течение ночи при 4°С. Затем каждую мембрану трижды промывали промывочным буфером, затем инкубировали со стрептавидином-HRP в течение 30 мин при комнатной температуре, а затем проявляли 1 мл приготовленной смеси химических реагентов в течение 1 мин.
Эксперименты с микроматрицами
Профили экспрессии генов WT H. pylori – инфицированных и неинфицированных клеток AGS анализировали с помощью Human Exon 1.0 ST GeneChip (Affymetrix) в строгом соответствии с протоколом производителя. Эксперименты с микрочипами проводились в компании Genminix Informatics (Китай) с сервисом микрочипов, сертифицированным Affymetrix.
Статистический анализ
Результаты выражены как среднее ± SEM. Критерий Стьюдента t обычно использовался для анализа различий между двумя группами, но когда дисперсии различались, использовался критерий Манна-Уитни U .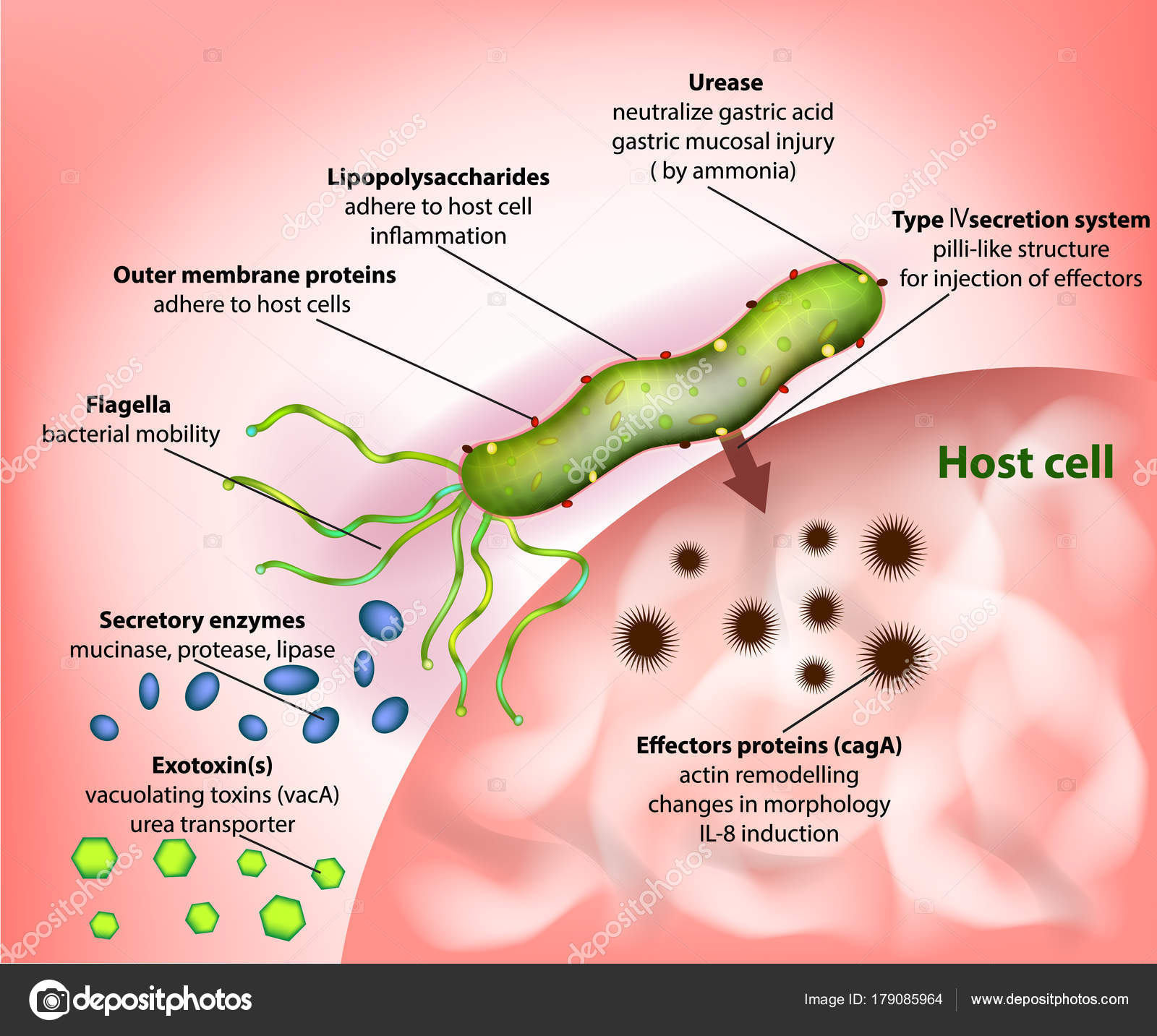 Данные оценки воспаления анализировали с помощью теста Манна-Уитни U . Корреляции между параметрами оценивались с использованием корреляционного анализа Пирсона и линейного регрессионного анализа, в зависимости от обстоятельств. Статистическое программное обеспечение SPSS (версия 13.0) использовалось для всего статистического анализа. Все данные были проанализированы с использованием двусторонних тестов, и P <0,05 считались статистически значимыми. Анализ данных микрочипов был выполнен с помощью Genminix Informatics. Необработанные данные из каждого массива анализировали с помощью TwoClassDif.
Данные оценки воспаления анализировали с помощью теста Манна-Уитни U . Корреляции между параметрами оценивались с использованием корреляционного анализа Пирсона и линейного регрессионного анализа, в зависимости от обстоятельств. Статистическое программное обеспечение SPSS (версия 13.0) использовалось для всего статистического анализа. Все данные были проанализированы с использованием двусторонних тестов, и P <0,05 считались статистически значимыми. Анализ данных микрочипов был выполнен с помощью Genminix Informatics. Необработанные данные из каждого массива анализировали с помощью TwoClassDif.
Благодарности
Финансирование: Эта работа была поддержана грантами Национального фонда естественных наук Китая (81670510) и Национальной ключевой программы исследований и разработок Китая (2016YFC1302200). Заявление об этике: Образцы биопсии были получены в соответствии с протоколами, одобренными комитетами по этике больницы СиньЦяо и Юго-Западной больницы, и от всех пациентов было получено информированное согласие. Все эксперименты на животных проводились с разрешения Комитета по этике и экспериментам на животных Третьего военно-медицинского университета. Участие авторов: Концепция и дизайн, анализ данных и составление рукописи: Ю.З. Редакция рукописи: Ю.З. и У.К. Статистический анализ: Y.Z., Y.-p.L., PC, J.-y.Z., Y.-s.T., F.-y.M., Y.-g.L., H.K., X.-l.W. и C.-j.H. Получено финансирование: Ю.З. Техническая поддержка: B.H., Q.M., S.-m.Y., L.-s.P., T.-t.W. и Q.-m.Z. Окончательное согласование представленной версии: Ю.З. Конкурирующие интересы : Авторы заявляют, что у них нет конкурирующих интересов. Доступность данных и материалов : Все данные, необходимые для оценки выводов в статье, присутствуют в статье и/или Дополнительных материалах.Дополнительные данные, относящиеся к данной статье, могут быть запрошены у авторов.
Все эксперименты на животных проводились с разрешения Комитета по этике и экспериментам на животных Третьего военно-медицинского университета. Участие авторов: Концепция и дизайн, анализ данных и составление рукописи: Ю.З. Редакция рукописи: Ю.З. и У.К. Статистический анализ: Y.Z., Y.-p.L., PC, J.-y.Z., Y.-s.T., F.-y.M., Y.-g.L., H.K., X.-l.W. и C.-j.H. Получено финансирование: Ю.З. Техническая поддержка: B.H., Q.M., S.-m.Y., L.-s.P., T.-t.W. и Q.-m.Z. Окончательное согласование представленной версии: Ю.З. Конкурирующие интересы : Авторы заявляют, что у них нет конкурирующих интересов. Доступность данных и материалов : Все данные, необходимые для оценки выводов в статье, присутствуют в статье и/или Дополнительных материалах.Дополнительные данные, относящиеся к данной статье, могут быть запрошены у авторов.
Желудочные микробы, связанные с воспалением, атрофией и кишечной метаплазией желудка через 1 год после эрадикации Helicobacter pylori ведущая причина смертности от онкологических заболеваний.
 Хроническое воспаление, вызванное H.pylori индуцирует несколько гистопатологических изменений в желудочном эпителии и поддерживает постоянную выработку каскада цитокинов, которые, в свою очередь, привлекают иммунные клетки, которые генерируют окислительные радикалы, способные повредить ДНК хозяина. появление предопухолевых поражений желудка (атрофия и кишечная метаплазия) преимущественно хронического воспаления. Схемы лечения, направленные на эрадикацию H. pylori , продемонстрировали свою эффективность в предотвращении прогрессирования патологических изменений слизистой оболочки желудка.3 4 Однако, несмотря на сообщения об эффективности эрадикационной терапии, у некоторых пациентов продолжают развиваться предраковые поражения желудка, включая атрофию желудка (ГА) и кишечную метаплазию (КМ).3 Примечательно, что менее 3% из H. pylori – у инфицированных людей развивается рак желудка,5 и около 20% людей с хроническим гастритом являются H. pylori отрицательными, что позволяет предположить, что другие микроорганизмы могут вызывать воспаление желудка и даже канцерогенез желудка.
Хроническое воспаление, вызванное H.pylori индуцирует несколько гистопатологических изменений в желудочном эпителии и поддерживает постоянную выработку каскада цитокинов, которые, в свою очередь, привлекают иммунные клетки, которые генерируют окислительные радикалы, способные повредить ДНК хозяина. появление предопухолевых поражений желудка (атрофия и кишечная метаплазия) преимущественно хронического воспаления. Схемы лечения, направленные на эрадикацию H. pylori , продемонстрировали свою эффективность в предотвращении прогрессирования патологических изменений слизистой оболочки желудка.3 4 Однако, несмотря на сообщения об эффективности эрадикационной терапии, у некоторых пациентов продолжают развиваться предраковые поражения желудка, включая атрофию желудка (ГА) и кишечную метаплазию (КМ).3 Примечательно, что менее 3% из H. pylori – у инфицированных людей развивается рак желудка,5 и около 20% людей с хроническим гастритом являются H. pylori отрицательными, что позволяет предположить, что другие микроорганизмы могут вызывать воспаление желудка и даже канцерогенез желудка.:max_bytes(150000):strip_icc()/H.pylori-5b563ae846e0fb0037012b90.jpg) 6
6Возможно, в то время как H.pylori инициируют воспалительный процесс в желудке, другие желудочные микробы с провоспалительным потенциалом играют важную роль в поддержании прогрессирования воспаления и диспластических изменений, приводящих к развитию рака желудка. Потеря секретирующих кислоту париетальных клеток, вызванная хронической инфекцией H. pylori в эпителии желудка, может создать благоприятную среду для колонизации не- H. pylori микробами, чтобы вызвать дальнейший проканцерогенный процесс.Более того, «точка невозврата» в каскаде событий, ведущих к раку желудка, как сообщается, связана с пациентами с ИМ и дисплазией, независимо от статуса H. pylori .2
Актуальность не-H. pylori в развитии рака желудка было ранее продемонстрировано с использованием трансгенных мышей INS-GAS, сверхэкспрессирующих гастрин. У мышей INS-GAS, получавших лечение антибиотиками, колонизированных H. pylori , было отсрочено начало рака желудка по сравнению с контрольными мышами, инфицированными H.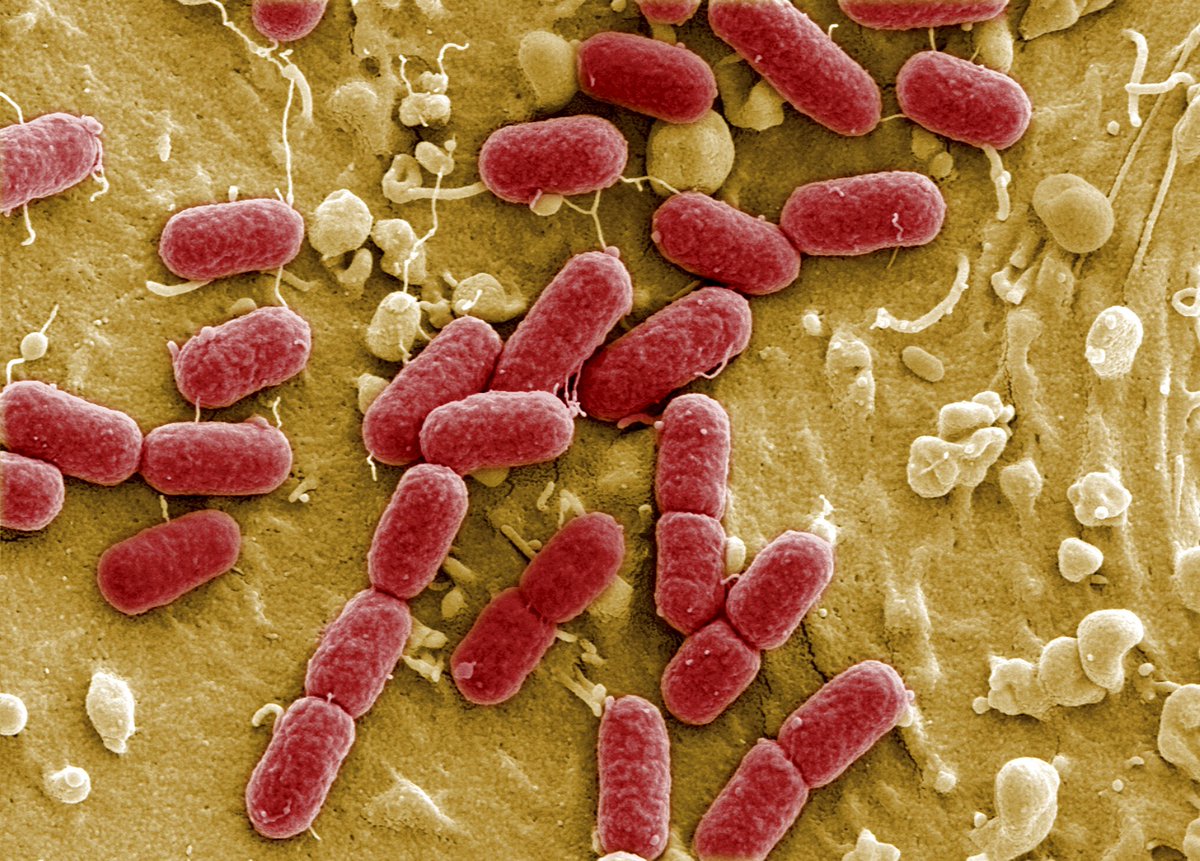 pylori без лечения антибиотиками,7 что позволяет предположить, что желудочные микробы могут усиливать эффекты H. pylori в канцерогенезе желудка. Также сообщалось об однонуклеотидных полиморфизмах в генах хозяина, которые влияют на рецепторы распознавания бактериального паттерна у пациентов с раком желудка,8 что подчеркивает активную роль перекрестных помех бактерии-хозяина в онкогенезе желудка. Поэтому уместно исследовать бактерии, которые связаны с воспалением, атрофией и ИМ после эрадикации H.pylori для создания программы эпиднадзора, основанной на стратификации риска рака желудка, специфичной для пациентов, не инфицированных H. pylori
pylori без лечения антибиотиками,7 что позволяет предположить, что желудочные микробы могут усиливать эффекты H. pylori в канцерогенезе желудка. Также сообщалось об однонуклеотидных полиморфизмах в генах хозяина, которые влияют на рецепторы распознавания бактериального паттерна у пациентов с раком желудка,8 что подчеркивает активную роль перекрестных помех бактерии-хозяина в онкогенезе желудка. Поэтому уместно исследовать бактерии, которые связаны с воспалением, атрофией и ИМ после эрадикации H.pylori для создания программы эпиднадзора, основанной на стратификации риска рака желудка, специфичной для пациентов, не инфицированных H. pylori
Здесь мы провели ретроспективное исследование, включающее 1-летнее наблюдение за H. pylori – положительные субъекты, получавшие эрадикационную терапию H. pylori , по сравнению с теми, кто получал плацебо. Мы идентифицировали желудочные микробы, которые связаны с воспалением желудка, атрофией и ИМ после эрадикации H. pylori .
pylori .
Материалы и методы
Пациенты
Всего 587 H . pylori – положительные пациенты, проживающие в уезде Яньтай провинции Шаньдун, Китай, с заболеваемостью 50 случаев рака желудка на 100 000 населения, были рандомизированы, как описано ранее4, из которых 295 H. pylori –положительные пациенты получили 1- недельный курс омепразола (20 мг), амоксициллина (1 г) и кларитромицина (500 мг) (лечение ОАК) два раза в день, в то время как 292 H . pylori – положительные субъекты получали плацебо (лечение плацебо). Субъектам была проведена эндоскопия с биопсией стерильными щипцами в начале исследования и через 1 год из одних и тех же участков антрального отдела и тела желудка. Для подтверждения эрадикации H. pylori использовались гистология и уреазный тест. Биоптаты тканей также были получены во время эндоскопии и немедленно заморожены при -80°C.
Гистологическое исследование
Тяжесть воспаления желудка, ГА и ИМ была оценена в соответствии с обновленной Сиднейской классификацией патологоанатомом, который не знал о лечении. Прогрессирование и регрессию определяли как увеличение или уменьшение, соответственно, воспаления, GA или IM баллов через 1 год.
Прогрессирование и регрессию определяли как увеличение или уменьшение, соответственно, воспаления, GA или IM баллов через 1 год.
Секвенирование образцов
Очистка ДНК для секвенирования гена 16S рРНК была проведена на 404 образцах биопсии желудка, включая 100 пар до и после 1 года лечения плацебо и 102 пары до и после эрадикации H. pylori при лечении OAC (дополнительная онлайн-таблица 1). Ткани биопсии желудка расщепляли с использованием ферментов лизоцима и мутанолизина (Sigma, Гонконг) с последующим измельчением и очисткой ДНК с помощью QIAamp DNA Mini Kit.Пара праймеров Illumina 515 f, 5’-GTGCCAGCMGCCGCGGTAA-3’ и 806 r, 5’-GGACTACHVGGGTWTCTAAT-3’, нацеленная на гипервариабельные области V4 гена 16S рРНК, использовалась для секвенирования на платформе Illumina MiSeq. Набор пластин для нормализации Invitrogen SequelPrep использовался для очистки и нормализации библиотеки.
Контроль качества и аннотирование последовательностей
Программный пакет Mothur9 использовался для курирования и анализа последовательностей. Вкратце, алгоритм выравнивания Needleman-Wunsch использовался для объединения чтений с парными концами в контиги с параметрами по умолчанию.За этим последовало выравнивание с базой данных последовательностей 16S рРНК SILVA (V.123) с использованием алгоритма ближайшего выравнивания пространства терминации (NAST). скрининг химерных последовательностей с использованием базы данных de novo Uchime.11 Greengenes (V.13.8) для определения таксономии. Прочтения, отнесенные к небактериальным или неизвестным царствам, отбрасывались. Алгоритм кластеризации средних соседей использовался для кластеризации полученных последовательностей в рабочие таксономические единицы (OTU) с отсечением идентичности 97%.Функциональный потенциал микробных сообществ желудка оценивали по алгоритму PICRUSt12. База данных Киотской энциклопедии генов и геномов (KEGG) использовалась для анализа обогащения пути.
Вкратце, алгоритм выравнивания Needleman-Wunsch использовался для объединения чтений с парными концами в контиги с параметрами по умолчанию.За этим последовало выравнивание с базой данных последовательностей 16S рРНК SILVA (V.123) с использованием алгоритма ближайшего выравнивания пространства терминации (NAST). скрининг химерных последовательностей с использованием базы данных de novo Uchime.11 Greengenes (V.13.8) для определения таксономии. Прочтения, отнесенные к небактериальным или неизвестным царствам, отбрасывались. Алгоритм кластеризации средних соседей использовался для кластеризации полученных последовательностей в рабочие таксономические единицы (OTU) с отсечением идентичности 97%.Функциональный потенциал микробных сообществ желудка оценивали по алгоритму PICRUSt12. База данных Киотской энциклопедии генов и геномов (KEGG) использовалась для анализа обогащения пути.
Статистический анализ
Дифференциально обильные микробы, не относящиеся к H. pylori , и прогнозируемые функциональные изменения микробиоты, связанные с воспалением, ГА и ИМ, были проанализированы с использованием алгоритма Лефсе. 13 Различия с логарифмом 10 баллов линейного дискриминантного анализа (абсолютные значения) >2.0 и значение p <0,05 считались значимыми. Отношения совместного появления и совместного исключения между бактериями с относительной численностью более 0,1% и с Helicobacter на уровне рода были оценены с использованием алгоритма SparCC,14 известного своей надежностью для данных о составе кишечного микробиома. Значения P менее 0,05 после коррекции множественных сравнений с использованием метода частоты ложных открытий считались значимыми. Cytoscape V.3.0.4 использовали для визуализации одновременного появления бактерий.Параметры сети, включая топологический коэффициент, центральность близости и напряжение, оценивались с использованием алгоритма сетевого анализатора Cytoscape V.3.0.4 с параметрами по умолчанию и сравнивались с использованием U-критерия Манна-Уитни.
13 Различия с логарифмом 10 баллов линейного дискриминантного анализа (абсолютные значения) >2.0 и значение p <0,05 считались значимыми. Отношения совместного появления и совместного исключения между бактериями с относительной численностью более 0,1% и с Helicobacter на уровне рода были оценены с использованием алгоритма SparCC,14 известного своей надежностью для данных о составе кишечного микробиома. Значения P менее 0,05 после коррекции множественных сравнений с использованием метода частоты ложных открытий считались значимыми. Cytoscape V.3.0.4 использовали для визуализации одновременного появления бактерий.Параметры сети, включая топологический коэффициент, центральность близости и напряжение, оценивались с использованием алгоритма сетевого анализатора Cytoscape V.3.0.4 с параметрами по умолчанию и сравнивались с использованием U-критерия Манна-Уитни.
Результаты
Эрадикация
H. pylori на фоне лечения ОАК Острый и хронический гастрит уменьшился как в антральном отделе, так и в теле желудка у пациентов после эрадикации H.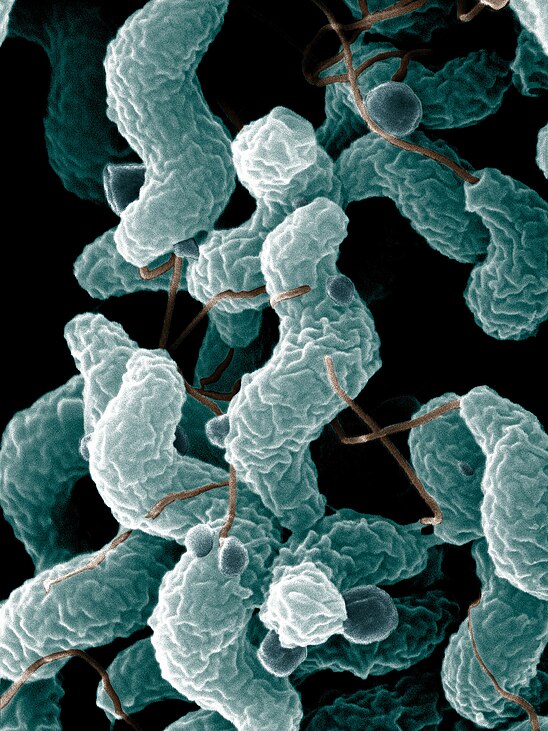 pylori . В группе плацебо образцы антральной биопсии имели более выраженный острый гастрит и незначительное увеличение атрофии по сравнению с группой, получавшей ОАК.Тем не менее, изменения IM были одинаковыми в группе, получавшей плацебо и в группе, получавшей ОАК.3
pylori . В группе плацебо образцы антральной биопсии имели более выраженный острый гастрит и незначительное увеличение атрофии по сравнению с группой, получавшей ОАК.Тем не менее, изменения IM были одинаковыми в группе, получавшей плацебо и в группе, получавшей ОАК.3
Анализ последовательностей гена 16S рРНК был проведен в общей сложности на 404 образцах биопсии желудка, включая 100 пар до и после 1 года лечения плацебо, а также 102 пары до и 1 год после лечения ОАК. Демографические данные субъектов представлены в таблице 1. Эрадикация H.pylori была подтверждена в группе, получавшей ОАК, при относительной численности H.pylori 0,016±0.0018 по сравнению с группами до лечения (0,68±0,027), до плацебо (0,67±0,025) и после плацебо (0,46±0,023) (p<0,00001) (рис. 1А). Анализ основных компонентов выявил отчетливый кластер желудочной микробиоты для группы, получавшей ОАК (рис. 1В). Эрадикация H. pylori была связана с увеличением бактериального разнообразия (p<0,00001) (рис.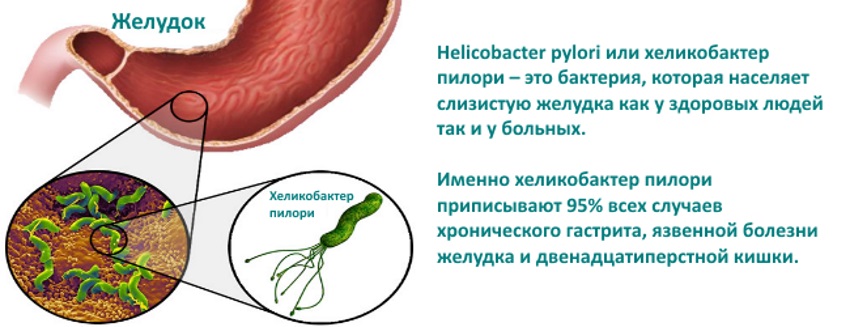 1C), что отражалось в пролиферации нескольких видов бактерий (рис. 1D). Однако после исключения H. pylori увеличение разнообразия бактерий больше не наблюдалось, что указывает на то, что увеличение разнообразия было результатом доминирующей численности H.pylori до терапии ОАК. Наиболее распространенные бактерии семейство после H. Pylori эрадикации с относительной численностью более 1% является Pseudomonadaceae , Oxalobacteriaceae , Microbacteriaceae , Enterobacteriaceae , Lachnospiraceae , Vibrionaceae и Halomonadaceae (онлайн дополнительного фигура 1). Они увеличились соответственно в 3,9, 4,6, 4,2, 2,3, 1,1, 6,9 и 5,7 раза через год после H.pylori эрадикация. В дополнение к Helicobacter , Haemophilus (p=0,0061), Actinobacillus (p=0,0019) и Neisseria (p=0,0056) наблюдалось снижение после лечения ОАК (рис. 1E), и они были представлены .
1C), что отражалось в пролиферации нескольких видов бактерий (рис. 1D). Однако после исключения H. pylori увеличение разнообразия бактерий больше не наблюдалось, что указывает на то, что увеличение разнообразия было результатом доминирующей численности H.pylori до терапии ОАК. Наиболее распространенные бактерии семейство после H. Pylori эрадикации с относительной численностью более 1% является Pseudomonadaceae , Oxalobacteriaceae , Microbacteriaceae , Enterobacteriaceae , Lachnospiraceae , Vibrionaceae и Halomonadaceae (онлайн дополнительного фигура 1). Они увеличились соответственно в 3,9, 4,6, 4,2, 2,3, 1,1, 6,9 и 5,7 раза через год после H.pylori эрадикация. В дополнение к Helicobacter , Haemophilus (p=0,0061), Actinobacillus (p=0,0019) и Neisseria (p=0,0056) наблюдалось снижение после лечения ОАК (рис. 1E), и они были представлены . Haemophilus influenzae_Otu42 , Actinobacillus parahaemolyticus _Otu100 и Neisseria subflava на уровне OTU (онлайн-дополнительная таблица 2). Образцы с >1% H . Относительная численность pylori в группе, получавшей ОАК, считалась положительной для H.pylori , как описано ранее15, и были исключены из последующего анализа.
Haemophilus influenzae_Otu42 , Actinobacillus parahaemolyticus _Otu100 и Neisseria subflava на уровне OTU (онлайн-дополнительная таблица 2). Образцы с >1% H . Относительная численность pylori в группе, получавшей ОАК, считалась положительной для H.pylori , как описано ранее15, и были исключены из последующего анализа.
Эрадикация Helicobacter pylori с помощью лечения омепразолом, амоксициллином и кларитромицином (ОАК). (A) Относительное количество H. pylori в группах до плацебо, после плацебо, до лечения ОАК и после лечения ОАК. (B) График анализа основных компонентов, показывающий отдельный кластер для группы лечения Post_OAC. (C) Бактериальное разнообразие, оцененное по индексу Шеннона для групп лечения Pre_OAC и Post_OAC.(D) 20 основных родов бактерий до и после 1 года лечения ОАК. (B) Относительная численность Neisseria , Haemophilus и Actinobacillus через 1 год после лечения ОАК. * Скорректировано p<0,05, ** Скорректировано p<0,01, *** Скорректировано p<0,001.
* Скорректировано p<0,05, ** Скорректировано p<0,01, *** Скорректировано p<0,001.
Демографические данные субъектов исследования
Экология микробиоты изменилась после эрадикации
H. pylori Сопутствующая встречаемость микробов в желудке осталась практически неизменной в группе, получавшей плацебо (рис. 2A, B, дополнительные онлайн-таблицы 3–4) .Однако через год после эрадикации H. pylori с помощью лечения пероральными антикоагулянтами наблюдалось гораздо меньше микробной одновременности (рис. 2C, D, дополнительные онлайн-таблицы 5–6). Анализ топологии сети показал, что топологический коэффициент (p=0,023), центральность близости (p=0,016) и стресс (p=0,01) узлов бактерий статистически различались в микробной экологической сети в отсутствие H. pylori по сравнению с H. pylori – инфицированная группа плацебо.Кроме того, H. pylori имели преимущественно коэксклюзивную ассоциацию с другими желудочными микробами в группах, инфицированных H. pylori . В группе обработанной OAC отчетливый кластер пероральных бактерий, включающий ParviMONEPTOCCUS , ParviMonas , Fusobacterium , Haemophilus, Neisseria , Gemella, Granulicatella, Rothia, Streptococcus и порфиромонас (рисунок 2d ). Изменение микробной экологии желудка после H.pylori указывает на то, что H. pylori влияет на взаимодействие с другими желудочными микробами, что может способствовать воспалению и развитию раковых поражений у инфицированных пациентов.
pylori . В группе обработанной OAC отчетливый кластер пероральных бактерий, включающий ParviMONEPTOCCUS , ParviMonas , Fusobacterium , Haemophilus, Neisseria , Gemella, Granulicatella, Rothia, Streptococcus и порфиромонас (рисунок 2d ). Изменение микробной экологии желудка после H.pylori указывает на то, что H. pylori влияет на взаимодействие с другими желудочными микробами, что может способствовать воспалению и развитию раковых поражений у инфицированных пациентов.
Экология микробиоты изменилась после эрадикации Helicobacter pylori . Экологическая сеть совместного возникновения в группах (A) до плацебо, (B) после плацебо, (C) до лечения OAC и (D) после лечения OAC. Значимый ( Q >0,05) Алгоритм SparCC использовался для вывода о совпадении среди лучших (0,05).1% относительной численности) родов бактерий и с Helicobacter .
Бактерии, ассоциированные с воспалением после эрадикации
H. pylori
pylori Интенсивность полиморфноядерной инфильтрации при остром воспалении уменьшилась у 84,1% пациентов после эрадикации H. pylori .3 Затем мы определили бактерии, которые потенциально могут способствовать персистирующей воспаление у пациентов после эрадикации H. pylori . Используя линейный дискриминантный анализ с величиной эффекта (Lefse), мы идентифицировали Acinetobacter , Ralstonia , Actinobacillus и Erwinia как обогащенные, в то время как Sphingomonas и Roseburia у пациентов с отсутствием бактериального воспаления родов с истощением. Х.pylori (рис. 3А). На OTU уровне, Acinetobacter iwoffii_Otu180 , Actinobacillus parahaemolyticus _Otu100, Prevotella nanceiences_Otu232 , Erwinia soli_Otu664 , стрептококк anginosus_Otu278 , Acinetobacter rhizosphaerae_Otu208 и Acinetobacer guillouiae_Otu81 были обогащены у больных с персистирующим воспалением 1 года после того, как эрадикация H. pylori (фиг.3В).
pylori (фиг.3В).
Бактерии, связанные с воспалением после эрадикации Helicobacter pylori .Линейный дискриминантный анализ (LDA) с размером эффекта (Lefse), показывающий (A) бактериальные роды и (B) бактериальные OTU, связанные с воспалением через 1 год после H. pylori . ОТЕ, операционная таксономическая единица.
Не
-H. pylori бактерии, связанные с атрофией желудка Гистологические изменения, вызванные хронической инфекцией H. pylori , могут усугубляться желудочными микробами. Мы исследовали различное обилие бактерий, связанных с атрофией, до и после лечения ОАК.Наш анализ показал, что Moraxella , Pasteurella , Bulleidia и Agrobacterium были обогащены у пациентов с атрофией до эрадикационной терапии H. pylori (рис. 4А). После эрадикационной терапии H. pylori показатели атрофии снизились у 20,8% субъектов.3 Корреляционный анализ показателей атрофии и обилия бактерий в группе, получавшей ОАК, показал, что Granulicatella (R = 0,41, p = 0,0027), Abiotrophia (Р=0. 31, p=0,023) и Peptostreptococcus (R=0,31, p=0,028) имели положительную корреляцию, а Faecalibacterium (R=-0,43, p=0,0013), Rahnella (R=-0,38, p=0,005). ), Bacteroides (R=-0,34, p=0,012), Clostridium (R=-0,29, p=0,035) и Acinetobacter (R=-0,27, p=0,046) отрицательно коррелировали с показателями атрофии ( рисунок 4В). Кроме того, мы наблюдали обогащение Granulicatella , Streptococcus , Rothia и Leptotrichia у субъектов с возникшей атрофией через 1 год после H.pylori (рис. 4С). Acinetobacter , Faecalibacterium , Rahnella , Kaistobacter , Blautia , Caulobacter , и Norcadioides Brevundimonas были более распространены в субъектах, не имеющих развития атрофии следующие H. пилори эрадикации.
31, p=0,023) и Peptostreptococcus (R=0,31, p=0,028) имели положительную корреляцию, а Faecalibacterium (R=-0,43, p=0,0013), Rahnella (R=-0,38, p=0,005). ), Bacteroides (R=-0,34, p=0,012), Clostridium (R=-0,29, p=0,035) и Acinetobacter (R=-0,27, p=0,046) отрицательно коррелировали с показателями атрофии ( рисунок 4В). Кроме того, мы наблюдали обогащение Granulicatella , Streptococcus , Rothia и Leptotrichia у субъектов с возникшей атрофией через 1 год после H.pylori (рис. 4С). Acinetobacter , Faecalibacterium , Rahnella , Kaistobacter , Blautia , Caulobacter , и Norcadioides Brevundimonas были более распространены в субъектах, не имеющих развития атрофии следующие H. пилори эрадикации.
Бактерии, ассоциированные с атрофией, до и после эрадикации Helicobacter pylori . (A) Линейный дискриминантный анализ (LDA) с величиной эффекта (Lefse), показывающий бактериальные роды, обогащенные у пациентов с атрофией до H.pylori эрадикация. (B) Корреляция Спирмена родов бактерий с показателями атрофии после эрадикации H. pylori . (C) LDA с размером эффекта (Lefse), показывающий обогащение или истощение бактериальных родов у пациентов с возникшей атрофией через 1 год после эрадикации H. pylori .
(A) Линейный дискриминантный анализ (LDA) с величиной эффекта (Lefse), показывающий бактериальные роды, обогащенные у пациентов с атрофией до H.pylori эрадикация. (B) Корреляция Спирмена родов бактерий с показателями атрофии после эрадикации H. pylori . (C) LDA с размером эффекта (Lefse), показывающий обогащение или истощение бактериальных родов у пациентов с возникшей атрофией через 1 год после эрадикации H. pylori .
Не
-H. pylori бактерий, ассоциированных с кишечной метаплазией Мы дополнительно исследовали ассоциацию микробов, не относящихся к H. pylori , с ИМ. Мы обнаружили обогащение Peptostreptococcus и истощение Lachnospira у пациентов с ИМ до лечения ОАК (рис. 5А).IM показал очень небольшие изменения после приема плацебо или OAC.3 Корреляционный анализ показал, что Parvimonas (R = 0,41, p = 0,043) положительно коррелировали с показателями IM, в то время как Kaistobacter (R = -0,5, p = 0,012) и Acinetobacter (R=-0,41, p=0,049) отрицательно коррелировали у пациентов с ИМ до эрадикации H. pylori (рис. 5B). Среди пациентов с IM на исходном уровне, Pseudomonas , Peptostreptococcus , Halomonas и Parvimonas были обогащены в тех с прогрессировали или сохранялись IM, в то время как Lachnospira , Kaistobacter , Кампилобактер , Devosia и Sphingobium были обогащены у субъектов с регрессом ИМ (фигура 5C).Среди субъектов, не имевших ИМ на исходном уровне, Mesorhizobium и Cupriavidus были обогащены, в то время как Actinomyces были истощены у лиц с возникшим ИМ после эрадикации H. pylori (рис. 5D). Мы наблюдали, что Peptostreptococcus неизменно положительно ассоциировались с ИМ до и после лечения ОАК.
pylori (рис. 5B). Среди пациентов с IM на исходном уровне, Pseudomonas , Peptostreptococcus , Halomonas и Parvimonas были обогащены в тех с прогрессировали или сохранялись IM, в то время как Lachnospira , Kaistobacter , Кампилобактер , Devosia и Sphingobium были обогащены у субъектов с регрессом ИМ (фигура 5C).Среди субъектов, не имевших ИМ на исходном уровне, Mesorhizobium и Cupriavidus были обогащены, в то время как Actinomyces были истощены у лиц с возникшим ИМ после эрадикации H. pylori (рис. 5D). Мы наблюдали, что Peptostreptococcus неизменно положительно ассоциировались с ИМ до и после лечения ОАК.
Бактерии, ассоциированные с кишечной метаплазией (КМ), до и после эрадикации Helicobacter pylori .(A) Линейный дискриминантный анализ (LDA) с величиной эффекта (Lefse), показывающий обогащение или истощение родов бактерий у пациентов с ИМ до эрадикации H. pylori . (B) Корреляция Спирмена родов бактерий с показателями IM после эрадикации H. pylori . (C) Линейный дискриминантный анализ (LDA) с величиной эффекта (Lefse), показывающий обогащение или истощение бактериальных родов у пациентов с персистирующей ИМ, или (C) ИМ, возникший через 1 год после эрадикации H. pylori .
pylori . (B) Корреляция Спирмена родов бактерий с показателями IM после эрадикации H. pylori . (C) Линейный дискриминантный анализ (LDA) с величиной эффекта (Lefse), показывающий обогащение или истощение бактериальных родов у пациентов с персистирующей ИМ, или (C) ИМ, возникший через 1 год после эрадикации H. pylori .
Функциональные особенности микробиоты желудка, ассоциированные с воспалением, атрофией и ИМ после
H.pylori эрадикация Вклад кишечной микробиоты в патологические состояния опосредован ее функциональными возможностями. Мы использовали PICRUSt, чтобы сделать вывод о функциональном содержании метагенома на основе профилей микробного сообщества, полученных из последовательностей генов 16S рРНК. Мы обнаружили, что ассоциированная с воспалением микробиота желудка была обогащена окислительным фосфорилированием, метановым обменом, шаперонным и фолдинговым катализом, энергетическим обменом, метаболизмом порфирина и хлорофилла, а также функциями биосинтеза липидов в отсутствие H. pylori (фиг. 6А). Это наблюдение предполагает увеличение выработки энергии и адаптации к стрессу в микробиоте желудка, связанной с воспалением. Действительно, адаптация к стрессу микробиоты, связанной с воспалением, поддерживалась обогащением K03088, который кодирует бактериальный внецитоплазматический белок реакции на стресс, РНК-полимеразу, фактор сигма-70. бактериальные вирулентные факторы были обогащены предсказанным метагеномом, связанным с воспалением.Несколько генов, кодирующих транспорт белка, были снижены в микробиоте желудка, связанной с воспалением (рис. 6В).
pylori (фиг. 6А). Это наблюдение предполагает увеличение выработки энергии и адаптации к стрессу в микробиоте желудка, связанной с воспалением. Действительно, адаптация к стрессу микробиоты, связанной с воспалением, поддерживалась обогащением K03088, который кодирует бактериальный внецитоплазматический белок реакции на стресс, РНК-полимеразу, фактор сигма-70. бактериальные вирулентные факторы были обогащены предсказанным метагеномом, связанным с воспалением.Несколько генов, кодирующих транспорт белка, были снижены в микробиоте желудка, связанной с воспалением (рис. 6В).
Функциональные особенности микробиоты желудка, связанные с воспалением, атрофией и ИМ после эрадикации H. pylori . (A) Прогнозируемые функциональные изменения микробиоты и (B) соответствующие онтологии KEGG в микробиоте желудка, связанной с персистирующим воспалением. (C) Прогнозируемые функциональные изменения микробиоты и (D) соответствующие онтологии KEGG в желудочной микробиоте, связанной с ГА. (E) Предсказанные функциональные изменения микробиоты и (F) соответствующие онтологии KEGG в стойкой микробиоте желудка, связанной с ИМ. ГА, атрофия желудка; IM, кишечная метаплазия; KEGG, Киотская энциклопедия генов и геномов.
(E) Предсказанные функциональные изменения микробиоты и (F) соответствующие онтологии KEGG в стойкой микробиоте желудка, связанной с ИМ. ГА, атрофия желудка; IM, кишечная метаплазия; KEGG, Киотская энциклопедия генов и геномов.
Мы также наблюдали снижение биогенеза рибосом, метаболизма линолевой кислоты и сигнальных путей адипоцитов (рис. 6C), кодируемых предсказанными генами K01897; длинноцепочечной ацил-коА-синтетазой, K00528; ферредоксин-НАДФ+редуктазой, K03786; 3-дегидрохинатдегидратазой, K07183. ;регулятор ответа NasT, K00937;полисфосфаткиназа, K00831;фосфосеринаминотрансфераза, K00818;ацетилорнитинаминотрансфераза, K00147;глутамат-5-полуальдегиддегидрогеназа и K00031;изоцитратдегидрогеназа при обострении, персистирующей или возникшей атрофии, связанной с микробиотой, по сравнению с регрессом атрофии после 92 .pylori (рис. 6D).
Метаболизм аминокислот и метаболизм инозитолфосфата были обогащены, в то время как биосинтез фолиевой кислоты и передача сигналов NOD-подобных рецепторов снизились у субъектов, у которых ИМ возник после эрадикации H. pylori (рис. 6E). Несколько генов KEGG, кодирующих систему секреции вирулентных бактерий типа IV, которая, как известно, важна для генетического обмена и доставки эффекторных молекул к эукариотическим клеткам-мишеням, были обнаружены в большом количестве у субъектов с возникшей ИМ.К ним относятся K03195 (VirB10), K03204 (VirB9), K03199 (VirB4) и K03196 (VirB11) (рис. 6F). Снижение K00147; глутамат-5-полуальдегиддегидрогеназы также было связано с появлением ИМ, наблюдаемого при атрофии, что свидетельствует о ее защитном значении против прогрессирования предраковых поражений желудка.
pylori (рис. 6E). Несколько генов KEGG, кодирующих систему секреции вирулентных бактерий типа IV, которая, как известно, важна для генетического обмена и доставки эффекторных молекул к эукариотическим клеткам-мишеням, были обнаружены в большом количестве у субъектов с возникшей ИМ.К ним относятся K03195 (VirB10), K03204 (VirB9), K03199 (VirB4) и K03196 (VirB11) (рис. 6F). Снижение K00147; глутамат-5-полуальдегиддегидрогеназы также было связано с появлением ИМ, наблюдаемого при атрофии, что свидетельствует о ее защитном значении против прогрессирования предраковых поражений желудка.
Обсуждение
Инфекция H. pylori является важным фактором риска развития рака желудка, согласно модели Корреа.18 Тем не менее риск рака желудка снижается только менее чем на 50% после введения H.pylori эрадикационная терапия.19 Как было показано ранее нами и другими,3 19 H. pylori эрадикационная терапия сама по себе не предотвращает развитие предраковых поражений желудка. Поэтому мы провели это ретроспективное исследование и определили желудочные микробы и связанные с ними функции, которые связаны с воспалением, атрофией и ИМ через 1 год после терапии H. pylori .
Поэтому мы провели это ретроспективное исследование и определили желудочные микробы и связанные с ними функции, которые связаны с воспалением, атрофией и ИМ через 1 год после терапии H. pylori .
Комбинированная терапия ОАК в течение 1 недели эффективно уничтожила H. pylori 3 , что привело к значительному увеличению бактериального разнообразия через 1 год.В дополнение к увеличению разнообразия мы наблюдали значительное изменение в совместном появлении бактерий и отчетливый кластер микробов полости рта в отсутствие H. pylori. Haemophilus , Neisseria и Actinobacillus наблюдалось значительное снижение после лечения ОАК. Сообщалось, что коинфекция H. pylori и N. subflava связана с образованием лимфоидных фолликулов в желудке человека. поражение желудка при гипохлоргидрии.21 Истощение Haemophilus , Neisseria и Actinobacillus , наблюдаемое в этом исследовании, может быть связано с последующим уменьшением воспаления в группе, получавшей ОАК.
Мы выявили высокую численность патогенных микробов у субъектов с персистирующим воспалением после эрадикации H. pylori . Обогащенные бактерии у субъектов с воспалением включали Acinetobacter lwoffii, S. anginosus, Ralstonia, Erwinia и Prevotella .Предыдущее исследование, проведенное на мышиной модели, показало, что инфекция A. lwoffii индуцирует выработку гастрина, пролиферацию желудочных G-клеток и париетальных клеток и воспаление желудка, сходное с инфекцией H. pylori , что подтверждает наши наблюдения в этом исследовании.8 Кроме того, Streptococcus чаще выделяют из желудочного сока при гастрите по сравнению со здоровым желудком.anginosus в слизистой оболочке пациентов с раком желудка и пищевода.14, 23, 24 В частности, S. anginosus является человеческим патогеном, пероральное присутствие которого связано с более высоким риском развития рака желудка.25 Ralstonia является грамположительной рост заболеваемости респираторными инфекциями. 26–28. Он был обогащен слизистой оболочкой желудка у пациентов с раком желудка до субтотальной гастрэктомии.29 В совокупности, обогащение этими бактериями у субъектов с воспалением в этом исследовании подчеркивает их потенциальную патогенную роль в развитии воспаления желудка. .
26–28. Он был обогащен слизистой оболочкой желудка у пациентов с раком желудка до субтотальной гастрэктомии.29 В совокупности, обогащение этими бактериями у субъектов с воспалением в этом исследовании подчеркивает их потенциальную патогенную роль в развитии воспаления желудка. .
Как и при других заболеваниях кишечника, таких как ВЗК, колит и колоректальный рак,30 31 мы обнаружили истощение потенциально защищающих кишечник бактерий Roseburia и Sphingomonas у пациентов с воспалением. Sphingomonas представляет собой аэробный и метаболически универсальный род бактерий, который характеризовался истощением тканей рака молочной железы по сравнению со здоровыми тканями молочной железы. .33 Важно отметить, что короткоцепочечные жирные кислоты также вырабатываются и всасываются в желудке44 и могут играть защитную роль, как описано в кишечнике.35 Потенциальная роль пробиотиков в облегчении воспаления желудка после эрадикации H. pylori были продемонстрированы ранее,36,37 еще раз подтверждают наши результаты в этом исследовании и позволяют предположить, что назначение пробиотиков пациентам, получающим эрадикационную терапию H. pylori , может предотвратить воспаление желудка, вызванное другими желудочными микробами.
pylori , может предотвратить воспаление желудка, вызванное другими желудочными микробами.
Развитие атрофии желудка и ИМ приводит к потере секретирующих кислоту париетальных клеток.38 Это может способствовать пролиферации желудочных микробов или колонизации желудка оральными микробами.39 Мы признали, что появление атрофии или ИМ было связано с повышенная численность Granulicatella , Actinomyces , Rothia , Peptostreptococcus , Streptococcus , Abiotrophia и Parvimonas 92.15пилори . Это преимущественно оральные микробы, образующие отдельный кластер в микробной экологии пациентов, получавших ОАК. Их совместное появление может иметь важное значение для их стимулирующего неоплазии эффекта и последующего развития рака желудка, как мы сообщали ранее. рак желудка,40,41 в то время как Abiotrophia был выделен как элемент потенциального риска развития рака желудка,25 что еще раз подтверждает их потенциальное участие в развитии атрофии желудка. Mesorhizobium , азотфиксирующая бактерия, которая была охарактеризована как способная проникать в клетки человека, была обогащена у пациентов, у которых ИМ прогрессировала в течение 1 года после эрадикации H. pylori . Бактерии, продуцирующие канцерогенные нитрозосоединения посредством преобразования нитратов, считаются важными факторами неоплазии желудка.43 Интересно, что Faecalibacterium , Kaistobacter и Rahnella были истощены у субъектов, у которых атрофия возникла после введения H.pylori эрадикация. Антиканцерогенная роль F. prausnitzii была продемонстрирована при желудочно-кишечных заболеваниях, включая ВЗК, колит-ассоциированный колоректальный рак и гепатоцеллюлярную карциному.44, 45 В этом исследовании мы впервые определили его потенциальную защитную роль при желудочной неоплазии. Примечательно, что мы наблюдали, что разные наборы бактерий связаны с атрофией и ИМ до и после эрадикации H. pylori . Значение этого в том, что присутствие H.
Mesorhizobium , азотфиксирующая бактерия, которая была охарактеризована как способная проникать в клетки человека, была обогащена у пациентов, у которых ИМ прогрессировала в течение 1 года после эрадикации H. pylori . Бактерии, продуцирующие канцерогенные нитрозосоединения посредством преобразования нитратов, считаются важными факторами неоплазии желудка.43 Интересно, что Faecalibacterium , Kaistobacter и Rahnella были истощены у субъектов, у которых атрофия возникла после введения H.pylori эрадикация. Антиканцерогенная роль F. prausnitzii была продемонстрирована при желудочно-кишечных заболеваниях, включая ВЗК, колит-ассоциированный колоректальный рак и гепатоцеллюлярную карциному.44, 45 В этом исследовании мы впервые определили его потенциальную защитную роль при желудочной неоплазии. Примечательно, что мы наблюдали, что разные наборы бактерий связаны с атрофией и ИМ до и после эрадикации H. pylori . Значение этого в том, что присутствие H. pylori изменяет желудочную среду, что может влиять на микрофлору желудка. Было бы интересно в будущем проследить влияние различной микробиоты на процесс канцерогенеза желудка.
pylori изменяет желудочную среду, что может влиять на микрофлору желудка. Было бы интересно в будущем проследить влияние различной микробиоты на процесс канцерогенеза желудка.
Кроме того, мы продемонстрировали, что выработка энергии и адаптация к стрессу усиливаются в кишечной микробиоте субъектов с воспалением желудка. Это наблюдение также подтверждается обогащенным бактериальным экстрацитоплазматическим белком реакции на стресс РНК-полимеразой sigma-70 factor16 в микробиоте желудка, связанной с воспалением.Наше открытие согласуется со снижением антиоксидантной защиты хозяина и последующим физиологическим и окислительным стрессом, которые характеризуют желудок во время воспаления желудка.46 Более того, биосинтез фолиевой кислоты и передача сигналов Nod-подобных рецепторов имели значительно более высокие прогнозируемые уровни в микробиоте желудка субъектов с ИМ после Эрадикация H. pylori . Биосинтез фолиевой кислоты микробиотой кишечника является источником водорастворимых тетрагидрофолатов, которые играют важную роль в метаболизме человека.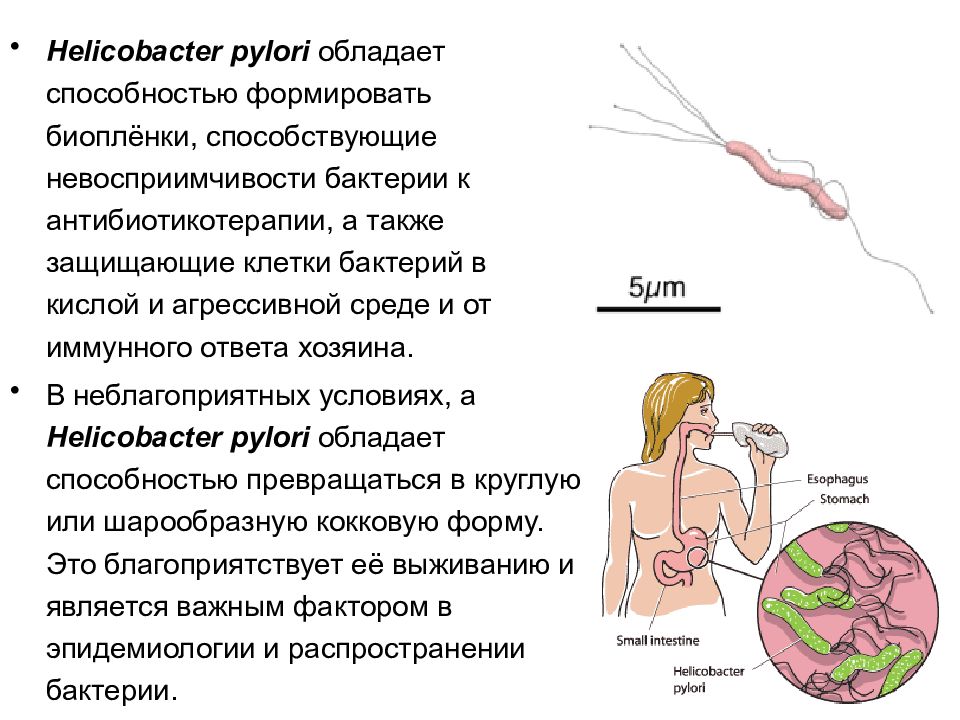 47 Неадекватное содержание фолиевой кислоты связано с повышенным риском рака толстой кишки, особенно если существуют предраковые поражения. 48 Это может быть применимо к канцерогенезу желудка, учитывая наши наблюдения в этом исследовании. Оптимизация бактериального производства фолиевой кислоты может снизить риск развития ИМ.48 Белки, содержащие домен олигомеризации нуклеотидов (NOD), представляют собой консервативные рецепторы распознавания образов, которые стимулируются патоген-ассоциированными молекулярными структурами (PAMPS). NOD-подобные рецепторы (NLR) могут регулировать врожденный и адаптивный иммунный ответ и могут участвовать в канцерогенезе, регулируя клеточный апоптоз.49 Наблюдаемое снижение передачи сигналов NLR кишечной микробиотой, связанной с IM, может представлять собой средство, с помощью которого ослабляется иммунный ответ на PAMPS, что, следовательно, способствует развитию поражений желудка. Несколько предсказанных генов, кодирующих систему секреции вирулентных бактерий типа IV, а именно VirB10, VirB9, VirB4 и VirB11, которые, как известно, важны для генетического обмена и доставки эффекторных молекул к эукариотическим клеткам-мишеням, были обнаружены в большом количестве у субъектов с возникшей ИМ.
47 Неадекватное содержание фолиевой кислоты связано с повышенным риском рака толстой кишки, особенно если существуют предраковые поражения. 48 Это может быть применимо к канцерогенезу желудка, учитывая наши наблюдения в этом исследовании. Оптимизация бактериального производства фолиевой кислоты может снизить риск развития ИМ.48 Белки, содержащие домен олигомеризации нуклеотидов (NOD), представляют собой консервативные рецепторы распознавания образов, которые стимулируются патоген-ассоциированными молекулярными структурами (PAMPS). NOD-подобные рецепторы (NLR) могут регулировать врожденный и адаптивный иммунный ответ и могут участвовать в канцерогенезе, регулируя клеточный апоптоз.49 Наблюдаемое снижение передачи сигналов NLR кишечной микробиотой, связанной с IM, может представлять собой средство, с помощью которого ослабляется иммунный ответ на PAMPS, что, следовательно, способствует развитию поражений желудка. Несколько предсказанных генов, кодирующих систему секреции вирулентных бактерий типа IV, а именно VirB10, VirB9, VirB4 и VirB11, которые, как известно, важны для генетического обмена и доставки эффекторных молекул к эукариотическим клеткам-мишеням, были обнаружены в большом количестве у субъектов с возникшей ИМ. Эти данные свидетельствуют о том, что желудочные микробы снижают биосинтез фолиевой кислоты, ослабляют иммунитет хозяина и доставляют эффекторные молекулы в клетки хозяина, способствуя развитию ИМ.
Эти данные свидетельствуют о том, что желудочные микробы снижают биосинтез фолиевой кислоты, ослабляют иммунитет хозяина и доставляют эффекторные молекулы в клетки хозяина, способствуя развитию ИМ.
В заключение, это исследование выявило желудочные патогенные микробы, которые связаны с персистирующим воспалением ( A. lwoffii , S. anginosus и Ralstonia ) и атрофией/ИМ ( Granulicatella, Actinomyces, Rothia, Peptostreptococcus, Abiotrophia и Parvimonas ) у пациентов через 1 год после эрадикации H. pylori , которые являются преимущественно оральными микробами и образуют отчетливый кластер в микробной экологии в отсутствие H.пилори . В соответствии с патогенной экологией функциональные пути, включая метаболизм аминокислот и метаболизм инозитолфосфата, были обогащены, в то время как биосинтез фолатов и передача сигналов NOD-подобных рецепторов снижались при атрофии / связанной с ИМ желудочной микробиоте. Таким образом, наше продольное исследование подчеркивает потенциальный вклад желудочных микробов в развитие и сохранение предраковых поражений желудка в отсутствие H. pylori, , которые могут служить терапевтическими мишенями для предотвращения канцерогенеза желудка.
pylori, , которые могут служить терапевтическими мишенями для предотвращения канцерогенеза желудка.
Желудочная бактерия Helicobacter pylori защищает от астмы — ScienceDaily
Заражение желудочной бактерией Helicobacter pylori обеспечивает надежную защиту от астмы, вызванной аллергией, как продемонстрировали иммунологи из Цюрихского университета на животных моделях совместно со специалистами по аллергии из Университетский медицинский центр Майнцского университета имени Иоганна Гутенберга. Их результаты, опубликованные в Journal of Clinical Investigation , подтверждают недавно выдвинутую гипотезу о том, что резкий рост аллергических заболеваний в индустриальных обществах связан с быстрым исчезновением специфических микроорганизмов, населяющих человеческий организм.
Аллергическая астма в промышленно развитых странах росла в течение десятилетий и фактически приобрела масштабы эпидемии. Быстрый рост аллергических заболеваний дыхательных путей объясняется загрязнением воздуха, курением, гигиенической гипотезой и широким использованием антибиотиков.:max_bytes(150000):strip_icc()/e--coli-bacterium-117451594-59df857dd963ac0011d01d49-5bbe7ebdc9e77c00511e6b65.jpg) Гигиеническая гипотеза утверждает, что современные меры гигиены привели к отсутствию контакта с инфекционными агентами, что важно для нормального созревания иммунной системы. В статье, опубликованной в журнале Journal of Clinical Investigation , ученые из Цюрихского университета и Университетского медицинского центра Университета имени Иоганна Гутенберга в Майнце теперь раскрывают, что рост астмы можно объяснить специфическим исчезновением желудочной бактерии . Helicobacter pylori ( H.pylori ) из западных обществ.
Гигиеническая гипотеза утверждает, что современные меры гигиены привели к отсутствию контакта с инфекционными агентами, что важно для нормального созревания иммунной системы. В статье, опубликованной в журнале Journal of Clinical Investigation , ученые из Цюрихского университета и Университетского медицинского центра Университета имени Иоганна Гутенберга в Майнце теперь раскрывают, что рост астмы можно объяснить специфическим исчезновением желудочной бактерии . Helicobacter pylori ( H.pylori ) из западных обществ.
H. pylori устойчив к желудочному соку. По оценкам, около половины населения мира может быть заражено бактериями. Заболевание часто протекает бессимптомно, но при определенных условиях может вызывать гастрит, язву желудка и двенадцатиперстной кишки, рак желудка. Следовательно, H. pylori часто убивают антибиотиками в качестве меры предосторожности, даже если у пациента нет никаких жалоб.
Раннее заражение H. pylori защищает от астмы
pylori защищает от астмы
Для своего исследования исследователи заразили мышей бактериями H. pylori . Если мышей заражали в возрасте нескольких дней, у них развивалась иммунологическая толерантность к бактерии и даже незначительно реагировали — если вообще реагировали — на сильные аллергены, вызывающие астму. Однако мыши, которые не были инфицированы H. pylori до достижения ими совершеннолетия, имели гораздо более слабую защиту. «Ранняя инфекция нарушает созревание дендритных клеток и вызывает накопление регуляторных Т-клеток, которые имеют решающее значение для подавления астмы», — объясняет защитный механизм Энн Мюллер, профессор молекулярного исследования рака в Цюрихском университете.
Если регуляторные Т-клетки были перенесены от инфицированных к неинфицированным мышам, они также получили эффективную защиту от астмы, вызванной аллергией. Однако мыши, инфицированные на ранней стадии, также теряли устойчивость к вызывающим астму аллергенам, если H. pylori уничтожали у них с помощью антибиотиков после фазы сенсибилизации. По словам пульмонолога и аллерголога Кристиана Таубе, старшего врача больницы III. Медицинская клиника Университета имени Иоганна Гутенберга в Майнце, новые результаты подтверждают гипотезу о том, что рост аллергической астмы в промышленно развитых странах связан с широким использованием антибиотиков и последующим исчезновением микроорганизмов, постоянно населяющих человеческий организм: «Исследование из этих фундаментальных механизмов чрезвычайно важно для нас, чтобы понять астму и быть в состоянии разработать профилактические и терапевтические стратегии позже.»
pylori уничтожали у них с помощью антибиотиков после фазы сенсибилизации. По словам пульмонолога и аллерголога Кристиана Таубе, старшего врача больницы III. Медицинская клиника Университета имени Иоганна Гутенберга в Майнце, новые результаты подтверждают гипотезу о том, что рост аллергической астмы в промышленно развитых странах связан с широким использованием антибиотиков и последующим исчезновением микроорганизмов, постоянно населяющих человеческий организм: «Исследование из этих фундаментальных механизмов чрезвычайно важно для нас, чтобы понять астму и быть в состоянии разработать профилактические и терапевтические стратегии позже.»
Источник истории:
Материалы предоставлены Университетом Цюриха . Примечание. Содержимое можно редактировать по стилю и длине.
Когда ученые экспериментируют на себе: H. pylori и язвы
Летом 1984 года австралийский ученый Нил Ноукс взял несколько бактерий из чашки Петри, смешал их с теплым экстрактом говядины — обычным питательным раствором для бактерий в лаборатории — и налил чуть больше одной чашки в стакан. Затем он передал эту смесь своему коллеге, гастроэнтерологу Барри Маршаллу, который безропотно выпил ее.
Затем он передал эту смесь своему коллеге, гастроэнтерологу Барри Маршаллу, который безропотно выпил ее.
Через три дня Маршалла стало тошнить, и мать сказала ему, что у него неприятный запах изо рта. Далее у него началась рвота. Но он все же подождал несколько дней, прежде чем принимать антибиотики, которые должны были убить бактерии в его желудке. Гастроскопия не только прояснила его диагноз, но и в конечном итоге привела к получению Нобелевской премии по физиологии и медицине около двадцати лет спустя.
С помощью своего знаменитого эксперимента над собой Маршалл смог продемонстрировать, что бактерии Helicobacter pylori могут вызывать острый гастрит, который, в свою очередь, может вызывать язву. Он не спрашивал разрешения ни у комиссии по этике, ни у своей жены на проведение этого эксперимента. Его коллеги считали его совершенно сумасшедшим, раз он так рисковал.
Еще в 1980-х преобладала теория о том, что язва желудка в основном является психосоматическим заболеванием, вызванным чрезмерным стрессом. Соответственно, пациентов лечили транквилизаторами, антидепрессантами, психотерапией или антацидами.Вместо этого молодой врач Маршалл лечил их всех антибиотиками, и его результаты были впечатляющими. Из своей клинической практики он разработал теорию о том, что спиралевидная бактерия Helicobacter вызывает гастрит, болезненные язвы желудка и даже рак желудка. Поскольку у него не было подходящих подопытных животных, он использовал собственное тело для описанного эксперимента.
Соответственно, пациентов лечили транквилизаторами, антидепрессантами, психотерапией или антацидами.Вместо этого молодой врач Маршалл лечил их всех антибиотиками, и его результаты были впечатляющими. Из своей клинической практики он разработал теорию о том, что спиралевидная бактерия Helicobacter вызывает гастрит, болезненные язвы желудка и даже рак желудка. Поскольку у него не было подходящих подопытных животных, он использовал собственное тело для описанного эксперимента.
С этого момента единственным хорошим хеликобактером был мертвый. Для борьбы с этим микробом использовалось множество антибиотиков. Некоторые эксперты даже хотели уничтожить Helicobacter в качестве меры предосторожности.А Маршалл получил Нобелевскую премию в 2005 году вместе со своим бывшим коллегой Робином Уорреном. Между тем, даже Маршалл стал более сочувствующим, когда говорит о микробе, сделавшем его знаменитым, почти как если бы он был старым другом. Во время своей лекции на 64-й встрече лауреатов Нобелевской премии в Линдау он отмечает, что этот одноклеточный организм может даже помочь в борьбе с некоторыми заболеваниями.
Действительно, H. pylori — один из старых друзей и компаньонов человечества: микроб живет с нами по меньшей мере 50 000 лет, а возможно, и дольше.Примерно пятьдесят процентов всех людей носят его в желудке. Интересно, что процент инфицированных людей снижается с 1950-х годов, причем в более богатых странах показатели гораздо ниже, чем в остальном мире. В США инфицированы менее 25 процентов взрослых и только около 5 процентов всех школьников. Маршалл говорит, что лучшая гигиена и чистая питьевая вода ответственны за выселение бактерий.
Врачи утверждают, что хеликобактер является причиной трех из четырех язв желудка, двух третей всех опухолей желудка и практически всех опухолей двенадцатиперстной кишки; двенадцатиперстная кишка – это часть тонкой кишки, которая следует непосредственно за желудком.Так что его истребление должно быть хорошим делом — не так ли?
Но одновременно с отступлением микроба возникли и другие проблемы со здоровьем. С 1950-х годов число пациентов с аллергией, астмой или аутоиммунными заболеваниями резко возросло. Дети без Helicobacter в желудке чаще страдают кожной аллергией или сенной лихорадкой. Бактерии также обеспечивают определенную защиту от целиакии, также известной как непереносимость пшеничного глютена. Бактерии могут даже манипулировать нашим аппетитом: доктор Мартин Блазер из Нью-Йорка предполагает связь между их искоренением и растущей проблемой ожирения во всем мире.
Дети без Helicobacter в желудке чаще страдают кожной аллергией или сенной лихорадкой. Бактерии также обеспечивают определенную защиту от целиакии, также известной как непереносимость пшеничного глютена. Бактерии могут даже манипулировать нашим аппетитом: доктор Мартин Блазер из Нью-Йорка предполагает связь между их искоренением и растущей проблемой ожирения во всем мире.
Блазер был фактически одним из первых ученых, которые заметили, что микроб не только причиняет вред. Впервые он задумался о его положительных сторонах, когда увидел данные о больных язвой желудка, которые редко страдали сердечным ожогом или раком пищевода. С другой стороны, у людей без Helicobacter в организме не развивается много язв, но гораздо чаще возникают проблемы с изжогой и рефлюксом, иногда даже приводящие к раку.
В наши дни даже Барри Маршалл видит два лица микроба — опасное и полезное.Многие исследования показывают, что H. pylori является важным тренировочным партнером для нашей иммунной системы: похоже, она способна сдерживать иммунный ответ. Если бактерии отсутствуют, наша иммунная система чрезмерно реагирует на пыльцу, пшеничный глютен или арахис.
Если бактерии отсутствуют, наша иммунная система чрезмерно реагирует на пыльцу, пшеничный глютен или арахис.
Маршалл считает, что эта связь была жизненно важным механизмом в истории человечества: когда группы homo sapiens покинули Африку в доисторические времена, эти бактерии не позволили им развить сильную аллергию на все новые растения, с которыми они столкнулись в своем долгом путешествии.Если бы они остались в Африке и питались только растениями и животными из непосредственной близости от них, не было бы необходимости в переключателе замедления для иммунной системы. «Одна из теорий гласит, что только с помощью этих бактерий мы, люди, смогли приспособиться к разнообразному питанию», — объясняет Маршалл.
Итак, теперь, вместо того, чтобы бороться со своими любимыми микробами, Маршалл сосредоточился на изучении последствий повторного заражения людей. Но не глотком какого-то мясного экстракта, как он это делал в прошлом. Существует множество различных Х.pylori, сильно различающиеся по агрессивности. Для подобных экспериментов следует использовать только более безвредные вещества, говорит Маршалл, который уже получил патенты в этой интересующей области.
Для подобных экспериментов следует использовать только более безвредные вещества, говорит Маршалл, который уже получил патенты в этой интересующей области.
Действительно ли повторное заражение обеспечивает определенную защиту от аллергии, в настоящее время проверяется на мышах в нескольких исследовательских группах. Но даже люди снова глотают эти микробы во имя науки, Маршалл в настоящее время планирует клинические исследования. Но он ожидает, что взрослые получат лишь небольшую пользу от его результатов.Контакт с этими микробами, по-видимому, имеет решающее значение в первые несколько лет жизни во время развития иммунной системы.
Но мысль о том, чтобы давать новорожденным бактерии, которые впоследствии могут вызвать рак, вызывает у большинства людей тревогу. Другая идея, вероятно, будет легче принята: мы можем предоставить только те компоненты бактерий, которые необходимы для контроля иммунной системы, сказал Маршалл. Это не должно вызывать воспаления, но все же может помочь обуздать нашу иммунную систему.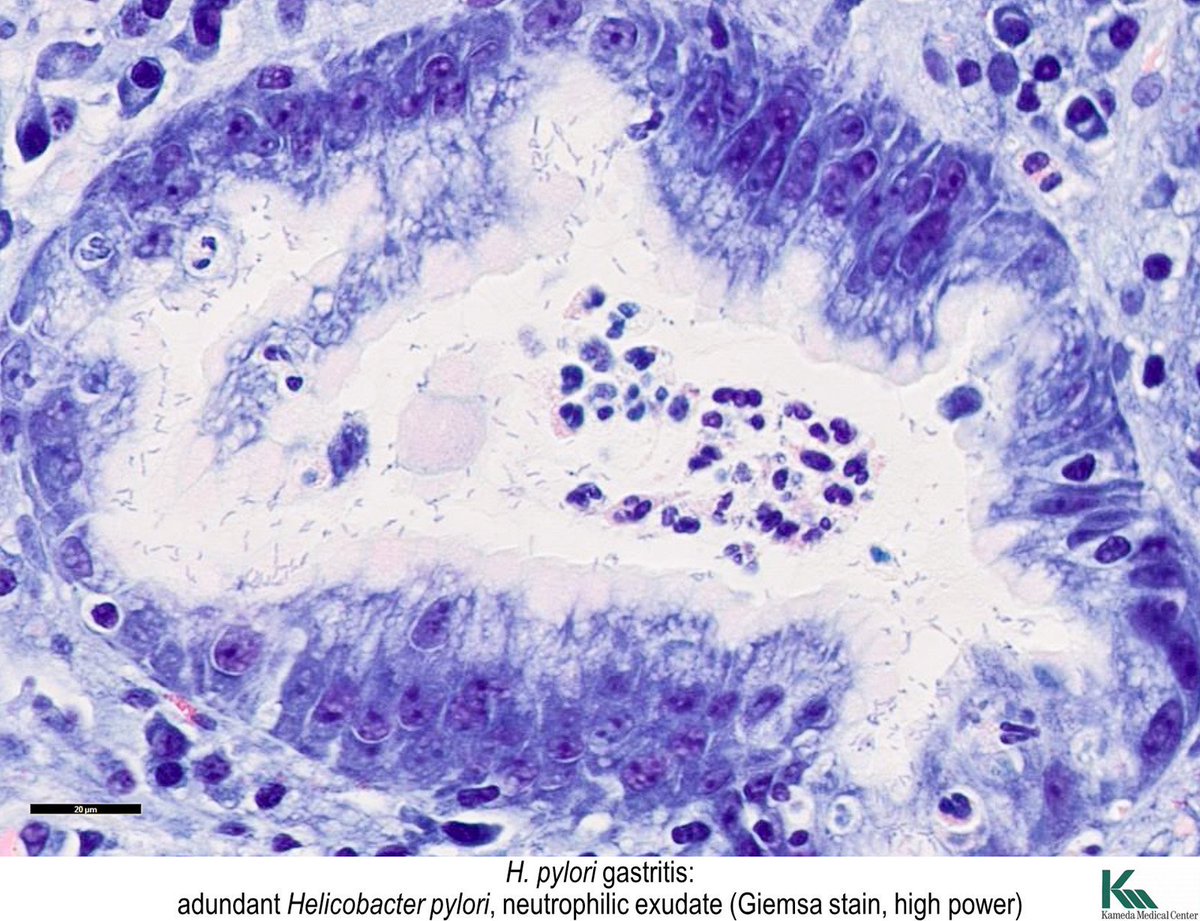 Молекулы на поверхности бактерии могли бы стать возможными кандидатами на эту работу.
Молекулы на поверхности бактерии могли бы стать возможными кандидатами на эту работу.
Хотя Маршалл сейчас более дружелюбно отзывается о своем бывшем противнике, в одной ситуации он остается бескомпромиссным: «Если бактерия доставляет неприятности, она должна уйти». Пока это не создает проблем, оно может оставаться. Но есть очень эффективные антибиотики, чтобы избавиться от него.
Помимо Helicobacter pylori, более 1000 других типов бактерий живут на теле человека и в нем, в результате чего общее число бактерий составляет около 100 триллионов. Так что не должно быть недостатка в заменяющих тренировочных партнерах для нашей иммунной системы.
Первоначально опубликовано на немецком языке под названием «Von Menschen und Mikroben — Barry Marshall» («О человеке и микробах — Барри Маршалл») в блоге собрания лауреатов Нобелевской премии в Линдау. Перевод: Susanne Dambeck
Frontiers | Сравнение бактериальных сообществ в слизистой оболочке у пациентов с язвой антрального отдела желудка и язвой двенадцатиперстной кишки
Введение
Язва желудка и язва двенадцатиперстной кишки являются двумя распространенными пептическими заболеваниями, наблюдаемыми в клинике. Helicobacter pylori ( H.pylori ) является важным причинным фактором (Graham and Shiotani, 2008), связанным с более чем 80% пептических язв (Alam et al., 2014). В предыдущих исследованиях сообщалось, что возникновение язв приводит к изменениям микробиоты желудка (Li et al., 1995; Zhang et al., 1996) аэробными бактериями, анаэробными бактериями, выделением грибов и культурой. Однако этот метод имеет свои ограничения; он не смог в полной мере продемонстрировать изменение микробиоты желудка у больных язвенной болезнью.
Helicobacter pylori ( H.pylori ) является важным причинным фактором (Graham and Shiotani, 2008), связанным с более чем 80% пептических язв (Alam et al., 2014). В предыдущих исследованиях сообщалось, что возникновение язв приводит к изменениям микробиоты желудка (Li et al., 1995; Zhang et al., 1996) аэробными бактериями, анаэробными бактериями, выделением грибов и культурой. Однако этот метод имеет свои ограничения; он не смог в полной мере продемонстрировать изменение микробиоты желудка у больных язвенной болезнью.
В последние годы наблюдается быстрое развитие технологии высокопроизводительного секвенирования, особенно широкое использование анализа последовательности гена, кодирующего бактериальную 16S рРНК, что позволило значительно улучшить идентификацию бактериальных линий и их относительную распространенность в микробной среде желудка. сообщество. Например, у пациентов, не инфицированных Hp, Zilberstein et al. (2007) обнаружили преимущественно кислотоустойчивые виды — Veillonella sp. Lactobacillus sp.и Clostridium sp. — в микробиоте пищеварительного тракта, в то время как у пациентов, инфицированных H. pylori , также были идентифицированы некоторые не- роды бактерий Hp , такие как Streptococcus, Neisseria, Staphylococcus и Roche . биоптатов желудка (Hu et al., 2012). Тем не менее, инфекция Hp является хорошо известным возбудителем пептической язвы (Groenen et al., 2009), и было немного сообщений о микробной структуре различных типов язв, таких как язвы желудка и двенадцатиперстной кишки.
Lactobacillus sp.и Clostridium sp. — в микробиоте пищеварительного тракта, в то время как у пациентов, инфицированных H. pylori , также были идентифицированы некоторые не- роды бактерий Hp , такие как Streptococcus, Neisseria, Staphylococcus и Roche . биоптатов желудка (Hu et al., 2012). Тем не менее, инфекция Hp является хорошо известным возбудителем пептической язвы (Groenen et al., 2009), и было немного сообщений о микробной структуре различных типов язв, таких как язвы желудка и двенадцатиперстной кишки.
Механизмы образования язв разнообразны и включают чрезмерную секрецию желудочного сока и использование нестероидных противовоспалительных препаратов (НПВП), и эти механизмы являются вторичными по отношению к механизмам при болезни Крона и туберкулезе (Yuan and Tang, 2008). В последние годы частота язв, не связанных с приемом НПВП, увеличилась (Hou and Zhang, 2015). С точки зрения микробной экологии количество Hp , которые колонизировались, не является единственной причиной пептической язвы. Другие бактерии, отличные от Hp , могут участвовать в развитии двух распространенных язв. Кроме того, в нескольких исследованиях уделялось внимание структуре ткани язвы желудка и двенадцатиперстной кишки. Актуальность содержания H. pylori и пропорции других бактерий к образованию язвы и другие вопросы также требуют срочного решения.
Другие бактерии, отличные от Hp , могут участвовать в развитии двух распространенных язв. Кроме того, в нескольких исследованиях уделялось внимание структуре ткани язвы желудка и двенадцатиперстной кишки. Актуальность содержания H. pylori и пропорции других бактерий к образованию язвы и другие вопросы также требуют срочного решения.
В этом исследовании, чтобы сравнить профиль бактериального сообщества слизистой оболочки язвы антрального отдела желудка и язвы двенадцатиперстной кишки, мы использовали метод высокопроизводительного секвенирования и анализа Miseq для выявления и сравнения структурного, биологического разнообразия и численности микробиоты слизистой оболочки. из 18 пациентов с H.pylori -положительные язвы антрального отдела желудка и двенадцатиперстной кишки. Состав микробиоты слизистой оболочки при различных типах язвы может обеспечить теоретическую основу для понимания значимости флоры слизистой оболочки для язвенной болезни.
Материалы и методы
Исследуемая популяция
Образцы биопсии желудка и двенадцатиперстной кишки были получены в период с 2016 по 2017 год от пациентов, направленных на эндоскопическое обследование в Первую народную больницу Венлинга. Образцы биопсии брали из антрального отдела и тела желудка у каждого пациента.Это исследование было одобрено Комитетом по медицинской этике Первой народной больницы Вэньлин, и от пациентов было получено письменное согласие до того, как они были включены в исследование.
Образцы биопсии брали из антрального отдела и тела желудка у каждого пациента.Это исследование было одобрено Комитетом по медицинской этике Первой народной больницы Вэньлин, и от пациентов было получено письменное согласие до того, как они были включены в исследование.
Все больные поступили амбулаторно в Первую народную больницу г. Вэньлин с диагнозом язвенная болезнь желудка и двенадцатиперстной кишки. Каждый пациент прошел дыхательный тест с мочевиной 13 C ( 13 C с использованием дозы 75 мг) перед эндоскопией, и результаты теста были положительными. У всех пациентов никогда не проводилась эрадикация Hp до проведения гастроскопии.И мы исследовали информацию пациентов, такую как гистопатологические данные, диетические привычки, экономический статус и семейный анамнез.
Сбор и обработка образцов
Каждому пациенту был проведен эндоскопический забор ткани слизистой оболочки, и два образца ткани слизистой оболочки были взяты параллельно в одном и том же месте биопсии. В частности, у пациентов с язвой антрального отдела желудка брали 3–5 см ткани вокруг поверхности язвы антрального отдела желудка, а у пациентов с язвой двенадцатиперстной кишки собирали ткань вокруг поверхности язвы двенадцатиперстной кишки.Для каждого пациента один из собранных образцов ткани слизистой оболочки помещали в пробирку для изоляционной культуры Hp , содержащую настой головного мозга и сердца, а другой помещали в пробирку для образца, содержащую раствор для сохранения ДНК.
В частности, у пациентов с язвой антрального отдела желудка брали 3–5 см ткани вокруг поверхности язвы антрального отдела желудка, а у пациентов с язвой двенадцатиперстной кишки собирали ткань вокруг поверхности язвы двенадцатиперстной кишки.Для каждого пациента один из собранных образцов ткани слизистой оболочки помещали в пробирку для изоляционной культуры Hp , содержащую настой головного мозга и сердца, а другой помещали в пробирку для образца, содержащую раствор для сохранения ДНК.
Бактериальный рост и идентификация
После того, как образец был получен, ткань сначала поместили при комнатной температуре, а ткань слизистой оболочки желудка всосали в шлифовальный станок с помощью пастеровской пипетки, а затем измельчили в достаточной степени для ее гомогенизации; затем его инокулировали на чашку с агаром с 5% дефибринированной овечьей кровью и равномерно распределяли.Засеянную чашку помещали в трехгазовый инкубатор при 37°С (5 % кислорода, 10 % углекислого газа, 85 % азота), культивировали в течение 3–11 дней и наблюдали за ростом.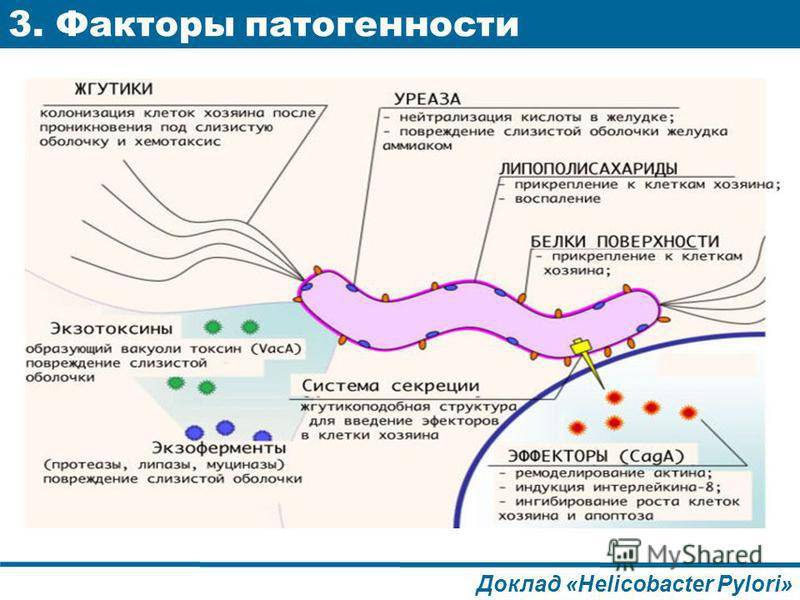 Подозрительные колонии мазали для микроскопического исследования бактериальной морфологии, соответствующей Hp , а штаммы, которые были положительными по уреазе, оксидазе и каталазе, классифицировали как Hp положительные, в противном случае они классифицировались как Hp отрицательные. Язва антрального отдела желудка H. pylori положительных пациента были обозначены как группа A (антральный отдел), а язва двенадцатиперстной кишки Hp положительных пациента были обозначены как группа B (двенадцатиперстная кишка).
Подозрительные колонии мазали для микроскопического исследования бактериальной морфологии, соответствующей Hp , а штаммы, которые были положительными по уреазе, оксидазе и каталазе, классифицировали как Hp положительные, в противном случае они классифицировались как Hp отрицательные. Язва антрального отдела желудка H. pylori положительных пациента были обозначены как группа A (антральный отдел), а язва двенадцатиперстной кишки Hp положительных пациента были обозначены как группа B (двенадцатиперстная кишка).
Выделение ДНК, подготовка библиотеки и секвенирование
Геномную ДНК из всех образцов слизистой флоры экстрагировали с использованием набора Invitrogen Purelink Genomic DNA (Life Technologies, Карлсбад, Калифорния, США). Операция проводилась строго по инструкции набора. Качественное и количественное определение нуклеиновых кислот осуществляли с помощью электрофореза в 1% агарозном геле и анализатора концентрации Qubit2. 0.
0.
Для участков 16S рРНК V3 и V4 образцов слизистой флоры был синтезирован специфический праймер с «линкером секвенирования».Последовательность праймера первой стадии ПЦР представляла собой 356F: 5′-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGN
GGCWGCAG-3′; 806R: 5′-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGGACTACH
VGGGTWTCTAAT-3′. Реакционная система ПЦР содержала 2 × буфера HiFi по 10 мкл, прямой праймер 5 мкмоль/л, обратный праймер 5 мкмоль/л, ДНК 10 нг, плюс ddH 2 O до общего объема 20 мкл. Условия проведения ПЦР: 95°С, 3 мин, 25 циклов, в том числе 95°С 30 с, 60°С 30 с, 72°С 30 с; 72°С 5 мин.
После ПЦР-амплификации продукты ПЦР очищали с помощью магнитных шариков Бэкмана.Вкратце, 20 мкл продукта реакции ПЦР смешивали с 16 мкл магнитных шариков для адсорбции ДНК, затем дважды промывали 80% этанолом и элюировали 40 мкл ddH 2 O для получения очищенного продукта ПЦР. Затем реакционная система ПЦР второго этапа содержала 2 × буфера HiFi 10 мкл, прямой праймер 10 мкмоль/л, обратный праймер 10 мкмоль/л, первую ПЦР-очистку шаблона продукта 2 мкл плюс ddh3O до общего объема 20 мкл. Условия проведения ПЦР: 95°С, 3 мин, 12 циклов, в том числе 95°С 30 с, 60°С 30 с, 72°С 30 с; 72°С 5 мин.После завершения реакции ПЦР выполняли очистку в соответствии с ранее упомянутым протоколом очистки на магнитных шариках и, наконец, элюировали 30 мкл ddH 2 O для получения библиотеки ДНК образцов слизистой оболочки.
Условия проведения ПЦР: 95°С, 3 мин, 12 циклов, в том числе 95°С 30 с, 60°С 30 с, 72°С 30 с; 72°С 5 мин.После завершения реакции ПЦР выполняли очистку в соответствии с ранее упомянутым протоколом очистки на магнитных шариках и, наконец, элюировали 30 мкл ddH 2 O для получения библиотеки ДНК образцов слизистой оболочки.
Контроль качества всех библиотек проводился с использованием анализатора Agilent 2100 Bioanalyzer и анализатора концентрации Qubit 2.0. Библиотека, прошедшая квалификацию, была секвенирована с помощью секвенатора Illumina MiSeq.
Анализ последовательностей генов 16S рРНК
Исходные данные изображения результатов секвенирования были проанализированы с помощью программного обеспечения CASAVA (v1.8.2), а данные секвенирования были получены после предварительного анализа качества. Pandaseq (v2.7) использовали для сравнения каждых двух последовательностей и их сборки в соответствии с концом перекрывающейся области. Используя Trimmomatic (v0. 30), были также удалены последовательности праймеров и линкеров, а также основания с массой <20 на обоих концах, а также последовательности с длиной <400 п.н. С помощью usearch (v8.0) оставшиеся последовательности сравнивали с таковыми в базе данных, а химерные последовательности удаляли для получения окончательных проверенных данных.Операционные таксономические единицы (OTU) представляют собой сгруппированные последовательности в ячейки, кластеризация была выполнена методом UCLUST с параметром подобия, установленным на 97%, и был получен список OTU и репрезентативные последовательности OTU. Последовательности были рандомизированы с использованием платформы Qiime (v1.7), а кривые разбавления были построены с использованием количества последовательностей образцов и количества OTU, которые они могли представлять. По результатам кластеризации OTU, ACE, Chao1, Shannon и Simpson были использованы для анализа обилия и разнообразия образцов слизистой оболочки.Используя платформу Qiime (v1.7), был выполнен анализ основных компонентов на основе расстояния UniFrac.
30), были также удалены последовательности праймеров и линкеров, а также основания с массой <20 на обоих концах, а также последовательности с длиной <400 п.н. С помощью usearch (v8.0) оставшиеся последовательности сравнивали с таковыми в базе данных, а химерные последовательности удаляли для получения окончательных проверенных данных.Операционные таксономические единицы (OTU) представляют собой сгруппированные последовательности в ячейки, кластеризация была выполнена методом UCLUST с параметром подобия, установленным на 97%, и был получен список OTU и репрезентативные последовательности OTU. Последовательности были рандомизированы с использованием платформы Qiime (v1.7), а кривые разбавления были построены с использованием количества последовательностей образцов и количества OTU, которые они могли представлять. По результатам кластеризации OTU, ACE, Chao1, Shannon и Simpson были использованы для анализа обилия и разнообразия образцов слизистой оболочки.Используя платформу Qiime (v1.7), был выполнен анализ основных компонентов на основе расстояния UniFrac.
Статистический анализ
Статистический анализ выполнен с использованием программного обеспечения SPSS19.0. Сравнение переменных непрерывности было проанализировано с использованием t -критерия, а классификация данных была проанализирована с использованием критерия хи-квадрат или точного критерия Фишера. Значение P ≤ 0,05 считалось статистически значимым.
Результаты
Клинические данные пациента
В этом исследовании в исследуемую группу было включено 20 случаев, в том числе 10 случаев язвы антрального отдела желудка и 10 случаев язвы двенадцатиперстной кишки.Возрастной диапазон пациентов составлял 33–67 лет, средний возраст – 45,3 года, соотношение мужчин и женщин – 1,857:1. были определены как отрицательные Hp и удалены. Таким образом, в группе с язвой антрального отдела желудка осталось 9 Hp положительных случая. Средний возраст пациентов составил 48,4 года, а соотношение мужчин и женщин было 1,25:1. Для язвенной болезни двенадцатиперстной кишки Hp положительной группы из девяти пациентов средний возраст составил 41 год, а соотношение мужчин и женщин было 2:1. .Не было существенной разницы между двумя группами по возрасту ( p > 0,05, тест T-) или соотношению полов ( p > 0,05, x 2 тест). Также не было существенной разницы в гистопатологических данных, пищевых привычках, экономическом статусе и т. д. между двумя группами (таблица 1).
Для язвенной болезни двенадцатиперстной кишки Hp положительной группы из девяти пациентов средний возраст составил 41 год, а соотношение мужчин и женщин было 2:1. .Не было существенной разницы между двумя группами по возрасту ( p > 0,05, тест T-) или соотношению полов ( p > 0,05, x 2 тест). Также не было существенной разницы в гистопатологических данных, пищевых привычках, экономическом статусе и т. д. между двумя группами (таблица 1).
Таблица 1 . Информация о пациентах.
Анализ разнообразия
Всего было получено 1 564 734 примитивных последовательности путем высокопроизводительного секвенирования гена 16S рРНК образцов слизистой оболочки с использованием двухэтапного метода амплификации ПЦР.Из этих последовательностей 1 520 613 последовательностей были эффективными с индексом охвата 97,18%. Последовательности были отсортированы по 97% сходству OTU, в результате чего было получено 32513 OTU. Количество OTU составило 21578 у Hp пациентов с язвой антрального отдела желудка (группа A) и 24226 у Hp пациентов с язвой двенадцатиперстной кишки (группа B) (таблица 2). Как показано на кривой разбавления образца на рисунке 1, количество OTU на кривой разбавления увеличивается с количеством последовательностей, не достигая плато, но имеет тенденцию достигать стадии платформы.Это указывает на то, что количества секвенирования для каждого образца было достаточно, чтобы охарактеризовать состав флоры образца. Бактериальное разнообразие в слизистой оболочке больных язвой двенадцатиперстной кишки было значительно выше, чем у больных язвой антрального отдела желудка (рис. 1).
Количество OTU составило 21578 у Hp пациентов с язвой антрального отдела желудка (группа A) и 24226 у Hp пациентов с язвой двенадцатиперстной кишки (группа B) (таблица 2). Как показано на кривой разбавления образца на рисунке 1, количество OTU на кривой разбавления увеличивается с количеством последовательностей, не достигая плато, но имеет тенденцию достигать стадии платформы.Это указывает на то, что количества секвенирования для каждого образца было достаточно, чтобы охарактеризовать состав флоры образца. Бактериальное разнообразие в слизистой оболочке больных язвой двенадцатиперстной кишки было значительно выше, чем у больных язвой антрального отдела желудка (рис. 1).
Таблица 2 . Индексы α-разнообразия бактериального сообщества для Hp положительных типов язвы желудка.
Рисунок 1 . Количество OTU кривой разбавления увеличивается с количеством последовательностей.
Состав бактериального сообщества в
Hp Положительной язве антрального отдела желудка по сравнению с язвой двенадцатиперстной кишкиКак показано на рисунке 2A, преобладающими типами бактерий в язвах двух типов были Proteobacteria, Bacteroidetes и Firmicutes . Следует отметить, что Proteobacteria составляли основную долю в Hp положительных язвах антрального отдела желудка, тогда как Bacteroidetes и Firmicutes составляли основную долю в Hp положительных язвах двенадцатиперстной кишки, и разница была статистически значимой. ( р < 0.05, x 2 тест).
Рисунок 2 . Состав бактериального сообщества для Hp положительных типов язвы антрального отдела желудка и двенадцатиперстной кишки, идентифицированных на уровне (A) типов, (B) уровней рода и (C) групп. **Статистически значимая разница в двух группах.
Состав бактериального сообщества на уровне рода в двух типах язв показан на рисунке 2B. В целом доля либо преобладающих, либо неизвестных бактерий была значительно выше для Hp положительной язвы антрального отдела двенадцатиперстной кишки, чем для Hp положительной язвы желудка. Helicobacter составлял основную долю в Hp положительной язве антрального отдела желудка, с коэффициентом более 40%. Однако Helicobacter не был преобладающим бактериальным родом в Hp положительной язве двенадцатиперстной кишки, а в некоторых образцах присутствовал только в количестве менее 10%. Примечательно, что роды бактерий, включая Prevotella (9,83%), Neisseria (5,03%), Streptococcus (3,96%), Veillonella (1,92%), Streptococcus (3.96%), и Porphyromonas (2,62%) также присутствовали в Hp положительной язве двенадцатиперстной кишки. Кроме того, роды Psychromonas, Frankia, Prevotella и Porphyromonas были идентифицированы и значительно отличались от Hp положительных образцов язвы двенадцатиперстной кишки ( p <0,05, x 2 тест).
Затем мы определили пропорцию колонизации Hp в Hp положительном антральном отделе желудка и язвах двенадцатиперстной кишки.Как показано на рисунке 2C, средняя доля Hp в образцах язвы антрального отдела желудка составляла 76,44%, а в образцах язвы двенадцатиперстной кишки — 24%. Разница была статистически значимой (тест p < 0,01, x 2 ).
Разнообразие бактериального сообщества в
Hp Положительный антральный отдел желудка и язва двенадцатиперстной кишкиМы исследовали разнообразие бактериального сообщества двух Hp положительных типов язв, сначала рассчитав четыре индекса α-разнообразия, включая индексы Chao1, Shannon, Simpson и ACE.Для Hp положительных язв антрального отдела желудка четыре индекса составили 9518,19, 3,81, 0,51 и 10224,67 (таблица 2). Для Hp положительной язвы желудка и двенадцатиперстной кишки четыре индекса составили 9561,53, 7,61, 0,91 и 10349,09 (табл. 2). Индексы ACE и Chao1 отражают богатство бактериального сообщества в одном образце. Ясно, что не было никаких существенных различий в ACE и Chao 1 для двух типов язв ( p > 0,05, t -тест, рисунки 2A, B), что указывает на отсутствие различий в общем количестве идентифицированных видов бактерий для двух типов язв. виды язвы.Для индексов Шеннона и Симпсона более высокое значение указывает на большее разнообразие бактериального сообщества. Как показано на рисунках 3C,D, расчетное значение индексов Шеннона и Симпсона для Hp положительной язвы антрального отдела желудка было значительно ниже, чем у Hp положительной язвы желудка двенадцатиперстной кишки ( p < 0,01, T -test), что свидетельствует о более низком разнообразии бактериального сообщества.
Рисунок 3 . Бактериальное сообщество α-разнообразие (A) Chao1, (B) ACE, (C) Simpson и (D) Shannon, индексы для Hp положительных язв антрального отдела желудка и двенадцатиперстной кишки.**Статистически значимая разница в двух группах.
Затем мы выполнили кластеризацию на основе невзвешенной матрицы расстояний и анализа основных компонентов, чтобы охарактеризовать β-разнообразие для обоих Hp положительных типов язвы желудка, которые сравнивали разницу в бактериальном сообществе между каждыми двумя образцами. Как показано на рисунке 4, главные оси 1 (ПК1), 2 (ПК2) и 3 (ПК3) могут объяснить 58,86, 18,95 и 10,01% вариации соответственно. Примечательно, что образцы Hp положительной язвы антрального отдела желудка были в основном сгруппированы в положительном квадранте, и их распределение было относительно концентрированным.Образцы Hp положительной язвы желудка и двенадцатиперстной кишки были в основном сгруппированы в квадранте отрицательного значения, и их распределение было относительно рассеянным. Это указывало на то, что внутривыборочное сходство выше для Hp положительной язвы желудка двенадцатиперстной кишки, чем для Hp положительной язвы антрального отдела желудка.
Рисунок 4 . Анализ основных компонентов (PCoA) для β-разнообразия бактериального сообщества в Hp положительных образцах антрального отдела желудка и язвы двенадцатиперстной кишки. (A) PCoA с использованием PC1 и PC2 в качестве главных осей; (B) PCoA с использованием PC1 и PC3 в качестве главных осей; (C) PCoA с использованием PC3 и PC2 в качестве главных осей.
Обсуждение
Ранее было хорошо известно, что кислая среда в желудке и другие антибактериальные факторы не подходят для бактериальной колонизации; таким образом, желудок должен находиться в относительно стерильном состоянии (1981). С развитием молекулярной биологии и технологии секвенирования в желудке впервые был обнаружен Hp , а затем были идентифицированы и другие микроорганизмы (1981; Wang, Yang, 2014).Тесная связь между инфекцией Hp и пептическими язвами известна давно; например, в Японии 94% пациентов с язвой желудка и 98% пациентов с язвой двенадцатиперстной кишки имеют ассоциированную инфекцию Hp (Alam et al., 2014). При среднем язва двенадцатиперстной кишки возникает в луковице двенадцатиперстной кишки, а язва желудка — в антральном отделе и других отделах желудка. Несмотря на то, что Hp является ведущей причиной язв, в нескольких исследованиях были обнаружены различия в популяциях микроорганизмов между двумя типами язв.В этом исследовании мы сравнили структуру слизистой флоры в 18 случаях Hp положительных язв антрального отдела желудка и двенадцатиперстной кишки.
Сравнивая бактерии на уровне типов, мы обнаружили, что Mycobacterium, Bacteroides и Firmicutes преобладали в язвах обоих типов, что согласуется с результатами, полученными Bik et al. (Бик и др., 2006). При сравнении на уровне рода мы также идентифицировали Prevotella, Neisseria и Streptococcus в Hp положительных тканях слизистой оболочки при обоих типах язвы, несмотря на преобладание бактерии Helicobacter .Эти бактерии в основном обнаруживаются во рту и в пище, и их присутствие было подтверждено в желудке Hp отрицательных пациентов в более ранних исследованиях (Jiang et al., 1990; Chen, 2004). Используя масс-спектрометрический биотипический анализ, Hu et al. (2012) обнаружили, что Streptococcus и Neisseria были преобладающими бактериальными родами в Hp положительных тканях слизистой оболочки желудка. Используя анализ высокопроизводительного секвенирования 16S рДНК (Li et al., 2009; Ahn et al., 2013) также обнаружили, что Streptococcus и Neisseria были преобладающими бактериальными родами у пациентов с Hp отрицательными язвами антрального отдела желудка, и их колонизация явно влияла на колонизацию Neisseria и Streptococcus , что преимущественно наблюдалось в желудке Hp. отрицательных пациента.
Тем не менее, в литературе имеется несколько сообщений о цветочной структуре слизистой оболочки двенадцатиперстной кишки. Наше исследование показывает, что у пациентов с язвой двенадцатиперстной кишки с положительным результатом на Hp доля Helicobacter значительно ниже, чем у пациентов с положительным результатом на Hp язвы антрального отдела желудка (рис. 1C), тогда как Pseudomonas, Neisseria и Streptococcus для относительно большей доли, поэтому Helicobacter не был единственным преобладающим родом.Кроме того, доля Bacteroides и Streptomyces у больных с язвами двенадцатиперстной кишки была значительно выше, чем у больных с язвами антрального отдела желудка; этот результат был также в случае с бактериями родов Halophilus, Frankesia, Prevobacteria и Porphyromonas . Объяснение может заключаться в том, что двенадцатиперстная кишка является частью тонкой кишки, которая находится ближе к тощей кишке и поэтому на нее влияет разнообразие кишечной флоры.Это также может быть связано с тем, что клетки слизистой оболочки двенадцатиперстной кишки не секретируют желудочную кислоту, а относительно высокое значение рН больше подходит для роста другой флоры.
Что касается биоразнообразия, бактериальное разнообразие в тканях слизистой оболочки пациентов с Hp положительной язвой двенадцатиперстной кишки было значительно выше, чем у пациентов с Hp положительной язвой антрального отдела желудка (рис. 3A–D, 4). Клиническое течение язвы желудка обычно более продолжительное, чем язвы двенадцатиперстной кишки, и имеет относительно большую вероятность онкогенеза.Сообщалось о связи между более низким разнообразием желудочной флоры и онкогенезом (Ahn et al., 2013). Еще одним преимуществом цветочного разнообразия является то, что метаболиты богаче, особенно метаболиты, которые являются пробиотиками, которые могут в определенной степени ингибировать пролиферацию Hp Song (2012). Таким образом, результаты нашего исследования убедительно свидетельствуют о том, что лечение язвы желудка может быть улучшено за счет эрадикации инфекции Hp вместе с адъювантной терапией пробиотиками для восстановления разнообразия желудочной флоры и поддержания стабильности микроэкологической среды желудка.
В заключение мы сравнили состав и разнообразие бактериального сообщества в тканях слизистой оболочки пациентов с Hp положительной язвой двенадцатиперстной кишки и язвой антрального отдела желудка, используя анализ секвенирования 16S рРНК, и выявили существенные различия. Мы полагаем, что аналогичные исследования с участием большего числа пациентов, использующих другие методы обнаружения бактерий, еще больше прояснят взаимосвязь между цветочной структурой и различными типами пептических язв, что, в конечном итоге, принесет пользу клинической терапии.
Вклад авторов
XC и ZW задумали и разработали исследование; CX, QL и LJ внесли свой вклад в собранные образцы; ЛЗ провела лабораторные испытания; XC и ZW участвовали в анализе данных и написании рукописи. Все авторы прочитали и одобрили окончательный вариант рукописи.
Финансирование
Это исследование было проведено при финансовой поддержке Общественного исследовательского центра по прикладным технологиям Зала науки и технологий провинции Чжэцзян (2017C33183).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
(1981). Бактерии в желудке. Ланцет 2, 906–907. дои: 10.1016/S0140-6736(81)-9
Полнотекстовая перекрестная ссылка
Ан, Дж., Синха, Р., Пей, З., Доминианни, К., Ву, Дж., Ши, Дж., и др. (2013). Микробиом кишечника человека и риск колоректального рака. Дж. Натл. Рак. Инст. 105, 1907–1911 гг. doi: 10.1093/jnci/djt300
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Алам, М. Р., Ахмед, Э.У., Рахман, М.З., Ислам, А.С.М.Н., Хан, М.М.Р., Ахмед, Д.С., и соавт. (2014). Исследование заживления язвенной болезни после эрадикации инфекции Helicobacter pylori . Бангладеш. Мед. Дж. 43, 84–89. дои: 10.3329/bmj.v43i2.21388
Полнотекстовая перекрестная ссылка
Бик, Э.М., Экбург, П.Б., Гилл, С.Р., Нельсон, К.Е., Пурдом, Э.А., Франсуа, Ф., и соавт. (2006). Молекулярный анализ бактериальной микробиоты желудка человека. Проц. Натл.акад. науч. США 103, 732–737. doi: 10.1073/pnas.0506655103
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чен, Дж. (2004). Журнал микробиологии полости рта. Шанхай: Издательство Университета Тунцзи.
Академия Google
Грэм, Д.Ю., и Шиотани, А. (2008). Новые концепции резистентности при лечении инфекций Helicobacter pylori . Нац. клин. Практика. Гастроэнтерол. Гепатол. 5, 321–331. дои: 10.1038/ncpgasthep1138
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Groenen, M.J., Kuipers, E.J., Hansen, B.E., and Ouwendijk, R.J. (2009). Заболеваемость язвой двенадцатиперстной кишки и язвой желудка в западном населении: назад к тому, с чего все началось. Кан. Дж. Гастроэнтерол. 23, 604–608. дои: 10.1155/2009/181059
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хоу, Л., и Чжан, X. (2015). Прогресс в исследованиях язв, не связанных с Hp и не связанных с приемом НПВП. Чжунхуа 13, 13:38–13:40. doi: 10.16766/j.cnki.issn.1674-4152.2015.08.033
Полнотекстовая перекрестная ссылка
Hu, Y., He, L.H., Xiao, D., Liu, G.D., Gu, Y.X., Tao, X.X., et al. (2012). Бактериальная флора на фоне Helicobacter pylori в желудке больных с заболеваниями верхних отделов желудочно-кишечного тракта. World J. Гастроэнтерол . 18, 1257–1261. дои: 10.3748/wjg.v18.i11.1257
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Цзян, Х., Xiao X., Yang M. и Kang B. (1990). Исследования нормальной флоры полости рта у здоровых подростков. Подбородок. Дж. Микробиол. 1, 31–34.
Li, X.X., Wong, G.L., To, K.F., Wong, V.W., Lai, L.H., Chow, D.K., et al. (2009). Профилирование бактериальной микробиоты при гастрите без инфекции Helicobacter pylori или применения нестероидных противовоспалительных препаратов. PLoS ONE 4:e7985. doi: 10.1371/journal.pone.0007985
Полнотекстовая перекрестная ссылка | Академия Google
Ли, З., Xiang, Y., Yi, C., and Zhang, J. (1995). Качественное и количественное исследование желудка общего желудка. Подбородок. Стажер Мед. 34, 408–410.
Песня, Ю. (2012). Инфекция Helicobacter pylori на структуру желудка и характеристики флоры [D] . Третий военно-медицинский университет.
Ван З. и Ян Ю. (2014). Состояние и перспективы взаимосвязи желудочной флоры и желудочных заболеваний. Подбородок. Дж. Дайджест. 34, 210–211.doi: 10.3760/cma.j.issn.0254-1432.2014.03.025
Полнотекстовая перекрестная ссылка
Юань Ю. и Тан Ю. (2008 г.). Ход исследований патогенеза язвенной болезни. Подбородок. Дайджест. Маг. 28, 435–436. doi: 10.3760/j.issn:0254-1432.2008.07.002
Полнотекстовая перекрестная ссылка
Zhang, B., Yu, C., Liu, W., et al. (1996). Изменения микроокружения желудка у больных желудочно-кишечными заболеваниями.
 1)
1) 5)
5) 3)
3)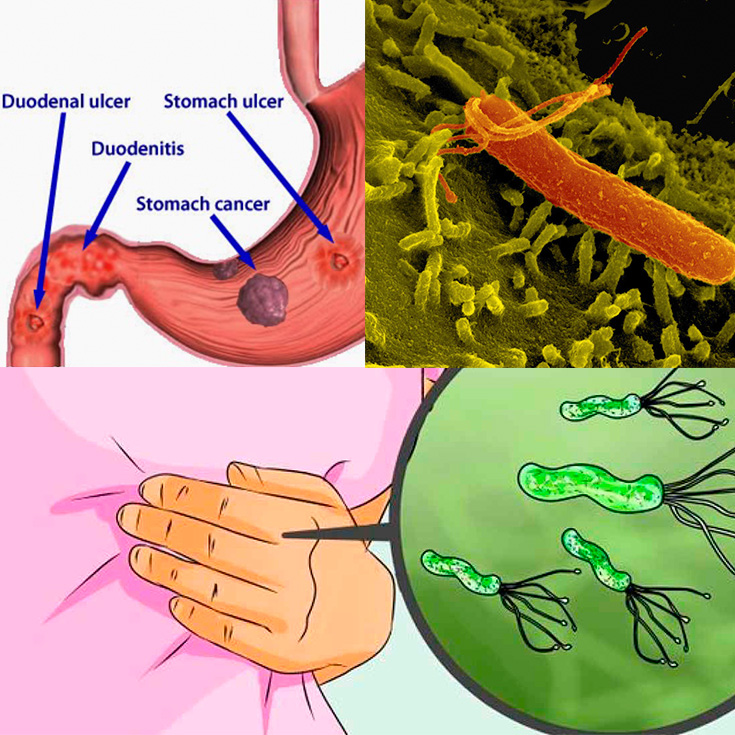 Gordonii
Gordonii  Flavescens
Flavescens  382
382  Johnsonii
Johnsonii  DentoCariosa
DentoCariosa  subtilis
subtilis  Hominis
Hominis  albicans
albicans  Graevenitzii
Graevenitzii  Haemolysans 51
Haemolysans 51 7)
7) 7)
7) 9 )
9 )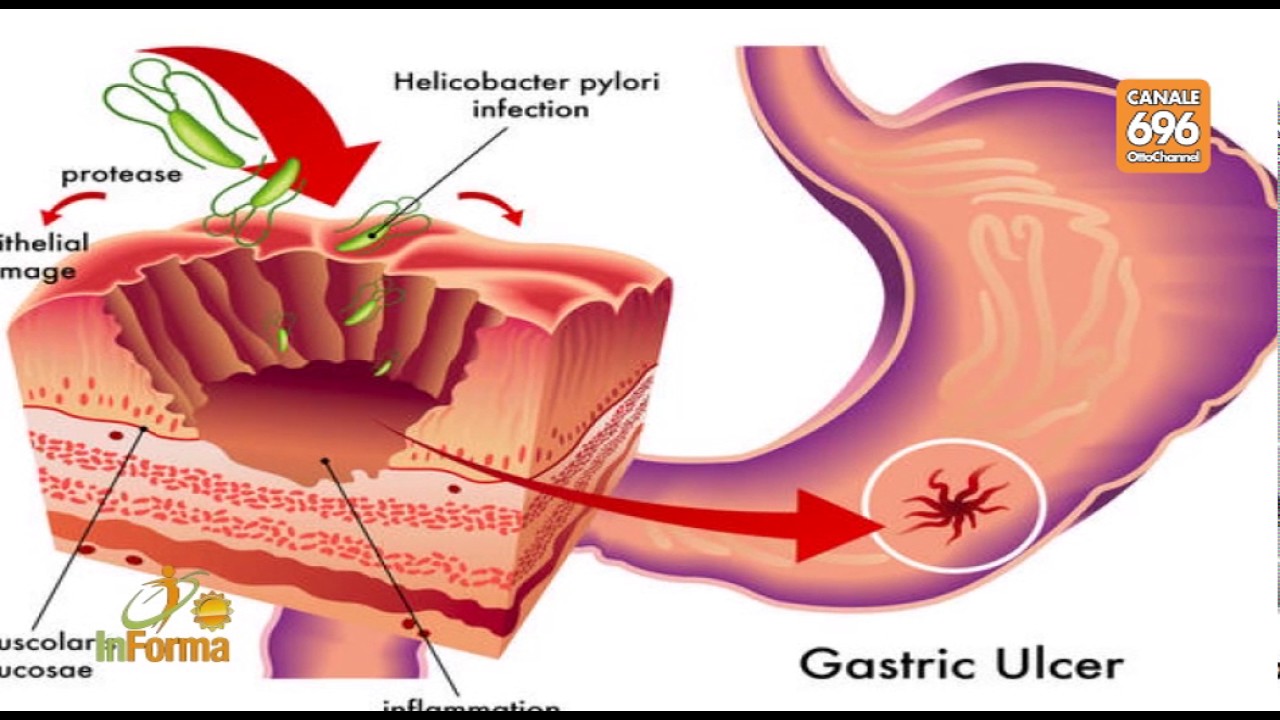 3)
3)
 90)
90) 50)
50) 40)
40)