АУТОАЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ
Поделись с друзьямиАутоаллергические (аутоиммунные) заболевания развиваются в результате выработки антител, которые могут взаимодействовать с антигенами собственного организма. Это может происходить при демаскировании антигенов, при снятии толерантности и при соматических мутациях.
Демаскирование антигенов наблюдается в высокодиф-ференцированных органах при нарушении гистогематических барьеров (в головном мозге, хрусталике, яичке, щитовидной железе и др.). В этих органах имеются вещества, которые являются аутоантигенами, поскольку в период формирования иммунной толерантности и в последующем они были изолированы от иммунной ткани гистогематическими барьерами. При нарушении барьеров происходят AAдемаскирование этих аутоантигенов и выработка против них аутоантител.
Демаскирование аутоантигенов, скрытых внутри биологических макромолекул, отмечается в органах, в которых специализированные барьеры отсутствуют. Под действием физических, химических и биологических факторов возможно обнаружение потенциально аутоантигенных детерминант и возникновение аутоаллергической реакции.
Снятие иммунной толерантности к нормальным компонентам тканей возможно, например к гаптенам своего организма, при замене носителя гаптенов. Известно, что к большому числу антигенов своего организма В-лимфоциты не толерантны. Объясняется это различиями в условиях формирования иммунной толерантности у Т- и В-лимфоцитов. Однако в норме В-лимфоциты не вырабатывают аутоантитела к компонентам собственного организма, так как к ним толерантны Т-лимфоциты. При встрече с этими антигенами Т-лимфоциты не вступают в кооперацию с В-лимфоцитами, без чего нетолерантные В-лимфоциты не вовлекаются в иммунный ответ.
Если в организм попадают макромолекулярные антигены, к которым присоединяются собственные, то Т-лимфоциты начинают реагировать на антигенные носители и кооперироваться с В-лимфоцитами, а последние в свою очередь начинают реагировать на гаптены своего организма, вошедшие в антигенный комплекс с чужеродным носителем. По-видимому, по такому механизму микроорганизмы и макромолекулярные вещества, выполняющие в организме функции носителей гаптенов, способны индуцировать аутоиммунные заболевания.
Ко многим веществам в организме поддерживается иммунная толерантность, в основе которой лежит активация антигенами Т-супрессоров. Неблагоприятные влияния на организм, а также наследственные нарушения могут вызвать снижение функции Т-супрессоров и развитие иммунного ответа против нормального компонента организма.
Снятие иммунной толерантности возможно при иммунизации близкородственными антигенами. Этот феномен может развиться за счет микрогетерогенности клона иммуноцитов и отмены активности супрессоров.
Соматические мутации в различных органах могут привести к появлению клеток, обладающих антигенными свойствами по отношению к своему организму. В большинстве случаев это завершается быстрой элиминацией мутировавшего клона соматических клеток.
Мутация иммуноцитов может стать причиной аутоиммунных заболеваний в связи с тем, что приводит к появлению «запретных» клонов, воспринимающих нормальные компоненты организма в качестве антигенов.
Появление запретных клонов может происходить и другим путем. Поскольку в нормальном организме у В-лимфоцитов не формируется иммунная толерантность к антигенам своего организма, то мутации первично могут приводить к отмене функции супрессоров или появлению запретного клона хелперов. В результате нетолерантные В-лимфоциты начинают реагировать на нормальные компоненты тканей своего организма. К аутоиммунным заболеваниям, возникающим по этому типу, относят ревматоидный артрит, системную красную волчанку, аутоиммунную гемолитическую анемию и лейкопению. При ревматоидном артрите наблюдается выработка антител к собственному гамма-глобулину крови. В патогенезе системной красной волчанки ведущее значение имеют противоядерные аутоантитела, реагирующие с компонентами ядер клеток крови и тканей.
Установлено существование еще двух механизмов аутоиммунных заболеваний:
а) недостаточность антиидиотипических антител;
б) срыв распознавания «своего» посредством рецепторов, в качестве которых Т-лимфоциты используют антигены главного комплекса гистосовместимости МНС.
Лауреат Нобелевской премии Ерне предсказал, что детерминанта антитела, реагирующая только с данным антигеном, имеет уникальное строение и сама является своеобразным антигеном — идиотипом (от греч, idios — своеобразный). Существование антиидиотипических антител было установлено экспериментально. Возникло предположение, что аутоиммунный процесс может развиться из-за недостаточной активности клона, вырабатывающего антиидиотипические антитела к каким-либо аутоантителам. Данное предположение экспериментально подтверждено при аутоиммунном адъювантном артрите (адъювант — смесь неорганического масла, ланолина и микробов), вызываемом находящимися в адъюванте туберкулезными микобактериями, обладающими двумя антигенами, имеющими общность с антигенами протеогликанов хрящей суставов. Введение животным, больным адъювантным артритом, клонов иммуноцитов, н»есущих антиидиотипические антитела к противохрящевым антителам, предупреждает или обрывает заболевание (А. Г. Коэн).
То обстоятельство, что антигены главного комплекса гистосовместимости используются Т-лимфоцитами в качестве рецепторов иммунного распознавания, создает возможность ошибки распознавания на основе различной экспрессии антигенов этой системы в клеточных мембранах и, особенно, на основе нарушения селекции клонов иммуноцитов по этим антигенам, которое у Т-лимфоцитов обязательно происходит в вилочковой железе. Эти механизмы аутоиммунной патологии имеют место при аутоиммунных антигенассоциированных заболеваниях. В частности, при инсулинзависимом диабете, когда Т-лимфоциты собственного организма убивают р-клетки островков поджелудочной железы, установлена явная связь с наследованием антигенов группы HLA-DR. Раскрыт механизм аутоиммунного поражения при инфекции нецитопатогенными вирусами, которыми у мышей является вирус хориоменингита и вирус гепатита В у человека. Эти вирусы не вызывают гибели инфицированных клеток, но антигены вирусов экспрессируются зараженными клетками в составе антигенов МНС в своих мембранах, где в ассоциированном виде распознаются Т-лимфоцитами, которые разрушают инфицированные клетки, вызывая тяжелое, иногда смертельное заболевание. Блокада активности Т-лимфоцитов при этих заболеваниях улучшает состояние заболевших, но они становятся вирусоносителями.
Аутоиммунная патология чаще наблюдается у женщин. Это связано, как полагают, с размещением генов, отвечающих за формирование иммунокомпетентной ткани, в Х-хромосоме. Поскольку у женщин две Х-хромосомы, то и мутации этих генов могут встречаться чаще, чем у мужчин.
students-library.com
Аутоаллергия
Аутоаллергия (греч. autos- сам + аллергия) — различные состояния измененной реактивности организма, вызванные повторными реакциями сенсибилизированных лимфоцитов и аутоантител с собственными тканями.
Возможность аутоаллергизации или аутосенсибилизации, т. е. сенсибилизации по отношению к собственным тканям организма, была продемонстрирована И. И. Мечниковым с сотрудниками в начале 20 в. Однако эти работы не привлекли к себе в то время должного внимания. В иммунологии долгие годы господствовало положение Эрлиха (P. Ehrlich) о невозможности выработки антител по отношению к собственным тканям в результате страха самоотравления (horror autotoxicus). Только последние 25—30 лет проблема аутоаллергии вновь привлекла к себе внимание исследователей. Был выявлен ряд реакций и заболеваний, в основе которых лежит аутоаллергический механизм.
Состояние аутоаллергии может развиться в организме в результате действия ряда механизмов. Чаще всего оно начинается с образования эндоаллергенов. А. Д. Адо (1960 год) предложил классификацию аутоаллергенов, которая отражает основные механизмы их образования в организме (схема).
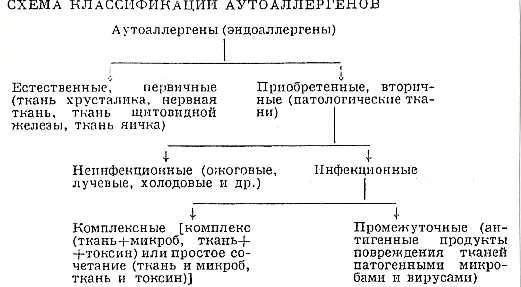
Естественные, или первичные, аутоаллергены- компоненты ряда неизмененных тканей (хрусталика, щитовидной железы и др.), по отношению к которым в организме отсутствует иммунологическая толерантность. При нарушении физиологической изоляции этих тканей иммунокомпетентные клетки продуцируют против них аутоантитела. Первичные аутоаллергены обладают слабыми аллергенными свойствами. Аутоантитела вырабатываются обычно в невысоких титрах, хотя и обладают выраженной специфичностью.
Механизм образования антител к первичным аутоаллергенам не до конца ясен. Иммунологическая толерантность организма к собственным белкам обусловлена наличием в иммунокомпетентных клетках особых веществ- репрессоров, угнетающих активность того участка генома, который связан с синтезом антител против собственных тканей. Исключение составляют ткани, относящиеся к естественным аутоаллергенам. Предполагают, что по отношению к ним действие репрессоров иммунокомпетентных клеток выпадает. По другой гипотезе, первичные аутоаллергены в процессе эмбрионального развития не имеют контакта с иммунокомпетентными клетками и поэтому в дальнейшем воспринимаются последними как чужеродные. По- видимому, нет иммунологической толерантности и в отношении антигенов, удаленных от циркуляции, а также некоторых внутриклеточных антигенов. Эти антигены под влиянием травмы или действия ферментов микробного и вирусного происхождения могут «обнажаться», попадать в кровоток и вызывать образование аутоантител.
Приобретенные, или вторичные аутоаллергены (неинфекционные и инфекционные) имеют большее значение в патологии. Неинфекционные аллергены могут образовываться при повреждении тканей физическими и химическими факторами, при гипоксии и пр. (например, в сердечной мышце при нарушениях ее кровоснабжения, в тканях при термических ожогах, повреждениях химическими веществами и прочих воздействиях). Образование аутоаллергенов может происходить также под влиянием некоторых лекарственных препаратов (антибиотики, сульфаниламиды, амидопирин и др.), после соединения с которыми белки организма приобретают аллергенные свойства. Поврежденная различными факторами ткань становится как бы чужеродной для организма и приобретает свойства аллергена. Часто повреждение, под влиянием которого образуются вторичные аутоаллергены, не ведет к полной деструкции ткани. Поэтому вырабатывающиеся аутоантитела обладают специфичностью и нередко органотропностью. Если повреждающее воздействие вызывает полную денатурацию белковых структур, то образующиеся антитела не реагируют с нормальными клетками и тканями.
Инфекционные аутоаллергены делятся на комплексные и промежуточные. Первые представляют собой комплекс (ткань + микроб, ткань + токсин) или простое сочетание (ткань и микроб, ткань и токсин) тканевого и инфекционного компонентов. Антитела, вырабатывающиеся на действие комплексного аутоаллергена, способны вступать в реакцию не только с ним, но и реагировать в отдельности как с тканью, так и с микробом, входящими в его состав. Промежуточные аутоаллергены (вирусиндуцированные антигены) были открыты А. Д. Адо и А. Х. Канчуриным (1960 год) при изучении иммунологических реакций, вызываемых некоторыми нейровирусами (например, фиксированным вирусом бешенства). По своим антигенным свойствам вирусиндуцированные антигены отличаются от свойств клетки и вируса. Антитела против данных антигенов реагируют лишь с ними, но не взаимодействуют ни с клеткой, ни с вирусом, взятыми в отдельности.
Аутоаллергические реакции, как показано исследованиями Каплана (M. H. Kaplan, 1958- 1964), И. М. Лямперт (1962- 1967) и др., могут возникнуть в результате действия так называемых общих или перекрестно реагирующих антигенов некоторых микробов и тканей организма (- гемолитический А- стрептококк- 5-й серотип и некоторые элементы ткани сердца; -гемолитический А-стрептококк- 12-й серотип и ткань почек; клебсиелла и ткань легких и др.). По- видимому, перекрестно реагирующие антигены микробов и тканей весьма широко распространены. При попадании в организм микробов, содержащих перекрестно реагирующие антигенные субстанции, против последних образуются антитела, которые взаимодействуют с элементами соответствующих тканей и вызывают их повреждение.
К развитию в организме аутоаллергических реакций могут привести нарушения в системах, продуцирующих антитела и сенсибилизированные лимфоциты, и в контролирующих эти системы механизмах. При этом может возникнуть продукция антител и сенсибилизированных лимфоцитов к компонентам собственных тканей, по отношению к которым в норме имеется иммунологическая толерантность. Бернет, Маккей и другие сторонники этой точки зрения считают, что аутоаллергические реакции развиваются тогда, когда в условиях патологии образуются так называемые запретные клоны клеток, участвующих в иммунологических реакциях против различных компонентов тканей (клонально- селекционная теория). Продукция аутоантител в значительной степени зависит от чувствительности иммунологического аппарата. Если эта чувствительность высокая, то образуется много антител даже при слабом антигенном раздражении. При низкой чувствительности иммунологического аппарата, напротив, антитела не продуцируются и при существенных антигенных воздействиях.
Образовавшийся аутоаллерген активируется, контактируя с макрофагами. В дальнейшем возможны два пути его воздействия. Во- первых, он может действовать на лимфоидную клетку, стимулируя ее пролиферацию и образование сенсибилизированных лимфоцитов. Образование сенсибилизированных лимфоцитов играет очень важную роль в патогенезе аутоаллергических реакций. Другой путь состоит во влиянии аутоаллергена на лимфоидную ткань таким образом, что она превращается в пиронинофильные клетки (плазмобласты, плазмоциты), вырабатывающие аутоантитела.
По местонахождению в организме различают фиксированные в тканях и свободно циркулирующие аутоантитела. Для определения аутоантител используют те же методики, что и для определения аллергических антител: реакцию связывания комплемента, прямую и непрямую реакции иммунофлюоресценции, реакцию преципитации в геле, реакцию пассивной гемагглютинации, реакцию потребления антиглобулина и др. При постановке иммунологических реакций иногда используют антигены, приготовленные не из собственных тканей обследуемого человека или животного, а из тканей других людей или других животных того же вида. При этом выявляются не истинные аутоантитела, а гомо- или изоантитела.
В патогенезе аутоаллергических реакций важное значение придается лимфоидным элементам. Пассивная передача некоторых экспериментальных аутоаллергических процессов (например, экспериментального аллергического энцефаломиелита) удается в основном при введении животным- реципиентам живых сенсибилизированных лимфоидных клеток, которые оказывают цитотоксическое действие на здоровые ткани. По- видимому, развитие аутоаллергических процессов обусловлено как возникновением повышенной чувствительности клеточного типа, так и выработкой аутоантител.
studfiles.net
Этиология аутоаллергических болезней.
Ткани и клетки организма приобретают аутоаллергенные (аутоантигенные) свойства в результате повреждающего воздействия различных факторов окружающей среды. Эти повреждения приводят к высвобождению и попаданию в общий кровоток физиологически изолированных компонентов клеток и тканей или к изменению антипенных свойств белковых структур. Повреждающими экзогенными факторами могут быть травма, инсоляция, охлаждение, инфекция бактериальная и особенно вирусная, поскольку именно вирусы обладают способностью проникать в клетки и резко изменять структуру внутриклеточного белка. Некоторые лекарственные вещества, обладая тропизмом к определенным клеткам крови, становятся гаптенами, входящими в состав аутоантигенов.
За последние годы получила подтверждение теория общих антигенных детерминант определенных штаммов микроорганизмов и тканей человека. Наличие таких детерминант приводит к сенсибилизации не только по отношению к микробам, но и по отношению к собственным тканям с последующим их повреждением.
Выделены штаммы стрептококка группы А, имеющие общие антигены с тканью сердца человека, а также нефритогенные штаммы стрептококка, колитогенные штаммы кишечной палочки.
При многих аутоаллергических болезнях этиологические факторы остаются до настоящего времени неизвестными. Аутоаллергические болезни чаще развиваются у женщин.
Патогенез аутоаллергических болезней.
Можно выделить три пути развития аутоаллергической болезни. Первый путь- образование в организме аутоаллергенов (освобождение изолированных антигенов- коллоид фолликулов щитовидной железы, миелин, антигены хрусталика, яичек; денатурация тканей при ожоге, лучевой болезни и др.; образование комплексных и промежуточных антигенов). В ответ на появление аутоаллергенов включаются иммунологические механизмы, направленные на инактивацию и удаление этих аутоаллергенов. Эти механизмы, будучи в своей основе защитными, в ряде случаев вызывают повреждение клеток и тканей. Такой механизм предполагается при тиреоидите Хасимото, орхите, энцефаломиелите.
Второй путь- дефекты в контроле за иммунологическими механизмами защиты организма- объясняет теория «запретного клона» по Бернету. В норме по отношению к антигенам собственных тканей существует иммунологическая толерантность и развитие клонов лимфоидных клеток, которые могли бы участвовать в иммунологических реакциях с собственными тканями, либо заторможено, либо эти клоны элиминированы. При патологии в силу пока неизвестных причин возможно развитие такого клона, либо такой клон появляется в результате соматической мутации лимфоцита. Клетки такого клона начинают повреждать ткани организма по механизму «трансплантат против хозяина». В реализации такого пути развития аутоаллергической болезни придают большое значение генетическому фактору, считая, что благодаря генетическим нарушениям функционируют так называемые запретные клоны иммунокомпетентных клеток, продуцирующих аутоантитела. В качестве фактов, подтверждающих роль генетического фактора, приводятся случаи семейного ревматизма, обнаружение ревматоидного фактора у родственников больных ревматоидным артритом, антител к тиреоглобулину у родственников больных аутоиммунным тиреоидитом, единичные наблюдения системной красной волчанки и других аутоаллергических болезней у однояйцевых близнецов. Однако этих фактов еще не достаточно, чтобы с уверенностью отнести аутоаллергические болезни к группе генетических.
Третий путь развития аутоаллергической болезни- активация иммунологических механизмов против микрофлоры, имеющей общие антигены с антигенами макроорганизма. В процессе приспособления к существованию в макроорганизме у многих микробов появились антигены, общие с антигенами хозяина. Это тормозит включение иммунологических механизмов защиты против такой микрофлоры, так как по отношению к своим антигенам в организме существует иммунологическая толерантность и такие микробные антигены принимаются как свои. Однако в силу каких то различий в строении общих антигенов все же происходит включение иммунологических механизмов защиты против микрофлоры, что одновременно ведет и к повреждения собственных тканей. Предполагают участие такого механизма в развитии ревматизма в связи с наличием общих антигенов у некоторых штаммов стрептококка группы А и в ткани сердца, язвенного колита в связи с наличием общих антигенов в слизистой оболочке толстой кишки и у некоторых штаммов E. coli, в некоторых случаях инфекционно- аллергической формы бронхиальной астмы в связи с наличием общих антигенов в ткани легкого и у микрофлоры, вегетирующей в дыхательных путях.
Независимо от патогенетического пути развития аутоаллергической болезни повреждение тканей может вызываться четырьмя иммунологическими (аллергическими) механизмами. Из них три механизма химергические, т. е. связанные с действием аутоантител, и четвертый- китергический, или клеточный. Первый механизм повреждения связан с образованием аллергических антител типа реагинов, которые фиксируются на поверхности клеток и при соединении с аллергеном вызывают освобождение вазоактивных аминов. Последние вызывают нарушение микроциркуляции и другие повреждения. Второй механизм- цитотоксический. Образовавшиеся антитела соединяются с соответствующими клетками и оказывают на них цитотоксическое и цитолитическое действие двумя путями. Прямой путь реализуется через активацию всех компонентов комплимента. Непрямой путь включает участие в этом процессе нейтрофилов, которые освобождают повреждающие факторы. Третий механизм- токсическое действие иммунного комплекса антиген + антитело. Этот комплекс фиксируется в тканях, особенно в стенках кровеносных сосудов. Преципитат фиксирует и активирует комплемент. Это ведет к аккумуляции в данной ткани нейтрофилов, которые фагоцитируют комплекс и при этом выделяют гидролазы и другие факторы, вызывающие повреждение тканей. Четвертый механизм- аллергическая реакция замедленного типа. Все четыре механизма могут принимать участие в повреждении тканей, однако при различных аутоаллергических болезнях действует преимущественно один из них. Участие первого механизма в развитии аутоаллергической болезни незначительно. Повреждающее действие цитотоксических аутоантител (второй механизм) наиболее четко демонстрируется при аутоаллергических болезнях крови, повреждающее действие иммунных комплексов- при узелковом периартериите, системной красной волчанке; клеточный механизм- при аутоаллергическом тиреоидите, симпатической офтальмии.
Фактором, способствующим развитию аутоаллергической болезни, является нарушение функции желез внутренней секреции. Так, например, при аутоаллергической болезни часто выявляется глюкокортикоидная недостаточность.
studfiles.net
Введение в понятие «аутоаллергические болезни».
ФГОУ ВПО «Московская государственная академия ветеринарной медицины и биотехнологии им. К. И. Скрябина»
Кафедра патологической физиологии
Реферат на тему: «Аутоаллергия»
Москва 2007 год
Содержание:
1. Введение.
2. Актуальность проблемы.
3. Аутоаллергия.
4. Патогенетическая роль аутоантител.
5. Воспроизведение аутоаллергических процессов в эксперименте.
6. Аутоаллергические болезни:
а) Этиология.
б) Патогенез.
в) Патологическая анатомия аутоаллергических (аутоиммунных) процессов и болезней.
г) Классификация.
д) Диагностика.
е) Прогноз.
ж) Принципы лечения.
з) Профилактика.
7. Красная волчанка.
8. Гломерулонефрит.
9. Заключение.
10. Список литературы.
Аутоаллергические болезни (греч. autos сам + аллергия; синоним: аутоиммунные, аутоагрессивные болезни) — группа заболеваний, основным механизмом развития которых является реакция аутоантител и сенсибилизированных лимфоцитов с собственными тканями. Практически все клетки и ткани человека при определенных условиях могут быть объектом повреждающего действия лимфоцитов и аутоантител; поэтому клинические симптомы аутоаллергических болезней чрезвычайно разнообразны и могут проявляться как органными, так и системными поражениями.
Возникновение учения об аутоаллергии как причине болезней связано с именем И. И. Мечникова. В 1900- 1901 годах И. И. Мечников и его ученики экспериментально доказали возможность продукции антител к белкам собственных клеток организма.
В 1904 году Донат и Ландштейнер обнаружили в сыворотке крови больных пароксизмальной холодовой гемоглобинурией антитела, специфически направленные против собственных эритроцитов. В 1908 году Видаль, Абрами, Брюле выявили аутогемолизины у больных приобретенной гемолитической анемией. С. С. Головин в 1904 году высказал предположение об аутоиммунном патогенезе симпатической офтальмии. Особенно широкое распространение учение об аутоаллергии получило начиная с 40-50-х годов 20 в. При многих заболеваниях установлены аутоаллергические механизмы патогенеза. Следует, однако, строго разграничивать аутоаллеогические болезни, где эти механизмы считаются ведущими, и аутоаллергические синдромы, осложняющие болезни другого генеза. Типичными примерами последних являются постинфарктный синдром, симптоматическая аутоиммунная анемия при лимфолейкозе, острая дистрофия печени при инфекционном гепатите, аутоаллергические синдромы при ожогах и лучевой болезни.
Актуальность проблемы.
Аллергию называют «болезнью цивилизации». Аллергические заболевания с каждым годом привлекают все более пристальное внимание врачей разных специальностей. Несмотря на то, что аллергические болезни известны человеку более двух с половиной тысяч лет, в современном мире проблемы, связанные с вопросами диагностики, терапии и профилактики аллергопатологий остаются весьма актуальными. За последние же десятилетия проблема аллергии приняла масштаб глобальной медико- социальной проблемы. Аллергия- это состояние патологически повышенной реакции организма на какие- либо вещества чужеродной природы, в основе которой лежат иммунологические механизмы. Патологические состояния, характеризующиеся образованием антител и специфически реагирующих лимфоцитов, развиваются в ответ на контакт с соответствующим аллергеном (или аллергенами), который рассматривается как этиологический фактор (или факторы ) болезни. Эндоаллергенами (аутоаллергенами) являются измененные под воздействием различных факторов (вирусы, бактерии и др. агенты) компоненты клеток тканей организма человека (тиреоглобулин щитовидной железы, миелин мышечных волокон, хрусталик глаза и др.), которые в норме изолированы от систем, продуцирующих антитела и сенсибилизированные лимфоциты. В условиях патологического процесса происходит нарушение физиологической изоляции, что способствует образованию эндо (ауто)аллергенов и развитию аллергической реакции.
В последнее время под действием экологических факторов, факторов питания, в частности- использование всевозможных пестицидов для выращивания продуктов питания, вызываются сбои иммунной системы, которые влекут за собой развитие аутоаллергий. Под этими сбоями организм начинает действовать на собственные клетки и ткани, что является достаточным бедствием, поскольку в настоящее время в мире полно болезней, и помимо них еще и сам организм разрушает свои структуры, поэтому очень важно вовремя, направленно и качественно производить лечение организмов, страдающих аутоаллергическими болезнями и аутоаллергиями.
studfiles.net
Классификация аутоаллергических болезней.
В связи с тем, что многие проблемы этиологии и патогенеза аутоаллергических болезней еще недостаточно изучены, общепринятой их классификации не существует. В качестве рабочей может быть использована классификация В. И. Иоффе (1963 год), в которой предпринята попытка разделить все аутоаллергические болезни по характеру аутоантигенов и механизмам аллергического (иммунологического) процесса и показать степень участия аутоаллергического процесса в развитии заболевания.
Основным недостатком этой классификации является нечеткое и неполное для современного уровня знаний изложение механизма аутоаллергических процессов. По этой классификации первую группу составляют истинные аутоиммунные болезни. Сюда включены заболевания, вызванные нарушением физиологической изоляции антигенов, по отношению к которым в организме нет иммунологической толерантности. Роль же аутоантител, которые, как правило, удается выявить в сыворотке больных, неизвестна, так как тканевые изменения имеют характер аллергической реакции замедленного типа. К этой группе с известной долей вероятности можно отнести следующие болезни: симпатическую офтальмию, аутоаллергический тиреоидит Хасимото, демиелинизирующие процессы- энцефаломиелит, рассеянный склероз, некоторые формы полиневрита, орхита, идиоматическую аддисонову болезнь.
Ко второй группе относятся приобретенная гемолитическая анемия, тромбоцитопеническая пурпура и коллагеновые болезни. Антигены при этих заболеваниях не обладают органной специфичностью. Патогенез связан с нарушением гомеостатического контроля иммунологических механизмов. Несомненно, что не все аутоаллергические болезни, включаемые в эту группу, имеют в своей основе нарушение гомеостаза иммуногенеза. Так, например, группа коллагенозов включает ряд нозологических форм, по-видимому, с различным механизмом и различной степенью нарушения гемеостатических механизмов иммуногенеза. Наиболее доказательна его ведущая роль при системной красной волчанке.
К третьей группе аутоаллергических болезней относятся гломерулонефрит, гепатит, агранулоцитоз. Сюда включены болезни, при которых аутоантигенность тканей приобретается за счет повреждающего действия внешних факторов (микробов, вирусов, лекарств) с образованием комплексных и промежуточных аутоаллергенов. К этой группе можно отнести также ревматизм и вакцинальный энцефаломиелит.
Более широкая классификации А. Д. Адо (1970 год) включает не только аутоаллергические болезни, но и аутоаллергические реакции (табл.).
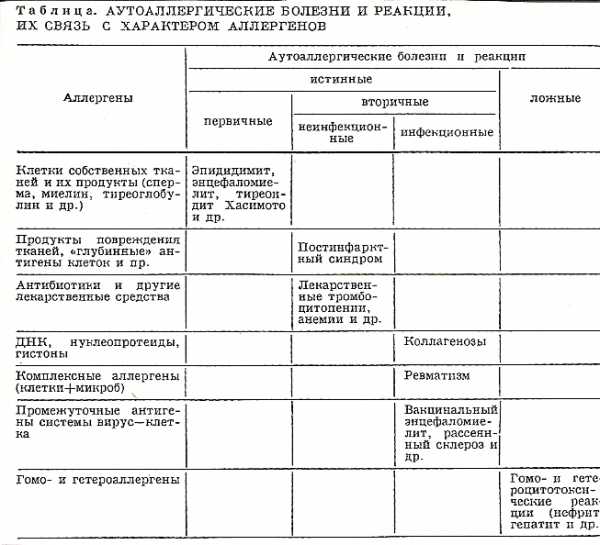
В основу этой классификации положены представления о
характере аутоаллергенов (аутоантигенов), участвующих в аутоаллергическом процессе, и о самых общих чертах его патогенеза. По патогенезу все аутоаллергические реакции разделены на две группы: 1) истинные, вызываемые активно образованными в организме аутоантителами и сенсибилизированными лимфоцитами; 2) ложные, вызываемые введением в организм готовых антител.
В иммунологических механизмах повреждения тканей участвуют все указанные выше четыре механизма. По характеру аутоаллергенов истинные аллергические болезни и реакции разделены на первичные и вторичные.
studfiles.net
Аутоаллергия. Аллергия: выбираем свободу
Профилактика
Аутоаллергия – повышенная и измененная способность организма реагировать на собственные белки клеток тканей, которые становятся аллергенами (эндоаллергенами).
Возникновение учения об аутоаллергиии как одном из механизмов развития болезни связано с именем русского физиолога – ученого И. И. Мечникова. Различают естественные и приобретенные эндоаллергены.
К естественным эндоаллергенам относятся некоторые белки нормальных тканей (мозг, тестикулум, хрусталик). Приобретенные – это белки организма, у которых появляются чужеродные (аллергические) свойства при ожогах, лучевой болезни, других процессах, а также при соединении с бактериальными токсинами, лекарствами. Организм способен отличить «свои» белки от чужеродных. В обычных условиях к собственным компонентам тела имеется устойчивость, и собственные ткани не повреждаются, то есть против них не образуются сенсибилизированные лимфоциты и антитела (аутоантитела). При аутоаллергии действие защитных механизмов направлено против собственных тканей хозяина. В этом заключается суть аутоаллергического процесса. Если повреждающее действие этих механизмов на ткани становится достаточно выраженным, процесс переходит в аутоаллергическую болезнь. К числу таких заболеваний относятся некоторые виды гемолитической анемии, миастения (тяжелая мышечная слабость), ревматоидный артрит, гломерулонефрит. Предполагают участие аутоаллергенов в развитии ревматизма, язвенного колита, а в некоторых случаях – бронхиальной астмы.
Механизм возникновения аллергии
Еще Гиппократ, Авиценна, Гален описывали случаи непереносимости некоторых пищевых продуктов, приводящей к желудочно-кишечным расстройствам и крапивнице. Аллергия преследует человечество с древнейших времен, но сейчас аллергенов стало значительно больше из-за ухудшающейся экологической обстановки и засилья бытовой, пищевой и промышленной химии.
Что такое аллергия и почему она возникает?
Общеизвестно, что иммунная система организма охраняет здоровье человека от самых разнообразных инфекций и прочих сторонних воздействий. В организме у всех без исключения людей вырабатываются защитные белки – иммуноглобулины нескольких видов (А, М, G, Е). Иммуноглобулинов Е, которые участвуют в аллергических реакциях, обычно вырабатывается не слишком много, например они нужны для уничтожения глистов.
Но оказывается, абсолютно все люди реагируют на разнообразные внешние раздражители (домашнюю пыль, бытовую и промышленную химию, шерсть животных, пыльцу растений и плесень) некоторым увеличением количества иммуноглобулинов Е в крови.
Необходимость такого увеличения носит охранный характер: иммуноглобулин Е выступает как сторожевые собаки, которые бросаются на чужака.
У большинства людей это не вызывает никаких внешних и внутренних симптомов, поскольку повышение количества иммуноглобулинов Е невелико. Но когда в организме вырабатывается много иммуноглобулинов Е, возникают хорошо знакомые нам аллергические реакции.
Как это происходит? Когда вещества, провоцирующие аллергические реакции (аллергены), попадают в организм, то иммуноглобулины бросаются на них и «хватают» вместе с аллергенами. Иммуноглобулины Е садятся на мембраны так называемых тучных клеток, внутри которых содержатся различные активные вещества, в частности серотонин, ацетилхолин, брадикинин, отвечающие за развитие воспалительных симптомов. Гистамин выбрасывается из тучных клеток, и у аллергиков происходит отек этих мест, появляются зуд, сыпь, выделения, например из носа. Данные реакции выполняют защитную биологическую функцию – расширяют сосуды и привлекают к этому месту другие активные клетки крови, также могут выделять вещества, разрушающие чужеродные белки.
Иммуноглобулины бывают специфическими, когда реагируют только на определение раздражителя, например на пыльцу растений или на какой-либо пищевой продукт (яйца, шоколад).
При некоторых заболеваниях, например гепатитах, СПИДе, количества вырабатываемых в организме иммуноглобулинов могут уменьшаться, поэтому аллергические симптомы могут ослабевать. Но одновременно у человека резко снижается иммунитет к разнообразным, зачастую очень опасным инфекциям, и он становится практически беззащитным перед онкологическими заболеваниями. Если вы истинный аллергик, вам повезло в том смысле, что вряд ли вам суждено заболеть другим бичом современной цивилизации – заполучить злокачественную опухоль. Ваша недремлющая иммунная система этого просто не допустит. По данным американских ученых из Национального института рака, при различных формах аллергии риск развития опухолей мозга снижается на 33?51%.
Итак, аллергия – это повышенная реактивность иммунной системы, возникающая по различным причинам и вызывающая сверхчувствительность к разнообразным бытовым, пищевым, лекарственным и промышленным раздражителям. Они могут быть как действительно опасными и вредными для здоровья (например, лекарства или бытовая химия), так и вполне безобидными, но организм все равно реагирует на вторжение чужеродных молекул неадекватно.
Чтобы образовать антитела в организме аллергены должны удовлетворять двум условиям: быть крупными, чтобы обладать антигенными свойствами, т. е. провоцировать выработку антител, и иметь такой размер, чтобы пройти через эпидермис кожи, эпителий дыхательных путей и желудочно-кишечного тракта, молекулярный вес от 50 000 до 40 000.
Причины возникновения аллергии
Врачи единодушны в том, что одна из основных аллергических реакций – определенные сбои в работе желудочно-кишечного тракта. Например, у человека развивается дисбактериоз из-за приема антибиотиков и других лекарств либо повышается проницаемость стенок кишечника как при язвенной болезни. Тогда крупные белковые молекулы-аллергены (которые в норме перевариваются до составляющих аминокислот и теряют свои аллергенные свойства) попадают в кровь, и человеческий организм начинает откликаться на вторжение незваных чужаков различными и подчас чрезмерными реакциями от простой крапивницы, зуда и насморка до тяжелого отека Квинке и шока. В течение суток человек сталкивается примерно с 120 пищевыми аллергенами, чаще всего без всякого вреда для здоровья. При переедании, когда аллергенов поступает много, при плохом пищеварении или воспалении кишечника, дисбактериозе или наличии паразитов в желудочно-кишечном тракте, которые выделяют ядовитые для человека продукты жизнедеятельности, риск развития аллергии очень высок.
Одним словом, все начинается с желудочно-кишечной патологии или плохой работы печени, если она не выполняет своей очистительной функции после перенесенного гепатита, холецистита или лямблиоза.
Лямблиоз – это поражение печени простейшими, которое часто протекает без явных симптомов, хотя могут встречаться различные нарушения пищеварения и боли в правом боку. Но со временем защитная функция печени снижается, что ухудшает состав крови и приводит к зашлакованности всего организма.
Причиной аллергии может быть и почечная недостаточность, когда почки не справляются со своей выделительной функцией.
В младенческом возрасте аллергия нередко развивается при слишком раннем прекращении кормления грудью и переходе к искусственному вскармливанию. К ней может присоединиться и ферментная недостаточность, просто у маленького ребенка не успел сформироваться и наладиться механизм усвоения взрослой пищи, а ему уже начинают давать разнообразный прикорм. Медики признают, что выявить подобную ферментативную недостаточность практически трудно и невозможно. Все они дружно (хотя и абсолютно независимо друг от друга) добавляют, что гораздо чаще, чем пресловутая ферментная недостаточность, которая практически всегда сама собой проходит, причиной аллергии, вернее, псевдоаллергии ребенка – равно как у взрослых, – является банальный дисбактериоз.
Все дело в постоянном самоотравлении организма массой вредных веществ, вырабатываемых патогенными бактериями, которыми забит кишечник. Именно эти бактерии выделяют гистамин, вызывающий разнообразные воспалительные симптомы.
Кто из детей и взрослых ни разу в жизни не простужался? И кому из них не назначали антибиотики? После такого лечения дисбактериоз и ребенку и взрослому практически гарантирован. Но выявляется он элементарно – с помощью анализа кала (посев кала). И лечится он очень просто – с помощью кишечных антисептиков нового поколения и избирательно уничтожающих вредную флору при сохранении полезной или бифидопрепаратов в капсулах. Обычно бифидобактерии практически полностью перевариваются в желудке, их суперполезность – не более чем рекламный трюк. Безусловно, они играют положительную роль в поддержании здоровой флоры в кишечнике, но с бактериозом справятся едва ли.
К сожалению, наследственность, генетическая структура – один из важнейших факторов в возможном развитии аллергии. Если один из родителей страдал от сенной лихорадки, астмы, экземы, пищевой аллергии, вероятность появления подобных или иных аллергических реакций у ребенка очень высока.
Причиной возникновения аллергии у ребенка может быть и несоблюдение его матерью диеты в период беременности. Врачи советует женщинам, ожидающим ребенка, воздержаться от классических аллергенов (шоколад, цитрусовые, кофе), чтобы плод не «нахватался» от матери антител и у малыша впоследствии не было проблем. Но далеко не все мамы способны на девять месяцев пожертвовать своими интересами и привычками ради здоровья ребенка. Поэтому если мама во время беременности часто пила кофе, ела яйца и апельсины, то у ребенка обнаруживается аллергия на эти продукты. Если они лечились от какой-либо болезни, то антитела к этому лекарству (например, антибиотику) передаются плоду. Поэтому женщинам советуем быть максимально осторожными, не переохлаждаться, не пить и не курить, иначе у ребенка, кроме аллергии, будет целый букет заболеваний, вплоть до самых тяжелых (поражения сердца, центральной нервной системы и различные пороки развития).
Следующая возможная причина возникновения аллергии у ребенка и взрослого – это грибки. Они действуют как инфекционный аллерген и тоже любят селиться в кишечнике, выделяя множество токсических веществ. Их также легко выявить с помощью анализа на дисбактериоз.
Грибки опасны и тогда, когда они находятся в кишечнике, когда они всего лишь украшают ногти или заводятся в перхоти. Все это приводит к повышению общей чувствительности организма к различным веществам.
Последняя причина, вызывающая возникновения аллергии, – это плохая аллергическая обстановка вокруг нас. Вода, которую мы пьем, воздух, которым мы дышим, продукты, которые едим ежедневно почва, по которой мы ходим, – все перенасыщено химикалиями. Кроме остатков удобрений продукты содержат различные пищевые добавки, консерванты, улучшители вкуса. Нечего говорить о бытовой химии или о вредном воздействии химически активных веществ на различных производствах. Совсем не редкость возникновение профессиональной аллергии у парикмахеров к применяемым ими составам, у работников резиновых, химических фабрик и заводов, производящих удобрения или стиральные порошки, шины. Очень много аллергиков в Донбассе, Кузбассе и иных угольных регионах в больших и малых городах с предприятиями, загрязняющими водоемы и воздух промышленными выбросами.
В Саратове даже тараканы покинули город из-за плохой экологической обстановки.
Многое зависит от ваших пищевых привычек. Так, бедный витаминами, микроэлементами и растительной клетчаткой с высоким содержанием полуфабрикатов и консервированных продуктов рацион резко повышает восприимчивость ко всему (подробнее смотрите в Пищевой аллергии).
От чего зависит сила проявления симптомов аллергии?
Проявление симптомов или появление новых или на новое вещество зависит от целого ряда факторов: состояния здоровья, степени усталости, продолжительности сна (сильно сказывается постоянное недосыпание), изнуренности физической или умственной работой, стрессами, качества воды, питания, частоты пользования бытовой химией, курения (курите вы сами или ваше окружение – это практически одно и то же). Любая свежая хирургическая операция (удаление зуба, гланд, травмы, особенно ожоги) также надолго сенсибилизирует организм. Любые сторонние заболевания ведут к ухудшению состояния всего организма, соответственно, к усилению аллергических реакций или появлению новых.
Сколько надо аллергена для начала реакции?
В случае истинной аллергии достаточно всего одной молекулы вещества, чтобы последствия в виде кожных высыпаний, насморка и даже шока не заставили себя ждать. Поэтому если у вашего ребенка выраженная аллергия на яйцо, не удивляйтесь у него крапивнице после того, как вы сварили ему кашу в той же кастрюле, где до этого варились яйца, даже если вы ополоснули ее водой.
Аллергические реакции
В ответ на внедрение в организм аллергенов и развиваются аллергические реакции, которые могут быть специфическими и неспецифическими. Специфической реакции предшествует скрытый период, когда развивается повышенная чувствительность к впервые попавшему в организм аллергену, – так называемая сенсибилизация. Происходит это в результате выработки антител – белковых веществ, образующихся в ответ на введение только данного аллергена, или появления лимфоцитов, способных взаимодействовать с данным аллергеном. Если к моменту их появления аллерген удален из организма, никаких болезненных проявлений не отмечается. При повторном воздействии аллергена на уже сенсибилизированный к нему организм развивается аллергическая реакция – взаимодействие антител или лимфоцитов с вызвавшим их образование аллергеном. В результате происходит ряд биохимических процессов с выделением химических вещества (гистамина, серотонина и др.), повреждающих клетки, ткани и органы, что и лежит в основе аллергических заболеваний. Повышенная чувствительность организма в таких случаях специфична, т. е. она проявляется по отношению к аллергену, который ранее вызывал состояние сенсибилизации.
Неспецифические аллергические реакции возникают при первичном контакте с аллергеном без предшествующей сенсибилизации. Попадающий в организм аллерген сам вызывает образование веществ, повреждающих клетки, ткани и органы. К числу таких реакций относится идиосинкразия – непереносимость некоторых пищевых продуктов и лекарственных веществ.
В большинстве случаев у человека развиваются специфические аллергические реакции. По времени проявления аллергические реакции принято делить на два типа – немедленный и замедленный. Реакциями немедленного типа считаются кожные и системные аллергические реакции (дыхательной, пищеварительной и других систем), возникающие через 15?20 мин после воздействия специфического аллергена. Они проявляются кожным волдырем, спазмом бронхов, расстройствам функции ЖКТ и др. К аллергическим реакциям немедленного типа относят анафилактический шок, сывороточную болезнь, поллинозы, крапивницу, бронхиальную астму, отек Квинке. Сывороточная болезнь у несенсибилизированных людей развивается через 2?12 дней после введения сыворотки или ?-глобулина, а при повторном введении сыворотки – намного раньше. Она характеризуется появлением сыпи с мучительным зудом, припухлостью лимфатических узлов, повышением температуры и другими симптомами. Отек Квинке – преходящий ограниченный отек кожи, подкожной клетчатки и слизистых оболочек – может развиться при попадании в организм любого аллергена; чаще бывает на лице, гортани, ЖКТ. Встречаются случаи и неаллергического – наследственного – отека Квинке. Реакции замедленного типа развиваются в течение многих часов и иногда суток. К ним относят повышенную чувствительность к бактериям (например, туберкулеза, бруцеллеза, сапа, туляремии и др.), контактные дерматиты у работников химической промышленности, фармацевтов, медперсонала.
Аллергия развивается не во всех случаях контакта организма с аллергенами. Определенную роль играют наследственность, состояние нервной и эндокринной систем. Если у обоих родителей, например, отмечаются поллинозы, анафилаксия, атоническая (наследственная) форма бронхиальной астмы, некоторые формы аллергического насморка, то у детей аллергические заболевания развиваются более чем в 70% случаев; в семьях, где болен только один из родителей, заболевает до 50% детей. Передаются не сами заболевания, которыми страдают родители, а предрасположенность к ним – повышенная способность отвечать аллергической реакцией на действие экзогенных аллергенов. Поэтому в зависимости от вида аллергена и путей его поступления в организм аллергическое заболевания у ребенка может проявляться в любой форме. К развитию аллергии предрасполагают нарушения функций нервной и эндокринной систем, а также травмы головного мозга, отрицательные эмоции, снижение функции надпочечников.
Мы привыкли относиться к дыханию как к естественному процессу, не требующему особых усилий. И только астматики знают цену воздуха, и только они знают, каково это стараться вдохнуть свежего воздуха и быть не в состоянии этого сделать. Каждый вдох на вес золота.
aupam.ru
Диагностика аутоаллергических болезней.
Клиническим выражением напряжения иммуногенеза является увеличение лимфатических узлов и селезенки. Помимо типичных для каждой аутоаллергической болезни признаков, большое значение для диагностики придается выявлению аутоантител в сыворотке больного. Последние могут быть выявлены различными, определенными для каждого заболевания тестами. При аутоаллергических гемолитических анемиях применяют прямой и непрямой тесты Кумбса. Для выявления противотканевых аутоантител применяют реакцию связывания комплемента, реакцию преципитации в геле по Оухтерлоню, реакцию пассивной гемагглютинации по Бойдену. При некоторых аутоаллергических болезнях в сыворотке выявляются особые белки, по- видимому, имеющие отношение к аутоантителам, например ревматоидный фактор при ревматоидном артрите, волчаночный фактор при системной красной волчанке. Результатом действия противоядерных антител при последнем заболевании следует считать образование волчаночных (LE) клеток. Ориентировочное значение в диагностике имеет гипергаммаглобулинемия. Нередко, особенно в диагностике коллагенозов, применяется анализ материала биопсии тканей.
При многих аутоаллергических болезнях можно получить положительную кожную аллергическую реакцию замедленного типа на соответствующий тканевой гомоантиген.
Однако широкого применения в клинической практике этот метод пока не получил.
Прогноз.
Наиболее общей чертой большинства аутоаллергических болезней является их тяжелое прогрессирующее течение, приводящее к необратимым нарушениям функции соответствующего органа или системы. Исключение составляют некоторые лекарственные гемопатии, имеющие благоприятный прогноз при отсутствии повторных контактов с соответствующими лекарствами. Введение в терапию аутоаллергических болезней кортикостероидов значительно продлило жизнь многих больных.
Принципы лечения аутоаллергических болезней.
Практически при всех аутоаллергических болезнях приходится прибегать к лечению кортикостероидными гормонами, которые действуют как на основной механизм развития болезни, подавляя продукцию аутоантител, так и на вторичные изменения благодаря противовоспалительному действию и замещению недостатка эндогенных кортикостероидов. Схемы лечения различны для каждого заболевания. Как правило, необходимо длительное лечение в сочетании со средствами, снижающими возможность развития побочных реакций. Благоприятные результаты достигнуты, в частности, при комбинированном лечении кортикостероидами в сочетании с производными хинолина (делагил, резохин и др.).
При установлении диагноза лекарственных гемопатий необходимо прекращение контакта с антигеном (гаптеном). При идиопатических формах гемолитической анемии и тромбоцитопении в ряде случаев показана спленэктомия.
В последние годы изучается вопрос лечения аутоаллергических болезней цитостатическими препаратами (новэмбихин, тиоТЭФ и др.) и иммунодепрессантами типа 6- меркаптопурина.
Профилактика аутоаллергических болезней.
В связи с неясностью многих вопросов этиологии и патогенеза аутоаллергических болезней абсолютно действенных мер их профилактики пока нет. Предположительно можно говорить о профилактическом значении ограничения чрезмерных воздействий антигенных раздражителей, таких как вакцинация, лекарственная терапия, переливание крови, особенно в периоды наиболее лабильной реактивности организма.
Имеет значение также борьба с бытовым и производственным травматизмом, рациональное лечение хронических общих и очаговых инфекций, ограничение инсоляции, предупреждение переохлаждения. Для профилактики аутоаллергических болезней особенно важна тщательная оценка реактивности организма при выборе момента плановых оперативных вмешательств, бальнео- и физиотерапии.
studfiles.net