Что такое аритмия сердца
Аритмией называют нарушение сердечного ритма, что может ощущаться как перебои в работе сердца. Причины для проявления аритмии бывают самыми разными, но при возникновении симптомов данного заболевания нужно сразу обращаться к врачу.
Аритмией называют заболевание сердца, в результате которого возникает нарушение нормального сердечного ритма. Происходит это, как правило, из-за неправильного функционирования электрических импульсов, инициирующих сокращение сердечной мышцы. Результатом становится нерегулярное, ускоренное или замедленное сердцебиение. В ощущениях это часто выражается как «пропуск» одного или нескольких сердечных сокращений, то есть сердце как бы «замирает», либо резко начинает биться в ускоренном темпе.
Как утверждают врачи, аритмия – не такое уж редкое явление, и не все проявления данной аномалии опасны. Однако некоторые причины данного заболевания могут нести достаточно серьезную угрозу, включая угрозу для жизни. Собственно и сама аритмия как таковая может значительно ухудшать состояние сердца, например, истощая сердечную мышцу постоянными повышенными нагрузками. Поэтому при тех или иных проявлениях данного заболевания обязательно необходимо проходить медицинское обследование, а при необходимости – и лечение сердца.
Поэтому при тех или иных проявлениях данного заболевания обязательно необходимо проходить медицинское обследование, а при необходимости – и лечение сердца.
Как проявляется аритмия?
Иногда болезнь сердца может и не подавать видимых симптомов, а выявиться, к примеру, при прохождении диспансеризации. Однако чаще всего нарушение ритма сердца обнаруживает себя определенными признаками. К их числу можно отнести ощущение «перебоев» сердца, чрезвычайно быстрое или замедленное сердцебиение, одышку, боли в грудной клетке, ощущение близкого обморока, головокружение и даже потерю сознания.
При появлении перечисленных симптомов не стоит паниковать, они далеко не всегда говорят о наличии серьезных проблем с сердцем. Нередко люди, чувствующие аритмию, не имеют тяжелых заболеваний сердечно-сосудистой системы. С другой стороны, реально угрожающая жизни аритмия может внешне никак не проявляться. Поэтому время от времени проходить диспансерное обследование все же необходимо.
Причины аритмии
В числе наиболее частых причин развития аритмии можно отметить болезни сердца, заболевания щитовидной железы, гипертонию, сахарный диабет, стресс, курение, злоупотребление алкоголем и неумеренное употребление кофеина. Также причиной может стать передозировка лекарственных препаратов, необдуманное использование БАДов, гомеопатических средств. Однако конкретный диагноз может поставить только врач после проведения всех необходимых процедур. И даже если вы уверены, что знаете, из-за чего у вас были симптомы аритмии (например, прием лекарства), обратиться к врачу все равно стоит. Ведь, как известно, на ранней стадии почти любую болезнь вылечить неизмеримо легче.
Также причиной может стать передозировка лекарственных препаратов, необдуманное использование БАДов, гомеопатических средств. Однако конкретный диагноз может поставить только врач после проведения всех необходимых процедур. И даже если вы уверены, что знаете, из-за чего у вас были симптомы аритмии (например, прием лекарства), обратиться к врачу все равно стоит. Ведь, как известно, на ранней стадии почти любую болезнь вылечить неизмеримо легче.
Что такое аритмия сердца и чем она опасна для здоровья ᐈ Блог Панорама Мед
Ощущения, когда сердце начинает усиленно биться, словно выскакивая из груди, — не из приятных. Какие виды аритмии бывают и чем они опасны, рассказывает врач-кардиолог медцентра «Панорама Мед» Юлия Шувалова.
Что такое аритмия и как она проявляется?
Аритмия – это изменение частоты и периодичности сердечного ритма. Есть несколько видов этого нарушения. Поскольку сбой сердечного ритма может произойти в разных отделах сердца, аритмии бывают желудочковые, наджелудочковые и из АВ-соединения. Само изменение ритма тоже может быть разным. Учащенное сердцебиение называется тахикардией, замедленное – брадикардией, но это лишь самые простые и часто встречающееся аритмии.
Само изменение ритма тоже может быть разным. Учащенное сердцебиение называется тахикардией, замедленное – брадикардией, но это лишь самые простые и часто встречающееся аритмии.
Тахикардия и брадикардия – серьезные нарушения, требующие постоянной коррекции и наблюдения. Если они появляются периодически, то могут быть следствием стресса, лихорадки (при неосложненном ОРВИ) или вегетососудистой дистонии, что не является опасным. В этих случаях сердце вновь возвращается к привычному ритму.
В каких случаях аритмия сердца не является поводом для беспокойства?
Довольно часто по результатам ЭКГ врачи делают заключение: синусовая аритмия. Эта аритмия вызвана работой синусового узла. Она характеризуется замедлением или удлинением промежутков между сердечными сокращениями и считается безопасной. В детском и подростковом возрасте в процессе быстрого роста организма такое бывает часто. В этих случаях синусовая аритмия является нормой, а не патологией, и с возрастом проходит.
Многие люди когда-либо испытывали ощущения замирания сердца, которые проходят без каких-либо последствий. Это очень распространенный вид аритмии — экстрасистолии. Экстрасистолы возникают из-за преждевременного прохождения импульса. В большинстве случаев они не опасны для здоровья и в норме составляют 1500 экстрасистол в сутки. Иногда человек даже не замечает их. Экстрасистолы появляются в результате психоэмоционального возбуждения, на фоне вегетососудистой дистонии или беспричинно. Однако частые приступы экстрасистолии – повод для обращения к врачу и полного обследования, причем не только у кардиолога, но и у других специалистов.
Это очень распространенный вид аритмии — экстрасистолии. Экстрасистолы возникают из-за преждевременного прохождения импульса. В большинстве случаев они не опасны для здоровья и в норме составляют 1500 экстрасистол в сутки. Иногда человек даже не замечает их. Экстрасистолы появляются в результате психоэмоционального возбуждения, на фоне вегетососудистой дистонии или беспричинно. Однако частые приступы экстрасистолии – повод для обращения к врачу и полного обследования, причем не только у кардиолога, но и у других специалистов.
Какие виды аритмии наиболее опасны?
- Самые опасные аритмии — пароксизмальные, которые возникают внезапно, приступообразно. Пароксизмальная аритмия может возникнуть на фоне хорошего самочувствия, но чаще она развивается при скачках давления и после психоэмоционального перенапряжения. Сердце начинает биться или учащенно, сбиваясь с ритма, или, наоборот, слишком медленно. Нарушению сердечного ритма сопутствуют резкое ухудшение самочувствия — внезапная слабость, головокружение, вплоть до потери сознания.
 Аритмия может возникать в ночное время, что может вызвать внезапную остановку сердца.
Аритмия может возникать в ночное время, что может вызвать внезапную остановку сердца. - Мерцательная аритмия (постоянная форма фибрилляции предсердий) — признак серьезного заболевания сердца, часто развивается как осложнение ишемической болезни, гипертонической болезни, пороков сердца, а также при нарушениях работы щитовидной железы. Аритмии подвержены люди, страдающие гипо- и гипертиреозами, если заболевания не компенсируются препаратами.
При мерцательной аритмии в предсердиях нарушается проведение импульса, из-за чего они «трепещут-мерцают». В результате сердце работает неравномерно и существует риск тромбообразования, которое может повлечь за собой развитие инсульта или инфаркта. Мерцательная аритмия проявляется очень неприятными симптомами – одышкой, слабостью, головокружениями, ощущением нехватки воздуха. Она требует лечения и постоянного наблюдения у кардиолога.
Какие обследования необходимы для постановки правильного диагноза аритмии?
Аритмию довольно трудно диагностировать, поскольку сбои сердечного ритма наблюдаются в разное время суток и между ними может быть длительный перерыв. Необходимо комплексное обследование и в первую очередь – суточное мониторирование ЭКГ и УЗИ сердца.
Необходимо комплексное обследование и в первую очередь – суточное мониторирование ЭКГ и УЗИ сердца.
Лечение аритмии сердца в Екатеринбурге
Аритмии – нарушение образования, проведения, а также частоты или периодичности сокращений сердца.
Этот термин имеет отношение только к сердцу и поэтому использовать словосочетание «аритмия сердца» не совсем корректно.
Виды аритмий
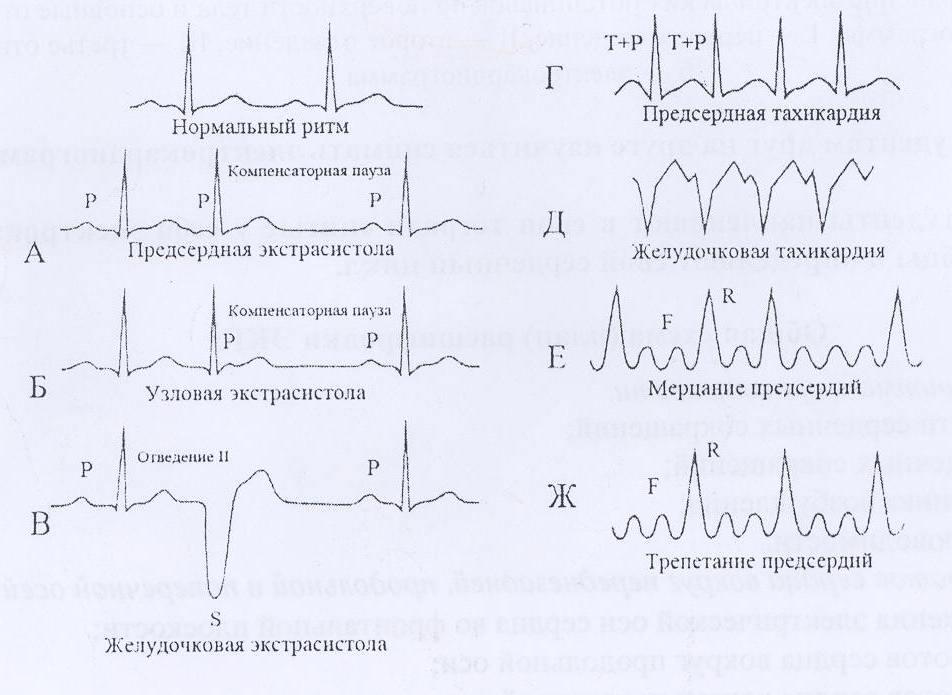
В зависимости от того, в каком отделе сердца возникло нарушение ритма, все аритмии (А.) делят на предсердные и желудочковые.Предсердные аритмии
- экстрасистолия
- мерцательная А.
- предсердная тахикардия
- синусовая тахикардия/брадикардия/А.
Желудочковые аритмии
- экстрасистолия.
- желудочковая тахикардия.
- фибрилляция желудочков.
По частоте сердечных сокращений нарушения ритма разделяют тахикардии и брадикардии.
ТАХИКАРДИИ — увеличение частоты сердечных сокращений свыше 80 в минуту.
 К ним относят:
К ним относят:- тахиформу мерцательной А.
- предсердную тахикардию
- синусовую тахикардию/А.
БРАДИКАРДИИ – снижение частоты сердечных сокращений ниже 60 в минуту. Эта группа аритмий включает в себя:
- синусовую брадикардию
- блокады сердца (предсердные, предсердно-желудочковые, желудочковые)
- брадиформу мерцательной аритмии.
- остановку сердца
Механизм развития аритмий
В норме у каждого человека в толще мышцы сердца (миокарде) располагается так называемая проводящая система. Она представляет собой сеть тонких нервных волокон, проводящих импульсы по миокарду и именно, она заставляет биться сердце человека с той или иной частотой.Принцип ее работы напоминает электрическую проводку — есть инициатор электрического импульса (собственно синусовый узел) и есть проводящие от него импульсы элементы. Если на этапе проведения импульса возникают «неполадки», то развиваются аритмии.
При тахиаритмии обычно повышается проводимость по собственной проводящей системе сердца — синусовая тахикардия. Либо возникают дополнительные очаги аритмий, как при предсердной тахикардии, мерцательной аритмии, экстрасистолии.
При брадикардиях замедляется/нарушается процесс проведения импульса по сердцу. Это сопровождается уменьшением, либо прекращением сокращений сердца.
Причины развития аритмий
1. инфекции вирусные, бактериальные любой локализации
2. заболевания сердечно-сосудистой системы:
- воспалительные заболевания сердца – миокардиты
- гипертоническая болезнь
- ишемическая болезнь сердца
- пороки сердца
- сердечная недостаточность
- кардиомиопатии
- бронхиальная астма
- хроническая обструктивная болезнь лёгких
- пневмония
- язвенная болезнь
- эрозивный гастродуоденит
- НР-инфекция (хеликобактерный гастродуоденит)
- желчнокаменная болезнь
- хронический панкреатит
- воспалительные заболевания кишечника
 эндокринные расстройства:
эндокринные расстройства:- заболевания щитовидной железы: повышенная функция (тиреотоксикоз), пониженная функция( гипотиреоз)
- сахарный диабет
- феохромоцитома
- опухоли гипофиза
- злоупотребление алкоголем
- применения наркотиков
- интенсивное курение
8. обострение любой сопутствующей патологии
9. онкологические заболевания. Особенно после курсов лучевой терапии, химиотерапии
10. сочетание факторов
КЛИНИКА АРИТМИЙ определяется ее формой. При тахикардиях определяется частый пульс, при брадикардиях-редкий. В случае экстрасистолии возникают внеочередные сокращения сердца, ощущаемые как «толчки», «паузы», «запинки» сердца
При предсердной тахикардии развивается учащенное сердцебиение в правильном ритме с высокой частотой — как правило, внезапное и кратковременное.
Мерцательная А. (как тахи-, так и брадиформа) проявляется сердцебиением в неправильном ритме.
При блокадах сердца, выраженной брадикардии, помимо редкого пульса, могут возникать обмороки.
У пожилых людей, а также страдающих сахарным диабетом, нередко приступ А. может проявляться одышкой, головокружением, слабостью, болью в груди.
ДИАГНОСТИКА АРИТМИЙ проводится на основании анамнеза, данных электрокардиограммы и холтеровского (суточного) мониторирования ЭКГ. В диагностике, выборе тактики при А. необходимы:
- ультразвуковое исследование сердца, органов брюшной полости,
- исследование функции щитовидной железы,
- фиброгастроскопия,
- общеклинические анализы крови, мочи,
- консультации смежных специалистов (при необходимости).
Аритмия сердца — симптомы, диагностика, лечение в Калининграде — Медцентр «Надежда»
Лечение аритмии
Любой механизм должен работать правильно, в заданном ритме.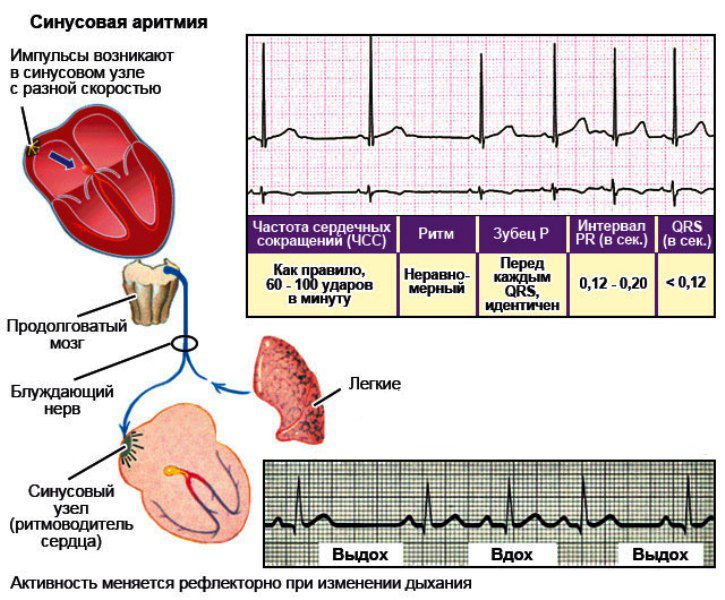 Человеческое сердце — не исключение, это такое же механическое устройство. Если возникает аритмия, пульс то ускоряется, то замедляется, а иногда и вовсе пропускает сокращения. Как же выявить такой недуг?
Человеческое сердце — не исключение, это такое же механическое устройство. Если возникает аритмия, пульс то ускоряется, то замедляется, а иногда и вовсе пропускает сокращения. Как же выявить такой недуг?
Причины появления аритмии
- Не выявленные вовремя болезни сердца.
- Высокое артериальное давление.
- Сахарный диабет.
- Вредные привычки, будь то алкоголь, курение, потребление наркотических средств.
- Воздействие электричества на организм, электрошок, поражение током.
- Потребление биологически активных добавок (БАД).
- Инфаркт миокарда.
Факторы риска появления аритмии
- Генетическая наследственность. Очень часто аритмия бывает врождённой.
- Болезни щитовидной железы.
- Повышенное артериальное давление.
- Диабет.
- Повышенное содержание электролитов, таких как магний, калий и кальций.
- Использование психостимуляторов, кофеина, никотина, наркотиков.
Аритмия: симптомы и лечение
- Частые головокружения.

- Одышка, нехватка воздуха.
- Ноющая боль в грудной клетке.
- Замедленное сердцебиение.
- Ускоренное сердцебиение, будто после тяжёлых физических нагрузок.
- Плохое самочувствие, возможна потеря сознания или состояние близкое к обмороку.
Лечение аритмии происходит несколькими способами:
- С помощью антиаритмических препаратов. Сюда входят препараты, влияющие на ионные каналы и лекарства, действующие на проводящую систему сердца. Недостатком такого лечения является большое число побочных эффектов.
- Апстрим терапия — лечение препаратами, не являющимися антиаритмическими. Недостатки аналогичны первому пункту.
- Установка кардиостимулятора. Из минусов такого лечения — дороговизна прибора.
- Операция от аритмии. Наша клиника предлагает лучших врачей, которые помогут избавиться от нарушений работы сердца.
Возможные осложнения при аритмии
Не вылеченная вовремя болезнь может привести к очень серьёзным последствиям, таким как:
- инсульт.
 Кровоизлияние в мозг может привести к отмиранию части мозга или смерти человека;
Кровоизлияние в мозг может привести к отмиранию части мозга или смерти человека; - сердечная недостаточность, которая может привести к инфаркту миокарда, артериальной гиперэкстензии и другим тяжёлым заболеваниям.
Наша клиника имеет многолетний опыт в лечении аритмии. Наши врачи — квалифицированные специалисты, настоящие профессионалы в своей деятельности. Мы предлагаем только адекватные цены и качественные услуги.
Нарушение ритма сердца (аритмия) | ГУЗ Городская клиническая больница №1
Работа сердца регулируется собственной электрической системой. Она вырабатывает импульсы, по «команде» которых сердечная мышца сокращается. Сокращение начинается, когда синусовый узел — небольшая группа клеток в правом предсердии — посылает электрический импульс, который и заставляет сократиться сначала оба предсердия. Затем импульс перемещается в атрио-вентрикулярный узел, находящийся в самом центре сердца и лежащий в месте перехода предсердий в желудочки. Выходя из атриовентрикулярного узла импульс, переходит на желудочки. В результате чего последние сокращаются и выталкивают кровь ко всем органам.
Выходя из атриовентрикулярного узла импульс, переходит на желудочки. В результате чего последние сокращаются и выталкивают кровь ко всем органам.
В здоровом сердце этот процесс происходит равномерно и постоянно с частотой сокращений сердца 60-80 в минуту в спокойном состоянии. У спортсменов, особенно атлетов с покое частота пульса обычно менее 60, поскольку их сердце значительно более тренировано, чем у обычного человека и обладает большой мышечной силой, выталкивая за одно сокращения большой объем крови. У детей — напротив — пульс в норме более 100 ударов в минуту, а в младенчестве составляет 140-160 сокращений в минуту. Это число может варьировать в зависимости от многих факторов: в покое, во время отдыха ритм урежается, а при физических и психоэмоциональных нагрузках – учащается.
При нарушении функции электрической системы сердца возникает сбой сердечного ритма – аритмия.
Наиболее частыми причинами аритмии или состояния, приводящего к её развитию, являются болезни сердца (ишемическая болезнь сердца, миокардит, миокардиопатии и т. д.), высокое артериальное давление, сахарный диабет, курение, чрезмерное употребление алкоголя и кофеина, злоупотребление лекарственными препаратами, стресс.
д.), высокое артериальное давление, сахарный диабет, курение, чрезмерное употребление алкоголя и кофеина, злоупотребление лекарственными препаратами, стресс.
Необычное увеличение частоты сердечных сокращений называется тахикардией.
Выделяют несколько типов тахикардий. Некоторые виды тахикардий достаточно безопасны, и могут не проявляться годами, лишь изредка напоминая о себе. В то же время другие виды тахиаритмии– такие, как фибрилляция желудочков – вызывают мгновенный обморок и могут привести к смерти.
Одним из основных факторов, повышающих риск возникновения аритмий, является возраст. Так, например, мерцательную аритмию (фибрилляцию предсердий) выявляют у 0,4% людей, при этом большую часть пациентов составляют люди старше 60 лет. Увеличение частоты развития нарушений ритма сердца с возрастом объясняется изменениями, возникающими в миокарде и проводящей системе сердца в процессе старения. Происходит замещение миоцитов фиброзной тканью, развиваются так называемые «склеродегенеративные» изменения. Кроме этого, с возрастом повышается частота сердечно-сосудистых и экстракардиальных заболеваний, что также увеличивает вероятность возникновения аритмий.
Кроме этого, с возрастом повышается частота сердечно-сосудистых и экстракардиальных заболеваний, что также увеличивает вероятность возникновения аритмий.
Аритмии могут и не проявляться. Врач может обнаружить аритмию до того, как она проявит себя какими-либо признаками, при обычном диспансерном обследовании. Но чаще нарушения сердечного ритма вызывают заметные изменения состояния, которые включают признаки:
- Ощущение сердцебиения и перебоев в груди
- Очень быстрое биение сердца
- Чрезвычайно медленное биение сердца
- Боли в груди
- Одышку
- Головокружение
- Потерю сознания или ощущение, близкое к обмороку
Даже такие значительные симптомы нездоровья не всегда свидетельствуют о наличии серьезной проблемы. Очень часто люди, ощущающие аритмию, не страдают тяжелыми заболеваниями сердца, в то время как, человек с жизнеугрожающей аритмией может не предъявлять вообще никаких жалоб.
Наиболее привычным методом диагностики аритмии на сегодня является проведение электрокардиографии (ЭКГ). Во время записи ЭКГ электроды прикрепленные к определенным местам на руках, ногах и грудной клетке, регистрируют электрическую активность сердца. На электрокардиограмме изучают интервалы и длительность каждой фазы сокращения сердца.
Во время записи ЭКГ электроды прикрепленные к определенным местам на руках, ногах и грудной клетке, регистрируют электрическую активность сердца. На электрокардиограмме изучают интервалы и длительность каждой фазы сокращения сердца.
Для длительного контроля ритма сердца применятся суточное мониторирование электрокардиографии (холтер), который позволяет регистрировать ЭКГ на протяжении более длительного промежутка времени.Портативный регистратор ЭКГ устанавливается на сутки и более для записи электрической активности сердца в процессе выполнения человеком его обычной дневной активности, а также во время сна.
Если же и этот метод не дает достаточной информации, то, по решению врача, для выявления нарушения сердечного ритма используется электрофизиологическое исследование сердца (ЭФИ).
ЭФИ на сегодняшний день – это наиболее достоверный метод диагностики нарушений сердечного ритма и оценки аритмии. Данный метод обследования помогает врачу выбрать необходимую тактику лечения.
Эхокардиография позволяет при помощи ультразвукового датчика получить изображение камер сердца, уточнить их размеры, движение стенок и клапанов и другую информацию.
Существует несколько способов лечения аритмии. Выбор метода осуществляет врач после тщательного изучения результатов исследований.
- прием лекарственных препаратов;
- имплантация электрокардиостимулятора (ЭКС);
- имплантациякардиовертера-дефибриллятора;
- Хирургическое лечение.
Для точного диагноза, оценки риска и выбора лечения необходимы тщательное обследование и консультация специалиста!
Ряд нарушений ритма сердца может повышать риск развития таких состояний и заболеваний, как:
- Инсульт. Когда возникает такое нарушение ритма как фибрилляция предсердий, то предсердия сердца не способны адекватно перекачивать кровь в желудочки. Замедление тока крови в предсердиях приводит к формированию сгустков крови (тромбов).
 Тромб может попадать в ток крови, разносится по всему организму, в том числе и в мозговые артерии, вызывая развитие инсульта, т.е. повреждения или гибели части мозга, а иногда приводит к смерти.
Тромб может попадать в ток крови, разносится по всему организму, в том числе и в мозговые артерии, вызывая развитие инсульта, т.е. повреждения или гибели части мозга, а иногда приводит к смерти. - Застойная сердечная недостаточность. Из-за длительного периода брадикардии или тахикардии, например, фибрилляции предсердий, сердце может сокращаться неэффективно.
Антиаритмические препараты (лекарства от аритмии)
Заказать антиаритмические препараты
На нашем сайте можно заказать как редкие, так и распространенные антиаритмические препараты по выгодной цене. У нас есть удобная система фильтров, которая производит быстрый подбор лекарств по названию, производителю и действующему веществу. Также на нашем сайте вы с легкостью найдете аналоги к любому препарату.
Благодаря постоянно действующим скидкам и бонусным программам по карте вы сэкономите деньги.
Цена каждого лекарственного средства указана в каталоге товаров на сайте 366.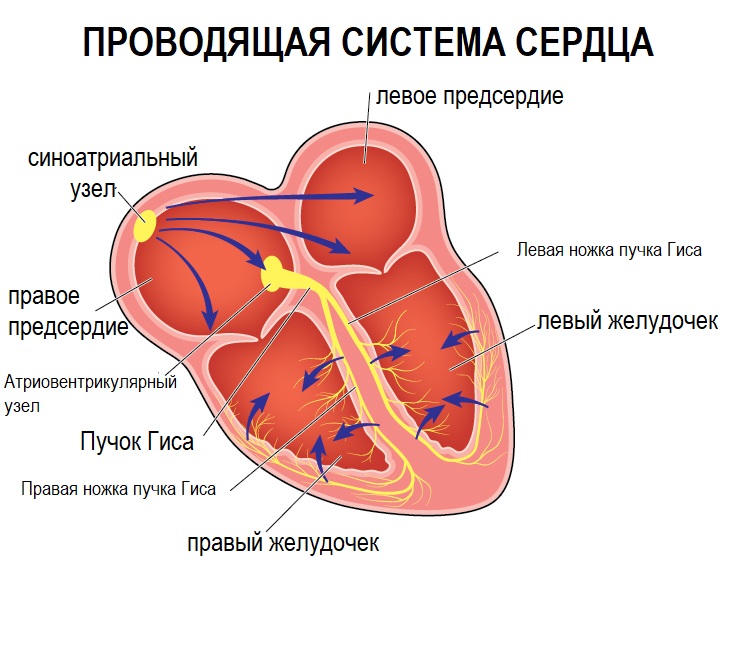 ru, где также имеются инструкции к применению каждого препарата.
ru, где также имеются инструкции к применению каждого препарата.
Показания
Существуют лекарства от аритмии 1 класса, 2 класса и 3 класса. Они отличаются друг от друга по степени воздействия и количеству побочных эффектов.
Чтобы узнать общие показания к применению различных антиаритмических лекарств, изучите представленный ниже список:
- Высокий пульс (тахикардия) и нарушенное сердцебиение;
- Сердечная недостаточность;
- Инфаркт миокарда.
Представленный перечень заболеваний, для лечения которых используют антиаритмические средства, не является полным. Названия всех препаратов данной категории вы найдете в каталоге нашего сайта.
Аритмии сердца являются самой актуальной и сложной проблемой в кардиологии[1] и не могут быть диагностированы самостоятельно, поэтому необходимо обращать к врачу.
Противопоказания
Прежде чем покупать и принимать антиаритмические медикаменты, необходимо ознакомиться с их противопоказаниями к применению, к которым относятся:
- Гиперчувствительность к компонентам препарата;
- Беременность;
- Период лактации;
- Низкий пульс и гипотония.

Также некоторые препараты с осторожностью назначают людям старше 60-70 лет (для пожилых людей их прием чреват побочными эффектами), и тем, у кого имеются заболевания почек. Перед приемом любого препарата пациент должен проконсультироваться с врачом.
Формы выпуска
На нашем сайте можно найти следующие лекарственные формы медикаментов от аритмии и других болезней, связанных с нарушением сердечного ритма:
- Капсулы;
- Таблетки;
- Растворы;
- Концентраты.
Некоторые медикаменты отпускаются только по рецепту. Доставка средств осуществляется более чем в 1200 аптек сети 36.6, расположенных в Москве и Санкт-Петербурге, а также в Московской и Ленинградской областях. Таблетки от аритмии являются наиболее распространенной лекарственной формой данной категории препаратов.
Страны изготовители
На нашем сайте можно заказать доставку в аптеку антиаритмических средств от проверенных производителей, изготовленных в различных странах.
У нас имеются следующие препараты:
- Российские;
- Латвийские;
- Чешские;
- Венгерские;
- Белорусские.
Представленный список не является полным. Подробную информацию о производителях, показаниях и противопоказаниях к использованию медикаментов вы найдете на официальном сайте 366.ru.
ПЕРЕД ПРИМЕНЕНИЕМ ПРЕПАРАТОВ НЕОБХОДИМО ОЗНАКОМИТЬСЯ С ИНСТРУКЦИЕЙ ПО ПРИМЕНЕНИЮ ИЛИ ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
Список литературы:
- [i] Шпак Л.В., «Нарушения сердечного ритма и проводимости, их диагностика и лечение» 2010 г.
Аритмия сердца – факторы риска, диагностика и лечение болезни
Аритмии, или нарушение ритма сердца – это нарушение частоты, ритмичности и последовательности сокращения сердечной мышцы. В норме у человека в состоянии покоя частота сердечных сокращений составляет 60-80 в минуту, при этом сокращения происходят через одинаковый промежуток времени – 1 секунду, последовательно сокращаются сначала предсердия, затем желудочки сердца. Происходит это благодаря проводящей системе сердца (нервные волокна).
Происходит это благодаря проводящей системе сердца (нервные волокна).
Существует множество классификаций аритмий. Условно их можно разделить на:
- Тахикардии – учащенное сердцебиение: синусовая, желудочковая тахикардия, экстрасистолия (внеочередное сокращение сердца) и др.
- Брадикардии – редкое сердцебиение: синусовая брадикардия, синдром слабости синусового узла, синус-арест, CA-блокада, AV-блокада и др.
- Мерцательная аритмия – слабые и частые сокращения предсердий (фибрилляция предсердий), при этом сокращение желудочков неритмичное и может быть частым (тахи-форма), редким (бради-форма) или нормальной частоты.
Также аритмии могут быть постоянные и непостоянные, протекающие приступообразно.
Подробнее о лечении аритмии Вы можете прочитать здесь: https://dr-lukin.ru/uslugi/lechenie-serdechnyh-zabolevanij/lechenie-aritmii/.
Клиническая картина
Часто аритмии могут вообще никак не проявляться и быть «находкой» при обычном диспансерном обследовании. Наиболее часто больные жалуются на:
Наиболее часто больные жалуются на:
- Перебои в работе сердца: ощущение сердцебиения, «замирание» сердца, «то бьется, то не бьется»
- слабость, одышку, плохую переносимость физической нагрузки
- головокружение
- приступы потери сознания или ощущение, близкое к обмороку, которые могут привести к летальному исходу.
Потеря сознания случается, когда происходит остановка сердца на продолжительный период времени, обычно более 5 секунд. Если сердце само «заводится», приступ проходит. Слишком длительная остановка может привести к летальному исходу. Это называется синдром Morgagni-Adams-Stokes (MAS)
Однако, не всегда наличие симптомов нездоровья свидетельствуют о серьезной проблеме. Очень часто люди, ощущающие аритмию, не страдают тяжелыми заболеваниями сердца, в то время как, человек с жизнеугрожающей аритмией может не предъявлять вообще никаких жалоб.
Факторы риска:
- Наследственность
- Различные заболевания сердца
- Сопутствующая патология: заболевания щитовидной железы, сахарный диабет и т.
 д.
д. - Образ жизни: стресс, курение, злоупотребление алкоголем
- Передозировка некоторых лекарственных препаратов.
Необходимо постараться максимально нивелировать факторы риска. Риск аритмии возможно уменьшить, приобщаясь к здоровому образу жизни, включающему правильное питание и занятие спортом. Также важно своевременно проходить диспансерное наблюдение и лечить сопутствующие заболевания.
Диагностика
Диагноз обычно устанавливается по ЭКГ. При необходимости записи ЭКГ в течении длительного времени выполняется суточное мониторирование ЭКГ по Холтеру. Для этого портативный регистратор ЭКГ устанавливается на сутки и более для записи электрической активности сердца в процессе выполнения человеком его обычной дневной активности, а также во время сна. Также возможна имплантация ЭКГ-рекодера – это устройство размером с обычную флэш-карту, которое зашивается под кожу и регистрирует ЭКГ в течении нескольких лет.![]()
В определенных случаях используется электрофизиологическое исследование сердца (ЭФИ). С его помощью можно изучить распространение электрического импульса по сердцу, индуцировать аритмию, изучив при этом ее локализацию, механизм, а также протестировать лечебный эффект различных лекарственных препаратов.
Лечение
Лечение тахикардий обычно консервативное (лекарственная терапия: таблетки, инъекции, капельницы и так далее) и проводится кардиологом. В ряде случаев требуется помощь сердечно-сосудистого хирурга.
Для лечения брадикардий выполняется операция – имплантация электрокардиостимулятора. Операция выполняется под местной анестезией и обычно хорошо переносится пациентами. Продолжительность операции редко превышает 1 час, а весь срок госпитализации составляет 2-3 дня. Но, несмотря на хорошую переносимость и небольшую длительность, данный вид операций является высокотехнологическим методом лечения.
Подробнее об электрокардиостимуляторах Вы можете прочитать в соответствующем разделе сайта: http://dr-lukin. ru/o-boleznyah/elektrokardiostimulyator/.
ru/o-boleznyah/elektrokardiostimulyator/.
Об аритмии | Американская кардиологическая ассоциация
Термин «аритмия» относится к любому изменению нормальной последовательности электрических импульсов. Электрические импульсы могут возникать слишком быстро, слишком медленно или беспорядочно, заставляя сердце биться слишком быстро, слишком медленно или беспорядочно. Когда сердце не бьется должным образом, оно не может эффективно перекачивать кровь. Когда сердце не может эффективно перекачивать кровь, легкие, мозг и все другие органы не могут работать должным образом и могут отключиться или быть повреждены.Посмотреть анимацию аритмии.
Типы аритмий
Нормальное сердце представляет собой мощный мышечный насос размером чуть больше кулака. Он непрерывно перекачивает кровь по кровеносной системе.
Каждый день сердце в среднем бьется (расширяется и сокращается) 100 000 раз и перекачивает около 2000 галлонов крови через тело. За 70 лет жизни среднее человеческое сердце сокращается более 2,5 миллиардов раз.
За 70 лет жизни среднее человеческое сердце сокращается более 2,5 миллиардов раз.Чтобы понять, как перекачивает сердце, узнайте о: Структуре сердца
Посмотреть анимацию анатомии сердечного клапана
Сердце: четыре камеры, четыре клапана
Сердце имеет четыре камеры, две справа и две слева:
- Две верхние камеры называются предсердиями (одна называется предсердием).
- Две нижние камеры называются желудочками.
Сердце также имеет четыре клапана, которые открываются и закрываются, позволяя крови течь только в одном направлении, когда сердце сокращается (сокращается). Четыре сердечных клапана:
- Трехстворчатый клапан, расположенный между правым предсердием и правым желудочком
- Легочный или легочный клапан между правым желудочком и легочной артерией
- Митральный клапан между левым предсердием и левым желудочком
- Аортальный клапан между левым желудочком и аортой
Каждый клапан имеет набор створок (также называемых створками или створками). Митральный клапан имеет две створки; у остальных три. Кровоток возникает только тогда, когда на клапанах есть разница в давлении, которая заставляет их открываться. В нормальных условиях клапаны позволяют крови течь только в одном направлении.
Митральный клапан имеет две створки; у остальных три. Кровоток возникает только тогда, когда на клапанах есть разница в давлении, которая заставляет их открываться. В нормальных условиях клапаны позволяют крови течь только в одном направлении.
Сердце перекачивает кровь к легким и ко всем тканям тела за счет последовательности высокоорганизованных сокращений четырех камер. Чтобы сердце функционировало должным образом, четыре камеры должны биться организованно.
Электрическая система сердца
Электрические сигналы управления насосом
Сердцебиение (сокращение) начинается, когда через него проходит электрический импульс от синоатриального узла (также называемого СА-узлом или синусовым узлом).Узел SA иногда называют «естественным кардиостимулятором» сердца, потому что он инициирует импульсы для сердцебиения.
Нормальная электрическая последовательность начинается в правом предсердии и распространяется по предсердиям до атриовентрикулярного (АВ) узла. От АВ-узла электрические импульсы проходят по группе специализированных волокон, называемых системой Гиса-Пуркинье, ко всем частям желудочков.
От АВ-узла электрические импульсы проходят по группе специализированных волокон, называемых системой Гиса-Пуркинье, ко всем частям желудочков.
Чтобы сердце работало правильно, необходимо следовать именно этому маршруту. Пока электрический импульс передается нормально, сердце работает в обычном ритме.У взрослого нормальное сердце бьется от 60 до 100 раз в минуту.
Электрокардиография (ЭКГ или ЭКГ) — это безболезненная неинвазивная процедура, которая регистрирует электрическую активность сердца и может помочь в диагностике аритмий.
Нарушения сердечного ритма (аритмии)
Аритмии – это аномальные сокращения. Термин «аритмия» относится к любому изменению нормальной последовательности электрических импульсов, вызывающему аномальные сердечные ритмы. Аритмии могут быть совершенно безвредными или опасными для жизни.
Некоторые аритмии настолько кратковременны (например, временная пауза или преждевременное сердцебиение), что общая частота сердечных сокращений или ритм не оказывают существенного влияния. Но если аритмии длятся дольше, они могут привести к тому, что частота сердечных сокращений станет слишком медленной или слишком быстрой, или сердечный ритм станет неустойчивым, поэтому сердце работает менее эффективно.
Но если аритмии длятся дольше, они могут привести к тому, что частота сердечных сокращений станет слишком медленной или слишком быстрой, или сердечный ритм станет неустойчивым, поэтому сердце работает менее эффективно.
- Учащенное сердцебиение (у взрослых более 100 ударов в минуту) называется тахикардией.
- Медленный сердечный ритм (менее 60 ударов в минуту) называется брадикардией.
Причины
- В норме наиболее быстро возбуждающиеся клетки сердца находятся в синусовом (или синоатриальном, или СА) узле, что делает эту область естественным водителем ритма.
- При некоторых условиях почти все ткани сердца могут инициировать импульс типа, который может генерировать сердцебиение.
- Клетки проводящей системы сердца могут автоматически срабатывать и запускать электрическую активность. Эта деятельность может нарушить нормальный порядок насосной деятельности сердца.
- Вторичные кардиостимуляторы в другом месте сердца обеспечивают «резервный» ритм, когда синусовый узел не работает должным образом или когда импульсы блокируются где-то в проводящей системе.

Аритмия возникает, когда:
- Естественный водитель ритма сердца развивает ненормальную частоту или ритм.
- Нормальный проводящий путь прерван.
- Другая часть сердца берет на себя функции кардиостимулятора.
Аритмия | Проблемы с сердечным ритмом
Аритмия — это когда ваше сердце бьется слишком быстро, слишком медленно или в неравномерном, нерегулярном ритме.Узнайте о различных типах аритмий, о том, как они диагностируются и лечатся.
В вашем сердце есть электрическая система, которая посылает сообщения сердечной мышце, сообщая ей, когда нужно прогонять кровь по всему телу. Это сердцебиение.
У большинства людей сердце бьется с постоянной частотой от 60 до 100 раз в минуту. Это называется синусовым ритмом .
Если у вас проблемы с электрической системой сердца, сообщения сердечной мышце не поступают в нужное время.Это может заставить ваше сердце биться слишком быстро или слишком медленно, или неравномерно.
Это аритмия . Вы также можете услышать, что это называется ненормальным сердечным ритмом, нерегулярным сердцебиением или проблемой сердечного ритма.
Распространенные виды аритмии
Существует несколько основных типов аритмий или нарушений сердечного ритма.
- Учащенное сердцебиение (тахикардия).
- Замедленное сердцебиение (брадикардия).
- Нерегулярное сердцебиение.
Наиболее распространенным видом нарушения сердечного ритма является фибрилляция предсердий (ФП), которая вызывает нерегулярный и часто быстрый сердечный ритм.
Существует ряд других видов аритмии.
Наджелудочковая тахикардия (СВТ) — сердечная аритмия, которая начинается в верхней части сердца, над нижними камерами (желудочками). При СВТ частота сердечных сокращений резко возрастает до более чем 100 ударов в минуту. Это может произойти, когда вы отдыхаете или тренируетесь.
Трепетание предсердий — это учащенное сердцебиение, которое начинается в верхних камерах сердца (предсердиях). При трепетании предсердий ваши предсердия часто сокращаются с частотой до 300 ударов в минуту.Ритм может быть правильным или нерегулярным. Это часто происходит у людей, у которых также есть фибрилляция предсердий.
При трепетании предсердий ваши предсердия часто сокращаются с частотой до 300 ударов в минуту.Ритм может быть правильным или нерегулярным. Это часто происходит у людей, у которых также есть фибрилляция предсердий.
Желудочковая тахикардия — это учащенное сердцебиение, которое начинается в нижних камерах сердца (желудочках). Эпизод ЖТ может начаться очень быстро и длиться всего несколько секунд или минут или продолжаться дольше. Иногда ЖТ прекращается сама по себе, но если она продолжается, ее необходимо лечить как можно скорее, поскольку она подвергает вас риску остановки сердца.
Фибрилляция желудочков — чрезвычайно быстрый, опасный для жизни сердечный ритм, который заставляет сердце «дрожать», а не перекачивать кровь по всему телу.Это может вызвать остановку сердца.
Синдром удлиненного интервала QT, синдром Бругада и синдром Вольфа-Паркинсона-Уайта (WPW) — это сердечные заболевания, которые вызывают быстрое, нерегулярное сердцебиение. Это может привести к обморокам или иногда к остановке сердца.
Это может привести к обморокам или иногда к остановке сердца.
Блокада сердца происходит, когда электрические сигналы, которые заставляют ваше сердце биться, задерживаются или блокируются. Это заставляет ваше сердце работать с медленным ритмом менее 60 ударов в минуту. Типы сердечных блокад включают атриовентрикулярную (АВ) блокаду сердца и блокаду ножек пучка Гиса.
Синдром тахибрадии (синдром слабости синусового узла) — это проблема с синусовым узлом сердца (иногда его называют естественным водителем сердечного ритма). Он включает в себя периоды очень быстрых или очень медленных сердечных сокращений.
Эктопические сокращения сердца — это когда ваше сердце пропускает один удар или добавляет дополнительный удар. Обычно они несерьезны, однако, если они происходят регулярно или вы плохо себя чувствуете, обратитесь к врачу.
Является ли сердечная аритмия серьезной?
У людей со здоровым сердцем время от времени могут возникать безопасные нерегулярные сердечные ритмы. Однако нерегулярное сердцебиение может быть признаком сердечного заболевания. Важно регулярно проверять свой пульс. Если вы заметили, что он не бьется нормально, обратитесь к врачу.
Однако нерегулярное сердцебиение может быть признаком сердечного заболевания. Важно регулярно проверять свой пульс. Если вы заметили, что он не бьется нормально, обратитесь к врачу.
Узнайте, как проверить свой пульс.
Что вызывает аритмии?
Существует множество вещей, которые могут вызвать нерегулярный сердечный ритм или частоту сердечных сокращений. К ним могут относиться:
- повреждение сердца в результате других сердечных заболеваний. Заболевания сердца, такие как сердечный приступ, кардиомиопатия, сердечная недостаточность и высокое кровяное давление, могут повредить сердечную ткань, что приведет к нарушениям сердечного ритма
- врожденные пороки сердца. Некоторые аритмии вызваны врожденными заболеваниями сердца
- другими заболеваниями , такими как гипертиреоз и синдром обструктивного апноэ во сне
- старение. Когда вы становитесь старше, ваши электрические пути не всегда работают так хорошо
- лекарства.
 Некоторые безрецептурные и отпускаемые по рецепту лекарства могут вызывать аритмии у некоторых людей
Некоторые безрецептурные и отпускаемые по рецепту лекарства могут вызывать аритмии у некоторых людей - стимуляторы , такие как алкоголь, табак и некоторые запрещенные наркотики, принимаемые в больших количествах в течение длительного периода времени, могут вызывать аритмии у некоторых людей
- избыточный вес.
Что может вызвать аритмию?
Если у вас проблемы с нерегулярным сердцебиением, которые приходят и уходят (пароксизмальная аритмия), вы обнаружите, что есть определенные факторы, которые могут спровоцировать приступ. Общие триггеры включают:
- усталость
- алкоголь
- никотин (как в сигаретах, так и в электронных сигаретах)
- кофеин
- другие не связанные болезни, такие как простуда или грипп
- физический или эмоциональный стресс 9002 — счетчик или рецепт.Поговорите со своим врачом, если вы считаете, что лекарства могут вызывать нерегулярное сердцебиение.
 Никогда не прекращайте принимать лекарства, отпускаемые по рецепту, не посоветовавшись предварительно с врачом.
Никогда не прекращайте принимать лекарства, отпускаемые по рецепту, не посоветовавшись предварительно с врачом.
Рекомендуется выяснить, что вызывает проблемы с сердечным ритмом, и по возможности избегать этих триггеров.
У некоторых людей определенные виды упражнений могут вызвать проблемы с сердечным ритмом. Однако полностью прекращать тренировки не следует.
Физическая активность очень важна для здоровья сердца и общего самочувствия.Если вы считаете, что физические упражнения вызывают аритмию, поговорите со своим врачом. Он или она может помочь вам справиться с проблемой и предложить альтернативные виды деятельности, которые могут вам подойти.
Тесты для выявления аритмий
Вы можете измерить частоту сердечных сокращений, измерив пульс. Если вы считаете, что у вас аномальный пульс, важно, чтобы его проверил медицинский работник.
Врачи могут использовать ряд тестов для диагностики аритмии. Сюда могут входить:
- ЭКГ (электрокардиограмма)
- эхокардиография (эхокардиограмма)
- ЭП (электрофизиологическое исследование).

Вы можете узнать больше об этих тестах на нашей странице сердечных тестов.
Как лечить аритмии
Тип лечения аритмии зависит от типа нарушения сердечного ритма и симптомов, которые вы испытываете.
Общие методы лечения аритмий включают:
Ваш врач обсудит с вами план лечения и управления вашим нарушением сердечного ритма.
Жизнь с аритмией
Если у вас недавно диагностировали аритмию, у вас наверняка появилось много вопросов.Вам может быть интересно, насколько серьезно ваше состояние и что оно означает для вашего будущего.
В это время нормально испытывать целый ряд эмоций, включая неуверенность, страх, тревогу и плохое настроение. Поговорите со своим врачом или медсестрой, если это длится дольше нескольких недель.
Вы играете важную роль в долгосрочном управлении своим сердечным ритмом. Хорошее понимание своего состояния и способов его лечения может помочь вам более успешно управлять своим состоянием.
Чтобы справиться со своим состоянием, вы можете:
- определить свои триггеры
- избегать или уменьшить потребление алкоголя
- принимать назначенные лекарства.

- знать, когда обращаться за неотложной помощью
- оставаться активным. Поговорите со своим врачом общей практики или поднесите зеленый рецепт, чтобы помочь вам начать.
Связь с другими
Иногда полезно услышать мнение других людей, страдающих нарушениями сердечного ритма. Вы можете прочитать личные истории людей, которые поделились своим опытом в рамках нашей программы Journeys .Вы найдете истории людей, живущих с аритмиями и другими заболеваниями сердца.
Вы также можете присоединиться к группе кардиологической поддержки в вашем районе или узнать, проводятся ли в вашем местном отделении Heart Foundation какие-либо мероприятия.
Найти группу кардиологической поддержкиПросмотреть события Heart FoundationОбзор аритмий — сердечно-сосудистые заболевания
Прохождение ионов через клеточную мембрану миоцитов регулируется с помощью специфических ионных каналов, которые вызывают циклическую деполяризацию и реполяризацию клетки, называемую потенциалом действия. Потенциал действия рабочего миоцита начинается, когда клетка деполяризуется от своего диастолического трансмембранного потенциала -90 мВ до потенциала около -50 мВ. При этом пороговом потенциале открываются потенциалзависимые быстрые натриевые каналы, вызывая быструю деполяризацию, опосредованную притоком натрия вниз по крутому градиенту концентрации. Быстрый натриевый канал быстро инактивируется, и приток натрия прекращается, но другие зависящие от времени и напряжения ионные каналы открываются, позволяя кальцию проникать через медленные кальциевые каналы (событие деполяризации) и калию выходить через калиевые каналы (событие реполяризации).
Потенциал действия рабочего миоцита начинается, когда клетка деполяризуется от своего диастолического трансмембранного потенциала -90 мВ до потенциала около -50 мВ. При этом пороговом потенциале открываются потенциалзависимые быстрые натриевые каналы, вызывая быструю деполяризацию, опосредованную притоком натрия вниз по крутому градиенту концентрации. Быстрый натриевый канал быстро инактивируется, и приток натрия прекращается, но другие зависящие от времени и напряжения ионные каналы открываются, позволяя кальцию проникать через медленные кальциевые каналы (событие деполяризации) и калию выходить через калиевые каналы (событие реполяризации).
Сначала эти 2 процесса уравновешиваются, поддерживая положительный трансмембранный потенциал и продлевая фазу плато потенциала действия. Во время этой фазы кальций, поступающий в клетку, отвечает за электромеханическую связь и сокращение миоцитов. В конце концов приток кальция прекращается, а отток калия увеличивается, вызывая быструю реполяризацию клетки обратно к трансмембранному потенциалу покоя -90 мВ. Будучи деполяризованной, клетка устойчива (рефрактерна) к последующему деполяризующему событию.Первоначально последующая деполяризация невозможна (абсолютный рефрактерный период), а после частичной, но неполной реполяризации последующая деполяризация возможна, но происходит медленно (относительный рефрактерный период).
Будучи деполяризованной, клетка устойчива (рефрактерна) к последующему деполяризующему событию.Первоначально последующая деполяризация невозможна (абсолютный рефрактерный период), а после частичной, но неполной реполяризации последующая деполяризация возможна, но происходит медленно (относительный рефрактерный период).
Существует 2 основных типа сердечной ткани:
Ткани быстрых каналов (рабочие миоциты предсердий и желудочков, система Гиса-Пуркинье) имеют высокую плотность быстрых натриевых каналов и потенциалы действия, характеризующиеся
отсутствие спонтанной диастолической деполяризации (и, следовательно, очень низкая скорость кардиостимулятора)
Очень высокая скорость начальной деполяризации (и, следовательно, высокая скорость проведения)
Потеря рефрактерности, совпадающая с реполяризацией (и, следовательно, короткие рефрактерные периоды и проводят повторяющиеся импульсы на высоких частотах)
Ткани медленных каналов (СА и АВ узлы) имеют низкую плотность быстрых натриевых каналов и потенциалы действия,
Более быстрая спонтанная диастолическая деполяризация (и, следовательно, более быстрая частоты кардиостимулятора)
Медленн.

Потеря рефрактерности, отсроченная после реполяризации (и, следовательно, длительные рефрактерные периоды и неспособность проводить повторяющиеся высокочастотные импульсы)
В норме СА-узел имеет самая высокая скорость спонтанной диастолической деполяризации, поэтому ее клетки продуцируют спонтанные потенциалы действия с большей частотой, чем клетки других тканей.Таким образом, узел SA является доминирующей автоматической тканью (водителем ритма) в нормальном сердце. Если СА-узел не производит импульсы, ткань со следующей по величине скоростью автоматизма, как правило, АВ-узел, функционирует как водитель ритма. Симпатическая стимуляция увеличивает частоту разрядов ткани водителя ритма, а парасимпатическая стимуляция снижает ее. Существует внутренний натриево-калиевый ток, называемый «забавным током», который проходит через активированный гиперполяризацией циклический нуклеотид-управляемый канал (HCN-канал) в клетках синусового узла, что объясняет большую часть их автоматизма. Ингибирование этого тока увеличивает время, необходимое для достижения критической спонтанной деполяризации клеток водителя ритма, и, таким образом, снижает частоту сердечных сокращений.
Ингибирование этого тока увеличивает время, необходимое для достижения критической спонтанной деполяризации клеток водителя ритма, и, таким образом, снижает частоту сердечных сокращений.
Электроиммунология и сердечная аритмия | Nature Reviews Cardiology
Адабаг А.С., Люпкер Р.В., Роджер В.Л. и Герш Б.Дж. Внезапная сердечная смерть: эпидемиология и факторы риска. Нац. Преподобный Кардиол. 7 , 216–225 (2010).
ПабМед ПабМед Центральный Статья Google Scholar
Бирн, Р. и др. Заболеваемость и этиология внебольничной внезапной сердечной смерти среди сельского населения на западе Ирландии. евро. Heart J. 29 , 1418–1423 (2008).
ПабМед Статья Google Scholar
Далия А.А. и др. Описательный обзор для анестезиологов Руководства Американской кардиологической ассоциации/Американского колледжа кардиологов/Общества сердечного ритма 2017 года по ведению пациентов с желудочковыми аритмиями и профилактике внезапной сердечной смерти. Дж. Кардиоторак. Васк. Анест. 33 , 1722–1730 (2019).
Дж. Кардиоторак. Васк. Анест. 33 , 1722–1730 (2019).
ПабМед Статья Google Scholar
Vaillancourt, C., Stiell, I.G. и канадская группа по исследованию сердечно-сосудистых исходов. Помощь при остановке сердца и неотложная медицинская помощь в Канаде. Кан. Дж. Кардиол. 20 , 1081–1090 (2004).
ПабМед Google Scholar
Чу, С. С. и др. Текущее бремя внезапной сердечной смерти: наблюдение из нескольких источников в сравнении с ретроспективным обзором на основе свидетельств о смерти в большом сообществе США. Дж. Ам. Сб. Кардиол. 44 , 1268–1275 (2004).
ПабМед Статья Google Scholar
Nichol, G. et al. Региональные различия в частоте и исходе внебольничной остановки сердца. JAMA 300 , 1423–1431 (2008 г.).
КАС пабмед ПабМед Центральный Статья Google Scholar

Bloom, H.L. et al. Долгосрочная выживаемость после успешной госпитальной реанимации при остановке сердца. утра. Heart J. 153 , 831–836 (2007).
ПабМед ПабМед Центральный Статья Google Scholar
Ян С. и др. Глобальная выживаемость среди взрослых пациентов с внебольничной остановкой сердца, получивших сердечно-легочную реанимацию: систематический обзор и метаанализ. Крит. Уход Лонд. англ. 24 , 61 (2020).
Артикул Google Scholar
Ивасаки Ю., Нисида К., Като Т. и Наттел С. Патофизиология мерцательной аритмии: последствия для лечения. Тираж 124 , 2264–2274 (2011).
КАС пабмед Статья Google Scholar
Chugh, S. S. et al.Эпидемиология мерцательной аритмии во всем мире: исследование глобального бремени болезни, 2010 г. Тираж 129 , 837–847 (2014).
Тираж 129 , 837–847 (2014).
ПабМед Статья Google Scholar
Naccarelli, G.V., Varker, H., Lin, J. & Schulman, K.L. Увеличение распространенности мерцательной аритмии и трепетания в Соединенных Штатах. утра. Дж. Кардиол. 104 , 1534–1539 (2009).
ПабМед Статья Google Scholar
Jousset, F., Maguy, A., Rohr, S. & Kucera, J.P. Миофибробласты, электротонически связанные с кардиомиоцитами, изменяют проводимость: выводы на клеточном уровне из подробной модели структуры ткани in silico. Перед. Физиол. 7 , 496 (2016).
ПабМед ПабМед Центральный Статья Google Scholar
Клабунде Р.Э. Электрофизиология сердца: нормальные и ишемические ионные токи и ЭКГ. Доп. Физиол. Образовательный 41 , 29–37 (2017).
ПабМед Статья Google Scholar

Kohl, P. & Gourdie, R.G. Электротоническая связь фибробластов и миоцитов: происходит ли она в нативной сердечной ткани? Дж. Мол. Клетка. Кардиол. 70 , 37–46 (2014).
КАС пабмед ПабМед Центральный Статья Google Scholar
Меджитов Р. и Джейнвей С.А. Врожденный иммунитет: достоинства неклональной системы распознавания. Cell 91 , 295–298 (1997).
КАС пабмед Статья Google Scholar
Хоффманн Дж. и Акира С. Врожденный иммунитет. Курс. мнение Иммунол. 25 , 1–3 (2013).
КАС пабмед Статья Google Scholar
Кумар, Х., Каваи, Т. и Акира, С. Распознавание патогенов врожденной иммунной системой. Междунар. Преподобный Иммунол. 30 , 16–34 (2011).
КАС пабмед Статья Google Scholar

Sirisinha, S. Взгляд на механизмы, регулирующие иммунный гомеостаз в норме и при болезни. Азиатский пакет. Дж. Аллергия Иммунол. 29 , 1–14 (2011).
КАС пабмед Google Scholar
Coillard, A. & Segura, E. Дифференцировка моноцитов человека in vivo. Перед. Иммунол. 10 , 1907 (2019).
КАС пабмед ПабМед Центральный Статья Google Scholar
Auffray, C. et al. Мониторинг сосудов и тканей популяцией моноцитов с патрулирующим поведением. Наука 317 , 666–670 (2007).
КАС пабмед Статья Google Scholar
Карлин Л.М. и др. Nr4a1-зависимые моноциты Ly6C low контролируют эндотелиальные клетки и управляют их удалением. Cell 153 , 362–375 (2013).
КАС пабмед ПабМед Центральный Статья Google Scholar

Heidt, T. et al. Дифференциальный вклад моноцитов в макрофаги сердца в стационарном состоянии и после инфаркта миокарда. Обр. Рез. 115 , 284–295 (2014).
КАС пабмед ПабМед Центральный Статья Google Scholar
Пинто, А. Р. и др. Пересмотр клеточного состава сердца. Обр. Рез. 118 , 400–409 (2016).
КАС пабмед Статья Google Scholar
Литвинюкова М. и др. Клетки сердца взрослого человека. Природа 588 , 466–472 (2020).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Bajpai, G. et al. Человеческое сердце содержит различные подмножества макрофагов с различным происхождением и функциями. Нац. Мед. 24 , 1234–1245 (2018).
КАС пабмед ПабМед Центральный Статья Google Scholar

Epelman, S. et al. Эмбриональные и взрослые резидентные сердечные макрофаги поддерживаются с помощью различных механизмов в стационарном состоянии и во время воспаления. Иммунитет 40 , 91–104 (2014).
КАС пабмед ПабМед Центральный Статья Google Scholar
Leid, J. et al. Примитивные эмбриональные макрофаги необходимы для коронарного развития и созревания. Обр. Рез. 118 , 1498–1511 (2016).
КАС пабмед ПабМед Центральный Статья Google Scholar
Мартини, Э. и др. Одноклеточное секвенирование иммунного инфильтрата сердца мыши при сердечной недостаточности, вызванной перегрузкой давлением, показывает степень активации иммунитета. Тираж 140 , 2089–2107 (2019).
КАС пабмед Статья Google Scholar
Dick, S. A. et al. Самообновляющиеся резидентные сердечные макрофаги ограничивают неблагоприятное ремоделирование после инфаркта миокарда. Нац. Иммунол. 20 , 29–39 (2019).
A. et al. Самообновляющиеся резидентные сердечные макрофаги ограничивают неблагоприятное ремоделирование после инфаркта миокарда. Нац. Иммунол. 20 , 29–39 (2019).
КАС пабмед Статья Google Scholar
Skelly, D. A. et al. Профилирование транскрипции отдельных клеток выявляет клеточное разнообразие и взаимосвязь в сердце мыши. Cell Rep. 22 , 600–610 (2018).
КАС пабмед Статья Google Scholar
Cahalan, M.D. & Chandy, K.G. Функциональная сеть ионных каналов в Т-лимфоцитах. Иммунол. 231 , 59–87 (2009).
КАС пабмед ПабМед Центральный Статья Google Scholar
Чен, Ю.-Дж., Нгуен, Х.М., Маэдзава, И., Джин, Л.-В. & Wulff, H. Ингибирование калиевого канала Kv1.3 уменьшает инфаркт и воспаление при ишемическом инсульте. Энн. клин. Перевод Нейрол. 5 , 147–161 (2018).
Энн. клин. Перевод Нейрол. 5 , 147–161 (2018).
КАС пабмед Статья Google Scholar
Ди, Л. и др. Ингибирование канала K + K Ca 3.1 облегчает Т-клеточно-опосредованный колит. Проц. Натл акад. науч. США 107 , 1541–1546 (2010).
КАС пабмед ПабМед Центральный Статья Google Scholar
Gallin, E.K. & Gallin, J.I. Взаимодействие хемотаксических факторов с макрофагами человека. Индукция изменений трансмембранного потенциала. J. Cell Biol. 75 , 277–289 (1977).
КАС пабмед ПабМед Центральный Статья Google Scholar
Галлин, Э. К. и Ливенгуд, Д. Р. Нелинейные отношения ток-напряжение в культивируемых макрофагах. J. Cell Biol. 85 , 160–165 (1980).
КАС пабмед Статья Google Scholar

Маккензи, А.Б., Чираккал, Х. и Норт, Р.А. Калиевые каналы Kv1.3 в альвеолярных макрофагах человека. утра. Дж. Физиол. Легочная клетка. Мол. Физиол. 285 , L862–L868 (2003 г.).
КАС пабмед Статья Google Scholar
Hulsmans, M. et al. Макрофаги облегчают электрическую проводимость в сердце. Cell 169 , 510–522.e20 (2017).
КАС пабмед ПабМед Центральный Статья Google Scholar
Rink, T.J., Montecucco, C., Hesketh, T.R. & Tsien, R.Y. Мембранный потенциал лимфоцитов, оцененный с помощью флуоресцентных зондов. Биохим. Биофиз. Acta 595 , 15–30 (1980).
КАС пабмед Статья Google Scholar
Мелло де Кейрос, Ф., Понте, К.Г., Бономо, А., Вианна-Хорхе, Р. и Суарес-Куртц, Г. Изучение мембранного потенциала в субпопуляциях Т-лимфоцитов с использованием проточной цитометрии.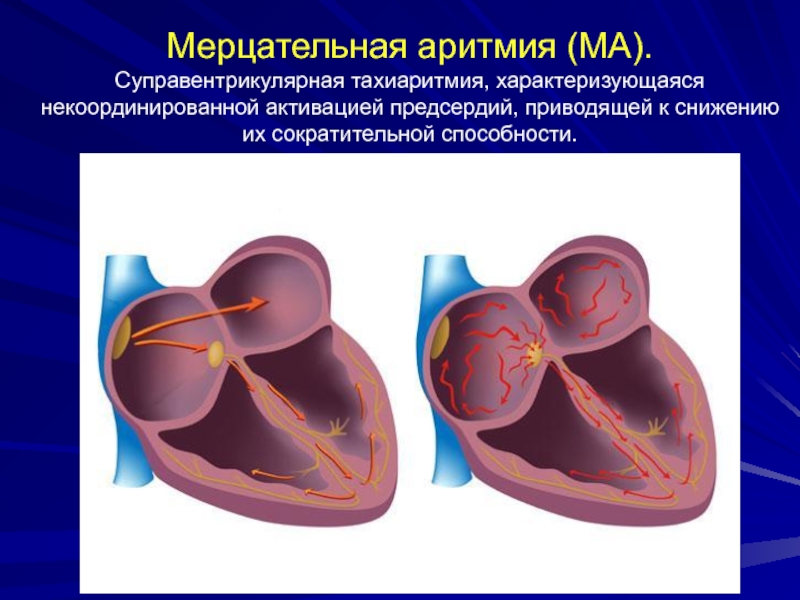 ВМС Иммунол. 9 , 63 (2008).
ВМС Иммунол. 9 , 63 (2008).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Галлин Э. К., Видерхольд М. Л., Липский П. Э. и Розенталь А. С. Спонтанная и индуцированная гиперполяризация мембран макрофагов. Дж. Сотовый. Физиол. 86 , 653–661 (1975).
ПабМед Статья Google Scholar
Кахалан, М. Д., Чанди, К. Г., ДеКурси, Т. Е. и Гупта, С. Потенциалзависимый калиевый канал в Т-лимфоцитах человека. J. Physiol. 358 , 197–237 (1985).
КАС пабмед ПабМед Центральный Статья Google Scholar
Vicente, R. et al. Ассоциация Kv1.5 и Kv1.3 вносит вклад в основной потенциалзависимый К+-канал в макрофагах. Дж. Биол. хим. 281 , 37675–37685 (2006 г.).
КАС Статья Google Scholar

Вильялонга, Н. и др. Гетеромерные каналы Kv1.3/Kv1.5 нарушают фармакологический ответ в макрофагах. Биохим. Биофиз. Рез. коммун. 352 , 913–918 (2007).
КАС Статья Google Scholar
Вильялонга, Н. и др. Иммуномодуляция потенциалзависимых каналов K + в макрофагах: молекулярные и биофизические последствия. J. Gen. Physiol. 135 , 135–147 (2010).
КАС пабмед ПабМед Центральный Статья Google Scholar
Xia, X.M. et al. Механизм блокировки кальция в калиевых каналах, активируемых кальцием, с малой проводимостью. Природа 395 , 503–507 (1998).
КАС пабмед Статья Google Scholar
Леонард Р. Дж., Гарсия М. Л., Слотер Р. С. и Рубен Дж. П. Селективные блокаторы потенциалзависимых каналов К + деполяризуют Т-лимфоциты человека: механизм антипролиферативного действия харибдотоксина.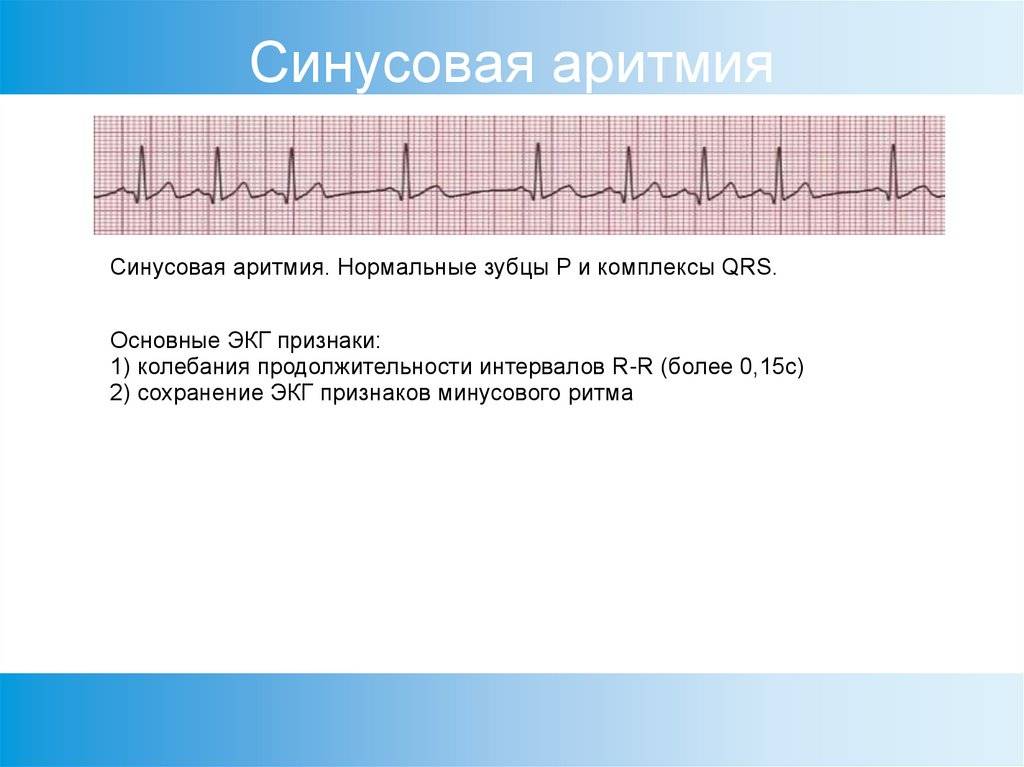 Проц. Натл акад. науч. США 89 , 10094–10098 (1992).
Проц. Натл акад. науч. США 89 , 10094–10098 (1992).
КАС пабмед ПабМед Центральный Статья Google Scholar
Ганшани, С. и др. Повышающая регуляция калиевого канала IKCa1 во время активации Т-клеток.Молекулярный механизм и функциональные последствия. Дж. Биол. хим. 275 , 37137–37149 (2000).
КАС пабмед Статья Google Scholar
Launay, P. et al. TRPM4 регулирует колебания кальция после активации Т-клеток. Наука 306 , 1374–1377 (2004).
КАС пабмед Статья Google Scholar
Luik, R.M., Wang, B., Prakriya, M., Wu, M.M. & Lewis, R.S. Олигомеризация STIM1 связывает истощение кальция в ER с активацией канала CRAC. Природа 454 , 538–542 (2008).
КАС пабмед ПабМед Центральный Статья Google Scholar

Stathopulos, P.B., Zheng, L., Li, G.-Y., Plevin, M.J. & Ikura, M. Структурное и механистическое понимание STIM1-опосредованной инициации поступления кальция в депо. Cell 135 , 110–122 (2008).
КАС пабмед Статья Google Scholar
Wu, M.M., Buchanan, J., Luik, R.M. & Lewis, R.S. Истощение запасов Ca 2+ вызывает накопление STIM1 в областях ER, тесно связанных с плазматической мембраной. J. Cell Biol. 174 , 803–813 (2006).
КАС пабмед ПабМед Центральный Статья Google Scholar
Feske, S. Дефицит ORAI1 и STIM1 у человека и мышей: роль депо-управляемого проникновения Ca 2+ в иммунную систему и за ее пределы. Иммунол. Ред. 231 , 189–209 (2009).
КАС пабмед Статья Google Scholar

Feske, S., Giltnane, J., Dolmetsch, R., Staudt, L.M. & Rao, A. Генная регуляция, опосредованная кальциевыми сигналами в Т-лимфоцитах. Нац. Иммунол. 2 , 316–324 (2001).
КАС пабмед Статья Google Scholar
Matsumoto, M. et al. Сенсоры кальция STIM1 и STIM2 контролируют регуляторную функцию В-клеток посредством продукции интерлейкина-10. Иммунитет 34 , 703–714 (2011).
КАС пабмед Статья Google Scholar
Cekic, C. & Linden, J. Пуринергическая регуляция иммунной системы. Нац. Преподобный Иммунол. 16 , 177–192 (2016).
КАС пабмед Статья Google Scholar
Baricordi, O.R. et al. АТФ-активируемый канал участвует в митогенной стимуляции Т-лимфоцитов человека. Кровь 87 , 682–690 (1996).
КАС пабмед Статья Google Scholar

Падех, С., Cohen, A. & Roifman, C.M. АТФ-индуцированная активация В-лимфоцитов человека через P2-пуринорецепторы. Дж. Иммунол. 146 , 1626–1632 (1991).
КАС пабмед Google Scholar
Shay, T. & Kang, J. Иммунологический геномный проект и системная иммунология. Тренды Иммунол. 34 , 602–609 (2013).
КАС пабмед ПабМед Центральный Статья Google Scholar
Пикард, К. и др. Мутация STIM1 ассоциирована с синдромом иммунодефицита и аутоиммунитета. Н. англ. Дж. Мед. 360 , 1971–1980 (2009).
КАС пабмед ПабМед Центральный Статья Google Scholar
Cacheux, M. et al. Истощение кардиомиоцит-специфического STIM1 (молекула стромального взаимодействия 1) во взрослом сердце способствует развитию аритмогенных дискордантных альтернаций. Обр.Аритмия. Электрофизиол. 12 , e007382 (2019).
Обр.Аритмия. Электрофизиол. 12 , e007382 (2019).
КАС пабмед ПабМед Центральный Статья Google Scholar
Николас-Авила, Дж. А. и др. Сеть макрофагов поддерживает митохондриальный гомеостаз в сердце. Cell 183 , 94–109.e23 (2020).
ПабМед Статья КАС Google Scholar
Эванс, У. Х. и Мартин, П. Е. М. Щелевые соединения: структура и функция (обзор). Мол. член биол. 19 , 121–136 (2002).
КАС пабмед Статья Google Scholar
Рор, С. Роль щелевых контактов в распространении сердечного потенциала действия. Кардиовасц. Рез. 62 , 309–322 (2004).
КАС пабмед Статья Google Scholar
Jongsma, HJ & Wilders, R. Щелевые соединения при сердечно-сосудистых заболеваниях. Обр. Рез. 86 , 1193–1197 (2000).
Обр. Рез. 86 , 1193–1197 (2000).
КАС пабмед Статья Google Scholar
Weidmann, S. Электрические константы волокон Пуркинье. J. Physiol. 118 , 348–360 (1952).
КАС пабмед ПабМед Центральный Статья Google Scholar
Ли, К. и Баррес, Б.А. Микроглия и макрофаги в гомеостазе головного мозга и заболеваниях. Нац. Преподобный Иммунол. 18 , 225–242 (2018).
КАС пабмед Статья Google Scholar
Schafer, D. P. et al. Микроглия формирует постнатальные нейронные цепи в зависимости от активности и комплемента. Нейрон 74 , 691–705 (2012).
КАС пабмед ПабМед Центральный Статья Google Scholar
Paolicelli, R.C. et al. Синаптическая обрезка микроглией необходима для нормального развития мозга. Наука 333 , 1456–1458 (2011).
Синаптическая обрезка микроглией необходима для нормального развития мозга. Наука 333 , 1456–1458 (2011).
КАС пабмед Статья Google Scholar
Vainchtein, I.D. et al. Интерлейкин-33, полученный из астроцитов, способствует поглощению синапсов микроглии и развитию нейронной цепи. Наука 359 , 1269–1273 (2018).
КАС пабмед ПабМед Центральный Статья Google Scholar
Миямото, А. и др. Контакт микроглии индуцирует образование синапсов в развивающейся соматосенсорной коре. Нац. коммун. 7 , 12540 (2016).
КАС пабмед ПабМед Центральный Статья Google Scholar
Hagemeyer, N. et al. Микроглия способствует нормальному миелиногенезу и поддержанию предшественников олигодендроцитов во взрослом возрасте. Акта Нейропатол. 134 , 441–458 (2017).
134 , 441–458 (2017).
ПабМед ПабМед Центральный Статья Google Scholar
Паскуаль, О., Бен Ачур, С., Ростэнг, П., Триллер, А. и Бессис, А. Активация микроглии запускает опосредованную астроцитами модуляцию возбуждающей нейротрансмиссии. Проц. Натл акад. науч. США 109 , E197–E205 (2012 г.).
КАС пабмед Статья Google Scholar
Добренис, К. и др. Микроглия человека и мыши экспрессирует connexin36, и между микроглией грызунов и нейронами образуются функциональные щелевые соединения. J. Neurosci. Рез. 82 , 306–315 (2005).
КАС пабмед ПабМед Центральный Статья Google Scholar
Маэдзава И. и Джин Л.-В. Микроглия при синдроме Ретта повреждает дендриты и синапсы за счет повышенного высвобождения глутамата. J. Neurosci. 30 , 5346–5356 (2010).
Neurosci. 30 , 5346–5356 (2010).
КАС пабмед ПабМед Центральный Статья Google Scholar
Vinegoni, C., Aguirre, A.D., Lee, S. & Weissleder, R. Визуализация бьющегося сердца мыши с использованием методов прижизненной микроскопии. Нац. протокол 10 , 1802–1819 (2015).
КАС пабмед ПабМед Центральный Статья Google Scholar
Чен, Т.-В. и другие. Сверхчувствительные флуоресцентные белки для визуализации активности нейронов. Природа 499 , 295–300 (2013).
КАС пабмед ПабМед Центральный Статья Google Scholar
Аренс, М. Б., Оргер, М. Б., Робсон, Д. Н., Ли, Дж. М. и Келлер, П. Дж. Функциональная визуализация всего мозга с клеточным разрешением с использованием световой микроскопии. Нац. Методы 10 , 413–420 (2013).
КАС пабмед Статья Google Scholar
Heeringa, J. et al. Распространенность, заболеваемость и пожизненный риск мерцательной аритмии: исследование в Роттердаме. евро. Heart J. 27 , 949–953 (2006).
ПабМед Статья Google Scholar
Wolf, P.A., Dawber, T.R., Thomas, H.E. & Kannel, W.B. Эпидемиологическая оценка хронической фибрилляции предсердий и риска инсульта: исследование Framingham. Неврология 28 , 973–977 (1978).
КАС пабмед Статья Google Scholar
Odutayo, A. et al. Мерцательная аритмия и риски сердечно-сосудистых заболеваний, заболеваний почек и смерти: систематический обзор и метаанализ. БМЖ 354 , i4482 (2016).
ПабМед Статья Google Scholar
Хейман, Дж., Фойгт Н., Наттел С. и Добрев Д. Клеточная и молекулярная электрофизиология возникновения, поддержания и прогрессирования мерцательной аритмии. Обр. Рез. 114 , 1483–1499 (2014).
КАС пабмед Статья Google Scholar
Workman, A.J., Kane, K.A. & Rankin, A.C. Клеточные основы мерцательной аритмии человека. Сердечный ритм 5 , S1–S6 (2008 г.).
ПабМед ПабМед Центральный Статья Google Scholar
Чжан, Х. и др. Ассоциация оценки системного воспаления с фибрилляцией предсердий: исследование случай-контроль с сопоставлением оценок склонности. Циркуляция сердца и легких. 27 , 489–496 (2018).
ПабМед Статья Google Scholar
Брюинз, П. и др. Активация системы комплемента во время и после операции искусственного кровообращения: послеоперационная активация включает С-реактивный белок и связана с послеоперационной аритмией.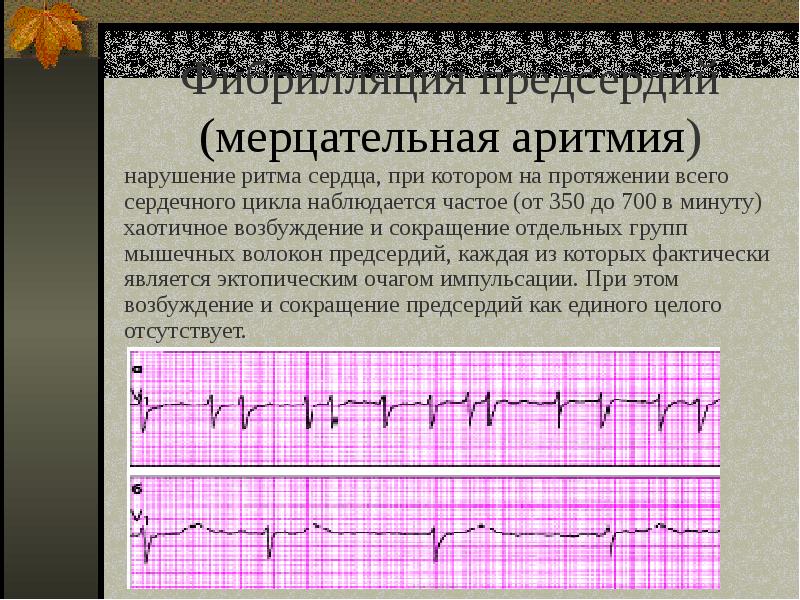 Тираж 96 , 3542–3548 (1997).
Тираж 96 , 3542–3548 (1997).
КАС пабмед Статья Google Scholar
Ху, Ю.-Ф., Чен, Ю.-Дж., Линь, Ю.-Дж. и Чен, С.-А. Воспаление и патогенез мерцательной аритмии. Нац. Преподобный Кардиол. 12 , 230–243 (2015).
КАС Статья Google Scholar
Чен, М.-К.и другие. Повышенная инфильтрация воспалительными клетками миокарда предсердий у больных с фибрилляцией предсердий. утра. Дж. Кардиол. 102 , 861–865 (2008).
ПабМед Статья Google Scholar
Смородинова Н. и др. Анализ популяций иммунных клеток в миокарде предсердий у пациентов с мерцательной аритмией или синусовым ритмом. PLoS ONE 12 , e0172691 (2017).
ПабМед ПабМед Центральный Статья КАС Google Scholar

Абдельхади, Р. Х., Гурм, Х. С., Ван Вагонер, Д. Р. и Чанг, М. К. Связь чрезмерного повышения лейкоцитов после коронарного шунтирования или операции на сердечном клапане с развитием фибрилляции предсердий после операции. утра. Дж. Кардиол. 93 , 1176–1178 (2004).
ПабМед Статья Google Scholar
Yamashita, T. et al. Рекрутирование иммунных клеток через эндокард предсердий при мерцательной аритмии человека. Обр. J. 74 , 262–270 (2010).
КАС пабмед Статья Google Scholar
Frangogiannis, N.G. Регуляция воспалительной реакции при восстановлении сердца. Обр. Рез. 110 , 159–173 (2012).
КАС пабмед ПабМед Центральный Статья Google Scholar
Патель П., Докайниш Х., Цай, П. и Лаккис, Н. Обновленная информация о связи воспаления и мерцательной аритмии. Дж. Кардиовасц. Электрофизиол. 21 , 1064–1070 (2010).
Дж. Кардиовасц. Электрофизиол. 21 , 1064–1070 (2010).
ПабМед Статья Google Scholar
Jacob, K.A. et al. Воспаление при впервые возникшей мерцательной аритмии после операции на сердце: систематический обзор. евро. Дж. Клин. Вкладывать деньги. 44 , 402–428 (2014).
ПабМед Статья Google Scholar
Ху, Ю.-Ф. и другие. Электрофизиологическая корреляция и прогностическое влияние белка теплового шока 27 на фибрилляцию предсердий. Обр. Аритмия. Электрофизиол. 5 , 334–340 (2012).
КАС пабмед Статья Google Scholar
Донг, К. и Райт, Дж. Р. Экспрессия С-реактивного белка альвеолярными макрофагами. Дж. Иммунол. 156 , 4815–4820 (1996).
КАС пабмед Google Scholar

Yasojima, K., Schwab, C., McGeer, E.G. & McGeer, PL. Генерация С-реактивного белка и компонентов комплемента в атеросклеротических бляшках. утра. Дж. Патол. 158 , 1039–1051 (2001).
КАС пабмед ПабМед Центральный Статья Google Scholar
Aviles, R.J. et al. Воспаление как фактор риска фибрилляции предсердий. Тираж 108 , 3006–3010 (2003 г.).
ПабМед Статья Google Scholar
Zhang, Z. et al. n-3 полиненасыщенные жирные кислоты предотвращают мерцательную аритмию, ингибируя воспаление в модели стерильного перикардита у собак. Междунар. Дж. Кардиол. 153 , 14–20 (2011).
ПабМед Статья Google Scholar
Ishii, Y. et al. Воспаление предсердий после кардиохирургических операций связано с неоднородностью предсердной проводимости и мерцательной аритмией. Тираж 111 , 2881–2888 (2005 г.).
Тираж 111 , 2881–2888 (2005 г.).
КАС пабмед Статья Google Scholar
Dernellis, J. & Panaretou, M. Взаимосвязь между концентрациями С-реактивного белка во время терапии глюкокортикоидами и рецидивирующей мерцательной аритмией. евро. Heart J. 25 , 1100–1107 (2004).
КАС пабмед Статья Google Scholar
Хо, К. М. и Тан, Дж. А. Польза и риски профилактики кортикостероидами в кардиохирургии у взрослых: метаанализ доза-реакция. Тираж 119 , 1853–1866 (2009 г.).
КАС пабмед Статья Google Scholar
Джабати, С. и др. Биомаркеры воспаления, тромбогенеза и метаболизма коллагена у пациентов с мерцательной аритмией. клин. заявл. тромб. 24 , 718–723 (2018).
КАС Статья Google Scholar

Hijazi, Z. et al. Биомаркеры воспаления и риск сердечно-сосудистых событий у пациентов с фибрилляцией предсердий, получающих антикоагулянты. Сердце 102 , 508–517 (2016).
КАС пабмед Статья Google Scholar
Мазурек Т. и др. Связь провоспалительной активности эпикардиальной жировой ткани с возникновением мерцательной аритмии. утра. Дж. Кардиол. 113 , 1505–1508 (2014).
ПабМед Статья Google Scholar
Kistler, P. M. et al. Электрические и структурные аномалии предсердий в овечьей модели хронического повышения артериального давления после пренатального воздействия кортикостероидов: значение для развития фибрилляции предсердий. евро. Heart J. 27 , 3045–3056 (2006).
ПабМед Статья Google Scholar
Андраде Дж. , Хайри П., Добрев Д. и Наттел С. Клинический профиль и патофизиология мерцательной аритмии: взаимосвязь между клиническими признаками, эпидемиологией и механизмами. Обр. Рез. 114 , 1453–1468 (2014).
, Хайри П., Добрев Д. и Наттел С. Клинический профиль и патофизиология мерцательной аритмии: взаимосвязь между клиническими признаками, эпидемиологией и механизмами. Обр. Рез. 114 , 1453–1468 (2014).
КАС пабмед Статья Google Scholar
Friedman, P.L., Stewart, J.R. & Wit, A.L. Спонтанные и индуцированные сердечные аритмии в субэндокардиальных волокнах Пуркинье, перенесших обширный инфаркт миокарда у собак. Обр. Рез. 33 , 612–626 (1973).
КАС пабмед Статья Google Scholar
Nuss, H.B., Kääb, S., Kass, D.A., Tomaselli, G.F. & Marbán, E. Клеточная основа желудочковых аритмий и нарушение автоматизма при сердечной недостаточности. утра. Дж. Физиол. 277 , H80–H91 (1999).
КАС пабмед Google Scholar
Морита, Н. , Мандель, В. Дж., Кобаяши, Ю. и Карагеузян, Х. С. Сердечный фиброз как детерминант желудочковых тахиаритмий. J. Аритмия 30 , 389–394 (2014).
, Мандель, В. Дж., Кобаяши, Ю. и Карагеузян, Х. С. Сердечный фиброз как детерминант желудочковых тахиаритмий. J. Аритмия 30 , 389–394 (2014).
Артикул Google Scholar
Anderson, R.D. et al. Фокальные желудочковые тахикардии при структурных заболеваниях сердца: распространенность, характеристики и клинические исходы после катетерной аблации. JACC клин. Электрофизиол. 6 , 56–69 (2020).
ПабМед Статья Google Scholar
Аюб К.Ф., Потинени Н.В.К., Ратленд Дж., Дин З. и Мехта Дж.Л. Иммунитет, воспаление и окислительный стресс при сердечной недостаточности: новые молекулярные мишени. Кардиовасц. Наркотики Тер. 31 , 593–608 (2017).
КАС пабмед Статья Google Scholar
Сингер, М. и др. Третье международное консенсусное определение сепсиса и септического шока (Сепсис-3). JAMA 315 , 801–810 (2016).
JAMA 315 , 801–810 (2016).
КАС пабмед ПабМед Центральный Статья Google Scholar
Ангус, Д. К. и ван дер Полл, Т. Тяжелый сепсис и септический шок. Н. англ. Дж. Мед. 369 , 840–851 (2013).
КАС пабмед Статья Google Scholar
[Нет авторов в списке]. Консенсусная конференция Американского колледжа врачей-пульмонологов/Общества медицины интенсивной терапии: определения сепсиса и органной недостаточности и рекомендации по использованию инновационных методов лечения сепсиса. Крит. Уход Мед. 20 , 864–874 (1992).
Артикул Google Scholar
Льюис О. и др. Заболеваемость, факторы риска и исходы новых наджелудочковых аритмий у афроамериканских пациентов с тяжелым сепсисом. Этн. Дис. 26 , 205–212 (2016).
ПабМед ПабМед Центральный Статья Google Scholar
Walkey, A.J., Wiener, R.S., Ghobrial, J.M., Curtis, L.H. & Benjamin, E.J. Инцидентный инсульт и смертность, связанные с впервые возникшей мерцательной аритмией у пациентов, госпитализированных с тяжелым сепсисом. JAMA 306 , 2248–2254 (2011).
КАС пабмед ПабМед Центральный Статья Google Scholar
Meierhenrich, R. et al. Заболеваемость и прогностическое влияние вновь возникшей фибрилляции предсердий у пациентов с септическим шоком: проспективное обсервационное исследование. Крит. Уход 14 , R108 (2010).
ПабМед ПабМед Центральный Статья Google Scholar
Кристиан, С.-А. и другие. Клинические характеристики и исходы септических пациентов с впервые возникшей мерцательной аритмией. Дж. Крит. Care 23 , 532–536 (2008 г.).
Дж. Крит. Care 23 , 532–536 (2008 г.).
ПабМед Статья Google Scholar
Brathwaite, D. & Weissman, C. Новые проявления предсердных аритмий после крупных несердечно-торакальных операций связаны с повышенной смертностью. Сундук 114 , 462–468 (1998).
КАС пабмед Статья Google Scholar
Launey, Y. et al. Влияние низких доз гидрокортизона на частоту фибрилляции предсердий у пациентов с септическим шоком: когортное исследование, основанное на оценке склонности к обратной вероятности лечения. J. Медицинская интенсивная терапия. 34 , 238–244 (2019).
ПабМед Статья Google Scholar
Oppert, M. et al. Низкие дозы гидрокортизона улучшают купирование шока и снижают уровень цитокинов при раннем гипердинамическом септическом шоке. Крит. Уход Мед. 33 , 2457–2464 (2005).
Крит. Уход Мед. 33 , 2457–2464 (2005).
КАС пабмед Статья Google Scholar
Trappe, H.J. et al. Прогноз у пациентов с желудочковой тахикардией и фибрилляцией желудочков: роль основной этиологии. Дж. Ам. Сб. Кардиол. 12 , 166–174 (1988).
КАС пабмед Статья Google Scholar
Henkel, D.M. et al. Желудочковые аритмии после острого инфаркта миокарда: 20-летнее исследование сообщества. утра. Heart J. 151 , 806–812 (2006).
ПабМед Статья Google Scholar
Хайри, П. и др. Прогностическое значение желудочковых аритмий после инфаркта миокарда. Кан. Дж. Кардиол. 19 , 1393–1404 (2003).
ПабМед Google Scholar
Салерно, Ф. и др. Миокардит и сердечные каналопатии: смертельная ассоциация? Междунар. Дж. Кардиол. 147 , 468–470 (2011).
ПабМед Статья Google Scholar
Ли Х.С., Лигонс Д.Л. и Роуз Н.Р. Генетическая сложность аутоиммунного миокардита. Аутоиммун. 7 , 168–173 (2008).
КАС пабмед Статья Google Scholar
Фентон Ф. Х., Черри Э. М., Гастингс Х. М. и Эванс С.J. Множественные механизмы распада спиральных волн в модели электрической активности сердца. Хаос 12 , 852–892 (2002).
ПабМед Статья Google Scholar
Jalife, J. Фибрилляция желудочков: механизмы возникновения и поддержания. год. Преподобный Физиол. 62 , 25–50 (2000).
КАС пабмед Статья Google Scholar
Курьян Т. К., Ефимов И. Р. Механизмы фибрилляции: нейрогенные или миогенные? Реентерабельный или фокальный? Несколько или один? Все еще озадачивает после 160 лет расследования. Дж. Кардиовасц. Электрофизиол. 21 , 1274–1275 (2010).
ПабМед ПабМед Центральный Статья Google Scholar
Aiba, T. & Tomaselli, G.F. Электрическая модернизация отказавшего сердца. Курс. мнение Кардиол. 25 , 29–36 (2010).
ПабМед ПабМед Центральный Статья Google Scholar
Anderson, M.E. Множественные проаритмические мишени для кальмодулинкиназы II: выход за пределы фокуса, ориентированного на ионный канал. Кардиовасц. Рез. 73 , 657–666 (2007).
КАС пабмед Статья Google Scholar
Янсе, М. Дж. Электрофизиологические изменения при сердечной недостаточности и их связь с аритмогенезом. Кардиовасц. Рез. 61 , 208–217 (2004).
КАС пабмед Статья Google Scholar
Стейнбергер Дж., Лукас Р.В., Эдвардс Дж.Е. и Титус Дж.Л. Причины внезапной неожиданной сердечной смерти в первые два десятилетия жизни. утра. Дж. Кардиол. 77 , 992–995 (1996).
КАС пабмед Статья Google Scholar
Бакси А.Дж., Канаганаягам Г.С. и Прасад С.К. Аритмии при вирусном миокардите и перикардите. Карточка. Электрофизиол. клин. 7 , 269–281 (2015).
ПабМед Статья Google Scholar
Вудрафф Дж. Ф. и Вудрафф Дж. Дж. Участие Т-лимфоцитов в патогенезе болезни сердца вирусом Коксаки В3. Дж. Иммунол. 113 , 1726–1734 (1974).
КАС пабмед Google Scholar
Liu, W. et al. Экспрессия IL-21R на CD8 + Т-клетках способствует активации CD8 + Т-клеток при миокардите, индуцированном вирусом Коксаки B3. Экспл. Мол. Патол. 92 , 327–333 (2012).
КАС пабмед ПабМед Центральный Статья Google Scholar
Лю, В., Муссави, М., Робертс, Б., Бойсон, Дж. Э. и Хубер, С. А. Перекрестная регуляция ответа Т-регуляторных клеток после заражения вирусом Коксаки В3 NKT и γδ Т-клетками у мыши. утра. Дж. Патол. 183 , 441–449 (2013).
КАС пабмед ПабМед Центральный Статья Google Scholar
Tavora, F. et al. Фатальный парвовирусный миокардит: клинический случай и обзор литературы. Диагн.Патол. 3 , 21 (2008).
ПабМед ПабМед Центральный Статья Google Scholar
Gaaloul, I. et al. Посмертная диагностика инфекционных заболеваний сердца: загадочная причина внезапной детской смерти. Судебно-медицинская экспертиза. Междунар. 262 , 166–172 (2016).
ПабМед ПабМед Центральный Статья Google Scholar
Перетто, Г. и др. Желудочковые аритмии при миокардите: характеристика и связь с воспалением миокарда. Дж. Ам. Сб. Кардиол. 75 , 1046–1057 (2020).
ПабМед Статья Google Scholar
Park, H. et al. Повышенное фосфорилирование Ca 2+ , обрабатывающего белки, как проаритмический механизм при миокардите. Обр. J. 78 , 2292–2301 (2014).
КАС пабмед Статья Google Scholar
Сюй, Х.-Ф. и другие. МикроРНК-1 подавляет экспрессию Cx43 при вирусном миокардите. Мол. Клетка. Биохим. 362 , 141–148 (2012).
КАС пабмед Статья Google Scholar
Паски Ж. Л. Может ли лихорадка вызвать фибрилляцию желудочков? Индийская кардиостимуляция Электрофизиол.J. 5 , 139–145 (2005).
ПабМед ПабМед Центральный Google Scholar
Porres, J.M. et al. Лихорадка, разоблачающая синдром Бругада. Клин. Электрофизиол. 25 , 1646–1648 (2002).
ПабМед Статья Google Scholar
Мок, Н.-С. и другие. Недавно охарактеризованная мутация SCN5A, лежащая в основе синдрома Бругада, разоблачается гипертермией. Дж. Кардиовасц. Электрофизиол. 14 , 407–411 (2003).
ПабМед Статья Google Scholar
Dinckal, M.H. et al. Непрекращающаяся мономорфная желудочковая тахикардия при лихорадке у больного с синдромом Бругада: фатальная гроза. Europace 5 , 257–261 (2003).
КАС пабмед Статья Google Scholar
Паски, Дж. Л. и др. Лихорадка как фактор, провоцирующий идиопатическую фибрилляцию желудочков у пациентов с нормальным сердцем. Дж. Кардиовасц. Электрофизиол. 15 , 1271–1276 (2004).
ПабМед Статья Google Scholar
Омори К. и др. Рецидивирующая идиопатическая фибрилляция желудочков, вызванная высокой температурой. утра. Дж. Эмерг. Мед. 33 , 1331.e1–1331.e3 (2015).
Артикул Google Scholar
Кумар, В., Патель, Н., Ван Хаузен, Н. и Саини, Н. Электрокардиографические изменения типа Бругада, вызванные лихорадкой. Тираж 127 , 2145–2146 (2013).
ПабМед Статья Google Scholar
Джаббари Р. и др. Частота и факторы риска фибрилляции желудочков перед первичной ангиопластикой у пациентов с первым инфарктом миокарда с подъемом сегмента ST: общенациональное исследование в Дании. Дж.Являюсь. Сердечный доц. 4 , e001399 (2015).
ПабМед ПабМед Центральный Статья Google Scholar
Карам Н. и др. Выявление пациентов с риском догоспитальной внезапной остановки сердца на ранней стадии инфаркта миокарда: исследование e-MUST (Evaluation en Médecine d’Urgence des Strategies Thérapeutiques des infarctus du myocarde). Тираж 134 , 2074–2083 (2016).
ПабМед Статья Google Scholar
Бхар-Амато Дж., Дэвис В. и Агарвал С. Желудочковая аритмия после острого инфаркта миокарда: «идеальный шторм». Аритмия Электрофизиол. 6 , 134–139 (2017).
Артикул Google Scholar
Mehta, R.H. et al. Частота и исходы, связанные с желудочковой тахикардией или фибрилляцией у пациентов, перенесших первичное чрескожное коронарное вмешательство. JAMA 301 , 1779–1789 (2009 г.).
КАС пабмед Статья Google Scholar
Piccini, J.P., Berger, J.S. & Brown, D.L. Ранние устойчивые желудочковые аритмии, осложняющие острый инфаркт миокарда. утра. Дж. Мед. 121 , 797–804 (2008).
ПабМед Статья Google Scholar
Нарендорф, М.и другие. Заживающий миокард последовательно мобилизует два подмножества моноцитов с расходящимися и взаимодополняющими функциями. Дж. Экспл. Мед. 204 , 3037–3047 (2007).
КАС пабмед ПабМед Центральный Статья Google Scholar
Дан Г. А. Динамический характер инициации желудочковой тахикардии. Drugs Today 46 , 777–783 (2010).
КАС Статья Google Scholar
Уокер, Н.Л., Бертон, Ф.Л., Кеттлвелл, С., Смит, Г.Л. и Коббе, С.М. Картирование эпикардиальной активации в кроличьей модели хронического инфаркта миокарда: ответ на предсердную, эндокардиальную и эпикардиальную стимуляцию. Дж. Кардиовасц. Электрофизиол. 18 , 862–868 (2007).
ПабМед Статья Google Scholar
Марчлински Ф.Е., Ваксман Х.Л., Бакстон А.Е. и Джозефсон М.Е. Устойчивые желудочковые тахиаритмии в раннем постинфарктном периоде: электрофизиологические данные и прогноз выживания. Дж. Ам. Сб. Кардиол. 2 , 240–250 (1983).
КАС пабмед Статья Google Scholar
Verma, A. et al. Взаимосвязь между успешными участками абляции и пограничной зоной рубца, определяемая картированием субстрата для желудочковой тахикардии после инфаркта миокарда. Дж. Кардиовасц. Электрофизиол. 16 , 465–471 (2005).
ПабМед Статья Google Scholar
Монт, Л. и др. Предрасполагающие факторы и прогностическое значение устойчивой мономорфной желудочковой тахикардии в ранний период острого инфаркта миокарда. Дж. Ам. Сб. Кардиол. 28 , 1670–1676 (1996).
КАС пабмед Статья Google Scholar
Gwechenberger, M. et al. Кардиальные миоциты продуцируют интерлейкин-6 в культуре и в жизнеспособной пограничной зоне реперфузированных инфарктов. Тираж 99 , 546–551 (1999).
КАС пабмед Статья Google Scholar
Frangogiannis, N.G. et al. Критическая роль моноцитарного хемоаттрактантного белка-1/СС-хемокинового лиганда 2 в патогенезе ишемической кардиомиопатии. Тираж 115 , 584–592 (2007).
КАС пабмед Статья Google Scholar
Frangogiannis, N.G. Хемокины в ишемизированном миокарде: от воспаления к фиброзу. Воспаление. Рез. 53 , 585–595 (2004).
КАС пабмед Статья Google Scholar
Anzai, A. et al. Инфарктный миокард требует GM-CSF для пагубного избытка воспалительных лейкоцитов. Дж. Экспл. Мед. 214 , 3293–3310 (2017).
КАС пабмед ПабМед Центральный Статья Google Scholar
Bloch Thomsen, P.E. et al. Долгосрочная регистрация сердечных аритмий с помощью имплантируемого кардиомонитора у пациентов со сниженной фракцией выброса после острого инфаркта миокарда: исследование сердечных аритмий и стратификации риска после острого инфаркта миокарда (CARISMA). Тираж 122 , 1258–1264 (2010).
ПабМед Статья Google Scholar
O’Gara, P. T. et al. Руководство ACCF/AHA 2013 г. по лечению инфаркта миокарда с подъемом сегмента ST. Дж. Ам. Сб. Кардиол. 61 , e78–e140 (2013 г.).
ПабМед Статья Google Scholar
Myerburg, R.J., Mitrani, R., Interian, A. & Castellanos, A. Интерпретация результатов антиаритмических клинических испытаний: особенности дизайна и влияние на популяцию. Тираж 97 , 1514–1521 (1998).
КАС пабмед Статья Google Scholar
Тунг, Р., Зиметбаум, П. и Джозефсон, М. Е. Критическая оценка имплантируемого кардиовертера-дефибриллятора для предотвращения внезапной сердечной смерти. Дж. Ам. Сб. Кардиол. 52 , 1111–1121 (2008).
ПабМед Статья Google Scholar
Wang, C. et al. Изменения интерлейкина-1бета и фактора некроза опухоли-альфа ушек правого предсердия у больных с ревматическим поражением клапанов сердца, осложненным хронической фибрилляцией предсердий [кит.]. Чжунхуа Синь Сюэ Гуань Бин За Чжи 33 , 522–525 (2005).
КАС пабмед Google Scholar
Chen, X. et al. Снижение экспрессии γ-рецептора, активируемого пролифератором пероксисом, при гипертонической фибрилляции предсердий. клин. Кардиол. 32 , 337–345 (2009).
ПабМед ПабМед Центральный Статья Google Scholar
Leftheriotis, D.I. et al. Прогностическое значение воспалительных и окислительных маркеров после успешной кардиоверсии персистирующей изолированной фибрилляции предсердий. Междунар. Дж. Кардиол. 135 , 361–369 (2009).
ПабМед Статья Google Scholar
Marcus, G.M. et al. Интерлейкин-6 и мерцательная аритмия у пациентов с ишемической болезнью сердца: данные исследования сердца и души. утра.Heart J. 155 , 303–309 (2008).
КАС пабмед Статья Google Scholar
Henningsen, K.M.A. et al. Прогностическое влияние вч-СРБ и ИЛ-6 у пациентов с персистирующей фибрилляцией предсердий, получавших электрическую кардиоверсию. Скан. Дж. Клин. лаборатория Вкладывать деньги. 69 , 425–432 (2009).
КАС пабмед Статья Google Scholar
Ли, Дж. и др. Роль воспаления и окислительного стресса в фибрилляции предсердий. Ритм сердца 7 , 438–444 (2010).
ПабМед Статья Google Scholar
Wu, N. et al. Повышенные уровни цитокинов, связанных с Th27, в плазме связаны с повышенным риском фибрилляции предсердий. науч. Респ. 6 , 26543 (2016).
КАС пабмед ПабМед Центральный Статья Google Scholar
Фу, X.-X. и другие. Интерлейкин-17А способствует развитию послеоперационной фибрилляции предсердий, регулируя воспаление и фиброз у крыс со стерильным перикардитом. Междунар. Дж. Мол. Мед. 36 , 83–92 (2015).
КАС пабмед ПабМед Центральный Статья Google Scholar
Nikoo, M.H. et al. Повышение IL-17A при мерцательной аритмии коррелирует с соотношением нейтрофилов и лимфоцитов. Иран. Дж. Иммунол. 11 , 246–258 (2014).
ПабМед Google Scholar
Пинто, А. и др. Иммуновоспалительные предикторы инсульта при диспансерном наблюдении у пациентов с хронической неклапанной фибрилляцией предсердий (НВАФ). клин. науч. 116 , 781–789 (2009).
КАС Статья Google Scholar
Вс, З.и другие. Взаимодействия между макрофагами и предсердными миоцитами при мерцательной аритмии. Базовое разрешение Кардиол. 111 , 63 (2016).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Monnerat, G. et al. Зависимая от макрофагов продукция IL-1β вызывает сердечные аритмии у мышей с диабетом. Нац. коммун. 7 , 13344 (2016).
КАС пабмед ПабМед Центральный Статья Google Scholar
El Khoury, N., Mathieu, S. & Fiset, C. Интерлейкин-1β снижает ток L-типа Ca 2+ посредством активации протеинкиназы Cϵ в сердце мыши. Дж. Биол. хим. 289 , 21896–21908 (2014).
КАС пабмед ПабМед Центральный Статья Google Scholar
Де Хесус, Н. М. и др. Антиаритмические эффекты ингибирования интерлейкина 1 после инфаркта миокарда. Ритм сердца 14 , 727–736 (2017).
ПабМед ПабМед Центральный Статья Google Scholar
Ridker, P. M. et al. Противовоспалительная терапия канакинумабом при атеросклеротическом заболевании. Н. англ. Дж. Мед. 377 , 1119–1131 (2017).
КАС Статья Google Scholar
Vasireddi, S., Sattayaprasert, P. & Laurita, K. Воспалительный цитокин интерлейкин-6 оказывает большее влияние на субстраты кальций-опосредованной аритмии по сравнению с интерлейкином-1β [аннотация]. Дж. Ам. Сб. Кардиол. 71 , А412 (2018).
Артикул Google Scholar
Lazzerini, P. E. et al. Системное воспаление быстро вызывает обратимое электрическое ремоделирование предсердий: роль опосредованных интерлейкином-6 изменений в экспрессии коннексина. Дж. Ам. Сердечный доц. 8 , e011006 (2019).
ПабМед ПабМед Центральный Статья Google Scholar
Aromolaran, A.S. et al. Ингибирование hERG интерлейкином-6 лежит в основе риска приобретения удлиненного интервала QT при сердечном и системном воспалении. PLoS ONE 13 , e0208321 (2018).
ПабМед ПабМед Центральный Статья Google Scholar
Lazzerini, P. E. et al. Антиаритмический потенциал антицитокиновой терапии при ревматоидном артрите: тоцилизумаб сокращает скорректированный интервал QT, контролируя системное воспаление. Рес. для ухода за артритом. 67 , 332–339 (2015).
КАС Статья Google Scholar
Сяо Ю.-В. и другие. Rhodiola crenulata уменьшает желудочковую аритмию за счет смягчения активации IL-17 и ингибирования сигнального пути MAPK. Кардиовасц. Наркотики Тер. https://doi.org/10.1007/s10557-020-07072-z (2020 г.).
Артикул пабмед Google Scholar
Лью, Р. и др. Роль фактора некроза опухоли-α в патогенезе фиброза предсердий и развитии аритмогенного субстрата. Обр. J. 77 , 1171–1179 (2013).
КАС пабмед Статья Google Scholar
Sawaya, S.E. et al. Снижение уровня коннексина40 и повышенная распространенность предсердных аритмий у трансгенных мышей с гиперэкспрессией фактора некроза опухоли, ограниченной сердечной недостаточностью. утра. Дж. Физиол. Цирк Сердца. Физиол. 292 , h2561–h2567 (2007 г.).
КАС пабмед Статья Google Scholar
Саба С. и др. Сократительная дисфункция предсердий, фиброз и аритмии в мышиной модели кардиомиопатии, вторичной по отношению к кардиоспецифической гиперэкспрессии фактора некроза опухоли-α. утра. Дж. Физиол. Цирк Сердца. Физиол. 289 , h2456–h2467 (2005 г.).
КАС пабмед Статья Google Scholar
Ли, С.-Х. и другие. Фактор некроза опухоли-альфа изменяет перенос кальция и усиливает аритмогенез кардиомиоцитов легочных вен. Науки о жизни. 80 , 1806–1815 (2007).
КАС пабмед Статья Google Scholar
Као Ю.-Х. и другие. Фактор некроза опухоли-α снижает экспрессию Са 2+ -АТФазы саркоплазматического ретикулума посредством метилирования промотора в кардиомиоцитах. Крит.Уход Мед. 38 , 217–222 (2010).
КАС пабмед Статья Google Scholar
Haudek, S.B., Taffet, G.E., Schneider, M.D. & Mann, D.L. TNF провоцирует апоптоз кардиомиоцитов и ремоделирование сердца посредством активации множественных путей гибели клеток. Дж. Клин. Вкладывать деньги. 117 , 2692–2701 (2007).
КАС пабмед ПабМед Центральный Статья Google Scholar
Baeuerle, P.A. & Henkel, T. Функция и активация NF-kappaB в иммунной системе. год. Преподобный Иммунол. 12 , 141–179 (1994).
КАС пабмед Статья Google Scholar
Chow, J.C., Young, D.W., Golenbock, D.T., Christ, W.J. & Gusovsky, F. Толл-подобный рецептор-4 опосредует липополисахарид-индуцированную передачу сигнала. Дж. Биол. хим. 274 , 10689–10692 (1999).
КАС пабмед Статья Google Scholar
Karki, R. & Igwe, O. J. Опосредованная 4-опосредованным ядерным фактором каппа B толл-подобный рецептор необходима для восприятия экзогенных оксидантов для распространения и поддержания окислительного/нитрозативного клеточного стресса. PLoS ONE 8 , e73840 (2013).
КАС пабмед ПабМед Центральный Статья Google Scholar
Сюй, К. и др. Группа высокой подвижности Box 1 была связана с тромбозом у пациентов с мерцательной аритмией. Медицина 97 , e0132 (2018).
КАС пабмед ПабМед Центральный Статья Google Scholar
Monnerat-Cahli, G. et al. Активация Toll-подобного рецептора 4 способствует развитию сердечных аритмий за счет уменьшения транзиторного оттока калия наружу ( I до ) посредством IRF3-зависимого и MyD88-независимого пути. Дж. Мол. Клетка. Кардиол. 76 , 116–125 (2014).
КАС пабмед Статья Google Scholar
Лю М. и др. Митохондриальная дисфункция, вызывающая снижение регуляции сердечных натриевых каналов при кардиомиопатии. Дж. Мол. Клетка. Кардиол. 54 , 25–34 (2013).
КАС пабмед Статья Google Scholar
Яо, К. и др. Усиленная передача сигналов инфламмасомы NLRP3 кардиомиоцитов способствует фибрилляции предсердий. Тираж 138 , 2227–2242 (2018).
КАС пабмед ПабМед Центральный Статья Google Scholar
Ван Вагонер, Д. Р. и Чанг, М. К. Воспаление, активация воспаления и мерцательная аритмия. Тираж 138 , 2243–2246 (2018).
ПабМед ПабМед Центральный Статья Google Scholar
Чен, Г., Челу, М. Г., Добрев, Д. и Ли, Н. Передача сигналов воспаления кардиомиоцитов при кардиомиопатиях и мерцательной аритмии: механизмы и потенциальные терапевтические последствия. Перед. Физиол. 9 , 1115 (2018).
ПабМед ПабМед Центральный Статья Google Scholar
Heijman, J. et al. Нексус предсердных миоцитов NLRP3/CaMKII образует субстрат для послеоперационной фибрилляции предсердий. Обр.Рез. 127 , 1036–1055 (2020).
КАС пабмед Статья Google Scholar
Temple, I.P., Inada, S., Dobrzynski, H. & Boyett, M.R. Коннексины и атриовентрикулярный узел. Ритм сердца 10 , 297–304 (2013).
ПабМед ПабМед Центральный Статья Google Scholar
Де Хесус, Нью-Мексикои другие. Атеросклероз усугубляет аритмию после инфаркта миокарда: роль воспаления миокарда. Ритм сердца 12 , 169–178 (2015).
ПабМед Статья Google Scholar
Goshima, K. & Tonomura, Y. Синхронное биение эмбриональных клеток миокарда мыши, опосредованное клетками FL в монослойной культуре. Экспл. Сотовый рез. 56 , 387–392 (1969).
КАС пабмед Статья Google Scholar
Gaudesius, G., Miragoli, M., Thomas, S.P. & Rohr, S. Связь электрической активности сердца на больших расстояниях с помощью фибробластов сердечного происхождения. Обр. Рез. 93 , 421–428 (2003).
КАС пабмед Статья Google Scholar
Camelliti, P., Green, C.R., LeGrice, I. & Kohl, P. Сеть фибробластов в синоатриальном узле кролика: структурная и функциональная идентификация гомогенного и гетерогенного клеточного сцепления. Обр. Рез. 94 , 828–835 (2004).
КАС пабмед Статья Google Scholar
Quinn, T. A. et al. Электротоническое сопряжение возбудимых и невозбудимых клеток сердца, выявленное методами оптогенетики. Проц. Натл акад. науч. США 113 , 14852–14857 (2016).
КАС пабмед ПабМед Центральный Статья Google Scholar
Рубарт, М. и др. Электрическая связь между желудочковыми миоцитами и миофибробластами в инфарктном сердце мыши. Кардиовасц. Рез. 114 , 389–400 (2018).
КАС пабмед Статья Google Scholar
Fontes, MSC, van Veen, TAB, de Bakker, JMT и van Rijen, HVM Функциональные последствия аномальной экспрессии Cx43 в сердце. Биохим. Биофиз. Acta 1818 , 2020–2029 (2012).
КАС пабмед Статья Google Scholar
Leuschner, F. et al. Быстрая кинетика моноцитов при остром инфаркте миокарда поддерживается экстрамедуллярным моноцитопоэзом. Дж. Экспл. Мед. 209 , 123–137 (2012).
КАС пабмед ПабМед Центральный Статья Google Scholar
Фэй Ю.-Д. и другие. Макрофаги облегчают постинфарктные аритмии: роль щелевых контактов и K Ca 3.1. Тераностика 9 , 6396–6411 (2019).
КАС пабмед ПабМед Центральный Статья Google Scholar
Kohl, P. & Noble, D. Механочувствительная соединительная ткань: потенциальное влияние на сердечный ритм. Кардиовасц. Рез. 32 , 62–68 (1996).
КАС пабмед Статья Google Scholar
Коль П., Камкин А. Г., Киселева И. С., Ноубл Д. Механочувствительные фибробласты в области синоатриального узла сердца крысы: взаимодействие с кардиомиоцитами и возможная роль. Экспл. Физиол. 79 , 943–956 (1994).
КАС пабмед Статья Google Scholar
Roell, W. et al. Сверхэкспрессия Cx43 в клетках рубца миокарда: коррекция постинфарктных аритмий посредством гетеротипического межклеточного сопряжения. науч. Респ. 8 , 7145 (2018).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Li, K. et al. Дифференциальная поляризация макрофагов у самцов и самок мышей BALB/c, инфицированных вирусом Коксаки В3, определяет предрасположенность к вирусному миокардиту. Обр. Рез. 105 , 353–364 (2009).
КАС пабмед Статья Google Scholar
Hoyer, F.F. et al. Тканеспецифические реакции макрофагов на отдаленное повреждение влияют на исход последующего локального иммунного воздействия. Иммунитет 51 , 899–914.e7 (2019).
КАС пабмед ПабМед Центральный Статья Google Scholar
Вилахур Г. и др. Молекулярные и клеточные механизмы ремоделирования сердца после острого инфаркта миокарда. Дж. Мол. Клетка. Кардиол. 50 , 522–533 (2011).
КАС пабмед Статья Google Scholar
Chen, B. & Frangogiannis, N.G. Роль макрофагов в неишемической сердечной недостаточности. Базовый перевод JACC. науч. 3 , 245–248 (2018).
ПабМед ПабМед Центральный Статья Google Scholar
Rosenkranz, S. TGF-β1 и сеть ангиотензина при ремоделировании сердца. Кардиовасц. Рез. 63 , 423–432 (2004).
КАС пабмед Статья Google Scholar
Kuwahara, F. et al. Гипертонический фиброз миокарда и диастолическая дисфункция: еще одна модель воспаления? Гипертония 43 , 739–745 (2004).
КАС пабмед Статья Google Scholar
Рен, Дж.и другие. Провоспалительный белок CARD9 необходим для инфильтрации моноцитарных предшественников фибробластов и сердечного фиброза, вызванного инфузией ангиотензина II. утра. Дж. Гипертензии. 24 , 701–707 (2011).
КАС пабмед Статья Google Scholar
Кагитани С. и др. Траниласт ослабляет фиброз миокарда в сочетании с подавлением инфильтрации моноцитов/макрофагов у крыс с DOCA/солевой гипертензией. Дж. Гипертензии. 22 , 1007–1015 (2004).
КАС пабмед Статья Google Scholar
Frangogiannis, N.G. et al. Доказательства активного воспалительного процесса в гибернирующем миокарде человека. утра. Дж. Патол. 160 , 1425–1433 (2002).
КАС пабмед ПабМед Центральный Статья Google Scholar
Frangogiannis, N.G. et al. Экспрессия MCSF индуцируется при заживлении инфарктов миокарда и может регулировать фенотип моноцитов и эндотелиальных клеток. утра. Дж. Физиол. Цирк Сердца. Физиол. 285 , h583–h592 (2003 г.).
КАС пабмед Статья Google Scholar
Frangogiannis, N. Трансформирующий фактор роста-β при фиброзе тканей. Дж. Экспл. Мед. 217 , e201 (2020).
ПабМед ПабМед Центральный Статья Google Scholar
Verma, S.K. et al. Интерлейкин-10 ингибирует опосредованный клетками-предшественниками фибробластов костного мозга сердечный фиброз в перегруженном давлением миокарде. Тираж 136 , 940–953 (2017).
КАС пабмед ПабМед Центральный Статья Google Scholar
Симойнс, Ф.С. и др. Макрофаги непосредственно способствуют образованию рубцов во время регенерации сердца рыбок данио и восстановления сердца мышей. Нац. коммун. 11 , 600 (2020).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Vasquez, C. et al. Усиление взаимодействия фибробластов с миоцитами в ответ на повреждение сердца. Обр. Рез. 107 , 1011–1020 (2010).
КАС пабмед ПабМед Центральный Статья Google Scholar
Рудольф В. и др. Миелопероксидаза действует как профибротический медиатор мерцательной аритмии. Нац. Мед. 16 , 470–474 (2010).
КАС пабмед ПабМед Центральный Статья Google Scholar
Fu, X., Kassim, SY, Parks, WC & Heinecke, JW Хлорноватистая кислота, образованная миелопероксидазой, модифицирует соседние остатки триптофана и глицина в каталитическом домене матриксной металлопротеиназы-7 (матрилизин): окислительный механизм для сдерживание протеолитической активности при воспалении. Дж. Биол. хим. 278 , 28403–28409 (2003 г.).
КАС пабмед Статья Google Scholar
Holzwirth, E. et al. Миелопероксидаза при фибрилляции предсердий: связь с прогрессированием, происхождение и влияние антагонистов ренин-ангиотензиновой системы. клин. Рез. Кардиол. 109 , 324–330 (2020).
ПабМед Статья Google Scholar
Ли, С. и др. Миелопероксидаза и риск рецидива фибрилляции предсердий после катетерной аблации. Дж. Расследование. Мед. 61 , 722–727 (2013).
КАС пабмед Статья Google Scholar
Friedrichs, K. et al. Индукция мерцательной аритмии нейтрофилами в решающей степени зависит от интегринов CD11b/CD18. PLoS ONE 9 , e89307 (2014).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Абэ, И. и др. Ассоциация фиброзного ремоделирования и содержания цитокинов/хемокинов в эпикардиальной жировой ткани с фиброзом миокарда предсердий у больных с мерцательной аритмией. Ритм сердца 15 , 1717–1727 (2018).
ПабМед Статья Google Scholar
Iacobellis, G. et al. Влияние избыточного жира на морфологию и функцию сердца: исследование неосложненного ожирения. Обес.Рез. 10 , 767–773 (2002).
ПабМед Статья Google Scholar
Thanassoulis, G. et al. Перикардиальный жир связан с распространенной фибрилляцией предсердий: исследование сердца Framingham. Обр. Аритмия. Электрофизиол. 3 , 345–350 (2010).
ПабМед ПабМед Центральный Статья Google Scholar
Lee, C.G. et al. Интерлейкин-13 вызывает фиброз тканей путем избирательной стимуляции и активации трансформирующего фактора роста β 1 . Дж. Экспл. Мед. 194 , 809–821 (2001).
КАС пабмед ПабМед Центральный Статья Google Scholar
Okuma, T. et al. Дефицит CC хемокинового рецептора 2 (CCR2) улучшает индуцированный блеомицином легочный фиброз за счет ослабления как инфильтрации макрофагов, так и продукции макрофагальных матриксных металлопротеиназ. Дж. Патол. 204 , 594–604 (2004).
КАС пабмед Статья Google Scholar
Johnson, J.L. et al. Связь экспрессии MMP-14 и TIMP-3 с активацией макрофагов и уязвимостью человека к атеросклеротическим бляшкам. Медиаторы воспаления. 2014 , 276457 (2014).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Fallowfield, J.A. et al. Связанные с рубцом макрофаги являются основным источником металлопротеиназы-13 печеночного матрикса и способствуют разрешению фиброза печени мышей. Дж. Иммунол. 178 , 5288–5295 (2007).
КАС пабмед Статья Google Scholar
Abe, H. et al. Передача сигналов гипоксии макрофагами регулирует сердечный фиброз посредством Онкостатина М. Nat. коммун. 10 , 2824 (2019).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Haro, H. et al. Зависимое от матриксной металлопротеиназы-7 высвобождение фактора некроза опухоли-α в модели резорбции грыжи диска. Дж. Клин. Вкладывать деньги. 105 , 143–150 (2000).
КАС пабмед ПабМед Центральный Статья Google Scholar
Бойксель, К.и другие. Фиброз левого предсердия при прогрессировании сердечной недостаточности связан с повышением матриксных металлопротеиназ у крыс. Дж. Ам. Сб. Кардиол. 42 , 336–344 (2003).
КАС пабмед Статья Google Scholar
Lindsey, M.L. et al. Матриксная металлопротеиназа-7 влияет на уровни коннексина-43, электропроводность и выживаемость после инфаркта миокарда. Тираж 113 , 2919–2928 (2006 г.).
КАС пабмед Статья Google Scholar
Аль-Хатиб, С. М. и др. Руководство AHA/ACC/HRS 2017 г. по ведению пациентов с желудочковыми аритмиями и профилактике внезапной сердечной смерти: резюме: отчет Целевой группы Американского колледжа кардиологов/Американской кардиологической ассоциации по клиническим рекомендациям и Обществу сердечного ритма. Тираж 138 , e272–e391 (2018 г.).
ПабМед Google Scholar
Lehnart, S.E. et al. Наследственные аритмии: консенсусный отчет Национального института сердца, легких и крови и Управления по редким заболеваниям о диагностике, фенотипировании, молекулярных механизмах и терапевтических подходах к первичным кардиомиопатиям генных мутаций, влияющих на функцию ионных каналов. Тираж 116 , 2325–2345 (2007 г.).
КАС пабмед Статья Google Scholar
Ли, Х. и др. Ингибитор пептидомиметика подавляет индуцируемость сердечных аритмий, опосредованных β1-адренергическими аутоантителами, у кроликов. Дж. Интерв. Карта. Электрофизиол. 44 , 205–212 (2015).
ПабМед ПабМед Центральный Статья Google Scholar
Lazzerini, P.E., Capecchi, P.L., Laghi-Pasini, F. & Boutjdir, M. Аутоиммунные каналопатии как новый механизм сердечных аритмий. Нац. Преподобный Кардиол. 14 , 521–535 (2017).
КАС пабмед Статья Google Scholar
Drew, B.J. et al. Профилактика torsade de pointes в больничных условиях: научное заявление Американской кардиологической ассоциации и Фонда Американского колледжа кардиологов. Дж. Ам. Сб. Кардиол. 55 , 934–947 (2010).
ПабМед ПабМед Центральный Статья Google Scholar
Priori, S.G. et al. Консенсус экспертов HRS/EHRA/APHRS по диагностике и лечению пациентов с наследственными первичными синдромами аритмии: документ, одобренный HRS, EHRA и APHRS в мае 2013 г. и ACCF, AHA, PACES и AEPC в июне 2013 г. Heart Rhythm 10 , 1932–1963 (2013).
ПабМед Статья Google Scholar
Каллергис Э. М., Гудис К. А., Симантиракис Э. Н., Кочиадакис Г.E. & Vardas, PE Механизмы, факторы риска и лечение приобретенного синдрома удлиненного интервала QT: всесторонний обзор. ScientificWorldJournal 2012 , 212178 (2012).
ПабМед ПабМед Центральный Статья Google Scholar
Nakamura, K. et al. Синдром удлиненного интервала QT, индуцированный антителами против KCNh3: новая приобретенная форма синдрома удлиненного интервала QT. Дж. Ам. Сб. Кардиол. 50 , 1808–1809 (2007).
ПабМед Статья Google Scholar
Suzuki, S. et al. Новые аутоантитела к потенциалзависимому калиевому каналу Kv1.4 при тяжелой форме миастении. J. Нейроиммунол. 170 , 141–149 (2005).
КАС пабмед Статья Google Scholar
Fabris, F. et al. Индукция аутоиммунного ответа на внеклеточную петлю поры канала HERG вызывает удлинение интервала QTc у морских свинок. J. Physiol. 594 , 6175–6187 (2016).
КАС пабмед ПабМед Центральный Статья Google Scholar
Li, J. et al. Аутоантитела против KCNQ1 K + увеличивают ток I Ks и связаны с укорочением интервала QT при дилатационной кардиомиопатии. Кардиовасц. Рез. 98 , 496–503 (2013).
КАС пабмед Статья Google Scholar
Ли, Дж. и др. Индуцированный аутоиммунитет KCNQ1 ускоряет реполяризацию сердца у кроликов: потенциальное значение в аритмогенезе и антиаритмической терапии. Ритм сердца 11 , 2092–2100 (2014).
ПабМед Статья Google Scholar
Эфтехари П. и др. Аутоантитела против SSA/Ro52, блокирующие сердечный серотонинергический рецептор 5-HT4, могут объяснить врожденную блокаду сердца у новорожденных, вызванную волчанкой. евро. Дж. Иммунол. 30 , 2782–2790 (2000).
КАС пабмед Статья Google Scholar
Fritsch, C. et al. Эпитопы Ro/SSA массой 52 кДа преимущественно распознаются антителами матерей детей с неонатальной волчанкой и врожденной блокадой сердца. Артрит Рез. тер. 8 , Р4 (2006).
ПабМед Статья КАС Google Scholar
Lazzerini, P. E. et al. Аритмогенность анти-Ro/SSA антител у пациентов с torsades de pointes. Обр. Аритмия. Электрофизиол. 9 , e003419 (2016).
КАС пабмед Статья Google Scholar
Халл, Д., Биннс, Б. А. и Джойс, Д. Врожденная блокада сердца и распространенный фиброз из-за материнской красной волчанки. Арх. Дис. Ребенок. 41 , 688–690 (1966).
КАС пабмед ПабМед Центральный Статья Google Scholar
Chameides, L. et al. Ассоциация материнской системной красной волчанки с врожденной полной блокадой сердца. Н. англ. Дж. Мед. 297 , 1204–1207 (1977).
КАС пабмед Статья Google Scholar
Брукато А., Чимаз Р., Капорали Р., Ramoni, V. & Buyon, J. Исходы беременности у пациентов с аутоиммунными заболеваниями и антителами против Ro/SSA. клин. Преподобный Аллергия Иммунол. 40 , 27–41 (2011).
КАС пабмед ПабМед Центральный Статья Google Scholar
Hayashi, T. et al. Исход пренатально диагностированной изолированной врожденной полной атриовентрикулярной блокады, леченной трансплацентарной терапией бетаметазоном или ритодрином. Педиатр. Кардиол. 30 , 35–40 (2009).
ПабМед Статья Google Scholar
Jaeggi, E. T. et al. Трансплацентарное лечение плода улучшает исход пренатально диагностированной полной атриовентрикулярной блокады без структурных заболеваний сердца. Тираж 110 , 1542–1548 (2004 г.).
ПабМед Статья Google Scholar
Seisenberger, C. et al. Функциональные эмбриональные кардиомиоциты после разрушения гена кальциевого канала L-типа α1C (Cav1.2) у мышей. Дж. Биол. хим. 275 , 39193–39199 (2000).
КАС пабмед Статья Google Scholar
Karnabi, E. et al. Врожденная блокада сердца: идентификация сайта связывания аутоантител на внеклеточной петле (домен I, S5-S6) Са-канала α 1D L-типа. J. Аутоиммун. 34 , 80–86 (2010).
КАС пабмед Статья Google Scholar
Ruffatti, A. et al. Плазмаферез, внутривенные иммуноглобулины и бетаметазон — комбинированный протокол лечения аутоиммунной врожденной блокады сердца: проспективное когортное исследование. клин. Эксп. Ревматол. 34 , 706–713 (2016).
ПабМед Google Scholar
Коркмаз, С. и др. Провокация аутоиммунного ответа на сердечный потенциалзависимый натриевый канал Na V 1,5 вызывает дефекты сердечной проводимости у крыс. Дж. Ам. Сб. Кардиол. 62 , 340–349 (2013).
КАС пабмед Статья Google Scholar
Магуй, А., Тардиф, Дж.-К., Буссей, Д., Риби, К. и Ли, Дж. Сигнатура аутоантител при остановке сердца. Тираж 141 , 1764–1774 (2020).
КАС пабмед Статья Google Scholar
Магуй, А. и др. Антитела KCNQ1 для иммунотерапии синдрома удлиненного интервала QT 2 типа. J. Am. Сб. Кардиол. 75 , 2140–2152 (2020).
КАС пабмед Статья Google Scholar
Ahmed, M. S. et al. Супрамолекулярный наноноситель для доставки амиодароновой антиаритмической терапии к сердцу. Биоконъюг. хим. 30 , 733–740 (2019).
КАС пабмед ПабМед Центральный Статья Google Scholar
Leuschner, F. et al. Сайленсинг CCR2 при миокардите. евро. Heart J. 36 , 1478–1488 (2015).
КАС пабмед Статья Google Scholar
Агаджанян Х. и др. Борьба с сердечным фиброзом с помощью инженерных Т-клеток. Природа 573 , 430–433 (2019).
КАС пабмед ПабМед Центральный Статья Google Scholar
Behling, J., Kaes, J., Münzel, T., Grabbe, S. & Loquai, C. Впервые начавшаяся атриовентрикулярная блокада третьей степени из-за аутоиммунного миозита при лечении антизапрограммированными препаратами. гибель клеток-1 (ниволумаб) при метастатической меланоме. Рез. меланомы. 27 , 155–158 (2017).
КАС пабмед Статья Google Scholar
Heinzerling, L. et al. Кардиотоксичность, связанная с иммунотерапией, блокирующей CTLA4 и PD1. Дж. Иммунотер. Рак 4 , 50 (2016).
ПабМед ПабМед Центральный Статья Google Scholar
Peretto, G. et al. Аритмии при миокардите: современное состояние. Ритм сердца 16 , 793–801 (2019).
ПабМед Статья Google Scholar
Mehta, D., Ravindran, K. & Kuebler, W.M. Новые регуляторы барьерной функции эндотелия. утра. Дж. Физиол. Легочная клетка. Мол. Физиол. 307 , L924–L935 (2014).
КАС пабмед ПабМед Центральный Статья Google Scholar
Wang, T.J. et al. Временные отношения мерцательной аритмии и застойной сердечной недостаточности и их совместное влияние на смертность: исследование сердца Framingham. Тираж 107 , 2920–2925 (2003 г.).
ПабМед Статья Google Scholar
Mahoney, P., Kimmel, S., DeNofrio, D., Wahl, P. & Loh, E. Прогностическое значение мерцательной аритмии у пациентов в третичном медицинском центре, направленных на трансплантацию сердца из-за тяжелой сердечной недостаточности отказ. утра. Дж. Кардиол. 83 , 1544–1547 (1999).
КАС пабмед Статья Google Scholar
Карсон, П. Е. и др. Влияние мерцательной аритмии на прогноз при сердечной недостаточности легкой и средней степени тяжести. Исследования V-HeFT. Группа совместных исследований V-HeFT VA. Тираж 87 , VI102–VI110 (1993).
КАС пабмед Google Scholar
Middlekauff, H.R., Stevenson, W.G. & Stevenson, L.W. Прогностическое значение мерцательной аритмии при далеко зашедшей сердечной недостаточности. Исследование 390 пациентов. Тираж 84 , 40–48 (1991).
КАС пабмед Статья Google Scholar
Кусумото, Ф. М. и др. Руководство ACC/AHA/HRS 2018 г. по оценке и ведению пациентов с брадикардией и задержкой сердечной проводимости: отчет Целевой группы Американского колледжа кардиологов/Американской кардиологической ассоциации по клиническим рекомендациям и Обществу сердечного ритма. Тираж 140 , e382–e482 (2019).
Google Scholar
Cheema, O. et al. Паттерны фиброза миокарда по данным МРТ у больных с нарушениями проводимости [аннотация]. Дж. Кардиовасц. Магн. Резон. 14 , стр. 213 (2012 г.).
Центральный пабмед Статья пабмед Google Scholar
Kottkamp, H. Фиброзная предсердная кардиомиопатия: специфическое заболевание/синдром, обеспечивающий субстраты для фибрилляции предсердий, предсердной тахикардии, болезни синусового узла, болезни атриовентрикулярного узла и тромбоэмболических осложнений. Дж. Кардиовасц. Электрофизиол. 23 , 797–799 (2012).
ПабМед Статья Google Scholar
Январь, C. T. et al. Специальное обновление AHA/ACC/HRS 2019 г. руководства AHA/ACC/HRS 2014 г. по ведению пациентов с фибрилляцией предсердий: отчет Целевой группы Американского колледжа кардиологов/Американской кардиологической ассоциации по клиническим рекомендациям и Обществу сердечного ритма в сотрудничество с Обществом торакальных хирургов. Тираж 140 , e125–e151 (2019).
ПабМед Статья Google Scholar
Январь, C. T. et al. Руководство AHA/ACC/HRS 2014 г. по ведению пациентов с мерцательной аритмией: краткое изложение: отчет Целевой группы Американского колледжа кардиологов/Американской кардиологической ассоциации о практических рекомендациях и Обществе сердечного ритма. Тираж 130 , 2071–2104 (2014).
ПабМед Статья Google Scholar
Ericson, J. et al. Данные экспрессии генов микрочипов ImmGen: конвейер генерации данных и контроля качества. ImmGen https://www.immgen.org/Protocols/ImmGenDataGenerationAndQCDocumentation.pdf (2012 г.).
Silvestre-Roig, C., Hidalgo, A. & Soehnlein, O. Неоднородность нейтрофилов: последствия для гомеостаза и патогенеза. Кровь 127 , 2173–2181 (2016).
КАС пабмед Статья Google Scholar
Николас-Авила, Дж. А., Адровер, Дж. М. и Идальго, А. Нейтрофилы в гомеостазе, иммунитете и раке. Иммунитет 46 , 15–28 (2017).
ПабМед Статья КАС Google Scholar
Ramos, G.C. et al. Старение миокарда как явление, опосредованное Т-клетками. Проц.Натл акад. науч. США 114 , E2420–E2429 (2017 г.).
КАС пабмед ПабМед Центральный Статья Google Scholar
Liu, K. et al. Анализ развития дендритных клеток и гомеостаза in vivo. Наука 324 , 392–397 (2009).
КАС пабмед ПабМед Центральный Статья Google Scholar
Чой, Дж.-ЧАС. и другие. Идентификация антигенпрезентирующих дендритных клеток в аорте и сердечных клапанах мышей. Дж. Экспл. Мед. 206 , 497–505 (2009).
КАС пабмед ПабМед Центральный Статья Google Scholar
Clemente-Casares, X. et al. Традиционная система наблюдения за дендритными клетками CD103 + предотвращает развитие явной сердечной недостаточности при субклиническом вирусном миокардите. Иммунитет 47 , 974–989.е8 (2017).
КАС пабмед Статья Google Scholar
Adamo, L. et al. Модуляция субпопуляций сердечных В-лимфоцитов улучшает сердечную функцию после острой травмы. JCI Insight 3 , e120137 (2018).
Центральный пабмед Статья пабмед Google Scholar
Боннер Ф., Борг Н., Бургхофф С. и Шрадер Дж.Резидентные сердечные иммунные клетки и экспрессия ферментов эктонуклеотидазы CD39 и CD73 после ишемического повреждения. PLoS ONE 7 , e34730 (2012 г.).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Adamo, L. et al. Миокардиальные В-клетки представляют собой подмножество циркулирующих лимфоцитов с замедленным транзитом через сердце. JCI Insight 5 , e134700 (2020).
Центральный пабмед Статья пабмед Google Scholar
Ingason, A.B., Mechmet, F., Atacho, D.A.M., Steingrímsson, E. & Petersen, P.H. Распределение тучных клеток в сердце мыши и его зависимость от Mitf. Мол. Иммунол. 105 , 9–15 (2019).
КАС пабмед Статья Google Scholar
Patella, V. et al. Тучные клетки сердца человека. Выделение, очистка, ультраструктура и иммунологическая характеристика. Дж. Иммунол. 154 , 2855–2865 (1995).
КАС пабмед Google Scholar
Mackins, C.J. et al. Ренин тучных клеток сердца способствует локальному образованию ангиотензина, высвобождению норадреналина и аритмиям при ишемии/реперфузии. Дж. Клин. Вкладывать деньги. 116 , 1063–1070 (2006).
КАС пабмед ПабМед Центральный Статья Google Scholar
Ляо, К.и другие. Кардиальные тучные клетки вызывают мерцательную аритмию посредством PDGF-A-опосредованного фиброза в перегруженных давлением сердцах мышей. Дж. Клин. Вкладывать деньги. 120 , 242–253 (2010).
КАС пабмед Статья Google Scholar
Дейссерот, К. Оптогенетика. Нац. Методы 8 , 26–29 (2011).
КАС пабмед Статья Google Scholar
Miesenböck, G. Оптогенетический катехизис. Наука 326 , 395–399 (2009).
ПабМед Статья КАС Google Scholar
Бойден, Э. С., Чжан, Ф., Бамберг, Э., Нагель, Г. и Дейссерот, К. Миллисекундный масштаб времени, генетически направленный оптический контроль нервной активности. Нац. Неврологи. 8 , 1263–1268 (2005).
КАС пабмед ПабМед Центральный Статья Google Scholar
Ли, X. и др. Быстрая неинвазивная активация и ингибирование нейронной и сетевой активности родопсином позвоночных и каналородопсином зеленых водорослей. Проц. Натл акад. науч. США 102 , 17816–17821 (2005 г.).
КАС пабмед ПабМед Центральный Статья Google Scholar
Nagel, G. et al. Каналродопсин-2 , катион-селективный мембранный канал, непосредственно управляемый светом. Проц. Натл акад.науч. США 100 , 13940–13945 (2003 г.).
КАС пабмед ПабМед Центральный Статья Google Scholar
Лундби А., Мутох Х., Димитров Д., Акеманн В. и Кнопфель Т. Разработка генетически кодируемого флуоресцентного датчика напряжения с использованием быстрых движений Ci-VSP, чувствительных к напряжению. PLoS ONE 3 , e2514 (2008 г.).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Накаи Дж., Окура М. и Имото К. Зонд Ca 2+ с высоким отношением сигнал-шум, состоящий из одного зеленого флуоресцентного белка. Нац. Биотехнолог. 19 , 137–141 (2001).
КАС пабмед Статья Google Scholar
Bruegmann, T. et al. Оптогенетический контроль сердечной мышцы in vitro и in vivo. Нац. Методы 7 , 897–900 (2010).
КАС пабмед Статья Google Scholar
Арренберг А.Б., Штайнер Д.Ю.Р., Байер Х. и Хуискен Дж. Оптогенетический контроль сердечной функции. Наука 330 , 971–974 (2010).
КАС пабмед Статья Google Scholar
Wang, Y. et al. Оптогенетический контроль сердечного ритма путем избирательной стимуляции кардиомиоцитов, полученных из клеток Pnmt + в сердце мыши. науч. Респ. 7 , 40687 (2017).
КАС пабмед ПабМед Центральный Статья Google Scholar
Bruegmann, T. et al. Оптогенетическая дефибрилляция прекращает желудочковую аритмию в сердцах мышей и симуляций человека. Дж. Клин. Вкладывать деньги. 126 , 3894–3904 (2016).
ПабМед ПабМед Центральный Статья Google Scholar
Брюгманн, Т., Бейерт, Т., Vogt, C.C., Schrickel, JW & Sasse, P. Оптогенетическое прекращение фибрилляции предсердий у мышей. Кардиовасц. Рез. 114 , 713–723 (2018).
КАС пабмед Статья Google Scholar
Nyns, E.C.A. et al. Оптогенетическая терминация желудочковых аритмий в целом сердце: к биологическому управлению сердечным ритмом. евро. Heart J. 38 , 2132–2136 (2017).
КАС пабмед Статья Google Scholar
Lee, S. et al. Визуализация in vivo бьющегося сердца мыши в режиме реального времени с микроскопическим разрешением. Нац. коммун. 3 , 1054 (2012).
ПабМед Статья КАС Google Scholar
Агирре А.Д., Винегони К., Себас М. и Вайсследер Р. Прижизненная визуализация сердечной функции на уровне отдельных клеток. Проц. Натл акад. науч. США 111 , 11257–11262 (2014).
КАС пабмед ПабМед Центральный Статья Google Scholar
Джонс, Дж. С., Смолл, Д. М. и Нишимура, Н. Визуализация кальция in vivo кардиомиоцитов в бьющемся сердце мыши с помощью многофотонной микроскопии. Перед. Физиол. 9 , 969 (2018).
ПабМед ПабМед Центральный Статья Google Scholar
Kavanagh, D.P.J., Lokman, A.B., Neag, G., Colley, A. & Kalia, N. Визуализация поврежденного работающего сердца прижизненно и васкулопротекция, обеспечиваемая гемопоэтическими стволовыми клетками. Кардиовасц. Рез. 115 , 1918–1932 (2019).
КАС пабмед ПабМед Центральный Статья Google Scholar
Аритмии | Кедры-Синай
Не то, что вы ищете?Что такое аритмия?
Аритмия – это нарушение сердечного ритма.
Некоторые аритмии могут вызывать проблемы с сокращениями камер сердца:
- Не позволяя нижним камерам (желудочкам) наполниться достаточным количеством крови, потому что аномальный электрический сигнал заставляет ваше сердце сокращаться слишком быстро или слишком медленно.
- Недостаточное перекачивание крови к вашему телу, потому что аномальный электрический сигнал заставляет ваше сердце сокращаться слишком медленно или нерегулярно.
- Не допуская верхних камер (предсердий) правильно сжимать.
Аритмия может возникнуть в синусовый узел, предсердия или атриовентрикулярный (АВ) узел. Это называется наджелудочковые аритмии. Аритмии могут возникать и в желудочках. вызвано аномальным электрическим фокусом в желудочках.Это приводит к ненормальному проведение электрических сигналов в желудочках. Аритмии также могут быть перечислены как медленные (брадиаритмии), так и быстрые (тахиаритмии). «Бради-» означает медленный, а «тахи-» значит быстро.
В любой из этих ситуаций жизненно важные органы вашего тела могут не получать достаточно крови, чтобы удовлетворить их потребности.
Что вызывает аритмию?
Аритмия возникает при наличии проблема с электрической системой, которая должна контролировать стабильное сердцебиение.При проблемах в электрической системе ваше сердце может биться слишком быстро, слишком медленно, или нерегулярно.
Кто подвержен риску аритмии?
Многие вещи могут повлиять на электрическую систему сердца и вызвать аритмию. Такие вещества, как кофеин, алкоголь, табак, незаконные наркотики, диетические лекарства, некоторые травы и даже лекарства, отпускаемые по рецепту. лекарства могут вызвать аритмию.Состояния здоровья, такие как ишемическая болезнь сердца, высокое кровяное давление, апноэ во сне и диабет повышают риск развития аритмии. Аритмии становятся более распространенными, когда вы становитесь старше.
Каковы симптомы аритмии?
Воздействие на организм часто одинаково, если сердцебиение слишком быстрое, слишком медленное или слишком нерегулярное. Некоторые симптомы К аритмиям относятся:
- Ощущение трепетания или нерегулярности сердцебиение (сердцебиение)
- Слабость
- Усталость (усталость)
- Низкое кровяное давление
- Головокружение
- Обморок
- Сердечная недостаточность
- Коллапс и остановка сердца
- Затрудненное кормление (у младенцев)
Симптомы аритмии могут похожи на другие условия.Всегда обращайтесь к своему лечащему врачу для постановки диагноза.
Как диагностируются аритмии?
Можно использовать несколько тестов для диагностировать аритмии. Некоторые из них обсуждаются ниже.
Электрокардиограмма (ЭКГ) измеряет электрическая активность сердца. Маленькие липкие участки, называемые электродами, помещаются в определенные места на вашем теле, такие как грудь, руки и ноги.Электроды являются соединены с проводами, которые улавливают электрическую активность сердца и передают ее в машина. Машина интерпретирует активность и составляет график (отслеживание). ЭКГ может показывать:
- Аритмия (как быстрая, так и медленная)
- Поражение сердца от недостатка кислорода в сердечной мышце (ишемия). Это также называется сердечным приступом (инфарктом миокарда).
- Измерения с нерегулярными интервалами
- Другие болезни сердца
ЭКГ имеет несколько вариантов:
- ЭКГ с нагрузкой или стресс-тест. Вы подключен к аппарату ЭКГ, как описано выше. Но вы ходите на беговой дорожке или педали велотренажер во время записи ЭКГ.Этот тест делается для проверки изменений на ЭКГ во время стресса, например, при физической нагрузке.
- Сигнал-усредненная ЭКГ. Эта процедура выполняется в том же как обычная ЭКГ, за исключением того, что регистрируется электрическая активность вашего сердца в течение более длительного периода времени, обычно от 15 до 20 минут. ЭКГ с усреднением сигнала выполнены когда ваш лечащий врач считает, что у вас может быть аномальная электрическая проводимость в сердечная мышца.но его не видно на обычной ЭКГ. Сигнал-усредненная ЭКГ имеет большая чувствительность к проблемам в желудочках, называемым «поздними потенциалами». ЭКГ с усреднением сигнала используется в исследованиях и редко применяется у пациентов.
- Электрофизиологические исследования (ЭФИ). Это нехирургический, но инвазивный тест, при котором небольшая тонкая трубка (катетер) вводят в крупный кровеносный сосуд на ноге или руке и перемещают к сердцу.Этот позволяет вашему лечащему врачу провести тест на аритмию и определить, где аритмия возникает в ткани вашего сердца. Затем ваш провайдер может выяснить, как лучше всего относиться к нему. Иногда ваш врач может лечить аритмию, выполняя аблацию в время исследования. Абляция создает рубцовую ткань в сердце, чтобы нарушить аномальный электрический сигнал.
- Холтеровское мониторирование. Монитор Холтера – это непрерывная запись ЭКГ в течение 24 и более часов. Электроды прикрепленный к груди и подключенный к небольшому портативному регистратору ЭКГ с помощью отведений. Холтеровское мониторирование может быть выполнено, когда ваш лечащий врач считает, что у вас может быть аритмия. Аритмии могут длиться очень короткое время и не проявляться во время в меньшее время записи обычной ЭКГ.Надев холтеровский монитор, вы можете о вашей повседневной деятельности. Но вы не должны заниматься деятельностью, которая вызывает много потливость. Это может привести к ослаблению или падению электродов. Вам следует также не принимайте душ и не плавайте с холтеровским монитором. Новые холтеровские мониторы не требуют электродов. Вместо этого они представляют собой единое патч-устройство, прикрепленное к коже. над сердцем.
- Монитор событий. Это похоже на Холтеровское мониторирование, за исключением того, что вы начинаете запись ЭКГ только тогда, когда чувствуете симптомы. Мониторы событий обычно носят дольше, чем мониторы Холтера, до 30 дней. Ты можно снять монитор, чтобы принять душ или принять ванну.
- Мобильный кардиомониторинг. Это аналогично холтеровскому мониторированию и мониторам событий. ЭКГ постоянно пересматривается по чтению центр для выявления аритмий.ЭКГ записывается и отправляется вашему лечащему врачу. независимо от того, есть ли у вас симптомы. Вы также можете начать запись самостоятельно, когда у вас есть симптомы. Эти мониторы можно носить до 30 дней.
- Имплантируемый петлевой регистратор. Это миниатюрное устройство для записи сердца, которое имплантируется под кожу над сердце. Он может записывать сердечный ритм до 3 лет.Это полезно при диагностике аритмии, которые случаются только время от времени или редко.
Как лечить аритмию?
Некоторые аритмии могут вызвать несколько, если какие-то проблемы. В этом случае вам может не понадобиться лечение. Когда возникает аритмия симптомы, у вас есть несколько вариантов лечения. Ваш поставщик медицинских услуг обсудит с вами варианты лечения.Вместе вы выберете лечение тот лучше всего для вас. Выбор будет основываться на типе вашей аритмии, тяжелая форма ваши симптомы, и если у вас есть другие состояния, такие как диабет, почечная недостаточность, или сердечная недостаточность. Они могут повлиять на ход лечения.
Некоторые методы лечения аритмий включают:
- Изменение образа жизни. Стресс, кофеин, и алкоголь может вызвать аритмии. Ваш лечащий врач может посоветовать вам не есть кофеин, алкоголь или любые другие вещества, которые могут вызывать проблему. Если ваш врач считает, что причиной является стресс, он может предложить медитацию, классы по управлению стрессом, программа упражнений или психотерапия для снятия стресса.
- Медицина. Медицина может лечить аритмии.Используемое лекарство будет основано на типе вашей аритмии, есть ли у вас другие заболевания и принимаете ли вы другие лекарства. Лекарства могут быть использованы для замедления быстрой аритмии или снижения вероятности ее возникновения. инсульт, препятствуя образованию тромбов.
- Кардиоверсия. В этой процедуре медицинский работник посылает вам через грудную клетку электрический шок.Этот может остановить некоторые очень быстрые аритмии, такие как мерцательная аритмия, суправентрикулярная тахикардия или трепетание предсердий. Вы подключены к монитору ЭКГ, который также подключен к дефибриллятору. Удар электрическим током наносится в определенный момент во время Цикл ЭКГ для смены ритма на нормальный.
- Абляция. Это агрессивное, но безоперационная процедура, проводимая в электрофизиологической лаборатории.Медицинский работник ставит тонкую гибкую трубку (катетер) в сердце через крупный кровеносный сосуд в пах или рука. Медицинский работник может использовать высокочастотные радиоволны для нагрева ткани на очаг аритмии и уничтожить его. Этот метод называется радиочастотным. абляция. Криоабляция — еще один метод, который можно использовать. Для этого ультрахолодный вещество используется для охлаждения кончика катетера или баллона.Это замораживает и разрушает ткань.
- Кардиостимулятор. Постоянный кардиостимулятор – это небольшое устройство, которое помещается под кожу, часто в области грудной клетки прямо под ключица. Он посылает электрические сигналы, чтобы ускорить медленное сердцебиение. постоянный кардиостимулятор можно использовать, чтобы заставить сердце биться, если естественный водитель ритма сердца (т. ЮАР узел) не работает должным образом, или если электрические пути заблокированы.Кардиостимуляторы часто используются при медленных аритмиях, таких как синусовая брадикардия, синдром слабости синусового узла. синдром или блокада сердца.
- Имплантируемый кардиовертер-дефибриллятор (МКД). ИКД — это небольшое устройство, похожее на кардиостимулятор. Он ставится под кожи, часто прямо под ключицей. ИКД определяет сердечный ритм. Когда Устройство обнаруживает аномальный ритм, оно посылает электрический разряд в сердце.Этот корректирует ритм до более нормального сердечного ритма. Некоторые ИКД могут действовать как кардиостимуляторы. послать электрический сигнал, чтобы отрегулировать медленную частоту сердечных сокращений. ИКД часто используются для опасные для жизни быстрые аритмии, такие как желудочковая тахикардия или желудочковая фибрилляция. ИКД нового поколения теперь можно размещать в левой подмышечной области. с проволокой, проложенной под кожей над грудиной. Этому ICD не нужен провод в само сердце, но не может действовать как водитель ритма.
- Хирургия. Операция обычно проводится только когда все другие методы лечения не помогли. Хирургическая абляция является серьезной операцией, требующей Общая анестезия. Хирург вскрывает грудную клетку или делает надрезы между ребра, чтобы добраться до вашего сердца. Хирург разрушает или удаляет ткани, вызывающие аритмия. Это чаще всего используется для лечения прогрессирующей фибрилляции предсердий.
Какие возможны осложнения аритмии?
Некоторые аритмии не имеют осложнения. Но более серьезные аритмии могут вызвать сердечную недостаточность, инсульт, или даже остановка сердца.
Жизнь с аритмией
Жизнь с аритмией включает внесение изменений в образ жизни, таких как отказ от кофеина, алкоголя или других триггеров.Это также включает прием лекарств по назначению. Это может также включать наличие кардиостимулятора или ИКД вставлен. Если у вас есть кардиостимулятор или ИКД, спросите своих медицинских работников о любой ограничения или изменения образа жизни, которые вам могут понадобиться. Работа с вашим поставщиком медицинских услуг может способствовать вашему здоровью и благополучию.
Когда мне следует позвонить своему лечащему врачу?
Сообщите своему лечащему врачу, если:
- Ваши симптомы ухудшаются или у вас появляются новые симптомы
- У вас есть побочные эффекты от вашего лекарства
- Вам нужна помощь в преодолении стресса или эмоции
Основные положения об аритмиях
Аритмия – это нарушение сердечного ритма.
- Аритмия может возникать в синусовом узле, предсердиях или атриовентрикулярном узле, или желудочка.
- Некоторые аритмии почти не вызывают проблем.
- Другие аритмии могут вызывать серьезные осложнения, такие как сердечная недостаточность, инсульт или даже остановка сердца.
- Доступны многие варианты лечения для лечения аритмии, включая лекарства, устройства, аблацию сердца и хирургию.Многие аритмии можно контролировать с помощью процедур.
Следующие шаги
Советы, которые помогут вам получить максимальную отдачу от посещения вашего поставщика медицинских услуг:
- Знайте причину вашего визита и то, что вы хотите, чтобы произошло.
- Перед посещением запишите вопросы, на которые вы хотите получить ответы.
- Возьмите с собой кого-нибудь, кто поможет вам задавать вопросы и помнить, что говорит ваш врач ты.
- При посещении запишите название нового диагноза и любые новые лекарства, методы лечения, или тесты. Также запишите все новые инструкции, которые дает вам ваш врач.
- Знайте, почему прописывается новое лекарство или лечение и как оно вам поможет. Также знать, каковы побочные эффекты.
- Спросите, можно ли вылечить ваше состояние другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если вы не примете лекарство или не пройдете тест или процедуру.
- Если у вас запланирована повторная встреча, запишите дату, время и цель этой встречи. визит.
- Знайте, как вы можете связаться со своим поставщиком услуг, если у вас есть вопросы.
Медицинский обозреватель: Стивен Канг, доктор медицины
Медицинский обозреватель: Энн Клейтон APRN
Медицинский обозреватель: Стейси Войцик MBA BSN RN
© 2000-2021 Компания StayWell, ООО.Все права защищены. Эта информация не предназначена для замены профессиональной медицинской помощи. Всегда следуйте инструкциям своего лечащего врача.
Не то, что вы ищете?Telemachus & Irene Demoulas Family Foundation Center for Heart Arrhythmias
Уход во время COVID-19
Наши преданные своему делу врачи, медсестры и персонал стремятся обеспечить наилучший уход. Мы предприняли беспрецедентные шаги, чтобы визиты в офис, процедуры и операции были приятными и безопасными.Ваше здоровье и безопасность являются нашим главным приоритетом.
Узнать больше >
Обзор
Врачи семейного фонда Telemachus & Irene Demoulas Центра сердечных аритмий при Массачусетской больнице общего профиля Corrigan Minehan Heart Center получили международное признание за свою работу в области клинической электрофизиологии, медицинской дисциплины, связанной с электрической системой сердца.
На протяжении почти 30 лет Центр сердечных аритмий оказывает современную медицинскую помощь пациентам со всеми видами сердечных аритмий.Наши опытные специалисты работают со всеми типами пациентов, чтобы определить причину их нарушений сердечного ритма, разработать план лечения, контролировать прогресс и реакцию на лечение. Хотя во многих случаях мы можем вылечить сердечные аритмии; в других случаях лечение направлено на уменьшение или устранение симптомов.
Наши специалисты лечат самых разных пациентов, в том числе молодых и пожилых пациентов, беременных женщин с аритмиями, пациентов с атипичными симптомами или уникальными состояниями, пациентов с семейными заболеваниями и пациентов, которым требуются кардиостимуляторы, ИКД или бивентрикулярные устройства.Мы также лечим пациентов с фибрилляцией предсердий и произвели революцию в медицинской помощи при этом заболевании.
Заболевания, которые мы лечим
Наши специалисты имеют опыт лечения целого ряда нарушений сердечного ритма, в том числе:
- Аритмии (нарушения сердечного ритма)
- Мерцательная аритмия
- Трепетание предсердий
- Наджелудочковая тахикардия
- Фибрилляция желудочков
- Желудочковая тахикардия
- Синдром Бругада (генетическое заболевание)
- Синдром удлиненного интервала QT (генетическое заболевание)
- Брадикардия (замедление сердечного ритма)
- Синдром слабости синусового узла (сердечный ритм слишком быстрый и слишком медленный)
Приверженность исследованиям и образованию
Врачи Центра сердечных аритмий произвели революцию в медицинской помощи при сердечных аритмиях.Врачи во всем мире могут лучше лечить мерцательную аритмию благодаря интеграции изображений — технологии, которую мы помогли разработать, которая объединяет высококачественные изображения анатомии пациента с реальной процедурой.
Многие из наших врачей преподают в Гарвардской медицинской школе, а это означает, что их миссия заключается не только в обеспечении наилучшего ухода за пациентами, но и в стремлении обучать следующее поколение медицинских работников.
Диагностика сердечной аритмии
Сердечные аритмии можно диагностировать с помощью неинвазивных процедур или инвазивных процедур, таких как электрофизиологические (ЭФ) исследования.Наши специалисты предлагают новейшие диагностические процедуры для всех сердечных аритмий. Ваш врач может назначить вам один или несколько из этих тестов.
Лечение и процедуры
Специалисты Центра сердечных аритмий одними из первых врачей в мире применили роботизированную компьютерную систему, которая помогает специалистам аблировать (разрушать) небольшие участки ткани сердечной мышцы, ответственные за распространенные сердечные аритмии. Эта революционная технология позволяет нашим специалистам лечить пациентов с большей точностью, безопасностью и эффективностью, чем это было возможно ранее.
Наши врачи также помогли внедрить новую процедуру катетерной аблации для лечения мерцательной аритмии, наиболее распространенного вида сердечной аритмии. Катетерная абляция подает радиочастотный ток через кончик катетера, чтобы предотвратить прохождение электрических импульсов через ткань сердца в месте аритмии. Эта новая терапия помогла устранить инвалидизирующие симптомы и восстановить качество жизни многих пациентов с мерцательной аритмией.
Обладая передовыми ресурсами, в том числе передовыми технологиями в руках опытных клиницистов, Центр сердечных аритмий предлагает несколько вариантов лечения аритмий.
Доступные методы лечения включают:
Аритмия сердца плода | Павильон для женщин
Обзор
Ритм здорового сердца требует тщательной координации, чтобы правильно перекачивать кровь по всему телу. Этот ритм контролируется электрическими импульсами, которые позволяют синхронизировать заполнение и опорожнение четырех камер сердца.
При многих состояниях электрические импульсы, управляющие сердцем, могут быть нерегулярными, слишком быстрыми (тахикардия) или слишком медленными (брадикардия).
Сердечная аритмия плода, или нерегулярное сердцебиение, является частой причиной обращения к фетальному кардиологу. В большинстве случаев слишком медленное или слишком быстрое сердцебиение носит временный характер. В этих случаях ваша команда будет внимательно следить за вашей беременностью.
Менее 2 процентов нарушений сердечного ритма плода представляют собой истинные сердечные аритмии. Однако, если сердечная аритмия не диагностирована или не лечится, это может привести к серьезным проблемам для ребенка, включая застойную сердечную недостаточность.
К 16 неделям беременности сердце плода полностью сформировано и бьется с частотой от 110 до 160 ударов в минуту (уд/мин).
Легкие случаи аритмии когда-то считались доброкачественными, но теперь врачи признают, что любое нерегулярное сердцебиение следует выявлять и тщательно контролировать, чтобы обеспечить наилучший исход для ребенка.
Сердечные аритмии плода чаще всего классифицируют по одному из следующих признаков:
- Брадикардия — ЧСС ниже 100 ударов в минуту
- Врожденная блокада сердца
- Преждевременные сокращения предсердий (PAC)
- Наджелудочковая тахикардия или трепетание предсердий – ЧСС выше 180 ударов в минуту
В редких случаях присутствуют другие нарушения ритма, над диагностикой и лечением которых мы будем работать
Симптомы и причины
Состояние часто впервые замечается, когда врач прослушивает сердцебиение плода примерно на 10–12 неделе беременности.Однако нарушение ритма может начаться только на более поздних сроках беременности. Как правило, мать не имеет никаких симптомов и не замечает изменений в движениях плода.
Причина большинства аритмий неизвестна, но некоторые случаи могут быть вызваны дисбалансом электролитов, воспалением, приемом лекарств или наследственным генетическим заболеванием. Тяжелые случаи аритмии могут быть вызваны пороком сердца, например врожденной блокадой сердца, или наследственным заболеванием, известным как синдром удлиненного интервала QT.
Тестирование и диагностика
При подозрении на аритмию будут назначены дополнительные тесты, включая эхокардиограмму плода.Этот тест поможет вашему фетальному кардиологу диагностировать, вызвана ли аритмия вашего ребенка нарушением структуры сердца.
Лечение
Все формы аритмий плода оцениваются и лечатся совместно с детскими электрофизиологами и специалистами по фетальной медицине.
Семьям, которые обращаются в Детский фетальный центр Техаса для лечения аритмии своего ребенка, сначала назначается медсестра-координатор, которая помогает планировать множество необходимых посещений и помогает ответить на вопросы.Эта медсестра-координатор доступна круглосуточно и без выходных, чтобы ответить на любые ваши вопросы, помочь вам связаться с врачами и другими специалистами в любое время и в целом провести вас через это сложное и эмоциональное время.
Программа «Сердце плода» в Детской больнице может наблюдать как за ребенком, так и за матерью на протяжении всей беременности и составлять план родов и ухода после родов.
В то время как некоторые нарушения ритма плода являются доброкачественными, другие могут привести к сердечной недостаточности плода и представлять риск для плода и матери.Мы предлагаем различные методы лечения, адаптированные как для плода, так и для матери. Мы тесно сотрудничаем со взрослыми кардиологами, чтобы обеспечить безопасность плода и матери во время лечения.
Если у вашего ребенка диагностирована сердечная аритмия плода, ваша беременность будет находиться под пристальным наблюдением для выявления водянки — серьезного состояния, которое иногда развивается при более тяжелых формах аритмии сердца плода.
Лечение зависит от тяжести и типа аритмии.Некоторые виды аритмии плода можно лечить внутриутробно с помощью определенных лекарств для матери. В других случаях тщательный мониторинг является лучшим вариантом. Это может означать частые повторные визиты в больницу для проведения эхокардиограмм до рождения ребенка.
Вы должны планировать роды в больнице с современным отделением интенсивной терапии и специалистами, которые могут быть рядом при родах, если потребуется операция на сердце.
Рекомендуемое лечение вашего ребенка будет зависеть от типа имеющейся проблемы с сердцем и ее тяжести.Однако чем раньше будет выявлена проблема, тем лучше вы и ваши врачи сможете подготовиться к тому, чтобы дать вашему ребенку наилучший возможный результат.
Узнайте больше об объемах и данных о результатах Детского кардиологического центра Техаса. Наш Кардиологический центр занимает первое место в стране по данным US News & World Report, что делает нашу программу кардиологии плода местом, где можно оказаться, если у вашего будущего ребенка есть проблемы с сердцем, такие как аритмия.
 Аритмия может возникать в ночное время, что может вызвать внезапную остановку сердца.
Аритмия может возникать в ночное время, что может вызвать внезапную остановку сердца.
 Кровоизлияние в мозг может привести к отмиранию части мозга или смерти человека;
Кровоизлияние в мозг может привести к отмиранию части мозга или смерти человека; Тромб может попадать в ток крови, разносится по всему организму, в том числе и в мозговые артерии, вызывая развитие инсульта, т.е. повреждения или гибели части мозга, а иногда приводит к смерти.
Тромб может попадать в ток крови, разносится по всему организму, в том числе и в мозговые артерии, вызывая развитие инсульта, т.е. повреждения или гибели части мозга, а иногда приводит к смерти.
 д.
д.
 Некоторые безрецептурные и отпускаемые по рецепту лекарства могут вызывать аритмии у некоторых людей
Некоторые безрецептурные и отпускаемые по рецепту лекарства могут вызывать аритмии у некоторых людей Никогда не прекращайте принимать лекарства, отпускаемые по рецепту, не посоветовавшись предварительно с врачом.
Никогда не прекращайте принимать лекарства, отпускаемые по рецепту, не посоветовавшись предварительно с врачом.

