АКТГ (Адренокортикотропный гормон, кортикотропин, Adrenocorticotropic Hormone, ACTH)
Метод определения Твердофазный хемилюминесцентный иммуноанализ.
Исследуемый материал Плазма крови
Доступен выезд на дом
Важнейший регулятор синтеза и выделения гормонов коры надпочечников.
Полипептидный гормон, вырабатываемый передней долей гипофиза.
АКТГ имеет два основных эффекта: ускоряет выработку стероидных гормонов (кортизола, а также небольших количеств андрогенов и эстрогенов) и обеспечивает поддержание массы надпочечника на нормальном уровне. АКТГ стимулирует в основном синтез кортизола, запасы которого в надпочечнике незначительны, в меньшей степени контролирует выделение этого гормона в кровь. АКТГ повышает чувствительность клубочковой зоны коры надпочечника к веществам, активирующим выработку альдостерона. В жировой ткани стимулирует расщепление жиров, поглощение аминокислот и глюкозы мышечной тканью, высвобождение инсулина из b-клеток поджелудочной железы, вызывая гипогликемию. АКТГ стимулирует пигментацию кожи.
Секреция АКТГ находится под контролем кортикотропин-рилизинг гормона (КРГ) гипоталамуса. Выделение гормона подчиняется выраженному суточному ритму. В 6 — 8 часов концентрация максимальна, в 21 — 22 часа — минимальна. Секреция АКТГ на некоторое время опережает повышение уровня кортизола в крови. В течение дня могут наблюдаться значительные колебания концентрации гормона. Основная роль в поддержании суточного ритма секреции принадлежит внешним факторам. При резкой смене часовых поясов суточный ритм секреции АКТГ нормализуется в течение 7 — 10 дней. Сильная стрессовая ситуация приводит к прерыванию суточного ритма, резкому повышению кортизола в крови через 25 — 30 минут от начала стресса. Также на уровень АКТГ влияют: фаза менструального цикла, беременность, эмоциональное состояние, боль, повышение температуры, физическая нагрузка, хирургические вмешательства и др. Из крови АКТГ захватывается паренхиматозными органами и быстро разрушается. Время биологического полураспада АКТГ — 7 — 12 минут.
Пределы определения: 5,0 пг/мл-1250 пг/мл
www.invitro.ru
Адренокортикотропный гормон
АКТГ – полипептидный гормон передней доли гипофиза, стимулирует выработку кортикостероидов корой надпочечников. Секреция АКТГ находится под контролем кортикотропин-рилизинг гормона (кортиколиберина) гипоталамуса. Синтезированные под действием АКТГ кортикостероиды воздействуют на гипоталамус и по механизму отрицательной обратной связи подавляют секрецию кортиколиберина. АКТГ активирует ферменты, обеспечивающие преобразование холестерина, основного субстрата для синтеза стероидов и таким образом ускоряет выработку стероидных гормонов – в основном кортизола, в меньшей степени – андрогенов и эстрогенов, минералкортикоидов и катехоламинов. АКТГ активно влияет на основные процессы метаболизма: стимулирует синтез ДНК, липолиз, поглощение глюкозы мышечной тканью и др.
АКТГ имеет суточный ритм секреции: максимум наблюдается с 06.00 до 08.00 часов, минимум – с 21.00 до 22.00, в течение дня возможны значительные колебания. Суточный ритм секреции подвержен влиянию внешних факторов: он меняется при смене часовых поясов, стрессе. Цикличность секреции АКТГ нарушается при всех формах гиперкортицизма, кроме некоторых опухолей надпочечников.
Уровень АКТГ меняется в результате многих физиологических (фаза менструального цикла, беременность, эмоциональное состояние физическая нагрузка) и патологических (боль, повышение температуры, хирургические вмешательства и др.) факторов. У пациентов с гипокортицизмом повышенный уровень АКТГ свидетельствует о первичной адреналовой недостаточности, тогда как отсутствие такового свидетельствует о вторичной надпочечниковой недостаточности гипофизарной или гипоталамической природы. У пациентов с гиперкортицизмом (синдромом Иценко Кушинга) низкий уровень АКТГ в крови может быть обусловлен кортизол-продуцирующей аденомой или карциномой, первичной надпочечниковой гиперплазией или применением терапии глюкокортикоидами. Нормальный или повышенный уровень АКТГ при клинически установленном синдроме Иценко-Кушинга относит пациен- та к категории АКТГ-зависимой формы синдрома Иценко-Кушинга. Это состояние может быть вызвано как аденомой гипофиза, так и эктопической продукцией АКТГ (бронхиальный карциноид, мелкоклеточный рак легкого и т.п.). При сомнительных результатах, а также при подозрении на синдром Иценко-Кушинга, при котором теряется суточный ритм секреции АКТГ, рекомендуется двукратный забор крови (утром и вечером). При необходимости повторного исследования для адекватного сравнения результатов последующие пробы берут в то же время, что и первые. Для определения источника продукции АКТГ необходима более углубленная диагностика, которая может включать тест подавления дексаметазоном (при болезни Кушинга дексаметазон в больших дозах подавляет секрецию АКТГ и кортизола, а при эктопической АКТГ–продуцирующей опухоли и опухоли надпочечника – нет), тест стимуляции кортикотропин-рилизинг гормоном, пункция пирамидального синуса височной кости, лучевые методы визуализации.
Показания к исследованию
- Дифференциальная диагностика первичной и вторичной надпочечниковой недостаточности;
- дифференциальная диагностика синдрома и болезни Иценко-Кушинга;
- исключение АКТГ-секретирующей опухоли при обнаружении объемного образования гипофиза;
- исключение эктопической продукции АКТГ при наличии опухоли неясного генеза и клиники гиперкортицизма.
Повышенные значения
Пониженные значения
- Вторичная недостаточность коры надпочечников;
- гипопитуитаризм;
- опухоль надпочечников.
www.cmd-online.ru
| Не-эндокрин. железы | Гастроэнтеропанкреатическая эндокринная система: Желудок: гастрин · грелин · 12-перстная: CCK · GIP · секретин · мотилин · Вазоактивный интестинальный пептид (VIP) · Подвздошная кишка: энтероглюкагон · Печень/другое: Инсулиноподобный фактор роста (IGF-1, IGF-2) Жировая ткань: лептин · адипонектин · резистин Скелет: Остеокальцин Почки: JGA (ренин) · перитубулярные клетки (EPO) · кальцитриол · простагландин Сердце: натрийуретический пептид (ANP, BNP) |
|---|
dic.academic.ru
Адренокортикотропный гормон — Википедия
Адренокортикотропный гормон, или АКТГ, кортикотропин, адренокортикотропин, кортикотропный гормон (лат. adrenalis-надпочечный, лат. cortex-кора и греч. tropos — направление) — тропный гормон, вырабатываемый базофильными клетками передней доли гипофиза. По химическому строению АКТГ является пептидным гормоном.
Строение
Последовательность аминокислотных остатков в АКТГМолекула АКТГ человека состоит из 39 аминокислотных остатков (4,540 Да). Характеристики АКТГ определяются различными участками его пептидной цепи: участок с 4 по 10 аминокислоту является актоном (пептидом, определящим функцию, синтетический аналог этого участка — препарат Семакс), с 15 по 21 (особенно с 15 по 18) аминокислоту — гаптоном (пептидом, определяющим специфичность связывания с рецептором). Участок с 1 по 3 и с 11 по 13, по-видимому, обуславливает меланоцитостимулирующую роль АКТГ, с 25 по 33 — иммуногенные свойства АКТГ данного вида животного (он более других участков различается у различных видов животных). Участок с 20 по 24 защищает АКТГ от действия экзопептидаз, играя роль стабилизатора. Такая множественность обладающих биологической активностью участков АКТГ обуславливает наличие нескольких биологических эффектов гормона и возможность связывания его с несколькими видами рецепторов.
По прошествии определенного периода времени молекула АКТГ может расщепиться на α-меланоцит-стимулирующий гормон и КЛИП, белок, роль которого ещё не изучена.
Видео по теме
Биосинтез
АКТГ, как и некоторые другие гормоны (меланоцитостимулирующий гормон, липотропины и β-эндорфин), синтезируется из белка-предшественника проопиомеланокортина (пре-проопиомеланокортина). Удаление из пре-проопиомеланокортина в процессе трансляции сигнальной пептидной последовательности, приводит к образованию проопиомеланокортина, который, претерпев ряд посттрансляционных модификаций (фосфорилирование и гликозилирование), расщепляется эндопептидазами на различные полипептидные фрагменты с разной активностью.
Синтез АКТГ подчинён особому ритму, который, в свою очередь, подчинён ритму выделения кортиколиберина. Максимальная секреция АКТГ (а также либерина и глюкокортикоидов) наблюдается утром в 6-8 часов, а минимальная — между 18 и 23 часами.
Рецепторы АКТГ
Специфическим рецептором АКТГ считается MC2R — один из меланокортиновых рецепторов, расположенных в основном на клетках коры надпочечников и жировой ткани. Это семиспиральный рецептор, связанный c Gs-белком. Кроме того, АКТГ связывается с разной степенью аффинности с остальными меланокортиновыми рецепторами, которые расположены на многих типах клеток — клетках кожи, меланоцитах, клетках иммунной системы и др.
Физиологическая роль
Кортикотропин контролирует синтез и секрецию гормонов коры надпочечников (особенно их пучковой зоны). В основном кортикотропин влияет на синтез и секрецию глюкокортикоидов — кортизола, кортизона, кортикостерона. Попутно повышается синтез надпочечниками прогестерона, андрогенов и эстрогенов. Это может иметь как хронический, так и кратковременный характер. Относительно механизма стимуляции АКТГ синтеза кортикостероидов выдвигалось несколько теорий:
- Теория Хейнса (R. C. Haynes). Согласно Хейнсу, АКТГ повышает активность аденилатциклазы, катализирующей превращение АТФ в циклический 3’,5’- аденозинмонофосфат (3’,5’- АМФ), активирующий фосфорилазу. Фосфорилаза, в свою очередь, расщепляет гликоген надпочечников до глюкозо-1-фосфата, превращающегося далее в глюкозо-6-фосфат. Глюкозо-6-фосфат, обмениваясь через пентозный цикл, приводит к увеличению восстановленного никотинамидадениндинуклеотидфосфата (НАДФН2), являющегося необходимым кофактором при превращении холестерина в прегненолон и при гидроксилировании стероидных предшественников до конечных продуктов стероидогенеза.
- Теория МакКёрнса (K. W. McKerns). В целом сходна с предыдущей за исключением одного момента: она объясняет повышение концентрации НАДФН2 в надпочечниках не как результат усиления гликогенолиза, а как результат повышения активности глюкозо-6-фосфатдегидрогиназы.
- Теория Гаррена (L. D. Garren) с сотр. Согласно этой теории, АКТГ стимулирует аденилатциклазу в мембранах клеток и увеличивает поступление циклического 3’,5’- АМФ в цитоплазму, где 3’,5’- цАМФ взаимодействует с комплексом рецепторный белок — протеинкиназа и, вызывая его диссоциацию, активирует протеинкиназу. Протеинкиназа фосфорилирует рибосомы и стимулирует в них синтез специального белка, проходящий с использованием стабильной иРНК в качестве матрицы. Образовавшийся белок производит перенос свободного холестерина из жировых капель цитоплазмы в митохондрии, где находится белок P450scc, имеющий ферментативную функцию. Он ускоряет образование стероидов, началом которого является разложение холестерина, вследствие чего, из него образуется прегненолон, а затем и кортикостероиды (транскрипцию генов стероидогенных ферментов, к которым и принадлежит P450scc, способен стимулировать сам АКТГ при длительном действии).
На данный момент подтверждённой считается теория Гаррена [1].
В некоторой степени кортикотропин повышает также синтез и секрецию минералокортикоидов — дезоксикортикостерона и альдостерона. Однако кортикотропин не является основным регулятором синтеза и секреции альдостерона. Основной механизм регуляции синтеза и секреции альдостерона находится вне влияния оси гипоталамус — гипофиз — кора надпочечников — это ренин-ангиотензин-альдостероновая система.
Кортикотропин также в небольшой степени увеличивает синтез и секрецию катехоламинов мозговым веществом надпочечников. Однако кортикотропин не является основным регулятором синтеза катехоламинов в мозговом веществе надпочечников. Регуляция синтеза катехоламинов осуществляется в основном через симпатическую стимуляцию хромаффинной ткани надпочечников либо через реакцию хромаффинной ткани надпочечников на такие факторы, как её ишемия или гипогликемия.
Кортикотропин также повышает чувствительность периферических тканей к действию гормонов коры надпочечников (глюкокортикоидов и минералокортикоидов).
В больших концентрациях и при длительном воздействии кортикотропин вызывает увеличение размеров и массы надпочечников, особенно их коркового слоя, увеличение запасов холестерина, аскорбиновой и пантотеновой кислот в коре надпочечников, то есть функциональную гипертрофию коры надпочечников, сопровождающуюся увеличением общего содержания в них белка и ДНК. Объясняется это тем, что под влиянием АКТГ в надпочечниках повышается активность ДНК-полимеразы и тимидинкиназы — ферментов, участвующих в биосинтезе ДНК. Длительное введение АКТГ ведёт к увеличению активности 11-бета-гидроксилазы, сопровождающееся появлением в цитоплазме белкового активатора фермента. При повторных инъекциях АКТГ в организме человека также изменяются соотношения секретируемых кортикостероидов (гидрокортизона и кортикостерона) в сторону значительного увеличения секреции гидрокортизона.
Также АКТГ способен к меланоцитостимулирующей активности (он способен активировать переход тирозина в меланин) за счет последовательности 13-ти аминокислотных остатков N-концевого участка. Это объясняется схожестью последней с последовательностью аминокислот в α-меланоцитостимулирующем гормоне.
Большое число данных указывает на то, что АКТГ/МСГ-подобные пептиды способны ингибировать процессы воспаления.
АКТГ способен к взаимодействию с другими пептидными гормонами (пролактином, вазопрессином, TRH, VIP, опиоидными пептидами), а также с медиаторными системами моноаминов гипоталамуса. Установлено, что АКТГ и его фрагменты способны влиять на память, мотивацию, процессы обучения.
Помимо ключевой функции, заключающейся в регуляции секреции коры надпочечников, АКТГ регулирует многие процессы в различных клетках, например, в остеобластах, отвечающих за образование костной ткани. Влияние АКТГ на остеобласты было обнаружено в 2005 году. Исследования показали, что ответная реакция остеобластов на АКТГ включает в себя выработку фактора роста эндотелия сосудов, сигнального белка, стимулирующего формирование кровеносных сосудов. Такая ответная реакция в некоторых случаях может играть важную роль в выживании остеобластов.
Медицинское значение
В ряде случаев с пациентами проводится АКТГ-тест (определение уровня АКТГ в крови). Нормальным считается уровень АКТГ 9-52 пг/мл. Повышенный уровень АКТГ наблюдается при болезни Аддисона (или первичной недостаточности) (возникает в результате хронически повышенного уровня АКТГ, что является причиной дефицита кортизола), болезни Кушинга, вызываемой опухолью гипофиза, ренолейкодистрофии, синдроме Нельсона и эктопических опухолях, продуцирующих АКТГ. Пониженный уровень АКТГ может наблюдаться при синдроме Кушинга, связанном с опухолями надпочечников, и при гипофизарной недостаточности.
При рецессивно-аутосомных мутациях рецептора АКТГ наблюдается семейный дефицит глюкокортикоидов.
Регуляция секреции
У человека синтез и секреция АКТГ в кровь регулируется гипоталамусом, выделяющим кортиколиберин — АКТГ-рилизинг-фактор. Синтезированные под действием АКТГ кортикостероиды выходят в кровь и воздействуют на гипоталамус и по механизму отрицательной обратной связи подавляют секрецию кортиколиберина. Кроме того, известно, что глюкокортикоиды могут также подавлять транскрипцию гена проопиомеланокортина и синтез полипептидной цепи.
Период полураспада АКТГ в крови человека составляет приблизительно десять минут.
Искусственный АКТГ
Искусственный АКТГ, состоящий из первых 24 аминокислот природного гормона, был впервые получен Клаусом Гофманном в Питтсбургском Университете. В синтетических формах АКТГ известен как Синактен или Кортрозин. Эти два вещества используются в Австралии и Великобритании для проведения АКТГ-тестов, показывающих эффективность работы надпочечников в стрессовых ситуациях.
Поначалу искусственный АКТГ использовали в качестве замены так называемого Актар геля для лечения эпилептических спазмов. Но из-за резко возросших цен лекарство потеряло популярность. Вскоре оно было также предложено для лечения аутоиммунных заболеваний и нефротических синдромов.
Открытие
Работая над диссертацией, Эвелин М. Андерсон, совместно с Джеймсом Бертрамом Коллипом и Дэвидом Томсоном Ландсборо, исследовала функцию АКТГ и объяснила её в статье, опубликованной в 1933 году.
Литература
- Агаджанян Н. А., Тель Л. З., Циркин В. И., Чеснокова С. А.. Физиология человека. Санкт — Петербург: Сотис, 1998 . с. 153—154
- Большая Медицинская Энциклопедия. Гл. ред. Б. В. Петровский. Изд. Советская Энциклопедия, 1982. 3-е издание; том 1, с. 110—111
- Розен В. Б. Основы эндокринологии // М.: Изд-во МГУ, 1994
- Strand F. et al., 1993 , Pranzatelli M. et al., 1994 , Googman B. et al., 1994 , Gotoh M. et al., 1994 , Hatzinger M. et al., 1995 , Kiem D. et al., 1995 , Musselman D. & Nemeroff C., 1995
Ссылки
- АКТГ (ACTH, кортикотропин, адренокортикотропный гормон) — humbio.ru
wiki2.red
Адренокортикотропный гормон (АКТГ). — МегаЛекции
Окситоцин.
Образуется преимущественно в нейронах паравентрикулярного ядра гипоталамуса -> аксоны -> нейрогипофиз -> кровь.
Основные мишени:
· мышечный слой матки (миометрий)
· мышечные клетки протоков молочных желез и семенников.
Стимулирует сокращение мускулатуры матки, способствует изгнанию плода при родах, усиливает лактацию.
Возбудитель секреции: раздражение рецепторов сосков при лактации. Уровень повышается в конце беременности -> продвижение плода к шейке матки. После родов секреция тормозится.
В молочные железы поступает с током крови.
Увеличивает перистальтику мышцы, поднимающей яичко. Стимулирует гладкую мускулатуру семенных протоков при эякуляции.
Антагонист – вазопрессин.
Ухудшает обучение, память.
Гипоталамус
Расположен под третьим желудочком, под таламусом (зрительные бугры). Вырабатывает специфические продукты нейросекреторными клетками (нейросекреция). Эти клетки объединяют свойства нейронов и эндокринных клеток. Способны генерировать, передавать по аксонам нервный импульс. В цитоплазме – синтез гормонов: пептиды, видоизмененные аминокислоты. У животных большая часть нейрогормонов вырабатывается в гипоталамусе.
Есть 2 группы крупных клеток, которые образуют:
· супраоптическое ядро
· паравентрикулярное ядро
Под действием внутренних и внешних факторов начинает усиленно синтезировать гормоны и транспортировать их к окончанию в виде гранул – нейрогемальные области. В них нейросекрет попадает в кровяное русло и переносится к мишеням.
Важнейшие нейрогемальные области:
· нейрогипофиз
· срединное возвышение (гипоталамус)
В задней доле гипофиза нет синтеза гормонов, только выделение гормонов гипоталамуса. В гипоталамусе образуются вещества пептидной структуры -> кровь -> аденогипофиз -> регуляция биосинтеза и выброса гормонов.
Гипоталамо-гипофизарная область функционирует как одно целое.
Вещества, стимулирующие образование гормонов аденогипофиза – либерины, тормозящие – статины.
Кортиколиберин – кортикотропин + бета-тропин.
Соматолиберин = соматотропин.
Поступают в венозное возвышение –> гипофиз –> воздействуют на продукцию.
2 системы:
· Гипоталамо-нейрогипофизарная
· Гипоталамо-аденогипофизарная (либерин/статин, контроль гормональной функции передней, средней долей гипофиза)
Гипоталамус – коллектор стимулов из внутренней и внешней среды. На него проецируется влияние подкорковых областей (мозжечок и тд). Влияют железы: щитовидная, половые, надпочечники.
Нейроэндокринная система: гипоталамус, гипофиз, периферические эндокринные железы.
Кортиколиберин – кора надпочечников.
Тиролиберин/тропин – тиреоидные гормоны.
Гонадолиберин, фоллитропин, лютропин – половые гормоны.
Функциональная роль (гипоталаммуса?) – поддержание постоянства внутренней среды, гомеостаз. Связующее звено между нервной и эндокринной системами: трансформация нейроэндокринного импульса в нейрогормоны. Место взаимодействия нервной и эндокринной систем. Регуляция ряда эндокринный функций – «эндокринный мозг». В нем грань между нервной и эндокринной системами стирается.
Гипофиз происходит из той же эмбриональной закладки, что и гипоталамус.
Еще ф-ции:
· Возможно, стимулирует и переднюю долю гипофиза (АКТГ)
· Регуляция температуры тела
· Регулятор аппетита (подавляет его)
Этот участок (регулятор аппетита) определяет уровень глюкозы в крови. При его падении – желание ЖРАТЬ.
· Регулирует цикл сон/бодрствование
Следит за сменой времени суток (ок. 24ч). Смещение цикла приводит к нарушению регулярности питания и сна. Депривация сна вызывает нарушение координации ЦНС. Отсутствие сна убивает быстрее, чем отсутствие пищи. Летаргический энцефалит -> длительная кома. Трипасономия – сонная болезнь.
· Центр удовольствия
Гипофиз
(нижний мозговой придаток)
· Аденогипофиз
· Нейрогипофиз
К аденогипофизу относят переднюю, среднюю, тубелярную зоны.
Нейрогипофиз: задняя доля, воронка, срединное возвышение.
Передняя и средняя доли образуются из выроста ротового углубления. Являются наиболее массивной частью, состоят из 3-х типов клеток:
· Главные (хромофобные)
· Оксифильные
· Базофильные
Роль туберальной части до конца не выяснена.
Средняя доля состоит у человека из щелевидных клеток. Выстилающие их клетки синтезируют гормон мелатонин.
Задняя доля – карман желудочка. Составляющие:
· клетки эпендимы (выстилают полости желудочков)
· волокна нейроглии
Гипофиз находится под контролем гипоталамуса.
Соматотропин (СТГ)
Синтез: ацидофильные клетки переднего гипофиза.
Один из самых важных гормонов с широким спектром действия: регулирует все виды обмена.
Функции. Важнейший регулятор ростовых процессов. Оказывает стимулирующее влияние на линейный рост, общие размеры тела, его массу, массу отдельных органов. При его удалении прекращается рост. Инъекции вызывают продолжение ростовых процессов.
Структура. Это белок, состоящий из 191 аминокислотного остатка (2 дисульфидных мостика). Кодируется геном из 17-й хромосомы. Примерно на 85% гомологичен соматомаммотропину и на 20% пролактину.
Образование на ранних этапах. Обнаруживается на 10-14 нед. в/у. С 20-й недели – увеличение концентрации (особенно с третьего месяца). В этот момент концентрация СТГ в 40 раз выше (чем у взрослых?). Остается одинаковой у плодов обоего пола. Перед рождением концентрация снижается в 10 раз.
Особо активен на ранних этапах онтогенеза и до 1 года. Чуть менее активен в период раннего детства.
Существует значительный индивидуальный разброс. Увеличение продукции неравномерно, зависит от возраста и физического развития. Первое значительное повышение в 10-11л, второе – в 14-15л (это 1-й и 2-ой перекрёсты ростовых кривых).
Существуют возрастные особенности чувствительности тканей-мишеней к СТГ. Первые 5-6л она низка -> необходимо увеличение концентрации. После пубертатной волны – снижение уровня, минимальный – к 20-и годам. Зависит от хронологического и биологического возраста. Положительно скоррелирован с линейными и общими размерами тела.
Физиологические эффекты:
1. Анаболический гормон: усиливает синтез белков. Создает условия для лучшего проникновения аминокислот через клеточную мембрану, особенно костей, мышц, печени, почек. Вместе с инсулином – главный белоксинтезирующий гормон.
2. Стимуляция линейного роста. Увеличивается длина трубчатых костей за счет стимуляции клеточного деления и синтеза белков + разрастание хрящевой ткани, эпифизов.
3. Липолитическое действие: стимулирует распад жира, особенно в период активного роста детей.
Высвобождающиеся жирные кислоты используются в качестве источника энергии для синтеза белков. Увеличивается объем мышц, мягких тканей.
Недостаток СТГ ведет к ограничению роста, развитию атеросклероза, активному жироотложению.
Синдром приобретенного СТГ дефицита у взрослых ведет к нарушению пропорций:
· Ожирение (трункальное – в области туловища)
· Остеопороз
· Уменьшение мышечной массы
· Нарушение метаболизма липидов
· Нарушения в сердечно-сосудистой системе
· Изменение психического статуса (депрессия и тд). Одна из причин – лизис дофамина.
4. Регуляция углеводного обмена. Осуществляется бимодально: 1-я фаза – инсулиноподобное действие (воздействует на клетки поджелудочной -> выброс инсулина), снижение потребления глюкозы, гипогликемия -> увеличение выброса СТГ (гипер -> снижение).
2-я фаза: антагонист инсулина; запуск гликонеогенеза. СТГ – диабетогенный гормон.
5. Выраженная лактогенная активность.
6. Адаптивный гормон (особенно во взрослом состоянии).
7. Рост лимфатических желез
8. Регулирует функцию вилочковой железы.
9. Лимфопоэз в красном костном мозгу.
Обладает видовой специфичностью. Человеку подходит СТГ приматов.
Классическая схема
Согласно классической схеме регуляция СТГ осуществляется гипоталамусом через соматолиберин (гормон роста/релизинг-гормон) – стимулирующее воздействие. Соматостатины подавляют выработку СТГ.
Вырабатываются нейросекреторными клетками гипоталамуса, достигают гипофиза и влияют на соматотрофы – высоко дифференцированные соматотропные клетки, имеющие рецепторы к сигнальным пептидам и продуцирующие СТГ. Базальный уровень секреции СТГ поддерживается базальным(?) выбросом гипофиза, ритмы суточные, порционные, в соответствии с фазами сна.
Максимум – в ночное время, соответственно 1-й фазе глубокого сна. Для возникновения выброса СТГ требуется одновременное уменьшение секреции соматостатина и увеличение соматолиберина.
Соматостатин – пептид, содержащий кольцевую структуру. Состоит из 14-и аминокислотных остатков. Впервые найден в гипоталамусе, позднее – в ЖКТ, поджелудочной. В островках Лангерганса есть немного дефинитивных клеток (D-клетки), в которых происходит синтез и локализация соматостатина.
Один из его эффектов – торможение секреции инсулина и глюкагона. Подавляет секрецию инсулина, вызванную введением глюкозы. Еще сильнее действует на глюкагон.
Регулятор многих секреторных циклов в организме. Тормозит «избыточные» реакции.
Действует посредством соматомединов (в периферических тканях). Через них оказывает опосредованное влияние на метаболизм. Стимулирует рост, связанный с инсулином.
Соматомедин. Молекулярная масса – 6-8 кДа. Есть формы А, В, С. А и С схожи с инсулином, В имеет своеобразное строение.
При тяжелых заболеваниях печени активность падает (особенно А), тормозится ростовое влияние СТГ.
Соматомедины – факторы роста ИФР-1, ИФР-2. Полагают, что циркулирующий в крови ИФР-1 – основной фактор роста, стимулирует встраивание сульфата в костную ткань.
Секреция происходит относительно равномерно. В плазме связаны со специфическими белками: ИФР-СБ-(1-6). Важный показатель – связывающий белок ИФР-СБ-3.
В основе отставания в росте из-за СТГ лежат разные причины:
1. Абсолютный дефицит СТГ
2. Недостаток соматомедина
3. Пониженная чувствительность клеток периферических тканей (напр. У пигмеев центральной Африки нормальное/повышенное содержание СТГ).
СТГ синтезируется с помощью рекомбинантной ДНК.
Патологии
Большинство – из-за гипо/гиперфункции эндокринной системы. Это приводит к клиническим заболеваниям.

 Гигантизм. Возникает при СТГ-продуцирующих опухолях гипофиза. Характерно значительное пропорциональное увеличение роста и массы тела (до 2м 70см, 250 кг и тд). Гиперфункция СТГ начинается еще до закрытия гипофизарных ростовых зон (до 10-и лет) и продолжается в течение всего физиологического роста. Тело пропорционально. Отличаются от конституциональной высокорослости и акселератов (13-15л). Одна из главных причин – эозинофильная аденома передней доли гипофиза. Допускают, что обусловлен реактивной реакцией хрящей на СТГ. Другая причина – инфекции (в т.ч. энцефалиты). Может начаться и в юношестве. Бывает преимущественно у лиц мужского пола. При рождении рост и вес в норме, родители нормальные. Продолжительность их жизни в среднем 21г. Есть данные, что некоторые доживали до 50-и. Если опухоль перерождается – слабость, гиперемия, гиподинамия, высокая вероятность инфекции -> смерть. При отсутствии опухолей сопровождается повышенной мышечной слабостью, утомляемостью.
Гигантизм. Возникает при СТГ-продуцирующих опухолях гипофиза. Характерно значительное пропорциональное увеличение роста и массы тела (до 2м 70см, 250 кг и тд). Гиперфункция СТГ начинается еще до закрытия гипофизарных ростовых зон (до 10-и лет) и продолжается в течение всего физиологического роста. Тело пропорционально. Отличаются от конституциональной высокорослости и акселератов (13-15л). Одна из главных причин – эозинофильная аденома передней доли гипофиза. Допускают, что обусловлен реактивной реакцией хрящей на СТГ. Другая причина – инфекции (в т.ч. энцефалиты). Может начаться и в юношестве. Бывает преимущественно у лиц мужского пола. При рождении рост и вес в норме, родители нормальные. Продолжительность их жизни в среднем 21г. Есть данные, что некоторые доживали до 50-и. Если опухоль перерождается – слабость, гиперемия, гиподинамия, высокая вероятность инфекции -> смерть. При отсутствии опухолей сопровождается повышенной мышечной слабостью, утомляемостью.
 Акромегалия. Если метафизарные ростовые области уже закрыты, возникает акромегалия. Гиперпродукция СТГ ведет к неравномерному разрастанию тканей скелета: череп, нижняя челюсть, расширение и утолщение кистей рук, ног, ушных раковин и тд. Начинается после окончания ростовых процессов, длится долгие годы.
Акромегалия. Если метафизарные ростовые области уже закрыты, возникает акромегалия. Гиперпродукция СТГ ведет к неравномерному разрастанию тканей скелета: череп, нижняя челюсть, расширение и утолщение кистей рук, ног, ушных раковин и тд. Начинается после окончания ростовых процессов, длится долгие годы.
СТГ действует через медиаторы. Наиболее чувствительна к нему хрящевая ткань (особенно в эпифизах трубчатых костей). При закрытии этих зон отсутствует реакция на СТГ.
Гипофизарная карликовость (церебральный гипофизарный нонизм). Уменьшение размеров тела.
Формы карликовости:
· Гипофизарная (первичная патология) – 1/15000 населения.
·  Идиопатическая – около 75% случаев.
Идиопатическая – около 75% случаев.
Уменьшение бывает:
· Пропорциональное
· Непропорциональное
Гипофизарная карликовость возникает из-за нарушения гипофиза, иногда соматотропная функция вообще отсутствует. Точная причина неизвестна. Возможно это внутриутробное (или генетическое) поражение ЦНС. При рождении карлики имеют нормальные размеры тела, растут до 2-3 лет, затем рост практически прекращается. Задержка развития костей. Ядра подвержены оссификации, зоны окостенения открыты долго (?). Часто отсутствуют вторичные половые признаки, стерильны, непропорциональны, раннее увядание кожи, образование складок. Интеллект обычно не нарушен, но снижена работоспособность. Замкнуты, негативны.
Наблюдается дефицит гонадотропных гормонов (в 94% случаев).
Адренокортикотропный гормон (АКТГ).
Другое название – кортикотропин. В 1955г установлена структура у свиньи.
Структура. Пептид, 4,5 кДа, 39 аминокислотных остатков. За биологические и имунные свойства ответственны четко отграниченные участки. С 4 по 10 остатки (АКТГ4-10) – октон, АКТГ11-14 – гаптон.
АКТГ1-3,15-21,22-24 – защитная и стабилизирующая роль, предохраняет октон и гаптон от разрушительных воздействий. АКТГ25-39 вероятно не имеет биологических эффектов.
Образование и функции. Образуется в базофильных клетках передней доли гипофиза. Нет видовой специфичности. Мишень – кора надпочечников. Стимулирует рост пучковой и сетчатой зон коры и биосинтез их гормонов: глюкокортикоидов и андрогенов.
Основной регулятор биосинтеза и секреции глюкокортикоидов. Секреция АКТГ стимулируется кортиколиберином (гипоталамус) -> в постнатальном развитии функционирует единая система. Длительное введение АКТГ ведет к гипертрофии надпочечников.
Через некоторое время после выброса начинается ответная реакция.
Кортизол и кортикостерон – для приспособления к неблагоприятным условиям, приводящим к стрессу.
АКТГ может оказывать влияние и независимо от коры надпочечников: повышает потребление кислорода, снижает уровень инсулина, стимулирует распад жиров жировой ткани, выход в кровь жирных кислот.
Меланостимулирующее действие: для пигментации кожи, адаптации к темноте.
Оказывает влияние на функции нейронов мозга: способствует формированию долговременной памяти. Даже только АКТГ4-10 в одиночку может проникать в мозг, действовать на ЦНС:
· Усиливает селективность внимания
· Стимулирует запоминание, обучение
· Улучшает настроение (антидепрессивный эффект)
Воздействие прямое, выраженное.
· Стимулирует эмоциональность, двигательную активность
· Усиливает тревожность
· Подавляет аппетит
· Усиливает половое влечение
· Улучшает когнитивные функции
Действует на стероидогенез.
Особенно сильно влияет на реакции стресса. При нарушении секреции – нарушение адаптации к стрессу.
Имеет суточный ритм, но выбрасывается в кровь постоянно. Наибольший выброс – в утренние часы (перед и во время пробуждения). Усиливается его секреция при любых неблагоприятных воздействиях: голод, боль и тд.
Стимулирует синтез прегненолона — основного предшественника стероидов.
Раннее развитие. Функция формируется на ранних стадиях внутриутробного развития. Впервые обнаруживается на 8 нед в/у. К 20-22 неделе содержание увеличивается, возрастает до рождения. Секреция начинается на 9-10 нед. Наиболее высокий уровень: на 12-19 нед (в 4-5 раз больше, чем у взрослых). Перед рождением его уровень падает.
Регуляция. Регуляция почти не изучена. Видимо, основная роль принадлежит кортикотропину: активация процессов биосинтеза в фетальной коре надпочечников. Гипофункция эндокринных желез матери сначала приводит к гипертрофии соответствующей железы плода, затем к истощению и гипофункции. Та же закономерность для гормонов коры надпочечников: гормональный транспорт в тело матери. На поздних стадиях уровень глюкокортикоидов может влиять на продукцию кортиколиберина – ключевое звено.
Факторы среды для матери: стресс, интоксикация, воспаление -> нарушение гормонов у плода. Уменьшение уровня гормонов – само по себе стресс.
Ганс Солье: введение животным глюкокортикоидов ведет к остановке роста. То же происходит и при стрессе, когда вся система активна. Введение СТГ не показывает обычного эффекта при одновременном введении глюкокортикоидов.
Психоэмоциональные факторы: дефицит эмоций, отказ от кормления, от ребенка – ведет к замедлению в росте, умственном созревании. У таких детей понижен кортикотропин, АКТГ и все гормоны аденогипофиза.
В постнатальном развитии наименьшая концентрация наблюдается в 13 и 16 лет (13л – первый перекрест). Наибольшая концентрация — 14-15 (2-й перекрест) и 17-18 лет. После 60-и лет уровень снижается.
В наибольших количествах обнаруживается в гипоталамусе.
Одна из особенностей системы – суточный ритм. При обычном режиме максимум действия (акрофаза) приходится на первые часы активности. Увеличивается уровень глюкокортикоидов в крови, происходит их экскреция с мочой. В основе этого – смена состояния нервных центров.
Длительное введение АКТГ -> гипертрофия, повышение содержания глюкокортикоидов в крови.
Минимальный уровень чувствительности коры к АКТГ – в 8 лет, максимальный – в 18 (относительно позднее изменение).
Деятельность надпочечников имеет и сезонные колебания. АКТГ не накапливается, а синтезируется и выделяется непосредственно перед действием. Уровень повышается зимой, особенно в январе. То есть зимой эффективность стимуляции надпочечников возрастает.
Концентрация кортизола минимальна в 8л, а АКТГ – максимальна. К 9-и годам кортизол/кортикостерон: 4-1 (???). Максимальная уровень чувствительности коры в 18-19 лет.
Патологии
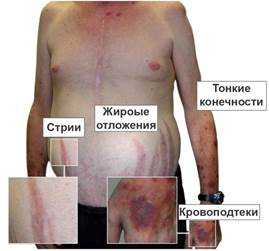
Болезнь Иценко-Кушинга. Гипертрофия базофилов гипофиза. Симптомы: ожирение (туловищное), стрии (растяжки) на коже, лунообразное лицо с ярким румянцем, артериальная гипертензия, оволошенность и тд.
1 случай на миллион. Возникает в 2-6, 20-40 лет. У женщин в 4 раза чаще. Причина – доброкачественные микроопухоли гипофиза.
Аменорея связана с увеличением продукции андрогенов. При этом в ягодичных и других областях жироотложения не наблюдается. Нарушения психики: расстройство сна, депрессии, эмоциональная нестабильность.
(извините, не удержалась)))))
Гипотоламическое ожирение. Возникает до 35 лет. Ускоряются темпы роста, полового созревания. В основе – повышение АКТГ, СТГ в период полового развития. Происходит задержка формирования вторичных половых признаков. Адипогенная дистрофия. Множественные нарушения тропных функций гипофиза.
Наиболее тяжелая форма – болезнь Симмондса – полное исчезновение подкожного жира, атрофия мышц, потеря веса до 20-25 кг. Уменьшаются внутренние органы, кровообращение.
Надпочечная недостаточность. Слабость, исхудание. Изреженный рост волос, их исчезновение в аксиллярных, лобковой областях.
Пролактин
Синтезируется в аденогипофизе (передняя доля). Белок. Схож по строению с СТГ.
В 1971г выделен в чистом виде. Один из древнейших гормонов.
· обладает лютотропным действием
· стимулирует процесс лактации
· тормозит секрецию ФСГ
· способствует образованию родительских инстинктов
· стимулирует развитие мужских половых органов, продукцию тестостерона.
Вырабатывается при стрессе. Необходим для созревания лёгких у плода. Угнетает половую потенцию (проказник). Необходим для памяти: его содержание понижено у неврологических больных.
У женщин находится в большой зависимости от стадий менструального цикла. Содержание ночью больше, чем днем.
Если его содержание 100 нг/л -> опухоль пролактилома.
В циркулирующей крови не обнаруживается. В покое – в виде больших мономеров, обладает малой рецептивной активностью. Активируется при превращении в малый мономер (?). Механизм изучен слабо.
Липотропин
Гипофиз. Полипептид. Бета- и гамма-липотропин.
Бета-липотропин – специфический жиромобилизующий гормон передней доли гипофиза. Активирует липолиз, освобождение жирных кислот. Ускоряет обмен глюкозы в жировой ткани.
Состоит из 91 аминокислотного остатка. Имеет фрагменты, сходные с кортико- и меланотропином.
Может расщепляться на фрагменты -> образуются гамма-липотропин, бета-меланотропин, бета-эндорфин (в больших количествах при стрессе). Меланотропин подвергается дальнейшему расщеплению в гипофизе — > бета-эндорфин.
По внутриутробному развитию данных нет. Полагают, что незадолго до родов вырабатывается бета-эндорфин.
Обладает видовой специфичностью.
Обладает кортикотропной, меланостимулирующей активностью.
Меланотропин
Промежуточная доля гипофиза. Есть 2 формы гормон: альфа и бета. В крови встречается только бета.
Состоит из 22 аминокислотных остатков. Бета видоспецифичен, альфа одинаков у всех животных. Последовательность остатков сходна с таковой кортикотропина.
Обнаруживается на 10-11 неделе в/у. Содержание в железе повышается со второй половины беременности. Роль в пренатальном развитии неизвестна.
Действует на меланоциты кожи рыб, амфибий, рептилий. Регулирует распределение меланина в коже человека.
Участвует в формировании памяти. Роль при стрессе не выяснена.
Липо-, кортико-, меланотропин принадлежат к одному семейству, имеют общее происхождение. Обе формы меланотропина имеют последовательность из 7-и аминокислот, сходную с таковой АКТГ. В 60-е группой Ли открыт бета-меланотропин – мощный липотроп, обладает кортикотропной, меланотропной активностью. С помощью высокочувствительных методов установлено, что эти 3 группы содержатся в одних и тех же клетках и секретируются гранулами.
Создана гипотетическая модель, объясняющая происхождение этих 3-х гормонов. Полагают, что в аденогипофизе синтезируется так называемая «стволовая молекула» (31 кДа) – предшественник. Она может расщипляться ферментами на несколько фрагментов. Если отщепить 1-39 -> кортикотропин, выделяется из гипофиза. В средней доле может отщепиться 1-13 -> альфа-меланотропин. 1-9 -> бета-липотропин, из которого может образоваться гамма-липотропин, бета-эндорфины.
Гонадотропины: ФСГ, ЛГ
ФСГ = фолликулотропин, фоллитропин.
ЛГ = лютеинизирующий гормон, лютеотропин, лютропин.
Секретируется гонадотропными клетками передней доли гипофиза. Сложные белки – гликопротеины. Состоят из 2-х ковалентно связанных субъединиц: альфа и бета. Альфа-ФСГ и ЛГ идентичны (?? Возможно, имелось ввиду, что не активны), бета специфичны и определяют биологическую активность. Субъединицы могут циркулировать в крови, но активны только при соединении.
ФСГ стимулируют созревание фолликулов яичников. ЛГ стимулирует разрыв яичников, овуляцию, образование желтого тела. ЛГ исследован лучше. Оба повышают активность гонад. Вырабатываются как у женщин, так и у мужчин, но количество и ритм секреции различны.
Факторы, контролирующие секрецию.
ЛГ-релизинг гормон. Дека-пептид, секретируется гипоталамусом. Используется в терапевтических и диагностических целях. Секретируется в портальную венозную систему гипофиза, где стимулирует образование и секрецию ЛГ (ФСГ в меньшей степени).
Стероидные гормоны. Эстрогены – по принципу «+/-» обратной связи. Увеличение содержания эстрогена в крови увеличивает секрецию ЛГ и подавляет секрецию ФСГ. Считают, что при уменьшении его содержания гонадолиберин стимулирует клетки, синтезирующие ФСГ, при увеличении – синтезирующие ЛГ.
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
megalektsii.ru
что это такое, норма по возрасту, таблица
АКТГ-гормон: что это такое у женщин? Адренокортикотропный гормон важен для нормального функционирования как женского, так и мужского организма. Есть некоторые особенности действия гормона в зависимости от пола.
За что отвечает АКТГ у женщин? Основная функция АКТГ – стимуляция выделения гормонов корой надпочечников – кортизола, половых стероидов (андрогенов и эстрогенов) и катехоламинов. Женщины испытывают более значительные колебания уровня гормона в течение жизни в связи с менструальным циклом, беременностью, периодом менопаузы.
Итак, какие функции осуществляет гормон АКТГ, за что отвечает у женщин. Функции адренокортикотропного гормона очень разнообразны и обусловлены воздействием гормонов, на выработку которых он влияет:

- Стимуляция роста надпочечников, особенно коркового вещества. Это приводит к увеличению концентрации гормонов, вырабатываемых надпочечниками.
- Прямое воздействие на увеличение синтеза кортизола при кратковременном воздействии. Эта функция реализуется в стрессовых ситуациях, когда необходима быстрая мобилизация ресурсов организма. Происходит усиление прилива крови к мышцам, для реализации рефлекса «бей или беги», повышается уровень глюкозы в крови для обеспечения энергией, оказывается некоторое обезболивающее, противовоспалительное, противоаллергическое действие, а также антистрессовый эффект. Однако у такого состояния есть и отрицательные стороны – угнетается иммунная система, снижается мышечная масса за счет ускоренного катаболизма белков, замедляется перистальтика и ухудшается пищеварение, наблюдается угнетение когнитивных способностей – памяти, обучаемости, мотивации.
- Влияние на секрецию минералокортикоидов: альдостерон, дезоксикортикостерон. Эти гормоны регулируют минеральный и водный обмен, влияют на артериальное давление.
- Стимуляция синтеза андрогенов, что приводит к повышению уровня мужских стероидов и появлению признаков гиперандрогении: акне, ухудшение состояния кожи и другие.
- Усиление синтеза холестерола, который нужен для построения клеток, нервов, защиты эритроцитов, синтеза витамина Д.
- Стимулирует синтез меланина за счет влияния на меланоциты, увеличивая количество пигмента для цвета кожи, волос, радужки глаз.
- Стимулирует активность головного мозга. Дефицит кортикотропина приводит к безучастности ко всему, депрессии, психозам, нарушениям памяти.
Особое воздействие на женский организм адренокортикотропного гормона обусловлено тем, что АКТГ взаимодействует с другими гормонами гипофиза, влияя на объем их секреции. Это касается пролактина, ФСГ, ЛГ. В результате такого взаимодействия опосредованно происходит регуляция работы яичников, созревание фолликула и процесс овуляции, созревание желтого тела, регуляция менструального цикла, а также механизмы поддержки беременности и процесса лактации.
Какие проявления у женщины, когда не соответствует нормам АКТГ гормон, что показывает у женщин его дисбаланс?
Если происходит нарушение синтеза АКТГ в детском возрасте, для девочки это чревато нарушениями полового развития. При повышении кортикотропина у девочек происходит параллельное снижение уровня женских половых гормонов и повышение уровня мужских стероидов. В результате развивается такое явление, как вирилизация – приобретение девочкой черт мужского организма. Клинически это проявляется в виде высокого роста, широких плечей и узких бедер, недоразвитие молочных желез, задержка первой менструации, нарушения цикла, недоразвитие половых органов.
При повышении АКТГ во взрослом возрасте также нарушается баланс между женскими и мужскими половыми гормонами. Симптоматика включает в себя нарушения менструального цикла, угревую сыпь, повышенное оволосение, бесплодие.
Если АКТГ понижен, у женщин наблюдаются следующие симптомы: явления гиперпигментации кожи, резкая потеря веса от 3 до 10 кг, расстройства со стороны пищеварительного тракта в виде запоров, анорексии, повышение чувствительности тканей к инсулину и, как следствие, частые приступы гипогликемии, снижение артериального давления, головокружения, мышечная слабость, миалгии, нарушения психических функций, депрессия, бессонница, малоподвижность, апатия, гипогонадизм (если нарушения в детском возрасте).
Поскольку АКТГ очень чувствителен к различного рода воздействиям, при сдаче анализа крови нужно правильно подготовиться. Следует избегать в течение минимум суток до сдачи крови стрессов, перенапряжения, чрезмерной физической нагрузки, переездов со сменой часовых поясов, курения, употребления алкогольсодержащих напитков, рентгенологических методов исследования. Также не рекомендовано сдавать кровь при обострении хронических заболеваний и в период острых инфекционных болезней. Прием медикаментов в период подготовки к сдаче анализа стоит обсудить с лечащим врачом. Кровь нужно сдавать утром, обязательно натощак, разрешается лишь пить воду. Имеет значение при анализе на АКТГ, на какой день цикла женщина его сдает. Женщины сдают кровь на АКТГ в первую фазу менструального цикла, то есть на 6-7 день цикла. Если нужно сдать АКТГ, цикл при этом нарушен вплоть до аменореи, то сдать АКТГ можно в любой день.
Адренокортикотропный гормон: норма у женщин. Норма АКТГ зависит от возраста пациентки, фазы цикла, времени суток и примерно составляет 9-52 пг/мл. В лабораториях приведены показатели АКТГ — норма у женщин по возрасту (таблица в бланке результатов). В период беременности допускаются более высокие показатели. На патологию указывает повышение уровня кортикотропина в 1,5 и более раз. Незначительные отклонения могут быть связаны с воздействием случайных факторов, однако также должны быть проанализированы для исключения начальных стадий патологии. Норма АКТГ в крови у женщин с выраженной клинической симптоматикой требует повторного исследования для исключения ложного результата.
standarts-hormones.ru
Адренокортикотропный гормон — Википедия
Адренокортикотропный гормон, или АКТГ, кортикотропин, адренокортикотропин, кортикотропный гормон (лат. adrenalis-надпочечный, лат. cortex-кора и греч. tropos — направление) — тропный гормон, вырабатываемый базофильными клетками передней доли гипофиза. По химическому строению АКТГ является пептидным гормоном.
Строение
Последовательность аминокислотных остатков в АКТГМолекула АКТГ человека состоит из 39 аминокислотных остатков (4,540 Да). Характеристики АКТГ определяются различными участками его пептидной цепи: участок с 4 по 10 аминокислоту является актоном (пептидом, определящим функцию, синтетический аналог этого участка — препарат Семакс), с 15 по 21 (особенно с 15 по 18) аминокислоту — гаптоном (пептидом, определяющим специфичность связывания с рецептором). Участок с 1 по 3 и с 11 по 13, по-видимому, обуславливает меланоцитостимулирующую роль АКТГ, с 25 по 33 — иммуногенные свойства АКТГ данного вида животного (он более других участков различается у различных видов животных). Участок с 20 по 24 защищает АКТГ от действия экзопептидаз, играя роль стабилизатора. Такая множественность обладающих биологической активностью участков АКТГ обуславливает наличие нескольких биологических эффектов гормона и возможность связывания его с несколькими видами рецепторов.
По прошествии определенного периода времени молекула АКТГ может расщепиться на α-меланоцит-стимулирующий гормон и КЛИП, белок, роль которого ещё не изучена.
Биосинтез
АКТГ, как и некоторые другие гормоны (меланоцитостимулирующий гормон, липотропины и β-эндорфин), синтезируется из белка-предшественника проопиомеланокортина (пре-проопиомеланокортина). Удаление из пре-проопиомеланокортина в процессе трансляции сигнальной пептидной последовательности, приводит к образованию проопиомеланокортина, который, претерпев ряд посттрансляционных модификаций (фосфорилирование и гликозилирование), расщепляется эндопептидазами на различные полипептидные фрагменты с разной активностью.
Синтез АКТГ подчинён особому ритму, который, в свою очередь, подчинён ритму выделения кортиколиберина. Максимальная секреция АКТГ (а также либерина и глюкокортикоидов) наблюдается утром в 6-8 часов, а минимальная — между 18 и 23 часами.
Рецепторы АКТГ
Специфическим рецептором АКТГ считается MC2R — один из меланокортиновых рецепторов, расположенных в основном на клетках коры надпочечников и жировой ткани. Это семиспиральный рецептор, связанный c Gs-белком. Кроме того, АКТГ связывается с разной степенью аффинности с остальными меланокортиновыми рецепторами, которые расположены на многих типах клеток — клетках кожи, меланоцитах, клетках иммунной системы и др.
Физиологическая роль
Кортикотропин контролирует синтез и секрецию гормонов коры надпочечников (особенно их пучковой зоны). В основном кортикотропин влияет на синтез и секрецию глюкокортикоидов — кортизола, кортизона, кортикостерона. Попутно повышается синтез надпочечниками прогестерона, андрогенов и эстрогенов. Это может иметь как хронический, так и кратковременный характер. Относительно механизма стимуляции АКТГ синтеза кортикостероидов выдвигалось несколько теорий:
- Теория Хейнса (R. C. Haynes). Согласно Хейнсу, АКТГ повышает активность аденилатциклазы, катализирующей превращение АТФ в циклический 3’,5’- аденозинмонофосфат (3’,5’- АМФ), активирующий фосфорилазу. Фосфорилаза, в свою очередь, расщепляет гликоген надпочечников до глюкозо-1-фосфата, превращающегося далее в глюкозо-6-фосфат. Глюкозо-6-фосфат, обмениваясь через пентозный цикл, приводит к увеличению восстановленного никотинамидадениндинуклеотидфосфата (НАДФН2), являющегося необходимым кофактором при превращении холестерина в прегненолон и при гидроксилировании стероидных предшественников до конечных продуктов стероидогенеза.
- Теория МакКёрнса (K. W. McKerns). В целом сходна с предыдущей за исключением одного момента: она объясняет повышение концентрации НАДФН2 в надпочечниках не как результат усиления гликогенолиза, а как результат повышения активности глюкозо-6-фосфатдегидрогиназы.
- Теория Гаррена (L. D. Garren) с сотр. Согласно этой теории, АКТГ стимулирует аденилатциклазу в мембранах клеток и увеличивает поступление циклического 3’,5’- АМФ в цитоплазму, где 3’,5’- цАМФ взаимодействует с комплексом рецепторный белок — протеинкиназа и, вызывая его диссоциацию, активирует протеинкиназу. Протеинкиназа фосфорилирует рибосомы и стимулирует в них синтез специального белка, проходящий с использованием стабильной иРНК в качестве матрицы. Образовавшийся белок производит перенос свободного холестерина из жировых капель цитоплазмы в митохондрии, где находится белок P450scc, имеющий ферментативную функцию. Он ускоряет образование стероидов, началом которого является разложение холестерина, вследствие чего, из него образуется прегненолон, а затем и кортикостероиды (транскрипцию генов стероидогенных ферментов, к которым и принадлежит P450scc, способен стимулировать сам АКТГ при длительном действии).
На данный момент подтверждённой считается теория Гаррена [1].
В некоторой степени кортикотропин повышает также синтез и секрецию минералокортикоидов — дезоксикортикостерона и альдостерона. Однако кортикотропин не является основным регулятором синтеза и секреции альдостерона. Основной механизм регуляции синтеза и секреции альдостерона находится вне влияния оси гипоталамус — гипофиз — кора надпочечников — это ренин-ангиотензин-альдостероновая система.
Кортикотропин также в небольшой степени увеличивает синтез и секрецию катехоламинов мозговым веществом надпочечников. Однако кортикотропин не является основным регулятором синтеза катехоламинов в мозговом веществе надпочечников. Регуляция синтеза катехоламинов осуществляется в основном через симпатическую стимуляцию хромаффинной ткани надпочечников либо через реакцию хромаффинной ткани надпочечников на такие факторы, как её ишемия или гипогликемия.
Кортикотропин также повышает чувствительность периферических тканей к действию гормонов коры надпочечников (глюкокортикоидов и минералокортикоидов).
В больших концентрациях и при длительном воздействии кортикотропин вызывает увеличение размеров и массы надпочечников, особенно их коркового слоя, увеличение запасов холестерина, аскорбиновой и пантотеновой кислот в коре надпочечников, то есть функциональную гипертрофию коры надпочечников, сопровождающуюся увеличением общего содержания в них белка и ДНК. Объясняется это тем, что под влиянием АКТГ в надпочечниках повышается активность ДНК-полимеразы и тимидинкиназы — ферментов, участвующих в биосинтезе ДНК. Длительное введение АКТГ ведёт к увеличению активности 11-бета-гидроксилазы, сопровождающееся появлением в цитоплазме белкового активатора фермента. При повторных инъекциях АКТГ в организме человека также изменяются соотношения секретируемых кортикостероидов (гидрокортизона и кортикостерона) в сторону значительного увеличения секреции гидрокортизона.
Также АКТГ способен к меланоцитостимулирующей активности (он способен активировать переход тирозина в меланин) за счет последовательности 13-ти аминокислотных остатков N-концевого участка. Это объясняется схожестью последней с последовательностью аминокислот в α-меланоцитостимулирующем гормоне.
Большое число данных указывает на то, что АКТГ/МСГ-подобные пептиды способны ингибировать процессы воспаления.
АКТГ способен к взаимодействию с другими пептидными гормонами (пролактином, вазопрессином, TRH, VIP, опиоидными пептидами), а также с медиаторными системами моноаминов гипоталамуса. Установлено, что АКТГ и его фрагменты способны влиять на память, мотивацию, процессы обучения.
Помимо ключевой функции, заключающейся в регуляции секреции коры надпочечников, АКТГ регулирует многие процессы в различных клетках, например, в остеобластах, отвечающих за образование костной ткани. Влияние АКТГ на остеобласты было обнаружено в 2005 году. Исследования показали, что ответная реакция остеобластов на АКТГ включает в себя выработку фактора роста эндотелия сосудов, сигнального белка, стимулирующего формирование кровеносных сосудов. Такая ответная реакция в некоторых случаях может играть важную роль в выживании остеобластов.
Медицинское значение
В ряде случаев с пациентами проводится АКТГ-тест (определение уровня АКТГ в крови). Нормальным считается уровень АКТГ 9-52 пг/мл. Повышенный уровень АКТГ наблюдается при болезни Аддисона (или первичной недостаточности) (возникает в результате хронически повышенного уровня АКТГ, что является причиной дефицита кортизола), болезни Кушинга, вызываемой опухолью гипофиза, ренолейкодистрофии, синдроме Нельсона и эктопических опухолях, продуцирующих АКТГ. Пониженный уровень АКТГ может наблюдаться при синдроме Кушинга, связанном с опухолями надпочечников, и при гипофизарной недостаточности.
При рецессивно-аутосомных мутациях рецептора АКТГ наблюдается семейный дефицит глюкокортикоидов.
Регуляция секреции
У человека синтез и секреция АКТГ в кровь регулируется гипоталамусом, выделяющим кортиколиберин — АКТГ-рилизинг-фактор. Синтезированные под действием АКТГ кортикостероиды выходят в кровь и воздействуют на гипоталамус и по механизму отрицательной обратной связи подавляют секрецию кортиколиберина. Кроме того, известно, что глюкокортикоиды могут также подавлять транскрипцию гена проопиомеланокортина и синтез полипептидной цепи.
Период полураспада АКТГ в крови человека составляет приблизительно десять минут.
Искусственный АКТГ
Искусственный АКТГ, состоящий из первых 24 аминокислот природного гормона, был впервые получен Клаусом Гофманном в Питтсбургском Университете. В синтетических формах АКТГ известен как Синактен или Кортрозин. Эти два вещества используются в Австралии и Великобритании для проведения АКТГ-тестов, показывающих эффективность работы надпочечников в стрессовых ситуациях.
Поначалу искусственный АКТГ использовали в качестве замены так называемого Актар геля для лечения эпилептических спазмов. Но из-за резко возросших цен лекарство потеряло популярность. Вскоре оно было также предложено для лечения аутоиммунных заболеваний и нефротических синдромов.
Открытие
Работая над диссертацией, Эвелин М. Андерсон, совместно с Джеймсом Бертрамом Коллипом и Дэвидом Томсоном Ландсборо, исследовала функцию АКТГ и объяснила её в статье, опубликованной в 1933 году.
Литература
- Агаджанян Н. А., Тель Л. З., Циркин В. И., Чеснокова С. А.. Физиология человека. Санкт — Петербург: Сотис, 1998 . с. 153—154
- Большая Медицинская Энциклопедия. Гл. ред. Б. В. Петровский. Изд. Советская Энциклопедия, 1982. 3-е издание; том 1, с. 110—111
- Розен В. Б. Основы эндокринологии // М.: Изд-во МГУ, 1994
- Strand F. et al., 1993 , Pranzatelli M. et al., 1994 , Googman B. et al., 1994 , Gotoh M. et al., 1994 , Hatzinger M. et al., 1995 , Kiem D. et al., 1995 , Musselman D. & Nemeroff C., 1995
Ссылки
- АКТГ (ACTH, кортикотропин, адренокортикотропный гормон) — humbio.ru
wikipedia.green